Соединение сложного эфира гуанидинобензойной кислоты - RU2661895C2
Код документа: RU2661895C2
Описание
Область техники
[0001]
Настоящее изобретение относится к соединению сложного эфира гуанидинобензойной кислоты, которое можно использовать в качестве активного ингредиента фармацевтической композиции, например, фармацевтической композиции для лечения заболеваний почек.
Уровень техники
[0002]
Терапия низкобелковой диетой для различных заболеваний почек (например, хроническая почечная недостаточность, острый гломерулонефрит и острое повреждение почек) практиковалась в течение длительного времени. Ее механизм действия до сих пор не выяснен, но полагают, что происходит (1) снижение общего количества соединений азота, получаемых из белка, и снижение нагрузки клубочков, (2) подавление образования уремических токсинов, получаемых из белка, которые вызывают повреждение почек, (3) подавление накопления фосфора или калия, получаемого из белка, (4) подавление образования кислот, получаемых из белка, и т.п. посредством ингибирования потребления белка, получаемого из диеты. Эффект терапии низкобелковой диетой, оказываемый на ингибирование прогрессирования заболеваний почек, доказан в клинических тестах, которые проводились прежде ((a) «The New England Journal of Medicine», 1989, том 321, № 26, стр. 1773-1777; и (b) «American Journal of Kidney Diseases», 2003, том 41, № 3, стр. S31-S34), и количество потребления белка для пациента с заболеванием почек также установлено в руководствах общества (Japan Society of Nephrology, «Evidence-Based Clinical Practice Guideline for CKD 2013», 2013, стр. 25-30). С другой стороны, терапия низкобелковой диетой имеет проблемы низкой степени длительной строгой практики из-за необходимости технических знаний, высокой стоимости и низкой диетической приверженности, которая обусловлена вкусом.
[0003]
Известно, что соединение, которое ингибирует трипсин в качестве одной из сериновых протеаз, можно использовать для заболеваний, в которых участвует этот фермент, таких как панкреатит и заболевание гастроэзофагеальный рефлюкс. В действительности, камостат мезилат (который далее в настоящем документе обозначают как камостат) следующей формулы (A), который представляет собой ингибитор трипсина (патентный документ 1), фактически использовали для хронического панкреатита и заболевания гастроэзофагеальный рефлюкс в клинической практике. Кроме того, также сообщалось о том, что камостат оказывает эффект на ингибирование экскреции мочевого альбумина в животных моделях с сахарным диабетом («Nephron», 1996, том 74, № 4, стр. 709-712) и снижение количества мочевой экскреции белка у пациентов с различными заболеваниями почек («Clinical Nephrology», 1989, том 32, стр. 119-123).
[Хим. 1]

[0004]
Кроме того, трипсин участвует в пролиферации вирусов гриппа. Например, необходимо, что гемагглютинин (HA) на поверхности вируса был расщеплен на две субъединицы HA1 и HA2 с помощью трипсина в легких путях или эпителии слизистой кишечника для того, чтобы достигать инфекционности вируса. Сообщалось о том, что посредством ингибирования трипсина подавляют расщепление этого HA и вирус утрачивает инфекционность, посредством чего подавляют пролиферацию. Следовательно, соединение, которое ингибирует трипсин, также можно использовать в качестве лекарственного средства против гриппа ((a) «Antiviral Research», 2011, том 92, № 1, стр. 27-36; (b) «Protease Groups of Individuals which Determine Susceptibility to Infection of Influenza Virus and Pathogenesis of Influenza-Associated Encephalopathy», «The Japanese Journal of Pharmacology», 2003, том 122, стр. 45-53).
[0005]
В качестве соединения, проявляющего ингибирующую трипсин активность, отличного от камостата, сообщалось о соединении (B) (патентный документ 2), соединении (C) (патентный документ 3), соединении (D) (патентный документ 4), соединении (E) (патентный документ 5), соединении (F) (патентный документ 6), соединении (G) (патентный документ 7) и соединении (H) (патентный документ 8) следующих формул. Однако не раскрыто соединение формулы (I) или его соль по настоящей заявке, как описано далее в этих документах.
[Хим. 2]

(В формуле (C), A представляет собой -N(R1, R2) или тому подобное, и R1 и R2 каждый представляет собой H, низший алкил, который имеет от 1 до 8 углеродных атомов, аралкил, который может иметь заместитель, или тому подобное. В формуле (D), X представляет собой атом кислорода или атом серы и R представляет собой -C(O)N(R1)-(CH2)m-(1-азабицикло[3.3.0]октан-5-ил) или тому подобное. В формуле (E) R1 представляет собой атом водорода или атом галогена и R2 представляет собой -OCOR3 или тому подобное. В формуле (F) A представляет собой (CH2)n или стироловую группу, R2 представляет собой -NH(CH2)mCOOR4, -NHCH-(-R5)-COOR4, -NH-C6H4-(CH2)p-COOR4 или тому подобное, m представляет собой 2 или 3, p представляет собой целое, равное 0 или 1, R4 представляет собой атом водорода, низшую алкиловую или замещенную или незамещенную бензиловую группу, R5 представляет собой замещенную или незамещенную бензиловую группу, метоксикарбонилметильную группу, и заместитель замещенной бензиловой группы обозначает атом галогена, нитрогруппу, низшую алкильную группу, гидроксигруппу, алкоксильную группу, которая имеет от 2 до 6 углеродных атомов, или тому подобное. В формуле (G), X представляет низший алкилен или тому подобное, Y представляет карбонильную группу или тому подобное, A представляет -NR6R7, R6 и R7 могут представлять собой одно и то же или отличное друг от друга и каждый представляет атом водорода, низшую алкильную группу, которая может иметь заместитель или тому подобное, или R6 и R7 могут образовывать связь друг с другом для того, чтобы формировать циклическую аминогруппу, которая может иметь заместитель. В формуле (H) R2 представляет собой замещенную фенильную группу или тому подобное, и R3 представляет собой какой-либо из различных заместителей. Другие символы см. в соответствующих патентных публикациях.)
[0006]
Кроме того, в качестве гуанидиносоединения, которое оказывает эффект ингибирования образования и высвобождения воспалительных цитокинов, сообщалось о соединении (J) (патентный документ 9). Однако нет раскрытия или предположения о конкретном соединении, таком как соединение формулы (I) или его соль по настоящей заявке, как описано далее в этих документах.
[Хим. 3]

(где R представляет собой гуанидиногруппу, амидиногруппу или тому подобное; A1, A2 и A3 каждая представляет собой связь или тому подобное; L представляет собой ариленовую группу или тому подобное; X представляет собой -COO- или тому подобное; M представляет собой ариленовую группу или тому подобное, или двухвалентную гетероциклическую группу, которая имеет по меньшей мере один гетероатом, выбранный из атома азота, атома серы или атома кислорода, и может формировать конденсированное кольцо или тому подобное; R5 представляет собой атом водорода или тому подобное; R6 представляет собой -CR12R13-(CH2)m-R11 или тому подобное; R12 и R13 представляют собой атом водорода или тому подобное; R11 представляет собой -COOR16 или тому подобное; и R16 представляет собой атом водорода или тому подобное. Другие символы см. в соответствующих патентных публикациях.)
[0007]
Кроме того, сообщалось о соединении (K) в качестве гуанидиносоединения, которое можно использовать в качестве ингибитора протеаз пыльцы (патентный документ 10). Однако нет раскрытия или предположения о конкретном соединении, таком как соединение формулы (I) или его соль по настоящей заявке, как описано далее в этом документе.
[Хим. 4]

(где R2c представляет группу ZcCONR5cR6c или тому подобное, Zc представляет связь или тому подобное, R5c и R6c каждый независимо представляет атом водорода, алкильную группу, которая имеет от 1 до 4 углеродных атомов, алкильную группу, которая имеет от 1 до 4 углеродных атомов, замещенную группой COOR4c, фенильной группой, бензиловой группой, пиридиловой группой или тому подобным, и R4c представляет алкильную группу, которая имеет от 1 до 4 углеродных атомов, фенильную группу или тому подобное).
[0008]
Кроме того, сообщалось о том, что можно использовать производное гуанидинобензойной кислоты (L), такое как ингибитор протеазы клеща домашней пыли (патентный документ 11). Однако нет раскрытия или предположения о конкретном соединении, таком как соединение формулы (I) или его соль по настоящей заявке, как описано далее в этом документе.
[Хим. 5]

(где R2 представляет фенильную группу, нафтильную группу, замещенную фенильную группу или замещенную нафтильную группу, и R3 представляет один из различных заместителей).
Связанная область
Патентные документы
[0009]
Патентный документ 1: JP-A-52-089640
Патентный документ 2: JP-A-57-053454
Патентный документ 3: WO 1994/013631
Патентный документ 4: JP-A-7-053500
Патентный документ 5: WO 1991/018869
Патентный документ 6: JP-A-8-048664
Патентный документ 7: WO 2011/071048
Патентный документ 8: WO 1997/037969
Патентный документ 9: JP-A-9-124571
Патентный документ 10: JP-A-10-306025
Патентный документ 11: JP-A-6-192085
Описание изобретения
Проблемы, подлежащие решению с помощью изобретения
[0010]
Предоставлено соединение сложного эфира гуанидинобензойной кислоты, которое можно использовать в качестве активного ингредиента фармацевтической композиции, например, фармацевтической композиции для предотвращения и/или лечения заболеваний почек.
Средства решения проблем
[0011]
Употребляемый с пищей белок проходит расщепление с помощью различных ферментов в двенадцатиперстной кишке и кишечнике, и наконец всасывается в виде аминокислот или пептидов. Трипсин, который поджелудочная железа образует и секретирует в тонкую кишку в процессе протеолиза, представляет собой важный протеолитический фермент. Кроме того, ожидают, что посредством подавления фермента можно имитировать состояние низкобелковой диеты, при которой происходит вызванное диетой подавление протеолиза, а также подавление всасывания. То есть, полагают, что ингибитор трипсина, который действует в кишечнике, потенциально можно использовать в качестве средства, которое будет замещать терапию низкобелковой диетой. В связи с этим, авторы настоящего изобретения проводили экстенсивные исследования соединений, обладающих ингибирующей трипсин активностью. Как результат, они обнаружили, что соединение сложного эфира гуанидинобензойной кислоты по настоящему изобретению обладает ингибирующей трипсин активность, и его можно использовать для предотвращения и лечения заболеваний почек в качестве средства, которое заменяет терапию низкобелковой диетой, и тем самым выполнили настоящее изобретение.
[0012]
В частности, настоящее изобретение относится к соединению формулы (I) или его соли и фармацевтической композиции, которая содержит соединение формулы (I) или его соль и эксципиент.
[Хим. 6]

(в котором
L1 представляет собой связь или -низший алкилен-,
L2 представляет собой низший алкилен, который может быть замещен,
R1 представляет собой низший алкил, который может быть замещен заместителем, выбранным из группы, состоящей из арила, который может быть замещен, ароматической гетероциклической группы, которая может быть замещена, и -CO2H или H, или R1 объединяют с атомом азота, связанным с ним, и группой HO2C-L2 на атоме азота для того, чтобы формировать циклический амино, который может быть замещен -CO2H, и
кольцо B представляет собой нафталендиил, 1,2,3,4-тетрагидронафталендиил, 2,3-дигидроиндендиил, бензотиофендиил, бензофурандиил или 2,3-дигидробензофурандиил).
[0013]
Кроме того, до тех пор, пока не определено иное, в случае, когда символы формул в настоящем описании также используют в других химических формулах, одни и те же символы имеют одни и те же значения.
[0014]
Кроме того, настоящее изобретение относится к фармацевтической композиции для предотвращения и/или лечения заболеваний почек (например, хроническая почечная недостаточность, острый гломерулонефрит, острое повреждение почек и т.п.), и/или фармацевтической композиции для предотвращения и/или лечения связанных с трипсином заболеваний (например, хронический панкреатит, заболевание гастроэзофагеальный рефлюкс, печеночная энцефалопатия, грипп и т.п.), которая содержит соединение формулы (I) или его соль. Кроме того, фармацевтическая композиция содержит средство для предотвращения и/или лечения заболеваний почек (например, хроническая почечная недостаточность, острый гломерулонефрит, острое повреждение почек и т.п.) и/или связанных с трипсином заболеваний (например, хронический панкреатит, заболевание гастроэзофагеальный рефлюкс, печеночная энцефалопатия, грипп и т.п.), которое содержит соединение формулы (I) или его соль. В одном из вариантов осуществления заболеванием почек является хроническая почечная недостаточность. В одном из вариантов осуществления хроническая почечная недостаточность представляет собой диабетическую нефропатию, хронический нефрит, нефротический синдром, нефросклероз или поликистозную болезнь почек.
Кроме того, настоящее изобретение относится к использованию соединения формулы (I) или его соли для изготовления фармацевтической композиции для предотвращения и/или лечения заболеваний почек (например, хроническая почечная недостаточность, острый гломерулонефрит, острое повреждение почек и т.п.) и/или связанных с трипсином заболеваний (например, хронический панкреатит, заболевание гастроэзофагеальный рефлюкс, печеночная энцефалопатия, грипп и т.п.); к использованию соединения формулы (I) или его соли для лечения заболеваний почек (например, хроническая почечная недостаточность, острый гломерулонефрит, острое повреждение почек и т.п.) и/или связанных с трипсином заболеваний (например, хронический панкреатит, заболевание гастроэзофагеальный рефлюкс, печеночная энцефалопатия, грипп и т.п.); к соединению формулы (I) или его соли для предотвращения и/или лечения заболеваний почек (например, хроническая почечная недостаточность, острый гломерулонефрит, острое повреждение почек и т.п.) и/или связанных с трипсином заболеваний (например, хронический панкреатит, заболевание гастроэзофагеальный рефлюкс, печеночная энцефалопатия, грипп и т.п.); и способу предотвращения и/или лечения заболеваний почек (например, хроническая почечная недостаточность, острый гломерулонефрит, острое повреждение почек и т.п.) или связанных с трипсином заболеваний (например, хронический панкреатит, заболевание гастроэзофагеальный рефлюкс, печеночная энцефалопатия, грипп и т.п.), который включает введение эффективного количества соединения формулы (I) или его соли субъекту. Кроме того, «субъектом» является человек или другое млекопитающее, нуждающееся в таком предотвращении или лечении, и, в определенном варианте осуществления, человек, нуждающийся в таком предотвращении или лечении.
Эффекты изобретения
[0015]
Соединение формулы (I) или его соль обладает ингибирующим трипсин действием и, следовательно, его можно использовать в качестве средства для предотвращения и/или лечения заболеваний почек (например, хроническая почечная недостаточность, острый гломерулонефрит, острое повреждение почек и т.п.), в качестве средства, которое замещает терапию низкобелковой диетой, и/или средства для предотвращения и/или лечения связанных с трипсином заболеваний (например, хронический панкреатит, заболевание гастроэзофагеальный рефлюкс, печеночная энцефалопатия, грипп и т.п.).
Варианты осуществления для выполнения изобретения
[0016]
Далее в настоящем документе настоящее изобретение описано подробно.
[0017]
В настоящем описании «низший алкил» относится к линейному или разветвленному алкилу, который имеет от 1 до 6 углеродных атомов (который далее в настоящем документе обозначают просто как C1-6), примеры которого включают метил, этил, пропил, изопропил, бутил, трет-бутил, пентил, гексил, и т.п.; в другом варианте осуществления C1-3 алкил; в дополнительном варианте осуществления метил, этил, пропил или изопропил; в еще одном дополнительном варианте осуществления метил или этил; в еще одном дополнительном варианте осуществления метил; и в еще одном дополнительном варианте осуществления этил.
«Низший алкилен» относится к двухвалентной группе, образованной посредством удаления какого-либо одного атома водорода из «низшего алкила», примеры которого включают метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, метилметилен, диметилметилен, этилметилен, изобутилметилен, метилэтилен, диметилэтилен, изобутилен, метилпропилен, этилэтилен, метилтетраметилен, метилтриметилен, диметилтетраметилен и т.п.; в другом варианте осуществления метилен, метилметилен и этилен; в дополнительном варианте осуществления C1-3 алкилен; в еще одном дополнительном варианте осуществления метилен и этилен; в еще одном дополнительном варианте осуществления метилен; и в еще одном дополнительном варианте осуществления этилен.
[0018]
«Арил» относится к от моноциклической до трициклической ароматической углеводородной кольцевой группе, которая имеет от 6 до 14 углеродных атомов, и в частности, к фенилу, нафтилу, антранилу и т.п.; в дополнительном варианте осуществления к фенилу; и в еще одном дополнительном варианте осуществления к нафтилу.
[0019]
«Ароматическая гетероциклическая группа» представляет собой ароматическую моноциклическую гетероциклическую группу, которая имеет от 5 до 6 звеньев кольца, которая содержит по меньшей мере один гетероатом, выбранный из O, N и S, в качестве атома, образующего кольцо, или ароматической бициклической гетероциклической группы, образованной посредством конденсации ароматического моноциклического гетероцикла с бензольным кольцом или тиофеновым кольцом, конкретные примеры которой включают пирролил, фурил, тиенил, пиразолил, имидазолил, оксазолил, тиазолил, оксадиазолил, тиадиазолил, тетразолил, пиридил, пиридазинил, пиримидинил, пиразинил, индолил, изоиндолил, бензофурил, бензотиенил, индазолил, бензоимидазолил, бензоксазолил, бензотиазолил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, тиенопиридил, тиенопиримидинил, тиенопиразинил и т.п.; в одном из вариантов осуществления ароматическую моноциклическую гетероциклическую группу; в другом варианте осуществления ароматическую бициклическую гетероциклическую группу; в дополнительном варианте осуществления тиенил, имидазолил, тиазолил, оксадиазолил, тетразолил, индолил и бензотиенил; и в еще одном дополнительном варианте осуществления тиенил и бензотиенил.
[0020]
«Неароматическая гетероциклическая группа» представляет собой неароматическую моноциклическую гетероциклическую группу, которая имеет от 3 до 7 звеньев кольца, содержащего по меньшей мере один гетероатом, выбранный из O, N и S, в качестве атома, образующего кольцо, или неароматическую бициклическую гетероциклическую группу, образованную посредством конденсации неароматического гетероцикла с бензольным кольцом, тиофеновым кольцом или циклогексановым кольцом, в котором часть связей могут быть ненасыщенными. Кроме того, атом серы, который представляет собой атом, образующий кольцо, может быть окислен. Неароматический гетероцикл также может быть замещен с использованием -оксо. Конкретные его примеры включают азепанил, диазепанил, азиридинил, азетидинил, пирролидинил, имидазолидинил, пиперидил, пиразолидинил, пиперазинил, азоканил, тиоморфолинил, тиазолидинил, 1,1-диоксидотиазолидинил, изотиазолидинил, 1,1-диоксидоизотиазолидинил, оксазолидинил, морфолинил, 1,1-диоксидотиоморфолинил, индолинил, изоиндолинил, тетрагидрохинолил, тетрагидроизохинолил и т.п.; в другом варианте осуществления пирролидинил, тетрагидрохинолил, и тетрагидроизохинолил; в дополнительном варианте осуществления тетрагидрохинолил и тетрагидроизохинолил; и в еще одном дополнительном варианте осуществления тетрагидроизохинолил.
[0021]
«Циклическая аминогруппа» представляет собой среди указанных выше «неароматических гетероциклических групп» неароматическую гетероциклическую группу, содержащую атом азота, на котором имеется связывающий участок. Конкретные примеры циклического амино включают азепан-1-ил, пирролидин-1-ил, пиперидин-1-ил, пиперазин-1-ил, тиоморфолин-4-ил, тиазолидин-3-ил, 1,1-диоксидотиазолидин-3-ил, изотиазолидин-2-ил, 1,1-диоксидоизотиазолидин-2-ил, оксазолидин-3-ил, морфолин-4-ил, 1,1-диоксидотиоморфолин-4-ил, индолин-1-ил, изоиндолин-2-ил, 1,2,3,4-тетрагидрохинолин-1-ил, 1,2,3,4-тетрагидроизохинолин-2-ил и т.п.; в другом варианте осуществления 1,2,3,4-тетрагидрохинолин-1-ил и 1,2,3,4-тетрагидроизохинолин-2-ил; и в дополнительном варианте осуществления 1,2,3,4-тетрагидроизохинолин-2-ил.
[0022]
«Галоген» относится к F, Cl, Br или I; и в другом варианте осуществления к F или Cl.
[0023]
В одном из вариантов осуществления «нафталендиила» используют нафтален-1,6-диил или нафтален-2,6-диил; в одном из вариантов осуществления «1,2,3,4-тетрагидронафталендиила» используют 1,2,3,4-тетрагидронафтален-1,6-диил или 1,2,3,4-тетрагидронафтален-2,6-диил; в одном из вариантов осуществления «2,3-дигидроиндендиила» используют 2,3-дигидроинден-1,5-диил; в одном из вариантов осуществления «бензотиофендиила» используют бензотиофен-2,6-диил или бензотиофен-3,6-диил; в одном из вариантов осуществления «бензофурандиила» используют бензофуран-3,6-диил; и в одном из вариантов осуществления «2,3-дигидробензофурандиила» используют 2,3-дигидробензофуран-3,6-диил.
[0024]
«Биологический эквивалент -CO2H» обозначает другой атом или группу атомов, имеющую общие биологические свойства, эквивалентные -CO2H, которая способна высвобождать кислые протоны. Ее примеры включают -C(O)-NH-OH, -C(O)-NH-O-низший алкил, -C(O)-NH-CN, -C(O)-NH-S(O)2-низший алкил, -C(O)-NH-S(O)2-N(низший алкил)2, тетразолил, оксадиазолонил, оксадиазолтионил, оксатиадиазолил, тиадиазолонил, триазолтионил, гидроксиизоксазолил и т.п.; в другом варианте осуществления -C(O)-NH-S(O)2-низший алкил, -C(O)-NH-S(O)2-N(низший алкил)2 и тетразолил; и в дополнительном варианте осуществления тетразолил.
[0025]
В настоящем описании выражение «который может быть замещен» представляет отсутствие замещения или замещение с использованием от 1 до 5 заместителей». Кроме того, что касается наличия множества заместителей, заместители могут быть одинаковыми или отличающимися друг от друга.
[0026]
Примеры заместителя в «низшем алкилене, который может быть замещен» в L2 формулы (I) включают заместители, выбранные из группы D1.
Группа D1:
(1) галоген,
(2) -OH и -O-низший алкил,
(3) -SH и -S-низший алкил,
(4) -S(O)-низший алкил и -S(O)2-низший алкил,
(5) -CN,
(6) -NO2,
(7) -NH2, -NH-(низший алкил), и -N(низший алкил)2,
(8) -C(O)-низший алкил,
(9) арил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из низшего алкила, который может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена и -CO2H, -O-(низший алкил, который может быть замещен по меньшей мере одной группой -CO2H), галоген и -CO2H и
(10) -C(O)-O-низший алкил и -CO2H или их биологический эквивалент.
[0027]
В другом варианте осуществления группа D1 содержит:
(1) арил, замещенный по меньшей мере одной группой -CO2H, и
(2) -CO2H.
[0028]
Примеры заместителя в «ариле, который может быть замещен» и «ароматической гетероциклической группе, которая может быть замещена» в R1 формулы (I) включают заместители, выбранные из группы D2.
Группа D2:
(1) галоген,
(2) -OH и -O-низший алкил,
(3) -SH и -S-низший алкил,
(4) -S(O)-низший алкил и -S(O)2-низший алкил,
(5) -CN,
(6) -NO2,
(7) -NH2, -NH-(низший алкил) и -N(низший алкил)2,
(8) -C(O)-низший алкил,
(9) -C(O)-NH2, -C(O)-NH-(низший алкил) и -C(O)-N(низший алкил)2,
(10) -C(O)-O-низший алкил и -CO2H или их биологический эквивалент, и
(11) низший алкил и -O-низший алкил, каждый из которых может быть замещен с использованием по меньшей мере одного заместителя, выбранного из группы, состоящей из заместителей, описанных выше с (1) до (10).
[0029]
В другом варианте осуществления группа D2 содержит:
(1) -CO2H, и
(2) низший алкил, замещенный по меньшей мере одной группой -CO2H.
[0030]
Один из вариантов осуществления соединения формулы (I) или его соли приведен ниже.
[0031]
(1) Соединение или его соль, в котором L1 представляет собой связь или метилен; в другом варианте осуществления соединение или его соль, в котором L1 представляет собой связь; в дополнительном варианте осуществления соединение или его соль, в котором L1 представляет собой низший алкилен; в еще одном дополнительном варианте осуществления соединение или его соль, в котором L1 представляет собой метилен; и в еще одном дополнительном варианте осуществления соединение или его соль, в котором L1 представляет собой связь или C1-3 алкилен.
[0032]
(2) Соединение или его соль, в котором L2 представляет собой низший алкилен, который может быть замещен заместителем, выбранным из группы D1; в другом варианте осуществления соединение или его соль, в котором L2 представляет собой низший алкилен, который может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из арила, замещенного по меньшей мере одной группой -CO2H, и -CO2H; в дополнительном варианте осуществления соединение или его соль, в котором L2 представляет собой низший алкилен; в еще одном дополнительном варианте осуществления соединение или его соль, в котором L2 представляет собой C1-3 алкилен; в еще одном дополнительном варианте осуществления соединение или его соль, в котором L2 представляет собой метилен, этилен или этилен, замещенный (фенилом, замещенным с использованием -CO2H); в еще одном дополнительном варианте осуществления соединение или его соль, в котором L2 представляет собой метилен; в еще одном дополнительном варианте осуществления соединение или его соль, в котором L2 представляет собой этилен, замещенный (фенилом, замещенным с использованием -CO2H); в еще одном дополнительном варианте осуществления соединение или его соль, в котором L2 представляет собой метилен, метилметилен, этилен, 2-(карбоксиметил)триметилен или метилметилен, замещенный (фенилом, замещенным с использованием -CO2H); в еще одном дополнительном варианте осуществления соединение или его соль, в котором L2 представляет собой метилен, метилметилен, этилен или метилметилен, замещенный (фенилом, замещенным с использованием -CO2H); в еще одном дополнительном варианте осуществления соединение или его соль, в котором L2 представляет собой метилен, метилметилен или метилметилен, замещенный (фенилом, замещенным с использованием -CO2H); в еще одном дополнительном варианте осуществления соединение или его соль, в котором L2 представляет собой C1-3 алкилен, замещенный (фенилом, замещенным с использованием -CO2H); в еще одном дополнительном варианте осуществления соединение или его соль, в котором L2 представляет собой метилен или метилметилен; в еще одном дополнительном варианте осуществления соединение или его соль, в котором L2 представляет собой метилметилен, замещенный (фенил, замещенный с использованием -CO2H).
[0033]
(3) Соединение или его соль, в котором R1 представляет собой низший алкил, который может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из i) арил, который может быть замещен заместителем, выбранным из группы D2, ii) ароматическая гетероциклическая группа, которая может быть замещена заместителем, выбранным из группы D2, и iii) -CO2H или H; в другом варианте осуществления соединение или его соль, в котором R1 представляет собой низший алкил, который может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из i) арил, замещенный заместителем, выбранным из группы D2, ii) ароматическая гетероциклическая группа, замещенная заместителем, выбранным из группы D2, и iii) -CO2H или H; в дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой низший алкил, который может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из i) арил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, ii) ароматическая гетероциклическая группа, замещенная по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, и iii) -CO2H или H; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой низший алкил, который может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из i) фенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, ii) тиенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, и iii) -CO2H или H; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой низший алкил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из i) фенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, ii) тиенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, и iii) -CO2H или H; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой (фенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H)-CH2-, (тиенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H)-CH2- или H; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой (фенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H)-CH2-; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой низший алкил, замещенный тиенилом, замещенным по меньшей мере одной группой -CO2H; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой (тиенил, замещенным по меньшей мере одной группой -CO2H)-CH2-; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой (фенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H)-CH2-, (тиенил, замещенный по меньшей мере одной группой -CO2H)-CH2-, или H; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой H; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой низший алкил, который может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из i) арил, который может быть замещен заместителем, выбранным из группы D2, ii) ароматическая гетероциклическая группа, которая может быть замещена заместителем, выбранным из группы D2, и iii) -CO2H или H, или R1 объединяют с атомом азота, связанным с ним, и группой HO2C-L2 на атоме азота для того, чтобы формировать 1,2,3,4-тетрагидроизохинолин-2-ил, замещенным по меньшей мере одной группой -CO2H; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой низший алкил, который замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из i) фенил, который может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, и ii) ароматическая гетероциклическая группа, выбранная из тиенила и бензотиенила, замещенного по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, и которое может быть замещено по меньшей мере одной группой -CO2H или H, или R1 объединяют с атомом азота, связанным с ним, и группой HO2C-L2 на атоме азота для того, чтобы формировать 1,2,3,4-тетрагидроизохинолин-2-ил, замещенный двумя группами -CO2H; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой низший алкил, замещенным по меньшей мере одним заместителем, выбранным из группы, состоящей из i) фенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, ii) тиенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, iii) бензотиенил, замещенный с использованием -CO2H, и iv) -CO2H или H; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой (фенил, замещенный с использованием -CO2H)-CH2-, (фенил, замещенный с использованием -CH2-CO2H)-CH2- или (тиенил, замещенный с использованием -CO2H)-CH2-; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 объединяют с атомом азота, связанным с ним и группой HO2C-L2 на атоме азота для того, чтобы формировать 1,2,3,4-тетрагидроизохинолин-2-ил, замещенный двумя группами -CO2H; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой низший алкил, который замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из i) фенил, который может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, и ii) ароматическая гетероциклическая группа, выбранная из тиенила и бензотиенила, замещенного по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, и которое может быть замещено по меньшей мере одной группой -CO2H; в еще одном дополнительном варианте осуществления соединение или его соль, в котором R1 представляет собой низший алкил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из i) фенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, и ii) тиенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H.
[0034]
(4) Соединение или его соль, в котором кольцо B представляет собой нафталендиил, 1,2,3,4-тетрагидронафталендиил, 2,3-дигидроиндендиил или бензотиофендиил; в другом варианте осуществления соединение или его соль, в котором кольцо B представляет собой нафтален-1,6-диил, нафтален-2,6-диил, 1,2,3,4-тетрагидронафтален-1,6-диил, 1,2,3,4-тетрагидронафтален-2,6-диил, 2,3-дигидроинден-1,5-диил или бензотиофен-3,6-диил; в дополнительном варианте осуществления соединение или его соль, в котором кольцо B представляет собой нафтален-1,6-диил, 1,2,3,4-тетрагидронафтален-1,6-диил или 1,2,3,4-тетрагидронафтален-2,6-диил; в еще одном дополнительном варианте осуществления соединение или его соль, в котором кольцо B представляет собой нафтален-1,6-диил, 1,2,3,4-тетрагидронафтален-1,6-диил, в котором положение 1 в 1,2,3,4-тетрагидронафталендииле связано с L1, или 1,2,3,4-тетрагидронафтален-2,6-диил, в котором положение 2 в 1,2,3,4-тетрагидронафталендииле связано с L1; в еще одном дополнительном варианте осуществления соединение или его соль, в котором кольцо B представляет собой 1,2,3,4-тетрагидронафтален-1,6-диил, который имеет положение 1, связанное с L1, или 1,2,3,4-тетрагидронафтален-2,6-диил, который имеет положение 2, связанное с L1; в еще одном дополнительном варианте осуществления соединение или его соль, в котором кольцо B представляет собой 1,2,3,4-тетрагидронафтален-1,6-диил, который имеет положение 1, связанное с L1; в еще одном дополнительном варианте осуществления соединение или его соль, в котором кольцо B представляет собой 1,2,3,4-тетрагидронафтален-2,6-диил, который имеет положение 2, связанное с L1; в еще одном дополнительном варианте осуществления соединение или его соль, в котором кольцо B представляет собой нафтален-1,6-диил, нафтален-2,6-диил, 1,2,3,4-тетрагидронафтален-1,6-диил, 1,2,3,4-тетрагидронафтален-2,6-диил, 2,3-дигидроинден-1,5-диил, бензотиофен-3,6-диил, бензофуран-3,6-диил или 2,3-дигидробензофуран-3,6-диил.
[0035]
(5) Соединение или его соль, в котором -L1-кольцо B- представляет собой -низший алкилен-(1,2,3,4-тетрагидронафталендиил, 2,3-дигидроиндендиил, бензофурандиил или 2,3-дигидробензофурандиил); в другом варианте осуществления соединение или его соль, в котором -L1-кольцо B- представляет собой -CH2-(1,2,3,4-тетрагидронафталендиил, 2,3-дигидроиндендиил, бензофурандиил или 2,3-дигидробензофурандиил); в дополнительном варианте осуществления соединение или его соль, в котором -L1-кольцо B- представляет собой -CH2-(1,2,3,4-тетрагидронафталендиил) или -CH2-(2,3-дигидроиндендиил); в еще одном дополнительном варианте осуществления соединение или его соль, в котором -L1-кольцо B- представляет собой -CH2-(1,2,3,4-тетрагидронафталендиил); в еще одном дополнительном варианте осуществления соединение или его соль, в котором -L1-кольцо B- представляет собой CH2-(2,3-дигидроиндендиил); в еще одном дополнительном варианте осуществления соединение или его соль, в котором -L1-кольцо B- представляет собой -CH2-(1,2,3,4-тетрагидронафтален-1,6-диил) или -CH2-(1,2,3,4-тетрагидронафтален-2,6-диил); в еще одном дополнительном варианте осуществления соединение или его соль, в котором -L1-кольцо B- представляет собой -CH2-(1,2,3,4-тетрагидронафтален-1,6-диил); в еще одном дополнительном варианте осуществления соединение или его соль, в котором -L1-кольцо B- представляет собой -CH2-(1,2,3,4-тетрагидронафтален-2,6-диил); в еще одном дополнительном варианте осуществления соединение или его соль, в котором -L1-кольцо B- представляет собой -CH2-(1,2,3,4-тетрагидронафтален-1,6-диил), в котором CH2 связан с положением 1 в 1,2,3,4-тетрагидронафталендииле; в еще одном дополнительном варианте осуществления соединение или его соль, в котором -L1-кольцо B- представляет собой -CH2-(1,2,3,4-тетрагидронафтален-2,6-диил), в котором CH2 связан с положением 2 в 1,2,3,4-тетрагидронафталендииле.
[0036]
(6) Соединение или его соль, которое представляет собой комбинацию каких-либо двух или более из вариантов осуществления, как описано выше с (1) до (5).
[0037]
Соединение или его соль, которое представляет собой комбинацию каких-либо двух или более из вышеописанных вариантов осуществления с (1) до (5), как описано выше в (6), также включено в настоящее изобретение, и его конкретные примеры также включают следующие варианты осуществления.
[0038]
(7) Соединение или его соль, в котором L1 представляет собой связь или метилен, L2 представляет собой низший алкилен, который может быть замещен заместителем, выбранным из группы D1, R1 представляет собой низший алкил, который может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из i) арил, который может быть замещен заместителем, выбранным из группы D2, ii) ароматическая гетероциклическая группа, которая может быть замещена заместителем, выбранным из группы D2, и iii) -CO2H или H, и кольцо B представляет собой нафталендиил, 1,2,3,4-тетрагидронафталендиил, 2,3-дигидроиндендиил или бензотиофендиил.
[0039]
(8) Соединение или его соль, как описано в (7), в котором L2 представляет собой метилен, этилен или этилен, замещенный (фенилом, замещенным с использованием -CO2H).
[0040]
(9) Соединение или его соль, как описано в (7), в котором L2 представляет собой метилен, метилметилен, этилен или метилметилен, замещенный (фенилом, замещенным с использованием -CO2H).
[0041]
(10) Соединение или его соль, как описано в (8) или (9), в котором R1 представляет собой низший алкил, который может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из i) фенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, ii) тиенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, и iii) -CO2H или H.
[0042]
(11) Соединение или его соль, как описано в (10), в котором кольцо B представляет собой нафтален-1,6-диил, нафтален-2,6-диил, 1,2,3,4-тетрагидронафтален-1,6-диил, 1,2,3,4-тетрагидронафтален-2,6-диил, 2,3-дигидроинден-1,5-диил или бензотиофен-3,6-диил.
[0043]
(12) Соединение или его соль, как описано в (11), в котором L2 представляет собой метилен или метилметилен и R1 представляет собой низший алкил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из i) фенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, и ii) тиенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, или L2 представляет собой метилметилен, замещенный (фенилом, замещенным с использованием -CO2H), и R1 представляет собой H.
[0044]
(13) Соединение или его соль, как описано в (12), в котором L2 представляет собой метилен или метилметилен, и R1 представляет собой (фенил, замещенный с использованием -CO2H)-CH2-, (фенил, замещенный с использованием -CH2-CO2H)-CH2-, или (тиенил, замещенный с использованием -CO2H)-CH2-.
[0045]
(14) Соединение или его соль, как описано в (12), в котором L2 представляет собой метилметилен, замещенный (фенилом, замещенным с использованием -CO2H), и R1 представляет собой H.
[0046]
(15) Соединение или его соль, в котором L1 представляет собой связь или C1-3 алкилен, L2 представляет собой низший алкилен, который может быть замещен заместителем, выбранным из группы D1, R1 представляет собой низший алкил, который может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из i) арил, который может быть замещен заместителем, выбранным из группы D2, ii) ароматическая гетероциклическая группа, которая может быть замещена заместителем, выбранным из группы D2, и iii) -CO2H или H, или R1 объединяют с атомом азота, связанным с ним, и группой HO2C-L2 на атоме азота для того, чтобы формировать 1,2,3,4-тетрагидроизохинолин-2-ил, замещенный по меньшей мере одной группой -CO2H.
[0047]
(16) Соединение или его соль, как описано в (15), в котором L1 представляет собой связь или метилен, кольцо B представляет собой нафтален-1,6-диил, нафтален-2,6-диил, 1,2,3,4-тетрагидронафтален-1,6-диил, 1,2,3,4-тетрагидронафтален-2,6-диил, 2,3-дигидроинден-1,5-диил, бензотиофен-3,6-диил, бензофуран-3,6-диил или 2,3-дигидробензофуран-3,6-диил, и
a) L2 представляет собой C1-3 алкилен, и R1 представляет собой низший алкил, который замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из i) фенил, который может быть замещен по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, и ii) ароматическая гетероциклическая группа, выбранная из тиенила и бензотиенила, замещенного по меньшей мере одним заместителем, выбранным из группы, состоящей из -CO2H и низшего алкила, замещенного с использованием -CO2H, и которая может быть замещена по меньшей мере одной группой -CO2H,
b) L2 представляет собой C1-3 алкилен, замещенный (фенилом, замещенным -CO2H), и R1 представляет собой H, или
c) R1 объединяют с атомом азота, связанным с ним, и группой HO2C-L2 на атоме азота для того, чтобы формировать 1,2,3,4-тетрагидроизохинолин-2-ил, замещенный двумя группами -CO2H.
[0048]
Примеры конкретных соединений, включенных в соединение формулы (I) или его соль, включают следующие соединения:
4-{[{6-[(4-карбамимидамидобензоил)окси]-2-нафтоил}(карбоксиметил)амино]метил}тиофен-2-карбоновая кислота,
3-{[({6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-1-ил}ацетил)(карбоксиметил)амино]метил}бензойная кислота,
3-{[({(1R)-6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-1-ил}ацетил)(карбоксиметил)амино]метил}бензойная кислота,
3-{[({(1S)-6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-1-ил}ацетил)(карбоксиметил)амино]метил}бензойная кислота,
N-{6-[(4-карбамимидамидобензоил)окси]-1-нафтоил}-4-карбокси-L-фенилаланин,
4-{[({6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-2-ил}карбонил)(карбоксиметил)амино]метил}тиофен-2-карбоновая кислота,
3-{[({5-[(4-карбамимидамидобензоил)окси]-2,3-дигидро-1H-инден-1-ил}ацетил)(карбоксиметил)амино]метил}бензойная кислота,
4-{[({6-[(4-карбамимидамидобензоил)окси]-1-бензотиофен-3-ил}карбонил)(карбоксиметил)амино]метил}тиофен-2-карбоновая кислота,
3-{[{6-[(4-карбамимидамидобензоил)окси]-1-нафтоил}(карбоксиметил)амино]метил}бензойная кислота,
N-{6-[(4-карбамимидамидобензоил)окси]-1-нафтоил}-N-[4-(карбоксиметил)бензил]глицин,
4-({({6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-1-ил}ацетил)[(1R)-1-карбоксиэтил]амино}метил)тиофен-2-карбоновая кислота,
4-({({6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-2-ил}карбонил)[(1R)-1-карбоксиэтил]амино}метил)тиофен-2-карбоновая кислота или
N-({6-[(4-карбамимидамидобензоил)окси]-1-бензотиофен-3-ил}карбонил)-N-[4-(карбоксиметил)бензил]глицин,
или его соль.
[0049]
Соединение формулы (I) может существовать в форме таутомеров или геометрических изомеров в зависимости от типа заместителей. В настоящем описании соединение формулы (I) следует описывать только в одной форме изомера, хотя настоящее изобретение включает другие изомеры, изолированные формы изомеров или их смесь.
Кроме того, соединение формулы (I) может иметь асимметричные углеродные атомы или осевую асимметрию в некоторых случаях и, соответственно, оно может существовать в форме оптических изомеров, основанных на этом. Настоящее изобретение включает как изолированную форму оптических изомеров соединения формулы (I), так и их смесь.
[0050]
Кроме того, настоящее изобретение также относится к фармацевтически приемлемому пролекарству соединения, представленного формулой (I). Фармацевтически приемлемое пролекарство представляет собой соединение, которое имеет группу, которую можно превращать в аминогруппу, гидроксильную группу, карбоксильную группу или тому подобное через сольволиз или в физиологических условиях. Примеры группы, образующей пролекарство, включают группы, описанные в Prog. Med., 5, 2157-2161 (1985) и «Pharmaceutical Research and Development» (Hirokawa Publishing Company, 1990), том 7, Molecular Design, 163-198.
[0051]
Кроме того, соль соединения формулы (I) представляет собой фармацевтически приемлемую соль соединения формулы (I) и может образовывать кислотно-аддитивную соль или соль с основанием в зависимости от типа заместителей. Конкретные ее примеры включают кислотно-аддитивные соли с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, йодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропановая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, миндальная кислота, винная кислота, дибензоилвинная кислота, дитолуоилвинная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, аспарагиновая кислота, глутаминовая кислота и т.п., и соли с неорганическими основаниями, такими как натрий, калий, магний, кальций, алюминий и т.п., или органическими основаниями, такими как метиламин, этиламин, этаноламин, лизин, орнитин и т.п., соли с различными аминокислотами или производными аминокислот, такими как ацетиллейцин и т.п., соли аммония и т. д.
[0052]
Кроме того, настоящее изобретение также относится к различным гидратам или сольватам и полиморфным кристаллическим веществам соединения формулы (I) и его солям. Кроме того, настоящее изобретение также относится к соединениям, меченым различными радиоактивными или нерадиоактивными изотопами.
[0053]
(Способы получения)
Соединение формулы (I) и его соль можно получать с использованием характеристик, основанных на его базовой структуре или типе заместителей, и посредством применения различных известных способов синтеза. Во время получения, замена релевантной функциональной группы на подходящую защитную группу (группу, которую можно легко превращать в релевантную функциональную группу) на этапе от исходного материала к промежуточному соединению может быть эффективна в зависимости от типа функциональной группы в технологии получения, в некоторых случаях. Защитная группа для такой функциональной группы может включать, например, защитные группы, описанные в «Greene’s Protective Groups in Organic Synthesis» (4-е издание, 2006), P. G. M. Wuts и T. W. Greene, и одну из них можно отбирать и использовать по мере необходимости в зависимости от условий реакции. В способе этого типа желаемое соединение можно получать посредством введения защитной группы, посредством осуществления реакции и посредством устранения защитной группы по мере необходимости.
Кроме того, пролекарство соединения формулы (I) можно получать посредством введения конкретной группы на этапе от исходного материала к промежуточному соединению или посредством осуществления реакции с использованием полученного соединения формулы (I), как в случае указанной выше защитной группы. Реакцию можно осуществлять с использованием способов, известных специалистам в данной области, таких как обычная этерификация, амидирование, дегидратация и т.п.
Ниже в настоящем документе описаны репрезентативные способы получения соединения формулы (I). Каждый из процессов получения также можно осуществлять со ссылкой на литературу, приложенную к настоящему описанию. Кроме того, способы получения по настоящему изобретению не ограничены примерами, как показано ниже.
[0054]
(Процесс получения 1)
[Хим. 7]

(в котором R3 представляет H или трет-бутил, Boc представляет трет-бутоксикарбонил, и R1’ представляет группу, описанную в R1, и группу, которая имеет -CO2-трет-бутил в качестве заместителя).
[0055]
Данный процесс получения представляет собой способ получения соединения (I), которое представляет собой соединение по настоящему изобретению, посредством снятия защитных групп с соединения 1.
[0056]
Данную стадию осуществляют посредством использования соединения 1 и снятия защитных групп с реактива в эквивалентных количествах, или для любого из них в избыточном количестве, и перемешивания смеси в растворителе, который является инертным для реакции, или в отсутствие растворителя, в диапазоне от охлаждения до нагрева и использования обратного холодильника, обычно в течение от 0,1 часа до 5 суток. Примеры растворителя, используемого в настоящем документе, конкретно не ограничены, но включают простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (THF), 1,4-диоксан и диметоксиэтан, и галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан, хлороформ и т.п. Примеры реактива для снятия защитных групп конкретно не ограничены, но включают раствор хлорида водорода в 1,4-диоксане, раствор хлорида водорода в этилацетате, трифторуксусную кислоту и т.п.
Кроме того, в случае, когда -CO2-трет-бутильная группа присутствует в качестве заместителя в R1’, на данной стадии одновременно снимают защиту трет-бутильной группой.
[0057]
(Получение начального соединения)
Начальное соединение в описанном выше способе получения можно получать посредством использования, например, описанного далее способа, способа, описанного в примерах получения, как описано далее, известного способа или его модифицированного способа.
[0058]
(Синтез исходного материала 1)
[Хим. 8]

(в котором R4 представляет трет-бутильную группу или бензиловую группу).
[0059]
Данный процесс получения представляет собой способ получения соединения 2e или 2f, которое представляет собой начальное соединение 1 процесса получения 1.
[0060]
(Стадия 1)
Данная стадия представляет собой стадию получения соединения 2c посредством амидирования соединения 2a и соединения 2b.
Данную стадию осуществляют посредством использования соединения 2a и соединения 2b в эквивалентных количествах, или любого из них в избыточном количестве, и перемешивания смеси в растворителе, который инертен для реакции, в диапазоне от охлаждения до нагрева и использования обратного холодильника, и предпочтительно от -20°C до 60°C, обычно в течение от 0,1 часа до 5 суток, в присутствии конденсирующего агента. Примеры растворителя, используемого в настоящем документе, конкретно не ограничены, но включают ароматические углеводороды, такие как бензол, толуол и ксилол, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, простые эфиры, такие как диэтиловый простой эфир, тетрагидрофуран, 1,4-диоксан и диметоксиэтан, N,N-диметилформамид (DMF), диметилсульфоксид (DMSO), этилацетат, ацетонитрил, воду и их смесь. Примеры конденсирующего агента включают, но не ограничиваясь этим, N-[3-(диметиламино)пропил]-N’-этилкарбодиимид гидрохлорид, дициклогексилкарбодиимид, 1,1’-карбонилбис-1H-имидазол, дифенилфосфорилазид, оксихлорид фосфора, O-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилуроний гексафторфосфат (HATU), (1-циано-2-этокси-2-оксоэтилиденаминокси)диметиламиноморфолинокарбений гексафторфосфат (COMU) и т.п. Предпочтительно в некоторых случаях для развития реакции использовать добавку, такую как 1H-бензотриазол-1-ол. Кроме того, предпочтительно в некоторых случаях для плавного развития реакции использовать органические основания, такие как триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, диметиламинопиридин и пиридин, или неорганические основания, такие как карбонат калия, карбонат натрия и гидроксид калия.
[0061]
Кроме того, соединения 2a и 2b коммерчески доступны, и их можно получать известным способом (например, Journal of Medicinal Chemistry, 2003, том 46, № 12, стр. 2446-2455; WO2006/083781; или тому подобное) или способом, эквивалентным ему, или способом, описанным в примерах получения, как описано далее.
[0062]
(Стадия 2)
Данная стадия представляет собой стадию получения соединения 2e посредством этерификации соединения 2c и соединения 2d.
На данной стадии можно использовать способ, эквивалентный стадии 1 синтеза исходного материала 1.
[0063]
Кроме того, соединение 2d можно получать известным способом (например, Tetrahedron Letters, 1993, том 34, № 21, стр. 3389-3392) или способом, эквивалентным ему.
[0064]
(Стадия 3)
Данная стадия представляет собой стадию получения соединения 2f, которое имеет депротектированную бензиловую группу, в случае, когда R4 в соединении 2e представляет собой бензиловую группу.
На данной стадии, соединение 2e перемешивают в растворителе, который инертен для реакции, в атмосфере водорода, в присутствии металлического катализатора, обычно в течение от 1 часа до 5 суток. Эту реакцию обычно осуществляют в диапазоне от охлаждения до нагрева, и предпочтительно при комнатной температуре. Примеры растворителя, используемого в настоящем документе, конкретно не ограничены, но включают спирты, такие как метанол, этанол и 2-пропанол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, 1,4-диоксан и диметоксиэтан, воду, этилацетат, N,N-диметилформамид, диметилсульфоксид, и их смесь. В качестве металлического катализатора соответственно используют палладиевые катализаторы, такие как палладированный уголь, палладированная чернь и гидроксид палладия, платиновые катализаторы, такие как оксид платины, никелевые катализаторы, такие как восстановленный никель и никель Ренея, или родиевые катализаторы, такие как трис(трифенилфосфин)хлорородий. Также возможно использовать муравьиную кислоту или формиат аммония в качестве источника водорода в эквивалентном количестве или избыточном количестве относительно количества соединения 2e.
[Документы]
M. Hudlicky, “Reductions in Organic Chemistry, 2nd edition (ACS Monograph: 188)”, ACS, 1996.
“Jikken Kagaku Koza (Courses in Experimental Chemistry) (5th edition)”, edited by The Chemical Society of Japan, Vol. 19 (2005) (Maruzen).
[0065]
Соединения формулы (I) можно выделять и очищать в виде их свободных соединений, солей, гидратов, сольватов или их полиморфных кристаллических веществ. Соли соединения формулы (I) можно получать посредством осуществления обработки в стандартной реакции образования соли.
Выделение и очистку осуществляют с использованием обычных химических операций, таких как экстрагирование, фракционная кристаллизация, фракционная хроматография различных типов и т.п.
Различные изомеры можно получать посредством выбора подходящего начального соединения или разделения, используя различия в физикохимических свойствах между изомерами. Например, оптические изомеры можно получать с использованием основного способа для оптического разделения рацемических продуктов (например, фракционная кристаллизация для получения диастереомерных солей с использованием оптически активных оснований или кислот, хроматография с использованием хиральной колонки или тому подобное, и другие), и, кроме того, изомеры также можно получать из подходящего оптически активного начального соединения.
[0066]
Фармакологическую активность соединения формулы (I) подтверждали с помощью тестов, приведенных далее.
1. Подтверждение ингибирующей трипсин активности у человека и мышей
В эксперименте использовали рекомбинантный трипсин человека (рч-трипсин; производства Wako Pure Chemical Industries, Ltd.), № по каталогу 206-17171) и трипсин мыши (м-трипсин; выделенный из содержимого тонкой кишки мыши авторами настоящего изобретения). Способ очистки м-трипсина от содержимого тонкой кишки мыши приведен ниже.
Содержимое тонкой кишки и желудочно-кишечный тракт, полученный от 10 мышей, гомогенизировали в забуференном фосфатом физиологическом растворе (PBS) с использованием Polytron, и подвергали центрифугированию несколько раз при 15000×g в течение 10 минут. Супернатант смешивали при 4°C в течение 16 часов с Benzamidine Sepharose 4 Fast Flow Resin (GE Healthcare: #17-5123-10). После промывания смолы в PBS, м-трипсин элюировали глицином в буфере (pH 3,0) для того, чтобы осуществлять очистку. В анализе вестерн-блоттинга подтверждали, что полученную очищенную фракцию распознавали как антитело против трипсина мыши (Santa Cruz Biotechnology, Inc.: sc-67388). Способ измерения ингибирующей трипсин активности приведен ниже.
Соединение растворяли в диметилсульфоксиде (DMSO) и разводили до произвольной концентрации (A). A 100-кратно разводили буфером (0,1 M Tris (pH 8,0), 0,15 M NaCl, 10 мМ CaCl2, 0,05% Brij35) (B). рч-трипсин разводили в буфере до 0,088 мкг/мл, и для м-трипсина, очищенную жидкую фракцию 50-кратно разводили буфером (C). Степень разведения м-трипсина задавали так, чтобы проявлять ту же активность, что 0,088 мкг/мл рч-трипсина, как определяют с помощью кинетического анализа. Раствор BZiPAR (Rhodamine Reference Substrate), который представляет собой субстрат для фермента трипсин, разводили в буфере до 5 мкмоль/L (D). 5 мкл B, 5 мкл C и 10 мкл D добавляли в 384-луночный планшет и инкубировали при комнатной температуре в течение 30 минут. Флуоресцентные сигналы обнаруживали при максимальном возбуждении (Ex)/длине волны флуоресценции (Em)=497 нм/520 нм с использованием Tecan Safire Fluorometer. Соединение изучали в концентрации 2500 нМ, 750 нМ, 250 нМ, 75 нМ, 25 нМ, 7,5 нМ, 2,5 нМ, 0,75 нМ, 0,25 нМ, 0,075 нМ, 0,025 нМ, и 0,0075 нМ, и вычисляли степень ингибирования каждого соединения, принимая ингибирование без добавления соединения (только DMSO) в присутствии фермента за 0% ингибирования и принимая ингибирование без добавления соединения в отсутствие фермента за 100% ингибирования. На основании полученных степеней ингибирования, ингибирующие трипсин активности (значения IC50, нМ) вычисляли по нелинейной регрессии.
[0067]
Результаты теста представлены в таблице 1. Пр в таблицах обозначает № примера, как указано далее (что следует применять далее в настоящем документе).
[0068]
[0069]
Соединение по настоящему изобретению демонстрировало хорошую ингибирующую трипсин активность.
[0070]
2. Тест на увеличение концентрации белка в фекалиях с использованием мышей
Для эксперимента использовали самцов мышей ICR в возрасте 6 недель. Эксперимент осуществляли в группах по пять мышей. После голодания мышей в течение 15 часов, контрольной группы принудительно перорально вводили 0,5% раствор метилцеллюлозы (MC) и группе тестирования лекарственного средства принудительно перорально вводили (5 мг/кг) раствор или суспензию, полученную посредством растворения или суспендирования соединения в 0,5% растворе MC. Голодание останавливали незамедлительно после этого, начинали свободное кормление (CE-2) и затем собирали фекалии от 3 часов после до 9 часов после и взвешивали. Все полученные фекалии суспендировали в 6 мл дистиллированной воды и центрифугировали при 1940×g в течение 10 минут. Концентрацию белка в полученном супернатанте измеряли способом Брэдфорда и количество белка в 1 г фекалий вычисляли посредством деления концентрации белка в фекалиях на общую массу фекалий. Кроме того, эффективность изучали по соотношению с контрольной группой. Для соединений, которые оценивали множество раз, вычисляли средние значения.
[0071]
Результаты активностей при увеличении белка фекалий, принимая значение для контрольной группы за 1, приведены в таблице 2.
[0072]
[0073]
Соединения, показанные выше в таблице, демонстрировали повышенное количество белка в диете, подлежащее выделению в непереваренном виде за счет ингибирующего активность трипсина действия и, таким образом, ингибирование захват белка биологическим организмом.
[0074]
3. Тестирование на модели вызванной доксорубицином (DXR) нефропатии на крысах, у которых удалена одна почка (редуцированная модель почечной функции)
У самцов крыс Wistar в возрасте 10 недель осуществляли удаление левой почки, и через одну неделю крысам вводили DXR (5 мг/кг) через хвостовую вену для того, чтобы получать модель нефропатии. Эксперимент осуществляли в группах по десять крыс. Во время периода введения соединения крыс кормили диетой только днем, а ночью не кормили. Тестируемое соединение (10 мг/кг) суспендировали в 0,5% растворе метилцеллюлозы (MC) с дня после получения модели и принудительно перорально вводили два раза (утром и ночью) ежедневно. В каждой из группы плацебо (нормальной) и контрольной группы принудительно перорально вводили 0,5% MC. На 1, 2 и 3 неделе после начала введения тестируемого соединения выполняли сбор мочи за 24 часа для того, чтобы измерять количество экскреции белка в моче. Кровь брали после окончания сбора мочи на неделе 3 и измеряли концентрацию креатинина в плазме.
[0075]
В результате описанного выше теста, например, соединение из примера 2 значительно снижало количество экскреции белка в моче по сравнению с контрольной группой, и степень ингибирования на неделе 3 составляла приблизительно 42%. Кроме того, данное соединение значительно снижало концентрацию креатинина в плазме, и степень ингибирования на неделе 3 составляла приблизительно 42%.
По результатам данного теста подтверждено, что соединения демонстрировали эффекты снижения экскреции белка в моче и концентрации креатинина в плазме и таким, образом, ингибировали прогрессирование нефропатии.
[0076]
По приведенному выше тесту подтверждали хорошую ингибирующую активность трипсина и ингибирующих эффектов для всасывания белка на основании ингибирования протеолитических ферментов. Кроме того, подтверждено, что, например, соединение из примера 2 обладало эффектом снижения количества экскреции белка и концентрации креатинина в плазме в модели с нефропатией, которая демонстрирует сниженную почечную функцию. Следовательно, соединение формулы (I) можно использовать в качестве средства для предотвращения и/или лечения связанных с трипсином заболеваний (например, хронический панкреатит, заболевание гастроэзофагеальный рефлюкс, печеночная энцефалопатия, грипп и т.п.) и заболеваний почек (например, хроническая почечная недостаточность, острый гломерулонефрит, острое повреждение почек и т.п.), которое будет действовать в качестве средства, которое будет заменять низкобелковую диету.
[0077]
Фармацевтическую композицию, которая содержит один или два или более типов соединения формулы (I) или его соли в качестве активного ингредиента, можно получать с использованием эксципиентов, которые обычно используют в данной области, то есть эксципиентов для фармацевтических препаратов, носителей для фармацевтических препаратов и т.п. в соответствии со способами, которые обычно используют.
Введение можно или посредством перорального введения через таблетки, пилюли, капсулы, гранулы, порошки, растворы и т.п. или парентеральное введение, такое как инъекции, такие как внутрисуставные, внутривенные и внутримышечные инъекции, суппозитории, глазные растворы, глазные мази, трансдермальные жидкие препараты, мази, трансдермальные пластыри, чресслизистые жидкие препараты, чресслизистые пластыри, ингаляторы и т.п.
[0078]
Твердую композицию для использования при пероральном введении используют в форме таблеток, порошков, гранул или тому подобного. В такой твердой композиции один или несколько активных ингредиентов смешивают по меньшей мере с одним неактивным эксципиентом. В стандартном способе композиция может содержать неактивные добавки, такие как смазывающее средство, средство для улучшения распадаемости, стабилизатор или средство, способствующее солюбилизации. В случае необходимости, таблетки или пилюли можно покрывать сахаром или пленкой из желудочного или энтеросолюбильного покрывающего вещества.
Жидкая композиция для перорального введения содержит фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы, настои или тому подобное, а также содержит обычно используемые инертные разбавители, например, очищенную воду или этанол. В дополнение к инертному разбавителю жидкая композиция также может содержать вспомогательные средства, такие как средство, способствующее солюбилизации, увлажняющее средство и суспендирующее средство, подсластители, ароматизаторы, ароматические средства или антисептики.
[0079]
Инъекции для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Водный растворитель включает, например, дистиллированную воду для инъекций и физиологический раствор. Примеры неводного растворителя включают спирты, такие как этанол. Такая композиция дополнительно может содержать регулирующее тоничность средство, антисептик, увлажняющее средство, эмульгирующее средство, диспергирующее средство, стабилизатор или средство, способствующее солюбилизации. Их стерилизуют, например, посредством фильтрования через задерживающий бактерии фильтр, посредством бактерицидного средства, которое примешивают, или посредством облучения. Кроме того, их также можно использовать посредством получения стерильной твердой композиции и растворения или суспендирования в стерильной воде или стерильном растворителе для инъекции перед ее использованием.
[0080]
Средство для наружного применения включает мази, пластыри, кремы, желе, припарки, спреи, лосьоны, глазные капли, глазные мази и т.п. Средства содержат обычно используемые основы для мазей, основы для лосьонов, водные или неводные жидкие препараты, суспензии, эмульсии и т.п.
[0081]
В качестве чресслизистых средств, таких как ингалятор, трансназальное средство и т.п., используют средства в форме твердого, жидкого или полутвердого состояния, и их можно получать в соответствии со стандартными известными способами. Например, известный эксципиент, в также корректирующее pH средство, антисептик, поверхностно-активное вещество, смазывающее средство, стабилизатор, загуститель или тому подобное можно добавлять в них надлежащим образом. Для их введения можно использовать подходящее устройство для ингаляции или вдувания. Например, соединение можно вводить отдельно или в виде порошковой формулированной смеси или в виде раствора или суспензии в комбинации с фармацевтически приемлемым носителем, используя известное устройство или распылитель, такой как ингаляционное устройство с отмеренным введением и т.п. Ингалятор сухого порошка или тому подобное можно использовать для однократного или многократного введения и можно использовать сухой порошок или содержащие порошок капсулы. Альтернативно, оно может быть в такой форме, как аэрозольный спрей под давлением, в котором используют подходящее выталкивающее средство, например, подходящий газ, такой как хлорфторалкан, диоксид углерода и т.п.
[0082]
При пероральном введении суточная доза надлежащим образом составляет приблизительно от 0,001 до 100 мг/кг, предпочтительно от 0,1 до 30 мг/кг и более предпочтительно от 0,1 до 10 мг/кг, в пересчете на массу тела, которую вводят одной частью или 2-4 отдельными частям. В случае внутривенного введения вводят суточную дозу, соответственно, приблизительно от 0,0001 до 10 мг/кг массы тела, один раз в сутки или два или более раз в сутки. Кроме того, чресслизистое средство вводят в дозе приблизительно от 0,001 до 100 мг/кг массы тела, раз в сутки или два или более раз в сутки. Решение о дозе надлежащим образом принимают в соответствии с отдельным случаем, учитывая симптомы, возраст и пол и т.п.
[0083]
Несмотря на варьирование в зависимости от пути введения, дозированные формы, места введения или типы эксципиентов и добавок, фармацевтическая композиция по настоящему изобретению содержит от 0,01 до 100% по массе и в определенном варианте осуществления от 0,01 до 50% по массе одного или нескольких типов соединения формулы (I) или его соли, которое является активным ингредиентом.
[0084]
Соединение формулы (I) или его соль можно использовать в комбинации с различными средствами для лечения или предотвращения заболеваний, для которых соединение формулы (I) или его считают эффективными, как описано выше. Комбинированный препарат можно вводить одновременно или отдельно и непрерывно или в желаемом временном интервале. Препараты, подлежащие введению одновременно, могут представлять собой смесь, или их можно получать индивидуально.
Примеры
[0085]
Ниже в настоящем документе более подробно описаны способы получения соединения формулы (I) или его соли со ссылкой на примеры, но настоящее изобретение не ограничено соединениями, описанными в примерах, как описано ниже. Кроме того, процессы получения начальных соединений описаны в примерах получения. Кроме того, способы получения соединения формулы (I) не ограничены способами получения конкретных примеров, как далее, но соединение формулы (I) можно получать посредством какой-либо комбинации способов получения или способов, которые очевидны специалисту в данной области.
[0086]
Кроме того, следующие сокращения можно использовать далее в некоторых случаях в примерах, примерах получения и таблицах.
[0087]
ПрП: пример получения № (соединения, которые в химических и структурных формулах помечены «*», обозначающей, что соединения представляют собой отдельные изомеры, которые имеют стерические конфигурации обозначенных структур; соединения, которые в химических и структурных формулах помечены «**», обозначающей, что соединения представляют собой отдельные изомеры, но не имеют определенной стерической конфигурации; и соединения, которые в химических и структурных формулах помечены «#», обозначающей диастереомерную смесь), Пр: пример № (соединения, которые в химических и структурных формулах помечены «*», обозначающей что соединения представляют собой отдельные изомеры, которые имеют стерические конфигурации обозначенных структур; соединения, которые в химических и структурных формулах помечены «**», обозначающей что соединения представляют собой отдельные изомеры, но не имеют определенной стерической конфигурации; и соединения, которые в химических и структурных формулах помечены «#», обозначающей диастереомерную смесь), ПрСин: пример получения №, полученный тем же способом, Син: пример №, полученный тем же способом, Стр: химическая структурная формула (Me: метил,tBu: трет-бутил, Ph: фенил, Boc: трет-бутоксикарбонил, Bn: бензил, OMe: -O-метил, OBn: -O-бензил, OtBu: -O-трет-бутил и NBoc: -N-трет-бутоксикарбонил), Данные: физикохимические данные, ESI+: m/z значения в масс-спектроскопии (ионизация ESI, представление (M+H)+, если не указано иное), ESI-: m/z значения (ионизация ESI, представление (M-H)-, если не указано иное), APCI+: m/z значения (химическая ионизация при атмосферном давлении APCI, представление (M+H)+, если не указано иное), APCI/ESI+: APCI/ESI-MS[M+H]+ (APCI/ESI обозначает одновременное измерение APCI и ESI), ЯМР1: характеристическая δ (м.д.) в1H ЯМР в диметилсульфоксиде-d6, ЯМР2: характеристическая δ (м. д.) в1H ЯМР в CDCl3, «M» в примерах получения и примерах: моль/л, и RT: время удержания в сверхкритической хроматографии или жидкостной хроматографии, в единицах «минуты» (мин).
[0088]
Кроме того, в структурных формулах HCl представляет гидрохлорид, а TFA представляет трифторацетат.
[0089]
Пример получения 1
Смесь трет-бутил 4-метилтиофен-2-карбоксилата (12,0 г), N-бромсукцинимида (10,8 г), 2,2’-азобис(изобутиронитрила) (496 мг) и тетрахлорида углерода (119 мл) перемешивали при 90°C в течение 1 часа. Кроме того, туда добавляли N-бромсукцинимид (1,08 г) и смесь перемешивали при 90°C в течение 1 часа. Реакционную суспензию охлаждали до комнатной температуры, затем нерастворимый материал отделяли посредством фильтрования и фильтрат концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии на силикагеле (гексанэтилацетат) для получения трет-бутил 4-(бромметил)тиофен-2-карбоксилата (16,3 г).
В раствор трет-бутил 4-(бромметил)тиофен-2-карбоксилата (9,90 г) в N,N-диметилформамиде (100 мл) добавляли трет-бутилглицината гидрохлорид (18,0 г) и триэтиламин (19,9 мл), после чего следовало перемешивание при 60°C в течение 15 часов. Реакционную суспензию охлаждали до комнатной температуры и затем в нее добавляли триацетоксиборогидрид натрия (22,7 г), после чего следовало перемешивание при комнатной температуре в течение 5 часов. В реакционную суспензию добавляли воду и водный раствор гидрокарбоната натрия, после чего следовало экстрагирование этилацетатом. Органический слой промывали 5% водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 4-{[(2-трет-бутокси-2-оксоэтил)амино]метил}тиофен-2-карбоксилата (5,67 г).
[0090]
Пример получения 2
В раствор 6-гидрокси-2-нафтойной кислоты (220 мг) в N,N-диметилформамиде (3,30 мл) добавляли трет-бутил 4-{[(2-трет-бутокси-2-оксоэтил)амино]метил}тиофен-2-карбоксилат (383 мг), O-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилурония гексафторфосфат (489 мг) и N,N-диизопропилэтиламин (500 мкл), после чего следовало перемешивание при комнатной температуре в течение 20 часов. Кроме того, в него добавляли O-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилурония гексафторфосфат (222 мг) и N,N-диизопропилэтиламин (200 мкл), после чего следовало перемешивание при комнатной температуре в течение 6 часов. В реакционный раствор добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой промывали водой и насыщенным водным раствором хлорида натрия в этом порядке, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 4-{[(2-трет-бутокси-2-оксоэтил)(6-гидрокси-2-нафтоил)амино]метил}тиофен-2-карбоксилата (277 мг).
[0091]
Пример получения 3
В раствор 4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензойной кислоты (194 мг) в дихлорметане (7,29 мл) добавляли N-[3-(диметиламино)пропил]-N’-этилкарбодиимида гидрохлорид (118 мг), трет-бутил 4-{[(2-трет-бутокси-2-оксоэтил)(6-гидрокси-2-нафтоил)амино]метил}тиофен-2-карбоксилат (255 мг), и 4-диметиламинопиридин (18,8 мг), после чего следовало перемешивание при комнатной температуре в течение 24 часов. В реакционную жидкость добавляли воду, после чего следовало экстрагирование хлороформом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 4-({[6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-2-нафтоил](2-трет-бутокси-2-оксоэтил)амино}метил)тиофен-2-карбоксилата (137 мг).
[0092]
Пример получения 4
В раствор 6-метокси-1-бензотиофен-2-карбоновой кислоты (960 мг) в дихлорметане (5,76 мл) добавляли по каплям 1 M раствор (37,5 мл) трехбромистого бора в дихлорметане в течение 10 минут при охлаждении льдом, после чего следовало перемешивание при комнатной температуре в течение 3 часов. Реакционную жидкость добавляли по каплям в лед, после чего следовало перемешивание. Осадок собирали посредством фильтрования и сушили при пониженном давлении для получения 6-гидрокси-1-бензотиофен-2-карбоновой кислоты (920 мг).
[0093]
Пример получения 5
В раствор 2-трет-бутил 3,7-диметил (3R)-3,4-дигидроизохинолин-2,3,7(1H)-трикарбоксилата (345 мг) в метаноле (7,00 мл) добавляли 1 M водный раствор гидроксида натрия (3,50 мл), после чего следовало перемешивание при комнатной температуре в течение 3 часов. Смесь нейтрализовали посредством добавления 1 M соляной кислоты (3,50 мл), и затем в нее добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении для получения (3R)-2-(трет-бутоксикарбонил)-1,2,3,4-тетрагидроизохинолин-3,7-дикарбоновой кислоты (328 мг).
[0094]
Пример получения 6
В раствор (6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил)уксусной кислоты (1,03 г) в N,N-диметилформамиде (20,5 мл) добавляли трет-бутил 3-{[(2-трет-бутокси-2-оксоэтил)амино]метил}бензоата гидрохлорид (1,96 г), триэтиламин (762 мкл), N-[3-(диметиламино)пропил]-N’-этилкарбодиимида гидрохлорид (1,00 г) и 1H-бензотриазол-1-ол (705 мг), после чего следовало перемешивание при комнатной температуре в течение 13 часов. В реакционную смесь добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 3-({(2-трет-бутокси-2-оксоэтил)[(6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил)ацетил]амино}метил)бензоата (2,41 г).
[0095]
Пример получения 7
В атмосфере азота в раствор трет-бутил 3-(хлорметил)бензоата (29,1 г) в N,N-диметилформамиде (300 мл) добавляли трет-бутилглицината гидрохлорид (43,0 г) и триэтиламин (71,6 мл), после чего следовало перемешивание при от 60°C до 63°C в течение 3 часов. Реакционную смесь охлаждали льдом и затем в нее добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой последовательно промывали 10% водным раствором хлорида аммония и 20% водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток растворяли в этилацетате (400 мл) и затем в него по каплям добавляли 4 M раствор (32,1 мл) хлорида водорода в этилацетате при охлаждении льдом в атмосфере азота, после чего следовало перемешивание в течение 1 часа. Осадок собирали посредством фильтрования, промывали этилацетатом и затем сушили при 50°C и пониженном давлении для получения трет-бутил 3-{[(2-трет-бутокси-2-оксоэтил)амино]метил}бензоата гидрохлорида (28,5 г).
[0096]
Пример получения 8
Смесь этил (6-метокси-1,2,3,4-тетрагидронафтален-1-ил)ацетата (2,08 г) и 48% бромистоводородной кислоты (40,0 мл) перемешивали при 120°C в течение 17 часов. Реакционную смесь оставляли для охлаждения и затем концентрировали при пониженном давлении. В остаток добавляли тетрагидрофуран (100 мл), после чего следовало перемешивание при комнатной температуре в течение 1 часа, и затем осадок собирали посредством фильтрования. Фильтрат концентрировали при пониженном давлении, и затем остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат). В очищенный продукт добавляли диизопропиловый эфир (15,0 мл), после чего следовало перемешивание при комнатной температуре в течение 1 часа. Осадок собирали посредством фильтрования, промывали диизопропиловым эфиром и затем сушили при комнатной температуре и пониженном давлении для получения (6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил)уксусной кислоты (1,06 г).
[0097]
Пример получения 9
В раствор 4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензойной кислоты (1,97 г) в дихлорметане (48,0 мл) добавляли трет-бутил 3-({(2-трет-бутокси-2-оксоэтил)[(6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил)ацетил]амино}метил)бензоат (2,40 г), N-[3-(диметиламино)пропил]-N’-этилкарбодиимида гидрохлорид (1,17 г) и 4-диметиламинопиридин (173 мг), после чего следовало перемешивание при комнатной температуре в течение 2 часов. Кроме того, в него добавляли 4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензойную кислоту (179 мг) и N-[3-(диметиламино)пропил]-N’-этилкарбодиимида гидрохлорид (100 мг), после чего следовало перемешивание при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 3-{[{[6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}(2-трет-бутокси-2-оксоэтил)амино]метил}бензоата (3,71 г).
[0098]
Пример получения 10
В раствор трет-бутил N-[(бензилокси)карбонил]-4-(трет-бутоксикарбонил)-L-фенилаланината (570 мг) в тетрагидрофуране (3,00 мл) и этанол (3,00 мл) добавляли 10% палладированный уголь (138 мг, 50% влажный продукт) в атмосфере аргона, после чего следовало перемешивание при комнатной температуре в течение ночи при нормальном давлении в атмосфере водорода. Реакционную суспензию фильтровали посредством пропускания ее через слой Celite (зарегистрированный товарный знак) и затем фильтрат концентрировали при пониженном давлении для получения трет-бутил 4-(трет-бутоксикарбонил)-L-фенилаланината (431 мг).
[0099]
Пример получения 11
Смесь 3-[(бензил{[6-(бензилокси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}амино)метил]пентандиоевой кислоты (886 мг), N,N-диметилформамид ди-трет-бутилацеталя (1,60 мл) и толуола (4,43 мл) перемешивали при 80°C в течение 4 часов. В реакционную смесь добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения ди-трет-бутил 3-[(бензил{[6-(бензилокси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}амино)метил]пентандиоата (232 мг).
[0100]
Пример получения 12
В 3,7-дибензил 2-трет-бутил (3R)-3,4-дигидроизохинолин-2,3,7(1H)-трикарбоксилат (413 мг) добавляли 4 M раствор (4,00 мл) хлорида водорода в 1,4-диоксане, после чего следовало перемешивание при комнатной температуре в течение ночи. Реакционную суспензию концентрировали при пониженном давлении и остаток сушили при пониженном давлении для получения дибензил (3R)-1,2,3,4-тетрагидроизохинолин-3,7-дикарбоксилата гидрохлорида (358 мг).
[0101]
Пример получения 13
В раствор 6-гидрокси-1-бензотиофен-3-карбоновой кислоты (100 мг), трет-бутил 4-{[(2-трет-бутокси-2-оксоэтил)амино]метил}тиофен-2-карбоксилата (186 мг) и N,N-диизопропилэтиламина (88,2 мкл) в N,N-диметилформамиде (3,00 мл) добавляли (1-циано-2-этокси-2-оксоэтилиденаминокси)диметиламиноморфолинокарбения гексафторфосфат (243 мг), после чего следовало перемешивание при комнатной температуре в течение 16 часов. Реакционную смесь разводили этилацетатом и органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 4-({(2-трет-бутокси-2-оксоэтил)[(6-гидрокси-1-бензотиофен-3-ил)карбонил]амино}метил)тиофен-2-карбоксилата (230 мг).
[0102]
Пример получения 14
В раствор трет-бутил [4-(аминометил)фенил]ацетата (1,00 г) в ацетонитриле (15,0 мл) добавляли триэтиламин (693 мкл) и трет-бутилбромацетата (668 мкл), после чего следовало перемешивание при комнатной температуре в течение 4 часов. Реакционную жидкость концентрировали при пониженном давлении и затем в нее добавляли этилацетат. Органический слой последовательно промывали 0,1 M соляной кислотой, водным насыщенным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил N-[4-(2-трет-бутокси-2-оксоэтил)бензил]глицината (747 мг).
[0103]
Пример получения 15
В раствор 6-гидрокси-1-нафтойной кислоты (190 мг) в N,N-диметилформамиде (2,85 мл) добавляли трет-бутил 4-({[(2R)-1-трет-бутокси-1-оксопропан-2-ил]амино}метил)тиофен-2-карбоксилат (345 мг), O-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилурония гексафторфосфат (422 мг) и N,N-диизопропилэтиламин (190 мкл), после чего следовало перемешивание при 50°C в течение 19 часов. В реакционный раствор добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 4-({[(2R)-1-трет-бутокси-1-оксопропан-2-ил](6-гидрокси-1-нафтоил)амино}метил)тиофен-2-карбоксилата (101 мг).
[0104]
Пример получения 16
В раствор N-[(бензилокси)карбонил]-4-(трет-бутоксикарбонил)-L-фенилаланина (500 мг) в тетрагидрофуране (4,00 мл) и трет-бутилового спирта (4,00 мл) добавляли сложный эфир ди-трет-бутилдикарбоната (656 мг) и 4-диметиламинопиридин (30,6 мг), после чего следовало перемешивание при комнатной температуре в течение ночи. В реакционный раствор добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой последовательно промывали водой, водным насыщенным раствором гидрокарбоната натрия и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении для получения трет-бутил N-[(бензилокси)карбонил]-4-(трет-бутоксикарбонил)-L-фенилаланината (641 мг).
[0105]
Пример получения 17
В раствор (6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил)уксусной кислоты (150 мг), трет-бутил N-(2-трет-бутокси-2-оксоэтил)-L-фенилаланината (293 мг) и N,N-диизопропилэтиламина (147 мкл) в N,N-диметилформамиде (4,50 мл) добавляли (1-циано-2-этокси-2-оксоэтилиденаминокси)диметиламиноморфолинокарбения гексафторфосфат (368 мг), после чего следовало перемешивание при 60°C в течение 8 часов. Реакционную смесь разводили этилацетатом и органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил N-(2-трет-бутокси-2-оксоэтил)-N-[(6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил)ацетил]-L-фенилаланината (347 мг).
[0106]
Пример получения 18
В раствор 5-метил-1-бензотиофен-2-карбоновой кислоты (1,50 г) в N,N-диметилформамиде (10,5 мл) добавляли 1,1’-карбонилбис-1H-имидазол (1,27 г), после чего следовало перемешивание при комнатной температуре в течение 2 часов и 30 минут. В реакционную смесь добавляли трет-бутиловый спирт (1,44 мл) и 1,8-диазабицикло[5.4.0]ундец-7-ен (1,17 мл), после чего следовало перемешивание при 50°C в течение 24 часов. Реакционную смесь разводили этилацетатом и затем органический слой последовательно промывали 0,1 M соляной кислотой и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 5-метил-1-бензотиофен-2-карбоксилата (1,78 г).
[0107]
Пример получения 19
В смесь трет-бутил 5-метил-1-бензотиофен-2-карбоксилата (1,77 г), тетрахлорида углерода (17,7 мл) и N-бромсукцинимида (2,16 г) добавляли 2,2’-азобис(изобутиронитрил) (58,5 мг), после чего следовало перемешивание при 90°C в течение ночи. Реакционную суспензию фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексанэтилацетат) для получения трет-бутил 5-(бромметил)-1-бензотиофен-2-карбоксилата (1,51 г).
[0108]
Пример получения 20
В раствор трет-бутил 5-(бромметил)-1-бензотиофен-2-карбоксилата (1,00 г) в N,N-диметилформамиде (10,0 мл) добавляли трет-бутилглицината гидрохлорид (1,02 г) и триэтиламин (1,70 мл), после чего следовало перемешивание при от 85°C до 95°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, после чего следовало экстрагирование этилацетатом. Органический слой промывали 25% водным раствором хлорида аммония, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 5-{[(2-трет-бутокси-2-оксоэтил)амино]метил}-1-бензотиофен-2-карбоксилата (359 мг).
[0109]
Пример получения 21
В раствор 2-трет-бутил 3-метил (3R)-7-гидрокси-3,4-дигидроизохинолин-2,3(1H)-дикарбоксилата (1,00 г) в дихлорметане (20,0 мл) добавляли ангидрид трифторметансульфоновой кислоты (770 мкл) и 2,6-диметилпиридин (800 мкл) при охлаждении льдом, после чего следовало перемешивание в течение 2 часов при охлаждении льдом. В реакционную смесь добавляли воду, после чего следовало экстрагирование хлороформом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. В остаток добавляли N,N-диметилформамид (15,0 мл), метанол (3,00 мл), ацетат палладия (II) (37,0 мг), 1,1’-бис(дифенилфосфино)ферроцен (90,0 мг) и триэтиламин (1,10 мл), после чего следовало перемешивание при 80°C в течение ночи в атмосфере монооксида углерода. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. В остаток добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения 2-трет-бутил 3,7-диметил (3R)-3,4-дигидроизохинолин-2,3,7(1H)-трикарбоксилата (350 мг).
[0110]
Пример получения 22
В раствор (3R)-2-(трет-бутоксикарбонил)-1,2,3,4-тетрагидроизохинолин-3,7-дикарбоновой кислоты (320 мг) в N,N-диметилформамиде (6,00 мл) добавляли карбонат калия (315 мг) и бензилбромид (275 мкл), после чего следовало перемешивание при комнатной температуре в течение ночи. В реакционную суспензию добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения 3,7-дибензил 2-трет-бутил (3R)-3,4-дигидроизохинолин-2,3,7(1H)-трикарбоксилата (415 мг).
[0111]
Пример получения 23
В раствор 2-бром-1,3,5-триметилбензола (925 мкл) в тетрагидрофуране (20,0 мл) добавляли по каплям 1,59 M раствор (3,86 мл) н-бутиллития в гексане при -78°C, после чего следовало перемешивание при -78°C в течение 30 минут. В реакционную смесь добавляли по каплям раствор трет-бутил (4-бром-2-тиенил)ацетата (1,55 г) в тетрагидрофуране (15,0 мл), после чего следовало перемешивание при -78°C в течение 30 минут. Впоследствии, в реакционную смесь добавляли по каплям 1,59 M раствор (3,51 мл) н-бутиллития в гексане, после чего следовало перемешивание при -78°C в течение 30 минут. В реакционную смесь добавляли по каплям N,N-диметилформамид (451 мкл), после чего следовало перемешивание при 78°C в течение 1 часа. В реакционную жидкость добавляли водный раствор хлорида аммония и этилацетат, тем самым экстрагируя органический слой. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил (4-формил-2-тиенил)ацетата (355 мг).
[0112]
Пример получения 24
В раствор трет-бутил (4-формил-2-тиенил)ацетата (350 мг), трет-бутилглицината (243 мг) и уксусной кислоты (265 мкл) в дихлорметане (4,05 мл) добавляли триацетоксиборогидрид натрия (656 мг) при охлаждении льдом, после чего следовало перемешивание при комнатной температуре в течение 3 часов. Реакционную смесь нейтрализовали посредством добавления водного насыщенного раствора гидрокарбоната натрия и затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил N-{[5-(2-трет-бутокси-2-оксоэтил)-3-тиенил]метил}глицината (237 мг).
[0113]
Пример получения 25
Смесь трет-бутил [3-(аминометил)фенил]ацетата (1,00 г), трет-бутил бромацетата (700 мкл), карбоната калия (650 мг) и ацетонитрила (20,0 мл) перемешивали при комнатной температуре в течение ночи. В реакционную смесь добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил N-[3-(2-трет-бутокси-2-оксоэтил)бензил]глицината (1,14 г).
[0114]
Пример получения 26
В смесь N-бензил-N-(циклопента-3-ен-1-илметил)-2-(6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил)ацетамида (430 мг), карбоната калия (174 мг) и N,N-диметилформамида (4,30 мл) добавляли бензилбромид (177 мкл), после чего следовало перемешивание при 50°C в течение 6 часов. Реакционную смесь охлаждали и в нее добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения N-бензил-2-[6-(бензилокси)-1,2,3,4-тетрагидронафтален-1-ил]-N-(циклопента-3-ен-1-илметил)ацетамид (416 мг).
[0115]
Пример получения 27
В смесь N-бензил-2-[6-(бензилокси)-1,2,3,4-тетрагидронафтален-1-ил]-N-(циклопента-3-ен-1-илметил)ацетамида (100 мг), трет-бутилового спирта (2,40 мл) и воды (600 мкл) добавляли 2,5% раствор (269 мкл) тетраоксида осмия в трет-бутиловом спирте и 4-метилморфолин 4-оксид (75,5 мг), после чего следовало перемешивание при комнатной температуре в течение 2 часов. В реакционную смесь добавляли водный раствор тиосульфата натрия, после чего следовало экстрагирование этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении для получения N-бензил-2-[6-(бензилокси)-1,2,3,4-тетрагидронафтален-1-ил]-N-[(3,4-дигидроксициклопентил)метил]ацетамида (107 мг).
[0116]
Пример получения 28
В смесь N-бензил-2-[6-(бензилокси)-1,2,3,4-тетрагидронафтален-1-ил]-N-[(3,4-дигидроксициклопентил)метил]ацетамида (106 мг), йодобензол диацетата (322 мг), дихлорметана (3,00 мл) и воды (1,00 мл) добавляли 1-метил-2-азаадамантан-N-оксил (3,33 мг), после чего следовало перемешивание при комнатной температуре в течение 3 часов. В реакционную смесь добавляли 20% водный раствор тиосульфата натрия, после чего следовало перемешивание при комнатной температуре в течение 5 минут. Впоследствии в нее добавляли 1 M соляную кислоту, после чего следовало экстрагирование этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении для получения 3-[(бензил{[6-(бензилокси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}амино)метил]пентандиоевой кислоты (110 мг).
[0117]
Пример получения 29
В смесь (1S)-1-фенилэтанаминной соли (370 мг) [(1R)-6-метокси-1,2,3,4-тетрагидронафтален-1-ил]уксусной кислоты или ее энантиомера и этилацетата (4,50 мл) добавляли 3 M соляную кислоту (4,50 мл), после чего следовало перемешивание при комнатной температуре в течение 2 часов. Реакционную смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении для получения [(1R)-6-метокси-1,2,3,4-тетрагидронафтален-1-ил]уксусной кислоты или ее энантиомера (243 мг).
[0118]
Пример получения 30
В смесь (1R)-1-фенилэтанаминной соли (450 мг) [(1R)-6-метокси-1,2,3,4-тетрагидронафтален-1-ил]уксусной кислоты или ее энантиомера и этилацетата (5,51 мл) добавляли 4 M раствор (4,13 мл) хлорида водорода в этилацетате, после чего следовало перемешивание при комнатной температуре в течение 2 часов. В реакционную смесь добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении для получения [(1R)-6-метокси-1,2,3,4-тетрагидронафтален-1-ил]уксусной кислоты или ее энантиомера (290 мг).
[0119]
Пример получения 31
В раствор [(1R)-6-метокси-1,2,3,4-тетрагидронафтален-1-ил]уксусной кислоты или ее энантиомера (238 мг), полученных в примере получения 29, в дихлорметане (8,00 мл) добавляли 1 M раствор (2,20 мл) трехбромистого бора в дихлорметане при охлаждении льдом, после чего следовало перемешивание при комнатной температуре в течение 2 часов. В реакционную смесь добавляли воду со льдом, после чего следовало экстрагирование этилацетатом. Органический слой промывали водой, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении для получения [(1R)-6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил]уксусной кислоты или ее энантиомера (147 мг).
[0120]
Пример получения 32
В раствор [(1R)-6-метокси-1,2,3,4-тетрагидронафтален-1-ил]уксусной кислоты или ее энантиомера (288 мг), полученных в примере получения 30, в дихлорметане (9,77 мл) добавляли по каплям 1 M раствор (2,66 мл) трехбромистого бора в дихлорметане при охлаждении льдом, после чего следовало перемешивание при комнатной температуре в течение 2 часов. В реакционную смесь добавляли воду со льдом, после чего следовало экстрагирование этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения [(1R)-6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил]уксусной кислоты или ее энантиомера (230 мг).
[0121]
Пример получения 33
В раствор [(1R)-6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил]уксусной кислоты или ее энантиомера (145 мг), полученных в примере получения 31, в N,N-диметилформамиде (2,90 мл) добавляли трет-бутил 4-({[(2R)-1-трет-бутокси-1-оксопропан-2-ил]амино}метил)тиофен-2-карбоксилат (255 мг), O-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилурония гексафторфосфат (295 мг) и N,N-диизопропилэтиламин (135 мкл), после чего следовало перемешивание при комнатной температуре в течение ночи. В реакционный раствор добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой промывали водой, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 4-[([(2R)-1-трет-бутокси-1-оксопропан-2-ил]{[(1R)-6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил]ацетил}амино)метил]тиофен-2-карбоксилата или эпимера в положении 1 в 1,2,3,4-тетрагидронафтален (237 мг).
[0122]
Пример получения 34
В раствор трет-бутил 4-[([(2R)-1-трет-бутокси-1-оксопропан-2-ил]{[(1R)-6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил]ацетил}амино)метил]тиофен-2-карбоксилата или эпимера в положении 1 в 1,2,3,4-тетрагидронафтален (235 мг), полученных в примере получения 33, в дихлорметане (3,00 мл) добавляли N-[3-(диметиламино)пропил]-N’-этилкарбодиимида гидрохлорид (115 мг), 4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензойную кислоту (220 мг) и 4-диметиламинопиридин (18,0 мг), после чего следовало перемешивание при комнатной температуре в течение 3 часов. В реакционный раствор добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой промывали водой, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 4-[({[(1R)-6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}[(2R)-1-трет-бутокси-1-оксопропан-2-ил]амино)метил]тиофен-2-карбоксилата или эпимера в положении 1 в 1,2,3,4-тетрагидронафтален (325 мг).
[0123]
Пример получения 35
В раствор [(1R)-6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил]уксусной кислоты или ее энантиомера (228 мг), полученных в примере получения 32, в N,N-диметилформамиде (4,56 мл) добавляли O-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилурония гексафторфосфат (504 мг), N,N-диизопропилэтиламин (227 мкл) и трет-бутил 4-({[(2R)-1-трет-бутокси-1-оксопропан-2-ил]амино}метил)тиофен-2-карбоксилат (453 мг), после чего следовало перемешивание при комнатной температуре в течение ночи. Реакционный раствор разводили этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 4-[([(2R)-1-трет-бутокси-1-оксопропан-2-ил]{[(1R)-6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил]ацетил}амино)метил]тиофен-2-карбоксилата или эпимера в положении 1 1,2,3,4-тетрагидронафталена (330 мг).
[0124]
Пример получения 36
В смесь трет-бутил 4-[([(2R)-1-трет-бутокси-1-оксопропан-2-ил]{[(1R)-6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил]ацетил}амино)метил]тиофен-2-карбоксилата или эпимера в положении 1 в 1,2,3,4-тетрагидронафтален (328 мг), полученных в примере получения 35, 4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензойной кислоты (282 мг), 4-диметиламинопиридина (22,7 мг) и дихлорметана (4,92 мл) добавляли N-[3-(диметиламино)пропил]-N’-этилкарбодиимида гидрохлорид (154 мг), после чего следовало перемешивание при комнатной температуре в течение 4 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 4-[({[(1R)-6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}[(2R)-1-трет-бутокси-1-оксопропан-2-ил]амино)метил]тиофен-2-карбоксилата или эпимера в положении 1 в 1,2,3,4-тетрагидронафтален (460 мг).
[0125]
Пример получения 37
Проводили препаративную очистку трет-бутил 3-{[{[6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}(2-трет-бутокси-2-оксоэтил)амино]метил}бензоата (395 мг) способом сверхкритической хроматографии (диоксид углерода-метанол) с помощью УФ триггера и затем концентрировали при пониженном давлении для получения ПрП. 37-1 (188 мг, RT: 4,02 мин) и ПрП. 37-2 (187 мг, RT: 4,87 мин) в виде трет-бутил 3-{[{[(1R)-6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}(2-трет-бутокси-2-оксоэтил)амино]метил}бензоата и его энантиомера. Кроме того, условия анализа для способа сверхкритической хроматографии, который осуществляли для того, чтобы определять RT, приведены ниже.
Колонка: CHIRALCEL OZ-H/SFC 4,6 мм I.D. × 250 мм (диаметр частиц: 5 мкм), производства Daicel Chemical Industries, Ltd.
Подвижная фаза: диоксид углерода 65%, метанол 35%
Скорость потока: 3 мл/мин (6 мин)
Длина волны обнаружения: от 220 нм до 300 нм
Температура колонки: 40°C
Давление на выпуске: 100 бар
[0126]
Пример получения 38
Смесь 6-гидрокси-1-нафтойной кислоты (150 мг), трет-бутил 4-(трет-бутоксикарбонил)-L-фенилаланината (200 мг), N-[3-(диметиламино)пропил]-N’-этилкарбодиимида гидрохлорида (160 мг), 1H-бензотриазол-1-ола (110 мг) и N,N-диметилформамида (4,00 мл) перемешивали при комнатной температуре в течение ночи. В реакционную смесь добавляли воду, после чего следовало перемешивание в течение 1 часа. Осадок собирали посредством фильтрования, промывали водой и затем сушили при пониженном давлении для получения трет-бутил 4-(трет-бутоксикарбонил)-N-(6-гидрокси-1-нафтоил)-L-фенилаланината (183 мг).
[0127]
Пример получения 39
Смесь трет-бутил 4-(трет-бутоксикарбонил)-N-(6-гидрокси-1-нафтоил)-L-фенилаланината (180 мг), 4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензойной кислоты (180 мг), N-[3-(диметиламино)пропил]-N’-этилкарбодиимида гидрохлорида (90,0 мг), 4-диметиламинопиридина (15,0 мг) и дихлорметана (2,00 мл) перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил N-[6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1-нафтоил]-4-(трет-бутоксикарбонил)-L-фенилаланината (303 мг).
[0128]
Пример получения 40
В раствор 6-гидрокси-1,2,3,4-тетрагидронафтален-2-карбоновой кислоты (200 мг) в N,N-диметилформамиде (3,00 мл) добавляли трет-бутил 4-{[(2-трет-бутокси-2-оксоэтил)амино]метил}тиофен-2-карбоксилат (341 мг), O-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилурония гексафторфосфат (435 мг) и N,N-диизопропилэтиламин (196 мкл), после чего следовало перемешивание при комнатной температуре в течение 2 часов. В реакционную смесь добавляли воду, после чего следовало экстрагирование этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 4-({(2-трет-бутокси-2-оксоэтил)[(6-гидрокси-1,2,3,4-тетрагидронафтален-2-ил)карбонил]амино}метил)тиофен-2-карбоксилата (522 мг).
[0129]
Пример получения 41
В раствор трет-бутил 4-({(2-трет-бутокси-2-оксоэтил)[(6-гидрокси-1,2,3,4-тетрагидронафтален-2-ил)карбонил]амино}метил)тиофен-2-карбоксилата (520 мг) в дихлорметане (10,4 мл) добавляли 4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензойную кислоту (433 мг), N-[3-(диметиламино)пропил]-N’-этилкарбодиимида гидрохлорид (298 мг) и 4-диметиламинопиридин (38,0 мг) при охлаждении льдом, после чего следовало перемешивание при комнатной температуре в течение 2 часов. В реакционный раствор добавляли воду и 1 M соляную кислоту, после чего следовало экстрагирование хлороформом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения трет-бутил 4-{[{[6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-2-ил]карбонил}(2-трет-бутокси-2-оксоэтил)амино]метил}тиофен-2-карбоксилата (723 мг).
[0130]
Пример получения 42
В раствор (3R)-2-(трет-бутоксикарбонил)-7-гидрокси-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислоты (1,50 г) в толуоле (60,0 мл) и метаноле (9,00 мл) добавляли по каплям 0,60 M раствор (10,0 мл) триметилсилилдиазометана в гексане, после чего следовало перемешивание при комнатной температуре в течение 30 минут. В реакционную смесь добавляли уксусную кислоту (300 мкл), и затем в нее добавляли водный раствор гидрокарбоната натрия, после чего следовало экстрагирование этилацетатом. Органический слой последовательно промывали водой и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан-этилацетат) для получения 2-трет-бутил 3-метил (3R)-7-гидрокси-3,4-дигидроизохинолин-2,3(1H)-дикарбоксилата (1,47 г).
[0131]
Пример получения 43
В раствор дибензил (3R)-2-{[6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}-1,2,3,4-тетрагидроизохинолин-3,7-дикарбоксилата (257 мг) в этаноле (5,00 мл) добавляли 10% палладированный уголь (52,0 мг, 50% влажный продукт), после чего следовало перемешивание при комнатной температуре в течение 2 часов при нормальном давлении в атмосфере водорода. Реакционную смесь фильтровали посредством пропускания ее через слой Celite (зарегистрированный товарный знак) и затем фильтрат концентрировали при пониженном давлении для получения (3R)-2-{[6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}-1,2,3,4-тетрагидроизохинолин-3,7-дикарбоновой кислоты (213 мг).
[0132]
Пример получения 44
Смесь ди-трет-бутил 3-[(бензил{[6-(бензилокси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}амино)метил]пентандиоата (230 мг), 10% палладированного угля (38,1 мг, 50% влажный продукт) и метанола (4,60 мл) перемешивали при комнатной температуре в течение 16 часов при нормальном давлении в атмосфере водорода. Реакционную смесь фильтровали посредством пропускания ее через слой Celite (зарегистрированный товарный знак) и затем фильтрат концентрировали при пониженном давлении для получения ди-трет-бутил 3-({бензил[(6-гидрокси-1,2,3,4-тетрагидронафтален-1-ил)ацетил]амино}метил)пентандиоата (186 мг).
[0133]
Пример 1
В трет-бутил 4-({[6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-2-нафтоил](2-трет-бутокси-2-оксоэтил)амино}метил)тиофен-2-карбоксилат (132 мг) добавляли 4 M раствор (2,02 мл) хлорида водорода в 1,4-диоксане, после чего следовало перемешивание при комнатной температуре в течение 24 часов. Реакционную суспензию концентрировали при пониженном давлении, и затем остаток очищали с помощью колоночной хроматографии на октадецилсилиле (далее в настоящем документе обозначаемом как ODS) (0,01 M соляная кислота-ацетонитрил) для получения 4-{[{6-[(4-карбамимидамидобензоил)окси]-2-нафтоил}(карбоксиметил)амино]метил}тиофен-2-карбоновой кислоты моногидрохлорида (62,7 мг).
[0134]
Пример 2
В раствор трет-бутил 3-{[{[6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}(2-трет-бутокси-2-оксоэтил)амино]метил}бензоата (528 мг) в дихлорметане (5,00 мл) добавляли трифторуксусную кислоту (2,00 мл), после чего следовало перемешивание при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и затем в остаток добавляли 1 M соляную кислоту (606 мкл) и ацетонитрил (10,0 мл), после чего следовало концентрирование при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на ODS (0,01 M соляная кислота-ацетонитрил) и сушили при пониженном давлении для получения 3-{[({6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-1-ил}ацетил)(карбоксиметил)амино]метил}бензойной кислоты моногидрохлорида (227 мг).
[0135]
Пример 3
В раствор трет-бутил N-[6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1-нафтоил]-4-(трет-бутоксикарбонил)-L-фенилаланината (300 мг) в дихлорметане (1,50 мл) добавляли трифторуксусную кислоту (1,50 мл), после чего следовало перемешивание при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении и затем в остаток добавляли 1 M соляную кислоту (1,00 мл) и ацетонитрил (1,00 мл), после чего следовало концентрирование при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на ODS (0,01 M соляная кислота-ацетонитрил) для получения N-{6-[(4-карбамимидамидобензоил)окси]-1-нафтоил}-4-карбокси-L-фенилаланина моногидрохлорида (158 мг).
[0136]
Пример 4
В раствор трет-бутил 4-{[{[6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-2-ил]карбонил}(2-трет-бутокси-2-оксоэтил)амино]метил}тиофен-2-карбоксилата (720 мг) в дихлорметане (5,33 мл) добавляли трифторуксусную кислоту (5,36 мл), после чего следовало перемешивание при комнатной температуре в течение 5 часов. В реакционную смесь добавляли ацетонитрил, после чего следовало концентрирование при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на ODS (0,01 M соляная кислота-ацетонитрил) для получения 4-{[({6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-2-ил}карбонил)(карбоксиметил)амино]метил}тиофен-2-карбоновой кислоты моногидрохлорида (440 мг).
[0137]
Пример 5
В раствор трет-бутил 3-{[{[(1R)-6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}(2-трет-бутокси-2-оксоэтил)амино]метил}бензоата или его энантиомера (ПрП. 37-1, 181 мг), полученных в примере получения 37, в дихлорметане (3,00 мл) добавляли трифторуксусную кислоту (686 мкл), после чего следовало перемешивание при комнатной температуре в течение 4 часов. Реакционный раствор концентрировали при пониженном давлении и затем в остаток добавляли 1 M соляную кислоту (208 мкл) и ацетонитрил (10,0 мл), после чего следовало концентрирование при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на ODS (0,01 M соляная кислота-ацетонитрил) и сушили при пониженном давлении для получения моногидрохлорида (91 мг, RT 10,6 мин) 3-{[({(1R)-6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-1-ил}ацетил)(карбоксиметил)амино]метил}бензойной кислоты или ее энантиомера. Кроме того, условия анализа для способа хиральной колоночной хроматографии, который осуществляли для того, чтобы определять RT, приведены ниже.
Колонка: CHIRALPAK IE-3 4,6 мм I.D. × 250 мм (диаметр частиц: 3 мкм), производства Daicel Chemical Industries, Ltd.
Подвижная фаза: гексан (содержащий 0,1% трифторуксусной кислоты) 60%, этанол (содержащий 0,1% трифторуксусной кислоты) 40%
Скорость потока: 1 мл/мин
Длина волны обнаружения: 254 нм
Температура колонки: 40°C
[0138]
Пример 6
В раствор трет-бутил 3-{[{[(1R)-6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}(2-трет-бутокси-2-оксоэтил)амино]метил}бензоата или его энантиомера (ПрП. 37-2, 183 мг), полученных в примере получения 37, в дихлорметане (3,03 мл) добавляли трифторуксусную кислоту (693 мкл), после чего следовало перемешивание при комнатной температуре в течение 4 часов. Реакционный раствор концентрировали при пониженном давлении, и затем в остаток добавляли 1 M соляную кислоту (210 мкл) и ацетонитрил (10,0 мл), после чего следовало концентрирование при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на ODS (0,01 M соляная кислота-ацетонитрил) и сушили при пониженном давлении для получения моногидрохлорида (98 мг, RT 14,1 мин) 3-{[({(1R)-6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-1-ил}ацетил)(карбоксиметил)амино]метил}бензойной кислоты или ее энантиомера. Кроме того, условия анализа для способа хиральной колоночной хроматографии, который осуществляли для того, чтобы определять RT, приведены ниже.
Колонка: CHIRALPAK IE-3 4,6 мм I.D. × 250 мм (диаметр частиц: 3 мкм), производства Daicel Chemical Industries, Ltd.
Подвижная фаза: гексан (содержащий 0,1% трифторуксусной кислоты) 60%, этанол (содержащий 0,1% трифторуксусной кислоты) 40%
Скорость потока: 1 мл/мин
Длина волны обнаружения: 254 нм
Температура колонки: 40°C
[0139]
Пример 7
В раствор трет-бутил 4-[({[(1R)-6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}[(2R)-1-трет-бутокси-1-оксопропан-2-ил]амино)метил]тиофен-2-карбоксилата или эпимера в положении 1 в 1,2,3,4-тетрагидронафтален (324 мг), полученных в примере получения 34, в дихлорметане (3,00 мл) добавляли трифторуксусную кислоту (1,50 мл), после чего следовало перемешивание при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и затем в остаток добавляли 1 M соляную кислоту (2,00 мл) и ацетонитрил (1,50 мл), после чего следовало концентрирование при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на ODS (0,01 M соляная кислота-ацетонитрил) для получения гидрохлорида (46 мг) 4-({({(1R)-6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-1-ил}ацетил)[(1R)-1-карбоксиэтил]амино}метил)тиофен-2-карбоновой кислоты или эпимера в положении 1 в 1,2,3,4-тетрагидронафтален.
[0140]
Пример 8
В раствор трет-бутил 4-[({[(1R)-6-({4-[N’,N’’-бис(трет-бутоксикарбонил)карбамимидамид]бензоил}окси)-1,2,3,4-тетрагидронафтален-1-ил]ацетил}[(2R)-1-трет-бутокси-1-оксопропан-2-ил]амино)метил]тиофен-2-карбоксилата или эпимера в положении 1 в 1,2,3,4-тетрагидронафтален (460 мг), полученных в примере получения 36, в дихлорметане (3,07 мл) добавляли трифторуксусную кислоту (2,06 мл), после чего следовало перемешивание при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, и затем в остаток добавляли 1 M соляную кислоту (588 мкл) и ацетонитрил (3,07 мл), после чего следовало концентрирование при пониженном давлении. В остаток добавляли этилацетат, после чего следовало концентрирование при пониженном давлении. Полученное твердое вещество промывали ацетонитрилом для получения 4-({({(1R)-6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-1-ил}ацетил)[(1R)-1-карбоксиэтил]амино}метил)тиофен-2-карбоновой кислоты или эпимера в положении 1 в 1,2,3,4-тетрагидронафтален (44 мг).
[0141]
Пример 9
В 50% водный ацетонитриловый раствор (80,0 мл) моногидрохлорида (3,83 г) 3-{[({(1R)-6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-1-ил}ацетил)(карбоксиметил)амино]метил}бензойной кислоты или ее энантиомера, полученных в примере 6, добавляли по каплям 1 M водный раствор гидроксида натрия (6,44 мл) при охлаждении льдом, после чего следовало перемешивание при комнатной температуре в течение 3 часов. Осадок собирали посредством фильтрования, затем промывали 50% водным ацетонитриловым раствором и сушили на воздухе в течение 1 часа. Высушенный продукт суспендировали в 50% водном ацетонитриловом растворе (400 мл), после чего следовало перемешивание при 120°C в течение 30 минут. Реакционную смесь перемешивали при комнатной температуре в течение 12 часов. Осадок собирали посредством фильтрования, затем промывали 50% водным ацетонитриловым раствором и сушили при комнатной температуре и пониженном давлении для получения 3-{[({(1R)-6-[(4-карбамимидамидобензоил)окси]-1,2,3,4-тетрагидронафтален-1-ил}ацетил)(карбоксиметил)амино]метил}бензойной кислоты или ее энантиомера (2,89 г).
[0142]
Соединения из примеров получения и примеров, представленные далее в таблицах, получали аналогичным образом, как в примерах получения и примерах, как описано выше.
[0143]
[0144]
[0145]
[0146]
[0147]
[0148]
[0149]
[0150]
[0151]
[0152]
[0153]
[0154]
[0155]
[0156]
[0157]
[0158]
[0159]
[0160]
[0161]
[0162]
[0163]
[0164]
[0165]
[0166]
[0167]
[0168]
[0169]
[0170]
[0171]
[0172]
[0173]
[0174]
[0175]
[0176]
[0177]
[0178]
[0179]
[0180]
[0181]
[0182]
[0183]
[0184]
[0185]
[0186]
[0187]
[0188]
[0189]
[0190]
[0191]
Промышленная применимость
[0192]
Соединение формулы (I) или его соль обладает ингибирующим трипсин действием и, следовательно, его можно использовать в качестве средства для предотвращения и/или лечения заболеваний почек в качестве средства, которое замещает терапию низкобелковой диетой, и/или средства для предотвращения и/или лечения связанных с трипсином заболеваний, таких как хронический панкреатит, заболевание гастроэзофагеальный рефлюкс, печеночная энцефалопатия и грипп.
Реферат
Изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, которые могут найти применение для предотвращения или лечения заболеваний почек. В формуле (I) Lпредставляет собой связь или Cалкилен, Lпредставляет собой Cалкилен, который может быть замещен заместителем, выбранным из группы D1, Rпредставляет собой Н, Cалкил, который может быть замещен заместителем, выбранным из группы, состоящей из фенила, который может быть замещен заместителем, выбранным из группы D2, ароматической гетероциклической группы, которая может быть замещена заместителем, выбранным из группы D2, и -COH, или Rобъединен с атомом азота, с которым он связан, и группой HOC-Lна атоме азота с образованием циклической аминогруппы, которая может быть замещена -COH. При этом D1 означает -COH, фенил, замещенный -COH, или Cалкил, замещенный -COH, D2 означает -COH или Cалкил, замещённый -COH, ароматическая гетероциклическая группа представляет собой ароматическую моноциклическую гетероциклическую группу, которая имеет от 5 до 6 звеньев кольца, которая содержит по меньшей мере один гетероатом, выбранный из S, или ароматическую бициклическую гетероциклическую группу, образованную посредством конденсации ароматического моноциклического гетероцикла с бензольным кольцом, и кольцо B представляет собой нафталендиил, 1,2,3,4-тетрагидронафталендиил, 2,3-дигидроиндендиил, бензотиофендиил, бензофурандиил или 2,3-дигидробензофурандиил. Изобретение относится также к фармацевтической композиции, содержащей указанные соединения, применению соединения или фармацевтической композиции для предотвращения или лечения заболеваний почек и способу предотвращения или лечения заболеваний почек. 5 н. и 22 з.п. ф-лы, 51 табл., 9 пр.
Формула





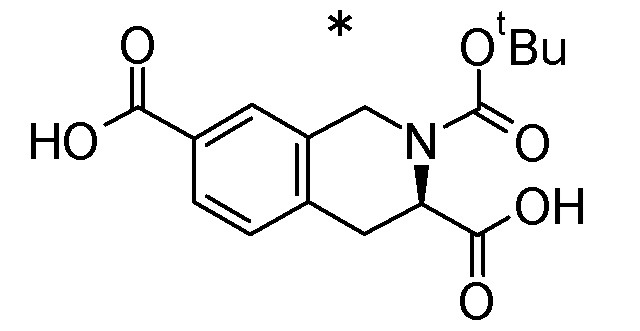





























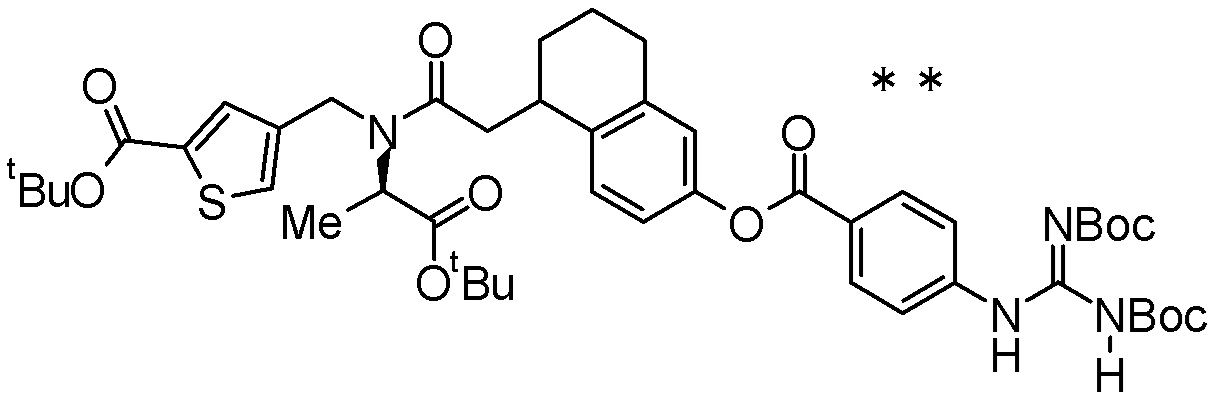







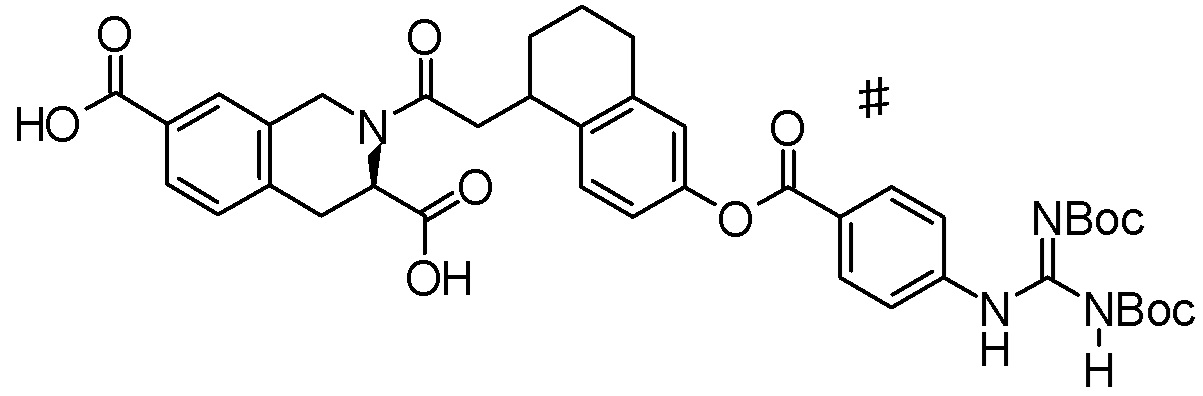












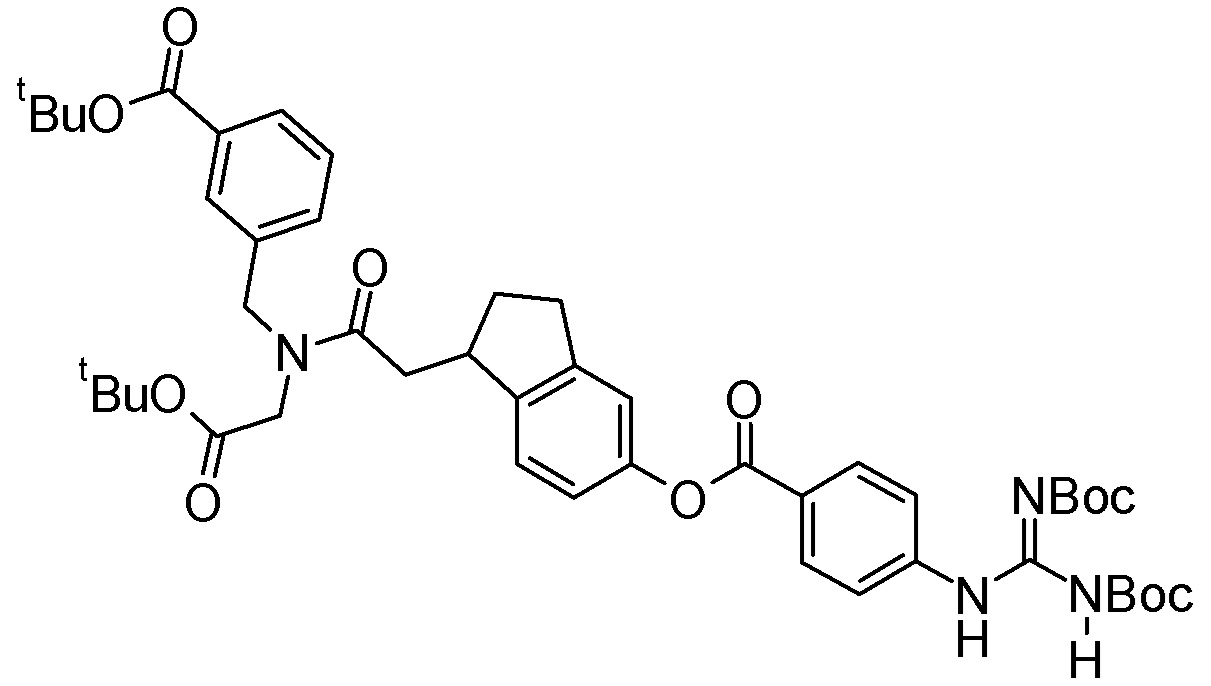












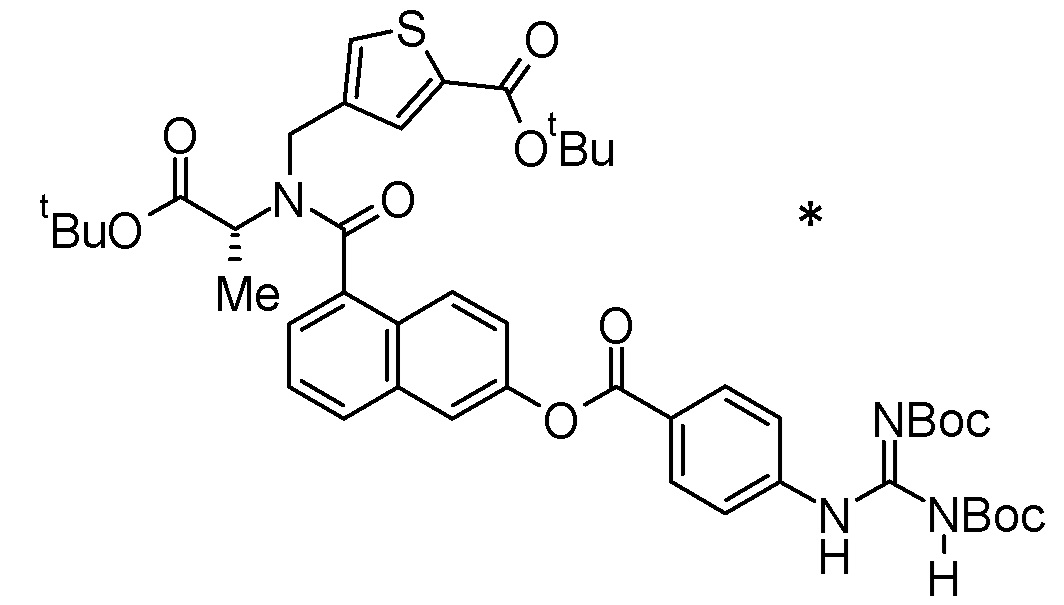






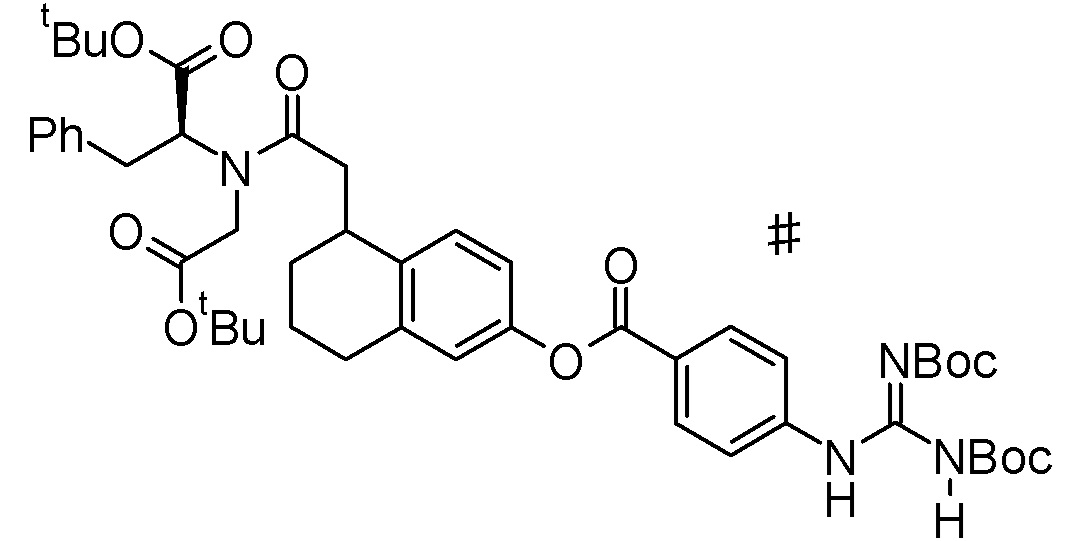












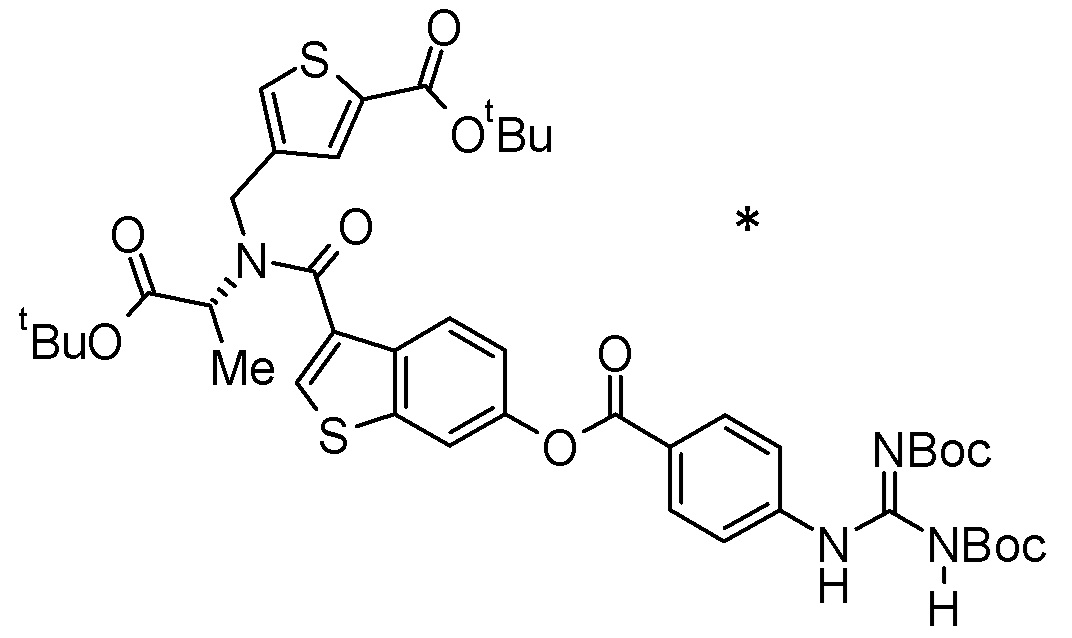

















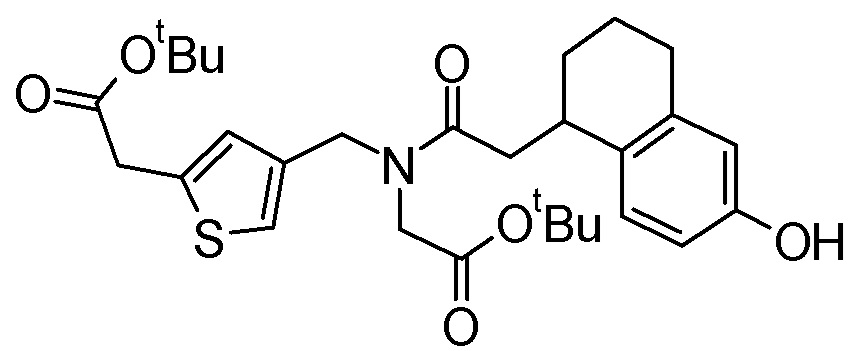













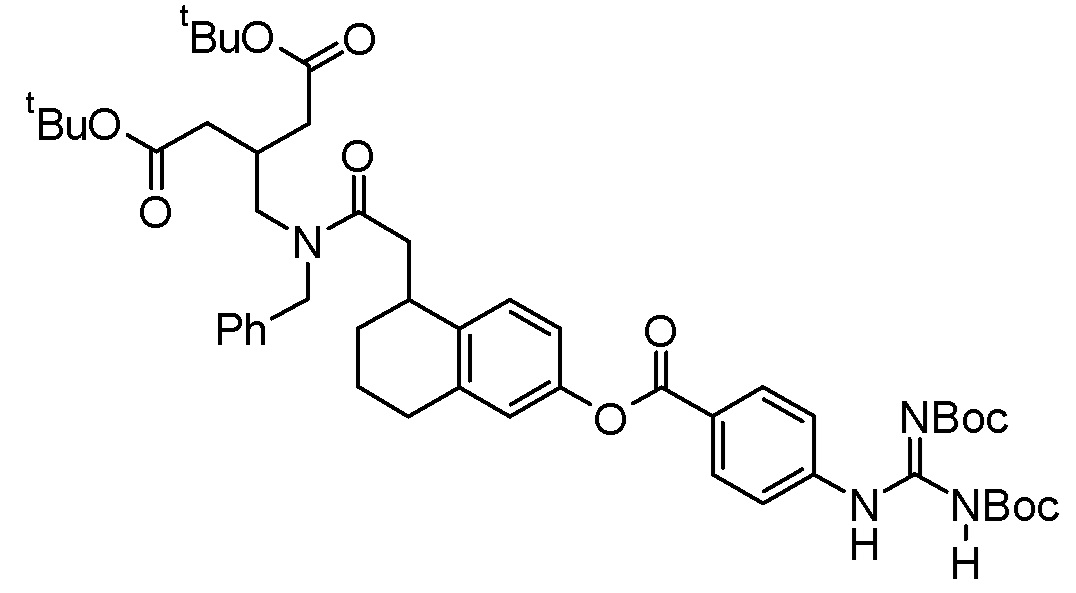





























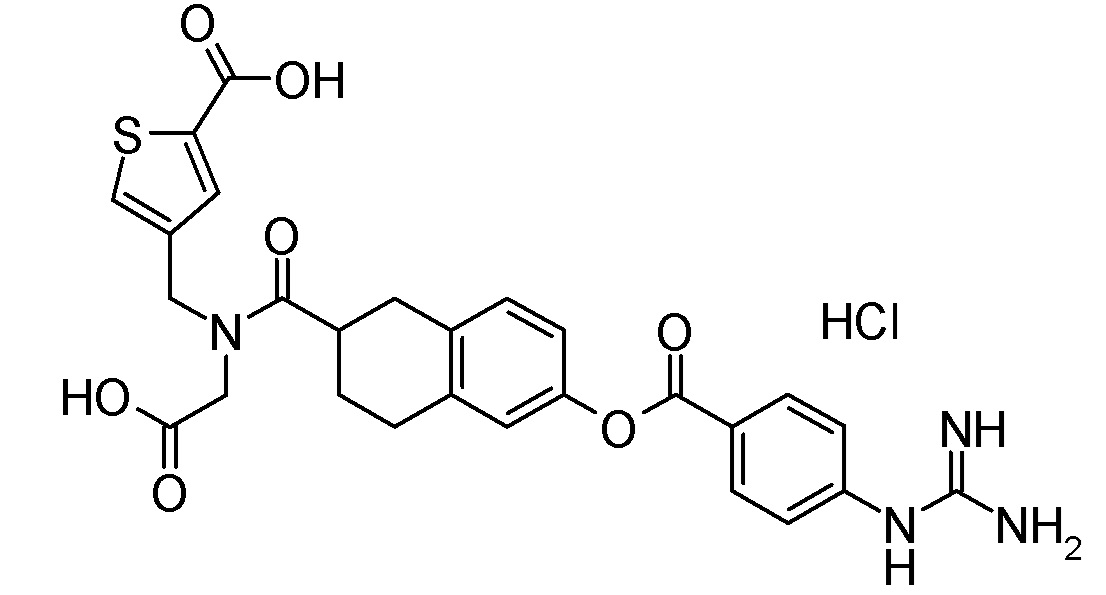








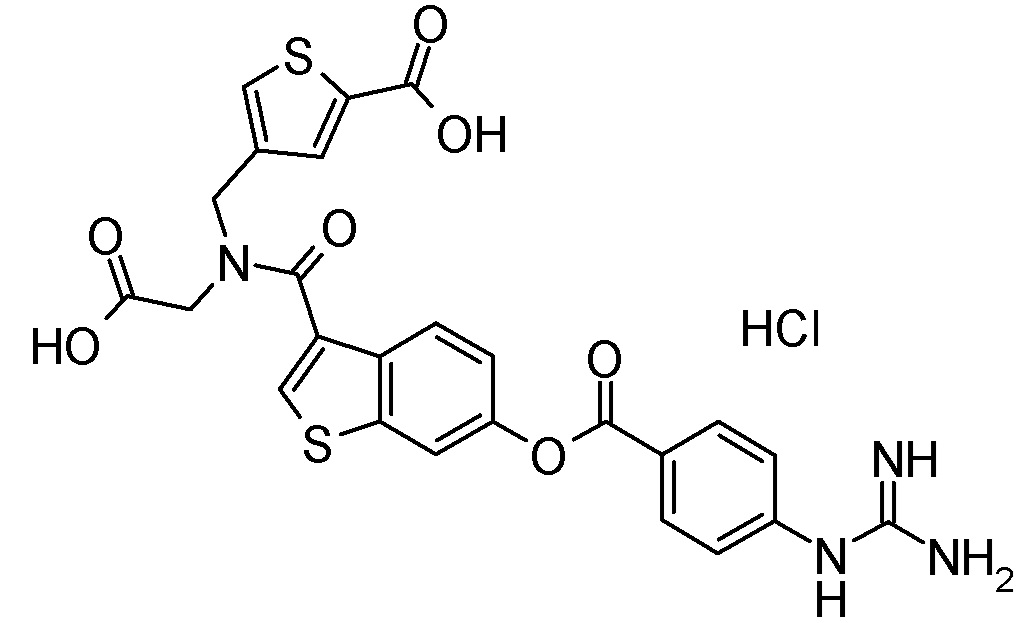



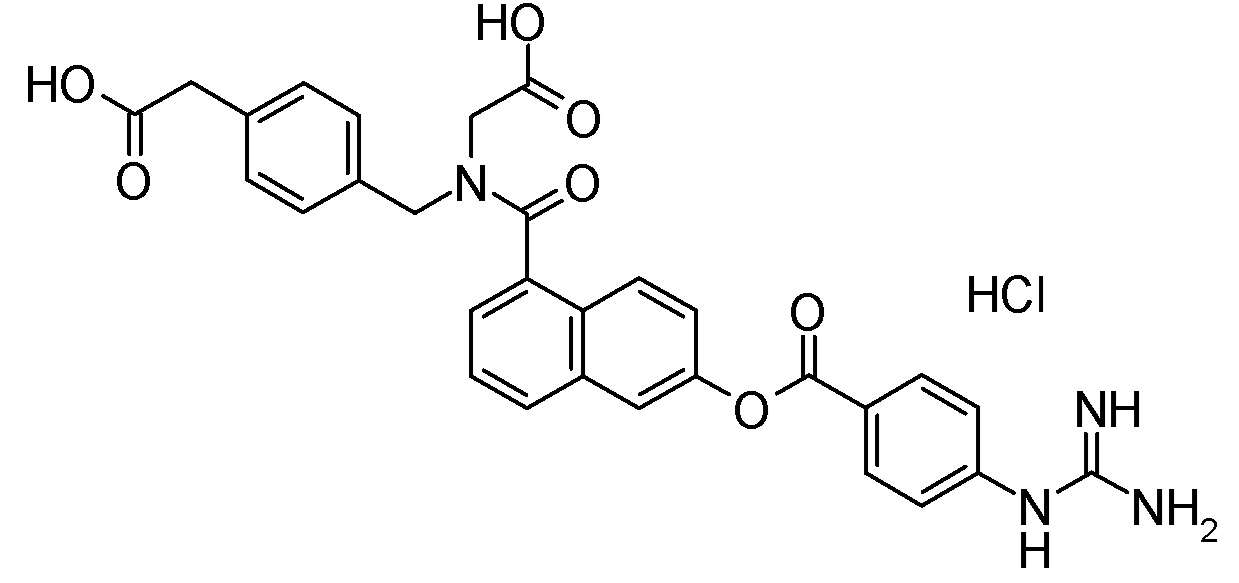



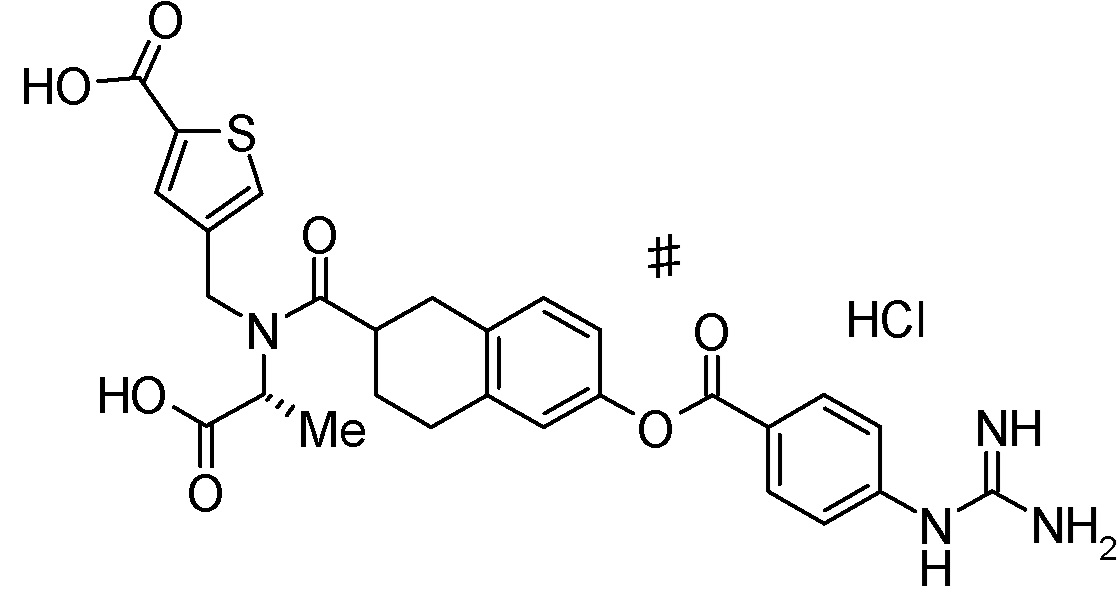





























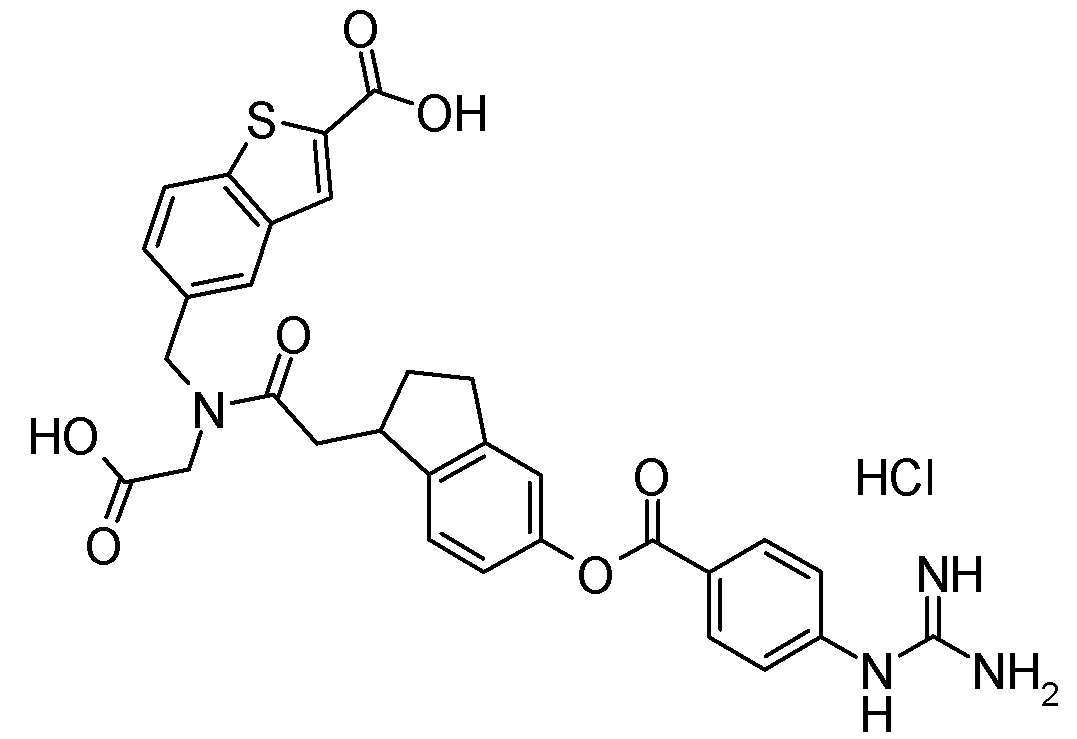



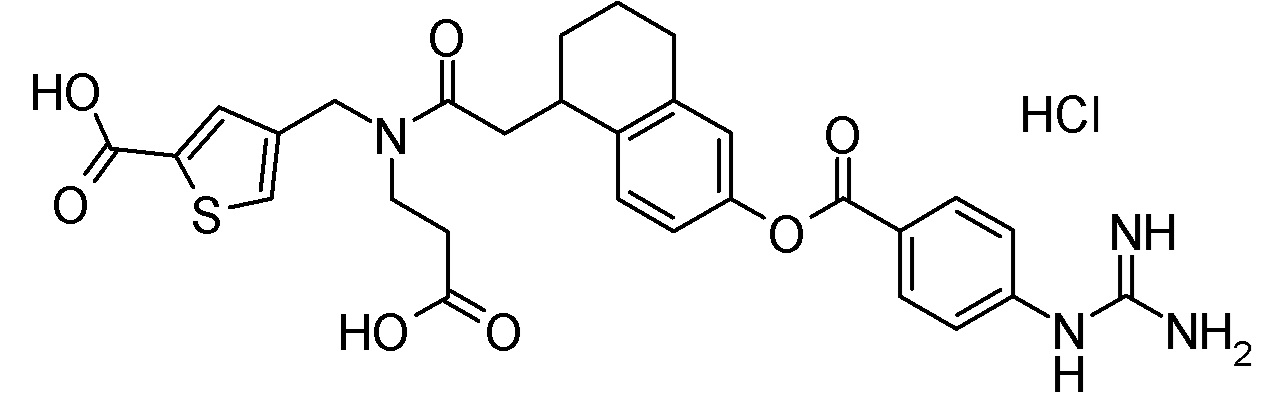


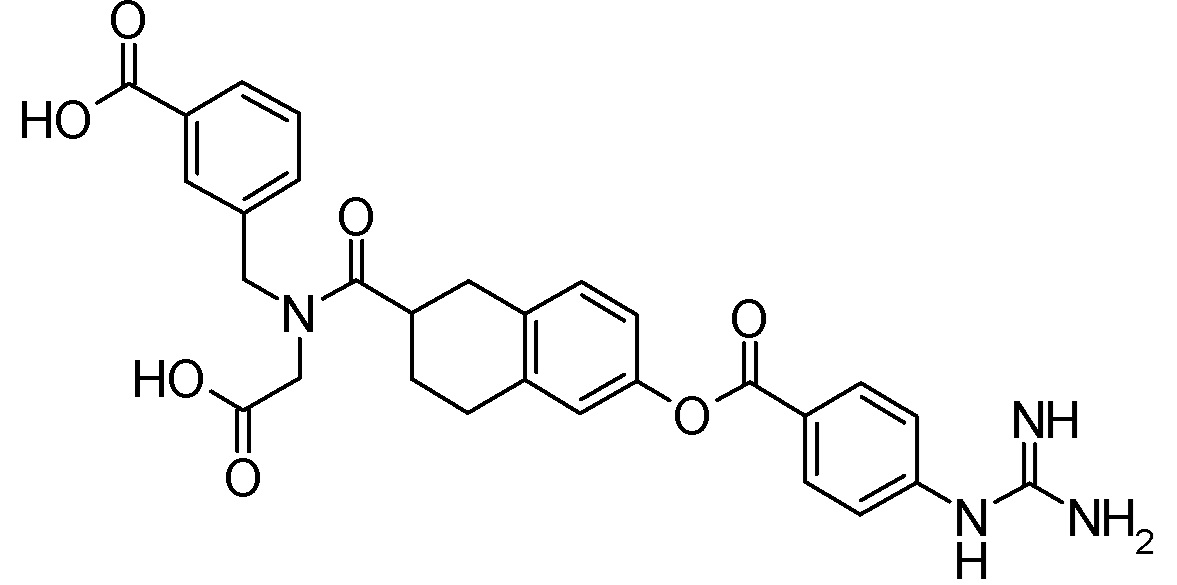



Комментарии