Производные бензодиоксола, бензофурана, дигидробензофурана и бензодиоксана и содержащие их композиции - RU2190609C2
Код документа: RU2190609C2
Чертежи















Описание
Область, к которой относится изобретение
Данное изобретение
относится к новым замещенным бензодиоксолам, бензофуранам, дигидробензофуранам, бензодиоксанам и соответствующим производным, обладающим лекарственной и биологической активностью, и к их получению,
фармацевтическим препаратам и применению. В частности, настоящее изобретение относится к бензодиоксолам, бензофуранам и соответствующим производным, содержащим замещенные аминометилциклопропильные
группы. Эти соединения проявляют мелатонергические свойства, что делает потенциально возможным их применение при лечении ряда заболеваний (расстройств).
Мелатонин (N-ацетил-5-метокситриптамин) представляет собой гормон, который синтезирует и секретирует в основном шишковидное тело. Содержание мелатонина характеризуется циклической зависимостью, причем наиболее высокие уровни наблюдаются в темный период циркадного цикла чередования света и темноты. Мелатонин участвует в трансдукции фотопериодичной информации и, по-видимому, модулирует ряд функций нервной и эндокринной системы позвоночных, включая регуляцию репродукции, вес тела и метаболизм фотопериодичных млекопитающих, регуляцию циркадного ритма и модулирование физиологических процессов в сетчатке.

Последние результаты показывают, что мелатонин оказывает биологическое воздействие через специальные рецепторы. Применение биологически активного агониста [125I] -2-йодмелатонина с радиоактивным изотопом I125 позволило идентифицировать рецепторы мелатонина с высокой степенью сродства в центральной нервной системе (CNS) ряда видов. Сообщалось о последовательностях клонированных человеческих рецепторов мелатонина [Reppert, et al., Proc. Natl. Acad. Sci. 92, p. 8734-8738 (1995) и Reppert, et al., Neuron 13, p. 1177-1185 (1994)] . Ауторадиографические исследования мозга млекопитающих позволили отнести местоположение распределения рецепторов мелатонина к нескольким конкретным структурам. Хотя существует значительная разница в распределении рецепторов мелатонина даже между близкородственными видами, в целом наиболее высокая плотность сайтов связывания наблюдается в дискретных ядрах гипоталамуса. У человека специфическое связывание [125I]-йодмелатонина в гипоталамусе полностью локализовано в надхиазматическом (супрахиазматическом) ядре, это убедительно доказывает, что рецепторы мелатонина расположены "внутри" биологических часов человека.
Было обнаружено, что экзогенное введение мелатонина синхронизирует циркадные ритмы у крыс (Cassone, et al., J. Biol. Rhythms. 1:219-229, 1986). У человека введение мелатонина применялось для лечения нарушения сна, связанного с расстройством суточного ритма организма, которое, как полагают, вызывается десинхронизацией циркадных ритмов (Arendt, et al., Br. Med. J. 292: 1170, 1986). Кроме того, назначение разовой дозы мелатонина для того, чтобы вызвать сон у индивидуумов, заявляется Wartman в Международной заявке WO 94/07487, опубликованной 10 апреля 1994 г.
Таким образом, мелатонин может быть особенно полезен для лечения нарушений сна и других хронобиологических расстройств. Агонисты мелатонина также могут применяться для дальнейшего исследования взаимодействия рецепторов мелатонина, а также при состояниях, вызванных активностью серотонина, таких как депрессия, нарушение суточного ритма организма, синдром изменения рабочего режима (сдвига времени работы), нарушение сна, глаукома, репродукция, рак,предменструальный синдром, расстройства иммунной системы, воспалительные заболевания суставов и нейроэндокринные расстройства.
Были получены азиды из простых индольных производных самого мелатонина, различные бициклические
структуры и заявлено их применение в качестве лигандов мелатонина. В общем виде эти бициклические амидные структуры можно представить следующим образом:

где Z означает арильную или гетероарильную систему, связанную мостиком из двух атомов углерода с амидной группой. Ниже даны некоторые конкретные примеры.
Yous, et al. в Европейской Заявке ЕР-527,687А, опубликованной 17 февраля 1993 г., раскрывает в качестве лигандов мелатонина арилэтиламины i

в которых Аr' означает, среди прочих, замещенный или незамещенный радикал бензо[b] тиофен-3-ил, бензимидазол-1-ил, бензо[b]фуран-3-ил, 1,2-бензизоксазол-3-ил, 1,2-бензизотиазол-3-ил и индазол-3-ил; R1 означает, среди прочих, алкильную или циклоалкильную группу; и R2 означает водород или низший алкил.
Yous, et al. в Европейской Заявке ЕР-506539 А, опубликованной 30 сентября 1992 г., заявляют лиганды ii

где А означает кислород или серу; Y означает метиленовую группу или связь; и R означает Н или низший алкил, когда р означает 1 и В описывается радикалом iii

в котором R1 означает водород или низший алкил и R2 означает, среди прочих, водород, низший алкил или циклоалкил. Или же R означает радикал iii, когда р означает 0 или 1 и В означает низшую алкоксигруппу.
В качестве лигандов мелатонина заявлялось несколько производных нафталина.
Andrieux, et al. в Европейской Заявке ЕР-447285 А, опубликованной 18 сентября 1991 г., заявляют амидоалкилнафталины iv

в которых R означает низший алкил; R1 означает водород или низший алкил; и R2 означает, среди прочих, водород, низший алкил или циклоалкил.
Yous, et al. в Европейской Заявке ЕР-562956 А, опубликованной 29 сентября 1993 г., заявляют амидные и карбамидные
производные нафталина v

в которых R означает водород или OR4, где R4 означает, среди прочих, водород, алкил, циклоалкил или циклоалкилалкил; R1 означает водород или COOR5, где R5 означает водород или алкил; Х означает NH или связь; и R3 означает, среди прочих, алкил, алкенил или циклоалкил.
Lesieur, et al. в Европейской Заявке ЕР-530087 А, опубликованной 3 марта 1993 г., раскрывают нафтилэтилмочевины и
нафтилэтилтиомочевины vi

в которых R означает водород или ОR3, где R3 означает, среди прочих, водород, низший алкил или циклоалкил; R1 означает водород или низший алкил; Х означает кислород или серу; и R2 означает, среди прочих, низший алкил или циклоалкил.
Langlois, et al. в Австралийской Заявке AU-A-48729/93 заявляют арилалкил(тио)амиды vii как мелатонергические лиганды

где R1 означает водород или низший алкил; R2 означает водород, галоген или низший алкил; R3 и R4 идентичные или отличающиеся группы, включающие, среди прочих, водород, галоген или низший алкил или R3 и R4, вместе с бензольным кольцом, с которым они связаны, образуют циклическую систему Е3, выбранную из, среди прочих, нафталина, при этом надо отдавать себе отчет, что часть циклической системы Е3, образованная R3 и R4 и двумя углеродными атомами соединенного с ними бензольного кольца, является негидрированной или частично гидрированной; R5 означает водород или низший алкил; и R6 означает

где Х означает серу или кислород и R7 означает, среди прочих, низший алкил или алкенил.
Соединение viii вводится в качестве конкретного примера

Horn and Dubocovich в Европейской Заявке ЕР-420064 А, опубликованной 3 апреля 1991 г., раскрывают 2-амидотетралин ix в качестве лиганда мелатонина

в котором R1 означает, среди прочих, водород, низший алкил или низший алкоксил, R2 означает, среди прочих, водород, галоген или низший алкоксил; R3 означает, среди прочих, водород или низший алкил; R4 означает, среди прочих, низший алкил, галоалкил или циклоалкил; и R5 означает водород, гидроксил, галоген, оксо, арил, низший алкил или алкиларил.
Copinga et аl. в J. Med. Chem., 36, p. 2891-2898 (1993), обсуждают амидометокситетралины со структурой x и их мелатонергические
свойства

В структуре х R1 означает Н или ОСН3 и R2 означает алкил, галоалкил, фенилалкил или фенил.
Lesieur, et al. в Европейской Заявке ЕР-708099 А, опубликованной 24 апреля 1996 г. , раскрывают соединения со структурой xi, которые применимы
для лечения заболеваний, вызванных дисбалансом мелатонина,

где

North et al. в Международной Заявке WO 95/29173, опубликованной 2 ноября 1995 г., раскрывают производные нафталина со структурой xii

в которой R1 означает группу формулы СR3R4(СН2)р NR5СОR6; R2 означает водород, галоген, С1-6-алкил, OR7 или СО2R7; и могут быть те же самые или другие заместители, когда q равно 2; R3, R4 и R5, которые могут быть одинаковыми или различными, означают водород или алкил C1-C6; R6 означает алкил C1 -C6 или циклоалкил С3-С7; R7 означает водород или алкил C1-C6; n означает ноль, 1 или 2; и пунктирные линии показывают наличие и отсутствие дополнительной (двойной) связи. North et al. сообщают, что эти соединения могут применяться для лечения хронобиологических расстройств.
В Международной Заявке WO 95/17405,
опубликованной 29 июня 1995 года, North et al. заявляют соединения со структурой xiii и сообщают об их применении для лечения состояний, связанных с системой мелатонина,

где R1 означает водород, галоген или алкил C1-C6; R2 означает группу формулы CR3R4(CH2)pNR5COR6; R3, R4 и R5, которые могут быть одинаковыми или различными, означают водород или алкил C1-C6; R6 означает алкил C1-C6 или циклоалкил С3-С7; n означает целое число 2, 3 или 4; и р означает целое число 1, 2, 3 или 4.
Ни в одном из вышецитированных источников не сообщаются, не предлагаются новые мелатонергические производные бензодиоксола, бензофурана или дигидробензофурана по данному изобретению. Новые соединения по данному изобретению проявляют мелатонергическую агонистическую активность.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное
изобретение предлагает (заявляет) новый ряд соединений Формулы 1

где R, R1, R2, Q1, Q2, X, Y, Z и m описаны ниже, включая их гидраты и сольваты, которые связываются с мелатонергическими рецепторами человека и, следовательно, могут применяться в качестве мелатонергических агентов при лечении нарушений сна, сезонных депрессий, сдвигов циркадных циклов, меланхолии, стресса, для регуляции аппетита, доброкачественной гиперплазии простаты и связанных с ними состояний.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение предлагает новый ряд соединений Формулы 1 и их сольватов:

отличающихся тем, что Q1 и О2 каждый означает независимо водород или галоген;
Х означает СН2, СН или кислород;
Y означает CR3, CR3R4 или (СН2)n с n = 1-4;
Z означает СН2, СН или кислород;
R означает водород, галоген или алкил С1-4 в обоих случаях;
m означает 1 или 2;
R1 означает C1-6-алкил, С3-6-циклоалкил, С1-3-галоалкил, C1-6-алкиламино, С2-6-алкенил, С1-4-алкокси(С1-4)алкил, С1-C4-алкилтио(С1-4)алкил или трифторметилалкил-С1-4;
R2 означает водород, галоген или С1-4-алкил;
и R3 и R4 каждый независимо означает водород или С1-4-алкил.
Данное изобретение также предоставляет способ лечения нарушений сна и родственных состояний, который заключается в назначении терапевтически эффективного количества соединения Формулы 1 или его сольвата или гидрата.
Q1 и Q2 выбираются из Н или галогена (то есть брома, хлора, йода или фтора). Наиболее предпочтительным является, когда Q1 и Q2 означают независимо Н.
Х может означать СН2, СН (когда имеется двойная связь) или кислород.
Y означает CR3 (когда имеется двойная связь), CR3R4 или (СН2)n и n означает целое число от 1 до 4, но предпочтительно 1 или 2.
Z может означать СН2, СН (когда имеется двойная связь) или кислород, причем наиболее предпочтителен кислород.
Когда Х и Y означают СН2, а Z означает кислород или Z и Y означают СН2, а Х означает кислород, соединение представляет собой дигидробензофуран. Когда Х и Y означают СН и Z означает кислород, или Z и Y означают СН и Х означает кислород, соединение представляет собойбензофуран. Когда X и Z означают кислород и Y означают СН2, соединение представляет собой бензодиоксол. Когда Х и Z означают кислород и Y означают СН2, соединение представляет собой бензодиоксан. Соединения, в которых Х и Y означают СН2 и Z означает кислород, являются предпочтительными.
Обе R-группы означают одинаковые частицы. Пригодные R-группы включают водород, галоген и С1-4-алкил. R предпочтительно означает водород.
m означает 1 или 2, предпочтительно m равно 1.
R1 означает одну или несколько видов групп. R1 выбирается из С1-6-алкила, С3-6-циклоалкила, С1-3-галоалкила, C1-6-алкиламино, С2-6 -алкенила, С1-4-алкокси(С1-4)алкила, С1-С4-алкилтио(С1-4)алкила или трифторметилалкила-С1-4. R1 предпочтительно означает C1-6-алкил или С3-6-циклоалкил.
R2 означает водород или С1-4-алкил. R2 предпочтительно означает водород.
R3 и R4 означают водород или С1-4-алкил. Предпочтительно, когда R3 и R4 оба означают водород. Также предпочтительно, когда R3 означает водород и R4 означает метил. Когда R3 означает водород и R4 означает метил, предпочтительны оба энантиомера и рацемат.
"Алкил" означает одновалентную группу с неразветвленной или разветвленной цепью формулы CxH2x+1, причем х означает число атомов углерода.
"Y-X" и "Y-Z" означает соединение одинарной или двойной связью заместителей X, Y или Z.
"Циклоалкильные" группы означают одновалентные циклические остатки, содержащие по меньшей мере 3 углеродных атома и отвечающие формуле Cx H(2x-1), причем х означает число имеющихся атомов углерода. Циклопропильная группа является предпочтительным циклоалкильным остатком.
"Галоидалкил" включает углеводородные радикалы с неразветвленной и разветвленной цепью, содержащие от 1 до 3 атомов галогена. "Галоген" ("галоид") означает F, Cl, Вr или I. Предпочтительными галоидными атомами в галоидалкильных остатках R1 являются F и Cl.
"Алкиламино" относится к -NH-алкильным заместителям, содержащим от 1 до 6 углеродных атомов, предпочтительно к группам -NНСН3 или -NНСН2СН3.
Предпочтительные соединения имеют значения IC50 250 нМ или менее в испытаниях по мелатонергическому связыванию, описанных ниже.
Одна группа предпочтительных соединений включает бензофураны Формулы 1, в которой группа -X-Y-Z- представляет собой -СН=СН-O- и -СН=ССН3-O-.
Некоторые предпочтительные соединения
этой группы включают:
(-)-(транс)-N-[[2-(2-бензофуран-4-ил)циклопроп-1-ил] метил] циклопропан карбоксамид;
(-)-(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил]метил]пропанамид;
(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил]метил]ацетамид;
(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил]метил]пропанамид;
(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил]метил]бутанамид;
(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил]метил]ацетамид;
(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил]метил]пропанамид;
(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил]метил]бутанамид;
(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил]метил]-2-метилпропанамид;
(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил] метил] циклопропан карбоксамид; и
(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил]метил]-N-метилмочевина.
Вторая группа предпочтительных соединений включает дигидробензофураны Формулы 1, в которой группа -X-Y-Z- представляет собой -СН2-СН2-О-, -СН2-С(СН3)2-O- и -СН2-СН(СН3)-O-.
Некоторые предпочтительные
соединения второй группы включают:
(+)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил]метил]пропанамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]
ацетамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] бутанамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]-N-метилмочевина;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] метоксиацетамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] циклопропанкарбоксамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] трифторацетамид;
(транс)-N-[[2-(2,3-дигидро-2,2-диметил-бензофуран-4-ил)циклопроп-1-ил] метил]пропанамид;
(транс)-N-[[2-(2,3-дигидро-2,2-диметил-бензофуран-4-ил)циклопроп-1-ил] метил]бутанамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] ацетамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] пропанамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] бутанамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] циклопропан карбоксамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] -2-метилпропанамид;
(+)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]хлорацетамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]пропанамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]-2-метилпропанамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]ацетамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]метоксиацетамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]циклоропан карбоксамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]бутанамид;
(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил]метил]ацетамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]пропанамид;
(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] пропанамид;
(транс)-N-[[2-(2,
3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] бутанамид;
(транс)-N-[[2-(2,3-дигидро-5,7-дийодбензофуран-4-ил)циклопроп-1-ил] метил]пропанамид; и
(транс)-N-[[2-(2,
3-дигидро-5-йодбензофуран-4-ил)циклопроп-1-ил] метил] пропанамид.
Третья группа предпочтительных соединений включает бензодиоксолы Формулы 1, в которой группа -X-Y-Z- представляет собой -О-СН2-О-.
Некоторые предпочтительные соединения в третьей группе включают:
(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил]метил]ацетамид;
(-)-(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил]метил]ацетамид;
(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил]метил]пропанамид;
(-)-(транс)-N-[[2-(1,
3-бензодиоксол-4-ил)циклопроп-1-ил] метил] пропанамид;
(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил]метил]бутанамид;
(-)-(транс)-N-[[2-(1,
3-бензодиоксол-4-ил)циклопроп-1-ил]метил]бутанамид;
(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил] метил] циклопропан карбоксамид;
(-)-(транс)-N-[[2-(1,
3-бензодиоксол-4-ил)циклопроп-1-ил] метил] циклопропан карбоксамид;
(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил] метил] -2-метилпропанамид;
(-)-(транс)-N-[[2-(1,
3-бензодиоксол-4-ил)циклопроп-1-ил]метил]-2-метилпропанамид;
(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил]метил]-N

(-)-(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил] метил] -N

Другая группа предпочтительных соединений включает бензодиоксаны Формулы 1, в которой группа -X-Y-Z- представляет собой -O(СН2 )2-О-.
Некоторые предпочтительные бензодиоксаны включают:
(-)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил]пропанамид;
(-)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил]ацетамид;
(+)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил]-N-метилмочевина;
(+)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил]-2-метоксиацетамид;
(-)- (транс)-N-[[2-( 2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил]циклопропан
карбоксамид;
(-)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил]бутанамид;
(+)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил]
метил]пропенамид;
(-)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил]трифторацетамид;
(-)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил]
метил]-3,3,3-трифторпропанамид;
(+)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил]пропанамид;
(транс)-N-[[2-(2,3-дигидро-1,
4-бензодиоксин-5-ил)циклопроп-1-ил] метил] ацетамид;
(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил] пропанамид;
(транс)-N-[[2-(2,3-дигидро-1,
4-бензодиоксин-5-ил)циклопроп-1-ил] метил] бутанамид;
(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил] -2-метилпропанамид;
(транс)-N-[[2-(2,3-дигидро-1,
4-бензодиоксин-5-ил)циклопроп-1-ил] метил] циклопропан карбоксамид;
(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил] -N-метилмочевина; и
(транс)-N-[[2-(2,
3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил] -N-этилмочевина.
Еще одна группа предпочтительных соединений включает бензофураны Формулы 1, в которой группа -X-Y-Z- представляет собой -O-СН=СН- и -O-ССН3=СН-.
Некоторые предпочтительные соединения этой группы включают:
(транс)-N-[[2-(бензофуран-7-ил)циклопроп-1-ил]метил]ацетамид;
(транс)-N-[[2-(бензофуран-7-ил)циклопроп-1-ил]метил]пропанамид;
(транс)-N-[[2-(бензофуран-7-ил)циклопроп-1-ил]метил]бутанамид; и
(транс)-N-[[2-(бензофуран-7-ил)циклопроп-1-ил]метил]циклопропан карбоксамид.
Еще одна группа предпочтительных соединений включает бензопираны Формулы 1, в которой группа -X-Y-Z- представляет собой -СН2-(СН2)2-О-.
Некоторые предпочтительные соединения этой
группы включают:
(транс)-N-[[2-(3,4-дигидро-2Н-1-бензопиран-5-ил)циклопроп-1-ил] метил] пропанамид;
(транс)-N-[[2-(3,4-дигидро-2Н-1-бензопиран-5-ил)циклопроп-1-ил] метил] циклопропан
карбоксамид;
(-)-
(транс)-N-[[2-(3,4-дигидро-2Н-1 -бензопиран-5-ил)циклопроп-1-ил] метил]пропанамид;
(-)-(транс)-N-[[2-(3,4-дигидро-2Н-1-бензопиран-5-ил)циклопроп-1-ил]
метил]ацетамид;
(транс)-N-[[2-(3,4-дигидро-2 Н-1-бензопиран-5-ил)циклопроп-1-ил] метил] бутанамид; и
(+)-(транс)-N-[[2-(3,4-дигидро-2Н-1-бензопиран-5-ил)циклопроп-1-ил]
метил]пропанамид.
Кроме того, соединения Формулы 1 охватывают все их фармацевтически приемлемые сольваты, в частности гидраты. Настоящее изобретение также охватывает диастереомеры, а также оптические изомеры, например смеси энантиомеров, включая рацемические смеси, а также индивидуальные энантиомеры и диастереомеры, которые получаются вследствие структурной асимметрии некоторых соединений Формулы 1. Разделение индивидуальных изомеров или селективный синтез индивидуальных изомеров осуществлен с применением различных методов, хорошо известных специалистам в данной области.
Соединения Формулы 1 можно получить с применением общих методов (см. Реакционные Схемы в конце описания).
Синтез производных 4-арилпропеновой кислоты, 2 и 3, показан на Реакционной Схеме 1. Исходные альдегиды 1 можно получить способами, хорошо известными специалистам в данной области. Конденсация малоновой кислоты с альдегидами 1 в растворителях, таких как пиридин, в присутствии катализаторов, таких как пиперидин или пирролидин, дает 4-арилпропеновую кислоту 2. Последующее превращение кислоты в хлорангидрид с помощью, например, хлористого тионила, хлорокиси фосфора или аналогичных соединений, а затем реакция с N, O-диметилгидроксиламином дает с хорошим выходом промежуточный амид 3. Или же альдегид 1 можно превратить непосредственно в амид 3, применяя такие реагенты, как диэтил (N-метокси-N-метил-карбамоилметил)фосфонат вместе с сильным основанием, например с гидридом натрия.
Превращение промежуточного амида 3 в промежуточный рацемат циклопропанкарбоксальдегида 4 изображено на Реакционной Схеме 2. Интермедиат 3 реагирует с циклопропанобразующими реагентами, такими как триметилсульфоксоний йодид и гидрид натрия, в таких растворителях, как ДМФА, ТГФ или им подобных. Последующее восстановление с помощью таких реагентов, как LAH (LiAlH4) в таких растворителях, как ТГФ, диэтиловый эфир и им подобных, дает рацемические промежуточные соединения, транс-циклопропанкарбоксальдегиды 4.
Рацемические промежуточные циклопропаны 5 (R означает галоген) можно получать из интермедиата 2, как показано на Реакционной Схеме 3. Промежуточное соединение 2 превращали в соответствующий аллиловый спирт с помощью таких восстановителей, как натрийборгидрид плюс йод в таких растворителях, как ТГФ. Последующее ацилирование с помощью таких реагентов, как уксусный ангидирид в пиридине или хлористый ацетил дали аллилацетат, который реагировал с циклопропанирующими реагентами, такими как хлордифторацетат натрия в диглиме, давая рацемические промежуточные транс-циклопропанацетаты 5.
Превращение кислоты 2 в хиральный промежуточный циклопропанкарбоксальдегид (-)-(транс)-4 показан на Реакционной Схеме 4. Промежуточное соединение 2 конденсируется с (-)-2-камфорсультамом в обычных условиях, а затем циклопропанируется в присутствии катализаторов, таких как ацетат палладия, с применением диазометана, образующегося из таких реагентов, как 1-метил-3-нитро-1-нитрозогуанидин. Последующее восстановление такими реагентами, как LiAlH4 в таких растворителях, как ТГФ, и затем окисление промежуточных спиртов с помощью, например, ДМСО/оксалилхлорида или РСС, дает промежуточный циклопропанкарбоксальдегид (-)-(транс)-4 с хорошим выходом. Энантиомер (+)-(транс)-4 можно также получить, применяя подобную методику, используя (+)-2,10-камфорсультам, вместо (-)-2,10-камфорсультама.
Когда требуется получить соединение Формулы 1, где m = 2, спиртовой интермедиат может быть соответствующим образом активирован, например, с помощью мезилхлорида и обработан цианидом натрия с последующим восстановлением нитрильной группы с помощью, например, LiAlH4, что дает промежуточный амин 6.
На Реакционной Схеме 5 показано превращение интермедиатов 4 и 5 в промежуточный амин 7, и последующее превращение 6 или 7 в соединения Формулы 1. Промежуточный карбоксальдегид, 4, конденсируется с гидроксиламином и затем восстанавливается такими реагентами, как LiАlH4, давая промежуточный амин 7. Промежуточный ацетат 5 гидролизуют гидроокисью калия до спирта, который превращают в мезилат с помощью метансульфонилхлорида и триэтиламина в СН2Сl2, а затем в азид обработкой азидом натрия в растворителе, например в ДМФА. Последующим восстановлением азидной группы таким восстановителем, как, например, LiАlH4, получают промежуточный амин 7. Далее реакцией 6 или 7 с ацилирующим агентом получают соединения Формулы 1. Соответствующие ацилирующие агенты включают хлорангидриды и ангидриды карбоновых кислот, ацилимидазолы, алкилизоцианаты, алкилизотиоцианаты и карбоновые кислоты в присутствии конденсирующих агентов, например карбонилимидазола, карбодиимидов и тому подобное.
На Реакционной Схеме 6 изображено алкилирование вторичных амидов Формулы 1 (R2 означает Н) с образованием третичных амидов Формулы 1 (R2 означает алкил). Вторичный амид реагирует с основанием, например с гидридом натрия, трет-бутоксилатом калия и им подобным, а затем с алкилирующим агентом, таким как галоидные алкилы, алкиловые эфиры сульфокислот или тому подобное, давая третичные амиды Формулы 1.
На Реакционной Схеме 7 изображено галогенирование соединений Формулы 1. Карбоксамиды I (Q1 = Q2 = Н) реагируют с избытком галоидирующих реагентов, таких как йод, N-бромсукцинимид и тому подобное, давая дигалоидные соединения Формулы 1 (Q1 = Q2 = галоген). Или же можно брать стехиометрическое количество этих галоидирующих агентов, при этом получают моногалоидные соединения Формулы 1 (Q1 = Н, Q2 = галоген; или Q1 = галоген, Q2 = Н). В обоих случаях для ускорения реакции вводят дополнительно такие соединения, как тетраацетат свинца IV.
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ СОЕДИНЕНИЙ
Соединения по данному изобретению являются мелатонергическими агентами. Было найдено, что они связывают мелатонергические рецепторы человека,
экспрессируемые в стабильной клеточной линии, с высокой афинностью (сродством). Кроме того, соединения являются агонистами, что определяется их способностью, подобно мелатонину, блокировать
стимулируемую форсколином аккумуляцию сАМР в некоторых клетках. Эти свойства соединений и композиций по данному изобретению делают возможным их применение в качестве седативных, хронобиотических
агентов, транквилизаторов, нейролептиков, анальгетиков и тому подобное. Конкретно, эти агенты могут найти применение при лечении стресса, расстройств сна, сезонной депрессии, для регуляции аппетита,
лечения сдвигов циркадных циклов, меланхолии, доброкачественной гиперплазии простаты и родственных состояний.
Активность мелатонергического рецепторного связывания
1.
Реагенты:
(а) ТМЕ означает 50 мМ буфер Трис, содержащий 12,5 мМ MgCl2 и 2 мМ EDTA, рН 7,4 при 37oС с концентрированной HCl.
(б) Водный буфер: 20 мМ основания Трис, содержащего 2 мМ MgCl2, рН 7,4 при комнатной температуре.
(в) 10-4 М мелатонин (конечная концентрация 10-5 М).
(г) 2-[125I]-йoдмeлaтoнин, конечная концентрация 0,1 М.
2. Гомогенаты мембран:
Рецептор кДАК мелатонин ML1a субклонировали в pcDNA3 и вводили в клетки
NIH-3T3, используя липофектамин. Трансформированные NIH-3T3, устойчивые к генетицину (G-418), изолировали и одиночные колонии с высоким уровнем связывания 2-[125I]-йoдмeлaтoнинa выделяли.
Клетки выдерживали в DMEM, дополненной 10% телячьей сывороткой и G-418 (0,5 г/л). Клетки выращивали до состояния монослоя в плоских флаконах Т-175, смывали со стекла с помощью сбалансированного
солевого раствора Хэнкса (Hank's) и замораживали при -80oС. Для приготовления мембранных гомогенатов, образцы помещали на лед и вновь суспендировали в буфере ТМЕ в присутствии 10 мкг/мл
апротинина и лейпептина и 100 мкМ фенилметилсульфонилфторида. Затем клетки гомогенизировали и центрифугировали. Образовавшийся осадок вновь суспендировали с гомогенизатором Даунса в ТМЕ (дополненном
вышеописанными ингибиторами протеазы) и замораживали. В день анализа малую аликвоту помещали на лед и суспендировали в холодном ТМЕ (температура льда) (1:50 - 1:100 об/об) и держали на льду до начала
испытания.
3. Термостатирование: 37oС в течение 1 часа. По окончании реакции фильтровали. Фильтры отмывали 3 раза.
4. Ссылки: Reppert, et al., Neuron. 13, р. 1177-1185 (1994).
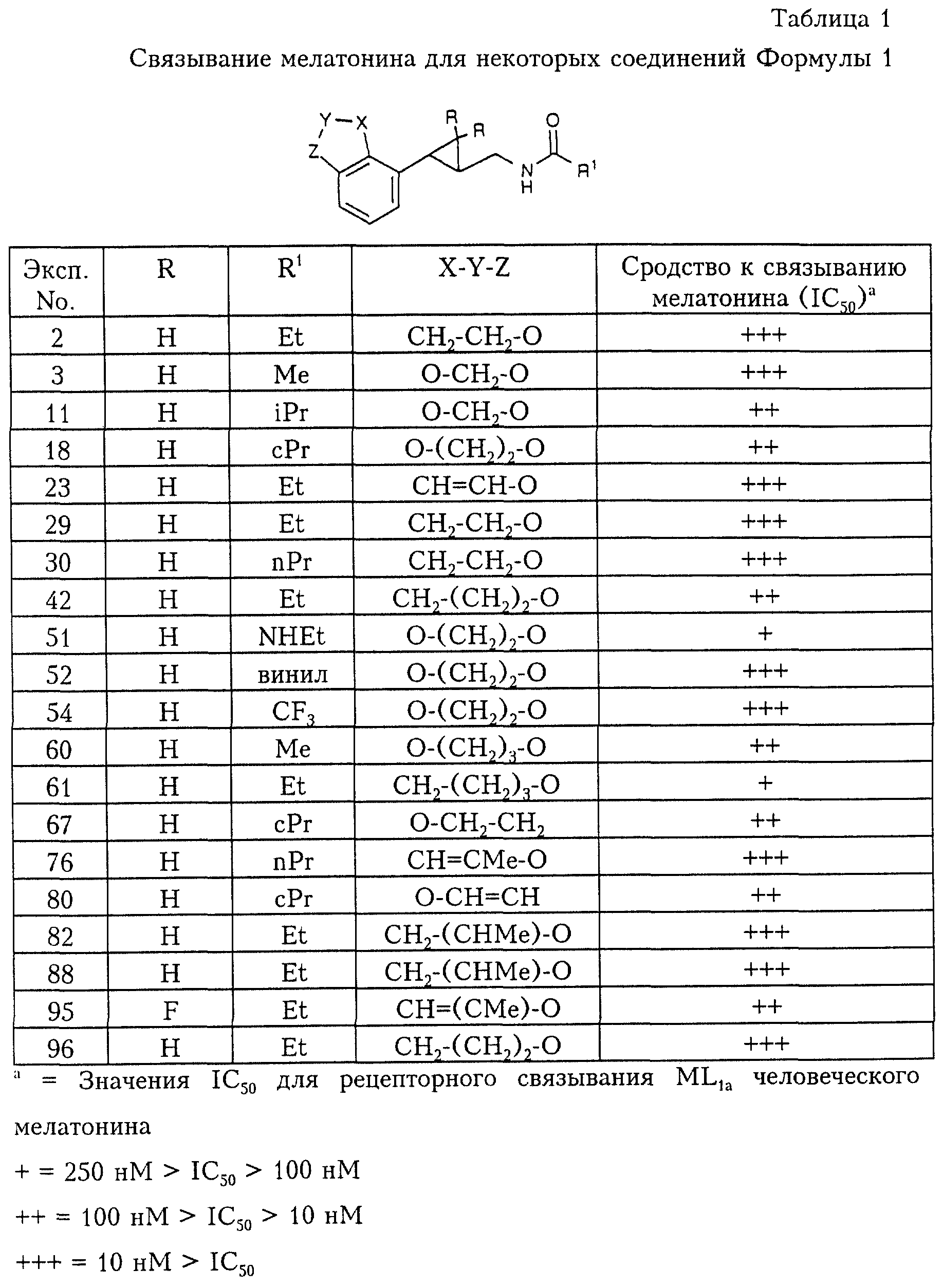
Данные по связыванию для некоторых соединений Формулы 1 представлены в табл. 1.
Соединения согласно данному изобретению обладают сродством по отношению к рецепторам эндогенного гормона шишковидного тела мелатонина, что определено анализом методом рецепторного связывания, как описано выше в табл. 1 для рецепторов ML1a (человека). Мелатонин участвует в регуляции ряда биологических ритмов и проявляет свое биологическое действие, взаимодействуя со специфическими рецепторами. Это факт, что введение агонистов мелатонина находит применение в клинике при лечении различных состояний, регулируемых действием мелатонина. Такие состояния включают депрессию, нарушение суточного ритма организма, синдром сдвига времени работы, расстройства сна, глаукому, нарушения, связанные с репродукцией, рак, доброкачественную гиперплазию простательной железы, расстройства иммунной и нейроэндокринной систем.
Для терапевтического применения фармакологически активные соединения Формулы 1 обычно следует назначать в виде фармацевтических композиций, содержащих в качестве (или только одного, или одного из) основного активного ингредиента, по меньшей мере одно такое соединение в сочетании с твердым или жидким фармацевтически приемлемым носителем и, возможно, но не обязательно, фармацевтически приемлемыми адъювантами и наполнителями с применением стандартных общепринятых методик.
Фармацевтические композиции включают соответствующие формы дозировки для перорального, парентерального (включая подкожное, внутримышечное, интрадермальное-внутрикожное и внутривенное), трансдермального, бронхиального или назального введения. Следовательно, если употребляется твердый носитель, препарат может быть таблетирован, помещен в твердые желатиновые капсулы в виде порошка или гранул, или быть в виде пастилок или лепешек. Твердый носитель может содержать обычные эксципиенты, такие как связующие, наполнители, смазки для таблетирования, расщепляющие агенты, увлажняющие агенты и тому подобное. Если требуется, таблетки могут быть покрыты оболочкой обычными методами. Если применяется жидкий носитель, препарат может быть в виде сиропа, мягкой желатиновой капсулы, стерильного раствора для инъекции и водной и неводной жидкой суспензии, или может быть в виде сухого продукта, который разводится водой или другим соответствующим носителем перед употреблением. Жидкие препараты могут содержать обычные добавки, такие как суспендирующие средства, эмульгаторы, увлажнители, неводные растворители (включая пищевые масла), консерванты, а также вкусовые добавки и/или красители. Для парентарального введения растворитель обычно представляет собой стерилизованную воду, по меньшей мере, в основном, хотя могут применяться также солевые растворы, растворы глюкозы и тому подобное. Для инъекций могут также применяться суспензии, в этом случае используют обычные суспендирующие средства. Обычные консерванты, реагенты для буферизации и тому подобное также могут входить в формы дозировки для парентерального введения. Особенно применимо назначение соединения Формулы 1 в виде рецептур для перорального приема. Фармацевтические композиции получают соответствующими методами, подходящими для требуемой рецептуры, содержащей соответствующие количества активного ингредиента, то есть соединения Формулы 1 согласно данному изобретению. См., например, Remington's Pharmaceutical Sciences. Mack Publishing Company, Easton, PA, 17-е издание, 1995.
При приготовлении фармацевтических композиций, содержащих соединения согласно данному изобретению, активный(е) ингредиент(ы) обычно смешивают с носителем, или разбавляют носителем, или помещают в носитель, который может иметь форму капсулы, саше, бумажной или другой упаковки. Когда носитель служит разбавителем, он может быть твердым, полутвердым или жидким, который играет роль растворителя, наполнителя или среды для активного ингредиента. Следовательно, композиция может быть в форме таблеток, драже, порошков, лепешек, саше, облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (в твердом виде или в жидкости), мазей, содержащих, например, до 10% весовых активного соединения, мягких и твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекций и стерильно упакованных порошков.
Некоторые примеры соответствующих носителей и разбавителей включают лактозу, декстрозу, сахарозу, сорбит, маннит, крахмалы, аравийскую камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп, метилцеллюлозу, метил- и пропил-гидроксибензоаты, тальк, стеарат магния и минеральное масло. Препараты могут дополнительно содержать смазки, увлажнители, эмульгаторы и суспендирующие средства, консерванты, подсластители и вкусовые добавки. Композиции согласно данному изобретению могут быть приготовлены таким образом, чтобы обеспечить быстрое, пролонгированное или замедленное высвобождение активного ингредиента после введения больному.
Дозировка соединения Формулы 1, обеспечивающая лечебное действие, будет зависеть не только от таких факторов, как возраст, вес и пол больного, и способа введения, а также от требуемой степени мелатонергической активности и эффективности конкретного соединения, применяемого для конкретного нарушения или состояния. Также предполагается, что лечение и дозировка конкретного соединения назначаются в виде стандартной дозы и что стандартную дозу подбирает специалист в данной области так, чтобы она отражала относительную степень активности. Решение о конкретной дозировке (и о том, сколько раз в день надо принимать) остается за врачом и может меняться корректировкой дозировки в зависимости от обстоятельств согласно данному изобретению для того, чтобы получить нужный терапевтический эффект.
Композиции предпочтительно готовят в виде стандартных доз, причем каждая доза содержит от, примерно, 0,1 до 100 мг, обычно от 1 до 10 мг активного ингредиента. Термин "унифицированная (стандартная) доза" относится к физически самостоятельным единицам, соответствующим единичным дозам для человека и других млекопитающих, причем каждая единица содержит заранее установленное количество активного материала, вычисленное с расчетом добиться заданного терапевтического эффекта, в сочетании с нужным фармацевтическим носителем.
Эти активные соединения эффективны в широком интервале доз. Например, ежедневная доза обычно колеблется в интервале от 0,1 до 500 мг. При лечении взрослых предпочтителен интервал от, примерно, 0,1 до 10 мг/день, в виде однократной дозы или многократных доз. Соединения согласно данному изобретению можно применять для лечения расстройств сна и родственных нарушений по способу, сходному с таковым, применяемым в случае мелатонина.
Однако, следует понимать, что на практике назначаемое количество соединения определяется врачом в зависимости от релевантных обстоятельств, включая состояние больного, выбор соединения, которое следует принимать, выбранный способ введения, возраст, вес и реакцию индивидуального больного и тяжесть симптомов у больного.
Соединения, которые входят в состав данного изобретения, способы их получения и их биологическая активность будут более понятны в результате рассмотрения следующих примеров, которые даны только в качестве иллюстрации и которые не ограничивают область и объем данного изобретения.
ОПИСАНИЕ КОНКРЕТНЫХ ВАРИАНТОВ ДАННОГО ИЗОБРЕТЕНИЯ
В следующих примерах, призванных проиллюстрировать вышеописанные синтетические методы,
все температуры даны в градусах Цельсия и температуры плавление не корректированы. Спектры протонного магнитного резонанса (1Н ЯМР) снимались в указанных растворителях и химические сдвиги
даны в единицах d, сдвиг в слабое поле относительно внутреннего стандарта тетраметилсилана (ТМС), а величины констант спин-спинового взаимодействия даны в герцах (Гц). Мультиплетность сигнала
обозначена следующим образом: с, синглет; д, дублет; т, триплет; кв, квадруплет; м, мультиплет; уш, уширенный сигнал; дд, дублет дублетов; уш.д, уширенный дублет; дт, дублет триплетов; уш.с, уширенный
синглет; дкв, дублет квадруплетов. Описание ИК-спектров включает только характеристические длины волн (см-1) функциональных групп. ИК-спектры регистрировали, используя чистые соединения в
тонком слое, либо в виде прессовки с KBr. Оптическое вращение [а]D25 определяли в указанных растворителях при указанных концентрациях. Данные элементного анализа указаны
в весовых процентах.
МЕТОДЫ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ ФОРМУЛЫ 1
Метод получения 1
Бензофуран-4-карбоксальдегид
Стадия 1:
N-метокси-N-метил-бензофуран-4-карбоксамид
Смесь бензофуран-4-карбоновой кислоты [Eissenstat, et al., J. Medicinal Chemistry, 38 (16) 3094-3105 (1995)] (2.8 г, 17.4 ммоль и тионилхлорида (25
мл) кипятят с обратным холодильником в течение 2 ч и затем концентрируют в вакууме. Твердый остаток растворяют в этилацетате (50 мл) и добавляют при перемешивании раствор гидрохлорида N,
O-диметилгидроксиламина в насыщенном NaHCO3 (60 мл). После перемешивания в течение 1.5 ч этилацетатный слой отделяют. Водный слой экстрагируют этилацетатом. Этилацетатные экстракты
объединяют, промывают насыщенным NаНСО3 и концентрируют в вакууме с получением масла (3.2 г, 95.4%).
Стадия 2: Бензофуран-4-карбоксальдегид
Раствор
N-метокси-N-метил-бензофуран-4-карбоксамида (3.2 г, 16.6 ммоль) в ТГФ (100 мл) охлаждают до -45oС и затем добавляют LiАlH4 (0.7 г, 18.7 ммоль). Смесь перемешивают в течение 15
мин, затем нагревают до -5oС, и затем снова охлаждают до -45oС. Добавляют при энергичном перемешивании насыщенный KHSO4 (25 мл), и затем смесь оставляют нагреваться до
комнатной температуры. Выпавший осадок отфильтровывают и промывают ацетоном. Фильтрат концентрируют в вакууме с получением масла (2.3 г, 94%).
Метод получения 2
2.3-Дигидробензофуран-4-карбоксальдегид
Стадия 1: 2.3-Дигидробензофуран-4-карбоновая кислота
Бензофуран-4-карбоновую кислоту (10.0 г, 61.7 ммоль) гидрируют (60 psi) (413.7 кПа) в
уксусной кислоте (100 мл) над 10% Pd/C (2 г) в течение 12 ч. Смесь фильтруют, и фильтрат разбавляют водой (500 мл) с получением 2,3-дигидробензофуран-4-карбоновой кислоты в виде белого порошка (8.4 г,
83%). Вещество перекристаллизовывают из изопропанола с получением прекрасных белых игл (т.пл. 185.5-187.5oС).
Стадия 2: (2,3-Дигидробензофуран-4-ил)метанол
Раствор
2,3-дигидробензофуран-4-карбоновой кислоты (10 г, 61 ммоль) в ТГФ (100 мл) перемешивают и медленно добавляют LiAlH4 (4.64 г, 122 ммоль). Смесь кипятят с обратным холодильником в течение 30
мин. Смесь охлаждают и разбавляют (гасят) этилацетатом и затем 1 N HCl (150 мл). Затем смесь подкисляют 1 N НCl пока весь неорганический осадок не растворится. Органический слой отделяют, а
неорганический слой дважды экстрагируют этилацетатом. Органические слои объединяют, промывают дважды рассолом и затем концентрируют в вакууме. Это масло перегоняют с дефлегматором с получением
прозрачного масла, которое кристаллизуется при охлаждении (8.53 г, 87.6%).
Стадия 3: 2.3-Дигидробензофуран-4-карбоксальдегид
ДМСО (8.10 мл, 114 ммоль) добавляют при -78oС к перемешиваемому раствору оксалилхлорида в CH2Cl2 (40 мл 2 М раствора). Добавляют по каплям раствор (2,3-дигидробензофуран-4-ил)метанола (8.53 г, 56.9 ммоль) в CH2Cl2 (35 мл) и раствор перемешивают при -78oС в течение 30 мин. Для гашения реакционной смеси осторожно добавляют триэтиламин (33 мл, 228 ммоль). Полученную суспензию
перемешивают при комнатной температуре в течение 30 мин и разбавляют CH2Cl2 (100 мл). Органический слой промывают три раза водой и дважды рассолом, и затем концентрируют в
вакууме до масла (8.42 г, 100%), которое используют без очистки.
Метод получения 3
2.3.4.5-Тетрагидробензоксепин-6-карбоксальдегид
Стадия 1: Этил
2-аллил-3-бензилоксибензоат
Смесь этил 2-аллил-3-гидроксибензоата (20.6 г, 100 ммоль), бензилбромида (18 г, 105 ммоль), карбоната калия (17 г, 123 ммоль) нагревают в ДМФА при 100oС
в течение 18 ч. Смесь охлаждают и разбавляют водой (500 мл), экстрагируют три раза этилацетатом. Этилацетатные экстракты сушат рассолом и концентрируют в вакууме до рыжевато-коричневого масла (29.6 г,
100%).
Стадия 2: Этил 2-(3-гидроксипропил)-3-бензилоксибензоат
Раствор этил 2-аллил-3-бензилоксибензоата (29.6 г, 100 ммоль) в ТГФ (300 мл) охлаждают до -10oС в
атмосфере азота. Добавляют по каплям раствор комплекса боран-ТГФ (110 мл 1 М раствора, 110 ммоль), и затем реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 1 ч. Затем
медленно добавляют раствор перекиси водорода (12 мл) в насыщенном NaHCO3 (200 мл), и смесь перемешивают в течение 30 мин. Смесь дважды экстрагируют этилацетатом. Этилацетатные экстракты
промывают водой, сушат рассолом и затем концентрируют в вакууме с получением прозрачного масла (27.6 г, 88%).
Стадия 3: Этил 2-(3-метансульфонилоксипропил)-3-бензилокси-бензоат
Раствор этил 2-(3-гидроксипропил)-3-бензилоксибензоата (10.19 г, 32.5 ммоль) и триэтиламина (4.05 г, 40 ммоль) в хлористом метилене (100 мл) охлаждают в бане со льдом и медленно добавляют
метансульфонилхлорид (2.79 мл, 36 моль). Удаляют баню со льдом и дают реакции нагреться до комнатной температуры в течение 1 часа. Смесь разбавляют водой и затем отделяют слой хлористого метилена.
Слой хлористого метилена промывают дважды водой, дважды 1 N НС1 и затем фильтруют через слой силикагеля с получением прозрачного раствора. Этот раствор концентрируют в вакууме с получением прозрачного
масла (12.4 г, 98%).
Стадия 4: Этил 2-(3-цианопропил)-3-бензилоксибензоат
Смесь этил 2-(3-метансульфонилоксипропил)-3-бензилоксибензоата (19.42 г, 31.7 ммоль) и цианистого
калия (2.28 г, 35 ммоль) в ДМФА (50 мл) нагревают при 100oС в течение 8 ч. Смесь охлаждают, разбавляют водой (250 мл) и экстрагируют три раза этилацетатом. Этилацетатные экстракты промывают
рассолом и концентрируют в вакууме. Сырой продукт хроматографируют на силикагеле с использованием хлористого метилена в качестве элюента и получают продукт в виде масла (5.25 г, 53%).
Стадия 5: 4-[2-Бензилокси-6-карбоксифенил]бутановая кислота
Смесь этил 2-(3-цианопропил)-3-бензилоксибензоата (5.25 г, 16.9 ммоль) в 5 N гидроксиде натрия (75 мл) кипятят с обратным
холодильником в течение 18 ч. Раствор охлаждают и подкисляют 12 N HCl. Белый твердый осадок отделяют и сушат на воздухе (5 г, 94%).
Стадия 6: 4-[2-Гидрокси-6-карбокси-фенил]бутановая
кислота
Раствор 4-[2-бензилокси-6-карбоксифенил] бутановой кислоты (5 г, 15.9 ммоль) в этаноле гидрируют при 60 psi (413.7 кПа) над 10% Pd/C (1 г). Смесь фильтруют и фильтрат концентрируют в
вакууме с получением белого твердого вещества (3.95 г, 99%).
Стадия 7: Этиловый эфир 4-[2-этоксикарбонил-6-гидроксифенил]-бутановой кислоты
Раствор
4-[2-гидрокси-6-карбокси-фенил] бутановой кислоты (7.84 г, 35 ммоль) в этаноле и серной кислоте (10 капель) кипятят с обратным холодильником в течение 18 ч. Раствор нейтрализуют бикарбонатом натрия и
охлаждают. Смесь фильтруют и фильтрат концентрируют в вакууме. Полученное масло растворяют в этилацетате, промывают водой, сушат над осушителем и концентрируют в вакууме с получением продукта в виде
масла (9.06 г, 92.4%).
Стадия 8: 4-[2-Этоксикарбонил-6-гидроксифенил]бутановая кислота
Этиловый эфир 4-[2-этоксикарбонил-6-гидроксифенил] бутановой кислоты (9.06 г, 32.4
ммоль) растворяют при комнатной температуре в растворе гидроксида калия (3.62 г, 64.6 ммоль) в воде (68 мл). Раствор перемешивают при комнатной температуре в течение 2 ч и затем подкисляют 12 N НСl.
Смесь дважды экстрагируют этилацетатом. Этилацетатные экстракты объединяют и экстрагируют 10%-ным водным карбонатом калия три раза. Эти водные экстракты подкисляют 12 N НСl и дважды экстрагируют
этилацетатом. Этилацетатные экстракты концентрируют в вакууме с получением белого твердого вещества (6.4 г, 79%).
Стадия 9: 4-[2-Этоксикарбонил-6-гидроксифенил]бутан-1-ол
Комплекс ВН3-ТГФ (56 мл 1 М раствора в ТГФ, 56 ммоль) медленно добавляют к раствору 4-[2-этоксикарбонил-6-гидроксифенил]бутановой кислоты в ТГФ при 0oС. Раствор перемешивают в
течение 2 ч и дают нагреться до комнатной температуры. Реакцию медленно гасят водной уксусной кислотой (5 мл 50%-ной) и перемешивают до прекращения выделения газа. Смесь концентрируют в вакууме до
суспензии, которую растворяют в холодном 10%-ном карбонате калия. Раствор дважды экстрагируют этилацетатом. Органические экстракты сушат над рассолом и концентрируют в вакууме до масла
желтовато-коричневого цвета, которое кристаллизуется при стоянии (5.14 г, 84.9%).
Стадия 10: Этил 2,3,4,5-тетрагидробензоксепин-6-карбоксилат
Раствор
4-[2-этоксикарбонил-6-гидроксифенил] бутан-1-ола (5.14 г, 21.6 ммоль) в ТГФ (20 мл) добавляют по каплям к охлажденному в бане со льдом раствору трифенилфосфина (7.37 г, 28.1 ммоль) и
диэтил-азодикарбоксилата (4.89 г, 28.1 ммоль) в ТГФ (60 мл). Реакционную смесь перемешивают 18 ч и концентрируют в вакууме. Остаток очищают с помощью хроматографии на силикагеле с использованием
хлористого метилена в качестве элюента с получением продукта в виде масла (2.85 г, 60%).
Стадия 11: 2,3,4,5-Тетрагидробензоксепин-6-метанол
Раствор этил 2,3,4,
5-тетрагидробензоксепин-6-карбоксилата (2.85 г, 13 ммоль) в ТГФ (30 мл) перемешивают и медленно добавляют LiAlH4 (1 г, 26 ммоль). Смесь перемешивают 18 ч и затем гасят, добавляя
последовательно воду (1 мл), 15%-ный гидроксид натрия (1 мл) и воду (3 мл). Смесь фильтруют и осадок на фильтре промывают этанолом. Фильтрат концентрируют в вакууме до масла (2.3 г, 100%).
Стадия 12: 2,3,4,5-Тетрагидробензоксепин-6-карбоксальдегид
ДМСО (1.85 мл, 26 ммоль) добавляют медленно к охлажденному до 78oС раствору оксалилхлорида в хлористом метилене
(10 мл 2 М раствора, 20 ммоль). К этому раствору добавляют медленно раствор 2,3,4,5-тетрагидробензоксепин-4-метанола (2.3 г, 13 ммоль) в хлористом метилене и смесь перемешивают при -78oС в
течение 30 мин. Медленно добавляют триэтиламин (7.53 мл, 52 ммоль) к реакционной смеси, которую затем доводят до комнатной температуры. Смесь разбавляют хлористым метиленом (50 мл), промывают водой и
затем рассолом. Органический слой концентрируют в вакууме до масла (2.28 г, 100%).
Метод получения 4
Бензофуран-7-карбоксальдегид
Стадия 1: Метил
2-аллилоксибензоат
Смесь аллилбромида (152.4 г, 1.27 моль), метилсалицилата (162.44 г, 1.06 моль) и карбоната калия (219.75 г, 1.59 моль) в ТГФ (600 мл) и ДМФА (600 мл) кипятят с обратным
холодильником в течение 6 ч. Смесь выливают в воду (3 л), экстрагируют три раза этилацетатом. Этилацетатные экстракты объединяют, промывают водой и сушат над рассолом. Этилацетатные экстракты
концентрируют в вакууме до желтого масла, которое перегоняют в вакууме с получением прозрачного масла (163.45 г, 80%).
Стадия 2: Метил 3-аллил-салицилат
Метил
2-аллилоксибензоат (163.45 г, 848 ммоль) нагревают при 220oС в течение 1 ч и затем вакуумной перегонкой получают продукт (163.5 г, 100%).
Стадия 3: Метил
бензофуран-7-карбоксилат
Через раствор метил 3-аллил-салицилата (30 г, 156 ммоль) при -78oС пропускают озон до исчезновения исходного вещества по ТСХ. Реакцию гасят
диметилсульфидом и перемешивают при комнатной температуре в течение 18 ч. Смесь концентрируют в вакууме и остаток растворяют в эфире. Эфирный раствор промывают три раза рассолом и затем концентрируют
в вакууме до зеленого масла. Это масло растворяют в толуоле и кипятят с серной кислотой (0.5 мл) с обратным холодильникомв течение 4 ч. Добавляют карбонат натрия (5 г), смесь охлаждают и затем
фильтруют. Фильтрат концентрируют в вакууме до темного масла, которое очищают с помощью хроматографии на силикагеле с использованием хлористого метилена в качестве элюента с получением продукта в виде
зеленого масла (12 г, 44%).
Стадия 4: Бензофуран-7-метанол
Раствор метил бензофуран-7-карбоксилата (5.34 г, 30 ммоль) добавляют к суспензии LiAlH4 (2.31 г, 61
ммоль) в ТГФ и затем кипятят с обратным холодильником в течение 30 мин. Реакционную смесь гасят этилацетатом и водой. Смесь подкисляют 12 N НСl пока весь осадок не растворится. Этилацетатный слой
отделяют, промывают водой, сушат над рассолом и концентрируют в вакууме с получением желтого масла (4.03 г, 91%).
Стадия 5: Бензофуран-7-карбоксальдегид
ДМСО (2.87 мл, 40
ммоль) добавляют медленно к охлажденному до -78oС раствору оксалилхлорида в хлористом метилене (20 мл 2 М раствора, 40 ммоль). К этому раствору добавляют медленно раствор
бензофуран-7-метанола (4.03 г, 27 ммоль) в хлористом метилене и смесь перемешивают при -78oС в течение 30 мин. Медленно добавляют триэтиламин (30 мл) к реакционной смеси, которую затем
доводят до комнатной температуры. Смесь разбавляют хлористым метиленом, промывают водой и затем рассолом. Органический слой концентрируют в вакууме до масла (3.16 г, 80%).
Метод
получения 5
2.3-Дигидро-бензофуран-7-карбоксальдегид
Стадия 1: Метил 2,3-дигидро-бензофуран-7-карбоксилат
Метил бензофуран-7-карбоксилат (12 г, 68 ммоль) гидрируют при 60
psi (413.7 кПа) над 10% Pd/C (2 г) в уксусной кислоте (60 мл) в течение 18 ч. Смесь фильтруют и фильтрат концентрируют в вакууме с получением светло-зеленого масла (12 г, 100%).
Стадия 2: 2,3-Дигидро-бензофуран-7-метанол
Метил 2,3-дигидро-бензофуран-7-карбоксилат (12 г, 68 ммоль) восстанавливают с помощью LiAlH4 (5.14 г, 136 ммоль) в ТГФ аналогично
вышеописанной методике с получением продукта в виде темного масла (8.13 г, 80%).
Стадия 3: 2,3-Дигидро-бензофуран-7-каобоксальдегид
Раствор 2,3-дигидро-бензофуран-7-метанола
(8.13 г, 54.5 ммоль) окисляют с использованием ДМСО, оксалилхлорида и триэтиламина аналогично вышеописанной методике с получением продукта в виде масла (7.7 г, 95%).
Метод получения
6
2,2-Диметил-2,3-дигидро-бензофуран-7-карбоксальдегид
Стадия 1: Этил-3-(2-метилпропенилокси)бензоат
Смесь 2-метил-3-хлорпропена (64.2 г, 710 ммоль), этил-3-гидроксибензоата
(48.21 г, 590 ммоль) и карбоната калия (122.3 г, 890 ммоль) в ТГФ (600 мл) и ДМФА (600 мл) кипятят с обратным холодильником в течение 6 ч. Смесь выливают в воду (3 л), экстрагируют три раза
этилацетатом. Этилацетатные экстракты объединяют, промывают водой, сушат над рассолом. Этилацетатные экстракты концентрируют в вакууме до желтого масла, которое перегоняют в вакууме с получением
бесцветного масла (112.9 г, 87%).
Стадия 2: Этил-2,2-диметил-2,3-дигидро-бензофуран-4-карбоксилат
Смесь этил-3-(2-метилпропенилокси)бензоата (23.6 г, 107 ммоль) перемешивают
со смолой SCX (2 г) при 220oС в течение 1 ч. Сырой продукт очищают с помощью
хроматографии на силикагеле с использованием хлористого метилена в качестве элюента с получением прозрачного
масла (8.7 г, 37%).
Стадия 3: 2,2-Диметил-2,3-дигидро-бензофуран-4-карбоновая кислота
Этил-2,2-диметил-2,3-дигидро-бензофуран-4-карбоксилат (10 г, 45 ммоль) кипятят с
обратным холодильником с гидроксидом натрия (16.3 мл 10 N раствора, 163 ммоль) в этаноле (50 мл) в течение 2 ч. Смесь концентрируют в вакууме, разбавляют водой и подкисляют 12 N НСl. Осадок
отфильтровывают и сушат на воздухе (8.6 г, 100%).
Стадия 4: 2,2-Диметил-2,3-дигидро-бензофуран-4-метанол
2,2-Диметил-2,3-дигидро-бензофуран-4-карбоновую кислоту (8.6 г, 45
ммоль) восстанавливают с помощью LiAlH4 (3.41 г, 89 ммоль) аналогично вышеописанной методике с получением продукта в виде прозрачного масла (7.35 г, 93%).
Стадия 5: 2,
2-Диметил-2,3-дигидро-бензофуран-4-карбоксальдегид
2,2-Диметил-2,3-дигидро-бензофуран-4-метанол (7.35 г, 41 ммоль) окисляют с использованием ДМСО, оксалилхлорида и триэтиламина аналогично
вышеописанной методике с получением продукта в виде прозрачного масла (8.87 г, 100%).
Метод получения 7
2-Метил-бензофуран-4-карбоксальдегид
Стадия 1: Этил
2-метил-бензофуран-4-карбоксилат
Через раствор этил-3-(2-метилпропенилокси)бензоата (10 г, 45 ммоль) при -78oС пропускают озон до исчезновения исходного вещества по ТСХ. Реакцию
гасят и продукт выделяют аналогично вышеописанной методике с получением продукта в виде белого твердого вещества (8.05 г, 87%).
Стадия 2: 2-Метил-бензофуран-4-метанол
Этил
2-метил-бензофуран-4-карбоновую кислоту (5.11 г, 26.6 ммоль) восстанавливают с помощью LiAlH4 (2 г, 53 ммоль) аналогично вышеописанной методике с получением продукта в виде прозрачного
масла (3.34 г, 78%).
Стадия 3: 2-Метил-бензофуран-4-карбоксадьдегид
2-Метил-бензофуран-4-метанол (3.34 г, 21 ммоль) окисляют с использованием ДМСО, оксалилхлорида и
триэтиламина аналогично вышеописанной методике с получением продукта в виде прозрачного масла (3.14 г, 93%).
Метод получения 8
2,3-Дигидро-1,
4-бензодиоксин-5-карбоксальдегид
2,3-Дигидроксибензальдегид (58 г, 420 ммоль) добавляют к кипящей смеси дибромэтана (107.4 г, 570 ммоль), гидроксида натрия (35.7 г, 890 ммоль) и
тетрабутиламмоний бромида (3 г) в воде (50 мл). После кипячения с обратным холодильником в течение 4 ч смесь охлаждают и органический слой отделяют, промывают основанием, сушат над сульфатом натрия
иконцентрируют в вакууме. Остаток перегоняют с дефлегматором при 135oС с получением продукта (48 г, 70%), который кристаллизуется при стоянии (т. пл. 61-62oС).
Анализ. Вычислено: С, 65.85; Н, 4.91.
Найдено: С, 65.73; Н, 4.86.
Метод получения 9
2Н-3,4-Дигидро-1,5-бензодиоксапин-6-карбоксальдегид
2,
3-Дигидроксибензальдегид и 1,3-дибромпропан (107.4 г, 570 ммоль), гидроксида натрия (35.7 г, 890 ммоль) взаимодействуют, как описано выше, с получением масла (43%).
Метод получения
10
(2Н-3,4-Дигидробензопиран-5-ил)карбоксальдегид
Стадия 1: (2Н-3,4-Дигидробензопиран-5-ил)карбоновая кислота
Комплекс ВН3-ТГФ (55 мл 1 М раствора в ТГФ, 55
ммоль) добавляют к раствору 2-аллил-3-гидроксибензоата (10.3 г, 50 ммоль) в ТГФ при -10oС. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 1 ч. Медленно
добавляют насыщенный раствор бикарбоната натрия (100 мл) и затем добавляют по каплям перекись водорода (6 мл). Смесь перемешивают в течение 30 мин, разбавляют этилацетатом (150 мл). Этилацетатный слой
отделяют, промывают водой, сушат над рассолом и концентрируют до прозрачного масла. Это вещество растворяют в ТГФ (100 мл) и медленно добавляют к раствору трифенилфосфина (20.85 г, 79.5 ммоль) и
диэтил-азодикарбоксилата (13.84 г, 79.5 ммоль) в ТГФ (250 мл). Раствор перемешивают в течение 18 ч и концентрируют в вакууме. Остаток перегоняют в вакууме с получением масла. Это масло очищают с
помощью хроматографии на силикагеле с использованием смеси этилацетата/хлористого метилена (1:1) в качестве элюента с получением прозрачного масла (11.3 г). Это масло кипятят в течение 2 ч с обратным
холодильником с гидроксидом натрия (25 мл 10 N раствора, 250 ммоль) и водой (50 мл). Реакционную смесь охлаждают и фильтруют. Фильтрат подкисляют 12 N соляной кислотой с получением белого твердого
осадка (7.96 г, 89%).
Стадия 2: (2Н-3,4-Дигидробензопиран-5-ил)метанол
(2Н-3,4-Дигидробензопиран-5-ил)карбоновую кислоту восстанавливают с помощью LiАlH4
аналогично вышеописанной методике с получением продукта (97%).
Стадия 3: (2Н-3,4-Дигидробензопиран-5-ил)карбоксальдегид
(2Н-3,4-Дигидробензопиран-5-ил)метанол окисляют с
использованием ДМСО, оксалилхлорида и триэтиламина аналогично вышеописанной методике с получением продукта в виде прозрачного масла (100%).
Метод получения 11
2-Метил-2,
3-дигидробензофуран-4-карбоксальдегид
Стадия 1: Этил 2-метил-2,3-дигидробензофуран-4-карбоксилат
Этил 2-метил-2,3-дигидробензофуран-4-карбоксилат (10 г), полученный как описано в
методике 7, гидрируют (60 psi) (413.7 кПа) в уксусной кислоте (100 мл) над 10% Pd/C (2 г) в течение 24 ч. Смесь фильтруют через целит и осадок на фильтре тщательно промывают этилацетатом. Фильтрат
концентрируют в вакууме с получением этил 2-метил-2,3-дигидробензофуран-4-карбоксилата.
Стадия 2: 2-Метил-2,3-дигидробензофуран-4-метанол
Раствор этил 2-метил-2,
3-дигидробензофуран-4-карбоксилата (10 г) в ТГФ (100 мл) перемешивают и медленно добавляют LiAlH4 (4.64 г, 122 ммоль). Смесь кипятят с обратным холодильником в течение 30 мин. Смесь
охлаждают и осторожно гасят этилацетатом и затем 1 N HCl (150 мл). Затем смесь подкисляют 12 N HCl пока весь неорганический осадок не растворится. Органический слой отделяют, а неорганический слой
дважды экстрагируют этилацетатом. Органические слои объединяют, промывают дважды рассолом и затем концентрируют в вакууме, что приводит к вышеназванному спирту.
Стадия 2: 2-Метил-2,
3-дигидробензофуран-4-карбоксальдегид
К раствору оксалилхлорида (51.6 мл 2 М раствора, 103.36 ммоль) в хлористом метилене (200 мл) при -78oС в атмосфере N2 добавляют по
каплям в течение 10 мин ДМСО (9.2 мл, 129.2 ммоль). После перемешивания в течение 20 мин добавляют по каплям в течение 10 мин раствор спирта (10.6 г, 64.6 ммоль) в хлористом метилене (50 мл).
Полученную смесь перемешивают в течение 1 ч. Добавляют триэтиламин (36 мл, 258.4 ммоль), доводят до комнатной температуры и перемешивают в течение 0.5 ч. Реакционную смесь гасят водой (30 мл),
промывают рассолом, сушат над MgSO4, концентрируют в вакууме с получением остатка. Остаток очищают флеш-хроматографией на силикагеле, элюирование 6% этилацетата в гексане дает 8.5 г (81%)
альдегида в виде масла.
МЕТОДЫ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ ФОРМУЛЫ 2
Метод получения 12
(транс)-3-(2,3-Дигидробензодиоксин-5-ил)пропеновая кислота
Смесь 2,3-Дигидробензодиоксин-5-карбоксальдегида (Vorishima, et al., ЕП-A-N309.766, 5 апреля 1989 г.) (9.25 г, 56.4 ммоль), малоновой кислоты (11.73 г, 112.8 ммоль), пирролидина (1 мл) и пиридина (25
мл) кипятят с обратным холодильником в течение 2 ч, охлаждают и затем выливают в ледяную воду (300 мл). Белый кристаллический осадок отфильтровывают, промывают 1 N HCl и сушат на воздухе (9.83 г,
84.6%).
Метод получения 13
Следующие соединения Формулы 2, (а)-(1) получают по общей методике, описанной для соединения в Методе получения 12.
(a)
(транс)-3- (2,3- Дигидробензофуран-4-ил) пропеновая кислота
Из 2,3-дигидробензофуран-4-карбоксальдегида по вышеописанной методике получают светло-желтый порошок, который кристаллизуют из
изопропанола с получением белых пластинок (95.3%, т. пл. 205-207oС).
Анализ. Вычислено для С11Н10О3: С, 69.46; Н, 5.30.
Найдено: С, 69.36; Н, 5.17.
(b) (транс)-3-(Бензофуран-4-ил)пропеновая кислота
Из бензофуран-4-карбоксальдегида по вышеописанной методике получают белый порошок (83%).
(c) (транс)-3-( 1,3-Бензодиоксол-4-ил)пропеновая кислота
Из 1,3-бензодиоксол-4-карбоксальдегида по вышеописанной методике получают белый порошок (99%).
(d)
(транс)-3-(2,3,4,5-Тетрагидробензоксепин-6-ил)пропеновая кислота
Этот продукт получают из 2,3,4,5-тетрагидробензоксепин-4-карбоксальдегида по вышеописанной методике в виде белого твердого
вещества (89%).
(е) (транс)-3-(Бензофуран-7-ил)пропеновая кислота
Этот продукт получают из бензофуран-7-карбоксальдегида по вышеописанной методике в виде белого твердого
вещества (100%).
(f) (транс)-3-(2,3-Дигидро-бензофуран-7-ил)пропеновая кислота
Этот продукт получают из 2,3-дигидро-бензофуран-7-карбоксальдегида по вышеописанной методике в
виде белого твердого вещества (100%).
(g) (транс)-3-(2,2-Диметил-2,3-дигидро-бензофуран-4-ил)пропеновая кислота
Этот продукт получают из 2,2-диметил-2,
3-дигидро-бензофуран-4-карбоксальдегида по вышеописанной методике в виде белого твердого вещества (81%).
(h) (транс)-3-(2-Метил-бензофуран-4-ил)пропеновая кислота
Этот
продукт получают из бензофуран-7-карбоксальдегида по вышеописанной методике в виде белого твердого вещества (97%).
(i) (транс)-3-(2,3-Дигидро-1,4-бензодиоксин-5-ил)пропеновая
кислота
2,3-Дигидро-1,4-бензодиоксан-5-карбоксальдегид реагирует с малоновой кислотой по вышеописанной методике с получением белого твердого вещества (90%).
(j)
(транс)-3-(2Н-3,4-Дигидро-1,5-бензодиоксапин-6-ил)пропеновая кислота
2Н-3,4-Дигидро-1,5-бензодиоксапин-6-карбоксальдегид реагирует с малоновой кислотой по вышеописанной методике с получением
белого твердого вещества (74%).
(k) (транс)-3-(2Н-2,3-Дигидробензопиран-4-ил)пропеновая кислота
(2Н-2,3-Дигидробензопиран-4-ил)карбоксальдегид реагирует с малоновой кислотой
по вышеописанной методике с получением белого твердого вещества (98%).
(l) (транс)-3-(2-Метил-2,3-дигидробензофуран-4-ил)пропеновая кислота
2-Метил-2,
3-дигидробензофуран-4-карбоксальдегид реагирует с малоновой кислотой по вышеописанной методике с получением вышеназванной кислоты (92%).
МЕТОДЫ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ
ФОРМУЛЫ 3
Метод получения 14
(транс)-N-Метокси-N-метил-3-(2,3-дигидробензодиоксин-5-ил)пропенамид
Смесь (транс)-3-(2,3-дигидробензодиоксин-5-ил)пропеновой кислоты (9.83 г,
47.7 ммоль), тионилхлорида (20 мл) и CH2Cl2 (75 мл) кипятят с обратным холодильником в течение 1 ч и затем концентрируют в вакууме с получением желто-зеленого твердого остатка.
Это вещество растворяют в этилацетате (75 мл) и добавляют при перемешивании раствор гидрохлорида N,О-диметилгидроксиламина (9.5 г) в насыщенном Nа2СО3 (100 мл). Смесь
перемешивают в течение 90 мин и затем разбавляют водой и этилацетатом. Этилацетатный слой отделяют и промывают дважды водой и дважды насыщенным рствором Nа2СО3. Этилацетатный
слой концентрируют в вакууме с получением коричневого масла. Этот сыройпродукт хроматографируют на силикагеле с использованием смеси 1:1 этилацетата/хлористого метилена в качестве элюента с получением
прозрачного масла, которое кристаллизуется при стоянии (11.1 г, 93.1%).
Метод получения 15
Следующие соединения Формулы 3, (a)-(k) получают по общей методике, описанной для
соединения в Методе получения 14.
(a) (транс)-N-Метокси-N-метил-3-(бензофуран-4-ил)пропенамид
Из (транс)-3-(бензофуран-4-ил)пропеновой кислоты по вышеописанной методике
получают масло (97.7%).
(b) (транс)-N-Метокси-N-метил-3-( 2,3,4,5-тетрагидробензоксепин-6-ил)пропенамид
Этот продукт получают из (транс)-3-(2,3,4,
5-тетрагидробензоксепин-6-ил)пропеновой кислоты по вышеописанной методике (88.6%).
(c) (транс)-N-Метокси-N-метил-3-(бензофуран-7-ил)пропенамид
Этот продукт получают из
(транс)-3-(бензофуран-7-ил)пропеновой кислоты по вышеописанной методике (90%).
(d) (транс)-N-Метокси-N-метил-3-(2,3-дигидро-бензофуран-7-ил)пропенамид
Этот продукт получают
из (транс)-3-(2,3-дигидро-бензофуран-7-ил)пропеновой кислоты по вышеописанной методике (68%).
(е) (транс)-N-Метокси-N-метил-3-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)пропенамид
Этот продукт получают из (транс)-3-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)пропеновой кислоты по вышеописанной методике (92%).
(f)
(транс)-N-Метокси-N-метил-3-(2-метил-бензофуран-4-ил)пропенамид
Из (транс)-3-(2-метил-бензофуран-4-ил)пропеновой кислоты по вышеописанной методике (100%).
(g)
(транс)-N-Метокси-N-метил-3-(2,3-дигидро-1,4-бензодиоксин-5-ил)пропенамид
Этот продукт получают из (транс)-3-(2,3-дигидро-1,4-бензодиоксан-5-ил)пропеновой кислоты по вышеописанной методике
(85%).
(h) (транс)-N-Метокси-N-метил-3-(2Н-3,4-дигидро-1,5-бензодиоксапин-6-ил)пропенамид
Этот продукт получают из (транс)-2Н-3-(3,4-дигидро-1,
5-бензодиоксапин-6-ил)пропеновой кислоты по вышеописанной методике (86%).
(i) (транс)-N-Метокси -N-метил-3-(2Н -2,3-дигидробензопиран-4-ил)пропенамид
Этот продукт получают из
(транс)-3-(2Н-2,3-дигидробензопиран-4-ил)пропеновой кислоты по вышеописанной методике (количественный выход).
(j) (транс)-N-Метокси-N-метил-3-( 1,3-бензодиоксол-4-ил)пропенамид
Из 1,3-бензодиоксол-4-карбоксальдегида по вышеописанной методике получают красное масло (100%).
(k) (транс)-N-Meтокси-N-метил-3-( 2,3-дигидро-бензофуран-4-ил)пропенамид
Диэтил-(N-метокси-N-метил-карбамоилметил)-фосфонат (4.0 г, 16.7 ммоль) добавляют по каплям к суспензии гидрида натрия (671 мг, 60% дисперсия в минеральном масле, 16.7 ммоль) в ТГФ (75 мл) при 0oС. Добавляют по каплям раствор 2,3-дигидробензофуран-4-карбоксальдегида (3.0 г, 15.2 ммоль) в ТГФ (25 мл). Полученной суспензии дают нагреться до комнатной температуры. Спустя 18 ч добавляют
воду (60 мл) и раствор экстрагируют три раза этилацетатом. Органические экстракты объединяют, промывают водой и рассолом, сушат над К2СО3 и концентрируют с получением масла
красноватого цвета, 3.5 г (100%).
МЕТОДЫ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ ФОРМУЛЫ 4
Метод получения 16
(±)-(транс)-2-(2,
3-Дигидробензофуран-4-ил)циклопропанкарбоксальдегид
Стадия 1: (±)-(транс)-N-Метокси-N-метил-2-(2,3-дигидробензофуран-4-ил)циклопропанкарбоксамид
Триметилсульфоксоний йодид
(9.9 г, 45 ммоль) добавляют небольшими порциями к суспензии гидрида натрия (1.8 г, 45 ммоль) в ДМФА (120 мл). По окончании выделения паров (10 мин) добавляют по каплям раствор
(транс)-N-метокси-N-метил-3-(2,3-дигидробензофуран-4-ил)пропенамида (3.5 г, 15 ммоль) в ДМФА (60 мл), поддерживая температуру между 35-40oС. Смесь перемешивают в течение 3 ч при комнатной
температуре. Добавляют по каплям насыщенный раствор NH4Cl (50 мл) и смесь экстрагируют три раза этилацетатом. Органические экстракты объединяют, промывают Н2O и рассолом, сушат
над К2СО3 и концентрируют в вакууме с получением белого воскообразного вещества (3.7 г, 100%).
Стадия 2: (±)-(транс)-2-(2,
3-Дигидробензофуран-4-ил)циклопропанкарбоксальдегид
Раствор (±)-(транс)-N-Метокси-N-метил-2-(2,3-дигидробензофуран-4-ил)циклопропанкарбоксамида (3.7 г, 15 ммоль) в ТГФ (10 мл)
добавляют по каплям к энергично перемешиваемой суспензии LiAlH4 (683 мг, 18 ммоль) в ТГФ (50 мл) при -45oС, поддерживая все время температуру ниже -40oС. Удаляют
охлаждающую баню, реакционной смеси дают разогреться до -5oС, и затем реакцию снова быстро охлаждают до -45oС. Добавляют осторожно по каплям гидросульфат калия (3.4 г, 25.5
ммоль) в Н2О (50 мл), поддерживая все время температуру ниже -30oС. Удаляют охлаждающую баню и суспензию перемешивают при комнатной температуре в течение 30 мин. Смесь фильтруют
через целит и осадок на фильтре промывают эфиром. Объединенные фильтраты затем промывают холодной 1 N HCl, 1 N NaOH и рассолом. Фильтраты сушат над MgSO4 и концентрируют в вакууме с
получением прозрачного масла (2.6 г, 99%).
Метод получения 17
Следующие соединения Формулы 4, (a)-(k) получают по общей методике, описанной для соединения в Методе получения
16.
(а) (±)-(транс)-2-(Бензофуран-4-ил)циклопропанкарбоксальдегид
Из (транс)-N-метокси-N-метил-3-(бензофуран-4-ил)пропенамида по вышеописанной методике получают масло
(93.3%).
(b) (±)-(транс)-2-(Бензодиоксол-4-ил)циклопропанкарбоксальдегид
Из (тpaнc)-N-метокси-N-мeтил-3-(l,3-бензодиоксол-4-ил)пропенамида по вышеописанной методике
получают прозрачное масло (100%).
(с) (±)-(транс)-2-(2,3-Дигидробензодиоксан-5-ил)циклопропанкарбоксальдегид
Из (транс)-N-метокси-N-метил-3-(2,
3-дигидробензодиоксан-5-ил)пропенамида по вышеописанной методике получают оранжевое масло (90%).
(d) (±)-(транс)-2-(2,3,4,5-Тетрагидробензоксепин-6-ил)
циклопропанкарбоксальдегид
Этот продукт получают из (транс)-N-метокси-N-метил-3-(2,3,4,5-тетрагидробензоксепин-6-ил)пропенамида по вышеописанной методике (36%).
(e) (±
)-(транс)-2-(Бензофуран-7-ил)циклопропанкарбоксальдегид
Этот продукт получают из (транс)-N-метокси-N-метил-3-(бензофуран-7-ил)пропенамида по вышеописанной методике (67%).
(f)
(±)-(транс)-2-(2,3-Дигидробензофуран-7-ил) циклопропанкарбоксальдегид
Этот продукт получают из (транс)-N-метокси-N-метил-3-(2,3-дигидробензофуран-7-ил)пропенамида по вышеописанной
методике (55%).
(g) (±)-(транс)-2-(2,2-Диметил-2,3-дигидро-бензофуран-4-ил) циклопропанкарбоксальдегид
Этот продукт получают из (транс)-N-метокси-N-метил-3-(2,
2-диметил-2,3-дигидро-бензофуран-4-ил)пропенамида по вышеописанной методике (64%).
(h) (±)-(транс)-2-(2-Метил-бензофуран-4-ил) циклопропанкарбоксальдегид
Этот продукт
получают из (транс)-N-метокси-N-метил-3-(2-метил-бензофуран-4-ил)пропенамида по вышеописанной методике (100%).
(i) (транс)-2-(2,3-Дигидро-1,4-бензодиоксан-5-ил)
циклопропанкарбоксальдегид
Этот продукт получают из (транс)-N-метокси-N-метил-3-(2,3-дигидро-1,4-бензодиоксан-5-ил)пропенамида по вышеописанной методике (79%).
(j)
(транс)-2-(2Н-3,4-Дигидро-1,5-бензодиоксапин-6-ил)циклопропанкарбоксальдегид
Из (транс)-N-метокси-N-метил-3-(2Н-3,4-дигидро-1,5-бензодиоксапин-6-ил)пропенамида по вышеописанной методике
получают масло (55%).
(k) (±)-(транс)-2-(2Н-2,3-Дигидробензопиран-4-ил)циклопропанкарбоксальдегид
Этот продукт получают из (транс)-N-метокси-N-метил-3-(2Н-2,
3-дигидробензопиран-4-ил)пропенамида по вышеописанной методике (86%).
Метод получения 18
(-)-(транс)-2-(2,3-Дигидробензофуран-4-ил) циклопропанкарбоксальдегид
Стадия
1: (-)-(транс)-N-[3-(2,3-Дигидробензофуран-4-ил)-пропеноил] -2,10-камфорсультам
К раствору (-)-2,10-камфорсультама (8.15 г, 37.9 ммоль) в 50 мл толуола при 0oС добавляют гидрид
натрия (1.67 г, 41.7 ммоль). После перемешивания в течение 0.33 ч при 0oС и 0.5 ч при 20oС и повторного охлаждения до 0oС прибавляют по каплям раствор 3-(2,
3-дигидробензофуран-4-ил)-2-пропеноилхлорида (37.9 ммоль), приготовленного in situ из соответствующей кислоты и тионилхлорида (75 мл), в толуоле (50 мл). После перемешивания в течение 18 ч при 20oС смесь разбавляют этилацетатом и промывают водой, 1 N HCl и 1 N NaOH. Органический раствор сушат и концентрируют в вакууме с получением 15.8 г сырого продукта. Перекристаллизация из смеси
этанол-метанол (600 мл, 1:1) приводит к продукту (13.5 г, 92%, т. пл. 199.5-200oС).
Стадия 2: (-)-N-[[(транс)-2-(2,3-Дигидробензофуран-4-ил)-циклопропил]-карбонил]-2,
10-камфорсультам
1-Метил-3-нитро-1-нитрозогуанидин (23.88 г, 163 ммоль) добавляют порциями к смеси 10 N гидроксида натрия (60 мл) и эфира (200 мл) при 0oС. Смесь энергично
встряхивают в течение 0.25 ч и эфирный слой тщательно декантируют в раствор (-)-(тpaнc)-N-[3-(2,3-дигидробензофуран-4-ил)-пропеноил]-2,10-камфорсультама (9.67 г, 25 ммоль) и ацетата палладия (35 мг) в
хлористом метилене (200 мл). После перемешивания в течение 18 ч к реакционной смеси добавляют уксусную кислоту (5 мл) и смесь перемешивают в течение 0.5 ч. Смесь промывают 1 N HCl, 1 N NaOH и
рассолом. Раствор сушат, концентрируют в вакууме и остаток дважды кристаллизуют из этанола с получением продукта (6.67 г, 66.5%, т. пл. 157-159oС).
Стадия 3:
(-)-(транс)-2-(2,3-Дигидробензофуран-4-ил)-циклопропан-метанол
Раствор (-)-N-[[(транс)-2-(2,3-дигидробензофуран-4-ил)-циклопропил] -карбонил]-2,10-камфорсультама (4.3 г, 10.7 ммоль) в ТГФ (50
мл) добавляют по каплям к смеси LiAlH4 (0.81 г, 21.4 ммоль) в ТГФ (50 мл) при -45oС. Смесь перемешивают в течение 2 ч, после чего ее нагревают до 10oС. Смесь снова
охлаждают до -40oС и гидролизуют добавлением насыщенного раствора KHSO4 (20 мл). Смесь перемешивают при комнатной температуре в течение 30 мин и фильтруют. Осадок промывают
дважды ацетоном. Объединенные фильтрат и ацетоновые промывки концентрируют в вакууме. Вязкий остаток растворяют в эфире, промывают 1 N NaOH и 1 N HCl, и затем сушат в вакууме с получением продукта
(2.0 г, 98.4%).
Стадия 4: (-)-(транс)-2-(2,3-Дигидробензофуран-4-ил)-циклопропан-карбоксальдегид
ДМСО (1.6 г, 21 ммоль) добавляют к оксалилхлориду в CH2Cl2 (7.4 мл 2 М раствора, 14.8 ммоль) при -78oС. Добавляют (-)-(транс)-2-(2,3-дигидробензофуран-4-ил)-циклопропан-метанол (2.0 г, 10.5 ммоль) в CH2Cl2 (15 мл).
Смесь перемешивают в течение 20 мин и затем добавляют триэтиламин (4.24 г, 42 ммоль). Смесь доводят до комнатной температуры и премешивают в течение 30 мин. Смесь разбавляют CH2Cl2 и промывают водой, 1 N HCl и затем 1 N NaOH. Органический слой сушат и концентрируют в вакууме с получением альдегидного продукта (1.98 г, 100%).
Метод получения 19
(-)-(транс)-2-(2,3-Дигидро-1,4-бензодиоксан-5-ил)циклопропанкарбоксальдегид
Стадия 1: (-)-(транс)-N-[3-(2,3-Дигидро-1,4-бензодиоксан-5-ил)-пропеноил] -2,10-камфорсультам
Из
(транс)-3-(2,3-дигидро-1,4-бензодиоксан-5-ил)-2-пропеновой кислоты по вышеописанной методике получают (88%, т. пл. 187-188oС).
Стадия 2: (-)-N-[[(транс)-2-(2,3-Дигидро-1,
4-бензодиоксан-5-ил)-циклопропил] -карбонил]-2,10-камфорсультам
Из (-)-(транс)-N-[3-(2,3-дигидро-1,4-бензодиоксан-5-ил)-пропеноил] -2,10-камфорсультама по вышеописанной методике получают (84%,
т. пл. 214-215oС, [а]D25 = -138.9).
Стадия 3: -(-)-(транс)-2-(2,3-Дигидро-1,4-бензодиоксан-5-ил)-циклопропанметанол
(-)-N-(транс)-[[3-(2,3-Дигидро-1,4-бензодиоксан-5-ил)-циклопропил] -карбонил] -2,10-камфорсультам восстанавливают LiAlH4 по вышеописанной методике и получают продукт в виде масла (100%).
Стадия 4: (-)-(транс)-2-(2,3-Дигидро-1,4-бензодиоксан-5-ил)-циклопропанкарбоксальдегид
(-)-(транс)-2-(2,3-Дигидро-1,4-бензодиоксан-5-ил)-циклопропан-метанол окисляют по
вышеописанной методике с получением альдегида в виде масла (100%), которое непосредственно используют в следующей реакции.
Метод получения 20
(+)-(транс)-2-(2-Метил-2,
3-дигидробензофуран-4-ил)циклопропан-карбоксальдегид и (-)-(транс)-2-(2-метил-2,3-дигидробензофуран-4-ил)циклопропан-карбоксальдегид
Стадия 1: (транс)-N-[3-(2-Метил-2,
3-дигидробензофуран-4-ил)-пропеноил] -2,10-камфорсультам
Из (транс)-N-[3-(2-метил-2,3-дигидробензофуран-4-ил)-2-пропеновой кислоты по вышеописанной методике получают вышеназванный сультам
(выход 95% на две стадии).
Стадия 2: N-(транс)-[[2-(2-Метил-2,3-дигидообензофуран-4-ил)-циклопропил] -карбонил]-2,10-камфорсультам
Из (транс)-N-[3-(2-метил-2,
3-дигидробензофуран-4-ил)-пропеноил] -2,10-камфорсультама по вышеописанной методике получают вышеназванное циклопропановое производное (61%).
Стадия 3: (транс)-2-(2-Метил-2,
3-дигидробензофуран-4-ил)-циклопропанметанол
N-(транс)-[[3-( 2,3-Дигидро-1,4-бензодиоксан-5-ил)-циклопропил] -карбонил] -2,10-камфорсультам восстанавливают LiAlH4 по вышеописанной
методике и получают вышеназванный спирт в виде смеси диастереомеров (96%). Смесь диастереомерных спиртов разделяют с помощью хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ) (Chiracel OD,
iPrOH/гексан) с получением как (+)-(транс)-2-(2-метил-2,3-дигидробензофуран-4-ил)-1-циклопропанметанола, так и (-)-(транс)-2-(2-метил-2,3-дигидробензофуран-4-ил)-1-циклопропанметанола.
Стадия 4: (+)-(транс)-2-(2-Метил-2,3-дигидробензофуран-4-ил)циклопропан-карбоксальдегид и (-)-(транс)-2-(2-метил-2,3-дигидробензофуран-4-ил)циклопропан-карбоксальдегид
Отдельно
(+)-(транс)-2-(2-метил-2,3-дигидробензофуран-4-ил)-1-циклопропанметанол и отдельно (-)-(транс)-2-(2-метил-2,3-дигидробензофуран-4-ил)-1-циклопропанметанол по отдельности окисляют по вышеописанной
методике с получением соответствующих вышеназванных альдегидов (выход 98 и 97% соответственно).
МЕТОДЫ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ ФОРМУЛЫ 5
Метод получения 21
2.2-Дифтор-3-(2-Метил-4-бензофуранил)циклопропанметанол, O-ацетат
Стадия 1: (транс)-3-(2-Метил-4-бензофуранил)-2-пропен-1-ол
Раствор (транс)-3-(2-метил-4-бензофуранил)-2-пропеновой
кислоты (2.53 г, 10.9 ммоль) в 30 мл безводного ТГФ медленно добавляют к смеси боргидрида натрия (592 мг, 16.6 ммоль) в 15 мл безводного ТГФ при комнатной температуре. Одновременно происходит
выделение водорода, реакционную смесь охлаждают до 0oС и прибавляют раствор I2 (1.72 г, 6.76 ммоль) в 15 мл ТГФ. Реакционную смесь перемешивают при 0oС в течение 1 ч,
доводят до комнатной температуры и перемешивают при комнатной температуре дополнительно в течение 3 ч. Затем реакционную смесь гасят 3 N НСl и водный слой экстрагируют эфиром. Объединенные
органические слои промывают 3 N NaOH и рассолом, затем сушат над MgSO4 и концентрируют в вакууме. Очистка на силикагеле (этилацетат/гексан) приводит к смеси аллилового спирта и насыщенного
спирта (10:1) с общим выходом 46%. Смесь вводят во вторую стадию.
Стадия 2: (транс)-3-(2-Метил-4-бензофуранил)-2-пропен-1-ол, O-ацетат
Уксусный ангидрид (1.20 мл, 12.6 ммоль)
добавляют к раствору смеси, содержащей (транс)-3-(2-метил-4-бензофуранил)-2-пропен-1-ол (полученной на предыдущей стадии) в 10 мл пиридина при -5oС. Реакционную смесь перемешивают при
комнатной температуре в течение 20 ч и затем разбавляют эфиром. Сырую смесь промывают 1 N HCl, насыщенным раствором NaHCO3, водой и рассолом, затем сушат над MgSO4, фильтруют и
сушат в вакууме. Очистка на силикагеле (этилацетат/гексан) приводит к смеси аллилового ацетата и насыщенного ацетата с общим выходом 73%.
Стадия 3:
2.2-Дифтор-3-(2-метил-4-бензофуранил)циклопропан-метанол, O-ацетат
К кипящему раствору O-ацетата (транс)-3-(2-метил-4-бензофуранил)-2-пропен-1-ола (0.1 г, 4.35 ммоль) в 10 мл диглима медленно
добавляют раствор ClF2CCOONa (5.0 г, 32.6 ммоль) в 10 мл диглима. Реакционный раствор перемешивают при 165oС в течение 1.5 ч, охлаждают до комнатной температуры и фильтруют через
целит. Фильтрат разбавляют эфиром и промывают большим количеством воды. Водные слои экстрагируют эфиром. Объединенные органические слои промывают водой и рассолом, раствор сушат над MgSO4.
Растворитель удаляют в вакууме. Очистка на силикагеле (этилацетат/гексан) приводит к O-ацетату 2,2-дифтор-3-(2-метил-4-бензофуранил)-циклопропанметанола (560 мг, 56%) в виде бесцветной жидкости.
1Н ЯМР (300 МГц, CDCl3) d 2.12 (с, 3Н); 2.25-2.36 (м, 1Н); 2.46 (с, 3Н); 2.76-2.88 (м, 1Н); 4.27-4.45 (м, 2Н); 6.47 (с, 1Н); 7.00 (д, 1Н. J = 7.5 Гц); 7.15 (т, 1Н, J = 7.5 Гц); 7.33 (д, 1Н, J = 7.5 Гц).
13С ЯМР (75 МГц, CDCl3) d 14.4; 18.4; 27.8 (т, J = 10.4 Гц); 29.8 (т, J = 10.4 Гц); 61.2; 101.2; 110.4; 113.5 (т, J = 286.7 Гц); 121.7; 123.3; 124.3; 129.7; 154.8; 156.2; 171.1.
МЕТОДЫ ПОЛУЧЕНИЯ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ ФОРМУЛЫ 7
Метод получения 22
(±)-(транс)-2-(2,
3-Дигидробензофуран-4 -ил)-циклопропанметанамин
Раствор (±)-(транс)-2-(2,3-дигидробензофуран-4-ил)-циклопропан-карбоксальдегида (2.6 г, 15 ммоль), гидрохлорида гидроксиламина (3.13 г,
45 ммоль) этанола (60 мл), воды (40 мл) и 10 N NaOH (4.5 мл, 45 ммоль) кипятят с обратным холодильником в течение 4 ч. Раствор охлаждают до комнатной температуры, разбавляют водой и этилацетатом.
Этилацетатный слой отделяют и промывают последовательно Н2О и рассолом. Этилацетатный экстракт сушат над К2СО3 и концентрируют в вакууме. Остаток растворяют в ТГФ (50
мл) и добавляют по каплям к охлажденной до -45oС суспензии LiAlH4 (1.06 г, 28 ммоль) в ТГФ (100 мл), поддерживая температуру ниже -40oС. Реакционную смесь доводят до
комнатной температуры и перемешивают в течение 2 ч. Реакционную смесь вновь охлаждают до -45oС и осторожно по каплям добавляют 1 N HCl (50 мл). Удаляют охлаждающую баню и суспензию
перемешивают при комнатной температуре в течение 30 мин. Полученную пасту затем разбавляют этиловым эфиром и экстрагируют 1 N HCl. Кислые экстракты объединяют, промывают этиловым эфиром, подщелачивают
50% раствором NaOH и экстрагируют хлористым метиленом. Дихлорметановые экстракты объединяют, промывают рассолом, сушат над К2СО3 и концентрируют в вакууме с получением
прозрачного масла (900 мг, 40%).
Метод получения 23
Следующие соединения Формулы 7, (а)-(m) получают по общей методике, описанной для соединения в Методе получения 22.
(a) (±)-(транс)-2-(Бензофуран-4-ил)циклопропанметанамин
Этот продукт получают из (±)-(транс)-2-(бензофуран-4-ил)-циклопропан-карбоксальдегида по вышеописанной
методике в виде масла (73.5%).
(b) (±)-(транс)-2-(1,3-Бензодиоксол-4-ил)циклопропанметанамин
Этот продукт получают из (±)-(транс)-2-(1,
3-бензодиоксол-4-ил)-циклопропан-карбоксальдегида по вышеописанной методике в виде красного масла (61%).
(c) (±)-(транс)-2-(2,3-Дигидробензодиоксан-5-ил)циклопропанметанамин
Этот продукт получают из (±)-(транс)-2-(2,3-дигидробензодиоксан-5-ил)-циклопропанкарбоксальдегида по вышеописанной методике в виде оранжевого масла (91,1%).
(d) (±
)-(транс)-2-(2,3,4,5-тетрагидробензоксепин-6-ил)циклопропанметанамин
Этот продукт получают из (±)-(транс)-2-(2,3,4,5-тетрагидробензоксепин-6-ил)циклопропан-карбоксальдегида по
вышеописанной методике (50%).
(e) (±)-(транс)-2-(Бензофуран-7-ил)циклопропанметанамин
Этот продукт получают из (±
)-(транс)-2-(бензофуран-7-ил)-циклопропанкарбоксальдегида по вышеописанной методике (66%).
(f) (±)-(транс)-2-(2,3-Дигидро-бензофуран-7-ил)циклопропанметанамин
Этот
продукт получают из (±)-(транс)-2-(2,3-дигидро-бензофуран-7-ил)-циклопропанкарбоксальдегида по вышеописанной методике (87%).
(g) (±)-(транс)-2-(2,2-Диметил-2,
3-дигидро-бензофуран-4-ил)циклопропанметанамин
Этот продукт получают из (±)-(транс)-2-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-циклопропанкарбоксальдегида по вышеописанной методике
(60%).
(h) (±)-(транс)-2-(2-Метил-бензофуран-4-ил)циклопропанметанамин
Этот продукт получают из (±
)-(транс)-2-(2-метил-бензофуран-4-ил)-циклопропанкарбоксальдегида по вышеописанной методике (63%).
(i) (транс)-2-(2,3-Дигидро-1,4-бензодиоксан-5-ил)циклопропанметанамин
Из
(транс)-2-(2,3-дигидро-1,4-бензодиоксан-5-ил)-циклопропан-карбоксальдегида по вышеописанной методике получают амин (67%), который превращают в фумарат (т.пл. 183-184oС).
(j) (транс)-2-(2Н-3,4-Дигидро-1,5-бензодиоксапин-6-ил)циклопропанметанамин
Из (транс)-2-(2Н-3,4-дигидро-1,5-бензодиоксапин-6-ил)-циклопропанкарбоксальдегида по вышеописанной методике получают
амин, который превращают в фумарат (65%, т.пл. 152-153oС).
Анализ. Вычислено для 0.3 Н2О: С, 59.92; H, 6.39; N, 4.11.
Найдено: С, 50.78; Н, 6.33; N, 4.01.
(k) (±)-(транс)-2-(2Н-2,3-дигидробензопиран-4-ил)циклопропанметанамин
Этот продукт получают из (±)-(транс)-2-(2Н-2,
3-дигидробензопиран-4-ил)-циклопропанкарбоксальдегида по вышеописанной методике (42%).
(1) (-)-(транс)-2-(2-Метил-2,3-дигидробензофуран-4-ил)циклопропанметанамин
Из
(-)-(транс)-2-(2-метил-2,3-дигидробензофуран-4-ил)циклопропанкарбоксальдегида по вышеописанной методике получают вышеназванный амин (71%).
(m) (+)-(транс)-2-(2-Метил-2,
3-дигидробензофуран-4-ил)циклопропанметанамин
Из (+)-(транс)-2-(2-метил-2,3-дигидробензофуран-4-ил)-циклопропанкарбоксальдегида по вышеописанной методике получают вышеназванный амин (59%).
Метод получения 24
(-)-(транс)-2-(2,3-Дигидробензофуран-4-ил)циклопропанметанамин
Смесь (-)-(транс)-2-(2,3-дигидробензофуран-4-ил)-циклопропанкарбоксальдегида (1.98 г,
10.5 ммоль), гидрохлорида гидроксиламина (2.29 г, 33 ммоль) и 30% NaOH (3.5 мл, 35 ммоль) в смеси 5:1 этанол/ вода (50 мл) нагревают на кипящей водяной бане течение 2 ч. Раствор концентрируют в
вакууме и остаток смешивают с водой. Смесь экстрагируют СН2Сl2. Органические экстракты сушат и концентрируют в вакууме с получением твердого остатка, который по данным
ЯМР-анализа является смесью цис- и транс-оксимов. Этот продукт растворяют в ТГФ (20 мл) и добавляют к раствору алана в ТГФ [полученному из LiAlH4 (1.14 г, 30 ммоль) и H2SO4 (1.47 г, 15 ммоль) при 0oС]. Реакционную смесь перемешивают в течение 18 ч и гасят последовательно водой (1.15 мл), 15% NaOH (1.15 мл) и затем водой (3.45 мл). Смесь фильтруют и
фильтрат концентрируют в вакууме. Остаток смешивают с эфиром и промывают водой и затем 1 N HCl. Кислые воды подщелачивают и экстрагируют хлористым метиленом. Экстракты сушат и концентрируют в вакууме
с получением аминного продукта (1.4 г, 70.5%). Амин превращают в фумаратную соль в этаноле (т.пл.: 197-198oС).
Анализ. Вычисл. для C12H15NO С4Н4O4: С, 62.94; Н, 6.27; N, 4.59.
Найдено: С, 62.87; Н, 6.31; N, 4.52.
Метод получения 25
(-)-(транс)-2-(1,
3-Бензодиоксол-4-ил)цикдопропанметанамин
Из (-)-(транс)-2-( 1,3-бензодиоксол-4-ил)циклопропанкарбоксальдегида по общей вышеописанной в Методе получения 24 методике получают твердое вещество
светло-коричневого цвета (52.6%).
Метод получения 26
(+)-(транс)-2-[(2,3-Дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метиламин
Стадия 1: Оксим (-)-(транс)-2-(2,
3-дигидро-1,4-6ензодиоксин-5-ил) циклопропанкарбоксальдегида
(-)-(транс)-2-(2,3-Дигидро-1,4-бензодиоксин-5-ил)циклопропан-карбоксальдегид взаимодействует с гидроксиламином по вышеописанной
методике с получением оксима в виде смеси изомеров.
Стадия 2: (+)-(транс)-2-[(2,3-Дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил]метиламин
Вышеописанный оксим восстанавливают
аланом в амин по вышеописанной методике с получением амина, который превращают в фумарат (80%, т.пл. 173-174oС для фумарата, [а]D25 = 6.15).
Анализ. Вычисл. для 0.5 Н2O: С, 58.36; Н, 6.10; N, 4.24.
Найдено: С, 58.36; Н, 6.09; N, 4.24.
Метод получения 27
2.2-Дифтор-3-(2-метил-4-бензофуранил)циклопропанметанамин
Стадия 1: 2,2- Дифтор-3- (2-метил-4-бензофуранил) циклопропанметанол
К перемешиваемому раствору O-ацетата 2,
2-дифтор-3-(2-метил-4-бензофуранил)циклопропанметанола (560 мг, 2.0 ммоль) в МеОН/ТГФ (10 мл, 3/1) добавляют порошкообразный КОН (560 мг, 10.0 ммоль). Полученный раствор перемешивают при комнатной
температуре в течение 2 ч. Растворитель удаляют в вакууме. Остаток разбавляют эфиром и водой. Водный слой экстрагируют эфиром и объединенные органические слои промывают насыщенным раствором NаНСО3, водой и рассолом. Растворитель удаляют в вакууме. Очистка на силикагеле (этилацетат/гексан) приводит к 2,2-дифтор-3-(2-метил-4-бензофуранил)циклопропанметанолу (420 мг, 88%) в виде белого
твердого вещества.
1Н ЯМР (300 МГц, CDCl3) d 1.67 (ш.с, 1Н); 2.19-2.31 (м, 1Н); 2.46 (с, 3Н); 2.73-2.80 (м, 1Н); 3.95-3.98 (м, 2Н); 6.51 (с, 1Н); 7.02 (д, 1Н, J = 7.5 Гц); 7.15 (т, 1Н, J = 7.5 Гц); 7.32 (д, 1Н, J = 7.5 Гц).
13С ЯМР (75 МГц, CDCl3) d 14.4; 29.3 (т, J = 10.4 Гц); 31.3 (т, J = 10.4 Гц); 60.1; 101.3; 110.2; 114.1 (т, J = 286.7 Гц); 121.7; 123.3; 124.7; 129.8; 154.7; 156.1.
Стадия 2: 4-[2-(Азидометил)-3,3-дифторциклопропил]-2-метилбензофуран
Триэтиламин (916 мл, 6.55 ммоль) и
CH3SO2Cl (355 мл, 4.59 ммоль) добавляют к раствору 2,2-дифтор-3-(2-метил-4-бензофуранил)циклопропанметанола (390 мг, 1.64 ммоль) в 15 мл СН2Сl2. Реакционную
смесь перемешивают при комнатной температуре в течение 0.5 ч и разбавляют СН2Сl2. Органический слой промывают водой и раствором NаНСО3 и сушат над безводным К2СО3. Удаление растворителя в вакууме приводит к сырому мезилату, который непосредственно используют в следующей стадии. Раствор мезилата и NаN3 (213 мг, 3.27 ммоль) в 12
мл CH2Cl2 нагревают при 70oС в течение 2.5 ч. Полученный раствор охлаждают до комнатной температуры и разбавляют этилацетатом и водой. Водный слой экстрагируют EtOAc.
Объединенные органические слои промывают водой и сушат над MgSO4. Удаление растворителя в вакууме приводит к 4-[2-(азидометил)-3,3-дифторциклопропил]-2-метилбензофурану (422 мг, 98%).
1Н ЯМР (300 МГц, CDCl3)) d 2.16-2.28 (м, 1Н); 2.47 (с, 3Н); 2.74-2.81 (м, 1Н); 3.52-3.70 (м, 2Н); 6.49 (с, 1Н); 7.02 (д, 1Н, J = 7.5 Гц); 7.16 (т, 1Н, J = 7.5 Гц); 7.34 (д, 1Н, J = 7.5 Гц).
Стадия 3: 2.2-Дифтор-3-(2-метил-4-бензофуранил)циклопропанметанамин
Раствор 4-[2-(азидометил) -3,3-дифторциклопропил] -2-метилбензофурана (203 мг, 0.78
ммоль) в 4 мл ТГФ добавляют по каплям к раствору LiA1H4 (1.0 М раствор в ТГФ, 1.56 мл, 1.56 ммоль) при -30oС. Полученный раствор доводят до комнатной температуры и перемешивают
при комнатной температуре в течение 3 ч. К реакционной смеси при -30oС добавляют раствор KHSO4 (130 мг, 0.96 ммоль) в 1 мл воды. После перемешивания при комнатной температуре в
течение 20 мин реакционный раствор фильтруют и фильтрат разбавляют СН2Сl2. Раствор доводят до рН = 10 добавлением NH4OH. Водный слой экстрагируют CH2Cl2. Объединенные органические слои промывают рассолом и сушат над К2СО3. Растворитель удаляют в вакууме и получают 2,2-дифтор-3-(2-метил-4-бензофуранил)-циклопропанметанамин
(182 мг, 99%) в виде бесцветной жидкости.
ПРИМЕРЫ
Следующие примеры иллюстрируют получение соединений по данному изобретению по общим методикам, описанным выше.
Пример 1
(±)-(транс)-N-[[2-(2,3-Дигидробензофуран-4-ил)циклопроп-1-ил]метил]ацетамид
Уксусный ангидрид (0.14 мл, 1.8 ммоль) добавляют по каплям к перемешиваемому
раствору (±)-(транс)-2-(2,3-дигидробензофуран-4-ил)циклопропанметанамина (300 мг, 1.6 ммоль) и триэтиламина (0.67 мл, 4.8 ммоль) в сухом хлористом метилене (15 мл) при 0oС.
Полученную суспензию доводят до комнатной температуры и перемешивают в течение 18 ч. Смесь концентрируют в вакууме и остаток очищают флеш-хроматографией (силикагель, СH2Сl2 и
затем 2% EtOAc/ CH2Cl2) с получением 200 мг (54%) прозрачного масла.
ИК (NaCl, тонкий слой): 3287, 2923, 1651, 1553, 1459 см-1.
Анализ. Вычисл. для С14Н17NО2•0.3 Н2О: С, 71.04; Н, 7.50; N, 5.92.
Найдено: С, 70.79; Н, 7.41; N, 5.58.
Пример 2
(-)-(Tpaнc)-N-[[ 2-(2,3-Дигидробензофуран -4-ил)циклопроп-1 -ил] метил] пропанамид
Это соединение получают аналогично по вышеприведенной методике с использованием пропионилхлорида и
(-)-(транс)-2-(2,3- дигидробензофуран-4-ил)циклопропанметанамина, что приводит к маслу, которое кристаллизуется при стоянии в твердое вещество грязно-белого цвета (61%, т.пл. 71-72oС).
ИК (NaCl, тонкий слой): 3298, 1645, 1548, 1459, 1235 см-1.
[а]D25=-17.3.
Анализ. Вычисл. для С15 Н19NО2: С, 73.44; Н, 7.87; N, 5.71.
Найдено: С, 73.28; Н, 7.68; N, 5.58.
Следующие соединения Формулы 1 получают по этой общей методике (см. табл. 2).
Пример 95
N-[[2-(2-Метил-4-бензофуранил) -3,3-дифторциклопропанил]метил]пропанамид
Получен с выходом 95% в виде твердого вещества белого цвета. Т.пл.
55-56oС.
Анализ. Вычисл. для C16H17F2NO2: C, 65.52; Н, 5.84; N, 4.78.
Найдено: С, 66.15; Н, 5.95; N, 4.73.
Пример 96
(+)-(транс)-N-[[2-(3,4-Дигидро-2Н-1-бензопиран-5-ил)циклопроп-1-ил] метил]пропанамид
Получен с выходом 14% в виде твердого вещества белого цвета. Т.пл.
81-82oС. [а]D25 = 16.29. Чистота = 95% по ВЭЖХ.
1Н ЯМР (300 МГц, CDCl3) d 6.98 (т, J = 7.8 Гц, 1Н), 6.65 (д, J = 7.9 Гц, 1Н), 6.50 (д, J = 7.5 Гц, 1Н), 5.57 (с, 1Н), 4.13 (т, J = 4.5 Гц, 2Н), 3.49-3.30 (м, 2Н), 3.23-3.16 (м, 1Н), 2.84-2.78 (м, 1Н), 2.21 (кв, J = 7.6 Гц, 2Н), 2.07-1.99 (м, 2Н), 1.75-1.69 (м, 1Н), 1.26-1.09 (м, 4Н), 0.92-0.81 (м, 4Н).
13С ЯМР (75 МГц, CDCl3) d 173.9, 155.2, 141.1, 126.1, 117.6, 115.1, 66.0, 43.9, 30.0, 22.6, 20.9, 19.6, 12.7, 10.1.
Пример 97
(±)-(транс)-N-[[2-(3,4-Дигидро-2Н-1-бензопиран-5-ил)циклопроп-1-ил] метил]бутанамид
Получен с выходом 10% в виде желтого масла. Чистота = 87% по ЯМР.
1H ЯМР (300 МГц, СDСl3) d 6.95 (д, J = 7.8 Гц, 1Н), 6.60 (д, J = 7.4 Гц, 1Н), 6.50 (д, J = 7.9 Гц, 1Н), 5.58 (с, 1Н). 4.07 (т, J = 4.7 Гц, 2Н), 3.44-3.35 (м, 1Н), 3.25-3.11 (м, 1Н), 2.78-2.73 (м, 2Н), 2.13-1.08 (т, J = 7.3 Гц, 2Н), 2.02-1.94 (м, 2Н), 1.70-1.55 (м, 3Н), 1.23-1.09 (м, 1Н), 0.95-0.75 (м,5Н).
13С ЯМР (75 МГц, СDСl3) d 155.1, 141.0, 126.8, 122.1, 117.5, 115.1, 65.9, 43.8, 38.9, 22.5, 20.8, 19.5, 19.3, 13.9, 12.7.
Пример 98
(+)-(транс)-N-[[2-(3,4-Дигидро-1,
4-бензодиоксин-5-ил)циклопроп-1-ил] метил]ацетамид
Получен с выходом 18% в виде масла. [а]D25 = 5.89. Чистота = 99% по ВЭЖХ.
1H ЯМР (300 МГц, СDСl3) d 6.77-6.71 (м, 2Н), 6.50-6.44 (м, 1Н), 6.04 (с, 1Н), 4.36-4.33 (м, 2Н), 4.29-4.26 (м, 2Н), 3.70-3.62 (м, 1Н), 2.87-2.79 (м, 1Н), 1.99 (с. 3Н), 1.86-1.80 (м, 1Н), 1.15-1.00 (м, 2Н), 0.87-0.81 (м, 1Н).
13С ЯМР (75 МГц, СDСl3) d 143.3, 130.4, 120.9, 118.5, 115.4, 64.6, 64.1, 44.3, 23.4, 20.8, 16.3, 11.8.
Пример 99
N-[[2-(2-Метил-4-бензофуранил)-3.3-дифторциклопропанил]метил]ацетамид
Получен с выходом 90% в виде бесцветной жидкости. Чистота = 98% по ВЭЖХ.
1Н ЯМР (300 МГц, СDСl3) d 2.01 (с, 3Н); 2.17-2.29 (м, 1Н); 2.45 (с, 3Н); 2.70 (м, 1Н); 3.29 (м, 1Н); 3.92 (м, 1Н); 5.89 (ш.с, 1Н); 6.44 (с, 1Н); 6.97 (д, 1Н, J = 7.5 Гц); 7.13 (т, 1Н, J = 7.5 Гц); 7.31 (д, 1Н, J = 7.5 Гц).
13С ЯМР (75 МГц, CDCl3) d 14.2; 23.3; 28.4 (т, J = 10.0 Гц); 29.7 (т, J = 10.0 Гц); 37.3; 101.7; 110.2; 114.0 (т, J = 288 Гц); 121.3; 123.1; 124.4; 125.8; 154.6; 156.0; 170.4.
Пример 100
(транс)-N-Метил-N-[[2-(2,3-дигидробензофуран-4-ил)циклопропил] метил] пропанамид
К раствору (транс)-N-[[2-(2,
3-дигидробензофуран-4-ил)циклопропил]метил] пропанамида (120 мг, 0.6 ммоль) в ТГФ (1.5 мл) добавляют гидрид натрия (30 мг 60%-ного, 0.75 ммоль). Смесь перемешивают в течение 0.5 ч и добавляют йодметан
(140 мг, 1 ммоль). После перемешивания в течение 18 ч раствор концентрируют в вакууме. Остаток растворяют в ацетонитриле и промывают гексаном. Ацетонитрильный раствор концентрируют в вакууме и остаток
очищают с помощью хроматографии на силикагеле, элюируя смесью этилацетат-гексан (2: 8) с получением продукта в виде янтарного масла (90 мг, 69%).
Анализ. Вычисл. для С16 Н21NО2•0,2 Н2О: С, 73.08; Н, 8.20; N, 5.33.
Найдено: С, 72.91; Н, 8.24; N, 5.23.
Пример 101
(транс)-N-[[2-(2,
3-Дигидро-5,7-дийодбензофуран-4-ил)циклопропил] метил] пропанамид
К раствору (тpaнc)-N-[ [2-(2,3-дигидробензофуран-4-ил)циклопропил]метил] пропанамида (245 мг, 1 ммоль) и тетраацетата свинца
IV (530 мг, 1.2 ммоль) в 1.5 мл уксусной кислоты добавляют йод (300 мг, 1.2 ммоль). Раствор перемешивают в течение 15 мин, за это время реакционная смесь затвердевает. Смесь разбавляют хлористым
метиленом и полученный раствор промывают водой и насыщенным раствором бикарбоната натрия и сушат. Раствор концентрируют в вакууме и остаток кристаллизуют из изопропилового эфира с получением продукта
(500 мг, 99%, т.пл. 198-199oС).
Анализ. Вычисл. для C15H17I2NO2: С, 36.24; Н, 3.45; N, 2.82.
Найдено: С, 36.29; Н, 3.59; N, 2.96.
Пример 102
(транс)-N-[[2-(2,3-Дигидро-5-йодбензофуран-4-ил)циклопропил] метил] пропанамид
К раствору 0.12 г (0.6 ммоль) (транс)-N-[[2-(2,
3-дигидробензофуран-4-ил)циклопропил]метил]пропанамида и 0.27 г (0.6 ммоль) тетраацетата свинца IV в 1 мл уксусной кислоты добавляют 0.075 г (0.25 ммоль) йода. Раствор перемешивают в течение 1.5 ч и
разбавляют хлористым метиленом. Полученный раствор промывают водой и насыщенным раствором бикарбоната натрия и сушат. Раствор концентрируют в вакууме и остаток очищают с помощью хроматографии на
силикагеле, элюируя смесью этилацетат-гексан, 3:7, содержащей 0.2% метанола, с получением продукта (25 мг, 11%, т.пл. 148-149oС).
Анализ. Вычисл. для C15H18INO2•0.1 H2O: С, 48.30; Н, 4.92; N, 3.75.
Найдено: С, 47.94; Н, 4.67; N, 3.70.
Реферат
Изобретение относится к новым производным бензодиоксола,
бензофурана, дигидробензофурана и бензодиоксана или их фармацевтически приемлемым сольватам общей формулы I
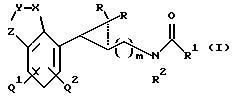
где Q1 и Q2 каждый означает независимо водород или галоген;
Х означает СН2, СН или кислород;
Y означает CR3, CR3 R4 или (СН2)n с n = 1-4;
Z означает СH2, СН или кислород;
R означает водород, галоген или алкил С1-4 в обоих случаях;
m означает 1 или 2;
R1 означает С1-6-алкил, С3-6-циклоалкил, С1-3-галоалкил, С1-6-алкиламино, С2-6-алкенил, С1-4 -алкокси(С1-4)алкил, С1-С4-алкилтио(С1-4)алкил или трифторметилалкил-С1-4;
R2 означает водород, галоген или C1-4 -алкил; и
R3 и R4 каждый независимо означает водород или C1-4-алкил,
и содержащим их фармацевтическим композициям для терапии расстройств сна, а также расстройств, связанных с нарушением циркадных ритмов. 3 с. и 14 з.п.ф-лы, 2 табл.
Формула

где Q1 и Q2 каждый означает независимо водород или галоген;
Х означает СН2, СН или кислород;
Y означает CR3, CR3R4 или (СН2)n с n = 1-4;
Z означает СН2, СН или кислород;
R означает водород, галоген или алкил С1-4 в обоих случаях;
m означает 1 или 2;
R1 означает С1-6-алкил, С3-6-циклоалкил, C1-3-галоалкил, С1-6-алкиламино, С2-6-алкенил, С1-4-алкокси(С1-4)алкил. С1-С4-алкилтио(С1-4)алкил или трифторметилалкил-С1-4;
R2 означает водород, галоген или С1-4-алкил; и
R3 и R4 каждый независимо означает водород или C1-4 -алкил.
(+)-N-[[2-(2, 3-дигидробензофуран-4-ил)циклопроп-1-ил]метил]пропанамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] ацетамид;
(-)-(транс)-N-[ [2-(2, 3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] бутанамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] метоксиацетамид;
(-)-(транс)-N-[[2-(2, 3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] циклопропанкарбоксамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] трифторацетамид;
(транс)-N-[[2-(2, 3-дигидро-2,2-диметил-бензофуран-4-ил)циклопроп-1-ил] метил]пропанамид;
(транс)-N-[[2-(2,3-дигидро-2,2-диметил-бензофуран-4-ил)циклопроп-1-ил] метил]бутанамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] ацетамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] пропанамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] бутанамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] циклопропан карбоксамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] -2-метилпропанамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] хлорацетамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]пропанамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]-2-метилпропанамид;
(-)-(транс)-N-[[2-(2-мeтил-2,3-дигидpoбeнзoфypaн-4-ил)циклoпpoп-1-ил] метил]ацетамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]метоксиацетамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]циклоропан карбоксамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]бутанамид;
(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил]метил]ацетамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] пропанамид;
(транс)-N-[[2-(2, 3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] пропанамид;
(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] бутанамид;
(транс)-N-[[2-(2,3-дигидро-5, 7-дииодбензофуран-4-ил)циклопроп-1-ил] метил]пропанамид;
(транс)-N-[[2-(2,3-дигидро-5-иодбензофуран-4-ил)циклопропил] метил] пропанамид;
(транс)-N-[[2-(3, 4-дигидро-2Н-1-бензопиран-5-ил)циклопроп-1-ил] метил] пропанамид;
(транс)-N-[[2-(3,4-дигидро-2Н-1-бензопиран-5-ил)циклопроп-1-ил] метил] циклопропан карбоксамид;
(транс)-N-[[2-(3, 4-дигидpo-2H-1-бeнзoпиpaн-5-ил)циклoпpoп-1-ил] метил] бутанамид; и
(+)-(транс)-N-[[2-(3,4-дигидро-2Н-1-бензопиран-5-ил)циклопроп-1-ил] метил]пропанамид.
(+)-N-[[2-(2,3-дигидробензофуран-4-ил)цикпопроп-1-ил]метил]пропанамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]ацетамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] бутанамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]циклопропан карбоксамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] ацетамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] пропанамид;
(+)-(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил]бутанамид;
(+)-(транс)-N-[ [2-(2-метил-бензофуран-4-ил)циклопроп-1-ил]метил]циклопропан карбоксамид;
(+)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]хлорацетамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]пропанамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]ацетамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]циклоропан карбоксамид;
(-)-(транс)-N-[[2-(2-метил-2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]бутанамид;
(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил]метил]ацетамид;
(-)-(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил]пропанамид;
(транс)-N-[[2-(2,3-дигидробензофуран-4-ил)циклопроп-1-ил] метил] пропанамид;
(транс)-N-[[2-(2, 3-дигидpoбeнзoфypaн-4-ил)циклoпpoп-1-ил] метил] бутанамид;
(транс)-N-[[2-(2,3-дигидро-5,7-дииодбензофуран-4-ил)циклопроп-1-ил] метил]пропанамид; и
(транс)-N-[[2-(2, 3-дигидро-5-иодбензофуран-4-ил)циклопроп-1-ил] метил] пропанамид.
(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил]метил]ацетамид;
(-)-(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил]метил]ацетамид;
(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил]метил]пропанамид;
(-)-(транс)-N-[[2-(1, 3-бензодиоксол-4-ил)циклопроп-1-ил] метил] пропанамид;
(транс)-N-[[2-( 1,3-бензодиоксол-4-ил)циклопроп-1-ил]метил]бутанамид;
(-)-(транс)-N-[[2-(1, 3-бензодиоксол-4-ил)циклопроп-1-ил]метил]бутанамид;
(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил] метил] циклопропан карбоксамид;
(-)-(транс)-N-[[2-(1, 3-бензодиоксол-4-ил)циклопроп-1-ил] метил] циклопропан карбоксамид;
(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил] метил] -2-метилпропанамид;
(-)-(транс)-N-[[2-(1, 3-бензодиоксол-4-ил)циклопроп-1-ил]метил]-2-метилпропанамид;
(-)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил]метил]пропанамид;
(-)-(транс)-N-[[2-(2,3-дигидро-1, 4-бензодиоксин-5-ил)циклопроп-1-ил]метил]ацетамид;
(-)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил]метил]циклопропан карбоксамид;
(-)-(транс)-N-[[2-(2,3-дигидpo-1, 4-бeнзoдиoкcин-5-ил)циклoпpoп-1-ил]метил]бутанамид;
(+)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил]метил]пропенамид;
(-)-(транс)-N-[[2-(2,3-дигидро-1, 4-бензодиоксин-5-ил)циклопроп-1-ил]метил]трифторацетамид;
(-)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил]метил]-3,3,3 -трифторпропанамид;
(+)-(транс)-N-[[2-(2, 3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил]метил]пропанамид;
(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил] ацетамид;
(транс)-N-[[2-(2,3-дигидpo-1, 4-бeнзoдиoкcин-5-ил)циклoпpoп-1-ил] метил] пропанамид;
(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил] бутанамид;
(транс)-N-[[2-(2,3-дигидро-1, 4-бензодиоксин-5-ил)циклопроп-1-ил] метил] -2-метилпропанамид; и
(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил] метил] циклопропан карбоксамид.
(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил]метил]ацетамид;
(-)-(транс)-N-[[2-(1, 3-бензодиоксол-4-ил)циклопроп-1-ил]метил]ацетамид;
(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил]метил]пропанамид; и
(-)-(транс)-N-[[2-(1,3-бензодиоксол-4-ил)циклопроп-1-ил] метил] пропанамид.
(-)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил]метил]пропанамид;
(-)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил]метил]ацетамид;
(-)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил]метил] циклопропан карбоксамид; и
(-)-(транс)-N-[[2-(2,3-дигидро-1,4-бензодиоксин-5-ил)циклопроп-1-ил]метил]бутанамид.
(-)-(транс)-N-[[2-(2-бензофуран-4-ил)пиклопроп-1-ил] метил] циклопропан карбоксамид;
(-)-(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил]метил]пропанамид;
(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил] метил] ацетамид;
(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил]метил]пропанамид;
(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил]метил]бутанамид;
(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил]метил]ацетамид;
(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил]метил]пропанамид;
(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил]метил]бутанамид;
(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил] метил]-2-метилпропанамид; и
(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил]метил]циклопропан карбоксамид.
(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил]метил]ацетамид;
(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил]метил]пропанамид;
(транс)-N-[[2-(2-метил-бензофуран-4-ил)циклопроп-1-ил]метил]бутанамид; и
(транс)-N-[[2-(бензофуран-4-ил)циклопроп-1-ил]метил]пропанамид.

Комментарии