Активатор kcnq2-5 каналов - RU2712163C2
Код документа: RU2712163C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение касается соединения, представленного общей формулой (I):

(где все символы имеют указанные ниже значения), его соли, сольвата или сокристалла (далее по тексту именуется также соединением по настоящему изобретению).
Предшествующий уровень техники
Было обнаружено, что у канала KCNQ существует пять подтипов, включая KCNQ1, KCNQ2, KCNQ3, KCNQ4 и KCNQ5. Среди них, KCNQ 2-5, в отличие от KCNQ1, экспрессированы в ноцицептивной сенсорной системе, например в спинномозговом ганглии или спинном мозге. Активация KCNQ2-5 канала приводит к гиперполяризации нервной клетки в ноцицептивном сигнальном пути.
Сообщалось, что активаторы KCNQ2-5 канала могут применяться для лечения множества нарушений, характеризующихся нарушениями возбуждения нейронов, включая эпилепсию, боль, мигрень и тревожные расстройства (см. Непатентный документ 1). И действительно, ретигабин как активатор KCNQ2-5 канала представлен на рынке в качестве противоэпилептического средства.
Также, в последние годы сообщалось, что ретигабин может применяться для лечения заболеваний мочевого пузыря (например, гиперактивности мочевого пузыря) (см. Непатентные документы 2 и 3).
Считается, что, поскольку гиперактивность мочевого пузыря обусловлена потенциальной гиперактивностью детрузора, антагонист мускаринового рецептора, который преимущественно подавляет сокращения мочевого пузыря, широко применялся для лечения гиперактивности мочевого пузыря. Однако мускариновый рецептор присутствует не только в мочевом пузыре, но также и в слюнной железе, кишечнике, ресничной мышце и тому подобных, и мускариновый рецептор также имеет функциональное значение. Следовательно, параллельно могут развиваться такие побочные реакции, как сухость во рту, констипация и нефелопсия. Также есть опасение, что подавление сокращений мочевого пузыря посредством антагониста мускаринового рецептора может приводить к таким побочным реакциям, как затруднение мочеиспускания, увеличение количества остаточной мочи и уродиализ. Следовательно, необходимое терапевтическое действие может не достигаться. Кроме того, в качестве лекарственного средства для устранения проблем, связанных с применением антагониста мускаринового рецептора, в 2011 году в Японии на рынок был выведен селективный агонист β3-адренорецептора. Предполагается, что селективный агонист β3-адренорецептора улучшает функцию сбора мочи посредством расслабления мочевого пузыря, и в то же время оказывает меньшее воздействие на функцию мочеиспускания. Так как селективный агонист β3-адренорецептора оказывает расслабляющее действие на мочевой пузырь без стимуляции сокращений, ожидается, что он будет эффективен для широкого круга пациентов. С другой стороны, его применение увеличивает риск удлинения интервала Q-T и повышает частоту сердечных сокращений вследствие воздействия на β-адренорецептор, что является ограничивающим применение фактором.
Как указано выше, в данной области существует потребность в лекарственном средстве, которое расслабляет мочевой пузырь без стимуляции сокращений и дает меньшее количество побочных эффектов. Ожидается, что активатор KCNQ2-5 канала будет представлять собой лекарственное средство, отвечающее обозначенным выше потребностям медицины.
К настоящему времени, в качестве активатора KCNQ, имеющего моноциклическую амидную структуру, известно, например, соединение, представленное общей формулой (a):

(где Za представляет собой O или S; qa равно 0 или 1; каждый Ra1 и Ra2 независимо выбран из группы, состоящей из атома галогена, циано-группы, амино-группы, C1-6-алкила (алкенила/алкинила) и т.д.; Ra3 выбран из группы, состоящей из C1-8-алкила (алкенила/алкинила), C3-8-циклоалкила (циклоалкенила), C3-8-циклоалкил (циклоалкенил)-C1-6-алкила (алкенила/алкинила), арил-C1-6-алкила (алкенила/алкинила), арил-C3-8-циклоалкила (циклоалкенила) и т.д.; Ra4 выбран из группы, состоящей из атома галогена, циано-группы, C1-6-алкила (алкенила/алкинила), C3-8-циклоалкила (циклоалкенила), C3-8-циклоалкил (циклоалкенил)-C1-6-алкила (алкенила/алкинила) и т.д. (определения групп были частично удалены) (см. Патентный документ 1).
Однако, соединение по настоящему изобретению не охватывается общей формулой (a) Патентного документа 1. Кроме того, в Патентный документ 1 не включены ни описания, ни рекомендации по методике получения соединения по настоящему изобретению из соединения, описанного в Патентном документе 1.
Также, в Патентном документе 2 описано следующее соединение:
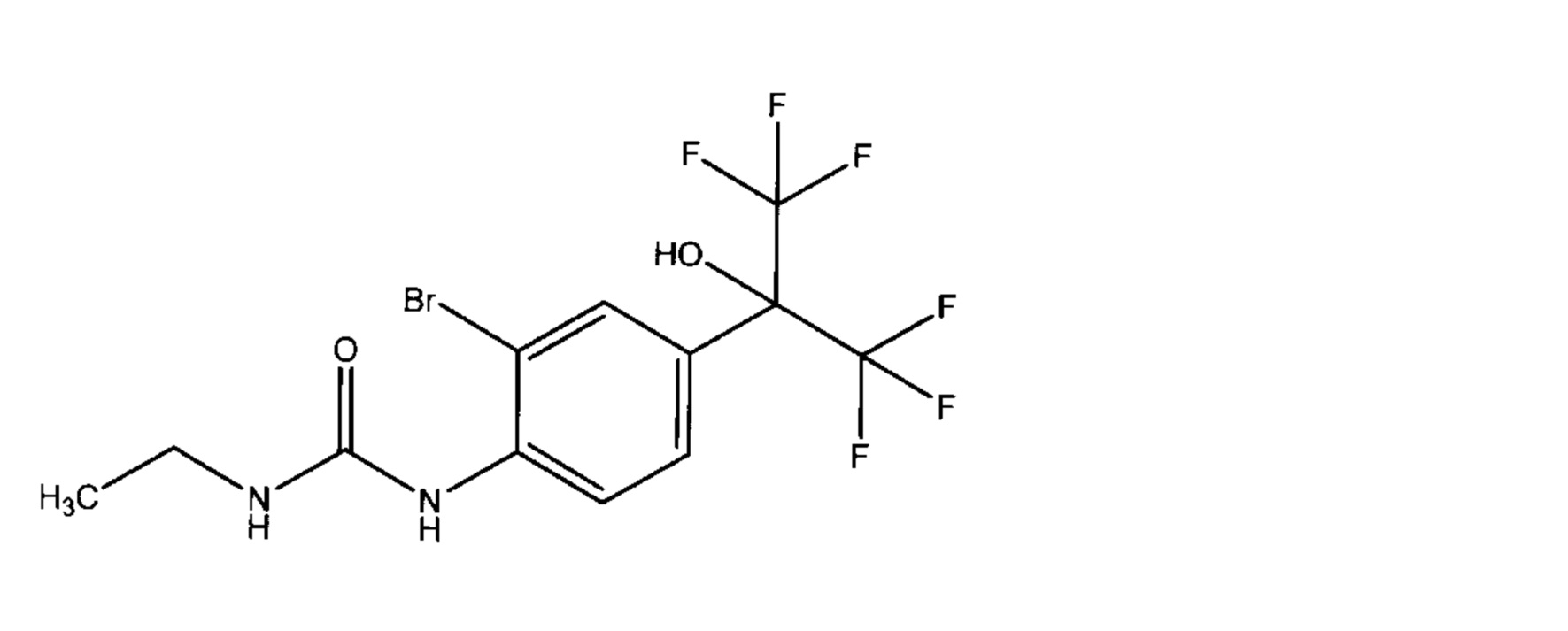
(N-этил-N'-[2-бром-4-(гексафтор-2-гидрокси-2-пропил)фенил]мочевина). Однако Патентный документ 2 касается соединения, обладающего гипотензивным действием, и не включает ни описания, ни предположения об активности в отношении KCNQ.
Список литературы
Патентные документы
Патентный документ 1: Международная заявка на патент WO2006/029623.
Патентный документ 2: Не прошедшая экспертизу заявка на патент Японии No. S51-82239.
Непатентные документы
Непатентный документ 1: Current Topics in Medicinal Chemistry, Vol. 6, p. 999-1023, 2006.
Непатентный документ 2: The Journal of Urology, Vol. 172, p. 2054-2058, 2004.
Непатентный документ 3: European Journal of Pharmacology, Vol. 638, p. 121-127, 2010.
Раскрытие изобретения
Техническая проблема
Целью настоящего изобретения является разработка соединения, оказывающего сильное открывающее действие на KCNQ2-5 каналы.
Решение обозначенной проблемы
Для решения вышеуказанной проблемы авторы настоящего изобретения провели тщательное исследование, в результате которого было обнаружено, что соединение по настоящему изобретению оказывает сильное открывающее действие на KCNQ2-5 каналы. Также авторы настоящего изобретения обнаружили, что соединение по настоящему изобретению обладает отличными показателями растворимости, устойчивости и/или безопасности. Таким образом, авторам удалось завершить настоящее изобретение.
А именно, настоящее изобретение касается следующего
(1) соединение, представленное общей формулой (1):

(где X1 представляет собой (1) атом азота или (2) C-R6; X2 представляет собой (1) атом азота или (2) C-R7; R11 представляет собой (1) OR1 или (2) NH2; R1 представляет собой (1) атом водорода или (2) C1-4 алкильную группу; каждый R2 и R3 независимо представляет собой (1) атом водорода или (2) C1-4 алкильную группу, которая может быть замещена атомом галогена, где R2 и R3 не могут оба одновременно представлять собой атом водорода; каждый R4, R5, R6 и R7 независимо представляет собой (1) атом водорода, (2) атом галогена, (3) C1-4 алкильную группу, которая может быть замещена атомом галогена, или (4) C1-4 алкокси-группу, которая может быть замещена атомом галогена, где R4 и R5 не могут оба одновременно представлять собой атом водорода; Y представляет собой (1) -NH-, (2) -O- или (3) связь; R8 представляет собой (1) атом водорода или (2) C1-4 алкильную группу, которая может быть замещена атомом галогена или гидрокси-группой; R9 представляет собой (1) цикл A, (2) C1-6 алкильную группу, (3) C2-6 алкенильную группу, (4) C2-6 алкинильную группу, (5) -C1-4 алкилен-цикл A, (6) -C2-4 алкенилен-цикл A, (7) -C2-4 алкинилен-цикл A, (8) -цикл B-цикл C, (9) -цикл B-C1-4 алкилен-цикл C, (10) -цикл B-C2-4 алкенилен-цикл C, (11) -цикл B-C2-4 алкинилен-цикл C или (12) -цикл B-O-цикл C, где каждая алкильная группа, алкенильная группа, алкинильная группа, алкиленовая группа, алкениленовая группа или алкиниленовая группа может быть замещена атомом галогена или гидрокси-группой; цикл A представляет собой (1) C3-8 циклоалкан, (2) 3-8-членный гетероциклоалкан, (3) C3-12 моноциклическое или бициклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, или (4) 3-12-членный моноциклический или бициклический ненасыщенный гетероцикл, содержащий от одного до четырех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным; каждый из циклов B и C независимо представляет собой (1) C3-8 циклоалкан, (2) 3-8-членный гетероциклоалкан, (3) C3-7 моноциклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, или (4) 3-7-членный моноциклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным; где каждый цикл A, цикл B и цикл C может быть независимо замещен одним-пятью R10, и при наличии нескольких R10, количество R10 может быть одинаковым или разным; R10 представляет собой (1) атом галогена, (2) гидрокси-группу, (3) циано-группу, (4) C1-6 алкильную группу, которая может быть замещена атомом галогена или гидрокси-группой, (5) C1-6 алкокси-группу, которая может быть замещена атомом галогена или гидрокси-группой, или (6) амино-группу, которая может быть замещена C1-4 алкильной группой или C2-5 ацильной группой (исключая N-этил-N'-[2-бром-4-(гексафтор-2-гидрокси-2-пропил)фенил]мочевину), его соль, сольват или сокристалл;
(2) соединение, описанное выше в п. (1), где Y представляет собой -NH- или связь, его соль, сольват или сокристалл;
(3) соединение, описанное выше в п. (1) или (2), где X1 представляет собой C-R6, и X2 представляет собой C-R7, его соль, сольват или сокристалл;
(4) соединение, описанное выше в любом из пп.(1) - (3), представленное общей формулой (II):

(где символы имеют значения, указанные выше в п. (1)), его соль, сольват или сокристалл;
(5) соединение, описанное выше в любом из пп.(1) - (4), где R1 представляет собой атом водорода, его соль, сольват или сокристалл;
(6) соединение, описанное выше в любом из пп.(1) - (5), где один из R2 и R3 представляет собой метильную группу, которая может быть замещена атомом галогена, а второй представляет собой атом водорода или метильную группу, которая может быть замещена атомом галогена, его соль, сольват или сокристалл;
(7) соединение, описанное выше в любом из пп.(1) - (6), где R6 представляет собой атом водорода или атом галогена, и R7 представляет собой атом водорода, его соль, сольват или сокристалл;
(8) соединение, описанное выше в любом из пп.(1) - (7), представленное общей формулой (II-1):

(где R6 представляет собой атом водорода или атом галогена, а другие символы имеют значения, указанные выше в п. (1)), его соль, сольват или сокристалл;
(9) соединение, описанное выше в любом из пп.(1) - (7), представленное общей формулой (II-2):

(где R6 представляет собой атом водорода или атом галогена, а другие символы имеют значения, указанные выше в п. (1)), его соль, сольват или сокристалл;
(10) соединение, описанное выше в любом из пп.(1) - (9), где каждый R4 и R5 независимо представляет собой атом галогена или метильную группу, его соль, сольват или сокристалл;
(11) соединение, описанное выше в любом из пп.(1) - (10), где R8 представляет собой атом водорода или метильную группу, его соль, сольват или сокристалл;
(12) соединение, описанное выше в п. (1), представляющее собой следующие:
(1) 1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина,
(2) 1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина,
(3) 1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[6-(трифторметил)-3-пиридинил]метил}мочевина,
(4) 1-[(5-хлор-2-пиридинил)метил]-3-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}мочевина,
(5) 1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[3-(трифторметил)-1,2,4-оксадиазол-5-ил]метил}мочевина,
(6) 1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина,
(7) 1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[6-(трифторметил)-3-пиридинил]метил}мочевина,
(8) 1-[(5-хлор-2-пиридинил)метил]-3-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}мочевина,
(9) 1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[3-(трифторметил)-1,2,4-оксадиазол-5-ил]метил}мочевина,
(10) 1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[3-(трифторметил)-1,2,4-оксадиазол-5-ил]метил}мочевина,
(11) 1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[2-(трифторметил)-5-пиримидинил]метил}мочевина,
(12) 1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина,
(13) 1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[2-(трифторметил)-1,3-тиазол-5-ил]метил}мочевина,
(14) 1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[3-(трифторметил)-1,2,4-оксадиазол-5-ил]метил}мочевина,
(15) 1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[2-(трифторметил)-5-пиримидинил]метил}мочевина,
(16) 1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[2-(трифторметил)-1,3-тиазол-5-ил]метил}мочевина,
(17) 1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина или
(18) 1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина,
его соль, сольват или сокристалл;
(13) фармацевтическая композиция, содержащая соединение, представленное общей формулой (I), его соль, сольват или сокристалл, и фармацевтически приемлемый носитель;
(14) фармацевтическая композиция, описанная выше в п. (13), которая представляет собой средство профилактики и/или лечения заболевания, связанного с KCNQ2-5 каналом;
(15) фармацевтическая композиция, описанная выше в п. (14), где заболевание, связанное с KCNQ2-5 каналом, представляет собой дизурию;
(16) фармацевтическая композиция, описанная выше в п. (15), где дизурия заключается в гиперактивности мочевого пузыря;
(17) способ профилактики и/или лечения заболевания, связанного с KCNQ2-5 каналом, включающий: введение млекопитающему эффективного количества соединения, представленного общей формулой (I), его соли, сольвата или сокристалла;
(18) соединение, представленное общей формулой (I), его соль, сольват или сокристалл, для профилактики и/или лечения заболевания, связанного с KCNQ2-5 каналом;
(19) применение соединения, представленного общей формулой (I), его соли, сольвата или сокристалла, для изготовления средства профилактики и/или лечения заболевания, связанного с KCNQ2-5 каналом;
(20) соединение, представленное общей формулой (I-1):
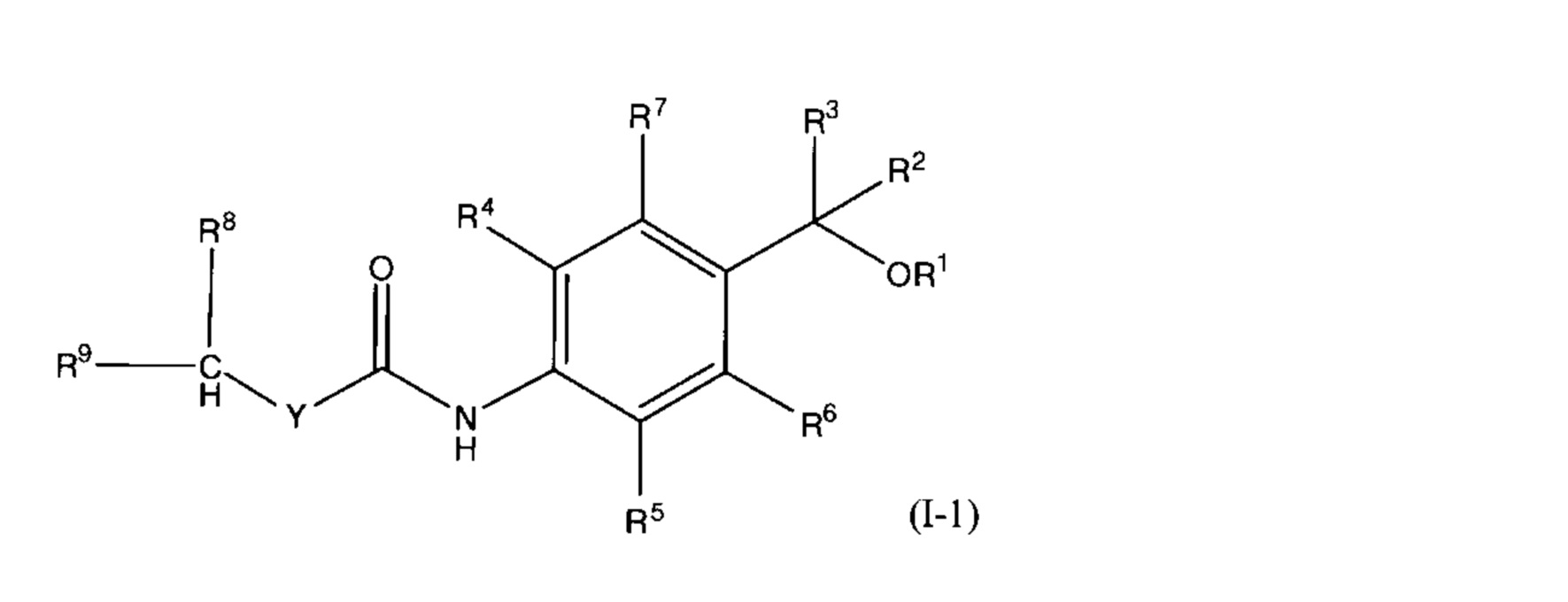
(где R1 представляет собой (1) атом водорода или (2) C1-4 алкильную группу; каждый R2 и R3 независимо представляет собой (1) атом водорода или (2) C1-4 алкильную группу, которая может быть замещена атомом галогена, где R2 и R3 не могут оба одновременно представлять собой атом водорода; каждый R4 и R5 независимо представляет собой (1) атом водорода, (2) атом галогена, (3) C1-4 алкильную группу, которая может быть замещена атомом галогена, или (4) C1-4 алкокси-группу, которая может быть замещена атомом галогена, где R4 и R5 не могут оба одновременно представлять собой атом водорода; каждый R6 и R7 независимо представляет собой атом водорода или атом галогена; Y представляет собой (1) -NH-, (2) -CH2-, (3) -O- или (4) связь; R8 представляет собой (1) атом водорода или (2) C1-4 алкильную группу, которая может быть замещена атомом галогена или гидрокси-группой; R9 представляет собой (1) цикл A, (2) C1-6 алкильную группу, (3) C2-6 алкенильную группу, (4) C2-6 алкинильную группу, (5) -C1-4 алкилен-цикл A, (6) -C2-4 алкенилен-цикл A, (7) -C2-4 алкинилен-цикл A, (8) -цикл B-цикл C, (9) -цикл B-C1-4 алкилен-цикл C, (10) -цикл B-C2-4 алкенилен-цикл C или (11) -цикл B-C2-4 алкинилен-цикл C, где каждая алкильная группа, алкенильная группа, алкинильная группа, алкиленовая группа, алкениленовая группа или алкиниленовая группа может быть замещена атомом галогена или гидрокси-группой; цикл A представляет собой (1) C3-8 циклоалкан, (2) 3-8-членный гетероциклоалкан, (3) C5-12 моноциклическое или бициклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, или (4) 5-12-членный моноциклический или бициклический ненасыщенный гетероцикл, содержащий от одного до четырех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным; каждый из циклов B и C независимо представляет собой (1) C3-8 циклоалкан, (2) 3-8-членный гетероциклоалкан, (3) C5-7 моноциклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, или (4) 5-7-членный моноциклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным; где каждый цикл A, цикл B и цикл C может быть независимо замещен одним-пятью R10, и при наличии нескольких R10, количество R10 может быть одинаковым или разным; R10 представляет собой (1) атом галогена, (2) гидрокси-группу, (3) циано-группу, (4) C1-6 алкильную группу, которая может быть замещена атомом галогена или гидрокси-группой, или (5) C1-6 алкокси-группу, которая может быть замещена атомом галогена или гидрокси-группой, его соль, сольват или сокристалл;
(21) соединение, описанное выше в п. (20), где Y представляет собой -NH-, -CH2- или связь, его соль, сольват или сокристалл;
(22) соединение, описанное выше в п. (20) или (21), представленное общей формулой (II):

(где символы имеют значения, указанные выше в п. (20)), его соль, сольват или сокристалл;
(23) соединение, описанное выше в любом из пп.(20) - (22), где R1 представляет собой атом водорода, его соль, сольват или сокристалл;
(24) соединение, описанное выше в любом из пп.(20) - (23), где один из R2 и R3 представляет собой метильную группу, которая может быть замещена атомом галогена, и второй представляет собой метильную группу, которая может быть замещена атомом водорода или атомом галогена, его соль, сольват или сокристалл;
(25) соединение, описанное выше в любом из пп.(20) - (24), где R7 представляет собой атом водорода, его соль, сольват или сокристалл;
(26) соединение, описанное выше в любом из пп.(20) - (25), представленное общей формулой (II-1):
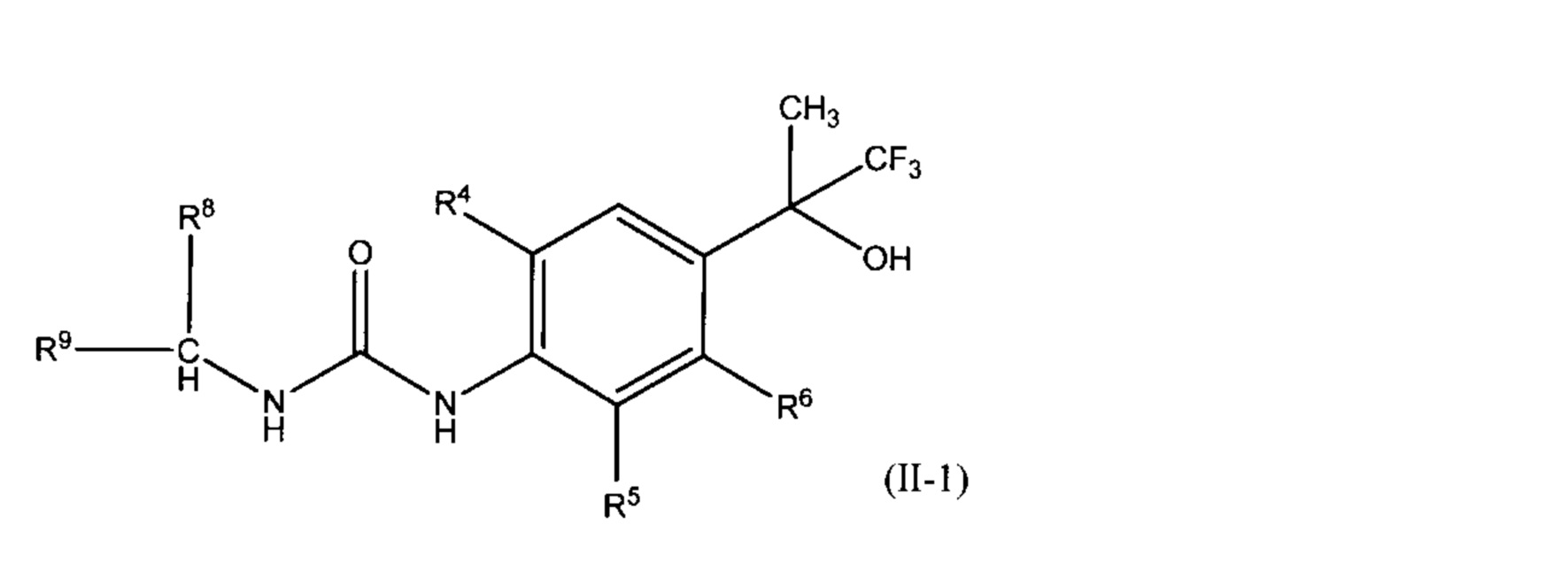
(где символы имеют значения, указанные выше в п. (20)), его соль, сольват или сокристалл;
(27) соединение, описанное выше в любом из пп.(20) - (25), представленное общей формулой (II-2):

(где символы имеют значения, указанные выше в п. (20)), его соль, сольват или сокристалл;
(28) соединение, описанное выше в любом из пп.(20) - (27), где каждый R4 и R5 независимо представляет собой атом галогена или метильную группу, его соль, сольват или сокристалл;
(29) соединение, описанное выше в любом из пп.(20) - (28), где R8 представляет собой атом водорода или метильную группу, его соль, сольват или сокристалл и т.д.
Преимущества, достигаемые с помощью настоящего изобретения
Соединение по настоящему изобретению можно применять в качестве средства профилактики и/или лечения заболеваний, связанных с KCNQ2-5 каналом.
Описание вариантов осуществления
Далее в настоящем тексте следует подробное описание настоящего изобретения.
В настоящем изобретении, C1-4 алкильная группа означает линейную или разветвленную C1-4 алкильную группу. Примеры C1-4 алкильной группы включают метил, этил, пропил, изопропил, бутил, втор-бутил и трет-бутил.
В настоящем изобретении, C2-4 алкильная группа означает линейную или разветвленную C2-4 алкильную группу. Примеры C2-4 алкильной группы включают этил, пропил, изопропил, бутил, втор-бутил и трет-бутил.
В настоящем изобретении, C1-6 алкильная группа означает линейную или разветвленную C1-6 алкильную группу. Примеры C1-6 алкильной группы включают метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, пентил, изопентил, трет-пентил, неопентил, гексил, изогексил, 3- метилпентил и т.д.
В настоящем изобретении, C2-5 ацильная группа означает линейную или разветвленную C2-5 ацильную группу. Примеры C2-5 ацильной группы включают ацетил, пропионил, бутаноил, пентаноил и т.д.
В настоящем изобретении, C2-6 алкенильная группа означает линейную или разветвленную C2-6 алкенильную группу, содержащую по меньшей мере одну углерод-углеродную двойную связь. Примеры C2-6 алкенильной группы включают этенил, 1-пропен-1-ил, 1-пропен-2-ил, 2-пропен-1-ил, 1-бутен-1-ил, 1-бутен-2-ил, 3-бутен-1-ил, 3-бутен-2-ил, 2-бутен-1-ил, 2-бутен-2-ил, 2-метил-1-пропен-1-ил, 2-метил-2-пропен-1-ил, 1,3-бутадиен-1-ил, 1,3-бутадиен -2-ил и т.д.
В настоящем изобретении, C2-6 алкинильная группа означает линейную или разветвленную C2-6 алкинильную группу, содержащую по меньшей мере одну углерод-углеродную тройную связь. Примеры C2-6 алкенильной группы включают этинил, 1-пропин-1-ил, 2-пропин-1-ил, 1-бутин-1-ил, 3-бутин-1-ил, 3-бутин-2-ил, 2-бутин-1-ил и т.д.
В настоящем изобретении, C1-4 алкиленовая группа означает линейную или разветвленную C1-4 алкиленовую группу. Примеры C1-4 алкиленовой группы включают метилен, этилен, метилметилен, этилметилен, пропилен, бутилен, изопропилен, изобутилен, втор-бутилен, трет-бутилен и т.д.
В настоящем изобретении, C2-4 алкениленовая группа означает линейную или разветвленную C2-4 алкениленовую группу. Примеры C2-4 алкениленовой группы включают этенилен, 1-пропенилен, 2-пропенилен, 1-бутенилен, 2-бутенилен, 3-бутенилен и т.д.
В настоящем изобретении, C2-4 алкиниленовая группа означает линейную или разветвленную C2-4 алкиниленовую группу. Примеры C2-4 алкиниленовой группы включают этинилен, 1-пропинилен, 2-пропинилен, 1-бутинилен, 2-бутинилен, 3-бутинилен и т.д.
В настоящем изобретении, C1-4 алкокси-группа означает линейную или разветвленную C1-4 алкокси-группу. Примеры C1-4 алкокси-группы включают метокси, этокси, пропокси, изопропокси, бутокси, изобутилокси, трет-бутокси и т.д.
В настоящем изобретении, C1-6 алкокси-группа означает линейную или разветвленную C1-6 алкокси-группу. Примеры C1-6 алкокси-группы включают метокси, этокси, пропокси, изопропокси, бутокси, изобутилокси, трет-бутокси, пентилокси, изопентилокси, трет-пентилокси, неопентилокси, гексилокси и т.д.
В настоящем изобретении, атом галогена означает атом фтора, хлора, брома, иода и т.д.
В настоящем изобретении, C3-8 циклоалкан представляет собой C3-8 насыщенный углеводородный цикл и может содержать спиро-связь или сшивку. Примеры C3-8 циклоалкана включают циклопропан, циклобутан, циклопентан, циклогексан, бицикло[2.2.1]гептан, бицикло[3.1.1]гептан, бицикло[2.2.2]октан, циклогептан, циклооктан, пергидропентален, кубан и т.д.
В настоящем изобретении, частные примеры C3-8 моноциклического циклоалкана включают циклопропан, циклобутан, циклопентан, циклогексан, циклогептан и циклооктан.
В настоящем изобретении, частные примеры C3-6 моноциклического циклоалкана включают циклопропан, циклобутан, циклопентан и циклогексан.
В настоящем изобретении, 3-8-членный гетероциклоалкан представляет собой 3-8-членный насыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, и может содержать спиро-связь или сшивку. Частные примеры 3-8-членного гетероциклоалкана включают азиридин, оксиран, тииран, азетидин, оксетан, тиетан, пирролидин, тетрагидрофуран, тетрагидротиофен, пиперидин, тетрагидропиран, тетрагидротиопиран, азабицикло[2.2.1]гептан, оксабицикло[2.2.1]гептан, азабицикло[3.1.1]гептан, азабицикло[2.2.2]октан, пергидроазепин, пергидрооксепин, пергидротиепин, азабицикло[3.2.1]октан, оксабицикло[3.2.1]октан, имидазолидин, пиразолидин, тетрагидро-оксазол (оксазолидин), тетрагидроизоксазол (изоксазолидин), тетрагидротиазол (тиазолидин), тетрагидро-изотиазол (изотиазолидин), диоксолан, дитиолан, пиперазин, пергидропиримидин, пергидропиридазин, тетрагидроксазин, тетрагидротиазин, морфолин, тиоморфолин, оксатиан, диоксан, дитиан, диазабицикло[2.2.2]октан, пергидродиазепин, пергидро-оксазепин, пергидротиазепин, триазолидин, тетрагидрофуразан, тетрагидрооксадиазол (оксадиазолидин), тетрагидротиадиазол (тиадиазолидин), тетрагидро-оксадиазин, тетрагидротиадиазин, пергидро-оксадиазепин, пергидротиадиазепин и т.д.
В настоящем изобретении, частные примеры 3-7-членного моноциклического гетероциклоалкана, содержащего один атом кислорода в качестве гетероатома, включают оксиран, оксетан, тетрагидрофуран, тетрагидропиран, пергидрооксепин и т.д.
В настоящем изобретении, частные примеры 3-7- членного моноциклического гетероциклоалкана, содержащего один атом кислорода или атом азота в качестве гетероатома, включают азиридин, оксиран, азетидин, оксетан, пирролидин, тетрагидрофуран, пиперидин, тетрагидропиран, пергидроазепин, пергидрооксепин и т.д.
В настоящем изобретении, частные примеры 3- 7-членного моноциклического гетероциклоалкана, содержащего один атом азота в качестве гетероатома, включают азиридин, азетидин, пирролидин, пиперидин, пергидроазепин и т.д.
В настоящем изобретении, частные примеры "C3-12 моноциклического или бициклического ненасыщенного карбоциклического кольца, которое может быть частично насыщенным" включают циклопропен, циклобутен, циклопентен, циклопентадиен, циклогексен, циклогексадиен, бензол, циклогептен, циклогептадиен, циклооктен, циклооктадиен, пентален, инден, индан, дигидронафталин, тетрагидронафталин, азулен, нафталин, гептален и т.д.
В настоящем изобретении, частные примеры "C5-12 моноциклического или бициклического ненасыщенного карбоциклического кольца, которое может быть частично насыщенным" включают циклопентен, циклопентадиен, циклогексен, циклогексадиен, бензол, циклогептен, циклогептадиен, циклооктен, циклооктадиен, пентален, инден, индан, дигидронафталин, тетрагидронафталин, азулен, нафталин, гептален и т.д.
В настоящем изобретении, частные примеры "C3-7 моноциклического ненасыщенного карбоциклического кольца, которое может быть частично насыщенным" включают циклопропен, циклобутен, циклопентен, циклопентадиен, циклогексен, циклогексадиен, бензол, циклогептен, циклогептадиен и т.д.
В настоящем изобретении, частные примеры "C5-7 моноциклического ненасыщенного карбоциклического кольца, которое может быть частично насыщенным" включают циклопентен, циклопентадиен, циклогексен, циклогексадиен, бензол, циклогептен, циклогептадиен и т.д.
В настоящем изобретении, частные примеры "C5-6 моноциклического ненасыщенного карбоциклического кольца, которое может быть частично насыщенным" включают циклопентен, циклопентадиен, циклогексен, циклогексадиен, бензол и т.д.
В настоящем изобретении, частные примеры "C8-10 бициклического ненасыщенного карбоциклического кольца, которое может быть частично насыщенным" включают пентален, инден, индан, дигидронафталин, тетрагидронафталин, азулен, нафталин и т.д.
В настоящем изобретении, частные примеры "3-12-членного моноциклического или бициклического ненасыщенного гетероцикла, содержащего от одного до четырех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным" включают азирин, оксирен, тиирен, азет, пирролин, имидазолин, тиазолин, тетразолин, пиразолин, дигидрофуран, дигидротиофен, дигидрооксазол, дигидроизоксазол, дигидротиазол, дигидроизотиазол, дигидрофуразан, дигидрооксадиазол, дигидротиадиазол, пиррол, имидазол, триазол, тетразол, пиразол, фуран, тиофен, оксазол, изоксазол, тиазол, изотиазол, фуразан, оксадиазол, тиадиазол, пиран, тиопиран, оксазин, оксадиазин, тиазин, тиадиазин, дигидропиридин, тетрагидропиридин, дигидропиразин, тетрагидропиразин, дигидропиримидин, тетрагидропиримидин, дигидропиридазин, тетрагидропиридазин, дигидропиран, дигидротиопиран, дигидрооксазин, дигидрооксадиазин, дигидротиазин, дигидротиадиазин, пиридин, пиразин, пиримидин, пиридазин, азепин, диазепин, оксепин, тиепин, оксазепин, оксадиазепин, тиазепин, тиадиазепин, дигидроазепин, тетрагидроазепин, дигидродиазепин, тетрагидродиазепин, дигидрооксепин, тетрагидрооксепин, дигидротиепин, тетрагидротиепин, дигидрооксазепин, тетрагидрооксазепин, дигидрооксадиазепин, тетрагидрооксадиазепин, дигидротиазепин, тетрагидротиазепин, дигидротиадиазепин, тетрагидротиадиазепин, индолизин, индолин, изоиндолин, дигидробензофуран, дигидроизобензофуран, дигидробензотиофен, дигидроизобензотиофен, дигидроиндазол, дигидробензоксазол, дигидробензотиазол, дигидробензимидазол, диоксаиндан, бензодитиолан, индол, изоиндол, бензофуран, изобензофуран, бензотиофен, изобензотиофен, индазол, пурин, бензоксазол, бензотиазол, бензимидазол, бензофуразан, бензотиадиазол, бензотриазол, дитианафталин, хинолизин, хромен, дигидрохинолин, тетрагидрохинолин, дигидроизохинолин, тетрагидроизохинолин, дигидрофталазин, тетрагидрофталазин, дигидронафтиридин, тетрагидронафтиридин, дигидрохиноксалин, тетрагидрохиноксалин, дигидрохиназолин, тетрагидрохиназолин, дигидроциннолин, тетрагидроциннолин, бензооксатиан, дигидробензооксазин, дигидробензотиазин, пиразиноморфолин, бензодиоксан, хроман, бензодитиан, хинолин, изохинолин, фталазин, птеридин, нафтиридин, хиноксалин, хиназолин, циннолин, бензооксепин, бензооксазепин, бензооксадиазепин, бензотиепин, бензотиазепин, бензотиадиазепин, бензоазепин, бензодиазепин, дигидробензоазепин, тетрагидробензоазепин, дигидробензодиазепин, тетрагидробензодиазепин, бензодиоксепан, дигидробензооксазепин, тетрагидробензооксазепин и т.д.
В настоящем изобретении, частные примеры "5-12-членного моноциклического или бициклического ненасыщенного гетероцикла, содержащего от одного до четырех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным" включают пирролин, имидазолин, тиазолин, тетразолин, пиразолин, дигидрофуран, дигидротиофен, дигидрооксазол, дигидроизоксазол, дигидротиазол, дигидроизотиазол, дигидрофуразан, дигидрооксадиазол, дигидротиадиазол, пиррол, имидазол, триазол, тетразол, пиразол, фуран, тиофен, оксазол, изоксазол, тиазол, изотиазол, фуразан, оксадиазол, тиадиазол, пиран, тиопиран, оксазин, оксадиазин, тиазин, тиадиазин, дигидропиридин, тетрагидропиридин, дигидропиразин, тетрагидропиразин, дигидропиримидин, тетрагидропиримидин, дигидропиридазин, тетрагидропиридазин, дигидропиран, дигидротиопиран, дигидрооксазин, дигидрооксадиазин, дигидротиазин, дигидротиадиазин, пиридин, пиразин, пиримидин, пиридазин, азепин, диазепин, оксепин, тиепин, оксазепин, оксадиазепин, тиазепин, тиадиазепин, дигидроазепин, тетрагидроазепин, дигидродиазепин, тетрагидродиазепин, дигидрооксепин, тетрагидрооксепин, дигидротиепин, тетрагидротиепин, дигидрооксазепин, тетрагидрооксазепин, дигидрооксадиазепин, тетрагидрооксадиазепин, дигидротиазепин, тетрагидротиазепин, дигидротиадиазепин, тетрагидротиадиазепин, индолизин, индолин, изоиндолин, дигидробензофуран, дигидроизобензофуран, дигидробензотиофен, дигидроизобензотиофен, дигидроиндазол, дигидробензоксазол, дигидробензотиазол, дигидробензимидазол, диоксаиндан, бензодитиолан, индол, изоиндол, бензофуран, изобензофуран, бензотиофен, изобензотиофен, индазол, пурин, бензоксазол, бензотиазол, бензимидазол, бензофуразан, бензотиадиазол, бензотриазол, дитианафталин, хинолизин, хромен, дигидрохинолин, тетрагидрохинолин, дигидроизохинолин, тетрагидроизохинолин, дигидрофталазин, тетрагидрофталазин, дигидронафтиридин, тетрагидронафтиридин, дигидрохиноксалин, тетрагидрохиноксалин, дигидрохиназолин, тетрагидрохиназолин, дигидроциннолин, тетрагидроциннолин, бензооксатиан, дигидробензооксазин, дигидробензотиазин, пиразиноморфолин, бензодиоксан, хроман, бензодитиан, хинолин, изохинолин, фталазин, птеридин, нафтиридин, хиноксалин, хиназолин, циннолин, бензооксепин, бензооксазепин, бензооксадиазепин, бензотиепин, бензотиазепин, бензотиадиазепин, бензоазепин, бензодиазепин, дигидробензоазепин, тетрагидробензоазепин, дигидробензодиазепин, тетрагидробензодиазепин, бензодиоксепан, дигидробензооксазепин, тетрагидробензооксазепин и т.д.
В настоящем изобретении, частные примеры "3-7-членного моноциклического ненасыщенного гетероцикла, содержащего от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным" включают азирин, оксирен, тиирен, азет, пирролин, дигидрофуран, дигидротиофен, пиррол, фуран, тиофен, пиран, тиопиран, дигидропиридин, тетрагидропиридин, дигидропиран, дигидротиопиран, пиридин, азепин, оксепин, тиепин, дигидроазепин, тетрагидроазепин, дигидрооксепин, тетрагидрооксепин, дигидротиепин, тетрагидротиепин, имидазолин, пиразолин, дигидрооксазол, дигидроизоксазол, дигидротиазол, дигидроизотиазол, имидазол, пиразол, оксазол, изоксазол, тиазол, изотиазол, оксазин, тиазин, дигидропиразин, тетрагидропиразин, дигидропиримидин, тетрагидропиримидин, дигидропиридазин, тетрагидропиридазин, дигидрооксазин, дигидротиазин, пиразин, пиримидин, пиридазин, диазепин, оксазепин, тиазепин, дигидродиазепин, тетрагидродиазепин, дигидрооксазепин, тетрагидрооксазепин, дигидротиазепин, тетрагидротиазепин, тиазолин, дигидрофуразан, дигидрооксадиазол, дигидротиадиазол, триазол, фуразан, оксадиазол, тиадиазол, оксадиазин, тиадиазин, дигидрооксадиазин, дигидротиадиазин, оксадиазепин, тиадиазепин, дигидрооксадиазепин, тетрагидрооксадиазепин, дигидротиадиазепин, тетрагидротиадиазепин и т.д.
В настоящем изобретении, частные примеры "5-7-членного моноциклического ненасыщенного гетероцикла, содержащего от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным" включают пирролин, дигидрофуран, дигидротиофен, пиррол, фуран, тиофен, пиран, тиопиран, дигидропиридин, тетрагидропиридин, дигидропиран, дигидротиопиран, пиридин, азепин, оксепин, тиепин, дигидроазепин, тетрагидроазепин, дигидрооксепин, тетрагидрооксепин, дигидротиепин, тетрагидротиепин, имидазолин, пиразолин, дигидрооксазол, дигидроизоксазол, дигидротиазол, дигидроизотиазол, имидазол, пиразол, оксазол, изоксазол, тиазол, изотиазол, оксазин, тиазин, дигидропиразин, тетрагидропиразин, дигидропиримидин, тетрагидропиримидин, дигидропиридазин, тетрагидропиридазин, дигидрооксазин, дигидротиазин, пиразин, пиримидин, пиридазин, диазепин, оксазепин, тиазепин, дигидродиазепин, тетрагидродиазепин, дигидрооксазепин, тетрагидрооксазепин, дигидротиазепин, тетрагидротиазепин, тиазолин, дигидрофуразан, дигидрооксадиазол, дигидротиадиазол, триазол, фуразан, оксадиазол, тиадиазол, оксадиазин, тиадиазин, дигидрооксадиазин, дигидротиадиазин, оксадиазепин, тиадиазепин, дигидрооксадиазепин, тетрагидрооксадиазепин, дигидротиадиазепин, тетрагидротиадиазепин и т.д.
В настоящем изобретении, частные примеры "5- 6-членного моноциклического ненасыщенного гетероцикла, содержащего от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным" включают пирролин, дигидрофуран, дигидротиофен, имидазолин, пиразолин, дигидрооксазол, дигидроизоксазол, дигидротиазол, дигидроизотиазол, тиазолин, дигидрофуразан, дигидрооксадиазол, дигидротиадиазол, пиран, тиопиран, дигидропиридин, тетрагидропиридин, дигидропиран, дигидротиопиран, оксазин, тиазин, дигидропиразин, тетрагидропиразин, дигидропиримидин, тетрагидропиримидин, дигидропиридазин, тетрагидропиридазин, дигидрооксазин, дигидротиазин, оксадиазин, тиадиазин, дигидрооксадиазин, дигидротиадиазин, пиррол, фуран, тиофен, имидазол, пиразол, оксазол, изоксазол, тиазол, изотиазол, триазол, фуразан, оксадиазол, тиадиазол, пиридин, пиразин, пиримидин, пиридазин и т.д.
В настоящем изобретении, частные примеры "5-6-членного ненасыщенного гетероцикла, содержащего от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы" включают пиррол, фуран, тиофен, имидазол, пиразол, оксазол, изоксазол, тиазол, изотиазол, триазол, фуразан, оксадиазол, тиадиазол, пиридин, пиразин, пиримидин, пиридазин и т.д.
В настоящем изобретении, частные примеры "5-6- членного моноциклического ненасыщенного азот-содержащего гетероцикла, содержащего от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, где указанный 5-6-членный моноциклический ненасыщенный азот-содержащий гетероцикл содержит по меньшей мере один атом азота" включают пиррол, оксазол, изоксазол, тиазол, изотиазол, пиридин, имидазол, пиразол, фуразан, оксадиазол, тиадиазол, пиразин, пиримидин, пиридазин, триазол и т.д.
В настоящем изобретении, частные примеры "9-10-членного бициклического ненасыщенного гетероцикла, содержащего от одного до четырех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным" включают индолизин, индолин, изоиндолин, дигидробензофуран, дигидроизобензофуран, дигидробензотиофен, дигидроизобензотиофен, дигидроиндазол, дигидробензоксазол, дигидробензотиазол, дигидробензимидазол, диоксаиндан, бензодитиолан, хинолизин, хромен, дигидрохинолин, тетрагидрохинолин, дигидроизохинолин, тетрагидроизохинолин, хроман, дитианафталин, дигидрофталазин, тетрагидрофталазин, дигидронафтиридин, тетрагидронафтиридин, дигидрохиноксалин, тетрагидрохиноксалин, дигидрохиназолин, тетрагидрохиназолин, дигидроциннолин, тетрагидроциннолин, бензооксатиан, дигидробензооксазин, дигидробензотиазин, бензодиоксан, бензодитиан, пиразиноморфолин, индол, изоиндол, бензофуран, изобензофуран, бензотиофен, изобензотиофен, индазол, бензоксазол, бензотиазол, бензимидазол, бензофуразан, бензотиадиазол, бензотриазол, пурин, хинолин, изохинолин, фталазин, нафтиридин, хиноксалин, хиназолин, циннолин, птеридин и т.д.
В настоящем изобретении, "9-10-членный бициклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, в котором 5- или 6-членный гетероцикл конденсирован с бензолом, который может быть частично насыщенным" включает индол, изоиндол, бензофуран, изобензофуран, бензотиофен, изобензотиофен, хинолин, изохинолин, индазол, бензоксазол, бензотиазол, бензимидазол, фталазин, хиноксалин, хиназолин, циннолин, бензофуразан, бензотиадиазол, бензотриазол, индолин, изоиндолин, дигидробензофуран, дигидроизобензофуран, дигидробензотиофен, дигидроизобензотиофен, хромен, дигидрохинолин, тетрагидрохинолин, дигидроизохинолин, тетрагидроизохинолин, хроман, дигидроиндазол, дигидробензоксазол, дигидробензотиазол, дигидробензимидазол, диоксаиндан, бензодитиолан, дитианафталин, дигидрофталазин, тетрагидрофталазин, дигидрохиноксалин, тетрагидрохиноксалин, дигидрохиназолин, тетрагидрохиназолин, дигидроциннолин, тетрагидроциннолин, бензооксатиан, дигидробензооксазин, дигидробензотиазин, бензодиоксан, бензодитиан и т.д.
В настоящем изобретении, если не указано количество заместителей, понимают, что количество заместителей, при наличии, составляет один или более.
В настоящем изобретении, определение каждого заместителя независимо для каждого случая присутствия в общей формуле. Например, при наличии более чем одного заместителя R10 в "цикле A" или в "цикле B" и/или в "цикле C", соответственно, каждый заместитель выбран независимо для каждого случая, при этом заместители могут быть идентичными или различаться.
В настоящем изобретении, каналы KCNQ2-5 означают KCNQ канал, в котором каждый из четырех подтипов KCNQ2 - KCNQ5 собраны с образованием гомотетрамера или гетеротетрамера. Их примеры включают гомотетрамеры, такие как KCNQ2, KCNQ3, KCNQ4 и KCNQ5 канал или гетеротетрамеры, такие как KCNQ2/3, KCNQ3/4, KCNQ3/5 канал и т.д. Предпочтительные примеры включают KCNQ2/3, KCNQ4 и/или KCNQ5 канал.
В настоящем изобретении, активатором KCNQ2-5 канала называют соединение, оказывающее сильное открывающее действие на KCNQ2-5 каналы (предпочтительно, KCNQ2/3, KCNQ4 и/или KCNQ5 канал). В настоящем изобретении, активирующее действие на KCNQ канал - это то же самое, что и открывающее действие на KCNQ канал.
В настоящем изобретении, X1 предпочтительно представляет собой C-R6.
В настоящем изобретении, X2 предпочтительно представляет собой C-R7.
В настоящем изобретении, R11 предпочтительно представляет собой OR1. Также предпочтительными являются OH и NH2.
В настоящем изобретении, Y предпочтительно представляет собой -NH- или связь, и более предпочтительно -NH-.
В настоящем изобретении, R1 предпочтительно представляет собой атом водорода или метильную группу, и более предпочтительно атом водорода.
В настоящем изобретении, R2 предпочтительно представляет собой атом водорода или C1-2 алкильную группу, которая может быть замещена атомом галогена, более предпочтительно атом водорода или метильную группу, которая может быть замещена атомом галогена, и еще более предпочтительно метильную группу или трифторметильную группу.
В настоящем изобретении, R3 предпочтительно представляет собой атом водорода или C1-2 алкильную группу, которая может быть замещена атомом галогена, более предпочтительно атом водорода или метильную группу, которая может быть замещена атомом галогена, и еще более предпочтительно атом водорода, метильную группу или трифторметильную группу.
В настоящем изобретении, комбинация R2 и R3 предпочтительно представляет собой комбинацию, в которой по меньшей мере один из R2 и R3 представляет собой метильную группу, которая может быть замещена атомом галогена, а второй представляет собой атом водорода или метильную группу, которая может быть замещена атомом галогена, и более предпочтительно - комбинацию, в которой по меньшей мере один из R2 и R3 представляет собой трифторметильную группу, а второй представляет собой атом водорода или метильную группу.
В настоящем изобретении, R4 предпочтительно представляет собой атом водорода, атом галогена, C1-4 алкильную группу или C1-4 алкокси-группу, более предпочтительно атом водорода, атом галогена или C1-4 алкильную группу, еще более предпочтительно атом галогена или метильную группу, и особенно предпочтительно атом галогена.
В настоящем изобретении, R5 предпочтительно представляет собой атом водорода, атом галогена, C1-4 алкильную группу или C1-4 алкокси-группу, более предпочтительно атом водорода, атом галогена или C1-4 алкильную группу, еще более предпочтительно атом галогена или метильную группу, и особенно предпочтительно атом галогена.
В настоящем изобретении, R6 предпочтительно представляет собой атом водорода или атом галогена, и еще более предпочтительно атом водорода.
В настоящем изобретении, R7 предпочтительно представляет собой атом водорода или атом галогена, и еще более предпочтительно атом водорода.
В настоящем изобретении, предпочтительно по меньшей мере один из R6 и R7 представляет собой атом водорода, и более предпочтительно - оба R6 и R7 представляют собой атом водорода.
В настоящем изобретении, R8 предпочтительно представляет собой атом водорода или метильную группу, и более предпочтительно атом водорода.
В настоящем изобретении, R9 предпочтительно представляет собой (1) цикл A, (2) C2-4 алкильную группу, которая может быть замещена атомом галогена или гидрокси-группой, (3) -цикл B-цикл C, (4) -цикл B-метилен-цикл C или (5) -цикл B-O-цикл C. В данном тексте, каждый цикл независимо может быть замещен одним - пятью R10. R9 более предпочтительно представляет собой цикл A, замещенный одним - пятью R10; еще более предпочтительно 5-6-членный моноциклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть замещен одним-тремя заместителями (предпочтительно, одним заместителем), каждый из которых выбран из группы, состоящей из (1) атома галогена, (2) C1-4 алкильной группы, которая может быть замещена атомом галогена, и (3) C1-4 алкокси-группы, которая может быть замещена атомом галогена (предпочтительно, выбран из группы, состоящей из атома галогена и C1-4 алкильной группы, которая может быть замещена атомом галогена); и особенно предпочтительно 5-6-членный моноциклический ненасыщенный азот-содержащий гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, где указанный 5-6-членный моноциклический ненасыщенный азот-содержащий гетероцикл содержит по меньшей мере один атом азота, имеющий один заместитель, представляющий собой атом галогена или C1-4 алкильную группу, которая может быть замещена атомом галогена (предпочтительно, атомом галогена или трифторметильной группой).
В настоящем изобретении, цикл A предпочтительно представляет собой (1) C3-8 моноциклический циклоалкан, (2) 3-7-членный моноциклический гетероциклоалкан, содержащий один атом кислорода в качестве гетероатома, (3) C5-7 моноциклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, (4) C8-10 бициклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, (5) 5-7-членный моноциклический ненасыщенный гетероцикл, содержащий один-три гетероатома, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным, (6) 9-10-членный бициклический ненасыщенный гетероцикл, содержащий от одного до четырех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным (в данном тексте, каждый цикл независимо может быть замещен одним-пятью R10); более предпочтительно (1) C3-6 моноциклический циклоалкан, (2) 5-6-членный моноциклический гетероциклоалкан, содержащий один атом кислорода в качестве гетероатома (тетрагидрофуран и тетрагидропиран), (3) C5-6 моноциклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, (4) 5-6-членный моноциклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным, (5) 9-10-членный бициклический ненасыщенный гетероцикл, содержащий один-три гетероатома, выбранных из атома кислорода, атома азота и атома серы, в котором 5- или 6-членный гетероцикл конденсирован с бензолом (в данном тексте, каждый цикл независимо может быть замещен одним-пятью R10); еще более предпочтительно, 5-6-членный моноциклический ненасыщенный гетероцикл, содержащий один-три гетероатома, выбранных из атома кислорода, атома азота и атома серы, который может быть замещен одним-тремя заместителями (предпочтительно, одним заместителем), каждый из которых выбран из группы, состоящей из (1) атома галогена, (2) C1-4 алкильной группы, которая может быть замещена атомом галогена, и (3) C1-4 алкокси-группы, которая может быть замещена атомом галогена (предпочтительно, выбран из группы, состоящей из атома галогена и C1-4 алкильной группы, которая может быть замещена атомом галогена); и особенно предпочтительно 5-6-членный моноциклический ненасыщенный азот-содержащий гетероцикл, содержащий один-три гетероатома, выбранных из атома кислорода, атома азота и атома серы, где указанный 5-6-членный моноциклический ненасыщенный азот-содержащий гетероцикл содержит по меньшей мере один атом азота, имеющий один заместитель, представляющий собой атом галогена или C1-4 алкильную группу, которая может быть замещена атомом галогена (предпочтительно, атомом галогена или трифторметильной группой).
В настоящем изобретении, цикл B предпочтительно представляет собой (1) C3-8 моноциклический циклоалкан, (2) 3-7-членный моноциклический гетероциклоалкан, содержащий один атом кислорода в качестве гетероатома, (3) C5-7 моноциклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, или (4) 5-7-членный моноциклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным (в данном тексте каждый цикл независимо может быть замещен одним-пятью R10); более предпочтительно 5-6-членный моноциклический ненасыщенный гетероцикл, содержащий один-три гетероатома, выбранных из атома кислорода, атома азота и атома серы, который может быть замещен одним-тремя заместителями (предпочтительно, одним заместителем), выбранными из группы, состоящей из (1) атома галогена, (2) C1-4 алкильной группы, которая может быть замещена атомом галогена, (3) C1-4 алкокси-группы, которая может быть замещена атомом галогена (предпочтительно каждый из которых выбран из группы, состоящей из атома галогена и C1-4 алкильной группы, которая может быть замещена атомом галогена); еще более предпочтительно 5- 6-членный моноциклический ненасыщенный азот-содержащий гетероцикл, содержащий один-три гетероатома, выбранных из атома кислорода, атома азота и атома серы, где указанный 5-6-членный моноциклический ненасыщенный азот-содержащий гетероцикл содержит по меньшей мере один атом азота, который может иметь один заместитель, представляющий собой атом галогена или C1-4 алкильную группу, которая может быть замещена атомом галогена (предпочтительно атомом галогена или трифторметильной группой); и особенно предпочтительно 5-6-членный моноциклический ненасыщенный азот-содержащий гетероцикл, содержащий один-три гетероатома, выбранных из атома кислорода, атома азота и атома серы, где указанный 5-6-членный моноциклический ненасыщенный азот-содержащий гетероцикл содержит по меньшей мере один атом азота, и который не содержит иных заместителей, помимо описанных в формуле.
В настоящем изобретении, цикл C предпочтительно представляет собой (1) C3-8 моноциклический циклоалкан, (2) 3-7-членный моноциклический гетероциклоалкан, содержащий один атом кислорода или атом азота в качестве гетероатома, (3) C5-7 моноциклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, или (4) 5-7-членный моноциклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным (в данном тексте каждый цикл независимо может быть замещен одним-пятью R10); более предпочтительно (1) C3-8 моноциклический циклоалкан, (2) 3-7-членный моноциклический гетероциклоалкан, содержащий один атом азота в качестве гетероатома, или (3) C5-7 моноциклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным (в данном тексте, каждое кольцо независимо может быть замещено одним-пятью R10); еще более предпочтительно C3-8 моноциклический циклоалкан, который может быть замещен одним-пятью R10, или бензол, который может быть замещен одним-тремя R10; и особенно предпочтительно C3-8 моноциклический циклоалкан или бензол.
В настоящем изобретении, R10 предпочтительно представляет собой (1) атом галогена, (2) гидрокси-группу, (3) циано-группу, (4) C1-4 алкильную группу, которая может быть замещена атомом галогена или гидрокси-группой, или (5) C1-4 алкокси-группу, которая может быть замещена атомом галогена или гидрокси-группой; более предпочтительно (1) атом галогена, (2) C1-4 алкильную группу, которая может быть замещена атомом галогена, или (3) C1-4 алкокси-группу, которая может быть замещена атомом галогена; еще более предпочтительно (1) атом галогена или (2) C1-4 алкильную группу, которая может быть замещена атомом галогена; и особенно предпочтительно атом галогена или трифторметильную группу.
В настоящем изобретении, соединение общей формулы (I), включая вышеуказанные предпочтительные комбинации, является предпочтительным.
В настоящем изобретении, предпочтительное соединение включает соединение, представленное общей формулой (I-1):

(где символы имеют указанные выше значения), его соль, сольват или сокристалл.
В настоящем изобретении, предпочтительное соединение включает соединение, представленное общей формулой (II):

(где символы имеют указанные выше значения), его соль, сольват или сокристалл.
Также, в настоящем изобретении, предпочтительное соединение включает соединение, представленное общей формулой (III):

(где символы имеют указанные выше значения), его соль, сольват или сокристалл.
Приведенные выше определения предпочтительных групп (одной группы или их комбинаций) также применимы к соединению общей формулы (I-1), (II) или (III).
В настоящем изобретении, соединения общей формулы (I-1), (II) или (III), включая комбинации перечисленных выше предпочтительных групп, являются предпочтительными.
В настоящем изобретении, более предпочтительное соединение включает соединение, представленное общей формулой (II-1):

(где R6 представляет собой атом водорода или атом галогена, и другие символы имеют указанные выше значения), его соль, сольват или сокристалл.
Также, в настоящем изобретении, более предпочтительное соединение включает соединение, представленное общей формулой (II-2):

(где R6 представляет собой атом водорода или атом галогена, и другие символы имеют указанные выше значения), его соль, сольват или сокристалл.
Приведенные выше определения предпочтительных групп (одной группы или их комбинаций) также применимы к соединению общей формулы (II-1) или (II-2).
В настоящем изобретении, соединения общей формулы (II-1) или (II-2), включая комбинации перечисленных выше предпочтительных групп, являются предпочтительными.
В настоящем изобретении, другое предпочтительное соединение включает соединение, представленное общей формулой (II-1-1):
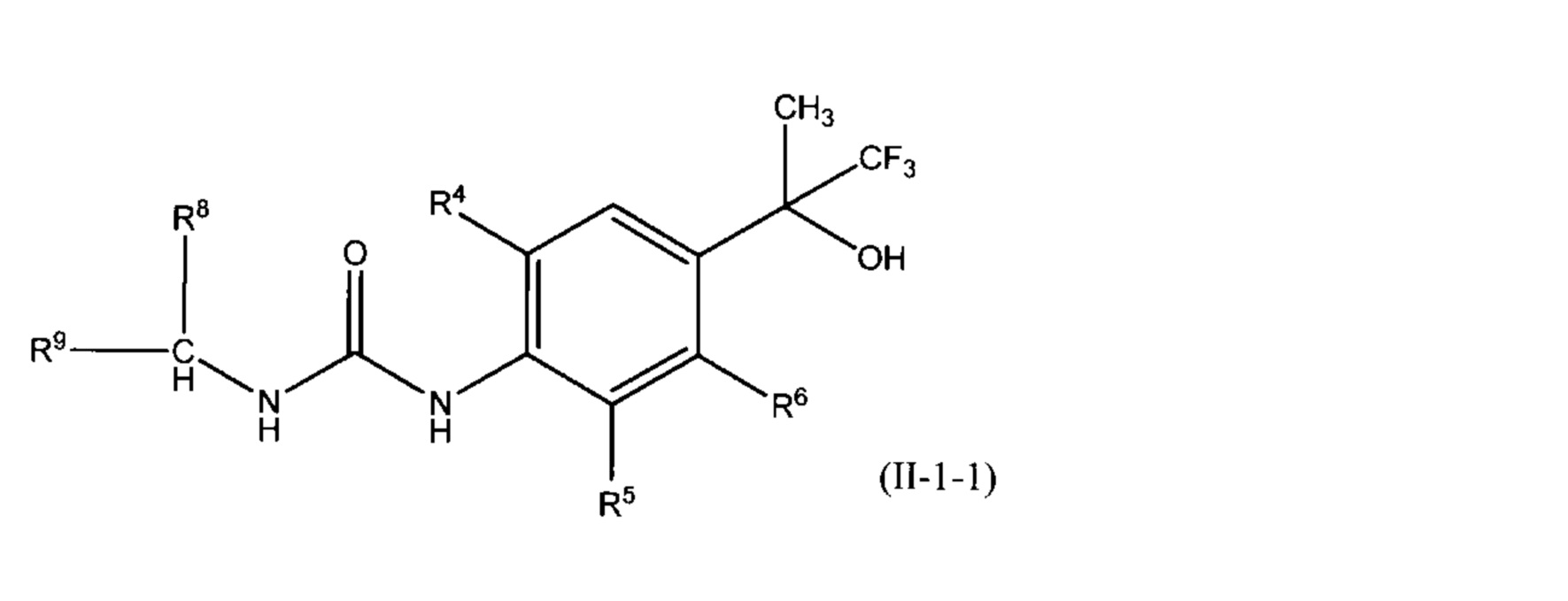
(где каждый R4 и R5 независимо представляет собой (1) атом водорода, (2) атом галогена, (3) C1-4 алкильную группу или (4) C1-4 алкокси-группу (предпочтительно, каждый R4 и R5 независимо представляет собой атом водорода, атом галогена или C1-4 алкильную группу), где R4 и R5 не могут оба одновременно представлять собой атом водорода; R6 представляет собой атом водорода или атом галогена; R8 представляет собой (1) атом водорода или (2) C1-4 алкильную группу, которая может быть замещена атомом галогена или гидрокси-группой (предпочтительно, атом водорода или метильную группу); R9 предпочтительно представляет собой (1) цикл A, (2) C2-4 алкильную группу, которая может быть замещена атомом галогена или гидрокси-группой, (3) -цикл B-цикл C, (4) -цикл B-метилен-цикл C, или (5) -цикл B-O-цикл C (R9 предпочтительно представляет собой цикл A); цикл A представляет собой (1) C3-8 моноциклический циклоалкан, (2) 3-7-членный моноциклический гетероциклоалкан, содержащий один атом кислорода в качестве гетероатома, (3) C5-7 моноциклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, (4) C8-10 бициклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, (5) 5-7-членный моноциклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным, или (6) 9-10-членный бициклический ненасыщенный гетероцикл, содержащий от одного до четырех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным; цикл B представляет собой (1) C3-8 моноциклический циклоалкан, (2) 3-7-членный моноциклический гетероциклоалкан, содержащий один атом кислорода в качестве гетероатома, (3) C5-7 моноциклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, или (4) 5-7-членный моноциклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным; цикл C представляет собой (1) C3-8 моноциклический циклоалкан, (2) 3- 7-членный моноциклический гетероциклоалкан, содержащий один атом кислорода или один атом азота в качестве гетероатома, (3) C5-7 моноциклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, или (4) 5-7-членный моноциклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным; в данном тексте каждый из циклов A, B или C может быть независимо замещен одним-пятью R10, и при наличии нескольких R10, количество R10 может быть одинаковым или разным; R10 представляет собой (1) атом галогена, (2) гидрокси-группу, (3) циано-группу, (4) C1-4 алкильную группу, которая может быть замещена атомом галогена или гидрокси-группой, или (5) C1-4 алкокси-группу, которая может быть замещена атомом галогена или гидрокси-группой, его соль, сольват или сокристалл.
В настоящем изобретении, другое предпочтительное соединение включает соединение, представленное общей формулой (II-2-1):

(где каждый R4 и R5 независимо представляет собой (1) атом водорода, (2) атом галогена, (3) C1-4 алкильную группу или (4) C1-4 алкокси-группу (предпочтительно, каждый R4 и R5 независимо представляет собой атом водорода, атом галогена или C1-4 алкильную группу), где R4 и R5 не могут оба одновременно представлять собой атом водорода; R6 представляет собой атом водорода или атом галогена; R8 представляет собой (1) атом водорода или (2) C1-4 алкильную группу, которая может быть замещена атомом галогена или гидрокси-группой (предпочтительно, атомом водорода или метильной группой); R9 предпочтительно представляет собой (1) цикл A, (2) C2-4 алкильную группу, которая может быть замещена атомом галогена или гидрокси-группой, (3) -цикл B-цикл C, (4) -цикл B-метилен-цикл C или (5) -цикл B-O-цикл C (R9 предпочтительно представляет собой цикл A); цикл A представляет собой (1) C3-8 моноциклический циклоалкан, (2) 3-7-членный моноциклический гетероциклоалкан, содержащий один атом кислорода в качестве гетероатома, (3) C5-7 моноциклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, (4) C8-10 бициклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, (5) 5-7-членный моноциклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным, или (6) 9-10-членный бициклический ненасыщенный гетероцикл, содержащий от одного до четырех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным; цикл B представляет собой (1) C3-8 моноциклический циклоалкан, (2) 3-7-членный моноциклический гетероциклоалкан, содержащий один атом кислорода в качестве гетероатома, (3) C5-7 моноциклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, или (4) 5-7-членный моноциклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным; цикл C представляет собой (1) C3-8 моноциклический циклоалкан, (2) 3- 7-членный моноциклический гетероциклоалкан, содержащий один атом кислорода или один атом азота в качестве гетероатома, (3) C5-7 моноциклическое ненасыщенное карбоциклическое кольцо, которое может быть частично насыщенным, или (4) 5-7-членный моноциклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атома кислорода, атома азота и атома серы, который может быть частично насыщенным; в данном тексте каждый из циклов A, B или C может быть независимо замещен одним-пятью R10, и при наличии нескольких R10 количество R10 может быть одинаковым или разным; R10 представляет собой (1) атом галогена, (2) гидрокси-группу, (3) циано-группу, (4) C1-4 алкильную группу, которая может быть замещена атомом галогена или гидрокси-группой, или (5) C1-4 алкокси-группу, которая может быть замещена атомом галогена или гидрокси-группой, его соль, сольват или сокристалл.
В настоящем изобретении, особенно предпочтительное соединение представляет собой соединение, представленное общей формулой (II-1-2):

(где каждый R4 и R5 независимо представляет собой атом галогена или метильную группу (предпочтительно, каждый R4 и R5 независимо представляет собой атом галогена); R6 представляет собой атом водорода или атом галогена (предпочтительно, атом водорода); R8 представляет собой атом водорода или метильную группу (предпочтительно, атом водорода); R9 представляет собой 5-6-членный моноциклический ненасыщенный гетероцикл, содержащий один-три гетероатома, выбранных из атома кислорода, атома азота и атома серы, который может быть замещен одним-тремя заместителями (предпочтительно, одним заместителем), каждый из которых выбран из группы, состоящей из (1) атома галогена, (2) C1-4 алкильной группы, которая может быть замещена атомом галогена, и (3) C1-4 алкокси-группы, которая может быть замещена атомом галогена (предпочтительно выбран из группы, состоящей из атома галогена и C1-4 алкильной группы, которая может быть замещена атомом галогена) (R9 предпочтительно представляет собой 5-6-членный моноциклический ненасыщенный азот-содержащий гетероцикл, содержащий один-три гетероатома, выбранных из атома кислорода, атома азота и атома серы, где указанный 5-6-членный моноциклический ненасыщенный азот-содержащий гетероцикл содержит по меньшей мере один атом азота, который имеет один заместитель, представляющий собой атом галогена или C1-4 алкильную группу, которая может быть замещена атомом галогена (предпочтительно атом галогена или трифторметильную группу)), его соль, сольват или сокристалл.
В настоящем изобретении, особенно предпочтительное соединение представляет собой соединение, представленное общей формулой (II-2-2):

(где каждый R4 и R5 независимо представляет собой атом галогена или метильную группу (предпочтительно, каждый R4 и R5 независимо представляет собой атом галогена); R6 представляет собой атом водорода или атом галогена (предпочтительно, атом водорода); R8 представляет собой атом водорода или метильную группу (предпочтительно, атом водорода); R9 представляет собой 5-6-членный моноциклический ненасыщенный гетероцикл, содержащий один-три гетероатома, выбранных из атома кислорода, атома азота и атома серы, который может быть замещен одним-тремя заместителями (предпочтительно, одним заместителем), каждый из которых выбран из группы, состоящей из (1) атома галогена, (2) C1-4 алкильной группы, которая может быть замещена атомом галогена, и (3) C1-4 алкокси-группы, которая может быть замещена атомом галогена (предпочтительно выбран из группы, состоящей из атома галогена и C1-4 алкильной группы, которая может быть замещена атомом галогена) (R9 предпочтительно представляет собой 5-6-членный моноциклический ненасыщенный азот-содержащий гетероцикл, содержащий один-три гетероатома, выбранных из атома кислорода, атома азота и атома серы, где указанный 5-6-членный моноциклический ненасыщенный азот-содержащий гетероцикл содержит по меньшей мере один атом азота, который имеет один заместитель, представляющий собой атом галогена или C1-4 алкильную группу, которая может быть замещена атомом галогена (предпочтительно, атом галогена или трифторметильную группу)), его соль, сольват или сокристалл.
В настоящем изобретении, предпочтительное соединение представляет собой следующие:
(1) 1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина,
(2) 1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина,
(3) 1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[6-(трифторметил)-3-пиридинил]метил}мочевина,
(4) 1-[(5-хлор-2-пиридинил)метил]-3-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}мочевина,
(5) 1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[3-(трифторметил)-1,2,4-оксадиазол-5-ил]метил}мочевина,
(6) 1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина,
(7) 1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[6-(трифторметил)-3-пиридинил]метил}мочевина,
(8) 1-[(5-хлор-2-пиридинил)метил]-3-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}мочевина,
(9) 1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[3-(трифторметил)-1,2,4-оксадиазол-5-ил]метил}мочевина,
(10) 1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[3-(трифторметил)-1,2,4-оксадиазол-5-ил]метил}мочевина,
(11) 1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[2-(трифторметил)-5-пиримидинил]метил}мочевина,
(12) 1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина,
(13) 1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[2-(трифторметил)-1,3-тиазол-5-ил]метил}мочевина,
(14) 1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[3-(трифторметил)-1,2,4-оксадиазол-5-ил]метил}мочевина,
(15) 1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[2-(трифторметил)-5-пиримидинил]метил }мочевина,
(16) 1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[2-(трифторметил)-1,3-тиазол-5-ил]метил }мочевина,
(17) 1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина,
(18) 1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина, или его стереоизомер, или его соль, сольват или сокристалл.
Соединение по настоящему изобретению предпочтительно представляет собой соединение, у которого значение EC50 (или ECrtg50 (см. (1) Биологический пример 1 ниже)) для открывающего действия на KCNQ2/3 составляет 100 мкМ или ниже, более предпочтительно при 10 мкМ или ниже, еще более предпочтительно 1 мкм или ниже, и особенно предпочтительно 0.1 мкМ или ниже. Соединение по настоящему изобретению еще более предпочтительно представляет собой соединение, оказывающее открывающее действие на все KCNQ2/3, KCNQ4 и KCNQ5 каналы (для любых каналов, значение EC50 (или ECrtg 50) предпочтительно составляет 100 мкМ или ниже, более предпочтительно 10 мкМ или ниже, и еще более предпочтительно 1 мкМ или ниже). Способ определения значения EC50 (или ECrtg 50) хорошо известен квалифицированному специалисту в данной области (см., например, Neuropharmacology, Vol. 40, 2001, pp. 888-898, European Journal of Pharmacology, Vol. 437, 2002, pp. 129-137). Значение EC50 предпочтительно определяют методом измерения флуоресценции, и более предпочтительно - методом, описанным ниже в п. (1) Биологического примера 1.
Соединение по настоящему изобретению предпочтительно представляет собой соединение, обладающее отличной растворимостью. В настоящем изобретении, растворимость может выражаться в виде растворимости во втором растворе (pH = 6.8), описанном для теста элюирования в Фармакопее Японии, например, методом высаживания в диметилсульфоксиде (ДМСО) (см. ниже (3) Тест на растворимость). Предпочтительно соединение, обладающее растворимостью 20 мкМ или выше, более предпочтительно 40 мкМ или выше, еще более предпочтительно 60 мкМ или выше, и особенно предпочтительно 80 мкМ или выше.
Соединение по настоящему изобретению предпочтительно представляет собой соединение, обладающее отличной метаболической устойчивостью. Метаболическую устойчивость можно определять общеизвестным методом, используя, например, микросомы печени человека или другого вида животного (предпочтительно, человека). Устойчивость соединения к микросоме печени человека можно определять, например, введением в реакцию коммерчески доступной микросомы печени человека и соединения по настоящему изобретению в течение определенного периода времени (например, 5 - 30 минут), и вычислением остаточного содержания в прореагировавшем образце по сравнению с непрореагировавшим образцом (см. ниже (4) Определение стабильности в микросоме печени человека).
Соединение по настоящему изобретению предпочтительно представляет собой соединение, обладающее высокой степенью безопасности. Например, соединение по настоящему изобретению включает соединение, не оказывающее воздействия на hERG канал (ген специфических калиевых каналов сердца человека), или соединение, оказывающее незначительное подавляющее действие на hERG канал. Подавляющее действие на hERG канал (hERG тест) можно измерять широко известными методами, например, рубидиевый метод - измерение потока ионов рубидия (Rb+) в hERG-экспрессирующей клетке, и пэтч-кламп метод - измерение HERG тока методом пэтч-клампа (см. ниже (5) Определение воздействия на поток hERG IKr).
В настоящее изобретение, если не указано иное, включены все стереоизомеры. Например, в настоящее изобретение включены все геометрические изомеры двойных связей, циклов и конденсированных циклов (E-, Z-, цис-, транс-изомеры), оптические изомеры, обусловленные наличием ассиметричного атома углерода (R-, S-изомер, α-, β-конфигурации, энантиомеры, диастереоизомеры), оптически активные изомеры, обладающие свойством оптического вращения (D, L, d, 1-изомеры), разнополярные изомеры в хроматографическом разделении (изомеры с высокой и низкой полярностью), соединения, находящиеся в равновесии, ротамеры, их смеси в любом соотношении и рацемические смеси. Также, в настоящее изобретение включены все изомеры, существование которых объясняется таутомерией.
В настоящем изобретении, если не указано иное, как будет понятно квалифицированному специалисту в данной области техники, символ:

обозначает связывание с объектом, находящимся за плоскостью бумаги (то есть, α-конфигурацию),

обозначает связывание с объектом, находящимся перед плоскостью бумаги (то есть, β-конфигурацию), и

обозначает α-конфигурацию, β-конфигурацию или их произвольную комбинацию.
Кроме того, оптически активное соединение по настоящему изобретению не сводится к соединению с чистотой 100%, но может включать другой энантиомер или диастереоизомер, имеющий чистоту менее 50%. Частные примеры рацемической смеси включают Пример 5:1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина, которая представляет собой смесь Примера 22(1):1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина и Примера 25(4):1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиридинил] метил}мочевина и т.д.
В настоящем изобретении, любые упоминания соединения по настоящему изобретению включают соединение, представленное общей формулой (I), его соль, сольват или сокристалл, и сольват соли соединения, представленного общей формулой (I), или его сокристалл.
Соединение, представленное общей формулой (I), превращают в соответствующую соль хорошо известными методами. В качестве соли предпочтительны фармацевтически приемлемые соли. Также предпочтительна водорастворимая соль. Подходящие соли включают соли, образующиеся при добавлении кислоты (соли неорганических кислот (гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат, нитрат и т.д.), соли органических кислот (формиат, ацетат, пропионат, трифторацетат, лактат, тартрат, оксалат, малонат, сукцинат, фумарат, малат, малеат, бензоат, цитрат, метансульфонат, этансульфонат, бензолсульфонат, толуолсульфонат, изетионат, глюкуронат, глюконат, аспартат, глютамат и т.д.).
Соединение, представленное общей формулой (I), и его соль могут присутствовать в несольватированной форме или в форме сольвата с фармацевтически приемлемым растворителем, таким как вода и этанол. Предпочтительным сольватом является гидрат. Соединение, представленное общей формулой (I), и его соль можно превращать в сольват хорошо известными методами.
Соединение, представленное общей формулой (I), может образовывать сокристалл с подходящим веществом, образующим сокристалл. В качестве сокристалла предпочтителен фармацевтически приемлемый сокристалл, образованный с помощью фармацевтически приемлемого вещества, образующего сокристалл. Сокристалл обычно определяют как кристалл, образованный двумя или более разными молекулами посредством межмолекулярного взаимодействия, отличного от ионной связи. Кроме того, сокристалл может представлять собой композит нейтральной молекулы и соли. Сокристалл можно получать широко известными методами, например, кристаллизацией расплава, перекристалиизацией из растворителя или физически совместным растиранием компонентов. Подходящие вещества, образующие сокристалл, включают вещества, описанные в WO2006/007448.
Соединение по настоящему изобретению можно вводить в форме пролекарства. Например, пролекарство соединения, представленного общей формулой (I), означает соединение, которое превращается в соединение, представленное общей формулой (I), при взаимодействии с энзимом, желудочным соком и т.д., в живом организме. Пролекарства соединения, представленного общей формулой (I), включают: соединения, в которых гидроксильная группа ацилирована, алкилирована, фосфорилирована или борирована, в случаях, когда соединения, представленные общей формулой (I), содержат гидроксильную группу (например, соединения, представленные общей формулой (I), в которых гидроксильная группа ацетилирована, пальмитоилирована, пропаноилирована, пивалоилирована, сукцинилирована, фумарилирована, аланилирована или диметиламинометилкарбонилирована). Указанные соединения можно получать широко известными методами. Кроме того, пролекарство соединения, представленного общей формулой (I), может представлять собой гидрат или негидрат. Кроме того, пролекарство соединения, представленного общей формулой (I), может представлять собой соединение, которое превращается в соединение, представленное общей формулой (I), в физиологических условиях, как описано в "Development of Medicaments", vol.7 "Molecular Design", pp.163-198, опубликованном Hirokawa Shoten в 1990 году.
Соединение, представленное общей формулой (I), включает все изотопы, то есть включает соединения, в которых по меньшей мере один атом замещен на атом с идентичным атомным номером, но имеющий атомную массу или массовое число, отличное от значений, доминирующих в природной среде. Примеры изотопов, включенных в соединение, представленное общей формулой (I), включают2H,3H,11C,13C,14C,13N,15N,15O,17O,18O,35S,18F,36Cl,123I,125I и т.д.
Способ получения соединения по настоящему изобретению
Соединение, представленное общей формулой (I), можно получать широко известными способами, например, описанными ниже способами, способами, схожими с этими способами, способами, описанными в Примерах, или способами, описанными в "Comprehensive Organic Transformations: A Guide to Functional Group Preparations, 2nd Edition (Richard C. Larock, John Wiley & Sons Inc, 1999)", и т.д., с необходимыми модификациями и комбинациями. Здесь необходимо заметить, что далее по тексту в каждом способе получения каждое исходное вещество можно использовать в виде соли. Такие соли включают соли, описанные выше в качестве фармацевтически приемлемых солей общей формулы (I).
Соединение, представленное общей формулой (I-1), в котором R11 представляет собой OR1, из числа соединений, представленных общей формулой (I), можно получать способом, показанным ниже на схеме реакции 1 или 2, с использованием соединения, представленного общей формулой (SM1):

(где T представляет собой R1 или защитную группу для гидроксильной группы, а другие символы имеют значения, указанные выше) в качестве исходного вещества.
Примеры защитной группы для гидроксильной группы в T включают метильную группу, этильную группу, пропильную группу, бутильную группу, тритильную группу, метоксиметильную (MOM) группу, 1-этоксиэтильную (EE) группу, метоксиэтоксиметильную (MEM) группу, 2-тетрагидропиранильную (THP) группу, триметилсилильную (TMS) группу, триэтилсилильную (TES) группу, трет-бутилдиметилсилильную (TBDMS) группу, трет-бутилдифенилсилильную (TBDPS) группу, ацетильную (Ac) группу, пивалоильную группу, бензоильную группу, бензильную (Bn) группу, п-метоксибензильную группу, аллилоксикарбонильную (Alloc) группу, 2,2,2-трихлорэтоксикарбонильную (Troc) группу и т.д.
Выбор защитных групп не ограничен только вышеуказанными группами и может включать, кроме указанных, группы, которые можно легко и селективно удалять. Например, можно использовать группы, описанные в книге "Protective Groups in Organic Synthesis (T. W. Greene, John Wiley & Sons Inc, 1999)".
Соединение, в котором Y представляет собой -NH- или -O-, из числа соединений, представленных общей формулой (I), то есть соединение, представленное общей формулой (1-a):

(где Y1 представляет собой -NH- или -O-, а другие символы имеют значения, указанные выше) можно получать способом, приведенным в схеме реакции 1:
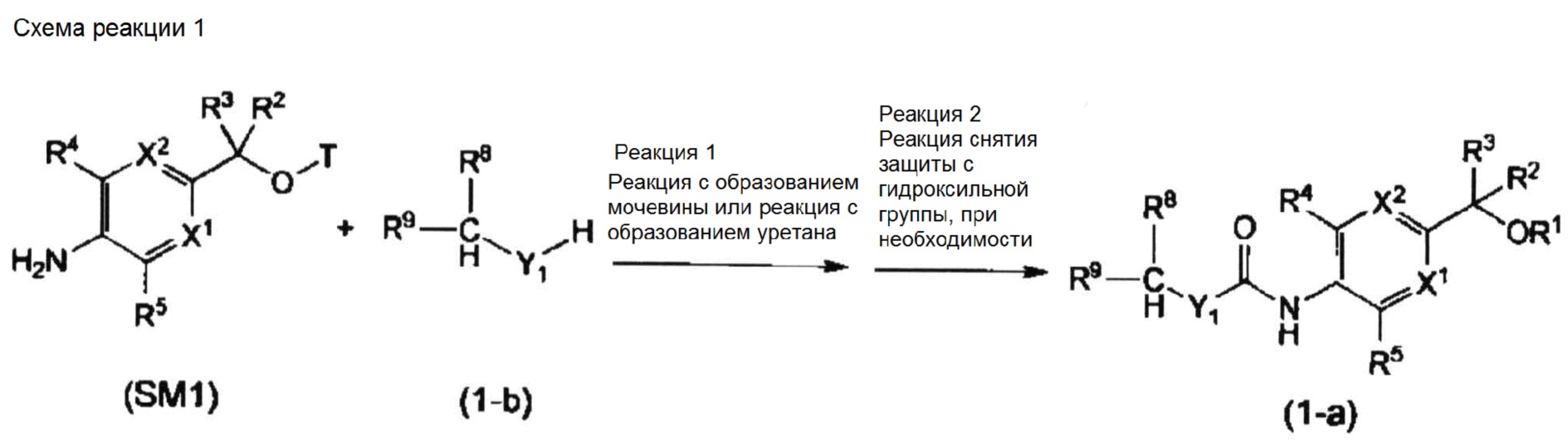
(где все символы имеют значения, указанные выше).
Реакцию получения мочевины или уретана, приведенную в качестве реакции 1 на схеме реакции 1, осуществляют, например, введением в реакцию соединения, представленного общей формулой (SM1), с трифосгеном при температуре от комнатной до 40°C в органическом растворителе (тетрагидрофуран, N-метил-2-пирролидинон, N,N-диметилформамид, дихлорметан и т.д.) в присутствии основания (триэтиламин, диизопропилэтиламин и т.д.) с образованием соответствующего изоцианата, и затем введением в реакцию с соединением, представленным общей формулой (1-b), в органическом растворителе (тетрагидрофуран, N-метил-2-пирролидинон, дихлорметан и т.д.) при температуре от комнатной до 60°C в присутствии основания (триэтиламин, диизопропилэтиламин и т.д.) или без него. Альтернативно, реакцию получения изоцианата из соединения, представленного общей формулой (SM1), и введение в реакцию соединения, представленного общей формулой (1-b), можно осуществлять в обратном порядке. Также, данную реакцию проводят, например, в органическом растворителе (дихлорметан, N,N-диметилформамид) в присутствии 1,1'-карбонилбис-1H-имидазола (CDI), в присутствии основания (триэтиламин, N-метил морфолин и т.д.) или без него при температуре от около 0 до 80°C. Предпочтительно все указанные реакции проводить в атмосфере инертного газа (аргон, азот и т.д.) в безводной среде.
В данном тексте, на схеме реакции 1, снятие защиты с гидроксильной группы, изображенное в качестве реакции 2, проводят при необходимости. В случае соединения, представленного общей формулой (1-a), когда T представляет собой R1, соединение, представленное общей формулой (1-a), можно получать без проведения реакции снятия защиты.
Реакция снятия защиты с гидроксильной группы широко известна, и ее можно проводить описанными ниже способами. Примеры таких способов включают следующие:
(1) реакция снятия защиты посредством щелочного гидролиза,
(2) реакция снятия защиты в кислой среде,
(3) реакция снятия защиты посредством гидрогенолиза,
(4) реакция снятия силильной защитной группы,
(5) реакция снятия защиты с помощью металла,
(6) реакция снятия защиты с помощью металлокомплекса и т.д.
Указанные способы будут описаны подробно:
(1) Реакцию снятия защиты посредством щелочного гидролиза проводят, например, в органическом растворителе (метанол, тетрагидрофуран, диоксан и т.д.), применяя гидроксид щелочного металла (гидроксид натрия, гидроксид калия, гидроксид лития и т.д.), гидроксид щелочно-земельного металла (гидроксид бария, гидроксид кальция и т.д.), или карбонат (карбонат натрия или карбонат калия и т.д.), или их водный раствор или их смесь при температуре от около 0 до 40°C.
(2) Реакцию снятия защиты в кислой среде проводят, например, в органическом растворителе (дихлорметан, хлороформ, диоксан, этилацетат, анизол и т.д.), в органической кислоте (уксусная кислота, трифторуксусная кислота, метансульфокислота, п-толуолсульфокислота и т.д.) или в неорганической кислоте (соляная кислота, серная кислота и т.д.) или в их смеси (бромоводород/уксусная кислота и т.д.) при температуре от около 0 до 100°C.
(3) Реакцию снятия защиты посредством гидрогенолиза проводят, например, в растворителе (простые эфиры (тетрагидрофуран, диоксан, диметоксиэтан, диэтиловый эфир и т.д.), спирты (метанол, этанол и т.д.), бензолы (бензол, толуол и т.д.), кетоны (ацетон, метилэтилкетон и т.д.), нитрилы (ацетонитрил и т.д.), амиды (диметилформамид и т.д.), вода, этилацетат, уксусная кислота, или смесь двух или более из перечисленных компонентов, и т.д.) в присутствии катализатора (палладий на угле, палладиевая чернь, гидроксид палладия, оксид платины, никель Ренея и т.д.) в атмосфере водорода при нормальном или повышенном давлении, или в присутствии формиата аммония при температуре от около 0 до 200°C.
(4) Реакцию снятия силильной защитной группы проводят, например, в смешивающемся с водой органическом растворителе (тетрагидрофуран, ацетонитрил и т.д.), применяя тетрабутиламмония фторид при температуре от около 0 до 40°C.
(5) Реакцию снятия защиты с помощью металла проводят, например, в кислом растворителе (уксусная кислота, буферный раствор с показателем pH от 4.2 до 7.2, или в их смеси с органическим растворителем, таким как тетрагидрофуран и т.д.), в присутствии цинкового порошка, при необходимости применяя обработку ультразвуком, при температуре от около 0 до 40°C.
(6) Реакцию снятия защиты с помощью комплекса металла проводят, например, в органическом растворителе (дихлорметан, диметилформамид, тетрагидрофуран, этилацетат, ацетонитрил, диоксан, этанол и т.д.), воде или их смеси, в присутствии улавливающего реагента (трибутилолова гидрид, триэтилсилан, димедон, морфолин, диэтиламин, пирролидин и т.д.), органической кислоты (уксусная кислота, муравьиная кислота, 2-этилгексановая кислота и т.д.) и/или соли органической кислоты (2-этилгексанат натрия, 2-этилгексанат калия и т.д.), в присутствии фосфинового реагента (трифенилфосфин и т.д.) или без него, используя комплекс металла (тетракис(трифенилфосфин)палладий(0), дихлорбис(трифенилфосфин)палладий (II), ацетат палладия (II), хлортрис(трифенилфосфин)родий (I) и т.д.) при температуре примерно от 0 до 40°C.
Кроме вышеуказанных способов, реакцию снятия защиты можно осуществлять, например, способом, описанным в "Protective Groups in Organic Synthesis (T.W.Greene, John Wiley&Sons Inc, 1999)".
Как очевидно квалифицированным специалистам в данной области техники, целевое соединение по настоящему изобретению можно легко получать, подходящим образом применяя описанные реакции снятия защиты.
Соединение, в котором Y представляет собой связь, из числа соединений, представленных общей формулой (I), то есть соединение, представленное общей формулой (2-a):

(где все символы имеют значения, указанные выше), можно получать способом, изображенным на схеме реакции 2:

(где все символы имеют значения, указанные выше).
То есть, целевое соединение можно получать введением соединения, представленного общей формулой (SM1), и соединения, представленного общей формулой (2-b), в реакцию 3: реакция амидирования, и в реакцию 4: снятие защиты с гидроксильной группы, при необходимости.
Реакция амидирования широко известна, и ее примеры включают:
(1) способ, включающий применение галогенангидрида,
(2) способ, включающий применение смешанного ангидрида кислоты, и
(3) способ, включающий применение конденсирующего средства.
Перечисленные способы подробно описаны ниже:
(1) Способ, включающий применение галогенангидрида, осуществляют, например, введением карбоновой кислоты в реакцию с галогенирующим кислоту агентом (оксалил хлорид, тионил хлорид и т.д.) в органическом растворителе (хлороформ, дихлорметан, диэтиловый эфир, тетрагидрофуран и т.д.) или без растворителей, при температуре от -20°C до температуры кипения растворителя, и затем введением полученного галогенангидрида в реакцию с амином в присутствии основания (пиридин, триэтиламин, диметиланилин, диметиламинопиридин, диизопропилэтиламин и т.д.) в органическом растворителе (хлороформ, дихлорметан, диэтиловый эфир, тетрагидрофуран и т.д.) при температуре от 0 до 40°C. Кроме того, этот способ можно осуществлять введением полученного галогенангидрида в реакцию с амином при температуре от 0 до 40°C, используя щелочной водный раствор (смесь бикарбоната натрия и воды или раствор гидроксида натрия и т.д.) в органическом растворителе (диоксан, тетрагидрофуран и т.д.).
(2) Способ, включающий применение смешанного ангидрида, осуществляют, например, введением карбоновой кислоты в реакцию с галогенангидридом (пивалоил хлорид, тозил хлорид, мезил хлорид и т.д.) или c производным кислоты (этилхлорформиат, изобутилхлорформиат и т.д.) в органическом растворителе (хлороформ, дихлорметан, диэтиловый эфир, тетрагидрофуран и т.д.) или без растворителя, в присутствии основания (пиридин, триэтиламин, диметиланилин, диметиламинопиридин, диизопропилэтиламин и т.д.) при температуре от 0 до 40°C, и затем введением полученного смешанного ангидрида в реакцию с амином в органическом растворителе (хлороформ, дихлорметан, диэтиловый эфир, тетрагидрофуран и т.д.) при температуре от 0 до 40°C.
(3) Способ, включающий применение конденсирующего средства, осуществляют, например, введением карбоновой кислоты в реакцию с амином в органическом растворителе (хлороформ, дихлорметан, диметил формамид, диэтиловый эфир, тетрагидрофуран и т.д.) или без растворителей, в присутствии основания (пиридин, триэтиламин, диметиланилин, диметиламинопиридин и т.д.) или без него, применяя конденсирующее средство (1,3-дициклогексилкарбодиимид (DCC), 1-этил-3-[3-(диметиламино)пропил]карбодиимид (EDC), 1,1'-карбонилбис-1H-имидазол (CDI), 2-хлор-1-метилпиридиния иодид, 1-пропилфосфоновой кислоты циклический ангидрид (циклический ангидрид 1-пропанфосфоновой кислоты, PPA) и т.д.), и в присутствии 1-гидроксибензтриазола (HOBt) или без него, при температуре от 0 до 40°C.
Эти реакции (1), (2) и (3) предпочтительно проводят в атмосфере инертного газа (аргон, азот и т.д.) в безводной среде.
В данном случае, при необходимости осуществляют снятие защиты с гидроксильной группы. В случае соединения, представленного общей формулой (2-a), когда T представляет собой R1, соединение, представленное общей формулой (2-a), можно получать без проведения реакции снятия защиты.
Реакцию снятия защиты с гидроксильной группы можно осуществлять таким же образом, как реакцию снятия защиты с гидроксильной группы, описанную на схеме реакции 1.
Соединение, представленное общей формулой (SM1), можно получать с применением соединения, представленного общей формулой (3-a):

(где W представляет собой атом галогена (Cl, Br, I), или Tf (трифторметансульфонил) O группу, или Ts (толуолсульфонил) O группу, R41 и R51 каждый имеют такие же значения, как R4 и R5 (где R41 и R51 оба одновременно могут представлять собой атом водорода), а другие символы имеют значения, указанные выше); и соединения, представленного общей формулой (3-b):

(где все символы имеют значения, указанные выше), или
соединения, представленного общей формулой (3-g):

(где X представляет собой атом галогена (Cl, Br, I), R100 и R110 каждый независимо представляет собой атом водорода или защитную группу для амино-группы, другие символы имеют значения, указанные выше), в качестве исходных веществ, способом, изображенным на схеме реакции 3:
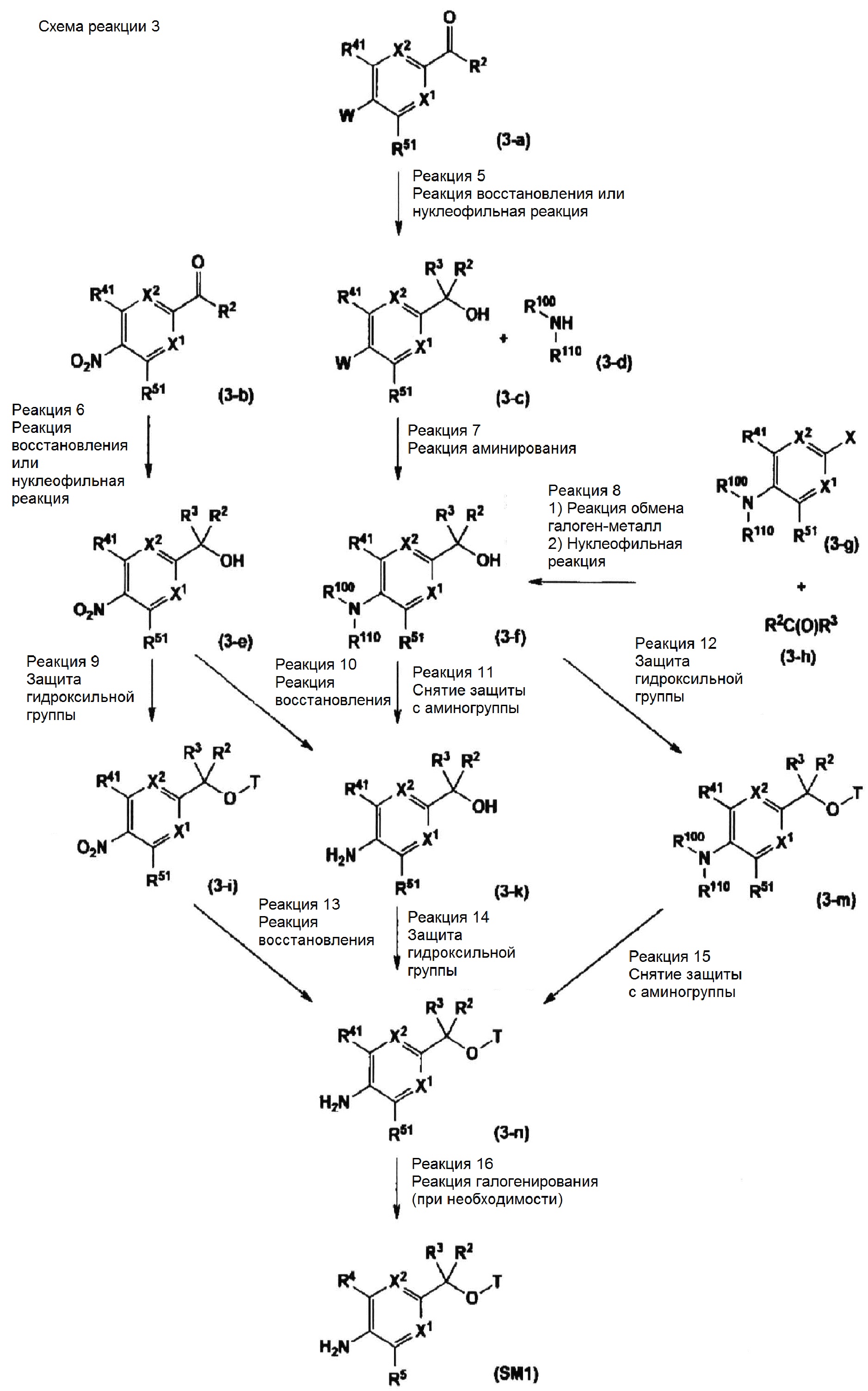
(где все символы имеют значения, указанные выше).
Соединения, представленные общей формулой (3-a), где W представляет собой TfO группу или TsO группу, можно получать из соединения, в котором W представляет собой гидроксильную группу, широко известными способами, например, способом, описанным в "Comprehensive Organic Transformations: A Guide to Functional Group Preparations, second edition (Richard C. Larock, John Wiley & Sons Inc, 1999)" и т.д. Также, эти соединения можно получать способом, описанным в Примере 37.
Примеры защитной группы для амино-группы в R100 и R110 включают бензилоксикарбонильную группу, трет-бутоксикарбонильную (Boc) группу, аллилоксикарбонильную (Alloc) группу, 1-метил-1-(4-бифенил)этоксикарбонильную (Bpoc) группу, трифторацетильную группу, 9-флуоренилметоксикарбонильную группу (Fmoc), бензильную (Bn) группу, п-метоксибензильную группу, бензилоксиметильную (BOM) группу, 2-(триметилсилил)этоксиметильную (SEM) группу и т.д.
Защитные группы не ограничены только вышеописанными группами и могут включать, кроме вышеописанных, группы, которые можно легко и селективно удалять. Например, можно использовать группы, описанные в "Protective Groups in Organic Synthesis (T. W. Greene, John Wiley & Sons Inc, 1999)".
На схеме реакции 3, реакцию нуклеофильного присоединения, изображенную в качестве реакций 5 и 6, осуществляют введением в реакцию соединения, представленного общей формулой (3-a) или общей формулой (3-b), с металлорганическим реагентом, соответствующим R3, например, алкил(R3) магния бромид, алкил(R3) литий, в органическом растворителе (тетрагидрофуран, диэтиловый эфир и т.д.) в присутствии хлорида церия или без него, при температуре от -78°C до комнатной. Кроме того, данную реакцию осуществляют введением в реакцию реагента Руперта (трифторметилтриметилсилан) в органическом растворителе (тетрагидрофуран, диэтиловый эфир и т.д.) в присутствии тетрабутиламмония фторида при температуре от -78°C до комнатной.
На схеме реакции 3, реакцию восстановления, изображенную в качестве реакций 5 и 6, осуществляют введением в реакцию соединения, представленного общей формулой (3-a) (где R2 отличен от атома водорода), с восстановителем (боргидрид натрия, боргидрид лития, лития алюмогидрид, диизобутилалюмогидрид и т.д.) в органическом растворителе (метанол, этанол, тетрагидрофуран, гексан и т.д.) при температуре от -78°C до 80°C.
На схеме реакции 3, реакцию аминирования, изображенную в качестве реакции 7, осуществляют введением в реакцию соединения, представленного общей формулой (3-c), и соединения, представленного общей формулой (3-d), при температуре от комнатной до -120°C, в органическом растворителе (этилацетат, изопропилацетат, бензол, толуол, ксилол, гептан, циклогексан, тетрагидрофуран, диоксан, диметоксиэтан, этанол, изопропанол, полиэтиленгликоль, диметилсульфоксид, N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пирролидинон, метиленхлорид, хлороформ, ацетон, ацетонитрил, вода или их смесь или тому подобные), в присутствии основания (диэтиламин, триэтиламин, пропиламин, диизопропиламин, диизопропилэтиламин, дибутиламин, трибутиламин, пирролидин, пиперидин, N-метилпиперидин, 1,4-диазабицикло[2.2.2]октан (DABCO), пиридин, гидроксид натрия, гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, фосфат натрия, фосфат калия, фторид калия или тому подобные), и катализатора (палладиевый катализатор (например, тетракис(трифенилфосфин) палладий (Pd(PPh3)4), бис(трифенилфосфин)палладия дихлорид (PdCl2(PPh3)2), ацетат палладия (Pd(OAc)2), дихлорид палладия (PdCl2), палладиевая чернь, 1,1'-бис(дифенилфосфиноферроцен)дихлорпалладий (PdCl2(dppf)2), диаллил дихлорид палладий (PdCl2(аллил)2), фенилбис(трифенилфосфин)палладия иодид (PhPdI(PPh3)2), трис(дибензилиденацетон)дипалладий (Pd2(DBA)3), бис(три-трет-бутилфосфин)палладий (Pd(tBu3P)2) и т.д.), и в присутствии лиганда (например, 4,5-бис(дифенилфосфино)-9,9-диметилксантен и т.д.).
На схеме реакции 3, реакцию обмена галоген-металл в арилгалогениде, и последующую реакцию нуклеофильного присоединения, изображенную в качестве реакции 8, осуществляют введением в реакцию соединения, представленного общей формулой (3-g), с металлорганическим реагентом (н-бутиллитий, трет-бутиллитий, изопропилмагния бромид, изопропилмагния хлорид) в органическом растворителе (тетрагидрофуран, диэтиловый эфир и т.д.) при температуре от -78 до 60°C, и затем введением в реакцию соединения, представленного общей формулой (3-h), в органическом растворителе (тетрагидрофуран, диэтиловый эфир и т.д.) при температуре от -78 до 60°C.
На схеме реакции 3, при необходимости осуществляют реакции защиты гидроксильной группы, изображенные в качестве реакций 9, 12, и 14. Реакцию введения защитной группы осуществляют, например, введением в реакцию соединений , представленных общими формулами (3-e), (3-f) и (3-k), с силилирующим агентом (хлортриметилсилан, хлортриэтилсилан, хлор-трет-бутилдиметилсилан, хлор-трет-бутил дифенилсилан и т.д.) в органическом растворителе (тетрагидрофуран, дихлорметан и т.д.) в присутствии основания (имидазол, триэтиламин и т.д.) при температуре от 0°C до комнатной.
Защитные группы не ограничены только вышеописанными группами и могут включать, кроме вышеописанных, группы, которые можно легко и селективно удалять. Например, можно использовать группы, описанные в "Protective Groups in Organic Synthesis (T. W. Greene, John Wiley & Sons Inc, 1999)".
На схеме реакции 3, реакции восстановления нитро-группы, изображенные в качестве реакций 10 и 13, проводят с соединением, представленным общей формулой (3-e) или (3-i), в растворителе (простые эфиры (тетрагидрофуран, диоксан, диметоксиэтан, диэтиловый эфир и т.д.), спирты (метанол, этанол и т.д.), бензолы (бензол, толуол и т.д.), кетоны (ацетон, метилэтилкетон и т.д.), нитрилы (ацетонитрил и т.д.), амиды (диметилформамид и т.д.), вода, этилацетат, уксусная кислота или смесь двух или более компонентов и т.д.) в присутствии катализатора (палладий на угле, палладиевая чернь, гидроксид палладия, оксид платины, никель Ренея и т.д.) в атмосфере водорода при нормальном или повышенном давлении, или в присутствии формиата аммония при температуре примерно от 0 до 200°C. Альтернативно, указанную реакцию проводят с помощью металл-содержащего реагента (цинк, железо, олово, хлорид олова, хлорид железа, самарий, индий, боргидрид натрия - хлорид никеля и т.д.) в смешивающемся с водой растворителе (этанол, метанол, тетрагидрофуран и т.д.), в присутствии кислот (соляная кислота, бромистоводородная кислота, хлорид аммония, уксусная кислота, формиат аммония и т.д.) или без них, при температуре примерно от 0 до 150°C.
На схеме реакции 3, реакцию снятия защиты с амино-группы, изображенную в качестве реакций 11 и 15, можно проводить описанным далее способом.
Реакция снятия защиты с амино-группы широко известна, и ее можно осуществлять приведенными ниже способами. Их примеры включают:
(1) реакция снятия защиты посредством щелочного гидролиза,
(2) реакция снятия защиты в кислой среде,
(3) реакция снятия защиты посредством гидрогенолиза,
(4) реакция снятия силильной защитной группы,
(5) реакция снятия защиты с помощью металла,
(6) реакция снятия защиты с помощью комплекса металла и т.д.
Указанные реакции снятия защиты можно проводить таким же образом, как реакции снятия защиты с гидроксильной группы, описанные выше.
Защитные группы не ограничены только вышеописанными группами и могут включать, кроме вышеописанных, группы, которые можно легко и селективно удалять. Например, можно использовать группы, описанные в "Protective Groups in Organic Synthesis (T. W. Greene, John Wiley & Sons Inc, 1999)".
В данном тексте, в случае соединения, представленного общей формулой (3-n), когда любой один из R41 и R51 представляет собой атом водорода, при необходимости, или когда оба R41 и R51 одновременно представляют собой атом водорода, соединение, представленное общей формулой (3-n), вводят в реакцию галогенирования, изображенную в качестве реакции 16.
На схеме реакции 3, реакцию галогенирования, изображенную в качестве реакции 16, проводят введением соединения, представленного общей формулой (3-n), в реакцию с галогенирующим реагентом (N-хлорсукцинимид, 1,3-дихлор-5,5-диметилгидантоин, N-бромсукцинимид, N-иодсукцинимид и т.д.) в органическом растворителе (ацетонитрил, N,N-диметилформамид и т.д.) при температуре от 0 до 80°C.
Соединение, представленное общей формулой (I), в котором R11 представляет собой NH2, и Y представляет собой -NH- или -O-, то есть соединение, представленное общей формулой (4-a) (где Y1 представляет собой -NH- или -O-, другие символы имеют значения, указанные выше), можно получать способом, изображенным на схеме реакции 4 (где все символы имеют значения, указанные выше) с применением соединения, представленного общей формулой (SM2).


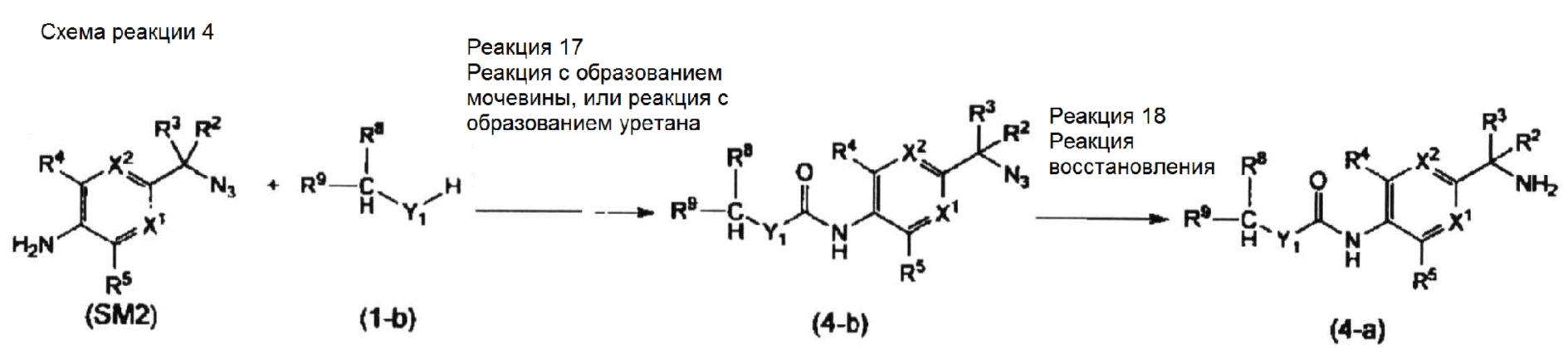
На схеме реакции 4, реакцию получения мочевины или реакцию получения уретана, изображенную в качестве реакции 17, можно проводить таким же способом, как реакцию 1, описанную выше на схеме реакции 1.
На схеме реакции 4, реакцию восстановления азидной группы, изображенную в качестве реакции 18, осуществляют введением в реакцию трифенилфосфина в смеси органического растворителя (тетрагидрофуран, диметилэтиловый эфир и т.д.) и воды при комнатной температуре. Также, указанную реакцию осуществляют введением в реакцию лития алюмогидрида в органическом растворителе (тетрагидрофуран и т.д.) при нагревании и кипячении, начиная с 0°C.
Соединение, представленное общей формулой (I), в которой R11 представляет собой NH2, и Y представляет собой связь, то есть соединение, представленное общей формулой (5-a) (где все символы имеют значения, указанные выше), можно получать способом, изображенным на схеме реакции 5 (где все символы имеют значения, указанные выше), с применением соединения, представленного общей формулой (SM2).


На схеме реакции 5, реакцию амидирования, изображенную в качестве реакции 19, можно осуществлять таким же способом, как реакцию 3, описанную выше на схеме реакции 2.
На схеме реакции 5, реакцию восстановления, изображенную в качестве реакции 20, можно осуществлять таким же способом, как реакцию 18, описанную выше на схеме реакции 4.
Соединение, представленное общей формулой (SM2), можно получать способом, изображенным на схеме реакции 6 (где все символы имеют значения, указанные выше), используя соединение, представленного общей формулой (SM1), в качестве исходного вещества.
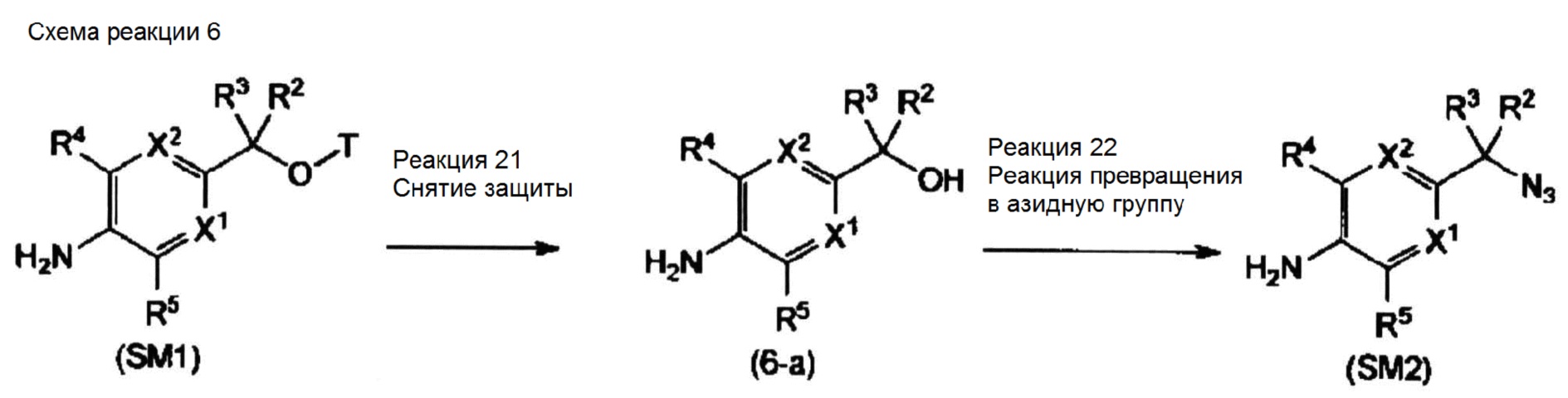
На схеме реакции 6, реакцию снятия защиты с гидроксильной группы, изображенную в качестве реакции 21, можно проводить таким же способом, как реакцию снятия защиты с гидроксильной группы, описанную выше на схеме 1.
На схеме реакции 6, реакцию превращения гидроксильной группы в азидную группу осуществляют введением соединения, представленного общей формулой (6-a), в реакцию с азидом натрия или азидом калия в органическом растворителе (хлороформ, дихлорметан и т.д.), в присутствии трифторуксусной кислоты при комнатной температуре. Также, указанную реакцию осуществляют введением в реакцию дифенилфосфоразидата и 2,3,4,6,7,8,9,10-октагидропиримидо[1,2-a]азепина в органическом растворителе (толуол, тетрагидрофуран и т.д.) при температуре от 0°C до комнатной температуры.
Оптически активную форму соединения, представленного общей формулой (I), можно получать обычной методикой (например, методом оптического расщепления с помощью хиральной колонки и т.д.). Также, оптически активную форму соединения, представленного общей формулой (I), можно получать способом, изображенным на схеме реакции выше, используя оптические изомеры соединений, представленных общими формулами (3-c), (3-e), (3-f), (3-i), (3-k), (3-m), (3-n), (SM1), (4-b), (5-b), (6-a) и (SM2), предварительно расщепленные обычной методикой оптического расщепления (например, методом оптического расщепления с помощью хиральной колонки и т.д.) или способом, описанным в разделе Примеры в настоящей заявке.
В каждой реакции, описанной в настоящем тексте, соединения, представленные общими формулами (1-b), (2-b), (3-a), (3-b), (3-d), (3-g) и (3-h), используемые в качестве исходного вещества или реагента, широко известны как таковые или могут быть легко получены с помощью Примеров, описанных в настоящем тексте, или широко известными методами.
В каждой реакции, описанной в настоящем тексте, как очевидно квалифицированным специалистам в данной области, реакции с применением нагревания можно проводить с помощью водяной бани, масляной бани, песчаной бани или микроволновой печи.
В каждой реакции, описанной в настоящем тексте, соответствующим образом можно использовать реагент на твердой подложке, нанесенный на высокомолекулярный полимер (например, полистирол, полиакриламид, полипропилен, полиэтиленгликоль и т.д.).
В каждой реакции, описанной в настоящем тексте, продукты реакции можно очищать обычными способами очистки, например, перегонкой при нормальном и пониженном давлении, высокоэффективной жидкостной хроматографией на силикагеле или на силикате магния, тонкослойной хроматографией, с помощью ионообменной смолы, улавливающего полимера, или колоночной хроматографией, или промыванием, перекристаллизацией или тому подобными. Очистку можно проводить после каждой реакции или после нескольких реакций.
Токсичность
Соединение по настоящему изобретению имеет достаточно низкую токсичность и может безопасно применяться в качестве фармацевтических средств.
Применение в качестве фармацевтических средств
Соединение по настоящему изобретению можно применять для профилактики и/или лечения заболеваний, связанных с KCNQ2-5 каналом.
Соединение по настоящему изобретению можно применять для профилактики и/или лечения заболеваний, связанных с KCNQ2-5 каналом. Примеры таких заболеваний включают следующие: эпилепсия, болевые синдромы (например, нейрогенная боль и мигрень), диабетические периферические нейропатии, тревожные расстройства, нарушения, связанные с колебаниями настроения, шизофрения, лекарственная зависимость, нарушения внимания, расстройства сна, инсульт, шум в ушах, нарушения памяти (например, болезнь Альцгеймера и слабоумие), боковой амиотрофический склероз, двигательное расстройство (например, болезнь Паркинсона и обусловленное дистонией двигательное расстройство), дизурия (например, гиперактивность мочевого пузыря, частое мочеиспускание, ноктурия, неотложный позыв к мочеиспусканию, императивное недержание мочи, стрессовое недержание мочи, интерстициальный цистит, хронический простатит и доброкачественная гипертрофия предстательной железы), тугоухость, астма, хроническое обструктивное заболевание легких, кашель, легочная гипертензия, нейродегенеративное заболевание органа зрения (например, глаукома, прогрессирующая диабетическая ретинопатия, возрастная макулопатия, пигментная дегенерация сетчатки), сахарный диабет и т.д.
Соединение по настоящему изобретению предпочтительно может применяться для профилактики и/или лечения дизурии.
Соединение по настоящему изобретению более предпочтительно может применяться для профилактики и/или лечения гиперактивности мочевого пузыря.
Гиперактивность мочевого пузыря представляет собой синдромы и симптомы, включающие неотложный позыв к мочеиспусканию, обычно частое мочеиспускание и ноктурию, и иногда недержание мочи.
Когда соединение по настоящему изобретению применяют для профилактики и/или лечения дизурии, для предотвращения побочных эффектов со стороны центральной нервной системы, таких как головокружение и сонливость, предпочтительно, чтобы миграция соединения по настоящему изобретению в головной мозг была низкой. Следовательно, соединение по настоящему изобретению предпочтительно представляет собой соединение с пониженной интрацеребральной миграцией. Интрацеребральную миграцию можно измерять, например, по интрацеребральному содержанию или по вычисленному коэффициенту интрацеребральной миграции (внутрицеребральное содержание/ концентрация в плазме), после введения тестового вещества млекопитающим (например, крысам или мышам) перорально или внутривенно, и измерением концентрации в плазме и/или внутрицеребрального содержания после введения (например, через один час после введения).
Соединение по настоящему изобретению можно вводить в качестве комбинированного препарата совместно с другими лекарственными средствами для достижения следующих целей:
1) для дополнения и/или улучшения профилактического и/или терапевтического эффекта;
2) для улучшения кинетики, улучшения абсорбции и снижения дозировки; и/или
3) для исключения побочных эффектов.
Комбинированный препарат, содержащий соединение по настоящему изобретению и одно или более других лекарственных средств, можно вводить в форме смешанного средства, содержащего все компоненты, смешанные в одном препарате, или можно вводить в форме отдельных составов. Введение в форме отдельных составов включает одновременное введение и введение в разное время. При введении в разное время, соединение по настоящему изобретению можно вводить перед другим лекарственным средством. Альтернативно, другое лекарственное средство можно вводить перед соединением по настоящему изобретению. Способы введения данных лекарственных средств могут быть идентичными или различаться.
Заболевания, на которые вышеуказанный комбинированный препарат оказывает профилактическое и/или терапевтическое действие, строго не ограничены, но могут представлять собой заболевания, при которых профилактическое и/или терапевтическое действие соединения по настоящему изобретению дополнено и/или улучшено.
Примеры других лекарственных средств для дополнения и/или улучшения профилактического и/или терапевтического действия на гиперактивность мочевого пузыря, оказываемого соединением по настоящему изобретению, включают: (1) антагонисты мускаринового рецептора (например, толтеродин, оксибутинин, гиосциамин, пропантелин, пропиверин, троспий, солифенацин, далифенацин, имидафенацин, фезотеродин, темиверин, флавоксат, тарафенацин, афацифенацин, THVD-101, THVD-201 и т.д.), (2) агонист β3 адренорецептора (мирабегрон, KRP-114V, солабегрон, TRK-380 и т.д.), (3) антагонист NK-1 или -2 (например, апрепитант, цизолиртин и т.д.), (4) генетически модифицированный ботулотоксин (сенреботаза и т.д.), (5) агонист опиоидного μ рецептора (TRK-130 или тому подобные), (6) антагонист α4β2 никотинового ацетилхолинорецептора (дексмекамиламин или тому подобные), (7) ингибитор C-волокон (безипирдин или тому подобные), (8) антагонист TRPV1 (XEN-D0501 или тому подобные), (9) антагонист EP1 (KEA-0447 или тому подобные), (10) лекарственное средство для центральной нервной системы (REC-1819 или тому подобные), (11) антагонист α1 адренорецептора (например, тамсулозин, силодозин, нафтопидил, урапидил и т.д.), (12) ингибитор 5α редуктазы (дутастерид, финастерид и т.д.), (13) ингибитор фосфодиэстеразы 5 (силденафил, тадалафил, варденафил), (14) агонист рецептора вазопрессина V2 (десмопрессин) или тому подобные.
Дозировку других лекарственных средств можно соответствующим образом подбирать, исходя из клинической дозировки. Также, соотношение в смеси соединения по настоящему изобретению и других лекарственных средств можно надлежащим образом подбирать, исходя из возраста и массы тела пациента, способа лечения, длительности периода введения, заболевания, симптомов или их комбинации и т.д. Например, можно использовать 0.01 - 100 массовых долей других лекарственных средств на одну массовую долю соединения по настоящему изобретению. Любые два или более других лекарственных средств можно вводить в комбинации в подходящем соотношении. Кроме того, другие лекарственные средства включают не только известные на данный момент лекарственные средства, но и средства, которые будут разработаны в будущем.
При использовании соединения по настоящему изобретению или комбинированных составов, содержащих соединение по настоящему изобретению и другие средства, в вышеуказанных целях, их обычно вводят системно или местно, обычно перорально или парентерально, обычно после объединения с фармацевтически приемлемым носителем в подходящей фармацевтической композиции.
Соединение по настоящему изобретению вводят млекопитающему (предпочтительно, человеку и, более предпочтительно, пациенту) в эффективном количестве.
Так как дозировка соединения по настоящему изобретению зависит от возраста, массы тела, симптомов, требуемого терапевтического эффекта, способа введения, длительности лечения и т.д., она неизбежно будет варьироваться. Дозировка на одного пациента обычно составляет от 0.1 мг до 1000 мг на одну дозу, за один или несколько приемов в день, перорально, или от 0.01 мг до 100 мг на одну дозу, за один или несколько приемов в день, парентерально или непрерывным введением внутривенно в течение 1 -24 часов в день.
Очевидно, что, как указано выше, применяемые дозировки варьируются в зависимости от различных условий. Следовательно, в некоторых случаях более низкие дозировки, чем указано выше, могут быть достаточными, а в некоторых случаях требуются дозировки, превышающие указанные выше диапазоны.
При введении соединения по настоящему изобретению или комбинированного состава, содержащего соединение по настоящему изобретению и другое фармацевтическое средство, их вводят в форме твердой или жидкой композиции для перорального введения, препарата с замедленным высвобождением и состава с контролируемым высвобождением для перорального введения, и в форме инъекции, состава для наружного применения, ингаляции, суппозитория для парентерального введения или тому подобных.
Примеры твердой композиции для перорального введения включают таблетки, пилюли, капсулы, порошок и гранулы. Капсулы включают твердые капсулы и мягкие капсулы.
В такой твердой композиции, одно или больше действующих веществ используют отдельно или смешивают с носителем (например, лактоза, маннит, глюкоза, микрокристаллическая целлюлоза и крахмал и т.д.), связующим средством (например, гидроксипропилцеллюлоза, поливинилпирролидон и алюмометасиликат магния и т.д.), разрыхлителем (например, кальций карбоксиметилцеллюлоза и т.д.), смазывающим средством (например, стеарат магния и т.д.), стабилизатором, ускоряющим растворение веществом (например, глютаминовая кислота, аспарагиновая кислота и т.д.) и т.д., и осуществляют производство традиционным для фармацевтики способом. Твердая композиция может иметь покрытие (например, сахароза, желатин, гидроксипропилцеллюлоза или фталат гидроксипропилметилцеллюлозы и т.д.), при необходимости, или может иметь покрытие из двух или более слоев. Также может применяться капсула, состоящая из адсорбируемого вещества, такого как желатин.
Жидкие композиции для перорального введения включают фармацевтически приемлемый раствор, суспензию, эмульсию, сироп и эликсир и т.д. В жидкой композиции, одно или больше действующих веществ растворены, суспендированы или эмульгированы в традиционно применяемом инертном растворителе (например, очищенная вода, этанол или их смесь и т.д.). Данная композиция может содержать смачивающее средство, суспендирующее средство, эмульгатор, подсластитель, вкусовую добавку, ароматизатор, консервант и буфер и т.д.
При пероральном введении эффективен также состав с замедленным высвобождением. Гелеобразующее вещество, используемое для составов с замедленным высвобождением, представляет собой вещество, которое набухает посредством поглощения растворителя, его коллоидные частицы связаны друг с другом с образованием трехмерной сетчатой структуры и могут формировать гелеобразную субстанцию, потерявшую текучесть. В составах оно преимущественно используется в качестве связующего средства, загустителя и материала, служащего основой для составов с замедленным высвобождением. Например, можно использовать такие вещества, как аравийская камедь, агар, поливинилпирролидон, альгинат натрия, пропиленгликоль альгинат, карбоксивиниловый полимер, карбоксиметилцеллюлоза, натрия карбоксиметилцеллюлоза, гуаровая камедь, желатин, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, поливиниловый спирт, метилцеллюлоза или гидроксиэтилметилцеллюлоза.
Инъекционные средства для парентерального введения включают растворы, суспензии, эмульсии и твердые инъекционные средства, которые необходимо смешивать с растворителем перед применением. Инъекционное средство применяют посредством растворения, суспендирования или эмульгирования одного или более действующих веществ в растворителе. Примеры растворителей включают дистиллированную воду для инъекций, физиологический раствор хлорида натрия, растительные масла, спирты, такие как пропиленгликоль, полиэтиленгликоль, этанол и их смеси. Кроме того, инъекционное средство может содержать стабилизатор, ускоряющее растворение вещество (глютаминовая кислота, аспарагиновая кислота и Полисорбат 80 (зарегистрированная торговая марка) и т.д.), суспендирующее средство, эмульгатор, успокаивающее средство, буфер, консервант и т.д. Такие инъекционные средства получают стерилизацией на финальной стадии или асептическим способом. Кроме того, также возможно применение в качестве антисептического твердого продукта (например, полученный лиофилизованный продукт растворяют в дистиллированной воде для инъекций или в другом растворителе, где указанная дистиллированная вода для инъекций или другой растворитель являются антисептическими или проходят стерилизацию перед применением).
Примеры наружных составов для парентерального введения включают средство для небулайзера, ингалянт, спрей, аэрозоль, мази, гели, кремы, компрессы, пластыри, линименты и назальные средства. Указанные составы могут содержать одно или больше действующих веществ и могут быть получены широко известными или традиционными методами.
Средство для небулайзера, ингалянт и спрей могут содержать стабилизатор, такой как гидросульфит натрия, буферное средство, обеспечивающее изотоничность, и изотоническое средство, например, хлорид натрия, цитрат натрия или лимонную кислоту, отличные от обычно применяемого разбавителя. Способ получения спрея подробно описан, например, в Патентах США № 2868691 и № 3095355.
Средства для ингаляционного парентерального введения включают аэрозольные препараты, порошок для ингаляции и жидкость для ингаляции. Жидкость для ингаляции может иметь форму ингредиента, который растворяют или суспендируют в воде или в другой подходящей среде при использовании.
Указанные средства для ингаляционного введения готовят широко известными методами.
Например, в случае жидкости для ингаляции, антисептическое средство (например, бензалконий хлорид, парабен и т.д.), краситель, буфер (например, фосфат натрия, ацетат натрия и т.д.), изотоническое средство (например, хлорид натрия, концентрированный глицерин и т.д.), загуститель (карбоксивиниловый полимер и т.д.), стимулятор абсорбции и т.д. при необходимости выбирают и готовят препарат должным образом.
В случае порошка для ингаляции, смазывающее средство (например, стеариновую кислоту, ее соль и т.д.), связующее средство (например, крахмал, декстрин и т.д.), наполнитель (например, лактозу, целлюлозу и т.д.), краситель, антисептик (например, бензалконий хлорид или парабен и т.д.) или стимулятор абсорбции и т.д. при необходимости выбирают и готовят препарат должным образом.
При введении жидкости для ингаляции обычно применяют распылитель (например, аэрозольный ингалятор, небулайзер или тому подобные). При введении порошка для ингаляции обычно применяют устройство для ингаляции порошкового фармацевтического средства.
Мазь готовят хорошо известными методами или согласно традиционным рецептам. Например, мазь получают смешиванием или плавлением одного или более действующих веществ в материале, служащем основой. Служащий основой материал для мази выбирают из широко известных или традиционно применяемых веществ. Например, единственное вещество или смесь двух или более веществ выбирают из высших жирных кислот и сложных эфиров высших жирных кислот (например, адипиновая кислота, миристиновая кислота, пальмитиновая кислота, стеариновая кислота, олеиновая кислота, эфиры адипиновой кислоты, эфиры миристиновой кислоты, эфиры пальмитиновой кислоты, эфиры стеариновой кислоты и эфиры олеиновой кислоты), восков (например, пчелиный воск, спермацет и церезин), поверхностно-активных веществ (например, фосфатные эфиры полиоксиэтиленалкиловых эфиров), высших спиртов (например, цетанол, стеариловый спирт и цетостеариловый спирт), силиконовых масел (например, диметилполисилоксан), углеводородов (например, гидрофильный вазелин, белый вазелин, очищенный ланолин и жидкий парафин), гликолей (например, этиленгликоль, диэтиленгликоль, пропиленгликоль, полиэтиленгликоль и макрогол), растительных масел (например, касторовое масло, оливковое масло, кунжутное масло и терпентинное масло), животных масел (например, норковый жир, масло яичного желтка, сквалан и сквален), воды, стимуляторов абсорбции и средств, предотвращающих появление сыпи. Также могут быть включены: увлажняющее средство, консервант, стабилизатор, антиоксидант, ароматизатор и т.д.
Гель готовят хорошо известными или традиционно применяемыми методами. Например, гель можно получать плавлением одного или более действующих веществ в материале, служащем основой. Гелевую основу выбирают из широко известных или традиционно применяемых основ. Например, гель получают смешиванием с одной или более основами, выбранными из низшего спирта (например, этанола и изопропилового спирта и т.д.), гелеобразующего компонента (например, карбоксиметилцеллюлозы, гидроксиэтилцеллюлозы, гидроксипропилцеллюлозы или этилцеллюлозы и т.д.), нейтрализатора (например, триэтаноламина или диизопропаноламина и т.д.), поверхностно-активного вещества (например, полиэтиленгликоль моностеарата и т.д.), смол, воды, стимулятора абсорбции и средств, предотвращающих появление сыпи. Также гель может содержать консервант, антиоксидант или отдушку и т.д.
Крем готовят известным или традиционно применяемым способом. Например, крем получают плавлением или эмульгированием одного или более действующих веществ в материале, служащем основой. Основу для крема выбирают из известных или традиционно применяемых основ. Примеры основ для кремов включают сложные эфиры высших жирных кислот, низшие спирты, углеводороды, многоатомные спирты (такие как пропиленгликоль и 1,3-бутиленгликоль), высшие спирты (такие как 2-гексилдеканол и цетанол), эмульгаторы (такие как полиоксиэтилен алкиловые эфиры и сложные эфиры жирных кислот), воду, стимуляторы абсорбции и средства, предотвращающие появление сыпи. Из указанных основ выбирают одну и используют ее отдельно, или выбирают две или более основ и используют их в смеси. Крем также может содержать консервант, антиоксидант, ароматизатор или тому подобные.
Компресс готовят согласно известным или традиционно используемым рецептам. Например, компресс получают плавлением одного или более действующих веществ в материале, служащем основой, с образованием перемешанного вещества, с последующим нанесением и распределением перемешанного вещества на подложке. Основу для компресса выбирают из известных или традиционно используемых основ. Примеры основ для компресса включают загустители (например, полиакриловая кислота, поливинилпирролидон, аравийская камедь, крахмал, желатин и метилцеллюлоза), увлажнители (например, мочевина, глицерин и пропиленгликоль), наполнители (например, каолин, оксид цинка, тальк, кальций и магний), воду, ускоряющие растворение средства, усилители клейкости и средства, предотвращающие появление сыпи. Из указанных основ выбирают одну и используют ее отдельно, или выбирают две или более основ и используют их в смеси. Компресс также может содержать консервант, антиоксидант, ароматизатор или тому подобные.
Пластырь готовят согласно известным или традиционно используемым рецептам. Например, пластырь получают плавлением одного или более действующих веществ в материале, служащем основой, и нанесением и распределением расплава по подложке. Основу для пластыря выбирают из известных или традиционно используемых основ. Примеры основ для пластырей включают полимерные основы, масла и жиры, высшие жирные кислоты, усилители клейкости и средства, предотвращающие появление сыпи. Из указанных основ выбирают одну и используют ее отдельно, или выбирают две или более основ и используют их в смеси. Пластырь также может содержать консервант, антиоксидант, ароматизатор или тому подобные.
Линимент готовят согласно известным или традиционно используемым рецептам. Например, линимент получают растворением, суспендированием или эмульгированием одного или более действующих веществ в одном или более веществах, выбранных из воды, спирта (например, этанола или полиэтиленгликоля), высшей жирной кислоты, глицерина, мыла, эмульгатора и суспендирующего средства. Линимент также может содержать консервант, антиоксидант, ароматизатор или тому подобные.
Примеры других композиций для парентерального введения включают суппозитории для ректального введения, пессарии для интравагинального введения и т.д., каждый из которых содержит одно или более действующих веществ, и которые готовят согласно стандартной методике.
Полное содержание всех Патентных документов и Непатентных документов или документов из списка литературы, непосредственно приведенных в настоящем тексте, включено в настоящий текст посредством ссылки в качестве части настоящего текста.
ПРИМЕРЫ
Далее настоящее изобретение будет подробно описано посредством Примеров. Однако, настоящее изобретение не ограничено приведенными Примерами.
Указанные в скобках растворители в разделах, посвященных хроматографии и ТСХ, представляют собой применявшиеся элюирующие или проявляющие растворители, а их соотношение представляет собой соотношение по объему.
В настоящем изобретении, для колоночной хроматографии на силикагеле применяли CHROMATOREX (зарегистрированная торговая марка) производства Fuji Silysia Chemical LTD., Yamazen High флэш-колонку (название продукта) и т.д., в качестве прибора для очистки использовали, например, жидкостной хроматограф среднего давления W-prep 2XY (наименование продукта) производства Yamazen Corporation.
Данные ЯМР представляют собой данные1H-ЯМР, если не указано иное.
В скобках при описании спектров ЯМР указан применявшийся растворитель.
Названия соединений, используемых в настоящем тексте, созданы с помощью ACD/Name (зарегистрированная торговая марка) производства Advanced Chemistry Development Inc., которая представляет собой компьютерную программу для генерации названий соединений согласно требованиям IUPAC, или созданы согласно методу генерации названий IUPAC.
В настоящем изобретении, время удерживания при анализе методом жидкостной хроматографии (LC) определяли с помощью указанных ниже приборов и в приведенных ниже условиях.
Анализатор: ACQUITY UPLC I-Class system (производство Waters)
Детектор: УФ (PDA), ELSD, MS
Условия 1
Колонка: ACQUITY UPLC BEH C18 Column (производство Waters, 1.7 мкм, 2.1 мм × 30 мм)
Подвижная фаза: Растворитель A: 0.1%-ный водный раствор муравьиной кислоты; Растворитель B: 0.1%-ный раствор муравьиной кислоты в ацетонитриле
Градиент: 0 мин (Растворитель A / Растворитель B = 95/5); 0.1 мин (Растворитель A / Растворитель B = 95/5); 1.2 мин (Растворитель A / Растворитель B = 5/95); 1.4 мин (Растворитель A / Растворитель B = 5/95); 1.5 мин (Растворитель A / Растворитель B = 95/5)
Скорость потока: 1 мл/мин,
Метод детектирования: 254 нм,
Температура колонки: 30°C,
Объем ввода: 2 мкл
Условия 2
Колонка: ACQUITY UPLC BEH C18 Column (производство Waters, 1.7 мкм, 2.1 мм × 30 мм)
Подвижная фаза: Растворитель A: 0.1%-ный водный раствор трифторуксусной кислоты; Растворитель B: 0.1%-ный раствор трифторуксусной кислоты в ацетонитриле
Градиент: 0 мин (Растворитель A / Растворитель B = 95/5); 0.1 мин (Растворитель A / Растворитель B = 95/5); 1.2 мин (Растворитель A / Растворитель B = 5/95); 1.4 мин (Растворитель A / Растворитель B = 5/95); 1.5 мин (Растворитель A / Растворитель B = 95/5)
Скорость потока: 1 мл/мин,
Метод детектирования: 254 нм,
Температура колонки: 30°C,
Объем ввода: 2 мкл
Условия 3
Колонка: YMC Triart C18 (производство YMC, 1.9 мкм, 2.1 мм × 30 мм)
Подвижная фаза: Растворитель A: 0.1%-ный водный раствор трифторуксусной кислоты; Растворитель B: 0.1%-ный раствор трифторуксусной кислоты в ацетонитриле
Градиент: 0 мин (Растворитель A / Растворитель B = 95/5); 0.1 мин (Растворитель A / Растворитель B = 95/5); 1.2 мин (Растворитель A / Растворитель B = 5/95); 1.4 мин (Растворитель A / Растворитель B = 5/95); 1.5 мин (Растворитель A / Растворитель B = 95/5)
Скорость потока: 1 мл/мин,
Метод детектирования: 254 нм,
Температура колонки: 30°C,
Объем ввода: 2 мкл
Пример 1
1,1,1-трифтор-2-(4-нитрофенил)-2-пропанол
В тетрагидрофурановый раствор (16 мл) 1-(4-нитрофенил)этанона (1.65 г) (Регистрационный номер CAS: 100-19-6) и (трифторметил)триметилсилана (4.26 г) добавляли тетрабутиламмония фторид (1 M раствор в тетрагидрофуране, 1 мл) при охлаждении на ледяной бане. Полученный раствор перемешивали при комнатной температуре в течение двух часов, добавляли насыщенный водный раствор хлорида аммония, затем экстрагировали этилацетатом. Полученный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, после чего упаривали при пониженном давлении. Полученный остаток растворяли в тетрагидрофуране (16 мл) и добавляли тетрабутиламмония фторид (1 M раствор в тетрагидрофуране, 12 мл) при охлаждении на ледяной бане. Полученную реакционную смесь перемешивали в течение десяти минут при охлаждении на ледяной бане и затем упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 85:15 → 80:20), получая целевое соединение (2.28 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.47 (гексан:этилацетат = 3:1);
1H-ЯМР (CDCl3): δ 1.83-1.84, 7.78-7.81, 8.23-8.28.
Пример 2
2-(4-аминофенил)-1,1,1-трифтор-2-пропанол
Соединение (2.28 г), полученное в Примере 1, суспендировали в смеси этанола (50 мл) и воды (10 мл), и добавляли цинковый порошок (3.17 г) и уксусную кислоту (2.82 мл). Реакционную смесь перемешивали в течение ночи при 50°C, затем охлаждали до комнатной температуры, добавляли насыщенный водный раствор гидрокарбоната натрия и перемешивали в течение 30 минут. В полученную реакционную смесь добавляли этилацетат, затем смесь фильтровали через слой целита, и фильтрат экстрагировали этилацетатом. Полученный органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и затем упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 80:20 → 20:80), получая целевое соединение (1.20 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.37 (гексан:этилацетат = 2:1);
1H-ЯМР (CDCl3): δ 1.72-1.73, 2.32, 6.65-6.70, 7.33-7.35.
Пример 3
2-(4-амино-3,5-дихлорфенил)-1,1,1-трифтор-2-пропанол
В N,N-диметилформамидный раствор (12 мл) полученного в Примере 2 соединения (1.20 г) добавляли N-хлорсукцинимид (1.56 г) и перемешивали при комнатной температуре в течение 15 часов, после чего добавляли воду и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и затем упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 80:20 → 40:60), получая целевое соединение (867 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.72 (гексан:этилацетат = 2:1);
1H-ЯМР (CDCl3): δ 1.72-1.73, 2.40, 7.39.
Пример 4
2,6-дихлор-4-{1,1,1-трифтор-2-[(триметилсилил)окси]-2-пропанил}анилин
В тетрагидрофурановый раствор (17 мл) полученного в Примере 3 соединения (860 мг) добавляли имидазол (1.07 г) и хлортриметилсилан (2 мл), перемешивали при комнатной температуре в течение 2.5 часов и добавляли воду, после чего экстрагировали этилацетатом. Органический слой промывали водой, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 100:0 → 60:40), получая целевое соединение (1.05 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.68 (гексан:этилацетат = 8:1);
1H-ЯМР (CDCl3): δ 0.15, 1.74-1.75, 4.51, 7.33.
Пример 5
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина

В тетрагидрофурановый раствор (9.5 мл) полученного в Примере 4 соединения (475 мг) добавляли N,N-диизопропилэтиламин (261 мкл) и трифосген (447 мг), перемешивали при комнатной температуре в течение 2.5 часов, после чего упаривали при пониженном давлении. Полученный остаток растворяли в тетрагидрофуране (1.4 мл) и добавляли 1-[5-(трифторметил)-2-пиридинил]метанамин гидрохлорид (583 мг) (Регистрационный номер CAS: 164341-39-3) и триэтиламин (401 мкл), перемешивали при комнатной температуре в течение ночи, затем добавляли воду и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток растворяли в смеси метанола (10 мл) и дихлорметана (10 мл) и добавляли трифторуксусную кислоту (4 мл), перемешивали при комнатной температуре в течение ночи, затем перемешивали при 50°C в течение двух часов, после чего упаривали при пониженном давлении, добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 60:40 → 30:70), получая целевое соединение (447 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.31 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.47, 6.93, 7.14, 7.58, 7.64, 8.24, 8.43, 8.89.
Примеры 5(1) - (35)
Вместо 1-[5-(трифторметил)-2-пиридинил]метанамина гидрохлорида использовали соответствующий амин и применяли ту же методику, которая описана в Примере 5, получая целевое соединение, имеющее описанные ниже физические свойства.
Пример 5(1)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-(4-фторбензил)мочевина
ТСХ: Rf 0.54 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.26, 6.89, 6.92, 7.10-7.19, 7.28-7.37, 7.63, 8.15.
Пример 5(2)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[(5-фтор-2-пиридинил)метил]мочевина
ТСХ: Rf 0.44 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.37, 6.93, 7.05, 7.41, 7.64, 7.74, 8.36, 8.50.
Пример 5(3)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[6-(1-пиперидинил)-2-пиридинил]метил}мочевина
ТСХ: Rf 0.89 (этилацетат);
1H-ЯМР (ДМСО-d6): δ 1.50-1.65, 1.69, 3.49-3.52, 4.19, 6.55, 6.65, 6.81, 6.93, 7.46, 7.64, 8.31.
Пример 5(4)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-(3,3-диметил-2-бутанил)мочевина
ТСХ: Rf 0.38 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 0.87, 0.95, 1.69, 3.44-3.54, 6.24, 6.91, 7.61, 7.83.
Пример 5(5)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[(2,2-диметил тетрагидро-2H-пиран-4-ил)метил]мочевина
ТСХ: Rf 0.19 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 0.91-1.05, 1.11, 1.50-1.54, 1.69, 1.75-1.87, 2.98-2.96, 3.46-3.54, 3.58-3.63, 6.43, 6.92, 7.62, 7.94.
Пример 5(6)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[(4,4-дифтор-1-гидрокси циклогексил)метил]мочевина
ТСХ: Rf 0.25 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.43-1.66, 1.69, 1.76-2.15, 3.10, 4.70, 6.50, 6.92, 7.62, 8.16.
Пример 5(7)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[(3-метил-2-пиридинил)метил]мочевина
ТСХ: Rf 0.15 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.70, 2.28, 4.40, 6.92, 7.10, 7.25, 7.61, 7.63, 8.39, 8.53.
Пример 5(8)
1-[(5-хлор-2-тиенил)метил]-3-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]мочевина
ТСХ: Rf 0.53 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.70, 4.34, 6.82, 6.93-6.94, 7.01, 7.64, 8.21.
Пример 5(9)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[3-(трифторметил)-2-пиридинил]метил}мочевина
ТСХ: Rf 0.35 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.60, 6.93, 7.11, 7.57, 7.63, 8.19, 8.51, 8.86.
Пример 5(10)
1-(циклогексил метил)-3-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил] мочевина
ТСХ: Rf 0.59 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 0.80-1.78, 2.91, 6.38, 6.91, 7.61, 7.90.
Пример 5(11)
1-[(5-бром-2-пиридинил)метил]-3-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил) фенил]мочевина
ТСХ: Rf 0.50 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.34, 6.93, 7.05, 7.34, 7.64, 8.06, 8.37, 8.63.
Пример 5(12)
1-[(1-бензил-1H-имидазол-2-ил)метил]-3-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]мочевина
ТСХ: Rf 0.64 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.31, 5.23, 6.87, 6.92, 6.96, 7.16-7.19, 7.28-7.37, 7.62, 8.24.
Пример 5(13)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[(5-фтор-1H-индол-2-ил)метил]мочевина
ТСХ: Rf 0.53 (дихлорметан:метанол =9:1);
1H-ЯМР (ДМСО-d6): δ 1.70, 4.39, 6.29, 6.81-6.90, 6.93, 7.19-7.23, 7.28-7.33, 7.64, 8.19, 11.02.
Пример 5(14)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[(2R)-тетрагидро-2-фуранил метил]мочевина
ТСХ: Rf 0.43 (гексан:этилацетат = 1:3);
1H-ЯМР (ДМСО-d6): δ 1.47-1.62, 1.69, 1.72-1.95, 3.01-3.12, 3.13-3.28, 3.59-3.66, 3.75-3.86, 6.45, 6.92, 7.62, 8.08.
Пример 5(15)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[(2S)-тетрагидро-2-фуранил метил]мочевина
ТСХ: Rf 0.43 (гексан:этилацетат = 1:3);
1H-ЯМР (ДМСО-d6): δ 1.47-1.62, 1.69, 1.72-1.95, 3.01-3.12, 3.13-3.28, 3.59-3.66, 3.75-3.86, 6.45, 6.92, 7.62, 8.08.
Пример 5(16)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[(5-фенил-1,2-оксазол-3-ил)метил]мочевина
ТСХ: Rf 0.37 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.70, 4.37, 6.85, 6.93, 7.03, 7.43-7.58, 7.65, 7.82, 8.30.
Пример 5(17)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-2-фурил]метил}мочевина
ТСХ: Rf 0.58 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.33, 6.44, 6.94, 6.97, 7.16, 7.64, 8.25.
Пример 5(18)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-1,2,4-оксадиазол-3-ил]метил}мочевина
ТСХ: Rf 0.65 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.54, 6.94, 7.14, 7.63, 8.43.
Пример 5(19)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-(3,3,3-трифторпропил) мочевина
ТСХ: Rf 0.28 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 2.26-2.44, 3.27-3.29, 6.55, 6.93, 7.63, 8.22.
Пример 5(20)
1-[(1R)-1-циклопропил этил]-3-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил) фенил]мочевина
ТСХ: Rf 0.30 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 0.15-0.41, 0.82-0.89, 1.12, 1.69, 3.18-3.25, 6.30, 6.91, 7.61, 7.85.
Пример 5(21)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[(2R)-3-метил-2-бутанил]мочевина
ТСХ: Rf 0.30 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 0.84-0.88, 1.01, 1.61-1.70, 3.46-3.53, 6.24, 6.91, 7.61, 7.82.
Пример 5(22)
1-[(3-циклопропил-1,2,4-оксадиазол-5-ил)метил]-3-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]мочевина
ТСХ: Rf 0.17 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 0.82-0.87, 1.01-1.08, 1.69, 2.05-2.14, 4.47, 6.93, 7.10, 7.63, 8.46.
Пример 5(23)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-1,2-оксазол-3-ил]метил}мочевина
ТСХ: Rf 0.45 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.42, 6.94, 7.08, 7.18, 7.64, 8.41.
Пример 5(24)
1-[(5-хлор-2-пиримидинил)метил]-3-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]мочевина
ТСХ: Rf 0.60 (гексан:этилацетат = 1:3);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.49, 6.92, 7.01, 7.62, 8.42, 8.92.
Пример 5(25)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-2-пиразинил]метил}мочевина
ТСХ: Rf 0.38 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.55, 6.94, 7.21, 7.64, 8.51, 8.78, 9.13.
Пример 5(26)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-2-тиенил]метил}мочевина
ТСХ: Rf 0.54 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.70, 4.48, 6.94, 7.05, 7.14, 7.54, 7.64, 8.31.
Пример 5(27)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[3-(2-метил-2-пропанил)-1,2,4-оксадиазол-5-ил]метил}мочевина
ТСХ: Rf 0.41 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.29, 1.69, 4.52, 6.93, 7.13, 7.63, 8.47.
Пример 5(28)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(2-метил-2-пропанил)-1,2,4-оксадиазол-3-ил]метил}мочевина
ТСХ: Rf 0.36 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.37, 1.69, 4.37, 6.92, 6.99, 7.63, 8.29.
Пример 5(29)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[4-(трифторметил) бензил]мочевина
Время удерживания ЖХ (мин), ЖХ условия 2: 0.96;
1H-ЯМР (ДМСО-d6): δ 1.68, 4.36, 6.91, 7.00, 7.49-7.51, 7.63, 7.68-7.71, 8.24.
Пример 5(30)
1-(циклопропил метил)-3-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил] мочевина
ТСХ: Rf 0.53 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 0.16-0.21, 0.38-0.44, 0.89-0.97, 1.70, 2.97, 6.45, 6.93, 7.63, 7.99.
Пример 5(31)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[(2,2-дифторциклопропил)метил]мочевина
ТСХ: Rf 0.29 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.24-1.34, 1.51-1.62, 1.70, 1.86-1.99, 3.08-3.29, 6.63, 6.94, 7.64, 8.13.
Пример 5(32)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-(1,2-оксазол-3-ил-метил)мочевина
ТСХ: Rf 0.34 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.70, 4.35, 6.45, 6.94, 6.99, 7.65, 8.29, 8.83.
Пример 5(33)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-(1,3-тиазол-2-ил метил)мочевина
ТСХ: Rf 0.12 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.71, 4.56, 6.95, 7.27, 7.61, 7.65, 7.72, 8.40.
Пример 5(34)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[(3,3-дифторциклобутил)метил]мочевина
ТСХ: Rf 0.42 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.70, 2.27-2.65, 3.19, 6.60, 6.93, 7.63, 8.07.
Пример 5(35)
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[4-(трифторметокси)бензил]мочевина
ТСХ: Rf 0.55 (гексан:этилацетат = 1:1);
1H-ЯМР (CD3OD): δ 1.72, 4.42, 7.22-7.25, 7.43-7.46, 7.66.
Пример 6
[2-(2-метил-2-пропанил)-1,3-оксазол-5-ил]метанол
В метанольный раствор (1.3 мл) [2-(2- метил-2-пропанил)-1,3-оксазол-5-ил] метил ацетата (52 мг) (Tetrahedron Letters, 2010, vol.51, p.2247-2250) добавляли карбонат калия (54 мг) при охлаждении на ледяной бане, перемешивали при комнатной температуре в течение 30 минут, затем добавляли воду, после чего экстрагировали этилацетатом. Полученный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, после чего упаривали при пониженном давлении, получая целевое соединение (40 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.31 (гексан:этилацетат = 1:1);
1H-ЯМР (CDCl3): δ 1.39, 1.71, 4.65, 6.88.
Пример 7
2-{[2-(2-метил-2-пропанил)-1,3-оксазол-5-ил] метил}-1H-изоиндол-1,3(2H)-дион
В атмосфере аргона трифенилфосфин (135 мг) и фталимид (75 мг) добавляли в тетрагидрофурановый раствор (1 мл) соединения (40 мг), полученного в Примере 6. При охлаждении на ледяной бане добавляли диэтил азодикарбоксилат (230 мкл) и перемешивали при комнатной температуре в течение одного часа, после чего упаривали. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 80/20 → 55/45), получая целевое соединение (93мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.64 (гексан:этилацетат = 1:1);
1H-ЯМР (CDCl3): δ 1.34, 4.87, 6.93, 7.73-7.78, 7.86-7.90.
Пример 8
1-[2-(2-метил-2-пропанил)-1,3-оксазол-5-ил]метанамин
В атмосфере аргона, гидразин 1-гидрат (129 мг) добавляли в этанольный раствор (1.7 мл) соединения (73 мг), полученного в Примере 7, перемешивали при 80°C в течение 30 минут и затем охлаждали до комнатной температуры. В реакционную смесь добавляли смесь этилацетата и этанола. Полученный раствор фильтровали. Фильтрат упаривали при пониженном давлении, получая целевое соединение (40 мг), имеющее описанные ниже физические свойства.
1H-ЯМР (CDCl3): δ 1.37, 3.85, 6.74.
Пример 9
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[2-(2-метил-2-пропанил)-1,3-оксазол-5-ил]метил}мочевина
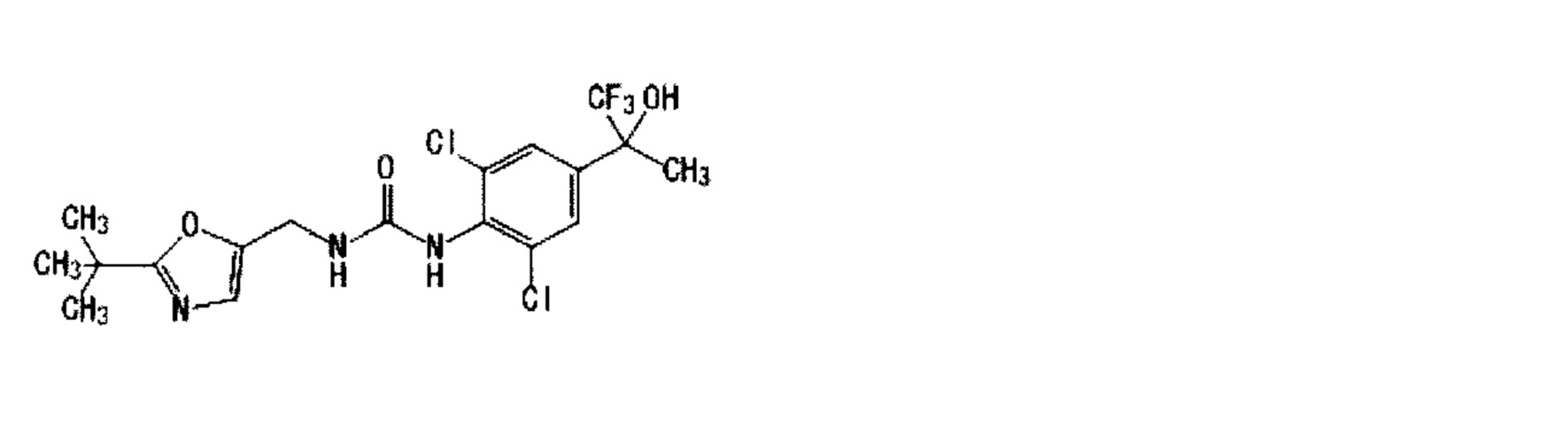
Использовали соединение, полученное в Примере 8, вместо 1-[5-(трифторметил)-2-пиридинил]метанамин гидрохлорида и применяли ту же методику, которая описана в Примере 5, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.40 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 1.29, 1.69, 4.28, 6.78, 6.84, 6.93, 7.64, 8.17.
Пример 10
1-[2-(трифторметил)-1,3-тиазол-5-ил]метанамин
Использовали (2-(трифторметил)тиазол-5-ил)метанол (Регистрационный номер CAS: 131748-97-5) вместо соединения, полученного в Примере 6, и применяли ту же методику, которая описана в Примере 7→ Примере 8, получая целевое соединение, имеющее описанные ниже физические свойства.
1H-ЯМР (ДМСО-d6): δ 2.27, 4.00, 7.91.
Пример 11
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[2-(трифторметил)-1,3-тиазол-5-ил]метил}мочевина

Использовали соединение, полученное в Примере 10, вместо 1-[5-(трифторметил)-2-пиридинил]метанамин гидрохлорида, и применяли ту же методику, которая описана в Примере 5, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.26 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.70, 4.53, 6.94, 7.19, 7.65, 7.96, 8.40.
Пример 12
1-[5-(2-метил-2-пропанил)-1,2-оксазол-3-ил]метанамин
Использовали (5-трет-бутил-1,2-оксазол-3-ил)метанол (Регистрационный номер CAS: 202817-06-9) вместо соединения, полученного в Примере 6, и применяли ту же методику, которая описана в Примере 7→ Пример 8, получая целевое соединение, имеющее описанные ниже физические свойства.
1H-ЯМР (ДМСО-d6): δ 1.27, 3.63, 6.20.
Пример 13
1-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(2-метил-2-пропанил)-1,2-оксазол 3-ил]метил}мочевина
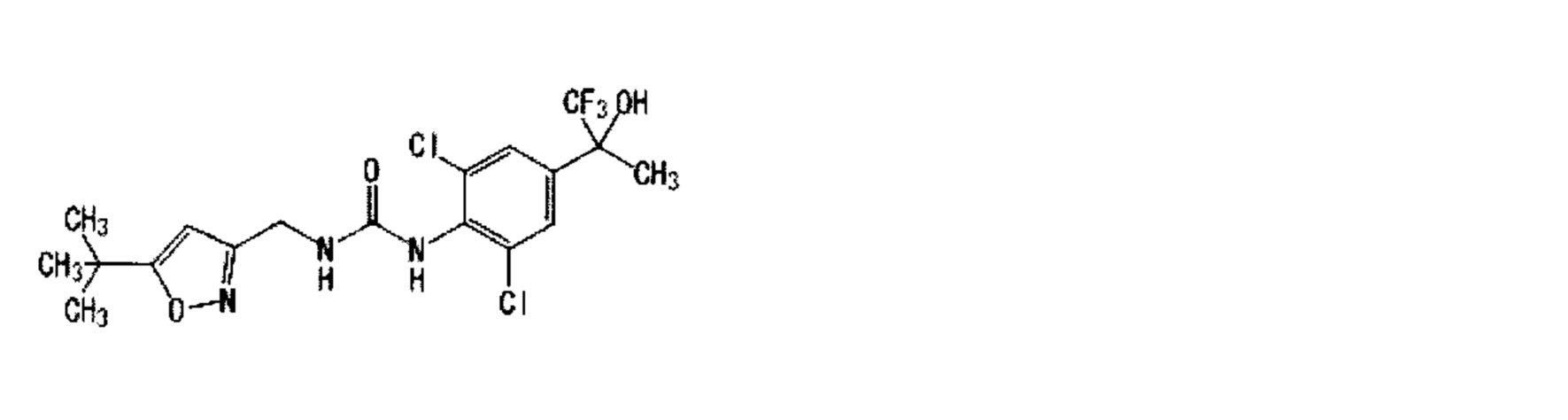
Использовали соединение, полученное в Примере 12, вместо 1-[5-(трифторметил)-2-пиридинил]метанамина гидрохлорида, и применяли ту же методику, которая описана в Примере 5, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.53 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.27, 1.69, 4.26, 6.10, 6.91-6.99, 7.64, 8.27.
Пример 14
2-(4-бромфенил)-1,1,1-трифтор-2-пропанол
В атмосфере аргона хлорид церия (51 г), который предварительно нагревали и сушили при пониженном давлении, суспендировали в тетрагидрофуране (316 мл), перемешивали при комнатной температуре в течение одного часа, и полученную реакционную смесь охлаждали до -70°C. Метиллитий (3.0 M раствор в диэтиловом эфире, 185 мл) добавляли по каплям и перемешивали при -70°C в течение 30 минут. Тетрагидрофурановый раствор (30 мл) 1-(4-бромфенил)-2,2,2-трифторэтанона (40 г) (Регистрационный номер CAS: 16184-89-7) добавляли в реакционную смесь, перемешивали при комнатной температуре в течение 1.5 часов. Полученный раствор выливали в смесь насыщенного водного раствора хлорида аммония (500 мл) и ледяной воды (500 мл) и добавляли 1н. раствор соляной кислоты до появления светло-желтого цвета смеси, затем экстрагировали этилацетатом. Полученный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, после чего упаривали при пониженном давлении, получая целевое соединение (51 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.59 (гексан:этилацетат = 4:1);
1H-ЯМР (CDCl3): δ 1.77, 2.42, 7.44-7.47, 7.52-7.55.
Примеры 15a и 15b
(2R)-2-(4-бромфенил)-1,1,1-трифтор-2-пропанил[(1S)-1-(1-нафтил)этил]карбамат (15a) и (2S)-2-(4-бромфенил)-1,1,1-трифтор-2-пропанил[(1S)-1-(1-нафтил)этил]карбамат (15b)
В дихлорметановый раствор (237 мл) соединения (43 г), полученного в Примере 14, добавляли диметиламинопиридин (23.2 г) и 4-нитрофенилхлорформиат (35.1 г) при охлаждении на ледяной бане и перемешивали при комнатной температуре в течение одного часа. Полученный раствор охлаждали на ледяной бане и добавляли (1S)-1-(1- нафтил)этиламин (33.2 мл) (Регистрационный номер CAS: 10420-89-0), после чего перемешивали при комнатной температуре в течение одного часа. В полученную реакционную смесь добавляли трет-бутилметиловый эфир (500 мл), осадок отделяли фильтрованием и промывали смесью гексана и этилацетата (1/1). Фильтрат и промывной раствор объединяли и упаривали при пониженном давлении до половины объема. Полученный продукт последовательно промывали 1н. водным раствором гидроксида натрия (150 мл × четыре раза), 1н. раствором соляной кислоты (200 мл), водой (150 мл) и насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 90:10 → 80:20), получая смесь диастереоизомеров целевого соединения (70 г). Смесь диастереоизомеров разделяли и очищали методом колоночной хроматографии на силикагеле (гексан:трет-бутилметиловый эфир = 80:20), получая целевые соединения 15a (28 г) и 15b (33 г), имеющие описанные ниже физические свойства.
15a
ТСХ: Rf 0.39 (гексан: диизопропиловый эфир =2:1);
1H-ЯМР (CDCl3): δ 1.63, 2.07, 5.35, 5.50-5.60, 7.32-7.35, 7.42-7.58, 7.78-7.90, 8.02-8.07.
15b
ТСХ: Rf 0.58 (гексан: диизопропиловый эфир =2:1);
1H-ЯМР (CDCl3): δ 1.69, 2.17, 5.25, 5.49-5.58, 7.22-7.25, 7.43-7.58, 7.80-7.95.
Пример 16
(2R)-2-(4-бромфенил)-1,1,1-трифтор-2-пропанол
В 1,4-диоксановый раствор (475 мл) соединения (44 г), полученного в Примере 15a, добавляли водный раствор (237 мл) гидрата гидроксида лития (40 г) и перемешивали при 55°C в течение одного часа. Полученную реакционную смесь охлаждали до 10°C, и затем добавляли 2н. раствор соляной кислоты (520 мл) до достижения значения pH 2, затем экстрагировали этилацетатом. Полученный органический слой последовательно промывали водным раствором гидрокарбоната натрия, водой, водным раствором хлорида аммония и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 90:10 → 80:20), получая целевое соединение (27 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.59 (гексан:этилацетат = 4:1);
1H-ЯМР (CDCl3): δ 1.78, 2.42, 7.43-7.56.
Пример 17
2-метил-2-пропанил{4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}карбамат
Смесь соединения (27 г), полученного в Примере 16, трет-бутил карбамата (15 г), ацетата палладия (II) (2.2 г), 4,5-бис(дифенилфосфино)-9,9-диметил ксантена (8.6 г), карбоната цезия (49 г), 1,4-диоксана (200 мл) перемешивали в атмосфере аргона при 100°C в течение двух часов. Полученную реакционную смесь охлаждали до комнатной температуры, и затем добавляли воду (250 мл) и этилацетат (250 мл). Реакционную смесь фильтровали через слой целита. В фильтрат добавляли воду (250 мл) для разделения двух слоев, после чего водный слой экстрагировали этилацетатом. Слой экстракта объединяли с полученным органическим слоем, промывали последовательно водным раствором хлорида аммония и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 90:10 → 50:50), получая целевое соединение (26 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.31 (гексан:этилацетат = 4:1);
1H-ЯМР (CDCl3): δ 1.52, 1.77, 2.56, 6.57, 7.37-7.40, 7.48-7.51.
Пример 18
(2R)-2-(4-аминофенил)-1,1,1-трифтор-2-пропанол
В дихлорметановый раствор (170 мл) соединения (26 г), полученного в Примере 17, добавляли трифторуксусную кислоту (85 мл), перемешивали при комнатной температуре в течение 1.5 часов и добавляли толуол, после чего упаривали при пониженном давлении. В полученный остаток добавляли насыщенный водный раствор гидрокарбоната натрия (300 мл) и экстрагировали этилацетатом. Органический слой промывали последовательно водным раствором хлорида аммония и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток растворяли в смеси трет-бутилметилового эфира и гексана (1:1, 30 мл) при 60°C. Полученный раствор охлаждали до 5°C, и выпавший осадок отфильтровывали. Фильтрат упаривали, получая целевое соединение (9.8 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.34 (гексан:этилацетат = 3:2);
1H-ЯМР (CDCl3): δ 1.74, 2.38, 3.77, 6.67-6.70, 7.33-7.36.
Пример 19
(2R)-2-(4-аминофенил)-1,1,1-трифтор-2-пропанола гидрохлорид
Раствор в трет-бутилметиловом эфире (96 мл) соединения (9.8 г), полученного в Примере 18, охлаждали на ледяной бане, добавляли 4н. раствор хлороводорода в 1,4-диоксане (15 мл) и перемешивали. Полученный осадок собирали фильтрованием и промывали трет-бутилметиловым эфиром. В полученное твердое вещество добавляли ацетонитрил (200 мл), затем перемешивали при 80°C. После растворения раствор охлаждали до комнатной температуры и перемешивали в течение ночи. Выпавшие кристаллы собирали фильтрованием и промывали последовательно ацетонитрилом и этилацетатом, затем сушили, получая целевое соединение (7.8 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.34 (гексан:этилацетат = 3:2);
1H-ЯМР (ДМСО-d6): δ 1.64, 3.57, 6.61, 7.19-7.22, 7.58-7.61.
Пример 20
4-{(2R)-1,1,1-трифтор-2-[(триметилсилил)окси]-2-пропанил}анилин
Соединение, полученное в Примере 19 (7.8 г), растворяли в смеси метанола (10 мл) и этилацетата (50 мл), и добавляли насыщенный водный раствор гидрокарбоната натрия (150 мл) в несколько порций при перемешивании. Затем полученную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. В полученный остаток добавляли тетрагидрофурановый раствор (130 мл). Реакционную смесь охлаждали на ледяной бане, добавляли имидазол (11 г) и хлортриметилсилан (20 мл), после чего перемешивали при 30°C в течение одного часа, выливали в воду (300 мл) и отделяли водный слой. В него добавляли насыщенный водный раствор гидрокарбоната натрия до значения pH 7 или более, затем экстрагировали этилацетатом. Полученный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении, получая целевое соединение (9.4 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.54 (гексан:этилацетат = 2:1);
1H-ЯМР (CDCl3): δ 0.12, 1.77, 3.69, 6.64-6.67, 7.29-7.32.
Пример 21
2,6-дихлор-4-{(2R)-1,1,1-трифтор-2-[(триметилсилил)окси]-2-пропанил}анилин
В N,N- диметилформамидный раствор (100 мл) соединения (9.4 г), полученного в Примере 20, добавляли N-хлорсукцинимид (9.1 г), перемешивали при комнатной температуре в течение 15 часов, и затем перемешивали при 40°C в течение двух часов. Полученную реакционную смесь выливали в воду (300 мл), после чего экстрагировали смесью гексана и этилацетата (1:1, 100 мл × трижды). Полученный органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 90:10 → 50:50), получая целевое соединение (9.0 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.55 (гексан:этилацетат = 4:1);
1H-ЯМР (CDCl3): δ 0.15, 1.75, 4.51, 7.33.
Пример 22
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-[(5-метил-1,2-оксазол 3-ил)метил]мочевина
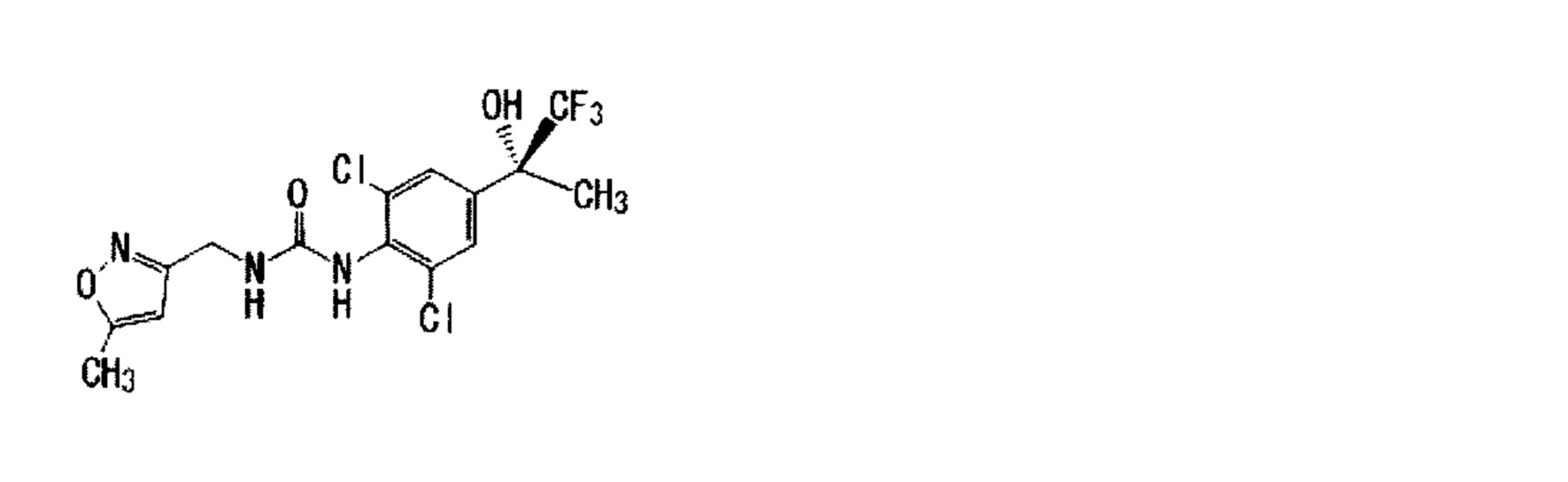
В тетрагидрофурановый раствор (5 мл) соединения, полученного в Примере 21 (300 мг), добавляли N,N-диизопропилэтиламин (160 мкл) и трифосген (283 мг), перемешивали при комнатной температуре в течение 30 минут и упаривали при пониженном давлении. Полученный остаток растворяли в тетрагидрофуране (5 мл) и добавляли 1-(5-метил-1,2-оксазол-3-ил)метанамина гидрохлорид (154 мг) (Регистрационный номер CAS: 1050590-34-5) и триэтиламин (290 мкл). Полученный раствор перемешивали при 50°C в течение одного часа, добавляли воду, после чего экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем упаривали при пониженном давлении. В полученный остаток добавляли метанол (4 мл) и трифторуксусную кислоту (1.8 мл), после чего перемешивали при комнатной температуре в течение одного часа и упаривали при пониженном давлении, добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 90:10 → 70/30→50:50), получая целевое соединение (310 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.27 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 2.37, 4.26, 6.10, 6.90-6.97, 7.64, 8.24.
Примеры 22(1) - (17)
Использовали амин, полученный в Примере 10, или другой соответствующий амин вместо 1-(5-метил-1,2-оксазол-3-ил)метанамина гидрохлорида, и применяли ту же методику, которая описана в Примере 22, получая целевое соединение, имеющее описанные ниже физические свойства.
Пример 22(1)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина

ТСХ: Rf 0.16 (гексан:этилацетат = 1:1);
1H-ЯМР (CDCl3): δ 1.75, 2.77, 4.65, 5.76, 6.60, 7.49, 7.61, 7.91-7.95, 8.78.
Пример 22(2)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина

ТСХ: Rf 0.34 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.61, 6.92, 7.08, 7.62, 8.46, 9.25.
Пример 22(3)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[6-(трифторметил)-3-пиридинил]метил}мочевина
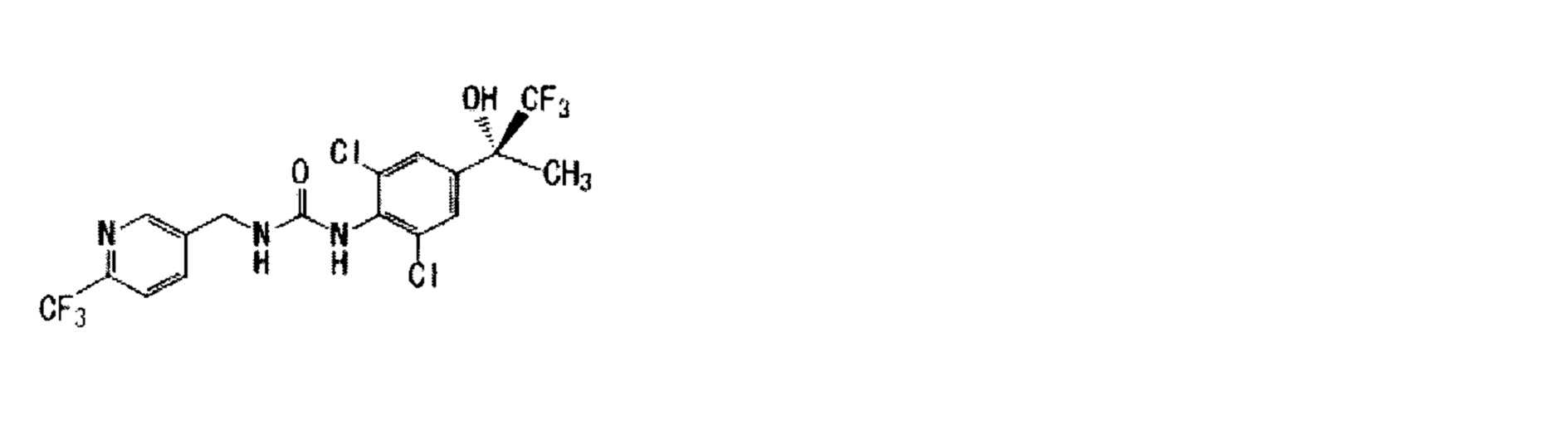
ТСХ: Rf 0.31 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.40, 6.93, 7.08, 7.64, 7.87-7.99, 8.35, 8.68.
Пример 22(4)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[2-(трифторметил)-5-пиримидинил]метил}мочевина
ТСХ: Rf 0.23 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.42, 6.94, 7.12, 7.64, 8.46, 8.95.
Пример 22(5)
1-[(5-хлор-2-пиридинил)метил]-3-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}мочевина

ТСХ: Rf 0.20 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.36, 6.93, 7.06, 7.39, 7.64, 7.94, 8.37, 8.55.
Пример 22(6)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[6-(2,2,2-трифтор-этокси)-3-пиридинил]метил}мочевина
ТСХ: Rf 0.38 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.70, 4.25, 4.93-5.02, 6.93-6.98, 7.64, 7.74, 8.11, 8.19.
Пример 22(7)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-[4-(трифторметил) бензил]мочевина
ТСХ: Rf 0.60 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.70, 4.38, 6.94, 7.02, 7.50-7.53, 7.65, 7.69-7.72, 8.26.
Пример 22(8)
1-бензил-3-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}мочевина
Время удерживания ЖХ (мин), ЖХ условия 3: 0.90;
1H-ЯМР (ДМСО-d6): δ 1.70, 4.29, 6.89, 6.95, 7.20-7.35, 7.64, 8.14.
Пример 22(9)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-(4-метоксибензил)мочевина
Время удерживания ЖХ (мин), ЖХ условия 3: 0.90;
1H-ЯМР (ДМСО-d6): δ 1.69, 3.72, 4.21, 6.79, 6.87-6.92, 7.20-7.23, 7.63, 8.07.
Пример 22(10)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-(4-метилбензил)мочевина
Время удерживания ЖХ (мин), ЖХ условия 3: 0.95;
1H-ЯМР (ДМСО-d6): δ 1.70, 2.27, 4.24, 6.82, 6.94, 7.14-7.20, 7.64, 8.10.
Пример 22(11)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-[4-(2-метил-2-пропанил)бензил]мочевина
Время удерживания ЖХ (мин), ЖХ условия 3: 1.05;
1H-ЯМР (ДМСО-d6): δ 1.27, 1.70, 4.25, 6.84, 6.92, 7.21-7.24, 7.34-7.36, 7.64, 8.09.
Пример 22(12)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-(4-феноксибензил) мочевина
Время удерживания ЖХ (мин), ЖХ условия 3: 1.03;
1H-ЯМР (ДМСО-d6): δ 1.70, 4.28, 6.87-6.91, 6.96-7.00, 7.09-7.15, 7.31-7.41, 7.64, 8.14.
Пример 22(13)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-[4-(дифторметокси) бензил]мочевина
Время удерживания ЖХ (мин), ЖХ условия 3: 0.94;
1H-ЯМР (ДМСО-d6): δ 1.70, 4.28, 6.88-6.94, 7.13-7.16, 7.20, 7.33-7.36, 7.64, 8.16.
Пример 22(14)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-[4-(4-морфолинил) бензил]мочевина
Время удерживания ЖХ (мин), ЖХ условия 3: 0.73;
1H-ЯМР (ДМСО-d6): δ 1.70, 3.07-3.11, 3.72-3.75, 4.19, 6.77, 6.92-6.95, 7.17-7.20, 7.64, 8.07.
Пример 22(15)
1-(4-цианобензил)-3-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил} мочевина
Время удерживания ЖХ (мин), ЖХ условия 3: 0.87;
1H-ЯМР (ДМСО-d6): δ 1.70, 4.37, 6.93, 7.02, 7.47-7.50, 7.65, 7.80-7.82, 8.28.
Пример 22(16)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-[4-(4-фторфеноксил)бензил]мочевина
Время удерживания ЖХ (мин), ЖХ условия 3: 1.03;
1H-ЯМР (ДМСО-d6): δ 1.70, 4.27, 6.86-7.05, 7.19-7.23, 7.30-7.33, 7.64, 8.13.
Пример 22(17)
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[2-(трифторметил)-1,3-тиазол-5-ил]метил}мочевина
ТСХ: Rf 0.50 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.71, 4.55, 6.95, 7.20, 7.66, 7.98, 8.41.
Пример 23
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[3-(трифторметил)-1,2,4-оксадиазол-5-ил]метил}мочевина

В тетрагидрофурановый раствор (6 мл) соединения, полученного в Примере 21 (300 мг), добавляли N,N-диизопропилэтиламин (165 мкл) и трифосген (283 мг), перемешивали при комнатной температуре в течение одного часа и затем упаривали при пониженном давлении. Полученный остаток растворяли в тетрагидрофуране (6 мл), добавляли 1-[3-(трифторметил)-1,2,4-оксадиазол-5-ил]метанамина гидрохлорид (264 мг) (Регистрационный номер CAS: 944905-93-5) и N,N-диизопропилэтиламин (750 мкл), перемешивали при 45°C в течение 17 часов. Затем добавляли тетрабутиламмония фторид (1 M раствор в тетрагидрофуране, 1 мл) и перемешивали при комнатной температуре в течение одного часа. В реакционную смесь добавляли насыщенный водный раствор хлорида аммония, после чего экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 60:40), получая целевое соединение (380 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.50 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.68, 4.68, 6.93, 7.24, 7.63, 8.61.
Пример 24
2,6-дихлор-4-{(2S)-1,1,1-трифтор-2-[(триметилсилил)окси]-2-пропанил}анилин
Использовали соединение, полученное в Примере 15b, вместо соединения, полученного в Примере 15a, и применяли ту же методику, которая описана в Примере 16 → Примере 17 → Примере 18 → Примере 19 → Примере 20 → Примере 21, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.56 (гексан:этилацетат = 4:1);
1H-ЯМР (CDCl3): δ 0.15, 1.75, 4.51, 7.33.
Пример 25
1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-[(5-метил-1,2-оксазол-3-ил)метил]мочевина
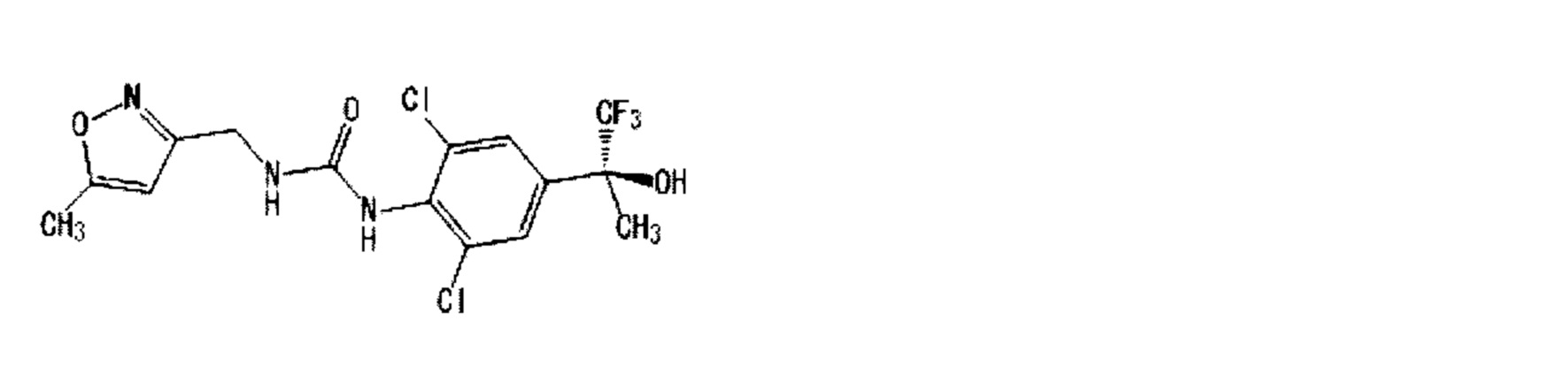
Использовали соединение, полученное в Примере 24, вместо соединения, полученного в Примере 21, и применяли ту же методику, которая описана в Примере 22, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.30 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 2.37, 4.25, 6.10, 6.91-7.00, 7.64, 8.24.
Примеры 25(1) - (8)
Использовали соединение, полученное в Примере 24, вместо соединения, полученного в Примере 21, и амин, полученный в Примере 10, или соответствующий амин вместо 1-(5-метил-1,2-оксазол-3-ил)метанамина гидрохлорида, и применяли ту же методику, которая описана в Примере 22, получая целевое соединение, имеющее описанные ниже физические свойства.
Пример 25(1)
1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина

ТСХ: Rf 0.34 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.60, 6.92, 7.08, 7.62, 8.46, 9.25.
Пример 25(2)
1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[6-(трифторметил)-3-пиридинил]метил}мочевина

ТСХ: Rf 0.29 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.40, 6.93, 7.08, 7.64, 7.89, 7.97, 8.35, 8.67.
Пример 25(3)
1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[2-(трифторметил)-5-пиримидинил]метил}мочевина
ТСХ: Rf 0.21 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.41, 6.93, 7.12, 7.65, 8.46, 8.95.
Пример 25(4)
1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина
ТСХ: Rf 0.16 (гексан:этилацетат = 1:1);
1H-ЯМР (CDCl3): δ 1.76, 2.67, 4.65, 5.73, 6.60, 7.49, 7.61, 7.91-7.95, 8.79.
Пример 25(5)
1-[(5-хлор-2-пиридинил)метил]-3-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}мочевина

ТСХ: Rf 0.24 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.69, 4.36, 6.93, 7.06, 7.38, 7.64, 7.94, 8.37, 8.55.
Пример 25(6)
1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[6-(2,2,2-трифторэтокси)-3-пиридинил]метил}мочевина
ТСХ: Rf 0.37 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.70, 4.25, 4.93-5.02, 6.93-6.98, 7.64, 7.74, 8.11, 8.19.
Пример 25(7)
1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-[4-(трифторметил) бензил]мочевина
ТСХ: Rf 0.60 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.70, 4.38, 6.93, 7.02, 7.50-7.53, 7.65, 7.69-7.72, 8.25.
Пример 25(8)
1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[2-(трифторметил)-1,3-тиазол-5-ил]метил}мочевина
ТСХ: Rf 0.50 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.71, 4.55, 6.95, 7.19, 7.66, 7.98, 8.40.
Пример 26
1-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[3-(трифторметил)-1,2,4-оксадиазол-5-ил]метил}мочевина
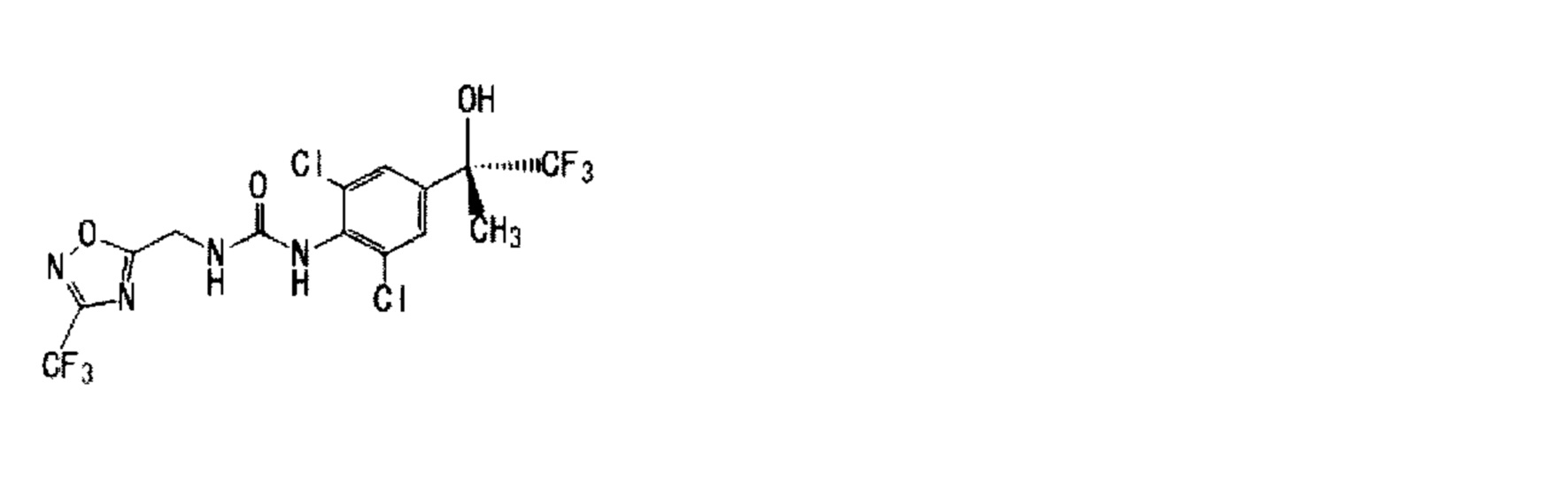
Использовали соединение, полученное в Примере 24, вместо соединения, полученного в Примере 21, и применяли ту же методику, которая описана в Примере 23, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.50 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.68, 4.68, 6.92, 7.24, 7.63, 8.60.
Примеры 27a и 27b
(1R)-1-(4-бромфенил)-2,2,2-трифтор этил[(1S)-1-(1-нафтил)этил]карбамат (27a) и (1S)-1-(4-бромфенил)-2,2,2-трифторэтил[(1S)-1-(1-нафтил)этил]карбамат (27b)
В дихлорметановый раствор (80 мл) 1-(4-бромфенил)-2,2,2-трифторэтанола (4.0 г) (Регистрационный номер CAS: 76911-73-4) добавляли 4-диметиламинопиридин (2.3 г) и 4-нитрофенил хлорформиат (3.3 мл) при охлаждении на ледяной бане и перемешивали при комнатной температуре в течение одного часа. Полученный раствор снова охлаждали на ледяной бане, добавляли (1S)-1-(1-нафтил)этанамин (4 мл) (Регистрационный номер CAS: 10420-89-0), после чего перемешивали при комнатной температуре в течение 30 минут. Полученный раствор фильтровали, и фильтрат промывали последовательно 1н. водным раствором гидроксида натрия дважды, один раз 1н. раствором соляной кислоты и один раз насыщенным раствором хлорида натрия. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:трет-бутилметиловый эфир = 90:10), получая целевые соединения 27a (1.91 г) и 27b (2.44 г), имеющее описанные ниже физические свойства.
27a
ТСХ: Rf 0.57 (гексан:трет-бутилметиловый эфир = 3:1);
1H-ЯМР (CDCl3): δ 1.65, 5.30, 5.64, 6.04, 7.34, 7.47-7.57, 7.82, 7.89, 8.07.
27b
ТСХ: Rf 0.69 (гексан:трет-бутилметиловый эфир = 3:1);
1H-ЯМР (CDCl3): δ 1.72, 5.29, 5.60, 6.03, 7.28, 7.41-7.51, 7.80, 7.86, 7.94.
Пример 28
(1R)-1-(4-бромфенил)-2,2,2-трифторэтанол
В раствор в 1,4-диоксане (40 мл) и воде (20 мл) соединения, полученного в Примере 27a (2.37 г), добавляли гидрат гидроксида лития (2.20 г), и полученную смесь перемешивали при 50°C в течение одного часа. Затем добавляли 2н. раствор соляной кислоты (40 мл) на ледяной бане, после чего экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 90:10), получая целевое соединение (1.34 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.65 (гексан:этилацетат = 3:1);
1H-ЯМР (CDCl3): δ 2.57, 4.97-5.05, 7.35-7.38, 7.54-7.57.
Пример 29
2-метил-2-пропанил{4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}карбамат
В 1,4-диоксановый раствор (30 мл) соединения, полученного в Примере 28 (1.34 г), добавляли трет-бутилкарбамат (800 мг), ацетат палладия (II) (118 мг), 4,5-бис(дифенилфосфино)-9,9-диметил ксантен (456 мг) и карбонат цезия (2.57 г), нагревали и кипятили в течение трех часов. Полученную реакционную смесь фильтровали через слой целита, и фильтрат упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 80:20), получая целевое соединение (1.32 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.48 (гексан:этилацетат = 3:1);
1H-ЯМР (CDCl3): δ 1.52, 2.58, 4.98, 6.56, 7.40.
Пример 30
(1R)-1-(4- амино-3,5-дихлорфенил)-2,2,2-трифторэтанол
В дихлорметановый раствор (20 мл) соединения, полученного в Примере 29 (1.32 г), на ледяной бане добавляли трифторуксусную кислоту (10 мл) и перемешивали при комнатной температуре в течение одного часа. Добавляли толуол (10 мл), после чего реакционную смесь упаривали при пониженном давлении. В полученный остаток добавляли насыщенный водный раствор гидрокарбоната натрия, затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток растворяли в N,N-диметилформамиде (10 мл), и добавляли N-хлорсукцинимид (684 мг). Реакционную смесь перемешивали при 40°C в течение 18 часов, добавляли воду, затем экстрагировали смесью этилацетата и гексана. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 85:15), получая целевое соединение (310 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.50 (гексан:этилацетат = 3:1);
1H-ЯМР (CDCl3): δ 4.58, 4.83-4.91, 7.31.
Пример 31
2,6-дихлор-4-{(1R)-2,2,2-трифтор-1-[(триметилсилил)окси]этил}анилин
В тетрагидрофурановый раствор (10 мл) соединения, полученного в Примере 30 (310 мг), добавляли хлортриметилсилан (583 мкл) и имидазол (405 мг) и перемешивали при комнатной температуре в течение трех часов, затем добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 95:5), получая целевое соединение (396 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.75 (гексан:этилацетат = 5:1);
1H-ЯМР (CDCl3): δ 0.13, 4.56, 4.75, 7.26.
Пример 32
1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[5-(трифторметил)-2-пиридинил] метил}мочевина

В тетрагидрофурановый раствор (4 мл) соединения, полученного в Примере 31 (80 мг), добавляли N,N-диизопропиламин (49 мкл) и трифосген (78 мг) и перемешивали при комнатной температуре в течение двух часов, после чего упаривали при пониженном давлении. Полученный остаток растворяли в тетрагидрофуране (4 мл) и добавляли 1-[5-(трифторметил)-2-пиридинил]метанамина гидрохлорид (76 мг) и N,N-диизопропилэтиламин (83 мкл), перемешивали при 50°C в течение двух часов, затем добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Полученный органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия, после чего упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 100:0 → 90/10 → 50/50), получая целевое соединение (67 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.21 (гексан:этилацетат = 1:1);
1H-ЯМР (CD3OD): δ 4.58, 5.07, 7.57, 7.64, 8.11, 8.80.
Примеры 32 (1) - (7)
Использовали соответствующий амин вместо 1-[5-(трифторметил)-2-пиридинил] метанамина гидрохлорида, и применяли ту же методику, которая описана в Примере 32, получая целевое соединение, имеющее описанные ниже физические свойства.
Пример 32(1)
1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[3-(трифторметил)-1,2,4-оксадиазол-5-ил]метил}мочевина

ТСХ: Rf 0.38 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 4.68, 5.27, 7.13, 7.25, 7.57, 8.62.
Пример 32(2)
1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-[(5-метил-1,2-оксазол-3-ил)метил]мочевина
ТСХ: Rf 0.23 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 2.36, 4.24, 5.27, 6.09, 6.95, 7.17, 7.57, 8.27.
Пример 32(3)
1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[2-(трифторметил)-5-пиримидинил]метил}мочевина

ТСХ: Rf 0.35 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 4.41, 5.27, 7.10-7.14, 7.58, 8.47, 8.94.
Пример 32(4)
1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина

ТСХ: Rf 0.27 (гексан:этилацетат = 1:1);
1H-ЯМР (CD3OD): δ 4.72, 5.06, 7.55, 9.08.
Пример 32(5)
1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[6-(трифторметил)-3-пиридинил]метил}мочевина
ТСХ: Rf 0.29 (гексан:этилацетат = 1:1);
1H-ЯМР (CD3OD): δ 4.51, 5.08, 7.57, 7.78, 8.00, 8.69.
Пример 32(6)
1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[6-(2,2,2-трифторэтокси)-3-пиридинил]метил}мочевина
ТСХ: Rf 0.36 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 4.24, 4.92-5.01, 5.27, 6.92-6.97, 7.11, 7.58, 7.73, 8.10, 8.19.
Пример 32(7)
1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-[4-(трифторметил)бензил] мочевина
ТСХ: Rf 0.55 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 4.38, 5.24-5.33, 7.02, 7.13, 7.50-7.53, 7.59, 7.69-7.72, 8.27.
Пример 33
1-{2,6-дихлор-4-[(1R)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[2-(трифторметил)-1,3-тиазол-5-ил]метил}мочевина

Использовали соединение, полученное в Примере 10, вместо 1-[5-(трифторметил)-2-пиридинил]метанамина гидрохлорида, и применяли ту же методику, которая описана в Примере 32, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.33 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 4.53, 5.27, 7.12, 7.18, 7.58, 7.95, 8.40.
Пример 34
2,6-дихлор-4-{(1S)-2,2,2-трифтор-1-[(триметилсилил)окси]этил}анилин
Использовали соединение, полученное в Примере 27b, вместо соединения, полученного в Примере 27a, и применяли ту же методику, которая описана в Примере 28 → Примере 29 → Примере 30 → Примере 31, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.75 (гексан:этилацетат = 5:1);
1H-ЯМР (CDCl3): δ 0.13, 4.56, 4.75, 7.26.
Пример 35
1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина

Использовали соединение, полученное в Примере 34, вместо соединения, полученного в Примере 31, и применяли ту же методику, которая описана в Примере 32, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.31 (гексан:этилацетат = 1:1);
1H-ЯМР (CD3OD): δ 4.58, 5.08, 7.57, 7.64, 8.11, 8.80.
Примеры 35(1) - (7)
Использовали соединение, полученное в Примере 34, вместо соединения, полученного в Примере 31, и соответствующий амин вместо 1-[5-(трифторметил)-2-пиридинил]метанамина гидрохлорида, и применяли ту же методику, которая описана в Примере 32, получая целевое соединение, имеющее описанные ниже физические свойства.
Пример 35(1)
1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[3-(трифторметил)-1,2,4-оксадиазол-5-ил]метил}мочевина

ТСХ: Rf 0.38 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 4.68, 5.28, 7.14, 7.26, 7.58, 8.63.
Пример 35(2)
1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-[(5-метил-1,2-оксазол-3-ил)метил]мочевина
ТСХ: Rf 0.23 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 2.36, 4.24, 5.27, 6.09, 6.95, 7.17, 7.57, 8.27.
Пример 35(3)
1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[2-(трифторметил)-5-пиримидинил]метил}мочевина

ТСХ: Rf 0.35 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 4.41, 5.27, 7.10-7.14, 7.58, 8.47, 8.94.
Пример 35(4)
1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина
ТСХ: Rf 0.48 (гексан:этилацетат = 3:2);
1H-ЯМР (CD3OD): δ 4.72, 5.07, 7.56, 9.09.
Пример 35(5)
1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[6-(трифторметил)-3-пиридинил]метил}мочевина
ТСХ: Rf 0.29 (гексан:этилацетат = 1:1);
1H-ЯМР (CD3OD): δ 4.51, 5.08, 7.57, 7.79, 8.00, 8.69.
Пример 35(6)
1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[6-(2,2,2-трифторэтокси)-3-пиридинил]метил}мочевина
ТСХ: Rf 0.38 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 4.24, 4.92-5.01, 5.27, 6.90-6.97, 7.11, 7.58, 7.73, 8.10, 8.20.
Пример 35(7)
1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-[4-(трифторметил)бензил] мочевина
ТСХ: Rf 0.55 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 4.38, 5.24-5.31, 7.02, 7.13, 7.50-7.53, 7.59, 7.69-7.72, 8.27.
Пример 36
1-{2,6-дихлор-4-[(1S)-2,2,2-трифтор-1-гидроксиэтил]фенил}-3-{[2-(трифторметил)-1,3-тиазол-5-ил]метил}мочевина
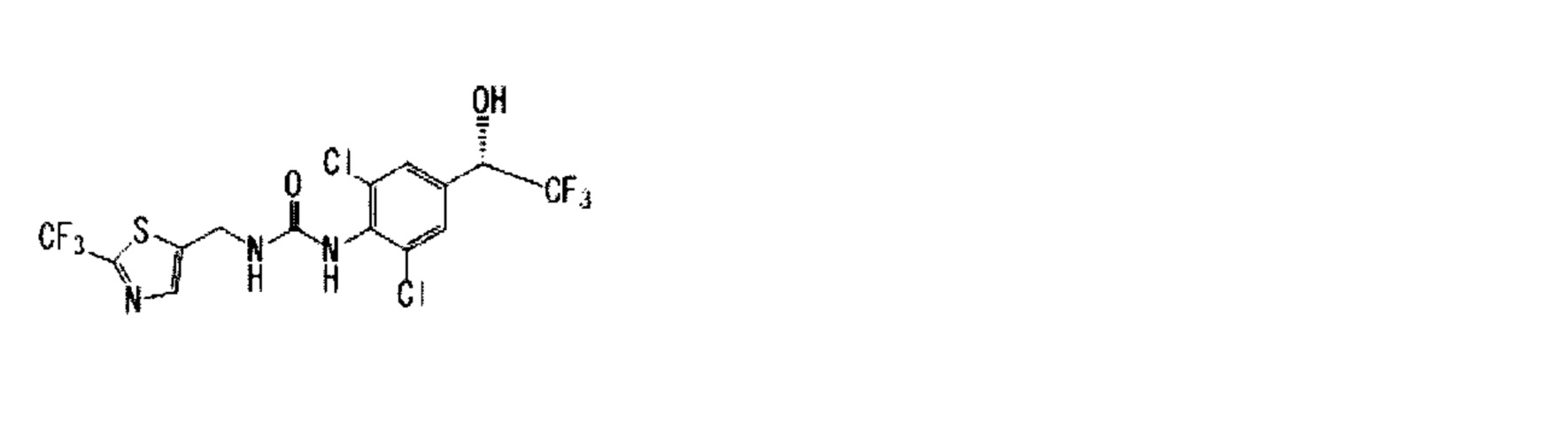
Использовали соединение, полученное в Примере 10, вместо 1-[5-(трифторметил)-2-пиридинил]метанамина гидрохлорида, и применяли ту же методику, которая описана в Примере 32, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.33 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 4.53, 5.27, 7.12, 7.18, 7.58, 7.96, 8.39.
Пример 37
4-ацетил-3-фторфенил трифторметан сульфонат
1-(2-фтор-4-гидроксифенил)этанон (2.05 г) (Регистрационный номер CAS: 68301-59-7) суспендировали в дихлорметане (20 мл), и добавляли триэтиламин (2.04 мл) и ангидрид трифторметансульфокислоты (2.46 мл) при охлаждении на ледяной бане. Реакционную смесь перемешивали при комнатной температуре в течение 30 минут, после чего упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 100:0 → 90/10 → 70/30), получая целевое соединение (3.90 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.69 (гексан:этилацетат = 3:1);
1H-ЯМР (CDCl3): δ 2.67, 7.13-7.21, 8.02.
Пример 38
3-фтор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил трифторметан сульфонат
В тетрагидрофурановый раствор (13.6 мл) соединения, полученного в Примере 37 (3.90 г), добавляли (трифторметил)триметилсилан (3.88 г) и тетрабутиламмония фторид (1M раствор в тетрагидрофуране, 40 мкл), перемешивали при комнатной температуре в течение 14 часов, добавляли (трифторметил)триметилсилан (2.9 г), после чего перемешивали при комнатной температуре в течение шести часов. Полученную реакционную смесь охлаждали на ледяной бане, добавляли тетрабутиламмония фторид (1M раствор в тетрагидрофуране, 7 мл), после чего перемешивали при комнатной температуре в течение пяти минут. В реакционную смесь добавляли 1н. раствор соляной кислоты, затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 90/10 → 60/40), получая целевое соединение (2.06 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.26 (гексан:этилацетат = 6:1);
1H-ЯМР (CDCl3): δ 1.90-1.92, 2.81, 7.07-7.11, 7.15-7.18, 7.82.
Пример 39
2-метил-2-пропанил[3-фтор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]карбамат
В 1,4-диоксановый раствор (22.4 мл) соединения, полученного в Примере 38 (1.49 г), добавляли трет-бутил карбамат (735 мг), ацетат палладия (II) (93 мг), 4,5-бис(дифенилфосфино)-9,9-диметил ксантен (363 мг) и карбонат цезия (2.04 г), перемешивали в атмосфере аргона при 110°C в течение 1.5 часов. Нерастворимый осадок отделяли фильтрованием. Фильтрат упаривали. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 95/5 → 75/25), получая целевое соединение (1.12 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.40 (гексан:этилацетат = 3:1);
1H-ЯМР (CDCl3): δ 1.52, 1.83, 3.10, 6.57, 6.97-7.00, 7.38-7.47.
Пример 40
2-(4-амино-2-фторфенил)-1,1,1-трифтор-2-пропанол
В дихлорметановый раствор (22 мл) соединения, полученного в Примере 39 (1.12 г), добавляли трифторуксусную кислоту (5 мл) при охлаждении на ледяной бане, перемешивали при комнатной температуре в течение 14 часов, после чего упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 80/20 → 60/40), получая целевое соединение (540 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.25 (гексан:этилацетат = 3:1);
1H-ЯМР (CDCl3): δ 1.79, 3.14, 3.86, 6.35-6.41, 6.44-6.48, 7.23-7.29.
Пример 41
2-(4-амино-3,5-дихлор-2-фторфенил)-1,1,1-трифтор-2-пропанол
В N,N-диметилформамидный раствор (5 мл) соединения, полученного в Примере 40 (290 мг), добавляли N-хлорсукцинимид (347 мг) и перемешивали при 80°C в течение 17 часов, затем добавляли воду, после чего экстрагировали смесью этилацетата и гексана (1:1). Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 90/10), получая целевое соединение (219 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.49 (гексан:этилацетат = 5:1);
1H-ЯМР (CDCl3): δ 1.84, 2.82, 4.67, 7.46.
Пример 42
2,6-дихлор-3-фтор-4-{1,1,1-трифтор-2-[(триметилсилил)окси]-2-пропанил}анилин
В тетрагидрофурановый раствор (5 мл) соединения, полученного в Примере 41 (250 мг), добавляли хлортриметилсилан (419 мкл) и имидазол (291 мг) и перемешивали при 55°C в течение трех часов, затем добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 95/5), получая целевое соединение (310 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.65 (гексан:этилацетат = 5:1);
1H-ЯМР (CDCl3): δ 0.19, 1.89, 4.63, 7.45.
Пример 43
1-[2,6-дихлор-3-фтор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина

Использовали соединение, полученное в Примере 42, вместо соединения, полученного в Примере 4, и применяли ту же методику, которая описана в Примере 5, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.30 (гексан:этилацетат = 1:1);
1H-ЯМР (CD3OD): δ 1.84, 4.59, 7.64, 7.85, 8.12, 8.81.
Примеры 43(1) - (3)
Использовали соединение, полученное в Примере 42, вместо соединения, полученного в Примере 4, и соответствующий амин вместо 1-[5-(трифторметил)-2-пиридинил]метанамина гидрохлорида, и применяли ту же методику, которая описана в Примере 5, получая целевое соединение, имеющее описанные ниже физические свойства.
Пример 43(1)
1-[2,6-дихлор-3-фтор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина
ТСХ: Rf 0.29 (гексан:этилацетат = 1:1);
1H-ЯМР (CD3OD): δ 1.83, 4.72, 7.83, 9.10.
Пример 43(2)
1-[(5-хлор-2-пиридинил)метил]-3-[2,6-дихлор-3-фтор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]мочевина
ТСХ: Rf 0.35 (гексан:этилацетат = 1:2);
1H-ЯМР (CD3OD): δ 1.84, 4.49, 7.45, 7.82-7.86, 8.49.
Пример 43(3)
1-[2,6-дихлор-3-фтор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-1,2,4-оксадиазол-3-ил]метил}мочевина
ТСХ: Rf 0.64 (гексан:этилацетат = 1:2);
1H-ЯМР (CD3OD): δ 1.83, 4.63, 7.84.
Пример 44
4-ацетил-2-фторфенилтрифторметан сульфонат
В дихлорметановый раствор (20 мл) 1-(3-фтор-4-гидроксифенил)этанона (1.0 г) (Регистрационный номер CAS: 403-14-5), добавляли триэтиламин (995 мкл) и ангидрид трифторметансульфокислоты (1.2 мл) при охлаждении на ледяной бане. Реакционную смесь перемешивали при комнатной температуре в течение одного часа, после чего добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 90/10), получая целевое соединение (1.8 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.57 (гексан:этилацетат = 3:1);
1H-ЯМР (CDCl3): δ 2.63, 7.46, 7.80-7.88.
Пример 45
2-фтор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил трифторметансульфонат
В тетрагидрофурановый раствор (54 мл) соединения, полученного в Примере 44 (1.8 г), и (трифторметил)триметилсилана (2.8 мл) добавляли тетрабутиламмония фторид (1M раствор в тетрагидрофуране, 310 мкл) на ледяной бане и перемешивали при комнатной температуре в течение двух часов. При охлаждении на ледяной бане добавляли тетрабутиламмония фторид (1M раствор в тетрагидрофуране, 7.5 мл) и перемешивали в течение 10 минут. В полученную реакционную смесь добавляли насыщенный водный раствор гидрокарбоната натрия, затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 90/10), получая целевое соединение (855 мг), имеющее описанные ниже физические свойства.
1H-ЯМР (CDCl3): δ 1.79, 2.52, 7.35-7.45, 7.56.
Пример 46
2-метил-2-пропанил[2-фтор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]карбамат
В 1,4-диоксановый раствор (12 мл) соединения, полученного в Примере 45 (855 мг), добавляли трет-бутил карбамат (421 мг), ацетат палладия (II) (54 мг), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (208 мг) и карбонат цезия (1.17 г) и оставляли под микроволновым излучением (Initiator60, производство Biotage) при 110°C на один час. Реакционную смесь фильтровали через слой целита, и фильтрат упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 80/20), получая целевое соединение (160 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.85 (гексан:этилацетат = 2:1);
1H-ЯМР (CDCl3): δ 1.53, 1.75, 2.36, 6.74, 7.27-7.39, 8.11.
Пример 47
2-(4-амино-3-фторфенил)-1,1,1-трифтор-2-пропанол
В дихлорметановый раствор (4 мл) соединения, полученного в Примере 46 (160 мг), добавляли трифторуксусную кислоту (2 мл) на ледяной бане. Реакционную смесь перемешивали при комнатной температуре в течение одного часа, после чего добавляли толуол (2 мл) и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 70/30), получая целевое соединение (53 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.65 (гексан:этилацетат = 2:1);
1H-ЯМР (CD3OD): δ 1.67, 6.95, 7.20, 7.28.
Пример 48
2-хлор-6-фтор-4-{1,1,1-трифтор-2-[(триметилсилил)окси]-2-пропанил}анилин
В N,N-диметилформамидный раствор (2 мл) соединения, полученного в Примере 47 (53 мг), добавляли N-хлорсукцинимид (32 мг) и перемешивали при комнатной температуре в течение 18 часов. Добавляли воду и экстрагировали смесью этилацетата и гексана. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток растворяли в тетрагидрофуране (2 мл), добавляли хлортриметилсилан (116 мкл) и имидазол (80 мг) и перемешивали при комнатной температуре в течение двух часов. В полученную смесь добавляли насыщенный водный раствор хлорида аммония, после чего экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 95/5), получая целевое соединение (53 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.84 (гексан:этилацетат = 3:1);
1H-ЯМР (CDCl3): δ 0.15, 1.75, 4.13, 7.13, 7.20.
Пример 49
1-[2-хлор-6-фтор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина

Использовали соединение, полученное в Примере 48, вместо соединения, полученного в Примере 4, и применяли ту же методику, которая описана в Примере 5, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.18 (гексан:этилацетат = 1:1);
1H-ЯМР (CD3OD): δ 1.70, 4.59, 7.38, 7.53, 7.62, 8.12, 8.82.
Пример 50
2-циклогексил-N-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]ацетамид

В толуольный раствор (2 мл) соединения, полученного в Примере 4 (50 мг), добавляли циклогексилацетил хлорид (27 мг) и перемешивали в микроволновой печи (Initiator60, производство Biotage) при 100°C в течение одного часа. Добавляли тетрабутиламмония фторид (1M раствор в тетрагидрофуране, 288 мкл) и перемешивали при комнатной температуре в течение 20 часов. В реакционную смесь добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 60/40), получая целевое соединение (8 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.50 (гексан:этилацетат = 3:1);
1H-ЯМР (CD3OD): δ 1.02-1.40, 1.65-1.91, 2.31, 7.67.
Примеры 50(1) - (7)
Использовали соответствующий хлорангидрид вместо циклогексилацетил хлорида, и применяли ту же методику, которая описана в Примере 50, получая целевое соединение, имеющее описанные ниже физические свойства.
Пример 50(1)
N-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-2-(4-фторфенил)ацетамид

ТСХ: Rf 0.47 (гексан:этилацетат = 2:1);
1H-ЯМР (ДМСО-d6): δ 1.70, 3.68, 6.97, 7.12-7.18, 7.35-7.40, 7.67, 10.11.
Пример 50(2)
N-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-(4-фторфенил) пропанамид
Время удерживания ЖХ (мин), ЖХ условия 1: 0.97;
1H-ЯМР (ДМСО-d6): δ 1.70, 2.62-2.67, 2.89-2.94, 6.96, 7.07-7.12, 7.27-7.32, 7.66, 9.87.
Пример 50(3)
N-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-2-[4-(трифторметил) фенил]ацетамид
ТСХ: Rf 0.70 (гексан:этилацетат = 1:1);
1H-ЯМР (CD3OD): δ 1.71, 3.86, 7.60-7.67.
Пример 50(4)
N-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3,3-диметилбутанамид
ТСХ: Rf 0.18 (гексан:этилацетат = 4:1);
1H-ЯМР (ДМСО-d6): δ 1.05, 1.70, 2.22, 6.97, 7.67, 9.74.
Пример 50(5)
N-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[4-(трифторметил) фенил]пропанамид
ТСХ: Rf 0.50 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.68, 2.70, 3.01, 6.94, 7.48, 7.62-7.65, 9.89.
Пример 50(6)
N-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[3-(трифторметил) фенил]пропанамид
Время удерживания ЖХ (мин), ЖХ условия 2: 1.03;
1H-ЯМР (ДМСО-d6): δ 1.69, 2.72, 3.02, 6.94, 7.50-7.65, 9.87.
Пример 50(7)
N-[2,6-дихлор-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[2-(трифторметил) фенил]пропанамид
Время удерживания ЖХ (мин), ЖХ условия 2: 1.03;
1H-ЯМР (ДМСО-d6): δ 1.70, 2.67-2.71, 3.06-3.11, 6.95, 7.42, 7.54-7.70, 9.94.
Пример 51
2-(4-бром-3-метилфенил)-1,1,1-трифтор-2-пропанол
В тетрагидрофурановый раствор (40 мл) 1-(4-бром-3-метил фенил)этанона (4.0 г) (Регистрационный номер CAS: 37074-40-1) добавляли (трифторметил)триметилсилан (8.3 мл) и тетрабутиламмония фторид (1M раствор в тетрагидрофуране, 0.9 мл) при охлаждении на ледяной бане. Реакционную смесь перемешивали при комнатной температуре в течение одного часа, после чего при охлаждении на ледяной бане добавляли тетрабутиламмония фторид (1M раствор в тетрагидрофуране, 22.5 мл) и затем добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над сульфатом натрия и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 95:5 → 85:15), получая целевое соединение (5.3 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.51 (гексан:этилацетат = 5:1);
1H-ЯМР (CDCl3): δ 1.76, 2.43, 2.48, 7.23-7.26, 7.45, 7.54.
Пример 52
2-метил-2-пропанил[2-метил-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]карбамат
В 1,4-диоксановый раствор (80 мл) соединения, полученного в Примере 51 (4.5 г), добавляли 4,5-бис(дифенилфосфино)-9,9-диметил ксантен (1.4 г), ацетат палладия (II) (360 мг), трет-бутил карбамат (2.4 г) и карбонат цезия (7.8 г). Реакционную смесь нагревали и кипятили в течение 1.5 часов, после чего разбавляли этилацетатом. Нерастворимый осадок отделяли фильтрованием через слой целита, и фильтрат упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 90:10 → 80:20 → 60:40), получая целевое соединение (1.7 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.49 (гексан:этилацетат = 2:1);
1H-ЯМР (CDCl3): δ 1.53, 1.75, 2.28, 2.67, 6.32, 7.36-7.39, 7.85-7.89.
Пример 53
2-(4-амино-3-метил фенил)-1,1,1-трифтор-2-пропанол
В дихлорметановый раствор (20 мл) соединения, полученного в Примере 52 (1.7 г), при охлаждении на ледяной бане добавляли трифторуксусную кислоту (12 мл) и перемешивали при комнатной температуре в течение одного часа. В реакционную смесь добавляли толуол, после чего упаривали при пониженном давлении. В полученный остаток добавляли насыщенный водный раствор гидрокарбоната натрия, затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и затем упаривали при пониженном давлении, получая целевое соединение (743 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.54 (гексан:этилацетат = 1:1);
1H-ЯМР (CDCl3): δ 1.73, 2.18, 2.27, 3.66, 6.67, 7.20-7.26.
Пример 54
2-метил-4-{1,1,1-трифтор-2-[(триметилсилил)окси]-2-пропанил}анилин
В тетрагидрофурановый раствор (15 мл) соединения, полученного в Примере 53 (743 мг), добавляли имидазол (1.15 г) и хлортриметилсилан (1.93 мл) и перемешивали при комнатной температуре в течение одного часа. В реакционную смесь добавляли насыщенный водный раствор хлорида аммония, затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и упаривали при пониженном давлении, получая целевое соединение (990 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.55 (гексан:этилацетат = 2:1);
1H-ЯМР (CDCl3): δ 0.11, 1.76, 2.17, 3.64, 6.62-6.65, 7.18.
Пример 55
2-хлор-6-метил-4-{1,1,1-трифтор-2-[(триметилсилил)окси]-2-пропанил}анилин
В N,N-диметилформамидный раствор (8 мл) соединения, полученного в Примере 54 (960 мг), добавляли N-хлорсукцинимид (439 мг) и перемешивали при комнатной температуре в течение шести часов. Затем добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 100:0 → 98:2), получая целевое соединение (619 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.47 (гексан:этилацетат = 8:1);
1H-ЯМР (CDCl3): δ 0.14, 1.75, 2.22, 4.07, 7.11, 7.30.
Пример 56
1-[2-хлор-6-метил-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина
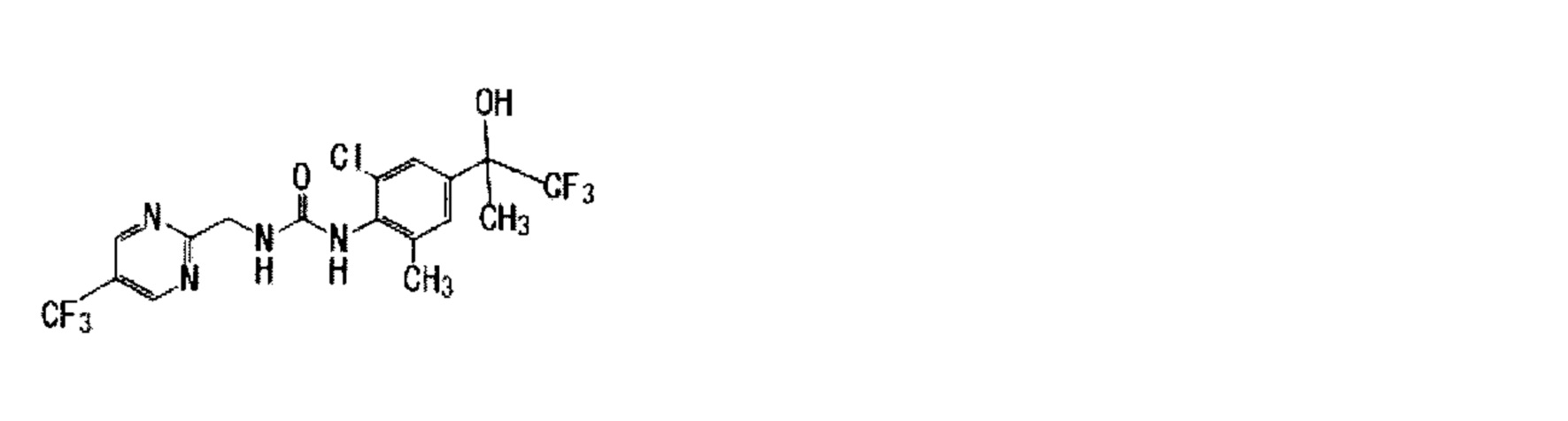
В тетрагидрофурановый раствор (0.4 мл) соединения, полученного в Примере 55 (20 мг), добавляли трифосген (20 мг) и диизопропилэтиламин (11 мкл) и перемешивали при комнатной температуре в течение одного часа. Реакционную смесь упаривали при пониженном давлении. Полученный остаток растворяли в тетрагидрофуране (0.4 мл), добавляли 1-[5-(трифторметил)-2-пиридинил]метанамина гидрохлорид (19 мг) и диизопропилэтиламин (53 мкл) и перемешивали при 45°C в течение 17 часов. В реакционную смесь добавляли тетрабутиламмония фторид (1M раствор в тетрагидрофуране, 73 мкл), перемешивали при комнатной температуре в течение одного часа, затем добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 70:30 → 50:50), получая целевое соединение (20 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.47 (гексан:этилацетат = 1:2);
1H-ЯМР (CDCl3): δ 1.78, 2.43, 2.56, 4.80, 5.57, 6.21, 7.43, 7.57, 8.93.
Примеры 56(1) - (3)
Использовали соответствующий амин вместо 1-[5-(трифторметил)-2-пиридинил] метанамина гидрохлорида, и применяли ту же методику, которая описана в Примере 56, получая целевое соединение, имеющее описанные ниже физические свойства.
Пример 56(1)
1-[2-хлор-6-метил-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина
ТСХ: Rf 0.40 (гексан:этилацетат = 1:2);
1H-ЯМР (CDCl3): δ 1.76, 2.38, 2.59, 4.62, 5.55, 6.20, 7.39, 7.47, 7.55, 7.91, 8.75.
Пример 56(2)
1-[2-хлор-6-метил-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[6-(трифторметил)-3-пиридинил]метил}мочевина
ТСХ: Rf 0.36 (гексан:этилацетат = 1:2);
1H-ЯМР (CDCl3): δ 1.76, 2.37, 2.53, 4.54, 4.89, 5.97, 7.40, 7.56, 7.66, 7.86-7.88, 8.64.
Пример 56(3)
1-[2-хлор-6-метил-4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-[(5-хлор-2-пиридинил)метил]мочевина
ТСХ: Rf 0.49 (гексан:этилацетат = 1:2);
1H-ЯМР (CDCl3): δ 1.76, 2.36, 2.50, 4.52, 5,45, 7.30, 7.38, 7.53, 7.65, 8.45.
Пример 57
2,2,2-трифтор-1-(3-метил-4-нитрофенил)этанол
В тетрагидрофурановый раствор (40 мл) 3-метил-4-нитробензальдегида (2.5 г) (Регистрационный номер CAS: 18515-67-8) при охлаждении на ледяной бане добавляли (трифторметил)триметилсилан (6.7 мл) и тетрабутиламмония фторид (1M раствор в тетрагидрофуране, 0.76 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут, затем добавляли тетрабутиламмония фторид (1M раствор в тетрагидрофуране, 18 мл) при охлаждении на ледяной бане и перемешивали при комнатной температуре в течение 30 минут. В реакционную смесь добавляли насыщенный водный раствор хлорида аммония, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 90:10 → 82:18 → 50:50), получая целевое соединение (2.0 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.50 (гексан:этилацетат = 2:1);
1H-ЯМР (CDCl3): δ 2.64, 2.89, 5.06-5.14, 7.46-7.49, 7.99-8.02.
Пример 58
1-(4-амино-3-метил фенил)-2,2,2-трифторэтанол
В этанольный раствор (90 мл) соединения, полученного в Примере 57 (1.95 г), добавляли 5%-ный палладий на угле (содержит 50% воды, 325 мг) и перемешивали в атмосфере водорода в течение 1.5 часов. Реакционную смесь разбавляли этилацетатом, фильтровали через слой целита, и фильтрат упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 80:20 → 67:33 → 0:100), получая целевое соединение (1.50 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.34 (гексан:этилацетат = 2:1);
1H-ЯМР (CDCl3): δ 2.18, 2.37, 3.72, 4.83-4.92, 6.68, 7.11-7.15.
Пример 59
4-(1-{[диметил(2-метил-2-пропанил)силил]окси}-2,2,2-трифторэтил)-2-метиланилин
В N,N-диметилформамидный раствор (30 мл) соединения, полученного в Примере 58 (1.50 г), добавляли имидазол (2.50 г) и хлор(диметил)(2-метил-2-пропанил)силан (4.94 г). Реакционную смесь перемешивали при комнатной температуре в течение 2.5 часов, затем при 50°C в течение одного часа. В полученную смесь добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 95:5 → 90:10), получая целевое соединение (507 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.63 (гексан:этилацетат = 2:1);
1H-ЯМР (CDCl3): δ 0.11, 0.89, 2.17, 3.66, 4.75-4.81, 6.63-6.66, 7.09.
Пример 60
1-[2-метил-4-(2,2,2-трифтор-1-гидроксиэтил)фенил]-3-{[5-(трифторметил)-2-пиридинил] метил}мочевина

В тетрагидрофурановый раствор (0.6 мл) соединения, полученного в Примере 59 (30 мг), добавляли трифосген (31 мг) и диизопропилэтиламин (17 мкл) и перемешивали при комнатной температуре в течение одного часа, после чего упаривали при пониженном давлении. Полученный остаток растворяли в тетрагидрофуране (0.6 мл), добавляли 1-[5-(трифторметил)-2-пиридинил]метанамина гидрохлорид (30 мг) и диизопропилэтиламин (81 мкл), затем перемешивали при комнатной температуре в течение одного часа. В реакционную смесь добавляли тетрабутиламмония фторид (1M раствор в тетрагидрофуране, 112 мкл) и перемешивали при комнатной температуре в течение одного часа, после чего добавляли тетрабутиламмония фторид (1M раствор в тетрагидрофуране, 940 мкл) и перемешивали при комнатной температуре в течение 30 минут. В реакционную смесь добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 70:30 → 50:50 → 30:70), получая целевое соединение (32 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.46 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 2.22, 4.51, 4.95-5.05, 6.66, 7.18, 7.24, 7.30, 7.58, 7.83, 8.02, 8.21, 8.92.
Пример 61
2-хлор-4-(1-{[диметил(2-метил-2-пропанил)силил]окси}-2,2,2-трифторэтил)-6-метил анилин
В ацетонитрильный раствор (20 мл) соединения, полученного в Примере 59 (470 мг), добавляли 1,3-дихлор-5,5-диметилгидантоин (290 мг) и перемешивали при комнатной температуре 40 минут, после чего добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 95:5 → 90:10), получая целевое соединение (435 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.58 (гексан:этилацетат = 8:1);
1H-ЯМР (CDCl3): δ 0.12, 0.91, 2.23, 4.11, 4.73-4.80, 7.04, 7.24.
Пример 62
1-[2-хлор-6-метил-4-(2,2,2-трифтор-1-гидроксиэтил)фенил]-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина
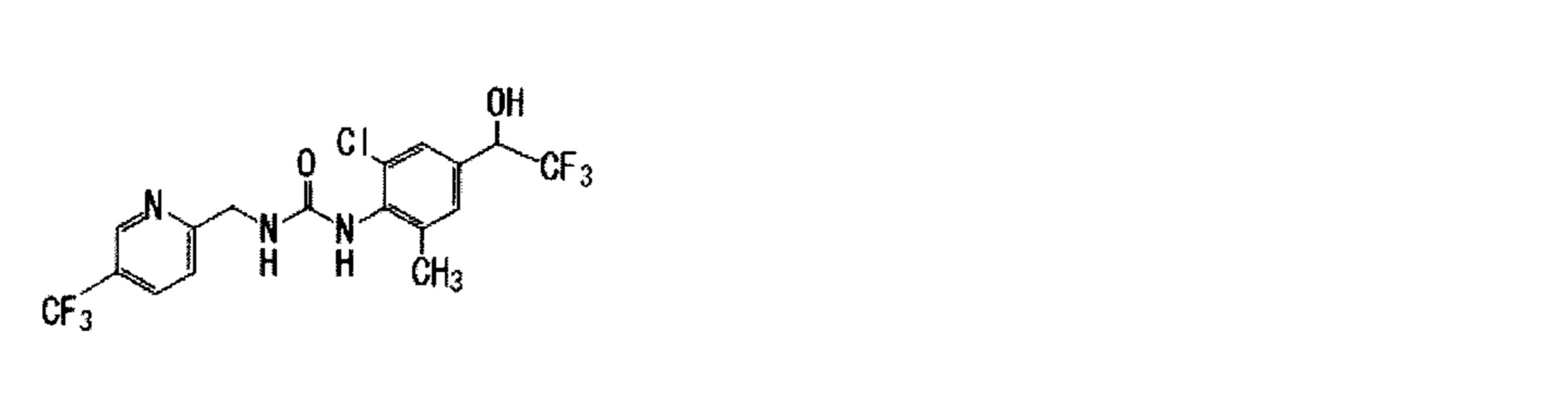
Использовали соединение, полученное в Примере 61, вместо соединения, полученного в Примере 59, и применяли ту же методику, которая описана в Примере 60, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.44 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 2.23, 4.47, 5.11-5.20, 6.92, 7.03, 7.30, 7.41, 7.57, 8.13, 8.23, 8.89.
Примеры 62(1) - (3)
Использовали соединение, полученное в Примере 61, вместо соединения, полученного в Примере 59, и соответствующий амин вместо 1-[5-(трифторметил)-2-пиридинил]метанамина гидрохлорида, и применяли ту же методику, которая описана в Примере 60, получая целевое соединение, имеющее описанные ниже физические свойства.
Пример 62(1)
1-[2-хлор-6-метил-4-(2,2,2-трифтор-1-гидроксиэтил)фенил]-3-{[5-(трифторметил)-2-пиримидинил]метил}мочевина
ТСХ: Rf 0.48 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 2.22, 4.59, 5.10-5.19, 6.90-6.97, 7.29, 7.40, 8.18, 9.24.
Пример 62(2)
1-[2-хлор-6-метил-4-(2,2,2-трифтор-1-гидроксиэтил)фенил]-3-{[6-(трифторметил)-3-пиридинил]метил}мочевина
ТСХ: Rf 0.56 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 2.21, 4.40, 5.11-5.20, 6.92, 6.98, 7.30, 7.41, 7.87-7.97, 8.04, 8.67.
Пример 62(3)
1-[2-хлор-6-метил-4-(2,2,2-трифтор-1-гидроксиэтил)фенил]-3-[(5-хлор-2-пиридинил) метил]мочевина
ТСХ: Rf 0.33 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 2.22, 4.36, 5.11-5.19, 6.90-6.97, 7.30-7.40, 7.93, 8.07, 8.55.
Пример 63
2-[4-(дибензиламино)фенил]-4,4,4-трифтор-2-бутанол
В тетрагидрофурановый раствор (4 мл) N,N-дибензил-4-броманилина (300 мг) (Регистрационный номер CAS: 65145-14-4) по каплям добавляли н-бутиллитий (1.64M раствор в гексане, 0.78 мл) при -78°C и перемешивали при -78°C в течение 10 минут, после чего добавляли 4,4,4-трифтор-2-бутанон (214 мг) и перемешивали при комнатной температуре в течение одного часа. В реакционную смесь добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и затем упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 85:15), получая целевое соединение (100 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.50 (гексан:этилацетат = 5:1);
1H-ЯМР (CDCl3): δ 1.67, 2.51-2.67, 4.65,6.68-6.73, 7.22-7.38.
Пример 64
2-(4-аминофенил)-4,4,4-трифтор-2-бутанол
В раствор соединения, полученного в Примере 63 (100 мг), в метаноле (2 мл) и этилацетате (2 мл) добавляли 5%-ный палладий на угле (содержит 50% воды, 10 мг) и перемешивали в атмосфере водорода при комнатной температуре в течение двух часов. Реакционную смесь фильтровали через слой целита, и фильтрат упаривали при пониженном давлении, получая целевое соединение.
ТСХ: Rf 0.15 (гексан:этилацетат = 3:1);
1H-ЯМР (CD3OD):δ 1.60, 2.56-2.70, 6.83-6.86, 7.31-7.34.
Пример 65
4-{4,4,4-трифтор-2-[( триметилсилил)окси]-2-бутанил}анилин
В тетрагидрофурановый раствор (5 мл) соединения, полученного в Примере 64 (54 мг), добавляли хлортриметилсилан (120 мкл) и имидазол (83 мг) и перемешивали при комнатной температуре в течение 17 часов. Добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 85:15), получая целевое соединение (31 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.61 (гексан:этилацетат = 2:1);
1H-ЯМР (CDCl3): δ 0.04, 1.74, 2.38-2.60, 3.65, 6.63-6.66, 7.18-7.21.
Пример 66
2,6-дихлор-4-{4,4,4-трифтор-2-[(триметилсилил)окси]-2-бутанил}анилин
В N,N-диметилформамидный раствор (2 мл) соединения, полученного в Примере 65 (31 мг), добавляли N-хлорсукцинимид (31 мг) и перемешивали при 40°C в течение 20 часов. Добавляли воду и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 95:5), получая целевое соединение (21 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.80 (гексан:этилацетат = 5:1);
1H-ЯМР (CDCl3): 0.09, 1.71, 2.37-2.56, 4.42, 7.22.
Пример 67
1-[2,6-дихлор-4-(4,4,4-трифтор-2-гидрокси-2-бутанил)фенил]-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина

В дихлорметановый раствор (2 мл) соединения, полученного в Примере 66 (21 мг), добавляли N,N-диизопропилэтиламин (11 мкл) и трифосген (19 мг) и перемешивали при 40°C в течение одного часа. Реакционную смесь упаривали при пониженном давлении, после чего остаток растворяли в тетрагидрофуране (2 мл). В полученный раствор добавляли N,N-диизопропилэтиламин (50 мкл) и 1-[5-(трифторметил)-2-пиридинил] метанамина гидрохлорид (14 мг) и перемешивали при 30°C в течение 20 часов. Затем добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток растворяли в тетрагидрофуране (1 мл), добавляли тетрабутиламмония фторид (1M раствор в тетрагидрофуране, 582 мкл) и перемешивали при комнатной температуре в течение одного часа. В полученную смесь добавляли насыщенный водный раствор хлорида аммония, затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 50:50), получая целевое соединение (2 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.35 (гексан:этилацетат = 1:2);
1H-ЯМР (CDCl3): δ 1.69, 2.42, 2.56-2.68, 4.62, 5.81, 6.62, 7.47, 7.49, 7.91, 8.76.
Пример 68
1-нитро-4-(1,1,1-трифтор-2-метокси-2-пропанил)бензол
В N,N-диметилформамидный раствор (13 мл) соединения, полученного в Примере 1 (1.49 г), при охлаждении на ледяной бане добавляли гидрид натрия (60% в масле, 278 мг) и перемешивали при комнатной температуре в течение 15 минут. Затем при охлаждении на ледяной бане добавляли метилиодид (987 мг) и перемешивали при комнатной температуре в течение одного часа. В реакционную смесь при охлаждении на ледяной бане добавляли насыщенный водный раствор хлорида аммония и воду, затем экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния, после чего упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 100:0 → 80:20), получая целевое соединение (1.55 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.69 (гексан:этилацетат = 4:1);
1H-ЯМР (CDCl3): δ 1.83, 3.29, 7.70-7.73, 8.25-8.28.
Пример 69
4-(1,1,1-трифтор-2-метокси-2-пропанил)анилин
В метанольный раствор (21 мл) соединения, полученного в Примере 68 (1.55 г), добавляли 5%-ный палладий на угле (содержит 50% воды, 155 мг) и перемешивали в атмосфере водорода при комнатной температуре в течение двух часов. Реакционную смесь фильтровали через слой целита, и затем фильтрат упаривали, получая целевое соединение (1.35 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.33 (гексан:этилацетат = 4:1);
1H-ЯМР (CDCl3): δ 1.72, 3.19, 3.75, 6.67-6.70, 7.27-7.29.
Пример 70
2,6-дихлор-4-(1,1,1-трифтор-2-метокси-2-пропанил)анилин
В ацетонитрильный раствор (25 мл) соединения, полученного в Примере 69 (1.35 г), при охлаждении на ледяной бане добавляли 1,3-дихлор-5,5-диметилгидантоин (1.21 г) и перемешивали при комнатной температуре в течение одного часа, затем при 45°C в течение трех часов. В реакционную смесь при охлаждении на ледяной бане добавляли водный раствор сульфита натрия и перемешивали при комнатной температуре в течение 30 минут, затем экстрагировали этилацетатом. Органический слой промывали последовательно водным раствором сульфита натрия, водой и насыщенным водным раствором хлорида натрия, затем сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 100:0 → 80:20), получая целевое соединение (1.74 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.62 (гексан:этилацетат = 4:1);
1H-ЯМР (CDCl3): δ 1.70, 3.22, 4.56, 7.31.
Пример 71
1-[2,6-дихлор-4-(1,1,1-трифтор-2-метокси-2-пропанил)фенил]-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина

В тетрагидрофурановый раствор (1 мл) соединения, полученного в Примере 70 (30 мг), добавляли диизопропилэтиламин (20 мкл) и трифосген (34 мг) и перемешивали при комнатной температуре в течение 30 минут, после чего упаривали при пониженном давлении. Полученный остаток растворяли в тетрагидрофуране (1 мл) и добавляли 1-[5-(трифторметил)-2-пиридинил]метанамина гидрохлорид (24 мг) и триэтиламин (35 мкл) и перемешивали в течение ночи при комнатной температуре. В реакционную смесь добавляли воду и экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток промывали смесью гексана и этилацетата (9:1), получая целевое соединение (40 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.32 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.78, 3.19, 4.46, 7.15, 7.54-7.62, 8.23, 8.48, 8.88.
Пример 72
{[1,1-дифтор-2-(4-нитрофенил)-2-пропанил]окси}(триметил)силан
В N,N-диметилформамидный раствор (15 мл) 1-(4-нитрофенил)этанона (Регистрационный номер CAS: 100-19-6) (1.00 г) добавляли фторид цезия (183 мг) и (дифторметил)(триметил)силан (Регистрационный номер CAS: 65864-64-4) (2.26 г) при охлаждении на ледяной бане. Реакционную смесь перемешивали при охлаждении на ледяной бане в течение одного часа, затем при комнатной температуре в течение двух часов и затем при 45°C в течение двух часов. В полученную смесь добавляли воду, после чего экстрагировали смесью этилацетата и гексана. Органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, затем упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 100/0 → 95/5 → 65/35 → 40/60), получая целевое соединение (454 мг), имеющее описанные ниже физические свойства.
1H-ЯМР (CDCl3): δ 0.17, 1.76, 5.58, 7.66-7.69, 8.21-8.26.
Пример 73
4-{1,1-дифтор-2-[( триметилсилил)окси]-2-пропанил}анилин
В метанольный раствор (4.1 мл) соединения, полученного в Примере 72 (237 мг), добавляли 5%-ный палладий на угле (производство N.E. CHEMCAT CORPORATION, содержит воду, KER тип) (20 мг) и перемешивали в атмосфере водорода при комнатной температуре в течение двух часов. Реакционную смесь фильтровали через слой целита, и фильтрат упаривали при пониженном давлении, получая целевое соединение (203 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.26 (гексан:этилацетат = 4:1);
1H-ЯМР (CDCl3): δ 0.08, 1.65, 3.68, 5.51, 6.64-6.69, 7.22-7.25.
Пример 74
2,6-дихлор-4-{1,1-дифтор-2-[(триметилсилил)окси]-2-пропанил}анилин
В N,N-диметилформамидный раствор (5.2 мл) соединения (203 мг), полученного в Примере 73, добавляли N-хлорсукцинимид (209 мг) и перемешивали при 35°C в течение одного часа и затем при 45°C в течение ночи. Реакционную смесь разбавляли смесью этилацетата и гексана, затем промывали последовательно водой и насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия, после чего упаривали при пониженном давлении. В тетрагидрофурановый раствор (5.2 мл) полученного остатка добавляли имидазол (106 мг) и хлортриметилсилан (0.20 мл) и перемешивали при комнатной температуре в течение двух часов. В полученную смесь добавляли воду и экстрагировали этилацетатом. Органический слой промывали последовательно водой и насыщенным водным раствором хлорида натрия, сушили над безводным сульфатом натрия и затем упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 100/0 → 95/5 → 90/10), получая целевое соединение (238 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.76 (гексан:этилацетат = 4:1);
1H-ЯМР (CDCl3): δ 0.13, 1.63, 4.47, 5.47, 7.26.
Пример 75
1-[2,6-дихлор-4-(1,1-дифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина
Использовали соединение, полученное в Примере 74, вместо соединения, полученного в Примере 4, и применяли ту же методику, которая описана в Примере 5, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.35 (гексан:этилацетат = 1:2);
1H-ЯМР (ДМСО-d6): δ 1.50, 4.47, 6.02, 7.10, 7.57-7.59, 8.22-8.26, 8.39, 8.89.
Пример 76
1-(4-амино-3,5-дихлорфенил)-2,2,2-трифторэтанон
В N,N-диметилформамидный раствор (30 мл) 1-(4-аминофенил)-2,2,2-трифторэтанона (Регистрационный номер CAS: 23516-79-2) (2.60 г) добавляли N-хлорсукцинимид (3.70 г) и перемешивали при 40°C в течение 18 часов. Затем добавляли водный раствор насыщенного гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 95/5), получая целевое соединение (3.20 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.55 (гексан:этилацетат = 5:1);
1H-ЯМР (CDCl3): δ 5.26, 7.94.
Пример 77
1-(4- амино-3,5-дихлорфенил)-2,2,2-трифторэтанол
В метанольный раствор (10 мл) соединения, полученного в Примере 76 (1.00 г), при охлаждении на ледяной бане добавляли боргидрид натрия (146 мг) и перемешивали при комнатной температуре в течение одного часа. Добавляли насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Полученный органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении, получая целевое соединение (975 мг), имеющее описанные ниже физические свойства.
1H-ЯМР (CDCl3): δ 4.58, 4.83-4.91, 7.31.
Пример 78
4-(1-азид-2,2,2-трифторэтил)-2,6-дихлоранилин
В толуольный раствор (10 мл) соединения, полученного в Примере 77 (314 мг), добавляли 2,3,4,6,7,8,9,10-октагидропиримидо[1,2-a]азепин (Регистрационный номер CAS: 41015-70-7) (0.22 мл) и дифенил фосфоразидат (Регистрационный номер CAS: 26386-88-9) (0.33 мл) и перемешивали при 45°C в течение трех часов Добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 95/5), получая целевое соединение (314 мг), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.70 (гексан:этилацетат = 5:1);
1H-ЯМР (CDCl3): δ 4.65, 4.75, 7.26.
Пример 79
1-[4-(1-амино-2,2,2-трифторэтил)-2,6-дихлорфенил]-3-{[6-(трифторметил)-3-пиридинил] метил}мочевина

В тетрагидрофурановый раствор (5 мл) соединения, полученного в Примере 78 (310 мг), добавляли трифосген (355 мг) и N,N-диизопропилэтиламин (207 мкл) и перемешивали при комнатной температуре в течение одного часа, после чего упаривали при пониженном давлении. Полученный остаток (55 мг) растворяли в тетрагидрофуране (2 мл), добавляли N,N-диизопропилэтиламин (153 мкл) и 1-[6-(трифторметил)-3-пиридинил]метанамин (Регистрационный номер CAS: 23586-96-1) (47 мг) и перемешивали при 45°C в течение двух часов. В полученную реакционную смесь добавляли насыщенный водный раствор гидрокарбоната натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток растворяли в тетрагидрофуране (2 мл), добавляли воду (0.2 мл) и трифенилфосфин (83 мг) и перемешивали при комнатной температуре в течение 30 минут, а затем при 50°C в течение четырех часов. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором хлорида натрия, сушили над безводным сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат = 20/80), получая целевое соединение (31 мг), имеющее описанные ниже физические свойства.
Время удерживания ЖХ (мин), ЖХ условия 3:0.72;
1H-ЯМР (ДМСО-d6): δ 4.41, 5.34-5.46, 7.18, 7.75, 7.88-7.97, 8.52, 8.68.
Примеры 79(1) - (4)
Использовали амин, полученный в Примере 10, или соответствующий амин вместо 1-[6-(трифторметил)-3-пиридинил]метанамина, и применяли ту же методику, которая описана в Примере 79, получая продукт по настоящему изобретению, имеющий описанные ниже физические свойства.
Пример 79(1)
1-[4-(1-амино-2,2,2-трифторэтил)-2,6-дихлорфенил]-3-{[5-(трифторметил)-2-пиридинил] метил}мочевина
ТСХ: Rf 0.50 (гексан:этилацетат = 1:2);
1H-ЯМР (CD3OD): δ 4.61, 5.37-5.45, 7.63-7.66, 7.69, 8.11-8.14, 8.83.
Пример 79(2)
1-[4-(1-амино-2,2,2-трифторэтил)-2,6-дихлорфенил]-3-[(5-хлор-2-пиридинил)метил] мочевина
Время удерживания ЖХ (мин), ЖХ условия 3: 0.66;
1H-ЯМР (ДМСО-d6): δ 4.38, 5.42-5.50, 7.14, 7.39, 7.75, 7.94, 8.54-8.56.
Пример 79(3)
1-[4-(1- амино-2,2,2-трифторэтил)-2,6-дихлорфенил]-3-(4-фторбензил)мочевина
Время удерживания ЖХ (мин), ЖХ условия 3: 0.74;
1H-ЯМР (ДМСО-d6): δ 4.26, 5.30-5.40, 6.98, 7.12-7.18, 7.30-7.35, 7.73, 8.29.
Пример 79(4)
1-[4-(1-амино-2,2,2-трифторэтил)-2,6-дихлорфенил]-3-{[2-(трифторметил)-1,3-тиазол-5-ил]метил}мочевина
Время удерживания ЖХ (мин), ЖХ условия 3: 0.74;
1H-ЯМР (ДМСО-d6): δ 4.54, 5.28-5.40, 7.28, 7.74, 7.97, 8.55.
Сравнительный Пример 1
1-[4-(1,1,1-трифтор-2-гидрокси-2-пропанил)фенил]-3-{[5-(трифторметил)-2-пиридинил] метил}мочевина
Использовали соединение, полученное в Примере 2, вместо соединения, полученного в Примере 4, и применяли ту же методику, которая описана в Примере 5, получая целевое соединение, имеющее описанные ниже физические свойства.
ТСХ: Rf 0.25 (гексан:этилацетат = 1:1);
1H-ЯМР (ДМСО-d6): δ 1.63, 4.49, 6.42, 6.86, 7.41, 7.57, 8.18, 8.90.
Сравнительный Пример 2
N-(2-бром-4,6-дихлорфенил)-2-(4-фторфенил)ацетамид (Пример 1g из Патентного документа 1)

В толуольный раствор (8 мл) 2-бром-4,6-дихлоранилина (1 г) (Регистрационный номер CAS: 697-86-9) добавляли 4-фторфенилацетилхлорид (788 мг), перемешивали при 90°C в течение ночи Затем реакционную смесь охлаждали до комнатной температуры, и осадок фильтровали. Осадок промывали толуолом и сушили при пониженном давлении при 50°C, получая целевое соединение (1.28 г), имеющее описанные ниже физические свойства.
ТСХ: Rf 0.43 (гексан:этилацетат = 1:1);
1H-ЯМР (CD3OD): δ 3.72, 7.02-7.08, 7.38-7.43, 7.58, 7.69.
Преимущества действия соединений по настоящему изобретению можно продемонстрировать с помощью описанных ниже экспериментов, но они не ограничиваются только ими.
(1) Биологический Пример 1: Открывающее действие на KCNQ2/3 канал при деполяризующем стимулировании
Человеческие клетки, экспрессирующие KCNQ2/3 (CHO-DHFR-клетки) помещали в каждую лунку 384-луночного планшета (покрыт коллагеном, черный, прозрачное дно) в концентрации 0.5х104 клеток/50 мкл на лунку, и выращивали в среде MEM ALPHA (содержит 10 об.% инактивированной (56ºC, 30 мин) фетальной бычьей сыворотки и 100 МЕ/мл пенициллин - 100 мкг/мл стрептомицин - 2 мМ L-глутамин) при 37ºC при 5% CO2 в течение 18 - 24 часов. Удаляли из планшета среду. Затем проводили инкубирование (комнатная температура, 60 мин, защита от света) в загрузочном буфере (приготовлен способом, описанным в руководстве для FluxOR Thallium Detection Kit (Invitrogen, F10016, F10017)). Открывающее действие на KCNQ2/3 канал (поток таллия в клетки) при деполяризующем стимулировании (5 мМ калия и 0.5 мМ таллия) замеряли с помощью FLIPR TETRA (Molecular Devices). Соединение по настоящему изобретению добавляли за 5 минут до деполяризующего стимулирования, и замеряли реакцию, вызываемую деполяризующим стимулированием, в течение 180 секунд. Открывающее действие на каналы для соединения по настоящему изобретению оценивали по изменению интенсивности флуоресценции между временем до деполяризующего стимулирования и временем после прохождения 180 секунд. Таким образом вычисляли концентрацию (ECrtg50), соответствующую 50% изменения интенсивности флуоресценции для максимальной реакции (во время 10 мкМ обработки) ретигабина в данных условиях эксперимента.
Значение ECrtg50 для открывающего действия соединения по настоящему изобретению на KCNQ2/3 каналы составляло 100 мкМ или ниже. В Таблице 1 показано открывающее действие (значения ECrtg50) на KCNQ2/3 каналы для соединений в качестве репрезентативных Примеров соединений по настоящему изобретению. Как понятно из Таблицы 1, соединение по настоящему изобретению оказало сильное открывающее действие на KCNQ2/3 каналы. С другой стороны, значение ECrtg50 для Сравнительного соединения 1 составило >10 мкМ. Это говорит о том, что для улучшения KCNQ открывающего действия соединения по настоящему изобретению важно, чтобы по меньшей мере один из R4 и R5 в общей формуле (I) представлял собой такой заместитель, как атом галогена.
Кроме того, в вышеописанном способе, при использовании клеток, экспрессирующих человеческие KCNQ4 или KCNQ5, вместо клеток, экспрессирующих человеческие KCNQ2/3, и должном изменении описанных выше условий согласно стандартным навыкам квалифицированного специалиста в данной области техники, может быть измерено открывающее действие на человеческий KCNQ4 канал или на человеческий KCNQ5 канал.
Таблица 1
(2) Биологический Пример 2: Расслабляющее действие на мочевой пузырь, извлеченный из крысы
Самок Jcl Wistar крыс (CLEA Japan, Inc., масса тела: 170 - 200 г) анестезировали интраперитонеальным введением около 40 мг/кг пентобарбитала (Somnopentyl, Schering Plough Animal Health Corporation), и умерщвляли посредством кровопускания, после чего с удаляли мочевой пузырь при рассечении брюшной стенки. Удаленный мочевой пузырь незамедлительно погружали в ледяной буфер Кребса (Krebs Ringer bicarbonate buffer (Sigma-Aldlich Co.), содержащий гидрокарбонат натрия (итоговая концентрация: 15 мМ) и хлорид кальция (итоговая концентрация: 2.5 мМ)), предварительно насыщенный смесью газов (95% O2, 5% CO2).
Мочевые пузыри разрезали в продольном направлении для получения образцов в форме полосок (около 10 × 3 мм) при охлаждении на льду. Полученные образцы незамедлительно суспендировали в пробирке Магнуса при напряжении 500 мг. Пробирку заполняли буфером Кребса (37°C), насыщенным смесью газов. Следует заметить, что образцы готовили в течение 24 часов после извлечения ткани.
Изменение напряжения образцов регистрировали в системе сбора данных (NR-1000, KEYENCE CORPORATION) с помощью системы Magnus, оснащенной изометрическим преобразователем (UFER UM-203, Iwashiya Kishimoto Medical Instruments) и усилителем (UFER AP-5, Iwashiya Kishimoto Medical Instruments), и выводили данные на компьютер через программу анализа данных WAVE THERMO 1000 (KEYENCE CORPORATION). По истечении одного часа или более после суспендирования образцов, добавляли 2.5M раствор KCl таким образом, чтобы итоговая концентрация составила 100 мМ, и использовали образцы, у которых наблюдалась реакция сокращения.
Карбахол (вещество, вызывающее сокращение) в концентрации 1 мкМ использовали для стимуляции сокращения. Вещества распределяли по группам произвольным образом, чтобы степень сокращения не различалась от группы к группе, и образцы, взятые у одного и того же носителя, не попали в одну группу. После стабилизации реакции сокращения, кумулятивно добавляли физиологический раствор или соединение по настоящему изобретению, начиная с низкой концентрации, так, чтобы финальная концентрация составила 1, 10, 100 нМ, 1 и 10 мкМ.
Напряжение (мг) извлеченного мочевого пузыря использовали в качестве параметра оценки. Напряжение определяли с помощью программы анализа WAVE THERMO 1000. Напряжение после добавления вещества, стимулирующего сокращение, принимали за 0%. Коэффициент изменения напряжения после добавления соединения по настоящему изобретению относительно напряжения после добавления вещества, стимулирующего сокращение, принимали за коэффициент изменения напряжения (%). Коэффициент изменения напряжения (%) принимали за индикатор оценки. Коэффициент изменения напряжения (%) вычисляли согласно приведенной ниже формуле.
Коэффициент изменения напряжения (%) = {Напряжение после добавления соединения по настоящему изобретению и т.д. (мг) - Напряжение до добавления стимулирующего сокращение вещества (мг)} / {Напряжение после добавления стимулирующего сокращение вещества (мг) - Напряжение до добавления стимулирующего сокращение вещества (мг)} × 100 - 100.
Значение, при котором коэффициент изменения напряжения (%) составил -20%, это IC20, и данное значение приняли за индикатор расслабляющего действия на извлеченный мочевой пузырь.
В Таблице 2 приведены значения IC20 при проведении теста Магнуса на крысах для указанных ниже соединений в качестве репрезентативных Примеров соединения по настоящему изобретению. Как понятно из Таблицы 2, соединение по настоящему изобретению оказывало расслабляющее действие на извлеченный из крысы мочевой пузырь. Следовательно, соединение по настоящему изобретению может применяться в качестве терапевтического средства при гиперактивности мочевого пузыря.
Таблица 2
(3) Тест на растворимость
Калибровочный раствор получали при разведении тестового вещества (10 мМ раствор в ДМСО) ацетонитрилом и добавлении ацетонитрила, содержащего внутренний стандарт (кандесартан) до 0.1, 0.4 и 2 мкМ.
Испытуемый раствор готовили как описано ниже: 5 мкл соединения по настоящему изобретению (10 мМ раствор в ДМСО) добавляли в 495 мкл второго тестового раствора по Фармакопее Японии (pH = 6.8) и перемешивали при комнатной температуре в течение пяти часов. Затем полученный раствор помещали на фильтровальную пластину для определения растворимости и фильтровали с отсасыванием. Фильтрат (20 мкл) разбавляли ацетонитрилом, затем добавляли ацетонитрил, содержащий внутренний стандарт (кандесартан).
Калибровочный и испытуемый растворы в количестве 5 мкл вводили в LC-MS/MS прибор (Discovery Max, производства Thermo Scientific) и проводили количественный анализ (диапазон количественного определения: 5 - 100 мкМ). Растворимость считали равной < 5 мкМ, когда полученное значение было ниже диапазона количественного определения, и растворимость принимали за 100 мкМ, когда значение было выше диапазона количественного определения.
Результаты приведены в Таблице 3. Как понятно из Таблицы 3, соединения, указанные в Таблице 3 в качестве репрезентативных Примеров соединения по настоящему изобретению, продемонстрировали отличную растворимость. Напротив, значение растворимости Сравнительного Примера 2 (Пример 1g из Патентного документа 1) не превышало предел определения (< 5 мкМ), показывая тем самым, что растворимость Сравнительного Примера 2 была низкой.
Таблица 3
(4) Определение устойчивости в микросоме печени человека
Тестовое соединение (10 ммоль/л раствор в ДМСО, 5 мкл) разбавляли 50%-ным водным раствором ацетонитрила (195 мкл), получая 0.25 ммоль/л раствор.
В реактор, предварительно нагретый до 37°C, добавляли 0.5 мг/мл микросом печени человека (Xenotech) и 245 мкл 0.1M фосфатного буферного раствора (pH 7.4), содержащего НАДФН-кофактор (BD Biosciences), после чего преинкубировали в течение пяти минут. Затем добавляли описанный выше раствор тестового соединения (5 мкл) для запуска реакции (иготовая концентрация: 5 мкмоль/л). Сразу после начала реакции отбирали 20 мкл и добавляли в 180 мкл ацетонитрила, содержащего внутренний стандарт (варфарин), для прекращения реакции. Этот раствор (20 мкл) перемешивали с 180 мкл 50%-ного водного раствора ацетонитрила на планшете, оснащенном депротеинизирующим фильтром. Затем полученный раствор фильтровали с отсасыванием. Фильтрат принимали за стандартный образец.
Вышеописанный раствор инкубировали при 37°C в течение 15 минут, и 20 мкл раствора добавляли в 180 мкл охлажденного ацетонитрила (содержащего варфарин, служащий внутренним стандартом) для прекращения реакции. Данный раствор (20 мкл) перемешивали с 180 мкл 50%-ного водного раствора ацетонитрила на планшете, оснащенном депротеинизирующим фильтром, и затем полученный раствор фильтровали с отсасыванием. Фильтрат принимали за реакционный образец.
Остаточное содержание (%) определяли следующим образом: 1 мкл тестового раствора вводили в LC-MS/MS прибор (Discovery Max, производство Thermo Scientific), и коэффициент, полученный при делении доли площади пика реакционного образца (площадь пика тестового соединения/площадь пика внутреннего стандарта) на долю площади пика стандартного образца, умножали на 100.
Результаты приведены в Таблице 4. Как понятно из Таблицы 4, соединения из Таблицы 4, представленные в качестве репрезентативных Примеров соединения по настоящему изобретению, продемонстрировали высокую устойчивость относительно микросомы печени человека, тем самым показывая, что соединение обладает отличной метаболической устойчивостью.
Таблица 4
(5) Оценка действия на hERG IKr поток
Используя HEK293 клетки, сверхэкспрессирующие ген специфических калиевых каналов сердца человека (hERG), замеряли методом пэтч-кламп максимальный поток hERG IKr, индуцируемый редеполяризующим импульсом после деполяризующего импульса. Вычисляли коэффициент изменения (коэффициент ингибирования) через 10 минут после введения тестируемого соединения, относительно максимального потока до введения тестируемого соединения (см. Biophysical Journal, Vol. 74, 230-241 (1998)). Результаты приведены в Таблице 5. Как понятно из Таблицы 5, соединения из Таблицы 5, представленные в качестве репрезентативных Примеров соединения по настоящему изобретению, продемонстрировали, что их 50%-ная ингибирующая активность в отношении hERG канала составляет >10 мкМ, и риск удлинения интервала Q-T из-за воздействия данных лекарственных средств меньше, тем самым показывая, что соединения по настоящему изобретению обладают высоким уровнем безопасности.
Таблица 5
Примеры составов
Репрезентативные примеры составов для использования по настоящему изобретению описаны ниже.
Пример состава 1
Перечисленные ниже ингредиенты смешивали обычным способом и формовали, получая 10000 таблеток по 10 мг действующего вещества в каждой.
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина (100 г);
кальция карбоксиметилцеллюлоза (разрыхлитель) (20 г);
стеарат магния (смазывающее средство) (10 г);
микрокристаллическая целлюлоза (870 г).
Пример состава 2
Перечисленные ниже ингредиенты смешивали обычным способом, фильтровали через пылеудаляющий фильтр, и помещали по 5 мл фильтрата в ампулы. Ампулы нагревали и стерилизовали в автоклаве, таким образом получая 10000 ампул по 20 мг действующего вещества в каждой.
1-{2,6-дихлор-4-[(2R)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}-3-{[5-(трифторметил)-2-пиридинил]метил}мочевина (200 г);
маннит (2 кг);
дистилированная вода (50 л).
Промышленная применимость
Соединение по настоящему изобретению имеет достаточно низкую токсичность и может безопасно применяться в качестве фармацевтического средства, а также может применяться в качестве терапевтического средства для лечения заболеваний, связанных с KCNQ2-5 каналом.
Реферат
Изобретение относится к соединению, представленному общей формулой (I), или его фармацевтически приемлемой соли, которые могут найти применение для профилактики и/или лечения заболевания, связанного с KCNQ2-3 каналом. В формуле (I) Xпредставляет собой C-R; Xпредставляет собой C-R; Rпредставляет собой (1) ORили (2) NH; Rпредставляет собой (1) атом водорода или (2) C1-4 алкильную группу; каждый Rи Rнезависимо представляет собой (1) атом водорода или (2) C1-4 алкильную группу, которая может быть замещена атомом галогена, где Rи Rне могут оба одновременно представлять собой атом водорода; каждый R, R, Rи Rнезависимо представляет собой (1) атом водорода, (2) атом галогена или (3) C1-4 алкильную группу, где Rи Rне могут оба одновременно представлять собой атом водорода; Y представляет собой (1) -NH- или (2) связь; Rпредставляет собой (1) атом водорода или (2) C1-4 алкильную группу; Rпредставляет собой (1) цикл A, (2) C1-6 алкильную группу, (3) -C1-4 алкилен-цикл A, (4) -цикл B-цикл C, (5) -цикл B-C1-4 алкилен-цикл C или (6) -цикл B-O-цикл C, где алкильная группа может быть замещена атомом галогена. Цикл A представляет собой (1) C3-8 циклоалкан, (2) 3-8-членный гетероциклоалкан, содержащий от одного до трех гетероатомов, выбранных из атомов кислорода и азота, (3) C3-12 моноциклическое или бициклическое ненасыщенное карбоциклическое кольцо или (4) 3-12-членный моноциклический или бициклический ненасыщенный гетероцикл, содержащий от одного до четырех гетероатомов, выбранных из атомов кислорода, азота и серы. Каждый цикл B и C независимо представляет собой (1) C3-8 циклоалкан, (2) 3-8-членный гетероциклоалкан, содержащий от одного до трех гетероатомов, выбранных из атомов кислорода и азота, (3) C3-7 моноциклическое ненасыщенное карбоциклическое кольцо или (4) 3-7-членный моноциклический ненасыщенный гетероцикл, содержащий от одного до трех гетероатомов, выбранных из атомов кислорода, азота и серы. Каждый из циклов A, B и C может быть независимо замещен одним-пятью R. Изобретение относится также к способу профилактики и/или лечения заболевания, связанного с KCNQ2-3 каналом, применению соединения формулы (I) для изготовления средства профилактики и/или лечения указанного заболевания и к конкретному соединению - 1-[(5-хлор-2-пиридинил)метил]-3-{2,6-дихлор-4-[(2S)-1,1,1-трифтор-2-гидрокси-2-пропанил]фенил}мочевине. 5 н. и 9 з.п. ф-лы, 5 табл., 79 пр.
Формула
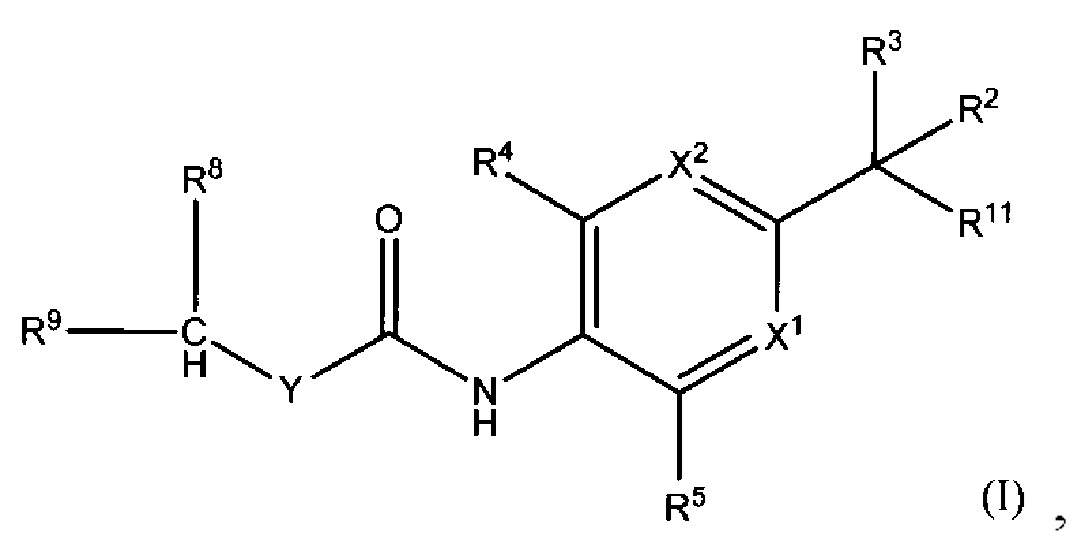



Документы, цитированные в отчёте о поиске
Замещенные никотинамиды в качестве ксnq2-3 модуляторов

Комментарии