Комбинированная терапия тетрациклическими аналогами хинолона для лечения рака - RU2752506C2
Код документа: RU2752506C2
Чертежи




















Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННЫЕ ПАТЕНТНЫЕ ЗАЯВКИ
[001] Данная заявка испрашивает приоритет и преимущество предварительной патентной заявки США, серийный № 62/258211, поданной 20 ноября 2015 года, которая включена в данный документ посредством ссылки в полном объеме и для всех целей.
ОБЛАСТЬ ТЕХНИКИ
[002] Данное изобретение в целом относится к комбинированной терапии для лечения рака и опухолей.
УРОВЕНЬ ТЕХНИКИ
[003] Было высказано предположение о том, что различные тетрациклические хинолоновые соединения функционируют путем взаимодействия с квадруплекс-образующими участками нуклеиновых кислот и модулируя транскрипцию рибосомной РНК. См., например, патенты США №№ 7928100 и 8853234. Конкретно, тетрациклические хинолоновые соединения могут стабилизировать G-квадруплексы ДНК (G4s) в раковых клетках и тем самым индуцировать синтетическую летальность в раковых клетках. Поскольку обработка клеток стабилизирующими G4 агентами может привести к образованию разрывов двойной цепи ДНК, РДЦ (DSB), то образование РДЦ, индуцированное обработкой G4-стабилизирующим лигандом/агентом (таким как тетрациклические хинолоны), было бы более выраженным в генетически несовершенных клетках или при химическом ингибировании путей восстановления, включающих в себя как негомологичное соединение концов, НГСК (NHEJ), так и репарацию путем гомологичной рекомбинации, РГР (HRR). Кроме того, тетрациклические хинолоновые соединения селективно ингибируют синтез рРНК Pol I в ядрышке, но не ингибируют синтез мРНК с помощью РНК-полимеразы II (Pol II) и не ингибируют репликацию ДНК или синтез белка. Например, было высказано предположение о том, что нацеливание на РНК-полимеразу I (Pol I) для активации р53 через путь ядрышкового стресса может приводить к избирательной активации р53 в опухолевых клетках. Белок р53 обычно функционирует как супрессор опухоли, вызывая саморазрушение раковых клеток. Активация р53 для уничтожения раковых клеток является хорошо подтвержденной противоопухолевой стратегией, и применяются многие подходы для использования этого пути. Селективная активация р53 в опухолевых клетках была бы привлекательным способом лечения, контроля, нейтрализации опухолевых клеток, не затрагивающим нормальные здоровые клетки. Вышеупомянутые тетрациклические хинолоны раскрыты в патентах США №№ 7928100 и 8853234, содержимое которых включено в данный документ посредством ссылки в полном объеме для всех намеченных целей.
[004] Несмотря на недавнюю разработку противораковых агентов, по-прежнему существует настоятельная потребность в создании эффективной новой терапии рака.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[005] В одном варианте реализации данное изобретение относится к фармацевтической комбинации, содержащей тетрациклическое хинолоновое соединение, имеющее структуру формулы (I);

(I)
или его фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство;
где:
X1 представляет собой CH или N;
X2, X3, X4, X5, X6 и X7 независимо представляют собой NR4, CH2, CHQ или C(Q)2, при условии, что нуль, один или два из X2, X3, X4, X5, X6 и X7 представляют собой NR4;
A и V независимо представляют собой H, галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2 или -R3;
каждый Q независимо представляет собой галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2 или -R3;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца;
R1 представляет собой H или C1-C6 алкил, необязательно замещенный одним или большим количеством атомов галогена или =O;
R2 представляет собой H или C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо;
R3 представляет собой необязательно замещенный C1-C10 алкил, C2-C10 алкенил, C5-C10 арил или C6-C12 арилалкил или гетероформу одного из них, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-6-членное карбоциклическое или гетероциклическое кольцо;
каждый R4 независимо представляет собой H или C1-C6 алкил;
R7 представляет собой H, и R8 представляет собой C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо; или в -NR7R8, R7 и R8 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца;
m равно 0, 1, 2, 3 или 4; и
n равно 0, 1, 2, 3, 4 или 5;
и по меньшей мере один дополнительный терапевтически активный агент, выбранный из группы, состоящей из иммунотерапевтических агентов, противораковых агентов и ангиогенных агентов.
[006] В другом варианте реализации изобретения предлагается фармацевтическая комбинация, содержащая терапевтически эффективное количество соединения формулы (II);
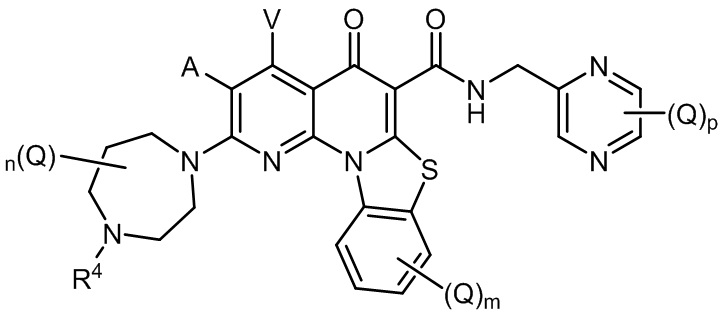
(II)
или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства;
где:
A и V независимо представляют собой H, галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2 или -R3;
каждый Q независимо представляет собой галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2 или -R3;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца;
R1 представляет собой H или C1-C6 алкил, необязательно замещенный одним или большим количеством атомов галогена или =O;
R2 представляет собой H или C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо;
R3 представляет собой необязательно замещенный C1-C10 алкил, C2-C10 алкенил, C5-C10 арил или C6-C12 арилалкил или гетероформу одного из них, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-6-членное карбоциклическое или гетероциклическое кольцо;
каждый R4 независимо представляет собой H или C1-C6 алкил;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3, 4 или 5; и
p равно 0, 1, 2 или 3;
и по меньшей мере один дополнительный терапевтически активный агент, выбранный из группы, состоящей из иммунотерапевтических агентов, противораковых агентов и ангиогенных агентов.
[007] В одном варианте реализации изобретения предлагается фармацевтическая комбинация, содержащая терапевтически эффективное количество соединения формулы (III);

(III)
или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства;
где:
A и V независимо представляют собой H, галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2 или -R3;
каждый Q независимо представляет собой галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2 или -R3;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца;
R1 представляет собой H или C1-C6 алкил, необязательно замещенный одним или большим количеством атомов галогена или =O;
R2 представляет собой H или C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо;
R3 представляет собой необязательно замещенный C1-C10 алкил, C2-C10 алкенил, C5-C10 арил или C6-C12 арилалкил или гетероформу одного из них, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена =O, или необязательно замещенное 3-6-членное карбоциклическое или гетероциклическое кольцо;
каждый R4 независимо представляет собой H или C1-C6 алкил;
R7 представляет собой H, и R8 представляет собой C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо;
m равно 0, 1, 2, 3 или 4; и
n равно 0, 1, 2, 3, 4 или 5;
и по меньшей мере один дополнительный терапевтически активный агент, выбранный из группы, состоящей из иммунотерапевтических агентов, противораковых агентов и ангиогенных агентов.
[008] В одном варианте реализации изобретения предлагается фармацевтическая комбинация, содержащая Соединение А и по меньшей мере один дополнительный терапевтически активный агент.

Соединение А
[009] В одном варианте реализации изобретения предлагается фармацевтическая комбинация, содержащая соединение формулы (I) и по меньшей мере один дополнительный терапевтически активный агент в одной и той же лекарственной форме или в отдельных лекарственных формах. В другом варианте реализации изобретения фармацевтическую комбинацию, в которой соединение формулы (I) и по меньшей мере один дополнительный терапевтически активный агент находятся в отдельных лекарственных формах, вводят одним и тем же способом введения или разными способами введения. В одном варианте реализации изобретения отдельные лекарственные формы фармацевтической комбинации, предложенной в данном изобретении, вводят путем одновременного введения, последовательного введения, перекрывающегося введения, интервального введения, непрерывного введения или их комбинации.
[010] В одном варианте реализации данного изобретения предлагается фармацевтическая комбинация, содержащая соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их соли, сольваты, сложные эфиры и/или пролекарства и по меньшей мере один дополнительный терапевтически активный агент. В некоторых вариантах реализации изобретения дополнительный терапевтически активный агент представляет собой иммунотерапевтический агент, противораковый агент и/или антиангиогенный агент.
[011] В одном варианте реализации изобретения по меньшей мере один дополнительный терапевтически активный агент является иммунотерапевтическим агентом. В некоторых вариантах реализации изобретения иммунотерапевтический агент выбирают из группы, состоящей из: моноклонального антитела, иммунной эффекторной клетки, адоптивного переноса клетки, иммунотоксина, вакцины или цитокина.
[012] В других вариантах реализации изобретения иммунотерапевтический агент представляет собой агент, который может модулировать физиологические уровни одного или большего количества цитокинов в микроокружении раковых опухолей. В некоторых вариантах реализации изобретения иммунотерапевтический агент индуцирует локальную выработку по меньшей мере одного эндогенного цитокина, который оказывает цитотоксическое действие на опухолевые клетки, такого как TNF-α или IFN-γ. В некоторых вариантах реализации изобретения иммунотерапевтический агент ингибирует образование эндогенного цитокина, который препятствует распознаванию Т-клетками и разрушению раковых клеток, такого как IL-10, TGFβ или VEGF.
[013] В других вариантах реализации изобретения иммунотерапевтический агент представляет собой агент, который может индуцировать выработку опухолевой клеткой одного или большего количества хемокинов, привлекающих иммунные клетки, такие как дендритные клетки, эффекторная Т-клетка (например, CD8+ лимфоциты) и природные клетки-киллеры, ПК (NK) к опухолевым клеткам. В некоторых вариантах реализации изобретения хемокины включают в себя, но не ограничиваясь этим, CCL19, CCL20, CCL21, CX3CL1, CXCL9 и CXCL10.
[014] В других вариантах реализации изобретения иммунотерапевтический агент представляет собой агент, который индуцирует блокаду иммунной контрольной точки, такую как блокада PD-1 и блокада CTLA-4.
[015] В некоторых вариантах реализации изобретения иммунотерапевтический агент представляет собой антитело или его антигенсвязывающую часть, которая нарушает взаимодействие между Programmed Death-1 (PD-1) и лигандом Programmed Death-1 (PD-L1). В одном варианте реализации изобретения иммунотерапевтический агент выбран из группы, состоящей из антитела против PD-1, антагониста PD-1, антитела против PD-L1, миРНК, направленно действующей на экспрессию PD-1, миРНК, направленно действующей на экспрессию PD-L1, и пептида, фрагмента, доминантной отрицательной формы или растворимой формы PD-1 или PD-L1.
[016] В одном варианте реализации изобретения иммунотерапевтический агент представляет собой моноклональное антитело. В одном варианте реализации изобретения моноклональное антитело выбрано из группы, состоящей из антитела против PD-1, ниволумаба, пембролизумаба, алемтузумаба, бевацизумаба, брентуксимаба ведотина, цетуксимаба, гемтузумаба озогамицина, ибритумомаба тиуксетана, ипилимумаба, офатумумаба, панитумумаба, ритуксимаба, тозитумомаба, трастузумаба, анти-B7-H4, анти-B7-H1, анти-LAG3, BTLA, анти-Tim3, анти-B7-DC, анти-CD160, антагонистических антител против MR, анти-4-1BB, анти-OX40, анти-CD27 и/или агонистических антител к CD40. В некоторых вариантах реализации изобретения иммунотерапевтический агент представляет собой антитело против PD-1. В других вариантах реализации изобретения антитело против PD-1 представляет собой гуманизированное антитело. В одном варианте реализации изобретения моноклональное антитело выбрано из группы, состоящей из ниволумаба и пембролизумаба. В конкретном варианте реализации изобретения моноклональное антитело является ниволумабом.
[017] В одном варианте реализации изобретения иммунотерапевтический агент выбран из группы, состоящей из антагониста CTLA-4, антитела против CTLA-4, миРНК, направленно действующей на экспрессию CTLA-4, и/или пептида, фрагмента, доминантной отрицательной или растворимой формы CTLA-4. В одном варианте реализации изобретения антитело против CTLA-4 является ипилимумабом.
[018] В некоторых вариантах реализации изобретения предлагается фармацевтическая комбинация, содержащая соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их соли, сольваты, сложные эфиры и/или пролекарства и по меньшей мере один противораковый агент. В одном варианте реализации изобретения указанный противораковый агент выбирают из группы, состоящей из алкилирующего агента, антиметаболита, алкалоида барвинка, таксана, ингибитора топоизомеразы, противоопухолевого антибиотика, ингибитора тирозинкиназы, иммуносупрессивного макролида, ингибитора Akt, ингибитора HDAC, ингибитора Hsp90, ингибитора mTOR, ингибитора PI3K/mTOR, ингибитора PI3K, ингибитора CDK (циклинзависимая киназа), ингибитора CHK (киназа контрольной точки), ингибиторов PARP (поли(DP-рибоза)полимераза) и их комбинаций.
[019] В одном варианте реализации изобретения по меньшей мере один противораковый агент представляет собой ингибитор PI3K. В другом варианте реализации изобретения ингибитор PI3K является иделализибом.
[020] В одном варианте реализации изобретения по меньшей мере один противораковый агент представляет собой ингибитор PARP. В другом варианте реализации изобретения ингибитор PARP является олапарибом.
[021] В других вариантах реализации изобретения предлагается фармацевтическая комбинация, содержащая соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их соли, сольваты, сложные эфиры и/или пролекарства и по меньшей мере один антиангиогенный агент. В одном варианте реализации изобретения указанный антиангиогенный агент выбран из группы, состоящей из 2-метоксиэстрадиола, AG3340, приномастата, батимастата, BAY 12-9566, карбоксиамидотриазола, CC-1088, декстрометорфан-уксусной кислоты, диметилксантенон-уксусной кислоты, EMD 121974, эндостатина, IM-862, маримастата, матриксной металлопротеиназы, пеницилламина, PTK787/ZK 222584, RPI.4610, скваламина, скваламина лактата, 3-[2,4-диметилпиррол-5-ил-метил-иденил]-2-индолинона (SU5416), (±)-талидомида, S-талидомида, R-талидомида, O-(хлорацетилкарбамоил)фумагиллола (TNP-470), комбретастатина, паклитаксела, тамоксифена, COL-3, неовастата, BMS-275291, SU6668, 2-ME, интерферона-альфа, антитела против VEGF, Medi-522 (Vitaxin II), CAI (ингибитор притока кальция), целекоксиба, интерлейкина-12, IM862, амиллорида, белка Angiostatin®, ангиостатина K1-3, ангиостатина K1-5, каптоприла, DL-альфа-дифторметилорнитина, DL-альфа-дифторметилорнитина HCl, белка His-Tag® Endostatin™, фумагиллина, гербимицина A, 4-гидроксифенилретинамида, гамма-интерферона, юглона, ламинина, ламинина гексапептида, ламинина пентапептида, лавендустина А, медроксипрогестерона, медроксипрогестерона ацетата, миноциклина, миноциклина HCl, ингибитора плацентарной рибонуклеазы, сурамина, натриевой соли сурамина, тромбоспондина тромбоцитов человека, тканевого ингибитора металлопротеиназы 1, тканевого ингибитора металлопротеиназы 1 нейтрофильных гранулоцитов, тканевого ингибитора металлопротеиназы 2 ревматоидных синовиальных фибробластов и их комбинаций.
[022] В некоторых вариантах реализации изобретения предлагается фармацевтическая комбинация, содержащая соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их соли, сольваты, сложные эфиры и/или пролекарства, по меньшей мере один дополнительный терапевтически активный агент и фармацевтически приемлемое вспомогательное вещество или фармацевтически приемлемый носитель.
[023] В одном варианте реализации изобретения предлагается фармацевтическая комбинация, содержащая соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их соли, сольваты, сложные эфиры и/или пролекарства, которое присутствует в количестве от около 1 до около 500 мг.
[024] В другом варианте реализации изобретения предлагается фармацевтическая комбинация, в которой соединение представляет собой Соединение А, и, при этом, по меньшей мере один дополнительный терапевтически активный агент выбран как один или большее количество из группы, состоящей из ингибитора PARP и антитела против PD-1. В конкретном варианте реализации изобретения ингибитор PARP является олапарибом. В другом конкретном варианте реализации изобретения антитело против PD-1 является ниволумабом.
[025] В одном варианте реализации изобретения предлагается способ стабилизации G-квадруплексов (G4s) у субъекта, причем способ включает в себя введение субъекту терапевтически эффективного количества фармацевтической комбинации, содержащей соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их соли, сольваты, сложные эфиры и/или их пролекарства и по меньшей мере один дополнительный терапевтически активный агент, как описано в данном документе. В некоторых вариантах реализации изобретения предлагается способ стабилизации G-квадруплексов (G4s) у субъекта, причем способ включает в себя введение субъекту терапевтически эффективного количества фармацевтической комбинации, содержащей соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их соли, сольваты, сложные эфиры и/или пролекарства, и проведение радиотерапии или введение по меньшей мере одного дополнительного терапевтически активного агента до, во время или после введения субъекту вышеупомянутого соединения.
[026] В одном варианте реализации изобретения предлагается способ модуляции активности р53 у субъекта, причем способ включает в себя введение субъекту терапевтически эффективного количества фармацевтической комбинации, содержащей соединение формулы (I), (IA), (IB), (II)), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их соли, сольваты, сложные эфиры и/или пролекарства и по меньшей мере один дополнительный терапевтически активный агент, как описано в данном документе. В некоторых вариантах реализации изобретения предлагается способ модуляции активности р53 у субъекта, причем способ включает в себя введение субъекту терапевтически эффективного количества фармацевтической комбинации, содержащей соединение формулы (I), (IA), (IB), (II)), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их соли, сольваты, сложные эфиры и/или пролекарства, и проведение лучевой терапии или введение по меньшей мере одного дополнительного терапевтически активного агента до, во время или после введения субъекту вышеупомянутого соединения.
[027] В одном варианте реализации изобретения предлагается способ лечения или облегчения расстройства клеточной пролиферации у субъекта, причем указанный способ включает в себя введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической комбинации, содержащей соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их соли, сольваты, сложные эфиры и/или пролекарства и по меньшей мере один дополнительный терапевтически активный агент, как описано в данном документе. В некоторых вариантах реализации изобретения предлагается способ лечения или облегчения расстройства клеточной пролиферации у субъекта, причем указанный способ включает в себя введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их солей, сольватов, сложных эфиров и/или пролекарств и проведение радиотерапии или введение по меньшей мере одного дополнительного терапевтически активного агента до, во время или после введения субъекту вышеупомянутого соединения.
[028] В одном варианте реализации изобретения описанные в данном документе способы обеспечивают введение терапевтически эффективного количества фармацевтической комбинации, содержащей соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их соли, сольваты, сложные эфиры и/или пролекарства и по меньшей мере один дополнительный терапевтически активный агент, причем указанный по меньшей мере один дополнительный терапевтически активный агент выбран из группы, состоящей из иммунотерапевтических агентов, противораковых агентов и ангиогенных агентов.
[029] В одном варианте реализации изобретения способы, описанные в данном документе, пригодны для лечения рака. В одном варианте реализации изобретения указанный рак выбран из группы, состоящей из: рака гема, рака ободочной и прямой кишки, рака яичника, рака молочной железы, рака шейки матки, рака легкого, рака печени, рака поджелудочной железы, рака лимфатических узлов, рака толстой кишки, рака предстательной железы, рака головного мозга, рака головы и шеи, рака кости, саркомы Юинга, рака кожи, рака почки и рака сердца. В другом варианте реализации изобретения указанный рак выбран из группы, состоящей из, причем рак выбран из группы, состоящей из рака молочной железы, рака яичника, рака поджелудочной железы, рака предстательной железы, рака легкого, саркомы Юинга, рака головы и шеи и рака шейки матки.
[030] В одном варианте реализации изобретения способы, описанные в данном документе, пригодны для лечения рака гема. В некоторых вариантах реализации изобретения указанный рак гема выбран из группы, состоящей из лейкоза, лимфомы, миеломы и множественной миеломы.
[031] В некоторых вариантах реализации изобретения способы, описанные в данном документе, пригодны для лечения рака, который представляет собой рак с дефицитом зависимой от гомологичной рекомбинации репарации разрывов двойной цепи. В другом варианте реализации изобретения способы, описанные в данном документе, пригодны для лечения раковых клеток, несущих дефекты breast cancer 1 (BRCA1), breast cancer 2 (BRCA2) и/или других компонентов пути гомологичной рекомбинации. В одном варианте реализации изобретения раковые клетки имеют фенотип, выбранный из группы, состоящей из: неполноценного фенотипа с мутацией атаксии-телеангиэктазии (АТМ), неполноценного фенотипа, связанного с атаксией-телеангиэктазией и Rad3 (ATR), неполноценного фенотипа гомолога контрольной точки CHK1 (S. pombe) (CHK1), неполноценного фенотипа гомолога контрольной точки CHK2 (S. pombe) (CHK2), неполноценного фенотипа гомолога RAD51 (гомолог RecA, E. coli) (S. cerevisiae) (Rad51), неполноценного фенотипа репликации белка A (RPA) и неполноценного фенотипа дополняемого репарацией рентгеновскими лучами дефектной репарации в клетках китайского хомяка 3 (XRCC3). В одном варианте реализации изобретения в раковых клетках присутствует дефицит гена, выбранного из группы, состоящей из: ATM, ATR, CHK1, CHK2, Rad51, RPA и XRCC3. В другом варианте реализации изобретения в раковых клетках присутствует дефицит гена, выбранного из группы, состоящей из: анемии Фанкони, комплементирующей группы A (FANCA), анемии Фанкони, комплементирующей группы (FANCC), анемии Фанкони, комплементирующей группы D2 (FANCD2), анемии Фанкони, комплементирующей группы F (FANCF), анемии Фанкони, комплементирующей группы G (FANCG) и анемии Фанкони, комплементирующей группы M (FANCM). В другом варианте реализации изобретения раковые клетки являются гомозиготными по мутации в гене, выбранном из группы, состоящей из: FANCA, FANCC, FANCD2, FANCF, FANCG и FANCM. В некоторых вариантах реализации изобретения в указанных раковых клетках присутствует дефицит BRCA1 и/или BRCA2. В одном варианте реализации изобретения раковые клетки являются гомозиготными по мутации в BRCA1 и/или BRCA2. В другом варианте реализации изобретения раковые клетки являются гетерозиготными по мутации в BRCA1 и/или BRCA2.
[032] В одном варианте реализации изобретения способы, описанные в данном документе, пригодны для лечения человека.
[033] В другом варианте реализации изобретения способы, описанные в данном документе, дополнительно включают в себя введение одного или большего количества дополнительных терапевтических агентов. В одном варианте реализации изобретения указанные один или большее количество дополнительных терапевтических агентов является противораковым агентом.
[034] В одном варианте реализации изобретения предлагается способ уменьшения или ингибирования пролиферации клеток, причем указанный способ включает в себя приведение клеток в контакт с терапевтически эффективным количеством фармацевтической комбинации, содержащей соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их соли, сольваты, сложные эфиры и/или пролекарства и по меньшей мере один дополнительный терапевтически активный агент, как описано в данном документе. В некоторых вариантах реализации изобретения предлагается способ уменьшения или ингибирования пролиферации клеток, причем указанный способ включает в себя приведение клеток в контакт с соединением формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединением А или их солями, сольватами, сложными эфирами и/или пролекарствами и проведение радиотерапии до, во время или после приведения клетки в контакт с соединением формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединением A.
[035] В одном варианте реализации изобретения способ уменьшения или ингибирования пролиферации клеток, как описано в данном документе, относится к линии раковых клеток или к опухоли у субъекта. В одном варианте реализации изобретения указанная линия раковых клеток представляет собой линию раковых клеток, выбранную из группы, состоящей из: рака гема, рака ободочной и прямой кишки, рака яичника, рака молочной железы, рака шейки матки, рака легкого, рака печени, рака поджелудочной железы, рака лимфатических узлов, рака толстой кишки, рака предстательной железы, рака головного мозга, рака головы и шеи, рака кости, саркомы Юинга, рака кожи, рака почки и рака сердца. В другом варианте реализации изобретения линия раковых клеток выбрана из группы, в которой рак выбран из группы, состоящей из рака молочной железы, рака яичника, рака поджелудочной железы, рака предстательной железы, рака легкого, саркомы Юинга, рака головы и шеи и рака шейки матки.
[036] В одном варианте реализации изобретения способ уменьшения или ингибирования пролиферации клеток, как описано в данном документе, относится к линии раковых клеток или к опухоли у субъекта, которая представляет собой клеточную линию рака гема, выбранную из группы, состоящей из: лейкоза, лимфомы, миеломы и множественной миеломы.
[037] В одном варианте реализации изобретения способ уменьшения или ингибирования клеточной пролиферации, как описано в данном документе, относится к раковым клеткам, несущим дефект breast cancer 1 (BRCA1), breast cancer 2 (BRCA2) и/или других компонентов пути гомологичной рекомбинации. В одном варианте реализации изобретения раковые клетки имеют фенотип, выбранный из группы, состоящей из: неполноценного фенотипа с мутацией атаксии-телеангиэктазии (АТМ), неполноценного фенотипа, связанного с атаксией-телеангиэктазией и Rad3 (ATR), неполноценного фенотипа гомолога контрольной точки CHK1 (S. pombe) (CHK1), неполноценного фенотипа гомолога контрольной точки CHK2 (S. pombe) (CHK2), неполноценного фенотипа гомолога RAD51 (гомолог RecA, E. coli) (S. cerevisiae) (Rad51), неполноценного фенотипа репликации белка A (RPA) и неполноценного фенотипа дополняемого репарацией рентгеновскими лучами дефектной репарации в клетках китайского хомяка 3 (XRCC3). В одном варианте реализации изобретения в раковых клетках присутствует дефицит гена, выбранного из группы, состоящей из: ATM, ATR, CHK1, CHK2, Rad51, RPA и XRCC3. В другом варианте реализации изобретения в раковых клетках присутствует дефицит гена, выбранного из группы, состоящей из: анемии Фанкони, комплементирующей группы A (FANCA), анемии Фанкони, комплементирующей группы (FANCC), анемии Фанкони, комплементирующей группы D2 (FANCD2), анемии Фанкони, комплементирующей группы F (FANCF), анемии Фанкони, комплементирующей группы G (FANCG) и анемии Фанкони, комплементирующей группы M (FANCM). В другом варианте реализации изобретения раковые клетки являются гомозиготными по мутации в гене, выбранном из группы, состоящей из: FANCA, FANCC, FANCD2, FANCF, FANCG и FANCM. В некоторых вариантах реализации изобретения в указанных раковых клетках присутствует дефицит BRCA1 и/или BRCA2. В одном варианте реализации изобретения раковые клетки являются гомозиготными по мутации в BRCA1 и/или BRCA2. В другом варианте реализации изобретения раковые клетки являются гетерозиготными по мутации в BRCA1 и/или BRCA2.
[038] В одном варианте реализации изобретения описанные в данном документе способы пригодны для введения указанных фармацевтических комбинаций от 1 до 4 раз в сутки, от 1 до 6 раз в неделю, от 1 до 4 раз в месяц, раз в неделю, раз в две недели, раз в три недели или один раз в месяц.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[039] На Фиг. 1А-1D изображено ингибирование роста и избыток Лоу для комбинации Соединения А и олапариба в течение 48 часов. На Фиг. 1А изображена матрица доз, демонстрирующая ингибирование (%) для комбинации на родительских клеточных линиях DLD1. На Фиг. 1В изображен избыток Лоу для комбинации с Фиг. 1А. На Фиг. 1С изображена матрица доз, демонстрирующая ингибирование (%) для комбинации в изогенных DLD1-BRCA2 (-/-) клеточных линиях. На Фиг. 1D изображен избыток Лоу для комбинации на Фиг. 1C.
[040] На Фиг. 2A-2D изображено ингибирование роста и избыток Лоу в комбинации Соединения A и олапариба в течение 144 часов. На Фиг. 2А изображена матрица доз, демонстрирующая ингибирование (%) для комбинации в родительских клеточных линиях DLD1. На Фиг. 2В изображен избыток Лоу для комбинации с Фиг. 2А. На Фиг. 2С изображена матрица доз, демонстрирующая ингибирование (%) для комбинации на изогенных DLD1-BRCA2 (-/-) клеточных линиях. На Фиг. 2D изображен избыток Лоу для комбинации с Фиг. 2C.
[041] На Фиг. 3А-3С изображена комбинированная терапия Соединением А и ингибитором PARP олапарибом, демонстрирующая синергия in vivo на модели ППК BRCA2-дефицитного ТОРМЖ. На Фиг. 3А изображено лечение олапарибом (50 мг, один раз в сутки x 7) и олапарибом (50 мг, один раз в сутки x 7) в сочетании с Соединением A (50 мг раз в неделю x 2). На Фиг. 3В изображено лечение олапарибом (50 мг, один раз в сутки x 28) и олапарибом (50 мг, один раз в сутки x 28) в сочетании с Соединением A (50 мг раз в неделю x 2). На Фиг. 3C изображено лечение олапарибом (50 мг, один раз в сутки x 28) и Соединением A (50 мг раз в неделю x 2) в сочетании с олапарибом (50 мг, один раз в сутки x 7).
[042] На Фиг. 4А изображены кривые зависимости дозы-ответа для влияния TNF-α на жизнеспособность BRCA-положительных клеток (UWB1.289) после обработки различными концентрациями Соединения A. На Фиг. 4B изображены кривые зависимости дозы-ответа для влияния INF-γ на жизнеспособность BRCA-положительных клеток после обработки различными концентрациями Соединения A. Значения % ингибирования по данным люминесцентного анализа жизнеспособности клеток CellTiter-Glo®.
[043] На Фиг. 5А изображены кривые зависимости дозы-ответа для влияния TNF-α на жизнеспособность BRCA1-положительных клеток (UWB1.289-2945) после обработки различными концентрациями Соединения A. На Фиг. 5B изображены кривые зависимости дозы-ответа для влияния INF-γ на жизнеспособность BRCA1-отрицательных клеток после обработки различными концентрациями Соединения A. Значения % ингибирования по данным люминесцентного анализа жизнеспособности клеток CellTiter-Glo®. Каждая точка данных представляет среднее значение ± стандартное отклонение, СО (SD) для трех независимых экспериментов.
[044] На Фиг. 6А изображен t-критерий Стьюдента для жизнеспособности под влиянием TNF-α BRCA1-отрицательной клетки (UWB1.289-2945) после обработки различными концентрациями Соединения A. На Фиг. 6B изображен t-критерий Стьюдента для жизнеспособности под влиянием INF-γ BRCA1-отрицательной клетки после обработки различными концентрациями Соединения A. Каждая точка данных представляет среднее значение ± СО для трех независимых экспериментов. ** p < 0,01, * p < 0,05.
[045] На Фиг. 7 изображена индукция IFN-γ in vitro ниволумабом или антителом контрольного изотипа (контроль hlgG4). 105 очищенных CD4+ Т-клеток культивируют с 104 дендритных клеток, ДК (DC), полученных из аллогенных моноцитов, в присутствии разведения ниволумаба или антитела контрольного изотипа в трех параллельных экспериментах на протяжении 6 дней. Супернатанты собирают на 5 день и измеряю выработку IFN-γ с помощью иммуноферментного анализа, ИФА (ELISA). Представлены репрезентативные данные для нескольких пар донорной T-клетки/ДК. Левая панель: индуцированная концентрация IFN-γ в присутствии разведения ниволумаба или антитела контрольного изотипа. Правая панель: концентрация IFN-γ, выраженная как импульсы в минуту (CPM).
[046] На Фиг. 8А-8С изображено влияние обработки Соединением А на экспрессию хемокинов в клетках рака молочной железы BRCA2 дикого типа, ДТ (WT) и мутантных, полученных из ППК, Мут (Mut). На Фиг. 8А изображена кратность изменения CCL19 как в ДТ (левая панель), так и в Мут (правая панель) раковых клетках при обработке разведением Соединения A на 14 день и 28 день. На Фиг. 8B изображена кратность изменения CCL21 как в ДТ (левая панель), так и в Мут (правая панель) раковых клетках при обработке разведением Соединения А на 14 и 28 день. На Фиг. 8C изображена кратность изменения CXCL9 как в ДТ (левая панель), так и в Мут (правая панель) раковых клетках при обработке разведением Соединения А на 14 день и 28 день.
[047] На Фиг. 9 изображены гипотетические механизмы, посредством которых действует фармацевтическая комбинация, содержащая соединение по данному изобретению, такое как Соединение А, и иммунотерапевтический агент, такой как агент, который может индуцировать выработку эндогенных цитотоксических цитокинов (например, TNF-α и IFN-γ), такой как антитело против PD-1, при лечении рака. Комбинация может оказывать выраженное противоопухолевое действие за счет повышенной иммуногенности раковых клеток. Соединение А включает выработку хемокинов, таких как CCL19, CCL20, CCL21, CXCL9, CXCL10 и CXCL12, в опухолевых клетках. Эти хемокины, в свою очередь, привлекают активные иммунные клетки, такие как ДК, ПК и TCD8. Указанные иммунные клетки высвобождают цитотоксические соединения, такие как цитокины TNF-α и IFN-γ. Таким образом, Соединение А усиливает цитотоксичность TNF-α и IFN-γ, что приводит к гибели опухолевых клеток. ДК: дендритная клетка; ПК: природная клетка-киллер; TCD8: CD8+ Т-клетка.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[048] У пациентов с расстройствами, связанными с клеточной пролиферацией, такими как раковые опухоли, активация белка р53 может ингибировать, модифицировать или уменьшать клеточную пролиферацию и/или индуцировать апоптоз клеток. Соответственно, предоставляя пациентам, страдающим такими нарушениями, фармацевтически активный ингибитор Pol I, который избирательно активирует белок p53 раковых и/или опухолевых клеток, можно облегчить или предотвратить расстройства или прогрессирование расстройств. Данное изобретение относится к способам, комбинациям и композициям для лечения рака или опухоли, которые включают в себя применение Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства в сочетании с по меньшей мере одним дополнительным терапевтически активным агентом или терапевтическим средством. В одном варианте реализации данного изобретения предлагается комбинированная терапия с применением Соединения А и другого терапевтического средства, такого как радиотерапия. В другом варианте реализации данное изобретение относится к комбинированной терапии с применением Соединения А и по меньшей мере одного дополнительного терапевтически активного агента, включая иммунотерапевтические агенты, терапевтические средства направленного действия (включая ингибиторы киназы) и антиангиогенные агенты.
[049] Определения
[050] Необходимо понимать, что используемая в данном документе терминология предназначена только для описания конкретных вариантов реализации изобретения и не предназначена для ограничения.
[051] Если в тексте прямо не указано противоположное, то все технические и научные термины, используемые в данном документе, имеют такое же значение, которое обычно придает им обычный специалист в области техники, к которой относится данная заявка. Хотя любые методы и материалы, подобные или эквивалентные описанным в данном документе, могут быть применены в практике или при тестировании данной заявки, в данном документе описаны типичные методы и материалы.
[052] Следуя устоявшейся конвенции по патентному праву, единственное число существительных при использовании в данной заявке, включая формулу изобретения, означает «один или большее количество». Так, например, ссылка на «носитель» включает в себя смеси одного или большего количества носителей, двух или большего количества носителей и т. п.
[053] Если в тексте прямо не указано противоположное, то все числа, выражающие количества ингредиентов, условия реакции и т. д., используемые в описании и формуле изобретения, необходимо понимать как модифицированные во всех случаях термином «около». Соответственно, если в тексте прямо не указано противоположное, числовые параметры, приведенные в данном документе и прилагаемой формуле изобретения, представляют собой приближения, которые могут варьироваться в зависимости от желаемых свойств, которые должны быть получены согласно данной заявке. Обычно термин «около», как используется в данном документе, если речь идет об измеряемом значении, таком как количество массы, времени, дозы и т. д., охватывает в одном примере вариации ± 15% или ± 10%, в другом примере ± 5%, в другом примере ± 1% и в еще одном примере ± 0,1% от указанного количества, в той степени, в которой такие вариации пригодны для осуществления раскрытого способа.
[054] Термин «соединение(-я) по данному изобретению» или «представленное(-ые) соединение(-я)» относится к соединениям формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или 2-(4-метил-[1,4]диазепан-1-ил)-5-оксо-5Н-7-тиа-1,11b-диазабензо[с]флуорен-6-карбоновой кислоты (5-метил-пиразин-2-илметил)-амиду (Соединение А) или его изомерам, N-оксидам, солям, сложным эфирам, сольватам, пролекарствам. В качестве альтернативы, вышеуказанные термины могут относиться к форме соли соединений формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения A или их сольватов. Соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A, описанные по всему тексту заявки, могут включать в себя любой отдельный изомер или смесь любого количества изомеров.

Соединение А
[055] Термин «изомер» относится к соединениям одной и той же химической формулы, которые иметь различную стереохимическую формулу, структурную формулу или особое расположение атомов. Примеры изомеров включают в себя стереоизомеры, диастереомеры, энантиомеры, конформационные изомеры, ротамеры, геометрические изомеры и атропоизомеры.
[056] Термин «N-оксид», также известный как оксид амина или амин-N-оксид, означает соединение, которое получают из соединения по данному изобретению путем окисления аминогруппы соединения по данному изобретению. N-оксид обычно содержит функциональную группу R3N+-O- (иногда обозначаемую R3N=O или R3N→O).
[057] Термин «сложный эфир» относится к любому сложному эфиру соединения по данному изобретению, в котором любая из функциональных групп -COOH молекулы заменена функциональной группой -COOR, где фрагмент R сложного эфира представляет собой любую углеродсодержащую группу, образующую стабильный сложноэфирный фрагмент, включая, но не ограничиваясь этим, алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, арил, арилалкил, гетероциклил, гетероциклилалкил и их замещенные производные. Термин «сложный эфир» включает в себя, но не ограничиваясь этим, фармацевтически приемлемые сложные эфиры. Фармацевтически приемлемые сложные эфиры включают в себя, но не ограничиваясь этим, алкильные, алкенильные, алкинильные, арильные, гетероарильные, аралкильные, гетероаралкильные, циклоалкильные и гетероциклильные сложные эфиры кислотных групп, включая, но не ограничиваясь этим, карбоновые кислоты, фосфорные кислоты, фосфиновые кислоты, сульфоновые кислоты, сульфиновые кислоты и бороновые кислоты.
[058] Термин «композиция» или «препарат» обозначает одно или большее количество веществ в физической форме, такой как твердое вещество, жидкость, газ или их смесь. Одним из примеров композиции является фармацевтическая композиция, т. е. композиция, связанная с, приготовленная или применяемая в медицинском лечении.
[059] Термин «карбоновая кислота» относится к органической кислоте, характеризующейся наличием одной или большего количества карбоксильных групп, такой как уксусная кислота и щавелевая кислота. «Сульфоновая кислота» относится к органической кислоте общей формулы R-(S(O)2-OH)n, где R представляет собой органический фрагмент, а n равно целому числу больше нуля, такому как 1, 2 или 3. Термин «полигидроксикислота» относится к карбоновой кислоте, содержащей две или большее количество гидроксильных групп. Примеры полигидроксикислоты включают в себя, но не ограничиваясь этим, лактобионовую кислоту, глюконовую кислоту и галактозу.
[060] Как используется в данном документе, термин «фармацевтически приемлемый» означает подходящий для применения в контакте с тканями человека и животных без ненужной токсичности, раздражения, аллергического ответа и т.п., соразмерно с разумным соотношением пользы/риска и эффективный с точки зрения его предполагаемого применения в пределах обоснованного врачебного решения.
[061] «Соли» включают в себя производные активного агента, в которых активный агент модифицирован путем получения его кислотно- или основно-аддитивных солей. Предпочтительно, соли представляют собой фармацевтически приемлемые соли. Такие соли включают в себя, но не ограничиваясь этим, фармацевтически приемлемые кислотно-аддитивные соли, фармацевтически приемлемые основно-аддитивные соли, фармацевтически приемлемые соли металлов, соли аммония и алкилированного аммония. Кислотно-аддитивные соли включают в себя соли неорганических кислот, а также органических кислот. Типичные примеры подходящих неорганических кислот включают в себя соляную, бромистоводородную, йодистоводородную, фосфорную, серную, азотную кислоту и т. п. Характерные примеры подходящих органических кислот включают в себя муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную, коричную, лимонную, фумаровую, гликолевую, молочную, малеиновую, яблочную, малоновую, манделовую, щавелевую, пикриновую, пировиноградную, салициловую, янтарную, метансульфоновую, этансульфоновую, винную, аскорбиновую, памовую, бисметиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспарагиновую, стеариновую, пальмитиновую, этилендиаминтетрауксусную кислоту (ЭДТК), гликолевую, п-аминобензойную, глутаминовую, бензолсульфоновую, п-толуолсульфоновую кислоту, сульфаты, нитраты, фосфаты, перхлораты, бораты, ацетаты, бензоаты, гидроксинафтоаты, глицерофосфаты, кетоглутараты и т. п. Основно-аддитивные соли включают в себя, но не ограничиваясь этим, этилендиамин, N-метилглюкамин, лизин, аргинин, орнитин, холин, N,N'-дибензилэтилендиамин, хлорпрокаин, диэтаноламин, прокаин, N-бензилфенэтиламин, диэтиламин, пиперазин, трис(гидроксиметил)-аминометан, гидроксид тетраметиламмония, триэтиламин, дибензиламин, эфенамин, дегидроабиэтиламин, N-этилпиперидин, бензиламин, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, этиламин, основные аминокислоты, например, лизин и аргинин, дициклогексиламин и т. п. Примеры солей металлов включают в себя соли лития, натрия, калия, магния и т. п. Примеры солей аммония и алкилированного аммония включают в себя соли аммония, метиламмония, диметиламмония, триметиламмония, этиламмония, гидроксиэтиламмония, диэтиламмония, бутиламмония, тетраметиламмония и т. п. Примеры органических оснований включают в себя лизин, аргинин, гуанидин, диэтаноламин, холин и т. п. Стандартные способы получения фармацевтически приемлемых солей и их препаратов хорошо известны в данной области техники и раскрыты в различных источниках, включая, например, «Remington: Science and Practice of Pharmacy», A. Gennaro, ed., 20th edition, Lippincott, Williams & Wilkins, Philadelphia, PA.
[062] Как используется в данном документе, термин «сольват» означает комплекс, образованный путем сольватации (комбинация молекул растворителя с молекулами или ионами активного агента по данному изобретению), или агрегат, который состоит из растворенного иона или молекулы (активный агент по данному изобретению) с одной или большим количеством молекул растворителя. В данном изобретении предпочтительным сольватом является гидрат. Примеры гидрата включают в себя, но не ограничиваясь этим, гемигидрат, моногидрат, дигидрат, тригидрат, гексагидрат и т. д. Обычному специалисту в данной области техники должно быть понятно, что фармацевтически приемлемая соль представленного соединения дополнительно может существовать в форме сольвата. Сольват обычно получают путем гидратации, которая представляет собой часть получения данного соединения, или путем естественного поглощения влаги безводным соединением по данному изобретению. Сольваты, включая гидраты, могут быть составлены в стехиометрических соотношениях, например, с двумя, тремя, четырьмя молекулами соли на молекулу сольвата или гидрата. Другая возможность, например, состоит в том, что две молекулы соли стехиометрически связаны с тремя, пятью, семью молекулами растворителя или гидрата. Растворители, применяемые для кристаллизации, такие как спирты, особенно метанол и этанол; альдегиды; кетоны, особенно ацетон; сложные эфиры, например, этилацетат; могут быть встроены в кристаллическую решетку. Предпочтительными являются фармацевтически приемлемые растворители.
[063] Термины «вспомогательное вещество», «носитель» и «основа» используются взаимозаменяемо во всем тексте данной заявки и обозначают вещество, с которым вводится соединение по данному изобретению.
[064] «Терапевтически эффективное количество» означает количество соединения или терапевтически активного агента, которое при введении пациенту для лечения заболевания или другого нежелательного медицинского состояния является достаточным для оказания благоприятного эффекта в отношении этого заболевания или состояния. Терапевтически эффективное количество будет варьироваться в зависимости от вида выбранного соединения или терапевтически активного агента, заболевания или состояния и его степени тяжести, а также от возраста, массы тела и т. д. пациента, подлежащего лечению. Определение терапевтически эффективного количества данного соединения или терапевтически активного агента находится в пределах квалификации обычного специалиста в данной области техники и требует не более чем шаблонных экспериментов.
[065] Термин «комбинированная терапия» относится к первому терапевтическому средству, которое содержит соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А в сочетании со вторым терапевтическим средством (например, терапией, хирургическим вмешательством и/или дополнительным фармацевтическим агентом), пригодным для лечения, стабилизации, профилактики и/или замедления развития заболевания или состояния. Введение в «сочетании с» другим терапевтически активным агентом включает в себя введение в одной и той же или разных композициях и/или комбинациях, последовательно, одновременно или непрерывно, одним и тем же или разными способами. В некоторых вариантах реализации изобретения комбинированная терапия необязательно включает в себя один или большее количество фармацевтически приемлемых носителей или вспомогательных веществ, фармацевтически неактивных соединений и/или инертных веществ.
[066] Термины «фармацевтическая комбинация», «терапевтическая комбинация» или «комбинация», как используется в данном документе, относятся к одной лекарственной форме, содержащей по меньшей мере два терапевтически активных агента, или отдельным лекарственным формам, содержащим по меньшей мере два терапевтически активных агента, совместно или по отдельности, для применения в комбинированной терапии. Например, один терапевтически активный агент может быть составлен в одной лекарственной форме, а другой терапевтически активный агент может быть составлен в одной и той же или разных лекарственных формах. Например, один терапевтически активный агент может быть составлен в твердой лекарственной форме для перорального применения, тогда как второй терапевтически активный агент может быть составлен в лекарственной форме в виде раствора для парентерального введения.
[067] Как используется в данном документе, термины «дополнительный фармацевтический агент» или «дополнительный терапевтический агент» или «дополнительный терапевтически активный агент» относительно соединений, описанных в данном изобретении, относятся к активному агенту, отличному от соединений формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или подклассов или Соединения А, которое вводят для достижения терапевтического эффекта. Фармацевтический(-ие) агент(-ы) может(-гут) быть направлен(-ы) на терапевтический эффект, связанный с состоянием, для лечения или предотвращения которого предназначены соединения по данному изобретению (например, рак), или фармацевтический агент может быть предназначен для лечения или предотвращения симптомов основного заболевания (например, рост опухоли, кровоизлияние, изъязвление, боль, увеличенные лимфатические узлы, кашель, желтуха, отек, снижение массы тела, кахексия, потоотделение, анемия, паранеопластические явления, тромбоз и т. д.) или для дальнейшего уменьшения частоты или степени тяжести побочных эффектов соединений по данному изобретению.
[068] Термин «иммунотерапия» относится к химическим веществам и биологическим веществам, которые модулируют иммунный ответ человека, чтобы достичь желаемого терапевтического эффекта.
[069] Термин «противораковые агенты» относится к химическим веществам и биологическим веществам, которые могут лечить, уменьшать, предотвращать или улучшать состояния, вызванные раком или ростом опухоли.
[070] Термин «антиангиогенные агенты» или «ингибиторы ангиогенеза» относится к химическим веществам, которые блокируют образование новых кровеносных сосудов опухолевыми и раковыми клетками (ангиогенез).
[071] Термин «радиотерапия» или «радиационная терапия» относится к лечению рака или опухолей с помощью луча ионизирующей радиации, как хорошо известно в данной области техники.
[072] Как используется в данном документе, термин «расстройство, характеризующееся клеточной пролиферацией» или «состояние, характеризующееся клеточной пролиферацией», включает в себя, но не ограничиваясь этим, раковые, доброкачественные и злокачественные опухоли. Примеры рака и опухолей включают в себя, но не ограничиваясь этим, виды рака или опухолевый рост ободочной и прямой кишки, молочной железы, легкого, печени, поджелудочной железы, лимфатического узла, толстой кишки, предстательной железы, головного мозга, головы и шеи, кожи, почек, крови и сердца (например, лейкоз, лимфома, карцинома).
[073] Термины «лечить», «лечение» или «терапия» применительно к конкретному заболеванию или расстройству включают в себя предупреждение заболевания или расстройства и/или уменьшение, улучшение, облегчение или устранение симптомов и/или патологии при заболевании или расстройстве. Как правило, используемые в данном документе термины означают облегчение, смягчение, уменьшение и устранение симптомов заболевания или состояния. Потенциальная молекула или соединение, описанные в данном документе, могут находиться в препарате или лекарственном средстве в терапевтически эффективном количестве, представляющем собой количество, которое может приводить к биологическому эффекту, например, такому как апоптоз определенных клеток (например, раковых клеток), уменьшение пролиферации определенных клеток или приводить к облегчению, смягчению, уменьшению или устранению симптомов заболевания или состояния. Кроме того, термины могут относиться к уменьшению или остановке клеточной пролиферации (например, замедлению или остановке роста опухоли) или уменьшению количества пролиферирующих раковых клеток (например, удалению части или всей опухоли). Дополнительно, указанные термины применимы к уменьшению титра микроорганизма в системе (т. е. клетке, ткани или организме субъекта), инфицированной микроорганизмом, снижению скорости размножения микробов, уменьшению количества симптомов или воздействия симптома, связанного с микробной инфекцией, и/или удалению обнаружимых количеств микроба из системы. Примеры микроорганизма включают в себя, но не ограничиваясь этим, вирус, бактерию и гриб.
[074] Как используется в данном документе, термины «ингибирование» или «уменьшение» клеточной пролиферация означают замедление, уменьшение или, например, остановку клеточной пролиферации, по данным измерения с применением способов, известных специалистам в данной области техники, например, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 100% по сравнению с пролиферирующими клетками, которые не подвергались воздействию способов, композиций и комбинаций в соответствии с данной заявкой.
[075] Как используется в данном документе, термин «апоптоз» относится к программе внутреннего саморазрушения или суицида клетки. В ответ на триггерный стимул в клетках возникает каскад событий, включая уменьшение клеток, пузырение клеточных мембран и конденсацию и фрагментацию хроматина. Эти события приводят к преобразованию клеток в кластеры связанных с мембраной частиц (апоптотических телец), которые затем поглощаются макрофагами.
[076] Как используется в данном документе, термин «пациент» или «субъект» включает в себя людей и животных, предпочтительно млекопитающих.
[077] Соединения
[078] Данное изобретение относится к хинолоновым соединениям формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединению А или их солям, сольватам, сложным эфирам и/или пролекарствам. Соединения, раскрытые в данном документе, можно применять в комбинации по меньшей мере с одним дополнительным терапевтическим агентом или терапевтическим средством (комбинированная терапия).
[079] В одном варианте реализации изобретение относится к соединению формулы (IA),

(IA)
или его фармацевтически приемлемой соли, сложному эфиру, сольвату и/или пролекарству;
где:
X1 представляет собой CH или N;
X2, X3, X4, X5, X6 и X7 независимо представляют собой NR4, CH2, CHQ или C(Q)2, при условии, что: (i) нуль, один или два из X2, X3, X4, X5, X6 и X7 представляют собой NR4; (ii) если X1 представляет собой N, то X2 и X7 оба не являются NR4; (iii) если X1 представляет собой N, то X3 и X6 не являются NR4; и (iv) если X1 представляет собой CH, а два из X2, X3, X4, X5, X6 и X7 представляют собой NR4, то два NR4 расположены в смежных положениях кольца или разделены двумя или большим количеством других положений кольца;
A и V независимо представляют собой H, галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
каждый Q независимо представляет собой галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца;
R1 представляет собой H или C1-C6 алкил, необязательно замещенный одним или большим количеством атомов галогена или =O;
R2 представляет собой H или C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо;
R3 представляет собой необязательно замещенный C1-C10 алкил, C2-C10 алкенил, C5-C10 арил или C6-C12 арилалкил или гетероформу одного из них, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-6-членное карбоциклическое или гетероциклическое кольцо;
каждый R4 независимо представляет собой H или C1-C6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R независимо представляет собой H или C1-C6 алкил;
R7 представляет собой H, и R8 представляет собой C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо; или в -NR7R8, R7 и R8 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца,
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3, 4 или 5;
L представляет собой C 1 -C 10 алкилен, C1-C10 гетероалкилен, C2-C10 алкенилен или C2-C10 гетероалкениленовый линкер, каждый из которых может быть необязательно замещен одним или большим количеством заместителей, выбранных из группы, состоящей из галогена, оксо (=O) или C1-C6 алкила;
W представляет собой необязательно замещенное 4-7-членное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца; и
W0 представляет собой необязательно замещенное 3-4-членное карбоциклическое кольцо или C1-C6 алкильную группу, замещенную от 1 до 4 атомами фтора.
[080] В некоторых вариантах реализации указанных соединений X1 представляет собой СН, а два из X2, X3, X4, X5, X6 и X7 представляют собой NR4. В некоторых вариантах реализации X1 представляет собой CH, а один из X2, X3, X4, X5, X6 и X7 представляет собой NR4. В других вариантах реализации X1 представляет собой CH, и ни один из X2, X3, X4, X5, X6 и X7 не является NR4. В других вариантах реализации X1 представляет собой N, и ни один из X2, X3, X4, X5, X6 и X7 не является NR4. В других вариантах реализации X1 представляет собой N, а один из X4 или X5 представляет собой NR4.
[081] В одном варианте реализации изобретение относится к соединению формулы (IB),

(IB)
или его фармацевтически приемлемой соли, сложному эфиру, сольвату и/или пролекарству;
где:
X1 представляет собой CH или N;
X2, X3, X4, X5, X6 и X7 независимо представляют собой NR4, CH2, CHQ или C(Q)2, при условии, что нуль, один или два из X2, X3, X4, X5, X6 и X7 представляют собой NR4;
A и V независимо представляют собой H, галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
каждый Q независимо представляет собой галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца;
R1 представляет собой H или C1-C6 алкил, необязательно замещенный одним или большим количеством атомов галогена или =O;
R2 представляет собой H или C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо;
R3 представляет собой необязательно замещенный C1-C10 алкил, C2-C10 алкенил, C5-C10 арил или C6-C12 арилалкил или гетероформу одного из них, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-6-членное карбоциклическое или гетероциклическое кольцо;
каждый R4 независимо представляет собой H или C1-C6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R независимо представляет собой H или C1-C6 алкил;
R7 представляет собой H, и R8 представляет собой C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо; или в -NR7R8, R7 и R8 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца,
m равно 0, 1, 2, 3 или 4,
n равно 0, 1, 2, 3, 4 или 5,
L представляет собой C1-C10 алкилен, C1-C10 гетероалкилен, C2-C10 алкенилен или C2-C10 гетероалкениленовый линкер, каждый из которых может быть необязательно замещен одним или большим количеством заместителей, выбранных из группы, состоящей из галогена, оксо (=O) или C1-C6 алкила;
W представляет собой необязательно замещенное 4-7-членное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца; и
W0 представляет собой необязательно замещенное 3-4-членное карбоциклическое кольцо или C1-C6 алкильную группу, замещенную от 1 до 4 атомами фтора.
[082] В одном варианте реализации изобретение относится к соединению формулы (I),

(I)
или его фармацевтически приемлемой соли, сложному эфиру, сольвату и/или пролекарству;
где:
X1 представляет собой CH или N;
X2, X3, X4, X5, X6 и X7 независимо представляют собой NR4, CH2, CHQ или C(Q)2, при условии, что нуль, один или два из X2, X3, X4, X5, X6 и X7 представляют собой NR4;
A и V независимо представляют собой H, галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2 или -R3;
каждый Q независимо представляет собой галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2 или -R3;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее один дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца;
R1 представляет собой H или C1-C6 алкил, необязательно замещенный одним или большим количеством атомов галогена или =O;
R2 представляет собой H или C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо;
R3 представляет собой необязательно замещенный C1-C10 алкил, C2-C10 алкенил, C5-C10 арил или C6-C12 арилалкил или гетероформу одного из них, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-6-членное карбоциклическое или гетероциклическое кольцо;
каждый R4 независимо представляет собой H или C1-C6 алкил;
R7 представляет собой H, и R8 представляет собой C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо; или в -NR7R8, R7 и R8 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца,
m равно 0, 1, 2, 3 или 4; и
n равно 0, 1, 2, 3, 4 или 5.
[083] В одном варианте реализации изобретение относится к соединению формулы (IIA),

(IIA)
или его фармацевтически приемлемой соли, сложному эфиру, сольвату и/или пролекарству;
где:
A и V независимо представляют собой H, галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -LN(R)-W0;
каждый Q независимо представляет собой галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца;
R1 представляет собой H или C1-C6 алкил, необязательно замещенный одним или большим количеством атомов галогена или =O;
R2 представляет собой H или C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо;
R3 представляет собой необязательно замещенный C1-C10 алкил, C2-C10 алкенил, C5-C10 арил или C6-C12 арилалкил или гетероформу одного из них, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-6-членное карбоциклическое или гетероциклическое кольцо;
каждый R4 независимо представляет собой H или C1-C6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R независимо представляет собой H или C1-C6 алкил;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3, 4 или 5;
p равно 0, 1, 2 или 3;
L представляет собой C1-C10 алкилен, C1-C10 гетероалкилен, C2-C10 алкенилен или C2-C10 гетероалкениленовый линкер, каждый из которых может быть необязательно замещен одним или большим количеством заместителей, выбранных из группы, состоящей из галогена, оксо (=O) или C1-C6 алкила;
W представляет собой необязательно замещенное 4-7-членное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца; и
W0 представляет собой необязательно замещенное 3-4-членное карбоциклическое кольцо или C1-C6 алкильную группу, замещенную от 1 до 4 атомами фтора.
[084] В одном варианте реализации изобретение относится к соединению формулы (II),

(II)
или его фармацевтически приемлемой соли, сложному эфиру, сольвату и/или пролекарству;
где A и V независимо представляют собой H, галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2 или -R3;
каждый Q независимо представляет собой галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2 или -R3;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца;
R1 представляет собой H или C1-C6 алкил, необязательно замещенный одним или большим количеством атомов галогена или =O;
R2 представляет собой H или C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо;
R3 представляет собой необязательно замещенный C1-C10 алкил, C2-C10 алкенил, C5-C10 арил или C6-C12 арилалкил или гетероформу одного из них, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена,=О, или необязательно замещенное 3-6-членное карбоциклическое или гетероциклическое кольцо;
каждый R4 независимо представляет собой H или C1-C6 алкил;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3, 4 или 5; и
p равно 0, 1, 2 или 3.
[085] В другом варианте реализации изобретение относится к соединению формулы (IIIA),

(IIIA)
или его фармацевтически приемлемой соли, сложному эфиру, сольвату и/или пролекарству;
где:
A и V независимо представляют собой H, галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -LW, -W0 или -LN(R)-W0;
каждый Q независимо представляет собой галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2, -R3, -W, -L-W, -W0 или -L-N(R)-W0;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца;
R1 представляет собой H или C1-C6 алкил, необязательно замещенный одним или большим количеством атомов галогена или =O;
R2 представляет собой H или C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо;
R3 представляет собой необязательно замещенный C1-C10 алкил, C2-C10 алкенил, C5-C10 арил или C6-C12 арилалкил или гетероформу одного из них, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-6-членное карбоциклическое или гетероциклическое кольцо;
каждый R4 независимо представляет собой H или C1-C6 алкил; или R4 может представлять собой -W, -L-W или -L-N(R)-W0;
каждый R независимо представляет собой H или C1-C6 алкил;
R7 представляет собой H, и R8 представляет собой C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо; или в -NR7R8, R7 и R8 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца,
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3, 4 или 5;
L представляет собой C1-C10 алкилен, C1-C10 гетероалкилен, C2-C10 алкенилен или C2-C10 гетероалкениленовый линкер, каждый из которых может быть необязательно замещен одним или большим количеством заместителей, выбранных из группы, состоящей из галогена, оксо (=O) или C1-C6 алкила;
W представляет собой необязательно замещенное 4-7-членное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца; и
W0 представляет собой необязательно замещенное 3-4-членное карбоциклическое кольцо или C1-C6 алкильную группу, замещенную от 1 до 4 атомами фтора.
[086] В другом варианте реализации изобретение относится к соединению формулы (III),

(III)
или его фармацевтически приемлемой соли, сложному эфиру, сольвату и/или пролекарству;
где:
A и V независимо представляют собой H, галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2 или -R3;
каждый Q независимо представляет собой галоген, азидо, -CN, -CF3, -CONR1R2, -NR1R2, -SR2, -OR2 или -R3;
в каждом -NR1R2, R1 и R2 вместе с N могут образовывать необязательно замещенное азациклическое кольцо, необязательно содержащее дополнительный гетероатом, выбранный из N, О и S, в качестве атома кольца;
R1 представляет собой H или C1-C6 алкил, необязательно замещенный одним или большим количеством атомов галогена или =O;
R2 представляет собой H или C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо;
R3 представляет собой необязательно замещенный C1-C10 алкил, C2-C10 алкенил, C5-C10 арил или C6-C12 арилалкил или гетероформу одного из них, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-6-членное карбоциклическое или гетероциклическое кольцо;
каждый R4 независимо представляет собой H или C1-C6 алкил;
R7 представляет собой H, и R8 представляет собой C1-C10 алкил, C1-C10 гетероалкил, C2-C10 алкенил или C2-C10 гетероалкенил, каждый из которых может быть необязательно замещен одним или большим количеством атомов галогена, =O, или необязательно замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо;
m равно 0, 1, 2, 3 или 4; и
n равно 0, 1, 2, 3, 4 или 5.
[087] В одном варианте реализации изобретение относится к 2-(4-метил-[1,4]диазепан-1-ил)-5-оксо-5H-7-тиа-1,11b-диазабензо[c]флуорен-6-карбоновой кислоты (5-метил-пиразин-2-илметил)амиду (Соединение А), как показано ниже.

Соединение А
[088] В другом варианте реализации изобретение относится к соли и/или сольвату Соединения А.
[089] Дополнительные терапевтически активные агенты
[090] В одном варианте реализации данного изобретения предлагается комбинированная терапия, включающая в себя соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А по меньшей мере с одним дополнительным терапевтическим агентом или терапевтическим средством. Следующие терапевтические агенты, терапевтически активные агенты и терапевтические средства могут применяться в сочетании с введением соединений, описанных выше.
[091] Иммунотерапевтические агенты
[092] Иммунотерапия относится к лечению субъекта, страдающего или подверженного риску развития или страдающего рецидивом заболевания, посредством способа, включающего в себя индуцирование, усиление, подавление или иную модификацию иммунного ответа. В одном варианте реализации изобретения иммунотерапевтический агент разрушает, уменьшает или подавляет проведение сигнала ингибирующего иммунорегулятора. Большинство иммунотерапевтических агентов сами по себе имеют ограниченную ценность против большинства видов рака. Причины этого включают в себя иммунную регуляцию, опосредованную раковыми клетками и популяциями лейкоцитов через различные клеточно-экспрессируемые и секретируемые молекулы. Например, противоопухолевый иммунитет в микроокружении опухоли подавляется различными инфильтрующими опухоль лейкоцитами, включая регуляторные Т-клетки (Treg), супрессорные клетки миелоидного происхождения, СКМП (MDSC) и альтернативно активированные (тип 2) макрофаги (M2). Механизмы, используемые этими типами клеток для подавления эффективного иммунитета, включают в себя секрецию цитокинов, таких как IL-10 и TGFβ, и экспрессию ингибирующих рецепторов, таких как CTLA-4 и PD-L1. Опухолевые клетки могут активно ингибировать иммунотерапевтическое воздействие с помощью ряда механизмов, таких как секреция цитокинов (например, VEGF и TGFβ), которые активно ингибируют распознавание Т-клетками и разрушение опухолевых клеток или выработку лиганда Programmed cell Death-1 (PD-L1), который ингибирует функцию PD-1, экспрессированного на активированных Т-клетках, см. (Devaud et al., Oncolmmunology 2:8 e25961, 2013).
[093] Данное изобретение относится к фармацевтическим комбинациям, содержащим в себя описанное в данном документе химическое соединение, такое как Соединение А, и по меньшей мере один иммунотерапевтический агент. Комбинации пригодны для лечения или облегчения расстройств клеточной клеток, таких как различные виды рака. В некоторых вариантах реализации изобретения комбинации обеспечивают синергетический терапевтический эффект по сравнению с монотерапией химическим соединением или монотерапией иммунотерапевтическим агентом.
[094] Не желая связывать себя какой-либо конкретной теорией, такие фармацевтические комбинации эффективны для лечения или облегчения расстройств клеточной пролиферации посредством одного или большего количества описанных в данном документе механизмов. В некоторых вариантах реализации изобретения иммунотерапевтический агент по данному изобретению увеличивает местную выработку одного или большего количества цитокинов, которые оказывают цитотоксическое действие на опухолевые клетки. Такие цитокины включают в себя, но не ограничиваясь этим, фактор некроза опухоли α (TNFα) и интерферон-гамма (IFNγ). Химическое соединение, описанное в данном документе, такое как Соединение А, может усиливать цитотоксический эффект TNF-α и/или IFN-γ, и таким образом комбинация может обеспечивать более выраженный терапевтический эффект. В некоторых вариантах реализации изобретения описанное в данном документе химическое соединение, такое как Соединение А, может индуцировать выработку хемокинов в опухолевых клетках, таких как опухолевые клетки с дефицитом гомологичной рекомбинации (например, опухолевые клетки, несущие мутацию BRCA1 и/или BRCA2). Образовавшиеся хемокины, в свою очередь, привлекают к опухолевым клеткам иммунные клетки, дендритные клетки (ДК), активированные эффекторные Т-клетки (например, CD8+ лимфоциты) и/или природные клетки-киллеры (ПК) и разрушают опухолевые клетки. В некоторых вариантах реализации изобретения индуцированные хемокины представляют собой CCL19, CCL20 и/или CCL21, которые привлекают дендритные клетки. В некоторых вариантах реализации изобретения индуцированный хемокин представляет собой CX3CL1, который привлекает активированные эффекторные Т-клетки (например, CD8+ лимфоциты). В некоторых вариантах реализации изобретения индуцированные хемокины представляют собой CXCL9 и/или CXCL10, которые привлекают активированные эффекторные Т-клетки (например, CD8+ лимфоциты) и ПК-клетки.
[095] В одном варианте реализации изобретения иммунотерапевтический агент представляет собой моноклональное антитело, иммунную эффекторную клетку, адоптивный перенос клетки, иммунотоксин, вакцину и/или цитокин.
[096] В одном варианте реализации изобретения иммунотерапевтический агент представляет собой агент, который может модулировать физиологические уровни одного или большего количества цитокинов в микроокружении раковых опухолей. В одном варианте реализации изобретения цитокин, модулируемый иммунотерапевтическим агентом, выбран как одно или большее количество из группы, состоящей из TNF-α, IFN-γ, IL-10, TGFβ и VEGF. В некоторых вариантах реализации изобретения иммунотерапевтический агент индуцирует выработку эндогенного цитокина, который оказывает цитотоксическое действие на опухолевые клетки, такого как TNF-α или IFN-γ. В некоторых вариантах реализации изобретения иммунотерапевтический агент ингибирует выработку эндогенного цитокина, который препятствует распознаванию Т-клетками и разрушению раковых клеток, такого как IL-10, TGFβ или VEGF.
[097] В других вариантах реализации изобретения иммунотерапевтический агент представляет собой агент, который может индуцировать выработку опухолевыми клетками одного или большего количества хемокинов, которые привлекают иммунные клетки, такие как дендритные клетки, эффекторная Т-клетка (например, CD8+ лимфоциты) и/или природные клетки-киллеры (ПК), к опухолевым клеткам. В некоторых вариантах реализации изобретения хемокины включают в себя, но не ограничиваясь этим, CCL19, CCL20, CCL21, CX3CL1, CXCL9 и CXCL10.
[098] В других вариантах реализации изобретения иммунотерапевтический агент представляет собой агент, который индуцирует блокаду иммунной контрольной точки, такую как блокада PD-1 и блокада CTLA-4.
[099] В некоторых вариантах реализации изобретения иммунотерапевтические агенты представляют собой антитело или его антигенсвязывающую часть, которая нарушает взаимодействие между PD-1 и PD-L1. В некоторых вариантах реализации изобретения иммунотерапевтический агент представляет собой антитело против PD-1, антагонист PD-1, антитело против PD-L1, миРНК, направленно действующую на экспрессию PD-1, миРНК, направленно действующую на экспрессию PD-L1, или пептид, фрагмент, доминантную отрицательную форму или растворимую форму PD-1 или PD-L1. В одном варианте реализации изобретения антитело против PD-1 представляет собой моноклональное антитело и/или гуманизированное антитело. Цитотоксический Т-лимфоцитарный антиген 4 (CTLA4, также известный как CD152) является членом суперсемейства иммуноглобулина, который экспрессируется исключительно на Т-клетках. Действие CTLA4 состоит в ингибировании активации Т-клеток и, как сообщалось, в ингибировании активности хелперных Т-клеток и усилении иммунодепрессивной активности регуляторных Т-клеток. В некоторых вариантах реализации изобретения иммунотерапевтический агент представляет собой антитело, которое разрушает CTLA4. В других вариантах реализации изобретения иммунотерапевтический агент представляет собой антагонист CTLA-4, антитело против CLTA-4, миРНК, направленно действующую на экспрессию CTLA-4, или пептид, фрагмент, доминантную отрицательную форму или растворимую форму CTLA-4. Другие члены суперсемейства иммуноглобулина включают в себя, но не ограничиваясь этим, CD28, ICOS и BTLA.
[0100] В некоторых вариантах реализации изобретения иммунотерапевтический агент выбран из группы, состоящей из антитела против PD-1, ниволумаба (BMS-936558, ONO-4538), ламбролизумаба (МК-3475), пидилизумаба (CT-011), алемтузумаба, бевацизумаба, брентуксимаба ведотина, цетуксимаба, гемтузумаба озогамицина, ибритумомаба тиуксетана, ипилимумаба, офатумумаба, панитумумаба, ритуксимаба, тозитумомаба, трастузумаба, тремилимумаба, лирлумаба, тревилизумаба, AB134090, 11159-H03H, 11159-H08H, PA5-29572, PA5-23967, PA5-26465, MA1-12205, MA1-35914, AMP-224, MDX-1105, MEDI4736, MPDL3280A, BMS-936559, MIH1, анти-B7-H4, анти-B7-H1, анти-LAG3, BTLA, анти-Tim3, анти-B7-DC, анти-CD160, антагонистических антител против MR, анти-4-1BB, анти-OX40, анти-CD27, агонистических антител к CD40, клона UC10-4F10-11, клона RPM1-14, клона 9D9, клона 10F.9G2 и т. п. и их смесей.
[0101] В одном варианте реализации изобретения иммунотерапевтический агент является антителом против PD-1. В другом варианте реализации изобретения иммунотерапевтический агент является ниволумабом или пембролизумабом. В других вариантах реализации изобретения иммунотерапевтический агент является антителом против CTLA-4. В одном варианте реализации изобретения иммунотерапевтический агент является имилимумабом.
[0102] Противораковые агенты
[0103] Противораковые агенты, применяемые в комбинации с соединениями в соответствии с данной заявкой, могут включать в себя агенты, выбранные из любого из классов, известных обычным специалистам в данной области техники, включая, например, алкилирующие агенты, антиметаболиты, растительные алкалоиды и терпеноиды (например, таксаны), ингибиторы топоизомеразы, противоопухолевые антибиотики, ингибиторы киназы, гормональные терапевтические средства, агенты направленного действия на молекулы и т. п. Обычно такой противораковый агент представляет собой алкилирующий агент, антиметаболит, алкалоид барвинка, таксан, ингибитор топоизомеразы, противоопухолевый антибиотик, ингибитор тирозинкиназы, иммуносупрессивный макролид, ингибитор Akt, ингибитор HDAC, ингибитор Hsp90 ингибитор mTOR, ингибитор PI3K/mTOR, ингибитор PI3K, ингибитор CDK (циклинзависимая киназа), ингибитор CHK (киназа контрольной точки), ингибиторы PARP (поли(DP-рибозо)полимераза) и т. п.
[0104] Алкилирующие агенты включают в себя (a) подобные алкилирующим агентам химиотерапевтические агенты на основе платины, такие как цисплатин, карбоплатин, недаплатин, оксалиплатин, сатраплатин и (SP-4-3)-(цис)-амминдихлор-[2-метилпиридин]платина (II); (b) алкилсульфонаты, такие как бусульфан; (с) производные этиленимина и метилмеламина, такие как алтретамин и тиотепа; (d) производные ипритного азота, такие как хлорамбуцил, циклофосфамид, эстрамустин, ифосфамид, мехлорэтамин, трофосамид, преднимустин, мелфалан и урамустин; (e) производные нитрозомочевины, такие как кармустин, ломустин, фотемустин, нимустин, ранимустин и стрептозоцин; (f) триазены и имидазотетразины, такие как дакарбазин, прокарбазин, темозоламид и темозоломид.
[0105] Антиметаболиты включают в себя (a) аналоги пурина, такие как флударабин, кладрибин, хлордезоксиаденозин, клофарабин, меркаптопурин, пентостатин и тиогуанин; (b) аналоги пиримидина, такие как фторурацил, гемцитабин, капецитабин, цитарабин, азацитидин, эдатрексат, флоксуридин и троксацитабин; (c) антифолаты, такие как метотрексат, пеметрексед, ралтитрексед и триметрексат. Кроме того, антиметаболиты включают в себя ингибиторы тимидилатсинтазы, такие как фторурацил, ралтитрексед, капецитабин, флоксуридин и пеметрексед; и ингибиторы рибонуклеотидредуктазы, такие как кларибин, клофарабин и флударабин.
[0106] Растительные алкалоиды и агенты-производные терпеноидов включают в себя ингибиторы митоза, такие как алкалоиды барвинка винбластин, винкристин, виндезин и винорелбин; и стабилизаторы полимера микротрубочек, такие как таксаны, включая, но не ограничиваясь этим, паклитаксел, доцетаксел, ларотаксел, ортатаксел и тезетаксел.
[0107] Ингибиторы топоизомеразы включают в себя ингибиторы топоизомеразы I, такие как камптотецин, топотекан, иринотекан, рубитекан и белотекан; и ингибиторы топоизомеразы II, такие как этопозид, тенипозид и амсакрин.
[0108] Противоопухолевые антибиотики включают в себя (a) антрациклины, такие как даунорубицин (включая липосомальный даунорубицин), доксорубицин (включая липосомальный доксорубицин), эпирубицин, идарубицин и валрубицин; (b) родственные стрептомицину агенты, такие как блеомицин, актиномицин, митрамицин, митомицин, порфиромицин; и (c) антрацендионы, такие как митоксантрон и пиксантрон. Антрациклины имеют три механизма действия: интеркалирование между парами оснований цепи ДНК/РНК; ингибирование фермента топоиозомеразы II; и создание опосредованных железом свободных радикалов кислорода, которые повреждают ДНК и клеточные мембраны. Антрациклины в общем характеризуются как ингибиторы топоизомеразы II.
[0109] Гормональные терапевтические средства включают в себя (a) андрогены, такие как флуоксиместерон и тестолактон; (b) антиандрогены, такие как бикалутамид, ципротерон, флутамид и нилутамид; (c) ингибиторы ароматазы, такие как аминоглутетимид, анастрозол, экземестан, форместан и летрозол; (d) кортикостероиды, такие как дексаметазон и преднизон; (e) эстрогены, такие как диэтилстильбэстрол; (f) антиэстрогены, такие как фулвестрант, ралоксифен, тамоксифен и торемифин; (g) агонисты и антагонисты LHRH, такие как бусерелин, гозерелин, лейпролид и трипторелин; (h) прогестины, такие как медроксипрогестерона ацетат и мегестрола ацетат; и (i) гормоны щитовидной железы, такие как левотироксин и лиотиронин.
[0110] Агенты направленного действия на молекулы включают в себя (a) ингибиторы рецептора тирозинкиназы (RTK), такие как ингибиторы EGFR, включая эрлотиниб, гефитиниб и нератиниб; ингибиторы VEGFR, включая вандетаниб, семаксиниб и цедираниб; и ингибиторы PDGFR; дополнительно включены ингибиторы RTK, которые действуют на нескольких сайтах рецептора, такие как лапатиниб, который ингибирует как EGFR, так и HER2, а также ингибиторы, которые воздействуют на каждый из C-kit, PDGFR и VEGFR, включая, но не ограничиваясь этим, акситиниб, сунитиниб, сорафениб и тоцераниб; кроме того, включены ингибиторы BCR-ABL, c-kit и PDGFR, такие как иматиниб; (b) связывающие FKBP агенты, такие как иммуносупрессивный макролидный антибиотик, включая бафиломицин, рапамицин (сиролимус) и эверолимус; (c) агенты генной терапии, антисмысловые терапевтические агенты и модуляторы экспрессии генов, такие как ретиноиды и рексиноиды, например. адапален, бексаротен, транс-ретиноевая кислота, 9-цис-ретиноевая кислота и N (4-гидроксифенил)ретинамид; (d) агенты, направленно действующие на фенотип, в том числе: моноклональные антитела, такие как алемтузумаб, бевацизумаб, цетуксимаб, ибритумомаб тиуксетан, ритуксимаб и трастузумаб; (e) иммунотоксины, такие как гемтузумаб озогамицин; (f) радиоиммуноконъюгаты, такие как 131I-тозитумомаб; и (g) противораковые вакцины.
[0111] Ингибиторы Akt включают в себя, но не ограничиваясь этим, 1L6 гидроксиметил-хиро-инозитол-2(R)-2-O-метил-3-O-октадецил-sn-глицерокарбонат, SH-5 (Calbiochem № по кат. 124008), SH-6 (Calbiochem № по кат. 124009), Calbiochem № по кат. 124011, трицирибин (NSC 154020, Calbiochem № по кат. 124012), 10-(4'-(N-диэтиламино)бутил)-2-хлорфеноксазин, Cu(II)Cl2(3-формилхромон тиосемикарбазон), 1,3-дигидро-1-(1-((4-(6-фенил-1H-имидазо[4,5-g]хиноксалин-7-ил)фенил)метил)-4-пиперидинил)-2H-бензимидазол-2-он, GSK690693 (4-(2-(4-амино-1,2,5-оксадиазол-3-ил)-1-этил-7-{[(3S)-3-пиперидинилметил]окси}-1H-имидазо[4,5-с]пиридин-4-ил)-2-метил-3-бутин-2-ол), SR13668 ((2,10-дикарбоэтокси-6-метокси-5,7-дигидроиндоло[2,3-b]карбазол), GSK2141795, перифозин, GSK21110183, XL418, XL147, PF-04691502, BEZ-235 [2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-с]хинолин-1-ил)фенил]пропионитрил], PX-866 ((уксусной кислоты (1S,4E,10R,11R,13S,14R)-[4-диаллиламинометилен-6-гидрокси-1-метоксиметил-10,13-диметил-3,7,17-триоксо-1,3,4,7,10,11,12,13,14,15,16,17-додекагидро-2-оксациклопента[a]фенантрен-11-иловый эфир)), D 106669, CAL-101, GDC0941 (2-(1H-индазол-4-ил)-6-(4-метансульфонилпиперазин-1-илметил)-4-морфолин-4-ил-тиено[3,2-d]пиримидин), SF1126, SF1188, SF2523, TG100-115 [3-[2,4-диамино-6-(3-гидроксифенил)птеридин-7-ил]фенол]. Ряд указанных ингибиторов, такие как, например, BEZ-235, PX-866, D 106669, CAL 101, GDC0941, SF1126, SF2523 также идентифицированы в данной области техники как ингибиторы PI3K/mTOR; дополнительные примеры, такие как PI-103 [3-[4-(4-морфолинилпиридо[3',2':4,5]фуро[3,2-d]пиримидин-2-ил]фенола гидрохлорид] хорошо известны специалистам в данной области техники. Дополнительные хорошо известные ингибиторы PI3K включают в себя LY294002 [2-(4-морфолинил)-8-фенил-4Н-1-бензопиран-4-он] и вортманнин. Ингибиторы mTOR, известные специалистам в данной области техники, включают в себя темсиролимус, дефоролимус, сиролимус, эверолимус, зотаролимус и биолимус A9. Репрезентативное подмножество таких ингибиторов включает в себя темсиролимус, дефоролимус, зотаролимус и биолимус A9.
[0112] Ингибиторы HDAC включают в себя, но не ограничиваясь этим: (i) гидроксамовые кислоты, такие как трихостатин А, вориностат (субероиланилид-гидроксамовая кислота (SAHA)), панобиностат (LBH589) и белиностат (PXD101) (ii) циклические пептиды, такие как трапоксин B, и депсипептиды, такие как ромидепсин (NSC 630176), (iii) бензамиды, такие как МС-275 (3-пиридилметил-N-{4-[(2-аминофенил)карбамоил]бензил}карбамат), CI994 (4-ацетиламино-N-(2-аминофенил)-бензамид) и MGCD0103 (N-(2-аминофенил)-4-((4-(пиридин-3-ил)пиримидин-2-иламино)метил)бензамид), (iv) электрофильные кетоны, (v) соединения алифатических кислот, такие как фенилбутират и вальпроевая кислота. В одном варианте реализации изобретения ингибитор PI3K является иделализибом (CAL-101).
[0113] Ингибиторы Hsp90 включают в себя, но не ограничиваясь этим, бензохинон-анзамицины, такие как гелданамицин, 17 DMAG (17-диметиламиноэтиламино-17-дезметоксигелданамицин), танеспимицин (17 AAG, 17-аллиламино-17-дезметоксигелданамицин), EC5, ретаспимицин (IPI-504, 18,21-дидегидро-17-дезметокси-18,21-дидезоксо-18,21-дигидрокси-17-(2-пропениламино)-гелданамицин) и гербимицин; пиразолы, такие как CCT 018159 (4-[4-(2,3-дигидро-1,4-бензодиоксин-6-ил)-5-метил-1Н-пиразол-3-ил]-6-этил-1,3-бензолдиол); макролиды, такие как радикокол; а также BIIB021 (CNF2024), SNX-5422, STA-9090 и AUY922.
[0114] Ингибиторы CDK включают в себя, но не ограничиваясь этим, AZD-5438, BMI-1040, BMS-032, BMS-387, CVT-2584, флавопиридол, GPC-286199, MCS-5A, PD0332991, PHA-690509, селициклиб (CYC202, R-росковитин), ZK-304709 AT7519M, P276-00, SCH 727965, AG-024322, LEE011, LY2835219, P1446A-05, BAY 1000394, SNS-032. и т. п.
[0115] Ингибиторы CHK включают в себя, но не ограничиваясь этим, 5-(3-фторфенил)-3-уреидотиофен-N-[(S)-пиперидин-3-ил]-2-карбоксамид (AZD7762), 7-нитро-1H-индол-2-карбоновой кислоты {4-[1-(гуанидиногидразон)-этил]фенил}-амид (PV1019), 5-[(8-хлор-3-изохинолинил)амино]-3-[(1R)-2-(диметиламино)-1-метилэтокси]-2-пиразинкарбонитрил (SAR-020106), PF-00477736, CCT241533, 6-бром-3-(1-метил-1Н-пиразол-4-ил)-5-(3R)-3-пиперидинил-пиразоло[1,5-а]пиримидин-7-амин (SCH900776), 7-гидроксистауроспорин (UCN-01), 4-[((3S)-1-азабицикло[2.2.2]окт-3-ил)амино]-3-(1Н-бензимидазол-2-ил)-6-хлорхинолин-2(1Н)-он (CHIR 124), 7-аминодактиномицин (7-AAD), изогранулятимид, дебромгимениальдизин, N-[5-бром-4-метил-2-[(2S)-2-морфолинилметокси]-фенил]-N'-(5-метил-2-пиразинилмочевину) (LY2603618), сульфорафан (4-метилсульфинилбутилизотиоцианат), 9,10,11,12-тетрагидро-9,12-эпокси-1Н-дииндоло[1,2,3-fg:3',2',1'-kl]пирроло[3,4-i][1,6]бензодиазоцин-1,3(2H)-дион (SB-218078), TAT-S216A (синтетический пептид; см. US9415118, включенный в данный документ посредством ссылки в полном объеме), CBP501 (см. US20100112089A1, включенный в данный документ посредством ссылки в полном объеме) и т. п.
[0116] Ингибиторы PARP включают в себя, но не ограничиваясь этим, 4-(3-(1-(циклопропанкарбонил)пиперазин-4-карбонил)-4-фторбензил)фталазин-1(2H)-он (олапариб, AZD2281, Ku-0059436), 2-[(2R)-2-метилпирролидин-2-ил]-1Н-бензимидазол-4-карбоксамид (велипариб, ABT-888), (8S,9R)-5-фтор-8-(4-фторфенил)-9-(1-метил-1Н-1,2,4-триазол-5-ил)-8,9-дигидро-2Н-пиридо[4,3,2-de]фталазин-3(7Н)-он (талазопариб, BMN 673), 4-йод-3-нитробензамид (инипариб, BSI-201), 8-фтор-5-(4-((метиламино)метил)фенил)-3,4-дигидро-2H-азепино[5,4,3-cd]индол-1(6H)-он-фосфорную кислоту (рукапариб, AG-014699, PF-01367338), 2-[4-[(диметиламино)метил]фенил]-5,6-дигидроимидазо[4,5,1-jk][1,4]бензодиазепин-7(4H)-он (AG14361), 3-аминобензамид (IΝΟ-1001), 2-(2-фтор-4-((S)-пирролидин-2-ил)фенил)-3Н-бензо[d]имидазол-4-карбоксамид (A-966492), N-(5,6-дигидро-6-оксо-2-фенантридинил)-2-ацетамида гидрохлорид (PJ34, PJ34 HCl), MK-4827, 3,4-дигидро-4-оксо-3,4-дигидро-4-оксо-N-[(1S)-1-фенилэтил]-2-хиназолинпропанамид (ME0328), 5-(2-оксо-2-фенилэтокси)-1(2H)-изохинолинон (UPF-1069), 4-[[4-фтор-3-[(4-метокси-1-пиперидинил)карбонил]фенил]метил]-1(2H)-фталазинон (AZD 2461) и т. п. В одном варианте реализации изобретения ингибитор PARP является олапарибом.
[0117] Различные агенты включают в себя алтретамин, триоксид мышьяка, нитрат галлия, гидроксимочевину, левамизол, митотан, октреотид, прокарбазин, сурамин, талидомид, фотодинамические соединения, такие как метоксален и натрий порфимер, и ингибиторы протеасомы, такие как бортезомиб.
[0118] Биологические терапевтические агенты включают в себя: интерфероны, такие как интерферон-α2a и интерферон-α2b, и интерлейкины, такие как алдеслейкин, денилейкин дифтитокс и опрелвекин.
[0119] В дополнение к противораковым агентам, предназначенным для борьбы с раковыми клетками, предусмотрены схемы комбинированной терапии, включающие применение защитных или вспомогательных агентов, в том числе: цитопротекторных агентов, таких как армифостин, дексразонксан и месна, фосфонатов, таких как пармидронат и золедроновая кислота, и стимулирующих факторов, таких как эпоэтин, дарбеопетин, филграстим, ПЭГ-филграстим и сарграмостим.
[0120] Антиангиогенные агенты
[0121] Ангиогенез относится к образованию новых кровеносных сосудов. Раковые клетки и опухоли выделяют химические вещества, которые сигнализируют о росте и образовании новых кровеносных сосудов. Ангиогенез играет важную роль в клеточной пролиферации раковых и опухолевых клеток, поскольку образование новых кровеносных сосудов позволяет обеспечить необходимое питание растущим клеткам. Ингибиторы ангиогенеза представляют собой важную группу химических веществ, поскольку они могут предотвратить рост рака, блокируя образование новых кровеносных сосудов из окружающей ткани к солидной опухоли.
[0122] Ингибиторы ангиогенеза включают в себя ингибиторы эндотелий-специфической рецепторной тирозинкиназы (Tie-2), ингибиторы рецепторов эпидермального фактора роста (EGFR), ингибиторы фактора роста 2 инсулина (IGFR-2), ингибиторы матриксной металлопротеиназы-2 (MMP-2), ингибиторы матриксной металлопротеиназы-9 (MMP-9), ингибиторы рецептора фактора роста тромбоцитов (PDGFR), ингибиторы тромбоспондиновых аналогов рецепторной тирозинкиназы сосудистого эндотелиального фактора роста (VEGFR) и т. п.
[0123] Кроме того, ингибиторы ангиогенеза могут включать в себя, но не ограничиваясь этим, 2-метоксиэстрадиол, AG3340, приномастат, батимастат, BAY 12-9566, карбоксиамидотриазол, CC-1088, декстрометорфан-уксусную кислоту, диметилксантенон-уксусную кислоту, EMD 121974, эндостатин, IM-862, маримастат, матриксную металлопротеиназу, пеницилламин, PTK787/ZK 222584, RPI.4610, скваламин, скваламина лактат, 3-[2,4-диметилпиррол-5-ил-метилиденил]-2-индолинон (SU5416), (±) талидомид, S-талидомид, R-талидомид, O-(хлорацетилкарбамоил)фумагиллол (TNP-470), комбретастатин, паклитаксел, тамоксифен, COL-3, неовастат, BMS-275291, SU6668, 2-ME, интерферон-альфа, антитело против VEGF, Medi-522 (Vitaxin II), CAI (ингибитор притока кальция), целекоксиб, интерлейкин-12, IM862, амиллорид, белок Angiostatin®, ангиостатин K1-3, ангиостатин K1-5, каптоприл, DL-альфа-дифторметилорнитин, DL-альфа-дифторметилорнитина HCl, белок His-Tag® Endostatin™, фумагиллин, гербимицин A, 4-гидроксифенилретинамид, гамма-интерферон, юглон, ламинин, ламинин гексапептид, ламинин пентапептид, лавендустин А, медроксипрогестерон, медроксипрогестерона ацетат, миноциклин, миноциклин HCl, плацентарный ингибитор рибонуклеазы, сурамин, натриевую соль сурамина, тромбоспондин тромбоцитов человека, тканевый ингибитор металлопротеиназы 1, тканевой ингибитор металлопротеиназы 1 нейтрофильных гранулоцитов, тканевой ингибитор металлопротеиназы 2 ревматоидных синовиальных фибробластов и т. п.
[0124] Радиотерапия
[0125] Для радиотерапии применяют высокоэнергетические рентгеновские лучи, в качестве радиотерапии внешним лучом или радиотерапии внутренним лучом, чтобы предотвратить или уменьшить дальнейшую пролиферацию раковых клеток или вызвать апоптоз в раковых клетках. Хотя радиотерапия может поражать как раковые клетки, так и здоровые клетки, здоровые клетки лучше способны сопротивляться или восстанавливаться после воздействия радиации.
[0126] В одном варианте реализации изобретения радиотерапия может быть пригодной при проведении в комбинации с введением терапевтически эффективного количества соединений формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства. В некоторых вариантах реализации изобретения радиотерапию можно проводить до, во время или после того, как субъект начал или закончил схему лечения, включающую в себя терапевтически эффективное количество соединений формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства.
[0127] Комбинированная терапия
[0128] В одном варианте реализации данное изобретение относится к способу лечения состояния, связанного с клеточной пролиферацией у пациента, нуждающегося в этом. В одном варианте реализации данное изобретение относится к способу лечения рака или опухолей. Способ включает в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества по меньшей мере одного соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и по меньшей мере одного дополнительного терапевтически активного агента. В некотором варианте реализации изобретения по меньшей мере один дополнительный терапевтически активный агент выбран из группы, состоящей из иммунотерапевтических агентов, противораковых агентов и антиангиогенных агентов.
[0129] В одном варианте реализации изобретения соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство вводят в дозе от около 5 мг/сутки до около 500 мг/сутки. В одном варианте реализации изобретения по меньшей мере один дополнительный терапевтически активный агент вводят в дозе от около 1 мг/сутки до около 500 мг/сутки.
[0130] В другом варианте реализации изобретения соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и/или по меньшей мере один дополнительный терапевтически активный агент вводят в дозе от около 1 мг/м2 до около 3 г/м2, от около 5 мг/м2 до около 1 г/м2 или от около 10 мг/м2 до около 500 мг/м2.
[0131] Введенная доза может быть выражена в единицах мг/м2/сутки, где площадь поверхности тела пациента, ППТ (BSA) может быть вычислена в м2 с помощью различных доступных формул с применением роста и массы тела пациента. В качестве альтернативы, вводимая доза может быть выражена в единицах мг/сутки, что не учитывает ППТ пациента. Не вызывает сложностей перевод из одной единицы в другую с учетом роста и массы тела пациента.
[0132] Термин «совместное введение» или «сопутствующее введение» относится к совместному, координированному введению (a) соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства, и (b) по меньшей мере одного дополнительного терапевтически активного агента. Например, совместное введение может быть одновременным введением, последовательным введением, перекрывающимся введением, интервальным введением, непрерывным введением или их комбинацией. В одном варианте реализации изобретения соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и по меньшей мере один дополнительный терапевтически активный агент составляют в виде одной лекарственной формы. В другом варианте реализации изобретения формулу (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или ее подклассы или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или его пролекарство и по меньшей мере один дополнительный терапевтически активный агент предоставляют в отдельных лекарственных формах.
[0133] В одном варианте реализации изобретения совместное введение осуществляют в течение одного или большего количества циклов лечения. «Цикл лечения» означает заранее определенный период времени для совместного введения соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и по меньшей мере одного терапевтически активного агента. Обычно, пациент проходит обследование в конце каждого цикла лечения для оценки эффекта представленной комбинированной терапии. В одном варианте реализации изобретения совместное введение осуществляют в течение от 1 до 48 циклов лечения. В другом варианте реализации изобретения совместное введение осуществляют в течение от 1 до 36 циклов лечения. В другом варианте реализации изобретения совместное введение осуществляют в течение от 1 до 24 циклов лечения.
[0134] В одном варианте реализации изобретения каждый из циклов лечения составляет около 3 или большее количество дней. В другом варианте реализации изобретения каждый из циклов лечения составляет от около 3 дней до около 60 дней. В другом варианте реализации изобретения каждый из циклов лечения составляет от около 5 дней до около 50 дней. В другом варианте реализации изобретения каждый из циклов лечения составляет от около 7 дней до около 28 дней. В другом варианте реализации изобретения каждый из циклов лечения составляет 28 дней. В одном варианте реализации изобретения цикл лечения составляет около 29 дней. В другом варианте реализации изобретения цикл лечения составляет около 30 дней. В другом варианте реализации изобретения цикл лечения представляет собой цикл лечения длительностью около месяца. В другом варианте реализации изобретения цикл лечения составляет от около 4 до около 6 недель.
[0135] В зависимости от состояния пациента и предполагаемого терапевтического эффекта частота введения для каждого из соединений формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и по меньшей мере одного терапевтически активного агент может варьироваться от одного раза в сутки до шести раз в сутки. Другими словами, частота введения может составлять один раз в сутки, два раза в сутки, три раза в сутки, четыре раза в сутки, пять раз в сутки или шесть раз в сутки. В некоторых вариантах реализации изобретения частота введения может составлять от одного до шести раз в неделю или от одного до четырех раз в месяц. В одном варианте реализации изобретения частота введения может составлять раз в неделю, раз в две недели, раз в три недели, раз в четыре недели или один раз в месяц.
[0136] В цикле лечения может быть один или большее количество дней отдыха. Под «днем отдыха» подразумевается день, когда не вводят ни соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство ни по меньшей мере один терапевтически активный агент. Другими словами, в день отдыха не вводят ни одно соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство ни по меньшей мере один терапевтически активный агент. Любой цикл лечения должен включать по крайней мере один день, не являющийся днем отдыха. «День, не являющийся днем отдыха» означает день, когда вводят по меньшей мере одно из соединений формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA), и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и по меньшей мере один терапевтически активный агент.
[0137] «Одновременное введение» означает, что соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и по меньшей мере один терапевтически активный агент вводят в один и тот же день. Для целей одновременного введения, соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и по меньшей мере один терапевтически активный агент можно вводить в одно и то же время или в разное время.
[0138] В одном варианте реализации одновременного введения соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство вводят от 1 до 4 раз в сутки, от 1 до 4 раз в неделю, раз в две недели, раз в три недели, раз в четыре недели или от 1 до 4 раз в месяц; и по меньшей мере один дополнительный терапевтически активный агент вводят от 1 до 4 раз в сутки от 1 до 4 раз в неделю, раз в две недели, раз в три недели, раз в четыре недели или от 1 до 4 раз в месяц. В другом варианте реализации одновременного введения соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство, вводят раз в неделю, раз в две недели, раз в три недели, раз в четыре недели или один раз в месяц; и по меньшей мере один дополнительный терапевтически активный агент вводят от 1 до 4 раз в сутки, от 1 до 4 раз в неделю, раз в две недели, раз в три недели, раз в четыре недели или от 1 до 4 раз в месяц.
[0139] Под «последовательным введением» подразумевается, что в любой день на протяжении двух или большего количества дней непрерывного совместного введения, без какого-либо дня отдыха, вводят только одно из соединений формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и по меньшей мере один терапевтически активный агент.
[0140] В одном варианте реализации последовательного введения соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство вводят от 1 до 4 раз в сутки от 1 до 4 раз в неделю раз в две недели, раз в три недели, раз в четыре недели или от 1 до 4 раз в месяц; и по меньшей мере один дополнительный терапевтически активный агент вводят от 1 до 4 раз в сутки, от 1 до 4 раз в неделю, раз в две недели, раз в три недели, один раз каждые четыре недели или от 1 до 4 раз в месяц. В другом варианте реализации последовательного введения соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство вводят раз в неделю, раз в две недели, раз в три недели, раз в четыре недели или один раз в месяц; и по меньшей мере один дополнительный терапевтически активный агент вводят от 1 до 4 раз в сутки от 1 до 4 раз в неделю, в две недели, раз в три недели, раз в четыре недели или от 1 до 4 раз в месяц.
[0141] «Перекрывающееся введение» означает, что в течение двух или большего количества дней непрерывного совместного введения без какого-либо дня отдыха присутствует по меньшей мере один день одновременного введения и по меньшей мере один день, когда вводят только одно из соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения A или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и по меньшей мере одного терапевтически активного агента.
[0142] «Интервальное введение» означает период совместного введения с по меньшей мере одним днем отдыха. «Непрерывное введение» означает период совместного введения без дня отдыха. Непрерывное введение может быть одновременным, последовательным или перекрывающимся, как описано выше.
[0143] В представленном способе совместное введение включает в себя пероральное введение, парентеральное введение или их комбинацию. Примеры парентерального введения включают в себя, но не ограничиваясь этим, внутривенное (в/в) введение, внутриартериальное введение, внутримышечное введение, подкожное введение, внутрикостное введение, интратекальное введение или их комбинацию. Соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и по меньшей мере один терапевтически активный агент можно независимо вводить перорально или парентерально. В одном варианте реализации изобретения соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или его пролекарство и по меньшей мере один терапевтически активный агент вводят парентерально. Парентеральное введение можно осуществлять путем инъекции или инфузии.
[0144] В одном варианте реализации представленного способа Соединение А предоставляется для применения в комбинированной терапии по меньшей мере с одним дополнительным терапевтически активным агентом. В одном варианте реализации изобретения комбинированная терапия включает в себя совместное введение Соединения А и иммунотерапевтического агента, противоракового агента или антиангиогенных агентов. В другом варианте реализации изобретения комбинированная терапия по данному изобретению включает Соединение А и по меньшей мере один дополнительный терапевтически активный агент, выбранный из ниволумаба, пембролизумаба и ипилимумаба.
[0145] В одном варианте реализации изобретения Соединение А и по меньшей мере один дополнительный терапевтически активный агент вводят перорально, подкожно или внутривенно.
[0146] Фармацевтические препараты
[0147] В другом варианте реализации данное изобретение относится к фармацевтической композиции и/или комбинации, содержащей терапевтически эффективное количество соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство, как раскрыто в данном документе, в качестве активного ингредиента, в сочетании с фармацевтически приемлемым вспомогательным веществом или носителем, Вспомогательные вещества добавляют в препарат для различных целей.
[0148] В некоторых вариантах реализации изобретения соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемые соль, сложный эфир, сольват и/или пролекарство и по меньшей мере один терапевтически активный агент могут быть составлены в виде одной фармацевтической композиции и/или комбинации. В некоторых вариантах реализации изобретения соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемая соль, сложный эфир, сольват и/или пролекарство и по меньшей мере один терапевтически активный агент составлены в виде отдельной фармацевтической композиции и/или комбинации, содержащей фармацевтически приемлемое вспомогательное вещество или носитель.
[0149] В одном варианте реализации изобретения по меньшей мере один терапевтически активный агент в одной фармацевтической композиции и/или комбинированной композиции представляет собой иммунотерапевтический, противораковый и/или антиангиогенный агент.
[0150] В одном варианте реализации изобретения иммунотерапевтический агент в композиции представляет собой моноклональное антитело, иммунную эффекторную клетку, адоптивный перенос клетки, иммунотоксин, вакцину и/или цитокин. В одном конкретном варианте реализации изобретения иммунотерапевтический агент является цитокином. В одном варианте реализации изобретения цитокин, которым является иммунотерапевтический агент, выбран из TNF-α и/или IFN-γ.
[0151] В некоторых вариантах реализации изобретения иммунотерапия в композиции представляет собой антитело или его антигенсвязывающую часть, которая нарушает взаимодействие между PD-1 и PD-L1, тем самым привлекая Т-клетки к раковым клеткам. В некоторых вариантах реализации изобретения иммунотерапевтический агент в композиции является антителом против PD-1, антагонистом PD-1, антителом против PD-L1, миРНК, направленно действующей на экспрессию PD-1, миРНК, направленно действующей на экспрессию PD-L1, или пептидом, фрагментом, доминантной отрицательной формой или растворимой формой PD-1 или PD-L1. В одном варианте реализации изобретения антитело против PD-1 представляет собой моноклональное антитело и/или гуманизированное антитело. Цитотоксический Т-лимфоцитарный антиген 4 (CTLA4, также известный как CD152) является членом суперсемейства иммуноглобулина, который экспрессируется исключительно на Т-клетках. Действие CTLA4 состоит в ингибировании активации Т-клеток и, как сообщалось, в ингибировании активности хелперных Т-клеток и усилении иммунодепрессивной активности регуляторных Т-клеток. В некоторых вариантах реализации изобретения иммунотерапевтический агент представляет собой антитело, которое разрушает CTLA4. В других вариантах реализации изобретения иммунотерапевтический агент представляет собой антагонист CTLA-4, антитело против CLTA-4, миРНК, направленно действующую на экспрессию CTLA-4, или пептид, фрагмент, доминантную отрицательную форму или растворимую форму CTLA-4. Другие члены суперсемейства иммуноглобулина включают в себя, но не ограничиваясь этим, CD28, ICOS и BTLA.
[0152] В некоторых вариантах реализации изобретения иммунотерапевтический агент в композиции выбран из группы, состоящей из антитела против PD-1, ниволумаба (BMS-936558, ONO-4538), ламбролизумаба (МК-3475), пидилизумаба (CT-011), алемтузумаба, бевацизумаба, брентуксимаба ведотина, цетуксимаба, гемтузумаба озогамицина, ибритумомаба тиуксетана, ипилимумаба, офатумумаба, панитумумаба, ритуксимаба, тозитумомаба, трастузумаба, тремилимумаба, лирлумаба, тревилизумаба, AB134090, 11159-H03H, 11159-H08H, PA5-29572, PA5-23967, PA5-26465, MA1-12205, MA1-35914, AMP-224, MDX-1105, MEDI4736, MPDL3280A, BMS-936559, MIH1, анти-B7-H4, анти-B7-H1, анти-LAG3, BTLA, анти-Tim3, анти-B7-DC, анти-CD160, антагонистических антител против MR, анти-4-1BB, анти-OX40, анти-CD27, агонистических антител к CD40, клона UC10-4F10-11, клона RPM1-14, клона 9D9, клона 10F.9G2 и т. п. и их смесей.
[0153] В одном варианте реализации изобретения иммунотерапевтический агент в композиции является антителом против PD-1. В другом варианте реализации изобретения иммунотерапевтический агент является ниволумабом или пембролизумабом. В других вариантах реализации изобретения иммунотерапевтический агент является антителом против CTLA-4. В одном варианте реализации изобретения иммунотерапевтический агент является имилимумабом.
[0154] В некоторых вариантах реализации изобретения иммунотерапевтический агент в композиции является антителом, которое разрушает CTLA4. В других вариантах реализации изобретения иммунотерапевтический агент в композиции представляет собой антагонист CTLA-4, антитело против CLTA-4, миРНК, направленно действующую на экспрессию CTLA-4, или пептид, фрагмент, доминантную отрицательную форму и/или растворимую форму CTLA-4. Другие члены суперсемейства иммуноглобулина включают в себя, но не ограничиваясь этим, CD28, ICOS и BTLA.
[0155] В некоторых вариантах реализации изобретения иммунотерапевтический агент в композиции выбран из группы, состоящей из пидилизумаба (CT-011), алемтузумаба, бевацизумаба, брентуксимаба ведотина, цетуксимаба, гемтузумаба озогамицина, ибритумомаба тиуксетана, ипилимумаба, офатумумаба, панитумумаба, ритуксимаба, тозитумомаба, трастузумаба, тремилимумаба, лирлумаба, тревилизумаба, AB134090, 11159-H03H, 11159-H08H, PA5-29572, PA5-23967, PA5-26465, MA1-12205, MA1-35914, AMP-224, MDX-1105, MEDI4736, MPDL3280A, BMS-936559, MIH1, анти-B7-H4, анти-B7-H1, анти-LAG3, BTLA, анти-Tim3, анти-B7-DC, анти-CD160, антагонистических антител против MR, анти-4-1BB, анти-OX40, анти-CD27, агонистических антител к CD40, клона UC10-4F10-11, клона RPM1-14, клона 9D9, клона 10F.9G2 и т. п. и их смесей.
[0156] В других вариантах реализации изобретения иммунотерапевтический агент в композиции является антителом против CTLA-4. В одном варианте реализации изобретения иммунотерапевтический агент в композиции является ипилимумабом.
[0157] Противораковые агенты в композиции по данному изобретению могут включать в себя агенты, выбранные из любого из классов, известных обычным специалистам в данной области техники, включая, например, алкилирующие агенты, антиметаболиты, растительные алкалоиды и терпеноиды (например, таксаны), ингибиторы топоизомеразы, противоопухолевые антибиотики, ингибиторы киназы, гормональные терапевтические средства, агенты направленного действия на молекулы и т. п. Обычно такой противораковый агент представляет собой алкилирующий агент, антиметаболит, алкалоид барвинка, таксан, ингибитор топоизомеразы, противоопухолевый антибиотик, ингибитор тирозинкиназы, иммуносупрессивный макролид, ингибитор Akt, ингибитор HDAC, ингибитор Hsp90 ингибитор mTOR, ингибитор PI3K/mTOR, ингибитор PI3K, ингибитор CDK (циклинзависимая киназа), ингибитор CHK (киназа контрольной точки), ингибиторы PARP (поли(DP-рибозо)полимераза) и т. п.
[0158] Алкилирующие агенты в композиции могут включать в себя (a) подобные алкилирующим агентам химиотерапевтические агенты на основе платины, такие как цисплатин, карбоплатин, недаплатин, оксалиплатин, сатраплатин и (SP-4-3)-(цис)-амминдихлор-[2-метилпиридин]платина (II); (b) алкилсульфонаты, такие как бусульфан; (с) производные этиленимина и метилмеламина, такие как алтретамин и тиотепа; (d) производные ипритного азота, такие как хлорамбуцил, циклофосфамид, эстрамустин, ифосфамид, мехлорэтамин, трофосамид, преднимустин, мелфалан и урамустин; (e) производные нитрозомочевины, такие как кармустин, ломустин, фотемустин, нимустин, ранимустин и стрептозоцин; (f) триазены и имидазотетразины, такие как дакарбазин, прокарбазин, темозоламид и темозоломид.
[0159] Антиметаболиты в композиции могут включать в себя (a) аналоги пурина, такие как флударабин, кладрибин, хлордезоксиаденозин, клофарабин, меркаптопурин, пентостатин и тиогуанин; (b) аналоги пиримидина, такие как фторурацил, гемцитабин, капецитабин, цитарабин, азацитидин, эдатрексат, флоксуридин и троксацитабин; (c) антифолаты, такие как метотрексат, пеметрексед, ралтитрексед и триметрексат. Кроме того, антиметаболиты включают в себя ингибиторы тимидилатсинтазы, такие как фторурацил, ралтитрексед, капецитабин, флоксуридин и пеметрексед; и ингибиторы рибонуклеотидредуктазы, такие как кларибин, клофарабин и флударабин.
[0160] Растительные алкалоиды и агенты-производные терпеноидов в композиции могут включать в себя ингибиторы митоза, такие как алкалоиды барвинка винбластин, винкристин, виндезин и винорелбин; и стабилизаторы полимера микротрубочек, такие как таксаны, включая, но не ограничиваясь этим, паклитаксел, доцетаксел, ларотаксел, ортатаксел и тезетаксел.
[0161] Ингибиторы топоизомеразы в композиции могут включать в себя ингибиторы топоизомеразы I, такие как камптотецин, топотекан, иринотекан, рубитекан и белотекан; и ингибиторы топоизомеразы II, такие как этопозид, тенипозид и амсакрин.
[0162] Противоопухолевые антибиотики в композиции могут включать в себя (a) антрациклины, такие как даунорубицин (включая липосомальный даунорубицин), доксорубицин (включая липосомальный доксорубицин), эпирубицин, идарубицин и валрубицин; (b) родственные стрептомицину агенты, такие как блеомицин, актиномицин, митрамицин, митомицин, порфиромицин; и (c) антрацендионы, такие как митоксантрон и пиксантрон. Антрациклины имеют три механизма действия: интеркалирование между парами оснований цепи ДНК/РНК; ингибирование фермента топоиозомеразы II; и создание опосредованных железом свободных радикалов кислорода, которые повреждают ДНК и клеточные мембраны. Антрациклины в общем характеризуются как ингибиторы топоизомеразы II.
[0163] Гормональные терапевтические средства в композиции могут включать в себя (a) андрогены, такие как флуоксиместерон и тестолактон; (b) антиандрогены, такие как бикалутамид, ципротерон, флутамид и нилутамид; (c) ингибиторы ароматазы, такие как аминоглутетимид, анастрозол, экземестан, форместан и летрозол; (d) кортикостероиды, такие как дексаметазон и преднизон; (e) эстрогены, такие как диэтилстильбэстрол; (f) антиэстрогены, такие как фулвестрант, ралоксифен, тамоксифен и торемифин; (g) агонисты и антагонисты LHRH, такие как бусерелин, гозерелин, лейпролид и трипторелин; (h) прогестины, такие как медроксипрогестерона ацетат и мегестрола ацетат; и (i) гормоны щитовидной железы, такие как левотироксин и лиотиронин.
[0164] Агенты направленного действия на молекулы в композиции могут включать в себя (a) ингибиторы рецептора тирозинкиназы (RTK), такие как ингибиторы EGFR, включая эрлотиниб, гефитиниб и нератиниб; ингибиторы VEGFR, включая вандетаниб, семаксиниб и цедираниб; и ингибиторы PDGFR; дополнительно включены ингибиторы RTK, которые действуют на нескольких сайтах рецептора, такие как лапатиниб, который ингибирует как EGFR, так и HER2, а также ингибиторы, которые воздействуют на каждый из C-kit, PDGFR и VEGFR, включая, но не ограничиваясь этим, акситиниб, сунитиниб, сорафениб и тоцераниб; кроме того, включены ингибиторы BCR-ABL, c-kit и PDGFR, такие как иматиниб; (b) связывающие FKBP агенты, такие как иммуносупрессивный макролидный антибиотик, включая бафиломицин, рапамицин (сиролимус) и эверолимус; (c) агенты генной терапии, антисмысловые терапевтические агенты и модуляторы экспрессии генов, такие как ретиноиды и рексиноиды, например. адапален, бексаротен, транс-ретиноевая кислота, 9-цис-ретиноевая кислота и N-(4-гидроксифенил)ретинамид; (d) агенты, направленно действующие на фенотип, в том числе: моноклональные антитела, такие как алемтузумаб, бевацизумаб, цетуксимаб, ибритумомаб тиуксетан, ритуксимаб и трастузумаб; (e) иммунотоксины, такие как гемтузумаб озогамицин; (f) радиоиммуноконъюгаты, такие как 131I-тозитумомаб; и (g) противораковые вакцины.
[0165] Ингибиторы Akt в композиции могут включать в себя, но не ограничиваясь этим, 1L6 гидроксиметил-хиро-инозитол-2(R)-2-O-метил-3-O-октадецил-sn-глицерокарбонат, SH-5 (Calbiochem № по кат. 124008), SH-6 (Calbiochem № по кат. 124009), Calbiochem № по кат. 124011, трицирибин (NSC 154020, Calbiochem № по кат. 124012), 10-(4'-(N-диэтиламино)бутил)-2-хлорфеноксазин, Cu(II)Cl2(3-формилхромон тиосемикарбазон), 1,3-дигидро-1-(1-((4-(6-фенил-1H-имидазо[4,5-g]хиноксалин-7-ил)фенил)метил)-4-пиперидинил)-2H-бензимидазол-2-он, GSK690693 (4-(2-(4-амино-1,2,5-оксадиазол-3-ил)-1-этил-7-{[(3S)-3-пиперидинилметил]окси}-1H-имидазо[4,5-с]пиридин-4-ил)-2-метил-3-бутин-2-ол), SR13668 ((2,10-дикарбоэтокси-6-метокси-5,7-дигидроиндоло[2,3-b]карбазол), GSK2141795, перифозин, GSK21110183, XL418, XL147, PF-04691502, BEZ-235 [2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-с]хинолин-1-ил)фенил]пропионитрил], PX-866 ((уксусной кислоты (1S,4E,10R,11R,13S,14R)-[4-диаллиламинометилен-6-гидрокси-1-метоксиметил-10,13-диметил-3,7,17-триоксо-1,3,4,7,10,11,12,13,14,15,16,17-додекагидро-2-оксациклопента[a]фенантрен-11-иловый эфир)), D 106669, CAL-101, GDC0941 (2-(1H-индазол-4-ил)-6-(4-метансульфонилпиперазин-1-илметил)-4-морфолин-4-ил-тиено[3,2-d]пиримидин), SF1126, SF1188, SF2523, TG100-115 [3-[2,4-диамино-6-(3-гидроксифенил)птеридин-7-ил]фенол]. Ряд указанных ингибиторов, такие как, например, BEZ-235, PX-866, D 106669, CAL 101, GDC0941, SF1126, SF2523 также идентифицированы в данной области техники как ингибиторы PI3K/mTOR; дополнительные примеры, такие как PI-103 [3-[4-(4-морфолинилпиридо[3',2':4,5]фуро[3,2-d]пиримидин-2-ил]фенола гидрохлорид] хорошо известны специалистам в данной области техники. Дополнительные хорошо известные ингибиторы PI3K в композиции могут включать в себя LY294002 [2-(4-морфолинил)-8-фенил-4Н-1-бензопиран-4-он] и вортманнин. Ингибиторы mTOR, известные специалистам в данной области техники включают в себя темсиролимус, дефоролимус, сиролимус, эверолимус, зотаролимус и биолимус A9. Репрезентативное подмножество таких ингибиторов включает в себя темсиролимус, дефоролимус, зотаролимус и биолимус A9.
[0166] Ингибиторы HDAC в композиции могут включать в себя, но не ограничиваясь этим: (i) гидроксамовые кислоты, такие как трихостатин А, вориностат (субероиланилид-гидроксамовая кислота (SAHA)), панобиностат (LBH589) и белиностат (PXD101) (ii) циклические пептиды, такие как трапоксин B, и депсипептиды, такие как ромидепсин (NSC 630176), (iii) бензамиды, такие как МС-275 (3-пиридилметил-N-{4-[(2-аминофенил)карбамоил]бензил}карбамат), CI994 (4-ацетиламино-N-(2-аминофенил)-бензамид) и MGCD0103 (N-(2-аминофенил)-4-((4-(пиридин-3-ил)пиримидин-2-иламино)метил)бензамид), (iv) электрофильные кетоны, (v) соединения алифатических кислот, такие как фенилбутират и вальпроевая кислота. В одном варианте реализации изобретения ингибитор PI3K в композиции является иделализибом (CAL-101).
[0167] Ингибиторы Hsp90 в композиции могут включать в себя, но не ограничиваясь этим, бензохинон-анзамицины, такие как гелданамицин, 17 DMAG (17-диметиламиноэтиламино-17-дезметоксигелданамицин), танеспимицин (17 AAG, 17-аллиламино-17-дезметоксигелданамицин), EC5, ретаспимицин (IPI-504, 18,21-дидегидро-17-дезметокси-18,21-дидезоксо-18,21-дигидрокси-17-(2-пропениламино)-гелданамицин) и гербимицин; пиразолы, такие как CCT 018159 (4-[4-(2,3-дигидро-1,4-бензодиоксин-6-ил)-5-метил-1Н-пиразол-3-ил]-6-этил-1,3-бензолдиол); макролиды, такие как радикокол; а также BIIB021 (CNF2024), SNX-5422, STA-9090 и AUY922.
[0168] Ингибиторы CDK в композиции могут включать в себя, но не ограничиваясь этим, AZD-5438, BMI-1040, BMS-032, BMS-387, CVT-2584, флавопиридол, GPC-286199, MCS-5A, PD0332991, PHA-690509, селициклиб (CYC202, R-росковитин), ZK-304709 AT7519M, P276-00, SCH 727965, AG-024322, LEE011, LY2835219, P1446A-05, BAY 1000394, SNS-032. и т. п.
[0169] Ингибиторы CHK в композиции могут включать в себя, но не ограничиваясь этим, 5-(3-фторфенил)-3-уреидотиофен-N-[(S)-пиперидин-3-ил]-2-карбоксамид (AZD7762), 7-нитро-1H-индол-2-карбоновой кислоты {4-[1-(гуанидиногидразон)-этил]фенил}-амид (PV1019), 5-[(8-хлор-3-изохинолинил)амино]-3-[(1R)-2-(диметиламино)-1-метилэтокси]-2-пиразинкарбонитрил (SAR-020106), PF-00477736, CCT241533, 6-бром-3-(1-метил-1Н-пиразол-4-ил)-5-(3R)-3-пиперидинил-пиразоло[1,5-а]пиримидин-7-амин (SCH900776), 7-гидроксистауроспорин (UCN-01), 4-[((3S)-1-азабицикло[2.2.2]окт-3-ил)амино]-3-(1Н-бензимидазол-2-ил)-6-хлорхинолин-2(1Н)-он (CHIR 124), 7-аминодактиномицин (7-AAD), изогранулятимид, дебромгимениальдизин, N-[5-бром-4-метил-2-[(2S)-2-морфолинилметокси]-фенил]-N'-(5-метил-2-пиразинилмочевину) (LY2603618), сульфорафан (4-метилсульфинилбутилизотиоцианат), 9,10,11,12-тетрагидро-9,12-эпокси-1Н-дииндоло[1,2,3-fg:3',2',1'-kl]пирроло[3,4-i][1,6]бензодиазоцин-1,3(2H)-дион (SB-218078), TAT-S216A (синтетический пептид; YGRKKRRQRRRLYRSPAMPENL), CBP501 ((d-Bpa)sws(d-Phe-F5)(d-Cha)rrrqrr) и т. п.
[0170] Ингибиторы PARP в композиции могут включать в себя, но не ограничиваясь этим, 4-(3-(1-(циклопропанкарбонил)пиперазин-4-карбонил)-4-фторбензил)фталазин-1(2H)-он (олапариб, AZD2281, Ku-0059436), 2-[(2R)-2-метилпирролидин-2-ил]-1Н-бензимидазол-4-карбоксамид (велипариб, ABT-888), (8S,9R)-5-фтор-8-(4-фторфенил)-9-(1-метил-1Н-1,2,4-триазол-5-ил)-8,9-дигидро-2Н-пиридо[4,3,2-de]фталазин-3(7Н)-он (талазопариб, BMN 673), 4-йод-3-нитробензамид (инипариб, BSI-201), 8-фтор-5-(4-((метиламино)метил)фенил)-3,4-дигидро-2H-азепино[5,4,3-cd]индол-1(6H)-он-фосфорную кислоту (рукапариб, AG-014699, PF-01367338), 2-[4-[(диметиламино)метил]фенил]-5,6-дигидроимидазо[4,5,1-jk][1,4]бензодиазепин-7(4H)-он (AG14361), 3-аминобензамид (IΝΟ-1001), 2-(2-фтор-4-((S)-пирролидин-2-ил)фенил)-3Н-бензо[d]имидазол-4-карбоксамид (A-966492), N-(5,6-дигидро-6-оксо-2-фенантридинил)-2-ацетамида гидрохлорид (PJ34, PJ34 HCl), MK-4827, 3,4-дигидро-4-оксо-3,4-дигидро-4-оксо-N-[(1S)-1-фенилэтил]-2-хиназолинпропанамид (ME0328), 5-(2-оксо-2-фенилэтокси)-1(2H)-изохинолинон (UPF-1069), 4-[[4-фтор-3-[(4-метокси-1-пиперидинил)карбонил]фенил]метил]-1(2H)-фталазинон (AZD 2461) и т. п. В одном варианте реализации изобретения ингибитор PARP является олапарибом.
[0171] Различные другие агенты в композиции могут включать в себя алтретамин, триоксид мышьяка, нитрат галлия, гидроксимочевину, левамизол, митотан, октреотид, прокарбазин, сурамин, талидомид, фотодинамические соединения, такие как метоксален и натрий порфимер, и ингибиторы протеасомы, такие как бортезомиб.
[0172] Биологические терапевтические агенты в композиции могут включать в себя: интерфероны, такие как интерферон-α2a и интерферон-α2b, и интерлейкины, такие как алдеслейкин, денилейкин дифтитокс и опрелвекин.
[0173] В дополнение к противораковым агентам, предназначенным для борьбы с раковыми клетками, предусмотрены схемы комбинированной терапии, включающие применение защитных или вспомогательных агентов, в том числе: цитопротекторных агентов, таких как армифостин, дексразонксан и месна, фосфонатов, таких как пармидронат и золедроновая кислота, и стимулирующих факторов, таких как эпоэтин, дарбеопетин, филграстим, ПЭГ-филграстим и сарграмостим.
[0174] Ингибиторы ангиогенеза в композиции могут включать в себя ингибиторы эндотелий-специфической рецепторной тирозинкиназы (Tie-2), ингибиторы рецепторов эпидермального фактора роста (EGFR), ингибиторы фактора роста 2 инсулина (IGFR-2), ингибиторы матриксной металлопротеиназы-2 (MMP-2), ингибиторы матриксной металлопротеиназы-9 (MMP-9), ингибиторы рецептора фактора роста тромбоцитов (PDGFR), ингибиторы тромбоспондиновых аналогов рецепторной тирозинкиназы сосудистого эндотелиального фактора роста (VEGFR) и т. п.
[0175] Кроме того, ингибиторы ангиогенеза могут включать в себя, но не ограничиваясь этим, 2-метоксиэстрадиол, AG3340, приномастат, батимастат, BAY 12-9566, карбоксиамидотриазол, CC-1088, декстрометорфан-уксусную кислоту, диметилксантенон-уксусную кислоту, EMD 121974, эндостатин, IM-862, маримастат, матриксную металлопротеиназу, пеницилламин, PTK787/ZK 222584, RPI.4610, скваламин, скваламина лактат, 3-[2,4-диметилпиррол-5-ил-метил-иденил]-2-индолинон (SU5416), (±) талидомид, S-талидомид, R-талидомид, O-(хлорацетилкарбамоил)фумагиллол (TNP-470), комбретастатин, паклитаксел, тамоксифен, COL-3, неовастат, BMS-275291, SU6668, 2-ME, интерферон-альфа, антитело против VEGF, Medi-522 (Vitaxin II), CAI (ингибитор притока кальция), целекоксиб, интерлейкин-12, IM862, амиллорид, белок Angiostatin®, ангиостатин K1-3, ангиостатин K1-5, каптоприл, DL-альфа-дифторметилорнитин, DL-альфа-дифторметилорнитина HCl, белок His-Tag® Endostatin™, фумагиллин, гербимицин A, 4-гидроксифенилретинамид, гамма-интерферон, юглон, ламинин, ламинин гексапептид, ламинин пентапептид, лавендустин А, медроксипрогестерон, медроксипрогестерона ацетат, миноциклин, миноциклин HCl, плацентарный ингибитор рибонуклеазы, сурамин, натриевую соль сурамина, тромбоспондин тромбоцитов человека, тканевый ингибитор металлопротеиназы 1, тканевой ингибитор металлопротеиназы 1 нейтрофильных гранулоцитов, тканевой ингибитор металлопротеиназы 2 ревматоидных синовиальных фибробластов и т. п.
[0176] В конкретном варианте реализации изобретения Соединение А или его фармацевтически приемлемая соль, сложный эфир, сольват и/или его пролекарство и по меньшей мере один терапевтически активный агент могут быть составлены в виде одной фармацевтической композиции и/или комбинированной композиции. В другом варианте реализации изобретения композиция может содержать Соединение А или его фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство, как описано в данном документе, в количестве от около 5 мг до около 500 мг. В другом варианте реализации изобретения это количество составляет от около 20 до около 400 мг. В другом варианте реализации изобретения это количество составляет от около 50 мг до около 300 мг. В другом варианте реализации изобретения количество составляет от около 100 мг до около 200 мг.
[0177] В другом варианте реализации изобретения композиция может содержать Соединение А или его фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и ингибитор PARP. В другом варианте реализации изобретения ингибитор PARP является олапарибом.
[0178] В другом варианте реализации изобретения композиция может содержать Соединение А или его фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и олапариб, причем количество олапариба в композиции составляет от около 10 мг до около 800 мг. В другом варианте реализации изобретения количество олапариба составляет от около 20 мг до около 600 мг. В другом варианте реализации изобретения количество олапариба составляет от около 100 мг до около 500 мг. В другом варианте реализации изобретения количество олапариба составляет от около 300 до около 400 мг.
[0179] В другом варианте реализации изобретения композиция может содержать Соединение А или его фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и ингибитор PI3K. В другом варианте реализации изобретения ингибитор PI3K является иделализибом.
[0180] В другом варианте реализации изобретения композиция может содержать Соединение А или его фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и иделализиб, причем количество иделализиба в композиции составляет от около 10 мг до около 500 мг. В другом варианте реализации изобретения количество иделализиба составляет от около 40 мг до около 300 мг. В другом варианте реализации изобретения количество иделализиба составляет от около 75 мг до около 200 мг. В другом варианте реализации изобретения количество иделализиба составляет от около 100 мг до около 175 мг.
[0181] В другом варианте реализации изобретения композиция может содержать Соединение А или его фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и один или большее количество иммунотерапевтических агентов, которые индуцируют эндогенную выработку цитокинов. В другом варианте реализации изобретения цитокины представляют собой TNF-α и/или IFN-γ.
[0182] В другом варианте реализации изобретения композиция может содержать Соединение А или его фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и иммунотерапевтический агент, который индуцирует эндогенную выработку TNF-α, причем количество индуцированного TNF-α в микроокружении опухоли (например, физиологический уровень, измеренный с помощью ИФА) составляет от около 0,01 нг/мл до около 20 нг/мл. В другом варианте реализации изобретения количество TNF-α составляет от около 0,1 нг/мл до около 10 нг/мл. В другом варианте реализации изобретения количество TNF-α составляет от около 0,2 нг/мл до около 5 нг/мл. В другом варианте реализации изобретения количество TNF-α составляет от около 0,5 нг/мл до около 2 нг/мл. Индуцированное количество TNF-α может быть определено любым подходящим способом, таким как иммуноферментный анализ (ИФА).
[0183] В другом варианте реализации изобретения композиция может содержать Соединение А или его фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и иммунотерапевтический агент, который индуцирует эндогенную выработку IFN-γ, причем количество индуцированного IFN-γ в микроокружении опухоли (например, физиологический уровень, измеренный с помощью ИФА) составляет от около 0,01 нг/мл до около 20 нг/мл. В другом варианте реализации изобретения количество IFN-γ составляет от около 0,1 нг/мл до около 10 нг/мл. В другом варианте реализации изобретения количество IFN-γ составляет от около 0,2 нг/мл до около 5 нг/мл. В другом варианте реализации изобретения количество IFN-γ составляет от около 0,5 нг/мл до около 2 нг/мл. Индуцированное количество IFN-γ может быть определено любым подходящим способом, таким как иммуноферментный анализ (ИФА).
[0184] В другом варианте реализации изобретения композиция может содержать Соединение А или его фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и иммунотерапевтический агент, который индуцирует эндогенную секрецию TNF-α и IFN-γ в диапазонах, описанных выше.
[0185] В другом варианте реализации изобретения композиция может содержать Соединение А или его фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и иммунотерапевтический агент, которое индуцирует эндогенную секрецию TNF-α и/или IFN-γ в диапазонах, описанных выше, причем иммунотерапевтический агент представляет собой ингибитор PD-1. В другом варианте реализации изобретения композиция может содержать Соединение А или его фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и иммунотерапевтический агент, который индуцирует эндогенную секрецию TNF-α и/или IFN-γ в диапазонах, описанных выше, причем ингибитор PD-1 является ниволумабом. В конкретном варианте реализации изобретения концентрация ниволумаба в композиции составляет от около 1 мг/мл до около 50 мг/мл. В другом варианте реализации изобретения концентрация составляет от около 2,5 мг/мл до около 25 мг/мл. В другом варианте реализации изобретения концентрация составляет от около 5 мг/мл до около 15 мг/мл. В другом варианте реализации изобретения количество ниволумаба в композиции составляет от около 25 мг до около 1000 мг. В другом варианте реализации изобретения количество ниволумаба в композиции составляет от около 50 мг до около 500 мг. В другом варианте реализации изобретения количество ниволумаба в композиции составляет от около 150 мг до около 300 мг.
[0186] Фармацевтические приемлемые вспомогательные вещества могут быть добавлены к композиции/препарату. Например, разбавители могут быть добавлены к препаратам по данному изобретению. Разбавители увеличивают объем твердой фармацевтической композиции и/или комбинации и могут сделать фармацевтическую лекарственную форму, содержащую композицию и/или комбинацию, более удобной для пациента и лица, осуществляющего уход. Разбавители для твердых композиций и/или комбинаций включают в себя, например, микрокристаллическую целлюлозу (например, AVICEL), микронизированную целлюлозу, лактозу, крахмал, предварительно желатинизированный крахмал, карбонат кальция, сульфат кальция, сахар, декстраты, декстрин, декстрозу, двухосновный кальция фосфат дигидрат, трехосновный кальция фосфат, каолин, карбонат магния, оксид магния, мальтодекстрин, маннит, полиметакрилаты (например, EUDRAGIT(r)), хлорид калия, порошкообразную целлюлозу, хлорид натрия, сорбит и тальк.
[0187] Твердые фармацевтические композиции и/или комбинации, которые прессуют в лекарственную форму, такую как таблетка, могут включать в себя вспомогательные вещества, функции которых включают в себя содействие связыванию активного ингредиента и других вспомогательных веществ вместе после сжатия. Связующие вещества для твердых фармацевтических композиций и/или комбинаций включают в себя аравийскую камедь, альгиновую кислоту, карбомер (например, карбопол), натрий карбоксиметилцеллюлозу, декстрин, этилцеллюлозу, желатин, гуаровую камедь, трагакантовую камедь, гидрогенизированное растительное масло, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу (например, KLUCEL), гидроксипропилметилцеллюлозу (например, METHOCEL), жидкую глюкозу, силикат магния алюминия, мальтодекстрин, метилцеллюлозу, полиметакрилаты, повидон (например, KOLLIDON, PLASDONE), предварительно желатинизированный крахмал, альгинат натрия и крахмал.
[0188] Скорость растворения прессованной твердой фармацевтической композиции и/или комбинации в желудке пациента может быть увеличена путем добавления разрыхлителя к композиции и/или комбинации. Разрыхлители включают в себя альгиновую кислоту, кальций карбоксиметилцеллюлозу, натрий карбоксиметилцеллюлозу (например, AC-DI-SOL и PRIMELLOSE), коллоидный кремния диоксид, натрий кроскармеллозу, кросповидон (например, KOLLIDON и POLYPLASDONE), гуаровую камедь, алюмосиликат магния, метилцеллюлозу, микрокристаллическую целлюлозу, полакрилин калий, порошкообразную целлюлозу, предварительно желатинизированный крахмал, альгинат натрия, натрия крахмал гликолят (например, EXPLOTAB), картофельный крахмал и крахмал.
[0189] Могут быть добавлены глиданты для улучшения сыпучести неуплотненной твердой композиции и/или комбинации и для повышения точности дозирования. Вспомогательные вещества, которые могут выполнять функцию глидантов, включают в себя коллоидный кремния диоксид, трисиликат магния, порошкообразную целлюлозу, крахмал, тальк и трехосновный кальция фосфат.
[0190] Если лекарственную форму, такую как таблетка, получают путем прессования порошкообразной композиции и/или комбинации, то композиция и/или комбинация подвергаются давлению штампа и пуансона. Некоторые вспомогательные вещества и активные ингредиенты имеют тенденцию прилипать к поверхностям штампа и пуансона, что может привести к выкрашиванию и образованию других неровностей поверхности. Любрикант может быть добавлен к композиции и/или комбинации для уменьшения адгезии и облегчения извлечения продукта из штампа. Любриканты включают в себя стеарат магния, стеарат кальция, глицерилмоностеарат, глицерилпальмитостеарат, гидрогенизированное касторовое масло, гидрогенизированное растительное масло, минеральное масло, полиэтиленгликоль, бензоат натрия, лаурилсульфат натрия, стеарилфумарат натрия, стеариновую кислоту, тальк и стеарат цинка.
[0191] Ароматизаторы и усилители вкуса делают лекарственную форму более приятной для пациента. Распространенные ароматизаторы и усилители вкуса для фармацевтических продуктов, которые могут быть введены в композицию и/или комбинацию по данному изобретению, включают в себя мальтол, ванилин, этилванилин, ментол, лимонную кислоту, фумаровую кислоту, этилмальтол и винную кислоту.
[0192] Дополнительно, твердые и жидкие композиции и/или комбинации могут быть окрашены с применением любого фармацевтически приемлемого красителя для улучшения их внешнего вида и/или облегчения идентификации пациентом продукта и уровня дозы в лекарственной форме.
[0193] Жидкие фармацевтические композиции и/или комбинации могут быть получены с применением соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства по данному изобретению и любых других твердых вспомогательных веществ, причем компоненты растворяют или суспендируют в жидком носителе, таком как вода, растительное масло, спирт, полиэтиленгликоль, пропиленгликоль или глицерин.
[0194] Жидкие фармацевтические композиции и/или комбинации могут содержать эмульгаторы для равномерного диспергирования активного ингредиента или другого вспомогательного вещества, нерастворимого в жидком носителе, по всей композиции и/или комбинации. Эмульгирующие агенты, которые могут быть пригодными для жидких композиций и/или комбинаций по данному изобретению, включают в себя, например, желатин, яичный желток, казеин, холестерин, аравийскую камедь, трагакант, карраген, пектин, метилцеллюлозу, карбомер, кетостеариловый спирт и цетиловый спирт.
[0195] Жидкие фармацевтические композиции и/или комбинации могут дополнительно содержать агент, повышающий вязкость, для улучшения ощущения продукта во рту и/или покрытия выстилки желудочно-кишечного тракта. Такие агенты включают в себя аравийскую камедь, альгиновую кислоту, бентонит, карбомер, кальций или натрий карбоксиметилцеллюлозу, цетостеариловый спирт, метилцеллюлозу, этилцеллюлозу, желатин, гуаровую камедь, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, мальтодекстрин, поливиниловый спирт, повидон, пропиленкарбонат, пропиленгликоль альгинат, альгинат натрия, натрий крахмал гликолят, крахмал трагакант и ксантановую камедь.
[0196] Для улучшения вкуса могут быть добавлены подсластители, такие как аспартам, лактоза, сорбит, сахарин, сахарин натрия, сахароза, аспартам, фруктоза, маннит и инвертный сахар.
[0197] Консерванты и хелатирующие агенты, такие как спирт, бензоат натрия, бутилированный гидрокситолуол, бутилированный гидроксианизол и этилендиаминтетрауксусная кислота, могут быть добавлены в количествах, безопасных для приема внутрь, для улучшения стабильности при хранении.
[0198] Жидкая композиция и/или комбинация может дополнительно содержать буфер, такой как гуконовая кислота, молочная кислота, лимонная кислота или уксусная кислота, гуконат натрия, лактат натрия, цитрат натрия или ацетат натрия. Выбор вспомогательных веществ и применяемых количеств может быть с легкостью определен специалистом в области составления препаратов на основе опыта, стандартных процедур и справочных работ в данной области техники.
[0199] Твердые композиции и/или комбинации по данному изобретению включают в себя порошки, грануляты, агрегаты и прессованные композиции и/или комбинации. Дозировки включают в себя дозировки, подходящие для перорального, буккального, ректального, парентерального (включая подкожное, внутримышечное и внутривенное), ингаляционного и офтальмологического введения. Хотя наиболее подходящий способ введения в любом конкретном случае будет зависеть от природы и тяжести состояния, подлежащего лечению, наиболее предпочтительным способом по данному изобретению является пероральный. Дозировки могут быть традиционным образом представлены в стандартной дозированной лекарственной форме и получены любым из способов, хорошо известных из уровня техники в области фармации.
[0200] Лекарственные формы включают в себя твердые лекарственные формы, такие как таблетки, порошки, капсулы, суппозитории, саше, пастилки и лепешки, а также жидкие сиропы, суспензии, аэрозоли и эликсиры.
[0201] Лекарственная форма по данному изобретению может представлять собой капсулу, содержащую композицию и/или комбинацию, предпочтительно порошкообразную или гранулированную твердую композицию и/или комбинацию по изобретению в твердой или мягкой оболочке. Оболочка может быть изготовлена из желатина и необязательно содержать пластификатор, такой как глицерин и сорбит, и замутнитель или краситель.
[0202] Композицию и/или комбинацию для таблетирования или заполнения капсул можно приготовить путем влажной грануляции. При влажной грануляции некоторые или все активные ингредиенты и вспомогательные вещества в порошкообразной форме смешивают, а затем дополнительно перемешивают в присутствии жидкости, обычно воды, что ведет к образованию гранул из порошков. Гранулят просеивают и/или измельчают, сушат, а затем просеивают и/или измельчают до желаемого размера частиц. Гранулят может быть таблетирован или перед таблетированием могут быть добавлены другие вспомогательные вещества, такие как глидант и/или любрикант.
[0203] Композицию и/или комбинацию для таблетирования можно получить обычным способом, путем смешивания сухих веществ. Например, смешанная композиция и/или комбинация активных веществ и вспомогательных веществ могут быть уплотнены в форме заготовки или листа, а затем измельчены с получением уплотненных гранул. Далее уплотненные гранулы можно спрессовать в таблетку.
[0204] В качестве альтернативы сухому гранулированию, смешанную композицию и/или комбинацию можно прессовать непосредственно в прессованную лекарственную форму с применением технологий прямого прессования. Прямое прессование дает более однородную таблетку без гранул. Вспомогательные вещества, которые особенно хорошо подходят для таблетирования с прямым прессованием, включают в себя микрокристаллическую целлюлозу, высушенную распылением лактозу, дикальций фосфат дигидрат и коллоидный кремния диоксид. Надлежащее применение этих и других вспомогательных веществ в таблетировании с прямым прессованием известно специалистам в данной области техники с опытом и навыками в конкретных задачах составления препаратов с применением таблетирования с прямым прессованием.
[0205] Наполнитель для капсул по данному изобретению может содержать любую из вышеупомянутых смесей и гранулятов, которые были описаны со ссылкой на таблетирование; однако для них не проводят заключительный этап таблетирования.
[0206] Активный ингредиент и вспомогательные вещества могут быть составлены в виде композиций и/или комбинаций и лекарственных форм в соответствии со способами, известными в данной области техники.
[0207] В одном варианте реализации изобретения лекарственная форма может быть представлена в виде набора, включающего в себя соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство и фармацевтически приемлемые вспомогательные вещества и носители в качестве отдельных компонентов. В одном варианте реализации изобретения лекарственная форма может быть представлена в виде набора, включающего в себя соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство, по меньшей мере один дополнительный терапевтически активный агент и фармацевтически приемлемые вспомогательные вещества и носители в качестве отдельных компонентов. В некоторых вариантах реализации изобретения набор лекарственных форм позволяет врачам и пациентам составлять раствор для перорального введения или раствор для инъекций перед применением путем растворения, суспендирования или смешивания соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства с фармацевтически приемлемыми вспомогательными веществами и носителями. В одном варианте реализации изобретения набор лекарственных форм, который предоставляет соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство, обладает улучшенной стабильностью по сравнению с предварительно составленными препаратами соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства.
[0208] В одном варианте реализации изобретения соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемая соль, сложный эфир, сольват и/или пролекарство применяются в виде препарата. Соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемая соль, сложный эфир, сольват и/или пролекарство по данному изобретению можно применять в фармацевтических препаратах или композициях и/или комбинациях в виде отдельных компонентов или смесей вместе с другими формами соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения A. В одном варианте реализации изобретения фармацевтические композиции или композиции и/или комбинации по данному изобретению содержат 25-100% или 50-100% масс. по меньшей мере одного соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения A или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства, как описано в данном документе, в препарате, композиции и/или комбинации.
[0209] Терапевтическое применение
[0210] Данное изобретение дополнительно относится к лечению расстройств, связанных с клеточной пролиферацией. В одном варианте реализации изобретения предлагается способ избирательной активации белка р53, включающий в себя приведение клетки, пораженной расстройством, связанным с клеточной пролиферацией, в контакт с представленным соединением. В одном варианте реализации изобретения способ включает в себя приведение раковых и/или опухолевых клеток в контакт с соединением формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединением А или их фармацевтически приемлемой солью, сложным эфиром, сольватом и/или пролекарством, как раскрыто в данном документе. В другом варианте реализации изобретения способ включает в себя приведение раковых и/или опухолевых клеток в контакт с соединением формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединением А или их фармацевтически приемлемой солью, сложным эфиром, сольватом и/или пролекарством и по меньшей мере одним терапевтически активным агентом, как раскрыто в данном документе.
[0211] В другом варианте реализации изобретения способ приведения раковых и/или опухолевых клеток в контакт с соединением формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединением А или их фармацевтически приемлемой солью, сложный эфиром, сольватом и/или пролекарством, как описано в данном документе, может индуцировать апоптоз клеток или облегчать или предупреждать прогрессирование расстройства. В одном варианте реализации изобретения способ приведения раковых и/или опухолевых клеток в контакт с соединением формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединением A или их фармацевтически приемлемой солью, сложным эфиром, сольватом и/или пролекарством и по меньшей мере одним терапевтически активным агентом, как раскрыто в данном документе, может индуцировать апоптоз клеток или облегчать или предотвращать прогрессирование расстройства.
[0212] В другом варианте реализации изобретения способ приведения в контакт раковых и/или опухолевых клеток с соединением формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединением А или их фармацевтически приемлемой солью, сложным эфиром, сольватом и/или пролекарством, как описано в данном документе, может снижать частоту встречаемости рака и/или опухолевого роста. Кроме того, раскрыты способы лечения рака, раковых клеток, опухолей или опухолевых клеток. Неограничивающие примеры рака, который можно лечить способами согласно данному раскрытию, включают в себя рак или раковые клетки: ободочной и прямой кишки, молочной железы, яичника, шейки матки, легкого, печени, поджелудочной железы, лимфатического узла, толстой кишки, предстательной железы, головного мозга, головы и шеи, кожи, почки, кости (например, саркома Юинга) и крови и сердца (например, лейкоз, лимфома, карцинома). Неограничивающие примеры опухолей, которые можно лечить способами согласно данному раскрытию, включают в себя опухоли и опухолевые клетки: ободочной и прямой кишки, молочной железы, яичника, шейки матки, легкого, печени, поджелудочной железы, лимфатического узла, толстой кишки, предстательной железы, головного мозга, головы и шеи, кожи, почки, кости (например, саркома Юинга) и крови и сердца (например, лейкоз, лимфома, карцинома).
[0213] В одном варианте реализации данное изобретение относится к способу уменьшения или ингибирования клеточной пролиферации и/или к способу лечения рака, включающему в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества по меньшей мере одного соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и ингибитора PI3K. В одном варианте реализации различных способов, описанных в данном документе, совместное введение включает в себя Соединение А и ингибитор PI3K. В одном варианте реализации изобретения совместное введение для любого способа, описанного в данном документе, включает в себя Соединение А и иделализиб.
[0214] В одном варианте реализации данное изобретение относится к способу уменьшения или ингибирования клеточной пролиферации и/или к способу лечения рака, включающему в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества по меньшей мере одного соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и ингибитора PARP. В одном варианте реализации различных способов, описанных в данном документе, совместное введение включает в себя Соединение А и ингибитор PARP. В одном варианте реализации изобретения совместное введение для любого способа, описанного в данном документе, включает в себя Соединение А и олапариб.
[0215] В одном варианте реализации данное изобретение относится к способу уменьшения или ингибирования клеточной пролиферации и/или к способу лечения рака, включающему в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества по меньшей мере одного соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и цитокинов, В одном варианте реализации различных способов, описанных в данном документе, совместное введение включает в себя Соединение А и цитокины. В одном варианте реализации изобретения совместное введение для любого способа, описанного в данном документе, включает в себя Соединение А и TNF-α. В другом варианте реализации изобретения совместное введение для любого способа, описанного в данном документе, включает в себя Соединение А и IFN-γ. В другом варианте реализации изобретения способы могут включать в себя уменьшение или ингибирование клеточной пролиферации и/или способ лечения рака, включающий в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и по меньшей мере одного терапевтически активного агента в одной фармацевтической композиции и/или комбинированной композиции. В одном варианте реализации изобретения способы могут включать в себя уменьшение или ингибирование клеточной пролиферации и/или способ лечения рака, включающий в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства, как описано в данном документе, в количестве от около 5 мг до около 500 мг. В другом варианте реализации изобретения это количество составляет от около 20 до около 400 мг. В другом варианте реализации изобретения это количество составляет от около 50 мг до около 300 мг. В другом варианте реализации изобретения это количество составляет от около 100 мг до около 200 мг.
[0216] В другом варианте реализации изобретения способы могут включать в себя уменьшение или ингибирование клеточной пролиферации и/или способ лечения рака, включающий в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и ингибитора PARP. В другом варианте реализации изобретения ингибитор PARP является олапарибом.
[0217] В другом варианте реализации изобретения способы могут включать в себя уменьшение или ингибирование клеточной пролиферации и/или способ лечения рака, включающий в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и олапариба, причем количество олапариба в композиции составляет от около 10 мг до около 800 мг. В другом варианте реализации изобретения количество олапариба составляет от около 20 мг до около 600 мг. В другом варианте реализации изобретения количество олапариба составляет от около 100 мг до около 500 мг. В другом варианте реализации изобретения количество олапариба составляет от около 300 до около 400 мг.
[0218] В другом варианте реализации изобретения способы могут включать в себя уменьшение или ингибирование клеточной пролиферации и/или способ лечения рака, включающий в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и ингибитора PI3K. В другом варианте реализации изобретения ингибитор PI3K является иделализибом.
[0219] В другом варианте реализации изобретения способы могут включать в себя уменьшение или ингибирование клеточной пролиферации и/или способ лечения рака, включающий в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и иделализиба, причем количество иделализиба в композиции составляет от около 10 мг до около 500 мг. В другом варианте реализации изобретения количество иделализиба составляет от около 40 мг до около 300 мг. В другом варианте реализации изобретения количество иделализиба составляет от около 75 мг до около 200 мг. В другом варианте реализации изобретения количество иделализиба составляет от около 100 мг до около 175 мг.
[0220] В другом варианте реализации изобретения способы могут включать в себя уменьшение или ингибирование клеточной пролиферации и/или способ лечения рака, включающий в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и иммунотерапевтического агента, который модулирует эндогенную секрецию одного или большего количества цитокинов. В другом варианте реализации изобретения цитокины представляют собой TNF-α и/или IFN-γ.
[0221] В другом варианте реализации изобретения способы могут включать в себя уменьшение или ингибирование клеточной пролиферации и/или способ лечения рака, включающий в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и иммунотерапевтического агента, который индуцирует эндогенную секрецию TNF-α, причем количество индуцированного TNF-α составляет от около 0,01 нг/мл до около 20 нг/мл. В другом варианте реализации изобретения количество индуцированного TNF-α составляет от около 0,1 нг/мл до около 10 нг/мл. В другом варианте реализации изобретения количество индуцированного TNF-α составляет от около 0,2 нг/мл до около 5 нг/мл. В другом варианте реализации изобретения количество индуцированного TNF-α составляет от около 0,5 нг/мл до около 2 нг/мл. Индуцированную эндогенную выработку TNF-α можно количественно определить любым подходящим способом, таким как ИФА.
[0222] В другом варианте реализации изобретения способы могут включать в себя уменьшение или ингибирование клеточной пролиферации и/или способ лечения рака, включающий в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и иммунотерапевтического агента, который индуцирует эндогенную секрецию IFN-γ, причем количество индуцированного IFN-γ составляет от около 0,01 нг/мл до около 20 нг/мл. В другом варианте реализации изобретения количество индуцированного IFN-γ составляет от около 0,1 нг/мл до около 10 нг/мл. В другом варианте реализации изобретения количество индуцированного IFN-γ составляет от около 0,2 нг/мл до около 5 нг/мл. В другом варианте реализации изобретения количество индуцированного IFN-γ составляет от около 0,5 нг/мл до около 2 нг/мл. Индуцированную эндогенную выработку IFN-γ можно количественно определить любым подходящим способом, таким как ИФА.
[0223] В другом варианте реализации изобретения способы могут включать в себя уменьшение или ингибирование клеточной пролиферации и/или способ лечения рака, включающий в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или его пролекарства и иммунотерапевтического агента, который индуцирует эндогенную секрецию TNF-α и/или IFN-γ в диапазонах, описанных выше.
[0224] В другом варианте реализации изобретения способы могут включать в себя уменьшение или ингибирование клеточной пролиферации и/или способ лечения рака, включающий в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и иммунотерапевтического агента, который индуцирует эндогенную секрецию TNF-α и/или IFN-γ в диапазонах, описанных выше, причем иммунотерапевтический агент является ингибитором PD-1. В другом варианте реализации изобретения способы могут включать в себя уменьшение или ингибирование клеточной пролиферации и/или способ лечения рака, включающий в себя совместное введение пациенту, нуждающемуся в этом, терапевтически эффективного количества Соединения А или фармацевтически приемлемой соли, сложного эфира, сольвата и/или его пролекарства и иммунотерапевтического агента, который индуцирует эндогенную секрецию TNF-α и/или IFN-γ в диапазонах, описанных выше, причем ингибитор PD-1 является ниволумабом. В конкретном варианте реализации изобретения концентрация ниволумаба в композиции составляет от около 1 мг/мл до около 50 мг/мл. В другом варианте реализации изобретения концентрация составляет от около 2,5 мг/мл до около 25 мг/мл. В другом варианте реализации изобретения концентрация составляет от около 5 мг/мл до около 15 мг/мл. В другом варианте реализации изобретения количество ниволумаба в композиции составляет от около 25 мг до около 1000 мг. В другом варианте реализации изобретения количество ниволумаба в композиции составляет от около 50 мг до около 500 мг. В другом варианте реализации изобретения количество ниволумаба в композиции составляет от около 150 мг до около 300 мг.
[0225] В одном варианте реализации изобретения совместное введение пациенту Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства с олапарибом, иделализибом или иммунотерапевтическим агентом, который индуцирует эндогенную секрецию TNF-α и/или IFN-γ в его организме, можно осуществлять один раз в сутки, два раза в сутки, три раза в сутки, четыре раза в сутки, пять раз в сутки, шесть раз в сутки, семь раз в сутки, восемь раз в сутки, девять раз в сутки или десять раз в сутки.
[0226] В некоторых вариантах реализации изобретения рак, который можно лечить способами, представленными в данном раскрытии, представляет собой рак с дефицитом зависимой от гомологичной рекомбинации репарации разрывов двойной цепи дезоксирибонуклеиновой кислоты (ГР-зависимая репарация РДЦ ДНК), также называемый раком ГРД (HRD). В некоторых вариантах реализации изобретения рак с дефицитом ГР-зависимой репарации РДЦ ДНК идентифицируют путем определения активности ГР-зависимой репарации РДЦ ДНК в раковых клетках, полученных от субъекта.
[0227] В одном варианте реализации изобретения композиции и/или комбинации, раскрытые в данном документе, пригодны для лечения рака ГРД. В одном варианте реализации изобретения совместное введение эффективного количества по меньшей мере одного соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и по меньшей мере одного терапевтически активного агента может быть пригодным для лечения рака ГРД. В другом варианте реализации изобретения совместное введение эффективного количества по меньшей мере одного соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и по меньшей мере одного терапевтически активного агента, выбранного из ингибитора PI3K, ингибитора PARP и цитокинов, может быть пригодным для лечения рака ГРД. В другом варианте реализации изобретения совместное введение Соединения А и по меньшей мере одного терапевтически активного агента, выбранного из ингибитора PI3K, ингибитора PARP и цитокинов, может быть пригодным для лечения рака ГРД.
[0228] Данное изобретение дополнительно относится к способам лечения, профилактики, облегчения и/или смягчения у субъекта прогресса нарушений или состояний, характеризующихся клеточной пролиферацией. Более конкретно, способы по данному изобретению включают в себя введение субъекту эффективного количества хинолоновых соединений, описанных в данном документе, для лечения расстройства или состояния, характеризующегося клеточной пролиферацией. Соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство можно вводить в количестве, эффективном для избирательной активизации белков р53 в раковых и/или опухолевых клетках, что может привести к гибели или апоптозу клеток. Термины «субъект» и «пациент» используются взаимозаменяемо по всему тексту заявку.
[0229] Как используется в данном документе, введение может быть осуществлено или проведено с применением любого из различных способов, известных специалистам в данной области техники. Соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемая соль, сложный эфир, сольват и/или его пролекарство можно вводить, например, подкожно, внутривенно, парентерально, внутрибрюшинно, внутрикожно, внутримышечно, местно, энтерально (например, перорально), ректально, назально, буккально, сублингвально, вагинально, в виде ингаляционного спрея, с помощью насоса для лекарственных средств или через имплантированный резервуар, в лекарственных формах, содержащих обычные нетоксичные, физиологически приемлемые носители или основы.
[0230] Кроме того, раскрытое в данном документе соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство, можно вводить в локализованную область, нуждающуюся в лечении. Это может быть достигнуто, для примера, а не в качестве ограничения, с помощью локальной инфузии в ходе хирургического вмешательства, местного нанесения, трансдермальных пластырей, инъекции, катетера, суппозитория или импланта (имплант необязательно может быть изготовлен из пористого, непористого или гелеподобного материала), включая мембраны, такие как сиаластиковые мембраны или волокна.
[0231] Форма, в которой вводят соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство (например, сироп, эликсир, капсула, таблетка, пены, эмульсия, гель и т. д.) будут частично зависеть от способа введения. Например, для слизистой оболочки (например, слизистой оболочки полости рта, прямой кишки, слизистой оболочки кишечника, слизистой оболочки бронхов) могут применяться назальные капли, аэрозоли, средства для ингаляций, небулайзеры, глазные капли или суппозитории. Кроме того, соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство, можно применять для покрытия биоимплантируемых материалов с целью роста нейритов, выживания нервов или клеточного взаимодействия с поверхностью импланта. Соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство, описанные в данном документе, можно вводить вместе с другими биологически активными агентами, такими как противораковые агенты, анальгетики, противовоспалительные агенты, анестетики и другие агенты, способные контролировать один или большее количество симптомов или причин расстройства или состояния, характеризующегося клеточной пролиферацией.
[0232] В одном варианте реализации изобретения соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или его пролекарство и дополнительный терапевтически активный агент можно вводить вместе со вторым терапевтически активным агентом или более. В одном варианте реализации изобретения второй терапевтически активный агент представляет собой противораковый агент. В некоторых вариантах реализации изобретения один или большее количество терапевтически активных противораковых агентов включают в себя, но не ограничиваясь этим, паклитаксел, винбластин, винкристин, этопозид, доксорубицин, герцептин, лапатиниб, гефитиниб, эрлотиниб, тамоксифен, фулвестрант, анастразол, лектрозол, экземестан, фадрозол, циклофосфамид, таксотер, мелфалан, хлорамбуцил, мехлорэтамин, хлорамбуцил, фенилаланин, производные ипритного азота, циклофосфамид, ифосфамид, кармустин (BCNU), ломустин (CCNU), стрептозотоцин, бусульфан, тиотепа, цисплатин, карбоплатин, дактиномицин (актиномицин D), доксорубицин (адриамицин) даунорубицин, идарубицин, митоксантрон, пликамицин, митомицин С, блеомицин, их комбинации и т. п.
[0233] Кроме того, введение может включать в себя введение субъекту нескольких доз на протяжении подходящего периода времени. Такие схемы введения могут быть определены шаблонными способами после рассмотрения данного раскрытия.
[0234] Соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство по изобретению, как правило, вводят в дозе от около 0,01 мг/кг/дозу до около 100 мг/кг/дозу. В качестве альтернативы, доза может составлять от около 0,1 мг/кг/дозу до около 10 мг/кг/дозу; или от около 1 мг/кг/дозу до 10 около мг/кг/дозу. Для удобства можно применять препараты с контролируемым высвобождением, или дозу можно вводить разделенной не несколько приемов. Если применяются другие способы (например, внутривенное введение), то соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство вводят в пораженную ткань со скоростью от около 0,05 до около 10 мг/кг/час, в качестве альтернативы, от около 0,1 до около 1 мг/кг/час. Такие значения скорости введения можно с легкостью поддерживать в случае внутривенного введения соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов, или Соединения A или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства, как описано в данном документе. Обычно, препараты для местного применения вводят в диапазоне доз от около 0,5 мг/кг/дозу до около 10 мг/кг/дозу. В качестве альтернативы, препараты для местного применения вводят в дозе около 1 мг/кг/дозу до около 7,5 мг/кг/дозу или даже от около 1 мг/кг/дозу до около 5 мг/кг/дозу.
[0235] Для однократного введения подходит диапазон доз от около 0,1 до около 100 мг/кг. Непрерывное введение будет подходящим в диапазоне от около 0,05 до около 10 мг/кг.
[0236] Кроме того, дозы лекарственного средства скорее могут быть указаны в миллиграммах на квадратный метр площади поверхности тела, а не на массу тела, поскольку этот метод обеспечивает хорошую корреляцию с некоторыми метаболическими и экскреторными функциями. Кроме того, площадь поверхности тела может применяться как общий знаменатель дозы лекарственного средства у взрослых и детей, а также у разных видов животных (Freireich et al., (1966) Cancer Chemother Rep. 50, 219-244). Вкратце, чтобы выразить дозу в мг/кг у любого данного вида в виде эквивалентной дозы в мг/кв.м, дозу умножают на соответствующий коэффициент km. У взрослого человека 100 мг/кг эквивалентно 100 мг/кг × 37 кг/кв.м=3700 мг/м2.
[0237] Лекарственная форма по данному изобретению может содержать соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство, как описано в данном документе, в количестве от около 5 до около 500 мг. Другими словами, лекарственная форма по данному изобретению может содержать Соединение А в количестве около 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 55 мг, 60 мг, 65 мг, 70 мг, 75 мг, 80 мг, 85 мг, 90 мг, 95 мг, 100 мг, 110 мг, 120 мг, 125 мг, 130 мг, 140 мг, 150 мг, 160 мг, 170 мг, 175 мг, 180 мг, 190 мг, 200 мг, 210 мг, 220 мг, 225 мг, 230 мг, 240 мг, 250 мг, 260 мг, 270 мг, 275 мг, 280 мг, 290 мг, 300 мг, 310 мг, 320 мг, 325 мг, 330 мг, 340 мг, 350 мг, 360 мг, 370 мг, 375 мг, 380 мг, 390 мг, 400 мг, 410 мг, 420 мг, 425 мг, 430 мг, 440 мг, 450 мг, 460 мг, 470 мг, 475 мг, 480 мг, 490 мг или 500 мг.
[0238] Лекарственную форму по данному изобретению можно вводить ежечасно, ежедневно, еженедельно или ежемесячно. Лекарственную форму по данному изобретению можно вводить два раза в сутки или один раз в сутки. Лекарственную форму по данному изобретению можно вводить с пищей или без пищи.
[0239] В том случае, когда соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или фармацевтически приемлемая соль, сложный эфир, сольват и/или пролекарство, описанные в данном документе, могут принимать форму миметика или его фрагмента, необходимо понимать, что активность и, следовательно, дозировка эффективного количества могут варьироваться. Однако специалист в данной области техники может с легкостью оценить активность соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства конкретного типа, предусмотренного данной заявкой.
[0240] В установках постепенного прогрессирующего нарушения или состояния, характеризующегося клеточной пролиферацией, соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение А или их фармацевтически приемлемую соль, сложный эфир, сольват и/или пролекарство, и по меньшей мере один дополнительный терапевтически активный агент обычно вводят на постоянной основе. В некоторых случаях введение соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения A или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и по меньшей мере одного дополнительного терапевтически активного агент, раскрытых в данном документе, может быть начато до развития симптомов заболевания как часть стратегии отодвигания во времени или предупреждения заболевания. В других случаях, соединение формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединение A или их фармацевтически приемлемую соль, сложный эфир, сольват и/или его пролекарство и по меньшей мере один дополнительный терапевтически активный агент, описанные в данном документе, вводят после появления симптомов болезни как часть стратегии замедления или обращения патологического процесса и/или часть стратегии улучшения клеточной функции и уменьшения симптомов.
[0241] Специалисту в данной области техники будет понятно, что диапазон доз будет зависеть от конкретного соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и по меньшей мере одного дополнительного терапевтически активного агента и их активности. Предполагается, что диапазон доз будет достаточно широким, чтобы достичь желаемого эффекта, при котором нейродегенеративное или другое расстройство и связанные с ним симптомы облегчаются и/или достигается выживание клеток, но не настолько широк, чтобы вызвать неуправляемые побочные эффекты, Однако необходимо понимать, что удельный уровень дозы для любого конкретного пациента будет зависеть от множества факторов, включая активность конкретного соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства; возраст, массу тела, общее состояние здоровья, пол и рацион индивидуума, подлежащего лечению; время и способ введения; скорость выделения; введение других препаратов в анамнезе; и степень тяжести конкретного заболевания, подлежащего лечению, как хорошо известно специалистам в данной области техники. Кроме того, в случае любого осложнения дозы может корректировать лечащий врач. При применении Соединения А, раскрытого в данном документе, в соответствии с данной заявкой не ожидается никаких неприемлемых токсикологических эффектов.
[0242] Эффективное количество соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения A или их фармацевтически приемлемой соли, сложного эфира, сольвата и/или его пролекарства и по меньшей мере одного дополнительного терапевтически активного агента, раскрытых в данном документе, включает количества, достаточные для получения измеримого биологического ответа. Фактические уровни доз активных ингредиентов по данному изобретению могут варьироваться таким образом, чтобы вводить количество соединения формулы (I), (IA), (IB), (II), (IIA), (III), (IIIA) и/или их подклассов или Соединения А или его фармацевтически приемлемой соли, сложного эфира, сольвата и/или пролекарства и по меньшей мере одного дополнительного терапевтически активного агента, эффективное для достижения желаемого терапевтического ответа в случае конкретного субъекта и/или применения. Предпочтительно вводить минимальную дозу, с повышением дозы в случае отсутствия ограничивающей дозу токсичности до минимально эффективного количества. Способы определения и корректировки терапевтически эффективной дозы, а также оценки того, когда и каким образом осуществлять такую корректировку, известны специалистам в данной области техники.
[0243] Следующие примеры дополнительно иллюстрируют данное изобретение, но не должны интерпретироваться как ограничивающие его объем каким-либо образом.
ПРИМЕРЫ
[0244] Пример 1: Анализ антипролиферативной активности
[0245] Три линии клеток лимфомы человека Toledo, MC116 и HT были приобретены в Центре сбора и исследования биоресурсов (BCRC, Тайвань). Все клетки инкубировали в увлажненной атмосфере, содержащей 5% СО2, при 37 ° С.
[0246] CAL-101, также известный как иделализиб, представляет собой ингибитор PI3K-дельта с потенциальной иммуномодулирующей и противоопухолевой активностью. Противораковую активность комбинации соединения A и CAL-101 на трех клеточных линиях лимфомы человека (Toledo, MC116, HT) оценивали с применением анализа пролиферации клеток in vitro. Клеточную пролиферацию обработанных лекарственным средством раковых клеток человека определяли через 96 часов после обработки с применением колориметрического анализа MTS (Promega). Значения ингибирующей концентрации 50% (IC50) и IC 25% (IC25) для исследуемого соединения вычислены с применением программного обеспечения GraphPad Prism. Антипролиферативный эффект Соединения А в отдельности и в составе комбинированной обработки на трех клеточных линиях приведен в Табл. 1-4.
[0247] Скорректированные значения поглощения были получены путем вычитания средней оптической плотности контрольных лунок на длине волны 490 нм (только среда, без клеток) из всех других значений поглощения. Процентное ингибирование клеточного роста для обработки соединением вычислено по следующей формуле:

[0248] Сигмоидальную кривую дозы-реакции получают аппроксимацией процентного значения ингибирования как функции логарифма концентрации соединения с применением программного обеспечения GraphPad Prism. Значения IC50 определяют как концентрацию, необходимую для 50% ингибирования клеточного роста. Значения IC25 определяют как концентрацию, необходимую для 25% ингибирования клеточного роста. Все данные представляют результаты трех параллельных экспериментов.
[0249] Обработка только соединением
[0250] Результаты показывают, что Соединение А эффективно ингибирует клеточную пролиферацию во всех трех клеточных линиях лимфомы человека со значениями IC50, варьирующими от 45,9 до 723,1 нМ. Соединение А проявляло наиболее выраженный ингибирующий эффект на клетке Toledo (IC50 составляет 45,9 нМ) и было менее активным в отношении клеток MC116 и HT (IC50 составляет 723,1 и 525,5 нМ, соответственно). CAL-101 оказывает антипролиферативное действие только в отношении клетки Toledo (IC50 составляет 76,0 нМ) и нечувствителен к другим двум клеточным линиям (IC50 более чем 10 мкМ). Оценен антипролиферативный эффект Соединения A или CAL-101, и оценочные значения IC50 и IC25 суммированы в Табл. 1.
[0251] Таблица 1. Оценочные значения IC50 и IC25 для обработки одним лекарственным средством на 3 клеточных линиях
[0252] Оценочные значения IC50 и IC25 вычислены на основе нелинейной регрессии кривых зависимости дозы-реакции коэффициента клеточной пролиферации (%), как функция логарифма концентраций лекарственного средства при обработке одним соединением.
[0253] Двухкомпонентная комбинированная обработка
[0254] Двухкомпонентную комбинированную обработку для определения клеточной пролиферации проводили с применением трех клеточных линий лимфомы человека (Toledo, MC116 и HT). CAL-101 объединяли с соединением А в концентрации, близкой к их оценочным IC50 и IC25. Антипролиферативный эффект Соединения А в отдельности и при комбинированной обработке на трех клеточных линиях приведен в Табл. 2-4. Как показало значение IC25, комбинированная обработка Соединением А и CAL-101 синергетически усиливает антипролиферативную активность в отношении клеток MC116 и HT.
[0255] Таблица 2. Антипролиферативная активность Соединения А в отдельности и при комбинированной обработке клеточных линий Toledo
*Ингибирование (%) представлено значением IC50 для ингибирования пролиферации клетки Toledo.
[0256] Таблица 3. Антипролиферативная активность Соединения А в отдельности и при комбинированной обработке на клеточных линиях MC116
*Ингибирование (%) представлено значением IC50 для ингибирования пролиферации клетки MC116.
[0257] Таблица 4. Антипролиферативная активность Соединения А в отдельности и при комбинированной обработке клеточных линий HT
*Ингибирование (%) представлено значением IC50 для ингибирования пролиферации клетки HT.
[0258] Пример 2: Анализ экспериментов с комбинацией
[0259] Взаимодействие комбинаций согласно матрице доз определяли на модели аддитивности Лоу с применением программного обеспечения для анализа комбинаций Chalice™ от Horizon, как описано в руководстве пользователя: (http://chalice.horizondiscovery.com/chalice-portal/documentation/analyzer/home.jsp).
[0260] Синергию определяют путем сравнения экспериментально наблюдаемого уровня ингибирования в точке каждой комбинации со значением, ожидаемым для аддитивности, которое получено на основе ответов на отдельные агенты вдоль осей матрицы. С применением Chalice™, потенциальные синергетические взаимодействия визуализируют путем нанесения на график расчетного избыточного ингибирования над ожидаемым в каждой контрольной точке матрицы в виде теплокарты, где более яркие/более теплые цвета указывают на более высокие уровни активности.
[0261] Общее взаимодействие комбинаций может быть оценено с применением простого балла объема, получаемого вычислением объема между измеренной и предсказанной поверхностью ответа. Такая оценка объема показывает, является ли общий ответ на комбинацию синергетическим (положительные значения), антагонистическим (отрицательные значения) или аддитивным (значения ~ 0).
[0262] Изучение комбинаций лекарственных средств
[0263] Эффект сочетания Соединения А с олапарибом оценивали на родительских DLD1 и изогенных DLD1-BRCA2 (-/-) клеточных линиях в матрице концентраций с применением аддитивной модели Лоу с программным обеспечением для анализа комбинаций Chalice™ от Horizon. Активность соединений оценивали для кратковременной (48 час) и длительной (6 дней, 144 час) обработки.
[0264] С применением Chalice™, потенциальные синергетические взаимодействия визуализируют путем нанесения на график расчетного избыточного ингибирования над ожидаемым в каждой контрольной точке матрицы в виде теплокарты, где более яркие/более теплые цвета указывают на более высокие уровни активности (Фиг. 1A-B и 2A-B).
[0265] Баллы объема для этой комбинации на обеих клеточных линиях были положительными, и это еще раз подтверждает, что взаимодействие является синергетическим (положительные значения) и (значения ~ 0). Баллы объема и синергии для комбинации на обеих линиях приведены на Фиг. 1C-D и 2C-D и в Табл. 5.
[0266] Валидация комбинированного лечения ингибитором PARP и Соединением А in vivo
[0267] По сравнению с лечением только ингибитором PARP олапарибом, комбинированная терапия олапарибом (50 мг/кг) и Соединением А (50 мг/кг) значительно ингибировала рост опухоли в случае BRCA2-дефицитного тройного отрицательного рака молочной железы, ТОРМЖ (TNBC) на модели полученного от пациента ксенотрансплантата, ППК (PDX) (Фиг. 3A-3B), подтверждая, что способность Соединения A к синергизму с ингибитором PARP (PARPi) in vivo связана с путями репарации ДНК в опухолях. Кроме того, мы лечили мышей с имплантированными ксенотрансплантатами ТОРМЖ олапарибом (50 мг, один раз в сутки x 28), с 2 последующими дозами Соединения A (50 мг раз в неделю x 2), а затем 7 последующими дозами олапариба (50 мг, один раз в сутки x 7) (Фиг. 3В-3С). Двухстадийная система лечения, включающая в себя предварительное лечение олапарибом (Фиг. 3B) или последующее лечение (Фиг. 3C), продемонстрировала выраженную противоопухолевую активность.
[0268] Таблица 5: Баллы объема и синергии для комбинации на родительских DLD1 и изогенных BRCA2 (-/-) клеточных линиях
Объемы Лоу:
[0269] Пример 3: Анализ антипролиферативной активности
[0270] BRCA1-отрицательная (UWB1.289-2945) и BRCA1-положительная (UWB1.289) клеточные линии рака яичника человека были приобретены в Американской коллекции типовых культур, АТКК (АТСС). Указанные клетки инкубировали в увлажненной атмосфере, содержащей 5% CO2, при 37 °C.
[0271] Противораковую активность Соединения А на BRCA1-отрицательных и BRCA1-положительных клеточных линиях рака яичника человека дополнительно оценивали с применением анализа пролиферации клеток in vitro. Клеточную пролиферацию обработанной лекарственным средством раковой клетки человека определяли через 72 часа после обработки с применением люминесцентного анализа жизнеспособности клеток CellTiter-Glo® (Promega). Значения IC50 определяют как концентрацию, необходимую для 50% ингибирования роста клеток и вычисляют в GraphPad. Антипролиферативный эффект Соединения А в отдельности и в комбинации с цитокинами в отношении указанных двух клеточных линий изображен на Фиг. 4-6.
[0272] Процентное ингибирование роста клеток при обработке соединениями вычисляли с применением следующей формулы:
% мертвых клеток =

[0273] Данные обрабатывали с помощью встроенного макроса Excel. Жизнеспособность/пролиферацию клеток выражали как % мертвых клеток относительно среднего сигнала необработанных контрольных лунок соответствующего планшета. Завышенные значения (в трех параллельных экспериментах) были отклонены во ходе контроля качества, КК (QC). Обработанные данные наносили на график с помощью программного обеспечения Graphpad. Статистический анализ проводили с помощью Excel (Microsoft), а сравнение двух групп осуществляли с применением t-критерия Стьюдента. Все данные представляют результаты трех параллельных экспериментов.
[0274] Как изображено на Фиг. 4 и B, BRCA1-отрицательная клеточная линия (Фиг. 5A-B) более чувствительна к Соединению A, чем BRCA1-положительная клеточная линия (Фиг. 4A-B). Соединение А ингибировало пролиферацию BRCA1-отрицательных клеточных линий рака яичника человека со значениями IC50 от около 2,34 ± 1,67 нМ до 3,78 ± 2,24 нМ. В отношении BRCA1-положительной клеточной линии рака яичника UWB1.289, Соединение A демонстрирует тенденцию к дозозависимой клеточной токсичности. Однако максимальная токсичность, наблюдаемая при самой высокой концентрации (100 нМ), не превышает 40%. Таким образом, IC50 не может быть вычислена.
[0275] Ранние исследования блокады CTLA-4 продемонстрировали, что обработка in vivo индуцирует увеличение популяций CD8+ T-клеток памяти, способных вырабатывать внутриклеточные цитокины. В данном случае применяли два типа цитокинов, TNF-α и IFN-γ (0, 0,008, 0,04, 0,2, 1, 5 нг/мл) в сочетании с Соединением A.
[0276] Оба цитокина, TNF-α и IFN-γ сами по себе демонстрируют минимальную, но возрастающую тенденцию к клеточной токсичности в отношении клеточных линий рака яичников с увеличением дозы. Анализы комбинаций лекарственных средств проводили с применением BRCA1-отрицательных и BRCA1-положительных клеточных линий рака яичника человека. В присутствии Соединения A два указанных цитокина, TNF-α и IFN-γ, демонстрируют аддитивное действие на клеточную токсичность на BRCA1-отрицательных клетках рака яичника человека. Фиг. 6А-6В демонстрируют кривые зависимости дозы-ответа для влияния TNF-α и IFN-γ с различными концентрациями Соединения А на BRCA1-отрицательные клетки.
[0277] Пример 4: Фармацевтическая комбинация Соединения А и иммунотерапевтического агента
[0278] Как показано в Примере 3, в присутствии Соединения А цитокины TNF-α и IFN-γ оказывают дозозависимое, аддитивное цитотоксическое воздействие на BRCA1-отрицательные клетки рака яичника. Соответственно, добавление другого агента, который увеличивает или индуцирует выработку эндогенных цитокинов в раковых клетках, также должно способствовать токсичности в отношении раковых клеток.
[0279] Таким образом, одним из вариантов реализации данного изобретения может быть фармацевтическая комбинация, содержащая соединение по данному изобретению, такое как Соединение А, и иммунотерапевтический агент, такой как агент, способный индуцировать выработку эндогенных цитотоксических цитокинов (например, TNF-α и IFN-γ). Такая фармацевтическая комбинация должна оказывать более выраженный эффект при лечении или облегчении расстройства клеточной пролиферации. Снова, не желая связывать себя какой-либо конкретной теорией, мы считаем, что иммунотерапевтический агент может увеличить локальную выработку одного или большего количества цитокинов, которые оказывают цитотоксическое действие на опухолевые клетки, таких как фактор некроза опухоли α (TNF-α) и интерферон-гамма (IFN-γ). Между тем, описанное в данном документе химическое соединение, такое как Соединение А, может усилить цитотоксический эффект TNF-α и/или IFN-γ, и таким образом комбинация может обеспечить более выраженный терапевтический эффект.
[0280] Фактически, антитело против PD-1 способно усиливать Т-клеточные ответы и выработку цитокинов in vitro. Например, Wang et al. (Cancer Immuno Res 2 (9): 846-856, включен посредством ссылки в полном объеме) продемонстрировали, что в аллогенной реакции смешанных лимфоцитов блокада PD-1 ниволумабом (BMS-936558) систематически приводила к титруемому усилению высвобождения IFN-γ, а в некоторых парах донорной Т-клетки/ДК наблюдалась усиленная пролиферация Т-клеток. (Фиг. 7, по Wang et al.). Кроме того, с применением рестимуляционного анализа цитомегаловируса, ЦМВ (CMV), Wang et al. показали, что ниволумаб приводил к зависимому от концентрации усилению секреции IFN-γ реагирующими на ЦМВ донорами.
[0281] Наши результаты в Примере 3 уже продемонстрировали, что TNF-α и IFN-γ оказывают аддитивное действие на клеточную токсичность в отношении BRCA1-отрицательных клеток рака яичника человека в присутствии Соединения A. В частности, Фиг. 6А-6В демонстрирует, что Соединение А может усиливать цитотоксический эффект TNF-α и IFN-γ дозозависимым образом. Следовательно, фармацевтическая комбинация, содержащая соединение по данному изобретению, такое как Соединение А, и иммунотерапевтический агент, такой как агент, способный может индуцировать выработку эндогенных цитотоксических цитокинов (например, TNF-α и IFN-γ), должна приводить к более выраженной эффективности с точки зрения гибели опухолевых клеток.
[0282] Дополнительно была исследована способность химического соединения по данному изобретению, такого как Соединение А, увеличивать выработку хемокинов в опухолевых клетках. Хемокины представляют собой молекулы, вырабатываемые опухолевыми клетками, которые привлекают иммунные клетки, такие как эффекторные Т-клетки. Хемокины и хемокиновые рецепторы играют ключевую роль в иммуногенности опухолей, поскольку они не только включают основную регуляторную систему, приводящую к инфильтрации лейкоцитами первичных опухолей, но также вмешиваются в пролиферацию раковых клеток и метастазирование. Раковые клетки, стромальные клетки и инфильтрованные иммунные клетки могут выделять хемокины. Кроме того, сами раковые клетки могут экспрессировать хемокиновые рецепторы и реагировать на указанные хемокины. Это образует сложную хемокиновую сеть, которая влияет на рост, выживание, миграцию и ангиогенез опухолевых клеток, а также на инфильтрацию иммунными клетками.
[0283] Соединение А применяли к линиям раковых клеток HBCx-39 (BRCA2 дикого типа) и HBCx-17 (BRCA2) in vitro. HBCx-17 представляет собой линию опухолевых клеток с дефицитом гомологичной рекомбинации, несущую мутацию BRCA2. Наши результаты неожиданно показали, что Соединение А способно индуцировать выработку нескольких значимых хемокинов в опухолевых клетках (Фиг. 8А-8С). Кроме того, обработка Соединением А повышала экспрессию мРНК CCL9, CCL21 и CXCL9 в раковых клетках, содержащих мутантный BRCA2, по сравнению с раковыми клетками дикого типа. Результаты дополнительно доказывают, что фармацевтическая комбинация, содержащая соединение по данному изобретению, такое как Соединение А, и иммунотерапевтический агент, такой как агент, способный индуцировать выработку эндогенных цитотоксических цитокинов (например, TNF-α и IFN-γ), будет более эффективной в лечении рака, поскольку хемокины, индуцированные соединением А, привлекают к опухолевым клеткам иммунные клетки, такие как дендритные клетки (ДК), активированные эффекторные Т-клетки (например, CD8+ лимфоциты) и/или природные клетки-киллеры (ПК) и приводят к разрушению опухолевых клеток.
[0284] Двойная функция фармацевтической комбинации по данному изобретению, как поясняется в данном документе, указывает на то, что такая фармацевтическая комбинация является удивительно эффективной при лечении рака.
[0285] Пример 5: Фармацевтическая комбинация Соединения А и антитела против PD-1
[0286] Проводятся эксперименты in vitro и in vivo с целью тестирования фармацевтической комбинации, содержащей Соединение А и антитело против PD-1, ниволумаб, для лечения рака, такого как лейкоз, лимфома, миелома, множественная миелома, рак молочной железы, рак яичника, рак поджелудочной железы, рак предстательной железы, рак легкого, саркома Юинга, рак головы и шеи, рак гема, рак ободочной и прямой кишки, рак шейки матки, рак печени, рак лимфатических узлов, рак толстой кишки, рак предстательной железы, рак головного мозга, рак головы и шеи, рак кости, рак кожи, рак почки и рак сердца. В некоторых тестах рак представляет собой рак с дефицитом зависимой от гомологичной рекомбинации (ГР) репарации разрывов двойной цепи (РДЦ) или рак с дефицитом репарации РДЦ с негомологичным соединением концов (НГСК).
[0287] Соединение А и ниволумаб совместно вводят in vitro или in vivo в соответствующие линии раковых клеток или пациентам, с монотерапией Соединением А и монотерапией антителом против PD-1 в качестве контроля. Результаты показывают, что фармацевтическая комбинация проявляет синергетический эффект при лечении рака по сравнению с монотерапией Соединением А и монотерапией антителом против PD-1.
[0288] Патенты и публикации, перечисленные в данном документе, описывают уровень техники в данной области техники и настоящим включены посредством ссылки в полном объеме и для всех целей в такой же степени, как если бы каждый был конкретно и отдельно указан как включенный посредством ссылки. Ничто в данном документе не должно толковаться как признание того, что данное изобретение не имеет права преподносить такую публикацию в силу предшествующего изобретения. В случае любого конфликта между цитируемой ссылкой и данным документом, данный документ должен преобладать. При описании вариантов реализации изобретения согласно данной заявке специфическая терминология используется для целей ясности. Однако изобретение не ограничивается конкретной выбранной терминологией. Ничто в данном документе не должно рассматриваться как ограничение объема данного изобретения. Многие модификации и другие варианты реализации изобретений, раскрытых в данном документе, будут очевидными для специалиста в данной области техники, к которой относятся данные изобретения, имеющие преимущество раскрытия, представленного в вышеприведенных описаниях и прилагаемых графических материалах. Все представленные примеры являются типичными и неограничивающими. Вышеописанные варианты реализации изобретения могут быть модифицированы или варьироваться без выхода за пределы объема изобретения, как это будет понятно специалистам в свете вышеизложенного раскрытия. Поэтому необходимо понимать, что в рамках формулы изобретения и ее эквивалентов изобретение может быть реализовано иначе, чем это конкретно описано.
Реферат
Изобретение относится к фармацевтической комбинации для лечения рака, содержащей терапевтически эффективное количество соединения формулы (I) и дополнительный терапевтически активный агент, выбранный из группы, состоящей из антитела против PD-1, антитела против PD-L1 и олапариба; где рак выбран из рака молочной железы, рака толстой кишки, рака кожи, а также к способу лечения или облегчения рака у субъекта, включающему введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтической комбинации. 2 н. и 27 з.п. ф-лы, 22 ил., 5 табл., 5 пр.
Формула



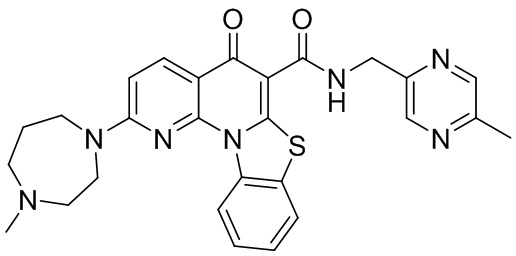




Комментарии