Способы модуляции проводимости устьица и растительные экспрессионные конструкции для их осуществления - RU2664461C2
Код документа: RU2664461C2
Чертежи

























































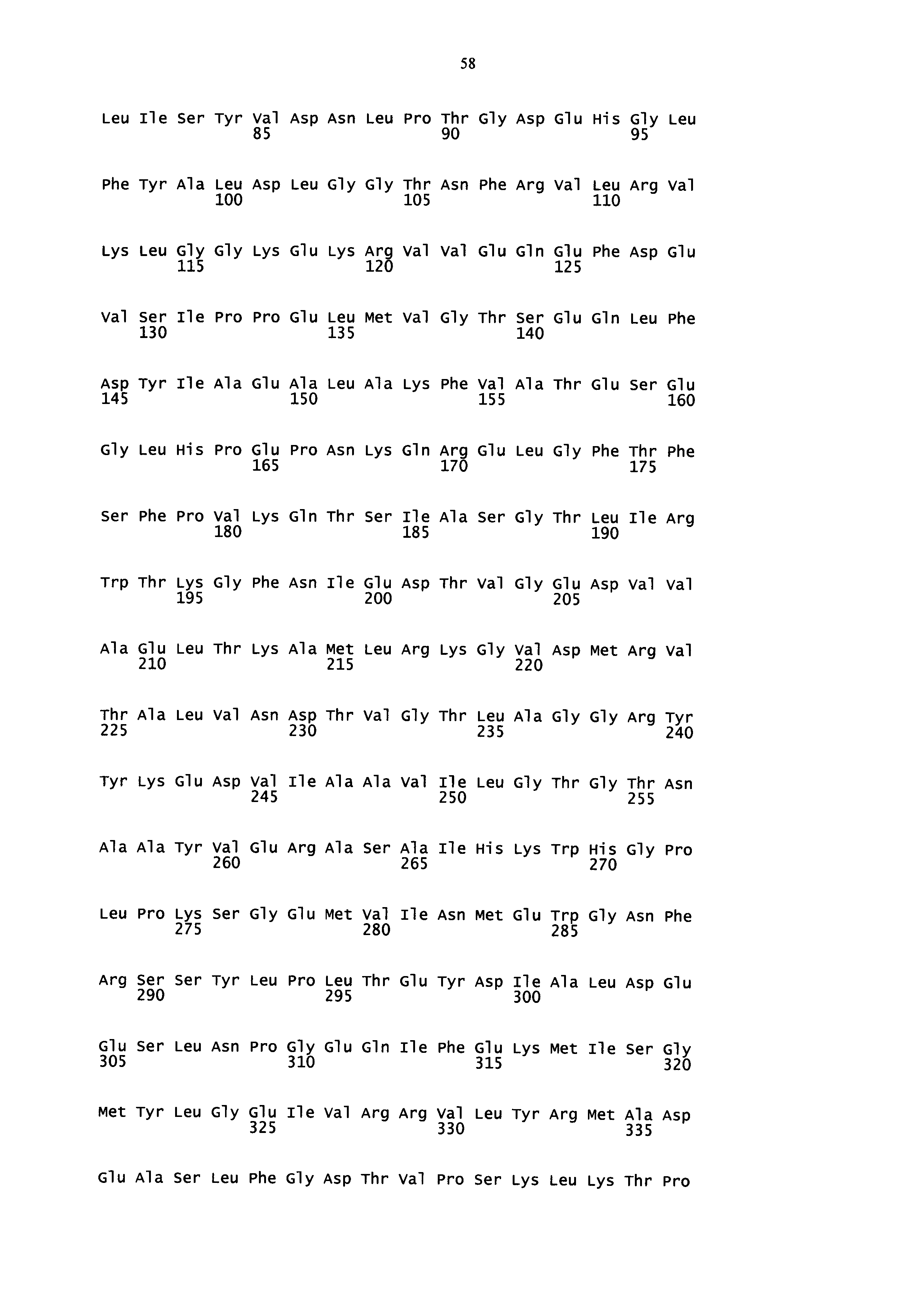




































































































Описание
Согласно настоящей заявке испрашивается приоритет по статье 35 U.S.С. § 119(e) в соответствии с предварительной заявкой на выдачу патента США с серийным №61/569251, поданной 11 декабря 2011 г., содержание которой включено в настоящий документ посредством ссылки во всей своей полноте.
Область техники
Настоящее изобретение согласно некоторым его вариантам осуществления относится к способам модуляции проводимости устьица и к растительным экспрессионным конструкциям для их осуществления.
Уровень техники
Устьица - это динамические поры в непроницаемой защитной кутикуле, которая покрывает надземные части сухопутных растений, развившиеся, главным, образом для сохранения воды. Устьице, состоящее из двух замыкающих клеток и поры, которую они окружают, открывается на рассвете для того, чтобы обеспечить поступление атмосферного диоксида углерода (СО2) для фотосинтеза за счет экстенсивной транспирационной потери воды. Устьице закрывается, когда фиксация и использование углерода менее эффективны, для того, чтобы снизить потерю воды в результате транспирации (Assmann, 1993). На механистическом уровне устьице открывается в ответ на повышение осмолярности замыкающих клеток. За этим повышением осмолярности следует движение воды в замыкающие клетки, что увеличивает их объем и открывает устьице (Taiz и Zeiger, 1998). Закрытие устьица происходит противоположным образом; по мере того, как осмолярность замыкающих клеток снижается, их объем уменьшается.
Нехватка воды является серьезной проблемой, которая будет обостряться по причине глобального изменения климата. Абиотические стрессы, особенно засуха и повышенная засоленность, являются основными причинами потери урожая во всем мире. Более того, в настоящее время сельское хозяйство использует свыше 70% (86% в развивающихся странах) доступной пресной воды. Один из подходов, который может быть принят в сельском хозяйстве для сохранения воды, заключается в получении растений, использующих меньше воды и при этом сохраняющих высокую урожайность в условиях нехватки воды. Поскольку растения теряют свыше 95% своей воды путем транспирации через устьица, управление активностью устьица представляет собой многообещающий подход для снижения потребности культур в воде и повышения продуктивности в стрессовых условиях.
Cominelli et al., Transcription. 2010 Jul-Aug; 1(1): 41-45, представляют обзор последних разработок по идентификации регуляторов транскрипции, регулирующих движения устьица и вовлеченных в закрытие устьица.
Дополнительные документы из уровня техники включают в себя:
патентный документ США 7423203, излагающий способ увеличения урожайности растений с помощью экспрессии грибной гексокиназы под действием специфичного для семени промотора;
заявку на выдачу патента США №20090265812, излагающую способ усиления выносливости растения к высокотемпературному стрессу с помощью экспрессии гексокиназы под действием специфичного для пыльцы промотора.
Сущность изобретения
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к растительной экспрессионной конструкции, содержащей последовательность нуклеиновой кислоты, кодирующую гексокиназу при транскрипционном регулировании специфичного по отношению к замыкающей клетке действующего в цис-положении регуляторного элемента.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к растительной экспрессионной конструкции, содержащей последовательность нуклеиновой кислоты, кодирующую средство нуклеиновую кислоту для сайленсинга экспрессии гексокиназы, при этом экспрессия средства нуклеиновой кислоты находится под транскрипционным регулированием специфичного по отношению к замыкающей клетке действующего в цис-положении регуляторного элемента.
Согласно некоторым вариантам осуществления настоящего изобретения специфичный по отношению к замыкающей клетке действующий в цис-положении регуляторный элемент является индуцибельным.
Согласно некоторым вариантам осуществления настоящего изобретения специфичный по отношению к замыкающей клетке действующий в цис-положении регуляторный элемент является конститутивным.
Согласно некоторым вариантам осуществления настоящего изобретения специфичный по отношению к замыкающей клетке действующий в цис-положении регуляторный элемент является специфичным по отношению к замыкающей клетке промотором.
Согласно некоторым вариантам осуществления настоящего изобретения, специфичный по отношению к замыкающей клетке промотор является промотором KST1.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к способу регулирования проводимости устьица растения, при этом способ включает модуляцию у растения уровня и/или активности гексокиназы специфичным по отношению к замыкающей клетке образом с регулированием тем самым проводимости растения.
Согласно некоторым вариантам осуществления настоящего изобретения модуляцией является повышающая регуляция.
Согласно некоторым вариантам осуществления настоящего изобретения повышающую регуляцию обеспечивают введением конструкции нуклеиновой кислоты по п. 1 в растение.
Согласно некоторым вариантам осуществления настоящего изобретения модуляцией является понижающая регуляция.
Согласно некоторым вариантам осуществления настоящего изобретения понижающую регуляцию обеспечивают введением в растение средства нуклеиновой кислоты для сайленсинга при транскрипционном регулировании специфичного по отношению к замыкающей клетке действующего в цис-положении регуляторного элемента.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к способу снижения проводимости устьица растения, при этом способ включает введение в клетку конструкции нуклеиновой кислоты растения со снижением тем самым проводимости устьица растения.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к способу увеличения эффективности использования воды растением, при этом способ включает введение в клетку растения конструкции нуклеиновой кислоты с увеличением тем самым эффективности использования воды растением.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к способу увеличения выносливости растения к засухе, засоленности или температурному стрессу, при этом способ включает введение в клетку растения конструкции нуклеиновой кислоты с увеличением тем самым выносливости растения к засухе, засоленности или температурному стрессу.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к способу увеличения биомассы, мощности или урожайности растения, при этом способ включает введение в клетку растения конструкции нуклеиновой кислоты с увеличением тем самым биомассы, мощности или урожайности растения.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к способу усиления выносливости растения к биотическому стрессу, при этом способ включает введение в клетку растения конструкции нуклеиновой кислоты с усилением тем самым выносливости растения к биотическому стрессу.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к трансгенному растению или к его части, содержащей растительную экспрессионную конструкцию.
Согласно аспекту некоторых вариантов осуществления настоящее изобретение относится к выделенной растительной клетке или культуре растительных клеток, содержащей растительную экспрессионную конструкцию.
Согласно некоторым вариантам осуществления настоящего изобретения частью трансгенного растения является семя.
Согласно некоторым вариантам осуществления настоящего изобретения частью трансгенного растения является лист.
Согласно некоторым вариантам осуществления настоящего изобретения семенем является гибридное семя.
Согласно некоторым вариантам осуществления настоящего изобретения способ дополнительно включает выращивание растения в условиях дефицита воды.
Согласно некоторым вариантам осуществления настоящего изобретения, способ дополнительно включает выращивание растения при засоленности.
Если не указано иное, все технические и/или научные термины, используемые в настоящем документе, имеют те же значения, что обычно подразумеваются специалистом в области, к которой относится настоящее изобретение. Хотя при осуществлении или тестировании вариантов осуществления настоящего изобретения могут быть использованы способы и материалы, подобные или эквивалентные описанным в настоящем документе, ниже описываются иллюстративные способы и/или материалы. В случае конфликта контролем будет служить описание настоящего изобретения, в том числе определения. Кроме того, материалы, способы и примеры являются исключительно иллюстративными и не предназначены в обязательном порядке быть ограничивающими.
Краткое описание чертежей
Некоторые варианты осуществления настоящего изобретения описываются в настоящем документе исключительно в качестве примера со ссылкой на прилагаемые графические материалы. Далее следует конкретная ссылка на графические материалы в подробностях, следует подчеркнуть, что детали показаны в качестве примера и с целью иллюстративного рассмотрения вариантов осуществления настоящего изобретения. В связи с этим, описание вместе с графическими материалами для специалистов в данной области делает очевидной реализацию вариантов осуществления настоящего изобретения.
В графических материалах:
На фиг. 1А-С изображены графики, показывающие, что сахароза стимулирует закрытие устьица посредством гексокиназы. На фиг. 1А представлены репрезентативные, полученные с помощью световой микроскопии изображения устьица, взятого из эпидермальных отпечатков через 3 часа после обработки 100 мМ сорбитом или 100 мМ сахарозой (белая полоска = 20 мкм). На В представлена реакция устьица на сахарозу у дикого типа (WT) и у растений, экспрессирующих AtHXK1 (НК4), оценивали на интактных листьях, погруженных на 3 часа в искусственный апопластический сок (Wilkinson и Davies, 1997), содержащий 100 мМ сорбита (в качестве осмотического контроля), 100 мМ сахарозы или 100 мМ сахарозы вместе с 20 мМ ингибитора гексокиназы N-ацетилглюкозамина (NAG). Затем брали эпидермальные отпечатки и измеряли щель устьица. На С представлены реакции устьица у растений WT на различные комбинации Сахаров, которые оценивали, как описано в фиг. 1В с 200 мМ маннитом, служащим в качестве дополнительного осмотического контроля. Данные, показанные на фиг. 1 В, С представляют собой среднее значение 300 устьиц из шести независимых биологических повторов ± SE. Различные буквы обозначают значимое различие (t-критерий, Ρ<0,05).
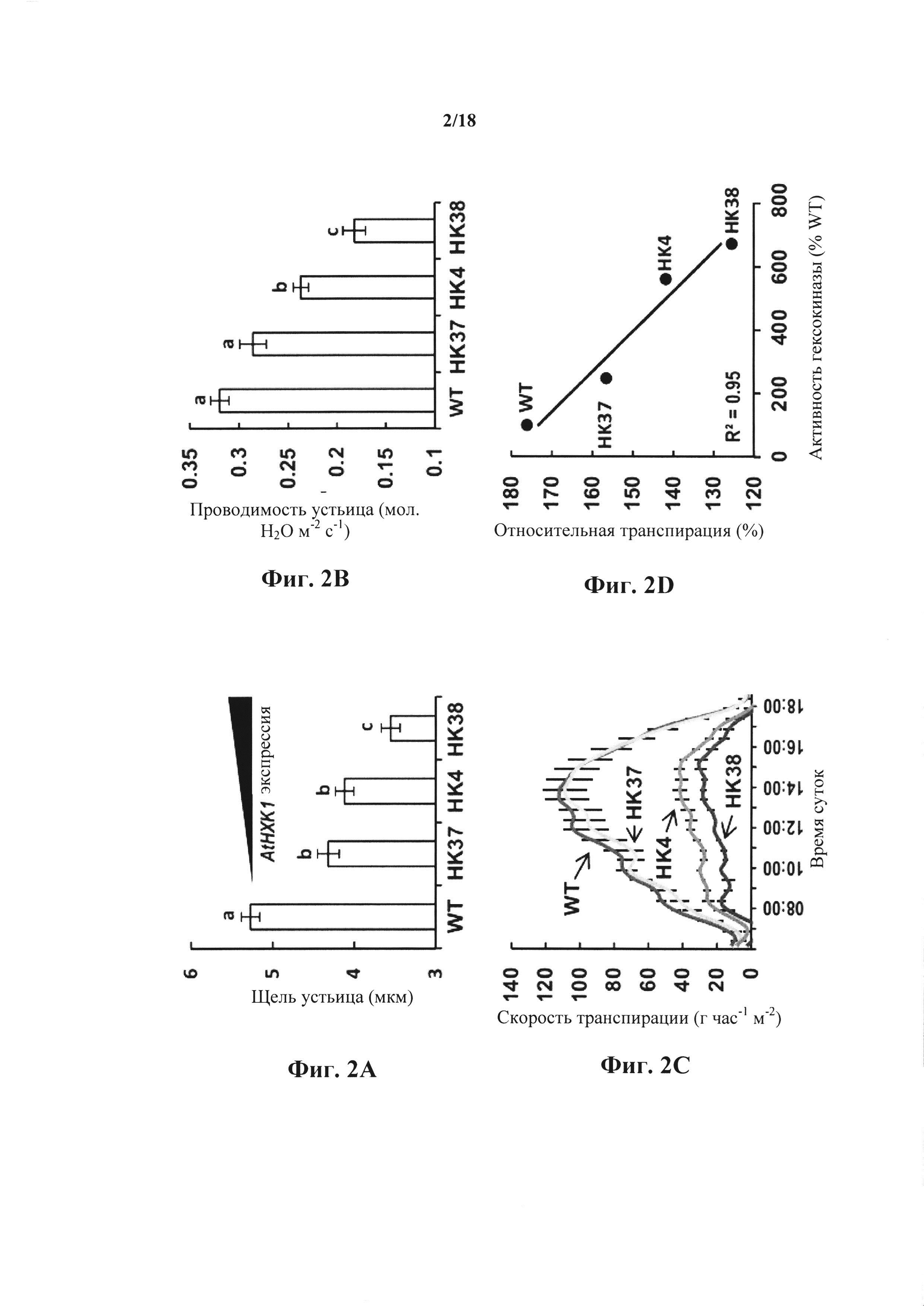
На фиг. 2A-D показано, что повышенная экспрессия гексокиназы усиливает закрытие устьица и снижает транспирацию. Щель устьица (фиг. 2А) и проводимость устьица (фиг. 2В) определяли для контрольных (WT) и трансгенных растений, экспрессирующих различные уровни AtHXK1 (НК38>НК4>НК37) (Dai et al., 1999). Данные по щели представляют собой среднее значение 200 устьиц из четырех независимых повторов ± SE. Данные проводимости устьица представляют собой среднее значение шести независимых повторов ± SE. Различные буквы обозначают значимое различие (t-критерий, Ρ<0,05). На фиг. 2С показано, как скорость транспирации, нормализованную на общую площадь листьев отслеживали одновременно и непрерывно на протяжении суток, и данные представлены как среднее значение ± SE для каждой 10-й точки забора образцов (n=6). На фиг. 2D показано, что отрицательную корреляцию наблюдали между относительной суточной транспирацией всего растения и относительной активностью гексокиназного фосфорилирования. Данные транспирации нормализовали на общую площадь листьев и на количество воды, впитываемое каждый день погруженным рядом тампоном фиксированного размера, которое принимали за 100%. Активность гексокиназы WT принимали за 100%.
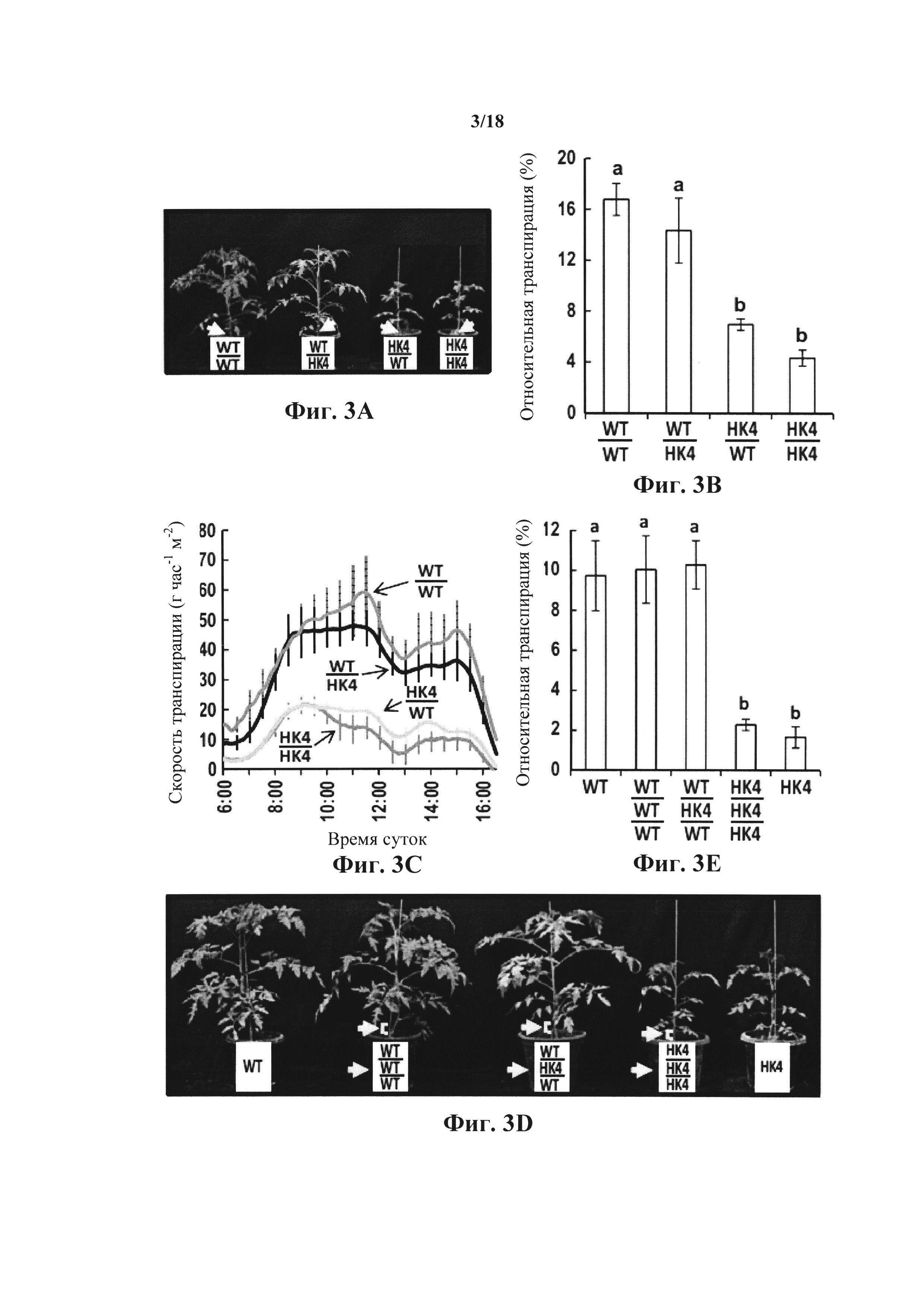
На фиг. 3А-Е показано, что AtHXKl снижает транспирацию преимущественно при экспрессии в листьях. Процедуры реципрокной прививки (фиг. 3A) и тройной прививки (фиг. 3D) выполняли на стадии проростков, фотографировали растения и использовали для измерений транспирации приблизительно через 4 недели после прививки. Желтые стрелки и скобки указывают на локализацию привоев. На фиг. 3В показана относительная суточная транспирация всего растения реципрокно привитых растений. Данные нормализовали на общую площадь листьев и на количество воды, впитываемое каждый день погруженным рядом тампоном фиксированного размера, которое принимали за 100%. Данные представлены в виде среднего значения четырех независимых повторов ± SE. Различные буквы обозначают значимое различие (t-критерий, Ρ<0,05). На фиг. 3С показано, что скорость транспирации, нормализованную на общую площадь листьев реципрокно привитых растений, отслеживали одновременно и непрерывно на протяжении суток. Данные представлены в виде среднего значения ± SE для каждой 10-й точки забора образцов (n=4). На фиг. 3Е показана относительная суточная транспирация всего растения с тройной прививкой, рассчитанная как на (фиг. 3В).
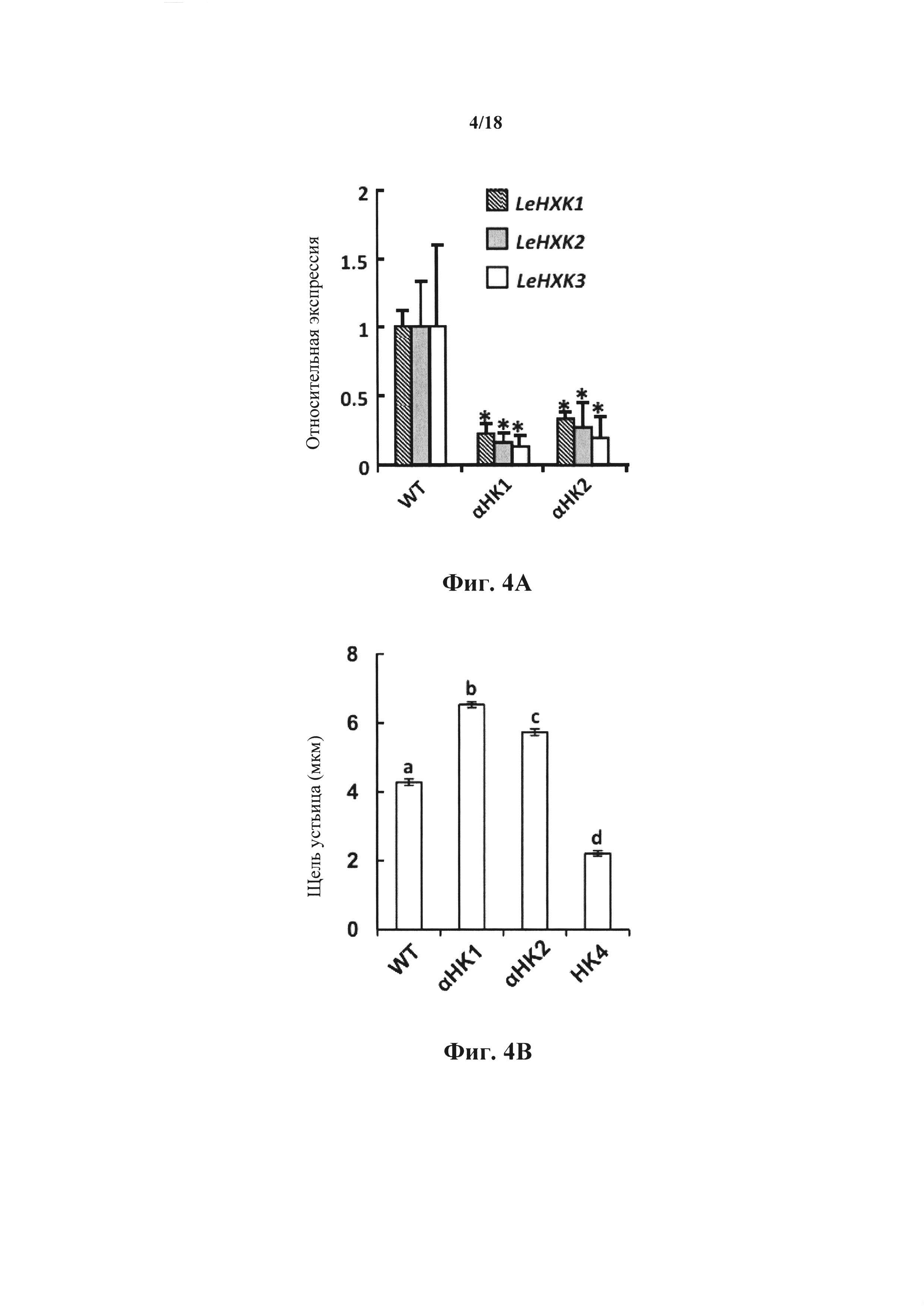
На фиг. 4А-В представлены графики, показывающие, что супрессия НХК ингибирует закрытие устьица в ответ на сахарозу. На фиг. 4А представлены количественные измерения в реальном времени экспрессии генов томата LeHXK1-3 у томата дикого типа (WT) и у двух независимых линий томатов с антисмысловой супрессией НХК, аНК1 и аНК2. Данные представляют собой среднее значение трех независимых биологических повторов ± SE. Звездочки обозначают значимые различия по сравнению с WT (t-критерий, Ρ<0,05). На фиг. 4В представлен ответ устьица на сахарозу у WT, двух линий с антисмысловой супрессией (аНК1 и аНК2) и линии, экспрессирующей AtHXK1 (НК4), который оценивали на интактных листьях, погруженных на 3 часа в искусственный апопластический сок (Wilkinson и Davies, 1997), содержащий 100 мМ сахарозы. Данные представлены как среднее значение 400 устьиц из восьми независимых биологических повторов ± SE. Различные буквы обозначают значимое различие (t-критерий, Ρ<0,05).
На фиг. 5 представлен график, показывающий, что глюкоза (Glc) и сахара, которые могут быть фосфорилированы, но не метаболизированы, стимулируют закрытие устьица. Ответы устьица на различные сахара оценивали на интактных листьях растений дикого типа. Листья погружали на 3 часа в искусственный апопластический сок (Wilkinson и Davies, 1997), содержащий маннит (в качестве осмотического контроля), глюкозу, 2-дезоксиглюкозу (2-dG) или маннозу. Затем брали эпидермальные отпечатки и измеряли щель устьица. Данные представлены как среднее значение 400 устьиц из восьми независимых биологических повторов ± SE. Различные буквы обозначают значимое различие (t-критерий, Ρ<0,05).
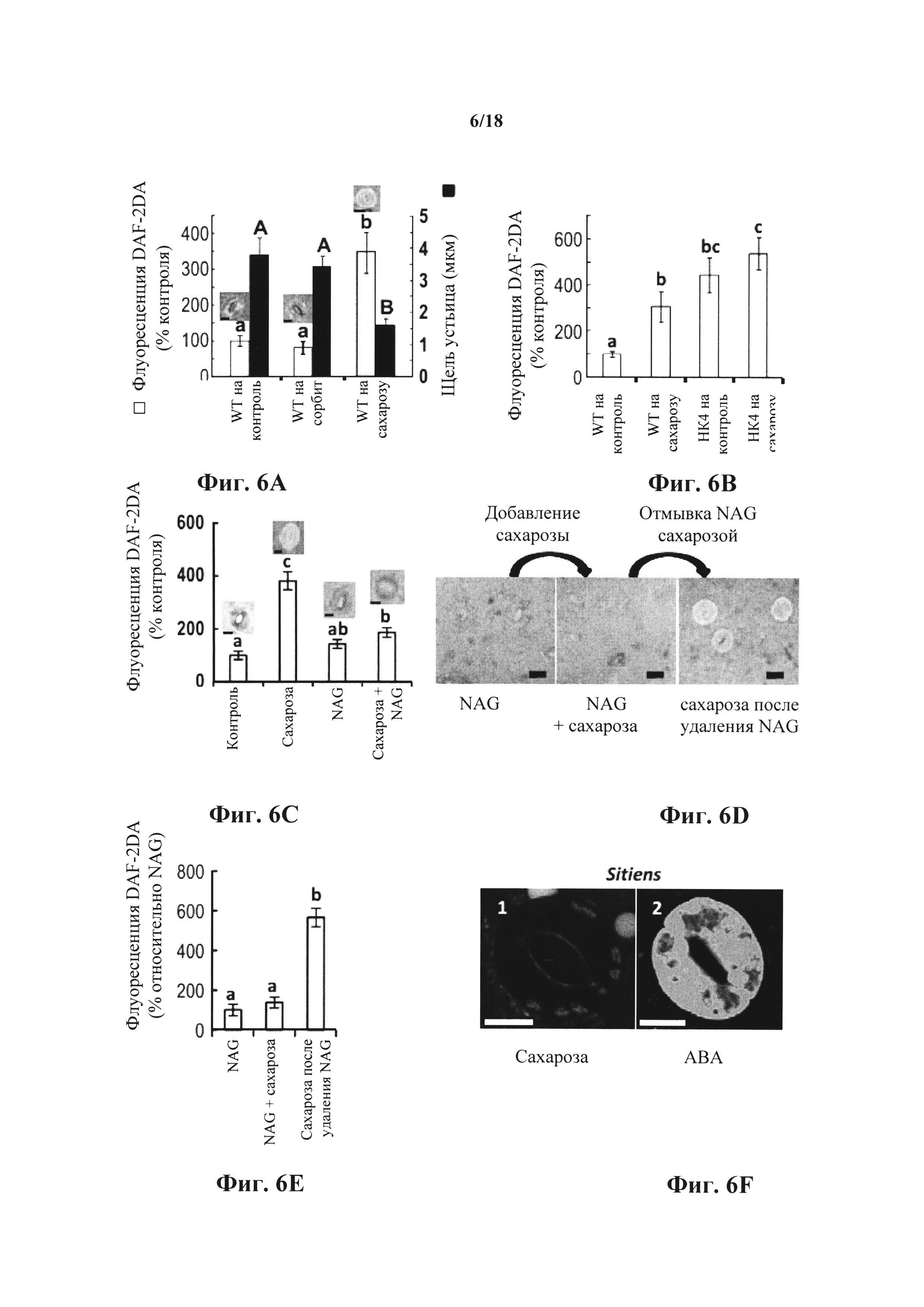
На фиг. 6A-F показано, что сахароза стимулирует АВА-зависимое продуцирование NO в замыкающих клетках, которое опосредовано НХК. На фиг. 6А-В показано, как уровни оксида азота (NO) отслеживали в замыкающих клетках из эпидермальных оболочек растений дикого типа (WT) и растений, экспрессирующих AtHXK1 (НК4), с использованием флуоресцентного индикатора NO - красителя DAF-2DA. Относительные уровни флуоресценции замыкающих клеток (белые столбики) и щелей устьица (черные столбики) определяли через 30 минут обработки буфером MES (контроль) или MES, содержащим либо 100 мМ сахарозы, либо 100 мМ сорбита в качестве осмотического контроля. Типичные изображения флуоресценции представлены над столбиками флуоресценции (полоска = 10 мкм). Данные представлены как среднее значение ± SE 90 устьиц (фиг. 6А) или 60 устьиц (фиг. 6В) для каждого типа обработки с тремя или четырьмя независимыми биологическими повторами для каждой обработки. На фиг. 6С показано, как относительные уровни флуоресценции замыкающих клеток WT определяли через 30 минут обработки буфером MES (контроль), MES, содержащим 20 мМ ингибитора гексокиназы - тΝ-ацетилглюкозамина (NAG), или 100 мМ сахарозы с 20 мМ NAG или без такового. Типичные изображения флуоресценции представлены над столбиками флуоресценции (полоска = 10 мкм). Данные представлены как среднее значение 60 устьиц из трех независимых биологических повторов на обработку ± SE. На фиг. 6D представлены конфокальные изображения продуцирования NO в замыкающих клетках эпидермальных оболочек, обработанных только 20 мМ NAG (слева), через 30 минут после добавления 100 мМ сахарозы (в середине) и через 30 минут после отмывки NAG 100 мМ сахарозой (справа). Анализ проводили одновременно с фотографированием того же узкого длинного кусочка эпидермиса (полоска = 20 мкм). На фиг. 6Е показаны относительные уровни флуоресценции замыкающих клеток из узкого длинного кусочка эпидермиса, обработанного как на фиг. 6D. Данные представлены как среднее значение 40-60 устьиц ± SE. На фиг. 6F представлены конфокальные изображения продуцирования NO в замыкающих клетках эпидермальных слоев Sitiens (ΑΒΑ-дефицитные мутанты) через 30 минут после обработки буфером MES, содержащим либо 100 мМ сахарозы (слева), либо 100 мМ ABA (справа); полоска = 10 мкм. Различные строчные буквы на фиг. 6А-С, Ε обозначают значимое различие между обработками для данных флуоресценции, а различные прописные буквы на фиг. 6А обозначают значимое различие между обработками для данных по щели устьица (t-критерий, Ρ<0,05).
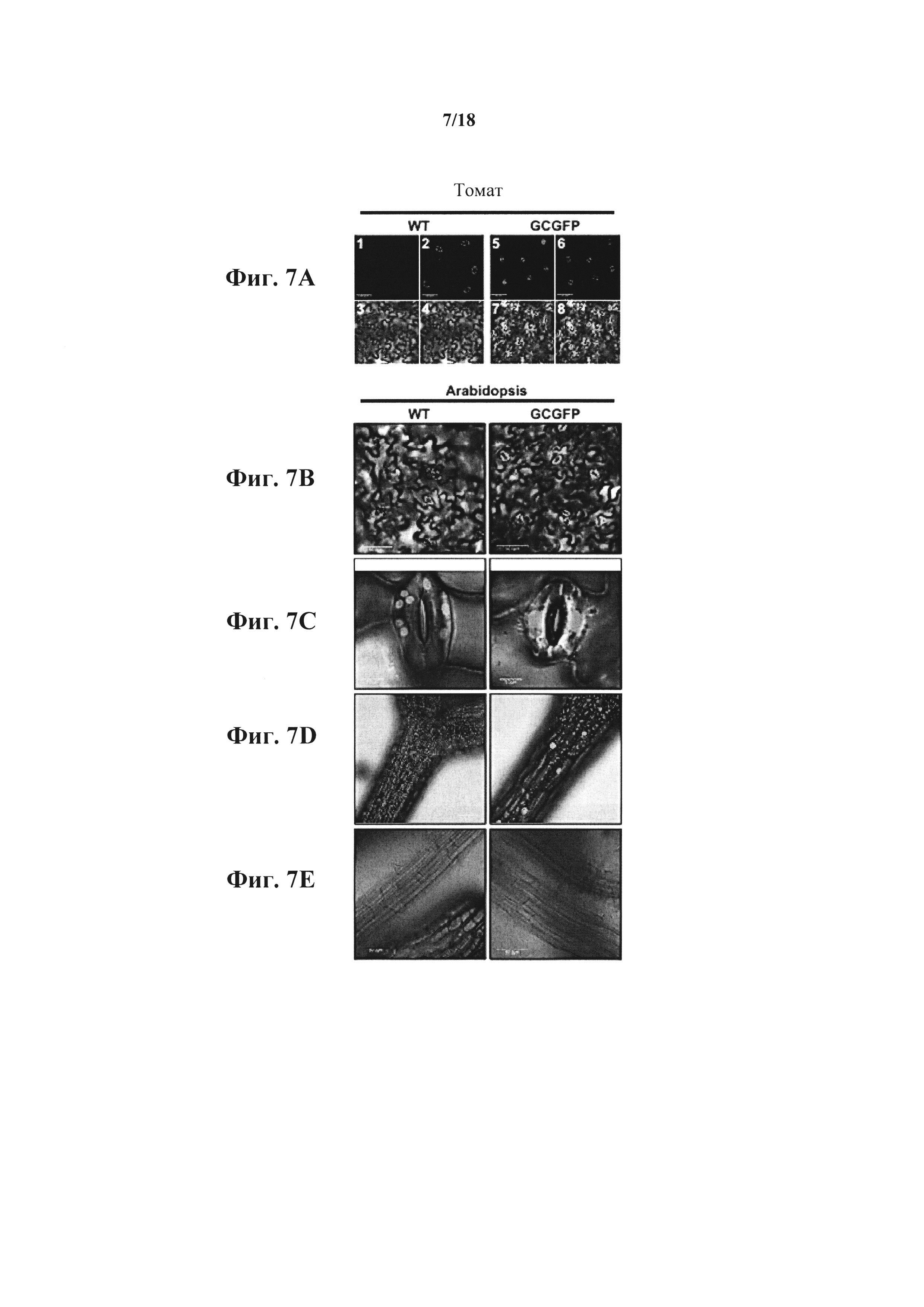
На фиг. 7А-Е показано, что экспрессия GFP под контролем промотора KST1 специфична для замыкающих клеток. На фиг. 7А представлены конфокальные изображения дикого типа (WT) (панели 1-4) и листьев томата трансгенных растений (панели 5-8) со специфичной по отношению к замыкающей клетке экспрессией GFP (обозначены GCGFP) под контролем промотора KST1. Панели 1 и 5 - это изображения флуоресценции GFP (зеленое окрашивание), панели 2 и 6 - это аутофлуоресценция хлорофилла (окрашивание фуксином), панели 3 и 7 - это изображения в белом свете, и панели 4 и 8 - это совмещенные изображения. На В-Е представлены конфокальные изображения растений WT (слева) и трансгенных растений Arabidopsis GCGFP (справа). Изображения были сделаны на листьях (фиг. 7В и С, полоски = 50 мкм и 5 мкм, соответственно), гипокотилях (фиг. 7D, полоска = 100 мкм) и корнях (фиг. 7Е, полоска = 50 мкм). Все панели являются совмещенными изображениями в белом свете, аутофлуоресценции хлорофилла (фуксин) и флуоресценции GFP (зеленый).
На фиг. 8A-F показано, что специфичная по отношению к замыкающей клетке экспрессия AtHXK1 индуцирует закрытие устьица и снижает транспирацию у растений томата и Arabidopsis. На фиг. 8А показаны типичные изображения дикого типа (WT) и двух независимых трансгенных линий томата, экспрессирующих AtHXK1 в особенности в замыкающих клетках (GCHXK7 и 12). На фиг. 8В и С показана проводимость устьица (gs,) и относительная суточная транспирация всего растения у WT и двух независимых трансгенных линий томата (GCHXK7 и 12). Данные проводимости устьица представлены в виде среднего значения четырех независимых повторов ± SE. Данные транспирации нормализовали на общую площадь листьев и на количество воды, впитываемое каждый день погруженным рядом тампоном фиксированного размера, которое принимали за 100%. Представлены данные трех последовательных дней. Данные для каждого дня представлены в виде среднего значения четырех независимых повторов ± SE. На фиг. 8D представлены типичные изображения Arabidopsis WT (экотип Col.) и двух независимых трансгенных линий, экспрессирующих AtHXK1 специфично в замыкающих клетках (GCHXK1 и 2). Фиг. 8Е и F - Проводимость устьица и измерения транспирации у WT, двух независимых трансгенных линий Arabidopsis, GCHXK1 и GCHXK2 (экотипа Col.) и gin 2-1 (нулевого мутанта AtHXKl, экотипа Ler.). Стрелки указывают на возрастание или снижение проводимости и транспирации по сравнению с WT. Данные представлены как среднее значение (± SE) 8 и 12 независимых повторов для линий GCHXK и gin2-l, соответственно. Звездочки обозначают значимые различия по сравнению с WT (t-критерий, Ρ<0,05).
На фиг. 9 показано, что экспрессия GFP под контролем промотора FBPase специфична по отношению к мезофильным клеткам. Конфокальные изображения листьев растений трансгенного томата и Arabidopsis с мезофильной специфичной экспрессией GFP (обозначенной MCGFP) под контролем промотора FBPase. Изображения являются совмещением флуоресценции GFP (зеленое окрашивание) и изображений в белом свете (полоска = 100 мкм). Флуоресценция является специфичной по отношению к мезофильным клеткам.
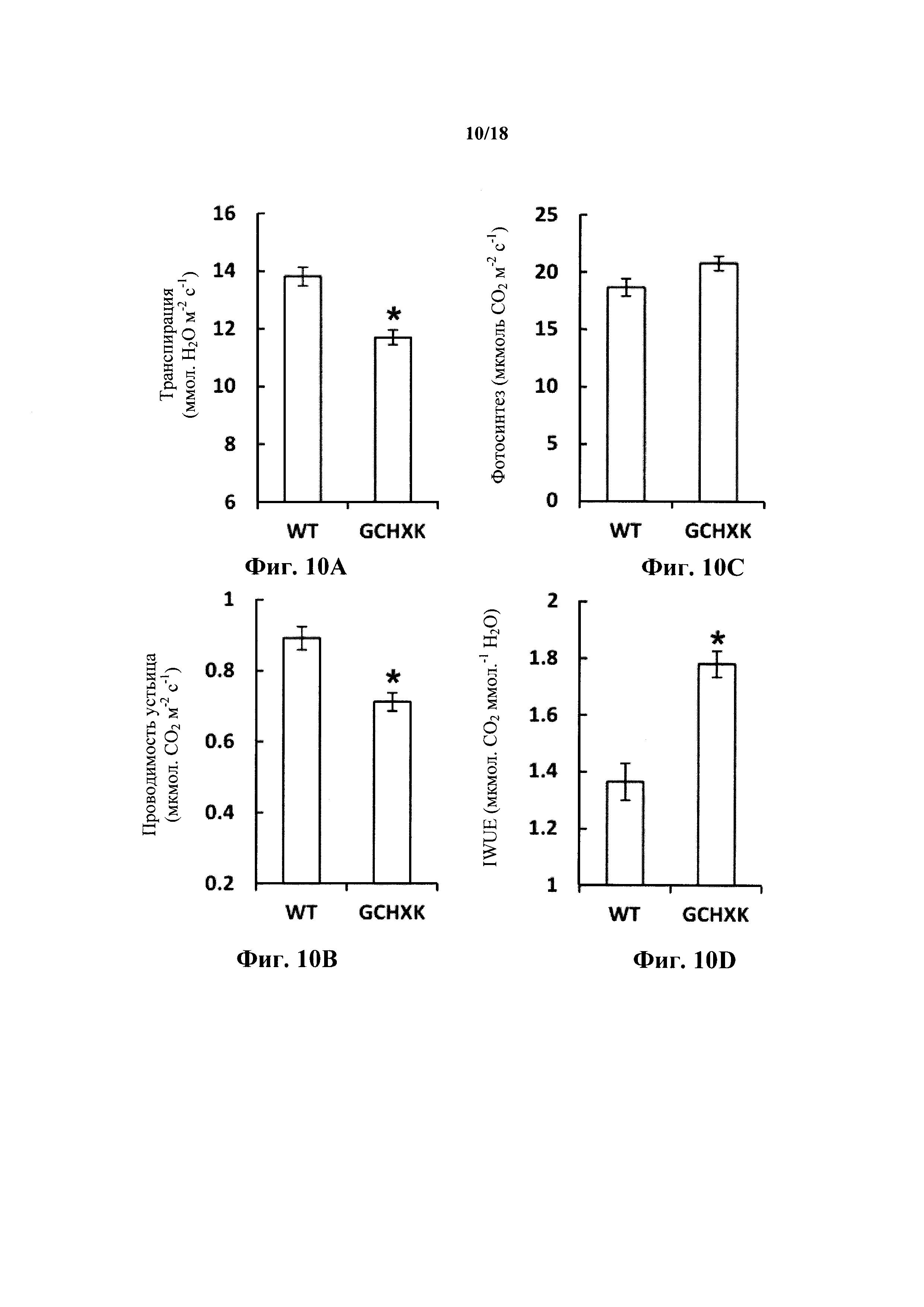
На фиг. 10A-D представлены графики, демонстрирующие, что повышенная экспрессия гексокиназы в замыкающих клетках снижает транспирацию, в то время как фотосинтез остается неизменным, с улучшением, таким образом, текущей эффективности использования воды. Газообменный анализ растений GCHXK и WT проводили с использованием портативной газообменной системы Li-6400 (LI-COR), проводимость устьица (фиг. 10А), транспирацию (фиг. 10В), фотосинтез (фиг. 10С) и текущую эффективность использования воды (IWUE, Фиг. 10D) измеряли и рассчитывали при благоприятных условиях роста. Данные представлены как среднее значение ± SE (n=10 для WT и n=20 для 10 разных трансгенных линий, по два измерения для каждой). Звездочка обозначает значимое различие (t-критерий, Ρ<0,05).
На фиг. 11А-С показано, что повышенная экспрессия гексокиназы в замыкающих клетках снижает транспирацию целого растения и повышает эффективность использования воды. На фиг. 11А-В показано, как относительную суточную транспирацию целого растения (RDT) анализировали с использованием широкомасштабной лизиметрической системы, как описано в примере 1. WT и две трансгенные линии GCHXK (GCHXK7, GCHXK12) помещали на весы. Транспирацию и общую массу растения регистрировали каждые 3 минуты во время эксперимента, при котором растения выращивали при нормальных условиях в течение 10 дней, затем подвергали стрессу засухи в течение 3 дней с последующим восстановительным орошением в течение дополнительных 7 дней. Данные нормализовали на общую массу растения и на количество воды, впитанное каждый день погруженным рядом тампоном фиксированного размера, которое принимали за 100% и которое служило в качестве эталона для временных вариаций потенциальной транспирации. На фиг. 11А показана по дням относительная суточная транспирация во время всего эксперимента. Данные представлены как среднее значение четырех независимых повторов ± SEM. На фиг. 11В показана относительная суточная транспирация выборочных дней для каждого типа обработки. Данные представлены как среднее значение четырех независимых повторов ± SEM. Звездочка обозначает значимое различие (t-критерий, Ρ<0,05). На фиг. 11С показано, как эффективность использования воды рассчитывали по отношению между наращиванием массы растения и потерей воды растением каждый день для каждого растения. Данные представлены как среднее значение четырех независимых повторов ± SEM. Звездочка обозначает значимое различие (t-критерий, Ρ<0,05). (A-увеличено) RDT растений WT и GCHXK в период перехода от нормального орошения (10-й день) к условиям засухи (11-й день). Красные и зеленые стрелки указывают на снижение RDT (представленное наклоном) у растений WT и GCHXK, соответственно, после воздействия на растения засухой.
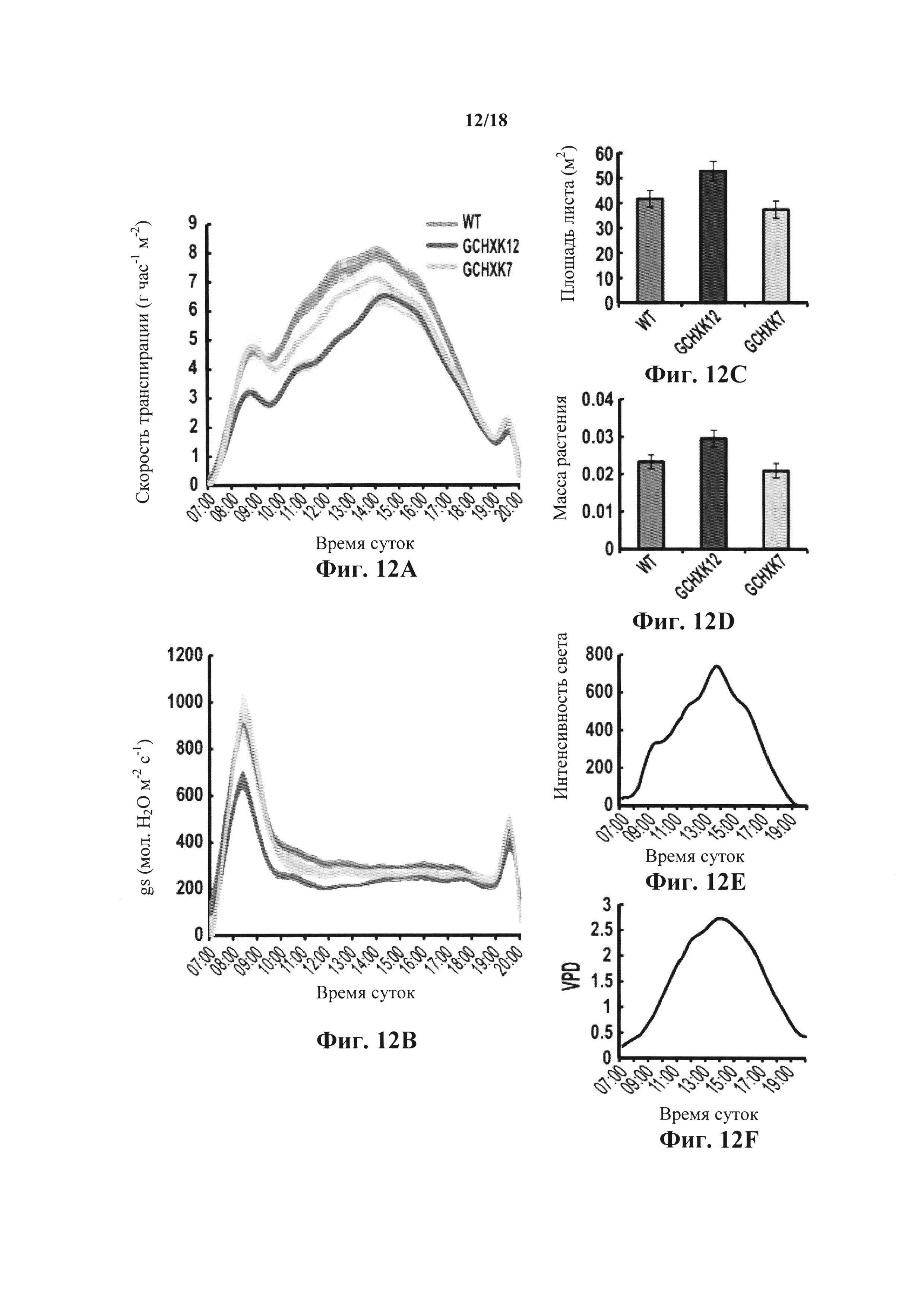
На фиг. 12A-F показано, что повышенная экспрессия гексокиназы в замыкающих клетках снижает транспирацию и проводимость устьиц на протяжении суток при демонстрации нормального роста. Относительную скорость транспирации целого растения (фиг. 12А) и проводимость устьиц (gs, фиг. 12В) анализировали с использованием широкомасштабной лизиметрической системы, как описано в способах. WT и две GCHXK трансгенные линии помещали на весы. Скорость транспирации, gs, интенсивность света (фиг. 12Е), дефицит давления пара (VPD, фиг. 12F) регистрировали одновременно каждые 3 минуты во время эксперимента, при котором растения выращивали при нормальных условиях. Данные для фиг. 12А и В нормализовали на общую площадь листьев и на количество воды, впитанное каждый день погруженным рядом тампоном фиксированного размера, которое принимали за 100% и которое служило в качестве эталона для временных вариаций потенциальной транспирации. На фиг. 12С показана общая площадь листьев растения, на фиг. 12D показана общая масса растения.
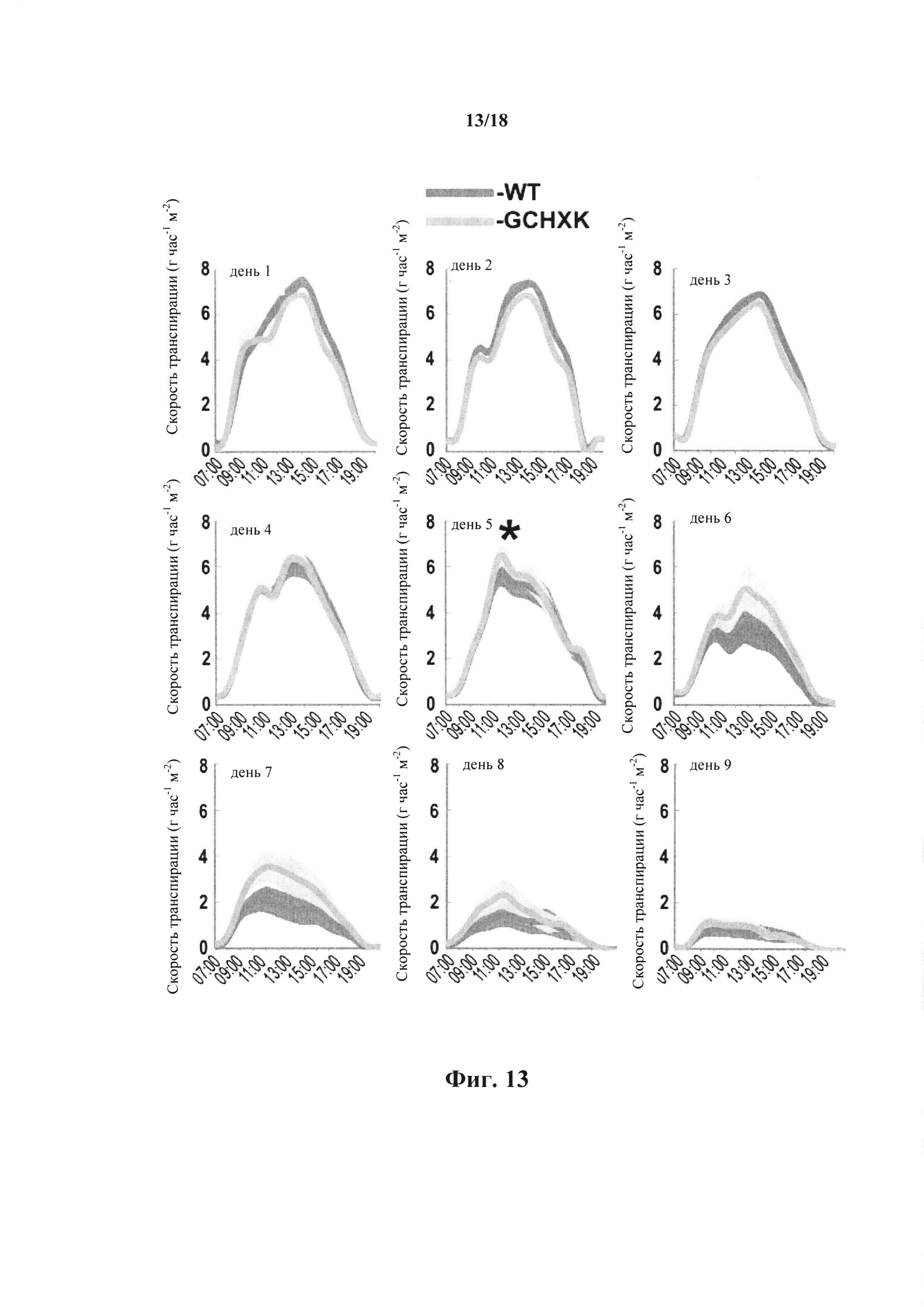
На фиг. 13 показана скорость транспирации растений WT и GCHXK в условиях засухи. Скорость транспирации всего растения анализировали с использованием широкомасштабной лизиметрической системы, как описано в примере 1. WT (голубой) и трансгенные линии GCHXK (зеленый) помещали на весы. Скорость транспирации регистрировали в течение 9 дней после воздействия на растения условий постепенно усиливающейся засухи до полного прекращения орошения. Скорость транспирации, нормализованную на общую площадь листьев, отслеживали одновременно и непрерывно в течение суток. Данные представлены как среднее значение ± SE для каждой точки забора образцов. Данные нормализовали на общую площадь листьев и на количество воды, впитанное каждый день погруженным рядом тампоном фиксированного размера, которое принимали за 100% и которое служило в качестве эталона для временных вариаций потенциальной транспирации. Звездочка обозначает день, в который произошел переход транспирации между WT и GCHXK.
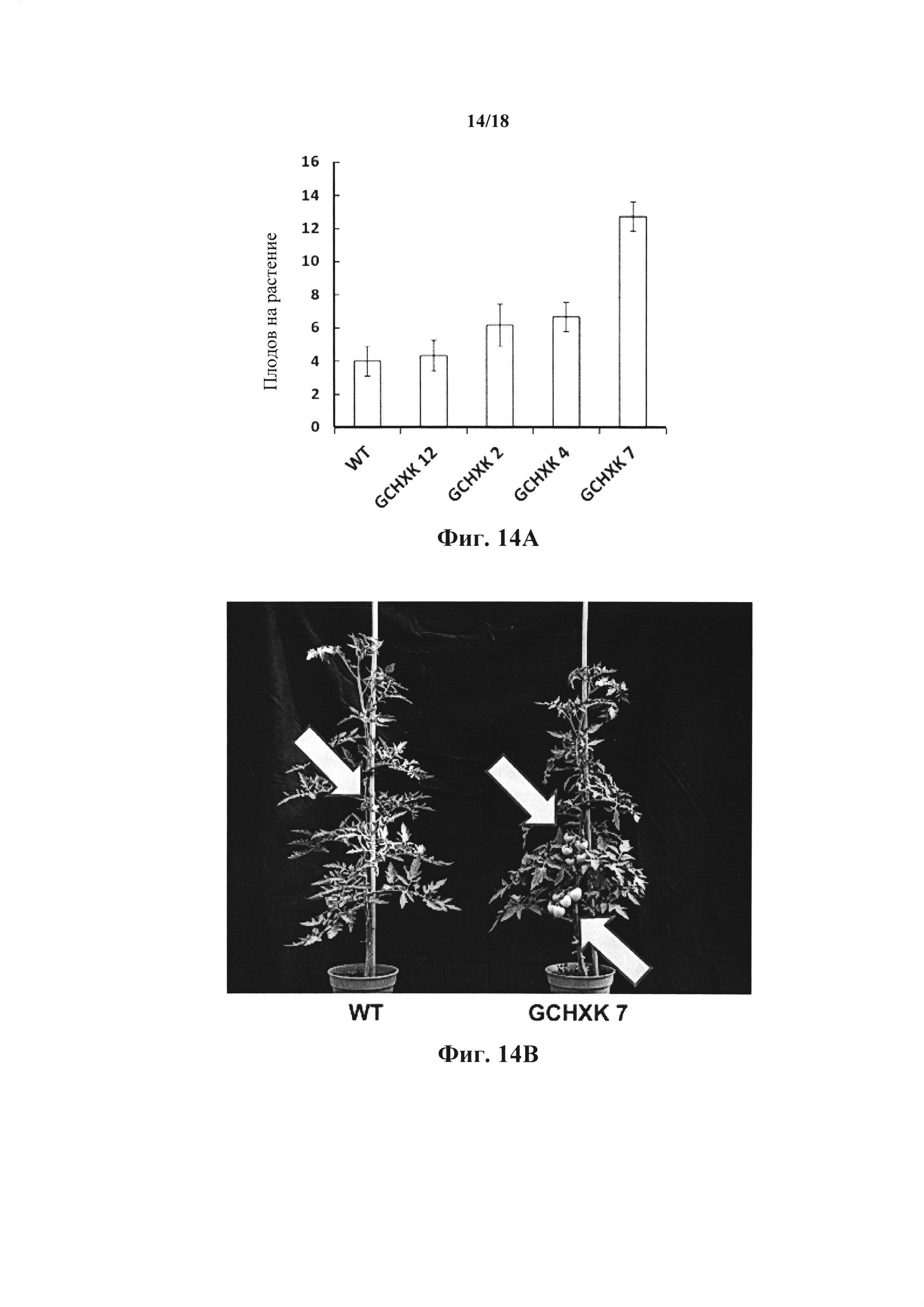
На фиг. 14А-В показана урожайность трансгенных растений, экспрессирующих гексокиназу специфично в замыкающих клетках. На фиг. 14А показано количество плодов, собранных с растений WT и GCHXK (4 независимые линии). На фиг. 14В представлены типичные изображения растений дикого типа (WT) и трансгенных томатов, экспрессирующих AtHXKl специфично в замыкающих клетках (GCHXK7).
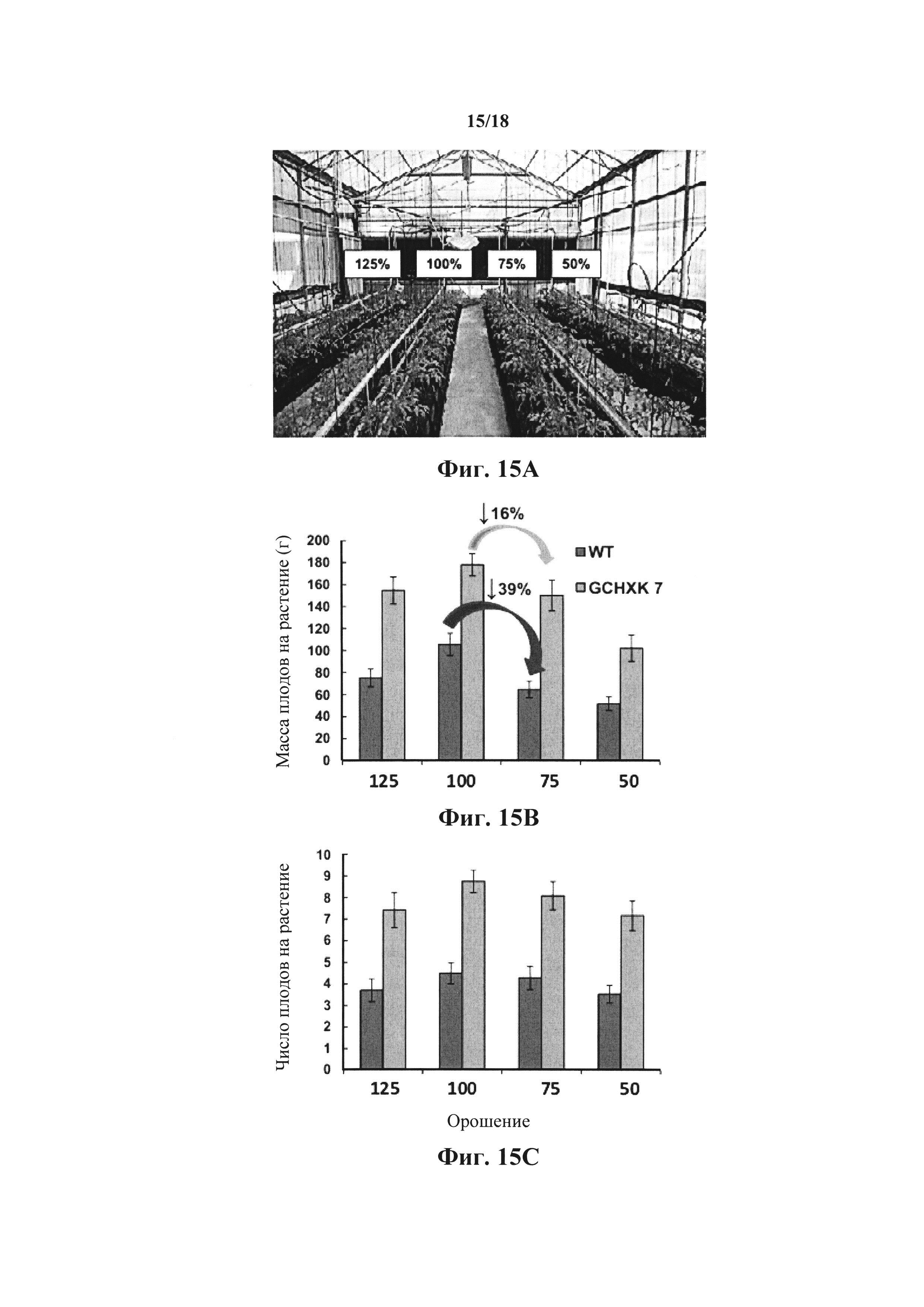
На фиг. 15А-С показана урожайность трансгенных растений, экспрессирующих гексокиназу специфично в замыкающих клетках в условиях ограниченного водоснабжения. На фиг. 15А показано, как растения выращивали в контролируемых условиях коммерческой теплицы согласно инструкциям эксперта относительно процедур выращивания (система почв, орошение, удобрение и т.д.). Проростки высаживали вперемешку по всему ряду посадки и в каждом ряду сохраняли одинаковый порядок. Каждый ряд орошали по-разному: либо полностью (100%), либо частично (режимы орошения на 75%, 50% и 25%). После первоначальной стадии бланжевого плода плоды собирали, подсчитывали и взвешивали для каждого растения индивидуально в течение 4 недель. Затем совокупную массу плодов (фиг. 15В) и число плодов (фиг. 15С) растений WT (голубой) и GCHXK (зеленый) усредняли для каждого режима орошения. Голубые и зеленые стрелки указывают на уменьшение массы плодов растений WT и GCHXK, соответственно, при переходе с 75%-ного на 50%-ное орошение.
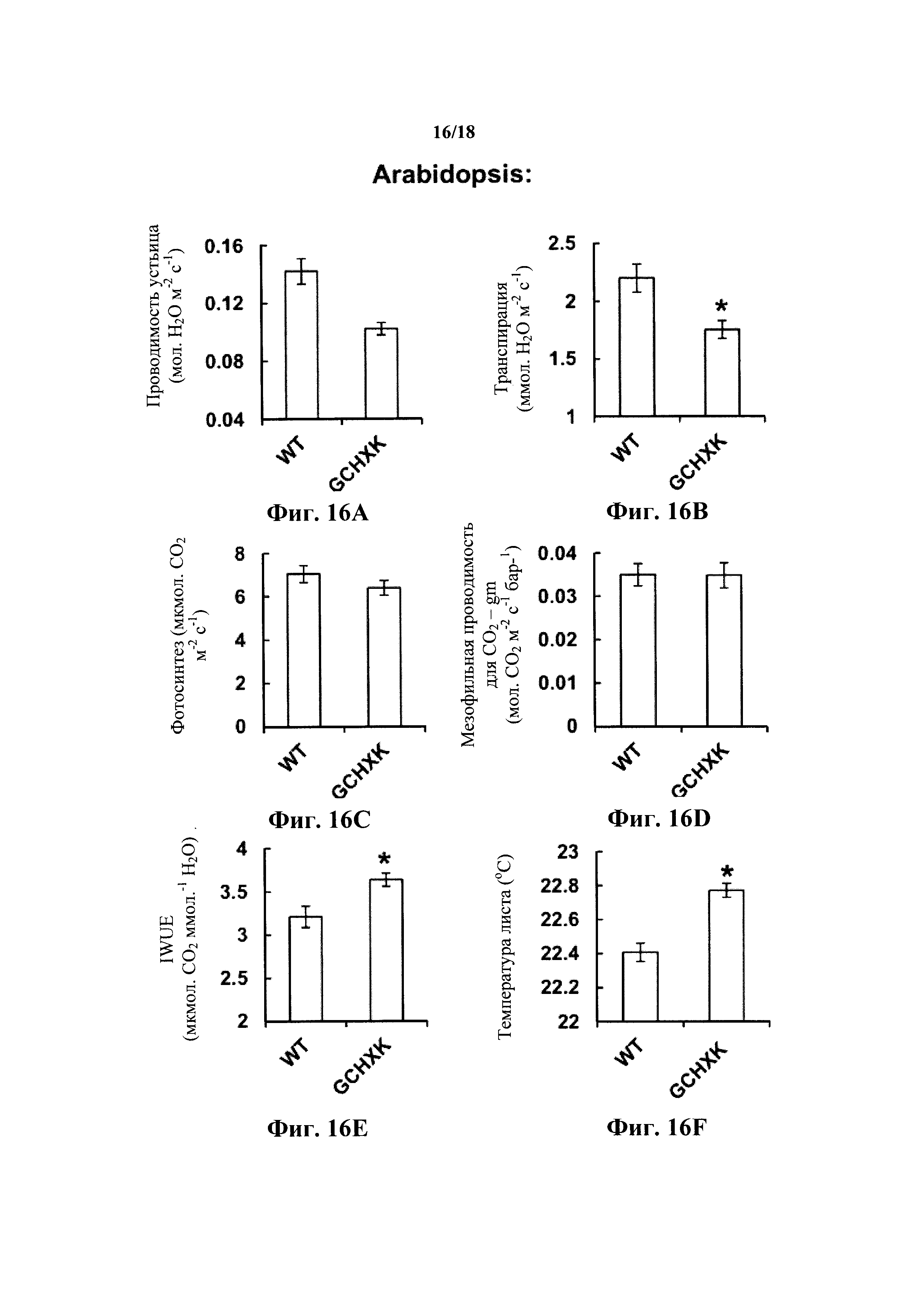
На фиг. 16A-F показано, что специфичная по отношению к замыкающей клетке экспрессия AtHXK1 индуцирует закрытие устьиц, снижает транспирацию и повышает температуру листьев, не снижая фотосинтеза или мезофильной проводимости для СО2, и увеличивает, таким образом, эффективность использования воды растениями Arabidopsis. Проводимость устьица (фиг. 16А), транспирацию (фиг. 16В), фотосинтез (фиг. 16С) и мезофильную проводимость для СО2 (gm, фиг. 16D) измеряли у растений WT и трансгенных растений Arabidopsis, экспрессирующих AtHXK1 специфично в замыкающих клетках (GCHXK). На фиг. 16Е показана текущая эффективность использования воды (IWUE) растений WT и GCHXK. На фиг. 16F показано, как температуру листьев (более теплые листья - закрытие устьиц) растений WT и GCHXK определяли с использованием программного обеспечения ThermaCam researcher pro 2.10. Точки данные представляют собой среднее значение ± SE 6 биологических повторов на фиг. 16А-Е и 12 биологических повторов на фиг. 16F. Звездочка обозначает значимое различие по сравнению с диким типом (t-критерий, Ρ<0,05).
На фиг. 17А-В представлены схематические карты бинарного вектора pGreeNO029, содержащего промотор KST1, кДНК AtHXK1 (фиг. 17А) или GFP (фиг. 17В) и терминатор. Вектор также содержит гены nos-Kan и неомицин-фосфотрансферазы II (NptII) в качестве селектируемых маркеров на трансформацию бактерий и растений.
Подробное описание изобретения
Согласно некоторым вариантам осуществления настоящее изобретение относится к способам модуляции проводимости устьица и к растительным экспрессионным конструкциям для их осуществления.
Перед подробным объяснением по меньшей мере одного варианта осуществления настоящего изобретения, следует учесть, что настоящее изобретение не обязательно ограничивается при его применении подробностями, изложенными в следующем описании или иллюстрировании с помощью примеров. Имеются и другие варианты осуществления настоящее изобретения, или оно осуществляется или выполняется различными путями.
Вода является основным фактором, ограничивающим рост и развитие многих наземных растений. Устьица, состоящие из двух замыкающих клеток, являются главными каналами, контролирующими потерю воды растениями. Открытие устьиц контролируется многими стимулами окружающей среды и физиологическими стимулами, но все они функционируют посредством регуляции осмолярности замыкающих клеток. Повышение осмолярности замыкающих клеток приводит к открытию устьица, а понижение осмолярности вызывает закрытие устьица. Господствующая парадигма заключается в том, что сахароза действует в качестве осмолита в замыкающих клетках, способствуя, таким образом, открытию устьица.
В процессе разработки настоящего изобретения авторы настоящего изобретения обнаружили, что вопреки господствующей парадигме сахароза закрывает устьице через механизм, отличный от осмотического (см. пример 2). Кроме того, ответ замыкающих клеток на сахарозу зависит от чувствительного к сахару фермента гексокиназы (НХК), которая запускает путь передачи сигнала абсцизовой кислоты в замыкающих клетках, что приводит к закрытию устьица.
Таким образом, в процессе доведения настоящего изобретения до осуществления авторы настоящего изобретения обнаружили, что модуляция активности или экспрессии гексокиназы коррелирует с устьичной щелью.
Как проиллюстрировано в настоящем документе ниже и в нижеследующем разделе Примеры, авторы настоящего изобретения надэкспрессировали НХК в устьице растений томата (специфичным по отношению к замыкающей клетке образом). Удивительно, что при сохранении фотосинтеза неизмененным (фиг. 10С) устьичная проводимость (указывающая на устьичную щель, фиг. 10В) и транспирация (фиг. 10А) были снижены. Подобные результаты были получены при мониторинге тех же параметров на протяжении суток (фиг. 12A-D). Важно, что измеряя общую площадь листьев и массу растения (фиг. 12С и 12D, соответственно), авторы настоящего изобретения открыли, что даже несмотря на то, что растения потребляли меньше воды (фиг. 12А), рост не ухудшался, а даже улучшался. Сохранение воды без влияния на рост растения улучшает эффективность использования воды растением. Повышенная экспрессия гексокиназы в замыкающих клетках улучшает получение урожая (фиг. 14А-В) даже при ограниченном водоснабжении (фиг. 15А-С). Подобные результаты получали на Arabidopsis. Эти результаты демонстрируют, что одинаковая трансгенная вставка гексокиназы под специфичный по отношению к замыкающей клетке промотор, используемый в случае с томатом (семейство Solanaceae), универсально применима для воздействия на устьица, а также повышает эффективность использования воды в случае с Arabidopsis (семейство Brassicaceae), и что эта методика может быть внедрена также и на других видах.
В отличие от предыдущих исследований, которые основывались на корреляциях между содержанием сахарозы и устьичной щелью, в данном исследовании предпринят функциональный подход для изучения эффектов сахарозы и продуктов ее расщепления на поведение устьица. На данный момент доказано, что сахароза стимулирует специфичный по отношению к замыкающей клетке ответ, который опосредуется НХК и ABA и приводит к закрытию устьица. Без углубления в теорию предполагают, что этот ответ представляет естественный механизм обратной связи, нацеленный на снижение транспирации и консервирование воды при избыточном фотосинтезе и осуществляющий, таким образом, координацию между фотосинтезом и транспирацией.
Таким образом, аспект настоящего изобретения относится к способу регулирования проводимости устьица растения, при этом способ включает модуляцию у растения уровня и/или активности гексокиназы специфичным по отношению к замыкающей клетке образом с регулированием тем самым проводимости устьица и транспирации растения.
Используемая в настоящем документе фраза «проводимость устьица» относится к газовому обмену через поровый комплекс устьица. Проводимость устьица регулируется устьичной щелью. Устьичная проводимость влияет на транспирацию растения, и, поэтому, методом в соответствии с настоящим изобретением согласно этому аспекту настоящего изобретения также регулируют транспирацию растения.
Используемая в настоящем документе фраза «регулирование проводимости устьица растения» относится к повышению или уменьшению проводимости устьица. Повышение или уменьшение может составлять по меньшей мере 2%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или более 90% или 100% (например, 20-40%).
Используемый в настоящем документе термин «гексокиназа», сокращенно НХК, называемая в настоящем документе «трансгеном» или «полипептидом», относится к ферменту, который, как правило, фосфорилирует гексозы (сахара с шестью углеродами) с образованием фосфата гексозы и имеет номер 2.7.1.1 по Е.С. Используемая в настоящем документе НХК также относится к подобному белку гексокиназе (HKL), который связывает гексозу и предает сигнал, независимый от его киназной активности (фосфорилирование гексозы).
Размер гексокиназ согласно идеям настоящего изобретения может составлять приблизительно 100 кДа у большинства многоклеточных организмов (например, млекопитающих и растений). Они состоят из двух половинок (N- и С-концевой), которые обладают существенной гомологией последовательностей. Это указывает на эволюционное происхождение путем дубликации и слияния 50-кДа подобных предковых гексокиназ.
Гексокиназа может быть естественного происхождения или может содержать синтетическую последовательность/состоять из синтетической последовательности (т.е. искусственной), пока она сохраняет гексокиназную активность.
Вследствие своего высокого уровня консервативности гексокиназа в соответствии с настоящим изобретением может быть растительного или животного происхождения. Согласно конкретному варианту осуществления гексокиназой является растительная гексокиназа.
Гексокиназы могут быть разделены на категории в соответствии с их клеточной локализацией. Таким образом, НХК могут быть ассоциированы с митохондриями, ассоциированы с пластидами или находиться внутри пластид или присутствовать в цитозоле. На данный момент было обнаружено, что все исследованные НХК двудольных имеют либо пластидный сигнальный пептид (тип А), либо N-терминальный мембранный якорный домен (тип В), однако, цитозольные гексокиназы также рассматриваются для применения в соответствии с идеями настоящего изобретения. Согласно конкретному варианту осуществления гексокиназой является НХК типа В (ассоциированная с митохондриями).
Используемая в настоящем документе фраза «гексокиназная активность» относится к способности фермента регулировать проводимость устьица. Фермент может связывать гексозу и стимулировать путь абсцизовой кислоты (ABA), который регулирует проводимость устьица. Активность может не зависеть от киназы.
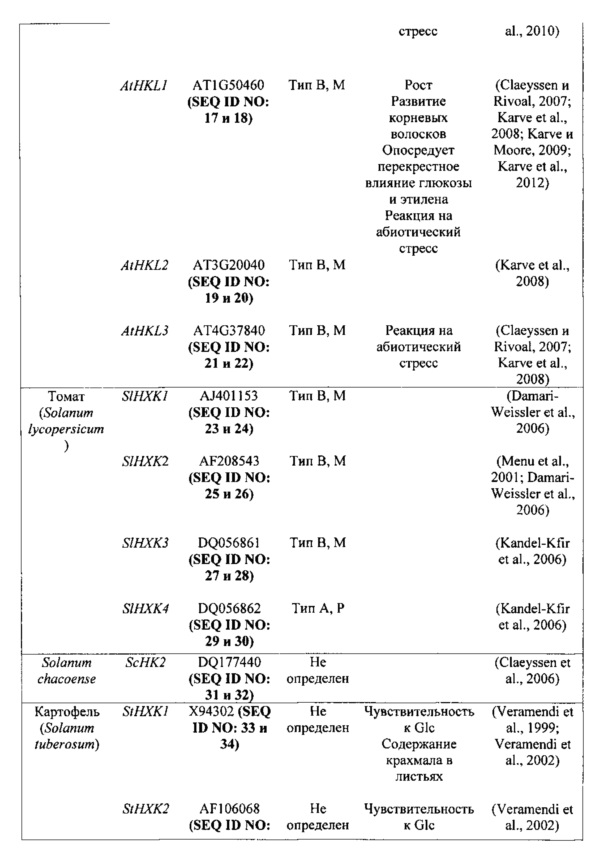
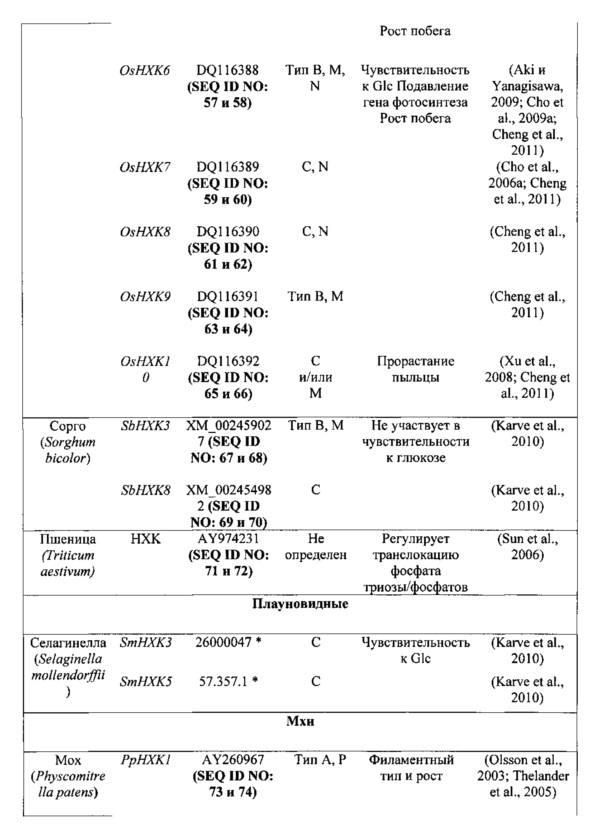
Неограничивающие примеры гексокиназ, которые предполагаются идеями настоящего изобретения, представлены в таблице 1 в настоящем документе ниже.


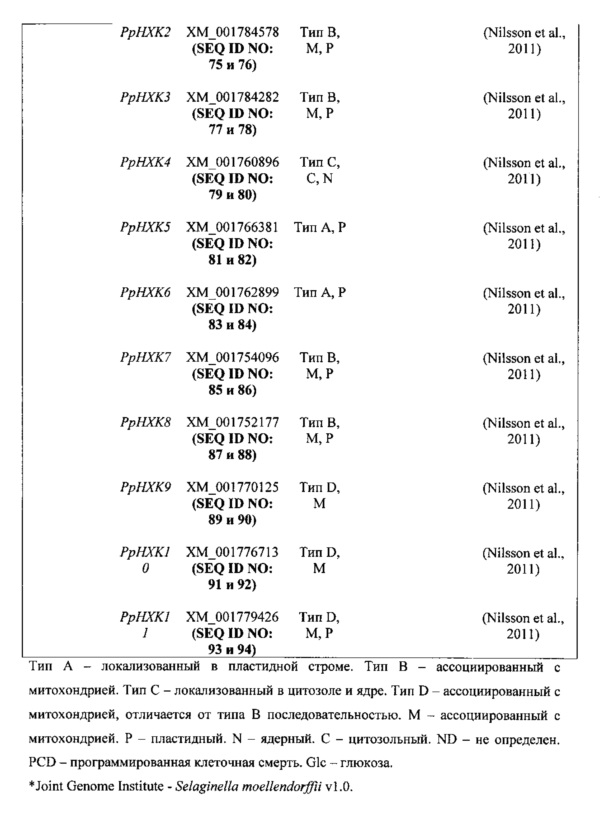
Как упоминалось, последовательность НХК может быть естественного происхождения или искусственно созданной (например, кодон-оптимизированной) в соответствии с намеченным применением.
Согласно конкретному варианту осуществления модуляция активности или экспрессии НХК относится к повышающей регуляции активности или экспрессии, которая приводит к снижению устьичной проводимости. Повышающая регуляция может составлять, по меньшей мере, 5%, 10%, 20,%, 30%, 40%, 50%, 60%, 70% 80% или больше, скажем 90% или даже 100% по сравнению с экспрессией или активностью гексокиназы в аналогичных клетках того же вида растений, условиях роста и стадии развития (например, растения дикого типа (WT)).
Как упоминалось выше, повышающая регуляция активности или экспрессии гексокиназы специфичным по отношению к замыкающей клетке образом имеет ряд преимуществ у культурных растений и в овощеводстве.
Таким образом, авторы настоящего изобретения показали, что повышающая регуляция НХК специфичным по отношению к замыкающей клетке образом уменьшает устьичную щель и проводимость (не влияя на фотосинтез), улучшает эффективность использования воды растением, вследствие этого увеличивает выносливость растения к засухе и в целом увеличивает мощность, биомассу или урожайность растений (при стрессовых или оптимальных условиях роста). Подобным образом, растения, экспрессирующие НХК специфичным по отношению к замыкающей клетке образом, выносливы к стрессу засоленности. Считается, что вода поглощается (впитывается) растениями в результате разницы между потенциалом воды в воздухе и внутри растениях. Эта разница называется дефицитом давления пара (VPD). VPD является движущей силой впитывания воды из почвы. Чем выше VPD, тем больше сила. Все же когда устьица частично закрыты, эффект VPD снижается и меньше воды поглощается растением. В этом случае растение поглотит меньше соли из почвы и будет меньше подвержено влиянию. Идеи настоящего изобретения имеют также беспрецедентное влияние на выносливость растений к биотическому стрессу. Многие человеческие и растительные патогены, такие как бактерии и грибы, проникают в растения через устьице (см., например, Kroupitski et al. Applied and Environmental Microbiology 2009 6076-6086 teaching that Salmonella enteric internalizes in leaves via open stomata). Устьице не только обеспечивает легкий вход, но и служит хорошей окружающей средой для привлечения патогенов, привлекая патогены накоплением сахаров вблизи замыкающих клеток, когда устьице открыто. Действительно, авторы настоящего изобретения наблюдали уменьшение грибковых и бактериальных инфекций у растений с высокой экспрессией НХК (не показано).
В качестве альтернативы или дополнительно, идеи настоящего изобретения могут быть также использованы для придания растению выносливости к температурному стрессу (тепловому или холодовому). Например, ожидается, что растения, экспрессирующие высокие уровни НХК специфичным по отношению к замыкающей клетке образом, будут демонстрировать повышенную тепловую и холодовую устойчивость в отношении завязывания плодов. Развитие пыльцы и прорастание чувствительны к теплу и холоду, вероятнее всего, по причине пертурбаций сахарного метаболизма. Предполагается, что во время теплового стресса меньше сахаров переносится к пыльцевым зернам (и к прочим акцептирующим тканям, накапливающим поступающие вещества также), поскольку большая часть воды транспирируется через устьице. Согласно идеям настоящего изобретения, если меньше воды транспирируется через устьица, следствием этого является то, что больше воды доступно для транспорта сахаров во флоэме. Это может влиять на устойчивость к температурному стрессу (например, к тепловому), обеспечивая таким образом продуцирование жизнеспособных пыльцевых зерен.
В качестве альтернативы или дополнительно, идеи настоящего изобретения могут быть использованы для предотвращения вершинной гнили (BER). BER - это видимое физиологическое повреждение, которое поражает многие культуры, такие как томат, баклажан, перец, дыня и многие другие. BER развивается преимущественно при тепловом и водном стрессах. В настоящее время предполагают, что при таких условиях большая часть воды транспирируется, и меньше воды доступно для переноса Сахаров, минералов и ионов к плодам. Соответственно, снижение транспирации может распределить больше воды для переноса большего количества Сахаров, минералов и ионов к плодам и к прочим акцептирующим тканям, накапливающим поступающие вещества (Nikinma et al. 2012 Plant, Cell and Environment 2012 1-15). BER определяется по процентному отношению плодов, которые демонстрируют видимую или выявляемую гниль (физическое повреждение) на плодах. Предотвращение BER означает снижение процентного отношения плодов с BER.
Таким образом, согласно типичному варианту осуществления идеи настоящего изобретения могут быть использованы для увеличения биомассы, мощности или урожайности растения.
Используемая в настоящем документе фраза «урожайность растения» относится к количеству (например, определяемому по массе или размеру) или количеству (числу) тканей или органов, продуцируемых на растение или на сезон выращивания. Следовательно, повышенная урожайность может приносить экономическую пользу, которую можно получить с растения на определенной площади выращивания и/или за определенное время выращивания.
Следует отметить, что на урожайность растений могут влиять различные параметры, в том числе без ограничения биомасса растений; мощность растений; скорость роста; урожайность семян; количество семян или зерен; качество семян или зерен; выход масла; содержание масла, крахмала и/или белка в собранных органах (например, семенах, плодах или вегетативных частях растения); число цветков (цветков соцветия) на метелку (выражаемое как отношение числа наполненных семян к числу первичных метелок); процентное отношение массы урожая к полной массе растений; число выросших растений на площадь; число и размер собранных органов на растение и на площадь; число растений на площадь выращивания (плотность); число собранных органов на поле; общая площадь листьев; ассимиляция углерода и распределение углерода (распространение/локализация углерода внутри растения); устойчивость к затенению; число собираемых органов (например, семян), семена на стручок, масса на семя и модифицированная архитектура (такая как увеличение диаметра, толщины или улучшение физических свойств стебля (например, эластичности)).
Используемая в настоящем документе фраза «урожайность семян» относится к числу или массе семян на растение, семян на стручок или на площадь выращивания или к массе одного семени, или к маслу, экстрагируемому на семя. Следовательно, на урожайность семян могут влиять размеры семени (например, длина, ширина, периметр, площадь и/или объем), число (наполненных) семян и скорость наполнения семян, а также содержание масла в семенах. Следовательно, урожайность семян на растение может влиять на экономическую пользу, которую можно получить с растения на определенной площади выращивания и/или за определенное время выращивания; и повышения урожайности семян на площадь выращивания можно достичь путем увеличения урожайности семян на растение и/или путем увеличения числа выращиваемых растений на той же данной площади.
Используемый в настоящем документе термин «семя» (иногда упоминаемое как «зерно» или «семечко») относится к маленькому зародышевому растению, заключенному в оболочке, называемой оболочкой семени (обычно с некоторыми запасенными питательными веществами), продукту созревшей семяпочки голосеменных и покрытосеменных растений, который возникает после оплодотворения и некоторого роста внутри материнского растения. Семя может быть гибридным семенем или гомозиготной линией.
Используемая в настоящем документе фраза «содержание масла» относится к количеству липидов в данном органе растения, либо в семенах (содержание масла в семенах), либо в вегетативной части растения (содержание масла в вегетативных органах), и обычно выражается как процентное отношение от сухой массы (10% влажность семян) или от влажной массы (для вегетативной части).
Следует отметить, что на содержание масла влияет продуцирование масла, присущее ткани (например, семени, плоду, вегетативной части), а также масса или размер продуцирующей масло ткани на растение или на период роста.
Согласно одному варианту осуществления повышение содержания масла в растении может быть достигнуто путем увеличения размера/массы ткани(ей) растения, которая содержит масло, на период роста. Таким образом, повышенное содержание масла в растении может быть достигнуто путем увеличения урожайности, скорости роста, биомассы и мощности растения.
Используемая в настоящем документе фраза «биомасса растения» относится к количеству (например, измеренному в граммах высушенной на воздухе ткани) ткани, продуцируемой растением в сезон выращивания, которое может также определять урожайность растений или урожайность на площадь выращивания или влиять на нее. Повышение биомассы растения может происходить в целом растении или в его частях, таких как надземные (собираемые) части, биомасса плодов, вегетативная биомасса, корни и семена.
Используемая в настоящем документе фраза «скорость роста» относится к увеличению размера органа/ткани растения за время (может быть измерено в см2 на день).
Используемая в настоящем документе фраза «мощность растения» относится к количеству (измеряемому по массе) ткани, продуцируемой растением за данное время. Следовательно, повышенная мощность может определять или влиять на урожайность растения или урожайность на время выращивания или на площадь выращивания. Кроме того, ранняя мощность (семени и/или проростка) приводит к улучшению стояния в поле.
Следует отметить, что урожайность растений может определяться при стрессовых (например, абиотический стресс) и/или нестрессовых (нормальных) условиях. В настоящем документе предполагается, что урожайность, мощность или биомасса растения, экспрессирующего НХК специфичным по отношению к замыкающей клетке образом, повышены по сравнению с таковыми у растения дикого типа (не экспрессирующего указанную НХК) в стрессовых или нестрессовых условиях.
Используемая в настоящем документе фраза «нестрессовые условия» (или нормальные, или оптимальные как упоминается в настоящем документе) относится к условиям роста (например, к воде, температуре, циклам свет-темнота, влажности, концентрации соли, концентрации удобрений в почве, снабжению питательными веществами, такими как азот, фосфор и/или калий), которые значимо не отклоняются от ежедневных климатических и прочих абиотических условий, с которыми растения могут столкнуться, и которые обеспечивают оптимальный рост, метаболизм, воспроизведение и/или жизнеспособность растения на любой стадии его жизненного цикла (например, у культурного растения от семени до зрелого растения и в обратном направлении до семени вновь). Специалистам в данной области известны нормальные почвенные условия и климатические условия для данного растения в данном географическом местоположении. Следует отметить, что хотя нестрессовые условия могут включать некоторые незначительные вариации от оптимальных условий (которые варьируют от одного типа/вида растения к другому), такие вариации не вызывают прекращение роста растения без способности к возобновлению роста.
Как упоминалось, повышенная урожайность может наблюдаться в нестрессовых условиях или в условиях абиотического/биотического стресса.
Используемая в настоящем документе фраза «абиотический стресс» относится к любому нежелательному эффекту на метаболизм, рост, воспроизведение и/или жизнеспособность растения. Соответственно, абиотический стресс может быть индуцирован субоптимальными окружающими условиями роста, такими как, например, засоленность, недостаток воды, затопление, замерзание, низкая или высокая температура (т.е., холод или тепло), токсичность, вызванная тяжелыми металлами, анаэробиоз, дефицит питательных веществ, атмосферное загрязнение или УФ облучение.
Используемая в настоящем документе фраза «выносливость к абиотическому стрессу» относится к способности растения выносить абиотический стресс, не испытывая существенного изменения метаболизма, роста, продуктивности и/или жизнеспособности.
Используемая в настоящем документе фраза «эффективность использования воды (WUE)» относится к уровню органического вещества, продуцируемого на единицу потребленной растением воды, т.е., к сухой массе растения по отношению к использованию воды растением, например, к биомассе, продуцируемой на единицу транспирации.
Аналогично, фраза «биотический стресс» относится к стрессу, который возникает в результате повреждения, причиненного растениям другими живыми организмами, такими как бактерии, вирусы, грибки, паразиты.
Повышающая регуляция НХК специфичным по отношению к замыкающей клетке образом может быть использована для исправления любого из вышеупомянутых состояний и для улучшения характеристики растений в целом. Таким образом, на повышающую регуляцию НХК может влиять экспрессия экзогенного полинуклеотида, кодирующего НХК, у растения специфичным по отношению к замыкающей клетке образом.
Используемая в настоящем документе фраза «экспрессия в растении экзогенного полинуклеотида, кодирующего НХК» относится к повышающей регуляции уровня экспрессии экзогенного полинуклеотида, кодирующего полипептид НХК, в растении путем введения экзогенного полинуклеотида в клетку растения или в растение и экспрессии с помощью рекомбинантных средств, как далее описано в настоящем документе ниже.
Используемая в настоящем документе фраза «экспрессия» относится к экспрессии на уровне мРНК и полипептида. Полагают, что сайленсинг экспрессии осуществляется только на уровне мРНК (механизмы сайленсинга НХК дополнительно описаны в настоящем документе ниже).
Используемая в настоящем документе фраза «экзогенный полинуклеотид» относится к гетерологичной последовательности нуклеиновой кислоты, которая может не экспрессироваться в естественном состоянии в растении, или надэкспрессия которой желательна у растения. Экзогенный полинуклеотид может быть введен в растение стабильным или временным образом с тем, чтобы продуцировать молекулу рибонуклеиновой кислоты (РНК) и/или молекулу полипептида. Следует отметить, что экзогенный полинуклеотид может включать последовательность нуклеиновой кислоты, которая идентична или частично гомологична эндогенной последовательности нуклеиновой кислоты растения.
Используемый в настоящем документе термин «эндогенный» относится к любому полинуклеотиду или полипептиду, который присутствует и/или экспрессируется в естественном состоянии в растении или в его клетке.
В соответствии с настоящим изобретением экзогенный полинуклеотид содержит последовательность нуклеиновой кислоты, кодирующую полипептид, имеющим аминокислотную последовательность гексокиназы.
Согласно конкретному варианту осуществления аминокислотная последовательность полипептида НХК (кодируемая экзогенным полинуклеотидом) обладает по меньшей мере приблизительно 30%, 40% или 50%, или по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 81%, по меньшей мере приблизительно 82%, по меньшей мере приблизительно 83%, по меньшей мере приблизительно 84%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, или более 100% гомологией по отношению к аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92 и 94, при условии, что ее гексокиназная активность сохраняется, как описано выше.
Гомология (например, процентная гомология, идентичность + подобие) может быть определена с использованием любого программного обеспечения для сравнения гомологии, включая, например, программное обеспечение BlastP или TBLASTN Национального центра биотехнологической информации (NCBI), например, с использованием параметров по умолчанию, при старте с последовательности полипептида; или алгоритм tBLASTX (доступный через NCBI), например, с использованием параметров по умолчанию, который сравнивает продукты шестирамочной концептуальной трансляции нуклеотидной поисковой последовательности (обеих нитей) с базой данных белковых последовательностей.
Согласно некоторым вариантам осуществления настоящего изобретения термин «гомология» или «гомологичный» относится к идентичности двух или более последовательностей нуклеиновой кислоты или к идентичности двух или более аминокислотных последовательностей.
Гомологичные последовательности включают в себя как ортологичные, так и паралогичные последовательности. Термин «паралогичный» относится дупликациям гена в геноме вида, приводящим к возникновению паралогичных генов. Термин «ортологичный» относится к гомологичным генам разных организмов, существующим вследствие наследственных взаимоотношений.
Одной опцией идентификации ортологов у видов однодольных растений является проведение реципрокного поиска с помощью BLAST. Это может быть сделано путем первого локального выравнивания, заключающегося в локальном выравнивании представляющей интерес последовательности против любой базы данных последовательностей, такой как общедоступная база данных NCBI, которую можно найти по адресу: Hypertext Transfer Protocol://World Wide Web (dot) ncbi (dot) nlm (dot) nih (dot) gov. Если ведется поиск ортологов у риса, представляющая интерес последовательность будет локально выровнена против, например, 28469 полноразмерных клонов кДНК из Oryza sativa Nipponbare, доступных на NCBI. Результаты локального выравнивания могут быть отфильтрованы. Полноразмерные последовательности либо отфильтрованных результатов, либо неотфильтрованных результатов затем локально выравнивают в обратном направлении (второе локальное выравнивание) против последовательностей организма, из которого получена представляющая интерес последовательность. Затем сравнивают результаты первого и второго локальных выравниваний. Ортолог идентифицируют, если последовательность, набравшая самые высокие баллы (наилучшее совпадение) в первом локальном выравнивании, идентифицирует поисковую последовательность во втором локальном выравнивании (первоначальную представляющую интерес последовательность) как наилучшее совпадение. С использованием такого же логического обоснования выявляют паралог (гомолог к гену в том же организме). В случае больших семейств последовательностей может быть использована программа ClustalW (Hypertext Transfer Protocol://World Wide Web (dot) ebi (dot) ac (dot) uk/Tools/clustalw2/index (dot) html) с последующим построением филогенетического дерева методом ближайших соседей (Hypertext Transfer Protocol://en (dot) wikipedia (dot) org/wiki/Neighbor-joining), которое помогает визуализации кластеризации.
Согласно некоторым вариантам осуществления настоящего изобретения экзогенный полинуклеотид в соответствии с настоящим изобретением кодирует полипептид, имеющий аминокислотную последовательность, обладающую по меньшей мере приблизительно 30%, 40%, 50%, 60%, 70% или по меньшей мере приблизительно 80%, по меньшей мере приблизительно 81%, по меньшей мере приблизительно 82%, по меньшей мере приблизительно 83%, по меньшей мере приблизительно 84%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99% или более 100% идентичностью по отношению к аминокислотной последовательности, выбранной из группы, состоящей из 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92 и 94, при условии, что гексокиназная активность белка сохраняется (как описано выше).
Используемый в настоящем документе термин «полинуклеотид» относится к последовательности одно- или двухнитевой нуклеиновой кислоты, которую выделяют и обеспечивают в форме последовательности РНК, комплементарной полинуклеотидной последовательности (кДНК), геномной полинуклеотидной последовательности и/или комбинированных полинуклеотидных последовательностей (например, комбинация вышеупомянутых).
Термин «выделенный» относится к по меньшей мере частично отделенному от природной окружающей среды, например, от растительной клетки.
Используемая в настоящем документе фраза «комплементарная полинуклеотидная последовательность» относится к последовательности, которая является результатом обратной транскрипции информационной РНК с использованием обратной транскриптазы или любой другой РНК-зависимой ДНК-полимеразы. Такая последовательность может быть впоследствии амплифицирована in vivo или in vitro с использованием ДНК-зависимой ДНК-полимеразы.
Используемая в настоящем документе фраза «геномная полинуклеотидная последовательность» относится к последовательности, полученной (выделенной) из хромосомы, и, таким образом, она представляет собой непрерывную часть хромосомы.
Используемая в настоящем документе фраза «составная полинуклеотидная последовательность» относится к последовательности, которая является, по меньшей мере частично, комплементарной и, по меньшей мере частично, геномной. Составная последовательность может включать в себя некоторые экзонные последовательности, необходимые для кодирования полипептида в соответствии с настоящим изобретением, а также некоторые интронные последовательности, вставленные между ними. Интронные последовательности могут быть из любого источника, в том числе из других генов, и, как правило, будут включать в себя сохраненные сплайсингом сигнальные последовательности. Такие интронные последовательности могут дополнительно включать в себя действующие в цис-положении регуляторные элементы экспрессии.
Последовательности нуклеиновой кислоты, кодирующие полипептиды НХК в соответствии с настоящим изобретением, могут быть оптимизированы для экспрессии. Примеры таких модификаций последовательности включают в себя без ограничения измененное содержание G/C для более точного охватывания типично встречающихся в представляющих интерес растительных видах, и удаление кодонов, нетипично встречающихся в растительных видах, обычно называемое оптимизацией кодона.
Фраза «оптимизация кодона» относится к выбору соответствующих нуклеотидов ДНК для использования в пределах структурного гена или его фрагмента, который включает использование кодона, в пределах представляющего интерес растения. Таким образом, оптимизированный ген или последовательность нуклеиновой кислоты относится к гену, в котором нуклеотидная последовательность нативного или встречающегося в природе гена была модифицирована с целью использования статистически предпочтительных или статистически благоприятных кодонов в растение. Нуклеотидную последовательность, как правило, изучают на уровне ДНК, а область кодирования, оптимизированную для экспрессии в растительных видах, определяют с использованием любой подходящей процедуры, например, как описано в Sardana et al. (1996, Plant Cell Reports 15:677-681). В этом способе стандартное отклонение использования кодона, мера смещения использования кодона, может быть рассчитана сначала путем нахождения квадрата пропорционального отклонения использования каждого кодона нативного гена по отношению к таковому у растений с высоким уровнем экспрессии генов, с последующим вычислением среднего квадрата отклонения. Используемая формула представляет собой: 1 SDCU=n=1 Ν [(Xn-Υn)/Υn] 2/Ν, в которой Xn относится к частоте использования кодона n в растениях с высоким уровнем экспрессии генов, где Υn относится к частоте использования кодона n в представляющем интерес гене, и N относится к общему количеству кодонов в представляющем интерес гене. Таблица использования кодона из двудольных растений с высоким уровнем экспрессии генов составлена с использованием данных Murray et al. (1989, Nuc Acids Res. 17:477-498).
Один из способов оптимизации последовательности нуклеиновой кислоты в соответствии с предпочтительным использованием кодонов для определенного типа растительной клетки основывается на прямом применении, без выполнения каких-либо дополнительных статистических вычислений, из таблиц оптимизации кодонов, таких как те, которые представлены «он-лайн» базе данных использования кодонов через банк ДНК NIAS (Национального института агробиологических наук) в Японии (Hypertext Transfer Protocol://World Wide Web (dot) kazusa (dot) or (dot) jp/codon/). База данных использования кодонов содержит таблицы использования кодона для ряда различных видов, причем каждая таблица использования кодона была статистически определена на основании данных, представленных в Genbank.
При использовании вышеупомянутых таблиц для определения наиболее предпочтительных или наиболее благоприятных кодонов для каждой аминокислоты у определенных видов (например, у риса), нуклеотидная последовательность природного происхождения, кодирующая представляющий интерес белок, может быть оптимизирована в отношении кодонов для этих определенных видов растений. Это осуществляют путем замены кодонов, которые могут иметь низкую статистическую встречаемость в геноме определенных видов, соответствующими кодонами, в отношении аминокислоты, которые являются статистически более предпочтительными. Тем не менее, один или несколько менее благоприятных кодонов могут быть выбраны для удаления существующих сайтов рестрикции, чтобы создать новые в потенциально полезных точках (на 5'- и 3'-концах для добавления сигнального пептида или кассет терминации, внутренних сайтов, которые могут быть использованы для резки и сплайсинга сегментов вместе, чтобы получить правильную полноразмерную последовательность), или для устранения нуклеотидных последовательностей, которые могут отрицательно сказаться на стабильности или экспрессии мРНК.
Кодирующая нуклеотидная последовательность природного происхождения может уже, до какой-либо модификации, содержать ряд кодонов, которые соответствуют статистически благоприятному кодону в определенных видах растений. Таким образом, оптимизация кодона нативной нуклеотидной последовательности может включать определение того, какие кодоны в нативной нуклеотидной последовательности не являются статистически благоприятными в отношении конкретного растения, и модификацию этих кодонов в соответствии с таблицей использованием кодонов конкретного растения с целью получения производной оптимизированного кодона. Модифицированная нуклеотидная последовательность может быть полностью или частично оптимизирована для использования кодонов растений при условии, что белок, кодируемый модифицированной нуклеотидной последовательностью, продуцируется при более высоком уровне, чем белок, кодируемый соответствующим встречающимся в природе или нативным геном. Конструкция синтетических генов путем изменения использования кодонов описана, например, в патентной РСТ заявке №93/07278.
Используемый в настоящем документе термин «растение» охватывает целые растения, предков и потомство растений, а также части растения (такие, которые содержат устьице, но не обязательно), в том числе семена, побеги, стебли, корни (включая клубни), а также растительные клетки, ткани и органы. Растение может быть в любой форме, в том числе в форме суспензионных культур, зародышей, участков меристемы, каллусной ткани, листьев, гаметофитов, спорофитов, пыльцы и микроспор.
Согласно некоторым вариантам осуществления настоящего изобретения растение является двудольным растением.
Согласно некоторым вариантам осуществления настоящего изобретения растение является однодольным растением.
Растения, которые особенно применимы в способах в соответствии с настоящим изобретением, включают в себя все растения, которые принадлежат надсемейству Viridiplantae, в частности, однодольные и двудольные растения, в том числе кормовое или фуражное бобовое растение, декоративное растение, пищевая культура, дерево или кустарник, выбранные из перечня, включающего в себя Acacia spp., Acer spp., Actinidia spp., Aesculus spp., Agathis australis, Albizia amara, Alsophila tricolor, Andropogon spp., Arachis spp, Areca catechu, Astelia fragrans, Astragalus cicer, Baikiaea plurijuga, Betula spp., Brassica spp., Braguiera gymnorrhiza, Burkea africana, Butea frondosa, Cadaba farinosa, Calliandra spp, Camellia sinensis, Canna indica, Capsicum spp., Cassia spp., Centroema pubescens, Chacoomeles spp., Cinnamomum cassia, Coffea arabica, Colophospermum mopane, Coronillia varia, Cotoneaster serotina, Crataegus spp., Cucumis spp., Cupressus spp., Cyathea dealbata, Cydonia oblonga, Cryptomeria japonica, Cymbopogon spp., Cynthea dealbata, Cydonia oblonga, Dalbergia monetaria, Davallia divaricata, Desmodium spp., Dicksonia squarosa, Dibeteropogon amplectens, Dioclea spp, Dolichos spp., Dorycnium rectum, Echinochloa pyramidalis, Ehraffia spp., Eleusine coracana, Eragrestis spp., Erythrina spp., Eucalypfus spp., Euclea schimperi, Eulalia vi/losa, Pagopyrum spp., Feijoa sellowlana, Fragaria spp., Flemingia spp, Freycinetia banksli, Geranium thunbergii, GinAgo biloba, Glycine javanica, Gliricidia spp, Gossypium hirsutum, Grevillea spp., Guibourtia coleosperma, Hedysarum spp., Hemaffhia altissima, Heteropogon contoffus, Hordeum vulgare, Hyparrhenia rufa, Hypericum erectum, Hypeffhelia dissolute, Indigo incamata, Iris spp., Leptarrhena pyrolifolia, Lespediza spp., Lettuca spp., Leucaena leucocephala, Loudetia simplex, Lotonus bainesli, Lotus spp., Macrotyloma axillare, Malus spp., Manihot esculenta, Medicago saliva, Metasequoia glyptostroboides, Musa sapientum, Nicotianum spp., Onobrychis spp., Ornithopus spp., Oryza spp., Peltophorum africanum, Pennisetum spp., Persea gratissima, Petunia spp., Phaseolus spp., Phoenix canariensis, Phormium cookianum, Photinia spp., Picea glauca, Pinus spp., Pisum sativam, Podocarpus totara, Pogonarthria fleckii, Pogonaffhria squarrosa, Populus spp., Prosopis cineraria, Pseudotsuga menziesii, Pterolobium stellatum, Pyrus communis, Quercus spp., Rhaphiolepsis umbellata, Rhopalostylis sapida, Rhus natalensis, Ribes grossularia, Ribes spp., Robinia pseudoacacia, Rosa spp., Rubus spp., Salix spp., Schyzachyrium sanguineum, Sciadopitys vefficillata, Sequoia sempervirens, Sequoiadendron giganteum, Sorghum bicolor, Spinacia spp., Sporobolus fimbriatus, Stiburus alopecuroides, Stylosanthos humilis, Tadehagi spp, Taxodium distichum, Themeda triandra, Trifolium spp., Triticum spp., Tsuga heterophylla, Vaccinium spp., Vicia spp., Vitis vinifera, Watsonia pyramidata, Zantedeschia aethiopica, Zea mays, амарант, артишок, спаржу, брокколи, брюссельскую капусту, капусту, канолу, морковь, цветную капусту, сельдерей, капусту листовую, лен, капусту кормовую, чечевицу, масличный рапс, окру, лук, картофель, рис, сою, клубнику, сахарную свеклу, сахарный тростник, подсолнечник, томат, тыкву, чай, кукурузу, пшеницу, ячмень, рожь, овес, арахис, горох, чечевицу и люцерну, хлопчатник, рапс, канолу, перец, подсолнечник, табак, баклажан, эвкалипт, дерево, декоративное растение, многолетнюю траву и кормовую культуру. В качестве альтернативы, для способов в соответствии с настоящим изобретением могут быть использованы водоросли и другие не относящиеся к Viridiplantae.
Согласно некоторым вариантам осуществления настоящего изобретения растением, включаемым способом в соответствии с настоящим изобретением, является культурное растение, такое как рис, кукуруза, пшеница, ячмень, арахис, картофель, кунжут, оливковое дерево, пальмовое масло, банан, соя, подсолнечник, канола, сахарный тростник, люцерна, просо, бобовые (фасоль, горох), лен, люпин, рапс, табак, тополь и хлопчатник.
Согласно некоторым вариантам осуществления настоящего изобретения, растением является томат или банан.
Согласно некоторым вариантам осуществления настоящего изобретения экспрессию экзогенного полинуклеотида в соответствии с настоящим изобретением в растении обеспечивают введением в клетку растения (например, трансформированием одной или нескольких клеток растения) экзогенного полинуклеотида, кодирующего НХК, под действующим в цис-положении регуляторным элементом, контролирующим экспрессию НХК специфичным по отношению к замыкающей клетке образом, с последующим получением зрелого растения из трансформированных клеток и культивированием зрелого растения при условиях, приемлемых для экспрессии экзогенного полинуклеотида в зрелом растении.
Таким образом, представлены растительная экспрессионная конструкция, содержащая последовательность нуклеиновой кислоты, кодирующую гексокиназу при транскрипционном регулировании специфичного по отношению к замыкающей клетке действующего в цис-положении регуляторного элемента, и способы, с помощью которых осуществляют ее применение.
Также представлен способ снижения проводимости устьица растения, при этом способ включает введение в клетку растения вышеописанной конструкции нуклеиновой кислоты со снижением тем самым проводимости устьица растения.
В качестве альтернативы или дополнительно, представлен способ повышения эффективности использования воды растением, при этом способ включает введение в клетку растения вышеописанной конструкции нуклеиновой кислоты с увеличением тем самым эффективности использования воды растением.
В качестве альтернативы или дополнительно, представлен способ усиления выносливости растения к засухе, засоленности или температурному стрессу, при этом способ включает введение в клетку растения вышеописанной конструкции нуклеиновой кислоты с усилением тем самым выносливости растения к засухе, засоленности или температурному стрессу.
В качестве альтернативы или дополнительно, представлен способ усиления выносливости растения к биотическому стрессу, при этом способ включает введение в клетку растения вышеописанной конструкции нуклеиновой кислоты с усилением тем самым выносливости растения к биотическому стрессу.
В качестве альтернативы или дополнительно, представлен способ увеличения биомассы, мощности или урожайности растения, при этом способ включает введение в клетку растения конструкции нуклеиновой кислоты с увеличением тем самым биомассы, мощности или урожайности растения.
Согласно некоторым вариантам осуществления настоящего изобретения трансформацию осуществляют путем введения в растительную клетку конструкции нуклеиновой кислоты, которая включает в себя экзогенный полинуклеотид согласно некоторым вариантам осуществления настоящего изобретения, кодирующий НХК (как описано выше), и специфичный по отношению к замыкающей клетке действующий в цис-положении регуляторный элемент. Ниже представлены дополнительные подробности приемлемых подходов трансформации.
Используемая в настоящем документе фраза «специфичный по отношению к замыкающей клетке действующий в цис-положении регуляторный элемент» относится к способности транскрипционного элемента управлять экспрессией последовательности нуклеиновой кислоты, при этом регуляция (например, НХК) осуществляется только в замыкающих клетках, остальные ткани у растения остаются немодифицированными трансгенной экспрессией (например, более 90% мРНК экспрессируется в представляющей интерес ткани, как выявлено с помощью RT-PCR). Специфичные по отношению к ткани действующие в цис-положении регуляторные элементы могут быть индуцированы эндогенными или экзогенными факторами, таким образом, они могут быть классифицированы также как индуцибельные промоторы. В других случаях они экспрессируются конститутивно.
Кодирующая последовательность нуклеиновой кислоты (например, НХК) «функционально связывается» с регуляторной последовательностью (например, со специфичным по отношению к замыкающей клетке промотором), если регуляторная последовательность способна оказывать регуляторное действие по отношению к связанной с ней кодирующей последовательности.
Согласно некоторым вариантам осуществления настоящего изобретения действующим в цис-положении регуляторным элементом является промотор.
Используемый в настоящем документе термин «промотор» относится к участку ДНК, который находится в 3'-5'-направлении сайта инициации транскрипции гена, с которым соединяется РНК-полимераза для инициации транскрипции РНК. Промотор контролирует, где (например, в какой части растения) и/или когда (например, на какой стадии или при каком состоянии срока жизни организма) экспрессируется ген.
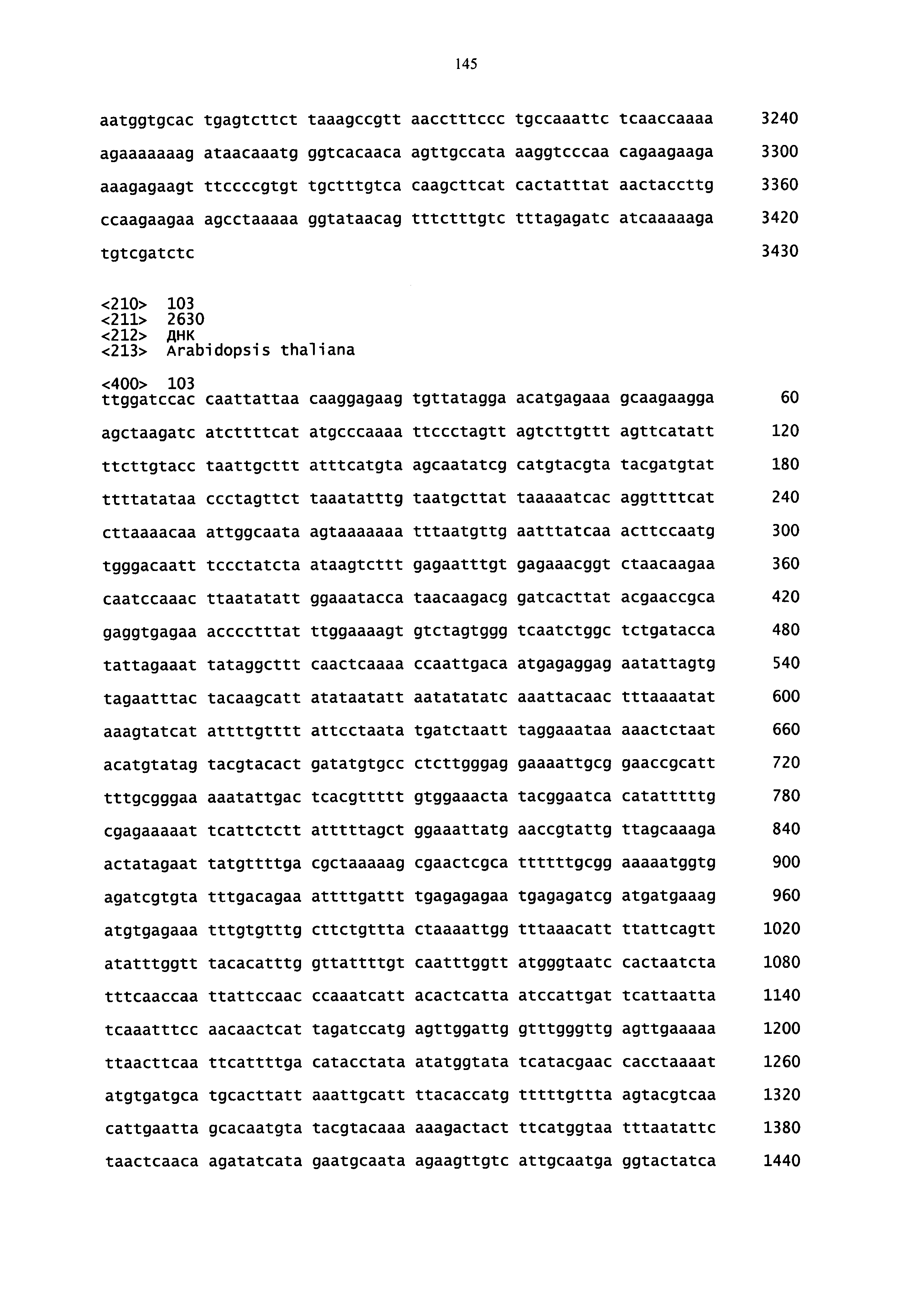
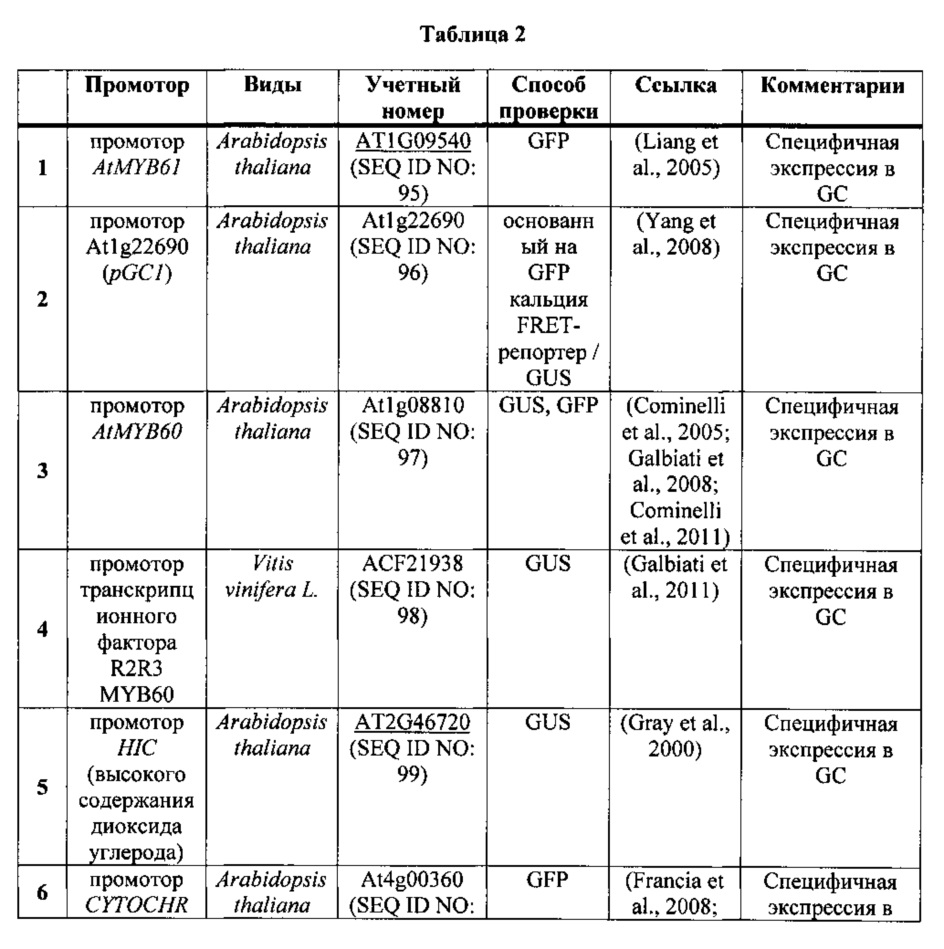
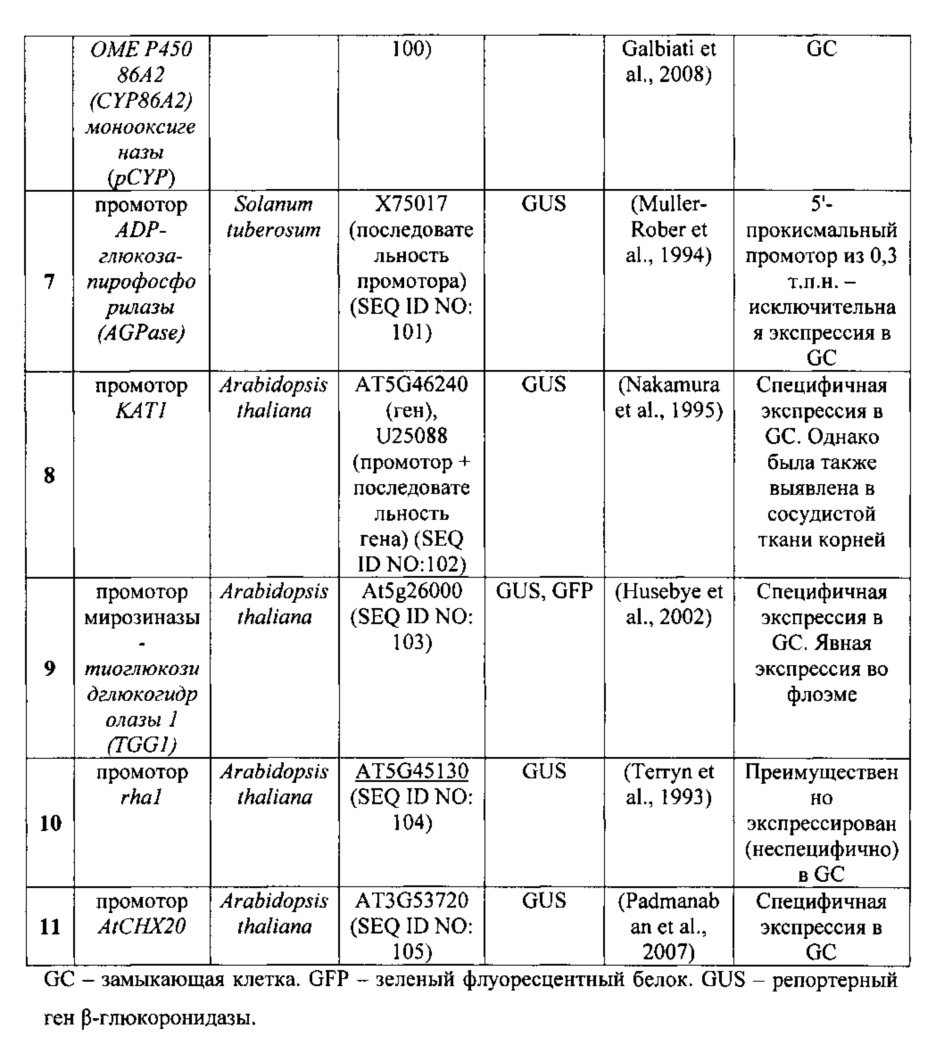
Примеры специфичных по отношению к замыкающей клетке промоторов включают в себя без ограничения промоторы, приведенные в таблице 2 ниже, а также промотор KST1, используемый в разделе Примеры (SEQ ID NO: 108).
Согласно некоторым вариантам осуществления настоящего изобретения конструкция нуклеиновой кислоты может дополнительно включать в себя соответствующий селективный маркер и/или точку начала репликации. Согласно некоторым вариантам осуществления настоящего изобретения используемая конструкция нуклеиновой кислоты представляет собой челночный вектор, который может и воспроизводиться в Е. coli (причем эта конструкция включает в себя соответствующий селективный маркер и точку начала репликации), и быть совместимым с размножением в клетках. Конструкция в соответствии с настоящим изобретением может представлять собой, например, плазмиду, бакмиду, фагмиду, космиду, фаг, вирус или искусственную хромосому.
Согласно некоторым вариантам осуществления настоящего изобретения конструкция нуклеиновой кислоты может применяться для стабильной или временной трансформации растительных клеток. При стабильной трансформации экзогенный полинуклеотид интегрируется в геном растения и как таковой представляет собой стабильный и наследуемый признак. При временной трансформации экзогенный полинуклеотид экспрессируется клеткой трансформированным, но не интегрируются в геном и, как таковой, представляет собой временный признак.
Существуют различные способы введения чужеродных генов и в однодольные, и в двудольные растения (Potrykus, I., Annu. Rev. Plant. Physiol., Plant. Mol. Biol. (1991) 42:205-225; Shimamoto et al., Nature (1989) 338:274-276).
Основные способы обеспечения стабильной интеграции экзогенной ДНК в растительную геномную ДНК включают два основных подхода.
(i) Agrobacterium-опосредованный перенос генов: Klee et al. (1987) Annu. Rev. Plant Physiol. 38:467-486; Klee and Rogers in Cell Culture and Somatic Cell Genetics of Plants, Vol. 6, Molecular Biology of Plant Nuclear Genes, eds. Schell, J., and Vasil, L.K., Academic Publishers, San Diego, Calif. (1989) p.2-25; Gatenby, in Plant Biotechnology, eds. Kung, S. and Arntzen, C.J., Butterworth Publishers, Boston, Mass. (1989) p. 93-112.
(ii) Прямое поглощение ДНК: Paszkowski et al., in Cell Culture and Somatic Cell Genetics of Plants, Vol. 6, Molecular Biology of Plant Nuclear Genes eds. Schell, J., and Vasil, L.K., Academic Publishers, San Diego, Calif. (1989) p. 52-68; в том числе способы прямого поглощения ДНК в протопласты, Toriyama, К. et al. (1988) Bio/Technology 6:1072-1074. Поглощение ДНК, индуцированное кратким поражением растительных клеток электрическим током: Zhang et al. Plant Cell Rep.(1988) 7:379-384. Fromm et al. Nature (1986) 319:791-793. Введение ДНК в растительные клетки или ткани путем бомбардировки частицами, Klein et al. Bio/Technology (1988) 6:559-563; McCabe et al. Bio/Technology (1988) 6:923-926; Sanford, Physiol. Plant. (1990) 79:206-209; путем использования систем микропипеток: Neuhaus et al., Theor. Appl. Genet. (1987) 75:30-36; Neuhaus and Spangenberg, Physiol. Plant. (1990) 79:213-217; трансформация клеточных культур, зародышей или каллусной ткани стеклянными волокнами или кристаллом карбида кремния, патент США №5464765, или путем прямой инкубации ДНК с прорастающей пыльцой, De Wet et al. in Experimental Manipulation of Ovule Tissue, eds. Chapman, G. P. and Mantell, S. H. and Daniels, W. Longman, London, (1985) p.197-209; и Ohta, Proc. Natl. Acad. Sci. USA (1986) 83:715-719.
Система Agrobacterium включает использование плазмидных векторов, содержащих определенные сегменты ДНК, которые интегрируют в растительную геномную ДНК. Способы инокуляции растительной ткани варьируют в зависимости от видов растений и системы доставки Agrobacterium. Широко используемым подходом является процедура с использованием листовых дисков, которая может быть выполнена с любым тканевым эксплантом, что обеспечивает хороший источник для инициации дифференциации всего растения. См., например, Horsch et al. in Plant Molecular Biology Manual A5, Kluwer Academic Publishers, Dordrecht (1988) p. 1-9. В дополнительном подходе используется система доставки Agrobacterium в сочетании с вакуумной инфильтрацией. Система Agrobacterium особенно успешна при создании трансгенных двудольных растений.
Существуют различные способы прямого переноса ДНК в клетки растений. При электропорации протопласты кратковременно подвергают воздействию сильного электрического поля. При микроинъекции ДНК механически вводят непосредственно в клетки с использованием очень маленьких микропипеток. При бомбардировке микрочастицами ДНК адсорбируется на микроснарядах, таких как кристаллы сульфата магния или частицы вольфрама, и микроснаряды физически ускоряются в клетки или ткани растений.
После стабильной трансформации осуществляет размножение растения. Наиболее распространенным способом размножения растения является семенное. Однако регенерация путем семенного размножения имеет недостаток, заключающийся в том, что из-за гетерозиготности отсутствует единообразие урожая, поскольку семена производятся растениями в соответствии с генетическими отклонениями, регулируемыми правилами Менделя. По существу, каждое семя является генетически различимым и будет расти со своими специфическими признаками. Поэтому предпочтительно, чтобы трансформированное растение получалось таким образом, чтобы регенерированное растение имело идентичные признаки и характеристики родительского трансгенного растения. Поэтому предпочтительно, чтобы трансформированное растение регенерировалось путем вегетативного размножения, которое обеспечивает быструю, последовательную репродукцию трансформированных растений.
Вегетативное размножение представляет собой процесс выращивания растений нового поколения из цельной ткани, которая была иссечена у выбранного родительского растения или сорта. Этот процесс делает возможным массовую репродукцию растений, имеющих предпочтительную ткань, экспрессирующую слитый белок. Растения нового поколения, которые производятся, являются генетически идентичными исходному растению и обладают всеми его характеристиками. Вегетативное размножение делает возможным серийное производство качественного растительного материала в течение короткого периода времени и предлагает быстрое размножение отборных сортов для сохранения характеристик исходного трансгенного или трансформированного растения. Преимущества клонирования растений состоят в скорости размножения растений, а также в качестве и единообразии произведенных растений.
Вегетативное размножение является многостадийной процедурой, которая требует изменения культуральной среды или условий роста между стадиями. Таким образом, процесс вегетативного размножения состоит из четырех основных стадий: первая стадия - начальное культивирование ткани; вторая стадия - приумножение тканевой культуры; третья стадия - дифференцировка и формирование растений; и четвертая стадия - культивирование и закалка в теплице. Во время первой стадии, начального культивирования ткани, устанавливают культуру ткани и удостоверяются, что она не содержит загрязнения. В ходе второй стадии первоначальную культуру ткани приумножают до получения количества образцов ткани, достаточного для удовлетворения производственных целей. В ходе третьей стадии образцы тканей, выращенные на второй стадии, делят и выращивают до отдельных проростков. На четвертой стадии трансформированные проростки переносят в теплицу для закалки, где постепенно повышают выносливость растения к свету, чтобы его можно было выращивать в естественной среде.
Согласно некоторым вариантам осуществления настоящего изобретения трансгенные растения создают с помощью временной трансформации клеток листьев, клеток меристемы или всего растения.
Временная трансформация может быть осуществлена с помощью любого из вышеописанных способов прямого переноса ДНК или с помощью вирусной инфекции с использованием модифицированных вирусов растений.
Вирусы, которые, как было показано, применимы для трансформации растений-хозяев, включают в себя CaMV, вирус мозаики табака (TMV), вирус мозаики костра (BMV) и вирус обыкновенной мозаики фасоли (BV или BCMV). Трансформация растений с использованием вирусов растений описана в патенте США №4855237 (вирус золотой мозаики фасоли, BGV), в европейском патентном документе №67553 (TMV), в опубликованной заявке на выдачу патента Японии №63-14693 (TMV), в европейском патентном документе №194809 (BV), в европейском патентном документе №278667 (BV); а также в Gluzman, Y. et al., Communications in Molecular Biology: Viral Vectors, Cold Spring Harbor Laboratory, New York, pp. 172-189 (1988). Частицы псевдовируса для использования в экспрессии чужеродной ДНК у многих хозяев, в том числе у растений, описаны в WO 87/06261.
Согласно некоторым вариантам осуществления настоящего изобретения вирус, используемый для временной трансформации, является авирулентным и, таким образом, не способен вызвать серьезные симптомы, такие как снижение скорости роста, мозаичность, кольцевые пятна, скручивание листьев, пожелтение, штриховатость, формирование оспы, образование опухолей и бороздчатости. Подходящий авирулентный вирус может быть встречающимся в природе авирулентным вирусом или искусственно ослабленным вирусом. Ослабление вируса может быть осуществлено с использованием способов, хорошо известных в уровне техники, в том числе без ограничения сублетальное нагревание, химическая обработка, или с помощью методик направленного мутагенеза, таких как описанные, например, у Kurihara and Watanabe (Molecular Plant Pathology 4:259-269, 2003), Gal-on et al. (1992), Atreya et al. (1992), и Huetetal.(1994).
Подходящие штаммы вируса могут быть получены из доступных источников, таких как, например, Американская коллекция типовых культур (АТСС), или путем выделения из инфицированных растений. Выделение вирусов из инфицированных тканей растений может быть осуществлено методиками, хорошо известными в уровне техники, такими, как описанные, например, в Foster and Tatlor, Eds. "Plant Virology Protocols: From Virus Isolation to Transgenic Resistance (Methods in Molecular Biology (Humana Pr), Vol 81)", Humana Press, 1998. Вкратце, ткани зараженного растения, предположительно характеризующиеся высокой концентрацией подходящего вируса, предпочтительно молодые листья и лепестки цветов, измельчают в буферном растворе (например, в растворе фосфатного буфера) с получением инфицированного вирусом сока, который может быть использован в последующих инокуляциях.
Конструирование РНК-вирусов растений для введения и экспрессии невирусных экзогенных полинуклеотидных последовательностей в растениях показано в вышеприведенных ссылках, а также в Dawson, W.О. et al., Virology (1989) 172:285-292; Takamatsu et al. EMBO J. (1987) 6:307-311; French et al. Science (1986) 231:1294-1297; Takamatsu et al. FEBS Letters (1990) 269:73-76; и в патенте США №5316931.
Если вирусом является ДНК-вирус, то подходящие модификации могут быть сделаны с самим вирусом. В качестве альтернативы, вирус сначала может быть клонирован в бактериальную плазмиду для простоты конструирования желаемого вирусного вектора с чужеродной ДНК. Затем вирус может быть вырезан из плазмиды. Если вирусом является ДНК-вирус, то бактериальная точка начала репликации может быть присоединена к вирусной ДНК, которая затем реплицируется бактериями. Транскрипция и трансляция этой ДНК будет продуцировать белок оболочки, который будет инкапсулировать вирусную ДНК. Если вирусом является РНК-вирус, то вирус, как правило, клонируют в виде кДНК и вставляют в плазмиду. Плазмиду затем используют, чтобы сделать все конструкции. Затем РНК-вирус получают путем транскрибирования вирусной последовательности плазмиды и трансляции вирусных генов для получения белка(ов) оболочки, которые инкапсулируют вирусную РНК.
Согласно одному варианту осуществления представлен полинуклеотид вируса растения, в котором нативная кодирующая белок оболочки последовательность была удалена из вирусного полинуклеотида, а были вставлены ненативная кодирующая белок оболочки последовательность вируса растения и ненативный промотор, предпочтительно субгеномный промотор ненативной кодирующей белок оболочки последовательности, способные к экспрессии у растения-хозяина, к упаковке рекомбинантного полинуклеотида вируса растения и к обеспечению системной инфекции у хозяина с помощью рекомбинантного полинуклеотида вируса растения. В качестве альтернативы, ген белка оболочки может быть инактивирован путем вставки в него ненативной полинуклеотидной последовательности таким образом, что продуцируется белок. Рекомбинантный полинуклеотид вируса растения может содержать один или несколько дополнительных ненативных субгеномных промоторов. Каждый ненативный субгеномный промотор способен транскрибировать или экспрессировать смежные гены или полинуклеотидные последовательности у растения-хозяина и не способен к рекомбинации с другим таким промотором и с нативными субгеномными промоторами. Ненативные (чужеродные) полинуклеотидные последовательности могут быть вставлены смежно с нативным субгеномным промотором вируса растения или с нативными и ненативными субгеномными промоторами вируса растения, если включают в себя более чем одну полинуклеотидную последовательность. Ненативные полинуклеотидные последовательности транскрибируются или экспрессируются в растении-хозяине под контролем субгеномного промотора с получением желаемых продуктов.
Согласно второму варианту осуществления представлен рекомбинантный полинуклеотид вируса растения как в первом варианте осуществления, за исключением того, что нативная кодирующая белок оболочки последовательность расположена смежно с одним из ненативных субгеномных промоторов белка оболочки, вместо ненативной кодирующей белок оболочки последовательности.
Согласно третьему варианту осуществления представлен рекомбинантный полинуклеотид вируса растения, в котором нативный ген белка оболочки является смежным с его субгеномным промотором, и один или несколько ненативных субгеномных промоторов вставлены в вирусный полинуклеотид. Вставленные ненативные субгеномные промоторы способны транскрибировать или экспрессировать смежные гены в растении-хозяине и не способны к рекомбинации друг с другом и с нативными субгеномными промоторами. Ненативные полинуклеотидные последовательности могут быть вставлены смежно с ненативными субгеномными промоторами вируса растения так, что последовательности транскрибируются или экспрессируются в растении-хозяине под контролем субгеномных промоторов с получением желаемых продуктов.
Согласно четвертому варианту осуществления представлен рекомбинантный полинуклеотид вируса растения как в третьем варианте осуществления, за исключением того, что нативная кодирующая белок оболочки последовательность заменяется ненативной кодирующей белок оболочки последовательностью.
Вирусные векторы инкапсулируются белками оболочки, кодируемыми рекомбинантным полинуклеотидом вируса растения для производства рекомбинантного вируса растения. Рекомбинантный полинуклеотид вируса растения или рекомбинантный вирус растения используют для инфицирования соответствующих растений-хозяев. Рекомбинантный полинуклеотид вируса растения способен к репликации в хозяине, системному распространению в хозяине и транскрипции или экспрессии чужеродного гена(ов) (экзогенный полинуклеотид) в хозяине с получением желаемых продуктов.
Методики для инокуляции вирусов в растения можно найти в Foster and Taylor, eds. "Plant Virology Protocols: From Virus Isolation to Transgenic Resistance (Methods in Molecular Biology (Humana Pr), Vol 81)", Humana Press, 1998; Maramorosh and Koprowski, eds. "Methods in Virology" 7 vols, Academic Press, New York 1967-1984; Hill, S.A. "Methods in Plant Virology", Blackwell, Oxford, 1984; Walkey, D.G.A. "Applied Plant Virology", Wiley, New York, 1985; и Kado and Agrawa, eds. "Principles and Techniques in Plant Virology", Van Nostrand-Reinhold, New York.
В дополнение к вышесказанному полинуклеотид в соответствии с настоящим изобретением также может быть введен в геном хлоропласта, что обеспечивает тем самым экспрессию в хлоропласте.
Известна методика для введения экзогенных полинуклеотидных последовательностей в геном хлоропластов. Эта методика предполагает следующие процедуры. Во-первых, растительные клетки химически обрабатывают таким образом, чтобы уменьшить количество хлоропластов на клетку до приблизительно одного. Затем экзогенный полинуклеотид вводят в клетки посредством бомбардировки частицами с целью введения в хлоропласты по меньшей мере одной экзогенной полинуклеотидной молекулы. Экзогенные полинуклеотиды выбирают так, чтобы они могли интегрироваться в геном хлоропласта посредством гомологичной рекомбинации, которая легко осуществима с помощью ферментов, присущих хлоропласту. С этой целью экзогенный полинуклеотид включает в себя, в дополнение к представляющему интерес гену, по меньшей мере одно удлинение полинуклеотида, которое получено из генома хлоропласта. Кроме того, экзогенный полинуклеотид включает в себя селективный маркер, который с помощью последующих процедур отбора позволяет становить, что все или, по сути, все копии генома хлоропласта после такого отбора будут включать в себя экзогенный полинуклеотид. Дополнительные подробности, касающиеся этой методики, можно найти в патентах США №№4945050 и 5693507, которые включены в настоящем документе посредством ссылки. Таким образом, полипептид может быть получен при помощи системы экспрессии белка хлоропласта и может стать интегрированным во внутреннюю мембрану хлоропласта.
Согласно некоторым вариантам осуществления настоящего изобретения способ дополнительно включает выращивание растений, экспрессирующих экзогенный полинуклеотид, при биотических или абиотических стрессах (например, при засухе, недостатке воды или температурном стрессе).
Таким образом, настоящее изобретение относится к (трансгенным) растениям, их частям или растительным клеткам, экзогенно экспрессирующим полинуклеотид(ы) или конструкции нуклеиновой кислоты в соответствии с настоящим изобретением.
После экспрессии в растительной клетке или во всем растении уровень полипептида, кодируемого экзогенным полинуклеотидом, может быть определен способами, хорошо известными в уровне техники, такими как, анализы активности, вестерн-блоттинг с использованием антител, способных специфично связывать полипептид, твердофазный иммуноферментный анализ (ELISA), радиоиммунные анализы (RIA), иммуногистохимия, иммуноцитохимия, иммунофлуоресценция и т.п.
Способы определения у растения уровня РНК, транскрибированной от экзогенного полинуклеотида, хорошо известны в уровне техники и включают в себя, например, анализ нозерн-блоттинга, анализ полимеразной цепной реакции с обратной транскрипцией (RT-PCR) (в том числе количественной, полуколичественной или в режиме реального времени RT-PCR) и гибридизацию РНК in situ.
Влияние экспрессированной НХК на проводимость устьица растения (например, проявляемого с помощью щели), эффективность использования воды, эффективность использования воды и/или фотосинтез могут быть охарактеризованы с использованием способов, которые хорошо известны в уровне техники. Анализы функциональности устьица описаны полно в разделе Примеры, который следует далее.
Влияние экзогенного полинуклеотида, кодирующего НХК, на выносливость к абиотическому стрессу, может быть определено с использованием известных способов, таких, которые подробно описаны ниже и в разделе Примеры, который следует далее.
Выносливость к абиотическому стрессу. Трансформированные (т.е. экспрессирующие НХК) и нетрансформированные (дикого типа) растения подвергали условию биотического или абиотического стресса, например, недостатку воды или субоптимальной температуре (низкой температуре, высокой температуре).
Выносливость к холодовому стрессу. Для анализа при холодовом стрессе зрелые (25 суточные) растения переносили в камеры с 4°С на 1 или 2 недели с нерегулируемым светом. Позже растения возвращали в теплицу. Две недели спустя повреждения от периода охлаждения, проявляющиеся в задержке роста и в других фенотипах, сравнивали у контрольных и трансгенных растений путем измерения массы растения (мокрой и сухой) и путем сравнения скоростей роста, измеренных как время до цветения, размера растений, урожайности и т.п.
Выносливость к тепловому стрессу. Выносливость к тепловому стрессу достигали путем воздействия на растения температур выше 34°С в течение определенного периода времени. Выносливость растений рассматривали после перенесения растений обратно в 22°С для восстановления и оценки через 5 дней по отношению к внутренним контролям (не трансгенным растениям) или к растениям, которых не подвергали холодовому или тепловому стрессу.
Эффективность использования воды может быть определена как биомасса, получаемая на единицу транспирации. Для анализа WUE относительное содержание воды листа может быть измерено у контрольного и трансгенного растений. Свежий вес (FW) регистрировали сразу; затем листья замачивали в течение 8 часов в дистиллированной воде при комнатной температуре в темноте и регистрировали массу при насыщении водой (TW). Общий сухой вес (DW) регистрировали после сушки листьев при 60°С до постоянного веса. Рассчитывали относительное содержание воды (RWC).
Анализ выносливости к засоленности. Ожидали, что трансгенные растения с выносливостью к высоким концентрациям солей проявят лучшую всхожесть, мощность проростков или рост при высокой концентрации соли. Солевой стресс можно осуществлять многими способами, такими как, например, путем орошения растений гиперосмотическим раствором, путем культивирования растений на гидропонике в гиперосмотическом ростовом растворе (например, в растворе Хогланда) или путем культивирования растений в гиперосмотической ростовой среде (например, в 50% среде Мурашиге-Скуга (среде MS)). Поскольку различные растения значительно различаются по своей выносливости к засоленности, концентрация соли в воде орошения, ростовом растворе или ростовой среде можно регулировать в зависимости от конкретных характеристик конкретного сорта или разновидности растения с тем, чтобы причинить от легкой или умеренной степени влияние на физиологию и/или морфологию растений (методические рекомендации в отношении соответствующей концентрации см. в Bernstein and Kafkafi, Root Growth Under Salinity Stress In: Plant Roots, The Hidden Half 3rd ed. Waisel Y, Eshel A and Kafkafi U. (editors) Marcel Dekker Inc., New York, 2002, и упомянутые в настоящем документе ссылки).
Например, тест на выносливость к засоленности можно выполнять путем орошения растений на различных стадиях развития с увеличением концентраций хлорида натрия (например, 50 мМ, 100 мМ, 200 мМ, 400 мМ NaCl), осуществляемого снизу и сверху для обеспечения равномерного рассредоточения соли. После воздействия стрессового условия на растения зачастую осуществляли мониторинг до появления заметных физиологических и/или морфологических эффектов у растений дикого типа. Таким образом, внешнее проявление фенотипа, степень увядания, полное успешное вызревание и получение потомства сравнивали у контрольных и трансгенных растений.
Количественные параметры измеренной выносливости включают в себя без ограничения среднюю мокрую и сухую массу, скорость роста, размер листа, листовой покров (общая площадь листьев), масса полученных семян, средний размер семени и количество семян, производимых на растение. Трансформированные растения, не проявляющие существенные физиологические и/или морфологические эффекты или показывающие более высокую биомассу, чем растения дикого типа, идентифицировали как растения, выносливые к абиотическому стрессу.
Тест на осмотическую выносливость. Анализы осмотического стресса (в том числе анализы с использованием хлористого натрия и маннита) проводили для определения того, являлся ли фенотип осмотического стресса специфичным по отношению к хлориду натрия, или это был общий осмотический стресс, связанный с фенотипом. Растения, которые выносливы к осмотическому стрессу, могут проявлять большую выносливость к засухе и/или замораживанию. Для экспериментов прорастания при солевом и осмотическом стрессе среду дополняли, например, 50 мМ, 100 мМ, 200 мМ NaCl или 100 мМ, 200 мМ NaCl, 400 мМ маннита.
Влияние трансгена на мощность растения, скорости роста, биомассу, урожайность и/или содержание масла может быть определено с использованием известных способов.
Мощность растения. Мощность растения может быть вычислена путем определения увеличения параметров роста, таких как площадь листа, длина волокна, диаметр розетки, сырая масса растения и т.п.на единицу времени.
Скорость роста. Скорость роста можно измерить с использованием цифрового анализа выращиваемых растений. Например, изображения растущих в теплице растений на графической основе может быть регистрированы каждые 3 дня, а площадь розетки может быть рассчитана с помощью цифрового анализа. Увеличение площади розетки рассчитывали с использованием разности площади розетки между днями выборки, поделенной на разность в днях между образцами.
Как уже упоминалось, идеи настоящего изобретения также относятся к понижающей регуляции активности или экспрессии НХК специфичным по отношению к замыкающей клетке образом. Это осуществляли для усиления обезвоживания растений при необходимости. Например, если имеется необходимость в ускорении дефолиации до или после уборки для таких культур как хлопок и другие, или например, для обезвоживания листьев и стеблей соломы.
Понижающая регуляция (сайленсинг гена) транскрипции или трансляции продукта эндогенной НХК специфичным по отношению к замыкающей клетке образом может быть достигнута совместной супрессией, антисмысловой супрессией, РНК-интерференцией и молекулами рибозима под контролем вышеупомянутого действующего в цис-положении регуляторного элемента, специфично активного в замыкающей клетке.
Таким образом, обеспечивают растительную экспрессионную конструкцию, содержащую последовательность нуклеиновой кислоты, кодирующую средство нуклеиновой кислоты для сайленсинга экспрессии гексокиназы, при этом экспрессия указанного средства нуклеиновой кислоты находится под транскрипционным контролем специфичного по отношению к замыкающей клетке действующего в цис-положении регуляторного элемента (как описано выше).
Совместная супрессия (смысловая супрессия). Ингибирование эндогенного гена может быть достигнуто совместной супрессией с использованием молекулы РНК (или кодирующего ее вектора экспрессии), которая находится в смысловой ориентации по отношению к направлению транскрипции эндогенного гена. Полинуклеотид, используемый для совместной супрессии, может соответствовать всей или части последовательности, кодирующей эндогенный полипептид, и/или всей или части 5'-и/или 3'-нетранслируемой области эндогенного транскрипта, он также может представлять собой неполиаденилированную РНК, РНК, в которой отсутствует структура 5'-кэпа или РНК, которая содержит несплайсируемый интрон. Согласно некоторым вариантам осуществления полинуклеотид, используемый для совместной супрессии, предназначен для устранения стартового кодона эндогенного полинуклеотида так, чтобы не был транслирован ни один белковый продукт. Способы совместной супрессии с использованием полноразмерной последовательности кДНК, а также частичной последовательности кДНК, известны в уровне техники (см., например, патент США №5231020).
Согласно некоторым вариантам осуществления настоящего изобретения понижающую регуляцию эндогенного гена осуществляли с использованием ампликон-вектора экспрессии, который содержит производную вируса растения последовательность, которая содержит всю или часть целевого гена, но обычно не все гены нативного вируса. Вирусные последовательности, присутствующие в продукте транскрипции вектора экспрессии, позволяют продукту транскрипции управлять своей собственной репликацией. Транскрипты, производимые ампликоном, могут быть либо смысловыми, либо антисмысловыми по отношению к целевой последовательности (см., например, Angell and Baulcombe, (1997) EMBO J. 16:3675-3684; Angell and Baulcombe, (1999) Plant J. 20:357-362, а также патент США №6646805, каждый из которых включен в настоящий документ посредством ссылки).
Антисмысловая супрессия. Антисмысловая супрессия может быть выполнена с использованием антисмыслового полинуклеотида или вектора экспрессии, который предназначен для экспрессии молекулы РНК, комплементарной ко всей или части информационной РНК (мРНК), кодирующей эндогенный полипептид, и/или ко всей или части 5'- и/или 3'-нетранслируемой области эндогенного гена. Надэкспрессия антисмысловой молекулы РНК может привести к снижению экспрессии нативного (эндогенного) гена. Антисмысловой полинуклеотид может быть полностью комплементарен целевой последовательности (т.е. на 100% идентичен комплементарной последовательности целевой последовательности) или частично комплементарен целевой последовательности (т.е. менее чем на 100% идентичен, например, менее чем на 90%, менее чем на 80% идентичен комплементарной последовательности целевой последовательности). Антисмысловая супрессия может быть использована для ингибирования экспрессии нескольких белков в одном и том же растении (см., например, патент США №5942657). К тому же части антисмысловых нуклеотидов могут быть использованы для разрушения экспрессии целевого гена. Как правило, могут быть использованы последовательности из по меньшей мере приблизительно 50 нуклеотидов, по меньшей мере приблизительно 100 нуклеотидов, по меньшей мере приблизительно 200 нуклеотидов, по меньшей мере приблизительно 300, по меньшей мере приблизительно 400, по меньшей мере приблизительно 450, по меньшей мере приблизительно 500, по меньшей мере приблизительно 550 или больше. Способы с использованием антисмысловой супрессии для ингибирования экспрессии эндогенных генов у растений, описаны, например, в Liu, et al., (2002) Plant Physiol. 129:1732-1743, и в патентах США №№5759829 и 5942657, каждый из которых включен в настоящий документ посредством ссылки. Эффективность антисмысловой супрессии может быть повышена путем введения области poly-dT в экспрессионную кассету в 3'-положение к антисмысловой последовательности, и в 5-положение сигнала полиаденилирования (см. публикацию патентного документа США №20020048814, включенную в настоящий документ посредством ссылки).
Интерференция РНК. Интерференция РНК может быть достигнута с использованием полинуклеотида, который может отжигать сам себя и образовывать двухнитевую РНК, имеющего структуру «стебель-петля» (также называемую шпилечной структурой), либо с использованием двух полинуклеотидов, которые образуют двухнитевую РНК.
Для интерференции шпилечной РНК (hpRNA) конструировали вектор экспрессии для экспрессии молекулы РНК, которая гибридизируется сам ас собой с образованием шпилечной структуры, которая содержит область однонитевой петли и спаренный основаниями стебель.
Согласно некоторым вариантам осуществления настоящего изобретения спаренная основаниями стеблевая область молекулы hpRNA определяет специфичность РНК-интерференции. В этой конфигурации смысловая последовательность спаренной основаниями стеблевой области может соответствовать всей или части эндогенной мРНК для понижающей регуляции, или части промоторной последовательности, контролирующей экспрессию эндогенного гена, подлежащего ингибированию; и антисмысловая последовательность спаренной основаниями стеблевой области полностью или частично комплементарна к смысловой последовательности. Такие молекулы hpRNA высокоэффективны в ингибировании экспрессии эндогенных генов, способом, который наследуется последующими поколениями растений (см., например, Chuang and Meyerowitz, (2000) Proc. Natl. Acad. Sci. USA 97: 4985-4990; Stoutjesdijk, et al., (2002) Plant Physiol. 129: 1723-1731; и Waterhouse and Helliwell, (2003) Nat. Rev. Genet. 4: 29-38; Chuang and Meyerowitz, (2000) Proc. Natl. Acad. Sci. USA 97: 4985-4990; Pandolfini et al., BMC Biotechnology 3:7; Panstruga, et al., (2003), Mol. Biol. Rep. 30: 135-140; и публикацию патентного документа США №2003/0175965; каждый из которых включен посредством ссылки).
Согласно некоторым вариантам осуществления настоящего изобретения смысловая последовательность спаренного основаниями стебля составляет от приблизительно 10 нуклеотидов до приблизительно 2500 нуклеотидов в длину, например, от приблизительно 10 нуклеотидов до приблизительно 500 нуклеотидов, например, от приблизительно 15 нуклеотидов до приблизительно 300 нуклеотидов, например, от приблизительно 20 нуклеотидов до приблизительно 100 нуклеотидов, например, от приблизительно 25 нуклеотидов до приблизительно 100 нуклеотидов.
Согласно некоторым вариантам осуществления настоящего изобретения антисмысловая последовательность спаренного основаниями стебля может иметь длину, которая меньше, такая же или больше длины соответствующей смысловой последовательности.
Согласно некоторым вариантам осуществления настоящего изобретения часть петли hpRNA может составлять от приблизительно 10 нуклеотидов до приблизительно 500 нуклеотидов в длину, например, от приблизительно 15 нуклеотидов до приблизительно 100 нуклеотидов, от приблизительно 20 нуклеотидов до приблизительно 300 нуклеотидов или от приблизительно 25 нуклеотидов до приблизительно 400 нуклеотидов в длину.
Согласно некоторым вариантам осуществления настоящего изобретения петлевой участок hpRNA может включать в себя интрон (ihpRNA), который способен быть сплайсированным в клетке-хозяине. Применение интрона минимизирует размер петли в молекуле шпилечной РНК после сплайсинга и, таким образом, увеличивает эффективность интерференции (см., например, Smith, et al., (2000) Nature 407: 319-320; Wesley, et al., (2001) Plant J. 27: 581-590; Wang and Waterhouse, (2001) Curr. Opin. Plant Biol. 5: 146-150; Helliwell and Waterhouse, (2003) Methods 30: 289-295; Brummell, et al. (2003) Plant J. 33: 793-800; и публикацию патентного документа США №2003/0180945; WO 98/53083; WO 99/32619; WO 98/36083; WO 99/53050; патентный документ США №20040214330; патентный документ США №20030180945; патент США №5034323; патент США №6452067; патент США №6777588; патент США №6573099 и патент США №6326527; каждый из которых включен в настоящий документ посредством ссылки).
Согласно некоторым вариантам осуществления настоящего изобретения петлевой участок шпилечной РНК определяет специфичность интерференции РНК по отношению к ее целевой эндогенной РНК. В этой конфигурации петлевая последовательность соответствует всей или части эндогенной матричной РНК целевого гена. См., например, WO 02/00904; Mette, et al., (2000), EMBO J 19: 5194-5201; Matzke, et al., (2001) Curr. Opin. Genet. Devel. 11: 221-227; Scheid, et al., (2002) Proc. Natl. Acad. Sci., USA 99: 13659-13662; Aufsaftz, et al., (2002) Proc. Nati Acad. Sci. 99(4): 16499-16506; Sijen, et al., Curr. Biol. (2001) 11: 436-440), каждый из которых включен в настоящий документ посредством ссылки.
Для интерференции двухнитевой РНК (dsRNA) молекулы смысловой и антисмысловой РНК могут быть экспрессированы в той же клетке от одного вектора экспрессии (который содержит последовательности обеих нитей) или от двух векторов экспрессии (каждый из которых содержит последовательность одной из нитей). Способы использования интерференции dsRNA для ингибирования экспрессии эндогенных генов растения описаны в Waterhouse, et al., (1998) Proc. Natl. Acad. Sci. USA 95: 13959-13964; а также в WO 99/49029, WO 99/53050, WO 99/61631 и WO 00/49035; каждый из которых включен в настоящий документ посредством ссылки.
Согласно некоторым вариантам осуществления настоящего изобретения интерференция РНК осуществляется с использованием вектора экспрессии, сконструированного для экспрессии молекулы РНК, которая моделирована на эндогенных генах микроРНК (miRNA). МикроРНК (miRNA) являются регуляторными средствами, состоящими из приблизительно 22 рибонуклеотидов и высоко эффективны при ингибировании экспрессии эндогенных генов (Javier, et al., (2003) Nature 425: 257-263). Ген miRNA кодирует РНК, которая формирует шпилечную структуру, содержащую 22-нуклеотидную последовательность, которая является комплементарной эндогенному целевому гену.
Таким образом, идеи настоящего изобретения включают трансгенное растение или его часть, содержащие растительную экспрессионную конструкцию, описанную в настоящем документе, а также выделенную растительную клетку или культуру растительных клеток, содержащую растительную экспрессионную конструкцию, описанную в настоящем документе.
Идеи настоящего изобретения также относятся к переработанным продуктам, полученным из растений, частей растения или растительных клеток в соответствии с настоящим изобретением. Такие переработанные продукты относятся к пищевому продукту, корму для животных, напиткам, строительному материалу, биотопливу, биодизельному топливу, маслам, соусам, макаронным изделиям, кондитерским изделиям, муке и т.п.
Предполагается, что во время срока действия патента, в который перейдет настоящая заявка, будет разработано множество соответствующих гексокиназ и специфичных по отношению к замыкающей клетке действующих в цис-положении регуляторных элементов, и объем используемых в настоящем документе терминов включает в себя все эти новые технологии a priori.
Используемый в настоящем документе термин «приблизительно» относится к ± 10%.
Термины «содержит», «содержащей», «включает в себя», «включающий в себя», «имеющий» и их спряжения означают «включающий в себя без ограничения».
Термин «состоящий из» означает «включающий в себя и ограниченный перечисленным».
Термин «состоящий в основном из» означает, что композиция, способ или структура могут включать в себя дополнительные ингредиенты, стадии и/или части, но только если дополнительные ингредиенты, стадии и/или части существенно не изменяет основные и новые характеристики заявляемых композиции, способа или структуры.
Используемая в настоящем документе форма единственного числа включает в себя ссылки во множественном числе, если в контексте четко не указано иное. Например, термин «соединение» или «по меньшей мере одно соединение» может подразумевать множество соединений, в том числе их смеси.
Во всей настоящей заявке различные варианты осуществления настоящего изобретения могут быть представлены в формате диапазона. Следует понимать, что описание в формате диапазона приводится исключительно для удобства и краткости и не должно интерпретироваться как негибкое ограничение объема настоящего изобретения. Следовательно, описание диапазона должно рассматриваться как конкретное раскрытие всех возможных поддиапазонов, а также отдельных числовых значений в диапазоне. Например, описание диапазона, такое как от 1 до 6 следует рассматривать как конкретно раскрытые поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также как отдельные числа в этом диапазоне, например, 1, 2, 3, 4, 5 и 6. Это применяется независимо от широты диапазона.
Всякий раз, когда числовой диапазон указывается в данном документе, это означает включение любого упомянутого числа (дробного или целого) в указанный диапазон. Фразы «варьирование/варьирует между» первым указанным числом и вторым указанным числом и «варьирование/варьирует от» первого указанного числа «до» второго указанного числа используются в настоящем документе взаимозаменяемо и означают включение первого и второго указанных чисел, а также всех дробных и целых чисел между ними.
Используемый в настоящем документе термин «способ» относится к путям, средствам, методикам и процедурам для осуществления данной задачи, в том силе без ограничения к тем путям, средствам, методикам и процедурам, которые либо известны, либо легко разрабатываются из известных путей, средств, методик и процедур специалистами химической, фармакологической, биологической, биохимической и медицинской областей.
Следует понимать, что определенные признаки настоящего изобретения, которые для ясности описаны в контексте отдельных вариантов осуществления, также могут быть представлены в комбинации в отдельном варианте осуществления. Наоборот, различные признаки настоящего изобретения, которые для краткости описаны в контексте отдельного варианта осуществления, также могут быть представлены отдельно или в какой-либо приемлемой субкомбинации или как приемлемые в любом другом описанном варианте осуществления настоящего изобретения. Определенные признаки, описанные в контексте различных вариантов осуществления, не следует рассматривать как основные признаки этих вариантов осуществления, если только вариант осуществления не выполняется без этих элементов.
Различные варианты осуществления и аспекты настоящего изобретения, как описывается выше и как заявляется в разделе Формула изобретения ниже, находят экспериментальную поддержку в следующих примерах.
ПРИМЕРЫ
Теперь приводится ссылка на следующие примеры, которые вместе с вышеприведенным описанием иллюстрируют некоторые варианты осуществления настоящего изобретения неограничивающим образом.
Как правило, используемая в настоящем документе номенклатура и используемые в настоящем изобретении лабораторные процедуры включают в себя молекулярные, биохимические, клеточные и процедуры рекомбинантной ДНК. Такие методики основательно объясняются в литературе. См., например, "Molecular Cloning: A laboratory Manual" Sambrook et al., (1989); "Current Protocols in Molecular Biology" Volumes I-III Ausubel, R. M., ed. (1994); Ausubel et al., "Current Protocols in Molecular Biology", John Wiley and Sons, Baltimore, Maryland (1989); Perbal, "A Practical Guide to Molecular Cloning", John Wiley & Sons, New York (1988); Watson et al., "Recombinant DNA", Scientific American Books, New York; Birren et al. (eds); методики, изложенные в патентах США №№4666828; 4683202; 4801531; 5192659 и 5,272,057; "Cell Biology: A Laboratory Handbook", Volumes I-III Cellis, J.E., ed. (1994); "Nucleic Acid Hybridization" Hames, B.D., and Higgins S.J., eds. (1985); "Transcription and Translation" Hames, B.D., and Higgins S.J., eds. (1984); "Animal Cell Culture" Freshney, R.I., ed. (1986); "Immobilized Cells and Enzymes" IRL Press, (1986); "A Practical Guide to Molecular Cloning" Perbal, В., (1984), и "Methods in Enzymology" Vol. 1-317, Academic Press; "PCR Protocols: A Guide To Methods And Applications", Academic Press, San Diego, С A (1990); все из которых включены посредством ссылки, как если бы они были полностью изложены в настоящем документе. Другие общие ссылки представлены по всему этому документу. Полагают, что процедуры в них хорошо известны в уровне техники и представлены для удобства читателя. Вся содержащаяся в них информация включена в настоящий документ посредством ссылки.
Пример 1
Материалы и способы
Растительный материал и условия выращивания
Эксперименты проводили с использованием томата WT (Solarium lycopersicum cv. МР-1), изогенных независимых трансгенных гомозиготных линий томата, экспрессирующих различные уровни AtHXKl Arabidopsis (35S::AtHXKl) (как ранее описано Dai et al. (1999)), изогенных трансгенных гомозиготных линий с антисмысловой супрессией генов томата LeHXK1,2&3, изогенных трансгенных гомозиготных линий, экспрессирующих GFP или AtHXK1 под контролем промотора KST1, и ΑΒΑ-дефицитного мутанта Sitiens (Dai et al., 1999) (S. lycopersicum cv. Ailsa Craig).
Независимые линии томата с антисмысловой супрессией НХК, αΗΚ1 и αНК2, получали после трансформации МР-1 антисмысловой конструкцией StHXKl (Х94302), экспрессируемой под промотором 35S. Последовательность StHXK1 картофеля более чем на 80% идентична LeHXK1,2&3 и характеризуется сопоставимой супрессией LeHXK1,2&3 (фиг. 4А). Линии Arabidopsis (Col.) и томата (МР-1), которые экспрессируют GFP или AtHXKl специфично в замыкающих клетках (линии GCGFP и GCHXK, соответственно), получали после трансформации GFP или AtHXK1, экспрессируемых под промотором KST1 (Muller-Rober et al., 1995). Затем идентифицировали независимые трансгенные гомозиготные линии для каждой конструкции. Растения томата выращивали в теплице с контролируемой температурой в условиях естественного роста, а растения Arabidopsis выращивали в вегетационной камере с возможностью входа при 22°С и фотопериоде 8 часов свет/16 часов темнота.
Измерения устьиц
Отверстие и плотность устьиц определяли с использованием методики быстрого отпечатка, описанной Geisler и Sack (2002). Этот подход позволяет надежно подсчитывать сотни устьиц в каждом эксперименте, каждое из которых в то же время берется в качестве образца. Полимеризованное под действием света винилполисилоксановое связующее для зубопротезных материалов (Heraeus-Kulzer, Hanau, Germany) прикрепляли к нижней поверхности листа и затем удаляли, как только оно высохнет (1 минута). Затем эпидермальные отпечатки на связующем покрывали лаком для ногтей, который удаляли после высыхания, что служило в качестве зеркального образа отпечатка на связующем. Отпечатки на лаке для ногтей помещали на покровные стекла и фотографировали через светлопольный микроскоп. Позже изображения устьиц анализировали с целью определения размера отверстия с использованием инструмента «fit-ellipse» в программном обеспечении ImageJ (www.rsb.info.nih.gov/ij/) или любом другом программном обеспечении, которое может обрабатывать и анализировать изображения. Для калибровки размера использовали линейку микроскопа. С помощью программного обеспечения можно получить дополнительную информацию, такую как ширина, длина, площадь, периметр устьица и т.д.
С целью оценки ответов устьица молодые листья срезали и немедленно погружали в раствор искусственного сока ксилемы (AXS) (Wilkinson и Davies, 1997), содержащего 100 мМ сахарозы (Duchefa Biochemie) с 20 мМ N-ацетилглюкозамина (NAG, Sigma-Aldrich), 100 мМ или 200 мМ глюкозы (Duchefa Biochemie), 100 мМ или 200 мМ фруктозы (Sigma-Aldrich), 100 мМ 2-дезоксиглюкозы (Sigma-Aldrich), 10 мМ или 100 мМ маннозы (Sigma-Aldrich), 100 мМ сорбита (Sigma-Aldrich) или 100 мМ или 200 мМ маннита (Duchefa Biochemie) или без таковых. Обработки сорбитом и маннитом служили в качестве неметаболических осмотических контролей. Отпечатки получали через 3 часа после погружения и анализировали щель устьиц. Могут быть использованы различные виды растений, а также растворы AXS, растворы для обработки и различные временные рамки на усмотрение.
Анализ газообмена
Параметры газообмена анализировали с использованием портативной газообменной системы Li-6400 (LI-COR). Растения выращивали при благоприятных или стрессовых условиях и проводили измерения на полностью расправленном листе, в случае томата на 5-ом-6-ом сверху. Все измерения проводили между 10.00 и 14.00. Авторы настоящего изобретения индуцировали фотосинтез под насыщающим светом (1000-1200 мкмоль м-2 сек-1) с 370 мкмоль моль-1 СО2 вокруг листа (Са). Количество голубого света устанавливали на 15% от плотности потока фотосинтетически активных фотонов для оптимизации щели устьиц. VPD (дефицит давления пара) в листе по отношению к воздуху поддерживали на уровне от приблизительно 1 до 2,5 кПа, а температуру листа поддерживали при приблизительно 25°С во время всех измерений. После достижения равновесного состояния проводили измерения. Возможна настройка каждого из вышеупомянутых параметров. Каждое измерение содержит данные по фотосинтезу (в мкмоль СО2 м-2 с-1), транспирации (в ммоль Н2О м-2 с-1), проводимости устьиц (в моль Н2О м-2 с-1) и расчетной текущей эффективности использования воды (в мкмоль СО2 ммоль-1 Н2О). Дополнительными данными, полученными из каждого измерения, являлись мезофильная проводимость для СО2 (в моль СО2 м-2 с-1 бар-1), скорость транспорта электронов, рассчитанная из квантового выхода PS (фотосистемы) II, и внутренние концентрации СО (Ci).
Для измерений проводимости устьиц (gs) использовали порометр LI-1600 (LICOR, Lincoln, NE) для проводимости листа в равновесном состоянии в соответствии с инструкциями производителя.
Измерения транспирации всего растения
Скорости транспирации всего растения и относительную суточную транспирацию (RDT) определяли с использованием широкоэкранной системы лизиметрических весов, которая обеспечивает измерения до 160 растений одновременно. Растения высаживали в горшки объемом 3,9 л и выращивали в контролируемых условиях. Каждый горшок помещали на датчик нагрузки с температурной компенсацией и выводом цифровых данных и запечатывали для предотвращения испарения с поверхности ростовой среды. Влажный вертикальный тампон, сделанный из хлопкового волокна площадью 0,15 м2, частично погруженный в резервуар с водой объемом 1 л, помещали на подобный датчик нагрузки и использовали в качестве эталона для временных вариаций скорости потенциальной транспирации. Выходные данные датчиков нагрузки отслеживали каждые 10 секунд и средние показания за 3 минуты заносили в устройство для регистрации данных для дальнейшего анализа. Выходные данные включают в себя транспирацию всего растения, массу растения, интенсивность света, дефицит давления пара (VPD), температуру, проводимость устьиц, эффективность использования воды и дополнительные параметры окружающей среды и физиологические параметры. Скорость транспирации всего растения рассчитывали по числовому производному выходных данных датчика нагрузки после процесса сглаживания данных (Sade et al., 2010). Скорость суточной транспирации растения нормализовали по отношению к общей массе растения и по отношению к данным для погруженного рядом тампона и эти числа усредняли для данной линии по всем растениям (количество, впитываемое тампоном ежесуточно = 100%). Эффективность использования воды рассчитывали из суточной массы, добавленной против суточной потери воды для каждого растения. RDT растений отслеживали в различных условиях роста на усмотрение авторов настоящего изобретения: нормальное орошение, засуха, обработка солью и др. Можно изменять условия роста посуточно и вести мониторинг ответов растений.
Экстракция РНК, создание кДНК и анализ экспрессии с помощью количественной PCR в реальном времени (по Goren, 2011, Kandel-Kfir, 2006)
Образцы ткани мгновенно замораживали и гомогенизировали в жидком азоте. РНК экстрагировали с использованием набора EZ-RNA (Biological Industries, Kibbutz Bet Haemek, Israel), отбирая до 500 мкл замороженной гомогенизированной ткани на пробирку для экстракции. По меньшей мере четыре независимые экстракции выполняли для каждого набора тканей. Экстракции проводили в соответствии с протоколом производителя, включая две необязательные отмывки в 2 M LiCl. Затем осадки РНК суспендировали в 25 мкл обработанной DEPC Н2О и обрабатывали ДНКазой (Ambion, Austin, ТХ, USA) в соответствии с инструкциями производителя. Наличие РНК подтверждали с помощью гель-электрофореза, а деградацию ДНК подтверждали с помощью PCR. Затем РНК (≤1 мкг) из каждого образца обратно транскрибировали с получением кДНК с использованием MMLV RT (ProMega, Madison, WI, USA) в реакционной смеси объемом 25 мкл, содержащей 2 мкл случайных праймеров и 1 мкл смешанных праймеров поли(дТ) (18-23 нуклеотидов). Все образцы кДНК разводили в соотношении 1:8 обработанной DEPC водой.
Реакции в реальном времени готовили с использованием смеси SYBR Green (Eurogentec S.A., Seraing, Belgium) в объеме 10 мкл, содержащем 4 мкл разведенной кДНК на реакцию, с двумя повторами на каждый образец кДНК. Реакции проводили в циклере RotorGene 6000 (Corbett, Mortlake, New South Wales, Australia), 40 циклов на прогон, с отбором образцов после каждого цикла. После первоначальной стадии предварительного нагрева при 95°С в течение 15 минут осуществляли 40 циклов амплификации, состоящих из 10 с при 95°С, 15 с при 55°С, 10 с при 60°С и 20 с при 72°С. Затем результаты интерпретировали с использованием программного обеспечения RotorGene с двумя повторами на образец. Данные нормализовали с использованием SlCyP в качестве гена-эталона (циклофилин - идентификационный номер М55019). Праймеры, используемые для амплификации: SlCyP -CGTCGTGTTTGGACAAGTTG (SEQ ID NO: 1) и CCGCAGTCAGCAATAACCA (SEQ ID NO: 2). Праймерами для SlHXK (LeHXK)являются следующие: для SlHXK1 - GACTTGCTGGGAGAGGAGT (SEQ ID NO: 3) и AAGGTACATTGAATGAGAGGCA (SEQ ID NO: 4); для SIHXK2 - GTCCTCCCATCTTCCCTTG (SEQ ID NO: 5) и CCCAAGTACATACCAGAACAT (SEQ ID NO: 6); для SlHXK3 - GCGATATTATCACCTCTCGTG (SEQ ID NO: 7) и CTGCTTCTCTCCGTCTTTAAA (SEQ ID NO: 8); и для SlHXK4 - GCTGAGGACACCTGATATATG (SEQ ID NO: 9) и GATCGGATTTTACCCCAGCTA (SEQ ID NO: 10).
Экстракция белков и анализ активности гексокиназы
Экстракцию белков из листьев растений проводили из 1-2 г растительной ткани, гомогенизированной в 4 объемах буфера для экстракции (50 мМ Hepes, рН 7,6, 1 мМ EDTA, 15 мМ КС1, 1 мМ MgCl2, 1 мМ фенилметилсульфонилфторид, 3 мМ диэтилдитиокарбаминовая кислота и 0,2% PVP). Смесь центрифугировали в течение 25 минут при 16000 g при 48°С и супернатант доводили до насыщения 80% сульфатом аммония. После центрифугирования осадок повторно суспендировали в 0,5 мл отмывочного буфера (50 мМ Hepes, рН 7,5, 1 мМ EDTA и 1 мМ DTT), обессоливали на колонке G-25 Sephadex (55×11 мм) и использовали в качестве неочищенного экстракта фермента для последующего ферментативного анализа.
Активность гексокиназы измеряли с помощью твердофазного ферментного анализа по Schaffer and Petreikov (1997). Общий объем проб составлял 1 мл и содержал 30 мМ Hepes-NaOH, рН 7,5, 2 мМ MgCl2, 0,6 мМ EDTA, 9 мМ KCl, 1 мМ NAD, 1 мМ АТФ и 1 единицу NAD-зависимой глюкозо-6-фосфатдегидрогеназы (G6PDH из Leuconostoc mesenteroides; Sigma). Для анализа фосфорилирования глюкозы реакцию инициировали 2 мМ глюкозой. Реакции проводили при 37°С и непрерывно регистрировали поглощение на 340 нм (см. дополнительную информацию в Dai et al. 1999, Schaffer and Petreikov, 1997).
Мониторинг продуцирования оксида азота в замыкающих клетках
Определение уровней оксида азота (NO) в устьицах выполняли следующим образом: готовили эпидермальные слои и инкубировали их в буфере MES (25 мМ MES-КОН, рН=6,15, и 10 мМ KCl (MES, 2-(N-морфолино)-этансульфоновая кислота; Sigma-Aldrich) с 20 мМ NAG или без такового в течение 2,5 часа под равномерным освещением, а затем нагружали 60 мкМ красителя-индикатора NO, DAF-2DA (4,5-диаминофлуоресцеина диацетат; Sigma-Aldrich), разведенного в буфере MES с 20 мМ N-ацетилглюкозамина (NAG, Sigma-Aldrich) или без такового, и оставляли еще на 50 минут. Затем слои отмывали с помощью MES 3 раза и инкубировали повторно в течение 30 минут в буфере (контроль, установленный как 100% флуоресценции) или в 100 мМ сорбите, 100 мМ сахарозе и 20 мМ NAG. Затем слои фотографировали под микроскопом (см. «Материалы и способы», «Получение изображения с помощью конфокальной микроскопии»). Каждый эксперимент включал три или четыре биологических повтора, содержащих по 20-30 устьиц каждый, и каждый эксперимент повторяли несколько раз. Изображения анализировали с использованием инструмента «histogram» в программном обеспечении ImageJ для оценки интенсивности флуоресценции и инструмента «fit-ellipse» для определения щели устьица. Можно использовать эпидермальные узкие длинные кусочки от разных видов, использовать разные растворы для обработки и различные временные рамки, все на усмотрение экспериментатора.
Получение изображений с помощью конфокальной микроскопии
Изображения получали с использованием инвертированного лазерного сканирующего конфокального микроскопа OLYMPUS IX 81 (Japan) (FLUOVIEW 500), оборудованного аргонным ионным лазером с длинной волны 488 нм и объективом водной иммерсии 60X1.0 NA PlanApo. Флуоресценцию оксида азота - DAF-2DA (4,5-диаминофлуоресцеина диацетат; Sigma-Aldrich) возбуждали светом на 488 нм и регистрировали эмиссию с использованием фильтра ВА 505-525. GFP возбуждали светом на 488 нм и регистрировали эмиссию с использованием фильтра ВА 505-525. Фильтр эмиссии ВА 660 IF использовали для наблюдения аутофлуоресценции хлорофилла. Конфокальные оптические срезы получали с шагом 0,5 мкм. Изображения цветокодировали зеленым для GFP и фуксином для аутофлуоресценции хлорофилла.
Получение термоизображений
Температура листа - это надежный инструмент для определения вариаций транспирации в зависимости от различных условий и различных видов растений. Высокие температуры связаны с закрытыми устьицами и низкой транспирацией, тогда как низкая температура указывает на открытые устьица и высокую транспирацию. Для получения термоизображений листья снимали с использованием тепловизора (ThermaCAM модель SC655; FLIR Systems). Позднее снимки анализировали с использованием программного обеспечения ThermaCAM researcher pro 2.10. Эксперименты повторяли несколько раз. Данные представлены в виде средних значений ± SE из пяти биологических повторов на линию; четыре листа анализировали на растение.
Использование KST1 в качестве специфичного по отношению к замыкающей клетке промотора
Было показано, что калиевый канал KST1 у картофеля (Solanum tuberosum L.) экспрессируется специфично в замыкающих клетках (Muller-Rober et al., 1995). Позднее по активности GUS и анализу с окрашиванием демонстрировали, что сегмент промотора KST1 можно использовать для экспрессии генов исключительно в замыкающих клетках (Plesch et al., 2001). С использованием этой информации создавали трансгенные растения томата и Arabidopsis с избыточной экспрессией гексокиназы 1 Arabidopsis (KST::AtHXK1) или GFP (белок зеленой флуоресценции) (в качестве контроля на исключительную экспрессию) специфично в замыкающих клетках путем следующих процедур:
1. создание бинарного вектора, содержащего вставку кДНК AtHXK1 под промотором KST1, за которой следовал терминатор;
2. создание бинарного вектора, содержащего вставку гена GFP под промотором KST1, за которой следовал терминатор;
3. трансформация растений;
4. идентификация растений, содержащих признак KST1::AtHXK1.
Создание бинарного вектора, содержащего вставку кДНК AtHXK1 или гена GFP под промотором KST1, за которой следовал терминатор
Для трансформации растений томата и Arabidopsis использовали бинарный вектор pGreeNO029 (Hellens et al., 2000b). Промотор KST1 лигировали в 3'-5'-направлении по отношению к кодирующей последовательности AtHXK1 (выделенной по Dai et al., 1995) или последовательности GFP, за которой следовал терминатор (см. фиг. 17А-В).
Пример 2
Стимулирование сахарозой закрытия устьица
Для изучения эффекта сахарозы на устьица интактные молодые листья томата дикого типа (WT) погружали в искусственные апопластические растворы (Wilkinson and Davies, 1997), содержащие 100 мМ сахарозу или 100 мМ сорбит, неметаболический сахар, используемый в качестве осмотического контроля, и измеряли щель устьица. Сахароза уменьшала размер щели устьица на 29% по сравнению с сорбитом (фиг. 1А, В). Сахароза - это дисахарид, который подвергается расщеплению. Она может быть расщеплена инвертазами клеточной стенки (апопластическими) с образованием глюкозы (Glc) и фруктозы (Fru) в равных пропорциях (Granot, 2007), результатом чего является возрастание внеклеточной осмолярности до 200 мОсм/л по сравнению с 100 мОсм/л при первоначальном добавлении сахарозы. Поэтому сравнивали эффекты 100 мМ сахарозы, 100 мМ глюкозы + 100 мМ фруктозы и 200 мМ глюкозы или фруктозы с эффектом 200 мМ маннита, который использовали в качестве дополнительного осмотического контроля. Все комбинации сахаров снижали размер щелей устьиц по сравнению с эффектом 200 мМ маннита (фиг. 1С), что подтверждает осмотически независимую роль сахаров в регуляции закрытия устьица.
Пример 3
Стимулирование сахарозой закрытия устьица через гексокиназу
Сахароза либо может быть расщеплена апопластической (внеклеточной) инвертазой, либо может войти в клетки с помощью переносчиков сахарозы, а затем может быть расщеплена внутриклеточными ферментами расщепления сахарозы с образованием гексоз глюкозы и фруктозы. Гексозы глюкоза и фруктоза могут быть фосфорилированы ферментами фосфорилирования гексоз (Granot, 2007). У растений гексокиназы (НХК) являются единственными ферментами, которые могут фосфорилировать глюкозу и могут также фосфорилировать фруктозу (Granot, 2007, 2008). НХК - это внутриклеточные ферменты, и известно, что они играют как кинетическую роль, так и роль передачи сахарного сигнала (Rolland et al., 2006). Для изучения стимуляции сахарозой закрытия устьиц через НХК тестировали эффект сахарозы в присутствии N-ацетилглюкозамина (NAG), эффективного ингибитора активности НХК (Hofmann и Roitsch, 2000). NAG практически полностью отменял эффект сахарозы и предотвращал закрытие устьиц, что подтверждает роль НХК в регуляции закрытия устьиц (фиг. 1В).
Пример 4
Усиление закрытия устьиц посредством повышенной экспрессии НХК
С целью дальнейшего изучения опосредования НХК закрытия устьиц проверяли эффект сахарозы на хорошо охарактеризованных трансгенных растениях томата, экспрессирующих НХК1 Arabidopsis (AtHXK1) под контролем универсального неспецифичного промотора 35S (Dai et al., 1999). Щель устьица у растений, экспрессирующих AtHXK1 (линия НК4, которая характеризуется активностью НХК на уровне в 5 раз выше, чем у растений WT), была уменьшено на 21% по сравнению с контрольными растениями даже при контрольных условиях (100 мМ сорбит) (фиг. 1В), уто свидетельствует о том, что повышенная экспрессия НХК индуцирует закрытие устьиц. Добавление сахарозы вызывало более выраженное закрытие устьиц (фиг. 1В), а ингибитор НХК NAG отменял закрывающий эффект сахарозы, что дает дополнительное подтверждение роли НХК в регуляции закрытия устьиц (фиг. 1В).
Пример 5
Прямая корреляция между активностью НХК, закрытием устьиц и сниженной транспирацией
Для исследования эффекта НХК на устьица томата измеряли щели и проводимость устьиц у линий томата, экспрессирующих повышенные уровни AtHXK1 (линии НК37, НК4 и НК38 имеют уровни активности НХК в 2, 5 и 6 раз выше, чем у растений WT, соответственно) (Dai et al., 1999). Плотность устьиц у линий, экспрессирующих AtHXK1, подобна значениям плотности у растений WT (таблица S1), при этом как щель, так и проводимость устьиц были значительно снижены при наличии прямой корреляции с уровнем экспрессии AtHXK1 (фиг. 2А, 2В). Кроме того, непрерывное измерение транспирации на протяжении суток продемонстрировало, что AtHXK1 снижала скорость транспирации на единицу площади листа у линий, экспрессирующих AtHXK1, что коррелировало с уровнем экспрессии AtHXK1 (фиг. 2С), так, что совокупная относительная суточная транспирация всего растения на единицу площади листа (RDT) явно отрицательно коррелировала с активностью НХК (фиг. 2D).
Для того, чтобы исключить возможность того, что наблюдаемое снижение транспирации было результатом ингибирующих эффектов AtHXK1 на захват воды корнями или на транспорт воды по стеблю, выполняли эксперименты по реципрокной прививке. Побеги НК4 прививали на корни WT, а побеги WT прививали на корни НК4 (фиг. 3А). Непрерывные измерения скорости транспирации и совокупной относительной суточной транспирации всего растения на единицу площади листа привитых растений показали, что пониженная транспирация, как правило, была связана с побегами НК4, а корни имели лишь несущественное значение (фиг. 3В, 3С). С целью дальнейшего исследования эффекта стеблей НК4 на транспирацию получали растения с тройной прививкой, в которых вставочный подвой НК4 заменял часть стебля растений WT (фиг. 3D). Вставочный подвой НК4 не оказывал влияния на RDT (фиг. 3Е), что свидетельствует о том, что пониженная транспирация у растений, экспрессирующих AtHXK1, являлась результатом пониженной транспирации листьями, а уменьшением захвата воды корнями или ослабления транспорта через стебель. Эффект AtHXK1 на транспирацию листа также указывает на то, что НХК контролирует поведение устьиц, которое влияет на транспирацию всего интактного растения.
Пример 6
Ингибирование закрытия устьиц посредством супрессии НХК
Далее роль НХК в закрытии устьиц исследовали с использованием растений томата и Arabidopsis с антисмысловой супрессией и нокдаун-мутациями НХК, соответственно. У растений томата известны четыре НХК, три из которых (LeHXK1, 2 и 3) являются ассоциированными с митохондриями НХК и подобны сахарному сенсору AtHXK1 (Granot, 2007, 2008). В отличие от закрытия устьиц, наблюдаемого у растений томата, экспрессирующих высокий уровень AtHXK1 (фиг. 2А, В), закрытие устьиц у линий томата (аНК1 и аНК2) с антисмысловой супрессией LeHXK1, 2 и 3 (фиг. 4А) было ослаблено в ответ на обработки сахарозой, (фиг. 4В). Подобным образом, мутант gin2-1 Arabidopsis, нокаутный по AtHXK1, имел более высокую проводимость устьиц и более высокую скорость транспирации по сравнению с контрольными растениями дикого типа (фиг. 8Е, F), что подтверждает гипотезу о том, что НХК играет роль в регуляции закрытия устьиц.
Пример 7
Опосредование НХК закрытия устьиц независимо от метаболизма фосфорилированных сахаров в прямом направлении
С целью изучения необходимости метаболизма фосфорилированных сахаров в прямом направлении для закрытия устьиц тестировали эффекты маннозы (эпимера глюкозы по второму атому углерода) и 2-дезоксиглюкозы (2-dG - аналога глюкозы). Оба сахара фосфорилируются НХК, но 2-дезоксиглюкоза далее не метаболизируется, а манноза метаболизируется слабо (Klein and Stitt, 1998; Pego et al., 1999). Как манноза, так и 2-дезоксиглюкоза уменьшали щель устьиц (фиг. 5). Более низкая концентрация маннозы (10 мМ) также уменьшала щель устьиц более выражено, чем 100 мМ глюкоза (фиг. 5), что согласуется с предыдущими наблюдениями, что манноза является более мощной чем глюкоза в отношении НХК-опосредованных эффектов сахаров (Jang and Sheen, 1994; Pego et al., 1999). Более того, эффект закрытия 10 мМ маннозой также подтверждает осмотически независимую роль сахаров в стимуляции закрытия устьиц. Результаты с маннозой и 2-дезоксиглюкозой свидетельствуют о том, что НХК стимулирует закрытие устьиц независимо от метаболизма фосфорилированных сахаров в прямом направлении.
Пример 8
Стимуляция сахарозой пути передачи сигнала ABA в замыкающих клетках
Ранее было показано, что сахарные сигнальные эффекты НХК, такие как ингибирование фотосинтеза и роста, опосредованы абсцизовой кислотой (ABA) (обновленный обзор см. в Rolland et al. (2006)), хорошо известным фитогормоном, который также индуцирует закрытие устьиц. Следовательно, было высказано предположение, что сахароза может модулировать щель замыкающих клеток через НХК и ABA в замыкающих клетках. Передача сигнала ABA в замыкающих клетках опосредована быстрым продуцированием оксида азота (NO), который требуется для индуцированного ABA закрытия устьиц и служит в качестве индикатора стимулов закрытия устьиц (Garcia-Mata et al., 2003; Neill et al., 2008). Для исследования эффекта сахарозы на путь передачи сигнала ABA в замыкающих клетках проводили мониторинг уровней NO в замыкающих клетках в ответ на применения сахарозы. Эпидермальные слои инкубировали с сахарозой и наблюдали с использованием флуоресцентного индикатора-красителя NO диаминофлуоресцеина диацетата (DAF-2DA). Применение 100 мМ сорбита не оказывало влияния на уровень NO в замыкающих клетках (фиг. 6А). Однако применение 100 мМ сахарозы приводило к 3,5-кратному возрастанию флуоресценции замыкающих клеток, что указывает на быстрое увеличение уровней NO, что коррелировало с закрытием устьиц (фиг. 6А). Замыкающие клетки необработанных эпидермальных слоев НК4 (линии, экспрессирующей AtHXK1) демонстрировали высокие уровни NO, сопоставимые со значениями в обработанных сахарозой эпидермальных слоях WT (фиг. 6В), и добавление сахарозы к отслоенному эпидермису НК4 приводило к еще более интенсивной флуоресценции (фиг. 6В).
С целью дальнейшего изучения участия НХК в продуцировании NO в замыкающих клетках использовали ингибитор НХК NAG на эпидермальных слоях. NAG не только ингибировал эффект сахарозы и блокировал закрытие устьиц (фиг. 1В), но и предотвращал продуцирование NO (фиг. 6С). Отмывка NAG 100 мМ сахарозой приводила к возобновлению продуцирования NO в течение менее 30 минут (фиг. 6D, Ε). Эти результаты свидетельствуют о том, что сахароза вызывает специфичный по отношению к замыкающей клетке ответ NO через НХК.
Для того, чтобы проверить, действительно ли требуется ABA для NO-ответа устьиц на сахарозу, те же эксперименты проводили на ΑΒΑ-дефицитном мутанте томата Sitiens, устьица которого всегда открыты (Neill and Horgan, 1985). В отличие от того, что наблюдалось на растениях WT, обработка эпидермальных слоев Sitiens 100 мМ сахарозой не вызывала какого-либо увеличения флуоресценции или закрытия устьиц, что указывает на отсутствие продуцирования NO (фиг. 6F). Однако обработка слоев Sitiens доставляемой извне ABA запускала продуцирование NO (фиг. 6F) и закрытие устьиц. Эти результаты указывают на то, что замыкающие клетки Sitiens сохраняют способность реагировать на доставляемую извне ABA путем продуцирования NO, и что только отсутствие продуцирования ABA у мутантов Sitiens предотвращает запускаемое сахарозой продуцирование NO и закрытие устьиц. Это наблюдение подтверждает, что устьица Sitiens не реагируют на сахарозу по причине дефицита ABA у этого мутанта, и что ABA является важным медиатором ответа устьиц на сахарозу.
Пример 9
Индуцирование специфичной по отношению к замыкающей клетке экспрессии АТНХК1 закрытия устьиц и снижение транспирации растений томата и Arabidopsis
Для изучения роли НХК специфично в замыкающих клетках получали растения томата и Arabidopsis, которые экспрессируют AtHXK1 под специфичным по отношению к замыкающей клетке промотором KST1 (Muller-Rober et al., 1995). Специфичную экспрессию промотора KST1 в замыкающих клетках томата и Arabidopsis проверяли по экспрессии GFP под промотором KST1 (линии GCGFP, фиг. 7А-Е). Экспрессия промотора KST1 являлась специфичной для замыкающих клеток во всех исследованных органах растения и не выявлялась в органах, которые не имеют устьиц, таких как корни (фиг. 7Е). Специфичную по отношению к замыкающей клетке экспрессию регистрировали, начиная с ранней стадии развития проростков по наблюдениям гипокотилей проростков (фиг. 7D) и до стадий, на которых листья полностью расправлены (фиг. 7А-С).
В отличие от экспрессии AtHXK1 под промотором 35S (Dai et al., 1999; Kelly et al., 2012) экспрессия AtHXK1 под специфичным по отношению к замыкающей клетке промотором KST1 (линии GCHXK) практически не оказывала негативного эффекта на рост (фиг. 8A, D). Все же экспрессия AtHXK1 под промотором KST1 уменьшала проводимость устьиц и транспирацию как у растений томата, так у растений Arabidopsis (фиг. 8В, С, Е, F). Эти результаты убедительно подтверждают предложенную в гипотезе специфичную роль НХК в замыкающих клетках, регулирующую закрытие устьиц.
Пример 10
Экспрессия GFP под контролем промотора FBPase, специфичная для мезофильных клеток
Чтобы различить эффекты НХК в замыкающих клетках от таковых в мезофильных клетках авторы настоящего изобретения создали трансгенные растения томата и Arabidopsis, экспрессирующие НХК под мезофильным промотором FBPase (Peleg et al., 2007). Специфичную экспрессию промотора FBPase продемонстрировали на трансгенных растениях томата и Arabidopsis, экспрессирующих GFP под контролем этого промотора (обозначенных MCGFP, фиг. 9). Идентифицировали несколько независимых гомозиготных линий Arabidopsis и томата с высокой экспрессией FBPase::AtHXK1 (названных растениями МСНХК).
Пример 11
Повышенная экспрессия гексокиназы в замыкающих клетках снижает транспирацию всего растения и повышает эффективность использования воды по результатам определения с использованием газообменной аналитической системы
С использованием газообменной системы LI-COR авторы настоящего изобретения анализировали 10 независимых линий GCHXK и обнаружили поразительное повышение эффективности использования воды у этих растений (фиг. 10A-D). Полученные авторами настоящего изобретения данные четко показывают, что при сохранении фотосинтеза неизменным (фиг. 10С) проводимость устьиц (указывающая на щель устьица, фиг. 10В) и транспирация (фиг. 10A) были снижены на 20% и 15%), соответственно, что таким образом улучшает эффективность использования воды с 1,36 у WT до 1,78 у линий GCHXK (фиг. 10D).
Пример 12
Снижение повышенной экспрессией гексокиназы в замыкающих клетках транспирации всего растения и повышение эффективности использования воды по результатам определения с использованием системы лизиметрических весов
Для оценки эффективности использования воды растениями GCHXK авторы настоящего изобретения использовали точную и чувствительную систему лизиметрических весов, которая измеряет наращивание массы растения и общую потерю воды растением в ходе долгосрочных экспериментов и может осуществлять мониторинг более 160 растений одновременно при различных режимах орошения (фиг. 11А-С). Анализировали две независимые трансгенные линии GCHXK (которые демонстрировали высокую WUE при измерении с помощью LI-COR (фиг. A-D 10)). Авторы настоящего изобретения обнаружили, что относительная суточная транспирация этих линий была ниже, чем у WT на протяжении всего эксперимента (20 дней) (фиг. 11А-С). Наращивание массы растения и рост не были подвержены влиянию. В результате отмечали приблизительно 20%-30% увеличение WUE у линий GCHXK по сравнению с растениями WT.
Пример 13
Повышенная экспрессия гексокиназы в замыкающих клетках снижает скорость транспирации всего растения и проводимость устьиц, не оказывая какого-либо негативного эффекта на рост, что повышает, таким образом, эффективность использования воды
С использованием системы лизиметрических весов авторы настоящего изобретения далее анализировали сохранение воды и WUE у растений GCHXK, которые демонстрировали высокую WUE при измерении LI-COR (фиг. 10A-D) и лизиметром (фиг. 11А-С). Проводили мониторинг нескольких параметров. Параметры потери воды являются скорость транспирации, проводимость устьиц (gs), параметрами роста являются общая масса растения, общая площадь листьев растения, и параметрами окружающей среды являются интенсивность света, дефицит давления пара (VPD). Было обнаружено, что на протяжении суток скорости транспирации, нормализованные на общую площадь листьев, коррелировали с изменениями окружающей среды (интенсивностью света и VPD, фиг. 12Е и 12F, соответственно). Скорости транспирации растений GCHXK были значительно ниже по сравнению с таковыми у WT на протяжении суток (фиг. 12А). Соответственно, было обнаружено, что проводимость устьиц также снижена (фиг. 12В), что доказывает то, что у растений GCHXK вода сохраняется, и устьица более закрытые. Более того, измеряя общую площадь листьев растения и массу (фиг. 12С и 12D, соответственно), авторы настоящего изобретения обнаружили, что даже несмотря на то, что растения потребляли меньше воды (фиг. 12А), рост не нарушался, он даже улучшался, как в случае с линией GCHXK 12. Сохранение воды без влияния на рост растения улучшает эффективность использования воды всем растением.
Пример 14
Повышенная экспрессия гексокиназы в замыкающих клетках повышает выносливость к засухе
Для проведения мониторинга поведения растений в стрессовых условиях использовали систему лизиметрических весов. После полного прекращения орошения растения подвергали стрессу засухи, который постепенно нарастал каждый день на протяжении эксперимента. Скорость транспирации растений WT и GCHXK анализировали в течение девяти последовательных дней (фиг. 13). В течение первых 3 дней растения GCHXK транспирировали меньше чем WT, что согласуется с поведением в нормальных условиях (фиг. 11А-С; 12A-F) и указывает на то, что стресс на то время был всего лишь умеренным. Однако в последующие дни (4-й и 5-й) наблюдали переход скоростей транспирации между WT и GCHXK (фиг. 13, *), и транспирация у WT резко падала по сравнению с GCHXK, что указывает на то, что растения WT более чувствительны к засухе. Как видно при умеренном стрессе (5-й и 6-й дни), а также в условиях тяжелого стресса (7-й и 8-й дни), транспирация у GCHXK менее чувствительна к ограничениям в воде по сравнению с WT, что проявляется в более медленном снижении транспирации на протяжении эксперимента. Эти результаты указывают на то, что растения GCHXK обладают лучшей выносливостью к нехватке воды, и что в условиях умеренного стресса эти растения могут все же нормально функционировать. Выносливость к засухе также определяли во время мониторинга относительной суточной транспирации (RDT) у растений WT и GCHXK в условиях засухи (фиг. 11А). При переходе от орошения к условиям засухи (фиг. 11А, 10й-11-й дни, увеличено), наблюдали резкое снижение транспирации у растений WT (красная стрелка). Однако на транспирацию у GCHXK экспозиция к засухе оказывала лишь умеренное влияние (зеленая стрелка), что указывает на то, что эти растения обладают лучшей выносливостью к засухе.
Пример 15
Повышенная экспрессия гексокиназы в замыкающих клетках улучшает урожайность
Для исследования эффекта GCHXK на урожайность проводили мониторинг числа фруктов на растениях GCHXK. Ни одна из линий не показала снижения урожайности, даже несмотря на то, что было обнаружено, что транспирация у этих линий ниже (фиг. 10-12). Наоборот, у нескольких линий число фруктов было даже больше чем в контроле (фиг. 14А-В).
Пример 16
Повышенная экспрессия гексокиназы в замыкающих клетках улучшает урожайность в условиях ограниченного водоснабжения
Для широкодиапазонного анализа урожайности растения выращивали в полукоммерческой теплице с контролируемыми условиями при четырех различных режимах водного стресса - орошения. Растения получали либо на 25% больше рекомендуемого объема орошения (125%), либо рекомендуемый объем орошения (100%), либо дефицит орошения (режимы орошения 75%, 50%, фиг. 15А). Плоды собирали и регистрировали совокупное число плодов и общую массу плодов для каждого растения (фиг. 15В-С). Как четко видно, урожайность GCHXK резко возросла. По сравнению с WT растения GCHXK характеризовались значительно более высокой урожайностью (числом плодов и общей массой плодов при всех режимах орошения). При этом дефицит орошения не влиял на число плодов на растение, но снижал массу плодов. Интересно отметить, что масса плодов GCHXK при условиях полного стресса (50%-ное орошение) была выше, чем у контрольных растений при 100%-ном орошении. Растения GCHXK также характеризовались лучшей выносливостью при ограничении в воде. При снижении орошения от 100% до 75% масса плодов растений GCHXK была снижена только на 16%, тогда как масса плодов контрольных растений WT была снижена на 39%. Следовательно, помимо более высокой урожайности при условиях нормального орошения (100%) (фиг. 14А-В и фиг. 15В) растения GCHXK также имели лучшую выносливость (более высокую урожайность) при ограниченном водоснабжении. В совокупности с результатами по транспирации (фиг. 13) эти результаты указывают на то, что специфичная экспрессия НХК в замыкающих клетках сохраняет воду, повышает эффективность использования воды и улучшает урожайность не только при нормальных условиях, но и в условиях засухи.
Пример 17
Повышенная экспрессия гексокиназы в замыкающих клетках снижает транспирацию всего растения, индуцирует закрытие устьиц и повышает эффективность использования воды у Arabidopsis
Получение термоизображений и газообменный анализ использовали с целью определения щели устьица, транспирации и WUE у растений Arabidopsis, экспрессирующих НХК специфично в замыкающих клетках (GCHXK, фиг. 16A-F). Авторы настоящего изобретения обнаружили, что у растений GCHXK проводимость устьиц и транспирация (фиг. 16А и В, соответственно, фиг. 8E-F) существенно снижены по сравнению с WT. Кроме того, с использованием методики получения термоизображений, было установлено, что температура листьев растений GCHXK была выше чем у WT, что указывает на то, что устьица более закрытые (фиг. 16F). Кроме того, несмотря на то, что транспирация была снижена, скорость фотосинтеза (фиг. 16С), а также мезофильная проводимость для СО2 (gm, фиг. 16D) не были подвержены влиянию. Более того, рост также не был подвержен влиянию (фиг. 8D). В целом, растения GCHXK характеризовались более высокой эффективностью использования воды (фиг. 16Е). Эти результаты демонстрируют, что одинаковая трансгенная вставка гена гексокиназы под специфичным по отношению к замыкающей клетке промотором, использованная в случае с томатом (семейство Solanaceae), является универсально применимой, при этом влияет на устьице и повышает эффективность использования воды также и в случае с Arabidopsis (семейство Brassicaceae), и что эта методика может быть внедрена также на других видах.
Хотя настоящее изобретение описано в сочетании с конкретными вариантами его осуществления, понятно, что многочисленные альтернативы, модификации и вариации будут очевидны специалистам в данной области. Следовательно, подразумевается, что оно охватывает все подобные альтернативы, модификации и вариации, которые предполагаются идеей и широким объемом приложенной формулы изобретения.
Все публикации, патенты и заявки на выдачу патентов, упомянутые в настоящем описании, включены в настоящий документ во всей своей полноте посредством ссылки в описании в той же степени, как если бы было указано, что каждый отдельный документ из публикации, патента или заявки на выдачу патента специально и отдельно включен в настоящий документ посредством ссылки. Кроме того, упоминание или идентификация какой-либо ссылки в настоящей заявке не должно истолковываться как допущение того, что такая ссылка упоминается в качестве известного уровня техники для настоящего изобретения. В тех случаях, когда используются заголовки разделов, их не следует истолковывать как обязательное ограничение.
Список литературы
Amodeo G, Talbott LD, Zeiger Ε (1996) Use of potassium and sucrose by onion guard cells during a daily cycle of osmoregulation. Plant Cell Physiol 37: 575-579.
Arenas-Huertero F, Arroyo A, Zhou L, Sheen J, Leon Ρ (2000) Analysis of Arabidopsis glucose insensitive mutants, gin5 and gin6, reveals a central role of the plant hormone ABA in the regulation of plant vegetative development by sugar. Genes Dev 14: 2085-2096.
Assmann SM (1993) Signal transduction in guard cells. Annu Rev Cell Biol 9: 345-375.
Baroli I, Price GD, Badger MR, von Caemmerer S (2008) The contribution of photosynthesis to the red light response of stomatal conductance. Plant Physiol 146: 737-747.
Cheng W, Zhang H, Zhou X, Liu H, Liu Y, Li J, Han S, Wang Y (2011) Subcellular localization of rice hexokinase in the mesophyll protoplasts of tobacco. Biologia Plantarum 55: 173-177.
Cho JI, Ryoo N, Eom JS, Lee DW, Kim HB, Jeong SW, Lee YH, Kwon YK, Cho MH, Bhoo SH, Hahn TR, Park YI, Hwang I, Sheen J, Jeon JS (2009) Role of the rice hexokinases OsHXK5 and OsHXK6 as glucose sensors. Plant physiology 149: 745-759.
Cho JI, Ryoo N, Ko S, Lee SK, Lee J, Jung KH, Lee YH, Bhoo SH, Winderickx J, An G, Hahn TR, Jeon JS (2006) Structure, expression, and functional analysis of the hexokinase gene family in rice (Oryza sativa L.). Planta 224: 598-611.
Christmann A, Hoffmann T, Teplova I, Grill E, Muller A (2005) Generation of active pools of abscisic acid revealed by in vivo imaging of water-stressed Arabidopsis. Plant Physiol 137: 209-219.
Claeyssen E, Rivoal J (2007) Isozymes of plant hexokinase: occurrence, properties and functions. Phytochemistry 68: 709-731.
Claeyssen Ε, Wally O, Matton DP, Morse D, Rivoal J (2006) Cloning, expression, purification, and properties of a putative plasma membrane hexokinase from Solanum chacoense. Protein Expr Purif 47: 329-339.
Cominelli E, Galbiati M, Albertini A, Fornara F, Conti L, Coupland G, Tonelli С (2011) DOF-binding sites additively contribute to guard cell-specificity of AtMYB60 promoter. BMC plant biology 11: 162.
Cominelli E, Galbiati M, Vavasseur A, Conti L, Sala Τ, Vuylsteke M, Leonhardt Ν, Dellaporta SL, Tonelli С (2005) A guard-cell-specific MYB transcription factor regulates stomatal movements and plant drought tolerance. Current biology: CB 15: 1196-1200.
Cominelli E, Galbiati M, Tonelli С (2010) Transcription factors controlling stomatal movements and drought tolerance. Transcription 1: 41-45.
Comstock JP (2002) Hydraulic and chemical signalling in the control of stomatal conductance and transpiration. J Exp Bot 53: 195-200.
Dai N, Schaffer A, Petreikov M, Shahak Y, Giller Y, Ratner K, Levine A, Granot D (1999) Overexpression of Arabidopsis hexokinase in tomato plants inhibits growth, reduces photosynthesis, and induces rapid senescence. Plant Cell 11: 1253-1266.
Damari-Weissler H, Kandel-Kfir M, Gidoni D, Mett A, Belausov E, Granot D (2006) Evidence for intracellular spatial separation of hexokinases and fructokinases in tomato plants. Planta 224: 1495-1502.
Ewert M, Outlaw W, Zhang S, Aghoram K, Riddle К (2000) Accumulation of an apoplastic solute in the guard-cell wall is sufficient to exert a significant effect on transpiration in Vicia faba leaflets. Plant Cell Environ 23: 195-203.
Francia Ρ, Simoni L, Cominelli E, Tonelli C, Galbiati M (2008) Gene trap-based identification of a guard cell promoter in Arabidopsis. Plant signaling & behavior 3: 684-686.
Galbiati M, Matus JT, Francia Ρ, Rusconi F, Canon Ρ, Medina С, Conti L, Cominelli E, Tonelli C, Arce-Johnson Ρ (2011) The grapevine guard cell-related VvMYB60 transcription factor is involved in the regulation of stomatal activity and is differentially expressed in response to ABA and osmotic stress. BMC plant biology 11: 142.
Galbiati M, Simoni L, Pavesi G, Cominelli E, Francia Ρ, Vavasseur A, Nelson T, Bevan M, Tonelli С (2008) Gene trap lines identify Arabidopsis genes expressed in stomatal guard cells. The Plant journal: for cell and molecular biology 53: 750-762.
Garcia-Mata C, Gay R, Sokolovski S, Hills A, Lamattina L, Blatt MR (2003) Nitric oxide regulates K+ and Cl- channels in guard cells through a subset of abscisic acid-evoked signaling pathways. Proc Natl Acad Sci USA 100: 11116-11121.
Giese JO, Herbers К, Hoffmann M, Klosgen RB, Sonnewald U (2005) Isolation and functional characterization of a novel plastidic hexokinase from Nicotiana tabacum. FEBS Lett 579: 827-831.
Geisler MJ, Sack FD (2002) Variable timing of developmental progression in the stomatal pathway in Arabidopsis cotyledons. New Phytol 153: 469-476.
Gotow K, Taylor S, Zeiger Ε (1988) Photosynthetic carbon fixation in guard cell protoplasts of Vicia faba L.: evidence from radiolabel experiments. Plant Physiol 86: 700-705.
Granot D (2007) Role of tomato hexose kinases. Funct Plant Biol 34: 564-570
Granot D (2008) Putting plant hexokinases in their proper place. Phytochemistry 69: 2649-2654.
Gray JE, Holroyd GH, van der Lee FM, Bahrami AR, Sijmons PC, Woodward FI, Schuch W, Hetherington AM (2000) The HIC signalling pathway links CO2 perception to stomatal development. Nature 408: 713-716.
Hofmann M, Roitsch Τ (2000) The hexokinase inhibitor glucosamine exerts a concentration dependent dual effect on protein kinase activity in vitro. J Plant Physiol 157: 13-16.
Husebye H, Chadchawan S, Winge P, Thangstad OP, Bones AM (2002) Guard cell- and phloem idioblast-specific expression of thioglucoside glucohydrolase 1 (myrosinase) in Arabidopsis. Plant physiology 128: 1180-1188.
Jang JC, Sheen J (1994) Sugar sensing in higher plants. Plant Cell 6: 1665-1679.
Jang JC, Leon P, Zhou L, Sheen J (1997) Hexokinase as a sugar sensor in higher plants. The Plant cell 9: 5-19.
Kandel-Kfir M, Damari-Weissler H, German MA, Gidoni D, Mett A, Belausov E, Petreikov M, Adir Ν, Granot D (2006) Two newly identified membrane-associated and plastidic tomato HXKs: characteristics, predicted structure and intracellular localization. Planta 224: 1341-1352.
Kang Y, Outlaw WH, Jr., Andersen PC, Fiore GB (2007) Guard-cell apoplastic sucrose concentration - a link between leaf photosynthesis and stomatal aperture size in the apoplastic phloem loader Vicia faba L. Plant Cell Environ 30: 551-558.
Karve A, Rauh BL, Xia X, Kandasamy M, Meagher RB, Sheen J, Moore BD (2008) Expression and evolutionary features of the hexokinase gene family in Arabidopsis. Planta 228:411-425.
Karve R, Lauria M, Virnig A, Xia X, Rauh BL, Moore BD (2010) Evolutionary lineages and functional diversification of plant hexokinases. Mol Plant 3: 334-346.
Kelly G, David-Schwartz R, Sade N, Moshelion M, Levi A, Alchanatis V, Granot D (2012) The pitfalls of transgenic selection and new roles of AtHXKl: a high level of AtHXKl expression uncouples hexokinasel-dependent sugar signaling from exogenous sugar. Plant Physiol 159: 47-51.
Kim M, Lim JH, Ahn CS, Park K, Kim GT, Kim WT, Pai HS (2006) Mitochondria-associated hexokinases play a role in the control of programmed cell death in Nicotiana benthamiana. Plant Cell 18: 2341-2355.
Klein D, Stitt M (1998) Effects of 2-deoxyglucose on the expression of rbcS and the metabolism of Chenopodium rubrum cell suspension cultures. Planta 205: 223-234.
Koiwai H, Nakaminami K, Seo M, Mitsuhashi W, Toyomasu T, Koshiba Τ (2004) Tissue-specific localization of an abscisic acid biosynthetic enzyme, ААОЗ, in Arabidopsis. Plant Physiol 134: 1697-1707.
Kroupitski Y, Golberg D, Belausov E, Pinto R, Swartzberg D, Granot D, Sela S (2009) Internalization of Salmonella enterica in leaves is induced by light and involves chemotaxis and penetration through open stomata. Appl Environ Microbiol 75: 6076-6086.
Lawson Τ (2009) Guard cell photosynthesis and stomatal function. New Phytol 181: 13-34.
Lawson T, Lefebvre S, Baker NR, Morison JI, Raines CA (2008) Reductions in mesophyll and guard cell photosynthesis impact on the control of stomatal responses to light and CO2. J Exp Bot 59: 3609-3619.
Leon P, Sheen J (2003) Sugar and hormone connections. Trends Plant Sci 8: 110-116.
Liang YK, Dubos C, Dodd 1С, Holroyd GH, Hetherington AM, Campbell MM (2005) AtMYB61, an R2R3-MYB transcription factor controlling stomatal aperture in Arabidopsis thaliana. Curr Biol 15: 1201-1206.
Lloyd FE (1908) The physiology of stomata. Carnegie Inst Washington Yearbook 82: 1-142.
Lu Ρ, Outlaw WH, Smith BG, Freed GA (1997) A new mechanism for the regulation of stomatal aperture size in intact leaves - Accumulation of mesophyll-derived sucrose in the guard-cell wall of Vicia faba. Plant Physiol 114: 109-118.
Lu Ρ, Zhang SQ, Outlaw WH, Jr., Riddle KA (1995) Sucrose: a solute that accumulates in the guard-cell apoplast and guard-cell symplast of open stomata. FEBS Lett 362: 180-184.
Melhorn V, Matsumi К, Koiwai H, Ikegami К, Okamoto M, Nambara Ε, Bittner F, Koshiba Τ (2008) Transient expression of AtNCED3 and ААОЗ genes in guard cells causes stomatal closure in Vicia faba. J Plant Res 121: 125-131.
Muller-Rober B, La Cognata U, Sonnewald U, Willmitzer L (1994) A truncated version of an ADP-glucose pyrophosphorylase promoter from potato specifies guard cell-selective expression in transgenic plants. The Plant cell 6: 601-612.
Muller-Rober B, Ellenberg J, Provart N, Willmitzer L, Busch H, Becker D, Dietrich P, Hoth S, Hedrich R (1995) Cloning and electrophysiological analysis of KST1, an inward rectifying K+ channel expressed in potato guard cells. Embo J 14: 2409-2416.
Menu T, Rothan C, Dai N, Petreikov M, Etienne С, Destrac-Irvine A, Schaffer A, Granot D, Ricard В (2001) Cloning and characterization of a cDNA encoding hexokinase from tomato. Plant Sci 160: 209-218.
Nakamura RL, McKendree WL, Jr., Hirsch RE, Sedbrook JC, Gaber RF, Sussman MR (1995) Expression of an Arabidopsis potassium channel gene in guard cells. Plant physiology 109: 371-374.
Neill S, Barros R, Bright J, Desikan R, Hancock J, Harrison J, Morris P, Ribeiro D, Wilson I (2008) Nitric oxide, stomatal closure, and abiotic stress. J Exp Bot 59: 165-176.
Neill SJ, Horgan R (1985) Abscisic acid production and water relations in wilty tomato mutants subjected to water deficiency. J Exp Bot 36: 1222-1231.
Nikinmaa E, Holtta T, Hari P, Kolari P, Makela A, Sevanto S, Vesala Τ (2012) Assimilate transport in phloem sets conditions for leaf gas exchange. Plant, Cell & Environment doi: 10.111 l/pce.12004.
Nilsson A, Olsson T, Ulfstedt M, Thelander M, Ronne Η (2011) Two novel types of hexokinases in the moss Physcomitrella patens. BMC Plant Biol 11: 32.
Nylander M, Svensson J, Palva ET, Welin BV (2001) Stress-induced accumulation and tissue-specific localization of dehydrins in Arabidopsis thaliana. Plant molecular biology 45: 263-279.
Olsson T, Thelander M, Ronne H (2003) A novel type of chloroplast stromal hexokinase is the major glucose-phosphorylating enzyme in the moss Physcomitrella patens. J Biol Chem 278: 44439-44447.
Outlaw WH (2003) Integration of cellular and physiological functions of guard cells. Crit Rev Plant Sci 22: 503-529.
Outlaw WH, Jr., De Vlieghere-He X (2001) Transpiration rate. An important factor controlling the sucrose content of the guard cell apoplast of broad bean. Plant Physiol 126: 1716-1724.
Pandey S, Zhang W, Assmann SM (2007) Roles of ion channels and transporters in guard cell signal transduction. FEBS Lett 581: 2325-2336.
Pego JV, Weisbeek PJ, Smeekens SC (1999) Mannose inhibits Arabidopsis germination via a hexokinase-mediated step. Plant Physiol 119: 1017-1023.
Padmanaban S, Chanroj S, Kwak JM, Li X, Ward JM, Sze H (2007) Participation of endomembrane cation/H+ exchanger AtCHX20 in osmoregulation of guard cells. Plant Physiol 144: 82-93.
Poffenroth M, Green DB, Tallman G (1992) Sugar concentrations in guard cells of Vicia faba illuminated with red or blue light: analysis by high performance liquid chromatography. Plant Physiol 98: 1460-1471.
Rennie EA, Turgeon R (2009) A comprehensive picture of phloem loading strategies. Proc Natl Acad Sci USA 106: 14162-14167.
Ritte G, Rosenfeld J, Rohrig K, Raschke K (1999) Rates of sugar uptake by guard cell protoplasts of Pisum sativum L. related to the solute requirement for stomatal opening. Plant Physiol 121:647-656.
Roelfsema MR, Hedrich R (2005) In the light of stomatal opening: new insights into 'the Watergate'. New Phytol 167: 665-691.
Rolland F, Baena-Gonzalez Б, Sheen J (2006) Sugar sensing and signaling in plants: conserved and novel mechanisms. Annu Rev Plant Biol 57: 675-709.
Sade Ν, Gebretsadik M, Seligmann R, Schwartz A, Wallach R, Moshelion M (2010) The role of tobacco Aquaporinl in improving water use efficiency, hydraulic conductivity, and yield production under salt stress. Plant Physiol 152: 245-254.
Schachtman DP, Goodger JQ (2008) Chemical root to shoot signaling under drought. Trends Plant Sci 13: 281-287.
Schroeder JI, Allen G J, Hugouvieux V, Kwak JM, Waner D (2001) Guard cell signal transduction. Annu Rev Plant Physiol Plant Mol Biol 52: 627-658.
Sun JY, Chen YM, Wang QM, Chen J, Wang XC (2006) Glucose inhibits the expression of triose phosphate/phosphate translocator gene in wheat via hexokinase-dependent mechanism. Int J Biochem Cell Biol 38: 1102-1113.
Taiz L, Zeiger Ε (1998) Plant Physiology, Ed. 2. Sinauer Associates, Sunderland, UK.
Tal M, Nevo Y (1973) Abnormal stomatal behavior and root resistance and hormonal imbalance in three wilty mutants of tomato. Biochem Genet 8: 291-300.
Talbott LD, Zeiger Ε (1993) Sugar and organic acid accumulation in guard cells of Vicia faba in response to red and blue light. Plant Physiol 102: 1163-1169.
Talbott LD, Zeiger Ε (1996) Central roles for potassium and sucrose in guard-cell osmoregulation. Plant Physiol 111: 1051-1057.
Talbott LD, Zeiger Ε (1998) The role of sucrose in guard cell osmoregulation. J Exp Bot 49: 329-337.
Tallman G, Zeiger Ε (1988) Light quality and osmoregulation in Vicia guard cells: evidence for involvement of three metabolic pathways. Plant Physiol 88: 887-895.
Terryn N, Arias MB, Engler G, Tire C, Villarroel R, Van Montagu M, Inze D (1993) rhal, a gene encoding a small GTP binding protein from Arabidopsis, is expressed primarily in developing guard cells. The Plant cell 5: 1761-1769.
Troncoso-Ponce MA, Rivoal J, Dorion S, Moisan MC, Garces R, Martinez-Force Ε (2011) Cloning, biochemical characterization and expression of a sunflower (Helianthus annuus L.) hexokinase associated with seed storage compounds accumulation. J Plant Physiol 168: 299-308.
Veramendi J, Fernie AR, Leisse A, Willmitzer L, Trethewey RN (2002) Potato hexokinase 2 complements transgenic Arabidopsis plants deficient in hexokinase 1 but does not play a key role in tuber carbohydrate metabolism. Plant Mol Biol 49: 491-501.
Veramendi J, Roessner U, Renz A, Willmitzer L, Trethewey RN (1999) Antisense repression of hexokinase 1 leads to an overaccumulation of starch in leaves of transgenic potato plants but not to significant changes in tuber carbohydrate metabolism. Plant Physiol 121: 123-134.
Wasilewska A, Vlad F, Sirichandra C, Redko Y, Jammes F, Valon C, Frei dit Frey N, Leung J (2008) An update on abscisic acid signaling in plants and more. Mol Plant 1: 198-217.
Wiese A, Groner F, Sonnewald U, Deppner H, Lerchl J, Hebbeker U, Flugge U, Weber A (1999) Spinach hexokinase I is located in the outer envelope membrane of plastids. FEBS Lett 461: 13-18.
Wilkinson S, Davies WJ (1997) Xylem sap pH increase: a drought signal received at the apoplastic face of the guard cell that involves the suppression of saturable abscisic acid uptake by the epidermal symplast. Plant Physiol 113: 559-573.
Xu FQ, Li XR, Ruan YL (2008) RNAi-mediated suppression of hexokinase gene OsHXK10 in rice leads to non-dehiscent anther and reduction of pollen germination. Plant Science 175: 674-684.
Yang Y, Costa A, Leonhardt N, Siegel RS, Schroeder JI (2008) Isolation of a strong Arabidopsis guard cell promoter and its potential as a research tool. Plant Methods 4:6.
Yu F, Li LM, Yang PP, Wang XQ (2012) Hexokinase from grape berries: its prokaryotic expression, polyclonal antibody preparation and biochemical property analyses. J. Plant Biochem. Biotechnol. DOI 10.1007/sl3562-012-0163-9.
Zhu GH, Liu YG, Ye NH, Liu R, Zhang JH (2011) Involvement of the abscisic acid catabolic gene CYP707A2 in the glucose-induced delay in seed germination and post-germination growth of Arabidopsis. Physiol Plant 143: 375-384.
Реферат
Изобретение относится к области биохимии, в частности к способу снижения проводимости устьица растения. Также раскрыты способы эффективности использования воды у растения, усиления выносливости растения к засухе, увеличения биомассы, усиления выносливости растения к биотическому стрессу. Изобретение позволяет увеличить урожайность растения даже при ограниченном водоснабжении. 5 н. и 2 з.п. ф-лы, 18 ил., 2 табл., 17 пр.

Комментарии