Соединения хинона и их применения для лечения рака - RU2688675C2
Код документа: RU2688675C2
Чертежи

Описание
Данная заявка является родственной Заявке на патент Великобритании GB 1213486.2, поданной 30 июля 2012, содержание которой полностью включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к соединениям хинона и их применениям в медицине, в частности, для лечения рака. Более конкретно, настоящее изобретение относится к соединениям 2,5-диазиридинилбензохинона, являющимся пролекарствами, способными активироваться в раковых клетках, экспрессирующих DT-диафоразу.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
DT-диафораза (англ. DTD) является ферментом, который сверхэкспрессируется во многих типах раковых тканей, включая опухоли молочных желез, толстой кишки, печени, мочевого пузыря, желудка, центральной нервной системы (ЦНС, англ. CNS) и рак легких, а также в меланомах. Были исследованы различные пролекарства на основе хинонов на предмет изучения их влияния на раковые клетки, экспрессирующие DTD. Например, при первичном немелкоклеточнрм раке легкого (англ. NSCLC, primary non-small cell lung cancer - первичный немелкоклеточный рак легкого) экспрессия DTD возрастает в 80 раз по сравнению с нормальным легким и возрастает до 400 раз при NSCLC относительно клеточных линий мелкоклеточного рака легкого (англ. SCLC, small cell lung cancer - мелкоклеточный рак легкого). Кроме того, DTD, как известно, активирует пролекарства на основе хинонов, и этот факт был предложен в качестве решения проблемы селективного нацеливания на раковые клетки, экспрессирующие DTD. Однако хотя пролекарства на основе хинонов находятся в стадии разработки и испытаний для изучения и использования их биологических свойств, на сегодняшний день они, как оказалось, не лишены некоторых недостатков.
Например, было установлено, что ксенотрансплантаты немелкоклеточного рака легкого с высокой активностью DTD чувствительны к пролекарству на основе хинона митомицину С. Однако, хотя митомицин С, как было показано, проявляет активность при лечении немелкоклеточного рака легкого, он является относительно слабым субстратом для DTD (Beall et al., Cancer Research, 54: 3196-3201, 1994), a метаболизм митомицина С по действием DTD зависит от величины рН, что приводит к рН-зависимому ингибированию DTD при повышении рН (Siegel et al., Mol. Pharmacol., 44:1128-1134, 1993).
Апазиквон или (Е)-5-(1-азиринил)-3-(гидроксиметил)-2-(3-гидрокси-1-пропенил)-1-метил-1Н-индол-4,7-дион является индолхиноном, родственным митомицину С, и также подвержен восстановительной конверсии до активных метаболитов под действием DTD. Это было предметом клинических исследований при лечении поверхностного рака мочевого пузыря. Однако, поскольку апазиквон эффективно восстанавливается под действием DTD, он преимущественно образует реакционноспособные кислородсодержащие радикалы, а не поперечные связи с ДНК (англ. DNA, desoxyribonucleic acid - дезоксирибонуктеиновая кислота) и, как показано, лишь разрушает нити ДНК. Будучи обычным "гипооксически-ориентированным" агентом, апазиквон оказался неактивным при изучении сфероидов, демонстрируя повышенную экспрессию DTD по отношению к некротическому центру сфероида. Результаты, вероятно, связаны с недостаточной способностью апазиквона проникать внутрь клеток и проходить сквозь клеточные мембраны (Bibby et al., Int. J. Oncol., 3: 661-666, 1993).
MeDZQ (2,5-диазиридинил-3,6-диметил-1,4-бензохинон) является еще одним примером весьма перспективного агента, в котором использован ориентированный на фермент DTD подход к лечению рака. Предварительные результаты показали, что он более чем в 150 раз эффективнее в качестве субстрата для рекомбинантного человеческого DTD, чем митомицин С, имеет независимый от рН метаболизм и не инактивирует DTD при повышении рН (Beall et al., выше; Ross et al. Oncol. Res., 6: 493-500, 1994). Хотя MeDZQ подвергается биоредуктивной активации под действием DTD, он несомненно отличается от апазиквона, поскольку обеспечивает лишь крайне незначительное увеличение цитотоксичности в гипоксических условиях по сравнению с аэробными условиями. Кроме того, несмотря на проявление хорошей корреляции между активностью DTD и цитотоксичностью MeDZQ во всем диапазоне клеточных линий опухолей человека, использование композиции MeDZQ в качестве полезного терапевтического агента было затруднено вследствие его плохой растворимости.
В патентном документе US 6156744 раскрыты водорастворимые пролекарства на основе хинонов, 2,5-диазиридинил-3-(гидроксиметил)-6-метил-1,4-бензохинон, именуемый "RH1", и его сложные эфиры, образованные с ацетильными, бензоильными, нафтоильными группами и защищенными аминокислотами. В патентном документе US 6156744 показано, что RH1 восстанавливается под действием DTD и селективно разрушает клетки, экспрессирующие DTD, путем сшивки ДНК, при этом он более растворим, чем MeDZQ.
Таким образом, в данной области техники сохраняется проблема создания пролекарств, которые бы активировались под действием DTD и обладали фармакологическими свойствами, делающими их эффективными потенциальными кандидатами в лекарства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В широком смысле, настоящее изобретение основано на понимании авторов изобретения того, что сложные эфиры RH1 предшествующего уровня техники, как правило, очень нестабильны в водном растворе, что ограничивает их полезность в качестве лекарственных средств. Соответственно, настоящее изобретение касается новых соединений на основе хинонов, обладающих улучшенными фармакологическими свойствами, выполненных с возможностью селективно активироваться посредством двухэлектронного восстановления внутри опухолей. Не желая быть связанными соответствием какой-либо конкретной теории, авторы настоящего изобретения полагают, что соединения настоящего изобретения являются пролекарствами на основе хинонов, претерпевающими в раковых клетках ферментативное двухэлектронное восстановление под действием DT-диафоразы с образованием гидрохинона, потенциального ДНК-сшивающего агента. Поскольку DT-диафораза сверхэкспрессируется в ряде опухолей человека, это означает, что соединения настоящего изобретения избирательно цитотоксичны в отношении раковых клеток по сравнению с нормальными клетками. Кроме того, настоящее изобретение также наглядно показывает, что соединения настоящего изобретения, как представлено на примере пролекарства на основе хинона Es5, обладают неожиданной стабильностью по сравнению с другими сложными эфирами RH1 и имеют более выраженную селективность в отношении клеток, экспрессирующих DT-диафоразу, чем соединения предшествующего уровня техники, такие как RH1 и его сложные эфиры. В частности, сложный эфир Es5 (соединение 4.65) имеет период полувыведения более 24 ч, равно как и продукт его гидролиза 4.61, благодаря чему он более чем в 20 раз стабильнее, чем другие сложные эфиры на основе RH1.
В широком смысле, настоящее изобретение относится к соединениям, представленным Формулой I:

где:
n=2, 3, 4, 5, 6 или 7;
R1 представляет собой водород, этаноил, пропаноил, бутаноил или бензоил, необязательно замещенные одной или несколькими С1-10 алкильными, C1-10 алкоксильными, гидроксильными группами, галогеном, нитро- или аминогруппами; и
R2 представляет собой метил, этил или фенил, необязательно замещенные одной или несколькими С1-10 алкильными, С1-10 алкоксильными, гидроксильными группами, галогеном, нитро- или аминогруппами;
и к их солям и/или сольватам, а также к способам лечения с применением таких соединений.
В частности, настоящее изобретение относится к соединениям, представленным Формулой Ia:

где:
n=2, 3 или 4; а
R1 представляет собой водород, этаноил, пропаноил или бутаноил; и
к их солям и/или сольватам.
Соответственно, согласно первому аспекту, в настоящем изобретении предложены соединения, представленные формулой I:

где:
n=3, 4, 5, 6 или 7;
R1 представляет собой водород, этаноил, пропаноил, бутаноил или бензоил, необязательно замещенные одной или несколькими C1-10 алкильными, C1-10 алкоксильными, гидроксильными группами, галогеном, нитро- или аминогруппами; а
R2 представляет собой метил, этил или фенил, необязательно замещенные одной или несколькими C1-10 алкильными, C1-10 алкоксильными, гидроксильными группами, галогеном, нитро- или аминогруппами;
или их соль и/или сольват.
Согласно некоторым вариантам осуществления, в настоящем изобретении предложены соединения, представленные формулой Ia:
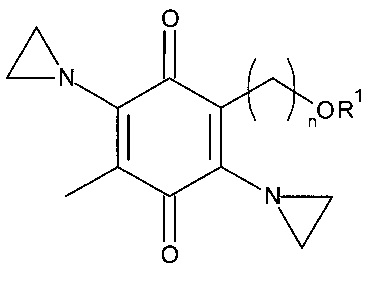
где:
n=3 или 4; и
R1 представляет собой водород, этаноил, пропаноил или бутаноил; а также
их соли и/или сольваты.
Согласно некоторым предпочтительным вариантам осуществления, n=3.
Согласно предпочтительному варианту осуществления, n=3, a R1 является водородом или этаноилом, так что соединение представляет собой 3-(2,5-бис-азиридин-1-ил-4-метил-3,6-диохоциклогекса-1,4-диенил)-пропиловый эфир уксусной кислоты или 2,5-бис-азиридин-1-ил-3-(3-гидроксипропил)-6-метил-1,4-бензохинон, именуемые в настоящей заявке Es5 и 4-61. Согласно любому аспекту настоящего изобретения, необязательные галогенсодержащие заместители могут быть группами, содержащими фтор, хлор или бром.
Согласно еще одному аспекту, в настоящем изобретении предложена фармацевтическая композиция, включающая в себя соединение Формулы I, такое как определено в данном контексте, и необязательно дополнительно включающая в себя один или несколько дополнительных терапевтических агентов, например, дополнительный терапевтический агент, предназначенный для лечения рака. Подходящие примеры могут включать в себя, не ограничиваясь перечнем, цисплатин (цис-платина), доцетаксел, хлорид кобальта, эпирубицин, цитарабин (ARA-C) и митомицин С. Предпочтительно, комбинация терапевтических агентов демонстрирует аддитивный или синергический эффект, более предпочтительно, синергический эффект.
Соответственно, согласно некоторым вариантам осуществления, в настоящем изобретении предложена фармацевтическая композиция, включающая в себя соединение Формулы I, такое как определено в данном контексте, в сочетании с одним или несколькими дополнительными терапевтическими агентами, выбранными из цисплатина, доцетаксела, хлорида кобальта и митомицина С. Предпочтительно, композиция включает в себя соединение Формулы I, такое как определено в данном контексте, в сочетании с цисплатином или хлоридом кобальта.
Особенно предпочтительные комбинации включают в себя Es5 (4.65) и цисплатин, а также Es5 (4.65) и хлорид кобальта.
Согласно еще одному аспекту, в настоящем изобретении предложено соединение Формулы I, такое как определено в данном контексте, или фармацевтическая композиция, включающая в себя соединение Формулы I, такое как определено в данном контексте, для использования в способе лечения.
Согласно еще одному аспекту, в настоящем изобретении предложено соединение Формулы I, такое как определено в данном контексте, или фармацевтическая композиция, включающая в себя соединение Формулы I, такое как определено в данном контексте, для использования в способе лечения рака. Предпочтительно, соединения настоящего изобретения применяют для лечения типов рака, при которых раковые клетки сверхэкспрессируют DT-диафоразу. В этом случае соединения настоящего изобретения действуют как пролекарства и подвергаются ферментативному восстановлению под действием DT-диафоразы с образованием гидроксихинона, соединения, цитотоксичного для раковых клеток. Для иллюстрации, настоящее изобретение может применяться при лечении рака мозга, лейкемии, немелкоклеточного рака легкого, рака толстой кишки, рака ЦНС, меланомы, рака яичников, рака почек, рака предстательной железы или рака молочной железы. Соответственно, настоящее изобретение может включать в себя выявление возможности применения в отношении больного раком лечения соединениями в соответствии с настоящим изобретением. Предпочтительно, это включает в себя получение образца раковых клеток у пациента; установление, сверхэкспрессируют ли раковые клетки DT-диафоразу; и в случае, если раковые клетки сверхэкспрессируют DT-диафоразу, лечение пациента соединением, представленным Формулой I. Способ может включать в себя стадию установления у человека наличия сверхэкспрессии DTD для определения, подходят он или нет для лечения соединением, представленным Формулой I. Это может включать в себя стадию установления сверхэкспрессии DTD по шкале, позволяющей отличить человека, способного с большой вероятностью получать пользу от лечения, от человека, который с меньшей вероятностью либо маловероятно будет получать пользу от лечения, например, в некоторых случаях раковые клетки такого человека не экспрессируют DT-диафоразу на уровне, позволяющем эффективно восстанавливать соединение настоящего изобретения до цитотоксичного гидрохинона.
Согласно еще одному аспекту, в настоящем изобретении предложено соединение Формулы I, такое как определено в данном контексте, для применения его в способе лечения рака, где способ включает в себя лечение дополнительным терапевтическим агентом, выбранным из цисплатина, доцетаксела, хлорида кобальта и митомицина С. Особенно предпочтительные комбинации включают в себя Es5 (4.65) и цисплатин, Es5 (4.65) и хлорид кобальта, Es5 (4.65) и доцетаксел, а также Es5 (4.65) и митомицин С.
Согласно еще одному аспекту, в настоящем изобретении предложен способ лечения рака, при этом способ включает в себя введение терапевтически эффективного количества соединения Формулы I, такого как определено в данном контексте, или фармацевтической композиции, включающей в себя соединение Формулы I, такое как определено в данном контексте, пациенту, нуждающемуся в таком лечении.
Согласно еще одному аспекту, в настоящем изобретении предложен способ лечения рака, при этом способ включает в себя введение терапевтически эффективного количества соединения Формулы I, такого как определено в данном контексте, и дополнительного терапевтического агента, выбранного из цисплатина, доцетаксела, хлорида кобальта и митомицина С, пациенту, нуждающемуся в таком лечении.
Настоящее изобретение включает в себя комбинацию описанных аспектов и предпочтительных признаков, кроме случаев, когда такая комбинация является очевидно недопустимой, либо указано, что ее следует специально избегать. Варианты осуществления настоящего изобретения далее будут описаны в качестве примера и без ограничения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1. Графическое изображение результатов экспериментов in vivo, показывающее сравнение лечения как % клеточного выживания в сравнении с соответствующим п/к (англ. s.c, subcutaneously - подкожно) или в/б (англ. i.p., intraperitoneal - внутрибрюшинно) контролем.
Фиг. 2. Графическое изображение результатов экспериментов in vivo, показывающее сравнение экспрессированных клеточных линий как % клеточного выживания в сравнении с соответствующим п/к или в/б контролем.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
DT-Диафораза
Соединения, фармацевтические композиции и медицинские применения настоящего изобретения особенно подходят для лечения опухолей, сверхэкспрессирующих фермент DT-диафоразу (DTD), по-другому известный в данной области техники как NQO1 и NАD(Р)Н:хинон-оксидоредуктаза 1 (ЕС 1.6.99.2). Не желая быть связанными соответствием какой-либо конкретной теории, обычно считают, что раковые клетки, сверхэкспрессирующие DTD, являются причиной того, что относительно неактивные пролекарства на основе хинонов селективно активируются путем ферментативного двухэлектронного восстановления внутри раковых клеток с образованием гидрохинона, являющегося потенциальным сшивающим агентом для ДНК, а следовательно, цитотоксичного для раковых клеток. Селективность такого применения в терапевтических целях является достижимой благодаря тому, что DTD сверхэкспрессируется в ряде опухолей человека по сравнению с нормальными клетками, включая рак мозга, лейкемию, немелкоклеточный рак легкого, рак толстой кишки, рак ЦНС, меланому, рак яичников, рак почек, рак предстательной железы и рак молочной железы (Zappa et al., J. Histochem. Cytochem., 49: 1187-1188, 2001; Tudor et al., Anti-Cancer лекарственное средство, 16: 381-391, 2005; Danson et al., Annals of Oncology, 22: 1653-1660, 2011). Обычно предпочтительно, что сверхэкспрессия DTD раковыми клетками является результатом фенотипа дикого типа клеток. В качестве альтернативы или дополнительно, сверхэкспрессия DTD может быть обусловлена трансформацией целевых раковых клеток нуклеиновой кислотой, кодирующей DTD (см. Danson et al., выше).
Однако хотя такое применение соединений является предпочтительным аспектом настоящего изобретения, в данной области техники также известно, что соединения 2,5-диазиридинилбензохинона являются цитотоксичными для некоторых форм рака, которые не сверхэкспрессируют DTD до какой-либо существенной степени, как, например, лейкемия. Кроме того известно, что соединения такого общего типа могут также подвергаться восстановлению с образованием цитотоксичных продуктов в результате воздействия других типов восстанавливающих ферментов, находящихся в раковых клетках.
Соответственно, экспрессия DTD является полезным инструментом в контексте настоящего изобретения для выявления того, может ли к данному типу рака быть применено лечение с помощью соединений и композиций, раскрытых в данном контексте, и/или в качестве критерия выбора пациента для лечения. В том и другом случае такое выявление может включать в себя испытание образца раковых клеток на предмет определения, происходит ли в них сверхэкспрессия DTD, и, соответственно, будет ли тип рака или данный конкретный пациент с большой вероятностью получать пользу от лечения, например, как показано в работе Hussein et al., British Journal of Cancer (2009) 101, pp. 55-63.
Соответственно, настоящее изобретение включает в себя испытание образца раковых клеток на предмет определения возможности лечения данного типа рака или данного конкретного пациента в соответствии с настоящим изобретением. Это может быть осуществлено путем выявления, имеется ли повышенный уровень белка DT-диафоразы в клетках образца, например, по сравнению с экспрессией в нормальных клетках, либо путем определения экспрессии генов DT-диафоразы. Образец может представлять собой раковые клетки конкретного пациента. В большинстве случаев сверхэкспрессия может быть определена относительно контрольного образца, например, относительно доброкачественных клеток, предпочтительно, из той же ткани. Способ может включать в себя стадию определения сверхэкспрессии DTD по шкале, позволяющей отличить человека, способного с большой вероятностью получать пользу от лечения, от человека, который менее вероятно или маловероятно будет получать пользу от лечения.
Таким образом, согласно одному из аспектов, настоящее изобретение включает в себя определение того, имеет ли пациент рак, сверхэкспрессирующий DT-диафоразу, что может быть осуществлено путем анализа экспрессии белка DT-диафоразы.
Предпочтительно, наличие или количество белка DT-диафоразы может быть определено при помощи связующего агента, способного специфически связываться с белком DT-диафоразы или его фрагментами. Предпочтительным типом связующего агента белка DT-диафоразы является антитело, способное специфически связываться с DT-диафоразой или ее фрагментом. Антитело может быть помечено, чтобы сделать его определяемым или пригодным к определению после реакции с одним или несколькими другими видами, например, используя вторичное антитело, которое помечено или способно продуцировать обнаружимый результат, например, при анализе методом ELISA (англ. Enzyme Linked Immuno Sorbent Assay - иммуноферментный твердофазный анализ). В качестве альтернативы, помеченный связующий агент может быть использован при вестерн-блоттинге белка DT-диафоразы. Также известно, что некоторые формы рака характеризуются наличием мутаций в гене NАD(Р)Н-дегидрогеназы (хинон), что означает что он кодирует функционально неактивную DT-диафоразу, и это также может обуславливать то, что лица, имеющие неактивные или восстановленные уровни DT-диафоразы, с меньшей вероятностью способны поддаваться лечению соединением в соответствии с настоящим изобретением. Это может быть определено при помощи SNP-анализа (англ. single nucleotide polymorphism - анализ однонуктеотидных полиморфизмов) или анализа полиморфизма длин рестрикционных фрагментов (англ. RFLP).
В качестве альтернативы или дополнительно, способ определения присутствия белка DT-диафоразы может быть осуществлен на образцах опухолей, например, при помощи иммуногистохимического (англ. IHC) анализа. IHC анализ может выполняться при использовании зафиксированных в парафине образцов или замороженных образцов тканей и, как правило, включает в себя окрашивание образцов для выделения присутствия и локализации белка DT-диафоразы.
Согласно одному из конкретных примеров, в соответствии с подходом, использованным в работе Zappa et al. (выше), образцы ткани, фиксированной в формалине и залитой в парафин, для определения экспрессии DTD могут быть проанализированы с помощью иммуногистохимии (IHC), используя анти-DTD моноклональные антитела (lgG1), полученные от белой мыши популяции BALB-c, иммунизированной очищенным рекомбинантным человеческим DTD белком (Siegelet al., Clin. Cancer Res., 4: 2065-2070, 1998). При таком подходе в качестве отрицательного контрольного реагента используются нереактивные для человека моноклональные антитела мыши (lgG1), полученные в тканевой культуре. Тканевые срезы (3 мкм) могут быть депарафинированы в ксилоле, регидратированы при помощи спиртов с повышающейся концентрацией и подвергнуты воздействию микроволн. Эндогенная пероксидазная активность и неспецифическое связывание могут быть блокированы добавлением, соответственно, блокатора пероксидазы (DAKO EnVision Kit; Carpinteria, СА) и 20% нормальной сыворотки кролика. Серийные срезы могут быть последовательно инкубированы либо с анти-DTD, либо с контрольными антителами и затем со вторичным антителом (анти-мышиным антителом, меченым пероксидазой хрена (HRP)). При иммунологическом анализе используют субстратно-хромогенный раствор (перекись водорода и 3,3-диаминобензидиновый хромоген). Препараты докрашивают гематоксилином. Интенсивность иммуноокрашивания (бурое окрашивание) визуально оценивали как 0 (отрицательное), +1 (очень слабое), +2 (слабое), +3 (сильное) и +4 (очень интенсивное). При таком типе анализа по существу не должно быть иммуноокрашивания в контрольных секциях при использовании неспецифических антител (оценка 0). С другой стороны, в раковых клетках злокачественных опухолей или отдельных пациентов, проходящих лечение в соответствии с настоящим изобретением, можно было бы ожидать, что окрашивание при проведении иммуногистохимического исследования (англ. IHC) будет иметь интенсивность +3 или +4.
Согласно еще одному примеру, активность DTD может быть определена спектрофотометрически при помощи измерения восстановления цитохрома на длине волны 550 нм при температуре 25°С, см. работу Chen et al., Biochem J. 284: 855-860, 1992. При таком анализе используют аналитическую смесь (1 мл), содержащую 25 мМ трис-буфера, рН 7,5, 200 мкМ NAD(P)H, 0,8 мкМ менадиона и 30 мкМ цитохрома С. При таком анализе менадион является акцептором электрона, а цитохром С используют для реокисления образовавшегося менадиола. Влияние других хинонредуктаз при таком анализе может быть распознано путем добавления 1 мкм дикумарола, селективного ингибитора DTD.
В качестве альтернативы или дополнительно, определение экспрессии генов DT-диафоразы может включать в себя определение присутствия или количества DT-диафоразы мРНК (англ. mRNA) в образце. Методы выполнения этого хорошо известны специалистам в данной области. Например, они включают в себя определение присутствия DT-диафоразы мРНК (i) с помощью меченой пробы, способной гибридизироваться до DT-диафоразы нуклеиновой кислоты, например, при использовании способа, такого как FISH (англ. fluorescence in situ hybridization - флуоресцентная гибридизация in situ), и/или (ii) с помощью ПЦР (англ. PCR, Polymerase Chain Reaction - полимеразная цепная реакция), включающей в себя праймеры на основе DT-диафоразы нуклеотиднной последовательности, для определения присутствия в образце транскрипта DT-диафоразы. Проба также может быть иммобилизирована в виде последовательности, включенной в микроматрицу.
Предпочтительно, определение DT-диафоразы мРНК осуществляют при помощи извлечения РНК из образца опухоли и измерения конкретно экспрессии DT-диафоразы с помощью количественной ПЦР в реальном масштабе времени (англ. RT-PCR). В качестве альтернативы или дополнительно, экспрессия DT-диафоразы может быть оценена с помощью РНК, извлеченной из образца опухоли при помощи микроматричного анализа, измеряющего уровни мРНК для группы генов, используя множество проб, иммобилизованных на субстрате с образованием матрицы.
Как упоминалось выше, выбор того, использовать ли экспрессию белка или экспрессию гена, либо то и другое, для определения сверхэкспрессии DTD, является решением, принимаемым специалистом в данной области с учетом знания о достоинствах и недостатках различных подходов, принимая во внимание соответствующую точность и чувствительность оборудования, возникновение ложно-положительных и ложно-отрицательных результатов, а также доступность различных анализов из экономических или других практических соображений.
Фармацевтические композиции
Соединения настоящего изобретения, раскрытые в данном контексте, для лечения рака могут применяться сами по себе, однако в большинстве случаев предпочтительно использовать их в составе фармацевтических композиций, дополнительно включающих в себя один или несколько фармацевтически приемлемых носителей, вспомогательных средств (адъювантов), инертных наполнителей, разбавителей, наполнителей, буферных смесей, стабилизаторов, консервантов, смазывающих веществ (лубрикантов) или других материалов, хорошо известных специалистам в данной области, а также необязательно других терапевтических или профилактических агентов. Примеры компонентов фармацевтических композиций представлены в справочнике Remington's Pharmaceutical Sciences, 20th Edition, 2000, pub. Lippincott, Williams & Wilkins.
Такие соединения или их производные могут быть использованы в настоящем изобретении для лечения рака, в частности, злокачественных опухолей, сверхэкспрессирующих DTD. При использовании в данном контексте термин "производные" лекарственных средств включает в себя соли, координационные комплексные соединения, сложные эфиры, такие как гидролизуемые in vivo сложные эфиры, свободные кислоты или основания, гидраты, пролекарства или липиды, и партнеры по связыванию.
Соли соединений изобретения предпочтительно являются физиологически хорошо переносимыми и нетоксичными. Специалистам в данной области известно множество примеров солей. Соединения, содержащие кислотные группы, такие как фосфаты или сульфаты, могут образовывать соли со щелочными или щелочноземельными металлами, такими как Na, К, Мg и Са, а также с органическими аминами, такими как триэтиламин и трис-(2-гидроксиэтил)амин. Соли могут образовываться между соединениями с основными группами, например, аминами, и неорганическими кислотами, такими как соляная кислота, фосфорная кислота или серная кислота, либо органическими кислотами, такими как уксусная кислота, лимонная кислота, бензойная кислота, фумаровая кислота или винная кислота. Соединения, содержащие и кислотные и основные группы, могут образовывать внутренние соли.
Сложные эфиры могут быть образованы между гидроксильными или карбоксильными группами, присутствующими в соединении и соответствующем партнере по реакции в виде карбоновой кислоты или спирта, с помощью способов, известных в данной области техники.
Производные, являющиеся пролекарствами соединений, могут превращаться in vivo или in vitro в одно из исходных соединений. Как правило, по меньшей мере одна из биологических активностей соединения будет снижена, когда соединение имеет форму пролекарства, и может быть активирована путем превращения пролекарства с высвобождением соединения или его метаболита. Введение пролекарств может быть благоприятно для улучшения, например, стабильности при хранении и/или композиции/биодоступности в отношении исходного соединения.
Другие производные включают в себя партнеров по связыванию соединений, с помощью которых соединения связаны с партнером по связыванию, например, будучи химически соединенным с соединением или физически связанным с ним. Примеры партнеров по связыванию включают меченую или репортерную молекулу, поддерживающую подложку, молекулоноситель или транспортную молекулу, эффектор, лекарственное средство, антитело или ингибитор. Партнеры по связыванию могут быть ковалентно присоединены к соединениям изобретения при помощи подходящей функциональной группы на соединении, такой как гидроксильная группа, карбоксильная группа или аминогруппа. Другие производные включают в себя объединение соединений с липосомами.
Термин "фармацевтически приемлемый" при использовании в данном контексте включает в себя соединения, материалы, композиции и/или лекарственные формы, являющиеся в рамках тщательного медицинского обследования пригодными для использования при соприкосновении с тканями субъекта (например, человека) без чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, соразмерно с оправданным соотношением польза/риск. Каждый носитель, наполнитель и т.д. также должен быть "приемлемым" в плане совместимости с другими ингредиентами композиции.
Активные агенты, раскрытые в данном контексте, для лечения злокачественных опухолей, сверхэкспрессирующих DTD, в соответствии с настоящим изобретением предпочтительно вводят пациенту в "профилактически эффективном количестве" или "терапевтически эффективном количестве" (в зависимости от ситуации, хотя профилактику можно рассматривать как терапию), это является достаточным, чтобы выявить пользу для пациента. Фактически введенное количество, а также скорость введения и длительность приема будут зависеть от природы заболевания и тяжести состояния, подлежащих лечению. Рекомендации по лечению, например, решения относительно дозирования и т.д., входят в компетенцию врачей общей практики и других врачей и, как правило, учитывают заболевание, подлежащее лечению, состояние конкретного пациента, место доставки, способ введения и другие факторы, известные практикующим врачам. Примеры методик и протоколов, упоминавшиеся выше, приведены в справочнике Remington's Pharmaceutical Sciences, 20th Edition, 2000, Lippincott, Williams & Wilkins. Композиция может использоваться в виде монотерапии или в сочетании с другими способами лечения, одновременно или последовательно, в зависимости от состояния, подлежащего лечению.
Композиции для удобства могут быть представлены в виде единичной лекарственной формы и могут быть приготовлены при помощи любого из способов, хорошо известных в фармацевтике. Такие способы включают в себя стадию связывания активного соединения с носителем, который может состоять из одного или нескольких вспомогательных ингредиентов. Как правило, композиции готовят при помощи однородного и тщательного объединения активного соединения с жидкими носителями или тонкоизмельченными твердыми носителями, либо с теми и другими, и последующего, при необходимости, формования продукта.
Агенты, раскрытые в данном контексте, для лечения злокачественной опухоли, сверхэкспрессирующей DTD, могут вводиться субъекту при помощи любого удобного способа введения, будь то системно/периферически или по месту требуемого воздействия, включая, но не ограничиваясь перечнем, перорально (например, путем проглатывания); местно (включая, например, чрескожно, интраназально, внутриглазно, защечно и подъязычно); пульмонально (например, при помощи ингаляционной терапии или инсуфляцией, например, аэрозоля, к примеру, через рот или нос); ректально; вагинально; парэнтерально, например, путем инъекции, включая подкожное, внутрикожное, внутримышечное, внутривенное, внутриартериальное, интракардиальное, интратекальное, интраспинальное, внутрикапсулярное, подкапсулярное, внутриглазное, внутрибрюшинное, внутритрахеальное, внутрикожное, внутрисуставное, сабарахноидальное и внутригрудинное введение; имплантацией препарата пролонгированного действия, например, подкожно или внутримышечно.
Композиции, подходящие для перорального способа введения (например, при помощи глотания), могут быть представлены в виде дискретных элементов, таких как капсулы, крахмальные капсулы или таблетки, каждая из которых содержит заранее определенное количество активного соединения; в виде порошка или гранул; в виде раствора или суспензии в водной или неводной жидкости; либо в виде жидкой эмульсии типа масло-в-воде или вода-в-масле; в виде шариков (болюсов); в виде лекарственной кашки (электуарии); или в виде пасты.
Композиции, подходящие для парэнтерального введения (например, путем инъекции, включая кожную, подкожную, внутримышечную, внутривенную и внутрикожную), включают в себя водные и неводные изотонические, апирогенные, стерильные растворы для инъекций, которые могут содержать антиокислители, буферные растворы, консерванты, стабилизаторы, антимикробные добавки и растворенные вещества, делающие композицию изотонической с кровью предполагаемого получателя; а также водные и неводные стерильные суспензии, которые могут включать в себя суспендирующие агенты и загустители, и липосомы или другие системы микрочастиц, предназначенные для нацеливания соединения на компоненты крови либо один или несколько органов. Примеры изотонических наполнителей, подходящих для использования в таких композициях, включают в себя физиологический раствор для инъекций, раствор Рингера или раствор Рингера с лактатом для инъекций. Как правило, концентрация активного соединения в растворе составляет от 1 нг/мл до 10 мкг/мл. Композиции могут быть представлены в герметичных контейнерах с однократной дозой или в герметичных контейнерах для многократного приема, например, в виде ампул и флаконов, и могут храниться в сублимированном (лиофилизированном) состоянии, требующем лишь добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением. Экстемпоральные растворы и суспензии для инъекций могут быть приготовлены из стерильных порошков, гранул и таблеток. Композиции могут иметь форму липосомов или других микрогранулированных систем, предназначенных для нацеливания активного соединения на компоненты крови или один или несколько органов.
Комбинации
Композиции, включающие в себя агенты, раскрытые в данном контексте, для лечения рака могут быть использованы в способах, описанных в данном контексте, в сочетании со стандартными химиотерапевтическими режимами или в сочетании с лучевой терапией. Примеры других химиотерапевтические агентов включают в себя Амсакрин (Амсидин), Блеомицин, Бусульфан, Капецитабин (Кселода), Карбоплатин, Кармустин (англ. BGNU, bischloroethylnitrosourea - бисхлорэтилнитрозомочевина), Хлорамбуцил (Лейкеран), Цисплатин (Цис-платина), Кладрибин (Леустат), Клофарабин (Эволтра), хлорид кобальта, Крисантаспас (Эрвиназа), Циклофосфамид, Цитарабин (ARA-C), Дакарбазин (DTIC), Дактиномицин (Актиномицин D), Даунорубициин, Доцетаксел (Таксотер), Доксорубицин, Эпирубицин, Этопозид (Вепезид, VP-16), Флударабин (Флудара), Фторурацил (5-FU), Гемцитабин (Гемзар), гидроксимочевина (гидроксикарбамид, Гидреа), Идарубицин (Заведос), Ифосфамид (Митоксан), Иринотекан (СРТ-11, Кампто), Лейковорин (фолиновая кислота), липосомальный доксорубицин (Келикс, Миоцет), липосомальный даунорубицин (Дауноксом, англ. DaunoXome®), Ломустин, Мелфалан, меркаптопурин, Месна, Метотрексат, Митомицин, Митоксантрон, Оксалиплатин (Элоксатин), Паклитаксел (Таксол), Пеметрексед (Алимта), Пентостатин (Нипент), Прокарбазин, Ралтитрексед (Томудекс, англ. Tomudex®), Стрептозоцин (Заносар, англ. Zanosar®), Тегафур-урацил (Уфторал), Темозоломид (Темодал), Тенипозид (Вумон), Тиотепа, тиогуанин (6-TG) (Ланвис), Топотекан (Гикамтин), Треосульфан, Винбластин (Велбе), Винкристин (Онковин), Виндезин (Элдизин) и Винорелбин (Навельбин). Предпочтительно, другой терапевтический агент выбирают таким образом, чтобы он создавал аддитивный или синергический эффект.
В данном контексте также описаны методы комбинированной терапии, где соединение Формулы I, такое как определено в данном контексте, используют в сочетании с дополнительным терапевтическим агентом, предпочтительно, химиотерапевтическим агентом, пациенту, нуждающемуся в таком лечении. Соответственно, согласно еще одному аспекту, в настоящем изобретении предложен способ лечения рака, при этом способ включает в себя введение терапевтически эффективного количества соединения Формулы I, такого как определено в данном контексте, и дополнительного терапевтического агента, выбранного из цисплатина, доцетаксела, хлорида кобальта и митомицина С, пациенту, нуждающемуся в таком лечении. Дополнительный терапевтический агент может вводиться совместно, либо введение может быть последовательным. Согласно некоторым предпочтительным вариантам осуществления, дополнительный терапевтический агент является цисплатином или хлоридом кобальта. Согласно некоторым предпочтительным вариантам осуществления, второй терапевтический агент является доцетакселом или митомицином С.Особенно предпочтительные комбинации включают в себя Es5 (4.65) и цисплатин, Es5 (4.65) и хлорид кобальта, Es5 (4.65) и доцетаксел, а также Es5 (4.65) и митомицин С.Рак может быть, например, раком мозга, лейкемией, немелкоклеточным раком легкого, раком толстой кишки, раком ЦНС, меланомой, раком яичников, раком почек, раком предстательной железы или раком молочной железы.
Согласно некоторым вариантам осуществления, раковые клетки сверхэкспрессируют DT-диафоразу. Согласно некоторым вариантам осуществления, соединение Формулы I, такое как определено в данном контексте, претерпевает ферментативное восстановление под действием DT-диафоразы с образованием гидроксихинона.
Согласно некоторым вариантам осуществления, способ включает в себя получение образца раковых клеток у пациента, определение того, сверхэкспрессируют ли раковые клетки DT-диафоразу и, в случае если раковые клетки сверхэкспрессируют DT-диафоразу, лечение пациента соединением, представленным Формулой I, и дополнительным терапевтическим агентом.
Согласно еще одному аспекту, в настоящем изобретении предложена фармацевтическая композиция, включающая в себя соединение Формулы I, такое как определено в данном контексте, и необязательно дополнительно включающая в себя один или несколько дополнительных терапевтических агентов, например, дополнительный терапевтический агент, предназначенный для лечения рака. Подходящие примеры могут включать в себя, не ограничиваясь перечнем, цисплатин, доцетаксел, хлорид кобальта, эпирубицин, цитарабин (ARA-C) и митомицин С. Предпочтительно, комбинация терапевтических агентов в композиции демонстрирует аддитивный или синергический эффект, более предпочтительно, синергический эффект.
Соответственно, согласно некоторым вариантам осуществления, в настоящем изобретении предложена фармацевтическая композиция, включающая в себя комбинацию соединения Формулы I, такого как определено в данном контексте, и одного или нескольких дополнительных терапевтических агентов, выбранных из цисплатина, доцетаксела, хлорида кобальта и митомицина С. Предпочтительно, композиция включает в себя соединение Формулы I, такое как определено в данном контексте, в сочетании с цисплатином или хлоридом кобальта.
Особенно предпочтительные комбинации включают в себя Es5 (4.65) и цисплатин, а также Es5 (4.65) и хлорид кобальта.
Соответственно, согласно еще одному аспекту, в настоящем изобретении предложена фармацевтическая композиция, включающая в себя комбинацию соединения Формулы I, такого как определено в данном контексте, с дополнительным терапевтическим агентом, предпочтительно, дополнительным терапевтическим агентом, таким как определен в данном контексте, для использования в способах лечения, таких как описаны в данном контексте.
Согласно одному из вариантов осуществления, в настоящем изобретении предложена композиция, включающая в себя Es5 (4.65) и цисплатин, для применения в способе лечения. Согласно другому варианту осуществления, в настоящем изобретении предложена композиция, включающая в себя Es5 (4.65) и хлорид кобальта, для использования в способе лечения, описанном в данном контексте.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Введение
Введение в условиях in vivo может осуществляться в виде одной дозы, постоянно или периодически (например, раздельными дозами через определенные интервалы времени) на всем протяжении курса лечения. Способы определения наиболее эффективных средств и определение доз для введения хорошо известны специалистам в данной области и будут изменяться в зависимости от композиции, используемой для лечения, назначения лечения, обрабатываемой клетки-мишени и субъекта, подлежащего лечению. Однократное или многократное введение может выполняться в соответствии с уровнем дозирования и схемой, которые выбирает лечащий врач.
Как правило, подходящая доза активного соединения составляет приблизительно от 100 мкг до 250 мг на кг массы тела субъекта в день. В случае если активное соединение представляет собой соль, сложный эфир, пролекарство или тому подобное, вводимое количество рассчитывают на основании исходного соединения и, соответственно, фактический вес, который будет использован, увеличивают пропорционально.
Экспериментальная часть
Материалы и методы

benzene - бензол
DCM - дихлорметан (англ. dichloromethane)
1,4-Диметокси-2-метилбензол 2 [1]

2,5-Диметокситолуол 1 (9,0 г, 59,21 ммоль) в диэтиловом эфире (90 см3) добавляли в перемешиваемый раствор однохлористого йода (10,17 г, 62,65 ммоль) в хлороформе (30 см3) в течение 30 минут. Смесь перемешивали в течение ночи, после чего добавляли 10% раствор тиосульфата натрия (150 см3). Органические фазы экстрагировали 2×75 см3 диэтилового эфира. Органические фракции объединяли, промывали насыщенным водным раствором NaHCO3 (150 см3), солевым раствором (100 см3), сушили (MgSO4) и сушили под вакуумом. Полученное в результате твердое вещество перекристаллизовывали из метанола и получали целевое соединение в виде твердого вещества 2 красного цвета (11,3 г, 69%).
Rf 0,52 (SiO2, гексан:ЕtOАс (этилацетат), 3:1).
Тпл. 80-82°С (литературные данные: 81-82°С (Reed et al., JACS, 120(38): 9729-9734, 1998)
1H ЯМР (400 МГц, CDCl3) 2,12(3Н, с, СН3), 3,72 (3Н, с, ОСН3), 3,75 (3Н, с, ОСН3), 6,60 (1Н, с, АrН), 7,10 (1Н, с, АrН) м.д..
3-(2,5-Диметокси-4-метилфенил)-проп-2-ин-1-ол 3 (Sato, J. Org. Chem., 66(1): 309-314, 2000)

В колбу с хлоридом бис(трифенилфосфин)палладия (151 мг, 0,215 ммоль) и йодидом меди (273 мг, 1,43 ммоль) добавляли раствор 1,4-диметокси-2-метилбензола 2 (2,0 г, 7,20 ммоль) в бензоле (40 см3). Смесь охлаждали до 0°С, после чего добавляли диэтиламин (5,19 см3, 50,35 ммоль) и пропаргиловый спирт (2,1 см3, 36,0 ммоль). Смесь перемешивали в течение ночи, затем гасили насыщенным раствором хлорида аммония (2 см3) и концентрировали в вакууме. После этого добавляли этилацетат (75 см3) и полученную смесь промывали солевым раствором (75 см3), сушили (MgSO4) и упаривали в вакууме. Продукт очищали при помощи колоночной хроматографии (силикагель, гексан:ЕtOАс (этилацетат), 3:1) и получали целевое соединение 3 в виде масла бледно-желтого цвета (1,33 г, 90%).
Rf 0.52 (SiO2, гексан:ЕtOАс, 1:1).
1Н ЯМР (400 МГц, CDCl3) 2,15 (3Н, с, СН3), 2,55 (1Н, ушир.с., ОН), 6,68 (3Н, с, ОСН3), 3,78 (3Н, с, ОСН3), 4,45 (2Н, с, СН2), 6,62 (1Н, с, АrН), 6,68 (1Н, с, АrН) м.д.
3-(2,5-Диметокси-4-метилфенил)-проп-2-иниловый эфир уксусной кислоты 4

В перемешиваемый раствор спирта (4,47 г, 21,69 ммоль) в дихлорметане (40 см3) добавляли триэтиламин (4,39 см3, 43,38 ммоль). Смесь охлаждали до 0°С, после чего по каплям прибавляли хлористый ацетил (2,55 см3, 32,48 ммоль). Смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Затем смесь гасили 1М HCl (15 см3), органический слой отделяли и промывали насыщенным водным раствором бикарбоната натрия (30 см3), солевым раствором (30 см3), сушили (MgSO4), упаривали в вакууме и получали целевое соединение в виде масла желтого цвета 4 (5,08 г, 94%).
Rf 0,61 (SiO2, гексан:ЕtOАс, 1:1).
1Н ЯМР (400 МГц, CDCl3) 2.08 (3Н, с, СН3), 2,18 (3Н, с, СН3), 3,72 (3Н, с, ОСН3), 3,80 (3Н, с, ОСН3), 4,90 (2Н, с, СН2), 6,62 (1Н, с, АrН), 6,78 (1Н, с, АrН) м.д.
3-(2,5-Диметокси-4-метилфенил)-пропиловый эфир уксусной кислоты 5

Алкин 3 (5,01 г, 20,2 ммоль) растворяли в метаноле (100 см3) и добавляли Pd/C (100 мг). Реакционную колбу продували газообразным водородом и перемешивали в течение ночи. Смесь фильтровали через целит, растворитель удаляли в вакууме и получали целевое соединение 5 в виде масла коричневого цвета (4,98 г, 98%).
Rf 0,36 (SiO2, гексан:ЕtOАс, 1:1).
1Н ЯМР (400 МГц, CDCl3) 1,98 (2Н, м, СН2), 2,10 (3Н, с, СН3), 2,24 (3Н, с, СН3), 2,68 (2Н, м, СН2), 3,82 (3Н, с, ОСН3), 3,86 (3Н, с, ОСН3), 4,15 (2Н, м, СН2), 6,66 (1Н, с, АrН), 6,70 (1Н, с, АrН) м.д.
13С ЯМР (400 МГц, CDCl3) 14,1, 16,1, 21,0, 26,7, 28,9, 32,3, 55,9, 56,1, 64,3, 112,8, 113,8, 124,9, 127,4, 151,2, 151,4, 171,22.
3-(4-Метил-3,6-диохоциклогекса-1,4-диенил)-пропиловый эфир уксусной кислоты 6

К раствору соединения 5 (1.26 г, 4,99 ммоль) в ацетонитриле (15 см3) по каплям прибавляли нитрат аммония-церия (5,50 г, 9,99 ммоль) в воде (10 см3). Смесь перемешивали в течение 1 ч, после чего органические фазы экстрагировали дихлорметаном (3×25 см3), промывали солевым раствором (25 см3), сушили (MgSO4) и концентрировали в вакууме, в результате получали целевое соединение в виде масла коричневого цвета 6 (756 мг, 68%).
Rf 0,69 (SiO2, гексан:ЕtOАс, 1:1).
1Н ЯМР (400 МГц, CDCl3)
3-(2,5-Бис-азиридин-1-ил-4-метил-3,6-диохоциклогекса-1,4-диенил)-пропиловый эфир уксусной кислоты 7

Хинон 6 (756 мг, 3,40 ммоль) растворяли в этаноле (15 см3), охлаждали до 0°С и по каплям прибавляли азиридин (0,50 см3, 11,6 ммоль). Смесь перемешивали в течение 1 часа при температуре 0°С, после чего оставляли в холодильнике на 72 ч. Растворитель отделяли в вакууме. Твердое вещество красного цвета растирали в диэтиловом эфире и сушили. Твердое вещество красного цвета дополнительно очищали при помощи колоночной хроматографии (силикагель, гексан:ЕtOАс, 1:1) и получали целевое соединение 7 в виде твердого вещества красного цвета (98 мг, 9%).
Rf 0,52 (SiO2, гексан:ЕtOАс, 1:1).
1Н ЯМР (400 МГц, CDCl3)
Синтез соединений сравнения
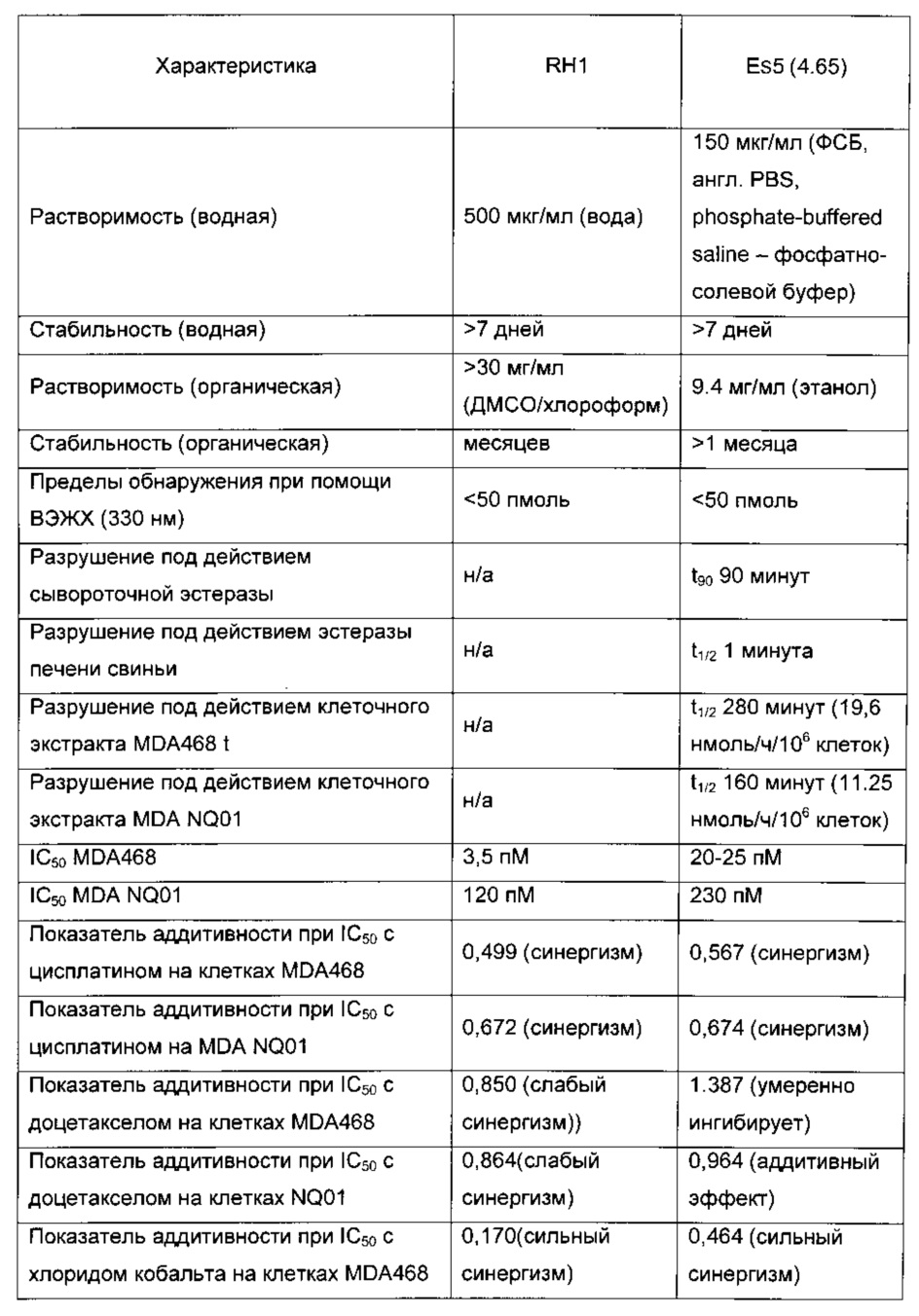
RH1, MeDZQ и все сложные эфиры синтезировали в соответствии с методиками известного уровня техники (лаборатории Kidscan) и готовили для тестирования в виде маточных растворов с концентрацией 10 мМ в ДМСО (англ. DMSO). В Таблице 1 представлены структуры некоторых сложных эфиров и их период полувыведения в трис-буферном растворе, в дополнение к их величинам IC50 на клеточных линиях MDA 468 и MDA NQ01.
Испытания на стабильность
Стабильность сложных эфиров и продуктов их гидролиза определяли в растворе (50 мкМ Es5 в трис-буферном растворе (0,1 моль/дм3) при рН 7,4). Образцы отбирали с временными интервалами в 24 часа и анализировали методом ВЭЖХ (англ. HPLC high-performance liquid chromatography - высокоэффективная жидкостная хроматография). Длина волны измерения соответствовала 330 нм. Хроматографический анализ проводили при изократическом элюировании 30:70 МеОН:трис-буферный раствор (0,1 моль/дм3, рН 7,4) со скоростью 1 мл/мин. Хроматографическое разделение лекарственного средства достигали с помощью колонки Hypersil ODS 250 мм×4,6 мм внутренний диаметр.



Испытания на селективность
Соединения настоящего изобретения, такие как Es5 и 4-61, проявили высокую селективность в отношении клеток, экспрессирующих DT-диафоразу. Было установлено, что селективность превысила величину, показанную RH1. Величины IC50 измеряли при помощи МТТ-теста.
В Таблице 2 представлен обзор величин IC50 для различных лекарственных средств, испытанных на клетках MDA483 и NQ01. Данные наглядно показывают, что Es5 проявляет достаточно высокую селективность в отношении клеток, экспрессирующих DT-диафоразу, по сравнению с другими противоопухолевыми средствами. Для сравнения, для клеток MDA468 и NQ01 разница в случае Es5 составляет более 80 раз по сравнению с приблизительно 5-кратной разницей в случае митомицина С и более чем 30-кратной для RH1. Продукт гидролиза 4-61 соединения Es5 также показывает достаточно высокую селективность и имеет величину IС50 0,41 нМ на клетках MDA NQ01 и 16,97 нМ на клетках MDA 468, и, соответственно, коэффициент увеличения DT диафоразы 41.

Активация Es5
Исследовали распад Es5 под действием эстеразы и клеточных экстрактов и ее активацию. Es5 стабилен в водных буферных растворах, но подвергался медленному гидролизу в сыворотке (t1/2=100 минут). Опыты с эстеразой свиньи показали, что она быстро разрушала Es5 до его продукта гидролиза, этот результат был повторен при использовании экстрактов мозга свиньи. Клеточные экстракты из клеточной линии MDA468 NQ01, экспрессирующей DT-диафоразу, быстро разрушали сложный эфир, тогда как экстракт клеточной линии MDA 468 с нулевой DT-диафоразой делал это со значительно меньшей скоростью, что свидетельствует о том, что активация, вероятно, будет выше в клетках или опухолях, экспрессирующих DT-диафоразу.
Как упоминалось выше, большинство сложных эфиров RH1 были чрезвычайно нестабильны в водном растворе и гидролизовались до RH1 в течение 30 минут. Скорости были таковы, что кинетику реакции оказалось невозможно определить методом ВЭЖХ. Es5 был значительно более стабильным, что отражено в приведенных выше таблицах.
Профиль стабильности Es5, измеренный в трис-буферном растворе (0,1 моль/дм3, рН 7,0), среде RPMI (рН 7,0) и сыворотке при комнатной температуре, показал убыль Es5 одновременно с приростом спирта 4.61 в сыворотке в течение одинакового промежутка времени.
Реакция клеточного лизата
Изучали разрушение Es5 под действием эстераз из клеточного лизата двух клеточных линий MDA NQ01 и MDA468. Es5 был нестабилен в экстракте клеточной линии MDA NQ01 и разрушался до спирта 4.61, показывая период полувыведения приблизительно 160 минут при комнатной температуре. В клеточной линии MDA468 с нулевой DTD разрушение исходной молекулы до ее спирта протекало с существенно более низкой скоростью.
Апоптоз
Индукцию апоптоза, вызванного соединениями настоящего изобретения, определяли на основании способа, описанного в работе Martin et al. (Journal of Experimental Medicine. 182, 1545-1556, 1995). Апоптоз, измерявшийся при помощи связывания аннексина V, показал, что в клетках, экспрессирующих DT-диафоразу, индукция запрограммированной гибели клеток происходит в течение 2 часов, тогда как в клетках MDA 468 с нулевой DT-диафоразой за это же время не наблюдается никакой гибели. Сниженный уровень апоптоза был отмечен в этой клеточной линии по истечении 4 часов. Это указывает на различающееся влияние Es5 на клетки, экспрессирующие и неэкспрессирующие DT-диафоразу.
Повреждение ДНК
Повреждение ДНК определяли при помощи кометного анализа (метода ДНК-комет) для оценки влияния Es5 на интенсивность головы и хвоста «кометы» после обработки клеточных линий MDA468NQ01 и клеточных линий MDA468 с нулевой DT-диафоразой. Эти опыты в случае обеих клеточных линий показали, что добавление Н2O2 вызывает разрывы нитей ДНК, приводя к увеличенной аккумуляции ДНК в хвосте кометы по сравнению с головой. В клеточной линии, экспрессирующей DT-диафоразу (NQ01), обработка 10 нМ Es5 в течение 2 часов приводила к увеличению доли ДНК в голове кометы по сравнению с обработкой одной только Н2O2. Это указывает на то, что ДНК поперечно сшивается Es5. В клеточной линии, лишенной DT-диафоразы, обработка Es5 не приводила к уменьшению интенсивности хвоста кометы, указывая на то, что в отсутствии активации DT-диафоразой Es5 не является ДНК-сшивающим агентом, в этом заключается предложенный механизм действия Es5. После 6 часов инкубации были получены доказательства перекрестного сшивания в клеточной линии с нулевой DT-диафоразой. Не желая быть связанными соответствием какой-либо конкретной теории, авторы изобретения полагают, что это должно являться результатом действия другого механизма, такого как двукратное одноэлектронное восстановление, а не двухэлектронное восстановление, имеющее место в случае DT-диафоразы.
Сравнение Es5 и RH1
В Таблице 3 показано сравнение характеристик Es5 (4.65) и RH1 и представлены их показатели аддитивности с цисплатином, доцетакселом, хлоридом кобальта, эпирубицином, Ara-С и митомицином С. Для сравнения, показатель аддитивности при IC50 ММС и хлорида кобальта составляет 0,443 в клетках MDA468 и 0,239 в клетках NQ01. Как можно видеть из Таблицы 3, комбинация Es5 и цисплатина демонстрирует синергический эффект в случае обеих клеточных линий, а комбинация Es5 и хлорида кобальта демонстрирует сильный синергический эффект в обеих клеточных линиях. Комбинация Es5 и доцетаксела показывает аддитивный эффект в отношении NQ01, в то же время проявляя умеренный ингибирующий эффект в отношении MDA468, тогда как комбинация Es5 и митомицина С показывает аддитивный эффект в отношении NQ01 и слабый антагонизм в отношении MDA468.



Эффективность Es5 in vivo
Активность Es5 (4.65) in vivo оценивали в отношении 3 клеточных линий злокачественных новообразований Н460, MDA-MB-468-NQ01 и MDA-MB-468-MOCK, используя in vivo анализ с помощью полых волокон (англ. HFA, hollow fibre assay), с волокнами, имплантированными в двух местах - внутрибрюшинно (в/б) и подкожно (п/к). Es5 и контрольный агент доксорубицин вводили в виде многократных доз при помощи внутрибрюшинной инъекции (в/б) через 3, 4, 5 и 6 дней по 0,5 мг/кг/день и 2,5 мг/кг/день, соответственно.
Es5 (4.65) продемонстрировал значительную эффективность (р<0,01) в том, что касается клеточного выживания по сравнению с необработанным контрольным опытом на всех 3 клеточных линиях, где волокна были имплантированы в/б, и на Н460, где волокна были имплантированы п/к. Эти результаты были аналогичны результатам, полученным для стандартного контрольного агента доксорубицина, указывая на то, что данное соединение перспективно в качестве противоопухолевого средства.
Материалы и методы
Es5 (4.65) растворяли в физиологическом солевом растворе при помощи произвольного встряхивания.
Клеточные линии. Для анализа были выбраны три клеточные линии опухолей человека: Н460 NSCLC (из ICT) и две линии карциномы молочной железы MDA-MB-468-NQ01 и MDA-MB-468-MOCK (обе предоставлены Onco-NX). Клетки культивировали в питательной среде для культур клеток RPMI 1640 с добавлением 1 мМ пирувата натрия, 2 мМ L-глутамина и 10% эмбриональной бычьей сыворотки (все из компании Sigma), и сохраняли в виде монослойных культур при температуре 37°С в увлажненной среде, содержащей 5% СO2.
Животные. Использовали самок иммунодефицитных бестимусных белых мышей популяции Balb/C возрастом 6-8 недель (Harlan UK, Blackthorn, UK). Мышей содержали в клетках-камерах, размещенных в изолированных боксах в помещении с кондиционированием воздуха с постоянными чередующимися циклами света и темноты. Они получали питание Teklad 2018 (Harlan, Blackthorn, UK) и воду ad libitum (неограниченно). Все процедуры с животными проводили по лицензии, выданной МВД Великобритании (англ. UK Home Office), и во всех отношениях следовали основным положениям UKCCCR (United Kingdom Coordinating Committee for Cancer Research - Координационная комиссия Соединенного Королевства по исследованиям в области онкологии).
Анализ с использованием полых волокон
Клетки были помещены в стерилизованные цветокодированные полые волокна (ПВ (англ. HF)) PVDF Spectra/Роr (Spectrum Medical Inc, Хьюстон, Техас, США). В течение короткого периода времени клетки отбирали для анализа и ресуспендировали в среде для выращивания культур клеток при требуемой плотности клеток. Полученный препарат затем загружали в ПВ, концы зажимали и запаивали. После этого ПВ нарезали на куски длиной 1,5 см, которые снова запаивали с обоих концов, и затем переносили в 6-луночные планшеты, содержащие среду перед имплантацией для опытов in vivo, или инкубировали при температуре 37°С во влажной среде, содержащей 5% СO2, в течение различного времени перед обработкой, используя модифицированный МТТ-тест, как описано ниже.
Для опытов in vivo, проводимых под кратким ингаляционным наркозом (2% изофлуран), по одному нагруженному полому волокну для каждой из клеточных линий трансплантировали внутрибрюшинно или подкожно в дорсальную боковую поверхность каждой мыши, и мышей возвращали обратно. Каждая группа состояла из 6 мышей, день имплантации был помечен как «день 0».
Для оценки терапевтического ответа Es5 (4.65) на 3, 4, 5 и 6 день мышей обрабатывали Es5 (4.65) 0,5 мг/кг/день или доксорубицином 2,5 мг/кг/день.
Мышей выводили из эксперимента на 7 день после имплантации, волокна извлекали и анализировали клеточное выживание с помощью модифицированного МТТ-теста, сравнивая показатели поглощения, наблюдаемые для обработанных групп, с соответствующей необработанной контрольной группой. Статистический анализ выполняли, используя критерий Стьюдента.
Результаты
На Фиг. 1 и 2 показаны результаты, полученные при проведении исследований, сданными, выраженными в виде клеточного выживания в процентах, по сравнению с соответствующим п/к или в/б необработанным контрольным опытом. На Фиг. 1 представлены данные, сгруппированные для каждой клеточной линии, а на Фиг. 2 приведены данные для каждой обработки.
Es5 продемонстрировал значительную эффективность (р<0,01) в том, что касается клеточного выживания, по сравнению с необработанным контрольным опытом на всех 3 клеточных линиях, где волокна были имплантированы в/б, и на Н460, где волокна были имплантированы п/к. Эти результаты были аналогичны результатам, полученным для стандартного контрольного агента доксорубицина, хотя этот агент не показал существенной эффективности в отношении какой-либо из клеточных линий при п/к введении.
Es5 также продемонстрировал улучшенную эффективность на экспрессирующих клетках NQ01 по сравнению с клеточной линией Mock MDA-MB-468, при этом было небольшое отличие, наблюдаемое для доксорубицина.
Все документы, раскрытые в данном контексте, явным образом полностью включены в настоящий документ посредством ссылок.
Реферат
Изобретение относится к соединениям хинона, которые обладают противоопухолевой активностью, и могут найти применение для лечения рака. Также описаны композиции, содержащие такие соединения, их применение для лечения рака. 4 н. и 35 з.п. ф-лы, 2 ил., 3 табл.
Формула


Документы, цитированные в отчёте о поиске
Внутрипузырное введение апазиквона после трансуретральной резекции при лечении рака

Комментарии