Антитело к notch4 человека - RU2720280C2
Код документа: RU2720280C2
Чертежи





Описание
Область техники
[0001]
Настоящее изобретение относится к антителу, которое связывается с Notch4 человека.
Уровень техники
[0002]
Notch представляет собой молекулу, которая участвует в определении пути клеток различных тканей и, как указывают, вовлекается, например, в дифференцировку, пролиферацию и выживаемость на протяжении каждой стадии из стадии раннего развития, эмбриональной стадии, и после рождения. Четыре типа рецепторов, в том числе Notch1, Notch2, Notch3 и Notch4, а также пять типов лигандов, в том числе Jagged1, Jagged2, DLL1, DLL3 и DLL4, представляют семейство Notch. Если рецептор Notch, экспрессируемый на соседней клетке, связывается с лигандом Notch, домен NRR, присутствующий в нижнем внеклеточном домене рецептора, расщепляется с помощью TACE, и из-за структурного изменения внутриклеточного домена, вызванного таким образом, внутриклеточный домен расщепляется γ-секретазой. Внутриклеточный (NIC) домен Notch, образовавшийся в результате, переносится в ядро, образует гетеродимер с фактором транскрипции CSL, и целевые молекулы, такие как представители семейства aHes или семейства Hey, индуцируются и экспрессируются. Эти молекулы по направлению передачи сигнала далее индуцируют и экспрессируют различные гены, и в результате сигнал Notch способствует, например, поддержанию стволовых клеток или клеток-предшественников, дифференцировке, остановке клеточного цикла и определению пути клеток (непатентная литература 1).
[0003]
Также известно, что Notch вовлечен в образование опухолей. О мутации Notch1 вследствие хромосомной транслокации t(7;9) впервые сообщали как о связанной с возникновением острого лимфобластного лейкоза из предшественников Т-клеток (T-ALL). Более того, сайтом инсерции в геноме вируса опухоли молочной железы мышей (MMTV), который является моделью возникновения спонтанной опухоли, как сообщается, является Int3 (внутриклеточный домен Notch4), а также сообщается, что рак эпителиальных клеток, такой как рак молочной железы или рак слюнной железы, индуцируется у трансгенной мыши, если Int3 характеризовался высоким уровнем экспрессии (непатентная литература 2). Также сообщалось, что Notch4 связан с онкогенезом, прогрессированием рака молочной железы (непатентная литература 3), меланомы (непатентная литература 4), рака желудка (непатентная литература 5), B-клеточного острого лимфоцитарного лейкоза (B-ALL) (непатентная литература 6), хронического лимфоцитарного лейкоза (CLL) (непатентная литература 7), глиомы (непатентная литература 8), гепатоцеллюлярной карциномы (непатентная литература 9), рака легкого (непатентная литература 10), рака почки (непатентная литература 11), саркомы Капоши (непатентная литература 12) или с образованием метастазов при данных типах рака и т. п. у людей.
[0004]
Сигнал Notch также способствует внутриопухолевой неоваскуляризации. Notch1 и Notch4 экспрессируются в качестве рецепторов Notch в васкулярных эндотелиальных клетках, и подтверждается экспрессия DLL4 и Jagged1 как лигандов. Ведущие клетки, находящиеся в самом начале отростков новых кровеносных сосудов, в высокой степени экспрессируют DDL4 со стимуляцией VEGF, и кровеносные сосуды удлиняются путем передачи сигнала на рецептор Notch соседней ведомой клетке. С другой стороны, Jagged1 конкурирует с DLL4 за рецептор Notch и ингибирует связывание DLL4 с рецептором Notch. Поскольку сигнал от Jagged1 является слабым по сравнению с таковым сигналом от DLL4, сигнал Notch подавляется путем связывания с Jagged1. Интенсивность сигнала Notch регулируется пространственно различающимися паттернами экспрессии этих двух лигандов для контроля неоваскуляризации (непатентная литература 13).
[0005]
Сообщалось о продуцировании ингибиторного антитела DLL4, при котором, если сигнал от DLL4 ингибируется ингибиторным антителом к DLL4, то незрелый ангиогенез в отсутствии кровотока усиливается внутри опухоли и индуцируется ингибирование пролиферации опухоли. Это совершенно другое явление, когда ингибитор VEGF ингибирует пролиферацию васкулярных эндотелиальных клеток для подавления ангиогенеза, и сигнал Notch привлекает внимание как новая мишень для ингибиторов неоваскуляризации (непатентная литература 14).
Список цитируемой литературы
[0006]
[Непатентная литература 1] Radtke et al. (2004), Nature Immunology 5,247-53.
[Непатентная литература 2] Jhappan et al. (1992), Genes Dev. 6,345-55
[Непатентная литература 3] Nagamatsu et al. (2014), Anticancer Res. 34, 69-80
[Непатентная литература 4] Hardy et al. (2010), Cancer Res. 70, 10340-50
[Непатентная литература 5] Qian et al. (2015), Mol Cell Biochem. 401, 165-74
[Непатентная литература 6] Nwabo Kamdje et al. (2011), Blood 118, 380-9
[Непатентная литература 7] Nwabo Kamdje et al. (2012), Blood Cancer Journal 2, e73
[Непатентная литература 8] Dell'Albani et al. (2012), Neuro-Oncology 16, 204-16
[Непатентная литература 9] Ahn et al. (2013), Hepatobiliary Pancreat Dis Int. 12, 286-94
[Непатентная литература 10] Justilien et al. (2012), PLoS ONE 7, e35040
[Непатентная литература 11] Boo et al. (2009), J Pediatr Surg. 44, 2031-6
[Непатентная литература 12] Curry et al. (2005), Oncogene 24, 6333-44
[Непатентная литература 13] Benedito et al. (2009), Cell 137, 1124-35
[Непатентная литература 14] Ridgway et al. (2006), Nature 444, 1083-7
Краткое описание изобретения
Задачи, решаемые с помощью настоящего изобретения
[0007]
Целью настоящего изобретения является обеспечение антитела к Notch4 человека или его фрагмента, связывающего Notch4, которые могут обладать нейтрализующей активностью в отношении Notch4 человека, а также фармацевтической композиции, содержащей их в качестве активного ингредиента.
Средства для решения задач
[0008]
В результате обширного исследования для решения вышеупомянутых задач авторы настоящего изобретения успешно получили мышиное антитело к Notch4 человека, которое обладает высокой нейтрализующей активностью и аффинностью связывания в отношении Notch4 человека. Более того, путем определения последовательности участка (CDR), определяющего комплементарность, указанного мышиного антитела к Notch4 человека авторы настоящего изобретения смогли получить гуманизированное антитело, содержащее вариабельный участок тяжелой и легкой цепей, а также последовательность CDR указанного мышиного антитела к Notch4 человека для осуществления настоящего изобретения.
[0009]
Другими словами, согласно одному варианту осуществления настоящее изобретение относится к следующим изобретениям.
(1) Антитело к Notch4 или его фрагмент, связывающий Notch4, содержащие:
(a) CDR 1 тяжелой цепи, содержащий аминокислотную последовательности под SEQ ID NO: 15 или 16;
(b) CDR 2 тяжелой цепи, содержащий аминокислотную последовательности под SEQ ID NO: 17 или 18;
(c) CDR 3 тяжелой цепи, содержащий аминокислотную последовательности под SEQ ID NO: 19;
(d) CDR 1 легкой цепи, содержащий аминокислотную последовательности под SEQ ID NO: 20;
(e) CDR 2 легкой цепи, содержащий аминокислотную последовательности под SEQ ID NO: 21; и
(f) CDR 3 легкой цепи, содержащий аминокислотную последовательности под SEQ ID NO: 22.
[0010]
(2) Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (1), где указанное антитело или его фрагмент, связывающий Notch4, содержат тяжелую и легкую цепи и выбраны из любого из следующих (i) - (vii):
(i) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45,
(ii) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45,
(iii) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 47,
(iv) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 49,
(v) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 51,
(vi) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 39, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45, и
(vii) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 47.
[0011]
(3) Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (2), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45.
[0012]
(4) Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (2), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45.
[0013]
(5) Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (2), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 47.
[0014]
(6) Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (2), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 49.
[0015]
(7) Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (2), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 51.
[0016]
(8) Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (2), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 39, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45.
[0017]
(9) Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (2), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 47.
[0018]
(10) Антитело или его фрагмент, связывающий Notch4, по любому из пунктов (1) - (9), где константный участок указанной тяжелой цепи и константный участок указанной легкой цепи содержат последовательность, полученную из человеческого антитела.
[0019]
(11) Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (10), где константный участок тяжелой цепи предусматривает константный участок человеческого IgG.
[0020]
(12) Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (11), где указанный константный участок человеческого IgG представляет собой константный участок человеческого IgG2.
[0021]
(13) Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (12), где указанное константный участок человеческого IgG2 имеет мутацию V234A и/или G237A.
[0022]
(14) Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (10), где остаток лизина на карбоксильном конце константного участка указанной тяжелой цепи удален искусственным путем.
[0023]
(15) Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (10), где константный участок указанной легкой цепи предусматривает константный участок человеческого Igκ.
[0024]
(16) Фармацевтическая композиция, содержащая антитело к Notch4 или его фрагмент, связывающий Notch4, по любому из пунктов (1) - (15).
[0025]
(17) Фармацевтическая композиция по пункту (16), которая дополнительно содержит фармацевтически приемлемый носитель.
[0026]
(18) Фармацевтическая композиция по пункту (17), которая применяется для лечения немелкоклеточного рака легкого.
[0027]
(19) Фармацевтическая композиция по пункту (17), которая применяется для лечения рака щитовидной железы.
[0028]
(20) Фармацевтическая композиция по пункту (17), которая применяется для лечения рака предстательной железы.
[0029]
(21) Фармацевтическая композиция по пункту (17), которая применяется для лечения гепатоцеллюлярной карциномы.
[0030]
Согласно другим вариантам осуществления настоящее изобретение также относится к следующим изобретениям.
(1) Антитело к Notch4 или его фрагмент, связывающий Notch4, где указанное антитело или его фрагмент, связывающий Notch4, содержат тяжелую и легкую цепи и выбраны из любого из следующих (i) - (vii):
(i) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45,
(ii) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45,
(iii) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 47,
(iv) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 49,
(v) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 51,
(vi) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 39, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45, и
(vii) антитела, в котором вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 47.
[0031]
(2') Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (1'), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45.
[0032]
(3') Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (1'), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45.
[0033]
(4') Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (1'), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 47.
[0034]
(5') Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (1'), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 49.
[0035]
(6') Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (1'), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 51.
[0036]
(7') Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (1'), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 39, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45.
[0037]
(8') Антитело к Notch4 или его фрагмент, связывающий Notch4, по пункту (1'), где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 47.
[0038]
(9') Антитело или его фрагмент, связывающий Notch4, по любому из пунктов (1') - (8'), где константный участок указанной тяжелой цепи и константный участок указанной легкой цепи содержат последовательность, полученную из человеческого антитела.
[0039]
(10') Антитело или его фрагмент, связывающий Notch4, по пункту (9'), где константный участок тяжелой цепи предусматривает константный участок человеческого IgG.
[0040]
(11') Антитело или его фрагмент, связывающий Notch4, по пункту (10'), где указанный константный участок человеческого IgG представляет собой константный участок человеческого IgG2.
[0041]
(12') Антитело или его фрагмент, связывающий Notch4, по пункту (11'), где указанное константный участок человеческого IgG2 имеет мутацию V234A и/или G237A.
[0042]
(13') Антитело или его фрагмент, связывающий Notch4, по пункту (9'), где остаток лизина на карбоксильном конце константного участка указанной тяжелой цепи удален искусственным путем.
[0043]
(14') Антитело или его фрагмент, связывающий Notch4, по пункту (9'), где константный участок указанной легкой цепи предусматривает константный участок человеческого Igκ.
[0044]
(15') Фармацевтическая композиция, содержащая антитело к Notch4 или его фрагмент, связывающий Notch4, по любому из пунктов (1') - (14').
[0045]
(16') Фармацевтическая композиция по пункту (15'), которая дополнительно содержит фармацевтически приемлемый носитель.
[0046]
(17') Фармацевтическая композиция по пункту (16'), которая применяется для лечения немелкоклеточного рака легкого.
[0047]
(18') Фармацевтическая композиция по пункту (16'), которая применяется для лечения рака щитовидной железы.
[0048]
(19') Фармацевтическая композиция по пункту (16'), которая применяется для лечения рака предстательной железы.
[0049]
(20') Фармацевтическая композиция по пункту (16'), которая применяется для лечения гепатоцеллюлярной карциномы.
[0050]
Согласно другим вариантам осуществления настоящее изобретение, кроме того, относится к следующим изобретениям.
(1'') Антитело к Notch4 или его фрагмент, связывающий Notch4, где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45.
[0051]
(2'') Антитело к Notch4 или его фрагмент, связывающий Notch4, где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45.
[0052]
(3'') Антитело к Notch4 или его фрагмент, связывающий Notch4, где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 47.
[0053]
(4'') Антитело к Notch4 или его фрагмент, связывающий Notch4, где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 49.
[0054]
(5'') Антитело к Notch4 или его фрагмент, связывающий Notch4, где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 33, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 51.
[0055]
(6'') Антитело к Notch4 или его фрагмент, связывающий Notch4, где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 39, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 45.
[0056]
(7'') Антитело к Notch4 или его фрагмент, связывающий Notch4, где указанное антитело или его фрагмент, связывающий Notch4, содержит тяжелую и легкую цепи, и вариабельный участок указанной тяжелой цепи содержит аминокислотную последовательность под SEQ ID NO. 35, а вариабельный участок указанной легкой цепи содержит аминокислотную последовательность под SEQ ID NO. 47.
[0057]
(8'') Антитело или его фрагмент, связывающий Notch4, по любому из пунктов (1'') - (7''), где константный участок указанной тяжелой цепи и константный участок указанной легкой цепи содержат последовательность, полученную из человеческого антитела.
[0058]
(9'') Антитело или его фрагмент, связывающий Notch4, по пункту (8''), где константный участок тяжелой цепи предусматривает константный участок человеческого IgG.
[0059]
(10'') Антитело или его фрагмент, связывающий Notch4, по пункту (9''), где указанный константный участок человеческого IgG представляет собой константный участок человеческого IgG2.
[0060]
(11'') Антитело или его фрагмент, связывающий Notch4, по пункту (10''), где указанное константный участок человеческого IgG2 имеет мутацию V234A и/или G237A.
[0061]
(12'') Антитело или его фрагмент, связывающий Notch4, по пункту (10''), где остаток лизина на карбоксильном конце константного участка указанной тяжелой цепи удален искусственным путем.
[0062]
(13'') Антитело или его фрагмент, связывающий Notch4, по пункту (8''), где константный участок указанной легкой цепи предусматривает константный участок человеческого Igκ.
[0063]
(14'') Фармацевтическая композиция, содержащая антитело к Notch4 или его фрагмент, связывающий Notch4, по любому из пунктов (1'') - (13'').
[0064]
(15'') Фармацевтическая композиция по пункту (14''), которая дополнительно содержит фармацевтически приемлемый носитель.
[0065]
(16'') Фармацевтическая композиция по пункту (15''), которая применяется для лечения немелкоклеточного рака легкого.
[0066]
(17'') Фармацевтическая композиция по пункту (15''), которая применяется для лечения рака щитовидной железы.
[0067]
(18'') Фармацевтическая композиция по пункту (15''), которая применяется для лечения рака предстательной железы.
[0068]
(19'') Фармацевтическая композиция по пункту (15''), которая применяется для лечения гепатоцеллюлярной карциномы.
[0069]
Изобретение с любой комбинацией одной или нескольких характеристик по настоящему изобретению, перечисленных выше, также охватывается объемом настоящего изобретения.
Краткое описание графических материалов
[0070]
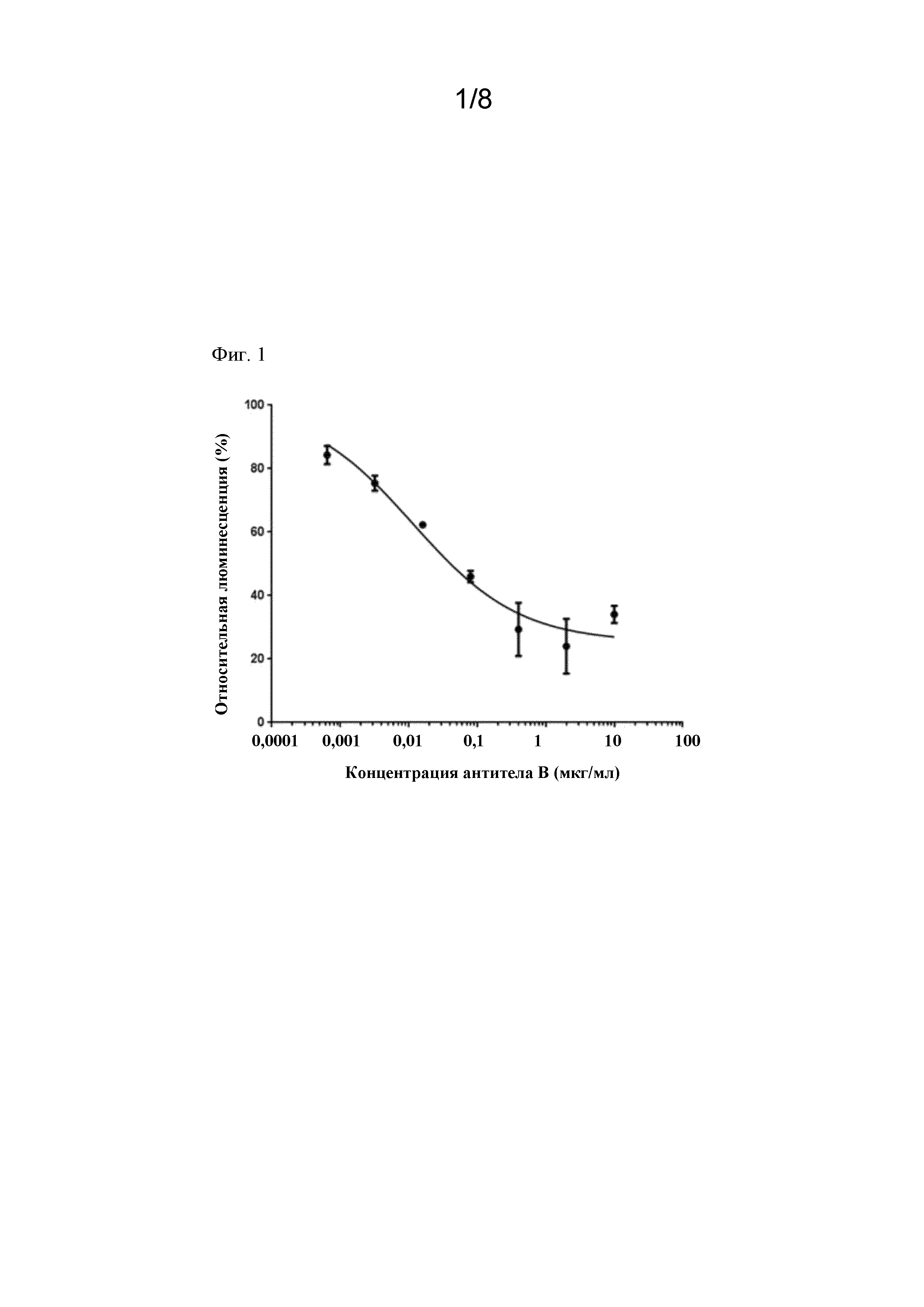
На фигуре 1 показана взаимосвязь концентрации антитела B и значения относительной люминесценции (%).
На фигуре 2 показан противоопухолевый эффект и эффект подавления перфузии крови антителом B на ксенотрансплантатной модели Calu6. На фигуре 2A показано изменение относительного объема опухоли (RTV) для каждой группы с введением в хвостовую вену IgG в дозе 10 мг/кг для контроля или антитела B в дозе 1, 3 или 10 мг/кг на ксенотрансплантатной модели Calu6 (N=8, среднее±стандартная погрешность). На фигуре 2B показан результат определения площади флуоресценции Hoechst для опухолей, отобранных в конце теста с введением (день 8) (N=8, среднее±стандартная погрешность) (*P < 0,05 против контрольной группы с введением IgG (критерий Даннета)).
На фигуре 3 показан противоопухолевый эффект комбинированного применения антитела B и цисплатина на мышиной модели подкожной трансплантации Calu6. Изменение относительного объема опухоли (RTV) в контрольной (не получавшей лечение) группе, группе с введением антитела B (с введением дважды в неделю в хвостовую вену), группе с введением цисплатина (с однократным введением в хвостовую вену) и группе с комбинированным введением антитела B (с введением дважды в неделю в хвостовую вену)+цисплатин (однократное введение в хвостовую вену) (N=4, среднее стандартная±погрешность) (*: P < 0,05 против контрольной группы (t-критерий Стьюдента, день 8, день 24), #: P < 0,05 группа с введением 10 мг/кг цисплатина против группы с комбинированным введением антитело B+цисплатин (t-критерий Стьюдента, день 36)).
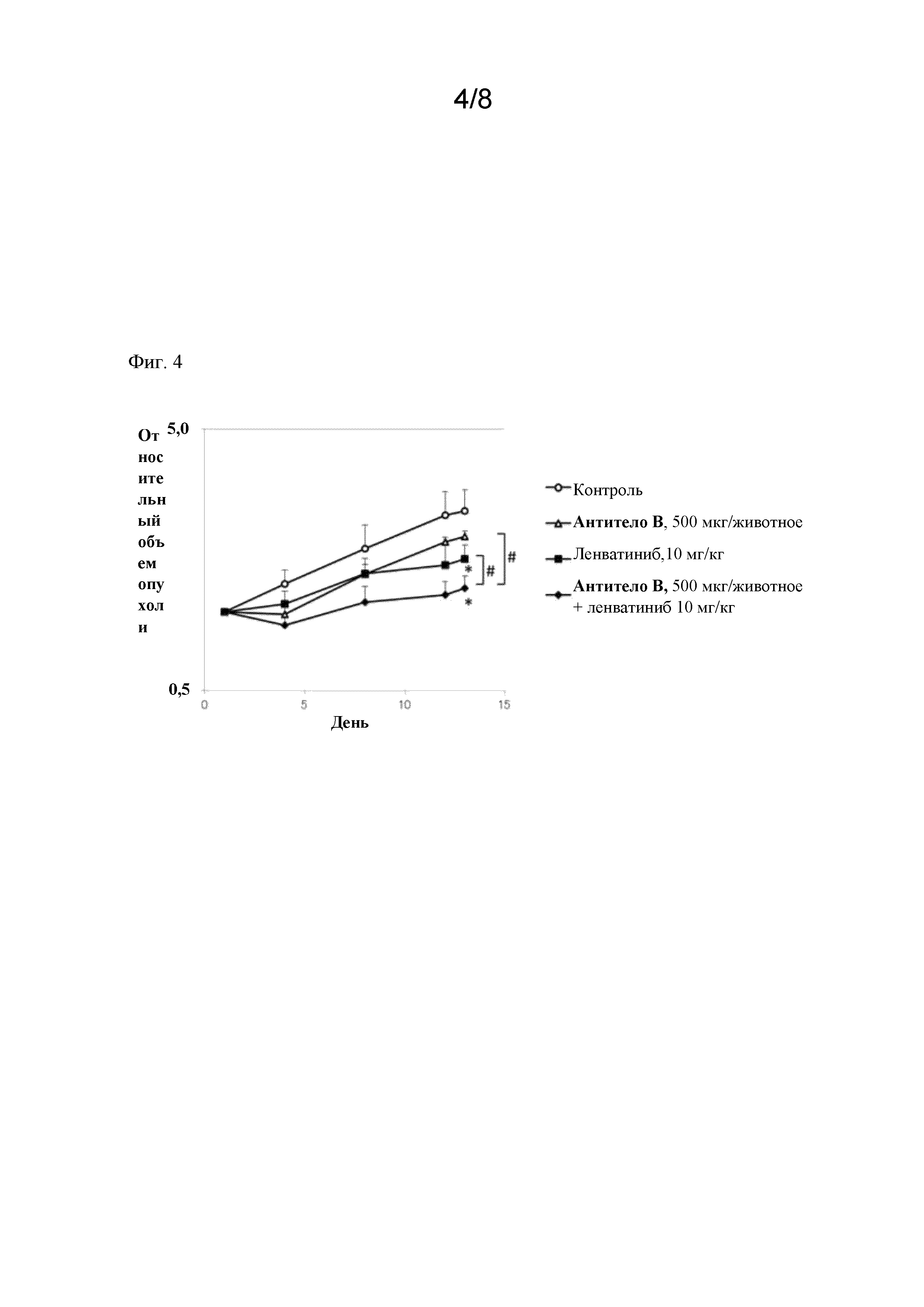
На фигуре 4 показан противоопухолевый эффект, обусловленный комбинированным применением антитела B и ленватиниба мезилата на ксенотрансплантатной модели клеточной линии рака щитовидной железы FTC238 человека. Изменение относительного объема опухоли (RTV) (N=5, среднее±стандартная погрешность) в контрольной (не получавшей лечение) группе, группе с введением антитела B (с введением дважды в неделю в хвостовую вену), группе с введением ленватиниба мезилата (с пероральным введением один раз в сутки) и группе с комбинированным введением антитело B (с введением дважды в неделю в хвостовую вену)+ленватиниба мезилат (с пероральным введением один раз в сутки) (*: P < 0,05 против контрольной группы (t-критерий Стьюдента, день 13), #: P < 0,05 группа с введением одного средства против группы с комбинированным введением антитело B+ленватиниба мезилат (t-критерий Стьюдента, день 13)).
На фигуре 5 показан противоопухолевый эффект комбинированного применения антитела B и паклитаксела на ксенотрансплантатной модели клеточной линии рака предстательной железы DU145 человека. Изменение объема опухоли (TV) в контрольной (не получавшей лечение) группе, группе с введением антитела B (с введением дважды в неделю в хвостовую вену), группе с введением паклитаксела (c введением один раз в сутки в течение 5 суток в хвостовую вену) и группе с комбинированным введением антитело В (введение дважды в неделю в хвостовую вену)+паклитаксел (c введением один раз в сутки в течение 5 суток в хвостовую вену) (N=4, среднее±стандартная погрешность) (*: P < 0,05 против контрольной группы (t-критерий Стьюдента, день 57)), #: P < 0,05 группа с введением одного средства против группы с комбинированным введением антитело B+паклитаксел (t-критерий Стьюдента, день 57).
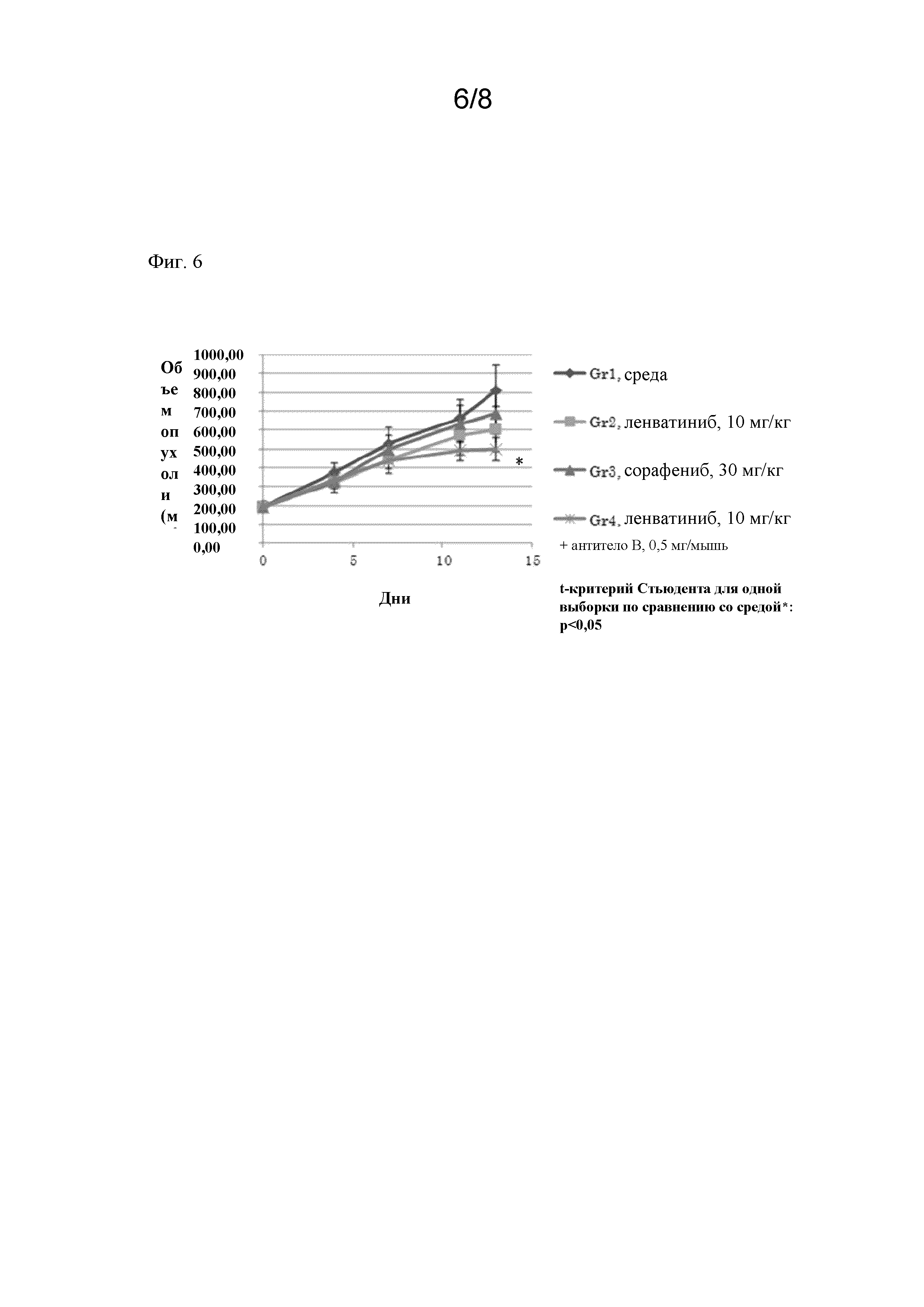
На фигуре 6 показан противоопухолевый эффект, обусловленный комбинированным применением антитела B и ленватиниба мезилата на ксенотрансплантатной модели гепатоцеллюлярной карциномы, полученной от пациента-человека. Изменение объема опухоли (TV) в контрольной группе (3 мМ HCl), группе, получавшей ленватиниба мезилат (10 мг/кг), группе, получавшей сорафениба тозилат (30 мг/кг), и группе, получавшей ленватиниба мезилат (10 мг/кг) плюс антитело B (0,5 мг/мышь) (N=10, среднее±погрешность) (*: P < 0,05 против контрольной группы, непарный t-критерий Стьюдента, день 13).
На фигуре 7 показана взаимосвязь концентрации антитела B и значения относительной люминесценции (%). На графике показано среднее значение результатов трех независимых тестов, и планка погрешностей показывает его стандартное отклонение.
На фигуре 8 показана перекрытая сенсограмма взаимодействия антитела B и доменов Notch NRR человека. (A) Notch1-NRR-SEAP-His человека, (B) Notch2-NRR-SEAP-His человека, (C) Notch3-NRR-SEAP-His человека и (D) Notch4-NRR-SEAP-His человека.
Описание вариантов осуществления
[0071]
Представленное в данном документе антитело может относиться к иммуноглобулиновой молекуле, которая может специфически связываться с мишенью, такой как сахар, полинуклеотид, липид, полипептид и белок, посредством по меньшей мере одного сайта распознавания антигена, расположенного в вариабельном участке иммуноглобулиновой молекулы. Антитело может относиться к полностью поликлональному или моноклональному антителу.
[0072]
Антитело может принадлежать к любому классу, такому как IgG, IgA или IgM (или их подклассу) и т. д., и не ограничивается конкретным классом. Иммуноглобулины разделяют на различные классы в зависимости от аминокислотной последовательности константного участка тяжелой цепи (иногда называемой цепью Н) антитела Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, некоторые из которых могут быть дополнительно разделены на подклассы (изотипы), такие как IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные участки тяжелой цепи, соответствующие различным классам иммуноглобулинов, называются α, δ, ε, γ, и μ, соответственно. Более того, типы легкой цепи (иногда называемой цепью L) антитела включают в себя λ и κ цепи.
[0073]
Согласно одному аспекту антитело к Notch4 человека по настоящему изобретению может представлять собой антитело IgG, например антитело IgG1 или антитело IgG2 и т. д. Более того, в некоторых случаях антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент может быть в виде мономера, димера или мультимера.
[0074]
Антигенсвязывающий фрагмент представленного в данном документе антитела особенно не ограничивается, если он является функциональным и структурным фрагментом указанного антитела и сохраняет способность связывания с антигеном, который может быть связан указанным антителом. Примеры антигенсвязывающего фрагмента антитела включают в себя без ограничения Fab, Fab', F(ab')2, Fv, одноцепочечный (ScFv), их варианты, белок слияния, содержащий часть антитела, другие модифицированные структуры иммуноглобулиновой молекулы, содержащей сайт распознавания антигена, и т. п.
[0075]
Антигенсвязывающий фрагмент антитела может быть получен, например, путем протеолитического расщепления полного антитела, или может быть получен непосредственно с помощью рекомбинантной клетки-хозяина (например, эукариотической, такой как дрожжевая клетка, растительная клетка, клетка насекомого или клетка млекопитающего, или прокариотической, такой как E. coli). Например, F(ab')2-фрагмент может быть образован путем отбора Fab'-SH-фрагментов непосредственно из E. coli и воздействия ими на химическую связь. F(ab')2 также может быть образован с использованием лейциновой "застежки" GCN4, которая обеспечивает сборку молекулы F(ab')2. Более того, может быть использован автоматический синтезатор при получении scFv с помощью технологии химического синтеза. Подходящая плазмида, содержащая полинуклеотид, кодирующий scFv, может быть введена в подходящую клетку-хозяина (например, эукариотическую, такую как дрожжевая клетка, растительная клетка, клетка насекомого или клетка млекопитающего, или прокариотическую, такую как E. coli) при получении scFv с помощью технологии генетической рекомбинации. Полинуклеотид, кодирующий представляющий интерес scFv, может быть получен с помощью хорошо известной манипуляции, такой как лигирование полинуклеотидов. Полученный в результате scFv может быть выделен с использованием стандартной технологии очистки белка, хорошо известной из уровня техники.
[0076]
Вариабельный участок антитела может означать вариабельный участок легкой цепи антитела и/или вариабельный участок тяжелой цепи антитело, а константный участок антитела может означать константный участок легкой цепи антитела и/или константный участок тяжелой цепи антитела. Каждый вариабельный участок тяжелой и легкой цепей состоит из четырех каркасных участков (FR), соединенных тремя CDR, также известными как гипервариабельные участки. CDR в каждой цепи удерживается поблизости от FR и вместе с CDR в другой цепи участвует в образовании антигенсвязывающего сайта в антителе. Технологии определения CDR предусматривают без ограничения, например, (1) подход, основанный межвидовой вариабельности последовательностей (такой как в Kabat et al, Sequences of Proteins of Immunological Interest, 5th ed., 1991, National Institutes of Health, Bethesda MD); и (2) подход, основанный на исследовании кристаллической структуры комплексов антиген-антитело (Al-lazikani et al., 1997 J. Molec. Biol. 273:927-948). Эти и другие подходы могут быть использованы в комбинации.
[0077]
Термин "специфически связывается с" является термином, хорошо известным специалистам в данной области, и способы определения специфического связывания антитела и т. п. с антигеном или эпитопом, также хорошо известны. Например, следует учитывать, что антитело или его антигенсвязывающий фрагмент, которые специфически связываются с эпитопом в Notch4, могут связываться с указанным эпитопом в Notch4 с более высокой аффинностью и активностью связывания, быстрее и/или с большей продолжительностью, чем с другим эпитопом или отличными от эпитопа сайтами. Однако антитело или его антигенсвязывающий фрагмент, которые специфически связываются с первой мишенью, не исключаются из специфического связывания со второй мишенью.
[0078]
Моноклональное антитело может означать антитело, которое получают из популяции практически однородных антител. Другими словами, отдельные антитела, содержащиеся в этой популяции, являются идентичными, за исключением возможного присутствия небольшого количества существующих в природе мутантов. Моноклональные антитела направляются на один антигенный сайт и являются высокоспецифическими. Кроме того, в отличии от типичного поликлонального антитела, которое нацеливается на разные антигены или разные эпитопы, каждое моноклональное антитело нацеливается на один эпитоп антигена. Определение "моноклональное" указывает на свойство антитела, которое получают из популяции практически однородных антител, и оно не должно истолковываться как ограниченное необходимостью получения антител конкретным способом.
[0079]
Антителом к Notch4 по настоящему изобретению или его антигенсвязывающим фрагментом может быть химерное антитело, гуманизированное антитело, человеческое антитело, антитело отличного от человека млекопитающего (такого как мышь, крыса, кролик, корова, лошадь и коза) или его антигенсвязывающий фрагмент. Химерным антителом является антитело, которое имеет, например, вариабельный участок не являющегося человеческим (например, мышиного или крысиного) антитела, введенного в константный участок человеческого антитела, и может относиться, например, к антителу, в котором вариабельный участок получен из не являющегося человеческим антитела, а константный участок получен из человеческого антитела. Гуманизированным антителом является антитело, которое имеет, например, гипервариабельный участок (также называемый участком (CDR), определяющим комплементарность) не являющегося человеческим антитела, введенный в человеческое антитело, и может относиться, например, к антителу, в котором CDR получен из не являющегося человеческим антитела, а другие участки антитела получены из человеческого антитела. Следует отметить, что в соответствии с настоящим изобретением граница между химерным антителом и гуманизированным антителом не должна быть обязательно четкой, и антитело может находиться в состоянии, которое может называться как химерным антителом, так и гуманизированным антителом.
[0080]
Совершенно очевидно, что представленное выше химерное или гуманизированное антитело, которое было соответствующим образом модифицировано (например, путем модификации антитела или частичных замены, добавления или делеции в аминокислотной последовательности антитела) с сохранением при этом функции указанного антитела (или с добавлением или улучшением функции указанного антитела) также охватывается антителом по настоящему изобретению. Более конкретно, антитело, модифицированное с помощью технологии POTELLIGENT™ для усиления активности антителозависимой клеточноопосредованной цитотоксичности (ADCC) антитела, связанного с мишенью, антитело, модифицированное с помощью технологии COMPLEGENT™ для усиления активности комплементзависимой цитотоксичности (CDC) антитела, или антитело, модифицированной с помощью комбинированного применения этих технологий, также охватываются объемом настоящего изобретения. Более того, антитело с лизином (Lys), расположенным на карбоксильном конце (C-конце) тяжелой цепи, удаленной искусственным способом, таким как генетическая модификация, для уменьшения неоднородности антител, полученных с помощью антителопродуцирующих клеток, также охватывается объемом настоящего изобретения. Кроме того, биспецифическое антитело, имеющее антителосвязывающий сайт, содержащий последовательность CDR антитела по настоящему изобретению, вместе с антигенсвязывающим сайтом, которые связывается с другим антигеном (Kontermann (2012), mAbs 4, 182-97), также охватывается объемом настоящего изобретения.
[0081]
Антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент при необходимости могут быть модифицированы. Модификацией антитела к Notch4 по настоящему изобретению или его антигенсвязывающего фрагмента может быть модификация, которая изменяет (a) трехмерную структуру аминокислотной последовательности в модифицированном участке, такую как листовая или спиральная конформация; (b) заряд или состояние гидрофобности молекулы по целевому сайту или (c) эффект модификации в объеме боковой цепи, или модификация, при которой эти изменения не являются четко выраженными.
[0082]
Модификация антитела к Notch4 по настоящему изобретению или его антигенсвязывающего фрагмента может быть достигнута, например, путем замены, делеции, добавления и т. д. конфигурирующих аминокислотных остатков.
[0083]
Аминокислота в данном документе используется в самом широком своем смысле и включает в себя не только встречающиеся в природе аминокислоты, такие как серин (Ser), аспарагин (Asn), валин (Val), лейцин (Leu), изолейцин (Ile), аланин (Ala), тирозин (Tyr), глицин (Gly), лизин (Lys), аргинин (Arg), гистидин (His), аспарагиновая кислота (Asp), глутаминовая кислота (Glu), глутамин (Gln), треонин (Thr), цистеин (Cys), метионин (Met), фенилаланин (Phe), триптофан (Trp) и пролин (Pro), а также не встречающиеся в природе аминокислоты, такие как варианты и производные аминокислот. Специалистам в данной области, естественно, будет понятно с учетом данного широкого определения, что примеры аминокислот в данном документе включают в себя L-аминокислоты; D-аминокислоты; химически модифицированные аминокислоты, такие как варианты и производные аминокислот; аминокислоты, которые не являются материалами, конфигурирующими белки in vivo, такие как норлейцин, β-аланин и орнитин; и химически синтезированные соединения, обладающие свойствами аминокислот, хорошо известных специалистам в данной области. Примеры не встречающейся в природе аминокислоты включают в себя α-метиламинокислоты (такие как α-метилаланин), D-аминокислоты (такие как D-аспарагиновая кислота и D-глутаминовая кислота), подобные гистидину аминокислоты (такие как 2-амино-гистидин, β-гидрокси-гистидин, гомогистидин, α-фторметил-гистидин, и α-метил-гистидин), аминокислоты с избытком метилена в боковой цепи ("гомо" аминокислоты) и аминокислоты, в которых карбоксилатная функциональная группа аминокислоты в боковой цепи замещена сульфонатной группой (такие как цистеиновая кислота).
[0084]
Остатки встречающихся в природе аминокислот могут быть разделены, например, на следующие группы на основании общих свойств боковой цепи:
(1) гидрофобные: Met, Ala, Val, Leu и Ile;
(2) нейтральные гидрофильные: Cys, Ser и Thr;
(3) кислые: Asp и Glu;
(4) основные: Asn, Gln, His, Lys и Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly и Pro; и
(6) ароматические: Trp, Tyr и Phe.
[0085]
Неконсервативная замена аминокислотной последовательности, конфигурирующей антитело или его антигенсвязывающий фрагмент, может быть выполнена путем обмена аминокислоты, которая принадлежит к одной из этих групп, на аминокислоту, которая принадлежит к другой группе. Более консервативная замена может быть может быть выполнена путем обмена аминокислоты, которая принадлежит к одной из этих групп, на другую аминокислоту, которая принадлежит к той же группе. Подобным образом может быть выполнена делеция или замена в аминокислотной последовательности.
[0086]
Модификацией аминокислоты, конфигурирующей антитело или его антигенсвязывающий фрагмент, может быть, например, посттрансляционная модификация, такая как гликозилирование с помощью сахара, ацетилирование или фосфорилирование. Антитело может быть гликозилировано по консервативному положению в своем константном участке. Гликозилирование антитела, как правило, является либо N-связанным, либо O-связанным. N-связанное означает связывание сахарного фрагмента с боковой цепью аспарагинового остатка. Трипептидные последовательности аспарагин-X-серин, аспарагин-X-треонин и аспарагин-X-цистеин (где X представляет собой любую аминокислоту, отличную от пролина) являются последовательностями распознавания для ферментативного добавления сахарного фрагмента к боковой цепи аспарагина. Сайт потенциального гликозилирования присутствует, если одна из этих трипептидных последовательностей присутствует в антителе или его антигенсвязывающем фрагменте. O-связанным гликозилированием может быть связывание либо N-ацетилгалактозамина, галактозы, либо ксилозы с гидроксиаминокислотой (такой как серин или треонин), а в некоторых случаях может быть связывание с 5-гидроксипролином или 5-гидроксилизином. Условие гликозилирования (например, если гликозилирование выполняют с биологическим средством, типом клетки-хозяина или клеточной средой, pH и т. п.) может быть соответствующим образом выбрано специалистом в данной области в соответствии с целью.
[0087]
Антитело к Notch4 в соответствии с настоящим изобретением или его антигенсвязывающий фрагмент могут быть дополнительно модифицированы в соответствии с общими техническими принципами, хорошо известными специалистам в данной области, с помощью других способов модификации отдельно или в комбинации.
[0088]
Антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент могут быть получены способом, хорошо известным специалистам в данной области. Например, антитело может быть получено с помощью гибридомы, которая продуцирует антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент, или с помощью интеграции гена, кодирующего антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент, в вектор экспрессии и введения указанного вектора экспрессии, например, в клетки E. coli, клетки обезьяны COS, клетки яичника китайского хомячка (CHO) и т. п.
[0089]
Антителом к Notch4 по настоящему изобретению или его антигенсвязывающим фрагментом могут быть такие, которые выделены или очищены в соответствии со способами, хорошо известными специалистам в данной области. В данном документе "выделенный" или "очищенный" означает искусственные выделение или очистку из естественного состояния. Если молекула или композиция встречается в природе, то она является "выделенной" или "очищенной", если ее изменили или удалили из ее исходной среды, или и первое, и второе. Примеры способа выделения или очистки включают в себя без ограничения электрофорез, молекулярно-биологические, иммунологические или хроматографические средства, особенно, ионообменную хроматографию, гидрофобную хроматографию или обращенно-фазовую HPLC хроматографию, или изоэлектрическое фокусирование.
[0090]
Способом, используемым для измерения связывающего свойства (такого как аффинность связывания и перекрестная реактивность) антитела или его антигенсвязывающего фрагмента с антигеном, может быть способ, хорошо известный специалистам в данной области. Например, аффинность связывания может быть измерена с помощью без ограничения биосенсора Biacore™, биосенсора KinExA, сцинтилляционного анализа сближения, ELISA, иммуноанализа ORIGEN (от IGEN), проточной цитометрии, гашения флуоресценции, переноса флуоресценции, дрожжевого дисплея и/или иммуноокрашивания. Нейтрализующая активность антитела или его антигенсвязывающего фрагмента в отношении связывания Notch4 с его лигандом может быть измерена с помощью без ограничения биосенсора Biacore™, ELISA и/или проточной цитометрии. Нейтрализующая активность антитела или его антигенсвязывающего фрагмента в отношении сигнала трансдукции, который индуцируется внутри организма человека из-за связывания Notch4 с его лигандом, или в отношении ответа в виде молекулярной экспрессии или функционального изменения клетки может быть измерена без ограничения, например, следующими способами: (i) анализ с геном-репортером, который выявляет вариацию в экспрессии молекулы по направлению передачи сигнала Notch, (ii) вестерн-блоттинг, который выявляет расщепление Notch4 TNF-α превращающим ферментом (TACE) или γ -селектазой, (iii) окрашивание иммунных клеток, который выявляет ядерный импорт внутриклеточного домена Notch (NIC), и (iv) оценку клеточной функциональности, в которой используют нормальную клетку, такую как сосудистая эндотелиальная клетка, или раковую клетку, которая экспрессирует Notch4.
[0091]
Согласно одному аспекту настоящее изобретение может относиться к фармацевтической композиции, содержащей антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент.
[0092]
Фармацевтическая композиция, содержащая антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент в водной или сухой препаративной форме, может дополнительно содержать фармацевтически приемлемый носитель, наполнитель и/или стабилизатор. Примеры приемлемого носителя, наполнителя или стабилизатора включают в себя солевой раствор; буфер, такой как фосфорная кислота, лимонная кислота и другие органические кислоты; антиоксидант, в том числе аскорбиновую кислоту; низкомолекулярный полипептид; белок (такой как сывороточный альбумин, желатин или иммуноглобулин); гидрофильный полимер, такой как поливинилпирролидон; аминокислоту; моносахариды, дисахариды и другие углеводы, в том числе глюкозу, маннозу или декстрины; хелатирующее средство, такое как EDTA; сахароспирты, такие как маннит или сорбит; противоион, который образует соль, такой как натрий; или неионогенное поверхностно-активное вещество, такое как TWEEN™, PLURONICS™ или PEG.
[0093]
Фармацевтическая композиция, содержащая антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент, может быть инкапсулирована, например, в микрокапсулу, в коллоидальную систему доставки лекарственного средства (такую как липосома, альбуминовая микросфера, микроэмульсия, наночастица или нанокапсула) или в макроэмульсию. При необходимости введения препарата с замедленным высвобождением антитела, обладающего свойством высвобождения, подходящим для любого заболевания, при котором требуется введение антитело, может быть предусмотрено микроинкапсулирование антитела. Примеры матрицы замедленного высвобождения включают в себя сложный полиэфир, гидрогель (такой как поли(2-гидроксиэтил-метакрилат) или поли(виниловый спирт)), полимолочные кислоты, сополимер L-глутаминовой кислоты и γ этил-L-глутамат, неразлагаемый этилен-винилацетат, разлагаемый сополимер молочной кислоты и гликолевой кислоты, такой как LUPRON DEPOT™ (инъекционная микросфера, состоящая з сополимера молочной кислоты и гликолевой кислоты и леупролидацетата), и поли-D-(-)-3-гидроксимасляная кислота.
[0094]
Препарат, используемый для in vivo введения, должен быть стерильным. Этого можно легко достичь путем фильтрации через стерильную фильтрующую мембрану.
[0095]
Фармацевтическая композиция, содержащая антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент, имеет потенциал в отношении применимости в лечении немелкоклеточного рака легкого, рака щитовидной железы, рака предстательной железы или гепатоцеллюлярной карциномы. Другими словами, другой аспект настоящего изобретения может относиться к способу лечения немелкоклеточного рака легкого, рака щитовидной железы, рака предстательной железы или гепатоцеллюлярной карциномы, предусматривающему стадию введение субъекту терапевтически эффективного количества антитела к Notch4 по настоящему изобретению или его антигенсвязывающего фрагмента. Более того, другой аспект настоящего изобретения может относиться к применению антитела к Notch4 по настоящему изобретению или его антигенсвязывающего фрагмента для изготовления терапевтического лекарственного средства против немелкоклеточного рака легкого, рака щитовидной железы, рака предстательной железы или гепатоцеллюлярной карциномы.
[0096]
Антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент, используемые для лечения немелкоклеточного рака легкого, рака щитовидной железы, рака предстательной железы или гепатоцеллюлярной карциномы, предпочтительно представляет собой антитело, которое распознает внеклеточный домен в Notch4. Например, антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент может представлять собой антитело или его антигенсвязывающий фрагмент, которые специфически связываются с любым сайтом в положениях 24-1447 в аминокислотной последовательности Notch4 человека, представленной под SEQ ID NO. 1. В аминокислотной последовательности Notch4 человека, представленной под SEQ ID NO. 1, положения 1-23 представляют собой сигнальную последовательность, а положения 1448-2003 представляют собой трансмембранный домен и внутриклеточный домен.
[0097]
Антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент могут быть использованы в терапевтическом способе отдельно или в комбинации с другими средствами или композициями. Например, антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент могут быть введены в одно и то же или в разное время с другим противораковым средством. Такая комбинированная терапия предусматривает комбинированное введение (два или более средств содержатся в одном и том же или в отдельном препарате) и отдельное введение (например, в одно и тоже время или непрерывно). При отдельном введении двух или более средств введение антитела к Notch4 по настоящему изобретению или его антигенсвязывающего фрагмента можно осуществлять до или после сопутствующего терапевтического способа. Противораковые средство, которое может быть использовано в комбинации с антителом к Notch4 по настоящему изобретению или его антигенсвязывающим фрагментом, может представлять собой, например, противораковое средство, которое является эффективным в лечении немелкоклеточного рака легкого, рака щитовидной железы, рака предстательной железы или гепатоцеллюлярной карциномы. Примеры такого противоракового средства могут включать в себя без ограничения цисплатин, ленватиниб и паклитаксел. Примеры фармацевтической композиции для такой комбинированной терапии могут включать в себя без ограничения фармацевтическую композицию, содержащую антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент и цисплатин, фармацевтическую композицию, содержащую антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент и ленватиниб, и фармацевтическую композицию, содержащую антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент и паклитаксел.
[0098]
Субъект для введения фармацевтической композиции, содержащей антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент, не является ограниченным, и настоящее изобретение может быть использовано для млекопитающего (такого как человек, свинья, корова, обезьяна, бабуин, собака, кот, крыса и мышь). Однако люди могут не быть субъектом, если это не является предпочтительным.
[0099]
Способ введения фармацевтической композиции, содержащей антитело к Notch4 по настоящему изобретению или его антигенсвязывающий фрагмент, субъекту (такой как путь введения, дозировка, частота введения за сутки и время введения) не является ограниченным, и может быть соответствующим образом определен специалистом в данной области (таким как врач) в соответствии с состоянием здоровья субъекта, степенью заболевания, типом средства, используемого в комбинации, и т. п.
[0100]
Специалистам в данной области известно, что если это не является технически противоречащим, любой один или несколько или все аспекты, описываемые в данном документе, могут быть соответствующим образом объединены для осуществления настоящего изобретения. Кроме того, специалистам в данной области известно, что пока это не является технически противоречащим, предпочтительно, чтобы любой и все предпочтительные или выгодные аспекты, описываемые в данном документе, были соответствующим образом объединены для осуществления настоящего изобретения.
[0101]
Все раскрытия литературных источников, цитируемых в данном документе, следует считать четко процитированными в данном документе посредством ссылки, и специалисты в данной области смогут цитировать и узнавать содержание раскрытия, относящегося к данным литературными источникам, в качестве части настоящего описания согласно контексту данного документа без отступления от сути и объема настоящего изобретения.
[0102]
Литературные источники, упоминаемые в настоящем документе, представлены исключительно с целью раскрытия связанной технологии, предшествующей дате подачи настоящей заявки, и не должны рассматриваться как признание того, что авторы настоящего изобретения не имеют приоритетного права на указанные раскрытия по причинам более раннего изобретения или по любой другой причине. Все описания этих литературных источников основываются на информации, доступной авторам настоящей заявки, и не является признанием того, что эти описания верны.
[0103]
Термины, используемые в настоящем документе, применяются для описания конкретных вариантов осуществления и не предназначены для ограничения настоящего изобретения.
[0104]
Термин "содержать", используемый в данном документе, если содержание явно не означает, что подразумевается иное, означает наличие описываемых объектов (таких как компоненты, стадии, элементы или числа) и не исключает наличие других объектов (таких как компоненты, стадии, элементы или числа). Термин "состоять из" охватывает аспекты, описываемые терминами "состоять из" и/или "состоять, по сути, из".
[0105]
Термин "нейтрализующая активность", используемый в данном документе, означает активность ингибирования связывания Notch4 с его лигандом и/или активность ингибирования трансдукции сигнала, которая индуцируется внутри организма человека связыванием Notch4 с его лигандом, или ответа в виде молекулярной экспрессии, или функционального изменения клетки.
[0106]
Если не указано иное, все термины, используемые в данном документе (в том числе технические и научные термины), имеют те же значения, которые широко известны специалистам в области технологии, к которой относится настоящее изобретение. Используемые в данном документе термины, если явно не указано иное, следует понимать, как имеющие значения, соответствующие значениям в данном документе и в соответствующих областях техники, и не следует считать имеющими упрощенные или чрезмерно формальные значения.
[0107]
Такие термины, как первый и второй, используются для выражения различных элементов, и следует отметить, что эти элементы не ограничиваются самими этими терминами. Эти термины используются исключительно с целью отделения одного элемента от другого, и, например, можно описывать первый элемент как второй элемент, и, подобным образом, описывать второй элемент как первый элемент, без отступления от объема настоящего изобретения.
[0108]
Числовые значения, используемые в данном документе для указания содержания компонента или диапазона числовых значений и т. п., если явно не указано, следует понимать как модифицированные термином "приблизительно". Например, если явно не указано, "4°C" означает "приблизительно 4°C", и специалисты в данной области естественно смогут логично определить его степень в соответствии с техническими общими принципами и контекстом настоящего описания.
[0109]
Если четко не указано, что контекст подразумевает иное, при использовании в описании и формуле изобретения данного документа следует учитывать, что каждый аспект, представленный в форме единственного числа также может иметь форму множественного числа, если это не является технически противоречивым, и наоборот.
[0110]
Далее настоящее изобретение будет подробно описано со ссылкой на примеры. Однако настоящее изобретение может быть осуществлено с помощью различных аспектов, и не должно истолковываться как ограничиваемое примерами, описываемыми в данном документе. Специалисты в соответствующей области техники смогут осуществить настоящее изобретение с различными модификациями, добавлениями, делециями, заменой и т. п. без изменения сути или объема настоящего изобретения.
Примеры
[0111]
Пример 1: получение моноклонального антитела к Notch4 человека
[0112]
Получение мышиного моноклонального антитела к Notch4 человека
Для получения моноклонального антитела к Notch4 человека (№ доступа в Genbank NP_004548,3) (SEQ ID NO. 1) мышей Balb/c иммунизировали тремя повторами EGF и негативным регуляторным участком (NRR) из Notch4 человека (положения 1046-1445 в SEQ ID NO. 1), слитыми с секреторной щелочной фосфатазой (SEAP) и гистидиновой меткой (далее конструкция называется "3EGF-NRR-SEAP-His Notch4 человека").
[0113]
Белок 3EGF-NRR-SEAP-His Notch4 человека получали с помощью следующих стадий: сначала конструировали вектор экспрессии pcDNA3.1-Notch4 человека-3EGF-NRR-SEAP-His. Три повтора EGF и NRR из Notch4 человека амплифицировали путем ПЦР и субклонировали в сайт SfiI/NotI в pcDNA3.1 (Invitrogen/LifeTechnologies), имеющий последовательность ДНК, кодирующую сигнальную последовательность Igκ, SEAP и гистидиновую метку. Далее вектором экспрессии pcDNA3.1-Notch4 человека-3EGF-NRR-SEAP-His трансфицировали клетки HEK293 EBNA (Invitrogen/LifeTechnologies) с помощью TransIT-LT1 (TAKARA). Через 6 дней инкубации (5% CO2, 37°C) собирали культуральный супернатант. Белок 3EGF-NRR-SEAP-His Notch4 человека очищали с помощью колонки Protino (MACHEREY-NAGEL).
[0114]
Двадцать микрограмм указанного белка 3EGF-NRR-SEAP-His Notch4 человека смешивали с таким же количеством адъюванта GERBU (GERBU Biotechnik GmbH) и подкожно вводили инъекцией мышам Balb/c в подушечки лап. Три дополнительных инъекции проводили в дни 3, 7 и 10. Мышей умерщвляли на следующий день и отбирали периферические лимфатические узлы. Половину каждого из периферических лимфатических узлов трансплантировали мышам SCID. Клетки лимфатических узлов получали из оставшейся половины каждого лимфатического узла и сливали с клетками миеломы P3U1 в соотношении 5:1 в присутствии GenomeONE-CF (Ishihara Sangyo Kaisha, Ltd.). Указанные слитые клетки культивировали в 96-луночном пластиковом планшете. Через 7 дней инкубации (5% CO2, 37°C) собирали культуральный супернатант.
[0115]
Десять микрограмм белка 3EGF-NRR-SEAP-His Notch4 человека внутривенно вводили указанным мышам SCID в ходе трансплантации лимфатического узла в день трансплантации и через 6 дней после трансплантации. Через три дня после заключительной иммунизации клетки периферических лимфатических узлов отбирали, сливали, как описывается выше, и культивировали.
[0116]
Получали мышиные моноклональные антитела из 8 клонов с помощью вышеупомянутых стадий. Из них отбирали наиболее предпочтительное лидерное антитело (6-3-A6) на основании Notch4-специфической активности ингибирования сигнала и активности связывания с мышиным Notch4 и Notch4 человека.
[0117]
Анализ последовательности мышиного моноклонального антитела к Notch4 человека(6-3-A6)
Последовательность ДНК, кодирующую тяжелую и легкую цепи клона 6-3-A6, амплифицировали с помощью 5'-RACE (быстрой амплификации 5'-концов для концов кДНК). Полную РНК получали из указанной гибридомы с помощью TRIZOL (Invitrogen/LifeTechnologies) и обрабатывали с использованием ДНКазы (QIAGEN, набор ДНКаз, не содержащий РНКаз). Получали двухнитевую кДНК из указанной полной РНК с использованием набора для синтеза кДНК (TAKARA). 5'-адаптор, полученный путем отжига ad29S (ACATCACTCCGT (SEQ ID NO. 2)) и ad29AS (ACGGAGTGATGTCCGTCGACGTATCTCTGCGTTGATACTTCAGCGTAGCT (SEQ ID NO. 3)), добавляли к указанной кДНК. Полученную кДНК амплифицировали с помощью 5'-прямого праймера (праймера 5'-PCR4, AGCTACGCTGAAGTATCAACGCAGAG (SEQ ID NO. 4)), а 3' обратный праймер (GCCAGTGGATAGACTGATGG (SEQ ID NO. 5) использовали для амплификации тяжелой цепи мышиного IgG1, и GATGGATACAGTTGGTGCAGC (SEQ ID NO. 6) использовали для амплификации легкой цепи мышиного Igκ). Указанную амплифицированную кДНК вставляли в вектор pCR2.1 (Invitrogen/LifeTechnologies). Последовательность гена анализировали с помощью ABI3130XL. В следующей таблице представлена аминокислотная последовательность, кодируемая последовательностью гена, идентифицированной с помощью данного анализа.
[0118]
Таблица 1. Аминокислотная последовательность мышиного антитела к Notch4 человека (6-3-A6)
[0119]
Таблица 2. Последовательность нуклеиновой кислоты мышиного антитела к Notch4 человека (6-3-A6)
[0120]
Получение химерного антитела к Notch4 человека и гуманизированного антитела к Notch4 человека
С помощью ПЦР с перекрывающимися праймерами последовательность гена вариабельного участка тяжелой цепи 6-3-A6 связывали с последовательностью гена константного участка человеческого IgG2, имеющего мутации V234A и G237A, в качестве тяжелой цепи, а последовательность гена вариабельной области легкой цепи 6-3-A6 связывали с последовательностью гена константного участка человеческого Igκ в качестве легкой цепи для получения последовательности ДНК, кодирующей химерное антитело. Как используется в данном документе, "V234A" представляет собой мутацию, при которой валин в положении 234 заменяется аланином, и "G237A" представляет собой мутацию, при которой глицин в положении 237 заменяется аланином. Последовательность, полученную в результате, встраивали в векторы экспрессии (pEE6.4 для тяжелой цепи и pEE12.4 для легкой цепи, Lonza). В следующих таблицах представлены аминокислотные и нуклеотидные последовательности химерного антитела.
[0121]
Таблица 3. Аминокислотная последовательность химерного антитела к Notch4 человека
[0122]
Таблица 4. Последовательность нуклеиновой кислоты химерного антитела к Notch4 человека
[0123]
Антитело гуманизировали путем трансплантации CDR из мышиного антитела 6-3-A6 в вариабельный участок человеческого антитела. Аминокислотную последовательность мышиного антитела 6-3-A6 нумеровали согласно системе нумерации по Кэбату с использованием программного обеспечения Abysis (лицензированного UCL) и на основании этой нумерации указанную CDR определяли согласно методу определения по Кэбату или методу определения AbM для идентификации CDR. В следующих таблицах представлены аминокислотные и нуклеотидные последовательности CDR 6-3-A6.
[0124]
Таблица 5. Аминокислотная последовательность CDR 6-3-A6
[0125]
Таблица 6. Последовательность нуклеиновой кислоты CDR 6-3-A6
[0126]
На основании гомологии высокой степени с каркасным участком (FR) в 6-3-A6 FR человеческого антитела, IGKV1-27*1 или IGKV3-15*1 и JK1 для легкой цепи, и IGHV3-64*01 и JH4 для тяжелой цепи выбирали в качестве FR гуманизированного антитела. Затем прогностическую модель 3D-структуры мышиного 6-3-A6 использовали для прогнозирования аминокислоты в FR, которая взаимодействует с аминокислотой в CDR и трансплантируется вместе с CDR. Константный участок человеческого IgG2 с мутациями V234A и G237A и с C-концевым остатком лизина или без него, а также человеческий Igκ использовали в качестве константного участка тяжелой и легкой цепей. HK1, HK2 и HK3 конструировали в виде тяжелой цепи гуманизированного антитела, в которое трансплантировали CDR, определенную согласно методу определения по Кэбату, HA1 и HA2 конструировали в виде тяжелой цепи гуманизированного антитела, в которое трансплантировали CDR, определенную согласно методу определения AbM, L1, L2 и L5 конструировали в виде легкой цепи гуманизированного антитела, в котором использовали IGKV1-27*1 и JK1, а L3, L4 и L6 конструировали в виде легкой цепи гуманизированного антитела, в котором использовали IGKV3-15*1 и JK1. В следующих таблицах представлены аминокислотные и нуклеотидные последовательности вариабельного участка гуманизированного антитела, константного участка человеческого IgG2 с мутациями V234A и G237A и с C-концевым остатком лизина или без него, а также человеческого Igκ.
[0127]
Таблица 7
Аминокислотная последовательность и последовательность нуклеиновой кислоты вариабельного участка тяжелой цепи гуманизированного антитела к Notch4 человека (HK1)
[0128]
Таблица 8
Аминокислотная последовательность и последовательность нуклеиновой кислоты вариабельного участка тяжелой цепи гуманизированного антитела к Notch4 человека (HK2)
[0129]
Таблица 9
Аминокислотная последовательность и последовательность нуклеиновой кислоты вариабельного участка тяжелой цепи гуманизированного антитела к Notch4 человека (HK3)
[0130]
Таблица 10
Аминокислотная последовательность и последовательность нуклеиновой кислоты вариабельного участка тяжелой цепи гуманизированного антитела к Notch4 человека (HA1)
[0131]
Таблица 11
Аминокислотная последовательность и последовательность нуклеиновой кислоты вариабельного участка тяжелой цепи гуманизированного антитела к Notch4 человека (HA2)
[0132]
Таблица 12
Аминокислотная последовательность и последовательность нуклеиновой кислоты вариабельного участка легкой цепи гуманизированного антитела к Notch4 человека (L1)
[0133]
Таблица 13
Аминокислотная последовательность и последовательность нуклеиновой кислоты вариабельного участка легкой цепи гуманизированного антитела к Notch4 человека (L2)
[0134]
Таблица 14
Аминокислотная последовательность и последовательность нуклеиновой кислоты вариабельного участка легкой цепи гуманизированного антитела к Notch4 человека (L3)
[0135]
Таблица 15
Аминокислотная последовательность и последовательность нуклеиновой кислоты вариабельного участка легкой цепи гуманизированного антитела к Notch4 человека (L4)
[0136]
Таблица 16
Аминокислотная последовательность и последовательность нуклеиновой кислоты вариабельного участка легкой цепи гуманизированного антитела к Notch4 человека (L5)
[0137]
Таблица 17
Аминокислотная последовательность и последовательность нуклеиновой кислоты вариабельного участка легкой цепи гуманизированного антитела к Notch4 человека (L6)
[0138]
Таблица 18
Аминокислотная последовательность и последовательность нуклеиновой кислоты константного участка человеческого IgG2 с мутациями V234A и G237A и С-концевым лизином
[0139]
Таблица 19
Аминокислотная последовательность и последовательность нуклеиновой кислоты константного участка человеческого IgG2 с мутациями V234A и G237A и без С-концевого лизина
[0140]
Таблица 20
Аминокислотная последовательность и последовательность нуклеиновой кислоты константного участка человеческого Igκ
[0141]
Последовательности гена вариабельного участка этих гуманизированных антител синтезировали с помощью GenScript USA Inc. и встраивали в константный участок человеческого IgG2 с или без С-концевого лизина или pcDNA3.3 (Invitrogen), содержащего последовательность ДНК, кодирующую константный участок человеческого Igκ. Указанными векторами экспрессии трансфицировали клетки FreeStyle 293-F (Invitrogen) с использованием системы экспрессии FreeStyle 293 (Invitrogen) для получения антител. Супернатант собирали и очищали с помощью белка A (GE Healthcare).
[0142]
Полноразмерные (вариабельный участок+константный участок) последовательности гена гуманизированных антител оптимизировали подобным образом, полностью синтезировали с помощью GenScript USA Inc. и встраивали тяжелую цепь в pEE6.4, а легкую цепь в pEE12.4 (Lonza). Эти векторы экспрессии использовали, как описывается выше, для получения антител. Оптимизированные нуклеотидные последовательности гуманизированных антител представлены в следующих таблицах.
[0143]
Таблица 21
Оптимизированная последовательность нуклеиновой кислоты тяжелой цепи гуманизированного антитела к Notch4 человека (вариабельный участок HK2+константный участок человеческого IgG2 с мутациями V234A и G237A и без С-концевого лизина)
[0144]
Таблица 22
Оптимизированная последовательность нуклеиновой кислоты тяжелой цепи гуманизированного антитела к Notch4 человека (вариабельный участок HK3+константный участок человеческого IgG2 с мутациями V234A и G237A и без С-концевого лизина)
[0145]
Таблица 23
Оптимизированная последовательность нуклеиновой кислоты тяжелой цепи гуманизированного антитела к Notch4 человека (вариабельный участок HА2+константный участок человеческого IgG2 с мутациями V234A и G237A и без С-концевого лизина)
[0146]
Таблица 24
Оптимизированная последовательность нуклеиновой кислоты легкой цепи гуманизированного антитела к Notch4 человека (вариабельный участок L3+константный участок человеческого Igκ)
[0147]
Таблица 25
Оптимизированная последовательность нуклеиновой кислоты легкой цепи гуманизированного антитела к Notch4 человека (вариабельный участок L4+константный участок человеческого Igκ)
[0148]
Таблица 26
Оптимизированная последовательность нуклеиновой кислоты легкой цепи гуманизированного антитела к Notch4 человека (вариабельный участок L5+константный участок человеческого Igκ)
[0149]
Таблица 27
Оптимизированная последовательность нуклеиновой кислоты легкой цепи гуманизированного антитела к Notch4 человека (вариабельный участок L6+константный участок человеческого Igκ)
[0150]
В следующих примерах эксперименты выполняли с антителами, содержащими аминокислотную последовательность CDR антитела 6-3-A6, определяемого в примере 1.
Для удобства конкретные антитела, используемые в следующем примере, будут обозначаться как "антитело A", "антитело B", "антитело C", "антитело D", "антитело E", "антитело F" и "антитело G."
В антителе A вариабельный участок тяжелой цепи предусматривает вариабельный участок тяжелой цепи HK2, описываемой в примере 1, и вариабельный участок легкой цепи предусматривает вариабельный участок легкой цепи L3, описываемой в примере 1.
В антителе B вариабельный участок тяжелой цепи предусматривает вариабельный участок тяжелой цепи HK3, описываемой в примере 1, и вариабельный участок легкой цепи предусматривает вариабельный участок легкой цепи L3, описываемой в примере 1.
В антителе C вариабельный участок тяжелой цепи предусматривает вариабельный участок тяжелой цепи HK2, описываемой в примере 1, и вариабельный участок легкой цепи предусматривает вариабельный участок легкой цепи L4, описываемой в примере 1.
В антителе D вариабельный участок тяжелой цепи предусматривает вариабельный участок тяжелой цепи HK3, описываемой в примере 1, и вариабельный участок легкой цепи предусматривает вариабельный участок легкой цепи L5, описываемой в примере 1.
В антителе E вариабельный участок тяжелой цепи предусматривает вариабельный участок тяжелой цепи HK2, описываемой в примере 1, и вариабельный участок легкой цепи предусматривает вариабельный участок легкой цепи L6, описываемой в примере 1.
В антителе F вариабельный участок тяжелой цепи предусматривает вариабельный участок тяжелой цепи HA2, описываемой в примере 1, и вариабельный участок легкой цепи предусматривает вариабельный участок легкой цепи L3, описываемой в примере 1.
В антителе G вариабельный участок тяжелой цепи предусматривает вариабельный участок тяжелой цепи HK3, описываемой в примере 1, и вариабельный участок легкой цепи предусматривает вариабельный участок легкой цепи L4, описываемой в примере 1.
Следует отметить, что в антителах A-G лизин (Lys), который располагается на C-конце тяжелой цепи обычного человеческого антитела, удален.
[0151]
Пример 2: нейтрализующая активность антитела к Notch4 человека
[0152]
Нейтрализующую активность антитела к Notch4 человека (антитела B) оценивали анализом с геном-репортером люциферазы Notch4-GAL4. Данный эксперимент представляет собой экспериментальную систему, с помощью которой оценивают трансдукцию сигнала, специфического для Notch4, путем оценки люциферазной активности при стимулировании линии клеток b.end3, в которую вводят модифицированный ген, имеющий часть внутриклеточного домена Notch4, замещенную GAL4 ДНК-связывающим доменом, а также вектор экспрессии слитого гена между GAL4 UAS и Luciferase 2CP (далее называемой "репортерной клеткой"), с помощью DLL4, который представляет собой лиганд Notch.
[0153]
Рекомбинантный человеческий DLL4 (R&D Systems, 1506-D4-050/CF) растворяли в PBS для получения 10 мкг/мл раствора (далее раствор DLL4). В плоскодонном 96-луночном белом планшете (Greiner, 655083) распределяли 50 мкл/лунка (500 нг/лунка) раствора DLL4 и 50 мкл/лунка PBS для лунок без стимуляции и оставляли на ночь при 4°C для обеспечения перехода DLL4 в твердую фазу в 96-луночном белом планшете. Репортерные клетки суспендировали в культуральной среде D-MEM, содержащей 10% фетальной бычьей сыворотки (FBS) и пенициллин/стрептомицин, с получением клеточной суспензии при 1×10^5/мл. Каждую лунку с DLL4 в твердой фазе промывали три раза с помощью PBS и высевали 50 мкл/лунка (5000 клеток/лунка) клеточной суспензии. Разбавления антитела к Notch4 человека (конечные концентрации: 0, 0,00064, 0,0032, 0,016, 0,08, 0,4, 2 и 10 мкг/мл) или человеческого IgG2κ (SIGMA, I5404, конечная концентрация 10 мкг/мл) добавляли по 50 мкл и культивировали при 37°C в течение 22 часов. Люциферазную активность репортерных клеток оценивали с помощью Steady-Glo Assay System (Promega, E2510) следующим образом.
[0154]
Сто микролитров раствора Steady-Glo добавляли в каждую лунку после культивирования, перемешивали, а затем оставляли при комнатной температуре на 30 минут. Люминесценцию измеряли с помощью планшет-ридера Multilabel Plate Reader (Envision 2102-0020, Perkin Elmer). Относительную люминесценция (%) вычисляли по измеренному значению люминесценции в соответствии со следующей формулой.
[0155]
Относительная люминесценция (%)=(интенсивность люминесценции в лунке с образцом - средняя интенсивность люминесценции в лунках без стимуляции)/(средняя интенсивность люминесценции в контрольных лунках - средняя интенсивность люминесценции в лунках без стимуляции).
[0156]
На фигуре 1 показана взаимосвязь концентрации антитела B и относительного значения люминесценции (%). На графике на фигуре 1 показано среднее значение результатов трех независимых тестов, и планка погрешностей показывает его стандартное отклонение. IC50 составляла 0,011 мкг/мл (95% CI; 0,0036-0,034).
[0157]
Далее подобные эксперименты выполняли для множества антител к Notch4 человека, в том числе для антитела B (антитела A, антитела B, антитела C, антитела D, антитела E, антитела F и антитела G) и измеряли нейтрализующую активность антител.
[0158]
Рекомбинантный человеческий DLL4 (R&D Systems, 1506-D4-050/CF) растворяли в PBS для получения 10 мкг/мл раствора (далее раствор DLL4). В плоскодонном 96-луночном белом планшете (Greiner, 655083) распределяли 50 мкл/лунка (500 нг/лунка) раствора DLL4 и 50 мкл/лунка PBS для лунок без стимуляции и оставляли на ночь при 4°C для обеспечения перехода DLL4 в твердую фазу в 96-луночном белом планшете. Репортерные клетки суспендировали в культуральной среде D-MEM, содержащей 10% фетальной бычьей сыворотки (FBS) и пенициллин/стрептомицин, с получением клеточной суспензии при 1×10^5/мл. Каждую лунку с DLL4 в твердой фазе промывали три раза с помощью PBS и высевали 50 мкл/лунка (5000 клеток/лунка) клеточной суспензии. Каждое разбавление антитела к Notch4 человека (конечные концентрации: 0 и 10 мкг/мл) или человеческого IgG2κ (SIGMA, I5404, конечная концентрация: 10 мкг/мл) добавляли по 50 мкл и культивировали при 37°C в течение 22 часов. Люциферазную активность репортерных клеток оценивали с помощью системы Dual luc-Glo Assay System (Promega, E2940) следующим образом.
[0159]
Сто микролитров раствора Dual-Glo Luciferase Substrate добавляли в каждую лунку после культивирования, перемешивали, а затем оставляли при комнатной температуре на 20 минут. Люминесценцию люциферазы светляка измеряли с помощью планшет-ридера Multilabel Plate Reader (Envision 2102-0020, Perkin Elmer). Затем добавляли 100 мкл раствора Dual-Glo Stop & Glo Substrate в каждую лунку, перемешивали, а затем оставляли при комнатной температуре на 20 минут. Люминесценцию люциферазы Renilla измеряли с помощью планшет-ридера Multilabel Plate Reader (Envision 2102-0020, Perkin Elmer). Относительную люминесценцию в каждой лунке (люциферазы светляка/люциферазы Renilla) вычисляли из соотношения значений люминесценции. Кроме того, относительную люминесценцию (%) вычисляли из каждого рассчитанного значения с использованием следующей формулы и оценивали ингибиторную активность каждого антитела в отношении сигнала Notch4.
[0160]
Относительная люминесценция (%)=(средняя относительная люминесценция в лунках с образом - средняя относительная люминесценция в лунках без стимуляции)/(средняя относительная люминесценция в контрольных лунках - средняя относительная люминесценция в лунах без стимуляции).
[0161]
Ингибиторная активность каждого антитела в отношении сигнала Notch4 (тесты выполняли при концентрации 10 мкг/мл) описывается в приведенной ниже таблице 28.
[0162]
В приведенной ниже таблице, например, описание "HK2L3 (Lys-)" означает, что вариабельный участок тяжелой цепи гуманизированного антитела к Notch4 человека, используемого в эксперименте, представляет собой вариабельный участок тяжелой цепи HK2 гуманизированного антитела к Notch4 человека в примере 1, вариабельный участок легкой цепи представляет собой вариабельный участок легкой цепи L3 гуманизированного антитела к Notch4 человека в примере 1, а лизин (Lys), расположенный на C-конце тяжелой цепи обычного человеческого антитела, в данном антителе удален.
[0163]
Таблица 28
[0164]
Пример 3: кинетический анализ связывания гуманизированного антитела к Notch4 с рекомбинантным белковым доменом Notch4-NRR
[0165]
Кинетический анализ взаимодействия доменов Notch4-NRR человека, яванского макака, мыши и крысы с антителом B выполняли с помощью BIACORE. Антитело B очищали аффинной хроматографией c белком А из культурального супернатанта стабильной линии клеток CHO, трансфицированной антителом B. Домены Notch4-NRR человека, обезьяны, мыши и крысы получали в виде белков слияния с секреторной щелочной фосфатазой (SEAP) и 10 x гистидиновой меткой. Генами этих белков трансфицировали клетки Expi293F в Opti-MEM (INVITROGEN) с использованием ExpiFectamine 293. Эти клетки культивировали в среде Expi293 Expression Medium (INVITROGEN). Вкратце, клетки разбавляли до 7,5×107 клеток/25,5 мл и трансфицировали с помощью реагента ExpiFectamine 293 в день 0. Через приблизительно 16 часов после трансфекции в каждую колбу добавляли 150 мкл ExpiFectamine 293 Transfection Enhancer 1 и 1,5 мл ExpiFectamine 293 Transfection Enhancer 2. Супернатант отбирали в день 4. Эти антигены очищали с помощью колонки Ni-NTA Superflow (QIAGEN). Взаимодействие анализировали, как описывается ниже. Очищенное антитело B захватывали антителом к Fc человеческого IgG, фиксированным на сенсорном чипе CM5 (GE Healthcare). Очищенные белки слияния Notch4-NRR вводили в сенсорный чип при 8 различных концентрациях и регистрировали их взаимодействие и диссоциацию согласно инструкциям изготовителя.
[0166]
Таблица 29. Вычисляемые кинетические параметры антитела B
[0167]
Кинетический анализ других ингибиторных гуманизированных антител к Notch4 выполняли следующим образом. Белки слияния на основе Fc-домена Notch4-NRR человека экспрессировали с помощью линии клеток CHO. Антиген в культуральном супернатанте захватывался антителом к Notch4 человека, фиксированным на сенсорном чипе CM5, который распознает разные эпитопы Notch4 человека. Затем гуманизированное антитело к Notch4 человека вводили в сенсорный чип при различных концентрациях. Его взаимодействие и константы диссоциации вычисляли согласно инструкциям изготовителя. Результаты приведены в таблице 30.
[0168]
В приведенной ниже таблице, например, описание "HK2L3 (Lys-)" означает, что вариабельный участок тяжелой цепи гуманизированного антитела к Notch4 человека, используемого в эксперименте, представляет собой вариабельный участок тяжелой цепи HK2 гуманизированного антитела к Notch4 человека в примере 1, вариабельный участок легкой цепи представляет собой вариабельный участок легкой цепи L3 гуманизированного антитела к Notch4 человека в примере 1, а лизин (Lys), расположенный на C-конце тяжелой цепи обычного человеческого антитела, в данном антителе удален. Отсутствие описания "(Lys-)" означает, что Lys, расположенный на C-конце тяжелой цепи человеческого антитела, не удален.
[0169]
Таблица 30
Рассчитанные кинетические параметры гуманизированных ингибиторных антител к Notch4 по отношению к белку слияния Notch4-NRR человека
[0170]
Подобные приведенным в вышеупомянутой таблице 30 результаты экспериментов, выполняемых с дополнительными антителами, представлены в таблице 31.
[0171]
Таблица 31
[0172]
Пример 4: in vivo фармакологический тест с использованием антитела к Notch4 человека (противоопухолевый эффект и эффект подавления антителом B перфузии крови на ксенотрансплантатной модели Calu6)
[0173]
Линию клеток Calu6 немелкоклеточного рака легкого человека (№ в ATCC HTB-56), культивируемую в культуральной среде EMEM, содержащей 10% FBS, заменимые аминокислоты MEM, натрия пируват и пенициллин/стрептомицин, получали с концентрацией 1,6×108 клеток/мл с культуральной средой EMEM и смешивали с Matrigel™ (№ по каталогу CORNING 354234) при 1:1 для получения клеточной суспензии 8,0×107 клеток/мл. Дозу 0,1 мл подкожно трансплантировали в правый задний дорсальный участок голым мышам возрастом 6 недель (CAnN.Cg-Foxn1nu/CrlCrlj, самки, CHARLES RIVER LABORATORIES JAPAN, INC.). Через двадцать восемь дней после трансплантации измеряли опухоль по малой и большой осям с помощью электронного цифрового штангенциркуля (DIGIMATIC™ CALIPER, Mitsutoyo Corporation) и объем опухоли (TV) вычисляли по следующей расчетной формуле.
[0174]
TV (мм3)=большая ось (мм) x малая ось (мм) x малая ось (мм)/2.
[0175]
Выполняли рандомизацию на основании объема опухоли в первый день введения так, чтобы среднее значение объемов опухоли было приблизительно равным в группах. Антитело B разбавляли непосредственно перед введением так, что соотношение раствора среды (25 мM гистидина, 250 мM сахарозы и 0,05% Tween80 (pH 5,3)) и солевого раствора составляло 1:9 с получением 0,1, 0,3 и 1,0 мг/мл оцениваемых образцов (группа с введением 1, 3 и 10 мг/кг, соответственно). Оцениваемые образцы вводили путем инъекции в хвостовую вену при дозировке 0,2 мл/20 г массы тела мыши дважды в неделю (в день 1 и день 4, если считать день распределения по группам как день 1). Для контрольной группы 11,6 мг/мл контрольного IgG (ChromPure Human IgG, полная молекула, Jackson ImmunoResearch Laboratories, № по каталогу 009-000-003) разбавляли с помощью PBS до 1,0 мг/мл и вводили путем инъекции в хвостовую вену в дозе 0,2 мл/20 г массы тела мыши (объем введения 10 мг/кг). Эксперимент выполняли с 8 мышами на группу. Относительный объем опухоли (RTV) вычисляли для каждой группы, получавшей контрольный IgG, и группы с введением антитела B по следующей формуле и показали на фигуре 2A.
[0176]
RTV=объем опухоли в день измерения/объем опухоли в начале введения.
[0177]
Антитело B демонстрировало значительный противоопухолевый эффект при всех дозировках на ксенотрансплантатной модели Calu6.
[0178]
Перфузию крови в опухоли оценивали путем определения флуоресценции с помощью ядерного окрашивания клеток вокруг кровеносных сосудов флуоресцентным красителем (Hoechst), вводимым в хвостовую вену (Funahashi et al. (2014), Cancer Sci., 105(10), 1334-42.). После измерения диаметра опухоли в последний день теста 10 мг/мл Hoechst 33342 (Life technologies, № по каталогу H3570) разбавляли до 2 x с помощью PBS и 5,0 мг/мл разбавленного Hoechst 33342 вводили в хвостовую вену в дозе 0,1 мл/животное. Мышей подвергали эвтаназии путем цервикальной дислокации через 5 минут после инъекции Hoechst, и отобранные опухоли заливали OCT Compound (Sakura Finetek Japan Co., Ltd., № по каталогу 4583) для получения замороженных блоков.
[0179]
Кровеносные сосуды опухоли в замороженных срезах подвергали иммунофлуоресцентному окрашиванию антителом к CD31 (конъюгированным с FITC, BD Pharmingen, № по каталогу 553372) и флуоресценцию Hoechst в участках кровеносных сосудов опухоли (по 5 на опухоль) фотографировали с помощью флуоресцентного микроскопа BIOREVO (KEYENCE, BZ-9000). Hoechst-позитивный участок определяли с помощью программного обеспечения для анализа изображений (Lumina Vision ver 2.2.2, MITANI CORPORATION) и усредненное для каждого опухолевого среза вычисляли и показали на фигуре 2B.
[0180]
Антитело B демонстрировало значительный эффект подавления перфузии крови при всех дозировках на ксенотрансплантатной модели Calu6.
[0181]
Пример 5: комбинированное применение антитела B и цисплатина на ксенотрансплантатной модели Calu6
[0182]
Линию клеток Calu6 немелкоклеточного рака легкого человека (№ в ATCC HTB-56), культивируемую в культуральной среде EMEM, содержащей 10% FBS и пенициллин/стрептомицин, получали при концентрации 1,2×108 клеток/мл с культуральной средой EMEM и смешивали с Matrigel™ (№ по каталогу CORNING 354234) при 1:1 для получения клеточной суспензии 6,0×107 клеток/мл. Дозу 0,1 мл подкожно трансплантировали в правый задний дорсальный участок голым мышам возрастом 7 недель (CAnN.Cg-Foxn1nu/CrlCrlj, самки, CHARLES RIVER LABORATORIES JAPAN, INC.). Через двадцать семь дней после трансплантации измеряли опухоль по малой и большой осям с помощью электронного цифрового штангенциркуля (DIGIMATIC™ CALIPER, Mitsutoyo Corporation) и объем опухоли (TV) вычисляли по следующей расчетной формуле.
[0183]
Объем опухоли TV (мм3)=большая ось (мм) x малая ось (мм) x малая ось (мм)/2.
[0184]
Выполняли рандомизацию на основании объема опухоли в первый день введения так, чтобы среднее значение объемов опухоли было приблизительно равным в группах. Для антитела B 10,34 мг/мл раствора (среда: 25 мM фосфата, 200 мM трегалозы и 0,05% Tween80 (pH 5,5)) разбавляли PBS непосредственно перед введением для получения раствора с концентрацией 2,5 мг/мл и вводили его путем внутривенной инъекции при дозировке 0,2 мл (500 мкг)/животное, дважды в неделю в течение 5 недель. Цисплатин вводили один раз в первый день введения путем введения в хвостовую вену при дозировке 10 мг/кг. Эксперимент выполняли с 4 мышами на группу. Относительный объем опухоли (RTV) вычисляли для каждой контрольной (не получавшей лечение) группы, группы с введением антитела B, группы с введением цисплатина и группы с комбинированным введением антитело B+цисплатин согласно следующей формуле и показали на фигуре 3.
[0185]
RTV=объем опухоли в день измерения/объем опухоли в начале введения.
[0186]
Комбинированное применение антитела B и цисплатина демонстрировало существенно превышающий противоопухолевый эффект по сравнению с цисплатином отдельно на ксенотрансплантатной модели Calu6.
[0187]
Пример 6: комбинированное применение антитела B и ленватиниба мезилата на ксенотрансплантатной модели FTC238
[0188]
Линию клеток FTC238 рака щитовидной железы человека (приобретенную в Sumitomo Dainippon Pharma Co., Ltd.), культивируемую в культуральной среде DMEM/F12 HAM (1:1), содержащей 10% FBS и пенициллин/стрептомицин, получали при концентрации 1,2×108 клеток/мл с культуральной средой DMEM/F12 HAM (1:1) и смешивали с Matrigel™ (CORNING № по каталогу 354234) при 1:1 для получения клеточной суспензии 6,0×107 клеток/мл. Дозу 0,1 мл подкожно трансплантировали в правый бок голым мышам возрастом 7 недель (CAnN.Cg-Foxn1nu/CrlCrlj, самки, CHARLES RIVER LABORATORIES JAPAN, INC.) Через восемь дней после трансплантации измеряли опухоль по малой и большой осям с помощью электронного цифрового штангенциркуля (DIGIMATIC™ CALIPER, Mitsutoyo Corporation) и объем опухоли (TV) вычисляли по следующей расчетной формуле.
[0189]
Объем опухоли TV (мм3)=большая ось (мм) x малая ось (мм) x малая ось (мм)/2.
[0190]
Выполняли рандомизацию на основании объема опухоли в первый день введения так, чтобы среднее значение объемов опухоли было приблизительно равным в группах. Для антитела B 10,8 мг/мл антитела B (среда: 25 мM гистидина и 250 мM сахарозы (pH 5,3)) разбавляли непосредственно перед введением раствором среды с получением 2,5 мг/мл антитела B и вводили его путем инъекции в хвостовую вену при дозировке 0,2 мл (500 мкг)/животное, дважды в неделю в течение 2 недель. Ленватиниба мезилат перорально вводили при дозировке 10 мг/кг, один раз в день в течение 12 дней. Эксперимент выполняли с 5 мышами на группу. Относительный объем опухоли (RTV) вычисляли для каждой контрольной (не получавшей лечение) группы, группы с введением антитела B, группы с введением ленватиниба мезилата и группы с комбинированным введением антитело B+ленватиниба мезилат согласно следующей формуле и показали на фигуре 4.
[0191]
RTV=объем опухоли в день измерения/объем опухоли в начале введения.
[0192]
Комбинированное применение антитела B и ленватиниба мезилата демонстрировало существенно превышающий противоопухолевый эффект по сравнению с антителом B, вводимым отдельно, или ленватиниба мезилатом отдельно на ксенотрансплантатной модели FTC238.
[0193]
Пример 7: комбинированное применение мышиного антитела 6-3-A6 и паклитаксела на ксенотрансплантатной модели DU145
[0194]
Линию клеток DU145 рака предстательной железы человека (№ в ATCC HTB-81), культивируемую в культуральной среде RPMI1640, содержащей 10% FBS, натрия пируват, 2-меркаптоэтанол и пенициллин/стрептомицин, получали при концентрации 6,0×107 клеток/мл с культуральной средой RPMI1640. Дозу 0,1 мл подкожно трансплантировали в правый бок голым мышам возрастом 6 недель (CAnN.Cg-Foxn1nu/CrlCrlj, самки, CHARLES RIVER LABORATORIES JAPAN, INC.). Через двадцать четыре дня после трансплантации измеряли опухоль по малой и большой осям с помощью электронного цифрового штангенциркуля (DIGIMATIC™ CALIPER, Mitsutoyo Corporation) и объем опухоли TV вычисляли по следующей расчетной формуле.
[0195]
Объем опухоли TV (мм3)=большая ось (мм) x малая ось (мм) x малая ось (мм)/2.
[0196]
Выполняли рандомизацию на основании объема опухоли в первый день введения так, чтобы среднее значение объемов опухоли было приблизительно равным в группах. Для 6-3-A6 5,11 мг/мл 6-3-A6 (среда: PBS) разбавляли PBS непосредственно перед введением с получением 2,5 мг/мл 6-3-A6 и вводили его путем инъекции в хвостовую вену в дозировке 0,2 мл (500 мкг)/животное, дважды в неделю в течение 4 недель. Паклитаксел вводили путем введения в хвостовую вену в дозе 20 мг/кг, один раз в день в течение 5 дней. Эксперимент выполняли с 4 мышами на группу. Объем опухоли (TV) каждой из контрольной (не получавшей лечение) группы, группы с введением 6-3-A6, группы с введением паклитаксела и группы с комбинированным введением 6-3-A6+паклитаксел показан на фигуре 5.
[0197]
Комбинированное применение 6-3-A6 и паклитаксела демонстрировало существенно превышающий противоопухолевый эффект по сравнению с 6-3-A6 отдельно или паклитакселом отдельно на ксенотрансплантатной модели DU145.
[0198]
Пример 8: комбинация антитела B с ленватиниба мезилатом на ксенотрансплантатной модели гепатоцеллюлярной карциномы, полученной от пациента.
[0199]
Для проверки противоопухолевого эффекта антитела B в отношении гепатоцеллюлярной карциномы (HCC), LI0050, использовали полученную от пациента ксенотрансплантатную модель HuPrime® (Crown Bioscience Inc.). LI0050 представляет собой мышиную модель, инокулированную первичными опухолевыми тканями от пациента-женщины с HCC, которая, как сообщалось, устойчива к сорафенибу (публикация международной патентной заявки WO2015/031604).
Фрагменты опухоли от исходных мышей LI0050 собирали и фрагмент диаметром 2-4 мм инокулировали подкожно в правый бок голым мышам BALB/c для развития опухоли. Размер опухоли измеряли в двух направлениях с использованием штангенциркуля и объем опухоли (TV) вычисляли по следующей расчетной формуле.
[0200]
Объем опухоли TV (мм3)=большая ось (мм) x малая ось (мм) x малая ось (мм)/2.
[0201]
Лечение начинали при достижении среднего размера опухоли приблизительно 192 мм3. Выполняли рандомизацию на основании объема опухоли в первый день введения так, чтобы среднее значение объемов опухоли было приблизительно равным в группах. Каждая группа состояла из 10 мышей. День рандомизации отмечали как день 0. От дня 0 до дня 13 мышей каждой группы обрабатывали один раз в день каждым из (i) контроля (3 мM HCl), (ii) ленватиниба мезилата (10 мг/кг), (iii) сорафениба тозилата (30 мг/кг) или (iv) ленватиниба мезилата (10 мг/кг) плюс антитело B (0,5 мг/мышь).
Для сравнения двух групп использовали t-критерий для независимых выборок.
[0202]
Комбинация антитела B и ленватиниба мезилата демонстрировала существенно превышающий противоопухолевый эффект по сравнению с контрольной группой.
[0203]
Пример 9: сравнение ингибиторной активности поликлонального антитела к Notch4 человека и антитела B в отношении сигнала
[0204]
Далее ингибиторные активности поликлонального антитела к Notch4 человека (Santa Cruz, SC8643, далее N-17) и антитела B в отношении сигнала сравнивали с помощью системы анализа с геном-репортером люциферазы Notch4-GAL4.
[0205]
Использовали Slide-A-Lyzer (Thermo scientific, 66333) для выполнения диализа при 4°C в течение 8 часов в PBS для удаления азида натрия, содержащегося в N-17. После концентрирования диализированного раствора N-17 на Amicon Ultra (Millipore, UFC503096) концентрацию измеряли с помощью микроспектрофотометра (Nano Drop, Thermo).
[0206]
Рекомбинантный человеческий DLL4 (R&D Systems, 1506-D4-050/CF) растворяли в PBS для получения 10 мкг/мл раствора (далее в данном документе раствор DLL4). В плоскодонном 96-луночном белом планшете (Greiner, 655083) распределяли 50 мкл/лунка (500 нг/лунка) раствора DLL4 и 50 мкл/лунка PBS для лунок без стимуляции и оставляли на ночь при 4°C для обеспечения перехода DLL4 в твердую фазу в 96-луночном белом планшете. Репортерные клетки суспендировали в культуральной среде D-MEM, содержащей 10% фетальной бычьей сыворотки (FBS) и пенициллин/стрептомицин, с получением клеточной суспензии при 1×10^5/мл. Каждую лунку с DLL4 в твердой фазе промывали три раза с помощью PBS и высевали 50 мкл/лунка (5000 клеток/лунка) клеточной суспензии. После диализа/концентрирования разведения N-17 или разведения антитела B разбавляли культуральной средой (конечные концентрации: 0, 0,01, 0,1, 1 и 10 мкг/мл) добавляли по 50 мкл и культивировали при 37°C в течение 22 часов. Люциферазную активность репортерных клеток оценивали с помощью Steady-Glo Assay System (Promega, E2510) следующим образом.
[0207]
Сто микролитров раствора Steady-Glo добавляли в каждую лунку после культивирования, перемешивали, а затем оставляли при комнатной температуре на 30 минут. Люминесценцию измеряли с помощью планшет-ридера Multilabel Plate Reader (Envision 2102-0020, Perkin Elmer). Относительную люминесценция вычисляли по измеренному значению люминесценции в соответствии со следующей формулой.
[0208]
Относительная люминесценция (%)=(интенсивность люминесценции в лунке с образцом - средняя интенсивность люминесценции в лунках без стимуляции)/(средняя интенсивность люминесценции в контрольных лунках - средняя интенсивность люминесценции в лунках без стимуляции).
[0209]
На фигуре 7 показана взаимосвязь концентрации антитела B и относительного значения люминесценции (%). На графике на фигуре 7 показано усредненное значение результатов трех независимых тестов, и планка погрешностей показывает его стандартное отклонение. Ингибиторную активность в отношении сигнала подтверждали для антитела B, но для N-17 ингибиторную активность N-17 в отношении сигнала Notch4 не наблюдали в диапазоне исследуемых концентраций.
[0210]
Пример 10: анализ кинетических показателей связывания между антителом B и рекомбинантным растворимым доменом Notch NRR человека
[0211]
Анализ кинетических показателей с использованием BIAcore T100 выполняли для определения взаимодействия домена NRR изотипов Notch человека (Notch1, Notch2, Notch3 и Notch4) и антитела B. Антитело B очищали от культурального супернатанта линии клеток CHO, стабильно экспрессирующей антитело B, с последующим применением аффинной хроматографии с белком А, анионообменной хроматографии Capto Q и катионообменной хроматографии UNOsphere S. Создавали белки слияния домена Notch1 NRR человека (№ доступа в Genbank 017617; положения в последовательности 1307-1733), домена Notch2 NRR человека (№ доступа в Genbank 024408; положения в последовательности 1239-1650), домена Notch3 NRR человека (№ доступа в Genbank 000435; положения в последовательности 1246-1641) и домена Notch4 NRR человека (№ доступа в Genbank NP_004548,3; положения в последовательности 1046-1445) с секреторной щелочной фосфатазой (SEAP), гемагглютининовой (HA) меткой и гистидиновой меткой (x 10) и очищали их с помощью колонки HisTrap™ Fast Flow (GE Healthcare). Взаимодействие между антителом B и доменом NRR каждого из изотипов Notch человека измеряли следующим способом. Очищенное антитело B захватывали антителом к Fc человеческого IgG, фиксированным на сенсорном чипе CM5 (GE Healthcare). Очищенный домен NRR каждого изотипа Notch человека вводили в сенсорный чип при 6 различных концентрациях и наблюдали взаимодействие и диссоциацию антителом согласно инструкции по эксплуатации.
[0212]
Перекрывающаяся сенсограмма взаимодействия и вычисляемые кинетические параметры показаны на фигуре 8 и в таблице 32.
[0213]
Таблица 32
Вычисляемые кинетические параметры взаимодействия между антителом B и белками слияния Notch4-NRR человека
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> EISAI R&D MANAGEMENT CO., LTD.
<120> АНТИТЕЛО К NOTCH4 ЧЕЛОВЕКА
<130> ESAP1402F
<150> US 62/148,253
<151> 2015-04-16
<160> 65
<170> PatentIn версия 3.5
<210> 1
<211> 2003
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Met Gln Pro Pro Ser Leu Leu Leu Leu Leu Leu Leu Leu Leu Leu Leu
1 5 10 15
Cys Val Ser Val Val Arg Pro Arg Gly Leu Leu Cys Gly Ser Phe Pro
20 25 30
Glu Pro Cys Ala Asn Gly Gly Thr Cys Leu Ser Leu Ser Leu Gly Gln
35 40 45
Gly Thr Cys Gln Cys Ala Pro Gly Phe Leu Gly Glu Thr Cys Gln Phe
50 55 60
Pro Asp Pro Cys Gln Asn Ala Gln Leu Cys Gln Asn Gly Gly Ser Cys
65 70 75 80
Gln Ala Leu Leu Pro Ala Pro Leu Gly Leu Pro Ser Ser Pro Ser Pro
85 90 95
Leu Thr Pro Ser Phe Leu Cys Thr Cys Leu Pro Gly Phe Thr Gly Glu
100 105 110
Arg Cys Gln Ala Lys Leu Glu Asp Pro Cys Pro Pro Ser Phe Cys Ser
115 120 125
Lys Arg Gly Arg Cys His Ile Gln Ala Ser Gly Arg Pro Gln Cys Ser
130 135 140
Cys Met Pro Gly Trp Thr Gly Glu Gln Cys Gln Leu Arg Asp Phe Cys
145 150 155 160
Ser Ala Asn Pro Cys Val Asn Gly Gly Val Cys Leu Ala Thr Tyr Pro
165 170 175
Gln Ile Gln Cys His Cys Pro Pro Gly Phe Glu Gly His Ala Cys Glu
180 185 190
Arg Asp Val Asn Glu Cys Phe Gln Asp Pro Gly Pro Cys Pro Lys Gly
195 200 205
Thr Ser Cys His Asn Thr Leu Gly Ser Phe Gln Cys Leu Cys Pro Val
210 215 220
Gly Gln Glu Gly Pro Arg Cys Glu Leu Arg Ala Gly Pro Cys Pro Pro
225 230 235 240
Arg Gly Cys Ser Asn Gly Gly Thr Cys Gln Leu Met Pro Glu Lys Asp
245 250 255
Ser Thr Phe His Leu Cys Leu Cys Pro Pro Gly Phe Ile Gly Pro Asp
260 265 270
Cys Glu Val Asn Pro Asp Asn Cys Val Ser His Gln Cys Gln Asn Gly
275 280 285
Gly Thr Cys Gln Asp Gly Leu Asp Thr Tyr Thr Cys Leu Cys Pro Glu
290 295 300
Thr Trp Thr Gly Trp Asp Cys Ser Glu Asp Val Asp Glu Cys Glu Thr
305 310 315 320
Gln Gly Pro Pro His Cys Arg Asn Gly Gly Thr Cys Gln Asn Ser Ala
325 330 335
Gly Ser Phe His Cys Val Cys Val Ser Gly Trp Gly Gly Thr Ser Cys
340 345 350
Glu Glu Asn Leu Asp Asp Cys Ile Ala Ala Thr Cys Ala Pro Gly Ser
355 360 365
Thr Cys Ile Asp Arg Val Gly Ser Phe Ser Cys Leu Cys Pro Pro Gly
370 375 380
Arg Thr Gly Leu Leu Cys His Leu Glu Asp Met Cys Leu Ser Gln Pro
385 390 395 400
Cys His Gly Asp Ala Gln Cys Ser Thr Asn Pro Leu Thr Gly Ser Thr
405 410 415
Leu Cys Leu Cys Gln Pro Gly Tyr Ser Gly Pro Thr Cys His Gln Asp
420 425 430
Leu Asp Glu Cys Leu Met Ala Gln Gln Gly Pro Ser Pro Cys Glu His
435 440 445
Gly Gly Ser Cys Leu Asn Thr Pro Gly Ser Phe Asn Cys Leu Cys Pro
450 455 460
Pro Gly Tyr Thr Gly Ser Arg Cys Glu Ala Asp His Asn Glu Cys Leu
465 470 475 480
Ser Gln Pro Cys His Pro Gly Ser Thr Cys Leu Asp Leu Leu Ala Thr
485 490 495
Phe His Cys Leu Cys Pro Pro Gly Leu Glu Gly Gln Leu Cys Glu Val
500 505 510
Glu Thr Asn Glu Cys Ala Ser Ala Pro Cys Leu Asn His Ala Asp Cys
515 520 525
His Asp Leu Leu Asn Gly Phe Gln Cys Ile Cys Leu Pro Gly Phe Ser
530 535 540
Gly Thr Arg Cys Glu Glu Asp Ile Asp Glu Cys Arg Ser Ser Pro Cys
545 550 555 560
Ala Asn Gly Gly Gln Cys Gln Asp Gln Pro Gly Ala Phe His Cys Lys
565 570 575
Cys Leu Pro Gly Phe Glu Gly Pro Arg Cys Gln Thr Glu Val Asp Glu
580 585 590
Cys Leu Ser Asp Pro Cys Pro Val Gly Ala Ser Cys Leu Asp Leu Pro
595 600 605
Gly Ala Phe Phe Cys Leu Cys Pro Ser Gly Phe Thr Gly Gln Leu Cys
610 615 620
Glu Val Pro Leu Cys Ala Pro Asn Leu Cys Gln Pro Lys Gln Ile Cys
625 630 635 640
Lys Asp Gln Lys Asp Lys Ala Asn Cys Leu Cys Pro Asp Gly Ser Pro
645 650 655
Gly Cys Ala Pro Pro Glu Asp Asn Cys Thr Cys His His Gly His Cys
660 665 670
Gln Arg Ser Ser Cys Val Cys Asp Val Gly Trp Thr Gly Pro Glu Cys
675 680 685
Glu Ala Glu Leu Gly Gly Cys Ile Ser Ala Pro Cys Ala His Gly Gly
690 695 700
Thr Cys Tyr Pro Gln Pro Ser Gly Tyr Asn Cys Thr Cys Pro Thr Gly
705 710 715 720
Tyr Thr Gly Pro Thr Cys Ser Glu Glu Met Thr Ala Cys His Ser Gly
725 730 735
Pro Cys Leu Asn Gly Gly Ser Cys Asn Pro Ser Pro Gly Gly Tyr Tyr
740 745 750
Cys Thr Cys Pro Pro Ser His Thr Gly Pro Gln Cys Gln Thr Ser Thr
755 760 765
Asp Tyr Cys Val Ser Ala Pro Cys Phe Asn Gly Gly Thr Cys Val Asn
770 775 780
Arg Pro Gly Thr Phe Ser Cys Leu Cys Ala Met Gly Phe Gln Gly Pro
785 790 795 800
Arg Cys Glu Gly Lys Leu Arg Pro Ser Cys Ala Asp Ser Pro Cys Arg
805 810 815
Asn Arg Ala Thr Cys Gln Asp Ser Pro Gln Gly Pro Arg Cys Leu Cys
820 825 830
Pro Thr Gly Tyr Thr Gly Gly Ser Cys Gln Thr Leu Met Asp Leu Cys
835 840 845
Ala Gln Lys Pro Cys Pro Arg Asn Ser His Cys Leu Gln Thr Gly Pro
850 855 860
Ser Phe His Cys Leu Cys Leu Gln Gly Trp Thr Gly Pro Leu Cys Asn
865 870 875 880
Leu Pro Leu Ser Ser Cys Gln Lys Ala Ala Leu Ser Gln Gly Ile Asp
885 890 895
Val Ser Ser Leu Cys His Asn Gly Gly Leu Cys Val Asp Ser Gly Pro
900 905 910
Ser Tyr Phe Cys His Cys Pro Pro Gly Phe Gln Gly Ser Leu Cys Gln
915 920 925
Asp His Val Asn Pro Cys Glu Ser Arg Pro Cys Gln Asn Gly Ala Thr
930 935 940
Cys Met Ala Gln Pro Ser Gly Tyr Leu Cys Gln Cys Ala Pro Gly Tyr
945 950 955 960
Asp Gly Gln Asn Cys Ser Lys Glu Leu Asp Ala Cys Gln Ser Gln Pro
965 970 975
Cys His Asn His Gly Thr Cys Thr Pro Lys Pro Gly Gly Phe His Cys
980 985 990
Ala Cys Pro Pro Gly Phe Val Gly Leu Arg Cys Glu Gly Asp Val Asp
995 1000 1005
Glu Cys Leu Asp Gln Pro Cys His Pro Thr Gly Thr Ala Ala Cys
1010 1015 1020
His Ser Leu Ala Asn Ala Phe Tyr Cys Gln Cys Leu Pro Gly His
1025 1030 1035
Thr Gly Gln Trp Cys Glu Val Glu Ile Asp Pro Cys His Ser Gln
1040 1045 1050
Pro Cys Phe His Gly Gly Thr Cys Glu Ala Thr Ala Gly Ser Pro
1055 1060 1065
Leu Gly Phe Ile Cys His Cys Pro Lys Gly Phe Glu Gly Pro Thr
1070 1075 1080
Cys Ser His Arg Ala Pro Ser Cys Gly Phe His His Cys His His
1085 1090 1095
Gly Gly Leu Cys Leu Pro Ser Pro Lys Pro Gly Phe Pro Pro Arg
1100 1105 1110
Cys Ala Cys Leu Ser Gly Tyr Gly Gly Pro Asp Cys Leu Thr Pro
1115 1120 1125
Pro Ala Pro Lys Gly Cys Gly Pro Pro Ser Pro Cys Leu Tyr Asn
1130 1135 1140
Gly Ser Cys Ser Glu Thr Thr Gly Leu Gly Gly Pro Gly Phe Arg
1145 1150 1155
Cys Ser Cys Pro His Ser Ser Pro Gly Pro Arg Cys Gln Lys Pro
1160 1165 1170
Gly Ala Lys Gly Cys Glu Gly Arg Ser Gly Asp Gly Ala Cys Asp
1175 1180 1185
Ala Gly Cys Ser Gly Pro Gly Gly Asn Trp Asp Gly Gly Asp Cys
1190 1195 1200
Ser Leu Gly Val Pro Asp Pro Trp Lys Gly Cys Pro Ser His Ser
1205 1210 1215
Arg Cys Trp Leu Leu Phe Arg Asp Gly Gln Cys His Pro Gln Cys
1220 1225 1230
Asp Ser Glu Glu Cys Leu Phe Asp Gly Tyr Asp Cys Glu Thr Pro
1235 1240 1245
Pro Ala Cys Thr Pro Ala Tyr Asp Gln Tyr Cys His Asp His Phe
1250 1255 1260
His Asn Gly His Cys Glu Lys Gly Cys Asn Thr Ala Glu Cys Gly
1265 1270 1275
Trp Asp Gly Gly Asp Cys Arg Pro Glu Asp Gly Asp Pro Glu Trp
1280 1285 1290
Gly Pro Ser Leu Ala Leu Leu Val Val Leu Ser Pro Pro Ala Leu
1295 1300 1305
Asp Gln Gln Leu Phe Ala Leu Ala Arg Val Leu Ser Leu Thr Leu
1310 1315 1320
Arg Val Gly Leu Trp Val Arg Lys Asp Arg Asp Gly Arg Asp Met
1325 1330 1335
Val Tyr Pro Tyr Pro Gly Ala Arg Ala Glu Glu Lys Leu Gly Gly
1340 1345 1350
Thr Arg Asp Pro Thr Tyr Gln Glu Arg Ala Ala Pro Gln Thr Gln
1355 1360 1365
Pro Leu Gly Lys Glu Thr Asp Ser Leu Ser Ala Gly Phe Val Val
1370 1375 1380
Val Met Gly Val Asp Leu Ser Arg Cys Gly Pro Asp His Pro Ala
1385 1390 1395
Ser Arg Cys Pro Trp Asp Pro Gly Leu Leu Leu Arg Phe Leu Ala
1400 1405 1410
Ala Met Ala Ala Val Gly Ala Leu Glu Pro Leu Leu Pro Gly Pro
1415 1420 1425
Leu Leu Ala Val His Pro His Ala Gly Thr Ala Pro Pro Ala Asn
1430 1435 1440
Gln Leu Pro Trp Pro Val Leu Cys Ser Pro Val Ala Gly Val Ile
1445 1450 1455
Leu Leu Ala Leu Gly Ala Leu Leu Val Leu Gln Leu Ile Arg Arg
1460 1465 1470
Arg Arg Arg Glu His Gly Ala Leu Trp Leu Pro Pro Gly Phe Thr
1475 1480 1485
Arg Arg Pro Arg Thr Gln Ser Ala Pro His Arg Arg Arg Pro Pro
1490 1495 1500
Leu Gly Glu Asp Ser Ile Gly Leu Lys Ala Leu Lys Pro Lys Ala
1505 1510 1515
Glu Val Asp Glu Asp Gly Val Val Met Cys Ser Gly Pro Glu Glu
1520 1525 1530
Gly Glu Glu Val Gly Gln Ala Glu Glu Thr Gly Pro Pro Ser Thr
1535 1540 1545
Cys Gln Leu Trp Ser Leu Ser Gly Gly Cys Gly Ala Leu Pro Gln
1550 1555 1560
Ala Ala Met Leu Thr Pro Pro Gln Glu Ser Glu Met Glu Ala Pro
1565 1570 1575
Asp Leu Asp Thr Arg Gly Pro Asp Gly Val Thr Pro Leu Met Ser
1580 1585 1590
Ala Val Cys Cys Gly Glu Val Gln Ser Gly Thr Phe Gln Gly Ala
1595 1600 1605
Trp Leu Gly Cys Pro Glu Pro Trp Glu Pro Leu Leu Asp Gly Gly
1610 1615 1620
Ala Cys Pro Gln Ala His Thr Val Gly Thr Gly Glu Thr Pro Leu
1625 1630 1635
His Leu Ala Ala Arg Phe Ser Arg Pro Thr Ala Ala Arg Arg Leu
1640 1645 1650
Leu Glu Ala Gly Ala Asn Pro Asn Gln Pro Asp Arg Ala Gly Arg
1655 1660 1665
Thr Pro Leu His Ala Ala Val Ala Ala Asp Ala Arg Glu Val Cys
1670 1675 1680
Gln Leu Leu Leu Arg Ser Arg Gln Thr Ala Val Asp Ala Arg Thr
1685 1690 1695
Glu Asp Gly Thr Thr Pro Leu Met Leu Ala Ala Arg Leu Ala Val
1700 1705 1710
Glu Asp Leu Val Glu Glu Leu Ile Ala Ala Gln Ala Asp Val Gly
1715 1720 1725
Ala Arg Asp Lys Trp Gly Lys Thr Ala Leu His Trp Ala Ala Ala
1730 1735 1740
Val Asn Asn Ala Arg Ala Ala Arg Ser Leu Leu Gln Ala Gly Ala
1745 1750 1755
Asp Lys Asp Ala Gln Asp Asn Arg Glu Gln Thr Pro Leu Phe Leu
1760 1765 1770
Ala Ala Arg Glu Gly Ala Val Glu Val Ala Gln Leu Leu Leu Gly
1775 1780 1785
Leu Gly Ala Ala Arg Glu Leu Arg Asp Gln Ala Gly Leu Ala Pro
1790 1795 1800
Ala Asp Val Ala His Gln Arg Asn His Trp Asp Leu Leu Thr Leu
1805 1810 1815
Leu Glu Gly Ala Gly Pro Pro Glu Ala Arg His Lys Ala Thr Pro
1820 1825 1830
Gly Arg Glu Ala Gly Pro Phe Pro Arg Ala Arg Thr Val Ser Val
1835 1840 1845
Ser Val Pro Pro His Gly Gly Gly Ala Leu Pro Arg Cys Arg Thr
1850 1855 1860
Leu Ser Ala Gly Ala Gly Pro Arg Gly Gly Gly Ala Cys Leu Gln
1865 1870 1875
Ala Arg Thr Trp Ser Val Asp Leu Ala Ala Arg Gly Gly Gly Ala
1880 1885 1890
Tyr Ser His Cys Arg Ser Leu Ser Gly Val Gly Ala Gly Gly Gly
1895 1900 1905
Pro Thr Pro Arg Gly Arg Arg Phe Ser Ala Gly Met Arg Gly Pro
1910 1915 1920
Arg Pro Asn Pro Ala Ile Met Arg Gly Arg Tyr Gly Val Ala Ala
1925 1930 1935
Gly Arg Gly Gly Arg Val Ser Thr Asp Asp Trp Pro Cys Asp Trp
1940 1945 1950
Val Ala Leu Gly Ala Cys Gly Ser Ala Ser Asn Ile Pro Ile Pro
1955 1960 1965
Pro Pro Cys Leu Thr Pro Ser Pro Glu Arg Gly Ser Pro Gln Leu
1970 1975 1980
Asp Cys Gly Pro Pro Ala Leu Gln Glu Met Pro Ile Asn Gln Gly
1985 1990 1995
Gly Glu Gly Lys Lys
2000
<210> 2
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический праймер
<400> 2
acatcactcc gt 12
<210> 3
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический праймер
<400> 3
acggagtgat gtccgtcgac gtatctctgc gttgatactt cagcgtagct 50
<210> 4
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический праймер
<400> 4
agctacgctg aagtatcaac gcagag 26
<210> 5
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический праймер
<400> 5
gccagtggat agactgatgg 20
<210> 6
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический праймер
<400> 6
gatggataca gttggtgcag c 21
<210> 7
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 7
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Asp Lys Arg Leu Glu Leu Val
35 40 45
Ala Thr Ile Asn Ser Asn Gly Gly Arg Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ala
115
<210> 8
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 8
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 9
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 9
gaggtgcagc tggtggagtc tgggggaggc ttagtgcagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt agctatggca tgtcttgggt tcgccagact 120
ccagacaaga ggctggagtt ggtcgcaacc attaatagta atggtggtag aacctattat 180
ccagacagtg tgaagggccg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctgcaaatga gcagtctgaa gtctgaggac acagccatgt attactgtgc aagagaccag 300
ggttttgctt actggggcca agggactctg gtcactgtct ctgca 345
<210> 10
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 10
gacattgtga tgacccagtc tcacaaattc atgtccacat cagtaggaga cagggtcagc 60
atcacctgca aggccagtca ggatgtgggt actgctgtag cctggtatca acagaaacca 120
gggcaatctc ctaaactact gatttactgg gcatccaccc ggcacactgg agtccctgat 180
cgcttcacag gcagtggatc tgggacagat ttcactctca ccattagcaa tgtgcagtct 240
gaagacttgg cagattattt ctgtcagcaa tatagcagct atccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa a 321
<210> 11
<211> 441
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Asp Lys Arg Leu Glu Leu Val
35 40 45
Ala Thr Ile Asn Ser Asn Gly Gly Arg Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ala Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
115 120 125
Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val
130 135 140
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
145 150 155 160
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
165 170 175
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly
180 185 190
Thr Gln Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys
195 200 205
Val Asp Lys Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys
210 215 220
Pro Ala Pro Pro Ala Ala Ala Pro Ser Val Phe Leu Phe Pro Pro Lys
225 230 235 240
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
245 250 255
Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
260 265 270
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
275 280 285
Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His
290 295 300
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
305 310 315 320
Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln
325 330 335
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
340 345 350
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
355 360 365
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
370 375 380
Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu
385 390 395 400
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
405 410 415
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
420 425 430
Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 12
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 12
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 13
<211> 1326
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 13
gaggtgcagc tggtggagtc tgggggaggc ttagtgcagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt agctatggca tgtcttgggt tcgccagact 120
ccagacaaga ggctggagtt ggtcgcaacc attaatagta atggtggtag aacctattat 180
ccagacagtg tgaagggccg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctgcaaatga gcagtctgaa gtctgaggac acagccatgt attactgtgc aagagaccag 300
ggttttgctt actggggcca agggactctg gtcactgtct ctgcagctag cacaaaaggc 360
ccctctgtct tccctctggc tccctgctcc cgctccacct ccgagtccac tgccgctctg 420
ggctgtctgg tcaaggatta cttccctgag ccagtcactg tgagttggaa ctcaggcgcc 480
ctgaccagcg gagtccacac atttcccgct gtgctgcaga gctccggcct gtactccctg 540
tctagtgtgg tcaccgtgcc ttcaagcaat ttcgggactc agacctatac atgcaacgtg 600
gaccataagc catctaatac taaggtcgat aaaaccgtgg agcgaaaatg ctgcgtggaa 660
tgcccacctt gtcctgctcc accagccgct gcaccaagcg tgttcctgtt tcctccaaag 720
cccaaagaca cactgatgat cagcagaact cctgaggtca cctgcgtggt cgtggacgtg 780
tcccacgagg atcccgaagt ccagtttaac tggtacgtgg atggggtcga agtgcataat 840
gcaaagacta aacctcggga ggaacagttc aactctacct ttagagtcgt gagtgtgctg 900
acagtcgtgc accaggactg gctgaacgga aaggagtata agtgcaaagt gtctaataag 960
ggcctgcccg cccctatcga gaaaacaatt agtaagacta aaggccagcc aagggaaccc 1020
caggtgtaca cactgccccc tagtcgcgag gaaatgacaa agaaccaggt ctcactgact 1080
tgtctggtga aagggttcta tccatccgac attgccgtgg agtgggaatc taatggacag 1140
cccgaaaaca attacaagac cacaccaccc atgctggaca gcgatggatc cttctttctg 1200
tattcaaagc tgaccgtgga taaaagccgg tggcagcagg gcaatgtctt ttcctgctct 1260
gtgatgcacg aagccctgca caaccactac actcagaagt ccctgtccct gtctcctggc 1320
aaatga 1326
<210> 14
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 14
gacattgtga tgacccagtc tcacaaattc atgtccacat cagtaggaga cagggtcagc 60
atcacctgca aggccagtca ggatgtgggt actgctgtag cctggtatca acagaaacca 120
gggcaatctc ctaaactact gatttactgg gcatccaccc ggcacactgg agtccctgat 180
cgcttcacag gcagtggatc tgggacagat ttcactctca ccattagcaa tgtgcagtct 240
gaagacttgg cagattattt ctgtcagcaa tatagcagct atccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa acgtacggtc gccgccccct ccgtgtttat ttttcctcca 360
tctgacgaac agctgaagag tgggaccgcc tccgtggtgt gcctgctgaa caatttctac 420
ccccgggagg ccaaggtgca gtggaaagtc gacaacgctc tgcagtctgg caatagtcag 480
gagtcagtga ctgaacagga cagcaaggat tccacctatt ctctgagctc caccctgaca 540
ctgagcaaag cagattacga aaagcacaaa gtctatgcct gcgaagtgac ccaccagggg 600
ctgagcagtc cagtgaccaa gtcctttaac aggggagagt gttga 645
<210> 15
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 15
Ser Tyr Gly Met Ser
1 5
<210> 16
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 16
Gly Phe Thr Phe Ser Ser Tyr Gly Met Ser
1 5 10
<210> 17
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 17
Thr Ile Asn Ser Asn Gly Gly Arg Thr Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
Gly
<210> 18
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 18
Thr Ile Asn Ser Asn Gly Gly Arg Thr Tyr
1 5 10
<210> 19
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 19
Asp Gln Gly Phe Ala Tyr
1 5
<210> 20
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 20
Lys Ala Ser Gln Asp Val Gly Thr Ala Val Ala
1 5 10
<210> 21
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 21
Trp Ala Ser Thr Arg His Thr
1 5
<210> 22
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический пептид
<400> 22
Gln Gln Tyr Ser Ser Tyr Pro Trp Thr
1 5
<210> 23
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 23
agctatggca tgtct 15
<210> 24
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 24
ggattcactt tcagtagcta tggcatgtct 30
<210> 25
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 25
accattaata gtaatggtgg tagaacctat tatccagaca gtgtgaaggg c 51
<210> 26
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 26
accattaata gtaatggtgg tagaacctat 30
<210> 27
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 27
gaccagggtt ttgcttac 18
<210> 28
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 28
aaggccagtc aggatgtggg tactgctgta gcc 33
<210> 29
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 29
tgggcatcca cccggcacac t 21
<210> 30
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 30
cagcaatata gcagctatcc gtggacg 27
<210> 31
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 31
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Tyr Val
35 40 45
Ser Thr Ile Asn Ser Asn Gly Gly Arg Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Gly Ser Leu Arg Ala Glu Asp Met Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 32
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 32
gaggtgcagc tggtcgagag cggagggggg ctggtgcagc caggagggtc tctgaggctg 60
agttgcgccg cttcaggctt caccttcagc tcctacggga tgtcttgggt gcgccaggct 120
ccagggaagg gactggagta tgtcagcacc atcaactcca atggaggccg aacatactat 180
cctgactccg tgaagggccg gttcactatc tctagagata acagtaagaa caccctgtac 240
ctgcagatgg gcagcctgag agcagaagac atggccgtct actattgtgc aagggatcag 300
ggattcgcat actggggaca gggaactctg gtgaccgtct caagc 345
<210> 33
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 33
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Val
35 40 45
Ser Thr Ile Asn Ser Asn Gly Gly Arg Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Gly Ser Leu Arg Ala Glu Asp Met Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 34
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 34
gaagtgcagc tggtcgagag cgggggaggg ctggtgcagc caggagggtc tctgaggctg 60
agttgcgccg cttcaggctt caccttcagc tcctacggga tgtcttgggt gcgccaggct 120
ccagggaagg gactggagct ggtcagcacc atcaactcca atggaggccg aacatactat 180
cctgactccg tgaagggccg gttcactatc tctagagata acagtaagaa caccctgtat 240
ctgcagatgg gcagcctgag agcagaagac atggccgtct actattgtgc ccgagatcag 300
gggttcgctt attggggaca ggggacactg gtgaccgtga gcagc 345
<210> 35
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 35
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Val
35 40 45
Ala Thr Ile Asn Ser Asn Gly Gly Arg Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Gly Ser Leu Lys Ala Glu Asp Met Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 36
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 36
gaagtgcagc tggtcgagag tgggggaggc ctggtgcagc caggagggtc tctgaggctg 60
agttgcgccg cttcaggctt caccttcagc tcctacggga tgtcctgggt gcgccaggct 120
ccagggaaag gactggagct ggtcgccacc atcaactcta atggaggccg aacatactat 180
cctgacagtg tgaagggccg gttcactatt agcagagata actccaaaaa taccctgtat 240
ctgcagatgg gcagcctgaa ggcagaagac atggccgtct actattgtgc tcgggatcag 300
gggttcgcct attgggggca ggggactctg gtcactgtct cttcc 345
<210> 37
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 37
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Tyr Val
35 40 45
Ser Thr Ile Asn Ser Asn Gly Gly Arg Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Gly Ser Leu Arg Ala Glu Asp Met Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 38
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 38
gaagtgcagc tggtcgaatc tgggggggga ctggtgcagc caggagggtc tctgaggctg 60
agttgcgccg cttcaggctt caccttcagc tcctacggga tgtcttgggt gcgccaggct 120
cctgggaagg gactggagta tgtcagcacc atcaactcca atggaggccg aacatactat 180
gccaactccg tgaagggccg gttcactatc tctagagaca acagtaagaa caccctgtac 240
ctgcagatgg gcagcctgag agcagaagat atggccgtct actattgtgc tcgggatcag 300
ggctttgctt attggggaca ggggacactg gtcaccgtct cctcc 345
<210> 39
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 39
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Val
35 40 45
Ser Thr Ile Asn Ser Asn Gly Gly Arg Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Gly Ser Leu Arg Ala Glu Asp Met Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gln Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 40
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 40
gaggtgcagc tggtcgaatc cggggggggg ctggtgcagc caggagggtc tctgaggctg 60
agttgcgccg cttcaggctt caccttcagc tcctacggga tgtcttgggt gcgccaggct 120
cctgggaagg gactggagct ggtcagcacc atcaactcca atggaggccg aacatactat 180
gccaactccg tgaagggccg gttcactatc tctagagaca acagtaagaa caccctgtat 240
ctgcagatgg gcagcctgag agcagaagat atggccgtct actattgtgc tcgggatcag 300
ggcttcgcct actgggggca gggaacactg gtcaccgtct cctca 345
<210> 41
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 41
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 42
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 42
gacattcaga tgacacagag cccttcatct ctgagtgcat cagtgggaga cagggtcacc 60
atcacatgca aagccagcca ggatgtggga accgcagtcg cttggtacca gcagaagccc 120
gggaaagtgc ctaagctgct gatctactgg gctagtacac ggcacactgg cgtcccatcc 180
agattcagcg gctccgggtc tggaaccgac tttactctga ccatcagctc cctgcagccc 240
gaggatgtgg ccacatacta ttgccagcag tattcatctt atccttggac cttcggacag 300
ggaacaaaag tggaaatcaa a 321
<210> 43
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 43
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 44
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 44
gatattcaga tgactcagag cccctcctct ctgagtgcat cagtgggaga cagggtcacc 60
atcacatgca aagccagcca ggatgtggga accgcagtcg cttggtacca gcagaagccc 120
gggaaagtgc ctaagctgct gatctactgg gctagtacac ggcacactgg cgtcccatcc 180
agattcagcg gctccgggtc tggaaccgac tttactctga ccatcagctc cctgcagccc 240
gaggatgtgg ccacatactt ctgccagcag tattcatcct atccttggac cttcggacag 300
ggaactaaag tggagattaa g 321
<210> 45
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 45
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ser Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 46
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 46
gaaattgtga tgacccagtc tcccgccaca ctgtctgtga gtccaggaga gagggcaact 60
ctgtcttgca aggccagtca ggacgtggga accgcagtcg cttggtacca gcagaaaccc 120
gggcaggctc ctcggctgct gatctattgg gcatccactc ggcacaccgg cattcccgcc 180
agattctcag gcagcgggtc cggaacagag tttaccctga caatcagctc cctgcagagc 240
gaagatttcg ctgtctacta ttgccagcag tattctagtt atccttggac attcggccag 300
ggaacaaaag tggaaatcaa a 321
<210> 47
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 47
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 48
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 48
gaaatcgtga tgacccagag ccccgcaaca ctgtctgtga gtccaggaga gagggcaact 60
ctgtcttgca aggccagtca ggacgtggga accgcagtcg cttggtacca gcagaaaccc 120
gggcaggctc ctcggctgct gatctattgg gcatccactc ggcacaccgg cattcccgcc 180
agattctcag gcagcgggtc cggaacagag tttaccctga caatcagctc cctgcagagc 240
gaagatttcg ctgtctactt ttgccagcag tattcatcct atccttggac cttcggacag 300
ggaacaaaag tggaaatcaa a 321
<210> 49
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 49
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 50
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 50
gatatccaga tgacccagtc cccaagctcc ctgtccgcat ctgtgggcga ccgggtcacc 60
attacatgta aagccagtca ggatgtggga acagccgtcg cttggtacca gcagaagccc 120
ggcaaatctc ctaagctgct gatctattgg gcttccacac ggcacactgg cgtgccctct 180
agattcagtg gctcagggag cggaacagac tttactctga ccatttctag tctgcagcca 240
gaggatgtgg caacttactt ctgccagcag tactcaagct atccctggac ctttggccag 300
gggacaaaag tcgaaatcaa g 321
<210> 51
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 51
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 52
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 52
gaaatcgtga tgacccagag ccccgcaaca ctgtctgtga gtccaggaga gagggcaact 60
ctgtcttgca aggccagtca ggacgtggga accgcagtcg cttggtacca gcagaaaccc 120
gggcagtctc ctcggctgct gatctattgg gcatccactc ggcacaccgg cattcccgcc 180
agattctcag gcagcgggtc cggaacagag tttaccctga caatcagctc cctgcagagc 240
gaagatttcg ctgtctactt ttgccagcag tattcatcct atccttggac cttcggacag 300
ggaacaaaag tggaaatcaa a 321
<210> 53
<211> 326
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 53
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Ala Ala Ala Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly Lys
325
<210> 54
<211> 981
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 54
gctagcacaa aaggcccctc tgtcttccct ctggctccct gctcccgctc cacctccgag 60
tccactgccg ctctgggctg tctggtcaag gattacttcc ctgagccagt cactgtgagt 120
tggaactcag gcgccctgac cagcggagtc cacacatttc ccgctgtgct gcagagctcc 180
ggcctgtact ccctgtctag tgtggtcacc gtgccttcaa gcaatttcgg gactcagacc 240
tatacatgca acgtggacca taagccatct aatactaagg tcgataaaac cgtggagcga 300
aaatgctgcg tggaatgccc accttgtcct gctccaccag ccgctgcacc aagcgtgttc 360
ctgtttcctc caaagcccaa agacacactg atgatcagca gaactcctga ggtcacctgc 420
gtggtcgtgg acgtgtccca cgaggatccc gaagtccagt ttaactggta cgtggatggg 480
gtcgaagtgc ataatgcaaa gactaaacct cgggaggaac agttcaactc tacctttaga 540
gtcgtgagtg tgctgacagt cgtgcaccag gactggctga acggaaagga gtataagtgc 600
aaagtgtcta ataagggcct gcccgcccct atcgagaaaa caattagtaa gactaaaggc 660
cagccaaggg aaccccaggt gtacacactg ccccctagtc gcgaggaaat gacaaagaac 720
caggtctcac tgacttgtct ggtgaaaggg ttctatccat ccgacattgc cgtggagtgg 780
gaatctaatg gacagcccga aaacaattac aagaccacac cacccatgct ggacagcgat 840
ggatccttct ttctgtattc aaagctgacc gtggataaaa gccggtggca gcagggcaat 900
gtcttttcct gctctgtgat gcacgaagcc ctgcacaacc actacactca gaagtccctg 960
tccctgtctc ctggcaaatg a 981
<210> 55
<211> 325
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 55
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro
100 105 110
Pro Ala Ala Ala Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
115 120 125
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
130 135 140
Val Ser His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
145 150 155 160
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
165 170 175
Ser Thr Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp
180 185 190
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
195 200 205
Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu
210 215 220
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
225 230 235 240
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
245 250 255
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
260 265 270
Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
275 280 285
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
290 295 300
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
305 310 315 320
Ser Leu Ser Pro Gly
325
<210> 56
<211> 978
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 56
gctagcacaa aaggcccctc tgtcttccct ctggctccct gctcccgctc cacctccgag 60
tccactgccg ctctgggctg tctggtcaag gattacttcc ctgagccagt cactgtgagt 120
tggaactcag gcgccctgac cagcggagtc cacacatttc ccgctgtgct gcagagctcc 180
ggcctgtact ccctgtctag tgtggtcacc gtgccttcaa gcaatttcgg gactcagacc 240
tatacatgca acgtggacca taagccatct aatactaagg tcgataaaac cgtggagcga 300
aaatgctgcg tggaatgccc accttgtcct gctccaccag ccgctgcacc aagcgtgttc 360
ctgtttcctc caaagcccaa agacacactg atgatcagca gaactcctga ggtcacctgc 420
gtggtcgtgg acgtgtccca cgaggatccc gaagtccagt ttaactggta cgtggatggg 480
gtcgaagtgc ataatgcaaa gactaaacct cgggaggaac agttcaactc tacctttaga 540
gtcgtgagtg tgctgacagt cgtgcaccag gactggctga acggaaagga gtataagtgc 600
aaagtgtcta ataagggcct gcccgcccct atcgagaaaa caattagtaa gactaaaggc 660
cagccaaggg aaccccaggt gtacacactg ccccctagtc gcgaggaaat gacaaagaac 720
caggtctcac tgacttgtct ggtgaaaggg ttctatccat ccgacattgc cgtggagtgg 780
gaatctaatg gacagcccga aaacaattac aagaccacac cacccatgct ggacagcgat 840
ggatccttct ttctgtattc aaagctgacc gtggataaaa gccggtggca gcagggcaat 900
gtcttttcct gctctgtgat gcacgaagcc ctgcacaacc actacactca gaagtccctg 960
tccctgtctc ctggctga 978
<210> 57
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полипептид
<400> 57
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 58
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 58
cgtacggtcg ccgccccctc cgtgtttatt tttcctccat ctgacgaaca gctgaagagt 60
gggaccgcct ccgtggtgtg cctgctgaac aatttctacc cccgggaggc caaggtgcag 120
tggaaagtcg acaacgctct gcagtctggc aatagtcagg agtcagtgac tgaacaggac 180
agcaaggatt ccacctattc tctgagctcc accctgacac tgagcaaagc agattacgaa 240
aagcacaaag tctatgcctg cgaagtgacc caccaggggc tgagcagtcc agtgaccaag 300
tcctttaaca ggggagagtg ttga 324
<210> 59
<211> 1323
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 59
gaagtgcagc tggtcgaatc tggggggggt ctggtgcagc caggcggatc cctgagactg 60
agctgcgccg cttctgggtt cacattttcc agctacggca tgtcctgggt ccgccaggct 120
ccaggcaagg gactggagct ggtgagtaca atcaactcaa atgggggtcg aacttactat 180
cccgactccg tgaagggcag gttcactatt tcccgggata acagcaaaaa taccctgtac 240
ctgcagatgg ggtccctgcg agctgaagac atggcagtgt actattgtgc ccgtgatcag 300
ggtttcgctt attgggggca gggtactctg gtcaccgtgt ctagtgcttc taccaaggga 360
ccatccgtgt tcccactggc accatgctcc cggagcacat ctgagagtac tgcagccctg 420
ggctgtctgg tgaaggacta tttccctgaa ccagtcacag tgagctggaa ctctggcgca 480
ctgacaagcg gagtccacac ttttcctgcc gtgctgcagt catccggcct gtactctctg 540
agctctgtgg tcactgtccc cagttcaaat ttcggaactc agacctatac atgcaacgtg 600
gaccataagc ctagcaatac caaggtcgat aaaacagtgg agcgtaaatg ctgcgtggaa 660
tgcccacctt gtccagcacc accagctgca gccccttccg tgttcctgtt tcctccaaag 720
ccaaaagaca ccctgatgat ctctagaacc cccgaggtca catgcgtggt cgtggacgtg 780
agtcacgagg atcctgaagt ccagtttaac tggtacgtgg atggcgtcga agtgcataat 840
gccaagacaa aaccaagaga ggaacagttc aactcaacct ttcgcgtcgt gtccgtgctg 900
acagtcgtgc accaggattg gctgaacggc aaggagtata agtgcaaagt gtccaataag 960
ggactgcccg ctcctatcga gaaaactatt tccaagacca aaggacagcc tagggaacca 1020
caggtgtaca ctctgccccc ttcccgggag gaaatgacta agaaccaggt cagcctgacc 1080
tgtctggtga aagggttcta tcctagtgac attgccgtgg agtgggaatc aaatggtcag 1140
ccagagaaca attacaagac cacaccaccc atgctggaca gtgatggctc attctttctg 1200
tatagcaagc tgaccgtcga taaatctagg tggcagcagg gaaacgtgtt ctcctgctcc 1260
gtgatgcacg aagcactgca caaccattac acccagaaat ccctgagcct gtcccccggc 1320
tga 1323
<210> 60
<211> 1323
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 60
gaggtgcagc tggtcgagtc cggggggggt ctggtgcagc caggaggatc cctgaggctg 60
agctgcgccg cttctgggtt cacattttcc agctacggca tgtcctgggt ccggcaggca 120
ccaggcaagg gactggagct ggtggccaca atcaacagta atgggggtag aacttactat 180
cccgactcag tgaagggcag gttcactatt agtcgggata actcaaaaaa taccctgtac 240
ctgcagatgg ggtccctgaa ggctgaagac atggcagtgt actattgtgc ccgcgatcag 300
ggtttcgctt attgggggca gggtactctg gtcaccgtgt ctagtgcctc caccaaaggg 360
cccagcgtgt ttccactggc tccctgctcc cgaagcacat ctgagagtac tgcagccctg 420
ggctgtctgg tgaaggacta tttccctgaa ccagtcacag tgagctggaa ctctggcgct 480
ctgacatctg gagtccacac ttttcctgca gtgctgcagt catccggcct gtactccctg 540
agctctgtgg tcactgtccc cagttcaaat ttcggaactc agacctatac atgcaacgtg 600
gaccataaac ctagcaatac caaggtcgat aaaacagtgg agcggaagtg ctgtgtggaa 660
tgcccacctt gtccagctcc accagctgca gccccttctg tgttcctgtt tcctccaaag 720
ccaaaagaca ccctgatgat cagcaggacc cccgaggtca catgtgtggt cgtggacgtg 780
tctcacgagg atcctgaagt ccagtttaac tggtacgtgg atggcgtcga agtgcataat 840
gcaaagacaa aaccaagaga ggaacagttc aactctacct ttcgcgtcgt gagtgtgctg 900
acagtcgtgc accaggattg gctgaacggc aaggagtata agtgcaaagt gtccaataag 960
ggactgcccg cccctatcga gaaaactatt agcaagacca aaggacagcc tcgagaacca 1020
caggtgtaca ctctgccccc tagtcgtgag gaaatgacta agaaccaggt ctccctgacc 1080
tgtctggtga aagggttcta tcctagcgac attgccgtgg agtgggaatc taatggtcag 1140
ccagagaaca attacaagac cacaccaccc atgctggaca gtgatggctc attctttctg 1200
tattcaaagc tgaccgtcga taaatccagg tggcagcagg gaaatgtgtt ttcatgctcc 1260
gtgatgcacg aagccctgca caaccattac acccagaaga gcctgtccct gagccccggc 1320
tga 1323
<210> 61
<211> 1323
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 61
gaagtgcagc tggtcgagtc tggggggggg ctggtgcagc ctggcggatc cctgagactg 60
agctgcgccg cttctgggtt cacattttcc agctacggca tgtcctgggt ccgccaggca 120
ccaggcaagg gactggagct ggtgagtaca atcaactcaa atgggggtcg aacttactat 180
gctaactccg tgaagggcag gttcactatt tcccgggaca acagcaaaaa taccctgtac 240
ctgcagatgg ggtccctgcg agctgaagac atggcagtgt actattgtgc ccgtgatcag 300
ggtttcgctt attgggggca gggtactctg gtcaccgtgt ctagtgcttc taccaagggg 360
cccagtgtgt ttccactggc accctgctcc cggagcacat ctgagagtac tgcagccctg 420
ggctgtctgg tgaaggatta tttccctgaa ccagtcacag tgagctggaa ctctggcgca 480
ctgacaagcg gagtccacac ttttcctgcc gtgctgcagt catccggcct gtactctctg 540
agctctgtgg tcactgtccc cagttcaaat ttcggaactc agacctatac atgcaacgtg 600
gaccataagc ctagcaatac caaggtcgat aaaacagtgg agcgtaaatg ctgtgtggaa 660
tgcccacctt gtccagctcc accagctgca gccccttctg tgttcctgtt tcctccaaag 720
ccaaaagaca ccctgatgat ctctagaacc cccgaggtca catgtgtggt cgtggacgtc 780
agtcacgagg atccagaagt ccagtttaac tggtacgtgg atggcgtcga agtgcataat 840
gcaaagacaa aacccagaga ggaacagttc aactcaacct ttcgcgtcgt gtccgtgctg 900
acagtcgtgc accaggactg gctgaacggc aaggagtata agtgcaaagt gtccaataag 960
ggactgcccg cccctatcga gaaaactatt tccaagacca aaggacagcc tagggaacca 1020
caggtgtaca ctctgccccc ttcccgggag gaaatgacta agaaccaggt cagcctgacc 1080
tgtctggtga aagggttcta tcctagtgac attgccgtgg agtgggaatc aaatggtcag 1140
ccagagaaca attacaagac cacaccaccc atgctggaca gtgatggctc attctttctg 1200
tatagcaagc tgaccgtcga taaatctagg tggcagcagg gaaatgtgtt ttcatgctcc 1260
gtgatgcacg aagccctgca caaccactac acacagaaaa gcctgagcct gagccccggc 1320
tga 1323
<210> 62
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 62
gaaatcgtga tgactcagtc ccccgctaca ctgagcgtgt ctcccggaga gagagctact 60
ctgtcttgca aggcaagtca ggacgtggga actgcagtcg cctggtacca gcagaaacca 120
ggacaggcac cacgactgct gatctattgg gctagtacaa ggcacactgg cattcctgcc 180
cggttcagtg gctcaggatc cgggacagag tttaccctga caatctccag cctgcagtcc 240
gaagatttcg ctgtgtacta ttgccagcag tactctagtt atccttggac ctttggtcag 300
ggcacaaagg tcgagatcaa acgaaccgtg gccgctccaa gcgtcttcat ttttccccct 360
tctgacgaac agctgaagtc aggtacagcc tccgtggtct gtctgctgaa caatttctac 420
ccaagggagg caaaggtgca gtggaaagtc gataacgccc tgcagagcgg caattctcag 480
gagagtgtga ctgaacagga ctcaaaggat tccacctata gcctgtcatc cactctgacc 540
ctgagcaaag ctgactacga aaagcataaa gtgtatgcat gtgaagtcac acaccagggt 600
ctgagttctc cagtcaccaa atcttttaat agaggcgagt gctga 645
<210> 63
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 63
gaaatcgtga tgacccagtc tcctgctaca ctgagcgtgt ctcccggaga gagagctact 60
ctgtcttgca aggcaagtca ggacgtggga actgcagtcg cctggtacca gcagaaacca 120
ggacaggcac cacgactgct gatctattgg gctagtacaa ggcacactgg cattcctgcc 180
cggttcagtg gctcaggatc cgggacagag tttaccctga caatctccag cctgcagtcc 240
gaagatttcg ctgtgtactt ttgccagcag tactctagtt atccttggac cttcggtcag 300
ggcacaaagg tcgagatcaa acgaaccgtg gccgctccaa gcgtcttcat ttttccccct 360
tctgacgaac agctgaagtc aggtacagcc tccgtggtct gtctgctgaa caatttttac 420
ccaagggagg caaaggtgca gtggaaagtc gataacgccc tgcagagcgg caattctcag 480
gagagtgtga ctgaacagga ctcaaaggat tccacctata gcctgtcatc cactctgacc 540
ctgagcaaag ctgactacga aaagcataaa gtgtatgcat gtgaagtcac acaccagggt 600
ctgtccagtc cagtcaccaa atcctttaat cggggagagt gctga 645
<210> 64
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 64
gatattcaga tgacccagtc tccttccagc ctgtctgcaa gtgtgggaga cagggtcacc 60
atcacatgca aagcctccca ggatgtggga accgcagtcg cctggtacca gcagaagcca 120
gggaaaagcc ccaagctgct gatctactgg gcttctacca ggcacacagg cgtgccaagt 180
cggttctcag gctccggaag cgggaccgac tttactctga ccatctccag cctgcagcct 240
gaggatgtgg caacatactt ctgccagcag tactctagtt atccatggac ttttggtcag 300
ggcaccaaag tcgagatcaa gagaactgtg gccgctccct ccgtcttcat ttttccccct 360
agcgacgaac agctgaagag tggtacagcc tcagtggtct gtctgctgaa caatttctac 420
cctagggagg ctaaagtgca gtggaaggtc gataacgcac tgcagtctgg caatagtcag 480
gagtcagtga cagaacagga ctccaaagat agcacttatt ctctgtcatc cacactgact 540
ctgtctaagg ccgactacga aaagcataaa gtgtatgctt gtgaggtcac acaccagggt 600
ctgagcagtc cagtcaccaa gagctttaac cgaggagagt gctga 645
<210> 65
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 65
gaaatcgtga tgacccagtc tcctgctaca ctgagcgtgt ctcccggaga gagagctact 60
ctgtcttgca aggcaagtca ggacgtggga actgcagtcg cctggtacca gcagaaacca 120
gggcagagtc cccgcctgct gatctattgg gcctccacaa ggcacactgg cattcctgct 180
cggttcagtg gctcaggatc cgggacagag tttaccctga caatctccag cctgcagagc 240
gaagatttcg ccgtgtactt ttgccagcag tactctagtt atccttggac cttcggtcag 300
ggcacaaagg tcgagatcaa acgaaccgtg gccgctccaa gcgtcttcat ttttccccct 360
tctgacgaac agctgaagtc aggtacagct tccgtggtct gtctgctgaa caatttttac 420
ccaagggagg caaaggtgca gtggaaagtc gataacgccc tgcagagcgg caattctcag 480
gagagtgtga ctgaacagga ctcaaaggat tccacctata gcctgtcatc cactctgacc 540
ctgtctaaag ctgactacga aaagcataaa gtgtatgcat gtgaagtcac ccaccagggg 600
ctgagtagtc cagtcaccaa gagttttaat cggggcgagt gttga 645
<---
Реферат
Изобретение относится к области биохимии, в частности к анти-Notch4 антителу и его Notch4-связывающему фрагменту. Также раскрыта фармацевтическая композиция, содержащая указанное антитело. Изобретение обладает способностью эффективно лечить заболевания, ассоциированные с Notch4. 2 н. и 18 з.п. ф-лы, 8 ил., 32 табл., 10 пр.
Формула
Документы, цитированные в отчёте о поиске
Композиции гуманизированных слитых белков notch и способы лечения

Комментарии