Покрытие для интралюминального расширяющегося катетера, обеспечивающее контактную доставку микрорезервуаров с лекарственным средством - RU2721655C2
Код документа: RU2721655C2
Чертежи



Описание
ВКЛЮЧЕНИЕ ЛЮБЫХ ПРИОРИТЕТНЫХ ЗАЯВОК ПОСРЕДСТВОМ ССЫЛКИ
[0001] Любые и все заявки, для которых в Информационном листке заявки, поданном с настоящей заявкой, указано заявление на приоритет в иностранном государстве или внутренний приоритет в США, тем самым включены в настоящую заявку посредством ссылки согласно п. 1,57 раздела 37 Свода законов США.
УРОВЕНЬ ТЕХНИКИ
Область техники
[0002] Настоящее описание относится к области доставки лекарственного средства посредством расширяемых катетеров.
Описание уровня техники
[0003] Баллонная ангиопластика является признанным способом лечения сосудистых заболеваний посредством физического расширения области атеросклероза, стеноза или уменьшения внутрипросветного диаметра в пораженном кровеносном сосуде. Ангиопластику обычно осуществляют с помощью катетера, который может быть введен в пораженную область в пределах кровеносной системы. Катетер имеет баллон на дистальном конце, который накачивают, чтобы дилатировать и расширить область стеноза. Во многих случаях, например, в случае коронарных артерий, стент также расширяется на наружной стороне баллона. Стент остается на месте после откачивания воздуха и удаления баллона для поддержания раскрытого состояния расширенного просвета.
[0004] Для достижения физического расширения сосуда, большие силы воздействуют на ткани сосуда во время накачивания баллона высоким давлением. Физическое расширение приводит к травмированию сосуда, в том числе повреждению эндотелия, фрагментации внутреннего эластичного слоя, и рассечению средней части оболочки сосуда. Повреждение часто распространяется также на внешнюю адвентициальную оболочку. Биологический ответ сосуда проходит через тромботическую фазу в течение от 0 до 3 дней с участием активации и адгезии тромбоцитов и образованием тромба. После тромботической фазы следует рекрут-фаза клеток в течение от 3 до 8 дней, которая включает инфильтрацию воспалительных клеток, макрофагов и лимфоцитов в месте повреждения сосуда. Высвобождение факторов роста и цитокинов из воспалительных клеток приводит к пролиферативной фазе в течение от 8 до 14 дней, в которой дремлющие клетки гладкой мускулатуры в средней части оболочки сосуда стимулируются к пролиферации. Впоследствии миграция пролиферирующих гладкомышечных клеток во внутреннюю оболочку и тромб в просвете приводит к гиперплазии неоинтимы, первичному компоненту рестеноза. Хотя пролиферация клеток прекращается через 14 дней, продолжительное продуцирование внеклеточного матрикса клетками гладкой мускулатуры продолжает увеличивать степень гиперплазии неоинтимы и рестеноза. Рестеноз эффективно обращает дилатационное лечение и потенциально создает критическую угрозу для пациента. Клинические исследования показали, что рестеноз в целом возникает в период от 1 до 3 месяцев после баллонной ангиопластики, и рестеноз обычно достигает максимума приблизительно через 3 месяца.
[0005] Хотя баллонная ангиопластика обеспечивает критическое увеличение кровотока в пораженных сосудах, рестеноз возникает из-за степени связанных механических повреждений. Одной из стратегий снижения ответа рестеноза является высвобождение лекарственных средств в сосуд в комбинации с лечением посредством баллонной дилатации для борьбы с воспалением и для ответа заживления. Подходы включают покрытие баллона лекарственными средствами, такими как паклитаксел и сиролимус (рапамицин), которые ограничивают клеточную пролиферацию. Полагают, что во время контакта баллона с внутрипросветной поверхностью сосуда покрытие облегчает доставку лекарственного средства к месту повреждения сосуда. С помощью данных способов пытаются обеспечить концентрацию лекарственного средства, достаточную для уменьшения рестеноза, вызванного пролиферацией клеток, и в то же время достаточно низкую, чтобы свести к минимуму токсичность по отношению к сосуду, которая может привести к повреждению или патологии сосуда. Полагают, что желательно поддерживать эффективную концентрацию лекарственного средства в течение периода времени, достаточного для минимизации рестеноза.
[0006] На практике, доставка лекарственных средств к тканям стенки сосуда с помощью баллонов, покрытых лекарственным средством, как описано в данной области, ограничивается коротким периодом времени, в течение которого баллон может быть приведен в контакт с сосудом. Как правило, накачивание баллона во время ангиопластики проводят в течение приблизительно от 30 до приблизительно 120 секунд, чтобы ограничить сердечную ишемию и возможные осложнения и дискомфорт у пациента. Данного кратковременного накачивания баллона и доставки лекарственных средств может быть достаточно для противоопухолевого лекарственного средства паклитаксела, который продемонстрировал ингибирование образования неоинтимы у животных после нескольких минут времени действия. Тем не менее, чтобы обеспечить максимальный терапевтический эффект и свести к минимуму потенциальную токсичность высоких доз по отношению к сосуду, было бы желательно обеспечить доставку лекарственных средств к сосуду в течение длительного периода времени, в идеале, более продолжительности накачивания баллона. Кроме того, лекарственные средства, такие как сиролимус и его аналоги, обладают как антипролиферативной, так и противовоспалительной активностью, которая может обеспечить преимущество вне острого периода рестеноза при доставке в течение длительного периода времени.
[0007] Во многих баллонах с покрытием, содержащим лекарственное средство, описанных в известном уровне техники, используют высокие начальные уровни активного агента и многократное лечение, чтобы создать высокую начальную концентрацию лечения, но затем концентрация быстро падает. Это нежелательно, так как большая часть активного агента на устройстве теряется из-за возможной эмболии частиц в кровоток или путем диффузии от места лечения.
[0008] Многие из покрытий, содержащих лекарственное средство, описанные в известном уровне техники, содержат гидрофильные полимеры и вспомогательные вещества, или вспомогательные вещества, которые являются жидкими при температуре тела. Такие гидрофильные составы покрытий обеспечивают гидрофильную матрицу для гидрофобных частиц лекарственного средства и могут быть эффективными при переносе лекарственного средства к стенке сосуда. Тем не менее, такие покрытия не обеспечивают значительной устойчивости к вымыванию кровью или во время перемещения баллона к месту лечения, или после переноса лекарственного средства к поверхности сосуда.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0009] В некоторых вариантах реализации предложено покрытие для расширяемой части катетера, содержащее гидрофобную матрицу и диспергированную фазу, при этом диспергированная фаза содержит множество микрорезервуаров, диспергированных в гидрофобной матрице, при этом множество микрорезервуаров содержит первый активный агент, перемешанный или диспергированный в биоразлагаемом или биоразрушаемом полимере. В некоторых вариантах реализации предложено покрытие, в котором диспергированная фаза содержит множество микрорезервуаров, диспергированных в гидрофобной матрице, при этом некоторые из множества микрорезервуаров содержат первый активный агент и биоразлагаемый или биоразрушаемый полимер.
[0010] В некоторых вариантах реализации предложен катетер, содержащий расширяемую часть на удлиненном теле, и покрытие, как описано в настоящем документе, на расширяемой части. В некоторых вариантах реализации катетер дополнительно содержит разделительный слой между расширяемой частью и покрытием, при этом разделительный слой выполнен, чтобы высвобождать покрытие из расширяемой части. В некоторых вариантах реализации катетер дополнительно содержит защитное покрытие над покрытием, содержащим микрорезервуары.
[0011] В некоторых вариантах реализации предложен состав покрытия для расширяемой части катетера, содержащий твердую часть и жидкость. Твердая часть содержит множество микрорезервуаров и по меньшей мере одно гидрофобное соединение. Множество микрорезервуаров содержит первый активный агент и биоразлагаемый или биоразрушаемый полимер. Жидкость диспергирует или растворяет по меньшей мере одно гидрофобное соединение и суспендирует множество микрорезервуаров.
[0012] В некоторых вариантах реализации предложен способ нанесения покрытия на расширяемую часть катетера, включающий нанесение покрывающего состава, описанного в настоящем документе, на поверхность накачанной расширяемой части катетера, выпаривание жидкости и откачивание воздуха из расширяемой части.
[0013] В некоторых вариантах реализации предложен способ лечения или предотвращения состояния в месте лечения, включающий введение катетера, содержащего расширяемую часть, к месту лечения, при этом расширяемая часть покрыта покрытием, описанным в настоящем документе, накачивание расширяемой части, чтобы обеспечить контакт между покрытием и тканью в месте лечения, спуск воздуха из расширяемой части, и удаление катетера.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0014] Характеристики и аспекты и преимущества вариантов реализации настоящего изобретения подробно описаны ниже со ссылками на прилагаемые чертежи различных вариантов реализации, которые предназначены для иллюстрации и не ограничивают настоящее изобретение. Данные чертежи изображают только некоторые варианты реализации настоящего изобретения в соответствии с настоящим описанием и не должны рассматриваться как ограничивающие его объем.
[0015] На фиг. 1 изображен один вариант реализации баллонного катетера с покрытием на расширяемой части катетера.
[0016] На фиг. 2 изображен один вариант реализации баллонного катетера с разделительным слоем между покрытием и расширяемой частью катетера.
[0017] На фиг. 3 изображен один вариант реализации баллонного катетера с защитным слоем на покрытии.
[0018] Фиг. 3 представляет собой микрофотографию внутрипросветной поверхности сосуда, обработанного одним вариантом реализации баллонного катетера.
[0019] Фиг. 5 представляет собой микрофотографию внутрипросветной поверхности сосуда, обработанного одним вариантом реализации баллонного катетера.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА РЕАЛИЗАЦИИ
[0020] Чтобы преодолеть ограничения предшествующего уровня техники, в вариантах реализации, раскрытых в настоящем документе, предложены покрытия для расширяемой части катетера, которые содержат микрорезервуары с медленным высвобождением лекарственного средства, перемешанные с или диспергированные в покрытии баллона, который может быть помещен к внутрипросветной поверхности сосуда в течение от 30 до примерно 120 секунд времени накачивания баллона. Такой подход обеспечивает пролонгированное и контролируемое высвобождение лекарственного средства к стенке сосуда в течение более длительного периода времени, который может быть подобран с помощью конструкции микрорезервуаров для характеристик конкретного лекарственного средства или патологии пораженного сосуда. В дополнение к обеспечению длительного высвобождения, покрытие, описанное в настоящем документе, также может быть устойчивым к вымыванию кровью, что одновременно повышает эффективность переноса лекарственного средства и безопасность пациента относительно избыточного получения частиц.
Покрытие
[0021] В настоящем документе описано покрытие для расширяемой части катетера или катетерной системы. Катетер предназначен для введения в живой организм для доставки по меньшей мере одного активного агента местно. Покрытие приготовлено и сконструировано для минимальной солюбилизации и дисперсии в кровотоке или физиологической жидкости при помещении катетера в целевой сосуд или просвет тела для лечения, или после переноса покрытия на ткань в месте лечения, таком как стенка сосуда или стенка просвета. Покрытие сконструировано для переноса на внутрипросветную поверхность или стенку просвета, контактирующего с покрытием, при накачивании расширяемой части. В некоторых сосудах или просветах тела внутренняя поверхность сосуда или просвета тела может быть поражена и может иметь неправильную топологию, например, из-за бляшек, повреждений или предшествующего вмешательства. Покрытие сконструировано для переноса к внутрипросветной поверхности, включая неправильную топологию, как описано в настоящей заявке под термином «стенки просвета». В некоторых вариантах реализации активный агент или лекарственное средство поступает в сосуд для предотвращения или минимизации рестеноза после баллонной ангиопластики. В некоторых вариантах реализации расширяемая часть может представлять собой баллон баллонного катетера.
[0022] На основании фиг. 1, в некоторых вариантах реализации покрытие 12 для расширяемой части 11 катетера 10 включает две фазы, гидрофобную матрицу 14 и дисперсную фазу 13. Дисперсную фазу 13 диспергируют в гидрофобной матрице 14. Дисперсная фаза 13 включает множество микрорезервуаров, а также множество микрорезервуаров включает первый активный агент и биоразлагаемый или биоразрушаемый полимер. В некоторых вариантах реализации первый активный агент смешан с или диспергирован в биоразлагаемом или биоразрушаемом полимере. При переносе покрытия 12 на стенку просвета или внутрипросветную поверхность перенесенное покрытие включает и гидрофобную матрицу 14, и дисперсную фазу 13.
[0023] В некоторых вариантах реализации некоторые или часть из множества микрорезервуаров могут содержать первый активный агент и биоразлагаемый или биоразрушаемый полимер, и некоторые могут содержать биоразлагаемый или биоразрушаемый полимер без первого активного агента.
[0024] В некоторых вариантах реализации гидрофобная матрица 14 может дополнительно включать второй активный агент. Второй активный агент присутствует вне множества микрорезервуаров. Второй активный агент может быть одинаковым или отличаться от первого активного агента.
[0025] В некоторых вариантах реализации множество микрорезервуаров может также включать третий активный агент. В некоторых вариантах реализации множество микрорезервуаров может дополнительно включать второй биоразлагаемый или биоразрушаемый полимер. В некоторых вариантах реализации первый и второй биоразлагаемые или биоразрушаемые полимеры могут быть одинаковыми или разными. В некоторых вариантах реализации множество микрорезервуаров может содержать только один тип микрорезервуаров.
[0026] В некоторых вариантах реализации покрытие 12 содержит от примерно 10% до примерно 75%, от примерно 20% до примерно 65% или от примерно 30% до примерно 55% по массе множества микрорезервуаров. В некоторых вариантах реализации покрытие 12 имеет поверхностную концентрацию от примерно 1 мкг/мм2 до примерно 10 мкг/мм2, от примерно 2 мкг/мм2 до примерно 9 мкг/мм2 или от примерно 3 мкг/мм2 до примерно 8 мкг/мм2 на расширяемой части катетера 10.
[0027] Гидрофобная матрица 14 содержит комбинацию материалов, выбранных по их адгезивным свойствам по отношению к внутрипросветной поверхности или стенке просвета. Предпочтительная гидрофобная матрица 14 содержит комбинацию гидрофобных соединений, устойчивых к растворению в крови или другой физиологической жидкости, но обеспечивающую однородное распределение состава, содержащего микрорезервуары, при нанесении на поверхность баллона. В некоторых вариантах реализации гидрофобная матрица 14 содержит по меньшей мере одно гидрофобное соединение, выбранное из группы, состоящей из стеринов, липидов, фосфолипидов, жиров, жирных кислот, поверхностно-активных веществ и их производных. Особенно подходящие составы представляют собой комбинацию стерина и жирной кислоты или фосфолипида. Стерин может представлять собой стерин, который использует естественный механизм клиренса организма, например, путем образования комплексов с липидами сыворотки или агрегатов с аполипопротеинами сыворотки, чтобы обеспечить транспорт в печень для метаболической переработки. В некоторых вариантах реализации стерин может представлять собой холестерин. Благодаря природной совместимости холестерина и жирных кислот и фосфолипидов, такие комбинации могут обеспечивать гомогенную смесь для покрытия 12 и обеспечивать гомогенное покрытие на поверхности баллона. Покрытие 12, образованное такими комбинациями, является гомогенным без образования мицелл или липосом в гидрофобной матрице 14.
[0028] В некоторых вариантах реализации гидрофобная матрица 14 содержит холестерин и жирную кислоту. В некоторых вариантах реализации массовое соотношение холестерина к жирной кислоте находится в диапазоне от примерно 1:2 до примерно 3:1, от примерно 1:1,5 до примерно 2,5:1 или от примерно 1:1 до примерно 2:1. Количество и доля холестерина и жирной кислоты является достаточным, чтобы обеспечить перенос покрытия с расширяемой части катетера к стенке просвета. Холестериновый компонент состава может включать холестерин, химически модифицированный холестерин или конъюгат холестерина. В некоторых вариантах реализации холестерин представляет собой диметиламиноэтан-карбамоил холестерин (DC-холестерин). Для физиологической совместимости предпочтительные жирные кислоты представляют собой жирные кислоты, как правило, обнаруживаемые в сыворотке крови или клеточных мембранах. В некоторых вариантах реализации жирная кислота выбрана из группы, состоящей из лауриновой кислоты, лауролеиновой кислоты, тетрадекадиеновой кислоты, октановой кислоты, миристиновой кислоты, миристолеиновой кислоты, деценовой кислоты, декановой кислоты, гексадеценовой кислоты, пальмитолеиновой кислоты, пальмитиновой кислоты, линоленовой кислоты, линолевой кислоты, олеиновой кислоты, вакценовой кислоты, стеариновой кислоты, эйкозапентаеновой кислоты, арахидоновой кислоты, мидовой кислоты, арахиновой кислоты, докозагексаеновой кислоты, докозапентаеновой кислоты, докозатетраеновой кислоты, докозеновой кислоты, тетракозановой кислоты, гексакозеновой кислоты, пристановой кислоты, фитановой кислоты и нервоновой кислоты.
[0029] В некоторых вариантах реализации гидрофобная матрица 14 содержит холестерин и фосфолипид. В некоторых вариантах реализации массовое соотношение холестерина и фосфолипида составляет в диапазоне от примерно 1:2 до примерно 3:1, от примерно 1:1,5 до примерно 2,5:1 или от примерно 1:1 до примерно 2:1. Количество и доля холестерина и фосфолипида является достаточной, чтобы обеспечить перенос покрытия с расширяемой части катетера к стенке просвета. Холестериновый компонент состава может включать холестерин, химически модифицированный холестерин или конъюгат холестерина. В некоторых вариантах реализации холестерин представляет собой DC-холестерин. Предпочтительные фосфолипиды представляют собой фосфолипиды, как правило, обнаруживаемые в сыворотке крови или клеточных мембранах. В некоторых вариантах реализации фосфолипид выбран из группы, состоящей из фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина или фосфатидилинозитола. В некоторых вариантах реализации фосфолипид включает длину ацильной цепи от примерно 20 до примерно 34 атомов углерода.
[0030] В некоторых вариантах реализации настоящего описания, гидрофобная матрица 14 содержит только гидрофобные компоненты, такие как липиды, стерины и жирные кислоты. Иначе говоря, в некоторых вариантах реализации гидрофобная матрица не содержит гидрофильных полимеров или гидрофильных вспомогательных веществ. В некоторых вариантах реализации настоящего описания, гидрофобная матрица 14 содержит только гидрофобные компоненты, такие как липиды, стерины и жирные кислоты, и амфифильные компоненты не присутствуют. Предпочтительно, покрытие 12 и его компоненты обладают ограниченной растворимостью в крови или аналогах, таких как плазма или фосфатный буферный солевой раствор. Применение катионного холестерина или катионного фосфолипида в составе может обеспечить дополнительное химическое сродство гидрофобной матрицы 14 стенке просвета и потенциально к поверхности микрорезервуаров для увеличения переноса покрытия 12 и устойчивости к растворению в крови после переноса. Подходящие катионные формы холестерина модифицированы в положении углерода 3, чтобы присоединить боковую цепь третичного или четвертичного амина, и включают DC-холестерин. Подходящие катионные формы фосфолипидов включают природные фосфолипиды и синтетические модификации фосфолипидов, такие как фосфатидилэтаноламин, диолеоилфосфатидилэтаноламин (DOPE) и аминопроизводные фосфатидилхолина, такие как этилфосфатидилхолин.
[0031] В некоторых вариантах реализации длину ацильной цепи и степень ненасыщенности фосфолипидного компонента гидрофобной матрицы 14 можно применять для адаптации физико-химических свойств гидрофобной матрицы 14. В некоторых вариантах реализации длина большой ацильной цепи выбрана таким образом, чтобы увеличить гидрофобность фосфолипида для адгезии со стенкой просвета и уменьшить растворимость и вымывание из-за воздействия кровотока. Длину ацильной цепи жирных кислот и жирнокислотную часть фосфолипидов описывают сокращенной записью как число атомов углерода с последующим двоеточием и числом углерод-углеродных двойных связей. В последующем описании фосфолипидов, и дженерическое и тривиальное название, стереоспецифическую нумерацию и сокращенное обозначение применяют для первого описания соединения. Длины ацильной цепи от 20 до 34 атомов углерода (от С20 до С34) подходят для применения в качестве компонента покрытия 12, длина ацильной цепи от 20 до 24 атомов углерода (от С20 до С24) является особенно предпочтительной. Хотя настоящее изобретение также действует с насыщенными ацильными цепями, один или несколько участков ненасыщенности могут обеспечить повышенную гибкость цепи. Примеры предпочтительных фосфолипидов включают диэйкозеноилфосфатидилхолин (1,2-диэйкозеноил-sn-глицеро-3-фосфохолин, С20:1 ФХ), диарахидоноилфосфатидилхолин (1,2-диарахидоил-sn-глицеро-3-фосфохолин, С20:0 ФХ), диэрукоилфосфатидилхолин (1,2-диэрукоил-sn-глицеро-3-фосфохолин, С22:1 ФХ), дидокозагексаеноилфосфатидилхолин (1,2-дидокозагексаеноил-sn-глицеро-3-фосфохолин, С22:6 ФХ), генэйкозеноилфосфатидилхолин (1,2-генэйкозеноил-sn-глицеро-3-фосфохолин, С21:1 ФХ) и динервонилфосфатидилхолин (1,2-динервоноил-sn-глицеро-3-фосфохолин, С24:1 ФХ). В некоторых вариантах реализации фосфолипиды имеют температуру перехода, составляющую или выше температуры окружающей среды (20°С), таким образом, гидрофобная матрица 14 представляет собой твердое вещество при хранении.
[0032] Множество микрорезервуаров содержит активный агент и полимер. Активный агент может упоминаться как первый активный агент или третий активный агент. Активный агент связан с полимером таким образом, чтобы обеспечить медленное или длительное высвобождение активного агента из микрорезервуаров. В некоторых вариантах реализации активный агент смешан с или диспергирован в биоразлагаемом или биоразрушаемом полимере. В некоторых вариантах реализации активный агент может быть инкапсулирован биоразлагаемым или биоразрушаемым полимером. В некоторых вариантах реализации множество микрорезервуаров может содержать первый активный агент. В некоторых вариантах реализации множество микрорезервуаров может дополнительно содержать третий активный агент. В некоторых вариантах реализации второй активный агент может присутствовать вне множества микрорезервуаров. Второй активный агент может быть включен в часть гидрофобной матрицы. Подходящий активный агент, такой как первый, второй или третий активный агент, может включать антипролиферативные или противовоспалительные агенты, такие как паклитаксел, сиролимус (рапамицин) и их химические производные или аналоги, которые представляют собой ингибиторы mTOR, ингибирующую РНК, ингибирующую ДНК, стероиды и ингибиторы комплемента. В некоторых вариантах реализации активный агент выбран из группы, состоящей из паклитаксела, сиролимуса, производного паклитаксела, производного сиролимуса, аналогов паклитаксела, аналогов сиролимуса, ингибирующей РНК, ингибирующей ДНК, стероидов и ингибиторов комплемента. В некоторых вариантах реализации активный агент составляет от примерно 10% до примерно 50%, от примерно 15% до примерно 45%, от примерно 20% до примерно 40% или от примерно 25% до примерно 35% по массе множества микрорезервуаров. Микрорезервуары могут включать микрочастицы или микросферы. В некоторых вариантах реализации микросферы из полимолочной-со-гликолевой кислоты (PLGA) хорошо подходят для включения активного агента для замедленного высвобождения до приблизительно 50% по массе активного агента в микросфере.
[0033] В некоторых вариантах реализации множество микрорезервуаров имеет средний диаметр от примерно 0,5 микрометров до примерно 8 микрометров, от примерно 2 микрометров до примерно 6 микрометров или от примерно 3 микрометров до примерно 5 микрометров. В некоторых вариантах реализации микрорезервуары желательно имеют размер, достаточно большой, чтобы обеспечить замедленное высвобождение активного агента, приблизительно 1,5 микрометра или более в диаметре, или средний размер поперечного сечения для микрочастиц неравномерного размера. Меньшие размеры микрорезервуаров обычно имеют увеличенное отношение площади поверхности к объему и уменьшенный диффузионный путь для активного агента, который не обеспечивает достаточного пролонгированного высвобождения. Максимальный размер микрорезервуаров составляет приблизительно размер красных кровяных телец, от примерно 6 микрометров до примерно 8 микрометров, чтобы предотвратить эмболизацию капилляров из-за каких-либо микрорезервуаров, высвобождаемых в кровоток во время или после лечения. В некоторых вариантах реализации микрорезервуары не обязательно имеют сродство или адгезию к стенке просвета.
[0034] Биоразлагаемый или биоразрушаемый полимер может обеспечивать контролируемое и длительное высвобождение активного агента. Биоразлагаемый или биоразрушаемый полимер может упоминаться как первый биоразлагаемый или биоразрушаемый полимер или второй биоразлагаемый или биоразрушаемый полимер. Полимер действует как барьер для диффузии лекарственного средства, тем самым обеспечивая профиль высвобождения, подобранный для фармакокинетики активного агента, действующего на сосуд, подвергаемый лечению. Например, активный агент может быть перемешан и распределен в полимере в твердом растворе. Полимер может обеспечивать контролируемое высвобождение за счет уменьшения диффузии активного агента или путем сочетания высвобождения лекарственного средства и биодеградации, растворения или биоэрозии полимера. В некоторых вариантах реализации биоразлагаемый или биоразрушаемый полимер выбран из группы, состоящей из полимолочной кислоты, полигликолевой кислоты и их сополимеров, полидиоксанона, поликапролактона, полифосфазена, коллагена, желатина, хитозана, гликозаминогликанов и их комбинаций. В некоторых вариантах реализации микрорезервуары также могут представлять собой микросферы или микрочастицы, содержащие по меньшей мере один активный агент, который лечит воспаление или вызывает ответ заживления. В некоторых вариантах реализации множество микрорезервуаров может включать первый биоразлагаемый или биоразрушаемый полимер. В некоторых вариантах реализации множество микрорезервуаров может включать второй биоразлагаемый или биоразрушаемый полимер.
[0035] После контакта покрытия 12 со стенкой просвета в организме кинетика высвобождения активного агента контролируется высвобождением активного агента из микрорезервуаров в окружающую среду, обеспечивая тем самым доступное длительное элюирование активного агента для проникновения в стенку сосуда. Для обеспечения значительного количества активного агента в течение начального периода высокого риска рестеноза после дилатации, предпочтительно, чтобы активный агент в покрытии 12 непрерывно высвобождался с кинетикой высвобождения с периодом полувыведения от примерно 2 недель до примерно 6 недель или более. В некоторых вариантах реализации множество микрорезервуаров имеет кинетику высвобождения активного агента с периодом полувыведения по меньшей мере 14 дней.
[0036] Кинетика высвобождения активного агента может быть подобрана по характеристикам микрорезервуаров. В покрытии 12 могут быть приготовлены два или более типа микрорезервуаров с различными активными агентами или различной кинетикой высвобождения для одного и того же активного агента для подбора лечебного эффекта. В некоторых вариантах реализации некоторые активные агенты могут быть включены в состав покрытия вне микрорезервуаров для обеспечения быстрого первоначального высвобождения активного агента к стенкам сосуда, что позволяет микрорезервуарам обеспечивать достаточное количество активного агента для поддержания эффективной концентрации активного агента в тканях в течение пролонгированного периода времени. Поскольку заживление и прекращение воспаления в области дилатации обычно занимает 4-12 недель, желательно, чтобы микрорезервуары и покрытие 12 элюировали активный агент, чтобы обеспечить терапевтические уровни в ткани в течение по меньшей мере примерно 4 недель до примерно 12 недель после лечения. В некоторых случаях применения, например, при очень длинных сосудах с обширными повреждениями, поддержание уровней активного агента в течение более 4-12 недель может быть желательным для обеспечения дополнительной защиты от эффектов менее распространенного позднего рестеноза.
[0037] Показано, что высвобождение активного агента, перемешанного с твердым веществом или диспергированного в нем, следует кинетике Хигучи с уменьшением выделения активного вещества с течением времени. Для сферических частиц с активным агентом, диспергированным в полимере, кинетика высвобождения активного агента также следует степенному закону уменьшения скорости высвобождения, кинетической модели Корсмейера-Пеппаса, аналогичной уравнению Хигучи. (J. Siepmanna J, Peppas NA, Modeling of active agent release from delivery systems based on hydroxypropyl methylcellulose (HPMC), Advanced Drug Delivery Reviews 48 (2001) 139-157). Кинетика высвобождения активного агента из таких микрорезервуаров хорошо подходит для лечения стенки сосуда после дилатации. Конструирование и выбор микрорезервуаров с соответствующей константой высвобождения обеспечивает быстрое начальное высвобождение активного агента с непрерывным высвобождением активного агента и продолжительным пребыванием активного агента в стенке сосуда в течение более длительных периодов времени по сравнению с устройствами предшествующего уровня техники. Скорость высвобождения активного агента может быть подобрана за счет растворимости активного агента в материале микрорезервуара и путем регулирования микропористости микрорезервуара. Длительность эффективной доставки активного агента может быть подобрана путем выбора размера микрорезервуара, растворимости активного агента в материале микрорезервуара и количества активного агента, загруженного в микрорезервуары. Общее количество активного агента, подлежащего доставке, определяется количеством микрорезервуаров в составе покрытия и их уровнем загрузки активного агента. В результате покрытие 12 может быть приготовлено таким образом, чтобы иметь концентрацию активного агента в диапазоне от примерно 0,3 до примерно 3 мкг на мм2 поверхности расширяемой части 11. Желательная кинетика высвобождения активного агента из покрытия 12 может быть обеспечена микрорезервуаром одного типа или в качестве альтернативы смесью микрорезервуаров с различными размерами или характеристиками высвобождения для обеспечения желаемого профиля высвобождения в стенку сосуда.
[0038] В некоторых вариантах реализации покрытие 12 дополнительно включает ПЭГ-липид для увеличения гемосовместимости. В некоторых вариантах реализации покрытие 12, описанное в настоящем документе, предназначено для переноса на внутрипросветную поверхность или стенку просвета кровеносного сосуда и пребывания там для высвобождения лекарственного средства в течение периода заживления сосуда, поэтому необходима гемосовместимость покрытия 12. В дополнение к предотвращению растворения покрытия 12 в кровотоке до заживления сосуда необходимо предотвратить начало значительного свертывания и прикрепления фибрина и тромбоцитов к поверхности покрытия, подвергаемой воздействию крови после переноса. Добавление ПЭГ-липида к композиции холестерина и фосфолипида или жирной кислоты можно применять для обеспечения повышенной гемосовместимости состава. ПЭГ-сшитые полимерные поверхности показали улучшенные характеристики контакта с кровью, в первую очередь, за счет снижения поверхностной свободной энергии и пространственного затруднения гидратированных цепочек ПЭГ на поверхности. Не желая быть связанными конкретной теорией действия, полагают, что небольшое количество ПЭГ-липидного конъюгата, добавленного к композиции, может мигрировать на поверхность поверхности раздела крови после переноса, особенно для ПЭГ-липидов с относительно низкой молекулярной массой. Таким образом, цепи ПЭГ способны снижать поверхностную свободную энергию на поверхности взаимодействия с кровью. Поскольку материал покрытия на границе раздела между кровью и жидкостью представляет собой небольшую часть общего покрытия, необходимо относительно небольшое количество ПЭГ-липида.
[0039] В некоторых вариантах реализации ПЭГ-липид выбран из группы, состоящей из 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-350 (DSPE-mPEG350), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-метокси(полиэтиленгликоль)-350 (DPPE-mPEG350), 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-350 (DOPE-mPEG350), 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-550 (DSPE-mPEG550), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-550 (DPPE-mPEG550) и 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-500 (DOPE-mPEG550). В некоторых вариантах реализации ПЭГ-липид составляет от примерно 1% до примерно 30% по массе гидрофобной матрицы 14, состоящей из комбинации холестерина, жирной кислоты или фосфолипида и ПЭГ-липида. В других вариантах реализации ПЭГ-липид составляет от примерно 2% до примерно 25%, от примерно 3% до примерно 20% или от примерно 5% до примерно 10% по массе гидрофобной матрицы 14. В некоторых вариантах реализации количество ПЭГ-липида составляет от примерно 12% или менее.
[0040] В некоторых вариантах реализации покрытие 12 дополнительно включает одну или более добавок. В некоторых вариантах реализации одна или более добавок независимо выбраны из усилителей проницаемости и стабилизаторов. Например, покрытие 12 может дополнительно содержать добавки для увеличения активности, например, усилители проницаемости. Усилитель проницаемости может способствовать диффузии активного агента к стенке сосуда и максимально увеличить доставку активного агента к ткани. Подходящие усилители проницаемости могут включать поверхностно-активные вещества, катионные вспомогательные вещества и катионные липиды. В некоторых вариантах реализации добавка может быть добавлена к гидрофобной матрице, микрорезервуарам или обоим. В некоторых вариантах реализации стабилизаторы могут быть добавлены для защиты лекарственного средства во время стерилизации баллонной катетерной системы и ее последующего хранения перед применением. Стабилизаторы могут включать антиоксиданты и поглотители свободных радикалов. Примеры стабилизаторов включают галловую кислоту, пропилгаллат, токоферолы и токотриенолы (витамин Е), бутилгидрокситолуол, бутилгидроксианизол, аскорбиновую кислоту, тиогликолевую кислоту, аскорбилпальмитат и ЭДТА.
[0041] В некоторых вариантах реализации покрытие 12 дополнительно содержит третий активный агент, где третий активный агент находится вне микрорезервуаров или в гидрофобной матрице 14. Третий активный агент может представлять собой тот же или отличный от первого или второго активного агента во множестве микрорезервуаров. Однако, так как активный агент(ы) в основном содержатся в микрорезервуарах, а не в непосредственном контакте с гидрофобной матрицей 14, необходимость солюбилизации или эмульгирования активного агента в самой гидрофобной матрице 14 отсутствует. Так как активный агент(ы) в основном содержатся в микрорезервуарах и не контактируют с гидрофобной матрицей 14, в некоторых вариантах реализации исключена необходимость включения в гидрофобную матрицу 14 амфифильного компонента или компонента с аффинностью активного агента. Таким образом, гидрофобную матрицу 14 можно оптимизировать по подходящим свойствам для устойчивости к вымыванию с кровью или жидкостью организма и адгезии к внутрипросветной поверхности или стенке просвета для переноса покрытия 12.
Катетер
[0042] Со ссылкой на фиг. 2, в настоящем документе также представлен катетер 10, который включает расширяемую часть 11 на удлиненном теле 17, покрытие 12, как описано выше, на расширяемой части 11, и разделительный слой 15 между расширяемой частью 11 и покрытием 12. В некоторых вариантах реализации разделительный слой 15 выполнен с возможностью разделения покрытия 12 от расширяемой части 11. Разделительный слой 15, который не смешивается с покрытием 12, является предпочтительным для сохранения отдельных слоев. В некоторых вариантах реализации ПЭГ конъюгированные липиды применяют в качестве разделительного слоя 15, так как степень гидрофильности и смешиваемости с покрытием активного агента 12 может быть подобрана путем выбора длины липида и длины цепи ПЭГ. В некоторых вариантах реализации разделительный слой 15 представляет собой 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-(метокси(полиэтиленгликоль)-350) (DSPE-mPEG350) или 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-(метокси(полиэтиленгликоль)-550) (DSPE-mPEG550). В некоторых вариантах реализации разделительный слой 15 имеет поверхностную концентрацию от примерно 0,1 мкг/мм2 до примерно 5 мкг/мм2, от примерно 0,25 мкг/мм2 до примерно 3 мкг/мм2 или от примерно 0,5 мкг/мм2 до примерно 2 мкг/мм2.
[0043] Со ссылкой на фиг. 3, в некоторых вариантах реализации катетер 10 дополнительно включает защитный слой 16 поверх покрытия 12 в качестве верхнего покрытия. В некоторых вариантах реализации защитный слой 16 включает гидрофильный полимер, углевод или амфифильный полимер. В некоторых вариантах реализации защитный слой 16 представляет собой гликозаминогликан или кристаллизованный сахар. Примеры гликозаминогликанов включают декстрансульфат, хондроитинсульфат, гепарансульфат и гиалуроновую кислоту. Примеры кристаллизованных сахаров включают маннит, сорбит, эритрит и ксилит. Кристаллическая природа этих сахаров обеспечивает твердую поверхность, которая защищает нижележащие микрорезервуары. Толщина защитного слоя 16 может быть подобрана таким образом, чтобы защитный слой 16 смывался в течение времени прохождения, необходимого для продвижения катетера 10 к целевому участку. В некоторых вариантах реализации защитный слой 16 имеет поверхностную концентрацию от примерно 0,1 мкг/мм2 до примерно 5 мкг/мм2, от примерно 0,2 мкг/мм2 до примерно 4 мкг/мм2 или от примерно 0,3 мкг/мм2 до примерно 3 мкг/мм2.
[0044] Расширяемая часть 11 катетера 10 может представлять собой баллон, который действует как основа для покрытия 12. В некоторых вариантах реализации баллон может иметь конструкцию низкого давления с применением эластомерного материала, такого как полиизопрен, сополимеры полистирола, полисилоксан или полиуретан. В некоторых вариантах реализации баллон может также иметь конструкцию высокого давления с применением полимеров с высокой прочностью на растяжение, таких как поливинилхлорид, полиэтилен, полиэтилентерефталат или нейлон. В некоторых вариантах реализации расширяемая часть 11 может быть изготовлена из нейлона 12. Покрытие 12 может быть в достаточной степени присоединено к расширяемой части 11, но легко переходить в ткани просвета сосуда при контакте. В таких случаях разделительный слой может быть опущен. Кроме того, нейлон 12 имеет достаточную прочность, так что баллон может дополнительно действовать как баллон после дилатации (если необходимо) в последующей процедуре после переноса покрытия 12.
[0045] В некоторых вариантах реализации расширяемую часть 11 под покрытием 12 можно применять для расширения целевого сосуда. В некоторых вариантах реализации сосуд может быть предварительно расширен другим баллонным катетером 10 до обработки покрытым баллоном в соответствии с настоящими вариантами реализации.
Состав покрытия
[0046] В настоящем документе также описан покрывающий состав для расширяемой части 11 катетера 10. Состав включает твердую часть и жидкость. Твердая часть включает множество микрорезервуаров и по меньшей мере одно гидрофобное соединение. Жидкость действует, чтобы диспергировать или солюбилизировать по меньшей мере одно гидрофобное соединение. В некоторых вариантах реализации жидкость может диспергировать некоторые гидрофобные соединения и солюбилизировать другие гидрофобные соединения. Микрорезервуары диспергируют и суспендируют в полученной смеси жидкой среды с получением покрывающего состава. Жидкую смесь готовят с образованием гомогенной смеси гидрофобных соединений, которая не разделяется во время сушки, что приводит к равномерному однородному покрытию гидрофобной матрицы 14. Состав покрытия характеризуется по массе твердой части, что относится ко всем нелетучим компонентам покрывающего состава, но исключает жидкость, которая затем испаряется во время сушки покрытия.
[0047] Микрорезервуары включают активный агент и полимер. Активный агент может упоминаться как первый активный агент или третий активный агент, как описано в настоящем документе. Полимер может представлять собой биоразлагаемый или биоразрушаемый полимер или второй биоразлагаемый или биоразрушаемый полимер, описанный в настоящем документе. В некоторых вариантах реализации активный агент смешан или диспергирован в биоразлагаемом или биоразрушаемом полимере, описанном в настоящем документе. В некоторых вариантах реализации состав может включать более одного типа микрорезервуаров. Например, множество микрорезервуаров может включать первый активный агент и биоразлагаемый или биоразрушаемый полимер. В некоторых вариантах реализации множество микрорезервуаров могут дополнительно включать второй активный агент. В некоторых вариантах реализации множество микрорезервуаров могут также включать второй биоразлагаемый или биоразрушаемый полимер.
[0048] Микрорезервуары могут быть изготовлены любым из известных способов получения частиц, включая распылительную сушку, коацервацию, микроформовку и помол. Все такие способы начинаются с растворения активного агента и полимера совместно в подходящем растворителе, таком как ацетонитрил или дихлорметан, после чего растворитель удаляют контролируемым образом, что создает однородные частицы. Частицы могут быть дополнительно формованы механическими средствами. Способы, с помощью которых получают частицы с распределением по размеру с коэффициентами вариации 10% или менее, особенно подходят для обеспечения более стабильных скоростей высвобождения активного агента. Способы получения микросфер однородного размера описаны посредством получения эмульсии материала микросфер и экструзии эмульсии через субстрат со сквозными отверстиями регулируемого размера, как описано в патентах США US 7972543 и US 8100348. Альтернативно, микросферы могут быть получены посредством распылительной сушки растворов полимеров, как описано в патентах США US 6560897 и US 20080206349.
[0049] Жидкость покрывающего состава может содержать воду, органический растворитель, перфторуглеродные жидкости или смесь таких жидкостей. В некоторых вариантах реализации жидкость выбрана из группы, состоящей из пентана, гексана, гептана, гептана и фторуглеродной смеси, спиртовой и фторуглеродной смеси, и смеси спирта и воды. Жидкости, которые легко солюбилизируют активный агент или полимер микрорезервуаров, не являются предпочтительными, поскольку они могут экстрагировать активный агент из микрорезервуаров. Такие нежелательные жидкости включают уксусную кислоту, ацетонитрил, ацетон, этилформиат, циклогексанон, ДМСО и хлороформ. Необязательно жидкость/жидкая смесь может быть выбрана для насыщения при желаемом уровне экстрагированного активного агента. Дополнительный активный агент, такой же, как находящийся в микрорезервуарах, может быть добавлен в жидкость заранее для предварительного насыщения раствора, таким образом уменьшая экстракцию из микрорезервуаров во время обработки покрытия.
[0050] В некоторых вариантах реализации по меньшей мере одно гидрофобное соединение выбрано из группы, состоящей из стеринов, липидов, фосфолипидов, жиров, жирных кислот и поверхностно-активных веществ и их производных. В некоторых вариантах реализации по меньшей мере одно гидрофобное соединение содержит холестерин и жирную кислоту, как описано в настоящем документе. В других вариантах реализации по меньшей мере одно гидрофобное соединение содержит холестерин и фосфолипид, как описано в настоящем документе. В некоторых вариантах реализации состав может также включать ПЭГ-липид, как описано в настоящем документе. В некоторых вариантах реализации состав может дополнительно включать добавки, такие как усилители проницаемости и стабилизаторы.
[0051] В некоторых вариантах реализации твердая часть дополнительно содержит третий активный агент вне множества микрорезервуаров. Иначе говоря, покрывающий состав может обеспечивать гидрофобную матрицу 14, которая дополнительно содержит третий активный агент. Активный агент вне микрорезервуаров может быть тем же или отличаться от активного агента(тов) в микрорезервуарах. В некоторых вариантах реализации твердая часть может дополнительно содержать ПЭГ-липид. В некоторых вариантах реализации твердая часть может также дополнительно содержать добавку, описанную в настоящем документе.
[0052] В некоторых вариантах реализации концентрация твердой части по массе в процентах в покрывающем составе составляет от приблизительно 1% до приблизительно 90%. В некоторых вариантах реализации содержание твердых веществ в покрывающем составе имеет концентрацию от примерно 2% до примерно 80% по массе, от примерно 3% до примерно 70% по массе или от примерно 4% до примерно 60% по массе. В некоторых вариантах реализации для покрытия распылением твердая часть покрывающего состава имеет концентрацию от примерно 2% до примерно 7% по массе. Твердая часть покрывающего состава составляет от примерно 10% до примерно 75%, от примерно 20% до примерно 65% или от примерно 30% до примерно 55% по массе множества микрорезервуаров.
[0053] Покрывающая композиция может быть получена путем получения смеси по меньшей мере двух гидрофобных соединений и множества микрорезервуаров, как описано в настоящем документе. Множество микрорезервуаров содержит первый активный агент и биоразлагаемый или биоразрушаемый полимер. По меньшей мере два гидрофобных соединения содержат холестерин и фосфолипид или холестерин и жирную кислоту, причем по меньшей мере два гидрофобных соединения присутствуют в количествах и в пропорциях, достаточных для переноса покрытия из расширяемой части катетера в стенку просвета, такую как стенка сосуда. В некоторых вариантах реализации смесь дополнительно включает ПЭГ-липид, как описано выше.
Способ нанесения покрытия
[0054] Описание настоящего изобретения также относится к способу нанесения покрытия на расширяемую часть 11 катетера 10. Эти стадии включают: нанесение состава, описанного в настоящем документе, на поверхность накачанной расширяемой части 11 катетера 10, испарение компонентов жидкости покрывающего состава и спуск воздуха из расширяемой части 11. Нанесение состава на поверхность накачанной расширяемой части 11 включает нанесение состава на поверхность накачанной расширяемой части 11. В некоторых вариантах реализации состав может быть нанесен на накачанную расширяемую часть 11 или поверх нее, посредством распыления, нанесения покрытия погружением, нанесения покрытия валиком, электростатического осаждения, печати, пипетирования или дозирования.
[0055] Покрывающий состав получают путем смешивания компонентов покрытия в жидкой среде, как описано в настоящем документе. В некоторых вариантах реализации микрорезервуары диспергируют в жидком составе. После полного смешивания покрывающий состав можно наносить на поверхность накачанной расширяемой части 11, такой как баллон, и высушивать, чтобы получить покрытие 12. Нанесение состава покрытия может быть повторено при необходимости для нанесения требуемого количества покрытия 12, обычно в диапазоне от примерно 5 мг до примерно 9 мг покрытия 12 на мм2 поверхности баллона. Покрытие 12 высушивают, и баллон сдувают и складывают, чтобы обеспечить введение в сосудистую систему. В некоторых вариантах реализации разделительный слой уже нанесен на поверхность накачанной расширяемой части 11, и покрывающий состав можно нанести на существующий разделительный слой и высушить, чтобы получить покрытие 12. По существу, разделительный слой находится между поверхностью накачанной расширяемой части 11 и покрытием 12.
[0056] В некоторых вариантах реализации способ может дополнительно включать нанесение разделительного слоя на поверхности накачанной расширяемой части 11. По существу, покрывающий состав наносят на разделительный слой, при этом разделительный слой наносят на поверхность накачанной расширяемой части 11. Разделительный слой описан выше.
Способ лечения или предотвращения состояния
[0057] В настоящем документе также описан способ лечения или предотвращения состояния в месте лечения. Способ включает стадии введения катетера 10, содержащего расширяемую часть 11, к месту лечения, накачивания расширяемой части 11 для обеспечения контакта между покрытием и тканью на участке лечения, спуска воздуха из расширяемой части 11 и удаления катетера 10. Расширяемая часть 11 покрыта описанным в настоящем документе покрытием. В некоторых вариантах реализации контакт между тканью и покрытием приводит к переносу по меньшей мере части покрытия на расширяемой части 11 к участку обработки расширяемой частью 11 и покрытием в течение периода от примерно 30 до примерно 120 секунд.
[0058] Катетер 10 с расширяемой частью 11, такой как баллонный катетер с покрытием, применяют в настоящем изобретении для демонстрации концепции доставки активного агента или комбинации активных агентов в сосуд. Покрытый баллонный катетер вводят в сосуд с сложенной расширяемой частью И для обеспечения небольшого профиля поперечного сечения и для облегчения чрескожного введения катетера 10, например, с помощью хорошо известной методики Селдингера. После введения расширяемой части 11 катетера 10 к пораженному участку сосуда для лечения, баллон накачивают, и покрытие плотно контактирует с просветом сосуда. Покрытие изготовлено таким образом, что оно имеет сродство к поверхности просветной ткани, что приводит к адгезии слоя покрытия к просвету сосуда. Расширяемая часть 11 может быть накачана или расширена в течение от 30 секунд до 2 минут, чтобы способствовать адгезии и обеспечивать первоначальное проникновение активного вещества в стенку сосуда. Расширяемую часть 11 можно сдуть и повторить накачивание, как необходимо для лечения, чтобы управлять периодом времени и рисками закупорки сосуда или ишемии тканей. Покрытие адгезивно переносится в просвет сосуда при надувании баллона и прочном контакте поверхности баллона с поверхностью просвета сосуда. Адгезия покрытия к поверхности сосуда тем самым переносит микрорезервуары и перемещает их на поверхность сосуда.
[0059] В некоторых вариантах реализации состояние выбрано из группы, состоящей из атеросклероза, стеноза или уменьшения диаметра просвета в пораженном кровеносном сосуде, рестеноза и внутристентового рестеноза. В некоторых вариантах реализации дополнительный разделительный слой, как описано в настоящем документе, расположен между расширяемой частью 11 и покрытием.
[0060] Хотя настоящее раскрытие направлено на лечение рестеноза, связанного с баллонной дилатацией кровеносных сосудов, настоящее изобретение можно применять для доставки лекарственных средств к различным другим просветам и полым структурам тела, таким как структуры дыхательной системы, желудочно-кишечной системы, мочевыделительной системы, репродуктивной системы и лимфатической системы. Устройство с покрытием может представлять собой надувной баллон или другое надувное устройство. Альтернативно, устройство, доставляющее покрытие согласно настоящему изобретению, может представлять собой ненадувное устройство или любое расширяемое устройство другого типа, которое применяют для лечения живого организма.
ПРИМЕРЫ
Пример 1
[0061] Получали микрорезервуары (микросферы), содержащие лекарственное средство, полученные посредством коацервации сополимера полимолочной-со-гликолевой кислоты, включая сиролимус (рапамицин).
[0062] Образец микросфер 1: 50% DL-лактид / 50% гликолид сополимер, средний диаметр 3,1 мкм, SD 0,44 мкм, 39% рапамицина по массе
[0063] Образец микросфер 2: 75% DL-лактид / 25% гликолид сополимер, средний диаметр 3,2 мкм, SD 0,76 мкм, 40% рапамицина по массе
[0064] Образец микросфер 3: 50% DL-лактид / 50% гликолид сополимер, средний диаметр 2,7 мкм, SD 0,8 мкм, 45% рапамицина по массе
[0065] Образец микросфер 4: 75% DL-лактид / 25% гликолид сополимер, средний диаметр 3,3 мкм, SD 1,2 мкм, 46% рапамицина по массе
[0066] Образец микросфер 5: 75% DL-лактид / 25% гликолид сополимер, средний диаметр 4,1 мкм, SD 0,61 мкм, 25% рапамицина по массе
[0067] Образец микросфер 6: 75% DL-лактид / 25% гликолид сополимер, средний диаметр 3,78 мкм, SD 0,44 мкм, 28,8% рапамицина по массе
[0068] Образец микросфер 7: 75% DL-лактид / 25% гликолид сополимер, средний диаметр 3,8 мкм, SD 0,34 мкм, 27,7% рапамицина по массе
[0069] Образец микросфер 8: 75% DL-лактид / 25% гликолид сополимер, средний диаметр 3,79 мкм, SD 0,39 мкм, 29,4% рапамицина по массе
[0070] Содержание лекарственного средства в данных микрорезервуарах проверяли способом количественной оценки посредством ВЭЖХ. Как правило, микрорезервуары (от 1 до 5 мг) взвешивали и растворяли в 1 мл ацетонитрила, осторожно перемешивали при комнатной температуре в течение нескольких часов или 37°С в течение 1 часа и разбавляли в 50-200 раз ацетонитрилом. Абсорбцию исследовали при 278 нм, и содержание определяли по линейным калибровочным кривым.
Пример 2: Непрерывное высвобождение лекарственного средства из микрорезервуаров при физиологических условиях
[0071] Микрорезервуары из примера 1 тестировали на непрерывное высвобождение лекарственного средства. Образцы микрорезервуаров массой 2-5 мг помещали в 1,6 мл пробирки Эппендорфа с 1,2 мл забуференного фосфатом физиологического раствора (PBS) для имитации физиологической среды. После первоначальной промывки для удаления любого лекарственного средства, не включенного в микрорезервуары, пробирки инкубировали при 37°C с легким перемешиванием при 250 об/мин. PBS отбирали через интервалы времени, и высвобождаемое лекарственное средство количественно определяли с помощью ВЭЖХ с обращенной фазой с применением колонки С18.
[0072] Микрорезервуары анализировали на элюирование лекарственного средства в течение 5 часов. Полученное высвобождение лекарственного средства соответствовало кинетическому уравнению Корсмейера-Пеппаса для высвобождения лекарственного средства из полимера с диспергированным лекарственным средством. Результаты модели Корсмейера-Пеппаса приведены в таблице 1.

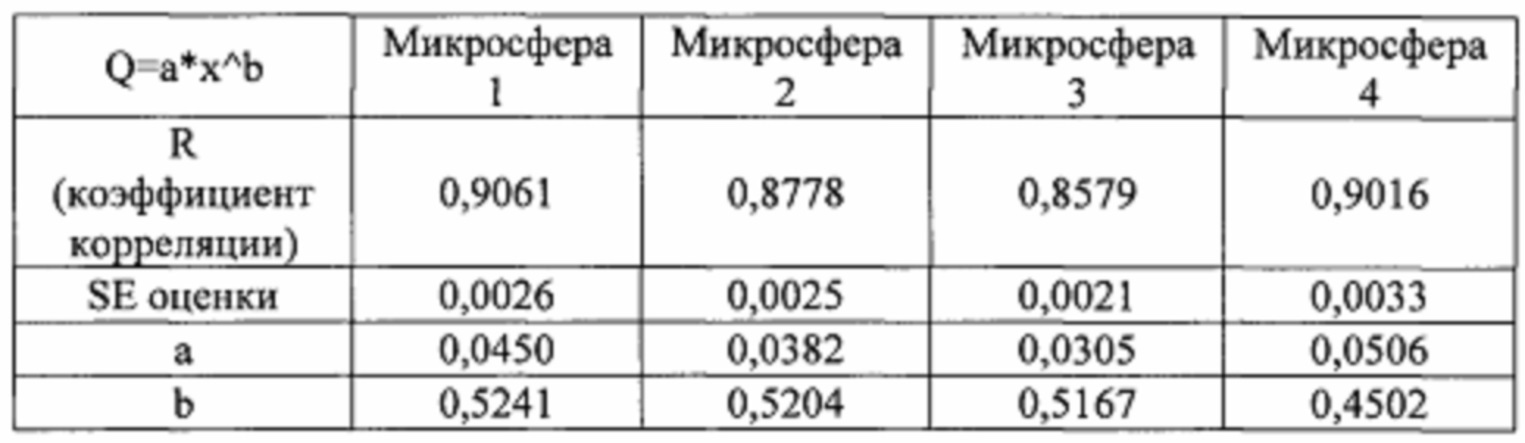
[0073] Кратковременные результаты доставки демонстрируют константы высвобождения лекарственного средства Корсмейера-Пеппаса, типичные для лекарственного средства, диспергированного в сферической полимерной частице, вероятно с небольшим вкладом эрозии или деградации полимера для образцов микросфер 1, 2 и 3.
[0074] Исследование пролонгированного высвобождения лекарственного средства: микросферы анализировали на элюирование лекарственного средства в течение 7 дней, применяя способы, описанные для тестирования в течение 5 часов. Полученное высвобождение лекарственного средства приведено в таблице 2.

[0075] Скорости высвобождения 7-дневных результатов доставки соответствовали уравнению Хигучи:
Q=A[D(2C-Cs)Cst]1/2
Q=Kh(t)1/2
где Q представляет собой количество лекарственного средства, высвобождаемое за время t на единицу площади А, С представляет собой начальную концентрацию лекарственного средства, Cs представляет собой растворимость лекарственного средства в полимерной среде, и D представляет собой коэффициент диффузии лекарственного средства в полимере микросфер. В обобщенном уравнении Kh представляет собой константу Хигучи, включающую площадь, коэффициент диффузии и коэффициенты концентрации лекарственного средства.
[0076] Уравнение Хигучи применяли для определения периода полувыведения лекарственного средства из микрорезервуаров, а также для оценки периода полувыведения в зависимости от размера микросферы. Полученные периоды полувыведения лекарственного средства представлены в таблице 3.

[0077] Полученные результаты показывают, что период полувыведения лекарственного средства из микрорезервуаров может быть подобран по составу и размеру микрорезервуаров. По оценкам, для периода полувыведения лекарственного средства по меньшей мере 14 дней требуется размер микросфер, составляющий 1,5 микрометра в диаметре или более.
[0078] Верификация пролонгированного высвобождения: Образец микросфер 4 анализировали на высвобождение лекарственного средства в течение 8 недель с применением ранее описанных способов. Из-за относительно больших временных интервалов между выборками по сравнению с предыдущими экспериментами по высвобождению, микрорезервуары, возможно, не высвобождали лекарственное средство в условиях полного растворения в более поздние моменты времени, потенциально замедляя эффективную скорость высвобождения. Полученное высвобождение лекарственного средства приведено в таблице 4.

[0079] Результаты подтверждают непрерывное высвобождение лекарственного средства из микрорезервуаров. Микрорезервуары могут быть подобраны или отобраны по периоду полувыведения лекарственного средства для обеспечения лекарственного средства в течение периода заживления расширенного сосуда.
Пример 3: Составы микрорезервуаров в покрывающем составе холестерина и жирной кислоты с ПЭГ-липидом
[0080] Покрывающий состав получали с 107 мг стеариновой кислоты, 105 мг холестерина и 50 мг DPPE-mPEG350, перемешанных с 14 мг гептана, и нагревали до 60°C с получением прозрачного раствора. Затем раствор перемешивали вихревой мешалкой в течение 30 секунд и оставляли охлаждаться. Затем добавляли 200 мг микросфер образца #6, загруженных сиролимусом, и состав помещали в ультразвуковую баню в течение 4 минут для диспергирования и суспендирования микросфер. [Состав 1023Е]
[0081] Покрывающий состав получали с 58 мг эруковой кислоты, 43 мг DC-холестерина и 6,25 мг DOPE-mPEG350, перемешанных с 7 мг гептана, и нагревали до 60°C с получением прозрачного раствора. Затем раствор перемешивали вихревой мешалкой в течение 30 секунд и оставляли охлаждаться. Затем добавляли 100 мг микросфер образца #8, загруженных сиролимусом, и состав помещали в ультразвуковую баню в течение 5 минут для диспергирования и суспендирования микросфер. [Состав 0424А]
[0082] Покрывающий состав получали с 25 мг нервоновой кислоты, 75 мг DC-холестерина и 6,25 мг DOPE-mPEG350, перемешанных с 7 мг гептана, и нагревали до 60°C с получением прозрачного раствора. Затем раствор перемешивали вихревой мешалкой в течение 30 секунд и оставляли охлаждаться. Затем добавляли 97 мг микросфер образца #8, загруженных сиролимусом, и состав помещали в ультразвуковую баню в течение 5 минут для диспергирования и суспендирования микросфер. [Состав 0422Е]
Пример 4: Состав микрорезервуаров в покрывающем составе холестерина и жирной кислоты, ПЭГ-липида и стабилизирующей добавки
[0083] Покрывающий состав получали с 77 мг стеариновой кислоты, 40 мг холестерина, 50 мг DPPE-mPEG350, и 58 мг альфа-токоферола, перемешанных с 7 мг гептана, и нагревали до 60°С до получения прозрачного раствора. Раствор перемешивали вихревой мешалкой в течение 1 минуты и затем оставляли охлаждаться до комнатной температуры. Затем добавляли 100 мг микросфер образца #5, загруженных сиролимусом. Состав помещали в ультразвуковую баню в течение 5 минут для диспергирования и суспендирования микросфер. [Состав 1009А]
Пример 5: Состав микрорезервуаров в покрывающем составе холестерина и фосфолипида
[0084] Покрывающий состав получали с 43 мг холестерина и 42 мг L-альфа-фосфатидилхолина, перемешанных с 7 мг гептана, и нагревали до 60°С. Раствор перемешивали вихревой мешалкой в течение 30 секунд и затем оставляли охлаждаться до комнатной температуры. Затем добавляли 100 мг микросфер образца #5, загруженных сиролимусом, в колбу, которую затем помещали на ультразвуковую баню в течение 8 минут для диспергирования и суспендирования микросфер. [Состав 0311А]
Пример 6: Состав микрорезервуаров в покрывающем составе холестерина и фосфолипида с длинной ацильной цепью с или без добавления ПЭГ-липида
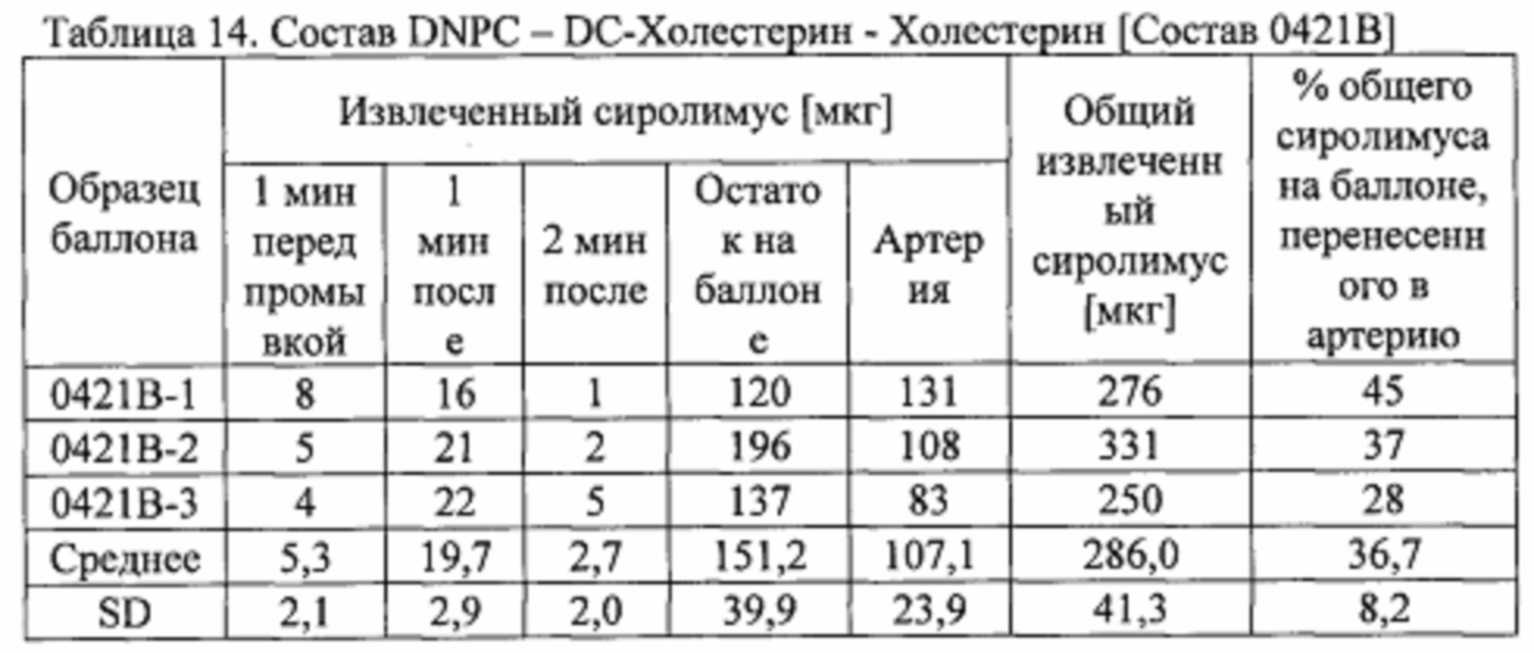
[0085] Покрывающий состав получали с 51 мг DC-холестерина, 6,25 мг DOPE-mPEG350 и 51 мг диэрукоилфосфатидилхолина (DEPC), перемешанных с 7 мг гептана, и нагревали до 60°С. Раствор перемешивали вихревой мешалкой в течение 30 секунд, и затем оставляли охлаждаться до комнатной температуры. Затем добавляли 100 мг микросфер образца #7, загруженных сиролимусом, в колбу, которую затем помещали на ультразвуковую баню в течение 5 минут для диспергирования и суспендирования микросфер. [Состав 0410А]
[0086] Покрывающий состав получали с 20 мг DC-холестерина, 26 мг холестерина, 6,25 мг DOPE-mPEG350 и 75 мг динервонилфосфатидилхолина (DNPC), перемешанных с 7 мг гептана, и нагревали до 60°С. Состав имел массовое соотношение DNPC к DC-холестерину, составляющее 1,6:1. Раствор оставляли охлаждаться до комнатной температуры. Затем добавляли 97 мг микросфер образца #7, загруженных сиролимусом, в колбу, которую затем перемешивали на вихревой мешалке в течение 30 секунд, и затем помещали в ультразвуковую баню в течение 5 минут для диспергирования и суспендирования микросфер. [Состав 0421А]
[0087] Покрывающий состав получали с 28 мг DC-холестерина, 26 мг холестерина, 6,25 мг DOPE-mPEG350 и 50 мг динервонилфосфатидилхолина (DNPC), перемешанных с 7 мг гептана, и нагревали до 60°С. Раствор перемешивали вихревой мешалкой в течение 30 секунд и затем оставляли охлаждаться до комнатной температуры. Затем добавляли 97 мг микросфер образца #7, загруженных сиролимусом, в колбу, которую затем помещали на ультразвуковую баню в течение 5 минут для диспергирования и суспендирования микросфер. [Состав 0421В]
[0088] Покрывающий состав получали с 50 мг DC-холестерина и 50 мг динервонилфосфатидилхолина (DNPC), перемешанных с 7 мг гептана, и нагревали до 60°С. Состав имел массовое соотношение DNPC к DC-холестерину, составляющее 1:1. Раствор перемешивали вихревой мешалкой в течение 30 секунд, и затем оставляли охлаждаться до комнатной температуры. Затем добавляли 100 мг микросфер образца #7, загруженных сиролимусом, в колбу, которую затем помещали на ультразвуковую баню в течение 4 минут для диспергирования и суспендирования микросфер. [Состав 1205А]
[0089] Покрывающий состав получали с 49 мг DC-холестерина, 6,25 мг DOPE-mPEG350 и 50 мг динервонилфосфатидилхолина (DNPC), перемешанных с 7 мг гептана, и нагревали до 60°С. Состав имел массовое соотношение DNPC к DC-холестерину, составляющее 1:1. Раствор перемешивали вихревой мешалкой в течение 30 секунд, и затем оставляли охлаждаться до комнатной температуры. Затем добавляли 100 мг микросфер образца #7, загруженных сиролимусом, в колбу, которую затем помещали на ультразвуковую баню в течение 2 минут для диспергирования и суспендирования микросфер. [Состав 1209А]
[0090] Покрывающий состав получали с 76 мг DC-холестерина, 6,25 мг DOPE-mPEG350 и 25 мг динервонилфосфатидилхолина (DNPC), перемешанных с 7 мг гептана, и нагревали до 60°С. Состав имел массовое соотношение DNPC к DC-холестерину, составляющее 1:3. Раствор оставляли охлаждаться до комнатной температуры. Затем добавляли 100,7 мг микросфер образца #8, загруженных сиролимусом, в колбу, которую затем перемешивали на вихревой мешалке в течение 30 секунд, и затем помещали в ультразвуковую баню в течение 5 минут для диспергирования и суспендирования микросфер [Состав 0513А]
Пример 7: Состав микрорезервуаров в покрывающем составе DC-холестерина с переменным содержанием ПЭГ-липида
[0091] Покрывающий состав получали с 12,5 мг DOPE-mPEG350, 44 мг DC-холестерина и 44 мг динервоноил фосфатидилхолина (DNPC), перемешанных с 7 мг гептана, нагретого до 60°С. Прозрачный раствор оставляли остывать до комнатной температуры, затем добавляли 97 мг микросфер, загруженных сиролимусом, из микросфер образца #8. Раствор затем помещали в ультразвуковую баню и обрабатывали ультразвуком в течение 5 минут для диспергирования и суспендирования микросфер. [Состав 0422А]
[0092] Покрывающий состав получали с 25 мг DOPE-mPEG350, 37,5 мг DC-холестерина и 37,5 мг динервоноил фосфатидилхолина (DNPC), перемешанных с 7 мг гептана, нагретого до 60°С. Прозрачный раствор оставляли остывать до комнатной температуры, затем добавляли 97 мг микросфер, загруженных сиролимусом, из образца микросфер #8. Раствор затем помещали в ультразвуковую баню и обрабатывали ультразвуком в течение 5 минут для диспергирования и суспендирования микросфер. [Состав 0422В]
Пример 8: Покрытие дополнительным лекарственным средством
[0093] Покрывающий состав получали с 72,9 мг DC-холестерина в 7 мг гептана и нагревали до 60С до солюбилизации DC-холестерина для получения прозрачного раствора. К раствору добавляли 15,5 мг сиролимуса и перемешивали на вихревой мешалке в течение 30 секунд. Раствор нагревали в течение 40 минут, перемешивая на вихревой мешалке в течение 10 секунд каждые 10 минут, и обрабатывали ультразвуком в течение 5 минут при охлаждении до комнатной температуры. К раствору добавляли 50 мг DNPC. При достижении комнатной температуры раствор фильтровали через PTFE фильтр 0,2 микрометров для удаления крупных частиц лекарственного средства. Раствор оставляли на ночь без наблюдения макрочастиц, образованных в течение ночи. Раствор анализировали, и определяли содержание сиролимуса 0,96 мг на мл. К раствору добавляли 98 мг микросфер, загруженных сиролимусом, из образца микросфер #8, перемешивали на вихревой мешалке в течение 30 секунд и обрабатывали ультразвуком в течение 8 минут для диспергирования и суспендирования микросфер. Полученный покрывающий состав содержал 0,71% по массе сиролимуса, в котором 19,1% лекарственного средства находилось в гидрофобной матрице DC-холестерина и DNPC и остаток в микросферах. [Состав 0512А]
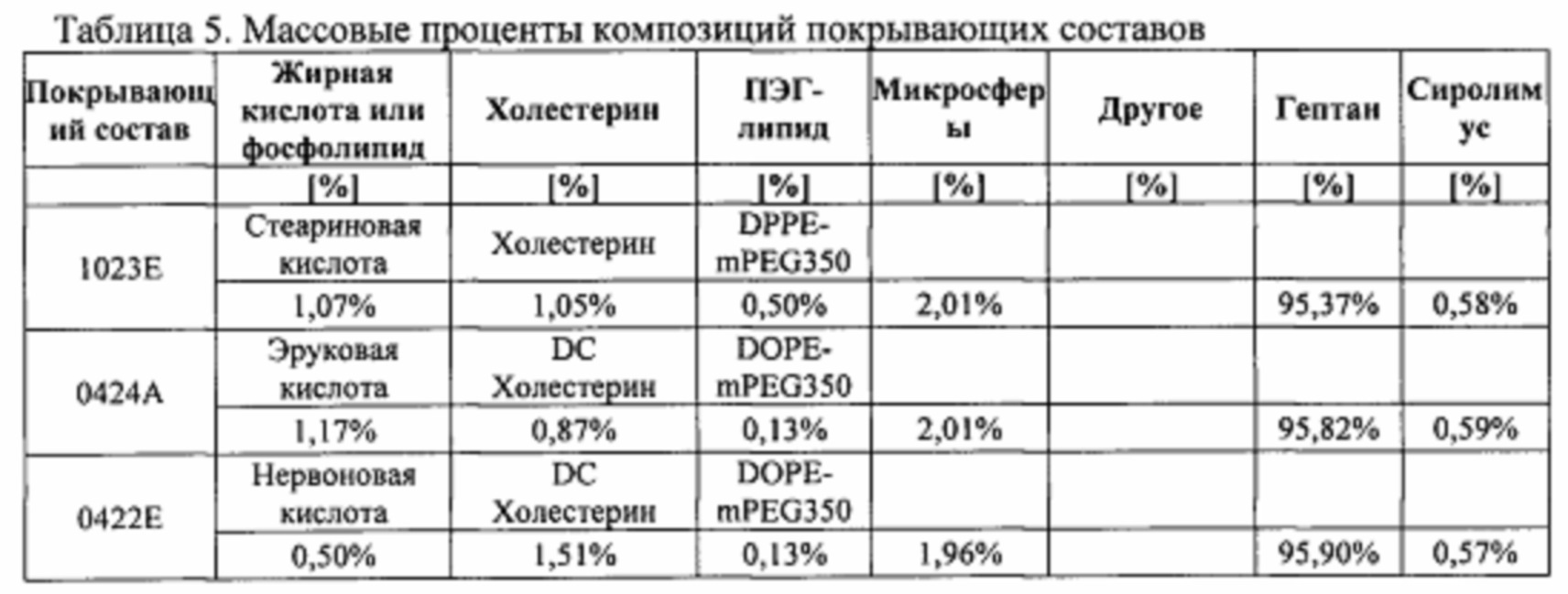
[0094][0089] Массовые проценты композиций покрывающих составов, описанных в примерах 3, 4, 5, 6, 7 и 8, представлены в таблице 5.

Пример 9: Нанесение покрывающего состава на баллонный катетер
[0095] Покрывающий состав стеариновой кислоты из примера 3 (состав 1023Е) распыляли на поверхность нейлонового баллона для ангиопластики диаметром 5,0 мм и длиной 20 мм. Семь мл покрывающего состава загружали в 25 мл газонепроницаемый шприц со встроенной магнитной мешалкой. Состав непрерывно перемешивали во время опрыскивания, чтобы поддерживать хорошую суспензию микрорезервуаров с лекарственным средством. С помощью шприцевого насоса доставляли покрывающий состав со скоростью 0,11 мл/мин через ультразвуковое сопло 120 кГц, активируемое мощностью 5,5 Вт [Sonotek DES1000]. Для верификации параметров способа цилиндр из материала баллона диаметром 5,0 мм × длиной 20 мм вырезали, взвешивали и помещали на баллон аналогичного размера. Данную оболочку баллонного материала затем покрывали, и наносили взвешенные для верификации приблизительно 2,2 мг общего покрытия, соответствующие плотности покрытия 7 мкг/мм2. Из этих 7 мкг/мм2 состава из примера 3 стеариновая кислота составляла приблизительно 1,6 мкг/мм2, холестерин составлял 1,6 мкг/мм2, DPPE-mPEG350 0,8 мкг/мм2 и микросферы, загруженные сиролимусом, из образца микросфер #5 составляли 3 мкг/мм2, обеспечивая плотность лекарственного средства 0,87 мкг/мм2. После подтверждения достижения целевой массы оболочки баллоны покрывали полностью. Баллон диаметром 5,0 мм × длиной 20 мм надували, располагали под распылителем, а затем постоянно вращали, перемещая назад и вперед 5 раз. Затем баллон удаляли и оставляли для высыхания. Способ повторяли до тех пор, пока не покрыли 6 баллонов. Этот же способ повторяли для распыления покрывающего состава из примера 6 (состав 0513А) на баллоны диаметром 3,0 мм × длиной 20 мм. Целевая масса покрытия оболочки баллона диаметром 3,0 мм × длиной 20 мм составом из примера 6 (композиция 0513А) составляла 1,4 мг, чтобы достичь плотности покрытия 7,6 мкг/мм2. Из этих 7,6 мкг/мм2 динервоноил фосфатидилхолин составлял 0,9 мкг/мм2, DC-холестерин составлял 2,7 мкг/мм2, DOPE-mPEG350 составлял 0,23 мкг/мм2, и микросферы, загруженные сиролимусом, из образца #5, составляли 3,7 мкг/мм2, обеспечивая плотность лекарственного средства 1,08 мкг/мм2.
[0096] Покрывающие составы из примеров 4, 5, 6, 7 и 8 также распыляли на поверхность баллонов длиной 20 мм способом распыления состава, как описано ранее для примера 3. Полученные массы покрытий и плотности покрытий представлены в таблице 6.


[0097] Для баллонов, покрытых составом из примера 4, на каждый баллон распыляли дополнительный состав верхнего покрытия (1010D), состоящий из 1 мг холестерина и ПЭГ600-холестерина, для покрытия слоя микрорезервуаров. Для получения данного верхнего покрытия 23 мг холестерина-PEG600 и 224 мг холестерина растворяли в 7 мл изопропанола. Масса целевого покрытия 1 мг на баллоне диаметром 5,0 мм × длиной 20 мм соответствует 3,2 мкг/мм2 общего верхнего покрытия, состоящего из 0,3 мкг/мм холестерин- PEG600 и 2,9 мкг/мм2 холестерина.
Пример 10: Адгезия покрытий к поверхности просвета сосуда
[0098] Свиные артерии ex-vivo промывали 37°С раствором Рингера с лактатом при пульсирующем потоке 50 мл/мин (приблизительно 72 ВРМ) в течение 5 минут. Баллоны, покрытые составом из примера 3, накачивали в просвете свиных артерий ex-vivo до приблизительного растяжения 1:1,2 для переноса покрытия, содержащего лекарственное средство, в просвет сосуда. Раствор, прошедший через артерии до и после накачивания (до и после смывания), баллон, применяемый для артерий, и участок артерии, контактирующий с накачанным баллоном, впоследствии анализировали на содержание лекарственного средства через 5 минут после накачивания. Сосуды, обработанные составами 1205А и 1209А, промывали в течение 60 мин для оценки увеличенной стабильности перенесенного покрытия. Количество лекарственного средства, измеренное во всех источниках анализа, суммировали и сравнивали с оценочным содержанием лекарственного средства баллона в расчете на массу покрытия. Долю лекарственного средства, переносимого в артерию, на основе оценочного содержания лекарственного средства баллона с учетом массы покрытия, применяли в качестве показателя эффективности переноса.




[0099] Баллоны, покрытые составом из примера 4, также тестировали на свиных артериях ex-vivo.
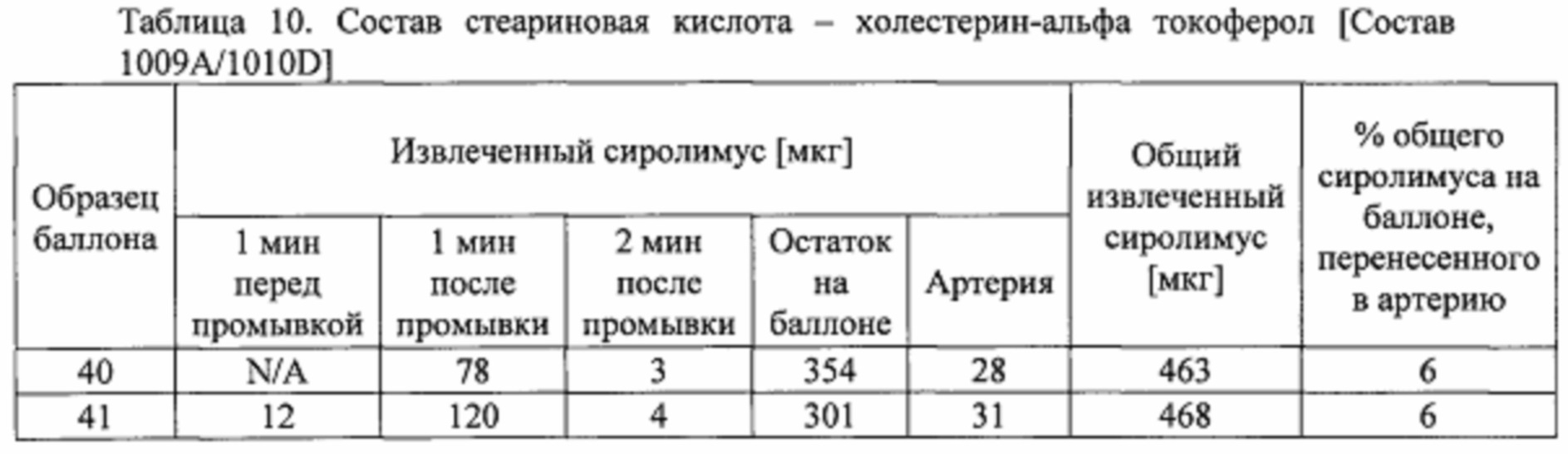
[0100] Баллоны, покрытые составом из примера 5, также тестировали на свиных артериях ex-vivo.

[0101] Баллоны, покрытые составом из примера 6, также тестировали на свиных артериях ex-vivo.







[0102] Поверхность просвета артерии после расширения баллона, покрытого составом 1209А, и через один час после промывки жидкостью после расширения исследовали посредством темнопольной микроскопии. Фиг. 4 представляет собой микрофотографию поверхности просвета при 200-кратном увеличении, показывающую сцепленный материал. Фиг. 5 представляет собой микрофотографию поверхности при 1000-кратном увеличении, показывающую, что сцепленный материал представляет собой слой сферических микрорезервуаров, окруженных материалом покрытия.
Пример 11: Адгезия покрытий на внутрипросветную поверхность сосуда для составов с переменным содержанием ПЭГ-липида
[0103] Образцы из примера 7 тестировали на перенос покрытия и устойчивость к смыванию с применением способов из примера 10. Результаты сведены в таблицу для сравнения покрытий с DNPC и DC-Холестерином в равной пропорции с различными количествами DOPE-mPEG350. [Составы 1205А, 1209А, 0422А, 0422В]


[0104] Результаты демонстрируют значительный перенос покрытия, содержащего лекарственное средство, в просвет сосуда. Потеря покрытия, содержащего лекарственное средство, во время предварительной промывки увеличилась для покрывающего состава с 25% ПЭГ-липид.
Пример 12: Адгезия покрытия с дополнительным содержанием рапамицина на внутрипросветную поверхность сосуда
[0105] Состав из примера 8 испытывали на перенос покрытия и устойчивость к смыванию с применением способов примера 10.

[0106] Результаты демонстрируют значительный перенос лекарственного средства в просвет сосуда из покрытия с добавлением дополнительного лекарственного средства к компонентам покрывающего состава фосфолипиду и холестерину.
Пример 13: Высвобождение лекарственного средства в сосуд, подлежащий лечению, in-vivo
[0107] Для получения баллонных катетеров, покрытых составом с микрорезервуарами, содержащими лекарственное средство, 100 мг DNPC, 103 мг DC-холестерина и 12,5 мг DOPE-mPEG350 смешивали с 14 мг гептана. Смесь нагревали до 60°С для растворения твердых компонентов и охлаждали до комнатной температуры. Затем добавляли 195 мг микросфер образца #6 и перемешивали для суспендирования микросфер. Баллонные катетеры с баллонами диаметром 3,0 мм × длиной 20 мм покрывали составом с применением способов, описанных в примере 9. Покрытые баллонные катетеры высушивали. На баллоны наносили в среднем 1,28 мг ± 0,12 мг сухого покрытия, в результате чего получали плотность покрытия 6,80 мкг/мм2 и плотность лекарственного средства 1,06 мкг/мм2. Баллоны сдували и складывали для последующего применения до конфигурации с меньшим поперечным сечением и упаковывали в оболочку для сохранения сложенной конфигурации. Баллонные катетеры упаковывали и стерилизовали ионизирующим излучением в минимальной дозе 25 килоГрей.
[0108] Илеофеморальную артерию кроликов применяли для оценки переноса in vivo лекарственного покрытия в артериальный сосуд. Сегмент илеоферморальной артерии для лечения сначала освобождали от эндотелия, чтобы воспроизвести повреждение ткани после ангиопластики. Осуществляли разрез общей сонной артерии, и баллонный клинообразный катетер размером вводили в артерию и направляли под флюороскопическим контролем к месту лечения идеофеморальной артерии. Контрастный агент вводили через катетер и записывали ангиограммы идеофеморальных артерий. Баллонный клинообразный катетер заменяли на баллонный катетер для стандартной ангиопластики диаметром 3,0 мм и длиной 8 мм под флюороскопическим контролем, накачивали и отводили проксимально в его расширенном состоянии примерно до уровня бифуркации подвздошной кости, чтобы оголить часть артерии. Баллонный катетер для ангиопластики заменяли на баллонный катетер с лекарственным покрытием. Катетер продвигали к участку оголенного сосуда и накачивали в течение 120 секунд. Баллон сдували и удаляли. Лечили как правую, так и левую подвздошные артерии каждого животного.
[0109] Всего обрабатывали 11 животных. Одно животное (2 обработанные подвздошные артерии) подвергали эвтаназии через 1 час после обработки, и участки сосудов извлекали для микроскопического исследования. Другое животное (2 обработанные подвздошные артерии) подвергали эвтаназии через 24 часа после обработки, и участки сосудов извлекали для микроскопического исследования. У трех животных (6 подвздошных артерий) извлекали в каждый момент времени 1 час, 7 дней и 28 дней. Образцы крови у этих животных отбирали до операции, через 0,5, 1, 4 часа после лечения и при умерщвлении. Сегменты сосуда извлекали и анализировали на содержание лекарственного средства путем количественного определения ВЭЖХ/МС.
[0110] Анализ образцов крови показал быстрое снижение количества лекарственного средства в циркулирующей крови с концентрацией 4,75 нг/мл через 30 минут, 2,63 нг/мл через 1 час и 0,82 нг/мл через 4 часа. Концентрация лекарственного средства в крови, собранной при умерщвлении в 7 день и 28 день, составляла ниже предела обнаружения для количественного анализа. Уровни в крови соответствовали экспоненциальной кривой затухания с периодом полувыведения 0,77 часа, что свидетельствует о быстром разведении и клиренсе лекарственного средства кровотоком.
[0111] Сканирующая электронная микроскопия и световая микроскопия образцов ткани, собранных через 1 час и 24 часа после обработки, показали слой материала на поверхности просвета сосуда со сферическими лекарственными микрорезервуарами в пределах слоя. Неравномерные участки фибрина наблюдали на поверхности просвета, но крупные отложения фибрина, свидетельствующие о несовместимости с кровью, связанные с покрытием, не были обнаружены.
[0112] Анализ обработанных сегментов сосудов показал, что уровни лекарственного средства в ткани составили 261 мкг/г ± 116,5 мкг/г через 1 час после обработки, 43,8 мкг/г ± 34,2 мкг/г через 7 дней после обработки и 21,5 мкг/г ± 17,3 мкг/г через 28 дней после обработки. Результаты указывают на адгезию покрытия, содержащего микрорезервуары с лекарственным средством, к внутрипросветной поверхности артерии с непрерывным присутствием лекарственного средства, связанного с тканями обрабатываемого сосуда, через 28 дней. Связанные с тканями уровни лекарственного средства демонстрировали быстрое начальное снижение, которое замедлялось между 7 и 28 днями. Связанные с тканями уровни лекарственного средства с 7 по 28 день соответствовали экспоненциальному затуханию, что указывает на период полувыведения приблизительно 20,4 дня.
Дополнительные варианты реализации
[0113] Хотя настоящее изобретение раскрыто в контексте некоторых предпочтительных вариантов реализации и примеров, специалистам в данной области техники будет понятно, что настоящее изобретение выходит за рамки конкретных раскрытых вариантов реализации для других альтернативных вариантов реализации и/или применения изобретения и очевидных модификаций и их эквивалентов. Кроме того, предполагают, что различные аспекты и признаки описанного изобретения могут быть реализованы на практике отдельно, объединены вместе или заменены друг другом, и что множество комбинаций и подкомбинаций признаков и аспектов может быть осуществлено, и все еще находиться в пределах объема настоящего изобретения. Кроме того, раскрытие в настоящем документе любого конкретного признака, аспекта, способа, свойства, характеристики, качества, атрибута, элемента и т.п. в связи с вариантом реализации может быть использовано во всех других вариантах реализации, изложенных в настоящем документе. Таким образом, предполагают, что объем настоящего изобретения, описанного в настоящем документе, не должен быть ограничен определенными раскрытыми вариантами реализации, описанными выше, но должен определяться только путем ясного прочтения формулы изобретения.
[0114] Условный язык, например, среди прочего, «мог бы», «возможно» или «может», если конкретно не указано иное или иным образом не понимается из контекста, в основном предназначен для выражения того, что определенные варианты реализации включают определенные функции или элементы, в то время как другие варианты реализации не включают. Таким образом, такой условный язык в целом не предназначен для того, чтобы подразумевать, что признаки или элементы каким-либо образом необходимы для одного или нескольких вариантов реализации.
Итоги вариантов реализации
[0115] Покрытие для расширяемой части катетера, содержащее гидрофобную матрицу и диспергированную фазу, содержащее множество микрорезервуаров в гидрофобной матрице, при этом множество микрорезервуаров содержит первый активный агент и биоразлагаемый и биоразрушаемый полимер. Покрытие сконструировано для переноса к внутрипросветной стенке, когда расширяемая часть накачана.
[0116] В вариантах реализации покрытия, как описано выше, первый активный агент смешан с или диспергирован в биоразлагаемом или биоразрушаемом полимере.
[0117] В вариантах реализации покрытия, как описано выше, биоразлагаемый или биоразрушаемый полимер выбран из группы, состоящей из полимолочной кислоты, полигликолевой кислоты и их сополимеров, полидиоксанона, поликапролактона, полифосфазена, коллагена, желатина, хитозана, гликозаминогликанов и их комбинаций.
[0118] В вариантах реализации покрытия, как описано выше, гидрофобная матрица включает по меньшей мере одно гидрофобное соединение, выбранное из группы, состоящей из стеринов, липидов, фосфолипидов, жиров, жирных кислот, поверхностно-активных веществ и их производных.
[0119] В некоторых вариантах реализации покрытия, описанного выше, гидрофобная матрица включает холестерин и жирную кислоту. В некоторых вариантах реализации массовое соотношение холестерина к жирной кислоте находится в диапазоне от примерно 1:2 до примерно 3:1.
[0120] В вариантах реализации покрытия, как описано выше, жирная кислота выбрана из группы, состоящей из лауриновой кислоты, лауролеиновой кислоты, тетрадекадиеновой кислоты, октановой кислоты, миристиновой кислоты, миристолеиновой кислоты, деценовой кислоты, декановой кислоты, гексадеценовой кислоты, пальмитолеиновой кислоты, пальмитиновой кислоты, линоленовой кислоты, линолевой кислоты, олеиновой кислоты, вакценовой кислоты, стеариновой кислоты, эйкозапентаеновой кислоты, арахидоновой кислоты, мидовой кислоты, арахиновой кислоты, докозагексаеновой кислоты, докозапентаеновой кислоты, докозатетраеновой кислоты, докозеновой кислоты, тетракозановой кислоты, гексакозеновой кислоты, пристановой кислоты, фитановой кислоты и нервоновой кислоты.
[0121] В некоторых вариантах реализации покрытия, описанного выше, гидрофобная матрица включает холестерин и фосфолипид. В некоторых вариантах реализации массовое соотношение холестерина и фосфолипида составляет в диапазоне от примерно 1:2 до примерно 3:1.
[0122] В некоторых вариантах реализации фосфолипид выбран из группы, состоящей из фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина или фосфатидилинозитола.
[0123] В некоторых вариантах реализации фосфолипид представляет собой катионный фосфолипид. В некоторых вариантах реализации катионный фосфолипид представляет собой фосфатидилэтаноламин, диолеоилфосфатидилэтаноламин (DOPE) или аминопроизводное фосфатидилхолина.
[0124] В некоторых вариантах реализации фосфолипид содержит ацильную цепь длиной от примерно 20 до примерно 34 атомов углерода. В некоторых вариантах реализации фосфолипид выбран из группы, состоящей из диэйкозеноилфосфатидилхолина (1,2-диэйкозеноил-sn-глицеро-3-фосфохолин, С20:1 PC), диарахидоноилфосфатидилхолина (1,2-диарахидоил-sn-глицеро-3-фосфохолин, С20:0 PC), диэрукоилфосфатидилхолина (1,2-диэрукоил-sn-глицеро-3-фосфохолин, C22:l PC), дидокозагексаеноилфосфатидилхолина (1,2-дидокозагексаеноил-sn-глицеро-3-фосфохолин, С22:6 PC), генэйкозеноилфосфатидилхолина (1,2-генэйкозеноил-sn-глицеро-3-фосфохолин, С21:1 PC) и динервонилфосфатидилхолина (1,2-динервоноил-sn-глицеро-3-фосфохолин, C24:l PC).
[0125] В вариантах реализации покрытия, как описано выше, холестерин представляет собой DC-Холестерин.
[0126] В вариантах реализации покрытия, как описано выше, множество микрорезервуаров составляет от примерно 10% до примерно 75% по массе покрытия.
[0127] В вариантах реализации покрытия, как описано выше, множество микрорезервуаров имеет средний диаметр от примерно 1,5 микрометров до примерно 8 микрометров. В некоторых вариантах реализации множество микрорезервуаров имеет средний диаметр от примерно 2 микрометров до примерно 6 микрометров. В некоторых вариантах реализации множество микрорезервуаров имеет средний диаметр от примерно 3 микрометров до примерно 5 микрометров.
[0128] В вариантах реализации покрытия, как описано выше, множество микрорезервуаров имеет кинетику высвобождения активного агента с периодом полувыведения не менее 14 дней.
[0129] В вариантах реализации покрытия, как описано выше, первый биоразлагаемый или биоразрушаемый полимер выбран из группы, состоящей из полимолочной кислоты, полигликолевой кислоты и их сополимеров, полидиоксанона, поликапролактона, полифосфазена, коллагена, желатина, хитозана, гликозаминогликанов и их комбинаций.
[0130] В вариантах реализации покрытия, как описано выше, первый активный агент выбран из группы, состоящей из паклитаксела, сиролимуса, производного паклитаксела, производного сиролимуса, аналогов паклитаксела, аналогов сиролимуса, ингибирующей РНК, ингибирующей ДНК, стероидов и ингибиторов комплемента.
[0131] В вариантах реализации покрытия, как описано выше, первый активный агент составляет от примерно 10% до примерно 50% по массе множества микрорезервуаров.
[0132] В вариантах реализации покрытия, как описано выше, покрытие дополнительно содержит второй активный агент вне множества микрорезервуаров. В некоторых вариантах реализации второй активный агент выбран из группы, состоящей из паклитаксела, сиролимуса, производного паклитаксела, производного сиролимуса, аналогов паклитаксела, аналогов сиролимуса, ингибирующей РНК, ингибирующей ДНК, стероидов и ингибиторов комплемента. В некоторых вариантах реализации второй активный агент является таким же, как первый активный агент.
[0133] В вариантах реализации покрытия, как описано выше, гидрофобная матрица дополнительно включает ПЭГ-липид. В некоторых вариантах реализации ПЭГ-липид выбран из группы, состоящей из 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-350 (DSPE-mPEG350), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-метокси(полиэтиленгликоль)-350 (DPPE-mPEG350), 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-350 (DOPE-mPEG350), 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-550 (DSPE-mPEG550), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-550 (DPPE-mPEG550) и 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-500 (DOPE-mPEG550). В некоторых вариантах реализации ПЭГ-липид составляет от примерно 1% до примерно 30% по массе гидрофобной матрицы. В некоторых вариантах реализации ПЭГ-липид составляет от примерно 12% или менее по массе гидрофобной матрицы.
[0134] В вариантах реализации покрытия, как описано выше, покрытие дополнительно содержит одну или более добавок, независимо выбранных из усилителей проницаемости и стабилизаторов.
[0135] В вариантах реализации покрытия, как описано выше, покрытие имеет поверхностную концентрацию от примерно 1 мкг/мм2 до примерно 10 мкг/мм2.
[0136] Катетер, содержащий расширяемую часть на удлиненном теле, и любой вариант реализации покрытия, описанный выше, на расширяемой части. В некоторых вариантах реализации катетер дополнительно содержит разделительный слой между расширяемой частью и покрытием, при этом разделительный слой сконструирован, чтобы отделять покрытие от расширяемой части. В некоторых вариантах реализации разделительный слой содержит DSPE-mPEG350 или DSPE-mPEG500. В некоторых вариантах реализации разделительный слой имеет поверхностную концентрацию от примерно 0,1 мкг/мм2 до примерно 5 мкг/мм2.
[0137] В вариантах реализации катетера, как описано выше, катетер дополнительно содержит защитное покрытие на покрытии. В некоторых вариантах реализации защитное покрытие содержит гидрофильный полимер, углевод или амфифильный полимер. В некоторых вариантах реализации защитное покрытие представляет собой гликозаминогликан или кристаллизованный сахар. В некоторых вариантах реализации защитное покрытие имеет поверхностную концентрацию от примерно 0,1 мкг/мм2 до примерно 5 мкг/мм2.
[0138] Покрывающий состав для расширяемой части катетера, содержащий твердую часть и жидкость. Твердая часть содержит множество микрорезервуаров и по меньшей мере одно гидрофобное соединение, при этом множество микрорезервуаров содержит первый активный агент и биоразлагаемый и биоразрушаемый полимер. В некоторых вариантах реализации первый активный агент смешан с или диспергирован в биоразлагаемом или биоразрушаемом полимере.
[0139] В некоторых вариантах реализации первый активный агент выбран из группы, состоящей из паклитаксела, сиролимуса, производного паклитаксела, производного сиролимуса, аналогов паклитаксела, аналогов сиролимуса, ингибирующей РНК, ингибирующей ДНК, стероидов и ингибиторов комплемента. В некоторых вариантах реализации биоразлагаемый или биоразрушаемый полимер выбран из группы, состоящей из полимолочной кислоты, полигликолевой кислоты и их сополимеров, полидиоксанона, поликапролактона, полифосфазена, коллагена, желатина, хитозана, гликозаминогликанов и их комбинаций.
[0140] В некоторых вариантах реализации покрывающего состава, описанного выше, жидкость выбрана из группы, состоящей из пентана, гексана, гептана, гептана и фторуглеродной смеси, спиртовой и фторуглеродной смеси, и смеси спирта и воды.
[0141] В некоторых вариантах реализации покрывающего состава, описанного выше, твердая часть дополнительно содержит второй активный агент вне множества микрорезервуаров. В некоторых вариантах реализации второй активный агент выбран из группы, состоящей из паклитаксела, сиролимуса, производного паклитаксела, производного сиролимуса, аналогов паклитаксела, аналогов сиролимуса, ингибирующей РНК, ингибирующей ДНК, стероидов и ингибиторов комплемента.
[0142] В некоторых вариантах реализации покрывающего состава, описанного выше, по меньшей мере одно гидрофобное соединение выбрано из группы, состоящей из стеринов, липидов, фосфолипидов, жиров, жирных кислот, поверхностно-активных веществ и их производных.
[0143] В некоторых вариантах реализации покрывающего состава, описанного выше, по меньшей мере одно гидрофобное соединение содержит холестерин и жирную кислоту. В некоторых вариантах реализации массовое соотношение холестерина к жирной кислоте находится в диапазоне от примерно 1:2 до примерно 3:1. В некоторых вариантах реализации жирная кислота выбрана из группы, состоящей из лауриновой кислоты, лауролеиновой кислоты, тетрадекадиеновой кислоты, октановой кислоты, миристиновой кислоты, миристолеиновой кислоты, деценовой кислоты, декановой кислоты, гексадеценовой кислоты, пальмитолеиновой кислоты, пальмитиновой кислоты, линоленовой кислоты, линолевой кислоты, олеиновой кислоты, вакценовой кислоты, стеариновой кислоты, эйкозапентаеновой кислоты, арахидоновой кислоты, мидовой кислоты, арахиновой кислоты, докозагексаеновой кислоты, докозапентаеновой кислоты, докозатетраеновой кислоты, докозеновой кислоты, тетракозановой кислоты, гексакозеновой кислоты, пристановой кислоты, фитановой кислоты и нервоновой кислоты.
[0144] В некоторых вариантах реализации покрывающего состава, описанного выше, по меньшей мере одно гидрофобное соединение содержит холестерин и фосфолипид. В некоторых вариантах реализации массовое соотношение холестерина и фосфолипида составляет в диапазоне от примерно 1:2 до примерно 3:1. В некоторых вариантах реализации фосфолипид выбран из группы, состоящей из фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина и фосфатидилинозитола.
[0145] В некоторых вариантах реализации фосфолипид представляет собой катионный фосфолипид. В некоторых вариантах реализации катионный фосфолипид представляет собой фосфатидилэтаноламин, диолеоилфосфатидилэтаноламин (DOPE) или аминопроизводные фосфатидилхолина.
[0146] В некоторых вариантах реализации фосфолипид содержит ацильную цепь длиной от примерно 20 до примерно 34 атомов углерода. В некоторых вариантах реализации фосфолипид выбран из группы, состоящей из диэйкозеноилфосфатидилхолина (1,2-диэйкозеноил-sn-глицеро-3-фосфохолин, С20:1 PC), диарахидоноилфосфатидилхолина (1,2-диарахидоил-sn-глицеро-3-фосфохолин, С20:0 PC), диэрукоилфосфатидилхолина (1,2-диэрукоил-sn-глицеро-3-фосфохолин, C22:l PC), дидокозагексаеноилфосфатидилхолина (1,2-дидокозагексаеноил-sn-глицеро-3-фосфохолин, С22:6 PC), генэйкозеноилфосфатидилхолина (1,2-генэйкозеноил-sn-глицеро-3-фосфохолин, C21:1 PC) и динервонилфосфатидилхолина (1,2-динервоноил-sn-глицеро-3-фосфохолин, C24:1 PC).
[0147] В некоторых вариантах реализации покрывающего состава, описанного выше, холестерин представляет собой DC-Холестерин.
[0148] В некоторых вариантах реализации покрывающего состава, описанного выше, твердая часть дополнительно содержит ПЭГ-липид и/или добавку. В некоторых вариантах реализации ПЭГ-липид выбран из группы, состоящей из 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-350 (DSPE-mPEG3 50), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-метокси(полиэтиленгликоль)-350 (DPPE-mPEG350), 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-350 (DOPE-mPEG350), 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-550 (DSPE-mPEG550), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-550 (DPPE-mPEG550) и 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин-N-метокси(полиэтиленгликоль)-500 (DOPE-mPEG550).
[0149] В некоторых вариантах реализации покрывающего состава, описанного выше, множество микрорезервуаров составляет от примерно 10% до примерно 75% по массе твердой части.
[0150] В некоторых вариантах реализации покрывающего состава, описанного выше, твердая часть составляет от примерно 2 до примерно 7% по массе покрывающего состава.
[0151] Способ нанесения покрытия на расширяемую часть катетера включающий нанесение покрывающего состава по любому из вариантов реализации, описанных выше, на поверхность накачанной расширяемой части катетера, выпаривание жидкости и спуск воздуха из расширяемой части. В некоторых вариантах реализации нанесение покрывающего состава включает распыление, нанесение покрытия погружением, нанесение покрытия валиком, электростатическое осаждение, печать, пипетирование или дозирование.
[0152] В некоторых вариантах реализации способа, описанного выше, способ дополнительно включает нанесение разделительного слоя на расширяемую часть. В некоторых вариантах реализации разделительный слой содержит DSPE-mPEG350 или DSPE-mPEG500.
[0153] Способ лечения или предотвращения состояния на участке лечения, включающий введение катетера, содержащего расширяемую часть, к участку лечения, при этом расширяемая часть покрыта покрытием по любому варианту реализации, описанному выше, накачивание расширяемой части, чтобы обеспечить контакт между покрытием и тканью на участке лечения, спуск воздуха из расширяемой части, и удаление катетера.
[0154] В вариантах реализации способа, описанного выше, контакт между тканью и покрытием обеспечивает перенос по меньшей мере части покрытия на расширяемой части к месту лечения. В некоторых вариантах реализации способ дополнительно включает поддержание контакта между покрытием и тканью в течение периода от примерно 30 до примерно 120 секунд.
[0155] В вариантах реализации любого способа, описанного выше, состояние выбрано из группы, состоящей из атеросклероза, стеноза или уменьшения диаметра просвета в пораженном кровеносном сосуде, рестеноза и внутристентового рестеноза и их комбинаций.
[0156] В вариантах реализации любого способа, описанного выше, дополнительный разделительный слой наносят между расширяемой частью и покрытием.
Реферат
Группа изобретений раскрывает катетер с покрытием на расширяемой части катетера, способ нанесения покрытия на расширяемую часть катетера и способ доставки активного агента к участку лечения. Покрывающий состав, который наносится на расширяемую часть катетера, характеризуется тем, что содержит гидрофобную матрицу и диспергированную фазу. Диспергированная фаза содержит множество микрорезервуаров, диспергированных в гидрофобной матрице, при этом множество микрорезервуаров содержит активный агент и биоразлагаемый полимер. Группа изобретений позволяет облегчать доставку лекарственных средств к поврежденным сосудам. 5 н. и 63 з.п. ф-лы, 5 ил., 13 пр., 19 табл.

Комментарии