Композиции и способы лечения и диагностики резистентного к химиотерапии рака - RU2710735C2
Код документа: RU2710735C2
Чертежи












Описание
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит Список последовательностей, представленный в электронном виде в формате ASCII и в полном объеме включенный в данный документ посредством ссылки. Указанная копия ASCII, созданная 22 декабря 2015 года, имеет название 50474_092WO3_Sequence_Listing_12_22_15_ST25, и ее размер составляет 4552 байта.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение направлено на способы идентификации пациентов с резистентным к химиотерапии раком.
УРОВЕНЬ ТЕХНИКИ
Эпителиальный рак яичника (ЭРЯ) является основной причиной смерти при гинекологических злокачественных опухолях, и лечение ЭРЯ продолжает оставаться серьезной клинической проблемой. Современный стандарт лечения ЭРЯ состоит из агрессивной хирургической циторедукции с последующей адъювантной химиотерапией на основе платины и таксана. Хотя частота ответа на это лечение является высокой, 20-30% случаев являются резистентными и прогрессируют вовремя или в течение шести месяцев после завершения первичной терапии. Таким образом, пациенты с резистентным раком получают небольшое преимущество от данного лечения и представляют собой значительную неудовлетворенную клиническую потребность. Чтобы спрогнозировать ответ на химиотерапию и разработать новые стратегии для преодоления первичной резистентности к химиотерапии при ЭРЯ и при раке в целом, необходимо более глубокое понимание молекулярных характеристик резистентности к химиотерапии.
Активация микросреды стромы хозяина, известной как "реактивная строма", играет роль критического компонента прогрессирования рака при многих видах рака. Стромальная активация при раке напоминает процесс заживления ран в нормальных тканях, поскольку активированные стромальные клетки демонстрируют повышенное продуцирование компонентов внеклеточного матрикса (ВКМ), факторов роста и матричных ремоделирующих ферментов для создания микросреды опухоли, которая способствует выживанию, пролиферации и инвазии раковых клеток. В частности, важная роль микросреды опухоли в патогенезе ЭРЯ все более и более подтверждается. Однако ключевые регуляторы реактивной стромы и специфические механизмы, посредством которых реактивная строма влияет на прогрессирование опухоли, ответ на лечение, и клинические результаты при ЭРЯ плохо изучены.
Соответственно, существует потребность в способах определения того, могут ли пациенты отвечать на химиотерапевтические методы лечения, а также в разработке альтернативных стратегий для лечения рака в целом.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте изобретение относится к способам идентификации пациентов с резистентным к химиотерапии раком, способы, включающие: а) определение уровня экспрессии одного или более генов сигнатуры стромы в образце, полученном от пациента, b) сравнение уровня экспрессии одного или более генов сигнатуры стромы с медианным уровнем экспрессии одного или более генов сигнатуры стромы в данном виде рака, и с) определение того, является ли рак пациента резистентным к химиотерапии, причем экспрессия одного или более генов сигнатуры стромы в образце пациента на уровне, превышающем медианный уровень экспрессии одного или более генов сигнатуры стромы в данном виде рака указывает на то, что пациент имеет резистентный к химиотерапии рак, например, в случае обнаружения уровней экспрессии одного или более генов сигнатуры стромы, которые повышаются при раке, резистентном к химиотерапии (например, химиотерапии на основе платины). Обнаружение пониженных уровней экспрессии (например, уровней, меньших, чем медианный уровень) также может указывать на то, что у пациента имеется рак, устойчивый к химиотерапии, в случае обнаружения уровней экспрессии одного или более генов сигнатуры стромы, которые являются пониженными при раке, резистентном к химиотерапии (например, химиотерапии на основе платины).
В одном варианте реализации изобретения пациент имеет рак, который является резистентным к химиотерапии, если определено, что рак пациента экспрессирует один или более генов сигнатуры стромы на уровне, превышающем 75-й процентиль для экспрессии одного или более генов сигнатуры стромы в данном виде рака (например, в случае одного или более генов сигнатуры стромы, уровень экспрессии которых повышается при раке, резистентном к химиотерапии (например, химиотерапии на основе платины). В некоторых других вариантах реализации вышеуказанного аспекта рак, который является резистентным к химиотерапии, является раком, который является резистентным к платине.
В некоторых вариантах реализации изобретения способы дополнительно включают стадию идентификации пациента, которому, вероятно, может принести пользу введение антагониста VEGF в случае, если у пациента установлено наличие рака, который является резистентным к химиотерапии. В некоторых других вариантах реализации изобретения способы дополнительно включают стадию введения антагониста VEGF в терапевтически эффективном количестве пациенту в случае, если у пациента установлено наличие рака, который является резистентным к химиотерапии. В предпочтительных вариантах реализации изобретения антагонист VEGF представляет собой антитело к VEGF. Предпочтительно антитело к VEGF представляет собой бевацизумаб.
В других вариантах реализации изобретения способы дополнительно включают стадию идентификации пациента, которому, вероятно, может принести пользу нацеленная на строму терапия в случае, если у пациента установлено наличие рака, который является резистентным к химиотерапии. В некоторых других вариантах реализации изобретения способы дополнительно включают стадию введения нацеленного на строму агента в терапевтически эффективном количестве пациенту в случае, если у пациента установлено наличие рака, который является резистентным к химиотерапии.
В другом варианте реализации изобретения способы дополнительно включают в себя стадию идентификации пациента, которому, вероятно, может принести пользу иммунотерапия в случае, если у пациента установлено наличие рака, который является резистентным к химиотерапии. В еще одном варианте реализации изобретения способы дополнительно включают стадию введения иммуномодулирующего агента в терапевтически эффективном количестве пациенту в случае, если у пациента установлено наличие рака, который является резистентным к химиотерапии. В предпочтительных вариантах реализации изобретения иммуномодулирующий агент включает антагониста TDO2, CD36, GZMK, CD247, CD1C, CSF1, IDO1, IL7R или CCR7.
Во втором аспекте изобретение относится к способам идентификации пациентов, имеющих рак, чувствительным к химиотерапии, способы, включающие: а) определение уровня экспрессии одного или более генов сигнатуры стромы в образце, полученном от пациента, b) сравнение уровня экспрессии одного или более генов сигнатуры стромы с медианным уровнем экспрессии одного или более генов сигнатуры стромы в данном виде рака и с) определение того, является ли рак пациента чувствительным к химиотерапии, причем экспрессия одного или более генов сигнатуры стромы в образце пациента на 5 меньшем уровне, чем медианный уровень экспрессии одного или более генов сигнатуры стромы в данном виде рака указывает на то, что пациент имеет чувствительный к химиотерапии рак, (например, в случае обнаружения уровней экспрессии одного или более генов сигнатуры стромы, которые повышаются при раке, резистентном к химиотерапии (например, химиотерапия на основе платины).
В некоторых вариантах реализации изобретения пациент имеет рак, который является чувствительным к химиотерапии, если определено, что рак пациента экспрессирует один или более генов сигнатуры стромы на уровне, который является меньшим, чем 25-й процентиль для экспрессии одного или более генов сигнатуры стромы в данном виде рака. В других вариантах реализации изобретения способ включает стадию введения одного или более химиотерапевтического(их) агента(ов) в схему химиотерапии, если у пациента установлено наличие рака, чувствительного к химиотерапии.
В некоторых вариантах реализации вышеуказанных аспектов и вариантов реализации изобретения образец представляет собой образец опухолевой ткани. В конкретных вариантах реализации изобретения перед введением химиотерапевтического агента выполняют способы для предоставления предварительного диагноза. В некоторых вариантах реализации изобретения пациент не подвергался химиотерапии или пациент в настоящее время подвергается химиотерапии.
В третьем аспекте изобретение относится к способам идентификации пациентов, страдающих от рака, которым может быть полезно введение антагониста VEGF или иммуномодулирующего агента, способы включают: а) определение уровня экспрессии одного или более генов сигнатуры стромы в образце, полученном от пациента, причем экспрессия одного или более генов сигнатуры стромы на уровне, превышающем медианный уровень экспрессии одного или более генов сигнатуры стромы в данном виде рака указывает на то, что пациенту может принести пользу введение антагониста VEGF или иммуномодулирующего агента (например, в случае обнаружения уровней экспрессии одного или более генов сигнатуры стромы, которые повышаются при раке, резистентном к химиотерапии, (например, химиотерапия на основе платины) и, необязательно, b) введение антагониста VEGF или иммуномодулирующего агента в терапевтически эффективном количестве пациенту.
В конкретных вариантах реализации изобретения вышеуказанные способы дополнительно включают стадию введения одного или более химиотерапевтического(их) агента(ов) в схему химиотерапии. В некоторых вариантах реализации изобретения химиотерапевтический(е) агент(ы) выбран из группы, состоящей из антитела HER, антитела, направленного против связанного с опухолью антигена, антигормонального соединения, кардиопротектора, цитокина, лекарственного средства, нацеленного на EGFR, антиангиогенного агента, ингибитора тирозинкиназы, ингибитора ЦОГ, нестероидного противовоспалительного лекарственного средства, ингибитора фарнезилтрансферазы, антитела, которое связывает онкофетальный белок СА 125, вакцины Her2, терапии, направленной на HER, ингибитора raf или ras, липосомального доксорубицина, топотекана, таксана, двойного ингибитора тирозинкиназы, TLK286, EMD-7200, лекарственного средства, которое лечит тошноту, лекарственного средства, которое предупреждает или лечит кожную сыпь, или стандартной терапии против угревой сыпи, лекарственного средства, которое лечит или предупреждает диарею, лекарственного средства для снижения температуры тела, и гемопоэтического фактора роста. В других вариантах реализации изобретения один или более химиотерапевтического(их) агента(ов) представляют собой гемцитабин, карбоплатин, оксалиплатин, иринотекан, фторпиримидин (например, 5-FU), паклитаксел (например, наб-паклитаксел), доцетаксел, топотекан, капецитабин, лейковорин, темозоломид, интерферон-альфа или липосомальный доксорубицин (например, ПЭГилированный липосомальный доксорубицин).
В одном предпочтительном варианте реализации изоберетния схема химиотерапии включает введение карбоплатина и паклитаксела; карбоплатина и гемцитабина; или паклитаксела, топотекана, или ПЭГилированного липосомального доксорубицина. Во втором предпочтительном варианте реализации изобретения схема химиотерапии включает введение капецитабина и паклитаксела; или капецитабина и доцетаксела. В третьем предпочтительном варианте реализации изобретения схема химиотерапии включает введение темозоломида и, необязательно, лучевую терапию. В четвертом предпочтительном варианте реализации изобретения схема химиотерапии включает введение флуропиримидина, иринотекана, цисплатина, флуропирамидина и оксалиплатина; флуропиримидина и иринотекана; флуропирамидина, лейковорина и оксалиплатина; или иринотекана, фторпиримидина и лейковорина. В пятом предпочтительном варианте реализации изобретения схема химиотерапии включает введение паклитаксела и топотекана; или паклитаксела и цисплатина. В шестом предпочтительном варианте реализации изобретения схема химиотерапии включает введение интерферона-альфа2а.
В некоторых вариантах реализации изобретения один или более генов сигнатуры стромы выбран из группы, состоящей из POSTN, LOX, TIMP3, FAP, BGN, FGF1, FN1, ANGPTL2, АСТА2, ММР11, RBP4, CD36, PLVAP, РЕСАМ1, GZMK, CD247, АВСС9, PCOLCE, CD1C, MS4A1, CD44, РМЕРА1, IL7R, FBLN1, TWIST1, ID1, RAC2, GFRA1, CCR7, MAN1A1, EVI2A, PTPRC CD45RA, FCRL5, NNMT, CD27, SLA, TDO2, NUAK1 и COL4A1. В предпочтительных вариантах реализации изобретения ген сигнатуры стромы представляет собой POSTN. В других предпочтительных вариантах реализации изобретения один или более генов сигнатуры стромы представляют собой POSTN и FAP; POSTN и TIMP3; POSTN и LOX; POSTN, FAP и TIMP3; POSTN, FAP и LOX; POSTN, TIMP3 и LOX; или POSTN, FAP, TIMP3 и LOX.
В четвертом аспекте настоящее изобретение относится к способу лечения пациента, имеющего рак, способ, включающий введение пациенту терапевтически эффективного количества агента, нацеленного на строму, при этом определено, что рак пациента экспрессирует один или более генов сигнатуры стромы на уровне, превышающем медианный уровень экспрессии одного или более генов сигнатуры стромы в данном виде рака.
В предпочтительных вариантах реализации вышеописанных способов агент, нацеленный на строму, представляет собой антитело к антипериостину (POSTN). В некоторых вариантах реализации вышеуказанных способов рак является первичным, прогрессирующим, рефрактерным или рецидивирующим. В других вариантах реализации изобретения рак представляет собой гинекологический рак, выбранный из группы, состоящей из рака яичника, перитонеального рака, рака маточной трубы, рака шейки матки, эндометриального рака, рака влагалища и рака вульвы. В предпочтительных вариантах реализации изобретения гинекологический рак является раком яичника. В некоторых других вариантах реализации вышеописанных способов рак выбран из группы, состоящей из колоректального рака, рака молочной железы, немелкоклеточного рака легкого (НМРЛ), рака почки (карциномы почки) или рак мозга (глиобластомы).
В пятом аспекте изобретение относится к способам определения стадии рака яичника у пациента. Способы включают определение уровня экспрессии POSTN в образце (например, образце опухолевой ткани, образце крови или образце сыворотки), полученном от пациента. Обнаружение повышенного уровня экспрессии POSTN в образце пациента по сравнению с контролем указывает на позднюю стадию рака яичника (например, стадию III или IV рака яичника согласно классификации FIGO). В некоторых вариантах реализации изобретения контроль представляет собой медианный уровень экспрессии POSTN в группе пациентов с раком яичника, тогда как в других вариантах реализации изобретения контроль представляет собой медианный уровень экспрессии POSTN в группе пациентов, имеющих стадию I и/или стадию II рака яичника согласно классификации FIGO. Необязательно эти способы также включают стадию введения терапии пациенту, если у пациента установлено наличие рака яичника, который находится на поздней стадии.
Другие особенности и преимущества данного изобретения станут очевидными из подробного описания сущности изобретения, графических материалов и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
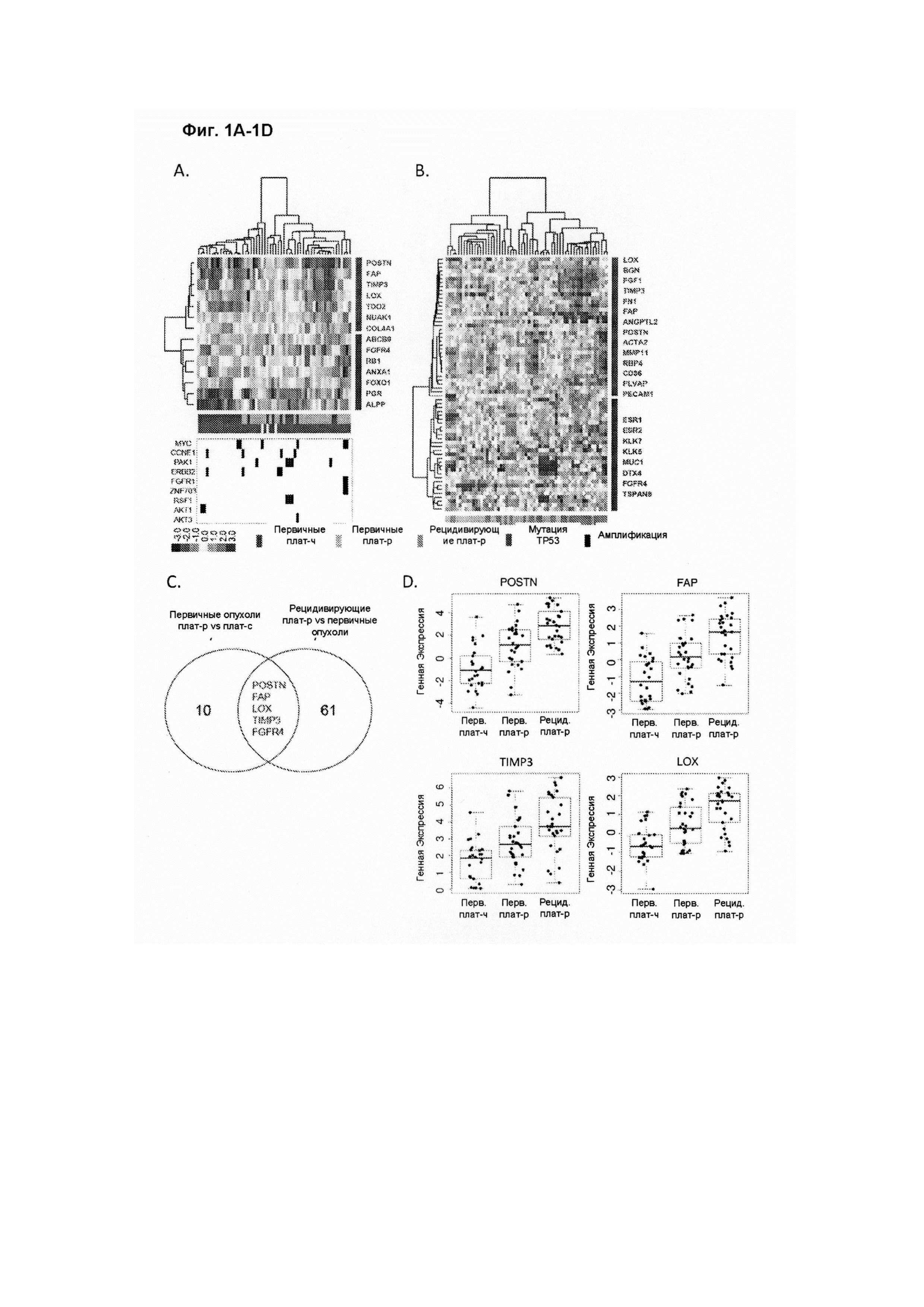
На ФИГ. 1A-1D проиллюстрирована идентификация сигнатуры гена "реактивной стромы", имеющего повышенный уровень экспрессии в первичных опухолях яичника, резистентных к химиотерапии. (А) Иерархическая кластеризация 14 наиболее дифференциально экспрессируемых генов (уровень ложноположительных результатов (УЛР) ≤10%, кратность изменения ≥1,5) между 32 первичными плат-р и 26 первичными плат-ч опухолями яичника. Клинически определенный ответ на первичную химиотерапию, мутационный статус ТР53 и 7 повторно амплифицированных генов (≥4 копии) аннотируются внизу; (В) Иерархическая кластеризация 65 значительно дифференциально экспрессированных генов (УЛР ≤10%, кратность изменения ≥1,5) между 27 сопоставимыми с пациентами первичными плат-р и рецидивирующими плат-р опухолями яичника; (С) Диаграмма Венна общих генов сигнатуры, значительно дифференцированно экспрессированных в первичных и рецидивирующих опухолях плат-р; (D) Генная экспрессия четырех генов сигнатуры реактивной стромы в 26 первичных плат-ч, 32 первичных плат-р и 27 рецидивирующих опухолях плат-р.
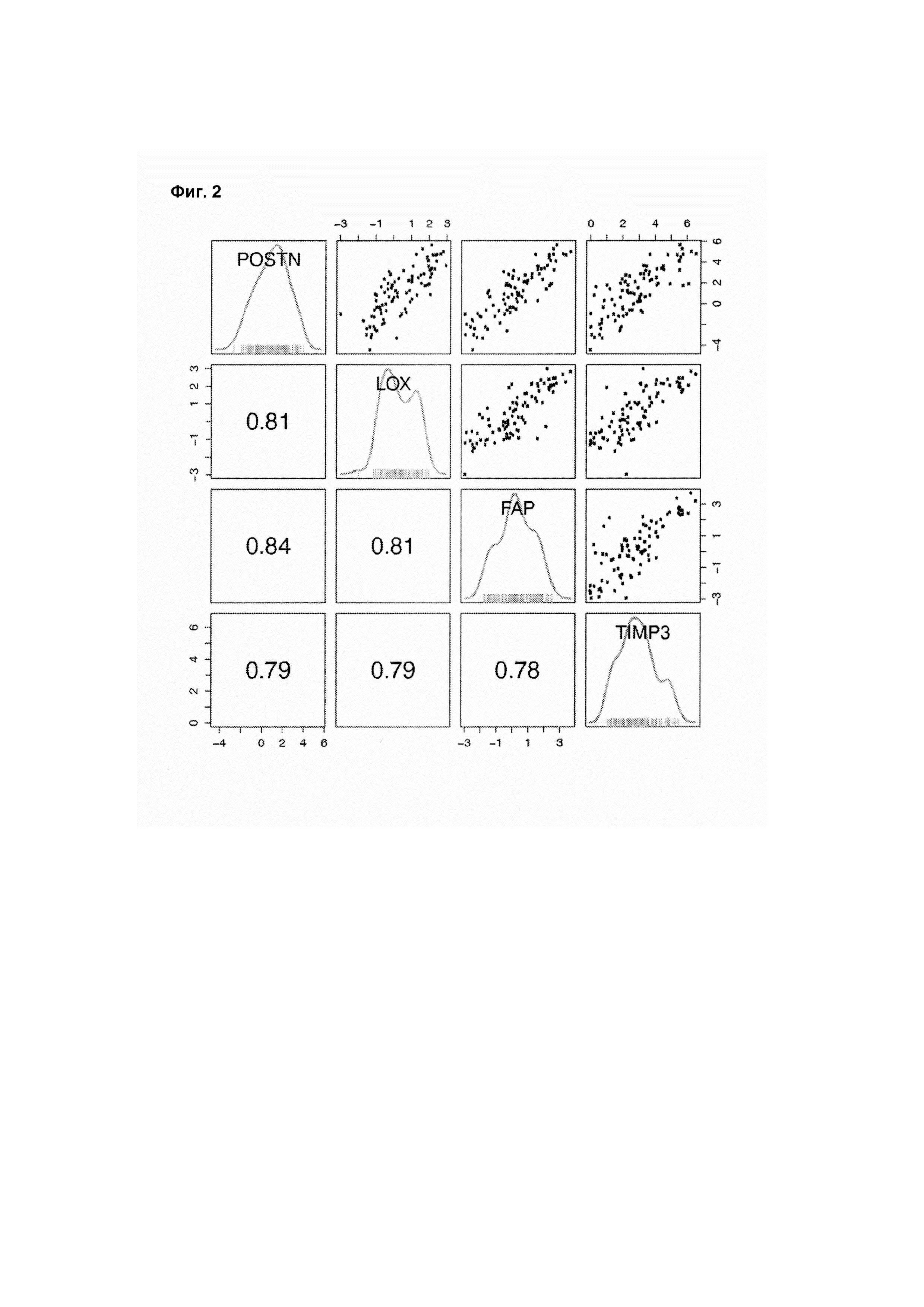
На ФИГ. 2 проиллюстрированы серии графиков, демонстрирующих уровни экспрессии мРНК четырех генов сигнатуры реактивной стромы, которые в значительной степени коррелируют друг с другом.
На ФИГ. 3А-3В проиллюстрирован анализ in situ генов сигнатуры реактивной стромы POSTN, LOX и FAP с помощью РНК ISH (in situ гибридизации) и ИГХ. (А) Репрезентативные изображения ISH и ИГХ первичной опухоли плат-ч, согласованной с пациентом первичной опухоли плат-р до химиотерапии, и рецидивирующих опухолей после химиотерапии при прогрессировании заболевания. Изображения в левых двух столбцах: 2-plex хромогенная РНК ISH для обнаружения POST, LOX и singleplex РНК ISH для обнаружения локализации мРНК FAP. Изображения в правых трех столбцах: Окрашивание ИГХ для локализации белка POSTN, FAP и aSMA. Масштаб = 100 мкм. (В) Резюме результатов ISH и ИГХ всех 85 образцов (POSTN и FAP ISH) или пяти репрезентативных образцов опухоли (LOX ISH, POSTN и FAP ИГХ) от каждой из групп ответа: Первичные плат-ч, согласованные с пациентом первичные плат-р и рецидивирующие опухоли. В опухолевых и стромальных клетках определяли как показатель гибридизации in situ гибридизации (ISH H-score) (Материалы и способы, представлена графически на основе средних и стандартных отклонений), так и общую оценку ИГХ. * р < 0,05, ** р < 0.01.
На ФИГ. 4А-4С проиллюстрировано, что уровни экспрессии POST коррелируют с фенотипом десмоплазии in vivo и что POST способствует резистентности к химиотерапии в клетках ЭРЯ in vitro. (А) Повышенная десмоплазия коррелирует с экспрессией POSTN и первичной резистентностью к химиотерапии. Показаны репрезентативные изображения с большим увеличением образцов опухолей, окрашенных гематоксилином и эозином (Н&Е) (верхние панели) и изображения POSTN ISH (нижняя панель). Показатели десмоплазии были определены следующим образом: 0 = отсутствие десмоплазии, 1 = несколько рассеянных десмопластических очагов, прилегающих к раковым клеткам, 2 = несколько десмопластических очагов, примыкающих к раковым клеткам или умеренная конфлюэнтная (широкая) десмоплазия, но не по всему срезу; 3 = десмопластическая реакция по всему срезу, связанная с большинством раковых клеток. Обозначения: ДС = десмопластическая строма, НС = нормальная строма, ОК = опухолевые клетки. Стрелки указывают на примеры опухолевых клеток. Пунктирная линия охватывает область, содержащую опухолевые клетки. Масштаб, 100 мкм. (В) Резюме показателей десмоплазии в 21 первичном плат-ч образце, 18 первичных плат-р образцах и 21 образце рецидивирующей опухоли плат-р; (С) POSTN способствует резистентности к химиотерапии в чувствительных к химиотерапии клетках яичника ES2 in vitro. 96-луночные планшеты покрывали рекомбинантным белком FN1 или POSTN или оставляли без покрытия перед тем, как клетки высевали в каждую лунку. Затем в каждую лунку на следующий день добавляли 10 мкМ карбоплатина или 10 нМ таксола. Реагенты Cell-Titre Glo® добавляли через 72 часа после обработки соединением для определения жизнеспособности клеток. Затем жизнеспособность в покрытых лунках сравнивали с жизнеспособностью в непокрытых лунках для расчета % роста.
На ФИГ. 5А-5В проиллюстрировано, что экспрессия генов реактивной стромы предсказывает клинический исход химиотерапии первой линии в группе лечения в исследовании химиотерапии ICON7. (А) Корреляция кратности изменений (плат-р vs. плат-ч) между набором данных поискового исследования (ось х) и независимой контрольной выборки (контрольная группа пациентов ICON7) (ось у). Пять генов на графике являются значительно дифференциально экспрессированными в обоих наборах данных (р ≤0,01 и кратность изменения ≥1,5); (В) Связь экспрессии генов сигнатуры реактивной стромы (медианное граничное значение) с результатом лечения пациента (ВБП) от первичной химиотерапии в независимом наборе данных (группа лечения в исследовании химиотерапии ICON7)
На ФИГ. 6 проиллюстрирована серия графиков, показывающих корреляцию между POSTN и известными прогностическими факторами при раке яичника.
На ФИГ. 7 проиллюстрирован многофакторный анализ четырех генов сигнатуры стромы. Экспрессия пяти генов (POSTN, PGR, FAP, LOX и TIMP3), дихотомизированных с применением медианного граничного значения, была проанализирована с применением многофакторной регрессионной модели Кокса для оценки степени связности для каждого гена. В данном многофакторном анализе достоверной была только экспрессия POSTN. Кроме того, когда экспрессия четырех генов усреднялась для каждого пациента, итоговая общая оценка стромы не улучшала связь с ВБП (ОР = 2,0, 95% ДИ: 1,3-3.1, р = 0,0013).
На ФИГ. 8 проиллюстрированы схематические диаграммы основных активированных сетей передачи сигнала и регулятора, находящегося выше в цепи метаболитических путей, которые идентифицированны путем анализа путей передачи сигнала с применением генных сигнатур, связанных с первичной резистентностью к химиотерапии (Ingenuity). Гены с пониженным уровнем экспрессии в резистентных к химиотерапии опухолях представляют собой FGFR4, CXCL10, IDO1, ММР10 и ММР7. Остальные гены различаются по степени повышения регуляции в резистентных к химиотерапии опухолях.
На ФИГ. 9 проиллюстрирован график, демонстрирующий, что экспрессия POSTN значительно коррелирует с маркерами проангиогенеза (PLVAP, РЕСАМ1 и ANGPTL2) и маркерами макрофагов М2 (CD68, CD163 и CD36).
На ФИГ. 10 проиллюстрирована сгруппированная точечная диаграмма, показывающую диапазон экспрессии POSTN в полученных от поставщика панелях образцов сыворотки от 102 нормальных здоровых субъектов (НЗС) соответствующей возрастной группы, 100 пациентов с эпителиальным раком яичника (ЭРЯ) с неизвестной чувствительностью к химиотерапии (рак яичника), 43 пациентов с ЭРЯ, которые, как известно, являются резистентными к платине (рак яичника плат-р), 96 пациентов с раком легких (НМКРЛ) и 29 пациентов с раком поджелудочной железы.
На ФИГ. 11 проиллюстрирована сгруппировання точечная диаграмма, показывающая корреляцию между циркулирующим POSTN и стадиями заболевания на полученных от поставщика образцах сыворотки пациентов на I стадии (25) и на II стадии (6) (31 комбинированных), и 69 образцах от пациентов на III стадии.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. ВВЕДЕНИЕ
Настоящее изобретение относится сигнатуре гена реактивной стромы, который специфически связан с первичной резистентностью к химиотерапии при раке яичника и экспрессия которых дополнительно повышается в рецидивирующих опухолях. Анализ in situ нескольких ключевых компонентов данной сигнатуры, включая периостин (POSTN), белок, активирующий фибробласты (FAP) и лизилоксидазу (LOX), показал, что экспрессия этих генов специфически повышается в связанных с опухолью фибробластах в резистентных к химиотерапии опухолях. Сигнатура гена реактивной стромы была подтверждена в независимом наборе данных от группы пациентов, получающих химиотерапию на фазе III исследования, и в этом валидационном анализе было показано, что высокие уровни экспрессии POSTN связаны с худшим результатом лечения (т.е. с выживанием без прогрессирования (ВБП)), для пациентов, получающих химиотерапию первой линии (карбоплатин и паклитаксел).
Соответственно, изобретение относится к способам идентификации пациентов с раком (например, гинекологическим раком (например, раком яичника, перитонеальный раком, раком фаллопиевой трубы, цервикальный раком, эндометриальный раком, вагинальным раком или рак вульвы)), который является резистентным к химиотерапии, путем определения уровня экспрессии одного или более генов сигнатуры стромы и сравнения этого уровня экспрессии с медианным уровнем экспрессии одного или более генов сигнатуры стромы в данном виде рака. Обнаружение экспрессии одного или более генов сигнатуры стромы на уровне, превышающем медианный уровень экспрессии одного или более генов сигнатуры стромы в данном виде рака, указывает на то, что у пациента имеется резистентный к химиотерапии рак. Изобретение также относится к способам лечения пациентов с раком (например, резистентным к химиотерапии раком) с помощью введения нацеленного на строму или другого агента пациентам. Изобретение дополнительно относится к способам идентификации пациентов с раком (например, резистентным к химиотерапии раком), который может быть полезным при введении антиангиогенного агента (например, антагониста VEGF, такого как антитело к VEGF, например, бевацизумаба) или иммуномодулирующего агента в комбинацииии со схемой химиотерапии, и/или агентом, нацеленным на строму.
II. ОПРЕДЕЛЕНИЯ
Если не указано иное, все технические и научные термины, применяемые в данном документе, имеют такое же значение, которое обычно понимается средним специалистом в данной области техники, к которой относится настоящее изобретение. Singleton et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J.Wiley & Sons (New York, N.Y. 1994), и March, Advanced Organic Chemistry Reactions, Mechanisms and Structure 4th ed., John Wiley & Sons (New York, N.Y. 1992), обеспечивают обычному специалисту в данной области техники общее руководство по многим терминам, применяемым в настоящей заявке.
Для целей пояснения в этом описании, будут применяться следующие определения и там, где это уместно, термины, применяемые в единственном числе будут также включать в себя множественное число и наоборот. В том случае, когда любое определение, представленное ниже, вступает в конфликт с любым документом, введенным в данный документе посредством ссылки, представленное ниже определение является главным.
Применяемый в данном документе термин "введение" означают введение химиотерапевтического агента (например, любого химиотерапевтического агента, описанного в данном документе, см. ниже), нацеленного на строму агента (например, антитело к POSTN), иммуномодулирующего агента и/или антиангиогенного агента (например, антитело к VEGF, такое как бевацизумаб), и/или фармацевтической композиции/схемы лечения, включающей химиотерапевтический агент (например, антитело к POSTN), иммуномодулирующего агента или антиангиогенного агента (например, антитело к VEGF, такое как бевацизумаб) пациенту, нуждающемуся в таком лечении или медицинском вмешательстве любыми подходящими средствами, известными в данной области техники для введения терапевтического антитела. Неограничивающие пути введения включают пероральное, внутривенное, внутрибрюшинное, подкожное, внутримышечное, локальное, внутрикожное, интраназальное или внутрибронхиальное введение (например, при вдыхании). Особенно предпочтительным в контексте данного изобретения является парентеральное введение, например, внутривенное введение. Что касается бевацизумаба для лечения колоректального рака, предпочтительные дозы в соответствии с ЕАЛС составляют 5 мг/кг или 10 мг/кг массы тела, вводимые один раз каждые 2 недели, или 7,5 мг/кг или 15 мг/кг массы тела, вводимые один раз в 3 недели. Для лечения НМРЛ предпочтительная доза составляет 15 мг/кг каждые 3 недели путем инфузии в комбинации с карбоплатином и паклитакселом. Для лечения карциномы почки предпочтительная доза составляет 10 мг/кг каждые 2 недели путем инфузии интерфероном α-2а или в виде монотерапии. Для лечения рака шейки матки предпочтительная доза составляет 15 мг/кг каждые три недели путем инфузии и вводится в комбинацииии с одной из следующих режимов химиотерапии: паклитаксел и цисплатин, или паклитаксел и топотекан. Для лечения глиобластомы предпочтительная доза составляет 10 мг/кг, вводимая один раз каждые две недели путем инфузии.
Способы идентификации агонистов или антагонистов полипептида могут включать контактирование полипептида с молекулой-кандидатом агонистом или антагонистом и измерение обнаруживаемого изменения одной или более биологических активностей, которые обычно связанны с полипептидом.
В данном контексте термин "антитело" применяется в самом широком смысле и охватывает различные структуры антител, включая, но не ограничиваясь ими, моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они проявляют желательную антигенсвязывающую активность. Антитело, связывающееся с мишенью, относятся к антителу, которое способно связываться с мишенью с достаточной аффинностью, таким образом, что антитело может применяться в качестве диагностического и/или терапевтического агента для целевого воздействия на мишень. В одном варианте реализации изобретения степень связывания антитела с мишенью, представляющей собой неродственный нецелевой белок, составляет менее чем около 10% связывания антитела с мишенью, например, по результатам измерения, например, посредством радиоиммуноанализа (РИА) или анализа Biacore. В некоторых вариантах реализации изобретения антитело, которое связывается с мишенью, имеет константу диссоциации (Kd) <1 мкМ, <100 нМ, <10 нМ, <1 нМ, <0,1 нМ, <0,01 нМ или <0,001 нМ (например, 10-8 М или меньше, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В некоторых вариантах реализации изобретения антитело к мишени связывается с эпитопом мишени, который является консервативным среди различных видов.
"Фрагмент антитела" относится к молекуле, не являющейся интактным антителом, но содержащей фрагмент интактного антитела, связывающий антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают, но не ограничиваются ими, Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; молекулы одноцепочечных антител (например, scFv); и мультиспецифические антитела, образованные из фрагментов антител.
"Антитело, связывающееся с тем же эпитопом" в качестве эталонного антитела относится к антителу, которое блокирует связывание эталонного антитела с его антигеном в конкурентном анализе на 50% или более, и, наоборот, эталонное антитело блокирует связывание антитела с его антигеном в конкурентном анализе на 50% или более.
Термин "польза" применяется в самом широком смысле и относится к любому желаемому эффекту и специфически включает клиническую пользу, как определено в данном документе. Клиническую пользу можно измерить, оценивая различные конечные показатели, например, ингибирование до некоторой степени прогрессирования заболевания, включая замедление и полную остановку; сокращение числа эпизодов заболевания и/или симптомов; уменьшение размера поражения; ингибирование (т.е. уменьшение, замедление или полное прекращение) инфильтрации клеточной популяции в соседние периферические органы и/или ткани; ингибирование (т.е. снижение, замедление или полное прекращение) распространения заболевания; снижение аутоиммунного ответа, что может, но необязательно, приводить к регрессии или удалению очага поражения; ослабление, до некоторой степени, одного или более симптомов, связанных с расстройством; увеличение продолжительности периода без рецидива после лечения, например, выживаемости без прогрессирования; увеличение общей выживаемости; более высокая частота ответа; и/или пониженная смертность в данный момент времени после лечения.
В данном контексте термин "биологический образец" включает, но не ограничивается ими, кровь, сыворотку, плазму, мокроту, биопсию ткани, опухолевую ткань и образцы из носа, включая носовые мазки или носовые полипы.
Термины "рак" и "раковый" относятся или описывают физиологическое состояние млекопитающих, которое, как правило, характеризуется нерегулируемым ростом клеток. Данное определение включает доброкачественные и злокачественные опухоли. Примеры рака включают, но не ограничиваются ими, карциному, лимфому, бластому, саркому и лейкоз. Более конкретные примеры таких видов рака включают плоскоклеточный рак, рак легких (включая мелкоклеточный рак легких, немелкоклеточный рак легких, аденокарциному легких и плоскоклеточную карциному легкого), рак брюшины, гепатоцеллюлярный рак, желудочный или рак желудка (включая рак желудочно-кишечного тракта), рак поджелудочной железы, глиобластому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, карциному эндометрия или карциному матки, карциному слюнных желез, рак почки, или ренальный рак, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени и различные виды рака головы и шеи, а также В-клеточные лимфомы (включая низкозлокачественную/фолликулярную неходжкинскую лимфому (НХЛ), мелкоклеточную лимфоцитарную (МЛ) НХЛ, среднезлокачественную/фолликулярную НХЛ, среднезлокачественную диффузную НХЛ, высокозлокачественную иммунобластную НХЛ, высокозлокачественную лимфобластную НХЛ, высокозлокачественную мелкоклеточную лимфома с нерассеченными ядрами, генерализованную лимфаденопатию НХЛ, мантийноклеточную лимфому; связанная со СПИДом лимфому; и макроглобулинемия Вальденстрема); хронический лимфоцитарный лейкоз (ХЛЛ); острый лимфобластный лейкоз (ОЛЛ); лейкоз ворсистых клеток; хронический миелобластный лейкоз; и посттрансплантационное лимфопролиферативное расстройство (ПТЛР), а также аномальную пролиферацию сосудов, связанную с факоматозами, отек (например, связанный с опухолями головного мозга), синдром Мейгса.
"Прогрессирующий (на поздней стадии)" рак представляет собой рак, который распространился за пределы участка или органа происхождения либо путем местного вторжения, либо метастазами.
"Рефрактерный" рак представляет собой рак, который прогрессирует, хотя противоопухолевый агент, такой как химиотерапевтический агент, вводится пациенту со злокачественным новообразованием. Примером рефрактерного рака является рак, который является рефрактерным к платине.
"Рецидивирующий" рак представляет собой рак, который регенерировался либо на начальном участке, либо на удаленном участке, после ответа на начальную терапию.
Термин "резистентный к платине" рак означает рак у пациента, который прогрессировал, пока пациент получал химиотерапию на основе платины, или рак у пациента, который прогрессировал в течение, например, 12 месяцев (например, в течение 6 месяцев) после завершения химиотерапии на основе платины. Можно сказать, что такой рак обладает или демонстрирует "резистентность к платине".
Термин "резистентный к химиотерапии" рак означает рак у пациента, который прогрессировал, пока пациент получает схему химиотерапии, или рак у пациента, который прогрессировал в течение, например, 12 месяцев (например, в течение 6 месяцев) после завершения схемы химиотерапии. Можно сказать, что такой рак обладает или демонстрирует "резистентность к химиотерапии".
Термин "химерное" антитело относится к антителу, в котором фрагмент тяжелой и/или легкой цепи происходит из конкретного источника или вида, в то время как остальная часть тяжелой и/или легкой цепи происходит из другого источника или вида.
"Класс" антитела относится к типу константного домена или константной области, содержащейся в его тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG, и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, δ, ε, γ и μ, соответственно.
"Химиотерапевтический агент" включает химические соединения, пригодные для лечения рака. Примеры химиотерапевтических агентов включают эрлотиниб (TARCEVA®, Genentech/OSI Pharm.), бортезомиб (VELCADE®, Millennium Pharm.), дисульфирам, эпигаллокатехингаллат, салиноспорамид А, карфилзомиб, 17-AAG (гельданамицин), радицикол, лактатдегидрогеназу A (LDH-A), фульвестрант (FASLODEX®, AstraZeneca), сунитиб (SUTENT®, Pfizer/Sugen), летрозол (FEMARA®, Novartis), иматиниб мезилат (GLEEVEC®, Novartis), финасунат (VATALANIB®, Novartis), оксалиплатин (ELOXATIN®, Sanofi), 5-FU (5-фторурацил), лейковорин, рапамицин (сиролимус, RAPAMUNE®, Wyeth), лапатиниб (TYKERB®, GSK572016, Glaxo Smith Kline), лонафамиб (SCH 66336), сорафениб (NEXAVAR®, Bayer Labs), гефитиниб (IRESSA®, AstraZeneca), AG1478, алкилирующие агенты, такие как тиотепа и CYTOXAN® циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленемеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоламин; ацетогенины (особенно бутатацин и бутатацинон); камптотецин (включая топотекан и иринотекан); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (в частности, криптофицин 1 и криптофицин 8); адренокортикостероиды (включая преднизон и преднизолон); ципротерона ацетат; 5α-редуктазы, включая финастерид и дутастерид); вориностат, ромидепсин, панобиностат, вальпроевую кислоту, моцетиностат доластатин; альдеслейкин, тальк дуокармицин (включая синтетические аналоги, KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хломафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлоретамин оксид гидрохлорид, мелфалан, новимбихин, фенстерин, преднимустин, трофосфамид, урациловый иприт; препараты нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин γ1I и калихеамицин ω1I (Angew Chem.Intl.Ed.Engl. 1994 33:183-186); динемицин, включая динемицин А; бисфосфонаты, такие как клодронат; эсперамицин; а также неокарциностатин-хромофор и родственные хромопротеиновые энедииновые антибиотики-хромофоры), аклациномизины, актиномицин, антрамицин, азасерин, блеомицины, кактиномицин, карабицин, каминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, ADRIAMYCIN® (доксорубицин), морфолиндоксорубицин, цианморфолиндоксорубицин, 2-пирролиндоксорубицин и деоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, тиберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-ФУ); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, например, анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидеоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; антиадреналовые агенты, такие как аминоглютетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фолиниевая кислота; ацеглатон; альдофосфамидглюкозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатрексат; дефофамин; демеколцин; диазиквон; элформитин; эллиптиния ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидамин; майтанзиноиды, такие как майтанзин и анзамитоцины; митогуазон; митоксантрон; мопиданмол; нитракрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Юджин, Орегон); разоксан; ризоксин; сизофуран; спирогерманий; тенуазониевую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены (особенно Т-2 токсин, верракурин А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-С"); циклофосфамид; тиотепу; таксоиды, например, Таксол (паклитаксел; Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANE® (без кремофора), препараты из наночастиц паклитаксела, сконструированные на основе альбумина (American Pharmaceutical Partners, Schaumberg, Ill.), а также "TAKCOTEP®" (доцетаксел, доксетаксел; Sanofi-Aventis); хлорамбуцил; ГЕМЗАР® (гемцитабин); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин, оксалиплатин и карбоплатин; винбластин; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; НАВЕЛБИН® (винорелбин); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; капецитабин (КСЕЛОДА®); ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДФМО); ретиноиды, такие как ретиноевая кислота; а также фармацевтически приемлемые соли, кислоты или производные любого из упомянутых выше агентов.
Химиотерапевтический агент также включает (i) антигормональные агенты, которые действуют для регулирования или ингибирования гормонального влияния на опухоли, такие как антиэстрогены и селективные модуляторы рецепторов эстрогена (СМРЭ), включая, например, тамоксифен (включая NOLVADEX®, цитрат тамоксифена), ралоксифен, дролоксифен, йодоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и FARESTON® (торемифинацитрат); (ii) ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующую продуцирование эстрогенов в надпочечниках, такие как, например, 4(5) -имидазолы, аминоглютетимид, MEGASE® (мегестрола ацетат), AROMASIN® (экземестан, Pfizer), форместан, фадрозол, RIVISOR® (ворозол), FEMARA® (летрозол, Novartis) и ARIMIDEX® (анастрозол, AstraZeneca); (iii)) антиандрогены, такие как флутамид, нилутамид, бикалютамид, лейпролид и госерелин; бусерелин, тритретелин, медроксипрогестерона ацетат, диэтилстильбэстрол, премарин, флуоксиместерон, все препараты трансретионной кислоты, фенретинид, а также троксацитабин (аналог цитозина с 1,3-диоксоланонуклеозидом); (iv) ингибиторы протеинкиназы; (v) ингибиторы липид-киназы; (vi) антисмысловые олигонуклеотиды, особенно те, которые ингибируют экспрессию генов в сигнальных путях, участвующих в аберрантной клеточной пролиферации, такие как, например, PKC-альфа, Ralf и H-Ras; (vii) рибозимы, такие как ингибиторы экспрессии VEGF (например, ANGIOZYME®) и ингибиторы экспрессии HER2; (viii) вакцины, такие как вакцины для генной терапии, например, ALLOVECTIN®, LEUVECTIN® и VAXID®; PROLEUKIN®, rIL-2; ингибитор топоизомеразы 1, такой как LURTOTECAN®; ABARELIX® rmRH; и (ix) фармацевтически приемлемые соли, кислоты и производные любого из указанных выше агентов.
Химиотерапевтический агент также включает антитела, такие как алемтузумаб (Кампат), бевацизумаб (AVASTIN®, Genentech); цетуксимаб (ERBITUX®, Imclone); панитумумаб (RITUXAN®, Amgen), ритуксимаб (RITUXAN®, Genentech/Biogen Idec), пертузумаб (OMNITARG®, 2С4, Genentech), трастузумаб (HERCEPTIN®, Genentech), тозитумомаб (бекксар, Corixia) и конъюгат антитела с препаратом, гемтузумаб озогамицин (MYLOTARG®, Wyeth). Дополнительные гуманизированные моноклональные антитела с терапевтической активностью в качестве агентов в комбинации с соединениями по данному изобретению включают: пполизумаб, аселизумаб, атлизумаб, бапинезумаб, биватузумаб мертансин, кантазумаб мертансин, седелизумаб, сертолизумаб пегол, цидуфузитузумаб, цидтузумаб, даклизумаб, экулизумаб, эфализумаб, эпратузумаб, эрлизумаб, фелвизумаб, фонтолизумаб, гемтузумаб озогамицин, инотузумаб озогамицин, ипилимумаб, лабетузумаб, линтузумаб, матузумаб, меполизумаб, мотавизумаб, мотовизумаб, натализумаб, нимотузумаб, ноловизумаб, нумавизумаб, окрелизумаб, омализумаб, паливизумаб, пасколизумаб, пекфуситузумаб, пектузумаб, пекселизумаб, раливизумаб, ранибизумаб, ресливизумаб, ресливизумаб, ресивизумаб, ровелизумаб, руплизумаб, сибротузумаб, сиплизумаб, сонтизумаб, такатузумаб тетраксетан, тадоцизумаб, тализумаб, тефибазумаб, тоцилизумаб, торализумаб, тукотузумаб целмолеукин, тукуситузумаб, умавизумаб, уртоксазумаб и висилизумаб и антиинтерлейкин-12 (ABT-874/J695, Wyeth Research и Abbott Laboratories), который является исключительно рекомбинантной последовательностью полноразмерного антитела IgG1 λ человека, генетически модифицированный для распознавания белка р40 интерлейкина-12.
Химиотерапевтический агент также включает "ингибиторы EGFR", которые относятся к соединениям, связывающим или непосредственно взаимодействующим с EGFR, и предотвращают или снижают его сигнальную активность, и в альтернативном варианте именуются "антагонистом EGFR". Примеры таких агентов включают антитела и небольшие молекулы, которые связываются с EGFR. Примеры антител, связывающихся с EGFR, включают мАт 579 (АТСС CRL НВ 8506), мАт 455 (АТСС CRL НВ8507), мАт 225 (АТСС CRL 8508), мАт 528 (АТСС CRL 8509) (см. патент США №4943533, Mendelsohn et al.) и их варианты, например, химеризованное антитело 225 (С225 или цетуксимаб; ERBUTIX®) и реконструированное антитело 225 человека (Н225) (см. WO 96/40210, Imclone Systems Inc.); IMC-11F8, полностью человеческое антитело к EGFR (Imclone); антитела, связывающие мутантный EGFR II типа (патент США №5212290); гуманизированные и химерные антитела, связывающие EGFR, как описано в патенте США №5891996; и человеческие антитела, связывающие EGFR, например, ABX-EGF (см. WO 98/50433, Abgenix/Amgen); EMD 55900 (Stragliotto et al.Eur.J.Cancer 32A:636-640 (1996)); EMD7200 (матузумаб), гуманизированное антитело, нацеленное против EGFR и конкурирующее за связывание EGFR как с ФРФ, так и с ТФР-альфа (EMD/Merck); человеческое антитело к EGFR, HuMax-EGFR (GenMab); полностью человеческие антитела, известные как E1.1, Е2.4, Е2.5, Е6.2, Е6.4, E.2.11, Е6.3 и Е7.6.3 и описанные в патенте США 6235883; MDX-447 (Medarex Inc); и мАт 806 или гуманизированное мАт 806 (Johns et al., J.Biol.Chem.279(29):30375-30384 (2004)). Антитело к EGFR можно конъюгировать с цитотоксическим агентом, тем самым получая иммуноконъюгат (см., например, ЕР 659,439 А2, Merck Patent GmbH). Антагонисты EGFR включают небольшие молекулы, такие как соединения, описанные в патентах США №: 5616582, 5457105, 5475001, 5654307, 5679683, 6084095, 6265410, 6455534, 6521620, 6596726, 6713484, 5770599, 6140332, 5866572, 6399602, 6344459, 6602863, 6391874, 6344455, 5760041, 6002008 и 5747498, а также в следующих публикациях PCT: WO 98/14451, WO 98/50038, WO 99/09016 и WO 99/24037. Конкретные низкомолекулярные антагонисты EGFR включают OSI-774 (СР-358774, эрлотиниб, TARCEVA® Genentech/OSI Pharmaceuticals); PD 183805 (CI 1033, 2-пропенамид, N-[4-[(3-хлор-4-фторфенил)амин]-7-[3-(4-морфолинил)пропокси]-6-хиназолинил]-дигидрохлорид, Pfizer Inc.);(ZD1839, гефинитиб (IRESSA®) 4-(3'-хлор-4'-фторанилино)-7-метокси-6-(3-морфолинопропокси) хиназолин, AstraZeneca); ZM 105180 ((6-амино-4-(3-метилфениламино)-хиназолин, Zeneca), BIBX-1382 (N8-(3-хлор-4-фторфенил)-N2-(1-метилпиперидин-4-ил)-пиримидо[5,4-d]пиримидин-2,8-диамин, Boehringer Ingelheim), PKI-166 ((R)-4-[4-[(1-фенилэтил)амино]-1Н-пирроло[2,3-d]пиримидин-6-ил]фенол), (R)-6-(4-гидроксифенил)-4-[(1-фенилэтил)амино]-7Н-пирроло[2,3-d]пиримидин); CL-387785 (N-[4-[(3-бромфенил)амино]-6-хиназолинил]-2-бутинамид); EKB-569 (N-[4-[(3-хлор-4-фторфенил) амино]-3-циано-7-этокси-6-хинолинил]-4-(диметиламино)-2-бутенамид) (Wyeth); AG1478 (Pfizer); AG1571 (SU 5271; Pfizer); двойные ингибиторы тирозинкиназы EGFR/HER2, такие как лапатиниб (TYKERB®, GSK572016 или N-[3-хлор-4-[(3-фторфенил)метокси]фенил]-6[5[[[2-метилсульфонил]этил]амино]метил]-2-фуранил]-4-хиназолинамин).
Химиотерапевтические агенты также включают "ингибиторы тирозинкиназы", в том числе препараты, нацеленные на EGFR, указанные в предыдущем абзаце; низкомолекулярный ингибитор тирозинкиназы HER2, такой как TAK165, доступный от Takeda; СР-724,714, пероральный селективный ингибитор рецептора тирозинкиназы ErbB2 (Pfizer и OSI); двойные ингибиторы HER, такие как EKB-569 (доступный от Wyeth), который предпочтительно связывает EGFR, но ингибирует как HER2-, так и EGFR-сверхэкспрессирующие клетки; лапатиниб (GSK572016, доступный от Glaxo-SmithKline), пероральный ингибитор тирозинкиназы HER2 и EGFR; PKI-166 (доступный от Novartis); ингибиторы pan-HER, такие как кетертиниб (CI-1033; Pharmacia); ингибиторы Raf-1, такие как антисмысловой агент ISIS-5132, доступный от ISIS Pharmaceuticals, которые ингибируют передачу сигналов Raf-1; TK-ингибиторы, нацеленные не на HER, такие как иматиниба мезилат (GLEEVEC®, доступный от Glaxo SmithKline); многонаправленные ингибиторы тирозинкиназы, такие как сунитиниб (SUTENT®, доступный от Pfizer); ингибиторы VEGF-рецептора тирозинкиназы, такие как ваталаниб (PTK787/ZK222584, доступный от Novartis/Schering AG); MAPK внеклеточный регулируемый ингибитор киназы I CI-1040 (доступный от Pharmacia); хиназолины, такие как PD 153035,4-(3-хлоранилино) хиназолин; пиридопиримидины; пиримидопиримидины; пирролопиримидины, такие как CGP 59326, CGP 60261 и CGP 62706; пиразолопиримидины, 4-(фениламино)-7Н-пирроло [2,3-d] пиримидины; куркумин (диферезуилметан, 4,5-бис(4-фторанилино)фталимид); тирфостины, содержащие нитротиофеновые фрагменты; PD-0183805 (Warner-Lamber); антисмысловые молекулы (например, те, которые связываются с HER-кодирующей нуклеиновой кислотой); хиноксалины (патент США №5,804,396); трифостины (патент США №5,804,396); ZD6474 (Astra Zeneca); РТК-787 (Novartis/Schering AG); ингибиторы pan-HER, такие как CI-1033 (Pfizer); Аффинитак (ISIS 3521; Isis/Lilly); иматиниба мезилат (GLEEVEC®); PKI 166 (Novartis); GW2016 (Glaxo SmithKline); CI-1033 (Pfizer); EKB-569 (Wyeth); Семаксиниб (Pfizer); ZD6474 (AstraZeneca); PTK-787 (Novartis/Schering AG); INC-1C11 (Imclone), рапамицин (сиролимус, RAPAMUNE®); или как описано в любой из следующих патентных публикаций: патент США №5,804,396; WO 1999/09016 (American Cyanamid); WO 1998/43960 (American Cyanamid); WO 1997/38983 (Warner Lambert); WO 1999/06378 (Warner Lambert); WO 1999/06396 (Warner Lambert); WO 1996/30347 (Pfizer, Inc); WO 1996/33978 (Zeneca); WO 1996/3397 (Zeneca) и WO 1996/33980 (Zeneca).
Химиотерапевтические агенты также включают дексаметазон, интерфероны, колхицин, метоприн, циклоспорин, амфотерицин, метронидазол, алемтузумаб, алитретиноин, аллопуринол, амифостин, триоксид мышьяка, аспарагиназу, живую БЦЖ, бевацузимаб, бексаротен, кладрибин, клофарабин, дарбэпоэтин альфа, денилейкин, дексразоксан, эпоэтин альфа, элотиниб, филграстим, гистрелина ацетат, ибритумомаб, интерферон альфа-2а, интерферон альфа-2b, леналидомид, левамизол, месна, метоксален, нандролон, неларабин, нофетумомаб, опрелвекин, палифермин, памидронат, пегадемаз, пегаспаргаз, пегфилграстим, пеметрексед динатрий, пликамицин, порфимер натрий, квинакрин, расбуриказ, сарграмостим, темозоломид, VM-26, 6-TG, торемифен, третиноин, ATRA, валрубицин, золедронат и золедроновую кислоту, а также их фармацевтически приемлемые соли.
Термин "химиотерапевтический агент на основе платины" или "платина" означает противоопухолевый препарат, который является координационным комплексом платины. Примеры агентов на основе платины включают карбоплатин, цисплатин, сатраплатин, пикоклатин, недеплатин, триплатин, липоплатин и оксалиплатин.
Термин "химиотерапия на основе платины" означает терапию с помощью одного или более химиотерапевтических агентов на основе платины, необязательно в комбинацииии с одним или несколькими химиотерапевтическими агентами.
Термин "эффекторные функции" относится к тем видам биологической активности, присущей Fc-области антитела, которые изменяются в зависимости от изотипа антитела. Примеры эффекторных функций антител включают: связывание C1q и комплемент-зависимую цитотоксичность (КЗЦ); связывание с рецептором Fc; антителозависимую клеточно-опосредованную цитотоксичность (АЗКЦ); фагоцитоз; понижающую регуляцию поверхностных рецепторов клетки (например, рецептора В-клеток); и активацию В-клеток.
Образец, клетка, опухоль или рак, который "определен как экспрессирующий" или "экспрессирует" ген сигнатуры стромы на уровне, превышающем медианный уровень экспрессии гена сигнатуры стромы при данном виде рака (или в данном виде рака, причем термин "вид рака" включает раковые клетки (например, опухолевые клетки, опухолевые ткани), а также не раковые клетки (например, стромальные клетки, стромальные ткани), которые окружают злокачественную/опухолевую среду), является таковым, при котором уровень экспрессии гена сигнатуры стромы рассматривается специалистом по данному виду рака как "высокий уровень экспрессии гена сигнатуры стромы". Как правило, такой уровень будет находиться в диапазоне от около 50% до около 100% или более (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100% или более) по сравнению с уровнями гена сигнатуры стромы в популяции образцов, клеток, опухолей или рака одной и том же виде рака. Например, популяция, которая применяется для достижения медианного уровня экспрессии, может быть как, как правило, образцами рака яичника или его подгруппами, такими как резистентный к химиотерапии рак яичника, резистентный к платине рак яичника, а также прогрессирующий, рефрактерный или рецидивирующий рак яичника.
Термин "рак является или был определен как экспрессирующий" или "рак, экспрессирующий" применяется в отношении конкретного биомаркера (например, одного или более генов сигнатуры стромы, например, POSTN), означает экспрессию биомаркера(ов) (например, одного или более генов сигнатуры стромы, например, POSTN) в связанной с раком биологической среде (например, экспрессия биомаркера(ов) в опухолевых клетках), связанных с опухолью клетках (например, связанные с опухолью стромальные клетки, такие как связанные с опухолью фибробласты), как определено с применением диагностического теста, любого из способов обнаружения, описанного в данном документе, или подобного. Например, экспрессия POSTN может быть определена с применением анализа общего периостина или общего POSTN. Термин "анализ общего POSTN" относится к анализу, который измеряет уровни общего POSTN в биологическом образце. В одном варианте реализации изобретения общий уровень POSTN измеряется с применением антител к POSTN. В другом варианте реализации изобретения антитела к POSTN представляют собой антитела к POSTN, описанные в данном документе. В другом примере общие уровни POSTN измеряют, применяя одну или более последовательностей нуклеиновых кислот, антисмысловых к мРНК, кодирующих изоформы 1-4 POSTN.В некоторых вариантах реализации изобретения анализ общего POSTN включает применение (1) антитела, содержащего последовательности из SEQ ID NO: 1 и SEQ ID NO: 2 (антитело «25D4»), и/или антитела, содержащего последовательности из SEQ ID NO: 3 и SEQ ID NO: 4 (антитело «23В9»), для связывания POSTN в биологическом образце, 2) антитела, содержащего последовательности вариабельной области из SEQ ID NO: 1 и SEQ ID NO: 2, и/или антитела, содержащего последовательности вариабельной области из SEQ ID NO: 3 и SEQ ID NO: 4, для связывания POSTN в биологическом образце, (3) антитела, содержащего последовательности HVR из SEQ ID NO: 1 и SEQ ID NO: 2, и/или антитела, содержащего последовательности HVR из SEQ ID NO: 3 и SEQ ID NO: 4 для связывания POSTN в биологическом образце, (4) антитела, содержащего последовательности HVR, которые на 95% или более идентичны последовательностям HVR из SEQ ID NO: 1 и SEQ ID NO: 2, и/или антитела, содержащего последовательности HVR, которые на 95% или более идентичны последовательностям HVR из SEQ ID NO: 3 или SEQ ID NO: 4.
В данном контексте термин "Fc-область" применяется для обозначения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере фрагмент константной области. Термин включает Fc-области с нативными последовательностями и вариантные Fc-области. В одном варианте реализации изобретения Fc-область тяжелой цепи IgG человека простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако, Fc-область может содержать или не содержать С-концевой лизин (Lys447). Если в данном документе не указано иное, нумерация аминокислотных остатков в Fc-области или константной области осуществляется согласно системе нумерации EU, также называемой индекс EU, как описано в Kabat et al, Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
В данном контексте "фиксированная" или "базовая" доза терапевтического агента относится к дозе, которую вводят пациенту без учета веса (В) или площади поверхности тела (ППТ) пациента. Поэтому фиксированная или базовая доза не предоставляется в виде дозы в мг/кг или дозы в мг/м2, а скорее в виде абсолютного количества терапевтического агента.
Термин "каркас" или "FR" относится к остаткам вариабельного домена, за исключением остатков гипервариабельной области (HVR). FR вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR в составе VH (или VL), как правило, определяются в следующей последовательности: FR1-Н1(L1)-FR2-H2(L2)-FR3-Н3(L3)-FR4.
В данном контексте термины "полноразмерное антитело", "интактное антитело" и "целое антитело" являются взаимозаменяемыми и относятся к антителу, структура которого по существу аналогична структуре нативного антитела, или которое включает тяжелые цепи, содержащие Fc-область, описанную в данном документе.
"Антитело человека" представляет собой антитело, обладающее аминокислотной последовательностью, соответствующей последовательности антитела, продуцированного в организме человека или клетке человека или происходящее из нечеловеческого источника, применяющего репертуар антител человека или другие последовательности, кодирующие антитело человека. Из этого определения антитела человека, в частности, исключено гуманизированное антитело, содержащее антигенсвязывающие остатки нечеловеческого происхождения.
"Консенсусный каркас человека" является каркасом, представляющим наиболее распространенные аминокислотные остатки при выборе каркасных последовательностей VL или VH иммуноглобулина человека. Как правило, выбор последовательностей VL или VH иммуноглобулина человека проводят из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу по Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. В одном варианте реализации изобретения VL подгруппа представляет собой подгруппу каппа I по Kabat et al., выше. В одном варианте реализации VH подгруппа представляет собой подгруппу III по Kabat et al., выше.
"Гуманизированное" антитело относится к химерному антителу, содержащему аминокислотные остатки из HVR нечеловеческого происхождения и аминокислотные остатки из FR человека. В некоторых вариантах реализации изобретения гуманизированное антитело содержит по существу все из по меньшей мере одного, а обычно - двух вариабельных доменов, в которых все или по существу все HVR (например, CDR) соответствуют аналогичным участкам антитела нечеловеческого происхождения, и все или по существу все FR соответствуют последовательности антитела человека. Гуманизированное антитело необязательно может содержать по меньшей мере фрагмент константной области антитела, происходящий из антитела человека. Термин "гуманизированная форма" антитела, например, антитела нечеловеческого происхождения, относится к антителу, подвергшемуся гуманизации.
В данном контексте термин "гипервариабельная область" или "HVR" относится к каждой из областей вариабельного домена антитела, обладающих гипервариабельными последовательностями и/или образующих структурно определенные петли ("гипервариабельные петли"). Как правило, нативные четырехцепочечные антитела содержат шесть HVR: три в VH (HI, Н2, Н3) и три в VL (LI, L2, L3). В целом, HVR содержат аминокислотные остатки из гипервариабельных петель и/или из областей, определяющих комплементарность (CDR), последние, как правило, характеризуются самой высокой вариабельностью последовательности и/или участвуют в распознавание антигена. В данном контексте область HVR содержит любое количество остатков, расположенных в положениях 24-36 (для HVRL1), 46-56 (для HVRL2), 89-97 (для HVRL3), 26-35В (для HVRH1), 47-65 (для HVRH2) и 93-102 (для HVRH3).
"Иммуноконъюгат" представляет собой антитело, конъюгированное с одной или более гетерологичными молекулами, включая цитотоксический агент, но не ограничиваясь им.
Термин "иммуномодулирующий агент" относится к агенту, который индуцирует, усиливает или подавляет иммунный ответ. Иммуномодулирующие агенты, предназначенные для вызова или усиления иммунного ответа, являются активационными иммуномодулирующими агентами. Иммуномодулирующие агенты, предназначенные для снижения или подавления иммунного ответа, являются подавляющими иммуномодулирующими агентами. Например, подавляющие иммуномодулирующие агенты могут представлять собой антагонисты TDO2, CD36, GZMK, CD247, CD1C, CSF1R, IDO1, IL7R или CCR7. Термин "антагонист" применяется в самом широком смысле и включает любую молекулу, которая частично или полностью блокирует, ингибирует или нейтрализует биологическую активность нативного полипептида. Такие агенты (например, антагонисты) включают полипептид(ы) (например, антитело, такое как антитело к CSF1R (RG7155), иммуноадгезин или пептидное антитело), аптамер или малую молекулу, которая может связываться с белком, или молекула нуклеиновой кислоты, которая может связываться с молекулой нуклеиновой кислоты, кодирующей указанную в данном документе мишень (т.е. миРНК), которая прямо или косвенно нацелена на клетки иммунной системы (например, эффекторные Т-клетки, регуляторные Т-клетки, В-клетки, NK-клетки, воспалительные клетки, антигенпредставляющие клетки (например, дендритные клетки, макрофаги) и т.д.). В некоторых вариантах реализации изобретения иммуномодулирующие агенты могут специфически связываться с рецепторами на клетках иммунной системы для воздействия на активность иммунных клеток. В других вариантах реализации изобретения иммуномодулирующие агенты нацелены на гены, которые участвуют в путях передачи сигналов иммунной системы и/или модулируют активность иммунных клеток.
"Индивидуум" или "субъект" представляет собой млекопитающее. Млекопитающие включают, но не ограничиваются ими, одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и приматов, не являющихся людьми, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В некоторых вариантах реализации изобретения индивидуум или субъект является человеком.
"Выделенное" антитело представляет собой антитело, отделенное от компонента своего природного окружения. В некоторых вариантах реализации изобретения антитело является очищенным до более чем 95% или 99% чистоты, определяемой, например, посредством электрофореза (например, электрофореза в ДСН-ПААГ, изоэлектрического фокусирования (ИЭФ), капиллярного электрофореза) или хроматографии (например, ионообменной или обращенно-фазной ВЭЖХ). Обзор способов анализа чистоты антител см., например, Flatman et al., J.Chxomatogr. B 848:79-87 (2007).
"Выделенная" нуклеиновая кислота относится к молекуле нуклеиновой кислоты, отделенной от компонента своего природного окружения. Выделенная нуклеиновая кислота содержит молекулу нуклеиновой кислоты, содержавшуюся в клетках, обычно содержащих указанную молекулу нуклеиновой кислоты, однако указанная молекула нуклеиновой кислоты присутствует вне хромосомы или в области хромосомы, отличающейся от ее естественного местоположения в хромосоме.
"Выделенная нуклеиновая кислота, кодирующая антитело против мишени" относится к одной или более молекулам нуклеиновой кислоты, кодирующим тяжелые и легкие цепи антитела (или их фрагменты), включая такую(ие) молекулу(ы) нуклеиновой кислоты в составе одного вектора или отдельных векторов и такую(ие) молекулу(ы) нуклеиновой кислоты, присутствующую(ие) в одном или более местоположениях в клетке-хозяине.
В данном документе "насыщающая" доза, как правило, включает начальную дозу терапевтического агента, вводимого пациенту, и сопровождается одной или более поддерживающей(ми) дозой(ами). Как правило, вводят одну насыщающую дозу, но в данном документе предусматривается введение множественных насыщающих доз. Как правило, количество вводимых насыщающих(ей) доз(ы) превышает количество вводимых поддерживающих(ей) доз(ы) и/или нагрузочную(ые) дозу(ы) вводят чаще, чем поддерживающую(ие) дозу(ы), чтобы достичь желаемой стационарной концентрации терапевтического агента раньше, чем это может быть достигнуто с помощью поддерживающих(ей) доз(ы).
В данном документе "поддерживающая" доза или "длительная" доза относится к одной или более дозам терапевтического агента, вводимого пациенту в течение периода лечения. Обычно поддерживающие дозы вводят с интервалами между приемами, например приблизительно каждую неделю, приблизительно каждые 2 недели, приблизительно каждые 3 недели или приблизительно каждые 4 недели.
В данном контексте термин "моноклональное антитело" в относится к антителу, полученному из популяции по существу однородных антител, т.е., отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантных антител, например, содержащих природные мутации или возникающих по время продукции моноклонального антитела, причем такие варианты присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые как правило содержат различные антитела против различных детерминант (эпитопов), каждое моноклональное антитело из препарата моноклонального антитела направлено против одной детерминанты антигена. Таким образом, модификатор "моноклональное" указывает на то, что антитело получают по существу из однородной популяции антител; его не следует интерпретировать как требование относительно продукции антитела с помощью какого-либо конкретного способа. Например, моноклональные антитела для применения согласно способам, представленных в данном документе, можно получить с помощью различных методов, включая, но не ограничиваясь ими, гибридомный способ, методы рекомбинантных ДНК, методы фагового дисплея и способы с применением трансгенных животных, полностью или частично содержащих локусы человеческого иммуноглобулина, причем такие способы и другие типовые способы получения моноклональных антител описаны в данном документе.
Термин "свободное антитело" относится к антителу, не конъюгированному с гетерологичным фрагментом (например, цитотоксичим фрагментом) или радиоизотопной меткой. Свободное антитело может присутствовать в фармацевтической композиции.
"Нативные антитела" относятся к природным молекулам иммуноглобулина с различной структурой. Например, нативные антитела IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой около 150000 дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, связанных дисульфидными связями. Каждая тяжелая цепь от N-конца к С-концу содержит вариабельную область (VH), также называемую вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, с последующими тремя константными доменами (CHI, СН2 и СН3). Аналогично, каждая легкая цепь от N-конца к С-концу содержит вариабельную область (VL), также называемую вариабельным легким доменом или вариабельным доменом легкой цепи, с последующим константным легким доменом (CL). В зависимости от аминокислотной последовательности константного домена легкую цепь антитела можно отнести к одному из двух типов, называемых каппа (κ) и лямбда (λ).
Фраза "пациент, страдающий от" согласно настоящему изобретению относится к пациенту, имеющему клинические признаки рака (например, рака яичника, перитонеального рака, рака фаллопиевой трубы, цервикального рака, эндометриального рака, вагинального рака или рака вульвы)) или рака груди (например, метастатического рака молочной железы, также см. ниже)). Фраза "восприимчивый к" или "предрасположенный" в контексте рака относится к индикации заболевания у пациента на основании, например, возможной генетической предрасположенности, предварительного или возможного воздействия опасных и/или канцерогенных соединений или воздействия канцерогенных физических опасных факторов, таких как радиация.
"Ответ пациента" или "ответ" (и их грамматические варианты) может быть оценен с применением любого конечного показателя, указывающего на пользу для пациента, включая, без ограничения: (1) ингибирование, до некоторой степени, прогрессирования заболевания, включая замедление и полную остановку; (2) сокращение числа эпизодов заболевания и/или симптомов; (3) уменьшение размера поражения; (4) ингибирование (т.е. уменьшение, замедление или полное прекращение) инфильтрации клеточной популяции в соседние периферические органы и/или ткани; (5) ингибирование (т.е. снижение, замедление или полное прекращение) распространения заболевания; (6) снижение аутоиммунного ответа, что может, но необязательно, приводить к регрессии или удалению очага поражения (7) ослабление, до некоторой степени, одного или более симптомов, связанных с расстройством; (8) увеличение продолжительности периода без рецидива после лечения, например, выживаемости без прогрессирования; (9) и/или сниженная смертность в данный момент времени после лечения.
Под "лучевой терапией" подразумевается применение направленных гамма-лучей или бета-лучей, чтобы причинить достаточный ущерб клетке, с целью ограничения ее способности нормально функционировать или вообще уничтожить клетку. Следует понимать, что в данной области техники существует много известных способов определения дозировки и продолжительности лечения. Типичное лечение предоставляется в виде однократного введения, а типичные дозы составляют от 10 до 200 единиц (Грей) в день.
Термин "малая молекула" относится к органической молекуле, имеющей молекулярную массу от 50 дальтон до 2500 дальтон.
Термины "ген сигнатуры стромы", "сигнатура гена стромы" и "сигнатура стромы" относятся к одному из генов, приведенному в таблицах 1-4, комбинациям генов, приведенных в таблицах 1-4, или подкомбинациям этих генов, уровень экспрессии которых коррелирует с резистентностью рака к химиотерапии. Каждый отдельный ген сигнатуры стромы является "геном сигнатуры стромы". К таким генам относятся: POSTN, LOX, BGN, FGF1, TIMP3, FN1, FAP, ANGPTL2, АСТА2, ММР11, RBP4, CD36, PLVAP, РЕСАМ1, GZMK, CD247, АВСС9, PCOLCE, CD1C, MS4A1, CD44, РМЕРА1, IL7R, FBLN1, TWIST1, ID1, RAC2, GFRA1, CCR7, MAN1A1, EVI2A, PTPRC CD45RA, FCRL5, NNMT, CD27, SLA, ESR2, KLK7, KLK6, MUC1, DTX4, FGFR4, TSPAN8, ESR1, KRT18, FUT2, HOXD10, EXO1, INADL, IGFBP2, MYCN, ERBB3, TMEM45B, PROM1, NCAM1, MKI67, CDH3, LY6E, TJP3, SLC7A11, BNIP3, PRAME, ESM1, VTCN1, CCL28, TDO2, NUAK1, COL4A1, ABCB9, RB1, ANXA1, FOXO1, PGR и ALPP.
Термин "агент, нацеленный на строму" означает агент, который прямо или косвенно воздействует на компоненты опухолевой стромы (например, фибробласты, эндотелиальные клетки, перициты, лейкоциты, внеклеточный матрикс и т.д.). Агент, нацеленный на строму, может прямо или косвенно влиять на активность любого гена из набора генов сигнатуры стромы, изложенного в данном документе, например, связывая или иным образом влияя на активность гена-мишени или кодирующего им белка. Агент, нацеленный на строму, также может воздействовать на строму опухоли другим способом, не влияя на активность любого из генов сигнатуры стромы (или соответствующего полипептида), как изложено в данном документе. Такие агенты могут включать, например, малые молекулы, аптамеры, полипептиды (которые включают, например, иммуноадгезины, антитела, пептидные антитела и пептиды) и терапевтические средства на основе РНК (которые включают, например, малую интерферирующую миРНК), микро РНК (микроRNА), антисмысловые олигонуклеотиды и пространственно блокирующие олигонуклеотиды).
"Выживаемость" относится к пациенту, оставшемуся в живых, и включает общую выживаемость и выживаемость без прогрессирования.
"Общая выживаемость" относится к пациенту, остающемуся в живых в течение определенного времени, такого как 1 год, 5 лет и т.д. от времени постановки диагноза или начала лечения.
Фраза "выживаемость без прогрессирования" в контексте настоящего изобретения относится к периоду времени во время и после лечения во время которого, согласно оценке лечащего врача или исследователя, заболевание пациента не ухудшается, т.е. не прогрессирует. Как оценит квалифицированный специалист, выживаемость без прогрессирования пациента является улучшенной или повышенной, если пациент испытывает более длительный период времени в течение которого болезнь не прогрессирует, по сравнению со средним временем выживаемости без прогрессирования контрольной группы пациентов, оказавшихся в такой же ситуации.
Термин "продление выживаемости" означает увеличение общей выживаемости или выживаемости без прогрессирования у пролеченного пациента по сравнению с непролеченным пациентом (т.е., по сравнению с пациентом, не получавшим лечение агентом, нацеленным на строму (например, антителом к POSTN), иммуномодулирующим агентом, антиангиогенным агентом (например, антагонистом VEGF, например антителом к VEGF, таким как бевацизумаб) или или по сравнению с пациентом, который не экспрессирует ген сигнатуры стромы на определенном уровне, и/или по сравнению с пациентом, получавшим химиотерапевтический агент (например, любой, описанный в данном документе), который является чувствительным к химиотерапии.
Термин "стандартное лечение" в данном документе означает противоопухолевый агент или агенты, которые применяются согласно обычной практике для лечения конкретного вида рака. Например, для резистентного к платине рака яичника стандартом лечения является комбинация карбоплатина и паклитаксела.
Термин "терапевтически эффективное количество" или "эффективное количество" относится к количеству лекарственного средства, эффективного для лечения рака у пациента. Эффективное количество лекарственного вещества может снизить количество раковых клеток; уменьшить размер опухоли; ингибировать (т.е. до некоторой степени замедлить и предпочтительно остановить) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. до некоторой степени замедлить и предпочтительно остановить) метастазирование опухоли; до определенной степени ингибировать рост опухоли; и/или до некоторой степени облегчить один или более симптомов, связанных с раком. В тех случаях, когда лекарственное средство может предотвращать рост и/или уничтожать существующие раковые клетки, оно может быть цитостатическим и/или цитотоксическим. Эффективное количество может продлевать выживаемость без прогрессирования (например, при с помощью измерения изменения критериев оценки ответа солидных опухолей, КООСО или СА-125), приводить к объективному ответу (включая частичную ремиссию, ЧР или полную ремиссию, ПР), улучшать выживаемость (включая общую выживаемость и выживаемость без прогрессирования) и/или улучшать один или более симптомов рака (например, по оценке FOSI). Наиболее предпочтительно терапевтически эффективное количество лекарственного средства является эффективным для улучшения выживаемости без прогрессирования (ВБП) и/или общей выживаемости (ОВ).
В данном контексте термин "общий периостин (POSTN)" относится к по меньшей мере изоформам 1, 2, 3 и 4 периостина. Изоформы 1, 2, 3 и 4 POSTN человека известны в данной области техники как содержащие следующие аминокислотные последовательности: NP 006466.2; NP 001129406.1, NP 001129407.1 и NP 001129408.1, соответственно, согласно базе данных NCBI (SEQ ID NO: (SEQ ID NO: 19-22 из US 2012/0156194, соответственно, которые включены в данный документ посредством ссылки вместе с данными последовательностями и SEQ ID NO: 23). Дополнительная форма POSTN описана в US 2012/0156194. Данная изоформа упоминается в данном документе как "изоформа 5" и была частично секвенирована. Изоформа 5 содержит аминокислотную последовательность SEQ ID NO: 23 из US 2012/0156194. В одном варианте реализации изобретения изоформы POSTN представляют собой POSTN человека. В дополнительном варианте реализации изобретения термин суммарный РОSTN включает изоформу 5 POSTN человека в дополнение к изоформам 1-4. В другом варианте реализации изобретения общий POSTN представляет собой общий POSTN сыворотки или общий POSTN плазмы (т.е., общий POSTN из образца сыворотки, полученного из цельной крови, или образца плазмы, полученного из цельной крови, соответственно, цельной крови, полученной от пациента).
Термин "периостин (POSTN) антитело» или "антитело к POSTN" относится к антителу, которое связывается с изоформой POSTN. В одном варианте реализации изобретения POSTN представляют собой POSTN человека. В одном варианте реализации изобретения антитело содержит последовательности из SEQ ID NO: 1 и SEQ ID NO: 2 (антитело «25D4») или содержит последовательности из SEQ ID NO: 3 и SEQ ID NO: 4 (антитело «23B9»). В другом варианте реализации изобретения антитело содержит последовательности вариабельной области из SEQ ID NO: 1 и SEQ ID NO: 2, или содержит последовательности вариабельной области из SEQ ID NO: 3 и SEQ ID NO: 4. В другом варианте реализации изобретения антитело содержит последовательности HVR из SEQ ID NO: 1 и SEQ ID NO: 2 или последовательности HVR из SEQ ID NO: 3 и SEQ ID NO: 4. В другом варианте реализации изобретения антитело содержит последовательности HVR, которые на 95% или более идентичны последовательностям HVR из SEQ ID NO: 1 и SEQ ID NO: 2, и/или антитела, содержащего последовательности HVR, которые на 95% или более идентичны последовательностям HVR из SEQ ID NO: 3 и SEQ ID NO: 4.
В данном контексте "лечение" относится к клиническому вмешательству в попытке изменить естественный ход болезни человека или клеток, подлежащих лечению, и может быть выполнено либо для профилактики или в процессе клинической патологии. Желательные эффекты лечения включают предупреждение возникновения или возобновления заболевания, облегчение симптомов, уменьшение прямых или косвенных патологических последствий заболевания, снижение скорости прогрессирования заболевания, улучшение или временное улучшение течения заболевания, и ремиссию или улучшение прогноза. В некоторых вариантах реализации изобретения способы и композиции по изобретению являются полезными в попытках замедлить развитие заболевания или расстройства.
Термин "вариабельная область" или "вариабельный домен" относится к домену тяжелой или легкой цепи антитела, участвующему в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно обладают аналогичной структурой, причем каждый домен содержит четыре консервативные каркасные области (FR) и три гипервариабельные области (HVR). (См., например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007)). Для придания антигенсвязывающей специфичности может быть достаточно одного домена VH или VL. Кроме того, антитела, которые связываются с конкретным антигеном, можно выделить, применяя VH или VL домен антитела, связывающийся с антигеном, для скрининга библиотеки последовательностей, комплементарных доменам VL или VH, соответственно. См., например, Portolano et al, J.Immunol. 150: 880-887 (1993); Clarkson et al, Nature 352: 624-628 (1991).
"Антагонист VEGF" или "антагонист, специфичный к VEGF" относится к молекуле, способной связываться с VEGF, снижать уровни экспрессии VEGF или нейтрализовывать, блокировать, ингибировать, подавлять, снижать или мешать биологической активности VEGF, включая, но не ограничиваясь ими, связывание VEGF с одним или более рецепторами VEGF, передачу сигналов VEGF и опосредованный VEGF ангиогенез, и выживаемость или пролиферацию эндотелиальных клеток. Например, молекула, способная нейтрализовать, блокировать, ингибировать, подавлять, снижать или мешать биологической активности VEGF, может оказывать свое действие путем связывания с одним или более рецепторами VEGF (VEGFR) (например, VEGFR1, VEGFR2, VEGFR3, мембранно-связанный рецептор VEGF (mbVEGFR) или растворимый рецептор VEGF (sVEGFR)). Антагонистами, специфичными к VEGF, применяемыми в способах по изобретению, являются полипептиды, которые специфически связываются с VEGF, антитела к VEGF и их антигенсвязывающие фрагменты, молекулы рецепторов и производные, которые специфически связываются с VEGF, таким образом предотвращая его связывание с одним или более рецепторами, слитые белки (например, VEGF-Trap (Regeneron)) и VEGF121-gelonin (Peregrine). Антагонисты, специфичные к VEGF, также включают антагонистические варианты полипептидов VEGF, олигомеры антисмысловых нуклеиновых оснований, комплементарные по меньшей мере фрагменту молекулы нуклеиновой кислоты, кодирующей полипептид VEGF; малые РНК, комплементарные по меньшей мере фрагменту молекулы нуклеиновой кислоты, кодирующей полипептид VEGF; рибозимы, которые нацелены на VEGF; пептидные антитела к VEGF; и аптамеры к VEGF. Антагонисты VEGF также включают полипептиды, которые связываются с VEGFR, антитела к VEGFR и их антигенсвязывающе фрагменты, и производные, которые связываются с VEGFR, тем самым блокируя, ингибируя, подавляя, снижая или мешая биологической активности VEGF (например, передаче сигналов VEGF) или слитые белки. Антагонисты, специфичные к VEGF, также включают непептидные малые молекулы, которые связываются с VEGF или VEGFR и способны блокировать, ингибировать, подавлять, снижать или мешать биологической активности VEGF. Таким образом, термин "активности VEGF" специфически включает опосредованные VEGF биологические активности VEGF. В некоторых вариантах реализации изобретения антагонист VEGF снижает или ингибирует уровень экспрессии или биологическую активность VEGF по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или более. В некоторых вариантах реализации изобретения VEGF, ингибированный антагонистом, специфичным к VEGF, представляет собой VEGF (8-109), VEGF (1-109) или VEGF165.
В данном контексте антагонисты VEGF могут включать, но не ограничиваться ими, антитела к VEGFR2 и родственные молекулы (например, рамуцирумаб, танибирумаб, афлиберцепт), антитела к VEGFR1 и родственные молекулы (например, икрукумаб, афлиберцепт (VEGF Trap-Eye; EYLEA®) и зив-афлиберцепт (VEGF Trap; ZALTRAP®)), биспецифические антитела VEGF (например, МР-0250, вануцизумаб (VEGF-ANG2) и биспецифические антитела, описанные в US 2001/0236388), биспецифические антитела, включая комбинации двух антител к VEGF, антител к VEGFR1 и антител к VEGFR2, антитела к VEGFA (например, бевацизумаб, севацизумаб), антитела к VEGFB, антитела к VEGFC (например, VGX-100), антитела к VEGFD и непептидные малые молекулы антагонистов VEGF (например, пазопаниб, акситиниб, вандетаниб, стиварга, кабозаниниб, ленвитиниб, ниндеданиб, орантиниб, телэтиниб, довитиниг, седираниб, мотосаниб, сульфатиб, апатиниб, фориниб, фамитиниб и тивозаниб).
"Антитело к VEGF" представляет собой антитело, которое связывается с VEGF с достаточной аффинностью и специфичностью. В некоторых вариантах реализации изобретения антитело будет иметь достаточно высокую аффинность связывания с VEGF, например, антитело может связывать hVEGF со значением Kd в диапазоне от 100 нМ до 1 пМ. Аффинность антител может быть определена, например, с помощью анализа на основе поверхностного плазмонного резонанса (например, анализа BIAcore, описанного в публикации заявки РСТ № WO 2005/012359); твердофазного иммуноферментного анализа (ИФА); и конкурентных анализов (например, РИА).
В некоторых вариантах реализации изобретения антитело к VEGF можно применять в качестве терапевтического средства для целенаправленного воздействия и вмешательства в ход заболеваний или патологических состояний, в которые вовлечена активность VEGF. Кроме того, антитело можно подвергать другим анализам биологической активности, например, с целью оценки его эффективности как терапевтического средства. Такие анализы известны в данной области техники и зависят от антигена-мишени и планируемого применения антитела. Примеры включают анализ ингибирования HUVEC; анализы ингибирования роста опухолевых клеток (например, описанные в WO 89/06692); анализы антитело-зависимой клеточной цитотоксичности (АЗКЦ) и комплемент-зависимой цитотоксичности (КЗЦ) (патент США №5500362); и анализы агонистической активности или гематопоэза (см WO 95/27062). Антитело к VEGF, как правило, не связывается с другими гомологами VEGF, например, VEGF-B или VEGF-C, и другими факторами роста, например, PlGF, PDGF или bFGF. B одном варианте реализации изобретения антитело к VEGF включает моноклональное антитело, связывающееся с тем же эпитопом, что и моноклональное антитело к VEGF А4.6.1, продуцируемое гибридомой АТСС НВ 10709. В другом варианте реализации изобретения антитело к VEGF представляет собой рекомбинантное гуманизированное моноклональное антитело к VEGF, полученное в соответствии с Presta et al. (1997) Cancer Res.57:4593-4599, включая, но не ограничиваясь им, антитело, известное как бевацизумаб (BV; AVASTIN®).
Антитело к VEGF "бевацизумаб (BV)", также известное как "rhuMAb VEGF" или "AVASTIN®", представляет собой рекомбинантное гуманизированное моноклональное антитело к VEGF, полученное в соответствии с Presta et al. (1997) Cancer ites. 57:4593-4599. Оно содержит мутантные каркасные области IgG1 человека и антигенсвязывающие области, определяющие комплементарность, из моноклонального антитела А.4.6.1 мыши к VEGF человека, которые блокируют связывание VEGF человека с его рецепторами. Приблизительно 93% аминокислотной последовательности бевацизумаба, включая большую часть каркасных областей, происходят от IgG1 человека, а около 7% последовательности происходят от антитела А4.6.1 мыши. Молекулярная масса бевацизумаба составляет около 149000 дальтон; он является гликозилированным антителом. Бевацизумаб и другие гуманизированные антитела к VEGF дополнительно описаны в патенте США №6884879, выданном 26 февраля 2005 года, содержание которого в полном объеме включено в данный документ посредством ссылки. Дополнительные предпочтительные антитела включают антитела серий G6 или В20 (например, С6-31, В20-4.1), как описано в публикации заявки РСТ № WO 2005/012359. Дополнительные предпочтительные антитела см. в патенте США №7060269, 6582959, 6703020; 6054297; WO 98/45332; WO 96/30046; WO 94/10202; ЕР 0666868 В1; публикациях патентных заявок США №2006009360, 20050186208, 20030206899, 20030190317, 20030203409 и 20050112126; и Popkov et al. Journal of Immunological Methods 288:149-164 (2004). Другие предпочтительные антитела включают антитела, связывающиеся с функциональным эпитопом на VEGF человека, содержащим остатки F17, М18, D19, Y21, Y25, Q89, I191, K101, Е103 и С104 или, в альтернативном варианте, содержащим остатки F17, Y21, Q22, Y25, D63, 183 и Q89.
III. СПОСОБЫ ПРОГНОЗА, ДИАГНОСТИКИ И ОБНАРУЖЕНИЯ
Настоящее изобретение относится к идентификации, отбору и применению биомаркеров рака (например, гинекологического рака (например, рака яичника, перитонеального рака, рака фаллопиевой трубы, цервикального рака, эндометриального рака, вагинального рака или рака вульвы)), которые связаны с резистентностью к химиотерапевтическим агентам (например, химиотерапевтические агента на основе платины, например цисплатин, карбоплатин, оксалиплатин, страплатин, пикоклатин, дедаплатин, триплатин, липоплатин и т.д.). В этом отношении изобретение относится к применению профиля(ей) экспрессии компонента стромы опухоли (например, связанных с опухолью фибробластов) у пациентов с раком (например, гинекологическим раком (например, раком яичника, перитонеальным раком, раком фаллопиевой трубы, цервикальным раком, эндометриальным раком, вагинальным раком или раком вульвы)), для которых установлено, что у них имеется резистентный к химиотерапии рак или чувствительный к химиотерапии рак, к идентификации биомаркеров, связанных с резистентностью к химиотерапевтических агентам (например, химиотерапевтическим агентам на основе платины, таким как цисплатин, карбоплатин, оксалиплатин, страплатин, пикоклатин, дедаплатин, триплатин, липоплатин и т.д.). Биомаркеры по изобретению перечислены в данном документе, например, в таблицах 1-4.
Изобретение относится к способам идентификации пациентов с раком (например, гинекологическим раком (например, раком яичника, перитонеальный раком, раком фаллопиевой трубы, цервикальный раком, эндометриальный раком, вагинальным раком или рак вульвы)), который является резистентным к химиотерапии, путем определения уровня экспрессии одного или более генов сигнатуры стромы (например, один или более генов, перечисленных в таблицах 1-4, и/или их комбинации), и сравнения уровня экспрессии гена сигнатуры стромы с медианным уровнем экспрессии гена сигнатуры стромы в данном виде рака. В некоторых вариантах реализации изобретения у пациента установлено наличие рака, который является резистентным к химиотерапии, если экспрессия гена сигнатуры стромы (например, любой из генов в таблицах 1 и 3 и/или их комбинации) находится на уровне, превышающем медианный уровень экспрессии гена сигнатуры стромы в данном виде рака. В других вариантах реализации изобретения у пациента установлено наличие рака, который является резистентным к химиотерапии, если экспрессия гена сигнатуры стромы (например, любой из генов в таблицах 2 и 4 и/или их комбинации) находится на уровне меньшем, чем медианный уровень экспрессии гена сигнатуры стромы в данном виде рака. Изобретение также относится к способам идентификации пациентов с раком (например, раком яичника, перитонеальный раком, раком фаллопиевой трубы, цервикальный раком, эндометриальный раком, вагинальным раком или рак вульвы)), который является чувствительным к химиотерапии, путем определения уровня экспрессии гена сигнатуры стромы (например, один или более генов, перечисленных в таблицах 1-4, и/или их комбинации), и сравнения уровня экспрессии гена сигнатуры стромы с медианным уровнем экспрессии гена сигнатуры стромы в данном виде рака. В некоторых вариантах реализации изобретения у пациента установлено наличие рака, который является чувствительным к химиотерапии, если экспрессия гена сигнатуры стромы (например, любой из генов в таблицах 1 и 3 и/или их комбинации) находится на уровне меньшем, чем медианный уровень экспрессии гена сигнатуры стромы в данном виде рака. В других вариантах реализации изобретения у пациента установлено наличие рака, который является чувствительным к химиотерапии, если экспрессия гена сигнатуры стромы (например, любой из генов в таблицах 2 и 4 и/или их комбинации) находится на уровне, превышающем медианный уровень экспрессии гена сигнатуры стромы в данном виде рака. Необязательно эти способы выполняют перед введением химиотерапевтического агента, чтобы предоставить пациенту предварительный диагноз резистентности к химиотерапии.
Изобретение также относится к способам прогноза относительно возможности получения химиотерапии с применением конкретных химиотерапевтических агентов (например, карбоплатина, цисплатина, оксалиплатина или любых описанных в данном документе агентов, см. выше) и/или вероятности применения альтернативной противораковой терапии в дополнение или вместо химиотерапии (например, введение агентов против ангиогенеза, иммуномодулирующих агентов и/или агентов, нацеленных на строму (например, антитело к POSTN)). Эти способы включают определение уровня экспрессии гена сигнатуры стромы (например, одного или более генов, перечисленных в таблицах 1-4, и/или их комбинаций) и сравнение уровня экспрессии гена сигнатуры стромы с медианным уровнем экспрессии гена сигнатуры стромы в данном виде рака. В некоторых вариантах реализации изобретения пациент, по-видимому, может получать пользу от введения противораковой терапии (например, антиангиогенезной терапии, иммунотерапии, терапии, нацеленной на строму и т.д.) в дополнение или вместо химиотерапии, если экспрессия гена сигнатуры стромы (например, любого гена из таблиц 1 и 3 и/или их комбинаций) находится на уровне, превышающем медианный уровень экспрессии гена сигнатуры стромы в данном виде рака. В других вариантах реализации изобретения пациент, по-видимому, может получать пользу от введения противораковой терапии (например, антиангиогенезной терапии, иммунотерапии, терапии, нацеленной на строму и т.д.) в дополнение или вместо химиотерапии, если экспрессия гена сигнатуры стромы (например, любого гена из таблиц 2 и 4 и/или их комбинаций) находится на уровне меньшем, чем медианный уровень экспрессии гена сигнатуры стромы в данном виде рака. Необязательно данные способы включают введение противораковой терапии (например, введение антиангиогенного агента (например, антагониста VEGF, такого как антитело к VEGF, например, бевацизумаба), иммуномодулирующего агента и/или агента, нацеленного на строму (например, антитела к POSTN)), пациенту в комбинацииии со схемой химиотерапии и/или как монотерапию.


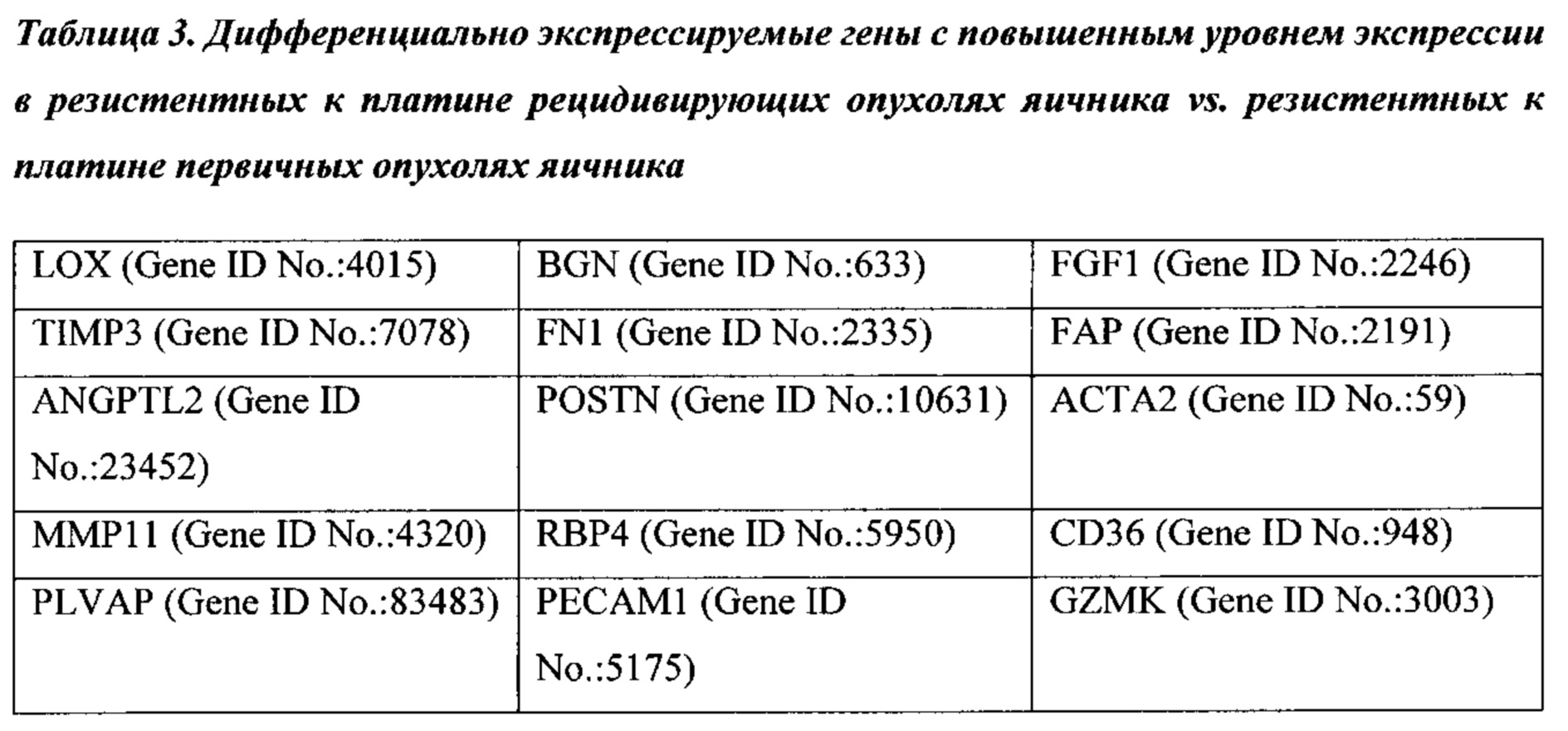

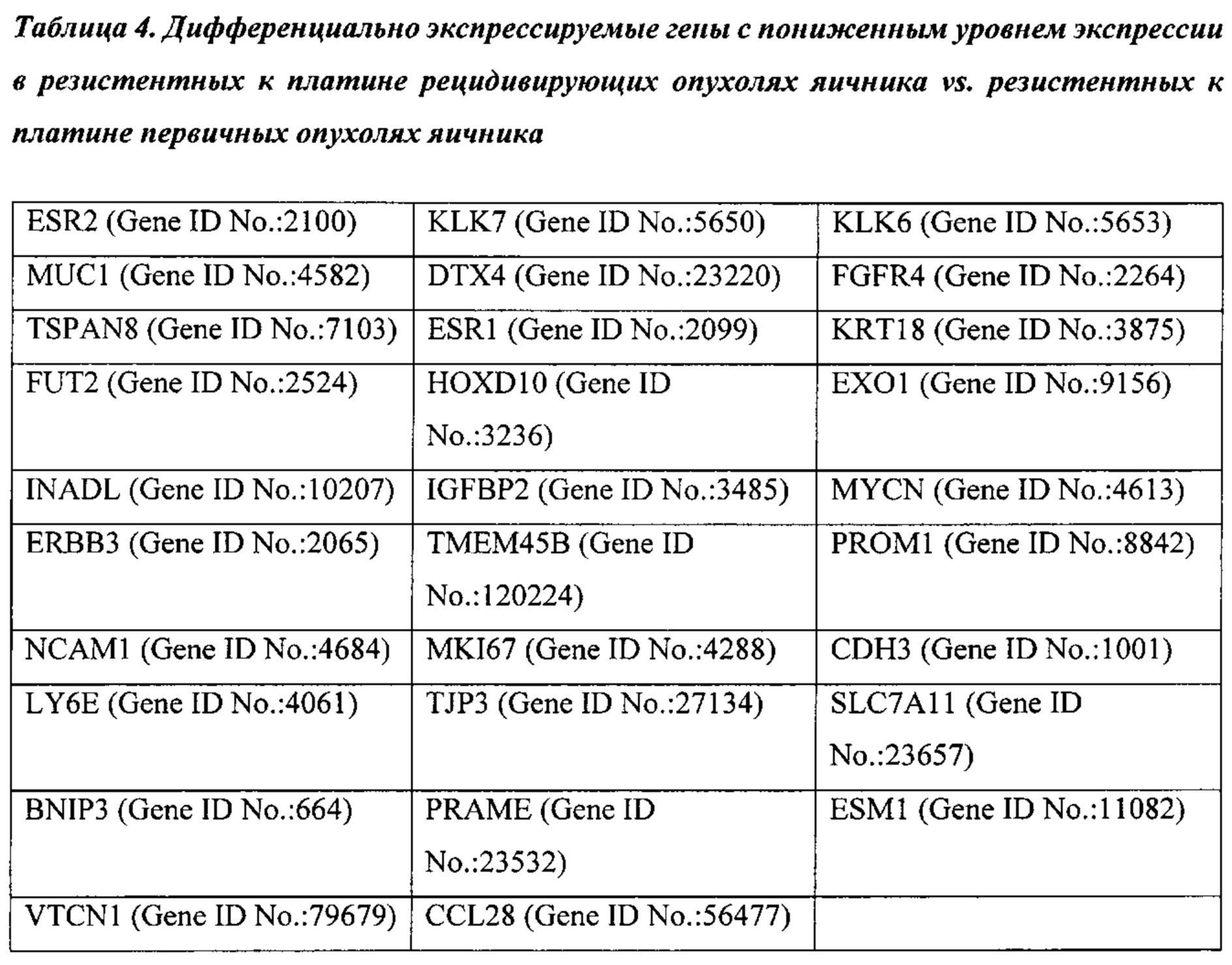
*Номера Gene ID были получены 29 июля 2015 года из веб-страницы Nanostring Technologies по адресу store.nanostring.com/search.
Изобретение также относится к способам определения стадии рака у пациента. В этих способах оценивают уровень экспрессии одного или более генов сигнатуры стромы, как описано в данном документе, и повышение экспрессии гена(ов) указывает на более позднюю стадию рака. В одном примере уровень, например, POSTN оценивают в образце (например, образце крови, таком как образец сыворотки), и определяют повышенный уровень экспрессии гена, например, POSTN, указывает на позднюю (например, стадию III (например, стадию IIIA, IIIB или III или IV согласно классификации FIGO) стадию ЭРЯ. Уровень экспрессии гена(ов) сигнатуры в образце можно сравнить, например, с медианным уровнем экспрессии гена в группе пациентов, имеющих вид рака, в общем, или можно сравнить с уровнями, определенными как связанные с конкретными стадиями (например, ранними стадиями, такими как стадия I или стадия II ЭРЯ согласно классификации FIGO), виды рака.
Уровень экспрессии гена сигнатуры стромы может быть оценен любым способом, известным в данной области техники, подходящим для определения специфичных уровней белка в образце пациента, и предпочтительно определяется иммуногистохимическим ("ИГХ") способом, применяющим антитела, специфичные для гена сигнатуры стромы. Такие способы являются хорошо известными и применяются согласно обычной практике в данной области техники, и соответственные коммерческие антитела и/или комплекты являются легко доступными. Предпочтительно уровни экспрессии маркерных/индикаторных белков по изобретению оценивают с применением рекомендованных производителем антитела или комплекта реагентов и/или протоколов. Квалифицированному специалисту также будут известны дополнительные средства для определения уровня экспрессии гена сигнатуры стромы с помощью методов ИГХ. Следовательно, уровень экспрессии одного или более маркеров/индикаторов по изобретению может быть определен согласно обычной практике и воспроизводимо специалистом в данной области техники без излишних трудностей. Однако для обеспечения точных и воспроизводимых результатов изобретение также включает исследование образцов пациентов в специализированной лаборатории, которая может обеспечить валидацию процедур исследования.
Предпочтительно уровень экспрессии гена сигнатуры стромы оценивают в биологическом образце, который содержит или предположительно содержит раковые клетки. Образец может представлять собой, например, резекцию ткани яичника, биопсию ткани яичника или метастатическое поражение, полученное от пациента, страдающего от, предположительно страдающего от или с пациента с диагнозом рак (например, гинекологический рак, в частности рак яичника). Предпочтительно образец представляет собой образец ткани яичника, резекцию или биопсию опухоли яичника, известное или предполагаемое метастатическое поражение, или участок рака яичника, или образец крови, например, образец периферической крови, известный или предположительно содержащий циркулирующие раковые клетки, например, раковые клетки яичника. Образец может содержать как раковые клетки, т.е. опухолевые клетки, так и нераковые клетки, и в некоторых вариантах реализации изобретения содержит как злокачественные, так и нераковые клетки (например, предпочтительно образцы содержат стромальные клетки). В аспектах изобретения, включающих определение экспрессии гена в компонентах стромы, образец содержит как раковые/опухолевые клетки, так и нераковые клетки, которые, например, связаны с раковыми/опухолевыми клетками (например, связанные с опухолью фибробласты, эндотелиальные клетки, перициты, внеклеточный матрикс и/или различные классы лейкоцитов). В других аспектах квалифицированный специалист, например, патолог, может легко отличить раковые клетки от нераковых (например, стромальных клеток, эндотелиальных клеток и т.д.). Способы получения биологических образцов, включая резекции тканей, биопсии и биологические жидкости, например, образцы крови, содержащие раковые/опухолевые клетки, хорошо известны в данной области техники. В некоторых вариантах реализации изобретения образец, полученный от пациента, отбирается до начала любой химиотерапевтической или другой схемы лечения, или терапии, например, терапии для лечения рака или симптоматического лечения, или улучшения симптома. Следовательно в некоторых вариантах реализации изобретения образец отбирают перед введением химиотерапевтических агентов или других агентов, или началом химиотерапии, или другой схемы лечения.
В дополнение к способам, описанным выше, изобретение также охватывает дополнительные иммуногистохимические способы для оценки уровня экспрессии одного или более генов сигнатуры стромы, такие как вестерн-блоттинг и определение на основе ИФА. Как известно в данной области техники, уровень экспрессии маркерных/индикаторных белков по изобретению можно также оценивать на уровне мРНК любым подходящим способом, известным в данной области техники, таким как нозерн-блоттинг, ПЦР в реальном времени и ОТ ПЦР. Способы и системы обнаружения на основе иммуногистохимимии и мРНК хорошо известны в данной области техники и могут быть получены из стандартных пособий, таких как Lottspeich (Bioanalytik, Spektrum Akademisher Verlag, 1998) или Sambrook and Russell (Molecular Cloning:A Laboratory Manual, CSH Press, Cold Spring Harbor, N.Y., U.S.A., 2001). В предпочтительных вариантах реализации изобретения способ определения уровней мРНК гена сигнатуры стромы выполняется с применением РНК in situ гибридизации (РНК ISH) (например, см. ниже). Описанные способы являются особенно полезными для определения уровней экспрессии гена сигнатуры стромы у пациента или группы пациентов по сравнению с контрольными уровнями, установленными в группе с диагнозом поздних стадий рака (например, гинекологического рака, такого как рак яичника).
Для применения способов обнаружения, описанных в данном документе, специалист в данной области техники имеет возможность маркировать полипептиды или олигонуклеотиды, охватываемые настоящим изобретением. Согласно обычной практике в данной области техники гибридизационные зонды для применения в определении уровней мРНК и/или антител, или фрагментов антител для применения в методах ИГХ могут быть помечены и визуализированы в соответствии со стандартными способами, известными в данной области техники. Неограничивающие примеры традиционно применяемых систем включают применение радиоактивных меток, ферментных меток, флуоресцентных меток, биотин-авидиновых комплексов, хемилюминесценции и т.п.
Уровень экспрессии одного или более генов сигнатуры стромы также можно определить на уровне белка, применяя иммуноагглютинацию, иммунопреципитацию (например, иммунодиффузию, иммуноэлектрофорез, иммунную фиксацию), методы вестерн-блоттинга (например, in situ иммуногистохимию, in situ иммуноцитохимию, аффинную хроматографию, иммуноферментный анализ) и т.п. Количество очищенного полипептида также может быть определено с помощью физических способов, например, фотометрии. Способы количественного определения конкретного полипептида в смеси обычно основаны на специфическом связывании, например, антител.
Как указано выше, уровень экспрессии маркерных/индикаторных белков в соответствии с настоящим изобретением также может отражаться на повышенной или пониженной экспрессии соответствующего гена(ов), кодирующего ген сигнатуры стромы. Поэтому количественную оценку продукта гена до трансляции (например, сплайсированной, несплайсированной или частично сплайсированной мРНК) можно провести для оценки экспрессии соответствующего гена(ов). Специалисту в данной области техники известно о стандартных способах, которые следует применять в данном контексте, или он может получить эти методы из стандартных пособий (например, Sambrook, 2001). Например, количественные данные о соответствующих концентрациях/количествах мРНК, кодирующей один или более генов сигнатуры стромы, как описано в данном документе, могут быть получены с помощью нозерн-блоттинга, ПЦР в реальном времени и т.п.
IV. СПОСОБЫ ЛЕЧЕНИЯ
Настоящее изобретение относится к способам лечения пациентов с раком (например, резистентный к химиотерапии рак, чувствительный к химиотерапии рак, первичный рак, прогрессирующий рак, рефрактерный рак и/или рецидивирующий рак). Способы включают введение пациенту терапевтически эффективного количества агента, нацеленного на строму (например, антитела к POSTN), если определено, что рак пациента экспрессирует ген сигнатуры стромы (например, один или более генов, описанных в таблицах 1 и 3) на уровне, превышающем медианный уровень экспрессии гена сигнатуры стромы в данном виде рака, или определено, что рак пациента экспрессирует ген сигнатуры стромы (например, один или более генов, описанных в таблицах 2 и 4), на уровне меньшем, чем медианный уровень экспрессии гена сигнатуры стромы в данном виде рака. В некоторых вариантах реализации изобретения агент, нацеленный на строму, может быть введен в виде монотерапии. В других вариантах реализации изобретения агент, нацеленный на строму, может быть введен в комбинацииии со схемой химеотерапии, лучевой терапией и/или иммунотерапией.
В конкретных вариантах реализации изобретения агент, нацеленный на строму, является агентом, который связывается с периостином (POSTN). В некоторых вариантах реализации изобретения агент, который связывается с POSTN, представляет собой выделенное антитело (т.е. антитело к периостину (POSTN) (антитело к POSTN).В конкретных вариантах реализации изобретения антитело к POSTN может связываться с изоформами 1-4 POSTN человека с хорошей аффинностью.
В одном варианте реализации изобретения антитело содержит последовательности из SEQ ID NO: 1 и SEQ ID NO: 2 (антитело «25D4») или содержит последовательности из SEQ ID NO: 3 и SEQ ID NO: 4 (антитело «23В9»). В другом варианте реализации изобретения антитело содержит последовательности вариабельной области из SEQ ID NO: 1 и SEQ ID NO: 2, или содержит последовательности вариабельной области из SEQ ID NO: 3 и SEQ ID NO: 4. В другом варианте реализации изобретения антитело содержит последовательности HVR из SEQ ID NO: 1 и SEQ ID NO: 2 или последовательности HVR из SEQ ID NO: 3 и SEQ ID NO: 4. В другом варианте реализации изобретения антитело содержит последовательности HVR, которые на 95% или более идентичны последовательностям HVR из SEQ ID NO: 1 и SEQ ID NO: 2, и/или антитела, содержащего последовательности HVR, которые на 95% или более идентичны последовательностям HVR из SEQ ID NO: 3 и SEQ ID NO: 4.
В любом из вышеуказанных вариантов реализации изобретения антитело к POSTN может быть гуманизированным. В одном варианте реализации изобретения антитело к POSTN содержит HVR согласно любому из вышеуказанных вариантов реализации изобретения и дополнительно содержит акцепторный человеческий каркас, например, каркас иммуноглобулина человека или консенсусный каркас человека.
В другом аспекте антитело к POSTN содержит последовательность вариабельного домена тяжелой цепи (VH), обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности по отношению к аминокислотной последовательности из SEQ ID NO: 1. В некоторых вариантах реализации изобретения последовательность VH, обладающая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью, содержит замены (например, консервативные замены), вставки или делеции по сравнению с эталонной последовательностью, но антитело к POSTN, содержащее указанную последовательность, сохраняет способность связываться с POSTN. В некоторых вариантах реализации изобретения заменены, вставлены и/или удалены в общей сложности от 1 до 10 аминокислот из SEQ ID NO: 1. В некоторых вариантах реализации изобретения замены, вставки или делеции присутствуют в областях, расположенных вне HVR (т.е. в FR). Необязательно антитело к POSTN содержит последовательность VH из SEQ ID NO: 1, включая посттрансляционные модификации этой последовательности.
В другом аспекте предложено антитело к POSTN, которое содержит последовательность вариабельного домена легкой цепи (VL), обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности по отношению к аминокислотной последовательности SEQ ID NO: 2В некоторых вариантах реализации изобретения последовательность VL, обладающая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью, содержит замены (например, консервативные замены), вставки или делеции по сравнению с эталонной последовательностью, но антитело к POSTN, содержащее указанную последовательность, сохраняет способность связываться с периостином. В некоторых вариантах реализации изобретения заменены, вставлены и/или удалены в общей сложности от 1 до 10 аминокислот из SEQ ID NO: 2. В некоторых вариантах реализации изобретения замены, вставки или делеции присутствуют в областях, расположенных вне HVR (т.е. в FR). Необязательно антитело к POSTN содержит последовательность VL из SEQ ID NO: 2, включая посттрансляционные модификации этой последовательности.
В другом аспекте антитело к POSTN содержит последовательность вариабельного домена тяжелой цепи (VH), обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности по отношению к аминокислотной последовательности из SEQ ID NO: 3. В некоторых вариантах реализации изобретения последовательность VH, обладающая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью, содержит замены (например, консервативные замены), вставки или делеции по сравнению с эталонной последовательностью, но антитело к POSTN, содержащее указанную последовательность, сохраняет способность связываться с POSTN. В некоторых вариантах реализации изобретения заменены, вставлены и/или удалены в общей сложности от 1 до 10 аминокислот из SEQ ID NO: 3. В некоторых вариантах реализации изобретения замены, вставки или делеции присутствуют в областях, расположенных вне HVR (т.е. в FR). Необязательно антитело к POSTN содержит последовательность VH из SEQ ID NO: 3, включая посттрансляционные модификации этой последовательности.
В другом аспекте антитело к POSTN содержит последовательность вариабельного домена легкой цепи (VL), обладающую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности по отношению к аминокислотной последовательности SEQ ID NO: 2. В некоторых вариантах реализации изобретения последовательность VL, обладающая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью, содержит замены (например, консервативные замены), вставки или делеции по сравнению с эталонной последовательностью, но антитело к POSTN, содержащее указанную последовательность, сохраняет способность связываться с периостином. В некоторых вариантах реализации изобретения заменены, вставлены и/или удалены в общей сложности от 1 до 10 аминокислот из SEQ ID NO: 4. В некоторых вариантах реализации изобретения замены, вставки или делеции присутствуют в областях, расположенных вне HVR (т.е. в FR). Необязательно антитело к POSTN содержит последовательность VL из SEQ ID NO: 4, включая посттрансляционные модификации этой последовательности.
В другом аспекте предложено антитело к POSTN, которое содержит VH согласно любому из вышеприведенных вариантов реализации изобретения и VL согласно любому из вышеприведенных вариантов реализации изобретения.
В дополнительном аспекте изобретение применяет антитело, связывающееся с тем же эпитопом, что и антитело к POSTN, предложенное в данном документе. Например, в некоторых вариантах реализации изобретения предлагается антитело, связывающееся с тем же эпитопом, что и антитело к POSTN, содержащее последовательность VH из SEQ ID NO: 1 и последовательность VL из SEQ ID NO: 2. Например, в некоторых вариантах реализации предложено антитело, связывающееся с тем же эпитопом, что и антитело к периостину, содержащее последовательность VH из SEQ ID NO: 3 и последовательность VL из SEQ ID NO: 4.
В дополнительном аспекте изобретения антитело к POSTN согласно любому из вышеупомянутых вариантов реализации изобретения является моноклональным антителом, включая химерное, гуманизированное или антитело человека. В одном варианте реализации изобретения антитело к POSTN представляет собой фрагмент антитела, например, фрагмент Fv, Fab, Fab', scFv, диатело или F(ab')2. В другом варианте реализации изобретения антитело представляет собой полноразмерное антитело, например, интактное антитело IgG1 или IgG4, или антитело, относящееся к другому классу или изотипу, как определено в данном документе. В другом варианте реализации изобретения антитело представляет собой биспецифическое антитело.
Настоящее изобретение также относится к способам идентификации пациента, страдающего от рака, который может получать пользу от введения антиангиогенного агента (например, антагониста VEGF, такого как антитело к VEGF, например бевацизумаб), или иммуномодулирующего агента путем определения уровня экспрессии гена сигнатуры стромы (например, любого из генов в таблицах 1-4 или их комбинаций), где пациенту вводят антиангиогенный агент или иммуномодулирующий агент, если экспрессия гена сигнатуры стромы (например, любого из генов в таблицах 1 и 3 и/или их комбинаций) находится на уровне, превышающем медианный уровень экспрессии гена сигнатуры стромы в данном виде рака. В других вариантах реализации изобретения пациенту вводят антиангиогенный агент или иммуномодулирующий агент, если экспрессия гена сигнатуры стромы (например, любого из генов в таблицах 2 и 4 и/или их комбинаций) находится на уровне, меньшем, чем медианный уровень экспрессии гена сигнатуры стромы в данном виде рака. Антиангиогенный агент (например, антагонист VEGF, такой как антитело к VEGF, например, бевацизумаб) может быть введен в комбинации с иммуномодулирующим агентом, схемой химиотерапии или агентом, нацеленным на строму (например, антителом к POSTN).
Соответственно, изобретение относится к способам лечения пациентов с раком (например, раком яичника, перитонеальный раком, раком фаллопиевой трубы, цервикальный раком, эндометриальный раком, вагинальным раком или рак вульвы)), который является устойчивым к химиотерапии, рефрактерным, первичным, прогрессирующим или рецидивирующим, включая введение терапевтически эффективного количества антиангиогенного агента (например, антагониста VEGF (например, антитела к VEGF, такого как бевацизумаб) пациенту, необязательно, эти способы включают совместное введение антагониста VEGF с одним или более дополнительными химиотерапевтическими агентами (например, карбоплатином и/или паклитакселом), как описано ниже.
Терапия с помощью агента, нацеленного на строму, иммуномодулирующего агента и/или антиангиогенного агента (например, антагониста VEGF (например, антитела к VEGF, такого как бевацизумаб)), необязательно в комбинацииии с одним или более химиотерапевтическими агентами (например, карбоплатином и/или паклитакселом) предпочтительно увеличивает и/или улучшает выживаемость, включая выживаемость без прогрессирования (ВБП) и/или общую выживаемость (ОВ). В одном варианте реализации изобретения терапия с помощью нацеленного на строму агента, иммуномодулирующего агента и/или антиангиогенного агента (например, антагониста VEGF (например, антитела к VEGF, такого как бевацизумаб)) увеличивает выживаемость по меньшей мере на около 20% по сравнению с выживаемостью, которая достигается с помощью введения одобренного противоопухолевого агента или стандарта лечения для лечения рака. В предпочтительных вариантах реализации изобретения пациент имеет гинекологический рак (например, рак яичника, перитонеальный рак, рак фаллопиевой трубы, цервикальный рак, эндометриальный рак, вагинальный рак или рак вульвы).
Для предупреждения или лечения рака доза нацеленного на строму агента, иммуномодулирующего агента и/или антиангиогенного агента (например, антагониста VEGF (например, антитела к VEGF, такого как бевацизумаб)) и/или химиотерапевтического агента будет зависеть от вида рака, подлежащего лечению, как определено выше, тяжести и течения рака, вводится ли антитело в профилактических или терапевтических целях, предшествующей терапии, истории болезни пациента и ответа на лекарственное средство, и усмотрения лечащего врача.
В одном варианте реализации изобретения вводят фиксированную дозу нацеленного на строму агента, иммуномодулирующего агента и/или антиангиогенного агента (например, антагониста VEGF (например, антитела к VEGF, такого как бевацизумаб)). Фиксированную дозу можно соответствующим образом вводить пациенту однократно или в ходе курса лечения. Если вводится фиксированная доза, предпочтительно она находится в диапазоне от около 20 мг до около 2000 мг. Например, фиксированная доза может составлять приблизительно 420 мг, приблизительно 525 мг, приблизительно 840 мг или приблизительно 1050 мг агента (например, агента, нацеленного на строму, иммуномодулирующего агента и/или антиангиогенного агента (например, антагониста VEGF (например, антитела к VEGF, такого как бевацизумаб)). В случае если вводят серию доз, они могут быть введены, например, приблизительно каждую неделю, приблизительно каждые 2 недели, приблизительно каждые 3 недели или приблизительно каждые 4 недели, но предпочтительно приблизительно каждые 3 недели. Фиксированные дозы могут продолжать вводить, например, до прогрессирования заболевания, нежелательного явления или в другого времени, как это определено врачом. Например, от около двух, трех или четырех до около 17 или более фиксированных доз могут быть введены.
В одном варианте реализации изобретения вводят одну или более насыщающих доз агента, нацеленного на строму, иммуномодулирующего агента и/или антиангиогенного агента (например, антагониста VEGF (например, антитела к VEGF, такого как бевацизумаб)), после чего следует одна или более поддерживающих доз. В другом варианте реализации изобретения пациенту вводят множество одинаковых доз.
Хотя агент, нацеленный на строму, иммуномодулирующий агент и/или антиангиогенный агент (например, антагонист VEGF (например, антитело к VEGF, такое как бевацизумаб)) может быть введен в виде единого противоопухолевого агента, пациент необязательно получает лечение с помощью комбинации агента, нацеленного на строму, иммуномодулирующего агента и/или антиангиогенного средства (например, антагониста VEGF (например, антитела к VEGF, такого как бевацизумаб)) и одного или более (дополнительных) химиотерапевтических агентов. В данном документе типовые химиотерапевтические агенты включают: гемцитабин, карбоплатин, оксалиплатин, иринотекан, фторпиримидин (например, 5-FU), паклитаксел (например, наб-паклитаксел), доцетаксел, топотекан, капецитабин, темозоломид, интерферон-альфа и/или липосомальный доксорубицин (например, ПЭГилированный липосомальный доксорубицин). В некоторых вариантах реализации изобретения по меньшей мере один из химиотерапевтических агентов представляет собой карбоплатин или паклитаксел. Комбинированное введение включает совместное введение или конкурентное введение при применении раздельных лекарственных форм или единого фармацевтического состава и последовательное введение в любом порядке, причем предпочтительно, чтобы существовал период времени, когда оба (или все) активные агенты одновременно проявляют свою биологическую активность. Таким образом, химиотерапевтический агент может быть введен до или после введения целевого агента, нацеленного на строму, иммуномодулирующего агента и/или антиангиогенного агента (например, антагониста VEGF (например, антитела к VEGF, такого как бевацизумаб)). В этом варианте реализации изобретения время между по меньшей мере одним введением химиотерапевтического агента и по меньшей мере одним введением агента, нацеленного на строму, иммуномодулирующего агента и/или антиангиогенного агента (например, антагониста VEGF (например, антитела к VEGF, такого как бевацизумаб)) предпочтительно составляет приблизительно 1 месяц или менее (3 недели, 2, недели, 1 неделя, 6 дней, 5 дней, 4 дня, 3 дня, 2 дня, 1 день). В альтернативном варианте химиотерапевтический агент и агент, нацеленный на строму, иммуномодулирующий агент и/или антиангиогенный агент (например, антагонист VEGF (например, антитело к VEGF, такое как бевацизумаб)) вводят одновременно пациенту в виде единой лекарственной формы или в виде раздельных лекарственных форм. Лечение с помощью комбинации химиотерапевтического агента (например, карбоплатина и/или паклитаксела) и агента, нацеленного на строму (например, антитела к POSTN), иммуномодулирующего агента, и/или антиангиогенного агента (например, антагониста VEGF (например, антитела к VEGF, такого как бевацизумаб)) может приводить к синергетическому или большему, чем аддитивный, терапевтическому эффекту для пациента.
Особенно желательные химиотерапевтические агенты для комбинирования с агентом, нацеленным на строму (например, антителом к POSTN), иммуномодулирующим агентом и/или антиангиогенным агентом (например, антагонистом VEGF (например, антителом к VEGF, таким как бевацизумаб)), например, для терапии рака яичника, включают: химиотерапевтический агент, такой как соединение платины (например, карбоплатин), таксол, такой как паклитаксел или доцетаксел, топотекан, или липосомальный доксорубицин.
Особенно желательные химиотерапевтические агенты для комбинирования с агентом, нацеленным на строму (например, антителом к POSTN), иммуномодулирующим агентом и/или антиангиогенным агентом (например, антагонистом VEGF (например, антителом к VEGF, таким как бевацизумаб)), например, для терапии эпителиального рака яичника на поздней стадии стадии, рака фаллопиевой трубы или первичного перитонеального рака включают: химиотерапевтические агенты, такие как карбоплатин и паклитаксел.
Особенно желательные химиотерапевтические агенты для комбинирования с агентом, нацеленным на строму (например, антителом к POSTN), иммуномодулирующим агентом и/или антиангиогенным агентом (например, антагонистом VEGF (например, антителом к VEGF, таким как бевацизумаб)), например, для терапии чувствительного к платине эпителиального рака яичника, рака фаллопиевой трубы или первичного перитонеального рака включают: химиотерапевтические агенты, такие как карбоплатин и паклитаксел.
Особенно желательные химиотерапевтические агенты для комбинирования с агентом, нацеленным на строму, (например, антителом к POSTN), иммуномодулирующим агентом и/или антиангиогенным агентом (например, антагонистом VEGF (например, антителом к VEGF, таким как бевацизумаб)), например, для терапии рецидивирующего резистентного к платине эпителиального рака яичника, рака фаллопиевой трубы или первичного перитонеального рака включают: химиотерапевтический агент, такой как паклитаксел, топотекан или ПЭГилированный липосомальный доксорубицин.
Особенно желательные химиотерапевтические агенты для комбинирования с агентом, нацеленным на строму (например, антителом к POSTN), иммуномодулирующим агентом и/или антиангиогенным агентом (например, антагонистом VEGF (например, антителом к VEGF, таким как бевацизумаб)), например, для терапии рака груди включают: капецитабин и таксол, такой как паклитаксел (например, наб-паклитаксел), или доцетаксел.
Особенно желательные химиотерапевтические агенты для комбинирования с агентом, нацеленным на строму (например, антителом к POSTN), иммуномодулирующим агентом и/или антиангиогенным агентом (например, антагонистом VEGF (например, антителом к VEGF, таким как бевацизумаб)), например, для терапии глиобластомы, включают: химиотерапевтические агенты, такие как темозоломид, необязательно в комбинации с лучевой терапией.
Особенно желательные химиотерапевтические агенты для комбинирования с агентом, нацеленным на строму (например, антителом к POSTN), иммуномодулирующим агентом и/или антиангиогенным агентом (например, антагонистом VEGF (например, антителом к VEGF, таким как бевацизумаб)), например, для терапии рака груди включают: химиотерапевтические агенты, такие как фторпиримидин (например, 5-FU), паклитаксел, цисплатин, топотекан, иринотекан, фторпиримидин-оксалиплатин, фторпиримидин-иринотекан, FOLFOX4 (5-FU, лейковорин, оксалиплатин) и IFL (иринотекан, 5-FU, лейковорин).
Особенно желательные химиотерапевтические агенты для комбинирования с агентом, нацеленным на строму (например, антителом к POSTN), иммуномодулирующим агентом и/или антиангиогенным агентом (например, антагонистом VEGF (например, антителом к VEGF, таким как бевацизумаб)), например, для терапии почечно-клеточного рака, включают: химиотерапевтические агенты, такие как интерферон-альфа2а.
Особенно желательные химиотерапевтические агенты для комбинирования с агентом, нацеленным на строму (например, антителом к POSTN), иммуномодулирующим агентом и/или антиангиогенным агентом (например, антагонистом VEGF (например, антителом к VEGF, таким как бевацизумаб)), например, для терапии рака шейки матки, включают: химиотерапевтические агенты, такие как паклитаксел, цисплатин, топотекан, паклитаксел в комбинации с цисплатином и паклитаксел в комбинации с топотеканом.
При введении химиотерапевтического агента, агент обычно вводят в дозах, известных таким образом, или необязательно пониженных дозах по причине комбинированного действия лекарственных средств или отрицательных побочных эффектов, связанных с введением химиотерапевтического агента. Препараты и графики приема таких химиотерапевтических агентов можно применять согласно инструкциям изготовителя или согласно эмпирическому определению, выполненному квалифицированным специалистом. В случае если химиотерапевтическим агентом является паклитаксел, его предпочтительно вводят в дозе от около 130 мг/м2 до 200 мг/м2 (например, приблизительно 175 мг/м2), например, более 3 часов, один раз каждые 3 недели. В случае если химиотерапевтическим агентом является карбоплатин, его предпочтительно вводят путем расчета дозы карбоплатина с применением формулы Кальверта, которая основана на предшествующей почечной функции пациента или почечной функции, и желаемом надире тромбоцитов. Почечная экскреция является основным путем элиминации карбоплатина. Применение данной формулы дозировки по сравнению с эмпирическим расчетом дозы, основанным на площади поверхности тела, позволяет компенсировать вариации почечной функции до лечения, которые в противном случае могли бы привести к лечению недостаточными дозами (у пациентов с почечной функцией на уровне выше среднего) или к передозировке (у пациентов с нарушением почечной функции). Целевой показатель AUC 4-6 мг/мл/мин для монотерапии карбоплатином, по-видимому, обеспечивает наиболее подходящий диапазон доз у пациентов, ранее получавших лечение.
Помимо агента, нацеленного на строму, (например, антитела к POSTN), иммуномодулирующего агента и/или антиангиогенного агента (например, антагониста VEGF (например, антитела к VEGF, такого как бевацизумаб)) и химиотерапевтического агента, одновременно могут комбинироваться другие схемы лечения. Например, может быть введен второй (третий, четвертый и т.д.) химиотерапевтический(ие) агент(ы), причем вторым химиотерапевтическим агентом является химиотерапевтический агент антиметаболит или химиотерапевтический агент, который не является антиметаболитом. Например, вторым химиотерапевтическим агентом может быть таксан (такой как паклитаксел или доцетаксел), капецитабин или химиотерапевтический агент на основе платины (такой как карбоплатин, цисплатин или оксалиплатин), антрациклин (такой как доксорубицин, включая липосомальный доксорубицин), топотекан, пеметрексед, алкалоид барвинка (такой как винорелбин) и TLK 286. Могут быть введены "коктейли" различных химиотерапевтических агентов.
Другие терапевтические агенты, которые могут быть объединены с агентом, нацеленным на строму, иммуномодулирующим агентом, антиангиогенным агентом (например, антагонистом VEGF (например, антителом к VEGF, таким как бевацизумаб)) и/или химиотерапевтическим агентом, включают любой один или более:ингибитор HER, ингибитор димеризации HER (например, антитело HER2, ингибирующее рост, такое как трастузумаб или антитело HER2, которое индуцирует апоптоз HER2-сверхэкспрессирующей клетки, такое как 7С2, 7F3 или его гуманизированные варианты); антитело, нацеленное против другого опухолеассоциированного антигена, такого как EGFR, HER3, HER4; антигормональное соединение, например, антиэстрогенное соединение, такое как тамоксифен или ингибитор ароматазы; кардиопротектор (для предотвращения или уменьшения любой дисфункции миокарда, связанной с терапией); цитокин; препарат, нацеленный на EGFR (такой как TARCEVA® IRESSA® или цетуксимаб); ингибитор тирозинкиназы; ингибитор СОХ (например, ингибитор СОХ-1 или СОХ-2); нестероидный противовоспалительный препарат, целекоксиб (CELEBREX®); ингибитор фарнезилтрансферазы (например, типифарниб/ZARNESTRA® R115777, доступный от Johnson and Johnson, или Lonafarnib SCH66336, доступный от Schering-Plough); антитело, которое связывает онкофетальный белок СА 125, такой как ореговомаб (мАт В43.13); вакцина HER2 (например, вакцина HER2AutoVac от Pharmexia или протеиновая вакцина АРС8024 от Dendreon, или пептидная вакцина HER2 от GSK/Corixa); другая целевая терапия HER (например, трастузумаб, цетуксимаб, ABX-EGF, EMD7200, гефитиниб, эрлотиниб, СР724714, CI1033, GW572016, IMC-11F8, TAK165 и т.д.); ингибитор Raf и/или ras (см., например, WO 2003/86467); липосомальный доксорубицин HCl для инъекций (DOXIL®); ингибитор топоизомеразы 1, такой как топотекан; таксан; двойной ингибитор тирозинкиназы HER2 и EGFR, такой как лапатиниб/GW572016; TLK286 (TELCYTA®); EMD-7200; лекарственное средство, которое лечит тошноту, такое как антагонист серотонина, стероид или бензодиазепин; лекарственное средство, которое предупреждает или лечит кожную сыпь или стандартная терапия против угрей, включая местный или пероральный антибиотик; лекарственное средство, которое лечит или предупреждает диарею; лекарственное средство для снижения температуры тела, такое как ацетаминофен, дифенгидрамин или меперидин; гемопоэтический фактор роста и т.д.
Подходящими дозами для любого из вышеуказанных совместно вводимых агентов являются те, которые в настоящее время применяются и могут быть снижены вследствие комбинированного действия (синергизма) агента и агента, нацеленного на строму, иммуномодулирующего агента и/или антиангиогенного агента (например, антагониста VEGF (например, антитела к VEGF, такого как бевацизумаб)). В дополнение к вышеуказанным терапевтическим режимам пациент может быть подвергнут хирургическому удалению опухолей и/или раковых клеток, и/или лучевой терапии.
В случае если агент, нацеленный на строму (например, антитело к POSTN), иммуномодулирующий агент и/или антиангиогенный агент (например, антагонист VEGF (например, антитело к VEGF, такое как бевацизумаб)) и химиотерапевтический агент является антителом, введенное антитело предпочтительно представляет собой свободное антитело. Вводимый агент, нацеленный на строму (например, антитело к POSTN), иммуномодулирующий агент и/или антиангиогенный агент (например, антагонист VEGF (например, антитело к VEGF, такое как бевацизумаб)) может быть конъюгирован с цитотоксическим агентом. Предпочтительно конъюгат и/или антиген, с которым он связан, интернализуется клеткой, что приводит к повышенной терапевтической эффективности конъюгата при уничтожении раковой клетки, с которой он связывается. В предпочтительном варианте реализации изобретения цитотоксический агент нацелен или взаимодействует с нуклеиновой кислотой в раковой клетке. Примеры таких цитотоксических агентов включают майтансиноиды, калихеамицины, рибонуклеазы и ДНК-эндонуклеазы.
Агент, нацеленный на строму (например, антитело к POSTN), иммуномодулирующий агент и/или антиангиогенный агент (например, антагонист VEGF (например, антитело к VEGF, такое как бевацизумаб)) может быть введен посредством генной терапии. См., например, WO 96/07321, опубликованную 14 марта 1996 относительно применения генной терапии для генерирования внутриклеточных антител. Существует два основных подхода к получению нуклеиновой кислоты (необязательно содержащейся в векторе) в клетках пациента; in vivo и ex vivo. Для доставки in vivo нуклеиновую кислоту вводят путем инъекции непосредственно пациенту, обычно в область, где требуется антитело. Для лечения ex vivo клетки пациента удаляют, нуклеиновую кислоту вводят в эти выделенные клетки, и модифицированные клетки вводят пациенту либо непосредственно, либо, например, инкапсулируют в пористые мембраны, которые имплантируют пациенту (см., например, патенты США №4892538 и 5283187). Существуют различные доступные способы введения нуклеиновых кислот в жизнеспособные клетки. Эти способы зависят от того, переносят ли нуклеиновые кислоты в культивируемые клетки in vitro или в клетки предполагаемого хозяина in vivo. Методики, пригодные для переноса нуклеиновой кислоты в клетки млекопитающих in vitro, включают применение липосом, электропорацию, микроинъекцию, слияние клеток, обработку ДЭАЭ-декстраном, осаждение с фосфатом кальция и т.д. Распространенный вектор для доставки гена ex vivo представляет собой ретровирус. Предпочтительно применяемые в настоящее время методики переноса нуклеиновых кислот in vivo включают трансфекцию с помощью вирусных векторов (например, аденовируса, вируса простого герпеса I или аденоассоциированного вируса) и системы на основе липидов (липиды, пригодные для липид-опосредованного переноса генов, представляют собой, например, DOTMA, DOPE и DC-Chol). В некоторых ситуациях желательно обеспечить исходную нуклеиновую кислоту агентом, который нацеливается на клетки-мишени, например, антителом, специфичным по отношению к белку поверхности мембраны или клетки-мишени, лигандом рецептора клетки-мишени и т.д. При применении липосом для адресного воздействия и/или облегчения поглощения можно применять белки, связывающиеся с белком поверхности мембраны клеток, ассоциированные с эндоцитозом, например, белки капсида или их фрагменты, тропные по отношению к клеткам конкретного типа, антитела к белкам, подвергающимся интернализации при клеточном цикле, и белки, мишенью которых являются внутриклеточные структуры, и белки, повышающие внутриклеточный период полувыведения. Методика рецептор-опосредованного эндоцитоза описана, например, в Wu et al., .J.Biol.Chem.262:44294432 (1987); и Wagner et al., Proc.Natl.Acad.Sci.USA 87:3410-3414 (1990). Для обзора известных в настоящее время протоколов маркировки генов и генной терапии см. Anderson et al., Science 256:808-813 (1992). См. также WO 93/25673 и приведенные в ней источники.
V. ДОЗИРОВКИ И ЛЕКАРСТВЕННЫЕ ФОРМЫ.
Агент, нацеленный на строму (например, антитело к POSTN), иммуномодулирующий агент и/или антиангиогенный агент (например, антагонист VEGF (например, антитело к VEGF, такое как бевацизумаб)) может быть введен любыми подходящими способами, включая парентеральный, внутрилегочной и назальный, и если это желательно для местного лечения - путем введения внутрь пораженных тканей. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Введение дозы может быть осуществлено любым подходящим способом, например, с помощью инъекции, как внутривенной или подкожной, частично в зависимости от того, является ли введение кратковременным или длительным. В данном документе рассмотрены различные схемы применения, включая, но не ограничиваясь ими, одно или множество введений в различные моменты времени, болюсное введение и пульс-терапию.
Агент, нацеленный на строму (например, антитело к POSTN), иммуномодулирующий агент и/или антиангиогенный агент (например, антагонист VEGF (например, антитело к VEGF, такое как бевацизумаб)) должен быть сформулирован, дозирован и вводиться в соответствии с хорошей медицинской практикой. Факторы, которые следует учитывать в данном контексте, включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подвергаемое лечению, клиническое состояние отдельно взятого пациента, причину нарушения, область доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам. Агент, нацеленный на строму (например, антитело к POSTN), иммуномодулирующий агент и/или антиангиогенный агент (например, антагонист VEGF (например, антитело к VEGF, такое как бевацизумаб)) необязательно, но может быть сформулирован с одним или более агентами, которые применяются в настоящее время для предупреждения или лечения рассматриваемого расстройства. Эффективное количество таких других агентов зависит от количества антитела, присутствующего в лекарственной форме, вида нарушения или лечения, и других факторов, описанных выше. Как правило, другие агенты применяют в тех же дозах и посредством того же пути введения, как описано в данном документе, или в дозах, составляющих от около 1 до 99% количества доз, описанных в данном документе, или в любой дозе и посредством любого пути введения, эмпирически/клинически считающихся пригодными.
Доза терапевтического агента согласно изобретению, пригодная для предупреждения или лечения заболевания (при применении в качестве монотерапии или в комбинации с одним или более дополнительными терапевтическими агентами), будет зависеть от типа заболевания, подлежащего лечению, типа агента, тяжести и течения заболевания, введения агента в профилактических или терапевтических целях, предыдущей терапии, истории болезни пациента и его ответа на агент, и усмотрения лечащего врача. Агент подходит для введения пациенту однократно или в ходе курса лечения. В зависимости от типа и тяжести заболевания, первоначальная предполагаемая доза антитела для введения пациенту, например, посредством одного или более раздельных введений или непрерывной инфузии, составляет от около 1 мкг/кг до 15 мг/кг. Типичная ежедневная доза может находиться в диапазоне от около 1 мкг/кг до 100 мг/кг или более в зависимости от вышеупомянутых факторов. При повторном введении в течение нескольких дней или дольше, в зависимости от состояния, лечение обычно следует продолжать до желаемого подавления симптомов заболевания. Одна типовая доза антитела будет находится в диапазоне от около 0,05 мг/кг до около 10 мг/кг. Так, пациенту можно вводить одну или более из доз, составляющих около 0,5 мг/кг, 2,0 мг/кг, 4,0 мг/кг или 10 мг/кг (или любую их комбинацию). Такие дозы можно вводить с перерывами, например, каждую неделю или каждые три недели (например, таким образом, что пациент получает от около двух до около двадцати, или, например, около шести доз антитела). В то же время можно применять другие схемы лечения. Ход лечения можно контролировать с помощью обычных методов и анализов.
В некоторых вариантах реализации изобретения агент, нацеленный на строму (например, антитело к POSTN), иммуномодулирующий агент и/или антиангиогенный агент (например, антагонист VEGF (например, антитело к VEGF, такое как бевацизумаб)) вводят в виде базовой дозы (т.е. не зависящей от веса), составляющей 37,5 мг или базовой дозы, составляющей 125 мг или плоской дозы, составляющей 250 мг. В некоторых вариантах реализации изобретения дозу вводят путем подкожной инъекции один раз каждые 4 недели или в течение определенного периода времени. В некоторых вариантах реализации изобретения период времени составляет 6 месяцев, один год, два года, пять лет, десять лет, 15 лет, 20 лет или время жизни пациента.
В другом варианте реализации изобретения у пациента установлено наличие рака, который является резистентным к химиотерапии, и выбран для лечения антителом к POSTN или любым из терапевтических агентов, как описано выше. В одном варианте реализации изобретения возраст пациента, больного раком, составляет 18 лет или старше. В одном варианте реализации изобретения возраст пациента, больного раком, составляет от 12 до 17 лет, и терапевтический агент вводится в виде базовой дозы, составляющей 250 мг, или базовой дозы, составляющей 125 мг. В одном варианте реализации изобретения возраст пациента, больного раком, составляет от 6 до 11 лет, и терапевтический агент вводится в виде базовой дозы, составляющей 125 мг.
VI. ИЗДЕЛИЯ
В другом аспекте изобретения предложено изделие, содержащее материалы, пригодные для лечения, предупреждения и/или диагностики нарушений, описанных выше. Изделие включает контейнер и этикетку или вкладыш в упаковку, вложенный или связанный с контейнером. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы, пакеты с растворами для внутривенного введения и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер содержит композицию, эффективно применяемую при лечении, предупреждении и/или диагностике патологического состояния отдельно или в комбинации с другой композицией, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет с раствором для внутривенного введения или флакон, содержащий пробку, прокалываемую иглой для подкожной инъекции). По меньшей мере один активный агент в композиции представляет собой агент по изобретению (например, агент, нацеленный на строму (например, антитело к POSTN), иммуномодулирующий агент и/или антиангиогенный агент (например, антагонист VEGF (например, антитело к VEGF, такое как бевацизумаб)). На этикетке или на вкладыше в упаковку указано, что композиция применяется для лечения выбранного патологического состояния. Кроме того, изделие может содержать (а) первый контейнер с композицией, содержащейся в нем, причем композиция содержит агент (например, агент, нацеленный на строму (например, антитело к POSTN), иммуномодулирующий агент и/или антиангиогенный агент (например, антагонист VEGF (например, антитело к VEGF, такое как бевацизумаб)); и (b) второй контейнер с композицией, содержащейся в нем, причем композиция содержит дополнительный цитотоксический или другой терапевтический агент. В данном варианте реализации изобретения изделие может дополнительно содержать вкладыш в упаковку, в котором указано, что композиции можно применять для лечения конкретного патологического состояния. В качестве альтернативы или дополнительно изделие может дополнительно содежать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буферный раствор, раствор Рингера и раствор декстрозы. Оно может дополнительно включать другие материалы, желательные с коммерческой и потребительской точки зрения, в том числе другие буферы, разбавители, фильтры, иглы и шприцы. Известно, что любое из вышеуказанных изделий может включать иммуноконъюгат по изобретению вместо или в дополнение к агенту (например, агенту, нацеленного на строму (например, антителу к POSTN), иммуномодулирующему агенту и/или антиангиогенному агенту (например, антагонисту VEGF (например, антителу к VEGF, такому как бевацизумаб)).
ПРИМЕРЫ
Был проведен систематический и углубленный анализ, чтобы обнаружить, функционально охарактеризовать и независимо подтвердить ключевые молекулярные характеристики, связанные с резистентностью к химиотерапии первичного лечения. Для поискового исследования была выбрана группа пациентов, имеющих клинически четко определенный ответ на первичную химиотерапию и соответствующие клинико-патологические характеристики. Для независимого валидационного исследования были применены образцы тканей пациентов, включенных в контрольную группу химиотерапии фазы III клинического исследования с репрезентативной группой пациентов, предназначенных для лечения (ПДЛ), и сбалансированные клинические характеристики, хорошо аннотированный клинический ответ и результаты лечения пациентого. Из поискового исследования была идентифицирована сигнатура реактивной стромы, которая специфически ассоциировалась с первичными опухолями, резистентными к платине (плат-р), и уровень экспрессии которой дополнительно повышался в рецидивирующих опухолях плат-р. Данная сигнатура была дополнительно валидирована в независимом наборе данных, и была продемонстрирована клиническая ценность в прогнозировании результатов лечения пациентов для первой линии химиотерапии препаратами платины. Данные результаты обеспечивают диагностическую стратегию для идентификации пациентов с резистентным к химиотерапии первичным раком яичника, и обеспечивают тестирование на основе биомаркеров для прогнозирования ответа на первичную химиотерапию.
Материалы и экспериментальные способы
Пациенты и образцы опухолей
Данное исследование состояло из двух групп когорт пациентов с раком яичника для целей поиска и валидации, соответственно.
Группа поиска состояла из 85 низко дифференцированный серозных или эндометриоидных опухолей яичника от 58 пациентов. Клинические характеристики данных пациентов описаны в таблице 6 и представляют собой типичные клинические профили пациентов с низкодифференцированным эпителиальным раком яичника. Все 58 пациентов изначально получали комбинацию платины и таксана. Из них 32 пациента имели первичные резистентные к платине опухоли (рецидив или прогрессирование заболевания в течение 6 месяцев после завершения первой линии платиновой химиотерапии), и 26 пациентов имели чувствительные к платине опухоли (рецидив или прогрессирование заболевания в течение 12 месяцев после первой линии химиотерапии). Образцы опухолей были собраны до первой линии химиотерапии от всех пациентов. 27 из 32 резистентных к платине пациентов также имели согласованные с пациентом образцы опухолей, собранные во время рецидива заболевания. Все образцы тканей из группы поиска были получены из коммерческих источников и имели соответствующее институционное разрешение.
Валидационная группа состояла из 138 низко дифференцированных серозных или эндометриоидных опухолей яичника от 138 пациентов из химиотерапевтической группы лечения фазы III исследования, для изучения воздействие стандартной химиотерапии против добавления бевацизумаба к стандартной химиотерапии у женщин с недавно диагностированным раком яичника. Клинические характеристики данных пациентов описаны в таблице 9.
Все опухолевые ткани изучались патоморфологом для подтверждения диагноза и содержимого опухоли. Макроскопическое препарирование проводили на образцах зафиксированной в формалине и залитой парафином (FFPE) опухолевой ткани, чтобы повысить процент опухоли до более 70%. Общую РНК очищали с применением High Pure FFPE RNA Micro Kits (Roche Diagnostics, Indianapolis, IN, USA). Опухолевая FFPE ДНК была подготовлена с применением QIAamp DNA FFPE Tissue Kits (Qiagen, CA).
Профиль генной экспрессии был получен с применением панели биомаркеров рака яичника Ovarian Cancer Biomarker Nanostring.
Набор NanoString 800 GX CodeSet был разработан для измерения генной экспрессии 800 биомаркеров и контролей, которые связаны с биологией заболевания яичника, включая классификаторы подтипов и прогнозов, эффлюксные транспортеры ABC, а также маркеры хемотолерантности, иммунитета и ангиогенеза (см. таблицу 5 для полного списка генов). 200 нг РНК анализировали с применением NanoString nCounter Analysis System в соответствии с протоколом производителя (NanoString Technologies). Исходные грубые показатели были нормализованы с помощью медианного подсчета всех 800 анализов для каждого образца.
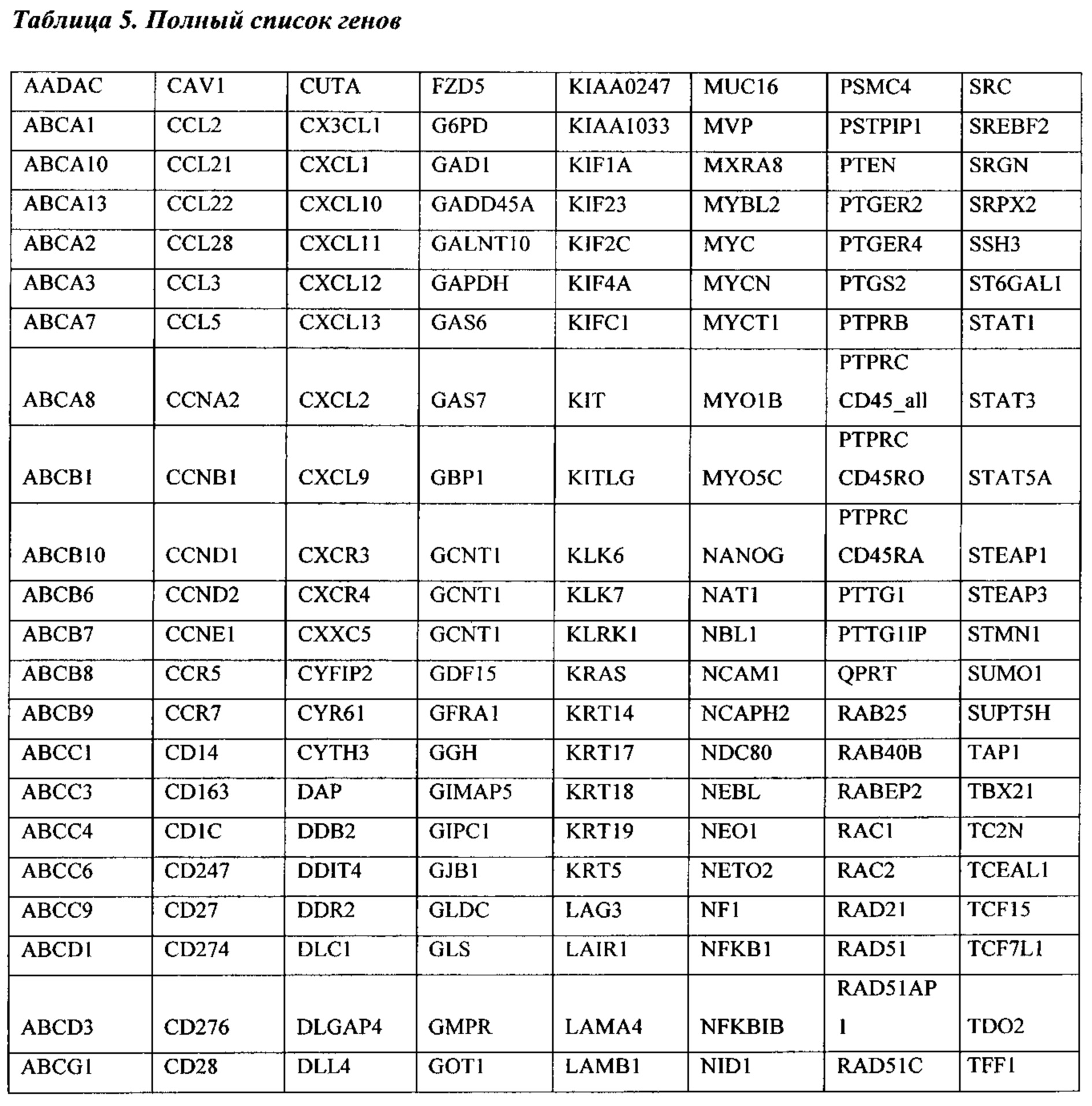



Статистический анализ
Выживаемость без прогрессирования рассчитывалась от даты рандомизации до даты первого признака прогрессирования заболевания или смерти, в зависимости от того, что наступило раньше; данные для пациентов, которые были живы без прогрессирования заболевания, были цензурированы от даты оценки последней не прогрессирующей опухоли. Общая выживаемость рассчитывалась от даты рандомизации до даты смерти по любой причине; данные о живых пациентах цензурировались в день, когда последний раз было известно, что пациент жив. Анализ выживаемости проводился с применением лонгрангового критерия для различия в распределении выживаемости без прогрессирования между группами с высоким и низким уровнем биомаркера. Медианное время выживаемости вычисляли с применением множительной оценки функции распределения по методу Каплана-Мейера.
Для сравнения различий в генной экспрессии между первичными опухолями плат-ч и плат-р применяли двухвыборочный t-критерий Стьюдента. Для сравнения различий в генной экспрессии между первичными и согласованными метастатическими опухолями плат-р применяли парный t-критерий Стьюдента. Получены двухсторонние р-значения и скорректированы для множественных сравнений с помощью контроля за уровнем ложноположительных результатов (УЛР) с применением метода Бенджамини-Хохберга.
Анализы in situ гибридизации (РНК ISH)
Дуплексные POSTN/LOX и одноплексные FAP RNAscope® анализы in situ гибридизации (ISH) были разработаны, реализованы и оценены в Advanced Cell Diagnostics, Hayward, CA. Одноцветный зонд для FAP (NM_004460.2, nt 237-1549) был предварительно разработан и коммерчески доступен. Двухцветные спаренные двойные-Z олигонуклеотидные зонды были сконструированы к РНК LOX (номер доступа GenBank NM_001178102.1, nt 223-1725) и РНК POSTN (NM_006475.2, nt 13-1199) с применением специального программного обеспечения, как описано в Wang et al., J Mol Diagn 14:22-29 (2012).РНК ISH выполняли с применением наборов реагентов RNAscope® 2-plex Chromogenic Reagent Kit и RNAscope® 2.0 HD Brown Reagent Kit на 4 мкм фиксированных в формалине, парафинированных (FFPE) тканевых срезах в соответствии с инструкциями производителя. Качество РНК оценивали для каждого образца с помощью двухцветного зонда, специфичного для гена "домашнего хозяйства" циклофилина В (PPIB) и субъединицы IIA РНК-полимеразы (PolR2A). Негативный контроль фоновой окраски оценивали с применением зонда, специфичного для бактериального гена dapB. Только образцы со среднем значение >4 точек на клетку с окрашиванием зонда для гена "домашнего хозяйства", и со средним значением <1 точки на 10 клеток с окрашиванием отрицательного контроля были проанализированы с целевыми зондами. Для проверки технической и оценочной точности контрольные предметные стекла, состоящие из клеточной FFPE HeLa, испытывали на PPIB и dapB вместе с предметными стеклами с тканью FFPE. Яркие изображения поля были получены с помощью микроскопа Zeiss Axio Imager M1 с применением объектива 40х. Сигнал RNAscope оценивался на основании количества точек на клетку следующим образом: 0=0 точек/клетку, 1=1-3 точки/клетку, 2=4-9 точек/клетку, 3=10-15 точек/клетку и 4=>15 точек/клетку > 10% точек в кластерах. Для оценки гетерогенности экспрессии маркера был выполнен анализ показателя гибридизации (H-score). Показатель гибридизации (H-score) рассчитывался путем суммирования процента клеток в каждой оценочной категории, умноженной на соответствующий балл, поэтому показатель находятся в масштабе 0-400.
Иммуногистохимия
Иммуногистохимию (ИГХ) выполняли на 4 мкм фиксированных в формалине, парафинированных (FFPE) тканевых срезах, помещенных на стеклянных предметные стекла. Применялись первичные антитела к FAP (GNE, клон 10D2.1.1), альфа-гладкомышечному актину (SMA) (AbCam, Cambridge, MA) и POSTN (BioVendor, Asheville, NC). Окрашивание FAP осуществляли на приборе для автоматической окраски DAKO, применяя демаскирование антигена Trilogy (Cell Marque, Rocklin, СА). Для обнаружения применяли анти-мышиное биотинилированное вторичное антитело лошади (VectorLabs, Burlingame, СА), затем стрептавидин-HRP с усилением TSA (PerkinElmer, Waltham, MA) и визуализацию DAB (Pierce, Rockford, IL). Окрашивание SMA и POST проводили на автоматизированной платформе Ventana Discovery XT (Ventana Medical Systems; Tucson, AZ). Срезы обрабатывали с помощью Cell Conditioner 1, стандартное время. Специфически связанное первичное антитело было обнаружено с помощью инкубации срезов в OmniMap anti-Rabbit-HRP (Ventana Medical Systems, Tucson, AZ), а затем с помощью ChromoMap DAB (Ventana Medical Systems; Tucson, AZ). Срезы контрастно окрашивали гематоксилином, обезвоживали и накрывали покровным стеклом.
Оценка десмоплазии с помощью окраски гематоксилином и эозином (Н&Е)
Репрезентативные окрашенные с помощью Н&Е срезы образцов опухолей из поискового исследования (всего 85, включая первичные плат-ч, сопоставимые с пациентом первичные плат-р и рецидивирующие опухоли) были исследованы на предмет подтверждения активации стромы, связанной с опухолевым поражением, и был определен показатель десмоплазии. Некоторые случаи считались слишком трудными для оценки доступных репрезентативных срезов из-за повреждения тканей, некроза, отека или ограниченного наличия стромы. Десмоплазия была идентифицирована в виде фиброзных областей, характеризующихся повышенной плотностью и дезорганизацией миофибробластов, отличных от резидентных неактивированных фибробластов. Применяемая система оценки десмоплазии аналогична системе, описанной Tothill et al., Clin Cancer Res. 14:5198-5298, 2008. Показатели десмоплазии были определены следующим образом: 0 = отсутствие десмоплазии, 1 = несколько рассеянных десмопластических очагов, прилегающих к раковым клеткам, 2 = несколько десмопластических очагов, примыкающих к раковым клеткам или умеренная конфлюэнтная (широкая) десмоплазия, но не по всему срезу; 3 = десмопластическая реакция по всему срезу.
Состояние мутации TP53
Глубокое секвенирование было выполнено на всех экзонах и экзон-интронных соединениях всего гена ТР53 с применением ранее разработанной нацеленной на рак панели MMP-Seq. Качество образцов ДНК FFPE определялось количественно как количество функциональных копий с применением TRAK2 qPCR "рулер анализа". 5000 функциональных копий ДНК из каждого образца были применены в качестве входных данных для целевого обогащения и построения библиотек с применением Fluidigm Access Arrays, после чего проводили глубокое секвенирование на секвенаторе Illumina MiSeq. Среднее перекрытие гена ТР53 составляло ~1000х на ампликон. Выравнивание последовательностей, первичное определение вариантов и фильтрация выполнялась, как описано в Bourgon et al., Clin Cancer Res 20:2080-2091 (2014).
Анализ вариаций числа копий с помощью ПЛР в реальном времени
Фиксированную в формалине и залитую парафином (FFPE) геномную ДНК (200 нг) подвергали 17 циклам предварительной амплификации с применением пула из 35 пар специфических генных праймеров с концентрацией 50 нм каждая и с мастер-микса Taqman Preamamification Master Mix (Life Technologies) в соответствии с протоколом производителя. Преамплифицированные образцы разбавляли и проводили кПЛР с применением Fluidigm 96.96 Dynamic Arrays на системе BioMark™. Вкратце, смесь образцов содержала ДНК, мастер-микс Taqman Gene Expression Master Mix (Life Technologies), ДНК-связывающий реагент для загрузки образца (Fluidigm) и краситель EvaGreen (Biotium). Аналитическая смесь содержала специфические генные пары праймеров и реагент для загрузки образца (Fluidigm). Определение Ct и анализ кривых плавления проводили с применением программного обеспечения для анализа генов Fluidigm. Относительные количества копий гена вычисляли с применением глобального метода Delta Delta Ct. Во-первых, медианную величину Ct всех генов в каждом образце применяли в качестве эталона для нормализации ввода образца ДНК и расчета дельта Ct. Медианную дельта Ct всех образцов для отдельных генов затем применяли в качестве 2 копий образца калибратора. Результаты являются средними для трех пар праймеров для каждого гена.
Клеточные анализы
Клеточную линию яичника ES-2 получали из АТСС и культивировали в среде RPMI1640 с 10% ФБС и 2 мМ глутамином. Сначала 96-луночные планшеты покрывали рекомбинантным полноразмерным FN1 (Cat# F2006, Sigma-Aldrich, St.Louis, MO), POSTN (Cat# 3548-F2, R&D Systems, Minneapolis, MN) или оставляли без покрытия при 37°С в течение 2 часов или 4°С в течение 16 часов. Клетки затем высевали в покрытые планшеты при 3000 клеток/лунку. В каждую лунку на следующий день добавляли 10 мкМ карбоплатина или 10 нМ паклитаксела. Реагенты Cell-Titre Glo® добавляли через 72 часа после обработки соединением для определения жизнеспособности клеток. Затем жизнеспособность в покрытых лунках сравнивали с жизнеспособностью в непокрытых лунках для расчета % роста.
Пример 1. Идентификация сигнатуры гена "реактивной стромы", имеющего повышенный уровень экспрессии в первичных опухолях яичника, резистентных к химиотерапии.
Для идентификации молекулярных характеристик, связанных с первичной резистентностью к химиотерапии при ЭРЯ, был выбран набор низкодифференцированных серозных или эндометриоидных опухолей яичника с клинически выраженным ответом на первичную химиотерапию (таблица 6). Данная поисковая группа состояла из образцов опухолей от 32 пациентов с первичной резистентностью к химиотерапии и 26 пациентов, которые были чувствительны к первичной химиотерапии. Все пациенты получали лечение комбинацией платины и таксана в качестве химиотерапии первой линии. Первичные резистентные к химиотерапии пациенты были отобраны на основании рецидива или прогрессирования заболевания в течение 6 месяцев после завершения химиотерапии первой линии на основе платины, в то время как пациенты, чувствительные к химиотерапии, были отобраны на основании отсутствия рецидива или прогрессирования в течение 12 месяцев после первичной химиотерапии. У 27 из 32 пациентов, резистентных к химиотерапии, были в наличии согласованные с пациентом образцы первичной опухоли, собранные до химиотерапии, и образцы рецидивирующей опухоли, собранные после терапии при прогрессировании заболевания (которые обозначаются как первичные плат-р и рецидивирующие плат-р, соответственно). Для 26 пациентов, чувствительных к химиотерапии, для анализа были доступны только образцы первичной опухоли до начала терапии (которые обозначаются как первичные плат-ч).


Определяли генную экспрессию сигнатуры, которая коррелирует с ответами на химиотерапию на основе платины. Определение профиля генной экспрессии осуществляли на образцах первичных плат-р, рецидивирующих плат-р и плат-ч с применением 800-генной панели биомаркеров рака яичника (таблица 5), разработанной на платформе Nanostring. С помощью двухвыборочного t-критерия Стьюдента для сравнения 32 первичных опухолей плат-р и 26 плат-ч перед химиотерапией были идентифицированы 14 генов, которые в значительной степени дифференциально экспрессируются между двумя группами (УЛР ≤10% и кратность изменения ≥1,5, таблица 7). Гены, имеющие повышенный уровень экспрессии в опухолях плат-р, представляли собой отчетливую сигнатуру "реактивной стромы" (ФИГ. 1А), в значительной степени обогащенную генами продуцирования и ремоделирования ВКМ (т.е. POSTN, FAP, LOX, TIMP3, COL4A1), генами, участвующими в миграции и инвазии клеток (т.е. NUAK1), а также генами, участвующими в иммуномодуляция (t.e. TDO2). С другой стороны, ключевые гены, связанные с чувствительными к химиотерапии опухолями, включают рецептор прогестерона (PGR), плацентарную щелочную фосфатазу (ALPP) и гены рецептора 4 фактора роста фибробластов (FGFR4). Для 27 пациентов плат-р, у которых были в наличии согласованные с пациентом образцы первичной опухоли, собранные до химиотерапии, и образцы рецидивирующей опухоли, собранные после терапии при прогрессировании заболевания, был проведен дальнейший анализ для поиска сигнатур генов, характеризующих рецидивирующие опухоли. С помощью парного t-критерия Стьюдента были идентифицированы 65 генов, которые в значительной степени дифференциально экспрессировались между первичными и рецидивирующими резистентными опухолями (УЛР ≤10% и кратность изменения ≥1,5, таблица 8). Опять же, отличительные гены, представляющие компоненты стромы опухоли, были в значительной степени представлены среди 36 генов, имеющих повышенный уровень экспрессии в рецидивирующих опухолях (ФИГ. 1В), включая активированный маркер фибробластов (АСТА2), ферменты продуцирования и ремоделирования ВКМ (т.е. POSTN, FAP, FN1, TIMP3, LOX, MMP11), факторы роста (т.е., FGF1), связанные с иммунитетом гены (т.е., CD36, GZMK, CD247), а также маркеры сосудистого эндотелия (т.е., PLVAP и РЕСАМ (antigen CD31)), и факторы роста (т.е., ANGPL2). По сравнению с первичными опухолями до терапии, 29 генов, в значительной степени имеющие пониженный уровень экспрессии в редуцидивирующих опухолях плат-р, представляли собой рецепторы эстрогенов (ESR1 и ESR2) и другие дифференцированные маркеры эпителиальных клеток (MUC1, KLK6, KLK7) (ФИГ. 1В). С помощью сравнения двух сигнатур, характеризующих первичные и рецидивирующие опухоли плат-р, было идентифицировало 4 общих гена сигнатуры реактивной стромы, POSTN, FAP, TIMP3 и LOX, имеющие уровни экспрессии, которые (1) в значительной степени коррелировали друг с другом (ФИГ. 2); (2) значительно повышались в первичных опухолях плат-р по сравнению с первичными опухолями плат-ч и (3) дополнительно индуцировались после химиотерапии в рецидивирующих опухолях плат-р (ФИГ. 1С и 1D). Вместе эти результаты показали, что повышение уровня экспрессии генов реактивной стромы может играть важную роль в модуляции резистентности к химиотерапии при ЭРЯ.
Мутации в гене супрессоре опухоли ТР53, и амплификация циклина E1 (CCNE1) ранее были связаны с первичной резистентностью к химиотерапии при раке яичника. Глубокое секвенирование было выполнено на всех экзонах всего гена ТР53 с применением нацеленной на рак панели MMP-Seq. Мутации ТР53 были обнаружены в 32 из 32 (100%) первичных опухолей плат-р и 23 из 26 (88%) первичных опухолей плат-ч (ФИГ. 1А). Наблюдаемая общая высокая частота мутации ТР53 согласуется с обнаружением TCGA в низкодифференцированных серозных опухолях яичника. Данные результаты также указывают на то, что мутационный статус ТР53 вряд ли может быть основным фактором в определении ответов на лечение химиотерапией. Анализ числа копий на основе кПЦР также был выполнен на 35 генах, о которых сообщалось, что они часто изменяются при многих видах рака. В этом исследовании были идентифицированы девять регулярно амплифицированных генов (рис. 1А, число копии ≥4). Среди них амплификация RSF1, АКТ1 и АКТ3 была идентифицирована только в опухолях плат-ч, тогда как амплификация FGFR1 и ZNF703 была идентифицирована только в опухолях плат-р. Однако достоверной корреляции между ответом на химиотерапию и амплификацией какой-либо одного (включая CCNE1) или комбинации данных генов не наблюдалось.

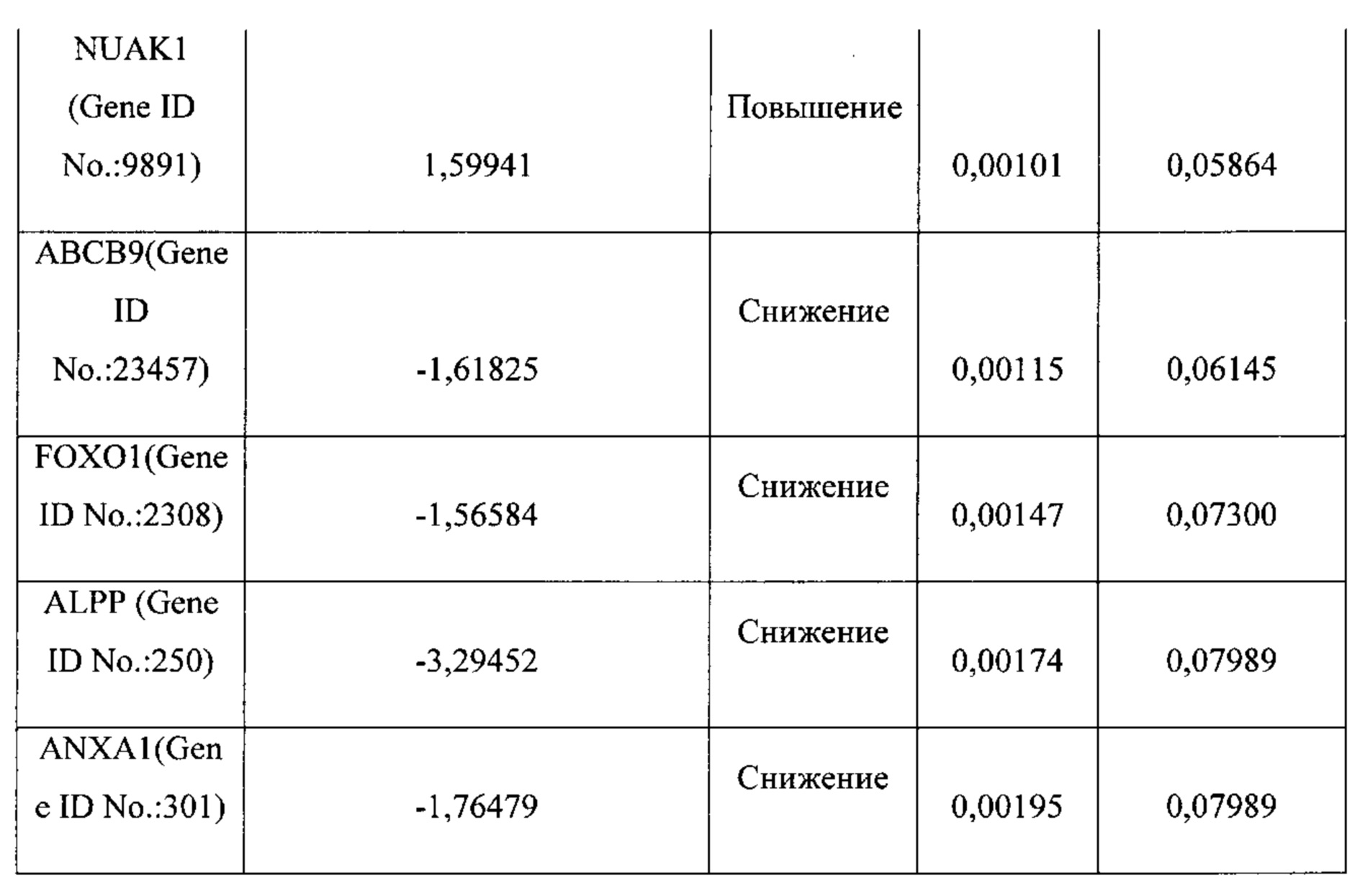
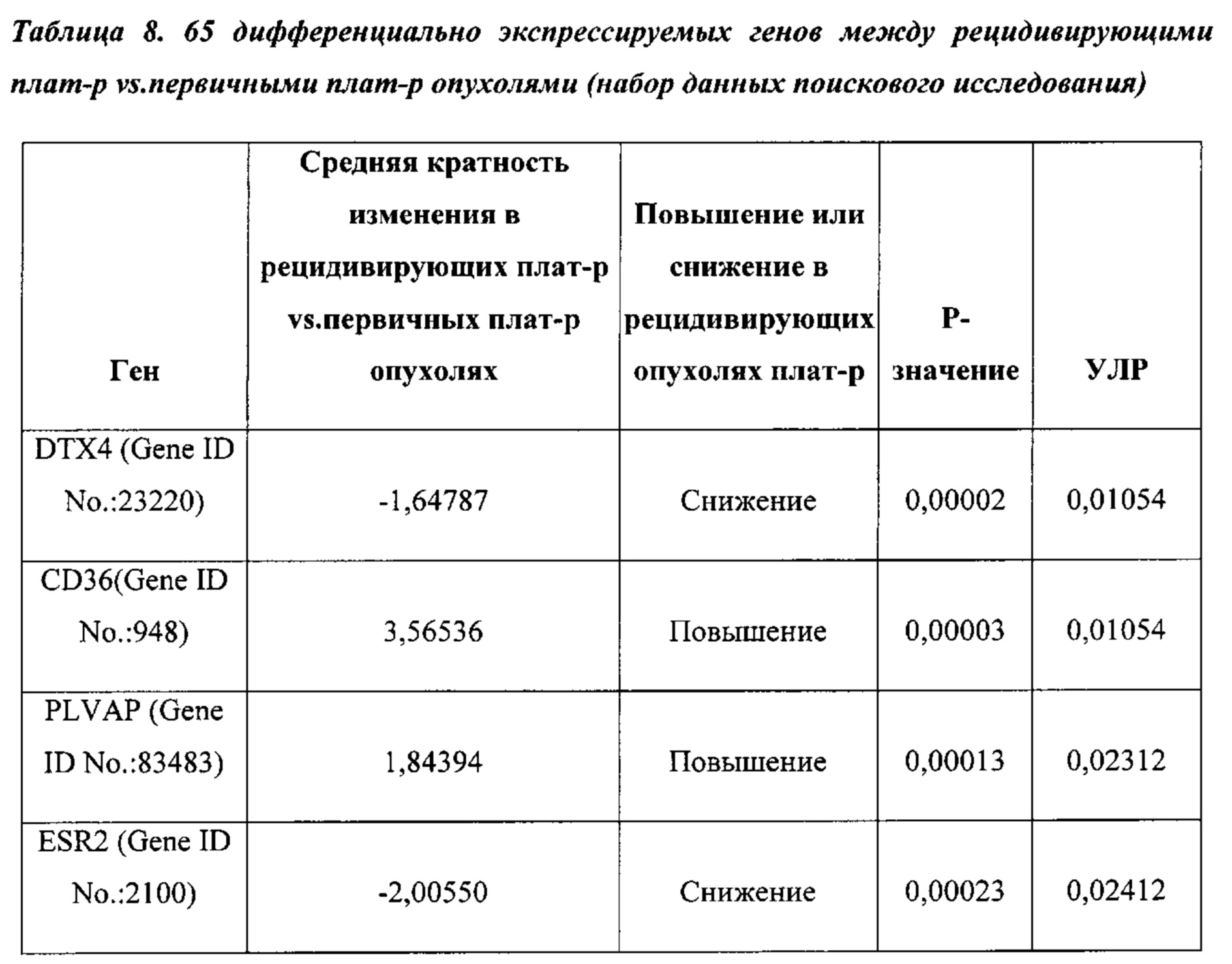
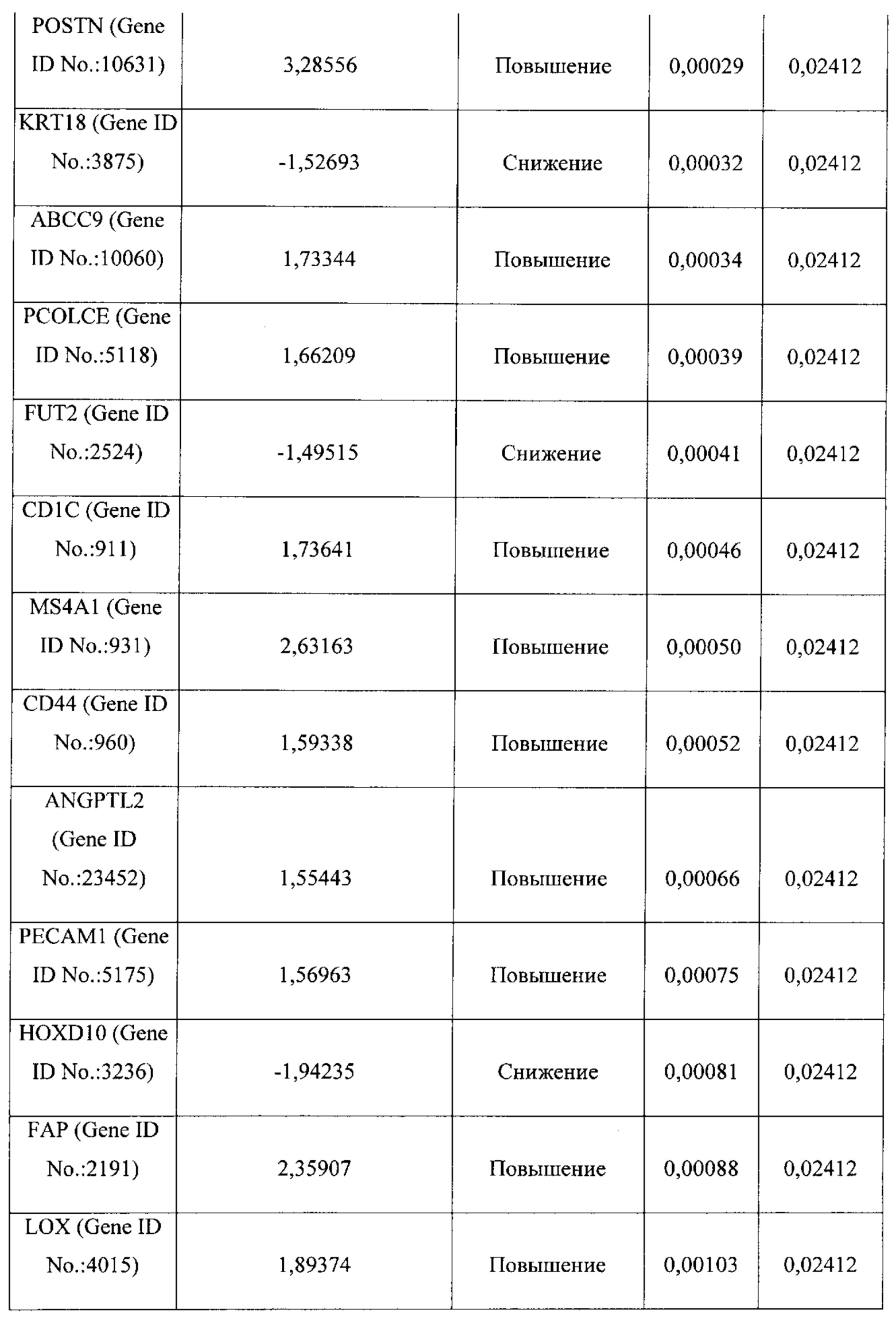
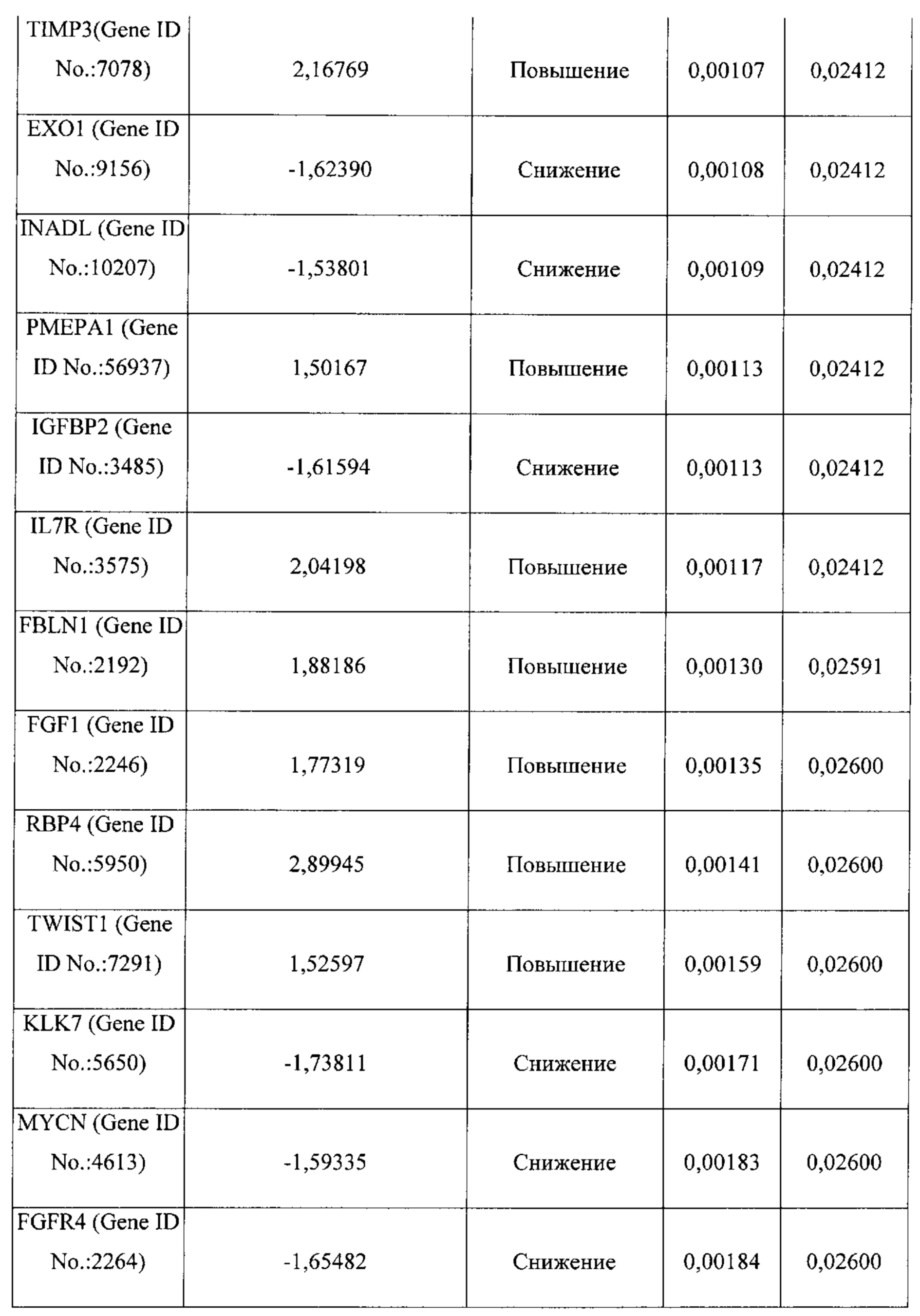



Пример 2. Гены сигнатуры реактивной стромы специфически получают и модулируют в связанных с опухолью фибробластах
Чтобы определить, какие специфические типы клеток экспрессируют гены сигнатуры реактивной стромы, проводили анализ РНК ISH POSTN и FAP на целых предметных стеклах с образцами опухолей из всего набора из 85 опухолей. Кроме того, ИГХ анализ POSTN и FAP, а также RNA ISH анализ LOX также проводили на 15 образцах репрезентативных опухолей. Репрезентативные изображения, на которых продемонстрированы ISH и ИГХ данных маркеров, показаны на рисунке 3А. В первичных опухолях плат-ч не обнаружено ни одного или обнаружены значительно более низкие уровни генов сигнатуры реактивной стромы в стромальных или опухолевых клетках с помощью ISH или ИГХ. Напротив, в первичных и рецидивирующих опухолях плат-р было обнаружено, что POSTN экспрессируется исключительно в связанных с опухолью фибробластах, тогда как LOX и FAP преимущественно экспрессируются в связанных с опухолью фибробластах и на более низких уровнях в опухолевых клетках. Связанные с опухолью фибробласты, экспрессирующие POSTN/LOX/FAP, также продемонстрировали значительное окрашивание альфа-актина гладких мышц (αSMA), которое является установленным маркером для активированных миофибробластов. В соответствии с результатами определения профилей генной экспрессии Nanostring (ФИГ. 1D), анализ ISH и ИГХ подтвердил, что уровень экспрессии генов реактивной стромы была значительно выше в первичных опухолях плат-р по сравнению с первичными опухолями плат-ч и была дополнительно повышена в рецидивирующих опухолях плат-р (ФИГ. 3В). Наблюдаемая модуляция генной экспрессии реактивной стромы в основном ограничивалась стромальным компартментом, непосредственно находящимся рядом с опухолевыми клетками в первичных и рецидивирующих опухолях плат-р (ФИГ. 3В), демонстрируя, что связанные с опухолью стромальные компартменты могут быть специфическим местом приложения действия в возникновении устойчивости к химиотерапии при раке яичника. Таким образом, применяя in situ анализ, включающий как ИГХ, так и РНК ISH, гены сигнатуры реактивной стромы были идентифицированы как исключительно или преимущественно экспрессируемые активированными клетками фибробластов, непосредственно находящимися рядом с опухолевыми клетками.
Пример 3. Стромальная экспрессия POSTN связана с фенотипом десмоплазии
Десмоплазия представляет собой общий патологический фенотип, который встречается во многих типах рака. Гистологические проявления десмоплазии включают сверхсинтез белков внеклеточного матрикса и экстенсивную пролиферацию, и дезорганизацию миобластоподобных клеток. Изменения в пролиферации стромальных клеток и отложение компонентов внеклеточного матрикса приводят к значительным изменениям в общей гетерогенности и эластичности тканей, а также сопутствующего давления межклеточной жидкости. Предполагается, что данные изменения содействуют резистентности к химиотерапии при раке. Чтобы оценить потенциальные связи между молекулярной характеристикой реактивной стромы и физиологическими особенностями десмоплазии, степень десмоплазии оценивали на окрашенных с помощью гематоксилина и эозина цельных тканевых срезах всех образцов опухоли, применяемых в данном исследовании. Из 85 образцов, которые были оценены, 26 из них были признаны слишком трудными для оценки из-за повреждения тканей, некроза, отека или ограниченного наличия стромы. Остальные образцы включали 21 первичных плат-ч, 18 первичных плат-р и 21 рецидивирующих плат-р опухолей. Как показано на ФИГ. 4А и 4В, в то время как в большинстве первичных опухолей плат-ч не было обнаружено или было обнаружено только несколько рассеянных десмопластических очагов, умеренно и экстенсивная десмоплазия в значительной степени наличествовала в первичных и рецидивирующих опухолями плат-р. Кроме того, степень десмоплазии в значительной степени коррелировала со стромальными уровнями экспрессии POSTN, одного из ключевых компонентов сигнатуры реактивной стромы, характеризующей первичную химиотерапию. Чтобы дополнительно установить прямую роль данных генов сигнатуры реактивной стромы в опосредовании резистентности к химиотерапии, было продемонстрировано, что чувствительные к химиотерапии клетки яичника, выращенные в присутствии рекомбинантного POSTN, становятся устойчивыми к лечению карбоплатином и паклитакселом in vitro.
Пример 4. POSTN способствует резистентности к химиотерапии клеток ЭРЯ in vitro
Далее было исследовано, играют ли специфическую роль гены сигнатуры реактивной стромы в развитии резистентности к химиотерапии в опухолевых клетках яичника. Для этого рекомбинантный белок POSTN человека применяли для покрытия чашек для культивирования тканей, чтобы непосредственно изучить его действие на устойчивость к химиореагентам в клетках ES-2, чувствительной к химиотерапии клеточной линии яичника без эндогенной экспрессии POSTN (ФИГ. 4С). Поскольку было показано, что фибронектин (FN) (гликопротеин и ключевой компонент ВКМ) модулирует резистентность к доцетакселу в раковых клетках яичника, в качестве контроля в данном эксперименте применяли покрытие белком FN. Как показано на ФИГ. 4С, клетки ES-2, выращенные на планшетах, покрытых POSTN, оказались значительно более резистентными к обработке карбоплатином или паклитакселом, чем клетки, выращенные на необработанных культуральных чашках. Хотя само по себе покрытие POSTN также продемонстрировало незначительное увеличение роста клеток в отсутствие химиотерапевтической обработки, его влияние на обеспечение выживаемости при химиотерапии было преобладающим и значительным. Напротив, покрытие FN оказывало гораздо меньшее влияние на стимуляцию резистентности к воздействию карбоплатина или паклитаксела в клетках ES-2 по сравнению с POSTN. Данное исследование показало, что POSTN может стимулировать устойчивость к химиотерапии в клетках ЭРЯ in vitro. Вместе данные результаты предоставили дополнительные доказательства того, что POSTN и другие компоненты реактивной стромы могут играть прямую роль в стимуляции резистентности к химиотерапии in vivo.
Пример 5. Независимая валидация сигнатуры реактивной стромы в комбинацииии с первичной резистентностью к химиотерапии
Для дальнейшей валидации прямой связи между сигнатурой реактивной стромы и первичной резистентностью к химиотерапии в независимом наборе данных подгруппа образцов ткани опухоли яичника из группы лечения химиотерапии в фазе III исследования применялась для оценки преимущества добавления бевацизумаба к стандартной химиотерапии в качестве первой линии лечения рака яичника (ICON7). Среди 510 пациентов, включенных в химио-контрольную группу, 138 пациентов с низкодифференцированными серозными или эндометриоидными опухолями имели ткань, доступную для профилирования генной экспрессии на панели биомаркеров рака яичника Nanostring (таблица 9). Никаких достоверных смещений с точки зрения распределения пациентов плат-р и плат-ч или клинико-патологических характеристик не было обнаружено в субпопуляции биомаркера, что свидетельствует о том, что данная популяция представляет собой группу пациентов, подлежащих лечению (ITT) (таблица 10). Пациенты из химио-контрольной группы исследования фазы III были разделены на группы плат-ч и плат-р с применением того же клинического определения, которое применялось в поисковом исследовании (пример 1 выше). С помощью двухвыборочного t-критерия Стьюдента для анализа 49 первичных опухолей плат-р и 86 плат-ч перед химиотерапией были идентифицированы 10 генов, которые в значительной степени дифференциально экспрессируются между двумя группами (р < 0,01 и кратность изменения ≥1,5, таблица 11). Сравнение дифференциально экспрессируемых генов из данного набора данных и набора данных поискового исследования показало, что все четыре гена сигнатуры реактивной стромы (POSTN, FAP, TIMP3 и LOX) составляют четыре основных гена, имеющих повышенный уровень экспрессии в первичных первичных резистентных к химиотерапии опухолях (ФИГ. 5А). Данные результаты независимо подтвердили, что сигнатура реактивной стромы представляет собой надежную и воспроизводимую сигнатуру резистентности к химиотерапии в ЭРЯ. Уровень экспрессии PGR последовательно снижался по меньшей мере в 2 раза в резистентной к химиотерапии группе, как в наборе данных поискового исследования, так и в валидационном наборе данных (р <0,001 и кратность изменения = 3,3 наборе данных поискового исследования и р = 0,0058 и кратность изменения = 2 в валидационном наборе данных) из чего можно заключить, что передача сигнала при участии прогестерона может играть важную роль в опосредовании чувствительности к химиотерапии при раке яичника.
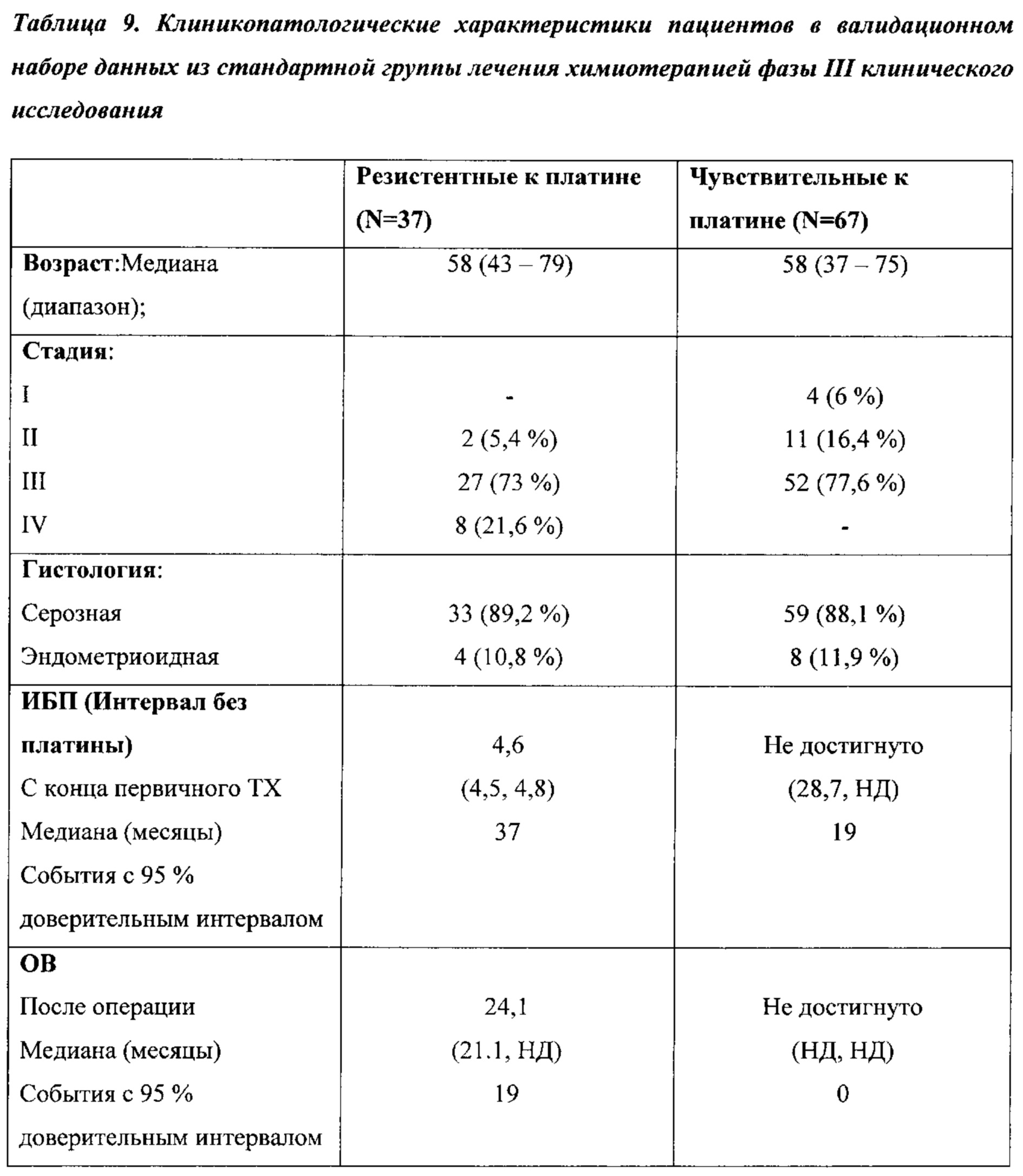



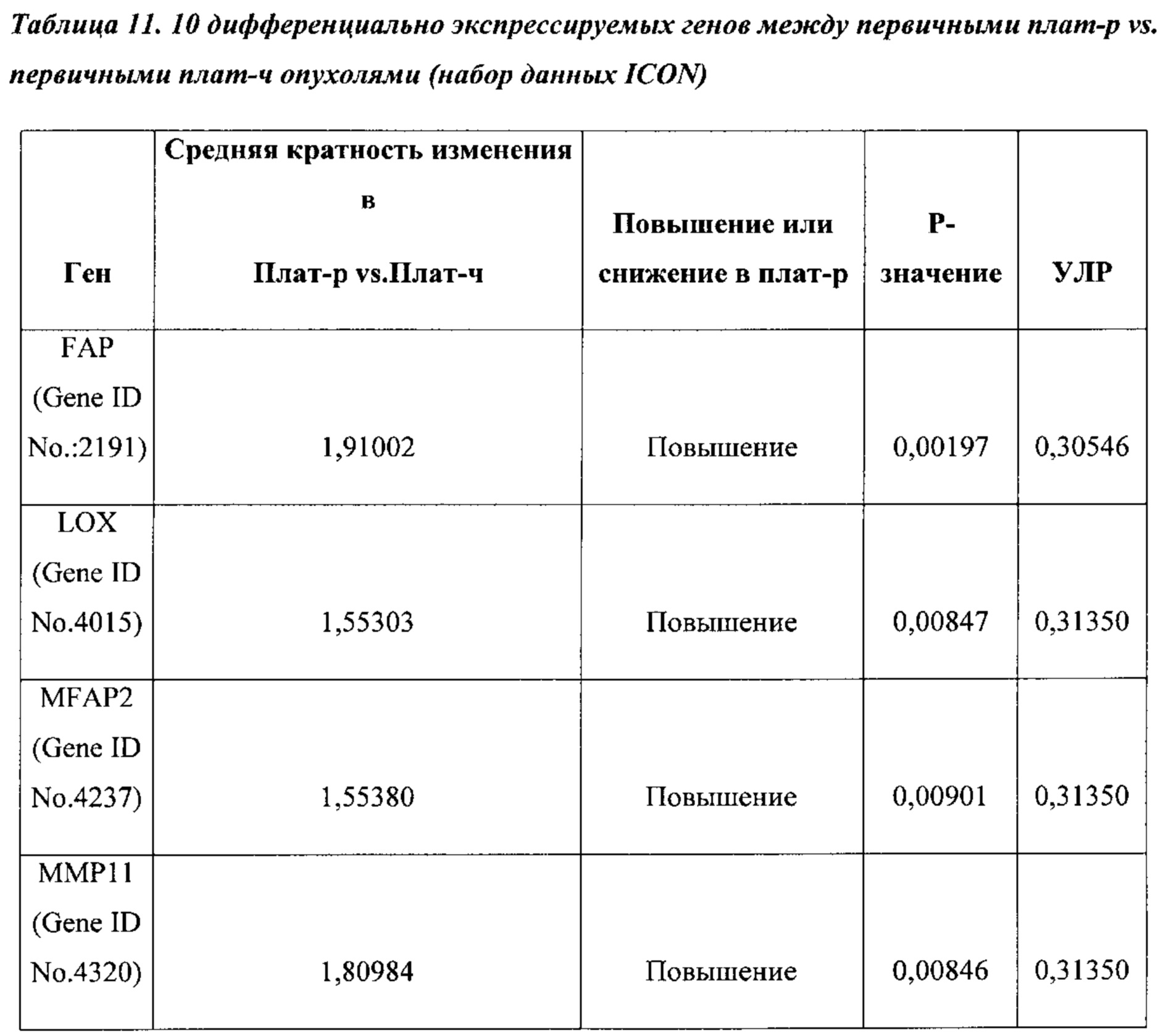

Пример 6. POSTN предсказывает клинический исход химиотерапии первой лини на основе платины при ЭРЯ
Чтобы изучить, можно ли с помощью генов сигнатуры реактивной стромы предсказать клинический исход химиотерапии первой линии при ЭРЯ был проведен однофакторный анализ выживаемости у пациентов химио-контрольной группы исследования фазы III с применением каждого из четырех заранее определенных генов сигнатуры реактивной стромы: POSTN, FAP, TIMP3 и LOX, а также PGR. Как показано на рисунке 5В, пациенты с высоким уровнем экспрессии POSTN (медианное граничное значение) имеют значительно более короткую выживаемость без прогрессирования (ВБП) со средним значением ВБП 12 месяцев по сравнению с 27 месяцами у пациентов с низким уровнем экспрессии POSTN (OP = 2,4, 95% ДИ: 1,6-3,7, р = 0,0001). Хотя наблюдалась слабая корреляция между уровнями экспрессии POSTN и несколькими известными клиническими прогностическими факторами, включая состояние циторедукции, уровень СА125 в сыворотке и стадии FIGO (ФИГ. 6), связь между уровнями POSTN и ВБП оставалась достоверной (ОР = 1,76, р = 0,015) после корректировки данных ковариат. Было обнаружено, что экспрессия TIMP3 также значительно связана с ВБП (ОР = 1,8, 95% ДИ: 1,2-2,8, р = 0,0073) в одномерной модели регрессии Кокса (ФИГ. 5В). С другой стороны, связь между экспрессией FAP или LOX, и PFS с применением медианного граничного значения не была статистически достоверной, но высоко достоверной при применении 75 процентильного граничного значения (ОР = 2,2, 95% ДИ: 1,4-3,4, р < 0.001 для FAP; ОР = 1.9, 9 5% ДИ: 1,2-3,0, р = 0.005 для LOX). Затем экспрессия всех четырех генов (POSTN, FAP, LOX и TIMP3), дихотомизированных с применением медианного граничного значения, была проанализирована с применением многофакторной регрессионной модели Кокса для оценки степени связности для каждого гена. Только экспрессия POSTN была достоверной в данном многофакторном анализе, указывая на то, что POSTN является основным драйвером и обеспечивает основную возможность для прогнозирования результатов лечения пациентов с помощью химиотерапии первой линии (ФИГ. 7). Кроме того, когда экспрессия четырех генов усреднялась для каждого пациента, итоговая общая оценка стромы не улучшала связь с ВБП (ОР = 2,0, 95% ДИ: 1,3-3,1, р = 0,0013), подтверждая роль POSTN как определяющего стромального фактора в прогнозировании выживаемости рака яичника при химиотерапии первой линии. Ни один из генов сигнатуры не показал достоверной связи с общей выживаемостью (ОВ). Для оценки того, обеспечивает ли PGR дополнительную прогнозирующую возможность для выживаемости пациентов, был выполнен многофакторный анализ модели Кокса с дихотомизированными POSTN и PGR в качестве ковариат (ФИГ. 7). После корректировки уровня экспрессии POSTN у пациентов с более высокой экспрессией PGR было обнаружено снижение риска прогрессирования рака яичника на 35%, однако этот эффект является только маргинальным, со значением р = 0,055 (ОР = 0,65, 95% ДИ: 0,42-1,01).
Пример 7. Терапевтические стратегии для преодоления резистентности к химиотерапии при раке
Идентифицированная в данном исследовании специфическая связь между реактивной стромой, резистентностью к химиотерапии и плохим клиническим результатом продемонстрировала важную взаимосвязь между раком и микроокружением опухоли в биологии и лечении рака яичника. Таким образом, нацеливание компонентов опухолевой стромы в комбинации с агентами, непосредственно нацеленными на опухолевые клетки, может обеспечить потенциальный новый подход для преодоления резистентности и повышения эффективности. Например, POSTN может быть одной из потенциальных терапевтических целей. Повышение уровня экспрессии POSTN наблюдалось во многих видах рака, таких как рак молочной железы, легких, толстой кишки, поджелудочной железы и яичника. POSTN взаимодействует с несколькими рецепторами клеточной поверхности, прежде всего с интегринами, и передает сигналы, главным образом, посредством PI3K/Akt и FAK-опосредованных путей передачи сигналов для стимулирования выживаемости раковых клеток, ангиогенеза, эпителиально-мезенхимального перехода (ЭМП), инвазии и метастазирования. Недавнее исследование показало, что стромальный POSTN имеет важнейшее значение для метастатической колонизации путем регулирования взаимодействий между стволовыми клетками рака молочной железы. Более того, нацеливание нейтрализующего антитела на эндогенный POSTN в клеточной линии рака яичника ингибировало рост опухоли яичника и метастазы в моделях на животных. В целом, важные роли POSTN в развитии рака, прогрессировании и ответе на лечение делают его перспективной новой терапевтической целью для преодоления резистентности к химиотерапии. В дополнение к отдельным стромальным компонентам, наше исследование показало, что сигнатура реактивной стромы, характеризующая резистентность к химиотерапии, в значительной степени обогащена генами, участвующими в нормальном процессе заживления ран. В соответствии с предыдущими экспериментальными данными наши данные свидетельствуют о том, что TGF-β, ключевой медиатор стромального ответа при заживлении ран, вероятно, будет играть важную роль в регулировании экстенсивного взаимодействия между опухолевыми клетками и связанной с ними стромой (ФИГ. 8). Следовательно, нацеливание на сигнальный путь TGF-β может быть еще одной потенциальной перспективной терапевтической стратегией для преодоления резистентности к химиотерапии.
Анализ генов, уровни экспрессии которых значительно коррелируют с генами сигнатуры реактивной стромы, выявил другие биологические процессы, которые могут быть вовлечены в стимулирование резистентности к химиотерапии. Например, мы обнаружили, что уровень экспрессии POSTN значительно коррелирует с PLVAP, РЕСАМ1 и ANGPTL2, ключевыми компонентами в развитии ангиогенеза и развития сосудов (ФИГ. 9). Таким образом, добавление реагентов антиангиогенеза, таких как бевацизумаб, в основную цепь химиотерапии может обеспечить дополнительные преимущества для пациентов с раком яичника, которые по своей природе устойчивы к первичной химиотерапии. Кроме того, другая терапевтическая стратегия для преодоления первичной резистентности к химиотерапии возникла из наблюдения, что уровень экспрессии POSTN в значительной степени коррелировали с CD68 и CD163, оба являются хорошо охарактеризованными поверхностными маркерами макрофагов М2, которые, как известно, участвуют в воспалительных и иммунных ответах во время процесса заживления ран (ФИГ. 9). Это наблюдение согласуется с недавним сообщением о том, что сигнатура экспрессии стромального ответа коррелирует с инфильтрацией макрофагов М2 и прогнозирует неблагоприятный прогноз при раке желудка и яичника. Таким образом, можно предположить, что противовоспалительные лекарственные средства, нацеленные на макрофаги М2 непосредственно или связанные с ними хемокины, цитокины или факторы роста, могут представлять собой новую терапевтическую стратегию для преодоления первичной резистентности к химиотерапии в ЭРЯ.
Пример 8. Циркулирующий POSTN в качестве маркера для прогнозирования резистентного к платине ЭРЯ
Чтобы исследовать, может ли циркулирующий POSTN применяться для прогнозирования химиорезистентности у пациентов с ЭРЯ, применяли анализ ИФА для измерения, циркулирующего POSTN в сыворотке. Уровни POSTN в сыворотке измеряли с помощью полученных от поставщика панелей образцов сыворотки от 102 нормальных здоровых субъектов (НЗС) соответствующей возрастной группы, 100 пациентов с эпителиальным раком яичника (ЭРЯ) с неизвестной чувствительностью к химиотерапии, 43 пациентов с ЭРЯ, которые, как известно, являются резистентными к платине (рак яичника плат-р), 96 пациентов с раком легких (НМКРЛ) и 29 пациентов с раком поджелудочной железы. Статус чувствительности к химиотерапии и время сбора сыворотки (до или после лечения) являются неизвестными для 100 образцов, заготовленных поставщиками, однако на основании исследований распространенности, вероятно, что по меньшей мере 30% проб были получены от пациентов с резистентностью к химиотерапии. ИФА POSTN в сыворотке был чувствителен до 1,88 нг/мл, и POSTN был обнаружен в сыворотке всех пациентов с раком яичника и NHS (нормальные субъекты люди). Сгруппированная точечная диаграмма на ФИГ. 10 показывает, что диапазон экспрессии POSTN у пациентов с ЭРЯ в значительной степени перекрывается с NHS и другими раковыми пациентами. Однако медиана и диапазон циркулирующего POSTN были значительно выше как у пациентов с резистентным к химиотерапии раком яичника, так и у пациентов с НМКРЛ, по сравнению с NHS. Данные результаты согласуются с тем, что экспрессия POSTN в ткани выше у пациентов с резистентным к химиотерапии раком яичника.
Уровни циркулирующего POSTN также измерялись в полученных от поставщика образцах сыворотки пациентов на I стадии (25) и на II стадии (6) (31 комбинированных), и 69 образцах на III стадии (по данным FIGO Staging of Ovarian Cancer). Была обнаружена положительная корреляция между циркулирующей POSTN и стадией заболевания (ФИГ. 11). На основании данных результатов измерение циркулирующего POSTN может также применяться как неинвазивный способ для определения стадии ЭРЯ у пациентов.
КЛЮЧЕВОЙ ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ

Хотя для ясности понимания некоторые детали настоящего исследования описаны посредством иллюстраций и примеров, не следует считать, что описание и примеры ограничивают рамки настоящего изобретения. Описание всех патентов, патентных заявок, научных источников, приведенных в данном документе, явным образом и в полном объеме включено в данный документ посредством ссылок для всех целей, как если бы каждый патент, патентная заявка, научный источник были специально и по отдельности включены в данный документ посредством ссылок.
Реферат
Настоящее изобретение относится к биотехнологии, в частности к способам применения уровней экспрессии одного или более генов сигнатуры стромы в качестве критериев отбора для определения пациента, больного раком, который является резистентным к химиотерапии, который может получить пользу от конкретной противораковой терапии, такой как нацеленная на строму терапия, антиангиогенная терапия и/или иммунотерапия. Настоящее изобретение также относится к способам применения уровней экспрессии одного или более генов сигнатуры стромы в качестве критерия отбора для лечения пациентов со злокачественным новообразованием, таких как пациенты с раком яичника, с помощью агента, нацеленного на строму. 4 н. и 52 з.п. ф-лы, 11 ил., 11 табл., 8 пр.

Комментарии