Блок-сополимерный конъюгат физиологически активного вещества - RU2732612C2
Код документа: RU2732612C2
Чертежи



Описание
Область техники
[0001]
Настоящее изобретение относится к макромолекулярному производному физиологически активного вещества и его применению.
Уровень техники
[0002]
Что качается фармацевтических продуктов, разработаны системы доставки лекарственных средств (DDS), которые регулируют фармакокинетику физиологически активных веществ, служащих в качестве активных ингредиентов, и тем самым обеспечивают доставку физиологически активных веществ к конкретным местам действия in vivo в требуемое время действия и определенной концентрации лекарственного средства. В непатентном литературном источнике 1 описан препарат DDS, в котором в качестве носителя для доставки лекарственного средства использован блок-сополимер, в котором полиэтиленгликолевый сегмент и полиаминокислотный сегмент связаны друг с другом. Описано, что такой блок-сополимер демонстрирует ассоциативные свойства и образует конфигурацию полимерной мицеллы с размером частиц от 20 до 100 нм, которая имеет полиэтиленгликолевую внешнюю оболочку и гидрофобное внутреннее ядро и, таким образом, указанный блок-сополимер стабильно заключает в себе различные лекарственные препараты во внутреннем ядре посредством химического связывания или физического захвата. Указанный препарат DDS типа полимерной мицеллы характеризуется тем, что при введении препарата DDS in vivo его экскреция подавляется, что приводит к увеличению удерживания in vivo, и известно, что такой препарат DDS пассивно мигрирует в ткани, такие как опухоли, и накапливается в них. Таким образом, физиологически активное вещество, удерживаемое in vivo в течение продолжительного периода времени, обеспечивает возможность увеличения доступности активного ингредиента, а лекарственные препараты, в которых используют такие системы, могут эффективно обеспечивать более мощное физиологически активное действие, по сравнению с введенными в лекарственную форму лекарственными препаратами.
[0003]
В отношении получения DDS типа полимерной мицеллы, описанной выше, известны способы получения, в которых лекарственное вещество внедряют во внутреннее ядро полимерных мицелл посредством химического связывания. Например, в патентном литературном источнике 1 описан пример получения производного камптотецина. Кроме того, в патентном литературном источнике 2 описан пример получения производного резорцина, имеющего ингибирующую активность в отношении HSP90, в патентном литературном источнике 3 описан пример получения производного таксана, и в патентном литературном источнике 4 описан пример получения стероидного производного. Так, в указанных патентных литературных источниках описаны блок-сополимеры, сопряженные с различными физиологически активными веществами, которые могут быть использованы для различных лекарственных препаратов.
[0004]
Обычные блок-сополимеры, сопряженные с физиологически активным веществом, могут увеличивать удерживание в крови конъюгированных лекарственных средств. Таким образом, лекарственные средства действуют на нормальные ткани, а также пораженные болезнью ткани в течение продолжительного периода времени. Например, блок-сополимер, сопряженный с производным камптотецина, противоопухолевым агентом, описанным в патентном литературном источнике 1, обеспечивает контролируемое высвобождение производного камптотецина вследствие диссоциации in vivo. В результате высвобожденное производное камптотецина действует на нормальные ткани, такие как костный мозг, а также опухолевые ткани в течение продолжительного периода времени. Поэтому обычные блок-сополимеры, сопряженные с производным камптотецина, демонстрируют мощный противоопухолевый эффект, а также неизбежно проявляют миелосупрессию, такую как нейтропения, и это влечет за собой дозолимитирующую токсичность (DLT) (непатентнный литературный источник 2). Таким образом, существует потребность в разработке производного камптотецина, которое демонстрирует еще более сниженную миелосупрессию при сохранении противоопухолевого действия. Следовательно, обычные блок-сополимеры, сопряженные с физиологически активным веществом, могут проявлять мощный фармакологически активный эффект; однако в ряде случаев указанные блок-сополимеры демонстрируют неблагоприятное действие на нормальные ткани.
[0005]
Соответственно, в отношении вышеупомянутых препаратов DDS типа полимерной мицеллы, существует потребность в разработке блок-сополимера, сопряженного с физиологически активным веществом, который подавляет проявление фармакологически активной функции на нормальные ткани и демонстрирует сниженные побочные эффекты при сохранении эффекта усиления функции физиологической активности, что является отличительной характеристикой препарата DDS.
Список литературы
Патентная литература
[0006]
Патентный литературный источник 1: WO 2004/039869 А
Патентный литературный источник 2: WO 2008/041610 А
Патентный литературный источник 3: WO 2007/111211 А
Патентный литературный источник 4: WO 2009/041570 А
Непатентная литература
[0007]
Непатентный литературный источник 1: Advanced Drug Delivery Reviews, том 60, 899-914 (2008)
Непатентный литературный источник 2: Clinical Cancer Research, том 16, 5058-5066 (2010)
Сущность изобретения
Техническая задача
[0008]
Задача настоящего изобретения заключается в обеспечении блок-сополимера, сопряженного с физиологически активным веществом, имеющего улучшенную эффективность и/или безопасность по сравнению с известными блок-сополимерами, сопряженными с физиологически активным веществом. В частности, задача заключается в эффективном обеспечении эффекта фармакологической активности посредством усиления характеристик проницаемости в ткань-мишень, пораженную заболеванием, и тем самым усиления действия фармакологически активного вещества, по сравнению с известными блок-сополимерами, сопряженными с физиологически активным веществом. Альтернативно, задача заключается в предотвращении возникновения расстройств нормальных тканей посредством регулирования удерживания в крови путем улучшения способности блок-сополимера к экскреции через почки и т.п., и тем самым подавления сенсибилизации физиологически активным веществом нормальных тканей, отличных от ткани-мишени, пораженной заболеванием.
Решение задачи
[0009]
Авторами настоящего изобретения проведено всестороннее исследование для решения задач, описанных выше, и в результате авторами изобретения было обнаружено, что блок-сополимер, в котором полиэтиленгликолевый сегмент связан с сегментом производного полиаминокислоты, содержащим связанное с ним физиологически активное вещество, причем молекулярная масса блок-сополимера составляет от 2 килодальтон до 15 килодальтон, и интенсивность светорассеяния водного раствора блок-сополимера, сопряженного с физиологически активным веществом, с концентрацией 1 мг/мл, при измерении с помощью фотометра для измерения рассеяния лазерного излучения по меньшей мере в два раза или более выше интенсивности светорассеяния толуола в таких же условиях измерения, как описаны выше, может улучшать эффективность и/или безопасность. Таким образом, авторами решена задача настоящего изобретения. В соответствии с другим аспектом, авторами настоящего изобретения обнаружено, что блок-сополимер, в котором полиэтиленгликолевый сегмент связан с сегментом производного полиаминокислоты, содержащим связанное с ним физиологически активное вещество, и блок-сополимер, способный образовывать наночастицы на основании ассоциативных свойств и имеющий молекулярную массу от 2 килодальтон до 15 килодальтон, может улучшать эффективность и/или безопасность. Таким образом, авторами решена задача настоящего изобретения.
[0010]
Таким образом, настоящее изобретение относится к следующим пунктам [1]-[17].
[1] Блок-сополимер, содержащий полиэтиленгликолевый сегмент, связанный с сегментом производного полиаминокислоты, содержащим производное аспарагиновой кислоты и/или производное глутаминовой кислоты, и сегмент производного полиаминокислоты содержит физиологически активное вещество с гидроксильной группой и/или аминогруппой, связанной с карбоксильной группой боковой цепи указанного производного,
где молекулярная масса блок-сополимера составляет от 2 килодальтон до 15 килодальтон, и
интенсивность светорассеяния 1 мг/мл водного раствора блок-сополимера, измеренная с помощью фотометра для измерения рассеяния лазерного излучения при следующих условиях измерения: температура измерения 25°С, угол рассеяния 90° и длина волны 632,8 нм - по меньшей мере в два раза или более выше интенсивности светорассеяния толуола, измеренной при таких же условиях измерения.
[0011]
[2] Блок-сополимер, содержащий полиэтиленгликолевый сегмент, связанный с сегментом производного полиаминокислоты, содержащим производное аспарагиновой кислоты и/или производное глутаминовой кислоты, и сегмент производного полиаминокислоты содержит физиологически активное вещество с гидроксильной группой и/или аминогруппой, связанной с карбоксильной группой боковой цепи указанного производного,
где блок-сополимер имеет способность образовывать наночастицу, и молекулярная масса блок-сополимера составляет от 2 килодальтон до 15 килодальтон.
[0012]
[3] Блок-сополимер по п. [1] или [2], отличающийся тем, что массовое содержание полиэтиленгликолевого сегмента в блок-сополимере составляет от 10% по массе до 80% по массе.
[0013]
[4] Блок-сополимер по п. [3], отличающийся тем, что массовое содержание полиэтиленгликолевого сегмента в блок-сополимере составляет от 30% по массе до 65% по массе.
[0014]
[5] Блок-сополимер по любому из пп. [1]-[4], отличающийся тем, что молекулярная масса полиэтиленгликолевого сегмента составляет от 1 килодальтон до 10 килодальтон.
[0015]
[6] Блок-сополимер по любому из пп. [1]-[5], отличающийся тем, что массовое содержание физиологически активного вещества, содержащего гидроксильную группу и/или аминогруппу, в блок-сополимере составляет от 10% по массе до 60% по массе.
[0016]
[7] Блок-сополимер по любому из пп. [1]-[6], отличающийся тем, что блок-сополимер представлен общей формулой (1):
[0017]

где R1 представляет собой атом водорода или С1-С6 алкильную группу, которая может иметь заместитель; t представляет собой целое число от 20 до 270; А представляет собой С1-С6 алкиленовую группу, которая может иметь заместитель; R2 представляет собой заместитель, выбранный из группы, состоящей из атома водорода, С1-С6 ацильной группы и С1-С6 алкоксикарбонильной группы; R3 представляет собой остаток физиологически активного вещества с гидроксильной группой и/или аминогруппой; R4 представляет собой один или более заместителей, выбранных из группы, состоящей из линейной, разветвленной или циклической С1-С30 алкокси-группы, которая может иметь заместитель, линейной, разветвленной или циклической С1-С30 алкиламино-группы, которая может иметь заместитель, линейной, разветвленной или циклической С1-С30 диалкиламино-группы, которая может иметь заместитель, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, остатка флуоресцентного вещества и гидроксильной группы; В представляет собой линкерную группу; n равен 1 или 2; x1, x2, y1, у2 и z, каждый независимо, представляют собой целое число от 0 до 25; (x1+х2) равно целому числу от 1 до 25; (x1+x2+y1+у2+z) равно целому числу от 3 до 25; и каждое составное звено, с которым связан R3 или R4, и составное звено, в котором внутримолекулярно циклизована карбонильная группа боковой цепи, независимо расположены случайным образом.
[0018]
[8] Блок-сополимер по любому из пп. [1]-[7], отличающийся тем, что физиологически активное вещество с гидроксильной группой и/или аминогруппой представляет собой одно или более физиологически активных веществ, выбранных из группы, состоящей из производного камптотецина, производного таксана, производного резорцина, производного антрациклина, производного рапамицина, антиметаболита на основе цитидина, антиметаболита фолиевой кислоты, антиметаболита на основе пурина, антиметаболита на основе фторированного пиримидина, платинового производного, производного митомицина, производного блеомицина, производного алкалоида барвинка, производного подофиллотоксина, производного галихондрина, производного стауроспорина, производного талидомида, производного витамина А, производного комбретастатина, антиандрогенного агента, антиэстрогенного агента, гормонального агента, производндого такролимуса, стероидного производного, антибиотика на основе полнена, производного на основе азола, производного на основе кандина и производного пиримидина.
[0019]
[9] Блок-сополимер по п. [8], отличающийся тем, что физиологически активное вещество с гидроксильной группой и/или аминогруппой представляет собой один или более противоопухолевых агентов, выбранных из группы, состоящей из производного камптотецина, производного таксана, производного резорцина, производного антрациклина, производного рапамицина, антиметаболита на основе цитидина, антиметаболита фолиевой кислоты, антиметаболита на основе пурина, антиметаболита на основе фторированного пиримидина, платинового производного, производного митомицина, производного блеомицина, производного алкалоида барвинка, производного подофиллотоксина, производного галихондрина, производного стауроспорина, производного талидомида, производного витамина А, производного комбретастатина, антиандрогенного агента, антиэстрогенного агента и гормонального агента.
[0020]
[10] Блок-сополимер по п. [7], отличающийся тем, что R3 представляет собой остаток производного камптотецина, представленный общей формулой (2):
[0021]

где R5 выбран из группы, состоящей из атома водорода, С1-С6 алкильной группы, которая может иметь заместитель, и силильной группы, которая может иметь заместитель; и R6 представляет собой атом водорода или С1-С6 алкильную группу, которая может иметь заместитель.
[0022]
[11] Блок-сополимер по п. [7], отличающийся тем, что R3 представляет собой остаток производного резорцина, представленный общей формулой (3):
[0023]

где R7 выбран из группы, состоящей из меркапто-группы, гидроксильной группы, атома галогена, нитро-группы, циано-группы, С1-С20 алкильной группы, С2-С20 алкенильной группы, С2-С20 алкинильной группы, карбоциклической или гетероциклической арильной группы, С1-С8 алкилтио-группы, арилтио-группы, С1-С8 алкилсульфинильной группы, арилсульфинильной группы, С1-С8 алкилсульфонильной группы, арилсульфонильной группы, сульфамоильной группы, С1-С8 алкокси-группы, арилокси-группы, С1-С8 ацилокси-группы С1-С8 алкоксикарбонилокси-группы, карбамоилокси-группы, аминогруппы, С1-С8 ациламино-группы, С1-С8 алкоксикарбониламино-группы, уреидо-группы, сульфониламино-группы, сульфамоиламино-группы, формильной группы, С1-С8 ацильной группы, карбоксильной группы, С1-С8 алкоксикарбонильной группы, карбамоильной группы и С1-С8 алкилсилильной группы;
R8 выбран из группы, состоящей из карбоциклической или гетероциклической арильной группы, которая может иметь заместитель, С1-С20 алкильной группы, С2-С20 алкенильной группы, С2-С20 алкинильной группы, С1-С20 алкиламино-группы и С1-С20 ациламино-группы; и
кольцо Н представляет собой гетероциклическую арильную группу, выбранную из группы, состоящей из общих формул (3-1), (3-2) и (3-3):
[0024]

где R9 выбран из группы, состоящей из меркапто-группы, гидроксильной группы, атома водорода, атома галогена, карбамоильной группы, С1-С20 алкоксикарбонильной группы, циано-группы, С1-С8 алкилтио-группы, арилтио-группы, С1-С8 алкилсульфинильной группы, арилсульфинильной группы, С1-С8 алкилсульфонильной группы, арилсульфонильной группы, сульфамоильной группы, С1-С8 алкокси-группы, арилокси-группы С1-С8 ацилокси-группы, С1-С8 алкоксикарбонилокси-группы, карбамоилокси-группы, аминогруппы, С1-С8 ациламино-группы С1-С8 алкоксикарбониламино-группы, уреидо-группы, сульфониламино-группы, сульфамоиламино-группы, формильной группы, С1-С8 ацильной группы и С1-С8 алкилсилильной группы.
[0025]
[12] Блок-сополимер по п. [7], отличающийся тем, что R3 представляет собой остаток паклитаксела, доцетаксела или кабазитаксела.
[0026]
[13] Блок-сополимер, полученный приведением во взаимодействие блок-сополимера, в котором полиэтиленгликолевый сегмент связан с полиаминокислотным сегментом, содержащим аспарагиновую кислоту и/или глутаминовую кислоту, с физиологически активным веществом, содержащим гидроксильную группу и/или аминогруппу, и необязательно с гидрофобным заместителем, содержащим гидроксильную группу и/или аминогруппу, с применением конденсирующего агента,
где молекулярная масса блок-сополимера составляет от 2 килодальтон до 15 килодальтон, и
интенсивность светорассеяния 1 мг/мл водного раствора блок-сополимера, измеренная с помощью фотометра для измерения рассеяния лазерного излучения при следующих условиях измерения: температура измерения 25°С, угол рассеяния 90° и длина волны 632,8 нм - по меньшей мере в два раза или более выше интенсивности светорассеяния толуола, измеренной при таких же условиях измерения.
[0027]
[14] Наночастицы, полученные из блок-сополимера по любому из пп. [1]-[13].
[0028]
[15] Наночастицы по п. [14], отличающиеся тем, что объемный средний диаметр указанных наночастиц составляет менее 20 нм.
[0029]
[16] Фармацевтический продукт, содержащий блок-сополимер по пп. [1]-[13] или наночастицы по п. [14] или [15] в качестве активного ингредиента.
[0030]
[17] Противоопухолевый агент, содержащий блок-сополимер по пп. [1]-[13] или наночастицы по п. [14] или [15] в качестве активного ингредиента.
Полезный эффект изобретения
[0031]
Блок-сополимер согласно настоящему изобретению представляет собой блок-сополимер полиэтиленгликолевого сегмента, связанного с полиаминокислотным сегментом, содержащим связанное с ним физиологически активное вещество, молекулярная масса блок-сополимера составляет от 2 килодальтон до 15 килодальтон, и интенсивность светорассеяния водного раствора блок-сополимера, измеренная с помощью фотометра для измерения рассеяния лазерного излучения, по меньшей мере в два раза или более выше интенсивности светорассеяния толуола.
[0032]
В соответствии с другим аспектом, блок-сополимер согласно настоящему изобретению представляет собой блок-сополимер полиэтиленгликолевого сегмента, связанного с сегментом производного полиаминокислоты, содержащим связанное с ним физиологически активное вещество, и указанный блок-сополимер может образовывать наночастицы и имеет молекулярную массу от 2 килодальтон до 15 килодальтон.
[0033]
Наночастицы, образованные блок-сополимером согласно настоящему изобретению, имеют меньший средний объемный диаметр частиц, чем известные препараты DDS типа полимерной мицеллы, и обладают улучшенным проникновением в ткань-мишень и/или способностью к экскреции через почки и т.п. после введения in vivo. Таким образом, поскольку блок-сополимер, сопряженный с физиологически активным веществом, согласно настоящему изобретению обладает высокими характеристиками проникновения в ткань-мишень, по сравнению с известными блок-сополимерами, то представленный блок-сополимер, сопряженный с физиологически активным веществом, может сенсибилизировать широкий ряд тканей-мишеней физиологически активным веществом и, следовательно, может эффективно обеспечивать эффект фармакологической активности. Альтернативно, поскольку блок-сополимер обладает улучшенной способностью к экскреции через почки и т.п., то удерживание в крови является регулируемым, так что сенсибилизация физиологически активным веществом нормальных тканей, отличных от ткани-мишени, подавлена и, таким образом, может быть исключено возникновение расстройств нормальных тканей.
[0034]
В частности, в случае использования в качестве физиологически активного вещества противоопухолевого агента, усиление противоопухолевого эффекта и/или предотвращение расстройств в нормальных тканях, таких как миелосупрессия, может быть достигнуто посредством улучшения характеристик проникновения в опухолевые ткани и/или посредством улучшения способности к экскреции через почки с применением указанного блок-сополимера.
Краткое описание чертежей
[0035]
На фиг. 1 представлены фотографии, демонстрирующие распределение в тканях примера А-4 и сравнительного примера А-4 в срезах опухоли ВхРС3 рака поджелудочной железы человека.
На фиг. 2 представлены фотографии, демонстрирующие распределение в тканях примера А-4 и сравнительного примера А-4 в срезах почки.
На фиг. 3 представлены фотографии, демонстрирующие распределение в тканях примера В-4 и сравнительного примера В-4 в срезах опухоли ВхРС3 рака поджелудочной железы человека и в срезах почки.
На фиг. 4 представлены результаты, демонстрирующие противоопухолевое действие примера В-1, сравнительного примера В-1 и ганетеспиба на рак толстой кишки человека Col-5-JCK.
На фиг. 5 представлены результаты, демонстрирующие противоопухолевое действие примера В-1, сравнительного примера В-1 и ганетеспиба на рак толстой кишки человека Со-3-KIST.
На фиг. 6 представлены результаты, демонстрирующие противоопухолевое действие примера В-1, сравнительного примера В-1 и ганетеспиба на рак молочной железы человека MC-19-JCK.
На фиг. 7 представлены фотографии, демонстрирующие распределение в тканях примера С-3, сравнительного примера С-2 и сравнительного примера С-3 в срезах опухоли ВхРС3 рака поджелудочной железы человека и в срезах почки.
Описание вариантов реализации изобретения
[0036]
Представленный блок-сополимер, сопряженный с физиологически активным веществом, представляет собой блок-сополимер полиэтиленгликолевого сегмента, связанного с сегментом производного полиаминокислоты, содержащим производное аспарагиновой кислоты и/или производное глутаминовой кислоты, причем производное полиаминокислоты содержит физиологически активное вещество с гидроксильной группой и/или аминогруппой, связанной с карбоксильной группой боковой цепи указанного производного, при этом молекулярная масса блок-сополимера составляет от 2 килодальтон до 15 килодальтон, и интенсивность светорассеяния водного раствора блок-сополимера с концентрацией 1 мг/мл, измеренная с помощью фотометра для измерения рассеяния лазерного излучения при следующих условиях измерения: температура измерения 25°С, угол рассеяния 90° и длина волны 632,8 нм - по меньшей мере в два раза или более выше интенсивности светорассеяния толуола при вышеуказанных условиях измерения.
[0037]
В соответствии с другим аспектом, представленный блок-сополимер, сопряженный с физиологически активным веществом, представляет собой блок-сополимер полиэтиленгликолевого сегмента, связанного с сегментом производного полиаминокислоты, содержащим производное аспарагиновой кислоты и/или производное глутаминовой кислоты, причем производное полиаминокислоты содержит физиологически активное вещество с гидроксильной группой и/или аминогруппой, связанной с карбоксильной группой боковой цепи указанного производного, при этом блок-сополимер может образовывать наночастицы, и молекулярная масса блок-сополимера составляет от 2 килодальтон до 15 килодальтон.
[0038]
То есть сополимер блочного типа представляет собой препарат DDS, в котором сополимер блочного типа, содержащий полиэтиленгликолевый сегмент и сегмент производного полиаминокислоты, связанные подходящей линкерной группой, использован в качестве главной цепи, и физиологически активное вещество связано с ней. Ниже представлено подробное пояснение.
[0039]
Полиэтиленгликолевый сегмент блок-сополимера согласно настоящему изобретению представляет собой сегмент, имеющий повторяющуюся структуру этиленокси-группы: звена (СН2СН2О). Полиэтиленгликолевый сегмент предпочтительно представляет собой сегментную структуру, которая содержит полиэтиленгликолевую цепь, имеющую степень полимеризации звеньев этиленокси-группы от 10 до 300 единиц, и более предпочтительно степень полимеризации от 20 до 270 единиц.
[0040]
То есть полиэтиленгликолевый сегмент предпочтительно представляет собой сегментную часть, имеющую молекулярную массу от 0,4 килодальтон до 13 килодальтон в качестве молекулярной массы, соответствующей полиэтилегликолю, более предпочтительно, структурную часть, имеющую молекулярную массу от 0,8 килодальтон до 12 килодальтон, и особенно предпочтительно структурную часть, имеющую молекулярную массу от 1 килодальтон до 10 килодальтон. Особенно предпочтителен полиэтиленгликолевый сегмент, имеющий молекулярную массу от 1 килодальтон до 5 килодальтон.
[0041]
В отношении молекулярной массы полиэтиленгликолевого сегмента, используемого для настоящего изобретения, используют среднюю молекулярную массу структурного соединения полиэтиленгликолевого сегмента, применяемого для получения представленного блок-сополимера, которую определяют по пиковой молекулярной массе, измеренной методом ГПХ на основании стандартных полиэтиленгликолевых продуктов.
[0042]
Концевая группа на одном конце полиэтиленгликолевого сегмента представляет собой связывающую группу, с которой связывается сегмент производного полиаминокислоты, описанный ниже. Концевая группа на другом конце не имеет специального ограничения, и ее примеры могут включать, но не ограничиваются ими, атом водорода, гидроксильную группу, С1-С6 алкокси-группу, которая может иметь заместитель, С7-С20 аралкилокси-группу, которая может иметь заместитель. Примеры заместителя для алкокси-группы и аралкилокси-группы включают, но не ограничиваются ими, гидроксильную группу, аминогруппу, формильную группу и карбоксильную группу. Полиэтиленгликолевый сегмент также может быть обеспечен направляющей молекулой посредством заместителя, описанного выше. Примеры направляющей молекулы включают, но не ограничиваются ими, белок, пептид и фолиевую кислоту.
[0043]
С1-С6 алкокси-группа, которая может иметь заместитель, в отношении концевой группы может быть линейной, разветвленной или циклической С1-С6 алкокси-группой. Ее примеры включают, но не ограничиваются ими, метокси-группу, этокси-группу, н-пропокси-группу, изопропокси-группу, н-бутокси-группу, изобутокси-группу, трет-бутокси-группу, н-пентилокси-группу, изопентилокси-группу, 2-метилбутокси-группу, неопентилокси-группу, 1-этилпропокси-группу, н-гексилокси-группу, 4-метилпентилокси-группу, 3-метилпентилокси-группу, 2-метилпентилокси-группу, 1-метилпентилокси-группу, 3,3-диметилбутокси-группу, 2,2-диметилбутокси-группу, 1,1-диметилбутокси-группу, 1,2-диметилбутокси-группу, 1,3-диметилбутокси-группу, 2,3-диметилбутокси-группу, 2-этилбутокси-группу, циклопропокси-группу, циклопентилокси-группу и циклогексилокси-группу. Предпочтительна С1-С4 алкокси-группа, и ее примеры включают, но не ограничиваются ими, метокси-группу, этокси-группу, н-пропокси-группу, изопропокси-группу, н-бутокси-группу, втор-бутокси-группу и трет-бутокси-группу. Особенно предпочтительные примеры включают, но не ограничиваются ими, метокси-группу, этокси-группу, н-пропокси-группу и изопропокси-группу.
[0044]
С7-С20 аралкилокси-группа, которая может иметь заместитель, в отношении концевой группы может быть линейной или разветвленной алкильной группой, в которой атом водорода в любом положении замещен арильной группой. Ее примеры включают, но не ограничиваются ими, бензилокси-группу, 2-фенилэтилокси-группу, 4-фенилбутилокси-группу, 3-фенилбутилокси-группу, 5-фенилпентилокси-группу, 6-фенилгексилокси-группу и 8-фенилоктилокси-группу. Предпочтительные примеры включают, но не ограничиваются ими, бензилокси-группу, 4-фенилбутилокси-группу и 8-фенилоктилокси-группу.
[0045]
Концевая группа полиэтиленгликолевого сегмента предпочтительно представляет собой гидроксильную группу или С1-С6 алкокси-группу, которая может иметь заместитель.
[0046]
Сегмент производного полиаминокислоты согласно настоящему изобретению представляет собой полиаминокислотный сегмент, содержащий производное аспарагиновой кислоты и/или производное полиглутаминовой кислоты, в котором физиологически активное вещество с гидроксильной группой и/или аминогруппой связано с карбоксильной группой боковой цепи указанного производного. То есть сегмент производного полиаминокислоты представляет собой полиаминокислотный сегмент, который содержит производное аспарагиновой кислоты и/или производное глутаминовой кислоты, с которым связано по меньшей мере одно или более звеньев физиологически активного вещества. Полиаминокислотный сегмент может быть линейным полиаминокислотным сегментом, или может быть сегментом, имеющим разветвленную структуру за счет боковых цепей. Предпочтительно, полиаминокислотный сегмент имеет структуру сегмента, в которой полимеризовано от 2 до 30 звеньев аминокислоты. Полиаминокислотный сегмент предпочтительно представляет собой полимер из 3-25 звеньев, и особенно предпочтительно полимер из 5-20 звеньев.
[0047]
Не существует конкретных ограничений для аминокислот, которые образуют полиаминокислотный сегмент, и могут быть использованы любые природные аминокислоты, синтетические аминокислоты и их формы с модифицированной боковой цепью. Допустимо использовать также любые L-формы, D-формы и рацематы. Примеры аминокислот могут включать, но не ограничиваются ими, глицин, аланин, β-аланин, лейцин, фенилаланин, серии, треонин, тирозин, аспарагиновую кислоту, глутаминовую кислоту, лизин, аргинин, гистидин, орнитин и цистеин. Примеры аминокислоты, имеющей модифицированную боковую цепь, включают, но не ограничиваются ими, алкильный сложный эфир аспарагиновой кислоты или глутаминовой кислоты, аралкильный сложный эфир аспарагиновой кислоты или глутаминовой кислоты, алкиламид аспарагиновой кислоты или глутаминовой кислоты, аралкиламид аспарагиновой кислоты или глутаминовой кислоты и алкилоксикарбонил-лизин, такой как Вос-лизин. Полиаминокислотный сегмент может быть таким, что указанный сегмент состоит из любого одного типа указанных аминокислот, или указанный сегмент состоит из смеси нескольких типов указанных аминокислот.
[0048]
Поскольку полиаминокислотный сегмент содержит производное аспарагиновой кислоты и/или производное полиглутаминовой кислоты, имеющее карбоксильную группу боковой цепи, с которой связывается физиологически активное вещество с гидроксильной группой и/или аминогруппой, то полиаминокислотный сегмент предпочтительно представляет собой полиаминокислотный сегмент, состоящий из аспарагиновой кислоты и/или глутаминовой кислоты. Более предпочтительно, полиаминокислотный сегмент представляет собой сегмент полиаспарагиновой кислоты, состоящий только из аспарагиновой кислоты или сегмент полиглутаминовой кислоты, состоящий только из глутаминовой кислоты. То есть, если полиаминокислотный сегмент содержит производное аспарагиновой кислоты, в котором физиологически активное вещество с гидроксильной группой и/или аминогруппой связано с карбоксильной группой боковой цепи указанного производного, предпочтительно использовать сегмент полиаспарагиновой кислоты, и если полиаминокислотный сегмент содержит производное глутаминовой кислоты, в котором физиологически активное вещество с гидроксильной группой и/или аминогруппой связано с карбоксильной группой боковой цепи указанного производного, предпочтительно использовать сегмент полиглутаминовой кислоты. Способ полимеризации полиаспарагиновой кислоты или полиглутаминовой кислоты представляет собой пептидную связь, и полимер может представлять собой α-связанное соединение, β-связанное соединение или γ-связанное соединение, или может быть их смесью.
[0049]
Концевая группа на одном конце полиаминокислотного сегмента представляет собой связывающую группу, с которой связывается полиэтиленгликолевый сегмент, описанный выше. Концевая группа на другом конце может представлять собой N-концевую группу или С-концевую группу, может быть любой из незащищенной свободной аминогруппы, свободной карбоновой кислоты и ее соли, или может быть подходящей модифицированной формой N-концевой группы или С-концевой группы.
[0050]
Примеры модифицированной формы N-концевой группы могут включать, но не ограничиваются ими, модифицированную форму ациламидного типа, модифицированную форму алкоксикарбониламидного типа (модифицированную форму уретанового типа) и модифицированную форму алкиламинокарбониламидного типа (модифицированную форму мочевинного типа). С другой стороны, примеры модифицированной формы С-концевой группы включают, но не ограничиваются ими, модифицированную форму сложноэфирного типа, модифицированную форму амидного типа и модифицированную форму сложного тиоэфирного типа.
[0051]
Модифицирующая группа N-концевой группы или С-концевой группы может быть любой произвольной модифицирующей группой, и ее предпочтительные примеры могут включать, но не ограничиваются ими, модифицированные на конце группы, такие как С1-С6 линейная, разветвленная или циклическая алкильная группа, которая может иметь заместитель, С6-С18 ароматическая группа, которая может иметь заместитель, и С7-С20 аралкильная группа, которая может иметь заместитель, все из которых связаны посредством подходящей линкерной группы, которая связана с N-концевой группой и С-концевой группой.
[0052]
То есть N-концевая группа предпочтительно представляет собой подходящую модифицированную форму ациламидного типа или модифицированную форму алкоксикарбониламидного типа (модифицированную форму уретанового типа), и N-концевая группа предпочтительно представляет собой С1-С6 линейную, разветвленную или циклическую алкильную группу, которая может иметь заместитель, С6-С18 ароматическую группу, которая может иметь заместитель, или С7-С20 аралкильную группу, которая может иметь заместитель, все из которых связаны посредством карбонильной группы или карбонилокси-группы.
[0053]
С другой стороны, С-концевая группа предпочтительно представляет собой подходящий заместитель амидного типа или заместитель сложноэфирного типа, и С-концевая группа предпочтительно представляет собой С1-С8 линейную, разветвленную или циклическую алкильную группу, которая может иметь заместитель, С6-С18 ароматическую группу, которая может иметь заместитель, или С7-С20 аралкильную группу, которая может иметь заместитель, все из которых связаны посредством амидной группы или сложноэфирной группы.
[0054]
Примеры С1-С6 линейной, разветвленной или циклической алкильной группы, которая может иметь заместитель, в отношении концевой группы включают, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, трет-бутильную группу и циклогексильную группу.
[0055]
Примеры С6-С18 ароматической группы, которая может иметь заместитель, в отношении концевой группы включают, но не ограничиваются ими, фенильную группу, пиридильную группу и нафтильную группу.
[0056]
С7-С20 аралкильная группа, которая может иметь заместитель, в отношении концевой группы представляет собой линейную или разветвленную алкильную группу, в которой атом водорода в любом положении замещен арильной группой. Ее примеры включают, но не ограничиваются ими, бензильную группу, 2-фенилэтильную группу, 4-фенилбутильную группу и 8-фенилоктильную группу.
[0057]
Предпочтительно, концевые группы полиаминокислотного сегмента представляют собой модифицированные формы на основе N-концевой группы и С-концевой группы.
[0058]
Настоящее изобретение относится к блок-сополимеру, в котором сегмент производного полиаминокислоты, содержащий производное аспарагиновой кислоты и/или полиглутаминовой кислоты, связан с полиэтиленгликолевым сегментом, а физиологически активное вещество с гидроксильной группой и/или аминогруппой связно с указанным производным. В отношении физиологически активного вещества с гидроксильной группой и/или аминогруппой, может быть использовано любое физиологически активное вещество с гидроксильной группой и/или аминогруппой в качестве функциональной группы, образующей связь посредством сложноэфирной связи или амидной связи, без каких-либо специальных ограничений. Может быть использовано любое вещество, содержащее физиологически активное вещество, и такое физиологически активное вещество может быть использовано в качестве физиологически активного вещества с гидроксильной группой и/или аминогруппой посредством внедрения гидроксильной группы и/или аминогруппы в физиологически активное вещество путем превращения физиологически активного вещества в его производное или пролекарство.
[0059]
Настоящее изобретение представляет собой технологию, связанную с применением блок-сополимера в качестве носителя физиологически активного вещества, и весьма практичную технологию, которая может быть использована в отношении всех веществ без особого ухудшения в результате функции фармакологической активности или химической структуры и физических свойств используемого физиологически активного вещества. Таким образом, настоящее изобретение не ограничено указанными физиологически активными веществами, которые используют для лечения заболеваний, и оно может быть использовано с любым веществом при условии, что такое вещество является физиологически активным веществом, имеющим гидроксильную группу и/или аминогруппу, образующую связь.
[0060]
Поскольку представленный блок-сополимер характеризуется улучшенной характеристикой проникновения в ткань, то указанный блок-сополимер предпочтительно использовать для лечения очаговых заболеваний тканей. Примеры таких заболеваний включают злокачественные опухолевые заболевания, воспалительные заболевания и инфекционные заболевания. Таким образом, в отношении физиологически активного вещества согласно настоящему изобретению предпочтительно использовать активные ингредиенты фармацевтических продуктов или соединения, которые являются потенциально фармацевтически активными ингредиентами, для лечения указанных заболеваний или для применения активных ингредиентов, полученных посредством превращения указанных соединений в производные или пролекарства. Примеры физиологически активных веществ, которые могут быть применимы согласно настоящему изобретению, перечислены ниже; однако настоящее изобретение не ограничивается ими.
[0061]
Примеры физиологически активных веществ, которые используют для лечения злокачественных опухолевых заболеваний, включают, но не ограничиваются следующими, производные камптотецина, такие как 7-этил-10-гидроксикамптотецин, иринотекан, ногитекан и 9-аминокамптотецин; производные таксана, такие как паклитаксел, доцетаксел и кабазитаксел; производные резорцина, обладающие ингибирующей активностью в отношении HSP90, такие как ганетеспиб и луминеспиб; производные антрациклина, такие как доксорубицин, эпирубицин, амрубицин, даунорубицин, идарубицин и пирарубицин; производные рапамицина, такие как сиролимус, эверолимус и темсиролимус; антиметаболиты на основе цитидина, такие как гемцитабин, цитозинарабинозид, эноцитабин, цитарабина окфосфат, этинилцитидин, азацитидин и децитабин; антиметаболиты фолиевой кислоты, такие как метотрексат, пеметрексед, левофолинат и фолинат; антиметаболиты на основе пурина, такие как флударабин, неларабин, пентостатин и кладрибин; антиметаболиты на основе фторированного пиримидина, такие как доксифлуридин, капецитабин, тегафур, фторурацил и кармофур; платиносодержащие соединения, такие как цисплатин, карбоплатин, оксалиплатин и недаплатин; производные митомицина, такие как митомицин С; производные блеомицина, такие как блеомицин и либромицин; производные алкалоидов барвинка, такие как винкристин, винбластин, виндезин и винорелбин; производные подофиллотоксина, такие как этопозид и тенипозид; производные галихондрина, такие как эрибулин; производные стуароспорина, такие как ребеккамицин и UCN-01; производные талидомида, такие как леналидомид и помалидомид; производные витамина А, такие как третиноин и тамибаротен; ингибиторы протеасом, такие как ботрезомиб, карфилзомиб и иксазомиб; производные комбретастатина, такие как комбретастатин А4; ингибиторы MEK, такие как биниметиниб, кобиметиниб и траметиниб; ингибиторы CDK, такие как динациклиб, флавопиридол и палбоциклиб; ингибиторы киназы Raf, такие как дабрафениб, сорафениб и вемурафениб; ингибиторы HDAC, такие как вориностат, белиностат, панабиностат и ромидепсин; ингибиторы полимеризации актина, такие как цитохалазин, латрункулин и фаллоидин; ингибиторы PARP, такие как велипариб, рукапариб и олапариб; ингибиторы тирозинкиназы, такие как кризотиниб, иматиниб, гефитиниб, эрлотиниб, афатиниб, дазатиниб, бусутиниб, вандетаниб, сунитиниб, акситиниб, пазопаниб, ленватиниб, лапатиниб, нинтеданиб, нилотиниб, церитиниб, алектиниб, руксолитиниб, кризотиниб и ибрутиниб; алкилирующие агенты на основе азотистых ипритов, такие как бендамустин, циклофосфамид, ифосфамид, бусульфан и мелфалан; алкилирующие агенты на основе нитрозомочевины, такие как нимустин, ранимустин и ломустин; алкилирующие агенты, такие как дакарбазин, темозоломид, прокарбазин и тиотепа; ингибиторы ароматазы, такие как анастрозол, эксеместан, летрозол и фадрозол; антиандрогенные производные, такие как гидроксифлутамид, флутамид, бикалутамид и энзалутамид; ингибиторы CYP17 (лиазы), такие как абиратерон; антиэстрогенные агенты, такие как тамоксифен и торемифен; и гормональные агенты, такие как эстрамустин, прогестерон, митотан и медроксипрогестерон.
[0062]
Примеры физиологически активных веществ, которые используют для лечения воспалительных заболеваний, включают, но не ограничиваются ими, производные такролимуса, такие как такролимус; стероидные производные, такие как дексаметазон и преднизолон; производные рапамицина, такие как сиролимус, эверолимус и темсиролимус; иммунодепрессанты, такие как циклоспорин, финголимод, азатиоприн, мизорибин, микофенолят мофетил и гусперимус; и нестероидные противовоспалительные агенты (NSAID), такие как дифлунизал и тиарамид.
[0063]
Примеры физиологически активных веществ, которые используют для лечения инфекционных заболеваний, включают, но не ограничиваются следующими, противогрибковые агенты, такие как антибиотики на основе полиенов, такие как амфотерицин В и нистатин, производные на основе азола, такие как флуконазол и вориконазол, производные на основе кандина, такие как микафунгин, и производные пиримидина, такие как флуцитозин; противовирусные агенты, такие как ацикловир, валацикловир и ганцикловир; и противовирусные агенты, такие как занамивир, озельтамивир и ланинамивир.
[0064]
Настоящее изобретение представляет собой технологию, связанную с применением блок-сополимера в качестве носителя физиологически активного вещества, и весьма практичную технологию, которая может быть использована в отношении всех веществ без особого ухудшения в результате функции фармакологической активности или химической структуры и физических свойств используемого физиологически активного вещества. Таким образом, настоящее изобретение не ограничено указанными физиологически активными веществами, которые используют для лечения заболеваний, и оно может быть использовано с любым веществом при условии, что такое вещество является физиологически активным веществом, имеющим гидроксильную группу и/или аминогруппу, образующую связь.
[0065]
В отношении физиологически активного вещества с гидроксильной группой и/или аминогруппой согласно настоящему изобретению, предпочтительно напрямую использовать известный фармацевтически активный ингредиент или соединение, которое потенциально является фармацевтически активным ингредиентом, которое содержит гидроксильную группу и/или аминогруппу, без превращения указанного соединения в производное или пролекарство. Примеры такого физиологически активного вещества могут включать, но не ограничиваются ими, следующие соединения.
[0066]
Примеры физиологически активных веществ, которые используют для лечения злокачественных опухолевых заболеваний, включают, но не ограничиваются ими, производные камптотецина, такие как 7-этил-10-гидроксикамптотецин, иринотекан, ногитекан и 9-аминокамптотецин; производные таксана, такие как паклитаксел, доцетаксел и кабазитаксел; производные резорцина, обладающие ингибирующей активностью в отношении HSP90, такие как ганетеспиб и луминеспиб; производные антрациклина, такие как доксорубицин, эпирубицин, амрубицин, даунорубицин, идарубицин и пирарубицин; производные рапамицина, такие как сиролимус, эверолимус и темсиролимус; антиметаболиты на основе цитидина, такие как гемцитабин, цитозинарабинозид, эноцитабин, цитарабина окфосфат, этинилцитидин, азацитидин и децитабин; антиметаболиты фолиевой кислоты, такие как метотрексат, пеметрексед, левофолинат и фолинат; антиметаболиты на основе пурина, такие как флударабин, неларабин, пентостатин и кладрибин; антиметаболиты на основе фторированного пиримидина, такие как доксифлуридин и капецитабин; платиносодержащие соединения, такие как цисплатин, карбоплатин, оксалиплатин и недаплатин; производные митомицина, такие как митомицин С; производные блеомицина, такие как блеомицин и либромицин; производные алкалоидов барвинка, такие как винкристин, винбластин, виндезин и винорелбин; производные подофиллотоксина, такие как этопозид и тенипозид; производные галихондрина, такие как эрибулин; производные стуароспорина, такие как ребеккамицин и UCN-01; производные талидомида, такие как леналидомид и помалидомид; производные витамина А, такие как третиноин; ингибиторы протеасом, такие как ботрезомиб и иксазомиб; производные комбретастатина, такие как комбретастатин А4; ингибиторы MEK, такие как биниметиниб и кобиметиниб; ингибиторы CDK, такие как динациклиб и флавопиридол; ингибиторы киназы Raf, такие как дабрафениб; ингибиторы HDAC, такие как вориностат, белиностат и панабиностат; ингибиторы полимеризации актина, такие как цитохалазин, латрункулин и фаллоидин; ингибиторы тирозинкиназы, такие как бозутиниб, кризотиниб и ибрутиниб; алкилирующие агенты на основе азотистых ипритов, такие как мелфалан; алкилирующие агенты на основе нитрозомочевины, такие как нимустин и ранимустин; алкилирующие агенты, такие как дакарбазин и прокарбазин; ингибиторы CYP17 (лиазы), такие как абиратерон; антиандрогенные производные, такие как гидроксифлутамид и бикалутамид; антиэстрогенные агенты, такие как тамоксифен; и гормональные агенты, такие как эстрамустин.
[0067]
Примеры физиологически активных веществ, которые используют для лечения воспалительных заболеваний, включают, но не ограничиваются ими, производные такролимуса, такие как такролимус; стероидные производные, такие как дексаметазон и преднизолон; производные рапамицина, такие как сиролимус, эверолимус и темсиролимус; иммунодепрессанты, такие как циклоспорин, финголимод, мизорибин, микофенолят мофетил и гусперимус; и нестероидные противовоспалительные агенты (NSAID), такие как дифлунизал и тиарамид.
[0068]
Примеры физиологически активных веществ, которые используют для лечения инфекционных заболеваний, включают, но не ограничиваются ими, противогрибковые агенты, такие как антибиотики на основе полиенов, такие как амфотерицин В и нистатин, производные на основе азола, такие как флуконазол и вориконазол, производные на основе кандина, такие как микафунгин, и производные пиримидина, такие как флуцитозин; противовирусные агенты, такие как ацикловир, валацикловир и ганцикловир; и противовирусные агенты, такие как занамивир, озельтамивир и ланинамивир.
[0069]
Блок-сополимер согласно настоящему изобретению имеет улучшенные свойства миграции и проникновения в ткань-мишень, пораженную заболеванием, и имеет свойство улучшенной экскреции через почки и т.п. Таким образом, сенсибилизация физиологически активным веществом нормальной ткани, отличной от ткани-мишени, пораженной заболеванием, снижена, и обеспечен эффект снижения неблагоприятных эффектов. Таким образом, предпочтительно внедрять физиологически активное вещество, которое используют для лечения заболеваний с задачей снижения неблагоприятных эффектов в нормальных тканях, и предпочтительно использовать противоопухолевый агент против злокачественных опухолевых заболеваний или лекарственный препарат против воспалительных заболеваний. Поскольку блок-сополимер, в который в качестве физиологически активного вещества внедряют противоопухолевый агент или лекарственный препарат для лечения воспалительного заболевания, может улучшать свойства миграции в ткань, такую как опухоль или очаг воспаления, и свойства проникновения во внутреннюю часть ткани, то блок-сополимер обеспечивает эффект, посредством которого может быть усилено противоопухолевое действие или противовоспалительное действие. Поскольку блок-сополимер также обладает способностью экскреции через почки и т.п., то удерживание in vivo, демонстрируемое макромолекулярным препаратом DDS, является регулируемым, нежелательная миграция в нормальные ткани может быть снижена, и может быть достигнуто уменьшение неблагоприятных эффектов.
[0070]
В отношении физиологически активного вещества, которое используют для лечения злокачественных опухолевых заболеваний, предпочтительны вышеупомянутые производные камптотецина, производные таксана, производные резорцина, производные антрациклина, производные рапамицина, антиметаболиты на основе цитидина, антиметаболиты фолиевой кислоты, антиметаболиты на основе пурина, антиметаболиты на основе фторированного пиримидина, платиносодержащие соединения, производные митомицина, производные блеомицина, производные алкалоидов барвинка, производные подофиллотоксина, производные галихондрина, производные стауроспорина, производные талидомида, производные витамина А, ингибиторы протеасом, производные комбретастатина, ингибиторы MEK, ингибиторы CDK, ингибиторы киназы Raf, Ингибиторы HDAC, ингибиторы полимеризации актина, ингибиторы PARP, ингибиторы тирозинкиназы, алкилирующие агенты на основе азотистых ипритов, алкилирующие агенты на основе нитрозомочевины, алкилирующие агенты, ингибиторы ароматазы, антиандрогенные агенты, ингибиторы CYP17 (лиазы), антиэстрогенные ингибиторы и гормональные агенты. Более предпочтительные производные камптотецина, производные таксана, производные резорцина, производные антрациклина, производные рапамицина, антиметаболиты на основе цитидина, антиметаболиты фолиевой кислоты и т.п. Особенно предпочтительны производные камптотецина, производные таксана, производные резорцина и производные рапамицина.
[0071]
В отношении физиологически активного вещества, которое используют для лечения воспалительных заболеваний, предпочтительны производные такролимуса, стероидные производные, производные рапамицина, иммунодепрессанты, NSAID и т.п. Особенно предпочтительны производные такролимуса, стероидные производные и производные рапамицины.
[0072]
Физиологически активное вещество, описанное выше, связано с карбоксильной группой боковой цепи аспарагиновой кислоты или глутаминовой кислоты через любую произвольную линкерную группу. Физиологически активное вещество связано с карбоксильной группой боковой цепи сложноэфирной связью или амидной связью через гидроксильную группу и/или аминогруппу, и такая связь должна обладать связывающими свойствами: медленно расщепляться под действием гидролиза после введения блок-сополимера in vivo, высвобождая физиологически активное вещество.
[0073]
Поскольку физиологически активное вещество имеет гидроксильную группу и/или аминогруппу, то можно упомянуть вариант реализации, в котором указанную группу используют в качестве функциональной группы, образующей связь, и в котором она связана с карбоксильной группой боковой цепи сложноэфирной связью или амидной связью. В таком случае связь образуется таким образом, который не подразумевает использование произвольной линкерной группы. Предпочтителен вариант реализации, в котором используют физиологически активное вещество с гидроксильной группой, и в котором оно связано с карбоксильной группой боковой цепи сложноэфирной связью. В отношении физиологически активного вещества, содержащего амино-связь, предпочтительно использовать физиологически активное вещество, имеющее ароматическую аминогруппу, такое как антиметаболит на основе цитидина, и предпочтителен вариант реализации, в котором ароматическая аминогруппа связана с карбоксильной группой боковой цепи амидной связью.
[0074]
В отношении произвольной линкерной группы, которая связывает физиологически активное вещество с карбоксильной группой боковой цепи аспарагиновой кислоты или глутаминовой кислоты, предпочтительная группа, которая может образовывать связь посредством сложноэфирной связи или амидной связи, с использованием гидроксильной группы и/или аминогруппы физиологически активного вещества в качестве функциональной группы, образующей связь. Таким образом, может быть использована любая подходящая связывающая группа, содержащая карбоксильную группу в качестве концевой группы на одном конце и гидроксильную группу, аминогруппу или меркапто-группу, способную связываться с карбоксильной группой боковой цепи аспарагиновой кислоты или глутаминовой кислоты, в качестве концевой группы на другом конце, без конкретных ограничений. Примеры связывающей группы включают линейную, разветвленную или циклическую С1-С8 алкиленовую группу, которая может иметь заместитель, и С6-С12 ароматическую группу, которая может иметь заместитель.
[0075]
Если вышеупомянутая линкерная группа представляет собой линкерную группу, в которой использована метиленовая группа, которая может иметь заместитель в качестве связывающей группы, то указанная линкерная группа может быть производным аминокислоты или производным гликолевой кислоты.
[0076]
При использовании в качестве линкерной группы производного аминокислоты, может быть использована любая природная аминокислота или синтетическая аминокислота и ее форма с модифицированной боковой цепью. Кроме того, может быть использована любая L-форма, D-форма и рацемат. Их примеры могут включать, но не ограничиваются ими, глицин, аланин, β-аланин, лейцин, фенилаланин, серии, треонин, тирозин, аспарагиновую кислоту, глутаминовую кислоту, лизин, аргинин, гистидин, орнитин и цистеин. Примеры аминокислоты, имеющей модифицированную боковую цепь, включают, но не ограничиваются ими, алкильный сложный эфир аспарагиновой кислоты или глутаминовой кислоты, аралкильный сложный эфир аспарагиновой кислоты или глутаминовой кислоты, алкиламид аспарагиновой кислоты или глутаминовой кислоты, аралкиламид аспарагиновой кислоты или глутаминовой кислоты и алкилоксикарбонил-лизин, такой как Вос-лизин.
[0077]
При использовании в качестве линкерной группы производного гликолевой кислоты, примеры включают, но не ограничиваются ими, гликолевую кислоту, молочную кислоту, яблочную кислоту, винную кислоту и лимонную кислоту. При использовании поливалентной карбоновой кислоты предпочтительно, что карбоксильная группа с одного конца связана с физиологически активным веществом, и карбоксильная группа с другого конца представляет собой сложноэфирное производное или амидное производное.
[0078]
Линкерная группа может представлять собой линкерную группу одного типа, или может присутствовать смесь нескольких типов линкерных групп.
[0079]
Сегмент производного полиаминокислоты согласно настоящему изобретению может содержать звено производного аспарагиновой кислоты и/или звено производного полиглутаминовой кислоты, которое не содержит физиологически активного вещества, связанного с карбоксильной группой боковой цепи. В таком случае карбоксильная группа боковой цепи может быть в форме свободной кислоты или может быть в форме фармацевтически приемлемой соли карбоновой кислоты. Примеры соли карбоновой кислоты могут включать, но не ограничиваются ими, литиевую соль, натриевую соль, калиевую соль, магниевую соль, кальциевую соль и аммониевую соль.
[0080]
Звено производного аспарагиновой кислоты и/или звено производного полиглутаминовой кислоты в сегменте производного полиаминокислоты может представлять собой сложноэфирное производное и/или амидное производное, имеющее подходящий заместитель. Такой заместитель может быть произвольно внедрен для регулирования физических свойств блок-сополимера, сопряженного с физиологически активным веществом, согласно настоящему изобретению. Например, гидрофобность сегмента производного полиаминокислоты в блок-сополимере, сопряженном с физиологически активным веществом, может быть увеличена посредством внедрения в него гидрофобной группы. В то же время гидрофильность полиаминокислотного сегмента в блок-сополимере, сопряженном с физиологически активным веществом, может быть увеличена посредством внедрения гидрофильного заместителя, включая ионную функциональную группу, которая может образовывать соль, такую как аминогруппа карбоновой кислоты или гидроксильная группа.
[0081]
Сложноэфирное производное и/или амидное производное звена производного аспарагиновой кислоты и/или звена производного полиглутаминовой кислоты предпочтительно выбрано из группы, состоящей, например, из С1-С30 алкокси-группы, которая может иметь заместитель, С1-С30 алкиламино-группы, которая может иметь заместитель, ди-С1-С30 алкиламино группы, которая может иметь заместитель, и С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель.
[0082]
С1-С30 алкокси-группа, которая может иметь заместитель, может быть линейной, разветвленной или циклической С1-С30 алкокси-группой, которая может иметь заместитель. То есть она представляет собой производное, в котором карбоксильная группа боковой цепи превращена в производное сложноэфирного типа. В отношении заместителя, алкокси-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. Примеры С1-С30 алкокси-группы включают, но не ограничиваются ими, метокси-группу, этокси-группу, пропокси-группу, изопропокси-группу, бутокси-группу, трет-бутокси-группу, циклогексилокси-группу, бензилокси-группу, 4-фенилбутокси-группу, октилокси-группу, децилокси-группу, додецилокси-группу, тетрадецилокси-группу, гексадецилокси-группу, октадецилокси-группу, эйкозилокси-группу, докозилокси-группу, тетракозилокси-группу, гексакозилокси-группу, октакозилокси-группу и триаконтилокси-группу.
[0083]
С1-С30 алкиламино-группа, которая может иметь заместитель, может быть линейной, разветвленной или циклической С1-С30 алкиламино-группой, которая может иметь заместитель. То есть она представляет собой производное, в котором карбоксильная группа боковой цепи превращена в производное алкиламидного типа. В отношении заместителя, алкиламино-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. Примеры С1-С30 алкиламино-группы включают, но не ограничиваются ими, метиламино-группу, этиламино-группу, пропиламино-группу, изопропиламино-группу, бутиламино-группу, трет-бутиламино-группу, циклогексиламино-группу, бензиламино-группу, 4-фенилбутиламино-группу, октиламино-группу, дециламино-группу, додециламино-группу, тетрадециламино-группу, гексадециламино-группу, октадециламино-группу, эйкозиламино-группу, докозиламино-группу, тетракозиламино-группу, гексакозиламино-группу, октакозиламино-группу и триаконтиламино-группу.
[0084]
Класс алкиламино-группы включает также остаток аминокислоты, содержащий защищенную карбоксильную группу, или флуоресцентное вещество, содержащее аминогруппу. В качестве аминокислоты, содержащей защищенную карбоксильную группу, может быть использован также, например, метиловый эфир глицина, бензиловый эфир глицина, метиловый эфир β-аланина, бензиловый эфир β-аланина, метиловый эфир аланина, метиловый эфир лейцина и метиловый эфир фенилаланина.
[0085]
В отношении флуоресцентного вещества, содержащего аминогруппу, включены также, например, 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-он, BODIPY (зарегистрированная торговая марка) TR Cadaverine, BODIPY (зарегистрированная торговая марка) FL Ethylenediamine, ALEXA FLUOR (зарегистрированная торговая марка) 594 Cadaverine, TEXAS RED (зарегистрированная торговая марка) Cadaverine и амин АТТО 594, а также их остатки с амидной связью.
[0086]
Ди-С1-С30 алкиламино-группа, которая может иметь заместитель, может быть линейной, разветвленной или циклической ди-С1-С30 алкиламино-группой, которая может иметь заместитель. То есть она представляет собой производное, в котором карбоксильная группа боковой цепи превращена в производное диалкиламидного типа. В отношении заместителя, диалкиламино-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу и т.п. Примеры ди-С1-С30 алкиламино-группы включают, но не ограничиваются ими, диметиламино-группу, диэтиламино-группу, дипропиламино-группу, диизопропиламино-группу, дибутиламино-группу, пирролидино-группу, пиперидино-группу, дибензиламино-группу, N-бензил-N-метиламино-группу, диоктиламино-группу, динониламино-группу, дидециламино-группу, дидодециламино-группу, дитетрадециламино-группу, дигексадециламино-группу, диоктадециламино-группу и диэйкозиламино-группу.
[0087]
С1-С8 алкиламинокарбонил-С1-С8-алкиламино-группа, которая может иметь заместитель, может представлять собой производное мочевинного типа, замещенное линейной, разветвленной или циклической С1-С8 алкильной группой, которая может иметь заместитель. Алкильные группы могут быть одинаковыми или различными. В отношении заместителя, алкиламинокарбонил-алкиламино-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу и т.п. Если алкиламинокарбонил-алкиламино-группа имеет заместитель, то предпочтительная диалкиламино-группа. Примеры С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, включают, но не ограничиваются ими, метиламинокарбонил-метиламино-группу, этиламинокарбонил-этиламино-группу, изопропиламинокарбонил изопропиламино-группу, циклогексиламинокарбонил-циклогексиламино-группу, этиламинокарбонил-(3-диметиламинопропил)амино-группу, и (3-диметиламинопропил)аминокарбонилэтиламино-группу.
[0088]
Сложноэфирное производное и/или амидное производное звена производного аспарагиновой кислоты и/или звена производного полиглутаминовой кислоты могут быть производными одного типа или могут быть смесью производных различных типов. Допустимо также, что карбоксильная группа боковой цепи представляет собой свободную кислоту или смесь их солей.
[0089]
В блок-сополимере согласно настоящему изобретению полиэтиленгликолевый сегмент и сегмент производного полиаминокислоты связаны друг с другом. Способ связи не имеет специального ограничения, при условии использования группы, которая связывает два сегмента полимера посредством химического связывания, и желательной группой является связывающая группа, содержащая функциональные группы, которые могут быть, соответственно, связаны с полиэтиленгликолевой концевой группой и концевой группой производного полиаминокислоты. Предпочтительна С1-С6 алкиленовая группа, содержащая связывающие функциональные группы в качестве концевых групп. Тип связывания полиэтиленгликолевого сегмента предпочтительно представляет собой простую эфирную связь через концевой атом кислорода полиоксиэтиленовой группы: (СН2СН2О), а тип связывания сегмента производного полиаминокислоты предпочтительно представляет собой амидную связь или сложноэфирную связь. То есть связывающая группа предпочтительно представляет собой группу -(CH2)s-NH- (где s представляет собой целое число от 1 до 6) или группу -(CH2)s-CO- (где s представляет собой целое число от 1 до 6).
[0090]
Блок-сополимер согласно настоящему изобретению характеризуется молекулярной массой от 2 килодальтон до 15 килодальтон. В отношении молекулярной массы блок-сополимера, в качестве молекулярной массы блок-сополимера используют рассчитанное значение, полученное суммированием соответствующей молекулярной массы каждой составляющей части. То есть в качестве молекулярной массы используют рассчитанное значение, полученное суммированием (1) молекулярной массы полиэтиленгликолевого сегмента, (2) молекулярной массы части главной цепи сегмента производного полиаминокислоты, (3) общей молекулярной массы физиологически активного вещества, полученной умножением молекулярной массы остатка физиологически активного вещества на количество его связей, и (4) общей молекулярной массы заместителей, отличных от физиологически активного вещества, полученной умножением молекулярной массы таких остатков на количество их связей. Таким образом, две концевые группы блок-сополимера или связывающих групп, которые образуют блок-сополимер, не учитывают для расчета молекулярной массы блок-сополимера, поскольку это не имеет практического смысла.
[0091]
Молекулярная масса блок-сополимера может представлять собой молекулярную массу, определенную с точностью до единиц килодальтон. Таким образом, метод анализа различных составляющих частей не имеет специального ограничения, при условии, что он представляет собой метод анализа с достаточной точностью для измерения молекулярной массы производного полиаминокислоты до единиц килодальтон, и в зависимости от обстоятельств могут быть выбраны различные методы анализа. Предпочтительный метод анализа для каждой составляющей части описан ниже.
[0092]
Молекулярная масса полиэтиленгликолевого звена в представленном выше слагаемом (1) представляет собой измеренное значение молекулярной массы полиэтиленгликолевого соединения, которое составляет полиэтиленгликолевый сегмент, и используют среднюю молекулярную массу, которая может быть определена по пиковой молекулярной массе, измеренной методом ГПХ на основании стандартных полиэтиленгликолевых продуктов.
[0093]
Молекулярная масса части главной цепи сегмента производного полиаминокислоты в представленном выше слагаемом (2) представляет собой рассчитанное значение, полученное умножением средней молекулярной массы полимеризованного мономерного звена сегмента на среднее количество полимеризованных звеньев. В отношении количества полимеризованных звеньев, предпочтительно использовать количество полимеризованных звеньев, рассчитанное методом количественного определения карбоксильных групп боковых цепей в полиаминокислоте методом нейтрализующего титрования, или количество полимеризованных звеньев, рассчитанное по интегральным значениям1Н-ЯМР. Предпочтительно использовать метод нейтрализующего титрования.
[0094]
Общая молекулярная масса физиологически активного вещества в представленном выше слагаемом (3) представляет собой рассчитанное значение, полученное умножением молекулярной массы физиологически активного вещества на количество связей. Количество связей может быть определено методом расчета количества связей по измерению массы не прореагировавшей части физиологически активного вещества в реакционном растворе методом ВЭЖХ, или методом отщепления физиологически активного вещества из блок-сополимера, сопряженного с физиологически активным веществом, и количественного анализа молекул высвобожденного физиологически активного вещества или фрагментов, происходящих из него.
[0095]
Общая молекулярная масса заместителей, отличных от физиологически активного вещества, в представленном выше слагаемом (4) представляет собой рассчитанное значение, полученное умножением молекулярной массы остатков таких заместителей на количество их связей. Количество связей заместителей может быть определено методом измерения и расчета не прореагировавших остатков в реакционном растворе методом ВЭЖХ, или количественным анализом после гидролиза из полиаминокислоты. Количество полимеризованных звеньев также может быть рассчитано по интегральным значениям1Н-ЯМР.
[0096]
Блок-сополимер согласно настоящему изобретению имеет молекулярную массу от 2 килодальтон до 15 килодальтон. Молекулярная масса меньше 2 килодальтон приводит к тому, что блок-сополимер, сопряженный с физиологически активным веществом, не имеет достаточной способности к образованию наночастиц, и достаточная способность к проникновению в ткань-мишень не достигнута. Таким образом, эффект фармакологического действия физиологически активного вещества не может быть проявлен эффективно. С другой стороны, при молекулярной массе более 15 килодальтон блок-сополимер имеет сниженную способность к экскреции через почки, и, следовательно, увеличивается удерживание in vivo. Соответственно, может происходить сенсибилизация физиологически активным веществом нормальных тканей, отличных от ткани-мишени, пораженной заболеванием, и, следовательно, существует риск возникновения расстройств в нормальных тканях. Например, при использовании цитотоксического физиологически активного вещества можно предположить сохранение токсичности для крови, связанной с миелопатией. Следовательно, необходимо регулировать молекулярную массу до 15 килодальтон или менее. Молекулярная масса блок-сополимера предпочтительно составляет от 3 килодальтон до 12 килодальтон и более предпочтительно от 3 килодальтон до 10 килодальтон.
[0097]
Блок-сополимер согласно настоящему изобретению, содержащий физиологически активное вещество, сопряженное с ним, демонстрирует свойство самоассоциации в водном растворе. То есть блок-сополимер, сопряженный с физиологически активным веществом, обладает таким свойством, что при исследовании 1 мг/мл водного раствора блок-сополимера, сопряженного с физиологически активным веществом, анализом распределения частиц по размеру на основе метода динамического рассеяния с использованием лазерного излучения, блок-сополимер, сопряженный с физиологически активным веществом измеряют в виде наночастиц, имеющих среднеобъемный диаметр частиц от примерно нескольких нанометров до примерно 20 нанометров. Предпочтительно, что блок-сополимер, сопряженный с физиологически активным веществом, согласно настоящему изобретению имеет такое свойство, что указанный блок-сополимер образует наночастицы, имеющие максимальный размер частиц менее 20 нм в 1 мг/мл водном растворе. В таком случае используют анализ распределения частиц по размеру в водном растворе на основе чистой воды. Предпочтительно, блок-сополимер, сопряженный с физиологически активным веществом, характеризуется тем, что среднеобъемный диаметр частиц, измеренный методом анализа распределения частиц по размеру на основе метода динамического светорассеяния с применением лазерного излучения, составляет менее 20 нм и более предпочтительно, указанный блок-сополимер имеет такое свойство, что блок-сополимер анализируют как наночастицы, имеющие размер частиц от 3 до 15 нм.
[0098]
Среднеобъемный диаметр частиц согласно настоящему изобретению представляет собой размер частиц пика, который существует как наибольшая часть в объемном распределении, которое может быть измерено, например, с помощью анализатора дзета-потенциала/размера частиц NICOMP 380 ZLS (метод анализа: метод NICOMP) производства компании Particle Sizing Systems, LLC, или с помощью анализатора размера частиц и дзета-потенциала ZETASIZER NANO ZS (метод анализа: метод NNLS) производства компании Malvern Instruments, Ltd.
[0099]
Поскольку блок-сополимер, сопряженный с физиологически активным веществом, согласно настоящему изобретению представляет собой блок-сополимер, в котором гидрофильный полиэтиленгликолевый сегмент связан с сегментом производного полиаминокислоты, который демонстрирует гидрофобность за счет физиологически активного вещества или другой гидрофобной боковой цепи, сделано предположение, что в водном растворе сегменты производного полиаминокислоты из множества молекул блок сополимера ассоциируются друг с другом вследствие гидрофобного взаимодействия сегмента производного полиаминокислоты. Следовательно, сделано предположение, что образуются ассоциированные объекты типа мицеллы, которые имеют структуру из ядра и оболочки, в которых сегмент производного полиаминокислоты образует внутреннее ядро (ядерную часть), а гидрофильный полиэтиленгликолевый сегмент покрывает периферию внутреннего ядра и образует внешний слой оболочки (оболочечную часть), и их можно наблюдать в виде наночастиц, описанных выше.
[0100]
Блок-сополимер, сопряженный с физиологически активным веществом, согласно настоящему изобретению, должен обладать свойством образования наночастиц в водном растворе для усиления эффекта фармакологического действия физиологически активного вещества и/или для уменьшения неблагоприятных эффектов.
[0101]
В качестве показателя свойства образования наночастиц блок-сополимера, сопряженного с физиологически активным веществом, согласно настоящему изобретению эффективно использовать интенсивность светорассеяния, полученную с помощью лазерного излучения. То есть свойства образования наночастиц блок-сополимера, сопряженного с физиологически активным веществом, в водном растворе могут быть проверены с применением интенсивности светорассеяния лазерного излучения в качестве показателя. В таком случае эффективен способ проверки свойств образования наночастиц блок-сополимера, сопряженного с физиологически активным веществом, в водном растворе с применением толуола в качестве стандартного образца интенсивности светорассеяния и с применением относительной интенсивности относительно толуола, в качестве показателя.
[0102]
Блок-сополимер, сопряженный с физиологически активным веществом, согласно настоящему изобретению является таким, что интенсивность рассеяния лазерного излучения в 1 мг/мл водном растворе блок-сополимера по меньшей мере в два раза или более выше, чем относительная интенсивность светорассеяния толуола.
[0103]
Если относительная интенсивность светорассеяния является менее чем двукратной, то показано, что блок-сополимер, сопряженный с физиологически активным веществом, не имеет достаточного свойства образования наночастиц, и достаточная способность к проникновению в ткань-мишень не достигнута. Таким образом, эффект фармакологического действия физиологически активного вещества не может быть проявлен эффективно. Согласно настоящему изобретению, значение относительной интенсивности светорассеяния представляет собой показатель, демонстрирующий, что блок-сополимер обладает способностью к образованию наночастиц, и приемлемо любое значение, при условии, что оно в два раза превышает интенсивность светорассеяния толуола, без каких-либо конкретных ограничений. То есть можно сказать, что даже если относительная интенсивность светорассеяния выше более чем в 100 раз, то блок-сополимер обладает достаточной способностью к образованию наночастиц. Однако можно предположить, что при более чем 100-кратной интенсивности светорассеяния блок-сополимер может не иметь требуемой способности к экскреции. В таком случае, поскольку увеличено удерживание блок-сополимера in vivo, может происходить сенсибилизация физиологически активным веществом нормальных тканей, отличных от ткани-мишени, пораженной заболеванием, и, следовательно, существует риск возникновения расстройств в нормальных тканях. Таким образом, необходимо регулировать относительную интенсивность светорассеяния на уровне 100 крат или менее.
[0104]
Блок-сополимер, сопряженный с физиологически активным соединением, согласно настоящему изобретению, является таким, что интенсивность светорассеяния его водного раствора предпочтительно в 2-50 раз и более предпочтительно в 2-30 раз выше относительной интенсивности светорассеяния толуола.
[0105]
В отношении метода измерения интенсивности светорассеяния, полученного с помощью лазерного излучения, для анализа свойств образования наночастиц блок-сополимера, сопряженного с физиологически активным веществом, согласно настоящему изобретению, подходит способ с применением 1 мг/мл водного раствора блок-сополимера, сопряженного с физиологически активным веществом, в качестве экспериментального образца, и измерения интенсивности светорассеяния с помощью фотометра для измерения рассеяния лазерного излучения при температуре измерения 25°С, угле рассеяния 90° и длине волны 632,8 нм. Примеры измерительного прибора могут включать, но не ограничиваются ими, фотометр для измерения динамического светорассеяния производства компании Otsuka Electronics Co., Ltd., DLS-8000DL (температура измерения: 25°С, угол рассеяния: 90°, длина волны: 632,8 нм, нейтральный фильтр: 2,5%, РН1: открыт, РН2: щель).
[0106]
Измерение интенсивности светорассеяния представляет собой анализируемое значение, полученное с применением водного раствора, полученного с использованием чистой воды, которая не содержит микрочастиц, в качестве аналитического образца. Необязательно, вещество может быть растворено в водном растворе с помощью ультразвука во время получения раствора. Водный раствор, полученный таким образом, предпочтительно представляет собой водный раствор, который дополнительно подвержен фильтрационной обработке для удаления микрочастиц субмикронного размера.
[0107]
В отношении толуола, который используют в качестве стандартного вещества для измерения интенсивности светорассеяния, может быть использован любой толуол без специальных ограничений, при условии, что толуол имеет реактивную степень чистоты. Предпочтительно использовать толуол, подверженный предварительной фильтрации, которую обычно осуществляют для получения образца для анализа светорассеяния.
[0108]
Блок-сополимер согласно настоящему изобретению предпочтительно является таким, что массовое содержание полиэтиленгликолевого сегмента составляет от 10% по массе до 80% по массе. То есть предпочтительно, что доля, которая приходится на молекулярную массу, соответствующую полиэтиленгликолевому сегменту, в молекулярной массе блок-сополимера составляет от 10% по массе до 80% по массе. Если массовое содержание полиэтиленгликолевого сегмента составляет менее 10% по массе, существует риск заметного снижения растворимости в воде и, следовательно, в водном растворе может отсутствовать образование наночастиц вследствие самоассоциации. С другой стороны, если массовое содержание полиэтиленгликолевого сегмента составляет более 80% по массе, то составляющая часть сегмента производного полиаминокислоты, которая отвечает за свойства самоассоциации, снижена, и, следовательно, существует риск снижения свойств образования наночастиц за счет гидрофобного взаимодействия. Предпочтительно обеспечивать такое массовое содержание полиэтиленгликолевого сегмента, чтобы достигать достаточной эффективности и снижения неблагоприятных эффектов.
[0109]
Более предпочтительно, доля молекулярной массы полиэтиленгликолевого сегмента составляет от 20% по массе до 70% по массе и особенно предпочтительно от 30% по массе до 65% по массе.
[0110]
Блок-сополимер согласно настоящему изобретению предпочтительно является таким, что массовое содержание физиологически активного вещества с гидроксильной группой и/или аминогруппой предпочтительно составляет от 10% по массе до 60% по массе. Если относительное содержание физиологически активного вещества ниже 10% по массе, то существует риск, что количество активного ингредиента, демонстрирующего фармакологическую активность, может становиться низкой, и эффективность может быть ухудшена. С другой стороны, если относительное содержание физиологически активного вещества составляет более 60% по массе, то существует риск, что баланс свойств самоассоциации блок-сополимера может быть заметно ухудшен, и что требуемые свойства образования наночастиц могут не быть обеспечены.
[0111]
Массовое содержание фармакологически активного вещества предпочтительно составляет от 10% по массе до 50% по массе и более предпочтительно от 10% по массе до 40% по массе.
[0112]
Блок-сополимер согласно настоящему изобретению предпочтительно представляет собой блок-сополимер, представленный общей формулой (1):
[0113]

где R1 представляет собой атом водорода или С1-С6 алкильную группу, которая может иметь заместитель; t представляет собой целое число от 20 до 270; А представляет собой С1-С6 алкиленовую группу, которая может иметь заместитель; R2 представляет собой заместитель, выбранный из группы, состоящей из атома водорода, С1-С6 ацильной группы и С1-С6 алкоксикарбонильной группы; R3 представляет собой остаток физиологически активного вещества с гидроксильной группой и/или аминогруппой;
R4 представляют собой один или более заместителей, выбранных из группы, состоящей из линейно, разветвленной или циклической С1-С30 алкокси-группы, которая может иметь заместитель, линейной, разветвленной или циклической С1-С30 алкиламино-группы, которая может иметь заместитель, линейной, разветвленной или циклической С1-С30 диалкиламино-группы, которая может иметь заместитель, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, остатка гидрофобного флуоресцентного вещества и гидроксильной группы; В представляет собой связывающую группу; n равен 1 или 2; x1, х2, y1, у2 и z, каждый независимо, представляют собой целое число от 0 до 25; (x1+х2) равно целому числу от 1 до 25; (x1+x2+y1+у2+z) равно целому числу от 3 до 25; и каждое составное звено, с которым связан R3 или R4, и составное звено, в котором внутримолекулярно циклизована карбонильная группа боковой цепи, независимо расположены случайным образом.
[0114]
С1-С6 алкильная группа, которая может иметь заместитель для R1, может быть линейной, разветвленной или циклической С1-С6 алкильной группой, которая может иметь заместитель. Ее примеры включают, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, циклопентильную группу, н-гексильную группу и циклогексильную группу.
[0115]
Примеры заместителя, который может быть присоединен, могут включать, но не ограничиваются ими, атом галогена, нитро-группу, циано-группу, гидроксильную группу, меркапто-группу, карбоциклическую или гетероциклическую арильную группу, алкилтио-группу, арилтио-группу, алкилсульфинильную группу, арилсульфинильную группу, алкилсульфонильную группу, арилсульфонильную группу, сульфамоильную группу, алкокси-группу, арилокси-группу, ацилокси-группу, алкоксикарбонилокси-группу, карбамоилокси-группу, замещенную или незамещенную аминогруппу, ациламино-группу, алкоксикарбониламино-группу, уреидо-группу, сульфониламино-группу, сульфамоиламино-группу, формильную группу, ацильную группу, карбоксильную группу, алкоксикарбонильную группу, карбамоильную группу и силильную группу. Положение замещения в ароматическом кольце может представлять собой орто-положение, мета-положение или пара-положение.
[0116]
Примеры R1 включают, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, бензильную группу, 2,2-диметоксиэтильную группу, 2,2-диэтоксиэтильную группу и 2-формилэтильную группу. В частности, более предпочтительна метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, втор-бутильная группа, трет-бутильная группа и т.п.
[0117]
В общей формуле (1) t представляет собой количество полимеризованных этиленокси-групп в полиэтиленгликолевом сегменте. Такой t представляет собой целое число от 20 до 270. То есть молекулярная масса полиэтиленгликолевого сегмента составляет от 0,8 килодальтон до 12 килодальтон.
[0118]
Если t меньше 20, то получаемый в результате блок-сополимер, сопряженный с физиологически активным веществом, не имеет достаточной растворимости в воде, и существует риск отсутствия требуемой биокинетики. С другой стороны, если t больше 270, то содержание сегмента производного полиаминокислоты, который отвечает за относительную гидрофобность, становится меньше и, следовательно, существует риск, что требуемые свойства самоассоциации могут не быть достигнуты, и биокинетика, связанная с ними, может отсутствовать. Предпочтительно, t представляет собой целое число от 22 до 230 и более предпочтительно целое число от 30 до 180. То есть молекулярная масса полиэтиленгликолевого сегмента предпочтительно составляет от 1 килодальтон до 10 килодальтон и более предпочтительно от 1,3 килодальтон до 8 килодальтон.
[0119]
Примеры С1-С6 алкиленовой группы, которая может иметь заместитель для А, включают, но не ограничиваются ими, метиленовую группу, этиленовую группу, н-пропиленовую группу и н-бутиленовую группу. В отношении заместителя, который может быть присоединен, может быть включена гидроксильная группа, атом галогена, аминогруппа, алкиламино-группа, диалкиламино-группа, алкокси-группа, арильная группа или т.п.
[0120]
В частности, такой А более предпочтительно представляет собой этиленовую группу или н-пропиленовую группу.
[0121]
С1-С6 ацильная группа, которая может иметь заместитель для R2, может быть линейной, разветвленной или циклической С1-С6 ацильной группой, которая может иметь заместитель. В отношении заместителя, может быть включена гидроксильная группа, атом галогена, аминогруппа, алкиламино-группа, диалкиламино-группа, алкокси-группа, арильная группа или т.п. Примеры С1-С6 ацильной группы для R2 включают, но не ограничиваются ими, формильную группу, ацетильную группу, трихлорацетильную группу, трифторацетильную группу, пропионильную группу, пивалоильную группу, бензилкарбонильную группу и фенетилкарбонильную группу. Более предпочтительна линейная, разветвленная или циклическая С1-С4 ацильная группа, которая может иметь заместитель, и более предпочтительная ацетильная группа, трихлорацетильная группа и трифторацетильная группа.
[0122]
С1-С6 алкоксикарбонильная группа, которая может иметь заместитель для R2, может быть линейной, разветвленной или циклической С1-С6 алкоксикарбонильной группой, которая может иметь заместитель. В отношении заместителя, может быть включена гидроксильная группа, атом галогена, аминогруппа, алкиламино-группа, диалкиламино-группа, алкокси-группа, арильная группа или т.п. Примеры С1-С6 алкоксикарбонильной группы для R2 включают, но не ограничиваются ими, метоксикарбонильную группу, этоксикарбонильную группу, трет-бутоксикарбонильную группу, бензилоксикарбонильную группу и 9-флуоренилметилоксикарбонильную группу.
[0123]
R3 представляет собой остаток физиологически активного вещества с гидроксильной группой и/или аминогруппой. То есть гидроксильная группа и/или аминогруппа представляет собой способную образовывать связь функциональную группу, и указанный остаток представляет собой остаток, полученный отщеплением атома водорода от такой функциональной группы, образующей связь. Физиологически активное вещество с гидроксильной группой и/или аминогруппой может быть использовано без каких-либо конкретных ограничений. Однако поскольку настоящее изобретение предназначено для применения в качестве фармацевтического продукта, предпочтительно использовать активный ингредиент фармацевтического продукта, и предпочтительно использовать известный фармацевтически активный ингредиент или соединение, представляющее собой потенциальный фармацевтически активный ингредиент, которое содержит гидроксильную группу и/или аминогруппу. Кроме того, в качестве физиологически активного вещества с гидроксильной группой и/или аминогруппой может быть использовано любое вещество, включая известный фармацевтически активный ингредиент или соединение, которое представляет собой потенциальный фармацевтически активный ингредиент, без каких-либо конкретных ограничений. То есть, посредством превращения фармацевтически активного ингредиента или соединения, представляющего собой потенциальный фармацевтически активный ингредиент, в его производное или пролекарство и внедрения гидроксильной группы и/или аминогруппы, фармацевтически активный ингредиент или соединение, представляющее собой потенциальный фармацевтически активный ингредиент, может быть использовано в качестве физиологически активного вещества с гидроксильной группой и/или аминогруппой.
[0124]
Поскольку представленный блок-сополимер согласно настоящему изобретению характеризуется улучшенной характеристикой проникновения в ткань, то указанный блок-сополимер предпочтительно использовать для лечения очаговых заболеваний тканей. Примеры таких заболеваний включают злокачественные опухолевые заболевания, воспалительные заболевания, инфекционные заболевания и т.п. Следовательно, в отношении физиологически активного вещества согласно настоящему изобретению предпочтительно использовать активный ингредиент для фармацевтического продукта, который используют для лечения таких заболеваний.
[0125]
Примеры физиологически активных веществ, которые используют для лечения злокачественных опухолевых заболеваний, включают, но не ограничиваются ими, производные камптотецина, такие как 7-этил-10-гидроксикамптотецин, иринотекан, ногитекан и 9-аминокамптотецин; производные таксана, такие как паклитаксел, доцетаксел и кабазитаксел; производные антрациклина, такие как доксорубицин, эпирубицин, амрубицин, даунорубицин, идарубицин и пирарубицин; производные рапамицина, такие как сиролимус, эверолимус и темсиролимус; антиметаболиты на основе цитидина, такие как гемцитабин, цитозинарабинозид, эноцитабин, цитарабина окфосфат, этинилцитидин, азацитидин и децитабин; антиметаболиты фолиевой кислоты, такие как метотрексат, пеметрексед, левофолинат и фолинат; антиметаболиты на основе пурина, такие как флударабин, неларабин, пентостатин и кладрибин; антиметаболиты на основе фторированного пиримидина, такие как доксифлуридин, капецитабин, тегафур, фторурацил и кармофур; платиносодержащие соединения, такие как цисплатин, карбоплатин, оксалиплатин и недаплатин; производные резорцина, обладающие ингибирующей активностью в отношении HSP90, такие как ганетеспиб и луминеспиб; производные митомицина, такие как митомицин С; производные блеомицина, такие как блеомицин и либромицин; производные алкалоидов барвинка, такие как винкристин, винбластин, виндезин и винорелбин; производные подофиллотоксина, такие как этопозид и тенипозид; производные галихондрина, такие как эрибулин; производные стуароспорина, такие как ребеккамицин и UCN-01; производные талидомида, такие как леналидомид и помалидомид; производные витамина А, такие как третиноин и тамибаротен; ингибиторы протеасом, такие как ботрезомиб, карфилзомиб и иксазомиб; производные комбретастатина, такие как комбретастатин А4; ингибиторы MEK, такие как биниметиниб, кобиметиниб и траметиниб; ингибиторы CDK, такие как динациклиб, флавопиридол и палбоциклиб; ингибиторы киназы Raf, такие как дабрафениб, сорафениб и вемурафениб; ингибиторы HDAC, такие как вориностат, белиностат, панабиностат и ромидепсин; ингибиторы полимеризации актина, такие как цитохалазин, латрункулин и фаллоидин; ингибиторы PARP, такие как велипариб, рукапариб и олапариб; ингибиторы тирозинкиназы, такие как кризотиниб, иматиниб, гефитиниб, эрлотиниб, афатиниб, дазатиниб, бусутиниб, вандетаниб, сунитиниб, акситиниб, пазопаниб, ленватиниб, лапатиниб, нинтеданиб, нилотиниб, церитиниб, алектиниб, руксолитиниб, кризотиниб и ибрутиниб; алкилирующие агенты на основе азотистых ипритов, такие как бендамустин, циклофосфамид, ифосфамид, бусульфан и мелфалан; алкилирующие агенты на основе нитрозомочевины, такие как нимустин, ранимустин и ломустин; алкилирующие агенты, такие как дакарбазин, темозоломид, прокарбазин и тиотепа; ингибиторы ароматазы, такие как анастрозол, эксеместан, летрозол и фадрозол; антиандрогенные производные, такие как гидроксифлутамид, флутамид, бикалутамид и энзалутамид; ингибиторы CYP17 (лиазы), такие как абиратерон; антиэстрогенные агенты, такие как тамоксифен и торемифен; и гормональные агенты, такие как эстрамустин, прогестерон, митотан и медроксипрогестерон.
[0126]
Примеры физиологически активных веществ, которые используют для лечения воспалительных заболеваний, включают, но не ограничиваются ими, производные такролимуса, такие как такролимус; стероидные производные, такие как дексаметазон и преднизолон; производные рапамицина, такие как сиролимус, эверолимус и темсиролимус; иммунодепрессанты, такие как циклоспорин, финголимод, азатиоприн, мизорибин, микофенолят мофетил и гусперимус; и нестероидные противовоспалительные агенты (NSAID), такие как дифлунизал и тиарамид.
[0127]
Примеры физиологически активных веществ, которые используют для лечения инфекционных заболеваний, включают, но не ограничиваются ими, противогрибковые агенты, такие как антибиотики на основе полиенов, такие как амфотерицин В и нистатин, производные на основе азола, такие как флуконазол и вориконазол, производные на основе кандина, такие как микафунгин, и производные пиримидина, такие как флуцитозин; противовирусные агенты, такие как ацикловир, валацикловир и ганцикловир; и противовирусные агенты, такие как занамивир, озельтамивир и ланинамивир.
[0128]
Настоящее изобретение представляет собой технологию, связанную с применением блок-сополимера в качестве носителя физиологически активного вещества, и весьма практичную технологию, которая может быть использована в отношении всех веществ без особого ухудшения в результате функции фармакологической активности или химической структуры и физических свойств используемого физиологически активного вещества. Таким образом, настоящее изобретение не ограничено указанными физиологически активными веществами, которые используют для лечения заболеваний, и оно может быть использовано с любым веществом при условии, что такое вещество является физиологически активным веществом, имеющим гидроксильную группу и/или аминогруппу, образующую связь.
[0129]
В отношении физиологически активного вещества с гидроксильной группой и/или аминогруппой согласно настоящему изобретению, более предпочтительно, что физиологически активное вещество представляет собой известный фармацевтически активный агент или соединение, которое потенциально является фармацевтически агентом, которое содержит гидроксильную группу и/или аминогруппу, без превращения в производное или пролекарство.
[0130]
Примеры физиологически активных веществ, которые используют для лечения злокачественных опухолевых заболеваний, включают, но не ограничиваются ими, производные камптотецина, такие как 7-этил-10-гидроксикамптотецин, иринотекан, ногитекан и 9-аминокамптотецин; производные таксана, такие как паклитаксел, доцетаксел и кабазитаксел; производные антрациклина, такие как доксорубицин, эпирубицин, амрубицин, даунорубицин, идарубицин и пирарубицин; производные рапамицина, такие как сиролимус, эверолимус и темсиролимус; антиметаболиты на основе цитидина, такие как гемцитабин, цитозинарабинозид, эноцитабин, цитарабина окфосфат, этинилцитидин, азацитидин и децитабин; антиметаболиты фолиевой кислоты, такие как метотрексат, пеметрексед, левофолинат и фолинат; антиметаболиты на основе пурина, такие как флударабин, неларабин, пентостатин и кладрибин; антиметаболиты на основе фторированного пиримидина, такие как доксифлуридин и капецитабин; платиносодержащие соединения, такие как цисплатин, карбоплатин, оксалиплатин и недаплатин; производные резорцина, обладающие ингибирующей активностью в отношении HSP90, такие как ганетеспиб и луминеспиб; производные митомицина, такие как митомицин С; производные блеомицина, такие как блеомицин и либромицин; производные алкалоидов барвинка, такие как винкристин, винбластин, виндезин и винорелбин; производные подофиллотоксина, такие как этопозид и тенипозид; производные галихондрина, такие как эрибулин; производные стуароспорина, такие как ребеккамицин и UCN-01; производные талидомида, такие как леналидомид и помалидомид; производные витамина А, такие как третиноин; ингибиторы протеасом, такие как ботрезомиб, карфилзомиб и иксазомиб; производные комбретастатина, такие как комбретастатин А4; ингибиторы MEK, такие как биниметиниб и кобиметиниб; ингибиторы CDK, такие как динациклиб и флавопиридол; ингибиторы киназы Raf, такие как дабрафениб; ингибиторы HDAC, такие как вориностат, белиностат и панабиностат; ингибиторы полимеризации актина, такие как цитохалазин, латрункулин и фаллоидин; ингибиторы тирозинкиназы, такие как бозутиниб, кризотиниб и ибрутиниб; алкилирующие агенты на основе азотистых ипритов, такие как мелфалан; алкилирующие агенты на основе нитрозомочевины, такие как нимустин и ранимустин; алкилирующие агенты, такие как дакарбазин и прокарбазин; ингибиторы CYP17 (лиазы), такие как абиратерон; антиандрогенные производные, такие как гидроксифлутамид и бикалутамид; антиэстрогенные агенты, такие как тамоксифен; и гормональные агенты, такие как эстрамустин.
[0131]
Примеры физиологически активных веществ, которые используют для лечения воспалительных заболеваний, включают, но не ограничиваются ими, производные такролимуса, такие как такролимус; стероидные производные, такие как дексаметазон и преднизолон; производные рапамицина, такие как сиролимус, эверолимус и темсиролимус; иммунодепрессанты, такие как циклоспорин, финголимод, азатиоприн, мизорибин, микофенолят мофетил и гусперимус; и нестероидные противовоспалительные агенты (NSAID), такие как дифлунизал и тиарамид.
[0132]
Примеры физиологически активных веществ, которые используют для лечения инфекционных заболеваний, включают, но не ограничиваются ими, противогрибковые агенты, такие как антибиотики на основе полиенов, такие как амфотерицин В и нистатин, производные на основе азола, такие как флуконазол и вориконазол, производные на основе кандина, такие как микафунгин, и производные пиримидина, такие как флуцитозин; противовирусные агенты, такие как ацикловир, валацикловир и ганцикловир; и противовирусные агенты, такие как занамивир, озельтамивир и ланинамивир.
[0133]
Блок-сополимер согласно настоящему изобретению имеет улучшенные свойства миграции и проникновения в ткань-мишень, пораженную заболеванием, и имеет свойство улучшенной экскреции через почки и т.п. Таким образом, сенсибилизация физиологически активным веществом нормальной ткани, отличной от ткани-мишени, пораженной заболеванием, снижена, и обеспечен эффект снижения неблагоприятных эффектов. Следовательно, предпочтительно использовать физиологически активное вещество, которое используют для лечения заболевания с задачей снижения неблагоприятных эффектов в нормальных тканях. Примеры таких заболеваний включают злокачественные опухолевые заболевания и воспалительные заболевания. Таким образом, в качестве физиологически активного вещества, используемого согласно настоящему изобретению, предпочтительно использовать противоопухолевый агент против злокачественного опухолевого заболевания. Кроме того, предпочтительно использовать физиологически активное вещество против воспалительного заболевания.
[0134]
В отношении физиологически активного вещества, которое используют для лечения злокачественных опухолевых заболеваний, предпочтительны вышеупомянутые производные камптотецина, производные таксана, производные резорцина, производные антрациклина, производные рапамицина, антиметаболиты на основе цитидина, антиметаболиты фолиевой кислоты, антиметаболиты на основе пурина, антиметаболиты на основе фторированного пиримидина, платиносодержащие соединения, производные митомицина, производные блеомицина, производные алкалоидов барвинка, производные подофиллотоксина, производные галихондрина, производные стауроспорина, производные талидомида, производные витамина А, ингибиторы протеасом, производные комбретастатина, ингибиторы MEK, ингибиторы CDK, ингибиторы киназы Raf, Ингибиторы HDAC, ингибиторы полимеризации актина, ингибиторы PARP, ингибиторы тирозинкиназы, алкилирующие агенты на основе азотистых ипритов, алкилирующие агенты на основе нитрозомочевины, алкилирующие агенты, производные ингибиторов ароматазы, антиандрогенные агенты, ингибиторы CYP17 (лиазы), антиэстрогенные ингибиторы и гормональные агенты.
[0135]
Более предпочтительные производные камптотецина, производные таксана, производные резорцина, производные антрациклина, производные рапамицина, антиметаболиты на основе цитидина, антиметаболиты фолиевой кислоты и т.п. Особенно предпочтительны производные камптотецина, производные таксана, производные резорцина, производные рапамицина и т.п.
[0136]
В качестве физиологически активного вещества, которое используют для лечения воспалительных заболеваний, предпочтительны вышеупомянутые производные такролимуса, стероидные производные, производные рапамицина, иммунодепрессанты, NSAID и т.п., и наиболее предпочтительны производные такролимуса, стероидные производные и производные рапамицина.
[0137]
Физиологически активное вещество R3 является таким, что в одной молекуле блок-сополимера, сопряженного с физиологически активным веществом, могут присутствовать одинаковые соединения, или могут присутствовать различные виды соединений в виде смеси. Предпочтительно, R3 представляют собой одинаковые соединения.
[0138]
В общей формуле (1) n равен 1 или 2. Если n равен 1, то аминокислота, которая образует сегмент производного полиаминокислоты, представляет собой аспарагиновую кислоту. Если n равен 2, то аминокислота, которая образует сегмент производного полиаминокислоты, представляет собой глутаминовую кислоту. Таким образом, сегмент производного полиаминокислоты для общей формулы (1) представляет собой сегмент полиаспарагиновой кислоты, сегмент полиглутаминовой кислоты или сегмент поли(смешанной аспарагиновой кислоты и глутаминовой кислоты).
[0139]
В общей формуле (1) В представляет собой линкерную группу остатка физиологически активного вещества с гидроксильной группой и/или аминогруппой R3 и карбоксильной группой боковой цепи звена аспарагиновой кислоты и/или звена глутаминовой кислоты.
[0140]
Линкерная группа В представляет собой линкерную группу, которая образует сложноэфирную связь и/или амидную связь с гидроксильной группой и/или аминогруппой физиологически активного вещества, и образует сложноэфирную связь, амидную связь или сложную тиоэфирную связь с карбоксильной группой боковой цепи звена аспарагиновой кислоты и/или звена глутаминовой кислоты. Примеры включают, но не ограничиваются следующими, -CO-(CH2)х-O- (где x представляет собой целое число от 1 до 8), -CO-(CH2)x-NH- (где x представляет собой целое число от 1 до 8) и -CO-(CH2)x-S- (где x представляет собой целое число от 1 до 8).
[0141]
Производное аминокислоты может быть использовано в качестве линкерной группы В. Вариант реализации применения линкерной группы в случае использования производных аминокислот в качестве линкерной группы, представляет собой вариант реализации, в котором N-концевая аминогруппа производного аминокислоты образует амидную связь с карбоксильной группой боковой цепи, и С-концевая карбоксильная группа образует сложноэфирную связь или амидную связь с гидроксильной группой и/или аминогруппой физиологически активного вещества.
[0142]
При использовании в качестве линкерной группы В производного аминокислоты, может быть использована любая природная аминокислота или синтетическая аминокислота и ее форма с модифицированной боковой цепью. Также может быть использована любая L-форма, D-форма и рацемат. Их примеры могут включать, но не ограничиваются ими, глицин, аланин, β-аланин, лейцин, фенилаланин, серии, треонин, тирозин, аспарагиновую кислоту, глутаминовую кислоту, лизин, аргинин, гистидин, орнитин и цистеин. Примеры аминокислоты, имеющей модифицированную боковую цепь, включают, но не ограничиваются ими, алкильный сложный эфир аспарагиновой кислоты или глутаминовой кислоты, аралкильный сложный эфир аспарагиновой кислоты или глутаминовой кислоты, алкиламид аспарагиновой кислоты или глутаминовой кислоты, аралкиламид аспарагиновой кислоты или глутаминовой кислоты и алкилоксикарбонил-лизин, такой как Boc-лизин.
[0143]
Также может быть использовано производное гликолевой кислоты, которое обеспечивает гидроксильную группу и карбоксильную группу через метиленовую группу в качестве линкерной группы. Вариант реализации применения линкерной группы в случае использования производного гликолевой кислоты в качестве линкерной группы, представляет собой вариант реализации, в котором гидроксильная группа производного гликолевой кислоты образует сложноэфирную связь с карбоксильной группой боковой цепи, и карбоксильная группа образует сложноэфирную связь или амидную связь с гидроксильной группой и/или аминогруппой физиологически активного вещества.
[0144]
Примеры производных гликолевой кислоты включают, но не ограничиваются ими, гликолевую кислоту, молочную кислоту, яблочную кислоту, винную кислоту и лимонную кислоту. В случае использования поливалентной карбоновой кислоты, производное гликолевой кислоты предпочтительно является таким, что физиологически активное вещество связано с одной из групп карбоновой кислоты, а другая карбоксильная группа представляет собой сложноэфирное производное или амидное производное.
[0145]
Линкерные группы могут представлять собой линкерные группы одного вида, или могут присутствовать несколько видов линкерных групп в виде смеси.
[0146]
Кроме того, В предпочтительно представляет собой «связь». Термин «связь» относится к варианту реализации, в котором карбоксильная группа боковой цепи звена аспарагиновой кислоты и/или звена глутаминовой кислоты напрямую связана с гидроксильной группой и/или аминогруппой физиологически активного вещества посредством сложноэфирной связи или амидной связи, в частности, без участия линкерной группы.
[0147]
R4 в общей формуле (1) представляют собой один или более заместителей, выбранных из группы, состоящей из линейной, разветвленной или циклической С1-С30 алкокси-группы, которая может иметь заместитель, линейной, разветвленной или циклической С1-С30 алкиламино-группы, которая может иметь заместитель, линейной, разветвленной или циклической С1-С30 диалкиламино-группы, которая может иметь заместитель, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, остатка гидрофобного флуоресцентного вещества и гидроксильной группы.
[0148]
Для такого R4 может быть произвольно внедрена любая группа для регулирования физических свойств блок-сополимера, сопряженного с физиологически активным веществом, согласно настоящему изобретению. Например, посредством внедрения гидрофобной группы в R4 может быть увеличена гидрофобность сегмента поли(аспарагиновой кислоты и/или глутаминовой кислоты) блок-сополимера, сопряженного с физиологически активным веществом. С другой стороны, при внедрении в качестве R4 гидрофильного заместителя, включая ионную функциональную группу, способную образовывать соль, такую как аминогруппа, карбоксильная группа или гидроксильная группа, может быть увеличена гидрофильность сегмента полиглутаминовой кислоты блок-сополимера, сопряженного с физиологически активным веществом. В том случае, если R4 представляет собой гидроксильную группу, карбоксильная группа боковой цепи сегмента поли(аспарагиновой кислоты и/или глутаминовой кислоты) представляет собой свободную карбоновую кислоту.
[0149]
Заместители для R4 могут представлять собой заместители одного вида или могут быть заместителями нескольких видов.
[0150]
Линейная, разветвленная или циклическая С1-С30 алкокси-группа, которая может иметь заместитель, для R4 представляет собой алкокси-группу, в которой модифицирующая группа сложноэфирного типа связана с карбоксильной группой боковой цепи сегмента поли(аспарагиновой кислоты и/или глутаминовой кислоты). Алкокси-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. в качестве заместителя. Примеры С1-С30 алкокси-группы для R4 включают, но не ограничиваются ими, метокси-группу, этокси-группу, 1-пропокси-группу, изопропилокси-группу, н-бутокси-группу, трет-бутокси-группу, циклогексилокси-группу, бензилокси-группу, 40фенилбутилокси-группу, н-октилокси-группу, децилокси-группу, додецилокси-группу, тетрадецилокси-группу, гексадецилокси-группу, октадецилокси-группу, эйкозилокси-группу, докозилокси-группу, тетракозилокси-группу, гексакозилокси-группу, октакозилокси-группу и триаконтилокси-группу.
[0151]
Линейная, разветвленная или циклическая С1-С30 алкиламино-группа, которая может иметь заместитель, для R4 представляет собой алкиламино-группу, в которой модифицирующая группа алкиламидного типа связана с карбоксильной группой боковой цепи сегмента поли(аспарагиновой кислоты и/или глутаминовой кислоты). Алкиламино-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. в качестве заместителя. Примеры С1-С30 алкиламино-группы для R4 включают, но не ограничиваются ими, метиламино-группу, этиламино-группу, пропиламино-группу, изопропиламино-группу, бутиламино-группу, трет-бутиламино-группу, циклогексиламино-группу, бензиламино-группу, 4-фенилбутиламино-группу, октиламино-группу, дециламино-группу, додециламино-группу, тетрадециламино-группу, гексадециламино-группу, октадециламино-группу, эйкозиламино-группу, докозиламино-группу, тетракозиламино-группу, гексакозиламино-группу, октакозиламино-группу и триаконтиламино-группу.
[0152]
Кроме того, аминокислота, имеющая защищенную карбоксильную группу, включена в такую С1-С30 алкиламино-группу, которая может иметь заместитель. В качестве аминокислоты, содержащей защищенную карбоксильную группу, может быть использован также, например, метиловый эфир глицерина, бензиловый эфир глицина, метиловый эфир β-аланина, бензиловый эфир β-аланина, метиловый эфир аланина, метиловый эфир лейцина и метиловый эфир фенилаланина.
[0153]
Линейная, разветвленная или циклическая С1-С30 диалкиламино-группа, которая может иметь заместитель, для R4 представляет собой диалкиламино-группу, в карбоксильная группа боковой цепи сегмента поли(аспарагиновой кислоты и/или глутаминовой кислоты) связана с модифицирующей группой диалкиламидного типа. В качестве заместителя диалкиламино-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. Примеры ди-С1-С30 алкиламино-группы для R4 включают, но не ограничиваются ими, диметиламино-группу, диэтиламино-группу, дипропиламино-группу, диизопропиламино-группу, дибутиламино-группу, пирролидино-группу, пиперидино-группу, дибензиламино-группу, N-бензил-N-метиламино-группу, диоктиламино-группу, динониламино-группу, дидециламино-группу, дидодециламино-группу, дитетрадециламино-группу, дигексадециламино-группу, диоктадециламино-группу и диэйкозиламино-группу.
[0154]
С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группа, которая может иметь заместитель, для R4 представляет собой группу, в карбоксильная группа боковой цепи сегмента поли(аспарагиновой кислоты и/или глутаминовой кислоты) связана с модифицирующей группой мочевинного типа. Алкильные группы могут быть одинаковыми или различными. В качестве заместителя указанная группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. При наличии заместителя предпочтительной является диалкиламино-группа. Примеры С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, включают, но не ограничиваются ими, метиламинокарбонил-метиламино-группу, этиламинокарбонил-этиламино-группу, изопропиламинокарбонил-изопропиламино-группу, циклогексиламинокарбонил-циклогексиламино-группу, этиламинокарбонил-(3-диметиламинопропил)амино-группу, и (3-диметиламинопропил)аминокарбонилэтиламино-группу.
[0155]
R4 преимущественно представляет собой остаток флуоресцентного вещества. В отношении флуоресцентного вещества предпочтительно использовать флуоресцентное вещество с гидроксильной группой и/или аминогруппой для связывания с карбоксильной группой боковой цепи звена аспарагиновой кислоты и/или звена глутаминовой кислоты. Таким образом, в том случае, если R4 представляет собой остаток флуоресцентного вещества, это относится к остатку флуоресцентного вещества, в котором атом водорода удален из гидроксильной группы и/или аминогруппы.
[0156]
Флуоресцентное вещество предпочтительно представляет собой флуоресцентное вещество, содержащее аминогруппу, и его примеры включают, но не ограничиваются ими, 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-он, BODIPY (зарегистрированная торговая марка) TR Cadaverine, BODIPY (зарегистрированная торговая марка) FL Ethylenediamine, ALEXA FLUOR (зарегистрированная торговая марка) 594 Cadaverine, TEXAS RED (зарегистрированная торговая марка) Cadaverine и амин АТТО 594. Таким образом, остаток флуоресцентного вещества R4 включает такой остаток, образующийся после амидного связывания.
[0157]
R4 в общей формуле (1) может представлять собой гидроксильную группу. То есть карбоновая кислота боковой цепи сегмента поли(аспарагиновой кислоты и/или глутаминовой кислоты) представляет собой свободную карбоновую кислоту. В таком случае карбоновая кислота боковой цепи может быть в форме свободной кислоты или может быть в форме любой фармацевтически приемлемой соли карбоновой кислоты. Примеры соли карбоновой кислоты включают, но не ограничиваются ими, литиевую соль, натриевую соль, калиевую соль, магниевую соль, кальциевую соль и аммониевую соль, которые включены в настоящее изобретение.
[0158]
В общей формуле (1) каждый x1, x2, y1, y2 и z представляет собой содержание составляющего звена производного аспарагиновой кислоты и/или звена производного глутаминовой кислоты в сегменте поли(аспарагиновой кислоты и/или глутаминовой кислоты) блок-сополимера, и каждый представляет собой целое число от 0 до 25. Кроме того, (x1+x2+y1+y2+z) представляет собой количество полимеризованных звеньев сегмента поли(аспарагиновой кислоты и/или глутаминовой кислоты), и представляет собой целое число от 3 до 25. То есть предполагается, что сегмент поли(аспарагиновой кислоты и/или глутаминовой кислоты) представляет собой полимер, имеющий среднее количество полимеризованных звеньев от 3 до 25. Если значение (x1+x2+y1+y2+z) меньше 3, то получаемый в результате блок-сополимер не обладает свойствами самоассоциации, и существует риск, что интенсивность рассеяния лазерного излучения может не входить в оптимальный диапазон. С другой стороны, если количество полимеризованных звеньев больше 25, существует возможность, что молекулярная масса получаемого в результате блок-сополимера, сопряженного с физиологически активным веществом, может превышать 15 килодальтон, и существует риск отсутствия требуемой фармакокинетики. То есть, если значение (x1+x2+y1+y2+z), которое представляет собой количество полимеризованных звеньев сегмента поли(аспарагиновой кислоты и/или глутаминовой кислоты), не входит в диапазон от 3 до 25, существует риск того, что действие усиления эффекта фармакологического действия физиологически активного вещества и действие снижения неблагоприятных эффектов может не быть достигнут. Предпочтительно, количество полимеризованных звеньев производного полиаминокислоты задано подходящим образом, с учетом молекулярной массы блок-сополимера, сопряженного с физиологически активным веществом. Значение (x1+x2+y1+y2+z) предпочтительно представляет собой целое число от 5 до 20.
[0159]
Значение (x1+x2+y1+y2+z), которое представляет собой количество полимеризованных звеньев производного полиаминокислоты, может быть определено с помощью анализа1Н-ЯМР или нейтрализующего титрования блок-сополимера полиэтиленгликоля-поли(аспарагиновой кислоты и/или глутаминовой кислоты) до связывания с ним R3 и R4.
[0160]
В общей формуле (1) (x1+x2) представляет собой общее количество звеньев аспарагиновой кислоты и/или звеньев глутаминовой кислоты, сопряженных с физиологически активным веществом R3. Обязательная конфигурация должна содержать указанные звенья, сопряженные с физиологически активным веществом, и (x1+x2) представляет собой целое число от 1 до 25. Предпочтительно, (x1+x2) представляет собой целое число от 2 до 20 и более предпочтительно целое число от 3 до 15. Отношение (x1+x2) к (x1+x2+y1+y2+z), которое представляет собой количество полимеризованных звеньев сегмента производного поли(аспарагиновой кислоты и/или глутаминовой кислоты), составляет от 4% до 100%, предпочтительно от 10% до 90%, и более предпочтительно от 20% до 80%.
[0161]
Количество содержащихся звеньев аспарагиновой кислоты и/или звеньев глутаминовой кислоты, сопряженных с физиологически активным веществом, (x1+x2), рассчитывают по количеству физиологически активного вещества, сопряженного с ними, и по количеству полимеризованных звеньев сегмента поли(аспарагиновой кислоты и/или глутаминовой кислоты). Количество физиологически активного вещества, сопряженного с ними, можно определить способом отщепления физиологически активного вещества от блок-сополимера, сопряженного с физиологически активным веществом, и количественным анализом высвобожденного физиологически активного вещества. Кроме того, может быть использован также способ расчета указанного количества по реакционному соотношению физиологически активного вещества при получении блок-сополимера, сопряженного с физиологически активным веществом.
[0162]
В общей формуле (1) (y1+y2) представляет собой общее количество звеньев аспарагиновой кислоты и/или звеньев глутаминовой кислоты, с которыми связан R4. Кроме того, z представляет собой общее количество звеньев аспарагиновой кислоты и/или звеньев глутаминовой кислоты, имеющих структуру, в которой карбоксильная группа боковой цепи внутримолекулярно циклизована. Существуют необязательные конфигурации, и (y1+y2) и z представляют собой целые числа от 0 до 24. Предпочтительно, (y1+y2) и z представляют собой целые числа от 1 до 20. Отношение (y1+y2+z) к (x1+x2+y1+y2+z), которое представляет собой количество полимеризованных звеньев сегмента производного поли(аспарагиновой кислоты и/или глутаминовой кислоты), составляет от 0% до 96% и предпочтительно от 4% до 90%.
[0163]
Количество включенных звеньев аспарагиновой кислоты и/или звеньев глутаминовой кислоты, с которыми связан R4, которое связано с (y1+y2), рассчитывают по количеству, с которым связаны заместители R4, и по количеству полимеризованных звеньев сегмента поли(аспарагиновой кислоты и/или глутаминовой кислоты). Количество, с которым связаны заместители R4, может быть определено способом отщепления заместителя R4 от блок-сополимера и количественного анализа высвобожденного физиологически активного вещества. Может быть использован также способ расчета количества по реакционному отношению заместителя R4 при получении блок-сополимера. Указанное количество также может быть рассчитано по интегральным значениям1Н-ЯМР.
[0164]
В отношении блок-сополимера, сопряженного с физиологически активным веществом, согласно настоящему изобретению, сегмент поли(аспарагиновой кислоты и/или глутаминовой кислоты) представляет собой сегмент полимера, который содержит смесь звеньев аспарагиновой кислоты и/или звеньев глутаминовой кислоты, имеющих R3 в карбоксильной группе боковой цепи, звеньев аспарагиновой кислоты и/или звеньев глутаминовой кислоты, имеющих R4, и звеньев аспарагиновой кислоты и/или глутаминовой кислоты, имеющих структуру, в которой карбоксильные группы боковой цепи внутримолекулярно циклизованы. Структура сегмента представляет собой такую структуру сегмента, в которой одно или более звеньев существуют для каждого из составляющих звеньев, их расположение не имеет специального ограничения, и составляющие звенья расположены случайным образом и неравномерно.
[0165]
Блок-сополимер, сопряженный с физиологически активным веществом, представленный общей формулой (1), предпочтительно является таким, что массовое содержание физиологически активного вещества, представленного R3, составляет от 10% по массе до 60% по массе. Если содержание физиологически активного вещества меньше 10% по массе, то существует риск, что содержание физиологически активного вещества может быть низким, и эффект фармакологической активности может быть обеспечен недостаточно. С другой стороны, если содержание физиологически активного вещества больше 60% по массе, существует риск, что баланс гидрофильности и гидрофобности блок-сополимера, сопряженного с физиологически активным веществом, может существенно изменяться, и блок-сополимер может не иметь надлежащих свойств самоассоциации и может не обеспечивать требуемую фармакокинетику. Массовое содержание физиологически активного вещества предпочтительно составляет от 10% по массе до 50% по массе и еще более предпочтительно от 10% по массе до 40% по массе.
[0166]
Блок-сополимер, представленный общей формулой (1), характеризуется молекулярной массой от 2 килодальтон до 15 килодальтон. В отношении молекулярной массы блок-сополимера, в качестве молекулярной массы блок-сополимера используют рассчитанное значение, полученное суммированием соответствующей молекулярной массы каждой составляющей части. То есть в качестве молекулярной массы используют расчетное значение, полученное суммированием: (1) молекулярной массы полиэтиленгликолевого сегмента; (2) молекулярной массы части главной цепи сегмента производного полиаминокислоты; (3) общей молекулярной массы физиологически активного вещества, полученной умножением молекулярной массы остатка физиологически активного вещества на количество его связей; и (4) общей молекулярной массы заместителей, отличных от физиологически активного вещества, полученной умножением молекулярной массы таких остатков на количество их связей.
[0167]
Молекулярная масса блок-сополимера может представлять собой молекулярную массу, определенную с точностью до единиц килодальтон. Таким образом, метод анализа каждой составляющих части не имеет специального ограничения, при условии, что он представляет собой метод анализа с достаточной точностью для измерения молекулярной массы производного полиаминокислоты до единиц килодальтон, и в зависимости от обстоятельств могут быть выбраны различные методы анализа. Предпочтительные методы анализа для каждой составляющей части описаны ниже.
[0168]
Молекулярная масса полиэтиленгликолевого звена в представленном выше слагаемом (1) представляет собой измеренное значение молекулярной массы полиэтиленгликолевого соединения, которое составляет полиэтиленгликолевый сегмент, и используют среднюю молекулярную массу, которая может быть определена по пиковой молекулярной массе, измеренной методом ГПХ на основании стандартных полиэтиленгликолевых продуктов.
[0169]
Молекулярная масса части главной цепи сегмента производного полиаминокислоты в представленном выше слагаемом (2) представляет собой рассчитанное значение, полученное умножением молекулярной массы полимеризованного мономерного звена сегмента на среднее количество полимеризованных звеньев. В отношении количества полимеризованных звеньев, предпочтительно использовать количество полимеризованных звеньев, рассчитанное методом количественного определения карбоксильных групп боковых цепей в полиаминокислоте методом нейтрализующего титрования, или количество полимеризованных звеньев, рассчитанное по интегральным значениям1Н-ЯМР. Предпочтительно использовать метод нейтрализующего титрования.
[0170]
Общая молекулярная масса физиологически активного вещества в представленном выше слагаемом (3) представляет собой рассчитанное значение, полученное умножением молекулярной массы физиологически активного вещества на количество полимеризованных звеньев. Количество полимеризованных звеньев может быть определено методом расчета количества полимеризованных звеньев по измерению массы не прореагировавшей части физиологически активного вещества в реакционном растворе методом ВЭЖХ, или методом отщепления физиологически активного вещества из блок-сополимера, сопряженного с физиологически активным веществом, и количественного анализа молекул высвобожденного физиологически активного вещества или фрагментов, происходящих из него.
[0171]
Общая молекулярная масса заместителей, отличных от физиологически активного вещества, в представленном выше слагаемом (4) представляет собой рассчитанное значение, полученное умножением молекулярной массы остатков таких заместителей на количество их связей. Количество связей заместителей может быть определено методом измерения и расчета не прореагировавших остатков в реакционном растворе методом ВЭЖХ, или количественным анализом после гидролиза из полиаминокислоты. Количество полимеризованных звеньев также может быть рассчитано по интегральным значениям1Н-ЯМР.
[0172]
Блок-сополимер согласно настоящему изобретению имеет молекулярную массу от 2 килодальтон до 15 килодальтон. Молекулярная масса меньше 2 килодальтон приводит к тому, что блок-сополимер, сопряженный с физиологически активным веществом, не имеет достаточной способности к образованию наночастиц, и достаточная способность к проникновению в ткань-мишень не достигнута. Таким образом, эффект фармакологического действия физиологически активного вещества не может быть проявлен эффективно. С другой стороны, при молекулярной массе более 15 килодальтон блок-сополимер имеет сниженную способность к экскреции через почки, и, следовательно, увеличивается удерживание in vivo. Соответственно, может происходить сенсибилизация физиологически активным веществом нормальных тканей, отличных от ткани-мишени, пораженной заболеванием, и, следовательно, существует риск возникновения расстройств в нормальных тканях. Например, при использовании цитотоксического физиологически активного вещества можно предположить сохранение токсичности для крови, связанной с миелопатией. Следовательно, необходимо регулировать молекулярную массу до 15 килодальтон или менее. Молекулярная масса блок-сополимера предпочтительно составляет от 3 килодальтон до 12 килодальтон и более предпочтительно от 3 килодальтон до 10 килодальтон.
[0173]
Блок-сополимер, сопряженный с физиологически активным веществом, представленный общей формулой (1), демонстрирует свойство самоассоциации в водном растворе. То есть блок-сополимер, сопряженный с физиологически активным веществом, обладает таким свойством, что при исследовании 1 мг/мл водного раствора блок-сополимера, сопряженного с физиологически активным веществом, анализом распределения частиц по размеру на основе метода динамического рассеяния с использованием лазерного излучения, блок-сополимер, сопряженный с физиологически активным веществом измеряют в виде наночастиц, имеющих среднеобъемный диаметр частиц от примерно нескольких нанометров до примерно 20 нанометров. Предпочтительно, что блок-сополимер, сопряженный с физиологически активным веществом, согласно настоящему изобретению имеет такое свойство, что указанный блок-сополимер образует наночастицы, имеющие максимальный размер частиц не более 20 нм в 1 мг/мл водном растворе. В таком случае используют анализ распределения частиц по размеру в водном растворе на основе чистой воды. Предпочтительно, блок-сополимер, сопряженный с физиологически активным веществом, характеризуется тем, что среднеобъемный диаметр частиц, измеренный методом анализа распределения частиц по размеру на основе метода динамического светорассеяния с применением лазерного излучения, составляет менее 20 нм и более предпочтительно, указанный блок-сополимер имеет такое свойство, что блок-сополимер анализируют как наночастицы, имеющие размер частиц от 3 до 15 нм.
[0174]
Среднеобъемный диаметр частиц согласно настоящему изобретению представляет собой размер частиц пика, который существует как наибольшая часть в объемном распределении, которое может быть измерено, например, с помощью анализатора дзета-потенциала/размера частиц NICOMP 380 ZLS (метод анализа: метод NICOMP) производства компании Particle Sizing Systems, LLC, или с помощью анализатора размера частиц и дзета-потенциала ZETASIZER NANO ZS (метод анализа: метод NNLS) производства компании Malvern Instruments, Ltd.
[0175]
Поскольку блок-сополимер, сопряженный с физиологически активным веществом, представленный общей формулой (1), представляет собой блок-сополимер, в котором гидрофильный полиэтиленгликолевый сегмент связан с сегментом производного полиаминокислоты, который демонстрирует гидрофобность за счет физиологически активного вещества или другой гидрофобной боковой цепи, сделано предположение, что в водном растворе сегменты производного полиаминокислоты из множества молекул блок-сополимера ассоциируются друг с другом вследствие гидрофобного взаимодействия сегмента производного полиаминокислоты. Следовательно, сделано предположение, что образуются ассоциированные объекты типа мицеллы, которые имеют структуру из ядра и оболочки, в которых сегмент производного полиаминокислоты образует внутреннее ядро (ядерную часть), а гидрофильный полиэтиленгликолевый сегмент покрывает периферию внутреннего ядра и образует внешний слой оболочки (оболочечную часть), и их можно наблюдать в виде наночастиц, описанных выше.
[0176]
Блок-сополимер, сопряженный с физиологически активным веществом, представленный общей формулой (1), должен обладать свойством образования наночастиц в водном растворе для усиления эффекта фармакологического действия физиологически активного вещества и/или для уменьшения неблагоприятных эффектов.
[0177]
В качестве показателя свойства образования наночастиц блок-сополимера, сопряженного с физиологически активным веществом, эффективно использовать интенсивность светорассеяния, полученную с помощью лазерного излучения. То есть свойства образования наночастиц блок-сополимера, сопряженного с физиологически активным веществом, в водном растворе могут быть проверены с применением интенсивности светорассеяния лазерного излучения в качестве показателя. В таком случае эффективен способ проверки свойств образования наночастиц блок-сополимера, сопряженного с физиологически активным веществом, в водном растворе с применением толуола в качестве стандартного образца интенсивности светорассеяния и с применением относительной интенсивности относительно толуола, в качестве показателя.
[0178]
Блок-сополимер, сопряженный с физиологически активным веществом, согласно настоящему изобретению является таким, что интенсивность рассеяния лазерного излучения в 1 мг/мл водном растворе блок-сополимера по меньшей мере в два раза или более выше, чем относительная интенсивность светорассеяния толуола.
[0179]
Если относительная интенсивность светорассеяния является менее чем двукратной, можно предположить, что блок-сополимер, сопряженный с физиологически активным веществом, не имеет достаточного свойства образования наночастиц, и достаточная способность к проникновению в ткань-мишень не достигнута. Таким образом, эффект фармакологического действия физиологически активного вещества не может быть проявлен эффективно. Согласно настоящему изобретению, значение относительной интенсивности светорассеяния представляет собой показатель, демонстрирующий, что блок-сополимер обладает способностью к образованию наночастиц, и приемлемо любое значение, при условии, что оно в два раза превышает интенсивность светорассеяния толуола, без каких-либо конкретных ограничений. То есть можно сказать, что даже если относительная интенсивность светорассеяния выше более чем в 100 раз, то блок-сополимер обладает достаточной способностью к образованию наночастиц. Однако можно предположить, что при более чем 100-кратной интенсивности светорассеяния блок-сополимер может не иметь требуемой способности к экскреции. В таком случае, поскольку увеличено удерживание блок-сополимера in vivo, может происходить сенсибилизация физиологически активным веществом нормальных тканей, отличных от ткани-мишени, пораженной заболеванием, и, следовательно, существует риск возникновения расстройств в нормальных тканях. Таким образом, необходимо регулировать относительную интенсивность светорассеяния на уровне 100 крат или менее.
[0180]
Блок-сополимер, сопряженный с физиологически активным соединением, согласно настоящему изобретению, является таким, что интенсивность светорассеяния его водного раствора предпочтительно в 2-50 раз и более предпочтительно в 2-30 раз выше относительной интенсивности светорассеяния толуола.
[0181]
В отношении метода измерения интенсивности светорассеяния, полученного с помощью лазерного излучения, для анализа свойств образования наночастиц блок-сополимера, сопряженного с физиологически активным веществом, согласно настоящему изобретению, подходит способ с применением 1 мг/мл водного раствора блок-сополимера, сопряженного с физиологически активным веществом, в качестве экспериментального образца, и измерения интенсивности светорассеяния с помощью фотометра для измерения рассеяния лазерного излучения при температуре измерения 25°C, угле рассеяния 90° и длине волны 632,8 нм. Примеры измерительного прибора могут включать, но не ограничиваются ими, фотометр для измерения динамического светорассеяния производства компании Otsuka Electronics Co., Ltd., DLS-8000DL (температура измерения: 25°C, угол рассеяния: 90°, длина волны: 632,8 нм, нейтральный фильтр: 2,5%, РН1: открыт, РН2: щель).
[0182]
Измерение интенсивности светорассеяния представляет собой анализируемое значение, полученное с применением водного раствора, полученного с использованием чистой воды, которая не содержит микрочастиц, в качестве аналитического образца. Необязательно, вещество может быть растворено в водном растворе с помощью ультразвука во время получения раствора. Водный раствор, полученный таким образом, предпочтительно представляет собой водный раствор, который дополнительно подвержен фильтрационной обработке для удаления микрочастиц субмикронного размера.
[0183]
В отношении толуола, который используют в качестве стандартного вещества для измерения интенсивности светорассеяния, может быть использован любой толуол без специальных ограничений, при условии, что толуол имеет реактивную степень чистоты. Предпочтительно использовать толуол, подверженный предварительной фильтрации, которую обычно осуществляют для получения образца для анализа светорассеяния.
[0184]
Далее описан способ получения блок-сополимера, сопряженного с физиологически активным соединением, согласно настоящему изобретению. Можно упомянуть способ получения АВ-блок-сополимера, в котором полиэтиленгликолевый сегмент представленного блок-сополимера связан с полиаминокислотным сегментом, содержащим аспарагиновую кислоту и/или глутаминовую кислоту, и получения блок-сополимера, сопряженного с физиологически активным веществом посредством реакции конденсации между указанным АВ-блок-сополимером и физиологически активным веществом; способ связывания полимерного компонента, содержащего полиэтиленгликолевый сегмент, с производным полиаминокислоты, связанным с физиологически активным веществом; и т.п. Первый способ получения предварительного получения АВ-блок-сополимера, в котором полиэтиленгликолевый сегмент связан с полиаминокислотным сегментом, и получения блок-сополимера, сопряженного с физиологически активным веществом, посредством осуществления реакции конденсации между указанным блок-сополимером и физиологически активным веществом, является предпочтительным.
[0185]
В отношении способа получения АВ-блок-сополимера, в котором полиэтиленгликолевый сегмент связан с полиаминокислотным сегментом, можно упомянуть способ получения полиаминокислотного сегмента посредством последовательной полимеризации аминокислоты-ангидрида N-карбоновой кислоты с соединением, содержащим полиэтиленгликолевый сегмент; способ связывания полиэтиленгликолевого сегмента с полиаминокислотным сегментом; и т.п. Поскольку блок-сополимер обладает высокой реакционной способностью, и количество полимеризованных звеньев полиаминокислоты можно легко регулировать, то предпочтительно использовать первый способ.
[0186]
Далее описан вариант реализации способа получения блок-сополимера согласно настоящему изобретению посредством предварительного получения АВ-блок-сополимера, в котором полиэтиленгликолевый сегмент связан с сегментом производного полиаминокислоты, и связывания физиологически активного вещества, содержащего гидроксильную группу и/или аминогруппу, с АВ-блок-сополимером.
[0187]
Во-первых, производное полиэтиленгликоля, содержащее аминогруппу на одном конце (например, метоксиполиэтиленгликоль-1-пропиламин) подвергают последовательному взаимодействию с ангидридом N-карбониламинокислоты, содержащим соответствующим образом защищенную функциональную группу аминокислоты в боковой цепи, и получают сополимерный скелет АВ-блочного типа, в котором полиэтиленгликолевый сегмент связан с полиаминокислотным сегментом, посредством последовательной полимеризации. В таком случае аспарагиновая кислота и/или глутаминовая кислота может быть внедрена в полиаминокислотный сегмент посредством внедрения ангидрида N-карбониласпарагиновой кислоты и/или ангидрида N-карбонилглутаминовой кислоты, оба из которых содержат соответствующим образом защищенную карбоксильную группу в боковой цепи, в качестве ангидрида N-карбониламинокислоты. Затем полученный продукт подвергают соответствующей реакции снятия защиты, и, таким образом, может быть получен АВ-блок-сополимер, содержащий аспарагиновую кислоту и/или глутаминовую кислоту, содержащую карбоксильную группу со снятой защитой в боковой цепи. В отношении реакции снятия защиты, в том случае, если карбоксильная группа боковой цепи представляет собой β-бензиловый эфир, то реакция снятия защиты может быть осуществлена гидролизом в щелочных условиях или реакцией гидрогенолиза.
[0188]
Такой АВ-блок-сополимер полиэтиленгликоля и полиаминокислоты может быть подвергнут взаимодействию с физиологически активным веществом, содержащим аминогруппу и/или гидроксильную группу, в подходящем реакционном растворителе в условиях реакции конденсации.
[0189]
В отношении растворителя, который используют для реакции конденсации между АВ-блок-сополимером полиэтиленгликоля и полиаминокислоты и физиологически активным веществом, может быть использован любой растворитель, без специальных ограничений, при условии, что он представляет собой растворитель, в котором растворимы оба соединения. Его примеры могут включать, но не ограничиваются ими, водорастворимые органические растворители, такие как N,N-диметилформамид (ДМФА), N-метилпирролидон (NMP) и 1,3-диметил-2-имидазолидинон (DMI). Указанные растворители могут быть использованы по отдельности, или может быть использован смешанный растворитель из них. Растворитель также может представлять собой смешанный растворитель из вышеупомянутых растворителей и других органических растворителей.
[0190]
В отношении используемого конденсирующего агента, может быть использован любой обычный водоотнимающий конденсирующий агент, который вызывает реакцию образования сложного эфира между карбоновой кислотой и гидроксильной группой по реакции конденсации с отщеплением воды, и/или реакцию амидирования между карбоновой кислотой и аминогруппой по реакции конденсации с отщеплением воды, без каких-либо особых проблем. Примеры конденсирующего агента, который может быть использован, включают, но не ограничиваются ими, конденсирующие агенты на основе карбодиимида, такие как дициклогексилкарбодиимид (DCC), диизопропилкарбодиимид (DIPCI) и 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (WSC); конденсирующие агенты на основе триазина, такие как 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорида n-гидрат (DMT-MM); 1-этоксикарбонил-2-этокси-1,2-дигидрохинолин (EEDQ) и ди-трет-бутилдикарбонат (Boc2O). Во время реакции конденсации может быть также использована реакционная добавка, такая как N,N-диметиламинопиридин (DMAP), 1-гидроксибензотриазол (HOBt) или N-гидроксисукцинимид (HOSu). При использовании конденсирующего агента на основе карбодиимида, С1-С8 алкиламинокарбонил-(С1-С8) аминогруппа, которая может иметь заместитель, может быть внедрена одновременно с физиологически активным веществом в R4 общей формулы (1).
[0191]
В отношении температуры реакции, реакция может быть осуществлена обычно при температуре от 0°C до 180°C и предпочтительно от 5°C до 100°C.
[0192]
Для регулирования свойств самоассоциации представленного сополимера, сопряженного с физиологически активным веществом, в полиаминокислотный сегмент может быть внедрен другой гидрофобный заместитель, такой как С1-С30 алкокси-группа, С1-С30 алкиламино-группа или ди-С1-С30 алкиламиногруппа. В отношении способа, может быть использован способ активации карбоксильных групп сополимера полиэтиленгликоля и полиаминокислоты посредством добавления конденсирующего агента, а затем взаимодействия указанного сополимера со спиртовым соединением или аминосоединением, которое соответствует гидрофобному заместителю, подлежащему внедрению, в требуемых эквивалентных количествах; или способ активации спиртового соединения или аминосоединения с последующим взаимодействием активированного соединения с полиаминокислотным сегментом указанного сополимера.
[0193]
В таком случае физиологически активное вещество может быть внедрено после внедрения гидрофобного заместителя посредством спиртового соединения или аминосоединения, или такое внедрение может быть осуществлено в обратном порядке. Физиологически активное вещество и гидрофобный заместитель также могут быть внедрены одновременно.
[0194]
Гидрофобные заместители могут быть заместителями одного вида или могут быть заместителями нескольких видов. В случае внедрения нескольких видов заместителей, может быть синтезирована смесь различных гидрофобных заместителей, если различные спиртовые соединения или аминосоединения приводят во взаимодействие многократно.
[0195]
После внедрения в АВ-блок-сополимер полиэтиленгликоля и аминокислоты физиологически активного вещества и необязательного гидрофобного заместителя, необязательно осуществляют обычные операции разделения или операции очистки. Таким образом, может быть получен блок-сополимер, сопряженный с физиологически активным веществом, согласно настоящему изобретению.
[0196]
Блок-сополимер, сопряженный с физиологически активным соединением, согласно настоящему изобретению обладает свойством медленного расщепления и высвобождения физиологически активного вещества после введения in vivo. Высвобожденное физиологически активное вещество может обеспечивать фармакологический эффект. Таким образом, блок-сополимер, сопряженный с физиологически активным веществом, согласно настоящему изобретению может быть использован в качестве фармацевтического продукта, содержащего физиологически активное вещество в качестве активного ингредиента.
[0197]
Если блок-сополимер, сопряженный с физиологически активным веществом, согласно настоящему изобретению используют в качестве фармацевтического продукта, то блок-сополимер может быть использован посредством любого перорального способа введения и парентерального способа введения. Предпочтительно, блок-сополимер, сопряженный с физиологически активным веществом, составлен в лекарственную форму для введения парентеральным способом посредством инъекции. Введение посредством инъекции осуществляют внутривенным введением, внутриартериальным введением, подкожным введением, внутримышечным введением, введением в опухоль или т.п.
[0198]
Для лекарственной формы блок-сополимера, сопряженного с физиологически активным веществом, согласно настоящему изобретению могут быть использованы обычно применяемые фармацевтически приемлемые носители, например, связующее вещество, смазывающий агент, разрыхлитель, растворитель, вспомогательное вещество, солюбилизирующий агент, диспергатор, стабилизатор, суспендирующий агент, консервант, успокоительный агент, красящее вещество и вкусовая добавка.
[0199]
В случае жидкого препарата для инъекций обычно используют растворитель. Примеры растворителя включают, но не ограничиваются ими, воду, физиологический солевой раствор, 5% раствор глюкозы или маннита; водорастворимые органические растворители, такие как, например, глицерин, этанол, диметилсульфоксид, N-метилпирролидон, полиэтиленгликоль и хромофор, а также их жидкие смеси; и жидкие смеси воды и водорастворимых органических растворителей. Предпочтительно, блок-сополимер, сопряженный с физиологически активным веществом, используют после получения в виде фармацевтического препарата, пригодного для введения, с применением указанных добавок для составления лекарственной формы.
[0200]
Доза блок-сополимера, сопряженного с физиологически активным веществом, согласно настоящему изобретению варьируется в зависимости от вида сопрягаемого физиологически активного вещества, возраста, пола, физиологического состояния и болезненного состояния пациента, или т.п. Однако предпочтительно вводить блок-сополимер, сопряженный с физиологически активным веществом, парентерально, обычно в дозе от 0,01 до 500 мг/м2 и предпочтительно от 0,1 до 250 мг/м2 в пересчете на активный ингредиент, в сутки для взрослого человека.
[0201]
Предпочтительный вариант реализации настоящего изобретения может представлять собой вышеописанный блок-сополимер, в котором использовано производное камптотецина, представляющее собой противоопухолевый агент, в качестве физиологически активного вещества. Ниже описан блок-сополимер, сопряженный с производным камптотецина, в котором использовано производное камптотецина в качестве физиологически активного вещества.
[0202]
Производное камптотецина представляет собой, например, такое производное камптотецина, как 7-этил-10-гидроксикамптотецин, иринотекан или ногитекан. Указанные производные камптотецина содержат гидроксильную группу в 20 положении скелета камптотецина. Кроме того, 7-этил-10-гидроксикамптотецин и ногитекан содержат гидроксильную группу в 10 положении. Указанная гидроксильная группа в 10 положении и/или в 20 положении образует сложноэфирную связь с карбоксильной группой боковой цепи аспарагиновой кислоты и/или глутаминовой кислоты напрямую или с помощью подходящей линкерной группы.
[0203]
В отношении производного камптотецина, предпочтительно используют производное камптотецина, представленное общей формулой (2):
[0204]

где R5 представляет собой заместитель, выбранный из группы, состоящей из атома водорода, С1-С6 алкильной группы, которая может иметь заместитель, и силильной группы, которая может иметь заместитель; и R6 представляет собой атом водорода или С1-С6 алкильную группу, которая может иметь заместитель.
[0205]
Способ связывания указанного остатка согласно одному из вариантов реализации представляет собой связывания на основании сложноэфирной связи между гидроксильной группой производного камптотецина и карбоксильной группой боковой цепи аспарагиновой кислоты и/или глутаминовой кислоты полиаминокислотного сегмента. Сложноэфирная связь может быть образована с любой из гидроксильной группы в 10 положении и гидроксильной группы в 20 положении производного камптотецина, или может быть их смесью. Предпочтительно, способ связывания указанного остатка представляет собой сложноэфирную связь, образованную гидроксильной группой в 10 положении. Более предпочтителен вариант реализации, который не включает сложноэфирную связь гидроксильной группы в 20 положении производного камптотецина.
[0206]
С1-С6 алкильная группа, которая может иметь заместитель для R5 в общей формуле (2), может быть линейной, разветвленной или циклической С1-С6 алкильной группой, которая может иметь заместитель. В качестве заместителя указанная алкильная группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. Примеры С1-С6 алкильной группы для R5 включают, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу и бензильную группу. Более предпочтительная линейная, разветвленная или циклическая С1-С4 алкильная группа, которая может иметь заместитель, и, в частности, более предпочтительна этильная группа.
[0207]
Примеры силильной группы, которая может иметь заместитель, для R5включают, но не ограничиваются ими, триметилсилильную группу, триэтилсилильную группу, трет-бутилдиметилсилильную группу, триизопропилсилильную группу и трет-бутилдифенилсилильную группу. Предпочтительна трет-бутилдиметилсилильная группа.
[0208]
В отношении R5, предпочтителен атом водорода или С1-С6 алкильная группа, которая может иметь заместитель. Особенно предпочтителен атом водорода или этильная группа.
[0209]
С1-С6 алкильная группа, которая может иметь заместитель для R6 в общей формуле (2), может быть линейной, разветвленной или циклической С1-С6 алкильной группой, которая может иметь заместитель. В качестве заместителя указанная алкильная группа может иметь гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. Примеры С1-С6 алкильной группы для R6 включают, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, бензильную группу и диметиламинометильную группу. Особенно предпочтительно, R6 представляет собой атом водорода или диметиламинометильную группу.
[0210]
Производное камптотецина R3 в общей формуле (1) предпочтительно представляет собой 7-этил-10-гидроксикамптотецин и/или ногитекан (9-диметиламинометил-10-гидроксикамптотецин). То есть предпочтителен 7-этил-10-гидроксикамтотецин, который представляет собой соединение, представленное общей формулой (2), имеющее этильную группу для R5 и атом водорода для R6. Альтернативно, предпочтителен ногитекан (9-диметиламинометил-10-гидроксикамптотецин), который представляет собой соединение, представленное общей формулой (2), имеющее атом водорода для R5 и диметиламинометильную группу для R6.
[0211]
Вариант реализации с применением производного камптотецина в качестве фармакологически активного вещества согласно настоящему изобретению, предпочтительно представляет собой блок-сополимер, сопряженный с производным камптотецина, в котором R3 в общей формуле (1) представляет собой производное камптотецина. Пояснение представлено ниже.
[0212]
Блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению, представляет собой блок-сополимер, представленный общей формулой (1), в котором полиэтиленгликолевый сегмент связан с сегментом производного поли(аспарагиновой кислоты и/или глутаминовой кислоты), и представляет собой блок-сополимер, сопряженный с производным камптотецина, в котором R3 представляет собой остаток производного камптотецина. То есть блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению, представляет собой блок-сополимер, сопряженный с производным камптотецина, представленный общей формулой (1):
[0213]

где R1 представляет собой атом водорода или С1-С6 алкильную группу, которая может иметь заместитель; t представляет собой целое число от 20 до 270; А представляет собой С1-С6 алкиленовую группу, которая может иметь заместитель; R2 представляет собой заместитель, выбранный из группы, состоящей из атома водорода, С1-С6 ацильной группы и С1-С6 алкоксикарбонильной группы; R3 представляет собой остаток производного камптотецина; R4 представляют собой один или более заместителей, выбранных из группы, состоящей из линейной, разветвленной или циклической С1-С30 алкокси-группы, которая может иметь заместитель, линейной, разветвленной или циклической С1-С30 алкиламино-группы, которая может иметь заместитель, линейной, разветвленной или циклической С1-С30 диалкиламино-группы, которая может иметь заместитель, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, остатка гидрофобного флуоресцентного вещества и гидроксильной группы; В представляет собой линкерную группу; n равен 1 или 2; каждый x1, х2, y1, y2 и z независимо представляет собой целое число от 0 до 25; (x1+x2) равно целому числу от 1 до 25; (x1+x2+y1+y2+z) равно целому числу от 3 до 25; и каждое составное звено, с которым связан R3 или R4, и составное звено, в котором внутри молекулярно циклизована карбонильная группа боковой цепи, независимо расположены случайным образом.
[0214]
В данном случае общие формулы R1, R2, R4, А, В, t, x1, x2, y1, y2 и z имеют такие же значения, как описаны выше.
[0215]
Если R3 в общей формуле (1) представляет собой остаток производного камптотецина, то производное камптотецина может представлять собой 7-этил-10-гидроксикамптотецин, иринотекан, ногитекан или т.п. Указанные производные камптотецина содержат гидроксильную группу в 20 положении скелета камптотецина. Кроме того, 7-этил-10-гидроксикамптотецин и ногитекан содержат гидроксильную группу в 10 положении. Таким образом, производное камптотецина является таким, что его гидроксильная группа в 10 положении и/или гидроксильная группа в 20 положении образует сложноэфирную связь с карбоксильной группой боковой цепи аспарагиновой кислоты и/или глутаминовой кислоты.
[0216]
Что касается производного камптотецина в связи с остатком производного камптотецина R3, предпочтительно использовать производное камптотецина, представленное общей формулой (2):
[0217]

где R5 представляет собой один заместитель, выбранный из группы, состоящей из атома водорода, С1-С6 алкильной группы, которая может иметь заместитель, и силильной группы, которая может иметь заместитель; и R6 представляет собой атом водорода или С1-С6 алкильную группу, которая может иметь заместитель.
В данном случае R5 и R6 в общей формуле (2) имеют такие же значения, как описаны выше.
[0218]
В соответствии с одним из вариантов реализации, способ связывания указанного остатка представляет собой связывания на основании сложноэфирной связи между гидроксильной группой производного камптотецина и карбоксильной группой боковой цепи аспарагиновой кислоты и/или глутаминовой кислоты полиаминокислотного сегмента. Сложноэфирная связь может быть образована любой из гидроксильной группы в 10 положении и гидроксильной группы в 20 положении производного камптотецина, или может быть их смесью. Предпочтительно, способ связывания указанного остатка представляет собой сложноэфирную связь, образованную гидроксильной группой в 10 положении. Более предпочтителен вариант реализации, который не включает сложноэфирную связь гидроксильной группы в 20 положении производного камптотецина.
[0219]
Производное камптотецина R3 в общей формуле (1) предпочтительно представляет собой 7-этил-10-гидроксикамптотецин и/или ногитекан (9-диметиламинометил-10-гидроксикамптотецин). То есть предпочтителен 7-этил-10-гидроксикамтотецин, который представляет собой соединение, представленное общей формулой (2), имеющее этильную группу для R5 и атом водорода для R6. Альтернативно, предпочтителен ногитекан (9-диметиламинометил-10-гидроксикамптотецин), который представляет собой соединение, представленное общей формулой (2), имеющее атом водорода для R5 и диметиламинометильную группу для R6.
[0220]
В отношении производного камптотецина R3 общей формулы (1), в одной молекуле блок-сополимера, сопряженного с производным камптотецина, могут присутствовать одинаковые соединения, или могут присутствовать различные соединения в виде смеси. Предпочтительно, R3 представляют собой одинаковые соединения.
[0221]
Предпочтительный вариант реализации случая, в котором физиологически активное вещество представляет собой производное камптотецина, может представлять собой блок-сополимер, в котором полиэтиленгликолевый сегмент связан с сегментом производного полиглутаминовой кислоты, и блок-сополимер, сопряженный с производным камптотецина, в котором производное камптотецина связано с карбоксильной группой боковой цепи звена глутаминовой кислоты. То есть предпочтительно использовать сегмент полиглутаминовой кислоты в качестве полиаминокислотного сегмента блок-сополимера. То есть в отношении общей формулы (1) предпочтительно, что n равен 2.
[0222]
Более предпочтительный вариант реализации блок-сополимера, сопряженного с производным камптотецина, представляет собой блок-сополимер, сопряженный с производным камптотецина, представленный общей формулой (4):
[0223]

где R1a представляет собой атом водорода или С1-С6 алкильную группу, которая может иметь заместитель; ta представляет собой целое число от 20 до 270; Аа представляет собой С1-С6 алкиленовую группу, которая может иметь заместитель; каждый xa и ya представляет собой целое число; (xa+ya) равно целому числу от 3 до 20; отношение ха к (ха+ya) составляет от 1 до 100%, а содержание ya составляет от 0% до 99%; R2a выбран из группы, состоящей из атома водорода, С1-С6 ацильной группы, которая может иметь заместитель, и С1-6 алкоксикарбонильной группы, которая может иметь заместитель; R3a представляет собой остаток производного камптотецина; R4a могут быть одинаковыми или различными и представляют собой один или более заместителей, выбранных из группы, состоящей из С1-С8 алкокси-группы, которая может иметь заместитель, С1-С8 алкиламино-группы, которая может иметь заместитель, ди-С1-С8 алкиламино-группы, которая может иметь заместитель, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, и гидроксильной группы; и каждое составное звено, с которым связан R3 или R4, и звенья глутаминовой кислоты, с которыми связан R3a, и звенья глутаминовой кислоты, с которыми связан R4a, независимо полимеризованы в случайном порядке.
[0224]
С1-С6 алкильная группа, которая может иметь заместитель для R1a, может быть линейной, разветвленной или циклической С1-С6 алкильной группой, которая может иметь заместитель. Ее примеры включают, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, циклопентильную группу, н-гексильную группу и циклогексильную группу.
[0225]
Примеры заместителя, который может быть присоединен, могут включать, но не ограничиваются ими, атом галогена, нитро-группу, циано-группу, гидроксильную группу, меркапто-группу, карбоциклическую или гетероциклическую арильную группу, алкилтио-группу, арилтио-группу, алкилсульфинильную группу, арилсульфинильную группу, алкилсульфонильную группу, арилсульфонильную группу, сульфамоильную группу, алкокси-группу, арилокси-группу, ацилокси-группу, алкоксикарбонилокси-группу, карбамоилокси-группу, замещенную или незамещенную аминогруппу, ациламино-группу, алкоксикарбониламино-группу, уреидо-группу, сульфониламино-группу, сульфамоиламино-группу, формильную группу, ацильную группу, карбоксильную группу, алкоксикарбонильную группу, карбамоильную группу и силильную группу. Положение замещения в ароматическом кольце может представлять собой орто-положение, мета-положение или пара-положение.
[0226]
Примеры R1a включают, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, бензильную группу, 2,2-диметоксиэтильную группу, 2,2-диэтоксиэтильную группу и 2-формилэтильную группу. Более предпочтительна линейная, разветвленная или циклическая С1-С4 алкильная группа, которая может иметь заместитель. В частности, более предпочтительна метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, втор-бутильная группа, трет-бутильная группа и т.п.
[0227]
Примеры С1-С6 алкиленовой группы, которая может иметь заместитель для Аа, включают, но не ограничиваются ими, метиленовую группу, этиленовую группу, н-пропиленовую группу и н-бутиленовую группу. В качестве заместителя указанная алкиленовая группа может иметь гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п.
[0228]
В частности, Аа более предпочтительно представляет собой этиленовую группу или н-пропиленовую группу.
[0229]
В общей формуле (4) ta представляет собой количество полимеризованных звеньев этиленокси-группы в полиэтиленгликолевом сегменте. Такой ta представляет собой целое число от 20 до 270. То есть молекулярная масса полиэтиленгликолевого сегмента составляет от 0,8 килодальтон до 12 килодальтон. Если значение ta, который представляет собой степень полимеризации полиэтиленгликолевого сегмента, меньше 20, то получаемый в результате блок-сополимер, сопряженный с производным камптотецина, не имеет достаточной растворимости в воде, и существует риск отсутствия требуемой биокинетики. С другой стороны, если ta больше 270, существует риск, что общая молекулярная масса получаемого в результате блок-сополимера, сопряженного с производным камптотецина, становится слишком большой, и требуемые свойства биокинетики могут отсутствовать, и могут развиваться неожиданные расстройства тканей, такие как гепатотоксичность. Предпочтительно, ta представляет собой целое число от 22 до 230 и более предпочтительно целое число от 30 до 180. То есть молекулярная масса полиэтиленгликолевого сегмента предпочтительно составляет от 1 килодальтон до 10 килодальтон и более предпочтительно от 1,3 килодальтон до 8 килодальтон.
[0230]
Блок-сополимер общей формулы (4) содержит сегмент производного полиглутаминовой кислоты, и (ха+ya) представляет собой количество полимеризованных звеньев производного полиглутаминовой кислоты. Количество полимеризованных звеньев производного полиглутаминовой кислоты составляет от 3 до 20, то есть (ха+ya) представляет собой целое число от 3 до 20. Если значение (ха+ya) меньше 3, то существует риск, что описанная ниже интенсивность рассеяния лазерного излучения получаемого в результате блок-сополимера, сопряженного с производным камптотецина, может не входить в оптимальный диапазон. С другой стороны, если значение (ха+ya) больше 20, то общая молекулярная масса получаемого в результате блок-сополимера, сопряженного с производным камптотецина, становится большое, и также существует риск, что интенсивность рассеяния лазерного излучения, описанная ниже, может не входить в оптимальный диапазон. То есть если значение (ха+ya) не входит в диапазон от 3 до 20, то существует иск, что действие усиления противоопухолевого эффекта и/или эффект снижения неблагоприятных эффектов может не быть достигнут. Предпочтительно, количество полимеризованных звеньев производного полиглутаминовой кислоты задано подходящим образом, с учетом общей молекулярной массы блок-сополимера, сопряженного с производным камптотецина. (ха+ya) предпочтительно представляет собой целое число от 5 до 15.
[0231]
Значение (ха+ya), которое представляет собой количество полимеризованных звеньев производного полиглутаминовой кислоты, может быть определено с помощью анализа1Н-ЯМР или нейтрализующего титрования блок-сополимера полиэтиленгликоля с полиглутаминовой кислоты до связывания с ним R3a и R4a.
[0232]
С1-С6 ацильная группа, которая может иметь заместитель для R2a, может быть линейной, разветвленной или циклической С1-С6 ацильной группой, которая может иметь заместитель. В отношении заместителя, может быть включена гидроксильная группа, атом галогена, аминогруппа, алкиламино-группа, диалкиламино-группа, алкокси-группа, арильная группа или т.п. Примеры С1-С6 ацильной группы для R2a включают, но не ограничиваются ими, формильную группу, ацетильную группу, трихлорацетильную группу, трифторацетильную группу, пропионильную группу, пивалоильную группу, бензилкарбонильную группу и фенетилкарбонильную группу. Более предпочтительна линейная, разветвленная или циклическая С1-С4 ацильная группа, которая может иметь заместитель, и более предпочтительная ацетильная группа, трихлорацетильная группа и трифторацетильная группа.
[0233]
С1-С6 алкоксикарбонильная группа, которая может иметь заместитель для R2a, может быть линейной, разветвленной или циклической С1-С6 алкоксикарбонильной группой, которая может иметь заместитель. В отношении заместителя, может быть включена гидроксильная группа, атом галогена, аминогруппа, алкиламино-группа, диалкиламино-группа, алкокси-группа, арильная группа или т.п. Примеры С1-С6 алкоксикарбонильной группы для R2a включают, но не ограничиваются ими, метоксикарбонильную группу, этоксикарбонильную группу, трет-бутоксикарбонильную группу, бензилоксикарбонильную группу и 9-флуоренилметилоксикарбонильную группу.
[0234]
R3a в общей формуле (4) представляет собой остаток производного камптотецина, представленный общей формулой (2):
[0235]

где R5 представляет собой заместитель, выбранный из группы, состоящей из атома водорода, С1-С6 алкильной группы, которая может иметь заместитель, и силильной группы, которая может иметь заместитель; и R6 представляет собой атом водорода или С1-С6 алкильную группу, которая может иметь заместитель.
[0236]
R5 и R6 в общей формуле (2) имеют такие же значения, как описаны выше.
[0237]
Способ связывания указанного остатка согласно одному из вариантов реализации предпочтительно представляет собой связывания на основании сложноэфирной связи между гидроксильной группой производного камптотецина и карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. Сложноэфирная связь может быть образована с любой из гидроксильной группы в 10 положении и гидроксильной группы в 20 положении производного камптотецина, или может быть их смесью. Предпочтительно, способ связывания указанного остатка представляет собой сложноэфирную связь, образованную гидроксильной группой в 10 положении. Более предпочтителен вариант реализации, который не включает сложноэфирную связь гидроксильной группы в 20 положении производного камптотецина.
[0238]
Производное камптотецина R3a в общей формуле (4) предпочтительно представляет собой 7-этил-10-гидроксикамптотецин и/или ногитекан (9-диметиламинометил-10-гидроксикамптотецин). То есть предпочтителен 7-этил-10-гидроксикамтотецин, который представляет собой соединение, представленное общей формулой (2), имеющее этильную группу для R5 и атом водорода для R6. Альтернативно, предпочтителен ногитекан (9-диметиламинометил-10-гидроксикамптотецин), который представляет собой соединение, представленное общей формулой (2), имеющее атом водорода для R5 и диметиламинометильную группу для R6.
[0239]
В отношении производного камптотецина R3a в общей формуле (4), в одной молекуле блок-сополимера, сопряженного с производным камптотецина, могут присутствовать одинаковые соединения, или могут присутствовать различные соединения в виде смеси. Предпочтительно, R3a представляют собой одинаковые соединения.
[0240]
В общей формуле (4) ха представляет собой общее количество звеньев глутаминовой кислоты, с которыми связано производное камптотецина R3a. Обязательная конфигурация должна содержать звено глутаминовой кислоты, с которым связано производное камптотецина, и ха представляет собой целое число, равное 1 или более. Предпочтительно, xa представляет собой целое число от 2 до 18, и более предпочтительно целое число от 3 до 16.
[0241]
Отношение ха к (ха+ya), которое представляет собой количество полимеризованных звеньев производного полиглутаминовой кислоты, составляет от 1% до 100%. Отношение xa к (ха+ya) предпочтительно составляет от 10% до 90%, и более предпочтительно от 20% до 80%.
[0242]
Количество связей камптотецина ха может быть получено посредством гидролиза получаемого блок-сополимера, сопряженного с производным камптотецина, количественного определения с помощью ВЭЖХ высвобожденных молекул производного камптотецина или молекулярных фрагментов, образованных из него, и расчета содержания производного камптотецина, и расчета количества связей на основании полученного значения.
[0243]
R4a в общей формуле (4) представляют собой один или более заместителей, выбранных из группы, состоящей из С1-С8 алкокси-группы, которая может иметь заместитель, С1-С8 алкиламино-группы, которая может иметь заместитель, ди-С1-С8 алкиламино-группы, которая может иметь заместитель, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, и гидроксильной группы.
[0244]
R4a могут быть необязательно введены для регулирования физических свойств блок-сополимера, сопряженного с производным камптотецина, согласно настоящему изобретению. Например, гидрофобность сегмента полиглутаминовой кислоты в блок-сополимере, сопряженном с производным камптотецина, может быть увеличена посредством внедрения гидрофобной группы в R4a. С другой стороны, при внедрении в качестве R4a гидрофильного заместителя, включая ионную функциональную группу, способную образовывать соль, такую как аминогруппа, карбоксильная группа или гидроксильная группа, может быть увеличена гидрофильность сегмента полиглутаминовой кислоты блок-сополимера, сопряженного с производным камптотецина. В том случае, если R4a представляет собой гидроксильную группу, карбоксильная группа боковой цепи сегмента полиглутаминовой кислоты представляет собой свободную карбоновую кислоту.
[0245]
Заместители для R4a могут представлять собой заместители одного вида или могут быть заместителями нескольких видов.
[0246]
С1-С8 алкокси-группа, которая может иметь заместитель для R4a, может быть линейной, разветвленной или циклической С1-С8 алкокси-группой, которая может иметь заместитель. То есть она представляет собой алкокси-группу, в которой модифицирующая группа сложноэфирного типа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. Алкокси-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. в качестве заместителя. Примеры С1-С8 алкокси-группы для R4a включают, но не ограничиваются ими, метокси-группу, этокси-группу, пропокси-группу, изопропокси-группу, бутокси-группу, трет-бутокси-группу, циклогексилокси-группу и бензилокси-группу.
[0247]
С1-С8 алкиламино-группа, которая может иметь заместитель для R4a, может быть линейной, разветвленной или циклической С1-С8 алкиламино-группой, которая может иметь заместитель. То есть она представляет собой алкиламино-группу, в которой модифицирующая группа алкиламидного типа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. Алкиламино-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. в качестве заместителя. Примеры С1-С8 алкиламино-группы для R4a включают, но не ограничиваются ими, метиламино-группу, этиламино-группу, пропиламино-группу, изопропиламино-группу, бутиламино-группу, трет-бутиламино-группу, циклогексиламино-группу и бензиламино-группу.
[0248]
Аминокислота, имеющая защищенную карбоксильную группу, также включена в такую С1-С8 алкиламино-группу, которая может иметь заместитель. Примеры аминокислоты, имеющей защищенную карбоксильную группу, которая может быть использована, включают, но не ограничиваются ими, метиловый эфир глицина, бензиловый эфир глицина, метиловый эфир β-аланина, бензиловый эфир β-аланина, метиловый эфир аланина, метиловый эфир лейцина и метиловый эфир фенилаланина.
[0249]
Ди-С1-С8 алкиламино-группа, которая может иметь заместитель для R4a, может быть линейной, разветвленной или циклической ди-С1-С8 алкиламино-группой, которая может иметь заместитель. То есть она представляет собой диалкиламино-группу, в которой модифицирующая группа диалкиламидного типа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. В качестве заместителя диалкиламино-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. Примеры ди-С1-С8 алкиламино-группы для R4a включают, но не ограничиваются ими, диметиламино-группу, диэтиламино-группу, дипропиламино-группу, диизопропиламино-группу, дибутиламино-группу, пирролидино-группу, пиперидино-группу, дибензиламино-группу и N-бензил-N-метиламино-группу.
[0250]
Заместитель для R4a также может представлять собой С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группу, которая может иметь заместитель. Она представляет собой группу, в которой модифицирующая группа мочевинного типа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты, и которая имеет -N(R4ax)CONH(R4ay) [где R4ax и R4ay могут быть одинаковыми или различными, и каждый представляет собой линейную, разветвленную или циклическую С1-С8 алкильную группу, которая может быть замещена третичной аминогруппой] в качестве карбоксильной группы боковой цепи.
[0251]
Примеры линейной, разветвленной или циклической С1-С8 алкильной группы, которая может быть замещена третичной аминогруппой для R4ax и R4ay, могут включать, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, циклогексильную группу, 2-диметиламиноэтильную группу и 3-диметиламинопропильную группу.
[0252]
Примеры С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель для R4a, включают, но не ограничиваются ими, метиламинокарбонил-метиламино-группу, этиламинокарбонил-этиламино-группу, изопропиламинокарбонил-изопропиламино-группу, циклогексиламинокарбонил-циклогексиламино-группу, этиламинокарбонил-(3-диметиламинопропил)амино-группу и (3-диметиламинопропил)аминокарбонилэтиламино-группу.
[0253]
R4a в общей формуле (4) также может представлять собой гидроксильную группу. То есть карбоксильная группа боковой цепи глутаминовой кислоты представляет собой свободную карбоновую кислоту. В таком случае карбоновая кислота боковой цепи может быть в форме свободной кислоты или может быть в форме любой фармацевтически приемлемой соли карбоновой кислоты. Примеры соли карбоновой кислоты включают, но не ограничиваются ими, литиевую соль, натриевую соль, калиевую соль, магниевую соль, кальциевую соль и аммониевую соль, которые включены в настоящее изобретение.
[0254]
R4a в общей формуле (4) предпочтительно представляет собой С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группу и/или гидроксильную группу. То есть вариант реализации, в котором R4a включают смесь С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы и гидроксильной группы, или вариант реализации, в котором R4a включают только гидроксильные группы, является предпочтительным.
[0255]
В общей формуле (4) ya представляет собой общее количество звеньев глутаминовой кислоты, с которыми связан R4a. Звено глутаминовой кислоты, с которым связан R4a, представляет собой необязательную конфигурацию, и уа представляет собой целое число от 0 до 19. Предпочтительно, уа представляет собой целое число от 2 до 18, и более предпочтительно от 4 до 17.
[0256]
Отношение ya к (xa+ya), которое представляет собой количество полимеризованных звеньев производного полиглутаминовой кислоты, составляет от 0% до 99%. Отношение уа к (xa+ya) предпочтительно составляет от 10% до 90%, и более предпочтительно от 20% до 80%.
[0257]
ya, который представляет собой количество связей R4a, может быть определен посредством измерения полученного блок-сополимера, сопряженного с производным камптотецина, с помощью1Н-ЯМР в щелочных условиях, и расчета ya по отношению интенсивности сигнала.
[0258]
В отношении блок-сополимера, сопряженного с производным камтотецина, согласно настоящему изобретению, сегмент производного полиглутаминовой кислоты представляет собой полимерный сегмент, содержащий смесь звеньев производного глутаминовой кислоты, которые содержат R3a в карбоксильной группе боковой цепи, и звеньев производного глутаминовой кислоты, которые содержат R4a. Звено производного глутаминовой кислоты, которое содержит R3a, и звено производного глутаминовой кислоты, которое содержит R4a, могут быть блочного типа полимеризации, в котором звенья производного глутаминовой кислоты расположены ориентированным образом, или могут быть статистического типа полимеризации, в котором звенья производного глутаминовой кислоты расположены неупорядоченно. Предпочтителен сегмент производного полиглутаминовой кислоты статистического типа полимеризации, в котором звенья производного глутаминовой кислоты, содержащие R3a, и звенья производного глутаминовой кислоты, содержащие R4a, расположены неупорядоченно.
[0259]
Блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению имеет молекулярную массу от 2 килодальтон до 15 килодальтон. Если молекулярная масса меньше 2 килодальтон, то существует риск, что фармакокинетические характеристики, основанные на образовании макромолекул, могут отсутствовать, и требуемое фармакологическое действие, такое как действие усиления противоопухолевого эффекта, может не быть достигнуто. В то же время, если молекулярная масса составляет более 15 килодальтон, то существует риск, что исключение неблагоприятных эффектов, обусловленных противоопухолевым действием, не будет легко достигнуто, и неблагоприятные эффекты могут присутствовать в значительной степени. В частности, производные камптотецина характеризуются стойкой гематотоксичностью, например, в значительной степени проявляется миелосупрессия. Если молекулярная масса составляет более 15 килодальтон, в значительной степени проявляется гематотоксичность. Следовательно, регулирование молекулярной массы является очень важным для представленного блок-сополимера, сопряженного с производным камптотецина. Молекулярная масса блок-сополимера, сопряженного с производным камптотецина, согласно настоящему изобретению предпочтительно составляет от 3 килодальтон до 12 килодальтон и более предпочтительно от 3 килодальтон до 10 килодальтон.
[0260]
В отношении молекулярной массы блок-сополимера, сопряженного с производным камптотецина, согласно настоящему изобретению, в качестве «молекулярной массы блок-сополимера, сопряженного с производным камптотецина» используют рассчитанное значение, полученное суммированием соответствующей молекулярной массы каждой составляющей части. То есть в качестве молекулярной массы используют расчетное значение, полученное суммированием: (1) молекулярной массы полиэтиленгликолевого сегмента; (2) молекулярной массы главной цепи полиглутаминовой кислоты; (3) общей молекулярной массы производного камптотецина, полученной умножением молекулярной массы остатка производного камптотецина на количество его связей; и (4) общей молекулярной массы заместителей, отличных от производного камптотецина, полученной умножением молекулярной массы таких остатков на количество их связей.
[0261]
«Молекулярная масса блок-сополимера, сопряженного с производным камптотецина» может представлять собой молекулярную массу, определенную с точностью до единиц килодальтон. Таким образом, метод анализа каждой составляющих части не имеет специального ограничения, при условии, что он представляет собой метод анализа с достаточной точностью для измерения молекулярной массы производного полиаминокислоты до единиц килодальтон, и в зависимости от обстоятельств могут быть выбраны различные методы анализа. Предпочтительный метод анализа для каждой составляющей части описан ниже.
[0262]
Молекулярная масса полиэтиленгликолевого звена в представленном выше слагаемом (1) представляет собой измеренное значение молекулярной массы полиэтиленгликолевого соединения, которое составляет полиэтиленгликолевый сегмент, и используют среднюю молекулярную массу, которая может быть определена по пиковой молекулярной массе, измеренной методом ГПХ на основании стандартных полиэтиленгликолевых продуктов.
[0263]
Молекулярная масса главной цепи полиглутаминовой кислоты в представленном выше слагаемом (2) представляет собой рассчитанное значение, полученное умножением молекулярной массы полимеризованного мономерного звена главной цепи на количество полимеризованных звеньев. В отношении количества полимеризованных звеньев, предпочтительно использовать количество полимеризованных звеньев, рассчитанное методом количественного определения карбоксильных групп боковых цепей в полиглутаминовой кислоте методом нейтрализующего титрования, или количество полимеризованных звеньев, рассчитанное по интегральным значениям1H-ЯМР. Предпочтительно использовать метод нейтрализующего титрования.
[0264]
Общая молекулярная масса производного камптотецина в представленном выше слагаемом (3) представляет собой рассчитанное значение, полученное умножением молекулярной массы производного камптотецина на количество его связей. Количество связей может быть определено посредством отщепления производного камптотецина из блок-сополимера, сопряженного с производным камптотецина, и количественного анализа высвобожденных молекул производного камптотецина или молекулярных фрагментов, образованных из него.
[0265]
Общая молекулярная масса заместителей, отличных от производного камптотецина, в представленном выше слагаемом (4) представляет собой рассчитанное значение, полученное умножением молекулярной массы остатков таких заместителей на количество их связей. Количество связей заместителей может быть определено количественным анализом после гидролиза из полиглутаминовой кислоты. Кроме того, количество связей также может быть рассчитано по интегральным значениям1H-ЯМР. В том случае, если заместитель, отличный от производного камптотецина, представляет собой модифицирующую группу сложноэфирного типа, предпочтителен способ количественного анализа соответствующего спиртового соединения, высвобожденного из сложного эфира при гидролизе. С другой стороны, в том случае, если заместитель, отличный от производного камптотецина, содержит модифицирующую группу амидного типа и модифицирующую группу мочевинного типа, предпочтительно рассчитывать количество связей по1H-ЯМР.
[0266]
Блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению демонстрирует свойства самоассоциации в водном растворе. То есть блок-сополимер, сопряженный с производным камптотецина, обладает таким свойством, что при исследовании 1 мг/мл водного раствора блок-сополимера, сопряженного с производным камптотецина, анализом распределения частиц по размеру на основе метода динамического рассеяния с использованием лазерного излучения, блок-сополимер, сопряженный с производным камптотецина, измеряют в виде наночастиц, имеющих среднеобъемный диаметр частиц от примерно нескольких нанометров до примерно 20 нанометров. Предпочтительно, что блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению имеет такое свойство, что указанное производное образует наночастицы, имеющие среднеобъемный диаметр частиц не более 20 нм в 1 мг/мл водном растворе. В таком случае используют анализ распределения частиц по размеру в водном растворе на основе чистой воды. Предпочтительно, блок-сополимер, сопряженный с производным камптотецина, характеризуется тем, что среднеобъемный диаметр частиц, измеренный методом анализа распределения частиц по размеру на основе метода динамического светорассеяния с применением лазерного излучения, составляет менее 20 нм и более предпочтительно, указанный блок-сополимер имеет такое свойство, что блок-сополимер анализируют как наночастицы, имеющие размер частиц от 3 до 15 нм.
[0267]
Среднеобъемный диаметр частиц согласно настоящему изобретению представляет собой размер частиц пика, который существует как наибольшая часть в объемном распределении, которое может быть измерено, например, с помощью анализатора дзета-потенциала/размера частиц NICOMP 380 ZLS (метод анализа: метод NICOMP) производства компании Particle Sizing Systems, LLC, или с помощью анализатора размера частиц и дзета-потенциала ZETASIZER NANO ZS (метод анализа: метод NNLS) производства компании Malvern Instruments, Ltd.
[0268]
Поскольку блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению представляет собой блок-сополимер, в котором гидрофильный полиэтиленгликолевый сегмент связан с сегментом полиглутаминовой кислоты, который содержит гидрофобное производное камптотецина, связанное сложноэфирной связью, сделано предположение, что в водном растворе сегменты полиглутаминовой кислоты из множества молекул блок-сополимера ассоциируются друг с другом вследствие гидрофобного взаимодействия сегмента производного полиглутаминовой кислоты. Следовательно, сделано предположение, что образуются ассоциированные объекты типа мицеллы, которые имеют структуру из ядра и оболочки, в которых сегмент полиглутаминовой кислоты образует внутреннее ядро (ядерную часть), а гидрофильный полиэтиленгликолевый сегмент покрывает периферию внутреннего ядра и образует внешний слой оболочки (оболочечную часть), и их можно наблюдать в виде наночастиц, описанных выше.
[0269]
Блок-сополимер, сопряженный с производным камптотецина, должен обладать свойством образования наночастиц в водном растворе для снижения неблагоприятных эффектов. В частности, важно, что блок-сополимер, сопряженный с производным камптотецина, обладает свойствами образования наночастиц для снижения частоты гепатотоксичности.
[0270]
В качестве показателя свойства образования наночастиц блок-сополимера, сопряженного с производным камптотецина, согласно настоящему изобретению эффективно использовать интенсивность светорассеяния, полученную с помощью лазерного излучения. То есть свойства образования наночастиц блок-сополимера, сопряженного с производным камптотецина, в водном растворе могут быть проверены с применением интенсивности светорассеяния лазерного излучения в качестве показателя. В таком случае эффективен способ проверки свойств образования наночастиц блок-сополимера, сопряженного с производным камптотецина, в водном растворе с применением толуола в качестве стандартного образца интенсивности светорассеяния и с применением относительной интенсивности относительно толуола, в качестве показателя.
[0271]
Блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению является таким, что интенсивность рассеяния лазерного излучения в 1 мг/мл водном растворе блок-сополимера в 2-10 раз выше, чем относительная интенсивность светорассеяния толуола. Если относительная интенсивность светорассеяния выше менее чем в два раза, полагают, что блок-сополимер, сопряженный с производным камптотецина, не обладает достаточными свойствами образования наночастиц, и существует риск проявления неблагоприятных эффектов, таких как гепатотоксичность. Согласно настоящему изобретению, значение относительной интенсивности светорассеяния представляет собой показатель, демонстрирующий, что вещество обладает способностью к образованию наночастиц, и приемлемо любое значение, при условии, что оно в два раза или более превышает интенсивность светорассеяния толуола, без каких-либо конкретных ограничений. То есть понятно, что даже если относительная интенсивность светорассеяния выше более чем в 10 раз, то полимерное производное обладает достаточной способностью к образованию наночастиц. Однако в таком случае, несмотря на отсутствие риска высокой частоты встречаемости гепатотоксичности, существует риск устойчивой гематотоксичности. Таким образом, необходимо регулировать относительную интенсивность светорассеяния на уровне 10 крат или менее.
[0272]
В отношении водного раствора, анализируемое значение получают с использованием водного раствора, полученного с применением чистой воды, которая не содержит микрочастиц, в качестве аналитического образца. Необязательно, вещество может быть растворено в водном растворе с помощью ультразвука во время получения раствора. Водный раствор, полученный таким образом, предпочтительно представляет собой водный раствор, который дополнительно подвержен фильтрационной обработке для удаления микрочастиц субмикронного размера.
[0273]
Блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению, является таким, что интенсивность светорассеяния его водного раствора предпочтительно в 2-8 раз и более предпочтительно в 2-6 раз выше относительной интенсивности светорассеяния толуола.
[0274]
В отношении метода измерения интенсивности светорассеяния, полученного с помощью лазерного излучения, для анализа свойств образования наночастиц блок-сополимера, сопряженного с производным камптотецина, согласно настоящему изобретению, подходит способ с применением 1 мг/мл водного раствора блок-сополимера, сопряженного с производным камптотецина, в качестве экспериментального образца, и измерения интенсивности светорассеяния с помощью фотометра для измерения рассеяния лазерного излучения при температуре измерения 25°С, угле рассеяния 90° и длине волны 632,8 нм. Примеры измерительного прибора могут включать, но не ограничиваются ими, фотометр для измерения динамического светорассеяния производства компании Otsuka Electronics Co., Ltd., DLS-8000DL (температура измерения: 25°С, угол рассеяния: 90°, длина волны: 632,8 нм, нейтральный фильтр: 2,5%, РН1: открыт, РН2: щель).
[0275]
В отношении толуола, который используют в качестве стандартного вещества для измерения интенсивности светорассеяния, может быть использован любой толуол без специальных ограничений, при условии, что толуол имеет реактивную степень чистоты. Предпочтительно использовать толуол, подверженный предварительной фильтрации, которую обычно осуществляют для получения образца для анализа светорассеяния.
[0276]
В отношении блок-сополимера, сопряженного с производным камптотецина, массовое содержание производного камптотецина, представленного общей формулой (2), составляет от 10% по массе до 60% по массе. Если содержание производного камптотецина меньше 10% по массе, то вследствие низкого содержания гидрофобного производного камптотецина ухудшаются свойства образования наночастиц на основе гидрофобного взаимодействия. С другой стороны, если содержание производного камптотецина больше 60% по массе, то существует риск заметного снижения растворимости в воде блок-сополимера, сопряженного с производным камптотецина. Массовое содержание физиологически активного вещества предпочтительно составляет от 15% по массе до 50% по массе и еще более предпочтительно от 15% по массе до 40% по массе.
[0277]
Если R4a в общей формуле (4) представляет собой С1-С8 алкокси-группу, которая может иметь заместитель, С1-С8 алкиламино-группу, которая может иметь заместитель, ди-С1-С8 алкиламино-группу, которая может иметь заместитель, или С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группу, которая может иметь заместитель, поскольку линкерная группа R4a представляет собой необязательный заместитель, относительное содержание заместителя составляет 30% по массе или менее. Относительное содержание заместителя предпочтительно составляет от 1% по массе до 20% по массе.
[0278]
Массовое содержание полиэтиленгликолевого сегмента в блок-сополимере, сопряженном с производным камптотецина, согласно настоящему изобретению предпочтительно составляет от 10% по массе до 80% по массе. Если массовое содержание полиэтиленгликолевого сегмента составляет менее 10% мо массе, то блок-сополимер, сопряженный с производным камптотецина, не обладает достаточной растворимостью в воде и, следовательно, существует риск, что свойства образования наночастиц в водном растворе могут не быть достигнуты. С другой стороны, если массовое содержание больше 80% по массе, то вследствие относительного снижения массового содержания сегмента полиглутаминовой кислоты, содержащего производное камптотецина, существует риск, что свойства образования наночастиц в водном растворе могут не быть достигнуты. Массовое содержание полиэтиленгликолевого сегмента предпочтительно составляет от 20% по массе до 70% по массе и более предпочтительно от 30% по массе до 65% по массе.
[0279]
Примеры способа получения блок-сополимера, сопряженного с производным камптотецина, согласно настоящему изобретению могут включать, но не ограничиваются ими, способ получения блок-сополимера, сопряженного с производным камптотецина, по реакции конденсации между блок-сополимером, в котором полиэтиленгликолевый сегмент связан с сегментом полиглутаминовой кислоты, и производным камптотецина с гидроксильной группой в 10-положении; и способ получения блок-сополимера, сопряженного с производным камптотецина, посредством связывания полимерного компонента, содержащего полиэтиленгликолевый сегмент, с производным полиглутаминовой кислоты, сопряженным с камптотецином. Предпочтителен способ предварительного получения блок-сополимера, в котором полиэтиленгликолевый сегмент связан с сегментом полиглутаминовой кислоты, и осуществление реакции конденсации указанного блок-сополимера и производного камптотецина с гидроксильной группой в 10-положении.
[0280]
В отношении способа получения блок-сополимера, в котором полиэтиленгликолевый сегмент связан с сегментом полиглутаминовой кислоты, можно упомянуть способ получения сегмента полиглутаминовой кислоты посредством последовательной полимеризации глутаминовой кислоты-ангидрида N-карбоновой кислоты с соединением, содержащим полиэтиленгликолевый сегмент; способ связывания полиэтиленгликолевого сегмента с полиаминокислотным сегментом; и т.п. Поскольку связывание полиэтиленгликолевого сегмента с сегментом полиглутаминовой кислоты происходит с высокой реакционной способностью, и количество полимеризованных звеньев полиглутаминовой кислоты можно легко регулировать, то предпочтительно использовать первый способ.
[0281]
То есть блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению может быть получен посредством создания сегмента полиглутаминовой кислоты последовательной полимеризацией глутаминовой кислоты-ангидрида N-карбоновой кислоты с соединением, содержащим полиэтиленгликолевый сегмент, получения блок-сополимера, в котором полиэтиленгликолевый сегмент связан с сегментом полиглутаминовой кислоты, и взаимодействия указанного блок-сополимера с производным камптотецина с использованием конденсирующего агента.
[0282]
Предпочтительно, что блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению получен в соответствии со способом, описанным в патентной литературе 1. То есть полиэтиленгликолевое соединение, имеющее концевую амино-группу, приводят во взаимодействие с ангидридом N-карбонилглутаминовой кислоты, содержащим защищенную карбоксильную группу в боковой цепи, в соответствующих эквивалентных количествах с получением сегмента полиглутаминовой кислоты, имеющего требуемое количество полимеризованных звеньев глутаминовой кислоты. Затем снимают защиту с карбоксильной группы боковой цепи с получением блок-сополимера полиэтиленгликоля-полиглутаминовой кислоты, в котором карбоксильная группа боковой цепи содержит свободную группу карбоновой кислотв. Блок-сополимер полиэтиленгликоля-полиглутаминовой кислоты подвергают реакции с производным камптотецина с гидроксильной группой в 10-положении, представленным общей формулой (2), в подходящем растворителе, используя конденсирующий агент, и, таким образом, может быть получен блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению.
[0283]
В отношении растворителя, который используют для реакции конденсации между блок-сополимером полиэтиленгликоля-полиглутаминовой кислоты и производным камптотецина, может быть использован любой растворитель, в котором растворимы оба соединения, без каких-либо специальных ограничений. Его примеры могут включать, но не ограничиваются ими, водорастворимые органические растворители, такие как N,N-диметилформамид (ДМФА), N-метилпирролидон (NMP) и 1,3-диметил-2-имидазолидинон (DMI). Указанные растворители могут быть использованы по отдельности или могут быть использованы в виде смешанных растворителей. Также может быть использован смешанный растворитель из вышеуказанных растворителей и других органических растворителей. В отношении температуры реакции, реакция может быть осуществлена обычно при температуре от 0°С до 180°С и предпочтительно от 5°С до 50°С.
[0284]
В отношении используемого конденсирующего агента, без проблем может быть использован любой обычный дегидратирующий конденсирующий агент, который инициирует реакцию эстерификации между карбоновой кислотой и гидроксильной группой посредством реакции конденсации с отщеплением воды. Примеры конденсирующего агента, который может быть использован, включают, но не ограничиваются ими, конденсирующие агенты на основе карбодиимида, такие как дициклогексилкарбодиимид (DCC), диизопропилкарбодиимид (DIPCI) и 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (WSC); конденсирующие агенты на основе триазина, такие как 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорида n-гидрат (DMT-MM); 1-этоксикарбонил-2-этокси-1,2-дигидрохинолин (EEDQ) и ди-трет-бутилдикарбонат (Boc2O).
[0285]
При использовании вышеупомянутых конденсирующих агентов на основе карбодиимида, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группа, которая может иметь заместитель: -N(R4ax)CONH(R4ay) [где R4ax и R4ay могут быть одинаковыми или различными, и каждый представляет собой линейную, разветвленную или циклическую С1-С8 алкильную группу, которая может быть замещена третичной аминогруппой], может быть внедрена одновременно с производным камптотецина в R4 общей формулы (1) и R4a общей формулы (4). Во время такой реакции конденсации также может быть использована добавка для осуществления реакции, такая как N,N-диметил-4-аминопиридин (DMAP).
[0286]
Состав заместителя R4a в сегменте полиглутаминовой кислоты в полимерном производном может быть подобран посредством регулирования условий реакции или т.п. Например, в соответствии со способом активной экстерификации с применением EEDQ, Boc2O или т.п. в качестве конденсирующего агента, или со способом получения хлорангидрида кислоты с применением оксихлорида фосфора, может быть получен сегмент полиглутаминовой кислоты, содержащий производное камптотецина для R3a и гидроксильную группу для R4a в общей формуле (4). В случае внедрения алкиламинокарбонилалкиламино-группы в R4a, может быть использована реакция с применением карбодиимидного конденсирующего агента, как описано выше.
[0287]
В отношении общей формулы (4), для регулирования гидрофобности сегмента полиглутаминовой кислоты, в R4a может быть внедрена С1-С8 алкокси-группа, С1-С8 алкиламино-группа или ди-С1-С8 алкиламино-группа. Примеры способа, используемого в таком случае, включают, но не ограничиваются ими, способ активации карбоксильных групп сополимера полиэтиленгликоля и полиглутаминовой кислоты посредством добавления конденсирующего агента, а затем взаимодействия указанного сополимера со спиртовым соединением или аминосоединением, которое соответствует заместителю для R4a, подлежащему внедрению, в требуемых эквивалентных количествах; или способ активации спиртового соединения или аминосоединения с последующим взаимодействием активированного соединения с сегментом полиглутаминовой кислоты указанного сополимера. В таком случае R4a может быть внедрен с помощью спиртового соединения или аминосоединения, а затем может быть внедрено производное камптотецина R3a, или приемлем также обратный порядок. R3a и R4a также могут быть внедрены одновременно.
[0288]
Группы, соответствующие R4a, могут быть функциональными группами одного типа или могут быть функциональными группами различных типов. При введении функциональных групп различных типов, при многократном взаимодействии различных спиртовых соединений или аминосоединений, может быть получен блок-сополимер, сопряженный с производным камптотецина, содержащий смесь различных заместителей для R4a.
[0289]
После введения производного камптотецина R3a и необязательно заместителя R4a по реакции конденсации необязательно осуществляют стандартные операции разделения или операции очистки, и в результате может быть получен блок-сополимер, сопряженный с производным камптотецина.
[0290]
Блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению может демонстрировать фармакологический эффект посредством медленного расщепления и высвобождения производного камптотецина после введения in vivo. Таким образом, блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению может быть использован в качестве противоопухолевого агента, который применяют для лечения злокачественных опухолей.
[0291]
При использовании блок-сополимера, сопряженного с производным камптотецина, согласно настоящему изобретению в качестве противоопухолевого агента доза может быть абсолютно изменена в зависимости от пола, возраста, физиологического состояния, болезненного состояния и т.п. пациента. Однако предпочтительно вводить блок-сополимер, сопряженный с производным камптотецина, парентерально, обычно в дозе от 0,01 до 500 мг/м2 (площадь поверхности тела) и предпочтительно от 0,1 до 250 мг/м2 в пересчете на активный ингредиент, в сутки для взрослого человека. В отношении способа введения, предпочтительно использовать блок-сополимер, сопряженный с производным камптотецина, посредством парентерального введения. Введение посредством инъекции осуществляют внутривенным введением, внутриартериальным введением, подкожным введением, внутримышечным введением, введением в опухоль или т.п.
[0292]
Предпочтительно, блок-сополимер, сопряженный с производным камптотецина, согласно настоящему изобретению, используют в качестве фармацевтического препарата, который обычно используют, например, в форме препарата для инъекций, таблетки или порошка. В отношении лекарственной формы, могут быть использованы обычно применяемые фармацевтически приемлемые носители, например, связующее вещество, смазывающий агент, разрыхлитель, растворитель, вспомогательное вещество, солюбилизирующий агент, диспергатор, стабилизатор, суспендирующий агент, консервант, успокоительный агент, красящее вещество и вкусовая добавка. В случае жидкого препарата для инъекций обычно используют растворитель. Примеры растворителя включают, но не ограничиваются ими, воду, физиологический солевой раствор, 5% раствор глюкозы или маннита; водорастворимые органические растворители, такие как, глицерин, этанол, диметилсульфоксид, N- метилпирролидон, полиэтиленгликоль и хромофор; их жидкие смеси; и жидкие смеси воды и водорастворимых органических растворителей. Предпочтительно, блок-сополимер, сопряженный с производным камптотецина, используют после получения в виде фармацевтического препарата, пригодного для введения, с применением указанных добавок для составления лекарственной формы.
[0293]
В отношении применения блок-сополимера, сопряженного с производным камптотецина, согласно настоящему изобретению в качестве противоопухолевого агента, указанный блок-сополимер используют для лечения злокачественных опухолевых заболеваний. Злокачественные опухоли, которые можно лечить, не имеют конкретного ограничения, и блок-сополимер, сопряженный с производным камптотецина, может быть использован для лечения злокачественных опухолей, таких как рак молочной железы, немелкоклеточный рак легких, мелкоклеточный рак легких, рак толстой и прямой кишок, неходжкинская лимфома (NHL), почечноклеточная карцинома, рак предстательной железы, гепатокарцинома, рак желудка, рак поджелудочной железы, саркома мягких тканей, злокачественный рак кожи, карциноидные опухоли, рак головы и шеи, мелоанома, рак яичников, холангиокарцинома, мезотелиома и множественная миелома. В частности, блок-сополимер, сопряженный с производным камптотецина, подходит для лечения немелкоклеточного рака легких, рака шейки матки, рака яичников, рака желудка (неоперабельного или рецидивирующего), рака толстой и прямой кишок (неоперабельного или рецидивирующего), рака молочной железы (неоперабельного или рецидивирующего), плоскоклеточной карциномы и злокачественной лимфомы (неходжкинской лимфомы), для лечения которых используют производные камптотецина.
[0294]
Другой предпочтительный вариант реалиации настоящего изобретения может представлять собой блок-сополимер, в котором присутствует производное резорцина, обладающее ингибирующей активностью в отношении HSP90, в качестве активного вещества. Ниже описан блок-сополимер, сопряженный с производным резорцина, в котором использовано производное резорцина в качестве физиологически активного вещества.
[0295]
Известно, что производные резорцина демонстрируют противоопухолевую и подобную активность посредством связывания с белками семейства HSP90 (белок теплового шока 90) и ингибирования функций белков семейства HSP90 (Hsp90 inhibitors as novel cancer chemotherapeutic agents. Trends Mol Med. 2002; 8 (4 Suppl.): с. S55-61). В отношении производных резорцина, обладающих ингибирующей активностью в отношении HSP90, известны соединения, имеющие триазольный скелет (см. WO 05/000300 A, WO 06/055760 А, WO 05/018674 А и т.п.), изоксазольный скелет (см. WO 04/072051 А) и пиразольный скелет (см. WO 03/055860 А и т.п.). Поскольку такие соединения имеют структуру резорцина с гидроксильными группами, то указанные соединения могут быть введены в блок-сополимер согласно настоящему изобретению с использованием гидроксильных групп в качестве линкерных групп. То есть блок-сополимер представлен в форме, в которой гидроксильная группа резорцинольной группы образует сложноэфирную связь с карбоксильной группой боковой цепи аспарагиновой кислоты и/или глутаминовой кислоты напрямую или через подходящую линкерную группу.
[0296]
Производное резорцина, обладающее ингибирующей активностью в отношении HSP90, предпочтительно представляет собой производное резорцина общей формулы (3):
[0297]

где R7 выбран из группы, состоящей из меркапто-группы, гидроксильной группы, атома галогена, нитро-группы, циано-группы, С1-С20 алкильной группы, С2-С20 алкенильной группы, С2-С20 алкинильной группы, карбоциклической или гетероциклической арильной группы, С1-С8 алкилтио-группы, арилтио-группы, С1-С8 алкилсульфинильной группы, арилсульфинильной группы, С1-С8 алкилсульфонильной группы, арилсульфонильной группы, сульфамоильной группы, С1-С8 алкокси-группы, арилокси-группы, С1-С8 ацилокси-группы С1-С8 алкоксикарбонилокси-группы, карбамоилокси-группы, аминогруппы, С1-С8 ациламино-группы, С1-С8 алкоксикарбониламино-группы, уреидо-группы, сульфониламино-группы, сульфамоиламино-группы, формильной группы, С1-С8 ацильной группы, карбоксильной группы, С1-С8 алкоксикарбонильной группы, карбамоильной группы и С1-С8 алкилсилильной группы;
R8 выбран из группы, состоящей из карбоциклической или гетероциклической арильной группы, которая может иметь заместитель, С1-С20 алкильной группы, С2-С20 алкенильной группы, С2-С20 алкинильной группы, С1-С20 алкиламино-группы и С1-С20 ациламино-группы; и
кольцо Н представляет собой остаток производного резорцина, представленный гетероциклической арильной группой, выбранной из группы, состоящей из общих формул (3-1), (3-2) и (3-3):
[0298]

где R9 выбран из группы, состоящей из меркапто-группы, гидроксильной группы, атома водорода, атома галогена, карбамоильной группы, С1-С8 алкоксикарбонильной группы, циано-группы, С1-С8 алкилтио-группы, арилтио-группы, С1-С8 алкилсульфинильной группы, арилсульфинильной группы, С1-С8 алкилсульфонильной группы, арилсульфонильной группы, сульфамоильной группы, С1-С8 алкокси-группы, арилокси-группы С1-С8 ацилокси-группы, С1-С8 алкоксикарбонилокси-группы, карбамоилокси-группы, аминогруппы, С1-С8 ациламино-группы С1-С8 алкоксикарбониламино-группы, уреидо-группы, сульфониламино-группы, сульфамоиламино-группы, формильной группы, С1-С8 ацильной группы и С1-С8 алкилсилильной группы.
[0299]
Атом галогена для R7 и R9 представляет собой атом фтора, атом хлора, атом брома или атом йода.
[0300]
Алкильная группа для R7 и R8 представляет собой линейную, разветвленную или циклическую С1-С20 алкильную группу. Примеры линейной алкильной группы включают, но не ограничиваются ими, метильную группу, этильную группу, пропильную группу, н-бутильную группу, н-пентильную группу, н-гексильную группу, октильную группу, децильную группу, додецильную группу, тетрадецильную группу, гексадецильную группу, октадецильную группу и эйкозильную группу. Примеры разветвленной алкильной группы включают, но не ограничиваются ими, изопропильную группу, трет-бутильную группу, 2,2-диметилпропильную группу, 2,3-диметилпентильную группу, 2,3-диметилоктильную группу, 3-метил-4-зтилдецильную группу и 3,4-диэтилундецильную группу. Примеры циклической алкильной группы включают, но не ограничиваются ими, циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, адамантильную группу, циклододецильную группу, циклогексадецильную группу, циклооктадецильную группу и циклоэйкозильную группу. Алкильная группа предпочтительно представляет собой линейную, разветвленную или циклическую С1-С8 алкильную группу
[0301]
Алкенильная группа для R7 и R8 представляет собой линейную, разветвленную или циклическую С2-С20 алкенильную группу, содержащую двойную углерод-углеродную связь в любом одном или более положениях. Примеры линейной алкенильной группы включают, но не ограничиваются ими, 1-алкенильную группу, такую как этенильная группа, 1-пропенильная группа, 1-бутенильная группа, 1-октенильная группа, 1-гексадеценильная группа или 1-октадецильная группа; и 2-алкенильную группу, такую как 2-бутенильная группа, 2-пентенильная группа, 2-октенильная группа, 2-гексадеценильная группа или 2-октадеценильная группа. Примеры разветвленной алкенильной группы включают, но не ограничиваются ими, изопропенильную группу, 3-метил-1-бутенильную группу или геранильную группу, 6-этил-3-метил-1-октенильную группу и 5,6-диметил-1-октадеценильную группу. Алкенильная группа предпочтительно представляет собой линейную, разветвленную или циклическую С2-С8 алкенильную группу.
[0302]
Алкинильная группа для R7 и R8 представляет собой С2-С20 алкинильную группу, содержащую тройную углерод-углеродную связь в одном или более положениях. Примеры включают, но не ограничиваются ими, 1-алкинильную группу, такую как этинильная группа, 1-пропинильная группа, 3,3-диметил-1-бутинильная группа, 1-октинильная группа, 1-гексадецинильная группа или 1-октадецинильная группа; и 2-алкинильную группу, такую как 2-пропинильная группа, 2-бутинильная группа, 3-фенил-2-пропинильная группа, 4,4-диметил-2-пентинильная группа, 3-триметилсилил-2-пропинильная группа, 2-гексинильная группа, 2-октинильная группа, 2-додецинильная группа, 2-гексадецинильная группа или 2-октадецинильная группа. Алкинильная группа предпочтительно представляет собой С2-С8 алкинильную группу.
[0303]
Примеры карбоциклической арильной группы для R7 и R8 включают, но не ограничиваются ими, фенильную группу и нафтильную группу. Кроме того, примеры гетероциклической арильной группы включают, но не ограничиваются ими, пиридильную группу, пиримидинильную группу, х инолильную группу, хиназолильную группу, нафтиридинильную группу, фурильную группу, пирролильную группу, индолильную группу, имидазолильную группу, пиразолильную группу, оксазолильную группу, изоксазолильную группу и триазолильную группу.
[0304]
Примеры заместителя, который может быть присоединен к R8, включают, но не ограничиваются ими, атом водорода, меркапто-группу, гидроксильную группу, атом галогена, нитро-группу, циано-группу, алкильную группу, алкенильную группу, алкинильную группу, карбоциклическую или гетероциклическую арильную группу, алкилтио-группу, арилтио-группу, алкилсульфинильную группу, арилсульфинильную группу, алкилсульфонильную группу, арилсульфонильную группу, сульфамоильную группу, алкокси-группу, арилокси-группу, ацилокси-группу, алкоксикарбонилокси-группу, карбамоилокси-группу, аминогруппу, ациламино-группу, алкоксикарбониламино-группу, уреидо-группу, сульфониламино-группу, сульфамоиламино-группу, формильную группу, ацильную группу, карбоксильную группу, алкоксикарбонильную группу, карбамоильную группу и силильную группу. Положение замещения в ароматическом кольце может представлять собой орто-положение, мета-положение или пара-положение.
[0305]
Алкилтио-группа для R7 и R9 представляет собой С1-С8 алкилтио-группу, и ее примеры включают, но не ограничиваются ими, метилтио-группу, изопропилтио-группу и бензилтио-группу. Примеры арилтио-группы включают, но не ограничиваются ими, фенилтио-группу, нафтилтио-группу и пиридилтио-группу.
[0306]
Алкилсульфинильная группа представляет собой С1-С8 алкилсульфинильную группу, и ее примеры включают, но не ограничиваются ими, метилсульфинильную группу, изопропилсульфинильную группу и бензилсульфинильную группу. Примеры арилсульфинильной группы включают, но не ограничиваются ими, фенилсульфинильную группу, нафтилсульфинильную группу и пиридилсульфинильную группу.
[0307]
Алкилсульфонильная группа представляет собой С1-С8 алкилсульфонильную группу, и ее примеры включают, но не ограничиваются ими, метилсульфонильную группу, изопропилсульфонильную группу и бензилсульфонильную группу. Примеры арилсульфонильной группы включают, но не ограничиваются ими, фенилсульфонильную группу, нафтилсульфонильную группу и пиридилсульфонильную группу.
[0308]
Примеры сульфамоильной группы включают, но не ограничиваются ими, диметилсульфамоильную группу и фенилсульфамоильную группу.
[0309]
Алкокси-группа для R7 и R8 представляет собой С1-С8 алкокси-группу, и ее примеры включают, но не ограничиваются ими, метокси-группу, изопропокси-группу и бензилокси-группу Примеры арилокси-группы включают, но не ограничиваются ими, фенокси-группу, нафтилокси-группу и пиридилокси-группу.
[0310]
Ацилокси-группа представляет собой С1-С8 ацилокси-группу, и ее примеры включают, но не ограничиваются ими, ацетокси-группу и бензоилокси-группу.
[0311]
Алкоксикарбонилокси-группа представляет собой С1-С8 алкоксикарбонилокси-группу, и ее примеры включают, но не ограничиваются ими, метоксикарбонилокси-группу и трифторметоксикарбонильную группу.
[0312]
Примеры карбамоилокси-группы включают, но не ограничиваются ими, диметилкарбамоилокси-группу и фенилкарбамоилокси-группу.
[0313]
Примеры аминогруппы для R7 и R9 включают, но не ограничиваются ими, незамещенную аминогруппу, диметиламино-группу, морфолино-группу, пиперидинильную группу, 4-метилпиперазин-1-ильную группу и фениламино-группу.
[0314]
Примеры ациламино-группы включают, но не ограничиваются ими, ацетиламино-группу и бензоиламино-группу.
[0315]
Примеры алкоксикарбониламино-группы включают, но не ограничиваются ими, метоксикарбониламино-группу, этоксикарбониламино-группу и бензилоксикарбониламино-группу.
[0316]
Примеры уреидо-группы включают, но не ограничиваются ими, триметилуреидо-группу и 1-метил-3-фенилуреидо-группу.
[0317]
Примеры сульфониламино-группы включают, но не ограничиваются ими, метансульфониламино-группу и бензолсульфониламино-группу.
[0318]
Примеры сульфамоиламино-группы включают диметилсульфамоиламино-группу.
[0319]
Примеры ацильной группы для R7 и R9 включают, но не ограничиваются ими, ацетильную группу, пивалоильную группу, бензоильную группу и пиридинкарбонильную группу
[0320]
Примеры алкоксикарбонильной группы включают, но не ограничиваются ими, метоксикарбонильную группу и бензилоксикарбонильную группу.
[0321]
Примеры алкилсилильной группы включают, но не ограничиваются ими, триметилсилильную группу, триизопропилсилильную группу и трет-бутилдифенилсилильную группу.
[0322]
Примеры карбамоильной группы для R7 включают, но не ограничиваются ими, диметилкарбамоильную группу и фенилкарбамоильную группу.
[0323]
Алкиламино-группа, которая может иметь заместитель, для R8, представляет собой линейную, разветвленную или циклическую С1-С8 алкильную группу, имеющую аминогруппу или алкиламино-группу в качестве заместителя. Примеры включают, но не ограничиваются ими, аминометиленовую группу, морфолинометиленовую группу, морфолино-3-пропиленовую группу и пиперазино-3-пропиленовую группу.
[0324]
Примеры ациламино-группы, которая может иметь заместитель, включают ацетиламино-группу и бензоиламино-группу.
[0325]
Заместитель, который может быть присоединен к R8, имеет такое же значение, как описано выше.
[0326]
В соответствии с настоящим изобретением, предпочтителен блок-сополимер, сопряженный с производным резорцина, в котором R3 в общей формуле (1) представляет собой остаток производного резорцина, обладающего ингибирующей активностью в отношении HSP90. Пояснение представлено ниже.
[0327]
Блок-сополимер, сопряженный с производным резорцина, согласно настоящему изобретению, представляет собой блок-сополимер, представленный общей формулой (1), в котором полиэтиленгликолевый сегмент связан с сегментом производного поли(аспарагиновой кислоты и/или глутаминовой кислоты), и R3 представляет собой остаток производного резорцина. То есть блок-сополимер, сопряженный с производным резорцина, согласно настоящему изобретению, представляет собой блок-сополимер, сопряженный с производным резорцина, представленный общей формулой (1):
[0328]

где R1 представляет собой атом водорода или С1-С6 алкильную группу, которая может иметь заместитель; t представляет собой целое число от 20 до 270; А представляет собой С1-С6 алкиленовую группу, которая может иметь заместитель; R2 представляет собой заместитель, выбранный из группы, состоящей из атома водорода, С1-С6 ацильной группы и С1-С6 алкоксикарбонильной группы; R3 представляет собой остаток производного резорцина; R4 представляет собой один или более заместителей, выбранных из группы, состоящей из линейной, разветвленной или циклической С1-С30 алкокси-группы, которая может иметь заместитель, линейной, разветвленной или циклической С1-С30 алкиламино-группы, которая может иметь заместитель, линейной, разветвленной или циклической С1-С30 диалкиламино-группы, которая может иметь заместитель, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, остатка гидрофобного флуоресцентного вещества и гидроксильной группы; В представляет собой линкерную группу; n равен 1 или 2; каждый x1, x2, y1, y2 и z независимо представляет собой целое число от 0 до 25; (x1+x2) равно целому числу от 1 до 25; (x1+x2+y1+y2+z) равно целому числу от 3 до 25; и каждое составное звено, с которым связан R3 или R4, и составное звено, в котором внутримолекулярно циклизована карбонильная группа боковой цепи, независимо расположены случайным образом.
[0329]
В данном случае общие формулы R1, R2, R4, А, В, t, x1, x2, y1, y2 и z имеют такие же значения, как описаны выше.
[0330]
Если R3 в общей формуле (1) представляет собой остаток производного резорцина, то соединения, обладающие ингибирующей активностью в отношении HSP90 и имеющие вышеупомянутый триазольный скелет, изоксазольный скелет и пиразольный скелет, известны как производные резорцина. Поскольку они имеют структуру резорцина с гидроксильными группами, то такие соединения могут быть использованы в качестве физиологически активного вещества согласно настоящему изобретению. Предпочтительны соединения, обладающие ингибирующей активностью в отношении HSP90, описанные в WO 05/000300 А, WO 06/055760 А и WO 05/018674 А, которые представляют собой производные резорцина, имеющие триазольный скелет.
[0331]
Производное резорцина для остатка производного резорцина, обладающего ингибирующей активностью в отношении HSP90, R3, предпочтительно представляет собой производное резорцина, которое представляет собой остаток производного резорцина, представленного общей формулой (3):
[0332]

где R7 выбран из группы, состоящей из меркапто-группы, гидроксильной группы, атома галогена, нитро-группы, циано-группы, С1-С20 алкильной группы, С2-С20 алкенильной группы, С2-С20 алкинильной группы, карбоциклической или гетероциклической арильной группы, С1-С8 алкилтио-группы, арилтио-группы, С1-С8 алкилсульфинильной группы, арилсульфинильной группы, С1-С8 алкилсульфонильной группы, арилсульфонильной группы, сульфамоильной группы, С1-С8 алкокси-группы, арилокси-группы, С1-С8 ацилокси-группы С1-С8 алкоксикарбонилокси-группы, карбамоилокси-группы, аминогруппы, С1-С8 ациламино-группы, С1-С8 алкоксикарбониламино-группы, уреидо-группы, сульфониламино-группы, сульфамоиламино-группы, формильной группы, С1-С8 ацильной группы, карбоксильной группы, С1-С8 алкоксикарбонильной группы, карбамоильной группы и С1-С8 алкилсилильной группы;
R8 выбран из группы, состоящей из карбоциклической или гетероциклической арильной группы, которая может иметь заместитель, С1-С20 алкильной группы, С2-С20 алкенильной группы, С2-С20 алкинильной группы, С1-С20 алкиламино-группы и С1-С20 ациламино-группы; и
кольцо Н представляет собой гетероциклическую арильную группу, выбранную из группы, состоящей из общих формул (3-1), (3-2) и (3-3):
[0333]

где R9 выбран из группы, состоящей из меркапто-группы, гидроксильной группы, атома водорода, атома галогена, карбамоильной группы, С1-С20 алкоксикарбонильной группы, циано-группы, С1-С8 алкилтио-группы, арилтио-группы, С1-С8 алкилсульфинильной группы, арилсульфинильной группы, С1-С8 алкилсульфонильной группы, арилсульфонильной группы, сульфамоильной группы, С1-С8 алкокси-группы, арилокси-группы С1-С8 ацилокси-группы, С1-С8 алкоксикарбонилокси-группы, карбамоилокси-группы, аминогруппы, С1-С8 ациламино-группы С1-С8 алкоксикарбониламино-группы, уреидо-группы, сульфониламино-группы, сульфамоиламино-группы, формильной группы, С1-С8 ацильной группы и С1-С8 алкилсилильной группы.
[0334]
R7-R9 и кольцо Н в общей формуле (3) имеют такие же значения, как описаны выше.
[0335]
Производное резорцина для остатка производного резорцина R3 предпочтительно представляет собой соединение, содержащее комбинацию R7-R9 и кольца Н в общей формуле (3), выбранных из следующих групп.
[0336]
R7 предпочтительно представляет собой атом галогена, линейную или разветвленную С1-С8 алкильную группу, которая может иметь заместитель, линейдную или разветвленную С1-С8 алкинильную группу, которая может иметь заместитель, карбамоильную группу или сульфамоильную группу, и особенно предпочтителен атом хлора, атом брома, этильная группа, изопропильная группа и 2-пропинильная группа.
[0337]
R8 предпочтительно представляет собой линейную или разветвленную С1-С8 алкильную группу, которая может иметь заместитель, фенильную группу, которая может иметь заместитель, нафтильную группу, пирролильную группу или индолильную группу. Заместитель для R8 в общей формуле (3) предпочтительно представляет собой гидроксильную группу, линейную, разветвленную или циклическую С1-С8 алкильную группу, С1-С8 алкокси-группу или аминогруппу, которая может иметь заместитель; и особенно предпочтительно гидроксильную группу, метокси-группу, морфолино-группу или 4-метилпиперазин-1-ильную группу.
[0338]
R9 предпочтительно представляет собой меркапто-группу, гидроксильную группу, алкилсульфонильную группу карбамоильную группу или алкоксикарбонильную группу; и особенно предпочтительно меркапто-группу или гидроксильную группу.
[0339]
Кольцо Н предпочтительно представляет собой триазолильную группу или изоксазолильную группу.
[0340]
Если R9 представляет собой меркапто-группу или гидроксильную группу, и кольцо Н представляет собой триазолильную группу, возможна таутомеризация, и могут быть использованы соответствующие таутомеры.
[0341]
Конкретные примеры производного резорцина согласно настоящему изобретению могут включать, но не ограничиваются ими, следующие одиннадцать соединений (3а)-(3k).
[0342]


[0343]
Производное резорцина R3 предпочтительно представляет собой 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол (общее название: Ганетеспиб) структурной формулы (3а).
[0344]
Производное резорцина R3 общей формулы (1) является таким, что в одной молекуле блок-сополимера, сопряженного с резорцином, могут присутствовать одинаковые соединения, или могут присутствовать соединения различных типов в виде смеси. Предпочтительно, R3 представляют собой одинаковое соединение.
[0345]
Предпочтительный вариант реализации случая, в котором представленное физиологически активное вещество представляет собой производное резорцина, обладающее ингибирующей активностью в отношении HSP90, может представлять собой блок-сополимер, сопряженный с производным резорцина, в котором полиэтиленгликолевый сегмент связан с сегментом производного полиглутаминовой кислоты, и карбоксильная группа боковой цепи звена глутаминовой кислоты связана с производным резорцина. То есть предпочтительно использовать сегмент полиглутаминовой кислоты в качестве полиаминокислотного сегмента блок-сополимера. То есть n в общей формуле (1) предпочтительно равен 2.
[0346]
Более предпочтительный вариант реализации блок-сополимера, сопряженного с производным резорцина, представляет собой блок-сополимер, сопряженный с производным резорцина, представленный общей формулой (5):
[0347]

где R1b представляет собой атом водорода или С1-С6 алкильную гурппу, которая может иметь заместитель; tb представляет собой целое число от 20 до 270; Ab представляет собой С1-С6 алкиленовую группу, которая может иметь заместитель; каждый xb и yb предсталвяют собой целое число; (xb+yb) равно целому числу от 3 до 20; отношение xb к (xb+yb) составляет от 1% до 100%, а отношение yb составляет от 0% до 99%; R2b выбран из группы, состоящей из атома водорода, С1-С6 ацильной группы, которая может иметь заместитель, и С1-С6 алкоксикарбонильной группы, которая может иметь заместитель; R3b представляет собой остаток производного резорцина, обладающего ингибирующей активностью в отношении HSP90; R4b могут быть одинаковыми или различными и представляют собой один или более заместителей, выбранных из группы, состоящей из С1-С8 алкокси-группы, которая может иметь заместитель, С1-С8 алкиламино-группы, которая может иметь заместитель, ди-С1-С8 алкиламино-группы, которая может иметь заместитель, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, и гидроксильной группы; и каждое звено глутаминовой кислоты, с которым связан R3b, и звено глутаминовой кислоты, с которым связан R4b, независимо полимеризованы в случайном порядке.
[0348]
С1-С6 алкильная группа, которая может иметь заместитель для R1b, может быть линейной, разветвленной или циклической С1-С6 алкильной группой, которая может иметь заместитель. Ее примеры включают, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, циклопентильную группу, н-гексильную группу и циклогексильную группу.
[0349]
Примеры заместителя, который может быть присоединен, могут включать, но не ограничиваются ими, атом галогена, нитро-группу, циано-группу, гидроксильную группу, меркапто-группу, карбоциклическую или гетероциклическую арильную группу, алкилтио-группу, арилтио-группу, алкилсульфинильную группу, арилсульфинильную группу, алкилсульфонильную группу, арилсульфонильную группу, сульфамоильную группу, алкокси-группу, арилокси-группу, ацилокси-группу, алкоксикарбонилокси-группу, карбамоилокси-группу, замещенную или незамещенную аминогруппу, ациламино-группу, алкоксикарбониламино-группу, уреидо-группу, сульфониламино-группу, сульфамоиламино-группу, формильную группу, ацильную группу, карбоксильную группу, алкоксикарбонильную группу, карбамоильную группу и силильную группу. Положение замещения в ароматическом кольце может представлять собой орто-положение, мета-положение или пара-положение.
[0350]
Примеры R1b включают, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, бензильную группу, 2,2-диметоксиэтильную группу, 2,2-диэтоксиэтильную группу и 2-формилэтильную группу. Более предпочтительна линейная, разветвленная или циклическая С1-С4 алкильная группа, которая может иметь заместитель. В частности, более предпочтительна метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, втор-бутильная группа, трет-бутильная группа и т.п.
[0351]
С1-С6 алкиленовая группа, которая может иметь заместитель для Ab, включает, но не ограничиваются ими, метиленовую группу, этиленовую группу, н-пропиленовую группу и н-бутиленовую группу. В отношении заместителя, который может быть присоединен, указанная алкиленовая группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п.
[0352]
В частности, Ab более предпочтительно представляет собой этиленовую группу или н-пропиленовую группу.
[0353]
В общей формуле (5) tb представляет собой количество полимеризованных звеньев этиленокси-группы в полиэтиленгликолевом сегменте. Такой tb представляет собой целое число от 20 до 270. То есть молекулярная масса полиэтиленгликолевого сегмента составляет от 0,8 килодальтон до 12 килодальтон. Если tb, который представляет собой степень полимеризации полиэтиленгликолевого сегмента, меньше 20, то получаемый в результате блок-сополимер, сопряженный с производным резорцина, не имеет достаточной растворимости в воде, и существует риск отсутствия требуемой биокинетики. С другой стороны, если tb больше 270, существует риск, что общая молекулярная масса получаемого в результате блок-сополимера, сопряженного с производным резорцина, становится слишком большой, и требуемые свойства биокинетики могут отсутствовать, и в результате могут развиваться неожиданные расстройства тканей, такие как гематотоксичность. Предпочтительно, tb представляет собой целое число от 22 до 230 и более предпочтительно целое число от 30 до 180. То есть молекулярная масса полиэтиленгликолевого сегмента предпочтительно составляет от 1 килодальтон до 10 килодальтон и более предпочтительно от 1,3 килодальтон до 8 килодальтон.
[0354]
Блок-сополимер общей формулы (5) содержит сегмент производного полиглутаминовой кислоты, и (xb+yb) представляет собой количество полимеризованных звеньев производного полиглутаминовой кислоты. Количество полимеризованных звеньев производного полиглутаминовой кислоты составляет от 3 до 20, то есть (xb+yb) представляет собой целое число от 3 до 20. Если значение (xb+yb) меньше 3, то существует риск, что описанная ниже интенсивность рассеяния лазерного излучения получаемого в результате блок-сополимера, сопряженного с производным камптотецина, может не входить в оптимальный диапазон. С другой стороны, если значение (xb+yb) больше 20, то общая молекулярная масса получаемого в результате блок-сополимера, сопряженного с производным камптотецина, становится большое, и также существует риск, что интенсивность рассеяния лазерного излучения, описанная ниже, может не входить в оптимальный диапазон. То есть если значение (xa+ya) не входит в диапазон от 3 до 20, то существует иск, что действие усиления противоопухолевого эффекта и/или эффект снижения неблагоприятных эффектов может не быть достигнут. Предпочтительно, количество полимеризованных звеньев производного полиглутаминовой кислоты задано подходящим образом, с учетом общей молекулярной массы блок-сополимера, сопряженного с производным камптотецина. (xb+yb) предпочтительно представляет собой целое число от 5 до 15.
[0355]
Значение (xb+yb), которое представляет собой количество полимеризованных звеньев производного полиглутаминовой кислоты, может быть определено с помощью анализа1H-ЯМР или нейтрализующего титрования блок-сополимера полиэтиленгликоля с полиглутаминовой кислоты до связывания с ним R3b и R4b.
[0356]
С1-С6 ацильная группа, которая может иметь заместитель для R2b, может быть линейной, разветвленной или циклической С1-С6 ацильной группой, которая может иметь заместитель. В отношении заместителя, может быть включена гидроксильная группа, атом галогена, аминогруппа, алкиламино-группа, диалкиламино-группа, алкокси-группа, арильная группа или т.п. Примеры С1-С6 ацильной группы для R2b включают, но не ограничиваются ими, формильную группу, ацетильную группу, трихлорацетильную группу, трифторацетильную группу, пропионильную группу, пивалоильную группу, бензилкарбонильную группу и фенетилкарбонильную группу. Более предпочтительна линейная, разветвленная или циклическая С1-С4 ацильная группа, которая может иметь заместитель, и более предпочтительная ацетильная группа, трихлорацетильная группа и трифторацетильная группа.
[0357]
С1-С6 алкоксикарбонильная группа, которая может иметь заместитель для R2b, может быть линейной, разветвленной или циклической С1-С6 алкоксикарбонильной группой, которая может иметь заместитель. В отношении заместителя, может быть включена гидроксильная группа, атом галогена, аминогруппа, алкиламино-группа, диалкиламино-группа, алкокси-группа, арильная группа или т.п. Примеры С1-С6 алкоксикарбонильной группы для R2b включают, но не ограничиваются ими, метоксикарбонильную группу, этоксикарбонильную группу, трет-бутоксикарбонильную группу, бензилоксикарбонильную группу и 9-флуоренилметилоксикарбонильную группу.
[0358]
Производное резорцина для остатка производного резорцина, обладающего ингибирующей активностью в отношении HSP90, R3b в общей формуле (5) предпочтительно представляет собой производное резорцина в качестве остатка производного резорцина, представленного общей формулой (3):
[0359]

где R7 выбран из группы, состоящей из меркапто-группы, гидроксильной группы, атома галогена, нитро-группы, циано-группы, С1-С20 алкильной группы, С2-С20 алкенильной группы, С2-С20 алкинильной группы, карбоциклической или гетероциклической арильной группы, С1-С8 алкилтио-группы, арилтио-группы, С1-С8 алкилсульфинильной группы, арилсульфинильной группы, С1-С8 алкилсульфонильной группы, арилсульфонильной группы, сульфамоильной группы, С1-С8 алкокси-группы, арилокси-группы, С1-С8 ацилокси-группы С1-С8 алкоксикарбонилокси-группы, карбамоилокси-группы, аминогруппы, С1-С8 ациламино-группы, С1-С8 алкоксикарбониламино-группы, уреидо-группы, сульфониламино-группы, сульфамоиламино-группы, формильной группы, С1-С8 ацильной группы, карбоксильной группы, С1-С8 алкоксикарбонильной группы, карбамоильной группы и С1-С8 алкилсилильной группы;
R8 выбран из группы, состоящей из карбоциклической или гетероциклической арильной группы, которая может иметь заместитель, С1-С20 алкильной группы, С2-С20 алкенильной группы, С2-С20 алкинильной группы, С1-С20 алкиламино-группы и С1-С20 ациламино-группы; и
кольцо Н представляет собой гетероциклическую арильную группу, выбранную из группы, состоящей из общих формул (3-1), (3-2) и (3-3):
[0360]

где R9 выбран из группы, состоящей из меркапто-группы, гидроксильной группы, атома водорода, атома галогена, карбамоильной группы, С1-С20 алкоксикарбонильной группы, циано-группы, С1-С8 алкилтио-группы, арилтио-группы, С1-С8 алкилсульфинильной группы, арилсульфинильной группы, С1-С8 алкилсульфонильной группы, арилсульфонильной группы, сульфамоильной группы, С1-С8 алкокси-группы, арилокси-группы С1-С8 ацилокси-группы, С1-С8 алкоксикарбонилокси-группы, карбамоилокси-группы, аминогруппы, С1-С8 ациламино-группы С1-С8 алкоксикарбониламино-группы, уреидо-группы, сульфониламино-группы, сульфамоиламино-группы, формильной группы, С1-С8 ацильной группы и С1-С8 алкилсилильной группы.
[0361]
При этом R5-R9 и кольцо Н в общей формуле (3) для R3b имеют такие же значения, как описаны выше.
[0362]
Способ связывания остатка производного резорцина согласно одному из вариантов реализации предпочтительно представляет собой сложноэфирную связь между гидроксильной группой производного резорцина и карбоксильной группой боковой цепи сегмента производного полиглутаминовой кислоты. Сложноэфирная связь может быть образована любой из гидроксильных групп заместителей резорцина в производном резорцина, или их смесью.
[0363]
Производное резорцина R3b общей формулы (5) предпочтительно представляет собой 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол (общее название: ганетеспиб).
[0364]
Производное резорцина R3b общей формулы (5) является таким, что в одной молекуле блок-сополимера, сопряженного с производным резорцина, могут присутствовать одинаковые соединения, или могут присутствовать соединения различных типов в виде смеси. Предпочтительно, R3b представляют собой одинаковые соединения.
[0365]
В общей формуле (5) xb представляет собой общее количество звеньев глутаминовой кислоты, с которыми связано производное резорцина R3b. Обязательная конфигурация должна содержать звено глутаминовой кислоты, с которым связано производное резорцина, и xb представляет собой целое число, равное 1 или более. Предпочтительно, xb представляет собой целое число от 2 до 18, и более предпочтительно целое число от 3 до 16.
[0366]
Отношение xb к (xb+yb), которое представляет собой количество полимеризованных звеньев производного полиглутаминовой кислоты, составляет от 1% до 100%. Отношение xb к (xb+yb) предпочтительно составляет от 10% до 90%, и более предпочтительно от 20% до 80%.
[0367]
Количество связей производного резорцина xb может быть получено посредством гидролиза получаемого блок-сополимера, сопряженного с производным резорцина, количественного определения с помощью ВЭЖХ высвобожденных молекул производного резорцина или молекулярных фрагментов, образованных из него, и расчета содержания производного резорцина, и расчета количества связей по полученному значению.
[0368]
R4b в общей формуле (5) представляют собой один или более заместителей, выбранных из группы, состоящей из С1-С8 алкокси-группы, которая может иметь заместитель, С1-С8 алкиламино-группы, которая может иметь заместитель, ди-С1-С8 алкиламино-группы, которая может иметь заместитель, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, и гидроксильной группы.
[0369]
R4b могут быть необязательно введены для регулирования физических свойств блок-сополимера, сопряженного с производным резорцина, согласно настоящему изобретению. Например, гидрофобность сегмента полиглутаминовой кислоты в блок-сополимере, сопряженном с производным резорцина, может быть увеличена посредством внедрения гидрофобной группы в R4b. С другой стороны, при внедрении в качестве R4b гидрофильного заместителя, включая ионную функциональную группу, способную образовывать соль, такую как аминогруппа, карбоксильная группа или гидроксильная группа, может быть увеличена гидрофильность сегмента полиглутаминовой кислоты блок-сополимера, сопряженного с производным резорцина. В том случае, если R4b представляет собой гидроксильную группу, карбоксильная группа боковой цепи сегмента полиглутаминовой кислоты представляет собой свободную карбоновую кислоту.
[0370]
Заместители для R4b могут представлять собой заместители одного вида или могут быть заместителями нескольких видов.
[0371]
С1-С8 алкокси-группа, которая может иметь заместитель для R4b, может быть линейной, разветвленной или циклической С1-С8 алкокси-группой, которая может иметь заместитель. То есть она представляет собой алкокси-группу, в которой модифицирующая группа сложноэфирного типа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. Алкокси-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. в качестве заместителя. Примеры С1-С8 алкокси-группы для R4b включают, но не ограничиваются ими, метокси-группу, этокси-группу, пропокси-группу, изопропокси-группу, бутокси-группу, трет-бутокси-группу, циклогексилокси-группу и бензилокси-группу. [0372]
С1-С8 алкиламино-группа, которая может иметь заместитель для R4b, может быть линейной, разветвленной или циклической С1-С8 алкиламино-группой, которая может иметь заместитель. То есть она представляет собой алкиламино-группу, в которой модифицирующая группа алкиламидного типа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. Алкиламино-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. в качестве заместителя. Примеры С1-С8 алкиламино-группы для R4a включают, но не ограничиваются ими, метиламино-группу, этиламино-группу, пропиламино-группу, изопропиламино-группу, бутиламино-группу, трет-бутиламино-группу, циклогексиламино-группу и бензиламино-группу.
[0373]
Аминокислота, имеющая защищенную карбоксильную группу, также включена в такую С1-С8 алкиламино-группу, которая может иметь заместитель. Примеры аминокислоты, имеющей защищенную карбоксильную группу, которая может быть использована, включают, но не ограничиваются ими, метиловый эфир глицина, бензиловый эфир глицина, метиловый эфир β-аланина, бензиловый эфир β-аланина, метиловый эфир аланина, метиловый эфир лейцина и метиловый эфир фенилаланина.
[0374]
Ди-С1-С8 алкиламино-группа, которая может иметь заместитель для R4b, может быть линейной, разветвленной или циклической ди-С1-С8 алкиламино-группой, которая может иметь заместитель. То есть она представляет собой диалкиламино-группу, в которой модифицирующая группа диалкиламидного типа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. В качестве заместителя диалкиламино-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. Примеры ди-С1-С8 алкиламино-группы для R4b включают, но не ограничиваются ими, диметиламино-группу, диэтиламино-группу, дипропиламино-группу, диизопропиламино-группу, дибутиламино-группу, пирролидино-группу, пиперидино-группу, дибензиламино-группу и N-бензил-N-метиламино-группу.
[0375]
Заместитель для R4b также может представлять собой С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группу, которая может иметь заместитель. Она представляет собой группу, в которой модифицирующая группа мочевинного типа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты, и которая имеет -N(R4bx)CONH(R4by) [где R4bx и R4by могут быть одинаковыми или различными, и каждый представляет собой линейную, разветвленную или циклическую С1-С8 алкильную группу, которая может быть замещена третичной аминогруппой] в качестве карбоксильной группы боковой цепи.
[0376]
Примеры линейной, разветвленной или циклической С1-С8 алкильной группы, которая может быть замещена третичной аминогруппой для R4bx и R4by, могут включать, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, циклогексильную группу, 2-диметиламиноэтильную группу и 3-диметиламинопропильную группу
[0377]
Примеры С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель для R4b, включают, но не ограничиваются ими, метиламинокарбонил-метиламино-группу, этиламинокарбонил-этиламино-группу, изопропиламинокарбонил-изопропиламино-группу, циклогексиламинокарбонил-циклогексиламино-группу этиламинокарбонил-(3-диметиламинопропил)амино-группу и (3-диметиламинопропил)аминокарбонилэтиламино-группу.
[0378]
R4b в общей формуле (5) также может представлять собой гидроксильную группу. То есть карбоксильная группа боковой цепи глутаминовой кислоты представляет собой свободную карбоновую кислоту. В таком случае карбоновая кислота боковой цепи может быть в форме свободной кислоты или может быть в форме любой фармацевтически приемлемой соли карбоновой кислоты. Примеры соли карбоновой кислоты включают, но не ограничиваются ими, литиевую соль, натриевую соль, калиевую соль, магниевую соль, кальциевую соль и аммониевую соль, которые включены в настоящее изобретение.
[0379]
R4b в общей формуле (4) предпочтительно представляет собой С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группу и/или гидроксильную группу. То есть вариант реализации, в котором R4b включают смесь С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы и гидроксильной группы, или вариант реализации, в котором R4b включают только гидроксильные группы, является предпочтительным.
[0380]
В общей формуле (4) yb представляет собой общее количество звеньев глутаминовой кислоты, с которыми связан R4b. Звено глутаминовой кислоты, с которым связан R4b, представляет собой необязательную конфигурацию, и yb представляет собой целое число от 0 до 19. Предпочтительно, yb представляет собой целое число от 2 до 18, и более предпочтительно от 4 до 17.
[0381]
Отношение yb к (xb+yb), которое представляет собой количество полимеризованных звеньев производного полиглутаминовой кислоты, составляет от 0% до 99%. Отношение yb к (xb+yb) предпочтительно составляет от 10% до 90%, и более предпочтительно от 20% до 80%.
[0382]
yb, который представляет собой количество связей R4b, может быть определен посредством измерения полученного блок-сополимера, сопряженного с производным резорцина, с помощью1H-ЯМР в щелочных условиях, и расчета yb по отношению интенсивности сигнала.
[0383]
В отношении блок-сополимера, сопряженного с производным резорцина, согласно настоящему изобретению, сегмент производного полиглутаминовой кислоты представляет собой полимерный сегмент, содержащий смесь звеньев производного глутаминовой кислоты, которые содержат карбоксильную группу боковой цепи и R3b, и звеньев производного глутаминовой кислоты, которые содержат R4b. Звено производного глутаминовой кислоты, которое содержит R3b, и звено производного глутаминовой кислоты, которое содержит R4b, могут быть блочного типа полимеризации, в котором звенья производного глутаминовой кислоты расположены ориентированным образом, или могут быть статистического типа полимеризации, в котором звенья производного глутаминовой кислоты расположены неупорядоченно. Предпочтителен сегмент производного полиглутаминовой кислоты статистического типа полимеризации, в котором звенья производного глутаминовой кислоты, содержащие R3b, и звенья производного глутаминовой кислоты, содержащие R4b, расположены неупорядоченно.
[0384]
Блок-сополимер, сопряженный с производным резорцина, согласно настоящему изобретению имеет молекулярную массу от 2 килодальтон до 15 килодальтон. Если молекулярная масса меньше 2 килодальтон, то существует риск, что фармакокинетические характеристики, основанные на образовании макромолекул, могут отсутствовать, и требуемое фармакологическое действие, такое как действие усиления противоопухолевого эффекта, может не быть достигнуто. В то же время, если молекулярная масса составляет более 15 килодальтон, то существует риск, что исключение неблагоприятных эффектов, обусловленных противоопухолевым действием, не будет легко достигнуто, и неблагоприятные эффекты могут присутствовать в значительной степени. В частности, производные резорцина характеризуются стойкой гематотоксичностью, например, в значительной степени проявляется миелосупрессия. Если молекулярная масса составляет более 15 килодальтон, в значительной степени проявляется продолжительная гематотоксичность. Следовательно, регулирование молекулярной массы является очень важным для представленного блок-сополимера, сопряженного с производным резорцина. Молекулярная масса блок-сополимера, сопряженного с производным резорцина, согласно настоящему изобретению предпочтительно составляет от 3 килодальтон до 12 килодальтон и более предпочтительно от 3 килодальтон до 10 килодальтон.
[0385]
В отношении молекулярной массы блок-сополимера, сопряженного с производным резорцина, согласно настоящему изобретению, в качестве «молекулярной массы блок-сополимера, сопряженного с производным резорцина» используют рассчитанное значение, полученное суммированием соответствующей молекулярной массы каждой составляющей части. То есть в качестве молекулярной массы используют расчетное значение, полученное суммированием: (1) молекулярной массы полиэтиленгликолевого сегмента; (2) молекулярной массы главной цепи полиглутаминовой кислоты; (3) общей молекулярной массы производного резорцина, полученной умножением молекулярной массы остатка производного резорцина на количество его связей; и (4) общей молекулярной массы заместителей, отличных от производного резорцина, полученной умножением молекулярной массы таких остатков на количество их связей.
[0386]
«Молекулярная масса блок-сополимера, сопряженного с производным резорцина» может представлять собой молекулярную массу, определенную с точностью до единиц килодальтон. Таким образом, метод анализа каждой составляющих части не имеет специального ограничения, при условии, что он представляет собой метод анализа с достаточной точностью для измерения молекулярной массы производного полиаминокислоты до единиц килодальтон, и в зависимости от обстоятельств могут быть выбраны различные методы анализа. Предпочтительный метод анализа для каждой составляющей части описан ниже.
[0387]
В отношении способа расчета соответствующей молекулярной массы каждой составляющей части, молекулярные массы компонентов могут быть рассчитаны способами в соответствии с представленным выше описанием.
[0388]
Блок-сополимер, сопряженный с производным резорцина, согласно настоящему изобретению демонстрирует свойства самоассоциации в водном растворе. То есть блок-сополимер, сопряженный с производным резорцина, обладает таким свойством, что при исследовании 1 мг/мл водного раствора блок-сополимера, сопряженного с производным резорцина, анализом распределения частиц по размеру на основе метода рассеяния с использованием лазерного излучения, блок-сополимер, сопряженный с производным резорцина, измеряют в виде наночастиц, имеющих среднеобъемный диаметр частиц от примерно нескольких нанометров до примерно 20 нанометров. Предпочтительно, что блок- сополимер, сопряженный с производным резорцина, согласно настоящему изобретению имеет такое свойство, что указанное производное образует наночастицы, имеющие среднеобъемный диаметр частиц не более 20 нм в 1 мг/мл водном растворе. В таком случае используют анализ распределения частиц по размеру в водном растворе на основе чистой воды. Предпочтительно, блок-сополимер, сопряженный с производным резорцина, характеризуется тем, что среднеобъемный диаметр частиц, измеренный методом анализа распределения частиц по размеру на основе метода динамического светорассеяния с применением лазерного излучения, составляет менее 20 нм и более предпочтительно, указанный блок-сополимер имеет такое свойство, что блок-сополимер анализируют как наночастицы, имеющие размер частиц от 3 до 15 нм.
[0389]
Среднеобъемный диаметр частиц согласно настоящему изобретению представляет собой размер частиц пика, который существует как наибольшая часть в объемном распределении, которое может быть измерено, например, с помощью анализатора дзета-потенциала/размера частиц NICOMP 380 ZLS (метод анализа: метод NICOMP) производства компании Particle Sizing Systems, LLC, или с помощью анализатора размера частиц и дзета-потенциала ZETASIZER NANO ZS (метод анализа: метод NNLS) производства компании Malvern Instruments, Ltd.
[0390]
Поскольку блок-сополимер, сопряженный с производным резорцина, согласно настоящему изобретению представляет собой блок-сополимер, в котором гидрофильный полиэтиленгликолевый сегмент связан с сегментом полиглутаминовой кислоты, который содержит гидрофобное производное резорцина, связанное сложноэфирной связью, сделано предположение, что в водном растворе сегменты полиглутаминовой кислоты из множества молекул блок-сополимера ассоциируются друг с другом вследствие гидрофобного взаимодействия сегмента производного полиглутаминовой кислоты. Следовательно, сделано предположение, что образуются ассоциированные объекты типа мицеллы, которые имеют структуру из ядра и оболочки, в которых сегмент полиглутаминовой кислоты образует внутреннее ядро (ядерную часть), а гидрофильный полиэтиленгликолевый сегмент покрывает периферию внутреннего ядра и образует внешний слой оболочки (оболочечную часть), и их можно наблюдать в виде наночастиц, описанных выше.
[0391]
Блок-сополимер, сопряженный с производным резорцина, должен обладать свойством образования наночастиц в водном растворе для обеспечения действия усиления противоопухолевого эффекта и подавления стойкой гематотоксичности.
[0392]
В качестве показателя свойства образования наночастиц блок-сополимера, сопряженного с производным резорцина, согласно настоящему изобретению эффективно использовать интенсивность светорассеяния, полученную с помощью лазерного излучения. То есть свойства образования наночастиц блок-сополимера, сопряженного с производным резорцина, в водном растворе могут быть проверены с применением интенсивности светорассеяния лазерного излучения в качестве показателя. В таком случае эффективен способ проверки свойств образования наночастиц блок-сополимера, сопряженного с производным камптотецина, в водном растворе с применением толуола в качестве стандартного образца интенсивности светорассеяния и с применением относительной интенсивности относительно толуола, в качестве показателя.
[0393]
Блок-сополимер, сопряженный с производным резорцина, согласно настоящему изобретению является таким, что интенсивность рассеяния лазерного излучения в 1 мг/мл водном растворе блок-сополимера в 2-50 раз выше, чем относительная интенсивность светорассеяния толуола. Если относительная интенсивность светорассеяния выше менее чем в два раза, полагают, что блок-сополимер, сопряженный с производным резорцина, не обладает достаточными свойствами образования наночастиц, и поскольку свойства миграции лекарства в пораженную ткань-мишень, такую как опухоль, и свойства проникновения во внутреннюю часть тканей могут не быть эффективно достигнуты, существует риск, что эффективность может не быть проявлена в достаточной степени. Согласно настоящему изобретению, значение относительной интенсивности светорассеяния представляет собой показатель, демонстрирующий, что вещество обладает способностью к образованию наночастиц, и приемлемо любое значение, при условии, что оно в два раза или более превышает интенсивность светорассеяния толуола, без каких-либо конкретных ограничений. То есть понятно, что даже если относительная интенсивность светорассеяния выше более чем в 50 раз, то полимерное производное обладает достаточной способностью к образованию наночастиц. Однако в таком случае удерживание in vivo блок-сополимера увеличивается, и лекарственное средство доставляется в ткани, отличные от пораженной ткани-мишени, поэтому существует риск возникновения неожиданных неблагоприятных эффектов, таких как стойкая гематотоксичность. Таким образом, необходимо регулировать относительную интенсивность светорассеяния на уровне 50 крат или менее и предпочтительно 40 крат или менее.
[0394]
В отношении водного раствора, измерение интенсивности светорассеяния представляет собой анализируемое значение, полученное с применением водного раствора, полученного с использованием чистой воды, которая не содержит микрочастиц, в качестве аналитического образца. Необязательно, вещество может быть растворено в водном растворе с помощью ультразвука во время получения раствора. Водный раствор, полученный таким образом, предпочтительно представляет собой водный раствор, который дополнительно подвержен фильтрационной обработке для удаления микрочастиц субмикронного размера.
[0395]
Блок-сополимер, сопряженный с производным резорцина, согласно настоящему изобретению является таким, что интенсивность светорассеяния его водного раствора предпочтительно в 2-40 раз и более предпочтительно в 2-30 раз выше относительной интенсивности светорассеяния толуола.
[0396]
В отношении метода измерения интенсивности светорассеяния, полученного с помощью лазерного излучения, для анализа свойств образования наночастиц блок-сополимера, сопряженного с производным резорцина, согласно настоящему изобретению, подходит способ с применением 1 мг/мл водного раствора блок-сополимера, сопряженного с производным резорцина, в качестве экспериментального образца, и измерения интенсивности светорассеяния с помощью фотометра для измерения рассеяния лазерного излучения при температуре измерения 25°С, угле рассеяния 90° и длине волны 632,8 нм. Примеры измерительного прибора могут включать, но не ограничиваются ими, фотометр для измерения динамического светорассеяния производства компании Otsuka Electronics Co., Ltd., DLS-8000DL (температура измерения: 25°С, угол рассеяния: 90°, длина волны: 632,8 нм, нейтральный фильтр: 2,5%, РН1: открыт, РН2: щель).
[0397]
В отношении толуола, который используют в качестве стандартного вещества для измерения интенсивности светорассеяния, может быть использован любой толуол без специальных ограничений, при условии, что толуол имеет реактивную степень чистоты. Предпочтительно использовать толуол, подверженный предварительной фильтрации, которую обычно осуществляют для получения образца для анализа светорассеяния.
[0398]
Блок-сополимер, сопряженный с производным резорцина, согласно настоящему изобретению предпочтительно является таким, что массовое содержание производного резорцина, представленного общей формулой (2), составляет от 10% по массе до 60% по массе. Если содержание производного камптотецина меньше 10% по массе, то вследствие низкого содержания гидрофобного производного резорцина ухудшаются свойства образования наночастиц на основе гидрофобного взаимодействия. С другой стороны, если содержание производного резорцина больше 60% по массе, то существует риск заметного снижения растворимости в воде блок-сополимера, сопряженного с производным резорцина. Массовое содержание производного резорцина предпочтительно составляет от 15% по массе до 50% по массе и еще более предпочтительно от 15% по массе до 40% по массе.
[0399]
Если R4b в общей формуле (5) представляет собой С1-С8 алкокси-группу, которая может иметь заместитель, С1-С8 алкиламино-группу, которая может иметь заместитель, ди-С1-С8 алкиламино-группу, которая может иметь заместитель, или С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группу, которая может иметь заместитель, поскольку линкерная группа R4b представляет собой необязательный заместитель, относительное содержание заместителя составляет 30% по массе или менее. Относительное содержание заместителя предпочтительно составляет от 1% по массе до 20% по массе.
[0400]
Массовое содержание полиэтиленгликолевого сегмента в блок-сополимере, сопряженном с производным резорцина, согласно настоящему изобретению предпочтительно составляет от 10% по массе до 80% по массе. Если массовое содержание полиэтиленгликолевого сегмента составляет менее 10% мо массе, то блок-сополимер, сопряженный с производным резорцина, не обладает достаточной растворимостью в воде и, следовательно, существует риск, что свойства образования наночастиц в водном растворе могут не быть достигнуты. С другой стороны, если массовое содержание больше 80% по массе, то вследствие относительного снижения массового содержания сегмента полиглутаминовой кислоты, содержащего производное резорцина, существует риск, что свойства образования наночастиц в водном растворе могут не быть достигнуты. Массовое содержание полиэтиленгликолевого сегмента предпочтительно составляет от 20% по массе до 70% по массе и более предпочтительно от 30% по массе до 65% по массе.
[0401]
Примеры способа получения блок-сополимера, сопряженного с производным резорцина, согласно настоящему изобретению могут включать, но не ограничиваются ими, способ получения блок-сополимера, сопряженного с производным резорцина, по реакции конденсации между блок-сополимером, в котором полиэтиленгликолевый сегмент связан с сегментом полиглутаминовой кислоты, и производным резорцина; и способ получения блок-сополимера, сопряженного с производным резорцина, посредством связывания полимерного компонента, содержащего полиэтиленгликолевый сегмент, с производным полиглутаминовой кислоты, сопряженным с производным резорцина. Предпочтителен способ предварительного получения блок-сополимера, в котором полиэтиленгликолевый сегмент связан с сегментом полиглутаминовой кислоты, и осуществление реакции конденсации указанного блок-сополимера и производного резорцина.
[0402]
В отношении способа получения блок-сополимера, в котором полиэтиленгликолевый сегмент связан с сегментом полиглутаминовой кислоты, и способа получения блок-сополимера, сопряженного с производным резорцина посредством реакции конденсации блок-сополимера и производного резорцина, получение может быть осуществлено в соответствии со способом получения блок-сополимера, сопряженного с производным камптотецина, описанного выше.
[0403]
Блок-сополимер, сопряженный с производным резорцина, согласно настоящему изобретению может демонстрировать фармакологический эффект посредством медленного расщепления и высвобождения производного резорцина, обладающего ингибирующей активностью в отношении HSP90, после введения in vivo. Таким образом, блок-сополимер, сопряженный с производным резорцина, согласно настоящему изобретению может быть использован в качестве терапевтического средства, которое применяют для лечения злокачественных опухолевых заболеваний или заболеваний, связанных с патологической пролиферацией клеток.
[0404]
При использовании блок-сополимера, сопряженного с производным резорцина, согласно настоящему изобретению в качестве фармацевтического продукта, доза может быть абсолютно изменена в зависимости от пола, возраста, физиологического состояния, болезненного состояния и т.п. пациента. Однако предпочтительно вводить блок-сополимер, сопряженный с производным резорцина, парентерально, обычно в дозе от 0,01 до 500 мг/м2 (площадь поверхности тела) и предпочтительно от 0,1 до 250 мг/м2 в пересчете на активный ингредиент, в сутки для взрослого человека. В отношении способа введения, предпочтительно использовать блок-сополимер, сопряженный с производным резорцина, посредством парентерального введения. Введение посредством инъекции осуществляют внутривенным введением, внутриартериальным введением, подкожным введением, внутримышечным введением, введением в опухоль или т.п.
[0405]
Предпочтительно, блок-сополимер, сопряженный с производным резорцина, согласно настоящему изобретению, используют в качестве фармацевтического препарата, который обычно используют, например, в форме препарата для инъекций, таблетки или порошка. В отношении лекарственной формы, могут быть использованы обычно применяемые фармацевтически приемлемые носители, например, связующее вещество, смазывающий агент, разрыхлитель, растворитель, вспомогательное вещество, солюбилизирующий агент, диспергатор, стабилизатор, суспендирующий агент, консервант, успокоительный агент, красящее вещество и вкусовая добавка. В случае жидкого препарата для инъекций обычно используют растворитель. Примеры растворителя включают, но не ограничиваются ими, воду, физиологический солевой раствор, 5% раствор глюкозы или маннита; водорастворимые органические растворители, такие как, глицерин, этанол, диметилсульфоксид, N-метилпирролидон, полиэтиленгликоль и хромофор; их жидкие смеси; и жидкие смеси воды и водорастворимых органических растворителей. Предпочтительно, блок-сополимер, сопряженный с производным резорцина, используют после получения в виде фармацевтического препарата, пригодного для введения, с применением указанных добавок для составления лекарственной формы.
[0406]
В отношении применения блок-сополимера, сопряженного с производным резорцина, согласно настоящему изобретению в качестве противоопухолевого агента, указанный блок-сополимер используют для лечения злокачественных опухолевых заболеваний. Злокачественные опухолевые заболевания, которые можно лечить, не имеют конкретного ограничения, и блок-сополимер, сопряженный с производным резорцина, может быть использован для лечения злокачественных опухолевых заболеваний, таких как рак молочной железы, немелкоклеточный рак легких, мелкоклеточный рак легких, рак толстой и прямой кишок, неходжкинская лимфома (NHL), почечноклеточная карцинома, рак предстательной железы, гепатокарцинома, рак желудка, рак поджелудочной железы, саркома мягких тканей, злокачественный рак кожи, карциноидные опухоли, рак головы и шеи, мелоанома, рак яичников, холангиокарцинома, мезотелиома и множественная миелома. В частности, блок-сополимер, сопряженный с производным резорцина, подходит для лечения немелкоклеточного рака легких, рака шейки матки, рака яичников, рака желудка (неоперабельного или рецидивирующего), рака толстой и прямой кишок (неоперабельного или рецидивирующего), рака молочной железы (неоперабельного или рецидивирующего), плоскоклеточной карциномы и злокачественной лимфомы (неходжкинской лимфомы), для лечения которых используют производные резорцина.
[0407]
Другой предпочтительный вариант реалиации настоящего изобретения может представлять собой блок-сополимер, в котором присутствует производное такасана, которое используют как противоопухолевый агент в качестве физиологически активного вещества. Ниже описан блок-сополимер, сопряженный с производным таксана, в котором использовано производное таксана в качестве физиологически активного вещества.
[0408]
Производные таксана представляют собой соединения, которые связаны с внутриклеточными микротрубочками и вследствие этого приобретают ингибирующую активность в отношении клеточной пролиферации, основанную на способности ингибировать деполимеризацию, и производные таксана используют в качестве противоопухолевых агентов. В отношении производных таксана, которые используют в качестве противоопухолевых агентов, известны паклитаксел, доцетаксел, кабазитаксел и т.п. Поскольку указанные соединения содержат гидроксильные группы в кольцевом скелете или в боковых цепях таксана, указанные соединения могут быть использованы для блок-сополимера согласно настоящему изобретению с применением гидроксильных групп в качестве линкерных групп. То есть блок-сополимер представлен в форме, в которой гидроксильная группа производного таксана образует сложноэфирную связь с карбоксильной группой боковой цепи аспарагиновой кислоты и/или глутаминовой кислоты напрямую или через подходящую линкерную группу.
[0409]
В соответствии с настоящим изобретением, предпочтителен блок-сополимер, сопряженный с производным таксана, в котором R3 в общей формуле (1) представляет собой остаток производного таксана. Пояснение представлено ниже.
[0410]
Блок-сополимер, сопряженный с производным таксана, согласно настоящему изобретению, представляет собой блок-сополимер, представленный общей формулой (1), в котором полиэтиленгликолевый сегмент связан с сегментом производного поли(аспарагиновой кислоты и/или глутаминовой кислоты), и R3 представляет собой остаток производного таксана. То есть блок-сополимер, сопряженный с производным таксана, согласно настоящему изобретению, представляет собой блок-сополимер, сопряженный с производным таксана, представленный общей формулой (1):
[0411]
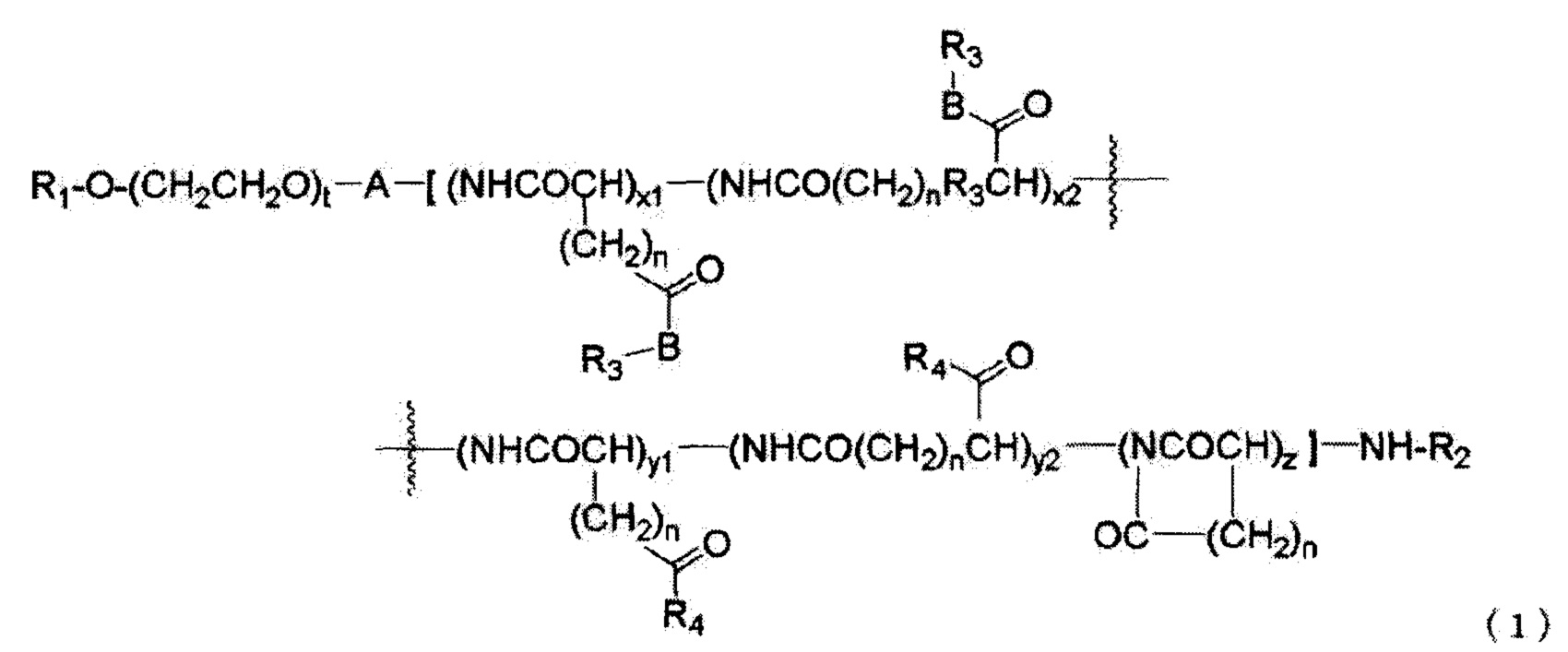
где R1 представляет собой атом водорода или С1-С6 алкильную группу, которая может иметь заместитель; t представляет собой целое число от 20 до 270; А представляет собой С1-С6 алкиленовую группу, которая может иметь заместитель; R2 представляет собой заместитель, выбранный из группы, состоящей из атома водорода, С1-С6 ацильной группы и С1-С20 алкоксикарбонильной группы; R3 представляет собой остаток производного таксана; R4 представляет собой один или более заместителей, выбранных из группы, состоящей из линейной, разветвленной или циклической С1-С30 алкокси-группы, которая может иметь заместитель, линейной, разветвленной или циклической С1-С30 алкиламино-группы, которая может иметь заместитель, линейной, разветвленной или циклической С1-С30 диалкиламино-группы, которая может иметь заместитель, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, линейной, разветвленной или циклической С1-С30 диалкиламино-группы, которая может иметь заместитель, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, остатка гидрофобного флуоресцентного вещества и гидроксильной группы; В представляет собой линкерную группу; n равен 1 или 2; каждый x1, x2, y1, y2 и z независимо представляет собой целое число от 0 до 25; (x1+x2) равно целому числу от 1 до 25; (x1+x2+y1+y2+z) равно целому числу от 3 до 25; и каждое составное звено, с которым связан R3 или R4, и составное звено, в котором внутримолекулярно циклизована карбонильная группа боковой цепи, независимо расположены случайным образом.
[0412]
В данном случае общие формулы R1, R2, R4, A, B, t, x1, x2, y1, y2 и z имеют такие же значения, как описаны выше.
[0413]
Если R3 в общей формуле (1) представляет собой остаток производного таксана, то известные примеры производного таксана включают паклитаксел, доцетаксел и кабазитаксел. Поскольку они имеют гидроксильные группы в кольце и в боковых цепях таксана, то указанные производные могут быть использованы в качестве физиологически активного вещества согласно настоящему изобретению.
[0414]
Предпочтительный вариант реализации случая, в котором представленное физиологически активное вещество представляет собой производное таксана, может представлять собой блок-сополимер, сопряженный с производным таксана, в котором полиэтиленгликолевый сегмент связан с сегментом производного полиаспарагиновой кислоты, и карбоксильная группа боковой цепи звена аспарагиновой кислоты связана с производным таксана. То есть предпочтительно использовать сегмент полиаспарагиновой кислоты в качестве полиаминокислотного сегмента блок-сополимера. В то же время сегмент полиаспарагиновой кислоты может представлять собой сегмент полимеризованной полиаспарагиновой кислоты α-формы, сегмент полимеризованной полиаспарагиновой кислоты β-формы или сегмент полимеризованной полиаспарагиновой кислоты смешанного α-β типа. То есть n в общей формуле (1) предпочтительно равен 1.
[0415]
Более предпочтительный вариант реализации блок-сополимера, сопряженного с производным таксана, представляет собой блок-сополимер, сопряженный с производным таксана, представленный общей формулой (6):
[0416]

где R1c представляет собой атом водорода или С1-С6 алкильную группу, которая может иметь заместитель; tc представляет собой целое число от 20 до 270; Ас представляет собой С1-С6 алкиленовую группу, которая может иметь заместитель; каждый x1c, x2c, y1c, y2c и zc представляют собой целое число; (x1c+x2c+y1c+y2c+zc) равно от 3 до 25; отношение (x1c+x2c) к (x1c+x2c+y1c+y2c+zc) составляет от 1% до 100%, а отношение (y1c+y2c+zc) составляет от 0% до 99%; R2c выбран из группы, состоящей из атома водорода, С1-С6 ацильной группы, которая может иметь заместитель, и С1-С6 алкоксикарбонильной группы, которая может иметь заместитель; R3c представляет собой остаток производного таксана; R4c могут быть одинаковыми или различными и представляют собой один или более заместителей, выбранных из группы, состоящей из С1-С8 алкокси-группы, которая может иметь заместитель, С1-С8 алкиламино-группы, которая может иметь заместитель, ди-С1-С8 алкиламино-группы, которая может иметь заместитель, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, и гидроксильной группы; и каждое звено аспарагиновой кислоты, с которым связан R3c, и звено аспарагиновой кислоты, с которым связан R4c, независимо полимеризованы в случайном порядке.
[0417]
С1-С6 алкильная группа, которая может иметь заместитель для R1c, может быть линейной, разветвленной или циклической С1-С6 алкильной группой, которая может иметь заместитель. Ее примеры включают, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, циклопентильную группу, н-гексильную группу и циклогексильную группу.
[0418]
Примеры заместителя, который может быть присоединен, могут включать, но не ограничиваются ими, атом галогена, нитро-группу, циано-группу, гидроксильную группу, меркапто-группу, карбоциклическую или гетероциклическую арильную группу, алкилтио-группу, арилтио-группу, алкилсульфинильную группу, арилсульфинильную группу, алкилсульфонильную группу, арилсульфонильную группу, сульфамоильную группу, алкокси-группу, арилокси-группу, ацилокси-группу, алкоксикарбонилокси-группу, карбамоилокси-группу, замещенную или незамещенную аминогруппу, ациламино-группу, алкоксикарбониламино-группу, уреидо-группу, сульфониламино-группу, сульфамоиламино-группу, формильную группу, ацильную группу, карбоксильную группу, алкоксикарбонильную группу, карбамоильную группу и силильную группу. Положение замещения в ароматическом кольце может представлять собой орто-положение, мета-положение или пара-положение.
[0419]
Примеры R1c включают, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, втор-бутильную группу трет-бутильную группу, бензильную группу, 2,2-диметоксиэтильную группу, 2,2-диэтоксиэтильную группу и 2-формилэтильную группу. Более предпочтительна линейная, разветвленная или циклическая С1-С4 алкильная группа, которая может иметь заместитель. В частности, более предпочтительна метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, втор-бутильная группа, трет-бутильная группа и т.п.
[0420]
С1-С6 алкиленовая группа, которая может иметь заместитель для Ас, включает, но не ограничиваются ими, метиленовую группу, этиленовую группу, н-пропиленовую группу и н-бутиленовую группу. В отношении заместителя, который может быть присоединен, указанная алкиленовая группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу алкокси-группу, арильную группу или т.п. В частности, Ас более предпочтительно представляет собой этиленовую группу или н-пропиленовую группу.
[0421]
tc представляет собой количество полимеризованных звеньев этиленокси-группы в полиэтиленгликолевом сегменте. Такой tc представляет собой целое число от 20 до 270. То есть молекулярная масса полиэтиленгликолевого сегмента составляет от 0,8 килодальтон до 12 килодальтон. Если tc, который представляет собой степень полимеризации полиэтиленгликолевого сегмента, меньше 20, то получаемый в результате блок-сополимер, сопряженный с производным таксана, не имеет достаточной растворимости в воде, и существует риск отсутствия требуемой биокинетики. С другой стороны, если tc больше 270, существует риск, что общая молекулярная масса получаемого в результате блок-сополимера, сопряженного с производным таксана, становится слишком большой, и требуемые свойства биокинетики могут отсутствовать, и в результате могут развиваться неожиданные расстройства тканей. Предпочтительно, tc представляет собой целое число от 22 до 230 и более предпочтительно целое число от 30 до 180. То есть молекулярная масса полиэтиленгликолевого сегмента предпочтительно составляет от 1 килодальтон до 10 килодальтон и более предпочтительно от 1,3 килодальтон до 8 килодальтон.
[0422]
Блок-сополимер общей формулы (6) содержит сегмент производного полиаспарагиновой кислоты, и (x1c+x2c+y1c+y2c+zc) представляет собой количество полимеризованных звеньев производного полиглутаминовой кислоты. Количество полимеризованных звеньев производного полиаспарагиновой кислоты составляет от 3 до 25, то есть (x1c+x2c+y1c+y2c+zc) представляет собой целое число от 3 до 25. Если значение (x1c+x2c+y1c+y2c+zc) меньше 3, то существует риск, что описанная ниже интенсивность рассеяния лазерного излучения получаемого в результате блок-сополимера, сопряженного с производным таксана, может не входить в оптимальный диапазон. С другой стороны, если значение (x1c+x2c+y1c+y2c+zc) больше 25, то общая молекулярная масса получаемого в результате блок-сополимера, сопряженного с производным таксана, становится большое, и также существует риск, что интенсивность рассеяния лазерного излучения, описанная ниже, может не входить в оптимальный диапазон. То есть если значение (x1c+x2c+y1c+y2c+zc) не входит в диапазон от 3 до 25, то существует иск, что действие усиления противоопухолевого эффекта и/или эффект снижения неблагоприятных эффектов может не быть достигнут. Предпочтительно, количество полимеризованных звеньев производного полиаспарагиновой кислоты задано подходящим образом, с учетом общей молекулярной массы блок-сополимера, сопряженного с производным таксана. Указанное значение (x1c+x2c+y1c+y2c+zc) предпочтительно представляет собой целое число от 5 до 20.
[0423]
Значение (x1c+x2c+y1c+y2c+zc), которое представляет собой количество полимеризованных звеньев производного полиаспарагиновой кислоты, может быть определено с помощью анализа1H-ЯМР или нейтрализующего титрования блок-сополимера полиэтиленгликоля с полиаспарагиновой кислоты до связывания с ним R3c и R4c.
[0424]
С1-С6 ацильная группа, которая может иметь заместитель для R2c, может быть линейной, разветвленной или циклической С1-С6 ацильной группой, которая может иметь заместитель. В отношении заместителя, может быть включена гидроксильная группа, атом галогена, аминогруппа, алкиламино-группа, диалкиламино-группа, алкокси-группа, арильная группа или т.п. Примеры С1-С6 ацильной группы для R2c включают, но не ограничиваются ими, формильную группу, ацетильную группу, трихлорацетильную группу, трифторацетильную группу, пропионильную группу, пивалоильную группу, бензилкарбонильную группу и фенетилкарбонильную группу. Более предпочтительна линейная, разветвленная или циклическая С1-С4 ацильная группа, которая может иметь заместитель, и более предпочтительная ацетильная группа, трихлорацетильная группа и трифторацетильная группа.
[0425]
С1-С6 алкоксикарбонильная группа, которая может иметь заместитель для R2c, может быть линейной, разветвленной или циклической С1-С6 алкоксикарбонильной группой, которая может иметь заместитель. В отношении заместителя, может быть включена гидроксильная группа, атом галогена, аминогруппа, алкиламино-группа, диалкиламино-группа, алкокси-группа, арильная группа или т.п. Примеры С1-С6 алкоксикарбонильной группы для R2c включают, но не ограничиваются ими, метоксикарбонильную группу, этоксикарбонильную группу, трет-бутоксикарбонильную группу, бензилоксикарбонильную группу и 9-флуоренилметилоксикарбонильную группу.
[0426]
Производное таксана для остатка производного таксана R3c предпочтительно представляет собой одно или более производных, выбранных из группы, состоящей из паклитаксела, доцетаксела и кабазитаксела. Производные таксана содержат гидроксильные группы в кольцевом скелете и в боковых цепях таксана. Способ связывания производного таксана R3c не имеет конкретного ограничения, и необходимо, чтобы любая одна гидроксильная группа такого производного таксана образовывала сложноэфирную связь с карбоксильной группой боковой цепи полиаспарагиновой кислоты.
[0427]
Производное таксана R3c является таким, что в одной молекуле блок-сополимера, сопряженного с производным таксана, могут присутствовать одинаковые соединения, или могут присутствовать различные виды соединений в виде смеси. Предпочтительно, R3c представляют собой одинаковые соединения.
[0428]
В общей формуле (6) (x1c+x2c) представляет собой общее количество звеньев аспарагиновой кислоты, с которыми связано производное таксана R3c. Обязательная конфигурация должна содержать звено аминокислоты, с которым связано производное таксана, и (x1c+x2c) представляет собой целое число, равное 1 или более. Предпочтительно, (x1c+x2c) представляет собой целое число от 2 до 20, и более предпочтительно целое число от 2 до 15.
[0429]
Отношение (x1c+x2c) к (x1c+x2c+y1c+y2c+zc), которое представляет собой количество полимеризованных звеньев производного полиаминокислоты, составляет от 1% до 100%. Отношение (x1c+x2c) к (x1c+x2c+y1c+y2c+zc) предпочтительно составляет от 5% до 80% и более предпочтительно от 5% до 60%.
[0430]
Количество связей производного таксана (x1c+x2c) может быть получено посредством гидролиза получаемого блок-сополимера, сопряженного с производным таксана, количественного определения с помощью ВЭЖХ высвобожденных молекул производного таксана или молекулярных фрагментов, образованных из него, и расчета содержания производного таксана, и расчета количества связей по полученному значению. Кроме того, содержание производного таксана может быть рассчитано по реакционному отношению производного таксана при получении блок-сополимера, сопряженного с производным таксана, и по полученному значению может быть рассчитано количество связей.
[0431]
R4c представляют собой один или более заместителей, выбранных из группы, состоящей из С1-С8 алкокси-группы, которая может иметь заместитель, С1-С8 алкиламино-группы, которая может иметь заместитель, ди-С1-С8 алкиламино-группы, которая может иметь заместитель, С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель, и гидроксильной группы.
[0432]
R4c могут быть необязательно введены для регулирования физических свойств блок-сополимера, сопряженного с производным таксана, согласно настоящему изобретению. Например, гидрофобность полиаминокислотного сегмента в блок-сополимере, сопряженном с производным таксана, может быть увеличена посредством внедрения гидрофобной группы в R4c. С другой стороны, при внедрении в качестве R4cгидрофильного заместителя, включая ионную функциональную группу, способную образовывать соль, такую как аминогруппа, карбоксильная группа или гидроксильная группа, может быть увеличена гидрофильность полиаминокислотного сегмента блок-сополимера, сопряженного с производным таксана. В том случае, если R4c представляет собой гидроксильную группу, карбоксильная группа боковой цепи сегмента полиаспарагиновой кислоты представляет собой свободную карбоновую кислоту.
[0433]
Заместители для R4c могут представлять собой заместители одного вида или могут быть заместителями нескольких видов.
[0434]
С1-С8 алкокси-группа, которая может иметь заместитель для R4c, может быть линейной, разветвленной или циклической С1-С8 алкокси-группой, которая может иметь заместитель. То есть она представляет собой алкокси-группу, в которой модифицирующая группа сложноэфирного типа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. Алкокси-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. в качестве заместителя. Примеры С1-С8 алкокси-группы для R4c включают, но не ограничиваются ими, метокси-группу, этокси-группу, пропокси-группу, изопропокси-группу, бутокси-группу, трет-бутокси-группу, циклогексилокси-группу и бензилокси-группу.
[0435]
С1-С8 алкиламино-группа, которая может иметь заместитель для R4c, может быть линейной, разветвленной или циклической С1-С8 алкиламино-группой, которая может иметь заместитель. То есть она представляет собой алкиламино-группу, в которой модифицирующая группа алкиламидного типа связана с карбоксильной группой боковой цепи сегмента полиаспарагиновой кислоты. Алкиламино-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. в качестве заместителя. Примеры С1-С8 алкиламино-группы для R4c включают, но не ограничиваются ими, метиламино-группу, этиламино-группу, пропиламино-группу, изопропиламино-группу, бутиламино-группу, трет-бутиламино-группу, циклогексиламино-группу и бензиламино-группу.
[0436]
Аминокислота, имеющая защищенную карбоксильную группу, также включена в такую С1-С8 алкиламино-группу, которая может иметь заместитель. Примеры аминокислоты, имеющей защищенную карбоксильную группу, которая может быть использована, включают, но не ограничиваются ими, метиловый эфир глицина, бензиловый эфир глицина, метиловый эфир β-аланина, бензиловый эфир β-аланина, метиловый эфир аланина, метиловый эфир лейцина и метиловый эфир фенилаланина.
[0437]
Ди-С1-С8 алкиламино-группа, которая может иметь заместитель для R4c, может быть линейной, разветвленной или циклической ди-С1-С8 алкиламино-группой, которая может иметь заместитель. То есть она представляет собой диалкиламино-группу, в которой модифицирующая группа диалкиламидного типа связана с карбоксильной группой боковой цепи сегмента полиаспарагиновой кислоты. В качестве заместителя диалкиламино-группа может содержать гидроксильную группу, атом галогена, аминогруппу, алкиламино-группу, диалкиламино-группу, алкокси-группу, арильную группу или т.п. Примеры ди-С1-С8 алкиламино-группы для R4c включают, но не ограничиваются ими, диметиламино-группу, диэтиламино-группу, дипропиламино-группу, диизопропиламино-группу, дибутиламино-группу, пирролидино-группу, пиперидино-группу, дибензиламино-группу и N-бензил-N-метиламино-группу.
[0438]
Заместитель для R4c также может представлять собой С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группу, которая может иметь заместитель. Она представляет собой группу, в которой модифицирующая группа мочевинного типа связана с карбоксильной группой боковой цепи сегмента полиаспарагиновой кислоты, и которая имеет -N(R4cx)CONH(R4cy) [где R4cx и R4cy могут быть одинаковыми или различными, и каждый представляет собой линейную, разветвленную или циклическую С1-С8 алкильную группу, которая может быть замещена третичной аминогруппой] в качестве карбоксильной группы боковой цепи.
[0439]
Примеры линейной, разветвленной или циклической С1-С8 алкильной группы, которая может быть замещена третичной аминогруппой для R4cx и R4cy, могут включать, но не ограничиваются ими, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, циклогексильную группу, 2-диметиламиноэтильную группу и 3-диметиламинопропильную группу.
[0440]
Примеры С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы, которая может иметь заместитель для R4c, включают, но не ограничиваются ими, метиламинокарбонил-метиламино-группу, этиламинокарбонил-этиламино-группу, изопропиламинокарбонил-изопропиламино-группу, циклогексиламинокарбонил-циклогексиламино-группу, этиламинокарбонил-(3-диметиламинопропил)амино-группу и (3-диметиламинопропил)аминокарбонилэтиламино-группу.
[0441]
R4c в общей формуле (6) также может представлять собой гидроксильную группу. То есть карбоксильная группа боковой цепи аминокислоты представляет собой свободную карбоновую кислоту. В таком случае карбоновая кислота боковой цепи может быть в форме свободной кислоты или может быть в форме любой фармацевтически приемлемой соли карбоновой кислоты. Примеры соли карбоновой кислоты включают, но не ограничиваются ими, литиевую соль, натриевую соль, калиевую соль, магниевую соль, кальциевую соль и аммониевую соль, которые включены в настоящее изобретение.
[0442]
R4c в общей формуле (6) предпочтительно представляет собой С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группу и/или гидроксильную группу. То есть вариант реализации, в котором R4c включают смесь С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группы и гидроксильной группы, или вариант реализации, в котором R4c включают только гидроксильные группы, является предпочтительным.
[0443]
В общей формуле (6) (y1c+y2c) представляет собой общее количество звеньев аспарагиновой кислоты, с которыми связан R4c. Звено аспарагиновой кислоты, с которым связан R4c, представляет собой необязательную конфигурацию, и (y1c+y2c) представляет собой целое число от 0 до 24. Предпочтительно, (y1c+y2c) представляет собой целое число от 5 до 24, и более предпочтительно от 10 до 24.
[0444]
Отношение (y1c+y2c) к (x1c+x2c+y1c+y2c+zc), которое представляет собой количество полимеризованных звеньев производного полиаспарагиновой кислоты, составляет от 0% до 99%. Отношение (y1c+y2c) к (x1c+x2c+y1c+y2c+zc) предпочтительно составляет от 10% до 95% и более предпочтительно от 30% до 95%.
[0445]
Кроме того, zc представляет собой общее количество составных звеньев полиаспарагиновой кислоты, в которых карбонильная группа боковой цепи внутримолекулярно циклизована и представляет собой необязательную конфигурацию. Такой z представляет собой остальную часть, получаемую вычитанием составных звеньев аспарагиновой кислоты, с которыми связаны R3c и R4c, из количества полимеризованных звеньев производного полиаспарагиновой кислоты.
[0446]
Таким образом, в отношении (y1c+y2c+zc), которое представляет собой количество составных звеньев аспарагиновой кислоты, отличных от звеньев аспарагиновой кислоты, с которыми связан R4c, содержащий остаток таксана, его отношение к общему количеству полимеризованных звеньев сегмента производного полиаспарагиновой кислоты составляет от 0% до 99%, предпочтительно от 20% до 95% и более предпочтительно от 40% до 95%.
[0447]
В отношении блок-сополимера, сопряженного с производным таксана, представленного общей формулой (6), сегмент производного полиаспарагиновой кислоты представляет собой полимерный сегмент, содержащий смесь звена производного аспарагиновой кислоты, содержащего R3c у качестве карбоксильной группы боковой цепи, звена производного аспарагиновой кислоты, содержащего R4c, и звена аспарагиновой кислоты, в котором карбонильная группа боковой цепи внутримолекулярно циклизована. Звено производного аспарагиновой кислоты, которое содержит R3c, звень производного аспарагиновой кислоты, которое содержит R4c, и звено аспарагиновой кислоты, в котором карбонильная группа боковой цепи внутримолекулярно циклизована, могут быть расположены ориентированным образом, или могут быть статистического типа полимеризации, в котором звенья производного аспарагиновой кислоты расположены неупорядоченно. Предпочтителен сегмент производного полиаспарагиновой кислоты статистического типа полимеризации, в котором звенья производного аминокислоты, содержащие R3c, звенья производного аминокислоты, содержащие R4c, и звенья аспарагиновой кислоты, в которых карбонильная группа боковой цепи внутримолекупярно циклизована, расположены неупорядоченно.
[0448]
Блок-сополимер, сопряженный с производным таксана, согласно настоящему изобретению имеет молекулярную массу от 2 килодальтон до 15 килодальтон. Если молекулярная масса меньше 2 килодальтон, то существует риск, что фармакокинетические характеристики, основанные на образовании макромолекул, могут отсутствовать, и требуемое фармакологическое действие, такое как действие усиления противоопухолевого эффекта, может не быть достигнуто. В то же время, если молекулярная масса составляет более 15 килодальтон, то существует риск, что исключение неблагоприятных эффектов, обусловленных противоопухолевым действием, не будет легко достигнуто, и неблагоприятные эффекты могут присутствовать в значительной степени. В частности, производные таксана характеризуются пролонгированной гематотоксичностью, например, в значительной степени проявляется миелосупрессия. Если молекулярная масса составляет более 15 килодальтон, в значительной степени проявляется пролонгированная гематотоксичность. Следовательно, регулирование молекулярной массы является очень важным для представленного блок-сополимера, сопряженного с производным таксана. Молекулярная масса блок-сополимера, сопряженного с производным таксана, согласно настоящему изобретению предпочтительно составляет от 3 килодальтон до 15 килодальтон и более предпочтительно от 3 килодальтон до 12 килодальтон.
[0449]
В отношении молекулярной массы блок-сополимера, сопряженного с производным таксана, согласно настоящему изобретению, в качестве «молекулярной массы блок-сополимера, сопряженного с производным таксана» используют рассчитанное значение, полученное суммированием соответствующей молекулярной массы каждой составляющей части. То есть в качестве молекулярной массы используют расчетное значение, полученное суммированием: (1) молекулярной массы полиэтиленгликолевого сегмента; (2) молекулярной массы главной цепи полиаспарагиновой кислоты; (3) общей молекулярной массы производного таксана, полученной умножением молекулярной массы остатка производного таксана на количество его связей; и (4) общей молекулярной массы заместителей, отличных от производного таксана, полученной умножением молекулярной массы таких остатков на количество их связей.
[0450]
«Молекулярная масса блок-сополимера, сопряженного с производным таксана» может представлять собой молекулярную массу, определенную с точностью до единиц килодальтон. Таким образом, метод анализа каждой составляющих части не имеет специального ограничения, при условии, что он представляет собой метод анализа с достаточной точностью для измерения молекулярной массы производного полиаминокислоты до единиц килодальтон, и в зависимости от обстоятельств могут быть выбраны различные методы анализа. Предпочтительный метод анализа для каждой составляющей части описан ниже.
[0451]
В отношении способа расчета соответствующей молекулярной массы каждой составляющей части, молекулярные массы компонентов могут быть рассчитаны способами в соответствии с представленным выше описанием.
[0452]
Блок-сополимер, сопряженный с производным таксана, согласно настоящему изобретению демонстрирует свойства самоассоциации в водном растворе. То есть блок-сополимер, сопряженный с производным таксана, обладает таким свойством, что при исследовании 1 мг/мл водного раствора блок-сополимера, сопряженного с производным таксана, анализом распределения частиц по размеру на основе метода рассеяния с использованием лазерного излучения, блок-сополимер, сопряженный с производным таксана, измеряют в виде наночастиц, имеющих среднеобъемный диаметр частиц от примерно нескольких нанометров до примерно 20 нанометров. Предпочтительно, что блок-сополимер, сопряженный с производным таксана, согласно настоящему изобретению имеет такое свойство, что указанное производное образует наночастицы, имеющие среднеобъемный диаметр частиц не более 20 нм в 1 мг/мл водном растворе. В таком случае используют анализ распределения частиц по размеру в водном растворе на основе чистой воды. Предпочтительно, блок-сополимер, сопряженный с производным таксана, характеризуется тем, что среднеобъемный диаметр частиц, измеренный методом анализа распределения частиц по размеру на основе метода динамического светорассеяния с применением лазерного излучения, составляет менее 20 нм и более предпочтительно, указанный блок-сополимер имеет такое свойство, что блок-сополимер анализируют как наночастицы, имеющие размер частиц от 3 до 15 нм.
[0453]
Среднеобъемный диаметр частиц согласно настоящему изобретению представляет собой размер частиц пика, который существует как наибольшая часть в объемном распределении, которое может быть измерено, например, с помощью анализатора дзета-потенциала/размера частиц NICOMP 380 ZLS (метод анализа: метод NICOMP) производства компании Particle Sizing Systems, LLC, или с помощью анализатора размера частиц и дзета-потенциала ZETASIZER NANO ZS (метод анализа: метод NNLS) производства компании Malvern Instruments, Ltd.
[0454]
Поскольку блок-сополимер, сопряженный с производным таксана, согласно настоящему изобретению представляет собой блок-сополимер, в котором гидрофильный полиэтиленгликолевый сегмент связан с сегментом полиаспарагиновой кислоты, который содержит гидрофобное производное таксана, связанное сложноэфирной связью, сделано предположение, что в водном растворе сегменты полиаспарагиновой кислоты из множества молекул блок-сополимера ассоциируются друг с другом вследствие гидрофобного взаимодействия сегмента производного полиаспарагиновой кислоты. Следовательно, сделано предположение, что образуются ассоциированные объекты типа мицеллы, которые имеют структуру из ядра и оболочки, в которых сегмент полиаспарагиновой кислоты образует внутреннее ядро (ядерную часть), а гидрофильный полиэтиленгликолевый сегмент покрывает периферию внутреннего ядра и образует внешний слой оболочки (оболочечную часть), и их можно наблюдать в виде наночастиц, описанных выше.
[0455]
Блок-сополимер, сопряженный с производным таксана, должен обладать свойством образования наночастиц в водном растворе для усиления эффективности производного таксана и/или уменьшения неблагоприятных эффектов.
[0456]
В качестве показателя свойства образования наночастиц блок-сополимера, сопряженного с производным таксана, согласно настоящему изобретению эффективно использовать интенсивность светорассеяния, полученную с помощью лазерного излучения. То есть свойства образования наночастиц блок-сополимера, сопряженного с производным таксана, в водном растворе могут быть проверены с применением интенсивности светорассеяния лазерного излучения в качестве показателя. В таком случае эффективен способ проверки свойств образования наночастиц блок-сополимера, сопряженного с производным таксана, в водном растворе с применением толуола в качестве стандартного образца интенсивности светорассеяния и с применением относительной интенсивности относительно толуола, в качестве показателя.
[0457]
Блок-сополимер, сопряженный с производным таксана, согласно настоящему изобретению является таким, что интенсивность рассеяния лазерного излучения в 1 мг/мл водном растворе блок-сополимера в 2 или более раз выше, чем относительная интенсивность светорассеяния толуола. Если относительная интенсивность светорассеяния является менее чем двукратной, можно предположить, что блок-сополимер, сопряженный с производным таксана, не обладает достаточными свойствами образования наночастиц, и, следовательно, свойства проникновения в ткань-мишень могут не быть достигнуты в достаточной степени, что приводит к риску возможных неблагоприятных эффектов. Согласно настоящему изобретению, значение относительной интенсивности светорассеяния представляет собой показатель, демонстрирующий, что вещество обладает способностью к образованию наночастиц, и приемлемо любое значение, при условии, что оно в два раза или более превышает интенсивность светорассеяния толуола, без каких-либо конкретных ограничений. То есть понятно, что даже если относительная интенсивность светорассеяния выше более чем в 100 раз, то полимерное производное обладает достаточной способностью к образованию наночастиц.
[0458]
Блок-сополимер, сопряженный с производным таксана, согласно настоящему изобретению является таким, что интенсивность светорассеяния его водного раствора предпочтительно в 2-70 раз и более предпочтительно в 2-50 раз выше относительной интенсивности светорассеяния толуола.
[0459]
В отношении водного раствора, измерение интенсивности светорассеяния представляет собой анализируемое значение, полученное с применением водного раствора, полученного с использованием чистой воды, которая не содержит микрочастиц, в качестве аналитического образца. Необязательно, вещество может быть растворено в водном растворе с помощью ультразвука во время получения раствора. Водный раствор, полученный таким образом, предпочтительно представляет собой водный раствор, который дополнительно подвержен фильтрационной обработке для удаления микрочастиц субмикронного размера.
[0460]
В отношении метода измерения интенсивности светорассеяния, полученного с помощью лазерного излучения, для анализа свойств образования наночастиц блок-сополимера, сопряженного с производным таксана, согласно настоящему изобретению, подходит способ с применением 1 мг/мл водного раствора блок-сополимера, сопряженного с производным таксана, в качестве экспериментального образца, и измерения интенсивности светорассеяния с помощью фотометра для измерения рассеяния лазерного излучения при температуре измерения 25°С, угле рассеяния 90° и длине волны 632,8 нм. Примеры измерительного прибора могут включать, но не ограничиваются ими, фотометр для измерения динамического светорассеяния производства компании Otsuka Electronics Co., Ltd., DLS-8000DL (температура измерения: 25°С, угол рассеяния: 90°, длина волны: 632,8 нм, нейтральный фильтр: 2,5%, РН1: открыт, РН2: щель).
[0461]
В отношении толуола, который используют в качестве стандартного вещества для измерения интенсивности светорассеяния, может быть использован любой толуол без специальных ограничений, при условии, что толуол имеет реактивную степень чистоты. Предпочтительно использовать толуол, подверженный предварительной фильтрации, которую обычно осуществляют для получения образца для анализа светорассеяния.
[0462]
Блок-сополимер, сопряженный с производным таксана, согласно настоящему изобретению предпочтительно является таким, что массовое содержание производного таксана, представленного структурой R3c в общей формуле

[0463]
В отношении блок-сополимера, сопряженного с производным таксана, согласно настоящему изобретению, если R4c в общей формуле (6) представляет собой С1-С8 алкокси-группу, которая может иметь заместитель, С1-С8 алкиламино-группу, которая может иметь заместитель, ди-С1-С8 алкиламино-группу, которая может иметь заместитель, или С1-С8 алкиламинокарбонил-С1-С8 алкиламино-группу, которая может иметь заместитель, поскольку линкерная группа R4c представляет собой необязательный заместитель, относительное содержание заместителя составляет 30% по массе или менее. Относительное содержание заместителя предпочтительно составляет от 1% по массе до 20% по массе.
[0464]
Массовое содержание полиэтиленгликолевого сегмента в блок-сополимере, сопряженном с производным таксана, согласно настоящему изобретению предпочтительно составляет от 10% по массе до 80% по массе. Если массовое содержание полиэтиленгликолевого сегмента составляет менее 10% мо массе, то блок-сополимер, сопряженный с производным таксана, не обладает достаточной растворимостью в воде и, следовательно, существует риск, что свойства образования наночастиц в водном растворе могут не быть достигнуты. С другой стороны, если массовое содержание больше 80% по массе, то вследствие относительного снижения массового содержания сегмента полиаспарагиновой кислоты, содержащего производное таксана, существует риск, что свойства образования наночастиц в водном растворе могут не быть достигнуты. Массовое содержание полиэтиленгликолевого сегмента предпочтительно составляет от 20% по массе до 70% по массе и более предпочтительно от 30% по массе до 65% по массе.
[0465]
Примеры способа получения блок-сополимера, сопряженного с производным таксана, согласно настоящему изобретению могут включать, но не ограничиваются ими, способ получения блок-сополимера, сопряженного с производным таксана, по реакции конденсации между блок-сополимером, в котором полиэтиленгликолевый сегмент связан с сегментом полиаспарагиновой кислоты, и производным таксана; и способ получения блок-сополимера, сопряженного с производным таксана, посредством связывания полимерного компонента, содержащего полиэтиленгликолевый сегмент, с производным полиаспарагиновой кислоты, сопряженным с производным таксана. Предпочтителен способ предварительного получения блок-сополимера, в котором полиэтиленгликолевый сегмент связан с сегментом полиаспарагиновой кислоты, и осуществление реакции конденсации указанного блок-сополимера и производного таксана.
[0466]
В отношении способа получения блок-сополимера, в котором полиэтиленгликолевый сегмент связан с сегментом полиаспарагиновой кислоты, и способа получения блок-сополимера, сопряженного с производным таксана посредством реакции конденсации блок-сополимера и производного таксана, получение может быть осуществлено в соответствии со способом получения блок-сополимера, сопряженного с производным камптотецина, описанного выше.
[0467]
Блок-сополимер, сопряженный с производным таксана, согласно настоящему изобретению может демонстрировать фармакологический эффект посредством медленного расщепления и высвобождения производного таксана после введения in vivo. Таким образом, блок-сополимер, сопряженный с производным таксана, согласно настоящему изобретению может быть использован в качестве противоопухолевого агента, который применяют для лечения злокачественных опухолевых заболеваний.
[0468]
При использовании блок-сополимера, сопряженного с производным таксана, согласно настоящему изобретению в качестве противоопухолевого агента доза может быть абсолютно изменена в зависимости от пола, возраста, физиологического состояния, болезненного состояния и т.п. пациента. Однако предпочтительно вводить блок-сополимер, сопряженный с производным таксана, парентерально, обычно в дозе от 0,01 до 500 мг/м2 (площадь поверхности тела) и предпочтительно от 0,1 до 250 мг/м2 в пересчете на активный ингредиент, в сутки для взрослого человека. В отношении способа введения, предпочтительно использовать блок-сополимер, сопряженный с производным таксана, посредством парентерального введения. Введение посредством инъекции осуществляют внутривенным введением, внутриартериальным введением, подкожным введением, внутримышечным введением, введением в опухоль или т.п.
[0469]
Предпочтительно, блок-сополимер, сопряженный с производным таксана, согласно настоящему изобретению, используют в качестве фармацевтического препарата, который обычно используют, например, в форме препарата для инъекций, таблетки или порошка. В отношении лекарственной формы, могут быть использованы обычно применяемые фармацевтически приемлемые носители, например, связующее вещество, смазывающий агент, разрыхлитель, растворитель, вспомогательное вещество, солюбилизирующий агент, диспергатор, стабилизатор, суспендирующий агент, консервант, успокоительный агент, красящее вещество и вкусовая добавка. В случае жидкого препарата для инъекций обычно используют растворитель. Примеры растворителя включают, но не ограничиваются ими, воду, физиологический солевой раствор, 5% раствор глюкозы или маннита; водорастворимые органические растворители, такие как, глицерин, этанол, диметилсульфоксид, N-метилпирролидон, полиэтиленгликоль и хромофор; их жидкие смеси; и жидкие смеси воды и водорастворимых органических растворителей. Предпочтительно, блок-сополимер, сопряженный с производным таксана, используют после получения в виде фармацевтического препарата, пригодного для введения, с применением указанных добавок для составления лекарственной формы.
[0470]
В отношении применения блок-сополимера, сопряженного с производным таксана, согласно настоящему изобретению в качестве противоопухолевого агента, указанный блок-сополимер используют для лечения злокачественных опухолевых заболеваний. Злокачественные опухолевые заболевания, которые можно лечить, не имеют конкретного ограничения, и блок-сополимер, сопряженный с производным таксана, может быть использован для лечения злокачественных опухолевых заболеваний, таких как рак молочной железы, немелкоклеточный рак легких, мелкоклеточный рак легких, рак толстой и прямой кишок, неходжкинская лимфома (NHL), почечноклеточная карцинома, рак предстательной железы, гепатокарцинома, рак желудка, рак поджелудочной железы, саркома мягких тканей, злокачественный рак кожи, карциноидные опухоли, рак головы и шеи, мелоанома, рак яичников, холангиокарцинома, мезотелиома и множественная миелома. В частности, блок-сополимер, сопряженный с производным таксана, подходит для лечения немелкоклеточного рака легких, рака шейки матки, рака яичников, рака желудка (неоперабельного или рецидивирующего), рака толстой и прямой кишок (неоперабельного или рецидивирующего), рака молочной железы (неоперабельного или рецидивирующего), плоскоклеточной карциномы и злокачественной лимфомы (неходжкинской лимфомы), для лечения которых используют производные таксана.
Примеры
[0471]
Здесь и далее настоящее изобретение дополнительно иллюстрировано с помощью примеров. Однако настоящее изобретение не ограничено указанными примерами.
[0472]
Измерения интенсивности рассеянного излучения блок-сополимеров, сопряженных с физиологически активным веществом, из примеров и сравнительных примеров проводили с помощью фотометра динамического светорассеяния производства компании Otsuka Electronics Co., Ltd., DLS-8000DL (температура измерения: 25°С, угол рассеяния: 90°, длина волны: 632,8 нм, нейтральный фильтр: 5%, РН1: открыт, РН2: щель). В отношении экспериментального образца для измерения интенсивности рассеянного излучения, использовали раствор, полученный добавлением сверхчистой воды к блок-сополимеру, сопряженному с физиологически активным веществом, с получением концентрации 1 мг/мл, растворением блок-сополимера обработкой смеси ультразвуковыми волнами в течение 10 минут при охлаждении на льду с последующим фильтрованием раствора через 0,2 мкм мембранный фильтр.
[0473]
Толуол (производства компании Junsei Chemical Co., Ltd., специальной марки), который использовали для измерения интенсивности светорассеяния, использовали после трехкратной фильтрации через 0,2 мкм мембранный фильтр.
[0474]
Измерение среднеобъемного диаметра частиц блок-сополимеров, сопряженных с физиологически активным веществом, из примеров и сравнительных примеров проводили с помощью анализатора дзета-потенциала/размера частиц NICOMP 380 ZLS (устройство А; температура: 25°С) производства компании Particle Sizing Systems, LLC, или с помощью анализатора размера частиц и дзета-потенциала ZETASIZER NANO ZS (устройство В; температура измерения: 25°С, аналитическая модель: общего назначения (нормальное разрешение), материал RI: 1,59) производства компании Malvern Instruments, Ltd. В отношении экспериментального образца для измерения среднеобъемного диаметра частиц, использовали раствор, полученный добавлением сверхчистой воды к блок-сополимеру, сопряженному с физиологически активным веществом, с получением концентрации 1 мг/мл или 5 мг/мл, растворением блок-сополимера обработкой смеси ультразвуковыми волнами в течение 10 минут при охлаждении на льду с последующим фильтрованием раствора через 0,2 мкм мембранный фильтр.
[0475]
[Пример синтеза 1] Синтез блок-сополимера полиэтиленгликоля и полиглутаминовой кислоты (молекулярная масса полиэтиленгликоля: 2 килодальтон, количество полимеризованных звеньев полиглутаминовой кислоты: 8; сополимер 1)
[0476]
Полиэтиленгликоль, содержащий одну концевую метокси-группу и одну концевую 3-аминопропильную группу (SUNBRIGHT MEPA-20H производства компании NOF Corporation, средняя молекулярная масса: 2 килодальтон, 7,00 г), растворяли в ДМСО (140 мл) и затем к нему добавляли ангидрид γ-бензил-L-глутамат-N-карбоновой кислоты (7,35 г). Смесь перемешивали в течение 24 часов при 30°С. Реакционный раствор в течение одного часа по каплям добавляли к перемешанному раствору диизопропилового эфира (2520 мл) и этанола (280 мл), и перемешивали полученную смесь в течение ночи при комнатной температуре. Затем собирали осадок фильтрацией и сушили при пониженном давлении с получением продукта полимеризации (12,77 г).
[0477]
Продукт полимеризации, полученный таким образом, растворяли в ДМФА (168 мл) и добавляли к нему уксусный ангидрид (2,6 мл). Смесь перемешивали в течение 21 часа при 20°С. Реакционный раствор в течение одного часа по каплям добавляли к перемешанному раствору диизопропилового эфира (1350 мл) и этилацетата (150 мл), и перемешивали полученную смесь в течение ночи при комнатной температуре. Затем собирали осадок фильтрацией и сушили при пониженном давлении с получением продукта ацетилированного полимера (11,66 г).
[0478]
Ацетилированный полимер, полученный таким образом, растворяли в ДМФА (291 мл) и добавляли к нему палладий на углероде (1,17 г). Затем реакционную атмосферу продували водородом и проводили гидрогенолиз в течение 24 часов при комнатной температуре и давлении 1 атм. Катализатор, 5% палладий на углероде, отделяли фильтрацией, а затем фильтрат в течение одного часа по каплям добавляли к перемешанной смеси гептана (1654 мл) и этилацетата (827 мл). Полученную смесь перемешивали в течение ночи при комнатной температуре. Затем осадок собирали фильтрацией и сушили при пониженном давлении. Остаток снова растворяли в воде и высушивали раствор замораживанием. Таким образом, получали блок-сополимер полиэтиленгликоля и полиглутаминовой кислоты (сополимер 1: 9,66 г).
[0479]
В отношении сополимера 1, количество полимеризованных звеньев глутаминовой кислоты, рассчитанное методом титрования с использованием 0,1 н. гидроксида калия, составляло 7,59.
[0480]
[Пример синтеза 2] Синтез блок-сополимера полиэтиленгликоля и полиглутаминовой кислоты (молекулярная масса полиэтиленгликоля: 2 килодальтон, количество полимеризованных звеньев полиглутаминовой кислоты: 10; сополимер 2)
[0481]
Полиэтиленгликоль, содержащий одну концевую метокси-группу и одну концевую 3-аминопропильную группу (SUNBRIGHT MEPA-20H производства компании NOF Corporation, средняя молекулярная масса: 2 килодальтон, 5,00 г), растворяли в ДМСО (100 мл) и затем к нему добавляли ангидрид γ-бензил-L-глутамат-N-карбоновой кислоты (7,50 г). Смесь перемешивали в течение 17 часов при 30°С. Реакционный раствор в течение одного часа по каплям добавляли к перемешанному раствору диизопропилового эфира (1800 мл) и этанола (200 мл), и перемешивали полученную смесь в течение ночи при комнатной температуре. Затем собирали осадок фильтрацией и сушили при пониженном давлении с получением продукта полимеризации (10,64 г).
[0482]
Продукт полимеризации, полученный таким образом, растворяли в ДМФА (176 мл) и добавляли к нему уксусный ангидрид (2,1 мл). Смесь перемешивали в течение 23 часов при 20°С. Реакционный раствор в течение одного часа по каплям добавляли к перемешанному раствору диизопропилового эфира (1584 мл) и этилацетата (176 мл), и перемешивали полученную смесь в течение ночи при комнатной температуре. Затем собирали осадок фильтрацией и сушили при пониженном давлении с получением продукта ацетилированного полимера (9,91 г).
[0483]
Ацетилированный полимер, полученный таким образом, растворяли в ДМФА (198 мл) и добавляли к нему палладий на углероде (0,99 г). Затем реакционную атмосферу продували водородом и проводили гидрогенолиз в течение 85 часов при комнатной температуре и давлении 1 атм. Катализатор, 5% палладий на углероде, отделяли фильтрацией, а затем фильтрат в течение одного часа по каплям добавляли к перемешанной смеси гептана (1125 мл) и этилацетата (563 мл). Полученную смесь перемешивали в течение ночи при комнатной температуре. Затем осадок собирали фильтрацией и сушили при пониженном давлении. Полученный осадок растворяли в 5% солевом растворе (570 мл) и доводили рН раствора до примерно 10, используя 2 н. водный раствор гидроксида натрия. Затем смесь очищали с помощью колоночной хроматографии на разделительной адсорбционной смоле с последующей колоночной хроматографией на ионообменной смоле. Элюированный раствор концентрировали при пониженном давлении, а затем сушили замораживанием. Таким образом, получали блок-сополимер полиэтиленгликоля и полиглутаминовой кислоты (сополимер 2: 5,66 г).
[0484]
В отношении сополимера 2, количество полимеризованных звеньев глутаминовой кислоты на основании значения, полученного титрованием с использованием 0,1 н. гидроксида калия, составляло 10,01.
[0485]
[Пример синтеза 3] Синтез блок-сополимера полиэтиленгликоля и полиглутаминовой кислоты (молекулярная масса полиэтиленгликоля: 5 килодальтон, количество полимеризованных звеньев полиглутаминовой кислоты: 10; сополимер 3)
[0486]
Указанный в заголовке блок-сополимер полиэтиленгликоля и полиглутаминовой кислоты (сополимер 3) получали способом, описанным в примере синтеза 2, с использованием полиэтиленгликоля, содержащего одну концевую метокси-группу и одну концевую 3-аминопропильную группу (SUNBRIGHT MEPA-50H производства компании NOF Corporation, средняя молекулярная масса: 5 килодальтон, 10,00 г), и ангидрид γ-бензил-L-глутамат-N-карбоновой кислоты (6,02 г).
[0487]
В отношении сополимера 3, количество полимеризованных звеньев глутаминовой кислоты на основании значения, полученного титрованием с использованием 0,1 н. гидроксида калия, составляло 10,02.
[0488]
[Пример синтеза 4] Синтез блок-сополимера полиэтиленгликоля и полиглутаминовой кислоты (молекулярная масса полиэтиленгликоля: 12 килодальтон, количество полимеризованных звеньев полиглутаминовой кислоты: 25; сополимер 4)
[0489]
Указанный в заголовке блок-сополимер полиэтиленгликоля и полиглутаминовой кислоты (сополимер 4) получали способом, описанным в эталонном примере 1 патентной литературы 1 (WO 2004/039869 А).
[0490]
В отношении сополимера 4, количество полимеризованных звеньев глутаминовой кислоты на основании значения, полученного титрованием с использованием 0,1 н. гидроксида калия, составляло 24,54.
[0491]
[Пример синтеза 5] Синтез блок-сополимера полиэтиленгликоля и полиглутаминовой кислоты (молекулярная масса полиэтиленгликоля: 3 килодальтон, количество полимеризованных звеньев полиглутаминовой кислоты: 7; сополимер 5)
[0492]
Указанный в заголовке блок-сополимер полиэтиленгликоля и полиглутаминовой кислоты (сополимер 5) получали способом, описанным в примере синтеза 1, с использованием полиэтиленгликоля, содержащего одну концевую 2-(трет-бутоксикарбониламино)этильную группу и одну концевую 2-аминоэтильную группу (H2N-PEG-NH-Boc, производства компании Rapp Polymere GmbH, средняя молекулярная масса: 3 килодальтон, 5,00 г), и ангидрид γ-бензил-L-глутамат-N-карбоновой кислоты (6,02 г).
[0493]
В отношении сополимера 5, количество полимеризованных звеньев глутаминовой кислоты на основании значения, полученного титрованием с использованием 0,1 н. гидроксида калия, составляло 6,55.
[0494]
[Пример синтеза 6] Синтез блок-сополимера полиэтиленгликоля и полиглутаминовой кислоты (молекулярная масса полиэтиленгликоля: 12 килодальтон, количество полимеризованных звеньев полиглутаминовой кислоты: 7; сополимер 6)
[0495]
Указанный в заголовке блок-сополимер полиэтиленгликоля и полиглутаминовой кислоты (сополимер 6) получали способом, описанным в эталонном примере 2 патентной литературы 1 (WO 2004/039869 А).
[0496]
В отношении сополимера 6, количество полимеризованных звеньев глутаминовой кислоты на основании значения, полученного титрованием с использованием 0,1 н. гидроксида калия, составляло 7,50.
[0497]
[Пример А-1] Синтез 7-этил-10-гидроксикамптотецинового (ЕНС) конъюгата блок-сополимера полиэтиленгликоля (2 килодальтон) и полиглутаминовой кислоты (7,6 полимер)
[0498]
Сополимер 1 (221 мг), полученный в примере синтеза 1, и 7-этил-10-гидроксикамптотецин (ЕНС, производства компании ScinoPharm Taiwan, Ltd., 120 мг) растворяли в ДМФА (17 мл) и добавляли к ним диметиламинопиридин (DMAP, 10 мг) и диизопропилкарбодиимид (DIPCI, 174 мкл). Смесь перемешивали в течение 24 часов при 25°С. Затем к ней добавляли DIPCI (174 мкл) и перемешивали смесь еще 3 часа. Реакционный раствор в течение одного часа по каплям добавляли к перемешанному раствору диизопропилового эфира (230 мл) и этилацетата (26 мл) и перемешивали полученную смесь в течение ночи при комнатной температуре. Затем собирали осадок фильтрацией и сушили при пониженном давлении с получением продукта (250 мг). Продукт, полученный таким образом, растворяли в смеси ацетонитрила/воды (98/2 (об./об.), 7 мл) и затем добавляли к ней ионообменную смолу. Смесь перемешивали в течение 7 часов при 5°С. Ионообменную смолу отделяли фильтрацией, а затем выпаривали ацетонитрил при пониженном давлении. Остаток сушили замораживанием с получением указанного в заголовке блок-сополимера, сопряженного с производным камптотецина (пример А-1).
[0499]
Пример А-1 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, а высвобожденный в результате ЕНС количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения содержания ЕНС. В результате содержание ЕНС в примере А-1 составило 29,0% (мас./мас.).
[0500]
Пример А-1 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1H-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению1H-NMR спектра соотношение изопропиламинокарбонил-изопропиламино-группы и остатка ЕНС составило 0,46.
[0501]
По указанным значениям рассчитывали общую молекулярную массу примера А-1, составившую 4519.
[0502]
Исходя из этого, массовая доля полиэтиленгликолевого сегмента составила 44,3%.
[0503]
Интенсивность светорассеяния 1 мг/мл водного раствора примера А-1 составляла 17070 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 5535 cps. Таким образом, отношение между интенсивностью светорассеяния примера А-1 и интенсивностью светорассеяния толуола составляло 3,1 раза. Среднеобъемный диаметр частиц составлял 6 нм (устройство А, 1 мг/мл).
[0504]
[Пример А-2] Синтез 7-этил-10-гидроксикамптотецинового (ЕНС) конъюгата блок-сополимера полиэтиленгликоля (2 килодальтон) и полиглутаминовой кислоты (10,0 полимер)
[0505]
Указанный в заголовке блок-сополимер, сопряженный с производным камптотецина (пример А-2) получали в соответствии со способом, описанным в примере А-1, используя сополимер 2 (324 мг), полученный в примере синтеза 2, и 7-этил-10-гидроксикамптотецин (ЕНС, производства компании ScinoPharm Taiwan, Ltd., 210 мг).
[0506]
Пример А-2 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, а высвобожденный в результате ЕНС количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения содержания ЕНС. В результате содержание ЕНС в примере А-2 составило 33,1% (мас./мас.).
[0507]
Пример А-2 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1H-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению1H-NMR спектра соотношение изопропиламинокарбонил-изопропиламино-группы и остатка ЕНС составило 0,47.
[0508]
По указанным значениям рассчитывали общую молекулярную массу примера А-2, составившую 5255.
[0509]
Исходя из этого, массовая доля полиэтиленгликолевого сегмента составила 38,1%.
[0510]
Интенсивность светорассеяния 1 мг/мл водного раствора примера А-2 составляла 27149 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 5535 cps. Таким образом, отношение между интенсивностью светорассеяния примера А-2 и интенсивностью светорассеяния толуола составляло 4,9 раза. Среднеобъемный диаметр частиц составлял 10 нм (устройство А, 1 мг/мл).
[0511]
[Пример А-3] Синтез 7-этил-Ю-гидроксикамптотецинового (ЕНС) конъюгата блок-сополимера полиэтиленгликоля (5 килодальтон) и полиглутаминовой кислоты (10,0 полимер)
[0512]
Указанный в заголовке блок-сополимер, сопряженный с производным камптотецина (пример А-3) получали в соответствии со способом, описанным в примере А-1, используя сополимер 3 (3,00 г), полученный в примере синтеза 3, и 7-этил-10-гидроксикамптотецин (ЕНС, производства компании ScinoPharm Taiwan, Ltd., 1,02 г).
[0513]
Пример А-3 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, а высвобожденный в результате ЕНС количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения содержания ЕНС. В результате содержание ЕНС в примере А-3 составило 21,0% (мас./мас.).
[0514]
Пример А-3 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1H-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению1H-NMR спектра соотношение изопропиламинокарбонил-изопропиламино-группы и остатка ЕНС составило 0,44.
[0515]
По указанным значениям рассчитывали общую молекулярную массу примера А-3, составившую 8225.
[0516]
Исходя из этого, массовая доля полиэтиленгликолевого сегмента составила 60,8%.
[0517]
Интенсивность светорассеяния 1 мг/мл водного раствора примера А-3 составляла 16750 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 5535 cps. Таким образом, отношение между интенсивностью светорассеяния примера А-3 и интенсивностью светорассеяния толуола составляло 3,0 раза. Среднеобъемный диаметр частиц составлял 8 нм (устройство А, 1 мг/мл).
[0518]
[Пример А-4] Синтез 7-этил-10-гидроксикамптотецинового (ЕНС) и 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-онового конъюгата блок-сополимера полиэтиленгликоля (2 килодальтон) и полиглутаминовой кислоты (7,6 полимер)
[0519]
Сополимер 1 (981 мг), полученный в примере синтеза 1, и 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-он (производства компании Fuji Molecular Planning Co., Ltd., 42,2 мг) растворяли в ДМФА (50 мл) и добавляли к ним диметиламинопиридин (DMAP, 45 мг) и диизопропилкарбодиимид (DIPCI, 35 мкл). Смесь перемешивали в течение 3 часов при 25°С. Затем к ней добавляли DIPCI (35 мкл) и перемешивали полученную смесь еще 1 час. Затем к ней добавляли 7-этил-10-гидроксикамптотецин (ЕНС, производства компании ScinoPharm Taiwan, Ltd., 532 мг) и DIPCI (771 мкл) и перемешивали смесь в течение 24 часов. К ней добавляли DIPCI (771 мкл) и перемешивали полученную смесь еще 4 часа. Затем реакционный раствор в течение одного часа по каплям добавляли к перемешанному раствору диизопропилового эфира (675 мл) и этилацетата (75 мл) и перемешивали смесь в течение ночи при комнатной температуре. Затем собирали осадок фильтрацией и сушили при пониженном давлении с получением продукта. Продукт, полученный таким образом, растворяли в смеси ацетонитрила/воды (98/2 (об./об.), 30 мл) и затем добавляли к ней ионообменную смолу. Смесь перемешивали в течение 7 часов при 5°С. Ионообменную смолу отделяли фильтрацией, а затем выпаривали ацетонитрил при пониженном давлении и сушили замораживанием. В результате получали указанный в заголовке блок-сополимер, сопряженный с производным камптотецина (пример А-4).
[0520]
Пример А-4 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, а высвобожденный в результате ЕНС количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения содержания ЕНС. В результате содержание ЕНС в примере А-4 составило 24,2% (мас./мас.).
[0521]
Количество сопряженного 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в примере А-4, рассчитанное по степени расходования 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), составляло одну молекулу. Следовательно, рассчитанная общая молекулярная масса 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в примере А-4 составляла 377.
[0522]
По указанным значениям рассчитывали общую молекулярную массу примера А-4, составившую 4617.
[0523]
Исходя из этого, содержание 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в примере А-4 составляло 8,2% по массе, а содержание полиэтиленгликолевого сегмента составляло 43,3% по массе.
[0524]
Пример А-4 использовали в испытании распределения, описанном ниже, в качестве частицы примера А-1 с флуоресцентной меткой.
[0525]
[Сравнительный пример А-1] Синтез 7-этил-10-гидроксикамптотецинового (ЕНС) конъюгата блок-сополимера полиэтиленгликоля (12 килодальтон) и полиглутаминовой кислоты (25 полимер)
[0526]
Указанный в заголовке блок-сополимер, сопряженный с производным камптотецина (сравнительный пример А-1), получали в соответствии со способом, описанным в примере 1 патентной литературы 1 (WO 2004/039869 А), используя сополимер 4, полученный в примере синтеза 4.
[0527]
Сравнительный пример А-1 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, а высвобожденный в результате ЕНС количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения содержания ЕНС. В результате содержание ЕНС в сравнительном примере А-1 составило 22,5% (мас./мас.).
[0528]
Сравнительный пример А-1 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1H-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению1H-NMR спектра соотношение изопропиламинокарбонил-изопропиламино-группы и остатка ЕНС составило 0,26.
[0529]
По указанным значениям рассчитывали общую молекулярную массу сравнительного примера А-1, составившую 19245.
[0530]
Исходя из этого, массовая доля полиэтиленгликолевого сегмента составила 62,4%.
[0531]
Интенсивность светорассеяния 1 мг/мл водного раствора сравнительного примера А-1 составляла 41321 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 5535 cps. Таким образом, отношение между интенсивностью светорассеяния сравнительного примера А-1 и интенсивностью светорассеяния толуола составляло 7,5 раза. Среднеобъемный диаметр частиц составлял 20 нм (устройство А, 1 мг/мл).
[0532]
[Сравнительный пример А-2] Синтез 7-этил-10-гидроксикамптотецинового (ЕНС) конъюгата блок-сополимера полиэтиленгликоля (3 килодальтон) и полиглутаминовой кислоты (6,6 полимер)
[0533]
Указанный в заголовке блок-сополимер, сопряженный с производным камптотецина (сравнительный пример А-2) получали в соответствии со способом, описанным в примере А-1, используя сополимер 5, полученный в примере синтеза 5, и 7-этил-10-гидроксикамптотецин (ЕНС, производства компании ScinoPharm Taiwan, Ltd., 91 мг).
[0534]
Сравнительный пример А-2 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, а высвобожденный в результате ЕНС количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения содержания ЕНС. В результате содержание ЕНС в сравнительном примере 2 составило 20,1% (мас./мас.).
[0535]
Сравнительный пример А-2 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1Н-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению1H-NMR спектра соотношение изопропиламинокарбонил-изопропиламино-группы и остатка ЕНС составило 0,37.
[0536]
По указанным значениям рассчитывали общую молекулярную массу сравнительного примера А-2, составившую 5031.
[0537]
Исходя из этого, массовая доля полиэтиленгликолевого сегмента составила 59,6%.
[0538]
Интенсивность светорассеяния 1 мг/мл водного раствора сравнительного примера А-2 составляла 9964 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 5535 cps. Таким образом, отношение между интенсивностью светорассеяния сравнительного примера А-2 и интенсивностью светорассеяния толуола составляло 1,80 раза. Блок-сополимер, сопряженный с производным камптотецина, из сравнительного примера А-2 не обладал способностью к ассоциации.
[0539]
[Сравнительный пример А-3] Синтез 7-этил-10-гидроксикамптотецинового (ЕНС) конъюгата блок-сополимера полиэтиленгликоля (12 килодальтон) и полиглутаминовой кислоты (7,5 полимер)
[0540]
Указанный в заголовке блок-сополимер, сопряженный с производным камптотецина (сравнительный пример А-3), получали в соответствии со способом, описанным в патентной литературе 1, используя сополимер 6, полученный в примере синтеза 6.
[0541]
Сравнительный пример А-3 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, а высвобожденный в результате ЕНС количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения содержания ЕНС. В результате содержание ЕНС в сравнительном примере А-3 составило 7,8% (мас./мас.).
[0542]
Сравнительный пример А-3 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1H-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению1H-ЯМР спектра соотношение изопропиламинокарбонил-изопропиламино-группы и остатка ЕНС составило 0,28.
[0543]
По указанным значениям рассчитывали общую молекулярную массу сравнительного примера А-3, составившую 14094.
[0544]
Исходя из этого, массовая доля полиэтиленгликолевого сегмента составила 85,1%.
[0545]
Интенсивность светорассеяния 1 мг/мл водного раствора сравнительного примера А-3 составляла 5625 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 5535 cps. Таким образом, отношение между интенсивностью светорассеяния сравнительного примера А-3 и интенсивностью светорассеяния толуола составляло 1,0 раза. Блок-сополимер, сопряженный с производным камптотецина, из сравнительного примера А-3 не обладал способностью к ассоциации.
[0546]
[Сравнительный пример А-4] Синтез 7-этил-10-гидроксикамптотецинового (ЕНС) и 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-онового конъюгата блок-сополимера полиэтиленгликоля (12 килодальтон) и полиглутаминовой кислоты (25 полимер)
[0547]
Сополимер 4 (6 г), полученный в примере синтеза 4, и 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-он (производства компании Fuji Molecular Planning Co., Ltd., 162,3 мг) растворяли в ДМФА (160 мл) и добавляли к ним 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид, n-гидрат (DMT-MM, 145 мг). Смесь перемешивали в течение 29 часов при 25°С и в течение 20 минут по каплям добавляли реакционный раствор к перемешанному раствору диизопропилового эфира (1460 мл) и этанола (360 мл). Полученную смесь перемешивали в течение 40 минут при комнатной температуре, а затем собирали осадок фильтрацией и сушили при пониженном давлении. Таким образом, получали продукт. Продукт, полученный таким образом, и 7-этил-10-гидроксикамптотецин (ЕНС, производства компании ScinoPharm Taiwan, Ltd., 1778 мг) растворяли в ДМФА (250 мл) и добавляли к ним диметиламинопиридин (DMAP, 151 мг) и диизопропилкарбодиимид (DIPCI, 2583 мкл). Смесь перемешивали в течение 22 часов при 25°С. Затем к ней добавляли DIPCI (646 мкл) и перемешивали полученную смесь в течение 2 часов. Реакционный раствор в течение 30 минут по каплям добавляли к перемешанному раствору диизопропилового эфира (3000 мл) и этанола (1000 мл) и перемешивали смесь в течение одного часа при комнатной температуре. Собирали осадок фильтрацией и сушили при пониженном давлении с получением продукта (7,3 г). Продукт, полученный таким образом, растворяли в смеси ацетонитрила/воды (98/2 (об./об.), 7 мл) и затем добавляли к ней ионообменную смолу. Смесь перемешивали в течение 3 часов при 5°С. Ионообменную смолу отделяли фильтрацией, а затем выпаривали ацетонитрил при пониженном давлении. Остаток сушили замораживанием с получением указанного в заголовке блок-сополимера, сопряженного с производным камптотецина (сравнительный пример А-4).
[0548]
Сравнительный пример А-4 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, а высвобожденный в результате ЕНС количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения содержания ЕНС. В результате содержание ЕНС в сравнительном примере А-4 составило 19,1% (мас./мас.).
[0549]
Количество сопряженного 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в сравнительном примере А-4, рассчитанное по степени расходования 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), составляло одну молекулу. Следовательно, рассчитанная общая молекулярная масса 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в сравнительном примере А-4 составляла 377.
[0550]
По указанным значениям рассчитывали общую молекулярную массу сравнительного примера А-4, составившую 19007.
[0551]
Исходя из этого, содержание 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в сравнительном примере А-4 составляло 1,9% по массе, а содержание полиэтиленгликолевого сегмента составляло 63,1% по массе.
Сравнительный пример А-4 использовали в испытании распределения, описанном ниже, в качестве частицы сравнительного примера А-1 с флуоресцентной меткой.
[0552]
[Экспериментальный пример А-1] Испытание внутриопухолевого распределения
[0553]
Опухолевое образование человеческого рака поджелудочной железы ВхРС3, субкультивированное подкожной трансплантацией у бестимусных мышей BALB/c, вырезали в виде блока с длиной каждой стороны примерно 3 мм, и полученный блок трансплантировали подкожно на спинку бестимусных мышей с помощью троакара. Пример А-4 и сравнительный пример А-4, соответственно, растворяли в 5% растворе глюкозы для инъекций и полученные растворы, соответственно, внутривенно вводили в однократной дозе 50 мг/кг в пересчете на 7-этил-10-гидроксикамптотецин. Через тридцать минут после введения у мышей извлекали кровь под изофлурановой анестезией, получали замороженные залитые препараты срезов извлеченной опухоли и измеряли флуоресценцию. Результаты представлены в Таблице 1.
[0554]
В результате экспериментального примера А-1 флуоресцентные сигналы наблюдали в широкой области опухолевых срезов в примере А-4. Исходя из этого, было установлено, что блок-сополимер примера А-4 может проникать в глубокие части опухолевой ткани. Напротив, было обнаружено, что в случае сравнительного примера А-4 имеет место неправильное распределение лишь в приграничной области опухоли, и блок-сополимер не проникает в глубокие части опухолевой ткани. Таким образом, сделано предположение, что пример А-4 может проникать в весь объем опухолевой ткани и обеспечивать действие производного камптотецина, которое представляет собой сопряженное лекарственное средство, на всю опухолевую ткань.
[0555]
[Экспериментальный пример А-2] Испытание внутрипочечного распределения
[0556]
Пример А-4 и сравнительный пример А-4, соответственно, растворяли в 5% растворе глюкозы для инъекций и полученные растворы, соответственно, внутривенно вводили в однократной дозе 50 мг/кг в пересчете на 7-этил-10-гидроксикамптотецин мышам C.B-17SCID. Через тридцать минут после введения у мышей извлекали кровь под изофлурановой анестезией, получали замороженные залитые препараты срезов извлеченной опухоли и измеряли флуоресценцию. Результаты представлены на фиг. 2.
[0557]
В результате экспериментального примера А-2 флуоресцентные сигналы наблюдали в кровеносных сосудах и почечных канальцах почек в примере А-4. Таким образом, было установлено, что блок-сополимер примера А-4, представляющий собой макромолекулу, обладает свойством экскреции через почки. С другой стороны было обнаружено, что в случае сравнительного примера А-4 флуоресценция отсутствовала в других областях почек, помимо кровеносных сосудов, и сравнительный пример А-4 не может экскретироваться через почки.
[0558]
[Экспериментальный пример А-3] Испытание гепатотоксичности у мышей, не имеющих опухоли
[0559]
[Введение лекарства]
Пример А-1, пример А-2, сравнительный пример А-2 и сравнительный пример А-3, соответственно, растворяли в 5% растворе глюкозы для инъекций, и полученные растворы, соответственно, однократно внутривенно вводили 6-недельным самцам мышей Crl:CD1(ICR)(ICR(IGS)) через хвостовую вену в дозе 50 мг/кг или 100 мг/кг в пересчете на 7-этил-10-гидроксикамптотецин, и указанные дозы представляли собой максимально переносимые дозы для различных соединений на основании массы тела, измеренной в день введения. Для контрольной группы однократно, внутривенно вводили только 5% раствор глюкозы для инъекций через хвостовую вену.
[0560]
[Исследование химического состава крови]
Через три дня после введения различных соединений кровь собирали из брюшной аорты под изофлурановой анестезией, используя одноразовый шприц объемом 1 мл с иглой 27G. В шприц заранее добавляли примерно 10 мкл раствора гепарина натрия, и полученный раствор тщательно перемешивали с собранной кровью. Плазму крови, полученную центрифугирование собранной крови (4°С, 1600×g, 10 минут), использовали в качестве образца для измерения, а исследование химического состава крови в образце для измерения проводили с помощью автоматического прибора для биохимического анализа модели 7180 (Hitachi High Technologies Corp.). Результаты измерения ALT (аланинаминотрансферазы) в плазме крови представлены в таблице 1.
[0561]


[0562]
При исследовании химического состава крови отмечено видимое увеличение ALT в сравнительном примере А-2 и признано появление гепатотоксичности. В сравнительном примере А-3, несмотря на низкую дозу, уровень ALT был увеличен, и гепатотоксичность была заметно выражена. Напротив, для соединений примеров А-1 и А-2 не наблюдали значительного увеличения ALT, и было установлено, что гепатотоксичность пренебрежимо мала.
[0563]
Соединения сравнительного примера А-2 и сравнительного примера А-3 не обладали свойством ассоциации, и их интенсивность светорассеяния в водном растворе была в два или менее раз выше интенсивности светорассеяния толуола. По полученным выше результатам в отношении блок-сополимеров, сопряженных с производным камптотецина, было обнаружено, что аналитические значения, представленные интенсивностью светорассеяния в водном растворе, коррелируют с проявлением гепатотоксичности. Так, блок-сополимер, сопряженный с производным камптотецина, обладающий низкой выраженностью гепатотоксичности, может быть получен с применением толуола в качестве стандартного вещества для измерения интенсивности рассеяния лазерного излучения и посредством измерения интенсивности светорассеяния водного раствора относительно интенсивности светорассеяния толуола.
[0564]
[Экспериментальный пример А-4] Испытание гематотоксичности у крыс, не имеющих опухоли
[0565]
[Введение лекарства]
Соединения из примера А-1, примера А-3, сравнительного примера А-1 и сравнительного примера А-2, соответственно, растворяли в 5% растворе глюкозы для инъекций, и растворы, соответственно, однократно внутривенно вводили 7-недельным самцам крыс Спрага-Доули (Crl:CD; IGS, Charles River Laboratories Japan, Inc.) через хвостовую вену в дозе 40 мг/кг в пересчете на 7-этил-10-гидроксикамптотецин на основании массы тела, измеренной в день введения. Для контрольной группы однократно, внутривенно вводили только 5% раствор глюкозы для инъекций через хвостовую вену.
[0566]
[Гематологическое исследование]
Через 3, 5, 7, 11 и 14 дней после дня введения различных соединений кровь собирали через подключичную вену без анестезии, используя одноразовый шприц объемом 1 мл с иглой 26G. В шприц заранее добавляли примерно 3 мкл раствора ЭДТА-2K, и полученный раствор тщательно перемешивали с собранной кровью. Полученные растворы использовали в качестве аналитических образцов. Образцы крови исследовали с помощью анализа кровяных клеток, используя прибор для анализа кровяных клеток XT-2000iV (Sysmex Corp.). Количество кровяных ретикулоцитов, полученных через 7 дней после введения, представлено в таблице 2.
[0567]


**Количество кровяных ретикулоцитов (×104/мкл) в различных экспериментальных группах на 7 день после введения.
[0568]
В результате гематологического исследования сравнительный пример А-1 приводил к снижению количества кровяных ретикулоцитов через 7 дней со дня введения, и была подтверждена пролонгированная гематотоксичность. Напротив, соединения примеров А-1 и А-3 согласно настоящему изобретению не вызывали снижения количества кровяных ретикулоцитов через 7 дней после введения, и пролонгированная гематотоксичность не была подтверждена. Таким образом, можно сделать вывод, что соединения из примеров А-1 и А-3 не продлевают гематотоксичность.
[0569]
Сравнительный пример А-1 представляет собой соединение, имеющее молекулярную массу 19 килодальтон. С другой стороны, примеры А-1 и А-3, а также сравнительный пример А-2 имеют небольшую молекулярную массу. Из представленных выше результатов можно сделать вывод, что стойкая гематотоксичность блок-сополимера, сопряженного с производным камптотецина, коррелирует с молекулярной массой. Таким образом, с использованием блок-сополимера, сопряженного с производным камптотецина, имеющего молекулярную массу 15 килодальтон или менее, можно получить противоопухолевый агент, препятствующий стойкой гематотоксичности.
[0570]
[Экспериментальный пример А-5] Испытание противоопухолевого эффекта у бестимусных мышей с трансплантированным человеческим раком желудка
[0571]
Опухолевое образование человеческого рака желудка SC-4-JCK, субкультивированное у бестимусных мышей, вырезали в виде блока с длиной каждой стороны примерно 3 мм, и полученный блок трансплантировали подкожно на спинку бестимусных мышей с помощью троакара. В тот момент, когда средний объем опухоли после трансплантации опухоли достиг примерно 150 мм3 или более, пример А-1, пример А-2, пример А-3, сравнительный пример А-1 и сравнительный пример А-2, соответственно, расторяли в 5% растворе глюкозы для инъекций и полученные растворы, соответственно, вводили внутривенно в однократной дозе 12 мг/кг в пересчете на 7-этил-10-гидроксикамптотецин.
[0572]
Относительный объем опухоли определяли по объемам опухоли, измеренным в день введения и на 14 день после введения, и использовали его в качестве показателя противоопухолевого эффекта. Объем опухоли определяли измерением главной оси (L: мм) и побочной оси (W: мм) опухоли и расчетом объема по расчетной формуле: (L×W2)/2. Результаты представлены в таблице 3.
[0573]
[Таблица 3]


*Относительный объем опухоли (среднее ± СО) в различных экспериментальных группах на 14 день после введения, причем объем опухоли в день введения лекарства принимали за 1,0.
[0574]
Примеры А-1 - А-3 и сравнительные примеры А-1 и А-2 обеспечивали небольшой объем опухоли, по сравнению с группой, которой не вводили лекарственное средство, и демонстрировали эффект подавления пролиферации опухоли. Среди них пример А-3 демонстрировал наиболее мощный противоопухолевый эффект по сравнению со сравнительными примерами.
[0575]
Известно, что блок-сополимеры, сопряженные с производным камптотецина, могут усиливать противоопухолевый эффект благодаря уникальной фармакокинетике, обусловленной полимерным носителем и контролируемым высвобождением производного камптотецина. Однако поскольку блок-сополимеры, сопряженные с производным камптотецина, вызывают фармакологическое действие производного камптотецина не только в опухолевых тканях, но и в нормальных тканях, неизбежно проявление неблагоприятных эффектов.
[0576]
Однако по результатам экспериментальных примеров А-1 - А-4 очевидно, что блок-сополимеры, сопряженные с производным камптотецина, согласно настоящему изобретению демонстрируют противоопухолевый эффект, который равен или превосходит эффект обычных блок-сополимеров, сопряженных с производным камптотецина, а также подавляют проявление гепатотоксичности, не продлевая гематотоксичность. Таким образом, понятно, что при использовании блок-сополимера, сопряженного с производным камптотецина, имеющего регулируемую молекулярную массу и регулируемую интенсивность светорассеяния в водном растворе, может быть получен противоопухолевый агент, который может препятствовать поражению нормальных тканей вследствие подавления пролиферации опухоли и может обеспечивать усиление эффективности и уменьшение неблагоприятных эффектов.
[0577]
[Пример синтеза 7] Синтез блок-сополимера полиэтиленгликоля и полиглутаминовой кислоты (молекулярная масса полиэтиленгликоля: 2 килодальтон, количество полимеризованных звеньев полиглутаминовой кислоты: 8; сополимер 7)
[0578]
Указанный в заголовке блок-сополимер полиэтиленгликоля и полиглутаминовой кислоты (сополимер 7) получали способом, описанным в примере синтеза 2, с использованием полиэтиленгликоля, содержащего одну концевую метокси-группу и одну концевую 3-аминопропильную группу (SUNBRIGHT МЕРА-50Н производства компании NOF Corp., средняя молекулярная масса: 5 килодальтон, 14,00 г), и ангидрид γ-бензил-L-глутамат-N-карбоновой кислоты (16,80 г).
[0579]
В отношении сополимера 7, количество полимеризованных звеньев глутаминовой кислоты на основании значения, полученного титрованием с использованием 0,1 н. гидроксида калия, составляло 7,90.
[0580]
[Пример синтеза 8] Синтез блок-сополимера полиэтиленгликоля и полиглутаминовой кислоты (молекулярная масса полиэтиленгликоля: 2 килодальтон, количество полимеризованных звеньев полиглутаминовой кислоты: 6; сополимер 8)
[0581]
Указанный в заголовке блок-сополимер полиэтиленгликоля и полиглутаминовой кислоты (сополимер 8) получали способом, описанным в примере синтеза 2, с использованием полиэтиленгликоля, содержащего одну концевую метокси-группу и одну концевую 3-аминопропильную группу (SUNBRIGHT МЕРА-50Н производства компании NOF Corp., средняя молекулярная масса: 5 килодальтон, 14,00 г), и ангидрид γ-бензил-L-глутамат-N-карбоновой кислоты (12,60 г).
[0582]
В отношении сополимера 8, количество полимеризованных звеньев глутаминовой кислоты на основании значения, полученного титрованием с использованием 0,1 н. гидроксида калия, составляло 6,46.
[0583]
[Пример синтеза 9] Синтез блок-сополимера полиэтиленгликоля и полиглутаминовой кислоты (молекулярная масса полиэтиленгликоля: 2 килодальтон, количество полимеризованных звеньев полиглутаминовой кислоты: 14; сополимер 9)
[0584]
Указанный в заголовке блок-сополимер полиэтиленгликоля и полиглутаминовой кислоты (сополимер 9) получали способом, описанным в примере синтеза 2, с использованием полиэтиленгликоля, содержащего одну концевую метокси-группу и одну концевую 3-аминопропильную группу (SUNBRIGHT МЕРА-50Н производства компании NOF Corp., средняя молекулярная масса: 2 килодальтон, 10,15 г), и ангидрид γ-бензил-L-глутамат-N-карбоновой кислоты (18,28 г).
[0585]
В отношении сополимера 9, количество полимеризованных звеньев глутаминовой кислоты на основании значения, полученного титрованием с использованием 0,1 н. гидроксида калия, составляло 13,69.
[0586]
[Пример В-1] Синтез 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диолового конъюгата блок-сополимера полиэтиленгликоля (2 килодальтон) и полиглутаминовой кислоты (7,9 полимер)
[0587]
Сополимер 7 (1300 мг), полученный в примере синтеза 7, и 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол (производства компании Shanghai Haoyuan Chemexpress Co., Ltd., 550 мг) растворяли в ДМФА (46 мл) и добавляли к ним диметиламинопиридин (DMAP, 64 мг) и диизопропилкарбодиимид (DIPCI, 1050 мкл). Смесь перемешивали в течение 24 часов при 25°C. Затем к ней добавляли DIPCI (525 мкл) и перемешивали полученную смесь еще 2 часа. Реакционный раствору в течение 15 минут по каплям добавляли к перемешанному раствору диизопропилового эфира (250 мл) и этилацетата (500 мл) и перемешивали смесь в течение 45 минут при комнатной температуре. Собирали осадок фильтрацией и сушили при пониженном давлении с получением продукта (1558 мг). Продукт, полученный таким образом, растворяли в смеси ацетонитрила/воды (1/1 (об./об.), 100 мл) и затем добавляли к ней ионообменную смолу. Смесь перемешивали в течение 3 часов при 5°C. Ионообменную смолу отделяли фильтрацией, а затем выпаривали ацетонитрил при пониженном давлении. Остаток сушили замораживанием с получением блок-сополимера, сопряженного с 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диолом (пример В-1).
[0588]
Пример В-1 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, и высвобожденный в результате 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения его содержания. В результате содержание 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола в примере В-1 составило 21,8% (мас./мас.).
[0589]
Пример В-1 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1Н-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению спектра1Н-ЯМР соотношение между изопропиламинокарбонил-изопропиламино-группой и остатком 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола составило 0,27.
[0590]
По указанным значениям рассчитывали общую молекулярную массу примера В-1, составившую 3963.
[0591]
Исходя из этого, массовая доля полиэтиленгликолевого сегмента составила 50,5%.
[0592]
Интенсивность светорассеяния 1 мг/мл водного раствора примера В-1 составляла 83228 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 7195 cps. Таким образом, отношение между интенсивностью светорассеяния примера В-1 и интенсивностью светорассеяния толуола составляло 11,6 раза. Среднеобъемный диаметр частиц составлял 11 нм (устройство А, 5 мг/мл).
[0593]
[Пример В-2] Синтез 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диолового и BODIPY-FL конъюгата блок-сополимера полиэтиленгликоля (2 килодальтон) и полиглутаминовой кислоты (7,9 полимер)
[0594]
Сополимер 7 (40 мг), полученный в примере синтеза 7, 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол (производства компании Shanghai Haoyuan Chemexpress Co., Ltd., 17 мг), EDA⋅HCI BODIPY-FL (производства компании Life Technologies Corp., 5 мг) и диизопропилэтиламин (4 мкл) растворяли в ДМФА (1 мл) и добавляли к ним диметиламинопиридин (DMAP, 2 мг) и диизопропилкарбодиимид (DIPCI, 33 мкл). Смесь перемешивали в течение 24 часов при 25°C. Затем к ней добавляли DIPCI (16 мкл) и перемешивали полученную смесь еще 3 часа. Реакционный раствору в течение 20 минут по каплям добавляли к перемешанному раствору диизопропилового эфира (7 мл) и этилацетата (14 мл) и перемешивали смесь в течение 20 минут при комнатной температуре. Затем осадок собирали фильтрацией и сушили при пониженном давлении. Таким образом, получали продукт. Продукт, полученный таким образом, растворяли в смеси ацетонитрила/воды (1/1 (об./об.), 10 мл) и затем добавляли к ней ионообменную смолу. Смесь перемешивали в течение 45 минут при 5°C. Ионообменную смолу отделяли фильтрацией, а затем выпаривали ацетонитрил при пониженном давлении. Остаток сушили замораживанием с получением блок-сополимера, сопряженного с 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диолом (пример В-2).
[0595]
Пример В-2 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, и определяли содержание высвобожденного 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола. В результате содержание 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола в примере В-2 количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), и его содержание составило 23,1% (мас./мас).
[0596]
Пример В-2 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1Н-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению спектра1Н-ЯМР соотношение между изопропиламинокарбонил-изопропиламино-группой и остатком 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола составило 0,27.
[0597]
Количество сопряженного BODIPY-FL в примере В-2 составляло 1,0 молекулу, по результатам расчета по степени расходования BODIPY-FL в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Таким образом, рассчитана общая молекулярная масса BODIPY-FL в примере В-2 составила 334.
[0598]
По указанным значениям рассчитывали общую молекулярную массу примера В-2, составившую 4451.
[0599]
Исходя из этого, содержание BODIPY-FL в примере 2 составило 7,5% по массе, а содержание полиэтиленгликолевого сегмента составило 44,9% по массе.
[0600]
Пример В-2 использовали в испытании распределения, описанном ниже, в качестве частицы примера В-1 с флуоресцентной меткой.
[0601]
[Пример В-3] Синтез 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диолового конъюгата блок-сополимера полиэтиленгликоля (2 килодальтон) и полиглутаминовой кислоты (6 полимер)
[0602]
Указанный в заголовке блок-сополимер, сопряженный с резорциновым соединением (пример В-3), получали в соответствии со способом, описанным в примере В-1, используя сополимер 8 (1100 мг), полученный в примере синтеза 8, и 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол (производства компании Shanghai Haoyuan Chemexpress Co., Ltd., 450 мг).
[0603]
Пример В-3 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, и высвобожденный в результате 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения его содержания. В результате содержание 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола в примере В-3 составило 18,8% (мас./мас.).
[0604]
Пример В-3 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1Н-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению спектра1Н-ЯМР соотношение между изопропиламинокарбонил-изопропиламино-группой и остатком 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола составило 0,11.
[0605]
По указанным значениям рассчитывали общую молекулярную массу примера В-3, составившую 3539.
[0606]
Исходя из этого, массовая доля полиэтиленгликолевого сегмента составила 56,5%.
[0607]
Интенсивность светорассеяния 1 мг/мл водного раствора примера В-3 составляла 37270 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 7195 cps. Таким образом, отношение между интенсивностью светорассеяния примера В-3 и интенсивностью светорассеяния толуола составляло 5,0 раза. Среднеобъемный диаметр частиц составлял 8 нм (устройство А, 5 мг/мл).
[0608]
[Пример В-4] Синтез 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диолового конъюгата блок-сополимера полиэтиленгликоля (2 килодальтон) и полиглутаминовой кислоты (10 полимер)
[0609]
Указанный в заголовке блок-сополимер, сопряженный с резорциновым соединением (пример В-4), получали в соответствии со способом, описанным в примере В-1, используя сополимер 2 (966 мг), полученный в примере синтеза 2, и 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол (производства компании Shanghai Haoyuan Chemexpress Co., Ltd., 317 мг).
[0610]
Пример B-4 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, и высвобожденный в результате 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения его содержания. В результате содержание 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола в примере В-4 составило 17,0% (мас./мас.).
[0611]
Пример В-4 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1Н-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению спектра1Н-ЯМР соотношение между изопропиламинокарбонил-изопропиламино-группой и остатком 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола составило 0,09.
[0612]
По указанным значениям рассчитывали общую молекулярную массу примера В-3, составившую 4001.
[0613]
Исходя из этого, массовая доля полиэтиленгликолевого сегмента составила 50,0%.
[0614]
Интенсивность светорассеяния 1 мг/мл водного раствора примера В-3 составляла 125125 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 7195 cps. Таким образом, отношение между интенсивностью светорассеяния примера В-3 и интенсивностью светорассеяния толуола составляло 16,9 раза. Среднеобъемный диаметр частиц составлял 11 нм (устройство А, 5 мг/мл).
[0615]
[Пример В-5] Синтез 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диолового конъюгата блок-сополимера полиэтиленгликоля (2 килодальтон) и полиглутаминовой кислоты (12 полимер)
[0616]
Указанный в заголовке блок-сополимер, сопряженный с резорциновым соединением (пример В-5), получали в соответствии со способом, описанным в примере В-1, используя сополимер 9 (1500 мг), полученный в примере синтеза 9, и 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол (производства компании Shanghai Haoyuan Chemexpress Co., Ltd., 393 мг).
[0617]
Пример В-5 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, и высвобожденный в результате 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения его содержания. В результате содержание 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола в примере В-5 составило 12,7% (мас./мас.).
[0618]
Пример В-5 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1Н-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению спектра1Н-ЯМР соотношение между изопропиламинокарбонил-изопропиламино-группой и остатком 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола составило 0,34.
[0619]
По указанным значениям рассчитывали общую молекулярную массу примера В-5, составившую 4409.
[0620]
Исходя из этого, массовая доля полиэтиленгликолевого сегмента составила 45,4%.
[0621]
Интенсивность светорассеяния 1 мг/мл водного раствора примера В-5 составляла 50425 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 7195 cps. Таким образом, отношение между интенсивностью светорассеяния примера В-5 и интенсивностью светорассеяния толуола составляло 6,8 раза. Среднеобъемный диаметр частиц составлял 14 нм (устройство В, 5 мг/мл).
[0622]
[Пример В-6] Синтез 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диолового конъюгата блок-сополимера полиэтиленгликоля (5 килодальтон) и полиглутаминовой кислоты (10 полимер)
[0623]
Указанный в заголовке блок-сополимер, сопряженный с резорциновым соединением (пример В-6), получали в соответствии со способом, описанным в примере В-1, используя сополимер 3 (953 мг), полученный в примере синтеза 3, и 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол (производства компании Shanghai Haoyuan Chemexpress Co., Ltd., 250 мг).
[0624]
Пример В-6 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, и высвобожденный в результате 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения его содержания. В результате содержание 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола в примере В-6 составило 17,3% (мас./мас.).
[0625]
Пример В-6 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1Н-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению спектра1Н-ЯМР соотношение между изопропиламинокарбонил-изопропиламино-группой и остатком 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола составило 0,23.
[0626]
По указанным значениям рассчитывали общую молекулярную массу примера В-6, составившую 7724.
[0627]
Исходя из этого, массовая доля полиэтиленгликолевого сегмента составила 64,7%.
[0628]
Интенсивность светорассеяния 1 мг/мл водного раствора примера В-6 составляла 88115 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 7195 cps. Таким образом, отношение между интенсивностью светорассеяния примера В-5 и интенсивностью светорассеяния толуола составляло 11,9 раза. Среднеобъемный диаметр частиц составлял 12 нм (устройство А, 5 мг/мл).
[0629]
[Сравнительный пример В-1] Синтез 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диолового конъюгата блок-сополимера полиэтиленгликоля (12 килодальтон) и полиглутаминовой кислоты (25 полимер)
[0630]
Указанный в заголовке блок-сополимер, сопряженный с ганетеспибом (сравнительный пример В-1), получали в соответствии со способом, описанным в примере В-1, используя сополимер 4 (2300 мг), полученный в примере синтеза 4, и 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол (производства компании Shanghai Haoyuan Chemexpress Co., Ltd., 557 мг).
[0631]
Сравнительный пример В-1 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, и высвобожденный в результате 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения его содержания. В результате содержание 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола в примере В-1 составило 14,1% (мас./мас.).
[0632]
Сравнительный пример В-1 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1Н-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению спектра1Н-ЯМР соотношение между изопропиламинокарбонил-изопропиламино-группой и остатком 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола составило 0,13.
[0633]
По указанным значениям рассчитывали общую молекулярную массу сравнительного примера В-1, составившую 17311.
[0634]
Исходя из этого, массовая доля полиэтиленгликолевого сегмента составила 69,3%.
[0635]
Интенсивность светорассеяния 1 мг/мл водного раствора сравнительного примера В-1 составляла 294722 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 7195 cps. Таким образом, отношение между интенсивностью светорассеяния примера В-1 и интенсивностью светорассеяния толуола составляло 41,0 раза. Среднеобъемный диаметр частиц составлял 25 нм (устройство А, 1 мг/мл).
[0636]
[Сравнительный пример В-2] Синтез 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диолового и BODIPY-TR конъюгата блок-сополимера полиэтиленгликоля (12 килодальтон) и полиглутаминовой кислоты (25 полимер)
[0637]
Указанный в заголовке блок-сополимер, сопряженный с 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диолом (сравнительный пример В-2), получали в соответствии со способом, описанным в примере В-2, используя сополимер 4 (170 мг), полученный в примере синтеза 4, и 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол (производства компании Shanghai Haoyuan Chemexpress Co., Ltd., 41 мг) и кадаверин ⋅ HCl BODIPY-TR (производства компании Life Technologies Corp., 6 мг).
[0638]
Сравнительный пример B-2 подвергали гидролизу, используя 1 н. водный раствор гидроксида натрия, и высвобожденный в результате 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол количественно определяли с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) для определения его содержания. В результате содержание 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола в примере 1 составило 14,2% (мас./мас.).
[0639]
Сравнительный пример В-2 подвергали гидролизу в растворе дейтерированной воды и дейтерированного ацетонитрила, содержащего дейтерированный гидроксид натрия, и анализировали1Н-ЯМР спектр полученного раствора. Таким образом, было подтверждено, что изопропиламинокарбонил-изопропиламино-группа связана с карбоксильной группой боковой цепи сегмента полиглутаминовой кислоты. По интегральному отношению спектра1Н-ЯМР соотношение между изопропиламинокарбонил-изопропиламино-группой и остатком 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диола составило 0,39.
[0640]
Количество сопряженного BODIPY-TR в сравнительном примере В-2 составляло 1,0 молекулу, по результатам расчета по степени расходования BODIPY-TR в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Таким образом, рассчитана общая молекулярная масса BODIPY-TR в сравнительном примере В-2 составила 334.
[0641]
По указанным значениям рассчитывали общую молекулярную массу сравнительного примера В-2, составившую 18171.
[0642]
Исходя из этого, содержание BODIPY-FL в сравнительном примере 2 составило 2,8% по массе, а содержание полиэтиленгликолевого сегмента составило 66,0% по массе.
[0643]
Сравнительный пример В-2 использовали в испытании распределения, описанном ниже, в качестве частицы сравнительного примера В-1 с флуоресцентной меткой.
[0644]
[Экспериментальный пример В-1] Испытание внутриопухолевого и внутрипочечного распределения
Опухолевое образование человеческого рака поджелудочной железы ВхРС3, субкультивированное подкожной трансплантацией у бестимусных мышей BALB/c, вырезали в виде блока с длиной каждой стороны примерно 3 мм, и полученный блок трансплантировали подкожно на спинку бестимусных мышей с помощью троакара. Пример В-2 и сравнительный пример В-2, соответственно, растворяли в 5% растворе глюкозы для инъекций в концентрации 5 мг/кг в пересчете на BODIPY, и смешивали равные количества растворов. Полученную смесь вводили однократно внутривенно. Через час после введения у бестимусных мышей извлекали кровь под изофлурановой анестезией, получали замороженные залитые препараты срезов опухолевой ткани и почек и измеряли флуоресценцию. Результаты представлены в Таблице 3.
[0645]
В результате экспериментального примера В-1, наблюдали флуоресцентные сигналы в широкой области опухолевых срезов при исследовании опухолевых срезов в примере с введением примера В-2. На основании этого было подтверждено, что блок-сополимер примера В-2 накапливается в опухолевой ткани и проникает в глубокие части опухолевой ткани. Напротив, было обнаружено, что в случае сравнительного примера В-2 флуоресценцию наблюдали в оболочечной области опухоли; однако флуоресцентные сигналы не обнаруживали в центральной области ткани, и блок-сополимер не обеспечивал доставку лекарства в весь объем опухолевой ткани.
[0646]
В почках флуоресценцию наблюдали в кровеносных сосудах и в почечных канальцах в случае примера В-2. С другой стороны, флуоресценцию не наблюдали в других областях, помимо кровеносных сосудов, в случае сравнительного примера В-2.
[0647]
На основании описанных выше результатов было установлено, что блок-сополимер примера В-2 демонстрирует накопление в опухолевой ткани, включая глубокие части опухолевой ткани, а также обладает свойством экскреции через почки и контролируемым удерживанием in vivo в течение продолжительного периода времени.
[0648]
[Экспериментальный пример В-2] Испытание гематотоксичности у мышей, не имеющих опухоли
[Введение лекарства]
[0649]
Пример В-1 и сравнительный пример В-1, соответственно, растворяли в 5% растворе глюкозы для инъекций, и полученные растворы, соответственно, однократно внутривенно вводили 5-недельным самцам мышей ICR (Crl:CD1(ICR), Charles River Laboratories Japan, Inc.) через хвостовую вену в дозе 75 мг/кг в пересчете на 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол, на основании массы тела, измеренной в день введения. Для контрольной группы однократно, внутривенно вводили только 5% раствор глюкозы для инъекций через хвостовую вену.
[0650]
[Гематологическое исследование]
Через 3 и 14 дней после дня введения различных соединений кровь собирали через подключичную вену без анестезии, используя одноразовый шприц объемом 1 мл с иглой 26G. В шприц заранее добавляли примерно 3 мкл раствора ЭДТА-2К, и полученный раствор тщательно перемешивали с собранной кровью. Полученные растворы использовали в качестве аналитических образцов. Образцы крови исследовали с помощью анализа кровяных клеток, используя прибор для анализа кровяных клеток XT-2000iV (Sysmex Corp.). Количество кровяных тромбоцитов, полученных через 3 дней после введения, представлено в таблице 4.
[0651]
[Таблица 4]


количество кровяных тромбоцитов (×104/мкл) в группе, обработанной лекарственным средством в дозе 75 мг/кг, на 3 день после введения.
[0652]
В результате гематологического исследования сравнительный пример В-1 приводил к снижению количества кровяных тромбоцитов через 3 дня со дня введения, и была подтверждена пролонгированная гематотоксичность. Напротив, в случае соединения из примера В-2 согласно настоящему изобретению, явление, касающееся количества тромбоцитов через 3 дня после введения, было дополнительно подавлено по сравнению со сравнительным примером В-1, и пролонгированная гематотоксичность проявлялась в меньшей степени.
Сравнительный пример В-1 представляет собой соединение, имеющее молекулярную массу 18 килодальтон. В то же время пример В-1 имеет молекулярную массу 4 килодальтон, то есть меньше. Из представленных выше результатов можно сделать вывод, что стойкая гематотоксичность полимерного производного, сопряженного с производным резорцина, коррелирует с молекулярной массой. Таким образом, было обнаружено, что с использованием полимерного производного, сопряженного с производным резорцина, имеющего молекулярную массу 15 килодальтон или менее, можно получить противоопухолевый агент, препятствующий стойкой гематотоксичности.
[0653]
[Экспериментальный пример В-3] Противоопухолевый эффект у мышей с трансплантированным раком толстой и прямой кишок человека и раком молочной железы человека
[0654]
Опухолевое образование рака толстой и прямой кишок человека Col-5-JCK и Со-3-KIST, подкожно субкультивированное у бестимусных мышей BALB/c, и опухолевое образование рака молочной железы человека MC-19-JCK, подкожно субкультивированное у мышей SCID, соответственно, вырезали в форме блока, имеющего размер каждой стороны примерно 3 мм, и указанные блоки, соответственно, подкожно трансплантировали в спинку бестимусных мышей или мышей SCID с помощью троакара. В тот момент, когда после трансплантации опухоли средний объем опухоли достигал примерно 150 мм3, проводили разделение на группы.
[0655]
Пример В-1 и сравнительный пример В-1, соответственно, растворяли в 5% растворе глюкозы для инъекций и полученные растворы, соответственно, внутривенно вводили в однократной дозе 75 или 50 мг/кг в пересчете на 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол.
[0656]
В качестве контрольного агента растворяли 4-изопропил-6-(4-(1-метил-1Н-индол-5-ил)-5-метилен-4,5-дигидро-1Н-1,2,4-триазол-3-ил)бензол-1,3-диол (ганетеспиб) в ДМСО, а затем полученный раствор разбавляли в 10 раз с помощью жидкой смеси CREMOPHORE RH40:5% раствора глюкозы (1:4). Полученное разбавление однократно внутривенно вводили через хвостовую вену в дозе 150 мг/кг.
[0657]
Относительный объем опухоли определяли по объему опухоли, полученному в день начала введения, и использовали его как показатель противоопухолевого эффекта. Объем опухоли определяли измерением главной оси (L: мм) и побочной оси (W: мм) опухоли и расчетом объема по расчетной формуле: (L×W2)/2. Результаты представлены на фиг. 4, фиг. 5 и фиг. 6.
[0658]
По сравнению со сравнительным примером В-1, пример В-1 демонстрировал превосходное действие в обеих моделях подкожной опухоли в одинаковых дозах. По результатам экспериментального примера В-1 понятно, что пример В-1 обладает свойством миграции в опухолевую ткань и свойством проникновения в глубокие части опухоли. Таким образом, сделан вывод, что различие фармакокинетики в указанных опухолевых тканях обусловлено действием усиления противоопухолевого эффекта.
[0659]
[Пример синтеза 10] Синтез блок-сополимера полиэтиленгликоля-α,β-полиаспарагиновой кислоты (молекулярная масса полиэтиленгликоля: 2 килодальтон, количество полимеризованных звеньев полиаспарагиновой кислоты: 12,5; сополимер 10)
[0660]
Полиэтиленгликоль, содержащий одну концевую метокси-группу и одну концевую 3-аминопропильную группу (SUNBRIGHT МЕРА-20Н производства компании NOF Corporation, средняя молекулярная масса: 2 килодальтон, 20,0 г), растворяли в ДМСО (400 мл) и затем к нему добавляли ангидрид γ-бензил-L-аспартат-N-карбоновой кислоты (29,8 г, 12 экв.). Смесь перемешивали в течение 20 часов при 32,5°C. Реакционный раствор в течение одного часа по каплям добавляли к перемешанному раствору диизопропилового эфира (3200 мл) и этанола (800 мл), и перемешивали полученную смесь в течение 3 часов при комнатной температуре. Затем собирали осадок фильтрацией и сушили при пониженном давлении с получением продукта полимеризации (31,2 г).
[0661]
Полученный продукт полимеризации (30,0 г) растворяли в ДМФА (300 мл), добавляли к нему уксусный ангидрид (7,3 мл) и перемешивали смесь в течение 3 часов при 35°C. Реакционный раствор в течение одного часа по каплям добавляли к перемешанному раствору диизопропилового эфира (2700 мл) и этанола (300 мл) и перемешивали смесь в течение одного часа при комнатной температуре. Затем собирали осадок фильтрацией и сушили при пониженном давлении с получением продукта ацетилированного полимера (26,6 г).
[0662]
Полученный ацетилированный полимер (25,0 г) растворяли в MeCN (500 мл) и затем добавляли к нему 0,2 н. гидроксид натрия (500 мл). Смесь подвергали гидролизу в течение 3 часов при 23°C. Реакционный раствор нейтрализовали добавлением 2 н. хлористоводородной кислоты, а затем удаляли ацетонитрил посредством концентрирования при пониженном давлении. Затем концентрат три раза промывали этилацетатом (500 мл). Водный слой концентрировали при пониженном давлении, а затем доводили рН раствора до 11,0 с помощью 1 н. водного раствора гидроксида натрия. Добавляли хлорид натрия (50 г), а затем очищали раствор с помощью колоночной хроматографии на разделительной адсорбционной смоле с последующей колоночной хроматографией на ионообменной смоле. Элюированный раствор концентрировали при пониженном давлении, а затем сушили замораживанием. Таким образом, получали блок-сополимер полиэтиленгликоля и полиаспарагиновой кислоты (сополимер 10: 13,0 г).
[0663]
В отношении сополимера 10, количество полимеризованных звеньев аспарагиновой кислоты, рассчитанное на основании значения, полученного титрованием с использованием 0,1 н. гидроксида калия, составляло 12,5.
[0664]
Интенсивность светорассеяния 1 мг/мл водного раствора примера синтеза 10 составляла 2179 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 7305 cps. Таким образом, отношение между интенсивностью светорассеяния примера синтеза 10 и интенсивностью светорассеяния толуола составляло 0,3 раза.
[0665]
[Пример синтеза 11] Синтез блок-сополимера полиэтиленгликоля-α-полиаспарагиновой кислоты (молекулярная масса полиэтиленгликоля: 5 килодальтон, количество полимеризованных звеньев полиаспарагиновой кислоты: 20,0; сополимер 11)
[0666]
Указанный в заголовке блок-сополимер полиэтиленгликоля-α-полиаспарагиновой кислоты (сополимер 11) получали способом, описанным в примере синтеза 2, с использованием полиэтиленгликоля, содержащего одну концевую метокси-группу и одну концевую 3-аминопропильную группу (SUNBRIGHT МЕРА-50Н производства компании NOF Corporation, средняя молекулярная масса: 5 килодальтон), и ангидрид γ-бензил-L-аспартат-N-карбоновой кислоты.
[0667]
В отношении сополимера 11, количество полимеризованных звеньев аспарагиновой кислоты, рассчитанное на основании значения, полученного титрованием с использованием 0,1 н. гидроксида калия, составляло 20,0.
[0668]
[Пример синтеза 12] Синтез блок-сополимера полиэтиленгликоля-α,β-полиаспарагиновой кислоты (молекулярная масса полиэтиленгликоля: 12 килодальтон, количество полимеризованных звеньев полиаспарагиновой кислоты: 23,8; сополимер 12)
[0669]
Полиэтиленгликоль, содержащий одну концевую метокси-группу и одну концевую 3-аминопропильную группу (SUNBRIGHT МЕРА-12К производства компании NOF Corporation, средняя молекулярная масса: 12 килодальтон, 75,0 г), растворяли в ДМСО (1430 мл) и затем к нему добавляли ангидрид γ-бензил-L-аспартат-N-карбоновой кислоты (45,0 г, 29 экв.). Смесь перемешивали в течение ночи при 32,0°C. Реакционный раствор в течение одного часа по каплям добавляли к перемешанному раствору диизопропилового эфира (12 л) и этанола (3 л), и перемешивали полученную смесь в течение одного часа при комнатной температуре. Затем собирали осадок фильтрацией и сушили при пониженном давлении с получением продукта полимеризации (106,0 г).
[0670]
Полученный продукт полимеризации (105,0 г) растворяли в ДМФА (1050 мл), добавляли к нему уксусный ангидрид (3,3 мл) и перемешивали смесь в течение 3 часов при 35°C. Реакционный раствор в течение одного часа по каплям добавляли к перемешанному раствору диизопропилового эфира (29450 мл) и этанола (1050 мл) и перемешивали смесь в течение одного часа при комнатной температуре. Затем собирали осадок фильтрацией и сушили при пониженном давлении с получением продукта ацетилированного полимера (103,0 г).
[0671]
Полученный ацетилированный полимер (100,0 г) растворяли в ацетонитриле (2 л) и затем добавляли к нему 0,2 н. гидроксид натрия (2 л). Смесь подвергали гидролизу в течение 3 часов при 23°C. Реакционный раствор нейтрализовали добавлением 2 н. хлористоводородной кислоты, а затем удаляли ацетонитрил посредством концентрирования при пониженном давлении. Затем концентрат три раза промывали этилацетатом (2 л). Водный слой концентрировали при пониженном давлении, а затем доводили рН раствора до 11,0 с помощью 1 н. водного раствора гидроксида натрия. Добавляли хлорид натрия (100 г), а затем очищали раствор с помощью колоночной хроматографии на разделительной адсорбционной смоле с последующей колоночной хроматографией на ионообменной смоле. Элюированный раствор концентрировали при пониженном давлении, а затем сушили замораживанием. Таким образом, получали блок-сополимер полиэтиленгликоля и полиаспарагиновой кислоты (сополимер 12: 75,4 г).
[0672]
В отношении сополимера 12, количество полимеризованных звеньев аспарагиновой кислоты, рассчитанное на основании значения, полученного титрованием с использованием 0,1 н. гидроксида калия, составляло 23,8.
[0673]
[Пример С-1] Синтез блок-сополимера полиэтиленгликоля (2 килодальтон)-α,β-полиаспарагиновой кислоты (12,5 полимер), сопряженного с кабазитакселем (CBZ) и н-бутиламином
[0674]
Сополимер 10 (707,6 мг), полученный в примере синтеза 10, и кабазитаксел (CBZ, 572,2 мг) растворяли в N-метилпирролидоне (NMP, 19,5 мл) и добавляли к ним н-бутиламин (125 мкл), диметиламинопиридин (DMAP, 154,9 мг) и диизопропилкарбодиимид (DIPCI, 911 мкл). Смесь перемешивали в течение 19 часов при 25°C. Затем к ней добавляли DIPCI (228 мкл) и перемешивали полученную смесь в течение 6 часов. К реакционному раствору добавляли этилацетат (20 мл), а затем в течение одного часа по каплям добавляли реакционный раствор к диизопропиловому эфиру (1560 мл). Смесь перемешивали в течение одного часа при комнатной температуре, а затем собирали осадок фильтрацией и сушили при пониженном давлении. Таким образом, получали продукт (950 мг). Продукт, полученный таким образом, растворяли в смеси ацетонитрила/воды (50/50 (об./об.), 140 мл) и затем добавляли к ней ионообменную смолу. Смесь перемешивали в течение 30 минут при 5°C. Ионообменную смолу отделяли фильтрацией, затем выпаривали ацетонитрил при пониженном давлении и сушили замораживанием. Таким образом, получали указанное в заголовке полимерное производное, сопряженное с таксановым соединением (пример С-1, 930 мг).
[0675]
Количество сопряженного CBZ в примере С-1 составляло 1,3 молекулы, по результатам расчета по степени расходования CBZ в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Таким образом, рассчитана общая молекулярная масса CBZ в примере С-1 составила 1087.
[0676]
Количество сопряженного н-бутиламина в примере С-1 составляло 6,2 молекулы, если принять, что в реакции было израсходовано все количество введенного н-бутиламина. Таким образом, рассчитана общая молекулярная масса н-бутиламина в примере С-1 составила 453.
[0677]
По указанным значениям рассчитывали общую молекулярную массу примера С-1, составившую 5516.
[0678]
На основании этого, содержание CBZ в примере С-1 составило 19,7% по массе, содержание н-бутиламина составило 8,2% по массе, и содержание полиэтиленгликолевого сегмента составило 36,3% по массе.
[0679]
Интенсивность светорассеяния 1 мг/мл водного раствора примера С-1 составляла 13018 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 4368 cps. Таким образом, отношение между интенсивностью светорассеяния примера С-1 и интенсивностью светорассеяния толуола составляло 3,0 раза. Среднеобъемный диаметр частиц составлял 6,3 нм (устройство А, 1 мг/мл).
[0680]
[Пример С-2] Синтез блок-сополимера полиэтиленгликоля (5 килодальтон)-α-полиаспарагиновой кислоты (20,0 полимер), сопряженного с кабазитакселем (CBZ)
[0681]
Сополимер 11 (1,50 г), полученный в примере синтеза 11, и кабазитаксел (CBZ, 342 мг) растворяли в NMP (31 мл) и добавляли к ним диметиламинопиридин (DMAP, 250 мг) и диизопропилкарбодиимид (DIPCI, 1468 мкл). Смесь перемешивали в течение 21 часа при 20°C. Затем к ней добавляли DIPCI (367 мкл) и перемешивали полученную смесь в течение 5 часов. К реакционному раствору добавляли этилацетат (31 мл), а затем в течение одного часа по каплям добавляли реакционный раствор к диизопропиловому эфиру (1260 мл). Смесь перемешивали в течение одного часа при комнатной температуре, а затем собирали осадок фильтрацией и сушили при пониженном давлении. Таким образом, получали продукт (1,71 г). Продукт, полученный таким образом, растворяли в смеси ацетонитрила/воды (50/50 (об./об.), 80 мл) и затем добавляли к ней ионообменную смолу. Смесь перемешивали в течение 30 минут при 5°C. Ионообменную смолу отделяли фильтрацией, затем выпаривали ацетонитрил при пониженном давлении и сушили замораживанием. Таким образом, получали указанное в заголовке полимерное производное, сопряженное с таксановым соединением (пример С-2, 1,58 г).
[0682]
Количество сопряженного CBZ в примере С-2 составляло 1,6 молекулы, по результатам расчета по степени расходования CBZ в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Таким образом, рассчитана общая молекулярная масса CBZ в примере С-2 составила 1337.
[0683]
По указанным значениям рассчитывали общую молекулярную массу примера С-2, составившую 10970.
[0684]
Исходя из этого, содержание CBZ в примере С-2 составило 12,2% по массе, а содержание полиэтиленгликолевого сегмента составило 45,6% по массе.
[0685]
Интенсивность светорассеяния 1 мг/мл водного раствора примера С-2 составляла 10382 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 4187 cps. Таким образом, отношение между интенсивностью светорассеяния примера С-2 и интенсивностью светорассеяния толуола составляло 2,5 раза. Среднеобъемный диаметр частиц составлял 10 нм (устройство В, 1 мг/мл).
[0686]
[Пример С-3] Синтез блок-сополимера полиэтиленгликоля (2 килодальтон)-α,β-полиаспарагиновой кислоты (12,5 полимер), сопряженного с кабазитакселем (CBZ)/н-бутиламином/2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-оном
[0687]
Сополимер 10 (205,6 мг), полученный в примере синтеза 10, кабазитаксел (CBZ, 166,3 мг) и 2-(2-аминоэтокси)-9-диэтиламино)-5Н-бензо[а]феноксазин-5-он (5,1 мг) растворяли в NMP (5,7 мл) и добавляли к ним н-бутиламин (36 мкл), диметиламинопиридин (DMAP, 45,0 мг) и диизопропилкарбодиимид (DIPCI, 265 мкл). Смесь перемешивали в течение 17,5 часов при 20°C. Затем к ней добавляли DIPCI (66 мкл) и перемешивали полученную смесь в течение 4,5 часов. К реакционному раствору добавляли этилацетат (5,5 мл), а затем в течение 10 минут по каплям добавляли реакционный раствор к диизопропиловому эфиру (440 мл). Смесь перемешивали в течение одного часа при комнатной температуре, а затем собирали осадок фильтрацией и сушили при пониженном давлении. Таким образом, получали продукт (300 мг). Продукт, полученный таким образом, растворяли в смеси ацетонитрила/воды (50/50 (об./об.), 20 мл) и затем добавляли к ней ионообменную смолу. Смесь перемешивали в течение 30 минут при 5°C. Ионообменную смолу отделяли фильтрацией, затем выпаривали ацетонитрил при пониженном давлении и сушили замораживанием. Таким образом, получали указанное в заголовке полимерное производное, сопряженное с таксановым соединением (пример С-3, 270,9 мг).
[0688]
Количество сопряженного CBZ в примере С-3 составляло 1,7 молекулы, по результатам расчета по степени расходования CBZ в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Таким образом, рассчитана общая молекулярная масса CBZ в примере С-3 составила 1421.
[0689]
Количество сопряженного н-бутиламина в примере С-3 составляло 6,2 молекулы, если принять, что в реакции было израсходовано все количество введенного н-бутиламина. Таким образом, рассчитана общая молекулярная масса н-бутиламина в примере С-3 составила 453.
[0690]
Количество сопряженного 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в примере С-3, рассчитанное по степени расходования 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), составляло 0,23 молекулы. Следовательно, рассчитанная общая молекулярная масса 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в примере С-3 составляла 87.
[0691]
По указанным значениям рассчитывали общую молекулярную массу примера С-3, составившую 5846.
[0692]
Исходя из этого, содержание CBZ в примере С-3 составило 24,3% по массе, содержание н-бутиламина составило 7,8% по массе, содержание 2-(2-аминоэтокси)-9-диэтиламино)-5Н-бензо[а]феноксазин-5-она составило 1,5% по массе, и содержание полиэтиленгликолевого сегмента составило 34,2% по массе.
[0693]
Пример С-3 использовали в испытании распределения, описанном ниже, в качестве частицы примера С-1 с флуоресцентной меткой.
[0694]
[Пример С-4] Синтез блок-сополимера полиэтиленгликоля (2 килодальтон)-α,β-полиаспарагиновой кислоты (12,5 полимер), сопряженного с кабазитакселем (CBZ)
[0695]
Сополимер 10 (51,5 мг), полученный в примере синтеза 10, и кабазитаксел (CBZ, 30,9 мг) растворяли в N-метилпирролидоне (NMP, 1,42 мл) и добавляли к ним диметиламинопиридин (DMAP, 11,3 мг) и диизопропилкарбодиимид (DIPCI, 66 мкл). Смесь перемешивали в течение 13 часов при 25°C. Затем к ней добавляли DIPCI (17 мкл) и перемешивали полученную смесь в течение 5 часов. К реакционному раствору добавляли этилацетат (1,42 мл), а затем в течение одного часа по каплям добавляли реакционный раствор к диизопропиловому эфиру (114 мл). Смесь перемешивали в течение одного часа при комнатной температуре, а затем собирали осадок фильтрацией и сушили при пониженном давлении. Таким образом, получали указанное в заголовке полимерное производное, сопряженное с таксановым соединением (пример С-4).
[0696]
Количество сопряженного CBZ в примере С-4 составляло 1,8 молекулы, по результатам расчета по степени расходования CBZ в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Таким образом, рассчитана общая молекулярная масса CBZ в примере С-4 составила 1505.
[0697]
По указанным значениям рассчитывали общую молекулярную массу примера С-4, составившую 6301.
[0698]
Исходя из этого, содержание CBZ в примере С-4 составило 23,9% по массе, а содержание полиэтиленгликолевого сегмента составило 31,7% по массе.
[0699]
Интенсивность светорассеяния 1 мг/мл водного раствора примера С-4 составляла 176886 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 7156 cps. Таким образом, отношение между интенсивностью светорассеяния примера С-4 и интенсивностью светорассеяния толуола составляло 24,7 раза. Среднеобъемный диаметр частиц составлял 12 нм (устройство А, 1 мг/мл).
[0700]
[Пример С-5] Синтез блок-сополимера полиэтиленгликоля (2 килодальтон)-α,β-полиаспарагиновой кислоты (12,5 полимер), сопряженного с доцетакселем (DTX) и 4-фенилбутиламином
[0701]
Сополимер 10 (33,4 мг), полученный в примере синтеза 10, и доцетаксел (DTX, 26,1 мг) растворяли в N-метилпирролидоне (NMP, 0,92 мл) и добавляли к ним 4-фенилбутиламин (6 мкл), диметиламинопиридин (DMAP, 7,3 мг) и диизопропилкарбодиимид (DIPCI, 43 мкл). Смесь перемешивали в течение 22 часов при 25°C. Затем к ней добавляли DIPCI (11 мкл) и перемешивали полученную смесь еще 6 часа. Реакционный раствор переносили на диализную мембрану с НОММ 2000 и проводили диализ в воде, а полученный продукт сушили замораживанием. Таким образом, получали указанное в заголовке полимерное производное, сопряженное с таксановым соединением (пример С-5, 59,6 мг).
[0702]
Количество сопряженного DTX в примере С-5 составляло 1,2 молекулы, по результатам расчета по степени расходования DTX в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Таким образом, рассчитана общая молекулярная масса DTX в примере С-5 составила 969.
[0703]
Количество сопряженного 4-фенилбутиламина в примере С-5 составляло 3,7 молекулы, если принять, что в реакции было израсходовано все количество введенного 4-фенилбутиламина. Таким образом, рассчитана общая молекулярная масса 4-фенилбутиламина в примере С-5 составила 552.
[0704]
По указанным значениям рассчитывали общую молекулярную массу примера С-5, составившую 5872.
[0705]
На основании этого, содержание DTX в примере С-5 составило 16,5% по массе, содержание 4-фенилбутиламина составило 9,4% по массе, и содержание полиэтиленгликолевого сегмента составило 34,1% по массе.
[0706]
Интенсивность светорассеяния 1 мг/мл водного раствора примера С-5 составляла 162126 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 7152 cps. Таким образом, отношение между интенсивностью светорассеяния примера С-5 и интенсивностью светорассеяния толуола составляло 22,7 раза.
[0707]
[Сравнительный пример С-1] Синтез блок-сополимера полиэтиленгликоля (12 килодальтон)-α,β-полиаспарагиновой кислоты (23,8 полимер), сопряженного с кабазитакселем (CBZ)
[0708]
Сополимер 12 (1,60 г), полученный в примере синтеза 12, и кабазитаксел (CBZ, 797,9 мг) растворяли в N-метилпирролидоне (NMP, 20,2 мл) и добавляли к ним диметиламинопиридин (DMAP, 35,2 мг) и диизопропилкарбодиимид (DIPCI, 942 мкл). Смесь перемешивали в течение 21 часа при 15°C. Затем к ней добавляли DIPCI (236 мкл) и перемешивали полученную смесь еще 7 часов. Реакционный раствор в течение 1 часа по каплям добавляли к перемешанному раствору диизопропилового эфира (360 мл) и этанола (90 мл). Смесь перемешивали в течение одного часа при комнатной температуре, а затем собирали осадок фильтрацией и сушили при пониженном давлении. Таким образом, получали продукт (1,98 г). Продукт, полученный таким образом, растворяли в смеси ацетонитрила/воды (50/50 (об./об.), 80 мл) и затем добавляли к ней ионообменную смолу. Смесь перемешивали в течение 30 минут при 5°C. Ионообменную смолу отделяли фильтрацией, затем выпаривали ацетонитрил при пониженном давлении и сушили замораживанием. Таким образом, получали указанное в заголовке полимерное производное, сопряженное с таксановым соединением (сравнительный пример С-1, 1,93 г).
[0709]
Количество сопряженного CBZ в сравнительном примере С-1 составляло 5,2 молекулы, по результатам расчета по степени расходования CBZ в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Таким образом, рассчитана общая молекулярная масса CBZ в сравнительном примере С-1 составила 4347.
[0710]
По указанным значениям рассчитывали общую молекулярную массу сравнительного примера С-1, составившую 21377.
[0711]
Исходя из этого, содержание CBZ в сравнительном примере С-1 составило 20,3% по массе, а содержание полиэтиленгликолевого сегмента составило 56,1% по массе.
[0712]
Интенсивность светорассеяния 1 мг/мл водного раствора сравнительного примера С-1 составляла 24804 отсчетов в секунду (cps), и интенсивность светорассеяния стандартного раствора толуола в таких же условиях составляла 4368 cps. Таким образом, отношение между интенсивностью светорассеяния сравнительного примера С-1 и интенсивностью светорассеяния толуола составляло 5,7 раза. Среднеобъемный диаметр частиц составлял 22 нм (устройство А, 1 мг/мл).
[0713]
[Сравнительный пример С-2] Синтез блок-сополимера полиэтиленгликоля (12 килодальтон)-α,β-полиаспарагиновой кислоты (23,8 полимер), сопряженного с кабазитакселем (CBZ) и 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-оном
[0714]
Сополимер 12 (200 мг), полученный в примере синтеза 12, кабазитаксел (CBZ, 99,7 мг) и 2-(2-аминоэтокси)-9-диэтиламино)-5Н-бензо[а]феноксазин-5-он (5,2 мг) растворяли в N-метилпирролидоне (NMP, 2,5 мл) и добавляли к ним диметиламинопиридин (DMAP, 4,4 мг) и диизопропилкарбодиимид (DIPCI, 118 мкл). Смесь перемешивали в течение 21 часа при 20°C. Затем к ней добавляли DIPCI (29 мкл) и перемешивали полученную смесь еще 5 часов. Реакционный раствор в течение 10 минут по каплям добавляли к перемешанному раствору диизопропилового эфира (18 мл) и этанола (4,5 мл) и перемешивали смесь в течение одного часа при комнатной температуре. Затем осадок собирали фильтрацией и сушили при пониженном давлении. Таким образом, получали продукт (235,0 мг). Продукт, полученный таким образом, растворяли в смеси ацетонитрила/воды (50/50 (об./об.), 10 мл) и затем добавляли к ней ионообменную смолу. Смесь перемешивали в течение 30 минут при 5°C. Ионообменную смолу отделяли фильтрацией, затем выпаривали ацетонитрил при пониженном давлении и сушили замораживанием. Таким образом, получали указанное в заголовке полимерное производное, сопряженное с таксановым соединением (сравнительный пример С-2, 205,6 мг).
[0715]
Количество сопряженного CBZ в сравнительном примере С-2 составляло 4,3 молекулы, по результатам расчета по степени расходования CBZ в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ). Таким образом, рассчитана общая молекулярная масса CBZ в сравнительном примере С-2 составила 3594.
[0716]
Количество сопряженного 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в сравнительном примере С-2, рассчитанное по степени расходования 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), составляло 1,0 молекулу. Следовательно, рассчитанная общая молекулярная масса 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в сравнительном примере С-2 составляла 377.
[0717]
По указанным значениям рассчитывали общую молекулярную массу сравнительного примера С-2, составившую 20988.
[0718]
Исходя из этого, содержание CBZ в сравнительном примере С-2 составило 17,1% по массе, содержание 2-(2-аминоэтокси)-9-диэтиламино)-5Н-бензо[а]феноксазин-5-она составило 1,8% по массе, и содержание полиэтиленгликолевого сегмента составило 57,2% по массе.
[0719]
Сравнительный пример С-2 использовали в испытании распределения, описанном ниже, в качестве частицы сравнительного примера С-1 с флуоресцентной меткой.
[0720]
[Сравнительный пример С-3] Синтез блок-сополимера полиэтиленгликоля (2 килодальтон)-α,β-полиаспарагиновой кислоты (12,5 полимер), сопряженного с 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-оном
[0721]
Сополимер 10 (205,7 мг), полученный в примере синтеза 10 и 2-(2-аминоэтокси)-9-диэтиламино)-5Н-бензо[а]феноксазин-5-он (5,1 мг) растворяли в N-метилпирролидоне (NMP, 5,7 мл) и добавляли к ним диметиламинопиридин (DMAP, 45,0 мг) и диизопропилкарбодиимид (DIPCI, 265 мкл). Смесь перемешивали в течение 18,5 часов при 20°C. Затем к ней добавляли DIPCI (66 мкл) и перемешивали полученную смесь еще 2,5 часа. Реакционный раствор переносили на диализную мембрану с НОММ 10000 и проводили диализ в воде, а полученный продукт сушили замораживанием. Таким образом, получали указанное в заголовке полимерное производное, сопряженное с таксановым соединением (сравнительный пример С-3, 247,7 мг).
[0722]
Количество сопряженного 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в сравнительном примере С-3, рассчитанное по степени расходования 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в реакционном растворе, измеренной с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), составляло 0,3 молекулы. Следовательно, рассчитанная общая молекулярная масса 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в сравнительном примере С-3 составляла 113.
[0723]
По указанным значениям рассчитывали общую молекулярную массу сравнительного примера С-3, составившую 5126.
[0724]
Исходя из этого, содержание 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-она в сравнительном примере С-3 составляло 2,2% по массе, а содержание полиэтиленгликолевого сегмента составляло 39,0% по массе.
[0725]
Сравнительный пример С-3 не обладал свойством ассоциации, и его использовали в испытании распределения, описанном ниже, в качестве частицы сополимера 12 с флуоресцентной меткой.
[0726]
[Экспериментальный пример С-1] Испытание внутриопухолевого и внутрипочечного распределения
Опухолевое образование человеческого рака поджелудочной железы ВхРС3, субкультивированное подкожной трансплантацией у бестимусных мышей BALB/c, вырезали в виде блока с длиной каждой стороны примерно 3 мм, и полученный блок трансплантировали подкожно на спинку бестимусных мышей с помощью троакара. Пример С-3, сравнительный пример С-2 и сравнительный пример С-3, соответственно, растворяли в 5% растворе глюкозы для инъекций, и полученные растворы, соответственно, вводили внутривенно в однократной дозе 5 мг/кг в пересчете на 2-(2-аминоэтокси)-9-(диэтиламино)-5Н-бензо[а]феноксазин-5-он. Через один час после введения у мышей извлекали кровь под изофлурановой анестезией, получали замороженные залитые препараты срезов извлеченной опухоли и почек и измеряли флуоресценцию. Результаты представлены на фиг. 7.
[0727]
В результате экспериментального примера С-1 сигналы флуоресценции наблюдали в широкой области опухолевых срезов в случае примера С-3. На основании этого было показано, что блок-сополимер примера С-3 может мигрировать и накапливаться в опухолевой ткани, а также может проникать в глубокие части опухолевой ткани. Напротив, в случае сравнительного примера С-2 и сравнительного примера С-3 было обнаружено, что сигналы флуоресценции наблюдали в приграничной области опухоли; однако свойства проникновения в опухолевую ткань не были подтверждены, и миграция и накопление в опухолевой ткани были незначительными.
[0728]
В почках флуоресценцию наблюдали в почечных канальцах в случае примера С-3 и сравнительного примера С-3. В то же время, в случае сравнительного примера С-2 флуоресценцию не наблюдали в других областях, помимо кровеносных сосудов. На основании этого было установлено, что пример С-3 обладает свойством быстрой экскреции через почки, по сравнению со сравнительным примером С-2.
[0729]
Не способный к ассоциации блок-сополимер сравнительного примера С-3, который имеет молекулярную массу менее 15 килодальтон, и в котором аналитическое значение, представленное интенсивностью светорассеяния в водном растворе, было менее чем двукратным, быстро выводился через почки; однако указанный блок-сополимер демонстрировал слабое накопление в опухоли. Блок-сополимер, сопряженный с таксановым соединением, из сравнительного примера С-2, который имеет молекулярную массу более 15 килодальтон и в котором аналитическое значение, представленное интенсивностью светорассеяния в водном растворе, было выше в два или более раз, не выводился через почки; однако накопление в опухоли было ниже, чем для примера С-3. Стало понятно, что блок-сополимер, сопряженный с таксановым соединением, который быстро экскретируется через почки и демонстрирует накопление в опухоли, может быть получен посредством регулирования аналитического значения, представленного интенсивностью светорассеяния в водном растворе, до двукратного значения или более, и посредством регулирования молекулярной массы до 15 килодальтон или менее.
[0730]
[Экспериментальный пример С-2] Испытание гематотоксичности у мышей, не имеющих опухоли
[0731]
[Введение лекарственного срества]
Пример С-1 и сравнительный пример С-1, соответственно, растворяли в 5% растворе глюкозы для инъекций, и полученные растворы, соответственно, однократно внутривенно вводили 5-недельным самцам мышей ICR (Crl:CD1(ICR), Charles River Laboratories Japan, Inc.) через хвостовую вену в дозе 60 мг/кг в пересчете на кабазитаксел, что является максимально переносимой дозой для различных соединений на основании массы тела, измеренной в день введения. Для контрольной группы однократно, внутривенно вводили только 5% раствор глюкозы для инъекций через хвостовую вену.
[0732]
Для соединений примера С-1 и сравнительного примера С-1 необходимое количество каждого соединения, рассчитанное в пересчете на содержание кабазитаксела, взвешивали в полипропиленовой пробирке для центрифуги, добавляли 5% раствор глюкозы для инъекций и растворяли соединение, облучая раствор ультразвуковыми волнами на ледяной бане.
[0733]
Для кабазитаксела как основного лекарственного средства необходимое количество, рассчитанное для получения концентрации, превышающей заданную концентрацию в 20 раз, взвешивали в полипропиленовой пробирке для центрифуги и добавляли безводный этанол для растворения соединения. Добавляли полисорбат 80 в количестве, равном количеству безводного этанола, и тщательно перемешивали смесь. Полученный раствор использовали в качестве исходного раствора препарата. Исходный раствор препарата разбавляли в 10 раз, используя 5% раствор глюкозы для инъекций непосредственно перед введением, и полученное разбавление однократно внутривенно вводили через хвостовую вену в дозе 30 мг/кг, которая представляет собой максимальную нелетальную дозу.
[0734]
[Гематологическое исследование]
Через 3, 5, 7, 11 и 14 дней после дня введения различных соединений кровь собирали через подключичную вену без анестезии, используя одноразовый шприц объемом 1 мл с иглой 26G. В шприц заранее добавляли примерно 3 мкл раствора ЭДТА-2К, и полученный раствор тщательно перемешивали с собранной кровью. Полученные растворы использовали в качестве аналитических образцов. Образцы крови исследовали с помощью анализа кровяных клеток, используя прибор для анализа кровяных клеток XT-2000iV (Sysmex Corp.). Количество кровяных ретикулоцитов, полученных через 5 дней после введения, представлено в таблице 5.
[0735]
[Таблица 5]
*Количество кровяных ретикулоцитов (×104/мкл) в различных экспериментальных группах на 5 день после введения.
[0736]
В результате гематологического исследования сравнительный пример С-1 приводил к снижению количества кровяных ретикулоцитов через 5 дней со дня введения, и была подтверждена пролонгированная гематотоксичность. Напротив, соединение из примера С-1 и кабазитаксел не вызывали снижения количества кровяных ретикулоцитов через 5 дней после введения, и пролонгированная гематотоксичность не была подтверждена. Таким образом, сделан вывод, что соединение из примера С-1 и кабазитаксел не продлевают гематотоксичность.
[0737]
Сравнительный пример С-1 представляет собой соединение, имеющее молекулярную массу 21 килодальтон. С другой стороны, пример С-1 имеет небольшую молекулярную массу, равную 5,5 килодальтон. Из представленных выше результатов можно сделать вывод, что стойкая гематотоксичность блок-сополимера, сопряженного с производным таксана, коррелирует с молекулярной массой. Таким образом, с использованием блок-сополимера, сопряженного с производным таксана, имеющего молекулярную массу 15 килодальтон или менее, можно получить противоопухолевый агент, препятствующий стойкой гематотоксичности.
[0738]
[Экспериментальный пример С-3] Испытание противоопухолевого эффекта у бестимусных мышей с трансплантированным раком поджелудочной железы человека
[0739]
Опухолевое образование человеческого рака поджелудочной железы ВхРС3, субкультивированное у бестимусных мышей, вырезали в виде блока с длиной каждой стороны примерно 3 мм, и полученный блок трансплантировали подкожно на спинку бестимусных мышей с помощью троакара. В то время, когда средний объем опухоли после трансплантации опухоли достиг примерно 200 мм3 или более, пример С-1, пример С-2 и сравнительный пример С-1, соответственно, растворяли в 5% растворе глюкозы для инъекций, и полученные растворы, соответственно, однократно внутривенно вводили через хвостовую вену в дозе 60 мг/кг в пересчете на кабазитаксел, что представляет собой максимально переносимую дозу для различных соединений, на основании массы тела, измеренной в день введения.
[0740]
Что касается кабазитаксела, раствор, полученный растворением кабазитаксела в полисорбате 80 с последующим разбавлением раствора в равном количестве безводного этанола, использовали в качестве исходного раствора препарата. Исходный раствор препарата разбавляли в 10 раз, используя 5% раствор глюкозы для инъекций непосредственно перед введением, и полученное разбавление однократно внутривенно вводили через хвостовую вену в дозе 30 мг/кг, которая представляет собой максимальную нелетальную дозу.
[0741]
Относительный объем опухоли определяли по объемам опухоли, измеренным в день введения и на 8 день после введения, и использовали его в качестве показателя противоопухолевого эффекта. Объем опухоли определяли измерением главной оси (L: мм) и побочной оси (W: мм) опухоли и расчетом объема по расчетной формуле: (L×W2)/2. Результаты представлены в таблице 6.
[0742]
[Таблица 6]


* Относительный объем опухоли (среднее ± СО) в различных экспериментальных группах на 8 день после введения, причем объем опухоли в день введения принимали за 1,0.
[0743]
В результате экспериментального примера С-3 было показано, что пример С-1, пример С-2 и сравнительный пример С-1 обеспечивают небольшой объем опухоли по сравнению с кабазитакселем и демонстрируют более сильное действие на подавление пролиферации опухоли.
[0744]
[Экспериментальный пример С-4] Испытание противоопухолевого эффекта у бестимусных мышей с трансплантированным раком легких человека
[0745]
Опухолевое образование человеческого рака легких Н460, субкультивированное у бестимусных мышей, вырезали в виде блока с длиной каждой стороны примерно 3 мм, и полученный блок трансплантировали подкожно на спинку бестимусных мышей с помощью троакара. В то время, когда средний объем опухоли после трансплантации опухоли достиг примерно 200 мм3 или более, пример С-1, пример С-2 и сравнительный пример С-1, соответственно, растворяли в 5% растворе глюкозы для инъекций, и полученные растворы, соответственно, однократно внутривенно вводили через хвостовую вену в дозе 60 мг/кг в пересчете на кабазитаксел, что представляет собой максимально переносимую дозу для различных соединений, на основании массы тела, измеренной в день введения.
[0746]
Что касается кабазитаксела, раствор, полученный растворением кабазитаксела в полисорбате 80 с последующим разбавлением раствора в равном количестве безводного этанола, использовали в качестве исходного раствора препарата. Исходный раствор препарата разбавляли в 10 раз, используя 5% раствор глюкозы для инъекций непосредственно перед введением, и полученное разбавление однократно внутривенно вводили через хвостовую вену в дозе 30 мг/кг, которая представляет собой максимальную нелетальную дозу.
[0747]
Относительный объем опухоли определяли по объемам опухоли, измеренным в день введения и на 15 день после введения, и использовали его в качестве показателя противоопухолевого эффекта. Объем опухоли определяли измерением главной оси (L: мм) и побочной оси (W: мм) опухоли и расчетом объема по расчетной формуле: (L×W2)/2. Результаты представлены в таблице 7.
[0748]
[Таблица 7]

*Относительный объем опухоли (среднее ± СО) в различных экспериментальных группах на 15 день после введения, причем объем опухоли в день введения лекарственного средства принимали за 1,0.
[0749]
В результате экспериментального примера С-4 было показано, что пример С-1, пример С-2 и сравнительный пример С-1 обеспечивают небольшой объем опухоли по сравнению с кабазитакселем и демонстрируют более сильное действие на подавление пролиферации опухоли.
[0750]
На основании результатов экспериментальных примеров С1-С4 наглядно показано, что блок-сополимеры, сопряженные с производным таксана, согласно настоящему изобретению подавляют стойкую гематотоксичность, проявляя противоопухолевый эффект, который равен или превосходит противоопухолевый эффект контрольных лекарств. Таким образом, понятно, что при использовании блок-сополимера, сопряженного с производным таксана, имеющего регулируемую молекулярную массу и регулируемую интенсивность светорассеяния в водном растворе, может быть получен противоопухолевый агент, который может препятствовать поражению нормальных тканей вследствие подавления пролиферации опухоли и может обеспечивать усиление эффективности и уменьшение неблагоприятных эффектов.
[0751]
На основании результатов, описанных выше, понятно, что в отношении препарата DDS, в котором использован блок-сополимер, в котором полиэтиленгликолевый сегмент связан с полиаминокислотным сегментом, в качестве носителя для доставки лекарственного средства, если молекулярная масса блок-сополимера отрегулирована на уровне 2 килодальтон или более и 15 килодальтон или менее, и если обеспечено свойство образования самоассоциирующихся частиц блок-сополимера в водном растворе в сочетании с анализом свойств в водном растворе в соответствии с фотометрическим методом рассеяния лазерного света, то может быть получен препарат DDS в виде наночастиц, имеющих среднеобъемный диаметр частиц меньше, чем обычные препараты DDS, и, таким образом, полученный препарат DDS демонстрирует фармакокинетические характеристики, которые отсутствуют у обычных блок-сополимеров.
[0752]
Таким образом, понятно, что блок-сополимер согласно настоящему изобретению обладает не только свойствами миграции в пораженную ткань-мишень, такую как опухоль, но и превосходными свойствами проникновения во внутреннюю часть ткани. Таким образом, указанный блок-сополимер проявляет превосходное свойство миграции в ткань-мишень и превосходное накопление. Кроме того, известно, что препараты DDS, в которых использованы полимерные носители, обладают сниженной способностью к экскреции через почки; однако было наглядно показано, что блок-сополимер согласно настоящему изобретению может быть выведен через почки. Такие уникальные фармакокинетические характеристики представляют собой свойства, обусловленные молекулярной массой блок-сополимера и свойствами самоассоциации, и было установлено, что указанныые фармакокинетические характеристики обеспечивают технологию составления повсеместно пригодного для применения препарата DDS, независимо от типа или химической структуры физиологически активного вещества, подлежащего сопряжению. Поскольку такие фармакокинетические характеристики обеспечивают возможность доставки физиологически активного вещества в глубокие части пораженной ткани-мишени и сенсибилизации пораженной ткани-мишени, то может быть эффективно проявлен эффект фармакологической активности. Кроме того, поскольку указанный блок-сополимер может быть выведен через почки, то молекулы блок-сополимера, которые не распределены и не накоплены в пораженной ткани-мишени, быстро экскретируются. Следовательно, снижено излишнее удерживание in vivo, и проявление неблагоприятных эффектов может быть уменьшено благодаря предотвращению распределения и накопления в тканях, отличных от пораженной ткани-мишени.
[0753]
Таким образом, блок-сополимер согласно настоящему изобретению представляет собой технологию, которая обеспечивает возможность внедрения новой концепции макромолекулярных препаратов DDS, и, таким образом, могут быть получены пригодные для применения фармацевтические продукты посредством использования указанного блок-сополимера в отношении лекарственных средств, предлагаемых для лечения различных заболеваний. В частности, предпочтительно использовать указанный блок-сополимер для лечения очаговых заболеваний тканей, и фармацевтические продукты для лечения злокачественных опухолевых заболеваний, воспалительных заболеваний и инфекционных заболеваний могут быть использованы вместе с указанным блок-сополимером.
Реферат
Группа изобретений относится к макромолекулярному производному физиологически активного вещества и его применению. Предложены блок-сополимеры, содержащие полиэтиленгликолевый сегмент, связанный с сегментом производного полиаминокислоты, сопряженный с физиологически активным веществом, в котором молекулярная масса блок-сополимера составляет от 2 до 15 кДа, и интенсивность светорассеяния 1 мг/мл водного раствора блок-сополимера, измеренная с помощью фотометра для измерения рассеяния лазерного излучения при следующих условиях измерения: температура измерения 25°С, угол рассеяния 90° и длина волны 632,8 нм - по меньшей мере в два раза или более выше интенсивности светорассеяния толуола, измеренной при таких же условиях. Наночастицы, полученные из блок-сополимера, пригодны для доставки физиологически активного вещества в глубокие части пораженной ткани-мишени и сенсибилизации пораженной ткани-мишени. Блок-сополимер применяют в составе фармацевтического продукта для лечения очаговых заболеваний тканей и в противоопухолевом агенте. Предложенный блок-сополимер обладает улучшенной эффективностью и безопасностью благодаря свойству проникновения в пораженную ткань-мишень и повышенной почечной экскреции, тем самым подавляется сенсибилизация физиологически активным веществом нормальных тканей. 6 н. и 9 з.п. ф-лы, 7 табл., 11 пр., 7 ил.
Формула






Документы, цитированные в отчёте о поиске
Высокомолекулярные производные камптотецинов

Комментарии