Растения дыни с повышенной урожайностью плодов - RU2696201C2
Код документа: RU2696201C2
Чертежи


















Описание
ОБЛАСТЬ И УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение, в некоторых вариантах его осуществления, относится к растениям дыни, имеющим небольшой бессемянной плод, с повышенной урожайностью плодов и способам их получения.
Партенокарпия, получение бессемянных плодов, может быть достигнута путем добавления регуляторов роста растений ауксина, кинина или гиббереллина во многие культуры. Было показано, что экзогенное применение ауксина или гиббереллина к неоплодотворенным цветам в нескольких видах растений, вызывало завязывание плода при отсутствии опыления, в результате чего получали партенокарпный плод. В предыдущих мерах, направленных на получение бессемянных плодов, традиционная селекция растений и экзогенное применение гормонов были использованы с некоторым успехом. Кроме того, экзогенное применение растительных гормонов является трудоемким процессом, а традиционное разведение растений является долгосрочным процессом. При этом по меньшей мере, некоторые из предыдущих попыток получения определенных бессемянных плодов приводили к небольшому количеству бессемянных плодов и/или к относительно небольшим бессемянным плодам по сравнению с нормальными, семенными плодами. В большинстве случаев, это приводило к значительному снижению урожайности в небольших сортах плодов.
Cucumis melo показывает чрезмерное разнообразие для признаков плода. Плоды дыни различаются по размеру, форме, внешнему цвету, запаху и признакам мякоти, таким как содержание сахара, кислотность и пигментация. Однако существует растущий спрос на новые виды плодов на современных продуктовых рынках. В дыне завязывание плодов и количество является особенностью, которая в основном регулируется на гормональном уровне. Завязывание плода подвергается гормональному воздействию в результате удачного или неудачного развития плода на ветке из предшествующего женского цветка, однако общее количество плодов на растение является достаточно постоянным. Как правило, наибольшее количество сортов дыни производит 1-5 плодов на растение в природных условиях.
Существует давно назревшая необходимость в данной области техники в эффективных и экономичных средствах и способах получения бессемянных плодов, особенно с хорошей урожайностью и качеством по сравнению с бессемянными плодами, известными из уровня техники.
Предшествующий уровень техники включает в себя заявку на патент США No. 20120324597 и WO 2011/018785.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, изобретение предлагает Cucumis melo растение или его часть, растение, плодоносящее более чем 12 плодов, где указанный плод бессемянной.
Согласно аспекту некоторых вариантов осуществления, настоящее изобретение предлагает Cucumis melo растение, содержащее MELO3C009603/melo3c009603 геном, такое, что при самоопылении 25% F1 плодоносит более чем 12 плодов, где указанные плоды бессемянные.
В соответствии с аспектом некоторых вариантов осуществления, настоящее изобретение предлагает побег С. melo растения из растений, описанных в настоящем изобретении.
В соответствии с аспектом некоторых вариантов осуществления, настоящее изобретение предлагает семя Cucumis melo растения, содержащего MELO3C009603/melo3c009603 геном, такое, что при самоопылении, 25% F1 плодоносит более чем 12 плодов, где указанные плоды бессемянные.
Согласно аспекту некоторых вариантов осуществления, настоящее изобретение предлагает клетку, содержащую геном любого из растений, описанных в настоящем изобретении.
В соответствии с аспектом некоторых вариантов осуществления, настоящее изобретение предлагает культуру, включающую в себя множество клеток, описанных в настоящем изобретении.
В соответствии с аспектом некоторых вариантов осуществления, настоящее изобретение предлагает способ селекции первого С. melo, включающий в себя скрещивание растений, описанных в настоящем изобретении, со вторым С. melo растением, тем самым выращивая С. melo.
Согласно аспекту некоторых вариантов осуществления, настоящее изобретение предлагает множество семян С. melo, которые гетерозиготны для MELO3C009603 мутации, которая при посадке приводит к фенотипу повышенной урожайностью плодов в 25% от растений, полученных из них.
В соответствии с аспектом некоторых вариантов осуществления, настоящее изобретение предлагает гибридное семя, полученное с помощью способов, описанных в настоящем изобретении.
В соответствии с аспектом некоторых вариантов осуществления, настоящее изобретение предлагает гибридное растение или его часть, полученное выращиванием гибридного семени, описанного в настоящем изобретении.
Согласно аспекту некоторых вариантов осуществления, настоящее изобретение предлагает способ выращивания любого из растений, описанных в настоящем изобретении, включающий в себя вегетативное размножение растения, посредством этого выращивали растение.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, изобретение предлагает выделенный полинуклеотид, включающий в себя последовательность, представленную в SEQ ID NO: 9.
В соответствии с аспектом некоторых вариантов осуществления, настоящее изобретение предлагает выделенный полипептид, включающий в себя последовательность, представленную в SEQ ID NO: 8.
В соответствии с аспектом некоторых вариантов осуществления настоящего изобретения, изобретение предлагает способ маркер-вспомогательной селекции С. melo растения, имеющего повышенную урожайность плодов или имеющего потомство с повышенной урожайностью, способ, включающий в себя проведение анализа на наличие мутации потери функции, по меньшей мере, в одной аллели MELO3C009603, отличающийся тем, что наличие указанной мутации показывает, что растение или его потомство будет нести более чем 5 бессемянных плодов.
Согласно аспекту некоторых вариантов осуществления, настоящее изобретение предлагает пищевой продукт или переработанный продукт, включающий в себя растения, описанные в настоящем изобретении, или его части.
Согласно некоторым аспектам настоящего изобретения, растение плодоносит более чем 15 плодов.
Согласно некоторым аспектам настоящего изобретения, растение плодоносит более чем 20 плодов.
Согласно некоторым аспектам настоящего изобретения, растение имеет аналогичное содержание общего количества растворимых твердых веществ (TSS) и содержание β-каротина как Cucumis melo растение дикого типа.
Согласно некоторым вариантам осуществления настоящего изобретения, вес общего количества плодов растения больше, чем вес общего количества плодов Cucumis melo растения дикого типа.
Согласно некоторым вариантам осуществления настоящего изобретения, растение представляет собой сорт С. melo Cantalupensis.
В соответствии с некоторыми вариантами осуществления настоящего изобретения, обе аллели MELO3C009603 генома растения имеют мутацию потери функции, что приводит к бессемянному признаку.
Согласно некоторым вариантам осуществления настоящего изобретения, обе аллели указанного MELO3C009603 имеют F/I мутацию в положении 97.
В соответствии с некоторыми вариантами осуществления настоящего изобретения, полинуклеотидная последовательность указанного MELO3C009603 представлена в SEQ ID NO: 7.
Согласно некоторым вариантам осуществления настоящего изобретения, полипептидная последовательность MELO3C009603 представлена в SEQ ID NO: 8.
Согласно некоторым вариантам осуществления настоящего изобретения, часть растения выбрана из группы, состоящей из корня, стебля, листьев, семядоли, цветов, плода, зародыша и пыльцы.
Согласно некоторым вариантам осуществления настоящего изобретения, скрещивание включает в себя опыление.
В соответствии с некоторыми вариантами осуществления настоящего изобретения, подвиды указанного растения дыни melo выбраны из группы, состоящей из melo Cantalupensis, Noy Yizre'el, Ein Dor и Piel De Sapo.
В соответствии с некоторыми вариантами осуществления настоящего изобретения, второе С. melo растение не является растением, описанным в настоящем изобретении (напр. не имеет мутации в MELO3C009603).
Согласно некоторым вариантами осуществления настоящего изобретения, 25% растений несут более чем 5 плодов, плоды бессемянные.
В соответствии с некоторыми вариантами осуществления настоящего изобретения, маркер-вспомогательная селекция проводится с применением анализа,
выбранного из группы, состоящей из анализа достройки по одному основанию (SBE), секвенирования аллельспецифического удлинения праймера (ASPE), секвенирования ДНК, секвенирования РНК, анализа на основе микроматрицы, универсальной ПЦР, аллельспецифического удлинения, гибридизации, масс-спектрометрии, сшивание, удлинение-сшивание, и флэп-эндонуклеаза опосредованного анализа.
Если не указано иное, все технические и/или научные термины, используемые в настоящем описании, имеют такое же значение, как обычно понимает любой средний специалист в данной области техники, к которой относится настоящее изобретение. Хотя способы и материалы, подобные или эквивалентные описанным в настоящем изобретении, могут быть использованы в практике или исследовании вариантов осуществления настоящего изобретения, примеры способов и/или материалов описаны в настоящем описании ниже. В случае противоречий, контролироваться будет описанием патента, включающего в себя все определения. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для обязательного ограничения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Некоторые варианты осуществления настоящего изобретения, описанные в настоящем описании, исключительно для примера, со ссылкой на прилагаемые чертежи. На конкретном примере чертежа в деталях, следует подчеркнуть, что данные показаны в качестве примера и с целью рассмотрения вариантов осуществления настоящего изобретения. В связи с этим, описание вместе с чертежами делает очевидным для специалиста в данной области техники как могут быть реализованы варианты осуществления настоящего изобретения.
На чертежах представлено следующее:
На Фиг. 1 представлена фотография 'супер плодового' ('sf') растения, приносящего плоды в природных условиях.
На ФИГ. 2 представлена фотография внутренней части различных 'sf' типов плода.
На ФИГ. 3 представлена фотография всех плодов типичного одного 'sf' растения.
На ФИГ. 4А-С представлены гистограммы, иллюстрирующие характеристики в полевых условиях сегрегантов 'sf' и F2 дикого типа, полученных от четырех независимых скрещиваний. Горизонтальные сплошные и пунктирные линии обозначают средние значения всех диких типов и 'sf' соответственно. А - средняя величина количества плодов; В - средний вес плодов; C - средний вес плодов на растение (урожайность).
На ФИГ. 5А-В представлены гистограммы, иллюстрирующие качество сегрегантов 'sf' и F2 дикого типа от CEZ х 'sf' скрещиваний. А - средняя величина брикс (TSS) 10 плодов CEZ, 'sf' и сегрегантов дикого типа; В - средняя величина содержания β-каротина 10 плодов CEZ, сегрегантов 'sf' и дикого типа.
На ФИГ. 6 представлена фотография продуктов расщепления АроI 213 пар оснований (bp) ПЦР продукта, амплифицированого из ДНК (слева направо) 'sf', 'CEZ' и их F1 растений. Размер в парах оснований (bp) ДНК фрагментов отображено слева. Прямой праймер TAGACATGAGCCGCATCTGA (SEQ ID NO: 3) и обратный праймер GAACGTGGCAACAACAACAA (SEQ ID NO: 4) применяли для ПЦР амплификации.
На ФИГ. 7 представлено выравнивание 'цинкового пальца' (ZF) мотива 'sƒ' (MELO3C009603), показывающее аминокислотную замену 'F97' к 'I' (красная рамка). Две аминокислоты цистеин и гистидин C2H2 выделены жирным шрифтом. CHYCCRNFPTSQALGGHQNAH (SEQ ID NO: 5); CHYCCRNIPTSQALGGHQNAH (SEQ ID NO: 6).
На ФИГ. 8A-B представлены графики, иллюстрирующие экспрессию MELO3C009603 (sƒ ген). На Фигуре 8А - РНК секвенирование на основе цифровой экспрессии MELO3C009603 (sƒ ген) в группах 'sf' и диком типа; На Фигуре 8В - анализ качественной ПЦР с обратной транскриптазой (qRTPCR) относительной экспрессии (APR1 ген в качестве эталона) MELO3C009603 в тканях, которые включают каждую группу.
На ФИГ. 9 представлена диаграмма Венна, показывающая все дифференциально экспрессирующие гены (DEG) в трех сегрегирующих популяциях и перекрытие из них.
На ФИГ. 10А представлен график, иллюстрирующий РНК секвенирование на основе цифровой экспрессии MELO3C021150 (ген нуцеллуса семян) в группах изогенной 'sf' и дикого типа (CEZ);
На ФИГ. 10В представлен график, иллюстрирующий относительную экспрессию MELO3C021150 в тканях, которые включают изогенные группы, проанализированные с помощью качественной ПЦР с обратной транскриптазой (qRTPCR) (APR1 ген в качестве эталона).
На ФИГ. 11А-В приведена комплементарная последовательность ДНК дикого типа (ФИГ. 11А - SEQ ID NO: 7) и мутантная аминокислотная последовательность (ФИГ. 11В - SEQ ID NO: 8) MELO3C009603 в мутантных растениях. Фигура 11А. Первый ATG выделен желтым цветом и стоп-кодон ТАА выделен красным цветом. 'ТТС', который кодирует 'F' в диком типе, выделен жирным шрифтом, а 'T', которая мутировала в 'A' в 'sf', окрашена в красный цвет; Фигура 11В - последовательность белка 'sf' гена. Домен цинкового пальца окрашен синим цветом, C2 и H2 зеленым, а мутантная аминокислота 'I' в красный. QAALGH мотив в ZF домене подчеркнут.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение, в некоторых вариантах его осуществления, относится к растениям дыни, имеющих повышенную урожайность плодов, и способам получения таковых.
Прежде, чем объяснять, по меньшей мере, один из вариантов осуществления настоящего изобретения подробно, нужно понимать, что изобретение не обязательно ограничивается в своем применении деталями, изложенными в приведенном ниже описании или примерами которых являются Примеры. Настоящее изобретение допускает другие варианты осуществления изобретения или осуществление на практике или выполнение различными способами.
Среди Тыквенных, С. melo является одним из наиболее важных культивируемых тыквенных. Их выращивают главным образом для их плодов, которые, как правило, имеют большое разнообразие в размерах (от 500 г до 5 кг), телесном цвете (оранжевый, зеленый и белый), цвете кожуры (зеленый, желтый, белый, оранжевый и серый), форме (круглая, овальная или удлиненная), и размерах (от 5 до 25 см в ширину; от 10 до 50 см в длину).
При попытке создания новых сортов растения дыни авторы настоящего изобретения обрабатывали семена CEZ дыни (сорт дыни 'charantais', полученный с помощью ARO) химическим мутагеном этил метансульфонатом (EMS) и выбирали 'супер плодовые' растения дыни (называемые в настоящем описании как ʺsfʺ растения), которые имели повышенное количество плодов и урожайность (Фигуры 1 и 3). Осмотр плодов от этих растений показал, что их плоды были бессемянными или имели маленькие пустые неразвитые семена (Фигура 2). Анализ каротеноидов в мутантном плоде с помощью ВЭЖХ показал одинаковое содержание бета-каротина по сравнению с немутантными изогенным аналогом, CEZ. Кроме того, содержание общего количества растворимых твердых веществ (TSS) показало, что мутантный плод имеет одинаковое содержание сахара по сравнению с немутантным изогенным аналогом.
'CEZ' растение дикого типа производит в среднем по четыре плода на растение и только один плод будет развиваться на ветке, тогда как 'sf' способен производить много плодов на каждой ветке. В растениях дикого типа, успешное опыление женского цветка и начало развития плода будет подавлять развитие дополнительного плода от следующего женского цветка на той же ветке. Этот механизм подавления инактивируется в 'sf'. Возвратное скрещивание, сделанное с 'sf', показало, что их пыльца полностью плодовита, плоды будут развиваться только после оплодотворения, однако не будут содержать семена или будут маленькие пустые семена в маленьком плоде 'sf'. Таким образом, 'sf' страдает от остановки развития семян, что не мешает развитию плода и не ингибирует производство многих дополнительных плодов на той же ветке.
Было показано, что это уникальное увеличение урожайности регулируется одним рецессивным геном (MELO3C009603, кодирующий цинковый палец типа Cys2His2 (C2H2) белка), как показывает анализ сегрегации 'sf' в четырех независимых сегрегирующих популяциях F2.
Таким образом, согласно одному аспекту настоящего изобретения, предложено С. melo растение или его часть, где растение плодоносит более чем 12 плодов, где указанный плод бессемянной.
Термин "растение" в контексте настоящего изобретения, включает в себя цельные растения, предшествующее растение и потомство растений и части растений, включающие в себя семена, плоды, побеги, стебли, корни (в том числе клубни), и растительные клетки, ткани и органы. Растение может быть в любом виде, включая каллус ткань, суспензионную культуру, зародыши, участки меристемы, листья, гаметофиты, спорофиты, пыльцу, семяпочки и микроспоры.
Термин "дыня" в контексте настоящего изобретения, относится к видам Cucumis melo L., включая подвиды agrestis (vars. conomon, makuwa, momordica и acidulous) и melo (vars. cantalupensis, reticulatus, adana, chandalok, ameri, inodorus, flexuosus, chate, tibish, dudaim и chito.
Термин "сорт" используется в настоящем описании для обозначения растения, имеющего биологический статус, отличный от статуса "дикого", где статус "дикий" указывает на первичное неокультуренное или естественное состояние растение или прирост. Термин "сорт" (для культивируемых сортов) включает в себя, но не ограничивается ими, полуприродный, полудикий, сорной, традиционные сорта, ландрас, селекционный материал, исследовательский материал, племенную линию, синтетическую популяцию, гибрид, маточный материал/основную популяцию, инбредную линию (родитель гибридного сорта), сегрегирующую популяцию, мутантный/генетический фонд и усовершенственный/улучшенный сорт. Примеры сортов включают в себя такие культурные сорта, которые относятся к таксономическим группам Cucumis melo var. cantalupensis (плоды канталупы типов Charantais и Italian), Cucumis melo var. reticularis (плоды типов Galia и Ananas), и Cucumis melo var. inodorus (включающие плоды типов Piel de Sapo, Yellow Canary, Branco и Honeydew). Таким образом, растение по настоящему изобретению представляет собой растение любого С. melo var. Термин "var." указывает на varietas (таксономический уровень ниже, чем у видов, как описано выше).
Согласно одному варианту осуществления настоящего изобретения, растение в соответствии с данным аспектом настоящего изобретения имеет повышенную урожайность плодов по сравнению с растениями дикого типа такого же генетического фона, выращенных в таких же условиях (т.е. плодоносят более чем 10 плодов, 12 плодов, 15 плодов, 20 плодов, 25 плодов или даже более чем 30 плодов в определенный момент времени). Как правило, средний вес каждого плода составляет 350 г с диапазоном 100-600 г, в зависимости от генетического фона (Фигура 4В). Растение может включать, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 5 плодов на ветке в определенный момент времени.
Большая часть плодов на растении находятся в одной стадии созревания, в зависимости от степени климатического/не-климатического режима созревания плодов.
Следует иметь в виду, что вес общего количества плодов (т.е. урожайность) указанного растения больше чем вес общего количества плодов растения Cucumis melo дикого типа.
В контексте настоящего изобретения фраза "растение Cucumis melo дикого типа" относится к растению Cucumis melo, имеющее немутированный, встречающийся в природе, геном.
Авторы настоящего изобретения показали, что содержание сахара и содержание бета-каротина растения дыни в соответствии с данным аспектом настоящего изобретения похоже на их немутированные (дикий тип) аналоги. Следует иметь в виду, что аналоги дикого типа не имеет мутаций в других генах, влияющих на содержание бета-каротина, таких как CRTISO, как раскрыто в заявке на патент США No. 20120324597. Таким образом, растения дыни согласно данному аспекту настоящего изобретения могут быть выращены съедобными и высокого качества при различном генетическом фоне. Они пригодны как свежие продукты или для переработки продуктов такой как, например, консервирования.
Как было указано, растения дыни в соответствии с данным аспектом настоящего изобретения являются бессемянными.
В контексте настоящего изобретения, термин "бессемянная дыня" относится к дыне, которая не содержит оплодотворенные зрелые семена. Хотя дыни по настоящему изобретению не содержат оплодотворенные зрелые семена, дыни могут содержать неоплодотворенные завязи, которые маленькие и белого цвета. Эти неоплодотворенные завязи не считаются истинными семенами. Содержание семян в плодах снижается, по меньшей мере, на 80% по сравнению с дыней дикого типа такого же генетического фона и условий роста.
В соответствии с данным аспектом настоящего изобретения бессемянной признак контролируется с помощью генетической детерминанты и является независимым от экзогенной обработки партенокарпия-индуцирующими растительными гормонами. Таким образом, бессемянной признак получают путем стеноспермокарпии, а не партенокарпии.
В соответствии с одним вариантом осуществления настоящего изобретения, по меньшей мере, 80% плодов данного растения имеют сниженное содержание семян, по меньшей мере, на 80%, по меньше мере, от 90% до приблизительно 99% или даже 100%.
В соответствии с одним вариантом осуществления настоящего изобретения, по меньшей мере, 85% плодов данного растения имеют сниженное содержание семян, по меньшей мере, на 80%, по меньшей мере, от 90% до приблизительно 99% или даже 100%.
Согласно другому варианту осуществления настоящего изобретения, по меньшей мере, 90% плодов данного растения имеют сниженное содержание семян, по меньшей мере, на 80%, по меньшей мере, от 90% до приблизительно 99% или даже 100%.
Согласно другому варианту осуществления настоящего изобретения, по меньшей мере, 55% плодов данного растения имеют сниженное содержание семян, по меньшей мере, на 80%, по меньшей мере, от 90% до приблизительно 99% или даже 100%.
Согласно другому варианту осуществления настоящего изобретения, по меньшей мере, 99% плодов данного растения имеют сниженное содержание семян, по меньшей мере, на 80%, по меньшей мере, от 90% до приблизительно 99% или даже 100%.
Растения дыни в соответствии с данным аспектом настоящего изобретения характеризуются наличием обоих аллелей гена MELO3C009603 (последовательность кДНК дикого типа - SEQ ID NO: 7), имеющих мутацию потери функции, что приводит к признаку повышенной урожайности плодов (и необязательно бессемянному признаку). MELO3C009603 может иметь одну мутацию, которая приводит к обоим признакам, или две мутации - одна из которых приводит к признаку повешенной урожайности плодов, а другая приводит к бессемянному признаку. В соответствии с конкретным вариантом осуществления настоящего изобретения, аминокислотная последовательность мутантного MELO3C009603 представлена в SEQ ID NO: 8.
MELO3C009603 может быть в гомозиготной форме или в гетерозиготной форме. Согласно данному варианту осуществления настоящего изобретения, гомозиготность представляет собой состояние, когда обе аллели в локусе MELO3C009603 характеризуются одинаковой нуклеотидной последовательностью. Гетерозиготность относится к различным состояниям в локусе MELO3C009603 гена.
Термин "аллель", в контексте настоящего изобретения, относится к любому из одного или нескольких альтернативных форм генного локуса, все из которых аллели относятся к признаку или характеристике. В диплоидной клетке или организме две аллеля данного гена занимаю соответствующие локусы на паре гомологичных хромосом.
Термин "ген" в контексте настоящего изобретения, относится к наследственному фактору, который определяет биологические характеристики организма (т.е. растение дыни), "аллель" представляет собой конкретный ген в паре генов, присутствующий в (диплоидном) растение дыни.
Растение называется "гомозиготным" для гена, когда он содержит одинаковые аллели указанного гена, а "гетерозиготным" для гена, когда он содержит два различных аллеля указанного гена. Использование заглавных букв указывает на доминирующий (форму) ген, а использование строчных букв указывает на рецессивный ген: "Х,Х", следовательно, означает гомозиготу с доминирующим генотипом для гена или свойств X; "Х,х" и "х,Х" означают генотипы гетерозиготы; и "х,х" означают рецессивные генотипы гомозиготы. Как известно, только рецессивный генотип гомозиготы, как правило, обеспечивает соответствующий рецессивный фенотип (т.е. приводит к растению, которое показывает свойство или признак "х"), тогда как доминантный генотип гетерозиготы и гомозиготы обычно обеспечивает соответствующий доминантный фенотип (т.е. приводит к растению, которое показывает свойство или признак "X"), если другие гены и/или факторы, такие как множественные аллели, супрессоры, кодоминантность и т.д. (тоже) играют роль в определении фенотипа.
"Мутация потери функции" представляет собой мутацию в последовательности гена, которая служит причиной либо снижения или полного отсутствия функции генного продукта, как правило, белка. Мутация потери функции может, к примеру, быть вызвана с помощью усечения генного продукта из-за сдвига рамки считывания или нонсенс-мутации или путем изменения одной или нескольких аминокислот. Фенотип, связанный с аллелем, с мутацией потери функции, является, как правило, рецессивным, но может также быть доминантным.
Согласно конкретному варианту осуществления настоящего изобретения, обе аллели MELO3C009603 несут мутации А к Т в положении 3,450,971 на каркасе 11 генома дыни, приводящие к F/I аминокислотной замене в положении 97 ожидаемого MELO3C009603 белка. Примерная полинуклеотидная последовательность мутантного MELO3C009603 представлена в SEQ ID NO: 9. Примерная полипептидная последовательность мутантного MELO3C009603 представлена в SEQ ID NO: 8.
Следует понимать, что настоящее изобретение также предусматривает получение плода Cucumis melo, делая обрезку из 'sf', растений дыни и выполняя вегетативное размножение.
Вегетативное размножение может быть осуществлено с использованием способов, известных из хорошо известной области техники, например, культивирование растительной ткани in-vitro, укоренение бокового побега или слияние протопластов. В одном варианте осуществления настоящего изобретения, способ вегетативного размножения растения по настоящему изобретению включает в себя: а) сбор ткани растения по настоящему изобретению; b) культивирование указанной ткани для достижения пролиферации побега; с) укоренение указанного пролиферирующего побега для получения укоренившихся проростков; и d) выращивание растений от указанных укоренившихся проростков.
Побеги согласно данному аспекту настоящего изобретения могут включать корни, стебли, листья, семядоли, цветы, плоды, зародыши и пыльцу. Предпочтительно, побеги включают в себя стебли и эпическую или боковую меристему побега.
Согласно одному из вариантов осуществления настоящего изобретения, растения по настоящему изобретению представляют собой гибридный сорт - т.е. получают после скрещивания (т.е. спаривания) двух не-изогенных растений. Гибрид может быть гибрид F1 или перекрестноопыляющийся вид.
"Гибрид F1" в контексте настоящего изобретения, относится к поколению первого поколения скрещивания двух не-изогенных растений.
Развитие гибридов дыни по настоящему изобретению требует разработки стабильных родительских клеточных линий, при этом, по меньшей мере, одна из них является гетерозиготной по sƒ гену. В программах селекции желательные признаки от двух или более источников зародышевой плазмы или генных пулов объединяют для развития превосходных сортов селекции. Желательные инбредные или родительские линии получают с помощью непрерывного самоопыления и отбором лучших селекционных линий, иногда с использованием молекулярных маркеров для ускорения процесса отбора.
После того, как родительские линии, которые давали наилучшую гибридную продуктивность, были идентифицированы, напр., как несущие мутацию в MELO3C009603, гибридное семя могло быть получены до бесконечности, поскольку гомогенность родителей сохраняется. Согласно одному из вариантов осуществления настоящего изобретения, растения дыни по настоящему изобретению являются стабильными родительскими клеточными линиями растения (несущие мутацию потери функции в MELO3C009603 гене в гетерозиготной форме).
В контексте настоящего изобретения, фраза "стабильные родительские клеточные линии" относятся к перекрестноопыляющимся, инбредным линиям, стабильные для желаемых растений в течение циклов самоопыления и посадки. Как правило, 95% генома в родительских клеточных линиях по настоящему изобретению находится в гомозиготной форме.
В соответствии с другим аспектом, настоящее изобретение предлагает способ получения первого поколения (F1) 'sf' гибридных проростков дыни.
Согласно одному из вариантов осуществления настоящего изобретения, настоящее изобретение предлагает способ получения первого поколения 'sf' гибридных проростков (а также семян), включающий в себя скрещивание (напр. опыление) первого стабильного родительского растения дыни, которое является бессемянным и имеет повышенную урожайность плодов (напр. либо гомозигота или гетерозигота по мутации MELO3C009603) со вторым стабильным 'sf' гетерозиготным родительским растением дыни.
Следует понимать, что 25 или 50% гибридных семян F1 дыни были гомозиготными по мутации MELO3C009603 в зависимости от того, одна или обе родительских линии являются гетерозиготами 'sf'.
Согласно другому варианту осуществления, настоящее изобретение также предлагает маркерную ДНК, которая позволяет отобрать F1 'sf' проростки.
Таким образом, согласно другому аспекту настоящего изобретения, предложено Cucumis melo растение, имеющее MELO3C009603/melo3c009603 геном, такое, что при самоопылении 25% F1 несет более чем 5 плодов, где указанные плоды бессемянные.
Настоящее изобретение также относится к семенам, собранным от этих F1 гибридных растений дыни и растений, выращенных от этих семян.
Общепринятой практикой в селекции растений используется способ обратного скрещивания для выведения новых сортов путем преобразования одного признака.
Фраза "единичное преобразование признака" в контексте настоящего изобретения относится к включению нового единичного гена в родительскую линию, где по существу все желаемые морфологически и физиологические характеристики родительских линий восстанавливаются в дополнение к перенесенному единичному гену.
Термин "возвратное скрещивание" в контексте настоящего изобретения относится к повторному скрещиванию гибридного потомства обратно одним из родительских растение дыни. Родительское растение дыни, которое дает ген желаемой характеристики, называется небэккроссируемым или родителем-донором. Эта терминология относится к тому факту, что небэккроссируемый родитель применяется один раз при возвратном скрещивании и, следовательно, не повторяется. Родительское растение дыни, к которому ген от небэккроссируемого родителя переносится, известен как рекуррентный родитель, поскольку он применяется для нескольких циклов в протоколе возвратного скрещивания.
В обычном протоколе возвратного скрещивания, растение от оригинальных сортов, представляющих интерес (рекуррентный родитель) скрещивают с растением, выбранным из вторых сортов (небэккроссируемый родитель), которое несет интересующий единичный ген, подлежащий переносу. Полученное в результате этого скрещивания потомство затем скрещивают снова с рекуррентным родителем и процесс повторяют до тех пор, пока не будет получено растение дыни, в котором по существу все желаемые морфологические и физиологические характеристики рекуррентного родителя восстановятся в преобразованном растении, в дополнение к единичному перенесенному гену от небэккроссируемого родителя.
Таким образом, почти изогенные линии (NIL) могут быть созданы путем многократных возвратных скрещиваний для получения матрицы отдельных растений, которые являются почти идентичными по набору генов, за исключением признака или геномной области под вопросом в случае 'sf' мутации в MELO3C009603.
Способы возвратного скрещивания могут применяться с настоящем изобретением для улучшения или введения характеристики в родительские линии.
Может быть выполнена маркер-вспомогательная селекция С. melo растений, которые плодоносят более чем 5 бессемянных плодов (или их частей, которые способны производить растение, которое несет более чем 5 бессемянных плодов). Это особенно удобно для селекции побегов или в течение процесса возвратного скрещивания. Способ включает в себя анализ на наличие А/Т мутации, которая приводит к аминокислотной замене F/I в положении 97 MELO3C009603 ожидаемого белка, в котором присутствие мутации указывает, что растение несет более чем 5 бессемянных плодов или его часть будет производить более чем 5 бессемянных плодов.
Многие способы известны из данной области техники для анализа на наличие мутаций, в том числе, например, анализ достройки по одному основанию (SBE), секвенирование аллель-специфического удлинения праймера (ASPE), ДНК секвенирование, РНК секвенирование, анализ на основе микроматрицы, универсальная ПЦР, аллель-специфическое удлинение, гибридизация, масс-спектрометрия, сшивание, удлинение-сшивание, флэп-эндонуклеаза опосредованный анализ, полиморфизм длин рестрикционных фрагментов (RFLP), электрофорез, линейная последовательность, аллель-специфическая олинуклеотидная гибридизация (ASO) и случайно амплифицированная полиморфная ДНК (RAPD).
Таким образом, настоящее изобретение предполагает олигонуклеотиды (напр. праймеры), которые могут применяться для проведения различий между мутантной и немутантной формой MELO3C009603. Примерный набор праймеров описан в разделе Примеров - SEQ ID NOs: 3 и 4.
Настоящее изобретение предполагает как химический мутагенез, так и рекомбинантные способы для получения растения дыни по настоящему изобретению.
Таким образом, растения дыни по настоящему изобретению могут быть получены путем воздействия на растение дыни или ее часть химическим мутагеном. Примеры химических мутагенов включают, но не ограничиваются ими, азотистую кислоту, алкилирующее вещество, такое как этил метансульфонат (EMS), метил метан сульфонат (MMS), диэтилсульфат (DES), и аналоги основания, такие как 5-бром-дезоксиуридин (5BU). Примерный способ получения растения дыни по настоящему изобретению с применением химических мутагенов включает в себя замачивание семян дыни в течение 12 часов в воде с последующими дополнительными 12 часами в EMS (напр. 1%). Обработанные семена (M1) затем высаживают и самоопыляются для создания семейства M2.
Как упоминалось, растение дыни по настоящему изобретению может также быть получено с применением других способов, включая в себя, но не ограничиваясь ими, (а) делеции MELO3C009603 гена; (b) транскрипционной инактивации MELO3C009603 гена (с) антисмысловая РНК опосредованная инактивация транскриптов MELO3C009603 гена; (d) трансляционная инактивация транскриптов MELO3C009603 гена; и (е) геномное редактирование MELO3C009603 гена.
Таким образом, например, конструкторы ген нокин или ген нокаут, включая последовательности, гомологичные с MELO3C009603 геном, могут быть получены и применяться для вставки вспомогательной последовательности в кодирующую последовательность гена, кодирующего фермент, чтобы, таким образом, инактивировать данный ген.
Эти конструкции предпочтительно включают в себя маркеры позитивного и негативного отбора и поэтому могут применяться в отборе для явления гомологичной рекомбинации. Специалист в данной области техники может легко создать конструкцию нокин/нокаут, включая положительные и отрицательные гены селекции для эффективного отбора трансформированных растительных клеток, которые подверглись явлению гомологичной рекомбинации с конструкцией. Такие клетки могут затем вырасти в полноценные растения. Стандартные способы, известные из уровня техники, могут применяться для проведения нокин/нокаут процедуры. Такие способы изложены, например, в патентах США Nos. 5,487,992, 5,464,764, 5,387,742, 5,360,735, 5,347,075, 5,298,422, 5,288,846, 5,221,778, 5,175,385, 5,175,384, 5,175,383, 4,736,866 а также Burke и Olson, Methods in Enzymology, 194: 251-270, 1991; Capecchi, Science 244: 1288-1292, 1989; Davies et al., Nucleic Acids Research, 20 (11) 2693-2698, 1992; Dickinson et al., Human Molecular Genetics, 2 (8): 1299-1302, 1993; Duff и Lincoln, "Insertion of a pathogenic mutation into a yeast artificial chromosome containing the human APP gene and expression in ES cells", Research Advances in Alzheimer's Disease and Related Disorders, 1995; Huxley et al., Genomics, 9: 742-750 1991; Jakobovits et al., Nature, 362: 255-261 1993; Lamb et al., Nature Genetics, 5: 22-29, 1993; Pearson и Choi, Proc. Natl. Acad. Sci. USA, 1993, 90: 10578-82; Rothstein, Methods in Enzymology, 194: 281-301, 1991; Schedl et al., Nature, 362: 258-261, 1993; Strauss et al., Science, 259: 1904-1907, 1993, WO 94/23049, WO 93/14200, WO 94/06908 и WO 94/28123 также предоставляют информацию.
Таким образом, согласно конкретному варианту осуществления настоящего изобретения, растение дыни получено путем введения в него конструкции нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую полинуклеотидное вещество, которое активирует экспрессию MELO3C009603, имеющего мутацию, которая приводит к признаку повышенной урожайности (и необязательно бессемянному признаку) и действующий в цис-положении регулирующий элемент, способный направлять экспрессию полинуклеотидного вещества в растении.
Конструкции, применяемые в способах согласно настоящему изобретению, могут быть созданы с использованием технологии рекомбинантной ДНК, хорошо известной специалистам в данной области техники. Генетические конструкции могут быть введены в векторы, которые могут быть коммерчески доступны, пригодными для трансформирования в растения и подходящие для экспрессии интересующего гена в трансформированных клетках. Генетическая конструкция может быть экспрессионным вектором, в котором нуклеотидная последовательность функционально связана с одной или несколькими регуляторными последовательностями, обеспечивающего экспрессию в растительных клетках.
Полинуклеотид согласно данному аспекту настоящего изобретения может кодировать MELO3C009603, имеющего, например, F/I мутацию в положении 97. Полипептидная последовательность примерного MELO3C009603, имеющего F/I мутацию в положении 97, является, как правило, по меньшей мере, на 90% гомологичной, по меньшей мере, 91% гомологичной, по меньшей мере, 92% гомологичной, по меньшей мере, 93% гомологичной, по меньшей мере, 94% гомологичной, по меньшей мере, 95% гомологичной, по меньшей мере, 96% гомологичной, по меньшей мере, 97% гомологичной, по меньшей мере, 98% гомологичной, по меньшей мере, 99% гомологичной, или 100% гомологичной к последовательности, представленной в SEQ ID NO: 8. Нуклеотидная последовательность примерного полинуклеотида, который кодирует такой белок, может быть, по меньшей мере, на 90% гомологичной, по меньшей мере, 91% гомологичной, по меньшей мере, 92% гомологичной, по меньшей мере, 93% гомологичной, по меньшей мере, 94% гомологичной, по меньшей мере, 95% гомологичной, по меньшей мере, 96% гомологичной, по меньшей мере, 97% гомологичной, по меньшей мере, 98% гомологичной, по меньшей мере, 99% гомологичной, или 100% гомологичной к нуклеиновой последовательности, представленной в SEQ ID NO: 9.
В конкретной варианте осуществления настоящего изобретения регуляторная последовательность представляет собой промотер, экспрессируемый в растениях.
В контексте настоящего изобретения фраза "экспрессируемый в растениях" относится к промоторной последовательности, в том числе любого дополнительного регуляторного элемента, добавленного к нему или содержащегося в нем, по меньшей мере, способной индуцировать, обеспечивать, активировать или усиливать экспрессию в клетке, ткани или органе дыни.
Промотор может быть индуцибельный промотор, конститутивный промотор или ткань-ассоциированный промотор.
В контексте настоящего изобретения, термин "индуцибельный промотор" относится к любому промотору, активность которого зависит от конкретной окружающей среды или условий развития.
В контексте настоящего изобретения, термин "конститутивный промотор" относится к любому промотору, который управляет производством РНК во многих или всех тканях трансформированных растения в большинстве случаев.
В контексте настоящего изобретения, термин "ткань-ассоциированный промотор" относится к любому промотору, который управляет процессом синтеза РНК на высоких уровнях в конкретных типах клеток и тканей (напр., плод-ассоциированный промотор).
Примеры промоторов, которые могут применяться для экспрессии функционально связанной нуклеотидной последовательности (т.е. трансгена), включая промотор вируса мозаики цветной капусты, CaMV и промотор вируса табачной мозаики, TMV.
Другие промоторы, которые могут быть использованы в контексте настоящего изобретения, включают те, которые описаны в патенте США No. 20060168699 и by Hector G. Numez-Palenius et al. [Critical Reviews in Biotechnology, Volume 28, Issue 1 March 2008, pages 13-55], оба из которых включены в настоящее описание посредством ссылки.
Растительные клетки могут быть трансформированы устойчиво или временно с конструкциями нуклеиновых кислот по настоящему изобретению. В устойчивой трансформации молекула нуклеиновой кислоты по настоящему изобретению интегрирована в растительный геном и, в связи с этим, она представляет собой устойчивый и наследуемый признак. Во временной трансформации молекула нуклеиновой кислоты экспрессируется транформированной клеткой, но она не интегрирована в геном и, в связи с этим, она представляет собой временный признак.
Существуют различные способы введения чужеродных генов в оба однодольные и двудольные растения (Potrykus, I., Annu. Rev. Plant. Physiol., Plant. Mol. Biol. (1991) 42: 205-225; Shimamoto et al., Nature (1989) 338: 274-276).
Основные способы, вызывающие устойчивую интеграцию экзогенной ДНК в растительную геномную ДНК, включают в себя два основных подхода:
(i) Agrobacterium-опосредованный перенос генов: Klee et al. (1987) Annu. Rev. Plant Physiol. 38: 467-486; Klee and Rogers in Cell Culture and Somatic Cell Genetics of Plants, Vol. 6, Molecular Biology of Plant Nuclear Genes, eds. Schell, J., и Vasil, L.K., Academic Publishers, San Diego, Calif. (1989) p. 2-25; Gatenby, in Plant Biotechnology, eds. Kung, S. и Arntzen, C.J., Butterworth Publishers, Boston, Mass. (1989) p. 93-112.
(ii) прямое поглощение ДНК: Paszkowski et al., в Cell Culture and Somatic Cell Genetics of Plants, Vol. 6, Molecular Biology of Plant Nuclear Genes eds. Schell, J., и Vasil, L.K., Academic Publishers, San Diego, Calif. (1989) p. 52-68; включающее в себя способы для прямого поглощения ДНК в протопласты, Toriyama, К. et al. (1988) Bio/Technology 6: 1072-1074. Поглощение ДНК индуцировали при помощи короткого электрического шока растительных клеток: Zhang et al. Plant Cell Rep.(1988) 7: 379-384. Fromm et al. Nature (1986) 319: 791-793. Введение ДНК в растительные клетки или ткани DN при помощи бомбардировки микрочастицами, Klein et al. Bio/Technology (1988) 6: 559-563; McCabe et al. Bio/Technology (1988) 6: 923-926; Sanford, Physiol. Plant. (1990) 79: 206-209; путем применения систем микропипетирования: Neuhaus et al., Theor. Appl. Genet. (1987) 75: 30-36; Neuhaus and Spangenberg, Physiol. Plant. (1990) 79: 213-217; трансформация культур клеток, эмбрионов или костной ткани с применением нитей стекловолокна или карбида кремния, патент США No. 5,464,765 или с помощью прямой инкубации ДНК с зародышевой пыльцой, DeWet et al. in Experimental Manipulation of Ovule Tissue, eds. Chapman, G. P. and Mantell, S. H. and Daniels, W. Longman, London, (1985) p. 197-209; and Ohta, Proc. Natl. Acad. Sci. USA (1986) 83: 715-719.
Система Agrobacterium включает в себя применение плазмидных векторов, которые содержат определенные сегменты ДНК, интегрирующие в геномную ДНК растения. Способы инокуляции растительной ткани очень зависят от растительных видов и системы доставки Agrobacterium. Широко используемой методикой является способ листовой пластины, который может осуществляться с любым эксплантатом ткани, что обеспечивает хороший источник для инициации дифференциации всего растения. Horsch et al. in Plant Molecular Biology Manual A5, Kluwer Academic Publishers, Dordrecht (1988) p. 1-9. Дополнительный подход использует систему доставки Agrobacterium совместно с вакуумной инфильтрацией. Система Agrobacterium является особенно жизнеспособной в создании трансгенных двудольных растений.
Существуют различные способы прямого переноса ДНК в клетки растения. При электропорации протопласты подвергаются кратковременному воздействию сильного электрического поля. При микроинъекции, ДНК механически вводят напрямую в клетки, применяя очень маленькие микропипетки. При бомбардировки микрочастицами, ДНК адсорбируют на бомбардирующие микрочастицы, такие как кристаллы сульфата магния или вольфрамовые частицы, а бомбардирующие микрочастицы физически ускоряют в клетки и ткани растения.
После устойчивой трансформации проводят выращивание растения. Наиболее распространенный способ выращивание растения является посев семян. Однако, регенерация путем выращивания семян имеет недостаток, что в связи с гетерозиготностью наблюдается отсутствия единообразия в культуре, поскольку семена образуются растениями в соответствии с генетической изменчивостью, обусловленной законами Менделя. В основном, каждое семя генетически отличается, и каждое из них будет расти со своими собственными специфическими признаками. Таким образом, предпочтительно, чтобы трансформированное растение было получено таким, что восстановленное растение имело идентичные признаки и свойства родительского трансгенного растения. Таким образом, предпочтительно, что трансформированное растение будет восстановлено с помощью вегетативного размножения, которое обеспечивает быстрое, устойчивое размножение трансформированных растений.
Вегетативное размножение представляет собой процесс роста нового поколения растений из одного образца ткани, который был отделен от выбранного родительского растения или сорта. Этот процесс позволяет массовое размножение растений, имеющих предпочтительную тканевую экспрессию гибридного белка. Новое поколение растений, которые производят, являются генетически идентичными и имеют все свойства первичного растения. Вегетативное размножение позволяет массовое размножение качественного растительного материала за короткий период времени и предлагает быстрое размножение выбранных сортов с сохранением свойств первичного трансгенного или трансформированного растения. Преимуществом вегетативного размножения растений является скорость размножения растения и качество и единообразие производимых растений.
Вегетативное размножение представляет собой многоступенчатый способ, который требует изменений среды культивирования или условий роста между стадиями. Таким образом, процесс вегетативного размножения включает в себя четыре основных стадии: Стадия первая, начальное культивирование ткани; Стадия вторая, размножение тканевой культуры; Стадия третья, дифференциация и формирование растения; и Стадия четвертая, культивирование в теплице и укрепление. В течение первой стадии, начального культивирования ткани, создавали культуру ткани и подтверждали отсутствия контаминации. В течение второй стадии, начальную тканевую культуру размножали до тех пор, пока не получали достаточного количества образцов ткани для удовлетворения производственных задач. В течение третьей стадии, образцы ткани, выращенные во второй стадии, разделяли и выращивали в отдельные проростки. На четвертой стадии, трансформированные проростки переносили в теплицу для укрепления, где устойчивость растений к свету постепенно увеличивалась так, что их становилось возможно выращивать в естественной среде.
Несмотря на то, что устойчивая трансформация является в настоящее время предпочтительной, неустойчивая трансформация клеток листьев, меристемных клеток или целого растения также предусмотрена настоящим изобретением.
Неустойчивая трансформация может быть выполнена с помощью любого способа прямого переноса ДНК, описанных выше, или с помощью вирусного заражения с использованием модифицированных вирусов растений.
Вирусы, для которых показано, что они пригодны для трансформации растений-хозяев, включают в себя CaMV, TMV и BV. Трансформация растения с применением вирусов растений, описана в патенте США No. 4,855,237 (BGV), EP-A 67,553 (TMV), Japanese Published Application No. 63-14693 (TMV), EPA 194,809 (BV), EPA 278,667 (BV); и Gluzman, Y. et al., Communications in Molecular Biology: Viral Vectors, Cold Spring Harbor Laboratory, New York, pp. 172-189 (1988). Псевдовирусные частицы для применения в экспрессии чужеродной ДНК во многих хозяевах, в том числе растениях, описаны в WO 87/06261.
В контексте настоящего изобретения, термин "приблизительно" относится к ±10%.
Термины "содержит", "содержащий", "включает", "включающий", "имеющий" и их производные означают "включая, но не ограничивается ими ".
Термин "состоящий из" означает "включая и ограничиваясь ими".
Термин "состоящей в основном из" означает, что композиция, способ или структура может включать в себя дополнительные составные части, стадии и/или части, но только если дополнительные составные части, стадии и/или части не существенно изменяют основные и новые свойства заявленной композиции, способы или структуры.
В контексте настоящего изобретения, форма единственного числа включает формы множественного числа, если из контекста явно не следует иное. Например, термин "соединение" или "по меньшей мере одно соединение" может включать в себя множество соединений, включая их смеси.
В контексте настоящего изобретения термин "способ" относится к методам, средствам, техническим приемам и порядку действий для достижения данной задачи, включая, но не ограничиваясь ими, такие методы, средства технические приемы и порядок действий либо известные, или легко разрабатываемые из известных методов, средств, технических приемов и порядка действий специалистами в области химии, фармакологии, биологии, биохимии и медицины.
Следует принимать во внимание, что определенные признаки по настоящему изобретению, которые для ясности описаны в контексте отдельных вариантов осуществления настоящего изобретения, могут также применяться совместно с одним из вариантов осуществления настоящего изобретения. Наоборот, различные признаки по настоящему изобретению, которые для краткости описаны в контексте одного варианта осуществления настоящего изобретения, могут также применяться раздельно или в любой подходящей субкомбинации или в качестве подходящих в любом другом описанном варианте осуществления изобретения. Некоторые признаки, описанные в контексте различных вариантов осуществления настоящего изобретения, не должны рассматриваться как существенные признаки таких вариантов осуществления настоящего изобретения, если осуществление изобретения не эффективно без этих элементов.
Различные варианты осуществления и аспекты настоящего изобретения, как это описано выше, и как заявлено в разделе формулы настоящего изобретения ниже, нашли экспериментальное подтверждение в следующих примерах.
ПРИМЕРЫ
Обратимся к следующим примерам, которые вместе с приведенным выше описанием иллюстрируют некоторые варианты осуществления настоящего изобретения в неограничивающей форме.
Как правило, номенклатура в контексте данного изобретения и лабораторные методики, применяемые в настоящем изобретении, включают в себя молекулярные, биохимические, микробиологические методики и технологию рекомбинантной ДНК. Такие методики подробно описаны в литературе. Смотри, например, "Molecular Cloning: A laboratory Manual" Sambrook et al., (1989); "Current Protocols in Molecular Biology" Volumes I-III Ausubel, R.M., ed. (1994); Ausubel et al., "Current Protocols in Molecular Biology", John Wiley and Sons, Baltimore, Maryland (1989); Perbal, "A Practical Guide to Molecular Cloning", John Wiley & Sons, New York (1988); Watson et al., "Recombinant DNA", Scientific American Books, New York; Birren et al. (eds) "Genome Analysis: A Laboratory Manual Series", Vols. 1-4, Cold Spring Harbor Laboratory Press, New York (1998); методологии предложены в патентах США Nos. 4,666,828; 4,683,202; 4,801,531; 5,192,659 и 5,272,057; "Cell Biology: A Laboratory Handbook", Volumes I-III Cellis, J.E., ed. (1994); "Culture of Animal Cells - A Manual of Basic Technique" by Freshney, Wiley-Liss, N.Y. (1994), Third Edition; "Current Protocols in Immunology" Volumes I-III Coligan J.E., ed. (1994); Stites et al. (eds), "Basic and Clinical Immunology" (8th Edition), Appleton & Lange, Norwalk, CT (1994); Mishell and Shiigi (eds), "Selected Methods in Cellular Immunology", W.H. Freeman and Co., New York (1980); доступные иммунологические анализы широко описаны в патентной и научной литературе, смотри, например, патенты США Nos. 3,791,932; 3,839,153; 3,850,752; 3,850,578; 3,853,987; 3,867,517; 3,879,262; 3,901,654; 3,935,074; 3,984,533; 3,996,345; 4,034,074; 4,098,876; 4,879,219; 5,011,771 и 5,281,521; "Oligonucleotide Synthesis" Gait, М. J., ed. (1984); "Nucleic Acid Hybridization" Hames, B.D., and Higgins S.J., eds. (1985); "Transcription and Translation" Hames, B.D., and Higgins S.J., eds. (1984); "Animal Cell Culture" Freshney, R.I., ed. (1986); "Immobilized Cells and Enzymes" IRL Press, (1986); "A Practical Guide to Molecular Cloning" Perbal, В., (1984) and "Methods in Enzymology" Vol. 1-317, Academic Press; "PCR Protocols: A Guide To Methods And Applications", Academic Press, San Diego, CA (1990); Marshak et al., "Strategies for Protein Purification and Characterization - A Laboratory Course Manual" CSHL Press (1996); все из которых включены посредством ссылок в полном объеме в настоящее изобретение. Другие общие ссылки приводятся в настоящем изобретении. Процедуры в них, как полагают, хорошо известны из данного уровня техники и представлены для удобства читателя. Вся информация, содержащаяся в них, включена в настоящее изобретение посредством ссылки.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал
Семена 'CEZ', 'Charentais' типа дыни (Cucumis melo подвид melo Cantalupensis Group), подвергались EMS мутагенезу, M1 растения были самоопыляемыми, М2 семейства визуально фенотипичными, а мутантные линии были отобраны, как описано ранее (Tadmor et al., 2007). Растения выращивали в обычных условиях на природе и в теплице.
Анализ каратиноидов плодов
Были собраны пять зрелых плодов, очищали, нарезали и центральную часть разрезали на маленькие кубики и немедленно замораживали в жидком азоте. Замороженные образцы плодов измельчали до мелкого порошка с помощью А11 аналитической мельницы (Ika) в присутствии жидкого азота. Каротиноиды извлекали из 0.5 г основной паренхимы в смеси гексан : ацетон : этанол (50:25:25, об/об/об), как описано в Tadmor et al., (2005) и анализировали, идентифицировали и оценивали количественно с помощью ВЭЖХ аппарата Waters 2695 (Milford, MA), оборудованного детектором Waters 996 PDA и программным обеспечением Millennium (Waters), как описано ранее (Tadmor et al., 2000).
Выделение РНК
Выделение РНК для анализа секвенирования РНК проводили согласно с Portnoy et al 2011, как описано ниже. Дополнительное выделение РНК для полимеразной цепной реакции с обратной транскриптазой (RT-PCR) применяли тот же протокол, уменьшенный до 1/20, начиная с приблизительно 100 мг замороженной ткани в 1.5 мл пробирки.
Замороженную ткань кожуры плода (приблизительно 5 г 1.5 мм шириной кожуры плода) измельчали со ступкой и пестиком в жидком азоте. Измельченную ткань хорошо перемешивали с помощью вортекса в 50 мл пробирке с 10 мл буфера для экстракции, содержащем 0.2 М Tris-HCl (pH 9.0), 0.2 М этилендиаминтетрауксусной кислоты (EDTA), 0.4 М NaCl и 2% (масса/объем) SDS, и инкубировали при 65°C в течение 5 минут. Затем 30% (масса/объем) лоуроилсаркозин натрия добавляли до конечной концентрации 2% (об/об), и смесь перемешивали на вортексе и инкубировали при 65°C в течение от 2 до 3 минут. К раствору добавляли равные объемы фенола, перемешивали на вортексе и центрифугировали при 5000 g в течение 5 минут. Водную фазу переносили в новую 50 мл пробирку на льду, после трех раундов выделения хлороформ-изоамиловый спирт (24:1, об/об). Нуклеиновая кислота осаждалась с 1/10 объемами 3 М ацетата натрия (NaAc) (pH 5.3) и 2 объемами 95% (об/об) EtOH. Полученный в результате осадок нуклеиновой кислоты разводили в 10 мл 2 М LiCl при 4°C в течение ночи. Общую РНК осаждали с помощью центрифугирования при 15,000 g в течение 10 минут при 4°C и растворяли в 0.5 мл водного диэтилпилокарбоната (DEPC). После переосаждения с 1/10 объемами 3 М NaAc (pH 5.3) и 2 объемами 95% EtOH, осадок растворяли в 50 до 100 мкл водного DEPC. РНК затем обрабатывали с DNase I (Thermo scientific) согласно инструкции производителя. После реакции ДНКазы, образцы очищали с помощью экстракции хлороформ-изоамиловым спиртом, осаждали с 1/10 объемами 3 М NaAc и 2 объемами 95% EtOH, очищали с 70% EtOH, высушивали на воздухе в течение 5 минут и растворяли в воде. Качество РНК анализировали с помощью спектрофотометра ND-1000 (NanoDrop Technologies, Wilmington, DE), электрофореза в SB 1%-ном агарозном геле, и ПЦР с праймерами, фланкирующими интрон для проверки наличия контаминации ДНК на агарозном геле.
РНК листа выделяли с triReagent (Sigma), в соответствии с инструкциями производителя. DNasel (Thermo scientific) применяли согласно инструкциям протокола, и очищали с помощью добавления хлороформ-изоамилового спирта, осаждали с изопропанолом, промывали с 70% ЕtOН, оставляли в течение 5 минут, чтобы высохнуть на воздухе и растворяли в ddH2O. Концентрацию РНК определяли с помощью NanoDrop.
Секвенирование РНК
После обработки ДНКазой, образцы РНК проверяли на целостность на 1%-ом агарозном геле, проверяли на чистоту в NanoDrop (260/280 отношение в размере около 2, 260/230 в размере около 2.4), а также отсутствие контаминации ДНК определяли с помощью ПЦР анализа с EF1α-интрон праймерами.
F-AGGCTGATTGTGCTGTCCTT - SEQ ID NO: 1;
R-GATGGGAACGAAGGGAATTT - SEQ ID NO: 2.
Образцы, содержащие контаминацию ДНК, должны давать ампликоны 391 bp, в отличие от кДНК 303 bp, когда разгоняли на агарозном геле. Образцы, содержащие приблизительно 30 мкг РНК, осаждали с двумя объемами EtOH и 1/10 объема 3 М NaAc и хранили при (-20°C). Создание спираль-специфичных библиотек осуществляли с набором TruSec RNA Samp Prep Kit FC-121-1031 (Illumina Inc) согласно инструкции производителя. Двенадцать библиотек отправили на сухой лед для секвенирования с Illumina HiSeq2000. Каждая библиотека была отдельно снабжена штрих-кодом и все библиотеки секвенировали в одном треке секвенатора Illumina, получая в среднем 17×106 считываний 50 bp на библиотеку. Считывания Illumina были отсортированы в их библиотеки и удаляли штрих-коды. Неформатированные чтения были обрезаны для некачественных основания на концах при секвенирование РНК и чтения низкого качества были удалены при помощи FASTX-набора программ. В результате чтения высокого качества затем были сопоставлены с геномом дыни, применяя TopHat версию v2.0.10 (Kim et al., 2011) и подсчитывались с использованием программного пакета HTseq v0.5.3p3. Bioconductor DESeq (Anders, 2010) в R среде применяли для определения дифференциально экспрессируемых генов между 'sf' и образцами 'дикого типа'. Гены, показывающие FDR<0.05, рассматривались в качестве дифференциально экспрессируемых. Анализ SNP проводили с применением программы порядка определения вариантов GATK Unified Genotyper (версия 2.5-2) (DePristo et al., 2011) и фильтровали до достижения набора SNP высокой достоверности.
Полимеразная цепная реакция с обратной транскриптазой (RT-PCR)
1 мкг РНК применяли для синтеза кДНК с использованием 'Verso system' (Thermo Scientific) согласно инструкциям изготовителя. Реакцию осуществляли в Есо RT-PCR системе (Illumina). Каждый образец содержал: 1 мкл кДНК, 0.2 мкл каждого праймера (10 мМ), 5 мкл FastSYBR зеленый мастер-микс реакционной смеси (Applied Biosystems) и 3.6 мкл ddH2O. Прибор был запрограммирован согласно требованиям производителя фермента. Каждый анализ проводился относительно конститутивного гена ARP1, и анализировали в программном обеспечении Есо версии 4.
Выделение ДНК
Меристемы молодого растения (приблизительно 1 г) измельчали в жидком азоте со ступкой и пестиком. Экстрактный раствор ДНК получали путем смешивания буфера для экстракции (0.35 М сорбитол, 0.1 М Tris, 5 мМ EDTA, pH7, добавляли 0.02 М бисульфит натрия перед использованием): нуклеиновый лизирующий буфер (0.35 М сорбитол, 0.1 М Tris, 5 мМ EDTA, pH7, добавляли 2% СТАВ до использования): 5% саркозил, в соотношении 1:1:0.4. Все химические реактивы поставлялись Sigma. Раствор для экстракции ДНК инкубировали при 65°C. 600 мкл раствора для экстракции ДНК добавляли к 100 мкг ткани, взвешенной в 1.5 мл пробирке, перемешивали и инкубировали при 65°C в течение 10 минут. 600 мкл хлороформ : изоамилового спирта (соотношение 24:1) добавляли, перемешивали в течение 5 минут в 200RPM, центрифугировали при 15,000 g в течение 10 минут и супернатант удаляли в новую пробирку. Холодный изопропанол (2/3 объема супернатанта) добавляли, перемешивали, инкубировали в течение 30 минут всю ночь при (-20°C), центрифугировали при 20,000 g в течение 10 минут, жидкую фазу удаляли, осадок промывали с 70% EtOH, осаждали снова и EtOH удаляли, осадок высушивали на воздухе в течение 5 минут, растворяли с 50-200 мкл воды, добавляли 2 мкл РНКазы, образцы инкубировали при 37°C в течение 30 минут, центрифугировали при 15,000 g в течение 3 минут и супернатант удаляли в новую пробирку. Концентрацию и чистоту ДНК устанавливали на NanoDrop, целостность ДНК проверяли на 0.8%-ном агарозном геле.
РЕЗУЛЬТАТЫ
Определение супер-плодового растения
Проводили визуальное определение фенотипа 2,000 M2 семейств, полученных из семян, подвергавшихся мутагенезу, линии разведения 'CEZ'. Каждое M2 семейство было представлено в природных условиях 12 растениями. Одно семейство отделяли для уникального фенотипа; 3 из 12 растений, выращиваемых в природных условиях, несли более чем 15 плодов на растение (Фигуры 1 и 2) по сравнению с растениями дикого типа, которые несли в среднем 3 плода. Каждый мутантный плод весил в среднем 300 г, тогда как плод дикого типа весил приблизительно 900 г. Интересно, что мутантный плод был без семян или были очень маленькие пустые семена. Эта мутация называется в контексте настоящего изобретения как 'супер плодовое' (Фигура 3). Когда плод 'sf' растения разводили, плод оставался маленьким.
Наследование свойств супер плодового растения
Побег супер плодовых растений ('sf') переносили в теплицу как только они развили достаточно корни, 'sf' растения, произошедшие из побега, не могут быть самоопыляемыми. Однако их пыльца применяется для успешного опыления 'CEZ', 'Noy Yizre'el', 'Ein Dor'и 'Piel De Sapo' линий и получали жизнеспособные F1 семена. Эти семена были посажены и F1 растения были успешно самоопыляемыми с образованием F2 семян. 150-200 растений каждой из F2 популяций были посажены в природных условиях, позволяли им расти в соответствии с коммерческими условиями производства и перекрестноопылялись пчелами. После того, как получали плод авторы настоящего изобретения могли визуально проводить отличия между фенотипами 'sf' и дикого типа. Во всех четырех F2 популяциях 'sf' отделяли как единичный рецессивный ген (Таблица 1).

Для оценки выхода 'sf', авторы настоящего изобретения измеряли количество плодов и массу всех 'sf' растений, делили сумму плодов на количество растений для получения среднего количества плодов на растении, делили сумму веса плодов на количество растений для получения среднего выхода на растение и делили сумму веса плодов на количество растений для получения среднего веса плода. Подобные измерения и расчеты проводили для растений дикого типа. Во всех исследуемых генетический фон 'sf' содержал значительно больше плодов (Фигура 4А), значительно меньше плодов (Фигура 4В) и значительно больше урожая на растение (Фигура 4С).
Для определения влияния 'sf' на качество плода, авторы настоящего изобретения в случайном порядке отбирали 10 зрелых плодов CEZ и CEZx'sf' дикого типа и фенотипа сегрегантов 'sf'. Плод пробовали на вкус, анализировали на общее количество растворимых твердых веществ (TSS) как показателя содержания сахара, анализировали ВЭЖХ на содержание β-каротина. Не было обнаружено влияния 'sf' на аромат плода дыни, который в основном определялся содержание сахара. Разницы в качестве не было обнаружено между сегрегантами 'sf', дикого типам или 'CEZ', включая содержание TSS или β-каротина (Фигуры 5А-В).
Для установления гена, который определяет фенотип 'sf', два повтора из 10 растений, показывающих фенотип либо 'sf' или дикого типа в 'sf X NY и в 'sf' X ED выделенных F2 популяций, 'sf' фенотип от 'sf' X CEZ выделенной F2 популяции и 'sf' источник линии, CEZ были выбраны. Для каждого из этих растений меристемы побегов растений, стеблей, женских цветов и завязей плодов в возрасте 2-4 дней после опыления были отобраны. РНК выделяли из основного объема каждого сочетания ткани x фенотипа. Равные количества РНК из всех тканей были объединены для развития двух повторов фенотипов 'sf' и дикого типа 'sf' X NY и 'sf' X ED выделенных F2 популяций (восемь пулов), фенотип 'sf' от 'sf' X CEZ выделенной F2 популяции и 'sf' источника линии, CEZ (четыре пула). Двенадцать библиотек были анализированы секвенированием РНК с Illumina HiSeq 2000, получая в среднем 17X106 считываний для каждой библиотеки. Единичный нуклеотидный полиморфизм (SNP) устанавливали путем сравнения данный секвенирования РНК фенотипических пулов, полученных от 'sf' X NY и 'sf' X ED выделенных F2 популяций, были рассеяны вдоль генома дыни, однако большинство из них располагалось на каркасе 11. Авторы настоящего изобретения затем искали SNP, которые были гомозиготными в 'CEZ', несущие альтернативный аллель во всех 'sf' фенотипах' и несущие главным образом 'CEZ' аллель в фенотипах дикого типа. Единичный SNP в MELO3C009603, который расположен на каркасе 11 хромосомы 4, фиксировали во всех 'sf' материалах ('А') по сравнению с 'CEZ' ('Т') и был минорным аллелем во всех фенотипах 'дикого типа'.
Праймеры были разработаны так, что при ПЦР амплифицировался фрагмент длиной 213bр, который имел АроI сайт рестрикции в аллеле дикого типа, который мутировал в sf.
F TAGACATGAGCCGCATCTGA - SEQ ID NO: 3
R GAACGTGGCAACAACAACAA - SEQ ID NO: 4
Проведенное ApoI расщепление на фрагментах, амплифицированных ПЦР, приводило к 140bр и 73bр фрагментам у дикого типа, 213 bp фрагмент, когда расщепляли гомозиготный 'sf' мутант, и все три полосы в гетерозиготе (Фигура 6В). Этот маркер показывал полное совместно отделение с 'sf' фенотипом в четырех независимых F2 популяциях, состоящих из, по меньшей мере 300 растений каждая.
MELO3C009603 кодирует Cys2 His2 цинковый палец (ZF) белка. Трансверсия 'Т' на 'А' изменила ТТС, который кодирует высококонсервативный фенилаланин аминокислоты в положении 97 (F97), в АТС, который кодирует изолейцин (I) в ZF мотиве (Фигура 7).
Данные секвенирования РНК показали, что цифровая экспрессия MELO3C009603 является низкой, только 40-60 считывались на каждый объем, и похожие в обеих объемах. Эти объемы включали смесь нескольких тканей. Анализировали относительную экспрессию MELO3C009603 в каждой из этих тканей с применением количественной RTPCR и было установлено, что она имела похожую низкую экспрессию в листьях и похожую очень низкую экспрессию во всех других анализируемых тканях (Фигуры 8А-В).
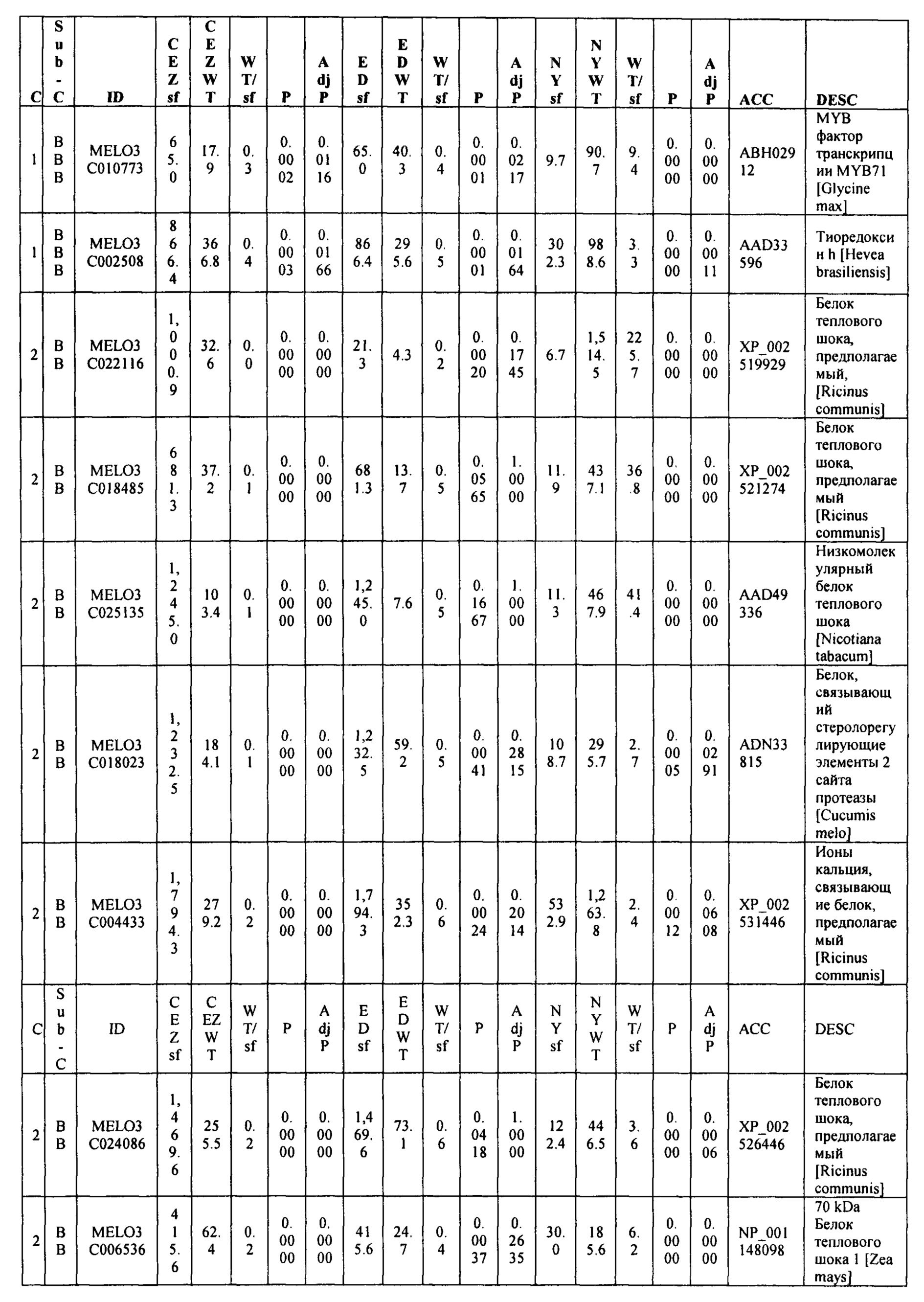
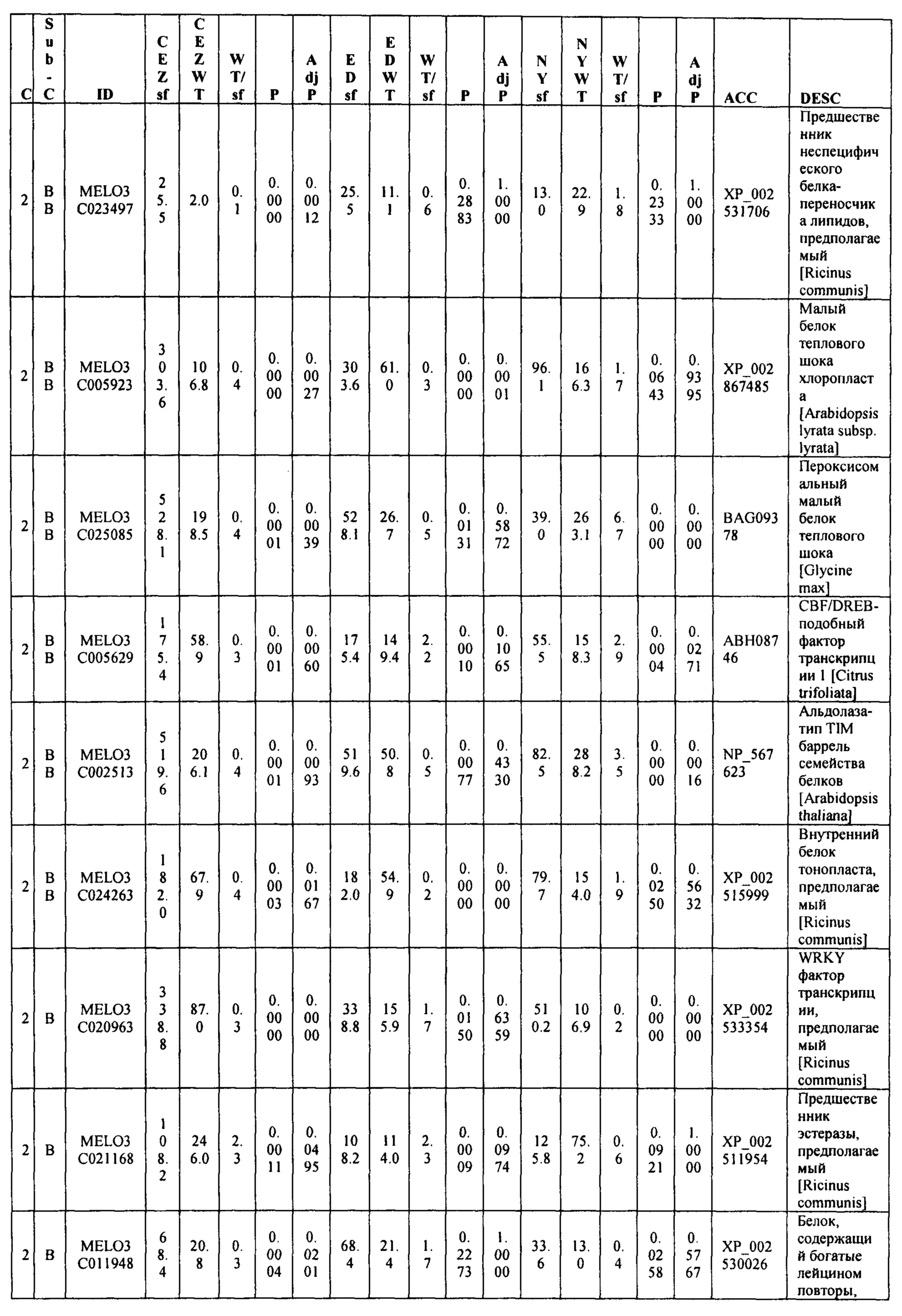
Данные секвенирования РНК для дифференциально экспрессирующих генов (DEG) установили 103 генов, которые показали более чем в два раза изменения между 'CEZ' и 'sf', изогенное сравнение. Только 55 генов, из этих 103, показали значительную разницу при использовании установленного значения P из этих 55 только 14 генов показали значительную разницу экспрессии между объемами 'sf' и 'дикого типа' во всех трех анализируемых выделенных популяциях (Фигура 9 и Таблица 2, ниже в настоящем изобретении). Из этих 14 генов только MELO3C021150, который кодирует гомолог нуцеллус-специфического белка семян, подавлены в 'sf' всех трех анализируемых популяции и MELO3C003230, который кодирует предполагаемого гомолога 5-ароматической ацилтрансферазы антоциана, были активированы в 'sf' анализируемых популяциях. Остальные двенадцать генов показали похожие направления изменения в 'CEZ x sf' и в 'ED x sf', но противоположное направление в 'NY x sf' F2 популяции (Таблица 2, ниже в настоящем изобретении). Количественный RT-PCR анализ MELO3C021150 различных органов показал, что цифровая экспрессия, найденная между объемами, внесена молодой тканью плодов и что MELO3C021150 не транскрибируется во всех других тканях (Фигура 10).





Несмотря на то, что настоящее изобретение было описано в связи с конкретными вариантами осуществления его, очевидно, что многие альтернативы, модификации и варианты будут очевидны для специалиста в данной области техники. Соответственно, предполагается охватить все такие альтернативы, модификации и варианты, которые, которые попадают в пределы сущности и широкий объем настоящего изобретения.
Все публикации, патенты и патентные заявки, упомянутые в описании настоящего изобретения, включены в своей полноте посредством ссылки в настоящее описание, в равной степени как если бы каждая отдельная публикация, патент или патентная заявка была конкретно и отдельно указана, что она включена в настоящее изобретение посредством ссылки. Кроме того, цитирование или идентификация любой ссылки в данной заявке не должно быть истолковано как признание того, что такая ссылка доступна в качестве в качестве предшествующего уровня техники для настоящего изобретения. В той степени, в которой используются заголовки разделов, они не должны быть истолкованы как обязательные ограничения.
ССЫЛКИ
Anders S (2010). Analysing RNA-Seq data with the DESeq package. Molecular biology, 1-17.
Cabezas JA, Cervera MT, Ruiz-Garcia L,

Cowan AK, Cripps RF, Richings EW, Taylor NJ (2001) Fruit size: towards an understanding of the metabolic control of fruit growth using avocado as a model system. Physiologia Plantarum, 111: 127-136.
Dathan N, Zaccaro L, Esposito S, Isernia C, Omichinski JG, Riccio A, … Pedone, P. V (2002).The Arabidopsis SUPERMAN protein is able to specifically bind DNA through its single Cys2-His2 zinc finger motif. Nucleic acids research, 30: 4945-4951
DePristo MA, Banks E, Poplin R, Garimella KV, Maguire JR, Hartl C, …& Daly MJ (2011) A framework for variation discovery and genotyping using next-generation DNA sequencing data. Nature genetics, 43 (5), 491-498.
Gidoni D, Carmi N (2007) Mutagenesis for seedlessness in Citrus. Israel J. Plant Sci. 55: 133-135.
Grumet R, Katzir N, Little HA, Portnoy V, Burger Y (2007) New insights into reproductive development in melon (Cucumis melo L.). Intl J Plant Developmental Biol: 253-264.
Jiang CJ, Aono M, Tamaoki M, Maeda S, Sugano S, Mori M, Takatsuji H (2008) SAZ, a new SUPERMAN-like protein, negatively regulates a subset of ABA-responsive genes in Arabidopsis. Molecular Genetics and Genomics, 279: 183-192.
Kim D, Pertea G, Trapnell C, Pimentel H, Kelley R, Salzberg SL (2013) TopHat2: accurate alignment of transcriptomes in the presence of insertions, deletions and gene fusions. Genome Biol, 14: R36.
Klug A (2010) The discovery of zinc fingers and their applications in gene regulation and genome manipulation. Annual review of biochemistry, 79: 213-231.
Klug A, Schwabe JW (1995) Protein motifs 5. Zinc fingers. The FASEB journal, 9: 597-604.
Lee MS, Gippert GP, Soman KV, CaseDA, Wright PE (1989) Three-dimensional solution structure of a single zinc finger DNA-binding domain. Science, 245: 635-637.
Liu QL, Xu KD, Ma N, Zhao LJ, Xi L (2014) Overexpression of a novel chrysanthemum SUPERMAN-like gene in tobacco affects lateral bud outgrowth and flower organ development. Plant Physiology and Biochemistry 77: 1-6.

Menda N, Semel Y, Peled D, Eshed Y, Zamir D (2004) In silico screening of a saturated mutation library of tomato. Plant J. 38: 861-872.
Papadopoulou E, Little HA, Hammar SA, Grumet R (2005) Effect of modified endogenous ethylene production on sex expression, bisexual flower development and fruit production in melon (Cucumis melo L.). Sexual plant reproduction, 18: 131-142.
Tadmor Y, Larkov O, Meir A, Minkoff M, Lastochkin E, Edelstein E, Levin S, Wong J, Rocheford T, and Lewinsohn E. (2000) Reversed-phase high performance liquid chromatographic determination of vitamin E components in maize kernels. Phytochem. Anal. 11: 370-374
Tadmor Y, King S, Levi A, Davis A, Meir A, Wasserman B, Hirschberg J, and Lewinsohn E. (2005) Comparative fruit colouration in watermelon and tomato. Food Res. Int. 38: 837-841.
Tadmor Y, Katzir N, Meir A, Yaniv-Yaakov A, Sa'ar U, Baumkoler F, Lavee T, Lewinsohn E, Schaffer AA, Burger J (2007) Induced mutagenesis to augment the natural genetic variability of melon (Cucumis melo L.). Israel J. Plant Sci. 55: 159-169.
Реферат
Изобретение относится к области биохимии, в частности к растению Cucumis melo, способному производить более чем 12 плодов, где указанные плоды являются бессемянными, к части вышеуказанного растения, а также к пищевому продукту, содержащему вышеуказанное растение или его часть. Также раскрыт способ маркер-вспомогательной селекции С. melo растения, способного производить более чем 5 бессемянных плодов. Изобретение позволяет эффективно получать растение Cucumis melo, способное производить более чем 12 плодов. 7 н. и 4 з.п. ф-лы, 11 ил., 2 табл.
Формула
Документы, цитированные в отчёте о поиске
Трансгенные растения с улучшенными характеристиками роста

Комментарии