Режим введения и составы для аденовирусов типа в - RU2671558C2
Код документа: RU2671558C2
Чертежи












































Описание
Настоящее описание относится к способу лечения пациента, например, с помощью способного реплицироваться онколитического аденовируса с использованием режима введения, разработанного таким образом, чтобы позволять вирусу оказывать требуемое терапевтическое действие и/или минимизировать нежелательные явления in vivo. Настоящее описание также распространяется на составы, описанные в данной заявке, способы получения указанных составов и их применение для лечения, в частности для лечения рака.
УРОВЕНЬ ТЕХНИКИ
Рак представляет собой тяжелую болезнь и основную причину смерти во всем мире. Существует более 200 различных типов рака, и тип лечения зависит от типа рака. Как правило, лечение будет включать хирургическое вмешательство, химиотерапию и/или радиотерапию. Данные способы лечения часто безуспешны или успешны лишь частично и оказывают значительные побочные действия. Уровни выживаемости за пятилетний период при раке могут находиться в диапазоне от менее 5% до более 95% в зависимости от типа рака (статистика CRUK, 2000-2001). Например, с 2005 по 2009 годы уровень выживаемости за пятилетний период пациентов с колоректальным раком, который составляет 13% от всех видов рака у мужчин и женщин в Великобритании, составил приблизительно 55% в Великобритании. Данное значение снижается до всего лишь 12% для пациентов с метастатическим колоректальным раком.
Тактика лечения метастатического рака преимущественно паллиативная и включает комбинацию паллиативного хирургического вмешательства, химиотерапии, радиации и поддерживающей терапии. Клинические результаты, такие как общая выживаемость, ответ на лечение и токсичность, имеют большое значение, но также важны и альтернативные результаты, такие как выживаемость без прогрессирования заболевания, качество жизни, удобство, переносимость и выбор пациентом. Очевидно, что необходимы новые способы лечения для того, чтобы улучшить данные результаты.
В процессе трансформации раковые клетки приобретают некоторые мутации, которые делают их более восприимчивыми к вирусной инфекции. Раковые клетки также вызывают подавление противоопухолевой активности хозяина. Изменения внутри опухолевых клеток и в локальном микроокружении вызывают потенциальную восприимчивость и оставляют опухоль незащищенной от инфицирования вирусами (Liu и др. 2007; Liu и др. 2008; Roberts, 2006).
Имеется продолжительный опыт применения вирусов для лечения рака, который начинался с невероятных сообщений о временной ремиссии рака после заражения природными вирусами или после вакцинаций вирусами. Наиболее раннее сообщение, вероятно, датируется 1912 г., в котором описана регрессия рака шейки матки у пациента, вакцинированного от бешенства. Аналогичные результаты наблюдали у раковых пациентов, прошедших вакцинации от вируса натуральной оспы, или после заражений природными вирусами, такими как свинка или корь. На основании данных сообщений, а также результатов исследований на животных, заражение пациентов живыми вирусами для лечения рака начали проводить в конце 1940-х - начале 1950-х.
Тем не менее, обычно результат состоял в том, что после случайной временной регрессии опухоли, опухоль заново вырастала и пациент умирал. Такие заражения изредка приводили к длительным полным ремиссиям. В 1957 г. д-р мед. наук Albert В. Sabin, который разработал живую пероральную вакцину от полиомиелита, прокомментировал: «Наиболее разочаровывающий аспект состоит в том факте, что даже если вирус онколитичен и пробивает дыру в опухоли, иммунный ответ индивида на этот вирус возникает настолько быстро, что его эффект быстро стирается и опухоль продолжает расти».
В настоящее время обнаружено множество онколитических вирусов, но единственным вирусом, который на данный момент одобрен для применения в клинической практике во всем мире, является Онкорин (Oncorine, H101), аденовирус подгруппы С, модифицированный путем делении Е1В с молекулярной массой 55 кДа, позволяющей осуществлять зависимую от условий репликацию в раковых клетках, лишенных р53 (H101 представляет собой близкий аналог ONYX015, описанный у Bischoff и др. 1996). Онкорин вводят путем внутриопухолевой инъекции при раке головы и шеи.
Талимоген лагерпарепвек (Talimogene laherparepvec, Tvec) представляет собой онколитический вирус, основанный на вирусе простого герпеса 1 типа, несущий делении ICP34.5 и ICP47, экспрессирующий US11 в качестве немедленно раннего гена и кодирующий GM-CSF. Исследование OPTiM представляет собой многонациональное открытое рандомизированное исследование, разработанное для того, чтобы оценить эффективность и безопасность лечения талимогеном лагерпарепвек, который вводят внутрь опухоли, по сравнению с подкожным введением GM-CSF, у пациентов с неоперабельной опухолью на стадии III (b-с) и стадии IV (М1а-с) заболевания. При промежуточном анализе талимоген лагерпарепвек вызывал устойчивый уровень положительного клинического ответа у 16% пациентов по сравнению с таковым у 2% пациентов, получающих GM-CSF.
Другие онколитические вирусы для внутриопухолевого введения, на данный момент находящиеся в разработке, включают (Sheridan 2013):
- Реолизин (Reolysin) - онколитический реовирус серотипа 3 (штамм Dearing);
- PV701 - онколитический вирус болезни Ньюкасла;
- CG0070 - аденовирус с зависимой от условий репликацией, кодирующий GM-CSF;
- Пексастимоген девацирепвек (Pexastimogene devacirepvec, Pexa-Vec, JX-594) - вирус коровьей оспы с удаленной тимидинкиназой, кодирующий GM-CSF;
- Каватак (Cavatak) - немодифицированный вирус Коксаки А21;
- Сепрегвир (Seprehvir, HSV1716) - вирус простого герпеса 1 типа с зависимой от условий репликацией, несущий делецию ICP34.5;
- DNX-2401 - аденовирус с зависимой от условий репликацией, кодирующий связывающийся с интегрином пептид;
- CGTG-102 -аденовирус с зависимой от условий репликацией, кодирующий GM-CSF.
ColoAd1 представляет собой химерный (Ad11/Ad3) аденовирус серогруппы В, который был разработан с применением процесса направленной эволюции, и его считают подходящим для лечения раков эпителиального происхождения и их метастатических форм, включая колоректальный рак (Kuhn, I и др. 2008).
На сегодняшний день в клинических испытаниях онколитических вирусов, главным образом, исследовали внутриопухолевую инъекцию вируса. В обзоре клинических исследований у Aghi и Martuza (2005) в 25 из 36 исследований применяли внутриопухолевую инъекцию для введения вируса. Тем не менее, данный способ практически осуществим лишь при лечении легкодоступных опухолей и при лечении пациентов, у которых структура опухоли, например, строма ткани и некротические области в ней, не ограничивает распространение вируса внутри опухоли (Ries и Korn 2002).
Смерть от рака часто происходит из-за недоступных опухолей или метастазов. Действие онколитических вирусов, введенных внутрь опухоли, основано на их распространении от опухоли по всему организму для достижения данных вторичных опухолей. Тем не менее, оказалось, что такое распространение является временным и часто неэффективным (Ferguson и др. 2012).
Таким образом, внутриопухолевая инъекция подходит лишь для ограниченного числа раков и не подходит для лечения, например, многих метастатических раков.
Когда использовали внутривенное введение онколитических вирусов, как правило, оно было связано с острой токсичностью и быстрым клиренсом. Например, в случае аденовируса Ad5 группы С, поглощение которого опосредуется широко распространенным Коксаки-аденовирусным рецептором (CAR), регулярно сообщается о побочных действиях, включающих острую печеночную токсичность, гриппоподобное заболевание и гематологические изменения, при этом также были хорошо описаны быстрый печеночный клиренс и иммунологическая нейтрализация.
Устоявшаяся на сегодняшний день точка зрения состоит в том, что необходимы повторные дозы для достижения и поддержания эффективности. Для всех исследуемых онколитических способов лечения рака, как правило, предусматривают, что лечение будет постоянным с введением повторных доз в течение многих недель, месяцев или лет. Например, в случае PV701 лечение по меньшей мере одного пациента продолжалось циклами в течение приблизительно 10 месяцев с перерывами в 6 дней между окончанием предыдущего цикла лечения и началом следующего цикла лечения.
Neumanatis и др. (2001) сообщали о проведении до 24 еженедельных циклов внутривенной инфузии ONYX-015 раковым пациентам. В фазе III продолжающегося клинического исследования (идентификационный номер на сайте Clinicaltrials.gov NCT01708993) Реолизин® (онколитический реовирус) вводили путем инфузии в течение одночасового периода в дни с 1 по 3, а затем каждые 3 недели до достижения прогресса. В фазе I клинического испытания (идентификационный номер на сайте Clinicaltrials.gov NCT01380600), о котором недавно сообщали, JX-594 вводили внутривенно раз в 2 недели, всего четыре раза, и во втором продолжающемся клиническом исследовании в фазе I/II (идентификационный номер на сайте Clinicaltrials.gov NCT01394939) JX-594 вводили внутривенно еженедельно в течение 5 недель, а затем проводили до 3 внутриопухолевых бустер-инъекций в печеночные метастазы пациентов с метастатическим колоректальным раком. В продолжающемся клиническом испытании OPTIM талимоген лагерпарепвек вводили внутрь опухоли раз в две недели в течение до 18 месяцев (идентификационный номер на сайте Clinicaltrials.gov NCT00769704).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В первом аспекте настоящего описания предложен способ лечения пациента-человека, включающий следующие этапы:
системное введение множества доз парентерального состава способного реплицироваться онколитического аденовируса подгруппы В, в рамках одного цикла лечения,
при этом суммарная доза, доставляемая при каждом введении, находится в диапазоне от 1×1010 до 1×1014 вирусных частиц на дозу, и
при этом каждую дозу вируса вводят таким образом, что скорость доставки вирусных частиц находится в диапазоне от 2×1010 частиц в минуту до 2×1012 частиц в минуту.
В независимом аспекте настоящее описание относится к ColoAd1 для применения для лечения рака яичников, например, к введению терапевтически эффективного количества ColoAd1 пациенту с раком яичников, например, используя режим введения, описанный в данной заявке.
В дополнительном независимом аспекте настоящее описание относится к комбинированной терапии, включающей онколитический аденовирус типа В, такой как ColoAd1, и химиотерапевтический агент, который не препятствует активности аденовируса, такой как репликация вируса in vivo.
В одном варианте реализации указанную комбинированную терапию применяют для лечения рака, в особенности, рака, описанного в данной заявке, в особенности, колоректального рака или рака яичников, включая их метастатические формы.
В одном варианте реализации дозы ColoAd1 в рамках комбинированной терапии вводят согласно режиму введения, описанному в данной заявке.
Также предложена парентеральный состав способного реплицироваться онколитического аденовируса подгруппы В для применения для лечения, описанного в данной заявке.
Настоящее описание также распространяется на применение парентерального состава способного реплицироваться онколитического аденовируса подгруппы В для получения лекарственного средства, описанного в данной заявке, и для применения в способах лечения, описанных в данной заявке.
В одном аспекте также предложена единичная доза в диапазоне от 1×1010 до 1×1014, такая как 6×1012 вирусных частиц способного реплицироваться онколитического аденовируса подгруппы В.
Также предложена скорость инфузии или инъекции для введения вирусных частиц от 2×109 до 2×1012 вирусных частиц (ВЧ) в минуту, например, 1,5×1011 ВЧ в минуту.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Фигура 1. Показан профиль цитотоксичности ColoAd1 для клеток А549 в присутствии свежей цельной крови человека.
Фигура 2. Биораспределение 1e11 (1×1011) частиц ColoAd1 у нормальных мышей BalbC через 24 часа после инъекции.
Фигура 3. Биораспределение ColoAd1 и ColoAd1CJ132 у трансгенных мышей CD46 через 1 час и 72 часа после инъекции.
Фигура 4. Кинетика клиренса ColoAd1 из основных органов: печени, селезенки и легких, - у экспрессирующих CD46 мышей, отслеживаемая в течение 65 дней.
Фигура 5. Кинетика ColoAd1 у мышей при одновременном введении либо без введения нейтрализующей сыворотки.
Фигура 6. Уровни цитокинов после первой и последующих равных терапевтических доз в доклиническом токсикологическом исследовании у мышей CD-1.
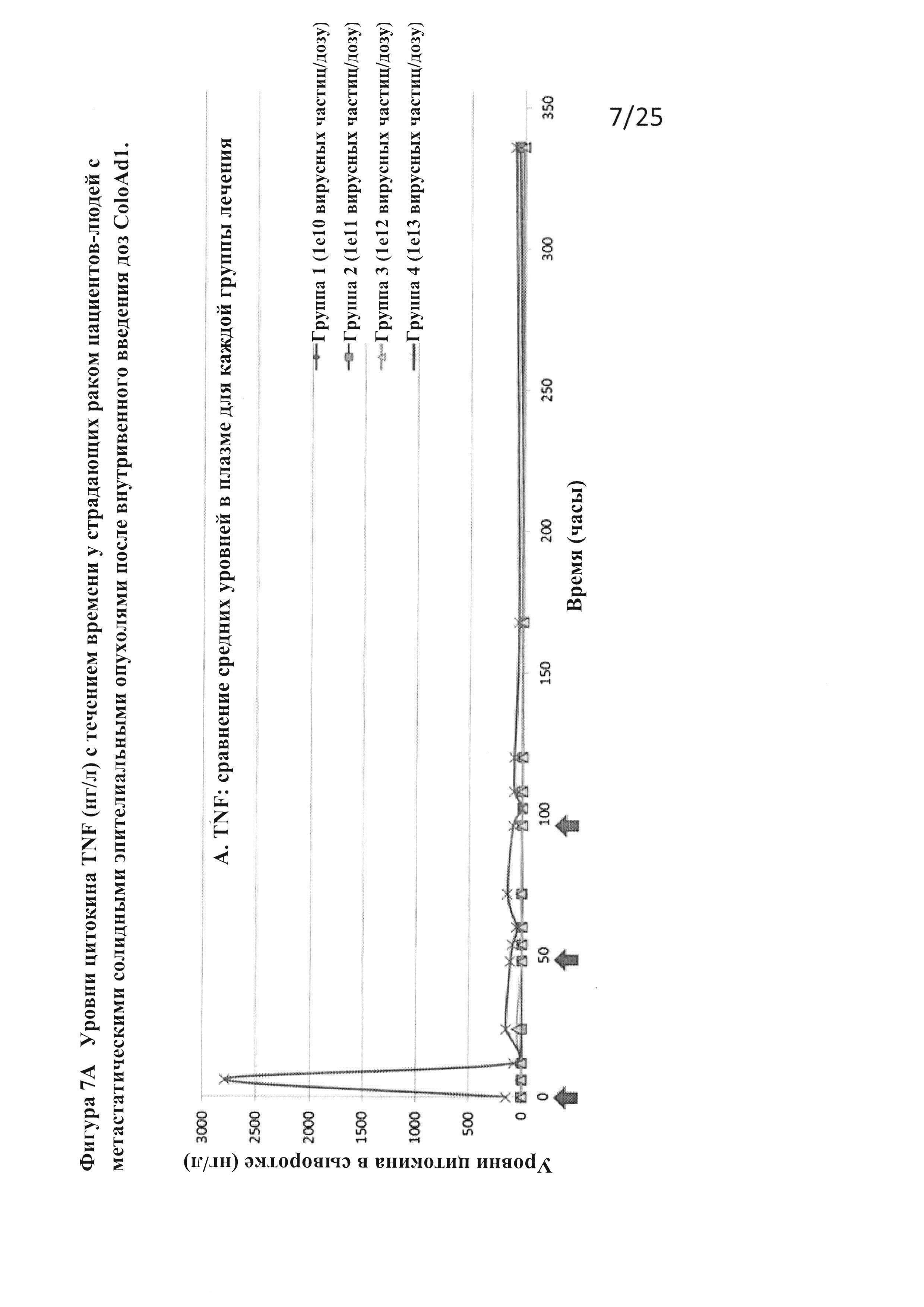
Фигуры 7А-С. Уровни цитокинов (нг/л) (TNF (А), интерферон-гамма (В) и IL6 (С)) с течением времени у страдающих раком пациентов-людей с метастатическими солидными эпителиальными опухолями после внутривенного введения доз ColoAd1.
Фигура 8А. Системная фармакокинетика ColoAd1 (копии генома на мл крови) у страдающих раком пациентов-людей с метастатическими солидными эпителиальными опухолями.
Фигура 8В. Системная фармакокинетика ColoAd1 (копии генома на мл крови) у страдающих раком пациентов-людей с метастатическими солидными эпителиальными опухолями.
Фигура 9А. Системная фармакокинетика ColoAd1 (копии генома на мл крови) у страдающих раком пациентов-людей, которым вводили 1e10 (1×1010) вирусных частиц ColoAd1 в течение 5 минут.
Фигура 9В. Системная фармакокинетика ColoAd1 (копии генома на мл крови) у страдающих раком пациентов-людей, которым вводили 1e11 (1×1011) вирусных частиц ColoAd1 в течение 5 минут.
Фигура 9С. Системная фармакокинетика ColoAd1 (копии генома на мл крови) у страдающих раком пациентов-людей, которым вводили 1е12 (1×1012) вирусных частиц ColoAd1 в течение 5 минут.
Фигура 9D. Системная фармакокинетика ColoAd1 (копии генома на мл крови) у страдающих раком пациентов-людей, которым вводили 1е13 (1×1013) вирусных частиц ColoAd1 в течение 5 минут.
Фигура 9Е. Системная фармакокинетика ColoAd1 (копии генома на мл крови) у страдающих раком пациентов-людей, которым вводили 3е12 (3×1012) вирусных частиц ColoAd1 в течение 5 минут.
Фигура 9F. Системная фармакокинетика ColoAd1 (копии генома на мл крови) у страдающих раком пациентов-людей, которым вводили 3е12 (3×1012) вирусных частиц ColoAd1 в течение 20 минут.
Фигура 9G. Системная фармакокинетика ColoAd1 (копии генома на мл крови) у страдающих раком пациентов-людей, которым вводили 6е12 (6×1012) вирусных частиц ColoAd1 в течение 40 минут.
Фигура 10. Более медленная инфузия такой же дозы уменьшает уровень Cmax по окончании инфузии (группа 5 по сравнению с 6).
Фигура 11. Уровни МСР1 (нг/л) с течением времени у страдающих раком пациентов-людей с метастатическими солидными эпителиальными опухолями после внутривенного введения доз ColoAd1.
Фигура 12. Схематическая диаграмма, на которой показан цикл репликации ColoAd1 в клетке.
Фигура 13. Инфицирование ColoAd1 раковых клеток, показанное как окрашивание ядер в линии колоректальных клеток после заражения вирусом in vitro.
Фигура 14А. Окрашивание ядер (окрашивание гексона) на ColoAd1 в колоректальной ткани из пациента с колоректальным раком после введения ColoAd1 путем внутриопухолевой инъекции.
Фигура 14В Изотипический контроль окрашивания для фигуры 14А. Фигура 14С В колоректальной ткани не выявили окрашивания ядер (окрашивания гексона) в стромальных клетках (после внутривенного (в/в) введения ColoAd1 пациенту с колоректальным раком).
Фигура 14D. Изотипический контроль для фигуры 14С.
Фигура 15. 320 соединений (клинически одобренных или находящихся в разработке соединений), влияние которых на репликацию вируса было проанализировано.
Фигуры 16A-D. Модель на мышах in vivo, показывающая влияние комбинированной терапии паклитакселом и ColoAd1 (и контроли).
Фигуры 17, 18. Результаты in vivo для ColoAd1 и химиотерапии в модели на мышах.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном варианте реализации введенная доза находится в диапазоне от 1×1010 до 1×1013, например, от 1×1010 до 1×1012 вирусных частиц.
В одном варианте реализации суммарная доза, введенная в рамках одного цикла лечения, составляет 1×1012, 2×1012, 3×1012, 4×1012, 5×1012, 6×1012, 7×1012, 8×1012 или 9×1012 вирусных частиц.
В одном варианте реализации суммарная доза, введенная в рамках одного цикла лечения, составляет 6×1012 вирусных частиц.
Авторы настоящего изобретения предположили, что решающее значение для эффективности может иметь установление продуктивной инфекции внутри опухоли на ранней стадии, например, до того, как разовьется противовирусный иммунный ответ.
Режим введения, таким образом, должен обеспечить баланс между доставкой достаточного количества вируса, чтобы получить, например, адекватные уровни вируса в плазме в течение периода времени, достаточного для того, чтобы обсеменить вирусной инфекцией раковые клетки, при этом не вызывая токсичности и тяжелых нежелательных явлений у пациента (или минимизируя их).
Авторы настоящего изобретения впервые показали, что инфицирование опухоли аденовирусом типа В можно осуществить путем внутривенного введения доз вирусных частиц. Подтверждение данного заключения приведено в данной заявке, когда показали, что у пациентов с колоректальным раком, которые получали лечение путем внутривенного введения ColoAd1, наблюдалась вирусная инфекция в ядрах раковых клеток после окрашивания указанных клеток на гексон, а также после независимого анализа с помощью ПЦР. Наличие вируса в ядре свидетельствует о том, что выполняется жизненный цикл вируса, и увеличение вирусной нагрузки у пациентов свидетельствует о том, что вирус способен реплицироваться.
При системном введении онколитического аденовируса пациенту необходимо учитывать множество изменяемых параметров введения доз. Данные изменяемые параметры введения доз включают, но не ограничены перечисленными: путь введения вируса; вводимую дозу вируса; скорость введения вируса для каждой дозы; промежуток времени между отдельными введениями вируса в данном цикле лечения; количество введений вируса на цикл лечения; промежуток времени между циклами лечения; количество циклов лечения; и, наконец, применение каких-либо сопутствующих лекарственных средств или другой поддерживающей терапии для повышения эффективности или минимизации нежелательных действий. Каждый из параметров введения доз, в свою очередь, зависит от конкретных свойств исследуемого типа онколитического вируса.
Ключевые параметры будут включать, но не ограничены перечисленными: относительную степень и авидность какого-либо связывания вируса с опухолевыми клетками по сравнению с неопухолевыми клетками; относительную селективность и эффективность вируса в опухолевых клетках по сравнению с неопухолевыми клетками; скорость активного поглощения и клиренс вируса ретикулоэндотелиальными клетками (например, купферовскими клетками печени) и какое-либо специфическое или неспецифическое связывание элементов крови с вирусом.
Данные ключевые параметры, в свою очередь, обусловлены важными физическими и фенотипическими свойствами конкретного типа вируса, которые включают но не ограничены перечисленными: специфичность вируса к рецептору; заряд, находящийся на оболочке вируса; наличие или отсутствие оболочки; размер вирусной частицы; иммуногенность вирусной частицы; воспалительный потенциал вирусной частицы; специфичность вируса к опухоли; скорость репликации вируса; и способность вируса к уничтожению клеток.
Следовательно, пригодность любого данного режима введения будет изменяться в зависимости от различных типов вируса, и наиболее подходящий режим может определяться типом вируса, который вводят. Например, у Zhang и др. (2012) описан химерный вирус Ad5-Ad48, созданный для того, чтобы уменьшить связывание гексона с фактором свертывания крови X, чтобы устранить разрушение в печени, повысить циркуляцию в кровотоке и уменьшить токсичность, при этом сохранив противоопухолевую активность. Аналогичным образом, у Shashkova и др. (2009) описаны значительные различия между серотипами 5, 6, 11 и 35 аденовируса человека дикого типа, когда их исследовали в качестве потенциальных противораковых агентов. Таким образом, предполагают, что поведение различных типов вируса будет существенно различаться при системном введении людям и, таким образом, оптимальную стратегию введения доз невозможно предсказать a priori без результатов экспериментов in vivo и, предпочтительно, без опорных результатов клинических исследований.
Режим введения доз, описанный в данной заявке, может быть особенно подходящим для достижения данной цели для аденовирусов группы В по сравнению, например, с современной практикой введения доз с более регулярными интервалами и длительного введения повторных доз.
Цель оптимизированного режима введения доз для любого данного онколитического аденовируса, таким образом, состояла в увеличении до максимума уровня доставки вируса в опухолевые клетки, при этом минимизируя индукцию как побочных действий (нежелательных явлений), так и противовирусного иммунитета, чтобы получить подходящий профиль риск/польза от лечения, при этом еще позволяя повторные введения вируса, если это необходимо для терапии. Оптимизированный режим введения доз, таким образом, будет отличаться для разных типов вируса и, в частности, для разных подтипов аденовируса вследствие различий в вирусной оболочке.
В известном уровне техники провели много работ, основанных на Ad5, который представляет собой аденовирус подгруппы С, инфекционная способность которого опосредуется Коксаки-аденовирусным рецептором. При системной доставке более 90% доставленной дозы поглощается печенью. Быстрая и существенная потеря в печени уменьшает поглощение вируса опухолями и снижает терапевтическую эффективность. Большая часть этой дозы поглощается продуцирующими цитокины клетками врожденного иммунного ответа, такими как купферовские клетки, которые представляют собой специализированные макрофаги, находящиеся в печени. Ad5 также проявляет печеночную токсичность и вызывает некроз и последующее уменьшение количества купферовских клеток.
Shoshkova и др. 2009 показали, что уменьшение количества купферовских клеток посредством Ad5 повышало уровни трансдукции гепатоцитов с помощью последующей доставки векторов Ad5, а также предположили, что механизмы, выявленные для Ad5, не обязательно подходят для аденовирусов из подгруппы В, например, Ad11 и Ad35. Описанные там результаты позволяют предположить, что аденовирусы подгруппы С взаимодействуют с купферовскими клетками аналогичным образом, тогда как аденовирусы подгруппы В либо недостаточно хорошо узнаются купферовскими клетками, либо не вызывают гибель данных клеток. В частности, Shoshkova предположила, что предварительное введение доз вирусов на основе Ad11 не приводит к такому же полезному эффекту на купферовские клетки, как Ad5. В данной статье пришли к заключению, что хотя может наблюдаться некоторое связывание с аденовирусами подгруппы В (включая Ad11), его вклад фактически минимален.
Без привязки к какой-либо конкретной теории авторы настоящего изобретения полагают, что, в противоположность предположениям известного уровня техники, продуцирующие цитокины клетки врожденного иммунного ответа, такие как купферовские клетки, могут играть роль в клиренсе аденовирусов подгруппы В.
Более того, связывание фактора свертывания крови X с гексоном Ad5 представляет собой механизм инфекции гепатоцитов, и данный механизм также может подходить для других аденовирусов in vivo (см., например, Molecular Therapy, том 17, номер 10, 1683-1691, октябрь 2009 г.), но, как правило, не является механизмом печеночного поглощения аденовирусов из подгруппы В.
Высокое доминирование серотипа Ad5 по всему миру (высокие титры нейтрализующего Ad5 антитела в популяциях человека) и некоторых других серотипов аденовируса вызывает значительное беспокойство относительно системного применения методов лечения на основе аденовируса с высоким доминированием серотипа, так как такие переносимые с кровью вирусы могут быть нейтрализованы предсуществующими антителами, Vogels и др. Journal of Virology, август 2003 г., том 77, номер 15, страницы 8263-8271.
Аденовирусам подгруппы В свойственны некоторые преимущества в данном отношении, состоящие в том, что для них выявили более низкое доминирование серотипа (Stone и др. Journal of Virology, 2005 г., том 79, номер 8, страницы 5090-5104) и более низкий воспалительный потенциал. Первоначальное введение доз, таким образом, может быть гораздо более эффективным, чем для Ad5, например. Тем не менее, способность уклониться от иммунной системы после системной доставки все еще может оказаться проблемой при повторном введении доз. Таким образом, даже при локальном подавлении иммунной системы раком, уклонение от иммунной системы все еще, вероятно, является наибольшим препятствием для длительного успеха терапии онколитическим вирусом на основе аденовирусов подгруппы В.
Результаты, полученные авторами настоящего изобретения, поддерживают точку зрения, состоящую в том, что терапевтическое действие онколитических аденовирусов подгруппы В, таким образом, можно улучшить и/или элиминирование или нейтрализацию аденовируса иммунной системой можно минимизировать путем применения подходящего режима введения.
В одном варианте реализации режимы введения, описанные в данной заявке, также могут минимизировать побочные эффекты, например, гриппоподобные симптомы и воспалительные ответы.
В одном варианте реализации способный реплицироваться аденовирус вводят повторно в условиях раннего «дозового окна» до того, как разовьется специфический противовирусный иммунный ответ, и более поздние дозовые окна можно снова использовать, когда специфический противовирусный иммунный ответ снова ослабеет. То есть, осуществляют несколько введений в течение короткого периода времени, после чего следует период времени до начала последующих циклов лечения.
Предпочтительно, при введении способного реплицироваться аденовируса таким способом, уровни вируса в крови достаточны для того, чтобы создать самоамплифицирующуюся инфекцию внутри опухоли (которая, как известно, выступает в роли иммуносупрессивной среды), тем самым потенциально позволяя избежать необходимости постоянных повторных введений онколитического вируса. Для того, чтобы создать самоамплифицирующуюся инфекцию внутри опухоли, целесообразно поддерживать уровень вируса в кровотоке пациентов выше эффективной инфицирующей концентрации в течение как можно дольшего времени, но не вызывая нежелательных явлений. Данная концепция сходна с определением терапевтического окна для вируса, т.е. диапазона доз или режимов введения, при котором терапевтическое действие оптимизировано и побочные действия минимизированы.
Этого можно добиться путем оптимизации как вводимой дозы, так и скорости инфузии вируса. В одном варианте реализации скорость инфузии вируса равна или больше, чем скорость клиренса вируса из организма.
Как только инфекция установилась внутри опухоли, вирус становится относительно защищенным от нейтрализующих антител и оказывается в потенциально благоприятной среде для репликации и для осуществления терапевтического действия без ограничивающей дозу токсичности.
Кроме того, авторы настоящего изобретения выдвинули гипотезу, состоящую в том, что пики концентрации вируса (Cmax) приводили к побочным эффектам, и что может быть желателен более плоский фармакологический профиль.
В одном варианте реализации Cmax поддерживают ниже конкретного значения, например, 3×108 копий ДНК на мл. Представляется, что уровень Cmax выше соответствующего порога с большей долей вероятности вызовет тяжелые нежелательные явления или токсичность у некоторых пациентов.
В одном варианте реализации скорость инфузии оказывает большее влияние, чем абсолютное количество введенного вируса.
На основании результатов, полученных в клинике, авторы настоящего изобретения также полагают, что вирус можно доставлять со скоростью выше скорости клиренса и до 1,5-2×1011 вирусных частиц в минуту в течение длительного периода времени, такого как до 72 часов или более (при этом суммарная доза доставленного вируса выше 6×1012 вирусных частиц), не вызывая тяжелых нежелательных явлений у пациента.
В одном варианте реализации Cmax вирусного генома в крови поддерживается на уровне менее чем 3×108 геномов на мл крови.
Авторы настоящего изобретения оценили исходную скорость клиренса вируса во множестве ситуаций и полагают, что оцененный период полураспределения находится в районе 18 минут.
Профилактическое применение противовоспалительных средств в процессе онколитической вирусной терапии противоречиво. С одной стороны, было выдвинуто предложение, что их применение может минимизировать нежелательные явления и, таким образом, улучшить переносимость онколитического вируса болезни Ньюкасла (Lorence и др. 2007). С другой стороны, были сообщения о том, что возникновение жара может быть связано с повышенной онколитической эффективностью аденовирусов (Yu и др. 2007).
Авторы настоящего изобретения обнаружили, что применение профилактических или терапевтических агентов (включая противовоспалительные средства, стероиды, противорвотные средства, противодиарейные средства или анальгетики), которые вводят во время данного цикла лечения, может улучшить переносимость данного режима, в частности, позволяя вводить большие дозы или с большей частотой.
В одном варианте реализации во время цикла лечения вводят стероиды.
Авторы настоящего изобретения, таким образом, выдвинули гипотезу о том, что шесть параметров, используемых либо отдельно, либо совместно, важны для достижения цели подходящей доставки онколитического аденовируса подгруппы В:
a) количество вирусных частиц, которые вводят с каждой дозой,
b) скорость, с которой вводят каждую дозу вируса (количество вирусных частиц, доставляемых в минуту),
c) количество отдельных доз вируса в цикле лечения,
d) промежуток времени между каждой отдельной дозой в течение циклов лечения,
e) применение профилактических противовоспалительных лекарственных средств во время цикла лечения, и
f) период времени между циклами лечения.
Данные параметры можно уравновесить друг с другом, т.е. можно дать повышенную дозу при более медленной скорости инфузии, чтобы компенсировать отрицательное влияние данного повышения.
Если доза слишком мала, то уровень вирусных частиц не достаточен для установления эффективной инфекции раковых клеток. Если скорость введения слишком низка, то вирусные частицы могут легко устраниться природными поглотителями вирусов (например, продуцирующими цитокины клетками врожденного иммунного ответа, такими как печеночные купферовские клетки или компоненты крови) и эффективная инфекция раковых/опухолевых клеток не будет достигнута. Если доза вируса слишком высока и/или если скорость введения слишком велика, то количество нежелательных явлений, вероятно, возрастет вследствие высокой концентрации вирусных частиц. Последняя затем вызовет ответ воспалительных цитокинов, который может увеличить побочные эффекты, которые испытывает пациент. Умеренная скорость инфузии, таким образом, может оптимизировать доставляемую дозу.
В среднем, скорость клиренса аденовирусов типа В, таких как ColoAd1, соответствует периоду полураспределения, приблизительно равному 18 минут.
Разовая доза вируса может оказаться не в состоянии сформировать инфекцию, но может в достаточной мере занять или исчерпать поглотителей вирусов (например, продуцирующих цитокины клеток врожденного иммунного ответа, таких как печеночные купферовские клетки или компоненты крови). Если поглотители вирусов были в достаточной мере заняты или исчерпаны и если последующие дозы вводят вскоре после этого, кинетика вируса может измениться для более поздних доз, при этом будут наблюдать большее время полувыведения из кровотока и/или более высокие пиковые уровни в плазме. В данном случае, одна или более доз, которые вводят вскоре после первой дозы, могут более эффективно сформировать эффективную инфекцию раковых клеток.
Тем не менее, если последующие дозы вводят слишком поздно (например, с интервалом более 14 дней), то у поглотителей вирусов может быть достаточно времени, чтобы восполниться, и польза от предшествующей дозы может быть утрачена, и/или может развиться специфический противовирусный иммунный ответ. Устранение, например, продуцирующих цитокины клеток врожденного иммунного ответа, таких как печеночные купферовские клетки, с помощью данной формы режима введения может принести значительную вторичную пользу, состоящую в том, что опосредованное купферовскими клетками высвобождение цитокинов на последующие дозы вируса можно сильно уменьшить, таким образом, что данные дозы лучше переносятся даже несмотря на более высокие уровни вируса в плазме.
Таким образом, авторы настоящего изобретения рекомендуют применение данного цикла лечения в течение относительно короткого периода времени, например, как описано ниже.
По результатам работы, выполненной авторами настоящего изобретения, представляется, что для аденовируса группы В множество доз в цикле лечения (при этом каждую дозу вводят в течение относительно короткого периода времени, при этом каждую дозу вводят в виде умеренно быстрой инфузии, возможно в комбинации с профилактическими агентами, и при этом между введением каждой дозы проходят относительно короткие периоды времени) подходит для инфицирования раковых клеток онколитическим аденовирусом типа В с минимальной токсичностью.
Циклы лечения можно повторять при необходимости.
Авторы настоящего изобретения отслеживали воспалительные цитокины TNF, интерферон-гамма, IL-6 и МСР-1 как маркеры острой токсичности и предположили, что после второй или последующих доз снижается токсичность и повышается потенциал инфицирования вирусом раковых клеток в каждом случае, так как нераковые поглотители вирусов либо удалены, либо заняты первой и второй дозами, при условии, что данные дозы вводили на подходящем уровне, при подходящей скорости и частоте введения доз.
В одном варианте реализации в цикле лечения применяют три дозы и в дополнительном варианте реализации в цикле лечения применяют более чем три дозы.
В одном варианте реализации дозу вводят в любой или в каждый из дней 1, 3, 5, 14 и 21.
В другом варианте реализации последующую дозу вводят в качестве поддерживающей или бустерной дозы, например, два раза в неделю, еженедельно, раз в две недели или раз в 3 недели, например, раз в неделю или раз в 3 недели, в течение подходящего периода, в частности, пока лечение полезно для пациента как поддерживающая терапия, например, пока пациент остается в ремиссии.
Для специалиста в данной области должно быть очевидно, что можно внести различные модификации в цикл лечения в зависимости от нужд конкретного пациента.
Настоящее описание также распространяется на способный реплицироваться онколитический аденовирус подгруппы В для применения для лечения пациента-человека путем системного введения по меньшей мере одной дозы, например, множества доз парентерального состава, содержащего аденовирус, в рамках одного цикла лечения, при этом суммарная доза, доставляемая при каждом введении, находится в диапазоне от 1×1010 до 7×1012, например, от 1×1010 до 5×1012 вирусных частиц, и ее вводят в течение периода от 1 минуты до 90 минут.
В дополнительном аспекте настоящее описание распространяется на применение способного реплицироваться онколитического аденовируса подгруппы В для получения лекарственного средства для применения для лечения пациента-человека путем системного введения по меньшей мере одной дозы, например, множества доз парентерального состава, содержащего аденовирус, в рамках одного цикла лечения, при этом суммарная доза, вводимая с каждой дозой, находится в диапазоне от 1×1010 до 1×1013, например, от 1×1010 до 7×1012, например, от 1×1010 до 5×1012 или 6×1012 вирусных частиц, и ее вводят в течение периода от 1 минуты до 90 минут.
В одном варианте реализации первая доза для лечения в данном цикле представляет собой более низкую дозу, чем следующие дозы, которые вводят в данном цикле.
Представляется, что в противоположность предположению Shoshkova, на основании работы на мышах выявили, что предварительное введение доз вирусов на основе Ad11 не вызывает полезного эффекта примирования продуцирующих цитокины клеток врожденного иммунного ответа, таких как купферовские клетки. Фактически, оптимизацию дозы и временных интервалов между введением доз онколитического аденовируса группы В можно использовать, чтобы минимизировать побочные действия и, следовательно, извлечь пользу.
В одном варианте реализации введенная доза составляет 6×1012, и ее вводят, например, в течение периода от 20 до 60 минут, например, в течение 40 минут.
В одном варианте реализации может быть желательно введение высокой первой и второй дозы (т.е. которая может соответствовать нормальной терапевтической дозе), чтобы полностью занять продуцирующие цитокины клетки врожденного иммунного ответа, такие как купферовские клетки (и/или другие поглотители вирусов) и, таким образом, оптимизировать доставку последующих доз. Иначе говоря, первая и вторая доза могут быть равны.
В одном варианте реализации все введенные дозы содержат равное количество вирусных частиц. Это может быть особенно полезно тем, что это упрощает производство вирусного состава, уменьшает риск ошибок при введении доз и фактически может обеспечить высокоэффективный режим лечения.
В одном варианте реализации предусмотрен дополнительный цикл лечения через промежуток времени от 1 месяца до 6 месяцев после завершения предыдущего цикла лечения, например, через 2, 3, 4, 5 месяцев после этого, чтобы позволить иммунному ответу ослабеть.
В одном варианте реализации дополнительные циклы могут представлять собой введение разовой дозы еженедельно или раз в две недели в течение периода времени от 1 месяца до 5 лет, например, в течение 6, 7, 8, 9, 10, 11, 12, 18, 24, 30 или 36 месяцев.
В одном варианте реализации дополнительный цикл лечения начинают в течение приблизительно 14 дней после введения последней дозы в первом цикле лечения.
Дополнительные циклы также могут выступать в роли поддерживающих доз, тем самым помогая поддерживать вирусную нагрузку на уровне, достаточном для осуществления терапевтического действия.
В одном варианте реализации проводят 1, 2, 3, 4, 5 или более последующих циклов лечения, например, 1 или 2.
В одном варианте реализации проводят только один цикл лечения без последующих циклов лечения.
В одном варианте реализации предложена жидкая парентеральный состав для инфузии или инъекции способного реплицироваться онколитического аденовируса подгруппы В (такого как ColoAd1), при этом указанный состав содержит дозу в диапазоне от 1×1010 до 1×1014 вирусных частиц на объем дозы, например, 6×1012 вирусных частиц на дозу.
Также раскрыт способ лечения пациента путем введения парентерального состава согласно настоящему описанию, содержащей способный реплицироваться онколитический аденовирус подгруппы В, например, содержащей дозу, описанную в данной заявке, такую как 6×1012 вирусных частиц на дозу.
Также раскрыт способ лечения пациента с помощью введенной парентерального состава согласно настоящему описанию, содержащей способный реплицироваться онколитический аденовирус подгруппы В, где указанный способ включает совместное введение пациенту одного или более веществ или лекарственных средств, выбранных из группы, включающей противовоспалительные средства, стероиды, противогистаминные средства, жаропонижающие лекарственные средства и жидкости для гидратации.
Также раскрыт способ определения момента, когда следует осуществлять последующие циклы введения субъекту парентерального состава согласно настоящему описанию, содержащей способный реплицироваться онколитический аденовирус подгруппы В, где указанный способ включает следующие этапы:
определение предсуществующего титра противовирусного иммунитета у конкретного пациента перед первым циклом лечения,
серийное измерение противовирусного иммунитета у конкретного пациента после указанного первого цикла лечения, и
отсрочку любых последующих циклов лечения до тех пор, пока у конкретного пациента не уменьшится противовирусный иммунитет до заранее определенного процента от исходного значения.
Термин «серийное измерение» в данной заявке относится к определению противовирусного иммунитета у пациента в несколько моментов времени, которые могут быть разделены регулярными или нерегулярными интервалами. Множество полученных значений можно применять, например, для вычисления среднего титра в течение конкретного периода времени.
Термин «заранее определенный процент от исходного значения» в данной заявке относится к титру вируса, который определяют как порог или предел для конкретного пациента, учитывающий такие факторы, как исходное значение, измеренное перед началом лечения, прогноз для данного пациента, продолжающаяся терапия рака, любые неблагоприятные побочные эффекты и т.д.
В одном варианте реализации «заранее определенный процент от исходного значения» составляет 90% или менее от исходного значения титра вируса для пациента, например, 80% или менее, 70% или менее, 60% или менее, 50% или менее, 40% или менее, 30% или менее, 20% или менее, или 10% или менее.
В альтернативном варианте реализации не проводят тестирования перед последующими циклами лечения.
В одном варианте реализации предложено применение стеклянного или пластикового шприца с внутренним объемом в диапазоне от 3 до 50 мл, указанный шприц содержит парентеральный состав, содержащий от 1×1010 до 1×1014, например, от 1×1010 до 7×1012 (например, от 1×1010 до 6×1012, или от 1×1010 до 5×1012, или от 1×1010 до 4×1012, или от 1×1010 до 3×1012, или от 1×1010 до 2×1012, или от 1×1010 до 1×1012) вирусных частиц способного реплицироваться онколитического аденовируса подгруппы В, при этом указанный состав стерильна и указанный шприц был ею наполнен при асептических условиях, для применения для лечения, в частности, для применения для получения лекарственного средства, которое можно вводить путем инъекции или внутривенной инфузии субъекту-человеку.
Для специалиста в данной области должно быть очевидно, что составы могут содержать избыток вирусных частиц, например, чтобы компенсировать вирусные частицы, которые могут прилипнуть к поверхности шприца и которые впоследствии не будут введены.
Предпочтительно, такой предварительно наполненный шприц будет значительно повышать практичность и экономическую эффективность получения онколитического аденовируса подгруппы В путем устранения необходимости приготовления дозы в специализированных аптеках с применением дорогостоящих ресурсов, таких как специализированное оборудование (включая вытяжные шкафы) и обученный персонал.
Настоящее описание также распространяется на предварительно наполненные флаконы, содержащие указанный состав, в частности, на флаконы, каждый из которых содержит разовую дозу в диапазоне, определенном в данной заявке.
В одном варианте реализации состав, содержащий вирус, предусмотрен в концентрированной форме, например, в виде концентрированной жидкости, подходящей для разбавления стерильным изотоническим разбавителем, таким как солевой раствор, глюкоза или аналогичный разбавитель, на месте перед введением пациенту.
Предпочтительно, режим введения, описанный в данной заявке, подходит для доставки терапевтически эффективного количества онколитического вируса подгруппы В в раковую мишень. В частности, режим введения, описанный в данной заявке, может минимизировать нейтрализацию и/или клиренс онколитического вируса, например, посредством переносимых с кровью агентов, поглотителей, продуцирующих цитокины клеток врожденного иммунного ответа, таких как купферовские клетки, и иммунной системы. Последнее может приводить к улучшению доступности терапевтической дозы онколитического вируса и, в целом, к улучшению прогноза для пациента и/или к улучшению выживаемости. Предпочтительно, схема приема согласно настоящему изобретению также может обеспечить улучшение качества жизни пациентов путем минимизации нежелательных явлений и/или побочных действий во время лечения.
В одном варианте реализации пациент, который получает лечение согласно настоящему описанию, проявляет повышенный уровень выживаемости по сравнению с пациентом, получающим современный стандарт лечения на момент подачи заявки, например, статистически значимое увеличение выживаемости.
В одном варианте реализации у пациента, который получает лечение согласно настоящему описанию, наблюдается уменьшение опухолевой массы по сравнению со стандартом лечения на момент подачи заявки, например, статистически значимое уменьшение.
В одном варианте реализации у пациента, который получает лечение согласно настоящему описанию, наблюдается повышенная вероятность вступления в ремиссию по сравнению со стандартом лечения на момент подачи заявки, например, статистически значимое повышение.
В одном варианте реализации количество или распространение метастаз уменьшается, например, статистически значительно уменьшается, у пациента, который получает лечение согласно настоящему описанию по сравнению со стандартом лечения на момент подачи заявки.
Без привязки к какой-либо конкретной теории полагают, что клетки системы мононуклеарных фагоцитов и, в частности, продуцирующие цитокины клетки врожденного иммунного ответа, такие как купферовские клетки, могут отвечать за клиренс онколитических вирусов типа В из кровотока, даже несмотря на то, что в известном уровне техники предполагают противоположное.
Более того, исследования на мышах, осуществленные авторами настоящего изобретения, привели их к предположению, что после первой или второй дозы в схеме лечения продуцирующие цитокины клетки врожденного иммунного ответа, такие как купферовские клетки, исчерпаны или заняты таким образом, что они неспособны эффективно устранять, например, третью дозу и последующие дозы, если такие дозы вводят в течение короткого периода времени после второй дозы, или, в качестве альтернативы, может наблюдаться более низкая токсичность или и то, и другое. Выдвинули гипотезу, что на последнее указывают цитокиновые маркеры, поскольку уровни цитокинов значительно не повышаются после введения второй или третьей дозы по сравнению с первой дозой в том случае, если дозы вводят в течение относительно короткого периода времени. Авторы настоящего изобретения рассматривают это как признак того, что механизмы клиренса вируса могут ослабеть после первой и второй дозы.
Хотя исследования на мышах не всегда соответствуют тому, что наблюдают в системе человека, особенно при исследовании вирусов, в данном случае наблюдения у человека, похоже, хорошо коррелируют с таковыми для модели на мышах, осуществленными авторами настоящего изобретения. Авторы настоящего изобретения также пояснили примером влияние режима введения на цитокиновые ответы и фармакокинетику ColoAd1 у людей.
В данной заявке предполагают, что «способ лечения пациента путем системного введения» относится к способу введения терапевтического агента человеку, чтобы повлиять на проникновение частицы в систему кровообращения пациента, в частности, когда лечение предназначается для предотвращения или замедления прогрессирования, снижения выраженности или излечения от злокачественного новообразования, такого как рак, или осложнений или симптомов, связанных с ним, например, непосредственного введения в систему кровообращения посредством внутривенного введения.
В одном варианте реализации системная доставка дает возможность лечить первичную опухоль, любые очевидные, недоступные или невыявленные опухоли и/или метастазы. Это дает особые преимущества, так как может приводить к лучшему общему прогнозу для пациента и/или лучшей выживаемости.
Таким образом, системная доставка, используемая в данной заявке, не относится к лечению, которое локализовано в опухоли или внутри некоторой полости тела, такой как перитонеальная полость. Примеры системной доставки включают внутривенную инфузию и внутримышечную и подкожную инъекцию.
Парентеральный состав означает состав, разработанный для доставки не через желудочно-кишечный тракт и не путем топического введения. Обычные пути парентеральной доставки включают инъекцию, имплантацию или инфузию. В одном варианте реализации состав предусмотрен в форме для болюсной доставки.
В одном варианте реализации парентеральный состав находится в форме для инъекции. Инъекция включает внутривенную, подкожную, внутриопухолевую или внутримышечную инъекцию. Термин «инъекция», используемый в данной заявке, означает введение жидкости в организм посредством шприца. В одном варианте реализации способ согласно настоящему описанию не включает внутриопухолевую инъекцию. Инъекция, как правило, будет включать введение 150 мл жидкости или менее в течение короткого периода времени, например, 1,5 минут или менее.
В одном варианте реализации состав доставляют в перитонеальную полость.
При раке головы и шеи или метастазах эпителиальных раков в головной мозг может потребоваться интракраниальная инъекция.
В одном варианте реализации парентеральный состав находится в форме для инфузии.
Термин «инфузия», используемый в данной заявке, означает введение жидкости при меньшей скорости с помощью капельницы, инфузионного насоса, шприцевого насоса или эквивалентного устройства. В одном варианте реализации инфузию осуществляют в течение периода времени в диапазоне от 1,5 минут до 90 минут, например, в течение 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 или 60 минут.
В одном варианте реализации вводимый объем состава составляет 100 мл или менее, в частности, 50 мл или менее, Например, 30 мл, 10 мл, 5 мл или менее, например, 3 мл, и его вводят, например, с помощью шприцевого насоса. Последний из упомянутых вариантов можно назвать медленной инъекцией.
В одном варианте реализации инфузию осуществляют со скоростью в диапазоне от 0,5 до 6 мл в минуту, например, 0,75 мл в минуту.
В одном варианте реализации инфузию осуществляют со скоростью в диапазоне от 2×109 до 2×1012 вирусных частиц (ВЧ) в минуту, например, 1,5×1011 ВЧ в минуту.
В одном варианте реализации инъекцию осуществляют в виде медленной инъекции, например, в течение периода от 1,5 до 30 или 1,5 до 40 минут.
В одном варианте реализации состав предназначен для внутривенного введения. Данный путь особенно эффективен для доставки онколитического вируса, так как он обеспечивает возможность быстрого доступа к большинству органов и тканей и особенно полезен для лечения метастаз, например, сформированных метастаз, особенно расположенных в высоко васкуляризированных областях, таких как печень и легкие.
В одном варианте реализации используют комбинацию способов введения, например, в/в и внутрь опухоли, или интраперитонеально и внутрь опухоли, или в/в и интраперитонеально.
Таким образом, в одном варианте реализации системное введение согласно настоящему описанию можно применять в комбинации с другими путями введения, такими как внутриопухолевое введение, либо одновременно, либо последовательно, например, первый цикл перед началом лечения может быть внутриопухолевым и второй цикл лечения может быть системным согласно настоящему описанию. В качестве альтернативы, первый цикл лечения может быть согласно настоящему описанию и последующие циклы или бустер-инъекции могут быть внутриопухолевыми, при необходимости. Составы, как правило, будут стерильны и стабильны при условиях производства и хранения. Композиция может находиться в виде раствора, микроэмульсии, липосомы или другой парентерального состава, подходящей для введения человеку, и может находиться в предварительно наполненном устройстве, таком как шприц или флакон, в частности, в виде разовой дозы.
В одном варианте реализации в цикле лечения используют 2 или более доз, например, в каждом цикле лечения используют 2, 3, 4, 5 или 6 доз, которые, например, могут быть представлены в виде набора.
Каждая доза, введенная в данном цикле лечения, в данной заявке может быть названа лечением.
В одном варианте реализации используют более низкую первую дозу по сравнению с последующими дозами, введенными в данном цикле, например, более низкая доза может находиться в диапазоне от 30 до 95% от последующей дозы или доз, например, 50, 60, 70 или 80%.
В одном варианте реализации используют более высокую первую дозу по сравнению с последующими дозами, введенными в данном цикле, которая может быть желательна, чтобы полностью занять продуцирующие цитокины клетки врожденного иммунного ответа, такие как купферовские клетки, и, таким образом, оптимизировать доставку последующих доз.
Более высокая доза означает более чем 100% от последующей дозы, например, от 105 до 150% от последующей дозы, например, 110%, 115%, 120%, 125%, 130%, 135%, 140% или 145% от последующей дозы.
В одном варианте реализации 1, 2, 3 или все введенные дозы содержат равное количество вирусных частиц. Это может быть особенно предпочтительным, так как упрощается производство состава с вирусом и, в действительности, можно обеспечить высоко эффективный режим лечения.
В одном варианте реализации «одинаковую дозу», т.е. одинаковое количество вирусных частиц, вводят в одной или более дозах, например, во всех дозах в цикле лечения, тем не менее, указанные дозы можно вводить при различных скоростях, например, описанных в данной заявке.
Цикл лечения в данной заявке представляет собой период лечения между периодами отдыха в курсе лечения, повторяемый в соответствии с расписанием, с периодами отдыха между циклами лечения. Цикл лечения, как правило, относится к нескольким (т.е. по меньшей мере двум) введениям, осуществляемым в рамках программы или расписания лечения, которые осуществляют в течение относительно короткого периода времени, например, приблизительно от 1 до 4 недель, например, в течение 3 недель, 2 недель или 1 недели. Как правило, данный цикл лечения будет частью более длительного режима лечения.
В одном варианте реализации цикл лечения представляет собой период, равный 14 дням или менее, например, 10, 9, 8, 7 или 5 дням, например, 7 или 5 дням.
В одном варианте реализации каждую дополнительную дозу или дозы вводят с интервалами, приблизительно равными 48 часам, такими как от 40 до 56 часов каждый. Это дает преимущество, поскольку позволяет осуществлять введение доз в течение обычной рабочей недели или в рамках амбулаторных учреждений.
В одном варианте реализации первую дозу вводят в день 1 и дополнительные терапевтические дозы вводят каждый второй день после этого, например, в дни 1, 3, 5, 7, 9, 11 и 13, или через каждые приблизительно 48 часов после этого, например, через каждые 40-56 часов.
В одном варианте реализации уровни вируса в плазме у пациента после введения дозы (например, второй или последующей дозы) составляют по меньшей мере 2×106 вирусных частиц на мл, например, в течение периода времени, равного 15 минутам или более, например, 20, 30, 40, 50, 60 минутам или более.
Исследования in vitro, проведенные авторами настоящего изобретения (см. фигуру 1), позволяют предположить, что для вирусных частиц в цельной крови человека при 37°С уничтожение снижается до уровня ниже 50% при дозе <2×106 частиц/мл. Более того, авторы настоящего изобретения смогли показать присутствие живых вирусных частиц в крови пациента, применяя анализы бляшек, когда уровни вирусного генома были выше, например, 1,6е6-1е8, и их можно было стабильно обнаружить.
В одном варианте реализации между циклами лечения проходит по меньшей мере 14 дней.
Состав, как правило, будет содержать фармацевтически приемлемый разбавитель или носитель, например, нетоксичный изотонический носитель, который совместим с вирусом и в котором вирус стабилен в течение необходимого периода времени.
Указанный носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль, и тому подобное), и подходящие их смеси. Подходящую текучесть можно поддерживать, например, применяя диспергирующее вещество или поверхностно-активное вещество, такое как лецитин, или неионное поверхностно-активное вещество, такое как полисорбат 80 или 40. В дисперсиях поддержанию необходимого размера частиц можно содействовать путем добавления поверхностно-активного вещества. Примеры изотонических агентов включают сахара, полиспирты, такие как маннит, сорбит или хлорид натрия в композиции.
В одном варианте реализации применяют стерильный изотонический разбавитель, такой как солевой раствор или глюкоза (например, 5% глюкоза).
В одном варианте реализации парентеральные составы, применяемые в данном способе, могут содержать один или более из следующих компонентов: буфер, например, 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту, фосфатный буфер и/или Трис-буфер, сахар, например, декстрозу, маннозу, сахарозу или аналогичный сахар, соль, такую как хлорид натрия, хлорид магния или хлорид калия, детергент, такой как неионное поверхностно-активное вещество, такое как BRIJ®, PS-80, PS-40 или аналогичное вещество. Состав также может содержать консервант, такой как ЭДТА или этанол, или комбинация ЭДТА и этанола, которые, как считают, предотвращают один или более возможных путей деградации.
В одном варианте реализации состав будет содержать очищенный онколитический вирус, например, от 1×1010 до 1×1014 вирусных частиц на дозу, например, от 1×1010 до 7×1012 вирусных частиц на дозу, в частности, от 1×1010 до 1×1012 вирусных частиц на дозу, включая избыток, при необходимости.
В одном варианте реализации состав согласно настоящему описанию содержит 6×1012 вирусных частиц.
В одном варианте реализации концентрация вируса в составе находится в диапазоне от 2×108 до 2×1014 ВЧ/мл, например, составляет 2×1012 ВЧ/мл.
В одном варианте реализации парентеральный состав содержит глицерин.
В одном варианте реализации состав содержит онколитический аденовирус подгруппы В, HEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновую кислоту), глицерин и буфер.
В одном варианте реализации парентеральный состав состоит из вируса, HEPES, например, 5 мМ, глицерина, например, 5-20% (в объемном отношении), соляной кислоты, например, для подведения рН до диапазона 7-8, и воды для инъекции.
В одном варианте реализации 0,7 мл ColoAd1 при концентрации 2×1012 ВЧ/мл входит в состав в 5 мМ HEPES, 20% глицерине, при конечном рН 7,8.
Пролонгированной абсорбции инъецируемых композиций можно добиться путем включения в состав композиции агента, который замедляет абсорбцию, например, солей моностеарата и желатина.
Таким образом, онколитические аденовирусы, используемые в данной заявке, можно вводить в составе с замедленным высвобождением, например, в композиции, которая содержит полимер, замедляющий высвобождение. Онколитический аденовирус может быть приготовлен совместно с носителями, которые будут защищать его от нейтрализации и/или предотвращать быстрое высвобождение, например в виде состава с контролируемым высвобождением, такого как имплантаты и микроинкапсулированные системы доставки.
Можно применять биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры, полимолочная кислота и сополимеры полимолочной и полигликолевой кислот (PLG). Также можно применять биосовместимые неразлагаемые полимеры, такие как полиэтиленгликоль и поли(N-(2-гидроксипропил)метакриламид). Множество способов получения таких составов известно специалистам в данной области.
Стерильные инъецируемые растворы можно получить путем включения онколитического аденовируса в требуемом количестве в подходящий растворитель, например, с одним ингредиентом или с комбинацией ингредиентов, описанных в данной заявке, соответственно, а затем стерилизации фильтрованием. Как правило, дисперсии получают путем добавления онколитического аденовируса в стерильную среду, которая содержит основную дисперсионную среду и другие необходимые ингредиенты.
Как правило, парентеральный состав согласно настоящему описанию представляет собой стерильный жидкий состав, такой как водный состав, по существу свободный от твердых частиц, например, полученный асептическим путем и стерилизованный путем пропускания через фильтр с диаметром пор 0,2 микрона.
В одном варианте реализации парентеральный состав вводят, чтобы минимизировать контакт состава с эпидермисом пациента, например, применяя иглу в защитном кожухе или посредством катетера. Считают, что такая предосторожность минимизирует иммунный ответ пациента на онколитический вирус, например, путем минимизации контакта с клетками Лангерганса в коже.
Термин «способный реплицироваться», используемый в данной заявке, описывает вирус, который может реплицироваться в клетке-хозяине. В одном варианте реализации в объем термина «способный реплицироваться» входят «репликационно-компетентные» и «репликационно-селективные» вирусы.
Предполагают, что термин «репликационно-компетентный», используемый в данной заявке, описывает онколитический аденовирус, который способен реплицироваться в клетке человека, такой как раковая клетка, без какой-либо дополнительной комплементации, которая необходима для вирусов дикого типа, например, не полагаясь на поврежденный клеточный аппарат. То есть они селективны по отношению к опухоли в том смысле, что инфицируют предпочтительно опухолевые клетки, по сравнению с неопухолевыми клетками. ColoAd1 представляет собой пример репликационно-компетентного вируса.
Предполагают, что термин «репликационно-селективный» или «селективная репликация», используемый в данной заявке, описывает онколитический аденовирус, который способен реплицироваться в раковых клетках, используя элемент, который специфичен для указанных раковых клеток или повышенно активен в них, например, поврежденный клеточный аппарат, например, мутация р53, что в некоторой степени обеспечивает селективность над здоровыми/нормальными клетками.
Онколитический аденовирус подгруппы В, используемый в данной заявке, относится к аденовирусу, содержащему по меньшей мере гексон и волоконный белок из подгруппы В (см. Shenk и др. и таблицу 1), который преимущественно заражает и/или лизирует опухолевые клетки по сравнению с нормальными клетками. Таким образом, онколитический аденовирус подгруппы В, используемый в данной заявке, включает химерный, мутантный аденовирус или его вариант с волоконным белком и гексоном аденовируса группы В, который сохраняет онколитические свойства.
Аденовирус или серотип аденовируса в данной заявке относится к любому из серотипов аденовируса человека, которые известны на сегодняшний день (51) или будут выделены в будущем. См., например, Strauss (1984) и Shenk (2001). Серотипы аденовируса классифицируют на подгруппы, показанные в таблице 1.
В таблице 1 показано разделение серотипов аденовируса на подгруппы.

Примеры вирусов из подгруппы В включают Ad11 (дикого типа), такой как Ad11a и Ad11p (номер доступа в Genbank AF532578), и химерный аденовирус ColoAd1. Последний из упомянутых описан в WO 2005/118825, и полная последовательность указанного вируса представлена в SEQ ID NO: 1 в упомянутом документе.
Таким образом, в одном варианте реализации вирус, используемый в способе согласно настоящему описанию, представляет собой химерный вирус.
Химерный аденовирус, используемый в данной заявке, относится к аденовирусам, которые содержат ДНК из двух или более различных серотипов аденовируса, таким как полученные с применением способа, описанного в WO 2005/118825, который включен в данную заявку посредством ссылки.
В одном варианте реализации химерный аденовирус представляет собой ColoAd1. Считают, что ColoAd1 убивает опухолевые клетки посредством механизма, который больше напоминает некроз, чем апоптоз (неопубликованные результаты, полученные в Оксфордском университете). Это вызывает несколько потенциально благоприятных эффектов (Kirn и др. 2001; Small и др. 2006; Reid и др. 2002; Liu и др. 2007; Ferguson и др. 2012).
- Было показано, что ColoAd1 эффективен против линий раковых клеток с множественной лекарственной устойчивостью и клеток, подобных раковым стволовым клеткам, которые, как известно, устойчивы к апоптозу.
- Воспалительная некротическая гибель клеток может лучше подходить для формирования специфического противоопухолевого иммунного ответа.
- ColoAd1 выходит из опухолевых клеток очень быстро, даже до гибели зараженной клетки, и, таким образом, может обладать повышенной способностью к распространению.
ColoAd1 представляет собой химеру Ad11 и Ad3, но имеет внешнюю капсулу, которая полностью гомологична таковой у Ad11. Кинетика вируса, воспалительный потенциал и иммунологические свойства ColoAd1, таким образом, наиболее близко напоминают и прогнозируют таковые у Ad11 и других аденовирусов подгруппы В.
В одном варианте реализации у онколитического вируса, используемого в способе согласно настоящему описанию, удалена область Е3 и/или Е4 или ее часть. Это может быть полезно, так как может обеспечить возможность более быстрой репликации вируса in vivo.
Дополнительно, делеция Е3 может способствовать быстрому клиренсу вируса из нераковых клеток, так как область Е3 кодирует белки, которые могут быть важны для уклонения от иммунитета хозяина.
В одном варианте реализации вирус, используемый в способе согласно настоящему описанию, основан на Ad11 или получен из него таким образом, что гексон и волоконный белок по существу аналогичны таковым у Ad11, такого как Ad11p. Более того, поскольку обозначение серотипа аденовируса основано на внешних свойствах вируса, т.е. свойствах гексона и волоконного белка, настоящее описание пригодно для аденовируса типа В, который обладает аналогичными поверхностными свойствами.
В одном варианте реализации аденовирус типа В представляет собой OvAd1 или OvAd2, последовательности которых представлены в SEQ ID NO: 1 и SEQ ID NO: 2, соответственно, в WO 2008/080003, включенном в данную заявку посредством ссылки.
Термин «по существу сходный», используемый в данной заявке, относится к последовательности аминокислот соответствующего белка или белков, которые на по меньшей мере 95% идентичны (например, на 96, 97, 98, 99 или 100% идентичны) по «всему» конкретному белку. Белок (белки), с которым производят сравнение, может быть частью большей молекулы, но сравнение будут проводить по всей длине соответствующего фрагмента или компонента.
Аденовирус типа 5 (Ad5), как правило, входит в клетку посредством Коксаки-аденовирусного рецептора (CAR). Тем не менее, аденовирус серотипа 11 (Ad11) представляет собой аденовирус подгруппы В, который нацелен на отличный рецептор (CD46), который экспрессируется на низких уровнях во всех содержащих ядро клетках. В нормальных клетках CD46 часто скрыт на базолатеральных поверхностях клеток и, таким образом, недоступен для связывания вируса (Varela JC, и др. Int J Cancer 2008, 15 сентября; 123(6): 1357-63; Maisner и др., 1997). Тем не менее, в опухолевых клетках он, как правило, экспрессируется на поверхности на повышенных уровнях, особенно при более запущенных и быстрорастущих опухолях (Kinugasa и др., 1999). Следовательно, Ad11 эффективно заражает линии клеток карциномы, например, из эпителиальной карциномы легкого (клетки А549), гепатомы (HepG2), рака предстательной железы (DU 145 и LNCaP), рака гортани (Нер2) и рака молочной железы (САМА и MG7), а также клетки глиобластомы, медуллобластомы и нейробластомы (Mei и др. 2003). Таким образом, Ad11 преимущественно заражает опухолевые клетки, и полученные из него вирусы считают полезными для лечения по меньшей мере одного или более из перечисленных выше раков. Являясь химерой Ad11 и Ad3, ColoAd1 разделяет данные свойства с Ad11.
В одном варианте реализации вирус, используемый в способе согласно настоящему описанию, содержит трансген (в частности, один или более трансгенов), например, терапевтический трансген, для экспрессии in vivo. Предполагают, что термин «трансгенный ген», используемый в данной заявке, относится к гену, не обнаруживаемому в исходном вирусе или вирусе дикого типа. Такие гены могут выполнять функцию маркера или репортера для отслеживания эффективности вирусной инфекции. В качестве альтернативы, указанный ген может играть роль в повышении эффективности вируса. В качестве альтернативы, указанный ген может доставлять цитотоксический агент в клетку.
Терапевтический трансген может экспрессировать терапевтический агент в клетке, например, миРНК; кшРНК; полипептид; опухолеассоциированный антиген (ТАА), цитокин; антитело; или антиангиогенный фактор.
Примеры терапевтических антител включают антитела против VGEF, такие как бевацизумаб, антитела против EGFR, такие как цетуксимаб, антитело против CD20, такое как ритуксимаб, или активатор/модулятор иммунной системы, такой как антитело против CTLA4 (например, ипилимумаб), антитело против PD-1 и антитело против PD-L1, среди прочих. Указанным геном также могут кодироваться одноцепочечные антитела, субъединицы антител, фрагменты антител и TRAP, а также полноразмерные антитела. Для настоящего описания важно, что включение данных белков не изменяет свойства поверхности вируса и, следовательно, он может легко встроиться в геном без вредного действия после введения доз, как описано в данной заявке, при этом обеспечивая дополнительные терапевтические механизмы для атаки раковых клеток.
Примеры цитокинов включают интерферон-альфа, интерферон-гамма и IL-2, среди прочих.
Так как указанная РНК, антитело, полипептид, ТАА или цитокин будут экспрессироваться в опухоли, полагают, что это представляет возможность изменить микроокружение опухоли, но избежать системных побочных действий доставленного агента. Например, можно стимулировать местную иммунную систему, чтобы она атаковала рак. Можно модулировать это местное действие путем изменения того, секретируются ли или нет РНК, антитело, полипептид, ТАА или цитокин из клетки, и когда в процессе жизненного цикла вируса они экспрессируются.
В одном варианте реализации трансген кодирует тимидинкиназу, например, не человеческого происхождения, или цитозиндезаминазу, например, бактериального происхождения или из дрожжей.
В одном варианте реализации антитело, полипептид, или цитокин, или тому подобная молекула не относятся к человеку по происхождению и не гуманизированы. Последний из упомянутых маловероятно будет пагубно влиять на активность указанной частицы в раковой клетке, и его преимущество состоит в том, что материал, который может выйти из раковой клетки, привлечет внимание иммунной системы к данному месту и будет быстро устранен.
В одном варианте реализации вирус кодирует и экспрессирует in vivo видимый или визуализируемый белок, например, флуоресцентный белок, такой как GFP или аналогичный белок. Учитывая тот факт, что вирус избирательно заражает раковые клетки, то когда он экспрессирует видимый или визуализируемый белок, его можно применять для выделения области раковой ткани для иссечения или радиации.
В одном варианте реализации вирусы можно вооружить терапевтическими генами, способными вызывать противоопухолевый иммунитет, ингибирование неоваскуляризации опухоли или активацию пролекарства. Термин «терапевтическая доза», используемый в данной заявке, относится к количеству онколитического аденовируса, которое подходит для достижения предполагаемого терапевтического действия при применении в подходящем режиме лечения, например, для снижения выраженности симптомов или состояний заболевания. Дозу можно считать терапевтической дозой для лечения рака или метастазов, если количества вирусных частиц может быть достаточно для того, чтобы привести к следующим эффектам: рост опухоли или метастазов замедляется или останавливается, или обнаруживают уменьшение размера опухоли или метастазов, и/или продлевается время жизни пациента. Подходящие терапевтические дозы, как правило, приводят к равновесию между терапевтическим действием и переносимой токсичностью, например, когда побочный эффект и токсичность переносятся при условии, что терапия приносит пользу.
В одном варианте реализации терапевтический диапазон доз не приводит к ограничивающей дозу токсичности.
Термин «ограничивающая дозу токсичность», используемый в данной заявке, означает появление побочных действий во время лечения, которые достаточно тяжелы для того, чтобы предотвратить любое из следующих: дальнейшее увеличение дозировки, частоты или силы, - или чтобы предотвратить продолжение лечения при любом уровне дозировки. Токсичное действие, которое не переносимо, например, связанное с высокой дозой, означает, что последняя не подходит для применения в качестве терапевтической дозы в контексте настоящего описания.
В одном варианте реализации предсуществующий иммунитет против капсида Ad11 достаточно слаб, чтобы позволить эффективное введение дополнительных терапевтических доз в день 7 или после дня 7.
В одном варианте реализации свойства капсида Ad11 слабо стимулировать иммунный ответ позволяют эффективное введение дополнительных терапевтических доз в день 7 или после дня 7.
В одном варианте реализации внутривенная доставка вируса менее иммуногенна в отношении противовирусной иммуногенности, чем подкожная или внутримышечная доставка вируса.
Считается общепринятым, что токсичность Ad11 может быть более низкой, чем у некоторых других аденовирусов, таких как Ad5. Это, наряду с более низким доминированием серотипа, полезно, но этого может быть не достаточно, чтобы позволить Ad11 избежать иммунных ответов. Даже несмотря на то, что согласно данным литературы можно предположить, что аденовирусы подгруппы В не токсичны для клеток печени, возможно, макрофаги в легких, печени (Купферовские клетки) и селезенке выводят онколитические вирусы после системной доставки.
Полагают, что быстрая доставка по меньшей мере двух доз онколитического вируса может быть полезна для получения достаточных уровней вируса, которые поддерживаются в течение периода времени, который позволяет достаточное инфицирование целевых клеток, а именно раковых клеток.
Введение по меньшей мере двух доз подряд может позволить произойти одному или более из следующих полезных событий: а) иммунные механизмы заняты первой дозой, что затем может позволить второй дозе ускользнуть от полной атаки иммунной системой и достигнуть мишени, и/или b) по меньшей мере две дозы подряд позволяют биораспределению вируса достигнуть достаточных уровней в течение достаточного периода времени для достижения целевых клеток in vivo, так или иначе, после того, как вирус достигает целевых клеток и заражает их, он способен реплицироваться.
Термин «биораспределение», используемый в данной заявке, означает распределение in vivo.
Без привязки к какой-либо конкретной теории авторы настоящего изобретения полагают, что первая доза вируса может понижающе регулировать клиренс, например, механизмы, которые используют продуцирующие цитокины клетки врожденного иммунного ответа, такие как купферовские клетки, тем самым улучшая биодоступность дополнительной терапевтической дозы (доз). Первая доза вируса, таким образом, может «исчерпать» фагоцитарные «поглотители» циркулирующего вируса, тем самым достигая лучшей доставки и/или повышенной эффективности. Исчерпывание фагоцитарных поглотителей также уменьшает тенденцию к высвобождению цитокинов в ответ на последующие дозы и, таким образом, позволяет достигнуть более высоких уровней вируса в крови без избыточной токсичности.
Термин «биодоступность», используемый в данной заявке, означает количество вируса, доступного для осуществления предполагаемой терапевтической функции in vivo.
В одном варианте реализации способ, описанный в данной заявке, в котором вводят по меньшей мере три дозы, минимизирует побочные эффекты и/или токсичность у пациента.
В одном варианте реализации аденовирус защищают путем покрытия указанного вируса полимером, например, чтобы по меньшей мере частично избежать действия иммунной системы пациента.
Термин «защищенный», используемый в данной заявке, означает, что внешняя поверхность аденовируса была модифицирована, чтобы избежать иммунного ответа пациента, например, с применением полимера. Примеры подходящих полимеров описаны в WO 98/19710, WO 00/74722, WO 2010/067041, WO 2010/067081 и WO 2006/008513, включенных в данную заявку посредством ссылки.
В одном варианте реализации онколитический вирус конъюгирован с цитотоксическим или иммуномодулирующим агентом.
В одном варианте реализации предложен онколитический аденовирус, который пегилирован, например, чтобы уменьшить иммуногенность и/или увеличить время полувыведения.
В одном варианте реализации способ лечения предусмотрен для применения для лечения опухоли.
Предполагают, что термин «опухоль», используемый в данной заявке, относится к аномальной массе ткани, которая возникает в результате избыточного деления клетки, которое не контролируется и прогрессирует, также используют термин «новообразование». Опухоли могут быть либо доброкачественными (не раковыми), либо злокачественными. В объем термина «опухоль» входят все формы рака и метастазов.
В одном варианте реализации опухоль представляет собой солидную опухоль. Солидная опухоль может быть локализованной или метастатической.
В одном варианте реализации опухоль эпителиального происхождения.
В одном варианте реализации опухоль представляет собой солидную опухоль.
В одном варианте реализации опухоль представляет собой злокачественное новообразование, такое как колоректальный рак, гепатома (рак печени), рак предстательной железы, рак поджелудочной железы, рак молочной железы, рак яичников, рак щитовидной железы, рак почки, рак мочевого пузыря, рак головы и шеи или рак легких.
В одном варианте реализации опухоль представляет собой колоректальное злокачественное новообразование.
Термин «злокачественное новообразование», используемый в данной заявке, означает раковые клетки.
В одном варианте реализации рак представляет собой колоректальный рак и/или его метастатические формы, например, с метастазами в печени.
В одном варианте реализации рак представляет собой рак печени и/или его метастатические формы.
В одном варианте реализации рак представляет собой рак легких и/или его метастатические формы.
В одном варианте реализации рак представляет собой рак яичников и/или его метастатические формы, например, с легочными метастазами.
В одном варианте реализации рак представляет собой рак почки и/или его метастатические формы.
В одном варианте реализации рак представляет собой рак мочевого пузыря и/или его метастатические формы.
В одном варианте реализации рак представляет собой рак гортани.
В одном варианте реализации рак представляет собой рак кожи, такой как меланома. В одном варианте реализации рак представляет собой лейкемию. В одном варианте реализации рак представляет собой глиобластому, медуллобластому или нейробластому. В одном варианте реализации рак представляет собой нейроэндокринный рак. В одном варианте реализации рак представляет собой ходжкинскую или неходжкинскую лимфому.
В одном варианте реализации онколитический аденовирус применяют для лечения или предотвращения метастазирования.
В одном варианте реализации онколитические аденовирусы, описанные в данной заявке, подходят для уничтожения раковых клеток, которые мигрировали в лимфатический узел. Авторы настоящего изобретения показали, что онколитический вирус, который вводили пациентам с колоректальным раком, может инфицировать раковые клетки, которые мигрировали в лимфатические узлы.
В одном варианте реализации вирус, составы и режимы введения согласно настоящему описанию подходят для уничтожения атипичных предраковых клеток.
В одном варианте реализации способ или состав, описанные в данной заявке, применяют для лечения фармакорезистентных раков.
В одном варианте реализации способ или состав применяют для того, чтобы сенсибилизировать фармакорезистентные раки к указанным лекарственным средствам.
БОЛЕЕ ПОДРОБНОЕ ОПИСАНИЕ ТИПОВ РАКА
Рак легких
Виды рака легких классифицируют согласно гистологическому типу и распределяют по категориям в зависимости от размера и вида злокачественных клеток, наблюдаемых патогистологом под микроскопом. Для терапевтических целей выделяют два широких класса: немелкоклеточная карцинома легкого и мелкоклеточная карцинома легкого.
В одном варианте реализации эпителиальный рак представляет собой рак легких, например, мелкоклеточный рак легких (SCLC) и немелкоклеточный рак легких (NSCLC).
Немелкоклеточная карцинома легкого. Три основных подтипа NSCLC представляют собой аденокарциному, плоскоклеточную карциному и крупноклеточную карциному.
Приблизительно 40% раков легких представляют собой аденокарциному, которая обычно возникает в периферической ткани легкого. Для подтипа аденокарциномы, бронхиолоальвеолярной карциномы, которая наиболее часто встречается у женщин, которые никогда не курили, может наблюдаться лучшая длительная выживаемость.
Плоскоклеточная карцинома составляет приблизительно 30% раков легких. Она обычно возникает близко к верхним дыхательным путям. В центре опухоли обычно обнаруживают пустую полость и ассоциированную с ней гибель клеток. Приблизительно 9% раков легких представляют собой крупноклеточную карциному. Ее так называют, потому что раковые клетки большие, с избытком цитоплазмы, большими ядрами и видимыми ядрышками.
Мелкоклеточная карцинома легкого. При мелкоклеточной карциноме легкого (SCLC) клетки содержат плотные нейросекреторные гранулы (везикулы, содержащие нейроэндокринные гормоны), благодаря которым данная опухоль ассоциирована с эндокринным/паранеопластическим синдромом. В большинстве случаев она возникает в более верхних дыхательных путях (бронхах первого и второго порядка). Данные виды рака быстро растут и рано распространяются в процессе заболевания. От шестидесяти до семидесяти процентов данных видов рака имеют метастазы при постановке диагноза.
В одном варианте реализации рак представляет собой немелкоклеточную карциному легкого.
Рак печени
В одном варианте реализации рак представляет собой рак печени, например, метастазы в печени от первичного рака, например, рака толстого кишечника, который распространился в печень. В одном варианте реализации рак печени представляет собой печеночно-клеточную карциному (НСС).
Рак почки
В одном варианте реализации предложено лечение рака почки, например, почечноклеточной карциномы и/или переходно-клеточной карциномы, с применением онколитического аденовируса, описанного в данной заявке. Другие примеры рака почки включают плоскоклеточную карциному, опухоль юкстагломерулярных клеток (рениному), ангиомиолипому, почечную онкоцитому, карциному канальцев Беллини, светлоклеточную саркому почки, нефробластому, опухоль Вильмса, смешанную эпителиально-стромальную опухоль, светлоклеточную аденокарциному, переходно-клеточную карциному, инвертированную папиллому, почечную лимфому, тератому, карциносаркому и карциноидную опухоль почечной лоханки.
Рак мочевого пузыря
В одном варианте реализации рак представляет собой рак мочевого пузыря, например, представляет собой любой из нескольких типов злокачественных новообразований, происходящих из эпителиальной выстилки мочевого пузыря (т.е. уротелия). Приблизительно 90% раков мочевого пузыря представляют собой переходно-клеточную карциному. Другие 10% представляют собой плоскоклеточную карциному, аденокарциному, саркому, мелкоклеточную карциному и вторичные метастазы рака в других местах в организме. Определение стадии приведено ниже.
Τ (первичная опухоль)
- ТХ - Первичную опухоль невозможно оценить
- Т0 - Нет признаков первичной опухоли
- Та - Неинвазивная папиллярная карцинома
- Tis - Карцинома in situ («плоская опухоль»)
- Т1 - Опухоль проникает в субэпителиальную соединительную ткань
- Т2а - Опухоль проникает в поверхностные мышцы (внутренняя часть)
- T2b - Опухоль проникает в глубокие мышцы (внешняя часть)
- Т3 - Опухоль проникает в перивезикальную ткань:
- Т3а - Микроскопические размеры
- T3b - Макроскопические размеры (внепузырная масса)
- Т4а - Опухоль проникает в предстательную железу, матку или влагалище
- T4b - Опухоль проникает в стенку таза или брюшную стенку
N (лимфатические узлы)
- NX - Регионарные лимфатические узлы невозможно оценить
- N0 - Нет метастазов в регионарных лимфатических узлах
- N1 - Метастаз в одном лимфатическом узле 2 см или менее в наибольшем измерении
- N2 - Метастаз в одном лимфатическом узле более 2 см, но не более 5 см в наибольшем измерении, или в нескольких лимфатических узлах, но ни в одном не более 5 см в наибольшем измерении
- N3 - Метастаз в лимфатическом узле более 5 см в наибольшем измерении
М (отдаленный метастаз)
- MX - Отдаленный метастаз невозможно оценить
- М0 - Нет отдаленных метастазов
- M1 - Отдаленный метастаз.
Настоящее описание распространяется на любую стадию рака мочевого пузыря.
Рак яичников
В независимом аспекте настоящее описание относится к ColoAd1, содержащему его составу или комбинированной терапии, включающей ColoAd1, для применения для лечения рака яичников, например, для введения терапевтически эффективного количества ColoAd1 пациенту с раком яичников, например, используя режим введения, описанный в данной заявке.
Существует более 30 различных типов рака яичников, которые классифицируют в зависимости от типа клетки, из которой они начинаются. Раковые опухоли яичника могут начинаться из трех обычных типов клеток:
- Поверхностного эпителия - клеток, покрывающих выстилку яичников
- Зародышевых клеток - клеток, которые предназначены для образования яйцеклетки
- Стромальных клеток - клеток, которые высвобождают гормоны и соединяют различные структуры яичников
Настоящее описание относится к лечению рака яичников из любого источника, например, описанного в данной заявке, в частности, из эпителиальных клеток. Эпителиальные карциномы яичников (ЕОС) составляют от 85 до 90 процентов всех видов рака яичников.
Обычные эпителиальные опухоли. Эпителиальные опухоли яичника возникают из клеток, которые покрывают внешнюю поверхность яичника. Большинство эпителиальных опухолей яичника доброкачественные (не раковые). Существует несколько типов доброкачественных эпителиальных опухолей, включая серозные аденомы, мукоидные аденомы и опухоли Бреннера. Раковые эпителиальные опухоли представляют собой карциномы, что означает, что они образуются в ткани, которая выстилает яичники. Они представляют собой наиболее распространенные и наиболее опасные из всех типов рака яичников. К сожалению, почти у 70 процентов женщин с обычным эпителиальным раком яичников он оказывается не диагностирован до тех пор, пока заболевание не достигнет запущенной стадии.
Существует несколько эпителиальных опухолей яичников, вид которых под микроскопом не позволяет явно определить, что они раковые. Такие опухоли называют пограничными опухолями или опухолями с низким злокачественным потенциалом (опухолями с НЗП). Способ согласно настоящему описанию включает лечение последних.
Опухоли зародышевых клеток. Опухоли зародышевых клеток яичников развиваются из клеток, которые образуют плодные яйца или яйцеклетки. Большинство опухолей зародышевых клеток доброкачественные (не раковые), хотя некоторые из них раковые и могут быть опасны для жизни. Наиболее распространенные злокачественные новообразования из зародышевых клеток представляют собой созревающие тератомы, дисгерминомы и опухоли эндодермального синуса. Злокачественные новообразования из зародышевых клеток наиболее часто встречаются у подростков и у женщин от двадцати до двадцати девяти лет. На сегодняшний день 90 процентов пациентов со злокачественными новообразованиями зародышевых клеток яичников можно вылечить и сохранить их фертильность.
Стромальные опухоли. Стромальные опухоли яичников представляют собой редкий класс опухолей, которые развиваются из клеток соединительной ткани, которые скрепляют яичник и продуцируют женские гормоны эстроген и прогестерон. Наиболее распространенными типами являются гранулезотекаклеточные опухоли и опухоли из сертоли-лейдиговских клеток. Данные опухоли достаточно редки, и их обычно считают раками низкой степени злокачественности, при которых приблизительно 70 процентам ставят диагноз I стадии заболевания (присутствие рака ограничивается одним или обоими яичниками).
Первичная перитонеальная карцинома. Удаление яичников пациента исключает риск рака яичников, но не риск менее распространенного рака, называемого первичной перитонеальной карциномой. Первичную перитонеальную карциному классифицируют аналогично эпителиальному раку яичников (наиболее распространенному типу). Она развивается из клеток брюшины (брюшной выстилки) и так же выглядит под микроскопом. Она аналогична по симптомам, распространению и лечению.
Стадии рака яичников.
После постановки диагноза рака яичников стадию опухоли можно определить во время хирургического вмешательства, когда доктор может сказать, распространился ли рак за пределы яичников. Существует четыре стадии рака яичников: от стадии I (раннее заболевание) до стадии IV (запущенное заболевание). План лечения и прогноз (предполагаемое течение и результат заболевания) будут определяться стадией рака пациента.
Далее представлено описание различных стадий рака яичников:
Стадия I - Рост рака ограничен яичником или яичниками.
Стадия IA - Рост ограничен одним яичником и опухоль заключена во внутренней части яичника. Рак отсутствует на внешней поверхности яичника. Отсутствует асцит, содержащий злокачественные клетки. Капсула интактна.
Стадия IB - Рост ограничен обоими яичниками при отсутствии опухоли на их внешних поверхностях. Отсутствует асцит, содержащий злокачественные клетки. Капсула интактна.
Стадия IC - Опухоль классифицируют либо как стадию IA, либо как стадию IB, и присутствует один или более из следующих признаков: (1) опухоль присутствует на внешней поверхности одного или обоих яичников; (2) капсула прорвана; и (3) присутствует асцит, содержащий злокачественные клетки или с положительным перитонеальным смывом.
Стадия II - Рост рака наблюдается в одном или обоих яичниках и распространяется на стенки таза.
Стадия IIA - Рак распространился и/или затрагивает матку или фаллопиевы трубы, или и то, и другое.
Стадия IIB - Рак распространился на другие тазовые органы.
Стадия IIC - Опухоль классифицируют либо как стадию IIA, либо как стадию IIB, и присутствует один или более из следующих признаков: (1) опухоль присутствует на внешней поверхности одного или обоих яичников; (2) капсула прорвана; и (3) присутствует асцит, содержащий злокачественные клетки или с положительным перитонеальным смывом.
Стадия III - Рост рака вовлекает один или оба яичника, и присутствует один или более из следующих признаков: (1) рак распространился за пределы таза на выстилку брюшной полости; и (2) рак распространился на лимфатические узлы. Опухоль ограничена малым тазом, но имеется подтвержденное гистологически злокачественное распространение на тонкий кишечник или сальник.
Стадия IIIA - Во время операции с целью определения стадии практический врач может наблюдать, что рак распространился на один или оба яичника, но рак макроскопически не виден в брюшной полости и не распространился на лимфатические узлы. Тем не менее, когда биоптаты проверяют под микроскопом, обнаруживают очень малые метастазы рака на поверхностях пристеночной брюшины.
Стадия IIIB - Опухоль находится в одном или обоих яичниках и в брюшной полости присутствуют метастазы рака, которые достаточно велики, чтобы хирург мог их увидеть, но не превышают 2 см в диаметре. Рак не распространился на лимфатические узлы.
Стадия IIIC - Опухоль находится в одном или обоих яичниках, и присутствует один или более из следующих признаков: (1) рак распространился на лимфатические узлы; и/или (2) метастазы рака превышают 2 см в диаметре и обнаруживаются в брюшной полости.
Стадия IV - Это наиболее запущенная стадия рака яичников. Рост рака наблюдается в одном или обоих яичниках и в отдаленных метастазах (распространение рака на органы, расположенные за пределами брюшной полости). Обнаружение клеток рака яичников в плевральной жидкости (из полости, которая окружает легкие) также свидетельствует о IV стадии заболевания.
В одном варианте реализации стадия рака яичников принадлежит к: типу I, например, IA, IB или IC; типу II, например, IIA, IIB или IIC; типу III, например, IIIA, IIIB или IIIC; или типу IV.
Настоящее описание относится к лечению любой стадии рака яичников, в частности, как описано в данной заявке.
КОМБИНИРОВАННАЯ ТЕРАПИЯ
В одном варианте реализации вирус вводят в комбинации с введением дополнительного лекарства от рака или проведением терапии рака.
Предполагают, что в объем термина «в комбинации», используемого в данной заявке, входит введение онколитического вируса до, одновременно и/или после лечения или терапии рака.
В одном варианте реализации онколитический аденовирус применяют в комбинации с лечением высокоинтенсивным фокусированным ультразвуком (HIFU).
Терапия рака включает хирургическое вмешательство, лучевую терапию, таргетную терапию и/или химиотерапию.
Термин «лечение рака», используемый в данной заявке, относится к лечению терапевтическим соединением или биологическим агентом, например, антителом, предназначенным для лечения рака и/или его поддерживающей терапии.
В одном варианте реализации лечение рака выбирают из любой другой противораковой терапии, включая химиотерапевтический агент, нацеленный противораковый агент, радиотерапию, радиоизотопную терапию или любую комбинацию перечисленных способов.
В дополнительном независимом аспекте настоящее описание относится к комбинированной терапии, включающей онколитический аденовирус типа В, такой как ColoAd1, и химиотерапевтический агент, который не препятствует активности аденовируса. Аденовирус типа В, такой как ColoAd1, используемый в данной заявке, включает его составы, например, его фармацевтические составы.
Термин «активность», используемый в данной заявке, относится к любому полезному свойству или особенности вируса, например, к онколитической активности и/или способности вируса реплицироваться в раковых клетках, такой как репликация вируса in vivo.
В одном варианте реализации дозы ColoAd1 в рамках комбинированной терапии вводят согласно режиму введения, описанному в данной заявке.
Как правило, комбинированная терапия будет предложена в виде состава с аденовирусом и состава с химиотерапевтическим агентом. Таким образом, введение аденовируса и введение химиотерапевтического агента для удобства будут отдельными событиями. Такие введения можно осуществлять в один и тот же день или в различные дни.
В одном варианте реализации аденовирус вводят в рамках подходящего режима на одной неделе, а химиотерапевтический агент вводят на последующих неделях, например, на следующей неделе.
В одном или более вариантах реализации химиотерапевтический агент и аденовирус могут оказывать синергичное терапевтическое действие.
Указанный онколитический аденовирус можно применять в качестве предварительного лечения перед терапией, такой как хирургическое вмешательство (неоадъювантная терапия), чтобы уменьшить опухоль, лечить метастазирование и/или предотвратить метастазирование или дальнейшее метастазирование. Онколитический аденовирус можно применять после терапии, такой как хирургическое вмешательство (адъювантная терапия), для лечения метастазирования и/или предотвращения метастазирования или дальнейшего метастазирования.
Термин «одновременное», используемый в данной заявке, описывает введение дополнительного лекарства от рака в то же время или приблизительно в то же время, в которое проводят введение состава, содержащего онколитический аденовирус. Указанное лекарство может содержаться в том же составе или вводиться в виде отдельного состава.
В одном варианте реализации вирус вводят в комбинации с введением химиотерапевтического агента, например, описанного в данной заявке, такого как паклитаксел, абраксан или аналогичный агент.
Предполагают, что термин «химиотерапевтический агент», используемый в данной заявке, относится к специфическим противоопухолевым химическим агентам или лекарственным средствам, которые избирательно разрушают злокачественные клетки и ткани. Например, алкилирующие агенты, антиметаболиты, антрациклины, растительные алкалоиды, ингибиторы топоизомеразы и другие противоопухолевые агенты. Другие примеры химиотерапевтических агентов включают доксорубицин, 5-фторурацил (5-FU), паклитаксел, капецитабин, иринотекан и платины, такие как цисплатин и оксалиплатин.
Предпочтительную дозу может выбрать практикующий врач на основании природы рака, который лечат.
Неожиданно авторы настоящего изобретения установили, что некоторые классы терапевтических агентов могут ингибировать репликацию вируса, например, ингибиторы топоизомеразы или PARP могут ингибировать репликацию вируса in vivo. Учитывая то, что считают желательным сформировать вирусную инфекцию в раковой клетке таким образом, чтобы вирус мог реплицироваться, совместное введение соединений, которые ингибируют репликацию вируса, вероятно, будет нежелательным.
В одном варианте реализации химиотерапевтический агент не является ингибитором фермента. Таким образом, в одном варианте реализации в комбинированной терапии не используется ингибитор топоизомеразы.
В одном варианте реализации химиотерапевтический агент не является ингибитором PARP.
В одном варианте реализации в комбинированной терапии используется содержащий платину химиотерапевтический агент, например, цисплатин, карбоплатин или оксалиплатин.
В одном варианте реализации в комбинированной терапии используется ингибитор микротрубочек, например, сульфат винкристина, эпотилон A, N-[2-[(4-гидроксифенил)амино]-3-пиридинил]-4-метоксибензолсульфонамид (АВТ-751), полученный из атаксола химиотерапевтический агент, например, паклитаксел, абраксан или доцетаксел, или комбинация перечисленных агентов.
В одном варианте реализации в комбинированной терапии используется ингибитор mTOR. Примеры ингибиторов mTOR включают: эверолимус (RAD001), WYE-354, KU-0063794, рапамицин (сиролимус), темсиролимус, дефоролимус (MK-8669), AZD8055 и BEZ235(NVP-BEZ235).
В одном варианте реализации в комбинированной терапии используется ингибитор PI3-киназы. Примеры ингибиторов PI3-киназы включают: GDC-0941, ZSTK474, PIK-90, LY294002, TG100-115, XL147, GDC-0941, ZSTK474, PIK-90, LY294002, TG100-115, XL147, AS-605240, PIK-293, AZD6482, PIK-93, TGX-221, IC-87114, AS-605240, PIK-293, AZD6482, PIK-93, TGX-221, IC-87114 и соединения, описанные в WO 2011/048111, включенном в данную заявку посредством ссылки, включая 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-этинилхиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(3-(2-(2-метоксиэтокси)этокси)проп-1-ин-1-ил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(6-морфолино-6-оксогекс-1-ин-1-ил)хиназолин-4(3Н)-он; 6-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)гекс-5-иноевую кислоту; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(6-морфолино-6-оксогекс-1-ин-1-ил)хиназолин-4(3H)-он; 3-((2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-(3-(2-(2-гидроксиэтокси)этокси)проп-1-ин-1-ил)-4-оксохиназолин-3(4H)-ил)метил)бензонитрил; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(3-(2-морфолиноэтокси)проп-1-инил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-этинилхиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(3-хлорбензил)-5-этинилхиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(3-хлорбензил)-5-этинилхиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(2-фторбензил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(2-фторбензил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(3-метоксибензил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(3-метоксибензил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(3-(трифторметил)бензил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(3-(трифторметил)бензил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(4-хлорбензил)-5-этинилхиназолин-4(3H)-он; 2-((4-амино-3-(3-гидрокснфенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(4-(метилсульфонил)бензил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(4-(метил-сульфонил)бензил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(4-(трифторметил)бензил)хиназолин-4(3H)-он; 3-((2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-4-оксохиназолин-3(4H)-ил)метил)бензонитрил; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(3-(метил-сульфонил)бензил)хиназолин-4(3H)-он; 3-((2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-4-оксохиназолин-3(4H)-ил)метил)бензонитрил; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(4-хлорбензил)-5-этинилхиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(4-хлорбензил)-5-(3-метоксипроп-1-инил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(3-метоксибензил)-5-(3-метоксипроп-1-инил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(3-метоксипроп-1-инил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(4-(трифторметил)бензил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(3-(2-метоксиэтокси)проп-1-инил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-((5-метилизоксазол-3-ил)метил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-((5-метилизоксазол-3-ил)метил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(3-хлор-2-фторбензил)-5-этинилхиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2,6-дифторбензил)-5-этинилхиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(4-хлор-2-фторбензил)-5-этинилхиназолин-4(3H)-он; 2-((4-амино-3-(3-фтор-4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-этинилхиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-(3-метоксипроп-1-инил)-3-(3-(трифторметил)бензил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(4-фторбензил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(3-циклопентилпроп-1-инил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-(3-(бензилокси)проп-1-инил)-3-(2-хлорбензил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(5-гидроксипент-1-инил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(2-фтор-5-метоксибензил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(3,4-дихлорбензил)-5-этинилхиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-бензил-5-этинилхиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(2-трифторметилбензил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(4-метоксибензил)хиназолин-4(3H)-он; 4-((2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-4-оксохиназолин-3(4H)-ил)метил)бензонитрил; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-этинил-3-(2-фтор-4-метоксибензил)хиназолин-4(3H)-он; 1-(3-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)проп-2-инил)мочевина; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-пиримидин-1-ил)метил)-3-(2-фторбензил)-5-(3-(2-(2-метоксиэтокси)этокси)проп-1-инил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-фтор-3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-этинилхиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(3-феноксипроп-1-инил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-фторбензил)-5-(6-морфолино-6-оксогекс-1-ин-1-ил)хиназолин-4(3H)-он; 6-(2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N-(2-метоксиэтил)гекс-5-инамид; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(7-морфолино-7-оксогепт-1-ин-1-ил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(5-морфолино-5-оксопент-1-ин-1-ил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-((5-метилпиразин-2-ил)метил)-5-(6-морфолино-6-оксогекс-1-ин-1-ил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(6-оксо-6-(пиперидин-1-ил)гекс-1-ин-1-ил)хиназолин-4(3H)-он; 6-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N,N-диэтилгекс-5-инамид; 7-(2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)гепт-6-иноевая кислота; 2-ацетамидо-N-(3-(2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)проп-2-ин-1-ил)ацетамид; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(3-метокси-5-(трифторметил)бензил)-5-(6-морфолино-6-оксогекс-1-ин-1-ил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-метоксифенэтил)-5-(6-морфолино-6-оксогекс-1-ин-1-ил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(бензо[b]тиофен-2-илметил)-5-(6-морфолино-6-оксогекс-1-ин-1-ил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-фтор-3-метоксибензил)-5-(6-морфолино-6-оксогекс-1-ин-1-ил)хиназолин-4(3H)-он; метил-3-((2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-(6-морфолино-6-оксогекс-1-ин-1-ил)-4-оксохиназолин-3(4H)-ил)метил)бензоат; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-((1-метил-1H-пиразол-4-ил)метил)-5-(6-морфолино-6-оксогекс-1-ин-1-ил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(бензофуран-5-илметил)-5-(6-морфолино-6-оксогекс-1-ин-1-ил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-((2-метилтиазол-4-ил)метил)-5-(6-морфолино-6-оксогекс-1-ин-1-ил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(6-(4-метилпиперазин-1-ил)-6-оксогекс-1-ин-1-ил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(6-(4-морфолинопиперидин-1-ил)-6-оксогекс-1-ин-1-ил)хиназолин-4(3H)-он; 5-(6-(4-ацетилпиперазин-1-ил)-6-оксогекс-1-ин-1-ил)-2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)хиназолин-4(3H)-он; N-(4-(2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)бут-3-ин-1-ил)морфолин-4-карбоксамид; 5-(6-(4-ацетилпиперазин-1-ил)-6-оксогекс-1-ин-1-ил)-2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)хиназолин-4(3H)-он; N-(4-(2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)бут-3-ин-1-ил)морфолин-4-карбоксамид; 2-((4-амино-3-(4-гидрокси-фенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-5-(5-(бис(2-метоксиэтил)амино)пент-1-инил)-3-(2-хлорбензил)хиназолин-4(3H)-он; 6-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N-циклопентилгекс-5-инамид; 6-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N-(тетрагидро-2H-пиран-4-ил)гекс-5-инамид; 6-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N-(2-морфолиноэтил)гекс-5-инамид; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(6-(4-(2-метоксиэтил)пиперазин-1-ил)-6-оксогекс-1-инил)хиназолин-4(3H)-он; 6-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N-(2-(диметиламино)этил)гекс-5-инамид; 6-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N-(пиридин-4-ил)гекс-5-инамид; 6-(2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N-(пиридин-4-ил)гекс-5-инамид; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(6-(4-(диметиламино)пиперидин-1-ил)-6-оксогекс-1-инил)хиназолин-4(3H)-он; 6-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N,N-бис(2-метоксиэтил)гекс-5-инамид; 6-(2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N,N-бис(2-метоксиэтил)гекс-5-инамид; 6-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N-(2-(4-метилпиперазин-1-ил)этил)гекс-5-инамид; 6-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N-метил-N-(2-(4-метилпиперазин-1-ил)этил)гекс-5-инамид; 6-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N-изопропилгекс-5-инамид; 6-(2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N-изопропилгекс-5-инамид; 6-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N,N-диметилгекс-5-инамид; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(6-оксо-6-(пирролидин-1-ил)гекс-1-ин-1-ил)хиназолин-4(3H)-он; 6-(2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-4-оксо-3,4-дигидрохиназолин-5-ил)-N-(пирролидин-3-ил)гекс-5-инамид; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(6-(3-(диметиламино)пирролидин-1-ил)-6-оксогекс-1-инил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(6-(3-(диметиламино)пирролидин-1-ил)-6-оксогекс-1-инил)хиназолин-4(3H)-он; 2-((4-амино-3-(4-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(6-(4-метил-1,4-диазепан-1-ил)-6-оксогекс-1-инил)хиназолин-4(3H)-он; 2-((4-амино-3-(3-гидроксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(6-(4-метил-1,4-диазепан-1-ил)-6-оксогекс-1-инил)хиназолин-4(3H)-он, 2-((4-амино-3-(4-гидрокси-3-метоксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил)метил)-3-(2-хлорбензил)-5-(6-морфолино-6-оксогекс-1-инил)хиназолин-4(3H)-он
или фармацевтически приемлемую соль указанных соединений, включая все их производные стереоизомеры, таутомеры и изотопы.
В одном варианте реализации в комбинированной терапии применяют ингибитор МЕK. Примеры ингибиторов МЕK включают: AS703026, CI-1040 (PD184352), AZD6244 (селуметиниб), PD318088, PD0325901, AZD8330, PD98059, U0126-EtOH, BIX 02189 или BIX 02188.
В одном варианте реализации в комбинированной терапии применяют ингибитор AKT. Примеры ингибиторов AKT включают MK-2206 и АТ7867.
В одном варианте реализации в комбинированной терапии применяют ингибитор киназы Aurora. Примеры ингибиторов киназы Aurora включают: ингибитор I Aurora А, VX-680, AZD1152-HQPA (барасертиб (barasertib)), SNS-314 мезилат, РНА-680632, ZM-447439, ССТ129202 и гесперадин.
В одном варианте реализации в комбинированной терапии применяют ингибитор р38, например, описанный в WO 2010/038086, такой как N-[4-({4-[3-(3-трет-бутил-1-пара-толил-1H-пиразол-5-ил)уреидо]нафталин-1-илокси}метил)пиридин-2-ил]-2-метоксиацетамид.
В одном варианте реализации в комбинированной терапии применяют ингибитор Вс1-2. Примеры ингибиторов Вс1-2 включают: обатоклакса мезилат, АВТ-737, АВТ-263 (навитоклакс) и TW-37.
В одном варианте реализации в комбинированной терапии применяют антиметаболит. Примеры антиметаболитов включают: капецитабин (кселода), фосфат флударабина, флударабин (флудара), децитабин, ралтитрексид (томудекс), гемцитабина гидрохлорид и кладрибин.
В одном варианте реализации терапевтический агент представляет собой ганцикловир, который может помочь контролировать иммунные ответы и/или васкуляризацию опухоли.
В одном варианте реализации один или более методов лечения, применяемых в способе в данной заявке, являются метрономными, то есть осуществляют непрерывное или частое лечение низкими дозами противораковых лекарственных средств, которые часто дают одновременно с другими способами терапии.
Онколитические аденовирусы подгруппы В, в частности, Ad11 и полученные из него аденовирусы, такие как ColoAd1, могут быть особенно синергичными с химиотерапевтическими веществами, так как их механизм действия в большей степени не зависит от апоптоза, убивая раковые клетки преимущественно посредством некролитического механизма. Более того, подавление иммунитета, которое происходит во время химиотерапии, может позволить онколитическому вирусу функционировать с большей эффективностью.
В одном варианте реализации химиотерапевтический агент вводят парентерально.
В одном варианте реализации химиотерапевтический агент вводят отдельно от вируса, либо по времени, либо с помощью альтернативного способа введения, либо и то, и другое. Лечение может быть одновременным или последовательным.
В одном варианте реализации лекарство от рака представляет собой направленный агент, например, моноклональное антитело, такое как бевацизумаб, цетуксимаб или панитумумаб, или конъюгат антитела, такой как конъюгат антитела с лекарственным средством, в частности, такого типа, когда антитело или связывающий фрагмент соединены с токсином.
В одном варианте реализации лекарство от рака представляет собой иммунотерапевтический агент, например, ипилимумаб или другое антитело к CTLA4, антитело к PD-1, антитело к PD-L1, или другие ингибиторы контрольных точек, или цитокин или аналог цитокина.
Предполагают, что термин «ингибитор контрольных точек», используемый в данной заявке, относится к агентам, которые ингибируют передачу сигналов от мембранных белков Т-клеток, которые ингибируют или понижающе регулируют активацию и функцию Т-клеток.
В одном варианте реализации вирус вводят в комбинации с проведением радиотерапии.
Предполагают, что термин «радиотерапия», используемый в данной заявке, относится к медицинскому применению ионизирующего излучения.
Раковые клетки, как правило, недифференцированы и подобны стволовым клеткам; они воспроизводятся интенсивнее, чем большинство здоровых дифференцированных клеток, и обладают пониженной способностью к репарации сублетального повреждения. Повреждение ДНК затем передается через деление клетки; повреждение ДНК раковых клеток накапливается, вызывая их гибель или более медленное воспроизведение.
В одном варианте реализации радиотерапию проводят одновременно.
В одном варианте реализации радиотерапию проводят последовательно.
В одном варианте реализации вирус вводят в комбинации с терапией, комплементарной к терапии рака, например, с лекарством от кахексии, такой как раковая кахексия, например, S-пиндололом, S-мепиндололом или S-бопиндололом. Подходящие дозы могут находиться в диапазоне от 2,5 мг до 100 мг, например, от 2,5 мг до 50 мг в день, при условии, что разовую дозу или множество доз дают в виде множества доз, вводимых в течение дня.
В одном варианте реализации вирус вводят в комбинации с введением одного или более профилактических агентов, например, выбранных из жаропонижающего средства, антигистаминного средства, противорвотного средства, противодиарейного средства, стероида и анальгетика.
Жаропонижающие средства включают аспирин и нестероидные противовоспалительные средства, например, ибупрофен, напроксен и кетопрофен.
Антигистаминные средства включают акривастин, азеластин, бромфенирамин, буклизин, бромдифенгидрамин, карбиноксамин, цетиризин, хлорпромазин, циклизин, хлорфенирамин, хлордифенгидрамин, клемастин, ципрогептадин, дезлоратадин, дексбромфенирамин, десхлорфенирамин, дексхлорфенирамин, дименгидринат, диметиндин, дифенгидрамин, доксиламин, эбастин, эмбрамин, фексофенадин, левоцетиризин, лоратадин, меклизин, миртазапин, олопатадин, фенидамин, фенирамин, фенилтлоксамин, прометазин, пириламин, кветиапин, рупатадин, трипеленнамин и трипролидин.
Противорвотные средства включают доласетрон, гранисетрон, ондансетрон, трописетрон, палоносетрон, миртазапин, домперидон, оланзапин, дроперидол, метоклопрамид, ализаприд, прохлорперазин. В некоторых случаях антигистаминные средства можно применять в качестве противорвотных средств.
Противодиарейные средства включают метилцеллюлозу, аттапульгит, субсалицилат висмута, атропин/дифеноксилат, лоперамид и другие опиаты, такие как кодеин и морфин.
Анальгетики включают нестероидные противовоспалительные средства, парацетамол, ингибиторы Сох-2, опиаты и морфиномиметики, такие как морфин, кодеин, оксикодон, гидрокодон, дигидроморфин, петидин, бупренорфин, трамадол и тому подобные анальгетики.
В одном варианте реализации лечение вирусом применяют в комбинации с курсом стероидов.
Стероиды включают гидрокортизон, кортизон, преднизон, преднизолон, метилпреднизолон, дексаметазон и тому подобные стероиды.
Предполагают, что термин «профилактический», используемый в данной заявке, относится к профилактической медицине или помощи, например, состоящей в принятии мер для предотвращения или снижения выраженности побочных действий во время или после введения вируса.
В одном варианте реализации профилактику проводят отдельно от вируса, либо по времени, либо с помощью альтернативного способа введения, либо и то, и другое. Лечение может быть одновременным или последовательным.
В одном варианте реализации предусмотрена дополнительная гидратация в комбинации с введением вируса, либо одновременно, либо последовательно.
Термин «дополнительная гидратация», используемый в данной заявке, означает, что пациенту дают жидкости помимо тех, которые содержатся в составе. Можно применять любую форму введения подходящей жидкости, например, инфузию солевого раствора или глюкозы.
В одном варианте реализации терапию вирусом в данной заявке проводят в комбинации с противовоспалительным средством, например, стероидным или нестероидным противовоспалительным средством.
В одном варианте реализации терапию вирусом согласно настоящему описанию проводят в комбинации с жаропонижающим средством.
В одном варианте реализации лечение вирусом проводят в комбинации с регидратационной терапией, например, с внутривенным введением жидкостей, в частности, изотонического солевого раствора или глюкозы.
В одном варианте реализации способ подходит для лечения пациента амбулаторно.
Термин «амбулаторный пациент», используемый в данной заявке, представляет собой пациента, которого не госпитализировали во время фазы лечения, и который вместо этого приходит для лечения в кабинет врача, клинику или дневной хирургический стационар.
В одном варианте реализации предложен способ лечения пациента с помощью состава, описанного в данной заявке, содержащего ColoAd1, где указанный способ включает этапы внутривенного введения указанному пациенту дозы в день 1, а затем дозы в день 3 и третьей дозы в день 5.
В одном варианте реализации предложена парентеральный состав способного реплицироваться онколитического аденовируса подгруппы В, описанного в данной заявке, для применения для лечения, такого как лечение опухоли, и/или злокачественного новообразования, и/или рака, путем введения первой дозы указанного состава, описанной в данной заявке, а затем одной или более дополнительных терапевтических доз указанного состава,
при этом первую дозу и дополнительные дозы вводят в течение периода времени, равного 14 дням, в частности, как описано выше.
В одном варианте реализации предложено применение нескольких циклов лечения способным реплицироваться онколитическим аденовирусом подгруппы В. Цикл лечения следует понимать в данной заявке как серию доз вируса, которые вводят пациенту в течение относительно короткого периода времени, после которой будут оценивать реакцию пациента на лечение. Циклы лечения можно повторять несколько раз, при условии, что соотношение риск/польза определяют так, чтобы оно представляло наилучший вариант с точки зрения интересов пациента.
В одном варианте реализации предложен способ оценки пригодности повторяющихся циклов лечения способным реплицироваться онколитическим аденовирусом подгруппы В путем определения титра специфических антител против вируса и его сравнения с титром до лечения, таким образом, что титр ниже некоторого процента от титра до лечения будет указывать на положительный профиль риск/польза для повторного лечения.
В одном варианте реализации предложено применение парентерального состава способного реплицироваться онколитического аденовируса подгруппы В для получения лекарственного средства для лечения опухоли и/или злокачественного новообразования и/или для лечения рака путем применения режима лечения, описанного в данной заявке.
В одном варианте реализации состав применяют для лечения или профилактики метастазирования.
В одном варианте реализации предложен состав, представленный в виде стерильного предварительно наполненного и упакованного шприца с подходящей дозой и объемом для того, чтобы избежать необходимости сложного и дорогостоящего получения доз в стерильных условиях с применением подходящих средств кондиционирования воздуха, таких как вытяжные шкафы, перед введением пациенту.
В контексте настоящего описания термин "содержащий" следует понимать как "включающий".
Также предполагается, что аспекты настоящего изобретения, включающие некоторые элементы, распространяются на альтернативные варианты реализации "состоящие" или "состоящие по существу" из соответствующих элементов.
Любой положительный вариант реализации или их комбинация, описанная в данной заявке, может быть основанием для негативного исключения, т.е. отказа.
ПРИМЕРЫ
Эффективность и селективность в доклинических исследованиях.
В таблице 2 показаны IC50 ColoAd1 для различных линий эпителиальных клеток.


В таблице 3 показаны IC50 ColoAd1 для различных линий неэпителиальных клеток.
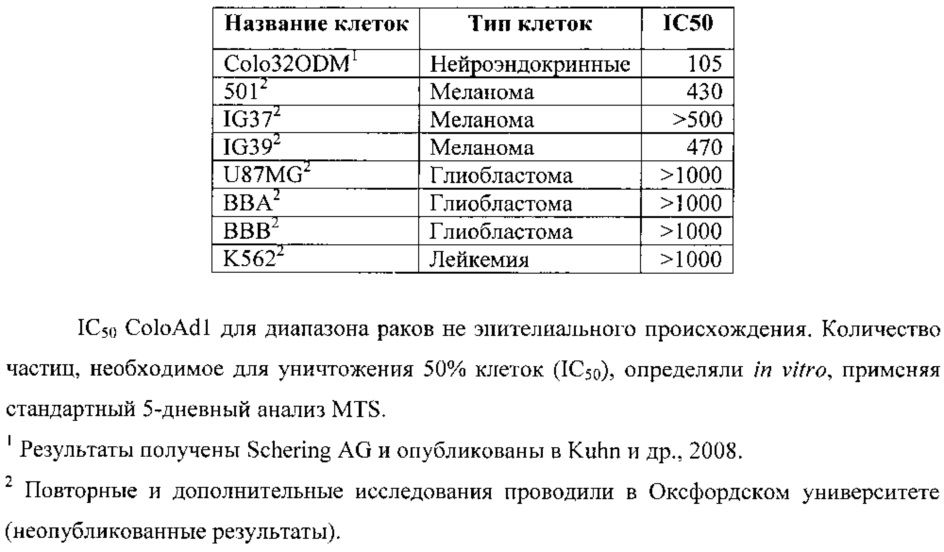
В таблице 4 показана репликация ColoAd1 в различных линиях нормальных нераковых клеток человека.

Клетки человека, растущие в монослоях, in vitro подвергали воздействию ColoAd1 в течение 72 часов. Суммарное количество копий генома ColoAd1 затем определяли с помощью количественной ПЦР. Результаты представлены в виде суммарного количества копий генома и в виде % от положительного контроля клеток карциномы (НТ29). Материалы ColoAd1, полученные из данных нормальных клеток человека, затем исследовали для определения жизнеспособности аденовируса в клетках карциномы НТ29. Во всех случаях по материалу ColoAd1, полученному таким образом, не выявили, что он реплицируется в клетках НТ29.
Доклиническое исследование кинетики в кровотоке.
Данные о кинетике ColoAd1 в кровотоке получили на мышах CD-1. Мышам (3 на группу) вводили вирусные частицы через хвостовую вену и определяли количество геномов ColoAd1, циркулирующих в образцах цельной крови, с помощью количественной ПЦР (кПЦР). Период полураспределения ColoAd1 в данной модели зависит от дозы. При более низких вводимых дозах (1×109-2×1010, введенных в течение нескольких дней) средний период полураспределения составляет 1,8+/-0,5 минут, что согласуется со значениями, ранее описанными для других аденовирусов (Green 2004). При более высоких дозах (более 2×1011), похоже, происходит насыщение клиренса, что приводит к дольшему нахождению уровней ColoAd1 в кровотоке (средний период полураспределения 7,8+/-2 минуты). Насыщение в исследовании ColoAd1, описанном здесь, отражается в нескольких фармакокинетических параметрах.
В таблице 5 продемонстрировано существенное увеличение площади под кривой (AUC), периода полураспределения и процента частиц, сохранившихся в момент времени 30 мин после введения доз более 2×1011 ColoAd1. В частности, было отмечено, что оптимальных кинетических параметров (AUC, процент сохранившихся частиц через 30 мин и средний период полураспределения (t1/2-альфа)) добивались, когда вводили три равные высокие дозы, в отличие от введения низкой примирующей дозы, а затем более высоких доз. По данным результатам, в связи с тем, что время нахождения в кровотоке у людей значительно больше, чем у мышей, предположили, что период полураспределения у людей будет значительно длиннее, и что низкие примирующие дозы маловероятно будут представлять ценность для аденовируса подгруппы В. Кроме того, ожидается, что у пациентов-людей, несущих опухоли, репликация вируса в раковых клетках, с последующим высвобождением, также приведет к дальнейшей амплификации вируса в более поздние моменты времени. Клинические исследования были спланированы соответствующим образом.

Доклинические исследования взаимодействия
Вирусные частицы могут взаимодействовать с компонентами крови человека, включая антитела, комплемент и кровяные клетки, что приводит к быстрой нейтрализации (Lyons 2005, Carlisle 2009). Данные события видоспецифичны, и их невозможно эффективно смоделировать у животных.
Для того, чтобы оценить нейтрализацию в крови человека, ColoAd1 можно инкубировать со свежесобранной человеческой цельной кровью от индивидов, перед применением для инкубации с пермиссивными клетками (клетками колоректальной опухоли НТ29). Диапазон концентраций вируса можно выбрать таким образом, чтобы он покрывал целевой диапазон клинических доз (2×106 до 2×109 частиц на мл крови человека, учитывая диапазон объемов крови человека). Эффективность оставшегося вируса можно определить по цитотоксичности и сравнить с таковой для вирусной инфекции при отсутствии инкубации с кровью человека (среда отдельно), и желательно определять уровни эффективности при концентрациях в диапазоне от 2×106 до 2×109 вирусных частиц на мл.
Результаты, приведенные на фигуре 1, дополнительно демонстрируют, что кровь человека лишь минимально влияла на ColoAd1. Свежую кровь человека собирали из 9 субъектов (А-I), применяя пробирки с гепарином лития. Вирусные частицы ColoAd1 добавляли в образцы крови при разведении в 10 раз дозы 2×109 ВЧ/мл, что отражает потенциально эквивалентную дозу для человека, равную 1×1013 ВЧ/мл, учитывая, что доза оказывается полностью разбавленной в объеме всей крови (допустили, что он равен 5 л крови). После инкубации в течение 20 минут при 37°С смесь вирус/кровь добавляли к опухолевым клеткам А549, растущим в 96-луночном планшете. Затем через 5 дней определяли долю оставшихся жизнеспособными клеток А549 и наносили на график в виде процента. IC50 наблюдали на уровне, приблизительно эквивалентном концентрации вируса в крови, равной 2×106 ВЧ/мл. Данный уровень вируса, таким образом, установили как минимальный целевой уровень, которого нужно достичь в клинических исследованиях на человеке.
Также проводили несколько исследований in vitro взаимодействия ColoAd1 с кровяными клетками человека. Свежую кровь получали из 4 индивидов, и полученные эритроциты, тромбоциты и лейкоциты промывали и ресуспендировали в ФБР при физиологических концентрациях клеток (5×109, 2×108 и 6×106 на мл, соответственно) для использования в отдельных экспериментах. Анализ путем количественной ПЦР выявил, что более 80% (82%±8%) ColoAd1 было связано с кровяными клетками человека, главным образом, с эритроцитами и лейкоцитами. Не наблюдали существенных различий во фракции ColoAd1, связанного с кровяными клетками через 5 или 30 минут инкубации. Для Ad5 показали сравнительно более высокие уровни связывания с кровяными клетками человека (95,5±1,2%), чем для ColoAd1. На основании измерений относительной флуоресценции выявили, что предварительная инкубация ColoAd1-GFP с кровяными клетками человека в течение 30 минут значительно ингибировала (>90%) инфицирование опухолевых клеток SW480, которые экспрессируют лишь низкие уровни CD46, клеточного рецептора для ColoAd1. Инфицирование клеток НТ29, которые экспрессируют более высокие уровни CD46, ингибировалось в гораздо меньшей степени (~ 41%), вероятно по причине более высокого уровня экспрессии рецептора ColoAd1 на данных опухолевых клетках. Наконец, инфицирование лейкоцитов, которые могут экспрессировать высокие уровни CD46 и, таким образом, служить в качестве «поглотителей» ColoAd1, оценивали, применяя ColoAd1-GFP, чтобы определить уровень экспрессии трансгена. Через 24 часа не наблюдали признаков экспрессии трансгена в лейкоцитах. Предыдущие исследования, напротив, показали, что Ad5 способен эффективно инфицировать моноциты in vitro при таких же условиях. Подводя итог вышесказанному, данные исследования позволяют предположить, что взаимодействие ColoAd1 с клеточными компонентами крови ограничено и значительно отличается от такового для Ad5. Опять же, клинические исследования были разработаны с учетом этого.
Доклиническое исследование биораспределения ColoAd1
Биораспределение и клиренс ColoAd1 определяли у нормальных мышей и у трансгенных мышей, экспрессирующих основной рецептор вируса CD46 (рецептор для аденовирусов группы В, который не экспрессируется у нормальных мышей). После введения в хвостовую вену нормальных мышей 1×1011 вирусных частиц, вирусные частицы преимущественно обнаруживали в печени, селезенке и легких через 24 часа (на фигуре 2 указаны копии вируса на мг, и, следовательно, данные более крупные органы представляют собой доминирующие области суммарного распределения вируса в процентах). Аналогичное распределение по тем же целевым органам наблюдали у трансгенных по CD46 мышей (фигура 3), что указывает на то, что рецептор CD46 не является решающим фактором распределения. Распределение нереплицирующегося мутанта (ColoAd1CJ132) было идентично таковому для ColoAd1, что указывает на то, что любые из данных эффектов распределения не зависели от репликации. Тем не менее, для пациентов-людей, несущих опухоли, ожидали, что репликация вируса в раковых клетках, с последующим высвобождением, также приведет к дальнейшей амплификации вируса в более поздние моменты времени и, следовательно, клинические исследования были спланированы соответствующим образом.
Доклиническое исследование клиренса вируса
Для того, чтобы определить время полного клиренс вируса, осуществляли длительное исследование клиренса частиц у нормальных мышей BalbC. Для анализа выбрали основные органы распределения вируса: печень, селезенку и легкие. Здесь регистрировали суммарное количество вирусных частиц на орган как процент от введенной дозы в каждый момент времени таким образом, что результаты не нормировали на массу органа. Через 1 час большая часть введенного вируса уже связывалась печенью, при этом менее чем 5% связывалось селезенкой и менее чем 0,1% связывался легкими. Через 24 часа после инъекции вирусные частицы быстро выводились из данных органов, при этом оставалось менее 1% от введенных геномов вируса. Позже дня 65 после инъекции не обнаруживали каких-либо существенных уровней вируса в какой-либо ткани, и указанные уровни были незначительно выше фоновых. Не смогли получить вирусные частицы не из какой ткани в день 65 после введения. Кинетика клиренса вируса (результаты представлены как % от введенной дозы на орган) резюмирована на фигуре 4.
Трансгенным по CD46 мышам вводили ColoAd1 в хвостовую вену однократно при дозе, равной 1×1010 ВЧ/мышь. n=3 животных на момент времени. Копии генома (измеренные с помощью количественной ПЦР) представлены в виде процента от введенной дозы копий генома.
Доклиническое исследование иммуногенности
Возможно, что выработка специфического противовирусного иммунного ответа может значительно влиять на кинетику в кровотоке. Для того, чтобы исследовать данную возможность, группе мышей вводили ColoAd1 многократно в течение нескольких месяцев, чтобы получить пул гипериммунной сыворотки. Вторую группу мышей затем пассивно иммунизировали против ColoAd1, применяя гипериммунную сыворотку, которую вводили путем в/в инъекции в объеме 10 или 20 мкл. Данных мышей затем оставляли отдыхать в течение 10 минут перед в/в введением 5×1010 ColoAd1. Кровь собирали из каждой мыши через 2, 10 и 30 минут после инъекции ColoAd1, а затем анализировали с помощью количественной ПЦР. Результаты представлены на фигуре 5, и по ним видно, что иммунный ответ на ColoAd1 будет оказывать существенное влияние на кинетику и доставку ColoAd1, таким образом, демонстрируя важность введения доз до того, как выработается такой ответ.
Доклиническое исследование безопасности и токсичности
Проводили несколько исследований безопасности и токсичности ColoAd1, включая пилотные исследования на мышах CD-1 и Balb/c, трансгенных мышах CD46. В завершающем исследовании токсичности у самцов и самок мышей CD-1 ColoAd1 вводили в виде трех доз, которые давали в течение 5-дневного периода (в дни 1, 3 и 5), чтобы смоделировать предполагаемый клинический режим введения. Самцы и самки мышей CD-1 получали внутривенные болюсные инъекции ColoAd1 (объем дозы = 100 мкл) или буфер для состава, как показано в таблице 6, в которой продемонстрирован конечный дизайн исследования после того, как незапланированная гибель двух самцов из группы 4 в день 1 привела к снижению доз в данной конкретной группе.

Периодически измеряли стандартный набор ожидаемых параметров безопасности, включая клинические признаки, массу тела, уровни цитокинов в плазме, клиническую патологию и макроскопические и микроскопические исследования. Собирали стандартный перечень тканей и органов при аутопсии в дни 6 и 17.
Не наблюдали существенных клинических признаков неблагоприятного действия у самцов и самок в группах 1, 2 или 3 в любой день лечения. Клинические признаки неблагоприятного действия наблюдали в группе 4 после первой дозы в день 1 при дозах, равных как 2,2×1011, так и 6,96×1010 ВЧ/животное, но, за исключением одного самца из группы 4 в день 3, дальнейших неблагоприятных клинических признаков не наблюдали. Зависящую от дозы потерю массы тела в день 2 наблюдали во всех группах, которых лечили ColoAd1, за исключением самцов из группы 2, несмотря на то, что масса тела впоследствии не изменялась во всех группах лечения. Гематологические изменения и изменения функции печени, когда они были зарегистрированы, происходили в течение более длительного времени, но они возвращались к нормальному диапазону к моменту окончания периода восстановления. Подводя итог вышесказанному, наиболее существенные клинические признаки наблюдали после первой дозы, при этом последующие дозы переносились лучше.
Цитокиновые ответы с течением времени в данном исследовании показаны на фигуре 6. Повышение уровней цитокина МСР-1 было наиболее значительным, и такое повышение наблюдали в группах 3 и 4 в день 1 через 6 и 24 часа после первого лечения и через 6 часов после лечения в день 5. Не наблюдали устойчивого повышения уровня какого-либо другого цитокина в группе животных 2. Менее выраженное, но зависящее от дозы повышение уровней IL-6, IFNγ и TNFα наблюдали только в группах животных 3 и 4, чаще всего при низких концентрациях по сравнению с МСР-1 и часто лишь у некоторых животных в каждой группе лечения, особенно в группе 3.
Паттерн цитокинов, наблюдаемый в данном исследовании, таким образом, соответствует наблюдаемым клиническим признакам, свидетельствуя о том, что после первой дозы каждая последующая доза лучше переносится, даже несмотря на то, что дозы равны.
Клинические исследования
На момент подачи заявки проводится два клинических испытания для исследования безопасности и эффективности ColoAd1 при внутривенной доставке людям с метастатическим раком.
Исследование Evolve (ColoAd1-1001) представляет собой фазу I/II клинического исследования, в котором часть фазы I с увеличением дозы осуществляли на пациентах с метастатической опухолью из эпителия (любого происхождения), которые не получали дополнительных видов лечения. Пациентам в данной части с увеличением дозы указанного исследования вводили три равные внутривенные дозы ColoAd1 в дни 1, 3 и 5 (с интервалами по 48 часов). Применяли медленную внутривенную инфузию, и на ранних стадиях данного исследования каждому пациенту в группах вводили путем инфузии 30 мл суспензии вируса в течение 5-минутного периода (6 мл в минуту). Первоначально каждой группе из трех пациентов вводили дозы с одинарными логарифмическими приращениями, начиная с 1×1010 вирусных частиц на дозу и до тех пор, пока нежелательные явления не указали на ограничивающую дозу токсичность. Каждый пациент также получал симптоматическое профилактическое лечение, включая дополнительные жидкости и противовоспалительные средства по установленной схеме приема (ацетаминофен/парацетамол и ибупрофен). Безопасность и переносимость данного режима введения при каждом уровне дозы оценивали, применяя физические исследования (включая исследования крови, давления, пульса и температуры), и по возникновению всех нежелательных явлений, а также путем оценки гематологии, биохимии и изменений профиля цитокинов. Кинетику и выделение вируса оценивали, применяя регулярный отбор образцов крови, мочи, кала и мокроты. Эффективность оценивали с помощью серии КТ-визуализаций согласно целевым критериям. Более поздние стадии данного исследования будут проводить для того, чтобы исследовать безопасность и эффективность внутривенного введения максимально переносимой дозы (МПД) ColoAd1 у пациентов с метастатическим колоректальным раком.
Второе клиническое исследование (ColoAd1-1002) представляет собой фазу 0 исследования «окна возможностей» для сравнения внутривенной доставки ColoAd1 с доставкой непосредственно внутрь опухоли у пациентов с впервые диагносцированной первичной (не метастатической) колоректальной опухолью. Пациентам в данном исследовании перед операцией будут вводить дозы ColoAd1 и после операции иссеченные опухоли будут изучать для того, чтобы исследовать меру доставки, репликации и распространения вируса после двух различных режимов доставки и дозировки. Показатели безопасности и кинетики вируса в данном исследовании в широком смысле сходны с таковыми для ColoAd1-1001.
Пациентам в фазе I с увеличением дозы в исследовании ColoAd1-1001 вводили внутривенно дозы ColoAd1 на уровнях до и включая 1×1013 вирусных частиц, в 7 группах пациентов (т.е. группах с 1 по 7), как показано ниже в таблице 7.

Профиль побочных действий ColoAd1 в данном исследовании включал жар, гриппоподобное заболевание, трансаминит, тромбоцитопению, нейтропению, диарею и рвоту. Тем не менее, при уровне дозы, равном 1×1013 вирусных частиц, которые вводили путем инфузии в течение 5 минут, данная доза плохо переносилась. В частности, два пациента испытывали ограничивающую дозу токсичность (ОДТ), включая опосредованное цитокинами острое повреждение легких при данной дозе, и не могли перенести более чем разовую дозу. Одному пациенту потребовались стероиды для лечения данного состояния. Пациенты при данном уровне дозы также страдали от ознобов, гипертонии, боли, трансаминита, увеличения частичного тромбопластинового времени (ЧТВ) и увеличения количества D-димера, хотя все эти симптомы проходили со временем. В результате данного токсичного действия при этой плохо переносимой дозе, указанную дозу ColoAd1 уменьшили, а затем заново увеличили, используя более медленные скорости инфузии. При применении данной стратегии выявили, что все дозы 3×1012 ВЧ, которые вводили в течение либо 5 (группа 5), либо 20 минут (группа 6), и 6×1012 ВЧ, которые вводили путем инфузии в течение 40 минут (группа 7), хорошо переносились.
Данные результаты относительно безопасности являются предварительными на момент написания данной заявки, но они подтверждают, что полученный профиль очень близок к таковому, наблюдаемому у мышей. Тем не менее, у некоторых пациентов продолжались жар и слабость до второй недели, несмотря на отсутствие введения новых доз, данное явление согласуется с продолжающейся репликацией вируса в опухолях человека (явление, которое не будут наблюдать в не несущих опухоль мышах). Следовательно, итоговая максимально переносимая доза для людей предположительно составляла от 1×1012 до 1×1013 вирусных частиц, которые вводили в дни 1, 3 и 5 при скорости инфузии до 6×1011 ВЧ/мин, и при этом каждый пациент также получал профилактическое противовоспалительное лекарственное средство и вводимые внутривенно жидкости согласно протоколу ColoAd1-1001. Итоговый оптимальный режим введения доз затем подвергали дополнительным подтверждающим исследованиям.
В таблице 8 резюмированы ключевые фармакокинетические параметры вируса, измеренные с помощью количественной ПЦР для каждого пациента в части с увеличением дозы фазы I клинического исследования ColoAd1-1001. Полученные результаты в значительной степени согласуются с результатами доклинических исследований. Подводя итог вышесказанному, наблюдали зависимые от дозы Cmax и AUC, и средний период полураспределения составлял приблизительно 18 минут, хотя присутствовали признаки возможной кинетики насыщения при более высоких исследуемых дозах.
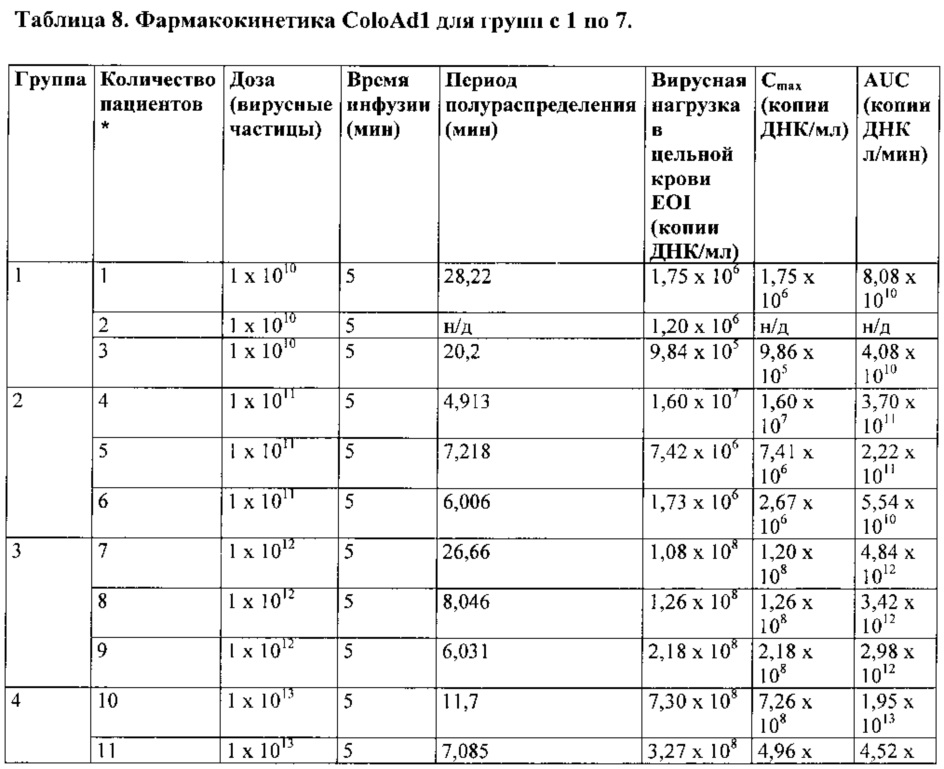

На фигуре 7 показан паттерн цитокинов, наблюдаемый у пациентов, страдающих от рака, которым вводили дозы в первоначальной фазе с увеличением дозы (до и включая определение ограничивающей дозу токсичности) клинического исследования ColoAd1-1001. Аналогично исследованиям на мышах, ответ воспалительных цитокинов, наблюдаемый у людей, достигал пика после первого введения ColoAd1, а затем снижался при последующих введениях. Интересно, что такой первоначальный эффект примирования ColoAd1 не всегда наблюдается при более низких дозах, но явно наблюдается при более высоких дозах, поддерживая утверждение, что режим введения высоких повторных доз при равных уровнях доз может быть оптимальным для внутривенного введения аденовирусов подгруппы В пациентам-людям, страдающим от рака.
В частности, на фигуре 7 показаны уровни цитокинов (мкг/л) с течением времени у страдающих раком пациентов-людей с метастатическими солидными эпителиальными опухолями после внутривенного введения доз ColoAd1, которые вводили в виде 5-минутных инфузий 30 мл суспензии вируса в дни 1, 3 и 5 (моменты введения доз указаны стрелками) при четырех различных уровнях доз (1e10, 1e11, 1е12 и 1е13 вирусных частиц, соответственно). Каждый пациент также получал профилактическое противовоспалительное лекарственное средство и вводимые внутривенно жидкости. Пациенты, которым вводили дозы до и включая 1e12, переносили данные дозы хорошо, у двух из четырех пациентов, которые получили дозу 1е13, развилась опосредованная цитокинами ограничивающая дозу токсичность, и они смогли получить только разовую дозу. Для отдельных пациентов повышенные уровни TNF и интерферона-гамма хорошо коррелировали с переносимостью, но повышенные уровни IL-6 - нет (результаты не представлены). Таким образом, определили, что скорости до 2е11 вирусных частиц в минуту можно считать хорошо переносимыми скоростями инфузии. Панель А - TNF; панель В - интерферон-гамма; панель С - IL-6.
На фигуре 8 показана системная фармакокинетика ColoAd1 (копии генома на мл крови) у страдающих раком пациентов-людей с метастатическими солидными эпителиальными опухолями. Копии генома измеряли с помощью количественной ПЦР.
В частности, на фигуре 8А показан средний уровень ColoAd1 в плазме у трех пациентов из исследования ColoAd1-1001, которым вводили хорошо переносимые дозы (1е12 ВЧ на дозу) при скорости введения 2е11 ВЧ/мин в виде равных внутривенных доз ColoAd1, которые вводили в виде инфузий в течение 5 минут 30 мл суспензии вируса в дни 1, 3 и 5 (моменты введения доз указаны стрелками). Характерна тенденция к увеличению пиков концентрации вируса с каждой последующей дозой.
Это явно показывает полезное влияние предложенного режима введения на фармакокинетику вируса, при котором пиковые уровни вируса после второй и третьей дозы последовательно возрастали относительно пиковых уровней вируса после первой дозы. Эти результаты демонстрируют пользу насыщения или устранения нераковых поглотителей вирусов путем введения более ранних доз. Такая доза хорошо переносилась данными тремя пациентами.
На фигуре 8В показаны средние значения первоначальной фармакокинетики (копии вирусной ДНК/мл) после введения первой дозы вируса при четырех различных уровнях доз для групп пациентов с 1 по 4 (1×1010, 1×1011, 1×1012 и 1×1013 вирусных частиц, соответственно) в клиническом исследовании ColoAd1-1001. В каждом случае дозу вводили в течение 5 минут, и, следовательно, скорость инфузии вируса повышалась от 2×109 вирусных частиц в минуту при наименьшей дозе до 2×1012 вирусных частиц в минуту при наибольшей дозе. При двух наибольших дозах концентрация вируса в крови оставалась на уровне выше 2×106 вирусных частиц на мл в течение длительного периода. Это минимальный уровень в крови (как прогнозировали по доклиническим исследованиям и показали на фигуре 1), который эффективно создает инфекцию внутри опухоли. Для дозы 11×1012 данный целевой уровень достигается в течение от 1 до 2 часов, тогда как для дозы 1×1013 данный целевой уровень сохраняется в течение более 6 часов. Тем не менее, доза вирусных частиц 1×1013, которую вводили при скорости 2×1012 вирусных частиц в минуту, плохо переносилась, при этом у двух пациентов наблюдалась острая опосредованная цитокинами ограничивающая дозу токсичность, и, следовательно, данный режим введения доз не был оптимальным. Режим введения доз с использованием хорошо переносимой скорости инфузии (такой как 2×1011 вирусных частиц в минуту или еще медленнее) может позволить введение дозы вплоть до и возможно выше, чем 1×1013 вирусных частиц. Используя данные результаты затем можно применить фармакокинетическое моделирование, чтобы показать, что доза, равная 1×1013 вирусных частиц, которую вводят путем инфузии в течение одного часа (1,67×1011 вирусных частиц в минуту), будет поддерживать уровни вируса в крови выше целевого уровня 2×106 в течение трех часов или более у большинства пациентов.
На фигурах 9А-9Н показана фармакокинетика для пациентов в клиническом испытании ColoAd1-1001. Пациентам вводили первую дозу ColoAd1 и затем оценивали вирусную нагрузку после серии взятий крови, применяя количественную ПЦР. Исследовали следующие режимы лечения.
Фигура 9А: 1e10 (1×1010) вирусных частиц вводили в течение 5 минут (группа 1);
фигура 9В: 1e11 (1×1011) вирусных частиц вводили в течение 5 минут (группа 2);
фигура 9С: 1е12 (1×1012) вирусных частиц вводили в течение 5 минут (группа 3);
фигура 9D: 1е13 (1×1013) вирусных частиц вводили в течение 5 минут (группа 4);
фигура 9Е: 3е12 (3×1012) вирусных частиц вводили в течение 5 минут (группа 5);
фигура 9F: 3е12 (3×1012) вирусных частиц вводили в течение 20 минут (группа 6); и
фигура 9G: 6е12 (6×1012) вирусных частиц вводили в течение 40 минут (группа 7).
На каждой кривой представлены уровни вируса в крови, измеренные для отдельного исследуемого субъекта в единицу времени до введения ColoAd1 и вплоть до приблизительно 6 часов после лечения.
Неблагоприятные побочные действия впервые наблюдали у пациентов, когда уровни вируса в крови превышали порог, равный приблизительно 3е8 геномов вируса на мл.
Следовательно, определили, что диапазон приблизительно от 3е7 до 3е8 геномов вируса на мл представляет собой идеальный терапевтический диапазон и что режим, который позволит сохранить уровни вируса в крови в рамках данного диапазона в течение как можно большего периода времени, позволит максимизировать уровни вируса в крови, при этом минимизируя токсичные побочные действия.
По фармакокинетическим кривым можно видеть, что на фигуре 9G (6е12 частиц, которые вводили в течение 40 минут) показан особенно подходящий профиль с уровнями вируса в крови, которые дольше всего сохраняются в пределах терапевтического диапазона.
На фигуре 10 показано сравнение уровней CMax, когда одну и ту же дозу вводили пациентам в исследовании ColoAd1-1001 в виде либо медленной инфузии, либо быстрой инфузии. Обеим группам 5 и 6 вводили суммарную дозу, равную 3×1012 вирусных частиц, но группе 5 указанную дозу вводили путем инфузии в течение 5 минут (быстрая инфузия), а группе 6 указанную дозу вводили путем инфузии в течение 20 минут (медленная инфузия). Можно наблюдать, что замедление скорости инфузии может эффективно приводить к меньшему изменению Cmax и более низкому среднему уровню Cmax, и, следовательно, ограничение скорости инфузии аденовируса группы В, таким образом, уместно, когда более высокие уровни Cmax связаны с токсичностью.
На фигуре 11 показаны уровни МСР1 (мкг/л) с течением времени у страдающих раком пациентов-людей после внутривенного введения доз ColoAd1 в дни 1, 3 и 5 (моменты введения доз указаны стрелками) в клиническом исследовании ColoAd1-1001. На диаграмме показано сравнение между различными группами пациентов (с 1 по 7), каждой из которых вводили дозы в соответствии с различными режимами введения, показанными в таблице 7.
Измерения уровней МСР1 (мкг/л) осуществляли в следующие моменты времени: 0 часов, 6 часов, 12 часов, 24 часа, 48 часов, 54 часа, 60 часов, 72 часа, 96 часов, 102 часа, 108 часов, 120 часов, 168 часов и 336 часов. Данные результаты исследования на человеке отражают паттерн, аналогичный таковому, наблюдаемому у мышей, со снижением уровней МСР1 после каждой дозы для каждой исследуемой дозы, таким образом, поддерживая особую пользу предложенного режима введения доз.
Паттерн цитокинов, наблюдаемый на фигуре 12, согласуется с паттернами цитокинов, ранее наблюдаемыми в исследованиях на мышах (см. фигуру 6), и видно, что после первой дозы каждая последующая доза лучше переносилась, даже если все 3 указанные дозы были равны.
Исследования, показывающие, что инфекцию опухолей аденовирусом типа В можно сформировать с помощью доз вирусных частиц, которые вводят путем в/в инъекции.
На фигуре 12 показан цикл репликации, типичный для аденовируса. Структурные белки аденовируса, например, гексон, который составляет 90% капсида вируса, экспрессируются лишь на позднем этапе в процессе инфекции, после того как произошла репликация. Указанные белки затем транспортируются обратно в ядро для сборки. Ядро, таким образом, содержит наиболее высокую концентрацию гексона и других структурных белков во время репликации. Следовательно, можно применять окрашивание гексона в ядре для количественного анализа аденовируса и в качестве маркера клеток, которые были успешно инфицированы ColoAd1.
В клиническом исследовании ColoAd1-1002 пациенты с первичными (не метастатическими) колоректальными опухолями получили ColoAd1 либо путем внутриопухолевой (в/о) доставки, или либо путем внутривенной (в/в) доставки. В группе с в/о введением вирус вводили через колоноскоп при дозе, равной до 1е8 ВЧ, в виде нескольких инъекций (фактическая доза зависела от размера опухоли). В группе с в/в введением доза составляла 1е12 ВЧ, которые вводили в виде инфузии в течение 5 мин в дни 1, 3 и 5. Затем, через 7-14 дней после введения первой дозы ColoAd1, первичную опухоль иссекали и посылали на патологическое исследование, включая иммуногистохимическое (ИГХ) окрашивание на гексон ColoAd1.
Срезы фиксированных в формалине и заключенных в парафин образцов опухоли человека анализировали для выявления наличия вируса, применяя антитело к гексону (ab8251).
Окрашивание осуществляли, применяя утвержденный анализ с применением Benchmark Ultra от Ventana. Сильное окрашивание ядер свидетельствовало о присутствии гексона, участвующего в сборке капсида.
Изотипические контроли обрабатывали одновременно и при тех же условиях.
На фигуре 13 показано изображение, полученное с помощью трансмиссионной электронной микроскопии (ТЭМ), линии клеток колоректального рака, инфицированного ColoAd1 in vitro.
На фигуре 14А показаны изображения окрашивания клеток образца опухоли, которая была инфицирована ColoAd1 после внутриопухолевой инъекции (в/о), а затем окрашена на гексон. Можно наблюдать, что присутствует значительное окрашивание ядер в клетках карциномы, тогда как не наблюдается окрашивания ядер стромальных клеток. На фигуре 14В показан соответствующий изотипический контроль. В совокупности на данных стеклах видно, что ColoAd1 заражает опухолевые клетки избирательно, не инфицируя нормальные клетки, после доставки непосредственно внутрь опухоли.
На фигуре 14С показано изображение окрашивания клеток образца опухоли, которая была инфицирована ColoAd1 после внутривенного (в/в) введения, а затем окрашена на гексон. Можно наблюдать, что присутствует значительное окрашивание ядер в клетках карциномы, тогда как не наблюдается окрашивания ядер стромальных клеток. На фигуре 14D представлен соответствующий изотипический контроль.
Следовательно, данные изображения представляют явные доказательства того, что ColoAd1 можно избирательно доставлять в опухолевые клетки таким способом, который эквивалентен внутриопухолевой доставке, применяя предложенный внутривенный режим введения.
Пример 2. Комбинация лекарственных средств
Оценивали репликацию вируса ColoAd1 в присутствии 320 клинически одобренных соединений или находящихся в разработке соединений в линии клеток карциномы толстого кишечника НТ-29. Клетки НТ-29 высевали при плотности 3,0е4 клеток на лунку в 96-луночные планшеты и инкубировали при 37°С, 5% СО2. После 4-6 часов инкубации клеток, смеси вируса и лекарственного соединения, приготовленные в средах для культивирования, разбавляли добавлением к клеткам с получением конечных доз ColoAd1, равных 10 вирусным частицам на клетку (ч/к), и 0,1 мкМ лекарственного соединения. Клетки инкубировали в течение 18 часов, а затем оценивали суммарное количество геномов вируса в клетках с помощью количественной ПЦР. Относительную кратность изменения репликации ColoAd1 по сравнению с вирусом ColoAd1 отдельно наносили на график на фигуре 15 для всех соединений. На вставке показано увеличение репликации вируса после 18 часов в присутствии ингибиторов микротрубочек и уменьшение репликации вируса в присутствии ингибиторов топоизомеразы.
Влияние лечения паклитакселом или цисплатином на эффективность ColoAd1 в модели опухоли оценивали в модели рака яичников при интраперитонеальном (и/п) введении. Мышам SCID имплантировали 2,5е6 экспрессирующих люциферазу клеток карциномы яичника человека SKOV-3. Опухолевые массы оценивали по экспрессии люциферазы. Изображения мышей получали в день 5, в день перед каждой серией лечений и по меньшей мере каждые 5-7 дней на всем протяжении исследования. Все виды лечения ColoAd1 осуществляли, применяя 5е9 вирусных частиц, которые доставляли путем интраперитонеальной инъекции, и в группах с комбинированным лечением паклитаксел (0,4 мг) или цисплатин (0,04 мг) доставляли на следующий день после лечения вирусом. Прогрессирование заболевания оценивали путем визуализации люциферазы, применяя систему визуализации IVIS. Изображения относительной люминесценции в мышах, которым вводили путем и/п инъекции либо ФБР (А), либо паклитаксел (В), либо ColoAd1 (С), либо паклитаксел и ColoAd1 (D), показаны на фигуре 16, и относительная люминесценция, прослеженная с течением времени для каждой группы введения доз, показана на фигуре 17. Относительная люминесценция в мышах, которым вводили путем и/п инъекции либо ФБР (группа 1), либо ColoAd1 и затем цисплатин (группа 2), либо цисплатин и затем ColoAd1 (группа 3), либо паклитаксел и ColoAd1 (группа 4), показаны на фигуре 18. Расписания введения доз подробно описаны на фигурах 17 и 18.
Реферат
Группа изобретений касается лечения опухоли. Предложены: способ лечения опухоли у пациента-человека, включающий системное внутривенное введение множества доз парентерального состава способного реплицироваться онколитического аденовируса подгруппы В (в частности, химерного аденовируса Ad11/Ad3) в рамках одного цикла лечения, при этом суммарная доза, доставляемая при каждом введении, находится в диапазоне от 1×10до 1×10вирусных частиц на дозу, и каждую дозу вируса вводят с обеспечением скорости доставки вирусных частиц в диапазоне от 2×10частиц в минуту до 6×10частиц в минуту (варианты), способ лечения опухоли посредством комбинированной терапии, способ лечения рака яичников, применение указанного аденовируса серогруппы В для лечения опухоли у человека (варианты), применение шприца, содержащего состав для инъекции или инфузии с указанным аденовирусом серогруппы В. Технический результат состоит в определении переносимой и безопасной дозы ColoAd1 для пациента-человека с опухолью и условий её введения; показано полезное влияние заявленного режима введения на фармакокинетику вируса и устранение нераковых поглотителей вирусов; побочные действия указанного режима (жар, слабость) у некоторых пациентов продолжались до второй недели в связи с продолжающейся репликацией вируса в опухолях. 8 н. и 20 з.п. ф-лы, 25 ил.

Комментарии