Агенты, связывающие рецептор "frizzled", и их применение - RU2579897C2
Код документа: RU2579897C2
Чертежи



































































































































Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0001] Область настоящего изобретения в целом относится к антителам и другим агентам, связывающимся с рецептором (рецепторами) "frizzled" человека, а также к способам применения антител для лечения заболеваний, таких как рак.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0002] Рак представляет собой одну из ведущих причин смерти в развитых странах мира, при этом в одних только Соединенных Штатах насчитывается более миллиона людей с диагнозом рак и 500000 смертей в год. В целом, по оценкам более чем у 1 из 3 людей развиваются те или иные формы рака в ходе их жизни. Существует более 200 различных типов рака, четыре из которых, рак молочной железы, рак легких, рак толстой кишки и рак простаты, в настоящее время составляют более половины всех случаев заболевания (Jemal et al., 2003, Cancer J. Clin. 53:5-26).
[0003] Было показано, что сигнальный путь, опосредованный Wnt, является потенциальной мишенью при терапии рака. Сигнальный путь, опосредованный Wnt, представляет собой один из нескольких ключевых регуляторов формирования плана строения эмбриона, постэмбрионального поддержания тканей и биологии стволовых клеток. В частности, сигнальный путь с участием Wnt, играет важную роль в формировании полярности клеток и определении пути их развития, в том числе в самоподдержании популяции стволовых клеток. Неконтролируемая активация сигнального пути через Wnt ассоциирована с многочисленными формами рака человека, где она может изменять судьбу развития опухолевых клеток, поддерживая их в недифференцированном и пролиферирующем состоянии. Таким образом, канцерогенез может развиваться за счет использования механизмов гомеостаза, контролирующих нормальное развитие и восстановление тканей с помощью стволовых клеток (см. обзор Reya & Clevers, 2005, Nature 434:843; Beachy et al., 2004, Nature 432:324).
[0004] Сигнальный путь, опосредованный Wnt, был впервые выявлен в отношении мутанта дрозофилы с аномалиями развития wingless (wg) и мышиного протоонкогена int-1, в настоящее время известного как Wnt1 (Nusse & Varmus. 1982, Cell 31:99-109; Van Ooyen & Nusse, 1984, Cell 39:233-40; Cabrera et al, 1987, Cell 50:659-63; Rijsewijk et al., 1987, Cell 50:649-57). Гены Wnt гены кодируют секретируемые липид-модифицированные гликопротеины, 19 из которых выявлены у млекопитающих. Такие секретируемые лиганды активируют рецепторный комплекс, включающий представитель семейства рецепторов "frizzled" (FZD) и белки 5 или 6, родственные рецептору липопротеинов низкой плотности (ЛПНП) (LPR5/6). Рецепторы FZD представляют собой белки с семью трансмембранными доменами из надсемейства G-белок-сопряженных рецепторов (GPCR) и содержат большой внеклеточный N-концевой лиганд-связывающий домен с 10 консервативными цистеинами, известный как богатый цистеином домен (cysteine-rich domain, CRD) или Fri-домен. У человека известно десять рецепторов FZD: FZD1-10. Различные CRD-домены белков Fzd обладают различным сродством связывания с конкретными лигандами Wnt (Wu & Nusse, 2002, J Biol. Chem. 277:41762-9), и среди рецепторов FZD выделяют группы, активирующие канонический β-катениновый путь, и активирующие неканонические пути, описанные ниже (Miller et al., 1999, Oncogene 18:7860-72). Для формирования рецепторного комплекса, связывающего лиганды FZD, рецепторы FZD взаимодействуют с LRP5/6, белками, содержащими трансмембранный домен, пронизывающий мембрану один раз, и четыре внеклеточных EGF-подобных домена, разделенных шестью повторами аминокислот YWTD (Johnson et al., 2004, J. Bone Mineral Res. 19:1749).
[0005] Канонический сигнальный путь через Wnt, активируемый при связывании рецептора, опосредован цитоплазматическим белком Dishevelled (Dsh), взаимодействующим непосредственно с рецептором Fzd, и приводит к стабилизации и накоплению цитоплазматического β-катенина. В отсутствие сигнала Wnt, β-катенин локализован в цитоплазматическом деструкционном комплексе, включающем опухоль-супрессорные белки АРС (adenomatous polyposis coli, аденоматозный полипоз толстой кишки) и Аксин. Эти белки играют роль необходимой основы, позволяющей гликоген-синтаза-киназе (GSK)-3f3 связывать и фосфорилировать β-катенин, направляя его (маркируя) на убиквитин/протеасомный путь деградации. Активация Dsh приводит к фосфорилированию GSK3P и диссоциации деструкционного комплекса. Накопленный цитоплазматический β-катенин затем транспортируется в ядро, где он взаимодействует с ДНК-связывающими белками семейства Tcf/Lef, что приводит к активации транскрипции.
[0006] Наряду с каноническим сигнальным путем, лиганды Wnt также активируют β-катенин-независимые пути (Veeman et al., 2003, Dev. Cell 5:367-77). Неканонические сигнальные пути, опосредованные Wnt, задействованы в различных процессах, но наиболее изучена их роль в перемещении клеточных масс в ходе гаструляции через механизм, схожий с путем формирования плоскостной полярности клеток (planar cell polarity, РСР) у дрозофилы. Другие возможные механизмы неканонических сигнальных путей, опосредованных Wnt, включают изменение концентрации кальция, JNK, а также как малые, так и гетеротримерные G-белки. Часто наблюдается антагонизм между каноническими и неканоническими путями, и ряд данных указывает на то, что неканонический сигнальный путь может подавлять развитие рака (Olson & Gibo, 1998, Exp.Cell Res. 241:134; Topol et al., 2003, J. Cell Biol. 162:899-908). Таким образом, при определенных условиях рецепторы FZD выступают в качестве негативных регуляторов канонического сигнального пути, опосредованного Wnt. Например, FZD6 подавляет индуцированный Wnt-3а канонический сигнальный путь при коэкспрессии с FZD1 посредством пути TAK1-NLK (Golan et al., 2004, JBC 279:14879-88). Аналогичным образом, Fzd2 антагонизирует канонический сигнальный путь, опосредованный Wnt, в присутствии Wnt-5a посредством каскада TAK1-NLK МАРК (Ishitani et al., 2003, Mol. Cell. Biol. 23:131-9).
[0007] Канонический сигнальный путь, опосредованный Wnt, также играет центральную роль в поддержании популяции стволовых клеток в тонкой и толстой кишке, и неконтролируемая активация этого пути играет важную роль в развитии колоректального рака (Reya & С levers, 2005, Nature 434:843). Всасывающий эпителий кишечника образован ворсинками и криптами. Стволовые клетки располагаются в криптах и делятся медленно с образованием быстро пролиферирующих клеток, дающих начало всем популяциям дифференцированных клеток, перемещаются вверх из крипт и заселяющих ворсинки кишечника. Сигнальный каскад через Wnt играет доминирующую роль в контроле судьбы клеток вдоль оси крипта-ворсинка оси, и он важен для поддержания популяции стволовых клеток. Нарушение сигнального пути через Wnt, либо за счет генетической потери Tcf7/2 путем гомологичной рекомбинации (Korinek et al., 1998, Nat. Genet. 19:379) или за счет сверхэкспрессии Dickkopf-1 (Dkkl), сильного секретируемого антагониста Wnt (Pinto et al., 2003, Genes Dev. 17:1709-13; Kuhnert et al., 2004, Proc. Nat'I. Acad. Sci. 101:266-71), приводит к истощению популяции стволовых клеток кишечника.
[0008] Наиболее часто колоректальный рак развивается в результате возникновения мутаций компонентов сигнального пути, опосредованного Wnt. Примерно 5-10% всех случаев колоректального рака являются наследственными, при этом одной из основных форм является семейный аденоматозный полипоз (САП), аутосомно-доминантное заболевание, при котором примерно около 80% больных несут мутации зародышевой линии в гене аденоматозного кишечного полипоза (adenomatous polyposis coli, АРС). Также были выявлены мутации в других компонентах пути, опосредованного Wnt, в том числе в генах аксина и β-катенина. Отдельные аденомы представляют собой клональные выросты эпителиальных клеток, содержащих вторую инактивированную аллель, и большое количество аденом САП неизбежно приводит к развитию аденокарцином вследствие дополнительных мутаций в онкогенах и/или генов-супрессоров опухолей. Кроме того, активация сигнального пути, опосредованного Wnt, в том числе за счет мутаций с приобретением функции (gain-of-function) в генах АРС и β-катенина, может вызывать гиперпластическое развитие и опухолевый рост на мышиных моделях (Oshima et al., 1997, Cancer Res. 57:1644-9; Harada et al., 1999, EMBO J. 18:5931-42).
[0009] Роль сигнального пути, опосредованного Wnt, в развитии рака, была впервые показана при идентификации Wnt1 (первоначально intl) в качестве онкогена в опухолях молочной железы, трансформированного в результате близлежащей вставки мышиного вируса (Nusse & Varmus, 1982, Cell 31:99-109). Были получены дополнительные доказательства роли сигнального пути через Wnt, в развитии рака молочной железы. Например, трансгенная сверхэкспрессия β-катенина в молочных железах приводит к гиперплазии и развитию аденокарциномы (Imbert et al., 2001, J. Cell Biol. 153:555-68; Michaelson & Feeler, 2001, Oncogene 20:5093-9), тогда как утрата сигнального пути, индуцируемого Wnt, нарушает нормальное развитие молочных желез (Tepera et al, 2003, J. Cell Sci. 116:1137-49; Ilatsell et al., 2003, J. Mammary Gland Biol. Neoplasia 8:145-58). Совсем недавно было показано, что стволовые клетки молочной железы активируются сигнальным путем с участием Wnt, ((Liu et al., 2004, Proc. Nat'I Acad. Sci. 101:4158). При раке молочной железы у человека, накопление β-катенина связано с активацией сигнального пути через Wnt в более 50% карцином, и хотя конкретные мутации не были выявлены, наблюдали повышение уровня экспрессии рецептора "frizzled" (Brennan & Brown, 2004, J. Mammary Gland Neoplasia 9:119-31; Malovanovic et al.,, 2004. Int. J. Oncol. 25:1337-42).
[0010] FZD10, FZD8, FZD7, FZD4 и FZD5 - пять из десяти выявленных рецепторов Wnt человека. FZD10 экспрессируется совместно с Wnt7b в легких, и исследования с помощью трансфекции показали, что корецептор Fzd10/LRP5 активирует канонический сигнальный путь через Wnt в ответ на Wnt7b (Wang et al, 2005, Mol. Cell Biol. 25:5022-30). Содержание мРНК FZD10 повышено в различных раковых клеточных линиях, в том числе в клетках рака шейки матки, рака желудка, и клеточной линии глиобластомы, и при первичном раке, в том числе примерно 40% первичного рака желудка, рака толстой кишки и синовиальной саркомы (Saitoh et al, 2002, Int. J. Oncol. 20:117-20; Ferasaki et al, 2002, Int. J. Mol. Med. 9:107-12; Nagayama et al., 2005, Oncogene 1-12). Экспрессия FZD8 повышена в нескольких линиях раковых клеток человека, первичного рака желудка и рака почек (Saitoh et al., 2001, Int. J. Oncol. 18:991-96; Kirikoshi et al., 2001, Int. J. Oncol. 19:111-5; Janssens et al., 2004, Tumor Biol. 25:161-71). FZD7 экспрессируется в клетках всего желудочно-кишечного тракта, и его экспрессия повышена в одном из шести случаев первичного рака желудка человека (Kirikoshi et al., 2001, Int. J. Oncol. 19:111-5). Экспрессия эктодомена FZD7 линии клеток рака толстой кишки индуцировала морфологические изменения и замедлению опухолевого роста на модели ксенотрансплантата (Vincan et al., 2005, Differentiation 73:142-53). FZD5 играет важную роль в ангиогенезе желточного мешка и плаценты (Ishikawa et al, 2001, Dev. 128:25-33) и его экспрессия повышена в почечной карциноме в сочетании с активацией сигнального пути Wnt /Р-катенин ((Janssens et al., 2004, Tumor Biology 25:161-71). FZD4 экспрессируется на высоком уровне в эпителиальных клетках крипт кишечника и является одним из факторов, демонстрирующих дифференциальную экспрессию в нормальных тканях, в сравнении с неопластическими тканями (Gregorieff et al., 2005, Gastroenterology 129:626-38). Идентификация рецепторов FZD как маркеров раковых стволовых клеток, таким образом, делает эти белки идеальными мишенями для терапии рака.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0011] Настоящее изобретение обеспечивает новые агенты, которые связывают один или более рецептор "frizzled" (FZD) человека, включающие, но не ограниченные перечисленными, антитела или другие агенты, связывающие два или более рецепторов "frizzled" человека, а также способы применения указанных агентов. Настоящее изобретение, кроме того, обеспечивает новые полипептиды, такие как антитела, которые связывают один или более рецепторов "frizzled", фрагменты таких антител и другие полипептиды, имеющие отношение к таким антителам. В некоторых вариантах реализации агенты, антитела, другие полипептиды или агенты, связывающиеся с FZD, связываются с областью FZD, именуемой в настоящей заявке биологическим сайтом связывания (БСС), который впервые был идентифицирован авторами настоящего изобретения как мишень для ингибирования сигнального пути с участием Wnt и/или опухолевого роста. Также предусмотрены антитела и другие полипептиды, включающие антиген-связывающий сайт, который связывает более одного FZD. Настоящее изобретение также обеспечивает полинуклеотиды, включающие последовательности нуклеиновых кислот, кодирующие указанные полипептиды, например, векторы, содержащие указанные полинуклеотиды. Кроме того, настоящее изобретение обеспечивает клетки, включающие указанные полипептиды и/или полинуклеотиды. Также настоящее изобретение обеспечивает композиции (например, фармацевтические композиции), которые содержат новые FZD-связывающие агенты или антитела. Кроме того, предусмотрены способы получения и применения новых FZD-связывающих агентов или антител, например, способы применения новых FZD-связывающих агентов или антител для ингибирования опухолевого роста и/или лечения рака.
[0012] Таким образом, в одном своем аспекте настоящее изобретение обеспечивает агент, специфично связывающий рецептор "frizzled" человека. В некоторых вариантах реализации указанный агент ингибирует связывание лиганда (например, Wnt) с биологическим сайтом связывания (БСС) рецептора "frizzled" человека. В некоторых вариантах реализации указанный агент связывается по меньшей мере с частью биологического сайта связывания (БСС) в составе рецептора "frizzled" человека. В некоторых вариантах реализации агент, связывающийся с БСС, вызывает ингибирование сигнального пути, индуцируемого Wnt и/или опухолевого роста. В некоторых вариантах реализации рецептор "frizzled" человека представляет собой FZD8, а агент связывается по меньшей мере с частью (а) конформационного эпитопа FZD8, образованного аминокислотами (F), 74-75(PL), 78(I), 92(Y), 121-122(LM) и 129-132(WPDR (SEQ ID NO: 70)) (б) области FZD8, включающей последовательность QDEAGLEVHQFWPL (SEQ ID NO: 67), и/или (в) области FZD8, включающей последовательность QYGFA (SEQ ID NO: 66). В некоторых вариантах реализации рецептор "frizzled" человека выбран из группы, включающей FZD1, FZD2, FZD5, FZD7 или FZD8, а указанный агент, связывается по меньшей мере с частью последовательности Q(DE/ED)AGLEVHQF(YAI)PL (SEQ ID NO: 24) в составе рецептора "frizzled" человека. Например, в некоторых вариантах реализации рецептор "frizzled" человека представляет собой FZD8, а агент связывается по меньшей мере с частью последовательности QDEAGLEVHQFWPL (SEQ Ш NO: 67) в составе FZD8. В некоторых вариантах реализации агент связывается по меньшей мере с частью последовательности GLEVIIQ (SEQ ID NO: 25). В некоторых вариантах реализации рецептор "frizzled" человека представляет собой FZD1, FZD2, FZD3, FZD4, FZD5, FZD6, FZD7, FZD9 или FZD10, и указанный агент связывается по меньшей мере с частью области рецептора "frizzled" человека, соответствующей области FZD8, включающей QDEAGLEVHQFWPL (SEQ ID NO: 67). В некоторых вариантах реализации указанный агент связывается по меньшей мере с частью последовательности K/Q)(F/Y)GF(Q/A) (SEQ ID NO: 69) в составе FZD1, FZD2, FZD5, FZD7 и/или FZD8. Например, в некоторых вариантах рецептор "frizzled" человека представляет собой FZD8, а указанный агент связывается по меньшей мере с частью последовательности QYGFA (SEQ Ш NO: 66) в составе FZD8. В некоторых альтернативных вариантах реализации рецептор "frizzled" человека представляет собой FZD1, FZD2, FZD3, FZD4, FZD5, FZD6, FZD7, FZD9 или FZD 10, а указанный агент связывается по меньшей мере с частью области рецептора "frizzled" человека, соответствующей области FZD8, включающей QYGFA (SEQ ID NO: 66). В некоторых вариантах реализации указанный агент специфично связывается с двумя или более, тремя или более, или четырьмя или более рецепторами "frizzled" человека. В некоторых вариантах реализации указанный агент специфично связывается с рецепторами "frizzled" человека, включающими FZD5 и FZD8.
[0013] В другом аспекте настоящее изобретение, обеспечивает агент, конкурирующий за специфичное связывание с рецептором "frizzled" человека с антителом (например, in vitro конкурентно-связывающий анализ), при этом указанное антитело содержит вариабельную область тяжелой цепи, включающую SEQ ID NO: 10 и вариабельную область легкой цепи, включающую SEQ ID NO: 12 или SEQ ID NO: 14. В некоторых вариантах реализации указанное антитело содержит вариабельную область тяжелой цепи, включающую SEQ ID NO: 10 и вариабельную область легкой цепи, включающую SEQ ID NO: 14. В некоторых вариантах реализации указанный агент конкурирует за специфичное связывание с двумя или более, или тремя или более, или четырьмя или более рецепторами "frizzled" человека. В некоторых вариантах реализации агент конкурирует за специфичное связывание с FZD1, FZD2, FZD5, FZD7 или FZD8.
[0014] В другом своем аспекте настоящее изобретение обеспечивает агент, конкурирующий за специфичное связывание с FZD5 и/или FZD8 человека с антителом, которое содержит вариабельную область тяжелой цепи, включающую SEQ ID NO: 85, и вариабельную область легкой цепи, включающую SEQ ID NO: 86.
[0015] В другом своем аспекте настоящее изобретение обеспечивает агент, специфично связывающийся с двумя или более рецепторами "frizzled" человека. В некоторых вариантах реализации указанные два или более рецептора "frizzled" включают: (a) FZD1 и второй рецептор "frizzled", выбранный из группы, включающей FZD2, FZD5, FZD7 и FZD8; (б) FZD2 и второй рецептор "frizzled", выбранный из группы, включающей FZD5, FZD7 и FZD8; (в) FZD5 и FZD7, или (г) FZD7 и FZD8. В некоторых вариантах реализации указанный агент специфично связывается с тремя или более (т.е. 3, 4 или 5) рецепторами "frizzled" человека, при этом указанные три или более рецептора "frizzled" человека включают FZD1, FZD2, FZD5, FZD7 и/или FZD8. В некоторых вариантах реализации три или более рецептора человека включают FZD5 и FZD8. В некоторых вариантах реализации указанные три или более рецептора "frizzled" человека дополнительно включают FZD3, FZD4, FZD6, FZD9 и/или FZD 10.
[0016] В другом своем аспекте настоящее изобретение обеспечивает полипептид, специфично связывающийся с рецептором "frizzled" человека, при этом указанный полипептид содержит вариабельную область тяжелой цепи, включающую: (a) CDR1 тяжелой цепи, включающий GFTFSHYTLS (SEQ ID NO: 1), или его вариант, включающий 1, 2, 3 или 4 замены аминокислот, (б) CDR2 тяжелой цепи, включающий VISGDGSYTYYADSVKG (SEQ ID NO: 2), или его вариант, включающий 1, 2, 3 или 4 замены аминокислот; и/или (в) CDR3 тяжелой цепи, включающий NFIKYVFAN (SEQ ID NO: 3), или его вариант, включающий 1, 2, 3 или 4 замены аминокислот.В некоторых вариантах реализации указанный полипептид специфично связывается с FZD1, FZD2, FZD5, FZD7 и/или FZD8. В некоторых вариантах реализации полипептид специфично связывается с двумя или более рецепторами "frizzled" человека, включающими FZD5 и FZD8. В некоторых вариантах реализации замены аминокислот представляют собой консервативные замены.
[0017] В дополнительных аспектах настоящее изобретение обеспечивает полипептид, специфично связывающийся с рецептором "frizzled" человека, при этом указанный полипептид содержит вариабельную область легкой цепи, включающую: (а) CDR1 легкой цепи, включающий SGDKLGKKYAS (SEQ ID NO: 4) или SGDNIGSFYVH(SEQ ID NO: 7), или вариант SEQ ID NO: 4 или SEQ ID NO: 7, включающий 1, 2, 3 или 4 замены аминокислот, (б) CDR2 легкой цепи, включающий EKDNRPSG (SEQ ID NO: 5) или DKSNRPSG (SEQ ID NO: 8), или вариант SEQ ID NO: 5 или SEQ ID NO: 8, включающий 1, 2, 3 или 4 замены аминокислот, и/или (в) CDR3 легкой цепи, включающий SSFAGNSLE (SEQ ID NO: 6) или QSYANTLSL (SEQ ID NO: 9), или вариант SEQ ID NO: 6 или SEQ ID NO: 9, включающий 1, 2, 3 или 4 замены аминокислот. В некоторых вариантах реализации полипептид специфично связывается с FZD1, FZD2, FZD5, FZD7 и/или FZD8. В некоторых вариантах реализации полипептид специфично связывается с двумя или более рецепторами "frizzled" человека, включающими FZD5 и FZD8. В некоторых вариантах реализации замены аминокислот представляют собой консервативные замены.
[0018] В другом аспекте настоящее изобретение обеспечивает полипептид, включающий: (a) CDR1 тяжелой цепи, включающий GFTFSHYTLS (SEQ ID NO: 1), CDR2 тяжелой цепи, включающий VISGDGSYTYYADSVKG (SEQ ID NO: 2), и CDR3 тяжелой цепи, включающий NFIKYVFAN (SEQ ID NO: 3), и/или (б) CDR1 легкой цепи, включающий SGDKLGKKYAS (SEQ ID NO: 4) или SGDNIGSFYVH (SEQ ID NO: 7), CDR2 легкой цепи, включающий EKDNRPSG (SEQ ID NO: 5) или DKSNRPSG (SEQ ID NO: 8), и CDR3 легкой цепи, включающий SSFAGNSLE (SEQ ID NO: 6) или QSYANTLSL (SEQ ID NO: 9). В некоторых вариантах реализации полипептид специфично связывается с рецептором "frizzled" человека. В некоторых вариантах реализации указанный полипептид специфично связывается с двумя или более (например, по меньшей мере с FZD5 и FZD8), тремя или более, или четырьмя или более рецепторами "frizzled" человека.
[0019] В другом аспекте, настоящее изобретение обеспечивает антитело, специфично связывающееся с рецептором "frizzled" человека, выбранным группы, включающей FZD1, FZD2, FZD5, FZD7 и FZD8, при этом указанное антитело содержит тяжелую цепь вариабельной области, включающую: (a) CDR1 тяжелой цепи, включающий GFTFSHYTLS (SEQ ID NO: 1), или его вариант, включающий 1, 2, 3 или 4 замены аминокислот; CDR2 тяжелой цепи, включающий VISGDGSYTYYADSVKG (SEQ ID NO: 2), или его вариант, включающий 1, 2, 3 или 4 замены аминокислот, и CDR3 тяжелой цепи, включающий NFIKYVFAN (SEQ ID NO: 3), или его вариант, включающий 1, 2, 3 или 4 замены аминокислот, и/или (б) CDR1 легкой цепи, включающий SGDKLGKKYAS (SEQ ID NO: 4), SGDNIGSFYVH (SEQ ID NO: 7), или вариант SEQ ID NO: 4 или SEQ ID NO: 7, включающий 1, 2, 3 или 4 консервативные замены аминокислот; CDR2 легкой цепи, включающий EKDNRPSG (SEQ ID NO: 5), DKSNRPSG (SEQ ID NO: 8), или вариант SEQ ID NO: 5 или SEQ ID NO: 8, включающий 1, 2, 3 или 4 консервативные замены аминокислот и CDR3 легкой цепи, включающий SSFAGNSLE (SEQ ID NO: 6), QSYANTLSL (SEQ ID NO: 9), или вариант SEQ ID NO: 6 или SEQ ID NO: 9, включающий 1, 2, 3 или 4 консервативные замены аминокислот.В некоторых вариантах реализации указанное антитело содержит: (a) CDR1 тяжелой цепи, включающий GFTFSHYTLS (SEQ ID NO: 1), CDR2 тяжелой цепи, включающий VISGDGSYTYYADSVKG (SEQ ID NO: 2), и CDR3 тяжелой цепи, включающий NFIKYVFAN (SEQ ID NO: 3), и/или (б) CDR1 легкой цепи, включающий SGDKLGKKYAS (SEQ ID NO: 4) или SGDNIGSFYVH (SEQ ID NO: 7), CDR2 легкой цепи, включающий EKDNRPSG (SEQ ID NO: 5) или DKSNRPSG (SEQ ID NO: 8), и CDR3 легкой цепи, включающий SSFAGNSLE (SEQ ID NO: 6) или QSYANTLSL (SEQ ID NO: 9). В некоторых вариантах реализации антитело содержит (a) CDR1 тяжелой цепи, включающий GFTFSHYTLS (SEQ ID NO: 1), CDR2 тяжелой цепи, включающий VISGDGSYTYYADSVKG (SEQ ID NO: 2), и CDR3 тяжелой цепи, включающий NFIKYVFAN (SEQ ID NO: 3), и/или (б) CDR1 легкой цепи, включающий SGDNIGSFYVH (SEQ ID NO: 7), CDR2 легкой цепи, включающий DKSNRPSG (SEQ ID NO: 8), и CDR3 легкой цепи, включающий QSYANTLSL (SEQ ID NO: 9).
[0020] В другом своем аспекте настоящее изобретение обеспечивает полипептид, включающий: (а) полипептид, имеющий по меньшей мере примерно 80% идентичности по последовательности с SEQ ID NO: 10; и/или (б) полипептид, имеющий по меньшей мере примерно 80% идентичности по последовательности с SEQ ID NO: 12 или SEQ ID NO: 14. В некоторых вариантах реализации изобретение обеспечивает полипептид, включающий (а) полипептид, имеющий по меньшей мере примерно 80% идентичности по последовательности с SEQ ID NO: 10; и/или (б) полипептид по меньшей мере имеющий примерно 80% идентичности по последовательности с SEQ ID NO 14. В некоторых вариантах реализации полипептид специфично связывается с рецептором "frizzled" человека. В некоторых вариантах реализации указанный полипептид специфично связывается с двумя или более, тремя или более, или четырьмя или более рецепторами "frizzled" человека. В некоторых вариантах реализации указанный рецептор (рецепторы) "frizzled" человека выбраны из группы, включающей FZD1, FZD2, FZD5, FZD7 и FZD8.
[0021] Еще в одном аспекте настоящее изобретение обеспечивает агент, такой как антитело, специфично связывающееся с FZD5 и/или FZD8 человека, при этом указанное антитело содержит: (a) CDR1 тяжелой цепи, включающий GFTFSSYYIT (SEQ ID NO: 77), или его вариант, включающий 1, 2, 3 или 4 консервативные замены аминокислот; CDR2 тяжелой цепи, включающий TISYSSSNTYYADSVKG (SEQ ID NO: 78), или его вариант, включающий 1, 2, 3 или 4 консервативные замены аминокислот, и CDR3 тяжелой цепи, включающий SIVFDY (SEQ ID NO: 79), или его вариант, включающий 1, 2, 3 или 4 консервативные замены аминокислот и/или (б) CDR1 легкой цепи, включающий SGDALGNRYVY (SEQ ID NO: 80), или его вариант, включающий 1, 2, 3 или 4 консервативные замены аминокислот; CDR2 легкой цепи, включающий SG (SEQ ID NO: 81), или его вариант, включающий 1, 2, 3 или 4 консервативные замены аминокислот, и CDR3 легкой цепи, включающий GSWDTRPYPKY (SEQ ID NO: 82), или его вариант, включающий 1, 2, 3 или 4 консервативные замены аминокислот. В некоторых вариантах реализации указанное антитело содержит: (a) CDR1 тяжелой цепи, включающий GFTFSSYYIT (SEQ ID NO: 77), CDR2 тяжелой цепи, включающий TISYSSSNTYYADSVKG (SEQ ID NO: 78), и CDR3 тяжелой цепи, включающий SIVFDY (SEQ ID NO: 79), и/или (б) CDR1 легкой цепи, включающий SGDALGNRYVY (SEQ ID NO: 80), CDR2 легкой цепи, включающий SG (SEQ ID NO: 81), и CDR3 легкой цепи, включающий GSWDTRPYPKY (SEQ ID NO: 82).
[0022] В другом аспекте настоящее изобретение обеспечивает полипептид, специфично связывающийся с FZD5 и/или FZD8, где указанный полипептид включает: (а) полипептид, по меньшей мере примерно на 80% идентичный SEQ ID NO: 85; и/или (б) полипептид, по меньшей мере примерно на 80% идентичный SEQ ID NO: 86.
[0023] Еще в одном аспекте настоящее изобретение обеспечивает агент, конкурирующий за специфичное связывание с FZD1, FZD2, FZD5, FZD7 и/или FZD8 человека с одним из следующих антител IgG: 18R8, 18R5, 18R4605 и 18R4805.
[0024] Еще в одном аспекте настоящее изобретение обеспечивает агент, конкурирующий за специфичное связывание с FZD5 и/или FZD8 с антителом IgG к FZD - 44R24.
[0025] В некоторых вариантах реализации каждого из вышеупомянутых аспектов, а также других аспектов, описанных в настоящей заявке, агент представляет собой антитело или полипептид. В некоторых альтернативных вариантах реализации указанный агент не является антителом.
[0026] В некоторых вариантах реализации каждого из вышеупомянутых аспектов настоящего изобретения, а также других аспектов, описанных в настоящей заявке, указанные агент или полипептид, или антитело специфично связываются с внеклеточным доменом (EDC) рецептора или рецепторов "frizzled" человека, с которым они связывается. В некоторых вариантах реализации каждого из вышеупомянутых аспектов, а также других аспектов, описанных в настоящей заявке, агент или антитело или полипептид специфично связываются с Fri-доменом (Fri) человеческого рецептора или рецепторов "frizzled", с которым они связывается.
[0027] В некоторых вариантах реализации каждого из вышеупомянутых аспектов, а также других аспектов, описанных в настоящей заявке, отдельный антиген-связывающий сайт антитела или другого полипептида специфично связывается (или способен связываться) более чем с одним рецептором "frizzled" человека.
[0028] В некоторых вариантах реализации каждого из вышеупомянутых аспектов, а также других аспектов, описанных в настоящей заявке, агент или полипептид, или антитело ингибирует связывание лиганда с рецептором (рецепторами) "frizzled" человека. В некоторых вариантах реализации лиганд представляет собой Wnt.
[0029] В некоторых вариантах реализации каждый из вышеупомянутых аспектов, а также других аспектов, описанных в настоящей заявке, агент или полипептид или антитело, связывающиеся с FZD, представляют собой антагонист FZD.
[0030] В некоторых вариантах реализации каждого из вышеупомянутых аспектов, а также других аспектов, описанных в настоящей заявке, указанные агент или полипептид, или антитело ингибируют сигнальный путь через Wnt. В некоторых вариантах реализации ингибируемый сигнальный путь через Wnt представляет собой канонический сигнальный путь через Wnt. В некоторых вариантах реализации ингибируемый FZD-связывающим агентом сигнальный путь через Wnt представляет собой канонический сигнальный путь через Wnt. В некоторых вариантах реализации сигнальный путь через Wnt представляет собой неканонический сигнальный путь через Wnt.
[0031] В некоторых вариантах реализации каждого из вышеупомянутых аспектов, а также других аспектов, описанных в настоящей заявке, FZD-связывающий полипептид или антитело ингибирует опухолевый рост.
[0032] Настоящее изобретение также обеспечивает антитела 18R8, 18R5, 18R4605, 44R24 и 18R4805, а также их фрагменты.
[0033] Настоящее изобретение кроме того обеспечивает композиции, например фармацевтические композиций, которые содержат FZD-связывающий агент или антитело.
[0034 Предусмотрены способы ингибирования сигнального пути через Wnt (например, канонического сигнального пути через Wnt,) и/или ингибирования опухолевого роста у субъекта, включающие введение терапевтически эффективного количества FZD-связывающего агента или полипептида, или антитела.
[0035] Также предусмотрены способы снижения туморогенности опухоли, включающей раковые стволовые клетки. В некоторых вариантах реализации указанные способы включают введение терапевтически эффективного количества FZD-связывающего агента или полипептида, или антитела субъекту, имеющему опухоль. В некоторых вариантах реализации количество раковых стволовых клеток в опухоли снижается в результате введения антитела. В некоторых вариантах реализации настоящего изобретения введение FZD-связывающего агента приводит к дифференцировке онкогенных клеток в опухоли в неонкогенное состояние.
[0036] Также предусмотрены способы индукции дифференцировки опухолевых клеток у субъекта, где указанные способы включают введение указанному субъекту терапевтически эффективного количества FZD-связывающего агента, полипептида или антитела.
[0037] Кроме того, предусмотрены способы лечения рака у субъекта, включающие введение указанному субъекту терапевтически эффективного количества FZD-связывающего полипептида, агента или антитела.
[0038] Кроме того, предусмотрены способы снижения активации миофибробластов в строме солидной опухоли, включающие воздействие на строму эффективным количеством FZD-связывающего агента, полипептида или антитела.
[0039] В некоторых вариантах реализации способы, включающие введение FZD-связывающего агента, полипептида, или антитела, дополнительно включают введение субъекту второго противоракового агента (например, химиотерапевтического агента). В некоторых вариантах реализации указанный второй агент представляет собой гемцитабин, иринотекан или паклитаксел. В некоторых вариантах реализации указанный второй агент представляет собой ингибитор ангиогенеза и/или ингибитор Notch-опосредованного сигнального пути.
[0040] В другом аспекте настоящее изобретение предусматривает полипептид, включающий последовательность, выбранную из группы, включающей SEQ ID NO: 10-15. Аналогичным образом предусмотрен полипептид, включающий последовательность, выбранную из группы, включающей SEQ ID NO: 85-86. Также предусмотрены полинуклеотиды, включающие последовательность нуклеиновых кислот, кодирующую такие полипептиды.
[0041] В другом своем аспекте настоящее изобретение обеспечивает полинуклеотид, включающий последовательность, выбранную из группы, включающей SEQ ID NO: 17-22. Также предусмотрен полинуклеотид, включающий последовательность, выбранную из группы, включающей SEQ ID NO: 87-90, 92 и 94-95.
[0042] Еще в одном аспекте настоящее изобретение обеспечивает полинуклеотид, включающий полинуклеотид, который гибридизуется в условиях высокой жесткости с полинуклеотидом, выбранном из группы, включающей SEQ ID NO: 17, 19, 21, 87-90, 92 и 94-95, или полинуклеотид, кодирующий полипептид, выбранный из группы, включающей SEQ ID NO: 10, 12, 14 и 85-86. В некоторых вариантах реализации настоящее изобретение включает полинуклеотид, который гибридизуется в условиях высокой жесткости с полинуклеотидом, включающим последовательность SEQ ID NO: 17, 19 или 21, или полинуклеотид, кодирующий SEQ ID NO: 10, 12, или 14.
[0043] В некоторых вариантах реализации каждого из вышеупомянутых аспектов, а также других аспектов, описанных в настоящей заявке, агент или полипептид, или антител, или является изолированным. В некоторых вариантах реализации агент или полипептид, или антитело, или полинуклеотид является по существу очищенным.
[0044] Настоящее изобретение также обеспечивает генную сигнатуру Wnt, применимую для идентификации опухолей и/или пациентов, которые вероятно будут отвечать на лечение с применением FZD-связывающего агента (например, антагониста рецептора "frizzled" человека и/или ингибитора сигнального пути через Wnt), или других ингибиторов сигнального пути через Wnt. Также предусмотрены способы применения такой генной сигнатуры Wnt для отбора пациентов для лечения с помощью FZD-связывающего агента или другого ингибитора сигнального пути через Wnt. В некоторых вариантах реализации способы включают оценку уровня экспрессии одного или нескольких генов из генной сигнатуры Wnt. Настоящее изобретение также обеспечивает способы скрининга противоопухолевых лекарств-кандидатов, идентифицированных с помощью генной сигнатуры Wnt. Также предусмотрены микрочипы, наборы и другие композиции, применимые в упомянутых способах.
[0045] Настоящее изобретение также обеспечивает способы скрининга лекарств- кандидатов или других агентов. Эти способы включают, но не ограничены перечисленными: способы, включающие сравнение уровня одного или более маркера дифференцировки в первой солидной опухоли, которая была подвергнута воздействию агента, с уровнем одного или более маркера дифференцировки второй солидной опухоли, которую не подвергали воздействию агента. В некоторых вариантах реализации такие способы включают: (а) воздействие агента на первую солидную опухоль, но не вторую солидную опухоль; (б) оценку уровня одного или более маркера дифференцировки в указанных первой и второй солидных опухолях, а также (в) сравнение уровней одного или более маркеров дифференцировки в указанных первой и второй солидных опухолях.
[0046] В случаях, где аспекты или варианты реализации настоящего изобретения описаны в терминах формулы Маркуша или других альтернативных групп, настоящее изобретение охватывает не только всю перечисленную группу в целом, но и каждого члена указанной группы в отдельности и все возможные подгруппы основной группы, а также основную группу в отсутствии одного или нескольких членов группы. Настоящее изобретение также предусматривает явное исключение любого одного или более из членов группы в заявленном изобретении.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
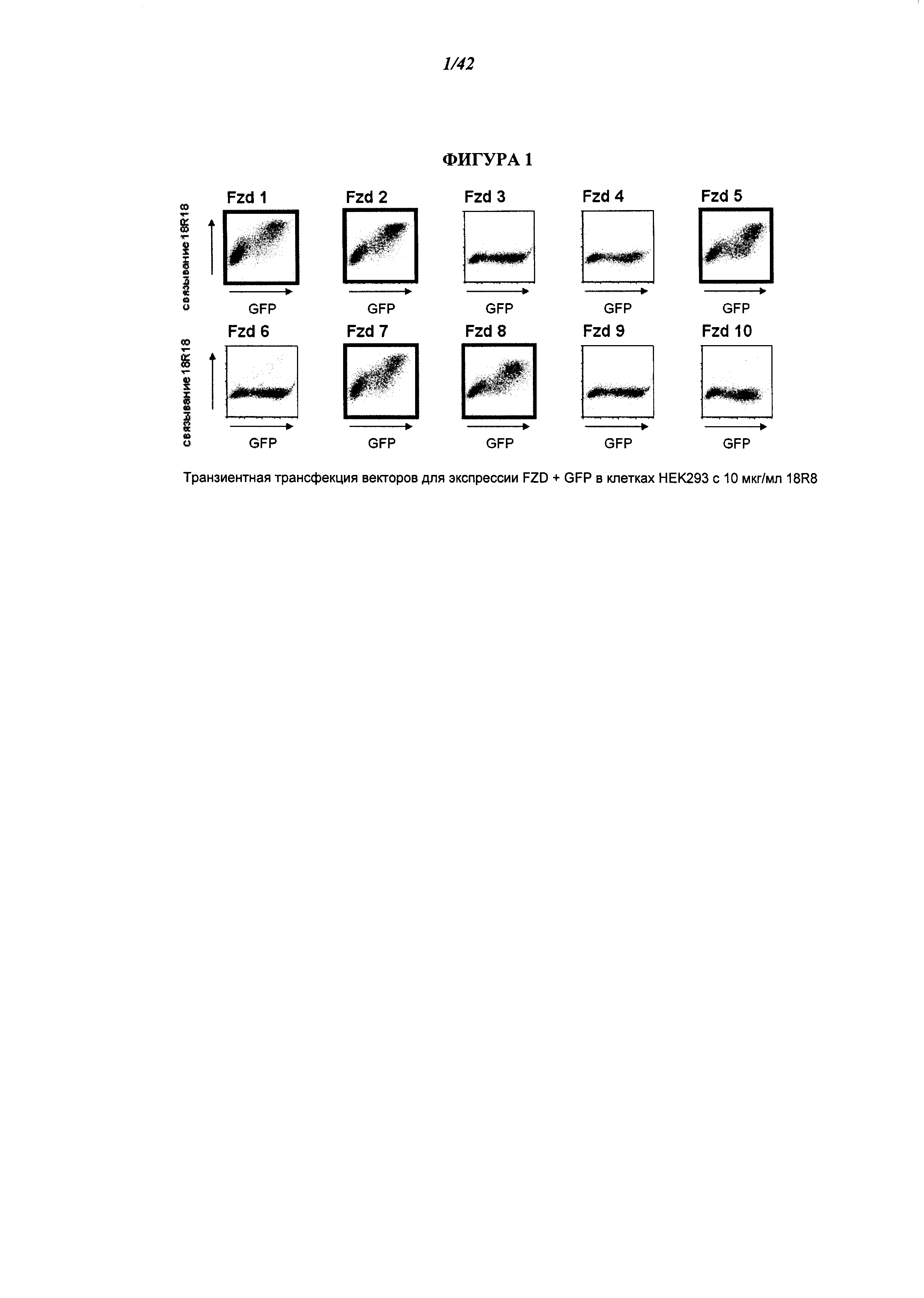
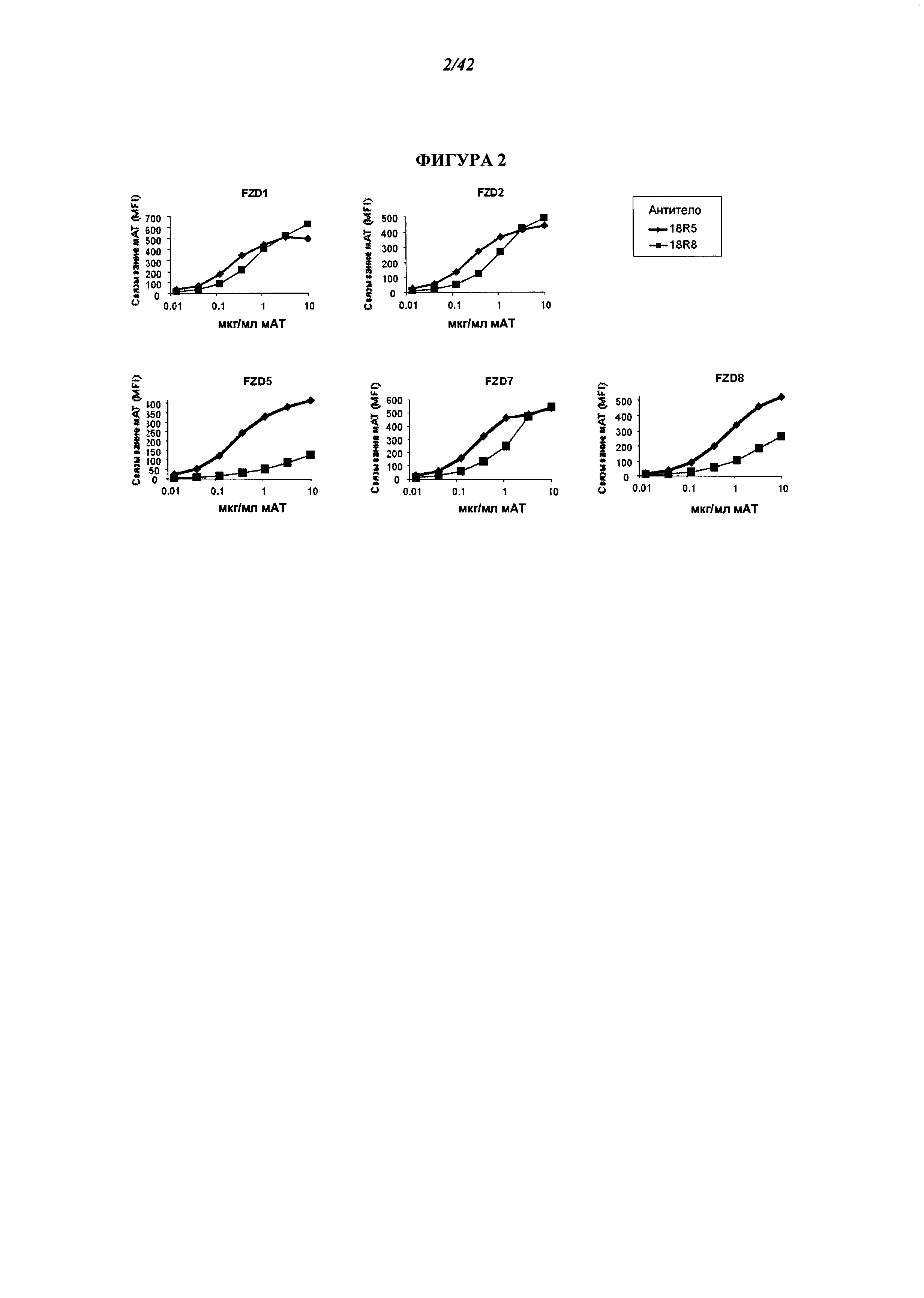
[0047] Фигура 1. 18R8 связывает несколько рецепторов "frizzled" человека. Анализ с помощью флуоресцентной сортировки клеток (ФСК) показал, что 18R8 связывается с последовательностями FZDL FZD2, FZD5, FZD7 и FZD8 на транзиентно трансфицированных клетках НЕК293. Представлены графики ФСК для связывания 18R8 с клетками НЕК293, трансфицированными векторами для экспрессии, кодирующими указанный FZD, и вектором для экспрессии, кодирующем GFP. О связывании 18R8 свидетельствует повышение степени окрашивания в составе котрансфицированной (GFP-положительной) клеточной популяции. Графики ФСК для FZD1, FZD2, FZDS, FZD7 и FZD8 заключены в рамку, при этом толстой линией отмечены FZD, демонстрирующие связывание с 18R8.
[0048] Фигура 2. Антитело 18R5 к FZD связывает несколько рецепторов "frizzled" человека на поверхности клеток. ФСК анализ показал, что 18R5, как и 18R8, связывается с последовательностями FZD1, FZD2, FZDS, FZD7 и FZD8 на клетках. Антитела 18R8 и 18R5 инкубировали в диапазоне концентраций с клетками НЕК293, сверхэкспрессирующими указанный FZD, и оценивали связывание антител методом проточной цитометрии. Хотя оба антитела, как 18R8, так и 18R5, связываются с FZD1, FZD2, FZDS, FZD7 и FZD8, 18R5 связывается с большим сродством.
[0049] Фигура 3. Проводили репортерный анализ с помощью люциферазы в клетках STF293, стабильно экспрессирующих промоторный элемент SxTCF, соединенный с последовательностью люциферазы. Клетки обрабатывали кондиционированной средой, содержащей Wnt3A, а также диапазон концентраций 18R8 и 18R5, и затем анализировали через 18 часов с помощью системы репортерного анализа люциферазы Dual-Glo (Promega). Результаты показывают, что оба антитела, как 18R8, так и 18R5, ингибируют сигнальный путь через Wnt, и что 18R5 связывается с большим сродством, чем 18R8.
[0050] Фигура 4. 18R8 блокирует сигнальный путь TCF через различные Wnt. Проводили репортерный анализ с помощью люциферазы в клетках STF293, стабильно экспрессирующих промоторный элемент 8xTCF, соединенный с последовательностью люциферазы. Клетки, сверхэкспрессирующие различные Wnt, получали путем трансфекции клеток НЕК293 (АТСС) векторами для экспрессии, кодирующими указанные белкки Wnt, с использованием Fugene 6 (Roche). Клетки STF293 обрабатывали 18R8, добавлял клетки НЕК293, сверхэкспрессирующие Wnt, и анализировали через 18 часов позже с помощью с помощью системы репортерного анализа люциферазы Dual-Glo.
[0051] Фигура 5. 18R8 непосредственно ингибирует связывание Wnt с FZD. В клетках STF293, стабильно экспрессирующих промоторный элемент 8xTCF, проводили репортерный анализ люциферазы. Смесь, содержащую кондиционированную Wnt3A среду, очищенный FZD8-FC и/или 18RS коинкубировали, как указано, в течение 2 часов при температуре 4°C с/без гранулами сефарозы с протеином А. После инкубации, гранулы сефарозы с протеином А удаляли и добавляли к клеткам STF293. Обработанные клетки STF293 анализировали через 18 часов с помощью системы репортерного анализа люциферазы Dual-Glo. Этот эксперимент показывает, что в отсутствие 18R8, Fzd8-Fc способен ингибировать способность Wnt3A стимулировать сигнальный путь, и 18R8 способен блокировать способность FZD8 связываться с Wnt3, о чем свидетельствует восстановление сигнального пути в случае использования гранул сефарозы для удаления FZD8-Fc (и 18R8) из коинкубационной смеси.
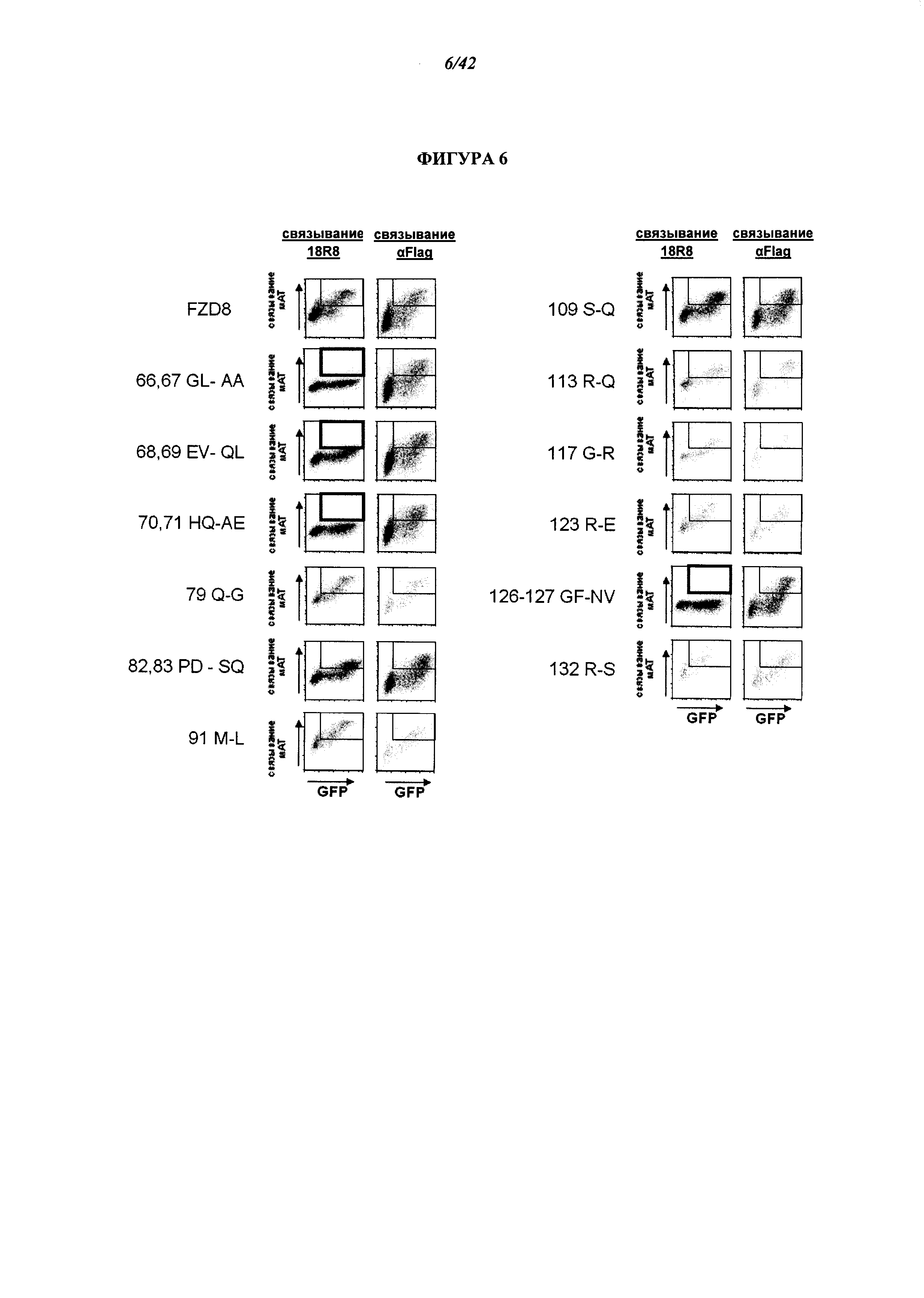
[0052] Фигура 6. Анализ ФСК связывания 18R8 с мутантной формой FZD8, в сравнении с FZD8 дикого типа. Для выявления эпитопов 18R8 на FZD проводили картирование эпитопов. В исследованиях с помощью транзиентной трансфекции использовали экспрессионную конструкцию, делающую возможной экспрессию экспрессию Fri-домена FZD8 человека с N-концевой последовательностью FLAG и С-концевым трансмембранным доменом CD4 и внутриклеточным доменом, вместе с экспрессионным вектором, кодирующем GFP. Также были получены варианты этого экспрессионного вектора, содержащие выбранные замены аминокислот в составе последовательности FZD8, кодирующие аминокислоты в соответствующей позиции в составе Fri-домена других отдельных FZD, не связывающихся с 18R8. Способность 18R8 связываться с такими последовательностями вариантов FZD8 оценивали способом проточной цитометрии. Было установлено, что некоторые позиции, включая аминокислоты 66-71 и 126-127 из FZD, необходимы для связывания 18R8, о чем свидетельствует уменьшение степени окрашивания в котрансфицированной (GFP-положительной) клеточной популяции. Области графиков ФСК, демонстрирующие связывание 18R8 с котрансфицированной клеточной популяцией выделены в рамку, и рамка обведена толстыми линиями для замен аминокислот, демонстрирующих заметное снижение степени связывания 18R8.
[0053] Фигура 7. Показано, что 18R5 и 18R8 имеют схожие связываемые эпитопы на поверхности FZD8 человека. Способность 18R5 связываться с эпитопами, аналогичными с эпитопами для 18R8, оценивали методом проточной цитометрии с помощью ряда вариантов с заменами аминокислот, которые, как было показано ранее, нарушают связывание 18R8. Было показано, что положения, включающие аминокислоты 66-71 и 126-127 из FZD8 необходимы для связывания как 18R8, так и 18R5, о чем свидетельствует ослабление окрашивания в котрансфицированной (GFP-положительной) клеточной популяции. Области графиков ФСК, демонстрирующие связывание 18R8 с котрансфицированной клеточной популяцией выделены в рамку, и рамка обведена толстыми линиями для замен аминокислот, демонстрирующих заметное снижение степени связывания 18R8 и 18R5.
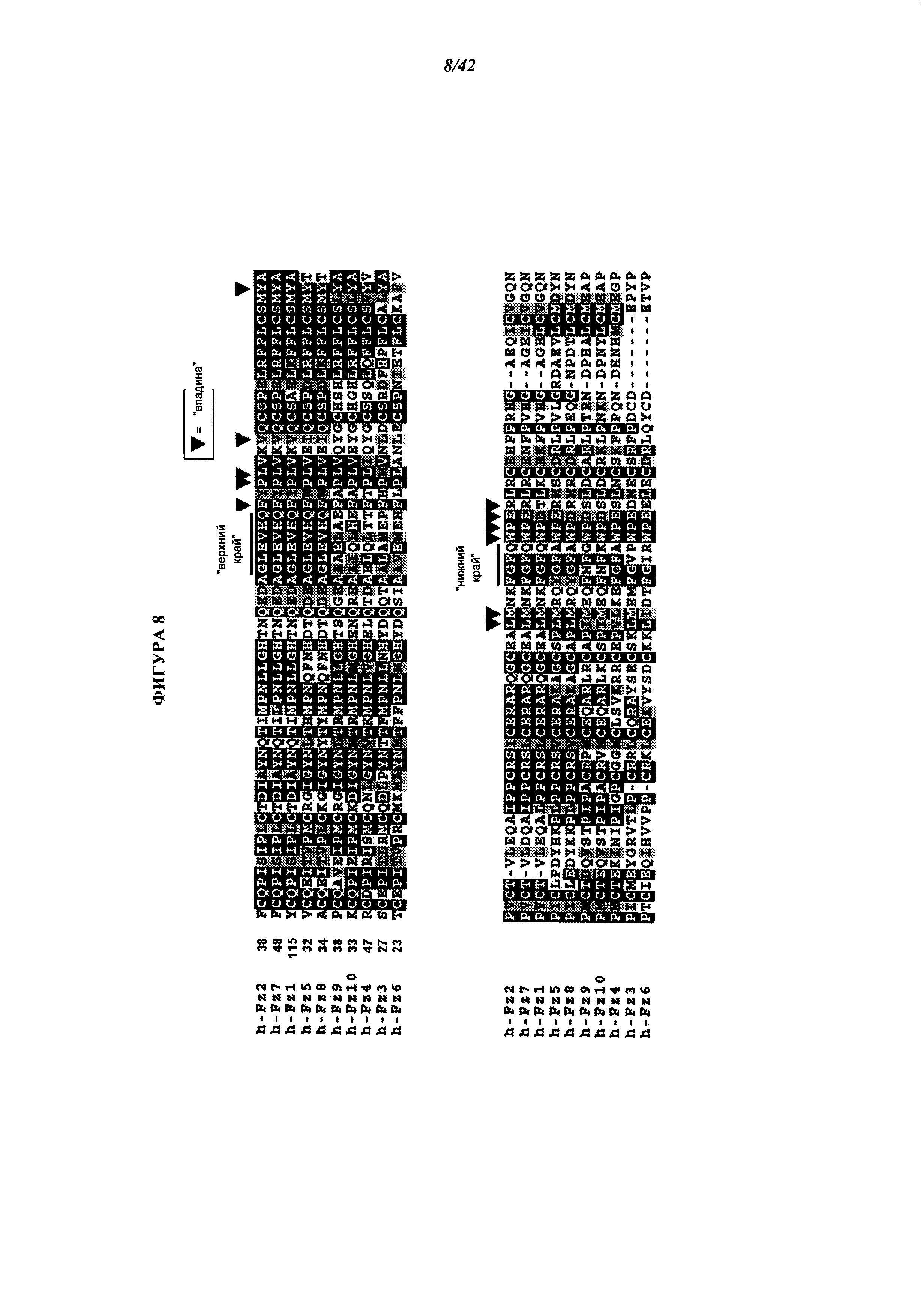
[0054] Фигура 8. Сравнение последовательностей аминокислот участков последовательностей Fri-домена рецепторов "frizzled" человека. Сайты с консервативными остатками закрашены черным цветом; сайты с аналогичными аминокислотными остатками, закрашены серым цветом. Эпитоп FZD в 18R8 и 18R5 содержит области, помеченные подчеркиванием и обозначенные как «верхний край» и «нижний край». Термины «верхний край» и «нижний край» отражают известные данные, основанные на исследовании кристаллической структуры Fri-домена, о том, что эти области фланкируют «впадину» на поверхности белка FZD. Эта «впадина» содержит несколько высоко консервативных остатков. Аминокислоты, формирующие эту «впадину», обозначены треугольниками (стрелками) над каждым соответствующим положением в пределах выравниваненной последовательности. Ранее для этой области не была известна какая-либо функция. Обнаружение антител, которые связываются с этой областью и обнаружение того факта, эти антитела ингибируют связывание Wnt и сигнальный путь, индуцируемый Wnt, а также установление консервативной природы данной «впадины» позволяют идентифицировать эту область как ключевой функциональный аспект белков FZD.
[0055] Фигура 9. Биологический сайт связывания (БСС) FZD. Показаны изображения структуры области fri-домена FZD. Изображения основаны на анализе установленной ранее кристаллической структуры FZD8 мыши (Dann СЕ et al, Nature 412 (6842) 86-90, 2001) и анализе с помощью программного обеспечения Pymol. В верхнем левом углу изображения представлен вид поверхности fri-домена FZD с областью белка Fzd, включающей биологический сайт связывания (БСС), установленный авторами изобретения (обведен белым овалом). С этой областью связываются антитела 18R8 и 18R5. Эта область содержит структурные элементы, которые авторы изобретения определили как «верхний край» и «нижний край» и «впадина». Каждый из этих элементов обозначен темным цветом на отдельных изображениях в нижней части панели. На верхнем правом изображении темным цветом обозначены остатки, консервативные у девяти или десяти из десяти членов семейства FZD человека, и подчеркнуто, что различные группировки этих остатков находятся в пределах центральной области «впадины», фланкированной эпитопом, с которым связываются антитела, ингибирующие функцию FZD.
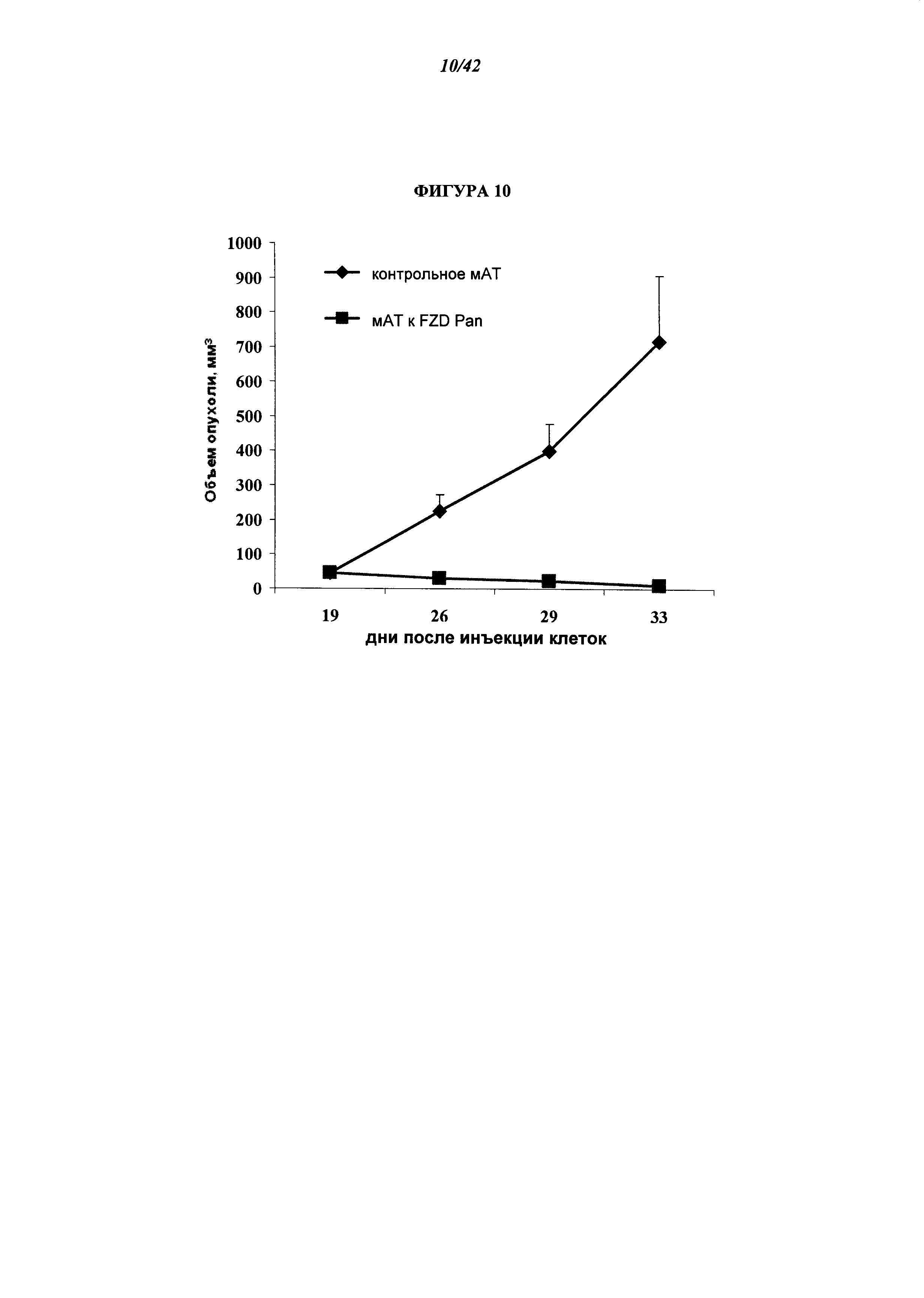
[0056] Фигура 10. Предотвращение Wnt-зависимого опухолевого роста с помощью МАТ (моноклональных антител) к FZD. Мышам NOD/SCID вводили клетки (50000), полученные из опухоли MMTV WNT1, и наблюдали за ними еженедельно до обнаружения опухолевого роста, после чего оценивали рост опухоли два раза в неделю. Десять мышей со сформированным опухолями обрабатывали либо 18R8, либо контрольным антителом (контроль). У животных, получавших 18R8, опухолевый рост был по существу ликвидирован, по сравнению с животными, получавшими контрольное антитело.
[0057] Фигура 11. Уменьшение роста опухоли ОМР-С28 ксенотрансплантата при комбинированном лечении с помощью 18R5 и иринотекана. Мышам NOD/SCID вводили клетки (10000) опухоли толстой кишки ОМР-С28. На 24 день в случайном порядке отбирали мышей, имеющих объем опухоли в среднем 129 мм3, и начинали указанное лечение. Рост опухоли оценивали раз в неделю. Опухолевый рост у животных, получавших 18R5, был значительно снижен. Кроме того, комбинированное лечение с помощью 18R5 и иринотекана приводило к значительному уменьшению роста, по сравнению с вариантами лечения с помощью каждого из агентов в отдельности.
[0058] Фигура 12. Уменьшение опухолевого роста ксенотрансплантата опухоли OMP-PN4 при комбинированном лечении с помощью 18R5 и гемцитабина. Мышам NOD/SCID вводили клетки (50000) опухоли поджелудочной железы OMP-PN4 клеток. На 38 день в случайном порядке отбирали мышей, имеющих объем опухоли в среднем 120 мм, и через два дня начинали указанное лечение. Рост опухоли у животных, получавших комбинированное лечение с помощью 18R5 и гемцитабина, был значительно уменьшен, по сравнению с вариантом лечение с помощью гемцитабина в отдельности.
[0059] Фигура 13. Последовательности аминокислот тяжелой цепи и легкой цепи 18R8 и 18R5, включающие последовательности VH и VL.
[0060] Фигура 14. Нуклеотидные последовательности, кодирующие тяжелую цепь и VH области 18R8 и 18R5.
[0061] Фигура 15. Нуклеотидные последовательности, кодирующие легкую цепь и VL области 18R8 и 18R5.
[0062] Фигура 16. Последовательности аминокислот белка Fc FZD7 ВКД и кодирующая ее последовательность нуклеотидов.
[0063] Фигура 17. Последовательности аминокислот FZD1 человека (SEQ ID NO:26), внеклеточного домена (ВКД) FZD1 (SEQ ID NO: 27, выделены подчеркиванием аминокислоты 1-321 SEQ ID NO: 26), и Fri-домена FZD1 (SEQ ID NO: 28).
[0064] Фигура 18. Последовательности аминокислот FZD2 человека (SEQ ID NO: 30), внеклеточного домена (ВКД) FZD2 (SEQ ID NO: 31, выделены подчеркиванием аминокислоты 1 - 250 SEQ ID NO: 30) и Fri-домена FZD2 (SEQ ID NO: 32).
[0065] Фигура 19. Нуклеотидная последовательность, кодирующая FZD1 человека.
[0066] Фигура 20. Нуклеотидная последовательность, кодирующая FZD2 человека.
[0067] Фигура 21. Последовательности аминокислот FZD3 человека (SEQ ID NO: 34), внеклеточного домена (ВКД) FZD3 (SEQ ID NO: 35, выделены подчеркиванием аминокислоты 1 - 204 SEQ ID NO: 34), и Fri-домена FZD3 (SEQ ID NO: 36).
[0068] Фигура 22. Последовательности аминокислот FZD4 человека (SEQ ID NO: 38), внеклеточного домена (ВКД) FZD4 (SEQ ID NO: 39, выделены подчеркиванием аминокислоты 1 - 224 SEQ ID NO: 38), и Fri-домена FZD4 (SEQ ID NO: 40).
[0069] Фигура 23. Последовательность нуклеотидов, кодирующая FZD3 человека.
[0070] Фигура 24. Последовательность нуклеотидов, кодирующая FZD4 человека.
[0071] Фигура 25. Последовательности аминокислот FZD5 человека (SEQ ID NO: 42), внеклеточного домена (ВКД) FZD5 (SEQ ID NO: 43, выделены подчеркиванием аминокислоты 1 - 233 SEQ ID NO: 42), и Fri-домена FZD5 (SEQ ID NO: 44).
[0072] Фигура 26. Последовательности аминокислот FZD6 человека (SEQ ID NO: 46), внеклеточного домена (ВКД) FZD6 (SEQ ID NO: 47, выделены подчеркиванием аминокислоты 1 - 207 SEQ ID NO: 46), и Fri-домена FZD6 (SEQ ID NO: 48).
[0073] Фигура 27. Последовательность нуклеотидов, кодирующая FZD5 человека.
[0074] Фигура 28. Последовательность нуклеотидов, кодирующая FZD6 человека
[0075] Фигура 29. Последовательности аминокислот FZD7 человека (SEQ ID NO: 50), внеклеточного домена (ВКД) FZD7 (SEQ ID NO: 51, выделены подчеркиванием аминокислоты 1 - 255 SEQ ID NO: 50), и Fri-домена FZD7 (SEQ ID NO: 52).
[0076] Фигура 30. Последовательности аминокислот FZD8 человека (SEQ ID NO: 54), внеклеточного домена (ВКД) FZD8 (SEQ ID NO: 55, выделены подчеркиванием аминокислоты 1 - 277 SEQ ID NO: 54), и Fri-домена FZD8 (SEQ ID NO: 56).
[0077] Фигура 31. Последовательность нуклеотидов, кодирующая FZD7 человека.
[0078] Фигура 32. Последовательность нуклеотидов, кодирующая FZD8 человека.
[0079] Фигура 33. Последовательности аминокислот FZD9 человека (SEQ ID NO: 58), внеклеточного домена (ВКД) FZD9 (SEQ ID NO: 59, выделены подчеркиванием аминокислоты 1 - 230 из SEQ ID NO: 58), и Fri-домена FZD9 (SEQ ID NO: 60).
[0080] Фигура 34. Последовательности аминокислот FZD10 человека (SEQ ID NO: 62), внеклеточного домена (ВКД) FZD10 (SEQ ID NO: 63, выделены подчеркиванием аминокислоты 1 - 227 SEQ ID NO: 62), и Fri-домена FZD 10 (SEQ ID NO: 64).
[0081] Фигура 35. Последовательность нуклеотидов, кодирующая FZD9 человека.
[0082] Фигура 36. Последовательность нуклеотидов, кодирующая FZD 10 человека.
[0083] Фигура 37. Сокращение роста опухоли молочной железы РЕ-13 при комбинированном лечении с помощью антитела 18R5 и паклитаксела. Мышам NOD/SCID вводили клетки (10000) опухоли молочной железы РЕ-13, и на 22 день случайным образом отбирали мышей со средним объемом примерно 120 мм. Мыши получали либо контрольное антитело («Контрольное АТ»), либо антитело 18R5 («АТ к FZD»), паклитаксел («Таксол»), или комбинацию антитела 18R5 с паклитакселом («АТ к FZD + Таксол»). Лечение с помощью антитела 18R5 в комбинации с паклитакселом обеспечивало противоопухолевую активность.
[0084] Фигура 38. Рост опухоли молочной железы у животных, получающих комбинированное лечение с помощью антитела 18R5 и паклитаксела. Лечение с помощью антитела 18R5 в комбинации с паклитакселом приводило к ремиссии опухолей молочной железы.
[0085] Фигура 39. Анализ клеток колоректального рака с помощью проточной цитометрии после воздействия контрольным антителом, антителом 18R5, иринотеканом или антителом 18R5 в сочетании с иринотеканом.
[0086] Фигура 40. Опухолевый рост у мышей после имплантации 30, 90, 270 или 810 опухолевых клеток, полученных от мышей, которые были обработаны в течение 41 дней либо контрольным антителом («контроль»), антитело 18R5 («АТ к FZD»), гемцитабином («Гемцитабин») или 18R5 в сочетании с гемцитабином («Комбинация»).
[0087] Фигура 41. Частота встречаемости раковых стволовых клеток (РСК) в опухолях поджелудочной железы PN-4 после воздействия контрольного антитела («Контрольное АТ»), антитела 18R5 в отдельности («АТ к FZD»), гемцитабина в отдельности («Гемцитабин») или антитела 18R5 в сочетании с гемцитабином («Комбинация»), определенная с помощью анализа путем предельного разведения.
[0088] Фигура 42. Экспрессия гена хроматогранина в клетках опухоли поджелудочной железы, обработанных контрольным антителом («LZ-1»), антителом 18R5 в отдельности («18R5»), гемцитабином в отдельности («Гем») или гемцитабином в сочетании с 18R5 («Комбо»).
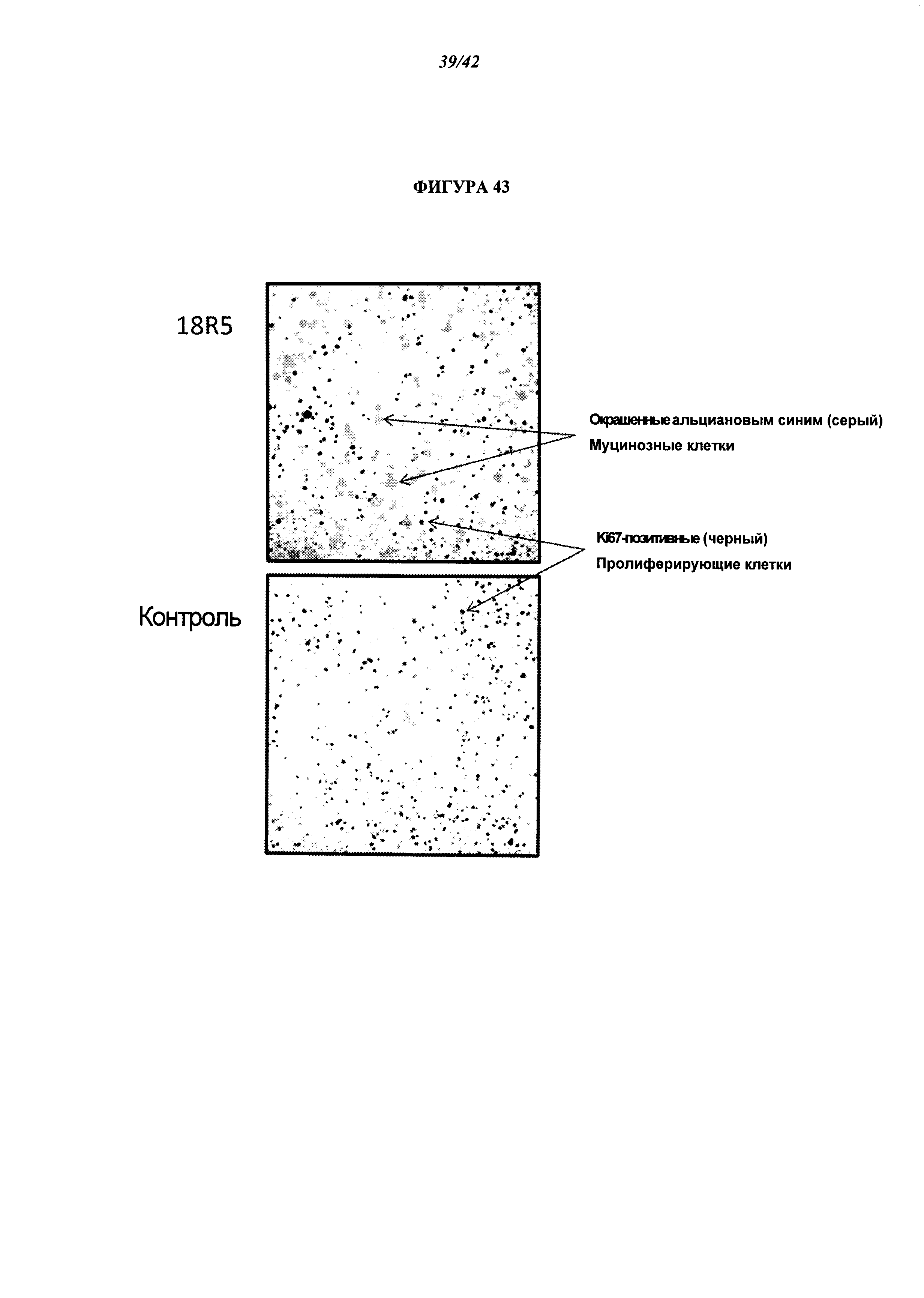
[0089] Фигура 43. Обработка с помощью антитела 18R5 к FZD способствует дифференцировке опухолевых клеток в непролиферирующие муцинозные клетки. Мышам NOD/SCID вводили клетки (50000) опухоли поджелудочной железы OMP-PN13, и на 23 день в случайном порядке отбирали мышей с опухолями среднего объема примерно 107 мм3, и через четыре дня начинали обработку контрольным антителом или антителом 18R5. Через 20 дней собирали опухоли и получали их срезы. Срезы опухолей мышей, получающих 18R5, или мышей, получающих контрольное антитело, окрашивали альциановым синим для выявления муцинозных клеток, и окрашивали иммуногистохимически с помощью антител к ki67 для выявления пролиферирующих клеток. Примеры муцинозных клеток и пролиферирующих клеток обозначены стрелками.
[0090] Фигура 44. Антитело 18R5 к FZD, как в отдельности, так и в сочетании с Таксолом® (паклитаксел), ингибирует опухолевый рост ксенотрансплантата OMP-LU24. Мыши с пересаженными опухолями OMP-LU24 легких человека получали либо контрольное антитело («Контрольное АТ»), либо антитело к FZD 18R5 («18R5»), Таксол® («Таксол») или 18R5 в сочетании с Таксолом® («18R5 + Таксол»).
[0091] Фигура 45. Антитело 18R5 к FZD, как в отдельности, так и в сочетании с Авастином® (бевацизумаб), ингибирует опухолевый рост ксенотрансплантата OMP-LU33. Мышей с пересаженными опухолями OMP-LU33 легких человека получали либо контрольное антитело (квадраты), либо Авастин® (направленные вниз треугольники), антитело 18R5 к FZD (направленные вверх треугольники), или 18R5 в сочетании с Авастином® (кружки).
[0092] Фигура 46. Антитело 18R5 к FZD в сочетании с Герцептином ® (Трастузумаб) подавляет опухолевый рост ксенотрансплантата Т3. Мыши с пересаженными опухолями Т3 молочной железы человека получали либо контрольное антитело (квадраты), антитело 18R5 к FZD (треугольники), Герцептин® (черные точки), 18R5 в сочетании с Герцептином® (кружки).
[0093] Фигура 47. Профили связывания 18R5 и 44R24 с FZD. Представлены кривые доза-ответ для каждого МАТ с FZD 1, 2, 5, 7 и 8.
[0094] Фигура 48. Ингибирование Wnt3a-индуцированной репортерной активности в клетках STF под воздействием 18R5 и 44R24 (кривые доза-ответ).
[0095] Фигура 49. Ингибирование базового уровня экспрессии гена аксина2 под воздействием 18R5 и 44R24.
[0096] Фигура 50. ИГХ окрашивание Mucl6 в опухолях OMP-PN13, обработанных 18R5 и 44R24.
[0097] Фигура 51. Ингибирование актина гладких мышц в опухолях поджелудочной железы, обработанных 18R5. А. Анализ уровеня экспрессии гена ACTA 2 с помощью микрочипов. В. Детекция SMA в опухолях OMP-PN4, обработанных контрольным антителом (верхняя панель) и 18R5 (нижняя панель).
[0098] Фигура 52. Исследование туморогенности обработанных 18R5 клеток Mucl6 + OMP-PN13. А. Анализ с помощью ФСК опухолевых клеток OMP-PN13 обедненной клеточной линии (lin-depleted), окрашенных Mucl6. Две отсортированные популяции обведены в круг. В. Типичные фотографии опухолей, индуцированных введением клеток Mucl6 - (верхняя панель) и Mucl6 + (нижняя панель). С. Кривые роста опухолей.
[0099] Фигура 53. Ингибирование рецидива опухоли с помощью мАТ к FZD 18R5 у ксенотрансплантата опухоли молочной железы РЕ13.
[00100] Фигура 54. Уменьшение частоты стволовых клеток рака молочной железы под действием мАТ к FZD 18R5.
[00101] Фигура 55. Ингибирование рецидива опухоли с помощью мАТ к FZD 18R5 у ксенотрансплантата опухоли поджелудочной железы PN4.
[00102] Фигура 56. Ингибирование роста опухоли с помощью мАТ к FZD 44R24 в сочетании с гемцитабином у ксенотрансплантата опухоли поджелудочной железы PN4.
[00103] Фигура 57. Сравнительный анализ связывания мАТ к FZD 44R24 с мутантной формой FZD8 и с FZD8 дикого типа способом ФСК. В рамку помещена область графика ФСК, иллюстрирующая связывание 44R24 с котрансфицированной популяцией клеток. Стрелкой отмечена рамка, соответствующая заменам аминокислот, демонстрирующим заметное снижение связывания 44R24.
[00104] Фигура 58. Противоопухолевая активность антител к FZD 44R24 и 18R5 на модели ксенотрансплантата опухоли толстой кишки С28.
[00105] Фигура 59. Индукция экспрессии цитокератина 7 на модели ксенотрансплантата опухоли толстой кишки С28 под воздействием антител к FZD 44R24 или 18R5.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[00106] Настоящее изобретение обеспечивает новые агенты, включающие без ограничений полипептиды, такие как антитела, которые связываются с одним или более рецептором "frizzled" (FZD) человека. Кроме того, настоящее изобретение обеспечивает родственные полипептиды и полинуклеотиды, композиции, включающие FZD-связывающие агенты, и способы получения FZD-связывающих агентов. Также предусмотрены способы применения новых FZD-связывающих агентов, например, способы ингибирования роста опухоли и/или лечения рака.
[00107] Настоящее изобретение основано, в частности, на идентификации области в составе рецепторов "frizzled" человека, которая является подходящей мишенью для FZD-связывающего противоракового агента. Было выявлено два антитела к FZI, 18R8 и 18R5, которые специфично связывающихся с FZD7, но кроме того перекрестно реагируют с FZD1, FZD2, FZD5 и FZD8 (Примеры 1 и 2, ниже). Эксперименты in vitro с использованием антитела 18R8 показали, что данное антитело способно ингибировать сигнальный путь, опосредованный Wnt, (Пример 3, ниже) и ингибировать связывание лигандов Wnt с FZD (Пример 4, ниже). Исследования в клеточных системах также показали, что антитело 18R5 способно ингибировать сигнальный путь, опосредованный Wnt (Примеры 3 и 20, ниже). Исследования in vivo с помощью антитела 18R5 показали, что антитело способны ингибировать рост опухоли или рецидив (Примеры 7, 17 и 23, ниже). Авторы изобретения также показали, что антитело к FZD 18R5 способно снижать частоту раковых стволовых клеток в опухолях (Примеры, 8 и 23, ниже) и индуцировать дифференцировку и/или снижение туморогенности опухолевых клеток (Примеры 16, 21, 22 и 25, ниже). Эксперименты по картированию эпитопов с активными антителами 18R8 и 18R5 показали, что оба антитела связываются по меньшей мере с частью последовательности GLEVHQ (SEQ ID NO: 25) и по меньшей мере с частью последовательности YGFA (SEQ ID NO: 74) в составе FZD8 (Пример 5, ниже). С учетом выявленной биологической активности этих двух антител была проанализирована кристаллическая структура мышиного "frizzled" 8 (Dann et al.. Nature, 412:86-90 (2001)), и было впервые показано, что внеклеточная область белков "frizzled", включающая эти последовательности, для которых ранее не были известны какие-либо конкретные функции, играет важную роль в функционировании FZD и сигнальном пути, индуцированном Wnt (Пример 6). Эта область рецепторов "frizzled" человека, обозначенная как биологический сайт связывания (БСС), является подходящей мишенью для противораковой терапии.
[00108] Кроме того, было выявлено третье антитело, 44R24, специфично связывающееся с FZD5 и FZD8 человека (Пример 19, ниже). Показано, что это антитело также способно ингибировать сигнальный путь, индуцированный Wnt, в клеточных системах (Пример 20, ниже) и демонстрирует противоопухолевую активность in vivo (Примеры 23 и 25, ниже). Как и обработка антителами к FZD 18R8 и 18R5, обработка опухоли с помощью 44R24 приводила к повышению уровня маркеров дифференцировки в опухоли (Пример 25, ниже). Картирование эпитопов также показало, что эпитоп антитела к FZD 44R24 частично перекрывается эпитопом для антител к FZD 18R8 и 18R5. В частности, было показано, что 44R24 связывается по меньшей мере с частью области YGFA (SEQ ID NO: 74) в БСС (Пример 24, ниже).
I. Определения
[00109] Для облегчения понимания настоящего изобретения ниже даны определения ряда терминов и фраз.
[00110] Термин «антитело» обозначает молекулу иммуноглобулина, узнающую и специфично связывающуюся с мишенью, такой как белок, полипептид, пептид, углевод, полинуклеотид, липид, или комбинацией перечисленных, через по меньшей мере один антиген-узнающий сайт в вариабельной области молекулы иммуноглобулина. Используемый в настоящей заявке термин «антитело» охватывает интактные поликлональные антитела, интактные моноклональные антитела, фрагменты антител (например, фрагменты Fab, Fab*, F(ab′)2 и Fv), мутантные формы одноцепочечных фрагментов Fv (single chain Fv, scFv), антитела мультиспецифичные антитела, например, биспецифичные антитела, полученные от по меньшей мере двух интактных антител, химерные антитела, гуманизированные антитела, антитела человека, слитые белки, включающие антиген-определяющую область антитела, и любые другие модифицированные молекулы иммуноглобулина, включающие антиген-узнающий сайт, при этом антитела демонстрируют желаемую биологическую активность. Антитело может относиться к любому из пяти основных классов иммуноглобулинов: IgA, IgD, IgF, IgG и IgM, или их подклассам (изотипам) (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) на основании особенности константных доменов их тяжелых цепей, известных как альфа, дельта, эпсилон, гамма и мю, соответственно. Различные классы иммуноглобулинов имеют различную и хорошо известную структуру субъединиц и трехмерную структуру. Антитела могут быть изолированными или конъюгированы с другими молекулами, такими как токсины, радиоактивные изотопы и т.д.
[00111] Термин «фрагмент антитела» относится к части интактного антитела и относится к антиген-определяющим вариабельным областям интактного антитела. Примеры фрагментов антител включают, но не ограничены перечисленными, фрагменты Fab, Fab′, F(ab′)2 и Fv, линейные антитела, одноцепочечные антитела, и мультиспецифичные антитела, образованные из фрагментов антител.
[00112] «Моноклональное антитело» относится к однородной популяции антител, вовлеченных в высоко специфичное узнавание и связывание одной антигенной детерминанты, или эпитопа. Это отличает их от поликлональных антител, которые обычно включают в себя различные антитела, направленные против различных антигенных детерминант. Термин «моноклональное антитело» охватывает как интактные и полноразмерные антитела, так и фрагменты антител (например, Fab, Fab′, F(ab′)2, Fv), одноцепочечные мутантные формы (ScFv), слитые белки, включающие антитело, и любые другие модифицированные молекулы иммуноглобулина, включающие антиген-узнающий сайт. Дополнительно, «моноклональное антитело» относится к антителам, полученным любым из способов, в том числе, без ограничений, с помощью гибридомы, фаговой селекции, рекомбинантной экспрессии и трансгенных животных.
[00113] Термин «гуманизированные антитела» относится к формам антител, полученных не от человека (например, мышиных), представляющим собой иммуноглобулиновые цепи, химерные иммуноглобулины или их фрагменты, содержащие минимальные последовательности, полученные не от человека (например, мышиные). Как правило, гуманизированные антитела представляют собой иммуноглобулины человека, в которых остатки гипервариабельного участка (complementary determining region, CDR) заменены на остатки CDR, полученные от вида, отличного от человека (например, мыши, крысы, кролика, хомяка), которые имеют желаемую специфичность, сродство, и функциональные свойства (Jones et al., 1986, Nature, 321:522-525; Riechmann et al., 1988, Nature, 332:323-327; Verhoeyen et al., 1988, Science, 239:1534-1536). В некоторых случаях остатки каркасной области Fv (framework region, FR) иммуноглобулина человека, заменяют на соответствующие остатки антитела, полученного не от человека, обладающие нужной специфичностью, сродством, и функциональными свойствами. Гуманизированное антитело может быть дополнительно модифицировано путем замены дополнительных остатков либо в каркасной области Fv и/или в пределах замещенных остатков, полученных не от человека, для улучшения и оптимизации специфичности, сродства и/или функциональных свойств антитела. В целом, гуманизированные антитела содержат по существу все из по меньшей мере одного, и, как правило двух или трех вариабельных доменов, содержащих все или практически все области CDR, которые соответствуют иммуноглобулину, полученному не от человека, тогда как все или практически все области FR имеют консенсусную последовательность иммуноглобулина человека. Гуманизированное антитело может также включать по меньшей мере часть константной области иммуноглобулина или домена (Fc), типичной для иммуноглобулина человека. Примеры способов, применяемых для получения гуманизированных антител, описаны в патенте США 5225539.
[00114] Термин «антитело человека» обозначает антитело, продуцируемое человеком, или антитело, имеющее последовательность аминокислот, соответствующую антителу, продуцируемому человеком, с помощью любого из способов, известного в данной области. Это определение антитела человека включает в себя интактные или полноразмерные антитела, их фрагменты и/или антитела, содержащие по меньшей мере одну тяжелую и/или легкую цепь иммуноглобулина человека, например, антитело, включающее полипептиды легкой цепи иммуноглобулина мыши и тяжелой цепи иммуноглобулина человека.
[00115] Термин «химерные антитела» относится к антителам, в которых последовательность аминокислот молекулы иммуноглобулина получена от двух или более видов. Как правило, вариабельная область как легкой, так и тяжелой цепи, соответствует вариабельной области антител, полученных от одного вида млекопитающих (например, мыши, крысы, кролика и т.д.), с желаемой специфичностью, сродством и функциональными свойствами, тогда как константные области гомологичны последовательностям антител, полученных от другого вида (обычно человека) во избежание возникновения иммунного ответа у этого вида.
[00116] Термины «эпитоп» или «антигенная детерминанта» взаимозаменяемы в настоящей заявке и относятся к части антигена, которую может узнавать и с которой специфично связывается конкретное антитело. В случае, когда антиген представляет собой полипептид, эпитопы могут быть сформированы как смежными аминокислотами, так и несмежными аминокислотами, которые «сближаются» при третичной укладке белка. Эпитопы, сформированные смежными аминокислотами, как правило, сохраняются при денатурации белка, в то время как эпитопы, образованные третичной структурой, как правило, утрачиваются при денатурации белка. Эпитоп обычно содержит по меньшей мере 3, и что более обычно, по меньшей мере 5 или 8-10 аминокислот в уникальной пространственной конформации.
[00117] То, что антитело «специфично связывается» с эпитопом или белком означает, что антитело реагирует или ассоциирует с большей частотой, с большей скоростью, с большей продолжительностью, с большим сродством, или комбинацией перечисленного, с эпитопом или белком, чем с альтернативными веществами, в том числе неродственными белками. В некоторых вариантах реализации термин «специфично связывается» означает, например, что антитело связывается с белком с KD примерно 0,1 мМ или менее, но, как правило, менее 1 мкМ. В некоторых вариантах реализации «специфично связывается» означает, что антитело связывается с белком в одних случаях с KD по меньшей мере примерно 0,1 пМ или менее, или в других случаях по меньшей мере примерно 0,01 пМ или менее. Вследствие идентичности последовательностей между гомологичными белками у различных видов, термин «специфическое связывание» может относиться к антителам, которые узнают конкретный белок, такой как рецептор "frizzled", более чем у одного вида. Кроме того, вследствие гомологии между различными рецепторами FZD (например, FZD5 и FZD8) в некоторых областях полипептидных последовательностей рецепторов, специфичное связывание может включать антитело (или другой полипептид или агента), которое узнает более одного рецептора "frizzled". Следует понимать, что антитело или связывающая часть, которая специфично связывается с первой мишенью, может связываться специфично или может не связываться специфично со второй мишенью. Таким образом, «специфичное связывание» не обязательно требует (хотя может включать) исключительного характера связывания, то есть связывания с единственной мишенью. Таким образом, антитело может, В некоторых вариантах реализации специфично связываться более чем с одной мишенью (например, FZD1, FZD2, FZD5, FZD7 и/или FZD8 человека). В некоторых вариантах реализации один и тот же антиген-связывающий участок антитела может связываться с несколькими мишенями. Например, в некоторых случаях антитело может состоять из двух идентичных антиген-связывающих участков, каждый из которых специфично связывается с двумя или более рецепторами "frizzled" человека (например, FZD1, FZD2, FZD5, FZD7 и/или FZD8 человека). В некоторых альтернативных вариантах реализации антитело может быть биспецифичным и включают в себя по меньшей мере два антиген-связывающих участка с различными специфичностями. В качестве примера, но не ограничения, биспецифичное антитело может содержать один антиген-связывающий сайт, который узнает эпитоп на одном рецепторе "frizzled", например FZD5 человека, и дополнительно содержит второй другой антиген-связывающий сайт, который узнает второй другой рецептор "frizzled", например FZD8 человека. Как правило, но не обязательно, «связывание» обозначает специфичное связывание.
[00118] Полипептид, антитело, полинуклеотид, вектор, клетка или композиция, которая является «изолированной» представляет собой полипептид, антитело, полинуклеотид, вектор, клетку или композицию, которая находится в форме, не встречающейся в природе. Изолированные полипептиды, антитела, полинуклеотиды, векторы, клетки или композиции включают те, которые были очищены до такой степени, что они уже не находятся в форме, в которой они встречаются в природе. В некоторых вариантах реализации изолированные антитела, полинуклеотиды, векторы, клетки или композиции являются по существу очищенными.
[00119] При использовании в настоящей заявке «по существу очищенный» обозначает вещество, которое является по меньшей мере на 50% чистым (т.е. свободным от загрязнений), более предпочтительно по меньшей мере на 90% чистым, более предпочтительно по меньшей мере на 95% чистым, более предпочтительно по меньшей мере на 98%, более предпочтительно по меньшей мере на 99% чистым.
[00120] Термины «рак» и «раковый» относятся к или описывает физиологическое состояние у млекопитающих, при котором популяция клеток характеризуются нарушение регуляции роста клеток. Примеры рака включают, но не ограничиваются перечисленными, рак, лимфому, бластому, саркому и лейкемию. Более конкретные примеры форм рака включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легких, плоскоклеточный рак легких, рак брюшины, гепатоцеллюлярной рак, рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, колоректальный рак, рак эндометрия или матки, рак слюнной железы, рак почки, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, рак печени и различные виды рака головы и шеи.
[00121] «Опухоль» и «неоплазия» относятся к любому разрастанию ткани в результате чрезмерного роста клеток или пролиферации, либо доброкачественной (нераковой) либо злокачественной (раковой), включающей предраковые поражения.
[00122] Термины «раковые стволовые клетки», «опухолевые стволовые клетки» или «стволовые клетки солидной опухоли» взаимозаменяемы в настоящей заявке и обозначают популяцию клеток солидных опухолей, которые: (1) имеют большую способность к пролиферации; (2) способны к асимметричным клеточным делениям с образованием одного или нескольких типов дифференцированных клеток, имеющих ограниченную способность к пролиферации и развитию, и (3) способны к симметричным клеточным делениям для самообновления и самоподдержания. Такие свойства «раковых стволовых клеток», «опухолевых стволовых клеток» или «стволовых клеток солидной опухоли» позволяют раковым стволовым клеткам образовывать доступный для пальпации опухоли при серийной трансплантации мышам с ослабленным иммунитетом, по сравнению с большинством опухолевых клеток, из которых не образуются опухоли. Раковые стволовые клетки претерпевают самообновлению в противоположность дифференцировке хаотичным образом, с образованием опухолей с аномальными типами клеток, которые могут меняться с течением времени вследствие возникновения мутаций.
[00123] Термин «раковые клетки», «опухолевые клетки» и грамматические эквиваленты относятся к совокупной популяции клеток, полученные из опухоли или предракового поражения, включающих как неонкогенные клетки, которые составляют большую часть популяции клеток опухоли, так и онкогенные стволовые клетки (раковые стволовые клетки). При использовании в настоящей заявке термин «опухолевых клетки» заменяется на «неонкогенные клетки», когда речь идет исключительно о тех опухолевых клетках, у которых отсутствует способность к возобновлению и дифференцировке, что позволяет провести отличить такие опухолевые клетки от раковых стволовых клеток.
[00124] Термин «онкогенный» относится к функциональным особенностям стволовых клеток солидных опухолей, в том числе свойству самообновления (появление дополнительных онкогенных стволовых опухолевых клеток) и пролиферации с образованием всех других опухолевых клеток (возникновение дифференцированных и, следовательно, неонкогенных опухолевых клеток), что делает возможным формирование опухоли из стволовых клеток солидной опухоли. Такие свойства самообновления и пролиферации с образованием всех других опухолевых клеток обеспечивают способность раковых стволовых клеток образовывать доступные пальпации при серийной трансплантации мышам с ослабленным иммунитетом, что отличает их от неонкогенных клеток опухоли, которые не способны давать начало опухолям при серийной трансплантации. Было отмечено, что неонкогенные клетки опухоли могут образовывать опухоли при первичной трансплантации мышам с ослабленным иммунитетом после получения опухолевых клеток от солидных опухолей, но такие неонкогенные клетки опухоли не дают начало опухолям при серийной трансплантации.
[00125] Термин «субъект» относится к любому животному (например, млекопитающему), в том числе, без ограничений, к человеку, отличным от человека приматам, грызунам, и т.п., которое получает конкретное лечение (подвергается воздействию конкретного вещества). Как правило, термин «субъект» и «пациент» являются взаимозаменяемыми в настоящей заявке при обозначении человека.
[00126] «Фармацевтически приемлемая соль» обозначает соль соединения, которое является фармацевтически приемлемым и обладает желаемой фармакологической активностью исходного соединения.
[00127] «Фармацевтически приемлемый эксципиент, носитель или адъювант» относится к эксципиенту, носителю или адъюванту, который можно вводить субъекту вместе по меньшей мере с одним антителом, описанным в настоящей заявке, и который не разрушает его фармакологическую активность и является нетоксичным при введении в дозах, достаточных для доставки терапевтического количества соединения.
[00128] «Фармацевтически приемлемый носитель» относится к разбавителю, адъюванту, эксципиенту или носителю, который вводят по меньшей мере с одним антителом, описанным в настоящей заявке.
[00129] Термин «терапевтически эффективное количество» относится к количеству антитела, полипептида, полинуклеотида, низкомолекулярному органическому соединению, или другому лекарственному средству, эффективному для «лечения» заболевания или нарушения у субъекта или млекопитающего. В случае рака, терапевтически эффективное количество лекарственного средства может уменьшить число раковых клеток, уменьшить размер опухоли; ингибировать или остановить инфильтрацию раковых клеток в периферические органы, включая, например, распространение рака в мягкие ткани и кости; ингибирование или остановку метастазы опухолей; ингибирование и остановку роста опухоли, облегчение до некоторой степени одно или нескольких симптомов, связанных с раком, снижение заболеваемости и смертности, улучшение качества жизни, уменьшение туморогенности, частоты образования опухолей, или онкогенного потенциала опухоли; уменьшение количества или частоты раковых стволовых клеток в опухоли; способствовать дифференцировке онкогенных клеток в неонкогенное состояние; или комбинацию таких эффектов. В зависимости от того, насколько лекарственное средство предотвращает рост и/или убивает существующие раковые клетки, его относят к цитостатическим и/или цитотоксическим веществам.
[00130] Такие термины, как «лечение» или «лечить» или «облегчение» или «облегчать» относятся как к 1) лечебным мероприятиям, которые облегчают, замедляют, уменьшают проявление симптомов, и/или остановку развития диагностированного патологического состояния или нарушения, так и к 2) профилактическим или профилактическим мерам по предотвращению и/или замедлению развития подвергаемых лечению патологических состояний или нарушений. Таким образом, субъекты, нуждающиеся в лечении, включают субъектов, уже имеющих нарушение, субъектов, склонных к развитию нарушения, а также субъектов, у которых необходимо предотвратить развитие нарушения. В некоторых вариантах реализации у субъекта успешно «лечат» рак в соответствии со способами настоящего изобретения, если пациент демонстрирует одно или несколько из следующих проявлений: уменьшение числа или полное отсутствие раковых клеток; уменьшение размера опухоли; ингибирование или отсутствие инфильтрации раковых клеток в периферические органы, в том числе, например, распространение рака в мягкие ткани и кости; подавление или отсутствие метастаз опухолей; подавление или отсутствие роста опухоли; облегчение одного или более симптомов, связанных с конкретным типом рака, снижение заболеваемости и смертности, улучшение качества жизни, снижение туморогенности, частоты образования опухолей, или онкогенного потенциала опухоли; уменьшение количества или частоты раковых стволовых клеток в опухоли; дифференцировку онкогенных клеток в неонкогенное состояние; или любые комбинации таких эффектов.
[00131] «Полинуклеотид» или «нуклеиновая кислота», используемые взаимозаменяемо в настоящей заявке, относятся к полимеру нуклеотидов любой длины, и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любые субстраты, которые могут быть включены в полимер ДНК- или РНК-полимеразой. Полинуклеотид может включать модифицированные нуклеотиды, например, метилированные нуклеотиды и их аналоги. При наличии модификации структуры нуклеотида такая модификация может быть осуществлена до или после сборки полимера. Последовательность нуклеотидов может прерываться ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например, путем конъюгации с компонентом метки. Другие виды модификации включают, например, «кэпирование», замену одного или более природных нуклеотидов на аналог, внутринуклеотидные модификации, такие как, например, содержащие незаряженные группы (например, метилфосфораты, фосфотриэфиры, фосфорамидаты, карбаматы, и т.д.) и содержащие заряженные связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), содержащие добавочные фрагменты, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин, и т.д.), содержащие интеркаляторы (например, акридин, псорален и т.д.), содержащие хелатирующие агенты (например, металлы, радиоактивные металлы, бор, окисляющие металлы и др.), содержащие алкилирующие агенты, содержащие модифицированные связи (например, альфа-аномерные нуклеиновые кислоты и др.), а также немодифицированные формы полинуклеотидов. Дополнительно, любая из гидроксильных групп, присутствующая в сахарах, можно заменить, например, фосфонатной группой, фосфатной группой, можно защитить с помощью стандартной защитной группой, или может быть активирована для образования дополнительных связи с дополнительными нуклеотидами, или может быть конъюгирована с твердой подложкой. 5′- и 3′-концевые OH-группы могут быть фосфорилированы или замещенными аминами или органическими «кэпирующими» группами, содержащими от 1 до 20 атомов углерода. Другие гидроксильные группы могут также образовывать производные со стандартными защитными группами. Полинуклеотиды могут также содержать формы-аналоги Сахаров рибозы или дезоксирибозы, которые широко известны в данной области, в том числе, например, 2′-O-метил-, 2′-O-аллил, 2′-фтор-или 2′-азидорибозу, карбоциклические сахара-аналоги, альфа-аномерные сахара, эпимерные сахара, такие как арабинозы, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и лишенные азотистого основания аналоги нуклеозидов, такие как метилрибозид. Одна или более фосфодиэфирная связь может быть заменена альтернативной присоединенной группой. Такие альтернативные присоединенные группы включают, но не ограничены перечисленными, варианты, в которых фосфат заменен Р (0) S («тиоат»), Р(S)S («дитиоат»), (0) NR2 («амидат»), P(0)R, P(0)0R′, СО или СН2 («формацеталь»), где каждый R или R′ независимо представляет собой Н или замещенный или незамещенный алкил (1-20 C), который может содержать эфир (-О-), арил, алкенил, циклоалкил, циклоалкенил или аралдил. Не все присоединенные группы должны быть обязательно идентичными. Предшествующее описание относится ко всем полинуклеотидам, упомянутым в настоящей заявке, в том числе РНК и ДНК
[00132] «Вариабельная область» антитела относится к вариабельной области легкой цепи антитела или вариабельной области тяжелой цепи антитела, либо в отдельности, либо в сочетании. Каждая вариабельная область тяжелой и легкой цепи каждого состоять из четырех каркасных областей (framework regions, FR), соединенных тремя областями, определяющими комплементарность (complementarity determining regions, CDR), также известными как гипервариабельные участки. Гипервариабельные участки в каждой цепи удерживаются вместе в непосредственной близости от каркасных областей, и наряду с CDR другой цепи участвуют в образовании антиген-связывающего сайта антитела. Существует по меньшей мере два способа определения CDR: (1) подход, основанный на межвидовой вариабельности последовательностей (Kabat et al. Sequences of Proteins of Immunological Interest, (5th ed., 1991, National Institutes of Health, Bethesda Md.)) и (2) подход, основанный на кристаллографических исследованих комплексов антиген-антитело (Al-lazikani et al (1997) J. Molec. Biol 273:927-948)). Кроме того, для определения CDR иногда применяют сочетание этих двух подходов.
[00133] Термин «вектор» обозначает конструкцию, которая способна осуществлять доставку и, предпочтительно, экспрессию одного или более гена (генов) или последовательности (последовательностей) интереса в клетке-хозяине. Примеры векторов включают, но не ограничены перечисленными, вирусные векторы, изолированные векторы для экспрессии на основе ДНК или РНК, плазмиды, космиды или фаговые векторы, экспрессионные векторы на основе ДНК или РНК, ассоциированные с катионными конденсирующими агентами, экспрессионные векторы на основе ДНК или РНК, заключенные в липосомы, и некоторые эукариотические клетки, такие как клетки-продуценты.
[00134] Термины «полипептид», «пептид» и «белок» взаимозаменяемы в настоящей заявке для обозначения полимеров аминокислот любой длины. Полимер может быть линейным или разветвленным, он может включать модифицированные аминокислоты, и его последовательность может быть прервана отличными от аминокислот соединениями. Термины также охватывают полимер из аминокислот, которые были модифицированы естественным путем или искусственно, например, в результате образования бисульфидных связей, гликозилирования, липидизации, ацетилирования, фосфорилирования или любым другим способом или модификацией, например, путем конъюгации с компонентом метки. Определение также включает, например, полипептиды, содержащие один или несколько аналогов аминокислот (в том числе, например, неприродных аминокислот и т.д.), а также другие модификации, известные в данной области. Очевидно, что, поскольку полипептиды настоящего изобретения основаны на антителах, в некоторых вариантах реализации полипептиды могут встречаться в виде одной цепи или ассоциированных цепей.
[00135] Термины «идентичные» или процент «идентичности» применительно к двум или более нуклеиновым кислотам или полипептидам, относятся к двум или более одинаковым последовательностям или подпоследовательностям или имеющим указанный процент одинаковых нуклеотидов или аминокислот, при их сравнении и выравнивании (с введением пробелов, если это необходимо) для максимального соответствия, при этом какие-либо консервативные замены аминокислот не считаются идентичными по последовательности. Процент идентичности может быть оценен с помощью программ или алгоритмов для сравнения последовательностей или визуально. В данной области известны различные алгоритмы и программы для выравнивания последовательностей аминокислот или нуклеотидов. Один из таких не ограничивающих примеров алгоритма выравнивания последовательностей - алгоритм, описанный в работе Karlin et al, 1990, Proc. Natl. Acad. Sci., 87:2264-2268, модифицированный Karlin et al., 1993, Proc. Natl. Acad. Sci, 90:5873-5877 и включенный в программы NBLAST и XBLAST (Altsehul et al., 1991, Nucleic Acids Res., 25:3389-3402). В некоторых вариантах реализации может быть использована программа Gapped BLAST, описанная в работе Altsehul et al., 1997, Nucleic Acids Res. 25:3389-3402). Другими публично доступными программами, которые можно применять для выравнивания последовательностей, являются программы BLAST-2, WLJ-BLAST-2 (Altsehul et al., 1996, Methods in Enzymology, 266:460-480), ALIGN, ALIGN-2 (Genentech, South San Francisco, California) или Megalign (DNASTAR). В некоторых вариантах реализации процент идентичности между двумя последовательностями нуклеотидов определяют с помощью программы GAP пакета программ GCG (например, с помощью матрицы NWSgapdna.CMP и веса пробела 40, 50, 60, 70 или 90, и веса длины 1, 2, 3, 4, 5 или 6). В некоторых альтернативных вариантах реализации для определения процента идентичности между двумя последовательностями аминокислот можно применять программу GAP из пакета программ GCG, включающую алгоритм Нидельмана-Вунша (Needleman and Wunsch, J. Mol. Biol. (48):444-453 (1970)) (например, с помощью матрицы Blossum 62 или РАМ250, и веса пробела 16, 14, 12, 10, 8, 6 и 4, веса длины 1, 2, 3, 4, 5). Дополнительно, в некоторых вариантах реализации процент идентичности между последовательностями нуклеотидов или аминокислот определяют с помощью алгоритма Майерса-Миллер (Myers and Miller, CABIOS, 4:11-17 (1989)). Например, процент идентичности может быть определен с помощью программы ALIGN (версия 2.0) с использованием таблицы остатков РАМ 120, штрафа за длину пробела 12 и штрафа за пробел 4. Подходящие параметры для максимального выравнивание с помощью конкретной программы для выравнивания могут быть определены специалистом в данной области. В некоторых вариантах реализации используют параметры выравнивания, заданные в программе по умолчанию. В некоторых вариантах реализации процент идентичности «X» первой последовательности аминокислот второй последовательности аминокислот рассчитывают как 100×(Y/Z), где Y - число остатков аминокислот, соответствующих идентичным совпадениям при выравниваниях первой и второй последовательностей (выравненных визуально или с помощью конкретной программы для выравнивания последовательности), a Z - общее число остатков во второй последовательности. Если длина первой последовательности больше, чем второй последовательности, процентов процент идентичности первой последовательности по отношению ко второй последовательности будет больше, чем процент идентичности второй последовательности по отношению к первой последовательности.
[00136] В качестве не ограничивающего примера, конкретный процент идентичности по последовательности конкретного полинуклеотида (например, по меньшей мере 80% идентичности, по меньшей мере 85% идентичности, по меньшей мере 90% идентичности, и в некоторых вариантах по меньшей мере 95%, 96%, 97%, 98% или 99% идентичности) относительно референсной последовательности в некоторых вариантах реализации определяют с помощью программы Bestfit (Wisconsin Sequence Analysis Package, Version 8 for Unix, Genetics Computer Group, University Research Park, 575 Science Drive, Madison, WI 53711). В программе Bestfit для поиска наилучшего участка гомологии между двумя последовательностями использован алгоритм локальной гомологии Смита-Уотермана (Smith and Waterman, Advances in Applied Mathematics 2: 482489 (1981). При использовании программы Bestfit или любой другой программы для выравнивания последовательностей, для определения того, является ли определенная последовательность, например, идентичной на 95% референсной последовательности согласно настоящему изобретению, параметры устанавливают таким образом, что процент идентичности рассчитывается по всей длине референсной последовательности нуклеотидов, и допускаются пробелы в гомологичных участках, составляющие до 5% от общего числа нуклеотидов в референсной последовательности.
[00137] В некоторых вариантах реализации две нуклеиновые кислоты или полипептида настоящего изобретения, являются по существу идентичными, если при сравнении и выравнивании с максимальным соответствием они имеют по меньшей мере 70%, по меньшей мере 75%, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90%, а в некоторых вариантах по меньшей мере 95%, 96%, 97%, 98%, 99% идентичных нуклеотидов или аминокислотных остатков, определенных с помощью алгоритма сравнения последовательностей или визуально. Предпочтительно, идентичность существует в составе последовательности, которая составляет по меньшей мере примерно 10, предпочтительно примерно 20, более предпочтительно примерно 40-60 остатков в длину или любое целочисленное значение в указанном промежутке, предпочтительно в пределах области, более протяженной чем 60-80 остатков, более предпочтительно по мере примерно 90-100 остатков, и наиболее предпочтительно последовательности по существу идентичны по всей длине сравниваемых последовательностей, например, кодирующей области нуклеотидной последовательности.
[00138] «Консервативная аминокислотная замена» представляет собой замену, при которой один аминокислотный остаток заменен другим аминокислотным остатком, имеющим сходную боковую цепь. В данной области были определены семейства аминокислотных остатков, имеющих сходные боковых цепи, в том числе основные боковые цепи (например, лизин, аргинин, гистидин), кислые боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серии, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). Например, замена фенилаланина на тирозин представляет собой консервативную замену. Предпочтительно, консервативные замены в последовательности полипептидов и антител настоящего изобретения не отменяют связывание полипептида или антитела, содержащего последовательность аминокислот, с антигеном (антигенами), т.е. одним или более рецептором "frizzled" человека, с которым связывается полипептид или антитело. Способы идентификации консервативных замен нуклеотидов и аминокислот, которые не отменяют связывание антигена, хорошо известны в данной области (см, например, Brammell et al, Biochem. 32: 11.80-1 187 (1993); Kobayashi et al. Protein Eng. 12(10):879-884 (1999); и Burks et al. Proc. Natl. Acad. Sci. USA 94:.412-417 (1997)).
[00139] Используемые в настоящем описании и формуле формы слов в единственном числе также включает формы слов во множественном числе, если из контекста не следует иное.
[00140] Следует понимать, что в настоящей заявке при описании вариантов реализации в терминах «включающий», также предусмотрены иные аналогичные варианты, описанные в терминах «состоящий из» или «по существу состоящий из».
[00141] Термин «и/или», используемый в таком словосочетании как «А и/или В» в настоящей заявке, включает как и «А и В», «А или В», «А» и «В». Аналогичным образом термин «и/или», используемый в таком словосочетании как «А, В и/или С» охватывает каждый из следующих вариантов: А, В, и С; А, В, или С; А или С; А или В; В или С; А и С; А и В; В и С; А (в отдельности); В (в отдельности) и С (в отдельности).
[00142] «Условия высокой жесткости» можно определить как условия, характеризующихся: (1) низкой ионной силой и высокой температурой для отмывки, например натрия 0,015 М хлорид натрия / 0,0015 цитрат натрия / 0,1% додецилсульфат натрия при 50°C; (2) использованием при гибридизации денатурирующих агентов, таких как формамид, например, 50% (по объему) формамид с 0,1% бычьим сывороточным альбумином / 0,1% фиколл / 0,1% поливинилпирролидон / 50 мМ натрий-фосфатный буфер при pH 6,5 с 750 мМ хлорида натрия, 75 мМ цитрат натрия при 42°C; или (3) используют 50% формамид, 5×SSC (0,75 М NaCl, 0,075 М цитрат натрия), 50 мМ натрий-фосфатный буфер (pH 6,8), 0,1% пирофосфат натрия, раствор 5х Денхардта, обработанная ультразвуком ДНК спермы лосося (50 мкг/мл), 0,1% ДСН, 10% декстран сульфата при 42°C, с промывками при 42°C в 0,2×ДСН (хлорид натрия/цитрат натрия) и 50% формамиде при 55°C, с последующей промывкой при условиях высокой жесткости с использованием 0,1×ДСН, содержащим ЭДТА, при 55°C.
II. FZD-связывающие агенты
[00143] Настоящее изобретение обеспечивает агенты, которые специфично связываются с одним или более рецептором "frizzled" (FZDs) человека. Такие агенты названы в настоящей заявке «FZD-связывающие агенты». В некоторых вариантах реализации такие агенты специфично связываются с двумя, тремя, четырьмя, пятью, шестью, семью, восьмью, девятью или десятью рецепторами "frizzled". Рецептор или рецепторы "frizzled" человека, с которым связывается указанный агент, может быть выбран из группы, включающей FZD1, FZD2, FZD3, FZD4, FZDS, FZD6, FZD7, FZD8, FZD9 и FZD10. В некоторых вариантах реализации указанные один или более рецепторы "frizzled" человека включают FZD1, FZD2, FZD5, FZD7, и/или FZD8. В некоторых вариантах реализации один или более рецептор "frizzled" человека включает FZD7. В некоторых вариантах реализации один или более рецептор "frizzled" человека включает FZD5 и/или FZD8. В некоторых вариантах реализации указанный агент специфично связывается с FZD1, FZD2, FZD5, FZD7 и FZD8. Полноразмерные аминокислотные (ак) и нуклеотидные (нт) последовательности для FZD 1-10 известны в данной области, и представлены в настоящей заявке как SEQ ID NO: 26 (FZD1 ак), SEQ ID NO: 30 (FZD2 ак), SEQ ID NO: 34 (FZDS ак), SEQ ID NO: 38 (FZD4 ак), SEQ ID NO: 42 (FZDS ак), SEQ ID NO: 46 (FZ.D6 ак), SEQ ID NO: 50 (FZD7 ак), SEQ ID NO: 54 (FZD8 ак), SEQ ID NO: 58 (FZD9 ак), SEQ ID NO: 62 (FZD 10 ак), SEQ ID NO: 29 (FZD1 нт), SEQ ID NO: 33 (FZD2 нт), SEQ ID NO: 37 (FZD3 нт), SEQ ID NO: 41 (FZD4 нт), SEQ ID NO: 45 (FZD5 нт), SEQ ID NO: 49 (FZD6 нт), SEQ ID NO: 53 (FZD7 нт), SEQ ID NO: 57 (FZD8 нт), SEQ ID NO: 61 (FZD9 нт) и SEQ ID NO: 65 (FZD 10 нт).
[00144] В некоторых вариантах реализации антитело или другой полипептид или агент, описанный в настоящей заявке, специфично связывается с FZD7. В некоторых вариантах реализации указанное антитело, полипептид, или агент может дополнительно специфично связываться или перекрестно реагировать с одним или более дополнительным рецептором "frizzled" человека.
[00145] В некоторых вариантах реализации антитело или другой полипептид или агент, описанные в настоящей заявке, специфично связывается с FZD5. В некоторых вариантах реализации указанное антитело, полипептид или агент может дополнительно специфично связываться или перекрестно реагировать с одним или более дополнительным рецептором "frizzled" человека.
[00146] В некоторых вариантах реализации указанный агент специфично связывается с двумя или более рецепторами "frizzled" человека. В некоторых вариантах реализации указанные два или более рецептора "frizzled" человека выбраны из группы, включающей FZD2, FZD5, FZD7 и FZD8. В некоторых вариантах реализации указанные два или более рецептора "frizzled" включают FZD1 и второй рецептор "frizzled", выбранный из группы, включающей FZD2, FZDS, FZD7 и FZD8. В некоторых вариантах реализации два или более рецептора "frizzled" включают FZD2 и второй рецептор "frizzled", выбранный из группы, включающей FZD1, FZD5, FZD7 и FZD8. В некоторых вариантах реализации два или более рецептора "frizzled" включают FZD5 и второй рецептор "frizzled" выбранный из группы, включающей FZD1, FZD2, FZD7 и FZD8. В некоторых вариантах реализации два или более рецептора "frizzled" включают как FZD5, так и FZD8. В некоторых вариантах реализации два или более рецептора "frizzled" включают FZD7 и второй рецептор "frizzled", выбранный из группы, включающей FZD1, FZD2, FZD5 и FZD8.
[00147] В некоторых вариантах реализации указанный агент специфично связывается с тремя или более рецепторами "frizzled" человека. В некоторых вариантах реализации три или более рецептора "frizzled" человека включают три или более рецептора "frizzled", выбранные из группы, включающей FZD1, FZD2, FZD5, FZD7 и FZD8. В некоторых вариантах реализации агент дополнительно специфично связывается с одним или более дополнительным рецептором "frizzled" человека.
[00148] В некоторых вариантах реализации указанные агент или антитело специфично связываются с внеклеточным доменом (ВКД) в составе одного или более рецептора "frizzled" человека, с которым он связывается. Последовательности внеклеточного домена для каждого из рецепторов "frizzled" человека известны в данной области и предоставлены в настоящей заявке как SEQ ID NO: 27 (FZD1 ВКД), SEQ ID NO: 31 (FZD2 ВКД), SEQ ID NO: 35 (FZD3 ВКД), SEQ ID NO: 39 (FZD4 ВКД), SEQ ID NO: 43 (FZD5 ВКД), SEQ ID NO: 47 (FZD6 ВКД), SEQ ID NO: 51 (FZD7 ВКД), SEQ ID NO: 55 (FZD8 ВКД), SEQ ID NO: 59 (FZD9 ВКД) и SEQ ID NO: 63 (FZD10 ВКД).
[00149] В некоторых вариантах реализации указанные агент или антитело специфично связываются с Fri-доменом (FRI) (также известным как цистеин-богатый домен (cysteine-rich domain, CRD)) в составе рецептора (рецепторов) "frizzled" человека, с которым он связывается. Последовательности Fri-домена для каждого из рецепторов "frizzled" человека известны в данной области и предоставлены также как SEQ ID NO: 28 (FZD1 FRI), SEQ ID NO: 32 (FZD2 FRI), SEQ ID NO: 36 (FZD3 FRI), SEQ ID NO: 40 (FZD4 FRI), SEQ ID NO: 44 (FZD5 FRI), SEQ ID NO: 48 (FZD6 FRI), SEQ ID NO: 52 (FZD7 FRI), SEQ ID NO: 56 (FZD8 FRI), SEQ ID NO: 60 (FZD9 FRI) и SEQ II) NO:64 (FZD10 FRI).
[00150] В некоторых вариантах реализации отдельный антиген-связывающий сайт FZD-связывающего антитела или полипептида, описанного в настоящей заявке, способен связываться (или связывается) с одним, двумя, тремя, четырьмя или пятью (или более) рецепторами "frizzled" человека. В некоторых вариантах реализации отдельные антиген-связывающие сайты FZD-связывающих антител или полипептида способны специфично связывать один, два, три, четыре или пять рецепторов "frizzled" человека, выбранных из группы, включающей FZD1, FZD2, FZD5, FZD7 и FZD8. В некоторых вариантах реализации отдельный сайт связывания антитела или полипептида специфично связывается по меньшей мере с FZD5 и FZD8.
[00151] В некоторых вариантах реализации FZD-связывающий агент или антитело связывается с одним или более (например, двумя или более, тремя или более, или четырьмя или более) рецептором "frizzled" человека с константой диссоциации (KD) примерно 1 пМ или менее, примерно 100 нм или менее, примерно 40 нм или менее, примерно 20 нм или менее, или примерно 10 нм или менее. Например, в некоторых вариантах реализации FZD-связывающий агент или антитело, описанное в настоящей заявке, связывается с константой диссоциации примерно 40 нМ или менее с одним или более (например, 1, 2, 3, 4 или 5) из следующих FZD: FZD1, FZD2, FZD5, FZD7 и FZD8. В некоторых вариантах реализации FZD-связывающий агент или антитело связывается с константой диссоциации примерно 10 нм или менее с одним или более (например, 1, 2, 3, 4 или 5) из следующих FZD: FZD1, FZD2, FZD5, FZD7 и FZD8. В некоторых вариантах реализации FZD-связывающий агент или антитело связывается с константой диссоциации примерно 10 нМ или менее с каждым из следующих FZD: FZD1, FZD2, FZD5, FZD7 и FZD8. В некоторых вариантах реализации константа диссоциации агента или антитела при связывании с конкретным FZD представляет собой константу диссоциации, определенную с помощью слитого (гибридного) белка FZD-Fc, включающего внеклеточный домен FZD или Fri-домен, иммобилизованного на чипе Biacore.
[00152] В некоторых вариантах реализации настоящего изобретения FZD-связывающий агент или антитело связывается с одним или более (например, двумя или более, тремя или более, или четырьмя или более) рецептором "frizzled" человека с ЭК50 примерно 1 мкМ или менее, примерно 100 нМ или менее, примерно 40 нМ или менее, примерно 20 нМ или менее, примерно 10 нМ или менее, или примерно 1 нМ или менее. Например, в некоторых вариантах реализации FZD-связывающий агент или антитело, описанное в настоящей заявке, связывается более чем с одним FZD с ЭК50 примерно 40 нМ или менее, примерно 20 нМ или менее, или примерно 10 нМ или менее по отношению к указанным FZD. В некоторых вариантах реализации FZD-связывающий агент или антитело имеет ЭК50 примерно 20 нМ или менее по отношению к одному или более (например, 1, 2, 3, 4 или 5) из следующих FZD: FZD1, FZD2, FZD5, FZD7 и FZD8. В некоторых вариантах реализации FZD-связывающий агент или антитело имеет ЭК50 примерно 10 нм или менее по отношению к одному или более (например, 1, 2, 3, 4 или 5) из следующих FZD: FZD1, FZD2, FZD5, FZD7 и FZD8. В некоторых вариантах реализации FZD-связывающий агент или антитело имеет ЭК50 примерно 40 нм или менее или 20 нм или менее при связывании с FZD5 и/или FZD8.
[00153] В некоторых вариантах реализации FZD-связывающий агент (например, антитело) связывается с тем же эпитопом, или связывается с эпитопом, который перекрывается с эпитопом антитела, включающего вариабельную область тяжелой цепи, включающую SEQ ID NO: 10, и вариабельную область легкой цепи, включающую SEQ ID NO: 12 или SEQ ID NO: 14 (например, антитело 18R5 или 18R8 IgG). В некоторых вариантах реализации FZD-связывающий агент или антитело связывается с тем же эпитопом, или связывается с эпитопом, который перекрывается с эпитопом антитела, включающего последовательность тяжелой цепи SEQ ID NO: 11 и последовательность легкой цепи SEQ ID NO: 13 или SEQ ID NO: 15. В некоторых вариантах реализации FZD-связывающий агент связывается с тем же эпитопом, или связывается с эпитопом, совпадающим с эпитопом антитела, включающего вариабельную область тяжелой цепи, включающую SEQ ID NO: 85 и вариабельную область легкой цепи, включающую SEQ ID NO: 86 (например, антитело 44R24 IgG).
[00154] В некоторых вариантах реализации FZD-связывающий агент конкурирует с антителом за специфичное связывание с рецептором "frizzled" человека в конкурентно-связывающем анализе, при этом указанное антитело содержит вариабельную область тяжелой цепи, включающую SEQ ID NO: 10, и вариабельную область легкой цепи, включающую SEQ ID NO: 12 или SEQ ID NO: 14. В некоторых вариантах реализации FZD-связывающий агент конкурирует за специфичное связывание с рецептором "frizzled" человека с антителом, включающим тяжелую цепь, включающую последовательность SEQ ID NO: 11, и легкую цепь, включающую последовательность SEQ ID NO: 13 или SEQ ID NO: 15. В некоторых вариантах реализации антитело, с которым указанный агент конкурирует за специфичное связывание с рецептором "frizzled" человека, представляет собой антитело 18R5 IgG. В некоторых альтернативных вариантах антитело представляет собой антитело 18R8 IgG.
[00155] В некоторых вариантах реализации FZD-связывающий агент конкурирует с антителом за специфичное связывание с рецептором "frizzled" человека в конкурентно-связывающем анализе, при этом указанное антитело содержит вариабельную область тяжелой цепи, включающую SEQ ID NO: 85 и вариабельную область легкой цепи, включающую SEQ ID NO: 86.
[00156] В некоторых вариантах реализации FZD-связывающий агент или антитело связывается по меньшей мере с частью области рецептора "frizzled" человека, обозначенной авторами настоящего изобретения как «биологический сайт связывания» (БСС) (Фигура. 9, Пример 6). В FZD8 человека (SEQ ID NO: 54), БСС включат следующие элементы: (а) конформационный эпитоп, включающий аминокислоты 72(F), 74-75(PL), 78(1), 92(Y), 121-122(LM) и 129-132(WPDR (SEQ ID NO: 70)) («впадина» БСС, представленная на Фигурах 8 и 9), (б) область FZD8, включающую последовательности GLEVHQ (SEQ ID NO: 25) («верхний край» БСС, представленный на Фигурах 8 и 9) и (в) область FZD8, включающую последовательности YGFA (SEQ ID NO: 74) («нижний край» БСС, представленный на Фигурах 8 и 9). Остатки, соответствующие БСС FZD 1-7, FZD9 и FZD 10, представлены в Таблице 1, ниже, и на Фигуре 8. В некоторых вариантах реализации агент, который блокирует связывание лиганда (например, Wnt) с FZD, подавляет связывание лиганда с БСС. Очевидно, что в некоторых вариантах реализации агенты, которые связываются по меньшей мере с частью БСС, могут также связываться с одной или более другой областью (т.е. за пределами БСС) человеческого рецептора "frizzled". Иными словами, в некоторых вариантах реализации эпитоп, с которым связывается FZD-связывающий агент или антитело, представляет собой область в составе внеклеточного домена рецептора FZD, которая перекрывается с БСС, но не полностью находится в пределах БСС. В некоторых альтернативных вариантах реализации, эпитоп, с которым связывается FZD-связывающий агент или антитело, полностью находится в пределах в БСС (т.е. БСС включает в себя весь эпитоп, с которым связывается FZD-связывающее антитело или другой агент).

[00157] Вне связи с какой-либо теорией, считается, что БСС включают возможный лиганд-связывающий сайт, например, сайт связывания Wnt. Для FZD8, такой возможный лиганд-связывающий сайт включает в себя конформационные эпитопы, сформированные аминокислотами (F), 74-75(PL), 78(1), 92(Y), 121-122(LM) и 129-132(WPDR (SEQ ID NO: 70)) («впадина» БСС, представленная на Фигурах 8 и 9). Соответствующие остатки возможного лиганд-связывающего сайта FZD1-7, FZD9 и FZD10 показаны на выравнивании последовательностей на Фигуре 8. В некоторых вариантах реализации агент, который блокирует связывание лигандов (например, Wnt) с БСС, подавляет связывание лиганда с таким конформационным эпитопом. Очевидно, что в некоторых вариантах реализации агенты, которые связываются по меньшей мере с частью такого лиганд-связывающего сайта могут также связываться с другой областью (например, за пределами БСС) рецептора "frizzled" человека. В некоторых альтернативных вариантах агент не связывается с какой-либо частью FZD вне конформационного эпитопа.
[00158] В некоторых вариантах реализации указанный агент связывается по меньшей мере с частью последовательности QDEAGLEVHQFWPL (SEQ ID NO: 67) в составе человеческого рецептора "frizzled", в случае, если человеческий рецептор "frizzled" представляет собой FZD8, или соответствующей последовательностью, в случае если человеческий рецептор "frizzled" представляет собой FZD 1-7, FZD9 или FZD10. Указанная область FZD включает «верхний край» БСС, обозначенный на Фигурах 8 и 9. Последовательности, соответствующие эпитопу QDEAGLEVHQFWPL (SEQ ID NO: 67) рецептора FZD8, в различных рецепторах "frizzled", указанные в Таблице 2, ниже, а также видны на выравнивании на Фигуре 8. В некоторых вариантах реализации агент специфично связывается с человеческим рецептором "frizzled", выбранным из группы, включающей FZD1, FZD2, FZDS, FZD7 и FZD8, и агент связывается по меньшей мере с частью последовательности Q(DE/ED)AGLEVHQF(Y/W)PL (SEQ ID NO: 24) в составе рецепторов "frizzled" человека. В некоторых вариантах реализации агент специфично связывается по меньшей мере с частью последовательности AGLEVHQF (SEQ ID NO: 68) в составе рецептора (рецепторов) "frizzled" человека FZD1, FZD2, FZD5, FZD7 и/или FZD8. В некоторых вариантах реализации агент связывается по меньшей мере с частью последовательности в составе FZD3, FZD4, FZD6, FZD9 и/или FZD10, которая соответствует последовательности AGLEVHQF (SEQ ID NO: 68) FZD8. В некоторых вариантах реализации агент специфично связывается по меньшей мере с частью последовательности GLEVHQ (SEQ ID NO: 25) в составе рецептора (рецепторов) "frizzled" человека FZD1, FZD2, FZD5, FZD7 и/или FZD 8. Указанная последовательность «верхнего края» БСС показана на Фигуре 9. В некоторых вариантах реализации агент связывается по меньшей мере с частью последовательности в составе FZD3, FZD4, FZD6, FZD9 и/или FZD 10, которая соответствует последовательности GLEVHQ (SEQ ID NO: 25) в составе FZD8. Последовательности, соответствующие последовательности GLEVHQ (SEQ ID NO: 25) в составе FZD8, подчеркнуты во втором и третьем столбцах Таблицы 2, ниже, и видны на выравнивании последовательностей на Фигуре 8. В некоторых вариантах реализации агент, который связывается по меньшей мере с частью SEQ ID NO: 67 или 68 в составе FZD 8, или с соответствующим эпитопом в составе другого FZD, подавляет связывание лиганда (например, Wnt) с FZD (например, с БСС в составе FZD). В некоторых вариантах реализации агенты, которые связываются с указанными выше областями, могут также связываться с другими дополнительными областями (например, за пределами указанных выше областей) рецептора “frizzled” человека.


(a): Подчеркнуты последовательности, соответствующие ак 66-71 GLEVHQ (SEQ ID NO: 25) в составе FZD8 (SEQ ID NO: 54).
(b): Подчеркнуты последовательности, соответствующие ак 125-128 YGFA (SEQ ID NO: 74) в составе FZD8 (SEQ ID NO: 54).
[00159] В некоторых вариантах реализации FZD-связывающий агент связывается по меньшей мере с частью области, включающей последовательность QYGFA (SEQ ID NO: 66), в случае, если рецептор "frizzled" человека представляет собой FZD8, которая включает «нижний край» БСС, или области, включающей соответствующую последовательность, в случае, если рецептор "frizzled" человека представляет собой FZD1-7, FZD9 или FZD10. Последовательности, соответствующие области QYGFA (SEQ ID NO: 66) в различных рецепторах "frizzled", указаны на Фигуре 8 и в Таблице 2, представленной выше. В некоторых вариантах реализации FZD-связывающий агент связывается по меньшей мере с частью области, включающей последовательность YGFA (SEQ ID NO: 74), «нижний край» БСС, в случае если рецептор "frizzled" человека представляет собой FZD8, или соответствующую последовательность, в случае если рецептор "frizzled" человека представляет собой FZD 1-7, FZD9 или FZD 10. Последовательности, соответствующие области YGFA (SEQ ID NO: 74) в различных рецепторах "frizzled", указаны на Фигуре 8, и подчеркнуты в четвертом столбце Таблицы 2, представленной выше. В некоторых вариантах реализации агент, который связывается по меньшей мере с частью SEQ ID NO: 66 или SEQ ID NO: 74 в FZD8, или с соответствующей ей последовательностью в составе другого рецептора FZD, подавляет связывание лиганда (например, Wnt) с FZD (например, БСС в составе FZD). В некоторых вариантах реализации агенты, которые связываются с этой областью, могут также связываться с одним или более аминокислотным остатков в другой области (например, за пределами указанной последовательности) рецептора "frizzled" человека.
[00160] В некоторых вариантах реализации FZD-связывающий агент связывается по меньшей мере с частью области, формирующей «верхний край» БСС, а также по меньшей мере с частью области, формирующий «нижний край» БСС. В некоторых вариантах реализации FZD-связывающий агент, который связывается по меньшей мере с частью Q(DE/ED)AGLEVHQF(Y/W)PL (SEQ ID NO: 24) в составе FZD1, FZD2, FZD5, FZD7, и/или FZD8, QDEAGLEVHQFWPL (SEQ ID NO: 67) в составе FZD8, AGLEVHQF (SEQ ID NO NO: 68) в составе FZD8, и/или GLEVHQ (SEQ ID NO: 25) в составе FZD8, и/или последовательности, соответствующей любой из указанных последовательностей в различных рецепторах "frizzled" человека (указаны в Таблице 2 выше) дополнительно связывается по меньшей мере с частью QYGFA (SEQ ID NO: 66) в составе FZD8 или YGFA (SEQ ID NO: 74) в составе FZD8, и/или последовательности, соответствующей одной из указанных последовательности в составе FZD 1-7, FZD9, или FZD10 (указаны в Таблице 2 выше). В некоторых вариантах реализации FZD-связывающий агент связывается по меньшей мере с частью последовательности GLEVHQ (SEQ ID NO: 25) в составе FZD8, а также по меньшей мере с частью последовательности YGFA (SEQ ID NO: 74) в составе FZD8. В некоторых вариантах реализации FZD-связывающий агент связывается по меньшей мере с частью области FZD 1-7, FZD9, или FZD10, соответствующей последовательности GLEVHQ (SEQ ID NO: 25) в составе FZD8, а также, по меньшей мере с частью области FZD 1-7, FZD9 или FZD10, соответствующей последовательности YGFA (SEQ ID NO: 74) в составе FZD8. В некоторых вариантах реализации FZD-связывающий агент, который связывается с указанной последовательностью, также связывается с одной или более последовательностью в другой области в составе рецептора (рецепторов) "frizzled" человека, с которым он связывается. Иными словами, в некоторых вариантах реализации эпитоп, с которым связывается FZD-связывающий агент или антитело, представляет собой область в составе внеклеточного домена FZD, которая перекрывается только частично с указанными выше последовательностями. В некоторых альтернативных вариантах реализации весь эпитоп, с которым связывается FZD-связывающий агент, целиком находится в составе указанных выше последовательностей.
[00161] В некоторых вариантах реализации агент представляет собой полипептид. В некоторых вариантах реализации агент или полипептид представляет собой антитело. В некоторых вариантах реализации антитело представляет собой антитело IgG1 или антитело IgG2. В некоторых вариантах реализации антитело представляет собой моноклональное антитело. В некоторых вариантах реализации антитело представляет собой антитело человека или гуманизированное антитело. В некоторых вариантах реализации антитело представляет собой фрагмент антитела.
[00162] Антитела или другие агенты настоящего изобретения могут быть проанализированы на специфическое связывание с помощью любого способа, известного в данной области. Способы иммунологического анализа, которые могут быть использованы для этой задачи, включают, но не ограничены перечисленными, конкурентные и неконкурентные системы анализа, такие как анализ с помощью системы BIAcore, ФСК, иммунофлуоресценции, иммуноцитохимии, Вестерн-блот, радиоиммунологический анализ, твердофазный ИФА, «сэндвич» иммунологический анализ, анализ путем иммунопреципитации, реакция преципитации в геле, анализ способом иммунодиффузии, анализ методом агглютинации, анализ связывания комплемента, иммунорадиометрический анализ, флуоресцентный иммунологический анализ и иммунологический анализ с помощью протеина А. Такие способы анализа являются стандартными и хорошо известно в данной области (см., например, работу Ausubel et al, eds, 1994, Current Protocols in Molecular Biology, Vol.1, John Wiley & Sons, Inc., New York, включенную в настоящую заявку посредством ссылки в полном объеме).
[00163] Например, специфичное связывание антитела с рецептором "frizzled" человека можно выявить с помощью твердофазного ИФА. Твердофазный ИФА включает получение антигена, нанесение на антигена поверхность 96-луночного титрационного микропланшета, добавление в лунку FZD-связывающего антитела или другого FZD-связывающего агента, конъюгированного с каким-либо детектируемым соединением, таким как ферментный субстрат (например, пероксидаза хрена или щелочная фосфатаза), инкубацию в течение некоторого периода времени и детекцию антигена. В некоторых вариантах реализации FZD-связывающее антитело или агент не конъюгирован с детектируемым соединением, вместо этого в лунку добавляют второе конъюгированное антитело, которое узнает FZD-связывающее антитело или агент. В некоторых вариантах реализации вместо нанесения на поверхность лунки антигена, на поверхность лунки наносят FZD-связывающее антитело или агент, и добавляют в лунку второе антитело, конъюгированное с детектируемым соединением. Специалисту в данной области известны параметры, которые могут быть модифицированы для усиления детектируемого сигнала, а также другие варианты ИФА, известные в данной области (см., например, Ausubel et al, eds, 1994, Current Protocols in Molecular Biology, Vol.1, John Wiley & Sons, Inc., New York at 11.2.1).
[00164] Сродство связывания антитела или другого агента с рецептором "frizzled" человека и скорость диссоциации взаимодействия антиген-антитело может быть определена с помощью конкурентно-связывающего анализа. Одним из примеров конкурентно-связывающего анализа является радиоиммунологический анализ, включающий инкубацию меченого антигена (например,3Н или125I), или фрагмента или его варианта, с антителами интереса в присутствии возрастающих количеств немеченого антигена с последующей детекцией антитела, связанного с меченым антигеном. Сродство антител к рецептору "frizzled" и скорость диссоциации связывания могут быть определены из полученных данных с помощью графика Скэтчарда. В некоторых вариантах реализации для определения скорости ассоциации и диссоциации при связывании антител или агентов, которые связываются с одним или более рецептором "frizzled" человека, используют кинетические исследования с помощью системы BIAcore. Кинетический анализ с помощью системы BIAcore включает анализ связывания и диссоциации антител на чипах с иммобилизованными на их поверхности антигенами FZD.
[00165] В некоторых вариантах реализации агент (например, антитело) является антагонистом по меньшей мере одного рецептор "frizzled" человека (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 FZD), с которым связывается агент.В некоторых вариантах реализации агент ингибирует по меньшей мере примерно 10%, по меньшей мере примерно 20%, по меньшей мере примерно 30%, по меньшей мере примерно 50%, по меньшей мере примерно 75%, по меньшей мере примерно 90% или примерно 100% одной или более активности рецептора "frizzled" человека, с которым он связывается.
[00166] В некоторых вариантах реализации FZD-связывающий агент ингибирует связывание лиганда по меньшей мере с одним рецептором "frizzled" человека. В некоторых вариантах реализации FZD-связывающий агент подавляет связывание лиганда с биологическим сайтом связывания (БСС) рецептора "frizzled" человека.
[00167] В некоторых вариантах реализации лиганд представляет собой белок Wnt человека. Идентифицировано девятнадцать белков Wnt человека: WNT1, WNT2, WNT2B/13, WNT3, WNT3A, WNT4, WNT5A, WNT5B, WNT6, WNT7A, WNT7B, WNT8A, WNT8B, WNT9A (ранее известный как WNT14), WNT9B (ранее известный как WNT15), WNT 10А, WNT10B, WNT11 и WNT16. В некоторых вариантах реализации агент подавляет связывание WNT3A с FZD8. В некоторых вариантах реализации ингибирование связывания конкретного лиганда с конкретным белком "frizzled" человека, осуществляемое FZD-связывающим агентом, составляет по меньшей мере 10%, по меньшей мере примерно 25%, по меньшей мере примерно 50%, по меньшей мере примерно 75%, по меньшей мере примерно 90% или по меньшей мере примерно 95%. В некоторых вариантах реализации агент, который ингибирует связывание лиганда, такого как Wnt, с FZD, дополнительно ингибирует сигнальный путь, опосредованный Wnt, (например, ингибирует канонический сигнальный путь, опосредованный Wnt).
[00168] В некоторых вариантах реализации FZD-связывающий агент ингибирует сигнальный путь, опосредованный Wnt. Очевидно, что FZD-связывающий агент, ингибирующий сигнальный путь, опосредованный Wnt, может в некоторых вариантах реализации ингибировать сигнальный путь через один или более Wnt, но не обязательно через все лиганды Wnt. В некоторых альтернативных вариантах реализации происходит ингибирование сигнального пути через все Wnt человека. В некоторых вариантах реализации происходит ингибирование сигнального пути через один или более Wnt, выбранный из группы, включающей WNT1, WNT2, WNT2B/13, WNT3, WNT3A, WNT4, WNT5A, WNT5B, WNT6, WNT7A, WNT7B, WNT8A, WNT8B, WNT9A (ранее известный как WNT14), WNT9B (ранее известный как WNT15), WNT10A, WNT10B, WNT11 и WNT16. В некоторых вариантах реализации ингибируемый сигнальный путь через Wnt представляет собой сигнальный путь через WNT1, WNT2, WNT3, WNT3A, WNT7a, WNT7b и/или WNT10B. В некоторых вариантах реализации агент ингибирует сигнальный путь через (по меньшей мере) WNT1, WNT3A, WNT7b и WNT10B. В конкретных вариантах реализации агент ингибирует сигнальный путь через (по меньшей мере) WNT3A. В некоторых вариантах реализации ингибирование сигнального пути через Wnt, осуществляемое FZD-связывающим агентом, представляет собой уменьшение уровня активности сигнального пути через Wnt по меньшей мере примерно на 10%, по меньшей мере примерно на 25%, по меньшей мере примерно на 50%, по меньшей мере примерно на 75%, по меньшей мере примерно на 90%, или по меньшей мере примерно на 95%. В некоторых вариантах реализации ингибируемый сигнальный путь через Wnt представляет собой ингибируемый сигнальный путь через Wnt. В данной области известны системы для анализа in vivo и in vitro, позволяющие исследовать, ингибирует ли FZD-связывающий агент (или FZD-связывающий агент-кандидат) сигнальный путь через Wnt. Например, для определения уровня активности канонического сигнального пути через Wnt in vitro, может быть использован анализ с помощью репортерного гена люциферазы в клеточной системе с использованием вектора TCF/Luc, содержащего перед геном люциферазы светлячка несколько копий TCP-связывающего домена (Gazit et al., 1999, Oncogene 18; 5959-66). Уровень активности сигнального пути через Wnt в присутствии одного или более Wnt (например, Wnt, экспрессируемого трансфицированными клетками или из кондиционированной Wnt) с присутствующим FZD-связывающим сравнивают с уровнем активности сигнального пути без FZD-связывающего агента. Не ограничивающие конкретные примеры применения такого способа репортерного анализа с помощью люциферазы для оценки ингибирования канонического сигнального пути через Wnt представлены в Примерах 3 и 11, ниже. В дополнение к репортерному анализу с помощью TCF/люциферазы, влияние FZD-связывающего агента (или агента-кандидата) на канонический сигнальный путь через Wnt можно оценить быть измерена in vitro или in vivo с помощью оценки влияния агента на уровень экспрессии генов, регулируемых бета-катенином, таких как c-myc (Не et al., Science, 281:1509-12 (1998)), циклин D1 (Tetsu et al., Nature, 398:422-6 (1999)) и/или фибронектин (Gradl et al. Mol. Cell Biol., 19:5576-87 (1999)). В некоторых вариантах реализации влияние агента на сигнальный путь через Wnt можно также оценить путем оценки влияния агента на степень фосфорилирования Dishevelled-1, Dishevelled-2, Dishevelled-3, LRP5, LRP6 и/или бета-катенина. В других вариантах реализации влияние FZD-связывающего агента на сигнальный путь через Wnt определяют путем оценки влияния FZD-связывающего агента на уровень экспрессии одного или нескольких генов из генной сигнатуры Wnt.
[00169] В некоторых вариантах реализации FZD-связывающие агенты характеризуются одним или более действием: ингибируют пролиферацию опухолевых клеток, уменьшает туморогенность опухоли за счет снижения частоты раковых стволовых клеток в опухоли, подавляют рост опухоли, увеличивают выживаемость, запускают гибель опухолевых клеток, обуславливают дифференцировку онкогенных в неонкогенное состояние или предотвращают метастазирование опухолевых клеток.
[00170] В некоторых вариантах реализации антитела или другие агенты, которые специфично связываются с одним или более рецептором "frizzled" человека, запускают гибель клеток посредством конъюгированного токсина, химиотерапевтического агента, радиоизотопа или другого подобного агента. Например, в некоторых вариантах реализации антитело к рецептору "frizzled" человека конъюгировано с токсином, который воздействует на опухолевые клетки, экспрессирующие белок FZD, при интернализации белка. В некоторых альтернативных вариантах реализации агент или антитело не конъюгировано с токсином, химиотерапевтическим агентом или радиоизотопом.
[00171] В некоторых вариантах реализации FZD-связывающие агенты способны ингибировать рост опухоли. В некоторых вариантах реализации FZD-связывающие агенты способны ингибировать рост опухолей in vivo (например, на модели ксенотрансплантата у мышее и/или у людей, имеющих рак).
[00172] В некоторых вариантах реализации FZD-связывающие агенты способны снижать туморогенность опухоли. В некоторых вариантах реализации агент или антитело способно снижать туморогенность опухоли, включающей раковые стволовые клетки у модельных животных, например на модели ксенотрансплантата мыши. В некоторых вариантах реализации количество или частота раковых стволовых клеток в опухоли снижается по меньшей мере примерно в два раза, примерно в три раза, примерно в пять раз, примерно в десять раз, примерно в 50 раз, примерно 100-кратного или примерно в 1000 раз. В некоторых вариантах реализации снижение числа или частоты раковых стволовых клеток определяют путем метода предельных разведений с использованием модельных животных. Пример анализа с помощью метода предельных разведений для исследования эффективности антитела к FZD приведен в Примере 8 ниже. Дополнительные примеры и рекомендации относительно применения анализа с помощью метода предельных разведений для определения снижения числа или частоты раковых стволовых клеток в опухоли приведены, например, в международной публикации WO 2008/042236, заявке на патент США №2008/0064049 и заявке на патент США №2008/0178305, каждая из которых включена в настоящую заявку посредством ссылки в полном объеме.
[00173] В некоторых вариантах реализации антитела к рецепторам "frizzled" человека опосредуют клеточную гибель клеток, экспрессирующих белок FZD, посредством антителозависимой клеточноопосредованной цитотоксичности (АЗКЦ). АЗКЦ включает клеточный лизис, осуществляемый клетками-эффекторами, которые узнают Fc-участок антитела часть. Многие лимфоциты, моноциты, тканевые макрофаги, гранулоциты и эозинофилы, например, имеют рецепторы Fc и могут опосредовать цитолиз (Dillman, 1994, J. Clin. Oncol. 12:1497).
[00174] В некоторых вариантах реализации антитела к одному или более FZD запускают клеточную гибель клетки, экспрессирующей белок (белки) FZD, активируя комплемент-зависимую цитотоксичность (КЗЦ). КЗЦ включает в себя связывание комплемента сыворотки с Fc-участком антитела и последующую активацию каскада белков комплемента, приводящего к повреждению мембраны клеток и в конечном итоге гибель клеток. Биологическая активность антител, как известно, определяется, в значительной степени, константными доменами или Fc-участком молекулы антитела (Uananuc and Benacerraf, Textbook of Immunology, 2nd Edition, Williams & Wilkins, p. 218 (1984)). Антитела различных классов и подклассов отличаются в этом отношении, также как и антитела одного и того же подкласса, но полученные от разных видов. Среди антител человека IgM является наиболее эффективным классом антител в отношении связывания с комплементом, за ним следует IgG1, IgG3 и IgG2, тогда как IgG4 оказываются практически не способными активировать каскад комплемента (Dillman, 1994, J. Clin. Oncol. 12:1497; Jefferis et al., 1998, Immunol. Rev. 163:59-76). В соответствии с настоящим изобретением получают антитела, относящиеся к тем классам, которые обладают желаемой биологической активностью.
[00175] Существуют способы анализа способности того или иного антитела против одного или более FZD опосредовать лизис клетки-мишени путем активации комплемента и/или АЗКЦ. Исследуемые клетки выращивают и маркируют in vitro, к культуре клеток добавляют антитело в сочетании либо с комплементом сыворотки, либо иммуноцитами, которые могут быть активированы комплексами антиген-антитело. Цитолиз клеток-мишеней может быть выявлен, например, при высвобождении метки из клеток, подвергшихся лизису. В действительности, возможно провести скрининг антител с использованием собственной сыворотки пациента в качестве источника комплемента и/или иммунноцитов. Антитела, способные активировать комплемент или опосредовать АЗКЦ в системе анализа in vitro, можно применять в терапевтических целях для данного конкретного пациента.
[00176] Настоящее изобретение обеспечивает полипептиды, включающие, но не ограниченные перечисленными, антитела, специфично связывающиеся с одним или более рецептором "frizzled" человека, включающие один, два, три, четыре, пять и/или шесть гипервариабельных участков (CDR) из 18R5 и/или 18R8 (см. Таблицу 4 Примера 1 ниже), содержащие до четырех (т.е. 0, 1, 2, 3 или 4) консервативных замен аминокислот на гипервариабельный участок. Таким образом, настоящее изобретение обеспечивает полипептиды, включающие, но не ограниченные перечисленными, антитела, которые специфично связываются с одним или более рецептором "frizzled" человека, который содержит один, два, три, четыре, пять и/или шесть гипервариабельных участков (CDR) из 18R5 и/или 18R8. В некоторых вариантах реализации полипептиды включают CDR3 тяжелой цепи 18R8 и/или CDR3 легкой цепи 18R5 или 18R8. В некоторых вариантах реализации гипервариабельный участок (участки) тяжелой цепи находится в пределах вариабельного домена тяжелой цепи и/или гипервариабельный участок (участки) легкой цепи находится в пределах вариабельного домена легкой цепи.
[00177] Например, настоящее изобретение обеспечивает полипептид (например, антитело), специфично связывающийся с рецептором "frizzled" человека, при этом указанный полипептид содержит вариабельную область тяжелой цепи, включающую: (а) CDR1 тяжелой цепи, включающий GFTFSHYTLS (SEQ ID NO: 1), или его вариант содержит 1, 2, 3 или 4 аминокислотные замены; (б) CDR2 тяжелой цепи включающий VISGDGSYTYYADSVKG (SEQ ID NO: 2), или его вариант содержит 1, 2, 3 или 4 аминокислотные замены, и/или (в) CDR3 тяжелой цепи, включающий NITKYVFAN (SEQ ID NO:3), или ее вариант, включающий 1, 2, 3 или 4 аминокислотные замены. В некоторых вариантах реализации указанный полипептид дополнительно содержит вариабельную область легкой цепи, включающую: (a) CDR1 легкой цепи, включающий SGDKLGKKYAS (SEQ ID NO: 4) или SGDNIGSFYVH (SEQ ID NO: 7), или вариант SEQ ID NO: 4 или SEQ ID NO: 7, включающий 1, 2, 3 или 4 аминокислотные замены; (б) CDR2 легкой цепи, включающий EKDNRPSG (SEQ ID NO: 5) или DKSNRPSG (SEQ ID NO: 8), или вариант SEQ ID NO: 5 или SEQ ID NO: 8, включающий 1, 2, 3 или 4 аминокислотные замены, и/или (в) CDR3 легкой цепи, включающий SSFAGNSLE (SEQ ID NO: 6) или QSYANTLSL (SEQ ID NO: 9), или вариант SEQ ID NO: 6 или SEQ ID NO: 9, включающий 1, 2, 3 или 4 аминокислотные замены. В некоторых вариантах реализации аминокислотные замены представляют собой консервативные замены.
[00178] Таким образом, настоящее изобретение обеспечивает полипептиды или антитела, которые содержат CDR1 тяжелой цепи, включающий GFTFSHYTLS (SEQ ID NO: 1), CDR2 тяжелой цепи, включающий VISGDGSYTYYADSVKG (SEQ ID NO: 2), и/или CDR3 тяжелой цепи, включающий NFIKYVFAN (SEQ ID NO: 3). В некоторых вариантах реализации гипервариабельный участок (участки) легкой цепи находятся в пределах вариабельной области тяжелой цепи антитела. В некоторых вариантах реализации указанные полипептид или антитело, включающие один или более гипервариабельный участок тяжелой цепи, специфично связывается с одним или более рецептором "frizzled" человека. В некоторых вариантах реализации гипервариабельный участок (участки) модифицированы с помощью 1, 2, 3 или 4 консервативных замен аминокислот. В некоторых вариантах реализации каждый из гипервариабельных участков (CDR) тяжелой цепи модифицирован с помощью не более 1-2 консервативных замен аминокислот.
[00179] Изобретение также обеспечивает антитело, специфично связывающееся с рецептором "frizzled" человека, при этом указанное антитело содержит вариабельную область тяжелой цепи, включающую: (a) CDR1 тяжелой цепи, включающий GFTFSHYTLS (SEQ ID NO: 1), или его вариант, включающий 1, 2, 3 или 4 аминокислотные замены; (б) CDR2 тяжелой цепи, включающий VISGDGSYTYYADSVKG (SEQ ID NO: 2), или его вариант, включающий 1,2,3 или 4 аминокислотные замены, и (в) CDR3 тяжелой цепи, включающий NFIKYVFAN (SEQ ID NO: 3), или его вариант, включающий 1, 2, 3 или 4 аминокислотные замен. В некоторых вариантах реализации указанное антитело, дополнительно, содержит вариабельную область легкой цепи, включающую: (a) CDR1 легкой цепи, включающий SGDKLGKKYAS (SEQ ID NO: 4) или SGDNIGSFYVH (SEQ ID NO: 7), или вариант SEQ ID NO: 4 или SEQ ID NO: 7, включающий 1, 2, 3 или 4 аминокислотные замены; (б) CDR2 легкой цепи, включающий EKDNRPSG (SEQ ID NO: 5) или DKSNRPSG (SEQ ID NO: 8), или вариант SEQ ID NO: 5 или SEQ ID NO: 8, включающий 1, 2, 3 или 4 аминокислотные замены, и (в) CDR3 легкой цепи, включающий SSFAGNSLE (SEQ ID NO: 6) или QSYANTLSL (SEQ ID NO: 9), или вариант SEQ ID NO: 6 или SEQ ID NO: 9, включающий 1, 2, 3 или 4 аминокислотные замены. В некоторых альтернативных вариантах реализации антитело содержит вариабельную область легкой цепи, включающую: (a) CDR1 легкой цепи, включающий SGDKLGKKYAS (SEQ ID NO: 4) или SGDNIGSFYVH (SEQ ID NO: 7); (б) CDR2 легкой цепи, включающий EKDNRPSG (SEQ ID NO: 5) или DKSNRPSG (SEQ ID NO: 8) и (в) CDR3 легкой цепи, включающий SSFAGNSLE (SEQ ID NO: 6) или QSYANTLSL (SEQ ID NO: 9). В некоторых вариантах реализации антитело специфично связывается с FZD1, FZD2, FZD5, FZD7 и/или FZD8. В некоторых вариантах реализации антитело специфично связывается с двумя или более рецепторами "frizzled" человека, в том числе FZD5 и FZD8. В некоторых вариантах реализации аминокислотные замены представляют собой консервативные замены.
[00180] Кроме того, настоящее изобретение обеспечивает полипептид (например, антитело), специфично связывающееся с рецептором "frizzled" человека, при этом указанный полипептид содержит вариабельную область легкой цепи, включающую: (а) CDR1 легкой цепи, включающий SGDKLGKKYAS (SEQ ID NO: 4) или SGDNIGSFYVH (SEQ ID NO: 7), или вариант SEQ ID NO: 4 или SEQ ID NO: 7, включающий 1, 2, 3 или 4 аминокислотные замены; (б) CDR2 легкой цепи, включающий EKDNRPSG (SEQ ID NO: 5) или DKSNRPSG (SEQ ID NO: 8), или вариант SEQ ID NO: 5 или SEQ ID NO: 8, включающий 1, 2, 3 или 4 аминокислотные замены, и/или (в) CDR3 легкой цепи, включающий SSFAGNSLE (SEQ ID NO: 6) или QSYANTLSL (SEQ II) NO: 9), или вариант SEQ ID NO: 6 или SEQ ID NO: 9, включающий 1, 2, 3 или 4 аминокислотные замены. В некоторых вариантах реализации аминокислотные замены представляют собой консервативные замены.
[00181] Кроме того, настоящее изобретение обеспечивает полипептиды или антитела, которые содержат: (a) CDR1 легкой цепи, содержащий последовательность SGD(K/N)(L/I)G(K/S)(K/F)Y(A/V)(S/H) (SEQ ID NO: 71) или последовательность SEQ ID NO: 71, включающую до четырех (т.е. 0, 1, 2, 3 или 4) консервативных замен аминокислот, (б) CDR2 легкой цепи, включающую последовательность (E/D)K(D/S)NRPSG (SEQ ID NO: 72) или последовательность SEQ ID NO: 72, включающую до четырех консервативных замен аминокислот, и/или (в) CDR3 легкой цепи, включающий последовательность (S/Q)S(F/Y)A(G/N)(N/T)(no aa/L)SL(E/no аа) (где «no аа/L» обозначает L или отсутствие аминокислоты и «Е/no аа» обозначает Е или отсутствие аминокислоты; SEQ NO: 73) или последовательность SEQ ID NO: 73, включающую до четырех консервативных замен аминокислот.
[00182] Настоящее изобретение также обеспечивает полипептиды или антитела, которые включают CDR1, легкой цепи, включающий SGDKLGKKYAS (SEQ ID NO: 4) или SGDNIGSFYVH (SEQ ID NO: 7), CDR2 легкой цепи, включающий EKDNRPSG (SEQ ID NO: 5) или DKSNRPSG (SEQ ID NO: 8). и/или CDR3 легкой цепи, включающий SSFAGNSLE (SEQ ID NO: 6) или QSYANTLSL (SEQ ID NO: 9). В некоторых вариантах реализации полипептид или антитело содержит CDR1 легкой цепи, включающий SGDNIGSFYVH (SEQ ID NO: 7), CDR2 легкой цепи, включающий DKSNRPSG (SEQ Ш NO: 8), и CDR3 легкой цепи, включающий QSYANTLSL (SEQ ID NO: 9). В некоторых альтернативных вариантах реализации полипептид или антитело содержит CDR1 легкой цепи, включающий SGDKLGKKYAS (SEQ ID NO: 4), CDR2 легкой цепи, включающий EKDNRPSG (SEQ ID NO: 5), и CDR3 легкой цепи, включающий SSFAGNSLE (SEQ ID NO: 6). В некоторых вариантах реализации CDR легкой цепи находится в пределах вариабельной области легкой цепи антитела. В некоторых вариантах реализации полипептид или антитело специфично связывается с одним или более рецептором "frizzled" человека. В некоторых вариантах реализации полипептид или антитело, включающее один или более CDR легкой цепи, специфично связывается с одним или более рецептором "frizzled" человека. В некоторых вариантах реализации CDR модифицирован с помощью 1, 2, 3 или 4 консервативными заменами. В некоторых вариантах реализации каждый из CDR легкой цепи модифицирован с помощью не более 1-2 консервативных замен аминокислот.
[00183] В некоторых вариантах реализации антитело содержит: (a) CDR1 тяжелой цепи, включающий GFTFSHYTLS (SEQ ID NO: 1), CDR2 тяжелой цепи, включающий VISGDGSYTYYADSVKG (SEQ ID NO: 2), и CDR3 тяжелой цепи, включающий NFIKYVFAN (SEQ ID NO: 3); и/или (б) CDR1 легкой цепи, включающий SGDKLGKKYAS (SEQ ID NO: 4) или SGDNIGSFYVH (SEQ ID NO: 7), CDR2 легкой цепи, включающий EKDNRPSG (SEQ ID NO: 5) или DKSNRPSG (SEQ ID NO: 8), и CDR3 легкой цепи, включающий SSFAGNSLE (SEQ ID NO: 6) или QSYANTLSL (SEQ ID NO: 9). В некоторых вариантах реализации антитело содержит: (a) CDR1 тяжелой цепи, включающий GFTFSHYTLS (SEQ ID NO: 1), CDR2 тяжелой цепи, включающий VISGDGSYTYYADSVKG (SEQ ID NO: 2), и CDR3 тяжелой цепи, включающий NFIKYVFAN (SEQ ID NO: 3) и (б) CDR1 легкой цепи, включающий SGDKLGKKYAS (SEQ ID NO: 4), CDR2 легкой цепи, включающий EKDNRPSG (SEQ ID NO: 5), и CDR3 легкой цепи, включающий SSFAGNSLE (SEQ ID NO: 6). В некоторых вариантах реализации антитело содержит: (a) CDRL тяжелой цепи включающий GFTFSHYTLS (SEQ ID NO: 1), CDR2 тяжелой цепи, включающий VISGDGSYTYYADSVKG (SEQ ID NO: 2), и CDR3 тяжелой цепи, включающий NFIKYVFAN (SEQ ID NO: 3) и (б) CDR1 легкой цепи, включающий SGDNIGSFYVH (SEQ ID NO: 7), CDR2 легкой цепи, включающий DKSNRPSG (SEQ ID NO: 8), и CDR3 легкой цепи, включающий QSYANTLSL (SEQ ID NO: 9). В некоторых вариантах реализации CDR модифицирован с помощью 1, 2, 3 или 4 консервативных замен аминокислот. В некоторых вариантах реализации каждый из CDR модифицирован с помощью не более 1-2 консервативных замен аминокислот.
[00184] Дополнительно, настоящее изобретение обеспечивает полипептиды, включающие, но не ограниченные перечисленными, антитела, которые специфично связываются с одним или более рецептором "frizzled" человека, которые включают один, два, три, четыре, пять и/или шесть CDR антител к FZD 44R24 (см. Таблицу 7 Примера 18 ниже), содержащие до четырех (то есть, 0, 1, 2, 3 или 4) консервативных замен аминокислот на CDR. Таким образом, настоящее изобретение обеспечивает полипептиды, включающие, но не ограниченные перечисленными, антитела, которые специфично связываются с одним или более рецептором "frizzled" человека, которые включают один, два, три, четыре, пять и/или шесть CDR из 44R24. В некоторых вариантах реализации полипептиды включают CDR3 тяжелой цепи 44R24 и/или CDR3 легкой цепи 44R24. В некоторых вариантах реализации CDR тяжелой цепи находится в пределах вариабельной области тяжелой цепи и/или CDR легкой цепи находится в пределах вариабельной области легкой цепи.
[00185] Изобретение также обеспечивает полипептид (например, антитело), специфично связывающийся с FZD5 и/или FZD8 человека, при этом указанное антитело содержит: (a) CDR1 тяжелой цепи, включающий GFTFSSYYIT (SEQ ID NO: 77), или его вариант, включающий 1, 2, 3 или 4 консервативные аминокислотные замены; CDR2 тяжелой цепи, включающий TISYSSSNTYYADSVKG (SEQ ID NO: 78), или его вариант, включающий 1, 2, 3 или 4 консервативные аминокислотные замены, и CDR3, тяжелой цепи включающий SIVFDY (SEQ ID NO: 79), или его вариант, включающий 1, 2, 3 или 4 консервативные аминокислотные замены, и/или (б) CDR1 легкой цепи, включающий SGDALGNRYVY (SEQ ID NO: 80), или его вариант, включающий 1, 2, 3 или 4 консервативные аминокислотные замены; CDR2 легкой цепи, включающий SG (SEQ ID NO: 81), или его вариант, включающий 1, 2, 3 или 4 консервативные аминокислотные замены, и CDR3 легкой цепи, включающий GSWDTRPYPKY (SEQ ID NO: 82), или его вариант, включающий 1, 2, 3 или 4 консервативные аминокислотные замены. В некоторых вариантах реализации указанное антитело (или другой FZD-связывающий полипептид) содержит: (a) CDR1 тяжелой цепи, включающий GFTFSSYYIT (SEQ ID NO: 77), CDR2 тяжелой цепи, включающий ТИС YSSSNTYY ADSVKG (SEQ ID NO: 78), и CDR3 тяжелой цепи, включающий SIVFDY (SEQ ID NO: 79); и/или (б) CDR1 легкой цепи, включающий SGDALGNRYVY (SEQ ГО NO: 80), CDR2 легкой цепи, включающий SG (SEQ ID NO: 81), и CDR3 легкой цепи, включающий GSWDTRPYPKY (SEQ ID NO: 82).
[00186] Также предусмотрены полипептиды, включающие одну из конкретных легких цепей или тяжелых цепей, описанных в настоящей заявке, а также полипептиды (например, антитела), включающие как легкую, так и тяжелую цепь.
[00187] Кроме того, предусмотрены полипептиды, которые включают: (а) полипептид, который имеет по меньшей мере примерно 80% идентичности по последовательности SEQ ID NO: 10; и/или (б) полипептид, имеющий по меньшей мере примерно 80% идентичности по последовательности SEQ ID NO: 12 или SEQ ID NO: 14. В некоторых вариантах реализации полипептид включает полипептид, имеющий по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95%, по меньшей мере примерно 97%, или по меньшей мере примерно 99% идентичности по последовательности SEQ ID NO: 10, 12 или 14. Таким образом, в некоторых вариантах реализации полипептид включает (а) полипептид, имеющий по меньшей мере примерно 95% идентичности по последовательности SEQ ID NO: 10, и/или (б) полипептид, имеющий по меньшей мере примерно 95% идентичности по последовательности SEQ ID NO: 12 или 14. В некоторых вариантах реализации указанный полипептид включает (а) полипептид с аминокислотной последовательностью SEQ ID NO: 10 и/или (б) полипептид с аминокислотной последовательностью SEQ ID NO: 12 или SEQ ID NO: 14. В некоторых вариантах реализации полипептид включает (а) полипептид с аминокислотной последовательностью SEQ ID NO: 11 и/или (б) полипептид с аминокислотной последовательностью SEQ ID NO: 13 или SEQ ID NO: 15. В некоторых вариантах реализации полипептида представляет собой антитело, и/или полипептид специфично связывается с одним или более рецептором "frizzled" человека (например, FZD1, FZD2, FZD5, FZD7 и/или FZD8). Например, настоящее изобретение обеспечивает антитело, специфично связывающееся с рецептором "frizzled" человека, которое включает: (а) полипептид с аминокислотной последовательностью SEQ ID NO: 10 и (б) полипептид с аминокислотной последовательностью SEQ ID NO: 14. В некоторых вариантах реализации полипептид, включающий SEQ ID NO: 10, представляет собой вариабельную область тяжелой цепи. В некоторых вариантах реализации полипептид, включающий SEQ ID NO: 12 или 14, представляет собой вариабельную область легкой цепи. В некоторых вариантах реализации полипептид, имеющий конкретный процент сходства по последовательности с SEQ ID NO: 10, 12, или 14, отличается от SEQ ID NO: 10, 12, или 14 только по консервативным аминокислотными заменам.
[00188] В некоторых вариантах реализации указанные полипептид или антитело включает: (a) SEQ ID NO: 10 и SEQ ID NO: 12, (б) SEQ ID NO: 10 и SEQ ID NO: 14; (в) SEQ ID NO: 11 и SEQ ID NO: 13, или (г) SEQ ID NO: 11 и SEQ ID NO: 15.
[00189] Кроме того, настоящее изобретение обеспечивает антитело или другой полипептид, специфично связывающийся с FZD5 и/или FZD8 и включает: (а) полипептид, имеющий по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95%, по меньшей мере примерно 97% или, по меньшей мере, примерно 99% идентичности SEQ ID NO: 85; и/или (б) полипептид, имеющий по меньшей мере примерно 80%, по меньшей мере примерно 85%, по меньшей мере примерно 90%, по меньшей мере примерно 95%, по меньшей мере примерно 97%, или, по меньшей мере, примерно 99% идентичности SEQ ID NO: 86. В некоторых альтернативных вариантах полипептид или антитело включает SEQ ID NO: 85 и/или SEQ ID NO: 86.
[00190] В некоторых вариантах реализации FZD-связывающий агент включает, содержит, или по существу состоит из антитела к FZD, выбранного из группы, включающей IgG антитело 18R8, 18R5, 18R4605, 18R4805, и 44R24.
[00191] В некоторых вариантах реализации указанный FZD-связывающий агент включает тяжелые цепи и легкие цепи IgG2 антитела 18R8 (с или без лидерной последовательности). В некоторых вариантах реализации FZD-связывающий агент представляет собой IgG2 антитело 18R8. ДНК, кодирующая тяжелые цепи и легкой цепи 18R8 IgG2 антитела, депонирована в Американской коллекции типовых культур (АТСС), 10801 Университетского бульвар, Манассас, Вирджиния, США, согласно условиям Будапештского договора от 29 сентября 2008 года, под установленным АТСС номером РТА-9540. В некоторых вариантах реализации указанный FZD-связывающий агент содержит тяжелые цепи и легкие цепи IgG2 антитела 18R5 (с или без лидерной последовательности). В некоторых вариантах реализации указанный FZD-связывающий агент представляет собой IgG2 антитело 18R5. ДНК, кодирующая тяжелые цепи и легкие цепи IgG2 антитела 18R5 депонирована в АТСС согласно условиям Будапештского договора от 29 сентября 2008 года под установленным АТСС номером РТА-9541.
[00192] В некоторых вариантах реализации указанный FZD-связывающий агент представляет собой IgG антитело, кодируемое плазмидой, депонированной в АТСС 26 августа 2009 года, и имеющие номер АТСС РТА-10307, РТА-10309, или РТА-10311.
[00193] В некоторых вариантах реализации указанный FZD-связывающий агент представляет собой агент, который конкурирует за специфичное связывание с FZD1, FZD2, FZD5, FZD7, и/или FZD8 с антителом, кодируемым плазмидой, имеющей номер в АТСС РТА-9540, РТА-9541, РТА-10307 или РТА-10309 (например, в конкурентно-связывающем анализе). В некоторых альтернативных вариантах реализации FZD-связывающий агент представляет собой агент, который конкурирует за специфичное связывание с FZD5 и/или FZD8 с антителом, кодируемым плазмидой с номером в АТСС РТА-10311.
[00194] В некоторых вариантах реализации указанный FZD-связывающий агент характеризуется периодом полувыведения из кровотока у мышей, яванских макак или у человека по меньшей мере, примерно 10 часов, по меньшей мере примерно 24 часа, по меньшей мере 3 дня, по меньшей мере примерно 1 недели или по меньшей мере примерно 2 недели. В некоторых вариантах реализации FZD-связывающий агент представляет собой IgG (например, IgG1 или IgG2) антитело, характеризующееся периодом полувыведения из кровотока у мышей, яванских макак или у человека примерно 10 часов, по меньшей мере примерно 24 часа, по меньшей мере примерно 3 дня, по меньшей мере примерно 1 недели, или, по меньшей мере примерно 2 недели. Способы увеличения периода полувыведения агентов, таких как полипептиды и антитела, известны в данной области. Например, известные способы увеличения периодом полувыведения из кровотока IgG антитела включают введение мутаций в Fc-область, усиливающих pH-зависимое связывание антитела с неонатальным рецептором Fc (FcRn) при pH 6,0 (см., например, публикации патентов США Ms 2005/0276799, 2007/0148164 и 2007/0122403). Известные способы увеличения периодом полувыведения из кровотока фрагментов антител, лишенных Fc-области, включают в такие способы, как пегилирование.
[00195] Поликлональные антитела могут быть получены любым известным способом. Образование поликлональных антител индуцируют путем иммунизации животного (например, кролика, крысы, мыши, осла и т.д.) с помощью многократных подкожных или внутрибрюшинных инъекций соответствующих антигенов (очищенного фрагмента пептида, полноразмерного рекомбинантного белка, гибридного белка и т.д.), которые могут быть конъюгированы с гемоцианином лимфы улитки (KLH), сывороточным альбумином и пр, которые растворяют в стерильном физиологическом растворе и в комбинации с адъювантом (например, полным или неполным адъювантом Фрейнда) с образованием устойчивой эмульсии. Поликлональное антитело затем выделяют из крови, асцита и т.п., полученного от иммунизированного животного. Собранную кровь коагулируют, отбирают сыворотку и осветляют ее путем центрифугирования и аналируют в ней титр антител. Поликлональные антитела могут быть очищены из сыворотки или асцита в соответствии со стандартными способами, известными в данной области, в том числе аффинной хроматографии, ионообменной хроматографии, гель-электрофореза, диализа и т.д.
[00196] Моноклональные антитела могут быть получены с помощью гибридомных технологий, например, описанных в работе Kohler and Milstein (1975) Nature 256:495. Согласно гибридомному методу, мышь, хомяка или другого подходящего животного-хозяина, иммунизируют, как описано выше, чтобы индуцировать выработку лимфоцитами антител, которые специфично связываются с антигеном, используемым для иммунизации. Лимфоциты также могут быть иммунизированы in vitro. После иммунизации выделяют лимфоциты сливают с подходящей линией клеток миеломы, с помощью, например, полиэтиленгликоля, с образованием клеток гибридомы, которые затем могут быть отселектированы от «неслитых» лимфоцитов и клеток миеломы. Гибридомы, которые продуцируют моноклональные антитела, направленные специфично против выбранного антигена, что определяют на основании иммунопреципитации, иммуноблоттинга или анализа связывания in vitro (например, радиоиммунологического анализа (РИА); иммуноферментного анализа (ИФА)), могут быть наработаны либо в культуре in vitro с помощью стандартных способов (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, 1986) или in vivo, например в асцитной опухоли животного. Моноклональные антитела могут быть выделены из питательной среды или асцитной жидкости, как описано для поликлональных антител выше.
[00197] В качестве альтернативы, моноклональные антитела могут также быть получены с помощью методов рекомбинантной ДНК, как описано в патенте США 4816567. Полинуклеотиды, кодирующие моноклональное антитело, выделяют из зрелых В-клеток или клеток гибридомы, например, путем ОТ-ПЦР с использованием олигонуклеотидных праймеров, позволяющих специфично амплифицировать гены, кодирующие тяжелую и легкую цепи антитела, и их последовательность определяют с помощью стандартных способов. Изолированные полинуклеотиды, кодирующие тяжелую и легкую цепи, затем клонируют в подходящих векторах для экспрессии, с помощью которых затем трансфицируют хозяйские клетки, например клетки E.coli, линию клеток COS, клетки яичника китайского хомячка (СНО), или клетки миеломы, которые не продуцируют иным способом белок иммуноглобулина, и хозяйские клетки продуцируют моноклональные антитела. Кроме того, рекомбинантные моноклональные антитела или их фрагменты, полученные от желаемого вида, могут быть выделены из библиотек фагового дисплея, экспрессирующих гипервариабельные участки (CDR) от желаемого вида, как описано в литературе (McCafferty et al., 1990, Nature, 348:552-554; Clackson et al., 1991, Nature, 352:624-628; and Marks et al., 1991, J. Mol. Biol., 222:581-597).
[00198] Полинуклеотид (полинуклеотиды), кодирующий моноклональное антитело, может быть дополнительно модифицирован различными способами с использованием технологии рекомбинантной ДНК с получением альтернативных антител. В некоторых вариантах реализации константные области легкой и тяжелой цепей, например, мышиного моноклонального антитела могут быть заменены 1) на участки, например, антитела человека с получением химерных антител или 2) на полипептид, не являющийся иммуноглобулином, с получением гибридного белка антитела. В некоторых вариантах реализации константные области укорачивают или удаляют для получения желаемого фрагмента моноклонального антитела. Для оптимизации специфичности, сродства, и т.д. моноклонального антитела можно использовать сайт-направленный мутагенез или мутагенез высокой плотности.
[00199] В некоторых вариантах реализации моноклональное антитело против рецептора (рецепторов) "frizzled" человека представляет собой гуманизированное антитело. В некоторых вариантах реализации такое антитела применяют в терапевтических целях для снижения антигенности и ответа на мышиные антитела при их введении человеку (НАМА реакция). Гуманизированные антитела могут быть получены с помощью различных способов, известных в данной области. В некоторых альтернативных вариантах антитело к рецептору (рецепторам) "frizzled" (человека) представляет собой антитело человека.
[00200] Антитела человека могут быть непосредственно получены с помощью различных способов, известных в данной области. Можно получить иммунизированные in vitro или выделенные от иммунизированного индивида иммортализированные В-лимфоциты человека, которые производят антитела против антигена-мишени (См., например, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boemer et al., 1991, J. Immunol, 147 (I):86-95; и патент США 5,750,373). Также, антитела человека можно селектировать из фаговой библиотеки, при этом фаговая библиотека экспрессирует антитела человека, как описано, например, в Vaughan et al., 1996, Nat. Biotech., 14:309-314, Sheets et al., 1998, Proc. Nat'l. Acad. Sci., 95:6157-6162, Hoogenboom and Winter, 1991, J. Mol. Biol., 227:381, и Marks et al., 1991, J. Mol. Biol., 222:581). Способы получения и применения фаговых библиотек антител также описаны в патентах США №№5,969,108, 6,172,197, 5,885,793, 6,521,404; 6,544,731; 6,555,313; 6,582,915; 6,593,081; 6,300,064; 6,653,068; 6,706,484; и 7,264,963; и Rothe et al., 2007, J. Mol. Bio., doi:10.1016/j.jmb.2007.12.018 (каждый из которых включена в настоящую заявку при помощи ссылки в полном объеме). Стратегии «созревания аффинности» и перетасовки цепи (см. работу Marks et al., 1992, Bio/Technology 10:779-783, приведенную посредством ссылки в полном объеме) известны в данной области, и их можно применять для получения антител человека с высокой аффиннностью.
[00201] Гуманизированные антитела также можно получить в организме трансгенных мышей, содержащих локусы иммуноглобулина человека, которые способны при иммунизации производить полный репертуар антител человека в отсутствие эндогенной продукции иммуноглобулинов. Этот подход описан в патентах США 5,545,807; 5,545,806; 5,569,825; 5,625,126; 5,633,425; и 5,661,016.
[00202] Данное изобретение также охватывает биспецифические антитела, которые специфично распознают рецепторы "frizzled" человека. Биспецифические антитела представляют собой антитела, которые способны специфично распознавать и связывать, по меньшей мере, два различных эпитопа. Различные эпитопы могут быть либо в составе одной молекулы (например, одного и того же рецептора "frizzled" человека), либо на разных молекулах, таких как обе вышеуказанные, например, антитела могут специфично распознавать и связывать рецептор "frizzled" человека, а также, например, 1) эффекторные молекулы на лейкоцитах, такие как Т-клеточный рецептор (например, CD3) или Fc рецептор (например, CD64, CD32, или CD 16) или 2) цитотоксический агент, как подробно описано ниже. В некоторых вариантах реализации биспецифические антитела специфично связывают, по меньшей мере, один рецептор "frizzled" человека, а также либо VEGF, лиганд Notch, такой как delta-подобный лиганд (например, DLL4) или jagged-лиганд, либо, по меньшей мере, один рецептор Notch, выбранный из группы, включающей Notch 1, Notch 2, Notch 3, и Notch 4. Биспецифические антитела могут представлять из себя интактные антитела или фрагменты антител.
[00203] Типичные биспецифические антитела могут связываться с двумя различными эпитопами, по меньшей мере, один из которых происходит от полипептида изобретения. Кроме того, направленная против антигена «рука» молекулы иммуноглобулина может быть объединена с «рукой», которая связывается с тригтерными молекулами на лейкоцитах, такими как молекулы Т-клеточного рецептора (например, CD2, CD3, CD28, или В7), или Fc рецепторы для IgG, с целью сосредоточения защитных клеточных механизмов к клетке, экспрессирующей определенный антиген. Биспецифические антитела можно также использовать для направления цитотоксических агентов к клеткам, экспрессирующим определенный антиген. Эти антитела имеют антиген-связывающую «руку» и «руку», связывающую цитотоксические агенты или радионуклидные хелаторы, такие как EOTUBE, DPTA, DOTA, или ТЕТА. Способы получения биспецифических антител широко распространены в данной области (Millstein et al., 1983, Nature 305:537-539; Brennan et al., 1985, Science 229:81; Surcsh et al, 1986, Methods in Enzymol. 121:120; Traunecker et al., 1991, EMBO J. 10:3655-3659; Shabby et al., 1992, J. Exp. Med. 175:217-225; Kostelnv et al., 1992, J. Immunol. 148:15471553; Graber et al., 1994, J. Immunol. 152:5368; и патент США 5,731,168). Антитела более чем с двумя валентностями также предусмотрены. Например, можно получить триспецифические антитела (Tutt et al., J. Immunol. 147:60 (1991)). Таким образом, в некоторых вариантах реализации антитела к рецептору (рецепторам) "frizzled" человека мультиспецифичны.
[00204] Кроме того, в некоторых альтернативных вариантах реализации, FZD-связывающие агенты изобретения не являются биспецифическими антителами.
[00205] В некоторых вариантах реализации антитела (или другие полипептиды), описанные здесь, могут быть моноспецифичны. Например, в некоторых вариантах реализации каждый из одного или нескольких антиген-связывающих сайтов, которые содержит антитело, способен связывать (или связывает) также один или более FZD рецепторов человека (например, FZD1, FZD2, FZDS, FZ/D7, или FZD8, или гомологичный эпитоп на некоторой комбинации FZDs). В некоторых вариантах реализации антиген-связывающий сайт моноспецифических антител, описанных здесь, способен связывать (или связывает) один, два, три, четыре или пять (или более) рецепторов "frizzled" человека.
[00206] В некоторых вариантах реализации предусмотрен фрагмент антитела, например, для усиления проникновения в опухоль. Известны различные способы получения фрагментов антител. Традиционно, эти фрагменты получают с помощью протеолитического расщепления интактных антител (например, Morimoto et al., 1993, Journal of Biochemical and Biophysical Methods 24:107-117; Brennan et al., 1985, Science, 229:81). В некоторых вариантах реализации фрагменты антител получают рекомбинантным способом. Fab, Fv и scFv фрагменты антител можно экспрессировать и выделить из Е. coli или других клеток-хозяев, что, таким образом, дает возможность производить большое количество этих фрагментов. Такие фрагменты антител также можно выделять из фаговых библиотек антител, обсуждавшихся выше. Фрагменты антител также могут быть представлены линейными антителами, как описано в патенте США 5,641,870, например, и могут быть моноспецифичны или биспецифичны. Специалисту в данной области известны другие способы получения фрагментов антител.
[00207] В соответствии с настоящим изобретением, способы могут быть адаптированы для производства одноцепочечных антител, специфичных к одному или нескольким рецепторам "frizzled" человека (см. U.S. Pat. No. 4,946,778). Кроме того, методы могут быть адаптированы для создания библиотек экспрессии Fab (Husc, et al„ Science 246:1275-1281 (1989)) для обеспечения быстрой и эффективной идентификации моноклональных Fab фрагментов с желаемой специфичностью к рецепторам FZD или их производным, фрагментам, аналогам или гомологам. Фрагменты антител могут быть получены с помощью способов, известных в данной области, включающих, но не ограниченных перечисленными: (a) F(ab′)2 фрагмент получают путем расщепления молекулы антитела пепсином; (b) Fab фрагмент образуется путем восстановления дисульфидных мостиков F(ab′)2 фрагмента, (с) Fab фрагмент образуется при обработке молекулы антитела папаином и восстанавливающим агентом, и (d) Fv фрагменты.
[00208] Кроме того, может быть целесообразно, особенно в случае фрагментов антител, модифицировать антитела с целью увеличения периода их полувыведения из сыворотки крови. Это может быть достигнуто, например, путем включения эпитопа, связывающегося с «рецептором спасения», в фрагмент антитела посредством внесения мутации в соответствующую области фрагмента антитела или путем включения эпитопа в пептидный тег (дополнительную последовательность), который затем «сшивают» с фрагментом антитела либо конце, либо в средней области (например, на уровне синтеза ДНК или пептида).
[00209] Гетероконъюгированные антитела также входят в область охвата настоящего изобретения. Гетероконъюгированные антитела состоят из двух ковалентно связанных антител. Такие антитела, например, предложены для направленного транспорта иммунных клеток к нежелательным клеткам (патент США №4,676,980). Предполагается, что антитела могут быть получены in vitro с использованием известных способов химии синтеза белка, в том числе с участием сшивающих агентов. Например, иммунотоксины можно сконструировать при помощи реакции дисульфидного обмена или путем формирования тиоэфирной связи. Примеры подходящих для этой цели реагентов включают иминотиолат и метил-4-меркаптобутиримидат.
[00210] Для целей настоящего изобретения, следует принимать во внимание, что модифицированные антитела могут содержать вариабельную область любого типа, что обуславливает ассоциацию антител с полипептидами рецептора FZD человека. В этой связи, вариабельная область может находиться в или быть получена от млекопитающего любого типа, у которого можно индуцировать гуморальный ответ и продукцию иммуноглобулинов против желаемого антигена, ассоциированного с опухолью. Таким образом, источниками вариабельной области модифицированных антител могут быть, например, человек, мыши, нечеловекообразные приматы (например, обезьяны яванские макаки, макаки, и т.д.) или волки. В некоторых вариантах реализации как вариабельная, так и константная области модифицированных иммуноглобулинов получены от человека. В других вариантах реализации вариабельные области совместимых антител (обычно полученные не от человека) могут быть сконструированы или специальным образом приспособлены для улучшения связывающих свойств или снижения иммуногенности молекулы. В этом отношении, вариабельные области, используемые в настоящем изобретении, могут быть гуманизированы или иным образом изменены за счет включения заимствованных аминокислотных последовательностей.
[00211] В некоторых вариантах реализации вариабельные домены как в тяжелой, так и в легкой цепях изменены путем, по меньшей мере, частичной замены одного или более CDR, и, при необходимости, путем частичной замены и изменения последовательности остовной области. Хотя CDR-участки могут происходить от антител одного и того же класса или даже подкласса, что и антитела, от которых происходят остовные области, предполагается, что CDR-участки происходят от антител различных классов и, предпочтительно, от антител различных видов. Для передачи антиген-связывающей способности одного вариабельного домена другому может не требоваться замещение всех CDR-участков полными CDR-участками из донорской вариабельной области. Скорее, может быть необходимо только перемещение тех остатков, которые необходимы для поддержания активности антиген-связывающего сайта. С учетом пояснений, изложенных в патентах США №№5,585,089, 5,693,761 и 5,693,762, получение функциональных антител с пониженной иммуногенностью находится в пределах компетенции специалистов в данной области, либо путем проведения рутинных экспериментов, либо путем исследования методом проб и ошибок.
[00212] Несмотря на изменения в вариабельной области, специалистам в данной области будет ясно, что модифицированные антитела настоящего изобретения включают антитела (например, полноразмерные антитела или их иммунореактивные фрагменты), в которых, по меньшей мере, часть одного или нескольких доменов константных областей делецирована или иным образом изменена для того, чтобы обеспечить желаемые биохимические характеристики, такие как увеличение направленности доставки («локализации») в опухоли или уменьшение периода полувыведения из сыворотки крови, по сравнению с антителами примерно такой же иммуногенности, содержащими нативную или неизмененную константную область. В некоторых вариантах реализации константная область модифицированных антител содержит константную область антитела человека. Модификации константной области, совместимые с данным изобретением, включают добавления, делеции или замены одной или нескольких аминокислот в одном или нескольких доменах. То есть, модифицированные антитела, описанные здесь, могут содержать изменения или модификации по одному или более из трех константных доменов тяжелых цепей (CHI, СН2 или СН3) и/или по константному домену легких цепей (CL). В некоторых вариантах реализации рассматриваются модифицированные константные области, в которых один или более домен частично или полностью делетирован. В некоторых вариантах реализации модифицированные антитела включают конструкции с делецированным доменом или варианты, в которых весь домен СН2 удален (конструкции ΔСН2). В некоторых вариантах реализации опущенный домен константной области будет заменен коротким аминокислотным спейсером (например, 10 остатков), что обеспечивает некоторую молекулярную гибкость, которую обычно придает отсутствующая константная область.
[00213] Помимо конфигурации константных областей, в данной области известно, что они опосредуют несколько эффекторных функций. Например, связывание компонента комплемента С1 с антителами активирует систему комплемента. Активация комплемента играет важную роль в опсонизации и лизисе клеточных патогенов. Активация комплемента также стимулирует воспалительную реакцию, а также может быть вовлечена в аутоиммунную гиперчувствительность. Кроме того, антитела связываются с клетками через Fc-область, причем сайт рецептора Fc на Fc-области антитела связывается с рецептором Fc (FcR) на поверхности клетки. Имеется ряд рецепторов Fc, специфичных для различных классов антител, в том числе IgG (гамма-рецепторы), IgE (эта-рецепторы), IgA (альфа-рецепторы) и IgM (мю-рецепторы). Связывание антитела с Fc рецепторами на поверхности клеток запускает ряд важных и разнообразных биологических реакций, включая поглощение и деструкцию покрытых антителами частиц, клиренс иммунных комплексов, лизис покрытых антителами клеток-мишеней клетками-киллерами (так называемая антителозависимая клеточно-опосредованная цитотоксичность, или АЗКЦ), высвобождение медиаторов воспаления, плацентарная передача и контроль продукции иммуноглобулинов.
[00214] В некоторых вариантах реализации предусмотрено изменение эффекторных функций FZD-связывающих антител, что, в свою очередь, влияет на биологический профиль вводимых антител. Например, деления или инактивация (посредством точечных мутаций или другими способами) домена константной области может ослаблять связывание циркулирующих модифицированных антител с Fc рецептором, тем самым повышая направленность доставки («локализации») в опухоль. В других случаях модификации константных областей, совместимые с настоящим изобретением, могут снижать связывание комплемента и, тем самым, уменьшать период полувыведения из сыворотки крови и неспецифическую ассоциацию конъюгированного цитотоксина. Кроме того, другие модификации константной области можно применять для элиминации дисульфидных связей или олигосахаридных компонентов, что позволяет повысить направленность «локализации» за счет увеличения антигенной специфичности или «гибкости» антител. Аналогичным образом, модификации в константной области, в соответствии с настоящим изобретением, можно легко получить с помощью хорошо известных биохимических способов или способов молекулярной инженерии, которые находятся в рамках компетенции специалиста в данной области.
[00215] В некоторых вариантах реализации FZD-связывающий агент, представляющий собой антитело, не имеет ни одной или более эффекторной функции. Например, в некоторых вариантах реализации антитела не обладают активностью антителозависимой клеточной цитотоксичности (АЗКЦ) и/или комплемент-зависимой цитотоксичности (КЗЦ). В некоторых вариантах реализации антитела не связываются с Fc-рецепторами и/или факторами комплемента. В некоторых вариантах реализации антитела не имеют эффекторных функций.
[00216] Следует отметить, что в некоторых вариантах реализации модифицированные антитела могут быть сконструированы таким образом, что СН3-домен непосредственно «слит» с шарнирной областью соответствующих модифицированных антител. В других конструкциях может быть целесообразно предоставить пептидный спейсер между шарнирной областью и модифицированными СН2- и/или СН3-доменами. Например, можно экспрессировать совместимые конструкции, в которых СН2 домен делетирован, а оставшийся СН3-домен (модифицированный или немодифицированный) соединен с шарнирной областью через 5-20 аминокислотный спейсер. Такие спейсеры можно добавлять, например, для обеспечения того, чтобы регуляторные элементы константного домена оставались свободными и доступными или чтобы шарнирная область оставалась гибкой. Однако, следует отметить, что аминокислотные спейсеры могут в некоторых случаях оказаться иммуногенными и вызывать нежелательный иммунный ответ против конструкции. Соответственно, в некоторых вариантах реализации любой спейсер, добавленный к конструкции, будет относительно не иммуногенен или даже вообще исключен с целью сохранения желаемых биохимических свойств модифицированных антител.
[00217] Следует понимать, что помимо делеции целых доменов константных областей, настоящее изобретение предусматривает антитела с частичной делецией или заменой нескольких или даже одной аминокислоты. Например, мутации одной аминокислоты в отдельных участках СН2-домена может быть достаточно, чтобы существенно снизить связывание Fc и тем самым повысить направленность «локализации» в опухоли. Также, может быть целесообразно просто делетировать часть одного или более домена константных областей, которые контролируют эффекторную функцию (например, связывание комплемента CLQ), которую необходимо модулировать. Такие частичные делеции константных областей могут улучшать выбранные характеристики антител (период полувыведения из сыворотки крови), оставляя другие желаемые функции, связанные с подверженным доменом константной области, незатронутыми. Дополнительно, как упоминалось выше, константные области раскрытых антител могут быть модифицированы посредством мутации или замещения одной или нескольких аминокислот, что повышает профиль результирующей конструкции. В этом отношении может быть возможно нарушение активности, обеспечиваемой сохраняющимся сайтом связывания (например, Fc связывание), тогда как конфигурация и иммуногенный профиль модифицированных антител в значительной степени сохраняется. Некоторые варианты реализации могут включать добавление одной или нескольких аминокислот в константную область для повышения желаемых характеристик, таких как уменьшение или увеличение эффекторных функций, или для обеспечения прикрепления дополнительных молекул цитотоксина или углеводов. В таких вариантах реализации может быть целесообразна вставка или повтор конкретных последовательностей, полученных от выбранных доменов константных областей.
[00218] Настоящее изобретение, дополнительно, охватывает варианты и эквиваленты, которые в значительной степени гомологичны химерным, гуманизированным антителам и антителам человека, или их фрагментам, описанным в настоящей заявке. Они могут содержать, например, консервативные мутации замещения, то есть замены одной или нескольких аминокислот сходными аминокислотами. Например, консервативное замещение относится к заменам одной аминокислоты другой в составе одного общего класса, таким как, например, замена одной кислой аминокислоты другой кислой аминокислотой, одной основной аминокислоты другой основной аминокислотой или одной нейтральной аминокислоты другой нейтральной аминокислотой. Что означает «консервативная аминокислотная замена» хорошо известно в данной области.
[00219] Настоящее изобретение также относится к иммуноконъюгатам, включающим антитела, конъюгированные с цитотоксическим агентом. Цитотоксические агенты включают химиотерапевтические агенты, агенты ингибирования роста, токсины (например, ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, или их фрагменты), радиоактивные изотопы (т.е., радиоконъюгаты) и др. Химиотерапевтические агенты, применимые для производства таких иммуноконъюгатов, включают, например, метотрексат, адриамицин, доксорубицин, мелфалан, митомицин С, хлорамбуцил, хлорамбуцил или другие интеркалирующие агенты. Ферментативно активные токсины и их фрагменты, которые можно использовать, включают дифтерийную А-цепь, несвязывающие активные фрагменты дифтерийного токсина, А-цепь экзотоксина, А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII, и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Saponaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены. Для производства радиоконъюгированных антител доступен ряд радионуклидов, включая 212Bi, 131I, 131In, 90Y и 186Re. Конъюгаты антител и цитотоксических агентов получают с помощью ряда бифункциональных белок-сопрягающих агентов, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметил адипимидат HCL), активные сложные эфиры (такие как дисукцинимидил суберат), альдегиды (такие как глутаральдегид), бис-азидо соединения (такие как бис(п-азидобензоил)гександиамин), производные бис-диазония (такие как бис-(п-диазонийбензоил)-этилендиамин), диизоцианаты (такие как толиен-2,6-диизоцианат) и бис-активные соединения фтора (такие как 1,5-дифтор-2,4-динитробензол). Также можно применять конъюгаты антител с одним или низкомолекулярным токсином, таким как калихеамицин, майтанзины, трихотен и СС1065, и производными этих токсинов, имеющими активность токсина.
[00220] Конъюгированные антитела состоят из двух ковалентно связанных антител. Такие антитела, например, предложены для направленной доставки иммунных клеток к нежелательным клеткам (U.S. Pat. No. 4,676,980). Предполагается, что антитела можно получить in vitro с использованием известных способов химии белкового синтеза, в том числе с участием сшивающих агентов. Например, иммунотоксины можно сконструировать с помощью реакции дисульфидного обмена или путем формирования тиоэфирной связи. Примеры подходящих для этой цели реагентов включают иминотиолат и метил-4-меркаптобутиримидат.
[00221] Независимо от того, как получены полезные характеристики, антитела настоящего изобретения можно применять в любой из ряда конъюгированных (т.е. иммуноконъюгаты) или неконъюгированных форм. Дополнительно, антитела согласно данному изобретению можно использовать в неконъюгированной или "голой" форме. В некоторых вариантах реализации антитела используются в неконъюгированной форме, затем чтобы использовать естественные защитные механизмы субъекта, включая комплемент-зависимую цитотоксичность (КЗЦ) и антителозависимую клеточную токсичность (АЗКЦ), для элиминации злокачественных клеток. В некоторых вариантах реализации антитела могут быть конъюгированы с радиоизотопами, такими как90Y,125I,131I,123I,ШШ,105Rh,153Sm,67Cu,67Ga,166FIo,177Lu,186Re и88Re, с применением любого из ряда хорошо известных хелаторов или посредством прямого мечения. В других вариантах реализации описанные композиции могут включать антитела, соединенные с лекарственными препаратами, пролекарствами или модификаторами биологического ответа, такими как метотрексат, адриамицин и лимфокины, такие как интерферон. Кроме того, другие варианты реализации настоящего изобретения включают применение антител, конъюгированных со специфическими биотоксинами, такими как рицин или дифтерийный токсин. Еще в других вариантах реализации модифицированные антитела могут быть в комплексе с другими иммунологически активными лигандами (например, антителами или их фрагментами), где результирующая молекула связывается как с опухолевыми клетками, так и эффекторными клетками, такими как Т-клетки. Выбор, какие конъюгированные или неконъюгированные модифицированные антитела следует применять, будет зависеть от типа и стадии рака, применения дополнительного способа лечения (например, химиотерапии или внешнего излучения) и состояния пациента. Следует понимать, что специалист в данной области может легко сделать такой выбор, учитывая наставления, приведенные в настоящей заявке.
[00222] Полипептиды настоящего изобретения могут представлять собой рекомбинантные полипептиды, природные полипептиды или синтетические полипептиды, включающие антитело, или его фрагмент, к рецептору FZD человека. В данной области признано, что некоторые аминокислотные последовательности изобретения могут варьировать без существенного влияния на структуру или функцию белка. Таким образом, настоящее изобретение также включает в себя вариации полипептидов, которые проявляют основную активность или которые включают в себя области антител, или их фрагментов, к белку рецептора FZD человека. Такие мутанты включают делеции, вставки, инверсии, повторы, и типичные замены.
[00223] Полипептиды и аналоги могут быть также модифицированы с включением дополнительных химических групп, которые обычно отсутствуют в белке. Такие дериватизированные группы могут улучшать растворимость, период полувыведения из организма или абсорбцию белка. Фрагменты могут также снижать или ликвидировать любые желаемые побочные эффекты белков и им подобных. Обзор по таким фрагментам можно найти в REMINGTON'S PHARMACEUTICAL SCIENCES, 20th ed.. Mack Publishing Co., Easton, PA (2000).
[00224] Изолированные полипептиды, описанные в настоящей заявке, можно получить любым подходящим способом, известным в данной области. Такие способы варьируют от способа прямого синтеза белка до конструирования последовательности ДНК, кодирующей последовательности изолированных полипептидов и экспрессирующей такие последовательности в подходящем трансформированном хозяине. В некоторых вариантах реализации последовательность ДНК сконструирована с использованием рекомбинантной технологии путем выделения или синтеза последовательности ДНК, кодирующей целевой белок дикого типа. В некоторых случаях последовательности можно мутагенезировать путем сайт-специфичного мутагенеза с получением их функциональных аналогов. См., например, Zoeller et al., Proc. Nat'l. Acad. Sci. USA 81:5662-5066 (1984) и патент США №4,588,585.
[00225] В некоторых вариантах реализации последовательность ДНК, кодирующая целевой полипептид, может быть сконструирована путем химического синтеза с использованием олигонуклеотидного синтезатора. Такие олигонуклеотиды могут быть разработаны на основе аминокислотной последовательности желаемого полипептида и, выбирая те кодоны, которые являются предпочтительными в клетке-хозяине, в которой будет производиться целевой рекомбинантный полипептид. Для синтеза последовательности изолированного полинуклеотида, кодирующей целевой изолированный полипептид, могут быть применены стандартные способы. Например, полная аминокислотная последовательность может быть использована для конструирования гена, считываемого в обратном направлении. Дополнительно, можно синтезировать олигомер ДНК, содержащий нуклеотидную последовательность, кодирующую определенный изолированный полипептид. Например, можно синтезировать несколько небольших олигонуклеотидов, кодирующих сегменты желаемого полипептида, а затем их лигировать. Отдельные олигонуклеотиды обычно содержат 5′ или 3′ «липкие» концы для комплементарной сборки.
[00226] После сборки (путем синтеза, сайт-направленного мутагенеза или другим способом) полинуклеотидные последовательности, кодирующие определенный целевой изолированный полипептид, вставляют в вектор для экспрессии и соединяют с сохранением функции с последовательностью экспрессионного контроля, подходящей для экспрессии белка в желаемом хозяине. Правильность сборки может быть подтверждена нуклеотидным секвенированием, рестрикционным картированием и экспрессией биологически активного полипептида в подходящем хозяине. Как хорошо известно в данной области, для достижения высокого уровня экспрессии трансфицированного гена в хозяине, ген должен быть соединен с сохранением функции с последовательностями, контролирующими экспрессию на уровне транскрипции и трансляции, функционирующими в выбранном для экспрессии хозяине.
[00227] В некоторых вариантах реализации рекомбинантные векторы для экспрессии применяют для амплификации и экспрессии ДНК, кодирующей антитела, или их фрагменты, к рецепторам "frizzled" человека. Рекомбинантные векторы экспрессии представляют собой воспроизводимые конструкции ДНК, которые имеют синтетические или полученные из кДНК фрагменты ДНК, кодирующие полипептидную цепь анти-FZD антител, или их фрагментов, соединенных с сохранением функции с подходящими регуляторными элементами, контролирующими транскрипцию или трансляцию, полученными от генов млекопитающих, микробов, вирусов или насекомых. Единица транскрипции обычно включает сборку (1) генетического элемента или элементов, имеющих регулирующую роль в экспрессии генов, например, транскрипционных промоторов или энхансеров, (2) структурной или кодирующей последовательности, которая транскрибируется в мРНК и транслируется в белок, и (3) соответствующих последовательностей инициации и терминации транскрипции и трансляции, как подробно описано ниже. Такие регуляторные элементы могут включать в себя последовательность оператора для контроля транскрипции. Дополнительно могут быть включены ориджины репликации, обуславливающие способность к репликации в хозяине, селективный ген для облегчения распознавания трансформантов. Области ДНК оперативно соединяются, когда они функционально связаны друг с другом. Например, ДНК, кодирующая сигнальный пептид (секреторная лидирующая последовательность) соединена с сохранением функции с ДНК, кодирующей полипептид (если такой полипептид экспрессируется в виде предшественника), которая участвует в секреции полипептида; промотор соединен с сохранением функции с кодирующей последовательностью, если он контролирует транскрипцию последовательности; или сайт связывания рибосом соединен с сохранением функции с кодирующей последовательностью, если он расположен так, что делает возможной трансляцию. Структурные элементы, предназначенные для применения в экспрессирующих системах дрожжей, включают лидерную последовательность, способствующую внеклеточной секреции транслированного белка клеткой-хозяином. Кроме того, если рекомбинантный белок экспрессируется без лидерной последовательности или последовательности для транспорта, он может включать N-концевой остаток метионина. В некоторых случаях этот остаток может быть впоследствии отщеплен от экспрессированного рекомбинантного белка для предоставления конечного продукта.
[00228] Выбор последовательности, контролирующей экспрессию, и вектора для экспрессии зависит от выбора хозяина. Можно применять широкий спектр комбинаций хозяин/вектор для экспрессии. Векторы для экспрессии, применимые для эукариотических хозяев, включают, например, векторы, содержащие последовательности, контролирующие экспрессию, от SV40, бычьего вируса папилломы, аденовируса и цитомегаловируса. Векторы экспрессии, применимые для бактериальных хозяев, включают известные бактериальные плазмиды, такие как плазмиды из Esherichia coli, в том числе pCR 1, pBR322, рМВ9 и их производные, плазмиды более широкого круга хозяев, такие как М13 и нитчатые одноцепочечные ДНК фаги.
[00229] Клетки-хозяева, подходящие для экспрессии FZD-связывающего полипептида или антитела (или белка FZD для применения в качестве антигена) включают клетки прокариот, дрожжей, насекомых или высших эукариот под контролем соответствующих промоторов. Прокариоты включают грамотрицательные и грамположительные организмы, например, Е. coli или бациллы, Высшие эукариотические клетки включают устойчивые клеточные линии, имеющие происхождение от млекопитающих, как описано ниже. Также можно применять бесклеточные системы трансляции. Соответствующие векторы для клонирования и экспрессии для применения с бактериальными, грибковыми, дрожжевыми клетками-хозяевами и клетками-хозяевами млекопитающих описаны в работе Pouwels et al. (Cloning Vectors: A Laboratory Manual, Elsevier, N.Y., 1985), приведенной в настоящей заявке при помощи ссылки. Дополнительную информацию касательно способов получения белков, в том числе антител, можно найти, например, в публикации патента США №2008/0187954, патентах США №№6,413,746 и 6,660,501, и международной публикации WO 04009823, каждая из которых включена в настоящую заявку при помощи ссылки в полном объеме.
[00230] Для экспрессии рекомбинантного белка можно также предпочтительно применять различные системы культур клеток млекопитающих или насекомых. Экспрессия рекомбинантных белков в клетках млекопитающих но проводить в силу того, что такие белки, как правило, имеют правильную укладку, соответствующим образом модифицированы и полностью функциональны. Примеры подходящих линий клеток-хозяев включают линию клеток почки обезьяны COS-7, описанную Gluzman (Cell 23:175, 1981), и другие клеточные линии, способные экспрессировать соответствующий вектор в том числе, например, L-клетки, С127, 3Т3, клетки яичника китайского хомячка (СНО), HeLa и линию клеток ВНК. Векторы для экспрессии в млекопитающих могут содержать нетранскрибируемые элементы, такие как ориджин репликации, подходящий промотер и энхансер, соединенный с экспрессируемым, и другие 5′- или 3′-фланкирующие нетранскрибируемые последовательности и 5′- и 3′-нетранслируемые последовательности, такие как необходимые сайты связывания рибосом, сайты полиаденилирования, донорные и акцепторные сайты, и последовательности терминации транскрипции. Бакуловирусные системы для продукции гетерологичных белков в клетках насекомых рассмотрены в работе Luckow and Summers, Bio/Technology 6:47 (1988).
[00231] Белки, продуцируемые трансформированными клетками-хозяевами, могут быть очищены в соответствии с любым подходящим способом. Такие стандартные способы включают хроматографию (например, ионнообменную, афинную и колоночную хроматографию по размеру), центрифугирование, дифференциальную растворимость или любой другой стандартный способ для очистки белков. Для облегчения очистки при прохождении через соответствующую аффинную колонку, к белку могут быть присоединены аффинные метки, например, гексагистидиновые «тэги», мальтоза-связывающий домен, последовательность оболочки гриппа и глутатион-S-трансфераза. Физические свойства изолированных белков могут также быть определены с помощью таких подходов как протеолиз, ядерный магнитный резонанс и рентгеноструктурный анализ.
[00232] Например, супернатанты из систем, которые секретируют рекомбинантные белки в культуральную среду, могут быть сначала сконцентрированы с помощью коммерчески доступных фильтров для концентрирования белков, например, устройств для ультрафильтрации Amicon или Millipore Pellicon. После этапа концентрирования, концентрат может быть нанесен на подходящий матрикс для очистки. Как альтернатива, можно применять анионообменную смолу, например, матриксы или подложки с подвешенными группами диэтиламиноэтила (ДЭАЭ). Матрикс может быть акриламидным, агарозным, декстрановым, целлюлозным или другого типа, широко применяемого для очистки белков. Как альтернатива, можно применять катионнообменную стадию. Подходящие катионообменники включают различные нерастворимые матриксы, включающие сульфопропиловые или карбоксиметильные групп. Наконец, для дальнейшей очистки FZD-связывающий агента может быть использована одна или более стадия очистки с помощью высокоэффективной жидкостной хроматографии с обращенными фазами (ОФ-ВЭЖХ), например, с силикагелем с подвешенными метальными или другими алифатическими группами. Некоторые или все с вышеуказанных стадий очистки, в различных сочетаниях, можно также применять для получения гомогенного рекомбинантного белка.
[00233] Рекомбинантный белок, продуцируемый в бактериальной культуре, можно выделить, например, с помощью первоначальной экстракции из осадков клеток с последующей одной или более стадией концентрования, высаливания, водного ионного обмена или эксклюзионной хроматографии. Высокоэффективную жидкостную хроматографию (ВЭЖХ) можно применять для окончательной стадии очистки. Микробные клетки, применяемые для экспрессии рекомбинантного белка, могут быть разрушены любым удобным способом, в том числе с помощью циклов замораживания-оттаивания, ультразвука, механического разрушения или с применением лизирующих клетки агентов.
[00234] Способы, известными в данной области для очистки антител и других белков, также включать, например, описанные в публикациях патента США №2008/0312425, 2008/0177048, и 2009/0187005, каждый из которых включена в настоящую заявку посредством ссылки в полном объеме.
[00235] В некоторых вариантах реализации FZD-связывающий агент представляет собой полипептид, который не является антителом. В данной области известны различные способы выявления и продукции полипептидов, не являющимися антителами, которые связывают с высоким сродством с белками-мишенями. См., например, работы Skerra, Curr. Opin. Biotechnol., 18:295-304 (2007), Hosse et al., Protein Science, 15:14-27 (2006), Gill et al., Curr. Opin. Biotechnol., 17:653-658 (2006), Nygren, FEBS J., 275:2668-76 (2008), и Skerra, FEBS J., 275:2677-83 (2008), каждая из которых включена в настоящую заявку посредством ссылки в полном объеме. В некоторых вариантах реализации для выявления/продукции FZD-связывающего полипептида может быть использована технология фагового дисплея. В некоторых вариантах реализации полипептид включает белковый остов, относящийся к типу, выбранного из группы, включающей протеин А, липокалин, фибронектиновый домен, анкириновые консенсусные повторы и тиоредоксин.
[00236] В некоторых вариантах реализации агент не является белком. В некоторых вариантах реализации агент представляет собой низкомолекулярное соединение. Комбинаторные химические библиотеки и способы, которые модно применять для выявления небелковых FZD-связывающих агентов известны специалистам в данной области. См., например, работы Kennedy et al., J. Comb. Chem, 10:345-354 (2008), Dolle et al, J. Comb. Chem., 9:855-902 (2007), and Bhattacharyya, Curr. Med. Chem., 8:1383-404 (2001), каждая из которых включена в настоящую заявку посредством ссылки в полном объеме. В некоторых других вариантах реализации агент представляет собой углевод, гликозаминогликан, гликопротеин или протеогликанов.
[00237] В некоторых вариантах реализации агент представляет собой аптамер нуклеиновой кислоты. Аптамеры представляют собой молекулы полинуклеотидов, которые были отселектированы (например, из случайной или подвергшейся мутагенез совокупности полинуклеотидов) на основании их способности связываться с другой молекулой. В некоторых вариантах реализации аптамер содержит полинуклеотида ДНК. В некоторых альтернативных вариантах реализации аптамер включает полинуклеотид РНК. В некоторых вариантах реализации аптамер включает один или более модифицированный остаток нуклеиновой кислоты. Способы получения и скрининга аптамеров нуклеиновых кислот для связывания с белками, хорошо известны в данной области. См., например, патент США №5270163, патент США №5683867, патент США №5763595, патент США №6344321, патент США №7368236, патент США №5582981, патент США №5756291, патент США №5840867, патент США №7312325, патент США №7329742, международная публикация патента WO 02/077262, международная публикация патента WO 03/070984, публикация заявки на патент США №2005/0239134, публикация заявки на патент США №2005/0124565 и публикация заявки на патент США №2008/0227735, каждый из которых включена в настоящую заявку посредством ссылки в полном объеме.
[00238] Настоящее изобретение также обеспечивает способы скрининга агентов на эффективность подавления сигнального пути через Wnt, на эффективность против опухоли, и/или эффективность против раковых стволовых клеток. Эти способы включают, но не ограничены перечисленными, способы, включающие сравнение уровня одного или более маркера дифференцировки в первой солидной опухоли, которая была подвергнута воздействию агентом, с уровнем одного или более маркера дифференцировки второй солидной опухоли, которая не была подвергнута действию агента. В некоторых вариантах реализации эти способы включают: (а) воздействие на первую солидную опухоль, но не вторую солидную опухоль, агента; (б) оценка уровня одного или более маркера дифференцировки в первой и второй солидной опухоли и (в) сравнение уровни одного или более маркера дифференцировки в первой и второй солидной опухоли. В некоторых вариантах реализации агент является ингибитором канонического сигнального пути, опосредованного Wnt, и/или подавляет связывание одного или нескольких белков Wnt человека с одним или более рецептором "frizzled" человека. В некоторых вариантах реализации агент представляет собой антитело, специфично связывающееся с одним или более рецептором "frizzled" человека. В некоторых вариантах реализации повышение уровня одного или более маркеров дифференцировки в первой солидной опухоли относительно второй солидной опухоли указывает на эффективность действия агента против стволовых клеток солидной опухоли. В некоторых альтернативных вариантах реализации снижение уровня одного или более маркера дифференцировки (т.е. негативные маркеры дифференцировки) в первой солидной опухоли относительно второй твердой опухоли указывает на эффективность действия агента против стволовых клеток солидной опухоли. В некоторых вариантах реализации солидная опухоль представляет собой опухоль поджелудочной железы. В некоторых вариантах реализации солидная опухоль представляет собой опухоль поджелудочной железы, а один или более маркер дифференцировки может включать один или более муцин (например, Mucl6) и/или хромогранин A (CHGA). В некоторых альтернативных вариантах реализации солидная опухоль представляет собой опухоль толстой кишки. В некоторых вариантах реализации солидная опухоль представляет собой опухоль толстой кишки, а один или более маркер дифференцировки включает цитокератин 7. Другие возможные маркеры дифференцировки для поджелудочной железы и толстой кишки, а также других типов опухолей известны специалистам в данной области. Специалист в данной области может легко определить возможность применения маркеров дифференцировки в способах скрининга с помощью обработки представляющего интерес типа опухоли одним или более антителом к FZD, описанным в настоящей заявке, таким как 18R5 и/или 44R24, и последующей оценки изменения в экспрессии маркера в обработанной опухоли, по сравнению с контролем. Неограничивающие примеры таких способов, может, например, можно найти в конкретных примерах ниже.
III. Полинуклеотиды
[00239] В некоторых вариантах реализации настоящее изобретение охватывает полинуклеотиды, включающие полинуклеотиды, кодирующие полипептид, специфично связывающийся с рецептором FZD человека или фрагмент такого полипептида. Например, настоящее изобретение обеспечивает полинуклеотид, включающий нуклеиновую кислоту, которая кодирует антитело к рецептору "frizzled" человека или кодирует фрагмент такого антитела. Полинуклеотиды согласно настоящему изобретению могут находиться в форме РНК или в форме ДНК. ДНК включает кДНК геномную ДНК и синтетическую молекулу ДНК, и может быть двухцепочечной или одноцепочечной, при этом одноцепочечная ДНК может представлять собой кодирующую цепь или некодирующую (антисмысловую) нить.
[00240] В некоторых вариантах реализации полинуклеотиды являются изолированными. В некоторых вариантах реализации полинуклеотиды являются по существу очищенными.
[00241] Настоящее изобретение обеспечивает полинуклеотид, включающий полинуклеотид, кодирующий полипептид, включающий последовательность, выбранную из группы, включающей SEQ ID NO: 10, 12, 14. Настоящее изобретение также обеспечивает полинуклеотид, включающий полинуклеотид, кодирующий полипептид, включающий последовательность, выбранную из группы, включающей SEQ ID NO: 85-86. Настоящее изобретение также предусматривает полинуклеотид, включающий полинуклеотид, кодирующий полипептид, включающий SEQ ID NO: 11, 13 или 15.
[00242] Кроме того, изобретение обеспечивает полинуклеотид, который содержит последовательность, выбранную из группы, включающей SEQ ID NO: 17, 19 и 21. Кроме того, в некоторых вариантах реализации полинуклеотид может включать последовательность, выбранную из группы, включающей SEQ ID NO: 87-90, 92 и 94-95. Также предусмотрены последовательности полинуклеотидов, включающие SEQ ID NO: 18, 20 или 22.
[00243] Кроме того, настоящее изобретение обеспечивает полинуклеотид, включающий полинуклеотид, который гибридизуется с полинуклеотидом, имеющим последовательность SEQ ID NO: 17, 19, или 21 и/или с полинуклеотидом, кодирующим полипептид, имеющий последовательность SEQ ID NO: 10, 12 или 14. Кроме того, изобретением предусмотрен полинуклеотид, включающий полинуклеотид, который гибридизуется с полинуклеотидом, имеющим последовательность, выбранную из группы, включающей SEQ ID NO: 87-90, 92 и 94-95 и/или с полинуклеотидом, кодирующим полипептид, имеющий последовательность SEQ ID NO: 85 или 86. В некоторых вариантах реализации гибридизацию проводят в условиях высокой жесткости.
[00244] В некоторых вариантах реализации полинуклеотиды включают кодирующую последовательность зрелого полипептида, слитого с сохранением рамки считывания с полинуклеотидом, который способствует, например, экспрессии и секреции полипептида из клетки-хозяина (например, лидерной последовательностью, которая функционирует как последовательность для секреции, для регуляции транспорта полипептида из клетки). Полипептид, содержащий лидерную последовательность, представляет собой белок-предшественник, и его лидерная последовательность может отщепляться в клетке-хозяине с образованием зрелой формы полипептида. Полинуклеотиды также могут кодировать белок-предшественник, соответствующий зрелому белку с добавлением 5′-аминокислотных остатков. Зрелый белок, имеющий пропоследовательность, представляет собой пробелок и является неактивной формой белка. После отщепления пропоследовательности остается активный зрелый белок.
[00245] В некоторых вариантах реализации полинуклеотиды включают кодирующую последовательность зрелого полипептида, слитого с сохранением рамки считывания с маркерной последовательностью, которая позволяет, например, осуществлять очистку кодируемого полипептида. Например, маркерная последовательность может представлять собой гексагистидиновую дополнительную последовательность, предоставляемую вектором pQE-9, для обеспечения очистки зрелого полипептида, слитого с маркерной последовательностью в случае бактериальных хозяйских клеток, или маркерная последовательность может представлять собой гемагглютининовую дополнительную последовательность (НА), производную белка гемагглютинина вируса гриппа, в случае использования хозяйских клеток млекопитающих (например, клеток COS-7).
[00246] Настоящее изобретение также относится к вариантам описанных выше полинуклеотидов, кодирующих, например, фрагменты, аналоги, и производные.
[00247] В некоторых вариантах реализации настоящее изобретение обеспечивает изолированные полинуклеотиды, включающие полинуклеотиды, имеющие нуклеотидную последовательность идентичную по меньшей мере на 80%, идентичную по меньшей мере на 85%, идентичную по меньшей мере на 90%, идентичную по меньшей мере на 95%, а в некоторых вариантах реализации идентичную по меньшей мере на 96%, 97%, 98% или 99% полинуклеотиду, кодирующему полипептид, включающий антитело или его фрагмент, к человеческому рецептору FZD, описанному в настоящей заявке.
[00248] Под полинуклеотидом, имеющим нуклеотидную последовательность, по меньшей мере, например, на 95% «идентичную» референсной нуклеотидной последовательности подразумевают, что нуклеотидная последовательность полинуклеотида идентична референсной последовательности за исключением того, что последовательность полинуклеотида может включать до пяти точечных мутаций на каждые 100 нуклеотидов референсной нуклеотидной последовательности. Иными словами, для получения полинуклеотида с нуклеотидной последовательностью, идентичной по меньшей мере на 95% референсной нуклеотидной последовательности, до 5% нуклеотидов в референсной последовательности могут быть делетированы или заменены другим нуклеотидом, или в референсную последовательность могут быть вставлены нуклеотиды, количество которых составляет до 5% от общего числа нуклеотидов в референсной последовательности. Такие мутации референсной последовательности могут происходить в аминоконцевом или карбоксиконцевом положении референсной нуклеотидной последовательности или в любом месте между такими концевыми положениями, чередующиеся либо по отдельности с нуклеотидами референсной последовательности, либо в одной или более группе из соседних нуклеотидов в составе референсной последовательности.
[00249] Варианты полинуклеотидов могут содержать изменения в кодирующих областях, некодирующих областях или в тех и других. В некоторых вариантах реализации варианты полинуклеотидов содержат изменения, обуславливающие молчащие замены, добавления или делеции, но не изменяют свойства или активность кодируемого полипептида. В некоторых вариантах реализации нуклеотидные варианты получают в результате молчащих замен вследствие вырожденности генетического кода. Варианты полинуклеотидов могут быть получены в силу ряда причин, например, для оптимизации экспрессии кодонов для конкретного хозяина (изменение кодонов в мРНК человека на кодоны, которые являются предпочтительными для бактериального хозяина, такого как Е. coli).
[00250] Изобретением также предусмотрены вектора и клетки, включающие полинуклеотиды, описанные в настоящей заявке.
IV. Способы применения и фармацевтические композиции
[00251] FZD-связывающие агенты (в том числе полипептиды и антитела) настоящего изобретения можно применять для различных целей, включающих, но не ограниченные перечисленными, терапевтические способы лечения, например лечения рака. В некоторых вариантах реализации агенты можно применять ингибирования сигнального пути через Wnt, (например, канонического сигнального пути через Wnt), ингибирования роста опухоли, стимуляции дифференцировки, сокращения объема опухоли и/или уменьшения туморогенности опухоли. Способы применения могут представлять собой способы, осуществляемые in vitro, ex vivo или in vivo. В некоторых вариантах реализации FZD-связывающий агент или полипептид или антитело является антагонистом одного или более рецептора "frizzled" человека, с которым он связывается.
[00252] В некоторых вариантах реализации FZD-связывающий агенты или антагонисты применяют для лечения заболеваний, ассоциированных с активацией сигнального пути через Wnt. В конкретных вариантах реализации заболевание зависит от сигнального пути через Wnt. В конкретных вариантах реализации сигнальный путь через Wnt представляет собой канонический сигнальный путь, опосредованный Wnt. В некоторых вариантах реализации FZD-связывающие агенты или антагонисты применяют для лечения нарушений, характеризующихся повышенным уровнем стволовых клеток и/или клеток-предшественников.
[00253] В некоторых вариантах реализации заболевание, которое лечат с помощью FZD-связывающего агента или антагониста (например, антитела к FZD), представляет собой рак. В некоторых вариантах реализации рак характеризуется Wnt-зависимыми опухолями. В некоторых вариантах реализации рак характеризуется опухолями, экспрессирующими один или более рецептор "frizzled", с которым связывается FZD-связывающий агент (например, антитело). В некоторых вариантах реализации рак характеризуется опухолями, экспрессирующими один или более генов из генной сигнатуры Wnt.
[00254] В некоторых вариантах реализации заболевание, которое лечат с помощью FZD-связывающего агента или антагониста, не является раком. Например, заболевание может представлять собой нарушение обмена веществ, такое как ожирение или диабет (например, диабет II типа) (Jin Т., Diabetologia, 2008 Oct; 51(10):1771-80). Кроме того, указанное заболевание может представлять собой поражение костей, например, остеопороз, остеоартроз или ревматоидный артрит Corr М., Nat Clin Pract Rheumatol, 2008 Oct; 4(10):550-6; Day et al., Bone Joint Surg Am, 2008 Feb; 90 Suppl 1:19-24). Заболеванием может также представлять собой поражение почек, например поликистоз почек Harris et al., Annu Rev Med, 2008 Oct. 23; Schmidt-Ott et al., Kidney Int, 2008 Oct; 74(8):1004-8; Benzing et al., J Am Soc Nephrol, 2007 May; 18(5):1389-98). Кроме того, лечению можно подвергать болезни глаз, включающие, но не ограниченные перечисленными, макулярную дистрофию и семейную эксудативную форму витреоретинопатии (Lad et al., Stem Cells Dev, 2008 Aug. 8). Лечению могут также подвергаться сердечно-сосудистые заболевания, в том числе инфаркт миокарда, атеросклероз, и поражения клапанов (А1-А1у Z., Transl Res, 2008 Мау; 151(5):233-9; Kobayashi et al., Nat Cell Biol, 2009 Jan; 11(1):46-55; van Gijn et al., Cardiovasc Res, 2002 Jul; 55(1):16-24; Christman et al., Am J Physiol Heart Circ Physiol, 2008 Jun; 294(6):H2864-70). В некоторых вариантах реализации заболевание представляет собой заболевание легких, такое как идиопатическая легочная артериальная гипертензия или легочный фиброз (Laumanns et al., Am J Respir Cell Mol Biol, 2008 Nov 21; Konigshoff et al., PLoS ONE, 2008 May 14; 3(5):e2142). В некоторых вариантах реализации заболевание, подвергаемое лечению с помощью FZD-связывающего агента, представляет собой заболевание печени, например, цирроз или фиброз печени (Cheng et al., Am J Physiol Gastrointest Liver Physiol, 2008 Jan; 294(1):G39-49).
[00255] Настоящее изобретение обеспечивает способы лечения рака, включающие введение терапевтически эффективного количества FZD-связывающего агента субъекту (например, субъекту, нуждающемуся в лечении). В некоторых вариантах реализации рак представляет собой рак, выбранный из группы, включающей колоректальный рак, рак поджелудочной железы, рак легкого, рак яичников, рак печени, рак молочной железы, рак почки, рак предстательной железы, двенадцатиперстной кишки, меланому, рак шейки матки, рак мочевого пузыря, глиобластому и рака головы и шеи. В некоторых вариантах реализации рак представляет собой рак поджелудочной железы. В некоторых вариантах реализации рак представляет собой колоректальный рак. В некоторых вариантах реализации субъект представляет собой человека.
[00256] Настоящее изобретение также обеспечивает способы ингибирования роста опухоли с помощью антител или других агентов, описанных в настоящей заявке. В некоторых вариантах реализации способ ингибирования роста опухоли включает воздействие на клетку FZD-связывающего агента (например, антитела) in vitro. Например, иммортализованную линию клеток или линию раковых клеток, экспрессирующих FZD-мишень (мишени) культивируют в среде, к которой добавляют антитело или другой агент для ингибирования роста опухоли. В некоторых вариантах реализации опухолевые клетки выделяют из образца ткани пациента, такого как биоптат, плевральный выпот, или кровь, и культивируют в среде, к которой добавляют FZD-связывающий агент для ингибирования роста опухоли.
[00257] В некоторых вариантах реализации способ ингибирования роста опухоли включает воздействие на опухоли или опухолевые клетки с FZD-связывающего агента (например, антитела) in vivo. В некоторых вариантах реализации воздействие на опухоль или опухолевые клетки FZD-связывающего агента осуществляют на модельном животном. Например, FZD-связывающий агент может быть введен в ксенотрансплантаты, экспрессирующие один или более FZD, у мышей с ослабленным иммунитетом (например, NOD/SCID) для ингибирования роста опухоли. В некоторых вариантах реализации раковые стволовые клетки выделяют из образца пациента, такого как, например, биоптат, плевральный выпот или кровь, и вводят мышам с ослабленным иммунитетом, которым затем вводят FZD-связывающий агент для ингибирования роста опухолевых клеток. В некоторых вариантах реализации FZD-связывающий агент вводят в то же время или вскоре после введения опухолевой клетки животному для предотвращения роста опухоли. В некоторых вариантах реализации FZD-связывающий агент вводят в качестве терапевтического средства после того, как туморогенные клетки вырастают до указанного размера.
[00258] В некоторых вариантах реализации способ ингибирования роста опухоли включает введение субъекту терапевтически эффективного количества FZD-связывающего агента. В некоторых вариантах реализации субъект представляет собой человека. В некоторых вариантах реализации у субъекта имеется опухоль или у него была удалена опухоль.
[00259] В некоторых вариантах реализации опухоль представляет собой опухоль, в которой активен сигнальный путь через Wnt. В некоторых вариантах реализации сигнальный путь, опосредованный Wnt, активный в опухолях, представляет собой канонический сигнальный путь через Wnt. В некоторых вариантах реализации опухоль представляет собой Wnt-зависимую опухоль. Например, в некоторых вариантах реализации опухоль чувствительна к сверхэкспрессии аксина. В некоторых вариантах реализации опухоль не содержит инактивирующую мутацию (например, мутацию, связанную с укорочением) в гене-супрессоре опухоли аденоматозного полипоза толстой кишки (АПТК) или активирующую мутацию в гене бета-катенина. В некоторых вариантах реализации опухоли экспрессирует один или более ген из генной сигнатуры Wnt. В некоторых вариантах реализации рак, подвергаемый лечению у субъекта, включает такую опухоль.
[00260] В некоторых вариантах реализации опухоль экспрессирует один или более рецептор "frizzled" человека, с которым связывается FZD-связывающий агент или антитело. В некоторых вариантах реализации в опухоли сверхэкспрессирован рецептор (рецепторы) "frizzled" человека.
[00261] В некоторых вариантах реализации опухоль представляет собой опухоль, выбранную из группы, включающей опухоль толстой кишки, опухоль поджелудочной железы, опухоль легких, опухоль яичников, опухоль печени, опухоль молочной железы, опухоль почки, опухоль простаты, опухоль желудочно-кишечного тракта, меланому, опухоль шейки матки, опухоль мочевого пузыря, глиобластому, опухоль головы и шеи. В некоторых вариантах реализации опухоль представляет собой опухоль толстой. В некоторых вариантах реализации опухоль представляет собой опухоль поджелудочной железы.
[00262] Настоящее изобретение также обеспечивает способ ингибирования сигнального пути, через Wnt в клетке, включающий воздействие на клетку эффективного количества FZD-связывающего агента. В некоторых вариантах реализации клетка представляет собой клетку опухоли. В некоторых вариантах реализации способ представляет собой способ, осуществляемый in vivo, в котором стадия воздействия на клетки агента включает введение субъекту терапевтически эффективного количества агента. В некоторых альтернативных вариантах способ представляет собой способ, осуществляемый in vitro или ex vivo. В некоторых вариантах реализации ингибируемый сигнальный путь через Wnt представляет собой канонический сигнальный путь через Wnt. В некоторых вариантах реализации сигнальный путь через Wnt представляет собой сигнальный путь через WNT1, WNT2, WNT3, WNT3A, WNT7a, WNT7b, и/или WNT10B. В некоторых вариантах реализации сигнальный путь через Wnt представляет собой сигнальный путь через WNT1, WNT3A, WNT7b и/или WNT10B.
[00263] Кроме того, настоящее изобретение обеспечивает способ снижения туморогенности опухоли у субъекта, включающий введение такому субъекту терапевтически эффективного количества FZD-связывающего агента. В некоторых вариантах реализации опухоль содержит раковые стволовые клетки. В некоторых вариантах реализации частота раковых стволовых клеток в опухоли снижается при введении агента.
[00264] Таким образом, настоящее изобретение также обеспечивает способ снижения частоты раковых стволовых клеток в опухоли, включающий воздействие на опухоль с эффективного количества FZD-связывающего агента (например, антитела к FZD).
[00265] Кроме того, настоящее изобретение обеспечивает способы дифференцировки туморогенных клеток в нетуморогенные клетки, способы, включающие воздействие на туморогенные клетки FZD-связывающего агента (например, путем введения FZD-связывающего агента субъекту, имеющему опухоль, включающую туморогенные клетки или субъекту, у которого была удалена такая опухоль. В некоторых вариантах реализации туморогенные клетки представляют собой клетки опухоли поджелудочной железы. В некоторых альтернативных вариантах туморогенные клетки представляют собой клетки опухоли толстой кишки.
[00266] Также предусмотрено применение FZD-связывающих агентов, полипептидов или антител, описанных в настоящей заявке, для стимулирования дифференцировки клеток, в том опухолевых клеток. Например, предусмотрены способы стимулирования дифференцировки клеток, включающие воздействие на клетки эффективного количества FZD-связывающего агента (например, антитела к FZD), описанного в настоящей заявке. Также предусмотрены способы стимулирования дифференцировки клеток опухоли у субъекта, включающие введение субъекту терапевтически эффективного количества FZD-связывающего агента, полипептида, или антитела. В некоторых вариантах реализации опухоль представляет собой опухоль поджелудочной железы, в некоторых других вариантах реализации опухоли представляет собой опухоль толстой кишки.
[00267] Кроме того, предусмотрены способы лечения заболевания или нарушения у субъекта, где заболевание или нарушение ассоциировано с активацией сигнального пути через Wnt и/или характеризуется повышенным уровнем стволовых клеток и/или клеток-предшественников. В некоторых вариантах реализации способы лечения включают введение субъекту терапевтически эффективного количества FZD-связывающего агента, полипептида или антитела. В некоторых вариантах реализации сигнальный путь через Wnt представляет собой канонический сигнальный путь через Wnt.
[00268] Настоящее изобретение также обеспечивает способы снижения активации миофибробластов в строме солидной опухоли, включающие воздействие на строму эффективного количества FZD-связывающего агента, полипептида или антитела.
[00269] Настоящее изобретение также обеспечивает фармацевтические композиции, содержащие один или более FZD-связывающий агент, описанный в настоящей заявке. В некоторых вариантах реализации фармацевтические композиции дополнительно включают фармацевтически приемлемый носитель. Такие фармацевтические композиции находят применение для ингибирования роста опухоли и лечения рака у человека.
[00270] В некоторых вариантах реализации препараты готовят для хранения и применения, комбинируя очищенное антитело или агент настоящего изобретения с фармацевтически приемлемым носителем (например, носителем, эксципиентом) (Remington, The Science and Practice of Pharmacy 20th Edition Mack Publishing, 2000). Подходящие фармацевтически приемлемые носители включают, но не ограничены перечисленными, нетоксичные буферы, такие как фосфатный, цитратный и других органических кислот, соли, такие как хлорид натрия, антиоксиданты, включающие аскорбиновую кислоту и метионин, консерванты (например, октадецилдиметилбензил аммония хлорид; гексаметония хлорид, бензалкония хлорид; бензетония хлорида; фенол, бутиловый или бензиновый спирт; алкил парабены, такие как метил или пропилпарабен, катехин, резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные полипептиды (например, менее чем из примерно 10 аминокислотных остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон, аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин, углеводы, такие как моносахариды, дисахариды, глюкоза, манноза или декстрины; хелатирующие агенты, такие как ЭДТА, сахара, такие как сахароза, маннит, трегалозы или сорбит, солеобразующие противоионы, такие как натрий, комплексы металлов (например, Zn-белковые комплексы) и неионогенные поверхностно-активные вещества, такие как Твин или полиэтиленгликоль (ПЭГ).
[00271] Фармацевтические композиции настоящего изобретения можно вводить любым из способов для локального или системного лечения. Введение может быть осуществлено локально (например, на слизистые оболочки, включая вагинальное и ректальное введение), например, посредством трансдермальных пластырей, мазей, лосьонов, кремов, гелей, капель, суппозиториев, аэрозолей, жидкостей и порошков; пульмонально (например, путем ингаляции или инсуффляции порошков или аэрозолей, в том числе посредством распылителя; интратрахеально, интраназально, эпидермально и трансдермально), перорально или парентерально, в том числе посредством внутривенной, внутриартериальной, подкожной, внутрибрюшинной или внутримышечной инъекции или инфузии, или введение может быть интракраниальным (например, интратекальным или интравентрикулярным).
[00272] Терапевтические препараты могут быть в дозированной форме для однократного введения. Такие препараты включают таблетки, драже, капсулы, порошки, гранулы, водные или неводные растворы или суспензии среде, или суппозитории для перорального, парентерального или ректального введения или для введения путем ингаляции. В твердых композиций, таких как таблетки, главный активный ингредиент находится в смеси с фармацевтическим носителем. Стандартные компоненты для таблетирования включают кукурузный крахмал, лактозу, сахарозу, сорбитол, тальк, стеариновую кислоту, стеарат магния, дикальция фосфат или камеди, и другие разбавители (например, воды) с образованием твердых предварительных препаратов, содержащих однородную смесь соединения настоящего изобретения или его нетоксичной фармацевтически приемлемой соли. Твердые предварительные препараты затем подразделяется на дозированные формы для однократного введения описанных выше типов. Таблетки, драже и т.д. новой композиции могут быть покрыты оболочкой или составлены иным образом с целью получения дозированной формы, обладающей преимуществом пролонгированного действия. Например, содержимое таблетки или драже может быть покрыто наружним компонентом (оболочкой). Кроме того, два компонента могут быть разделены энтеросолюбильным слоем, который препятствует распадаемости и обеспечивает сохранение внутренних компонентов интактными при проходе через желудок или обеспечивает их замедленное высвобождение. Для таких энтеросолюбильных слоев или оболочек можно применять различные вещества, в том числе ряд полимерных кислот и смеси полимерных кислот с такими веществами, как шеллак, цетиловый спирт и ацетата целлюлозы.
[00273] Антитела или агенты также можно заключать в микрокапсулы. Такие микрокапсулы получают, например, помощью коацервации или межфазной полимеризации, например, микрокапсулы из гидроксиметилцеллюлозы или желатиновые микрокапсулы и микрокапсулы из полиметилметакрилата, соответственно, в коллоидной системе доставки лекарственного средства (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в виде макроэмульсий, как описано в Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing (2000).
[00274] В некоторых вариантах реализации фармацевтические препараты включают антитела или другие агенты настоящего изобретения в комплексе с липосомами (Epstein, et al., 1985, Proc. Natl. Acad. Sci. USA 82:3688; Hwang, et al., 1980, Proc. Natl. Acad. Sci. USA 77:4030; and U.S. Patent 4,485,045 and 4,544,545). Липосомы с увеличенным периодом циркуляции описаны в патенте США 5013556. Некоторые липосомы можно получать путем обращенно-фазового выпаривания с липидной композиции, содержащей фосфатидилхолин, холестерин и ПЭГ-производные фосфатидилэтаноламина (PEG-РЕ). Липосомы экструдируют через фильтры с заданным размером пор для получения липосом желаемого диаметра.
[00275] Кроме того, могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемый матрикс твердых гидрофобных полимеров, содержащий антитела, при этом матрикс находится в виде профилированных изделий (например, пленки или микрокапсулы). Примеры матрикса с замедленным высвобождением включают сложные полиэфиры, гидрогели, такие как поли(2-гидроксиэтил-метакрилат) или поливиниловый спирт, полилактиды (патент США 3773919), кополимеры L-глутаминовой кислоты и 7 этил-L-глутамата, неразлагаемый этилен-винил ацетат, разлагаемые кополимеры молочной кислоты и гликолевой кислоты, такие как кополимеры LUPRON DEPOT ТМ (микросферы для инъекций, состоящие из кополимера молочной кислоты и гликолевой кислоты и лейпролида ацетат), изобутират ацетата сахарозы и поли-D-(-)-3-гидроксимасляную кислоту.
[00276] В некоторых вариантах реализации в дополнение введению FZD-связывающего агента, способ или лечения дополнительно включает введение второго противоракового агента (до, одновременно с и/или после введения FZD-связывающего агента). Также предусмотрены фармацевтические композиции, содержащие FZD-связывающий агент, и второй противораковый агент.
[00277] Следует отметить, что комбинация FZD-связывающего агента и второго противоракового агента можно вводить в любом порядке или одновременно. В отдельных вариантах FZD-связывающие агенты вводят пациентам, которые ранее прошли лечение с помощью второго противоракового агента. В некоторых других вариантах реализации FZD-связывающий агент и второй противораковый агента вводят по существу одновременно или параллельно. Например, субъект может получать FZD-связывающий агент и при этом проходить курс лечения с помощью второго противоракового агента (например, химиотерапия). В некоторых вариантах реализации FZD-связывающий агент вводят в течение 1 года с помощью второго противоракового агента. В некоторых альтернативных вариантах FZD-связывающий агент вводят в течение 10, 8, 6, 4 или 2 месяцев того или иного варианта лечения с помощью второго противоракового агента. В некоторых других вариантах FZD-связывающий агент вводят в течение 4, 3, 2, или 1 недели того или иного варианта лечения с помощью второго противоракового агента. В некоторых вариантах реализации FZD-связывающий агент вводят в течение 5, 4, 3, 2, или 1 того или иного варианта лечения с помощью второго противоракового агента. Также следует отметить, субъект может получать два таких агента или лечение в течение часов или минут (то есть, по существу одновременно).
[00278] Классы применимых противораковых агентов включают, например, антитубулиновые агенты, ауристатин, агенты, связывающие с малой бороздкой ДНК, ингибиторы репликации ДНК, алкилирующие агенты (например, комплексы платины, такие как цис-платина, моноплатина, диплатина и трехъядерные комплексы платины и карбоплатин); антрациклины, антибиотики, антифолаты, антиметаболиты, сенсибилизаторы химиотерапии, дуокармицины, этопозиды, фторированные пиримидины, ионофоры, лекситропсины, соединения нитрозомочевины, платинолы, каналообразующие соединения, пуриновые антиметаболиты, пуромицины, радиосенсибилизаторы, стероиды, таксаны, ингибиторы топоизомеразы, алкалоиды барвинка и т.п. В некоторых вариантах реализации второй противораковый агент представляет собой антиметаболит, антимитотический агент, ингибитор топоизомеразы, или ингибитор ангиогенеза.
[00279] Противораковые агенты, которые можно вводить в комбинации с FZD-связывающими агентами, включают химиотерапевтические агенты. Таким образом, в некоторых вариантах реализации способ или лечение включает совместное введение антитела или агента настоящего изобретения и химиотерапевтического агента или смеси из нескольких различных химиотерапевтических агентов. Лечение с помощью антитела можно осуществлять до, одновременно с или после химиотерапевтического агента. Химиотерапевтические агенты, предусмотренные настоящим изобретением, включают в себя химические вещества или препараты, которые известны в данной области и являются коммерчески доступными, такие, как гемцитабин, иринотекан, доксорубицин, 5-фторурацил, цитозинарабинозид («Ara-С»), циклофосфамид, тиотепа, бисульфан, цитоксин, таксол, метотрексат, цисплатин, мелфалан, винбластин и карбоплатин. Комбинированное введение может включать в себя совместное введение, либо в виде одного фармацевтического препарата, либо с помощью посредством отдельных препаратов, или последовательное введение в любом порядке, но в целом в течение такого периода времени, при котором все активные вещества могут проявлять свою биологическую активность одновременно. Приготовление и режим дозирования для таких химиотерапевтических агентов могут соответствовать инструкциями производителя или можно определять эмпирически квалифицированным врачом. Приготовление и дозирование таких химиотерапевтических средств также описаны в Chemotherapy Service Ed., М.С. Perry, Williams & Wilkins, Baltimore, Md. (1992).
[00280] Химиотерапевтические агенты, которые можно применять согласно изобретению, также включают, но не ограничены перечисленными, алкилирующие агенты, такие как тиотепа и циклофосфамид (цитоксан); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, таких как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, в том числе алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфаорамид и триметилоломеламин; производные азотистого иприта такие, как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, меклоретамин, меклоретамина оксид гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорзотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики такие, как аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, мукофенольная кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зоробицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-ФУ); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов такие, как флударабин, 6-меркаптопурин, тиамиприн, тиоруанин; аналоги пиримидинов такие, как анцитабин, азацитидин, 6-азауридин, карморфур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-ФУ; андрогены, такие как калустерон, дромостанолон пропионат, эпитиостанол, мепитиостан, тестолактон; антагонисты надпочечников такие, как аминоглютетимид, митотан, трилостан; аналоги фолиевой кислоты, такие как фролиниковая кислота; ацеглатон; альдофосфамидгликозид; аминолевулиновая кислота; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазихинон; элфорнитин; эллиптиния ацетат; этоглуцид; галлия нитрат; оксимочевина лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбазин; PSK; разоксан; сизофиран, спирогерманий; тенуазоновая кислота; триазихинон; 2,2,2"-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-С»); циклофосфамид; тиотепа; таксоиды, например, паклитаксел (таксол, Bristol-Myers Squibb Oncology, Princeton, NJ) и доксетаксел (таксотер, Rhone-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин С; митоксантрон; винкристин; винорелбин; навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; СРТ11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноевая кислота; эсперамицины; капецитабин; и фармацевтически приемлемые соли, кислоты и производные любого из вышеуказанного. Кроме того, химиотерапевтические агенты также включают антигормональные средства, которые регулируют или ингибируют действие гормонов на опухоли такие, как антиэстрогены, в том числе, например, тамоксифен, ралоксифен, ингибирующие ароматазу 4(5)-имидазолы, 4-окситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (фарестон); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, льюпролид и гозерелин и фармацевтически приемлемые соли, кислоты или производные любого из вышеуказанного.
[00281] В некоторых вариантах реализации химиотерапевтический агент представляет собой ингибитор топоизомеразы. Ингибиторы топоизомеразы представляют собой химиотерапевтические агенты, которые препятствуют действию фермента топоизомеразы (например, топоизомеразы I или II). Ингибиторы топоизомеразы включают, но не ограничены перечисленными, доксорубицина гидрохлорид, даунорубицина цитрат, митоксантрона гидрохлорид, актиномицин D, этопозид, топотекана гидрохлорид, тенипозид (VM-26) и иринотекан. В некоторых вариантах реализации второй противоопухолевый агент представляет собой иринотекан. В некоторых вариантах реализации подвергаемые лечению опухоли представляют собой колоректальную опухоль, а второй противоопухолевый агент представляет собой ингибитор топоизомеразы, такой как иринотекан.
[00282] В некоторых вариантах реализации химиотерапевтический агент представляет собой антиметаболит.Антиметаболит представляет собой химическое вещество, сходное по структуре с метаболитом, необходимым для нормальных биохимических реакций, но отличающееся тем, что оно препятствует одной или более нормальной функции клеток, такой, как деление клетки. Антиметаболиты включают, но не ограничены перечисленными, гемцитабин, фторурацил, капецитабин, натрия метотрексат, ралтитрексед, пеметрексед, тегафур, цитозинарабинозид, тиогуанин (GlaxoSmithKline), 5-аазацитидин, 6-меркаптопурин, азатиоприн, 6-тиогуанин, пентостатин, флударабина фосфат и кладрибин, а также фармацевтически приемлемые соли, кислоты, или производные любого из вышеуказанного. В некоторых вариантах реализации второй противоопухолевый агент представляет собой гемцитабин. В некоторых вариантах реализации подвергаемая лечению опухоль представляет собой опухоль поджелудочной железы, а второй противоопухолевый агент представляет собой антиметаболит (например, гемцитабин).
[00283] В некоторых вариантах реализации химиотерапевтический агент представляет собой антимитотический агента, включающий, без ограничений, агенты, связывающиеся с тубулином. В качестве не ограничивающего примера, агент включает таксан. В некоторых вариантах реализации агент включает паклитаксел или доцетаксел, или его фармацевтически приемлемую соль, кислоту или производную паклитаксела или доцетаксела. В некоторых вариантах реализации агент представляет собой паклитаксел (таксол), доцетаксел (таксотер), связанный с альбумином паклитаксел (например, абраксан), DHA-паклитаксел или PG-паклитаксел. В некоторых альтернативных вариантах антимитотический агент включает алкалоид барвинка, такой как винкристин, бинбластин, винорельбин или виндезин, или их фармацевтически приемлемые соли, кислоты или производные. В некоторых вариантах реализации антимитотический агент представляет собой ингибитор кинезина Eg5 или ингибитор митотической киназы, такой как Aurora А или Plk1. В некоторых вариантах реализации, в случае, когда химиотерапевтический агент, который вводят в комбинации с FZD-связывающим агентом или полипептидом, или антителом, включает антимитотический агент, подверагаемый лечению рак или опухоль представляет собой рак молочной железы или опухоль молочной железы.
[00284] В некоторых вариантах реализации лечение включает совместное введение антитела (или другого агента) настоящего изобретения и лучевую терапию. Лечение с помощью антитела (или агента) может происходить до, одновременно с или после лучевой терапии. Можно применять любые режимы дозирования такой лучевой терапии, назначенные квалифицированным практикующим врачом.
[00285] В некоторых вариантах реализации второй противораковый агент включает антитело. Таким образом, лечение может включать совместное введение антитела (или других агентов) настоящего изобретения с другими антителами против дополнительных ассоциированных с опухолями антигенами, включающими, но не ограниченными перечисленными, антитела, которые связываются с EGFR, ErbB2, HER2, DLL4, Notch и/или VEGF. В качестве примера, антитела к DLL4, описанных, например, в заявке на патент США №US 2008/0187532, включенной в настоящую заявку посредством ссылки в полном объеме. В некоторых вариантах реализации второй противораковый агент представляет собой антитело, которое является ингибитором ангиогенеза (например, антитело к VEGF). Дополнительные антитела к DLL4 описаны, например, в международных публикациях WO 2008/091222 и WO 2008/0793326, и заявках на патент США Nos. US 2008/0014196, US 2008/0175847, US 2008/0181899 и US 2008/0107648, каждая из которых включена в настоящую заявку посредством ссылки в полном объеме. В качестве примера, антитела к Notch, описанные, например, в публикации заявки на патент США №US 2008/0131434, включенной в настоящую заявку посредством ссылки в полном объеме. В некоторых вариантах реализации второй противораковый агент представляет собой антитело, которое является ингибитором ангиогенеза (например, антитело к VEGF). В некоторых вариантах реализации второй противораковый агент представляет собой ингибитор сигнального пути, опосредованного Notch. В некоторых вариантах реализации второй противораковый агент представляет собой авастин (бевацизумаб), герцептина (трастузумаб), вектибикс (панитумумаб) или эрбитукс (цетуксимаб). Комбинированное введение может включать совместное введение либо в виде одного фармацевтического препарата или с применением отдельных препаратов, либо последовательное введение в любом порядке, но в целом в течение такого периода времени, что все активные вещества могут проявлять свою биологическую активность одновременно.
[00286] Кроме того, лечение может включать введение одного или нескольких цитокинов (например, лимфокинов, интерлейкинов, фактора некроза опухоли и/или факторов роста) или может сопровождаться хирургическим удалением раковых клеток или любой другой терапии, признанной необходимой лечащим врачом.
[00287] Для лечения заболевания, подходящая доза антитела или агента настоящего изобретения зависит от типа заболевания, подлежащего лечению, и тяжести и течения заболевания, восприимчивость заболевания к антителу или агенту, вводимого в терапевтических или профилактических целях, предшествующей терапии, клинической истории пациента, и так далее, по усмотрению лечащего врача. Введение антитела или агента может осуществляться однократно или в ходе серии процедур продолжительностью от нескольких дней до нескольких месяцев, или до тех пор, пока лечение не окажется эффективным или до достижения облегчения состояния заболевания (например, уменьшения размера опухоли). Оптимальный режим дозирования может быть рассчитан из измерений накопления препарата в организме пациента, и он варьирует в зависимости от относительной активности конкретных антител или агента. Врач, осуществляющий введение, может легко определить оптимальные дозировки, принципы дозирования и частоту повторений. В некоторых вариантах реализации доза составляет от 0,01 мкг до 100 мг на кг массы тела, и ее можно вводить один или более раз в день, неделю, месяц или год. В некоторых вариантах реализации антитело или другой FZD-связывающий агент вводяь раз в две недели или раз в три недели. В некоторых вариантах реализации доза антитела или другого FZD-связывающего агента составляет от 0,1 мг до 20 мг на кг массы тела. Лечащий врач может определить частоту повторений для дозирования на основании оценки времени удержания и концентрации препарата в биологических жидкостях и тканях.
V. Генные сигнатуры Wnt и их применение
[00288] Настоящее изобретение также обеспечивает генные сигнатуры Wnt, сигнатуры генов, являющихся показателем активности сигнального пути через Wnt в опухолях, которые можно применять при отборе опухолей, пациентов и/или способа терапии.
[00289] Генная сигнатура Wnt включает дифференциально экспрессируемый набор генов в опухолях, в которых активирован сигнальный путь через Wnt (и/или которые зависят от сигнального пути через Wnt,), по отношению к опухолям, в которых сигнальный путь Wnt не активирован. В некоторых вариантах реализации сигнальный путь через Wnt представляет собой канонический сигнальный путь через Wnt. Генную сигнатуру Wnt можно применять для выявления опухолей и/или пациентов, для которых характерна высокая вероятность ответа на лечение с помощью ингибитора сигнального пути через Wnt, (например, FZD-связывающий агента, который является антагонистом по меньшей мере одного рецептора "frizzled" человека и/или ингибитора сигнального пути через Wnt).
[00290] В некоторых вариантах реализации генная сигнатура Wnt включает один или более из генов (то есть, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18 или 19 генов), перечисленных в Таблице 3, ниже. Номера «Probe Set ID» соответствуют идентификационным номерам микрочипа GeneChip® Human Genome U133 Plus 2.0 Array (("HG_U133_Plus_2"; Affymetrix, Santa Clara, CA). В опухолях, в которых активен сигнальный путь через Wnt (т.е., опухолях, имеющих положительный ответ на сигнатуру генов Wnt), уровни экспрессии гена (генов) из Таблицы 3, которые входят в генную сигнатуру Wnt, повышен, по сравнению с опухолями, в которых не активен сигнальный путь через Wnt. В некоторых вариантах реализации генная сигнатура Wnt включает два или более гена, перечисленных в Таблице 3, ниже. В некоторых вариантах реализации генная сигнатура Wnt включает три или более, четыре или более, пять или более, шесть или более, семь или больше, восемь или более, девять или более, десять или более, одиннадцать или более, двенадцать или более, тринадцать или более, четырнадцать или более, пятнадцать или более, шестнадцать или более, семнадцать или более, восемнадцать или более или девятнадцать генов, перечисленных в Таблице 3, ниже. В некоторых вариантах реализации опухоль, в которой оценивают уровень экспрессии одного или более генов из Таблицы 3, представляет собой колоректальную опухоль. В некоторых вариантах реализации генная сигнатура Wnt включает AXIN2 и/или FOXQ1. В некоторых вариантах реализации опухоль представляет собой колоректальную опухоль, а генная сигнатура Wnt ген включает AXIN2, LGR5 и/или FOXQ1.

[00291] Настоящее изобретение также предусматривает способы применения генной сигнатуры Wnt генов для отбора пациентов (или для выявления пациентов), для которых показано лечение ингибиторами сигнального пути Wnt, или для оценки эффективности конкретной терапии. В некоторых вариантах реализации ингибитор сигнального пути, опосредованного Wnt, представляет собой FZD-связывающий агент, например антагонистическое антитело к FZD. Например, пациент может быть признан пригодным для лечения с помощью FZD-связывающего агента (или FZD-связывающих агентов) в результате определения того, демонстрирует ли опухоль пациента или опухоль, которая была удалена у пациента, генную сигнатуру Wnt. В некоторых вариантах реализации выявление генной сигнатуры Wnt включает оценку уровня экспрессии в опухоли одного или более гена из Таблицы 3. Если уровень экспрессии одного или более гена из Таблицы 3, включающей генную сигнатуру Wnt, повышен в опухоли (что таким образом указывает на активность сигнального пути через Wnt в опухоли), пациента признают пригодным для лечения с помощью FZD-связывающего агента, такого как антитело к FZD, подавляющего сигнальный путь через Wnt. Также изобретением предусмотрены способы применения генной сигнатуры Wnt для выбора подходящего варианта лечения для конкретного пациента.
[00292] Изобретение обеспечивает способ лечения рака у пациента, имеющего опухоль, или у пациента, у которого была удалена опухоль, включающий (а) выявление уровня экспрессии в опухоли одного или более генов из Таблицы 3 (б) отбор пациента для начала или продолжения лечения с помощью FZD-связывающего агента на основе уровня экспрессии одного или более генов, и (в) введение пациенту FZD-связывающего агента. В некоторых вариантах реализации способ включает оценку уровня экспрессии одного или более генов в опухоли. В некоторых вариантах реализации уровень экспрессии одного или более генов сравнивают с контрольным или референсным уровнем.
[00293] Также предусмотрены способы выявления опухоли, которая может реагировать на лечение с помощью ингибитора сигнального пути через Wnt. В некоторых вариантах реализации ингибитор сигнального пути через Wnt представляет собой FZD-связывающий агент.В некоторых вариантах реализации способы включают анализ генной сигнатуры Wnt в опухоли. В некоторых вариантах реализации способы включают оценку уровня экспрессии в опухоли одного или более генов из Таблицы 3.
[00294] Также предумотрены способы скрининга противоопухолевых лекарств-кандидатов определены как имеющие генную сигнатуру Wnt. В некоторых вариантах реализации лекарства-кандидаты представляют собой ингибиторы сигнального пути через Wnt. Эффективность таких лекарств-кандидатов предпочтительно тестируют на тех опухолях, в которых активен сигнальный путь через Wnt, и/или которые зависят от сигнальный путь через Wnt. Настоящее изобретение также обеспечивает способ скрининга лекарств-кандидатов, включающий оценку уровня экспрессии одного или нескольких генов из Таблицы 3 в опухоли (б) выбор опухоли для тестирования с лекарств-кандидатов на основании (по меньшей мере, частично) уровня экспрессии одного или более генов, и (в) тестирование действия лекарства-кандидата на опухоль.
[00295] Кроме того, в некоторых вариантах реализации можно определить влияние препарата на генную сигнатуру Wnt, и использовать для оценки эффективности лечения опухоли, в которой активен сигнальный путь через Wnt. В некоторых вариантах реализации, это обеспечивает способ наблюдения лечения пациента. В некоторых альтернативных вариантах это обеспечивает способ оценки эффективности лекарства-кандидата. В некоторых вариантах реализации снижение уровня экспрессии одного или более генов из Таблицы 3 (т.е. уменьшение или устранение генной сигнатуры Wnt) свидетельствует об эффективности лечения.
[00296] В некоторых вариантах реализации оценка уровня одного или более генов в генной сигнатуре Wnt включает определение уровня экспрессии полинуклеотидов одного или более генов. В некоторых вариантах реализации выявление генной сигнатуры Wnt включает выявление мРНК полинуклеотидов одного или более генов, входящих в состав сигнатуры. В некоторых вариантах реализации выявление экспрессии мРНК осуществляют с помощью Нозерн-блот анализа. В некоторых вариантах реализации детекция экспрессии мРНК осуществляют с помощью ОТ-ПЦР, ПЦР в режиме реального времени или количественной ПЦР с использованием наборов праймеров, которые специфично амплифицируют полинуклеотиды, входящие в сигнатуру раковых стволовых клеток. В некоторых вариантах реализации детекция мРНК включает реакцию образца с зондами из нуклеиновых кислот, комплементарных полинуклеотидам, входящих в состав генной сигнатуры раковых стволовых клеток. В некоторых вариантах реализации мРНК преобразуют в кДНК до детекции. В некоторых вариантах реализации детекцию мРНК осуществляют с помощью микрочипов, которые включают полинуклеотиды, которые гибридизуются с одним или более геном из генной сигнатуры Wnt.
[00297] В некоторых вариантах реализации анализ уровня одного или нескольких генов в генной сигнатуре Wnt включает в себя детекцию полипептидов, кодируемых одним или более генами. В некоторых вариантах реализации оценка уровня экспрессии полипептидных продуктов одного или более генов включает реакцию образца с антителами, специфичными к полипептидам, и выявление связывания антитела с полипептидами, например, посредством количественной иммунофлуоресценции или ИФА. Описание других средств детекции, известных специалисту в данной области, можно найти, например, в патенте США №6057105.
[00298] Также предусмотрен чип, включающий полинуклеотиды, которые гибридизуют при жестких условиях с одним или более геном из Таблицы 3. Также предусмотрен набор, включающий такой чип.
[00299] Набор, включающий антитела, которые связываются с продуктом экспрессии одного или более гена из Таблицы 3 также предусмотрен.
VI. Наборы, включающие Fzd-связывающие агенты
[00300] Настоящее изобретение предлагает наборы, которые включают антитела или другие агенты, описанные в настоящей заявке, и которые можно применять выполнения способов, описанных в данном документе. В некоторых вариантах реализации набор включает по меньшей мере одно очищенное антитело против одного или более рецептора "frizzled" человека, в одном или более контейнере. В некоторых вариантах реализации указанные наборы содержат все компоненты, необходимые и достаточные для проведения анализа детекции, включая все контроли, инструкции для проведения анализа, а также все необходимое программное обеспечение для анализа и представления результатов. Специалисту в данной очевидно, что описанные антитела или агенты настоящего изобретения могут быть легко включены в набор одного из установленных форматов, которые хорошо известны в данной области.
[00301] Кроме того, предусмотрены наборы, включающие FZD-связывающий агент (например, FZD-связывающее антитело), а также второй противораковый агент.В некоторых вариантах реализации второй противораковый агент представляет собой химиотерапевтический агент (например, гемцитабин или иринотекан). В некоторых вариантах реализации второй противораковый агент представляет собой ингибитор ангиогенеза. В некоторых вариантах реализации второй противораковый агент представляет собой ингибитор сигнального пути, опосредованного Notch (например, антитело к DLL4 или антитело к Notch).
[00302] Кроме того, предусмотрены наборы, включающие FZD-связывающий агент и реагент или реагенты для оценки экспрессии одного или более генов из Таблицы 3, представленной выше («Примеры генов из генной сигнатуры Wnt»).
[00303] Варианты реализации описания настоящего изобретения дополнительно определить с помощью следующих неограничивающих примеров, которые подробно описывают получение конкретных антител настоящего изобретения и способы применения антител настоящего описания. Специалисту в данной области очевидно, что возможны различные модификации, как материалов, так и способов, не выходящие за пределы области охвата настоящего описания.
ПРИМЕРЫ
[00304] Следует понимать, что примеры и варианты, описанные в настоящем документе, представлены только с целью иллюстрации и, что специалистам в данной области могут быть предложены различные их модификации или изменения, не выходящие за пределы объема и сущности настоящего изобретения.
Пример 1
Выявление/продукция антител к белку FZD
[00305] Антитела человека, которые специфично узнают один или несколько рецепторов "frizzled" человека, можно выделить с использованием фагового дисплея. Например, библиотека синтетических антител, содержащая вариабельные домены антител человека, можно подготовить к специфичному узнаванию с высоким сродством внеклеточного домена человеческого рецептора FZD7. Как только был выявлен специфический Fab-фрагмент с требуемыми характеристиками, вариабельные области данного Fab-фрагмента человека клонировали в экспрессионный вектор Ig, содержащий тяжелую цепь иммунноглобулина человека IgG2 и легкую цепь (каппа или лямбда) для выработки антител человека в клетках СНО.
[00306] Способ фагового дисплея был использован для выявления специфичного 18R8 Fab-фрагмента, который связывается с внеклеточным доменом белка FZD7. Фаговые частицы из бибилиотеки Fab-фрагментов человека, отображающие 2×1Q13 Fab-фрагмент, были инкубированы с пассивно иммобилизованным Fc-фрагментом рекомбинантного белка FZD7 ECD. Неспецифичные фаговые частицы смывали, а специфичные фаговые частицы элюировали DTT. Элюат использовали для заражения TG1 F+бактерий, обработанных вспомогательными фагами. Дисплей Fab-фрагмента был индуцирован при помощи ИПТГ (0,25 мМ). Результат данного этапа служил в качестве отсчетной точки для дальнейших отборочных туров. Отбор был продолжен до 3-го этапа, а затем конечный результат был получен путем твердофазного ИФА со специфичными к рекомбинантному белку FZD7 ECD Fc-фрагментами. Был выявлен Fab-фрагмент, который специфично связывается с человеческим белком FZD7.
[00307] Были получены последовательности вариабельных областей выявленного Fab-фрагмента. Сайт N-гликозилирования был удален из исходной последовательности путем сайт-направленного мутагенеза. Сайт N-гликозилирования в тяжелой цепи CDR1, Asn, был заменен на His. Данную мутацию внесли в целях предотвращения гликозилирования при экспрессии в клетках млекопитающих. Полученный Fab-фрагмент был обозначен как 18R8. CDR последовательности тяжелой и легкой цепей 18R8 приведены в Таблице 4. Последовательности VH и VL 18R8 Fab-фрагмента приводятся в SEQ ID NO: 10 и SEQ ID NO: 12, соответственно.

[00308] Fab-фрагменты 18R5 к белку FZD были получены путем соединения цепей VII-CHL 18R8 Fab-фрагмента с различными VL-CL цепями из той исходной фаговой библиотеки Fab-фрагментов, из которой был выделен 18R8 Fab-фрагмент.18R5 был выделен из библиотеки после трех этапов пэннинга со связанным рекомбинантным белком FZD7 ECD Fc. Последовательности CDRs 1SR5 приведены в таблице 4, см. выше. Последовательность VL антитела 18R5 приведена в SEQ ID NO: 14. Тяжелая цепь CDRs и цепь VII антитела 18R5 идентичны такой же цепи антитела 18R8.
[00309] Вариабельные области 18R8 и 18R5 Fab-фрагментов человека клонировали в экспрессионный вектор Ig, содержащий тяжелую цепь иммунноглобулина человека IgG2 и легкую цепь (каппа или лямбда) для выработки антител человека в клетках СНО. Аминокислотные последовательности тяжелой цепи и легкой цепи 18R8 IgG антител (включая сигнальные последовательности) приведены в SEQ ID NO: 11 и SEQ ID NO: 13, соответственно. N-концевая сигнальная последовательность аминокислотной последовательности каждой из цепей отщепляется после секреции. Нуклеотидные последовательности, кодирующие тяжелую и легкую цепи антитела 18R8 IgG, приведены в SEQ ID NO: 18 и SEQ ID NO: 20, соответственно. Аминокислотные последовательности тяжелой цепи и легкой цепи IgG антител 18R5 приводятся в SEQ ID NO: 11 и SEQ ID NO: 15, соответственно. (Как и в прошлом случае, N-концевая сигнальная последовательность аминокислотной последовательности каждой из цепей отщепляется после секреции.) Нуклеотидные последовательности, кодирующие тяжелую и легкую цепи антитела 18R5 IgG, приведены в SEQ ID NO: 18 и SEQ ID NO: 22, соответственно. Процедура очистки была применена для очищения антител.
[00310] Константу KdS 18R8 и 18R5 антител определяли с помощью системы Biacore 2000 от Biacore LifeScience (GE Healthcare). В частности, готовили серийное разведение очищенных антител к белку Fzd7 с 2-кратным шагом от 100 до 0,78 нМ в HBS-Р буфере (0,01 М HEPES pH 7,4, 0,15 М NaCl, 0,005% по объему Сурфактант-Р20). Каждое разведение тестировали против Fc-фрагментов рекомбинантных белков FZD, связанных с чипом CMS Biacore. Измеряли параметры ассоциации и диссоциации; значение KD было определено с использованием программного обеспечения Biaevaluation (Таблица 5, ниже)

Пример 2
ФСК-анализ антител к белку FZD свидетельствует о связывании с множественными белками FZD, локализованными на поверхности клетки человека.
[00311] Способ проточной цитометрии был использован для определения способности антител связываться с FZD белками клеточной поверхности. [00312] Для того, чтобы обеспечить надежную экспрессию отдельных белков FZD на клеточной поверхности, экспрессионные плазмиды млекопитающих, содержащие промотор CMV перед нуклеотидной последовательностью, кодирующей белок FZD, были получены с использованием стандартных способов генной инженерии (такие конструкции были названы "FL no FLAG"). Аналогичные экспрессивные плазмиды были получены для каждого из десяти белков человека "frizzled". Также с использованием стандартных способов генной инженерии были созданы альтернативные варианты экспрессионных векторов FZD, в которых нуклеотидная последовательность, кодирующая N-концевую сигнальную последовательность-FLAG (эпитоп, тэг), слита с N-концом зрелого белка FZD (такие конструкции были названы "FL FLAG"). Дополнительно, были сконструированы экспрессионные плазмиды, которые кодируют химерные белки, состоящие как из CRD-домена (также обозначается как "fri" домен) белка FZD, так и всего N-концевого внеклеточного домена белка FZD, слитого с N-концевой сигнальной последовательностью эпитопа FLAG (называется "fri flag" и "ECD flag", соответственно), и с С-концевой последовательностью, кодирующей трансмембранный и цитоплазматический домены белка CD4 человека.
[00313] Для оценки связывания антител с белком FZD способом проточной цитометрии в клетки HEK293 были введены экспрессионные вектора FZD и маркер трансфекции GFP. По истечении от двадцати четырех до сорока восьми часов после трансфекции, клетки собирали в виде суспензии и инкубировали на льду с антителами к белку FZD (10 мкг/мл, если не указано иное) или с контрольными IgG для выявления неспецифического связывания антител. После отмывки клеток проводили визуализацию первичных антител путем гибридизации с вторичными антителами к домену Fc, конъюгированными с флуоресцентным хромофором (например, фикоэритрином, связанным с антителами к IgG человека). Затем меченые клетки были проанализированы способом проточной цитометрии для определения антител к белку FZD, которые специфично связались с белком FZD на клеточной поверхности. Моноклональные антитела 18R5 и 18R8 узнавали белок FZD на поверхности трансфицированных клеток. Как показано на Фигурах 1 и 2, 18R8 и 18R5 связываются с несколькими FZD, включая FZD1, FZD2, FZD5, FZD7 и FZD8. Чтобы изучить относительную способность 18R8 и 18R5 связываться с конкретными белками FZD, было проведено титрование, при котором варьировалось количество антител в реакции связывания (Фигура 2). Этот анализ показал, что 18R5 демонстрирует большую способность к связыванию с каждым из рецепторов FZD (FZD1, FZD2, FZD5, FZD7 и FZD8), чем 18R8.
Пример 3
Ингибирование сигнального пути через Wnt антителами 18R8 и 18R5.
[00314] Способность антител 18R8 и 18R5 к рецептору FZD блокировать активацию сигнального пути через Wnt была определена в опытах in vitro с использованием репортера люциферазы.
[00315] STF293 клетки культивировали в среде DMEM, содержащей антибиотики и 10% FCS. STF293 клетки являются модифицированными 293-клетками, в которых стабильно введены следующие конструкции: (1) 8×TCF Luc репортерный вектор, содержащий семь копий сайта связывания TCF, связанных с промотором гена репортерного гена люциферазы светлячка для измерения уровня канонического сигнального пути через Wnt (Gazit et al., 1999, Oncogene 18:5959-66) и (2) репортер люциферазы морской фиалки (Promega;. Мэдисон, Висконсин) в качестве внутреннего контроля эффективности трансфекции. Клетки были введены в культуральные чашки. Антитела к FZD, предназначенные для тестирования, (или варианты без антител) были добавлены к клеткам. Затем клетки инкубировали в присутствии или отсутствии Wnt3A-содержащей среды, которая была приготовлена из L-клеток, которые стабильно экспрессируют Wnt3a (АТСС CRL-2647), или в контроле среда была приготовлена из L-клеток, не сверхэкспрессирующих Wnt3A (АТСС клеточная линия CRL-2648). После инкубации в течение ночи, уровни свечения люциферазы были измерены с помощью двойного комплекта анализа люциферазы (Promega; Мэдисон, Висконсин), причем активность люцифераза светлячков была нормирована по активности люциферазы морской фиалки.
[00316] Способность 18R8 и 18R5 антител подавлять активацию сигнального пути через Wnt была определена следующим образом. STF293 клетки обрабатывали различными концентрациями 18R8 или 18R5 антител IgG, после чего добавляли Wnt3A-содержащую среду. Клетки анализировали 18 часов спустя с использованием двойного комплекта анализа люциферазы. Результаты представлены на Фигуре 3. Более значительное ингибирование FTC-сигналинга Wnt3a-сигнального пути наблюдалось с применением антитела 18R5 к белку FZD.
[00317] В дальнейших экспериментах была определена способность 18R8 антитела к ингибированию передачи сигнала через различные лиганды Wnt. HEK 293 клетки были трансфицированы Wnt1, Wnt2, Wnt2b2, Wnt3, Wnt3a, Wnt7a, Wnt7b, Wnt8a, Wnt9b и Wnt10b в течение сорока восьми часов при помощи Fugene 6 (Roche). Wnt3A-содержащая среда ("WNT3ACM") была использована в качестве положительного контроля активации. STF293 клетки культивировали в среде DMEM, содержащей антибиотики и 10% FCS; к клеткам добавляли 18R8 антитела в концентрации 20 мкг/мл (или не добавляли антитела). Затем к STF293 клеткам добавляли НЕК293 клетки со сверхэкспрессией Wnt. Уровни люциферазы измеряли с помощью двойного комплекта анализа люциферазы спустя восемнадцать часов после воздействия. Результаты представлены на Фигуре 4. Было показано, что 18R8 антитела к белку FZD подавляют передачу сигнала через множество Wnt, в том числе, в дополнение к Wnt3A, происходит подавление сигнала через Wnt1, Wnt2, Wnt3, Wnt7A, Wnt7B и Wnt10B.
Пример 4. 18R8 блокирует связывание Wnt с FZD
[00318] Для оценки способности 18R8 блокировать связывание лиганда Wnt с рецептором FZD 2 мкл стокового раствора с концентрацией 1,32 мкг/мкл растворимых FZD8-Fc антител, содержащих Fri-домен (1-157 аминокислотные остатки последовательности FZD8 сшиты с попаданием в рамку считывания с Fc-фрагментом IgG1 человека), было добавлено в культуральную среду для связывания Wnt3A (добавлено как 20 мкл Wnt3A-содержащей среды) либо самостоятельно, либо в присутствии антител 18R8 IgG (добавлено как 4 мкл стокового раствора с концентрацией 3,71 мкг/мкл). Смеси инкубировали либо отдельно, либо в присутствии бусин сефарозы с белком А (продукция GE Healthcare; 20 мкл 50% раствора в PBS) в течение двух часов при температуре 4°C. После инкубации бусины белка А (и любые белки, связавшиеся с бусинами белка А) удаляли из каждого образца путем центрифугирования; супернатант анализировали на способность индуцировать 8×TCF активность люциферазы. Супернатант добавляли к STF293 клеткам, культивируемым в среде DMEM с антибиотиками и 10% PCS, которые стабильно экспрессируют 8×TCF (8 копий ТСР-связывающего домена перед последовательностью репортерного гена люциферазы светлячка), для оценки уровней канонического сигнального пути через Wnt. Уровни активности люциферазы измеряли с помощью двойного комплекта анализа люциферазы (Promega; Мэдисон, Висконсин) через восемнадцать часов после обработки STF293 клеток.
[00319] Как видно из Фигуры 5, Wnt 3А совместно с белком А вызывает сильную активацию репортерного гена, что измерено в единицах люциферазы (RLU) (Фигура 5, колонка 1). Добавление FzdB-Fc индуцирует образование комплекса между Wnt 3A-Fzd8 и между гибридным белком Fc и сефарозными бусинами белка А; поскольку белковый комплекс белок A-Wnt3A-Fzd8 удаляют центрифугированием, оставшийся супернатант не активирует репортерный ген (Фигура 5; колонка 2). При добавлении 18R8 анител данный комплекс предположительно нарушается по причине связывания антител с доменом Wnt3A, взаимодействующим с Fzd8, потому что, хотя белок А-Fzd8-Fc комплекс удаляется вместе с 18R8, которые могут взаимодействовать с белком А через собственный Fc-домен, наблюдается активность репортера, что свидетельствует о достаточном уровне не вошедшего в состав комплекса Wnt 3А (Фигура 5, колонка 3). 18R8 также взаимодействует с эндогенными белками FZD, находящимися на STF293 клетках, так как попытки удалить 18R8 белком А не приводит к возобновлению активации Wnt 3А (Фигура 5, колонка 6).
[00320] Данные на Фигуре 5 показывают, что инкубация с антителами 18R8 IgG приводят к сохранению активности Wnt3A в супернатанте относительно активности, детектируемой с только FZD8-Fc. Эти результаты показывают, что 18R8 блокирует способность FZD8 связывать Wnt3A и что антитела к эпитопу, узнаваемому 18R8, способны блокировать взаимодействие Wnt-FZD.
Пример 5 Картирование эпитопа 18R8 и 18R5
[00321] Чтобы определить эпитоп белка FZD, узнаваемый антителами 18R8 IgG, было выполнено картирование эпитопа. Для измерения связывания антител использовали способ проточной цитометрии клеток, экспрессирующих на поверхности FZD. Экспрессионные плазмидные вектора млекопитающих, содержащие промотор CMV перед последовательностью нуклеотидов, кодирующей N-концевую сигнальную последовательность FLAG (эпитоп, тэг), слитую с N-концом Fri-домена FZD8, в свою очередь, слитого с трансмембранным доменом и внутриклеточным доменом белка CD4, были получены при помощи стандартных способов генной инженерии. Такая экспрессионная конструкция позволяет экспрессировать Fri-домен белка FZD8 на поверхности клеток, а также экспрессировать тэг-эпитоп FLAG, чтобы контролировать процесс. Сайт-направленный мутагенез был использован для изменения выбранных аминокислот в последовательности внеклеточного домена FZD. НЕК293 были совместно трансфицированы экспрессионным вектором, кодирующим белок FZD, и маркером трансфекции GFP. Через сорок восемь часов после трансфекции клетки собирали в виде суспензии и инкубировали на льду с антителами к белку FZD или контрольными IgG для детекции неспецифического связывания антител. Клетки промывали, первичные антитела визуализировали при помощи вторичных антител (антитела против первичных антител), конъюгированных с флуоресцентным хромофором. Затем меченые клетки анализировали способом проточной цитометрии для оценки связывания антител к белку FZD с белками FZD на поверхности клетки.
[00322] При помощи такого подхода были выявлены специфичные аминокислоты внеклеточного домена FZD, важные для связывания антител к белку FZD. Когда аминокислотные остатки 82-83 белка FZDS PD были заменены на SQ, связывание 18R8 с FZD8 в основном не изменилось (Фигура 6). Аналогичным образом, замена аминокислотного остатка 109S на 109Q не оказывает заметного влияния на связывание. С другой стороны, когда остатки 70-71 HQ белка FZD8 были изменены на АЕ, связывание 18R8 с клеточным FZD8 заметно уменьшилось (Фигура 6 и Фигура 7). Во всех случаях, когда аминокислоты 66-67 GL были заменены на АА, или когда аминокислоты 68-69 EV были заменены на QL, или когда аминокислоты 126-127 FG были заменены на NV, пропадало связывание антител 18R8 с клеточным FZD8. Исчезновение связывания с белком FZD при заменах определенных аминокислот показало специфичные сайты связывания антитела во внеклеточном домене белка FZD. Таким образом, было определено, что антитела 18R8 связываются с эпитопом, состоящим из аминокислот 66-71 GLEVPIQ (SEQ ID NO: 25) белка FZD8 и аминокислот 124-128 GF белка FZD8 человека. Эта область эпитопа достаточно консервативна среди рецепторов "frizzled" человека, с которыми связывается FZD8 (т.е., FZD1, FZD2, FZD5, FZD7 и FZD8), и не очень консервативна у тех рецепторов "frizzled" человека, с которыми FZD8 не связывается (т.е., FZD3, FZD4, FZD6, FZD9 или FZD 10)
[00323] Также был проеден ФСК-анализ для сравнению связывания 18R5 IgG и 18R8 IgG с клетками дикого типа и мутантами по FZD8. Эти эксперименты показали, что антитела 18R8 и 18R5 связываются со сходными эпитопами FZD8 (Фигура 7).
Пример 6
Определение биологического сайта связывания (БСС рецепторов FZD)
[00324] Открытие антител, которые подавляют сигнальный путь через Wnt, и открытие эпитопа в белке FZD, с которым связываются эти антитела, позволило проанализировать, какие области структуры белка FZD важны для сигнального пути, опосредованного Wnt. Чтобы изучить области структуры белка, была проанализирована кристаллическая структура области Fri-домена белка FZD8 мыши. Мы определили, что эпитоп, узнаваемый 18R8 и 18R5, локализован в той области структуры белка FZD, для которой конкретная функциональная роль ранее не была описана. Кроме того, эпитоп содержит два отдельных элемента поверхности FZD (которые мы назвали "верхний края" и "нижний край"), разделенных выемкой (cleft). Также, при сравнении десяти рецепторов человека "frizzled", было обнаружено, что существует поразительное сохранение последовательности аминокислот, которые локализованы в нижней части этой выемки. Область, включающая эту выемку, а также "верхний край" и "нижний край", с которыми связываются 18R8 и 18R5, был обозначена как биологический сайт связывания (БСС) белка FZD. На Фигуре 9 представлены изображения структуры Fri-домена белка FZD, полученные на основе анализа ранее опубликованной кристаллической структуры белка мыши FZD8 (Dann СЕ et al.. Nature 412 (6842) 86-90, 2001); обработка информации была произведена с помощью программного обеспечения PyMOL. Изображение, приведенное в левом верхнем углу, представляет вид поверхности Fri-домена белка FZD с областью белка Fzd, включающей биологический сайт связывания (БСС), отмеченный белым кругом. Каждая область, обозначенная как "верхний край", "нижний край" и "выемка" БСС, выделена более темной окраской поверхности на отдельных изображениях в нижней части панели. На верхнем правом изображении Фигуры 9 выделены более темной поверхностью те остатки, которые консервативны у 9 или 10 из десяти членов семейства белков FZD человека.
Пример 7
Предупреждение роста опухоли антителами 18R5 in vivo
Предупреждение Wnt-зависимого роста опухоли антителами 18R5
[00325] Самкам мышей NOD/SCID в возрасте 5-7 недель вводили 50.000 клеток вируса опухоли-WNT1 молочной железы мышей, вызванной вирусом MMTV, в жировое тело верхней правой части молочной железы. Трансгенные (MMTV)-Wnt-1 мыши демонстрировали различные стадии опухолеобразования молочных желез, в том числе гиперплазию, инвазивную карциному протоков и отдаленные метастазы; следовательно, эта модель рака молочной железы мышей является полезным инструментом для анализа роли WNT в формировании и росте опухоли (Nusse and Varmus (1.982) Cell 31:99-109). Опухоли из мышей были диссоциировании; диссоциированные опухолевые клетки использовали для размножения опухоли. Опухолевые клетки имплантировали в жировую ткань молочной железы мышей; таких мышей осматривали два раза в неделю. После того, как опухоли стали ощутимыми при пальпации, размер опухолей оценивали два раза в неделю; объем опухолей был определен с помощью формулы ½(а×b2); где а = длина, b = ширина. Данные были представлены как среднее значение и среднее значение ± стандартная ошибка. Средние значения по группам сравнивали с использованием t-теста Стьюдента. Значения вероятности (Р)<0,05 были интерпретированы как существенно различающиеся. На 19 день мыши со средним объемом опухоли 44 мм3 были случайным образом разделены на 2 группы по 10 животных в каждой. Животным вводили либо контрольные антитела, либо антитела 18R5 IgG (10 мг/кг). Антитела вводили внутрь брюшной полости, два раза в неделю. Применение антител 18R5 полностью заблокировало рост опухоли по сравнению с применением контрольных антител (Фигура 10, р=0,002).
Уменьшение роста опухолевого ксенотрансплантата ОМР-С28 путем сочетания терапии антителами 18R5 и иринотеканом
[00326] В другом варианте, антитела к белку FZD были проанализированы на способность сокращать рост опухолевых ксенотрансплантатов ОМР-С28 толстой кишки. Диссоциированные клетки человека ОМР-С28 (10.000 в расчете на одно животное) вводили подкожно 6-8 недельным самцам линии мышей NOD/SCID. Рост опухоли проверяли еженедельно; измерения опухолей были начаты, как только опухоли стали ощутимыми при пальпации. На 24 день мыши со средним объемом опухоли 129 мм3 были разделены случайным образом на 4 группы по 10 животных в каждой. Животным вводили либо контрольные антитела, либо антитела 18R5 IgG (10 мг/кг), либо иринотекан (7,5 мг/кг), либо комбинацию 18R5 антител и иринотекана. Антитела и иринотекан вводили внутрь брюшной полости, два раза в неделю. Опухоли измеряли два раза в неделю, объем опухоли определяли по формуле ½(а×b2); где а = длина, b = ширина. Данные были представлены как среднее значение и среднее значение ± стандартная ошибка. Средние значения по группам сравнивали с использованием t-теста Стьюдента. Значения вероятности (Р)<0,05 были интерпретированы как существенно различающиеся. Воздействие только 18R5 антителами привело к 40% снижению роста опухоли, как показано на Фигуре 11 (р=0,02). Более того, воздействие 18R5 и иринотекана привело к 53% снижению роста опухоли по отношению к лечению только иринотеканом (р=0,0002 по сравнению с иринотеканом) (Фигура 11). Таким образом, антитела 18R5 продемонстрировали противоопухолевую активность на модели опухоли ОМР-С28 толстой кишки как в качестве монотерапии, так и в комбинации с иринотеканом. Уменьшение роста опухолевого ксенотрансплантата OMP-PN4 путем сочетания терапии антителами 18R5 и гемцитабином
[00327] В другом варианте антитела к белку FZD были проанализированы на способность к уменьшению роста опухолевого ксенотрансплантата OMP-PN4 поджелудочной железы. Линия мышей NOD/SCID была приобретена у Harlan (Indianapolis, Indiana); мыши были оставлены на несколько дней для акклиматизации перед исследованием. Создание и характеристика in vivo моделей рака ксенотрансплантата поджелудочной железы под управлением стволовых клеток были описаны ранее (Li et al.. Cancer Res., 67:1030-7, 2007). Для эффективности исследования, OMP-PN4 опухолевые клетки поджелудочной железы человека диссоциировали до клеточной суспензии, ресуспендировали в смеси 1:1 (по объему) буфера FACS (сбалансированный солевой раствора Хэнка [FIBSS] с добавлением 2% инактивированной нагреванием эмбриональной телячьей сыворотки и 20 мМ Hepes) и Матригеля (BD Bioscience, San Jose, СА) и имплантировали подкожно в правый бок при помощи иглы 25 диаметра, содержащей 50000 клеток/100 мкл, 6-7 недельным самцам линии мышей NOD/SCID. Рост опухоли проверяли еженедельно; измерения опухолей были начаты, как только опухоли стали ощутимыми при пальпации. На 36-й день средний объем опухоли достиг примерно 120 мм3; животные с опухолями были разделены случайным образом (4 группы по 9 животных на группу). Терапия была начата через два дня. Животным были введены либо контрольные антитела, либо антитела 18R5 IgG (10 мг/кг), либо гемцитабин (40 мг/кг), или комбинация антител 18R5 IgG и гемцитабина. Антитела и/или гемцитабин вводили в брюшную полость один раз в неделю. Рост опухоли измеряли при помощи электронного штангенциркуля (Coast Tools Company, San Leandro, СА). Опухоли измеряли раз в неделю, объем опухоли определяли по формуле ½(а×b2); где а = длина (длинная ось опухоли), b = ширина (короткая ось опухоли). Животных взвешивали каждый день, если они показывали более 15%-ю потерю массы тела и подвергали эвтаназии, если они достигали 20% от массы тела. Данные были представлены как среднее значение ± стандартная ошибка. Различия в средних значениях между группами анализировали по непараметрическому тесту. В множественных сравнениях использовали односторонний ANOVA тест с posthoc сравнением при помощи t-теста. Значения р<0,05 были интерпретированы как существенно различающиеся. Программное обеспечение для статистического анализа было GraphPad Prism4 (GraphPad Software Inc., San Diego, СА). В конце исследования, мыши были подвергнуты эвтаназии с использованием СО2 камеры и последующим смещением шейных позвонков. Опухоли были собраны для выделения РНК и гистологического анализ. Остальные опухоли переносили в холодной среде 199 для переработки в одноклеточную суспензию для анализа частоты раковых стволовых клеток.
[00328] Результаты исследования OMP-PN4 ксенотрансплантата показаны на Ill Фигуре 12. Лечение 18R5 антителами в качестве монотерапии не привело к существенному уменьшению роста опухоли в этом эксперименте. Однако, терапия 18R5 и гемцитабином привели к уменьшению роста опухоли на 42% по сравнению с обработкой только гемцитабином (Фигура 12, р=<0,001 по сравнению с гемцитабином). Таким образом, 18R5 продемонстрировали совместную противоопухолевую активность в сочетании с гемцитабином, утвержденным химиотерапевтическим агентом, на модели OMP-PN4 опухоли поджелудочной железы.
Уменьшение роста РЕ-13 опухоли молочной железы путем сочетания терапии антителами 18R5 и паклитакселом.
[00329] 10000 опухолевых клеток РЕ-13 молочной железы человека (HER2-отрицательных) были имплантированы NOD-SCID мышам; опухоли растили в течение 22 дней, пока они не достигли среднего объема приблизительно 120 мм3. Животных случайным образом разделили на 4 группы по 10 животных в каждой; животным вводили либо контрольные антитела, либо антитела 18R5 к FZD, либо паклитаксел (TAXOL®), либо комбинацию 18R5 и паклитаксела. Фигура 37 показывает средний размер опухолей у мышей, которым вводили контрольные антитела, антитела 18R5 к FZD, паклитаксел (TAXOL®), комбинацию 18R5 и паклитаксела. Антитела вводили дозами 10 мг/кг, внутрь брюшной полости, два раза в неделю. Паклитаксел вводили дозами 10 мг/кг, внутрь брюшной полости, раз в неделю. Опухоли измеряли по дням, указанным в Фигуре 37. Фигура 38 показывает рост опухоли отдельных животных группы, которой давали 18R5 и паклитаксел. Терапия антителами 18R5 совместно с паклитакселом приводило к противоопухолевой активности и регрессии опухолей молочной железы.
Пример 8
Исследования по определению влияния на частоту раковых стволовых клеток
[00330] Тест по предельному разведению (LDAs) можно использовать для оценки влияния FZD-связывающего агента или антител на стволовые клетки твердых раковых опухолей и на онкогенность опухоли, состоящей из раковых стволовых клеток. Анализы можно использовать для определения частоты раковых стволовых клеток в опухолях животных, получавших FZD-связывающие антитела или другие агенты, и сравнения данного параметра с частотой раковых стволовых клеток в опухолях контрольных животных.
Влияние комбинированной терапии антителами 18R5 и иринотеканом раковых стволовых клеток опухолей ОМР-С28.
[00331] Контрольные и подвергшиеся терапии опухоли от исследования ОМР-С28 ксенотрансплантата, описанного выше (Пример 7), были собраны в конце исследования (день 48). Опухоли были обработаны и диссоциированы на отдельные клетки. Затем опухолевые клетки инкубировали с биотинилированными антителами мыши (CD45-биотин мыши, разбавление 1:200 и H2Kd-биотин крысы-мыши, разбавление 1:100 (BioLegend, San Diego, СА) на льду в течение 30 минут с последующим добавлением стрептавидин-меченных магнитных бусин (Invitrogen, Карлсбад, Калифорния), чтобы удалить клетки мыши при помощи магнита.
[00332] Для LDA, клетки человека в суспензии собирали, подсчитывали; соответствующие дозы клеток (5, 25 и 125 клеток) в буфере FACS смешивали в соотношении 1:1 с Матригелем и вводили подкожно NOD/SCID линии мышей (10 мышей на дозу клеток в опытной группе). Опухоли растили в течение до 4 месяцев. В желаемый момент времени процент мышей с детектируемыми опухолями определяли во всех группах, которым вводили опухолевые клетки, обработанные антителами к FZD, и сравнивали с процентом мышей с детектируемыми опухолями в контрольной группе. Например, определяли число мышей с детектируемыми опухолями, которым вводили 125 контрольных клеток опухоли, и сравнивали с числом мышей с детектируемыми опухолями, которым вводили 125 клеток опухоли, обработанных антителами к FZD. Частота раковых стволовых клеток рассчитывали с использованием программного обеспечения L-CalcTM (StemCell Technologies Inc). Вкратце, исходя из статистики Пуассона, ровно одна раковая стволовая клетка существует среди известного числа инъецированных клеток, если у 37% животных не развиваются опухоли.
[00333] Для анализа маркеров клеточной поверхности, суспензию отдельных клеток опухоли маркировали антителами, непосредственно конъюгированными с флуорохромом, к ESA (Biomeda) и к CD44 (BD Biosciences). Мертвые клетки были исключены при помощи прижизненного красителя DAPI. Проточную цитометрию выполнили с использованием FACS Aria (Becton Dickinson). Профили разброса по сторонам и разброса вперед были использованы для удаления комочков клеток. Анализ опухолей, обработанных контрольными антителами, показал, что 64% от группы опухолей экспрессируют ESA и CD44 на высоком уровне (Фигура 39). Терапия иринотеканом существенно не повлияла на двойную положительную популяцию (double positive population) (55%), как показано на Фигуре 39, но терапия антителами 18R5 или терапия антителами 18R5 в сочетании с иринотеканом снижала двойную положительную популяцию (40% и 32% соответственно).
Влияние комбинированной терапии антителами 18R5 и гемцитабина на раковые стволовые клетки OMP-PN4 опухолей
[00334] Контроль и подвергшиеся терапии опухоли от исследования OMP-PN4 ксенотрансплантата, описанного выше (пример 7), были собраны после 41 дня терапии. Опухоли были обработаны и диссоциированы на отдельные клетки. Затем опухолевые клетки инкубировали с биотинилированными антителами мыши (CD45-биотин мыши, разбавление 1:200 и H2Kd-биотин крысы-мыши, разбавление 1:100, BioLegend, Сан-Диего, Калифорния) на льду в течение 30 минут с последующим добавлением стрептавидин-меченных магнитных бусин (Invitrogen, Карлсбад, Калифорния), чтобы удалить клетки мыши при помощи магнита. Клетки человека, оставшиеся в суспензии, собирали, подсчитывали и разводили до соответствующих доз клеток (30, 90, 270 и 810 клеток), смешивали со смесью буфера FACS с Матригелем в соотношении 1:1 и вводили подкожно NOD/SCID линии мышей (10 мышей на дозу клеток в опытной группе). Опухоли развивались в течение 75 дней, как показано на Фигуре 40. Каждая точка на рисунке 40 представляет объем опухоли отдельной мыши. Процент мышей с детектируемыми опухолями определяли во всех группах, которым вводили опухолевые клетки, обработанные антителами к FZD, и сравнивали с процентом мышей с детектируемыми опухолями в контрольной группе. Например, определяли число мышей с детектируемыми опухолями, которым вводили 810 контрольных клеток опухоли, и сравнивали с числом мышей с детектируемыми опухолями, которым вводили 810 клеток опухоли, обработанных антителами к FZD. Частоту возникновения опухолей использовали для подсчета частоты раковых стволовых клеток с использованием программного обеспечения L-CalcTM. Рассчитанные частоты раковых стволовых клеток для каждой из опытных групп показаны на Фигуре 41. Терапия только антителами 18R5 и терапия антителами 18R5 в сочетании с гемцитабином снижала частоту раковых стволовых клеток, в то время как терапия только гемцитабином не оказывала эффекта.
Пример 9
Продукция антител к FZD
Продукция антигена
[00335] Фрагменты рекомбинантного полипептида внеклеточного домена (ECD) или Fri домена (Fri) рецепторов человека FZD (FZDs) были использованы в качестве антигенов для производства антител. Для выделения последовательностей ДНК, кодирующих аминокислотные последовательности доменов интереса рецептора или рецепторов "frizzled" человека, использовали стандартные способы генной инженерии. Эти последовательности ДНК соединяли в рамке считывания в качестве N-концевых как с Fc-тэгом или гистидиновым-тэгом и клонировали в плазмидный вектор переноса для бакуловирус-опосредованной экспрессии в клетках насекомых. Для получения рекомбинантных клеток насекомых, экспрессирующих соответствующие полипептиды FZD, использовали стандартные способы трансфицирования, инфицирования и протоколы культивирования клеток (O'Reilley et al., Baculovirus expression vectors: A Laboratory Manual, Oxford: Oxford University Press (1994).
[00336] Белковый антиген очищали от среды, содержащей клетки насекомых, с использованием белка А и Ni +- хелат афинной хроматографии. Очищенный белковый антиген белок подвергали диализу в PBS (pH=7), концентрировали до примерно 1 мг/мл и подготавливали для иммунизации путем стерильной фильтрации.
Иммунизация
[00337] Мышей иммунизировали очищенным белковым антигеном FZD по стандартной методике. Примерно через 70 дней после первичной иммунизации кровь отдельных мышей проверяли методами твердофазного ИФА и FACS-анализа (подробно описаны ниже)для обнаружения антигена. Двое животных с высоким титром антител были выбраны для окончательного производства антигена, после чего выделяли клетки селезенки для получения гибридомы. Клетки гибридомы высевали по 1 клетке на лунку в 96-луночный планшет; супернатант из каждой лунки анализировали способом твердофазного ИФА и FACS-анализом с антителами к белковому антигену. Несколько гибридом с высоким титром антител были отобраны и перенесены в культуральный сосуд. Антитела очищали от гибридомного супернатанта с использованием белок А или белок G агарозной хроматографии. Очищенные моноклональные антител снова проверяли FACS-анализом и изотипировали для IgG и IgM антител.
Картирование эпитопа
[00338] Для выявления антител, которые специфично узнают внеклеточный домен белка FZD, в том числе цистеин-обогащенный домен, провели картирование эпитопа. Экспрессионные плазмидные векторы млекопитающих, содержащие промотор CMV перед последовательностью ДНК, кодирующей фрагменты внеклеточного домена FZD, были получены при помощи стандартных способов генной инженерии. Затем рекомбинантные белки экспрессировали в культуре клеток млекопитающих путем временной трансфекции. Через период от двадцати четырех до 48 часов после трансфекции клетки собирали; белки клеточного лизата разделяли при помощи SDS-PAGE акриламидного геля для иммуноблоттинга с антителами, полученными от мышей, иммунизированных антигеном FZD. Антитела, которые узнавали лиганд-связывающий домен FZD, в дальнейшем можно проанализировать на конкурентное связывание с белками Wnt способом твердофазного ИФА.
[00339] Чтобы определить специфичные эпитопы, узнаваемые антителами к FZD, в составе внеклеточного домена, использовали SPOTs-систему (Sigma Genosys, Вудлендс, ТХ). Синтезировали серию линейных пептидов, из 10 остатков аминокислот каждый, перекрывающихся на одну аминокислоту и охватывающих весь внеклеточный домен FZD, и ковалентно связывали данные пептиды с целлюлозой мембраны по способу синтеза SPOT. Мембрану инкубировали в течение 8 часов при комнатной температуре с блокирующим буфером и гибридизовали с антителами в течение ночи при 4°C. Затем мембрану промывали, инкубировали с вторичными антителами, конъюгированными с пероксидазой хрена (HRP) (Amersham Bioscience, Piscataway, NJ), вновь промывали, и визуализировали путем нанесения раствора-проявителя сигнала, содержащего 3-амино-9-этилкарбазол. Таким образом, были определены специфичные эпитопы, узнаваемые антителами. ФСК-анализ
[00340] Для отбора моноклональных антител, вырабатываемых клонами гибридом, которые узнают нативный белок FZD поверхности клетки, был применен ФСК-анализ. PIEK293 клетки трансфицировали либо только экспрессионным вектором, кодирующим клон полноразмерной кДНК белка FZD, либо совместно с вектором, экспрессирующим GFP. Эпитоп-тэг FLAG можно присоединить к N-концу, что позволит подтвердить экспрессию меченых рецепторов FZD на поверхности клетки. От двадцати четырех до 48-часов после трансфекции клетки собирали в суспензию клеток и инкубировали на льду с антителами к FZD, антителами к FLAG, с иммунной сывороткой (для FZD5-экспрессирующих клеток) или с контрольными антителами IgG для выявления неспецифического связывания антител. Клетки промывали, первичные антитела визуализировали вторичными антителами против иммуноглобулинов мыши, конъюгированными с флуоресцентным хромофором. Затем меченые клетки сортировали способом FACS для выявления антител к FZD, которые специфично узнают соответствующие рецепторы FZD на поверхности клеток. Были выявлены антитела, которые узнают изучаемые рецептор(ы) "frizzled" человека. Химерные антитела
[00341] После того, как были выявлены моноклональные антитела, которые специфично узнают рецепторы FZD, эти антитела были изменены, чтобы преодолеть иммунный ответ человеческих антител на иммуноглобулины мыши (НАМА), поскольку антитела грызунов используются как терапевтические агенты. Вариабельные области тяжелой цепи и легкой цепи выбранных моноклональных антител получали из клеток гибридомы способом RT-PCR и соединяли в рамке считывания с тяжелой цепью или легкой цепью каппа константой области IgG1 человека в экспрессионных векторах млекопитающих. Дополнительно, использовали экспрессионный вектор Ig человека, например, ТСАЕ 5, 3, который содержит тяжелую цепь и легкую цепь каппа константной области IgG1 человека в составе одной плазмиды (Preston et al., 1998, Infection & Immunity 66:4137-42). Экспрессионные вектора, кодирующие химерные тяжелые и легкие цепи, совместно трансфицировали в клетки яичника китайского хомячка (СНО) для продукции химерных антител. Иммунореактивность и афинность химерных антител сравнивали с мышиными антителами способами твердофазного ИФА и FACS-анализа.
Гуманизированные антитела
[00342] Поскольку терапевтические химерные антител часто остаются антигенными, вызывая иммунный ответ человека на химерные антитела (НАСА), следовало подвергнуть гуманизации химерные антитела к рецепторам FZD. Для того чтобы получить гуманизированные антитела, ключевые аспекты мотивов определения специфичности антител, в том числе потенциальные элементы от трех коротких гипервариабельных последовательностей, или области комплементарности (CDR), и/или области рамки, необходимые для правильного определения областей CDR вариабельных доменов тяжелых и легких цепей антител, описанных выше, были встроены с использованием способов генной инженерии в последовательности генов зародышевой линии клеток, кодирующих тяжелые и легкие цепей антител, соответственно, а затем клонированы в экспрессионный вектор млекопитающих для экспрессии в клетках СНО. Иммунореактивность и афинность гуманизированных антител сравнивали с химерными антителами способами твердофазного ИФА и FACS-анализа. Дополнительно, сайт-направленный мутагенез или мутагенез высокой плотности вариабельной области можно использовать для повышения специфичности, афинности и т.д. гуманизированных антител.
Антитела человека
[00343] В некоторых вариантах реализации, антитела человека, которые специфично узнавали внеклеточный домен рецептора FZD, изолировали с использованием способа фагового дисплея. Библиотеку фагового дисплея антител, содержащую вариабельные домены антител человека и демонстрирующую одиночные цепи Fv или Fab области, проверяли на специфичное и высокоафинное узнавание антигена рецептора FZD, описанного выше. Выявленные последовательности вариабельных областей антитела переносили в экспрессионный вектор Ig, содержащий тяжелую цепь и легкую цепь каппа IgG1 человека для экспрессии человеческих антител в клетках СНО.
Пример 10
Производство антител, которые узнают специфичные эпитопы
Моноклональные антитела из гибридом
[00344] В некоторых вариантах реализации, антитела, узнающие функциональные эпитопы рецепторов FZD, получали путем иммунизации мышей одним или несколькими антигенами рецепторов FZD. Мышей иммунизировали очищенным белковым антигеном FZD по стандартной методике. В некоторых вариантах реализации мышей иммунизировали последовательно различными антигенами рецептора FZD. Примерно через 70 дней после первичной иммунизации анализировали кровь отдельных мышей. Животных с высоким титром антител к антигену FZD отбирали для окончательного производства антигена, после чего выделяли клетки селезенки для получения гибридомы. Клетки гибридомы высевали по 1 клетке на лунку в 96-луночный планшет; супернатант из каждой лунки анализировали методом твердофазного ИФА и методом проточной цитометрии. Для выявления моноклональных антител, которые узнают специфичные эпитопы, в том числе в пределах биологического сайта связывания (БСС) или в случае частичного совпадения с ним, супернатант клеток гибридомы анализировали как на связывание с антителами к изучаемым FZD, так и на отсутствие связывания с FZD, которые несут определенные замены аминокислотных остатков в пределах изучаемого специфичного эпитопа (т.е., БСС).
Антитела человека
[00345] Библиотека фагового дисплея может быть использована для выявления антител, которые узнают изучаемые эпитопы рецепторов FZD (например, эпитопы, общие для нескольких FZD, и/или эпитопы в пределах БСС или его части, или частичного совпадающие с ним). Например, Fri- домен выбранного FZD экспрессируется как рекомбинантный белок и покрывает соответствующую поверхность при 10 мкг/мл. Человеческая библиотека фагов была проведена через два или более раунда обогащения (см., например, Griffiths et al., EMBO J. 12:715-34). При необходимости последующие раунды пэннинга можно проводить с использованием различных белков FZD. По усмотрению, каждый раунд пэннинга мог быть проведен в присутствии ложных растворимых белков FZD, содержащие специфичные замены аминокислот в изучаемой области-мишени эпитопа (например, в том числе эпитопы в пределах биологического сайта связывания (БСС)). Индивидуальные клоны, прошедшие пэннинг, тестировали на способность связываться с изучаемым белком FZD методом твердофазного ИФА или методом проточной цитометрии; связывание с изучаемым эпитопом оценивали по отсутствию связывания с белками FZD, содержащими специфичные замены аминокислот в составе изучаемого эпитопа-мишени. Гены, кодирующие антиген-связывающий домен, выделяли из фагов и использовали для построения полной молекулы антитела человека путем соединения антиген-связывающего домена с константными областями для экспрессии в подходящей клеточной линии. Антитела выявляли и тестировали на способность предотвращать рост опухолевых клеток, как было описано ранее в данном документе.
Пример 11 Дополнительные тесты in vitro для оценки антител к рецепторам FZD
[00346] Этот пример описывает репрезентативные тесты in vitro для проверки активности полученных антител к рецептору FZD по отношении к пролиферации клеток, запуску путей и цитотоксичности.
Исследование пролиферации.
[00347] Экспрессию рецепторов FZD у различных раковых клеточных линий количественно оценивали методом Taqman. Клеточные линии, для которых была показана экспрессия рецепторов FZD, высевали по 104 клетки в каждую лунку 96-луночных культуральных микропланшетов и растили в течение 24 часов. Далее клетки культивировали в течение еще 12 часов в свежем DMEM-буфере с 2% FCS; в этот время к питательной среде добавляли BrdU в концентрации 10 мкмоль/л и антитела к FZD или контрольные антитела. После включения клетками BrdU питательную среду удаляли, а клетки фиксировали при комнатной температуре в течение 30 минут в этиловом спирте и инкубировали в течение 90 минут с моноклональными антителами к BrdU, конъюгированными с пероксидазой (клон BMG 6Н8, Fab фрагменты). Субстрат проявляли в растворе, содержащем тетраметилбензидина; реакцию останавливали после 15 минут 25 мкл H2SO4 в концентрации 1 моль/л. Интенсивность цветной реакции измеряли при помощи устройства автоматического считывания планшетов для твердофазного ИФА с использованием 450 нм фильтра (UV Microplate Reader; Bio-Rad Laboratories, Richmond, СА). Все эксперименты проводили в трехкратной повторности. Была определена способность антител к FZD подавлять пролиферацию клеток по сравнению с контрольными антителами.
Исследование запуска сигнальных путей
[00348] В некоторых вариантах реализации, способность антител к рецепторам FZD блокировать активацию сигнального пути, опосредованного Wnt, была определена in vitro. Например, HEK 293 клетки, культивируемые в среде DMEM с антибиотиками и 10% FCS, совместно трансфицировали 1) Wnt7B и FZD 10 экспрессионными векторами для активации сигнального пути через Wnt 2) TCF/Luc дикого типа или мутантным репортерным вектором, содержащим три или восемь копий TCF-связывающего домена перед репортерным генотм люциферазы светлячка для измерения уровней канонического сигнального пути через Wnt (Gazit et al., 1999, Oncogene 18:5959-66) и 3) репортером люциферазы морской фиалки (Promega; Madison, WI) в качестве внутреннего контроля эффективности трансфекции. Затем в культуральную среду добавляли антитела к FZD10 и контрольные антитела. Через сорок восемь часов после трансфекции измеряли уровни люциферазы с помощью двойного комплекта анализа люциферазы (Promega; Madison, WI); активность люциферазы светлячков нормировали по активности люциферазы морской фиалки. Три независимых эксперимента проводили в трехкратной повторности. Таким образом, была определена способность антител к FZD ингибировать запуск сигнального пути через Wnt.
Исследование комплемент-зависимой цитотоксичности
[00349J В некоторых вариантах реализации, для измерения комплемент-зависимой цитотоксичности (CDC), опосредованной антителами к рецепторам FZD, использовали раковые линии клеток, экспрессирующие рецепторы FZD, или раковые стволовые клетки, выделенные из образцов пациентов и размноженные как ксенотрансплантат в мышах с ослабленным иммунитетом. Клетки разводили в 200 мкл культуральной среды RPMI 1640 с добавлением антибиотиков и 5% FBS до 106 клеток/мл. Затем разведенные клетки смешивали с 200 мкл сыворотки, содержащей антитела к рецептору FZD или контрольные антитела, или с сывороткой, инактивированной нагреванием; эксперимент проводили в трех повторностях. Смесь клеток инкубировали от 1 до 4 часов при температуре 37°C в атмосфере 5% CO2. Затем обработанные клетки собирали, ресуспендировали в 100 мкл FITC-меченого аннексина V, разведенного в культуральной среде, и инкубировали при комнатной температуре в течение 10 минут.К клеткам добавляли сто микролитров раствора иодида пропидия (25 мкг/мл), разведенного в HBSS, и инкубировали в течение 5 минут при комнатной температуре. Клетки собирали, ресуспендировали в культуральной среде и анализировали способом проточной цитометрии. Способ проточной цитометрии позволяет определить общее количество клеток, окрашенных FITC; окрашивание мертвых клеток йодидом пропидия в процентах от общего количества клеток используется для оценки гибели клеток в присутствии сыворотки и антител к FZD по сравнению с сывороткой, инактивированной нагреванием и контрольными антителами. Таким образом, была определена способность антител к FZD опосредовать комплемент-зависимую цитотоксичность.
Исследование клеточной цитотоксичности, зависимой от антител.
[00350] Для оценки клеточной цитотоксичности, зависимой от антител (ADCC), опосредованной антителами к FZD, можно использовать раковые линии клеток, экспрессирующие рецепторы FZD, или раковые стволовые клетки, выделенные из образцов пациентов и размноженные как ксенотрансплантат в мышах с ослабленным иммунитетом. Клетки разводили в 200 мкл культуральной среды RPMI 1640 без фенола с добавлением антибиотиков и 5% FBS до 106 клеток/мл. Периферические мононуклеарные клетки крови () были выделены из гепаринизированной периферической крови путем центрифугирования в градиенте плотности Фиколл-Пак для использования в качестве клеток-эффекторов. Затем клетки-мишени (Т), смешивали с РВМС клетками-эффекторами (Е) при соотношениях Е/Т 25:1, 10:1 и 5:1 в 96-луночных планшетах в присутствии по крайней мере одного антитела к рецептору FZD или контрольного антитела. В качестве контроля клетки-мишени и клетки-эффекторы инкубировали раздельно в присутствии антител. Клеточные смеси инкубировали от 1 до 6 часов при температуре 37°C в атмосфере 5% CO2. Свободную лактатдегидрогеназу (ЛДГ), стабильный цитоплазматический фермент, образовавшийся после лизиса клеток, измеряли колориметрическим способом (CytoTox96 Non-radioactive Cytotoxicity Assay; Promega; Мэдисон, Висконсин). Данные по абсорбции при длине волны 490 нм получали со стандартного устройства для считывния 96-луночных планшетов и производили поправку на фон. Процент специфической цитотоксичности рассчитывали по формуле: % цитотоксичности = 100 × (экспериментальный выход ЛДГ - спонтанный выход ЛДГ из клеток-эффекторов - спонтанный выход ЛДГ из клеток-мишеней) / (максимальный выход ЛДГ из клеток-мишеней - спонтанный выход ЛДГ из клеток-мишеней). Таким образом, была определена способность антител к рецептору FZD опосредовать клеточную цитотоксичность, зависимую от антител.
Пример 12
Предотвращение роста опухоли in vivo с помощью антител к рецептору FZD
[00351] Этот пример описывает применение антител к рецепторам FZD для предотвращения роста опухоли на модели ксенотрансплантата. В некоторых вариантах реализации, опухолевые клетки образца, полученного от пациента (биопсия твердой опухоли или плевральный экссудат) и размноженные как ксенотрансплантат в мышах, подготавливали к пересадке экспериментальным животным. В стерильных условиях удаляли опухолевую ткань, разрезали на мелкие кусочки, размалывали стерильными лезвиями и получали суспензию отдельных клеток путем ферментативного расщепления и механического разрушения. В частности, клетки плеврального экссудата или кусочки результирующей опухоли смешивали с ультра-чистой коллагеназой III в культуральной среде (200-250 единиц коллагеназы на мл) и инкубировали при 37°C в течение 3-4 часов, пипетируя культуральную среду каждые 15-20 минут при помощи 10-мл пипетки. Расщепленные клетки фильтровали через 45 мкм нейлоновую сетку, промывали RPMI/20% FBS и промывали дважды HBSS. Диссоциированные опухолевые клетки затем вводили подкожно в жировое тело молочной железы NOD/SCID мышей, чтобы вызвать рост опухоли.
[00352] В некоторых вариантах реализации, диссоциированные опухолевые клетки сначала разделяли на туморогенные и нетуморогенные на основе маркеров клеточной поверхности до их введения экспериментальным животным. В частности, опухолевые клетки диссоциированные, как было описано выше, дважды промывали буферным солевым раствором Hepes (HBSS), содержащим 2% инактивированной нагреванием телячьей сыворотки (HICS), и разводили по 106 клеток на 100 мкл. После добавления антител клетки инкубировали в течение 20 минут на льду, а затем два раза промывали HBSS/2% HICS. Использовали следующие антитела: против ESA (Biomeda, Foster City, СА), против CD44, против CD24, и против маркеров линий CD2, CD3, CD10, CD16,CD18, CD31, CD64, и CD-140B (совместно называемые Lin; PharMingen, San Jose, СА). Антитела были непосредственно конъюгированны с флуорохромами и предназначались для позитивного и негативного отбора клеток, экспрессирующих эти маркеры. Мышиные клетки удаляли путем выбора H2Kd + клеток, а мертвые клетки удаляются с помощью прижизненного красителя 7AAD. Проточную цитометрию проводили на FACSVantage (Becton Dickinson, Franklin Lakes, NJ). Профили разброса по сторонам и разброса вперед были использованы для удаления комочков клеток. Выделенные ESA+, CD44+, CD24-/low, Lin-туморогенные клетки затем вводили подкожно NOD / SCID мышам, чтобы вызвать рост опухоли.
[00353] В качестве примера, антитела к FZD анализировали на их способность к уменьшению роста опухолевых клеток. Диссоциированные опухолевые клетки (10000 в расчете на одно животное) вводили подкожно в подвздошную область 6-8 недельным NOD/SCID мышам. Начиная со второго дня после введения опухолевых клеток, животным вводили внутрь брюшной полости (ВБ) антитела к FZD 10 мг/кг два раза в неделю. Рост опухоли проверяли еженедельно, пока опухоль не становилась детектируемой, после чего рост опухоли измеряли дважды в неделю в течение 8 недель. Таким образом, было выявлено, что антитела, связывающиеся с FZD, значительно снижали рост опухоли по сравнению с PBS. введенным в качестве контроля.
Пример 13
Терапия опухолей in vivo с использованием антител к рецептору FZD
[00354] Этот пример описывает использование антител к рецептору FZD для терапии опухолей на модели ксенотрансплантата. В некоторых вариантах реализации, опухолевые клетки образца, полученного от пациента (биопсия твердой опухоли или плевральный экссудат) и размноженные как ксенотрансплантат в мышах, подготавливали к пересадке экспериментальным животным. В стерильных условиях удаляли опухолевую ткань, разрезали на мелкие кусочки, размалывали стерильными лезвиями и получали суспензию отдельных клеток путем ферментативного расщепления и механического разрушения. Чтобы вызвать рост опухоли, диссоциированные опухолевые клетки затем вводили подкожно NOD/SCID мышам либо в жировое тело молочной железы, чтобы вызвать рак груди, либо в подвздошную область, чтобы вызвать другие виды рака. Как альтернатива, туморогенные опухолевые клетки ESA+, CD44+, CD24-/low, Lin- выделяли и вводили, как описано выше.
[00355] После введения опухолевых клеток, животных проверяли на рост опухоли. Как только опухоли достигали среднего размера примерно от 150 до 200 мм3, начинали терапию антителами. Каждому животному внутрь брюшной полости вводили 100 мкг антител к рецептору FZD или контрольных антител от двух до пяти раз в неделю в течение 6 недель. Размер опухоли оценивали два раза в неделю в течение этих 6 недель. Таким путем определяли способность антител к рецептору FZD предотвращать дальнейший рост опухоли или уменьшать размер опухоли по сравнению с контрольными антителами.
[00356] В конце срока терапии антителами опухоли собирали для дальнейших исследований. В некоторых вариантах реализации часть опухоли анализировали способом иммунофлуоресценции для оценки степени проникновения антител в опухоль и ответ опухоли. Часть каждой собраной опухоли от мышей, которых лечили антителами к рецептору FZD или контрольными антителами, немедленно замораживали в жидком азоте, заключали в О.С.Т, и разрезали на криостате на срезы толщиной 10 мкм, срезы монтировали на предметные стекла. В некоторых вариантах реализации, часть каждой опухоли фиксировали в формалине, заключали в парафин и получали серийные срезы по 10 мкм толщиной при помощи микротома, срезы монтировали на предметные стекла. Срезы после проводки инкубировали с антителами, меченными хромофором, которые специфично узнают введенные антитела для выявления антител к рецептору FZD или контрольных антител, присутствующих в биоптате опухоли. Кроме того, антитела, которые обнаруживают различные опухолевые и вовлеченные в опухолеобразование типы клеток, такие как, например, антитела к VE кадгерину (CD 144) или к РЕСАМ-1 (CD31) для выявления эндотелиальных клеток сосудов, антитела к альфа-актину гладких мышц для выявления гладкомышечных клеток сосудов, антитела к Ki67 для выявления пролиферирующих клеток, TUNEL тест для выявления гибнущих клеток, антитела к Р-катенину для выявления сигнального пути через Wnt и антитела к внутриклеточному домену (ICD) фрагмента Notch для обнаружения сигнального пути через Notch, могут использоваться для оценки последствия терапии антителами, например, ангиогенеза, рост опухоли и морфологии опухоли.
[00357] В некоторых вариантах реализации также оценивали влияние терапии антителами к рецептору FZD на экспрессию генов опухолевой клетки. Тотальную РНК выделяли из части каждой собраной опухоли от мышей, которых лечили антителами к рецептору FZD или контрольными антителами, и использовали для количественного RT-PCR. Уровни экспрессии рецепторов FZD, компонентов сигнального пути через Wnt, включая, например, Wnt1 и Р-катенин, а также ранее выявленных маркеров раковых стволовых клеток (например, CD44) анализировали относительно уровня экспрессии гена домашнего хозяйства GAPDH, использованного в качестве внутреннего контроля. Таким образом, были выявлены изменения в экспрессии генов опухолевых клеток после терапии антителами к рецептору FZD.
[00358] Дополнительно, оценивали влияние терапии антителами к рецептору FZD на частоту раковых стволовых клеток в опухоли. Образцы опухолей от мышей, подвергшихся терапии антителами к рецептору FZD или контрольными антителами, разрезали на мелкие кусочки, размалывали стерильными лезвиями и получали суспензию отдельных клеток путем ферментативного расщепления и механического разрушения. Затем диссоциированные опухолевые клетки тестировали с помощью FACS-анализа на наличие онкогенных раковых стволовых клеток на основе ESA+, CD44+, CD24-/мало, Lin-маркеров экспрессии клеточной поверхности по методике, подробно описанной выше.
[00359] Таким образом, стало возможным изучить онкогенность клеток, выделенных на основе экспрессии ESA+, CD44+, CD24-/мало, Lin-, после терапии антителами к рецептору FZD. Раковые стволовые клетки ESA+, CD44+, CD24-/мало, Lin, полученные от мышей, подвергшихся терапии антителами к рецептору FZD или контрольными антителами, повторно вводили NOD/ SCID мышам в жировое тело молочной железы. Таким образом, онкогенность раковых стволовых клеток была определена в зависимости от числа введенных клеток, необходимых для последующего формирования опухоли.
Пример 14 Выявление генной сигнатуры Wnt
[00360] Эксперименты проводили с целью определить группу генов, экспрессия которых специфична для запуска сигнального пути, опосредованного Wnt, в опухолях толстой кишки человека.
Блокировка роста опухоли путем сверхэкспрессии аксина.
[00361] Аксин является важным регулятором канонического пути Wnt. Он входит в многокомпонентный белковый комплекс, который запускает деградацию р-катенина, таким способом предотвращая активацию сигнального пути в отсутствие Wnt. Этот эффект устраняется Wnt, который удаляет аксин из комплекса деградации, тем самым позволяя перемещение р-катенина и TCF-опосредованную активациию специфических генов-мишеней. Как сверхэкспрессия экзогенного аксина, так и экспрессия доминантной негативной усеченной формы TCF (DNTCF4) представляют собой хорошо известные меры для блокирования сигнального пути, опосредованного Wnt.
[00362] Мы показали, что лентивирус-опосредованная сверхэкспрессия аксина полностью блокирует рост UM-PE13 и UM-Т3 опухолей молочной железы, а также рост ОМР-С11 и С17-ОМР опухолей толстой кишки у NOD/SCID мышей. Стабильная экспрессия DNTCF4 в UM-Т3 опухолевых клетках оказывала такой же эффект. При совместном рассмотрении, эти данные показывают, что внутриклеточная блокада Wnt может отрицательно влиять на развитие различных видов опухолей, что позволяет рассматривать сигнальный путь через Wnt как важную мишень для лечения рака молочной железы и рака толстой кишки.
[00363] Сигнальный путь, опосредованный Wnt, постоянно активен во многих типах опухолей. В большинстве опухолей толстой кишки эта активации связана с мутацией, приводящей к формированию усеченной формы АРС, или мутацией, активирующей С-катенин. Такие мутации не описаны для других тканей, в которых сигнальный путь через Wnt может запускаться другим набором мутаций или по аутокринному механизму. Блокирование сигнального пути через Wnt путем применения внеклеточных средств, таких как антитела или другие растворимые белки-ингибиторы, должно влиять на развитие опухолей, в которых сигнальный путь через Wnt продолжает реагировать на аутокринные стимулы. Выявление таких Wnt-зависимых опухолей могло бы быть полезным при разработке агентов против Wnt и при определении типов опухолей для их лечения.
[00364] По данным иммунногистохимии, большинство ОМР-С11 опухолевых клеток экспрессируют цитоплазматический/ядерный р-катенин на высоком уровне, что позволяет предположить постоянную активацию сигнального пути через Wnt в этом типе опухоли. Эти данные подтвердила детекция высокого уровня р-катенина в ОМР-С11 способом иммунноблотинга. Сочетание постоянной активации пути через Wnt и чувствительности к сверхэкспрессии аксина делает ОМР-С11 подходящими опухолями для изучения регуляции экспрессии генов в ответ Wnt и на блокирование Wnt, а также для выявления генной сигнатуры Wnt.
Анализ дифференциальной экспрессии генов в ответ на сверхэкспрессию аксина при помощи микрочипов.
[00365] Дифференциальную экспрессию генов после терапии аксином опухолевых клеток ОМР-С11 толстой кишки определяли при помощи микрочипов.
[00366] В качестве источника опухолевых клеток толстой кишки использовали только что извлеченные из NOD/SCID мышей (модель опухоловего ксенотрансплантата) опухоли толстой кишки человека ОМР-С11. Были созданы два лентивирусных вектора для доставки экспрессионной кассеты конститутивной конструкции аксин-IRES-GFP и контрольной экспрессионной кассеты IRES-GFP, которые были обозначены как LOM91 и LOM92, соответственно.
[00367] ОМР-С11 опухоли гомогенизировали до суспензии отдельных клеток и затем удаляли клетки мыши. Lin-обедненные клетки инфицировали LOM91 (с аксином) или 92 (контрольным) лентивирусными векторами с использованием коэффициента множественности инфекции 2,5, поддерживали в культуре в течение 3-4 дней и отбирали по экспрессии GFP. Суммарную РНК выделяли из каждого образца отобранных клеток.
РНК была проанализирована на микрочипе GeneChip® Human Genome U133 Plus 2.0 (Affymetrix, Санта-Клара, штат Калифорния). Эксперимент был повторен дважды.
[00368] Генную сигнатуру, включающую основной набор генов, регулируемых сигнальным путем через Wnt, получили на основе анализа генов, которые дифференциально экспрессируются после терапии аксином и которые корреллируют с экспрессией аксина2 в ряде образцов доброкачественных и злокачественных опухолей толстой кишки. Гены, экспрессия которых снижалась в ответ на сверхэкспрессию аксина в эксперименте с микрочипами (см. выше), были идентифицированы как гены интереса. Главным критерием для отбора генов было снижение экспрессии на 50% или более по сравнению с экспрессией в образцах со сверхэкспрессией аксина 1 или с контрольными образцами (log2 коэффициент образцов со сверхэкспрессией Аксина 1 по сравнению с контрольными образцами должен быть -1 или меньше), показатель T-теста р менее 0,1. Поскольку Аксин 1 известен как ингибитор пути через Wnt, гены, ингибируемые сверхэкспрессией Аксина 1, являются прямыми или косвенными мишенями пути через Wnt. В дальнейшем из набора выявленных генов были отобраны гены, которые показали высокую корреляцию (значение корреляции >0,3) с аксином 2 среди множества образцов злокачественных опухолей толстой кишки/кишечника/других тканей пищеварительного тракта (всего 232 образца). Поскольку аксин 2 известен как мишень пути через Wnt, гены с паттернами экспрессии, сходными с аксином 2, вероятно, также будут мишенями пути через Wnt. В данном исследовании была определена генная сигнатура для пути Wnt (Таблица 6). Уровни экспрессии данной группы генов можно использовать для оценки нарушений сигнального пути через Wnt отдельных образцов опухоли или различных типов опухолей.


Пример 15
Лечение рака человека с применением антител к рецептору FZD
[00369] Этот пример описывает способы лечения рака с применением антител к рецепторам FZD для маркирования опухолей, содержащих раковые стволовые клетки и/или опухолевые клетки, в которых была обнаружена экспрессия рецепторов FZD, и/или опухолевые клетки, содержащие какой-либо ген из группы генов, отвечающих за ингибирование сигнального пути через Wnt (например, генная сигнатура Wnt из Примера 14).
[00370] Наличие маркера раковых стволовых клеток или рецептора FZD или экспрессии одного или нескольких генов из группы генов, необходимых для пути через Wnt, в первую очередь, можно определить по биоптату опухоли. Опухолевые клетки удаляли в стерильных условиях из биоптата, полученного у пациента с диагнозом рак. В некоторых вариантах реализации биоптаты тканей замораживали в жидком азоте, заключали в О.С.Т и получали срезы толщиной 10 мкм при помощи криостата; срезы монтировали на предметные стекла. В некоторых вариантах реализации, биоптаты тканей фиксировали в формалине, заключали в парафин и получали срезы толщиной 10 мкм при помощи микротома; срезы монтировали на предметные стекла.
[00371] Для обнаружения экспрессии белка FZD, срезы инкубировали с антителами к рецептору FZD. Дополнительно, срезы можно проанализировать на наличие одного или нескольких генов из генной сигнатуры Wnt, как описано в Примере 14.
[00372] Наличие раковых стволовых клеток также можно определить. Образцы биоптатов тканей разрезали на мелкие кусочки, размалывали стерильными лезвиями и получали суспензию отдельных клеток путем ферментативного расщепления и механического разрушения. Затем диссоциированные опухолевые клетки инкубировали с антителами к ESA, CD44, CD24, Lin- и FZD для выявления раковых стволовых клеток; наличие ESA+, CD44+, CD24-/low, Lin-, FZD+ опухолевых стволовых клеток определяли с помощью проточной цитометрии по методике, подробно описанной выше.
[00373] Терапию пациентов с раком антителами к рецептору FZD начинали, если в опухоли детектировали экспрессию рецептора FZD и/или одного или нескольких генов генной сигнатуры Wnt. В некоторых вариантах реализации, гуманизированные или моноклональные антитела человека к рецептору FZD, полученные как описано выше, очищали и смешивали с подходящей средой для лекарственных препаратов. В некоторых вариантах реализации, пациентам вводили антитела к FZD по меньшей мере один раз в месяц в течение по меньшей мере 10 недель. В некоторых вариантах реализации, пациентам вводили антитела к FZD не реже одного раза в неделю в течение по меньшей мере примерно 14 недель. Каждое введение антител должно было быть фармацевтически эффективной дозой. В некоторых вариантах реализации вводили примерно от 2 до 100 мг/мл антител к FZD. В некоторых вариантах реализации вводили примерно от 5 до 40 мг/мл антител к FZD. Антитела можно вводить до, одновременно или после стандартных схем лучевой терапии или схем химиотерапии с использованием одного или нескольких химиотерапевтических агентов, таких как оксалиплатин, флуороурацил, лейковорин или стрептозоцин. Пациентов наблюдали, чтобы определить, приводит ли терапия такого рода к противоопухолевому ответу, например, на основе регрессии опухоли, уменьшении случаев возникновения новых опухолей, снижению экспрессии опухолевых антигенов, снижению числа раковых стволовых клеток, или других средств оценки прогноза заболевания.
Пример 16
Дифференцировка клеток опухоли поджелудочной железы после терапии антителами 18R5 и гемцитабином.
Анализ экспрессии генов обработанных опухолевых клеток поджелудочной железы, методом количественного ПЦР (Q-PCR)
[00374] Ксенотрансплантаты опухоли PN4, обработанные либо контрольными антителами, либо антителами 18R5 IgG, гемцитабином, или комбинацией гемцитабина и 18R5 антител IgG, как описано выше (Пример 7), были проанализированы на уровень экспрессии хромогранина A (CHGA) методом количественного ПЦР. CHGA описан как маркер нейроэндокринной дифференцировки различных опухолей, включая рак груди, толстой кишки, легких и опухолей поджелудочной железы; было установлено, что повышенная экспрессия CHGA в опухолях поджелудочной железы коррелирует с более высокой выживаемостью (Tezel et al. 2000. Cancer 89, 2230-6).
[00375] Тотальную РНК выделяли из 5 опухолей каждой группы опыта с ксенотрансплантатом PN4 и оценивали путем ПЦР, совмещенной с обратной транскрипцией (RT)-ПЦР проводили с использованием инвентаризованных зондов Applied Biosystems Taqman® в соответствии со стандартными протоколами. Пара зонд-праймер (Hs00154441_m1), используемая для анализа CHGA, включала зонд, меченый красителем FAM, и следующий праймер: 5′-CGCTCTCCAAGGCGCCAAGGAGAGG-3′ (SEQ ID NO: 75). GUS В был использован в качестве внутреннего контроля. Вкратце, RT проводили при 48°C в течение 30 минут, начальную денатурацию при 95°C в течение 10 мин, затем проводили 40 циклов, денатурация при 95°C в течение 15 секунд, синтез при 60°C в течение 1 мин; рост сигнала/включение флуоресцентных зондов наблюдали в режиме реального времени.
[00376] Уровень экспрессии маркера бэта-клеток островка CHGA был значительно увеличен только в образцах из мышей, которых лечили гемцитабином и 18R5. Опухоли из групп, которых обрабатывали контрольными антителами, только 18R5 или только гемцитабином, показали сходные уровни РНК, соответствующей CHGA, в то время как опухоли из комбинированной группы показали явное усиление экспрессии CHGA. Уровни CHGA были повышены в 10 раз и в 7 раз в двух экспериментах, в которых в опухоли обрабатывали 18R5 и гемцитабином. Результаты типичного эксперимента представлены на Фигуре 42.
Анализ экспрессии генов обработанных опухолевых клеток поджелудочной железы, методом иммуногистохимии.
[00377] Повышенную экспрессию CHGA изучали также на уровне белка методом иммуногистохимии на срезах ткани, приготовленных из обработанных опухолей (данные не приведены). Опухоли, обработанные контрольными антителами, показали интенсивное окрашивание небольшого числа клеток, разбросанных по опухоли. Опухоли, обработанные только 18R5 или только гемцитабином, экспрессировали CHGA на том же уровне, что и контрольные. Напротив, опухоли, обработанные сочетанием 18R5 и гемцитабина, показали увеличение числа CHGA-положительных клеток, в соответствии с повышенной экспрессией РНК, детектированной методом количественной ПЦР. Окрашивание алъциановым синим и антителами к ki67.
[00378] Другой характеристикой эндокринных, секреторных клеток и клеток протоков является синтез слизи, так что эти клетки могут быть обнаружены при окрашивании альциановым синим (van Es et al. 2005. Nature 435 959-63). В процессе сбора и обработки опухолей было отмечено, что опухоли, обработанные 18R5, гораздо более слизистые по сравнению с контрольными. Таким образом, срезы опухолей PN4 от мышей, которым давали контрольные антитела, только гемцитабин, только 18R5, или комбинацию 18R5 и гемцитабина, окрашивали альциановым синим. Опухоли, обработанные 18R5, показали более интенсивное окрашивание альциановым синим как в случае обработки только 18R5, так и в группе комбинации 18R5 и гемцитабина, относительно контрольной группы и группы с только гемцитабином (данные не приведены).
[00379] Увеличение содержания муцинозных клеток также было отмечено для второй опухолевой линии, PN13, после обработки 18R5 или контрольными антителами (Фигура 43). В этом эксперименте мышей с опухолями PN13 обрабатывали, как описано выше (Пример 7). Срезы опухолей окрашивали альциановым синим для выявления слизистых клеток, а также окрашивали антителами к Ki67 методом иммуногистохимии, чтобы выявить пролиферирующие клетки. Результаты показали, что терапия 18R5 привела к значительному увеличению числа муцинозных клеток, окрашиваемых альциановым синим. Кроме того, частота Ki67-положительных клеток сокращалась при терапии 18R5. Интересно, что не было перекрытия между Ki67-положительными клетками и муцинозными клетками; это позволяет предположить, что слизистые клетки не пролиферируют. Результаты данного эксперимента свидетельствуют, что терапия 18R5 способствует дифференцировке опухолевых клеток в непролиферирующее потомство.
[00380] Таким образом, повышение экспрессии CHGA, усиление синтеза слизей, о чем свидетельствует окрашивание альциановым синим, и производство непролиферирующего потомства, о чем свидетельствует меченье антителами к Ki67, согласуются с моделью, по которой ингибирование сигнального пути через Wnt-FZD путем терапии 18R5, способствует дифференцировке опухолевых клеток поджелудочной железы в несколько различных типов клеток с особенностями, характерными для непролиферирующих дифференцированных клеток.
Пример 17
Дополнительные исследования in vivo эффективности 18R5 в отдельности и/или в сочетании с другими противоопухолевыми агентами.
Влияние на рост ксенотрансплантата опухоли ОМР-L1124
[00381] Изучали эффективность 18R5 антител к FZD, как в отдельности, так и в сочетании с Таксолом® (паклитакселом), в подавлении роста OMP-LU24 опухолей легких человека in vivo.
[00382] 50000 опухолевых клеток легких OMP-LU24 человека вводили подкожно NOD-SCID мышам. Опухоли растили в течение 27 дней, пока они не достигли среднего объем 143 мм3. Животных случайным образом разделили на 4 группы (по 9 животных на группу) и проводили терапию либо контрольными антителами («контрольные антитела»), либо антителами 18R5 к FZD ("18R5"), либо паклитакселом (Таксол®), либо комбинацией 18R5 и паклитаксела ("18R5+Таксол). Опухоли были измерены в дни, указанные на Фигуре 44. Антитела вводили в дозе 10 мг/кг внутрь брюшной полости (IP), один раз в неделю; Таксол® вводили в дозе 15 мг/кг, внутрь брюшной полости, раз в неделю.
[00383] Результаты приведены на Фигуре 44. Было отмечено, что терапия антителами к FZD сокращает рост опухоли, а комбинированная терапия показывает усиление противоопухолевой активности по сравнению с только Таксолом®. Влияние на рост ксенотрансплантата опухоли OMP-LU33.
[00384] Также in vivo определяли влияние 18R5 антител к FZD на подавление роста опухолей легких человека OMP-LU33, как самостоятельно, так и в сочетании с Авастином® (бевацизумабом).
[00385] 10000 опухолевых клеток легких OMP-LU33 человека вводили подкожно
NOD-SCID мышам. Опухоли растили в течение 30 дней, пока они не достигли среднего объем 124 мм3. Животных случайным образом разделили на 4 группы (по 10 животных на группу) и проводили терапию либо контрольными антителами (квадраты), либо Авастином® (треугольники острием вниз), либо антителами 18R5 к FZD (треугольники острием вверх), либо комбинацией 18R5 и Авастина® (круги). Опухоли были измерены в дни, указанные на Фигуре 45. Антитела вводили в дозе 10 мг/кг внутрь брюшной полости (ВБ), два раза в неделю.
[00386] Результаты представлены на Фигуре 45. Было показано, что терапия антителами к FZD сокращает рост опухоли, а комбинированная терапия показывает усиление противоопухолевой активности по сравнению с только Авастином®.
Влияние на рост ксенотрансплантата опухоли Т3
[00387] Также in vivo определяли влияние 18R5 антител к FZD на подавление роста HER2-положительных Т3-опухолей молочной железы человека, как самостоятельно, так и в комбинации с Герцептином® (трастузумабом).
[00388] 50000 опухолевых клеток молочной железы Т3 человека вводили подкожно NOD-SCID мышам. Опухоли растили в течение 32 дней, пока они не достигли среднего объем 125 мм3. Животных случайным образом разделили на 4 группы (по 10 животных на группу) и проводили терапию либо контрольными антителами (квадраты), либо антителами 18R5 к FZD (треугольники), либо Герцептином® (маленькие закрашенные кружки), либо комбинацией 18R5 и Герцептина® (не закрашенные круги). Опухоли были измерены в дни, указанные на Фигуре 46. Антитела вводили в дозе 10 мг/кг внутрь брюшной полости (IP), два раза в неделю.
[00389] Результаты представлены на Фигуре 46. Было показано, что терапия антителами к FZD сокращает рост опухоли, а комбинированная терапия показывает усиление противоопухолевой активности по сравнению с только Герцептином®.
Пример 18
Последовательности антител к FZD
[00390] Тяжелая и легкая цепи CDR-участков антител к FZD представлены, соответственно, в Таблицах 7 и 8, ниже. Вариабельные области (VH) тяжелой цепи и вариабельные области легкой цепи (VL) антител к FZD и их кодирующие последовательности представлены в Таблице 9, ниже. Аминокислотные и нуклеотидные последовательности VH и VL, перечисленных в таблице 9, представлены на Фигурах 13-15 или Таблицах 10 и 11, ниже. Последовательности, кодирующие тяжелую или легкую цепи антител к FZD, представлены на Фигурах 14-15 или в Таблице 12, ниже.











[00391] Плазмиды, выделенные из культуры E.coli и кодирующие антитела к FZD IgG 18R4605 (номер доступа АТСС РТА-10307), 18R4805 (номер доступа АТСС РТА-10309) и 44R24 (номер доступа АТСС РТА-10311), были внесены в Американскую коллекцию типовых культур (АТСС), 10801, 10801 University Boulevard, Manassas, VA, USA на условиях Будапештского договора от 26 августа 2009 года.
Пример 19
Профили связывания антител к FZD.
[00392] Для характеристики профилей связывания моноклональных антител к FZD с FZD1, 2, 5, 7 и 8 применяли ФСК-анализ.
[00393] Клетки НЕК293 были совместно трансфицированы плазмидной ДНК, экспрессирующей полную последовательность FZD1, 2, 5, 7 или 8, а также другой плазмидой, экспрессирующей репортерный ген GFP, который использовали как маркер трансфекции. Fugene 6 (Roche) использовали в качестве реагента трансфекции в соответствии с рекомендациями производителя. Трансфицированные клетки инкубировали от двадцати четырех до сорока восьми часов при 37°C в 5% CXb. Затем моноклональные антитела к FZD разводили до конечного объема 50 мкл, начиная с концентрации 20 мкг/мл и серийно разводили с 4-кратным шагом до 8 разведений в общей сложности. Каждый пул временных трансфектантов FZD/GFP 293 был собран в виде суспензии; тестировали 100.000 трансфицированных клеток путем инкубирования на льду в течение 30-60 минут с разведенными моноклональными антителами к FZD. Клетки промывали, связанные антитела к FZD были визуализированы путем нанесения с вторичных антител к иммуноглобулинам человека, меченных флуоресцентным хромофором. Затем меченые клетки были выявлены и подсчитаны путем FACS-анализа. Полученные данные были выражены в единицах Средней Интенсивности Флуоресценции (СИФ). Программное обеспечение GraphPad Prism было использовано для построения графиков и анализа данных. Значения СИФ были построены в зависимости от концентрации анител, чтобы получить кривые дозы-реакции. Алгоритм нелинейной регрессии был применен к данным, чтобы оптимизировать кривую и вычислить параметры ЕС50.
[00394] Были определены профили связывания для моноклональных антител 18R5 и 44R24, и проведено их сравнение. Кривые дозы-реакции, показывающие связывание 18R5 и 44R24 антител с Fzd1, 2, 5, 7 и 8, показаны на Фигуре 47. Параметры ЕС50 (нМ), рассчитанные для двух моноклональных антител, показаны в таблице 13. Антитела 44R24 связывают Fzd5 и Fzd8 с высокой афинностью. Не получилось построить сигмоидальные кривые дозы-реакции для других трех рецепторов Fzd, что позволяет предположить, что 44R24 не связывается с Fzd1, 2 и 7. Для антитела 18R5 была подтверждена высокая афинность связывания с Fzd1, 2, 5 и 7.

Пример 20
Оценка активности, направленной против Wnt, моноклональных антител (МАТ) к FZD путем анализа в клеточной системе.
[00395] Был проведен анализ с сравнение способности 18R5 и 44R24 ингибировать сигнальный путь, опосредованный Wnt, в клетках STF-293. Клетки STF представляют собой эмбриональные клетки почки человека (HEK)-293, стабильно трансфицированные репортерной кассетой Super Top Flash (STF), в которой экспрессия репортерного гена люциферазы (Luc) регулируется множественными копиями TCF-сайта связывания, предшествующими минимальному промотеру. Низкая базальная экспрессия Luc может быть увеличена в 30-60 раз в ответ на Wnt3a, обеспечивая большое окно для оценки ингибиторной активности антител к FZD.
[00396] Для оценки моноклональных антител клетки STF-293 выращивали в DMEM-10% ЭБС. В первый день высевали по 10000 клеток на лунку в 96-луночных планшетах Optical Bottom White (Nunc # 165306). Клетки инкубировали в течение ночи при 37°C и 5% CO2. На второй день тестируемые антитела разбавляли до конечной концентрации 40 мкг/мкл, используя питательную среду. Проводились семь 5-кратных серийных разведений. Среду культуры клеток STF-293 заменяли смесью, содержащей 50 мкл разбавленных антител, 25 мкл Wnt3a-кондиционированной среды из L-клеток со стабильным Wnt3a и 25 мкл DMEM-10% ЭБС.Конечные концентрации, протестированные для каждого анитела, составили 20, 4, 0,8, 0,16, 0,03, 0,006, 0,0013, 0,0003 мкг/мкл. Каждая концентрация антитела была протестирована в трех повторностях. В качестве негативного контроля использовали антитела к гаптенам человека, LZ1. Не кондиционированная с помощью Wnt3a среда из родительских L-клеток была использована в качестве индуктора негативного контроля. Планшеты помещали обратно в инкубатор. Активность люциферазы измеряли на 3-й день, используя набор Promega Steady Glo (VWR # PAE2550-A) согласно протоколу производителя. Результаты были выражены в фотонах в секунду. Для построения графиков и анализа данных использовали программное обеспечение GraphPad Prism. Для определения кривых доза-ответ строили диаграммы активности люциферазы как функции от концентрации антител. Для построения кривой и расчета IC50 для полученных значений использовали нелинейную регрессию.
[00397] Также проводили анализ и сравнение способности 44R24 и 18R5 ингибировать сигнальный путь, опосредованный Wnt, в клетках STF. Результаты показаны на Фигуре 48 и в Таблице 14. Активность 44R24 была обнаружена только при более высоких концентрациях антител, что отражает низкую активность антител в анализе. Рассчитанная IC50 для 44R24 была в 13 раз ниже, чем для 18R5.

[00398] Также определяли способность 18R5 и 44R24 ингибировать сигнальный путь, опосредованный Wnt, в клетках А549. Клетки А549 представляют собой клетки легочной карциномы человека, в которых на высоком уровне экспрессируется ген Axin2, определяющий эндогенную активность сигнального пути, опосредованного Wnt. Axin2 - хорошо известный ген-мишень для Wnt, который отвечает за активацию пути через положительную регуляцию транскрипции и, в конечном итоге, ингибирует передачу сигнала, опосредованного Wnt, по механизму обратной связи. Эту систему использовали для проверки действия антитела к FZD на уровень мРНК Axin2 методом количественной ПЦР.
[00399] В 12-луночные планшеты высевали 30000 клеток А549 на лунку и выращивали в течение 3 дней в DMEM+10% ЭБС. Антитела добавляли в различных концентрациях (5, 1, 0.2, 0.04, 0.008 мкг/мл) на 24 часа, и выделяли тотальную РНК из клеток. В качестве негативного контроля использовали не связывающееся антитело LZ1 только при наиболее высокой концентрации.
[00400] В 12-луночные планшеты засевали 30000 клеток А549 и выращивали в течение 3 дней в DMEM+10% ЭБС. Добавляли антитела к FZD 18R5 или 44R24 в различных концентрациях (5, 1, 0,2, 0,04, 0,008 мкг/мл), и в качестве отрицательного контроля использовали не связывающееся антитело LZ1 только при наиболее высокой концентрации. РНК выделяли через 24 часа после обработки, а затем обрабатывали ее ДНКазой.
[00401] Axin2, как известно, является проверенным геном-мишенью сигнального пути через Wnt, и относительный уровень его экспрессии (ΔΔСТ) оценивали методом Taqman с использованием прибора Applied Biosystems 7900 НТ. В каждой из трех повторностей использовали по 50 нг РНК, и в качестве эндогенного контроля использовали зонд GUSB. Все результаты нормализовали относительно уровня Axin2 в контрольных образцах с LZ1.
[00402] На Фигуре 49 показана кривая доза-ответ, демонстрирующая ингибирование базального уровня экспрессии гена axin2 под действием 18R5 и 44R24, и представлены расчитанные значения ЕС50 для этих антител. 18R5 и 44R24 ингибируют базальный уровень Axin2, по сравнению с контролем LZ1, с сопоставимой эффективностью.
Пример 21
Оценка противоопухолевой активности моноклональных антител к FZD на модели ксенотрансплантата поджелудочной железы
Опухоли поджелудочной железы OMP-PN13:
[00403] Замороженные опухолевые клетки OMP-PN13, дважды пассированные в мышах, были получены из банка опухолей Oncomed. Клетки размораживали и вводили подкожно в левый бок NOD/SCID мышам сразу после оттаивания. Каждому животному было введено ~25000 жизнеспособных клеток. Наблюдение за ростом опухолей у мышей осуществлялось еженедельно. После образования опухоли, измеряли размер опухоли один раз в неделю с помощью калипера. Мыши с опухолями в 200-300 мм3 распределяли в группы для обработки, по 5 животных в каждую. Средний размер опухоли был сопоставим в каждой группе. Обработку антителами начинали на следующий день после рандомизации. В качестве негативного контроля использовали антитела LZ1. 3 дозы антител в концентрации 10 мг/кг вводили внутрибрюшинно в течение 12 дней. Мышей подвергали эвтаназии через 24 часа после последней инъекции. Собирали опухоль, двенадцатиперстную кишку и печень.
[00404] Опухолевые ткани фиксировали в формалине для заключения в парафин и получения срезов. Детекцию Mucl6 проводили с помощью иммуногистохимического анализа для наблюдения за появлением муцин-продуцирующих клеток. Муцины являются специфичными для подтипа дифференцированных клеток в поджелудочной железе, и их используют в качестве маркеров дифференцировки в опухоли.
[00405] Фиксированные в формалине заключенные в парафин (ФФЗП) срезы очищали от парафинина. Сначала препараты депарафинизировали последовательной обработкой с помощью ксилола, два раза в течение 5 минут. Затем проводили регидратацию ткани, помещая ее в серию водных разведений этанола: 100% этанол, два раза в течение 3 минут, 90% этанол, однократно в течение 1 минуты, 80% этанол однократно в течение 1 минуты и 70% этанол однократно в течение 1 минуты. Ткань промывали проточной дистиллированной водой в течение 1 минуты.
[00406] Антитело к муцину 16 (клон Х325 из AbCAM, кат.номер ab0033) использовали для обнаружения путем ИГХ анализа клеток, экспрессирующих муцин 16 в клеток на срезах ткани в ФФЗП. Термическое восстановление антигенов проводили в 10 мМ цитратном буфере при рН 6,0 в автоклаве. После этого препараты выдерживали при комнатной температуре для медленного восстановления антигенности белков (около 2 часов).
[00407] Срезы тканей блокировали с использованием водного раствора 3% перекиси водорода, промывали, после чего снова блокировали с помощью блокирующего раствора нормальной лошадиной сыворотки (НЛС) (на 50 мл: ФСБ (38,5 мл), 10% НЛС (5 мл), 1% БСА (5 мл), 0,1% желатина (500 мкл), 0,1% ТХ-100 (500 мкл), 0,05% NaN3 (500 мкл)) в течение 1 часа при комнатной температуре. После этого проводили окрашивание срезов с помощью первичных антител к Mucl6, разведение 1:200 в разбавители Da Vinci Green Diluent pH 7,3 (PD 900, Biocare Medical), в течение 1 часа при комнатной температуре с последующим трехкратной промывкой с использованием фосфатного буферного раствора, содержащего 0,1% тритон Х-100. Затем окрашивали срезы с использованием 3 капель противомышиных IgG, конъюгированных с HRP (пероксидазой хрена) ImmPress (кат. номер 101098-260, VWR) в течение 30 минут при комнатной температуре с последующей трехкратной промывкой с использованием фосфатного буферного раствора, содержащего 0,1% тритон Х-100. Слайды затем помещали в чашки Петри и проводили реакцию проявления с помощью набора Vector NovaRed (SK4800, Vector labs) в течение 1-2 минут. Реакцию останавливали добавлением дистиллированной воды. Препараты тщательно промывали проточной дистиллированной водой. Срезы тканей были затем контрастировали с помощью гематоксилина (кат.номер Н3401, Vector Labs Gill's formula) в течение 1 минуты, промывали, а затем нейтрализовали с помощью окрашивающего в синий цвет раствора в течение 30 секунд. Препараты высушивали в течение ночи и монтировали с использованием VectaMount (Vector Labs).
[00408] Примеры типичных полей опухолей, обработанных с помощью AT (LZ1), 18R5 или 44R24 показаны на Фигуре 50. Тогда как для LZ1 наблюдали низкую интенсивность окрашивания, в опухолях, обработанных 18R5, наблюдали более высокую интенсивность окрашивания с помощью антитела Mucl6. Это говорит о том, что 18R5 стимулировал дифференцировку опухолевых клеток в муцин-продуцирующую клеточную линию. Уровень окрашивания Mucl6 в обработанных 44R24 опухолях был более умеренным, по сравнению с опухолями, обработанными 18R5, но все же был несколько выше, чем в опухолях, обработанных LZ1 в этом эксперименте.
[00409] Также из опухоли, двенадцатиперстной кишки и печени выделяли тотальную РНК для анализа экспрессии генов-мишеней Wnt с использованием количественной ПЦР.
[00410] При сборе материала ткани немедленно помещали в RNAlater (QIAGEN). Выделение РНК проводили с помощью набора QIAGEN RNeasy для фиброзных тканей в соответствии с инструкциями производителя. Для анализа экспрессии генов брали 50 нг тотальной РНК с использованием протокола и реагентов ABI для одношаговой ОТ-ПЦР. Экспрессию GusB использовали в качестве эндогенного контроля. Анализ каждого образца проводили в трех повторностях. Анализировали все 5 опухолей из группы для каждого варианта обработки. Для проведения анализа использовали прибор ABI 7900 TaqMan. Для анализа данных и расчета значений DeltaCt, которые были преобразованы в относительные единицы, использовали программное обеспечение ABI SDS 2.2.1. Для каждой группы брали среднее значение для всех 5 опухолей. Степень снижения экспрессии рассчитывали относительно контрольного антитела (LZ1).
[00411] Результаты приведены в Таблице 15. Антитела к FZD оказывали различный эффект на гены-мишени Wnt. 18R5 индуцировал 2,3-кратное и 5-кратное снижение экспрессии в опухоли и печени, при этом не оказывал действие на двенадцатиперстную кишку. Изменения, вызванные 44R24, были более умеренными.

ND: нет данных
Отдельные эксперименты выделены курсивом
Опухоли поджелудочной железы OMP-PN4:
[00412] Воздействие 18R5 на строму опухоли на модели ксенотрансплантата опухоли поджелудочной железы OMP-PN4 также было исследовано. С помощью микрочипового анализа был выявлен ряд генов, уровень экспрессии которых изменялся в результате обработки. Среди них особый интерес представляет ген АСТА2, который кодирует гладкомышечный актин (ГМА). Было показано, что ГМА ассоциирован с активированной стромой опухоли. Таким образом, снижение уровня его экспрессии можно рассматривать показатель снижения степени выраженности туморогенного фенотипа.
[00413] Воздействие 18R5 на строму опухоли на модели ксенотрансплантата опухоли поджелудочной железы OMP-PN4 также было исследовано. С помощью микрочипового анализа был выявлен ряд генов, уровень экспрессии которых изменялся в результате обработки. Среди них особый интерес представляет ген АСТА2, который кодирует гладкомышечный актин (ГМА). Было показано, что ГМА ассоциирован с активированной стромой опухоли. Таким образом, снижение уровня его экспрессии можно рассматривать показатель снижения степени выраженности туморогенного фенотипа.
[00414] Как было описано в Примере 7, выше, мышей NOD/SCID с опухолями OMP-PN4 подвергали воздействию контрольного антитела (LZ-1), 18R5, гемцитабина или комбинации 18R5 и гемцитабина раз в неделю в течение 6 недель. Антитела вводили в концентрации 10 мг/кг. После этого, собирали ткани опухоли из этого эксперимента, и анализировали в них экспрессию генов-мишеней Wnt цель как на уровне РНК, так и на уровне белка, с использованием микрочипов и анализа с помощью ИГХ, соответственно. Из опухолей выделяли тотальную РНК, амплифицировали и анализировали с помощью. Амплификацию тотальной РНК проводили с использованием системы для амплификации РНК Ovation RNA Amplification System V2 (NuGEN, San Carlos, СА). Полученные амплифицированные одноцепочечные антисмысловые молекулы кДНК разрезали на фрагменты и биотинилировали с использованием набора FL-Ovation cDNA Biotin Module V2 (NuGEN) для применения на чипах Affymetrix. В этих экспериментах использовали олигонуклеотидные микрочипы Affymetrix HG-U133 plus 2 или MG 430 2.0 (разработанные Almac Diagnostics, Durham, NC). После гибридизации, генные чипы промывали, окрашивали и сканировали в соответствии с инструкцией производителя (Affymetrix, Santa Clara, СА). Перед гибридизацией на микрочипах проводили проверку качества кДНК и фрагментированной кДНК с помощью спектрофотометра и биоанализатора (Bioanalyzer). Количественный анализ и масштабирование исходных данных, полученных в результате сканирования микрочипов, проводили с помощью программного обеспечения GCOS (Affymetrix), и оценивали данные согласно инструкциям по контролю качества Gene Chip Quality Control, рекомендованных Affymetrix, для обнаружения любых дефектов чипов и выпадающих значений, которые были исключены из последующего анализа данных.
[00415] Корректировку фоновых показателей микрочипов и нормализацию интенсивности сигнала проводили с помощью алгоритма GCRMA с помощью программы Bioconductor с открытым исходным кодом (). Гены, дифференциально экспрессирующиеся между двумя группами или на двух временных интервалах, выявляли с помощью Байесовского t-теста (Cyber-T), сочетающего t-критерий Стьюдента и Байесовскую оценку внутригрупповых дисперсии, полученных из наблюдаемых дисперсий набора зондов при одинаковых уровнях экспрессии (Baldi Р, Long AD. A Bayesian framework for the analysis of microarray expression data: regularized t -test and statistical inferences of gene changes. Bioinformatics. 2001; 17(6):509-19).
[00416] Для микрочипового анализа экспрессии генов в опухолях человека, образцы анализировали как с помощью чипов, разработанных для мыши, так и чипов, разработанных для человека, для независимой оценки воздействия обработки на опухоль человека и строму мыши. Микрочиповые зонды Affymetrix, не являющиеся видоспецифичными, исключали из анализа
[00417] Для проведения иммунофлюоресцентного анализа гладкомышечного альфа -актина (SMAa) ткани опухоли замораживали с использованием ОСТ. Получали срезы толщиной 4 микрон, и замораживали их для хранения при температуре -80°C. Для окрашивания SMAa ткани фиксировали с использованием охлажденного ацетона при - 20°C в течение 15 минут, высушивали, нагревали до комнатной температуры и затем маркировали с помощью с помощью гидрофобного маркера РАР. Затем препараты промывали с помощью фосфатного буфера (ФСБ). Ткань блокировали с помощью нормальной лошадиной сыворотки R.T.U. (Vector Labs) в течение 2 часов при комнатной температуре. Окрашивание с помощью первичных антител проводили при разведении 1:10000 конъюгированных с FITC антител к гладкомышечному альфа-актину (cline 1А4, #F3777, SIGMA) в течение 1 часа. Срезы промывали 3 раза с использованием ФСБ, содержащего 0,1% тритон Х-100. Затем препараты высушивали на воздухе и монтировали с использованием содержащей DAPI среды Hard set mounting medium (vectashied H-500).
[00418] На Фигуре 51А приведены уровни экспрессии гена АСТА2, определенные с помощью микрочипов. Опухоли, обработанные антителами 18R5 к FZD, демонстрировали снижение уровня экспрессии АСТА2. На Фигуре 51 В представлены результаты иммунофлюоресцентного анализа гладко-мышечного альфа-активна (SMAa) в опухолях OMP-PN4, обработанных контрольным мАТ (верхняя панель) и 18R5 (нижняя панель). В опухолях, обработанных 18R5, было выявлено снижение количества SMAa. Экспрессия АСТА2 и количество SMA резко снижалось в строме опухоли в ответ на 18R5, указывая на то, что блокада Wnt (i) оказывает влияние на данную область опухоли и (ii) это воздействие осуществляется через снижение уровня хорошо охарактеризованного маркера туморогенности. Такие результаты позволяют предположить, что одним из противоопухолевых механизмов действия 18R5 является снижение степени активации миофибробластов.
Пример 22
Оценка туморогенного потенциала Mucl6-позитивных клеток OMP-PN13
[00419] Как описано выше, о6работка 18R5 вызывала изменения экспрессии генов и фенотипа клеток в поджелудочной железе, в том числе увеличение экспрессии муцина. В частности, ИГХ анализ обработанных опухолей PN-13, выявил увеличение числа Mucl6-позитивных клеток. Уровень экспрессии гена Mucl6 также был выше в обработанных опухолях, по сравнению с контрольными опухолями. Для проверки гипотезы о том, что 18R5-индуцированнве Mucl6-позитивные клетки представляют субпопуляцию дифференцированных опухолевых клеток, оценивали туморогенность 18R5-индуцированных Mucl6-позитивных клеток.
[00420] Мышей, несущих OMP-PN13, обрабатывали 18R5 согласно протоколу, описанному в Примере 21. Мышей подвергали эвтаназии через 12 дней после начала обработки с помощью АТ. Собирали опухоли, и обрабатывали их с помощью коллагеназы III для ферментативного расщепления с получением суспензии отдельных клеток. Клетки стромы мыши окрашивали с помощью биотинилированного антитела к Н-2Kd и биотинилированного антитела к CD45. Затем инкубировали клетки с магнитными шариками, конъюгированными со стрептавидином (Thermo MagnaBind) и удаляли их с использованием магнита Dynal. В результате Lin-обедненные опухолевые клетки окрашивали с помощью антител к Mucl6, которые детектировали с помощью вторичных AT, конъюгированнх с ФЭ. Mucl6-позитивные и Mucl6-негативные клетки сортировали с помощью прибора для флуоресцентной сортировки клеток ARIA FACS и программного обеспечения DIVA. См. Фиг. 52А. Клетки вновь вводили мышам NOD/SCID подкожно в левый бок для сравнения их туморогенного потенциала. Клетки каждого типа инъецировали 10 мышам, при этом каждая мышь получала 75 клеток. Примеры фотографий опухолей, образующихся в результате введения Mucl6 - (верхняя панель) и Mucl6 + (нижняя панель)-клеток представлены на Фиг. 52В. Кривые роста Mucl6- и Mucl6 +- опухолей после инъекции мышам представлены на Фигуре 52С. После введения Mucl6+клеток не наблюдали опухолевого роста, тогда как у 7 из 10 мышей, которым вводили Mucl6-клетки, образовывались опухоли. Данные свидетельствуют о том, что 18R5-индуцированные Mucl6 + клетки не являются туморогенными, что подтверждает гипотезу о том, что индукция дифференцировки является основным механизмом 1 противоопухолевой активности 18R5.
Пример 23
Дополнительные исследования антител к FZD in vivo
[00421] Исследование рецидива опухоли молочной железы РЕ13 с помощью МАТ 18R5: Клетки опухоли молочной железы РЕ13 вводили мышам Nod-Scid, и ожидали, пока размер опухоли достигал приблизительно 100 мм3. Животных распределяли в случайном порядке на две группы (N=10) и вводили им таксол (15 мг/кг, два раза в неделю) вместе с контрольным антителом (черные квадраты) или же аналогичную дозу таксола вместе с антителом 18R5 к FZD (серые кружки). Антитела вводили в дозе 20 мг/кг один раз в неделю. Введение таксола прекращали на 70 день, тогда как введение антитела продолжали. Результаты показаны на Фигуре 53. Показано, что антитело 18R5 увеличивало скорость регрессии опухоли и вызывало задержку рецидива опухоли после прекращения введения таксола.
[00422] Анализ опухоли молочной железы РЕ13 с помощью предельных разведений с мАТ 18R5: Животные, несущие опухоли молочной железы РЕ 13, получали либо контрольное антитело (серые кружки), либо 18R5 (неокрашенные треугольники), либо таксол (черные кружки), либо комбинацию таксола и 18R5 (неокрашенные квадраты). Таксол вводили в дозе 15 мг/кг два раза в неделю, а антитела вводили в дозе 20 мг/кг один раз в неделю. Опухоли собирали и очищали путем «обеднения» клеточной линии. 50, 150 или 500 опухолевых клеток вводили новой группе мышей (n=10 на клетку). Результаты показаны на Фигуре 54. Частоту опухолевого роста оценивали после 59 дней, и использовали для расчета частоты стволовых опухолевых клеток - CSC (L-Calc).
[00423] Исследование рецидива опухоли поджелудочной железы PN4 с помощью MAT 18R5: Клетки опухоли поджелудочной железы PN4 вводили мышам Nod-Scid, и ожидали, пока размер опухоли достигал приблизительно 250 мм3. Животным затем давали гемцитабин (75 мг/кг один раз в неделю) в течение 5 недель, пока опухоли не регрессировали. Животных разделяли в случайном порядке на две группы и вводили им контрольное антитело (черные квадраты) или антитело к FZD 18R5 (серые кружки). Антитела вводили в дозе 10 мг/кг один раз в неделю. Результаты показаны на Фигуре 55. Показано, что антитело 18R5 вызывает задержку рецидива опухоли после введения гемцитабина.
[00424] Исследование роста опухоли поджелудочной железы PN4 с помощью МАТ 44R24: Опухоли поджелудочной железы PN4 вводили вводили мышам Nod-Scid и ожидали, пока объем опухоли достигал приблизительно 150 мм3. Животных разделяли на 4 группы (n=10 в группе) и вводили им контрольное антитело (черные квадраты), антитело к FZD5/8 44R24 (серый треугольники), гемцитабин (черные треугольники) или комбинацию 44R24 с гемцитабином (серые кружки). Гемцитабин вводили в дозе 15 мг/кг один раз в неделю, а антитела вводили в дозе 20 мг/кг два раза в неделю. Результаты показаны на Фигуре 56. Показано, что антитело 44R24 вызывает уменьшение роста опухоли в сочетании с гемцитабином, по сравнению с гемцитабином в отдельности.
Пример 24
Картирование эпитопов антитела к FZD 44R24
[00425] Картирование эпитопов антитела к FZD 44R24 проводил способом, как описано в Примере 5 для антител 18R8 и 18R5. Способность 44R24 связываться с эпитопами, аналогичными для 18R8 оценивали с помощью проточной цитометрии с использованием ряда вариантов FZD8 с аминокислотными заменами, которые как было показано ранее, нарушают связывание 18R8 (см. Пример 5 и Фигуры 6 и 7). Показано, что аминокислоты 126-127 в составе FZD8 необходимы для связывания 44R24, о чем свидетельствует снижение окрашивания в составе котрансфицированной (GFP-положительной) клеточной популяции. Результаты анализа с помощью с FACS показаны на Фигуре 57. Полученные результаты свидетельствуют о том, что 44R24 связывается с эпитопом, который перекрывается с эпитопом для 18R8, и содержит общие аминокислоты 126-127.
Пример 25
Исследование роста опухоли толстой кишки С28 с помощью с антител к FZD 18R5, 18R8 и 44R24.
[00426] Клетки опухоли С28 клетки вводили подкожно мышам Nod-Scid. Ожидали, пока средний объем опухоли достигал 126 мм3. Животных, несущих опухоли, распределяли в случайном порядке на четыре группы (n=10 мышей на группу), и вводили им контрольное АТ (черные квадраты), 18R8 (серые треугольники), 44R24 (черные кружки) или 18R5 (серые кружки) (Фиг. 58). Антитела вводили внутрибрюшинно в дозе 15 мг/кг дважды в неделю. Обозначены объемы опухоли. Обработка антителами 44R24 и 18R5 снижала темп роста опухоли, по сравнению с контрольной группой, в то время как антитело 18R8 не оказывало влияние на рост опухоли (Фиг. 58).
[00427] После обработки животных в эксперименте, представленном на Фигуре 58, опухоли собирали, фиксированные в формалине, заключали в парафин, и получали срезы опухолей толщиной 5 микрон. Срезы опухолей анализировали на экспрессию цитокератина 7, маркера дифференцировки клеток толстой кишки, с помощью иммуногистохимического анализа (Vectastain kit, Vector Labs). Показано, что экспрессия цитокератина 7 повышается после обработки 44R24 или 18R5 (Фиг. 59).
[00428] Все публикации, патенты, заявки на патент, интернет-сайты, и регистрационные номера (номера доступа)/базы данных последовательностей (включающих полинуклеотидные и полипептидные последовательности), процитированные в настоящей заявке, включены в настоящую заявку посредством ссылки в полном объеме для всех целей в одинаковой степени, как если бы каждая отдельная публикация, патент, заявка на патент, интернет-сайт, и регистрационный номера (номер доступа)/база данных последовательностей была включена в настоящую заявку в отдельно порядке посредством ссылки.
Реферат
Изобретение относится к области биотехнологии и иммунологии. Предложены новые противораковые антитела, которые связываются с рецептором “frizzled” человека. Также идентифицированы новые эпитопы в составе рецепторов “frizzled” человека, которые являются подходящими мишенями для противораковых агентов. Кроме того, предложены способы применения антител для ингибирования сигнального пути через Wnt и/или ингибирования роста опухоли. Предложенная группа изобретений может быть использована в медицине. 12 н. и 8 з.п.ф-лы, 46 ил., 15 табл., 25 пр.
Формула
(а) CDR1 тяжелой цепи, включающий GFTFSHYTLS (SEQ ID NO: 1); CDR2 тяжелой цепи, включающий VISGDGSYTYYADSVKG (SEQ ID NO: 2); и CDR3 тяжелой цепи, включающий NFIKYVFAN (SEQ ID NO: 3); и
(б) CDR1 легкой цепи, включающий SGDNIGSFYVH (SEQ ID NO: 7); CDR2 легкой цепи, включающий DKSNRPSG (SEQ ID NO: 8); и CDR3 легкой цепи, включающий QSYANTLSL (SEQ ID NO: 9) или
CDR1 легкой цепи, включающий SGDKLGKKYAS (SEQ ID NO: 4); CDR2 легкой цепи, включающий EKDNRPSG (SEQ ID NO: 5); и CDR3 легкой цепи, включающий SSFAGNSLE (SEQ ID NO: 6).
(а) CDR1 тяжелой цепи, включающий GFTFSHYTLS (SEQ ID NO: 1), CDR2 тяжелой цепи, включающий VISGDGSYTYYADSVKG (SEQ ID NO: 2), и CDR3 тяжелой цепи, включающий NFIKYVFAN (SEQ ID NO: 3); и
(б) CDR1 легкой цепи, включающий SGDNIGSFYVH (SEQ ID NO: 7), CDR2 легкой цепи, включающий DKSNRPSG (SEQ ID NO: 8), и CDR3 легкой цепи, включающий QSYANTLSL (SEQ ID NO: 9).
(а) полипептид, имеющий по меньшей мере примерно 80% идентичности по последовательности SEQ ID NO: 10; и/или
(б) полипептид, имеющий по меньшей мере примерно 80% идентичности по последовательности SEQ ID NO: 14 или SEQ ID NO: 12,
при этом:
указанный полипептид, имеющий по меньшей мере примерно 80% идентичности по последовательности SEQ ID NO: 10, содержит CDR1, CDR2 и CDR3 тяжелой цепи с последовательностью SEQ ID NO: 1, 2 и 3, соответственно, и указанный полипептид, имеющий по меньшей мере примерно 80% идентичности по последовательности SEQ ID NO: 14 или SEQ ID NO: 12, содержит CDR1, CDR2 и CDR3 легкой цепи с последовательностью SEQ ID NO: 7, 8, и 9, соответственно, или последовательностью SEQ ID NO: 4, 5, и 6, соответственно.
(а) полипептид с аминокислотной последовательностью SEQ ID NO: 10 и/или
(б) полипептид с аминокислотной последовательностью SEQ ID NO: 14.
(а) CDR1 тяжелой цепи, включающий GFTFSSYYIT (SEQ ID NO: 77), CDR2 тяжелой цепи, включающий TISYSSSNTYYADSVKG (SEQ ID NO: 78), и CDR3 тяжелой цепи, включающий SIVFDY (SEQ ID NO: 79); и
(б) CDR1 легкой цепи, включающий SGDALGNRYVY (SEQ ID NO: 80), CDR2 легкой цепи, включающий SG (SEQ ID NO: 81), и CDR3 легкой цепи, включающий GSWDTRPYPKY (SEQ ID NO: 82).
(а) полипептид, имеющий по меньшей мере примерно 80% идентичности SEQ ID NO: 85; и/или
(б) полипептид, имеющий по меньшей мере примерно 80% идентичности SEQ ID NO: 86, при этом:
указанный полипептид, имеющий по меньшей мере примерно 80% идентичности по последовательности SEQ ID NO: 85, содержит CDR1, CDR2 и CDR3 тяжелой цепи с последовательностью SEQ ID NO: 77, 78 и 79, соответственно, и указанный полипептид, имеющий по меньшей мере примерно 80% идентичности по последовательности SEQ ID NO: 86 содержит CDR1, CDR2 и CDR3 легкой цепи с последовательностью SEQ ID NO: 80, 81, и 82, соответственно.
(1) обеспечения репертуара антител, способных связываться с рецептором "frizzled" человека, выбранным из группы, состоящей из FZD1, FZD2, FZD5, FZD7 и FZD8; и
(2) отбора антител, обладающих способностью к специфичному связыванию:
(а) по меньшей мере части последовательности Q(DE/ED)AGLEVHQF(Y/W)PL (SEQ ID NO: 24) в составе рецептора "frizzled" человека, и/или
(б) по меньшей мере части последовательности (K/Q)(F/Y)GF(Q/A) (SEQ ID NO: 69) в составе рецептора "frizzled" человека.
(1) обеспечения репертуара антител, способных связываться с FZD8; и
(2) отбора антител, обладающих способностью к специфичному связыванию:
(а) по меньшей мере части последовательности GLEVHQ (SEQ ID NO: 25) в составе FZD8; и/или
(б) по меньшей мере части последовательности QYGFA (SEQ ID NO: 66) в составе FZD8.

Комментарии