Модифицированный экзотоксин а псевдомонад - RU2687143C2
Код документа: RU2687143C2
Чертежи


































































































































Описание
Перекрестная ссылка на родственные заявки
[0001] Эта заявка на патент испрашивает приоритет предварительных заявок США на патенты №№61/887418, поданной 6 октября 2013 г.; 61/908464, поданной 25 ноября 2013 г.; 61/982051, поданной 21 апреля 2014 г.; и 62/052665, поданной 19 сентября 2014 г., каждая из которых включена в данный документ посредством ссылки во всей ее полноте.
Настоящее изобретение было создано при поддержке Правительства с № проекта ВС008753 Национальным институтом здоровья, Национальным институтом онкологии. Правительство имеет определенные права на изобретение.
Включение посредством ссылки материала, представленного в электронном виде
[0002] В данный документ включен посредством ссылки во всей его полноте список машинно-читаемых нуклеотидных/аминокислотных последовательностей, представленный одновременно с данной заявкой и определенный следующим образом: один файл ASCII (текст) объемом 144505 байт под названием "718581_ST25.txt" от 1 октября 2014 года.
Уровень техники
[0003] Экзотоксин А псевдомонад (от англ. Pseudomonas exotoxin - РЕ) является бактериальным токсином с цитотоксической активностью, которая может эффективно разрушать или ингибировать рост нежелательных клеток, например, раковых клеток. Соответственно, РЕ может быть использован для лечения или профилактики заболеваний, таких как, например, рак. Тем не менее, РЕ может быть высоко иммуногенным. Соответственно, введение РЕ может стимулировать иммунный ответ против РЕ, в том числе, например, продукцию анти-РЕ-антител и/или Т-клеток, что нежелательно нейтрализует цитотоксическую активность РЕ. Такая иммуногенность может уменьшить количество РЕ, который может быть введен пациенту, что, в свою очередь, может снижать эффективность РЕ в лечении заболевания, например, рака. Таким образом, существует потребность в улучшенном РЕ.
[0004] В данной области известно несколько деиммунизированных экзотоксинов псевдомонад (РЕ). Варианты с делецией домена II (например, РЕ24) могут быть менее иммуногенными и могут вызывать меньше побочных эффектов (таких как, например, синдром капиллярной утечки и гепатотоксичность) по сравнению с РЕ38, который содержит домен II. Не привязываясь к определенной теории, полагают, что снижение иммуногенности и меньшее число побочных эффектов РЕ24 может быть объяснено, по меньшей мере частично, уменьшенным размером РЕ24, что неблагоприятно приводит к снижению периода его полужизни в сыворотке. В вариантах РЕ24 могут быть использованы различные фурин-расщепляемые линкеры. РЕ-иммуноконъюгаты в основном используют dsFv-фрагменты в качестве как специфических группировок. Такие деиммунизированные экзотоксины псевдомонад (РЕ) описаны, например, в публикациях международных патентных заявок WO 2005052006, WO 2007016150, WO 2007014743, WO 2007031741, WO 200932954, WO 201132022, WO 2012/154530 и WO 2012/170617.
[0005] Предыдущие иммунотоксины имеют много недостатков. Например, деиммунизация предыдущих иммунотоксинов была неполной в отношении В-клеточных эпитопов человека, так как иммуногенные реакции до сих пор происходят. Кроме того, деиммунизация предыдущих иммунотоксинов сопровождалась снижением цитотоксической активности. Например, деиммунизированный вариант PE LO10, описанный в публикации WO 2012/170617, имеет потерю активности по меньшей мере на 40% по сравнению с РЕ дикого типа (wild type, WT) и другими вариантами РЕ. В публикации международной патентной заявки WO 2013/040141 были описаны экзотоксины псевдомонад с менее иммуногенными В-клеточными эпитопами. В варианте PE LRO10 все В-клеточные эпитопы были удалены. Тем не менее, это также привело к уменьшению цитотоксичности по отношению к опухолевым клеткам.
[0006] Кроме того, гибрид dsFv с домен II-делетированными вариантами РЕ (РЕ24) имеет более короткий период полужизни в сыворотке из-за снижения его общего размера по сравнению с гибридами dsFv с РЕ38. Линкеры предыдущих иммунотоксинов также содержали Т-клеточные эпитопы и слабую перспективность, например, плохую стабильность при 37°C. Кроме того, предыдущие иммунотоксины против мезотелина (MSLN) использовали только dsFv-фрагменты мышиного происхождения, слитые с РЕ, что может дополнительно способствовать иммуногенности. Международная патентная заявка WO 2012/154530 относится к вариантным химерным молекулам экзотоксина псевдомонад с короткими гибкими линкерами, которые имеют улучшенную цитотоксичность в отношении опухолевых клеток.
Краткое изложение сущности изобретения
[0007] Данное изобретение относится к деиммунизированным экзотоксинам псевдомонад и их Fab-гибридам (например, гуманизированным анти-MSLN), к способам лечения рака, стабилизированным фармацевтическим составам, способам уменьшения побочных эффектов и способам повышения периода полужизни в сыворотке и оптимизации схемы лечения.
[0008] Одно из воплощений согласно изобретению относится к экзотоксину А псевдомонад (РЕ), содержащему аминокислотную последовательность РЕ, где один или более чем один из аминокислотных остатков F443, R456, L477, R494 и L552, определенных относительно SEQ ID NO 1, является замещенным независимо от других, где РЕ, возможно, имеет:
(i) дополнительную замену одного или более чем одного аминокислотного остатка в одном или более чем одном В-клеточном эпитопе, и эта дополнительная аминокислотная замена в одном или более чем одном В-клеточном эпитопе представляет собой, независимо от других, замену одного или более чем одного аминокислотного остатка D403, D406, R412, R427, Е431, R432, D461, R463, R467, R490, R505, R513, Е522, R538, Е548, R551, R576, Q592 и L597, определенного относительно SEQ ID NO 1,
(ii) дополнительную замену одного или более чем одного аминокислотного остатка в одном или более чем одном Т-клеточном эпитопе,
(iii) делецию одного или более чем одного из смежных аминокислотных остатков среди остатков 1-273 и 285-394, определенных согласно SEQ ID NO 1, или
(iv) сочетание любого одного, двух или трех пунктов из (i)-(iii).
[0009] Еще одно воплощение данного изобретения относится к выделенному мутантному экзотоксину А псевдомонад (РЕ), который содержит последовательность следующей формулы:
R1n-FCS-R2n-R3n-функциональный домен РЕ III
в которой:
n равно 0 или 1 независимо для каждого из R1, R2 и R3,
R1 представляет собой от 1 до 10 аминокислотных остатков
FCS (от англ. furin cleavage sequence) представляет собой фурин-расщепляемую последовательность аминокислотных остатков, которая расщепляется фурином и имеет амино-конец и карбоксильный конец,
R2 представляет собой от 1 до 10 аминокислотных остатков;
R3 представляет собой 1 или более чем один из смежных остатков с 365 по 394 последовательности SEQ ID 1; а также,
функциональный домен РЕ III представляет собой остатки с 395 по 613 последовательности SEQ ID NO 1, где один или более чем один из аминокислотных остатков F443, R456, L477, R494 и L552, определенных относительно SEQ ID NO 1, независимо от других является замещенным, где РЕ, возможно, имеет:
(i) дополнительную замену одного или более чем одного аминокислотного остатка в одном или более чем одном В-клеточном эпитопе, и эта дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой, независимо от других, замену одного или более чем одного аминокислотного остатка D403, D406, R412, R427, Е431, R432, D461, R463, R467, R490, R505, R513, Е522, R538, Е548, R551, R576, Q592 и L597, определенного относительно SEQ ID NO 1,
(ii) дополнительную замену одного или более чем одного аминокислотного остатка в одном или более чем одном Т-клеточном эпитопе, или
(iii) вместе (i) и (ii)
[0010] Другое воплощение данного изобретения относится к выделенному мутантному экзотоксину А псевдомонад (РЕ), который содержит последовательность следующей формулы:
R1n-FCS-R2n-R3n-функциональный домен РЕ III
в которой:
n равно 0 или 1 независимо для каждого из R1, R2 и R3,
R1 представляет собой от 1 до 10 аминокислотных остатков
FCS представляет собой фурин-расщепляемую последовательность аминокислотных остатков, которая расщепляется фурином и имеет амино-конец и карбоксильный конец,
R2 представляет собой от 1 до 10 аминокислотных остатков;
R3 представляет собой 1 или более смежных остатков среди остатков с 365 по 394 последовательности SEQ ID 1; а также,
Функциональный домен РЕ III представляет собой остатки с 395 по 613 последовательности SEQ ID NO 1, где РЕ включает аргинин в позиции 458, определенной относительно SEQ ID NO 1, и
где РЕ имеет:
(a) замену аланином аминокислотного остатка R427;
(b) замену аланином аминокислотного остатка R463;
(c) замену аланином аминокислотного остатка R467;
(d) замену аланином аминокислотного остатка R490;
(e) замену аланином аминокислотного остатка R505; и
(f) замену аланином аминокислотного остатка R538.
[0011] Дополнительные воплощения данного изобретения относятся к родственным химерным молекулам, а также родственным нуклеиновым кислотам, рекомбинантным экспрессионным векторам, клеткам-хозяевам, популяциям клеток и фармацевтическим композициям.
[0012] Еще одно воплощение данного изобретения относится к способу лечения или профилактики рака у млекопитающего, включающему введение млекопитающему РЕ, химерной молекулы, нуклеиновой кислоты, рекомбинантного экспрессионного вектора, клетки-хозяина, популяции клеток или фармацевтической композиции согласно изобретению в количестве, эффективном для лечения или профилактики рака у млекопитающего.
[0013] Еще одно воплощение данного изобретения относится к способу ингибирования роста клетки-мишени, включающему контактирование клетки с РЕ, химерной молекулой, нуклеиновой кислотой, рекомбинантным экспрессионным вектором, клеткой-хозяином, популяцией клеток или фармацевтической композицией согласно изобретению в количестве, эффективном для ингибирования роста клетки-мишени.
[0014] Дополнительные воплощения согласно данному изобретению относятся к способам получения РЕ согласно изобретению и способам получения химерной молекулы согласно изобретению.
Краткое описание графических материалов
[0015] На фиг. 1А и 1В представлены тепловые карты Т-клеточных эпитопов, показывающие наиболее сильные (более20%, черные квадраты), средней силы (от 10 до 20%, темно-серые квадраты), слабые (от 3% до 10%, светло-серые квадраты) и отрицательные (отсутствие реакции; менее 3%, белые квадраты) ответы наивных доноров (n равно 50) (А) и ранее лечившихся пациентов (n равно 16) (В). Ответы представлены в процентах реагирующих пятен для каждого донора. Ответы были сгруппированы путем автоматической сортировки на основе способности реагировать на пулы.
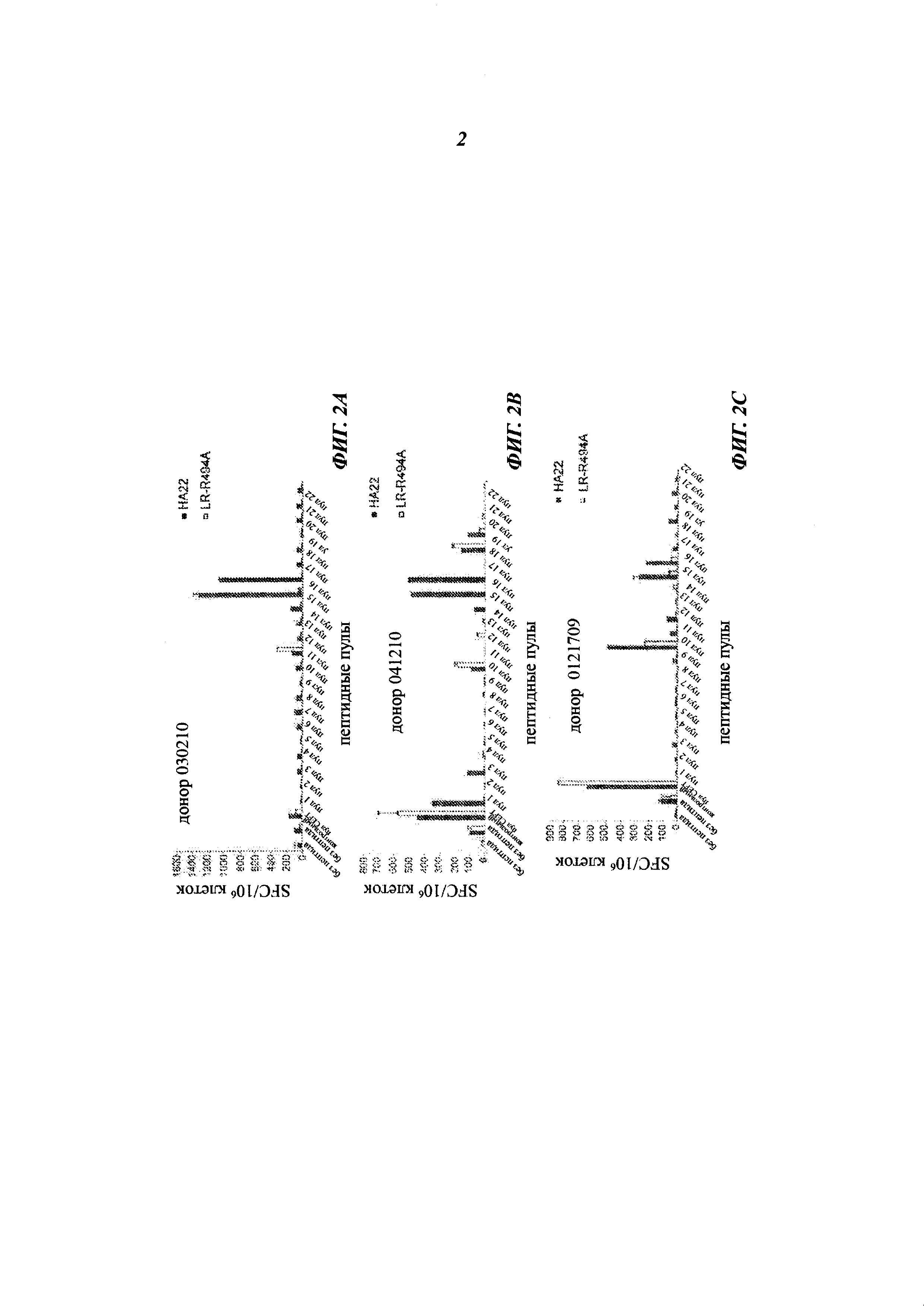
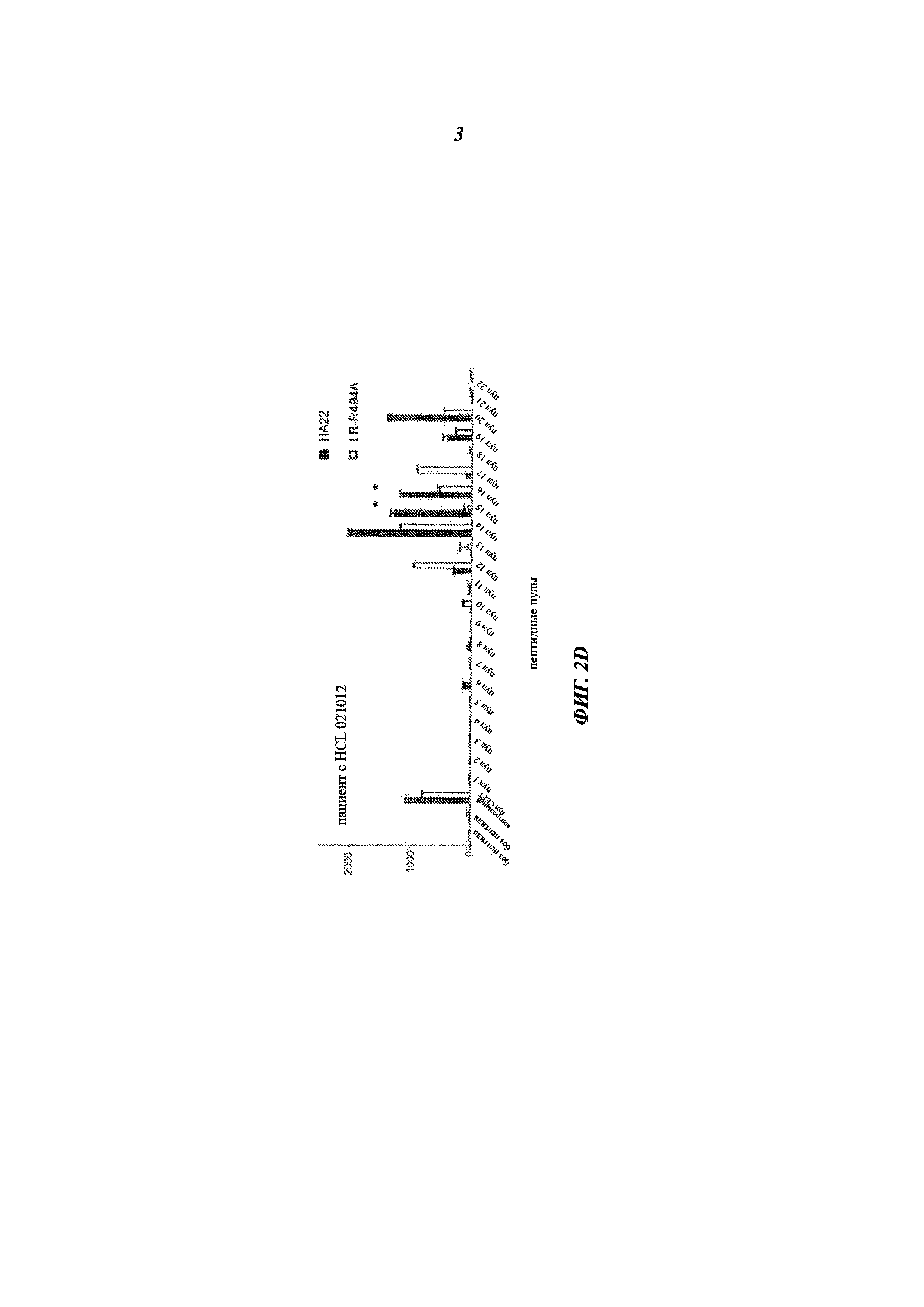
[0016] На фиг. 2A-2D изображены графики, показывающие реакцию трех донорских образцов (А-С) и одного образца от пациента с HCL (D) (от англ. Hairy Cell Leukaemia - волосатоклеточный лейкоз) на один из 22 пептидных пулов, контрольный пул (CEFT) или на отсутствие пептида после стимуляции НА22 (заштрихованные столбцы) или LR-R494A (незаштрихованные столбцы), измеренную в образующих пятна клетках (spot-forming cell, SFC) на 10×106 клеток. * указывает на статистическую значимость между НА22 и LR-R494A (рменее0,01).
[0017] На фиг. 3А-3С представлены графики, показывающие реакцию двух донорских образцов (А-В) и одного образца от пациента с HCL (С) на один из 22 пептидных пулов, CEFT или на отсутствие пептида после стимуляции НА22 (заштрихованные столбцы) или LR-R505A (незаштрихованные столбцы), измеренную в SFC на 10×106 клеток. * указывает на статистическую значимость (p менее0,01).
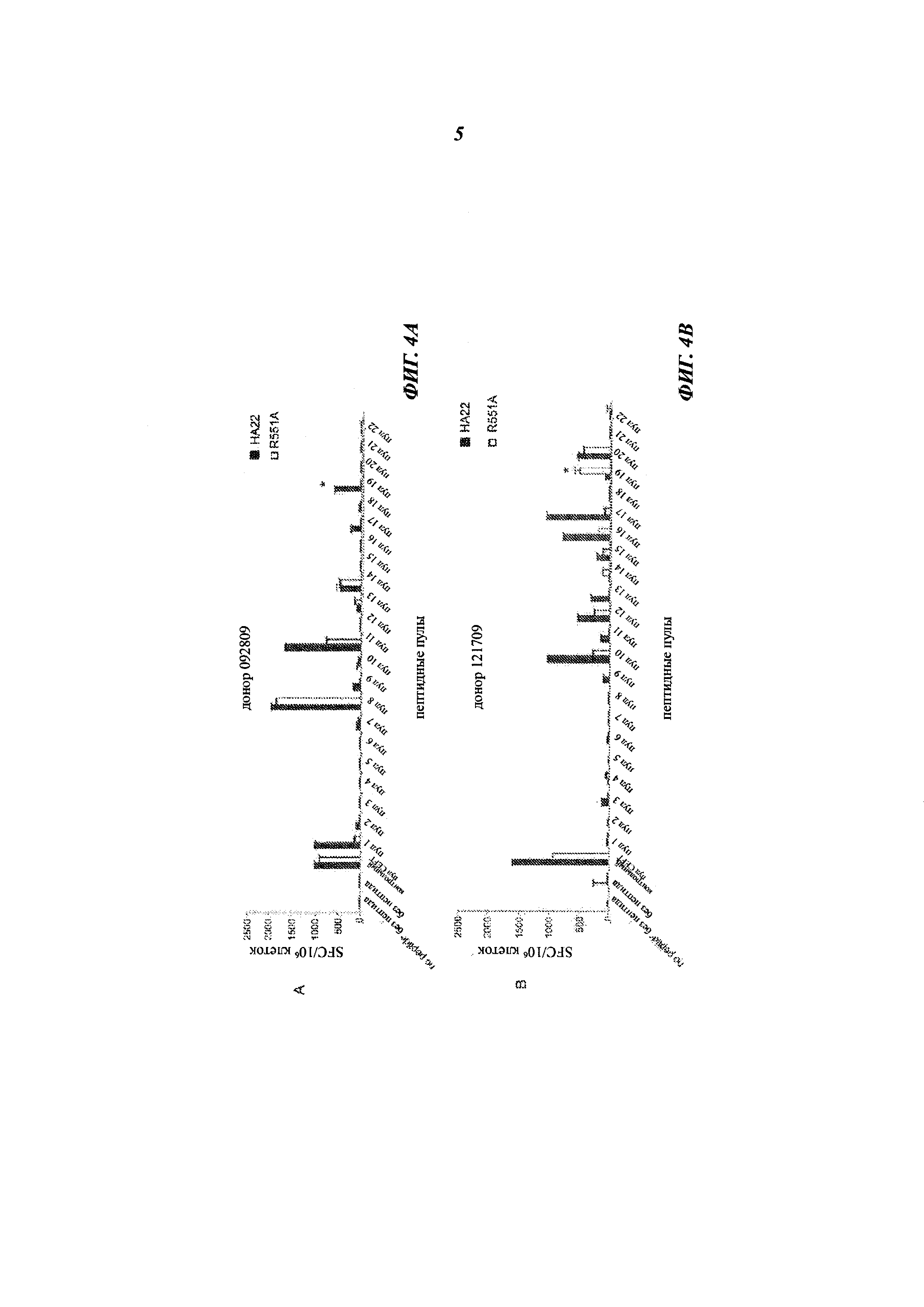
[0018] На фиг. 4А-4В представлены графики, показывающие реакцию двух донорских образцов (А-В) на один из 22 пептидных пулов, CEFT или на отсутствие пептида после стимуляции НА22 (заштрихованные столбцы) или LR-R551A (незаштрихованные столбцы), измеренную в SFC на 10×106 клеток. * указывает на статистическую значимость в t-тесте Стьюдента (рменее0,01).
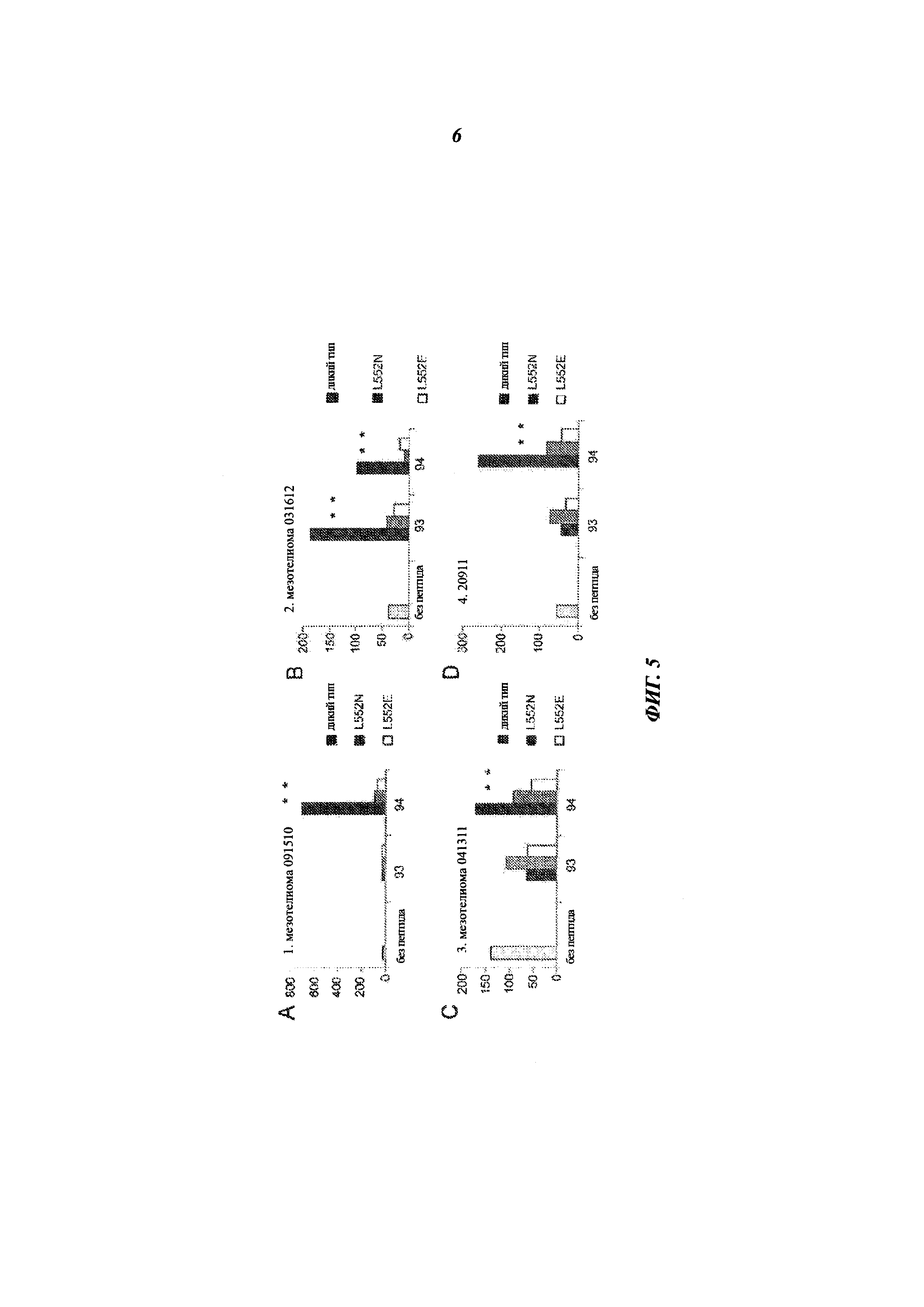
[0019] На фиг. 5A-5D представлены графики, показывающие реакцию двух донорских образцов (C-D) и двух образцов от пациентов с мезотелиомой (А-В) после стимуляции рекомбинантным иммунотоксином (RIT) и повторной стимуляции пептидом 93 или 94 с аминокислотной последовательностью дикого типа (WT) (черные столбцы), L552N (темно-серые столбцы) или L552E (незаштрихованные столбцы) или обработки без пептидов (светло-серые столбцы). * указывает на статистическую значимость в t-тесте Стьюдента (рменее0,05).
[0020] На фиг. 6А-6С представлены графики, показывающие реакцию трех донорских образцов на 22 пептидных пула после стимуляции либо HA22-LR (WT) (заштрихованные столбцы), либо LR-R427A (незаштрихованные столбцы) и повторной стимуляции соответствующими пептидами, измеренную в SFC на 10×106 клеток. * указывает на статистическую значимость (рменее0,05).
[0021] На фиг. 7А-7С представлены графики, показывающие реакцию двух образцов от пациентов (А-В) и одного донорского (С) на один из пулов с 8 по 22 после стимуляции либо HA22-LR (WT) (заштрихованные столбцы), либо LR-F443A (незаштрихованные столбцы) и повторной стимуляции соответствующими пептидами, измеренную в SFC на 10×106 клеток. * указывает на статистическую значимость (рменее0,01).
[0022] На фиг. 8 представлен график, показывающий кратное изменение ЕС50 при HA22-LR-GGS (круги), НА22 (вертикальная штриховка) или HA22-LR-T18 (треугольники) при различных температурах.
[0023] На фиг. 9A-9D представлены графики, показывающие реакцию четырех донорских образцов после стимуляции RIT и повторной стимуляции в отсутствие пептида, пептида WT 67 или пептида 67 с валином или аланином в позиции 471, измеренную в SFC на 10×106 клеток.
[0024] На фиг. 10А-10Е представлены графики, показывающие реакцию трех донорских образцов (А-С), образца от пациента с HCL (D) и образца от пациента с мезотелиомой (Е) после стимуляции пептидом 67 или 68, который содержит мутацию аланина (белые столбцы) или мутацию гистидина (серые столбцы) в позиции 477, или без мутации (WT) (черные столбцы).
[0025] На фиг. 11А и 11В представлены графики, демонстрирующие реакцию образцов от пациента с мезотелиомой (А) и пациента с волосатоклеточной лейкемией (hairy cell leukemia, HCL) (В) после стимуляции RIT и повторной стимуляции в отсутствие пептида, с пептидом 93, 94 или 95 либо с аминокислотной последовательностью WT (заштрихованные столбцы), либо с L556V (незаштрихованные столбцы).
[0026] На фиг. 12 представлен график, показывающий агрегацию (% площади) HMW cFP-0170 (Fab-LO10R-456A-короткий линкер, столбцы, заштрихованные по диагонали) или HMW cFP-0171 (Fab-LO10R-456А-удлиненный линкер; столбцы, заштрихованные горизонтально), измеренную путем эксклюзионной хроматографии (size exclusion chromatograph, SEC), после инкубации при 33°С.
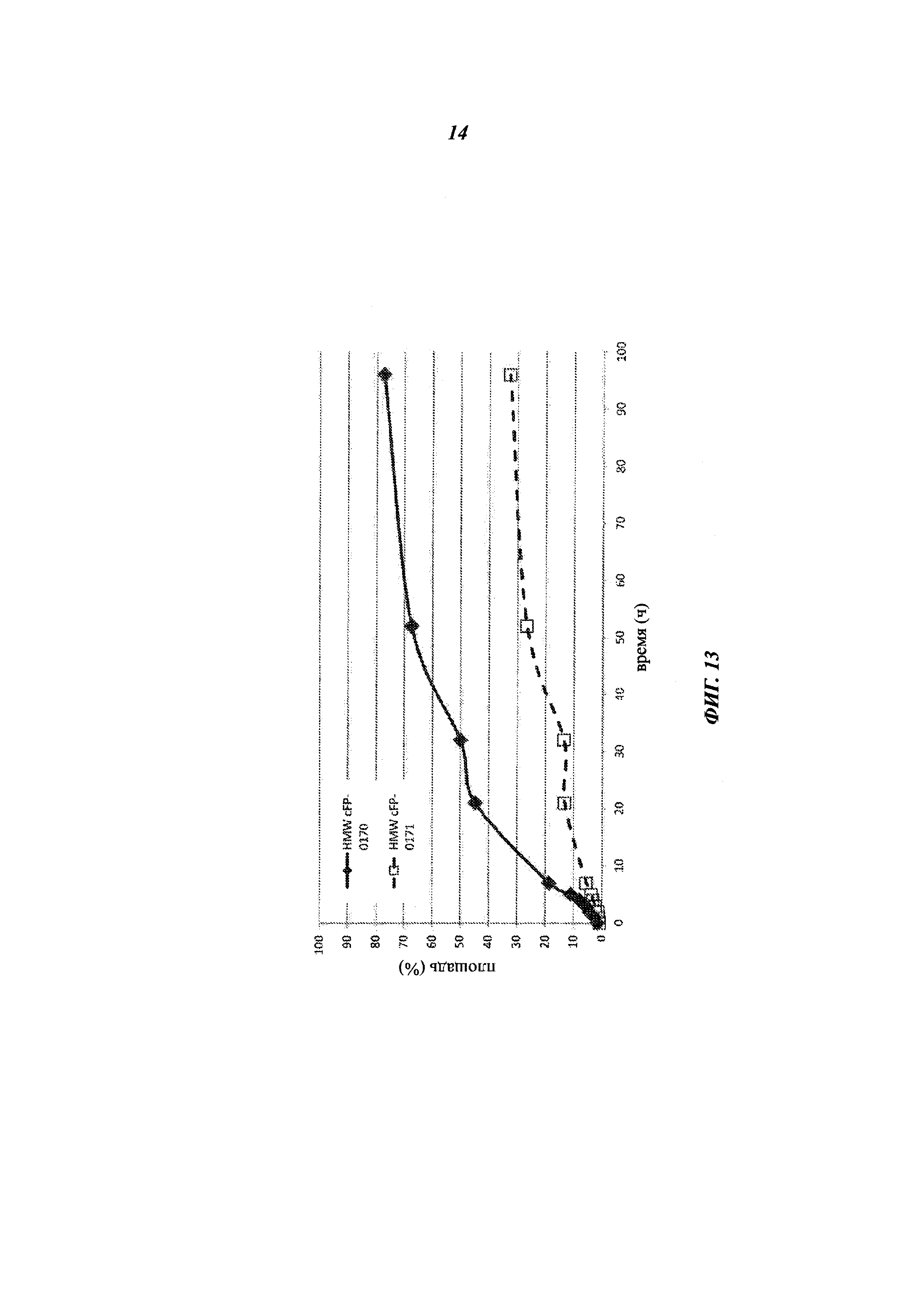
[0027] На фиг. 13 представлен график, показывающий агрегацию (% площади) HMW cFP-0170 (Fab-LO10R-456A-короткий линкер, ромбы) или HMW cFP-0171 (Fab-LO10R-456А-удлиненный линкер; квадраты), измеренную путем эксклюзионной хроматографии (SEC), после инкубации при 33°С.
[0028] На фиг. 14 представлен график, показывающий агрегацию (радиус в нм) cFP-0166 (Fab-LO10R-короткий линкер, ромбы) или cFP-0174 (Fab-LO10R-удиненный линкер; круги), измеренную с помощью динамического рассеяния света (dynamic light scattering, DLS) при различных температурах в диапазоне от 25°С до 50°С.
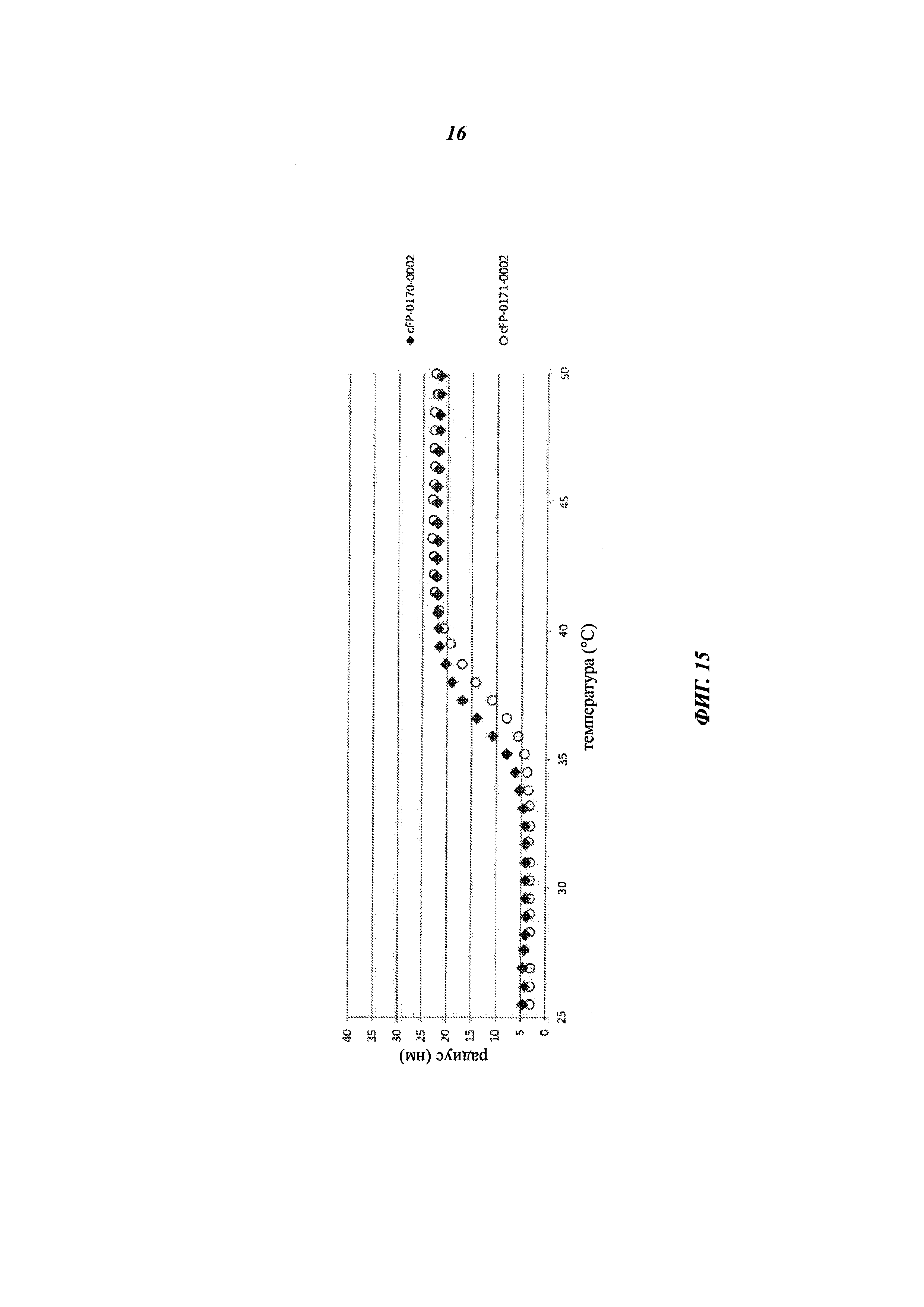
[0029] На фиг. 15 представлен график, показывающий агрегацию (радиус в нм) cFP-0170 (Fab-LO10R-короткий линкер, ромбы) или cFP-0171 (Fab-LO10R-456A-удлиненный линкер; круги), измеренную с помощью DLS при различных температурах в диапазоне от 25°С до 50°С.
[0030] На фиг. 16 представлен график, показывающий агрегацию (радиус в нм) cFP-0172 (Fab-LO10R-456A-551A-короткий линкер, ромбы) или cFP-0173 (Fab-LO10R-456A-551A-удиненный линкер; круги), измеренную с помощью DLS при различных температурах в диапазоне от 25°С до 50°С.
[0031] На фиг. 17 представлен график, показывающий реакцию сывороток пациентов клона 9НЗ на (107) или (108) фагов/лунку или (107) или (108) фагов/лунку с предварительной инкубацией с антигеном, где сыворотки инкубировали с huSS1Fab-PE24LRO10 (с мутацией 458А) (заштрихованные диагональю влево столбцы), huSS1Fab-PE24LRO10R (с обратной мутацией 458R) (заштрихованные горизонтально столбцы) или huSS1Fab-PE24LRO10R-456A (с обратной мутацией 458R и мутацией 456А) (заштрихованные диагональю вправо столбцы), измеренную по оптической плотности при 450 нм.
[0032] На фиг. 18А и 18В представлены графики, показывающие антигенность химерных молекул SS1P (Т1), SS1-dsFv-LR-LO10R (Т2), SS1-dsFv-LR-LO10R456A (Т3), SS1-FABLO10R (Roche 116, Т4), SS1-FABLO10R456A-длинный линкер (Roche 171, Т5) и SS1-FABLO10R-длинный линкер (Roche 174, Т6) в отношении 20 сывороток от пациентов. Показано два репрезентативных примера (А и В). Ось Y представляет относительную IC50 (%).
[0033] На фиг. 19 представлен график, показывающий плазменную концентрацию (нг/мл) химерных молекул SS1P38 (0,4 мг/кг (ромбы)), SS1P38 (0,2 мг/кг (квадраты)), Fab-PE24 (0,231 мг/кг (треугольники)), (dsFv-PE24 (0,16 мг/кг (х)), вводимых мышам в течение определенного периода времени (в часах (ч)).
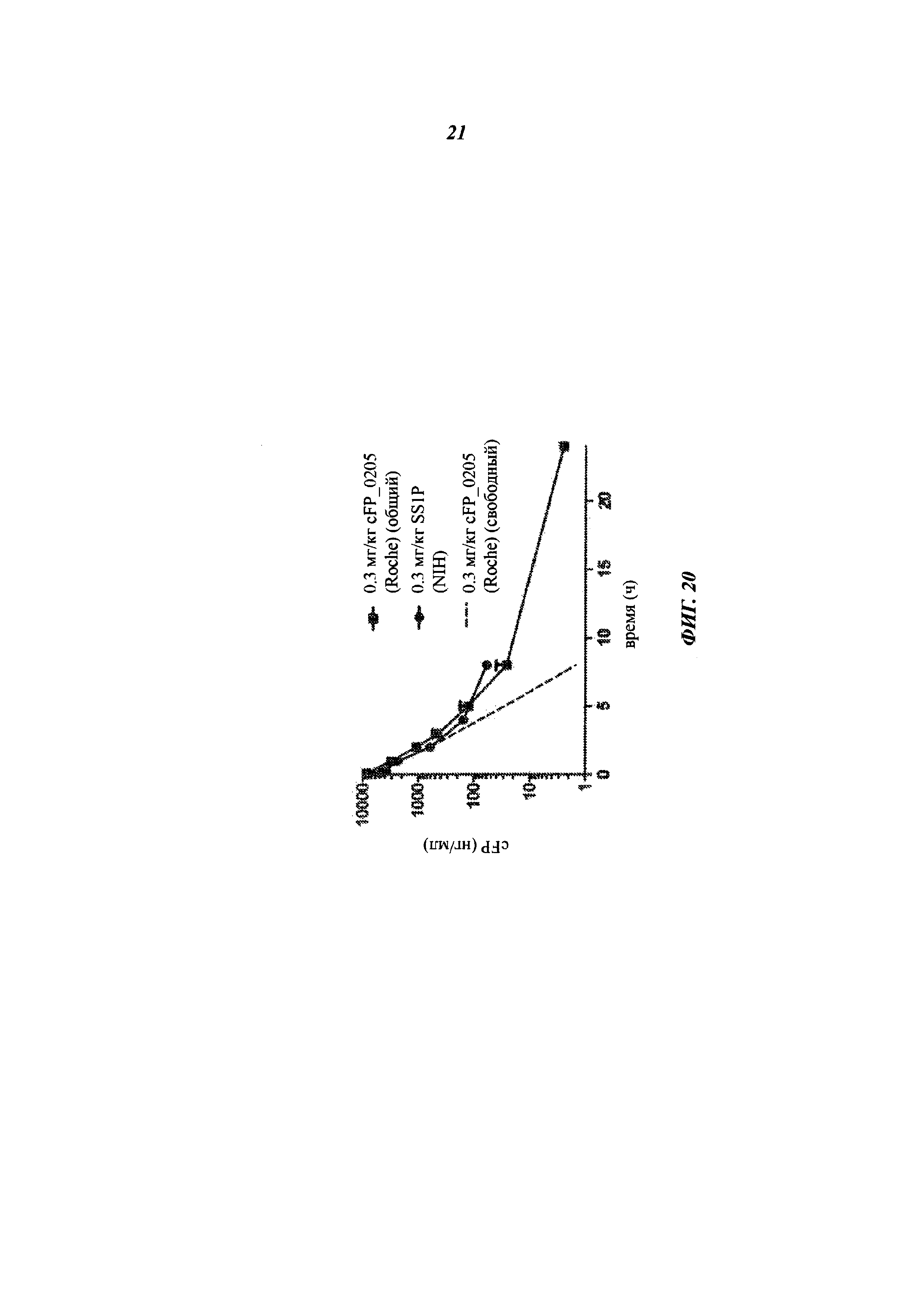
[0034] На фиг. 20 представлен график, показывающий период полужизни в сыворотке cFP (нг/мл) в дозе 0,3 мг/кг cFP_0205 (квадраты), 0,3 мг/кг SS1P (круги) или 0,3 мг/кг cFP_0205 (пунктирные линии) в течение определенного времени (часы) у яванских макак.
[0035] На фиг. 21 представлен график, показывающий изменение массы тела мышей, получавших контроль (носитель; круги); cFP 0205 3 мг/кг в/в 3q7d (квадраты на сплошной линии); cFP 0205 2 мг/кг в/в 3q7d (квадраты на линии с широким пунктиром); cFP 0205 1 мг/кг в/в 3q7d (квадраты на линии с коротким пунктиром); cFP0205 0,5 мг/кг в/в 3q7d (квадраты на линии с точечным пунктиром) с течением времени (дни после инокуляции клеток).
[0036] На фиг. 22A-F представлены флуоресцентные изображения срезов легких (А-В), селезенки (C-D) или печени (E-F) мышей, получавших меченый cFP0205, в 10× (А, С, Е) или 40× (В, D, F) увеличении.
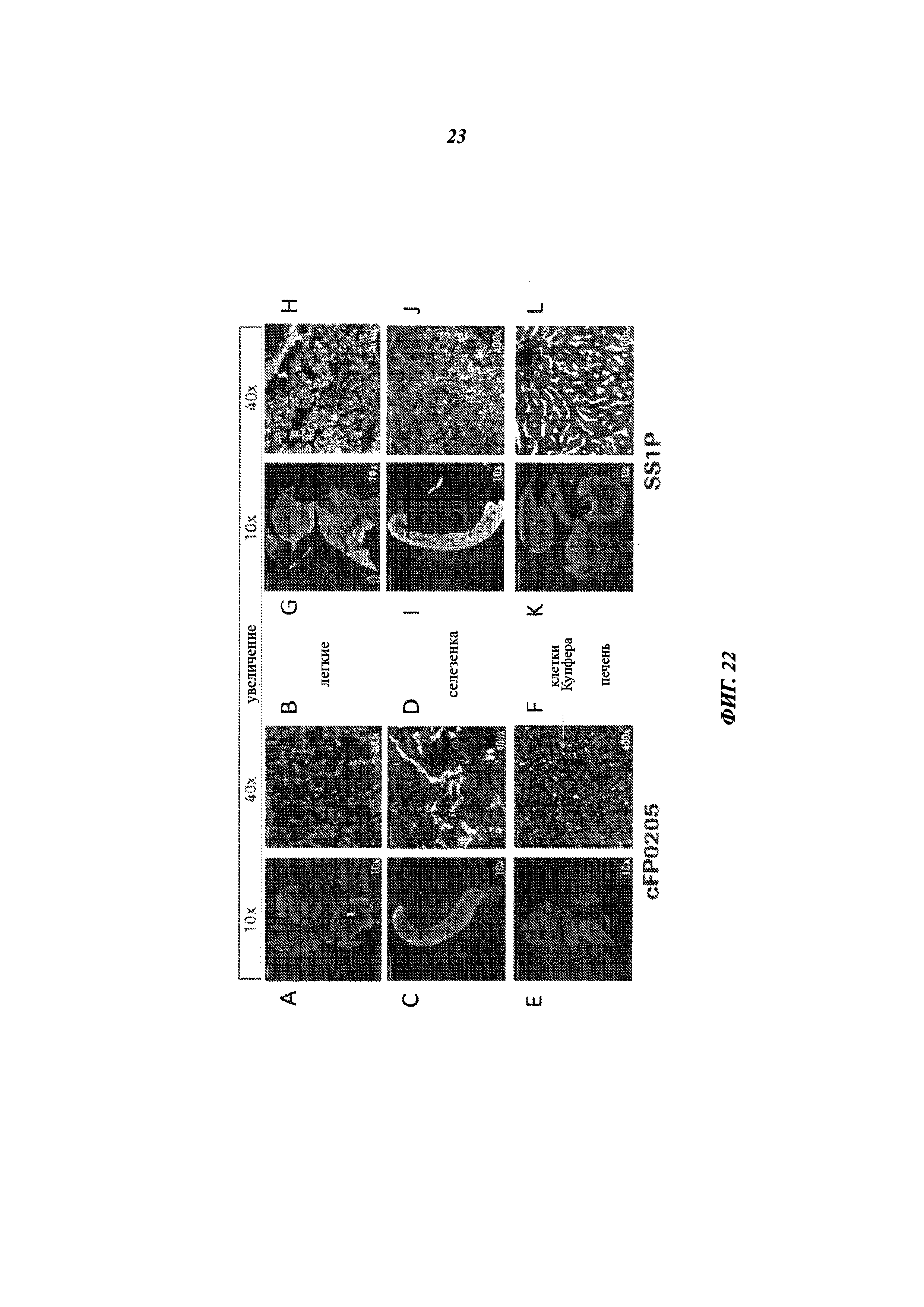
[0037] На фиг. 22G-L представлены флуоресцентные изображения срезов легких (G-H), селезенки (I-J) или печени (K-L) мышей, получавших меченый SS1P, в 10× (G, I, K) или 40× (Н, J, L) увеличении.
[0038] На фиг. 23 представлен график, показывающий размер опухоли у мышей, не подвергавшихся лечению (незаштрихованные ромбы) или получавших только паклитаксел (серые ромбы), только RG7787 (также называемый R205 или cFP 0205) (черные ромбы) или комбинацию RG7787 и паклитаксела (черно-белые ромбы) с течением времени, измеряемого в днях.
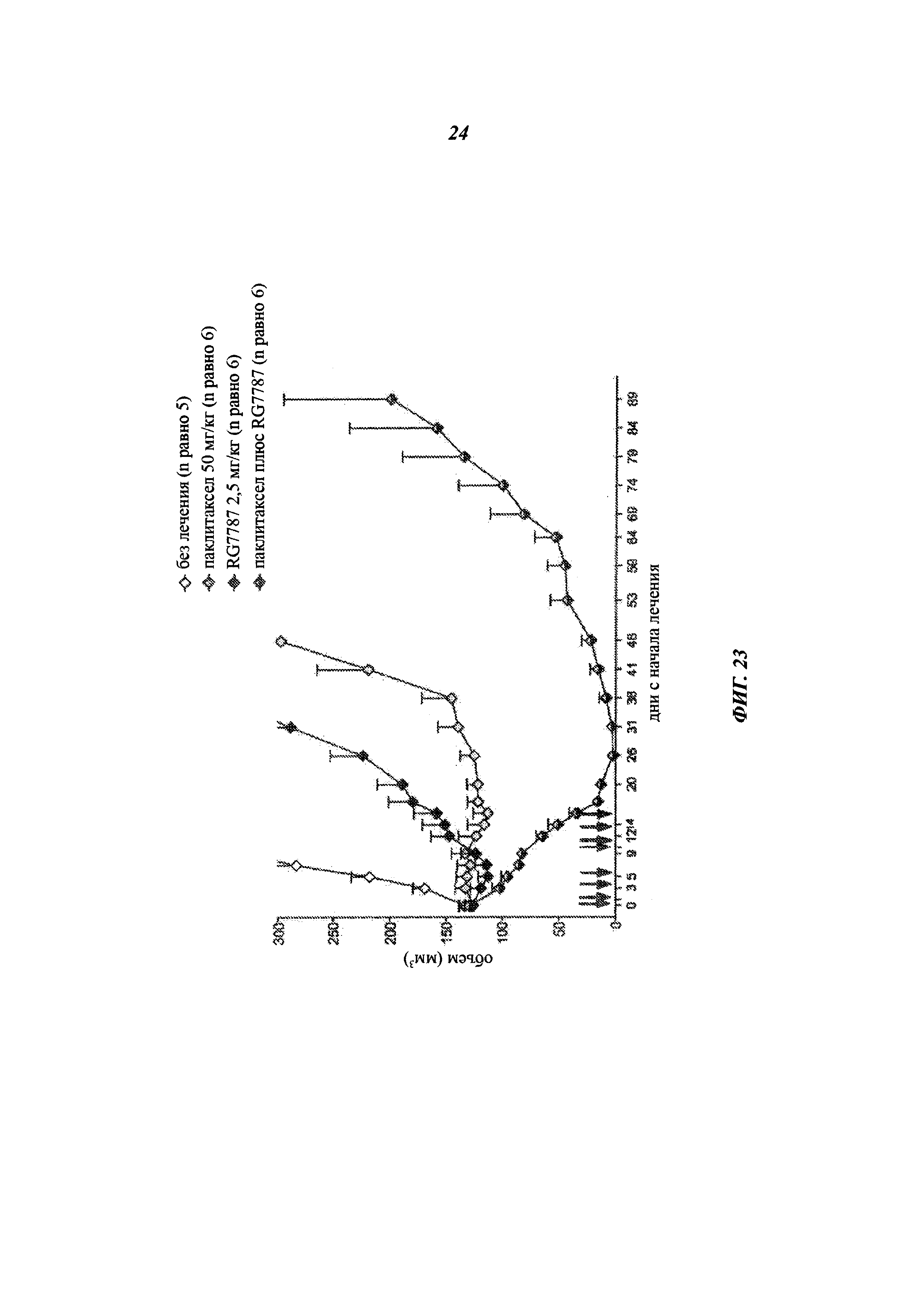
[0039] На фиг. 24 представлен график, показывающий размер опухоли у мышей, не подвергавшихся лечению (носитель) (круги) или получавших RG7787 (квадраты), с течением времени, измеряемого в днях. Каждая точка данных представляет собой среднее значение среднего объема опухоли для n равному 9 животных, получавших RG7787, и n равному 8 контрольных животных. Столбцы погрешности показывают стандартные отклонения.
[0040] На фиг. 25 представлен график, показывающий размер опухоли у мышей, получавших носитель (контроль) (круги), только RG7787 (квадраты), только паклитаксель (треугольники), либо комбинацию RG7787 и паклитаксела (ромбы), с течением времени, измеряемого в днях. Столбцы погрешности показывают стандартные отклонения.
[0041] На фиг. 26 представлен график, показывающий размер опухоли у мышей, не получавших лечение (untreated, UT) (x), или мышей, получавших только R205 (ромбы), комбинацию R205 и таксола (квадраты), либо только таксол (треугольники) с течением времени, измеряемого в днях.
[0042] На фиг. 27А представлен график, показывающий жизнеспособность (%) CD22-экспрессирующих клеточных линий, обработанных различными концентрациями Т18 или MP RIT (нг/мл).
[0043] На фиг. 27В представлен график, показывающий относительную цитотоксическую активность (%) Т18 или MP RIT, которые нагревали до одной из различных температур (°C).
[0044] На фиг. 27C-D представлены графики, показывающие цитотоксическую активность (IC50 (нг/мл)) для MP или Т18 RIT на клетках пациентов с волосатоклеточной лейкемией (HCL) (С) или хронической лимфоцитарной лейкемией (chronic lymphocytic leukemia, CLL) (D).
[0045] На фиг. 27E представлен график, показывающий влияние LMB-T18 на размер опухоли в мышиной модели с ксенотрансплантатом после четырех инъекций 5 мг/кг (квадраты) LMB-T18, трех инъекций 7,5 мг/кг (треугольники) LMB-T18 или 0,2% человеческого сывороточного альбумина в PBS (круги). Стрелки обозначают дни инъекции для всех групп. Прерывистая стрелка указывает на группу с дополнительной инъекцией 5 мг/мл. (*) Рболее0,01 в одностороннем анализе ANOVA. Столбцы погрешности показывают SD.
[0046] На фиг. 27F представлен график, показывающий % связывания MP, HA22-LR и LMB-T18 с сывороткой пациентов с нейтрализующими антителами к MP.
Подробное описание изобретения
[0047] Экзотоксин А псевдомонад ("РЕ") представляет собой бактериальный токсин (с молекулярной массой 66 кДа), секретируемый синегнойной палочкой Pseudomonas aeruginosa. Нативная последовательность РЕ дикого типа (SEQ ID NO 1) приведена в патенте США 5602095, который включен в данный документ посредством ссылки. Нативный РЕ дикого типа включает три структурных домена, которые способствуют цитотоксичности. Домен Ia (аминокислоты с 1 по 252) опосредует клеточное связывание, домен II (аминокислоты с 253 по 364) опосредует транслокацию в цитозоль, а домен III (аминокислоты с 400 по 613) опосредует АДФ-рибозилирование фактора элонгации 2. Хотя считается, что структурная граница домена III РЕ начинается с остатка 400, предполагается, что домену III может потребоваться сегмент домена Ib для сохранения АДФ-рибозилирующей активности. Соответственно, функциональный домен III определяется как остатки РЕ с 395 по 613. Функция домена Ib (аминокислоты с 365 по 399) остается неопределенной. Не связываясь с конкретной теорией или механизмом, полагают, что цитотоксическая активность РЕ происходит через ингибирование синтеза белка в эукариотических клетках, например, путем инактивации АДФ-рибозилирования фактора элонгации 2 (elongation factor 2, EF-2).
[0048] Замены в РЕ определяются в данном документе относительно аминокислотной последовательности РЕ. Таким образом, замены в РЕ описаны в данном документе относительно аминокислотного остатка, присутствующего в определенной позиции, с идущей далее аминокислотой, на которую был заменен остаток в конкретной обсуждаемой замене. В связи с этим позиции в аминокислотной последовательности в конкретном воплощении РЕ упоминаются в данном документе как позиции в аминокислотной последовательности согласно конкретному воплощению или как позиции, определенные относительно SEQ ID NO 1. Когда позиции являются такими, как определено в SEQ ID NO 1, фактические позиции аминокислотной последовательности согласно конкретному воплощению РЕ определяются относительно соответствующих позиций в SEQ ID NO 1 и могут представлять номера позиций остатков, отличающиеся от номеров позиций остатков в SEQ ID NO 1. Так, например, замены относятся к замене аминокислотного остатка в аминокислотной последовательности согласно конкретному воплощению РЕ, соответствующего указанной позиции в 613-аминокислотной последовательности SEQ ID NO 1, с пониманием того, что фактические позиция в соответствующих аминокислотных последовательностях могут отличаться. Например, когда позиции определены согласно SEQ ID NO 1, термин "R490" относится к аргинину, обычно присутствующему в позиции 490 SEQ ID NO 1, "R490A" указывает на то, что аргинин, обычно присутствующий в позиции 490 SEQ ID NO 1, заменен аланином, в то время как "K590Q" указывает на то, что лизин, обычно присутствующий в позиции 590 в SEQ ID NO 1, заменен глутамином. В случае многократных замен в двух или более позициях два или более заместителя могут быть одинаковыми или различными, т.е. каждый аминокислотный остаток из двух или более замещенных аминокислотных остатков может быть замещен таким же или другим аминокислотным остатком, если явно не указано иное.
[0049] Термины "экзотоксин псевдомонад" и "РЕ", используемые в данном изобретении, включают РЕ, который был модифицирован по сравнению с нативным белком для уменьшения или устранения иммуногенности. Такие модификации могут включать, но не ограничиваясь ими, удаление домена Ia, различные аминокислотные делеции в доменах Ib, II и III, одиночные аминокислотные замены и добавление одной или более чем одной последовательности на карбоксильном конце, например DEL и REDL (SEQ ID NO 7). См. Siegall et al. J. Biol. Chem., 264: 14256-14261 (1989). Такие модифицированные РЕ могут быть дополнительно модифицированы так, чтобы они включали любую из замен согласно изобретению в одном или более чем одном аминокислотном остатке в одном или более чем одном Т-клеточном и/или В-клеточном эпитопе, описанном в данном документе. В одном воплощении модифицированный РЕ может быть цитотоксическим фрагментом нативного РЕ дикого типа. Цитотоксические фрагменты РЕ могут включать те, которые являются цитотоксическими, с последующим протеолитическим или другим процессингом в клетке-мишени (например, в виде белка или пребелка) или без него. В предпочтительном воплощении цитотоксический фрагмент РЕ сохраняет по меньшей мере примерно 20%, предпочтительно по меньшей мере примерно 40%, более предпочтительно по меньшей мере примерно 50%, еще более предпочтительно по меньшей мере примерно 75%, более предпочтительно по меньшей мере примерно 90%, и еще более предпочтительно по меньшей мере примерно 95% цитотоксичности нативного РЕ. В особенно предпочтительных воплощениях цитотоксический фрагмент имеет по меньшей мере цитотоксичность нативного РЕ, а предпочтительно имеет повышенную цитотоксичность по сравнению с нативным РЕ.
[0050] Модифицированный РЕ, который уменьшает или устраняет иммуногенность, включает, например, РЕ4Е, РЕ40, РЕ38, РЕ25, PE38QQR, PE38KDEL и РЕ35. В одном из воплощений РЕ может быть любым из РЕ4Е, РЕ40, РЕ38, РЕ25, PE38QQR (в котором РЕ38 имеет последовательность QQR, добавленную на С-конце), PE38KDEL (в котором РЕ38 имеет последовательность KDEL (SEQ ID NO 5), добавленную на С-конце), PE-LR (устойчивость к лизосомальной деградации) (также упоминается как РЕ24), PE24-LO10 и РЕ35.
[0051] В одном воплощении РЕ модифицировали таким образом, чтобы уменьшить иммуногенность путем удаления домена Ia, как описано в патенте США N0 4892827, который включен в данный документ посредством ссылки. РЕ также может быть модифицирован путем замены определенных остатков домена Ia. В одном из воплощений РЕ может представлять собой РЕ4Е, который является замещенным РЕ, в котором присутствует домен Ia, но в котором основные остатки домена Ia в позициях 57, 246, 247 и 249 заменены кислотными остатками (например, глутаминовой кислотой), как описано в патенте США NO 5512658, который включен в данный документ посредством ссылки.
[0052] РЕ40 представляет собой усеченное производное PE (Pai et al., Proc. Nat 'I Acad. Sci. USA, 88: 3358-62 (1991) и Kondo et al., Biol. Chem., 263: 9470-9475 (1988)). PE35 представляет собой концевой карбоксильный фрагмент РЕ размером 35 кДа, в котором аминокислотные остатки 1-279 были удалены, а молекула начинается с Met в позиции 280, за которым следуют аминокислоты 281-364 и 381-613 нативного PE. РЕ35 и РЕ40 раскрыты, например, в патентах США NONO 5602095 и 4892827, каждый из которых включен в данный документ посредством ссылки. РЕ25 содержит фрагменты из 11 остатков из домена II и весь домен III. В некоторых воплощениях РЕ содержит только домен III.
[0053] В предпочтительном воплощении РЕ представляет собой РЕ38. РЕ38 содержит транслоцирующие и АДФ-рибозилирующие домены РЕ, но не часть, связывающуюся с клеткой (Hwang J. et al., Cell, 48: 129-136 (1987)). PE38 представляет собой усеченный пробелок РЕ, состоящий из аминокислот 253-364 и 381-613, который активируется в его цитотоксическую форму при процессинге внутри клетки (см., например, патент США N0 5608039, который включен в данный документ посредством ссылки, а также Pastan et al., Biochim. Biophys. Acta, 1333: C1-C6(1997)).
[0054] В другом предпочтительном воплощении изобретения РЕ представляет собой PE-LR. PE-LR содержит делецию домена II за исключением последовательности расщепления фурином (FCS), соответствующей аминокислотным остаткам с 274 по 284 в последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и делецию аминокислотных остатков с 365 по 394 домена Ib. Таким образом, PE-LR содержит аминокислотные остатки с 274 по 284 и с 395 по 613 последовательности SEQ ID NO 1. PE-LR описан в публикации международной патентной заявки WO 2009/032954, которая включена в данный документ посредством ссылки. PE-LR, возможно, может также содержать линкерный пептид GGS (SEQ ID NO 283) между FCS и аминокислотными остатками с 395 по 613 последовательности SEQ ID N0 1.
[0055] Как было отмечено выше, альтернативно или дополнительно часть или весь домен Ib может быть удален, а остальные части соединены мостиком или непосредственно пептидной связью. Альтернативно или дополнительно некторая часть амино-части домена II может быть удалена. Альтернативно или дополнительно С-конец может содержать нативную последовательность остатков с 609 по 613 (REDLK) (SEQ ID NO 6) или может содержать изменение, которая может поддерживать способность РЕ к транслокации в цитозоль, такое как KDEL (SEQ ID NO 5) или REDL (SEQ ID NO 7) и повторы этих последовательностей. См., например, патенты США 5854044; 5821238; и 5602095 и публикацию международной патентной заявки WO 1999/051643, которые включены в данный документ посредством ссылки. Любая форма РЕ, иммуногенность которой была устранена или уменьшена, может быть использована в сочетании с любой из замен согласно изобретению одного или более чем одного аминокислотного остатка в одном или более чем одном Т-клеточном и/или В-клеточном эпитопе, описанных в данном документе, до тех пор пока она сохраняет цитотоксичность по отношению к клеткам-мишеням, например, за счет транслокации и рибозилирования EF-2 в клетке-мишени.
[0056] Воплощение данного изобретения относится к экзотоксину А псевдомонад (РЕ), содержащему аминокислотную последовательность РЕ, в которой один или более чем один из аминокислотных остатков F443, R456, L477, R494 и L552, которые определены относительно SEQ ID NO 1, независимо от других является замещенным, где РЕ, возможно, имеет:
(i) дополнительную замену одного или более чем одного аминокислотного остатка в одном или более чем одном В-клеточном эпитопе, и эта дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой замену, независимо от других, одного или более чем одного из аминокислотных остатков D403, D406, R412, R427, Е431, R432, D461, R463, R467, R490, R505, R513, Е522, R538, Е548, R551, R576, Q592 и L597, определенных относительно SEQ ID NO 1,
(ii) дополнительную замену одного или более чем одного аминокислотного остатка в одном или более чем одном Т-клеточном эпитопе,
(iii) делецию одного или более чем одного из смежных аминокислотных остатков среди остатков с 1 по 273 и с 285 по 394, определенных относительно SEQ ID NO 1, или
(iv) сочетание любого одного, двух или трех из (i)-(iii).
[0057] Было обнаружено, что аминокислотные остатки F443, L477, R494 и L552 расположены в пределах одного или более чем одного Т-клеточного эпитопа РЕ. Таким образом, замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 может преимущественно удалить один или более чем один Т-клеточный эпитоп(ы). Соответственно, РЕ согласно изобретению может преимущественно быть менее иммуногенным, чем незамещенный РЕ (например, дикого типа).
[0058] Предпочтительное воплощение данного изобретения относится к выделенному мутантному экзотоксину А псевдомонад (РЕ), который содержит последовательность следующей формулы:
R1n-FCS-R2n-R3n-функциональныый домен РЕ III
в которой:
n равно 0 или 1 независимо для каждого из R1, R2 и R3,
R1 представляет собой от 1 до 10 аминокислотных остатков
FCS представляет собой фурин-расщепляемую последовательность аминокислотных остатков, которая расщепляется фурином и имеет амино-конец и карбоксильный конец,
R2 представляет собой от 1 до 10 аминокислотных остатков;
R3 представляет собой 1 или более смежных остатков среди остатков с 365 по 394 последовательности SEQ ID 1; а также,
функциональный домен РЕ III представляет собой остатки с 395 по 613 последовательности SEQ ID NO 1,
где один или более чем один из аминокислотных остатков F443, L477, R494 и L552, определенных относительно SEQ ID NO 1, независимо от других является замещенным,
а РЕ, возможно, дополнительно включает еще одну замену аминокислоты в одном или более чем одном В-клеточном эпитопе.
[0059] Замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 может представлять собой замену любого аминокислотного остатка одним или более чем одним из аминокислотных остатков F443, L477, R494 и L552. В одном из воплощений согласно изобретению замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену, независимо от других, аланином, глутаминовой кислотой, гистидином или аспарагином одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552. В одном из воплощений согласно изобретению замена L552 представляет собой замену L552 глутаминовой кислотой или аспарагином, а замена L477 представляет собой замену L477 гистидином.
[0060] В одном из воплощений согласно изобретению замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443; замену гистидином аминокислотного остатка L477; замену аланином аминокислотного остатка R494; и замену глутаминовой кислотой или аспарагином аминокислотного остатка L552.
[0061] В дополнение к замене (заменам) одного или более чем одного аминокислотного остатка в одном или более чем одном Т-клеточном эпитопе РЕ, описанном в данном документе, РЕ согласно изобретению, возможно, также может включать дополнительную замену(ы) одного или более чем одного аминокислотного остатка в одном или более чем одном В-клеточном эпитопе SEQ ID NO 1. В связи с этим в одном из воплощений согласно изобретению РЕ имеет замену одной или более чем одной аминокислоты в одном или более чем одном В-клеточном эпитопе SEQ ID NO: 1. В предпочтительном воплощении согласно данному изобретению замена одного или более чем одного аминокислотного остатка в одном или более чем одном В-клеточном эпитопе SEQ ID NO 1 включает замену аланином, глицином, серином или глутамином одной или более чем одной аминокислоты в одном или более чем одном В-клеточном эпитопе SEQ ID NO 1. Замена(ы) в пределах одного или более чем одного В-клеточного эпитопа может, преимущественно, дополнительно уменьшать иммуногенность за счет удаления одного или более чем одного В-клеточного эпитопа. Замена(ы) может быть расположена в пределах любого подходящего В-клеточного эпитопа РЕ. Примеры В-клеточных эпитопов описаны, например, в публикациях международных патентных заявок WO 2007/016150, WO 2009/032954 и WO 2011/032022, каждая из которых включена в данный документ посредством ссылки. В предпочтительном воплощении замена одной или более чем одной аминокислоты в одном или более чем одном В-клеточном эпитопе SEQ ID NO 1 представляет собой замену аланином, глицином, серином или глутамином, независимо от других, одного или более чем одного из аминокислотных остатков Е282, Е285, Р290, R313, N314, Р319, D324, Е327, Е331, Q332, D403, D406, R412, R427, Е431, R432, D461, D463, R467, Y481, R490, R505, R513, L516, Е522, R538, Е548, R551, R576, K590, Q592 и L597, где аминокислотные остатки Е282, Е285, Р290, R313, N314, Р319, D324, Е327, Е331, Q332, D403, D406, R412, R427, Е431, R432, D461, D463, R467, Y481, R490, R505, R513, L516, Е522, R538, Е548, R551, R576, K590, Q592 и L597, определенных относительно SEQ ID NO 1.
[0062] В одном из воплощений согласно изобретению дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой замену, независимо от других, аланином, глицином, серином или глутамином одного или более чем одного из аминокислотных остатков Е282, Е285, Р290, R313, N314, Р319, D324, Е327, Е331, Q332, D403, D406, R412, R427, Е431, R432, D461, R463, R467, R490, R505, R513, Е522, R538, Е548, R551, R576, K590, Q592, и L597, определенных относительно SEQ ID NO 1. Предпочтительно дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой замену, независимо от других, аланином, глицином или серином одного или более чем одного из аминокислотных остатков R427, R505 и R551. В особенно предпочтительном воплощении замена одного или более чем одного из аминокислотных остатков F443, R456, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443, замену гистидином L477, замену аланином R494 и замену глутаминовой кислотой L552, и дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427; и (b) замену аланином аминокислотного остатка R505, определенного относительно SEQ ID NO 1.
[0063] В одном из воплощений согласно изобретению любой из РЕ, описанных в данном документе, может иметь аргинин в позиции 458 относительно SEQ ID NO 1. Не связываясь с конкретной теорией или механизмом, полагают, что аргинин в позиции 458 связан с повышенной цитотоксичностью.
[0064] В одном из воплощений согласно изобретению РЕ имеет остаток аргинина в позиции 458, определенной относительно SEQ ID NO 1. В предпочтительном воплощении замена одного или более чем одного из аминокислотных остатков F443, R456, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка R456, РЕ имеет остаток аргинина в позиции 458, и дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427; (b) замену аланином аминокислотного остатка R463; (с) замену аланином аминокислотного остатка R467; (d) замену аланином аминокислотного остатка R490; (е) замену аланином аминокислотного остатка R505; и (f) замену аланином аминокислотного остатка R538; которые определены относительно SEQ ID NO 1.
[0065] В одном из воплощений согласно изобретению замена одного или более чем одного из аминокислотных остатков F443, R456, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443; замену аланином аминокислотного остатка R456; замену гистидином аминокислотного остатка L477; замену аланином аминокислотного остатка R494; и замену глутаминовой кислотой аминокислотного остатка L552, РЕ имеет остаток аргинина в позиции 458, и дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427; (b) замену аланином аминокислотного остатка R463; (с) замену аланином аминокислотного остатка R467; (d) замену аланином аминокислотного остатка R490; (е) замену аланином аминокислотного остатка R505; и (f) замену аланином аминокислотного остатка R538; которые определены относительно SEQ ID NO 1.
[0066] В одном из воплощений согласно изобретению замена одного или более чем одного из аминокислотных остатков F443, R456, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка R456, РЕ имеет остаток аргинина в позиции 458, и дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427; (b) замену аланином аминокислотного остатка R463; (с) замену аланином аминокислотного остатка R467; (d) замену аланином аминокислотного остатка R490; (е) замену аланином аминокислотного остатка R505; и (f) замену аланином аминокислотного остатка R538; которые определены относительно SEQ ID NO 1.
[0067] В другом воплощении согласно данному изобретению замена одного или более чем одного из аминокислотных остатков F443, R456, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443; замену аланином аминокислотного остатка R456; замену гистидином аминокислотного остатка L477; замену аланином аминокислотного остатка R494; и замену аспарагином аминокислотного остатка L552, РЕ имеет остаток аргинина в позиции 458, и дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427; (b) замену аланином аминокислотного остатка R463; (с) замену аланином аминокислотного остатка R467; (d) замену аланином аминокислотного остатка R490; (е) замену аланином аминокислотного остатка R505; и (f) замену аланином аминокислотного остатка R538; которые определены относительно SEQ ID NO 1.
[0068] В предпочтительном воплощении согласно данному изобретению замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443; замену гистидином аминокислотного остатка L477; замену аланином аминокислотного остатка R494; и замену глутаминовой кислотой аминокислотного остатка L552, РЕ имеет остаток аргинина в позиции 458, и дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427; (b) замену аланином аминокислотного остатка R456; (с) замену аланином аминокислотного остатка R463; (d) замену аланином аминокислотного остатка R467; (е) замену аланином аминокислотного остатка R490; (f) замену аланином аминокислотного остатка R505; и (g) замену аланином аминокислотного остатка R538; которые определены относительно SEQ ID NO 1. Предпочтительное воплощение представляет собой РЕ, который содержит SEQ ID NO 285 (T14-L010R+456A).
[0069] В предпочтительном воплощении согласно данному изобретению замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443; замену гистидином аминокислотного остатка L477; замену аланином аминокислотного остатка R494; и замену аспарагином аминокислотного остатка L552, РЕ имеет остаток аргинина в позиции 458, и дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427; (b) замену аланином аминокислотного остатка R456; (с) замену аланином аминокислотного остатка R463; (d) замену аланином аминокислотного остатка R467; (е) замену аланином аминокислотного остатка R490; (f) замену аланином аминокислотного остатка R505; и (g) замену аланином аминокислотного остатка R538; которые определены относительно SEQ ID NO 1. Предпочтительное воплощение представляет собой РЕ, который содержит SEQ ID NO 286 (T15-L010R+456A).
[0070] В предпочтительном воплощении согласно данному изобретению замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443; замену гистидином аминокислотного остатка L477; замену аланином аминокислотного остатка R494; и замену глутаминовой кислотой аминокислотного остатка L552, РЕ имеет остаток аргинина в позиции 458, и дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427; (b) замену аланином аминокислотного остатка R463; (с) замену аланином аминокислотного остатка R467; (d) замену аланином аминокислотного остатка R490; (е) замену аланином аминокислотного остатка R505; и (f) замену аланином аминокислотного остатка R538; которые определены относительно SEQ ID NO 1. Предпочтительное воплощение представляет собой РЕ, который содержит SEQ ID NO 287 (T14-L010R).
[0071] В предпочтительном воплощении согласно данному изобретению замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443; замену гистидином аминокислотного остатка L477; замену аланином аминокислотного остатка R494; и замену аспарагином аминокислотного остатка L552, РЕ имеет остаток аргинина в позиции 458, и дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427; (b) замену аланином аминокислотного остатка R463; (с) замену аланином аминокислотного остатка R467; (d) замену аланином аминокислотного остатка R490; (е) замену аланином аминокислотного остатка R505; и (f) замену аланином аминокислотного остатка R538; которые определены относительно SEQ ID NO 1. Предпочтительное воплощение представляет собой РЕ, который содержит SEQ ID NO 288 (T15-L010R).
[0072] В предпочтительном воплощении FCS представляет собой фурин-расщепляемую последовательность (furin cleavage sequence, FCS), соответствующую аминокислотным остаткам 274-284 SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)).
[0073] В предпочтительном воплощении
n равно 1 для R1 и R2,
R1 представляет собой линкер аминокислотной последовательности SEQ ID NO 282 (DKTHKASGG),
R2 представляет собой линкер аминокислотной последовательности SEQ ID NO 284 (GGGGGS), и
FCS представляет собой фурин-расщепляемую последовательность (FCS), соответствующая аминокислотным остаткам 274-284 SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)). В особенно предпочтительном воплощении n равен 0 для R3.
[0074] В одном из воплощений согласно изобретению РЕ имеет дополнительную замену аминокислоты в одном или более чем одном Т-клеточном эпитопе. В связи с этим РЕ может содержать аминокислотную последовательность, имеющую дополнительную замену любой аминокислотой одного или более чем одного из аминокислотных остатков в позициях R421, L422, L423, А425, R427, L429, Y439, Н440, F443, L444, А446, А447, I450, 463-519, R551, L552, Т554, I555, L556 и W558, определенных относительно SEQ ID NO 1. В одном из воплощений согласно изобретению дополнительная замена любой аминокислотой одного или более чем одного из аминокислотных остатков в позициях R421, L422, L423, А425, R427, L429, Y439, Н440, F443, L444, А446, А447, I450, 463-519, R551, L552, Т554, I555, L556 и W558 представляет собой замену одного или более чем одного из аминокислотных остатков в позициях R421, L422, L423, А425, R427, L429, Y439, Н440, F443, L444, А446, А447, i450, Y470, I471, А472, Р475, А476, L477, I493, R494, N495, L498, L499, R500, V501, Y502, V503, R505, L508, Р509, R551, L552, Т554, I555, L556 и W558.
[0075] Замена одного или более чем одного из аминокислотных остатков в позициях R421, L422, L423, А425, R427, L429, Y439, Н440, F443, L444, А446, А447, I450, 463-519, R551, L552, Т554, I555, L556 и W558 SEQ ID NO 1 может представлять собой замену любым аминокислотным остатком аминокислотного остатка в одной или более чем одной из позиций R421, L422, L423, А425, R427, L429, Y439, Н440, F443, L444, А446, А447, I450, 463-519, R551, L552, Т554, I555, L556 и W558 SEQ ID NO 1. Замена одного или более чем одного из аминокислотных остатков в позициях R421, L422, L423, А425, R427, L429, Y439, Н440, F443, L444, А446, А447, I450, 463-519, R551, L552, Т554, I555, L556 и W558 SEQ ID NO 1 может включать, например, замену аланином, глицином, серином или глутамином одного или более чем одного из аминокислотных остатков в позициях 421, 422, 423, 425, 427, 429, 439, 440, 443, 444, 446, 447, 450, 463, 464, 465, 466, 467, 468, 469, 470, 471, 472, 473, 474, 475, 476, 477, 478, 479, 480, 481, 482, 483, 484, 485, 486, 487, 488, 489, 490, 491, 492, 493, 494, 495, 496, 497, 498, 499, 500, 501, 502, 503, 504, 505, 506, 507, 508, 509, 510, 511, 512, 513, 514, 515, 516, 517, 518, 519, 551, 552, 554, 555, 556 и 558 в SEQ ID NO 1. В предпочтительном воплощении замена одного или более чем одного из аминокислотных остатков в позициях R421, L422, L423, А425, R427, L429, Y439, Н440, F443, L444, А446, А447, I450, 463-519, R551, L552, Т554, I555, L556 и W558 SEQ ID NO 1 представляет собой замену аланином, глицином, серином или глутамином одного или более чем одного из аминокислотных остатков R421, L422, L423, А425, R427, L429, Y439, Н440, F443, L444, А446, А447, I450, Y470, I471, А472, Р475, А476, L477, I493, R494, N495, L498, L499, R500, V501, Y502, V503, R505, L508, Р509, R551, L552, Т554, I555, L556 и W558. Одна или более чем одна замена в одном или более чем одном Т-клеточном эпитопе, находящаяся в позициях R421, L422, L423, А425, R427, L429, Y439, Н440, F443, L444, А446, А447, I450, 463-519, R551, L552, Т554, I555, L556 и W558 РЕ, определенных относительно SEQ ID NO 1, может дополнительно снижать иммуногенность РЕ. В одном из воплощений аминокислотная последовательность не имеет замен одного или более чем одного из аминокислотных остатков в позициях 427, 467, 485, 490, 505, 513, 516 и 551.
[0076] Предпочтительно РЕ содержит одну или более чем одну замену, которая повышает цитотоксичность, как описано, например, в публикации международной патентной заявки WO 2007/016150, которая включена в данный документ посредством ссылки. В связи с этим воплощение данного изобретения относится к РЕ с заменой одной аминокислоты в одном или более чем одном В-клеточном эпитопе SEQ ID NO 1, и данная замена аминокислоты в одном или более чем одном В-клеточном эпитопе SEQ ID NO 1 представляет собой замену валином, лейцином или изолейцином аминокислотного остатка R490, где аминокислотный остаток R490 определен относительно SEQ ID NO 1. В одном из воплощений согласно изобретению замена аланином или глутамином одного или более чем одного из аминокислотных остатков в позициях 313, 327, 331, 332, 431, 432, 505, 516, 538 и 590, определенных относительно SEQ ID NO 1, может дать РЕ с увеличенной цитотоксичностью, как описано, например, в публикации международной патентной заявки WO 2007/016150, которая включена в данный документ посредством ссылки. Повышение цитотоксической активности и снижение иммуногенности могут происходить одновременно и не являются взаимоисключающими. Замены, которые одновременно повышают цитотоксическую активность и снижают иммуногенность, такие как замена R490 глицином или, более предпочтительно, аланином, являются особенно предпочтительными.
[0077] В одном из воплощений согласно изобретению другое воплощение данного изобретения относится к выделенному мутантному экзотоксину А псевдомонад (РЕ), который содержит последовательность следующей формулы:
R1n-FCS-R2n-R3n-функциональный домен РЕ III
в которой:
n равно 0 или 1 независимо для каждого из R1, R2 и R3,
R1 представляет собой от 1 до 10 аминокислотных остатков
FCS представляет собой фурин-расщепляемую последовательность аминокислотных остатков, которая расщепляется фурином и имеет амино-конец и карбоксильный конец,
R2 представляет собой от 1 до 10 аминокислотных остатков;
R3 представляет собой 1 или более смежных остатков среди остатков с 365 по 394 последовательности SEQ ID 1; а также,
функциональный домен РЕ III представляет собой остатки с 395 по 613 последовательности SEQ ID NO 1, где один или более чем один из аминокислотных остатков F443, R456, L477, R494 и L552, определенных относительно SEQ ID NO 1, независимо от других является замещенным, где РЕ, возможно, имеет:
(i) дополнительную замену одного или более чем одного аминокислотного остатка в одном или более чем одном В-клеточном эпитопе, и эта дополнительная замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой, независимо от других, замену одного или более чем одного из аминокислотных остатков D403, D406, R412, R427, Е431, R432, D461, R463, R467, R490, R505, R513, Е522, R538, Е548, R551, R576, Q592 и L597, определенных относительно SEQ ID NO 1,
(ii) дополнительную замену одного или более чем одного аминокислотного остатка в одном или более чем одном Т-клеточном эпитопе, или
(iii) вместе (i) и (ii).
[0078] Другое воплощение согласно изобретению относится к выделенному мутантному экзотоксину А псевдомонад (РЕ), который содержит последовательность следующей формулы:
R1n-FCS-R2n-R3n-функциональный домен РЕ III
в которой:
n равно 0 или 1 независимо для каждого из R1, R2 и R3,
R1 представляет собой от 1 до 10 аминокислотных остатков
FCS представляет собой фурин-расщепляемую последовательность аминокислотных остатков, которая расщепляется фурином и имеет амино-конец и карбоксильный конец,
R2 представляет собой от 1 до 10 аминокислотных остатков;
R3 представляет собой 1 или более смежных остатков среди остатков с 365 по 394 последовательности SEQ ID 1; а также,
функциональный домен РЕ III представляет собой остатки с 395 по 613 последовательности SEQ ID NO 1, где РЕ включает остаток аргинина в позиции 458, определенной относительно SEQ ID NO 1, и
где РЕ имеет:
(a) замену аланином аминокислотного остатка R427;
(b) замену аланином аминокислотного остатка R463;
(c) замену аланином аминокислотного остатка R467;
(d) замену аланином аминокислотного остатка R490;
(e) замену аланином аминокислотного остатка R505; и
(f) замену аланином аминокислотного остатка R538.
[0079] В одном из воплощений согласно изобретению n равен 0 для R1 и R2 формулы I. В другом воплощении согласно данному изобретению n равен 1 для R1 и R2. В одном из воплощений согласно изобретению, когда n равен 0 для R1 и R2, РЕ формулы I может дополнительно содержать линкерный пептид GGS (SEQ ID NO 283) между последовательностью расщепления фурином (FCS) и функциональным доменом III РЕ.
[0080] Не связываясь с конкретной теорией или механизмом, полагают, что РЕ, содержащие FCS, подвергаются протеолитическому процессингу внутри клетки-мишени, таким образом, активируя цитотоксическую активность токсина. FCS РЕ согласно изобретению могут содержать любую подходящую фурин-расщепляемую последовательность аминокислотных остатков, где указанная последовательность может быть расщеплена фурином. Примеры фурин-расщепляемых последовательностей описаны в Duckert et al., Protein Engineering, Design & Selection, 17(1):107-112 (2004) и в публикации международной патентной заявки WO 2009/032954, оба документа включены в данный документ посредством ссылки. В одном из воплощений согласно изобретению FCS содержит остатки с 274 по 284 последовательности SEQ ID NO 1 (т.е. RHRQPRGWEQL (SEQ ID NO 8)), где замена аминокислоты в одном или более чем одном из В-клеточных эпитопов SEQ ID NO 1 представляет собой замену аланином, глицином, серином или глутамином аминокислотного остатка Е282 SEQ ID NO 1. Другие подходящие аминокислотные последовательности FCS включают, но не ограничиваясь ими: R-X1-X2-R, где X1 представляет собой любую природную аминокислоту, и Х2 представляет собой любую природную аминокислоту (SEQ ID NO 9), RKKR (SEQ ID NO 10), RRRR (SEQ ID NO 11), RKAR (SEQ ID NO 12), SRVARS (SEQ ID NO 13), TSSRKRRFW (SEQ ID NO 14), ASRRKARSW (SEQ ID NO 15), RRVKKRFW (SEQ ID NO 16), RNVVRRDW (SEQ ID NO 17), TRAVRRRSW (SEQ ID NO 18), RQPR (SEQ ID NO 19), RHRQPRGW (SEQ ID NO 20), RHRQPRGWE (SEQ ID NO 21), HRQPRGWEQ (SEQ ID NO 22), RQPRGWE (SEQ ID NO 23), RHRSKRGWEQL (SEQ ID NO 24), RSKR (SEQ ID NO 25), RHRSKRGW (SEQ ID NO 26), HRSKRGWE (SEQ ID NO 27), RSKRGWEQL (SEQ ID NO 28), HRSKRGWEQL (SEQ ID NO 29), RHRSKR (SEQ ID NO 30), и R-X1-X2-R, где X1 представляет собой любую природную аминокислоту, а Х2 представляет собой аргинин или лизин (SEQ ID NO 4).
[0081] В еще одном воплощении согласно данному изобретению функциональный домен III РЕ содержит остатки с 395 по 613 последовательности SEQ ID NO 1, где один или более чем один из аминокислотных остатков F443, R456, L477, R494 и L552, определенных относительно SEQ ID NO 1, независимо от других является замещенным. Аминокислотные остатки F443, R456, L477, R494 и L552 могут быть замещены, как описано в данном документе в отношении других аспектов изобретения.
[0082] В одном из воплощений согласно изобретению FCS представлен формулой Р4-Р3-Р2-Р1, в которой Р4 представляет собой аминокислотный остаток на амино-конце, Р1 представляет собой аминокислотный остаток на карбоксильном конце, Р1 представляет собой остаток аргинина или лизина, и последовательность может расщепляться на карбоксильном конце Р1 фурином.
[0083] В другом воплощении согласно данному изобретению FCS (i) также содержит аминокислотные остатки, представленные Р6-Р5, на амино-конце, (ii) также содержит аминокислотные остатки, представленные Р1'-Р2', на карбоксильном конце, (iii) где если Р1 представляет собой остаток аргинина или лизина, то Р2' представляет собой триптофан, а Р4 представляет собой аргинин, валин или лизин, при условии, что если Р4 не является аргинином, то Р6 и Р2 являются основными остатками, и (iv) последовательность может расщепляться на карбоксильном конце Р1 фурином.
[0084] В еще одном воплощении изобретения функциональный домен III РЕ состоит из последовательности остатков с 395 по 613 последовательности SEQ ID NO 1.
[0085] В еще одном воплощении согласно данному изобретению мутантный РЕ содержит между FCS и доменом III РЕ один или более чем один из смежных остатков с 365 по 394 последовательности SEQ ID NO 1.
[0086] Аспекты для разработки химерных молекул экзотоксина псевдомонад в качестве противораковых агентов включают их цитотоксичность в отношении опухолевых клеток, их иммуногенность в отношении человеческих В-клеток и человеческих Т-клеток, а также их термостабильность. Термостабильность может быть полезна для разработки фармацевтических составов или композиций.
[0087] Таким образом, в одном аспекте согласно данному изобретению было обнаружено, что путем введения мутации R456A вместо R458A можно удалить все В-клеточные эпитопы из РЕ без существенного снижения его цитотоксичности в отношении опухолевых клеток (в случае, если другие Т-клеточные эпитопы не удаляются последующими заменами). Таким образом, впервые предложен РЕ, в котором все В-клеточные эпитопы полностью удалены, и который сохраняет свою цитотоксическую активность.
[0088] Воплощение данного изобретения относится к выделенному мутантному экзотоксину А псевдомонад (РЕ), который содержит последовательность следующей формулы:
R1n-FCS-R2n-R3n-функциональный домен III РЕ
в которой:
n равно 0 или 1 независимо для каждого из R1, R2 и R3,
R1 представляет собой от 1 до 10 аминокислотных остатков
FCS представляет собой фурин-расщепляемая последовательность аминокислотных остатков, которая расщепляется фурином и имеет амино-конец и карбоксильный конец,
R2 представляет собой от 1 до 10 аминокислотных остатков;
R3 представляет собой 1 или более смежных остатков среди остатков с 365 по 394 последовательности SEQ ID 1; а также
функциональный домен III РЕ представляет собой остатки с 395 по 613 последовательности SEQ ID NO 1, и где РЕ имеет:
(a) замену аланином аминокислотного остатка R427;
(b) замену аланином аминокислотного остатка R463;
(c) замену аланином аминокислотного остатка R467;
(d) замену аланином аминокислотного остатка R490;
(e) замену аланином аминокислотного остатка R505
(f) замену аланином аминокислотного остатка R538; и
(g) замену аланином аминокислотного остатка R456.
[0089] В предпочтительном воплощении FCS представляет собой фурин-расщепляемую последовательность, соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)).
[0090] В предпочтительном воплощении
n равно 1 для R1 и R2,
R1 представляет собой линкер аминокислотной последовательности SEQ ID NO 282 (DKTHKASGG),
R2 представляет собой линкер аминокислотной последовательности SEQ ID NO 284 (GGGGGS), и
FCS представляет собой фурин-расщепляемую последовательность (FCS), соответствующая аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)). В особенно предпочтительном воплощении n равен 0 для R3.
[0091] В предпочтительном воплощении функциональный домен III РЕ включает аминокислотную последовательность SEQ ID NO 37.
[0092] Воплощение данного изобретения относится к выделенному мутантному экзотоксину А псевдомонад (РЕ), который содержит последовательность следующей формулы:
R1n-FCS-R2n-R3n-функциональный домен III РЕ
в которой:
n равно 0 или 1 независимо для каждого из R1, R2 и R3,
R1 представляет собой от 1 до 10 аминокислотных остатков
FCS представляет собой фурин-расщепляемую последовательность аминокислотных остатков, которая расщепляется фурином и имеет амино-конец и карбоксильный конец,
R2 представляет собой от 1 до 10 аминокислотных остатков;
R3 представляет собой 1 или более смежных остатков среди остатков с 365 по 394 последовательности SEQ ID 1; а также
функциональный домен III РЕ представляет собой остатки с 395 по 613 последовательности SEQ ID NO 1, где РЕ включает аргинин в позиции 458, определенной относительно SEQ ID NO 1.
[0093] РЕ согласно изобретению может быть менее иммуногенным, чем незамещенный РЕ в соответствии с данным изобретением, если иммунный ответ на РЕ согласно изобретению количественно или качественно уменьшается по сравнению с иммунным ответом на незамещенный РЕ. Количественное снижение иммуногенности включает уменьшение величины или степени иммунного ответа. Величина или степень иммуногенности могут быть измерены на основании любого числа известных параметров, таких как снижение уровня продукции цитокина (например, антигенспецифического цитокина) (концентрации цитокина), уменьшение числа активированных лимфоцитов (например, пролиферации лимфоцитов (например, антигенспецифических лимфоцитов)) или привлеченных лимфоцитов и/или снижение продукции антител (антигенспецифических антител) и т.д. Качественное снижение иммуногенности охватывает любое изменение в отношении природы иммунного ответа, которое приводит к иммунному ответу, менее эффективному в опосредовании снижения цитотоксической активности РЕ. Способы измерения иммуногенности известны в данной области. Например, измеряя типы и уровни продуцируемых цитокинов, может измерять иммуногенность. Альтернативно или дополнительно, измеряя связывание РЕ с антителами (например, антителами, ранее подвергшимися воздействию РЕ) и/или измеряя способность РЕ индуцировать антитела при введении млекопитающему (например, людям, мышам и/или мышам, у которых мышиная иммунная система заменена человеческой иммунной системой), можно измерять иммуногенность. Менее иммуногенный РЕ может быть охарактеризован снижением продукции цитокинов, таких как любой один или более чем один из IFN-γ, TNF-a и гранзим В, и/или сниженной стимуляцией клеточно-опосредованного иммунного ответа, например, снижением пролиферации и активации Т-клеток и/или макрофагов, специфических для РЕ, по сравнению с результатами, полученными с незамещенным РЕ. Альтернативно или дополнительно, менее иммуногенный РЕ может характеризоваться увеличением продукции TGF-β и/или IL-10 по сравнению с результатами, полученными с незамещенным РЕ. В предпочтительном воплощении снижение иммуногенности характеризуется одним или более чем одним эффектом среди уменьшения стимуляции Т-клеток, уменьшения пролиферации Т-клеток, а также уменьшения Т-клеточной секреции IFN-γ и/или гранзима В. Альтернативно или дополнительно, менее иммуногенный РЕ может характеризоваться уменьшением стимуляции и/или активации В-клеток, специфичных для РЕ, по сравнению результатами, полученными с незамещенным РЕ. Например, менее иммуногенный РЕ может характеризоваться снижением дифференцировки В-клеток в плазматические клетки, секретирующие антитела, и/или в клетки памяти по сравнению с результатами, полученными с незамещенным РЕ. Снижение иммуногенности может быть охарактеризовано любым одним или более чем одним явлением среди уменьшения стимуляции В-клеток, уменьшения пролиферации В-клеток, а также уменьшения секреции анти-РЕ-антител. Качественное и количественное уменьшение иммуногенности могут происходить одновременно и не являются взаимоисключающими.
[0094] Специалисты в данной области легко поймут, что РЕ согласно изобретению могут быть модифицированы любым числом способов таким образом, чтобы терапевтическая или профилактическая эффективность РЕ согласно изобретению увеличивалась за счет модификации. Например, РЕ согласно изобретению могут быть конъюгированы или слиты либо непосредственно, либо опосредованно через линкер со специфической группировкой (нацеливающим агентом). В связи с этим воплощение данного изобретения относится к химерной молекуле, содержащей (а) специфическую группировку, конъюгированную или слитую с (b) любым из РЕ согласно изобретению, описанных в данном документе. Практика конъюгированных соединений, например, РЕ согласно изобретению, с специфическими группировками известна в данной области. См, например, Wadwa et al., J. Drug Targeting, 3: 111 (1995) и патент США NO 5087616. В одном воплощении любой из РЕ согласно изобретению, описанных в данном документе, может не иметь специфической группировки. В одном воплощении любой из РЕ согласно изобретению, описанных в данном документе, может иметь любую из специфических группировок, имеющих любую из последовательностей, описанных в данном документе.
[0095] Термин "специфическая группировка" ("нацеливающий агент"), используемый в данном документе, относится к любой молекуле или агенту, который специфически распознает и связывает маркер клеточной поверхности таким образом, что специфическая группировка направляет доставку РЕ согласно изобретению в популяцию клеток, на поверхности которых экспрессируется рецептор. Специфические группировки включают, но не ограничиваясь ими, антитела (например, моноклональные антитела) или их фрагменты, пептиды, гормоны, факторы роста, цитокины, а также любые другие природные или неприродные лиганды, такие как, например, платформенные антигенсвязывающие белки.
[0096] Платформенные антигенсвязывающие белки известны в данной области. Например, фибронектин и сконструированные белки с анкириновыми повторами (DARPin) были использованы в качестве альтернативных платформ для антигенсвязывающих доменов, см., например, Gebauer and Skerra, Curr. Opin. Chem. Biol., 13:245-255 (2009) и Stumpp et al., Drug Discov. Today, 13:695-701 (2008), обе публикации включены в данный документ посредством ссылки во всей их полноте.
[0097] В одном воплощении платформенный антигенсвязывающий белок выбран из группы, включающей CTLA-4 (фирма Evibody), липокалин, молекулы-производные белка А, например, Z-домен белка А (фирма Affibody, SpA), А-домен (фирма Avimer, Maxibody), белки теплового шока, например, GroE1 и GroES, трансферрин (трансантитело), белок с анкириновыми повторами (DARPin), пептидный аптамер, домен лектина С-типа (тетранектин), человеческий у-кристаллин и человеческий убиквитин (аффилины); домены PDZ; токсин скорпиона; домены типа kunitz ингибиторов протеазы человека; и фибронектин (аднектин), который подвергли белковой инженерии для получения связывания с лигандом, отличным от природного лиганда.
[0098] CTLA-4 (цитотоксический Т-лимфоцит-ассоциированный антиген 4) представляет собой рецептор семейства CD28, экспрессируемый в основном CD4+ Т-клетками. Его внеклеточный домен имеет складку типа вариабельного домена Ig. Петли, соответствующие участкам CDR (гипервариабельный участок, от англ. complementarity determining regions) антител, могут быть замещены гетерологичной последовательностью для придания различных связывающих свойств. Молекулы CTLA-4, сконструированные так, чтобы они имели различную специфичность связывания, также известны как Evibodies. Для получения более подробной информации см. J. Immunol. Methods, 248(1-2): 31-45 (2001).
[0099] Липокалины представляют собой семейство внеклеточных белков, которые переносят небольшие гидрофобные молекулы, такие как стероиды, билины, ретиноиды и липиды. Они имеют жесткую вторичную структуру бета-листа с некоторым количеством петель на открытом конце конической структуры, которую можно сконструировать таким образом, чтобы она связывала различные антигены-мишени. Антикалины содержат от 160 до 180 аминокислот и являются производными липокалинов. Для получения более подробной информации см. Biochim. Biophys. Acta., 1482: 337-350 (2000), US 7250297 B1 и US 20070224633.
[0100] Белок-миметик антитела (affibody, "аффитело") представляет собой платформу, полученную из белка A Staphylococcus aureus, которая может быть сконструирована для связывания с антигеном. Домен включает трехспиральный пучок длиной приблизительно 58 аминокислот. Библиотеки были получены путем рандомизации поверхностных остатков. Для получения более подробной информации см. Protein Eng. Des. Sel., 17: 455-462 (2004) и EP 1641818A1. Авимеры (avimer) представляют собой полидоменные белки, полученные из платформы семейства А-доменов. Нативные домены длиной приблизительно 35 аминокислот принимают определенную структуру, связанную дисульфидными мостиками. Разнообразие образуется за счет перетасовки природных вариантов, демонстрируемых семейством А-доменов. Для получения более подробной информации см. Nature Biotechnology, 23(12): 1556-1561 (2005) и Expert Opinion on Investigational Drugs, 16(6): 909-917(2007).
[0101] Трансферрин представляет собой мономерный сывороточный транспортный гликопротеин. Трансферрины можно сконструировать таким образом, чтобы они связывались с различными антигенами-мишенями, за счет введения пептидных последовательностей в наружные петли, доступные для встраивания. Примеры сконструированных трансферриновых платформ включают трансантитело. Для получения более подробной информации см. J. Biol. Chem., 274: 24066-24073(1999).
[0102] Сконструированные белки с анкириновыми повторами (белки DARP) являются производными анкиринов, которые представляют собой семейство белков, которые опосредуют прикрепление интегральных мембранных белков к цитоскелету. Один анкириновый повтор представляет собой мотив длиной 33 остатка, состоящий из двух альфа-спиралей и бета-изгиба. Их можно сконструировать таким образом, чтобы они связывались с различными антигенами-мишенями, за счет рандомизации остатков в первой альфа-спирали и бета-изгибе каждого повтора. Поверхность их связывания может быть увеличена за счет увеличения числа модулей (способ созревания аффинности). Для получения более подробной информации см. J. Mol. Biol., 332: 489-503 (2003); PNAS, 100(4): 1700-1705 (2003); J. Mol. Biol., 369, 1015-1028 (2007); и публикацию заявки на патент США 20040132028 А1.
[0103] Фибронектин представляет собой платформу, которую можно сконструировать таким образом, чтобы она связывалась с антигеном. Аднектины содержат остов из природной аминокислотной последовательности 10-го домена, состоящей из 15 повторяющихся единиц человеческого фибронектина типа III (FN3). Три петли на одном конце бета-сэндвича можно сконструировать таким образом, чтобы дать возможность аднектину специфически распознавать терапевтическую мишень, представляющую интерес. Для получения более подробной информации см. Protein Eng. Des. Sel., 18: 435- 444 (2005), публикацию заявки на патент США 20080139791, публикацию заявки на международный патент WO 2005056764 и патент США 6818418 В1.
[0104] Пептидные аптамеры представляет собой комбинаторные распознающие молекулы, которые включают постоянный платформенный белок, как правило, тиоредоксин (TrxA), который содержит вариабельную пептидную петлю с ограниченной конформационной свободой, вставленную на активном участке. Для получения более подробной информации см. Expert Opin. Biol. Ther., 5: 783-797 (2005).
[0105] Микроантитела являются производными природных микробелков длиной от 25 до 50 аминокислот, которые содержат от 3 до 4 цистеиновых мостика. Примеры микробелков включают KalataBI, конотоксин и кноттины. В микробелках есть петля, которую можно сконструировать таким образом, чтобы она включала до 25 аминокислот, не влияя на общее сворачивание микробелка. Для получения более подробной информации см. публикацию заявки на международный патент WO 2008098796.
[0106] Другие антигенсвязывающие белки включают белки, которые были использованы в качестве платформы для конструирования антигенсвязывающих свойств в отношении различных антигенов, включая человеческий гамма-кристаллин и человеческий убиквитин (аффилины), домены типа kunitz ингибиторов протеазы человека, домены PDZ Ras-связывающего белка AF-6, токсины скорпиона (чарибдотоксин) и домен лектина С-типа (тетранектин). См. главу 7 "Non-Antibody Scaffolds" в Handbook of Therapeutic Antibodies (2007, под редакцией Stefan Dubel) и Protein Science, 15:14-27 (2006). Эпитопсвязывающие домены согласно данному изобретению могут быть получены из любого из этих альтернативных белковых доменов.
[0107] Термин "антитело", используемый в данном документе, относится к целым (также известным как "интактные") антителам или их антигенсвязывающим частям, которые сохраняют способность распознавать и связывать антиген. Антитело или его антигенсвязывающие части могут представлять собой антитело или его антигенсвязывающую часть природного происхождения, например, антитело или его антигенсвязывающую часть, выделенную и/или очищенную из млекопитающего, например, мыши, кролика, козы, лошади, курицы, хомяка, человека и т.д. Антитело или его антигенсвязывающая часть может находиться в мономерной или полимерной форме. Кроме того, антитело или его антигенсвязывающая часть может иметь любой уровень аффинности или авидности в отношении маркера клеточной поверхности. При желании антитело или его антигенсвязывающая часть могут быть специфичными к маркеру клеточной поверхности, так что перекрестная реакция с другими пептидами или белками минимальна.
[0108] Антитело может быть моноклональным или поликлональным и может относиться к любому изотипу, например, IgM, IgG (например, IgG, IgG2, IgG3 или IgG4), IgD, IgA или IgE. Определяющие комплементарность области (complementarity determining region, CDR) антитела или одноцепочечные вариабельные фрагменты (Fv) антитела против поверхностного маркера клетки-мишени могут быть привиты или введены генно-инженерным способом в антитело выбора для придания этому антителу специфичности к поверхностному маркеру клетки-мишени. Например, CDR антитела против поверхностного маркера клетки-мишени могут быть привиты в каркасный участок человеческого антитела известной трехмерной структуры (см., например, публикации международных патентных заявок WO 1998/045322 и WO 1987/002671, патенты США 5859205; 5585089; и 4816567; публикацию европейской патентной заявки 0173494; Jones et al., Nature, 321:522 (1986); Verhoeyen et al., Science, 239: 1534 (1988), Riechmann et al., Nature, 332:323 (1988); и Winter & Milstein, Nature, 349: 293 (1991)) с образованием антител, которые могут почти не повышать или не вызывать иммуногенную реакцию при введении человеку. В предпочтительном воплощении специфическая группировка представляет собой моноклональное антитело или антигенсвязывающую часть моноклонального антитела.
[0109] Антигенсвязывающая часть может быть любой частью, которая имеет по меньшей мере один антигенсвязывающий сайт, такой как, например, вариабельные области или CDR интактного антитела. Примеры антигенсвязывающих частей антител включают, но не ограничиваясь ими, тяжелую цепь, легкую цепь, вариабельную или константную область тяжелой или легкой цепи, одноцепочечный вариабельный фрагмент (scFv) или Fc-, Fab-, Fab'-, Fv- или F(ab)2'-фрагмент; однодоменные антитела (см., например, Wesolowski, Med Microbiol Immunol., 198(3): 157-74 (2009); Saerens et al., Curr. Opin. Pharmacol., 8(5):600-8 (2008); Harmsen and de Haard, Appl. Microbiol. Biotechnol., 77(1): 13-22 (2007), спирально-стабилизированные антитела (см., например, Arndt et al., J. Mol. Biol., 312: 221-228 (2001); тримерные антитела; димерные антитела (публикация заявки на европейский патент 0404097; публикация заявки на международный патент WO 1993/011161; и Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993)); молекулы одноцепочечных антител ("scFv", см., например, патент США 5888773); антитела, стабилизированные дисульфидными мостиками ("dsFv", см., например, патент США 5747654 и 6558672) и доменные антитела ("dAb", см., например, Holt et al., Trends Biotech, 21(11):484-490 (2003), Ghahroudi et al., FEBS Lett., 414:521 -526 (1997), Lauwereys et al., EMBO J 17:3512- 3520 (1998), Reiter et al., J. Mol. Biol. 290:685-698 (1999); и Davies и Riechmann, Biotechnology, 13:475-479 (2001)).
[0110] Способы тестирования антител или их антигенсвязывающих частей на способность связывать какой-либо маркер клеточной поверхности известны в данной области и включают любой анализ связывания типа "антитело - антиген", такой как, например, радиоиммуноанализ (RIA), ИФА (ELISA), вестерн-блот, иммунопреципитация и анализы конкурентного ингибирования (см., например, Janeway et al., см. выше, и публикацию заявки на патент США 2002/0197266 А1).
[0111] Подходящие способы изготовления антител известны в данной области. Например, стандартные гибридомные способы описаны в

[0112] Фаговый дисплей также может быть использован для создания антитела, которое может быть использовано в химерных молекулах согласно изобретению. В связи с этим фаговые библиотеки, кодирующие антигенсвязывающие вариабельные (V) домены антител, могут быть получены с использованием стандартной молекулярной биологии и методик рекомбинантной ДНК (см., например, Sambrook et al. (eds.), Molecular Cloning, A Laboratory Manual, 3rd Edition, Cold Spring Harbor Laboratory Press, New York (2001)). Фаг, кодирующий вариабельную область с нужной специфичностью, выбирают по специфическому связыванию с нужным антигеном и восстанавливают полное или частичное антитело, содержащее выбранный вариабельный домен. Нуклеиновокислотные последовательности, кодирующие восстановленное антитело, вводят в подходящую линию клеток, такую как клетки миеломы, используемые для получения гибридом, так что клетка секретирует антитела с характеристиками моноклональных антител (см., например, Janeway et al., см. выше, Huse et al., и патент США 6265150).
[0113] Альтернативно, антитела могут быть получены с помощью трансгенных мышей, которые являются трансгенными по специфическим генам тяжелой и легкой цепи иммуноглобулина. Такие способы известны в данной области и описаны, например, в патентах США 5545806 и 5569825, а также в Janeway et al., см. выше.
[0114] Альтернативно, антитело может быть генно-инженерным антителом, например, гуманизированным антителом или химерным антителом. Гуманизированные антитела преимущественно обеспечивают более низкий риск побочных эффектов и могут дольше оставаться в кровотоке. Способы получения гуманизированных антител известны в данной области и описаны подробно, например, в Janeway et al., см. выше, в патентах США 5225539, 5585089 и 5693761, европейском патенте 0239400 В1 и патенте Великобритании 2188638. Гуманизированные антитела также могут быть созданы с использованием методики перекладки антитела, описанной, например, в патенте США 5639641 и в Pedersen et al., J. Mol., Biol., 235, 959-973 (1994).
[0115] Специфическая группировка может специфически связываться с любым подходящим маркером клеточной поверхности. Выбор конкретной специфической группировки и/или маркера клеточной поверхности может быть сделан в зависимости от конкретной клеточной популяции, которая будет целевой. Маркеры клеточной поверхности известны в данной области (см., например, Mufson et al., Front. Biosci., 11:337-43 (2006); Frankel et al., Clin. Cancer Res., 6:326-334 (2000); и Kreitman et al., AAPS Journal, 8(3): E532-E551 (2006)) и могут представлять собой, например, белки или углеводы. В одном из воплощений согласно изобретению специфическая группировка представляет собой лиганд, который специфически связывается с рецептором на клеточной поверхности. Примеры лигандов включают, но не ограничиваясь ими, сосудистый эндотелиальный фактор роста (vascular endothelial growth factor, VEGF), Fas, TNF-связанный апоптозиндуцирующий лиганд (TNF-related apoptosis-inducing ligand, TRAIL), цитокин (например, IL-2, IL-15, IL-4, IL-13), лимфокин, гормон и фактор роста (например, трансформирующий фактор роста (TGFa), фактор роста нервов, эпидермальный фактор роста).
[0116] Маркер клеточной поверхности может быть, например, раковым антигеном. Термин "раковый антиген", используемый в данном документе, относится к любой молекуле (например, белку, пептиду, липиду, углеводу и т.д.) которая исключительно или преимущественно экспрессируется или сверхэкспрессируется на опухолевых клетках или раковых клетках, так что данный антиген ассоциирован с опухолью или раком. Раковый антиген дополнительно может экспрессироваться нормальными, неопухолевыми или незлокачественными клетками. Тем не менее, в таких случаях экспрессия ракового антигена нормальными, неопухолевыми или незлокачественными клетками не является столь мощной, как экспрессия опухолевыми или раковыми клетками. В связи с этим опухолевые или раковые клетки могут сверхэкспрессировать антиген или экспрессировать антиген на значительно более высоком уровне по сравнению с экспрессией антигена нормальными, неопухолевыми или незлокачественными. Кроме того, раковый антиген дополнительно может быть экспрессирован клетками различного состояния развития или созревания. Например, раковый антиген может дополнительно экспрессироваться клетками, находящимися на различных эмбриональных или фетальных стадиях, которые в норме не встречаются у взрослого хозяина. Альтернативно, раковый антиген может дополнительно экспрессироваться стволовыми клетками или клетками-предшественниками, которые в норме не встречаются у взрослого хозяина.
[0117] Раковый антиген может представлять собой антиген, экспрессированный любой клеткой любого рака или опухоли, включая раки и опухоли, описанные в данном документе. Раковый антиген может быть раковым антигеном только одного типа рака или опухоли, так что данный раковый антиген ассоциирован или характерен только для одного типа рака или опухоли. Альтернативно, раковый антиген может быть раковым антигеном (например, может быть характерен для) более чем одного типа рака или опухоли. Например, раковый антиген может экспрессироваться как клетками рака молочной железы, так и клетками рака предстательной железы, и совсем не экспрессироваться нормальными, неопухолевыми или нераковыми клетками.
[0118] Примеры раковых антигенов, с которыми может специфически связываться специфическая группировка, включают, но не ограничиваясь ими, муцин 1 (MUC1, опухоль-ассоциированный эпителиальный муцин), ассоциированный с меланомой антиген (melanoma associated antigen, MAGE), преимущественно экспрессируемый меланомой антиген (preferentially expressed antigen of melanoma, PRAME), карциноэмбриональный антиген (carcinoembryonic antigen, CEA), простатический специфический антиген (prostate-specific antigen, PSA), простатический специфический мембранный антиген (prostate specific membrane antigen, PSMA), рецептор гранулоцитарно-макрофагального колониестимулирующего фактора (granulocyte-macrophage colony-stimulating factor receptor, GM-CSFR), CD56, человеческий рецептор эпидермального фактора роста 2 (HER2/neu) (также известный как erbB-2), CD5, CD7, опухолевый антиген тирозиназа, тирозиназа-связанный белок (tyrosinase related protein, TRP)1, Trp2, NY-ESO-1, теломераза и p53. В предпочтительном воплощении маркер клеточной поверхности, с которым специфически связывается специфическая группировка, выбран из группы, включающей кластер дифференцировки (cluster of differentiation, CD) 19, CD21, CD22, CD25, CD30, CD33 (связывающий сиаловые кислоты Ig-подобный лектин 3, миелоидный антиген клеточной поверхности), CD79b, CD123 (рецептор альфа интерлейкина 3), рецептор трансферрина, рецептор EGF (от англ. epidermal growth factor), мезотелин, кадгерин, антиген Льюиса Y, глипикан-3, FAP (от англ. fibroblast activation protein alpha - белок активации фибробластов альфа), PSMA (простатический специфический мембранный антиген), СА9 или CAIX (карбоангидраза IX), L1CAM (от англ. cell adhesion molecule - молекула адгезии нервных клеток L1), эндосиалин, HER3 (активированная конформация члена 3 семейства рецепторов эпидермального фактора роста), комплекс Alk1/BMP9 (киназа 1 анапластической лимфомы/костный морфогенетический белок 9), TPBG или 5Т4 (от англ. trophoblast glycoprotein - гликопротеин трофобласта), ROR1 (рецепторный тирозинкиназоподобный поверхностный антиген), HER1 (активированная конформация рецептора эпидермального фактора роста) и CLL1 (семейство лектиновых доменов С-типа 12, член А). Мезотелин экспрессируется, например, на клетках рака яичника, мезотелиомы, немелкоклеточного рака легкого, аденокарциномы легкого, рака фаллопиевых труб, рака головы и шеи, рака шейки матки, рака поджелудочной железы. CD22 экспрессируется, например, на клетках волосатоклеточной лейкемии, хронического лимфоцитарного лейкоза (chronic lymphocytic leukemia, CLL), пролимфоцитарного лейкоза (prolymphocyte leukemia, PLL), неходжкинской лимфомы, мелкоклеточной лимфоцитарной лимфомы (small lymphocytic lymphoma, SLL) и острого лимфолейкоза (acute lymphatic leukemia, ALL). CD25 экспрессируется, например, на клетках лейкемии и лимфомы, включая волосатоклеточную лейкемию и лимфому Ходжкина. Антиген Льюиса Y экспрессируется, например, на клетках рака мочевого пузыря, рака молочной железы, рака яичников, рака толстой кишки, рака пищевода, рака желудка, рака легкого, рака поджелудочной железы. CD33 экспрессируется, например, на клетках острого миелоидного лейкоза (acute myeloid leukemia, AML), хронического миеломоноцитарного лейкоза (chronic myelomonocytic leukemia, ML) и миелопролиферативных нарушений.
[0119] В одном из воплощений согласно изобретению специфическая группировка представляет собой антитело, которое специфически связывается с раковым антигеном. Примеры антител, которые специфически связываются с раковым антигеном, включают, но не ограничиваясь ими, антитела против рецептора трансферрина (например, НВ21 и его варианты), антитела против CD22 (например, RFB4 и его варианты), антитела против CD25 (например, анти-Тас и его варианты), антитела против мезотелина (например, SS1, MORAb-009, SS, HN1, HN2, MN, MB и их варианты) и антитела против антигена Льюиса Y (например, В3 и его варианты). В связи с этим специфическая группировка может представлять собой антитело, выбранное из группы, состоящей из В3, RFB4, SS, SS1, MN, MB, HN1, HN2, НВ21 и MORAb-009, и его антигенсвязывающие части. Другие примеры специфических группировок, пригодных для использования в химерных молекулах согласно изобретению, раскрыты, например, в патентах США 5242824 (против рецептора трансферрина); 5846535 (анти-CD25); 5889157 (против антигена Льюиса Y); 5981726 (против антигена Льюиса Y); 5990296 (против антигена Льюиса Y); 7081518 (против мезотелина); 7355012 (анти-CD22 и анти-CD25); 7368110 (против мезотелина); 7470775 (анти-CD30); 7521054 (анти-CD25); и 7541034 (анти-CD22); в публикации заявки на патент США 2007/0189962 (анти-CD22); Frankel et al., Clin. Cancer Res., 6: 326-334 (2000), и Kreitman et al., AAPS Journal, 8(3): E532-E551 (2006), каждый из которых включен в данный документ посредством ссылки. В другом воплощении специфическая группировка может включать специфическую группировку иммунотоксинов, известных в данной области. Примеры иммунотоксинов включают, но не ограничиваясь ими, LMB-2 (Anti-Tac(Fv)-PE38), BL22 и НА22 (RFB4(dsFv)-PE38), SS1P (SS 1 (dsFv)-PE38), НВ21-РЕ40 и их варианты. В предпочтительном воплощении специфическая группировка представляет собой антигенсвязывающую часть НА22. НА22 содержит Fv-фрагмент анти-CD22-антитела, связанный дисульфидными мостиками, который конъюгирован с РЕ38. НА22 и его варианты описаны в публикациях международных патентных заявок WO 2003/027135 и WO 2009/032954, которые включены в данный документ посредством ссылки.
[0120] Антигенсвязывающая часть специфической группировки может содержать вариабельную область легкой цепи и/или вариабельную область тяжелой цепи. В одном воплощении согласно данному изобретению вариабельная область тяжелой цепи содержит CDR1-область тяжелой цепи, CDR2-область тяжелой цепи и CDRS-область тяжелой цепи. В связи с этим антигенсвязывающий домен может содержать одну или более чем одну из CDR1-областей тяжелой цепи, содержащих SEQ ID NO 49, 65, 81, 97, 113, 129, 145, 161 или 177; CDR2-областей тяжелой цепи, содержащих SEQ ID NO 53, 69, 85, 101, 117, 133, 149, 165 или 181; и CDR3-областей тяжелой цепи, содержащих SEQ ID NO 57, 73, 89, 105, 121, 137, 153, 169 или 185. Предпочтительно, тяжелая цепь содержит все следующие (a) SEQ ID NONO 49, 53 и 57 (CDR1-CDR3 тяжелой цепи против мезотелина, соответственно); (b) SEQ ID NONO 65, 69 и 73 (CDR1-CDR3 тяжелой цепи gc33 против глипикана 3, соответственно); (с) SEQ ID NONO 81, 85 и 89 (CDR1-CDR3 кислой тяжелой цепи антитела против глипикана 3, соответственно); (d) SEQ ID NONO 97, 101 и 105 (CDR1-CDR3 тяжелой цепи анти-FAP, соответственно); (е) SEQ ID NONO 113, 117, 121 (CDR1-CDR3 тяжелой цепи анти-PSMA, соответственно); (f) SEQ ID NONO 129, 133 и 137 (CDR1-CDR3 тяжелой цепи анти-CAIX, соответственно); (g) SEQ ID NONO 145, 149 и 153 (CDR1-CDR3 тяжелой цепи анти-L1CAM-(1), соответственно); (h) SEQ ID NONO 161, 165, 169 (CDR1-CDR3 тяжелой цепи анти-L1CAM (2), соответственно); или (i) SEQ ID NONO 177, 181 и 185 (анти-L1CAM(3) CDR1-CDR3 тяжелой цепи, соответственно).
[0121] В одном воплощении согласно данному изобретению вариабельная область легкой цепи может содержать CDR1-область легкой цепи, CDR2-область легкой цепи и CDR3-область легкой цепи. В связи с этим антигенсвязывающий домен может содержать одну или более чем одну CDR1-область легкой Цепи, содержащую SEQ ID NO 50, 66, 82, 98, 114, 130, 146, 162 или 178; CDR2-область легкой цепи, содержащую SEQ ID NO 54, 70, 86, 102, 118, 134, 150, 166 или 182; и CDR3-область легкой цепи, содержащую SEQ ID NO 58, 74, 90, 106, 122, 138, 154, 170 или 186. Предпочтительно, легкая цепь содержит все следующие (a) SEQ ID NONO 50, 54 и 58 (CDR1-CDR3 легкой цепи против мезотелина, соответственно); (b) SEQ ID NONO 66, 70 и 74 (CDR1-CDR3 легкой цепи gc33 против глипикана 3, соответственно); (с) SEQ ID NONO 82, 86 и 90 (CDR1-CDR3 кислой легкой цепи антитела против глипикана 3, соответственно); (d) SEQ ID NONO 98, 102 и 106 (CDR1-CDR3 легкой цепи анти-FAP, соответственно); (е) SEQ ID NONO 114, 118 и 122 (CDR1-CDR3 легкой цепи анти-PSMA, соответственно); (f) SEQ ID NONO 130, 134 и 138 (CDR1-CDR3 легкой цепи анти-CAIX, соответственно); (g) SEQ ID NONO 146, 150 и 154 (CDR1-CDR3 легкой цепи анти-L1CAM-(1), соответственно); (h) SEQ ID NONO 162, 166 и 170 (CDR1-CDR3 легкой цепи анти- L1CAM-(2), соответственно); или (i) SEQ ID NONO 178, 182 и 186 (CDR1-CDR3 легкой цепи анти-L1CAM-(3), соответственно).
[0122] В особенно предпочтительном воплощении антигенсвязывающая часть содержит CDR1-, CDR2-, CDR3-области легкой цепи и CDR1-, CDR2-, CDR3-области тяжелой цепи. В связи с этим антигенсвязывающая часть содержит (a) SEQ ID NONO 49, 50, 53, 54, 57 и 58; (b) SEQ ID NONO 65, 66, 69, 70, 73 и 74; (с) SEQ ID NONO 81, 82, 85, 86, 89 и 90; (d) SEQ ID NONO 97, 98, 101, 102, 105 и 106; (e) SEQ ID NONO 113, 114, 117, 118, 121 и 122; (f) SEQ ID NONO 129, 130, 133, 134, 137 и 138; (g) SEQ ID NONO 145, 146, 149, 150, 153 и 154; (h) SEQ ID NONO 161, 162, 165, 166, 169 и 170; или (i) SEQ ID NONO 177, 178, 181, 182, 185 и 186.
[0123] В одном воплощении антигенсвязывающая часть содержит каркасные области FR1, FR2, FR3, FR4 тяжелой цепи и FR1, FR2, FR3, FR4 легкой цепи в дополнение к CDR-областям, описанным выше. В связи с этим антигенсвязывающая часть может содержать FR1-область тяжелой цепи, содержащую SEQ ID NO 47, 63, 79, 95, 111, 127, 143, 159 или 175; FR2-область тяжелой цепи, содержащую SEQ ID NO 51, 67, 83, 99, 115, 131, 147, 163 или 179; FR3-область тяжелой цепи, содержащую SEQ ID NO 55, 71, 87, 103, 119, 135, 151, 167, 183; и FR4-область тяжелой цепи, содержащую SEQ ID NO 59, 75, 91, 107, 123, 139, 155, 171 или 187. Антигенсвязывающая часть может содержать FR1-область легкой цепи, содержащую SEQ ID NO 48, 64, 80, 96, 112, 128, 144, 160, 176; FR2-область легкой цепи, содержащую SEQ ID NO 52, 68, 84, 100, 116, 132, 148, 164 или 180; FR3-область легкой цепи, содержащую SEQ ID NO 56, 72, 88, 104, 120, 136, 152, 168 или 184; и FR4-область легкой цепи, содержащую SEQ ID NO 60, 76, 92, 108, 124, 140, 156, 172 или 188. Предпочтительно, антигенсвязывающая часть содержит FR1-, FR2-, FR3-, F4-, CDR1-, CDR2- и CDR3-области легкой цепи и FR1-, FR2-, FR3-, F4-, CDR1-, CDR2- и CDR3-области тяжелой цепи. В связи с этим антигенсвязывающая часть содержит (a) SEQ ID NONO с 47 по 60 (анти-мезотелин); (b) SEQ ID NONO с 63 по 76 (антитело gc33 против глипикана 3); (с) SEQ ID NONO с 79 по 92 (кислое антитело против глипикана 3); (d) SEQ ID NONO с 95 по 108 (анти-FAP); (е) SEQ ID NONO с 111 по 124 (анти-PSMA); (f) SEQ ID NONO с 127 по 140 (анти-CAIX); (g) SEQ ID NONO с 143 по 156 (анти- L1CAM(1)); (h) SEQ ID NONO с 159 по 172 (анти-L1CAM(2)); или (i) SEQ ID NONO с 175 по 188 (анти-LI CAM(3)).
[0124] В одном воплощении вариабельная область легкой цепи антигенсвязывающего домена может содержать SEQ ID NO 46, 62, 78, 94, 110, 126, 142, 158 или 174. В одном воплощении вариабельная область тяжелой цепи антигенсвязывающего домена может содержать SEQ ID NO 45, 61, 77, 93, 109, 125, 141, 157 или 173. В предпочтительном воплощении антигенсвязывающий домен содержит обе (a) SEQ ID NONO 45 и 46 (анти-мезотелин); (b) SEQ ID NONO 61 и 62 (антитела gc33 против глипикана 3); (с) SEQ ID NONO 77 и 78 (анти-gc33 кислый); (d) SEQ ID NONO 93 и 94 (анти-FAP); (e) SEQ ID NONO 109 и 110 (анти-PSMA); (f) SEQ ID NONO 125 и 126 (анти-CAIX); (g) SEQ ID NONO 141 и 142 (анти-L1CAM(1)); (h) SEQ ID NONO 157 и 158 (анти-L1CAM(2)); (i) SEQ ID NONO 173 и 174 (анти-L1CAM(3)); или (j) SEQ ID NONO 93 и 290 (анти-FAP).
[0125] Другой аспект согласно данному изобретению представляет собой гуманизированное анти-мезотелин-антитело, содержащее вариабельный домен тяжелой цепи VH SEQ ID NO 45 и вариабельный домен легкой цепи SEQ ID NO 46. Гуманизированное антитело создается путем использования мышиного анти-мезотелин-антитела SS1 в качестве исходного материала и образования специфических комбинаций определенных каркасных областей с CDR-областями мышиного антитела SS1. Гуманизированное антитело преимущественно связано с хорошими связывающими свойствами, стабильностью и перспективностью использования.
[0126] В одном из воплощений согласно изобретению специфическая группировка может быть гуманизированной. В одном из воплощений согласно изобретению специфическая группировка представляет собой гуманизированное SS1 или антигенсвязывающую часть гуманизированного SS1. В связи с этим специфическая группировка может содержать легкую цепь, содержащую SEQ ID NO 33 (cFP-0199), и тяжелую цепь, содержащую SEQ ID NO 38 (cFP-0200). В другом воплощении специфическая группировка может содержать легкую цепь, содержащую SEQ ID NO 31 (cFP-0199 гуманизированный вариабельный домен легкой цепи VL) и SEQ ID NO 32 (cFP-0199 константный домен легкой цепи каппа). В одном воплощении специфическая группировка может содержать тяжелую цепь, содержащую SEQ ID NO 34 (cFP-0200 гуманизированный вариабельный домен тяжелой цепи VH) и SEQ ID NO 35 (cFP-0200 константный домен тяжелой цепи СН1). В одном воплощении специфическая группировка содержит все последовательности SEQ ID NO 31, 32, 34 и 35.
[0127] В одном из воплощений согласно изобретению химерная молекула содержит линкер. Термин "линкер", используемый в данном документе, относится к любому агенту или молекуле, которая соединяет РЕ согласно изобретению с специфической группировкой. Специалисту в данной области будет понятно, что сайты на РЕ согласно изобретению, которые не являются необходимыми для функционирования РЕ согласно изобретению, представляют собой идеальное место для прикрепления линкера и/или специфической группировки, при условии, что линкер и/или специфическая группировка, после того как они прикреплены к РЕ согласно изобретению, не мешают функциям РЕ согласно изобретению, т.е. его цитотоксической активности, ингибированию роста клетки-мишени или лечения или профилактики рака. Линкер может быть способен к формированию ковалентных связей с как РЕ, так и с специфической группировкой. Подходящие линкеры известны в данной области и включают, но не ограничиваясь ими, углеродные линкеры с прямой или разветвленной цепью, гетероциклические углеродные линкеры и пептидные линкеры. Если РЕ и специфическая группировка представляют собой полипептиды, то линкер может быть присоединен к аминокислотам через боковые группы (например, посредством дисульфидной связи с цистеином). Предпочтительно, линкеры будут присоединены к альфа-углероду амино- и карбоксильных групп концевых аминокислот.
[0128] В другом аспекте данного изобретения было обнаружено, что путем введения специфических аминокислот на обеих сторонах последовательности расщепления фурином (FCS) можно получить более стабильную химерную молекулу экзотоксина псевдомонад с специфической группировкой. Кроме того, также были удалены потенциальные Т-клеточные эпитопы в линкерной области, что может быть особенно полезным при использовании Fab-фрагментов антитела в качестве специфической группировки. Эти химерные молекулы имеют повышенную термодинамическую стабильность по сравнению с химерными молекулами без таких удлиненных линкеров и сохраняют свою цитотоксичность по отношению к опухолевым клеткам. Соответственно, в одном из воплощений согласно изобретению линкер представляет собой удлиненный линкер. Удлиненный линкер может содержать последовательность SEQ ID NO 36.
[0129] В предпочтительном воплощении R1n-FCS-R2n представляет собой линкер с аминокислотной последовательностью SEQ ID NO 36. Сайт расщепления фурином находится между аминокислотными остатками 15 и 16 в SEQ ID NO 36.
[0130] Воплощение согласно данному изобретению относится к химерной молекуле, содержащей (а) специфическую группировку, конъюгированную или слитую с (b) любым из РЕ, описанных в данном документе.
[0131] Воплощение согласно данному изобретению относится к выделенной химерной молекуле, содержащей (а) специфическую группировку, конъюгированную или слитую с (b) мутантным экзотоксином А псевдомонад (РЕ), который содержит последовательность следующей формулы:
R1n-FCS-R2n-R3n-функциональный домен РЕ III,
в которой:
n равно 0 или 1 независимо для каждого из R1, R2 и R3,
R1 представляет собой от 1 до 10 аминокислотных остатков
FCS представляет собой фурин-расщепляемая последовательность аминокислотных остатков, которая расщепляется фурином и имеет амино-конец и карбоксильный конец,
R2 представляет собой от 1 до 10 аминокислотных остатков;
R3 представляет собой 1 или более смежных остатков среди остатков с 365 по 394 последовательности SEQ ID 1; и
функциональный домен РЕ III представляет собой остатки с 395 по 613 последовательности SEQ ID NO 1, где РЕ содержит аргинин в позиции 458, определенной относительно SEQ ID NO 1, и где РЕ имеет:
(a) замену аланином аминокислотного остатка R427;
(b) замену аланином аминокислотного остатка R463;
(c) замену аланином аминокислотного остатка R467;
(d) замену аланином аминокислотного остатка R490;
(e) замену аланином аминокислотного остатка R505;
(f) замену аланином аминокислотного остатка R538; и
(g) замену аланином аминокислотного остатка R456.
[0132] В предпочтительном воплощении химерной молекулы FCS представляет собой фурин-расщепляемую последовательность (FCS), соответствующая аминокислотным остаткам 274-284 SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)).
[0133] В предпочтительном воплощении химерной молекулы
n равно 1 для R1 и R2,
R1 представляет собой линкер с аминокислотной последовательностью SEQ ID NO 282 (DKTHKASGG),
R2 представляет собой линкер с аминокислотной последовательностью SEQ ID NO 284 (GGGGGS), и
FCS представляет собой фурин-расщепляемую последовательность (FCS), соответствующая аминокислотным остаткам 274-284 SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)). В особенно предпочтительном воплощении n равен 0 для R3.
[0134] В предпочтительном воплощении химерной молекулы R1n-FCS-R2n представляет собой линкер с аминокислотной последовательностью SEQ ID NO 36, а специфическая группировка содержит Fab-фрагмент антитела.
[0135] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против мезотелина, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 37 (LO10R-456A). В одном предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против мезотелина, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 45 и вариабельный домен легкой цепи SEQ ID NO 46. В связи с этим химерная молекула может содержать (a) SEQ ID NONO 39 и 40; (b) SEQ ID NONO 41 и 42; или (с) SEQ ID NONO 43 и 44.
[0136] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против глипикана 3, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 37 (L010R-456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 61 и вариабельный домен легкой цепи SEQ ID NO 62.
[0137] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против глипикана 3, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 37 (L010R-456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 77 и вариабельный домен легкой цепи SEQ ID NO 78.
[0138] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-FAP-антитела, FCS, соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 37 (L010R-456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-FAP-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 37 (L010R-456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 93 (SEQ ID NONO 97, 101 и 105, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 94 (SEQ ID NONO 98, 102 и 106, соответственно). В одном предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 94. В другом предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи VL SEQ ID NO 290. В связи с этим химерная молекула может содержать (a) SEQ ID NONO 291 и 293; (b) SEQ ID NONO 291 и 294; или (с) SEQ ID NONO 292 и 294.
[0139] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-PSMA-антитела, FCS, соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 37 (L010R-456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-PSMA-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 37 (L010R-456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-PSMA-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 109 (SEQ ID NONO 113, 117 и 121, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 110 (SEQ ID NONO 114, 118 и 122, соответственно).
[0140] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-CAIX-антитела, FCS, соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и PE, содержащий SEQ ID NO 37 (L010R-456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-CAIX-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 37 (L010R-456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-CAIX-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 125 (SEQ ID NONO 129, 133 и 137, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 126 (SEQ ID NONO 130, 134 и 138, соответственно). В связи с этим химерная молекула может содержать (a) SEQ ID NONO 295 и 297 или (b) SEQ ID NONO 296 и 297.
[0141] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-L1CAM-антитела, FCS, соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 37 (L010R-456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-L1CAM-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 37 (L010R-456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 141 (SEQ ID NONO 145, 149 и 153, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 142 (SEQ ID NONO 146, 150 и 154, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 157 и вариабельный домен легкой цепи SEQ ID NO 158. В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 173 и вариабельный домен легкой цепи SEQ ID NO 174.
[0142] В предпочтительном воплощении изобретение относится к выделенной химерной молекуле, содержащей (а) специфическую группировку, конъюгированную или слитую с (b) мутантным экзотоксином А псевдомонад (РЕ), который содержит последовательность следующей формулы:
R1n-FCS-R2n-R3n-функциональный домен PE III,
в которой:
n равно 0 или 1 независимо для каждого из R1, R2 и R3,
R1 представляет собой от 1 до 10 аминокислотных остатков
FCS представляет собой фурин-расщепляемую последовательность аминокислотных остатков, которая расщепляется фурином и имеет амино-конец и карбоксильный конец,
R2 представляет собой от 1 до 10 аминокислотных остатков;
R3 представляет собой 1 или более смежных остатков среди остатков с 365 по 394 последовательности SEQ ID 1; и
функциональный домен PE III представляет собой остатки с 395 по 613 последовательности SEQ ID NO 1.
где один или более чем один из аминокислотных остатков F443, L477, R494 и L552, определенных относительно SEQ ID NO 1, независимо от других является замещенным;
а РЕ, возможно, содержит дополнительную замену аминокислоты в одном или более чем одном В-клеточном эпитопе.
[0143] Было обнаружено, что замена гистидином аминокислотного остатка L477 ведет в сильному уменьшению Т-клеточных ответов по сравнению с заменами другими аминокислотами (см., например, пример 4) и в то же время повышает цитотоксическую эффективность РЕ по сравнению с заменами другими аминокислотами (см., например, примеры 3, 5 и 6). Таким образом, в предпочтительном воплощении данного изобретения относительно химерной молекулы замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену гистидином аминокислотного остатка L477. Замена глутаминовой кислотой или аспарагином аминокислотного остатка L552 также приводит к дальнейшему увеличению токсичности, уменьшая при этом Т-клеточные ответы. В предпочтительном воплощении данного изобретения относительно химерной молекулы замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену гистидином аминокислотного остатка L477 и замену глутаминовой кислотой или аспарагином аминокислотного остатка L552. В одном воплощении данного изобретения относительно химерной молекулы замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443; замену гистидином аминокислотного остатка L477; замену аланином аминокислотного остатка R494; и замену глутаминовой кислотой или аспарагином аминокислотного остатка L552.
[0144] В предпочтительном воплощении данного изобретения относительно химерной молекулы замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443; замену гистидином аминокислотного остатка L477; замену аланином аминокислотного остатка R494; и замену глутаминовой кислотой аминокислотного остатка L552, РЕ имеет остаток аргинина в позиции 458, а другая замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427 и (b) замену аланином аминокислотного остатка R505, определенного относительно SEQ ID NO 1. В предпочтительном воплощении данного изобретения РЕ химерной молекулы содержит аминокислотную последовательность SEQ ID NO 289 (Т18/Т20).
[0145] В предпочтительном воплощении данного изобретения относительно химерной молекулы замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443; замену гистидином аминокислотного остатка L477; замену аланином аминокислотного остатка R494; и замену глутаминовой кислотой аминокислотного остатка L552, РЕ имеет остаток аргинина в позиции 458, а другая замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427; (b) замену аланином аминокислотного остатка R456; (с) замену аланином аминокислотного остатка R463; (d) замену аланином аминокислотного остатка R467; (е) замену аланином аминокислотного остатка R490; (f) замену аланином аминокислотного остатка R505; и (g) замену аланином аминокислотного остатка R538; определенных относительно SEQ ID NO 1. В предпочтительном воплощении РЕ химерной молекулы содержит аминокислотную последовательность SEQ ID NO 285 (Т14-L010R+456A).
[0146] В предпочтительном воплощении данного изобретения относительно химерной молекулы замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443; замену гистидином аминокислотного остатка L477; замену аланином аминокислотного остатка R494; и замену аспарагином аминокислотного остатка L552, РЕ имеет остаток аргинина в позиции 458, а другая замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427; (b) замену аланином аминокислотного остатка R456; (с) замену аланином аминокислотного остатка R463; (d) замену аланином аминокислотного остатка R467; (е) замену аланином аминокислотного остатка R490; (f) замену аланином аминокислотного остатка R505; и (g) замену аланином аминокислотного остатка R538; определенных относительно SEQ ID NO 1. В предпочтительном воплощении РЕ химерной молекулы содержит аминокислотную последовательность SEQ ID NO 286 (Т15-L010R+456A).
[0147] В предпочтительном воплощении данного изобретения относительно химерной молекулы замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443; замену гистидином аминокислотного остатка L477; замену аланином аминокислотного остатка R494; и замену глутаминовой кислотой аминокислотного остатка L552, РЕ имеет остаток аргинина в позиции 458, а другая замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427; (b) замену аланином аминокислотного остатка R463; (с) замену аланином аминокислотного остатка R467; (d) замену аланином аминокислотного остатка R490; (е) замену аланином аминокислотного остатка R505; и (f) замену аланином аминокислотного остатка R538; определенных относительно SEQ ID NO 1. В предпочтительном воплощении РЕ химерной молекулы содержит аминокислотную последовательность SEQ ID NO 287 (T14-L010R).
[0148] В предпочтительном воплощении данного изобретения относительно химерной молекулы замена одного или более чем одного из аминокислотных остатков F443, L477, R494 и L552 представляет собой замену аланином аминокислотного остатка F443; замену гистидином аминокислотного остатка L477; замену аланином аминокислотного остатка R494; и замену аспарагином аминокислотного остатка L552, РЕ имеет остаток аргинина в позиции 458, а другая замена аминокислоты в одном или более чем одном В-клеточном эпитопе представляет собой: (а) замену аланином аминокислотного остатка R427; (b) замену аланином аминокислотного остатка R463; (с) замену аланином аминокислотного остатка R467; (d) замену аланином аминокислотного остатка R490; (е) замену аланином аминокислотного остатка R505; и (f) замену аланином аминокислотного остатка R538; определенных относительно SEQ ID NO 1. В предпочтительном воплощении РЕ химерной молекулы содержит аминокислотную последовательность SEQ ID NO 288 (T15-L010R).
[0149] В предпочтительном воплощении относительно химерной молекулы FCS представляет собой фурин-расщепляемую последовательность (FCS), соответствующая аминокислотным остаткам 274-284 SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)).
[0150] В предпочтительном воплощении относительно химерной молекулы
n равно 1 для R1 и R2,
R1 представляет собой линкер с аминокислотной последовательностью SEQ ID NO 282 (DKTHKASGG),
R2 представляет собой линкер с аминокислотной последовательностью SEQ ID NO 284 (GGGGGS), и
FCS представляет собой фурин-расщепляемую последовательность (FCS), соответствующая аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)). В особенно предпочтительном воплощении n составляет 0 для R3.
[0151] В предпочтительном воплощении относительно химерной молекулы R1n-FCS-R2n представляет собой линкер с аминокислотной последовательностью SEQ ID NO 36, а специфическая группировка содержит Fab-фрагмент антитела.
[0152] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против мезотелина, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 285 (T14-L010R+456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против мезотелина, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 45 и вариабельный домен легкой цепи SEQ ID NO 46.
[0153] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против мезотелина, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 286 (T15-L010R+456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против мезотелина, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 45 и вариабельный домен легкой цепи SEQ ID NO 46.
[0154] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против мезотелина, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 287 (T14-L010R). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против мезотелина, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 45 и вариабельный домен легкой цепи SEQ ID NO 46.
[0155] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против мезотелина, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 288 (T15-L010R). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против мезотелина, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 45 и вариабельный домен легкой цепи SEQ ID NO 46.
[0156] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против глипикана 3, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 289 (Т18/T20). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против глипикана 3, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 289 (Т18/T20). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 61 (SEQ ID NONO 65, 69 и 73, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 62 (SEQ ID NONO 66, 70 и 74, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 77 (SEQ ID NO 81, 85 и 89, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 78 (SEQ ID NONO 82, 86 и 90, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 61 и вариабельный домен легкой цепи SEQ ID NO 62. В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 77 и вариабельный домен легкой цепи SEQ ID NO 78.
[0157] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против глипикана 3, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам 274-284 SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 285 (T14-LO10R+456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против глипикана 3, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 285 (T14-LO10R+456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 61 (SEQ ID NO 65, 69 и 73, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 62 (SEQ ID NONO 66, 70 и 74, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 77 (SEQ ID NONO 81, 85 и 89, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 78 (SEQ ID NONO 82, 86 и 90, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 61 и вариабельный домен легкой цепи SEQ ID NO 62. В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 77 и вариабельный домен легкой цепи SEQ ID NO 78.
[0158] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против глипикана 3, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 286 (T15-LO10R+456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против глипикана 3, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 286 (T15-L010R+456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 61 (SEQ ID NO 65, 69 и 73, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 62 (SEQ ID NONO 66, 70 и 74, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 77 (SEQ ID NONO 81, 85 и 89, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 78 (SEQ ID NONO 82, 86 и 90, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 61 и вариабельный домен легкой цепи SEQ ID NO 62. В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 77 и вариабельный домен легкой цепи SEQ ID NO 78.
[0159] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против глипикана 3, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 287 (T14-LO10R). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против глипикана 3, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 287 (T14-LO-10R). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 61 (SEQ ID NONO 65, 69 и 73, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 62 (SEQ ID NONO 66, 70 и 74, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 77 (SEQ ID NONO 81, 85 и 89, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 78 (SEQ ID NONO 82, 86 и 90, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 61 и вариабельный домен легкой цепи SEQ ID NO 62. В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 77 и вариабельный домен легкой цепи SEQ ID NO 78.
[0160] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против глипикана 3, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 288 (T15-LO10R). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть антитела против глипикана 3, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 288 (T15-L010R). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 61 (SEQ ID NONO 65, 69 и 73, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 62 (SEQ ID NONO 66, 70 и 74, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 77 (SEQ ID NONO 81, 85 и 89, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 78 (SEQ ID NONO 82, 86 и 90, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 61 и вариабельный домен легкой цепи SEQ ID NO 62. В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент антитела против глипикана 3, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 77 и вариабельный домен легкой цепи SEQ ID NO 78.
В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-FAP-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 289 (T18/T20). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-FAP-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 289 (Т18/T20). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 93 (SEQ ID NONO 97, 101 и 105, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 94 (SEQ ID NONO 98, 102 и 106, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 94. В другом предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 290.
[0161] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-FAP-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 285 (T14-LO10R+456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-FAP-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 285 (T14-L010R+456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 93 (SEQ ID NONO 97, 101 и 105, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 94 (SEQ ID NONO 98, 102 и 106, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 94. В другом предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 290.
[0162] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-FAP-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам 274-284 SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и PE, содержащий SEQ ID NO 286 (T15-LO10R+456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-FAP-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 286 (T15-L010R+456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 93 (SEQ ID NONO 97, 101 и 105, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 94 (SEQ ID NONO 98, 102 и 106, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 94. В другом предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 290.
[0163] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-FAP-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 287 (T14-LO10R). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-FAP-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 287 (T14-L010R). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 93 (SEQ ID NONO 97, 101 и 105, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 94 (SEQ ID NONO 98, 102 и 106). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 94. В другом предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 290.
[0164] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-FAP-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 288 (T15-LO10R). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-FAP-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 288 (T15-L010R). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 93 (SEQ ID NONO 97, 101 и 105, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 94 (SEQ ID NONO 98, 102 и 106, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 94. В другом предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-FAP-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 290. В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-PSMA-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 289 (T18/T20). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-PSMA-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 289 (Т18/Т20). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-PSMA-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 109 (SEQ ID NONO 113, 117 и 121, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 110 (SEQ ID NONO 114, 118 и 122, соответственно).
[0165] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-PSMA-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 285 (TI4-LO10R+456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-PSMA-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 285 (T14-L010R+456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-PSMA-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 109 (SEQ ID NONO 113, 117 и 121, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 110 (SEQ ID NONO 114, 118 и 122, соответственно).
[0166] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-PSMA-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 286 (T15-LO10R+456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-PSMA-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 286 (T15-L010R+456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-PSMA-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 109 (SEQ ID NONO 113, 117 и 121, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 110 (SEQ ID NONO 114, 118 и 122, соответственно).
[0167] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-PSMA-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 287 (T14-LO10R). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-PSMA-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 287 (T14-L010R). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-PSMA-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 109 (SEQ ID NONO 113, 117 и 121, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 110 (SEQ ID NONO 114, 118 и 122, соответственно).
[0168] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-PSMA-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 288 (T15-LO10R). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-PSMA-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 288 (T15-L010R). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-PSMA-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 109 (SEQ ID NONO 113, 117 и 121, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 110 (SEQ ID NONO 114, 118 и 122, соответственно).
[0169] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-CAIX-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 289 (T18/T20). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-CAIX-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 289 (Т18/Т20). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-CAIX-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 125 (SEQ ID NONO 129, 133 и 137, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 126 (SEQ ID NONO 130, 134 и 138).
[0170] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-CAIX-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 285 (TI4-LO10R+456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-CAIX-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 285 (T14-L010R+456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-CAIX-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 125 (SEQ ID NONO 129, 133 и 137, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID N0 126 (SEQ ID NONO 130, 134 и 138, соответственно).
[0171] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-CAIX-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 286 (T15-LO10R+456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-CAIX-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 286 (T15-L010R+456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-CAIX-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 125 (SEQ ID NONO 129, 133 и 137, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 126 (SEQ ID NONO 130, 134 и 138, соответственно).
[0172] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-CAIX-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 287 (T14-LO10R). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-CAIX-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 287 (T14-L010R). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-CAIX-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 125 (SEQ ID NONO 129, 133 и 137, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 126 (SEQ ID NONO 130, 134 и 138, соответственно).
[0173] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-CAIX-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 288 (T15-LO10R). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-CAIX-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 288 (T15-L010R). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-CAIX-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 125 (SEQ ID NONO 129, 133 и 137, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 126 (SEQ ID NONO 130, 134 и 138, соответственно). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-L1CAM-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 289 (T18/T20). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-L1CAM-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий. В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 141 (SEQ ID NONO 145, 149 и 153, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 142 (SEQ ID NONO 146, 150 и 154, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 157 и вариабельный домен легкой цепи SEQ ID NO 158. В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 173 и вариабельный домен легкой цепи SEQ ID NO 174.
[0174] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-L1CAM-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 285 (TI4-LO10R+456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-L1CAM-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 285 (T14-L010R+456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 141 (SEQ ID NONO 145, 149 и 153, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 142 (SEQ ID NONO 146, 150 и 154, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 157 и вариабельный домен легкой цепи SEQ ID NO 158. В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 173 и вариабельный домен легкой цепи SEQ ID NO 174.
[0175] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-L1CAM-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 286 (T15-LO10R+456A). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-L1CAM-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 286 (T15-L010R+456A). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти- L1CAM-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 141 (SEQ ID NONO 145, 149 и 153, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 142 (SEQ ID NONO 146, 150 и 154, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 157 и вариабельный домен легкой цепи SEQ ID NO 158. В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 173 и вариабельный домен легкой цепи SEQ ID NO 174.
[0176] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-L1CAM-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 287 (T14-LO10R). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-L1CAM-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 287 (T14-L010R). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 141 (SEQ ID NONO 145, 149 и 153, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 142 (SEQ ID NONO 146, 150 и 154, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 157 и вариабельный домен легкой цепи SEQ ID NO 158. В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 173 и вариабельный домен легкой цепи SEQ ID NO 174.
[0177] В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-L1CAM-антитела, фурин-расщепляемую последовательность (FCS), соответствующую аминокислотным остаткам с 274 по 284 последовательности SEQ ID NO 1 (RHRQPRGWEQL (SEQ ID NO 8)), и РЕ, содержащий SEQ ID NO 288 (T15-LO10R). В предпочтительном воплощении химерная молекула содержит антигенсвязывающую часть анти-L1CAM-антитела, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 288 (T15-L010R). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий CDR1, CDR2 и CDR3 вариабельного домена тяжелой цепи VH SEQ ID NO 141 (SEQ ID NONO 145, 149 и 153, соответственно) и CDR1, CDR2 и CDR3 вариабельного домена легкой цепи SEQ ID NO 142 (SEQ ID NONO 146, 150 и 154, соответственно). В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 157 и вариабельный домен легкой цепи SEQ ID NO 158. В предпочтительном воплощении антигенсвязывающая часть представляет собой Fab-фрагмент анти-L1CAM-антитела, содержащий вариабельный домен тяжелой цепи VH SEQ ID NO 173 и вариабельный домен легкой цепи SEQ ID NO 174. В объем данного изобретения включены функциональные части РЕ согласно изобретению и химерные молекулы, описанные в данном документе. Термин "функциональная часть" при использовании в отношении РЕ или химерной молекулы относится к какой-либо части или фрагменту РЕ или химерной молекулы согласно изобретению, где указанная часть или фрагмент сохраняет биологическую активность РЕ или химерной молекулы, частью которой он является (родительского РЕ или химерной молекулы). Функциональные части включают, например, те части РЕ или химерной молекулы, которые сохраняют способность специфически связываться и разрушать или ингибировать рост клеток-мишеней или лечить или предотвращать рак в похожей степени, в той же степени или в более высокой степени, чем родительский РЕ или химерная молекула. В отношении родительского РЕ или химерной молекулы функциональная часть может включать, например, примерно 10% или более, примерно 25% или более, примерно 30% или более, примерно 50% или более, примерно 68% или более, примерно 80% или более, примерно 90% или более, или примерно 95% или более родительского РЕ или химерной молекулы.
[0178] Функциональная часть может включать дополнительные аминокислоты на амино- или карбоксильном конце части или на обоих концах, при этом указанных дополнительных аминокислот нет в аминокислотной последовательности родительского РЕ или химерной молекулы. Желательно, чтобы дополнительные аминокислоты не мешали биологической функции функциональной части, т.е. специфическому связыванию и разрушению или ингибированию роста клеток-мишеней, наличию возможности лечения или профилактики рака и т.д. Более желательно, чтобы дополнительные аминокислоты повышали биологическую активность по сравнению с биологической активностью родительского РЕ или химерной молекулы.
[0179] В объем данного изобретения включены функциональные варианты РЕ согласно изобретению и химерные молекулы, описанные в данном документе. Термин "функциональный вариант", используемый в данном документе, относится к РЕ или химерной молекуле, имеющей существенную или значительную идентичность или сходство последовательности с родительским РЕ или химерной молекулой, где указанный функциональный вариант сохраняет биологическую активность РЕ или химерной молекулы, вариантом которых он является. Функциональные варианты включают, например, те варианты РЕ или химерной молекулы, описанные в данном документе (родительского РЕ или химерной молекулы), которые сохраняют способность специфически связываться и разрушать или ингибировать рост клеток-мишеней в похожей степени, в той же степени или в более высокой степени, чем родительский РЕ или химерная молекула. В отношении родительского РЕ или химерной молекулы функциональный вариант может, например, иметь примерно 30% или более, примерно 50% или более, примерно 75% или более, примерно 80% или более, примерно 90% или более, примерно 95% или более, примерно 96% или более, примерно 97% или более, примерно 98% или более, или примерно 99% или более идентичности с аминокислотной последовательностью родительского РЕ или химерной молекулы.
[0180] Функциональный вариант может, например, включать аминокислотную последовательность родительского РЕ или химерной молекулы по меньшей мере с одной консервативной аминокислотной заменой. Консервативные аминокислотные замены известны в данной области и включают аминокислотные замены, в которых одна аминокислота, имеющая определенные химические и/или физические свойства, заменяет другую аминокислоту с такими же химическими или физическими свойствами. Например, консервативная аминокислотная замена может представлять собой кислую аминокислоту, замененную другой кислой аминокислотой (например, Asp или Glu), аминокислоту с неполярной боковой цепью, замененную другой аминокислотой с неполярной боковой цепью (например, Ala, Gly, Val, Ile, Leu, Met, Phe, Pro, Trp, Val и т.д.), основную аминокислоту, замененную другой основной аминокислотой (Lys, Arg и т.д.), аминокислоту с полярной боковой цепи, замененную другой аминокислотой с полярной боковой цепью (Asn, Cys, Gin, Ser, Thr, Tyr и т.п.) и т.д.
[0181] Альтернативно или дополнительно функциональные варианты могут содержать аминокислотную последовательность родительского РЕ или химерной молекулы по меньшей мере с одной неконсервативной аминокислотной заменой. В этом случае предпочтительно, чтобы неконсервативная аминокислотная замена не мешала или не ингибировала биологическую активность функционального варианта. Предпочтительно, чтобы неконсервативная аминокислотная замена повышала биологическую активность функционального варианта, чтобы биологическая активность функционального варианта увеличивалась по сравнению с родительским РЕ или химерной молекулой.
[0182] РЕ или химерная молекула согласно изобретению может состоять по существу из указанной аминокислотной последовательности или последовательностей, описанных в данном документе, так, чтобы другие компоненты функционального варианта, например, другие аминокислоты, не приводили к существенному изменению биологической активности функционального варианта.
[0183] РЕ или химерная молекула согласно изобретению (в том числе функциональные части и функциональные варианты) согласно данному изобретению могут содержать синтетические аминокислоты вместо одной или более чем одной природной аминокислоты. Такие синтетические аминокислоты известны в данной области и включают, например, аминоциклогексанкарбоновую кислоту, норлейцин, α-амино-н-декановую кислоту, гомосерин, S-ацетиламинометилцистеин, транс-3- и транс-4-гидроксипролин, 4-аминофенилаланин, 4-нитрофенилаланин, 4-хлорофенилаланин, 4-карбоксифенилаланин, β-фенилсерин, β-гидроксифенилаланин, фенилглицин, α-нафтилаланин, циклогексилаланин, циклогексилглицин, индолин-2-карбоновую кислоту, 1,2,3,4-тетрагидроизохинолин-3-карбоновую кислоту, аминомалоновую кислоту, моноамид аминомалоновой кислоты, N'-бензил-N'-метиллизин, N',N'-дибензиллизин, 6-гидроксилизин, орнитин, α-аминоциклопентанкарбоновую кислоту, α-аминоциклогексанкарбоновую кислоту, α-аминоциклогептанкарбоновую кислоту, α-(2-амино-2-норборнан)карбоновую кислоту, α,γ-диаминомасляную кислоту, α,β-диаминопропионовую кислоту, гомофенилаланин и α-трет-бутилглицин.
[0184] РЕ или химерная молекула согласно изобретению (в том числе функциональные части и функциональные варианты) могут быть гликозилированы, амидированы, карбоксилированы, фосфорилированы, этерифицированы, N-ацилированы, циклизованы, например, через дисульфидный мостик, или превращены в соль присоединения кислоты и/или, возможно, димеризованы или полимеризованы или конъюгированы.
[0185] Воплощение данного изобретения относится к способу получения РЕ согласно изобретению, включающему (а) рекомбинантную экспрессию РЕ и (b) очистку РЕ. РЕ и химерные молекулы согласно изобретению (в том числе функциональные части и функциональные варианты) могут быть получены с помощью способов получения белков и полипептидов, известных в данной области. Подходящие способы синтеза полипептидов и белков de novo описаны в таких документах как Chan et al., Fmoc Solid Phase Peptide Synthesis, Oxford University Press, Oxford, United Kingdom, 2005; Peptide and Protein Drug Analysis, ed. Reid, R., Marcel Dekker, Inc., 2000; Epitope Mapping, ed. Westwood et al., Oxford University Press, Oxford, United Kingdom, 2000; и патент США 5449752. Кроме того, РЕ и химерные молекулы согласно изобретению могут быть рекомбинантно экспрессированы с помощью нуклеиновых кислот, описанных в данном документе, с использованием стандартных рекомбинантных способов. См, например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Press, Cold Spring Harbor, NY 2001; и Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley & Sons, NY, 1994.
[0186] Данный способ также содержит очистку РЕ. После экспрессии РЕ согласно изобретению могут быть очищены в соответствии с методиками очистки, известными в данной области. Примеры способов очистки включают, но не ограничиваясь ими, осаждение сульфатом аммония, аффинные колонки и колоночную хроматографию или процедуры, описанные, например, в R. Scopes, Protein Purification, Springer-Verlag, NY (1982).
[0187] Другое воплощение данного изобретения относится к способу получения химерной молекулы согласно изобретению, включающему (а) рекомбинантную экспрессию химерной молекулы и (b) очистку химерной молекулы. Химерная молекула может быть рекомбинантно экспрессирована и очищена, как описано в данном документе в отношении других аспектов изобретения. В одном из воплощений согласно изобретению рекомбинантная экспрессия химерной молекулы включает вставление нуклеотидной последовательности, кодирующей специфическую группировку, и нуклеотидной последовательности, кодирующей РЕ, в вектор. Способ может включать вставление нуклеотидной последовательности, кодирующей специфическую группировку, и нуклеотидной последовательности, кодирующей РЕ, в рамку таким образом, что она кодирует один непрерывный полипептид, включающий функциональную область специфической группировки и функциональную область РЕ. В одном из воплощений согласно изобретению способ включает лигирование нуклеотидной последовательности, кодирующей РЕ, с нуклеотидной последовательностью, кодирующей специфическую группировку, таким образом, что при экспрессии РЕ находится на карбоксильном конце специфической группировки. В альтернативном воплощении способ включает лигирование нуклеотидной последовательности, кодирующей РЕ, с нуклеотидной последовательностью, кодирующей специфическую группировку, таким образом, что при экспрессии РЕ находится на амино-конце специфической группировки.
[0188] Еще одно воплощение данного изобретения относится к способу получения химерной молекулы согласно изобретению, включающему (а) рекомбинантную экспрессию РЕ согласно изобретению, (b) очистку РЕ и (с) ковалентное связывание специфической группировки с очищенным РЕ. РЕ согласно изобретению может быть рекомбинантно экспрессирован, как описано в данном документе в отношении других аспектов изобретения. Способ также включает ковалентное связывание специфической группировки с очищенным РЕ. Способ присоединения РЕ к специфической группировке может варьировать в зависимости от химической структуры специфической группировки. Например, способ может включать взаимодействие любой одной или более чем одной из множества функциональных групп, например, карбоксильной (СООН), аминной (-NH2) или сульфгидрильной (-SH) группы, присутствующей на РЕ, с подходящей функциональной группой специфической группировки, и, тем самым, формирование ковалентной связи между РЕ и специфической группировкой. Альтернативно или дополнительно в способ можно включить дериватизацию специфической группировки или РЕ, чтобы экспонировать или прикрепить дополнительные реакционноспособные функциональные группы. Дериватизация может также включать присоединение одного или более чем одного линкера к специфической группировке или РЕ.
[0189] В другом воплощении данного изобретения РЕ и химерные молекулы согласно изобретению могут быть получены с использованием нерекомбинантных способов. Например, РЕ согласно изобретению и химерные молекулы, описанные в данном документе (включая функциональные части и функциональные варианты), могут быть коммерчески синтезированы компаниями, такими как Synpep (Дублин, Калифорния), Peptide Technologies Corp. (Гейтерсберг, Мэриленд) и Multiple Peptide Systems (Сан-Диего, Калифорния). В связи с этим РЕ и химерные молекулы согласно изобретению могут быть синтетическими, рекомбинантными, выделенными и/или очищенными.
[0190] В некоторых обстоятельствах может быть желательным освобождение РЕ от специфической группировки, когда химерная молекула достигает одной или более чем одной клетки-мишени. В связи с этим химерные молекулы согласно изобретению могут содержать расщепляемый линкер. Линкер может расщепляться с помощью любых подходящих средств, например, ферментативно. Например, когда клетка-мишень представляет собой раковую (например, опухолевую) клетку, химерная молекула может включать линкер, расщепляемый в условиях, присутствующих в месте опухоли (например, при воздействии ассоциированных с опухолью ферментов или кислого pH).
[0191] Воплощение данного изобретения относится к нуклеиновой кислоте, содержащей нуклеотидную последовательность, кодирующую любой из РЕ согласно изобретению или химерных молекул, описанных в данном документе. Термин "нуклеиновая кислота", используемый в данном документе, включает "полинуклеотид", "олигонуклеотид" и "нуклеиновокислотную молекулу" и, как правило, означает полимер ДНК или РНК, который может быть одноцепочечным или двухцепочечным, который может быть синтезированным или полученным (например, выделенным и/или очищенным) из природных источников, который может содержать природные, неприродные или измененные нуклеотиды, и который может содержать природные, неприродные или измененные межнуклеотидные связи, такие как фосфорамидатные связи или фосфоротиоатные связи вместо фосфодиэфирных, находящихся между нуклеотидами в немодифицированном олигонуклеотиде. В общем случае предпочтительно, чтобы нуклеиновая кислота не содержала никаких вставок, делеций, инверсий и/или замен. Тем не менее, в некоторых случаях может быть пригодным, как описано в данном документе, чтобы нуклеиновая кислота содержала одну или более чем одну вставку, делецию, инверсию и/или замену.
[0192] Предпочтительно, нуклеиновые кислоты согласно данному изобретению являются рекомбинантными. Используемый в данном документе термин "рекомбинантный" относится к (i) молекулам, которые сконструированы вне живых клеток путем соединения природных или синтетических нуклеиновокислотных сегментов, или (ii) молекулам, которые являются результатом репликации описанных выше в (i). Для целей согласно данному изобретению репликация может представлять собой репликацию in vitro или репликацию in vivo.
[0193] Нуклеиновые кислоты могут быть сконструированы на основе химического синтеза и/или ферментативных реакций лигирования с использованием процедур, известных в данной области. См., например, Sambrook et al., см. выше, и Ausubel et al., см. выше. Например, нуклеиновая кислота может быть химически синтезирована с использованием природных нуклеотидов или различным образом модифицированных нуклеотидов, предназначенных для повышения биологической стабильности молекул или для увеличения физической стабильности дуплекса, формирующегося при гибридизации (например, фосфоротиоатные производные и акридин-замещенные нуклеотиды). Примеры модифицированных нуклеотидов, которые могут быть использованы для создания нуклеиновых кислот, включают, но не ограничиваясь ими, 5-фторурацил, 5-бромурацил, 5-хлорурацил, 5-йодурацил, гипоксантин, ксантин, 4-ацетилцитозин, 5-(карбоксигидроксиметил)урацил, 5-карбоксиметиламинометил-2-тиоуридин, 5-карбоксиметиламинометилурацил, дигидроурацил, бета-D-галактозилквеуозин, инозин, N6-изопентениладенин, 1-метилгуанин, 1-метилинозин, 2,2-диметилгуанин, 2-метиладенин, 2-метилгуанин, 3-метилцитозин, 5-метилцитозин, N6-замещенный аденин, 7-метилгуанин, 5-метиламинометилурацил, 5-метоксиаминометил-2-тиоурацил, бета-D-маннозилквеуозин, 5'-метоксикарбоксиметилурацил, 5-метоксиурацил, 2-метилтио-N6-изопентениладенин, урацил-5-оксиуксусную кислоту (v), вибутоксозин, псевдоурацил, квеозин, 2-тиоцитозин, 5-метил-2-тиоурацил, 2-тиоурацил, 4-тиоурацил, 5-метилурацил, сложный метиловый эфир урацил-5-оксиуксусной кислоты, 3-(3-амино-3-N-2-карбоксипропил)урацил и 2,6-диаминопурин. Альтернативно, одна или более чем одна из нуклеиновых кислот согласно изобретению может быть приобретена у таких компаний как Macromolecular Resources (Форт-Коллинс, Колорадо) и Synthegen (Хьюстон, Техас).
[0194] Данное изобретение также относится к нуклеиновой кислоте, содержащей нуклеотидную последовательность, которая комплементарна нуклеотидной последовательности любой из нуклеиновых кислот, описанных в данном документе, или нуклеотидную последовательность, которая гибридизуется в жестких условиях с нуклеотидной последовательностью любой из нуклеиновых кислот, описанных в данном документе.
[0195] Нуклеотидная последовательность, которая гибридизуется в жестких условиях, предпочтительно гибридизуется в условиях высокой жесткости. Под "условиями высокой жесткости" подразумевается, что нуклеотидная последовательность специфически гибридизуется с последовательностью-мишенью (нуклеотидной последовательностью любой из нуклеиновых кислот, описанных в данном документе) в количестве, которое проявляется сильнее, чем неспецифическая гибридизация. Условия высокой жесткости включают условия, которые отличают полинуклеотид с точной комплементарной последовательностью или полинуклеотид, содержащий лишь несколько разрозненных несовпадений, от случайной последовательности, которая имеет лишь несколько коротких областей (например, 3-10 оснований), которые совпадают с нуклеотидной последовательностью. Такие небольшие области комплементарности более легко плавятся, чем полноразмерный комплемент из 14-17 или более оснований, а гибридизация в условиях высокой жесткости позволяет их легко отличить. Условия относительно высокой жесткости будут включать, например, низкое содержание солей и/или высокую температуру, например, примерно 0,02-0,1 М NaCl или эквивалент этого, при температуре примерно от 50 до 70°C. Такие условия высокой жесткости слабо переносят несоответствия, если таковые имеются, между нуклеотидной последовательностью и матрицей или нитью-мишенью, и особенно пригодны для определения экспрессии любого из РЕ или химерных молекул согласно изобретению. Как правило, можно учитывать, что условия можно сделать более жесткими путем добавления возрастающих количеств формамида.
[0196] Данное изобретение также относится к нуклеиновой кислоте, содержащей нуклеотидную последовательность, которая имеет примерно 70% или более, например, примерно 80% или более, примерно 90% или более, примерно 91% или более, примерно 92% или более, примерно 93% или более, примерно 94% или более, примерно 95% или более, примерно 96% или более, примерно 97% или более, примерно 98% или более, или примерно 99% или более идентичности с любой из нуклеиновых кислот, описанных в данном документе.
[0197] Нуклеиновые кислоты согласно изобретению могут быть вставлены в рекомбинантный экспрессионный вектор. В связи с этим данное изобретение относится к рекомбинантным экспрессионным векторам, содержащим любую из нуклеиновых кислот согласно изобретению. В данном описании термин "рекомбинантный экспрессионный вектор" означает генетически модифицированную олигонуклеотидную или полинуклеотидную конструкцию, которая позволяет экспрессировать мРНК, белок, полипептид или пептид клеткой-хозяином, когда конструкция содержит нуклеотидную последовательность, кодирующую мРНК, белок, полипептид или пептид, и вектор вводят в контакт с клеткой в условиях, достаточных для того, чтобы мРНК, белок, полипептид или пептид экспрессировались в клетке. Векторы согласно изобретению не встречаются в природе целиком. Тем не менее, некоторые части векторов могут иметь природное происхождение. Рекомбинантные экспрессионные векторы согласно изобретению могут содержать любой тип нуклеотидов, в том числе, но не ограничиваясь ими, ДНК и РНК, которые могут быть одноцепочечными или двухцепочечными, которые могут быть синтезированными или полученными из природных источников, и которые могут содержать природные, неприродные или измененные нуклеотиды. Рекомбинантные экспрессионные векторы могут включать природные, неприродные межнуклеотидные связи или оба типа связей. Предпочтительно, неприродные или измененные нуклеотиды или межнуклеотидные связи не препятствуют транскрипции или репликации вектора.
[0198] Рекомбинантный экспрессионный вектор согласно изобретению может представлять собой любой подходящий рекомбинантный экспрессионный вектор и может быть использован для трансформации или трансфекции любой подходящей клетки-хозяина. Подходящие векторы включают те, которые предназначены для экспансии и размножения или для экспрессии плазмид и вирусов, или для того и другого. Вектор может быть выбран из группы, состоящей из серии pUC (Fermentas Life Sciences), серии pBluescript (Stratagene, Ла-Холья, Калифорния), серии pET (Novagen, Мэдисон, Висконсин), серия pGEX (Pharmacia Biotech, Уппсала, Швеция) и серии рЕХ (Clontech, Пало-Альто, Калифорния). Также могут быть использованы бактериофаговые векторы, такие как λGT10, λGT11, λZapll (Stratagene), λEMBL4 и λNM1149. Примеры векторов для экспрессии в растениях включают pBI01, pBI101.2, pBI101.3, pBI121 и pBIN19 (Clontech). Примеры векторов для экспрессии в животных включают pEUK-Cl, pMAM и pMAMneo (Clontech). Предпочтительно, рекомбинантный экспрессионный вектор представляет собой вирусный вектор, например, ретровирусный вектор.
[0199] Рекомбинантные экспрессионные векторы согласно изобретению могут быть получены с использованием стандартных методик рекомбинантной ДНК, описанных, например, в Sambrook et al., см. выше, и Ausubel et al., см. выше. Конструкции экспрессионных векторов, которые являются кольцевыми или линейными, могут быть сделаны таким образом, чтобы содержать систему репликации, функционирующую в прокариотической или эукариотической клетке-хозяине. Системы репликации могут быть получены, например, из ColEl, плазмиды 2 μ, λ, SV40, вируса бычьей папилломы и т.п.
[0200] Желательно, чтобы рекомбинантный экспрессионный вектор содержал регуляторные последовательности, такие как кодоны инициации и терминации транскрипции и трансляции, которые являются специфическими для типа хозяина (например, бактерии, грибы, растения или животные), в которого должен быть введен вектор, в зависимости от обстоятельств и с учетом того, имеет ли вектор ДНК- или РНК-основу.
[0201] Рекомбинантный экспрессионный вектор может включать один или более чем один маркерный ген, который позволяет выбирать трансформированных или трансфицированных хозяев. Маркерные гены включают устойчивость к биоцидам, например, устойчивость к антибиотикам, тяжелым металлам и т.д., комплементацию в ауксотрофном хозяине для получения прототрофии и т.п. Подходящие гены-маркеры для экспрессионных векторов согласно изобретению включают, например, гены устойчивости к неомицину/G418, гены устойчивости к гигромицину, гены устойчивости к гистидинолу, гены устойчивости к тетрациклину, а также гены устойчивости к ампициллину.
[0202] Рекомбинантный экспрессионный вектор может содержать нативный или ненативнный промотор, функционально связанный с нуклеотидной последовательностью, кодирующей РЕ или химерную молекулу согласно изобретению (в том числе функциональные части и функциональные варианты), или с нуклеотидной последовательностью, которая комплементарна или которая гибридизуется с нуклеотидной последовательностью, кодирующей РЕ или химерную молекулу. Специалист в данной области способен выбрать промотор, например, сильный, слабый, индуцируемый, тканеспецифический и специфический к стадии развития. Аналогичным образом, объединение нуклеотидной последовательности с промотором также находится в пределах квалификации специалиста в данной области. Промотор может быть невирусным промотором или вирусным промотором, например, цитомегаловирусным (CMV) промотором, промотором SV40, промотором RSV или промотором, находящимся в длинном концевом повторе вируса мышиных стволовых клеток.
[0203] Рекомбинантные экспрессионные векторы согласно изобретению могут быть сконструированы либо для временной экспрессии, для стабильной экспрессии, либо для обоих вариантов экспрессии. Кроме того, рекомбинантные экспрессионные векторы могут быть сделаны для конститутивной экспрессии или для индуцируемой экспрессии.
[0204] Еще одно воплощение данного изобретения также относится к клетке-хозяину, содержащей любой из рекомбинантных экспрессионных векторов, описанных в данном документе. Используемый в данном документе термин "клетка-хозяин" относится к любому типу клеток, который может содержать рекомбинантный экспрессионный вектор согласно изобретению. Клетка-хозяин может быть эукариотической клеткой, например, клеткой растения, животного, гриба или водоросли, или может быть прокариотической клеткой, например, бактерией или простейшим. Клетка-хозяин может быть культивируемой клеткой, прикрепленной клеткой или суспендированной клеткой, т.е. клеткой, которая растет в суспензии. Для получения рекомбинантного РЕ или химерной молекулы согласно изобретению клетка-хозяин предпочтительно является прокариотической клеткой, например, клеткой Е. coli.
[0205] Данное изобретение также относится к популяции клеток, содержащей по меньшей мере одну клетку-хозяина, описанную в данном документе. Популяция клеток может быть гетерогенной популяцией, содержащей клетку-хозяина с любым из описанных рекомбинантных экспрессионных векторов в дополнение по меньшей мере к одной другой клетке, например, клетке-хозяину, которая не содержит никаких рекомбинантных экспрессионных векторов. Альтернативно, популяция клеток может быть по существу гомогенной популяцией, где указанная популяция содержит в основном (например, по существу состоит из) клетки-хозяева, содержащие рекомбинантный экспрессионный вектор. Популяция также может быть клональной популяцией клеток, когда все клетки популяции являются клонами одной клетки-хозяина, содержащей рекомбинантный экспрессионный вектор, так что все клетки популяции содержат рекомбинантный экспрессионный вектор. В одном из воплощений согласно изобретению популяция клеток является клональной популяцией клетки-хозяина, содержащей рекомбинантный экспрессионный вектор, описанный в данном документе.
[0206] РЕ, химерные молекулы (в том числе функциональные части и функциональные варианты), нуклеиновые кислоты, рекомбинантные экспрессионные векторы, клетки-хозяева (в том числе их популяции) и популяции клеток согласно изобретению могут быть выделены и/или очищены. Термин "выделенный", используемый в данном документе, означает "извлеченный из природной среды". Термин "очищенный", используемый в данном документе, означает повышенную чистоту, где "чистота" является относительным термином и не должна быть обязательно истолкована как абсолютная чистота. Например, чистота может составлять примерно 50% или более, примерно 60% или более, примерно 70% или более, примерно 80% или более, примерно 90% или более, или примерно 100%. Чистота предпочтительно составляет примерно 90% или более (например, от примерно 90% до примерно 95%), а более предпочтительно примерно 98% или более (например, от примерно 98% до примерно 99%).
[0207] РЕ, химерные молекулы (в том числе функциональные части и функциональные варианты), нуклеиновые кислоты, рекомбинантные экспрессионные векторы, клетки-хозяева (в том числе их популяции) и популяции клеток согласно изобретению, которые далее все вместе называются "РЕ-материалами согласно изобретению", могут быть включены в состав композиции, такой как фармацевтическая композиция. В связи с этим данное изобретение относится к фармацевтической композиции, содержащей любой из РЕ, химерных молекул (включая функциональные части и функциональные варианты), нуклеиновых кислот, рекомбинантных экспрессионных векторов, клеток-хозяев (включая их популяции) и популяций клеток и фармацевтически приемлемый носитель. Фармацевтическая композиция согласно изобретению, содержащая любой из предлагаемых в изобретении РЕ-материалов, может содержать более чем один РЕ-материал согласно изобретению, например, полипептид и нуклеиновую кислоту, или два или более двух различных РЕ. Альтернативно, фармацевтическая композиция может включать РЕ-материал согласно изобретению в комбинации с одним или более чем одним другим фармацевтически активным агентом или препаратом, таким как химиотерапевтический агент, например, аспарагиназа, бусульфан, карбоплатин, цисплатин, даунорубицин, доксорубицин, фторурацил, гемцитабин, гидроксимочевина, метотрексат, паклитаксел, ритуксимаб, винбластин, винкристин и т.п.
[0208] Предпочтительно, носитель представляет собой фармацевтически приемлемый носитель. Что касается фармацевтических композиций, носитель может быть любым из обычно используемых носителей и ограничен только физико-химическими соображениями, такими как растворимость и отсутствие реакционной способности в отношении активного соединения (соединений), а также путем введения. Фармацевтически приемлемые носители, описанные в данном документе, например, носители, адъюванты, эксципиенты и разбавители, хорошо известны специалистам в данной области и легко доступны. Предпочтительно, фармацевтически приемлемый носитель является таким, который химически инертен по отношению к активному агенту (агентам), и таким, который не имеет вредных побочных эффектов или токсичности в условиях применения.
[0209] Выбор носителя частично будет определяться конкретным РЕ-материалом согласно изобретению, а также конкретным способом, используемым для введения РЕ-материала согласно изобретению. Соответственно, существует множество подходящих составов фармацевтической композиции согласно данному изобретению. Следующие препараты для парентерального (например, подкожного, внутривенного, внутриартериального, внутримышечного, внутрикожного, внутрибрюшинного и интратекального), перорального и аэрозольного введения являются иллюстративными и никоим образом не ограничивающими. Для введения РЕ-материалов согласно изобретению может быть использован более чем один путь, а в некоторых случаях конкретный путь может обеспечить более быстрый и более эффективный ответ, чем другой путь.
[0210] Составы для местного применения хорошо известны специалистам в данной области. Такие составы особенно пригодны в контексте данного изобретения для нанесения на кожу.
[0211] Составы, пригодные для перорального введения, могут включать (а) жидкие растворы, такие как эффективное количество РЕ-материала согласно изобретению, растворенное в разбавителе, таком как вода, физиологический раствор или апельсиновый сок; (b) капсулы, саше, таблетки, леденцы и пастилки, каждая из которых содержит определенное количество активного ингредиента в виде твердого вещества или гранул; (с) порошки; (g) суспензии в подходящей жидкости; и (е) подходящие эмульсии. Жидкие составы могут включать разбавители, такие как воду и спирты, например, этанол, бензиловый спирт и полиэтиленовые спирты, с добавлением или без добавления фармацевтически приемлемого поверхностно-активного вещества. Капсульные формы могут быть обычными капсулами в твердой или мягкой желатиновой оболочке, содержащими, например, поверхностно-активные вещества, смазывающие вещества и инертные наполнители, такие как лактоза, сахароза, фосфат кальция и кукурузный крахмал. Таблетированные формы могут включать одно или более чем одно вещество из лактозы, сахарозы, маннита, кукурузного крахмала, картофельного крахмала, альгиновой кислоты, микрокристаллической целлюлозы, аравийской камеди, желатина, гуаровой камеди, коллоидного диоксида кремния, кроскармеллозы натрия, талька, стеарата магния, стеарата кальция, стеарата цинка, стеариновой кислоты и других эксципиентов, красителей, разбавителей, буферных агентов, дезинтегрирующих агентов, увлажняющих агентов, консервантов, ароматизаторов и других фармакологически приемлемых эксципиентов. Леденцовые формы могут включать РЕ-материал согласно изобретению во вкусовом агенте, как правило, в сахарозе и аравийской камеди или трагаканте, как и пастилки, содержащие РЕ-материал согласно изобретению в инертной основе, такой как желатин и глицерин или сахароза и гуммиарабик, эмульсии, гели и т.п., дополнительно содержащие такие эксципиенты, которые хорошо известны в данной области.
[0212] РЕ-материал согласно изобретению, используемый в одиночку или в комбинации с другими подходящими компонентами, может быть превращен в аэрозольные составы для введения посредством ингаляции. Эти аэрозольные составы могут быть помещены в находящиеся под давлением подходящие пропелленты, такие как дихлордифторметан, пропан, азот и т.п. Аэрозольные составы также могут быть приготовлены в виде фармацевтических препаратов для введения не под давлением, например, с помощью небулайзера или атомайзера. Такие составы-спреи также могут быть использованы для распыления на слизистую оболочку.
[0213] Составы, пригодные для парентерального введения, включают водные и неводные изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические факторы и растворенные вещества, которые делают состав изотоничным крови предполагаемого реципиента, а также водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, солюбилизаторы, загустители, стабилизаторы и консерванты. РЕ-материал согласно изобретению может быть введен в физиологически приемлемом разбавителе в фармацевтическом носителе, таком как стерильная жидкость или смесь жидкостей, включая воду, физиологический раствор, водные растворы декстрозы и родственных сахаров, спирт, такой как этанол или гексадециловый спирт, гликоль, такой как пропиленгликоль или полиэтиленгликоль, диметилсульфоксид, глицерин, кеталь, такой как 2,2-диметил-1,3-диоксолан-4-метанол, простые эфиры, полиэтиленгликоль 400, масла, жирные кислоты, сложные эфиры или глицериды жирных кислот или ацетилированные глицериды жирных кислот с добавлением или без добавления фармацевтически приемлемого поверхностно-активного вещества, такого как мыло или детергент, суспендирующий агент, такой как пектин, карбомеры, метилцеллюлозу, гидроксипропилметилцеллюлозу или карбоксиметилцеллюлозу, или эмульгирующие агенты и другие фармацевтические адъюванты.
[0214] Масла, которые могут быть использованы в композициях для парентерального введения, включают минеральные масла, масла животного и растительного происхождения или синтетические масла. Конкретные примеры масел включают арахисовое, соевое, кунжутное, хлопковое, кукурузное, оливковое, вазелиновое и минеральное. Подходящие жирные кислоты для применения в составах для парентерального введения включают олеиновую кислоту, стеариновую кислоту и изостеариновую кислоту. Этилолеат и изопропилмиристат являются примерами подходящих сложных эфиров жирных кислот.
[0215] Подходящие мыла для применения в составах для парентерального введения включают жирнокислотные соли щелочных металлов, аммония и триэтаноламина, а подходящие детергенты включают (а) катионные детергенты, такие как, например, диметилдиалкиламмония галогениды и алкилпиридина галогениды, (b) анионные детергенты, такие как, например, алкил-, арил- и олефинсульфонаты, алкил-, олефин-, эфир- и моноглицеридсульфаты и сульфосукцинаты, (с) неионные детергенты, такие как, например, оксиды жирных аминов, алканоламиды жирных кислот и сополимеры полиоксиэтиленполипропилена, (d) амфотерные детергенты, такие как, например, алкил-β-аминопропионаты и 2-алкилимидазолина четвертичные аммониевые соли, и (d) их смеси.
[0216] Составы для парентерального введения, как правило, будут содержат от примерно 0,5% до примерно 25% по массе РЕ-материала согласно изобретению в растворе. Могут быть использованы консерванты и буферы. Для того чтобы свести к минимуму или устранить раздражение в месте инъекции, такие композиции могут содержать одно или более чем одно неионогенное поверхностно-активное вещество, имеющее гидрофильно-липофильный баланс (hydrophile-lipophile balance, HLB) от примерно 12 до примерно 17. Количество поверхностно-активного вещества в таких составах, как правило, находится в диапазоне от примерно 5% до примерно 15% по весу. Подходящие поверхностно-активные вещества включают полиэтиленгликолевые эфиры сорбита и жирной кислоты, такие как сорбитан моноолеат и высокомолекулярный продукт присоединения этиленоксида с гидрофобным основанием, образованный путем конденсации пропиленоксида с пропиленгликолем. Составы для парентерального введения могут быть представлены в единичной дозе или в многодозовых герметичных контейнерах, таких как ампулы и пузырьки, и могут храниться в лиофилизированном (высушенном замораживанием) состоянии, требующем только добавления стерильного жидкого эксципиента, например, воды для инъекций, непосредственно перед применением. Растворы и суспензии для инъекций, которые готовят непосредственно перед применением, могут быть приготовлены из стерильных порошков, гранул и таблеток типа таких, которые описаны ранее. Требования, предъявляемые к эффективным фармацевтическим носителям для парентеральных композиций, хорошо известны специалистам в данной области (см., например, Pharmaceutics and Pharmacy Practice, J.B. Lippincott Company, Philadelphia, PA, Banker and Chalmers, eds., страницы 238-250 (1982), и ASHP Handbook on Injectable Drugs, Toissel, 4th ed., страницы 622-630 (1986)).
[0217] Специалистам в данной области будет понятно, что в дополнение к описанным выше фармацевтическим композициям РЕ-материал согласно данному изобретению может быть приготовлен в виде комплексов включения, таких как комплексы включения циклодекстринов, или липосом.
[0218] Для целей данного изобретения количество или доза вводимого РЕ-материала согласно изобретению должны быть достаточными для осуществления у млекопитающего желаемого ответа, например, терапевтического или профилактического ответа, в течение разумного периода времени. Например, доза РЕ-материала согласно изобретению должна быть достаточной для ингибирования роста клетки-мишени или лечения или профилактики рака в течение периода примерно от 2 часов или дольше, например, от 12 до 24 и более часов с момента введения. В некоторых воплощениях период времени может быть даже больше. Доза будет определяться эффективностью конкретного РЕ-материала согласно изобретению и состоянием млекопитающего (например, человека), а также массой тела млекопитающего (например, человека), подлежащего лечению.
[0219] В данной области известно много анализов для определения вводимой дозы. Вводимая доза может быть определена in vitro (например, на клеточных культурах) или in vivo (например, исследования на животных). Например, вводимая доза может быть определена путем определения IC50 (дозы, которая позволяет достичь половины максимального ингибирования симптомов), LD50 (дозы, летальной для 50% популяции), ED50 (дозы, терапевтически эффективной для 50% популяции), а также терапевтического индекса в культуре клеток и/или в исследованиях на животных. Терапевтический индекс представляет собой отношение LD50 к ED50 (т.е. LD50/ED50).
[0220] Доза РЕ-материала согласно изобретению также будет определяться наличием, природой и степенью каких-либо неблагоприятных побочных эффектов, которые могут сопровождать введение конкретного РЕ-материала согласно изобретению. Как правило, лечащий врач будет определять дозировку РЕ-материала согласно изобретению, которым он будет лечить каждого отдельного пациента, принимая во внимание различные факторы, такие как возраст, масса тела, общее состояние здоровья, диета, пол, РЕ-материал для введения согласно изобретению, путь введения, а также тяжесть состояния, подлежащего лечению. В качестве примера и без намерения ограничить изобретение, доза РЕ-материала согласно изобретению может составлять от примерно 0,001 до примерно 1000 мг/кг массы тела субъекта, подлежащего лечению, в день, от примерно 0,01 до примерно 10 мг/кг массы тела/день, от примерно 0,01 мг до примерно 1 мг/кг массы тела/день, от примерно 1 до примерно 1000 мг/кг массы тела/день, от примерно 5 до примерно 500 мг/кг массы тела/день, от примерно 10 до примерно 250 мг/кг массы тела/день, от примерно 25 до примерно 150 мг/кг массы тела/день, или примерно 10 мг/кг массы тела/день.
[0221] Альтернативно РЕ-материалы согласно изобретению могут быть переведены в депо-форму, так что способ, в котором РЕ-материал согласно изобретению выпускается в организм, в который его вводят, контролируется временем и расположением в пределах организма (см., например, патент США 4450150). Депо-формы РЕ-материалов согласно изобретению могут представлять собой, например, имплантируемую композицию, содержащую РЕ-материалы согласно изобретению и пористый или непористый материал, такой как полимер, где РЕ-материал согласно изобретению инкапсулирован или рассеян по всему материалу и/или возникает при деградации непористого материала. Затем депо имплантируют в нужное место в организме и РЕ-материалы согласно изобретению высвобождаются из имплантата с заданной скоростью.
[0222] РЕ-материалы согласно изобретению могут быть исследованы на цитотоксичность с помощью анализов, известных в данной области. Примеры анализов цитотоксичности включают WST-анализ, который измеряет пролиферацию клеток с использованием тетразолиевой соли WST-1 (реагенты и наборы, доступные от Roche Applied Sciences), как описано в публикации международной патентной заявки WO 2011/032022.
[0223] Предполагается, что фармацевтические композиции, РЕ, химерные молекулы, нуклеиновые кислоты, рекомбинантные экспрессионные векторы, клетки-хозяева или популяции клеток согласно изобретению могут быть использованы в способах лечения или профилактики рака. Не связываясь с конкретной теорией или механизмом, полагают, что РЕ согласно изобретению разрушают или ингибируют рост клеток посредством ингибирования синтеза белка в эукариотических клетках, например, путем инактивации АДФ-рибозилирования фактора элонгации 2 (EF-2). Без связи с конкретной теорией или механизмом, химерные молекулы согласно изобретению распознают и специфически связываются с маркерами клеточной поверхности, тем самым доставляя цитотоксический РЕ к популяции клеток, экспрессирующих маркер клеточной поверхности, с минимальной перекрестной реактивностью или вообще без нее в отношении клеток, которые не экспрессируют маркер клеточной поверхности. Таким образом, цитотоксичность РЕ может быть направлена на уничтожение или ингибирование роста определенной популяции клеток, например, раковых клеток. В связи с этим данное изобретение относится к способу лечения или профилактики рака у млекопитающего, включающему введение млекопитающему любого из РЕ, химерных молекул, нуклеиновых кислот, рекомбинантных экспрессионных векторов, клеток-хозяев, популяций клеток или фармацевтических композиций, описанных в данном документе, в количестве, эффективном для лечения или профилактики рака у млекопитающего.
[0224] Термины "лечить" и "предотвращать", а также их слова-производные, используемые в данном документе, не обязательно означают 100% или полное лечение или предотвращение (профилактику). Скорее, существуют различные степени лечения или профилактики, которые специалисты в данной области смогут распознать как имеющие потенциальное преимущество или терапевтический эффект. В этой связи способы согласно изобретению могут обеспечить некоторый уровень лечения или профилактики рака у млекопитающего. Кроме того, лечение или профилактика способом согласно изобретению могут включать лечение или профилактику одного или более чем одного из состояний или симптомов заболевания, например, рака, который лечат или предотвращают. Кроме того, для целей согласно данному изобретению термин "профилактика" может включать отсрочку начала заболевания или симптома или состояния.
[0225] В способах согласно данному изобретению, в которых вводят клетки-хозяева или популяции клеток, клетки могут быть аллогенны или аутологичны хозяину. Предпочтительно клетки являются аутологичными хозяину.
[0226] Что касается способов согласно изобретению, рак может представлять собой любой рак, включая любой из перечисленных: рак надпочечников, саркомы (например, синовиальная саркома, остеогенная саркома, лейомиосаркома матки, ангиосаркома, фибросаркома, рабдомиосаркома, липосаркома, миксома, рабдомиома, фиброма, липома и тератома), лимфомы (например, мелкоклеточная лимфоцитраная лимфома, лимфома Ходжкина и неходжкинская лимфома), гепатоцеллюлярная карцинома, глиома, злокачественные опухоли головы (например, плоскоклеточная карцинома), злокачественные опухоли шеи (например, плоскоклеточная карцинома), острый лимфоцитарный рак, лейкемии (например, волосатоклеточная лейкемия, миелоидная лейкемия (острая и хроническая), лимфолейкоз (острый и хронический), пролимфоцитарный лейкоз (prolymphocytic leukemia, PLL), миеломоноцитарный лейкоз (острый и хронический) и лимфоцитарный лейкоз (острый и хронический), рак кости (остеогенная саркома, фибросаркома, злокачественная фиброзная гистиоцитома, хондросаркома, саркома Юинга, злокачественная лимфома (ретикулярноклеточная саркома), множественная миелома, злокачественная гигантоклеточная опухоль, хордома, остеохондрома (костно-хрящевые экзостозы), доброкачественная хондрома, хондробластома, хондромиксоидная фиброма, остеоидная остеома и гигантоклеточная опухоль), рак головного мозга (астроцитома, медуллобластома, глиома, эпендимома, герминома (пинеалома), мультиформная глиобластома, олигодендроглиома, шваннома и ретинобластома), рак фаллопиевой трубы, рак молочной железы, рак заднего прохода, рак анального канала или рак прямой кишки, рак глаза, рак внутрипеченочных желчных протоков, рак суставов, рак шеи, желчного пузыря или плевры, рак носа, носовой полости или среднего уха, рак полости рта, рак вульвы (например, плоскоклеточная карцинома, интраэпителиальная карцинома, аденокарцинома и фибросаркома), миелопролиферативные нарушения (например, хронический миелоидный рак), рак толстой кишки (например, карцинома толстой кишки), рак пищевода (например, плоскоклеточная карцинома, аденокарцинома, леймиосаркома и лимфома), рак шейки матки (карцинома шейки матки и преинвазивная дисплазия шейки матки), рак желудка, желудочно-кишечная карциноидная опухоль, рак гортаноглотки, рак гортани, рак печени (например, гепатоцеллюлярная карцинома, холангиокарцинома, гепатобластома, ангиосаркома, гепатоцеллюлярная аденома и гемангиома), рак легких (например, бронхогенная карцинома (плоскоклеточная, недифференцированная мелкоклеточная, недифференцированная крупноклеточная и аденокарцинома), альвеолярная (бронхиолярная) карцинома, бронхиальная аденома, хондроматозная гамартома, мелкоклеточный рак легкого, немелкоклеточный рак легкого и аденокарцинома легкого), мезотелиома, рак кожи (например, меланома, базально-клеточная карцинома, плоскоклеточная карцинома, саркома Капоши, невусы, диспластические невусы, липома, ангиома, фиброма кожи и келоиды), множественная миелома, рак носоглотки, рак яичников (например, карцинома яичников (серозная цистаденокарцинома, муцинозная цистаденокарцинома, эндометриоидная карцинома и светлоклеточная аденокарцинома), гранулезотекаклеточные опухоли, опухоли из клеток Сертоли-Лейдига, дисгерминома и злокачественная тератома), рак поджелудочной железы (например, протоковая аденокарцинома, инсулинома, глюкагонома, гастринома, карциноидные опухоли и ВИПома), рак брюшины, сальника, брыжейки, рак глотки, рак предстательной железы (например, аденокарцинома и саркома), рак прямой кишки, рак почки (например, аденокарцинома, опухоль Вильмса (нефробластома) и почечно-клеточная карцинома), рак тонкого кишечника (аденокарцинома, лимфома, карциноидные опухоли, саркома Капоши, лейомиома, гемангиома, липома, нейрофиброма и фиброма), рак мягких тканей, рак желудка (например, карцинома, лимфома и леймиосаркома), рак яичка (например, семинома, тератома, эмбриональная карцинома, тератокарцинома, хориокарцинома, саркома, опухоль из клеток Лейдига, фиброма, фиброаденома, аденоматоидные опухоли и липома), рак матки (например, карцинома эндометрия), рак щитовидной железы и уротелиальные злокачественные опухоли (например, плоскоклеточная карцинома, переходно-клеточная карцинома, аденокарцинома, рак мочеточника и рак мочевого пузыря).
[0227] Используемый в данном документе термин "млекопитающее" относится к любому млекопитающему, включая, но не ограничиваясь ими, млекопитающих отряда Rodentia, таких как мыши и хомяки, и млекопитающих отряда Logomorpha, таких как кролики. Предпочтительно, чтобы млекопитающие были из отряда Carnivora, включая Felines (кошки) и Canines (собаки). Более предпочтительно, чтобы млекопитающие были из отряда Artiodactyla, включая Bovines (коровы) и Swines (свиньи), или из отряда Perssodactyla, включая Equines (лошади). Наиболее предпочтительно, чтобы млекопитающие были из отряда Primates, Ceboids или Simoids (обезьяны) или отряда Anthropoids (люди и человекообразные обезьяны). Особенно предпочтительным млекопитающим является человек.
[0228] Данное изобретение также относится к способу ингибирования роста клетки-мишени, включающему контактирование клетки с РЕ, выбранным среди любых РЕ, химерных молекул, нуклеиновых кислот, рекомбинантных экспрессионных векторов, клеток-хозяев, популяций клеток или фармацевтических композиций, описанных в данном документе, в количестве, эффективном для ингибирования роста клетки-мишени. Рост клетки-мишени может быть подавлен на любое значение, например, примерно на 10% или более, примерно на 15% или более, примерно на 20% или более, примерно на 25% или более, примерно на 30% или более, примерно на 35% или более того, примерно на 40% или более, примерно на 45% или более, примерно на 50% или более, примерно на 55% или более, примерно на 60% или более, примерно на 65% или более, примерно на 70% или более, примерно на 75% или более, примерно на 80% или более, примерно на 85% или более, примерно на 90% или более, примерно на 95% или более, или примерно на 100%. Клетка-мишень может находиться в биологическом образце. Биологический образец может быть получен из млекопитающего любым подходящим способом и из любого подходящего источника. Биологический образец, например, может быть получен путем сбора крови, лейкафереза и/или биопсии опухоли или аутопсии. Контактирование может происходить in vitro или in vivo относительно млекопитающего. Предпочтительно, чтобы контактирование происходило in vitro.
[0229] В одном из воплощений согласно изобретению клетка-мишень представляет собой раковую клетку. Клетка-мишень может представлять собой раковую клетку любого из видов рака, описанных в данном документе. В одном из воплощений согласно изобретению мишень может экспрессировать маркер клеточной поверхности. Маркер клеточной поверхности может быть любым маркером клеточной поверхности, описанным в данном документе в отношении других аспектов изобретения. Маркер клеточной поверхности может быть, например, выбран из группы, состоящей из CD19, CD21, CD22, CD25, CD30, CD33, CD79b, рецептора трансферрина, EGF-рецептор, мезотелина, кадгерина и антигена Льюиса Y.
[0230] Следующие примеры дополнительно иллюстрируют изобретение, но, разумеется, их не следует рассматривать как каким-либо образом ограничивающие его объем.
Пример 1
[0231] В этом примере показана идентификация Т-клеточных эпитопов в домене III РЕ38.
[0232] Для идентификации Т-клеточных эпитопов в РЕ38 мононуклеарные клетки периферической крови (peripheral blood mononuclear cells, PBMC) сначала инкубировали с рекомбинантным иммунотоксином (от англ. recombinant immunotoxin - RIT) в течение 14 дней, чтобы RIT процессировался донорскими АРС до релевантных пептидов, которые будут представлены Т-клеткам. Затем обогащенные PBMC подвергали воздействию пептидной библиотеки, состоящей из 111 частично перекрывающихся пептидов, охватывающих последовательность РЕ38, и измеряли активацию Т-клеток с помощью анализа ELISpot для интерлейкина-2 (IL-2).
[0233] Анализировали образцы от 50 здоровых доноров без зарегистрированного предыдущего воздействия РЕ38 и с широким распределением аллелей человеческого лейкоцитарного антигена (human leukocyte antigen, HLA). Клетки этой популяции содержали наивный Т-клеточный эпитоп. Также были проанализированы образцы от девяти пациентов с мезотелиомой и от семи пациентов с волосатоклеточным лейкозом (HCL), которые ранее получали RIT на основе РЕ, и у которых развивались высокие уровни нейтрализующих антител. Клетки этой популяции содержали эпитопы Т-клеток памяти. Ответы наивных доноров и ранее лечившихся пациентов приведены в формате тепловой карты на фиг. 1А-1В.
[0234] Фиг. 1А представляет положительные и отрицательные ответы 50 наивных доноров. Ответы представлены в процентах реагирующих пятен для каждого донора. Самый сильный положительный ответ показан как более20%, ответы средней силы показаны как от 10% до 20%, слабые ответы показаны как от 3% до 10%, а отсутствие ответа (отрицательный ответ) показано как менее 3%. Результаты включали в общей сложности 258 положительных ответов, и 201 из них были слабыми (от 3 до 10%), 44 были средней силы (от 10 до 20%), и 13 были сильными (более20%), остальные 5292 ответа были отрицательными (менее 3%). Было получено 122 ответа на домен II (пептиды 1-38), включая 11 сильных, 24 ответа средней силы и 87 слабых ответов. Было получено 136 ответов на домен III (пептиды с 39 по 111), включая 2 сильных, 20 средних и 114 слабых ответов.
[0235] Пептиды 15 и 14 (в пуле 3) давали самые сильные и наиболее частые ответы в исследовании с 21 и 18 положительными ответами, соответственно. В общей сложности 36 пептидов не вызывали никакого ответа. 16 из 50 наивных доноров имели единственный эпитоп, дающий ответ, что показано одним, двумя или тремя ответами в перекрывающихся последовательных пептидах. Пятнадцать доноров имели два отдельных эпитопа, 14 имели три эпитопа, а пятеро имели четыре эпитопа. В 22 случаях скрининг положительного пула не дал специфического ответа на пептиды или не был сделан, что дало пять последовательных положительных ответов на тепловой карте.
[0236] Фиг. 1В представляет положительные и отрицательные ответы от девяти пациентов с мезотелиомой и от семи пациентов с HCL. У пациентов с мезотелиомой было установлено 919 отрицательных ответов и 80 ответов, включающих два сильных ответа (более20%), четыре ответа средней силы (от 10 до 20%) и 74 слабых ответа (от 3 до 10%). Два сильных ответа были вызваны пептидами 13 и 14, а ответы средней силы были вызваны пептидами 15, 35, 57 и 74. Тридцать пять из этих ответов были в домене II (пептиды с 1 по 38), а 45 - в домене III (пептиды с 38 по 111). Паттерн теплового пятна, созданный в карте, был похож на паттерн теплового пятна в карте наивных доноров. Способность отвечать (которая означает, сколько эпитопов было найдено для каждого пациента) была выше, чем паттерн доноров, при этом у одного пациента было два эпитопа, у четырех пациентов было три эпитопа, у двух пациентов было четыре эпитопа, и еще двух пациентов было пять эпитопов.
[0237] Кроме того, у семи пациентов с HCL было обнаружено три сильных ответа (более20%), девять ответов средней силы (от 10 до 20%), 37 слабых ответов (от 3 до 10%) и 728 отрицательных ответов (менее 3%). Все сильные ответы были в последовательных пептидах 75, 76 и 77. 22 ответа были в домене II, и 37 ответов были в домене III. Интересно отметить, что иммунодоминантный эпитоп в пептидах 14 и 15, который был идентифицирован более чем у 40% наивных доноров и 55% пациентов с мезотелиомой (пять из девяти образцов), не был обнаружен ни у одного из пациентов с HCL. Один пациент ответил на пептиды 12 и 13, которые имеют общие аминокислоты с пептидами 14 и 15. Тем не менее, непосредственно к пептидам 14 и 15 не было обнаружено никакой реакции. Это может быть связано со смещенным распределением HLA в образцах этих пациентов или с природой заболевания.
[0238] В целом, в РЕ38 было идентифицировано восемь основных эпитопов, на которые приходилось 93% ответов. Поскольку все Т-клеточные эпитопы в домене II могут быть устранены путем удаления LR, пять эпитопов, оставшихся в домене III, оказались в центре внимания при последующем изучении. В таблице 1А приведено расположение эпитопов, последовательности, скорости ответов и мутации, которые вызывают минимальное нарушение цитотоксической активности. Рейтинг эпитопов был составлен из целого ряда факторов, включая число наивных доноров, отвечающих на эпитоп, относительную силу ответа, число отвечающих пациентов с мезотелиомой и, в меньшей степени, отвечающих пациентов с HCL. Эпитопы от пациентов с HCL в данном анализе были оценены в меньшей степени из-за смещения HLA в когорте пациентов и в популяции пациентов с HCL, где пациенты с HCL имели обогащение BRB1_11 (Annino et al., Leuk. Lymphoma, 14 (Suppl.) 1:63-5 (1994)). Эпитоп 2 охватывает пять пептидов. Для упрощения анализа он был разделен на два субэпитопа: пептиды 77-78 (2А) и пептиды 75-76 (2В). Некоторые доноры ответили на оба эпитопа, 2А и 2В, в то время как другие ответили только на один. Эпитоп 6 (пептиды с 93 по 96) и эпитоп 8 (пептиды с 56 по 59) также были разделены на два субэпитопа.
[0239] Для сравнения результатов от наивных доноров и пациентов, получавших иммунотоксин, были изучены две когорты пациентов, у которых развивались нейтрализующие антитела против RIT. Пациенты с аллелью HLA DRB1 приведены в таблице 1В. Такие же эпитопы, которые были идентифицированы в когорте доноров, присутствовали также в когортах пациентов. Одна когорта была от пациентов с мезотелиомой, получавших SS1P (анти-мезотелин-Fv, слитый с P38) (Chowdhury et al., Nat. Biotechnol., 17: 568-572 (1999)); другая от пациентов с лейкемией, получавших моксетумомаб пасудотокс (moxetumomab pasudotox, MP), RIT, включающий PE38, слитый с анти-CD22-Fv (Kreitman et al., Clin. Cancer Res., 17: 6398-6405 (2011)). Ответы на эпитопы у наивных доноров варьировали в пределах от 1 до 4 эпитопа на одного донора, в среднем 2,1, а ответы у пациентов варьировали в пределах от 1 до 7 на одного пациента с более высоким средним числом 3,4 (рменее0,001 в t-тесте Стьюдента). Это говорит о том, что некоторые ответы в наивной популяции были слишком слабы, чтобы быть обнаруженными с помощью этого способа, и усиливались после воздействия иммунотоксина. В образцах пациентов не было выявлено каких-либо главных эпитопов, которые не были бы выявлены в когорте доноров.

Пример 2
[0240] В этом примере показано устранение Т-клеточных эпитопов в домене III.
[0241] Для каждого из эпитопов в домене III, которые описаны в таблице 1, был выполнен аланин-сканирующий мутагенез. Аланиновый мутант был встроен в RIT в соответствии со следующими 11 этапами: (1) составляли список всех аланиновых пептидных вариантов для каждого эпитопа; (2) проводили прогнозирование in silico, чтобы исключить аланиновые варианты, которые увеличивают связывание по меньшей мере с шестью аллелями HLA, с использованием алгоритма связывания HLA (Immune Epitope Database, IEDB) (Wang et al., PLoS Comput. Biol., 4:e1000048 (2008)), который измерял их способность связываться с 13 основными группами HLA; (3) аланиновые варианты анализировали с использованием от 8 до 15 образцов от доноров и пациентов с экспансией in vitro и ELIspot; (4) идентифицировали аланиновую мутацию, вызывающую пониженную активацию Т-клеток; (5) клонировали аланиновую мутацию в плазмиду HA22-LR и строили RIT с одной точечной мутацией; (6) изучали активность с помощью анализа WST8.
[0242] Если белок агрегировал или обладал низкой цитотоксической активностью, использовали прогнозирование in silico (7) и кристаллическую структуру для определения альтернативных аминокислот для аланина, и (8) в плазмиду HA22-LR клонировали новую мутацию, конструировали RIT с одной точечной мутацией и изучали активность. Если белок агрегировал или обладал низкой цитотоксической активностью, то идентифицировали следующий лучший аланиновый мутант, как это было проведено на этапе 4 и 5. Если белок был активным, проводили этап 10.
[0243] Если белок был активным, (10) проводили валидацию с целью определить, что эпитоп уменьшился, и что никакие новые эпитопы не появились из-за мутации; и (11) успешные точечные мутации объединяли в один RIT.
[0244] Результаты для всех эпитопов приведены в таблицах с 2 по 7. В таблицах 2-7 подчеркнутые значения представляют менее10%, D - донор, Pt - пациент, "Meso" - мезотелиома, позиция, в которой аминокислота заменена аланином, подчеркнута, а средние значения выделены жирным шрифтом. Аланиновые варианты были проанализированы с помощью от 8 до 15 образцов от доноров и пациентов с экспансией in vitro и ELIspot.





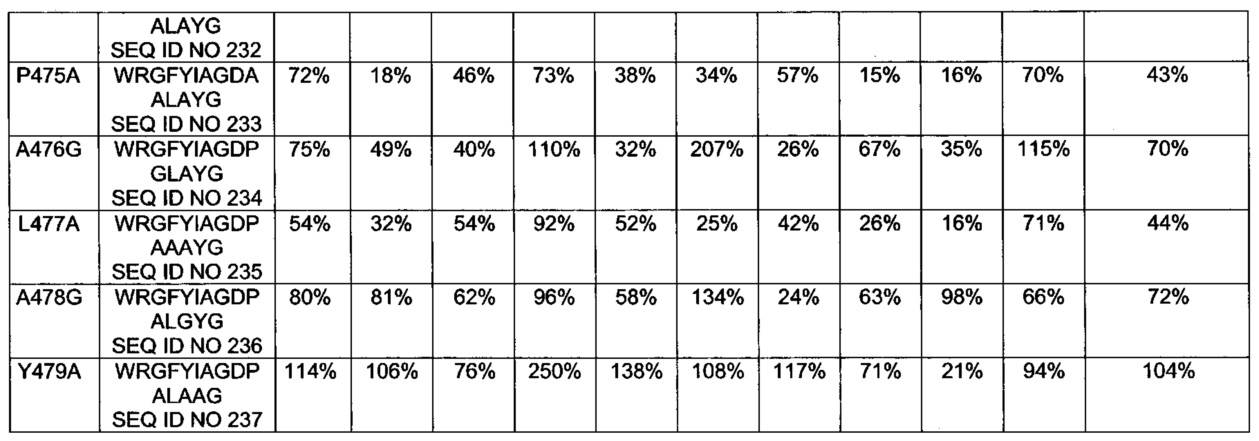


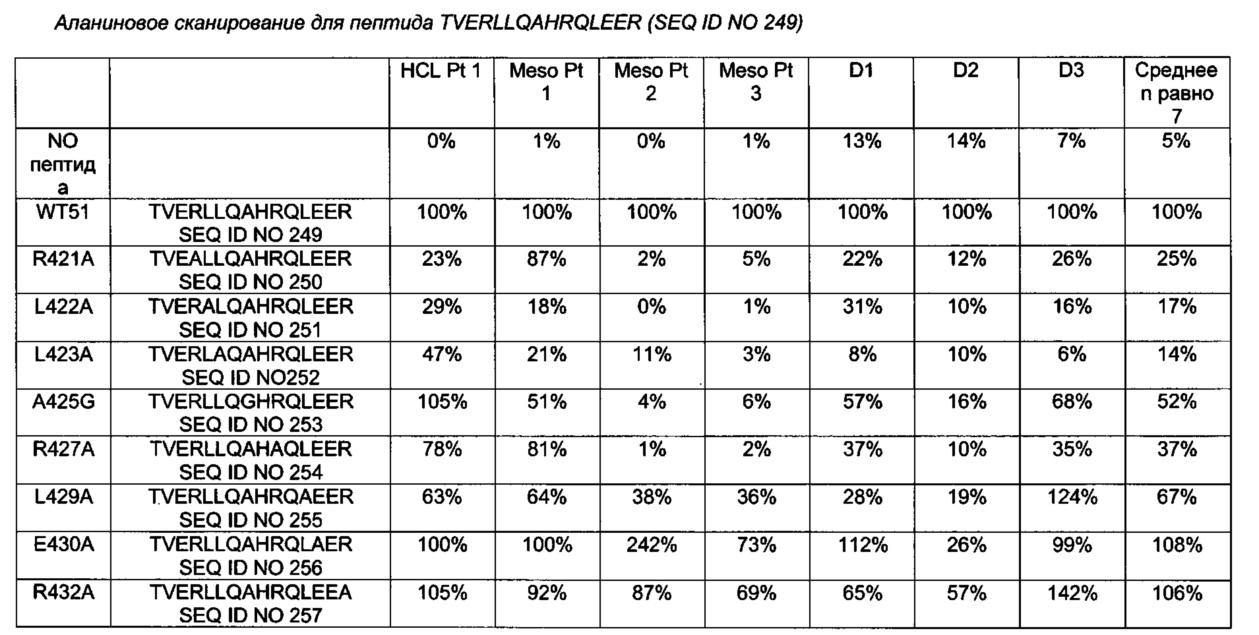
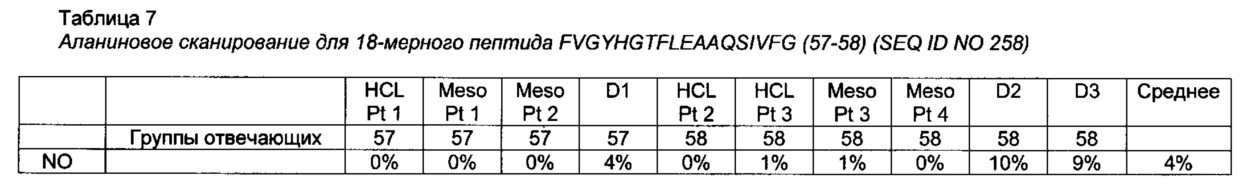
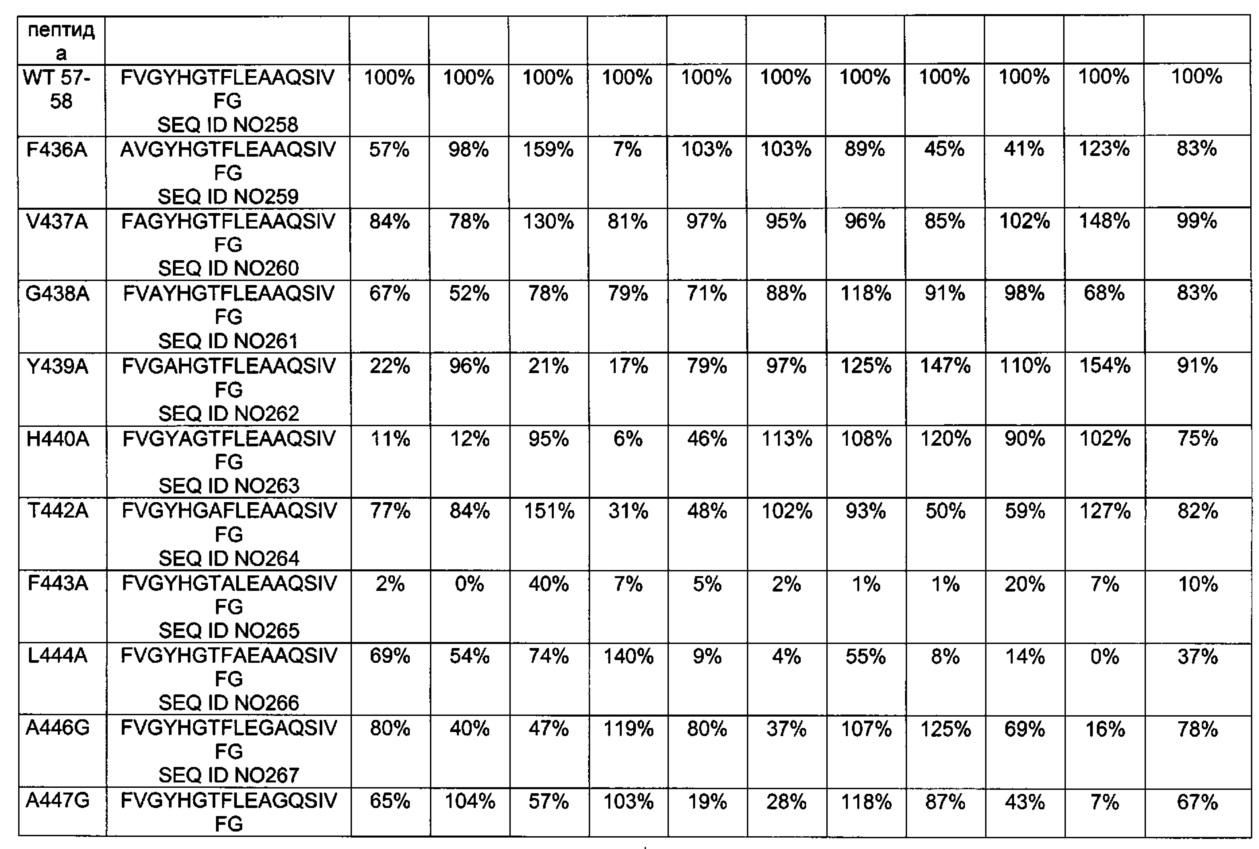
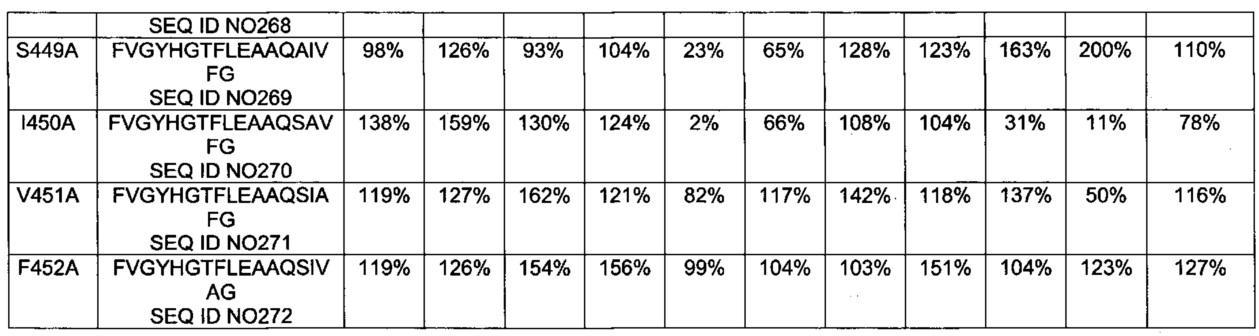
[0245] Эпитопы 2А и 2В сканировали по отдельности, чтобы охватить 9-мерное ядро всех пяти пептидов, которые дали ответы. Y502A уменьшала ответы обоих эпитопов (таблицы 2 и 3). Для эпитопов 5 и 7 аланиновые мутанты сравнивали с пептидом 67 и 51, соответственно, и I471A и L423A имели самый низкий Т-клеточный ответ (таблицы 4 и 6). Чтобы охватить все 9-мерные ядра в эпитопах 6 и 8, которые содержали четыре положительных пептида, был синтезирован 18-мерный WT и аланиновые варианты. Было установлено, что L552A является наиболее эффективной в снижении ответа в отношении эпитопа 6 (таблица 5), a F443A был лучшим в отношении эпитопа 8 (таблица 7).
Пример 3
[0246] Этот пример демонстрирует цитотоксическую активность белков с точечной мутацией в HA22-LR.
[0247] Проводили этап 4 из примера 2. Лучшие варианты, определенные при аланиновом сканировании или с использованием дополнительного предсказания in silico, описаны в таблице 1А.
[0248] Были сконструированы 40 мутантных RIT. Цитотоксическую активность белков с точечной мутацией в HA22-LR оценивали в отношении клеток СА46, Raji и Daudi. Выход очищенного белка, рассчитанные доступные площади поверхности (Lee et al., J. Mol. Biol., 55:379-400 (1971); Roscoe et al., Infect. Immunity, 62:5055-5065 (1994)) аминокислотных остатков WT и цитотоксическая активность каждого RIT приведены в таблице 8.


Пример 4
[0249] Этот пример демонстрирует, что замены в домене III РЕ уменьшают эпитоп и не создают новых эпитопов вследствие мутации.
[0250] Измеряли ответ трех донорских образцов и одного образца от пациента на 22 пептидных пула после стимуляции либо НА22 (wt), либо LR-R494A. "LR" означает удаление всего домена II за исключением последовательности расщепления фурином. Результаты показаны на фиг. 2A-2D. Как показано на фиг. 2A-2D, эпитоп в пептиде 76 уменьшался за счет мутации R494A.
[0251] Измеряли ответ двух донорских образцов и одного образца от пациента на 22 пептидных пула после стимуляции либо НА22 (wt), либо LR-R505A. Результаты показаны на фиг. 3А-3С. Как показано на фиг. 3А-3С, эпитоп в пептиде 77 уменьшался за счет мутации R505A.
[0252] Измеряли ответ двух донорских образцов на 22 пептидных пула после стимуляции либо HA22-LR (WT), либо LR-R551A и рестимуляции соответствующими пептидами. Результаты показаны на фиг. 4А-4В. Как показано на фиг. 4А-4В, мутация R551A уменьшила эпитоп в пептиде 93.
[0253] Измеряли ответ клеток от двух доноров и от двух пациентов после стимуляции RIT и рестимуляции пептидами 93, 94 с аминокислотной последовательностью WT, L552E или L552N. Результаты показаны на фиг. 5A-5D. Как показано на фиг. 5A-5D, эпитоп в пептидах 93 и 94 уменьшался за счет мутаций L552N и L552E.
[0254] Также измеряли ответ трех донорских образцов на 22 пептидных пула после стимуляции либо HA22-LR (WT), либо LR-R427A и рестимуляции соответствующими пептидами. Результаты показаны на фиг. 6А-6С. Как показано на фиг. 6А-6С, мутация R427A уменьшила эпитоп в пептиде 51.
[0255] Измеряли ответ двух образцов от пациентов и одного донорского образца на пулы 8-22 после стимуляции либо HA22-LR (WT), либо LR-F443A и рестимуляции соответствующими пептидами. Результаты показаны на фиг. 7А-7С. Как показано на фиг. 7А-7С, мутация F443A уменьшила эпитоп в пулах 11 и 12.
[0256] Четыре донорских образца стимулировали RIT и рестимулировали пептидом 67, содержащим валин или аланин в позиции I471. Ответ показан на фиг. 9A-9D в клетках, формирующих пятно (spot forming cells, SFC)/106 клеток. Как показано на фиг. 9A-9D, мутация 1471V не уменьшила эпитоп в пептиде 67.
[0257] Также измеряли Т-клеточную активацию в ответ на стимуляцию пептидами 67 или 68, которые содержат аланиновую или гистидиновую мутацию в позиции L477 или не содержат мутаций (WT). Результаты (SFC/106 клеток) приведены в таблице 9 и на фиг. 10A-10D. Как показано на фиг. 10A-10D и в таблице 9, мутация L477H уменьшила эпитоп в пептиде 67 и 68.


[0258] Клетки от двух пациентов стимулировали RIT и рестимулировали пептидом 93, 94 или 95 с аминокислотной последовательностью WT или L556V. Результаты показаны на фиг. 11А и В. Мутация L477V не уменьшала эпитоп в пептиде 94.
Пример 5
[0259] Этот пример демонстрирует активность комбинаций мутаций в НА22-LR.
[0260] Чтобы объединить точечные мутации, которые были эффективны в уменьшении Т-клеточных эпитопов, и поддержать хорошую цитотоксическую активность, были разработаны гены, которые содержат различные комбинации точечных мутаций. Эти гены были клонированы в плазмиду HA22-LR RIT. В таблице 10 показаны семь RIT, которые были сконструированы, а также HA22-LR WT. В таблице 10 также показана цитотоксическая активность на двух клеточных линиях и вычисленный остаточный Т-клеточный ответ. Вычисленный остаточный ответ является суммой ответов, показанных на тепловой карте эпитопов для каждого из эпитопов, при условии, что мутация будет устранять ответы в эпитопе полностью. Этот расчет не принимает во внимание силу ответа.
[0261] Как показано в таблице 10, из 258 ответов, определенных в донорском скрининге РЕ38, 136 ответов были в домене III и присутствовали в HA22-LR. Устранение эпитопов в пептиде (с 77 по 78), (с 51 по 52) и (с 57 по 58) с помощью мутаций R505A, R427A и F443A (HA22-LR-T2) уменьшало рассчитанные ответы до 82 ответов и поддерживало очень активный белок с относительной активностью 280% и 135% на клетках СА46 и Raji, соответственно, по сравнению с WT. HA22-LR-Т3 содержит четыре мутации: R505A, R427A, F443A и R494A и сниженную активность 55% и 50%. HA22-LR-T7 также имеет четыре мутации (R505A, R427A, R551A и F443A) и хорошую цитотоксическую активность с относительной активностью 113% и 100% на клетках СА46 и Raji. Для конструирования HA22-LR-T5 было вставлено пять мутаций, R505A, R494A, R551A, L427A и F443A, которые уменьшали вычисленный остаточный ответ до 39 ответов. Тем не менее, цитотоксическая активность белка значительно снижалась до относительной активности 24% и 19% с ЕС50 более1 нг/мл. HA22-LR-T9 также имела пять точечных мутаций (R505A, R427A, F443A, R494A и L477A). Т9 имел 46 рассчитанных остаточных ответов; все 46 остаточных ответов были слабыми или средней силы). Он поддерживал цитотоксическую активность с ЕС50 менее1 нг/мл с относительной активностью 36% и 26% в клетках CA46 и Raji, соответственно. HA22-LR-T11 замещает L477A в Т9 на L477H, что позволяет улучшить эту активность до 0,2 нг/мл при относительной активности 85% на СА46. Наконец, Т18 (также упоминается как "LMB-T18") был первым RIT, который содержал шесть мутаций и уменьшал все главные эпитопы, которые были идентифицированы. Он имел хорошую относительную активность с IC50 менее 0,3 нг/мл и относительную активность 63% и 104% по сравнению с HA22-LR на клетках СА46 и Raji. Для повышения цитотоксической активности после сайта расщепления фурином был вставлен пептидный линкер Gly-Gly-Ser.
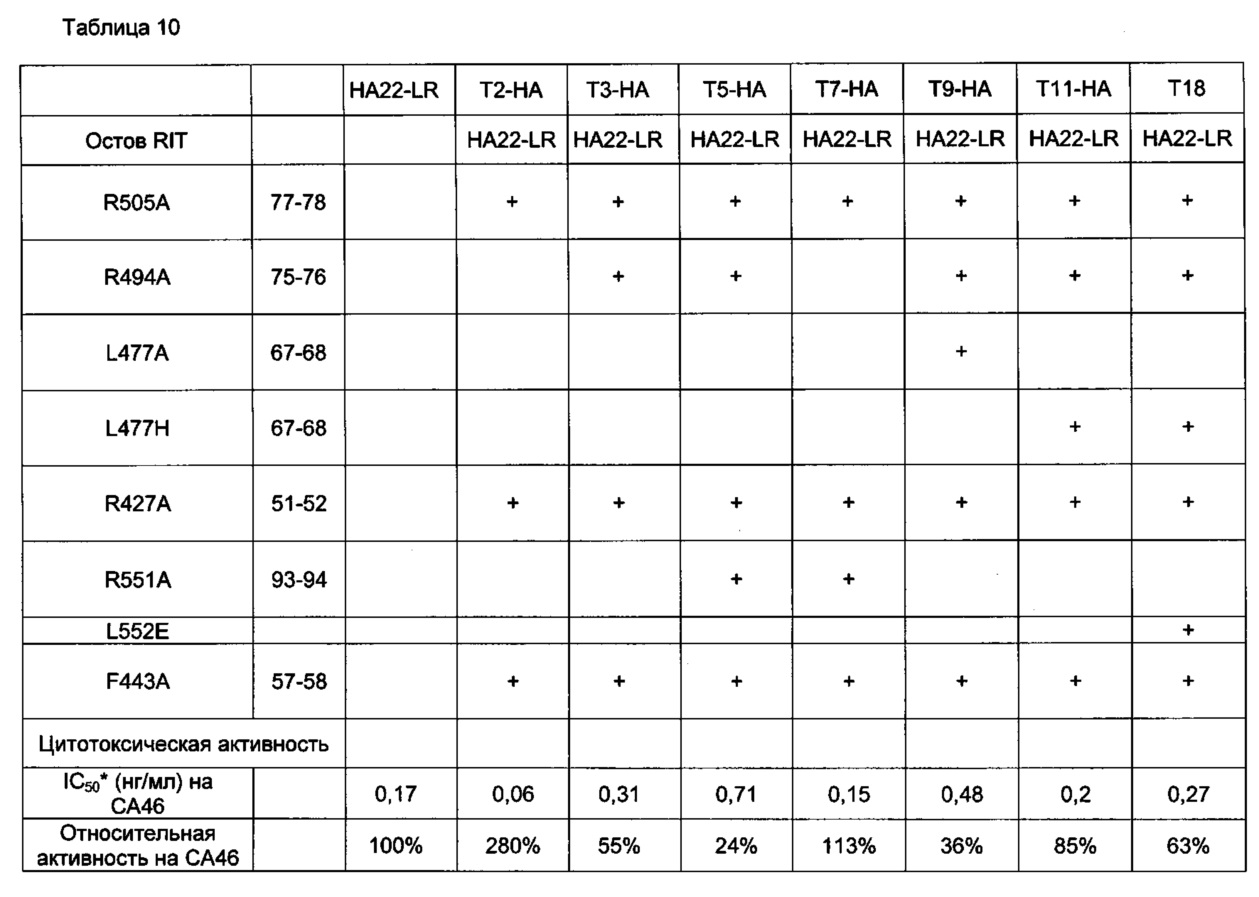

[0262] Чтобы охарактеризовать свойства цитотоксической активности Т3 и Т18, проводили анализы WST-8 на четырех клеточных линиях, которые экспрессируют CD22: са46, Raji, Daudi и HAL-01. Каждый анализ проводили трижды. В таблице 11А показаны средние значения ЕС50 для каждой клеточной линии. Как HA22-LR-T3, так и HA22-LR-T18 были очень цитотоксическими, хотя и несколько меньше, чем исходная молекула HA22-LR-GGS. По сравнению с HA22-LR-GGS HA22-LR-T18 показала относительную активность, которая колебалась от 28% до 55% с IC50 менее1 нг/мл в четырех клеточных линиях. HA22-LR-T3 также был очень активен, однако менее активен, чем Т18.
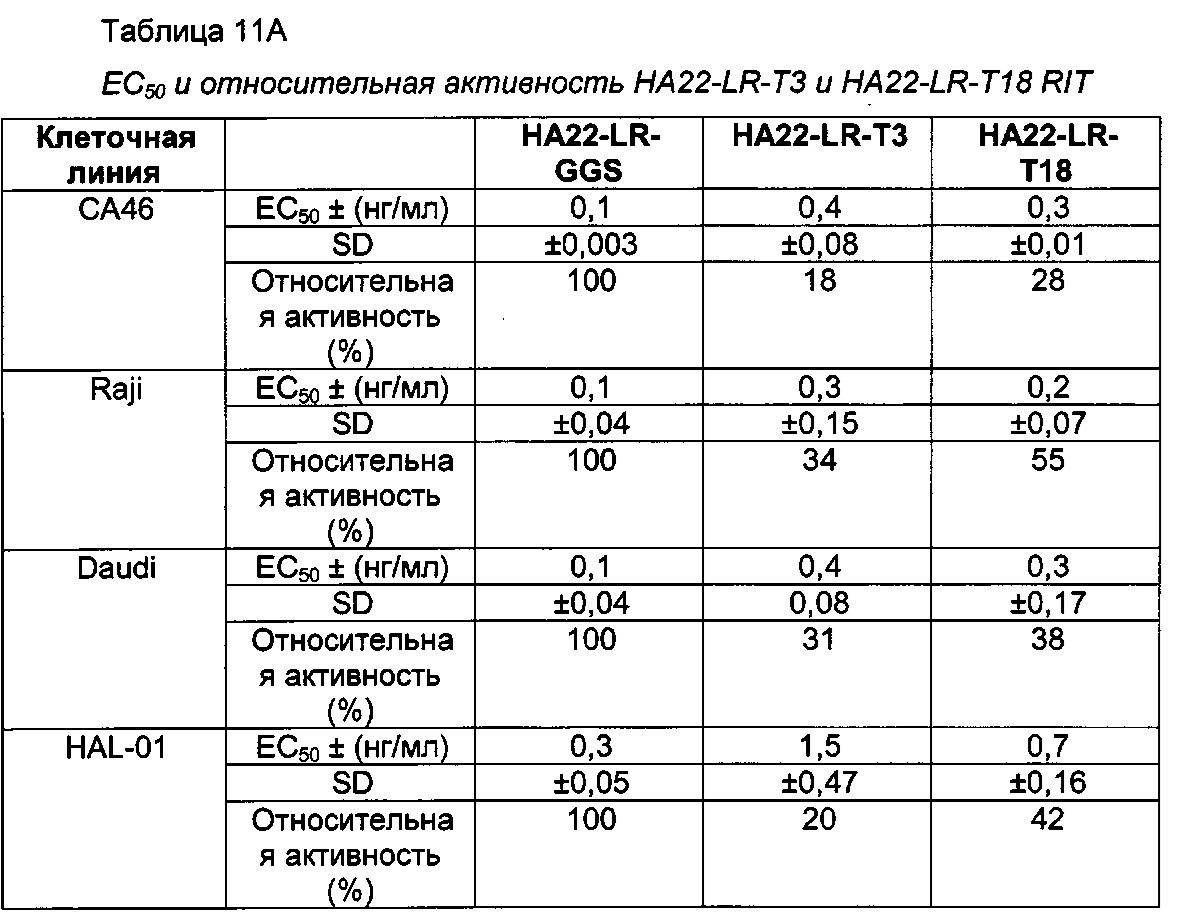
[0263] Анализы цитотоксичности LMB-T18 проводили на четырех клеточных линиях, экспрессирующих CD22, и сравнивали с цитотоксической активностью MP (фиг. 27А, таблица 11В). LMB-T18 был очень мощным с ЕС50 менее 10 пМ на всех клеточных линиях. По сравнению с MP наблюдалось небольшое увеличение активности LMB-T18: на 53% на клетках СА46, на 54% на клетках Daudi и более чем на 200% на клетках HAL-01 (р равно 0,2, 0,06 и 0,01, соответственно, в t-тесте Стьюдента); тем не менее, на клетках Raji наблюдалось снижение активности LMB-Т18 на 52% (р равно 0,3 в t-тесте Стьюдента). Не связываясь с конкретной теорией или механизмом, полагают, что снижение активности на клетках Raji, вероятно, вызвано делецией домена II (Weldon et al., Blood, 113: 3792-3800 (2009)). Стабильность LMB-T18 сравнивали с MP путем нагрева образцов в течение 15 мин при различных температурах и, после охлаждения, измерения остаточного цитотоксического действия (фиг. 27В) на клетках Raji. MP потерял 50% своей активности после 15-минутной инкубации при 56°С. Неожиданно было обнаружено, что LMB-T18 был более термостабильным (р менее0,05 в t-тесте Стьюдента); он потерял только 50% своей активности после 15-минутной инкубации при 70°С. Клетки от семи пациентов с HCL и шести пациентов с хроническим лимфолейкозом (CLL) использовали для определения активности на клетках пациента. Фигуры 27С-D показывают, что LMB-T18 более активен, чем MP на CLL-клетках, хотя эта разница не видна на клетках HCL.
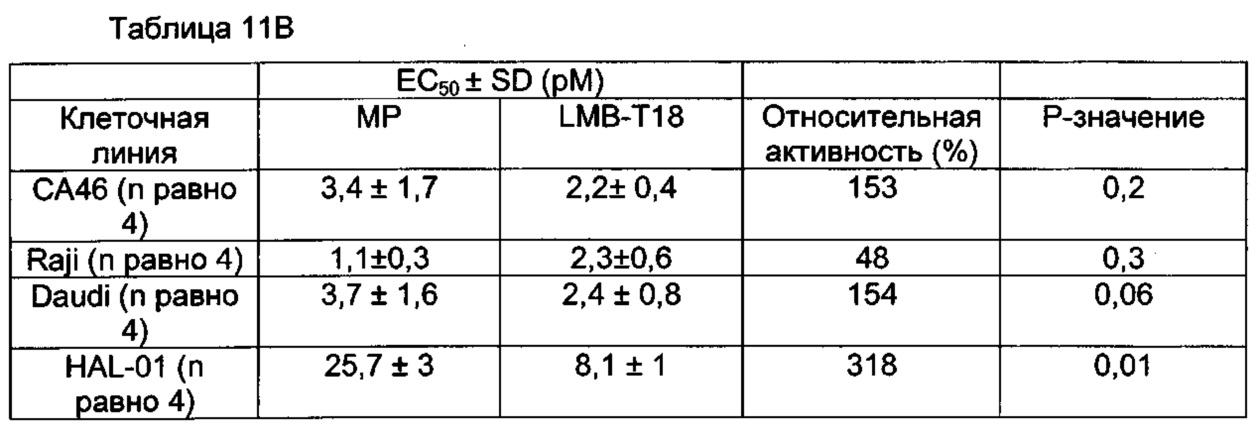
Пример 6
[0264] Этот пример демонстрирует относительную активность RIT с модифицированным В- и Т-клеточным эпитопом.
[0265] В-клеточные эпитопы в РЕ38 предварительно идентифицировали и объемные поверхностные остатки подвергали мутированию аланином или серином для снижения антигенности (Liu et al., Protein Eng. Dec. Sel., (25)(1): 1-6 (2012)). Ранее идентифицированный мутантный RIT с низкой антигенностью был назван SS1LO10R, и он содержал следующие мутации: R505A, R427A, R490A, R463A, R467A, R538A.
[0266] Чтобы минимизировать иммуногенность RIT, нацеленного на мезотелин, в SS1P встраивали модификации LO10, а затем одну за другой включали точечные мутации Т-клеточного эпитопа. Цитотоксическую активность анализировали для каждого из вариантов с использованием клеточных линий, экспрессирующих мезотелин (А9/431 и HAY). Было обнаружено, что две мутации, R505A и R427A, являются эффективными в уменьшении как В-, так и Т-клеточных эпитопов.
[0267] В таблице 12 приведена цитотоксическая активность мутантного РЕ в отношении двух клеточных линий и вычисленный остаточный ответ комбинированного RIT, который был сконструирован. Сочетание SS1-LO10 с одной точечной мутации F443A (SS1-LO10-T2) имело высокую (от 100 до 115%) относительную активность, которая соответствует активности этих точечных мутаций в HA22-LR. Сочетание R494A и R551A в SS1-LO10-T1 давало очень низкую активность, что показывает, что сочетание R551A и R494A снижает активность белка как в НА22, так и в SS1-LO10.

[0268] SS1 LO10R-T11, который содержал R505A, R427A, R494A, F443A и L477H, имел 71% активности на клетках Н9, но только 7% на клетках HAY (анализ в HAY был сделан один раз). Т14 и Т15, которые содержали R505A, R427A, R494A, F443A и L477H, с дополнительной мутацией (L552E и L552N, соответственно) имели более100% относительной активности на клетках Н9 и IC50 более 1 нг/мл. Эти два мутанта представляют максимальную деиммунизацию Т-клеток, полученную в этом проекте до сих пор.
[0269] Мутант Т14 был выбран как лучший кандидат для этапа клинической разработки, так как она включает удаление В-клеточных и многих Т-клеточных эпитопов, но обеспечивает хорошую цитотоксическую активность в отношении клеточных линий, экспрессирующих мезотелин.
Пример 7
[0270] Этот пример демонстрирует противоопухолевую активность Т14.
[0271] Противоопухолевые эксперименты проводили путем введения физиологического раствора (контроль) или Т14 голым мышам с ксенотрансплантатами А431/Н9. Размер опухоли измеряли каждый день и отмечали в мм. В это же время взвешивали животных, и вес представляли в граммах. Результаты приведены ниже в таблице 13. В таблице 13 стрелки показывают день введения иммунотоксина. Как показано в таблице 13, дозы до 7 мг/г × 3 хорошо переносились без каких-либо признаков токсичности у мышей. Кроме того, на всех дозах Т14 была отмечена сильная регрессия опухоли.


Пример 8
[0272] Этот пример демонстрирует термическую стабильность Т18.
[0273] Стабильность Т18 исследовали путем нагревания RIT в течение 15 мин при различных температурах. Затем выполняли анализы цитотоксичности. Рассчитывали ЕС50 по-разному нагреваемых белков. Результаты показаны на фиг. 8. Показано кратное увеличение ЕС50. Как показано на фиг. 8, было установлено, что Т18 сохранял цитотоксическую активность при 60°С и терял 50% своей активности при 68°С. Leaver et al., Methods in Enzymology, 487: 545-74 (2011).
Пример 9.1
[0274] В этом примере показано конструирование, экспрессия и очистка деиммунизированных РЕ-химерных молекул против мезотелина с удлиненным линкером между тяжелой цепью анти-мезотелин-Fab-фрагмента и доменом РЕ 24 и удаление предсказанных Т-клеточных эпитопов в линкере.
[0275] Последовательность линкера, использованную в WO 2012/154530 и Weldon et al., Mol. Cancer Ther., 12: 48-57 (2013) для слияния dsFv-фрагмента (через С-конец домена VH) с деиммунизированым РЕ, также использовали для слияния Fab-фрагмента (через С-конец домена СН1) с деиммунизированным РЕ. Полученную область пептида, включающую части домена СН1, линкер и часть деиммунизированного РЕ (SEQ ID NO 273), исследовали с помощью анализа TEPITOPE (Bian et al., Methods, 34: 468-475 (2004)). Потенциальные Т-клеточные эпитопы, релевантные для населения Европы (ЕС) и Соединенных Штатов Америки, были выявлены в области между доменом СН1 и линкером и в области между линкером и доменом РЕ24. Потенциальные Т-клеточные эпитопы характеризовались доверительным числом 3 или ниже. Результаты приведены в таблице 14. Как показано в таблице 14, линкерная область без специфических удлинений (SEQ ID NO 273) показала семь потенциальных Т-клеточных эпитопов. Один из потенциальных Т-клеточных эпитопов расположен в переходной области WEQLGGSPT (SEQ ID NO 274), а остальные шесть Т-клеточных эпитопов расположены в переходной области VEPKSCKAS (SEQ ID NO 275). Обе эти области релевантны в основном для населения Европы (ЕС) и Азии.
[0276] Потенциальные Т-клеточные эпитопы разрушали за счет встраивания аминокислотной последовательности (вставки) в каждую из переходных областей, тем самым получая вставку на каждой из обеих сторон сайта расщепления фурином. Последовательность DKTH (SEQ ID NO 276) вставляли в линкер в месте, которое непосредственно не примыкает к последовательности расщепления фурином (FCS), а последовательность GGG (SEQ ID NO 277) вставляли в линкер в месте, которое непосредственно прилегает к FCS без потенциальных Т-клеточных эпитопов. Полученная удлиненная пептидная область, включающая а) части домена СН1, b) линкер, удлиненный в области Fab-слияния и удлиненный в области РЕ-слияния, и с) часть деиммунизированного РЕ, содержала аминокислотной SEQ ID NO: 278. Удлиненную пептидную область изучали с помощью анализа TEPITOPE, полученные результаты приведены в таблице 15А. Как показано в таблице 15А, удлиненный линкер не давал сигнала в анализе TEPITOPE (доверительные значения 6 или выше) и, в то же время, давал улучшенную стабильность (см. пример 9.2 ниже).
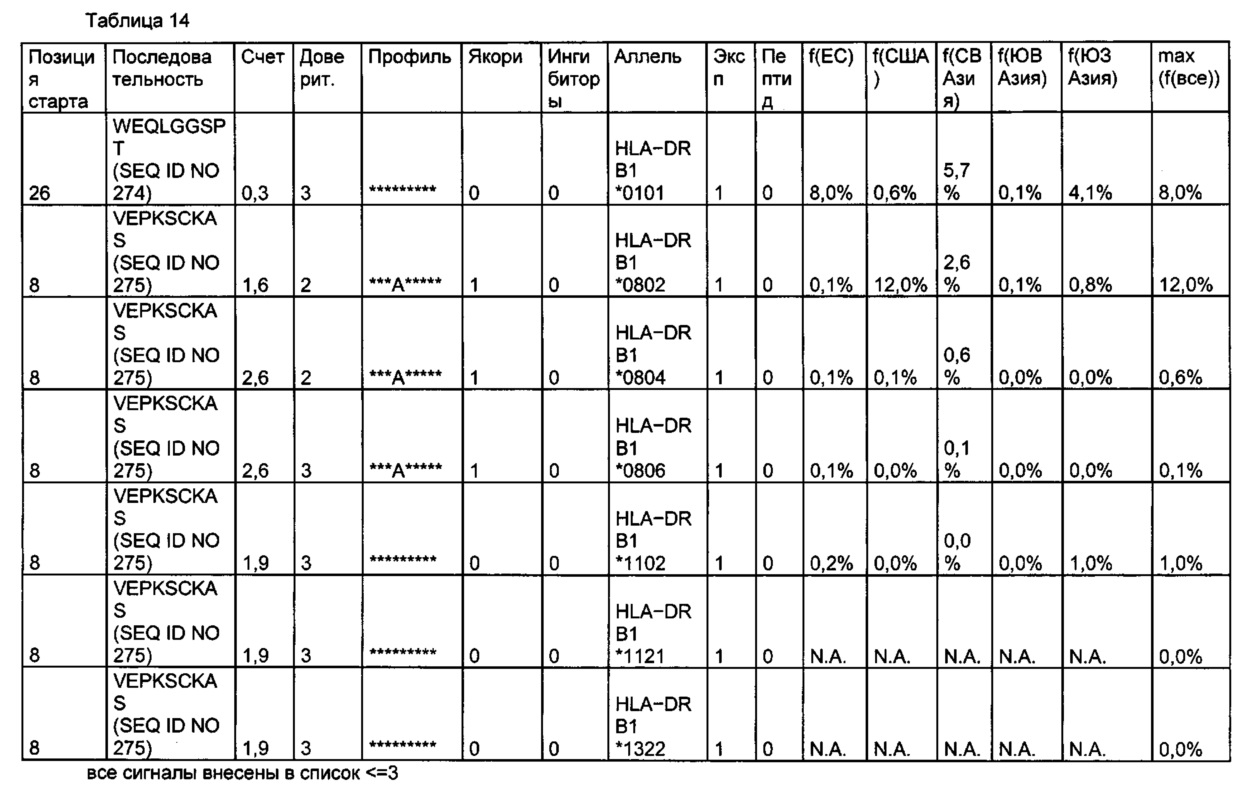

Пример 9.2
[0277] Этот пример демонстрирует стабильность деиммунизированных РЕ-гибридных белков и конъюгатов, имеющих удлиненный линкер с последовательностью SEQ ID NO 36.
[0278] Шесть вариантов Fab-линкер-РЕ24 получали и сравнивали с учетом их термической стабильности и склонности к агрегации. Все шесть вариантов содержали один и тот же гуманизированный Fab-вариант H1/L1 антитела SS1, но отличались в отношении линкера и мутанта РЕ24. Что касается линкера, был использован либо линкер, описанный в публикации международной патентной заявки WO 2012/154530 (kasggrhrqprgweqlggs (SEQ ID NO 281)), либо удлиненный линкер с дополнительными аминокислотами ("длинный линкер"; SEQ ID NO 36 (dkthkasggrhrqprgweqlgggggs))). В качестве вариантов РЕ24 в конструкциях были использованы LRO10R, LRO10R-456A (SEQ ID NO 37) или LRO10R-456A-551A.
[0279] На фиг. 12-13 показан уровень агрегации двух конструкций с вариантом РЕ24 LRO10R-456A, который измеряли как площадь под пиком агрегата при эксклюзионной хроматографии (SEC) после инкубации при 33°C. Эти две конструкции на фиг. 12-13 отличались только в отношении используемого линкера. Короткий линкер SEQ ID NO 281 был использован в конструкции cFP-0170, а удлиненный линкер SEQ ID NO 36 был использован в конструкции cFP-0171.
[0280] На фиг. 14-16 показана термическая стабильность конструкций, измеренная с помощью динамического рассеяния света (dynamic light scattering, DLS). Для динамического рассеяния света образцы готовили в концентрации 1 мг/мл в растворе 20 мМ гистидина/хлорида гистидина, 140 мМ NaCl, pH 6,0, переносили в оптический 384-луночный планшет путем центрифугирования через фильтровальный планшет с диаметром пор 0,4 мкм и покрывали парафиновым маслом. Гидродинамический радиус измеряли в планшетном ридере WYATT DYNAPRO II повторно путем динамического рассеяния света, в то время как образцы нагревали со скоростью 0,05°C/мин от 25°C до 80°C. Температуру начала агрегации определяли как температуру, при которой начинает возрастать гидродинамический радиус. Результаты показаны на фиг. с 14 по 16. Кривые DLS для шести конструкций показали более высокие температуры агрегации при удлиненном линкере по сравнению с коротким опубликованным линкером, с сильным сдвигом к более высокой температуре агрегации для варианта LRO10R (фиг. с 14 по 16).
[0281] В таблице 15В показана термическая стабильность конструкций cFP-0170 и cFP-0171, измеренная с помощью дифференциальной сканирующей калориметрии (differential scanning calorimetry, DSC). Дифференциальную сканирующую калориметрию выполняли с использованием системы MicroCal DSC (GE Healthcare). Образцы доводили до концентрации белка примерно 1 мг/мл в растворе 20 мМ гистидина/HCl, 140 мМ хлорида натрия, pH 6,0. Референсную ячейку заполняли буфером, который соответствовал буферу для образцов. Образцы помещали в ячейку для образца и нагревали от 4°C до 110°C со скоростью нагрева 60°C/ч. Предварительное сканирование составляло 15 минут, период фильтрации составлял 10 секунд, а режим обратной связи/усиления был установлен на пассивный. Срединную точку температуры теплового перехода (Tm, thermal transition temperature) получали на основе анализа данных с помощью программного обеспечения для анализа MicroCal DSC.

[0282] Как показано на фиг. с 12 по 16 и в таблице 15В, все химерные Fab-РЕ-молекулы с удлиненным линкер имели сниженную склонность к агрегации и более высокую температуру агрегации по сравнению с химерными Fab-PE-молекулами с коротким линкером, который не был удлинен.
Пример 10
[0283] Этот пример демонстрирует способность деиммунизированных РЕ-гибридных белков с удлиненным линкером уничтожать опухолевые клетки и ингибировать синтез клеточных белков. Этот пример также демонстрирует антигенность деиммунизированных РЕ-гибридных белков с удлиненным линкером.
[0284] Сравнивали активность различных Fab-РЕ24-вариантов в отношении их способности ингибировать синтез белка. Использовали клон клеточной линии рака поджелудочной линии ASPC-1 (ASPC-1 Luc), которая была стабильно трансфицирована люциферазой. Белок люцифераза в этих клетках подвергается высокому обмену, так что измеряемая активность заметно падает в течение 24 часов ингибирования его ресинтеза. Вкратце, клетки высевали в 96-луночные планшеты. После культивирования в течение ночи в среду добавляли различные концентрации cFP-вариантов и клетки инкубировали еще в течение 72 часов. В конце периода инкубации клетки лизировали, а активность люциферазы определяли с помощью анализа STEADY-GLOW в соответствии с инструкциями изготовителя. В типичном эксперименте наблюдалось снижение активности люциферазы на 80-90% в лизатах обработанных клеток по сравнению с лизатами необработанных контрольных клеток. Значения ЕС50, т.е. концентрации, которые дают половину максимального эффекта, определяли на основе свободной четырехпараметрической подгонки. В таблице 16 сравнены относительные активности в репрезентативном эксперименте с установкой значения IC50 huFabLRO10R равным 1.
[0285] Нецелевой РЕ24 (вариант LR8M) ингибировался при концентрации более 3,5 мкг/мл, в то время как ранее описанный вариант LRO10, слитый с гуманизированным Fab-фрагментом SS1, был примерно в 500 раз более активным в расчете на моли. Обратная мутация LRO10R повышала активность от 10 до 20 раз (значения ЕС50 1-2 нг/мл против 18 нг/мл). Мутация 456А не имела отрицательного влияния на активность, в то время как мутация 551А снижала активность до уровня LRO10 (EC50 от 10 до 23 нг/мл). Новый удлиненный линкер также не оказал отрицательного влияния на клеточную активность молекул при сравнении любой из трех пар конструктов с удлиненным линкером против ранее описанных с более коротким линкером.
[0286] Используя жизнеспособность клеток, оцениваемую с помощью анализов CELLTITERGLOW, сравнивали цитотоксическую активность различных Fab-РЕ24-вариантов с использованием одного и того же гуманизированного SS1 специфическего варианта на двух различных линиях опухолевых клеток (А431 Н9 и Н596). Вкратце, клетки высевали в 96-луночные планшеты. После культивирования в течение ночи в среду добавляли различные концентрации cFP, и клетки инкубировали в течение 72 часов. В конце периода инкубации жизнеспособность клеток определяли с помощью анализа CELLTITERGLOW. В таблице 16 сравнены относительные активности с установкой значения IC50 huFabLRO10R равным 1.


[0287] Результаты, аналогичные приведенным в таблице 16, также были получены с использованием анализа жизнеспособности клеток со считыванием на основе 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия бромида (МТТ) на разных клеточных линиях (таблица 17).

Пример 11
[0288] В этом примере показано удаление В-клеточных эпитопов с помощью мутаций 456А в РЕ.
[0289] Фагмиду, содержащую scFv 9Н3 в векторе pCANTAB, описанном в Liu et al., PNAS, 109: 11782-11787 (2012), получали с помощью стандартных способов, описанных в Sambrook, J. et al., Molecular cloning: A laboratory manual; Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Молекулярно-биологические реагенты использовали в соответствии с инструкциями изготовителя. Фагмидой трансформировали электрокомпетентные клетки TG1. Из отдельных колоний в течение ночи выращивали предварительные культуры и использовали для инокуляции 4 мл культуры 2×YT/1% глюкозы, дополненной соответствующим селективным антибиотиком ампициллином. При OD600 0,3-0,8 добавляли 1010 KOE фага-помощника VCSM 13 и IPTG до конечной концентрации 1 мМ. После инкубации в течение 15 минут при 37°C культуру выращивали при 37°C в течение ночи. Через два часа после добавления фага-помощника добавляли канамицин до конечной концентрации 30 мкг/мл. Содержащий фаги супернатант собирали из ночной культуры центрифугированием, а фаг, представляющий scFv, осаждали из супернатанта путем добавления 1/5 по объему 20% PEG-6000/2.5M NaCl и выделяли центрифугированием. Осадок с фагом растворяли в 0,5 мл PBS/1% BSA, и раствор фага осветляли путем центрифугирования и стерильной фильтрации. Титр фага в растворе определяли с помощью стандартных способов, описанных в Barbas, С. et al., Phage Display - A laboratory manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 2001.
[0290] 96-луночные микротитровальные планшеты MaxiSorp покрывали 100 мкг/мл Fab-РЕ24-вариантов. После блокирования PBS-буфером с добавлением 2% BSA на планшете проводили захват 107 и 108 scFv-представляющих фагов в течение одного часа. В качестве специфических отрицательных контролей scFv-представляющие фаги предварительно инкубировали с 50 мкг/м Fab-PE24-вариантов в течение 1 ч при комнатной температуре (RT) перед захватом их на планшет. Планшеты промывали PBST-буфером (PBS плюс 0,5% Tween 20). Связывание scFv-представляющего фага обнаруживали с помощью POD-конъюгированного анти-m13-антитела (Progen). После последней промывки планшеты инкубировали с субстратом POD. Абсорбцию измеряли при 405 нм. Результаты показаны на фиг. 17, где можно видеть, что В-клеточный эпитоп, содержащийся в фагмиде, содержащей scFv 9Н3, не был удален в LRO10R (с обратной мутацией 458R), в то время как он устранялся обеими мутациями 458А и 456А с немного более сильным эффектом при мутации 456А.
[0291] Тестирование антигенности проводили так, как описано в Weldon et al., Mol. Cancer Ther., 12: 48-57 (2013). Как показано на фиг. 18, по сравнению с SS1P (Т1) деиммунизированный вариант LRO10R (Т2) имел от 100 до 10000-кратное снижение реактивности с большинством сывороток от пациентов, которые ранее подвергались воздействию терапевтического гибридного белка на основе РЕ, как с форматом гибрида мышиного dsFv, так и с форматом гибрида гуманизированного Fab. Также введение мутации 456А (Т3 и Т5) или нового удлиненного линкера (Т5 и Т6) показало от 100 до 10000-кратное снижение реактивности с большинством сывороток от пациентов, которые ранее подвергались воздействию терапевтического гибридного белка на основе РЕ.
Пример 12
[0292] Этот пример демонстрирует конструирование, экспрессию и очистку деиммунизированных РЕ-вариантов и их Fab-гибридов, а также dsFv-гибридов для сравнения.
Пример 12.1: Клонирование деиммунизированных РЕ-химерных молекул против мезотелина cFP-0077 (SEQ ID NO 41 и 42) и cFP-0078 (SEQ ID NO 43 и 44).
[0293] Для экспрессии cFP-0077 и cFP-0078 использовали систему вектор/хозяин E. coli, которая делает возможной селекцию плазмиды без антибиотика с помощью комплементации ауксотрофии Е. coli (PyrF) (публикация Европейской патентной заявки 0972838 и патент США 6291245). Для манипуляций с ДНК были использованы стандартные способы, описанные в Sambrook, J. et al., см. выше. Молекулярно-биологические реагенты использовали в соответствии с инструкциями изготовителя. Нужные генные сегменты получали коммерческим путем методом генного синтеза. Синтезированные фрагменты генов клонировали в указанный экспрессионный вектор. ДНК-последовательности субклонированных фрагментов генов подтверждали секвенированием ДНК.
[0294] Экспрессионные плазмиды для продукции легкой цепи и тяжелой цепи, соответственно, были получены следующим образом: плазмиды с легкой цепью (LC) 15478 (на основе аминокислотных последовательностей cFP-0077 и кодирующей SEQ ID NO 41) и 15479 (на основе аминокислотных последовательностей cFP-0078 и кодирующей SEQ ID NO 43) являются экспрессионными плазмидами для экспрессии фрагментов легкой цепи антитела в Е. coli. Они были получены путем лигирования фрагмента VL-домена антитела в вектор с использованием сайтов рестрикции Xhol/BsiWI для 15478 и Xhol/Blpl для 15479.
[0295] Плазмиды для экспрессии легкой цепи в Е. coli содержат следующие элементы:
- сайт начала репликации из вектора pBR322 для репликации в Е. coli (соответствующий позициям 2517-3160 в соответствии с Sutcliffe et al., Quant. Biol., 43: 77-90(1979),
- ген URA3 от Saccharomyces cerevisiae, кодирующий оротидин-5'-фосфатдекарбоксилазу (Rose et al., Gene, 29: 113-124 (1984), которая позволяет выбирать плазмиды с помощью комплементации мутантных штаммов Е. coli pyrF (урацил-ауксотрофия),
- экспрессионную кассету легкой цепи антитела, содержащую:
- гибридный промотор Т5 (гибридный промотор T5-PN25/03/04 в соответствии с Bujard et al., Methods. Enzymol., 155: 416-433 (1987) и Stueber, et al., Immunol. Methods IV, 121-152 (1990), включающий синтетический сайт посадки рибосомы в соответствии с Stueber et al. (см. выше),
- вариабельный домен легкой цепи антитела, включающий CDR из SS1,
и
- человеческий Ск-домен для 15478, но не для 15479,
- два терминатора транскрипции бактериофагального происхождения, терминатор λ-Т0 (Schwarz et al., Nature, 272: 410-414 (1978)) и fd-терминатор (Beck et al., Gene, 1-3: 35-58(1981)), и
- ген-репрессор lad из E. coli (Farabaugh, Nature, 274: 765-769 (1978).
[0296] Плазмиды тяжелой цепи (НС) 15476 (на основе аминокислотных последовательностей cFP-0077 и кодирующей SEQ ID NO 42) и 15477 (на основе аминокислотных последовательностей cFP-0078 и кодирующей SEQ ID NO 44) являются экспрессионными плазмидами для экспрессии гибридного белка, включающего фрагмент тяжелой цепи антитела, линкер с сайтом расщепления фурином и мутантный домен III из экзотоксина A Pseudomonas aeruginosa (РЕ), в Е. coli. Они были получены путем лигирования фрагмента VH-домена в вектор с использованием сайтов рестрикции Xhol/BsrGl для 15476 и Xhol/HindIII для 15477.
[0297] Плазмиды для экспрессии тяжелой цепи цитолитического гибридного белка в Е. coli содержат следующие элементы:
- сайт начала репликации из вектора pBR322 для репликации в Е. coli (соответствующий позициям 2517-3160 в соответствии с Sutcliffe et al., Quant. Biol., 43: 77-90(1979),
- ген URA3 от Saccharomyces cerevisiae, кодирующий оротидин-5'-фосфатдекарбоксилазу (Rose et al., Gene, 29: 113-124 (1984), которая позволяет выбирать плазмиды с помощью комплементации мутантных штаммов Е. coli pyrF (урацил-ауксотрофия),
- экспрессионную кассету гибридного белка "тяжелая цепь - домен РЕ III", содержащую:
- гибридный промотор Т5 (гибридный промотор T5-PN25/03/04 в соответствии с Bujard et al., Methods. Enzymol., 155: 416-433 (1987) и Stueber, et al., Immunol. Methods IV, 121-152 (1990), включающий синтетический сайт посадки рибосомы в соответствии с Stueber et al. (см. выше),
- вариабельный домен тяжелой цепи антитела, включающий CDR из SS1,
- человеческий СН1-домен для 15476, но не для 15477,
- линкер, содержащий сайт расщепления фурином,
- мутантный вариант домена III из экзотоксина A Pseudomonas aeruginosa,
- два терминатора транскрипции бактериофагального происхождения: терминатор λ-Т0 (Schwarz et al., Nature, 272: 410-414 (1978)) и fd-терминатор (Beck et al., Gene, 1-3: 35-58(1981)), и
- ген-репрессор lad из E. coli (Farabaugh, Nature, 274: 765-769 (1978).
Пример 12.2: Экспрессия деиммунизированных РЕ-химерных молекул против мезотелина cFP-0077 и cFP-0078 в Е. coli.
[0298] Все полипептидные цепи экспрессировали по отдельности в штамме Е. coli CSPZ-6.
[0299] Штамм Е. coli К12 CSPZ-6 (thi-1, ΔpyrF) трансформировали путем электропорации экспрессионными плазмидами 15476, 15477, 15478 и 15479, соответственно, получая 4 штамма: cFP-0019 (на основании плазмиды 15476), cFP-0020 (на основании плазмиды 15477), cFP-0040 (на основании плазмиды 15478) и cFP-0041 (на основании плазмиды 15479). Для каждого из четырех штаммов трансформированные клетки Е. coli сначала выращивали при 37°C на чашках с агаром. Колонии, собранные с этой чашки, переносили в перемешиваемую культуру объемом 3 мл и выращивали при 37°C до оптической плотности составляющей от 1 до 2 (измеренной при 578 нм). Затем 1000 мкл культуры смешивали с 1000 мкл стерильного 86% глицерина и немедленно замораживали при -80°C для длительного хранения. Правильный продукт экспрессии этого клона вначале проверяли в мелкомасштабных экспериментах со встряхиваемыми колбами и анализировали с помощью SDS-PAGE до передачи в ферментер объемом 10 л.
Предварительное культивирование:
[0300] Для предварительной ферментации использовали среду с определенным химическим составом (CD-PCMv2.20): NH4Cl 1,0 г/л, K2HPO4*3H2O 18,3 г/л, цитрат 1,6 г/л, глицин 0,78 г/л, L-аланин 0,29 г/л, L-аргинин 0,41 г/л, L-аспарагин*H2O 0,37 г/л, L-аспартат 0,05 г/л, L-цистеин*HCl*H2O 0,05 г/л, L-гистидин 0,05 г/л, L-изодейцин 0,31 г/л, L-лейцин 0,38 г/л, L-лизин*HCl 0,40 г/л, L-метионин 0,27 г/л, L-фенилаланин 0,43 г/л, L-пролин 0,36 г/л, L-серин 0,15 г/л, L-треонин 0,40 г/л, L-триптофан 0,07 г/л, L-валин 0,33 г/л, L-тирозин 0,51 г/л, L-глутамин 0,12 г/л, Na-L-глутамат*H2O 0,82 г/л, глюкоза*H2O 6,0 г/л, раствор микроэлементов 0,5 мл/л, MgSO4*7H2O 0,86 г/л и тиамин*HCl 17,5 м г/л. Раствор микроэлементов содержал FeSO4*7H2O 10,0 г/л, ZnSO4*7H2O 2,25 г/л, MnSO4*H2O 2,13 г/л, H3BO3 0,50 г/л, (NH4)6Mo7O24*4H2O 0,3 г/л, CoCl2*6H2O 0,42 г/л и CuSO4*5H2O 1,0 г/л, растворенные в 0,5М HCl.
[0301] Для предварительной ферментации в 220 мл среды CD-PCMv2.20 в колбе Эрленмейера с четырьмя перегородками объемом 1000 мл засевали 1,0 мл из ампулы с банком исследования. Культивирование проводили на ротационном шейкере в течение 8 часов при 32°C и скорости 170 оборотов в минуту до получения оптической плотности (578 нм) 2,9. 100 мл предварительного культивирования использовали для инокуляции в партию среды для биореактора объемом 10 л.
Ферментация cFP-0019 и cFP-0020:
[0302] Для ферментации в ферментере BioStat С, DCU3 объемом 10 л (Sartorius, Мельзунген, Германия) использовали следующую партию среду с определенным химическим составом: KH2PO4 1,59 г/л, (NH4)2HPO4 7,45 г/л, K2HPO4*3H2O 13,32 г/л, цитрат 2,07 г/л, L-метионин 1,22 г/л, NaHCO3 0,82 г/л, раствор микроэлементов 7,3 мл/л, MgSO4*7H2O 0,99 г/л, тиамин*HCl 20,9 м г/л, глюкоза*H2O 29,3 г/л, биотин 0,2 м г/л и 1,2 мл/л 10% противопенного агента Synperonic. Раствор микроэлементов содержал FeSO4*7H2O 10 г/л, ZnSO4*7H2O 2,25 г/л, MnSO4*H2O 2,13 г/л, CuSO4*5H2O 1,0 г/л, CoCl2*6H2O 0,42 г/л, (NH4)6Mo7O24*4H2O 0,3 г/л, и H3BO3 0,50 г/л, солюбилизированные в 0,5М растворе HCl.
[0303] Питательный раствор 1 содержал 700 г/л глюкозы*H2O, 7,4 г/л MgSO4*7H2O и 0,1 г/л FeSO4*7H2O. Питательный раствор 2 содержал KH2PO4 52,7 г/л, K2HPO4*3H2O 139,9 г/л и (NH4)2HPO4 66,0 г/л. Все компоненты были растворены в деионизированной воде. Щелочной раствор для регулирования pH представлял собой водный 12,5% (вес/объем) раствор NH3, дополненный 11,25 г/л L-метионина.
[0304] Начиная с 4,2 л стерильной партии среды плюс 100 мл инокулята из предварительного культивирования, периодическую ферментацию проводили при 31°C, pH 6,9±0,2, противодавлении 800 мбар и начальной скорости аэрации 10 л/мин. Относительное значение растворенного кислорода (рО2) поддерживали на уровне 50% в ходе ферментации за счет увеличения скорости мешалки до 1500 оборотов в минуту. После того, как первоначально введенная глюкоза истощалась, что обозначалось резким повышением значений растворенного кислорода, температуру сдвигали на 25°C, и через 15 минут ферментацию вводили в режим подпитки с началом введения обоих питательных растворов (60 и 14 г/ч соответственно). Скорость подачи раствора 2 поддерживали постоянной, в то время как скорость подачи раствора 1 увеличивали ступенчато с заранее определенным профилем подачи от 60 до 160 г/ч в течение 7 часов. Когда концентрация выделяемого газообразного диоксида углерода устанавливалась выше 2%, скорость аэрации постоянно увеличили с 10 до 20 л/мин в течение 5 часов. Экспрессию рекомбинантного белка индуцировали добавлением 2,4 г IPTG при оптической плотности примерно 120. Целевой белок экспрессировался в виде телец включения в цитоплазме.
[0305] После 24 часов культивирования была достигнута оптическая плотность 209, и весь бульон охлаждали до 4-8°C. Бактерии собирали центрифугированием с помощью проточной центрифуги (13000 оборотов в минуту, 13 л/ч), и полученную биомассу хранили при -20°C до дальнейшей обработки (разрушения клеток).
Ферментация cFP-0040 и cFP-0041:
[0306] Для ферментации в ферментере Biostat С, DCU3 объемом 10 л (Sartorius, Мельзунген, Германия) использовали следующую комплексную партию среды: бактотриптон 20 г/л, дрожжевой экстракт 15 г/л, KH2PO4 1,5 г/л, K2HPO4*3H2O 6,6 г/л, NaCl 1,0 г/л, MgSO4*7H2O 0,74 г/л, глюкоза*H2O 3,0 г/л, и 0,2 мл/л противопенного агента.
[0307] Питательный раствор 1 содержал бактотриптон 250 г/л и дрожжевой экстракт 175 г/л. pH регулировали с помощью 75% раствора глюкозы*H2O. Все компоненты были растворены в деионизированной воде.
[0308] Начиная с 7,6 л стерильной партии среды плюс 100 мл инокулята из предварительно культивирования, периодическую ферментацию проводили при температуре 37°C, pH 7,0±0,3, противодавлении 500 мбар и начальной скорости аэрации 10 л/мин. Относительное значение растворенного кислорода (рО2) поддерживали на уровне 50% в ходе ферментации путем увеличения скорости мешалки до 1500 оборотов в минуту. Подачу питательного раствора 1 начинали после того, как культура достигала оптической плотности 15. Когда концентрация выделяемого газообразного диоксида углерода устанавливалась выше 2%, скорость аэрации постоянно увеличивали с 10 до 20 л/мин в течение 5 часов. Экспрессию рекомбинантного белка индуцировали добавлением 2,4 г IPTG при оптической плотности примерно 20. Целевой белок экспрессировался в виде телец включения в цитоплазме.
[0309] После 13 часов культивирования была достигнута оптическая плотность 100-115, и весь бульон охлаждали до температуры от 4 до 8°C. Бактерии собирали центрифугированием с помощью проточной центрифуги (13000 оборотов в минуту, 13 л/ч), и полученную биомассу хранили при -20°C до дальнейшей обработки (разрушения клеток и получения телец включения).
Анализ формирования продукта (для cFP-0019, -0020 -0040 и -0041):
[0310] Образцы забирали из ферментера, один перед индукцией, а остальные в определенные временные точки после индукции экспрессии белка, и анализировали с помощью электрофореза в SDS-полиакриламидном геле. Из каждого образца одинаковое количество клеток (ODцелевое равно 10) суспендировали в 5 мл PBS-буфера и разрушали путем обработки ультразвуком на льду. Затем 100 мкл каждой суспензии центрифугировали (15000 оборотов в минуту, 5 минут), и каждый супернатант отбирали и переносили в отдельную пробирку. Это делали для различения растворимого и нерастворимого экспрессированного белка-мишени. К каждому супернатанту (растворимой фракции белка) добавляли 100 мкл, а к каждому осадку (нерастворимой фракции белка) 200 мкл SDS-буфера для образцов (Laemmli, Nature, 227: 680-685 (1970). Образцы нагревали в течение 15 мин при температуре 95°C в условиях интенсивного смешивания для солюбилизации и восстановления всех белков в образцах. После охлаждения до комнатной температуры 5 мкл каждого образца переносили на 4-20% полиакриламидный гель TGX Criterion Stain Free (Bio-Rad). Кроме того, наносили 5 мкл стандарта молекулярной массы (Precision Plus Protein Standard, Bio-Rad).
[0311] Электрофорез проводили в течение 60 мин при 200 В, а после этого гель переносили на GELDOC EZ Imager (Bio-Rad) и обрабатывали в течение 5 мин УФ-излучением. Изображения геля анализировали с помощью программного обеспечения для анализа изображений IMAGE LAB (Bio-Rad). Относительную количественную оценку экспрессии белка проводили путем сравнения объема полос продукта с объемом полосы стандарта молекулярной массы 25 кДа.
Подготовка препаратов телец включения:
[0312] Получение препаратов телец включения (inclusion body preparation, IBP) из ферментеров объемом 10 л начинали сразу после сбора бактерий, ресуспендируя собранные бактериальные клетки в буфере 1 (12,1 г/л Tris, 0,246 г/л MgSO4*7H2O, 12 мл/л 25% HCl). Объем буфера рассчитывали в зависимости от содержания сухого вещества в биомассе. Добавляли лизоцим (100 кЕд/мг, 0,12 мг/г сухой вес) и небольшое количество бензоназы (5 Ед/г сухой вес). Затем суспензию гомогенизировали при 900 бар (APV Rannie 5, 1 проход) для разрушения бактериальных клеток, добавляли дополнительную бензоназу (30 Ед/г сухой вес) и инкубировали в течение 30 мин при температуре от 30 до 37°C. Затем добавляли первый промывочный буфер (60 г/л Brij, 87,6 г/л NaCl, 22,5 г/л EDTA, 6 мл/л 10н NaOH) и снова инкубировали суспензию в течение 30 минут. Следующий этап центрифугирования (ВР12, Sorvall) приводил к получению взвеси телец включения, которую ресуспендировали во втором промывочном буфере (12,1 г/л Tris, 7,4 г/л EDTA, 11 мл/л 25% HCl) и инкубировали в течение 20 минут. После еще одного этапа разделения получали тельца включения, которые хранили замороженными при -20°C или немедленно солюбилизировали для рефолдинга и очистки.
Пример 12.3: Рефолдинг и очистка деиммунизированных РЕ-химерных молекул против мезотелина cFP-0077 и cFP-0078.
[0313] cFP-0077 и cFP-0078 были получены путем рефолдинга и очистки.
[0314] Ренатурация и очистка Fab-PE24 (cFP-0077): тельца включения НС-РЕ24 и LC солюбилизировали по отдельности в растворе, содержащем 8 М гуанидина гидрохлорид, 100 мМ Tris/HCl, 1 мМ EDTA, pH 8,0 плюс 100 мМ дитиотреитол (DTT), в течение ночи при комнатной температуре (1 г IB в 5 мл). Солюбилизаты доводили до pH 3 и центрифугировали, и осадок отбрасывали. После экстенсивного диализа против 8 М гуанидин-HCl, 10 мМ EDTA, pH 3,0, чтобы удалить DTT, определяли общую концентрацию белка биуретовым способом. Чистоту содержания НС и LC оценивали с помощью SDS-PAGE.
[0315] Солюбилизаты разводили в молярном соотношении 1:1 в буфере для ренатурации, содержащем 0,5 М аргинина, 2 мМ EDTA, pH 10 плюс 0,9 мМ GSH/GSSG, соответственно, при температуре 2-10°C. Концентрацию белка-мишени увеличивали на двух этапах до 0,22 г/л, при этом время инкубации между двумя дозами составляло 4 ч. После этого раствор ренатурата хранили при 2-10°C в течение ночи.
[0316] Ренатурат разбавляли H2O до менее 3 мСм/см и закачивали на анионообменную колонку (AIEX), уравновешенную 20 мМ Tris/HCl, pH 7,4. После промывания колонки уравновешивающим буфером белок элюировали градиентом до 20 мМ Tris/HCl, 400 мМ NaCl, рН 7,4. Пиковые фракции, содержащие Fab-PE24, объединяли, концентрировали и наносили на препаративную эксклюзионную колонку (SEC) в 20 мМ Tris, 150 мМ NaCl, рН 7?4, для удаления агрегатов, фрагментов и белков Е. coli. Конечный пул белка доводили до требуемой концентрации белка и анализировали с помощью SDS-PAGE, аналитической SEC и UV280, а идентичность подтверждали методом масс-спектрометрии.
[0317] Ренатурация и очистка dsFv-PE24 (cFP-0078): тельца включения НС-РЕ24 и LC солюбилизировали по отдельности в растворе, содержащем 8 М гуанидина гидрохлорид, 100 мМ Tris/HCl, 1 мМ EDTA, pH 8,0 плюс 100 мМ дитиотреитол (DTT), в течение ночи при комнатной температуре (1 г IB в 5 мл). Солюбилизаты доводили до pH 3 и центрифугировали, и осадок отбрасывали. После экстенсивного диализа против 7,2 М гуанидин-HCl, 10 мМ EDTA, pH 3,0, чтобы удалить DTT, определяли общую концентрацию белка биуретовым способом, а чистоту содержания НС и LC оценивали с помощью SDS-PAGE.
[0318] Солюбилизаты разводили 1:100 в буфере для ренатурации, содержащем 0,5 М аргинина, 2 мМ EDTA, pH 10 плюс 0,9 мМ GSH/GSSG, соответственно, в молярном соотношении 1:1, и хранили в течение ночи при температуре от 2 до 10°C.
[0319] Ренатурат разводили H2O до менее 3 мСм/см и закачивали на анионообменную колонку (AIEX), уравновешенную 20 мМ Tris/HCl, 1 мМ EDTA, pH 7,4. После промывания колонки уравновешивающим буфером белок элюировали градиентом до 20 мМ Tris/HCl, 1 мМ EDTA, 400 мМ NaCl, pH 7,4. Пиковые фракции, содержащие dsFv-PE24, объединяли, концентрировали и наносили на препаративную эксклюзионную колонку (size exclusion column, SEC) в 20 мМ Tris, 150 мМ NaCl, рН 7,4, для удаления агрегатов, фрагментов и белков Е. coli. Конечный пул белка доводили до требуемой концентрации белка и анализировали с помощью CE-SDS, аналитической SEC и UV280. Идентичность подтверждали путем масс-спектрометрии.
Пример 12.4: Белковый анализ cFP-0077 и cFP-0078.
[0320] Образцы анализировали по OD при 280 нм с помощью УФ-спектрофотометра для определения концентрации белка в растворе. Коэффициент экстинкции, необходимый для этого, рассчитывали из аминокислотной последовательности в соответствии с Pace et al., Protein Science, 4: 2411-2423 (1995). Эксклюзионную хроматографию (size-exclusion chromatography, SE-HPLC) проводили на колонках TSK-Gel300SWXL или Superdex 200 с 0,2 М калий-фосфатным буфером, включающим 0,25 М KCl, pH 7,0, в качестве подвижной фазы, чтобы определить содержание мономерных, агрегированных и деградированных форм в образцах. Электрофорез в полиакриламидном геле с додецилсульфатом натрия (sodium dodecyl sulfate, SDS) (в восстанавливающих и невосстанавливающих условиях) проводили для анализа чистоты комплексных препаратов в отношении продуктов распада, связанных с целевым продуктом, и примесей, не связанных с целевым продуктом (подробнее см. ниже) Масс-спектрометрию с ионизацией электрораспылением (electrospray ionisation mass spectrometry, ESI-MC) проводили с восстановленными (TCEP) образцами, чтобы подтвердить правильную массу/идентичность каждой цепи и выявить химические модификации. ESI-MC невосстановленных образцов проводили для анализа природы и качества полностью собранного белка и для обнаружения потенциальных побочных продуктов, связанных с целевым продуктом.
Способ SDS-PAGE и окрашивание Кумасси

[0321] Образец доводили буфером до концентрации белка 1 мг/мл. Для восстановления образца проводили следующую процедуру: готовили буфер для восстановления, содержащий 4 мл буфера для образцов (2×) и 1 мл восстанавливающего буфера (10×). Образец разводили 1:1 буфером для восстановления и инкубировали в течение 5 минут при 70°C.
[0322] Гель-электрофорез проводили при 125 В в течение 90 минут. Гели окрашивали SIMPLY BLUE Safe Stain (Invitrogen, кат. NO LC6065).
Пример 12.5: Сравнение цитотоксических свойств Fab- и dsFv-гибридных белков
[0323] Цитотоксическую активность гибридного белка формата dsFv-PE24 и формата Fab-PE24 сравнивали с использованием одной и той же гуманизированной SS1 специфической группировки на трех различных опухолевых клеточных линиях (MKN45, Н596 и А431Н9). Вкратце, клетки высевали в 96-луночные планшеты. После культивирования в течение ночи в среду добавляли различные концентрации cFP и клетки инкубировали в течение 72 часов. В конце периода инкубации жизнеспособность клеток определяли с использованием анализа CELLTITERGLOW.
[0324] В каждом случае кривые "доза - ответ" и значения IC50 для ингибирования жизнеспособности клеток были похожими для форматов dsFv-PE24 и Fab-PE24. Молярное соотношение значений IC50 приведено в таблице 18. В зависимости от анализируемой клеточной линии нацеленные РЕ24-гибридные белки были от нескольких сотен до одной тысячи раз более активными, чем ненацеленные РЕ24.

Пример 12.6: Сравнение сывороточной кинетики Fab- и dsFv-гибридных белков
[0325] Сывороточную кинетику следующих трех иммунотоксинов против мезотелина на основе экзотоксина А псевдомонад (РЕ) сравнивали на мышах SCID beige: SS1dsFv-PE38 (MW: 62,5 кДа), SS1dsFv-PE24 (MW: 49,9 кДа) и SS1Fab-PE24 (MW: 72,2 кДа). Группировку мышиного SS1-антитела использовали для всех конструкций. Кинетику сравнивали в дозах, эквимолярных 0,2 мг/кг (3,2 нмоль/кг) SS1P, что соответствует 0,231 мг/кг для SS1Fab-PE24 и 0,160 мг/кг для SS1dsFv-РЕ24.
[0326] Конструкции вводили в виде однократной внутривенной дозы и анализировали их уровни в сыворотке через 0,08, 0,5, 1, 1,5, 2, 3, 4, 5 и 7 часов после введения дозы. Девяти мышам в группе вводили исследуемый препарат и собирали кровь в шахматном порядке по три раза у каждого животного путем ретроорбитальной пункции, получая девять временных точек с n равно 3 образцов. Образцы сыворотки анализировали с помощью анализа ELISA, который выявляет только интактные тестируемые соединения, имеющие фрагмент антитела плюс РЕ-часть. В этом формате анализа cFP захватывается MSLN-покрытой поверхностью, и РЕ-группировка детектируется с помощью кроличьего поликлонального анти-РЕ-антитела и биотинилированного противокроличьего вторичного антитела.
[0327] Для каждой временной точки на графике откладывали средние сывороточные значения от трех животных для анализируемых групп вместе с архивными данными от мышей CD2F1. Конструкция SS1dsFv-PE24 очень быстро выводилась из сыворотки, имея период полужизни всего примерно 12 минут. В соответствии с архивными данными клиренс SS1P был гораздо более медленным, давая период полужизни в сыворотке от 35 до 44 минут (значения, полученные на основе измеренных и архивными данных, соответственно). Фармакокинетические свойства конструкции SS1Fab-PE24 были очень похожи на SS1dsFv-PE38 с периодом полужизни в сыворотке 43 минуты, и близкие значения были получены и для скорости клиренса, объема распределения, cmax и площади под кривой (таблица 19 и фиг. 19).

Пример 13
[0328] Этот пример демонстрирует гуманизацию антитела SS1 против мезотелина.
Пример 13.1: Разработка гуманизированных вариабельной областей тяжелой и легкой цепи.
[0329] Структуры VH- и VL-домена антитела SS1 были смоделированы in silico, и модель сравнивали со структурной базой данных человеческих доменов VH и VL. Панель наиболее структурно подобных V-доменов была выбрана для прививки CDR из SS1 в человеческие домены VH и VL. Кроме того, чтобы сузить выбор человеческих V-доменов, было принято во внимание сходство первичной последовательности при выравнивании первичной последовательности VH- и VL-домена из SS1 с репертуаром человеческих V-доменов. В некоторых вариантах гуманизации в человеческие каркасные области были введены обратные мутации на мышиные родительские остатки. Аналогичным образом, в некоторых вариантах были введены мутации в CDR, когда это было целесообразно, для потенциального повышения аффинности к антигену или для поддержания третичной структуры CDR.
[0330] Разработанные варианты V-доменов клонировали в векторы 6318 и 6319 с тяжелой цепью и легкой цепью с помощью уникальных сайтов клонирования для создания легких и тяжелых цепей человеческого IgG. Векторами с тяжелой цепью и легкой цепью котрансфицировали суспензионные клетки НЕК293 в микротитровальных планшетах для культивирования в матричной форме, чтобы получить культуры клеток, экспрессирующие полноразмерные IgG, имеющие все возможные комбинации тяжелой/легкой цепей. Через 5 дней культивирования при 37°C супернатант собирали и очищали с помощью аффинной хроматографии на белке А в микротитровальной шкале.
Пример 13.2: Клонирование гуманизированных вариабельных областей тяжелой и легкой цепи
[0331] Для манипулирования ДНК использовали стандартные способы, описанные в Sambrook, J. et al., см. выше. Молекулярно-биологические реагенты использовали в соответствии с инструкциями изготовителя. Нужные генные сегменты получали коммерческим путем методом генного синтеза. Синтезированные фрагменты генов клонировали в указанный экспрессионный вектор. ДНК-последовательности субклонированных фрагментов генов подтверждали секвенированием ДНК.
[0332] Векторы для экспрессии тяжелых цепей антитела: генные сегменты разработанных гуманизированных вариабельных доменов тяжелой цепи антитела клонировали в указанный экспрессионный вектор с помощью уникальных сайтов рестрикции HindIII и Xhol. Экспрессионный вектор разрабатывали для экспрессии вариабельного домена тяжелой цепи антитела, слитого с СН1-, шарнирным, СН2- и СН3-доменами человеческого антитела, в клетках HEK293, получая обычную тяжелую цепь антитела. Все домены были отделены нитронами. Помимо экспрессионной кассеты для тяжелой цепи антитела вектор содержал:
- сайт начала репликации из вектора pUC18 для репликации этой плазмиды в Е. coli,
- ген бета-лактамазы, который придает устойчивость к ампициллину в Е. coli,
- промотор SV40 и сайт начала экспрессии маркера селекции DHFR,
- ген мышиной дигидрофолатредуктазы (dihydrofolate reductase, DHFR) в качестве селективного маркера для экспрессии антитела, и
- раннюю сигнальную последовательность полиаденилирования SV40' ("ранний поли-А").
[0333] Транскрипционный блок тяжелой цепи антитела состоит из следующих элементов:
- немедленный ранний энхансер и промотор цитомегаловируса человека,
- 5'-нетранслируемая область зародышевого гена антитела человека,
- сигнальная последовательность тяжелой цепи мышиного иммуноглобулина, включающая интрон сигнальной последовательности (сигнальная последовательность 1, интрон, сигнальная последовательность 2 [L1- интрон-L2]),
- последовательность VH, за которой следует интрон,
- человеческие СН1-, шарнирный, СН2-, СН3-домены, разделенные интронами,
- сигнальная последовательность полиаденилирования бычьего гормона роста (bovine growth hormone, bGH) ("поли А"), и
- терминатор транскрипции человеческого гастрина (human gastrin transcription, HGT).
[0334] Векторы для экспрессии легких цепей антитела: генные сегменты разработанных гуманизированных вариабельных доменов легкой цепи антитела клонировали в указанный экспрессионный вектор с помощью уникальных сайтов рестрикции BsmI и Cell. Экспрессионный вектор разрабатывали для размещения вариабельного домена легкой цепи антитела в гибриде с доменом Ck человеческого антитела в клетках HEK293. Оба домена были разделены интронами. Помимо экспрессионной кассеты для легкой цепи антитела вектор содержал:
- сайт начала репликации из вектора pUC18 для репликации этой плазмиды в Е. coli,
- ген бета-лактамазы, который придает устойчивость к ампициллину в Е. coli.
[0335] Транскрипционный блок легкой цепи антитела состоит из следующих элементов:
- немедленный ранний энхансер и промотор цитомегаловируса человека,
- 5'-нетранслируемая область цитомегаловируса человека,
- последовательность интрона А цитомегаловируса человека,
- 5'-нетранслируемая область зародышевого гена антитела человека
- сигнальная последовательность тяжелой цепи мышиного иммуноглобулина, включающая интрон сигнальной последовательности (сигнальная последовательность 1, интрон, сигнальная последовательность 2 [L1-интрон-L2]) и уникальный сайт рестрикции BsmI на 3'-конце L2,
- домен VL с последующим интроном,
- человеческий Ск-домен,
- сигнальная последовательность полиаденилирования бычьего гормона роста (bGH) ("поли А"), и
- терминатор транскрипции человеческого гастрина (HGT).
Пример 13.3: Экспрессия гуманизированных антител
[0336] Временная трансфекция гуманизированных легких и тяжелых цепей антитела: Рекомбинантные варианты гуманизированного антитела получали путем временной трансфекции клеток HEK293-Freestyle (линии клеток человеческой эмбриональной почки 293, Invitrogen), выращенных в суспензии. Трансфицированные клетки культивировали в среде F17 (Gibco) или в среде Freestyle 293 (Invitrogen), либо в среде с добавлением 6 мМ глутамина, ультраглутамина (Biowhittake/Lonza) или L-глутамина (Sigma), с 8% CO2 при 37°C во встряхиваемых колбах в масштабе от 2 мл среды в планшетах с 48 глубокими лунками до 1 л среды в колбах. Реагент для трансфекции 293-Free (Novagen/Merck) использовали в соотношении количества реагента (мкл) к ДНК (мкг) как 4:3. Легкие и тяжелые цепи экспрессировали из двух различных плазмид, используя молярное отношение плазмид, кодирующих легкую цепь и тяжелую цепь, в пределах от 1:2 до 2:1, соответственно. Клеточные культуральные супернатанты, содержащие гуманизированное антитело, собирали через 6-8 суток после трансфекции. Общая информация касательно рекомбинантной экспрессии человеческих иммуноглобулинов, например, в клетках НЕК293, дана в: Meissner et al., Biotechnol. Bioeng., 75: 197-203 (2001). Супернатанты очищали с помощью аффинной хроматографии на колонке MabSelect Sure (GE, Protein А), уравновешенной PBS. После нанесения профильтрованных супернатантов антитела элюировали с использованием 50 мМ ацетата натрия, pH 3,2. Значение pH элюата немедленно доводили до pH более 6 с помощью 2 М Tris/HCl, pH 9,0, с последующим диализом в растворе 20 мМ гистидина, 140 мМ NaCl, pH 6,0. Антитела анализировали по UV280, SDS-PAGE и аналитической SEC. Последовательность подтверждали путем масс-спектрометрии.
Пример 13.4: Характеризация гуманизированных вариантов SS1.
[0337] ELISA-скрининг гуманизированных вариантов SS1: все варианты гуманизации SS1 в формате IgG подвергали скринингу на аффинность путем ELISA. 384-луночные микротитровальные планшеты MaxiSorp покрывали 0,5 мкг/мл анти-His-антитела (Novagen). После блокировки PBS-буфером с добавлением 2% BSA, 0,1% Tween 20 и 0,2 мкг/мл человеческого/собачьего/мышиного мезотелина (собственный/R&D Systems) проводили захват всех белков с His-меткой на планшете в течение одного часа. Планшеты промывали PBST-буфером (PBS плюс 0,1% Tween 20) и инкубировали с разведениями гуманизированных антител против мезотелина в PBS в течение 1 ч при комнатной температуре. Связывание антител определяли с помощью HRP-конъюгированного антитела против человеческого Fc (GE Healthcare). После последней промывки планшеты инкубировали с субстратом HRP. Абсорбцию измеряли при длине волны 370 нм на планшетном ридере ENVISION. Анализ подгонки кривой ЕС50 проводили с использованием плагина для анализа XLfit4 для программного обеспечения EXCEL (модель 205).
[0338] Для того чтобы нормировать полученные значения для титра IgG, определяли количество человеческого IgG путем сэндвич-ELISA с использованием планшетов, покрытых стрептавидином. Покрытые стрептавидином 384-луночные микротитровальые планшеты (Microcoat) инкубировали со смесью 0,25 мкг/мл биотинилированного антитела против человеческого IgG (Jackson Imm. Res.), 0,05 мкг/мл конъюгата противочеловеческого IgG с HRP (Jackson Imm. Res.) и разведениями гуманизированных против антител мезотелина. Через 1,5 часа инкубации при комнатной температуре (RT) планшеты промывали PBS-буфером с добавлением 0,1% Tween 20. Дабвляли субстрат HRP и измеряли абсорбцию при длине волны 370 нм на планшетном ридере ENVISION. Расчет данных проводили с использованием человеческого референсного IgG (собственный) в качестве стандарта для калибровки и с помощью плагина для анализа XLfit4 для программного обеспечения EXCEL (модель 205) для анализа путем подбора кривой.
[0339] В таблицах 20-21 ниже показаны данные ELISA для всех вариантов гуманизации. Измеряли ELISA/BIACORE-связывание с huMesothelin (ЕС50 нг/мл), результаты приведены в таблице 20 (собственный) и в таблице 21 (R&D). Нормированный по титру IgG, этот первичный скрининг выявил вариант VL001/VH001 в качестве одной из комбинаций с лучшим значением ЕС50.
[0340] BIAcore-скрининг гуманизированных вариантов SS1: лучшие варианты, содержащие CDR, наиболее близкие к SS1, были выбраны для кинетического анализа с помощью поверхностного плазмонного резонанса (SPR). Анализ на основе SPR использовали для определения кинетических параметров связывания между несколькими вариантами гуманизации MSLN PE cFP и человеческим мезотелином. Так, белок А иммобилизировали путем аминного сочетания с поверхностью биосенсорного чипа СМ5. Затем проводили захват образцов и вводили человеческий мезотелин. Поверхность сенсорного чипа подвергали регенерации между всеми циклами анализа. Наконец, получали константу равновесия KD, а также константы скорости kd и ka, путем подгонки данных по модели взаимодействия Ленгмюра 1:1. Примерно 175 единиц ответа (RU) белка А (10 мкг/мл) связывали с сенсорным чипом СМ5 при pH 4,0 с помощью набора для аминного сочетания, поставляемого компанией GE Healthcare (активация 10 минут). В качестве буфера для образцов и системного буфера выступал HBS-P + (0,01 М HEPES, 0,15 М NaCl, 0,005% поверхностно-активного вещества Р20, стерильно профильтрован, pH 7,4). Температуру проточной ячейки устанавливали на 25°C, а температуру отсека для образцов устанавливали на 12°C. Систему промывали рабочим буфером. Сайты связывания белка А насыщали IgG (примерно 0,03 мкг/мл), получая одинаковые уровни захвата для каждого образца, вводя его в течение 40 секунд со скоростью потока 10 мкл/мин. После этого один раствор человеческого мезотелина с концентрацией 50 нМ вводили в течение 120 секунд со скоростью потока 30 мкл/мин с последующей фазой диссоциации 180 секунд. Тем самым определение относительной KD позволяло ранжировать различные молекулы, связывающие MSLN. Каждый цикл подвергали регенерации двумя инъекциями глицин-HCl с pH 1,5 (30 секунд, 30 мкл/мин).
[0341] В таблице 22 ниже приведены данные BIAcore от 12 отобранных вариантов гуманизации. Окончательный вариант гуманизации VL01/VH01 показал одно из самых низких значений Kd среди всех вариантов гуманизации. В таблице 22 представлены результаты BIAcore для cFP. 15438-15457 и cFP. 15438-15459, все они содержат гуманизированный VH1. cFP.15438, который включает аминокислотную последовательность SEQ ID NO 45, демонстрирует самую высокую аффинность гуманизированных вариантов антитела SS1. Таким образом, VH в cFP.15438 обеспечивает выгодные связывающие свойства.
[0342] Пять лучших вариантов клонировали в формате Fab-линкер-РЕ, содержащем опубликованный линкер и LRO10 в качестве варианта РЕ24, экспрессировали, подвергали рефолдингу и очищали. Клонирование, экспрессию, рефолдинг и очистку проводили, как описано ниже для cFP-0205. Пять вариантов гуманизации в цитолитическом гибридном формате анализировали на стабильность при 37°C в течение 7 дней путем динамического рассеяния света, описанного в примере 9.2, эксклюзионной хроматографии, SDS-PAGE и масс-спектрометрии в различных временных точках.
[0343] Эксклюзионную хроматографию (SE-HPLC) проводили на колонках TSK-Gel300SWXL или Superdex 200 с 0,2 М калий-фосфатным буфером, содержащим 0,25 М KCl (pH 7,0), в качестве подвижной фазы, чтобы определить содержание мономерных, агрегированных и деградированных форм в образцах. Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS) (в восстанавливающих и невосстанавливающих условиях) проводили для анализа чистоты комплексных препаратов в отношении продуктов распада, связанных с целевым продуктом, и примесей, не связанных с целевым продуктом (подробнее см. ниже) Масс-спектрометрию с ионизацией электрораспылением (ESI-MC) проводили с восстановленными (ТСЕР) образцами, чтобы подтвердить правильную массу/идентичность каждой цепи и выявить химические модификации. ESI-MC невосстановленных образцов проводили для анализа природы и качества полностью собранного белка и для обнаружения потенциальных побочных продуктов, связанных с целевым продуктом.
[0344] С помощью поверхностного плазмонного резонанса (SPR) контролировали активную концентрацию Fab-фрагментов в цитолитическом гибридном формате после температурного стресса при 37°C в течение 7 дней. Мезотелин иммобилизовали на поверхности SPR-биосенсора. При введении образца в проточные ячейки SPR-спектрометра он формировал комплекс с иммобилизованным мезотелином, что приводило к повышению массы, на поверхности сенсорного чипа и, следовательно, к более высокому ответу (такому как 1 RU, что определяется как 1 пг/мм2). После этого сенсорный чип подвергали регенерации, растворяя комплекс "образец - мезотелин". Затем полученный ответ оценивали относительно ответа, получаемого с референсным стандартом (активность которого принимается за 100%). Вначале примерно 50 единиц ответа (RU) человеческого MSLN (0,75 мкг/мл) связывали с сенсорным чипом С1 (GE Healthcare) при pH 4,5 с помощью набора для аминного сочетания от GE Healthcare. В качестве буфера для образцов и системного буфера выступал HBS-P+ (0,01 М HEPES, 0,15 М NaCl, 0,005% поверхностно-активного вещества Р20, стерильно профильтрован, pH 7,4). Температуру проточной ячейки устанавливали на 25°C, а температуру отсека для образцов устанавливали на 12°C. Систему промывали рабочим буфером. Затем вводили 5 нМ раствор конструкции MSLN РЕ cFP в течение 60 секунд со скоростью потока 30 мкл/мин с последующей фазой диссоциации 60 секунд. Затем поверхность сенсорного чипа подвергали регенерации двумя 20-секундными введениями раствора для регенерации (00,31 М KSCN, 1.22М MgCl2, 0,61 М мочевина, 1,22М гуанидин-HCl, 6,7 мМ EDTA) со скоростью потока 30 мкл/мин, после чего следовал дополнительный этап промывки буфером и 5-секундный период стабилизации.
[0345] Данные по стабильности получали путем инкубации 5 лучших гуманизированных вариантов в формате Fab-линкер-PE24LRO10 при 37°C в течение 7 дней. Результаты представлены в таблице 23. Как показано в таблице 23, вариант VH01/VL01 был единственным вариантом, который не показал никакой фрагментации после температурного стресса. При усиленном восстановлении VL01, как и всех комбинаций VL01, после температурного стресса образовывались только агрегаты, но осадок не выпадал. Отрицательные результаты измерений аффинности после температурного стресса возникали из-за этих агрегатов. Соответственно, вариант гуманизации VH1/VL1 (SEQ ID NO 45)/(SEQ ID NO 46) был выбран для дальнейшей разработки. VH1 (SEQ ID NO 45) обеспечивал благоприятные функциональные возможности и связывающие свойства. Сочетание VH1 (SEQ ID NO 45)/VL1 (SEQ ID NO 46) обеспечивало хорошую перспективность.



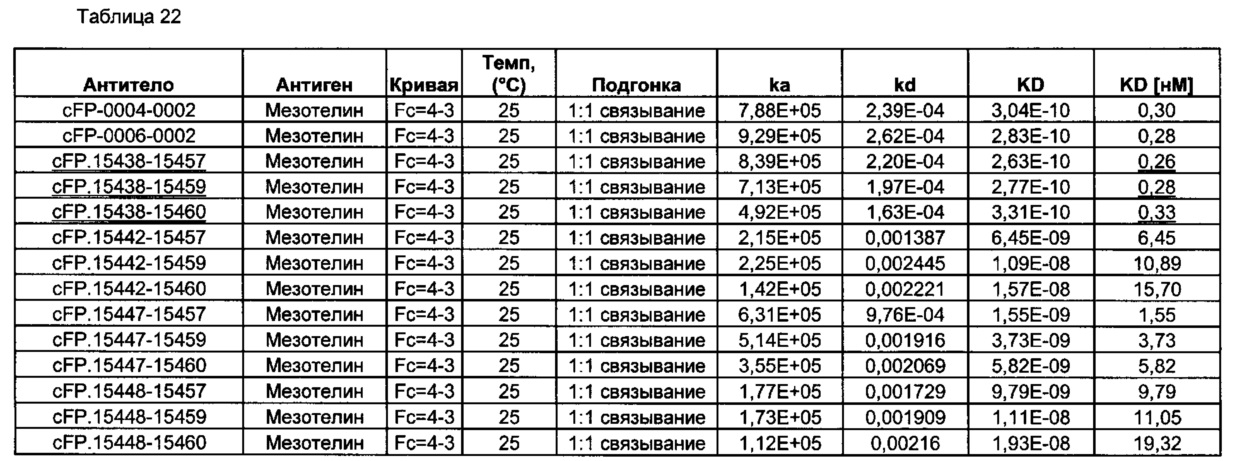
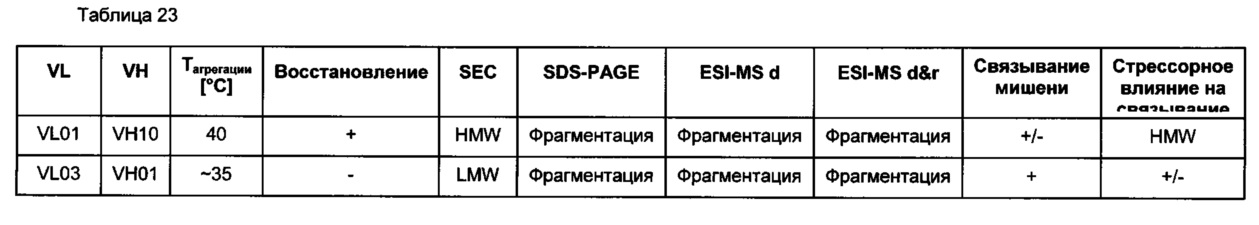

Пример 14
[0346] Этот пример показывает клонирование, экспрессию, рефолдинг и очистку химерного деиммунизированного PE LOR10-456A в виде Fab-гибрида с гуманизированным SS1 против мезотелина (cFP-0205).
[0347] Химерная РЕ-молекула против мезотелина cFP-0205 была получена после клонирования, экспрессии, рефолдинга и очистки. cFP-0205 (также называемый R205 или RG7787) включает аминокислотные последовательности SEQ ID NO 39 и 40.
[0348] Клонирование cFP-0205: для экспрессии cFP-0205 использовали систему вектор/хозяин Е. coli, которая делает возможной селекцию плазмиды без антибиотика с помощью комплементации ауксотрофии E. coli (PyrF) (ЕР 0972838 и US 6291245). Для манипуляций с ДНК были использованы стандартные способы, описанные в Sambrook, J. et al., см. выше. Молекулярно-биологические реагенты использовали в соответствии с инструкциями изготовителя. Нужные генные сегменты получали коммерческим путем методом генного синтеза. Синтезированные фрагменты генов клонировали в указанный экспрессионный вектор. ДНК-последовательности субклонированных фрагментов генов подтверждали секвенированием ДНК.
[0349] Экспрессионные плазмиды для продукции легкой цепи (LC) и тяжелой цепи (НС), соответственно, были получены следующим образом: плазмида LC 15496 является экспрессионной плазмидой для экспрессии легкой цепи антитела в Е. coli. Она была получена путем лигирования фрагмента VL-домена антитела в вектор с использованием сайтов рестрикции Ndel/BsiWI.
[0350] Плазмида для экспрессии легкой цепи в Е. coli содержит следующие элементы:
- сайт начала репликации из вектора pBR322 для репликации в Е. coli (соответствующий позициям 2517-3160 в соответствии с Sutcliffe et al., Quant. Biol., 43: 77-90(1979),
- ген URA3 от Saccharomyces cerevisiae, кодирующий оротидин-5'-фосфатдекарбоксилазу (Rose et al., Gene, 29: 113-124 (1984), которая позволяет выбирать плазмиды с помощью комплементации мутантных штаммов Е. coli pyrF (урацил-ауксотрофия),
- экспрессионную кассету легкой цепи антитела, содержащую:
- гибридный промотор Т5 (гибридный промотор T5-PN25/03/04 в соответствии с Bujard et al., Methods. Enzymol., 155: 416-433 (1987) и Stueber, et al., Immunol. Methods IV, 121-152 (1990), включающий синтетический сайт посадки рибосомы в соответствии с Stueber et al. (см. выше),
- вариабельный домен легкой цепи антитела, включающий CDR из SS1,
- человеческий Ск-домен,
- два терминатора транскрипции бактериофагального происхождения: терминатор λ-Т0 (Schwarz et al., Nature, 272: 410-414 (1978)) и fd-терминатор (Beck et al., Gene, 1-3: 35-58(1981)), и
- ген-репрессор lad из E.coli (Farabaugh, Nature, 274: 765-769 (1978).
[0351] Плазмида НС 18023 является экспрессионной плазмидой для экспрессии гибридного белка, включающего тяжелую цепь антитела, линкер с сайтом расщепления фурином и мутантный домен III из экзотоксина А псевдомонад (РЕ), в Е. coli. Она была получена путем лигирования фрагмента VH-домена в вектор с использованием сайтов рестрикции NdeI/BsrGI.
[0352] Плазмида для экспрессии цитолитического гибридного белка тяжелой цепи в Е. coli содержит следующие элементы:
- сайт начала репликации из вектора pBR322 для репликации в Е. coli (соответствующий позициям 2517-3160 в соответствии с Sutcliffe et al., Quant. Biol., 43: 77-90(1979),
- ген URA3 от Saccharomyces cerevisiae, кодирующий оротидин-5'-фосфатдекарбоксилазу (Rose et al., Gene, 29: 113-124 (1984), которая позволяет выбирать плазмиды с помощью комплементации мутантных штаммов Е. coli pyrF (урацил-ауксотрофия),
- экспрессионная кассета гибридного белка "тяжелая цепь - РЕ домен IIIʺ, содержащая:
- гибридный промотор Т5 (гибридный промотор T5-PN25/03/04 в соответствии с Bujard et al., Methods. Enzymol, 155: 416-433 (1987) и Stueber, et al., Immunol. Methods IV, 121-152 (1990), включающий синтетический сайт посадки рибосомы в соответствии с Stueber et al. (см. выше),
- вариабельный домен тяжелой цепи антитела, включающий CDR из SS1,
- человеческий СН1-домен,
- линкер, содержащий сайт расщепления фурином,
- мутантный вариант домена III из экзотоксина А псевдомонад
- два терминатора транскрипции бактериофагального происхождения: терминатор λ-T0 (Schwarz et al., Nature, 272: 410-414 (1978)) и fd-терминатор (Beck et al., Gene, 1-3: 35-58(1981)), и
- ген-репрессор lad из Е. coli (Farabaugh, Nature, 274: 765-769 (1978).
[0353] Экспрессия cFP-0205 в E. coli: штаммы E. coli K12 CSPZ-6 (thi-1, ΔpyrF) и CSPZ-13 (thi-1, ΔompT, ΔpyrF) трансформировали путем электропорации экспрессионными плазмидами NONO 15496 и 18023. Трансформированные клетки Е. coli сначала выращивали при 37°C на чашках с агаром. Для каждой трансформации колонии, собранные с этой чашки, переносили в перемешиваемую культуру объемом 3 мл и выращивали при 37°C до оптической плотности составляющей от 1 до 2 (измеренной при 578 нм). Затем 1000 мкл культуры смешивали с 1000 мкл стерильного 86% глицерина и немедленно замораживали при -80°C для длительного хранения. Правильный продукт экспрессии этого клона вначале проверяли в мелкомасштабных экспериментах со встряхиваемыми колбами и анализировали с помощью SDS-PAGE до передачи в ферментер объемом 10 л.
Предварительное культивирование:
[0354] Для предварительной ферментации использовали среду с определенным химическим составом (CD-PCMv2.60): NH4Cl 1,25 г/л, K2HPO4*3H2O 18,3 г/л, цитрат 1,6 г/л, L-метионин 0,20 г/л, глюкоза*H2O 8,0 г/л, раствор микроэлементов 0,5 мл/л, MgSO4*7H2O 0,86 г/л и тиамин*HCl 17,5 м г/л. Раствор микроэлементов содержал FeSO4*7H2O 10,0 г/л, ZnSO4*7H2O 2,25 г/л, MnSO4*H2O 2,13 г/л, H3BO3 0,50 г/л, (NH4)6Mo7O24*4H2O 0,3 г/л, CoCl2*6H2O 0,42 г/л, CuSO4*5H2O 1,0 г/л, растворенные в 0,5М HCl
[0355] Для предварительной ферментации в пяти встряхиваемых колбах объемом 1000 мл с четырьмя перегородками в 220 мл среды засевали 1,0 мл из ампулы с банком исследования. Культивирование проводили на ротационном шейкере в течение 11-12 часов при 37°C и скорости 170 оборотов в минуту до получения оптической плотности (578 нм) от 7 до 9. Встряхиваемые колбы объединяли и определяли оптическую плотность. Объем инокулята рассчитывали по формуле Vинок. равно 1000 мл*5/ODPC, и он зависел от оптической плотности предварительной культуры, которую использовали для инокуляции в партию среды для биореактора объемом 100 л с равным числом клеток.
Ферментация объемом 100 л:
[0356] Для ферментации в ферментере объемом 100 л (Sartorius, Мельзунген, Германия) использовали следующую партию с определенным химическим составом: KH2PO4 1.59 г/л, (NH4)2HPO4 7,45 г/л, K2HPO4*3H2O 13,32 г/л, цитрат 2,07 г/л, L-метионин 1,22 г/л, NaHCO3 0,82 г/л, раствор микроэлементов 7,3 мл/л, MgSO4*7H2O 0,99 г/л, тиамин*HCl 20,9 м г/л, глюкоза*H2O 29,3 г/л, биотин 0,2 мг/л и 1,2 мл/л 10% противопенного агента Synperonic. Раствор микроэлементов содержал FeSO4*7H2O 10 г/л, ZnSO4*7H2O 2,25 г/л, MnSO4*H2O 2,13 г/л, CuSO4*5H2O 1,0 г/л, CoCl2*6H2O 0,42 г/л, (NH4)6Mo7O24*4H2O 0,3 г/л и H3BO3 0,50 г/л, солюбилизированные в 0,5М растворе HCl.
[0357] Питательный раствор 1 содержал 700 г/л глюкозы*H2O, 7,4 г/л MgSO4*7H2O и 0,1 г/л FeSO4*7H2O. Питательный раствор 2 содержал KH2PO4 52,7 г/л, K2HPO4*3H2O 139,9 г/л и (NH4)2HPO4 66,0 г/л. Все компоненты были растворены в деионизированной воде. Щелочной раствор для регулирования pH представлял собой водный 12,5% (вес/объем) раствор NH3, дополненный 11,25 г/л L-метионина.
[0358] Начиная с 42 л стерильной партии среды плюс рассчитанное количество инокулята из предварительного культивирования, периодическую ферментацию проводили при 31°C, pH 6,9±0,2, противодавлении 800 мбар и начальной скорости аэрации 50 л/мин. Относительное значение растворенного кислорода (рО2) поддерживали на уровне 50% в ходе ферментации за счет увеличения скорости мешалки до 1000 оборотов в минуту. После того, как первоначально введенная глюкоза истощалась, что обозначалось резким повышением значений растворенного кислорода, температуру сдвигали на 37°C, когда получали легкую цепь, или сохраняли постоянной, когда получали конструкцию тяжелой цепи, и через 15 минут ферментацию переводили в режим подпитки с началом введения обоих питательных растворов (600 и 140 г/ч соответственно). Скорость подачи раствора 2 поддерживали постоянной, в то время как скорость подачи раствора 1 увеличивали ступенчато с заранее определенным профилем подачи от 600 до 1400 г/ч, когда получали легкую цепь, или до 1600 г/ч, когда получали конструкцию тяжелой цепи, в течение 6-7 часов. Когда концентрация выделяемого газообразного диоксида углерода устанавливалась выше 2%, скорость аэрации ступенчато увеличивали на 10 л/мин с 50 до 100 л/мин в течение 5 часов. Экспрессию рекомбинантных целевых белков в виде телец включения, расположенных в цитоплазме, индуцировали добавлением 24 г IPTG при оптической плотности примерно 40 для вариабельной легкой Fab-цепи и 120 для вариабельной тяжелой Fab-цепи.
[0359] После 24 часов культивирования весь бульон охлаждали до температуры от 4 до 8°C и оставляли в течение ночи в сосуде ферментера. Бактерии собирали центрифугированием с помощью проточной центрифуги (13000 оборотов в минуту, 13 л/ч) и полученную биомассу хранили при -20°C до дальнейшей обработки (разрушения клеток) или немедленно обрабатывали для выделения телец включения.
Анализ образования продуктов:
[0360] Образцы забирали из ферментера, один перед индукцией, а остальные в определенные временные точки после индукции экспрессии белка. Образцы анализировали с помощью электрофореза в SDS-полиакриламидном геле. Из каждого образца одинаковое количество клеток (ODцелевое равно 10) суспендировали в 5 мл PBS-буфера и разрушали путем обработки ультразвуком на льду. Затем 100 мкл каждой суспензии центрифугировали (15000 оборотов в минуту, 5 минут), и каждый супернатант отбирали и переносили в отдельную пробирку. Это делали для различения растворимого и нерастворимого экспрессированного белка-мишени. К каждому супернатанту (растворимой фракции белка) добавляли 100 мкл, а к каждому осадку (нерастворимой фракции белка) 200 мкл SDS-буфера для образцов (Laemmli, Nature, 227: 680-685 (1970). Образцы нагревали в течение 15 мин при температуре 95°C в условиях интенсивного смешивания для солюбилизации и восстановления всех белков в образцах. После охлаждения до комнатной температуры 5 мкл каждого образца наносили на от 4 до 20% полиакриламидный гель TGX Criterion Stain Free (Bio-Rad). Кроме того, наносили 5 мкл стандарта молекулярных весов (Precision Plus Protein Standard, Bio-Rad) и 3 различных количества (0,3 мкл, 0,6 мкл и 0,9 мкл) количественного стандарта с известной концентрацией целевого белка (0,1 мкг/мкл).
[0361] Электрофорез проводили в течение 60 мин при 200 В, а после этого гель переносили на GelDoc EZ Imager (Bio-Rad) и обрабатывали в течение 5 мин УФ-излучением. Изображения геля анализировали с помощью программного обеспечения для анализа изображений IMAGE LAB (Bio-Rad). С помощью трех стандартов рассчитывали кривую линейной регрессии с коэффициентом более0,99 и рассчитывали концентрацию белка-мишени в исходном образце. Выход составлял до от 3 до 4 г/л Fab-легкой цепи и от 10 до 12 г/л гибрида PE-Fab-тяжелой цепи.
Подготовка препаратов телец включения:
[0362] Получение препаратов телец включения (IBP) из ферментеров объемом 100 л начинали сразу после сбора бактерий, ресуспендируя собранные бактериальные клетки в буфере 1 (12,1 г/л Tris, 0,246 г/л MgSO4*7H2O, 12 мл/л 25% HCl). Объем буфера рассчитывали в зависимости от содержания сухого вещества в биомассе. Добавляли лизоцим (100 кЕд/мг, 0,12 мг/г сухой вес) и небольшое количество бензоназы (5 Ед/г сухой вес). Затем суспензию гомогенизировали при 900 бар (APV Rannie 5, 1 проход) для разрушения бактериальных клеток, добавляли дополнительную бензоназу (30 Ед/г сухой вес) и инкубировали в течение 30 мин при температуре 30-37°C. Затем добавляли первый промывочный буфер (60 г/л Brij, 87,6 г/л NaCl, 22,5 г/л EDTA, 6 мл/л 10н NaOH) и снова инкубировали суспензию в течение 30 минут. Следующий этап центрифугирования (CSC6, Westfalia) приводил к получению взвеси телец включения, которую ресуспендировали во втором промывочном буфере (12,1 г/л Tris, 7,4 г/л EDTA, 11 мл/л 25% HCl) и инкубировали в течение 20 минут. Еще один этап разделения давал тельца включения в одном стерильном пластиковом пакете, который немедленно перемещали в DSP-отдел.
Результаты:
[0363] Ферментация легкой цепи давала оптическую плотность от 170 до 190, измеренную при 578 нм, и конечный выход продукта от 10 до 12 г/л. Ферментация гибрида тяжелой цепи и токсина давала оптическую плотность от 210 до 230, измеренную при 578 нм, и конечный выход продукта от 3 до 4,5 г/л.
[0364] Рефолдинг и очистка cFP-0205: тельца включения НС-РЕ24 и LC солюбилизировали по отдельности в растворе, содержащем 8 М гуанидина гидрохлорид, 100 мМ Tris/HCl, 1 мМ EDTA, pH 8,0 плюс 100 мМ дитиотреитол (DTT), в течение ночи при комнатной температуре (1 г IB в 5 мл). Солюбилизаты доводили до pH 3 и центрифугировали, а осадок отбрасывали. После экстенсивного диализа против 8 М гуанидина-HCl, 10 мМ EDTA, pH 3,0, чтобы удалить DTT, определяли общую концентрацию белка биуретовым способом. Чистоту содержания НС и LC оценивали с помощью SDS-PAGE.
[0365] Солюбилизаты разводили в молярном соотношении 1:1 в буфере для ренатурации, содержащем 0,5 М аргинин, 2 мМ EDTA, pH 10 плюс 0,9 мМ GSH/GSSG, соответственно, при температуре 2-10°C. Концентрацию белка-мишени увеличивали поэтапно от 0,1 до 0,5 г/л, при этом время инкубации между двумя дозами составляло 2 ч. После 5 повышений раствор ренатурата хранили при температуре от 2 до 10°C в течение ночи.
[0316] Ренатурат разбавляли H2O до менее 3 мСм/см и закачивали на анионообменную колонку (AIEX), уравновешенную 20 мМ Tris/HCl, pH 7,4. После промывания колонки уравновешивающим буфером белок элюировали градиентом до 20 мМ Tris/HCl, 400 мМ NaCl, pH 7,4. Пиковые фракции, содержащие Fab-PE24, объединяли, концентрировали и наносили на препаративную эксклюзионную колонку (SEC) в 20 мМ Tris, 140 мМ NaCl, pH 5,5 или 6,0, для удаления агрегатов, фрагментов и белков Е. coli. Конечный пул белка доводили до требуемой концентрации белка и анализировали с помощью SDS-PAGE, аналитической SEC и UV280. Идентичность подтверждали методом масс-спектрометрии.
[0367] Анализ белка cFP-0205: Анализ образцов проводили так, как описано выше.
Характеризация конечного деиммунизированного РЕ-варианта в форме Fab-гибрида с гуманизированным SS1 против мезотелина (cFP0205).
[0368] Цитотоксичность и уничтожение опухолевых клеток in vitro: цитотоксическую активность CFP0205 сравнивали с таковой у SS1P в анализах клеточной жизнеспособности на различных раковых клеточных линиях и клетках первичной мезотелиомы. Результаты представлены в таблице 24. Как показано в таблице 24 для многих раковых клеточных линий, SS1P и cFP0205 имели сопоставимую активность (разница в значениях IC50 меньше или равна 3). Тем не менее, некоторые клеточные линии (например, Hu-1 и Hu-2), а также клетки первичной мезотелиомы (RH19, RH21) были значительно более чувствительными к cFP0205, чем к SS1P (значения IC50 в 6-10 раз ниже).

Характеризация конечного деиммунизированного РЕ-варианта в форме Fab-гибрида с гуманизированным SS1 против мезотелина (cFP0205).
[0369] Период полужизни в сыворотке: пилотное исследование проводили на яванских макаках (1 самец и 1 самка) с cFP0205 для оценки фармакокинетики отднократных доз. Животным внутривенно вводили 0,3 мг/кг cFP0205. Для фармакокинетического анализа брали образцы крови до введения дозы, через 0,083 (5 минут, в конце инфузии), 1, 2, 3, 5, 8, 24, 48 и 168 часов после введения дозы. Уровни свободного лекарственного препарата (пунктирная линия), а также общего препарата (черные квадраты и сплошная линия) определяли с помощью различных форматов ELISA (фиг. 20). Для определения общего уровня лекарственного препарата проводили одностадийную кислотную диссоциацию перед этапом захвата на планшете, покрытом мезотелином. Уровни свободного и общего лекарственного препарата откладывали на графике в зависимости от времени. Для сравнения архивные данные с SS1P также вставили в фиг.20 (черные круги и сплошная линия). Эти архивные данные были получены с помощью анализа цитотоксической активности в виде показаний для сывороточных уровней SS1P. Анализ цитотоксичности обнаруживает свободный лекарственный препарат, но также обнаруживает, по меньшей мере частично, лекарственный препарат, связанный с растворимым мезотелином, который может вносить вклад в наблюдаемую активность. Измеренные уровни свободного лекарственного препарата для cFP0205 были аналогичны первой фазе архивных данных с SS1P. Измеренные уровни общего лекарственного препарата для cFP0205 были сопоставимы со второй фазой кинетики, наблюдаемой для SS1P. Таким образом, не только у мышей, но также и у яванских макак кинетика сывороточного уровня SS1P и cFP0205 была очень сопоставимой.
Характеризация конечного деиммунизированного РЕ-варианта в форме Fab-гибрида с гуманизированным SS1 против мезотелина (cFP0205)
[0370] Сниженная нецелевая токсичность: мышам SCID beige с небольшими подкожными опухолями из клеток рака легкого Н596 (средний объем опухоли 100 мм3) вводили дозы 0,5, 1, 2 и 3 мг/кг cFP0205 3 раза в неделю через день (QOD) и контролировали потерю массы тела в течение одного месяца. Результаты показаны на фиг. 21.
[0371] Как показано на фиг. 21, максимально переносимая доза SS1P у мышей при внутривенном введении 3 раза в неделю QOD составляла 0,4 мг/кг.CFP0205, вводимый в таком же режиме, переносился мышами SCID beige в дозах до 3 мг/кг. Некоторая потеря массы тела наблюдалась во всех группах. Тем не менее, эффект дозы 0,5 мг/кг cFP0205 был неотличим от контроля с носителем. Дозозависимо возрастающая потеря массы тела имела место с 1, 2 и 3 мг/кг. В группе 3 мг/кг максимальная потеря веса составила 15%, и это было отмечено через 4 дня после последнего применения cFP0205. В группах 2 и 3 мг/кг после последнего введения не наблюдалось дополнительного снижения массы тела. Все животные начали восстанавливать массу тела с 5-го день после последнего введения и далее. Начальное восстановление массы тела было наиболее выраженным в группе 3 мг/кг. Таким образом, несмотря на схожие фармакокинетические свойства обеих молекул у мышей, cFP0205 переносился в дозе, почти в 10 раз превышающей дозу SS1P.
[0372] Токсикологическое исследование однократной внутривенной дозы (короткой инфузии) проводили на 8-недельных самках крыс Wistar Furth (масса тела 150-175 г) для того, чтобы оценить и сравнить нецелевую токсичность SS1P и cFP0205. В частности, исследовали риск индуцирования сосудистой утечки (отека) в легких, вызванной анализируемым продуктом. Три животных в каждой группе получали активное вещество или носитель путем внутривенной короткой инфузии со скоростью инфузии 0,3 мл/мин. Животных вскрывали через 24 часа после введения дозы. Легкие с главными бронхами и печень оценивали макроскопически, оценивали сбор жидкости в легких и проводили биохимический анализ образцов крови. Результаты приведены в таблице 25.

Ожидается, что период полужизни SS1P и cFP0205 в сыворотке у крыс будет очень похожим на тот, который показан у мышей.
[0373] Как показано в Таблице 25, у двух из трех крыс, которым внутривенно вводили 2 мг/кг SS1P, наблюдалось накопление жидкости в легких. Все животные в этой группе показали четкие клинические признаки токсичности, и у всех животных биохимические показатели свидетельствовали о серьезных повреждениях печени. Напротив, у всех трех животных, которым вводили 10 мг/кг cFP0205, не наблюдалось никаких признаков токсичности. Только у одного животного было незначительно повышено значение одного из ферментов печени. Эти результаты показывают, что молекула cFP0205 вызывает значительно меньшую гепатотоксичность и синдром утечки, чем классический формат иммунотоксина SS1P.
[0374] Пилотное токсикологическое исследование проводили на яванских макаках (1 самец и 1 самка) с cFP0205 для определения переносимости повторных ежедневных доз анализируемого продукта при внутривенном введении и для проверки на предмет возможного позднего начала токсичности (до 72 ч после последнего введения дозы). Наблюдения за животными после введения доз проводили сразу же, через 0,25, 0,5, 1, 2 и 4 часа после окончания введения дозы. Во время фазы введения дозы два раза в день наблюдали за общим поведением и внешним видом животных, а массу тела, потребление пищи и фекалии анализировали ежедневно.
[0375] Введение cFP0205 в дозе 1 мг/кг ежедневно в течение 5 дней подряд хорошо переносилось обоими животными. Не было отмечено ни одного кровоизлияния, острого воспаления или изъязвления в месте инъекции. Тот факт, что животные не показали никаких клинических признаков токсичности или непереносимости, позволил твердо установить 1 мг/кг/день ×5 как не сильно токсичную дозу, в то время как классический формат иммунотоксина, представленный SS1P, ранее был показан как непереносимый в дозе 0,3 мг/кг/день ×5 у животных, вызывая стойкие клинические признаки токсичности, такие как сгорбленная поза с тремором, пониженная активность и плохой аппетит. Таким образом, cFP0205 гораздо лучше переносится, чем SS1P, не только у мышей, но и у яванских макак, полностью перекрестно реактивных видов для целевых группировок этих иммуноконъюгатов.
Характеризация конечного деиммунизированного РЕ-варианта в форме Fab-гибрида с гуманизированным SS1 (cFP0205)
[0376] cFP0205 и SS1P метили Су5 на свободных аминогруппах. Мышам линии SCID beige с подкожными опухолями Н596 внутривенно вводили (4 мыши/группа) две флуоресцентно меченные молекулы в дозе 2 мг/кг. Через 6 часов животных умерщвляли. Легкие, печень и селезенку фиксировали формалином, заливали в воск и нарезали. Флуоресцентные изображения репрезентативных срезов этих органов снимали при разном увеличении. Результаты показаны на фиг.22A-22L.
[0377] Как показано на фиг. 22A-22L, введение SS1P привело к выраженному флуоресцентному окрашиванию ткани легких и селезенки и к массивному окрашиванию, по-видимому, ретикулоэндотелиальной системы в печени. Напротив, при использовании cFP0205 окрашивание легочной ткани не наблюдалось. Кроме того, окрашивание селезенки было значительно более слабым, и характер окрашивания отличался от животных, получавших SS1P. Кроме того, окрашивание cFP0205 в печени было резко снижено по сравнению с SS1P. Только выделенные одиночные клетки, которые, по-видимому, являются клетками Купфера, были флуоресцентно окрашены. Это говорит о том, что более низкая нецелевая токсичность Fab-PE24 по сравнению с dsFv-PE38 связана с различиями в распределении в нормальной ткани.
Пример 15
[0378] В этом примере показано получение 3-РЕ-вариантных химерных молекул против глипикана.
[0379] 3-РЕ-вариантную химерную молекулу против глипикана, содержащую линкер с аминокислотной последовательностью SEQ ID NO 36, РЕ с SEQ ID NO 37 (L010R-456A), вариабельный домен тяжелой цепи VH SEQ ID NO 61 и вариабельный домен легкой цепи SEQ ID NO 62 (GPC3-PE24-LR-LO10R-456A-длинный линкер), получали способом, аналогичным способу получения РЕ-вариантной химерной молекулы против мезотелина cFP-077, описанному в примере 12 (от клонирования до очистки).
[0380] 3-РЕ-вариантную химерную молекулу против глипикана, содержащую линкер с аминокислотной последовательностью SEQ ID NO 36, РЕ с SEQ ID NO 37 (L010R-456A), вариабельный домен тяжелой цепи VH SEQ ID NO 77 и вариабельный домен легкой цепи SEQ ID NO 78, также получали способом, аналогичным способу получения РЕ-вариантной химерной молекулы против мезотелина cFP-077, описанному в примере 12 (от клонирования до очистки).
Пример 16
[0381] Этот пример демонстрирует цитотоксические свойства 3-РЕ-вариантной химерной молекулы против глипикана GPC3-PE24-LR-LO10R-456A-длинный линкер по сравнению с GPC3-PE24-LR-LO10R.
[0382] Цитотоксическую активность GPC3-PE24-LR-LO10R сравнивали с таковой у GPC3-PE24-LR-LO10R-456A-длинный линкер на глипикан 3-положительной линии клеток рака печени HepG2. Вкратце, клетки HepG2 высевали по 6000 клеток/лунка в 96-луночные планшеты. После культивирования в течение ночи в среду добавляли различные концентрации cFP, и клетки инкубировали в течение 72 часов. В конце периода инкубации жизнеспособность клеток определяли с помощью анализа CELLTITERGLOW. Результаты приведены в таблице 26.
[0383] Как показано в таблице 26, для обеих молекул на клетках HepG2 наблюдались сопоставимые кривые "доза - ответ" для ингибирования жизнеспособности клеток. Значение IC50 для более полно деиммунизированного варианта РЕ с мутацией 456А и с более длинным линкером было даже немного ниже, чем для варианта LR-LO10R с коротким линкером. Нецелевой ("свободный РЕ24") или неправильно нацеленный РЕ24 ("CD33-Fab-PE"; HepG2-клетки не экспрессируют CD33) не показал какого-либо значительного снижения жизнеспособности клеток при концентрациях менее 30 мкМ. Таким образом, более полно деиммунизированный GPC3-нацеленный вариант LR-LO10R-456A-длинный линкер имел такую же или даже чуть более высокую цитотоксическую активность по сравнению с GPC3-нацеленным LR-LO10R-вариантом с коротким линкером. Из-за дополнительной 456А мутации в РЕ все В-клеточные эпитопы были удалены.

Пример 17
[0384] Этот пример показывает цитотоксичность деиммунизированных РЕ-гибридных белков с мутацией A458R.
[0385] Цитотоксичность SS1P, SS1-LR-GGS, SS1-LR-GGS-LO10, SS1-LR-GGS-LO10-A458R и SS1-LR-GGS-LO10-A458-456A измеряли способом WST. Результаты показаны в таблице 27.
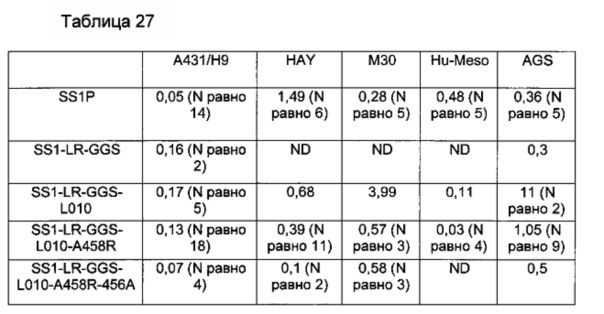
[0386] Как показано в таблице 27, мутация A458R повышает активность SS1-LR-GGS-L010 на нескольких клеточных линиях. Добавление мутации 456А также повышает активность на нескольких клеточных линиях. А431/Н9 представляет собой плоскоклеточный рак, экспрессирующий мезотелин, а Hay представляет собой линию мезотелиомы. М30 также представляет собой клеточную линию мезотелиомы, a AGS представляет собой клеточную линию рака желудка. Hu-Meso представляет собой клетки от пациента с мезотелиомой, которые находились в культуре в течение нескольких месяцев.
Пример 18
[0387] Этот пример демонстрирует лечение опухолей НСС70 с помощью RG7787.
[0388] Самкам голых мышей инокулировали в интрамаммарный жир прокладку с клетками НСС70 в момент времени 0. НСС70 является клеточной линией рака молочной железы. Внутривенное введение RG7787 (2,5 мг/кг внутривенно) или носителя начинали на 6-й день и продолжали через день в течение всего 5 доз (стрелки). Оценивали размер опухоли. Результаты показаны на фиг. 24.
[0389] Как показано на фиг. 24, размер опухоли у мышей, получавших RG7787, был снижен по сравнению с контрольными мышами (получавшими носитель). Начиная с 10-го дня, между двумя группами наблюдается статистически значимая разница, на 14-й день р составляет менее0,00001.
Пример 19
[0390] Этот пример демонстрирует лечение опухолей KLM1 у мышей с помощью комбинации паклитаксела и RG7787.
[0391] Мышам в возрасте четырех недель и четырех дней вводили 4×106 клеток KLM1. KLM1 представляет собой клеточную линию рака поджелудочной железы, которая экспрессирует мезотелин. Через тринадцать дней мышам либо не вводили никакой агент, либо вводили паклитаксел (50 мг/кг), RG7787 (2,5 мг/кг) или комбинацию RG7787 (2,5 мг/кг) и паклитаксела (50 мг/кг). Размер опухоли оценивали в течение периода до 89 дней после введения. Результаты показаны на фиг. 23.
[0392] Как показано на фиг. 23, размер опухоли у мышей, которых лечили комбинацией паклитаксела и RG7787, уменьшался по сравнению с таковым у контрольных (нелеченных) мышей или у мышей, которым вводили только паклитаксел или только RG7787.
Пример 20
[0393] В данном примере показано лечение опухолей НСС70 у мышей с помощью комбинации паклитаксела и RG7787.
[0394] Самкам бестимусных голых мышей инокулировали клетки НСС70 в момент времени 0. Животным вводили носитель, RG7787 с внутрибрюшинным введением носителя, паклитаксел с внутривенным введением носителя или комбинацию паклитаксела и RG7787. Паклитаксел (50 мг/кг) вводили путем внутрибрюшинной инъекции в дни, отмеченные длинными стрелками. RG7787 (2,5 мг/кг) вводили внутривенно в дни, указанные короткими стрелками. Средние объемы опухолей с n равно 5 для мышей, получавших носитель, и n равно 6 для мышей, получавших RG7787, паклитаксел или комбинацию, отмечены. Результаты показаны на фиг. 25.
[0395] Как показано на фиг.25, размер опухоли у мышей, получавших комбинацию паклитаксела и RG7787, уменьшался по сравнению с контрольными мышами (носитель) или с мышами, которым вводили только паклитаксел или только RG7787.
Пример 21
[0396] Этот пример демонстрирует лечение опухолей MKN-28 у мышей с помощью комбинации паклитаксела и R205.
[0397] Бестимусным голым мышам инокулировали клетки MKN-28 в момент времени 0. MKN-28 представляет собой клеточную линию рака желудка, экспрессирующую мезотелин. Животным либо не вводили никакой агент, либо вводили только Roche 205 (R205 или 205), только паклитаксел (таксол) или комбинацию R205 и паклитаксела. Оценивали размер опухоли. Результаты показаны на фиг. 26.
Как показано на фиг.26, размер опухоли у мышей, которых лечили комбинацией паклитаксела и R205, уменьшался по сравнению с таковым у контрольных (нелеченных) мышей или у мышей, которым вводили только паклитаксел или только R205.
Пример 22
[0398] В этом примере показана противоопухолевая активность LMB-T18 in vivo.
Мышам с тяжелым комбинированным иммунодефицитом (severe combined immunodeficient, SCID) имплантировали клетки СА46. Через семь дней, когда объем опухоли превышал 100 мм3, мышам вводили PBS (контроль) или LMB-T18 (5 мг/кг × 4 или 7,5 мг/кг × 3) внутривенно. Мышам, получавшим 5,0 мг/кг, дозу вводили четыре раза, в дни 7, 9, 11 и 16, а группа с более высокой дозой получала 7,5 мг/кг три раза в дни 7, 9 и 11. Заметная регрессия опухолей наблюдалась у всех мышей (фиг.27Е) лишь с небольшой потерей веса (в среднем 6%). 5 из 7 мышей, получавших 5,0 мг/кг, сохранили полную регрессию опухоли на день 33, и 3 из 7 мышей сохранили полную регрессию опухоли в группе 7,5 мг/кг. Для оценки неспецифической токсичности LMB-T18 шести мышам с опухолями внутривенно вводили две дозы по 10 мг/кг QOD. Одна мышь продемонстрировала серьезную потерю веса и была подвергнута эвтаназии.
Пример 23
[0399] Этот пример демонстрирует, что LMB-T18 значительно уменьшил активацию Т-клеток.
[0400] Для того чтобы определить, уменьшает ли LMB-T18 стимуляцию Т-клеток или создает новые Т-клеточные эпитопы за счет мутаций, стимулировали РВМС от доноров с самым высоким ответом (n равно 13) и от пациентов с HCL и мезотелиомой (n равно 7) с помощью MP или LMB-T18. Клетки повторно стимулировали 39 новыми пептидами, представляющими различия между MP и LMB-T18. Наблюдалось снижение на 90% активации донорских Т-клеток (рменее0,0001 в t-тесте Стьюдента). Даже у пациентов с активированными Т-клетками наблюдалось снижение на 83% (рменее0,0001 в t-тесте Стьюдента). Кроме того, никакие новые эпитопы не были созданы за счет мутаций.
Пример 24
[0401] Этот пример демонстрирует, что LMB-T18 уменьшил связывание с антисывороткой от пациентов.
[0402] Антигенность LMB-T18 оценивали путем сравнения реактивности MP, HA22-LR и LMB-T18 в отношении сыворотки от пациентов с нейтрализующими антителами к MP. Связывание измеряли с помощью ICC-ELISA с сывороткой от 13 пациентов, леченных MP, оно показано на фиг. 27F. Было установлено, что как и HA22-LR, LMB-T18 значительно уменьшал связывание с сывороткой по сравнению с MP (рменее0,001 в одностороннем анализе ANOVA). Также было установлено, что LMB-T18 имел значительно более низкое связывание, чем HA22-LR (рменее0,001 в одностороннем анализе ANOVA), что указывает на то, что мутации в LMB-T18 снижают связывание с антисывороткой.
Пример 25
[0403] В этом примере показано получение анти-FAP-PE-вариантных химерных молекул.
[0404] Три анти-FAP-РЕ-вариантных химерных молекулы, содержащие:
(a) линкер, содержащий аминокислотную последовательность SEQ ID NO 36, РЕ, содержащий SEQ ID NO 37 (L010R-456A)), вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 94 (iFAP-PE24-LR-LO10R-456A-длинный линкер)
(b) линкер, содержащий аминокислотную последовательность SEQ ID NO 36, РЕ, содержащий SEQ ID NO 37 ((L010R-456A)), вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 294 (LCL4-PE24-LR-LO10R-456A-длинный-линкер) (в том числе VL-вариант SEQ ID NO 290), и
(c) линкер, содержащий аминокислотную последовательность SEQ ID NO 36, РЕ, содержащий SEQ ID NO 37 (Т-20), вариабельный домен тяжелой цепи VH SEQ ID NO 93 и вариабельный домен легкой цепи SEQ ID NO 290 (LCL4-T20);
были получены способом, аналогичным способу получения РЕ-вариантной химерной молекулы против мезотелина cFP-077, описанному в примере 12 (от клонирования до очистки), за исключением того, что описано ниже.
[0405] Анти-FAP-РЕ-вариантные химерные молекулы (b) и (с) включали модифицированный вариабельный домен легкой цепи (VL), в котором метионин в позиции 4 исходной VL-последовательности SEQ ID NO 94 заменяли лейцином, чтобы получить модифицированную VL-последовательность SEQ ID NO 290 ("LCL4"). Было обнаружено, что модифицированный вариабельный домен легкой цепи SEQ ID NO 290 уменьшает образование примесей, связанных с N-концевыми модификациями. Эти N-концевые модификации дают смесь вариантов с легкими цепями различной длины вследствие инициации экспрессии немодифицированной последовательности либо с N-концевого метионина, либо с метионина в позиции 4 в SEQ ID NO 94.
Предварительное культивирование:
[0406] Для предварительной ферментации использовали ту же среду с химически определенным составом (CD-PCMv2.20), которая описана в примере 12.
[0407] Культивирование проводили на ротационном шейкере в течение 8 часов при температуре 37°C и скорости 170 оборотов в минуту до получения оптической плотности (578 нм) 13,3 или 14,4. 150 мл культуры из предварительного культивирования использовали для инокуляции в партию среды для биореактора объемом 10 л.
Ферментация:
[0408] Для ферментации в ферментере BioStat С, DCU3, объемом 10 л (Sartorius, Мельзунген, Германия) использовали такую же парию среды с определенным химическим составом, которая описана в примере 12.
[0409] Один питательный раствор содержал 700 г/л глюкозы*H2O, 7,4 г/л MgSO4*7H2O и 0,1 г/л FeSO4*7H2O. Все компоненты растворяли в деионизированной воде. Щелочной раствор для регулирования pH представлял собой водный 12,5% (вес/объем) раствор NH3, дополненный 11,25 г/л L-метионина, 10 г/л лейцина и 10 г/л треонина.
[0410] Начиная с 6,24 л стерильной парии среды плюс 150 мл инокулята из предварительного культивирования, периодическую ферментацию проводили при 32°C, pH 6,9±0,2, противодавлении 800 мбар и начальной скорости аэрации 10 л/мин. Относительное значение растворенного кислорода (рО2) в ходе ферментации поддерживали на уровне 50% за счет увеличения скорости мешалки до 1500 оборотов в минуту. После того, как первоначально введенная глюкоза истощалась, что обозначалось резким повышением значений растворенного кислорода, температуру сдвигали на 32°C или 37°C, и через 15 минут ферментацию вводили в режим подпитки с началом введения обоих питательных растворов (60 и 14 г/ч, соответственно). Скорость подачи раствора увеличивали ступенчато с заранее определенным профилем подачи от 90 до 210 или 240 г/ч в течение 5,5 или 6,5 часов. Когда концентрация выделяемого газообразного диоксида углерода устанавливалась выше 2%, скорость аэрации постоянно увеличили с 10 до 20 л/мин в течение 5 часов. Экспрессию рекомбинантного белка индуцировали добавлением 3,6 г IPTG при оптической плотности примерно 40 или 120. Целевой белок экспрессировался в виде телец включения в цитоплазме.
[0411] После 24 часов культивирования была достигнута оптическая плотность 179 или 171, и цельный бульон охлаждали до температуры от 4 до 8°C. Бактерии собирали центрифугированием с помощью проточной центрифуги (4500 оборотов в минуту, 4°C, в течение 1 ч), и полученную биомассу хранили при -20°C до дальнейшей обработки (разрушения клеток).
Анализ образования продукта:
[0412] Специфические различия в сравнении со способом примера 12 описаны ниже:
[0413] Из каждого образца одинаковое количество клеток (ODцелевое равно 10) суспендировали в 5 мл PBS-буфера и разрушали путем обработки ультразвуком на льду. Затем 100 мкл каждой суспензии центрифугировали (8000 оборотов в минуту, 5 минут), и каждый супернатант отбирали и переносили в отдельную пробирку.
[0414] После добавления буфера Laemmli образцы нагревали в течение 45 мин при температуре 40°C в условиях интенсивного смешивания для солюбилизации и восстановления всех белков в образцах.
Подготовка препаратов телец включения:
[0415] Препараты телец включения (IBP) из ферментеров объемом 10 л обрабатывали способом, аналогичным способу, описанному в примере 12, за исключением того, что после разрушения бактериальных клеток добавляли дополнительную бензоазу (30 Ед/г сухой вес) и инкубировали в течение 60 минут при 25°C.
[0416] Солюбилизацию, ренатурацию и очистку проводили способом, аналогичным способу, описанному в примере 12. Были использованы следующие последовательности:
- Последовательность химерной полноразмерной тяжелой цепи iFAP-РЕ24-LR-LO10R-456А-длинный линкер и LCL4-PE24-LR-LO10R-456A-длинный линкер, содержащая вариабельный домен VH SEQ ID NO 93, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, and а РЕ comprising SEQ ID NO 37 (SEQ ID NO 291);
- Последовательность химерной конструкции тяжелой цепи LCL4-T20, содержащая полноразмерную тяжелую цепь, содержащую вариабельный домен VH SEQ ID NO 93, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и PE, содержащий SEQ ID NO 289 (T18/T20) (SEQ ID NO 292);
- Последовательность полноразмерной легкой цепи iFAP (SEQ ID NO 293), содержащая вариабельный домен легкой цепи SEQ ID NO 94 и константную область;
- Последовательность полноразмерной легкой цепи LCL4 (SEQ ID NO 294), содержащая вариабельный домен легкой цепи SEQ ID NO 290 и константную область; и
- Последовательность вариабельного домена легкой цепи SEQ ID NO 290 (с мутацией M4L в позиции 4 (в сравнении с SEQ ID NO 94).
Пример 26
[0417] Этот пример демонстрирует цитотоксичность анти-FAP-PE-вариантных химерных молекул iFAP-PE24-LR-LO10R-456A-длинный линкер, LCL4-PE24-LR-LO10R-456A-длинный линкер и LCL4-T20.
[0418] Цитотоксичность iFAP-PE24-LR-LO10R-456A-длинный линкер сравнивали с таковой у LCL4-PE24-LR-LO10R-456A-длинный линкер и LCL4-T20 ("cFP") в отношении FAP-положительной клеточной линии фибробластов MRC-5, FAP-положительной клеточной линии десмопластической меланомы LOX-IMVI и FAP-положительной клеточной линии саркомы OsA-CL. Вкратце, клетки высевали с плотностью 10000 клеток/лунка в 96-луночные планшеты. После культивирования в течение ночи в среду добавляли различные концентрации cFP и клетки инкубировали в течение 72 часов. В конце периода инкубации определяли жизнеспособность клеток с помощью анализа CELLTITER GLO. Результаты представлены в таблице 28 и таблице 29.
[0419] Как показано в таблице 28, наблюдались сравнимые величины IC50 для ингибирования жизнеспособности клеток на всех трех тестируемых клеточных линиях для iFAP-PE24-LR-LO10R-456A-длинный линкер (3 разных партии) и для LCL4-PE24-LR-LO10R-456A-длинный линкер. Как показано в таблице 29, LCL4-T20 также показала сильное ингибирование жизнеспособности клеток. Таким образом, iFAP-PE24-LR-L010 R-456А-длинный линкер, LCL4-PE24-LR-L010R-456A-длинный линкер и LCL4-T20 показали сильное цитотоксическое воздействие на FAP-положительные опухолевые клеточные линии и фибробласты.
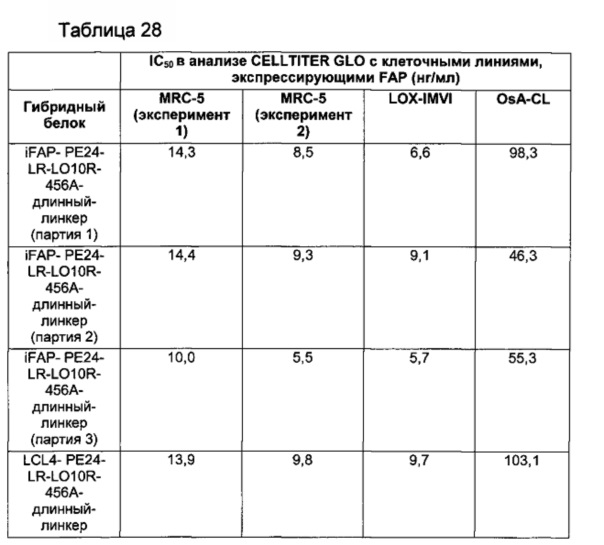

Пример 27
[0420] В этом примере показано получение анти-CAIX-РЕ-вариантных химерных молекул.
[0421] Две анти-CAIX-РЕ-вариантные химерные молекулы, включающие:
(а) линкер, содержащий аминокислотную последовательность SEQ ID NO 36, РЕ, содержащий SEQ ID NO 37 (L010R-456A), вариабельный домен тяжелой цепи VH SEQ ID NO 125 и вариабельный домен легкой цепи SEQ ID NO 126; или
(b) линкер, содержащий аминокислотную последовательность SEQ ID NO 36, РЕ, содержащий SEQ ID NO 289 (Т-20), вариабельный домен тяжелой цепи VH SEQ ID NO 125 и вариабельный домен легкой цепи SEQ ID NO 126;
были получены способом, аналогичным способу, описанному для анти-мезотелин-РЕ-вариантной химерной молекулы cFP-077 из примера 12 (от клонирования до очистки), за исключением того, что описано ниже.
[0422] Образцы анализировали по OD 280 нм с помощью УФ-спектрофотометра для определения концентрации белка в растворе. Материалы для SDS-PAGE и устройство для окрашивания Кумасси приведены в таблице 30 ниже.

[0423] После добавления буфера Laemmli образцы нагревали в течение 45 мин при температуре 40°C в условиях интенсивного смешивания для солюбилизации и восстановления всех белков в образцах.
[0424] Образец доводили буфером до концентрации белка 1 мг/мл. Образец восстанавливали с помощью буфера для восстановления, содержащего 4 мл буфера для образцов (2×) и 1 мл восстанавливающего буфера (10×). Образцы восстанавливали путем разведения пробы 1:1 буфером для восстановления и инкубации образца в течение 10 минут при 70°C.
[0425] Гель-электрофорез проводили при 200 В в течение 40 минут. Гели окрашивали SIMPLY BLUE Safe Stain (Invitrogen, кат. NO LC6065).
Подготовка препаратов телец включения:
[0426] Препараты телец включения (IBP) из ферментеров объемом 10 л обрабатывали способом, аналогичным способу, описанному в примере 12, за исключением того, что после разрушения бактериальных клеток добавляли дополнительную бензоазу (30 Ед/г сухой вес) и инкубировали в течение 60 минут при 25°C.
[0427] Солюбилизацию, ренатурацию и очистку проводили способом, аналогичным способу, описанному в примере 12.
[0428] Были использованы следующие последовательности:
- Последовательность химерной конструкции тяжелой цепи CAIX-PE24-LR-LO10R-456A-длинный линкер (SEQ ID NO 295), содержащая вариабельный домен тяжелой цепи VH SEQ ID NO 125, линкер, содержащий аминокислотную последовательность SEQ ID NO 36, и РЕ, содержащий SEQ ID NO 37;
- Последовательность химерной конструкции тяжелой цепи CAIX-T20 (SEQ ID NO 296), содержащая вариабельный домен тяжелой цепи VH SEQ ID NO 125, линкер, содержащий аминокислотную последовательность SEQ ID NO 36 и РЕ, содержащий SEQ ID NO 289 (Т18/Т20); и
- Последовательность полноразмерной легкой цепи (SEQ ID NO 297), содержащая вариабельный домен легкой цепи SEQ ID NO 126) и константную область.
Пример 28
[0429] Этот пример демонстрирует цитотоксичность (уничтожение опухолевых клеток in vitro) анти-CAIX-РЕ-вариантных химерных молекул CAIX-PE24-LR-LO10R-456А-длинный линкер и CAIX-T20.
[0430] Цитотоксичность CAIX-PE24-LR-LO10R-456A-длинный линкер и CAIX-Т20 ("cFP") сравнивали в анализах клеточной жизнеспособности с помощью CAIX-экспрессирующих клеток RCC-MF. Вкратце, клетки высевали с плотностью 7500 клеток/лунка в 96-луночные планшеты. После культивирования в течение ночи в среду добавляли различные концентрации cFP и клетки инкубировали в течение 72 часов. В конце периода инкубации определяли жизнеспособность клеток с помощью анализа CELLTITER GLO. Результаты представлены в таблице 31.
[0431] Таким образом, CAIX-PE24-LR-LO10R-456A-длинный линкер и CAIX-Т20 показали мощное цитотоксическое воздействие на CAIX-положительные опухолевые клеточные линии.

[0432] Все ссылки, включая публикации, патентные заявки и патенты, процитированные в данном документе, включены в него посредством ссылки в той же степени, как если бы про каждую ссылку было отдельно и конкретно указано, что она включена в данный документ посредством ссылки и изложена в полном объеме.
[0433] Использование терминов в единственном числе и выражения "по меньшей мере один" и подобных ссылок в контексте описания изобретения (особенно в контексте следующей ниже формулы изобретения) должно толковаться как охватывающее как единственное, так и множественное число, если иное не указано в данном документе, или если это явно не противоречит контексту. Использование термина "по меньшей мере один" с последующим списком из одного или более чем одного элемента (например, "по меньшей мере один из А и В") должно быть истолковано как один элемент, выбранный из перечисленных элементов (А или В) или любая комбинация двух или более из перечисленных элементов (А или В), если иное не указано в данном документе, или если это явно не противоречит контексту. Термины "содержащий", "имеющий" и "включающий" должны быть истолкованы как открытые термины (т.е. означающие "включающий, но не ограничиваясь этим"), если не указано иное. Указание диапазонов значений в данном документе предназначено только для использования в качестве быстрого способа указать индивидуально на каждое отдельное значение, попадающее в диапазон, если в данном документе не указано иное, и каждое отдельное значение включено в описание, как если бы оно было индивидуально указано в данном документе. Все описанные в данном документе способы могут быть выполнены в любом подходящем порядке, если в данном документе не указано иное, или если это явно не противоречит контексту. Использование любого и всех примеров или выражений (например, "такой как") в данном документе предназначено только для лучшего освещения изобретения и не накладывает ограничений на объем изобретения, если не заявлено иное. Ни одно из выражений в описании не должно быть истолковано как указание на какой-либо не заявленный элемент как существенный для осуществления данного изобретения.
[0434] В данном документе описаны предпочтительные воплощения согласно данному изобретению, в том числе лучший способ осуществления изобретения, известный авторам данного изобретения. Вариации этих предпочтительных воплощений могут стать очевидны специалистам в данной области после прочтения приведенного выше описания. Авторы данного изобретения ожидают, что квалифицированные специалисты будут использовать такие вариации в зависимости от обстоятельств, и авторы данного изобретения подразумевают, что данное изобретение может быть осуществлено на практике другим путем, отличающимся от конкретно описанного в данном документе. Соответственно, данное изобретение включает все модификации и эквиваленты объекта изобретения, изложенного в формуле изобретения, прилагаемой к данному документу, в соответствии с действующим законодательством. Кроме того, любая комбинация описанных выше элементов во всех возможных вариантах охватывается изобретением, если иное не указано в данном документе, или если это явно не противоречит контексту.
Реферат
Изобретение относится к биотехнологии, конкретно к получению модифицированных экзотоксинов Pseudomonas, и может быть использовано в медицине для противоопухолевой терапии. Получен экзотоксин A Pseudomonas (РЕ), в котором аминокислотный остаток R456 замещен на аланин, один или в сочетании с F443, замещенным на аланин, L477, замещенным на гистидин, R494, замещенным на аланин, и/или L552, замещенным на глутаминовую кислоту или аспарагин. На основе модифицированного РЕ получены химерные молекулы, содержащие нацеливающий на раковую клетку-мишень агент, слитый с РЕ или конъюгированный с РЕ. Изобретение обеспечивает получение экзотоксина A Pseudomonas с уменьшенной иммуногенностью при сохранении цитотоксичности. 17 н. и 25 з.п. ф-лы, 27 ил., 31 табл., 28 пр.

Комментарии