Способ получения макролидного соединения и штаммыstreptomyces sp., mortierella sp. и micromonosporaceae - RU2330069C2
Код документа: RU2330069C2
Описание
Данное изобретение относится к способу получения 12-членного циклического макролидного соединения 11107D, обладающего противоопухолевой активностью, биологическим превращением и к новому штамму, используемому для этого получения.
12-членное циклическое макролидное соединение 11107D является 12-членным циклическим соединением, имеющим превосходную противоопухолевую активность, которое обнаружено вместе с веществом 11107В в культуральном продукте штамма Streptomyces sp. Mer-11107 (см. WO-А02/060890). Вещество 11107D соответствует веществу 11107В, имеющему гидроксильную группу в положении 16. Продуктивность вещества 11107D является худшей, чем продуктивность вещества 11107В, и, следовательно, является желательным развитие эффективного способа его получения.
Целью данного изобретения является обеспечение нового способа получения макролидного соединения 11107D с использованием макролидного соединения 11107В в качестве исходного материала посредством биологического способа превращения.
Авторы данного изобретения провели испытание для отбора микроорганизмов, способных к превращению атома водорода положения 16 в гидроксильную группу макролидного соединения 11107В, посредством скрининга из широкого диапазона групп микроорганизмов для решения вышеуказанной проблемы и в результате обнаружили, что штамм, принадлежащий к роду Mortierella, классифицированный как относящийся к нитевидным грибам, штамм, принадлежащий к роду Streptomyces, классифицированный как относящийся к актиномицетам, и штамм, принадлежащий к семейству Micromonosporaceae, также классифицированный как относящийся к актиномицетам, имеют вышеупомянутую функцию превращения для выполнения данного изобретения.
Таким образом, данное изобретение относится к следующим пунктам (1)-(3).
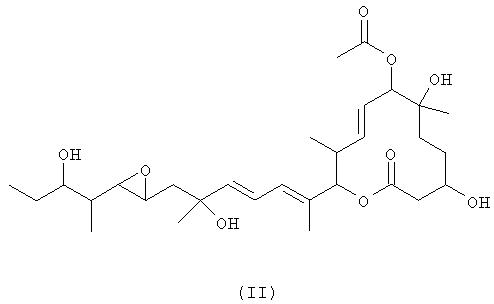
(1) Способ получения макролидного соединения 11107D, представленного формулой (II):
http://www.ddbj.nig.ac.jp/http://www.ddbj.nig.ac.jp/http://www.ddbj.nig.ac.jp/

где макролидное соединение 11107D получают из макролидного соединения 11107В, представленного формулой (I):

способом биологического превращения, который предусматривает следующие процессы (А) и (В):
(А) процесс инкубирования макролидного соединения 11107В, представленного формулой (I), в присутствии штамма, имеющего способность проведения вышеупомянутого биологического превращения и принадлежащего к роду Mortierella, роду Streptomyces или семейству Micromonosporaceae, или получения его культивируемого мицелия; и
(В) процесс сбора макролидного соединения 11107D, представленного формулой (II), из инкубируемого раствора, полученного в стадии (А).
(2) Способ получения по вышеуказанному (1), где штаммом, принадлежащим к роду Mortierella, является штамм Mortierella sp. F-1529 (FERM BP-8547) или штамм F-1530 (FERM BP-8548).
(3) Способ получения по вышеуказанному (1), где штаммом, принадлежащим к роду Streptomyces, является штамм Streptomyces sp. AB-1704 (FERM BP-8551), штамм А-1544 (FERM BP-8446) или штамм А-1545 (FERM BP-8447).
(4) Способ получения по вышеуказанному (1), где штаммом, принадлежащим к семейству Micromonosporaceae, является штамм АВ-1896 (FERM BP-8550).
(5) Штамм Streptomyces sp. AB-1704 (FERM BP-8551), имеющий способность превращения макролидного соединения 11107В, представленного формулой (I), в макролидное соединение 11107D, представленное формулой (II).
(6) Штамм Mortierella sp. F-1529 (FERM BP-8547) или штамм F-1530 (FERM BP-8548), имеющий способность превращения макролидного соединения 11107В, представленного формулой (I), в макролидное соединение 11107D, представленное формулой (II).
(7) Штамм АВ-1896 (FERM BP-8550), имеющий способность превращения макролидного соединения 11107В, представленного формулой (I), в макролидное соединение 11107D, представленное формулой (II).
Подробное описание изобретения
В способе биологического превращения данного изобретения любой микроорганизм, принадлежащий к роду Mortierella, роду Strepromyces или семейству Micromonosporaceae, может быть использован независимо от типа вида или штамма, пока он имеет способность превращать макролидное соединение 11107В, представленное приведенной выше формулой (I), в макролидное соединение 11107D, представленное приведенной выше формулой (II). Однако предпочтительные примеры этого микроорганизма могут включать в себя штамм Mortierella sp. F-1529 и штамм F-1530, принадлежащие к роду Mortierella, штамм Streptomyces sp. АВ-1704, штамм А-1544 и штамм А-1545, принадлежащие к роду Streptomyces, и штамм АВ-1896, принадлежащий к семейству Micromonosporaceae, каждый из которых был выделен из почвы.
Штамм Mer-11107 был депонирован как FERM P-18144 в National Institute of Bioscience and Human-Technology Agency of Industrial Science and Technology (1-3, Higadhi 1-chome Tsukuba-shi, Ibaraki-ken 305-8566 Japan) 19 декабря 2000 года и затем преобразован как депонент FERM BP-7812 в международном депозитарии для целей патентования (International Patent Organism Depositary (IPOD) National Institute of Advanced Industrial Science and Technology (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken 305-8566 Japan)) 27 ноября 2001 года.
Штамм Mortierella sp. F-1529 был депонирован на международном уровне в International Patent Organism Depositary National Institute of Advanced Industrial Science and Technology (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken 305-8566 Japan) 12 ноября 2003 года как FERM BP-8547. Штамм Mortierella sp. F-1530 был также депонирован на международном уровне в International Patent Organism Depositary National Institute of Advanced Industrial Science and Technology (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken 305-8566 Japan) 12 ноября 2003 года как FERM BP-8548.
Штамм Streptomyces sp. AB-1704 был депонирован в International Patent Organism Depositary National Institute of Advanced Industrial Science and Technology (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken 305-8566 Japan) как FERM P-18999 5 сентября 2002 года и затем перенесен в International Deposit FERM BP-8551 12 ноября 2003 года в International Patent Organism Depositary (IPOD) National Institute of Advanced Industrial Science and Technology (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken 305-8566 Japan). Штамм А-1544 и штамм А-1545 были также депонированы в International Patent Organism Depositary (IPOD) National Institute of Advanced Industrial Science and Technology (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken 305-8566 Japan) как FERM P-18943 и FERM P18944 23 июля 2002 года и затем перенесены в International Deposit FERM BP-8446 и FERM BP-8447 30 июля 2003 года, соответственно, в International Patent Organism Depositary (IPOD) National Institute of Advanced Industrial Science and Technology (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken 305-8566 Japan).
Штамм АВ-1896, принадлежащий к семейству Micromonosporaceae, был депонирован на международном уровне в International Patent Organism Depositary National Institute of Advanced Industrial Science and Technology (Tsukuba Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken 305-8566 Japan) как FERM-ВР 8550 12 ноября 2003 года.
Таксономические свойства вышеуказанных штаммов являются следующими.
(Таксономические свойства штамма F-1529)
(1) Морфологические характеристики
На каждой чашке с агаром на отваре из овсяной муки (далее называемым ОА в зависимости от обстоятельств), солодовым агаром (2% экстракта солода + 1,5% агар: далее называемым МЕА в зависимости от обстоятельств) и картофельным агаром с декстрозой (далее называемым PDA в зависимости от обстоятельств) эта колония имела хлопьевидноопушенную форму и цвет гиф был белым, проявляющим белый оттенок (1А-1). Что касается роста, когда этот штамм культивировали при 25°С в течение одной недели, эти колонии достигали 75 мм в диаметре на ОА-чашке, 75-80 мм в диаметре на МЕА-чашке и 75-80 мм в диаметре на PDA-чашке. Колонии имели окаймленную форму. Не наблюдали ни окрашивания задней стороны, ни образования растворимого пигмента. Цветовой тон был описан в соответствии с "Methuen Handbook of Colour (Kornerup & Wanscher, 1978)".
В результате наблюдения под оптическим микроскопом вегетативные гифы были бесцветными, имели гладкую поверхность, не имели перегородок и имели ширину 4-5 мкм. Набухшую структуру, подобную структуре споры с толстой стенкой, имеющую сферическую форму и размер приблизительно 26,5-33 мкм, наблюдали в части гиф. В культуральной среде для подвергания этому тесту, любая структура, которая казалась бы половым органом, не образовывалась даже при культивировании в течение срока, не превышающего 3 недель.
(2) Анализ гена рРНК 18S
Мицелии штамма F-1529, культивируемые на чашке с агаром, подвергали экстракции ДНК с использованием набора Fast Prep FP120 (изготовляемого Q-Bio gene) и набора Fast DNA (изготовляемого Q-Bio gene). ПЦР проводили с использованием гранул puRetaq Ready-To-Go (изготовляемых Amersham Biosciences) и ПЦР-праймеров NS1 и NS8, показанных в таблицах 1 и 2. ПЦР-продукты очищали с использованием набора QIAquick PCR Purification Kit (изготовляемого QIAGEN) и затем обрабатывали с использованием набора ABI Prism BigDye Terminator Kit (изготовляемого Applied Biosystems). В качестве секвенирующих праймеров использовали NS1, NS2, NS3, NS4, NS5, NS6, NS7 и NS8, показанные в таблицах 1 и 2. Продукты реакции очищали с использованием набора Dye EX 2.0 Spin Kit (изготовляемого QIAGEN) и подвергали анализу секвенирования с использованием анализатора ABI PRISM 3100 Genetic Analyzer (изготовляемого Applied Biosystems). Затем секвенированные фрагменты объединяли вместе с использованием Auto Assembler (изготовляемого Applied Biosystems) для получения полноразмерной нуклеотидной последовательности.
Полученный таким образом ген РНК 18S этого штамма имеет нуклеотидную последовательность, описанную в Последовательности № 9 (SEQ ID NO:9).
ДНК-последовательность известного штамма получали из Базы данных ДНК Японии (http://www.ddbj.nig.ac.jp./) для испытания гомологии генов рРНК 18S. В результате, этот ген рРНК 18S имел 99% (803 основания против хода транскрипции) гомологию с геном рРНК 18s Mortierella hyalina (GenBank, номер доступа AY157493), 98% (полноразмерная последовательность) гомологию с геном рРНК 18S Mortierella chlamydospora (GenBank, номер доступа AF157143) и 98% (полноразмерная последовательность) гомологию с геном рРНК 18S Mortierella multidivaricata (GenBank, номер доступа AF157144).
Из приведенных выше микологических свойств авторы данного изобретения определили, что этот штамм принадлежит к роду Mortierella.
Таксономические свойства штамма F-1530
(1) Морфологические характеристики
На каждой чашке с агаром на отваре из овсяной муки, солодовым агаром и картофельным агаром с декстрозой эта колония имела хлопковую (пушистую) форму и цвет гиф был белым, проявляющим белый оттенок (1А-1). Что касается роста, когда этот штамм культивировали при 25°С в течение одной недели, колонии этого штамма достигали 80-85 мм в диаметре на ОА-чашке, 85 мм в диаметре на МЕА-чашке и 85 мм в диаметре на PDA-чашке. Колонии имели окаймленную форму. Не наблюдали ни окрашивания задней стороны, ни образования растворимого пигмента. Цветовой тон был описан в соответствии с "Methuen Handbook of Colour (Kornerup & Wanscher, 1978)".
В результате наблюдения под оптическим микроскопом вегетативные гифы были бесцветными, имели гладкую поверхность, не имели перегородок и имели ширину 2,5-5 мкм. Набухшую структуру, подобную структуре споры с толстой стенкой, имеющую сферическую форму и размер приблизительно 10 мкм, наблюдали в части гиф. В культуральной среде для подвергания этому тесту любая структура, которая казалась бы половым органом, не образовывалась даже при культивировании в течение срока, не превышающего 3 недель.
(2) Анализ гена рРНК 18S
Ген рРНК 18S F-1530 анализировали таким же образом, каким и в случае штамма F1529.
Полученный таким образом ген рРНК 18S штамма F-1530 имел нуклеотидную последовательность, описанную в Последовательности № 10 (SEQ ID NO:10).
ДНК-последовательность известного штамма получали из Базы данных ДНК Японии (http://www.ddbj.nig.ac.jp./) для испытания гомологии генов рРНК 18S. В результате, этот ген рРНК 18S имел 100% (803 основания против хода транскрипции) гомологию с геном рРНК 18s Mortierella hyalina (GenBank, номер доступа AY157493), 98% (полноразмерная последовательность) гомологию с геном рРНК 18S Mortierella chlamydospora (GenBank, номер доступа AF157143) и 98% (полноразмерная последовательность) гомологию с геном рРНК 18S Mortierella multidivaricata (GenBank, номер доступа AF157144).
Из приведенных выше микробных характеристик авторы данного изобретения определили, что этот штамм принадлежит к роду Mortierella.
(Таксономические свойства штамма АВ-1704)
(1) Морфологические характеристики
В этом штамме из вегетативных гиф простирались воздушные гифы типа расположенных правильными вертикальными рядами пластичных гиф. На конце этих зрелых воздушных гиф образовывались цепи спор. Размер этих спор был приблизительно 0,6-0,8 х 1,0 - 1,1 мкм, поверхность спор была гладкой и специальных органов, таких как спорангий, склероций и жгутик, не наблюдали.
(2) Культуральные характеристики на различных средах
Культуральные характеристики этого штамма после инкубирования при 28°С в течение двух недель на различных средах показаны в таблице 3. Цветовой тон описан с использованием названий и кодов цвета, которые показаны в скобках Tresner's Color wheels.
(3) Использование различных источников углерода
Различные источники углерода добавляли к агару Pridham-Gottlieb и культивировали при 28°С в течение 2 недель. Рост этого штамма показан в таблице 4.
(+: положительный, ±: слабо положительный; -: отрицательный)
(4) Различные физиологические свойства
Различные физиологические свойства данного штамма являются следующими.
(а) Диапазон температур роста (дрожжевой экстракт-солодовый агар, инкубирование в течение 2 недель) 5°С-33°С
(b) Диапазон оптимальной температуры роста (дрожжевой экстракт-солодовый агар, инкубирование в течение 2 недель) 15°С-33°С
(с) Разжижение желатина (глюкозопептонная среда с желатином) положительное
(d) Свертывание молока (среда с обезжиренным молоком) положительное
(e) Пептонизация молока (среда с обезжиренным молоком) положительная
(f) Гидролиз крахмала (неорганические соли-крахмалсодержащий агар) положительный
(g) Образование меланоидного пигмента (пептон-дрожжевой экстракт-железосодержащий агар) отрицательное
(h) Продуцирование гидросульфида (пептон-дрожжевой экстракт-железосодержащий агар) отрицательное
(i) Восстановление нитрата (бульон, содержащий 0,1% нитрат калия) положительное
(j) Устойчивость к хлориду натрия (дрожжевой экстракт-солодовый агар, инкубирование в течение 2 недель) - растет при содержании соли 7% или менее
(5) Хемотаксономия
LL-диаминопимелиновая кислота детектировалась из клеточной стенки данного штамма.
Из вышеупомянутых микробных характеристик авторы данного изобретения определили, что данный штамм принадлежит к роду Streptomyces.
(Таксономические свойства штамма А-1544)
(1) Морфологические характеристики
Воздушные гифы спирального типа простирались из вегетативных гиф в этом штамме. Цепи спор, состоящие из приблизительно 10-20 цилиндрических спор, образовывались на конце зрелых воздушных гиф. Размер этих спор был приблизительно 1,0×1,2-1,4 мкм, поверхность спор была колючей, и специфические органы, такие как спорангий, склероций и жгутик, не наблюдали.
(2) Культуральные характеристики на различных средах
Культуральные характеристики этого штамма после инкубирования при 28°С в течение двух недель на различных средах показаны в таблице 5. Цветовой тон описан с использованием названий и кодов цвета, которые показаны в скобках Tresner's Color wheels.
(3) Использование различных источников углерода
Различные источники углерода добавляли к агару Pridham-Gottlieb и культивировали при 28°С в течение 2 недель. Рост этого штамма показан в таблице 6.
(+: положительный, -: отрицательный)
(4) Различные физиологические свойства
Различные физиологические свойства данного штамма являются следующими.
(а) Диапазон температур роста (дрожжевой экстракт-солодовый агар, инкубирование в течение 2 недель) 15°С-41°С
(b) Диапазон оптимальной температуры роста (дрожжевой экстракт-солодовый агар, инкубирование в течение 2 недель) 20°С-37°С
(с) Разжижение желатина (глюкозопептонная среда с желатином) положительное
(d) Свертывание молока (среда с обезжиренным молоком) положительное
(e) Пептонизация молока (среда с обезжиренным молоком) положительная
(f) Гидролиз крахмала (неорганические соли-крахмалсодержащий агар) положительный
(g) Образование меланоидного пигмента (пептон-дрожжевой экстракт-железосодержащий агар) положительное, (тирозин-агар) отрицательное
(h) Продуцирование гидросульфида (пептон-дрожжевой экстракт-железосодержащий агар) положительное
(i) Восстановление нитрата (бульон, содержащий 0,1% нитрат калия) отрицательное
(j) Устойчивость к хлориду натрия (дрожжевой экстракт-солодовый агар, инкубирование в течение 2 недель) - растет при содержании соли 7% или менее
(5) Хемотаксономия
LL-диаминопимелиновая кислота детектировалась из клеточной стенки данного штамма.
Из вышеупомянутых микробных характеристик авторы данного изобретения определили, что данный штамм принадлежит к роду Streptomyces.
(Таксономические свойства штамма А-1545)
(1) Морфологические характеристики
В этом штамме из вегетативных гиф простирались воздушные гифы типа расположенных правильными вертикальными рядами пластичных гиф. На конце этих зрелых воздушных гиф образовывались цепи спор из приблизительно 50 спор. Размер этих спор был приблизительно 0,8×1,0 мкм, поверхность спор была гладкой, и специфических органов, таких как спорангий, склероций и жгутик, не наблюдали.
(2) Культуральные характеристики на различных средах
Культуральные характеристики этого штамма после инкубирования при 28°С в течение двух недель на различных средах показаны в таблице 7. Цветовой тон описан с использованием названий и кодов цвета, которые показаны в скобках Tresner's Color wheels.
(3) Использование различных источников углерода
Различные источники углерода добавляли к агару Pridham-Gottlieb и культивировали при 28°С в течение 2 недель. Рост этого штамма показан в таблице 8.
(+: положительный, ±: слабо положительный; -: отрицательный)
(4) Различные физиологические свойства
Различные физиологические свойства данного штамма являются следующими.
(а) Диапазон температур роста (дрожжевой экстракт-солодовый агар, инкубирование в течение 2 недель) 10°С-37°С
(b) Диапазон оптимальной температуры роста (дрожжевой экстракт-солодовый агар, инкубирование в течение 2 недель) 20°С-33°С
(с) Разжижение желатина (глюкозопептонная среда с желатином) отрицательное
(d) Свертывание молока (среда с обезжиренным молоком) положительное
(e) Пептонизация молока (среда с обезжиренным молоком) положительная
(f) Гидролиз крахмала (неорганические соли-крахмалсодержащий агар) положительный
(g) Образование меланоидного пигмента (пептон-дрожжевой экстракт-железосодержащий агар) отрицательное (тирозинсодержащий агар) отрицательное
(h) Продуцирование гидросульфида (пептон-дрожжевой экстракт-железосодержащий агар) положительное
(i) Восстановление нитрата (бульон, содержащий 0,1% нитрат калия) отрицательное
(j) Устойчивость к хлориду натрия (дрожжевой экстракт-солодовый агар, инкубирование в течение 2 недель) - растет при содержании соли 7% или менее
(5) Хемотаксономия
LL-диаминопимелиновая кислота детектировалась из клеточной стенки данного штамма.
Из вышеупомянутых микробных характеристик авторы данного изобретения определили, что данный штамм принадлежит к роду Streptomyces.
(Таксономические свойства штамма АВ-1896)
(1) Морфологические характеристики
Штамм АВ-1896 обнаруживал хороший или умеренный рост на культуральных средах, использованных для идентификации этого штамма, при 28°С в течение 7-14 дней. Гифы (воздушные) не наблюдали во время культивирования и на каждой из вегетативных гиф наблюдали одну спору. Специфические органы, такие как спорангий, склероций и жгутик, не наблюдали.
(2) Культуральные характеристики на различных средах
Культуральные характеристики этого штамма после инкубирования при 28°С в течение двух недель на различных средах показаны в таблице 9. Цветовой тон описан с использованием названий и кодов цвета, которые показаны в скобках Tresner's Color wheels.
(3) Использование различных источников углерода
Различные источники углерода добавляли к агару Pridham-Gottlieb и культивировали при 28°С в течение 2 недель. Рост этого штамма показан в таблице 10.
(+: положительный, -: отрицательный)
(4) Различные физиологические свойства
Различные физиологические свойства данного штамма являются следующими.
(а) Диапазон температур роста (дрожжевой экстракт-солодовый агар, инкубирование в течение 2 недель) 20°С-41°С
(b) Диапазон оптимальной температуры роста (дрожжевой экстракт-солодовый агар, инкубирование в течение 2 недель) 25° С-37°С
(с) Разжижение желатина (глюкозопептонная среда с желатином) отрицательное
(d) Свертывание молока (среда с обезжиренным молоком) отрицательное
(e) Пептонизация молока (среда с обезжиренным молоком) положительная
(f) Гидролиз крахмала (неорганические соли-крахмалсодержащий агар) положительный
(g) Образование меланоидного пигмента (пептон-дрожжевой экстракт-железосодержащий агар) отрицательное (тирозинсодержащий агар) отрицательное
(h) Продуцирование гидросульфида (пептон-дрожжевой экстракт-железосодержащий агар) отрицательное
(i) Восстановление нитрата (бульон, содержащий 0,1% нитрат калия) положительное
(j) Устойчивость к хлориду натрия (дрожжевой экстракт-солодовый агар, инкубирование в течение 2 недель) - растет при содержании соли 4%
(5) Хемотаксономия
Диаминопимелиновая кислота мезотипа детектировалась из клеточной стенки штамма АВ-1896. В качестве основных структурных сахаров целого мицелия детектировали ксилозу и маннозу. Типом ацила в пептидогликане клеточной стенки был тип гликолила. В качестве главных менахиноновых компонентов детектировали МК-9 (Н4), МК-9 (Н6), МК-10 (Н4) и МК-10 (Н6).
(6) Анализ гена рРНК 16S
Культуральный бульон штамма АВ-1896 собирали и затем подвергали экстракции ДНК с использованием набора Fast DNA (изготовляемого Q-Bio gene). ПЦР проводили в условиях реакции 96°С/20 секунд, 50°С/20 секунд и 72°С/одна минута в 30 циклах в целом. В качестве праймеров использовали 9F (5'-GTGTTTGATCCTGGCTCAG-3') (последовательность № 11) и 536R (5'-GTATTACCGCGGCTGCTG-3') (последовательность № 12). ПЦР-продукт очищали с использованием набора MinElute PCR Purification Kit (изготовляемого QIAGEN) для получения пробы для секвенирования.
Секвенирование проводили с использованием анализатора ABI PRISM 310 Genetic Analyzer (изготовляемого Applied Biosystems) и набора BigDye Terminator Kit в соответствии с их стандартными протоколами. В качестве праймеров использовали 9F и 536R.
Полученная таким образом нуклеотидная последовательность приблизительно из 500 нуклеотидов на 5'-концевой стороне гена рРНК 16S данного штамма описана в последовательности № 13.
ДНК-последовательности известных штаммов получали из Базы данных ДНК Японии (http://www.ddbj.nig.ac.jp./) для испытания гомологии 400-500 оснований на 5'-концевой стороне генов рРНК 16S. В результате, этот ген рРНК 16S имел 98% гомологию с геном рРНК 16s Micromonospora sp. DSM44396 (GenBank, номер доступа AJ560637), 98% гомологию с геном Micromonospora purpureochromogenes (GenBank, номер доступа Х92611) и 95% гомологию с геном M. Chalcea IFO12135 (GenBank, номер доступа D85489), который является разновидностью штамма рода Micromonospora и 95% гомологию с геном Verrucosispora gifhornensis (GenBank, номер доступа Y15523), который является разновидностью штамма рода Verrucosispora.
Хотя штамм АВ-1896 имел почти одинаковые характеристики с характеристиками рода Micromonospora, он не соответствовал точно роду Micromonospora в том смысле, что арабиноза не была детектируемой, а маннозу детектировали в качестве главного структурного сахара всего мицелия. Штамм АВ-1896 также не соответствовал точно роду Verrucosispora в том смысле, что споры, специфические в Verrucosispora gifhornensis, не наблюдали на среде, используемой для идентификации этого штамма. Авторы данного изобретения решили, что штамм АВ-1896 является актиномицетом, принадлежащим к Micromonosporaceae, с учетом приведенных выше таксономических свойств.
В соответствии с данным изобретением сначала в процессе (А) макролидное соединение 11107В, которое является исходным материалом (субстратом), инкубируют в присутствии вышеописанных штаммов или продуктов, полученных с использованием их культивируемого мицелия, и дополнительно в присутствии кислорода. Эта обработка может проводиться добавлением этого субстрата в культуральный бульон при культивировании вышеуказанных штаммов в аэробных условиях или, в зависимости от обстоятельств, добавлением этого субстрата фактически в суспензионный раствор культивируемого мицелия вышеуказанных штаммов или продукта, полученного гомогенизацией этих клеток, с пропускаемым газом, содержащим кислород, например воздухом.
Этот субстрат может быть добавлен к культуральному бульону перед культивированием после прохождения фиксированного времени после начала культивирования. Описанные выше мицелии могут быть получены инокуляцией любого из вышеупомянутых штаммов в среду, содержащую питательные вещества, и культивированием в аэробных условиях. Культивирование этого штамма для получения препаратов мицелия или культивирование этого штамма, которое проводят в ситуации, когда субстрат является добавленным, может проводиться в соответствии с фундаментальным способом культивирования обычных микроорганизмов. Однако обычно это культивирование проводят предпочтительно в аэробных условиях с использованием например, культуры во встряхиваемых колбах и тэнк-культуры в соответствии с культурой в жидкой среде.
В качестве среды, используемой для культивирования, может быть использована любая среда при условии, что она содержит питательные вещества, которые микроорганизмы, принадлежащие к роду Mortierella, роду Streptomyces или семейству Micromonosporaceae, могут использовать, и могут быть использованы различные синтетические среды, полусинтетические среды и природные среды. Что касается состава среды, могут быть использованы различные источники углерода, такие как глюкоза, галактоза, сахароза, мальтоза, фруктоза, глицерин, декстрин, крахмал, мелассы и соевое масло, либо независимо, либо в комбинации.
Что касается источника азота, могут быть использованы единственный источник азота или комбинация органических источников азота, например фармацевтические среды, пептон, мясной экстракт, соевая мука, рыбная мука, мука из клейковины, казеин, сухие дрожжи, аминокислота, дрожжевой экстракт, NZ-казеин и мочевина, и неорганические источники азота, такие как нитрат натрия и сульфат аммония. Кроме того, могут быть добавлены и использованы, например, соли, такие как хлорид натрия, хлорид калия, карбонат кальция, сульфат магния, фосфат натрия, фосфат калия, сульфат меди, сульфат железа, хлорид марганца или хлорид кобальта; соли тяжелых металлов; витамины, такие как витамин В или биотин; и агенты включения, такие как циклодекстрины, если необходимо. Далее, при заметном пенообразовании во время культивирования в среду могут добавляться подходящим образом противовспенивающие агенты по мере необходимости. При добавлении противовспенивающего агента его следует добавлять в концентрации, не оказывающей вредного влияния на получение целевого вещества.
Условия культивирования могут быть подходящим образом выбраны в пределах, в которых конкретный микробный штамм растет хорошо и может продуцировать вышеупомянутое вещество. Например, рН среды равен приблизительно 5-9 и предпочтительно близок к нейтральному рН. Температуру ферментации обычно поддерживают при 20-40°С и предпочтительно 24-30°С. Период ферментации равен приблизительно 1-8 дней и обычно приблизительно 2-5 дней. Вышеупомянутые условия ферментации могут подходящим образом изменяться в зависимости от типа и свойств используемого микроорганизма, внешних условий и т.п., и нет необходимости говорить о том, что могут быть выбраны оптимальные условия.
Препарат культурального мицелия получают также суспендированием мицелия, отделенного центрифугированием или фильтрованием или гомогенизированного в подходящем растворе, после завершения культивирования. Примеры раствора, используемого для суспендирования мицелия, включают в себя вышеуказанные среду или буферные растворы, такие как трис-уксусная кислота, трис-хлористоводородная кислота, сукцинат натрия, цитрат натрия, фосфат натрия и фосфат калия, либо независимо, либо в комбинациях. рН буферного раствора равен 5,0-9,0 и предпочтительно 6,0-7,5.
Вещество 11107В в качестве субстрата может быть добавлено в культуральный бульон или суспензионный раствор мицелия либо в виде порошка как такового, или в виде раствора, растворенного в водорастворимом растворителе, например этаноле, метаноле, ацетоне или диметилсульфоксиде. Количество добавляемого вещества 11107В равно предпочтительно 50-5000 мг на 1 л культурального бульона в случае культурального бульона. После добавления субстрата проводят такие процедуры, как встряхивание колб или культивирование в тэнк-культуре при 20-40°С в течение приблизительно 1-5 дней для проведения реакции в аэробных условиях, посредством чего вещество 11107В в качестве субстрата превращается в вещество 11107D.
Затем в процессе (В) целевое вещество 11107D извлекают из инкубируемого раствора, полученного в процессе (А). Выбирают подходящие способы из разнообразных известных способов очистки, которые обычно используют для выделения метаболитов микроорганизмов, и используют их для выделения вещества 11107D из реакционной смеси в процессе (А). Например, экстракция органическим растворителем, таким как метанол, этанол, бутанол, ацетон, этилацетат, бутилацетат, хлороформ или толуол; различные типы ионообменной хроматографии; гель-фильтрационная хроматография с использованием Сефадекса LH-20; обработка адсорбции и десорбции абсорбционной хроматографией с использованием гидрофобной адсорбирующей смолы, такой как Diaion HP-20, активный углерод или силикагель, или тонкослойная хроматография; или высокоэффективная жидкостная хроматография с использованием колонки с обращенной фазой и т.д., могут быть использованы независимо или в комбинации или использованы повторяемо, посредством чего может быть выделено и очищено вещество 11107D.
Примеры
Данное изобретение будет объясняться более подробно с использованием примеров, которые не предназначены для ограничения объема данного изобретения. В следующих примерах все обозначения % являются масс. процентами (масс.%), если нет других указаний.
Ссылочный пример 1. Получение вещества 11107В в качестве исходного материала
Одну петлю культуры на скошенном агаре (среда ISP-2) штамма Streptomyces sp. Mer-11107 (FERM BP-7812) инокулировали в колбу Эрленмейера на 500 мл, содержащую 50 мл посевной среды (2,0% глюкоза, 1,0% соевая мука (ESUSAN-MEAT, изготовляемая Ajinomoto Co. Ltd.), 0,5% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.), 0,25% хлорид натрия, 0,32% карбонат кальция, рН 6,8 перед стерилизацией), и культивировали при 28°С в течение двух дней с получением первого посевного культурального бульона. 0,1 мл этого культурального бульона инокулировали в колбу Эрленмейера на 500 мл, содержащую 100 мл той же самой посевной среды и культивировали при 28°С в течение одного дня с получением второго посевного культурального бульона. Этот второй посевной культуральный бульон (800 мл), полученный таким образом, инокулировали в тэнк на 200 литров, содержащий 100 л производственной питательной среды (5% растворимый крахмал, 0,8% фармацевтическая среда, 0,8% мука из клейковины, 0,5% дрожжевой экстракт и 0,1% карбонат кальция, рН 6,8 перед стерилизацией) и культивировали в течение пяти дней в следующих условиях, с получением культурального бульона.
Температура культивирования: 28оС
Перемешивание: 90 об/мин
Внутреннее давление: 20 кПа
Часть культурального бульона (10 л), полученного таким образом, экстрагировали 10 л 1-бутанола и затем полученный бутанольный слой упаривали досуха с получением 100 г неочищенной активной фракции. Эту неочищенную активную фракцию наносили на Сефадекс LH-20 (1500 мл; изготовляемый Pharmacia, Co. Ltd.) и элюировали смесью тетрагидрофуран-метанол (1:1) в качестве растворителя. Элюированную фракцию от 540 до 660 мл концентрировали досуха с получением остатка (660 мг). Полученный остаток растворяли в смеси этилацетата и метанола (9:1, об./об.) и подвергали колоночной хроматографии на силикагеле (WAKO GEL C-200, 50 г). Колонку элюировали смесью (2 л), состоящей из н-гексана и этилацетата (1:9, об./об.), фракции, элюированные от 468 до 1260 мл, собирали и упаривали с получением 25 мг неочищенной активной фракции.
Полученную неочищенную активную фракцию подвергали препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) при следующих далее условиях препаративной ВЭЖХ (А) и фракции, элюированные при времени удерживания 34 минуты, собирали. После удаления ацетонитрила соответствующие фракции обессоливали при помощи ВЭЖХ при следующих далее условиях препаративной ВЭЖХ (В) с получением 11107В (Время удерживания: 37 минут, 6 мг).
Условия препаративной ВЭЖХ А:
Колонка: YMC-PACK ODS-AM SH-343-5AM, ϕ20 мм × 250 мм (изготовляемая YMC Co.)
Температура: комнатная температура
Скорость тока: 10 мл/мин
Детектирование: 240 нм
Элюент: ацетонитрил/0,15% водный дигидрофосфат калия (рН 3,5) (2:8-8:2, об./об., 0-50 минут, линейный градиент).
Условия препаративной ВЭЖХ В:
Колонка: YMC-PACK ODS-AM SH-343-5AM, ϕ20 мм × 250 мм (изготовляемая YMC Co.)
Температура: комнатная температура
Скорость тока: 10 мл/мин
Детектирование: 240 нм
Элюент: метанол/вода (2:8-10:0, об./об., 0-40 минут, линейный градиент).
Пример 1. Выделение штамма АВ-1704
Одну петлю культуры на скошенном агаре (0,5% растворимый крахмал, 0,5% глюкоза, 0,1% экстракт рыбного мяса (изготовляемый WAKO Pure Chemical Industries, Ltd.), 0,1% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.), 0,2% NZ-казеин (изготовляемый Humko Sheffield Chemical Co.), 0,2% хлорид натрия, 0,1% карбонат кальция, и 1,6% агар (изготовляемой WAKO Pure Chemical Industries, Ltd.)) штамма, выделенного из почвы, инокулировали в тест-пробирку на 65 мл, содержащую 7 мл посевной среды (2,0% растворимый крахмал, 1,0% глюкоза, 0,5% полипептон (изготовляемый Nihon Pharmaceutical Co., Ltd.), 0,5% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.) и 0,1% карбонат кальция) и культивировали при 28°С в течение трех дней на роторном шейкере с получением посевного культурального бульона.
Затем 0,5 мл этого посевного культурального пепетона инокулировали в тест-пробирку на 65 мл, содержащую 7 мл производственной питательной среды (2,0% растворимый крахмал, 1,0% глюкоза, 0,5% полипептон (изготовляемый Nihon Pharmaceutical Co., Ltd.), 0,5% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.) и 0,1% карбонат кальция) и культивировали при 28°С в течение трех дней на роторном шейкере. Затем готовили раствор 25 мг/мл субстратного вещества 11107В в этаноле и 0,2 мл этого раствора добавляли к культуре. После добавления его встряхивали при 28°С в течение 48 часов для проведения реакции превращения. После этой реакции реакционную смесь анализировали при помощи ВЭЖХ в следующих ниже условиях (а) аналитической ВЭЖХ с получением штамма АВ-1704 (FERM BP-8551), который образовывал вещество 11107D в этой реакционной смеси.
Условия аналитической ВЭЖХ (а)
Колонка: CAPCELL PAK C18 SG120 ϕ4,6 мм × 250 мм (изготовляемая SHISEIDO CO.)
Температура: 40°С
Скорость тока: 1 мл/мин
Детектирование: 240 нм
Элюент: ацетонитрил/0,15% водный дигидрофосфат калия (рН 3,5) (3:7-5:5, об./об., 0-18 минут, линейный градиент), ацетонитрил/0,15% дигидрофосфат калия (рН 3,5) (5:5-85:15, об./об., 18-22 минуты, линейный °С)
Время удерживания: вещество 11107D 9,9 мин, вещество 11107В 19,4 мин.
Пример 2. Выделение штамма А-1544 и штамма А-1545
Одну петлю культуры на скошенном агаре (дрожжи-солодовый агар) штамма, выделенного из почвы, инокулировали в колбу Эрленмейера на 250 мл, содержащую 20 мл посевной среды (2,4% растворимый крахмал, 0,1% глюкоза, 0,5% соевая мука (ESUSAN-MEAT, изготовляемая Ajinomoto Co. Ltd.), 0,3% мясной экстракт (изготовляемый Difco), 0,5% дрожжевой экстракт (изготовляемый Difco), 0,5% триптон-пептон (изготовляемый Difco) и 0,4% карбонат кальция), и культивировали при 28°С в течение трех дней в роторном шейкере с получением посевного культурального бульона.
Затем 0,6 мл этого культурального посевного бульона инокулировали в колбу Эрленмейера на 500 мл, содержащую 60 мл производственной питательной среды (2,0% растворимый крахмал, 2,0% глюкоза, 2,0% соевая мука (ESUSAN-MEAT, изготовляемая Ajinomoto Co. Ltd.), 0,5% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.), 0,25% хлорид натрия, 0,32% карбонат кальция, 0,0005% сульфат меди, 0,0005% хлорид марганца, 0,0005% сульфат цинка, рН 7,4 перед стерилизацией) и культивировали при 28° С в течение четырех дней в роторном шейкере. По 2 мл полученной культуры разливали в тест-пробирки на 15 мл. Затем готовили раствор 20 мг/мл субстратного вещества 11107В в диметилсульфоксиде и добавляли 0,05 мл этого раствора. После добавления тест-пробирки встряхивали при 28°С в течение 23 часов для проведения превращения. После реакции реакционную смесь анализировали при помощи ВЭЖХ в следующих ниже условиях (b) аналитической ВЭЖХ с получением штамма А-1544 (FERM BP-8446) и штамма А-1545 (FERM-BP-8447), которые образовывали вещество 11107D в этой реакционной смеси.
Условия аналитической ВЭЖХ (b)
Колонка: CAPCELL PAK C18 SG120 ϕ4,6 мм × 250 мм (изготовляемая SHISEIDO CO.)
Температура: 40°С
Скорость тока: 1 мл/мин
Детектирование: 240 нм
Элюент: ацетонитрил/вода (50:50, об./об.). Изократический
Время удерживания: вещество 11107В 7, 2 мин, вещество 11107D 3,6 мин.
Пример 3. Превращение штаммом АВ-1704 в масштабе колб
Одну петлю культуры на скошенном агаре (0,5% растворимый крахмал, 0,5% глюкоза, 0,1% экстракт рыбного мяса (изготовляемый WAKO Pure Chemical Industries, Ltd.), 0,1% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.), 0,2% NZ-казеин (изготовляемый Humko Sheffield Chemical Co.), 0,2% хлорид натрия, 0,1% карбонат кальция, и 1,6% агар (изготовляемой WAKO Pure Chemical Industries, Ltd.)) штамма Streptomyces sp. AB-1704, выделенного из почвы, инокулировали в колбу Эрленмейера, содержащую 100 мл посевной среды (2,0% растворимый крахмал, 1,0% глюкоза, 0,5% полипептон (изготовляемый Nihon Pharmaceutical Co., Ltd.), 0,5% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.) и 0,1% карбонат кальция) и культивировали при 28°С в течение трех дней на роторном шейкере с получением посевного культурального бульона. Затем 2 мл этого посевного культурального бульона инокулировали в каждую из 150 колб Эрленмейера, имеющих емкость 500 мл и содержащих 100 мл производственной питательной среды (2,0% растворимый крахмал, 1,0% глюкоза, 0,5% полипептон (изготовляемый Nihon Pharmaceutical Co., Ltd.), 0,5% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.) и 0,1% карбонат кальция), и культивировали при 28°С в течение двух дней на роторном шейкере.
Готовили раствор 20 мг/мл субстратного вещества 11107В в этаноле и по 0,44 мл этого раствора добавляли к полученной культуре (100 мл/500 мл-колба Эрленмейера, 150 колб). После добавления колбы встряхивали при 28°С в течение 9 часов для проведения реакции превращения. После завершения реакции эти культуры собирали и разделяли на культуральный супернатант и мицелий центрифугированием при 2700 об/мин в течение 10 минут. Мицелий экстрагировали 5 л метанола и фильтровали с получением раствора метанольного экстракта. Этот метанольный экстракт упаривали для удаления метанола, объединяли с культуральным супернатантом и экстрагировали 10 л этилацетата. Полученный этилацетатный раствор упаривали с получением 2090 мг неочищенной активной фракции. Неочищенную активную фракцию растворяли в 4 мл смеси тетрагидрофуран-метанол (1:1, об./об.) и 6 мл 50% водного раствора ацетонитрила, подвергали хроматографии на колонке ODS (изготовляемой YMC Co., ODS-AM 120-S50 ϕ3,6 см × 43 см) и элюировали 40% водным раствором ацетонитрила. Элюированную фракцию от 336 мл до 408 мл концентрировали досуха при пониженном давлении с получением 560 мг остатка. Далее, этот остаток растворяли в 10 мл 50% водного раствора метанола, подвергали хроматографии на колонке ODS (изготовляемой YMC Co., ODS-AM 120-S50 ϕ3,6 см × 40 см) и элюировали 50% водным раствором метанола. Элюированную фракцию от 1344 мл до 1824 мл концентрировали досуха при пониженном давлении с получением 252 мг вещества 11107D.
Пример 4. Превращение штаммом А-1545 в масштабе колб
Одну петлю культуры на скошенном агаре (дрожжи-солодовый агар) штамма А-1545 (FERM BP-8447) инокулировали в колбу Эрленмейера на 250 мл, содержащую 25 мл посевной среды (2,0% растворимый крахмал, 2,0% глюкоза, 2,0% соевая мука (ESUSAN-MEAT, изготовляемая Ajinomoto Co. Ltd.), 0,5% дрожжевой экстракт (изготовляемый Difco), 0,25% хлорид натрия и 0,32% карбонат кальция, рН 7,4 перед стерилизацией), и культивировали при 28°С в течение двух дней на роторном шейкере с получением посевного культурального бульона. По 0,75 мл этого бульона разливали в пробирки для сыворотки (изготовляемые Sumimoto Bakelite Co., Ltd.) и добавляли равное количество 40% водного раствора глицерина. После перемешивания их замораживали при -70°С с получением замороженного посевного материала. Замороженный посевной материал оттаивали, 0,25 мл из него инокулировали в колбу Эрленмейера на 250 мл, содержащую 25 мл посевной среды (2,0% растворимый крахмал, 2,0% глюкоза, 2,0% соевая мука (ESUSAN-MEAT, изготовляемая Ajinomoto Co. Ltd.), 0,5% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.), 0,25% хлорид натрия и 0,32% карбонат кальция, рН 7,4 перед стерилизацией) и культивировали при 28°С в течение двух дней на роторном шейкере с получением посевного культурального бульона. Затем этот посевной культуральный бульон (0,5 мл) инокулировали в колбу Эрленмейера на 500 мл, содержащую 100 мл производственной питательной среды (2,0% растворимый крахмал, 2,0% глюкоза, 2, 0% соевая мука (ESUSAN-MEAT, изготовляемая Ajinomoto Co. Ltd.), 0,5% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.), 0,25% хлорид натрия и 0,32% карбонат кальция, рН 7,4 перед стерилизацией), и культивировали при 28°С в течение трех дней на роторном шейкере.
Каждый из полученных культуральных бульонов (100 мл/500 мл-колба Эрленмейера, 10 колб) подвергали центрифугированию при 3000 об/мин в течение 10 минут для сбора клеток микроорганизма и эти клетки суспендировали в 100 мл 50 мМ раствора фосфатного буфера (рН 6,0). Затем готовили раствор 100 мг/мл субстратного вещества 11107В в диметилсульфоксиде и добавляли по 1 мл этого раствора. После добавления встряхивали при 28°С в течение 24 часов для проведения реакции превращения. После завершения реакции эти реакционные растворы собирали и разделяли на культуральный супернатант и мицелий центрифугированием при 5000 об/мин в течение 20 минут. Супернатант экстрагировали 1 л этилацетата. Мицелий экстрагировали 500 мл метанола и затем фильтровали с получением метанольного экстракта. Этот метанольный экстракт упаривали для удаления метанола и экстрагировали 1 л этилацетата. Каждый из этилацетатных слоев промывали водой, сушили и дегидратировали над безводным сульфатом натрия и объединенные слои упаривали с получением 937 мг неочищенной фракции. Неочищенную фракцию подвергали колоночной хроматографии на силикагеле (Kiesel gel 60, 50 г) и элюировали 1200 мл смеси этилацетат-н-гексан (90:10; об./об.) с получением 234 мг фракции, содержащей вещество 11107D. Полученную активную фракцию подвергали препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) при следующих условиях (С) препаративной ВЭЖХ и полученный элюат анализировали при помощи ВЭЖХ при следующих условиях аналитической ВЭЖХ (с). Растворитель удаляли из фракции, содержащей полученное таким образом вещество 11107D, с получением 80 мг вещества 11107D.
Условия препаративной ВЭЖХ (С)
Колонка: CAPCELL PAK C18 UG120 ϕ30 мм × 250 мм (изготовляемая SHISEIDO CO.)
Скорость тока: 20 мл/мин
Детектирование: 240 нм
Элюент: ацетонитрил/вода (30:70, об./об.). Изократический
Условия аналитической ВЭЖХ (с)
Колонка: CAPCELL PAK C18 SG120 ϕ4, 6 мм × 250 мм (изготовляемая SHISEIDO CO.)
Температура: 40°С
Скорость тока: 1 мл/мин
Детектирование: 240 нм
Элюент: ацетонитрил/вода (35:65, об./об.). Изократический
Время удерживания: вещество 11107D 7,8 мин.
Пример 5. Превращение штаммом А-1544 в масштабе колб
Каждую из культур штамма А-1544 (FERM BP-8446) (100 мл/500 мл-колба Эрленмейера, 10 колб), полученных способом, сходным со способом, описанным в примере 4, подвергали центрифугированию при 3000 об/мин в течение 10 минут для сбора клеток микроорганизма и эти клетки суспендировали в 100 мл 50 мМ раствора фосфатного буфера (рН 6,0). Затем готовили раствор 100 мг/мл субстрата 11107В в диметилсульфоксиде и добавляли по 1 мл этого раствора. После добавления встряхивали при 28°С в течение 24 часов для проведения реакции превращения. После завершения реакции эти реакционные растворы собирали и разделяли на культуральный супернатант и мицелий центрифугированием при 5000 об/мин в течение 20 минут. Супернатант экстрагировали 1 л этилацетата. Мицелий экстрагировали 500 мл ацетона и затем фильтровали с получением ацетонового экстракта. Этот ацетоновый экстракт выпаривали для удаления ацетона и затем остаток экстрагировали 1 л этилацетата. Каждый из этилацетатных слоев промывали водой, сушили и дегидратировали над безводным сульфатом натрия и объединенные слои упаривали с получением 945 мг неочищенной фракции. Неочищенную фракцию подвергали колоночной хроматографии на силикагеле (Kiesel gel 60, 50 г) и элюировали 100 мл смеси этилацетат-н-гексан (50:50; об./об.), 200 мл смеси этилацетат-н-гексан (75:25; об./об.) и смесью (600 мл) этилацетат-н-гексан (90:10; об./об.) с получением 463 мг фракции, содержащей вещество 11107D. Полученную активную фракцию подвергали препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) при условиях препаративной ВЭЖХ (С), описанных в примере 4, и при условиях аналитической ВЭЖХ (с), описанных в примере 4. Растворитель удаляли из фракции, содержащей полученное таким образом вещество 11107D, с получением 304 мг вещества 11107D.
Пример 6. Выделение штамма F-1529 и штамма F-1530
Одну петлю культуры на скошенном агаре (картофельный агар с декстрозой) штамма, выделенного из почвы, инокулировали в колбу Эрленмейера на 250 мл, содержащую 20 мл посевной среды (2,0% картофельный крахмал, 1,0% глюкоза, 2,0% соевая мука (ESUSAN-MEAT, изготовляемая Ajinomoto Co. Ltd.), 0,1% дигидрофосфат калия и 0,05% гептагидрат сульфата магния), и культивировали при 25°С в течение трех дней на роторном шейкере с получением посевного культурального бульона. Далее, 0,6 мл этого посевного бульона инокулировали в колбы Эрленмейера на 500 мл, содержащие 60 мл производственной питательной среды (2,0% картофельный крахмал, 1, 0% глюкоза, 2,0% соевая мука (ESUSAN-MEAT, изготовляемая Ajinomoto Co. Ltd.), 0,1% дигидрофосфат калия и 0,05% гептагидрат сульфата магния) и культивировали при 28°С в течение четырех дней на роторном шейкере. По 2 мл полученного культурального бульона разливали в тест-пробирки на 15 мл. Каждую тест-пробирку подвергали центрифугированию при 3000 об/мин в течение 5 минут для сбора клеток микроорганизма и затем суспендировали в 2 мл 50 мМ раствора фосфатного буфера (рН 7,0). Затем готовили раствор 20 мг/мл субстратного вещества 11107В в диметилсульфоксиде и добавляли 0,05 мл этого раствора. После добавления встряхивали при 28°С в течение 23 часов для проведения реакции гидроксилирования. После этой реакции реакционную смесь анализировали ВЭЖХ при аналитических условиях (с), описанных в примере 4, с получением штамма F-1529 (FERM BP-8547) и штамма F-1530 (FERM BP-8548), оба из которых имели пик вещества 11107D в ВЭЖХ.
Пример 7. Превращение штаммом F-1529 в масштабе колб
Одну петлю культуры на скошенном агаре (картофельный агар с декстрозой) штамма Mortierella sp. F-1529 (FERM BP-8547) инокулировали в колбу Эрленмейера на 250 мл, содержащую 25 мл посевной среды (2,0% картофельный крахмал, 1,0% глюкоза, 2,0% соевая мука (ESUSAN-MEAT, изготовляемая Ajinomoto Co. Ltd.), 0,1% дигидрофосфат калия и 0, 05% гептагидрат сульфата магния), и культивировали при 25°С в течение двух дней на роторном шейкере с получением посевного культурального бульона. Далее, 0,6 мл этого посевного бульона инокулировали в колбы Эрленмейера на 500 мл, содержащие 60 мл производственной питательной среды (2,0% картофельный крахмал, 1,0% глюкоза, 2,0% соевая мука (ESUSAN-MEAT, изготовляемая Ajinomoto Co. Ltd.), 0,1% дигидрофосфат калия и 0,05% гептагидрат сульфата магния) и культивировали при 25°С в течение трех дней на роторном шейкере.
Каждый полученный культуральный бульон (60 мл/500 мл-колба Эрленмейера, 18 колб) подвергали центрифугированию при 3000 об/мин в течение 5 минут для сбора клеток микроорганизма и затем суспендировали в 60 мл 50 мМ раствора фосфатного буфера (рН 7,0). Затем готовили раствор 100 мг/мл субстрата 11107В в диметилсульфоксиде и добавляли по 0,6 мл этого раствора. После добавления встряхивали при 25°С в течение 22 часов для проведения реакции превращения. После завершения реакции культуральный бульон разделяли на супернатант и мицелий центрифугированием при 5000 об/мин в течение 20 минут. Супернатант экстрагировали 1 л этилацетата. Мицелий экстрагировали 500 мл ацетона и затем фильтровали с получением раствора ацетонового экстракта. Этот раствор ацетонового экстракта упаривали для удаления ацетона и затем экстрагировали 1 л этилацетата. Каждый из этилацетатных слоев соответственно промывали водой, дегидратировали и сушили над безводным сульфатом натрия и затем объединяли вместе и упаривали с получением 1,21 г неочищенной фракции, включающей в себя вещество 11107D. Неочищенную фракцию, включающую в себя вещество 11107D, подвергали колоночной хроматографии на силикагеле (Kiesel gel 60, 50 г) и элюировали 1200 мл смеси этилацетат-н-гексан (90:10; об./об.) с получением 369 мг фракции, содержащей вещество 11107D.
Полученную фракцию подвергали препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) при условиях препаративной ВЭЖХ (С), описанных в примере 4, с получением элюированной фракции, содержащей вещество 11107D. Затем растворитель удаляли с получением 180 мг вещества 11107D.
Пример 8. Превращение штаммом F-1530 в масштабе колб
Одну петлю культуры на скошенном агаре (картофельный агар с декстрозой) штамма Mortierella sp. F-1530 (FERM BP-8548) инокулировали в колбу Эрленмейера на 250 мл, содержащую 25 мл посевной среды (2,0% картофельный крахмал, 1,0% глюкоза, 2,0% соевая мука (ESUSAN-MEAT, изготовляемая Ajinomoto Co. Ltd.), 0,1% дигидрофосфат калия и 0,05% гептагидрат сульфата магния), и культивировали при 25°С в течение двух дней на роторном шейкере с получением посевного культурального бульона. Далее, 0,6 мл этого посевного бульона инокулировали в колбы Эрленмейера на 500 мл, содержащие 60 мл производственной питательной среды (2,0% картофельный крахмал, 1,0% глюкоза, 2,0% соевая мука (ESUSAN-MEAT, изготовляемая Ajinomoto Co. Ltd.), 0,1% дигидрофосфат калия и 0,05% гептагидрат сульфата магния), и культивировали при 25°С в течение трех дней на роторном шейкере.
Каждый полученный культуральный бульон (60 мл/500 мл-колба Эрленмейера, 18 колб) подвергали центрифугированию при 3000 об/мин в течение 5 минут для сбора клеток микроорганизма и затем суспендировали в 60 мл 50 мМ раствора фосфатного буфера (рН 7,0). Затем готовили раствор 100 мг/мл субстрата 11107В в диметилсульфоксиде и добавляли по 0,6 мл этого раствора. После добавления встряхивали при 25°С в течение 22 часов для проведения реакции превращения. После завершения реакции культуральный бульон разделяли на супернатант и мицелий центрифугированием при 5000 об/мин в течение 20 минут. Супернатант экстрагировали 1 л этилацетата. Мицелий экстрагировали 500 мл ацетона и затем фильтровали с получением раствора ацетонового экстракта. Этот раствор ацетонового экстракта упаривали для удаления ацетона и затем экстрагировали 1 л этилацетата. Этилацетатные слои соответственно промывали водой, дегидратировали и сушили над безводным сульфатом натрия и затем объединяли вместе и упаривали с получением 0, 89 г неочищенной фракции, включающей в себя вещество 11107D. Неочищенную фракцию, включающую в себя вещество 11107D, подвергали колоночной хроматографии на силикагеле (Kiesel gel 60, 50 г) и элюировали 1200 мл смеси этилацетат-н-гексан (90:10; об./об.) и затем 500 мл этилацетата с получением 163 мг фракции, содержащей вещество 11107D. Полученную фракцию подвергали препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) при условиях препаративной ВЭЖХ (С), описанных в примере 4, с получением элюированной фракции, содержащей вещество 11107D. Затем растворитель удаляли с получением 30 мг вещества 11107D.
Пример 9. Выделение штамма АВ-1896
Одну петлю культуры на скошенном агаре (0,5% растворимый крахмал, 0,5% глюкоза, 0,1% экстракт рыбного мяса (изготовляемый WAKO Pure Chemical Industries, Ltd.), 0,1% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.), 0,2% NZ-казеин (изготовляемый Humko Sheffield Chemical Co.), 0,2% хлорид натрия, 0,1% карбонат кальция, и 1,6% агар (изготовляемой WAKO Pure Chemical Industries, Ltd.)) штамма, выделенного из почвы, инокулировали в тест-пробирку на 65 мл, содержащую 5 мл посевной среды (2,0% растворимый крахмал, 1,0% глюкоза, 0,5% полипептон (изготовляемый Nihon Pharmaceutical Co., Ltd.), 0,5% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.) и 0,1% карбонат кальция) и культивировали при 28°С в течение десяти дней на роторном шейкере с получением посевного культурального бульона. Затем 0,1 мл этого посевного культурального бульона инокулировали в тест-пробирку на 65 мл, содержащую 5 мл производственной питательной среды (2,0% растворимый крахмал, 1,0% глюкоза, 0,5% полипептон (изготовляемый Nihon Pharmaceutical Co., Ltd.), 0,5% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.) и 0,1% карбонат кальция) и культивировали при 28°С в течение трех дней на роторном шейкере. Затем готовили раствор 40 мг/мл субстратного вещества 11107В в этаноле и 0,05 мл этого раствора добавляли к культуре. После добавления его встряхивали при 28°С в течение 24 часов для проведения реакции гидроксилирования. После этой реакции культуральный бульон подвергали анализу ВЭЖХ в соответствии со следующими аналитическими условиями (d) с получением штамма АВ-1896, который образовывал вещество 11107D.
Условия аналитической ВЭЖХ (d)
Колонка: UNISON UK-C18, ϕ4,6 мм × 50 мм (изготовляемая Imtakt)
Температура: 30°С
Скорость тока: 2 мл/мин
Детектирование: 240 нм
Элюент: вода/ацетонитрил/муравьиная кислота (1000:10:1 - 10:1000:1 об./об./об., 0-4 минут, линейный градиент)
Время удерживания: вещество 11107D 2,5 мин.
Пример 10. Превращение штаммом АВ-1896 в масштабе тест-пробирки
Одну петлю культуры на скошенном агаре (0,5% растворимый крахмал, 0,5% глюкоза, 0,1% экстракт рыбного мяса (изготовляемый WAKO Pure Chemical Industries, Ltd.), 0,1% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.), 0,2% NZ-казеин (изготовляемый Humko Sheffield Chemical Co.), 0,2% хлорид натрия, 0,1% карбонат кальция, и 1,6% агар (изготовляемой WAKO Pure Chemical Industries, Ltd.)) штамма АВ-1896 инокулировали в тест-пробирку на 65 мл, содержащую 5 мл посевной среды (2,0% растворимый крахмал, 1,0% глюкоза, 0,5% полипептон (изготовляемый Nihon Pharmaceutical Co., Ltd.), 0,5% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.) и 0,1% карбонат кальция) и культивировали при 28°С в течение десяти дней на роторном шейкере с получением посевного культурального бульона. Затем 0,1 мл этого посевного культурального бульона инокулировали в тест-прообирку на 65 мл, содержащую 5 мл производственной питательной среды (2,0% растворимый крахмал, 1,0% глюкоза, 0,5% полипептон (изготовляемый Nihon Pharmaceutical Co., Ltd.), 0,5% дрожжевой экстракт (изготовляемый Oriental Yeast Co., Ltd.) и 0,1% карбонат кальция) и культивировали при 28°С в течение трех дней на роторном шейкере.
Готовили раствор 40 мг/мл субстратного вещества 11107В в этаноле, и 0,05 мл этого раствора добавляли к полученному культуральному бульону (5 мл/65 мл-тест-пробирка). После добавления тест-пробирку встряхивали при 28°С в течение 24 часов для проведения реакции гидроксилирования. 3 мл полученного культурального бульона собирали отдельно, добавляли к ним 2 мл 1-бутанола, встряхивали и затем центрифугировали при 3000 об/мин в течение 10 минут. Полученный супернатант удаляли с получением 2 мл метанольного раствора этого остатка. Его подвергали ВЭЖХ-анализу в соответствии со следующими аналитическими условиями (е) и (f) для подтверждения, что вещество 11107D образовывалось в этой реакционной смеси.
Условия аналитической ВЭЖХ (е)
Колонка: UNISON UK-C18, ϕ4,6 мм × 50 мм (изготовляемая Imtakt)
Температура: 40°С
Скорость тока: 2 мл/мин
Детектирование: 240 нм
Элюент: ацетонитрил/0,01% трифторуксусная кислота (2:8 - 5:5 об./об., 0-10 минут, линейный градиент)
Время удерживания: вещество 11107D 6,1 мин.
Условия аналитической ВЭЖХ (f)
Колонка: UNISON UK-C18, ϕ4,6 мм × 50 мм (изготовляемая Imtakt)
Температура: 40°С
Скорость тока: 2 мл/мин
Детектирование: 240 нм
Элюент: метанол/0,01% трифторуксусная кислота (4:6 - 7:3 об./об., 0-10 минут, линейный градиент)
Время удерживания: вещество 11107D 6,1 мин.





Реферат
Группа изобретений относится к биотехнологии, в частности к способу получения макролидного соединения 11107D формулы (II) и к штаммам Streptomyces sp. FERM BP-8551, Mortierella sp. FERM BP-8547, Mortierella sp. FERM BP-8548 и Micromonosporaceae FERM BP-8550. Исходное соединение 11107В формулы (I) подвергают биотрансформации в целевое соединение формулы (II) инкубированием его в присутствии штамма, имеющего способность превращать макролидное соединение 11107В в вещество 11107D и принадлежащего к роду Mortierella, роду Streptomyces или семейству Micromonosporaceae, или препарата культивируемого мицелия штамма. Целевое вещество 11107D выделяют из реакционной среды. Изобретения позволяют получить целевое соединение 11107D, которое обладает повышенной противоопухолевой активностью и более стабильно, чем соединение 11107В. 5 н. и 3 з.п. ф-лы, 10 табл.
Формула


Комментарии