Фармацевтическая композиция, содержащая dhmeq или его аналоги - RU2703735C1
Код документа: RU2703735C1
Чертежи


Описание
Область техники
Изобретение относится к области медицины и фармакологии и касается разработки и получения лекарственных средств, включающих DHMEQ, которые могут быть использованы для лечения и/или профилактики онкологических, аутоиммунных или воспалительных заболеваний.
Уровень техники
Транскрипционный фактор NF-κB является универсальным фактором транскрипции, регулирующим множество жизненно важных процессов в клетке, таких как воспаление, иммунный ответ и пролиферация, он вовлечен в процессы канцерогенеза целого ряда злокачественных новообразований. Нарушение регуляции NF-kB вызывает воспаление, аутоиммунные заболевания, а также развитие вирусных инфекций и рака.
Из документа EP1219596 известна группа соединений на основе антибиотика эпоксикуиномицина С, в частности соединение дегидроксиметилэпоксиквиномицин (DHMEQ), которое обладает противоопухолевой и противовоспалительной активностями. DHMEQ является уникальным ингибитором NF-kB, который действует на двух уровнях ядерной транслокации. DHMEQ ингибирует как канонический, так и неканонический пути активации NF-kB. Из документа WO2006060819A2 известно применение DHMEQ в качестве сенсибилизирующего агента для терапии (например, химиотерапии, гормональной терапии, лучевой терапии и иммунотерапии), направленной как против терапевтически устойчивых, так и против терапевтически чувствительных опухолевых клеток. Из данного документа также известно применение DHMEQ и структурно подобных соединений отдельно, либо в сочетании с химиотерапией, гормональной терапией, лучевой терапией и иммунотерапевтическими средствами, для лечения онкологических заболеваний, как лекарственно и иммунотерапевтически чувствительных, так и лекарственно иммунотерапевтически устойчивых.
Однако существует проблема с созданием лекарственных форм DHMEQ и его аналогов с высокой стабильностью и биодоступностью, так как DHMEQ обладает низкой растворимостью в водной среде, а также быстро инактивируется в крови, тем самым умаляя терапевтический эффект. DHMEQ растворим в органических растворителях, например, ДМСО, но такой раствор имеет ограничения в плане промышленной применимости ввиду короткого срока стабильности, что приводит к необходимости приготовления растворов практически перед введением. Исходя из вышесказанного, сохраняется проблема разработки лекарственного средства на основе DHMEQ и его аналогов, обладающих приемлемой стабильностью, биодоступностью, являющихся пригодными для применения в терапии различных заболеваний и обладающих промышленной применимостью.
Большинство лекарственных средств доходит до потребителя в готовом к употреблению виде или в виде так называемого лекарственного препарата. Под готовым лекарственным средством подразумевается комплекс, состоящий из самого лекарственного средства и вспомогательных веществ в виде определенной формы или агрегатного состояния. Очень часто лекарственная форма определяет не только удобство применения лекарственного средства, но также и другие характеристики эффективности лекарственного средства, такие как биодоступность, время действия и т.д.
Сополимер стирола с малеиновым ангидридом широко используется в нефтедобывающей промышленности в качестве песконесущей жидкости для гидроразрыва. Сополимер также обычно применяется в промышленности, строительстве и т.д. Имеются только очень ограниченные сведения о применении его в качестве компонента для приготовления косметических и фармацевтических композиций [US8623414]. Способ получения сополимера стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА) известен из документа RU2135187.
Таким образом, приоритетным является создание нового лекарственного средства на основе DHMEQ или его аналогов, и поиск способов повышения стабильности DHMEQ или его аналогов для использования в фармацевтической промышленности.
Раскрытие изобретения
Задачей данного изобретения является разработка и получение нового нетоксичного эффективного лекарственного средства на основе DHEMQ или его аналогов, характеризующегося высокой стабильностью и биодоступностью, для лечения и/или профилактики онкологических, аутоиммунных или воспалительных заболеваний.
Техническим результатом данного изобретения является разработка и создание нового эффективного нетоксичного лекарственного средства, включающего DHMEQ или его аналоги и целевую добавку, для лечения и/или профилактики онкологических, аутоиммунных или воспалительных заболеваний, которое обладает высокой стабильностью и биодоступностью.
Указанный технический результат достигается посредством разработки и создания лекарственного средства, содержащего, по меньшей мере, одно соединение формулы 1:

где R1выбирается независимо и представляет собой атом водорода или -C2-4-алкил, -OH,
R2 выбирается независимо и представляет собой группу, выбранную из (A), (B), (C), (D), (E), (F) или (G):

где R3 выбирается независимо и представляет собой -C1-4-алкил;
R4выбирается независимо и представляет собой -C1-4-алкил;
или его фармацевтически приемлемую соль, в терапевтически эффективном количестве, и целевую добавку, отличающегося тем, что целевая добавка содержит сополимер стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА).
В частных вариантах воплощения изобретения лекарственное средство характеризуется тем, что соединение формулы 1 представляет собой DHMEQ.
В частных вариантах воплощения изобретения лекарственное средство характеризуется тем, что целевая добавка дополнительно содержит воду.
В частных вариантах воплощения изобретения лекарственное средство характеризуется следующим соотношением компонентов, мас.%:
В частных вариантах воплощения изобретения лекарственное средство характеризуется следующим соотношением компонентов, мас.%:
В частных вариантах воплощения изобретения лекарственное средство характеризуется следующим соотношением компонентов, мас.%:
В частных вариантах воплощения изобретения лекарственное средство по изобретению предназначено для лечения онкологических, аутоиммунных или воспалительных заболеваний.
Изобретение также предусматривает лекарственный препарат, представляющий собой лекарственное средство, описанное выше, выполненное в жидкой лекарственной форме.
В частных вариантах воплощения изобретения лекарственный препарат характеризуется тем, что жидкая лекарственная форма выбрана из группы: раствор, суспензия, эмульсия, слизь, линимент, пластырь жидкий, сироп лекарственный.
В частных вариантах воплощения изобретения лекарственный препарат, характеризуется тем, что раствор представляет собой раствор для инъекций.
Изобретение также включает лекарственный препарат, представляющий собой лекарственное средство, описанное выше, выполненное в мягкой лекарственной форме.
В частных вариантах воплощения изобретения лекарственный препарат характеризуется тем, что мягкая лекарственная форма выбрана из группы: мазь, суппозиторий, пластырь, пилюля.
Изобретение также включает лекарственный препарат, представляющий собой лекарственное средство, описанное выше, выполненное в твёрдой лекарственной форме.
В частных вариантах воплощения изобретения лекарственный препарат характеризуется тем, что твёрдая лекарственная форма выбрана из группы: таблетка, драже, гранула, порошок, капсула, спансула, карандаш лекарственный, пленка лекарственная.
В частных вариантах воплощения изобретения лекарственный препарат по изобретению предназначен для лечения онкологических, аутоиммунных или воспалительных заболеваний.
Изобретение также включает получение лекарственного средства по изобретению. В частных вариантах воплощения изобретения лекарственное средство по изобретению (инъекционный состав) получают путем введения измельченного DHMEQ по типу суспензии в заявляемый состав.
Изобретение также относится к способу лечения и/или профилактики онкологических, аутоиммунных или воспалительных заболеваний у субъекта, а именно у млекопитающих, в том числе человека.
Подробное раскрытие изобретения
Определение и термины
Для лучшего понимания настоящего изобретения ниже приведены некоторые термины, используемые в настоящем описании изобретения.
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из».
Термины «лечение», «терапия» охватывают лечение патологических состояний у субъекта, предпочтительно у человека, и включают: а) блокирование (приостановку) течения заболевания, б) облегчение тяжести заболевания, т.е. индукцию регрессии заболевания.
Термин «профилактика», «предотвращение» охватывает устранение факторов риска, а также профилактическое лечение субклинических стадий заболевания у субъекта, предпочтительно у человека, направленное на уменьшение вероятности возникновения клинических стадий заболевания. Субъекты для профилактической терапии отбираются на основе факторов, которые, на основании известных данных, влекут увеличение риска возникновения клинических стадий заболевания по сравнению с общим населением. К профилактической терапии относится, а) первичная профилактика и б) вторичная профилактика. Первичная профилактика определяется как профилактическое лечение у пациентов (субъектов), клиническая стадия заболевания у которых ещё не наступила. Вторичная профилактика - это предотвращение повторного наступления того же или близкого клинического состояния заболевания.
Термин «уменьшение риска» охватывает терапию, которая снижает частоту возникновения клинической стадии заболевания. Примерами уменьшения риска заболевания является первичная и вторичная профилактика заболевания.
Термин «субъект» охватывает все виды млекопитающих, предпочтительно человека.
Термин «DHMEQ» в настоящем документе означает соединение дегидроксиметилэпоксиквиномицин, структурная формула которого представляет собой:
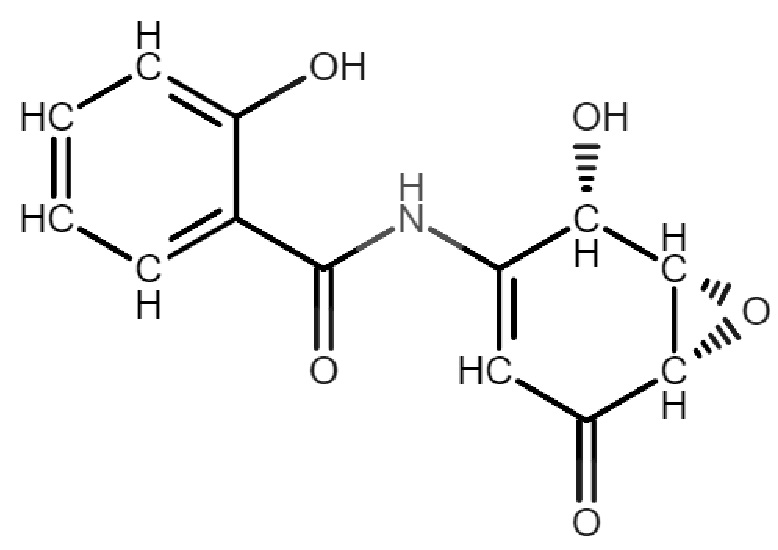
Термин сополимер стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА) в настоящем документе означает продукт сополимеризации стирола с малеиновым ангидридом, модифицированный аммиаком, структурная формула которого представляет собой:

где n означает количество мономерных звеньев в молекуле ССМА и представляет собой 3÷15.
Сополимер стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА) представляет собой порошок белого цвета. Внешний вид 2%-ного раствора ССМА в воде – прозрачная или слегка мутноватая жидкость – гель. Растворим в воде – набухает, растворяется в глицерине, спирте. 2% гель сополимера стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА) обладает выраженным противовирусным действием (RU2135187).
В данном документе под «составом 100,0 инъекционного раствора» следует понимать 100 г инъекционного раствора.
Термин «стоковый раствор» в настоящем документе означает заранее приготовленный обычно концентрированный раствор, который затем разбавляют для применения.
Термин «терапевтически эффективное количество» подразумевает такое количество соединения, вводимого или доставляемого пациенту, при котором у пациента с наибольшей вероятностью проявится желаемая реакция на лечение (профилактику). Точное требуемое количество может меняться от субъекта к субъекту в зависимости от вида млекопитающего, возраста и общего состояния пациента, тяжести заболевания, методики введения препарата, комбинированного лечения с другими препаратами и т.п.
В том случае, когда композиции (лекарственные средства) данного изобретения используются как часть режима комбинированной терапии, доза каждого из компонентов комбинированной терапии вводится в течение требуемого периода лечения. Соединения, составляющие комбинированную терапию, могут вводиться в организм пациента как единовременно, в виде дозировки, содержащей все компоненты, так и в виде индивидуальных дозировок компонентов.
Под «лекарственной формой» в данном документе понимается состояние лекарственного препарата, соответствующее способам его введения и применения и обеспечивающее достижение необходимого лечебного эффекта.
Термин «алкил» сам по себе или как часть другого заместителя, относится к насыщенным углеводородным группам с прямой или разветвленной цепью, включая углеводородные группы, имеющие указанное число атомов углерода (то есть, С1-4 подразумевает от одного до четырех атомов углерода). Примеры алкилов включают, в частности, метил, этил, н-пропил, изо-пропил.
Соединения настоящего изобретения могут существовать в свободной форме или, если требуется, в виде фармацевтически приемлемой соли или другого производного. Используемый здесь термин «фармацевтически приемлемая соль» относится к таким солям, которые, в рамках проведенного медицинского заключения, пригодны для использования в контакте с тканями человека и животных без излишней токсичности, раздражения, аллергической реакции и т.д., и отвечают разумному соотношению пользы и риска. Фармацевтически приемлемые соли аминов, карбоновых кислот, фосфонатов и другие типы соединений хорошо известны в медицине. Соли могут быть получены in situ в процессе выделения или очистки соединений изобретения, а также могут быть получены отдельно, путем взаимодействия свободной кислоты или свободного основания соединения изобретения с подходящим основанием или кислотой, соответственно. Примерами приемлемых солей являются феноляты калия и натрия.
Краткое описание чертежей
Фигура 1. Рентгенограмма, показывающая распределение маркера (сульфат бария) в составе лекарственного средства по изобретению в брюшной полости крысы через 30 минут после введения. Частицы маркера для улучшения контрастности подсвечены зеленым цветом.
Фигура 2. Данные некропсии, распределение лекарственного средства в брюшной полости крысы через 2 часа после введения.
Фигура 3. Данные некропсии, интактная брюшина исследуемого животного через 14 дней после введения лекарственного средства по изобретению.
Фигура 4. Показатели выживаемости крыс с опухолью яичника в контрольной и опытной группах:
кривая 1- контрольная группа животных с опухолью яичника;
кривая 2- группа животных с опухолью яичника, которым вводилось лекарственное средство по изобретению на основе DHMEQ.
Подробное раскрытие изобретения
Для создания лекарственного средства на основе соединений общей формулы 1, как они описаны в данном изобретении, в частности на основе DHMEQ, пригодного для введения, готовый препарат должен обладать приемлемой биодоступностью и стабильностью. Известно, что соединения общей формулы 1, в частности соединение DHMEQ, обладают низкой растворимостью и стабильностью в водной среде. При этом также известно о применении ДМСО в качестве растворителя для DHMEQ. Однако такие растворы обладают рядом ограничений в плане промышленной применимости, ввиду короткого срока стабильности, что приводит к необходимости приготовления растворов практически перед введением. Для устранения вышеизложенной проблемы, а именно создания препарата на основе соединений общей формулы 1, в частности DHMEQ, обладающего приемлемой стабильностью и биодостпуностью, и пригодного для введения субъекту, нуждающемуся в соответствующем лечении, как это описано в настоящем изобретении, разработано лекарственное средство, включающее, по меньшей мере, одно соединение формулы 1 или его фармацевтически приемлемую соль, в терапевтически эффективном количестве, и целевую добавку, включающую сополимер стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА).
Как показали исследования, при приготовлении лекарственного средства по изобретению молекулы соединения общей формулы 1, в частности DHMEQ, располагаются между макромолекулами сополимера стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА). Молекулы DHMEQ находится в «заботливо» удерживающих ячейках между макромолекулами сополимера стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА). Это также подтверждают результаты эксперимента, в ходе которого в процессе приготовления лекарственного средства по изобретению осуществляли предварительное растирание (измельчение) в ступке сополимера стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА), при этом его макромолекулы при механическом растирании были изменены, разрушены связи, в результате чего при набухании наблюдалась иная вязкость растворов сополимера стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА), растворы получались более жидкими. При добавлении DHMEQ в такие растворы полученные образцы были менее стабильными, поскольку наблюдалось изменение их физико-химических свойств.
Целевая добавка сополимера стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА) не агрессивна (то есть не оказывает влияния на вводимые действующие вещества) в отношении соединений общей формулы 1, в частности в отношении молекулы DHMEQ, наблюдения проводились в условиях холодильной камеры.
Осуществление изобретения
Возможность объективного проявления технического результата при использовании изобретения подтверждена достоверными данными, приведенными в примерах, содержащих сведения экспериментального характера, полученных в процессе проведения исследований по методикам, принятым в данной области.
Следует понимать, что эти и все приведенные в материалах заявки примеры не являются ограничивающими и приведены только для иллюстрации настоящего изобретения.
Фармацевтическая композиция с DHMEQ по изобретению
Метод получения DHMEQ описан, в частности, в документе WO2006060819A2.
Метод получения сополимера стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА),описан, в частности, в документе RU2135187.
Пример 1. Состав 100,0 инъекционного раствора: DHMEQ – 0,102 масс.%; ССМА – 0,2 масс.%, вода для инъекций – остальное до 100 масс.%.
Лекарственное средство с DHMEQ по изобретению получают следующим образом:
В воду для инъекций помещают ССМА, перемешивают и оставляют для набухания на 60 минут. Субстанцию DHMEQ предварительно растирают, тонко измельчают и добавляют раствор ССМА в количестве 3% от общего объема раствора сополимера стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА), растирают до однородной массы, после чего добавляют оставшееся количество раствора сополимера стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА). Полученную композицию тщательно перемешивают, расфасовывают в стерильные флаконы под обкатку и стерилизуют методом гамма стерилизации. Готовая фармацевтическая композиция – инъекционное средство для внутрибрюшинного введения представляет собой густую вязкую массу белого цвета с желтым оттенком, с мелкодисперсными вкраплениями субстанции, равномерно распределенную в массе раствора, плотность – 1,0 г/см3, рН – 6,0. Полученный состав для инъекций имеет вязкую консистенцию.
При необходимости фармацевтическую композицию можно разбавить водой для инъекций или раствором натрия хлорида изотоническим непосредственно перед введением.
Пример 2. Состав 100,0 инъекционного состава: DHMEQ – 0,143 масс. %; сополимер стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА) – 0,2 масс. %; лутрол F-68 – 0,2 масс. %; кремофор СО–40 – 0,64 масс.%, вода для инъекций – остальное до 100 масс.%.
Лекарственное средство с DHMEQ получают следующим образом:
В половинном количестве воды для инъекций растворяют лутрол F-68, перемешивают, затем растворяют кремофор СО-40. В другую часть воды для инъекций помещают сополимер стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА), перемешивают и оставляют для набухания на 60 минут. Затем вышеуказанные растворы объединяют в единый раствор (А). Субстанцию ингибитора DHMEQ предварительно растирают, тонко измельчают и добавляют раствор (А) в количестве 3% от общего объема раствора (А), растирают, затем добавляют еще 3% раствора (А), растирают до однородной массы, после чего добавляют оставшееся количество раствора (А). Полученную композицию тщательно перемешивают, расфасовывают в стерильные флаконы под обкатку и стерилизуют методом гамма-стерилизации.
Готовое средство для инъекций внутрибрюшинного введения представляет собой однородную массу в виде геля белого цвета с желто-серым оттенком, плотность – 1,0 г/см3, рН – 6,0.
За счет консистенции и физико-химических свойств композиции инъекционное средство надежно удерживается в тканях при инъекционном введении, а входящие вспомогательные вещества обеспечивают равномерное распределение тонко измельченного DHMEQ в инъекционном составе, который введен по типу суспензии в заявляемый состав; средство также удобно и гигиенично в применении.
Исследование лекарственного средства по изобретению в условиях in vivo
Оценка применимости лекарственного средства для выбранного пути введения.
Для оценки применимости лекарственного средства для внутрибрюшинного введения был проведен эксперимент по анализу распределения вещества в брюшинной полости, влияния состава лекарственного средства на мезотелий (спайки, асептический перитонит и органы брюшной полости при внутрибрюшинном введении).
Раствор стерилизовали гамма-излучением. В исследовании использованы 9 крыс Вистар массой 160–200 г. Животные имели все ветеринарные свидетельства государственного образца, эксперименты были проведены с соблюдением Европейской конвенции по защите позвоночных животных, используемых в экспериментальных и других научных целях.
Для индикации распределения раствора в брюшинной полости в состав лекарственного средства по изобретению (например, состава по примеру 1 или 2) были введены частицы сульфата бария. По данным рентгенографии органов брюшной полости введенный состав распределился по брюшинной полости равномерно (фиг. 1). Также была проведена некропсия через 2 часа после введения, которая подтвердила равномерное распределение введенного состава в брюшинной полости (фиг. 2).
Для оценки резорбции лекарственного средства в организме животного были изучены данные некропсии, проведенные до полной резорбции лекарственного средства в брюшинной полости, а также в интервалах согласно фазам адгезиогенеза при повреждении брюшины:
1. Реактивная фаза (первые 12 часов) - клинически и морфологически проявляется признаками шока, определяется повреждение брюшины.
2. Фаза экссудации (1-3 сутки). Процессы экссудации превалируют над другими процессами воспаления. Повышается проницаемость сосудистого русла, что способствует выходу в свободную брюшную полость перитонеальных малодифференцированных полипотентных клеток, клеток воспаления и жидкой части крови, содержащей фибриноген.
3. Фаза адгезии (3 сутки). Выпадение фибрина на поврежденных поверхностях, их склеивание. Полипотентные клетки брюшинного экссудата дифференцируются в фибробласты, которые продуцируют коллаген.
4. Фаза молодых сращений (7-14 сутки). Образуются рыхлые, содержащие недостаточное количество коллагена, спайки. Происходит новообразование сосудов в спайке и миграция в нее гладкомышечных клеток.
5. Фаза зрелых сращений (14-30 сутки). Образуются плотные соединительно-тканные спайки за счет продукции и уплотнения коллагена, редукция капиллярного русла, перекалибровка сосудов.
Были предусмотрены следующие интервалы выведения животных из эксперимента: 2 часа с момента введения, 24 часа с момента введения, 7 суток с момента введения, 14 суток с момента введения.
Главный элемент в формировании спайки - гелеобразный матрикс из фибрина. Макроскопически матрикс схож с введенным и распределенным лекарственным средством, имеет белесоватый цвет и липкий на ощупь. Но так как фибриновый матрикс формируется только на 3 сутки, некропсия, проведенная через 2 часа, исключает ошибку в оценке содержимого брюшинной полости.
Данные некропсии через 7 и 14 суток продемонстрировали полную резорбцию введенного состава и интактную брюшину (фиг. 3).
Результаты эксперимента продемонстрировали равномерное распределение лекарственного средства в брюшинной полости, отсутствие отграниченного или разлитого перитонита, в том числе асептического, отсутствие спаек брюшины и повреждающего воздействия состава инъекционного растворителя на мезотелий.
Оценка противоопухолевого эффекта лекарственного средства
Для оценки противоопухолевого эффекта лекарственного средства проведены исследования in vivo лекарственных средств по изобретению. В исследовании использованы 100 крыс-самок Вистар массой 160–200 г. Часть животных, после карантина, была использована для поддержания штамма опухоли. Животные имели все ветеринарные свидетельства государственного образца, эксперименты были проведены с соблюдением Европейской конвенции по защите позвоночных животных, используемых в экспериментальных и других научных целях.
Штамм опухоли
В эксперименте был использован штамм опухоли яичника (ОЯ) Опухоль перевивалась крысам-самкам Вистар внутрибрюшинно в виде клеточной суспензии опухоли в объеме 0,5 мл/крысу (1×107 клеток/мл), полученной из асцитического содержимого брюшной полости крысы-опухоленосителя.
Исследование противоопухолевой активности лекарственного средства по изобретению на основе DHMEQ на крысах-самках Вистар с перевитой асцитной опухолью яичника.
Животным, полученным из питомника, после двухнедельного карантина проводилась перевивка асцитной ОЯ, после этого животные рандомизировались на опытную и контрольную группы с использованием соответствующей таблицы сгенерированных случайных чисел в программе MSExcel 2010. Нулевым днем эксперимента считался день перевивки ОЯ. В первые сутки после перевивки было начато внутрибрюшинное введение.
Контрольную группу составили 50 животных с опухолью яичника. Опытную группу составили 50 животных, которым ежедневно в течение 14 дней вводилось лекарственное средство по изобретению в дозе действующего вещества (DHMEQ) 14,2 мг/кг.
Кривые выживаемости крыс в опытной и контрольной группах представлены на фигуре 4.
Таким образом, лекарственное средство по изобретению, включающее DHMEQ и целевую добавку, достоверно продемонстрировало выраженную противоопухолевую активность.
Исследование органолептических свойств и стабильности лекарственного средства по изобретению
Были проведены исследования лекарственного средства по изобретению, в частности, исследовалось лекарственное средство следующего состава - 100,0 инъекционного раствора: DHMEQ – 0,102 масс. %; сополимер стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА) – 0,2 масс. %, вода для инъекций – остальное до 100 масс.% (лекарственная форма).
Были приготовлены несколько растворов с разной концентрацией DHMEQ:
1. 0 мг/мл – контроль (состав 100,0 инъекционного раствора: сополимер стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА) – 0,2 масс.%, вода для инъекций – остальное до 100 масс.%);
2. 0,21 мг/мл (состав 100,0 инъекционного раствора: DHMEQ – 0,021 масс.%; сополимер стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА) – 0,2 масс.%, вода для инъекций – остальное до 100 масс.%);
3. 1,02 мг/мл (состав 100,0 инъекционного раствора: DHMEQ – 0,102 масс.%; сополимер стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА) – 0,2 масс.%, вода для инъекций – остальное до 100 масс.%);
4. 2,05 мг/мл (состав 100,0 инъекционного раствора: DHMEQ – 0,205 масс.%; сополимер стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА) – 0,2 масс.%, вода для инъекций – остальное до 100 масс.%).
Соответственно, на 100 мл стокового раствора лекарственной формы потребуется от 21 до 205 мг DHMEQ.
Результаты наблюдения за приготовленными препаратами в процессе хранения (холодильная камера при температуре +5°С) представлены в таблицах 1 и 2 ниже.
Таблица 1. Органолептические свойства DHMEQ в растворителе, содержащем ССМА и воду для инъекций
Таблица 2. Органолептические свойства DHMEQ в растворителе (заданные концентрации стоковых растворов), содержащем ССМА и воду для инъекций
Данные проведенных экспериментов, представленные в таблицах 1 и 2, свидетельствуют о стабильности композиционных составов лекарственных средств по изобретению в процессе хранения в различном диапазоне концентраций, при суспензионном введении DHMEQ в готовый состав инъекционного растворителя, содержащего сополимер стирола с малеиновым ангидридом, модифицированный аммиаком (ССМА) и воду для инъекций.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
Реферат
Данное изобретение относится к области медицины и фармакологии и касается разработки и получения лекарственных средств, включающих DHMEQ или его аналоги, которые могут быть использованы для лечения и/или профилактики онкологических, аутоиммунных или воспалительных заболеваний. Изобретение также относится к лекарственным препаратам, включающим вышеуказанные лекарственные средства в жидкой, мягкой или твердой лекарственной форме. Лекарственные средства по изобретению характеризуются высокой эффективностью и низкой токсичностью, кроме того, указанные лекарственные средства по изобретению обладают высокой стабильностью и биодоступностью. 6 з.п. ф-лы, 4 ил., 2 пр., 2 табл.
Формула



Комментарии