Ферроценилалкильные производные дипиразолилселенидов в качестве биологически активных соединений и способы их получения (варианты) - RU2714891C1
Код документа: RU2714891C1
Описание
Группа изобретений относится к области медицинской химии и фармацевтики, в частности, к биологически активным соединениям на основе гетероциклических производных ферроцена (азолов).
Известно соединение 1-(1,1,1,3,3,3-Гексафтор-2-ферроценилпроп-2-ил)-имидазол, проявляющее противоопухолевую активность.
Получение данного соединения по первому варианту способа осуществляют взаимодействием 1-ферроценил-1-трифторметил-2,2,2-трифторэтанол с 1,1'-карбонилдиимидазолом при кипячении в толуоле. По второму варианту способа соединение получают путем взаимодействия 1-[1,1,1,3,3,3-гексафтор-2-хлорпроп-2-ил] ферроцена, имидазола и трет.-бутилата калия также в толуоле при кипячении (RU 2533823, 2014).
Адаптогенные свойства данного соединения не известны.
Известны С-бис-(пиразолильные) производные селена - «Селекор», представляющий собой бис-(3,5-диметил-1Н-пиразол-4-ил)селен, обладающий биологической активностью и рекомендованный, как источник органического селена (Сырье для производства биологически активных добавок к пище-порошок; упаковка 10 г; Свидетельство о государственной регистрации (СГР) №RU.77.99.11.003.E.005695.03.11, 2011-03-17 от Селекор (Россия); Производитель: ООО "Ареал"). Способ получения известного вещества не описан. Не описаны также адаптогенная и протективная активность этого соединения.
Задачей настоящего изобретения является расширение спектра биологически активных органических соединений, содержащих селен, за счет синтеза новых соединений, обладающих повышенной адаптогенной и протективной активностью.
Из уровня техники неизвестны ферроценилалкильные производные - С,С'-дипиразолилселенидов, имеющие химическую формулу, приведенную ниже, способы их получения, и, соответственно, не известны их химические свойства и биологическая активность.
Поставленная задача решается описываемыми новыми соединениями, а именно, ферроценилалкильными производными дипиразолилселена, общей формулы 1, в качестве биологически активных соединений, обладающих адаптогенной и протективной активностью.

где R - H, CH3, C6H5 ^ - CH3, CF3, C6H5; R2 - CH3, CF3, C6H5
Поставленная задача решается также описанными ниже вариантами способа получения заявленных соединений.
Согласно первому варианту, проводят взаимодействие при перемешивании α-гидроксиалкилферроцена, выбранного из ферроценилметанола, ферроценилэтанола, ферроценилфенилметанола с дипиразолилселенидом в двухфазной системе, содержащей несмешивающийся с водой органический растворитель, выбранный из CH2Cl2, C2H4Cl2, CHCl3, CCl4, бензола, и водный раствор концентрированной кислоты, выбранной из HBF4, HClO4, с последующим отделением органической фазы, промывкой раствором соды и водой, сушкой органической фазы над безводным сернокислым натрием, удалением растворителя, растворением осадка в хлористом метилене и хроматографической очисткой на силикагеле с использованием в качестве элюента хлористого метилена.
Согласно второму варианту, осуществляют взаимодействие соответствующего ферроценилалкилпиразола с диоксидом селена в растворе пиридина при кипячении и перемешивании, удаление растворителя, обработку полученного осадка раствором гидроксидом натрия, с последующей фильтрацией, промывкой осадка водой, сушкой и хроматографической очисткой полученного продукта на силикагеле с использованием в качестве элюента хлористого метилена.
Техническим результатом заявленной группы изобретений является получение нового соединения, обладающего повышенными адаптогенными свойствами в условиях высоких нагрузок на организм.
Ниже приведены примеры на получение заявленных соединений двумя вариантами способа, а также результаты испытаний для оценки адаптогенной и протективной активности полученных соединений.
Пример 1. (согласно первому варианту способа). К смеси 0,436 г (2 ммоль) ферроценилметанола и 0,27 г (1 ммоль) бис(3,5-пиризол-4-ил)селана в хлористом метилене прибавляют 0,42 мл (2 ммоль) 45% водного раствора HBF4. Реакционную смесь интенсивно перемешивают, отделяют органическую фазу, промывают ее раствором соды, водой. Органическую фазу сушат над безводным сернокислым натрием. Растворитель удаляют. Продукт очищают колоночной хроматографией на силикагеле, элюент - хлористый метилен.
Получение заявленных соединений (2-12) по первому варианту способа проведено в условиях примера, химическая реакция показана ниже, при этом исходные вещества и характеристики полученных соединений приведены в табл. 1.
Схема взаимодействия (реакция):
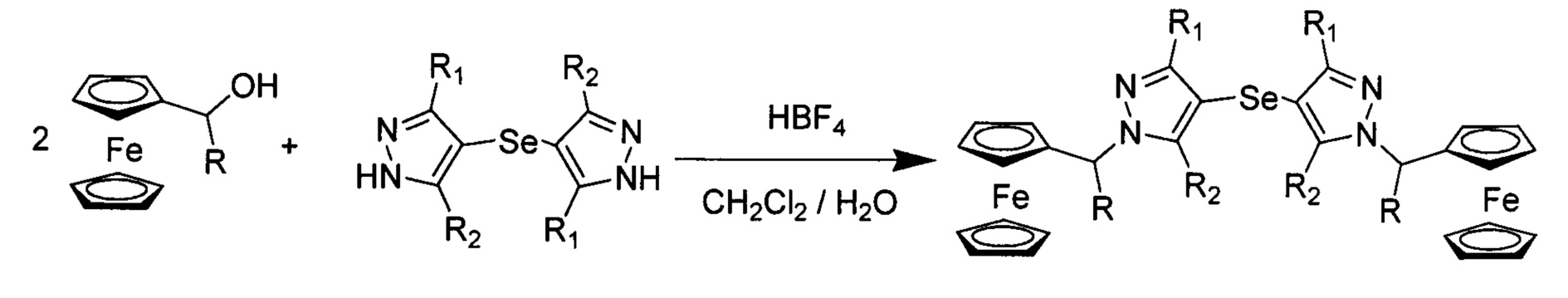




Способ по второму варианту заключается во взаимодействии α-ферроценилалкилпиразола, имеющего соответствующие заявленным радикалы, с оксидом селена в пиридине при кипячении. Пример 13. 294 г (1 ммоль) 1-ферроценилметил-3,5-диметил-пиразола и 0.17 г (1.5 ммоль) диоксида селена растворили в 10 мл свежеперегнанного пиридина и кипятили при перемешивании в течение 6 часов. Растворитель удалили на роторном испарителе в вакууме водоструйного насоса. Желто-коричневый остаток обработали 5 мл водного раствора NaOH (60 мг, 1,5 ммоль). Полученный желтый осадок отфильтровали, промыли дважды дистиллированной водой и сушили над безводным сернокислым натрием. Продукт очищали путем колоночной хроматографией на силикагеле, элюент - хлористый метилен.
Примеры 14-24 отражены ниже в таблице 2.
Схема химического взаимодействия:




Как видно из приведенных выше примеров, заявляемые соединения по каждому из вариантов способа получены с использованием простых технологичных приемов, не требующих жестких условий, специального оборудования, инертной атмосферы и высоких температур.
Ниже приведены результаты исследований заявленного продукта, подтверждающие достижение технического результата. Заявленный ряд соединений показал идентичные результаты.
Пример 25. Адаптогенные свойства.
Заявляемые соединения I обладают оптимальным, с точки зрения фармакокинетики и фармакодинамики, соотношением липофильных и гидрофильных свойств, так как в нейтральной форме они обладают повышенной растворимостью в липидах (благодаря объемному неполярному ферроценовому заместителю). Это облегчает прохождению соединений через биологические мембраны, в полярных средах организма оно может переходить в ионную форму (благодаря окислению ферроценового фрагмента до катиона феррициния), что способствует миграции в полярных биологических жидкостях (кровь, лимфа).
Физиологическая активность соединений типа I, проявляющаяся в адаптогенных свойствах, в условиях высоких и сверхвысоких нагрузок была показана на всем ряде веществ. Ниже приводятся данные для одного из них а именно, бис-(1-ферроценилэтил-3,5-диметил-5метил-1Н-пиразол-4-ил)селена.
Высокие нагрузки выводят организм человека на грань его физических возможностей, даже в тех случаях, когда субъект владеет техникой эффективной релаксации и динамического селективного расслабления различных групп мышц.
Когда стресс-раздражитель имеет высокие интенсивность и продолжительность воздействия или многократно повторяется, собственные приспособительные возможности организма существенно снижаются, а собственные энергометаболические ресурсы оказываются исчерпанными. Это вызывает потерю сопротивляемости и развитие тех механизмов общего адаптационного синдрома, который называют фазой истощения.
Эта стадия стресса (третья, по Селье - фаза дезадаптации) характеризуется расстройством механизмов нервной и гуморальной регуляции, доминированием катаболических процессов (процессов деструкции и распада) в тканях и органах, нарушением их функционирования. В конечном итоге снижается общая резистентность и приспособляемость организма, нарушается его жизнедеятельность.
В этих условиях на фоне нарастающего энергодефицита, утраты метаболических ресурсов с высокой скоростью происходит накопление токсических недовосстановленных метаболитов кислорода, что, в свою очередь, порождает накопление в организме перекисей липидов и повреждение мембран клеток различных тканей.
Результатом срыва тканевого гомеостаза в организме является возникновение травм, развитие вторичных иммунодефицитов с активацией патогенного потенциала собственной микрофлоры, срывов пищеварения, язвенных изменений слизистой пищеварительного тракта, нейродермитов, грибковых заболеваний кожи, снижения потенции. В условиях арктического стресса к этому добавляется глубокая гипоксия организма.
Употребление полученных продуктов по настоящему изобретению способствует: ускорению релаксации после высоких нагрузок, восстановлению иммунологического гомеостаза, профилактике посленагрузочного стресса и, самое главное, перераспределению тканевых депо и скрытых липидных ресурсов, в частности, переводу висцерального жира в митохондриальный бурый жир и затем в синтез белка и формированию новых миофибрилл.
Продукт позволяет повысить работоспособность организма в экстремальных условиях, повысить скорость ответов на внешние раздражители (физическая и психоэмоциональная нагрузка, воздействие электромагнитных и радиационных полей и их комбинаций) и устранить последствия стрессорных посленагрузочных напряжений.
Биологические испытания проведены нами в три этапа: (1) исследование острой токсичности, (2) определение диапазона рабочих доз, (3) исследование адаптогенной эффективности. Первые два проводились на лабораторных животных - линейных мышах, третий - на свиньях.
Дозы для свиней определялись после предварительной оценки острой токсичности соединения I и определения диапазона рабочих доз в испытаниях in vivo на инбредных мышах - гибридах первого поколения f1(C57Bl/6xDBA2) - BDF1 разведения питомника РАМН "Столбовая". В опытах использовано 70 мышей, самцов с массой тела 20-22 г.
Пример 26.
Препарат соединения I вводился мышам перорально (п/о) в растворе подсолнечного масла с концентрацией 10 мг/мл.
Изучение острой токсичности препарата показало, что при однократном п/о введении в диапазоне доз 50-750 мг/кг он хорошо переносится животными, не вызывает их гибели, снижения массы тела, изменения внешнего вида шерстного покрова, поведенческих реакций, активности мышей в течение всего периода наблюдения (1 месяц). Объем вводимого п/о раствора препарата колебался в зависимости от дозы соединения Ia (R=Ri=R2=СН3) в пределах от 0,1 мл до 1,5 мл.
Соединение Ia в примененных дозах не оказывает отрицательного влияния на динамику изменения массы тела подопытных животных. Показатели массы тела мышей, получавших соединение Ia, практически не отличаются от контрольных значений.
Внешний вид животных, получавших соединение Ia, их аппетит, активность, подвижность, поведенческие реакции, деятельность желудочно-кишечного тракта соответствовали норме.
Таким образом, установлено, что в испытанном диапазоне доз соединение Ia хорошо переносился животными, не вызывал их гибели, снижения массы тела, изменения поведенческих реакций в течение периода наблюдения (1 месяц).
Пример 27.
Определение рабочего дозового диапазона проводилось на модели перевиваемой опухоли мышей - карциноме легких Льюис (мыши линии BDF1).
Соединение Ia вводилось мышам в дозах 50, 100, 150 мг/кг в сутки п/о в растворе подсолнечного масла по 0,4 мл ежедневно, четырехкратно, начиная со следующих суток после перевивки опухоли.
Значения коэффициента торможения роста опухоли составляют 77, 65 и 71%, для доз 100, 50, и 150 мг/кг в сутки на 8 сутки после перевивки опухоли.
В соответствии с этим, в качестве основной рабочей дозы для эксперимента на свиньях была выбрана доза 100 мг/кг
Пример 28.
Влияние препарата соединения Ia на сердечную и дыхательную системы.
Испытания препарата соединения Ia проводились на свиньях-кроссах пород крупная белая/йоркшир на опытно-экспериментальной базе ГосНИИ животноводства (пос.Дубровицы). В экспериментах было использовано 18 свинок в возрасте 3-4,5 месяцев. Полная продолжительность эксперимента составила 48 дней, из них 14 дней подготовительный этап и 34 дня опыт (тренировочные нагрузки).
Препарат соединения Ia (ПС Ia) выдавалось перорально, в составе корма в соответствии с Программой испытаний, в течение 34 дней (опытный период). Суточная доза ПС Ia составила: первые 13 дней 50 мг/кг, в последующие дни - 100 мг/кг.
В результате предварительных испытаний установлено, что включение в рацион свинок ПС Ia в дозе 150 мг/кг не оказывало негативного влияния на функциональное состояние систем организма подопытных животных и способствовало улучшению их адаптации к интенсивным беговым нагрузкам.
Тренировку свинок осуществляли на специально оборудованной беговой дорожке MaxFit 26W с использованием системы интервального бега по Герштейну в варианте переменного бега: интенсивные отрезки чередовали с периодами релаксационного бега.
У свинок, получавших ПС Ia, по сравнению с контрольными животными отмечалось улучшение качественных и количественных показателей тренировок.
Например, отмечалось существенное снижение утомляемости животных в ходе тренировок, снижение числа ошибок при беге и повышалась скорость восстановления организма после интенсивных физических нагрузок. В частности, это иллюстрирует табл. 1, со средними значениями частоты сердечных сокращений (ЧСС) в контрольной и опытной группах (по 6 голов каждая).

Видно, что уже через 10 дней после начала тренировочных нагрузок базальный уровень ЧСС в контроле выше, чем в опытной группе. Следовательно, адаптация сердечной мышцы к нагрузкам в контроле ниже.
С этим наблюдением согласуются данные патоморфоза.
На вскрытии после завершения тренировочного цикла в контроле обнаружена гипертрофия сердечной мышцы, в то время как, в опытной группе, кардиогипертрофии не наблюдается.
Этот результат отчетливо проявляется в изменениях массы сердца опытных и контрольных животных.
В среднем в группе опытных животных по завершении беговых нагрузок масса сердца - около 215 г, в то время как, у контрольных ~ 267 г, т.е. на 24,2% больше. Это свидетельствует о том, что повышенная нагрузка, выражающаяся, в частности в том, что ЧСС у контрольных животных постоянно выше, чем в опыте, что и приводит к перегрузке сердца и возникающей вследствие этого к определенной дизадаптации в контроле и гипертрофии сердечной мышцы.
Кардиологические показатели корреспондируются с
морфофункциональными показателями альвеол легких. На вскрытии у контрольных животных обнаруживался ателектаз альвеол, чего не наблюдалось у опытных свинок.

Негативные последствия высоких нагрузок в контроле проявляются также на размерах альвеол (диаметр и площадь сечения). У опытных животных альвеолы заметно больше. Соответственно возрастает жизненная емкость легких.
Таким образом, на фоне высоких беговых нагрузок опытные животные оказываются более адаптированными к ним, нежели контроли.
Пример 29.
Влияние препарата соединения I на опорно-двигательный аппарат и на жировой обмен в организме.
В условиях высоких нагрузок большое значение имеет способность к адаптации опорно-двигательного аппарата.
Поскольку физический стресс приводит к истощению ресурсов, то возможна перестройка стратегии метаболизма с подключением жировых депо. Основная проблема в этом случае состоит в том, чтобы переключение метаболизма и мобилизация дополнительных ресурсов успевали бы за ростом нагрузки.
В этих условиях, регуляторы и адаптогены, влияющие на эту скорость, могут играть значительную или даже критическую роль.
В таблице 5 представлены морфометрические показатели волокон мышечной ткани свиней экспериментальных групп, М±m

Из данных табл. 5, колонка 4 отчетливо видно, что ПС Ia, не являясь стероидным гормоном, значительно усиливает пролиферацию мышечных клеток (миосателлитов) даже на фоне высоких нагрузок. Таким образом, мы наблюдаем рост числа миофибрилл, наращивание скелетной мускулатуры на фоне высоких нагрузок (колонки 2, 3).
Источник ресурсов организма становится ясен при анализе жировых тканей (табл. 6).


Из данных табл. 6 видно, что под влиянием препарата мышцы скелетной мускулатуры, задействованные в тренировочных нагрузках, становятся мощнее и суше (согласуется с данными табл. 3), повышается их рН, по сравнению с контролем, то есть токсическая нагрузка лактата становится ниже, что обусловлено ростом МПК.
Параллельно с этим, увеличивается выработка метаболически активного бурого жира (БЖ), являющегося мощным энергометаболическим резервом при высоких нагрузках, поскольку БЖ, в отличие от «классического» висцерального и подкожного жира, насыщен митохондриями и способен вырабатывать не только метаболическую энергию, но и чисто калорическое тепло. Это хорошо согласуется с данными об увеличении пролиферативной активности миоцитов (табл. 5, кол. 4), которая, как известно, приводит в выработке фактора транскрипции PGC1-α, стимулирующего переход обычных адипоцитов в клетки БЖ.
Как видно из приведенных выше результатов исследований, проведенных нами, заявленные соединения обладают повышенной адаптогенной и протективной активностью. Они также выполняют в организме функцию регуляторов липидного метаболизма. В этой связи представляется перспективным использовать заявленные новые соединения в функциональном питании в качестве источника селена.
Реферат
Изобретение относится к новым биологически активным ферроценилалкильным производным С,С'-дипиразолилселенидов общей формулы (I), где R представляет собой H или СНили СН, Rпредставляет собой СН, CF, СН, Rпредставляет собой СН, CF, СН. Кроме того, изобретение относится к вариантам способа их получения. Первый вариант способа заключается во взаимодействии α-гидроксиалкилферроцена, выбранного из ферроценилметанола, ферроценилэтанола, ферроценилфенилметанола с дипиразолилселенидом в двухфазной системе, содержащей несмешивающийся с водой органический растворитель, выбранный из CHCl, CHCl, CHCl, CCl, бензола, и водный раствор концентрированной кислоты, выбранной из HBF, HClO. Второй вариант способа предусматривает взаимодействии ферроценилалкилпиразола с диоксидом селена в растворе пиридина при кипячении. Целевой продукт по обоим вариантам способа подвергают хроматографической очистке на силикагеле с использованием в качестве элюента хлористого метилена. Изобретение обеспечивает расширение ассортимента биологически активных веществ с повышенной адаптогенной и протективной активностью. 3 н.п. ф-лы, 6 табл., 25 пр.(I)
Формула


Комментарии