Катионно - анионные комплексы палладия - RU2699809C9
Код документа: RU2699809C9
Чертежи


Описание
Область техники.
Изобретение относится к химии и медицине, а именно к новым катионно-анионным комплексам палладия, которые проявляют противоопухолевую и радиопротекторную активность и могут быть использованы при лечении широкого спектра злокачественных опухолей.
Предшествующий уровень техники
В настоящее время в клинической практике широко применяются противоопухолевые препараты на основе комплексов платины (цисплатин, карбоплатин и оксалиплатин).
Однако сохраняется большой круг злокачественных новообразований не чувствительных к этим препаратам, а также при повторных курсах химиотерапии нередко развивается резистентность опухоли к ним.
Кроме того, указанные выше противоопухолевые препараты на основе платины обладают высокой токсичностью, которая нередко не позволяет в необходимом объеме проводить лечение вследствие угнетения иммунной системы, кроветворной функции костного мозга, нарушения жизнедеятельности сердечно сосудистой и нервной систем, печени, почек и других систем организма.
В связи с этим, поиск новых препаратов в этой группе металлов является актуальной задачей, так как позволит предложить для лечения более эффективные и менее токсичные препараты и решить проблему приобретенной резистентности.
Разрабатываемые палладий-содержащие препараты являются близкими по группе к платиносодержащим противоопухолевым препаратам, при этом существующие отличия в механизме противоопухолевого действия обеспечивают соединениям палладия преимущество по эффективности и безопасности.
Известен класс соединений, представляющих собой моноядерные комплексы палладия, с общей формулой [AmH]n[PdCl4], проявляющие противоопухолевую активность, равную или превосходящую активность цисплатина.
В частности, наиболее перспективные соединения палладия этого класса - [C5H12NO]2[tPdCl4] и [C10H16NO]2[PdCl4] - обладают противоопухолевой активностью, равной или превосходящей цисплатин [1-3], и радиопротекторной активностью, равной или превосходящей таковую активность ранее изученных соединений на основе палладия и производных ароматических аминов [10, 11].
Кроме того, в евразийском патенте №010431 на изобретение «КООРДИНАЦИОННОЕ СОЕДИНЕНИЕ ПАЛЛАДИЯ И СПОСОБ ЕГО ПОЛУЧЕНИЯ» описан новый способ получения соединения палладия с формулой [C10H16NO]2[PdCl4], заключающийся во взаимодействии водного раствора 2-метиламино-1-фенил-1-пропанола солянокислого с сухим порошком хлористого палладия.
Известно изобретение «КОМПЛЕКСЫ ПАЛЛАДИЯ С ГЕТЕРОЦИКЛИЧЕСКИМИ ЛИГАНДАМИ» по патенту RU2291872, согласно которому получены соединения, общей формулы I:
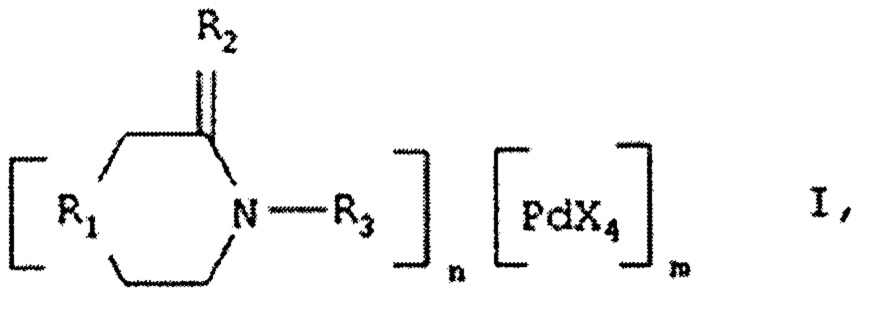
где R1-NH, О, СН2, R2-2H, О, R3-H, СН3, CH2-CH2-NH2, (СО)-СН3, X-Cl, Br, n=1, m-1, при R1-NH, О; R2-2H; R3-H, СН3; CH2-CH2-NH2; (СО)-СН3, n=2, m=1, при R1-O, СН2; R2-O, 2Н; R3-H, СН3, (СО)-СН3, n=2, m=3, при R1-NH; R2-2H; R3-CH2-CH2-NH2.
Данные соединения представляют собой комплексы палладия катион-анионного типа, проявляющие противоопухолевую активность и характеризующиеся пониженной токсичностью по сравнению с комплексами платины.
В качестве ближайшего аналога заявляемого изобретения могут быть выбраны ониевые (катион-анион) комплексы палладия, которые содержат протонированный катион и полиядерный анион, представленные на фиг. 1 в статье Efimenko I.A., Shishilov O.N. // Rus. J. Inorg. Chem. 2012, v. 57, IS. 14, p. 1695. В данном источнике информации описаны потенциально возможные моноядерные комплексы [PdCl4]2- с водородной связью катион - анион. Вместе с тем, проведенные исследования показали, что для наиболее эффективного использования моноядерных комплексов палладия в клинической практике требуется многократное (3-4-разовое) введение препарата. При разовом применении отмечено снижение лечебного эффекта, которое может быть объяснено недостаточным количеством активного вещества (палладия) при однократном введении препарата.
Краткое описание изобретения
Задачей изобретения является расширение арсенала химических соединений на основе палладия за счет полиядерных катионно-анионных комплексов, характеризующихся низкой токсичностью и обладающих высокой противоопухолевой активностью.
Поставленная задача решается созданием новых катионно-анионных комплексов палладия, которые согласно изобретению представляют собой полиядерные комплексы палладия, где в качестве катионов используются протонированные метилморфолин [C5H12NO]+(1) или 1-фенил-2-метиламинопропанол [C10H16NO]+(2), а в качестве анионов, соответственно [PdCl3]n1- (1) или [Pd2Cl6]2- (2), и проявляющие высокую противоопухолевую и радиопротекторную активность.
Комплекс 1: [C5H12NO]n[PdCl3]n имеет полимерную структуру, количество его фрагментов может быть многократно увеличено и, следовательно, индекс «n» принимает любые целые числовые значения без ограничения.
Создание полиядерных катионно-анионных комплексов палладия с катионом - протонированным амином, заключается в уменьшении в синтезе соотношения Pd:Am до соотношения 1:1 в противоположность синтезам многоядерных комплексов палладия с такими же катионами, в синтезе которых соотношение Pd:Am равно 1:2.
Такой подход при осуществлении синтеза в водной среде мог бы привести к образованию моноядерных комплексов [Am2PdCl2], не обладающих биологической активностью. Однако депротонирование катиона предотвращается за счет использования повышенного количества кислоты в синтезе. В случае осуществления синтеза в неводной среде решение поставленной задачи осуществляется использованием гидрохлоридов аминов.
Таким образом, протонированные катионы [C5H12NO]+и [C10H16NO]+ при изменении условий синтеза участвуют в образовании полиядерных соединений с анионами [PdCl3]n1- и [Pd2Cl6]2-.
Заявляемые полиядерные комплексы палладия и их свойства ранее не описаны.
В примерах 1-3 представлены схемы синтеза комплексов [C5H12NO]n[PdCl3]n (1) и [C10H16NO]2[Pd2Cl6] (2), а также изложены результаты изучения их структуры и физико-химических свойств.
Заявляемое изобретение позволяет получить новые катионно-анионные полиядерные комплексы палладия, которые обеспечивают более высокое содержание активного элемента - палладия. Так, сравнительный расчет содержания палладия в моноядерных соединениях (прототип) и биядерных (заявляемые соединения) показал его увеличение более чем на 10% в заявляемых комплексах.
В опытах 1-3 описаны исследования токсичности и биологической активности комплексов 1 и 2. Экспериментальные данные свидетельствуют о низкой токсичности и выраженной противоопухолевой и радиопротекторной активности заявляемых комплексов палладия.
Таким образом, полиядерные комплексы, содержащие в качестве катиона протонированные метилморфолин [C5H12NO]+ в (1) или 1-фенил-2-метиламинопропанол [C10H16NO]+ во (2), а в качестве аниона используют соответственно [PdCl3]n в (1) или [Pd2Cl6]2 во (2), являются перспективными для получения препаратов с высокой лечебной эффективностью.
Подробное описание изобретения
Пример 1. Синтез соединения [C5H12NO)]n[PdCl3]n(1) в водной среде
В круглодонную колбу помещали 0,89 г (8,8 ммоль) метилморфолина в смеси 20 мл воды и 0,90 мл конц. HCl. Затем при перемешивании добавляли 1,56 г (8,8 ммоль) дихлорида палладия, предварительно растертого до порошкообразного состояния, и еще 25 мл воды. Содержимое колбы перемешивали при t=40°С на магнитной мешалке в течение 5 часов до полного растворения дихлорида палладия. Раствор коричневого цвета профильтровывали и выпаривали на водяной бане при t=35°C до минимального объема. Образовавшийся при охлаждении осадок отфильтровали и высушивали в вакууме. Выход составлял 2.43 г (88% от введенного палладия).
Для [C5H12NO]n[PdCl3]n вычислено, %: С-19,07; N-4,44; Н-3,84; Pd-33,79; Cl-33,77.
Найдено, %: С-19,07; N-3,94; Н-4,34; Pd-33,66; Cl-33,97.
Пример 2. Синтез соединения [C5H12NO]n[PdCl3]n(l) в неводной среде
Для осуществления синтеза в неводной среде необходимо предварительное получение гидрохлорида метилморфолония по реакции: C5H11NO+HCl→C5H12NOCl, при взаимодействии 2,5 г метилморфолина, растворенного в 30 мл Н2О, с 3 мл конц. HCl, с последующим выделением из раствора кристаллического продукта в твердом виде.
В коническую колбу с обратным холодильником помещали 0,45 г (3,32 ммоль) гидрохлорида метилморфолония и 0,59 г (3,32 ммоль) хлорида палладия, предварительно растертых до порошкообразного состояния, и приливали 30 мл хлористого метилена. Смесь перемешивали при 30°С в течение 15 часов. Образовавшийся осадок розовато-бежевого цвета отфильтровывали, промывали хлористым метиленом и высушивали на воздухе при комнатной температуре до постоянной массы. При перекристаллизации из водного раствора получали монокристаллы вишневого цвета для РСА. Выход продукта - 0.96 г (91% в расчете на введенный в реакцию палладий).
Для [C5H12NO]n[PdCl3]n вычислено, %: С-19,07; N-4,44; Н-3,84; Pd-33,79; Cl-33,77.
Найдено, %: С-18,97; N-4,14; Н-4,47; Pd-33,65; Cl-33,52.
Пример 3. Синтез соединения [С10Н16NО]2[Pd2Cl6](2) в неводной среде
В круглодонную колбу помещали раствор 0,25 г (1,24 ммоль) солянокислого 1-фенил-2-аминопропанола, добавляли 10 мл ацетона и 2 мл ледяной уксусной кислоты и раствор 0,4760 г (1,25 ммоль) (C6H5CN)2PdCl2 в 30 мл ацетона. Смесь перемешивали с помощью магнитной мешалки при комнатной температуре до полного растворения твердой фазы (4 часа), затем на роторном испарителе выпаривали до объема 10 мл. После охлаждения смеси осадок отфильтровывали через стеклянный фильтр, сушили в вакууме при комнатной температуре. Выход продукта составлял 0,34 г (93% от введенного палладия).
Для [C10H16NO]2[Pd2Cl6] вычислено, %: С-31,69; N-3,70; Н-4,26; Pd-28,08; Cl-28,06.
Найдено, %: С-32,23; N-4,02; Н-4,35; Pd-28,43; Cl-28,31.
Изучение структур 1 и 2 было проведено методом рентгеноструктурного анализа.
Рентгеноструктурные данные показали, что если строение комплекса 2 описывается формулой [C10H16NO+]2⋅[Pd2Cl62-], то комплекс 1 следует описывать формулой [C5H12NO+]n⋅[PdCl3-]n.
Полученные хлорпалладаты 1 ([C5H12NO+]n⋅[PdCl3-]n) и 2 ([C10H16NO+]2⋅[Pd2Cl62-]) содержат в 1 - полимерный цепочечный анионы [PdCl3-]n и во 2 - димерный Pd2Cl62- соответственно. В качестве противоиона в 1 - катион N-метилморфолоний, а в 2 - молекула (1R,2S)-(-)-эфедрония)-1-фенил-2-аминопропалоний.
В структуре 2 практически плоский (в пределах 0.145(2) Å) анион находится в общем положении (фиг. 1). Оба атома палладия имеют слегка искаженное плоско-квадратное окружение с цис-углами Cl-Pd-Cl, лежащими в пределах 85.70(6)-94.33(7)°. Как и следует ожидать, терминальные расстояния Pd-Cl (2.273(2)-2.297(2) Å) заметно меньше мостиковых (2.311(2)-2.339(2) Å). Это находится в согласии с данными Кэмбриджского банка структурных данных (КБСД, ноябрь 2017 г., вер. 5.39), в котором для 34 изолированных анионов Pd2Cl62- эти расстояния в среднем составляют 2.275 и 2.327 Å соответственно.
В структуре 1 были обнаружены полимерные цепочечные анионы [PdCl3-]n. Фрагменты PdCl3- находятся в общем положении, а соседние элементы цепи порождаются кристаллографическими осями 21, проходящими вдоль направления а. Атом палладия имеет почти идеальное плоско-квадратное окружение с цис-углами Cl-Pd-Cl, лежащими в пределах 89.44(2)-90.28(2)°. Интересно отметить, что в отличие от предыдущего случая, терминальные и мостиковые расстояния Pd-Cl в этом анионе практически одинаковы: 2.2975(6), 2.3045(6) и 2.3082(6), 2.3137(7) Å соответственно. Кроме того, в отличие от мостикового димерного аниона Pd2Cl62- в структуре 2, где углы Pd-Cl-Pd при мостиковых атомах хлора в силу стерических близки к 90° (93.37(7) и 94.33(7)°), в анионе [PdCl3-]n данный угол значительно больше и составляет 107.08(3)°. К настоящему времени в КБСД имеются сведения только об одной структуре, содержащей аналогичный цепочечный анион, диметиламмонийной соли n[Me2NH2+]⋅[PdCl3-]n (5) [4-7]. Однако в соединении 5 плоско-квадратный атом палладия расположен на кристаллографическом центре инверсии, а угол при мостиковом атоме хлора значительно меньше - 101.2°. А вот мостиковые и терминальные расстояния Pd-Cl в кристалле 5, как и в соединении 2, весьма близки и составляют ~2.31 Å.
В соединении 1 катион метилморфолиния принимает конформацию ванны, а метальная группа занимает экваториальное положение. В структуре 2 присутствуют два кристаллографически независимых хиральных катиона с близкими геометрическими параметрами. Интересно, что они оба имеют гош-конформацию относительно связи Ph(HO)C-C(Me)NH2Me с торсионными углами Ph-C-C-N, близкими к 180° (176.1(6) и 172.8(6)°). Аналогично, в обоих катионах связи Me-C-N-Me принимают транс-конформацию с торсионными углами 158.5(7) и 171.7(7)° соответственно.
В кристалле 1 катионы N-метилморфолиния связаны слабой бифуркатной водородной связью N-H…Cl с терминальными атомами хлора полимерного аниона (d(N…Cl)=3.353(2), 3.401(2) Å) (фиг. 1).
В структуре 2 димерные анионы Pd2Cl62- связаны между собой в слои, перпендикулярные кристаллографической оси а за счет слабых, направленных почти перпендикулярно плоскостям анионов, взаимодействий Pd1…Cl1 (3.229 Å) и Pd1…C16 (3.751 Å). Межслоевые пространства заняты катионами, связанными с анионами за счет слабых водородных связей типа ОН…Cl и NH…Cl, образованных только за счет всех четырех терминальных атомов хлора (фиг. 2). Параметры этих Н-связей приведены в таблице 1.

Опыт 1. Изучение токсичности полученных соединений
Острую токсичность определяли при однократном внутривенном введении аутбредным мышам самкам растворов комплексов в диапазоне доз. Перед введением комплексы растворяли в 0,9% изотоническом растворе натрия хлорида (ООО Гротекс, РФ) до концентрации препарата 0,4%. Введение осуществляли в хвостовую вену мыши внутривенно медленно в течение 15-20 секунд. В качестве тест-системы были использованы здоровые половозрелые аутбредные нелинейные мыши самки массой 18-20 г. В каждую экспериментальную группу включали по 6 особей. Общее количество животных на каждый комплекс составило 36 особей. За два часа до эксперимента животных лишали корма, но не воды. Срок наблюдения за животными составил 14 дней. В период эксперимента регистрировались гибель животных и клинические признаки интоксикации.
Исследование острой токсичности комплексов 1 и 2 при их внутривенном введении показало, что у комплекса 1 LD50=95 мг/кг, а у комплекса 2-100,4 мг/кг, т.е. эти соединения принадлежат к соединениям 3-го класса токсичности и опасности, что позволяет считать их умеренно токсичными соединениями. [8].
Опыт 2. Изучение противоопухолевой активности полученных соединений
Оценка противоопухолевой активности проведена на перевиваемой мышиной карциноме легких Льюис (КЛЛ).
Штамм КЛЛ получен из банка опухолевых материалов ФГБУ РОНЦ им. Н.Н. Блохина и поддерживался на самцах мышей C57BL6j. Трансплантацию КЛЛ самцам мышей F1 (CBA×C57BL6j) проводили подкожным введением 1,9⋅106 опухолевых клеток в 0,1 мл суспензии в область латеральной поверхности правого бедра, на которой предварительно депилировали шерстный покров.
Животных включали в опыт на 7 сутки после перевивки КЛЛ, когда опухолевый узел уже сформировался и достигал измеряемого размера практически у всех мышей. Методом рандомизации животных распределили на четыре группы - контрольную и три подопытных, по 15 мышей в каждой. Животные контрольной группы в дальнейшем не получали никаких воздействий. Животным первой подопытной группы на 7, 8, 11, 12 и 13 сутки роста КЛЛ проводили в/в введение в боковую вену хвоста препарата сравнения цисплатину (EBEWEPharmaGes.m.b.H. Nfg. KG, Австрия) в дозе 1,2 мг/кг в виде 0,012% раствора - 0,1 мл на 10 г массы тела. Животным второй и третьей подопытных групп в эти же сроки проводили в/в введение в боковую вену хвоста, соответственно, комплекс 1, комплекс 2 в дозе 22 мг/кг в виде 0,22% раствора - 0,1 мл на 10 г массы тела. Все инъекционные растворы изготавливались extempore на основе изотонического раствора натрия хлорида (ОАО Дальхимфарм, РФ) и вводились внутривенно медленно.
Переносимость изучаемых препаратов оценивали по реакции животных на их введение и путем ежедневного осмотра и наблюдения за животными, в котором изучался неврологический статус по характеру спонтанной двигательной активности, общей возбудимости и реакции на тактильные и звуковые раздражители, а также по пищевой активности животных и динамике прироста их массы тела.
Влияние препаратов на опухолевый процесс изучали по динамике роста и активности метастазирования КЛЛ. Для этого каждые 3-4 суток у всех животных измеряли калипером максимальный (L) и минимальный (W) диаметр опухолевых узлов, и оценивали их объем в приближении V=(L×W2)×(π/6), которое надежно коррелирует с данными МРТ [12].
Противоопухолевый эффект оценивали путем статистического сравнения объема опухолевых узлов в контрольной и подопытных группах на различных сроках наблюдения, и по индексу торможения роста (ТРО): ТРО=(VK-VO)/VK×100%; где VK и VO - средние объемы узлов в контрольной и опытной группе [9]. На 21 сутки роста карциномы животных выводили из опыта путем цервикальной дислокации под эфирным наркозом, выделяли легкие, фиксировали их 24 часа в жидкости Буэна, и далее под микроскопом СХ21 (Olympus Corp., Япония; ×400) проводили подсчет числа крупных и мелких легочных метастазов. Антиметастатический эффект оценивали путем статистического сравнения числа метастазов в группах и по индексу ингибирования метастазирования (ИИМ): ИИМ=(fKMK - fOMO)/fKMK×100%; где fK и fO - доля животных с метастазами в контрольной и опытной группе, MK и МO - средние число метастазов в контрольной и опытной группе [9].
Статистическую оценку значимости межгрупповых различий регистрируемых показателей проводили путем рангового дисперсионного анализа Краскела-Уоллиса с последующим применением критерия Данна. Различия полагали достоверными на 0,05 уровне значимости. Расчеты выполнены с помощью программного пакета Statistica 7.0 (StatSofflnc, США).
Первичный анализ динамики роста КЛЛ в различных группах показал, что цисплатин и изучаемые комплексы в той или иной мере вызывали торможение роста опухоли (таблица 2). При этом наиболее выраженный, статистически достоверный противоопухолевый эффект наблюдался у животных-опухоленосителей, получавших комплекс 1 (таблица 2).

Примечание:* - статистически достоверное (р<0,05) с контролем по критерию Данна.
Показатели роста КЛЛ по каждому животному были нормированы на величину объема КЛЛ у этого животного на 7-е сутки после перевивки.
Результаты анализа показателей относительного роста КЛЛ в экспериментальных группах показали, что в данном опыте статистически достоверное противоопухолевое действие оказывали цисплатин, комплекс 1 и комплекс 2 (таблица 3).

Примечание:* - статистически достоверное (р<0,05) с контролем по критерию Данна.
Существенное торможение роста КЛЛ при воздействии цисплатина развивалось только к концу курса препарата (ТРО=28%) и в последующем возрастало до конца наблюдения (ТРО=48%). Развитие торможения КЛЛ при воздействии изучаемых комплексов развивалось более стремительно - уже после первых двух инъекций наблюдалось существенное торможение (ТРО=23-32%), к концу курса возрастало до 42-55%, и в дальнейшем достигало 60% (комплекс 1 и комплекс 2). При этом важно отметить, что в данном опыте выраженный противоопухолевый эффект комплекса 1 и комплекса 2 в отношении КЛЛ стабильно сохранялся по окончанию их курса (11-е сутки) не менее 10-ти суток.
Таким образом, по действующим формальным критериям отбора перспективных противоопухолевых средств (ТРО>50%; длительность эффекта по окончанию воздействия - не менее 1 недели [9]) комплекс 1 и комплекс 2 следует рассматривать как перспективные к дальнейшей разработке.
Активность метастазирования КЛЛ, как и ее рост, в данном опыте отличалась атипично высокой вариабельностью. Анализ показателей метастазирования карциномы показал, что выраженность антиметастатического действия изучаемых комплексов, в целом коррелировала с их противоопухолевым действием (таблица 4).

Примечание:* - статистически достоверное (р<0,05) с контролем по критерию Данна.
Цисплатин отчетливо подавлял процессы метастазирования (ИММ=69%), тем не менее, его эффект в данном опыте оставался в пределах статистической тенденции (р=0,08-0,17). Существенно более выраженное, статистически достоверное антиметастатическое действие оказывал комплекс 2 (ИММ=91%). Причем действие комплекса 2 не только ингибировало процессы метастазирования КЛЛ, но и достоверно подавляло рост легочных метастазов, число крупных метастазов снижалось более чем в 4 раза. Комплекс 1 по выраженности антиметастатического действия превосходил таковую у Цисплатина.
Таким образом, согласно действующим критериям по первичному отбору потенциальных антиметастатических средств (ИИМ>70% [9]) комплексы 1 и 2 следует рассматривать как перспективные соединения для дальнейшей разработки в качестве противоопухолевых средств с выраженными антиметастатическими свойствами.
Результаты эксперимента свидетельствуют, что карцинома легких Льюис - перевиваемая опухоль мышей, относящаяся к списку обязательных к использованию при доклиническом исследовании противоопухолевых средств [9], является чувствительной к действию комплекса 1 и комплекса 2.
По полученным в данном эксперименте показателям комплексы 1 и 2 проявляют выраженное противоопухолевое действие.
Опыт 3. Изучение радиопротекторной активности полученных соединений
Ранее у моноядерных соединений на основе палладия и производных ароматических аминов формулы(AmH)n[PdCl4], были обнаружены радиопротекторные свойства. [10, 11] В связи с этим комплекс 1 и комплекс 2 были подвергнуты исследованию на наличие у них защитных свойств при воздействии ионизирующего излучения.
Радиозащитные свойства комплекса 1 и комплекса 2 изучали на инбредных мышах самцах линии С57В1 массой тела 18-24 г. при внутривенном введении в дозах, составляющих 1/8 и 1/2 величины ЛД16 за 15-20 минут до однократного облучения и через 15-20 минут после облучения каждой фракцией при трехкратном ежедневном облучении.
Облучение осуществляли γ-лучами137Cs с мощностью 1,88-1,75 рад/с на установке «ИГУР». Однократное облучение животных производили в дозе 8,2 Гр, при которой ранее было обнаружено защитное действие соединений на основе палладия и производных ароматических аминов [10, 11], шкала возрастающих доз облучения при трехкратном ежедневном фракционном воздействии включала дозы 2,5, 3,0 и 3,5 Гр.
Животным опытных групп внутривенно в хвостовую вену вводили 0,35%-й раствор комплексов в изотоническом растворе хлорида натрия в дозах от 1/8 и 1/2 величины ЛД16 (у комплекса 1 ЛД16 - 71 мг/кг, у комплекса 2 ЛД16 - 77 мг/кг). Животным соответствующих групп контроля облучения вводили внутривенно физиологический раствор в объеме 0,3 мл на мышь. Животные группы биологического контроля не подвергались воздействию облучения, исследуемых комплексов и растворителя. Каждая экспериментальная группа животных включала от 12 до 24 особей, в том числе группа контроля облучения и группа биологического контроля.
Наблюдение за животными проводили в течение 30 суток. Следили за состоянием и поведением животных, отмечали количество павших и сроки их гибели. Выживаемость животных определяли в процентах на 30-й день наблюдения.
Результаты эксперимента свидетельствуют о наличии у обоих исследуемых комплексов радиозащитных свойств, которые более выражены у комплекса 2 в дозе 10 мг/кг (1/8 ЛД16) при однократном и фракционном (трехкратном) облучении.
Так, при однократном облучении профилактическое введение комплекса 2 в дозе 10 мг/кг (1/8 ЛД50) существенно облегчало течение лучевого поражения и обеспечило достоверное увеличение выживаемости животных до 58% по сравнению с контролем облучения - 4,5% (р<0,05). При введении комплекса 2 в дозе 39 мг/кг (1/2 ЛД16) перед однократным облучением также был зарегистрирован высокий процент выживаемости животных - 33%. Комплекс 1 в этом опыте также проявил радиозащитный эффект - при дозе 1/8 ЛД16 выживаемость составила 21%, при дозе 1/2 ЛД16 - 12,5%. При анализе смертности в группах животных контроля облучения и группах животных, получавших комплекс 1 и комплекс 2 в дозах 1/8 ЛД16 и 1/2 ЛД16 не выявлено каких-либо отличий: средняя продолжительность жизни павших животных в указанных группах находилась в диапазоне от 13,0±1,6 до 15,0±0,8 суток. Как известно, именно на 10-20 сутки после облучения происходит резкое угнетение гемопоэза и развитие острой лучевой болезни [13] (таблица 5).
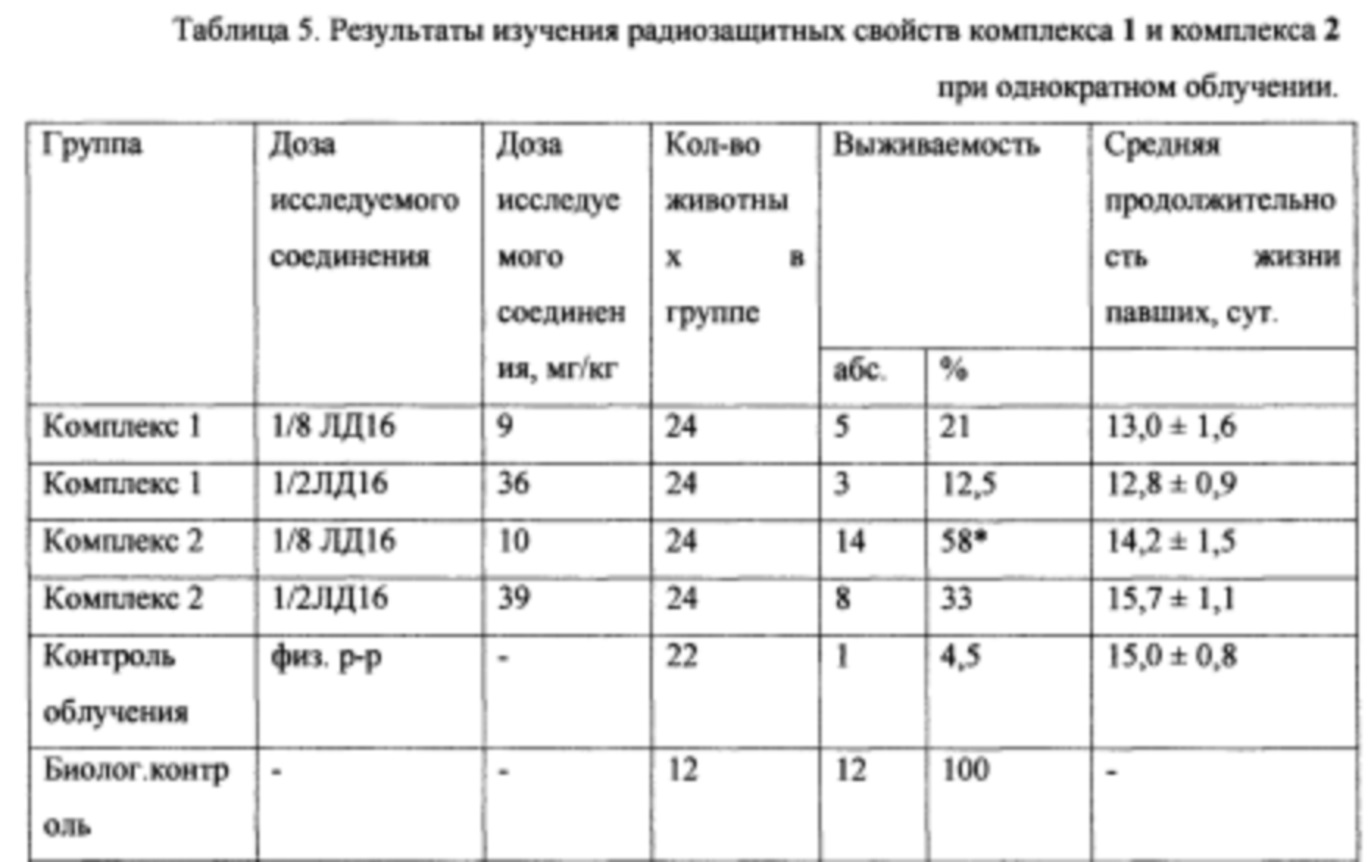
Примечание: * - статистически достоверное (р<0,01) с контролем по критерию Вилкоксона-Манн-Уитни.
В опыте с фракционным трехкратным облучением в возрастающих дозах 2,5 Гр, 3,0 Гр, 3,5 Гр наиболее эффективным также проявил себя комплекс 2, который в дозе 1/8 ЛД16 (10 мг/кг) обеспечил 75% выживаемости животных в сравнении с контролем облучения 33,3% и обеспечил максимальную защиту животным в самый пик развития острой лучевой болезни (10-20 сутки после облучения), продлив им жизнь до 21,3±5,5 суток, что на 8 суток дольше, чем в группе контроля облучения - 13,6±2,4 сут. Эффективность комплекса 1 при фракционном облучении составила при дозе 1/8 ЛД16 (9 мг/кг) - 42% выживаемости.
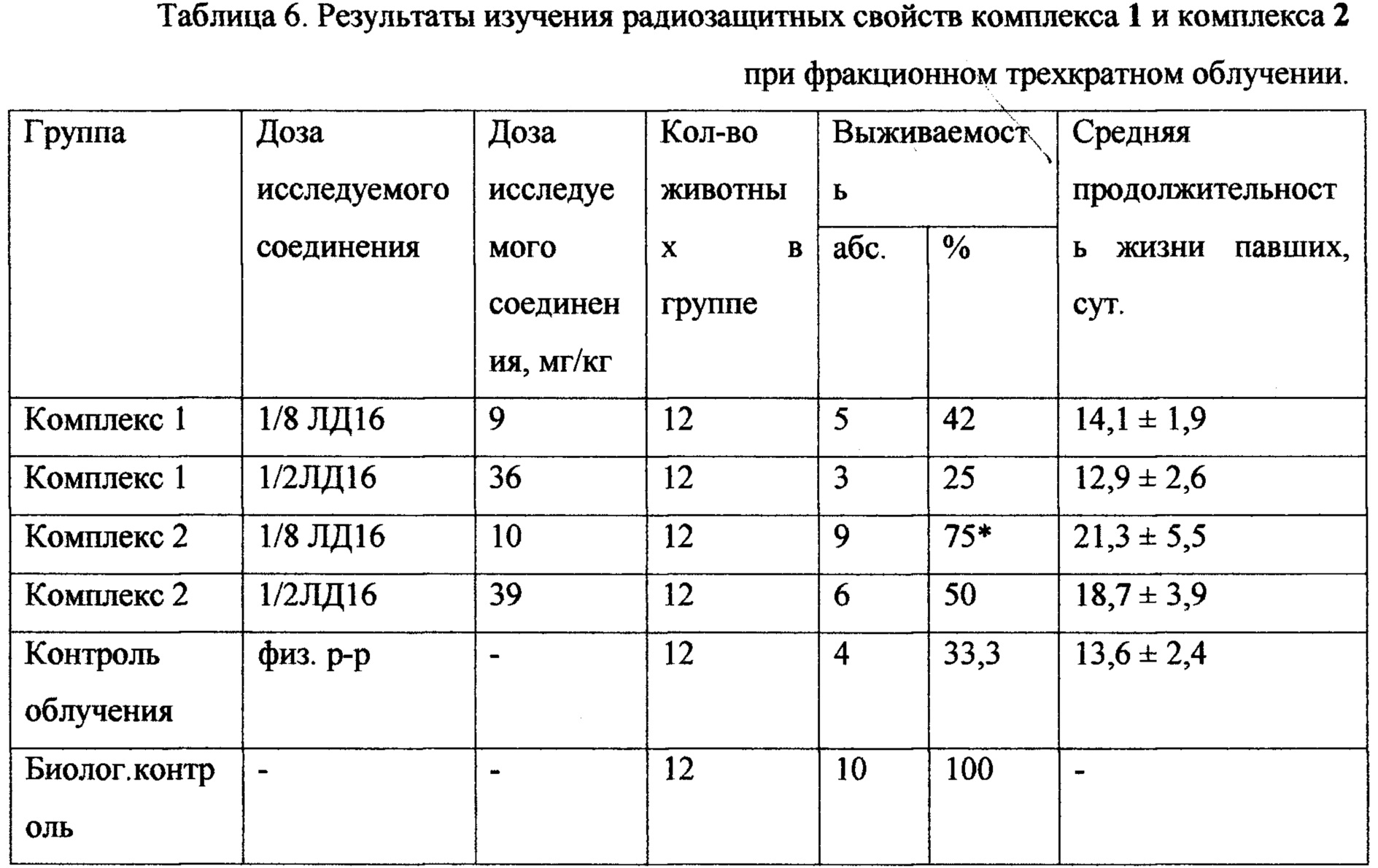
Примечание:* - статистически достоверное (р<0,01) с контролем по критерию Вилкоксона-Манн-Уитни.
По полученным в данном эксперименте показателям комплексы 1 и 2 проявляют выраженное радиопротекторное действие.
Таким образом, заявляемые полиядерные комплексы палладия характеризуются низкой токсичностью и проявляют высокую противоопухолевую и радиопротекторную активность.
Список литературы
1. Efimenko I.A., Shishilov O.N. // Rus. J. Inorg. Chem. 2012, v. 57, IS. 14, p.1695.
2. Ефименко И.А., Чураков A.B., Иванова Н.А., Ерофеева О.С., Демина Л.И. // Журн. неорг. хим., 2017, т. 62, №11. С. 1476.
3. Кузнецов Н.Т., Ефименко И.А., Иванова Н.А., Ерофеева О.С., Коновалова Н.П., Барчуков В.Г., Барчуков В.В., Петренко Е.Р. // Патент №2613305 от 15.03.2017.
4. Colin R. Groom, Frank Н. Allen, Angew. Chem. Int. Ed., 2014, 53, 662-671.
5. E.S. Raper, M. Kubiak, T. Glowiak, ActaCrystallogr., Sect. C., 1997, 53,1201-1204.
6. P. Vranec, I. Potocnak, P. Repovsky, ActaCrystallogr., Sect. C., 2012, 68, m370-m376.
7. Sheldrick, G.M., Acta. Crystallogr. A 2008, A64, 112-122.
8. Березовская И.В.// Токсикологический вестник, 2010, №5, с. 1041.
9. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. - М.. Гриф и К, 2012. - 944 с.
10. Патент РФ 2022968 от 15.11.1994 г. Соединения на основе палладия и производных ароматических аминов и способ их получения.
11. Патент РФ 2089186 от 10.09.1997 г. Способ защиты организма при многократном облучении ионизирующей радиацией.
12. Kawano K., Hattori Y., Iwakura Н. et al. Adrenal tumor volume in genetically engineered mouse model of neuroblastoma determined by magnetic resonance imaging // Exp. Ther. Med. - 2012. - V.4, N. 1. - P.61-64.
13. Радиационная медицина. Том I. Теоретические основы радиационной медицины. Под ред. Ильина Л.А. М.: Изд. AT, Государственный научный центр Институт биофизики. 2004.
Реферат
Изобретение относится к химии и медицине, а именно к новым катионно-анионным комплексам палладия. Комплексы содержат протонированный катион и полиядерный анион палладия. В качестве катионов используют протонированные метилморфолин [CHNO]или 1-фенил-2-метиламинопропанол [CHNO], а в качестве анионов, соответственно - [PdCl], где n - любое целое число, или [PdCl]. Новые полиядерные комплексы характеризуются низкой токсичностью и проявляют высокую противоопухолевую и радиопротекторную активность. 1 з.п. ф-лы, 2 ил., 6 табл., 3 пр.
Формула
Документы, цитированные в отчёте о поиске
Фармацевтическая композиция на основе соединения палладия

Комментарии