Комплексные соединения железа(iii) для лечения и профилактики симптомов железодефицита и железодефицитной анемии - RU2589710C2
Код документа: RU2589710C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение касается комплексных соединений железа(III) с β-кетоамидами и содержащих их фармацевтических композиций для применения в качестве лекарственных средств, в частности для лечения и/или профилактики симптомов железодефицита и железодефицитной анемии.
Уровень техники
Железо является незаменимым микроэлементом почти для всех организмов и необходимо, в частности, для роста и образования элементов крови. Сбалансированность метаболизма железа в данном случае регулируется главным образом на уровне возврата железа из гемоглобина стареющих эритроцитов и всасывания поступающего с пищей железа в двенадцатиперстной кишке. Высвобождающееся железо всасывается в кишечнике, в частности с помощью специфических транспортных систем (DMT-1, ферропортин, трансферрин, трансферриновые рецепторы), поступает в кровеносную систему и доставляется в соответствующие ткани и органы.
В организме человека железо играет огромную роль в переносе кислорода, усвоении кислорода, осуществлении функций клеток, таких как перенос электронов в митохондриях, и в энергообмене в целом.
В среднем, тело человека содержит 4-5 г железа, которое присутствует в ферментах, в гемоглобине и миоглобине, а также в виде депонированного или резервного железа в форме ферритина и гемосидерина.
Примерно половина этого железа, около 2 г, представляет собой железо-гем, связанное в составе гемоглобина эритроцитов. Поскольку эритроциты имеют ограниченное время жизни (75-150 дней), необходимо непрерывное образование новых и удаление старых эритроцитов (свыше 2 миллионов эритроцитов образуются каждую секунду). Высокую регенеративную способность обеспечивают макрофаги, поглощающие старые эритроциты посредством фагоцитоза, лизирующие их и регенерирующие полученное таким образом железо для дальнейшего метаболизма железа. Таким образом покрывается большая часть ежедневной потребности железа для эритропоэза, равной 25 мг.
Ежедневная потребность в железе у взрослого человека составляет от 0.5 до 1.5 мг в день, детям и беременным женщинам необходимо 2-5 мг железа в день. Ежедневная потеря железа, например вследствие отслоения клеток кожи и эпителия, невелика;
повышенная потеря железа наблюдается, например, во время менструального кровотечения у женщин. В целом, потеря крови может заметно понизить содержание железа, поскольку с двумя миллилитрами крови теряется примерно 1 мг железа. У здорового взрослого человека ежедневная потеря железа, в норме составляющая около 1 мг, обычно восполняется за счет ежедневного поступления с пищей. Уровень железа регулируется всасыванием, и процент всасывания железа из пищи составляет от 6 до 12%; в случае железодефицита процент всасывания возрастает до 25%. Уровень всасывания регулируется организмом в зависимости от потребности в железе и размера запасов железа. В ходе этого процесса организм человека усваивает ионы как двухвалентного, так и трехвалентного железа. Обычно соединения железа(III) растворяются в желудке при достаточно кислых значениях pH, и таким образом становятся доступны для всасывания. Всасывание железа осуществляется в верхнем отделе тонкого кишечника клетками слизистой. В ходе этого процесса трехвалентное железо, не входящее в состав гема, сначала восстанавливается в мембране клеток кишечника до Fe(II) для всасывания, например с помощью железо-редуктазы (связанный с мембраной дуоденальный цитохром b), так что затем оно может транспортироваться в клетки кишечника посредством транспортного белка DMT1 (переносчик 1 двухвалентного металла). Напротив, железо-гем поступает в энтероциты через клеточную мембрану без каких-либо изменений. В энтероцитах железо либо хранится в составе ферритина в качестве депонированного железа, либо выбрасывается в кровь транспортным белком ферропортином. В данном процессе центральную роль играет гепсидин, поскольку он представляет собой наиболее важный регулирующий фактор усвоения железа. Двухвалентное железо, транспортируемое в кровь ферропортином, превращают в трехвалентное железо оксидазы (церулоплазмин, гефестин), и затем трехвалентное железо транспортируется в соответствующие участки организма трансферрином (см., например, "Balancing acts: molecular control of mammalian iron metabolism". M.W.Hentze, Cell 117, 2004, 285-297.)
Организмы млекопитающих неспособны активно выводить железо. Метаболизм железа главным образом контролируется гепсидином через клеточное высвобождение железа из макрофагов, гепатоцитов и энтероцитов.
В случае патологий, пониженное содержание железа в плазме крови приводит к снижению уровня гемоглобина, ухудшенной выработке эритроцитов и, таким образом, к анемии.
Внешние симптомы анемии включают утомляемость, бледность и снижение концентрации. Клинические симптомы анемии включают низкое содержание железа в плазме крови (гипоферремия), низкие уровни гемоглобина, низкий уровень гематокрита, а также уменьшение количества эритроцитов, уменьшение количества ретикулоцитов и повышенный уровень рецепторов растворимого трансферрина.
Симптомы железодефицита или железодефицитную анемию лечат добавками железа. В данном случае, заместительную терапию железом осуществляют введением железа перорально или внутривенно. Кроме того, для стимулирования образования эритроцитов в лечении анемии можно применять эритропоэтин и другие вещества, стимулирующие эритрпоэз.
Частыми причинами анемии являются недоедание или диета с низким содержанием железа, или пристрастия к пище с несбалансированным содержанием железа. Кроме того, анемия возникает вследствие пониженного или плохого всасывания железа, например вследствие резекции желудка или таких заболеваний, как болезнь Крона. Кроме того, железодефицит может развиваться как последствие большой потери крови, такой как травма, сильное менструальное кровотечение или сдача крови. Кроме того, известна повышенная потребность в железе у подростков и детей в фазе роста, а также у беременных женщин. Поскольку железодефицит приводит не только к уменьшению образования эритроцитов, но также к ухудшению снабжения организма кислородом, следствием которого могут быть перечисленные выше симптомы, такие как утомляемость, бледность, снижение концентрации, и, особенно у подростков, долговременные отрицательные последствия в умственном развитии, высокоэффективная и хорошо переносимая терапия представляет особый интерес.
Применение комплексных соединений Fe(III) по настоящему изобретению дает возможность эффективно лечить симптомы железодефицита и железодефицитную анемию посредством составов для перорального введения, без необходимости мириться с потенциальными сильными побочными эффектами, присущими классическим препаратам, солям Fe(II), таким как FeSO4, которые вызваны окислительным стрессом. Таким образом можно избежать недостаточного соблюдения режима и схемы лечения, которое часто является причиной неполного выведения из состояния железодефицита.
В предшествующем уровне техники описано множество комплексов железа для лечения состояния железодефицита.
Очень большая часть таких комплексных соединений состоит из полимерных структур. Большинство таких комплексных соединений представляют собой железо-полисахаридные комплексные соединения (WO 20081455586, WO 2007062546, WO 20040437865, US 2003236224, ЕР 150085). Лекарственные средства именно из этой области доступны на рынке (такие как Maltofer, Venofer, Ferinject, Dexferrum, Ferumoxytol).
Другая большая часть группы полимерных комплексных соединений представляет собой железо-белковые комплексные соединения (CN 101481404, ЕР 939083, JP 02083400).
В литературе описаны также комплексные соединения Fe, структура которых является производной таких макромолекул, как гемоглобин, хлорофилл, куркумин и гепарин (US 474670, CN 1687089, Biometals, 2009, 22, 701-710).
Низкомолекулярные комплексные соединения Fe также описаны в литературе. Большое число таких комплексных соединений Fe содержат карбоновые кислоты и аминокислоты в качестве лигандов. В данном случае, в центре внимания находятся аспартаты (US 2009035385) и цитраты (ЕР 308362) в качестве лигандов. В этом контексте описаны также комплексные соединения Fe, содержащие производные фенилаланиновых групп в качестве лигандов, (ES 2044777).
Кроме того, в литературе описаны комплексные соединения Fe, построенные из мономерных фрагментов Сахаров или из комбинации мономерных и полимерных фрагментов (FR 19671016).
Гидроксипироновые и гидроксипиридоновые комплексные соединения Fe также описаны в литературе (ЕР 159194, ЕР 138420, ЕР 107458). Также описаны аналогичные им соответствующие 5-членные циклические системы, гидроксифураноновые комплексные соединения Fe (WO 2006037449).
В литературе описаны также железо-циклопентадиенильные комплексные соединения (GB 842637).
В литературе описаны также β-кетоамиды в качестве лигандов для железа. Однако такие соединения не были предложены или использованы в качестве лекарственных средств, в частности для лечения состояния железодефицита. Они представляют собой кетоамидные структурные фрагменты, являющиеся структурными элементами сидерофоров (JACS, 2008, 130, 2124-2125). Кроме того, были описаны шестидентатные комплексные соединения железа с аэробактином (Inorg.chem. 2006, 45, 6028-6033). Кроме того, в литературе описаны триподные лиганды для Fe с β-кетоамидными структурными фрагментами (Inorg. chem. 1990, 29, 4096-9).
В литературе в качестве лигандов для Fe описаны также β-кетоамиды, несущие ароматические группы на амиде или кетоне, дающие комплексы с Fe(III) (Journal of the Chemical Society of Pakistan, 1991, 73, 79-83; Indian Journal of Chemistry, 1981, 20 A, 372-4; Journal of Inorganic and Nuclear Chemistry, 1973, 35, 1397-400; CanJChem. 1969, 47, 1693-6; Indian Journal of Chemistry, 1968, 6, 516-20).
В литературе в качестве лигандов для Fe(II) описаны также β-кетоамиды, содержащие пиридиновые группы (Journal of Inorganic and Nuclear Chemistry, 1967, 29, 2484-6.), бензилоксазолидиноновые или замещенные султамовые группы (Polyhedron, 1995, 14, 1397-9).
В US 2005/0192315 описаны соли хинолиновых соединений, стабилизированные относительно нейтральных форм хинолиновых соединений (см. части 2 и 3). Среди описанных солей присутствует также N-этил-N-фенил-5-хлор-1,2-дигидро-4-гидрокси-1-метил-2-оксо-3-хинолинкарбоксамидная соль железа(III). В данном документе упомянуты также фармацевтические композиции. Однако в тексте документа не приведено никаких конкретных медицинских показаний, подкрепленных какими-либо данными. Таким образом, в данном документе не изучено медицинское применение комплексных соединений железа(III) с β-кетоамидами. Поскольку в этом документе все же должно быть изучено медицинское применение N-этил-N-фенил-5-хлор-1,2-дигидро-4-гидрокси-1-метил-2-оксо-3-хинолинкарбоксамидной соли железа(III), это исключено из настоящего изобретения. В статье Syamal, A.: "Ferric benzoylacetanilides" Canadian Journal of Chemistry, 47 (10), 1969, 1693-6, описаны только синтез и спектральные характеристики отдельных комплексных соединений бензоилацетанилид-железо.
Применение этих комплексов для лечения и профилактики симптомов железодефицита и железодефицитной анемии не описывается ни в одном из документов, процитированных выше по тексту.
Соли железа (например, сульфат железа(II), фумарат железа(II), хлорид железа(III), аспартат железа(II), сукцинат железа(II)) представляют собой другие важные компоненты лечения симптомов железодефицита и железодефицитной анемии.
Большой проблемой этих солей железа является то, что, частично, они имеют высокую несовместимость (до 50%) проявляющуюся в форме тошноты, рвоты, диареи, а также запоров и колик. Кроме того, при применении перечисленных солей железа(II) образуются свободные ионы железа(II), которые катализируют образование (среди прочего, реакцию Фентона) активных форм кислорода (ROS). Указанные ROS повреждают ДНК, липиды, белки и углеводы, что является причиной далеко идущих последствий в клетках, тканях и органах. Этот комплекс проблем известен и считается в литературе причиной высокой несовместимости и именуется окислительным стрессом.
Задача изобретения
Задачей настоящего изобретения является разработка новых терапевтически эффективных соединений, которые могут применяться для эффективной терапии симптомов железодефицита и железодефицитной анемии, предпочтительно с пероральным введением. В данном случае, описываемые комплексы железа должны обладать значительно меньшими побочными эффектами, чем классические применяемые соли Fe(II). Кроме того, описываемые комплексы железа, в отличие от известных полимерных комплексных соединений железа, должны иметь определенную структуру (стехиометрию) и могут быть получены простыми методами синтеза. Данная задача была выполнена путем разработки новых комплексных соединений Fe(III).
Кроме того, новые комплексы железа разрабатывались таким образом, чтобы они всасывались в клетки кишечника напрямую через мембрану, чтобы высвобождать связанное в комплексе железо напрямую в ферритин или трансферрин, или чтобы они поступали в кровеносную систему непосредственно в виде интактного комплекса. Предполагается, что, благодаря своим свойствам, разработанные новые комплексы практически не приводят к высоким концентрациям свободных ионов железа. А именно свободные ионы железа приводят к появлению ROS, которые вызывают наблюдающиеся побочные действия.
Чтобы удовлетворить перечисленные требования, авторы настоящего изобретения разработали новые комплексные соединения Fe(III) с не очень большим молекулярным весом, средней липофильности и оптимальной устойчивостью комплексов.
Раскрытие изобретения
Авторы настоящего изобретения обнаружили, что комплексные соединения Fe(III) с β-кетоамидными лигандами особенно хорошо удовлетворяют перечисленным выше требованиям. Оказалось возможным продемонстрировать, что разработанные комплексные соединения Fe(III) обеспечивают высокую всасываемость железа, что позволяет достичь быстрого терапевтического успеха в лечении железодефицитной анемии. Комплексные соединения по настоящему изобретению характеризуются более быстрой и высокой усваиваемостью, особенно в сравнении с солями железа. Кроме того, описываемые новые системы оказывают значительно более слабое побочное действие, чем классические применяемые соли железа, поскольку в их случае не образуется заметных количеств свободных ионов железа. Комплексные соединения по настоящему изобретению практически не вызывают окислительного стресса, поскольку не наблюдается образования свободных радикалов. Поэтому в случае описываемых в настоящем изобретении комплексных соединений наблюдается значительно меньше побочных эффектов, чем в случае солей Fe, ранее известных в данной области техники. Разработанные комплексные соединения демонстрируют хорошую устойчивость в разных диапазонах pH. Разработанные комплексные соединения могут быть легко получены и оптимально подходят для приготовления лекарственных составов, в частности применяемых перорально.
Таким образом, объектом настоящего изобретения являются комплексные соединения железа(III) с β-кетоамидами или их фармацевтически приемлемые соли, предназначенные для применения в качестве лекарственных средств. Также объектом настоящего изобретения являются комплексные соединения железа(III) с β-кетоамидами или их фармацевтически приемлемые соли, предназначенные для использования в способе терапевтического лечения человека или животного.
Описываемые комплексные соединения железа(III) с β-кетоамидами, в частности, включают соединения, содержащие следующий структурный элемент:


где

Настоящее изобретение охватывает также комплексные соединения железа(III) с β-кетоамидами, в которых β-кетоамидный лиганд образует мостик между разными атомами железа:

По настоящему изобретению, предпочтительными являются бидентатные β-кетоамидные лиганды, в которых связывание с атомом железа происходит через два кислородных атома в β-кето структурном фрагменте. Хотя настоящее изобретение охватывает β-кетоамидные лиганды с большим значением дентатности, такие как тридентатные, тетрадентатные, пентадентатные или даже гексадентатные β-кетоамидные лиганды, они менее предпочтительны вследствие высокой устойчивости комплексов (хелатный эффект), поскольку железо может не высвобождаться в организме в достаточном количестве из-за слишком высокой устойчивости комплексов. β-Кетоамидные лиганды с большим значением дентатности, в частности, представляют собой лиганды, которые, помимо двух кислородных атомов в β-кетоамидном фрагменте, содержат дополнительные координирующиеся функциональные группы, которые находятся, например, в описанных ниже заместителях R1-R4. Такими группами могут быть, например, кислород- или азотсодержащие функциональные группы, такие как гидроксигруппа, аминогруппа и т.п.
Комплексные соединения железа(III) с β-кетоамидами по настоящему изобретению включают, в частности, такие комплексные соединения, которые содержат по меньшей мере один, предпочтительно бидентатный, β-кетоамидный лиганд, связанный с одним или двумя разными атомами железа, как показано выше.
Предпочтительны комплексные соединения железа(III) с β-кетоамидами, которые содержат предпочтительно только бидентатные β-кетоамидные лиганды, которые могут быть одинаковыми или разными.
Кроме того, особенно предпочтительны комплексные соединения железа(III) с β-кетоамидами, которые содержат только одинаковые, предпочтительно бидентатные β-кетоамидные лиганды.
Однако настоящее изобретение охватывает также комплексные соединения, которые помимо β-кетоамидного лиганда, предпочтительно содержат один или больше (например, два или три) моно- или полидентатных лигандов, одинаковых или разных, таких как, например, карбоновые кислоты или карбоксилатные лиганды (R-COOH или RCOO-), спиртовые лиганды (R-OH), такие как углеводные лиганды, первичные или вторичные аминные лиганды (R-NH2, R-NHR), иминные лиганды (R=NH), оксимные лиганды (R=N-OH), гидроксильные лиганды (ОН или Н2О), простоэфирные лиганды или галогеновые лиганды. Такие комплексные соединения могут также образовываться как промежуточные при распаде в организме, то есть в особенности в водном растворе, и, где это применимо, в таком случае могут на промежуточных этапах быть координационно ненасыщенными.
В комплексных соединениях железа(III) с β-кетоамидами по настоящему изобретению, координационное число атомов железа обычно равно шести (6), при этом координирующиеся атомы обычно располагаются октаэдрически.
Кроме того, настоящее изобретение охватывает также моно- или полиядерные комплексные соединения железа(III) с β-кетоамидами, в которых присутствуют один или больше (например, 2, 3 или 4) атомов желез. Однако предпочтительны одноядерные комплексные соединения железа(III) с β-кетоамидами, в которых имеется центральный атом железа.
В целом, в комплексных соединениях железа(III) с β-кетоамидами могут присутствовать 1-4 атомов железа и 2-10 лигандов. Предпочтительны одноядерные комплексные соединения железа(III) с β-кетоамидами, содержащие по меньшей мере один предпочтительно три-, предпочтительно бидентатный β-кетоамидный лиганд.
Комплексные соединения железа(III) с β-кетоамидами обычно присутствуют в нейтральной форме. Однако в настоящее изобретение включены также солеобразные комплексные соединения железа(III) с β-кетоамидами, в которых комплекс имеет положительный или отрицательный заряд, скомпенсированный, в частности, фармакологически совместимыми, практически некоординирующими анионами (такими как, в частности, галогениды, такие как хлорид) или катионами (такими как, в частности, ионы щелочных или щелочноземельных металлов).
По настоящему изобретению, особенно предпочтительны комплексные соединения железа(III), содержащие по меньшей мере один лиганд формулы (I):
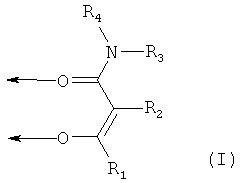
где
стрелки означают координационную связь с одним или разными атомами железа,
R1 выбран из группы, состоящей из необязательно замещенного алкила и необязательно замещенного алкоксикарбонила,
R2 выбран из группы, состоящей из атома водорода, необязательно замещенного алкила, атома галогена и цианогруппы, или
R1 и R2, вместе с атомами углерода, с которыми они связаны, образуют необязательно замещенный 5- или 6-членный цикл, который необязательно может содержать один или более гетероатомов,
R3 и R4 одинаковые или разные и соответственно выбраны из группы, состоящей из атома водорода, необязательно замещенной аминогруппы и необязательно замещенного алкила, или
R3 и R4, вместе с атомом азота, с которым они связаны, образуют необязательно замещенный 3-6-членный цикл, который необязательно может содержать один или более дополнительных гетероатомов,
или
R2 и R3 вместе образуют насыщенный или ненасыщенный, необязательно замещенный 5- или 6-членный цикл, формируя лиганд формулы (Ia):
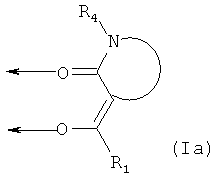
где R1 и R4 соответствуют данным выше определениям,
или
R2 и R3 вместе образуют насыщенный или ненасыщенный, необязательно замещенный 5- или 6-членный цикл, и R1 и R2 вместе образуют насыщенный или ненасыщенный, необязательно замещенный 5- или 6-членный цикл, формируя лиганд формулы (Ib):

где R4 соответствует данному выше определению, или их фармацевтически приемлемые соли.
Особенно предпочтительны по настоящему изобретению комплексные соединения железа(III), содержащие по меньшей мере один лиганд формулы (I):

где
стрелки означают координационную связь с одним или разными атомами железа,
R1 представляет собой необязательно замещенный алкил,
R2 выбран из группы, состоящей из атома водорода, необязательно замещенного алкила, атома галогена и цианогруппы, или
R1 и R2, вместе с атомами углерода, с которыми они связаны, образуют необязательно
замещенный 5- или 6-членный цикл, который необязательно может содержать один или более гетероатомов,
R3 и R4 одинаковые или разные и соответственно выбраны из группы, состоящей из атома водорода и необязательно замещенного алкила, или
R3 и R4, вместе с атомом азота, с которым они связаны, образуют необязательно замещенный 3-6-членный цикл, который необязательно может содержать один или более дополнительных гетероатомов, или, в другом варианте осуществления настоящего изобретения:
R2 и R3 вместе образуют насыщенный или ненасыщенный, необязательно замещенный 5-или 6-членный цикл, формируя лиганд формулы (Ia):

где R1 и R4 соответствуют данным выше определениям, или, в другом варианте осуществления настоящего изобретения:
R2 и R3 вместе образуют насыщенный или ненасыщенный, необязательно замещенный 5-или 6-членный цикл, и R1 и R2 вместе образуют насыщенный или ненасыщенный, необязательно замещенный 5- или 6-членный цикл, формируя лиганд формулы (Ib):

где R4 соответствует данному выше определению, или их фармацевтически приемлемые соли.
Предпочтительный вариант осуществления настоящего изобретения касается комплексных соединений железа(III), содержащих по меньшей мере один лиганд формулы (I):

где
стрелки означают координационную связь с одним или разными атомами железа,
R1 выбран из группы, состоящей из необязательно замещенного алкила и необязательно замещенного алкоксикарбонила, предпочтительно необязательно замещенного алкила,
R2 выбран из группы, состоящей из атома водорода, необязательно замещенного алкила, атома галогена и цианогруппы, или
R1 и R2, вместе с атомами углерода, с которыми они связаны, образуют необязательно замещенный 5- или 6-членный цикл, который необязательно может содержать один или более гетероатомов,
R3 и R4 одинаковые или разные, и соответственно выбраны из группы, состоящей из атома водорода, необязательно замещенной аминогруппы и необязательно замещенного алкила, предпочтительно атома водорода и необязательно замещенного алкила, или
R3 и R4, вместе с атомом азота, с которым они связаны, образуют необязательно замещенный 3-6-членный цикл, который необязательно может содержать один или более дополнительных гетероатомов.
В контексте настоящего изобретения, необязательно замещенный алкил, в частности для заместителей R1-R4, предпочтительно включает:
Линейный или разветвленный алкил, содержащий 1-8, предпочтительно 1-6, атомов углерода, циклоалкил, содержащий 3-8, предпочтительно 5 или 6, атомов углерода, или алкил, содержащий 1-4 атомов углерода, замещенный циклоалкилом, где перечисленные алкильные группы необязательно могут быть замещенными.
Упомянутые выше алкильные группы могут при необходимости иметь от 1 до 3 заместителей.
Данные заместители предпочтительно выбраны из группы, состоящей из: гидроксигруппы, необязательно замещенного арила, в частности как описано ниже, необязательно замещенного гетероарила, в частности как описано ниже, необязательно замещенной алкоксигруппы, в частности как описано ниже, необязательно замещенного алкоксикарбонила, в частности как описано ниже, необязательно замещенного ацила, в частности как описано ниже, галогена, в частности как описано ниже, необязательно замещенной аминогруппы, в частности как описано ниже, необязательно замещенного аминокарбонила, в частности как описано ниже, и цианогруппы.
Комплексные соединения железа(III), в которых R1, R2, R3 и/или R4 представляют собой арил- или гетероарил-замещенные алкильные группы, менее предпочтительны по настоящему изобретению.
Галогены включают, в данном случае и в контексте настоящего изобретения, фтор, хлор, бром и иод, предпочтительно фтор или хлор.
В описанных выше алкильных группах, при необходимости один или больше, более предпочтительно 1-3 атомов углерода, могут быть заменены на гетероаналогичные группы, содержащие азот, кислород или серу. Это означает, в частности, что, например, один или больше, предпочтительно 1-3, еще более предпочтительно одна (1) метиленовая группа (-СН2-) в составе алкильных групп может быть заменена на -NH-, -NR5-, -О- или -S-, где R5 представляет собой необязательно замещенный алкил, определение которому дано выше, предпочтительно С1-С6 алкил, такой как метил или этил, необязательно замещенный 1-3 заместителями, такими как фтор, хлор, гидроксигруппа, алкоксигруппа.
Примеры алкильных остатков, содержащих 1-8 атомов углерода, включают следующие: метильная группа, этильная группа, н-пропильная группа, изо-пропильная группа, н-бутильная группа, изо-бутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, изо-пентильная группа, втор-пентильная группа, трет-пентильная группа, 2-метилбутильная группа, н-гексильная группа, 1-метилпентильная группа, 2-метилпентильная группа, 3-метилпентильная группа, 4-метилпентильная группа, 1-этилбутильная группа, 2-этилбутильная группа, 3-этилбутильная группа, 1,1-диметилбутильная группа, 2,2-диметилбутильная группа, 3,3-диметилбутильная группа, 1-этил-1-метилпропильная группа, н-гептильная группа, 1-метилгексильная группа, 2-метилгексильная группа, 3-метилгексильная группа, 4-метилгексильная группа, 5-метилгексильная группа, 1-этилпентильная группа, 2-этилпентильная группа, 3-этилпентильная группа, 4-этилпентильная группа, 1,1-диметилпентильная группа, 2,2-диметилпентильная группа, 3,3-диметилпентильная группа, 4,4-диметилпентильная группа, 1-пропилбутильная группа, н-октильная группа, 1-метилгептильная группа, 2-метилгептильная группа, 3-метилгептильная группа, 4-метилгептильная группа, 5-метилгептильная группа, 6-метилгептильная группа, 1-этилгексильная группа, 2-этилгексильная группа, 3-этилгексильная группа, 4-этилгексильная группа, 5-этилгексильная группа, 1,1-диметилгексильная группа, 2,2-диметилгексильная группа, 3,3-диметилгексильная группа, 4,4-диметилгексильная группа, 5,5-диметилгексильная группа, 1-пропилпентильная группа, 2-пропилпентильная группа и т.д. Предпочтительными являются группы, содержащие 1-6 атомов углерода. Наиболее предпочтительны метил, этил, н-пропил и н-бутил.
Примерами алкильных групп, получаемых заменой на одну или больше гетеро-аналогичные группы, такие как -O-, -S-, -NH- или -N(R5)-, предпочтительно являются такие группы, в которых одна или больше метиленовых групп (-СН2-) заменены на -О- с образованием простоэфирной группы, такой как метоксиметил, этоксиметил, 2-метоксиэтил и т.п. Поэтому определение алкила также включает, например, алкоксиалкильные группы, определение которых дано ниже, которые получаются из описанных выше алкильных групп заменой метиленовой группы на -O-. Если в соответствии с настоящим изобретением алкоксигруппа дополнительно допускается в качестве заместителя для алкила, таким образом могут формироваться несколько простоэфирных групп (такие как -СН2-O-СН2-ОСН3-группа). Таким образом, по настоящему изобретению поли-простоэфирные группы также входят в определение алкила.
Примерами тио-содержащих алкильных радикалов, особенно в качестве R4, являются:
Циклоалкильные группы, содержащие 3-8 атомов углерода, предпочтительно включают следующие: циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, циклогептильная группа, циклооктильная группа и т.п. Предпочтительны циклопропильная группа, циклобутильная группа, циклопентильная группа и циклогексильная группа. Циклоалкильные группы могут быть необязательно замещены, предпочтительно 1-2 заместителями, такими как гидроксил, как например в случае 4-гидроксициклогексила, или C1-С6-алкоксикарбонил, как например в случае следующих радикалов:


Определение необязательно замещенного алкила также включает алкильные группы, которые замещены описанными выше циклоалкильными группами, такими как циклопропилметил, циклобутилметил, циклопентилметил или циклогексилметил.
Гетероциклические алкильные группы по настоящему изобретению предпочтительно представляют собой группы, образующиеся из циклоалкила при замене метилена на гетеро-аналогичные группы, и включают, например, насыщенные 5- или 6-членные гетероциклические остатки, которые могут быть присоединены через атом углерода или атом азота, и которые предпочтительно могут иметь 1-3, предпочтительно 2, гетероатома, особенно О, N, такие как тетрагидрофурил, азетидин-1-ил, замещенный азетидинил, такой как 3-гидроксиазетидин-1-ил, пирролидинил, такой как пирролидин-1-ил, замещенный пирролидинил, такой как 3-гидроксипирролидин-1-ил, 2-гидроксипирролидин-1-ил 2-метоксикарбонилпирролидин-1-ил, 2-этоксикарбонилпирролидин-1-ил, 2-метоксипирролидин-1-ил, 2-этоксипирролидин-1-ил, 3-метоксикарбонилпирролидин-1-ил, 3-этоксикарбонилпирролидин-1-ил, 3-метоксипирролидин-1-ил, 3-этоксипирролидин-1-ил, пиперидинил, такой как пиперидин-1-ил, пиперидин-4-ил, замещенный пиперидинил, такой как 4-метил-1-пиперидил, 4-гидрокси-1-пиперидил, 4-метокси-1-пиперидил, 4-этокси-1-пиперидил, 4-метоксикарбонил-1-пиперидил, 4-этоксикарбонил-1-пиперидил, 4-карбокси-1-пиперидил, 4-ацетил-1-пиперидил, 4-формил-1-пиперидил, 1-метил-4-пиперидил, 4-гидрокси-2,2,6,6-тетраметил-1-пиперидил, 4-(диметиламино)-1-пиперидил, 4-(диэтиламино)-1-пиперидил, 4-амино-1-пиперидил, 2-(гидроксиметил)-1-пиперидил, 3-(гидроксиметил)-1-пиперидил, 4-(гидроксиметил)-1-пиперидил, 2-гидрокси-1-пиперидил, 3-гидрокси-1-пиперидил, 4-гидрокси-1-пиперидил, морфолин-4-ил, замещенный морфолинил, такой как 2,6-диметил-морфолин-4-ил, пиперазинил, такой как пиперазин-1-ил, замещенный пиперазинил, такой как 4-метилпиперазин-1-ил, 4-этилпиперазин-1-ил, 4-этоксикарбонилпиперазин-1-ил, 4-метоксикарбонилпиперазин-1-ил или тетрагидропиранил, такой как тетрагидропиран-4-ил, и которые при необходимости могут быть конденсированы с ароматическими кольцами, и которые при необходимости могут быть замещены, например 1-2 заместителями, такими как гидроксигруппа, галоген, С1-С6-алкил и т.д. Таким образом, определение необязательно замещенных алкильных групп включает также алкильные группы, замещенные описанными выше гетероциклическими группами, такие как 3-(1-пиперидил)пропил, 3-пирролидин-1-илпропил, 3-морфолинопропил, 2-морфолиноэтил, 2-тетрагидропиран-4-илэтил, 3-тетрагидропиран-4-илпропил, 3-(азетидин-1-ил)пропил и т.п.
Примеры линейных или разветвленных алкильных групп, замещенных галогеном и содержащих 1-8 атомов углерода, включают, в частности, следующие: фторметильная группа, дифторметильная группа, трифторметильная группа, хлорметильная группа, дихлорметильная группа, трихлорметильная группа, бромметильная группа, дибромметильная группа, трибромметильная группа, 1-фторэтильная группа, 1-хлорэтильная группа, 1-бромэтильная группа, 2-фторэтильная группа, 2-хлорэтильная группа, 2-бромэтильная группа, 1,2-дифторэтильная группа, 1,2-дихлорэтильная группа, 1,2-дибромэтильная группа, 2,2,2-трифторэтильная группа, гептафторэтильная группа, 1-фторпропильная группа, 1-хлорпропильная группа, 1-бромпропильная группа, 2-фторпропильная группа, 2-хлорпропильная группа, 2-бромпропильная группа, 3-фторпропильная группа, 3-хлорпропильная группа, 3-бромпропильная группа, 1,2-дифторпропильная группа, 1,2-дихлорпропильная группа, 1,2-дибромпропильная группа, 2,3-дифторпропильная группа, 2,3-дихлорпропильная группа, 2,3-дибромпропильная группа, 3,3,3-трифторпропильная группа, 2,2,3,3,3-пентафторпропильная группа, 2-фторбутильная группа, 2-хлорбутильная группа, 2-бромбутильная группа, 4-фторбутильная группа, 4-хлорбутильная группа, 4-бромбутильная группа, 4,4,4-трифторбутильная группа, 2,2,3,3,4,4,4-гептафторбутильная группа, перфторбутильная группа, 2-фторпентильная группа, 2-хлорпентильная группа, 2-бромпентильная группа, 5-фторпентильная группа, 5-хлорпентильная группа, 5-бромпентильная группа, перфторпентильная группа, 2-фторгексильная группа, 2-хлоргексильная группа, 2-бромгексильная группа, 6-фторгексильная группа, 6-хлоргексильная группа, 6-бромгексильная группа, перфторгексильная группа, 2-фторгептильная группа, 2-хлоргептильная группа, 2-бромгептильная группа, 7-фторгептильная группа, 7-хлоргептильная группа, 7-бромгептильная группа, перфторгептильная группа и т.д.
Примеры алкильной группы, замещенной гидроксигруппой, включают перечисленные выше алкильные остатки, содержащие 1-3 гидроксильных фрагментов, такие как, например, гидроксиметил, 2-гидроксиэтил, 3-гидроксипропил, 4-гидроксибутил, 5-гидроксипентил, 6-гидроксигексил и т.п., и которые могут также содержать другие заместители, такие как алкоксикарбонил или могут содержать гетероатомы, такие как сера, такие как, например:
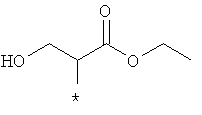
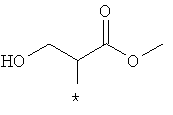
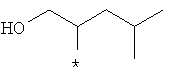
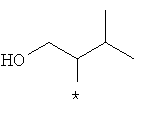
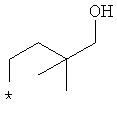

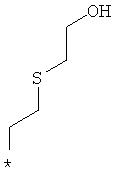

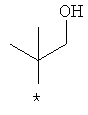




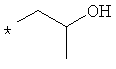

которые также все являются примерами R3 и/или R4.
Необязательно замещенный арил предпочтительно включает, в соответствии с настоящим изобретением, ароматические углеводородные остатки, содержащие 6-14 атомов углерода (без гетероатомов в ароматической циклической системе), например: фенил, нафтил, фенантренил и антраценил. Перечисленные выше ароматические группы при необходимости могут предпочтительно содержать один или больше, предпочтительно один, заместитель, в частности галоген, гидроксигруппу, алкил, алкоксигруппу, в каждом случае в соответствии с описаниями выше или ниже по тексту. Предпочтительной ароматической группой является фенил. Предпочтительным алкилом, замещенным ароматической группой (арилалкилом), является бензил.
Необязательно замещенный арил по настоящему изобретению также включает необязательно замещенный гетероарил, то есть гетероароматические группы, такие как, например: пиридил, пиридил-N-оксид, пиримидил, пиридазинил, пиразинил, тиенил, фурил, пирролил, пиразолил, имидазолил, тиазолил, оксазолил или изоксазолил, индолизинил, индолил, бензо[b]тиенил, бензо[b] фурил, индазолил, хинолил, изохинолил, нафтиридинил, хиназолинил. 5- или 6-членные ароматические гетероциклы, такие как, например пиридил, пиридил-N-оксид, пиримидил, пиридазинил, фурил и тиенил, являются предпочтительными. Перечисленные выше гетероароматические группы могут предпочтительно содержать один или больше, предпочтительно один, заместитель, в частности галоген, гидроксигруппу, алкил, алкоксигруппу, в каждом случае в соответствии с описаниями выше или ниже по тексту. Предпочтительными примерами алкила, замещенного гетероароматической группой (гетарилалкила) являются метил, этил, или пропил, в каждом случае замещенные гетероароматической группой, такие как тиенилметил, пиридилметил и т.д.
По настоящему изобретению, необязательно замещенная алкоксигруппа (RO-) включает, например, линейные или разветвленные алкоксигруппы, содержащие до 6 атомов углерода, такие как метоксигруппа, этоксигруппа, н-пропилоксигруппа, изо-пропилоксигруппа, н-бутилоксигруппа, изо-бутилоксигруппа, втор-бутилоксигруппа, трет-бутилоксигруппа, н-пентилоксигруппа, изо-пентилоксигруппа, втор-пентилоксигруппа, трет-пентилоксигруппа, 2-метилбутоксигруппа, н-гексилоксигруппа, изо-гексилоксигруппа, трет-гексилоксигруппа, втор-гексилоксигруппа, 2-метилпентилоксигруппа, 3-метилпентилоксигруппа, 1-этилбутилоксигруппа, 2-этилбутилоксигруппа, 1,1-диметилбутилоксигруппа, 2,2-диметилбутилоксигруппа, 3,3-диметилбутилоксигруппа, 1-этил-1-метилпропилоксигруппа и т.д. Предпочтительными являются метоксигруппа, этоксигруппа, н-пропилоксигруппа, изо-пропилоксигруппа, н-бутилоксигруппа, изо-бутилоксигруппа, втор-бутилоксигруппа, трет-бутилоксигруппа и т.д. Алкоксигруппы могут при необходимости быть замещенными, например заместителями, перечисленными выше как возможные для алкила.
Предпочтительными алкоксигруппами являются метокси, этокси, н-пропокси, н-бутокси и т.д.
Соответственно, необязательно замещенные алкоксикарбонильные (RO-CO-) группы формально являются производными описанных выше алкильных групп, получаемыми добавлением остатка -ОС(O)- с образованием необязательно замещенного алкилоксикарбонильного остатка. В этой связи смотри определение описанных выше алкильных групп. Альтернативно, необязательно замещенные алкоксикарбонильные (RO-CO-) группы являются производными упомянутых ранее алкоксигрупп, получаемыми добавлением карбонильной группы. Метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, н-бутоксикарбонил, трет-бутоксикарбонил и т.п. являются предпочтительными алкоксикарбонилами, которые могут быть замещены, как описано выше для алкильных групп.
Необязательно замещенные аминогруппы в соответствии с настоящим изобретением включают предпочтительно: аминогруппу (-NH2), необязательно замещенные моно- или диалкиламиногруппы (RHN-, (R)2N-), для которых определение необязательно замещенного алкила соответствует приведенному ранее описанию. Кроме того, включены необязательно замещенные моно- или диариламиногруппы или смешанные необязательно замещенные алкилариламиногруппы, для которых определение необязательно замещенного алкила или арила соответствует приведенному ранее описанию. Такие группы включают, например, метиламиногруппу, диметиламиногруппу, этиламиногруппу, гидроксиэтиламиногруппу, такую как 2-гидроксиэтиламиногруппа, диэтиламиногруппу, фениламиногруппу, метилфениламиногруппу и т.п. Необязательно замещенные аминогруппы дополнительно включают необязательно замещенную циклическую аминогруппу, такую как необязательно замещенная 5- или 6-членная циклическая аминогруппа, которая может содержать дополнительные гетероатомы, такие как N, О, S, предпочтительно О. Примеры таких циклических аминогрупп включают указанные выше азот-содержащие гетероциклические группы, связанные через атом азота, такие как пиперидин-1-ил, 4-гидрокси-пиперидин-1-ил, 2-(метоксикарбонил)пирролидин-1-ил, пирролидин-1-ил, морфолин-4-ил и т.п.
Необязательно замещенный ацил включает, в контексте настоящего изобретения, алифатический или ароматический ацил, где алифатический ацил представляет собой, в частности, формил и необязательно замещенный алкилкарбонил, для которых определение необязательно замещенного алкила соответствует приведенному ранее определению необязательно замещенного алкила. Ароматический ацил, таким образом, включает необязательно замещенный арилкарбонил, для которого определение необязательно замещенного арила соответствует приведенному ранее определению необязательно замещенного арила. Предпочтительные ацильные группы по настоящему изобретению включают, например: формил (-C(=O)H), ацетил, пропионил, бутаноил, пентаноил, гексаноил, и их изомеры в каждом случае, и бензоил. Заместители в составе ацильных групп включают перечисленные выше заместители для алкила и арила, соответствующие определения смотри выше.
Необязательно замещенный аминокарбонил по настоящему изобретению может формально рассматриваться как производное описанной выше необязательно замещенной аминогруппы, полученное добавлением карбонила ((R)2N-C(=O)-), и определение необязательно замещенной аминогруппы соответствует приведенному ранее. Примеры включают карбамоил (H2NC(=O)-), необязательно замещенный моно- или диалкиламинокарбонил (RHNC(=O)-, (R)2NC(=O)-), где определение необязательно замещенного алкила соответствует приведенному ранее. Кроме того, включены необязательно замещенные моно- или диариламинокарбонильные остатки или смешанные необязательно замещенные алкилариламинокарбонильные радикалы, где определение необязательно замещенного алкила и арила соответствует приведенным ранее. Такие группы включают, например метиламинокарбонил, диметиламинокарбонил, этиламинокарбонил, диэтиламинокарбонил, фениламинокарбонил, метилфениламинокарбонил и т.п.
По настоящему изобретению, предпочтительны комплексные соединения железа(III), содержащие по меньшей мере один лиганд формулы (I):

где
стрелки означают координационную связь с одним или разными атомами железа,
R1 представляет собой алкил, который необязательно может быть замещен 1-3 заместителями, выбранными из группы, состоящей из гидроксигруппы, алкоксигруппы, определение которой дано выше, в частности метоксигруппы, этоксигруппы, галогена, цианогруппы, алкоксикарбонила, определение которому дано выше, такого как, в особенности, метоксикарбонил, этоксикарбонил, и аминокарбонила, определение которого дано выше, в частности карбамоила, диметиламинокарбонила, или
R1 представляет собой алкоксикарбонил, который может быть замещен 1-3 заместителями, выбранными из группы, состоящей из гидроксигруппы, C1-C6-алкоксигруппы и галогена, в частности метоксикарбонил, этоксикарбонил, пропоксикарбонил и т.п.,
R2 выбран из группы, состоящей из
- атома водорода,
- алкила, который может быть необязательно замещен 1-3 заместителями, выбранными из группы, состоящей из гидроксигруппы, алкоксигруппы, галогена, цианогруппы и алкоксикарбонила,
- галогена, такого как хлор, фтор, предпочтительно фтор, и
- цианогруппы или
R1 и R2, вместе с атомами углерода, с которыми они связаны, образуют необязательно замещенный 5- или 6-членный цикл, такой как циклопентановый цикл или циклогексановый цикл, который может при необходимости также содержать один или более гетероатомов, и может иметь дополнительные заместители, такие как перечисленные выше для алкила,
R2 и R4 одинаковые или разные, и соответственно выбраны из группы, состоящей из атома водорода и алкила, который может необязательно быть замещен 1-3 заместителями, выбранными из группы, состоящей из гидроксигруппы, алкоксигруппы, галогена, цианогруппы, необязательно замещенной аминогруппы и алкоксикарбонила, и где алкил может содержать один или больше гетероатомов, выбранных из -О- или -S-, вместо -СН2-, и/или R3 и R4 выбраны из необязательно замещенных аминогрупп, описанных выше, в частности, гидроксиэтиламиногруппы, 4-морфолинила, 1-пиперидила, 4-гидрокси-1-пиперидила, пиперазин-1-ила, 4-метилпиперазин-1-ила.
В предпочтительном варианте осуществления, только один из R3 или R4 представляет собой атом водорода.
Или R3 и R4, вместе с атомом азота, с которым они связаны, образуют необязательно замещенный 3-6-членный цикл, который необязательно может содержать один или более дополнительных гетероатомов, такой как описанные выше необязательно замещенные гетероциклы, связанные через атом азота.
Или, в другом варианте осуществления настоящего изобретения R2 и R3 вместе образуют насыщенный или ненасыщенный, необязательно замещенный 5-или 6-членный цикл, формируя лиганд формулы (1а):

где R1 и R4 соответствуют данным выше определениям, как, например, реализуется в следующих соединениях:
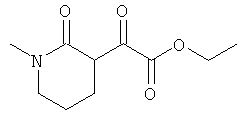
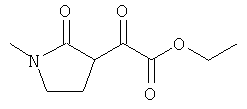

в котором роль заместителя играет оксогруппа,
или, в другом варианте осуществления настоящего изобретения R2 и R3 вместе образуют насыщенный или ненасыщенный, необязательно замещенный 5-или 6-членный цикл, и R1 и R2 вместе образуют насыщенный или ненасыщенный, необязательно замещенный 5- или 6-членный цикл, формируя лиганд формулы (Ib):

где R1 соответствует данному выше определению, или их фармацевтически приемлемые соли.
Особенно предпочтительны комплексные соединения железа(III) формулы (II):
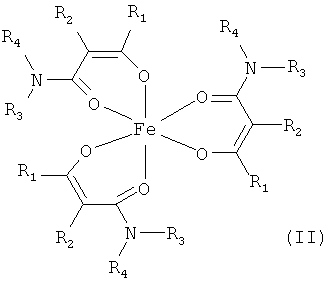
где R1, R2, R3 и R4 соответствуют определениям, приведенным выше или, предпочтительно, ниже по тексту.
В предпочтительном варианте осуществления настоящего изобретения, R1 выбран из группы, состоящей из:
- C1-6-алкила, предпочтительно как описано выше, необязательно замещенного С1-4 алкоксигруппой, как описано выше, или диалкиламинокарбонилом, тоже как описано выше,
- C3-6-циклоалкила, предпочтительно как описано выше,
- C3-6-циклоалкил-C1-4-алкила, предпочтительно как описано выше,
- C1-4-алкокси-C1-4-алкила, предпочтительно как описано выше,
- гидрокси-C1-4-алкила, предпочтительно как описано выше, и
- галоген-C1-4-алкила, предпочтительно как описано выше, или
- C1-4-алкоксикарбонила, предпочтительно как описано выше.
Особенно предпочтительно, R1 представляет собой C1-6-алкил, предпочтительно как описано выше, в частности метил, этил, пропил, в частности н-пропил, и бутил, в частности н-бутил. Наиболее предпочтительно, R1 представляет собой метил, этил и н-бутил, которые необязательно замещены C1-6-алкоксигруппой, такой как метоксигруппа, или ди-C1-6-алкиламинокарбонилом, таким как диметиламинокарбонил, или R1 представляет собой C1-4 алкоксикарбонил, в особенности метоксикарбонил или этоксикарбонил.
В предпочтительном варианте осуществления настоящего изобретения, R2 выбран из группы, состоящей из:
- атома водорода,
- галогена, предпочтительно как описано выше,
- C1-6-алкила, предпочтительно как описано выше,
- C3-6-циклоалкила, предпочтительно как описано выше,
- галоген-C1-4-алкила, предпочтительно как описано выше, и
- цианогруппы.
Особенно предпочтительно, R2 представляет собой атом водорода, галоген, C1-6-алкил или цианогруппу, соответственно предпочтительно как описано выше, еще более предпочтительно атом водорода, метил и галоген, в частности хлор или фтор, наиболее предпочтительно атом водорода или фтор.
В одном варианте осуществления настоящего изобретения, R1 и R2, вместе с атомами углерода, с которыми они связаны, могут образовывать необязательно замещенный 5- или 6-членный цикл, который необязательно может содержать один или больше (в частности, 2) гетероатомов. В этом случае присутствуют β-кетоамидные лиганды следующей формулы:

где R3 и R4 соответствуют описанию, приведенному выше или ниже по тексту. Однако, этот вариант осуществления менее предпочтителен.
В этом варианте осуществления, R1 и R2 совместно предпочтительно представляют собой пропиленовые (-CH2-CH2-CH2-)- и бутиленовые (-СН2-СН2-СН2-СН2-)-группы, в которых одна метиленовая группа (-СН2-), соответственно, может быть заменена на -O-, -NH- или -NR5-, где R5 представляет собой необязательно замещенный алкил, и где группы, образованные радикалами R1 и R2, могут кроме того иметь 1-3 заместителей, выбранных из группы, состоящей из гидроксигруппы, C1-4-алкоксигруппы, аминогруппы и моно- или ди-(C1-4-алкил)аминогруппы. Примерами лигандов являются следующие:
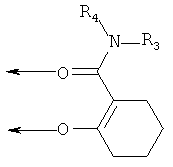
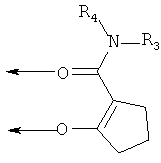
где R3 и R4 соответствуют определениям, приведенным выше, и где циклы могут при необходимости иметь 1-2 заместителей, таких как оксо-, алкил или галоген.
В настоящем изобретении, R3 и R4 одинаковые или разные, и соответственно выбраны из группы, состоящей из атома водорода, необязательно замещенной аминогруппы и необязательно замещенного алкила, предпочтительно из атома водорода и необязательно замещенного алкила, определение каждого из которых дано выше.
Или R3 и R4, вместе с атомом азота, с которым они связаны, образуют необязательно замещенный 3-6-членный цикл, который необязательно может содержать один или более дополнительных гетероатомов, определение каждого из которых дано выше.
Предпочтительно, R3 и R4 одинаковые или разные, и соответственно выбраны из группы, состоящей из:
- атома водорода и
замещенных или незамещенных алкильных групп, таких как выбранные из:
- C1-6-алкила, предпочтительно как описано выше,
- ди(С1-6-алкил)амино-С1-6-алкила, такого как диметил- или диэтиламино-C1-6-алкил, предпочтительно как описано выше,
- ди(С1-6-алкил)аминокарбонил-C1-6-алкила, такого как аминокарбонил-C1-6-алкил, или диметил- или диэтиламинокарбонил-C1-6-алкил, предпочтительно как описано выше,
- C3-6-циклоалкила, предпочтительно как описано выше,
- C3-6-циклоалкил-C1-4-алкила, предпочтительно как описано выше,
- C1-4-алкокси-C1-4-алкила, предпочтительно как описано выше,
- C1-3-алкоксикарбонил-C3-6-циклоалкила, предпочтительно как описано выше,
- C1-3-алкоксикарбонил-C1-6-алкила, предпочтительно как описано выше,
- гидрокси-C1-4-алкила, предпочтительно как описано выше, и
- галоген-C1-4-алкила, предпочтительно как описано выше,
также, где это возможно, в алкиле может одновременно присутствовать более одного заместителя, такие как гидроксигруппа и C1-3-алкоксикарбонил, или больше гидроксильных групп, например 2-3
гидроксильные группы,
C3-6-циклоалкил включает также C3-6-гетероциклил, и
где необходимо, -CH2- может быть заменен на -S-,
в каждом случае как описано выше, или
R3 и R4 вместе образуют этиленовую (-CH2-СН2-)-, пропиленовую (-СН2-СН2-СН2-)-, изопропиленовую (-СН2-СН(СН3)-)-, бутиленовую (-СН2-СН2-СН2-СН2-)-, изобутиленовую, пентиленовую (-СН2-СН2-СН2-СН2-СН2-)- или изопентиленовую группу, в которых в каждом случае одна метиленовая группа (-СН2-), соответственно, может быть заменена на -O-, -NH- или -NR5-, где R5 представляет собой необязательно замещенный алкил, и где группа, образованная из R3 и R4, кроме того может быть замещена 1-3 заместителями, выбранными из группы, состоящей из гидроксигруппы, C1-4-алкоксигруппы, аминогруппы (-NH2) и моно- или ди(C1-6-алкил)аминогруппы. Это означает, что R3 и R4 в этом случае образуют необязательно замещенный азот-содержащий 5-6-членный гетероцикл, такой как указанные выше или ниже по тексту.
Особенно предпочтительно, R3 и R4 одинаковые или разные, и выбраны из
- атома водорода,
- C1-6-алкила, предпочтительно как описано выше, в частности метил, этил, пропил, в частности н-пропил, бутил, в частности н-бутил, пентил, в частности н-пентил и гексил, в частности н-гексил, и
- гидрокси-C1-4-алкила, предпочтительно как описано выше, и предпочтительно гидроксиметил, гидроксиэтил,
- С1-3-алкоксикарбонил-С1-6-алкил, предпочтительно как описано выше, и предпочтительно метоксикарбонил, этоксикарбонил,
- С1-4-алкокси-С1-4-алкили, как описано выше.
Кроме того, в предпочтительном варианте осуществления, R3 и R4 вместе образуют пентиленовую (-СН2-СН2-СН2-СН2-СН2-)- группу, в которой одна метиленовая группа (-СН2-), соответственно, может быть заменена на -O-, -NH- или -NR5- (как описано выше), и в которой может иметься заместитель, выбранный из гидроксигруппы, C1-4-алкоксигруппы, аминогруппы (-NH2) и моно- или ди(С1-4-алкил)аминогруппы. Примеры групп, сформированных из R3 и R4 и атома азота, с которым они связаны, представляют собой, например, указанные выше связанные через атом азота гетероциклы, которые могут при необходимости иметь 1-3, например 1 или 2, гетероатомов, таких как, в частности. О, N, такие как азетидин-1-ил, замещенный азетидинил, такой как 3-гидроксиазетидин-1-ил, пирролидинил, такой как пирролидин-1-ил, замещенный пирролидинил, такой как 3-гидроксипирролидин-1-ил, 2-гидроксипирролидин-1-ил, 2-метоксикарбонилпирролидин-1-ил, 2-этоксикарбонилпирролидин-1-ил, 2-метоксипирролидин-1-ил, 2-этоксипирролидин-1-ил, 3-метоксикарбонилпирролидин-1-ил, 3-этоксикарбонилпирролидин-1-ил, 3-метоксипирролидин-1-ил, 3-этоксипирролидин-1-ил, пиперидинил, такой как пиперидин-1-ил, замещенный пиперидинил, такой как 4-метил-1-пиперидил, 4-гидрокси-1-пиперидил, 4-метокси-1-пиперидил, 4-этокси-1-пиперидил, 4-метоксикарбонил-1-пиперидил, 4-этоксикарбонил-1-пиперидил, 4-карбокси-1-пиперидил, 4-ацетил-1-пиперидил, 4-формил-1-пиперидил, 4-гидрокси-2,2,6,6-тетраметил-1-пиперидил, 4-(диметиламино)-1-пиперидил, 4-(диэтиламино)-1-пиперидил, 4-амино-1-пиперидил, 2-(гидроксиметил)-1-пиперидил, 3-(гидроксиметил)-1-пиперидил, 4-(гидроксиметил)-1-пиперидил, 2-гидрокси-1-пиперидил, 3-гидрокси-1-пиперидил, морфолино-4-ил, замещенный морфолинил, такой как 2,6-диметил-морфолин-4-ил, пиперазинил, такой как пиперазин-1-ил, замещенный пиперазинил, такой как 4-метил-пиперазин-1-ил, 4-этилпиперазин-1-ил, 4-этоксикарбонилпиперазин-1-ил, 4-метоксикарбонилпиперазин-1-ил.
Особенно предпочтительны пиперидин-1-ил, пиперазин-1-ил, морфолин-4-ил, которые могут быть дополнительно замещены, например гидроксильной группой, например 4-гидрокси-пиперидин-1-ил. Еще более предпочтительны 4-гидрокси-пиперидин-1-ил и пиперидин-1-ил.
В другом менее предпочтительном варианте осуществления настоящего изобретения, R2 и R3 вместе образуют насыщенный или ненасыщенный, необязательно замещенный 5- или 6-членный цикл, формируя β-кетоамид формулы (Ia):

где R1 и R4 соответствуют данным выше определениям. Примерами таких лигандов являются соединения, в которых R2 и R3 вместе образуют этиленовую (-СН2-СН2-)- или пропиленовую (-СН2-СН2-СН2-)- группу:
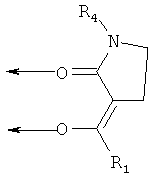

Лиганды такого типа описаны, например, в статьях Korte et al., Chemische Berichte, 95,2424 и Wamhoffet al., Liebigs Ann. Chem. 715,23-34 (1968).
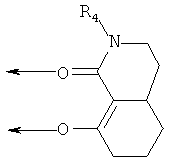
В другом, также менее предпочтительном варианте осуществления настоящего изобретения, R2 и R3 вместе образуют насыщенный или ненасыщенный, необязательно замещенный 5- или 6-членный цикл, и R1 и R2 вместе образуют насыщенный или ненасыщенный, необязательно замещенный 5- или 6-членный цикл, формируя β-кетоамид формулы (Ib):

где R4 соответствует данному выше определению. Примеры таких лигандов включают:
Квалифицированному специалисту в данной области понятно, что лиганды по настоящему изобретению
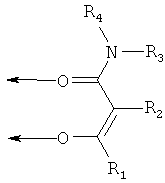
являются производными соответствующих β-кетоамидных соединений:
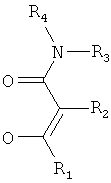
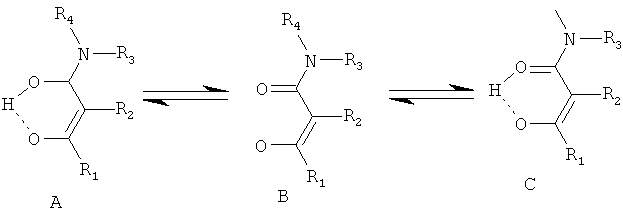
Мезомерные формы А и С неотличимы аналитическими методами. В контексте настоящего изобретения, в каждом случае включены все формы, но в контексте настоящего изобретения лиганды в целом изображаются только в виде кето-формы.
Формально, описанный лиганд образуется из соответствующих β-кетоамидных соединений при отщеплении протона.
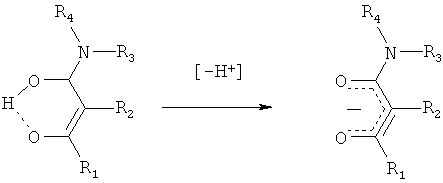
и поэтому формально несет единичный отрицательный заряд. Также, в контексте настоящего изобретения, для комплексных соединений железа изображена только одна из локализованных резонансных формул:

хотя, вследствие более низкой электронной плотности на амидном атоме кислорода, следует ожидать превалирования резонансной формулы С.Как разъяснено выше, аналитически различить резонансные формулы А и С невозможно.
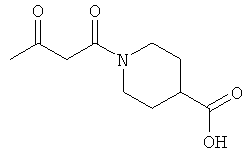
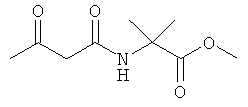
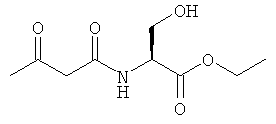
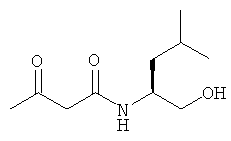
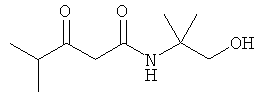
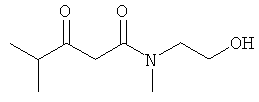
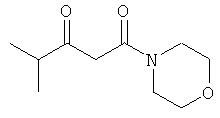
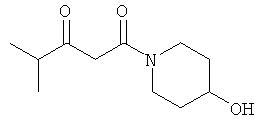
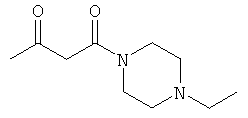
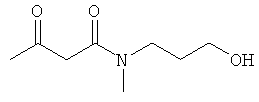
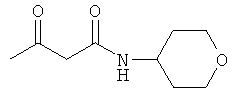
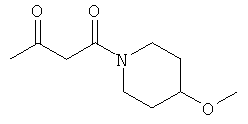
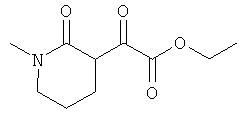
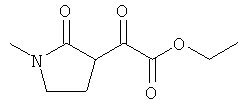
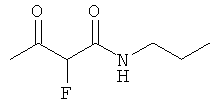
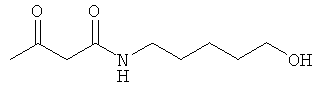
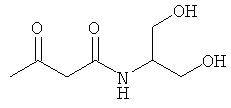
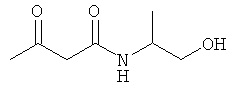
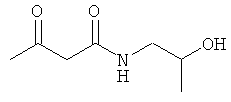
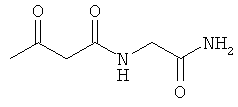
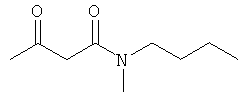
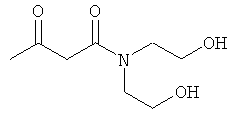
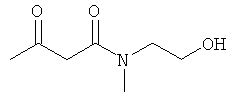
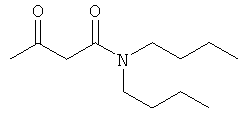
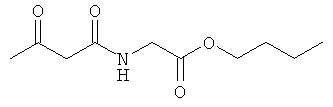
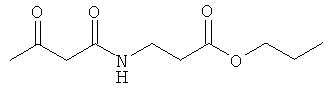
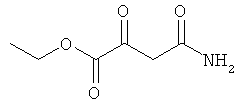
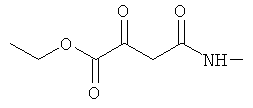
Примеры β-кетоамидных лигандов, использующихся в настоящем изобретении, изображены ниже:

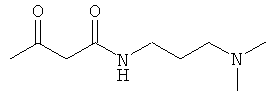
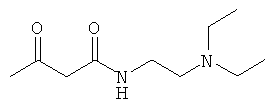
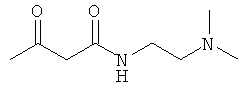



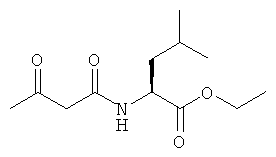

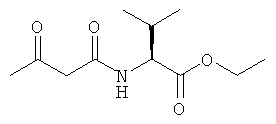
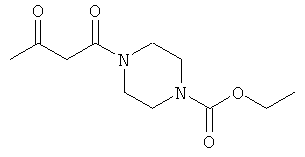
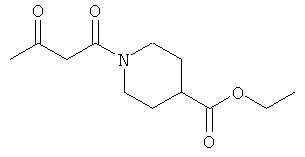
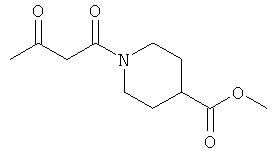



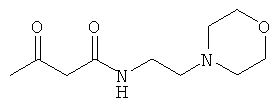






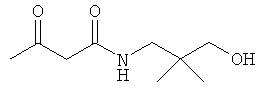

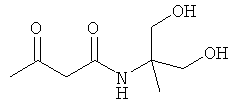
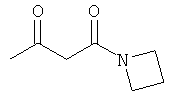


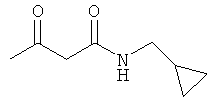

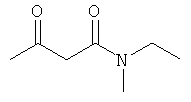


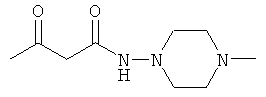






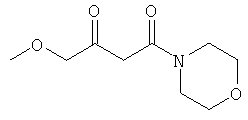







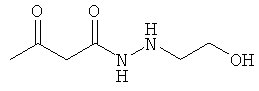

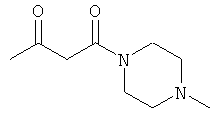


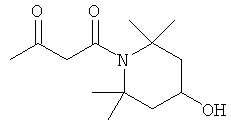




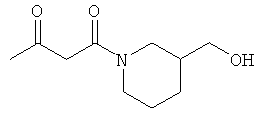
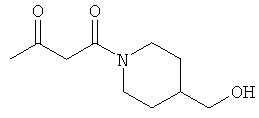

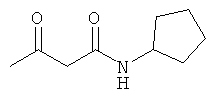





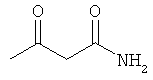

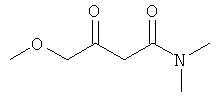




















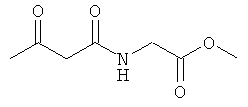

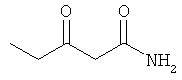

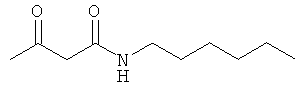

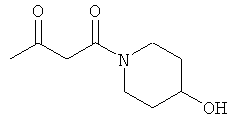














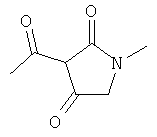





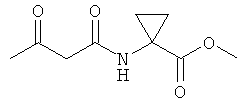



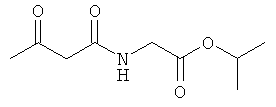
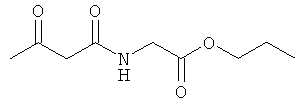




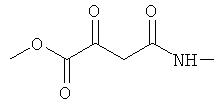

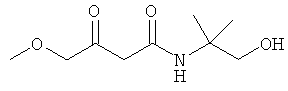
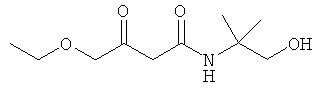
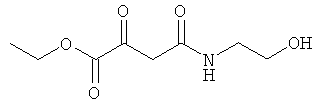






Комплексные соединения железа(III) с β-кетоамидами, в частности общей формулы (II), можно представить в виде разных изомеров. Изомерные формы включают, например, региоизомеры, которые отличаются расположением лигандов относительно друг друга. Если присутствуют асимметрические атомы углерода, лиганды могут присутствовать в форме оптических изомеров, которые относятся друг к другу как зеркальные отражения, и включают чистые энантиомеры, смеси энантиомеров, в частности рацематы. Как известно квалифицированному специалисту в данной области, можно получить энантиомерно чистые лиганды методами оптического расщепления, например реакцией с хиральными реагентами с образованием диастереомеров, разделением полученных диастереомеров и высвобождением энантиомеров.
Кроме того, в частности далее описаны предпочтительные варианты осуществления настоящего изобретения:
(В настоящем изобретении, цифры 1-6 в „1-6C" или „C1-6", или „1-4" в „1-4C" или „C1-4„ и т.д. в каждом случае означают число атомов углерода в указанной далее углеводородной группе).
R1 выбран из группы, состоящей из:
- 1-6C-алкила, (т.е. алкила, содержащего 1-6 атомов углерода),
- 3-6C-циклоалкила,
- 3-6C-циклоалкил-1-4C-алкила,
- 1-4C-алкокси-1-4C-алкила,
- гидрокси-1-4C-алкила,
- фтор-1-4C-алкила;
R2 выбран из группы, состоящей из:
- H,
- 1-6C-алкила,
- 3-6C-циклоалкила,
- фтор-1-4C-алкила,
- галогена,
- цианогруппы;
или R1 и R2 вместе образуют пропиленовую (-CH2-CH2-CH2), бутиленовую (-CH2-CH2-CH2-CH2-), азабутиленовую или оксабутиленовую группу;
R3 и R4 одинаковые или разные, и соответственно выбраны из группы, состоящей из:
- H,
- 1-6C-алкила,
- 3-6C-циклоалкила,
- 3-6C-циклоалкил-1-4C-алкила,
- 1-4C-алкокси-1-4C-алкила,
- 1-3C-алкокси-карбонил-1-6C-алкила,
- гидрокси-1-4C-алкила,
- фтор-1-4C-алкила;
или R3 и R4 вместе образуют этиленовую (-CH2-CH2-)-, пропиленовую (-CH2-CH2-CH2-)-, гидроксипропиленовую, предпочтительно 2-гидроксипропиленовую, 3-метилпропиленовую, бутиленовую (-CH2-CH2-CH2-CH2-), 2-гидроксибутиленовую, 2-метоксибутиленовую, изобутиленовую, пентиленовую (-CH2-CH2-CH2-CH2-CH2-), гидроксипентиленовую, предпочтительно 3-гидроксипентиленовую, метоксипентиленовую, предпочтительно 3-метоксипентиленовую, этоксипентиленовую, предпочтительно 3-этоксипентиленовую, пропоксипентиленовую, предпочтительно 3-пропоксипентиленовую, изопропоксипентиленовую, предпочтительно 3-изопропоксипентиленовую, циклопропоксипентиленовую, предпочтительно 3-циклопропоксипентиленовую, азапентиленовую, в частности -CH2-CH2-NH-CH2-CH2-, или оксапентиленовую группу, в частности -CH2-CH2-O-CH2-CH2-,
или их фармацевтически приемлемые соли.
Предпочтительно, указанные выше группы-заместители соответствуют следующим определениям:
1-6C-алкил предпочтительно включает линейные или разветвленные алкильные группы, содержащие 1-6 атомов углерода. Примерами могут служить метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, н-пентил, изо-пентил, нео-пентил, н-гексил, изо-гексил и нео-гексил.
3-6C-Циклоалкил предпочтительно включает циклоалкилы, содержащие 1-6 атомов углерода, такие как циклопропил, циклобутил, циклопентил, циклогексил.
3-6C-циклоалкил-1-4C-алкил предпочтительно включает описанную выше 1-6C-алкильную группу, замещенную описанной выше 3-бС-циклоалкильной группой. Примерами могут служить циклопропилметильная, циклопентилметильная и циклогексилметильная группа.
1-3C-алкокси-карбонил-1-6C-алкил, предпочтительно включает описанную выше 1-6C-алкильную группу, которая связана с карбонильной группой, связанной с 1-3C алкоксигруппой в виде сложного эфира карбоновой кислоты. Примерами могут служить метоксикарбонилметил, этоксикарбонилметил, метоксикарбонилэтил, этоксикарбонилэтил и изопропоксикарбонилметил.
1-4C-алкокси предпочтительно включает 1-4C-алкоксигруппу, в которой атом кислорода соединен с линейной или разветвленной алкильной цепочкой, содержащей 1-4 атомов углерода. Примерами такой группы могут служить метокси, этокси, пропокси и изобутокси.
1-4C-алкокси-1-4C-алкил предпочтительно включает описанную выше 1-4C-алкокси-группу, замещенную описанной выше 1-4C-алкильной группой. Примерами такой группы могут служить метоксиэтил, этоксипропил, метоксипропил, изобутоксиметил. Гидрокси-1-4C-алкил включает описанную выше 1-4C-алкильную группу, замещенную гироксильной группой. Примерами могут служить гидроксиэтил, гидроксибутил и гидроксиизопропил.
Фтор-1-4C-алкил включает описанную выше 1-4C-алкильную группу, замещенную 1-3 атомами фтора. Примерами могут служить трифторметил и трифторэтил. Галоген означает F, Cl, Br, I.
Группы и остатки могут также содержать хиральные центры. В этом случае включены все возможные смеси энантиомеров и чистые энантиомеры.
Особенно предпочтительно:
R1 выбран из группы, состоящей из:
- 1-6C-алкила,
- 1-4C-алкокси-1-4C-алкила,
- гидрокси-1-4С-алкила;
R2 выбран из группы, состоящей из:
- H,
- 1-6C-алкила;
и R3 и R4 одинаковые или разные, и соответственно выбраны из группы, состоящей из:
- H,
- 1-6C-алкила,
- 1-4C-алкокси-1-4C-алкила,
- 1-3C-алкокси-карбонил-1-6C-алкила,
- гидрокси-1-4C-алкила;
или R3 и R4 вместе образуют бутиленовую (-CH2-CH2-CH2-CH2-)-, пентиленовую (-CH2-CH2-CH2-CH2-CH2-), гидроксипентиленовую, азапентиленовую или оксапентиленовую группу.
Особенно предпочтительно:
R1 выбран из группы, состоящей из:
- 1-6C-алкила;
R2 выбран из группы, состоящей из:
- H.
- 1-6C-алкила;
и
R3 и R1 одинаковые или разные, и соответственно выбраны из группы, состоящей из:
- H,
- 1-6C-алкила,
- 1-4C-алкокси-1-4C-алкила,
- 1-3C-алкокси-карбонил-1-6C-алкила,
- гидрокси-1-4C-алкила;
или R3 и R4 вместе образуют пентиленовую (-CH2-CH2-CH2-CH2-CH2-), гидроксипентиленовую, предпочтительно 3-гидроксипентиленовую или оксапентиленовую группу, как описано выше.
Особенно предпочтительные комплексные соединения общей формулы (II) описаны в примерах.
Настоящее изобретение также касается способа получения комплексных соединений железа(III) по настоящему изобретению, который включает реакцию 6-кетоамида с солью железа(III).
β-Кетоамид включает, в частности, соединения формулы (III):
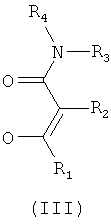
где R1-R4 соответствуют данным выше определениям.
Примеры подходящих солей железа(III) включают: хлорид железа(III), ацетат железа(III), сульфат железа(III), нитрат железа(III) и ацетилацетонат железа(III), из которых предпочтителен хлорид железа(III).
Другой предпочтительный способ изображен на следующей схеме:
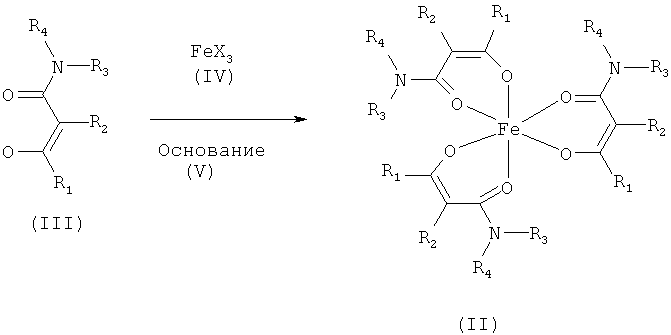
где R1-R4 соответствуют данным выше определениям, Х представляет собой анион, такой как галогенид, такой как хлорид, карбоксилат, такой как ацетат, сульфат, нитрат и ацетилацетонат, а основание представляет собой общеупотребимое органическое или неорганическое основание.
В способе по настоящему изобретению, предпочтительно, 3-5 экв. лиганда (III) вводят в реакцию с подходящими солями железа(III) (IV) (в данном случае особенно подходящими являются хлорид Fe(III), ацетат Fe(III), сульфат Fe(III) и ацетилацетонат Fe(III)) в стандартных условиях, с образованием соответствующих комплексов общей формулы (II). В данном случае синтез проводят при значении pH, оптимальном для образования комплекса. Оптимальное значение pH устанавливают добавлением основания (V); в данном случае особенно уместно использование карбоната натрия, гидрокарбоната натрия, метанолята натрия, карбоната калия, гидрокарбоната калия или метанолята калия.
Лиганды (III), необходимые для получения комплексов, либо коммерчески доступны, либо получены согласно описанному далее методу синтеза. Для этой цели были использованы две различные синтетические методики. Для лигандов общей формулы с R1=метил, R2=Н, коммерчески доступный дикетон (3) вводили в реакцию в стандартных условиях с соответствующим амином (4), получая лиганд общей формулы (III).
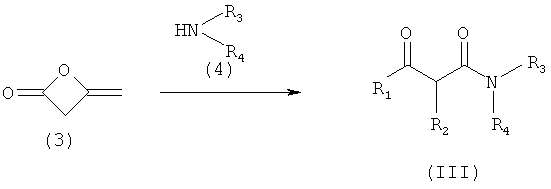
Для других лигандов общей формулы (III), подходящий кетоэфир (5) вводили в реакцию в стандартных условиях с соответствующим амином (6).

где R1-R4 соответствуют определениям, приведенным выше.
Фармацевтически приемлемые соли соединений по настоящему изобретению, в которых комплекс железа(III) формально несет положительный заряд, включают, например, соли с подходящими анионами, такими как карбоксилаты, сульфонаты, сульфаты, хлориды, бромиды, иодиды, фосфаты, тартраты, метансульфонаты, гидроксиэтансульфонаты, глицинаты, малеаты, пропионаты, фумараты, толуолсульфонаты, бензолсульфонаты, трифторацетаты, нафталиндисульфонаты-1,5, салицилаты, бензоаты, лактаты, соли яблочной кислоты, соли 3-гидрокси-2-нафтойной кислоты, цитраты и ацетаты.
Фармацевтически приемлемые соли соединений по настоящему изобретению, в которых комплекс железа(III) формально несет отрицательный заряд, включают, например, соли с подходящими фармацевтически приемлемыми основаниями, такими как, например, гидроксиды щелочных или щелочноземельных металлов, такие как NaOH, KOH, Ca(OH)2, Mg(OH)2 и т.д., аминосоединения, такие как этиламин, диэтиламин, триэтиламин, этилдиизопропиламин, этаноламин, диэтаноламин, триэтаноламин, метилглюкамин, дициклогексиламин, диметиламиноэтанол, прокаин, дибензиламин, N-метилморфолин, аргинин, лизин, этилендиамин, N-метилпиперидин, 2-амино-2-метил-пропанол-(1), 2-амино-2-метил-пропандиол-(1,3), 2-амино-2-гидроксил-метил-пропандиол-(1,3) (TRIS) и т.д.
На растворимость в воде или растворимость в физиологическом растворе и, таким образом, на эффективность соединений по настоящему изобретению может заметно влиять образование солей в целом, и в частности выбор противоиона.
Предпочтительно, соединения по настоящему изобретению представляют собой нейтральные комплексные соединения.
Полезное фармакологическое действие
Авторы настоящего изобретения неожиданно обнаружили, что комплексные соединения железа(III) с β-кетоамидами, являющиеся объектом настоящего изобретения и представленные, в частности, общей структурной формулой (II), представляют собой устойчивые биодоступные комплексы железа и могут применяться в качестве лекарственного средства для лечения и профилактики симптомов железодефицита и железодефицитной анемии, а также сопровождающих их симптомов.
Лекарственные средства, содержащие соединения по настоящему изобретению, могут применяться в медицине и ветеринарии.
Соединения по настоящему изобретению могут также применяться для приготовления лекарственных средств для лечения пациентов, страдающих от симптомов железодефицитной анемии, таких как, например: утомляемость, апатия, утрата концентрации, низкая эффективность мыслительной деятельности, трудности в подборе правильных слов, забывчивость, неестественная бледность, раздражительность, ускорение сердечного ритма (тахикардия), раздраженный или раздутый язык, увеличенная селезенка, необычные пищевые пристрастия (парорексия), головные боли, отсутствие аппетита, повышенная подверженность инфекциям или подавленное настроение.
Комплексные соединения железа(III) по настоящему изобретению, кроме того, могут применяться для лечения железодефицитной анемии у беременных женщин, скрытой железодефицитной анемии у детей и подростков, железодефицитной анемии, вызванной нарушениями в желудочно-кишечном тракте, железодефицитной анемии, вызванной потерей крови, такой как желудочно-кишечное кровотечение (например, вследствие язвы, карциномы, геморроя, воспалительных расстройств, приема ацетилсалициловой кислоты), железодефицитной анемии, вызванной менструацией, железодефицитной анемии, вызванной травмами, железодефицитной анемии, вызванной алопецией (спру), железодефицитной анемии, вызванной пониженным содержанием железа в пище, в частности при избирательном питании у детей и подростков, иммунодефицита, вызванного железодефицитной анемией, ухудшения работы мозга, вызванного железодефицитной анемией, синдрома беспокойных ног, вызванного железодефицитной анемией, железодефицитной анемии при раковых заболеваниях, железодефицитной анемии при химиотерапии, железодефицитной анемии, вызванной воспалением (AI), железодефицитной анемии при застойной сердечной недостаточности (CHF; острая сердечная недостаточность), железодефицитной анемии при хронической почечной недостаточности 3-5 стадии (CDK. 3-5; хроническая болезнь почек 3-5 стадии), железодефицитной анемии, вызванной хроническим воспалением (ACD), железодефицитной анемии при ревматоидном артрите (RA), железодефицитной анемии при системной красной волчанке (SLE) и железодефицитной анемии при воспалительной болезни кишечника (IBD).
Прием может продолжаться несколько месяцев, до улучшения показателей содержания железа, которые выражаются, например, в уровне гемоглобина, насыщении трансферрина и содержании ферритина в плазме крови пациентов; или до желаемого улучшения состояния здоровья, нарушенного вследствие железодефицитной анемии.
Составы по настоящему изобретению пригодны для приема детьми, подростками и взрослыми.
Принимаемые соединения по настоящему изобретению в данном случае могут вводиться как перорально, так и парэнтерально. Предпочтительно пероральное введение.
Соединения по настоящему изобретению и упомянутые выше комбинации соединений по настоящему изобретению с другими действующими веществами или лекарственными средствами могут применяться, в частности, для приготовления лекарственных средств для лечения железодефицитной анемии, такой как железодефицитная анемия у беременных женщин, скрытая железодефицитная анемия у детей и подростков, железодефицитная анемия, вызванная нарушениями в желудочно-кишечном тракте, железодефицитная анемия, вызванная потерей крови, такой как желудочно-кишечное кровотечение (например, вследствие язвы, карциномы, геморроя, воспалительных расстройств, приема ацетилсалициловой кислоты), железодефицитная анемия, вызванная менструацией, травмами, железодефицитная анемия, вызванная алопецией (спру), железодефицитная анемия, вызванная пониженным содержанием железа в пище, в частности при избирательном питании у детей и подростков, иммунодефицит, вызванный железодефицитной анемией, ухудшение работы мозга, вызванное железодефицитной анемией, синдром беспокойных ног.
Применение в соответствии с настоящим изобретением приводит к повышению уровня железа, гемоглобина, ферритина и трансферрина, которое, в частности у детей и подростков, но также и у взрослых, сопровождается улучшением результатов испытаний кратковременной памяти, испытаний долговременной памяти, тестов прогрессивных матриц Равенна, тестов по шкале интеллекта взрослых Векслера (WAIS) и/или эмоционального коэффициента (Baron EQ-i, YV тест, детская версия), или к повышению уровня нейтрофилов, уровня антител и/или улучшению работы лимфоцитов.
Кроме того, настоящее изобретение касается фармацевтических композиций, содержащих одно или больше соединений по настоящему изобретению, в частности отвечающих формуле (II), а также одно или больше дополнительных фармацевтически эффективных соединений, а также одно или больше фармакологически приемлемых носителей и/или вспомогательных веществ и/или растворителей.
Они представляют собой общеупотребимые фармацевтические носители, вспомогательные вещества или растворители. Упомянутые выше фармацевтические композиции могут применяться, например, для внутривенного, внутрибрюшинного, внутримышечного, интравагинального, интрабуккального, чрезкожного, подкожного, кожно-слизистого, перорального, ректального, чрезкожного, местного, внутрикожного, внутрижелудочного введения, и выпускаться, например, в виде пилюль, таблеток, таблеток с энтеросолюбильным покрытием, таблеток, покрытых пленкой, многослойных таблеток, составов с замедленным высвобождением для перорального, подкожного или накожного применения (в частности, в виде пластыря), составов замедленного всасывания, драже, суппозиториев, гелей, кремов, сиропа, эликсира, гранулята, суппозиториев, эмульсий, дисперсий, микрокапсул, микросоставов, наносоставов, липосомных составов, капсул, капсул с энтеросолюбильным покрытием, порошков, порошков для ингаляций, микрокристаллических составов, спреев для ингаляций, порошков, капель, назальных капель, назальных спреев, аэрозолей, ампул, растворов, соков, суспензий, растворов для вливания или растворов для инъекций и т.д.
Предпочтительно, соединения по настоящему изобретению, а также фармацевтические композиции, содержащие такие соединения, применяют перорально, хотя возможны также другие формы, такие как составы для парэнтерального введения, в частности для внутривенного введения.
Для этих целей, соединения по настоящему изобретению предпочтительно входят в состав фармацевтических композиций в виде пилюль, таблеток, таблеток с энтеросолюбильным покрытием, таблеток, покрытых пленкой, многослойных таблеток, составов с замедленным высвобождением для перорального применения, составов замедленного всасывания, драже, гранулята, эмульсий, дисперсий, микрокапсул, микросоставов, наносоставов, липосомных составов, капсул, капсул с энтеросолюбильным покрытием, порошков, микрокристаллических составов, порошков, капель, ампул, растворов, суспензий, растворов для вливания или растворов для инъекций.
Соединения по настоящему изобретению можно вводить в составе фармацевтических композиций, которые могут содержать различные органические или неорганические носители и/или вспомогательные вещества, обычно применяемые для фармацевтических целей, в частности для приготовления твердых лекарственных составов, такие как, например, наполнители (такие как сахароза, крахмал, маннит, сорбит, лактоза, глюкоза, целлюлоза, тальк, фосфат кальция, карбонат кальция), связующие вещества (такие как целлюлоза, метилцеллюлоза, гидроксипропилцеллюлоза, полипропилпирролидон, желатин, гуммиарабик, полиэтиленгликоль, сахароза, крахмал), вещества для улучшения распадаемости таблеток (такие как крахмал, гидролизованный крахмал, карбоксиметилцеллюлоза, кальциевая соль карбоксиметилцеллюлозы, гидроксипропилкрахмал, натрия гликоль крахмал, бикарбонат натрия, фосфат кальция, цитрат кальция), лубриканты (такие как стеарат магния, тальк, лаурилсульфат натрия), ароматизаторы (такие как лимонная кислота, ментол, глицин, апельсиновый порошок), консерванты (такие как бензоат натрия, бисульфит натрия, метилапарбен, пропилпарабен), стабилизаторы (такие как лимонная кислота, цитрат натрия, уксусная кислота и многоосновные карбоновые кислоты из титриплексной серии, такие как, например, диэтилентриаминпентауксусная кислота (DNPA), суспендирующие средства (такие как метилцеллюлоза, поливинилпирролидон, стеарат алюминия), диспергирующие средства, разбавители (такие как вода, органические растворители), пчелиный воск, масло какао, полиэтиленгликоль, белый вазелин и т.д.
Жидкие лекарственные составы, такие как растворы, суспензии и гели, обычно содержат жидкий носитель, такой как вода и/или фармацевтически приемлемые органические растворители. Кроме того, такие жидкие составы могут также содержать pH-регуляторы, эмульгаторы или диспергирующие средства, буферные вещества, консерванты, увлажняющие вещества, желатинизирующие вещества (например, метилцеллюлоза), красители и/или ароматизаторы. Композиции могут быть изотоническими, то есть они могут иметь одинаковое с кровью осмотическое давление. Изотоничность композиций можно регулировать с помощью хлорида натрия и других фармацевтически приемлемых веществ, таких как, например, декстроза, мальтоза, борная кислота, тартрат натрия, пропиленгликоль и другие неорганические и органические растворимые вещества. Вязкость жидких композиций можно регулировать с помощью фармацевтически приемлемых загустителей, таких как метилцеллюлоза. Другие подходящие загустители включают, например, ксантановую камедь, карбоксиметилцеллюлозу, гидроксипропилцеллюлозу, карбомер и т.п. Предпочтительная концентрация загустителя зависит от выбранного вещества. Фармацевтически приемлемые консерванты могут применяться для увеличения срока хранения жидких композиций. Подходящим средством является бензиловый спирт, хотя также могут применяться разнообразные консерванты, включая, например, парабены, тимеросал, хлорбутанол и бензалкония хлорид.
Действующее вещество можно вводить, например, в однократной дозировке от 0.001 мг/кг до 500 мг/кг веса тела, например 1-4 раза в день. Однако дозировку можно увеличивать или уменьшать в зависимости от возраста, веса, состояния пациента, тяжести заболевания или способа введения.
Осуществление изобретения
Примеры
Настоящее изобретение более подробно проиллюстрировано представленными далее примерами. Примеры носят больше иллюстративный характер, и квалифицированный специалист в данной области может расширить представленные частные примеры на другие заявленные в формуле изобретения соединения. Названия соединений в примерах были сгенерированы компьютерной программой ACD/Name Version 12.
Исходные соединения:
Использованные в Примерах исходные соединения были получены описанным ниже образом.
А. N,N-диэтил-3-оксобутанамид

Коммерчески доступен: Fluka 00405
В. N,N-диэтил-3-оксобутанамид

Коммерчески доступен: Aldrich 165093
С. N,N-диметил-3-оксобутанамид

Коммерчески доступен: Aldrich 407054
D. N-метил-3-оксобутанамид
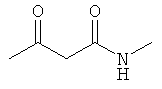
Коммерчески доступен: Acros 25544
Е. 2-хлор-N-метил-3-оксобутанамид
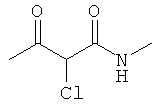
Коммерчески доступен: Aurora Fine Chemicals Ltd. Kafd-00164
F. 1-(пиперидин-1-ил)-бутан-1,3-дион

Раствор 25 г (0.294 моль) пиперидина в 100 мл трет-бутил-метилового эфира прикапывали к раствору 26.25 г (0.310 моль) дикетона в 200 мл трет-бутил-метилового эфира при температуре от -5 до 0°С. После перемешивания в течение 1 часа при -1°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения.
Реакционную смесь упаривали, и остаток перегоняли в вакууме. Получали 49.55 г продукта в виде желтоватой жидкости.
ИК (чистое вещество, см-1): 3001, 2936, 2856, 1719, 1631, 1584, 1486, 1441, 1389, 1355, 1302, 1255, 1219, 1159, 1137.
Элементный анализ: С 63.51; Н 8.94; N 8.36.
LC-MS: 170 (М+Н), 192 (M+Na)
1Н-ЯМР (CDCl3,400 МГц): δ [м.д.]=35 (4Н), 3.3 (2Н), 2.2 (3H), 1.6 (2Н), 1.5 (4Н).
G. N,N-бис-(2-гидроксиэтил)-3-оксобутанамид

Раствор 52.53 г (0.50 моль) диэтаноламина в 100 мл МеОН прикапывали к раствору 40.00 г (0.48 моль) дикетона в 100 мл МеОН при 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 81.32 г продукта в виде желтоватого масла.
ИК (чистое вещество, см-1): 3381, 2941, 2885, 1718, 1626, 1481, 1432, 1361, 1312, 1212, 1053.
Элементный анализ: С 50.62; Н 8.05; N 7.28.
1Н-ЯМР (CDCl3, 400 МГц): 5 [м.д.]=2.2 (3H), 3.5 (4Н), 3.7 (6Н), 4.15 (1Н), 4.35 (1H).
Н. N-бутил-N-метил-3-оксобутанамид

14.1 мл (0.12 моль) N-н-бутилметиламина прикапывали к раствору 10.00 г (0.12 моль) дикетона в 500 мл МеОН при 0°С. После перемешивания в течение 6 ч при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения.
Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии.
Получали 11.61 г продукта в виде желтоватого масла.
ИК (чистое вещество, см-1): 2958, 2932, 2873, 1721, 1635, 1593, 1493, 1381, 1358, 1307, 1228, 1209, 1144.
LC-MS: 172 (М+Н).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=0.9 (ЗН), 1.3 (2Н), 1.5 (2Н), 1.9 (1H), 2.2 (2Н), 2.9 (3Н), 3.2 (1Н), 3.3 (1Н), 3.5 (1Н).
I. 1-(4-гидроксипиперидин-1-ил)-бутан-1,3-дион
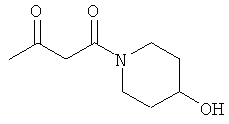
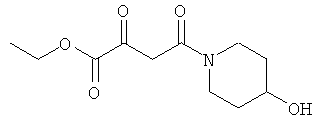
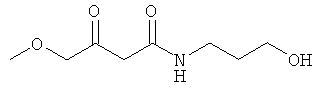
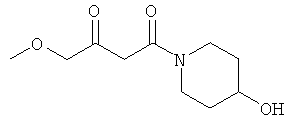
Раствор 25.30 г (0.25 моль) 4-гидрокси-пиперидина в 50 мл МеОН прикапывали к раствору 20.00 г (0.24 моль) дикетона в 50 мл МеОН при 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 42.54 г (96% выход) желтоватого масла.
ИК (чистое вещество, см-1): 3401, 2928, 2869, 1717, 1617, 1448. 1360, 1307, 1268, 1206, 1158, 1074, 1026.
CHN элементный анализ: С 57.98; Н 8.69; N 7.32.
LC-MS: 186 (M+H).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=1.5 (2Н), 1.8 (2Н), 2.2 (3H), 3.2 (2Н), 3.6 (3H), 3.9 (2Н).
J. 3-оксо-N,N-дипропилбутанамид
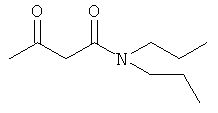
Раствор 27.80 г (0.28 моль) N,N-ди-н-пропиламина прикапывали к раствору 20.00 г (0.24 моль) дикетона в 100 мл МеОН при 0°С. После перемешивания в течение 3 ч при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии.
Получали 38.05 г продукта в виде желтоватого масла.
ИК (чистое вещество, см-1): 2964, 2934, 2876, 1721, 1634, 1589, 1490, 1456, 1430, 1392, 1381, 1359, 1301, 12444, 1101.
Элементный анализ: С 64.28; Н 10.17; N 7.36.
1Н-ЯМР (CDCl3, 400 МГц): 5 [м.д.]=0.9 (6Н), 1.6 (4Н), 1.9 (1Н), 2.3 (2Н), 3.1 (2Н), 3.3 (2Н), 3.5 (2Н).
K. N-гексил-3-оксобутанамид
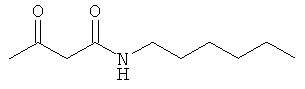
Раствор 27.83 г (0.28 моль) N-н-гексиламина прикапывали к раствору 20.00 г (0.24 моль) дикетона в 100 мл МеОН при 0°С. После перемешивания в течение 4 ч при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения.
Реакционную смесь упаривали, и оставшееся твердое вещество растворяли в 200 мл н-гексана, фильтровали и сушили в течение ночи в вакууме. Получали 22.53 г продукта в виде белого твердого вещества.
ИК (чистое вещество, см-1): 3272, 3098, 2956, 2921, 2872, 2853, 1728, 1709, 1644, 1563, 1467, 1419, 1363, 1347, 1336, 1190, 1167.
Элементный анализ: С 64.85; Н 10.28; N 7.62.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=0.9 (3Н), 1.3 (6Н), 1.5 (2Н), 2.2 (3Н), 3.2 (2Н), 3.4 (2Н), 6.9 (1Н).
L. Этил-N-(3-оксобутаноил)глицинат(3-оксо-бутириламино)этилацетат)
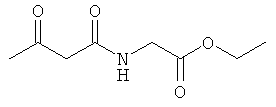
Раствор 20.00 г (0.24 моль) дикетона в 250 мл толуола прикапывали при 0°С в раствор 33.21 г (0.24 моль) гидрохлорида этилового эфира глицина (гидрохлорид эфира аминоуксусной кислоты). Затем добавляли 40.00 г (0.48 моль) NaHCO3, и реакционную смесь перемешивали при комнатной температуре в течение ночи. Поскольку исходное соединение не детектировалось методом тонкослойной хроматографии, реакционную смесь упаривали, и оставшееся твердое вещество растворяли в 100 мл диэтилового эфира, перемешивали в течение короткого времени, фильтровали и сушили в течение ночи в вакууме. Получали 40.00 г продукта в виде белого твердого вещества.
ИК (чистое вещество, см-1): 3346, 1750, 1708, 1669, 1538, 1399, 1360, 1320, 1278, 1198, 1165, 1024.
Элементный анализ: С 51.57; Н 7.05; N 7.55.
LC-MS: 210 (M+Na), 188 (M+H).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=1.2 (3Н), 2.2 (3Н), 3.4 (2Н), 4.0 (2Н), 4.2 (2Н), 7.4 (1Н).
M. 3-оксогептанамид
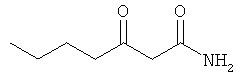
0.4 моль (63.7 мл) метилового эфира 3-оксо-гептановой кислоты и 400 мл 7н. раствора аммиака перемешивали три часа при 100°С в автоклаве. После охлаждения, растворители отгоняли на роторном испарителе, неочищенные продукты растворяли в 200 мл воды и 40 мл этанола, и значение pH доводили примерно до 3 добавлением 40 мл 32%-ного HCl.
Реакционную смесь нагревали до 90°С на 4 часа, и затем снова упаривали досуха на роторном испарителе, растворяли в 600 мл дихлорметана и промывали 3 раза по 100 мл воды. Органическую фазу упаривали, и полученный неочищенный продукт перекристаллизовывали из 100 мл толуола. Продукт фильтровали и сушили в вакуумном сушильном шкафу при 50°С. Получали 3.5 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 3368, 3178, 2956, 2932, 2872, 1703, 1651, 1619, 1466, 1439, 1408, 1376, 1345, 1306, 1221, 1183, 1125, 1058, 716, 663.
Элементный анализ: С 58.38; Н 9.12; N 9.90.
LC-MS: 144 (M+H).
1Н-ЯМР (ДМСО-d6, 400 МГц): δ [м.д.]=14.5 (с, 1Н), 7.45 (с, 1Н), 7.01 (с, 1Н), 4.92 (с, 1Н), 2.06 (т, 2Н), 1.47-1.38 (м. ЗН), 1.31-1.18 (м, 2Н), 0.88-0.81 (м, 3Н); кето-таутомер (86%), δ=7.45 (с, 1Н), 7.01 (с, 1Н), 3.23 (с, 2Н), 2.49 (т, 2Н), 1.47-1.38 (м, 2Н), 1.31-1.18 (м, 2Н), 0.88-0.81 (м, 3Н).
N. N-метил-3-оксогептанамид
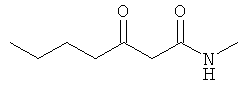
0.378 моль (60.2 мл) метилового эфира 3-оксо-гептановой кислоты, 400 мл 33%-ного раствора метиламина в этаноле и 40 мл воды перемешивали 48 часов при 80°С в круглодонной колбе с обратным холодильником. После охлаждения растворители отгоняли на роторном испарителе, неочищенные продукты растворяли в 200 мл воды и 40 мл этанола, и значение pH доводили примерно до 3 добавлением 40 мл 32%-ного HCl.
Реакционную смесь нагревали до 90°С на 24 ч, и затем снова упаривали досуха на роторном испарителе. Сырой продукт нагревали с 150 мл толуола до кипения, фильтровали в горячем состоянии и оставляли фильтрат охлаждаться. Продукт фильтровали и сушили в вакуумном сушильном шкафу при 50°С. Получали 5.9 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 3368, 3178, 2956, 2932, 2872, 1703, 1651, 1619, 1466, 1439, 1408, 1376, 1345, 1306, 1221, 1183, 1125, 1058, 716, 663.
Элементный анализ: С 60.22; Н 9.69; N 8.75.
1Н-ЯМР (ДМСО-d6, 400 МГц): δ [м.д.] = кето-таутомер (около 90%), енольный таутомер* (около 10%), = 8.21*/7.81* (м, 1Н), 7.94 (с, 1Н), 6.12*/4.91* (с, 1Н), 3.25 (с, 2Н), 2.69*/2.61* (д, 3Н), 2.57 (д, 3Н), 2.50-2.46 (м, 2 Н), 2.06* (т, 2Н), 1.45-1.38 (м, 2Н), 1.31-1.18 (м, 2Н), 0.88-0.81 (м, 3Н)
(* енольный таутомер, скорее всего, присутствует как E-Z изомер по амидной связи)
О. N,N-диметил-3-оксогептанамид
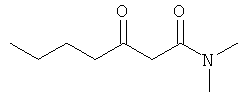
0.632 моль (100 мл) метил-3-оксогептаноата (метилового эфира 3-оксо-гептановой кислоты) и 227 мл 33%-ного раствора диметиламина в этаноле (примерно 1.26 моль диметиламина) перемешивали 4 часа при 110°С в автоклаве. После охлаждения растворители отгоняли на роторном испарителе, неочищенный продукт растворяли в 40 мл воды, 30 мл 32%-ного HCl и 40 мл этанола и перемешивали 24 часа при 100°С. Реакционную смесь снова упаривали досуха, снова растворяли в 300 мл этилацетата и фильтровали, после чего растворители упаривали на роторном испарителе. 26 г полученного неочищенного продукта очищали на 500 г силикагеля 60 (элюент: этилацетат: гексан 1:1, скорость потока 50 мл/мин, размер фракции: 100 мл, продукт: фракции 20-35), получая продукт в виде подвижного масла. Получали 17.8 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2957, 2932, 2873, 1717, 1639, 1597, 1501, 1465, 1396, 1366, 1302, 1262, 1197, 1142, 1058, 933, 776, 726, 692, 645, 612.
Элементный анализ: С 62.12; Н 9.965; N 8.17.
1Н-ЯМР (ДМСО-d6, 400 МГц): δ [м.д.] = енольный таутомер (28%), δ=15.1 (с, 1Н), 5.32 (с, 1Н), 3.3-2.4 (м, 6Н), 2.13 (т, 2Н), 1.51-1.39 (м, 2Н), 1.34-1.18 (м, 2Н), 0.89-0.82 (м, 3Н); кето-таутомер (72%), δ=3.57 (с, 2Н), 2.88 (с, 3Н), 2.80 (с, 3Н), 2.50-2.48 (м, 2Н), 1.51-1.39 (м, 2Н), 1.34-1.18 (м, 2Н), 0.89-0.82 (м, 3Н).
Р. 3-оксопентанамид
0.8 моль (100 мл) метил-3-оксовалерата (метиловый эфир 3-оксо-пентановой кислоты) и 220 мл 7н. раствора аммиака в метаноле перемешивали 4 часа при 110°С в автоклаве.
После охлаждения растворители отгоняли на роторном испарителе, неочищенный продукт растворяли в 100 мл этанола и фильтровали. Фильтрат упаривали, полученный остаток растворяли в 40 мл диэтилового эфира и оставляли при +5°С на 2 дня. Продукт, кристаллизующийся в виде белых игл, отфильтровывали и сушили в вакуумном сушильном шкафу при 50°С. Получали 7.10 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 3370, 3177, 2974, 2937, 2878, 1705, 1651, 1620, 1440, 1384, 1355, 1301, 1268, 1189, 1109, 1043, 999, 911, 863, 804,740,659.
Элементный анализ: С 51.48; Н 7.924; N 12.28.
1H-ЯМР (ДМСО-d6, 400 МГц): δ [м.д.] = енольный таутомер (12%), δ=14.5 (с, 1Н), 7.45 (с, 1Н), 7.01 (с, 1Н), 4.93 (с, 1Н), 2.09 (кв, 2Н), 1.00 (т, 3Н); кето-таутомер (88%), δ=7.45 (с, 1Н), 7.01 (с, 1Н), 3.24 (с, 2Н), 2.5 (кв, перекрывается, 2Н), 0.90 (т, 3Н).
Q. N,N-диметил-3-оксопентанамид

0.8 моль (100 мл) метил-3-оксовалерата (метиловый эфир 3-оксо-пентановой кислоты) и 250 мл 33%-ного раствора диметиламина в этаноле (примерно 1.4 моль диметиламина) перемешивали 4 часа при 110°С в автоклаве. После охлаждения, растворители отгоняли на роторном испарителе, неочищенные продукты растворяли в 40 мл воды, 30 мл 32%-ного HCl и 40 мл этанола, и перемешивали 24 часа при 100°С. Реакционную смесь снова упаривали досуха, снова растворяли в 300 мл этилацетата и фильтровали. Фильтрат упаривали досуха, и сушили продукт в вакууме масляного насоса. Получали 25.8 г
указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2976, 2939, 1717, 1637, 1500, 1459, 1396, 1376, 1357, 1298, 1262, 1198, 1142, 1107, 1055, 967, 912, 775, 647, 611.
Элементный анализ: С 54.78; Н 8.724; N 9.20.
1Н-ЯМР (ДМСО-d6, 400 МГц): δ [м.д.] = енольный таутомер (12%), δ=15.1 (с, 1Н), 5.31 (с, 1Н), 2.89 (с, 3Н), 2.81 (с, ЗН), 2.15 (кв, 2Н), 1.04 (т, 3Н); кето-таутомер (87%), δ=3.57 (с, 2Н), 2.89 (с, 3Н), 2.81 (с, 3Н), 2.49 (кв, 2Н), 0.91 (т, 3Н).
R. 3-оксо-2-(пиперидин-1-илкарбонил)бутаннитрил
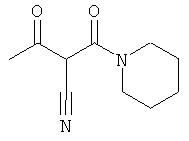
В атмосфере азота, 45.6 г (0.30 моль) 1-цианоацетилпиперидина растворяли в 800 мл ТГФ (безводн.). Добавляли 18.7 г (0.47 моль) NaH (60%-ная суспензия в минеральном масле) таким образом, чтобы внутренняя температура не превышала 10°С (охлаждение в бане лед/NaCl). После этого перемешивали смесь 30 мин при 0-10°С. Добавляли 20 мл (0.28 моль) ацетилхлорида таким образом, чтобы внутренняя температура не превышала 10°С.
Реакционную смесь затем перемешивали 1 час при 45°С. После этого медленно добавляли 40 мл уксусной кислоты, реакционную смесь помещали в 2.0 л ледяной воды и добавляли 50 мл HCl (20% вес/вес). Смесь встряхивали с 500 мл толуола, органическую фазу отделяли, сушили над 120 г Na2SO4 и фильтровали. Раствор упаривали при 40°С/80 мбар на роторном испарителе, получая масло, и охлаждали смесью льда и соли. Выпавший твердый осадок отфильтровывали, промывали 50 мл холодного толуола, и сушили по меньшей мере 15 часов при 50°С/<100 мбар. Получали 35.1 г продукта в виде твердого вещества.
ИК (чистое вещество, см-1): 3009, 2943, 2863, 2206, 2147, 1763, 1659, 1573, 1483, 1455, 1275, 1229, 1131, 1022, 969.
Элементный анализ: С 60.22; Н 9.69; N 8.75.
δ-ЯМР (CDCl3, 400 МГц): δ [м.д.]=1.56-1.67 (м, 6Н), 2.27 (с, 3Н), 3.66 (т, 4Н), 17.17 (ушир. с, 1Н).
S. N-бутил-3-оксобутанамид

14.64 г (0.2 моль) н-бутиламина и 200 мг DMAP растворяли в 60 мл ТГФ (безводн.) и добавляли 16.8 г (0.2 моль) дикетона при температуре от -5 до 5°С. Реакционную смесь затем перемешивали 2 часа при 20-25°С и упаривали на роторном испарителе.
Полученный остаток сушили по меньшей мере 15 ч при 50°С/<100 мбар. Получали 16.0 г продукта.
ИК (чистое вещество, см-1): 3271, 3097, 2959, 2928, 2867, 1714, 1644, 1561, 1459, 1421, 1357, 1227, 1163, 1000, 968, 759, 724, 656, 619.
1H-ЯМР (CDCl3, 400 МГц): δ [м.д.]=0.86-0.94 (м, 3Н), 1.26-1.71 (м, 4Н), 2.23 (с, 3Н), 3.23 (кв, 2Н), 3.36 (с, 2Н), 7.00 (ушир. с, 1Н).
Т. N,N-дибутил-3-оксобутанамид
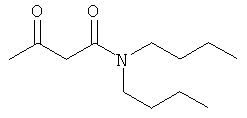
16.8 г (0.20 моль) дикетона растворяли в 60 мл ТГФ в атмосфере азота и охлаждали раствор до температуры примерно -10°С смесью лед/NaCl. Добавляли 25.6 г (0.20 моль) ди-н-бутиламина таким образом, чтобы внутренняя температура не превышала 0°С. Реакционную смесь затем перемешивали 1 час при температуре от -10 до 0°С, и затем 2 часа при 20-25°С. Растворитель из реакционной смеси упаривали на роторном испарителе при 50°С/<100 мбар. Получали 45.9 г продукта в виде масла. Порции полученного сырого продукта по 10 г каждую наносили на 200 г силикагеля и элюировали смесью 21 этилацетат/н-гексан (2:1 об/об). Элюат упаривали на роторном испарителе при 50°С 7<100 мбар, получая масло, и далее сушили по меньшей мере 15 часов в высоком вакууме при 20-25°С. Получали 31.5 г продукта в виде масла.
ИК (чистое вещество, см-1): 2958, 2932, 2873, 1722, 1635, 1590, 1490, 1458, 1431, 1392, 1372, 1292, 1226, 1144, 1113, 1037, 1007, 931, 774, 732, 683.
δ-ЯМР (CDCl3, 400 МГц): δ [м.д.] / кето-таутомер δ=0.87-0.92 (м, 3Н), 1.25-1.31 (м, 2Н), 1.47-1.50 (м, 2Н), 2.23 (с, 3Н), 3.26-3.30 (м, 2Н), 3.45 (с, 2Н); енольный таутомер δ=0.87-0.92 (м, 3Н), 1.25-1.31 (м, 2Н), 1.47-1.50 (м, 2Н), 1.91 (м, 3Н), 3.13-3.17 (м, 2Н), 5.00 (с, 1Н), 14.95 (ушир. с, 1Н).
U. Нет
V. N,N-дибутил-3-оксопентанамид

0.16 моль (20 мл) метил 3-оксовалерата (метиловый эфир 3-оксо-пентановой кислоты) и 0.415 моль (70 мл) дибутиламина перемешивали в течение 3 ч при 130°С, удаляя выделяющийся метанол через перегонный отвод. После этого отгоняли избыток дибутиламина на роторном испарителе, сырой продукт растворяли в 40 мл воды и 90 мл этанола, доводили значение pH до 3 добавлением 3 мл 20%-ного HCl и перемешивали 1 час при 50°С. Смесь снова упаривали досуха, снова растворяли в 200 мл этилацетата и промывали водой (3 раза по 100 мл). Органическую фазу сушили над Na2SO4, и после фильтрования упаривали на роторном испарителе досуха. После сушки получали 31.8 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2959, 2933, 2874, 1721, 1631, 1589, 1490, 1458, 1429, 1393, 1374, 1320, 1292, 1250, 1223, 1188, 1144, 1111, 1061, 940, 914, 800, 775, 732, 689, 635.
CHN-Элементный анализ: С, 68.22; Н, 11.336; N, 6.51.
LC-MS: M+H+ 228.5; M+Na+ 250.5.
1Н-ЯМР (ДМСО-d6, 400 МГц): Енольный таутомер (40%), δ=15.1 (с, 1Н), 5.31 (с, 1Н), 2.89 (с, 3Н), 2.81 (с, 3Н), 2.15 (кв, 2Н), 1.04 (т, 3Н); Кето-таутомер (60%), δ=3.57 (с, 2Н), 2.89 (с, 3Н), 2.81 (с, 3Н), 2.49 (кв, 2Н), 0.91 (т, 3Н).
W. 2-фтор-N,N-диметил-3-оксобутанамид
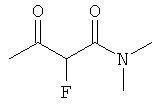
0.2 моль (25 мл) этил 2-фторацетата и 107 мл 33%-ного раствора диметиламина в этаноле (0.6 моль диметиламина) перемешивали в течение 3 ч при 70°С. Реакционную смесь упаривали досуха, и 27 г сырого продукта хроматографировали на 350 г силикагеля, элюируя смесью этилацетат/метанол 9/1. Получали 13.4 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2942, 1729, 1650, 1501, 1403, 1358, 1260, 1217, 1176, 1151, 1072, 962, 829, 705, 681, 632,611.
CHN-Элементный анализ: С, 47.99; Н, 6.70; N, 9.05.
LC-MS: М+H+ 148.2; M-Na+ 170.2.
1Н-ЯМР (ДМСО-d6, 400 МГц): δ=5.96 (д (J=48 Гц), 1Н), 3.03 (д (J=1.4 Гц), 3Н), 2.86 (д (J=1.3 Гц), 3Н), 2.18 (д (J=4.0 Гц), 3Н).
X. 2-фтор-3-оксо-N-пропилбутанамид
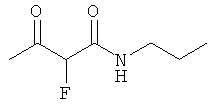
0.8 моль (65.8 мл) н-пропиламина прикапывали в течение 0.5 ч к 0.2 моль (25 мл) этил 2-фторацетата. Реакционную смесь нагревали и выдерживали 2 часа при 60°С. Затем ее упаривали досуха, растворяли в 50 мл воды и 60 мл этанола, и доводили pH до 3 добавлением 32%-ной HCl. Смесь снова упаривали, растворяли в 300 мл этилацетата, фильтровали и снова упаривали досуха. 17 г сырого продукта хроматографировали на 800 г силикагеля смесью этилацетат/гексан 1/1. После сушки получали 14 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 3325, 2967, 2938, 2878, 1736, 1665, 1535, 1460, 1441, 1421, 1359, 1277, 1235, 1210, 1179, 1150, 1089, 963, 892, 818, 617.
CHN-Элементный анализ: С, 50.61; Н, 7.19; N, 8.58.
LC-MS: М+H+, 162.7; M+Na+ 184.6.
1Н-ЯМР (ДМСО-d6, 400 МГц): δ=8.47 (с (ушир.), 1Н), 5.49 (д (J=49 Гц), 1Н), 3.05 (м, 2Н), 2.22 (д (J=3.1 Гц), 3Н), 2.18 (д (J=4.0 Гц), 3Н); 1.42 (секстет, 2Н); 0.81 (т, 3Н).
Y. 4-Метокси-N,N-диметил-3-оксобутанамид

0.17 моль (25 г) метил 4-метокси-ацетоацетата и 91 мл 33%-ного раствора диметиламина в этаноле (примерно 0.51 моль диметиламина) перемешивали в автоклаве 4 часа при 110°С. Реакционную смесь затем упаривали досуха, и 27 г сырого продукта хроматографировали на 350 г силикагеля, элюируя смесью этилацетат/метанол 9/1. После сушки получали 12.4 г указанного в заголовке соединения.
LC-MS: М+H+, 160.7; M+Na+ 182.6.
1Н-ЯМР (ДМСО-d6, 400 МГц): Енольный таутомер (21%), δ=15.1 (с, 1Н), 5.48 (с, 1Н), 3.90 (с, 2Н), 3.30 (с, 3Н), 3.0-2.8 (м, 6Н); Кето-таутомер (79%), δ=4.10 (с, 2Н), 3.55 (с, 2Н), 3.27 (с, 3Н), 2.90 (с, 3Н), 2.81 (с, 3Н).
Z. N,N-Триметил-3-оксопентанамид
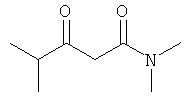
0.69 моль (100 г) метилового эфира 4-метил-3-оксовалериановой кислоты и 309 мл 33%-ного раствора диметиламина в этаноле (примерно 1.73 моль диметиламина) перемешивали в автоклаве 2 часа при 110°С. После охлаждения растворители упаривали на роторном испарителе. После сушки получали 93 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2969, 2934, 2875, 1714, 1630, 1597, 1502, 1467, 1396, 1384, 1359, 1322, 1263, 1207, 1162, 1142, 1073, 1047, 972, 927, 892, 782, 725, 701, 650,614.
CHN-Элементный анализ: С, 59.51; Н, 9.60; N, 8.47.
LC-MS; M+H+, 158.5; M+Na+, 180.2.
1Н-ЯМР (ДМСО-d6, 400 МГц): Енольный таутомер (19%), δ=15.18 (с, 1Н), 5.28 (с, 1Н), 2.87 (с, 3Н), 2.80 (с, 3Н), 2.35 (гептет, 1Н), 1.05 (д, 6Н); Кето-таутомер (81%), δ=3.62 (с, 2Н), 2.87 (с, 3Н), 2.80 (с, 3Н), 2.68 (гептет, 1Н), 1.00 (д, 6Н).
АА. 4-метил-1-(морфолин-4-ил)-пентан-1,3-дион
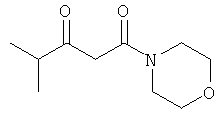
0.351 моль (49.6 мл) метилового эфира 4-метил-3-оксовалериановой кислоты и 0.369 моль (32.3 мл) морфолина перемешивали в течение 14 ч при 110°C с насадкой Дина-Старка. Отогналось 8 мл метанола. После этого избыток исходных соединений упаривали в течение 3 часов на роторном испарителе (80°С водяная баня, 2 мбар). Сырой продукт растворяли в 500 мл толуола и экстрагировали 50 мл 1 М раствора NaOH и 3 раза по 50 мл воды, и органическую фазу упаривали на роторном испарителе досуха. После сушки получали 62.2 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2969, 2929, 2858, 1713, 1636, 1587, 1460, 1436, 1385, 1361, 1301, 1272, 1243, 1190, 1166, 1113, 1069, 1050, 1036, 984, 964, 929, 886, 850, 779, 733, 700, 660, 619.
CHN-Элементный анализ: С, 58.04; Н, 8.24; N, 6.95.
LC-MS: М+Н+, 200 9; М+Na+, 222.8.
1Н-ЯМР (ДМСО-d6, 400 МГц): Енольный таутомер (16%), δ=14.7 (с, 1Н), 5.37 (с, 1Н), 3.57-3.28 (м, 8Н), 2.36 (гептет, 1Н), 1.06 (д, 6Н); Кето-таутомер (84%), 5=3.70 (с, 2Н), 3.57-3.28 (м, 8Н), 2.67 (гептет, 1Н), 1.00 (д, 6Н).
АВ. 4-Метокси-1-(морфолин-4-ил)бутан-1,3-дион

0.346 моль (50.5 г) метил 4-метокси-ацетоацетата и 0.363 моль (31.6 г) морфолина перемешивали 20 часов при 110°C с насадкой Дина-Старка. Добавляли еще 0.069 моль (6.02 г) морфолина и перемешивали еще 3 часа. После этого избыток исходных соединений упаривали на роторном испарителе. 67.3 г сырого продукта хроматографировали на 600 г силикагеля, элюируя смесью этилацетат/этанол 9/1. Получали 36.9 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2921, 2857, 2361, 1729, 1633, 1590, 1438, 1362, 1303, 1272, 1244, 1199, 1111, 1069, 1038, 1019, 984, 965, 939, 920, 849, 778, 718, 681, 631.
LC-MS: М+Н+, 202.7; M+Na+, 224.6.
1Н-ЯМР CHMCO-d6, 400 МГц): δ Енольный таутомер (14%), δ=14.8 (с, 1Н), 5.55 (с, 1Н), 3.91 (с, 2Н), 3.60-3.32 (м, 8Н), 3.30 (с, 3Н); Кето-таутомер (86%), δ=4.11 (с, 2Н), 3.60 (с, 2Н), 3.60-3.32 (м, 8Н), 3.28 (с, 3Н).
АС. 3-Ацетил-1-метилпирролидин-2-он

20.40 г (0.20 моль) диизопропиламина растворяли в 200 мл безводного ТГФ в атмосфере азота и прикапывали 80 мл раствора н-бутиллития в гексане (2.5 М). Перемешивали 20 минут и затем прикапывали 20.00 г (0.20 моль) 1-метил-2-пирролидинона при -78°С. После перемешивания реакционной смеси в течение 1 часа, добавляли 17.64 г (0.20 моль) безводного этилацетата при -78°С. Реакционную смесь нагревали до комнатной температуры и перемешивали 14 часов. ТГФ удаляли на роторном испарителе при пониженном давлении, и остаток растворяли в 80 мл 6н. раствора HCl. Кислую водную фазу насыщали NaCl и экстрагировали 5 порциями по 300 мл этилацетата. Объединенные органические слои сушили над Na2SO4, и растворитель удаляли на роторном испарителе. Оставшееся после упаривания желтое масло очищали методом колоночной хроматографии. Получали 5.10 г продукта в виде светло-желтого масла.
ИК (чистое вещество, см-1): 3495, 2929, 2885, 1714, 1674, 1500, 1433, 1403, 1358, 1297, 1262, 1166, 1107, 989, 763, 712.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=1.95 (1Н), 2.30 (3Н), 2.45 (1Н), 2.75 (3Н), 3.25 (1Н), 3.35 (1Н), 3.5 (1Н).
AD. Этил (1-метил-2-оксопирролидин-3-ил)(оксо)ацетат

13.20 г 60%-ного NaH (в парафине) (0.33 моль) добавляли в 100 мл безводного диэтилового эфира. При интенсивном перемешивании добавляли 19.83 г (0.20 моль) N-метилпирролидона. Затем в течение одного часа прикапывали 121.30 г (0.83 моль) диэтилоксалата. После добавления, полученную суспензию нагревали до 40°С и перемешивали 21 час. Реакционную смесь охлаждали на ледяной бане, смешивали с 66 мл 5 М HCl, и один раз фильтровали полученную 2-фазную смесь. Затем разделяли две фазы, и водную фазу дважды экстрагировали порциями по 100 мл диэтилового эфира. Объединенные эфирные фазы сушили над Na2SO4 и упаривали на роторном испарителе досуха. Маслообразный остаток охлаждали до -80°С и смешивали с 200 мл диэтилового эфира. Полученный коричневый твердый осадок отфильтровывали и перекристаллизовывали из гептана. Получали 5.2 г продукта в виде белых игл.
ИК (чистое вещество, см-1): 3342, 2977, 2939, 1723, 1658, 1581, 1498, 1469, 1448, 1373, 1344, 1307, 1269, 1196, 1160, 1117, 1094, 1024, 977, 903, 876, 819, 783, 737, 701, 675.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=1.26 (3Н), 2.83 (3Н), 2.94 (2Н), 3.37 (2Н), 4.21 (2Н), 11.80 (1Н).
АЕ. Этил (1-метил-2-оксопиперидин-3-ил)(оксо)ацетат
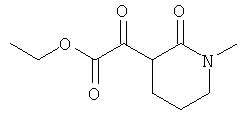
20.4 г диизопропиламина (0.1 моль) растворяли в 200 мл безводного ТГФ в атмосфере азота и охлаждали в охлаждающей бане. Медленно прикапывали 80 мл раствора н-бутиллития в гексане (2.5 М, 0.2 моль). После добавления смесь перемешивали 60 минут и затем прикапывали 22.6 г N-метил-2-пиперидона (0.2 моль). Реакционную смесь перемешивали еще 20 минут в охлаждающей бане. В другой колбе, охлаждали в охлаждающей бане 87.7 г диэтилоксалата (0.6 моль) в 100 мл безводного ТГФ, и небольшими порциями при перемешивании в этот раствор передавливали через канюлю охлажденную реакционную смесь. Оставляли на ночь нагреваться при перемешивании до комнатной температуры. ТГФ удаляли на роторном испарителе, и остаток растворяли в 80 мл разбавленной в два раза концентрированной соляной кислоты. Водную фазу экстрагировали пятью порциями по 300 мл этилацетата, объединенные органические фазы сушили над сульфатом натрия, и упаривали на роторном испарителе досуха. Избыток диэтилоксалата отгоняли (2-3 мбар, 80°С) и получали 45 г сырого продукта. Получали 10.4 г продукта в виде белых кристаллов с температурой плавления 23°С после кристаллизации из смеси диэтилового эфира и н-гексана.
ИК (чистое вещество, см-1): 2981, 2935, 1721, 1610, 1503, 1449, 1393, 1371, 1331, 1304, 1247, 1223, 1193, 1095, 1081, 1028, 995, 944, 895, 860, 794, 758, 722, 671, 628.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=14.00 (1Н), 4.20 (2Н), 3.25 (2Н), 2.90 (3Н), 2.65 (2Н), 1.73 (2Н), 1.23 (3Н).
AF. 3-Ацетил-1-метил-пиперидин-2-он
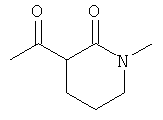
20.6 г диизопропиламина (0.2 моль) растворяли в 200 мл безводного ТГФ в атмосфере азота и охлаждали до -80°С. Медленно прикапывали 80 мл раствора н-бутиллития в гексане (2.5 М, 0.2 моль). После добавления смесь перемешивали 15 минут и затем прикапывали 22.6 г N-метил-2-пиперидона (0.2 моль). Реакционную смесь перемешивали 30 минут, после чего добавляли 17.6 г безводного этилацетата (0.2 моль). Реакционную смесь оставляли нагреваться до комнатной температуры при перемешивании в течение ночи. ТГФ удаляли на роторном испарителе, и остаток растворяли в 80 мл 6 М раствора HCl. Водную фазу экстрагировали пятью порциями по 100 мл этилацетата. Объединенные органические слои сушили над сульфатом натрия, и растворитель удаляли на роторном испарителе. Продукт (кето-форма : енольная форма = 1:1) фракционировали перегонкой при 0.6 мбар и получали в виде желтоватой жидкости (т.кип. 70°С.).
ИК (чистое вещество, см-1): 3506, 2940, 2865, 1715, 1632, 1597, 1498, 1463, 1443, 1401, 1386, 1354, 1330, 1310, 1252, 1203, 1160, 1118, 1081, 983, 952, 887, 762, 686, 651, 606.
Енольная форма:
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=1.81 (2Н), 1.92 (3Н), 2.38 (2Н), 2.96 (3Н), 3.30 (2Н), 14.8 (1Н).
Кето-форма:
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=1.81 (3Н), 2.14 (1Н), 2.34 (3Н), 2.99 (3Н), 3.30 (2Н), 3.48 (1Н).
AG. Этил 4-(диметиламино)-2,4-диоксобутаноат
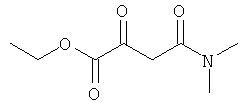
10.2 г диизопропиламина (0.1 моль) растворяли в 100 мл безводного ТГФ в атмосфере азота и охлаждали в охлаждающей бане. Медленно прикапывали 40 мл раствора н-бутиллития в гексане (2.5 М, 0.1 моль). По окончании добавления оставляли перемешиваться на 60 минут и затем прикапывали 8.7 г (0.1 моль) N,N-диметилацетамида. Реакционную смесь перемешивали еще 20 минут в охлаждающей бане. В другой колбе, 43.7 г диэтилоксалата (0.3 моль) в 50 мл безводного ТГФ охлаждали в охлаждающей бане, и охлажденную реакционную смесь передавливали через канюлю при перемешивании небольшими порциями. Оставляли на ночь нагреваться при перемешивании до комнатной температуры. ТГФ удаляли на роторном испарителе, и остаток растворяли в 80 мл концентрированной соляной кислоты, наполовину разбавленной водой. Водную фазу экстрагировали пятью порциями по 150 мл этилацетата, объединенные органические фазы сушили над сульфатом натрия и упаривали на роторном испарителе досуха. Избыток диэтилоксалата отгоняли (2-3 мбар, 80°С) и получали 17 г сырого продукта. Получали 5.5 г продукта в виде белых кристаллов с температурой плавления 28°С после кристаллизации из н-гексана.
ИК (чистое вещество, см-1): 2984, 2941, 1738, 1620, 1507, 1467, 1393, 1370, 1355, 1313, 1260, 1170, 1126, 1016, 927, 860, 823, 772,7 23, 628.
1Н-ЯМР (CDCl3,400 МГц): δ [м.д.]=1.38 (3Н), 3.06 (6Н), 4.33 (2Н), 6.25 (1Н)
АН. 1-(Морфолин-4-ил)бутан-1,3-дион
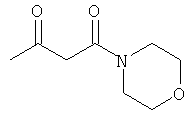
33 мл (0.38 моль) морфолина прикапывали при температуре от -5 до 0°С в раствор 30 г дикетона (0.36 моль) в 300 мл тетрагидрофурана. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 49.48 г (0.29 моль, 81% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 2965, 2918, 2858, 1718, 1633, 1587, 1488, 1436, 1359, 1303, 1273, 1245, 1220, 1112.
CHN-Элементный анализ: С 56.03, Н 7.62, N 8.12.
LC-MS: 172 (М+Н), 194 (M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=3.6 bis 3.3 (10H), 2.2 (3Н).
AI. Т-(2-Метоксиэтил)-3-оксобутанамид
33 мл (0.38 моль) метоксиэтиламина прикапывали в раствор 30 г дикетона (0.36 моль) в 300 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 47.15 г (0.30 моль, 83% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3291, 3095, 2978, 2922, 2887, 2851, 1709, 1643, 1560, 1417, 1356, 1344, 1297, 1195, 1166, 1122, 1092.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.1 (1Н), 3.4 bis 3.3 (9H), 2.2 (3Н).
AJ. N-Циклопропил-3-оксобутанамид
26 мл (0.38 ммоль) циклопропиламина прикапывали к раствору 30 г дикетона (0.36 моль) в 300 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 43.83 г (0.31 моль, 87% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3266, 3082, 3017, 2953, 2922, 1724, 1666, 1636, 1450, 1421, 1358, 1338, 1221, 1193, 1161, 1014.
LC-MS: 140 (М-Н).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.2 (1Н), 3.4 (2Н), 2.7 (1Н), 2.2 (3Н), 0.7 (2Н), 0.5 (2Н).
AK. 3-оксо-N-(пропан-2-ил)бутанамид

32 мл (0.38 ммоль) изопропиламина прикапывали в раствор 30 г дикетона (0.36 моль) в 300 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 40.36 г (0.28 моль, 79% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3254, 3088, 2975, 2925, 1725, 1633, 1561, 1459, 1422, 1350, 1334, 1314, 1289, 1190, 1160, 1133.
1Н-ЯМР (CDCl3,400 МГц): δ [м.д.]=6.9 (1Н), 4.0 (1Н), 3.3 (2Н), 2.2 (3Н), 1.1 (6Н).
AL. N-(2-Гидроксиэтил)-3-оксобутанамид
23 мл (0.38 ммоль) этаноламина прикапывали в раствор 30 г дикетона (0.36 моль) в 300 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 41.44 г (0.29 моль, 80% выход) в виде белого твердого вещества.
ИК (чистое вещество, см-1): 3273, 3097, 2973, 2938, 2880, 1710, 1646, 1558, 1494, 1465, 1420, 1362, 1347, 1312, 1297, 1215, 1190, 1166, 1052, 1038.
CHN-Элементный анализ: С 49.13, Н 7.76, N 9.71.
LC-MS: 145 (М), 127 (М-H2O).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.5 (1Н), 3.7 (2Н), 3.4 (4Н), 2.2 (3Н).
AM. N-(3-гидроксипропил)-3-оксобутанамид

28 мл (0.38 ммоль) 3-амино-1-пропанола прикапывали в раствор 30 г дикетона (0.36 моль) в 300 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 47.15 г (0.30 моль, 83% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3295, 3090, 2940, 2877, 1715, 1643, 1545, 1470, 1416, 1358, 1324, 1213, 1160, 1056, 963.
LC-MS: 182 (M+Na), 160 (M+H), 142 (M-OH).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.4 (1Н), 3.6 (3Н), 3.3 (4Н), 2.2 (3Н), 1.6 (2Н).
AN. N-(4-Гидроксибутил)-3-оксобутанамид
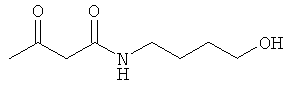
Раствор 22 мл (0.24 моль) 4-амино-1-бутанола в 50 мл тетрагидрофурана прикапывали к раствору 20 г дикетона (0.24 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 35.43 г (0.21 моль, 86% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3273, 3098, 2933, 2866, 1712, 1644, 1555, 1418, 1361, 1344, 1322, 1188, 1167, 1060.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.4 (1Н), 3.6 (2Н), 3.3 (2Н), 3.2 (2Н), 3.1 (1Н), 2.22 (3Н), 1.5 (4Н).
AO-1. N-(5-Гидроксипентил)-3-оксобутанамид

Раствор 39 г (0.38 моль) 5-амино-1-пентанола в 300 мл тетрагидрофурана прикапывали к раствору 30 г дикетона (0.36 моль) в 300 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 52.70 г (0.28 моль, 79% выход) в виде белого твердого вещества.
ИК (чистое вещество, см-1): 3269, 3096, 2928, 2855, 1725, 1711, 1643, 1418, 1361, 1340, 1190, 1166, 1060, 1007.
LCMS: 188 (M+H).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.2 (1Н), 3.6 (2H), 3.4 (2Н), 3.2 (2Н), 2.8 (1Н), 2.2 (3Н), 1.5 (4Н), 1.3 (2Н).
AO-2. N-(1-Гидрокси-2-метилпропан-2-ил)-3-оксобутанамид

Раствор 33,40 г (0.38 моль) 2-амино-2-метил-1-пропанола в 300 мл тетрагидрофурана прикапывали к раствору 30 г дикетона (0.36 моль) в 300 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 50.00 г (0.29 моль, 81% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3308, 2973, 2932, 1714, 1646, 1545, 1456, 1412, 1359, 1331, 1267, 1160, 1057.
CHN-Элементный анализ: С 54.99, Н 8.67, N 8.42.
LCMS: 172 (М-Н).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.1 (1Н), 4.6 (1Н), 3.5 (2Н), 3.3 (2Н), 2.2 (3Н), 1.3 (3Н).
AP. N-(2-Гидроксиэтил)-N-метил-3-оксобутанамид
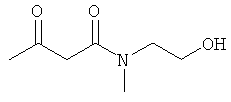
Раствор 30 мл (0.38 моль) 2-(метиламино)этанола в 300 мл тетрагидрофурана прикапывали к раствору 30 г дикетона (0.36 моль) в 300 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 41.46 г (0.26 моль, 73% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3407. 2934, 1717, 1620, 1491, 1401, 1357, 1308, 1161, 1121, 1050, 928, 861, 778.
LCMS: 159 (М), 141 (М-H2O).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=3.7 (3Н), 3.5 (2Н), 3.3 (1Н), 3.0 (2Н), 2.9 (1Н), 2.2 (3Н).
AQ. N-(2-Гидроксипропил)-3-оксобутанамид
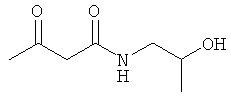
19 мл (0.24 моль) 1-амино-2-пропанола прикапывали в раствор 20 г дикетона (0.24 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 29.50 г (0.19 моль, 78% выход) бесцветного масла.
ИК (чистое вещество, см-1): 3307, 3088, 2972, 2930, 1714, 1643, 1545, 1415, 1359, 1326, 1161, 1134, 1090.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.4 (1Н), 3.9 (1Н), 3.8 (1Н), 3.3 (2Н), 3.1 (2Н), 2.2 (3Н), 1.1 (3Н).
AR. N-(1-Гидроксипропан-2-ил)-3-оксобутанамид

19 мл (0.24 моль) 2-амино-1-пропанола прикапывали в раствор 20 г дикетона (0.24 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 27.12 г (0.17 моль, 71% выход) бесцветного масла.
ИК (чистое вещество, см-1): 3295, 3083, 2974, 2935, 2877, 1714, 1640, 1544, 1454, 1413, 1358, 1324, 1220, 1160, 1095, 1050, 992.
1H-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.2 (1Н), 4.0 (1Н), 3.9 (1Н), 3.6 (1Н), 3.4 (2Н), 2.2 (3Н), 1.1 (3Н).
AS. N-(1-Гидроксибутан-2-ил)-3-оксобутанамид
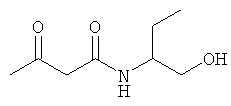
34 мл (0.36 моль) 2-амино-1-бутанола прикапывали в раствор 30 г дикетона (0.36 моль) в 300 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 46.97 г (0.27 моль, 76% выход) бесцветного масла.
ИК (чистое вещество, см-1): 3294, 3085, 2986, 2936, 2878, 1714, 1640, 1544, 1461, 1414, 1358, 1218, 1160, 1089, 1052.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.2 (1Н), 3.8 (1Н), 3.6 (1Н), 3.5 (1Н), 3.4 (1Н), 3.3 (1Н), 2.2 (3Н), 1.5 (1Н), 1.4 (1Н), 0.8 (3Н).
AT. N-(2,3-дигидроксипропил)-3-оксобутанамид

Раствор 22.5 г (0.21 моль) 3-метиламино-1,2-пропандиола в 200 мл тетрагидрофурана прикапывали к раствору 18 г дикетона (0.21 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 32.00 г (0.17 моль, 79% выход) бесцветного масла.
ИК (чистое вещество, см-1): 3385, 2931, 1716, 1616, 1492, 1403, 1358, 1310, 1162, 1103, 1040, 925.
LC-MS: 212 (M+Na), 190 (M+H), 172 (M-OH).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=3.9 (1Н), 4.8 bis 3.3 (8H), 3.1 (3Н), 2.3 (3Н).
AU. 1-(3-Гидроксипиперидин-1-ил)бутан-1,3-дион
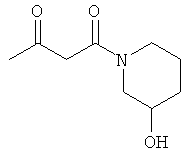
Раствор 36.10 г (0.36 моль) 3-гидроксипиперидина в 300 мл тетрагидрофурана прикапывали к раствору 30 г дикетона (0.36 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 53.53 г (0.29 моль, 81% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3340, 1716, 1618, 1596, 1485, 1462, 1437, 1410, 1360, 1343, 1319, 1279, 1263, 1185, 1159, 1138, 1001, 921, 858.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=3.8 (2Н), 3.6 bis 3.2 (5H), 2.9 (1Н), 2.2 (3Н), 1.8 (2H), 1.6 (1H), 1.4 (1H).
AV. 1-[4-(Гидроксиметил)пиперидин-1-ил]бутан-1,3-дион
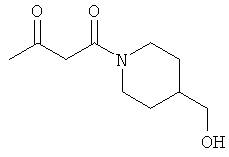
Раствор 25 г (0.22 моль) 4-пиперидинметанола в 200 мл тетрагидрофурана прикапывали к раствору 18 г дикетона (0.2 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 35.40 г (0.18 моль, 83% выход) бесцветного масла.
ИК (чистое вещество, см-1): 3401, 3003, 2918. 2860, 1718, 1618, 1447, 1358, 1313, 1270, 1200, 1158, 1089, 1036, 987, 956.
1H-ЯМР (CDCl3, 400 МГц): δ [м.д.]=4.5 (1Н), 3.7 (1Н), 3.4 (2Н), 3.3 (2Н), 2.9 (1Н), 2.6 (1Н), 2.5 (1Н), 2.2 (3Н), 1.7 (3Н), 1.1 (2Н).
AW. 1-[3-(Гидроксиметил)пиперидин-1-ил]бутан-1,3-дион

Раствор 25 г (0.22 моль) 3-пиперидинметанола в 200 мл тетрагидрофурана прикапывали к раствору 18 г дикетона (0.2 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 31.50 г (0.16 моль, 74% выход) бесцветного масла.
ИК (чистое вещество, см-1): 3411, 2926, 2859, 1717, 1618, 1442, 1358, 1308, 1262, 1222, 1183, 1160, 1036, 855.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=4.1 (1Н), 3.6-3.2 (7Н), 2.9 (1Н), 2.2 (3Н), 1.7 (3Н), 1.3 (2Н).
АХ. 1-[2-(Гидроксиметил)пиперидин-1-ил]бутан-1,3-дион
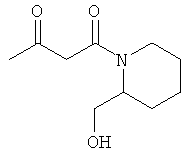
Раствор 25 г (0.22 моль) 2-пиперидинметанола в 200 мл тетрагидрофурана прикапывали к раствору 18 г дикетона (0.2 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 32.40 г (0.17 моль, 76% выход) бесцветного масла.
ИК (чистое вещество, см-1): 3403, 2936, 1717, 1612, 1442, 1357, 1309, 1267, 1226, 1158, 1139, 1049.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=4.7 (1Н), 4.4 (1Н), 3.9 bis 3.7 (2H), 3.6-3.3 (3H), 2.2 (3H), 1.7-1.3 (6H).
AY. 1-[(3S)-3-Гидроксипирролидин-1-ил]бутан-1,3-дион
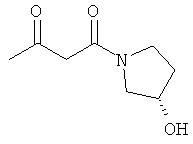
Раствор 21.8 г (0.25 моль) (S)-3-пирролидинола в 200 мл тетрагидрофурана прикапывали к раствору 20 г дикетона (0.24 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 31.35 г (0.18 моль, 77% выход) бесцветного масла.
ИК (чистое вещество, см-1): 3390, 2948, 1717, 1616, 1438, 1383, 1357, 1224, 1188, 1160, 1102, 988, 871.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=4.4 (1Н), 4.1 (1Н), 3.6-3.3 (5Н), 2.2 (3H), 2.0-1.8 (3H).
AZ. 1-[4-(2-Гидроксиэтил)пиперазин-1-ил]бутан-1,3-дион
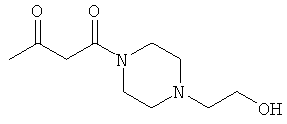
Раствор 32.5 г (0.25 моль) 1-(2-гидроксиэтил)пиперазина в 100 мл тетрагидрофурана прикапывали к раствору 20 г дикетона (0.24 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 36.10 г (0.17 моль, 71% выход) бесцветного масла.
ИК (чистое вещество, см-1); 3412, 2922, 2812, 1717, 1628, 1441, 1357, 1305, 1156, 1051, 1001, 875.
LC-MS: 237 (M+Na), 215 (M+H).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=3.6 (4Н), 3.5 (2H), 3.4 (2H), 2.7 (1Н), 2.6 (2H), 2.5 (4Н), 2.2 (3Н).
ААА. 1-(4-метилпиперазин-1-ил)бутан-1,3-дион
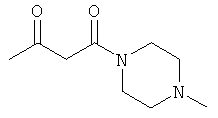
28 мл (0.25 моль) 1-(2-гидроксиэтил)пиперазина прикапывали к раствору 20 г дикетона (0.24 моль) в 300 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 33.70 г (0.18 моль, 77% выход) бесцветного масла.
ИК (чистое вещество, см-1): 2938, 2847, 2792, 1719, 1633, 1586, 1488, 1440, 1338, 1358, 1291, 1257, 1141, 1050, 1001, 778.
LC-MS: 207 (M+Na), 185 (M+H).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=3.6 (2Н), 3.5 (2Н), 3.4 (2Н), 2.4 (4Н), 2.3 (3Н), 2.2 (3Н).
ААВ. N-(3-Гидроксипропил)-N-метил-3-оксобутанамид
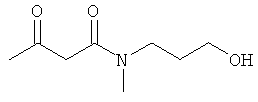
Раствор 20 г (0.23 моль) 3-метиламино-1-пропанола в 50 мл тетрагидрофурана прикапывали к раствору 18 г дикетона (0.21 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 29.2 г (0.17 моль, 79% выход) бесцветного масла.
ИК (чистое вещество, см-1): 3407, 2936, 1718, 1622, 1493, 1402, 1358, 1310, 1161, 1128, 1058, 945.
LC-MS: 156 (М-ОН), 174 (M+H), 196 (M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=3.8 bis 3.4 (7H), 2.9 (3Н), 2.2 (3Н), 1.7 (2Н).
AAC. N-(транс-4-Гидроксициклогексил)-3-оксобутанамид

Раствор 28.8 г (0.25 моль) транс-4-аминоциклогексанола в 200 мл тетрагидрофурана прикапывали к раствору 20 г дикетона (0.24 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток перекристаллизовывали из 200 мл этилацетата.
Получали 33.6 г (0.17 моль, 71% выход) бесцветного твердого вещества.
ИК (чистое вещество, см-1): 3274, 2940, 2859, 1716, 1639, 1543, 1450, 1423, 1338, 1221, 1136, 1098, 1058, 1009, 963, 948, 900.
LC-MS: 200 (М+Н), 222 (M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=6.9 (1Н), 3.7 (1H), 3.6 (1H), 3.3 (2H), 2.5 (1Н), 2.2 (3H), 1.9 (4H), 1.4-1.1 (4H).
AAD. N-(3-Гидрокси-2,2-диметилпропил)-3-оксобутанамид

Раствор 32.2 г (0.31 моль) 3-амино-2,2-диметил-пропан-1-ола в 60 мл тетрагидрофурана прикапывали к раствору 25 г дикетона (0.30 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток перекристаллизовывали из 150 мл этилацетата. Получали 40.6 г (0.21 моль, 73% выход) бесцветного твердого вещества.
ИК (чистое вещество, см-1): 3253, 3099, 2957, 2873, 1724, 1637, 1581, 1476, 1453, 1428, 1358, 1325, 1162, 1035, 995, 785.
LC-MS: (M+H), (M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.5 (1H), 3.8 (1H), 3.4 (2H), 3.1 (4Н), 2.3 (3Н), 0.8 (6Н).
ААЕ. 1-[4-(Диметиламино)пиперидин-1-ил]бутан-1,3-дион
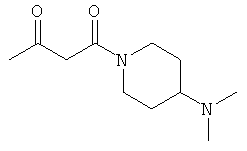
20 г (0.16 моль) 4-пиперидин-диметиламина прикапывали в раствор 12.5 г дикетона (0.15 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 23.9 г (0.11 моль, 76% выход) бесцветного масла.
ИК (чистое вещество, см-1): 3270, 2930, 2863, 2721, 1719, 1633, 1585, 1492, 1448, 1389, 1360, 1270, 1238, 1198, 1154, 1060, 1040, 958, 873, 775.
LC-MS: 213 (М+Н), 235 (M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=4.5 (1Н), 3.7 (1Н), 3.5 (2Н), 3.0 (1Н), 2.6 (1Н), 2.3 (1Н), 2.2 (9Н), 1.8 (2Н), 1.3 (2Н).
AAF. 1-(4-Метоксипиперидин-1-ил)бутан-1,3-дион
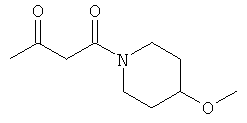
15 г (0.13 моль) 4-метокси-пиперидина прикапывали в раствор 10.4 г дикетона (0.12 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 17.0 г (0.085 моль, 71% выход) бесцветного масла.
ИК (чистое вещество, см-1): 2930, 2863, 1720, 1635, 1586, 1488, 1445, 1390, 1359, 1270, 1188, 1097, 1077, 1067, 1024, 939, 904.
LC-MS: 200 (М+Н), 223 (M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=3.8-3.2 (8Н), 2.2 (3Н), 1.8 (4Н), 1.5 (2Н).
AAG. 1-(2,6-Диметилморфолин-4-ил)бутан-1,3-дион
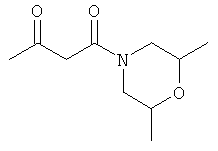
23 мл (0.19 моль) 2,6-диметилморфолина прикапывали в раствор 15 г дикетона (0.18 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 26.5 г (0.13 моль, 74% выход) бесцветного масла.
ИК (чистое вещество, см-1): 3683, 2974, 2863, 1720, 1635, 1440, 1377, 1359, 1322, 1246, 1223, 1171, 1139, 1083, 1035, 966, 839.
LC-MS: 200 (М+Н), 223 (M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=4.4 (1Н), 4.0 (1Н), 3.6-3.3 (3Н), 2.8 (1Н), 2.4 (1Н), 2.3 (1Н), 2.2 (3Н), 1.1 (6Н).
ААН. N-(Морфолин-4-ил)-3-оксобутанамид
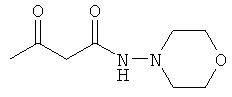
18 мл (0.19 моль) 4-аминоморфолина прикапывали в раствор 15 г дикетона (0.18 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 26.1 г (0.14 моль, 78% выход) бесцветного масла.
ИК (чистое вещество, см-1): 3095, 2940, 2841, 1711, 1677, 1625, 1591, 1504, 1448, 1380, 1358, 1302, 1263, 1193, 1163, 1109, 1073, 1038, 912, 869.
LC-MS: 187 (М+Н), 210 (M+Na).
1Н-ЯМР (ДМСО, 400 МГц): δ [м.д.]=3.8-3.3 (6Н), 2.8-2.5 (4Н), 2.2 (3Н), 2.1 (1Н).
AAI. 1-(Морфолин-4-ил)пентан-1,3-дион
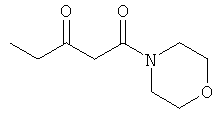
50.0 г (384 ммоль) метилового эфира 3-оксовалериановой кислоты и 35.1 г (403 ммоль) морфолина нагревали 9 часов при 110°С, удаляя образующийся метанол через насадку для перегонки. Реакционную смесь затем упаривали на роторном испарителе и очищали методом колоночной хроматографии (силикагель, элюент: градиент этилацетат/этанол). Фракции, содержащие чистый продукт, упаривали на роторном испарителе и получали 39.7 г (60%) вязкого бесцветного прозрачного масла.
ИК (чистое вещество, см-1): 2973, 2858, 1716, 1633, 1437, 1359, 1301, 1272, 1247, 1171, 1111, 1068, 1032, 961, 850, 584.
Элементный анализ: С, 57.26; Н, 8.00; N, 7.96.
LC-MS: 186.7 (M+H+), 208.7 (M+Na+).
1Н-ЯМР (CDCl3, 400 МГц): 3.59-3.46 (8Н), 3.33 (2Н), 2.48 (2Н), 0.98 (3Н).
AAJ. 1-(4-Гидроксипиперидин-1-ил)пентан-1,3-дион

59.0 г (583 ммоль) 4-гидроксипиперидина и 79.7 г (612 ммоль) метилового эфира 3-оксовалериановой кислоты нагревали 9 часов при 110°С, удаляя образующийся метанол через насадку для перегонки. Реакционную смесь затем упаривали на роторном испарителе, растворяли в этаноле и фильтровали через 600 мл сильнокислой ионообменной смолы (Dowex® HCR-W2), снова упаривали и очищали методом колоночной хроматографии (силикагель, элюент: градиент этилацетат/этанол). Фракции, содержащие чистый продукт, упаривали на роторном испарителе и получали 63.6 г (55%) вязкого бесцветного прозрачного масла.
ИК (чистое вещество, см-1): 2940, 2877, 1715. 1616, 1449, 1369, 1299, 1171, 1108, 1077, 1059, 1018, 978, 930, 583.
LC-MS: 186.8 (М+Н+); 208.7 (M+Na+).
1Н-ЯМР (CDCl3, 400 МГц): 3.85 (2Н). 3.60-3.51 (1Н), 3.47 (2Н), 3.23 (1Н), 3.18-3.07 (2Н), 2.47 (2Н), 1.75 (2Н), 1.42 (2Н), 0.96 (3Н).
ААК. TV-бутил-3-оксогептанамид
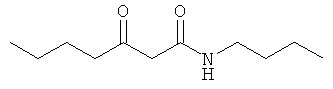
0.9 моль (150 мл) метил 3-оксогептаноата и 2.7 моль (270 мл) бутиламина перемешивали 5 ч при 100°С в герметично закрытом реакторе. Затем избыток бутиламина упаривали на роторном испарителе, сырой продукт растворяли в смеси вода/этанол, и pH раствора доводили до 3 добавлением концентрированной HCl. Смесь снова упаривали досуха, растворяли в этилацетате и фильтровали. Фильтрат промывали 1 М раствором HCl и водой. Органическую фазу сушили над Каз804, фильтровали и упаривали на роторном испарителе досуха. Сырой продукт растворяли в 100 мл диэтилового эфира и кристаллизовали при 5°С. Продукт отфильтровывали и сушили. Получали 36.0 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 3268, 3098, 2958, 2931, 2873, 1723, 1707, 1641, 1563, 1466, 1455, 1434, 1416, 1377, 1350, 1337, 1255, 1227, 1176, 1159, 1125, 1098, 1065, 1013, 969, 904, 881, 774, 734, 716, 650.
CHN-Элементный анализ: С, 66.77; Н, 10.62; N, 6.93.
LC-MS: M+H+ 200.6; M+Na+ 222.7.
1Н-ЯМР (ДМСО-d6, 400 МГц): Енольный таутомер (12%), δ [м.д.]=14.16 (с, 1Н), 7.82 (м, 1Н), 4.92 (с, 1Н), 3.1-3.0 (м, 2Н), 2.06 (т, 2Н), 1.5-1.3 (м, 4Н), 1.3-1.2 (м, 4Н), 0.88-0.82 (м, 6Н); Кето-таутомер (88%), δ=7.97 (м, 1Н), 3.24 (с, 2Н), 3.02 (кв, 2Н), 2.47 (т, 2Н), 1.5-1.3 (м, 4Н), 1.3-1.2 (м, 4Н), 0.88-0.81 (м, 6Н).
AAL. 1-(4-Гидроксипиперидин-1-ил)-4-метилпентан-1,3-дион

0.351 моль (49.6 мл) метилового эфира 4-метил-3-оксовалериановой кислоты и 0.369 моль (37.3 г) 4-гидроксипиперидина перемешивали в течение 6 ч при 120°C с насадкой Дина-Старка. Отгонялось 12 мл метанола. После этого избыток исходных соединений упаривали 3 часа на роторном испарителе (80°С водяная баня, 2 мбар). Получали 71 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2934, 2873, 1712, 1619, 1449, 1384, 1364, 1330, 1300, 1267, 1225, 1187, 1166, 1117, 1071, 1025, 979, 955, 930, 846, 808, 777, 733, 693.
CHN-Элементный анализ: С, 50.13; Н, 7.514; N, 5.89.
LC-MS: М+H+, 214.9; M+Na+ 239.9.
1Н-ЯМР (ДМСО-d6, 400 МГц): Енольный таутомер (15%), δ [м.д.]=5.39 (с, 1Н), 4.49 (с (ушир.), 1Н), 3.9-2.9 (м, 5Н), 2.6-2.5 (м, 1Н), 1.75-1.11 (м. 4Н), 1.06 (д, 6Н); Кето-таутомер (85%), δ=4.73 (с (ушир.), 1Н), 3.67 (с, 2Н), 3.9-2.9 (м, 5Н), 2.68 (гептет, 1Н), 1.75-1.11 (м, 4Н), 1.00 (д, 6Н).
ААМ. N-(2-Гидроксиэтил)-N,4-диметил-3-оксопентанамид
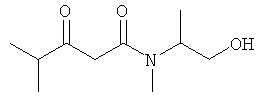
0.351 моль (50 мл) метилового эфира 4-метил-3-оксовалериановой кислоты и 0.369 моль (29.5 мл) 2-(метиламино)этаноли перемешивали в течение 15 ч при 120°C с насадкой Дина-Старка. Отгонялось 12 мл метанола. Затем в течение 2 часов отгоняли избыток исходных соединений на роторном испарителе (80°С водяная баня, 1 мбар). Получали 64 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2969, 2934, 2875, 1713, 1621, 1491, 1466, 1401, 1384, 1358, 1303, 1265, 1211, 1120, 1072, 1048, 996, 926, 892, 862, 784, 726, 692, 615.
CHN-Элементный анализ: С, 52.00; Н, 6.84; N, 6.01.
LC-MS: М+H+, 188.7; M+Na+ 210.6.
1Н-ЯМР (ДМСО-d6, 400 МГц): E/Z-изомеры в соотношении примерно 45/55; Енольный таутомер (20%), δ [м.д.]=5.31, 5.28 (с, 1Н), 3.55-3.42 (м, 2Н), 3.42-3.25 (м, 2Н), 3.0-2.8 (м, 3Н), 2.4-2.3 (м, 1Н), 1.07 (д, 6Н); Кето-таутомер (80%), δ=3.70, 3.66 (с, 2Н), 3.55-3.42 (м, 2Н), 3.42-3.25 (м, 2Н), 2.94,2.83 (с, 3Н), 2.71,2.70 (гептет, 1Н), 1.02,1.01 (д, 6Н).
AAN. N,N,2-Триметил-3-оксобутанамид

0.318 моль (50 мл) этилового эфира 2-метилацетоуксусной кислоты (этил 2-метил-3-оксо-бутаноата) (техн., 90%) и 143 мл 33%-ного раствора диметиламина в этаноле (примерно 0.795 моль диметиламина) перемешивали в автоклаве 8 часов при 130°С. После охлаждения, реакционную смесь упаривали на роторном испарителе, полученный остаток растворяли в 400 мл этилацетата и экстрагировали 5 порциями по 150 мл воды.
Объединенные водные фазы упаривали на роторном испарителе досуха. Получали 18.8 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2984, 2938, 1721, 1632, 1497, 1451, 1396, 1355, 1312, 1265, 1214, 1180, 1145, 1078, 1041, 952,795, 770, 734, 689, 635, 623.
CHN-Элементный анализ: С, 71.21; Н, 7.81; N, 6.39; 0,14.59.
LC-MS: М+H+, 144.6; M+Na+ 166.6.
1Н-ЯМР (ДМСО-d6, 400 МГц): δ [м.д.]=3.92 (кв, 1Н); 3.03 (с, 3Н); 2.84 (с, 3Н); 2.06 (с, 3Н); 1.12 (д, 3Н).
ААО. N,N-Диметил-2-оксоциклогексанкарбоксамид
0.313 моль (50 мл) этил циклогексанон-2-карбоксилата и 140 мл 33%-ного раствора диметиламина в этаноле (примерно 0.78 моль диметиламина) перемешивали в автоклаве 12 часов при 110°С. После охлаждения, реакционную смесь упаривали на роторном испарителе, полученный остаток растворяли в 500 мл этилацетата, и органическую фазу промывали 200 мл 1М раствора NaOH и 3×50 мл воды. Органическую фазу затем упаривали на роторном испарителе досуха. 46 г сырого продукта растворяли в 100 мл трет-бутил-метилового эфира и охлаждали до 0°С. Выпавший в осадок продукт отфильтровывали и сушили, получая 3.6 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2939, 2867, 1691, 1639, 1496, 1454, 1442, 1429, 1409, 1396, 1342, 1316, 1287, 1261, 1208, 1155, 1130, 1096, 1067, 1038, 1012, 959, 923, 897, 870, 853, 808, 769, 696, 659, 623.
CHN-Элементный анализ: С, 71.21; Н, 7.81; N, 6.39; 0,14.59.
LC-MS: M+H+, 170.6; M+Na+ 192.8.
1Н-ЯМР (ДМСО-d6, 400 МГц): δ [м.д.]=3.86 (дд, 1Н), 2.82 (с, 3Н), 2.81 (с, 3Н), 2.54-2.22 (м, 2Н), 2.0-1.5 (м, 6Н).
ААР. N-Диметил-N-оксоциклопентанкарбоксамид
0.337 моль (50 мл) этил 2-оксоциклопентанкарбоксилата и 152 мл 33%-ного раствора диметиламин в этаноле перемешивали в автоклаве 4 часа при 110°С. Реакционную смесь затем упаривали досуха, и сырой продукт очищали на 400 г силикагеля, элюируя смесью этилацетат/гексан 1/1. Получали 17.7 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2955, 2884, 1735, 1634, 1494, 1455, 1396, 1320, 1260, 1198, 1167, 1140, 1101, 1059, 1025, 1004, 983, 946, 915, 904, 833, 752, 689, 623.
LC-MS: M+H+ 156.7; M+Na+ 178.6.
1Н-ЯМР (ДМСО-d6, 400 МГц): δ [м.д.]=3.72 (т, 1Н); 3.03 (с, 3Н); 2.83 (с, 3Н); 2.3-1.4 (м, 6Н).
AAQ. N-Циклопентил-3-оксобутанамид

Раствор 21.3 г (0.25 моль) циклопентиламина в 50 мл тетрагидрофурана прикапывали при температуре от -5 до 0°С в раствор 20 г дикетона (0.24 моль) в 200 мл тетрагидрофурана.
После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток перекристаллизовывали из 100 мл этилацетата. Получали 31.4 г (0.19 моль, 78% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3256, 3083, 2947, 2919, 2868, 1719, 1647, 1626, 1556, 1422, 1357, 1197, 1161, 999.
LC-MS: 170 (М+Н).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=6.9 (1Н), 4.2 (1Н), 3.3 (2Н), 2.2 (3Н), 1.9 (2Н), 1.6 (4Н), 1.4 (2Н).
AAR. 1-(Пирролидин-1-ил)бутан-1,3-дион

Раствор 21 мл (0.25 моль) пирролидина в 50 мл тетрагидрофурана прикапывали к раствору 20 г дикетона (0.24 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 29.9 г (0.19 моль, 81% выход) масла.
ИК (чистое вещество, см-1): 2972, 2875, 1719, 1633, 1589, 1481, 1433, 1381, 1356, 1226, 1193, 1159, 934, 776.
LC-MS: 156 (М+Н), 178 (M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=3.2 (5Н), 2.1 (3Н), 1.7 (5Н).
AAS. Метил N-(3-оксобутаноил)-L-серинат

10.8 г (0.13 моль) дикетона, 20 г гидрохлорида метилового эфира L-серина (0.13 моль) и 21.6 г (0.26 моль, 2 экв.) NaHCO3 смешивали в 1000 мл ТГФ при 0°С. Затем удаляли ледяную баню и перемешивали смесь при комнатной температуре. После 24 часов перемешивания при комнатной температуре, реакционную смесь фильтровали, и остаток перекристаллизовывали из 100 мл этилацетата. Получали 21.14 г (0.10 моль, 81% выход) продукта в виде белого твердого вещества.
ИК (чистое вещество, см-1): 3499, 3297, 2962, 1734, 1712, 1642, 1556, 1430, 1416, 1351, 1316, 1246, 1209, 1190, 1170, 1137, 1081, 1040, 978, 704.
LC-MS: 226 (M+Na), 187 (M-CH3-H).
1Н-ЯМР (CDCl3,400 МГц): δ [м.д.]=8.4 (1Н), 5.1 (1Н), 4.4 (1Н), 3.7-3.4 (7Н), 2.1 (3Н).
ААТ. 1-(4-Ацетилпиперазин-1-ил)бутан-1,3-дион

Раствор 20.8 г (0.17 моль) 1-ацетилпиперазина в 50 мл тетрагидрофурана прикапывали в раствор 13 г дикетона (0.16 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 27.2 г (0.13 моль, 83% выход) бесцветного масла.
ИК (чистое вещество, см-1): 2919, 2864, 1718, 1631, 1422, 1358, 1307, 1284, 1248, 1159, 1063, 993.
LC-MS: 213 (М+Н), 235 (M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=3.6 (6Н), 3.4 (ЗН), 3.3 (1Н), 2.2 (ЗН), 2.1 (3Н).
AAU. N-Циклогексил-3-оксобутанамид

Раствор 23.6 г (0.24 моль) циклогексиламина в 50 мл тетрагидрофурана прикапывали к раствору 20 г дикетона (0.24 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток перекристаллизовывали из 100 мл этилацетата. Получали 30.0 г (0.16 моль, 69% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3259, 3088, 2929, 2852, 1716, 1648, 1627, 1560, 1449, 1427, 1359, 1346, 1193, 1162, 1105, 1001, 892, 751, 718.
LC-MS: 184 (М+Н), 206 (M+Na).
1H-ЯМР (CDCl3, 400 МГц): δ [м.д.]=6.9 (1Н), 3.7 (1Н), 3.3 (2Н), 2.2 (3Н), 1.9 (2Н), 1.7 (2Н), 1.6 (1Н), 1.2 (2Н), 1.1 (3Н).
AAV. Метил N-(3-оксобутаноил)глицинат
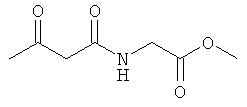
29.87 г (0.24 моль) гидрохлорида метилового эфира глицина добавляли в раствор 20.00 г (0.24 моль) дикетона в 250 мл толуола при 0°С. Затем добавляли 40.00 г (0.48 моль) NaHCO3, и реакционную смесь перемешивали в течение ночи при комнатной температуре. Поскольку исходные соединения не обнаруживались методом ТСХ, реакционную смесь фильтровали, упаривали, и остаток очищали методом колоночной хроматографии. Получали 33.4 г (0.19 моль, 81% выход) масла.
ИК (чистое вещество, см-1): 3346, 1750, 1708, 1669, 1538, 1399, 1360, 1320, 1278, 1198, 1165, 1024.
LC-MS: 174 (М+Н), 196 (M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.5 (1Н), 4.0 (2Н), 3.7 (3Н). 3.4 (2Н), 2.2 (3Н).
AAW. N-(2-метилпропил)-3-оксобутанамид

Раствор 18.20 г (0.25 моль) изобутиламина в 50 мл тетрагидрофурана прикапывали к раствору 20 г дикетона (0.24 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток перекристаллизовывали из 100 мл этилацетата. Получали 26.93 г (0.17 моль, 72% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3269, 3098, 2964, 2875, 1711, 1640, 1574. 1473, 1414, 1355, 1328, 1271, 1190, 1160, 976, 823, 764, 727.
LC-MS: 158 (M+H), 180(M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.1 (1Н), 4.3 (2Н), 3.1 (2Н), 2.2 (3Н), 1.7 (1Н), 0.9 (6Н).
AAX. N-(Циклопропилметил)-3-оксобутанамид

Раствор 15.1 г (0.22 моль) циклопропилметиламина в 50 мл тетрагидрофурана добавляли по каплям в раствор 17 г дикетона (0.20 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток перекристаллизовывали из 100 мл этилацетата. Получали 19.7 г (0.13 моль, 63% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3255, 3083, 3008, 2932, 1712, 1640, 1415, 1356, 1326, 1276, 1191, 1160, 1079, 1017, 830, 800, 775, 729.
LC-MS: 156 (M+H), 178 (M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.0 (1Н), 3.4 (2Н), 3.1 (2Н), 2.3 (3Н), 0.9 (1Н), 0.5 (2Н),0.1(2Н).
AAY. Этил 4-(морфолин-4-ил)-2,4-диоксобутаноат

10.2 г диизопропиламина (0.1 моль) растворяли в 100 мл безводного ТГФ в атмосфере азота и охлаждали в охлаждающей бане. Медленно прикапывали 40 мл раствора н-бутиллития в гексане (2.5 М, 0.1 моль). По окончании добавления смесь перемешивали 60 минут и затем прикапывали ацетилморфолин 12.9 г (0.1 моль). Реакционную смесь перемешивали 20 минут в охлаждающей бане. Во второй колбе, 43.7 г диэтилоксалата (0.3 моль) в 50 мл безводного ТГФ охлаждали в охлаждающей бане, и небольшими порциями при перемешивании в этот раствор передавливали через канюлю охлажденную реакционную смесь. Оставляли на ночь нагреваться при перемешивании до комнатной температуры. ТГФ удаляли на роторном испарителе, и остаток растворяли в 80 мл разбавленной в два раза концентрированной соляной кислоты. Водную фазу экстрагировали пятью порциями по 150 мл этилацетата, объединенные органические фазы сушили над сульфатом натрия, и упаривали на роторном испарителе досуха. Избыток диэтилоксалата отгоняли (2-3 мбар, 80°С) и получали 5 г продукта в виде белых кристаллов с температурой плавления 60°С после кристаллизации из петролейного эфира.
ИК (чистое вещество, см-1): 2998. 2980, 2915, 2873, 1722, 1632, 1585, 1489, 1446, 1396, 1375, 1271, 1236, 1136, 1113, 1072, 1054, 1019, 981, 917, 874. 858, 837, 825, 766, 723, 639.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=1.35 (3Н), 3.50-3.73 (8Н), 4.33 (2Н), 6.20 (1Н), 14.32 (1Н).
AAZ. Этил N-(3-оксобутаноил)-L-аланинат

20.00 г (0.13 моль) гидрохлорида этил (2S)-2-аминопропаноата добавляли в раствор 10.95 г (0.13 моль) дикетона в 500 мл толуола при 0°С. Затем добавляли 21.90 г (0.26 моль) NaHCO3, и реакционную смесь перемешивали в течение ночи при комнатной температуре. Поскольку исходные соединения не детектировались методом тонкослойной хроматографии, реакционную смесь фильтровали, упаривали, и остаток от упаривания очищали методом колоночной хроматографии. Получали 19.36 г (0.096 моль, 74% выход) бесцветного масла.
ИК (чистое вещество, см-1): 3308, 2985, 1720, 1647, 1537, 1453, 1360, 1205, 1155, 1056, 1021.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.4 (1Н), 4.5 (1Н), 4.1 (2Н), 3.4 (2Н), 2.2 (3Н), 1.3 (3Н), 1.2 (3Н).
АВА. N-Циклобутил-3-оксобутанамид
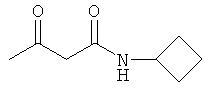
Раствор 20.00 г (0.28 моль) циклобутиламина в 50 мл тетрагидрофурана прикапывали к раствору 22.00 г дикетона (0.26 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток перекристаллизовывали из 100 мл этилацетата. Получали 24.60 г (0.16 моль, 61% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3251, 3080, 2974, 2949, 1721, 1649, 1626, 1554, 1423, 1356, 1341, 1243, 1216, 1162, 994, 748, 717.
LC-MS: 156 (М+Н), 178 (M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=7.2 (1Н), 4.3 (1Н), 3.3 (2Н), 2.3 (5Н), 2.8 (2Н), 2.6 (2Н).
ABB. 1-(Азетиди н-1-ил)-бутан-1,3-дион

Раствор 18.00 г (0.31 моль) азетидина в 50 мл тетрагидрофурана прикапывали к раствору 25.00 г дикетона (0.30 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток перекристаллизовывали из 100 мл этилацетата. Получали 26.45 г (0.19 моль, 63% выход) белого твердого вещества.
ИК (чистое вещество, см-1): 3107, 2983, 2958, 2885, 1718, 1631, 1462, 1443, 1410, 1367, 1306, 1298, 1237, 1188, 1168, 1154, 1112, 1014, 851, 736.
LC-MS: 142 (М+Н), 164 (M+Na).
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=4.1 (2Н), 3.9 (2Н), 3.1 (2Н), 2.1 (5Н).
АВС. Этил 1-(3-оксобутаноил)-пиперидин-4-карбоксилат
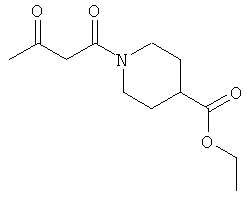
Раствор 18.70 г (0.12 моль) этил 4-пиперидинкарбоксилата в 50 мл тетрагидрофурана прикапывали к раствору 10.00 г дикетона (0.12 моль) в 200 мл тетрагидрофурана при температуре от -5 до 0°С. После перемешивания в течение 1 часа при 0°С, метод тонкослойной хроматографии показал отсутствие в системе исходного соединения. Реакционную смесь упаривали, и остаток очищали методом колоночной хроматографии. Получали 19.52 г (0.081 моль, 68% выход) бесцветного масла.
ИК (чистое вещество, см-1): 2957, 2932, 2863, 1721, 1634, 1446, 1314, 1272, 1250, 1173, 1158, 1110, 1097, 1039, 939.
1Н-ЯМР (CDCl3, 400 МГц): δ [м.д.]=4.3 (1Н), 4.1 (2Н), 3.7 (1Н), 3.5 (2Н), 3.1 (1Н), 2.9 (1Н), 2.5 (1Н), 2.2 (3Н), 1.9 (2Н), 1.6 (2Н), 1.2 (3Н).
ABD. 1-(4-Гидроксипиперидин-1-ил)-4-метоксибутан-1,3-дион
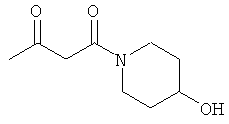
0.34 моль (48.7 г) метил 4-метокси-ацетоацетата и 0.36 моль (36.0 г) 4-гидроксипиперидина перемешивали в течение 5 часов при 120°C с насадкой Дина-Старка. 45 г сырого продукта очищали на 1 кг силикагеля, элюируя смесью этилацетат/этанол 9/1.
Получали 23.7 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2931, 1729, 1618, 1448, 1365, 1310, 1266, 1201, 1132, 1101, 1072, 1025, 977, 935, 809, 776, 716, 681.
LC-MS: M+H+ 216.8; M+Na+ 238.7.
1Н-ЯМР (ДМСО-d6, 400 МГц): Енольный таутомер (14%), δ [м.д.]=15.10 (с, 1Н), 5.56 (с, 1Н), 4.76 (д (J=4 Гц), 1Н), 3.90 (с, 2Н), 3.9-2.9 (м, 5Н), 3.29 (с, 3Н), 1.8-1.1 (м, 4Н); Кето-таутомер (86%), δ [м.д.]=4.73 (д (J=4 Гц), 1Н), 4.10 (с, 2Н), 3.9-2.9 (м, 5Н), 3.57 (с, 2Н), 3.27 (с, 3Н), 1.8-1.1 (м, 4Н).
Метод тестирования
Прекрасную всасываемость Fe, обеспечиваемую комплексами Fe по настоящему изобретению, определяли с помощью описанной далее мышиной модели.
Самцов мышей NMRI (SPF) (возраст примерно 3 недели) держали на диете с низким содержанием железа (примерно 5 частей железа на миллион) примерно 3 недели. Затем им вводили комплексы железа через желудочную трубку (2 мг железа на килограмм веса тела в день) 2 раза в день в течение 5 дней, с перерывом на 2 дня (дни 1-5 и 8-12). На 15-й день вычисляли всасываемость по увеличению содержания гемоглобина и увеличению веса тела согласно формуле
=[(Hb2(3)*BW9(14)-Hb1*BW4)*0.07.*0.0034-(Hb2(3) контроль*BW9(14) контроль-Hb1 контроль*BW4 контроль)*0.07*0.0034)]*100/Fe доз.
=[(Hb2(3)*BW9(14)-Hb1*BW4)*0.000238-(Hb2(3) контроль*BW9(14) контроль-Hb1 контроль*BW4 контроль)*0.000238]*100/Fe доз.
=(Hb2(3)*BW9(14)-Hb1*BW4-Hb2(3) контроль*BW9(14) контроль+Hb1 контроль*BW4 контроль)*0.0238 / Fe доз.
0.07=Коэффициент для 70 мл крови на килограмм веса тела (BW)
0.0034=Коэффициент для 0.0034 г Fe/г Hb
Hb1=Уровень гемоглобина (г/л) в день 1
Hb2(3)=Уровень гемоглобина (г/л) в день 8 (или 15)
BW4=вес тела (г) в день 1
BW9(14)=вес тела (г) в день 8 (или 15)
Hb1 контроль=средний уровень гемоглобина (г/л) в день 1 в контрольной группе,
Hb2(3) контроль=средний уровень гемоглобина (г/л) в день 8 (или 15) в контрольной группе,
BW4 контроль=средний вес тела (г) в день 1 в контрольной группе,
BW9(14) контроль=средний вес тела (г) в день 8 (или 15) в контрольной группе,
Fe доз.=всего введено железа (мг Fe) за 5 или 10 дней,
Fe усв.=(Hb2(3)*BW9(14)-Hb1*BW4)*0.07*0.0034 (мг Fe)
ΔУсваиваемость=Fe всего введено (тестируемая группа) - Fe усв. Контрольная группа, усвоено из пищи (мг Fe)
Примеры получения
Пример 1
Трис-(3-оксобутанамид)-железо(III) комплекс:

Раствор 24.00 г (0.15 моль) хлорида железа(III) (безводного) в 400 мл этанола прикапывали к раствору 45.00 г (0.45 моль) 3-оксобутанамида в 400 мл этанола. Затем порциями добавляли 37.46 г (0.45 моль) бикарбоната натрия. После 4 ч перемешивания при комнатной температуре, реакционную смесь отфильтровывали, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 51.63 г продукта в виде черно-красного твердого вещества.
ИК (чистое вещество, см-1): 3317, 3187, 1618, 1569, 1507, 1415, 1328, 1194, 1092, 1034, 978, 935, 780.
Элементный анализ: С 37.41; Н 5.78; N 8.80.
Содержание Fe 15.80% [вес/вес].
Пример 2
Трис-(N,N-диэтил-3-оксобутанамид)-железо(III) комплекс:
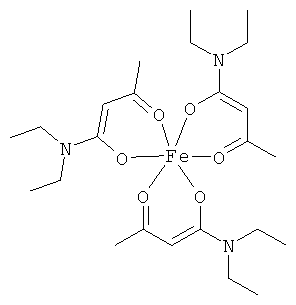
Раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола прикапывали к раствору 2.90 г (18.50 ммоль) N-диэтил-3-оксобутанамида в 30 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После 2 ч перемешивания при комнатной температуре, реакционную смесь отфильтровывали, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.50 г продукта в виде черно-красного масла.
ИК (чистое вещество, см-1): 2973, 2932, 1597, 1557, 1511, 1492, 1454, 1434, 1374, 1356, 1309, 1274, 1204, 1163, 1082, 1004, 962.
Элементный анализ: С 53.54; Н 8.00; N 7.88.
Содержание Fe 9.63% [вес/вес].
Пример 3
Трис-(N,N-диметил-3-оксобутанамид)-железо(III) комплекс:
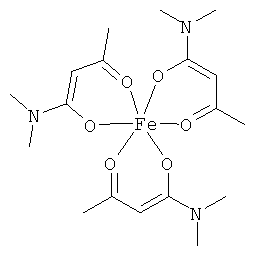
Раствор 3.00 г (18.50 ммоль) хлорида железа(III) (безводного) в 50 мл этанола прикапывали к раствору 8.96 г (55.50 ммоль, 80%-ный раствор в воде) N-диметил-3-оксобутанамида в 50 мл этанола. Затем порциями добавляли 4.66 г (55.50 ммоль) бикарбоната натрия. После 4 ч перемешивания при комнатной температуре, реакционную смесь отфильтровывали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 8.37 г продукта в виде черно-красного масла.
ИК (чистое вещество, см-1): 2918, 1720, 1643, 1557, 1523, 1490, 1433, 1401, 1347, 1260, 1211, 1177, 1061, 1032, 989, 955.
Элементный анализ: С 47.39; Н 6.70; N 9.22. Содержание Fe 11.13% [вес/вес].
Пример 4
Трис-(N-метил-3-оксобутанамид)-железо(III) комплекс:
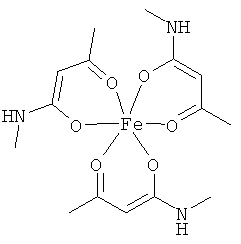
Раствор 3.00 г (18,.50 ммоль) хлорида железа(III) (безводного) в 50 мл этанола прикапывали к раствору 9.13 г (55.50 ммоль, 80%-ный раствор в воде) N-метил-3-оксобутанамида в 50 мл этанола. Затем порциями добавляли 4.66 г (55.50 ммоль) бикарбоната натрия. После 2 ч перемешивания при комнатной температуре, реакционную смесь отфильтровывали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 7.98 г продукта в виде черно-красного твердого вещества.
ИК (чистое вещество, см-1): 3336, 3119, 2913, 1558, 1500, 1448, 1411, 1275, 1191, 1157, 1104, 1010, 959, 935, 779.
Элементный анализ: С 42.23; Н 5.78; N 9.70.
Содержание Fe 12.46% [вес/вес].
Пример 5
Трис(3-оксо-2-(пиперидин-1-илкарбонил)бутаннитрил)-железо(III) комплекс

1.4 г (8.5 ммоль) FeCl3 (безводный), растворенного в 20 мл этанола 99%, добавляли в раствор 5.0 г (25.7 ммоль) 2,4-диоксо-3-цианобутилпиперидина в 40 мл этанола 99%. Затем добавляли 2.2 г (25.6 ммоль) NaHCO3 и перемешивали 1 час при 20-25°С. Реакционную смесь фильтровали, фильтрат упаривали досуха на роторном испарителе при 50°С/<100 мбар, и остаток сушили в вакуумном сушильном шкафу по меньшей мере 15 часов при 50°С/<100 мбар. Полученное твердое вещество суспендировали в 200 мл воды в течение примерно 30 минут с помощью Ultraturax, отфильтровывали и снова сушили в вакуумном сушильном шкафу по меньшей мере 15 часов при 50°С/<100 мбар.
Получали 5.3 г продукта в виде оранжевого твердого вещества.
ИК (чистое вещество, см-1): 2936, 2858, 2197, 1594, 1532, 1506, 1439, 1387, 1270, 1217, 1169, 1145, 1072, 1020, 973, 905, 854, 755, 700, 653.
Элементный анализ: С 57.0; Н 6.40; N 12.60.
Содержание Fe 8.30% [вес/вес].
Пример 6
Трис-(2-хлор-N-метил-3-оксобутанамид)-железо(III) комплекс

Раствор 1.00 г (6.17 ммоль) безводного хлорида железа(Ш) в 10 мл этанола прикапывали к раствору 2.77 г (18.50 ммоль) 2-хлор-N-метил-3-оксобутанамида в 30 мл этанола. Затем порциями добавляли 1.55 г (18.50 ммоль) бикарбоната натрия. После 2 ч перемешивания при комнатной температуре, реакционную смесь отфильтровывали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.19 г продукта в виде фиолетового твердого вещества.
ИК (чистое вещество, см-1): 3359.2942, 1545, 1468, 1406, 1375, 1260, 1155, 1118, 1028, 935, 796, 748.
Элементный анализ: С 33.42; Н 4.23; N 7.74.
Содержание Fe 10.72% [вес/вес].
Пример 7
Трис(N-бутил-3-оксобутанамид)-железо(III) комплекс
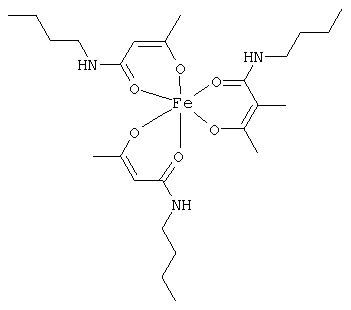
1.4 г (8.6 ммоль) FeCl3 (безводного), растворенного в 10 мл метанола, добавляли в раствор 5 г (31.8 ммоль) N-н-бутил-3-оксо-бутанамида в 40 мл толуола. Затем добавляли 4.4 г (52.4 ммоль) NaHCO3 и 2.2 г (15.5 ммоль) Na2SO4 (безводный) и перемешивали 1 час при 20-25°С. Реакционную смесь фильтровали, фильтрат упаривали досуха на роторном испарителе при 50°С/<100 мбар, и остаток сушили в вакуумном сушильном шкафу по меньшей мере 15 часов при 50°С/<100 мбар. Получали 5.0 г продукта в виде красного твердого вещества.
ИК (чистое вещество, см-1): 2935, 1645, 1592, 1533, 1508, 1439, 1387, 1270, 1219, 1143, 1073, 1020, 973, 909, 855, 822, 699, 652.
Содержание Fe 9.0% [вес/вес].
Пример 8
Трис(N,N-дибутил-3-оксобутанамид)-железо(III) комплекс

48.5 г (0.23 моль) НН-дибутил-3-оксо-бутанамида и 20.6 г (0.08 моль) FeCl3×6Н2О смешивали с 245 мл этанола 96%. Добавляли 14.1 г (0.13 моль) Na2CO3 (безводного) в несколько приемов в течение примерно 5 минут. Реактор в ходе процесса охлаждали на водяной бане с температурой примерно 20°С. Реакционную смесь перемешивали 6 часов при 20-25°С, затем фильтровали через стеклянный фильтр и упаривали досуха на роторном испарителе при 50°С/<100 мбар. Маслообразный продукт сушили по меньшей мере 15 часов при 20-25°С в высоком вакууме. Получали 50 г продукта в виде красно-коричневого масла.
ИК (чистое вещество, см-1): 2957, 2931, 2872, 1596, 1558, 1513, 1492, 1461, 1431, 1366, 1292, 1257, 1229, 1199, 1155, 1112, 1007, 956,764.
CHN элементный анализ: С 61.10; Н 9.60; N 6.00.
Содержание Fe 8.00% [вес/вес].
Пример 9
Трис-(1-(пиперидин-1-ил)-бутан-1,3-дион)-железо(III) комплекс
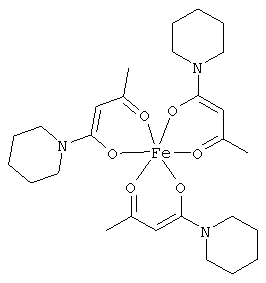
Раствор 1.00 г (6.17 моль) хлорида железа(Ш) (безводного) в 10 мл этанола прикапывали к раствору 3.13 г (18.50 ммоль) 1-(пиперидин-1-ил)-бутан-1,3-диона в 40 мл этанола. Затем порциями добавляли 6.26 г (74.00 ммоль) бикарбоната натрия. После 2 ч перемешивания при комнатной температуре, реакционную смесь отфильтровывали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.72 г продукта в виде черного масла.
ИК (чистое вещество, см-1): 2930, 2852, 1594, 1556, 1509, 1483, 1461, 1442, 1374, 1347, 1256, 1231, 1205, 1022, 958.
Элементный анализ: С 55.33; Н 7.49; N 7.01.
Содержание Fe 9.30% [вес/вес].
Пример 10
Трис(3-оксогептанамид)-железо(III) комплекс

15 ммоль (2.147 г) 3-оксогептанамида растворяли в 50 мл этанола (безводного) в 100-миллилитровой колбе Эрленмейера, снабженной насадкой с осушителем, и добавляли 5 ммоль (0.811 г) FeCl3 (безводного). Через 5 минут добавляли 20 ммоль (1.68 г) NaHCO3 и продолжали перемешивание еще 2 часа. Контроль pH показал значение pH 3.78 через 2 ч (образец фильтровали и разбавляли водой; pH 2.78 через 0.5 ч; 3.19 через 1 ч; 3.56 через 1.5 ч). Реакционную смесь фильтровали, фильтрат упаривали на роторном испарителе, и продукт сушили в вакууме масляного насоса. Получали 2.25 г продукта.
ИК (чистое вещество, см-1): 3318, 3195, 2956, 2930, 2870, 1715, 1617, 1564, 1507, 1458, 1355, 1192, 1093, 946, 780, 663.
Элементный анализ: С 49.06; Н 7.45; N 8.28.
Со держание Fe 10.91% [вес/вес].
Пример 11
Трис(N-метил-3-оксогептанамид)-железо(III) комплекс

8.3 ммоль (1.37 г) метиламида 3-оксогептановой кислоты растворяли в 40 мл этанола (безводного) в 100-миллилитровой колбе Эрленмейера, снабженной насадкой с осушителем, и добавляли 2.8 ммоль (0.447 г) FeCl3 (безводного). Добавляли 11 ммоль (0.927 г) NaHCO3, затем перемешивали 2.5 ч. Контроль pH показал значение pH 3.8 через 2.5 ч (образец фильтровали и разбавляли водой). Реакционную смесь фильтровали, фильтрат упаривали на роторном испарителе, и продукт сушили при 50°С в вакуумном сушильном шкафу. Получали 1.20 г продукта.
ИК (чистое вещество, см-1): 3283, 3117, 2956, 2932, 2871, 1718, 1561, 1502, 1420, 1377, 1271, 1157, 1108, 1082, 967, 937, 886, 779, 649.
Элементный анализ: С 52.2; Н 7.65; N 7.61.
Содержание Fe 9.14% [вес/вес].
Пример 12
Трис-(N,N-бис-(2-гидроксиэтил)-3-оксобутанамид)-железо(III) комплекс

Раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола прикапывали к раствору 3.50 г (18.50 ммоль) N-бис-(2-гидроксиэтил)-3-оксобутанамида в 30 мл этанола. Затем порциями добавляли 1.56 г (18.50 ммоль) бикарбоната натрия. После 4 ч перемешивания при комнатной температуре, реакционную смесь отфильтровывали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 4.19 г продукта в виде черного масла.
ИК (чистое вещество, см-1): 3327, 2974, 2934, 2880, 1632, 1567, 1516, 1494, 1438, 1361, 1301, 1228, 1206, 1170, 1052.
Элементный анализ: С 43.61; Н 7.46; N 5.34.
Содержание Fe 8.14% [вес/вес].
Пример 13
Трис-(N-бутил-N-метил-3-оксобутанамид)-железо(III) комплекс
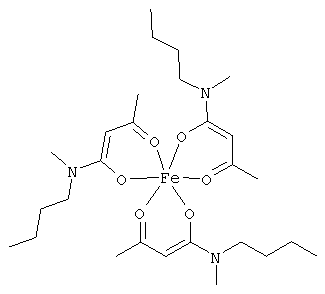
Раствор 0.50 г (3.08 ммоль) хлорида железа(III) (безводного) в 5 мл этанола прикапывали к раствору 1.58 г (9.25 ммоль) N-н-бутил-N-метил-3-оксобутирамида в 15 мл этанола. Затем порциями добавляли 0.78 г (9.25 ммоль) бикарбоната натрия. После 4 ч перемешивания при комнатной температуре, реакционную смесь отфильтровывали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 1.80 г продукта в виде черного масла.
ИК (чистое вещество, см-1): 2956, 2930, 2871, 1598, 1557, 1515, 1492, 1464, 1353, 1308, 1230, 1211, 1088, 957.
Элементный анализ: С 55.26; Н 8.25; N 7.21.
Содержание Fe 9.36% [вес/вес].
Пример 14
Трис-(1-(4-гидроксипиперидин-1-ил)-бутан-1,3-дион)-железо(III) комплекс
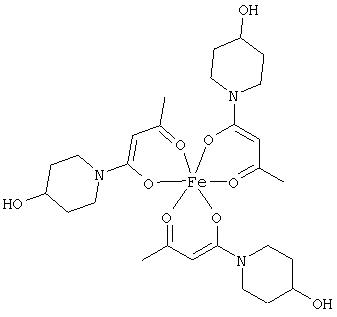
Раствор 1.00 г (6.17 моль) хлорида железа(III) (безводного) в 10 мл этанола прикапывали к раствору 3.43 г (18.51 ммоль) 1-(4-гидроксипиперидин-1-ил)-бутан-1,3-диона в 30 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После 4 ч перемешивания при комнатной температуре, реакционную смесь отфильтровывали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.98 г продукта в виде коричневого твердого вещества.
ИК (чистое вещество, см-1): 3334, 2923, 2859, 1589, 1554, 1509, 1485, 1443, 1362, 1265, 1227, 1205, 1054, 1023, 954.
Элементный анализ: С 51.47; Н 7.26; N 6.37.
Содержание Fe 8.28% [вес/вес].
Пример 15
Трис-(3-оксо-N,N-дипропилбутанамид)-железо(III) комплекс
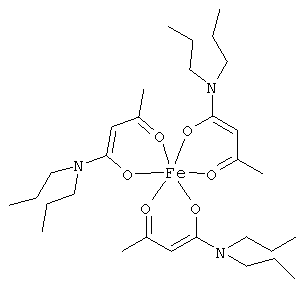
Раствор 0.50 г (3.08 ммоль) хлорида железа(III) (безводного) в 5 мл этанола прикапывали к раствору 1.71 г (9.25 ммоль) 3-оксо-N-ди-н-пропилбутанамида в 20 мл этанола. Затем порциями добавляли 1.56 г (18.50 ммоль) бикарбоната натрия. После 2 ч перемешивания при комнатной температуре, реакционную смесь отфильтровывали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 1.94 г продукта в виде коричневого масла.
ИК (чистое вещество, см-1): 2962, 2931, 2874, 1597, 1557, 1510, 1491, 1468, 1456, 1431, 1367, 1299, 1246, 1202, 1164, 1102, 1058, 996, 958.
Элементный анализ: С 56.93; Н 8.73; N 6.50.
Содержание Fe 8.15% [вес/вес].
Пример 16
Трис-(N-гексил-3-оксобутанамид)-железо(III) комплекс

Раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 5 мл этанола прикапывали к раствору 3.43 г (18.50 ммоль) N-н-гексил-3-оксобутанамида в 25 мл этанола. Затем порциями добавляли 3.12 г (37.00 ммоль) бикарбоната натрия. После 4 ч перемешивания при комнатной температуре, реакционную смесь отфильтровывали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.86 г продукта в виде коричневого масла.
ИК (чистое вещество, см-1): 3289, 2956, 2926, 2857, 1719, 1656, 1589, 1556, 1503, 1453, 1434, 1410, 1274, 1188, 1037, 1017, 960, 946.
Содержание Fe 8.34% [вес/вес].
Пример 17
Трис(N,N-диметил-3-оксогептанамид)-железо(III) комплекс

Аналогично описанным выше примерам, комплекс трис(N,N-диметил-3-оксогептанамид)-железо(III) получали из хлорида железа(III) и диметиламида 3-оксо-гептановой кислоты.
Пример 18
Трис(3-оксопентанамид)-железо(III) комплекс
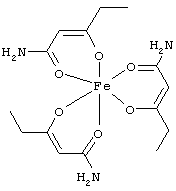
15.0 ммоль (1.73 г) 3-оксопентанамида растворяли в 100 мл этанола (безводного) в круглодонной колбе объемом 250 мл, снабженной насадкой с осушителем, и добавляли 5.0 ммоль (0.811 г) FeCl3 (безводного). Добавляли 20 ммоль (1.68 г) NaHCO3, затем перемешивали 3 ч. Контроль pH показал значение pH 5.2 (образец фильтровали и разбавляли водой). Реакционную смесь фильтровали, фильтрат упаривали на роторном испарителе, и продукт сушили при 50°С в вакуумном сушильном шкафу. Получали 2.1 г продукта.
ИК (чистое вещество, см-1): 3318, 3189, 2974, 2938, 2361, 1715, 1625, 1567, 1509, 1458, 1341, 1299, 1242, 1184, 1107, 1077, 1020, 952, 917, 804, 785.
Элементный анализ: С 39.86; Н 5.821; N 9.28.
Содержание Fe 11.85% [вес/вес].
Пример 19
Трис(N,N-диметил-3-оксопентанамид)-железо(III) комплекс

15.0 ммоль (2.15 г) N,N-диметил-3-оксопентанамида растворяли в 75 мл этанола (безводного) в круглодонной колбе объемом 100 мл, снабженной насадкой с осушителем, и добавляли 5.0 ммоль (0.811 г) FeCl3 (безводного). Добавляли 20 ммоль (1.68 г) NaHCO3, затем перемешивали 1.5 ч. Контроль pH показал значение pH 4.2 (образец фильтровали и разбавляли водой). Реакционную смесь фильтровали, фильтрат упаривали на роторном испарителе, и продукт сушили при 50°С в вакуумном сушильном шкафу. Получали 2.4 г продукта.
ИК (чистое вещество, см-1): 2965, 2933, 2871, 2362, 1720, 1596, 1553, 1526, 1492, 1428, 1402, 1371, 1352, 1311, 1259, 1197, 1175, 1061, 1020, 983, 932, 835, 798, 766, 718, 688.
Элементный анализ: С 50.35; Н 7.307; N 8.31.
Содержание Fe 10.50% [вес/вес].
Пример 20
Трис-(этил N-(3-оксобутаноил)глицинат)-железо(III) комплекс
(Трис((3-оксо-бутириламино)этилацетат)железо)
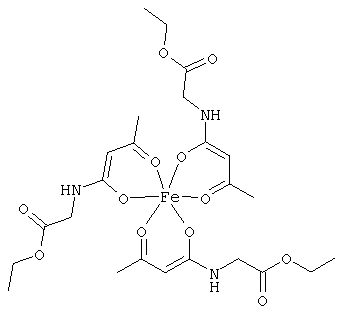
Раствор 0.50 г (3.08 ммоль) хлорида железа(III) (безводного) в 5 мл этанола прикапывали к раствору 1.73 г (9.25 ммоль) этил N-(3-оксобутаноил)глицината (или (3-оксо-бутириламино)этилацетата, соответственно) в 20 мл этанола. Затем порциями добавляли 1.56 г (18.50 ммоль) бикарбоната натрия. После 2 ч перемешивания при комнатной температуре, реакционную смесь отфильтровывали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 2.11 г продукта в виде коричневого масла.
ИК (чистое вещество, см-1): 3304, 2982, 2936, 1736, 1661, 1586, 1543, 1497, 1453, 1411, 1374, 1284, 1184, 1134, 1051, 1026.
Элементный анализ: С 44.14; Н 6.11; N 6.18.
Содержание Fe 8.47% [вес/вес].
Пример 21
Трис-(N,N-дибутил-3-оксопентанамид)-железо(III)-комплекс
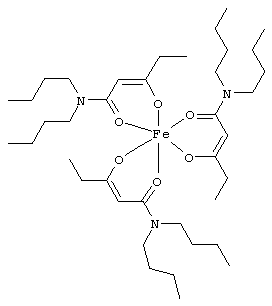
18 ммоль (4.09 г) N-дибутил-3-оксопентанамида растворяли в 90 мл этанола (безводного) и добавляли 6 ммоль (0.811 г) FeCl3 (безводного). Затем добавляли 5.93 мл раствора этилата натрия (21% вес/вес, около 18 ммоль этилата натрия) и перемешивали 1 час. Реакционную смесь фильтровали, и фильтрат упаривали на роторном испарителе. Полученный остаток растворяли в 120 мл дихлорметана, снова фильтровали, фильтрат упаривали, и продукт сушили в вакуумном сушильном шкафу при 50°С. Получали 4.0 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2957, 2931, 2872, 2359, 1721, 1634, 1596, 1556, 1513, 1491, 1461, 1429, 1393, 1366, 1316, 1291, 1254, 1225, 1190, 1155, 1112, 1079, 1062, 990, 926, 799, 767, 733, 711, 657.
CHN-Элементный анализ: С, 62.57; Н, 9.64; N, 5.66.
Содержание Fe: 7.3% [вес/вес]
Пример 22
Трис-(2-фтор-N,N-диметил-3-оксобутанамид)-железо(III)-комплекс

15 ммоль (2.32 г) 2-фтор-N,N-диметил-3-оксобутанамида растворяли в 125 мл этанола (безводного), и добавляли 4.86 мл раствора этилата натрия (21% вес/вес, около 15 ммоль этоксида натрия). Затем добавляли 5 ммоль (0.811 г) РеС1з (безводного) и перемешивали 2 часа при 50°С. Реакционную смесь фильтровали после охлаждения, фильтрат упаривали на роторном испарителе, и продукт сушили в вакуумном сушильном шкафу при 50°С.
Получали 2.5 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2937, 2361, 2341, 1737, 1656, 1573, 1477, 1419, 1402, 1361, 1332, 1259, 1209, 1145, 1051, 1020, 977, 894, 870, 736.
CHN-Элементный анализ: С, 38.59; Н, 5.23; N, 7.15.
Содержание Fe: 9.96% [вес/вес]
Пример 23
Трис-(2-фтор-3-оксо-N,N-пропилбутанамид)-железо(III)-комплекс
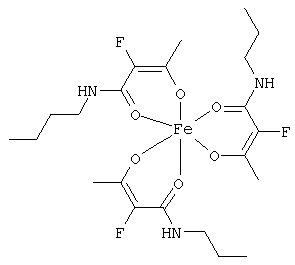
18 ммоль (2.9 г) 2-фтор-3-оксо-N-пропилбутанамида и 6 ммоль (0.972 г) FeCl3 (безводного) растворяли в 90 мл этанола (безводного) и добавляли 2.78 мл раствора метилата натрия (30% вес/вес, около 15 ммоль метоксида натрия). Смесь перемешивали еще 1 час, и реакционный раствор фильтровали. Фильтрат упаривали на роторном испарителе, и продукт сушили в вакуумном сушильном шкафу при 50°С. Получали 3.14 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 3306, 3090, 2966, 2936, 2876, 1736, 1674, 1602, 1549, 1522, 1459, 1438, 1382, 1275, 1246, 1160, 1114, 1088, 1050, 992, 958, 899, 821, 774, 744, 645.
CHN-Элементный анализ: С, 44.36; Н, 6.08; N, 7.22.
Содержание Fe: 9.34% [вес/вес].
Пример 24
Трис-(4-Метокси-N,N-диметил-3-оксобутанамид)-железо(III)-комплекс
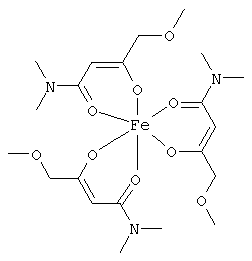
57 ммоль (9.1 г) 4-метокси-N,N-диметил-3-оксобутанамида и 19 ммоль (3.08 г) FeCl3 (безводного) растворяли в 260 мл этанола (безводного), и добавляли 9.84 мл раствора метоксида натрия (30% вес/вес, около 53 ммоль метоксида натрия). Смесь перемешивали еще 1 час, и реакционный раствор фильтровали. Фильтрат упаривали на роторном испарителе, и продукт сушили в вакуумном сушильном шкафу при 50°С. Получали 10.5 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2930, 2822, 1730, 1603, 1568, 1497, 1424, 1402, 1368, 1331, 1260, 1200, 1174, 1109, 1059, 1023, 992, 959, 924, 862, 769, 736, 681.
CHN-Элементный анализ: С, 44.94; Н, 6.66; N, 7.06.
Содержание Fe: 9.49% [вес/вес].
Пример 25
Трис-(N,N,4-триметил-3-оксопентанамид)-железо(III)-комплекс

16 ммоль (2.36 г) N,N,4-триметил-3-оксопентанамида и 5 ммоль (0.811 r) FeCl3 (безводного) растворяли в 100 мл этанола (безводного), и добавляли 2.78 мл раствора метоксида натрия (30% вес/вес, около 15 ммоль метоксида натрия). Смесь перемешивали еще 1 час, и реакционный раствор фильтровали. Фильтрат упаривали на роторном испарителе, и продукт сушили в вакуумном сушильном шкафу при 50°С. Получали 2.6 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2958, 2927, 2868, 1720, 1593, 1556, 1526, 1502, 1487, 1402, 1378, 1359, 1311, 1260, 1198, 1176, 1157, 1083, 1006, 946, 891, 801, 773, 722, 678, 655.
CHN-Элементный анализ: С, 52.88; Н, 7.91; N, 7.50. Содержание Fe: 10.40% [вес/вес].
Пример 26
Трис-(4-метил-1-(морфолин-4-ил)-пентан-1,3-дион)-железо(III)-комплекс

18 ммоль (3.59 г) 4-метил-1-(морфолин-4-ил)пентан-1,3-диона и 6 ммоль (0.973 г) FeCl3 (безводного) растворяли в 50 мл этанола (безводного), и добавляли 3.00 мл раствора метилата натрия (30% вес/вес, около 16 ммоль метилата натрия). Смесь перемешивали еще 1 час, и реакционный раствор фильтровали. Фильтрат упаривали на роторном испарителе, и продукт сушили в вакуумном сушильном шкафу при 50°С. Получали 4.0 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2964, 2924, 2857, 1714, 1678, 1640, 1549, 1516, 1478, 1459, 1439, 1384, 1371, 1357, 1313, 1300, 1273, 1244, 1189, 1159, 1114, 1087, 1065, 1018, 990, 947, 885, 851, 773, 717, 680.
CHN-Элементный анализ: С, 48.70; Н, 6.84; N, 6.01.
Содержание Fe: 7.89% [вес/вес].
Пример 27
Трис-(4-Метокси-1-(морфолин-4-ил)бутан-1,3-дион)-железо(III)-комплекс
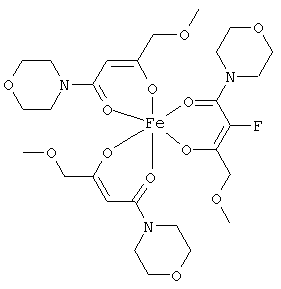
15 ммоль (3.02 г) 4-метокси-1-(морфолин-4-ил)бутан-1,3-диона и 5 ммоль (0.811 г) FeCl3 (безводного) растворяли в 65 мл этанола (безводного), и добавляли 2,59 мл раствора метилата натрия (30% вес/вес, около 14 ммоль метилата натрия). Смесь перемешивали еще 1 час, и реакционный раствор фильтровали. Фильтрат упаривали на роторном испарителе, и продукт сушили в вакуумном сушильном шкафу при 50°С. Получали 3.66 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2969, 2897, 2856, 1732, 1640, 1597, 1563, 1514, 1441, 1383, 1301, 1273, 1246, 1197, 1110, 1065, 1017, 992, 961, 922, 863, 765, 730, 676.
CHN-Элементный анализ: С, 47.62; Н, 6.90; N, 5.44.
Содержание Fe: 7.13% [вес/вес].
Пример 28
Трис-(3-ацетил-1-метилпирролидин-2-он)-железо(III)-комплекс

2.48 г (15,30 ммоль) хлорида железа(III) растворяли в 700 мл этанола, и добавляли 6.91 г (49.00 ммоль) 3-ацетил-1-метилпирролидин-2-она. 9.76 г 25%-ного раствора метанолята натрия (45.17 ммоль) разбавляли 80 мл этанола и прикапывали в раствор хлорида железа(III). Реакционный раствор перемешивали 30 минут и затем фильтровали. Фильтрат упаривали на роторном испарителе досуха, и остаток сушили в течение ночи при 50°С в вакууме. Получали 7.4 г продукта в виде фиолетового порошка.
ИК (чистое вещество, см-1): 2915, 2866, 1677, 1601, 1553, 1497, 1476, 1443, 1401, 1365, 1344, 1267, 1182, 996, 964, 908, 746, 612.
Содержание Fe: 11.74% [вес/вес].
Пример 29
Трис-(этил(1-метил-2-оксопирролидин-3-ил)(оксо)ацетат)-железо(III)-комплекс
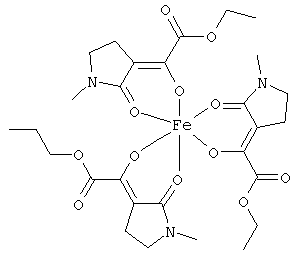
9.72 г раствора этоксида железа (2.22% Fe [вес/вес], 3.86 ммоль) в этаноле разбавляли в атмосфере азота добавлением 40 мл безводного этанола. В полученный раствор добавляли 2.30 г (11.55 ммоль) этил (1-метил-2-оксопирролидин-3-ил)(оксо)ацетата и перемешивали при комнатной температуре в течение ночи. Затем раствор упаривали на роторном испарителе досуха, и остаток сушили при 50°С в течение ночи в вакууме. Получали 2.6 г продукта в виде красного твердого вещества.
ИК (чистое вещество, см-1): 2933, 2896, 1719, 1704, 1607, 1500, 1477, 1455, 1407, 1395, 1367, 1350, 1303, 1270, 1207, 1170, 1107, 1031, 1008, 914, 869, 780, 743, 718, 633.
Элементный анализ: С 47.90% Н 5.43% N 6.11%. Содержание Fe: 8.48% [вес/вес].
Пример 30
Трис-(этил(1-метил-2-оксопиперидин-3-ил)(оксо)ацетат)-железо(III)-комплекс
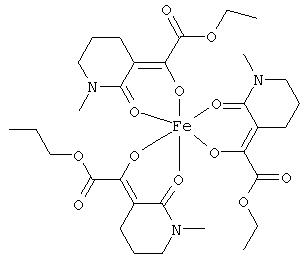
0.65 г (4.00 ммоль) хлорида железа(III) растворяли в 25 мл ТГФ и добавляли 2.56 г (12.00 ммоль) этил (1-метил-2-оксопиперидин-3-ил)(оксо)ацетата. После 40 минут перемешивания, добавляли 1.21 г (12.00 ммоль) триэтиламина и перемешивали еще 60 минут при комнатной температуре. Затем прикапывали 2.59 г 25%-ного раствора метоксида натрия (12.00 ммоль) и перемешивали полученный раствор еще 2 часа. Выпавшую в осадок соль отфильтровывали, и фильтрат упаривали на роторном испарителе досуха. Полученный остаток сушили 1 день при 50°С в высоком вакууме.
Получали 2.6 г продукта в виде красного твердого вещества.
ИК (чистое вещество, см-1): 2939, 2863, 1724, 1610, 1573, 1538, 1480, 1402, 1364, 1308, 1256, 1219, 1195, 1101, 1079, 1060, 1016, 959, 920, 892, 858, 811, 764, 724,692.
Элементный анализ: С 51.62%, Н 6.23%, N 5.90%.
Содержание Fe: 8.2% [вес/вес].
Пример 31
Трис-(3-ацетил-1-метилпиперидин-2-он)-железо(III)-комплекс

0.34 г (2.10 ммоль) хлорида железа(III) растворяли в 100 мл этанола и добавляли 1.34 г (6.30 ммоль) 3-ацетил-1-метилпиперидин-2-она. 1.33 г 25%-ного раствора метоксида натрия (6.13 ммоль) разбавляли добавлением 10 мл этанола и прикапывали в реакционный раствор. Реакционный раствор перемешивали 30 минут и затем фильтровали. Фильтрат упаривали на роторном испарителе досуха, и остаток растворяли в 50 мл дихлорметана. Раствор снова фильтровали, дихлорметан удаляли на роторном испарителе, и остаток сушили 2 дня при 50°С в высоком вакууме. Получали 1.2 г продукта в виде темно-красного твердого вещества.
ИК (чистое вещество, см-1): 2927, 2855, 1559, 1462, 1399, 1303, 1254, 1202, 1181, 1082, 992, 921, 887, 856, 757, 707, 626.
Элементный анализ: С 49.63%, Н 6.43%, N 7.23%. Содержание Fe: 9.80% [вес/вес].
Пример 32
Трис-(этил4-(диметиламино)-2,4-диоксобутаноат)-железо(III)-комплекс
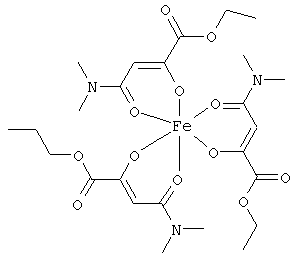
0.58 г (3.56 ммоль) хлорида железа(III) растворяли в 80 мл ТГФ, и добавляли 2.00 г (10.69 ммоль) этил 4-(диметиламино)-2,4-диоксобутаноата. После 40 минут перемешивания, добавляли 1.07 г (10.69 ммоль) триэтиламина, и смесь перемешивали еще 60 минут при комнатной температуре. Затем прикапывали 2.31 г 25%-ного раствора метоксида натрия (10.69 ммоль), и раствор перемешивали еще 2 часа. Выпавшую в осадок соль отфильтровывали, и фильтрат упаривали на роторном испарителе досуха. Полученный остаток сушили 1 день при 50°С в высоком вакууме. Получали 2.0 г продукта в виде красного твердого вещества.
ИК (чистое вещество, см-1): 2927, 1719, 1616, 1575, 1501, 1433, 1404, 1362, 1235, 1174, 1136, 1019, 944, 924, 767, 742, 652.
Элементный анализ: С 45.83%, Н 5.82%, N 6.83%.
Содержание Fe: 8.54% [вес/вес].
Пример 33
Трис-(1-(морфолин-4-ил)бутан-1,3-дион)-железо(III)-комплекс

В раствор 3.17 г (18.50 ммоль) 1-(морфолин-4-ил)бутан-1,3-диона в 40 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 6.22 г (74,00 ммоль) бикарбоната натрия. После 1.5 часов перемешивания при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали на роторном испарителе, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.50 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 2961, 2896, 2854. 1595, 1553, 1509, 1476, 1443, 1362, 1299, 1273, 1244, 1193, 1110.
Содержание Fe: 9.62% [вес/вес].
Пример 34
Трис-(N-(-(2-метоксиэтил)-3-оксобутанамид)-железо(III)-комплекс
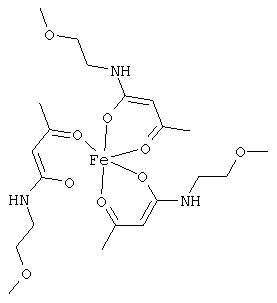
В раствор 1.47 г (9.25 ммоль) N-(2-метоксиэтил)-3-оксобутанамида в 15 мл этанола прикапывали раствор 0.5 г (3.08 ммоль) хлорида железа(III) (безводного) в 5 мл этанола. Затем порциями добавляли 1.56 г (18.50 ммоль) бикарбоната натрия. После перемешивания в течение 1 часа при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали на роторном испарителе, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 1.51 г коричневого масла.
ИК (чистое вещество, см-1): 3269, 2980, 2928, 2882, 2830, 1650, 1550, 1499, 1451, 1410, 1275, 1192, 1117, 1092, 1017, 958.
Содержание Fe: 9.68% [вес/вес].
Пример 35
Трис-(N-Циклопропил-3-оксобутанамид)-железо(III)-комплекс

В раствор 2.61 г (18.50 ммоль) N-циклопропил-3-оксобутанамида в 30 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 1 часа при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 2.57 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3245, 3088, 3008, 1549, 1493, 1453, 1405, 1334, 1275, 1219, 1189, 1060, 1023, 981, 937.
Содержание Fe: 11.00% [вес/вес].
Пример 36
Трис-(3-оксо-N-(пропан-2-ил)бутанамид)-железо(III)-комплекс
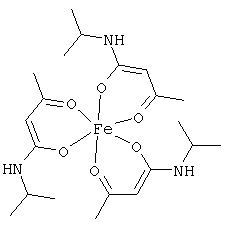
В раствор 1.32 г (9.25 ммоль) 3-оксо-N-(пропан-2-ил)бутанамида в 15 мл этанола прикапывали раствор 0.5 г (3.08 ммоль) хлорида железа(III) (безводного) в 5 мл этанола. Затем порциями добавляли 1.56 г (18.50 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 1.30 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3248, 3101, 2972, 2936, 2873, 1544, 1492, 1468, 1447, 1365, 1321, 1265, 1187, 1171, 1129, 998, 968.
Содержание Fe: 11.22% [вес/вес].
Пример 37
Трис-(N-(2-гидроксиэтил)-3-оксобутанамид)-железо(III)-комплекс
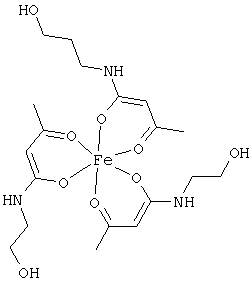
В раствор 2.69 г (18.50 ммоль) N-(2-гидроксиэтил)-3-оксобутанамида в 40 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 6.22 г (74,00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 2.72 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3259, 3110, 2946, 2875, 1552, 1498, 1451, 1405, 1360, 1273, 1188, 1059, 1018, 955, 778.
Содержание Fe: 11.30% [вес/вес].
Пример 38
Трис-(N-(3-гидроксипропил)-3-оксобутанамид)-железо(III)-комплекс
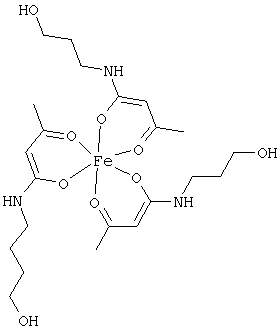
В раствор 1.47 г (9.25 ммоль) N-(3-гидроксипропил)-3-оксобутанамида в 20 мл этанола прикапывали раствор 0.5 г (3.08 ммоль) хлорида железа(III) (безводного) в 5 мл этанола. Затем порциями добавляли 1.56 г (18.50 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 1.80 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3270, 2939, 1551, 1500, 1407, 1270, 1188, 1008, 973, 947, 777.
Содержание Fe: 10.05% [вес/вес].
Пример 39
Трис-N-(4-гидроксибутил)-3-оксобутанамид)-железо(III)-комплекс

В раствор 2.94 г (18.50 ммоль) N-(4-гидроксибутил)-3-оксобутанамида в 40 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 2.72 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3273, 2934, 2867, 1649, 1555, 1502, 1436, 1409, 1272, 1188, 1053, 1027, 946, 778.
Содержание Fe: 9.36% [вес/вес].
Пример 40
Трис-(N-(5-гидроксипентил)-3-оксобутанамид)-железо(III)-комплекс

В раствор 3.46 г (18.50 ммоль) N-(5-гидроксипентил)-3-оксобутанамида в 40 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного)) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 1 часа при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.51 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3255, 3109, 2932, 2862, 1558, 1500, 1433, 1407, 1274, 1187, 1021, 949, 779.
Содержание Fe: 8.85% [вес/вес].
Пример 41
Трис-(N-(1-гидрокси-2-метилпропан-2-ил)-3-оксобутанамид)-железо(III)-комплекс

В раствор 3.20 г (18.50 ммоль) N-(1-гидрокси-2-метилпропан-2-ил)-3-оксобутанамида в 40 мл этанола, прикапывали раствор 1.00 г (6.17 ммоль) безводного хлорида железа(III) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 1 часа при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.42 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3286, 2972, 2927, 1593, 1550, 1498, 1446, 1411, 1363, 1287, 1225, 1189, 1050, 962.
Содержание Fe: 9.17% [вес/вес].
Пример 42
Трис-(N-(2-гидроксиэтил)-N-метил-3-оксобутанамид)-железо(III)-комплекс
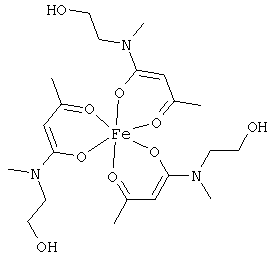
В раствор 2.94 г (18.50 ммоль) N-(2-гидроксиэтил)-N-метил-3-оксобутанамида в 30 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 1 часа при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.11 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3371, 2975, 2930, 2884, 1638, 1561, 1517, 1494, 1436, 1351, 1301, 1205, 1170, 1051, 958.
Содержание Fe: 9.61% [вес/вес].
Пример 43
Трис-(N-(2-гидроксипропил)-3-оксобутанамид)-железо(III)-комплекс
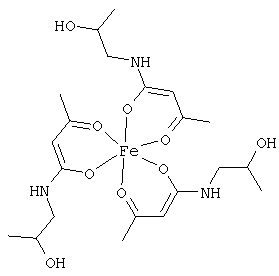
В раствор 2.94 г (18.50 ммоль) N-(2-гидроксипропил)-3-оксобутанамида в 30 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола.
Затем порциями добавляли 6.22 г (74.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.11 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3281, 2973, 2925, 1552, 1501, 1454, 1409, 1377, 1272, 1190, 1079, 1053, 951, 777.
Содержание Fe: 9.84% [вес/вес].
Пример 44
Трис-(N-(1-гидроксипропан-2-ил)-3-оксобутанамид)-железо(III)-комплекс
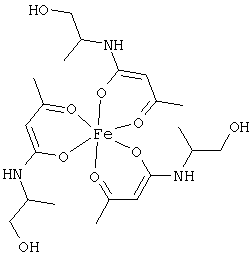
В раствор 2.94 г (18.50 ммоль) N-(2-гидроксипропил)-3-оксобутанамида в 30 мл этанола
прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 6.22 г (74.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.22 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3259, 2973, 1551, 1494, 1451, 1409, 1270, 1189, 1158, 1091, 1041, 962.
Содержание Fe: 9.57% [вес/вес].
Пример 45
Трис-(N-(1-гидроксибутан-2-ил)-3-оксобутанамид)-железо(III)-комплекс
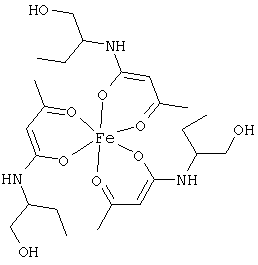
В раствор 3.21 г (18.50 ммоль) N-(1-гидроксибутан-2-ил)-3-оксобутанамида в 30 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 6.22 г (74,00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.22 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3268, 2965, 2933, 2875, 1546, 1493, 1457, 1410, 1285, 1188, 1049, 1000, 959, 775.
Содержание Fe: 9.39% [вес/вес].
Пример 46
Трис-N-(2,3-дигидроксипропил)-3-оксобутанамид)-железо(III)-комплекс
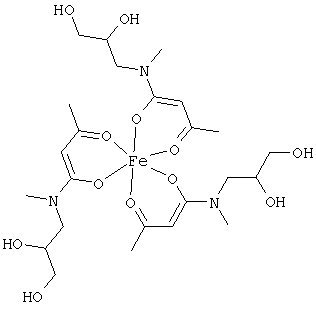
В раствор 1.75 г (9.25 ммоль) N-(2,3-дигидроксипропил)-3-оксобутанамида в 20 мл этанола прикапывали раствор 0.5 г (3.08 ммоль) хлорида железа(III) (безводного) в 5 мл этанола. Затем порциями добавляли 1.56 г (18.50 ммоль) бикарбоната натрия. После перемешивания в течение 1 часа при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 1.80 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3349, 2929, 1635, 15559, 1519, 1493, 1353, 1210, 1157, 1099, 1044, 996, 956, 765.
Содержание Fe: 8.81% [вес/вес].
Пример 47
Трис-(1-(3-гидроксипиперидин-1-ил)бутан-1,3-дион)-железо(III)-комплекс
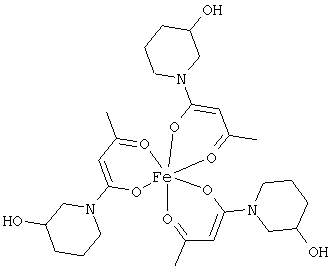
В раствор 3.43 г (18.50 ммоль) 1-(3-гидроксипиперидин-1-ил)бутан-1,3-диона в 50 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 1.56 г (18.50 ммоль) бикарбоната натрия. После перемешивания в течение 4 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.51 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3290, 2929. 2859, 1554, 1509, 1483, 1441, 1363, 1254, 1228, 1206, 1143, 1072, 997,953, 858,760.
Содержание Fe: 8.73% [вес/вес].
Пример 48
Трис-(1-[4-(гидроксиметил)пиперидин-1-ил]бутан-1,3-дион)-железо(III)-комплекс

В раствор 3.68 г (18.50 ммоль) 1-[4-(гидроксиметил)пиперидин-1-ил]бутан-1,3-диона в 50 мл этанола прикапывали раствор 1.00 г (6,17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.81 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3334, 2916, 2858, 1555, 1511, 1485, 1445, 1366, 1268, 1247, 1217, 1088, 1033, 979, 953, 760.
Содержание Fe: 8.39% [вес/вес].
Пример 49
Трис-(1-[3-(гидроксиметил)пиперидин-1-ил]бутан-1,3-дион)-железо(III)-комплекс

В раствор 3.68 г (18.50 ммоль) 1-[3-(гидроксиметил)пиперидин-1-ил]бутан-1,3-диона в 50 мл этанола прикапывали раствор 1.00 г (6,17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 1 часа при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.92 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3350, 2922, 2858, 1555, 1510, 1485, 1440, 1366, 1259, 1088, 1039, 995, 953, 760.
Содержание Fe: 8.27% [вес/вес].
Пример 50
Трис-(1-[2-(гидроксиметил)пиперидин-1-ил]бутан-1,3-дион)-железо(III)-комплекс

В раствор 3.68 г (18.50 ммоль) 1-[2-(гидроксиметил)пиперидин-1-ил]бутан-1,3-диона в 50 мл этанола прикапывали раствор 1.00 г (6,17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.88 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3358, 2914, 2854, 1554, 1509, 1484, 1445, 1370, 1311, 1269, 1245, 1217, 1088, 1035, 978, 953, 759.
Содержание Fe: 8.37% [вес/вес].
Пример 51
Трис-(1-[(3S)-3-гидроксипирролидин-1-ил]бутан-1,3-дион)-железо(III)-комплекс
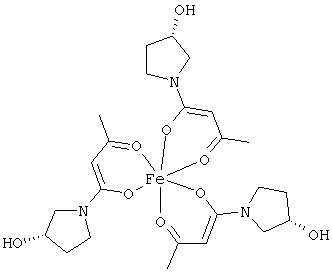
В раствор 3.17 г (18.50 ммоль) 1-[(3S)-3-гидроксипирролидин-1-ил]бутан-1,3-диона в 50 мл этанола прикапывали раствор 1.00 г (6,17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.23 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3315, 2946, 1558, 1514, 1472, 1350, 1206, 1103, 1054, 951, 875, 763.
Содержание Fe: 8.61% [вес/вес].
Пример 52
Трис-(1-[4-(2-гидроксиэтил)пиперазин-1-ил]бутан-1,3-дион)-железо(III)-комплекс
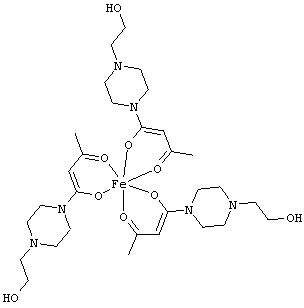
В раствор 3.96 г (18.50 ммоль) 1-[4-(2-гидроксиэтил)пиперазин-1-ил]бутан-1,3-диона в 80 мл МеОН прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(ГО) (безводного) в 20 мл МеОН. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь упаривали, остаток растворяли в 100 мл дихлорметана, перемешивали 15 минут, фильтровали, и фильтрат упаривали. Полученный остаток растворяли в 50 мл этанола, снова упаривали, и полученный остаток сушили в течение ночи в сушильном шкафу. Получали 4.10 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3365, 2914, 2809, 1591, 1554, 1509, 1480, 1443, 1369, 1290, 1249, 1138, 1050, 983, 960, 876, 759, 673.
Содержание Fe: 7.89% [вес/вес].
Пример 53
Трис-(1-(4-метилпиперазин-1-ил)бутан-1,3-дион)-железо(III)-комплекс

В раствор 3.41 г (18.50 ммоль) 1-(4-метил-1-ил)бутан-1,3-диона в 80 мл МеОН прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(П1) (безводного) в 20 мл МеОН. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь упаривали, остаток растворяли в 100 мл дихлорметана, перемешивали 15 минут, фильтровали, и фильтрат упаривали. Полученный остаток растворяли в 50 мл этанола, снова упаривали, и полученный остаток сушили в течение ночи в сушильном шкафу. Получали 3.52 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 2934, 2845, 2789, 1554, 1507, 1478, 1445, 1370, 1291, 1257, 1235, 1142, 1092, 1072, 1000, 981, 959, 757.
Содержание Fe: 8.77% [вес/вес].
Пример 54
Трис-(N-(3-гидроксипропил)-N-метил-3-оксобутанамид)-железо(III)-комплекс

В раствор 3.20 г (18.50 ммоль) N-(3-гидроксипропил)-N-метил-3-оксобутанамида в 40 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 1 часа при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.31 г коричневого масла.
ИК (чистое вещество, см-1): 3376, 2919, 1557, 1492, 1348, 1296, 1263, 1212, 1190, 1051, 989, 955, 763.
Содержание Fe: 9.08% [вес/вес].
Пример 55
Трис-N-(транс-4-гидроксициклогексил)-3-оксобутанамид)-железо(III)-комплекс
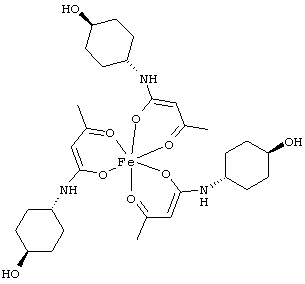
В раствор 3.68 г (18.50 ммоль) N-(транс-4-гидроксициклогексил)-3-оксобутанамида в 80 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 20 мл этанола. Затем порциями добавляли 6.22 г (74.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.81 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3280, 2932, 2859, 1549, 1494, 1453, 1409, 1371, 1309, 1265, 1187, 1055, 1014, 961, 941, 776.
Содержание Fe: 7.84% [вес/вес].
Пример 56
Трис-(N-(3-гидрокси-2,2-диметилпропил)-3-оксобутанамид)-железо(III)-комплекс

В раствор 3.46 г (18.50 ммоль) N-(3-гидрокси-2,2-диметилпропил)-3-оксобутанамида в 50 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 15 мл этанола. Затем порциями добавляли 6.22 г (74.00 ммоль) бикарбоната натрия. После перемешивания в течение 4 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 4.40 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3289, 2963, 2872, 1554, 1502, 1450, 1410, 1265, 1190, 1050, 1014, 948, 777.
Содержание Fe: 8.3% [вес/вес].
Пример 57
Трис-(1-[4-(диметиламино)пиперидин-1-ил]бутан-1,3-дион)-железо(III)-комплекс
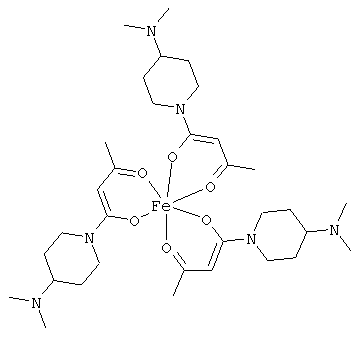
В раствор 3.93 г (18.50 ммоль) 1-[4-(диметиламино)пиперидин-1-ил] бутан- 1,3-диона в 80 мл МеОН прикапывали раствор 1.00 г (6,17 ммоль) хлорида железа(III) (безводного) в 10 мл МеОН. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь упаривали, остаток растворяли в 100 мл дихлорметана, перемешивали 15 минут, фильтровали, и фильтрат упаривали. Полученный остаток растворяли в 50 мл этанола, снова упаривали, и полученный остаток сушили в течение ночи в сушильном шкафу. Получали 4.23 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 2940, 2858, 2769, 1593, 1553, 1509, 1482, 1448, 1372, 1328, 1271, 1236, 1205, 1040, 957, 874, 758.
Содержание Fe: 7.97% [вес/вес].
Пример 58
Трис-(1-(4-метоксипиперидин-1-ил]бутан-1,3-дион)-железо(III)-комплекс

В раствор 3.69 г (18.50 ммоль) 1-(4-метоксипиперидин-1-ил]бутан-1,3-диона в 80 мл МеОН прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл МеОН. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 1 часа при комнатной температуре, реакционную смесь упаривали, остаток растворяли в 100 мл дихлорметана, 15 минут перемешивали, фильтровали, и фильтрат упаривали. Полученный остаток растворяли в 50 мл этанола, снова упаривали, и полученный остаток сушили в течение ночи в сушильном шкафу. Получали 4.01 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 2944, 2825, 1634, 1557, 1511, 1452, 1376, 1317, 1271, 1235, 1184, 1096, 1047, 1023, 959, 939, 759.
Содержание Fe: 8.42% [вес/вес].
Пример 59
Трис-(1-(2,6-диметилморфолин-4-ил]бутан-1,3-дион)-железо(III)-комплекс

В раствор 3.69 г (18.50 ммоль) 1-(2,6-диметилморфолин-4-ил]бутан-1,3-диона в 40 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.92 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 2974, 2872, 1556, 1510, 1477, 1373, 1258, 1244, 1172, 1138, 1116, 1082, 1050, 1002, 958, 759.
Содержание Fe: 8.10% [вес/вес].
Пример 60
Трис-N-(морфолин-4-ил)-3-оксобутанамид)-железо(III)-комплекс
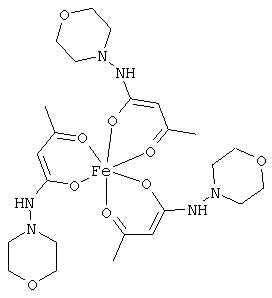
В раствор 3.44 г (18.50 ммоль) N-(морфолин-4-ил)-3-оксобутанамида в 50 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 20 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.63 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3209, 2854, 1569, 1518, 1430, 1366, 1335, 1265, 1204, 1108, 1072, 1044, 975, 952, 869, 778, 703.
Содержание Fe: 8.34% [вес/вес].
Пример 61
Трис-(1-(4-гидроксипиперидин-1-ил)пентан-1,3-дион)-железо(III)-комплекс
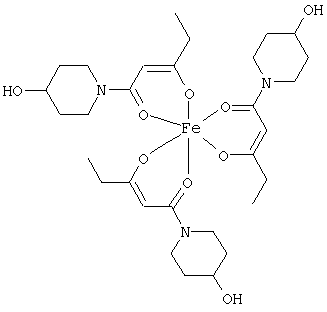
В раствор 5.54 г (27.8 ммоль) 1-(4-гидроксипиперидин-1-ил)пентан-1,3-диона в 45 мл безводного этанола добавляли раствор 1.51 г (9.31 ммоль) безводного хлорида железа(III) в 10 мл безводного этанола, затем добавляли 4.67 г (55.6 ммоль) бикарбоната натрия. Через 6.5 часов реакционную смесь фильтровали, и осадок отбрасывали. Из фильтрата удаляли растворитель на роторном испарителе, и остаток сушили 16 часов в вакуумном сушильном шкафу. Получали 5.56 г коричнево-красного твердого вещества.
ИК (чистое вещество, см-1): 2932, 2870, 1588, 1551, 1509, 1444, 1382, 1366. 1314, 1265, 1224, 1119, 1074, 978, 924, 832, 801, 764, 705, 661.
Содержание Fe: 8.26%
Пример 62
Трис-(1-(морфолин-4-ил)пентан-1,3-дион)-железо(III)-комплекс

В раствор 3.18 г (17.2 ммоль) 1-(морфолин-4-ил)пентан-1,3-диона в безводном этаноле добавляли раствор 0.997 г (6.15 ммоль) безводного хлорида железа(III) в 11 мл безводного этанола. Затем добавляли 3.11 г (37.0 ммоль) гидрокарбоната натрия, и реакционную смесь перемешивали 4 часа. Осадок отфильтровывали и отбрасывали. Фильтрат упаривали на роторном испарителе досуха, и остаток сушили 16 часов в вакуумном сушильном шкафу. Получали 3.33 г красно-коричневого твердого вещества.
ИК (чистое вещество, см-1): 2964, 2851, 1591, 1551, 1510, 1473, 1439, 1380, 1315, 1300, 1274, 1241, 1189, 1112, 1063, 1003, 929, 857, 801, 763, 706, 664, 593.
Содержание Fe: 9.13% [вес/вес/].
Пример 63
Трис-(N-бутил-3-оксогептанамид)-железо(III)-комплекс
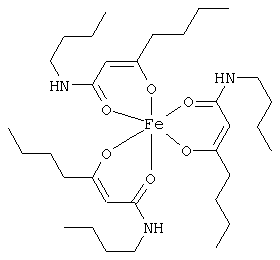
60 ммоль (11.96 г) N-бутил-3-оксогептанамида и 20 ммоль (3.24 г) FeCl3 (безводного) растворяли в 110 мл этанола (безводного) и добавляли 10.4 мл раствора метилата натрия (30% вес/вес). Смесь перемешивали 0.5 часа, и реакционный раствор фильтровали. Фильтрат упаривали на роторном испарителе, и продукт сушили. Получали 13.7 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2956, 2930, 2871, 1717, 1656, 1558, 1500, 1435, 1376, 1325, 1299, 1271, 1177, 1103, 1085, 1050, 994, 948, 894, 778, 682.
CHN-Элементный анализ: С, 59.26; Н, 9.21; N, 6.12.
Содержание Fe: 7.39% [вес/вес]
Пример 64
Трис-(1-(4-Гидроксипиперидин-1-ил)-4-метилпентан-1,3-дион)-железо(III)-комплекс

90 ммоль (19.2 г) 1-(4-гидроксипиперидин-1-ил)-4-метилпентан-1,3-диона и 30 ммоль (4.87 г) FeCl3 (безводного) растворяли в 150 мл этанола (безводного), и добавляли 30 мл раствора этилата натрия (21% вес/вес). Смесь перемешивали 0.5 часа, и реакционный раствор фильтровали. Фильтрат упаривали на роторном испарителе, и продукт сушили в вакуумном сушильном шкафу при 50°С. Получали 19.8 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2927, 2866, 1550, 1513, 1443, 1372, 1312, 1265, 1225, 1190, 1157, 1119, 1072, 1022, 980, 945, 882, 823, 808, 771, 714, 660, 646.
CHN-Элементный анализ: С, 52.00; Н, 7.79; N, 5.99.
Содержание Fe: 7.21% [вес/вес]
Пример 65
Трис-(N-(2-Гидроксиэтил)-N,4-диметил-3-оксопентанамид)-железо(III)-комплекс

90 ммоль (17.93 г) N-(2-гидроксиэтил)-N,4-диметил-3-оксопентанамида и 30 ммоль (4.87 г) FeCl3 (безводного) растворяли в 150 мл этанола (безводного) и добавляли 15 мл раствора метилата натрия (30% вес/вес). Смесь перемешивали еще 0.5 часа, и реакционный раствор фильтровали. Фильтрат упаривали на роторном испарителе, и продукт сушили в вакуумном сушильном шкафу при 50°С. Получали 20.7 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2966, 2926, 2859, 1714, 1627, 1550, 1517, 1479, 1460, 1439, 1384, 1371, 1358, 1301, 1273, 1246, 1190, 1159, 1114, 1087, 1065, 1051, 1019, 991, 947, 927, 884, 850, 774, 717, 682.
CHN-Элементный анализ: С, 44.04; Н, 6.97; N, 6.33.
Содержание Fe: 7.79% [вес/вес]
Пример 66
Трис-(N,N-Диметил-2-оксоциклопентанкарбоксамид)-железо(III)-комплекс

18 ммоль (3.29 г) N,N-диметил-2-оксоциклопентанкарбоксамида (чистота >85%) и 6 ммоль (0.925 г) FeCl3 (безводного) растворяли в 50 мл этанола (безводного) и добавляли 3 мл раствора метилата натрия (30% вес/вес). Смесь перемешивали 1 час, и реакционный раствор фильтровали. Фильтрат упаривали на роторном испарителе, и продукт сушили в вакуумном сушильном шкафу при 50°С. Получали 3.9 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2945, 2882, 1735, 1635, 1555, 1491, 1466, 1451, 1411, 1395, 1362, 1347, 1303, 1262, 1215, 1186, 1169, 1141, 1099, 1050, 1020, 983, 946, 915, 903, 885, 834, 770, 754, 733, 694, 638.
Содержание Fe: 8.03% [вес/вес]
Пример 67
Трис-(N-циклопентил-3-оксобутанамид)-железо(III)-комплекс
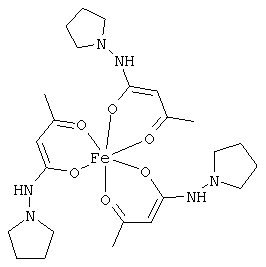
В раствор 31.3 г (18.50 ммоль) N-циклопентил-3-оксобутанамида в 40 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 6.22 г (74.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.74 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3256, 2956, 2869, 1550, 1491, 1450, 1409, 1357, 1265, 1185, 1042, 1015, 951, 780.
Содержание Fe: 9.17% [вес/вес].
Пример 68
Трис-(1-(пирролидин-1-ил)бутан-1,3-дион)-железо(III)-комплекс

В раствор 2.87 г (18.50 ммоль) 1-(пирролидин-1-ил)бутан-1,3-диона в 40 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 6.22 г (74.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.41 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 2966, 2869, 1556, 1511, 1473, 1457, 1351, 1328, 1224, 1206, 1117, 1080, 996, 971, 953, 761.
Содержание Fe: 10.16% [вес/вес].
Пример 69
Трис-(метил-N-(3-оксобутаноил)-L-серинат)-железо(III)-комплекс

В раствор 3.75 г (18.50 ммоль) метил N-(3-оксобутаноил)-L-серината в 50 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного)) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 4.45 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3285, 2955, 1733, 1543, 1491, 1408, 1343, 1274, 1209, 1186, 1146, 1077, 1054, 1029, 958, 779.
Содержание Fe: 8.02% [вес/вес].
Пример 70
Трис-(1-(4-ацетилпиперазин-1-ил)бутан-1,3-дион)-железо(III)-комплекс

В раствор 3.92 г (18.50 ммоль) 1-(4-ацетилпиперазин-1-ил)бутан-1,3-диона в 80 мл МеОН прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 20 мл МеОН. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 1 часа при комнатной температуре, реакционную смесь упаривали, остаток растворяли в 200 мл дихлорметана, перемешивали 15 минут, фильтровали, и фильтрат упаривали. Полученный остаток растворяли в 50 мл этанола, снова упаривали, и полученный остаток сушили в течение ночи в сушильном шкафу. Получали 4.1 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 2914, 1637, 1555, 1511, 1468, 1421, 1367, 1284, 1239, 1172, 1046, 981, 958, 760.
Содержание Fe: 7.74% [вес/вес].
Пример 71
Трис-(N-циклогексил-3-оксобутанамид)-железо(III)-комплекс

В раствор 3.39 г (18.50 ммоль) N-циклогексил-3-оксобутанамида в 40 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.8 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3282, 2928, 2854, 1552, 1488, 1448, 1408, 1315, 1278, 1256, 1187, 1150, 1109, 1041, 975, 942, 781.
Содержание Fe: 8.81% [вес/вес].
Пример 72
Трис-(метил-N-(3-оксобуганоил)глицинат)-железо(III)-комплекс
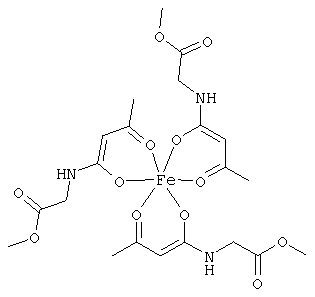
В раствор 3.21 г (18.50 ммоль) метил N-(3-оксобутаноил)глицината в 40 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 1 часа при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.95 г коричневого масла.
ИК (чистое вещество, см-1): 3343, 2955, 1739, 1543, 1495, 1409, 1365, 1284, 1179, 1051, 1011, 988, 779.
Содержание Fe: 8.95% [вес/вес].
Пример 73
Трис-(N-(2-метилпропил)-3-оксобутанамид)-железо(III)-комплекс

В раствор 2.90 г (18.50 ммоль) N-(2-метилпропил)-3-оксобутанамида в 40 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 4 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 3.49 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3284, 3110, 2959, 2927, 2871, 1551, 1499, 1433, 1408, 1271, 1188, 1156, 1102, 1018, 954, 940, 777.
Содержание Fe: 9.70% [вес/вес].
Пример 74
Трис-(N-(циклопропилметил)-3-оксобутанамид)-железо(1П)-комплекс

В раствор 1.44 г (9.25 ммоль) N-(циклопропилметил)-3-оксобутанамида в 20 мл этанола прикапывали раствор 0.5 г (3.08 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 1.56 г (18.50 ммоль) бикарбоната натрия. После перемешивания в течение 4 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 1.75 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3270, 1549, 1498, 1431, 1407, 1265, 1187, 1165, 1096, 1023, 951, 830, 778.
Содержание Fe: 9.89% [вес/вес].
Пример 75
Трис-(этил4-(морфолин-4-ил)-2,4-диоксобутаноат)-железо(III)-комплекс
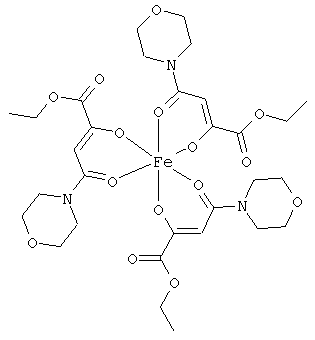
0.24 г (1.45 ммоль) хлорида железа(III) растворяли в 20 мл ТГФ и добавляли 1.00 г (4.36 ммоль) этил 4-(морфолин-4-ил)-2,4-диоксобутаноата. После 40 минут перемешивания добавляли 0.44 г (4.36 ммоль) триэтиламина, и оставляли перемешиваться еще 60 минут при комнатной температуре. Затем прикапывали 4.6 г 6%-ного раствора этоксида натрия (4.4 ммоль), и раствор перемешивали еще 2 часа. Выпавшую в осадок соль отфильтровывали, и фильтрат упаривали на роторном испарителе досуха. Полученный остаток сушили 1 день при 50°С в высоком вакууме. Получали 0.8 г продукта в виде оранжевого твердого вещества.
ИК (чистое вещество, см-1): 2978, 2923, 2863, 1704, 1610, 1568, 1511, 1442, 1375, 1300, 1275, 1246, 1138, 1111, 1062, 1018, 946, 860, 759, 722, 651.
Элементный анализ: С 48.54%, Н 5.8%, N 5.48%
Содержание Fe: 6.9% [вес/вес].
Пример 76
Трис-(этил N-(3-оксобутаноил)-L-аланинат)-железо(III)-комплекс

В раствор 3.72 г (18.50 ммоль) этил N-(3-оксобутаноил)-L-аланината в 40 мл этанола прикапывали раствор 1.00 г (6.17 ммоль) хлорида железа(III) (безводного) в 10 мл этанола.
Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 4.00 г коричневого масла.
ИК (чистое вещество, см-1): 3348, 2981, 1733, 1658, 1589, 1539, 1490, 1448, 1411, 1300, 1206, 1186, 1155, 1051, 965, 777.
Содержание Fe: 7.80% [вес/вес].
Пример 77
Трис-(N-циклобутил-3-оксобутанамид)-железо(III)-комплекс
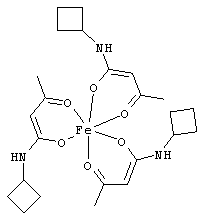
В раствор 1.43 г (9.25 ммоль) N-циклобутил-3-оксобутанамида в 20 мл этанола прикапывали раствор 0.5 г (3.08 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 1.56 г (18.50 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 1.71 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 3280, 2978, 2943, 1546, 1488, 1408, 1274, 1187, 1156, 1031, 970, 946, 779, 757.
Содержание Fe: 9.98% [вес/вес].
Пример 78
Трис-(1-(азетидин-1-ил)бутан-1,3-дион)-железо(III)-комплекс

В раствор 1.30 г (9.25 ммоль) 1-(азетидин-1-ил)бутан-1,3-диона в 20 мл этанола прикапывали раствор 0.5 г (3.08 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 1.58 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 2945, 2878, 1558, 1510, 1473, 1344, 1297, 1201, 1003, 948, 753.
Содержание Fe: 11.13% [вес/вес].
Пример 79
Трис-(этил 1-(3-оксобутаноил)-пиперидин-4-карбоксилат)-железо(III)-комплекс
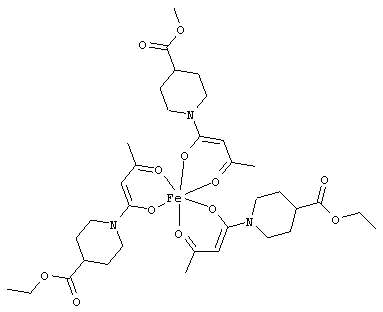
В раствор 2.23 г (9.25 ммоль) этил 1-(3-оксобутаноил)-пиперидин-4-карбоксилата в 30 мл этанола прикапывали раствор 0.5 г (3.08 ммоль) хлорида железа(III) (безводного) в 10 мл этанола. Затем порциями добавляли 3.11 г (37.00 ммоль) бикарбоната натрия. После перемешивания в течение 2 часов при комнатной температуре, реакционную смесь фильтровали, промывали 10 мл этанола, фильтрат упаривали, и остаток сушили в течение ночи в сушильном шкафу при 50°С. Получали 2.43 г коричневого твердого вещества.
ИК (чистое вещество, см-1): 2957, 2931, 2862, 1724, 1639, 1555, 1511, 1485, 1446, 1372, 1312, 1271, 1236, 1174, 1038, 973, 958, 760.
Содержание Fe: 6.67% [вес/вес].
Пример 80
Трис-(1-(4-Гидроксипиперидин-1-ил)-4-метоксибутан-1,3-дион)-железо(III)-комплекс
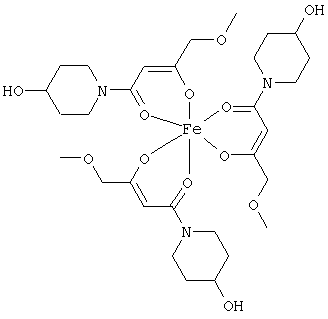
18 ммоль (3.91 г) 1-(4-гидроксипиперидин-1-ил)-4-метоксибутан-1,3-диона и 6 ммоль (0.96 г) FeCl3 (безводного) растворяли в 80 мл этанола (безводного), и добавляли 4 мл раствора метоксида натрия (30% вес/вес). Смесь перемешивали 1 час, и реакционный раствор фильтровали. Фильтрат упаривали на роторном испарителе, и продукт сушили. Получали 4.36 г указанного в заголовке соединения.
ИК (чистое вещество, см-1): 2928, 2824, 1727, 1597, 1564, 1513, 1491, 1445, 1385, 1331, 1265, 1227, 1197, 1109, 1074, 1051, 1025, 990, 957, 845, 807, 765, 723, 653.
Содержание Fe: 7.11% [вес/вес].
Реферат
Настоящее изобретение относится к комплексному соединению железа(III). Соединение содержит по меньшей мере один лиганд формулы (I):где стрелки означают координационную связь с одним или разными атомами железа, Rвыбран из группы, состоящей из линейного или разветвленного C-алкила, который может быть замещен C-алкокси (RO-), где R означает незамещенный алкил, или C-алкоксикарбонила (RO-CO-), где R означает незамещенный алкил; Rвыбран из группы, состоящей из атома водорода, незамещенного С-алкила, атома галогена и цианогруппы, или Rи R, вместе с атомами углерода, с которыми они связаны, образуют незамещенный 5- или 6-членный цикл, Rи Rсоответственно выбраны из группы, состоящей из атома водорода, морфолинила, С-циклоалкила и линейного или разветвленного C-алкила, который может быть замещен гидрокси, алкокси, циклоалкилом, C-алкоксикарбонилом (RO-CO-), где R означает незамещенный алкил, или Rи R, вместе с атомом азота, с которым они связаны, образуют необязательно замещенный 3-6-членный цикл, который необязательно может содержать один или более дополнительных гетероатомов, выбранных из N и О, или его фармацевтически приемлемые соли. Также предложены применение комплексного соединения, лекарственные средства и фармацевтическая композиция. Полученные соединения предназначены для применения в качестве лекарственных средств для лечения и/или профилактики симптомов железодефицита и железодефицитной анемии. 5 н. и 11 з.п. ф-лы, 1 табл., 80 пр.
Формула

где
стрелки означают координационную связь с одним или разными атомами железа,
R1 выбран из группы, состоящей из
- линейного или разветвленного C1-8-алкила, который может быть замещен C1-6-алкокси (RO-), где R означает незамещенный алкил, или C1-8-алкоксикарбонила (RO-CO-), где R означает незамещенный алкил,
R2 выбран из группы, состоящей из
- атома водорода,
- незамещенного С1-8-алкила,
- атома галогена и
- цианогруппы, или
R1 и R2, вместе с атомами углерода, с которыми они связаны, образуют незамещенный 5- или 6-членный цикл,
R3 и R4 соответственно выбраны из группы, состоящей из
- атома водорода,
- морфолинила,
- С3-6-циклоалкила и
- линейного или разветвленного C1-8-алкила, который может быть замещен
или
R3 и R4, вместе с атомом азота, с которым они связаны, образуют необязательно замещенный 3-6-членный цикл, который необязательно может содержать один или более дополнительных гетероатомов, выбранных из N и О,
или его фармацевтически приемлемые соли.

где
стрелки означают координационную связь с одним или разными атомами железа,
R1 представляет собой линейный или разветвленный C1-8-алкил, как определено в п.1, или C1-8-алкоксикарбонил (RO-CO-), где R означает незамещенный алкил;
R2 выбран из группы, состоящей из
- атома водорода,
- С1-8-алкила, как определено в п.1,
- атома галогена и
- цианогруппы,
R3 и R4 соответственно выбраны из группы, состоящей из
- атома водорода,
- морфолинила,
- C1-8-алкила, как определено в п.1, и
- С3-6-циклоалкила, который может быть замещен гидрокси; или
R3 и R4, вместе с атомом азота, с которым они связаны, образуют необязательно замещенный 3-6-членный цикл, который необязательно может содержать один или более дополнительных гетероатомов, выбранных из N и О,
или его фармацевтически приемлемые соли.
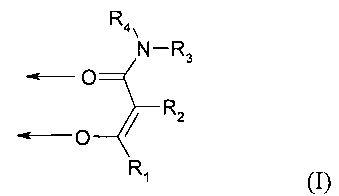
где
стрелки означают координационную связь с одним или разными атомами железа,
R1 представляет собой
- линейный или разветвленный C1-8-алкил, как определено в п.1, или
- C1-3-алкоксикарбонил;
R2 выбран из группы, состоящей из
- атома водорода,
- C1-8-алкила, как определено в п.1,
- галогена и
- цианогруппы, или
R3 и R4 соответственно выбраны из группы, состоящей из
- атома водорода,
- морфолинила,
- C1-8-алкила, как определено в п.1, и
- С3-6-циклоалкила, который может быть замещен гидрокси; или
R3 и R4, вместе с атомом азота, с которым они связаны, образуют 3-6-членный цикл, который может быть необязательно замещен
- гидрокси,
- C1-3-алкилом, который может быть замещен гидрокси,
- C1-3-алкокси,
- диметиламино,
- ацилом (R-(C=O)-), где R означает -СН3,
- этоксикарбонилом; и
который необязательно может содержать один или более дополнительных гетероатомов, выбранных из N и О,
или его фармацевтически приемлемые соли.

где R1, R2, R3 и R4 соответствуют данным выше определениям.
- C1-6-алкила,
- C1-4-алкокси-C1-4-алкила и
- C1-3-алкоксикарбонила.
- атома водорода,
- галогена,
- C1-6-алкила и
- цианогруппы.
- атома водорода,
- морфолинила,
- C1-6-алкила,
- C3-6-циклоалкила,
- С3-6-циклоалкил-C1-4-алкила,
- C1-4-алкокси-C1-4-алкила,
- C1-3-алкоксикарбонил-C1-6-алкила,
- гидрокси-C1-4-алкила и
- гидрокси-С3-6-циклоалкила, или
R3 и R4 вместе образуют этиленовую (-СН2-СН2-)-, пропиленовую (-СН2-СН2-СН2)-, изопропиленовую (-СН2-СН(СН3)-)-, бутиленовую (-СН2-СН2-СН2-СН2-)-, изобутиленовую, пентиленовую (-СН2-СН2-СН2-СН2-СН2-)- или изопентиленовую группу, в которой одна метиленовая группа (-СН2-) соответственно может быть заменена на -О-, -NH- или -NR5-, где R5 представляет собой C1-8-алкил, как определено в п. 1, и где группы, образованные радикалами R3 и R4, могут дополнительно быть замещены 1-3 заместителями, выбранными из группы, состоящей из гидроксигруппы, C1-4-алкоксигруппы, аминогруппы и моно- или ди-(C1-4-алкил)аминогруппы.

Комментарии