Изобретение белка pi4kiiia и родственного мембранного белкового комплекса в лечении болезни альцгеймера - RU2724493C2
Код документа: RU2724493C2
Чертежи







Описание
ИЗЛОЖЕНИЕ ФИНАНСИРУЕМЫХ ИССЛЕДОВАНИЙ
Данное изобретение всегда поддерживалось 973-мя программами Министерства науки и технологии (номера грантов 2013СВ530900 и 2011СВА00408), Национальным фондом естественных наук (номера грантов 81371400, 81071026 и 81571101) и Шанхайской программой фундаментальных исследований (грант №06dj14010) Китая.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области медицины, конкретно относится к способу понижающей регуляции (даун-регуляции) киназы PI4KIIIα и ее комплексов с мембранными белками, образованных с белком RBO/EFR3/EFR3A/EFR3B и белком ТТС7, с использованием родственных ингибиторов с возможностью лечения болезни Альцгеймера. В другом аспекте настоящее изобретение относится к способу скрининга лекарственных средств и терапевтических мишеней для лечения болезни Альцгеймера в зависимости от того облегчена ли секреция Aβ из клеток или нет.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Болезнь Альцгеймера (БА, AD) является наиболее распространенным нейродегенеративным заболеванием у пожилых людей, характеризующимся постепенной потерей способности к обучению и памяти. Дисфункция и потеря синапсов происходят на ранних стадиях БА, которая широко признана в качестве основного клеточного механизма нарушения обучения и памяти при БА, при котором накопление Аβ играет важную роль (в частности, Аβ42). Хотя были проведены различные клинические испытания соединений или молекул, предназначенных для ингибирования продуцирования Aβ и для усиления клиренса Аβ, но до сих пор еще не найдено соединение или молекула, которые могут улучшить обучение и память или предотвратить дальнейшее ухудшение обучения и нарушение памяти. Одно из возможных объяснений состоит в том, что эти лекарственные средства или способы лечения не смогли изменить ключевой патогенез, вызывающий обучение и нарушение памяти при БА. Требуется более глубокое понимание во всех аспектах накопления Аβ при БА.
Аβ накапливается не только во внеклеточном пространстве, но также накапливается в нейронах. Растущее количество свидетельств позволяет предположить, что Аβ накапливается внутри различных внутриклеточных органов в нейроне и принимает участие в изменениях при патогенезе БА, таких как дефицит синапсов, образование амилоидных бляшек, гибель нейронов и тому подобное. Кроме того считается, что олигомерный Аβ, который, обладает самым вредным действием на синаптические и когнитивные функции, образуется внутриклеточно и накапливается в нейронах головного мозга или клеточных мембранах пациентов с БА и трансгенных мышей АРР. Такой ассоциированный с мембраной Аβ может находиться на клеточной мембране нейронов или мембране внутриклеточных органов. Существуют определенные возможности, которые могут приводить к накоплению Аβ в нейронах, например, эндоцитоз внеклеточного Аβ, удерживание, вызванное пониженной секрецией образованного внутри клетки Аβ, образование и накопление Аβ в аутофагосоме, а также снижение деградации внутриклеточного Аβ.
Хотя Аβ накапливается как внутри клетки так и внеклеточно, концентрация Аβ42 в цереброспинальной (спинномозговой) жидкости (CSF) у пациентов с БА или пациентов на ранних стадиях БА, снижается примерно на половину от контрольной популяции. В мышиной модели БА концентрация Аβ42 в спинномозговой жидкости и интерстициальной жидкости головного мозга (ISF) показывает возрастное снижение, тогда как димеры Аβ не обнаруживаются в ISF. Предполагается, что снижение концентрации Аβ42 в CSF, возможно, вызвано секвестрирующим эффектом внеклеточной амилоидной бляшки, снижением секреции Аβ42 и накоплением Аβ42 в нейронах или мембранах церебральных клеток.
Исследования показали, что фосфолипиды и их метаболизирующие ферменты могут способствовать патогенезу БА посредством их взаимодействия с Аβ или участия в связанных с БА изменениях, посредством различных клеточных и молекулярных процессов, включающих: 1) вставку Аβ42 в липидную мембрану и связывание с кислыми фосфолипидами, которые, в свою очередь, индуцируют превращение случайной спирали в β-структуру в Аβ42, что приводит к агрегации Аβ42 в мембране или на мембране; 2) уровень фосфатидилинозитол-4,5-фосфата (PIP2) плазмалеммы обратно коррелирует с секрецией Аβ42 из культивируемых клеток; 3) экспрессия Аβ42 индуцирует дисфункцию нейронов и нарушение обучения и памяти у мух, которое может быть сохранено ингибированием фосфатидилинозитол-3-киназы (PI3K); 4) недавнее открытие того факта, что продукт фосфатидилинозитол-4-киназы (PI4KIIIα), фосфатидилинозитол-4-фосфат (PI4P) значимо возрастает в коре головного мозга у пациентов с БА, и повышенный уровень тесно связан со степенью когнитивного расстройства у пациентов с БА (Zhu, L., et al., Proc Natl Acad Sci USA, 2015).
У дрозофилы, ген rolling blackout (rbo) кодирует белок плазматической мембраны RBO, который имеет определенную гомологию с диацилглицерин-лиазой. Белок RBO функционирует в метаболизме фосфолипидов, фототрансдукции, передаче возбуждения по синапсам и объем а эндоцитоза у Drosophila. Белок RBO является консервативным от дрожжей до человека. Гомологи RBO у дрожжей (EFR3) и мышей (EFR3A и EFR3B) образуют комплекс с фосфатидилинозитол-4-киназой IIIα (PI4KIIIα) и каркасным белком (который называется повторяющийся домен Тетратрикопептид 7, ТТС7, см., Baird D, Stefan С, et al., 2008, J Cell Biol; Nakatsu F, Baskin JF, et al., 2012, J Cell Biol) на клеточной мембране, чтобы закрепить PI4KIIIα на клеточной мембране и далее регулировать уровни фосфатидилинозитол-4-фосфата (PI4P) и PIP2 в плазмалемме.
У Drosophila, эспрессированный в первичных афферентных нейронах (pan) Аβ42, слитый с секреторным сигнальным пептидом, индуцирует накопление Аβ внутри нейронов и дефицит нейронов. Авторы изобретения ранее показали, что экспрессия секреторного сигнального пептида, содержащего Аβ42 в простом нейронном проводящем пути, пути гигантского волокна (GF) Drosophila, вызывает накопление Аβ внутри нейронов и возрастную синаптическую недостаточность и дефицит двигательной способности. Такая Drosophila, экспрессирующая Аβ42, обеспечивает пригодную для данной цели основу для исследования роли генов-кандидатов в накоплении Аβ42 внутри нейронов и ассоциированном дефиците синапсов. Имея в виду это обстоятельство, авторы изобретения протестировали эффект мутации или сверхэкспрессии генов rbo, PI4KIIIα, и ttc7, а также общепринятых ингибиторов белка PI4KIIIα на нейродегенеративное заболевание в этой модели. Авторы изобретения дополнительно исследовали у трансгенных APP/PS1 мышей эффект нокдауна гена Efr3a (мышиного гомолога гена rbo) на атрофию нейронов гиппокампа и влияние ингибитора малых молекул фениларсиноксида (РАО), часто используемого ингибитора PI4KIIIα на обучение и память, уровень Аβ42 в CSF и мембранах паренхимы головного мозга, а также эффект понижающей регуляции (даун-регуляции) гена PI4KA (который кодирует белок PI4KIIIα) на обучение и память, и эффект продукта PI4KIIIα PI4P на образование олигомеров Аβ42 в липосомах.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение раскрывает, что понижающая регуляция (даун-регуляция) белка PI4KIIIα, белка RBO/EFR3/EFR3A/EFR3B, белка ТТС7, и количество их мембранных белковых комплексов или активность родственных ферментов, с использованием генетических способов или родственных ингибиторов, может облегчать секрецию Аβ (в частности, Аβ42) нейронных клеток и соответственно уменьшать накопление Аβ внутри нейронов, с тем, чтобы уменьшить выраженность дефицита нейронов у Drosophila и в мышиных моделях с БА. Следовательно, изобретение раскрывает существенную роль нейронной секреции Аβ42 в лечении БА, и обеспечивает новую стратегию лечения БА; в то же время изобретение обеспечивает новые лекарственные средства для лечения БА, и дополнительно показывает новое направление скрининга лекарственного средства и терапевтической мишени для лечения БА.
В одном аспекте изобретение относится к новому способу лечения БА. В соответствии с конкретным вариантом изобретения, данное изобретение раскрывает способ лечения БА посредством использования ингибитора PI4KIIIα, которым может быть анти-PI4KIIIα антитело, ингибирующий нуклеотид специфический к PI4KIIIα или ингибиторы малых молекул специфические к PI4KIIIα. Предпочтительно, специфический к PI4KIIIα ингибирующий нуклеотид может быть нуклеотидной последовательностью как показано в SEQ ID NO:6; ингибитор PI4KIIIα выбран из одного или нескольких следующих малых молекул-ингибиторов: РАО, производных РАО, аналогов G1, А1, G1 или А1.
В соответствии с другим вариантом осуществления данного изобретения, настоящее изобретение также раскрывает способ лечения БА с использованием ингибитора RBO/EFR3/EFR3A/EFR3B. Ингибитором RBO/EFR3/EFR3A/EFR3B может быть анти-RBO/EFR3/EFR3A/EFR3B антитело.
В соответствии с другим вариантом осуществления данного изобретения, настоящее изобретение также раскрывает способ лечения БА с использованием ингибитора PI4P. Ингибитором PI4P может быть анти-PI4P антитело, слитый белок OSH2-PH2X, или слитый белок OSH2-2x-PH.
В другом аспекте настоящее изобретение также относится к фармацевтической композиции, которая может быть использована для лечения БА, содержащей один или несколько ингибиторов PI4KIIIα, ингибиторов RBO/EFR3/EFR3A/EFR3B и ингибитор PI4P, и возможно фармацевтический носитель. Предпочтительно, фармацевтическая композиция может дополнительно содержать одно или несколько анти-Аβ антител и/или соединений, способных удалять или убирать внеклеточные Аβ бляшки или отложения, выбранных из группы, состоящей из олигосахаридов морского происхождения углеводов HSH971 и их аналогов, акампросата и его аналогов, и эдаравона и его аналогов.
Кроме того, настоящее изобретение также относится к способу скрининга лекарственного средства для лечения БА. В соответствии с конкретным вариантом данного изобретения, настоящее изобретение раскрывает способ скрининга лекарственных средств для лечения БА, которые нацелены на киназную активность белка PI4KIIIα, и способ содержит следующие этапы: наблюдения эффекта лекарственного средства-кандидата на фосфокиназную активность PI4KIIIα, если лекарственные средства-кандидаты могут ингибировать фосфокиназную активность PI4KIIIα, что является признаком того, что лекарственное средство-кандидат является потенциальным лекарственным средством для лечения БА.
В соответствии с другим вариантом осуществления данного изобретения, настоящее изобретение также раскрывает способ скрининга лекарственного средства, нацеленного на БА, путем направленного воздействия (таргетинга) на взаимодействие между белком RBO/EFR3/EFR3A/EFR3B, белком ТТС7 и белком PI4KIIIα, содержащий следующие этапы: наблюдения эффекта лекарственного средства-кандидата на взаимодействие белка RBO/EFR3/EFR3A/EFR3B, белка ТТС7 и белка PI4KIIIα, если лекарственное средство-кандидат может ингибировать взаимодействие белка RBO/EFR3/EFR3A/EFR3B, белка ТТС7 и белка PI4KIIIα, посредством чего снижается образование белкового комплекса RBO/EFR3/EFR3A/EFR3B-TTC7-PI4KIIIα, что является признаком того, что лекарственное средство-кандидат является потенциальным лекарственным средством для лечения БА.
В соответствии с другим вариантом осуществления данного изобретения, настоящее изобретение также раскрывает способ скрининга лекарственных средств против БА, лекарственных средств, которые нацелены на уровень PI4P на клеточной мембране, и способ содержит следующие этапы: наблюдения за лекарственными средствами-кандидатами независимо от их эффекта на уровень PI4P на клеточной мембране, и если кандидат в лекарственное средство может снизить уровень PI4P на клеточной мембране, это указывает на то, что лекарственное средство-кандидат является потенциальным лекарственным средством для лечения БА.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Мутация гена rbo уменьшает выраженность дефицита нейронов у мух, экспрессирующих Аβarc, и снижает уровень экспрессии белка PI4KIIIα или ослабляет взаимодействие белка PI4KIIIα с белком RBO.
Фиг. 2. Понижающая регуляция (даун-регуляция) или ингибирование фармацевтическим препаратом уровня экспрессии белка PI4KIIIα уменьшает выраженность дефицита нейронов у мух, экспрессирующих Аβarc.
Фиг. 3. Понижающая регуляция (даун-регуляция) уровня экспрессии или функции белка RBO/PI4KIIIα уменьшает накопление Аβ внутри нейронов.
Фиг. 4. Понижающая регуляция (даун-регуляция) уровня экспрессии белка или функции RBO/PI4KIIIα облегчает секрецию Аβ42.
Фиг. 5. Эффекты нокдауна гена Efr3a на диаметр дендритов и плотность шипиков нейронов в сегментах СА3 и DG гиппокампа у мышей APP/PS1 и контрольных мышей.
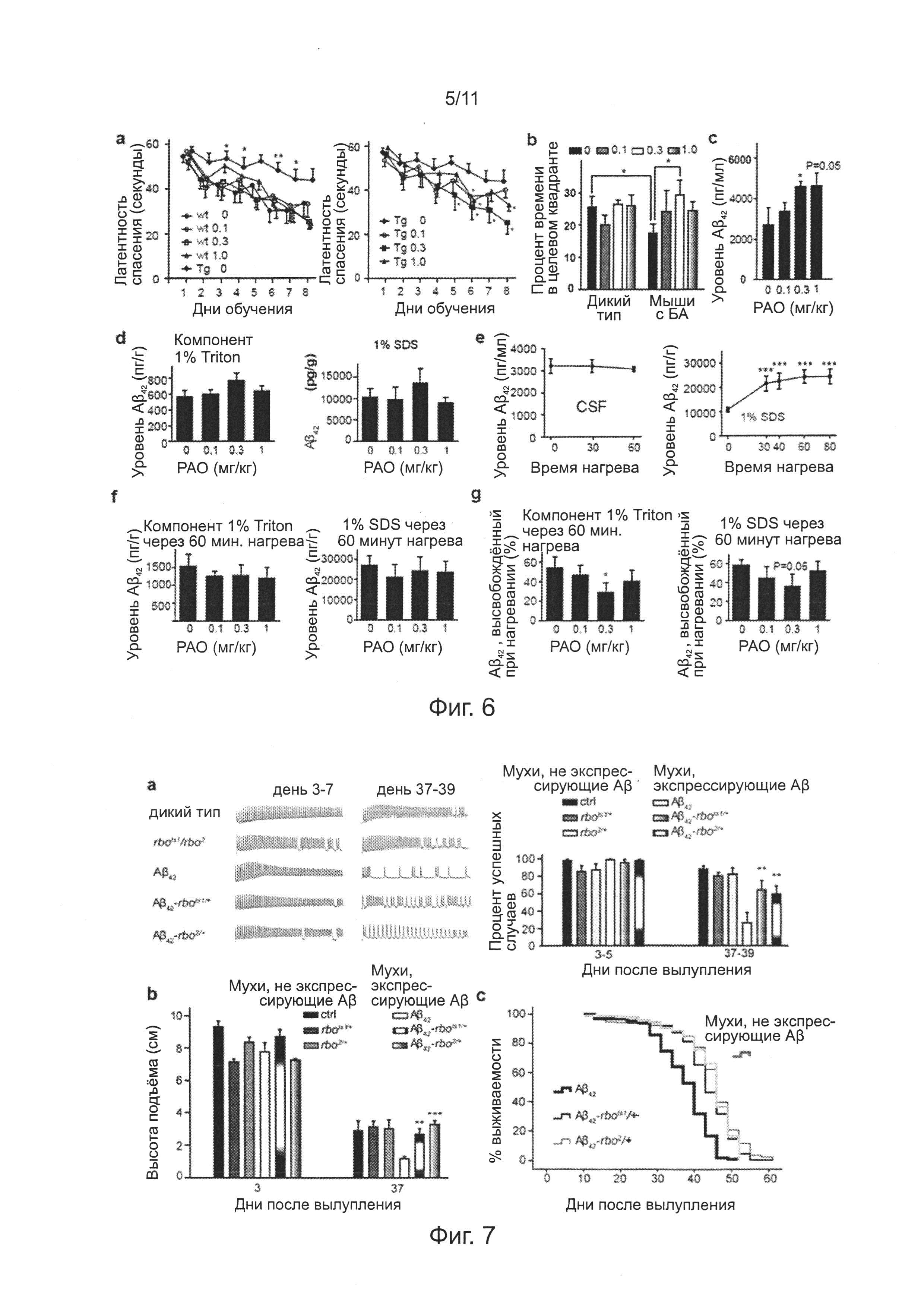
Фиг. 6. Эффекты лечения РАО на способность к обучению и запоминанию, уровень ассоциированного с CSF (пер., спинномозговой (цереброспинальной) жидкостью) и мембранами головного мозга Аβ42, у мышей APP/PS1 и контрольных мышей.
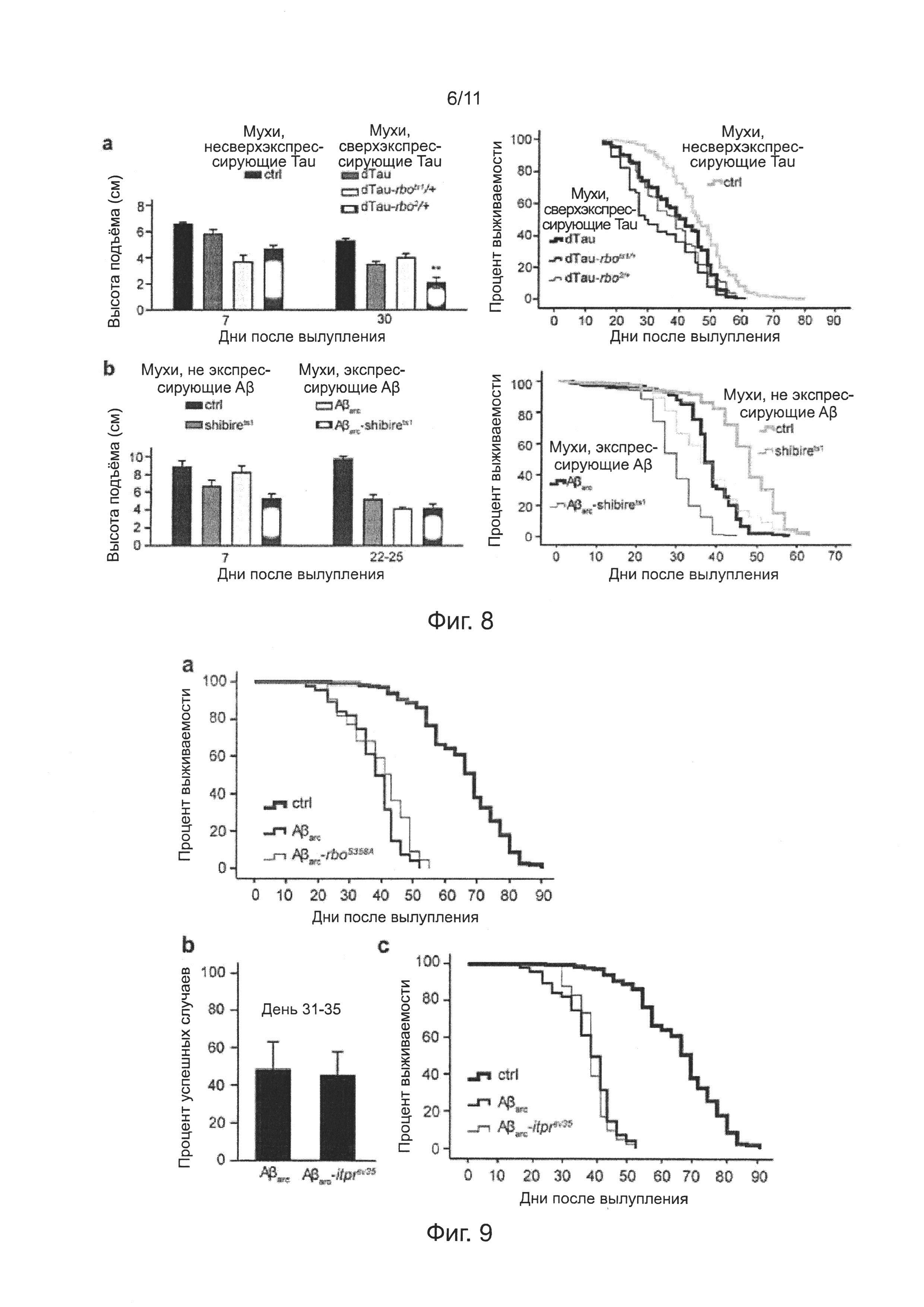
Фиг. 7. Мутация гена rbo уменьшает выраженность дефицита нейронов у мух, экспрессирующих Аβ42.
Фиг. 8. Эффекты мутаций генов rbo и shibire на двигательную способность и продолжительность жизни мух, сверхэкспрессирующих Аβarc или Tau Drosophila, соответственно.
Фиг. 9. Эффекты мутаций генов rboS358A и itprSV35 мух, экспрессирующих Аβarc.
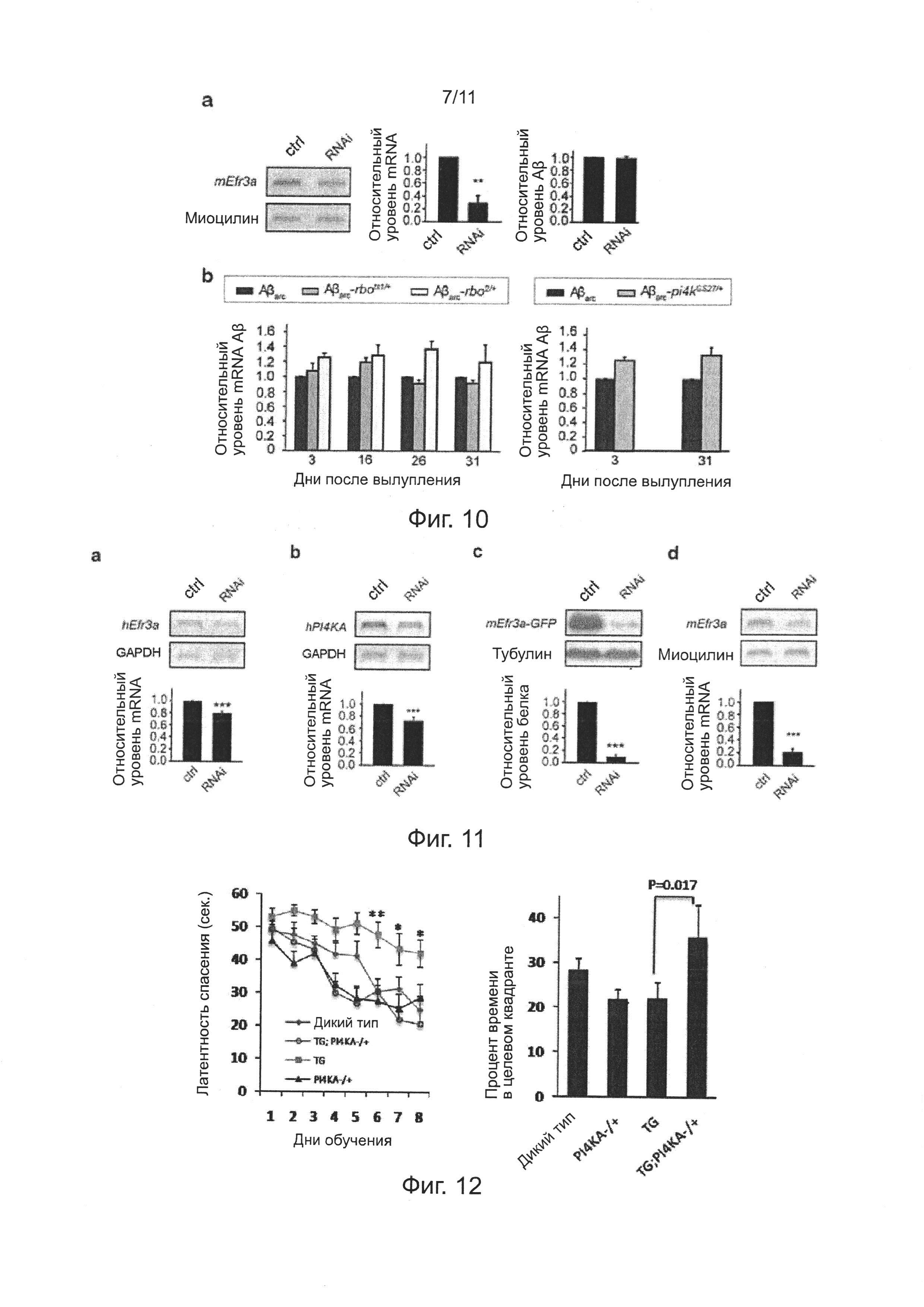
Фиг. 10. Эффекты нокдауна гена Efr3a на эндоцитоз внеклеточного Аβ клеток N2a, и эффекты мутаций генов rbo и PI4KA на транскрипцию Аβarc у мух, экспрессирующих Аβarc.
Фиг. 11. Эффективность нокдауна гена Efr3a или PI4KA в клетках HEK293 или первичных нейронах гиппокампа мышей.
Фиг. 12. Инсерция транспозона в копию гена PI4KA мышей APP/PS1 значимо улучшает дефект обучения и памяти.
Фиг. 13. PI4P облегчает олигомеризацию Аβ42 в липосомах.
Фиг. 14. Эффекты РАО на уровень экспрессии АРР и активность α-, β-, и γ-секретазы.
Фиг. 15. Эффекты мутаций и сверхэкспрессии гена ttc7 на дефицит нейронов у мух, экспрессирующих Аβarc.
Фиг. 16. Концентрационная зависимость эффекта облегчения РАО на секрецию Аβ42 из HEK293T, стабильно трансфицированных АРР.
Фиг. 17. Структурное моделирование связывания активного центра фермента PI4KIIIα человека с РАО.
Фиг. 18. Эффект лечения РАО на когнитивные расстройства у мышей APP/PS1 в возрасте старше полугода.
Фиг. 19. Понижающая регуляция (даун-регуляция) уровня экспрессии PI4KIIIα и ингибирования ферментативной активности PI4KIIIα с использованием РАО, оба значимо улучшают нарушение пластичности синаптической передачи в гиппокампе мыши.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении, включающем описание и формулу изобретения, если не указано иное, используют следующие термины со следующими значениями:
Используемый здесь термин "ген rbo/Efr3/Efr3a/Efr3b", относится к гену rbo, (полученному из) Drosophila, гену Efr3 дрожжей, или гену Efr3a и гену Efr3b млекопитающих; используемый здесь термин "белок RBO/EFR3/EFR3A/EFR3B" относится к белкам, кодируемым геном rbo, источником происхождения которого является Drosophila, геном Efr3, источником происхождения которого являются дрожжи, или геном Efr3a/Efr3b, источником происхождения которого являются млекопитающие.
Используемый здесь термин "ген PI4KIIIα/PI4KA", относится к PI4KIIIα или гену PI4KA, источником происхождения которого является Drosophila или млекопитающие; используемый здесь термин "белок PI4KIIIα" относится к белкам, кодируемым геном PI4KIIIα/PI4KA в Drosophila или млекопитающих.
Используемый здесь термин "ген ttc7" относится к гену ttc7, источником происхождения которого является Drosophila и млекопитающие; в применении здесь термин "белок ТТС7" относится белкам, кодируемым ttc7 в упомянутых выше Drosophila и млекопитающих.
Используемый здесь термин "ингибитор", относится к материалам, способным снижать, уменьшать или устранять количество, конкретную функцию и конкретное свойство объекта-мишени. Указанный объект-мишень может быть белком, полипептидом, нуклеиновой кислотой и т.п., тогда как указанный ингибитор непосредственно или косвенно влияет на количество, конкретную функцию и конкретное свойство объекта-мишени, что приводит к соответствующему снижению, уменьшению или устранению количества, конкретной функции и конкретного свойства объекта-мишени. Указанный ингибитор может быть белком, полипептидом, нуклеиновой кислотой, соединением со сравнительно малой молекулярной массой и т.п.
Например, используемый здесь термин "ингибитор PI4KIIIα", относится к материалам, способным снижать, уменьшать или устранять экспрессию, транскрипцию, трансляцию гена PI4KIIIα/PI4KA, и/или стабильность, продуцируемого этим геном белка PI4KIIIα, способность к связыванию с белком RBO/EFR3/EFR3A/EFR3B и белком ТТС7 и его фосфокиназную активность, и т.д., который включает, без ограничения перечисленным, специфические к PI4KIIIα/PI4KA ингибирующие нуклеотиды, антитела против белка PI4KIIIα, малые молекулы-ингибиторы способные ингибировать киназную активность PI4KIIIα, и/или материалы способные ингибировать взаимодействие между белком PI4KIIIα и другими мембранными белками и т.п..
Аналогично, используемый здесь термин "ингибитор RBO/EFR3/EFR3A/EFR3B", относится к материалам, способным ингибировать, снижать или устранять экспрессию, транскрипцию, трансляцию гена rbo/Efr3/Efr3a/Efr3b и/или стабильность белка RBO/EFR3/EFR3A/EFR3B, продуцируемого этим геном, и способность к связыванию с белком PI4KIIIα и т.д., который включает, без ограничения перечисленным, специфические к rbo/Efr3/Efr3a/Efr3b ингибирующие нуклеотиды, антитела против белка RBO/EFR3/EFR3A/EFR3B и материалы способные ингибировать образование комплексов белка RBO/EFR3/EFR3A/EFR3B и белка PI4KIIIα и т.п..
Используемый здесь термин "ингибитор ТТС7", относится к материалам, способным снижать, уменьшать или устранять экспрессию, транскрипцию, трансляцию гена ttc7, и/или стабильность белка ТТС7 продуцируемого этим геном, и способность к связыванию с белком RBO/EFR3/EFR3A/EFR3B и т.д.., который включает, без ограничения перечисленным, специфические к ttc7 ингибирующие нуклеотиды, антитела против белка ТТС7, и/или материалы способные ингибировать взаимодействие между белком ТТС7 и мембранным белком RBO/EFR3/EFR3A/EFR3B и т.п..
Так же как и приведенный выше, используемый здесь термин "ингибитор PI4P", относится к материалам, способным снижать, уменьшать или устранять количественный уровень PI4P на клеточной мембране, который включает, без ограничения перечисленным, антитела против PI4P, и слитый белок OSH2-PH2X или слитый белок OSH2-2x-PH, который способен специфически связываться с PI4P.
Используемый здесь термин "антитело", относится к любому иммноглобулину или целой молекуле и ее фрагментам, которые связываются со специфическим эпитопом. Указанное антитело включает, без ограничения перечисленным, поликлональные антитела, моноклональные антитела, химерные антитела, гуманизированные антитела, одноцепочечные антитела и фрагменты и/или части интактных антител, до тех пор, пока такие фрагменты или части сохраняют антигенсвязывающую способность исходного антитела. В изобретении, например, "антитело против PI4KIIIα" относится к моноклональным антителам, поликлональным антителам, одноцепочечным антителам и активным иммунологическим фрагментам или их частям, которые способны специфически связываться с белком PI4KIIIα, или его функциональными вариантами или функциональными фрагментами. В изобретении термины такие как "антитело PI4KIIIα", "антитело против PI4KIIIα" и "анти-PI4KIIIα антитело" используют взаимозаменяемо.
В изобретении, "функциональный вариант" относится к белку или полипептиду изобретения с одной или несколькими модификациями аминокислотных остатков в его аминокислотной последовательности. Модификация может быть "консервативной" модификацией (в которой замещенная аминокислота имеет сходную структуру или химическое свойство) или "неконсервативной" модификацией; сходная модификация также включает присоединение или делецию аминокислоты или и то и другое. Однако, ни модификация аминокислотного остатка, ни присоединение или делеция аминокислоты не могли бы по существу изменить или повредить биологическую или иммунологическую активность и функцию исходной аминокислотной последовательности. В изобретении, аналогично, "функциональный фрагмент" относится к любой части белка или полипептида по изобретению, которая сохраняет по существу сходную или идентичную биологическую или иммунологическую активность и функцию белка или полипептида, частью которого он является (исходного белка или полипептида).
Используемый здесь термин "ингибирующий нуклеотид", относится к нуклеотидным соединениям способным связываться с конкретным геном и ингибировать его экспрессию. Типичный ингибирующий нуклеотид включает, но без ограничения перечисленным, антисмысловые олигонуклеотиды, трехспиральные ДНК, РНК-аптамеры, рибозимы, малые интерферирующие РНК (siRNA), короткие шпилечные РНК (shRNA) и микроРНК. Эти нуклеотидные соединения связываются с указанными конкретными генами с более высоким сродством (аффинностью), чем другие нуклеотидные последовательности, с тем, чтобы ингибировать экспрессию определенных генов.
Используемый здесь термин "соединение, имеющее малую молекулу", относится к органическим соединениям с молекулярной массой менее 3 килодальтон, которые могут быть как природными, так и химически синтезированными. Используемый здесь термин "производное" относится к соединениям, полученным модификацией исходного органического соединения посредством одной или нескольких химических реакций, которые имеют сходные структуры с исходным органическим соединением и сходные эффекты в своих функциях. Используемый здесь термин "аналог" относится к соединениям, которые не были получены путем химической модификации исходного органического соединения, но являются сходными с исходным органическим соединением по структуре и имеют сходные эффекты в своих функциях.
Используемый здесь термин "болезнь Альцгеймера" (БА), относится к возрастному нейродегенеративному заболеванию, отличающемуся прогрессирующим нарушением обучения и памяти. Большинство пациентов с БА на средних и поздних стадиях имеют бета-амилоидные бляшки вне нейронов, внутриклеточные нейрофибриллярные клубки, образованные из тау-белка (Tau), или потерю синапса и нервных клеток. Болезнь может существовать у человека или у животных, таких как собаки.
Используемый здесь термин "Аβ", относится к серии полипептидов длиной 38-48 аминокислот, полученных расщеплением секретазой белка-предшественника амилоида (АРР), которые включают полипептиды Аβ38, Аβ40, Аβ42, Аβ44, Аβ45 и т.п., имеющие одинаковые аминокислотные последовательности. В настоящем изобретении Аβ также может быть получен расщеплением другим протеолитическим ферментом слитого белка Аβ, экспрессированного трансгенным методом, или заражения клеток вирусными векторами посредством конкретной экспрессирующей системы, например, Аβ через его N-конец может образовывать слитые белки с секреторным сигнальным пептидом, полученным из белков, кодируемых геном некроза Drosophila (аминокислотная последовательность: MASKVSILLLLTVHLLAAQTFAQDAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIA) (SEQ ID NO: 1), или секреторным сигнальным пептидом, полученным из пре-проэнкефалина крысы (аминокислотная последовательность: MAQFLRLCIWLLALGSCLLATVQA) (SEQ ID NO: 2) и т.п..
Используемый здесь термин "секреция Аβ", относится к способу выделения Аβ, образованного внутри клеток или на клеточных мембранах, через клеточную мембрану, который может уменьшать накопление внутриклеточного Аβ. Причем "секреция Аβ42" конкретно относится к способу выделения Аβ42, образованного внутри клеток или на клеточных мембранах, через клеточную мембрану, что может уменьшать накопление внутриклеточного Аβ42.
Используемый здесь термин "терапевтическая мишень", относится к различным материалам, которые могут быть использованы для лечения определенного заболевания и мишени материала в организме животных или человека. Эффекты лечения по указанному заболеванию можно получить при действии указанных материалов на указанную мишень. Указанными материалами могут быть различные материалы, такие как белки, полипептиды, нуклеиновые кислоты, соединения, имеющие малую молекулу, указанная мишень может быть веществом, таким как определенный ген (включающий специфическую последовательность гена), определенный белок (включающий специфический сайт белка), определенный белковый комплекс (включающий его специфический сайт свзывания), или определенные характеристики, определенные функции, определенная связь взаимодействия с периферическими веществами и окружением вышеупомянутых генов и/или белков, и т.д, до тех пор, пока указанные материалы могут влиять на ген, белок, белковый комплекс, или характерную, функциональную связь их взаимодействия с тем, чтобы лечить заболевание.
Используемые здесь термины "лечить", "леченный" или "лечение" относятся к обращению вспять, улучшению или замедлению прогрессирования заболевания, к которому применяется этот термин, или одному или нескольким симптомам заболевания. При использовании в данном документе, в зависимости от состояния пациента, этот термин также включает профилактику заболевания, которая включает в себя профилактику заболевания или появление любых связанным с ним симптомов, а также уменьшение выраженности симптомов или снижение тяжести любого состояния до его начала.
Термины «ингибировать», «ослаблять», «понижать», «удалять» и т.п., все относятся к снижению или уменьшению количества или степени. Такое снижение или уменьшение не ограничивается в той или иной мере, до тех пор, пока оно проявляет такую тенденцию. Например, уменьшение или снижение может составлять 100% относительно исходного количества или степени, или может составлять 50% или даже 1% или менее.
Данное изобретение раскрывает ряд действий, таких как понижающая регуляция (даун-регуляция) экспрессии белка RBO/EFR3/EFR3A/EFR3B, белка ТТС7 или белка PI4KIIIα, ослабление взаимодействия между белком RBO/EFR3/EFR3A/EFR3B, белком ТТС7 и белком PI4KIIIα, и ингибирование ферментативной активности PI4KIIIα может улучшить возрастные дисфункции, такие как дефицит синапсов и потеря нейронов, экспрессирующих Аβ42, и раскрывает, что эти эффекты достигаются за счет облегчения нейронной секреции Аβ (в частности, Аβ42) и уменьшения накопления Аβ (в частности, Аβ42) на клеточных мембранах нейронов или в клетках.
В данном изобретении, например, авторы изобретения обнаружили, что нокдаун гена Efr3a может снижать атрофию дендритов и шипов нейронов гиппокампа у трансгенных мышей APP/PS1, тогда как кормление через желудочный зонд фениларсиноксидом (РАО), общим ингибитором белка PI4KIIIα, может значительно улучшить обучение и память у мышей APP/PS1, и может уменьшить содержание свзанного с плазмалеммой Аβ42 (в частности Аβ42, в агрегатах/олигомерах Аβ42) в ткани головного мозга, хотя этот процесс может сопровождаться увеличением содержания Аβ42в цереброспинальной (спинномозговой) жидкости. Эти результаты продемонстрировали, что симптомы деменции у мышей APP/PS1 могут быть улучшены путем облегчения нейронной секреции Аβ42 и уменьшения накопления Аβ42 (в частности, агрегированного Аβ42) в нейронах или на нейронных мембранах.
Авторы изобретения обнаружили, что понижающая регуляция (даун-регуляция) экспрессии белка RBO/EFR3/EFR3A/EFR3B, белка ТТС7 или белка PI4KIIIα в клетках или нейронах, или предупреждение образования их белковых комплексов для уменьшения локализации белка PI4KIIIα на мембранах, или ингибирование фосфокиназной активности белка PI4KIIIα, может облегчать секрецию клеток и нейронов Аβ42, уменьшая накопление Аβ42 в нейронах, и уменьшать выраженность свзанной с БА нейродегенерации и нарушения функции нейронов; при этом, ни уровни экспрессии Аβ42 или АРР, ни активности α-, β- и γ-секретазы, которая расщепляет АРР, не были существенно нарушены. Кроме того, авторы изобретения также обнаружили, что PI4P, продукт белка PI4KIIIα, облегчает агрегацию мономеров Аβ42 в липосомах, тогда как такое облегчение намного сильнее, чем агрегация предшественника PI4P (PI) и его производного PI4,5Р.
Авторы изобретения полагают, что Аβ (в том числе Аβ42) образуются из плазмалеммы или внутриклеточных органелл; образованный таким образом Аβ может быть секретирован из клеток путем пассивного высвобождения, экзоцитоза, опосредованного лизосомами высвобождения или другими неисследованными путями. Несмотря на источник происхождения Аβ или как он секретируется, плазмалемма является последним путем, через который Аβ покидает клетку. Из-за гидрофобности Аβ, на плазмалемме Аβ встраивается в гидрофобную область цепочки жирных кислот с одной стороны, и взаимодействует с фосфатидилинозитолом (в частности, фосфорилированным фосфатидилинозитолом PI4P) и другим кислым фосфолипидом с другой стороны, такое взаимодействие облегчает изменения конформации Аβ из случайного клубка в β-структуру, и далее собирается в виде агрегата Аβ, который накапливается в виде отложений на мембранах или накапливается в клетках путем эндоцитоза. Кроме того, исследования показали, что аффинность растворимых агрегатов/олигомеров Аβ (в том числе Аβ42) с клеточной или липосомной мембраной является намного выше, чем аффинность мономера Аβ. Следовательно, агрегированный Аβ намного легче накапливается на клеточных мембранах.
PI4P является основным компонентом фосфорилированного фосфатидилинозитола плазмалеммы, который более сильно облегчает образование агрегатов/олигомеров Аβ, чем PI и PIP2. В даном изобретении, авторы обнаружили, что эффект облегчения PI4P на образование агрегатов/олигомеров Аβ42 в липосомах явно зависит от дозы. Понижающее регулирование (даун-регулирование) экспрессии белка RBO/EFR3/EFR3A/EFR3B, белка ТТС7 или белка PI4KIIIα, предотвращающее образование их белковых комплексов, или ингибирование киназной активности белка PI4KIIIα, может снижать продуцирование PI4P на клеточных мембранах. Следовательно, понижающее регулирование (даун-регулирование) экспрессии белка RBO/EFR3/EFR3A/EFR3B, белка ТТС7 или белка PI4KIIIα, или предотвращение образования прикрепленных к мембране белковых комплексов белка RBO/EFR3/EFR3A/EFR3B, белка ТТС7 и белка PI4KIIIα, или ингибирование соответствующей фосфокиназной активности белка PI4KIIIα, может по существу снизить количество фосфорилированного фосфатидилинозитола плазмалеммы (в частности, PI4P), с тем чтобы ослабить взаимодействие между Аβ плазмалеммы (в том числе Аβ42) и фосфорилированного фосфатидилинозитола, и привести к большему количеству плазмалеммного Аβ, существующему в виде мономера Аβ случайной формы. Как описано выше, такая случайная форма мономера Аβ имеет низкую аффинность с мембраной, таким образом мономер относительно легко высвобождается из мембраны и секретируется внеклеточно. Следовательно, вышесказанное поведение регуляции может эффективно снижать внутриклеточное накопление Аβ, не влияя на уровень экспрессии АРР или активность α-, β- и γ-секретазы, с тем, чтобы привести к очевидному увеличению уровня внеклеточного Аβ.
Предыдущие исследования показали, что накопление Аβ42 у Drosophila может активировать PI3K и связанный сигнальный путь PI3K/Akt, таким образом индуцируя связанный с БА дефицит синапсов и потерю долговременной памяти; соответственно, родственные исследования дали основания полагать, что ингибирование активности PI3K может быть способом лечения БА. Однако, в настоящем изобретении авторы обнаружили, что накопление внутриклеточного Аβ42 не вызвано активацией сигнального пути PI3K/Akt фосфатидилинозитолкиназ (в том числе PI3K), но более прямо вызвано фосфатидилинозитолом на фосфорилированных мембранах после активации фосфатидилинозитолкиназы в плазмалемме; кроме того, фосфатидилинозитолкиназа, участвующая в настоящем изобретении, представялет собой, главным образом, PI4KIIIα, а не PI3K в сигнальном пути PI3K/Akt. Например, авторы изобретения обнаружили, что с использованием ингибитора фосфатидилинозитолкиназы, высокоспецифичного к PI4KIIIα, но не чувствительного к PI3K, такого как РАО, секреция Аβ42 из клеток может быть эффективно облегчена низкой концентрацией ингибитора.
Таким образом, авторы изобретения обнаружили, что для обеспечения лечения БА можно принять способ облегчения секреции Аβ, конкретно секреции Аβ42, с тем, чтобы уменьшить накопление Аβ (в том числе Аβ42) в нейрональных клетках или на клеточных мембранах. Но повышенная секреция Аβ не может быть связана с повышающей регуляцией (up-регуляцией) АРР, или увеличенным продуцированием Аβ, вызванным изменением активностей α-, β- и γ-секретаз.
Специалисту в данной области техники понятно, что существуют различные пути облегчения секреции Аβ нейрональных клеток, в том числе ослабление связывания или взаимодействия между Аβ и сахаридами, липидами и белками плазмалеммы. В данном изобретении предпочтительным является облегчение секреции Аβ клеток путем снижения агрегации Аβ (в частности, Аβ42) на клеточных мембранах, как описано выше.
Кроме того, настоящее изобретение показывает, что регулируя количество белка RBO/EFR3/EFR3A/EFR3B, белка ТТС7 и белка PI4KIIIα и их способность образовывать комплексы, а также регулируя фосфокиназную активность белка PI4KIIIα, могут быть уменьшены образованные на клеточных мембранах агрегаты/олигомеры Аβ, с тем, чтобы облегчить секрецию Аβ (в частности, Аβ42) клеток, следовательно, эти белки и их взаимосвязи могут составлять потенциальные терапевтические мишени для лечения БА.
Таким образом, специалисту в данной области техники понятно, что ингибиторы или способы, способные ингибировать, понижать, уменьшать или устранять экспрессию, транскрипцию или трансляцию гена rbo/Efr3/Efr3a/Efr3b, и способные снижать стабильность белка RBO/EFR3/EFR3A/EFR3B, кодируемого этим геном, а также ингибиторы или способы, способные ингибировать образование его белковых кломплексов с белком фосфатидилинозитолкиназой PI4KIIIα и белком ТТС7, могут быть использованы для лечения БА. Указанные ингибиторы RBO/EFR3/EFR3A/EFR3B включают, без ограничения перечисленным, ингибирующий нуклеотид гена rbo/Efr3/Efr3a/Efr3b (включающие антисмысловую РНК, siRNA (пер., малые интерферирующие РНК), miRNA (пер., микроРНК) и т.п., антитела против белка RBO/EFR3/EFR3A/EFR3B и т.п..
Специалисту в данной области техники понятно, что ингибирующие нуклеотиды гена rbo/Efr3/Efr3a/Efr3b хорошо известны в данной области техники (например, см., www.genecards.org, и доступные продукты: ORIGENE, каталожный номер: SR308056 и каталожный номер: TR303768). Аналогично, антитела против белка RBO/EFR3/EFR3A/EFR3B хорошо известны в данной области техники (например, см., www.genecards.org, и доступные продукты: Novus, каталожный номер: NBP1-81539; Thermo Fisher Scientific, каталожный номер: РА5-24904).
Кроме того, как описано выше, регуляция клеточной экспрессии, транскрипции или трансляции гена PI4KIIIα/PI4KA, регуляция стабильности белка PI4KIIIα, кодируемого геном PI4KIIIα/PI4KA, регуляция способности белка PI4KIIIα к образованию комплексов с мембранным белком RBO/EFR3/EFR3A/EFR3B и белком ТТС7, и регуляция фосфокиназной активности белка PI4KIIIα, может рассматриваться в качестве способов лечения БА. Следовательно, специалисту с обычной квалификацией в данной области понятно, что ингибиторы или способы, способные ингибировать, понижать, уменьшать или устранять экспрессию, транскрипцию или трансляцию гена PI4KIIIα/PI4KA, или способные снижать стабильность белка PI4KIIIα, кодируемого этим геном, ингибирующие нуклеотиды включают без ограничения перечисленным, специфичне к гену PI4KIIIα/PI4KA, антитела к белку PI4KIIIα, и имеющие малую молекулу соединения-ингибиторы, способные ингибировать образование белкового комплекса белка PI4KIIIα с мембранными белками и способные ингибировать киназную активность, могут быть использованы для лечения БА. Предпочтительно, ингибитором является соединение, имеющее малую молекулу, например, РАО (фениларсиноксид), производные РАО, А1, G1, или аналоги А1 и G1. Более предпочтительно ингибитором является РАО или производные РАО.
Специалисту в данной области понятно, что РАО представляет собой соединение, имеющие малую молекулу, имеющее основную структуру, содержащую оксоарсиновую группу и фенильную группу, которое проявляет сильное ингибирующее действие на фосфокиназную активность белка PI4KIIIα. Химическая структура РАО представляет собой:

Фениларсиноксид (оксо(фенил)арсан)
Способ синтеза РАО хорошо известен специалистам в данной области техники. Согласно настоящему изобретению, соединения, которые могут быть применены в лечении БА, дополнительно включают производные РАО, поскольку соединение проявляет ингибирующее действие на фосфокиназную активность белка PI4KIIIα. Специалисту в данной области понятно, что способы синтеза таких производных хорошо известны в данной области техники.
Аналогично, специалисту в данной области техники понятно, что А1 и G1 оба являются, имеющими малую молекулу соединениями-ингибиторами белка PI4KIIIα и имеющими сходные структуры. Где химическая структура А1 представляет собой:

5-(2-амино-1-(4-(4-морфолинил)фенил)-1Н-бензимидазол-6-ил)-N-(2-фторфенил)-2-метокси-3-пиридинсульфонамид
Химическая структура G1 представляет собой:

(aS)-5-(2-амино-4-оксо-3-(2-(трифторметил)фенил)-3,4-дигидрохиназолин-6-ил)-N-(2,4-дифторфенил)-2-метоксипиридин-3-сульфонамид.
Способы синтеза А1 и G1 хорошо известны в данной области техники (например, см., Bojjireddy, N., et al. (2014), JBC 289:6120-6132; Leivers, A.L., et al. (2014), JMC 57:2091-2106). Согласно настоящему изобретению, структурные аналоги А1 и G1 могут быть применены для лечения БА, поскольку они проявляют ингибирующее действие на фосфокиназную активность белка PI4KIIIα. Специалистам в данной области понятно, что способы синтеза таких структурных аналогов хорошо известны в данной области техники.
Кроме того, образование мембранных комплексов белка PI4KIIIα и белка RBO/EFR3/EFR3A/EFR3B требует содействия каркасного белка ТТС7. Следовательно, согласно данному изобретению, специалисту с обычной квалификацией в данной области понятно, что ингибиторы или способы, способные ингибировать, понижать, уменьшать или устранять экспрессию, транскрипцию или трансляцию гена ttc7, и способные снижать стабильность белка ТТС7, кодируемого этим геном, а также ингибиторы или способы, способные ингибировать образование его белковых комплексов с белком RBO/EFR3/EFR3A/EFR3B и белком PI4KIIIα, могут быть применены для лечения БА. Указанные ингибиторы ТТС7 включают, без ограничения перечисленным, ингибирующие нуклеотиды гена ttc7 (включающие антисмысловую РНК, siRNA, miRNA и т.п.), антитела к белку ТТС7, и т.п.
Кроме того, согласно изобретению, понижающее регулирование (даун-регулирование) экспрессии белка RBO/EFR3/EFR3A/EFR3B и белка PI4KIIIα, или предотвращение образования их белковых комплексов для уменьшения распространения белка PI4KIIIα на мембранах, или ингибирование фосфокиназной активности белка PI4KIIIα, по существу приводит к уменьшению плазмалеммного PI4P и дополнительно облегчает секрецию Аβ клеток. Следовательно, специалисту с обычной квалификацией в данной области понятно, что любой ингибитор или способ, способный уменьшить количество или уровень плазмалемного PI4P, и дополнительно уменьшить образование агрегатов/олигомеров Аβ на клеточных мембранах, может достичь эффекта лечения БА, как описано выше.
Специалисту в данной области понятно, что вышесказанные ингибиторы PI4P могут быть антителами или другими молекулами, которые специфически связываются с PI4P. В настоящее время методы синтеза антител против PI4P хорошо известны в данной области техники (см., Brown BK and Karasavass N, et al., 2007, J virol; Wassef NM and Roerdink F, et al. 1984, Mol Immunol). Например, это может быть имеющее человеческое происхождение антитело с широким нейтрализующим действием 4Е10, и другие антитела против PI4P. В настоящее время методы синтеза молекул, специфически связывающихся с PI4P, хорошо известны в данной области техники (см., Balla A and Kim YJ, et al., 2008, Mol Biol Cell; Zubenko GS and Stiffler et al., 1999, Biol Psychiary). Например, это может быть слитый белок OSH2-PH2X, или слитый белок OSH2-2x-PH.
Вышеупомянутые материалы, обеспечиваемые настоящим изобретением, которые могут быть применены для лечения БА или имеющие потенциал для лечения БА (далее в совокупности называемые «материалами изобретения»), включая, без ограничения перечисленным, антитела против RBO/EFR3/EFR3A/EFR3B, антитела против PI4KIIIα, антитела против ТТС7, антитела против PI4P, ингибирующие полипептиды специфические к гену rbo/Efr3/Efr3a/Efr3b, ингибирующие полипептиды специфические к гену PI4KIIIα/PI4KA, и соединения с малой молекулярной массой, ингибирующие фосфокиназную активность белка PI4KIIIα, и т.д., могут быть выделены, очищены, синтезированы и/или рекомбинированы.
Кроме того, материалы по изобретению также могут быть приготовлены в виде композиции, такой как фармацевтическая композиция. В этом отношении, изобретение обеспечивает фармацевтическую композицию, содержащую любые вышесказанные антитела, ингибирующие полипептиды и/или соединения со сравнительно малой молекулярной массой (пер., малые молекулы) и фармацевтически приемлемый носитель.
Фармацевтическая композиция по изобретению, содержащая любой из материалов изобретения, может содержать более одного материала изобретения, например, антитело и соединение с малой молекулярной массой, ингибирующий полипептид и антитело, или два или несколько антител, или соединений с малой молекулярной массой. Альтернативно, фармацевтическая композиция может также содержать материал по изобретению в комбинации с другим фармацевтически активным агентом или лекарственным средством. Например, фармацевтическая композиция может содержать лекарственное средство, которое представляет собой антитело против Аβ, такое как Бапинейзумаб (Bapineuzumab), или соединение, которое связывается с Аβ или β-амилоидными бляшками вне нейронов в головном мозге для блокирования агрегации Аβ или для облегчения распада агрегатов Аβ, такое как сульфатированный олигосахарид морского происхождения HSH971 и его аналоги, акампросат (трамипросат) и его аналоги, и Эдаравон и его аналоги. Таким образом, фармацевтическая композиция облегчает секрецию Аβ из нейронов с одной стороны, и с другой стороны облегчает удаление Аβ снаружи нейронов, посредством чего достигается лучший терапевтический эффект при лечении БА.
В другом аспекте настоящее изобретение обеспечивает способ скрининга новых лекарственных средств или терапевтических мишеней для лечения БА. Способ разработан на основе вышесказанных открытий данного изобретения, то есть, внутриклеточное накопление Аβ42 может быть уменьшено путем облегчения секреции Аβ42, с тем, чтобы улучшить и предотвратить ассоциированную с БА нейродегенерацию и дисфункцию. Таким образом, критерием для скрининга лекарственных средств или терапевтических мишеней является эффект облегчения секреции Аβ (конкретно секреции Аβ42) после введения лекарственного средства или регулирования терапевтической мишени, тогда как повышенная секреция Аβ не может быть связана с повышающей регуляцией (up-регуляцией) АРР или повышенным продуцированием Аβ, вызванным изменением активности α-, β- и γ-секретаз.
В соответствии с настоящим изобретением, регулирование терапевтической мишени относится к применению релевантных материалов для воздействия на терапевтическую мишень либо прямо, либо косвенно, с тем, чтобы изменить функцию, свойство или взаимосвязь с периферическим окружением терапевтической мишени, тем самым, вызывая или индуцируя облегчение секреции Аβ (конкретно секреции Аβ42) клеток.
Специалисту с обычной квалификацией в данной области понятно, что для того, чтобы выбрать эффективное лекарственное средство для лечения болезни Альцгеймера, клеточные линии для скрининг-теста могут быть эукариотическими клеточными линиями млекопитающих, насекомых и т.п., например, HEK293, COS7, N2a, SH-SY5Y, S2, sf9 и т.п. Способ включает в себя тестирование, может ли кандидат в лекарственное средство снижать накопление Аβ, конкретно накопление Аβ42, на клеточной мембране или в клетках, с тем, чтобы выбрать эффективные лекарственные средства для лечения болезни Альцгеймера. Предпочтительно, тест на повышение секреции Аβ может быть выполнен на клеточных линиях, сверхэкспрессирующих АРР (например, клеточных линиях HEK293, COS7, N2a, SH-SY5Y, стабильно трансфицированных АРР, имеющим человеческое происхождение) или на модели Drosophila, предпочтительно тканях личинок третьего возраста Drosophila. Увеличивается ли секреция Аβ может быть обнаружено методами иммунологического анализа, включая иммуноферментный твердофазный анализ (ELISA) или электрохемилюминесцентный иммуноанализ (ECLIA).
Предпочтительно, способ скрининга лекарственных средств или терапевтических мишеней для лечения БА может включать: наблюдение эффекта от изобретения кандидата в лекарственное средство или таргетной (целевой) регуляции на ферментативную активность PI4KIIIα, если изобретение кандидата в лекарственное средство или целевая регуляция отрицательно влияют на функцию киназы PI4KIIIα в системе обнаружения, т.е., отличающейся снижением киназной активности PI4KIIIα или уровня PI4P в плазмалемме, тогда это указывает на то, что лекарственное средство-кандидат, агент или мишень является потенциальным лекарственным средством или терапевтической мишенью для лечения БА. После такого скрининга дополнительно обнаруживается, уменьшается ли накопление внутриклеточного Аβ (конкретно Аβ42) и облегчается ли секреция Аβ во внеклеточное пространство. С помощью этих методов, эффективность скрининга кандидатов может быть значительно улучшена.
Согласно одному конкретному варианту осуществления данного изобретения способ скрининга лекарственных средств или терапевтических мишеней для лечения БА может включать в себя: определение на основе прямого анализа перераспределяют ли лекарственное средство-кандидат или регуляция мишени терапевтического воздействия по изобретению белок PI4KIII плазмалеммы в эндохилему, с тем, чтобы уменьшить количество белка PI4KIII на мембране и индуцировать снижение агрегации/олигомеризации плазмалеммного мономера Аβ, а также увеличить секрецию во внеклеточное пространство. Предпочтительно, флуоресцентно-меченный PI4KIIIα может быть выбран для изучения, такой как PI4KIIIα, меченный флуоресцентным белком (GFP-PI4KIIIα), и наблюдения переносится ли флуоресцентно-меченный PI4KIIIα из плазмалеммы в эндохилему.
В соответствии с одним конкретным вариантом осуществления данного изобретения способ скрининга лекарственных средств или мишеней терапевтического воздействия для лечения БА также может быть проведен методами, такими как метод коиммунопреципитации, в котором анализируют взаимодействия между белками. Если лекарственное средство-кандидат или регуляция мишени терапевтического воздействия данного изобретения уменьшают взаимодействие между белком RBO/EFR3/EFR3A/EFR3B, белком ТТС7 и белком PI4KIIIα, то это указывает на то, что лекарственное средство или мишень терапевтического воздействия способны ослабить способность белка PI4KIIIα в образовании мембранных белковых комплексов, с тем, чтобы ослабить агрегацию Аβ-мономера плазмалеммы, а также увеличить секрецию во внеклеточное пространство.
В соответствии с одним конкретным вариантом осуществления настоящего изобретения, способ скрининга лекарственных средств или терапевтических мишеней для лечения БА также может быть выполнен прямым анализом, снижает ли лекарственное средство-кандидат или регуляция терапевтической мишени данного изобретения уровень плазмалеммного PI4P. Предпочтительно, флуоресцентный микроскоп, конфокальный микроскоп или двухфотонный микроскоп могут быть использованы для наблюдения за тем, уменьшается ли количество флуорсцентно-меченных молекул, которые специфически связываются с PI4P, такими как OSH2-PH2X или слитый белок, меченный флуоресцентным белком OSH2-2x-PH, в плазмалемме или переносится из плазмалеммы в эндохилему.
Настоящее изобретение будет дополнительно подробно проиллюстрировано ниже. Однако способы осуществления данного изобретения не ограничиваются следующими примерами.
Ниже в документе, данные получают преимущественно посредством экспериментов с животными и клеточной культурой и анализируют с использованием программного обеспечения SPSS. Если не указано иное, данные представлены в виде среднего значения и стандартной ошибки среднего mean ± sem. Р<0,05 указывает на то, что разница является статистически значимой. Все данные, приведенные здесь и ниже, представляют в виде среднего значения ± sem. "*", "**" и "***" каждое означает, что р<0,05, 0,01 и 0,001, соответственно.
Пример 1: Линии Drosophila и генетические методы
Стандартная культуральная среда, чередующийся цикл 12-часовой световой и 12-часовой темновой, культивирование при постоянной температуре 25°С.
Следующие трансгенные линии Drosophila использовали в данном изобретении: rboS358A, [UAS]Aβarc, [UAS]Aβ42, [UAS]dtau, [UAS]mCD8-gfp (предоставленные Dr. Z. Wang), [UAS]shibirets1 (предоставленную Dr. A Guo), [Gal4]A307 (предоставленную Dr.

Предварительное исследование авторов изобретения обнаружило, что мухи (Drosophila), экспрессирующие Аβ42 дикого типа или арктического мутанта (arctic mutant) (Аβ42 или Аβarc мух или Drosophila) в нейронах пути GF обнаруживают накопление Аβ42внутри нейронов, возрастное нарушение синаптической передачи, и преждевременную смерть. Такие мухи также проявляют возрастное снижение способности преодолевать подъем. Для изучения роли гена rbo при дефиците нейронов, обусловленном накоплением Аβ42 внутри нейронов, две мутации гена rbo, миссенс-мутацию (rbots1) и нокдаун-мутацию (rbo2), вводили у мух Аβarc, и соответственно были протестированы эффекты на синаптическую передачу, способность преодолевать подъем и возраст. Было сконструировано четыре группы мух: контрольные группы (контроль, ctrl), гетерозиготы rbots1/+ или rbo2/+ (rbo), мухи Аβarc (Аβarc) и мухи Аβarc с гетерозиготной мутацией rbots1/+ или rbo2/+ (Аβarc-rbo). Каждая группа содержит 1-2 линии, в которой, "ctrl" обозначает мух дикого типа контроля, имеющих трансген [Gal4]A307; "rbots1/+" и "rbo2/+" обозначает rbots1/+ и rbo2/+ гетерозиготных мух, имеющих одну копию трансгена [Gal4]A307; "Аβarc" обозначает [Gal4]A307/[UAS]Aβarc двойных трансгенных мух; "Aβarc-rbots1/+" и "Аβarc-rbo2/+" каждый обозначает [Gal4]A307-rbots1/[UAS]Aβarc и [Gal4]A307-rbo2/[UAS]Aβarc, соответственно. Первые две группы мух не экспрессировали Аβarc и были классифицированы как "мухи non-Аβ", тогда как последние две группы мух экспрессируют Аβarc и были классифицированы как "мухи Аβ".
Пример 2: Мутация гена rbo специфически подавляет дефицит нейронов у экспрессирующих Аβ42 Drosophila, протестированных исследованием синаптической передачи
Метод исследования синаптической передачи:
Регистрация разности потенциалов при возбуждении (EJPs) в системе гигантских волокон (GF) внутриклеточно. Взрослую самку мухи в определенный день жизни водружали вентральной стороной вниз на предметные стекла с легкоплавким воском tackiwax (Boekel Scientific) под препаровальной лупой. Система регистрации включает в себя один ссылочный электрод в брюшке, два стимулирующих электрода встраивали в два глаза, и один регистрирующий электрод встраивали в клетку продольной дорсальной мышцы. Оба глаза подвергали электростимуляции (100 Гц, 50 импульсов). Интенсивность стимуляции составляет 5-20 вольт с длительностью 0,2 мс, приблизительно 150% от пороговой интенсивности стимуляции. Электрические сигналы регистрировались и амплифицировались с использованием Axonal clamp 900А (Molecular Devices), и были оцифрованы на частоте 10 кГц посредством Digidata 1440А (Molecular Devices). Данные регистрировались и анализировались с использованием программного обеспечения pClamp software (версия 10.0; Molecular Devices). Все электроды являются стеклянными электродами, заполненными раствором 3М KCl. Температура окружающей среды во время регистрации составляла 25°С.
На фиг. 1 показаны зарегистрированные репрезентативные данные головного мозга, стимулированного EJP в различные дни жизни четырех групп мух (фиг. 1а) и количественный анализ успешных случаев, вызванных EJPs (фиг. 1b). Особенно отмечают, что мутация rbo значимо ингибировала возрастное нейронное нарушение синаптической передачи, вызванное Аβarc. Статистический анализ данных выполняли с использованием однофакторного дисперсионного анализа ANOVA на 3-7-й, 15-17-й и 25-27-й день (n=6~12), и 31-35-й день (n=10~23).
Согласно описанному выше методу исследования синаптической передачи, внутриклеточную регистрацию EJPs в дорсальных продольных мышечных волокнах при высокочастотной электрической стимуляции (100 Гц, 50 импульсов) выполняли на 3-7-й, 15-17-й, 25-27-й и 31-35-й дни после вылупления. Доля успешных случаев EJPs, вызванная высокочастотной электрической стимуляцией в первой группе не была значимо дифференцируемой от доли успешных случаев EJPs остальных трех групп на 3-7-й и 15-17-й дни (фиг. 1а-1b). На 25-27-й и 31-35-й дни, доля успешных случаев EJPs у мух Аβarc-rbo стала ниже, чем доля успешных случаев EJPs у контрольных мух и мух rbo, но была значимо выше, чем доля успешных случаев EJPs у мух Аβarc (фиг. 1а-1b).
Эти результаты демонстрируют, что мутация гена rbo улучшает возрастное нейронное нарушение синаптической передачи, вызванное накоплением Аβarc внутри нейронов. Маловероятно, что разница в генетическом фоне способствовала улучшению, поскольку генетический фон трансгенных мух и мутантов rbo, используемых для создания четырех групп мух, был подвергнут возвратному скрещиванию с дикой изогенной линией (изогенная w1118) на протяжении более 5-ти поколений перед использованием, таким образом, генетический фон является по существу очищенным. Поскольку полный нокдаун гена rbo вызывает эмбриональную смертность, его эффект на нарушение синаптической передачи, индуцированное Аβarc, не может быть исследовано.
Пример 3: Мутация rbo специфически подавляет дефицит нейронов у экспрессирующих Аβ42 мух, протестированных на способность преодолевать подъем в пробирке
Тест на способность преодолевать подъем в пробирке:
Способность преодолевать подъем исследовали измерением средней высоты подъема 10 мух через семь секунд со дна вертикально расположенных пробирок для тестирования. Было разработано устройство для тестирования с высокой воспроизводимостью способности к подъему у плодовой мушки. Устройство включает в себя: 1) прямоугольную металлическую раму (шириной 32 см, высотой 21 см), внутри которой вертикально установлены 10 прозрачных пластиковых пробирок; 2) электрический двигатель для управления перемещением металлической рамы в вертикальном направлении; 3) шаговый привод для управления электрическим двигателем в рабочем цикле быстрого перемещения металлической рамы вверх и вниз четыре раза на заданную высоту с интервалом в 1 минуту; 4) видеокамера для видеосъемки процесса восхождения; 5) аналитическое программное обеспечение для анализа положения при подъеме мух в определенное время видеоизображения. В экспериментах 10 мух определенного генотипа переносили в каждую прозрачную пластиковую пробирку. Пробирки были равномерно распределены и смонтированы в металлической коробке. Металлическая коробка может скользить вертикально вдоль двух металлических стержней, которые были установлены вертикально на основании. В тесте на способность преодолевать подъем шаговый привод управляет электродвигателем для подъема металлического ящика на 5,8 см, а затем высвобождается, так что металлическая коробка падает в исходное положение под действием силы тяжести. При остановке металлической коробки, мухи падали на дно пробирок. После того, как металлическая коробка была перемещена вверх и вниз 4 раза за 3 секунды, все мухи находились на дне пробирок. Затем мухам позволяли подниматься по стенке пробирок. Процессы полностью были сняты на видео для последующего анализа. Авторы изобретения разработали компьютерную программу для измерения высоты подъема мухи в любой момент времени после начала подъема в пробирке.
На фиг. 1с, мутация гена rbo улучшала возрастную способность преодолевать подъем у мух, экспрессирующих Аβarc, выполняли однофакторный дисперсионный анализ ANOVA, n=3 (3 группы мух, 10 мух в каждой группе).
Способность преодолевать подъем исследовали на 3-й, 16-й, 26-й и 31-й день после вылупления. На 3-й и 16-й день, способность преодолевать подъем у мух в четырех группах были сходными (фиг. 1с). На 26-й и 31-й день, мухи Aβarc-rbo поднимались значимо выше, чем мухи Аβarc, хотя не так высоко, как контрольные мухи rbo (фиг. 1с).
Пример 4: Мутация гена rbo специфически подавляет дефицит нейронов у мух, экспрессирующих Аβ42, протестированных в анализе на продолжительность жизни
Анализ продолжительности жизни:
100 или 200 мух каждого генотипа были поровну разделены на 5 или 10 пробирок, содержащих стандартный корм для мух и сухие дрожжи, и культивировали при 25°С. Мух переносили в пробирки со свежим кормом и сухими дрожжами каждые 3 дня, и при каждом переносе подсчитывали мертвых мух. Уровни выживания анализировали с помощью программного обеспечения SPSS 11 Kaplan-Meier.
На фиг. 1d мутация гена rbo продлевала продолжительность жизни мух, экспрессирующих Аβarc. n=200 мух для каждой группы, р<0,001, логарифмический ранговый критерий.
На фиг. 7 показаны зарегистрированные репрезентативные данные стимуляции мозга EJP в различные дни жизни на трех группах мух (фиг. 7а) и количественный анализ успешных случаев, вызванных EJPs (фиг. 7b). "ctrl" обозначает контрольных мух дикого типа, имеющих трансген [Gal4]A307; "Аβ42" обозначает [Gal4]A307/[UAS]Aβ42 двойных трансгенных мух; "Aβ42-rbots1/+" и "Аβ42-rbo2/+" каждый обозначает [Gal4]A307-rbots1/[UAS]Aβ42 и [Gal4]A307-rbo2/[UAS]Aβ42, соответственно. Авторы изобретения отмечают, что мутация rbo значимо ингибировала возрастное нейронное нарушение синаптической передачи, вызываемое Аβ42. n=6~12 для данных на 3-5-й день, и n=10~12 для данных на 37-39-й день, однофакторный дисперсионный анализ ANOVA.
На фиг. 7с, мутация гена rbo улучшала возрастную способность преодолевать подъем у мух, экспрессирующих Аβ42, был выполнен однофакторный дисперсионный анализ ANOVA, n=3.
На фиг. 7d, мутация гена rbo продлевала продолжительность жизни мух, экспрессирующих Аβ42. n=200 мух для каждой группы, р<0,001, логранговый критерий.
Анализ продолжительности жизни мух показал, что продолжительность жизни у мух Aβarc-rbo была длиннее, чем продолжительность жизни у мух Аβarc, хотя короче, чем продолжительность жизни у контрольных и rbo мух (фиг. 1d); такое же самое заключение можно получить, сравнивая среднюю продолжительность мух в четырех группах (таблица 1). Эти результаты совместимы с результатами исследования синаптической передачи. Были проведены дополнительные исследования влияния мутации гена rbo на синаптическую передачу, способность преодолевать подъем и продолжительность жизни у мух, экспрессирующих Аβ42 дикого типа, и мутация проявила еще большее улучшение (фиг. 7a-d).

На фиг. 8а показан эффект мутации гена rbo на двигательное нарушение (слева) и преждевременную смерть, индуцированную сверхэкспрессией белка Tau Drosophila в пути гигантских волокон Drosophila. На фиг. 8b показан эффект мутации гена shibire на двигательное нарушение (слева) и преждевременную смерть, индуцированную сверхэкспрессией Аβarc в пути гигантских волокон Drosophila. В анализе продолжительности жизни, n=100 мух на каждую группу, логранговый критерий.
Влияние мутации гена rbo на токсичность Аβ42 не могло быть приписано общему эффекту на накопление внутри нейронов токсичных белков, поскольку мутация гена rbo не могла улучшить сокращение продолжительности жизни мух, сверхэкспрессирующих белок tau (фиг. 8а). Влияние мутации гена rbo на токсичность Аβ42 не могло быть приписано общему эффекту, потенциально основанному на синаптических или эндоцитозных функциях, потому что введение генной мутации shibire (shibirets1) в мух Аβarc, не могло ослабить преждевременную смерть мух Аβarc (фиг. 8b). Так же как генная мутация rbots1, генная мутация shibirets1 также индуцировала эффекты на зависящую от температуры синаптическую передачу, суммарный эндоцитоз и двигательную способность.
В примерах 1-4, результаты показали, что мутация гена rbo или недостаточность могут специфически подавлять дефицит нейронов у мух дикого типа и мутантных мух, экспрессирующих Аβ42.
Пример 5: Дефицит или ингибирование фермента PI4KIIIα, который взаимодействует с белком RBO, улучшает дефицит нейронов у мух Аβarc, протестированных методом иммунопреципитации
Иммунопреципитация и иммуноблот:
Общее количество 300 головок мух собирали и гомогенизировали измельчением в 500 мкл предварительно охлажденного Tris-буфера. Композиция Tris-буфера содержит: 50 мМ Tris, 50 мМ KCl, 1 мМ ЭДТА, 1% смесь ингибиторов протеаз (Calbiochem), и рН доводили до 7,4. Гомогенат ткани центрифугировали при 10000 g в течение 10 мин. Супернатант собирали и подвергали тесту иммунопреципитации или иммуноблоттинга с приблизительно 1 мкг мышиного моноклонального антитела против RBO или кроличьего поликлонального антитела против PI4KIIIα Drosophila. Два антитела получали в сотрудничестве с Abmart (Shanghai) или с Abgent (China), соответственно. Антитело RBO получали с использованием с 251-й по 500-ю аминокислоту белка RBO Drosophila подтипа С; антитело PI4KIIIα получали с использованием пептида NH2-KRSNRSKRLQYQKDSYC-CONH2 (SEQ ID NO: 3). В тестах- иммуноблота, антитела против RBO и PI4KIIIα Drosophila разводили 1:2000. Гомогенаты тканей головок мух дикого типа и соответствующих гомозиготных мутантов использовали для обнаружения антител против RBO и PI4KIIIα Drosophila, соответственно.
На фиг. 9а, мутация гена rboS358A не улучшала продолжительность жизни мух, экспрессирующих Аβarc (Р=0,07).
Хотя RBO может быть предполагаемой диацилглицерол-липазой (DAG-липазой), и активность DAG-липазы, как стало известно, была повышена в гиппокампе пациентов с БА и на животных моделях, белок RBO не мог регулировать токсичность Аβarc, действуя в качестве DAG-липазы, поскольку введение трансгена rboS358A мухам Аβarc не могло изменить преждевременную смерть (фиг. 9а). В белке RBO, кодируемом геном rboS358A, предполагаемый активный центр фермента был мутирован.
На фиг. 1е показан репрезентативный иммуноблот ко-иммунопреципитации белка RBO и белка PI4KIIIα, n=3.
На фиг. 1f показан репрезентативный иммуноблот-анализ (слева) и полуколичественный анализ (справа) уровней белка RBO и белка PI4KIIIα у контрольных мух дикого типа и гетерозиготных rbo, n=7, однофакторный дисперсионный анализ ANOVA.
На фиг. 1g показан репрезентативный иммуноблот-анализ (слева) и полуколичественный анализ (справа) PI4KIIIα, ко-иммунопреципитированного с белком RBO дикого типа (wtRBO) и мутантным белком RBO (mRBO), n=4, t-критерий.
На фиг. 1h показан количественный анализ RT-PCR (пер., ПЦР с обратной транскрипцией (ОТ-ПЦР) уровней экспрессии mRNA PI4KIIIα мух Аβarc, Aβarc-rbots1/+ и Аβarc-rbo2/+, n=5-6, однофакторный дисперсионный анализ ANOVA.
Дрожжевые и мышиные гомологи RBO вовлекают PI4KIIIα и образуют с ней комплекс на клеточной мембране. В соответствии с этим, белок RBO специфически ко-иммунопреципитировал с PI4KIIIα Drosophila (фиг. 1е). Кроме того, удаление одной копии гена rbo (rbo2/+) у Drosophila Аβarc-rbo может значимо понизить уровни экспрессии белка RBO и белка PI4KIIIα (фиг. 1f), тогда как мутация гена rbots1/+ значимо не понижала уровни экспрессии белка RBO и белка PI4KIIIα, но значимо ослабляла взаимодействие между белком RBO и белком PI4KIIIα (фиг. 1g). Примечательно, что ни одна из двух мутаций rbo не изменила транскрипцию гена PI4KIIIα (фиг. 1h).
Чтобы проверить, играет ли PI4KIIIα ту же роль, что и белок RBO в дефиците нейронов мух Аβarc, нехватку хромосомы (делецию PI4KIIIα-содержащего сегмента ДНК хромосомы, pi4kdef/+) и нонсенс-мутацию PI4KIIIα (PI4KIIIαGS27/+) отдельно вводили мухам, экспрессирующим Аβarc.
На фиг. 2 показано, что синаптическая передача, двигательная функция и преждевременная смерть были подавлены гетерозиготной делецией гена PI4KIIIα (PI4KIIIαdef/+) (см. фиг. 2а) или нонсен-мутацией (PI4KIIIαGS27/+) (см. фиг. 2b), а также были подавлены РАО (фиг. 2с-е). "ctrl" обозначает контрольных мух дикого типа, имеющих трансген [Gal4]A307; "PI4KIIIαdef/+" и "PI4KIIIαGS27/+" обозначает гетерозиготных мух PI4KIIIαdef/+ и PI4KIIIαGS27/+ имеющих одну копию трансгена [Gal4]A307; "Аβarc" обозначает двойных трансгенных мух [Gal4]A307/[UAS]Aβarc; "Aβarc-PI4KIIIαdef/+" и "Aβarc-PI4KIIIαGS27/+" каждый обозначает PI4KIIIαdef/+; [Gal4]A307/[UAS]Aβarc и PI4KIIIαGS27/+; [Gal4]A307/[UAS]Aβarc, соответственно. Для регистрации данных EJP в каждой группе, n=6~10. Для каждого анализа способности преодолевать подъем, n=3~5. Для данных о продолжительности жизни каждой линии мух, n=100~200, значение Р менее чем 0,001. Методы статистического анализа описаны выше.
Фактически, экспериментальные результаты показали, что такие мутации PI4KIIIα подавляли индуцированные Аβarc дефекты в синаптической передаче, двигательной функции и продолжительности жизни (фиг 2а-b). Соответственно, кормление мух Аβarc РАО, ингибитором PI4KIIIα, также значимо улучшало эти дефекты в зависимости от дозы (фиг. 2с-е).
На фиг. 9b, мутация гена itprSV35 не улучшала синаптическую передачу или продолжительность жизни мух, экспрессирующих Аβarc (Р=0,13). В анализе на продолжительность жизни, n=100 мух на каждую группу, логранговый критерий. В анализе успешных случаев, вызванных EJP, n=5.
Однако, подавление дефицита нейронов понижающей регуляцией (даун-регуляцией) RBO/PI4KIIIα не может относиться к эффекту токсичности, вызванному ослаблением высвобождения кальция, опосредованного фосфолипазой С, PI4,5Р и рецептором инозитолтрифосфата (IP3R), поскольку введение нонсенс-мутации гена, кодирующего IP3R, мухам, экспрессирующим Аβarc, не могло ослабить синаптическую недостаточность или преждевременную смерть (фиг. 9b-с).
Пример 6: Понижающая регуляция (даун-регуляция) RBO/PI4KIIIα уменьшает накопление внутриклеточного Аβ42, которое детектируется окрашиванием и получением изображений
Окрашивание и получение изображений:
Центральная нервная система Drosophila была окрашена следующим образом. Вся центральная нервная система (ЦНС) мух, включая головной мозг и брюшной ганглий, рассекали в холодном фосфатно-солевом буферном растворов (PBS) и фиксировали 4% параформальдегидом (PFA) в PBS в течение приблизительно 45 мин. Препараты промывали PBS в течение 30 мин, обрабатывали муравьиной кислотой (70% в воде) в течение 45 мин для повторной экспозиции антигенной детерминанты, промывали повторно 5% BSA в растворе PBS, дополненном 0,25% Triton, инкубировали с первичным антителом (6Е10, разведение 1:100) при 4°С в течение 10-12 часов, снова промывали PBS и, наконец, инкубировали с су3-конъюгированным вторичным антителом (Jackson ImmunoResearch Laboratories, разведение 1:200) при комнатной температуре в течение 2 часов. Изображения были сделаны в конфокальном микроскопе Nikon A1R-A1; генотипы ЦНС мух были слепыми для персонала, получающего изображения.
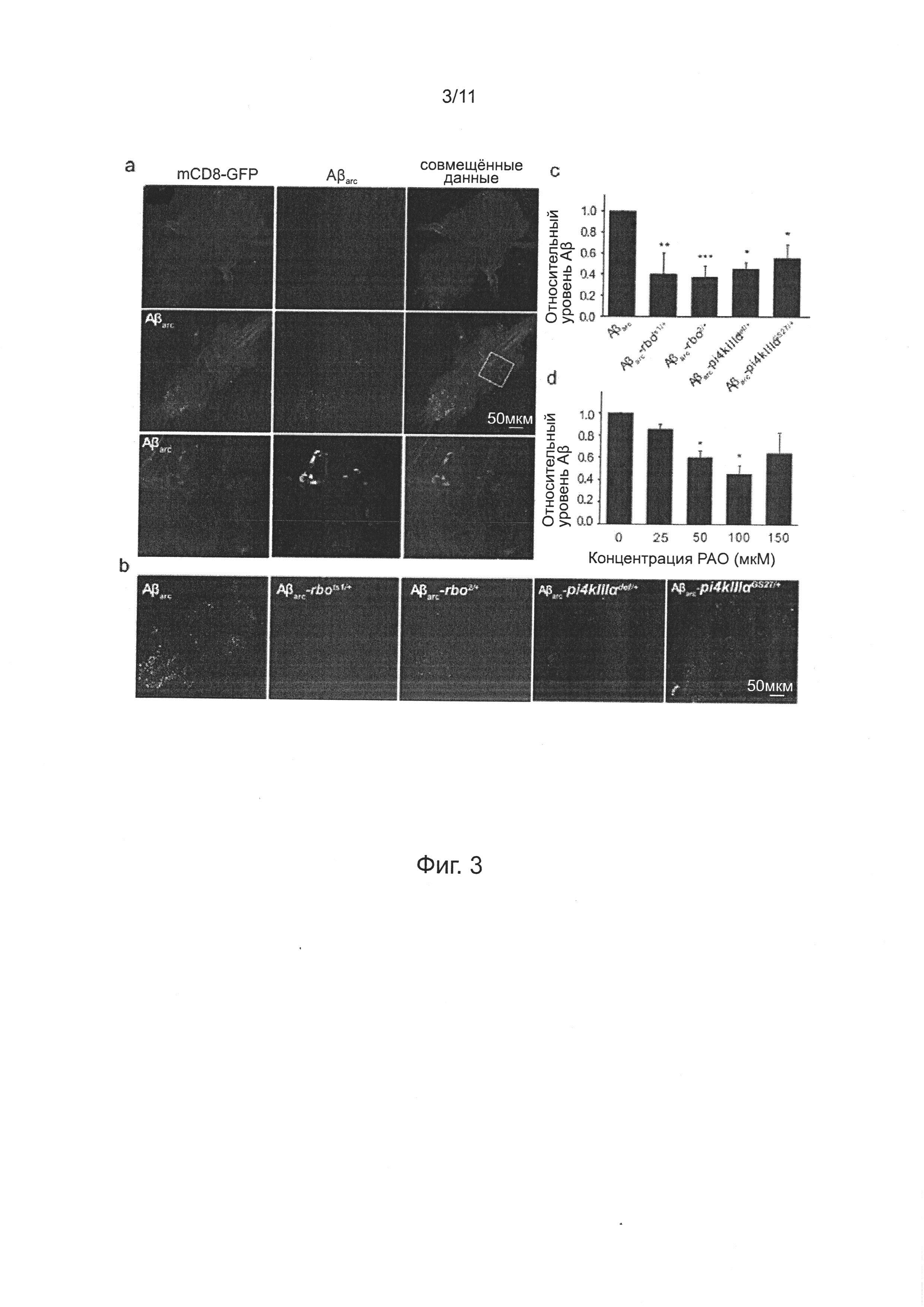
На фиг. 3а показаны изображения конфокальной микроскопии окрашивания Aβ в тотальных препаратах брюшного ганглия контрольных мух, экспрессирующих mCD8-GFP (верхний ряд) и мух, экспрессирующих Аβarc (средний ряд) 21-25-дневного возраста; экспрессия mCD8-GFP и Аβarc обе управлялись [Gal4]A307. Каждую группу окрашивания повторяли дважды; нижний ряд представляет собой увеличенное изображение области, обозначенной квадратом в среднем ряду. На фиг. 3b показаны репрезентативные изображения конфокальной микроскопии окрашивания Аβ в тотальных препаратах брюшного ганглия мух Aβarc, Aβarc-rbots1/+, Aβarc-rbo2/+, Aβarc-PI4KIIIαdef/+ и Aβarc-PI4KIIIαGS27/+ 21-25-дневного возраста, каждую группу окрашивания повторяли дважды; тогда как на фиг. 3с (верх) показан уровень Аβ головы, определено с помощью количественного твердофазного ИФА. На фиг. 3с (низ) показан уровень Аβ головы, у мух, экспрессирующих Аβarc, обработанных РАО в различных концентрациях, определяли количественно методом. n=3~5 для каждой группы данных в количественном твердофазном ИФА, однофакторный ANOVA. На фиг. 3а-3b, масштабная линейка обозначает 50 мкм.
Ранее, повреждение нейронов, индуцированное экспрессией Аβarc в пути GF было связано с внутриклеточным накоплением белка Аβ. В данном документе, авторы изобретения дополнительно подтвердили накопление Аβ внутри нейронов введением трансгена uas-mCD8-gfp мухам Aβarc. uas-mCD8-GFP экспрессирует флуоресцентный белок mCD8-GFP, который нацелен на плазматическую мембрану и управлялся тем же самым драйвером, что и Аβarc, так что нейроны, экспрессирующие Аβarc, могут быть мечены GFP. Изображения конфокальной микроскопии показали, что сигнал иммуноокрашивания Аβ колокализован с сигналом GFP (фиг. 3а), демонстрирующий феномен накопления Аβ внутри нейронов в этой модели мух.
Для анализа, влияет ли недостаточность RBO/PI4KIIIα на внутриклеточное накопление Аβ, выполняли иммуноокрашивание Аβ у мух Аβarc, Аβarc-rbo и Аβarc-PI4KIIIα. Обнаружено, что сигнал иммуноокрашивания мух Аβarc-rbo и Аβarc-PI4KIIIα значимо понижался по сравнению сигналом мух Аβarc (фиг. 3b).
Пример 7: Понижающая регуляция (даун-регуляция) RBO/PI4KIIIα уменьшает накопление внутриклеточного Аβ42, определено с помощью количественного твердофазного ИФА
Метод твердофазного ИФА:
Твердофазный ИФА выполняли с использованием набора Аβ42 Human ELISA Kit (Invitrogen) в соответствии с подробным описанием производителя. Для анализа уровня Аβ42 в ЦНС, интактный мозг 25-ти мух на линию иссекали в холодном PBS и немедленно помещали в холодный буфер для разведения проб твердофазного ИФА, дополненный смесью ингибиторов протеаз (Calbiochem). Мозги тщательно гомогенизировали, инкубировали при комнатной температуре в течение 4 часов и хранили при -20°С.
Как и примере 6, количественный твердофазный ИФА показывает, что количество Аβ42 значимо уменьшалось у мух Аβarc-rbo, мух Аβarc-PI4KIIIα и мух Аβarc после обработки РАО (фиг. 3c-3d).
На фиг. 10а показаны репрезентативные изображения эффективности нокдауна гена EFR3a (слева) и нормализованной количественной оценки (в середине) в клетках N2 методом RT-PCR (ОТ-ПЦР), правое изображение иллюстрирует, что нокдауна гена EFR3a не влияет на эндоцитоз внеклеточного Аβ клеток N2a. Последовательность, используемая для конструирования RNAi (РНК-интерференции) для нокдауна Efra представляет собой 5'-AGGTATCATTCAGGTTCTGTT-3' (SEQ ID NO: 4). На фиг. 10b показано, что мутации гена rbo и PI4KIIIa не снижают уровень транскрипции Аβarc у мух, экспрессирующих Аβarc, методом ОТ-ПЦР.
В примерах 6-7, показано, что уменьшение накопления Аβ внутри нейронов, индуцированное понижающей регуляцией (даун-регуляцией) RBO/PI4KIIIα, маловероятно из-за снижения поглощения внеклеточного Аβ42. Причинами являются: 1) поглощение внеклеточного Аβ42 в клетках N2a, имеющих нокдаун гомолога гена rbo, значимо не уменьшается (фиг. 10а); 2) уровни экспрессии mRNA Аβarc у мух Аβarc-rbo и Аβarc-PI4KIIIα различного возраста не уменьшаются по сравнению с мухами Аβarc в экспериментальной группе (фиг. 10b).
Пример 8: Получение препарата и исследование токсичности ингибиторов PI4KIIIα РАО, А1 и G1
Клетки HEK293, личинок и взрослых мух Drosophila обрабатывали РАО или А1, стоковые растворы (пер., исходные, маточные растворы) А1 10 мМ и 0,9 mM готовили отдельно растворением порошка РАО (Sigma-Aldrich, каталожный №637-03-6) и порошка А1 в DMSO (диметилсульфоксиде). Затем градиентно разбавляли дистиллированной водой до необходимых концентраций; конечную концентрацию DMSO доводили до идентичного уровня для гарантии того, что на экспериментальные результаты не влияли вариации DMSO.
Для проверки токсичности РАО на живых мухах, авторы изобретения культивировали мух дикого типа с пищей для мух, содержащей 50, 100, 200, 300, 400 и 600 мкМ РАО, начиная с эмбриональной стадии развития. Было обнаружено, что обработка РАО при 200 мкМ или менее не меняет скорость вылупления не изменяет способность преодолевать подъем после вылупления. Таким образом, были выбраны концентрации 25, 50, 100 и 150 мкМ РАО для культивированных Аβarc и контрольных мух.
Для проверки токсичности РАО на иссеченных личинках Drosophila третьей возрастной стадии, использовали культуральную среду Шнайдера, содержащую 50, 100, 200, 300, 400 и 500 нМ РАО для культивирования иссеченных личинок Drosophila третьей возрастной стадии при 25°С в течение ночи. Установлено, что клетки слюнных желез и нейроны ЦНС у личинок, обработанных РАО при 300 нМ или более, стали белыми, отражающими повреждение, тогда как такой эффект с использованием РАО при 150 нМ или менее не проявляется. Таким образом, для культивирования были выбраны 50, 100 и 150 нМ РАО.
Для проверки токсичности РАО и А1 на клетках HEK293T, использовали культуральную среду DMEM, содержащую 50, 100, 200, 300, 400 и 600 нМ РАО или А1, для культивирования клеток HEK239 в течение 12 часов. В соответствии с МТТ-тестами, установлено, что при концентрации РАО или А1 250 нМ или более, большая часть клеток погибала, тогда как такого эффекта не было при 150 нМ или менее. Таким образом, для культивирования были выбраны 25, 50, 100 и 150 нМ РАО или А1.
Для проверки токсичности РАО на мышах кормлением через желудочный зонд, порошок растворяли РАО в DMSO для получения стокового раствора 30 мг/мл. Затем градиентно разбавляли дистиллированной водой до необходимых концентраций; конечную концентрацию DMSO доводили до идентичного уровня для гарантии того, что на экспериментальные результаты не влияли вариации DMSO. Мышей C57BL/6 3-месячного возраста подвергали кормлению через желудочный зонд в дозах 18, 10 и 6 мг/кг массы тела, две мыши для каждого уровня дозы. Все мыши были найдены мертвыми во второй день. Затем мышей подвергали кормлению через желудочный зонд в дозах 4,5 и 2,0 мг/кг массы тела, пять мышей для каждого уровня дозы. В отношении дозы 4,5 мг/кг массы тела, кормление через желудочный зонд один раз в день в течение пяти последующих дней, четверо мышей из пяти выживших. В отношении дозы 2,0 мг/кг массы тела, кормление через желудочный зонд один раз в день с понедельника по пятницу, без зонда в выходные дни. Через две последующие недели все пять мышей выжили. Таким образом, в отношении мышей С57/В6, доза половинной выживаемости при кормлении РАО через желудочный зонд составляет 2-6 мг/кг массы тела, приблизительно 4 мг/кг массы тела. Таким образом, дозы 0,1, 0,3 и 1,0 мг/кг массы тела, были выбраны для кормления РАО через желудочный зонд мышей APP/PS1 и контрольных мышей, кормление через желудочный зонд один раз в день с понедельника по пятницу, без зонда в выходные дни, без кормления через зонд в течение шести последующих недель.
Пример 9: Понижающая (даун-регуляция) RBO/PI4KIIIα облегчает секрецию Аβ42, определено культивированием ткани личинок, экспрессирующих Аβ
Культивирование ткани личинок, экспрессирующих Аβ:
Личинки третьей возрастной стадии промывали водой и стерилизовали 70% спиртом в течение 2 минут и расчленяли вдоль дорсальной средней линии в культуральной среде Шнайдера (Sigma). Трахею, кишечник и жировое тело личинок осторожно были удалены. Рассеченные личинки промывали культуральной средой Шнайдера и переносили в 2 мл центрифужную пробирку, содержащую 150 мкл культуральной среды Шнайдера, дополненную гентамицином (20 мг/мл). Каждая пробирка содержала 5 рассеченных личинок. Центрифужные пробирки помещали во влажную и темную окружающую среду при 25°С в течение 8 часов. Затем из каждой пробирки отбирали по 100 мкл и использовали для количественного определения Аβ42 методом твердофазного ИФА (ELISA). ELISA выполняли с использованием Аβ42 набора Human ELISA Kit (Invitrogen).
На фиг. 4, фигуры 4а-4с, показана нормализованная количественная оценка уровней Аβ42 в среде инкубирования рассеченных Аβarc-экспрессирующих личинок Drosophila третьей возрастной стадии с обработкой РАО при различных концентрациях, мутации гена rbo и PI4KIIIα.
Для изучения механизма лечения РАО и недостаточности RBO/PI4KIIIα, снижающей накопление Аβ внутри нейронов, определяли секрецию Аβ42 при инкубировании рассеченной пробы Аβarc-экспрессирующих личинок третьей возрастной стадии в культуральной среде Шнайдера. Анализ ELISA показывает, что лечение РАО облегчает секрецию Аβ42 и проявляет тенденцию зависимости от дозы лекарственного средства (фиг. 4а), которая демонстрирует, что ингибирование ферментативной активности PI4KIIIα облегчает секрецию Аβ42. Последовательно, по сравнению со средой культивирования рассеченных личинок Аβarc, концентрация Аβ42 в среде культивирования личинок Аβarc-rbo и Аβarc-PI4KIIIα значимо повышается (фиг. 4b-4с).
Пример 10: Понижающая регуляция (даун-регуляция) RBO/PI4KIIIα облегчает секрецию Аβ42, обнаружено культивированием клеток HEK293T человеческого происхождения, экспрессирующих АРР
Культивирование клеток HEK293T человеческого происхождения, экспрессирующих АРР:
Клетки HEK293T, стабильно трансфицированные человеческим АРР (названные здесь клетками HEK293T-АРР) культивировали в DMEM (Hyclone), с добавлением 10% FBS (Gibco), пенициллина, стрептомицина и G418 (100 мкг/мл). Рекомбинантную плазмиду pSUPER.basic, экспрессирующую shRNA (пер., малая шпилечную РНК) генов-мишеней, транзиентно трансфицировали в HEK293T с использованием Lipofectamine™ 2000 (Invitrogen). Клетки инкубировали в течение двух дней после трансфекции, сопровождаемой последующими экспериментами. Для количественного определения концентрации Аβ42 в культуральной среде методом твердофазного ИФА (ELISA), свежезамененную культуральную среду анализировали после культивирования клеток в течение 12 часов.
Анализ активности α-, β- и γ-секретаз АРР и уровня экспресси АРР в клетках HEK293T-АРР:
Клетки HEK293T-АРР инкубировали в 12-луночном планшете, культуральные жидкости содержали РАО в концентрациях 0, 25, 50, 100 или 150 нМ. Через 6-8 часов инкубации одинаковые количества клеток собирали отдельно. Для анализа активности секретаз, клетки лизировали отдельно с 500 мкл буфера TBS, центрифугировали в течение 15 минут, супернатанты собирали и осадки ресуспендировали с 500 мкл буфера TBS. Для анализа активности α- и β-секретаз, 100 мкл супернатанта смешивали с 2х-кратным реакционным раствором (50 мМ Tris-HCl, рН 6,8, 4 мМ EDTA, 0,5% CHAPSO (мас./об.)), содержащим 10 мкМ специфических флуорогенных субстратов α- или β-секретаз (Calbiochem, каталожный №. 565767/565758); для анализа активности γ-секретазы, 100 мкл ресуспендированного раствора смешивали с 2х-кратным реакционным раствором (50 мМ Tris-HCl, рН 6,8, 4 мМ EDTA, 0,5% CHAPSO мас./об.)), содержащим 10 мкМ специфических флуорогенных субстратов γ-секретазы (Calbiochem, каталожный №. 565764). После взаимодействия при 37°С в течение 30 минут, анализировали с помощью ридера для микропланшет (возбуждение/эмиссия: 365/490 нм для ферментативной активности α/β, 365/440 нм для ферментативной активности γ).
При анализе уровня экспрессии АРР, выполняли Вестерн-блоттинг с использованием анти-АРР/Аβ антитела (6Е10) на собранных клетках после лизирования в буфере TBS, содержащем ингибитор протеаз (1% смесь, Invitrogen).
На фиг. 14а показана нормализованная количественная оценка эффектов РАО на активности α-, β- и γ-секретаз клеток HEK293T-АРР, n=5 для каждой точки данных, однофакторный дисперсионный анализ ANOVA; на фиг. 14b показан репрезентативный иммуноблот, показывающий клетки АРР-АРР после обработки РАО в различных концентрациях, эксперименты повторяли в течение 3 или более раз.
Для обнаружения, влияет ли такое облегчение на секрецию Аβ42, полученного из расщепления белка-предшественника β-амилоида (АРР), анализировали секрецию Аβ42клеток HEK293T-АРР. На фиг. 4d-4g показана нормализованная количественная оценка уровней Аβ42 в среде инкубирования клеток HEK293T-АРР с обработкой РАО и А1 в различных концентрациях, и нокдауном EFR3a и PI4KA. Фактически, обработка РАО в культуральной среде имеет сходный эффект в увеличении концентрации Аβ42 в культуральной среде (фиг. 4d), а РАО даже увеличивает концентрацию Аβ42 в культуральной среде в присутствии DAPT (1 мкМ), который является ингибитором γ-секретазы (фиг. 4е). Примечательно, что РАО по-прежнему имеет стабильный эффект, даже при довольно низкой концентрации РАО (до 1,0 нМ) (фиг. 16). Кроме того, нокдаун гена EFR3a или PI4KA или применение лечения А1 в клетках HEK293T-АРР может значимо увеличить концентрацию Аβ42 в культуральной среде (фигуры 4f-4g). n=4~15 для каждой группы данных, однофакторный дисперсионный ANOVA.
РАО и производные РАО анализировали в соответствии с секрецией Аβ42, обнаруженной в клетках HEK293T-АРР, и были получены следующие результаты, перечисленные в таблице 2.


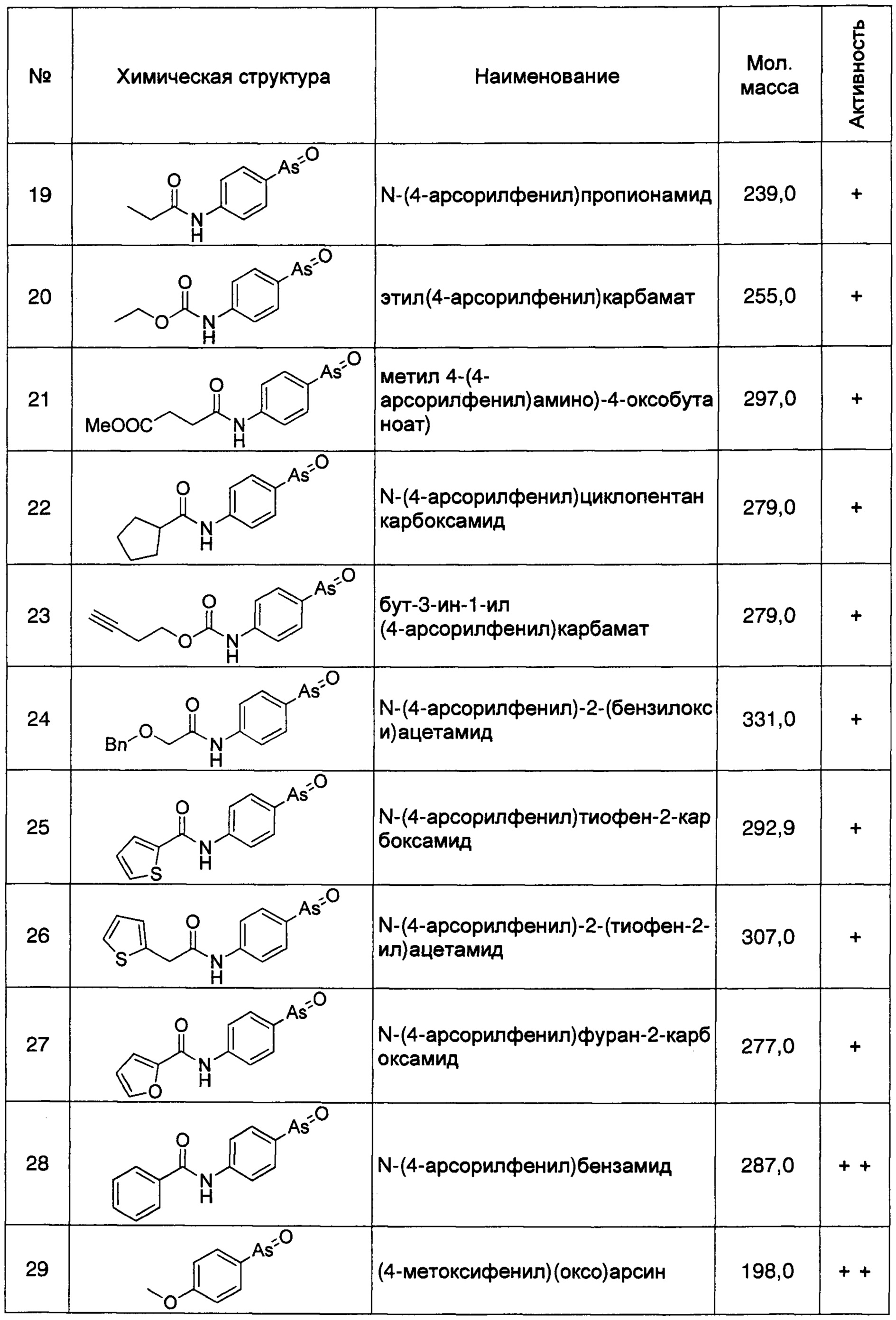
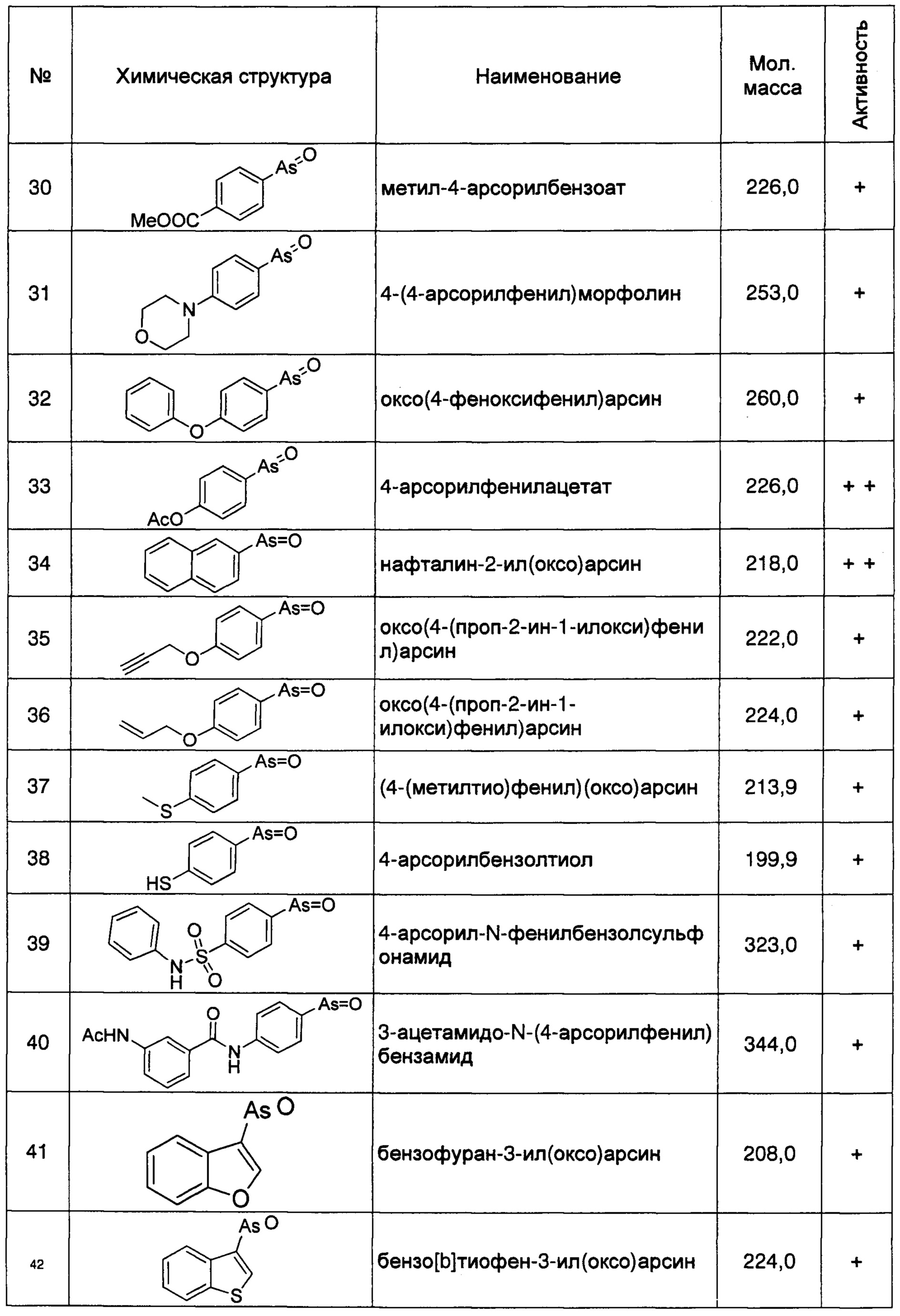
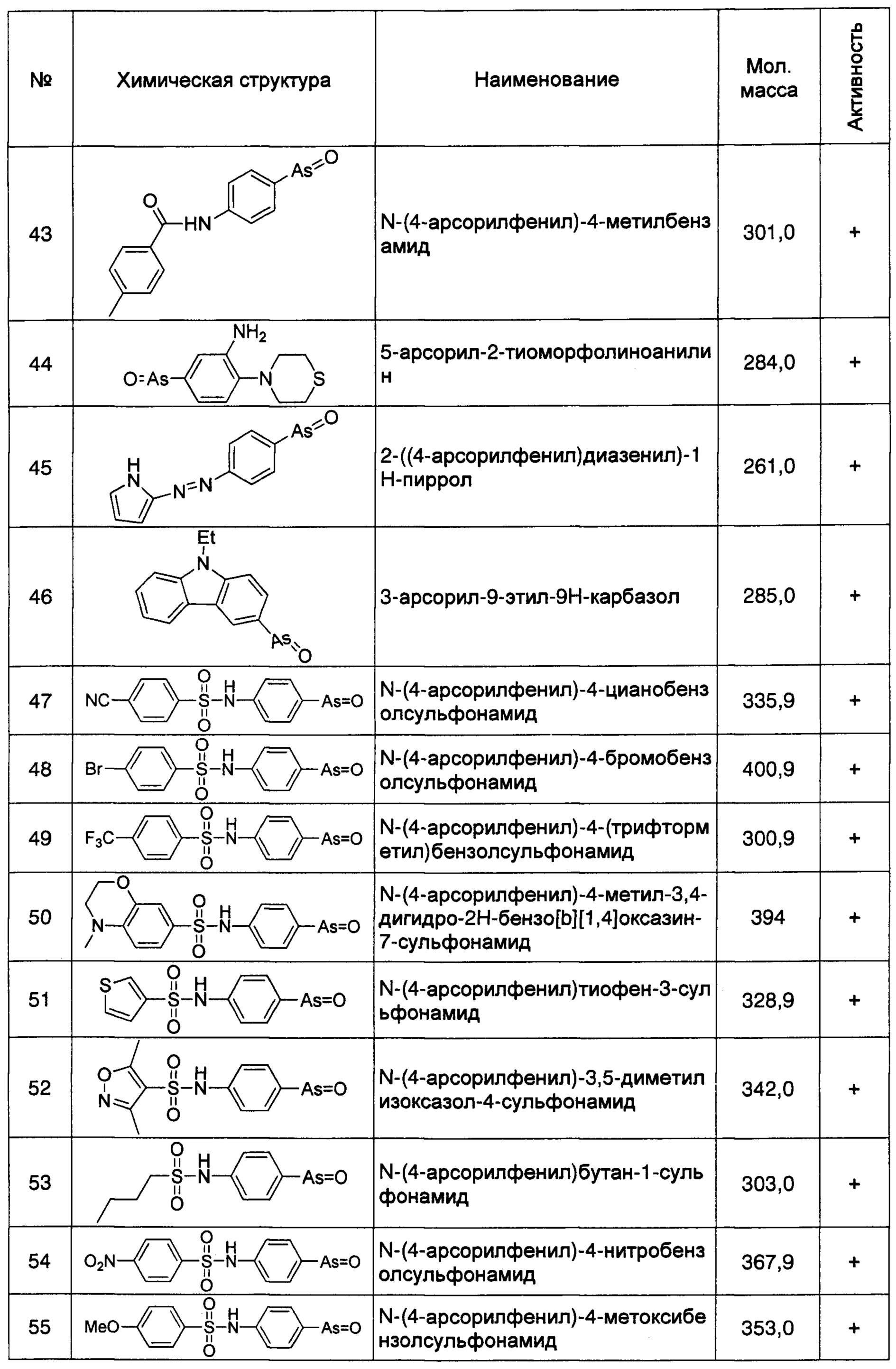

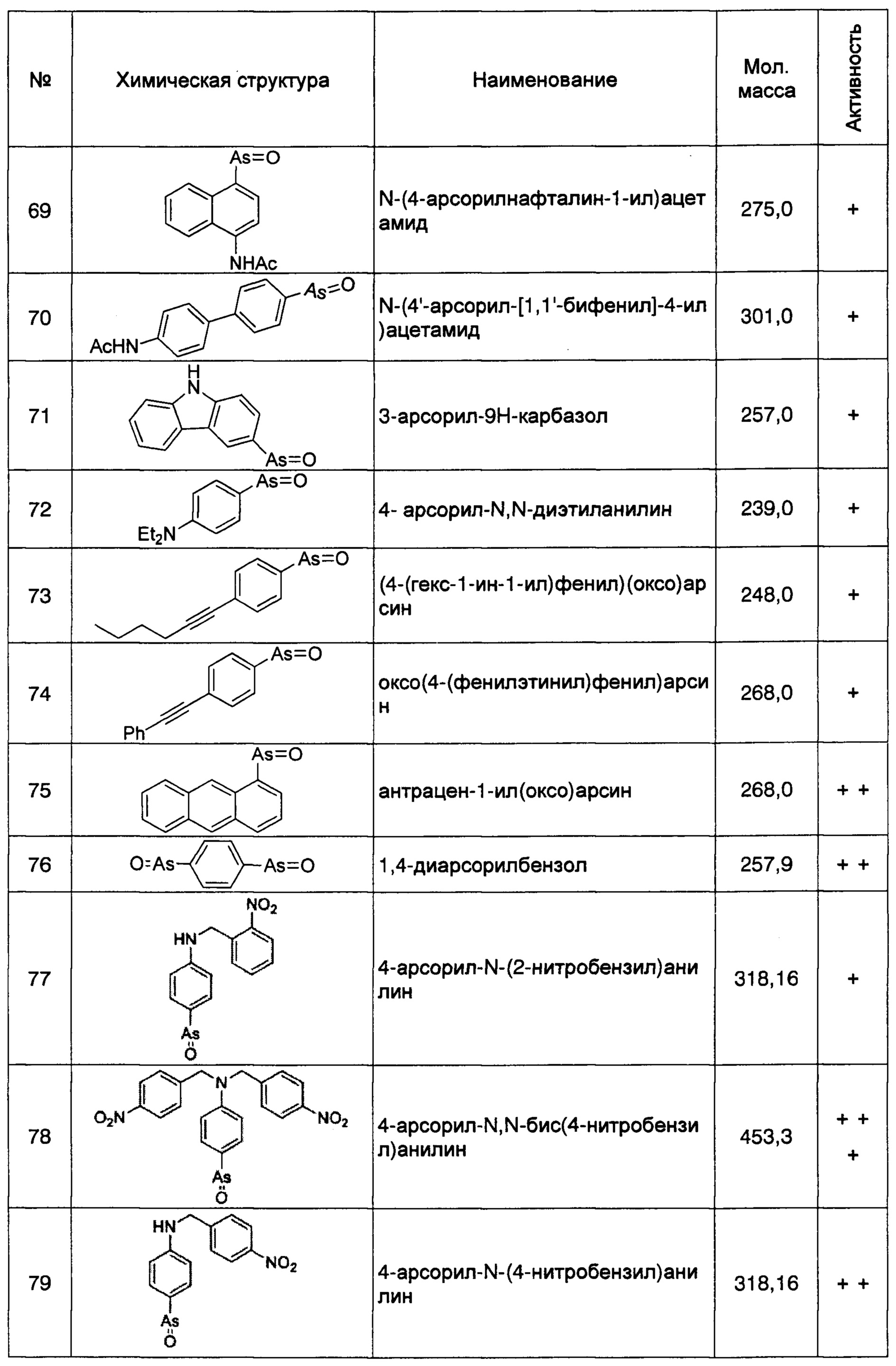
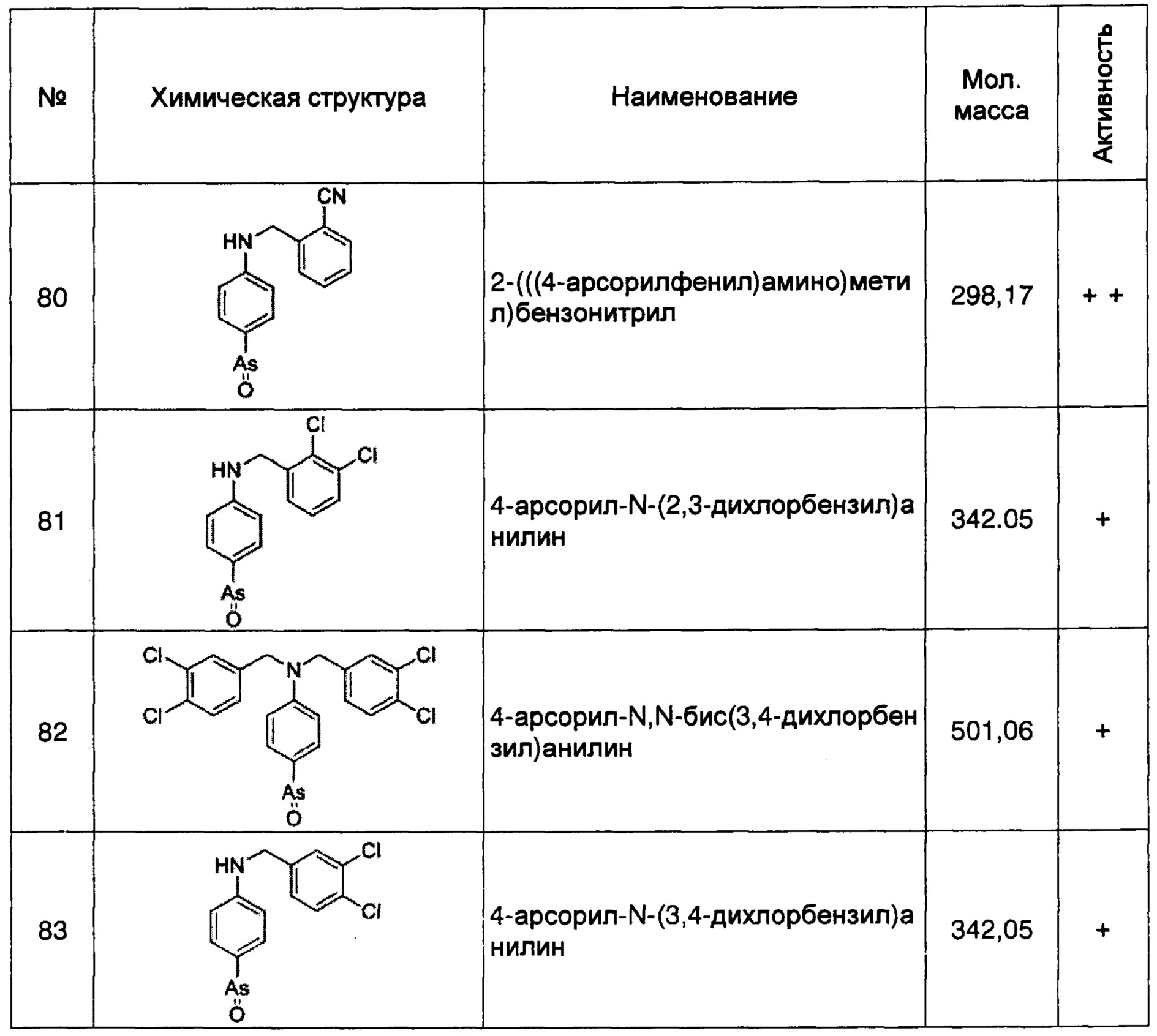
Кроме того, РАО облегчает секрецию Аβ42 в клетках HEK293T, стабильно трансфицированных АРР, имеющим человеческое происхождение, не оказывая влияние на активность α-, β- и γ-секретазы, которая расщепляет АРР (фиг. 14а) или вызывая повышения уровня АРР (фиг. 4b).
Моделирование связывания РАО и его производных с PI4KIIIα
В настоящее время, структура PI4KIIIα еще не измерена и не опубликована. Авторы изобретения применяют два широко используемых программных обеспечения, SWISS-MODEL и MODELLER, со ссылкой на опубликованную 4D0L структуру PI4KIIIβ, 4YKN структуру PI3Kα и 1е8х структуру PI3Kγ в качестве матриц для построения 6 структурных моделей PI4KIIIα. Обнаружено, что структуры 6 моделей являются очень совместимыми друг с другом; среднеквадратичное отклонение между структурами составляет менее 3


Из моделирования очевидно, что tPAO образует две водородные связи с атомом N остова и атомом S боковой цепи CYS1844, причем водородная связь с N также является сильной с расстоянием O--Н 2,03

Пример 11: Генерация вирусов и микроинъекция у мышей
Лентивирус был получен корпорацией Invitrogen (Shanghai) с использованием экспрессионной системы BLOCK-iT™ HiPerform™ Lentiviral Pol II miR RNAi с EmGFP (пер., с зеленым мономерным флуоресцентным белком Emerald, EmGFP). Было синтезировано четыре олиго-miRNAs нацеленных на Efr3a и встроенных в вектор pcDNA™6.2-GW/EmGFPmi. Эффективность нокдауна тестировали методом RT-PCR или Вестерн-блоттинга. Результаты показали, что один из векторов был наиболее эффективен в нокдауне экспрессии Efr3a в клетках HEK293T, сверхэкспрессирующих ген EFR3a. Последовательность вектора, имеющего самую высокую эффективность нокдауна, представляет собой AGGTATCATTCAGGTTCTGTT. Наиболее эффективный вектор miRNA рекомбинировали с pDONRTM221 и pLenti6/V5 DEST для создания вектора pLENT6/V5-GW/±EmGFP-miRNA с использованием реакций рекомбинации Gateway®. Лентивирус получали котрансфекцией вектора pLENT6/V5-GW/±EmGFP-miRNA и Упаковывающей смеси (Packaging Mix). Титр вируса получали серийными разведениями в клетках HEK293T. EGFP-положительные клетки подсчитывали каждые 3 дня. Эффективность нокдауна была дополнительно получена в трансфицированных лентивирусом первичных нейронах гиппокампа.
Мужские особи трансгенных мышей APP/PS1 (B6C3-Tg(APPswe,PSEN1dE9)85Dbo/Mmjax (MMRRC ID 034832-JAX) поддерживались скрещиванием с мышами C57BL. В 6-месячном возрасте мышей анестезировали кетамином 100 мг/кг плюс 20 мг/кг ксилазина и готовили для исследований вентральной стороной вниз на стереотаксическом аппарате с электрическим одеялом, расположенным под его животом. Волосы на голове были удалены, кожа была разрезана и в черепе было сделано небольшое отверстие. 2 мкл раствора лентивируса (титр вируса: 6×10-7) инъецировали с помощью шприцевого насоса (Harvard Apparatus) в течение 20 минут через систему канюли (наружный диаметр 0,29 мм, внутренний диаметр 0,1 мм, RWD Life Science Co., Ltd) на 2,1 мм сзади до брегмы, 2,3 мм латерально и 1,9 мм вентрально. Через 5 мин после инъекции иглу удаляли, на кожу накладывали шов и мышь переносили в среду с температурой 25°С с подачей пищи и воды. В возрасте 12 месяцев мышей снова анестезировали и подвергали транскардиальной перфузии с использованием 4% параформальдегида (PFA) в PBS. Эксперименты соответствовали политике Общества неврологии (США) по использованию животных.
Пример 12: нокдаун EFR3a может восстановить атрофию нейронных дендритов нейронов у мышей APP/PS1, проанализированных окрашиванием GFP в срезах мозга мыши
Окрашивание GFP в срезах мозга мыши:
Срезы мозга (толщиной 60 мкм) блокировали с использованием PBS-0,3% тритон-5% BSA в течение 1 часа с последующей инкубацией с кроличьим анти-GFP антителом (А11122, Invitrogen, разведение 1:100) в течение ночи при 4°С. Затем промывали PBS, инкубировали с биотинилированным козьим антителом против кроличьего IgG (H+L) (AbboMax, Inc, разведение 1:100) в течение ночи при 4°С. Снова промывали PBS, инкубировали с Су3-Streptavidin (Jackson ImmunoResearch Laboratories Inc, разведение 1:1000) в течение 2 часов при комнатной температуре. Изображения делали под конфокальным микроскопом Zeiss LSM 511, деконволюцией с помощью AutoQuant Х2 и анализировали с помощью программного обеспечения NeuronStudio. Генотипы срезов мозга и изображений дендритов были слепыми для персонала при визуализации и анализе, соответственно.
На фиг. 11, RT-PCR применяли для анализа эффективности нокдауна внутреннего гена EFR3a (а) и PI4KA (b) в клетках HEK293, сверхэкспрессирующих мышиный рекомбинантный ген EFR3a-gfp (с) в клетках HEK293 и внутренний ген Efr3a (d) в первичных нейронах гиппокампа мышей. Репрезентативные изображения находятся сверху, а нормализованная количественная оценка внизу. Последовательности RNAi, используемые для конструирования нокдауна генов Efr3a и PI4KA представляют собой 5'-GGTTATTGAAATTCGAACT-3' (SEQ ID NO: 5) и 5'-TGCTCATTAGCAGTAAAGA-3' (SEQ ID NO: 6), соответственно. n=3-5 для каждого из данных, t-критерий для получения Р-значения.
На фиг. 5а, конфокальные изображения показывают иммуноокрашенные анти-GFP целые срезы гиппокампа (сверху) и трансфицированные лентивирусом пирамидальные клетки в сегментах СА3 (внизу). Дендритный фрагмент размером около 30 мкм был выбран для количественной оценки диаметра и плотности дендритного шипика. Масштабные линейки обозначают 500 мкм (верхняя) и 50 мкм (нижняя), соответственно. В сегменте СА3 пирамидальных нейронов (фиг. 5b) и сегменте СА3 зерновидных нейронов (фиг. 5с) мышей APP/PS1 и контрольных однопометных животных, нокдаун гена EFR3a влияет на диаметр и плотность дендритного шипика. Реперезентативные изображения дендритов сегмента СА3 и DG находятся сверху, а количественная оценка диаметра и плотности дендритного шипика находятся внизу. Каждая точка данных была получена из n≥25 срезов 3~4 животных, Р-значения получали однофакторным дисперсионным анализом, ANOVA. На фиг. 5b-5с, масштабная линейка обозначает 1,0 мкм.
Мыши и человек обладают двумя гомологами rbo, EFR3a и EFR3b, оба из которых обогащают гиппокамп и подобные области (Allen Brain Atlas, пер. транскриптомный атлас мозга человека,) которые очень восприимчивы к БА. Авторы изобретения исследовали, может ли понижающая регуляция (даун-регуляция) гена EFR3a защищать нейроны гиппокампа у мышей APP/PS1 с использованием метода RNAi, меченной EGFP. Эффективность нокдауна RNAi была показана на фиг. 11а-11b. Конфокальное получение изображений показало, что лентивирус, экспрессирующий EGFP, заразил небольшое число нейронов в сегменте СА3 и DG (фиг. 11а). Диаметр и плотность дендритного шипика измеряли на случайно выбранных проксимальных сегментах (~30 мкм в длину) апикальных дендритов второго порядка. Значения двух параметров как сегмента нейронов СА3, так и DG мышей APP/PS1, инфицированных контрольным лентивирусом, были значимо меньше, чем значения у контрольных мышей дикого типа и мышей APP/PS1 (фиг. 5b-5с), что указывает на атрофию дендритов и шипов в нейронах гиппокампа у мышей APP/PS1. Сравнение между мышами APP/PS1, значения двух параметров были значимо увеличены в нейронах, инфицированных RNAi лентивируса, достоверной разницы не существует между значениями у мышей дикого типа (фиг. 5b-5с). Таким образом, понижающая регуляция (даун-регуляция) гомолога rbo EFR3a в нейронах гиппокампа у мышей APP/PS1 также защищает нейроны.
Пример 13: РАО улучшает нарушение обучения и памяти, увеличивает Аβ42 в CSF, но уменьшает Аβ42 в мембранах головного мозга мышей APP/PS1, определено анализом состава CSF и мембран, фракционированного головного мозга мыши
Сбор цереброспинальной жидкости:
Мышей анестезировали кетамином и ксилазином, и они были закреплены адаптерами для головы. Кожу шеи выбривали и разрезали, подкожную ткань и мышцы отделяли в сторону с помощью щипцов для обнажения твердой мозговой оболочки над задней мозжечково-мозговой цистерной. Для проникновения в твердую мозговую оболочку использовали стеклянный капилляр с острым наконечником, соединенным со шприцем для микроинъекций тупым концом. После заметного изменения сопротивления вставке капиллярной трубки, капилляр вводили в заднюю мозжечково-мозговую цистерну, спинномозговая жидкость (CSF) вливалась в капиллярную трубку, до тех пор, пока не было собрано приблизительно 10-20 мкл. Собранную CSF переносили в пробирку Эппендорф, содержащую ингибитор протеаз, и хранили при -80°С до использования.
Фракционирование мембран головного мозга мышей:
Получение растворимого в детергенте Аβ42 посредством серийных экстракций. 5-ти кратный объем физраствора, забуференного Трис (TBS) по отношению к объем у полушария головного мозга мыши добавляли для измельчения и гомогенизации, центрифугировали при 100000g в течение 60 мин и супернатант представлял собой экстракт в TBS. Осадок собирали, добавляли 5-ти кратный объем TBS, содержащий 1% простого октилфенолового эфира полиэтиленгликоля для измельчения, центрифугировали и супернатант представлял собой экстракт в TBS-Triton. Осадок снова собирали, добавляли 5-ти кратный объем TBS, содержащий 1% SDS для измельчения, центрифугировали и супернатант представлял собой экстракт в TBS-SDS. Все три супернатанта собирали, делили на аликвоты и хранили в при -80°С морозильной камере для анализа методом твердофазного ИФА (ELISA).
Вышеизложенные результаты в культивируемых клетках и на мухах демонстрируют, что РАО облегчает секрецию Аβ42, уменьшает накопление Аβ42 внутри нейронов и улучшает синаптическую недостаточность, указывая на то, что РАО является потенциальным лекарственным средством для лечения БА путем облегчения секреции Аβ42. Для проверки этого, авторы изобретения выполнили поведенческие и биохимические эксперименты с мышами APP/PS1, с кормлением РАО в различных дозах через желудочный зонд.
На фиг. 6а показаны кривые обучения в водном лабиринте Морриса мышей APP/PS1, леченных РАО в различных дозах (слева) и однопометных животных дикого типа (справа). Для сравнения, кривая обучения мышей APP/PS1, с кормлением 0 дозой РАО через желудочный зонд, была показана как на левом, так и на правом графиках. На фиг. 6b показано процент затраченного времени на поиск целевого квадранта к общему времени поиска контрольных мышей и мышей APP/PS1 после обучения. Количественное определение Аβ42 методом твердофазного ИФА (ELISA) использовали для анализа уровня Аβ42 в CSF мышей APP/PS1, леченных различными концентрациями РАО (фиг. 6с), и во фракционированных мембранах головного мозга, экстрагированных TBS, содержащим 1% Triton и 1% SDS (фиг. 6d). На фиг. 6е показан эффект времени термической обработки при 100°С на измеренное значение Аβ42 в количественном определении методом твердофазного ИФА (ELISA) в CSF мышей APP/PS1 (слева) и фракционированных мембранах головного мозга, экстрагированных TBS, содержащим 1% SDS (справа). На фиг. 6f показан уровень Аβ42 в количественном определении методом твердофазного ИФА (ELISA) во фракционированных мембранах головного мозга, экстрагированных TBS, содержащем 1% Triton и 1% SDS после термической обработки при 100°С в течение 60 минут. На фиг. 6g показан процент Аβ42, высвобожденного после термической обработки при 100°С в течение 60 минут во фракционированных мембранах головного мозга, экстрагированных TBS, содержащем 1% Triton и 1% SDS от общего количества Аβ42. На фиг. 6а-6b, n=6-8 для контроля дикого типа, n=7-8 для каждой группы APP/PS1. На фиг. 6е, n=3 для левого графического изображения и n=23 для правого графического изображения. На фиг. 6с, 6d и 6f, n=5-6. Все Р-значения получали однофакторным дисперсионным анализом ANOVA.
Изучив токсичность при кормлении РАО через желудочный зонд на мышах дикого типа, как описано в примере 8, были выполнены следующие эксперименты с градиентом концентрации 0, 0,1, 0,3 и 1,0 мг/кг. Мышей APP/PS1 4-месячного возраста и мышей дикого типа подвергали кормлению РАО через желудочный зонд один раз в день, с понедельника по пятницу в течение 6 последующих недель. Затем введение РАО останавливали на одну неделю, и тестировали способность к обучению и память у мышей экспериментом по водному лабиринту в соответствии с Vorhees и Williams. По сравнению с контролем дикого типа, мыши APP/PS1 без лечения РАО демонстрировали ухудшенные способности пространственного обучения и памяти (фиг. 6а-6b). Это ухудшение было значительно меньше у мышей APP/PS1, леченных РАО, в особенности при дозировке 0,3 мг/кг (фиг. 6а-6b). Этот результат указывает на то, что РАО может быть использован для лечения нарушения обучения и памяти у мышей APP/PS1. После теста на поведение, CSF собирали и фракционирование мембран головного мозга извлекали из каждой мыши APP/PS1. Мозг подвергли фракционированию для экстрагирования ассоциированного с мембранами Аβ42 двумя буферами TBS, содержащими 1% Triton Х-100 или 1% SDS, для количественного определения методом твердофазного ИФА (ELISA). Было обнаружено, что РАО повышал уровень Аβ42, содержащийся в CSF (фиг. 6с), а также неожиданно увеличивал уровень Аβ42 в мембранах головного мозга, особенно при дозировке 0,3 мг/кг (фиг. 6d). Однако, на фиг. 6f показано, что лечение РАО уменьшало уровень агрегированного Аβ42 в мембранах головного мозга, особенно при дозировке 0,3 мг/кг.
Пример 14: кормление РАО через желудочный зонд улучшает когнитивные нарушения мышей APP/PS1 в возрасте старше полугода
Для изучения эффекта лечения РАО на мышах APP/PS1, уже имеющих идентифицируемое нарушение обучения и памяти, 8-месячного возраста мышей APP/PS1 и однопометных животных дикого типа подвергали кормлению РАО через желудочный зонд в дозировках 0 или 0,3 мг/кг массы тела, один раз в день, с понедельника по пятницу в течение 6 последующих недель. Затем введение останавливали в течение одной недели, и мышей подвергали тесту на распознавание новых объектов (NOR). Результаты показали, что мыши, леченные РАО, тратили значительно больше времени на исследование нового объекта, чем старого объекта, который был исследован накануне. Для изучения эффекта РАО на мышей APP/PS1 в возрасте старше полугода, а также токсичности на мышах при длительном введении, 20 мышей APP/PS1 в возрасте 18 месяцев были случайным образом разделены на две группы, по 10 мышей в каждой группе. Одну группу подвергали кормлению РАО через желудочный зонд в дозировке 0,3 мг/кг массы тела, один раз в день, с понедельника по пятницу, другую группу подвергали кормлению водой через желудочный зонд; без введения в выходные дни. Через последующие 8 месяцев, введение прекращали в течение одной недели, а мышей подвергали тесту NOR. В течение 8 месяцев кормления через зонд, в каждой группе умерли по две мыши. Тест NOR показал, что мыши в группе лечения РАО тратили значительно больше времени, исследуя новый объект, чем мыши в другой группе (фиг. 18).
Планирование теста NOR и фиг. 18: В первое утро мышей помещали в прозрачную стеклянную акриловую коробку 20×20×32 см с задней двери, затем вынимали после привыкания в течение 30 минут; коробку не очищают. Днем того же дня перед коробкой помещали камеру, а два одинаковых предмета были помещены в два угла коробки, обращенной к камере. В коробку помещали одну мышь; через 7 мин мышь и два объекта вынимали. Снова ящик не очищали; помещали еще два одинаковых объекта, а затем вторую мышь. Повторяли таким же образом, пока все мыши не закончили обучение. Во второй половине второго дня проводили тест с использованием той же самой коробки. В коробку были помещены два объекта, причем один объект был исследован мышью в первый день, а другой объект был новым для мыши. Весь процесс от вхождения мыши в коробку, до теста, был закончен через 7 минут и был записан на видео. Во время всей процедуры тестирования ящик не был очищен. В автономном анализе воспроизведение видео в компьютере и время, проведенное мышью при исследовании новых и старых объектов, были подсчитаны человеком, не участвующим в тесте NOR.
На фиг. 18 верхний ряд представляет собой принципиальную схему проектирования теста NOR мыши. Нижняя строка представляет собой процент времени, затрачиваемого на исследование нового объекта, по сравнению с общим временем на исследование мышью как новых, так и старых объектов в тесте NOR. Каждая группа данных на левом графике является средним и SEM (пер., стандартная ошибка среднего) для 9 мышей. Каждая группа данных на правом графике является средним и SEM для 8 мышей. Односторонний t-тест.
Пример 15: мутация PI4KIIIα улучшает дефект обучения и памяти у мышей APP/PS1, протестированных в эксперименте с водным лабиринтом
Генетическая понижающая регуляция (даун-регуляция) уровня экспрессии PI4KIIIα или ингибирование ее ферментативной активности с помощью РАО у мух, экспрессирующих Аβ42, оба уменьшают выраженность дисфункции нейронов; ингибирование ферментативной активности PI4KIIIα с помощью РАО у мышей APP/PS1 также улучшает способность к обучению и память. Для дальнейшего прояснения роли PI4KIIIa в отношении нейродегенерации у мышей APP/PS1, исследовали эффект гетерозиготной мутации PI4KIIIα (Pi4kaGt(RRO073)Byg/+: вставка (инсерция) транспозона pGT2Lxf в одну копию гена PI4KA может задерживать транскрипцию копии гена, полученная mRNA может только транслировать укороченный белок, образованный первыми ~265 аминокислотами на N-конце PI4KIIIα, и белок, кодируемый репортерным геном) в эксперименте с водным лабиринтом на мышах APP/PS1. Мутационные гетерозиготы Pi4kaGt(RRO073)Byg/+ (MMRRC, каталожный №016351-UCD) скрещивали с мышами APP/PS1 для получения четырех групп генотипов мышей: дикого типа (WT), мутационную гетерозиготу PI4KIIIa (PI4K*/+), APP/PS1 (TG) и APP/PS1 с гетерозиготной мутацией PI4KIIIa (TG;PWK*/+). Когда мыши в четырех группах достигли 5-месячного возраста, выполняли эксперименты с водным лабиринтом в соответствии с Vorhees и Williams. Как показано на фиг. 12, гетерозиготная мутация PI4KIIIa может значимо улучшить пространственное обучение и расстройство памяти у мышей APP/PS1 5-месячного возраста. Слева на фиг. 12 показаны кривые обучения четырех групп генотипов мышей, справа на фиг. 12 показан процент времени плавания в целевом квадранте от общего времени плавания в первый день после тренировочного дня четырех групп генотипа мышей.
Пример 16: Понижающая регуляция (даун-регуляция) уровня экспрессии PI4KIIIα и ингибирование ферментативной активности PI4KIIIα с помощью РАО оба уменьшают нарушение пластичности синаптической передачи в гиппокампе мышей APP/PS1.
Для обнружения эффекта понижающей регуляции (даун-регуляции) уровня экспрессии PI4KIIIα и ингибирования ферментативной активности PI4KIIIα с помощью РАО на ухудшение пластичности синаптической передачи в гиппокампе мыши, авторы изобретения индуцировали и регистрировали долговременную потенциацию (LTP) синапсов гиппокампа СА3-СА1 в срезах головного мозга мыши. 4-месячного возраста мышей APP/PS1 и однопометных животных дикого типа подвергали кормлению РАО через желудочный зонд в дозах 0 или 0,3 мг/кг массы тела, один раз в день с понедельника по пятницу в течение 4 недель подряд. Затем введение останавливали на одну неделю. Авторы изобретения обнаружили, что амплитуда LTP мышей APP/PS1 без лечения РАО была значимо ниже, чем амплитуда LTP мышей дикого типа и мышей APP/PS1, леченных РАО (фиг. 19а), что указывает на то, что лечение РАО значимо улучшало нарушение пластичности синаптической передачи в гиппокампе мыши APP/PS1. Соответственно, ген PI4KA с копией на одну меньше, также значимо улучшал нарушение пластичности синаптической передачи в гиппокампе мыши APP/PS1 (фиг. 19b), тогда как PI4KA с копией на одну меньше, не влияла на саму LTP (фиг. 19с).
Способ: Получение срезов гиппокампа мыши и запись LTP гиппокампа СА3-СА1: Берут мышь, приблизительно 6-месячного возраста, масса тела 30 г, чистой породы. Анестезируют мышь внутрибрюшинной инъекцией 1% пентобарбитала натрия. Анестезируется до комы, и хирург торакотомией полностью обнажает сердце; разрезает, чтобы открыть правое предсердие; быстро инъецирует 30 мл 4°С PBS с помощью шприца 50 мл и иглы №3 через левый желудочек; декапитирует; фиксирует голову и разрезает ножницами вдоль средней линии черепа и по обеим сторонам черепной ямки, чтобы открыть череп, при постоянном промывании мозга анатомической жидкостью 0°С (анатомическая жидкость предварительно заполнена смешанным газом, содержащим 95% O2+5% CO2 в течение 30 мин); затем мозг полностью помещают на пластину, содержащую анатомическую жидкость 0°С; удаляют обонятельную луковицу и мозжечок хирургическим ножом и изогнутыми пинцетами; разделяют два полушария мозга вдоль черепной линии; после обрезки блока головного мозга добавляют небольшое количество этил-цианоакрилатного клея к основанию, чтобы обеспечить стабильное положение ткани гиппокампа; быстро помещают основание в резервуар для срезов, содержащий анатомическую жидкость ~ 0°С, при непрерывном заполнении смешанного газа; разрезают сагиттально для получения среза головного мозга толщиной 400 мкм; помещают срез головного мозга в стеклянную чашку, содержащую искусственную спинномозговую жидкость (ACSF, предварительно заполненную смешанным газом в течение 30 мин); инкубируют при комнатной температуре; (~25°С) в течение 1~2 часов перед использованием. (ACSF в мМ: 124 NaCl, 2 KCl, 2 MgSO4, 1,25 KH2PO4, 2 CaCl2, 26 NaHCO3, 10 D-глюкоза [рН 7,4], 300 мОсм).
Регистрировать поле возбуждающего постсинаптического потенциала (ВПСП, fEPSPs) в области гиппокампа СА1 в соответствии со стандартной процедурой: поместить два стимулирующих зонда (FHC Inc., Bowdoin, ME) в коллатералях Шаффера области СА3 гиппокампа, поместить один стеклянный микроэлектрод и один регистрирующий электрод в stratum radiatum (лучистый слой) области СА1. Расстояние между стимулирующим зондом и регистрирующим зондом 200~300 мкм. Интенсивность стимуляции составляет 30-50% от интенсивности стимуляции для индуцирования максимальной амплитуды fEPSPs; частота стимуляции составляет 0,05 Гц. После того, как амплитуда индуцированных fEPSP стабилизировалась в течение 20 мин, высокочастотная стимуляция при 100 Гц давалась через стимулирующие зонды и повторялась через 20 секунд. После стимуляции, продолжают стимуляцию 0,05 Гц и регистрируют fEPSPs в течение 80 мин., высокочастотный фильтр на частоте 1 кГц, частота записи на частоте 20 кГц, предварительный усилитель представляет собой усилитель Heka ЕРС 10 (Harvard Bioscience Inc., Ludwigshafen, HRB).
На фиг. 19 показано, понижающая регуляция (даун-регуляция) уровня экспрессии PI4KIIIα и ингибирование ферментативной активности PI4KIIIα с помощью РАО оба значимо улучшают нарушение пластичности синаптической передачи в гиппокампе мышей APP/PS1. На А-С, верхний ряд представляет собой реперезентативные записи fEPSP СА1 до высокочастотной стимуляции (серый) и после высокочастотной стимуляции (черный), нижний ряд представляет собой количественный анализ. Срезы головного мозга мышей были получены из трех групп однопометных мышей в возрасте 6 месяцев: леченные РАО мыши дикого типа (WT 0,3), нелеченные мыши APP/PS1 (Tg 0), и РАО леченные мыши APP/PS1 (Tg 0,3); были получены из четырех групп однопометных мышей: дикого типа (WT), PI4KA-/+, APP/PS1 (Tg) и APP/PS1; PI4KA-/+ (Tg; PI4KA-/+). Каждая точка на графике получена в виде средних значений и стандартной ошибки средних значений (SEM) из 7~9 срезов головного мозга от 3~4 мышей. Однофакторный ANOVA.
Пример 17: Эффекты PI, PI4P, PI4,5Р на агрегацию/олигомеризацию Аβ42 в липосомах, протестированные экспериментом на липосомах
Эксперимент на липосомах:
1) Растворение синтетического Аβ42 гексафтор-2-пропанолом (HFIP) в соотношении 1:1 (мг:мл), с последующей обработкой ультразвуком 50 Гц при комнатной температуре в течение 15 мин для гомогенизации. Ультразвуковой прибор представляет собой ультразвуковой аппарат KUDOS (Model SK250HP).
2) Растворение липидов (таблица 1) отдельно в хлороформе для получения липидов, используемых для создания липосом (таблица 3) в соотношении 1:1 (мг:мл), с последующей обработкой ультразвуком 50 Гц при комнатной температуре в течение 15 мин для гомогенизации.
3) Смешивание липидов в соответствии с композицией, как указано в таблице 3, с последующим удалением органических растворителей из раствора лиофилизатором.
4) Ресуспендирование осадка после лиофилизации в 1,0 мл Tris-буфера (50 мМ Tris, 120 мМ NaCl, рН 7,0), с последующей обработкой ультразвуком в ледяной воде в течение 30 мин для гомогенизации. Оставить при 4°С в течение 48 часов для иммуноблот-анализа (первичное антитело представляет собой гуманизированное анти-Аβ моноклональное антитело 6Е10, разведение 1:1000). Перед анализом иммуноблота требуется 15-минутная обработка ультразвуком для гомогенизации.
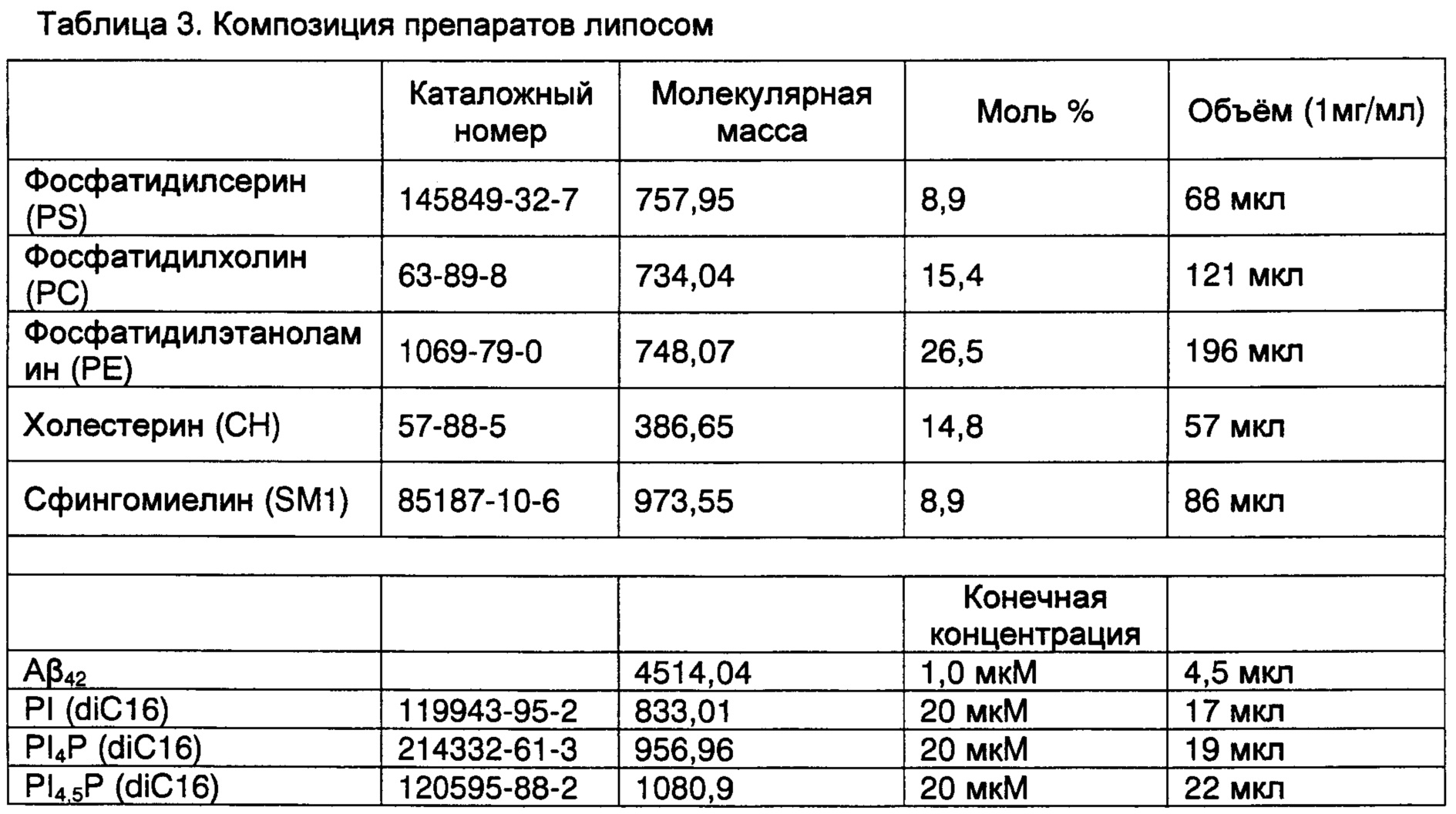
Анализировали и сравнивали эффекты PI, PI4P, PIP2 на агрегацию/олигомеризацию Аβ42 в липосоме. На фиг. 13 (левая колонка) показано, что PI4P облегчает олигомеризацию Аβ42 в липосоме зависимым от концентрации способом, где верхняя и нижняя части представляют собой результаты той же самой мембраны для иммуноблоттинга при короткой и длительной световой экспозиции, соответственно; авторы изобретения отмечают, что при концентрации PI4P 80 мкМ, эффект облегчения олигомеризации Аβ42уменьшается по сравнению с концентрацией 40 мкМ. Правая колонка на фиг. 13 демонстрирует эффекты облегчения PI, PI4P и PIP2 на агрегацию Аβ42 в липосомах, где верхняя и нижняя части представляют собой результаты той же самой мембраны для иммуноблоттинга при короткой и длительной световой экспозиции, соответственно; авторы изобретения отмечают, что эффект PI4P является значимо сильнее, чем эффект PI и PIP2, тогда как эффект облегчения PI4P на олигомеризацию тримера Аβ42 и выше и сильнее, чем эффекты PI и PIP2.
Пример 18: Образование комплекса RBO/EFR3/EFR3A/EFR3B, PI4KIIIa, и ТТС7 на клеточной мембране
Авторы изобретения отмечают, что белок дрожжей EFR3 образует комплекс с PI4KIIIα и каркасным белком YYP1 (называемым ТС7 у млекопитающих, в том числе двумя гомологами ТТС7А и ТТС7В) на клеточной мембране и агрегирует в виде бляшек PIK, и вместе регулируют уровень PI4P в плазмалемме и даже уровень PI4,5Р. YYP1 взаимодействует непосредственно с N-концом и центральной областью белка PI4KIIIa дрожжей, играя, таким образом, важную роль в конструировании и стабилизации бляшек PIK (Baird D, Stefan С, et al., 2008, J Cell Biol). Образование и функционирование бляшек PIK также является консервативным в клетках млекопитающих (Nakatsu F, Baskin JF, et al., 2012, J Cell Biol). Гомолог TTC7 Drosophila у мух кодируется летальным геном (2) k14710 (I(2) k14710).
Для тестирования роли белка ТТС7 в нейродегенерации, вызванной накоплением Аβ внутри нейронов, два транспозон-опосредованных трансгена вводили в Аβarc мух. Транспозон P{lacW}I(2)k14710k15603 (Bloomington, каталожный №11134) встраивали в первый экзон гена I(2) k14710 для предотвращения транскрипции I(2) k14710; другим транспозоном является P{EPgy2}bin3EY09582 (Bloomington Stock №20043). В этом эксперименте было сконструировано четыре группы мух: контрольные мухи (ctrl), мухи Аβarc (Аβarc), мухи Аβarc, имеющие одну копию P{lacW}I(2) k14710k15603 (Aβarc-dttc7+/-, понижающее регулирование (даун-регулирование) ТТС7) и мухи Аβarc, имеющие одну копию P{EPgy2}bin3EY09582 (Aβarc-dttc7-OE, сверхэкспрессирующих ТТС7). Когда взрослые мухи четырех групп достигли возрастного периода 5-10-дневного возраста и 30-35-дневного возраста, проводили запись EJP в пути GF при 100 Гц стимуляции головного мозга.
На фиг. 15 показан количественный анализ эффектов понижающей регуляции (даун-регуляции) ttc7 и сверхэкспрессии на передачу нервного импульса у мух Аβarc. В возрасте 5-10 дней, не существовало значимых различий в доле успешных результатов при стимуляции 100 Гц передачи нервного импульса, индуцированной стимуляцией головного мозга; однако, в возрасте 30-35 дней, доля успешных результатов у мух Аβarcбыла значимо ниже, чем доля успешных результатов у контрольных мух (ctrl), сверхэкспрессия ТТС7 (Aβarc-dttc7-OE) дополнительно снижает долю успешных результатов, тогда как понижающая регуляция (даун-регуляция) ТТС7 (Aβarc-dttc7+/-) повышает долю успешных результатов передачи нервного импульса.
Предпочтительные варианты осуществления изобретения описаны здесь. Настоящее изобретение не ограничено вышеприведенными вариантами осуществления. Любые изменения, модификации, замещения, комбинации и упрощения без отхода от сущности и принципа настоящего изобретения относятся к эквивалентам настоящего изобретения и включены в объем защиты настоящего изобретения
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЦЗЯНСУ НУО-БЕТА ФАРМАСЬЮТИКАЛ ТЕКНОЛОДЖИ КО., ЛТД.
<120> Изобретение белка PI4KIIIα и родственного мембранного белкового комплекса в лечении болезни Альцгеймера
<130> PCTF1604
<150> PCT/CN2015/078058
<151> 2015-04-30
<160> 6
<170> PatentIn version 3.3
<210> 1
<211> 65
<212> PRT
<213> Drosophila melanogaster
<400> 1
Met Ala Ser Lys Val Ser Ile Leu Leu Leu Leu Thr Val His Leu Leu
1 5 10 15
Ala Ala Gln Thr Phe Ala Gln Asp Ala Glu Phe Arg His Asp Ser Gly
20 25 30
Tyr Glu Val His His Gln Lys Leu Val Phe Phe Ala Glu Asp Val Gly
35 40 45
Ser Asn Lys Gly Ala Ile Ile Gly Leu Met Val Gly Gly Val Val Ile
50 55 60
Ala
65
<210> 2
<211> 24
<212> PRT
<213> Ratus norvegicus
<400> 2
Met Ala Gln Phe Leu Arg Leu Cys Ile Trp Leu Leu Ala Leu Gly Ser
1 5 10 15
Cys Leu Leu Ala Thr Val Gln Ala
20
<210> 3
<211> 17
<212> PRT
<213> Artificial sequence
<400> 3
Lys Arg Ser Asn Arg Ser Lys Arg Leu Gln Tyr Gln Lys Asp Ser Tyr
1 5 10 15
Cys
<210> 4
<211> 21
<212> DNA
<213> Artificial sequence
<400> 4
aggtatcatt caggttctgt t 21
<210> 5
<211> 19
<212> DNA
<213> Artificial sequence
<400> 5
ggttattgaa attcgaact 19
<210> 6
<211> 19
<212> DNA
<213> Artificial sequence
<400> 6
tgctcattag cagtaaaga 19
<---
Реферат
Изобретение относится к биотехнологии. Описан способ лечения болезни Альцгеймера ингибитором PI4KIIIα, который специфически нацелен на PI4KIIIα, при этом указанный ингибитор PI4KIIIα выбирают из одного или нескольких имеющих малую молекулу соединений-ингибиторов: РАО, производных РАО, G1, А1, указанные производные РАО содержат структуры, приведенные в п. 1 формулы. Изобретение расширяет арсенал средств лечения болезни Альцгеймера. 1 з.п. ф-лы, 19 ил., 3 табл., 18 пр.
Формула




Комментарии