Липохитоолигосахариды, стимулирующие арбускулярно-микоризный симбиоз - RU2539028C2
Код документа: RU2539028C2
Чертежи



Описание
Настоящее изобретение относится к липохитоолигосахаридам, вовлеченным в арбускулярно-микоризный симбиоз, и к способам их применения.
Считается, что грибы арбускулярной микоризы (AM) установили симбиотические отношения с корнями растений более 400 миллионов лет назад, начиная с появления самых ранних наземных растений, что позволяет предположить, что АМ-грибы помогали растениям в освоении суши (Remy et al., 1994). Эта группа грибов, недавно переименованная в Glomeromycota, является одной из наиболее широко распространенных, и AM отношения широко встречаются по всему царству растений, включая покрытосеменные и голосеменные растения, папоротникообразные и некоторые мохообразные (Smith and Read., 2008). Среди покрытосеменных растений по меньшей мере 80% видов способны формировать AM симбиозы; единственными важными исключениями из этого являются Brassicaceae и Chenopodiaceae. АМ-грибы способны транспортировать редкие или плохо растворимые минеральные питательные вещества, такие как фосфор, цинк и медь, из почвы в растение, которое в свою очередь снабжает гриб углеводами. Этот обмен питательными веществами может иметь жизненно важное значение, когда плодородие почвы и доступность воды понижены, то есть в условиях, резко ограничивающих сельскохозяйственное производство в большинстве регионов мира (Smith and Read, 2008).
Другим примером известных симбиотических отношений между растениями и микроорганизмами почвы является ризобиальный симбиоз. В отличие от арбускулярно-микоризного симбиоза, который широко распространен среди растений, ризобиальный симбиоз встречается только у бобовых растений, и вместо грибов в нем участвуют азотфиксирующие бактерии, совокупно названные ризобиями, которые принадлежат к нескольким родам, включая Rhizobium, Bradyrhizobium, Azorhizobium и Sinorhizobium. Ризобиальный симбиоз приводит к формированию определенных структур - клубеньков - на корнях бобового растения-хозяина. Клубеньки обеспечивают соответствующую окружающую среду для ризобий, позволяя им фиксировать молекулярный азот и обеспечивать растение-хозяина связанным азотом. Инициация бобово-ризобиального симбиоза зависит от симбиотических сигналов, которые производят оба партнера-симбионта. Сигналы, испускаемые растением, обычно представляют собой флавоноиды, выделяемые в составе корневых экссудатов. Эти флавоноиды взаимодействуют с ризобиальными транскрипционными факторами семейства NodD, которые активизируют транскрипцию генов клубенькообразования (nod-генов), участвующих в выработке бактериальных сигнальных молекул, называемых Nod-факторами (Denarie et al., 1996). Nod-факторы имеют общую базовую структуру, включающую хитиновый остов из четырех или пяти остатков N-ацетилглюкозамина, связанных между собой бета-1,4-связями, N-ацилированный по нередуцирующему концу остатком жирной кислоты различной длины и степени ненасыщенности. Эта базовая структура может быть далее N-метилирована по нередуцирующему концу, а также может быть O-замещена по нередуцирующему и/или по редуцирующему концу. Это разнообразие заместителей обеспечивает широкое разнообразие Nod-факторов с различными структурами (разнообразные структуры Nod-факторов описаны в Denarie et al., 1996; D'Haeze et al., 2002). Специфичность бобово-ризобиального взаимодействия (то есть данный вид ризобий формирует клубеньки на определенных видах бобовых растений) является результатом этого разнообразия.
С помощью генетического анализа пути сигналинга Nod-факторов в корнях модельного бобового растения Medicago truncatula был идентифицирован ряд генов, вовлеченных в этот путь (Stacey et al., 2006). Растущее число фактов указывает на то, что рецепторы Nod-факторов представляют собой рецептороподобные киназы с внеклеточными связывающими сахар доменами LysM, такими как продукты генов NFP и LYK3 из M.truncatula. Взаимодействие Nod-фактора со своим рецептором запускает последующий сигнальный каскад, который включает быстрый приток ионов кальция, кальциевый спайк и экспрессию определенных генов нодулинов. Эти последующие события затрагивают определенные гены, кодирующие белки, вовлеченные в кальциевый сигналинг, такие как DMI1, DMI2 и DMI3 из M.truncatula, кодирующие соответственно кагионный канал, рецептороподобную киназу, содержащую богатые лейцином повторы, и Са2+/кальмодулин-зависимую протеинкиназу, а также гены, кодирующие белки, которые участвуют в контроле экспрессии генов, такие как NSP1 и NSP2, которые кодируют транскрипционные факторы.
Хотя AM-грибы с точки зрения сельского хозяйства и экологически чрезвычайно важны, клеточные и молекулярные механизмы, которые контролируют формирование микоризного симбиоза, намного менее известны, чем механизмы, вовлеченные в ризобиальный симбиоз.
На M.truncatula было показано, что клубеньковые и микоризные программы имеют по меньшей мере три общих компонента (Catoira et al. 2000), а именно, продукты генов DMI1, DMI2 и DMI3, участвующие в кальциевом сигналинге.
Однако события, как предшествующие, так и следующие за кальциевым сигналингом, все еще плохо охарактеризованы в случае арбускулярно-микоризного симбиоза, в особенности те, которые вовлечены в ранний сигналинг и приводят к взаимному распознаванию растительного и грибного партнеров. Исследование этих событий затруднял тот факт, что грибной партнер представляет собой облигатный симбионт, который не может быть выращен в чистой культуре в отсутствие живых растений, а также отсутствие генетических инструментов, доступных для этой группы грибов (Harrison, 2005). Однако недавно было показано, что между симбионтами до физического взаимодействия происходит обмен диффундирующими сигналами. Со стороны растения в составе корневых экссудатов могут выделяться вещества апокаротиноидного семейства, стриголактоны и стимулировать ветвление гиф прорастающих спор АМ-грибов, давая сигнал для переключения физиологического состояния гриба на активный пресимбиотический рост (Akiyama et al., 2005; Besserer et al., 2006). Сообщалось также и о существовании со стороны гриба диффундирующих веществ, производимых АМ-грибами и способных активизировать ответы растения, связанные с программой эндомикоризации (Kosuta et al., 2003; Weidmann et al., 2004; Navazio et al., 2007). Более конкретно, ряд экспериментов, выполненных на М.truncatula, недавно показал, что АМ-грибы вырабатывают диффундирующие вещества, способные стимулировать экспрессию разнообразных ответов растения. Три вида Gigaspora и один вид Glomus были способны через целлофановую мембрану вызывать индукцию экспрессии симбиотического гена MtENOD11 в корнях рассады (Kosuta et al., 2003). Три грибные патогена не вызывали подобный ответ, что говорит в поддержку гипотезы об индукции ответа определенной сигнальной молекулой АМ-гриба. Подобным образом AM-гриб Glomus intraradices, как было показано, активизировал через мембрану транскрипцию растительных генов, экспрессия которых зависит от симбиотического гена DMI3 (Weidmann et al. 2004). Кроме того, было обнаружено, что диффундирующий сигнал АМ-грибов вызывал временное повышение цитозольного уровня кальция в клеточных культурах сои и осуществлял повышающую регуляцию генов, связанных с DMI1, DMI2 и DMI3 (Navazio el al., 2007).
Olah et al. (2005) сообщали, что Nod-факторы из Sinorhizobium meliloli, ризобиального симбионта M.truncatula, были способны стимулировать микоризацию и формирование боковых корней у М.truncatula. Стимуляция формирования боковых корней также наблюдалась при использовании диффундирующих факторов из арбускулярно-микоризиых грибов (факторы Мус), но не Nod-факторов из ризобиальных видов {Sinorhizobium fredii и Rhizobium leguminosarum), которые не способны вызывать формирование клубеньков у видов рода Medicago. Сообщалось также, что все гены пути сигналинга Nod-фактора, идентифицированные на настоящий момент, в частности ген NFP, кодирующий предполагаемый рецептор Nod-фактора, как и гены DMI3 и NSP1, были необходимы для стимуляции формирования боковых корней Nod-факторами, но не факторами Мус, которым требовались только гены DMI1 и DMI2. На основе этих наблюдений данные авторы предложили модель, объясняющую стимуляцию микоризации и формирования боковых корней у бобовых факторами Мус и Nod-факторами. Согласно этой модели, факторы Мус и Nod-факторы, которые узнаются различными рецепторами на поверхности клеток, активизируют общий путь сигналинга DMI1/DMI2/DMI3; в случае факторов Мус, DMI1 и DMI2 были достаточны для стимуляции формирования боковых корней, в то время как DMI3 требовался для стимуляции микоризации. Olah et al. также обсуждали возможную химическую природу факторов Мус. Они выдвинули гипотезу о том, что эти факторы скорее всего не являются ауксин-подобными веществами, поскольку их эффект на развитие корня отличался от того, который наблюдался под воздействием этих веществ. Они также предположили, что их структура должна отличаться от структуры Nod-факторов, так как рецептор NFP, по-видимому, различал их.
Поэтому очевидно, что хотя существование диффундирующих "факторов Мус", выделяемых АМ-грибами и способных активизировать ответы растения, признано в данной области техники, химическая природа этих факторов не была идентифицирована до сих пор.
Авторам настоящего изобретения удалось очистить факторы Мус из экссудатов как микоризированных корней, так и прорастающих спор АМ-гриба Glomus intradices. Они также определили их химическую структуру и показали, что они эффективно стимулируют развитие корневой системы и колонизацию корня АМ-грибом.
Факторы Мус, очищенные авторами настоящего изобретения, представляют собой смесь сульфатированных и несульфатированных липохитоолигосахаридов (ЛХО); они и Nod-факторы имеют одинаковый хитиновый остов из остатков N-ацетилглюкозамина, связанных между собой бета-1,4-связями, N-ацилированный по нередуцирующему концу остатком жирной кислоты. Однако факторы Мус имеют более простые структуры по сравнению с Nod-факторами. Единственным О-замещением, которое наблюдали в факторах Мус, является О-сульфатирование по редуцирующему концу молекулы. Никакие другие О-замещения, такие как О-карбамоил на нередуцирующем конце или О-фукозил на редуцирующем конце, не были обнаружены. Единственным N-замещением по концевому нередуцирующему остатку GlcNAc у факторов Мус, очищенных из Glomus intradices, является ацилирование обычными жирными кислотами, главным образом олеиновой (C18:1) и пальмитиновой кислотами (C16:0). В отличие от этого, N-замещение Nod-факторов более сложно. Часто это двойное замещение N-метильной группой и N-ацильной группой (часто это вакценовая кислота), как у штаммов ризобий, которые образуют клубеньки на большинстве тропических бобовых и бобовых подсемейства Mimosoideae. N-метилирование определяется широко распространенным ризобиальным геном nods (Denarie et al., 1996). В качестве альтернативы, N-ацилирование определенной полиненасыщенной жирной кислотой является правилом среди ризобий, образующих клубеньки на бобовых умеренных широт, относящихся к кладе Galegoid (Denarie et al., 1996). Фактически, ЛХО, обладающие структурой столь же простой, как охарактеризованные изобретателями факторы Мус, не наблюдали среди Nod-факторов, синтезируемых различными штаммами ризобий, изученными до сих пор (Denarie et al., 1996; D'Haeze et al., 2002).
Согласно данному изобретению предложен способ получения факторов Мус из гриба группы Glomeromycota, при этом указанный способ включает получение экссудата из корней растений, микоризированных указанным грибом, или из прорастающих спор указанного гриба, экстракцию указанных экссудатов бутанолом и сбор бутанольного экстракта, содержащего указанные липохитоолигосахариды.
Согласно предпочтительному варианту реализации настоящего изобретения, указанный способ включает дальнейшие этапы твердофазной экстракции указанного бутанольного экстракта с помощью обращенно-фазной хроматографии на С18 с последовательными промывками 20%-ым, 50%-ым и 100%-ым ацетонитрилом и сбором фракции, элюированной в 50%-ом ацетонитриле, содержащей указанные факторы Мус.
Согласно еще более предпочтительному варианту реализации, указанный способ включает дальнейшие этапы очистки указанной фракции, элюированной в 50%-ом ацетонитриле, с помощью обращенно-фазной высокоэффективной жидкостной хроматографии на обращенно-фазной колонке С18 с использованием линейного градиента от 20% до 100% по ацетонитрилу и сбора фракции, элюированпой в 3,0-48% ацетонитрила, которая содержит сульфатированные липохитоолигосахариды, и/или фракции, элюированной в 64-72% ацетонитрила, которая содержит несульфатированные липохитоолигосахариды.
Согласно конкретному варианту реализации данного изобретения, указанный гриб из группы Glomeromycota представляет собой Glomus intraradices.
Однако грибные факторы Мус могут быть также получены из других видов Glomeromycota, продуцирующих их, с использованием вышеописанных этапов экстракции или их вариантов.
"Фактор Мус" определен в данном описании как липохитоолигосахарид, который соответствует приведенной ниже формуле (I):
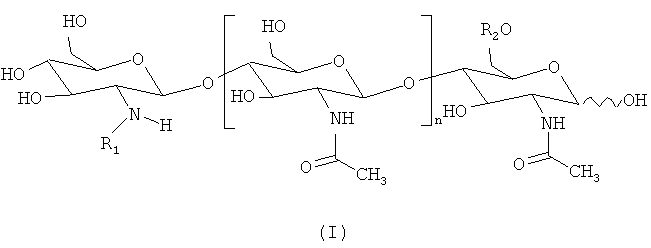
где n=0, 1,2, 3, 4 или 5, предпочтительно 2 или 3;
R1 представляет собой липидный заместитель, содержащий от 12 до 22, предпочтительно от 14 до 20, атомов углерода, который может быть насыщенным, или моно-, ди-, три-, тетра-, пента- или гексаненасыщенным;
R2 представляет собой Н или SO3H.
Липидный заместитель R1 предпочтительно представляет собой цепь жирной кислоты. R1 также может представлять собой ароматический аналог цепи жирной кислоты, как в аналогах Nod-фактора, описанных, например, Grenouillat et al. (2004), или в РСТ WO/2005/063784.
Предпочтительно, R1представляет собой цепь жирной кислоты, синтезируемой грибом арбускулярной микоризы, в частности цепь насыщенной, или моно- или диненасыщенной жирной кислоты, которая содержит 16 или 18 атомов углерода. Предпочтительно, чтобы в случае, если указанная цепь жирной кислоты является ненасыщенной, она включала по меньшей мере одну двойную связь в цис-конформации (например, С18:1 олеиновая кислота). Не ограничивающий список примеров предпочтительных цепей жирной кислоты включает С16:0, С18:0, С16:1ω5, С16:1ω7, С18:1ω5, С18:1ω7, С18:1ω9, 18:2ω6,9, С20:0 изо, С20:1ω9 и С20:4ω6, 9, 12, 15.
Факторы Мус можно также охарактеризовать и отличить от липохитоолигосахаридов родственной структуры, таких как Nod-факторы, по их биологическим свойствам. Эти биологические свойства можно протестировать с использованием соответствующих биотестов. В частности, можно использовать биотесты, основанные на способности факторов Мус стимулировать формирование боковых корней у модельного бобового растения M.truncaluta. Более конкретно, в то время как факторы Мус, подобно Nod-факторам, способны стимулировать формирование боковых корней у растений дикого типа, но не у дефектных по симбиозу мутантов dmi1, dmi2 и dmi3, факторы Мус также могут, в отличие от Nod-факторов, стимулировать формирование боковых корней у дефектного по симбиозу мутанта nsp1.
При необходимости, также доступны биотесты, позволяющие отличить несульфатированные факторы Мус от сульфатированных факторов Мус, (например, при необходимости разделить в грибном экстракте фракции, содержащие несульфатированные факторы Мус от тех, которые содержат сульфатированные факторы Мус): например, сульфатированные факторы Мус способны индуцировать экспрессию гена MtENODll в растущих корнях M.truncatula, в то время как несульфатированные факторы Мус способны вызывать ветвление корневых волосков у горошка посевного.
Факторы Мус можно очистить из грибов, как описано выше. Они также могут быть получены путем химического синтеза и/или произведены в генетически модифицированных бактериальных клетках. Например, хитоолигосахаридный остов, сульфатированный или нет, может быть синтезирован в рекомбинантных бактериях, как описано, например, Samain et al. (1997, 1999) для синтеза предшественников Nod-фактора, и впоследствии ацилирован по свободной аминогруппе нередуцирующего концевого сахара, как описано, например, Ohsten Rasmussen et al. (2004). Можно также использовать мутантный штамм бактерии Rhizobiaceae, продуцирующий факторы Мус вместо Nod-факторов, например, штамм, генетически модифицированный для экспрессии только тех из структурных генов биосинтетического пути Nod, которые участвуют в синтезе хитоолигосахаридного остова, и тех, что вовлечены в N-ацилирование нередуцирующего концевого глюкозамина соответствующей жирной кислотой С16 или С18, а также возможно и тех, которые участвуют в О-сульфатировании редуцирующего концевого глюкозамина, как описано, например, Ardourel et al. (1994) или Lugtenberg et al. (1995).
Настоящее изобретение также охватывает смеси различных факторов Мус формулы (I). и в частности смеси сульфатированных и несульфатированных факторов Мус, включающие один или более липохитоолигосахаридов формулы (I) таких, что R2представляет собой H, и один или более липохитоолигосахаридов формулы (I) таких, что R2 представляет собой SO3H. Липохитоолигосахариды указанной смеси могут также отличаться между собой числом остатков N-ацетилглюкозамина и/или природой заместителя R1 (например, длиной и/или степенью ненасыщенности цепи жирной кислоты).
Смеси факторов Мус настоящего изобретения могут, например, быть получены путем экстракции факторов Мус из арбускулярно-микоризных грибов, как описано выше, и сбора грибного экстракта. Также они могут быть получены путем производства различных факторов Мус по отдельности и их смешивания.
Очищенные или синтетические липохитоолигосахариды, и более конкретно, очищенные или синтетические факторы Мус формулы (I) или их смеси, описанные здесь, могут применяться для стимуляции микоризообразования и таким образом иметь широкий диапазон применений в сельском хозяйстве, садоводстве и лесоводстве для наиболее культивируемых растений, способных образовывать микоризу и вследствие этого обладающих рецепторами фактора Мус.
В дополнение к их применению для стимуляции арбускулярно-микоризного симбиоза, очищенные или синтетические факторы Мус или их смеси можно также применять:
- для стимуляции прорастания семян, что может быть полезно при обработке семян с широким спектром применений в сельском хозяйстве, садоводстве и лесоводстве;
- для стимуляции развития корневой системы, что полезно для улучшения водного и минерального питания.
Их можно применять, например, для обработки семян или добавлять в инокулянты, содержащие грибы арбускулярной микоризы, или добавлять в почву либо культуральный субстрат растения. Очищенные или синтетические факторы Мус настоящего изобретения можно применять с любыми растениями, а именно с растениями, способными к образованию микоризы, включая как бобовые, так и не относящиеся к бобовым растения, как двудольные, так и однодольные растения, в том числе злаки. Их также можно применять для растений, выращиваемых как в вегетационной камере, так и в теплице или в полевых условиях.
Их также можно применять для стимуляции микоризной колонизации при производстве микоризных инокулянтов (то есть споры или гифы АМ-грибов, или фрагменты микоризированных корней), в качестве добавки в культуральную среду, используемую для производства этих инокулянтов растениями, выращиваемыми в почве или в гидропонных или аэропонных условиях, или путем кокультивирования микоризных грибов и вырезанных корней.
Настоящее изобретение также охватывает составы, содержащие очищенные или синтетические факторы Мус или их смеси и приемлемый в сельском хозяйстве носитель. Составы настоящего изобретения могут дополнительно содержать мутантные штаммы бактерий Rhizobiaceae, генетически модифицированные для продукции факторов Мус вместо Nod-факторов, как описано выше. Предпочтительными составами являются те, которые содержат смесь сульфатированных и несульфатированных факторов Мус.
Дополнительно, факторы Мус можно объединить с другими активными элементами, такими как флавоноиды, апокаротиноиды, например стриголактоны, или жасмонат, представляющие собой растительные вещества, которые, как сообщалось, действуют как симбиотические сигналы (Harrison, 2005; Akiyama et al., 2005; Bcsscrer et al., 2006).
Состав этих смесей зависит от намеченного способа применения (например, покрытие семян, добавление в культуральную среду для производства микоризных инокулянтов, обработка растения или почвы). Их можно, например, приготовить как диспергируемые в воде или водорастворимые твердые частицы, такие как порошки, гранулы, драже или пленки, как жидкие водные растворы, суспензии, эмульсии или гели.
Согласно предпочтительному варианту реализации, эти составы связаны с грибным и/или растительным материалом, например с инокулянтом арбускулярно-микоризного гриба или с семенами растения, способного образовывать микоризу; предпочтительно, чтобы указанные семена были покрыты этим составом.
Предпочтительно, факторы Мус используются в составе в концентрации от 10-3 M до 10-12 M. При добавлении в культуральную среду для производства спор АМ-грибов их можно применять в концентрации от 10-6 M до 10-10 M, предпочтительно в концентрации от 10-7 до 10-9 M в среде. При использовании для обработки семян или для стимуляции развития корневой системы, их можно применять в концентрации от 10-6 M до 10-10 M, предпочтительно в концентрации от 10-7 до 10-9 M. При использовании смеси сульфатированных и несульфатированных факторов Мус могут быть использованы концентрации от 10-8 до 10-10 M.
Суть настоящего изобретения станет более понята в свете дополнительного описания, заключающегося в приведенных ниже примерах и приложенных чертежах. Следует понимать, однако, что эти примеры и чертежи являются исключительно иллюстративными и не ограничивают настоящее изобретение каким-либо образом.
ПОДПИСИ К ЧЕРТЕЖАМ
Фиг.1. Биологические тесты, использованные для обнаружения
симбиотических сигналов АМ-грибов
a. Тест на MtENOD11. Корни трансгенной рассады M.truncatula Jemalong А17, несущей репортерную конструкцию pMtENODl 1-GUS. Активность GUS определяли с помощью гистохимического окрашивания 5-бром-4-хлор-3-индолил-β-глюкуронидом. (1) Корни в контроле, обработанные 2,5%-ым ацетонитрилом. (2) Фракция после ТФЭ и элюирования 50%-ым ацетонитрилом, разбавленная в 40 раз. (3) Та же самая фракция после дальнейшего десятикратного разбавления.
b. Тест на VsHab. Корневые волоски горошка посевного (Vicia saliva, подвид nigra), наблюдаемые под оптическим микроскопом после окрашивания метиленовым синим. (1) Корневые волоски, обработанные неактивной фракцией, являлись прямыми. (2) Корневые волоски, обработанные активными фракциями, демонстрировали заметное ветвление.
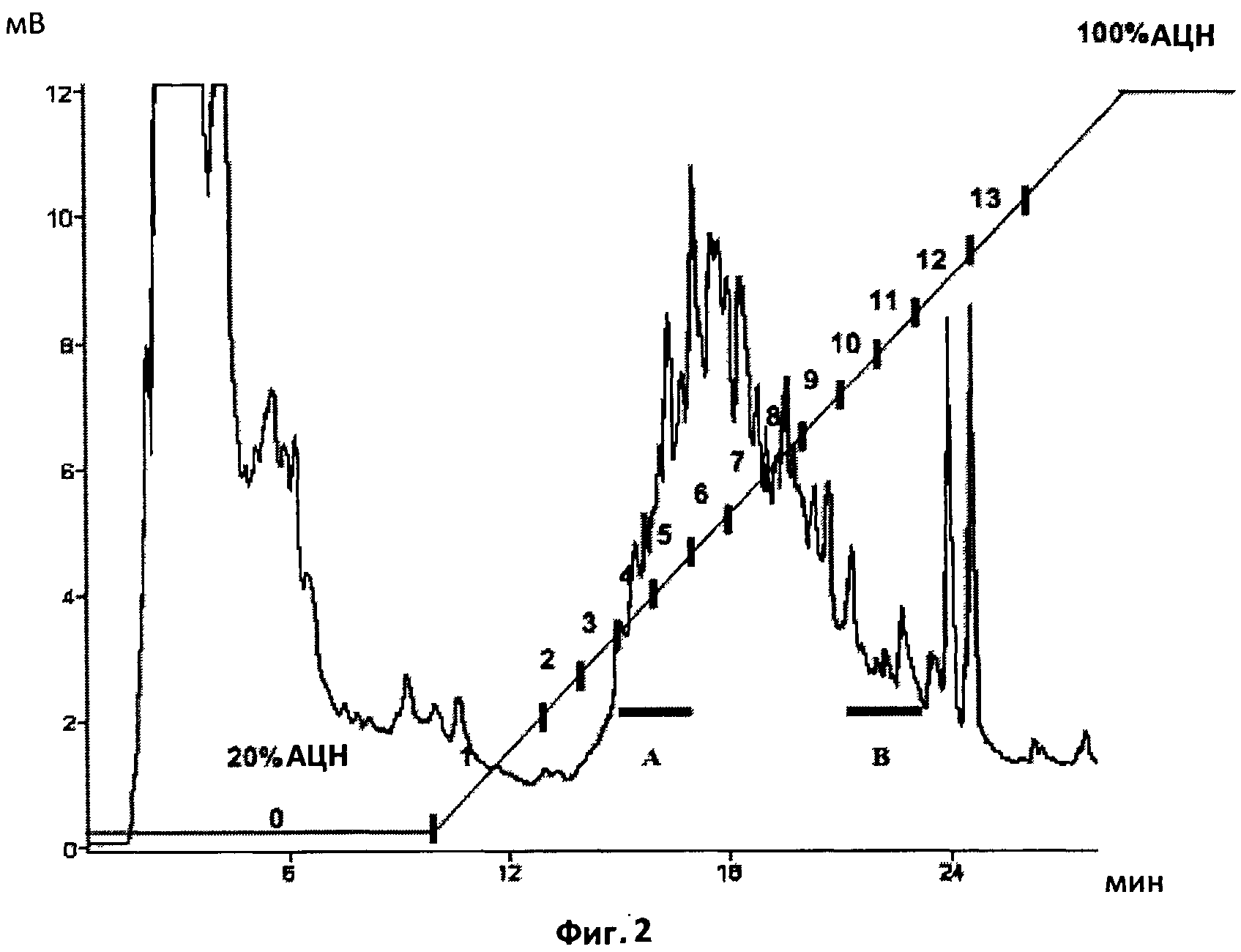
Фиг.2. Полупрепаративный профиль обращенно-фазной ВЭЖХ на С18 экстрактов из экссудатов микоризированных корней.
Начальная изократическая фаза с 20%-ым ацетонитрилом длилась 10 минут, после чего следовал 20-минутный 20-100%-ый градиент ацетонитрила. Профиль демонстрирует большое количество загрязняющего материала, присутствующего в экссудатах микоризированных корней. Сбор фракций производился каждые две минуты, и фракции были протестированы на биологическую активность с помощью MtENOD11 и VsHab. Горизонтальные столбики показывают время удерживания веществ из фракции A, активных по отношению к MtENOD11, и более гидрофобных веществ из фракции B, которые активны по отношению к VsHab.
Фиг.3. Полупрепаративный профиль обращенно-фазной ВЭЖХ на С18 экстрактов из экссудатов прорастающих спор.
Хроматографические условия те же, что и па Фиг.2. Профиль демонстрирует, что экссудаты спор содержат намного меньше загрязняющего материала по сравнению с экссудатами микоризированных корней. Сбор фракций производился каждые две минуты, и фракции были протестированы на биологическую активность с помощью MtENOD11 и VsHab. Горизонтальные столбики показывают время удерживания веществ из фракции A, активных по отношению к MtENOD11, и более гидрофобных веществ из фракции B, которые были активны по отношению к VsHab.
Фиг.4. Влияние мягкого метанольного гидролиза на биологическую активность фракции A.
Мягкий метанольный гидролиз, как сообщалось, удаляет сульфатную группу у сульфатированных ЛХО без изменения других структурных особенностей этих молекул. Фракция A, собранная во время полупрепаративной ВЭЖХ экссудатов прорастающих спор, была подвергнута мягкому гидролизу и проверена на биологическую активность в тестах на MtENOD11 и VsHab. Биологическая активность представлена вертикальными столбиками. В то время как негидролизованная фракция А являлась активной в отношении MtETMODll и неактивной в отношении VsHab, гидролизованная фракция потеряла активность в отношении MtENOD11 и приобрела активность в отношении VsHab. Эти данные свидетельствуют о том, что биологическая активность фракции А в тесте на MtENOD11 являлась результатом присутствия сульфатированных ЛХО.
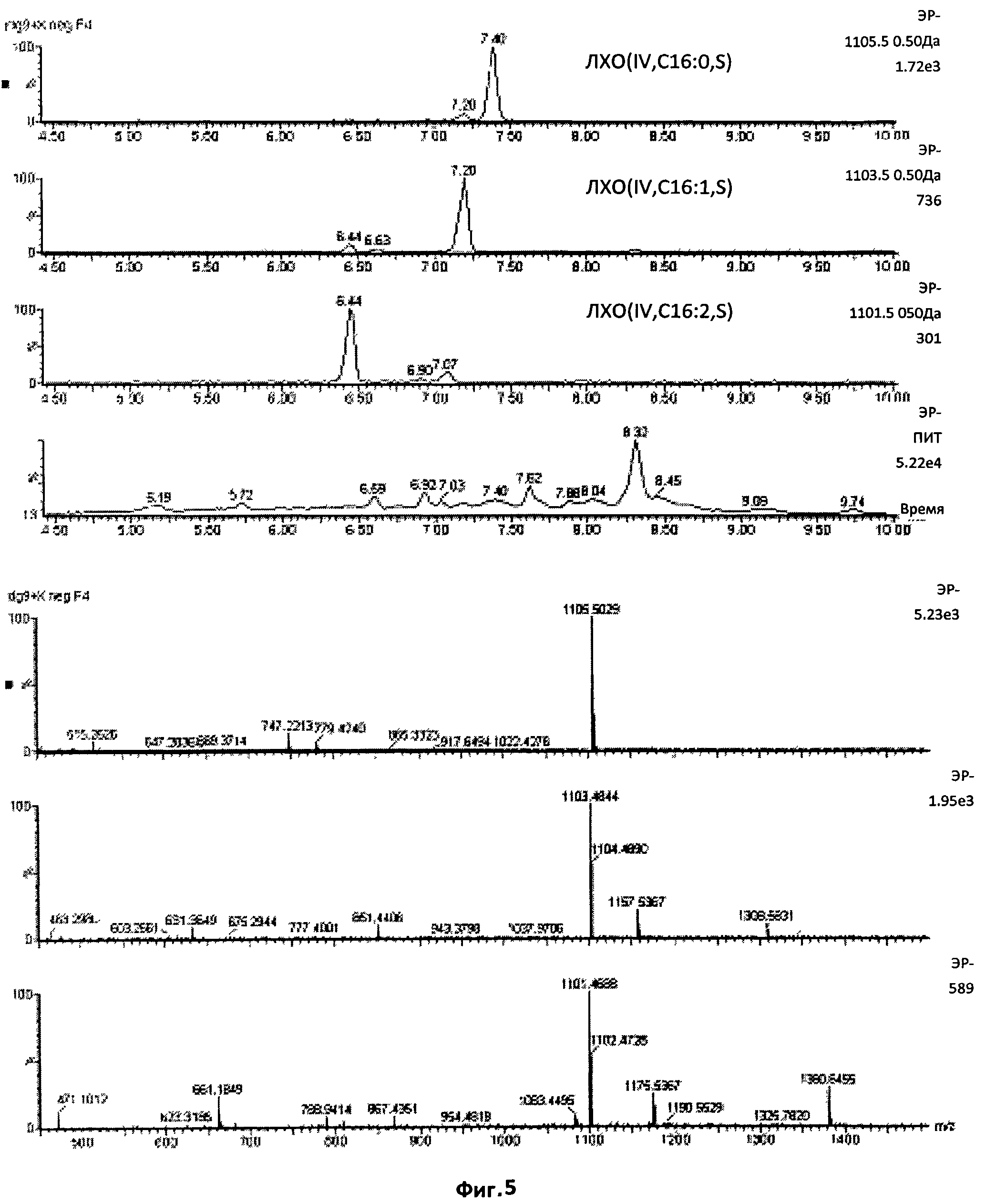
Фиг.5. Тетрамерные сульфатированные ЛХО, N-ацилированные жирными кислотами, содержащими 16 атомов углерода.
Масс-спектр УЭЖХ/МС, в режиме отрицательных ионов, фракции 4, изолированной после полупрепаративной ВЭЖХ на С18. Приведены экстрагированные ионные токи, соответствующие сульфатированным тетрамерам, и соответствующие им спектры. Эта фигура демонстрирует, что соединения, дававшие сигнал в области отношения массы к заряду, равного 1101,5, 1103,5 и 1105,5, фактически присутствовали в образцах. Эти значения отношения массы к заряду (m/z) соответствуют сульфатированным тетрамерным ЛХО, N-ацилированным, соответственно, C16:2, C16:1 и C16:0. Что касается относительной интенсивности этих трех сигналов, 1105,5 (ЛХО-IV-C1 6:0) являлся самым сильным, за которым следовал 1103,5 (ЛХО-IV-C16:1).
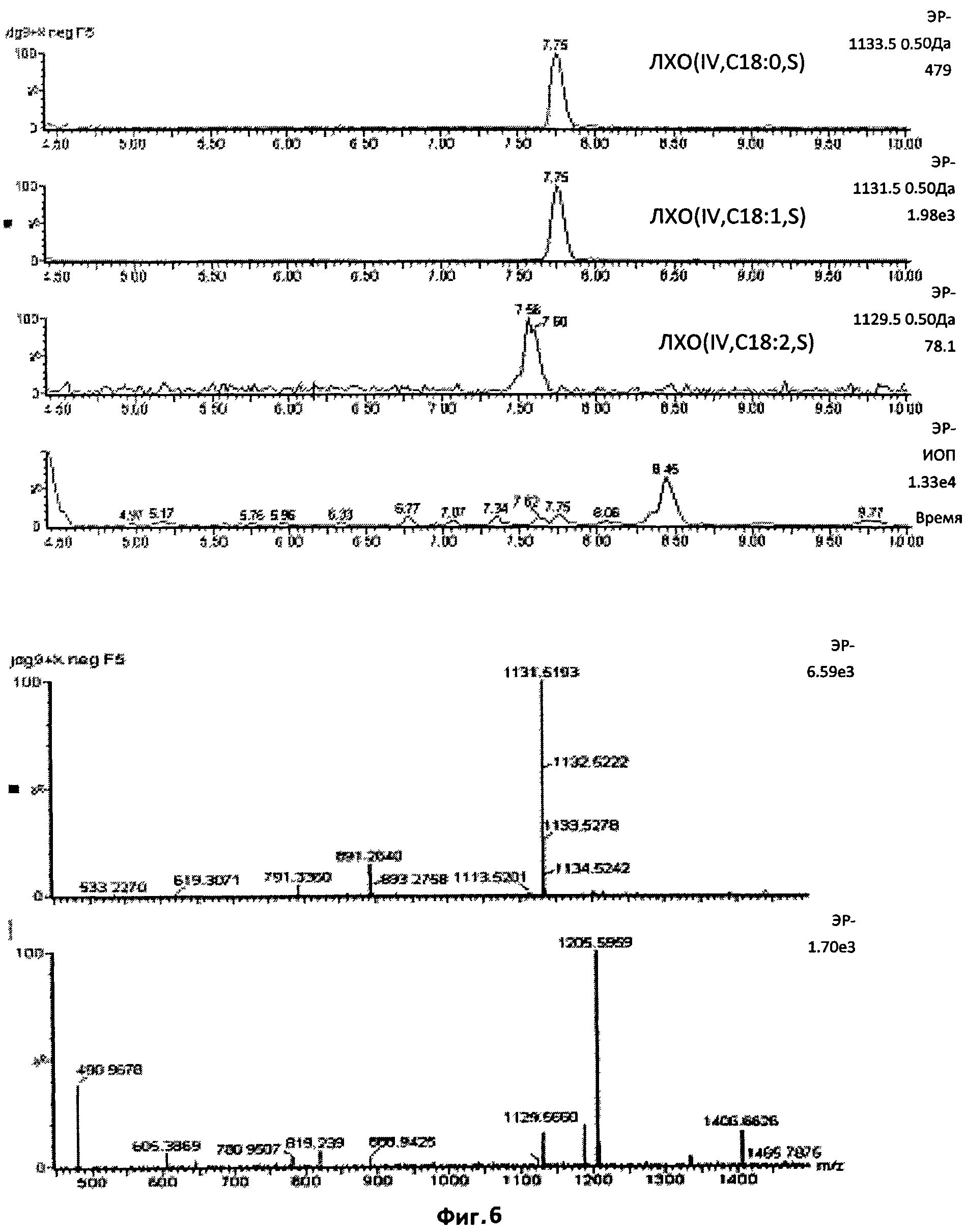
Фиг.6. Тетрамерные сульфатированные ЛХО, N-ацилированные жирной кислотой С18:1.
Масс-спектр УЭЖХ/МС, в режиме отрицательных ионов, фракции 5, изолированной после полупрепаративной ВЭЖХ на С18, демонстрирующий, что соединение, присутствовавшее в наибольшем количестве (отношение массы к заряду 1135,5), N-ацилирование жирной кислотой С18:1.
Этот профиль также показывает, что ЛХО, несущий жирную кислоту С18:0 (отношение массы к заряду 1133,5), отсутствовал в этой фракции, так как этот ион является единственным, превышающим на две единицы отношения массы к заряду ЛХО, несущий цепь С18:1. Как демонстрирует второй масс-спектр, диненасыщенный С18-ЛХО присутствовал в очень незначительном количестве.
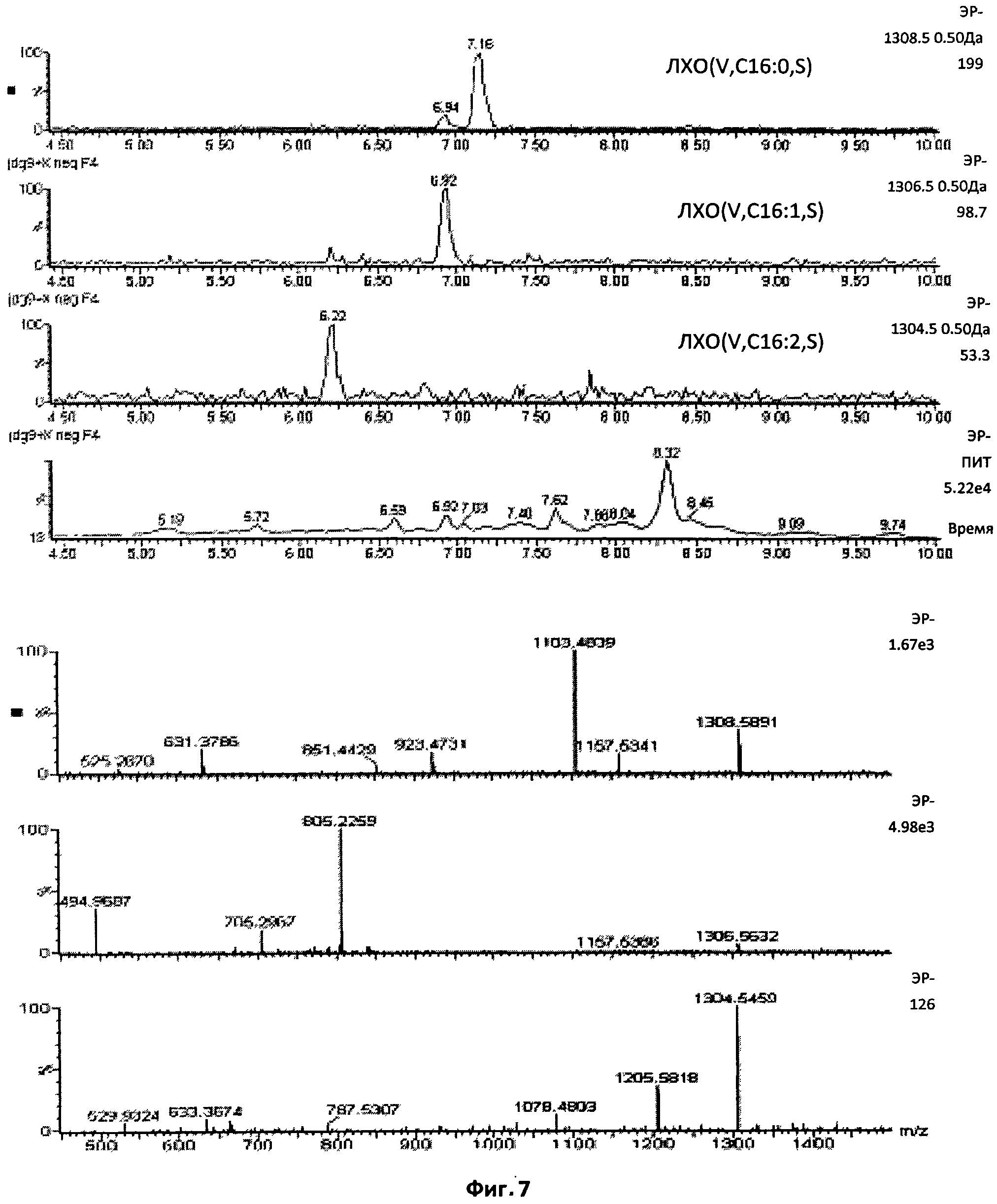
Фиг.7. Пентамерные сульфатированные ЛХО, N-ацилированные остатком жирной кислоты С18:1.
Этот профиль демонстрирует, что также присутствовали липохитопентамеры, но по сравнению с соответствующими тетрамерами (см. Фиг.5), их содержание было приблизительно в 30 раз ниже. Был обнаружен ЛХО-V-C18:1.
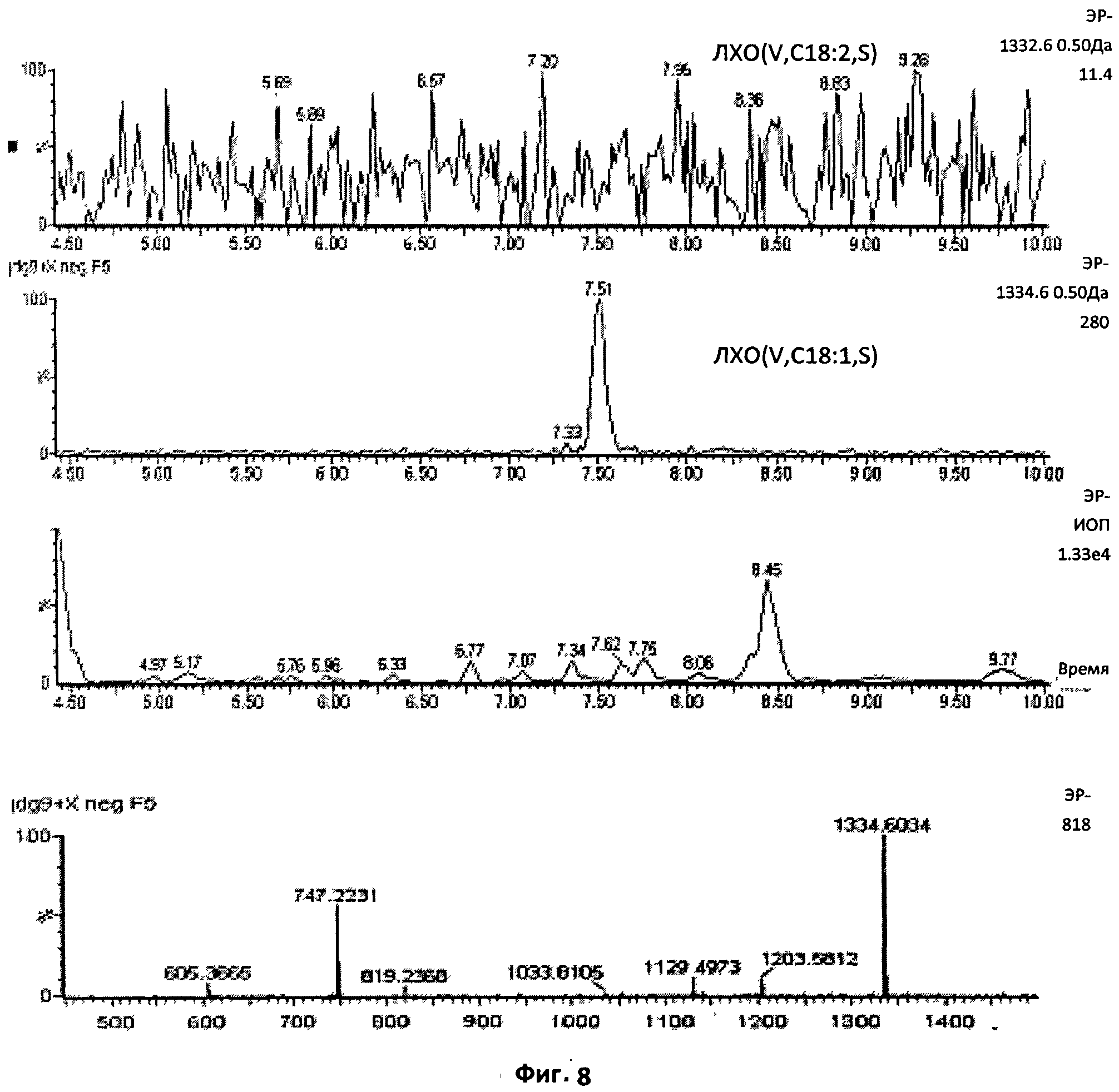
Фиг.8. Проверка на присутствие или отсутствие конкретного соединения.
Когда расчетная масса не соответствовала ионам, присутствовавшим в образце, в профиле вместо единственного пика появлялось очень большое количество фоновых пиков. Очень сложный профиль, полученный при использовании ионного тока с отношением массы к заряду 1332.6, демонстрирует отсутствие в образце хитопентамера С18:2. Напротив, отчетливый единственный пик, наблюдавшийся при использовании ионного тока с отношением массы к заряду 1334.6, ясно указывает на присутствие пентамера С18:1.
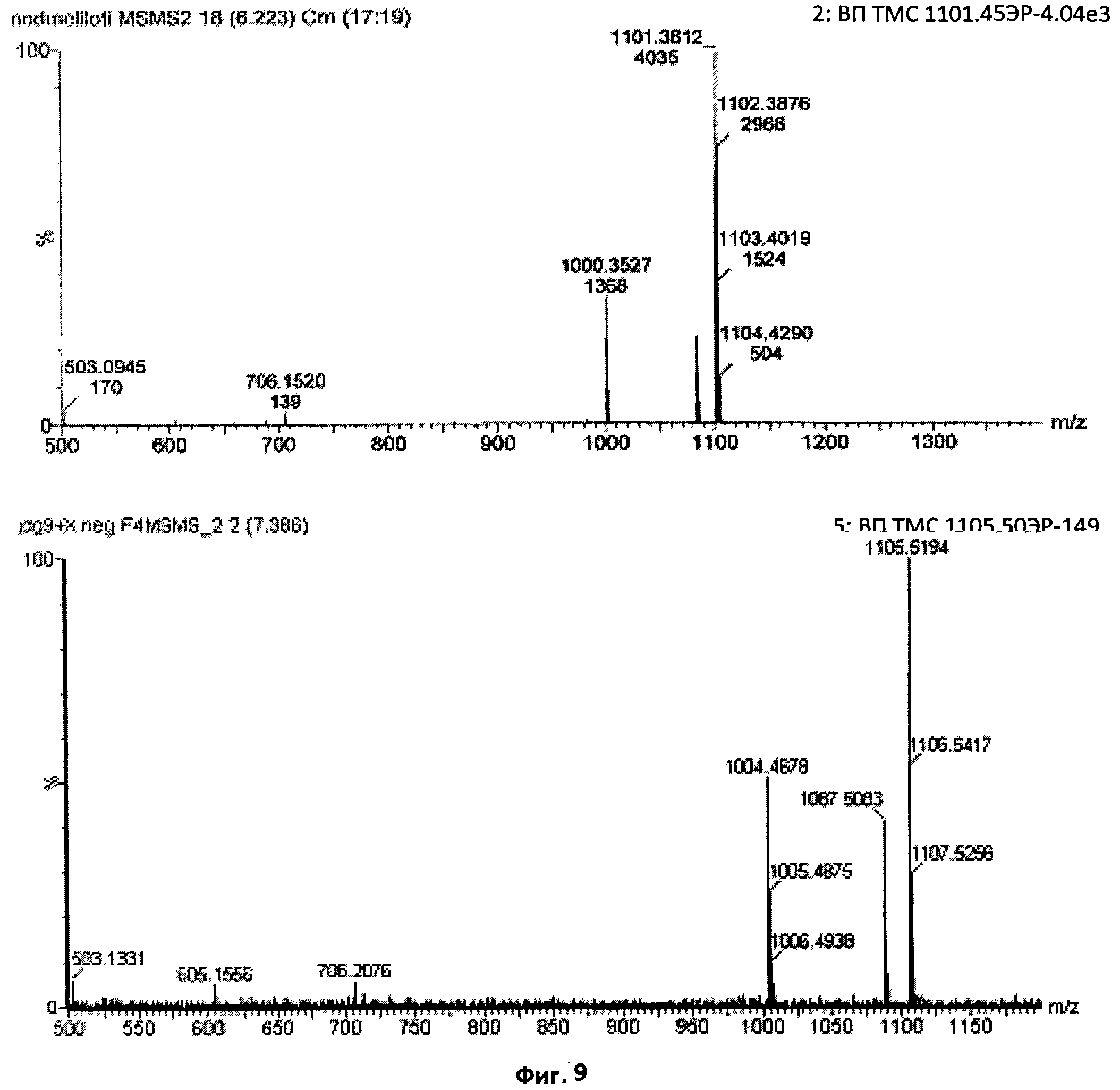
Фиг.9. Сравнение характера фрагментации при ТМС основного сульфатированного фактора Мус и Nod-фактора из S.meliloti.
Демонстрация присутствия соединений, имеющих массу, соответствующую ожидаемому времени удерживания в ВЭЖХ, недостаточна для подтверждения их структуры. По этой причине был проведен анализ основного сульфатированного соединения Мус с помощью ТМС. На данной фигуре приведено сравнение, при ТМС в режиме отрицательных ионов, сульфатированного тетрамерного Nod-фактора из S.meliloti, N-ацилированного С16:2, с основным тетрамерным "фактором Мус", присутствовавшим в образце. Характерные ионы редуцирующего конца с отношением массы к заряду 503 (Y2), 605 и 706 (Y3) отчетливо обнаруживались в обоих случаях, как и характерная потеря нейтрального фрагмента массой 101 а.е.м. (внутрициклический разрыв), начинавшаяся на стадии молекулярного иона. Точное совпадение характера фрагментации указывает на структурное единство этих двух молекул.
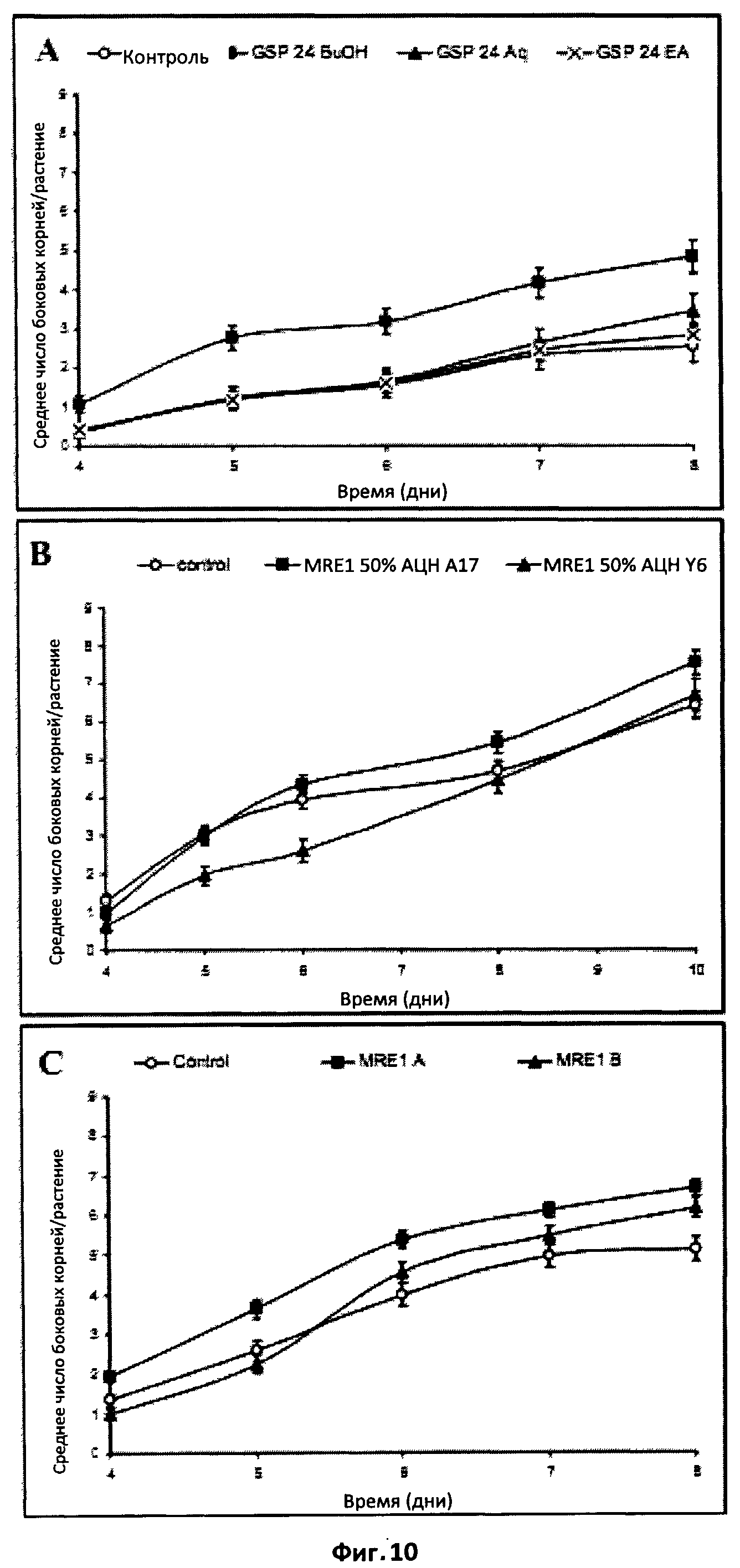
Фиг.10. Эффект фракций экстракта Мус на формирование боковых корней у M.truncatula.
(A) Сигнал АМ-гриба, который стимулирует ФБК, является амфифильным.
Сравнение действия водного (Aq), бутанольного (ВиОН) и этилацетатного (ЕА) экстрактов из экссудатов прорастающих спор (GSP24) на M.truncatula А17. Бутанольный экстракт стимулировал ФБК, начиная с 5-го дня (статистически достоверно при P<0,05), тогда как водный и этилацетатный экстракты были неактивны.
(B) Стимуляция ФБК осуществляется через симбиотический путь сигналинга DMI.
Сравнение действия бутанольного экстракта экссудата микоризированных корней (MRE1), очищенного ТФЭ и элюированного 50%-ым ацетонитрилом, у M.truncatula дикого типа (A17) и у мутанта dmil (Y6). Экстракт Мус стимулировал ФБК у растения дикого типа, но не у мутанта dmil.
(C) Как фракция A, так и фракция B стимулировали ФБК.
Фракции A и B собирали после полупрепаративной ВЭЖХ экссудатов микоризированных корней (MRE-1). Фракция MRE-1A содержала сульфатированные ЛХО, а фракция MRE-1B - несульфатированные ЛХО. Обе фракции статистически достоверно стимулировали ФБК (P<0,05).
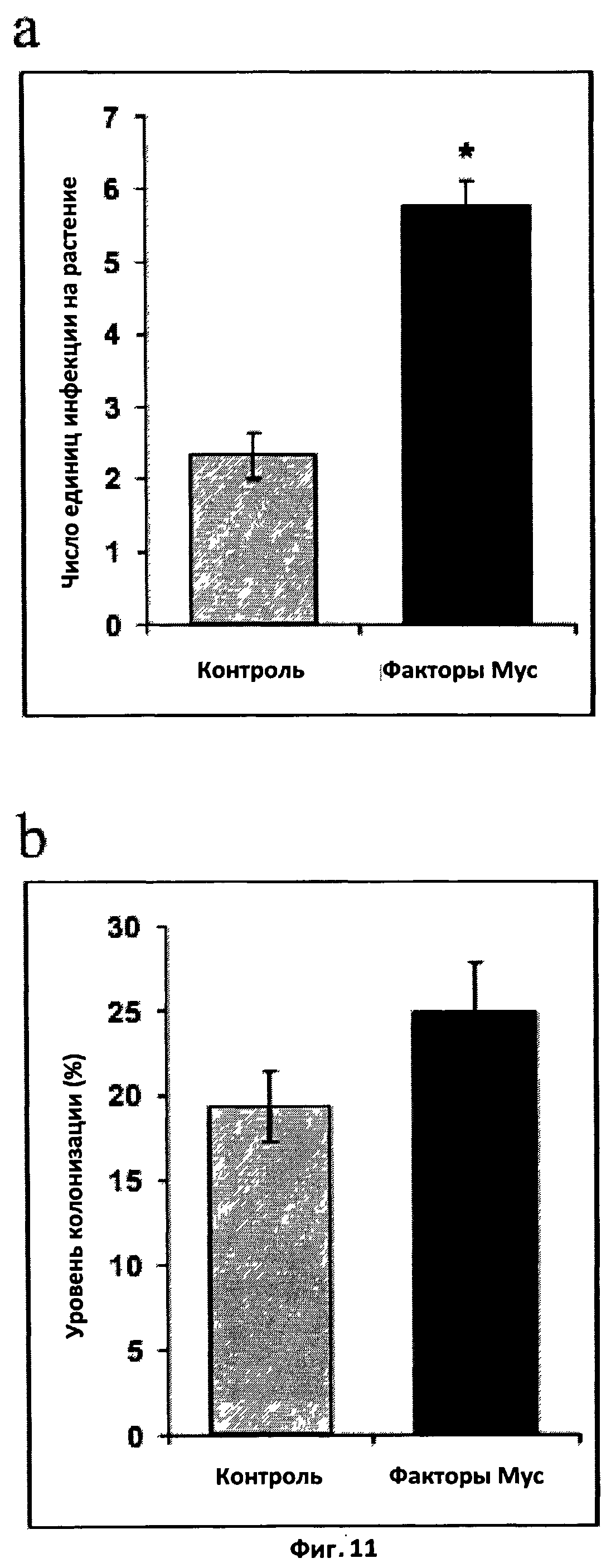
Фиг.11. Эффект смеси сульфатированных и несульфатированных факторов Мус на микоризацию Medicago truncatula.
a. Микоризация в аксенических условиях. Растения выращивали в пробирках на желированной скошенной питательной среде M, содержащей факторы Мус в концентрации 10-8 M. 50 стерильных спор (Glomus intraradices) были помещены вблизи от корней рассады. Степень микоризации была измерена путем подсчета единиц инфекции спустя шесть недель после инокуляции. Результаты были проанализированы с применением непараметрического статистического теста Крускала-Уоллиса.
b. Микоризация в нестерильных условиях. Растения выращивали на субстрате, состоящем из обожженных глиняных гранул и инокулированном 50 стерильными спорами G.intraradices; факторы Мус добавляли к питательному раствору в концентрации 10-8 M. Спустя три недели после инокуляции колонизацию корня оценивали методом пересечения решетки.
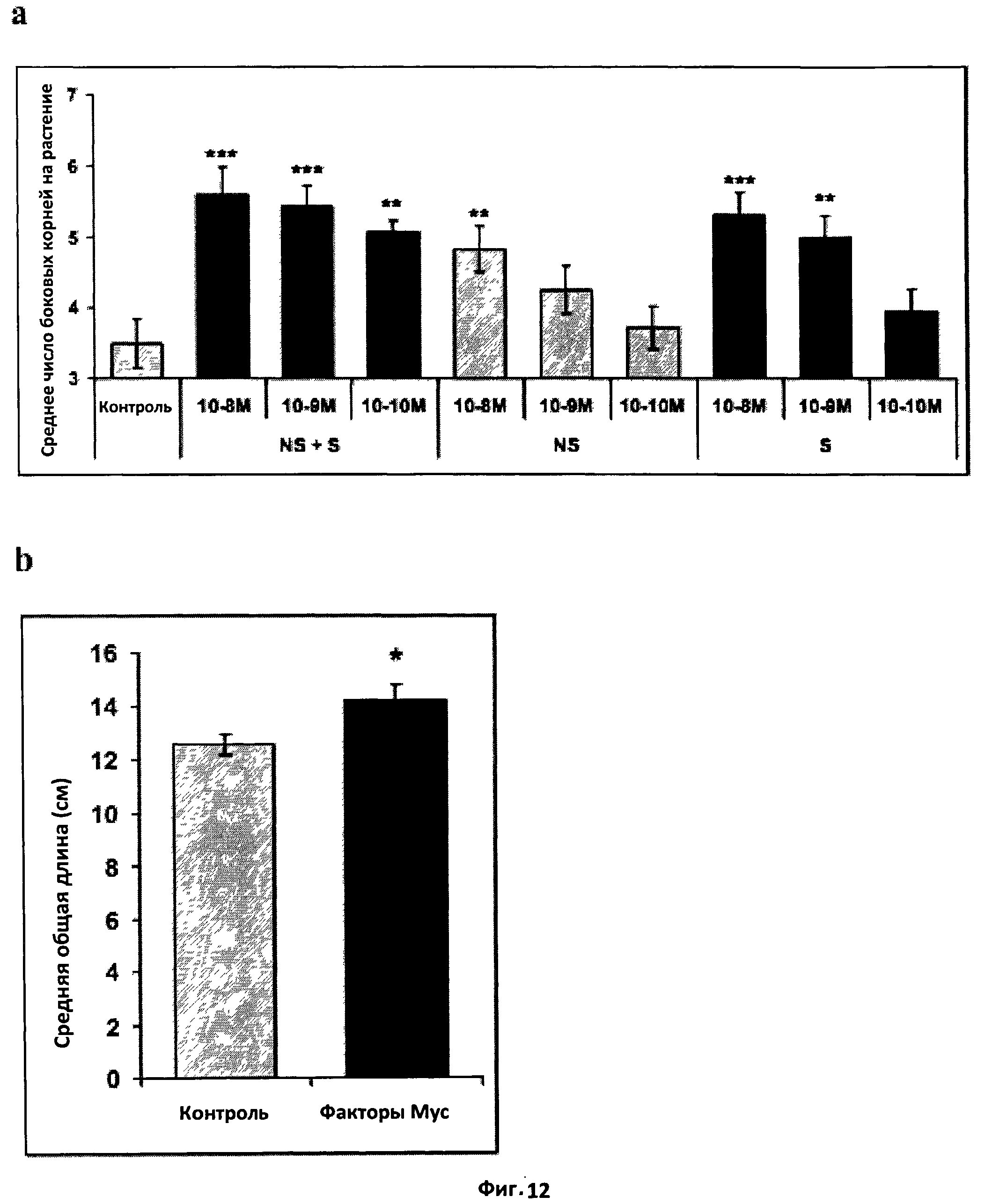
Фиг.12. Эффект факторов Мус на архитектуру корня Medicago truncatula.
a. Эффект на формирование боковых корней. Гистограмма, показывающая эффект смеси сульфатированных и несульфатированных факторов Мус (NS+S), сульфатированных факторов Мус (S) и несульфатированных факторов Мус (NS) в концентрации 10-8 M, 10-9 M и 10-10 M на формирование боковых корней M.truncatula дикого типа (A17) спустя восемь дней после обработки.
В эксперименте были использованы сорок растений, и статистический анализ был проведен с применением t-теста Стьюдента при сравнении контрольных и обработанных растений.
b. Эффект на общую длину корня. Гистограмма, показывающая эффект смеси сульфатированных и несульфатированных факторов Мус на общую длину корней рассады. Рассаду выращивали в течение восьми дней, затем корни отрезали и проводили сканирование и измерение корневой системы с помощью программного обеспечения WinRhizo. Данные были проанализированы с применением теста Крускала-Уоллиса.
(*) и (**) обозначают, соответственно, значимое (Р<0,05) или высоко значимое (Р<0,01) различие, а вертикальная черта обозначает стандартную ошибку среднего (СОС).
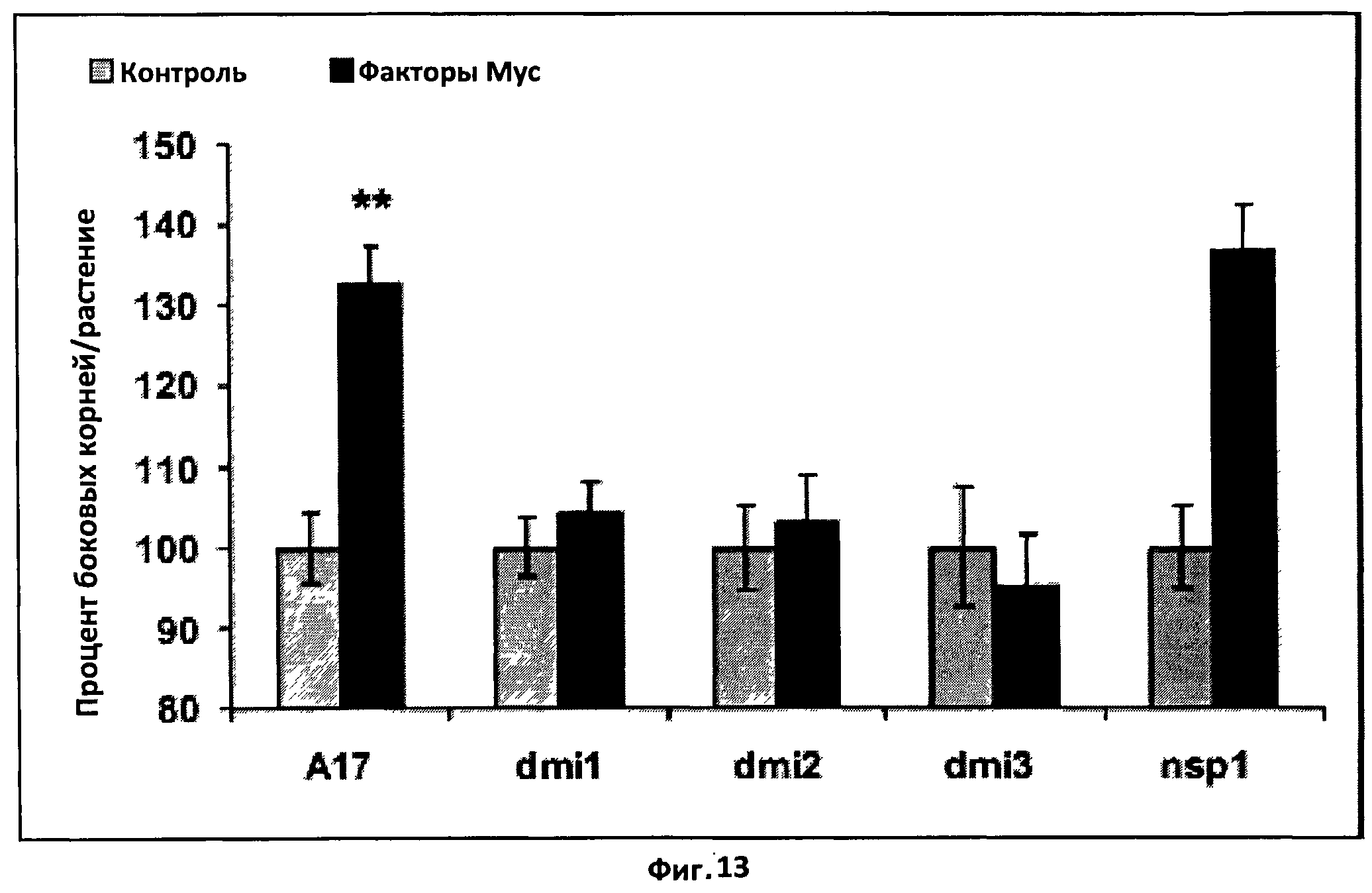
Фиг.13. Генетический анализ активируемого фактором Мус пути сигналинга, приводящего к стимуляции формирования боковых корней.
Гистограмма, показывающая эффект несульфатированного фактора Мус 10-8 M) на формирование боковых корней M.truncatula дикого типа (A17) и мутантов по симбиотическому пути сигналинга dmil, dmi2, dmi3 и nsp1. Средние значения представлены как процент от контрольной величины спустя восемь дней после обработки.
Для каждого генотипа были объединены данные по меньшей мере двух независимых экспериментов с 40 растениями в каждом, и статистические сравнения были сделаны с использованием t-теста Стьюдента при сравнении контроля и каждой из обработок. (**) указывает на высоко значимое (Р<0,01) различие, а вертикальная черта обозначает стандартную ошибку среднего (СОС).
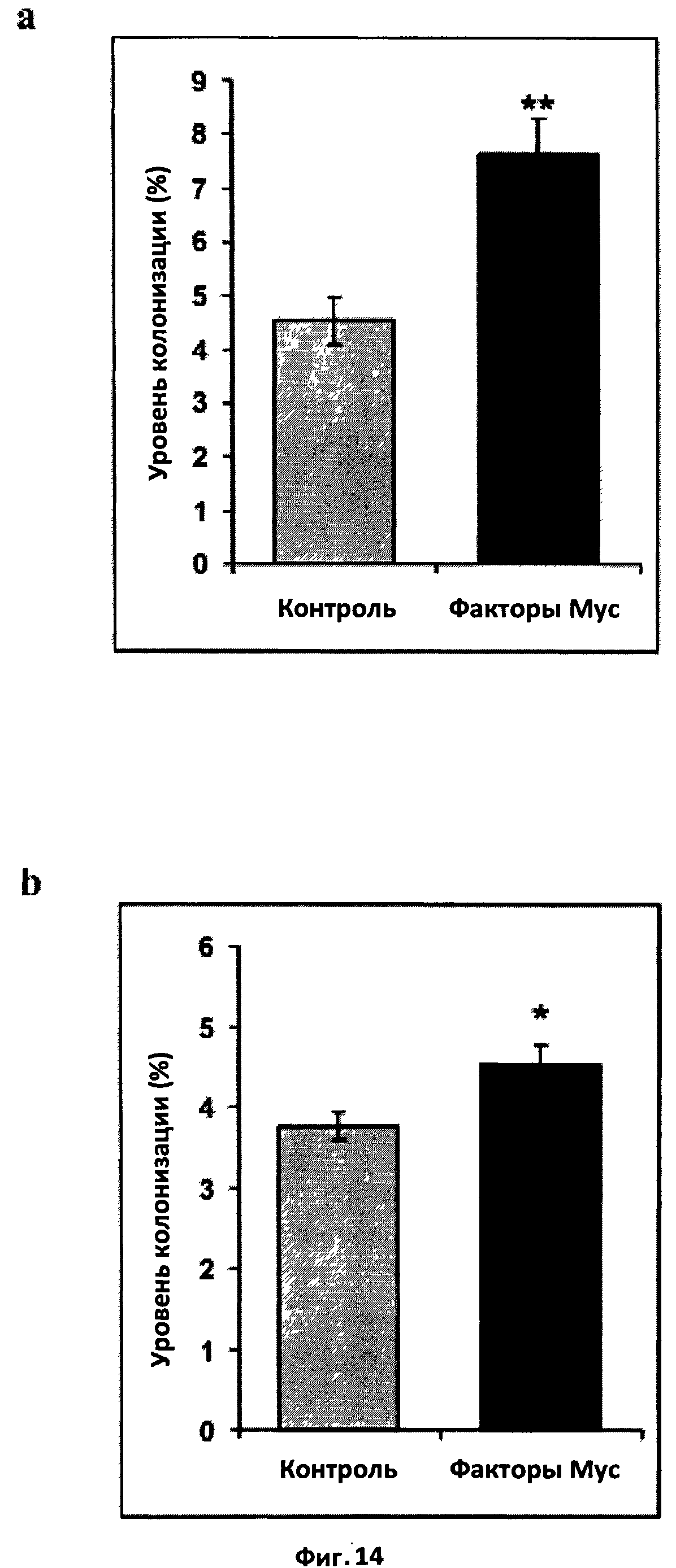
Фиг.14. Эффект факторов Мус на микоризную колонизацию вырезанных трансформированных корней моркови in vitro.
a. Эффект смеси бактериальных сульфатированных и несульфатированных
факторов Мус. Корни инокулировали стерильными спорами G.intraradices (10 спор/мл питательной среды) и обрабатывали один раз в неделю в течение трех недель составом, в котором присутствовала или отсутствовала смесь факторов Мус в концентрации 10-8 M. Шесть недель спустя наблюдали уровень микоризной колонизации. (**) обозначает высоко достоверное различие с контролем (t-тест Стьюдента, значение Р<0,01). Вертикальная черта обозначает стандартную ошибку среднего (СОС).
b. Эффект смеси синтетических сульфатированных и несульфатированных факторов Мус. Корни инокулировали стерильными спорами G.intraradices (100 спор/мл питательной среды) и обрабатывали один раз в неделю в течение четырех недель составом, в котором присутствовала или отсутствовала смесь факторов Мус в концентрации 10-8 M. Восемь недель спустя наблюдали уровень микоризной колонизации. (*) обозначает достоверное различие с контролем (t-тест Стьюдента, значение P=0,0119).
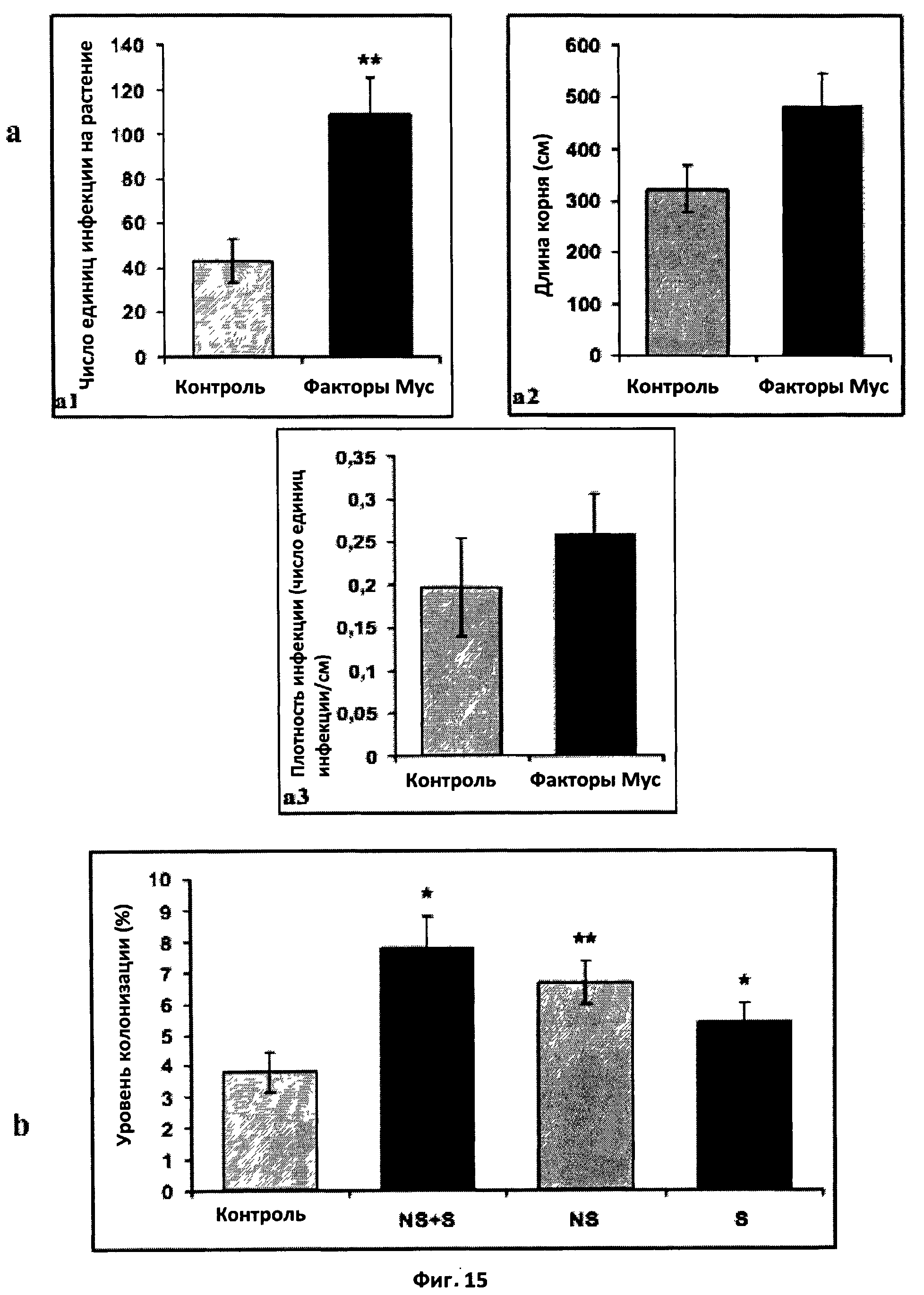
Фиг.15. Эффект факторов Мус на микоризацию Tagetes patula.
a: Эффект смеси сульфатированных и несульфатированных факторов Мус на число единиц инфекции на растение (a1), длину корня (a2) и плотность инфекции (a3). Растения инокулировали приблизительно 100 стерильными спорами Glomus inlraradices и обрабатывали дважды в неделю в течение трех недель составом, в котором присутствовали или отсутствовали факторы Мус в концентрации 10-8 M. После четырех недель определяли число единиц инфекции, длину корня и плотность единиц инфекции. (**) обозначает высоко достоверное различие с контролем (t-тест Стьюдента, значение Р=0,004086).
b: Эффект сульфатированных (S), несульфатированных (NS) или смеси сульфатированных и несульфатированных (NS+S) факторов Мус на микоризную колонизацию корня. Растения инокулировали приблизительно 100 стерильными спорами Glomus intraradices и обрабатывали дважды в неделю в течение трех недель составом, в котором присутствовали или отсутствовали факторы Мус в концентрации 10-8 M. После четырех недель измеряли уровень колонизации.
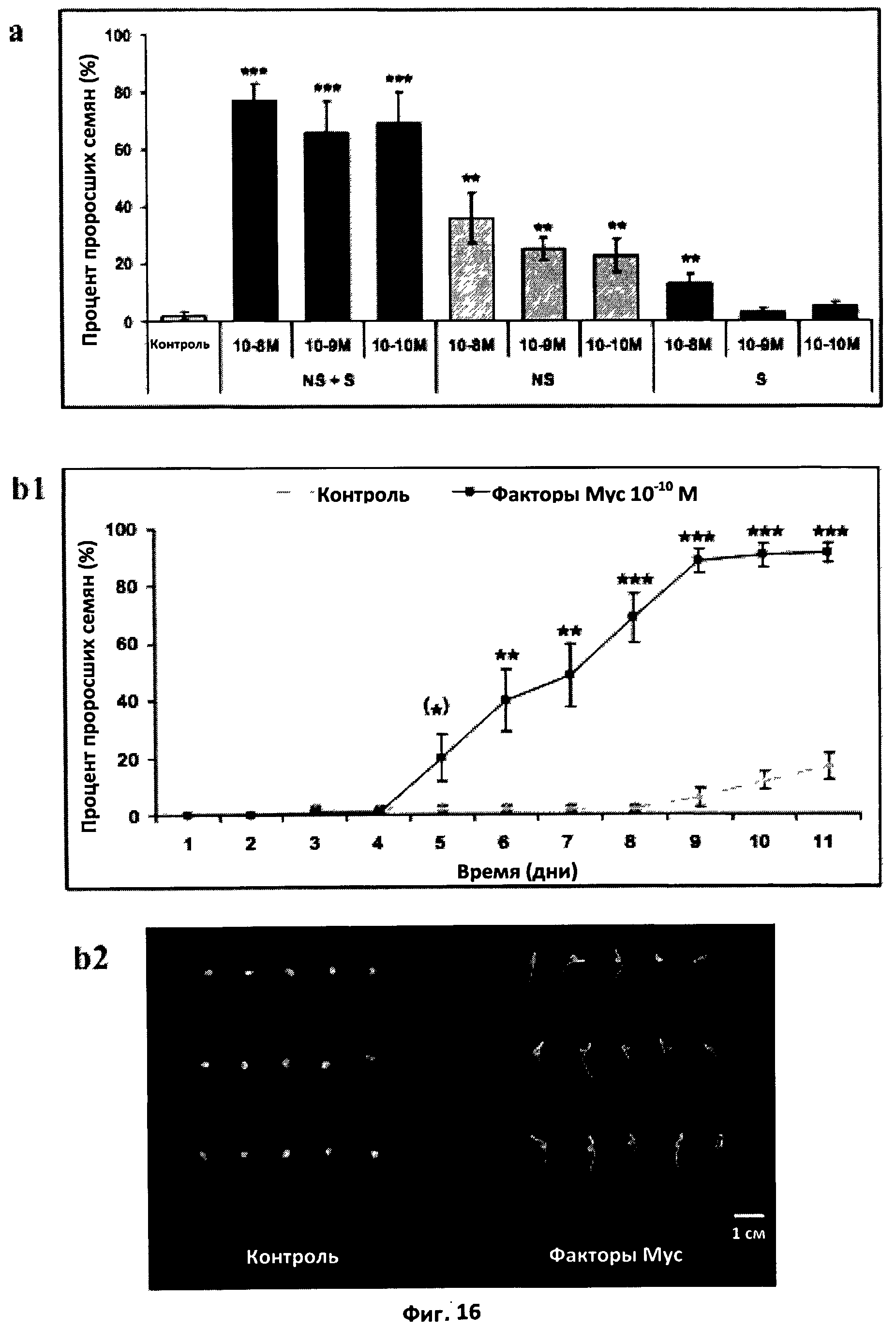
Фиг.16. Эффект факторов Мус на прорастание семян томата.
a. Эффект несульфатированных (NS), сульфатированных (S) и смеси сульфатированных и несульфатированных (NS+S) факторов Мус на прорастание семян томата при 14°C. Факторы Мус добавляли в чашки для прорастания в концентрации 10-8 M, 10-9 M и 10-10 M. Уровень прорастания оценивали ежедневно. Результаты были проанализированы с помощью теста Крускала-Уоллиса. (***) и (**) обозначают, соответственно, очень высоко (значение Р<0,001) и высоко (<0,01) достоверное различие с контролем, а вертикальная черта обозначает стандартную ошибку среднего (СОС).
b. Эффект смеси сульфатированных и несульфатированных факторов Мус на прорастание семян при 14°C.
b1. Кинетика прорастания. Факторы Мус были добавлены в концентрации 10-10 M. Результаты были проанализированы с помощью непараметрического теста Крускала-Уоллиса. После 6-го дня различия были высоко значимыми. Вертикальная черта обозначает стандартную ошибку среднего (СОС).
b2. Фотография характерных чашек для прорастания с добавлением и без добавления факторов Мус спустя десять дней после засевания.
МАТЕРИАЛЫ И МЕТОДЫ
Естественные источники факторов Мус
Штамм DAOM 197198 АМ-гриба Glomus inlraradices, который поддерживался в совместной культуре с вырезанными корнями в течение многих лет (Chabot et al., 1992), хорошо охарактеризован, и его геном в настоящее время секвенируется. Этот штамм используется компанией PREMIER TECH для промышленного производства коммерческих инокулянтов и для производства очищенных спор в исследовательских целях. Например, эти очищенные споры были использованы в качестве источника ДНК для проекта секвенирования генома G.intraradices. Авторы настоящего изобретения использовали два вида экссудатов, оба из которых были приготовлены из материалов, приобретенных в PREMIER TECH BIOTECHNOLOGIES (Rivere-du-Loup, Quebec, Canada):
(i) Экссудаты микоризированных корней (ЭМК). Микоризу продуцировали совместным культивированием G.intraradices с вырезанными трансформированными корнями моркови. Питательная среда была отверждена с помощью Phytagel. После соответствующего роста микоризированных корней гель разжижали путем добавления цитрата натрия в качестве хелатирующего агента, и жидкие ЭМК выдерживали в 4-литровых контейнерах, которые хранили при 4°C.
(ii) Экссудаты прорастающих спор (ЭПС). Очищенные стерильные споры АМ-гриба Glomus intraradices выдерживали в бутылках, содержащих приблизительно один миллион спор. Бутылки хранили при 4°C. Споры проращивали при 30°C в инкубаторе с 2%-ым CO2 в течение 10 дней.
Биотесты, использованные для очистки факторов Мус
Для обнаружения присутствия симбиотических сигналов AM-грибов на различных стадиях выделения и очистки использовались три биотеста. (i) Было показано, что конструкция M.truncatula ENOD11::GUS индуцируется при формировании микоризы и при воздействии диффундирующих соединений из различных АМ-грибов j (Journet ct. al., 2001; Kosuta et al. 2003) (=тест на MtENOD11). (ii) Формирование боковых корней у M.truncatula, как было показано, стимулируется диффундирующими соединениями из различных АМ-грибов, и для этой реакции необходим симбиотический путь сигналинга DMI (Olah et al., 2005) (=тест на MtLRF). (iii) Кроме того, авторы данного изобретения использовали модифицированный тест на ветвление корневых волосков у Vicia saliva (горошка посевного), позволяющий обнаруживать различные несульфатированные ЛХО (=тест на VsHab).
(i) Индукция симбиотического гена MtENODl 1 у трансгенного Medicago truncatula.
Ранее было показано с помощью экспериментов, в которых АМ-гриб был отделен от корня растения целлофановой мембраной, что диффундирующее соединение АМ-гриба может индуцировать экспрессию трансгена промотор MtENODl 1-gusA в растущих боковых корнях М.truncatula (Kosuta et al., 2003). Авторы настоящего изобретения использовали ранее описанный протокол (Andriakaja et al., 2007) со следующими модификациями: бумажный диск не был помещен на чашку с агаром, и обработку производили путем добавления 40 микролитров на проросток. Чтобы проверить, был ли ответ ENOD11 индуцирован через сигнальный путь DMI, сравнили ответ, наблюдавшийся в М. truncatula у линии дикого типа А17 и у мутантной линии, несущей мутацию в гене DMI1 (мутация Y6).
(ii) Ветвление корневого волоска горошка посевного
Горошек посевной (Vicia sativa, подвид nigra) представляет собой мелкосеменное бобовое растение, удобное для микроскопического наблюдения за деформациями корневых волосков. Деформации корневых волосков горошка посевного вызываются не только Nod-факторами определенного бактериального симбионта Rhizobium leguminosarum, биовар viciae, но также и множеством несульфатированных Nod-факторов (Roche et al., 1991; Price ct al., 1992).
Таким образом, этот тест подходит для обнаружения присутствия несульфатированных ЛХО. В предыдущих работах тест проводили в жидкой среде. Авторы данного изобретения разработали тест на чашке с агаром, который более чувствителен и воспроизводим. Семена сначала стерилизовали в серной кислоте в течение 20 минут, дважды ополаскивали стерильной водой, затем обрабатывали в течение 20 минут гипохлоритом кальция (5 г/150 мл после фильтрации через бумажный фильтр) и пять раз ополаскивали стерильной водой. Семена выдерживали в воде в течение ночи при 4°C, переносили на чашки с мягким агаром и инкубировали три дня при 4°C для увеличения однородности прорастания. Вслед за этим чашки выдерживали в течение 36 часов в темноте при 22°C для прорастания. Пять молодых проростков (длина корня приблизительно 1 см) засевали в чашки Петри со средой Фареуса, запечатывали Парафильмом и инкубировали три дня в вертикальном положении в вегетационной камере при 22°C. Когда на корнях появлялись волоски, вдоль корней осторожно помещали 40 микролитров тестируемого раствора и выращивали рассаду в течение 30 часов при 22°C. Для наблюдения ветвления корневых волосков, из корней приготовляли срезы, которые помещали между предметным и покровным стеклом в 0,02%-ом растворе метилена синего и наблюдали под оптическим микроскопом. Наблюдали десять растений для каждого из экспериментальных условий.
Тесты на микоризацию
Источниками инокулюма АМ-грибов для экспериментов по микоризации были стерильные споры Glomus intraradices, приобретенные в Premier Tech Biotechnologies Ltee (Riviere-du-loup, Quebec, Canada) или полученные на вырезанных корнях трансформированной моркови, как описано Becard and Fortin (1988). Микоризированные корни трансформированной моркови культивировали, как описано в Chabot ct al. (1992), и пересевали каждые десять недель на среде M (Becard and Fortin, 1988) желированной с помощью 0,4%-ного Phytagel (Sigma). После разжижения Phytagel цитратным буфером (Doner and Becard, 1991), споры собирали, как описано, в стерильных условиях и хранили при 4°C в воде Ultrapure в течение по меньшей мере четырех недель перед использованием.
Тесты на микоризацию были выполнены на трех видах растений, модельном бобовом M.truncatula и двух не относящихся к бобовым растениях, моркови (Daucus carota, семейство Umbelliferae) и бархатцах мелкоцветных (Tagetes pa tula, семейство Asteraceae).
Факторы Мус растворяли в воде/ацетонитриле (50/50) для приготовления 10-3 M базового раствора, который затем разбавляли до нужной концентрации водой или питательной средой. Равное количество следов растворителя ацетонитрила добавляли в контрольные чашки.
Микоризация вырезанных корней трансформированной моркови in vitro
Стерильные вырезанные корни трансформированной моркови выращивали на среде M, желированной с помощью 0,4%-ного Phytagcl, при 24°C в темноте и пересевали каждые десять недель (Chabot et al., 1992). Корни собирали путем разжижения Phytagel нитратным буфером (Doner and Becard, 1991) и промывали стерильной деионизированной водой. Чашки для теста на микоризацию были приготовлены следующим образом: в чашки Петри (0 90 мм) наливали первый слой 20 мл среды M, содержащей 0,3% Phytagel, и давали ему затвердеть. Затем наливали второй слой той же самой среды, содержащий 20 или 200 спор/мл и факторы Мус в нужной концентрации. В контрольных чашках вместо раствора факторов Мус использовали равный объем среды, используемой для приготовления раствора факторов Мус. Фрагменты корней располагали на поверхности среды приблизительно в равном количестве (число фрагментов и длина корней) в разных чашках. Чашки запечатывали лентой Parafilm и инкубировали в темноте в фитотроне при 24°C и 50%-ой влажности в течение шести или восьми недель. Факторы Мус добавляли один раз в неделю на поверхность чашки в течение трех или четырех первых недель для экспериментов длительностью шесть или восемь недель соответственно. Для наблюдения грибной колонизации корни собирали после разжижения Phytagel цитратным буфером, промывали и окрашивали чернильно-уксусным методом (Vierheilig et al., 1988). Уровень колонизации оценивали методом пересечения решетки (Giovanetti and Mosse, 1980).
Микоризация Tagetes patula in vivo
Семена Tagetes patula, сорт Legion d'honneur, были получены от Caillard (84091 Avignon, France). Рассаду выращивали четыре недели в пробирках Falcon объемом 50 мл, заполненных субстратом, приготовленным из вымытой и обработанной в автоклаве глины (charred granular Montmorillonite; ref "Oil Dry US Special", Brenntag Bretagne, Zl dc Tory, BP41, Avenue des Ferrancins, 71210 Montchanin). Чтобы обеспечить водоснабжение рассады, в основании пробирок были проделаны три небольших отверстия, и пробирки были индивидуально помещены в пластмассовые коробки (5,5 см диаметром, 7 см высотой) объемом 120 мл, закрытые непрозрачной крышкой с отверстиями,' куда вставляли и фиксировали пробирки Falcon.
Коробки были заполнены водой на 80 мл и обернуты алюминиевой фольгой. Глиняный субстрат в пробирках Falcon был увлажнен 20 мл низкофосфатного раствора Лонг-Эштона (Flewitl el al, 1966). В каждую пробирку под поверхность субстрата было помещено одно семя, и сто грибных спор были распределены вокруг семени в 1 мл 10-7 M раствора факторов Мус или контрольного раствора. Каждое растение получало 1 мл 10-7 M раствора факторов Мус или 1 мл контрольного раствора два раза в неделю в течение трех недель. Горшки были помещены в вегетационную камеру при 25°C, со световым периодом длительностью 16 ч и интенсивностью света 180 мкэйнштейнов·m-2·s-1.
Были проведены два ряда экспериментов. В первом смесь сульфатированных и несульфатированных синтетических факторов Мус была протестирована на 12 проростках за обработку. Во втором сульфатированные, несульфатированные факторы Мус и их смесь были протестированы на 20 проростках за обработку. После 4 недель растения были собраны. Внутренняя корневая система была покрашена черными чернилами Шеффера (Vicrheilig et al, 1998). Количественная оценка колонизации корня грибом была выполнена под бинокулярной лупой, при этом использовали два способа: (i) в первом эксперименте число единиц инфекции (зон, содержащих арбускулы, везикулы и внутренние сети гиф) было подсчитано для каждого растения, и (ii) во втором эксперименте процент длины корня, колонизированной грибом, то есть демонстрирующей арбускулы, везикулы или и то, и другое, был определен методом пересечения решетки (Giovannetti et al, 1980).
Микоризация Medicago truncatula в аксенических условиях
Растения выращивали в пробирках на желированной скошенной питательной среде MM (Olah et al, 2005) объемом 20 мл, как описано в Ben Amor et al. (2003). Факторы Мус в концентрации 10-8 M (либо контрольный раствор) были включены непосредственно в стерильную среду. Пятьдесят стерильных спор G.intraradices были помещены на дне питательной среды около корня рассады. Пробирки помещали в вегетационную камеру при 25°C со световым периодом длительностью 16 ч и интенсивностью света 366 микроэйнштейнов·m-2·s-1. После шести недель архитектура корневой системы была проанализирована с помощью программного обеспечения Winrhizo Scientific Software (Instruments Regent Inc, 2672 Chemin Ste Foy RD, Sainte Foy, Quebec, Canada). Количественная оценка колонизации корня была проведена прямым подсчетом единиц инфекции под бинокулярной лупой после окрашивания корня чернильно-уксусным методом (Vierheilig et al, 1998).
Микоризация Medicago truncatula на субстрате из обожженной глины
Проросшую рассаду выращивали в течение трех недель в пробирках Falcon объемом 50 мл, как описано выше для экспериментов по микоризации Tagetes. Двадцать спор G.intraradices были распределены вокруг корней рассады в 1 мл 10-7 M раствора факторов Мус или контрольного раствора. Затем каждое растение получало 1 мл 10-7 M раствора факторов Мус или 1 мл контрольного раствора два раза в неделю в течение двух недель. Были проведены две серии экспериментов с использованием 12 проростков на обработку. Горшки помещали в вегетационную камеру при 25°C со световым периодом длительностью 16 ч и интенсивностью света 366 мкэйнштейнов·m-2·s-1.
После 3 недель растения были собраны. Внутренняя корневая система была окрашена черными чернилами Шеффера (Vierheilig et al, 1998). Процент длины корня, колонизированной грибом, то есть демонстрирующей арбускулы, везикулы или и то, и другое, был определен методом пересечения решетки (Giovannctti et al, 1980).
Биотесты для проверки активности факторов Мус, связанной с развитием
Были разработаны биотесты для проверки активности очищенных или синтетических факторов Мус, связанной с развитием.
(i) Стимуляция развития корневой системы у модельного бобового растения M.truncatula.
Ранее авторы данного изобретения показали, что диффундирующий фактор АМ-грибов стимулирует формирование боковых корней (ФБК) у M.truncatula через путь DMI (Olah el al., 2005). Этот биотест использовали для проверки активности очищенных факторов Мус, связанной с развитием. Использовали описанный ранее протокол за исключением того, что витамины не были добавлены в среду М.
Идентификация генов растения, вовлеченных в сигналинг фактора Мус, была выполнена у M.truncatula с использованием уже описанного генетического анализа ответа ФБК (Olah el al., 2005). Ответы ФБК на факторы Мус были изучены на M.truncatula у линии дикого типа Jcmalong A17, в качестве контроля, и у дефектных по симбиозу мутантов dmil (Y6), dmi2 (TR25), dmi3 (TRV25) и nspl (JB85).
(ii) Прорастание семени томата
Семена сорта томата Heinz 1706 были получены из Главной коллекции семян томата INRA. Их любезно предоставил Rene Damidaux из лаборатории "Genetique et Amelioration des Fruits et Legumes" INRA 84143 Montfavet cedex (France). Из этого образца основной коллекции семена были размножены в L1PM (INRA-CNRS, Toulouse). Семена хранили при 4°C. Семена стерилизовали в течение 45 минут в фильтрованном растворе 0,262 М гипохлорита кальция (2,5 г СаОСl2 в 75 мл воды), в который были добавлены две капли Tween 20. Затем раствор гипохлорита удаляли, и три раза ополаскивали семена стерильной дистиллированной водой. Чашки с агаром для прорастания были приготовлены путем растворения 9,375 г Difco Agar Granulated (Becton-Dickinson) в одном литре дистиллированной воды. 10-3 M раствор фактора Мус готовили в 50/50 воде/ацетонитриле и затем разбавляли до нужных концентраций водой. Равное количество следов растворителя ацетонитрила было добавлено в контрольные чашки. На одну чашку приходилось пятнадцать семян с шестью или восемью повторностями за обработку. Чашки инкубировали в темноте при 14°C, 20°C и 28°C. Уровень прорастания оценивали ежедневно.
Статистический анализ данных
Данные биологических экспериментов были статистически проанализированы с помощью t-теста Стьюдента или дисперсионного анализа для данных, соответствующих нормальному распределению с однородной дисперсией, или непараметрических тестов Крускала-Уоллиса или Вилкоксона для распределений, отличающихся от нормального. Было использовано статистическое программное обеспечение R system (R Development Core Team, 2009).
Биохимические эксперименты
Жидкость-жидкостная экстракция экссудатов микоризированных корней:
Первую экстракцию экссудатов микоризированных корней проводили в двухлитровом круглом сосуде, в котором 1,6 литра экссудатов смешивали с 400 мл (1/4 объема), бутанола (1-бутанола или 2-метил-1-пропанола), и оставляли смесь для отстаивания, чтобы получить четкую фазу бутанола с тонкой промежуточной фазой, что позволяет хорошо разделить водную и бутанольную фазы (по меньшей мере шесть часов). Затем проводили вторую экстракцию водной фазы с помощью 350 мл (приблизительно 1/5 объема) бутанола и оставляли на ночь. После этой второй экстракции объединенную бутанольную фазу (из экстракции 1 и экстракции 2) упаривали до объема около 0,5 литра, который промывали жидкость-жидкостной экстракцией равным объемом бидистиллята. Промытую бутанольную фазу упаривали, переносили в небольшую колбу и высушивали с использованием ротационного испарителя. После этого сухой экстракт повторно растворяли в 5 мл воды/ацетонитрила (1/1) и фильтровали через вату (предварительно промытую хлороформом) в стеклянной трубке объемом 8 мл, а затем сушили под потоком азота.
Жидкость-жидкостная экстракция экссудатов прорастающих спор:
Экссудаты из одного миллиона прорастающих спор (приблизительно 150 мл) сначала экстрагировали 1/3 объема этилацетата. Смесь оставляли для отстаивания, чтобы получить тонкую промежуточную фазу и достичь хорошего разделения водной фазы и фазы этилацетата (по меньшей мере шесть часов). Вторую экстракцию водной фазы проводили с помощью 1/3 объема этилацетата в течение ночи. Затем проводили экстракцию водной фазы бутанолом (1-бутанолом или 2-метил-1-пропанолом) в той же последовательности, которая использовалась для проведения экстракции этилацетатом. Объемы фаз бутанола и этилацетата были уменьшены до нескольких мл с использованием ротационного испарителя. Каждую фазу переносили в пробирку объемом 5 мл и высушивали под потоком азота.
Очистка с помощью твердофазной экстракции (ТФЭ):
Подготовка колонки: система ТФЭ состояла из стеклянной колонки Chromabond объемом 3 мл, заполненной обратной фазой С18 (SUPELCO Discovery DSC-18). Первый стекловолоконный фильтр был помещен у основания колонки. Твердую фазу добавляли в колонку так, чтобы она заняла объем колонки высотой 3,5 см. Второй стекловолоконный фильтр помещали поверх твердой фазы и проталкивали внутрь для уплотнения твердой фазы. Перед использованием колонку промывали ацетонитрилом (ЛЦП) и водой, а затем уравновешивали 20%-ым раствором ацетонитрила (АЦН) в воде.
Предварительная фильтрация: Экстракт растворяли в одном мл 20%-ого АЦН. Экстракт фильтровали через вату в пипетке Пастера (предварительно промытой хлороформом) и наносили на колонку С18. Пробирку и фильтры ополаскивали 1,5 мл 20%-го АЦН.
Хроматография: Экстракт проталкивали через фазу С18, используя шприц. Проточную фракцию колонки собирали в стеклянной пробирке объемом 8 мл. Чтобы избавиться от не связавшихся веществ, фазу обильно промывали (20%-ым раствором АЦН в воде, пятикратным объемом твердой фазы). Этот объем собирали в той же пробирке. Затем молекулы, связавшиеся с колонкой, элюировали 50%-ым раствором АЦН в воде. Объем элюата, равный 5 объемам твердой фазы, собирали во второй стеклянной пробирке. Наконец, сильно связавшиеся молекулы элюировали с колонки с помощью 100%-го АЦН. Объем растворителя (приблизительно 6 мл) собирали в третьей пробирке. Эти три раствора (20%-ый, 50%-ый и 100%-ый по АЦН) упаривали под потоком азота для получения сухого остатка. Каждый остаток впоследствии можно было повторно растворить в объеме, подходящем для проведения полупрепаративной ВЭЖХ. Колонку ТФЭ использовали для очистки приблизительно 5 литров экссудатов микоризированных корней.
Полупрепаративная ВЭЖХ:
Очистка была выполнена на сепарационном модуле высокоэффективной жидкостной хроматографии Shimadzu LC10 (Shimadzu corporation, Kyoto, Japan) с полупрепаративной обращенно-фазной колонкой С18 (8 мм×250 мм; 5 мкм, Equisorb, CIL-Cluzeau). Объем петлевого дозатора составлял 100 мкл. Использовали следующую хроматографическую процедуру: 10 минут в изократическом режиме с растворителем (20%-ый ацетонитрил в воде), после чего в течение 20 минут следовал линейный градиент от растворителя A к растворителю B (100%-ый ацетонитрил) и еще один изократический этап в 100%-ом ацетонитриле в течение 5 минут. Две минуты требовалось для возвращения к начальным условиям (20%-ый АЦН). Скорость потока составляла 2 мл·мин-1, а ультрафиолетовое поглощение измеряли в области 206 нм. Сбор образцов по ходу градиента проводился каждую минуту (2 мл), что составило 14 фракций.
Дополнительная аналитическая ВЭЖХ для обнаружения несульфатированных ЛХО
Очистку выполняли на сепарационном модуле высокоэффективной жидкостной хроматографии Shimadzu LC10 (Shimadzu corporation, Kyoto, Japan) с колонкой фазы С8 (Zorbax XDB-C8 HP-Eclipse (Hewlett Packard) 5 мкм, 4,6×150 мм) в течение 5 минут в изократическом режиме с 30%-ым метанолом в водном растворителе, после чего в течение 20 минут следовал линейный градиент к 100%-ому метанольному растворителю, а затем еще один изократический этап в 100%-ом метаноле в течение 5 минут. 2 минуты требовалось для возвращения к начальным условиям. Скорость потока составляла 1 мл·мин-1, а ультрафиолетовое поглощение измеряли в области 206 нм. Сбор образцов проводился по ходу градиента и изократического этапа в 100%-ом метаноле каждую минуту (около 1 мл) от 15 до 23 мин, что составило 8 фракций.
Эксперименты по УЭЖХ-ВП МС:
Каждую фракцию, собранную в результате полупрепаративной ВЭЖХ, подвергали анализу с помощью УЭЖХ-МС на Acquity UPLC, соединенном с масс-спектрометром Q-Tof Premier (Waters Corporation). В качестве колонки для УЭЖХ использовали колонку Acquity (2.1 мм×10 см, 1,7 мкм) (Waters, USA), а скорость потока составляла 0,45 мл/мин. Для более гидрофильных соединений (фракции 1-9 из полупрепаративиой ВЭЖХ) использовали программу линейного градиента от 10%-ого АЦН (в 1%-ом водном растворе уксусной кислоты) до 100%-ого АЦН в течение 7 минут, после чего в течение 2 минут следовал изократический этап в 100%-ом АЦН, а затем возврат к начальным условиям (2 минуты), и наконец, этап регенерации в течение 1 минуты в 10%-ом АЦН (в 1%-ом водном растворе уксусной кислоты). Для улучшения разрешения более гидрофобных соединений (фракции 6-11 из полупрепаративной ВЭЖХ), градиент УЭЖХ был расширен: использовали линейный градиент, начинавшийся в 25%-ом АЦН в 0,1%-ом водном растворе уксусной кислоты и достигающий 100%-ого АЦН в течение 7 минут. Капилляр масс-спектрометра был настроен на 3,2 кВ, а конус - на 10 B. Внутренняя подстройка массы была выполнена непрерывным введением в источник раствора лейцин-энкефалина. Спектрометр калибровали перед каждым экспериментом. Более гидрофильные соединения (фракции 1-9 из полупрепаративной ВЭЖХ) анализировали как в режиме отрицательных ионов, так и в режиме положительных ионов, чтобы облегчить обнаружение соответственно анионных (сульфатированных) и катионных (несульфатированных) соединений.
Для фрагментации молекул определенные ионы отбирали и подвергали анализу ТМС с использованием энергии столкновения 15 B.
Умеренный гидролиз:
Этот способ используется для удаления сульфатной группы у сульфатированных ЛХО без изменения остальной части молекулы (Roche et al., 1991b). Фракцию A, элюция которой происходила между 15 и 16 минутами полупрепаративной ВЭЖХ, переносили в стеклянный стакан с отвинчивающейся крышкой и высушивали под потоком азота. Затем ее дважды растворяли в безводном метаноле и снова высушивали для удаления остаточной воды. К сухому образцу добавляли 250 мкл 0,05 М НСl в метаноле. Реакцию проводили при комнатной температуре в течение ночи. Затем образец снова высушивали под потоком азота и дважды промывали безводным метанолом, чтобы удалить всю кислоту.
Производство миллиграммных количеств факторов Мус
Очистка факторов Мус из экссудатов прорастающих спор Glomus intraradices и микоризированных корней дает чрезвычайно низкий выход. Для производства большого количества этих молекул применяли две стратегии, использующие генную инженерию бактерий.
(i) Производство факторов Мус в мутантах ризобий.
Ризобий вырабатывают Nod-факторы, представляющие собой замещенные ЛХО, которые имеют сходные структурные черты с факторами Мус. Существенное различие состоит в том, что факторы Мус представляют собой очень простые ЛХО с весьма ограниченным числом замещений, по существу сводящихся к возможному О-сульфатированию редуцирующего остатка N-ацетилглюкозамина. Наша стратегия состояла в том, чтобы использовать мутанты ризобий, модифицированные по генам, которые кодируют ферменты, ответственные за замещения у предшественников Nod-факторов, и потому секретирующие очень простые ЛХО, сходные с факторами Мус. Авторы данного изобретения остановили свой выбор на мутантных штаммах, являющихся производными видов ризобий, которые вырабатывают максимум тетрамерных ЛХО и минимум (приблизительно 10%) пентамерных ЛХО, как и в случае грибных факторов Мус.
Для получения сульфатированных факторов Мус авторы данного изобретения использовали двойного мутанта nodFEnodL Sinorhizobium meliloti. Мутация nodL подавляет O-ацетилирование нередуцирующего концевого остатка N-ацетилглюкозамина, а мутация nodFE блокирует синтез ненасыщенной жирной кислоты 16:2, что приводит к N-ацилированию жирными кислотами С18:1 (вакценовой) или С16:0 (пальмитиновой) (Ardourel el al., 1994). Для повышения выработки ЛХО в мутантный штамм вводили мультикопийную плазмиду рМН682, несущую регуляторные гены nod. Получившийся в результате высокопродуктивный штамм GMI 6629 культивировали в жидкой питательной среде, содержащей 5 мкг/мл тетрациклина для поддержания плазмиды рМН682 и лутсолин (10 мкМ) в качестве индуктора генов nod (Ardourel et al, 1994). При достижении бактериальной культурой плотности порядка 109 клеток на мл, Nod-факторы выделяли путем жидкость-жидкостной экстракции бутанолом или этилацетатом (Roche et al, 1991). После этого проводили очистку ЛХО с помощью ВЭЖХ на обращенно-фазной колонке С18, как было описано ранее (Dcmont et al., 1993) со следующей модификацией градиента вода-ацетонитрил: за 10-минутной изократической фазой в 20%-ном ацетонитриле следовал линейный градиент от 20 до 65% ацетонитрила в течение 30 минут при скорости потока 2 мл/мин. Пиковые фракции, содержащие сульфатированные ЛХО, были собраны на участке градиента между 32 и 35% ацетонитрила и проанализированы с помощью масс-спектрометрии. Большая часть ЛХО были тетрамерными, а меньшая - пентамерными, как и факторы Мус. ЛХО были O-сульфатированы по редуцирующему концу и N-ацилированы жирными кислотами С18:1 и С16:0 по нередуцирующему концу. O-ацетилирование не было обнаружено.
Для производства несульфатированных факторов Мус использовали штамм LPR5045 (рМР247). Он является производным штамма RCR5 R. leguminosarum, биовар trifolii, в котором была элиминирована плазмида Sym, а затем введена мультикопийная плазмида рМР247, содержащая общие гены nodABCIJ (Lugtenberg et al, 1995). Высокопродуктивный штамм выращивали в культуральной среде В, содержащей 5 мкг/мл тетрациклина для поддержания плазмиды рМР247 и 10 мкМ нарингенина в качестве индуктора nod-гена (Spaink. et al, 1994). ЛХО выделяли из культуральной среды как описано выше. Очистка ВЭЖХ была выполнена на такой же обращенно-фазной колонке С18, как и в случае сульфатированных ЛХО, с 20-минутной изократической фазой в 26,5%-ном ацетонитриле и последующим линейным градиентом ацетонитрил-вода от 26,5 до 100% ацетонитрила в течение 40 минут при скорости потока 2 мл/мин. Пиковые фракции, соответствующие несульфатированным ЛХО, были собраны приблизительно на уровне 50%-ого ацетонитрила и проанализированы с помощью масс-спектрометрии. Большинство ЛХО были тетрамерными, а меньшинство - пентамерными, как и факторы Мус. В N-ацилировании участвовали жирные кислоты С18:1 и С16:0. O-ацетилирование или O-сульфатирование не было обнаружено.
Структура основных сульфатированных и несульфатированных ЛХО, вырабатываемых мутантными штаммами ризобий GMI 6629 Sinorhizobium meliloti и LPR5045 (рМР247) Rhizobium leguminosarum, биовар trifolii, соответственно, приведены ниже. Они с большой точностью имитируют факторы Мус, вырабатываемые АМ-грибом Glomus intraradices (см. Пример 2).

Эти факторы Мус, приготовленные из культур мутантов ризобий, были проверены на биологическую активность. Пример 7 показывает, что смесь этих сульфатированных и несульфатированных факторов Мус в значительной степени стимулирует формирование микоризы (Фигура 14а), что показывает, что эти молекулы действуют как подлинные сигналы микоризации.
(ii) Производство факторов Мус с использованием методологии «клеточной фабрики».
Эти синтетические факторы Мус были любезно предоставлены Eduardo Andres Martinez и Hugues Driguez из лаборатории CERMAV CNRS в Grenoble, France. Процедура, которую они использовали, была по существу такой, как описано в литературе (Samain el а,. 1999): в результате культивирования рекомбинантных штаммов E.coli, несущих гены nodBC или nodBCH из Sinorhizobium meliloti, в условиях высокой плотности клеток получали NI,II,III-триацетил-хитинтетраозу и 6ОI-сульфо-NI,II,III-триацетил-хитинтетраозу в качестве основных соединений вместе с небольшими количествами соответствующих им пентамеров.
После выделения и очистки этих соединений было проведено выборочное N-ацилирование с использованием хлорангидридов пальмитиновой или олеиновой кислот в различных водно-органических растворителях, либо свободных кислот, и способа N-ацилирования, разработанного ранее для получения липохитоолигосахаридных факторов образования клубеньков (Ohsten Rasmussen et al, 2004).
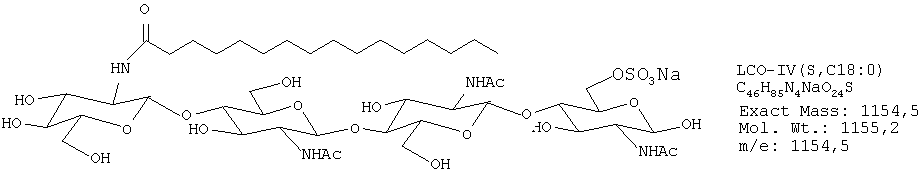
Были получены следующие четыре липохитоолигосахарида:
ЛХО IV (контаминированный≈10% ЛХО V) С16:0

ЛХО IV (контаминированный≈10% ЛХО V) S С16:0
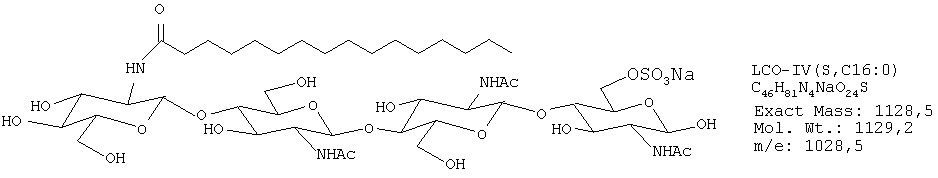
ЛХО IV (контаминированный≈10% ЛХО V) С18:1
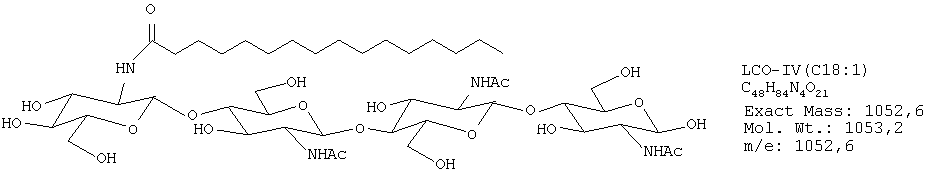
ЛХО IV (контаминированный≈10% ЛХО V) S С18:1
РЕЗУЛЬТАТЫ
ПРИМЕР 15: ОЧИСТКА ФАКТОРОВ МУС ИЗ ЭКССУДАТОВ МИКОРИЗИРОВАННЫХ КОРНЕЙ И ЭКССУДАТОВ ПРОРАСТАЮЩИХ СПОР
Общая стратегия
В качестве источника факторов Мус был использован штамм DAOM 197198 Glomus intraradices, поскольку он обладает широким кругом хозяев и используется для крупномасштабного промышленного производства инокулянтов АМ-грибов. Этот штамм хорошо охарактеризован, и его геном в настоящее время секвенируется. Использовали два взаимодополняющих источника факторов Мус. Преимущество экссудатов микоризированных корней состоит в возможности проводить выделение из большого объема с получением значительного количества факторов Мус. Недостаток этого источника в том, что экссудаты содержат смесь соединений растительного и грибного происхождения. По этой причине авторы данного изобретения использовали еще один источник, экссудаты очищенных прорастающих спор, которые содержат только вещества АМ-грибного происхождения, но имеют недостаток, заключающийся в получении "чрезвычайно низких концентраций факторов Мус.
Биологически активные соединения, присутствующие в экссудатах АМ-грибов, являются амфифильными.
Экссудаты микоризированных корней были сначала подвергнуты жидкость-жидкостной экстракции бутанолом и этилацетатом. Водную, бутанольную и этилацетатную фазы проверяли на биологическую активность с помощью биотестов на MtENOD11 и VsHab: активность была обнаружена в бутанольной фракции, что указывает на то, что факторы Мус представляют собой амфифильные соединения. Как показано на Фиг.1, активное соединение проявлялось в тесте па MtENOD1l как синее окрашивание, появляющееся на растущих корнях, и в тесте на VsHab в качестве заметного ветвления вблизи верхушки корневых волосков горошка посевного.
Затем бутанольный экстракт подвергали твердофазной экстракции (ТФЭ) с обращенно-фазной колонкой С18 и последующему элюированию 20%, 50% и 100%-ым ацетонитрильным растворителем. Биологическая активность в тестах на MlENOD11 и VsHab была обнаружена во фракции, элюированной 50%-ым ацетонитрилом, подтверждая, что активное соединение (или соединения) является амфифильным. Сходные результаты были получены более чем с пятью независимыми образцами экссудатов микоризированных корней. Небольшую активность в тесте на VsHab также можно было, иногда наблюдать у элюата 100%-ного ацетонитрила, что указывает на то, что различные соединения могут быть ответственны за активность в тестах на MtENOD1l и VsHab, причем соединение, действующее в тесте на VsHab, является немного более гидрофобным, чем соединение, действующее в тесте на MtENOD11.
Экссудаты прорастающих спор выделяли с помощью такой же жидкость-жидкостной экстракции бутанолом и этилацетатом. Активность в тестах на MtENOD11 и VsHab присутствовала только у бутанольной фазы. Сходные результаты были получены с пятью независимыми образцами прорастающих спор. Таким образом, можно сделать вывод, что амфифильное соединение (соединения), проявляющее активность в тестах на MtENOD11 и VsHab, имеет АМ-грибное происхождение.
Два типа активных соединений в экссудатах микоризированных корней
Для дальнейшего разделения соединений, проявляющих активность в тестах на MtENOD11 и VsHab, и получения информации об их хроматографических свойствах было необходимо проанализировать бутанольную фракцию с помощью ВЭЖХ. Однако, поскольку экссудаты микоризированных корней были сильно загрязнены веществами корня, а также Phytagel, бутанольную фракцию перед этапом ВЭЖХ подвергли ТФЭ, как описано в предыдущем параграфе. Фракция ТФЭ, элюированная 50%-ым ацетонитрилом и активная в двух биотестах, была затем проанализирована с помощью полупрепаративной ВЭЖХ на обращенно-фазной колонке С18 в градиенте ацетонитрил-вода. С интервалом в две минуты были собраны четырнадцать фракций. Характерный профиль приведен на Фиг.2. Активность каждой фракции была проверена в тестах на MtENODl 1 и VsHab. Было обнаружено, что фракции, элюированные в 30-48% ацетонитрила (АЦН) (фракция A), активны в тесте на MtENOD11, а фракции, элюированные в 64-72% ЛЦН (фракция B), активны в тесте на VsHab. Эти данные показывают, что активными в разных биогестах являются разные соединения. Соединение (соединения), активное в тесте па MtENOD11, является более гидрофильным, чем соединение (соединения), активное в тесте на VsHab.
Интересно отметить, что характеристики элюирования фракции, активной в тесте на MtENOD11, хорошо соответствуют характеристикам элюирования, наблюдаемым у сульфатированных Nod-факторов из Sinorhizobium meliloti и Rhizobium tropici (33-45%), которые, в свою очередь, могут также проявлять активность в биотесте на MtENOD11. С другой стороны, характеристики элюирования фракции, активной в тесте на VsHab, хорошо соответствуют характеристикам элюирования, наблюдаемым у несульфатированного Nod-фактора из R.Leguminosarum, биовар viciae (67%)), и неацетилированного Nod-фактора из Rhizobium meliloti nodHnodL (66%), которые, в свою очередь, могут также проявлять активность в биотесте с использованием посевного горошка. Эти данные не противоречат гипотезе, согласно которой экссудаты микоризированных корней содержат смесь сульфатированных и несульфатированных ЛХО.
Два типа активных соединений в экссудатах прорастающих спор
Бутанольные экстракты из экссудатов прорастающих спор были проанализированы с помощью полупрепаративной ВЭЖХ в условиях, аналогичных описанным выше. Как видно на Фиг.3, экссудаты спор также содержат два типа активных соединений, более гидрофильные, которые активны в биотесте на MtENODl 1 (фракция A), и более гидрофобные, которые активны в биотесте на VsHab (фракция B). Характеристики элюирования этих двух типов соединений идентичны характеристикам элюирования, наблюдаемым у двух типов активных соединений из экссудатов микоризированных корней. Эти результаты указывают на то, что два активных соединения, присутствующие в экссудатах микоризированных корней, имеют АМ-грибное происхождение. Их хроматографическая динамика и биологические свойства не противоречат гипотезе, согласно которой эти соединения соответствуют сульфатированным и несульфатированным ЛХО.
Изменение активности, связанное с десульфированием фракции A
Было показано, что мягкий метанольный гидролиз сульфатированных ЛХО, таких как Nod-факторы S.meliloti, приводит к удалению сульфатной группы, не вызывая других структурных модификаций (Roche et al., 1991b). Чтобы проверить, могла ли биологическая активность фракции A, собранной после ВЭЖХ бутанольных экстрактов из экссудатов прорастающих спор, по отношению к MtENODl 1 быть вызвана присутствием сульфатированных ЛХО, образец фракции A был подвергнут мягкому гидролизу. Обработанная фракция полностью потеряла активность по отношению к MtENOD11 (см. Фиг.4). Интересно отметить, что в то время как фракция A первоначально не была активна в биотесте на VsHab, обработанная фракция демонстрировала заметную активность в этом тесте (Фиг.4). Тот факт, что фракция A после мягкого гидролиза способна приобрести новую функцию - активность по отношению к VsHab - демонстрирует, что мягкий метанольный гидролиз не привел к существенной деградации активного соединения фракции A, а просто модифицировал его, вероятно, путем удаления сульфатной группы, которая является очень подвижным O-заместителем в ЛХО. Эти данные указывают на то, что активность фракции A по отношению к MtENOD11 может быть следствием присутствия сульфатированного(ых) ЛХО, а активность более гидрофобной фракции В по отношению к VsHab - следствием присутствия несульфатированного(ых) ЛХО.
ПРИМЕР 2: БИОХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА ФАКТОРОВ МУС
ЖХ/МС и УЭЖХ/МС
Различные фракции, полученные после полупрепаративной обращенно-фазной ВЭЖХ экссудатов микоризированных корней, были подвергнуты индивидуальной хроматографии на аналитической обращенно-фазной колонке под ультравысоким давлением (УЭЖХ). Измерение проводили с помощью ИЭР-МС.
Результаты приведены на Фигурах 5-8. Эти фигуры показывают ионные токи, соответствующие ЛХО, которые, как ожидалось на основании показателей времени удерживания в ВЭЖХ и УЭЖХ и биологической активности, присутствовали в образцах.
Если соединения, обладающие расчетной массой в пределах их изотопного распределения, присутствовали в анализируемом образце, то они проявились бы на хроматограмме в виде пиков. Поскольку полученные этим способом пики могли представлять собой артефакты (пики могли соответствовать минорному компоненту изотопного профиля), соответствующие спектры также приведены в нижней части каждой фигуры.
Первые восемь фракций ВЭЖХ, для которых хроматографическая динамика и биологические свойства предполагали присутствие сульфатированных ЛХО, были проанализированы в отрицательном ионном режиме. Согласно показателям времени удерживания, измеренным в ВЭЖХ с использованием стандартных тетрамерных (СП4) и пентамерных (СП5) ЛХО, поиск точных масс (ошибка менее 10 миллионных долей), соответствующих сульфатированным соединениям со СП4 и СП5, проводили во фракции 4, которая показала самую высокую активность в тесте на MtENOD11. В этой фракции можно было легко обнаружить массы, соответствующие сульфатированным соединениям со СП4, ацилированным жирными кислотами, содержащими 16 атомов углерода (Фиг.5). В соответствии с показателями времени удерживания в ВЭЖХ, нам удалось обнаружить в предыдущей фракции (фракция 3) соответствующие соединения со СП5 (Фиг.7), а в последующей фракции (фракция 5) - сульфатированные соединения со СП4, имеющие цепи из 18 атомов углерода (фиг.6). В следующих фракциях (6-8) поиск соединений со СП3 не дал результатов. Соединения были охарактеризованы, во-первых, с использованием различных ионных токов (соответствие между расчетными точными массами и ожидаемыми временами удерживания), и во-вторых, относительно изотопного профиля соответствующих спектров. Фиг.8 иллюстрирует эффективность метода по установлению присутствия или отсутствия конкретного соединения, обладающего определенной массой. Ионный ток со значением отношения массы к заряду, равным 1332,6, соответствующий предполагаемому ЛХО (V, C18:2, S), давал лишь усиление фонового шума (отсутствие отдельного четко оформленного пика), тогда как ионный ток со значением отношения массы к заряду, равным 1334,6, соответствующий предполагаемому ЛХО (V, C18:1, S), ясно продемонстрировал присутствие пика УЭЖХ, содержащего соединение с ожидаемой массой (данные подтверждены зарегистрированным масс-спектром). Таким образом, экстракты Мус содержат пентамерные сульфатированные ЛХО N-ацилированные C18:1, но не их производные, ацилированные C18:2.
При использовании этого способа невозможно было обнаружить сульфатированные соединения со СП4 или СП5, O-замещенные такими функциональными группами, как ацетил, карбамоил или фукозил, или N-замещенные такими группами, как метил, которые очень часто встречаются у липохитоолигосахаридных Nod-факторов, вырабатываемых различными штаммами ризобий.
Фракции 7-11 были затем проанализированы с помощью УЭЖХ, но измерения производили в положительном режиме ИЭР-МС. Была применена та же самая стратегия: выбор иона с последующим анализом соответствующих спектров.
Экстракты микоризированных корней были также проанализированы с помощью ЖХ/МС. Фракции, элюированные между 20 и 23 минутами полупрепаративной ВЭЖХ, были объединены, высушены под потоком азота и повторно растворены в 150 мкл 50%-ого АЦН в воде и 1%-ой уксусной кислоте. Растворы были внесены непосредственно в источник ИЭР спектрометра Q-Tof Ultima (Waters, US). Капилляр был настроен на 3 кВ, напряжение конуса составляло 70 В, a Rf линзы 35 В. Молекулярные ионы двух минорных соединений с отношением массы к заряду, равным 1045,5 и 1047.5, можно было обнаружить в положительном режиме, что соответствовало катионизированным натрием ЛХО, содержащим ацильные радикалы C16:1 или C16:2 и не имеющим O-замещений. Массы и изотопные профили подтвердили предложенные структуры.
Поскольку значительное количество загрязнений (например, ПЭГ), элюируемых вместе с искомыми несульфатированными ЛХО соединениями во фракциях 9-11, препятствовало их обнаружению с помощью МС, была выполнена дополнительная очистка путем ВЭЖХ. Фракции 9 и 10 из полупрепаративной ВЭЖХ объединили и нанесли на аналитическую колонку С8, а затем элюировали градиентом, начинающимся 30%-ым МеОН в воде и заканчивающимся 100%-ым МеОН. Загрязнения были элюированы с 1 по 15 минуту. Предполагаемые ЛХО соединения ожидались около 20-ой минуты. Фракции, собранные между 15 и 23 минутами, были отдельно проанализированы с помощью УЭЖХ-МС, и обнаружение конкретных ионов проводилось на основании соответствующих наблюдаемых сульфатированных разновидностей (СП4 и СП5; ацильные цепочки C16:0 и C18:1). Сигнал расчетного иона точной массы с отношением массы к заряду, равным 1027,56 (DP4, C16:1), был обнаружен во фракции, элюирующей между 18 и 19 минутами. Время удерживания по сравнению с синтетическими стандартами, а также точная масса и изотопный профиль соответствовали искомому соединению. Структура была окончательно подтверждена зарегистрированным масс-спектром, который показал классическую В-фрагментацию в областях отношения массы к заряду, равного 400,2, 603,3, 806,4.
ТМС
Демонстрация присутствия соединений, имеющих массу, соответствующую ожидаемому времени удерживания в ВЭЖХ или УЭЖХ, недостаточна для подтверждения их структуры. По этой причине авторы данного изобретения провели анализ одного из предполагаемых ЛХО соединений с помощью ТМС. Фиг.9 демонстрирует сравнение, при ТМС в режиме отрицательных ионов, сульфатированного Nod-фактора СП4 C16:2 из S.meliloti с возможным "фактором Мус", ЛХО (IV, C16:0,S), присутствовавшим в образце. Характерные ионы редуцирующего конца с отношением массы к заряду 503 (Y2), 605 и 706 (Y3) отчетливо обнаруживались в обоих случаях, как и характерная потеря нейтрального фрагмента массой 101 а.е.м. (внутрициклический разрыв), начинавшаяся на стадии молекулярного иона. Точное совпадение характера фрагментации указывает на структурное единство этих двух молекул, а также на то, что сульфатная группа расположена на редуцирующем остатке глюкозамина, тогда как остаток жирной кислоты находится па концевом нередуцирующем остатке глюкозамина. Так как фрагментация не приводила к появлению ионов бета-элиминирования (ионов жирной кислоты), весьма вероятно, что ацилирование жирной кислотой происходило по атому N остатка глюкозамина.
ПРИМЕР 3: СТИМУЛЯЦИЯ ФОРМИРОВАНИЯ БОКОВЫХ КОРНЕЙ ФАКТОРАМИ МУС
После дальнейшей очистки с помощью твердофазной экстракции (ТФЭ) и элюирования 50%-ым ацетонитрилом, бутанольный экстракт из экссудатов микоризированных корней был внесен в чашки со средой M и протестирован выращиванием рассады A17 M.truncatula. Этот очищенный экстракт Мус значимо стимулировал формирование боковых корней (P=0,05). Этот экстракт Мус не стимулировал формирование боковых корней у мутанта dmil (Y6) M.truncatula, что говорит о присутствии в этом полуочищенном экстракте сигнала Мус, который активизирует формирование боковых корней (ФБК) через симбиотический путь сигналинга DMI (Фиг.10А).
Экссудаты прорастающих спор выделяли с помощью этилацетата и бутанола. Три экстракта (водный, этилацетатный и бутанольный) протестировали на способность стимулировать ФБК у рассады M.truncatula А17. Бутанольный экстракт значимо стимулировал ФБК (Р=0,05), тогда как водный и этилацетатный экстракты не проявляли активности (Фиг.10B). Этот эксперимент подтверждает АМ-грибное происхождение амфифильного соединения (соединений), стимулирующего ФБК.
После ТФЭ, бутанольный экстракт экссудатов микоризированных корней был далее очищен с помощью полупрепаративной ВЭЖХ, и фракции, соответствующие сульфатированным ЛХО (фракция A, активная в тесте на MtENODl 1) и несульфатированным ЛХО (фракция B, активная в тесте на VsHab), были отдельно собраны и протестированы на рассаде А17 M.truncatula. Было обнаружено, что эти две фракции значительно стимулировали ФБК (Фиг.10C). Эти данные указывают на то, что факторы Мус состоят из смеси сульфатированных и несульфатированных простых ЛХО, и те, и другие из которых способны стимулировать формирование боковых корней у растений.
ПРИМЕР 4: ЭФФЕКТ ФАКТОРОВ МУС НА ФОРМИРОВАНИЕ AM У МОДЕЛЬНОГО БОБОВОГО РАСТЕНИЯ M.TRUNCATULA
Синтетические факторы Мус, полученные с использованием методологии клеточного завода, как описано в Материалах и Методах, были использованы для изучения возможного влияния факторов Мус на микоризацию корней модельного бобового растения Medicago truncatula АМ-грибом Glomus intraradices.
В первой серии экспериментов рассаду M.truncatula выращивали в аксенических условиях в пробирках на желированной скошенной питательной среде с дефицитом фосфора и азота, в которую были добавлены факторы Мус в концентрации 10-8 M. Каждый проросток инокулировали 500 стерильными спорами гриба (Olah et al., 2005). Подсчет числа единиц инфекции (зоны, содержащие арбускулы, везикулы и внутренние сети гиф) в пересчете на одно растение был выполнен под бинокулярной лупой спустя шесть недель после инокуляции. Обработка факторами Мус увеличивала число единиц инфекции в пересчете на одно растение на 148% (см. Фиг.11а).
Во второй серии экспериментов рассаду M.truncatula выращивали на субстрате, состоящем из обожженных глиняных гранул, в нестерильных условиях, и каждый проросток инокулировали 50 спорами гриба. Факторы Мус были добавлены в среду в концентрации 10-8 M. Процент колонизации корня оценивали методом пересечения решетки спустя три недели после инокуляции. Процент микоризированных корней у растений, обработанных факторами Мус, был на 28,5% выше, чем у контрольных растений (Фиг.11b).
Выводы: В низкой концентрации (10-8 M) синтетические факторы Мус стимулируют формирование AM у модельного бобового растения M.truncatula, предоставляя дальнейшие доказательства того, что обнаруженные нами факторы Мус являются подлинными сигналами микоризации.
Способность факторов Мус эффективно стимулировать формирование AM у бобовых открывает возможности для широкого спектра применения в садоводстве (например, у фасоли, нута, чечевицы), сельском хозяйстве (например, у сои, гороха, конских бобов, люцерны, арахиса) и лесоводстве (например, у лжеакации).
ПРИМЕР 5: ЭФФЕКТ ФАКТОРОВ MYC НА РАЗВИТИЕ КОРНЯ У БОБОВЫХ РАСТЕНИЙ
AM-грибы выделяют диффундирующие соединения, стимулирующие формирование боковых корней (ФБК) у модельного бобового растения Medicago truncatula (Olah et al., 2005). Было показано (см. Пример 3), что фракции ВЭЖХ, содержащие сульфатированные и несульфатированные ЛХО грибов, оказывают такую же стимуляцию ФБК. Чтобы продемонстрировать, что эта стимуляция ФБК на самом деле является следствием присутствия ЛХО, а не загрязняющих соединений гриба, которые могут содержаться в этих фракциях ВЭЖХ, авторы данного изобретения использовали синтетические сульфатированные и несульфатированные ЛХО, имеющие ту же структуру, что и соединения, обнаруженные в грибных экссудатах (см. Пример 4 и Материалы и Методы).
В концентрации 10-8 M чистые синтетические сульфатированные факторы Мус или чистые несульфатированные факторы, так же как и смеси сульфатированных и несульфатированных факторов Мус, явно стимулировали ФБК (см. Фиг. 12а), демонстрируя, что оба типа соединений действуют как регуляторы роста растений. Напротив, в концентрации 10-10 M смесь сульфатированных и несульфатированных факторов Мус была все еще чрезвычайно активной, тогда как чистые соединения, будь то сульфатированные или нет, были неактивны. Эти данные показывают, что смесь сульфатированных и несульфатированных факторов Мус является заметно более активной, чем чистые сульфатированные или несульфатированные факторы Мус.
Таким образом, факторы Мус не только являются симбиотическими сигналами, активизирующими симбиотическую программу растения-хозяина на ранних этапах микоризации, но и могут также действовать как подлинные регуляторы растения, стимулировать формирование боковых корней и влиять на архитектуру корня.
С сельскохозяйственной точки зрения важно было исследовать вопрос возможного влияния факторов Мус не только на ветвление корня, но также и на общее развитие корневой системы. После выращивания рассады в течение 8 дней на питательной среде, содержащей или не содержащей смесь сульфатированных и несульфатированных факторов Мус, корни отрезали и проводили сканирование и анализ корневой системы с помощью программного обеспечения WinRhizo. Обработка факторами Мус привела к увеличению общей длины корня на 13,16% (Фиг.12b). Таким образом, обработка факторами Мус способна стимулировать развитие всей корневой системы.
Выводы: Как сульфатированные, так и несульфатированные факторы Мус являются активными сигналами, действующими в низких концентрациях (10-8 M), но смесь сульфатированных и несульфатированных факторов Мус является явно более активной (действующая концентрация снижается до 10-10 M).
Они эффективно стимулируют формирование боковых корней и развитие корневой системы и поэтому являются не только симбиотическими сигналами, цо также и мощными регуляторами роста растений.
Данные результаты открывают возможность использования этих молекул в садоводстве, сельском хозяйстве и лесоводстве для стимуляции развития корней растений и их роста.
ПРИМЕР 6: ФАКТОРЫ МУС ВЫЗЫВАЮТ ОТВЕТЫ РАСТЕНИЯ ЧЕРЕЗ СИМБИОТИЧЕСКИЙ ПУТЬ СИГНАЛИНГА DMI
Симбиотический путь сигналинга была обнаружен у M.truncatula вместе с генами, кодирующими рецепцию Nod-фактора (NFP), кальциевый сигналинг {DMI1, DMI2 и DMI3) и активатор транскрипции, специфичный для клубенькообразования (NSP1) (Catoira et al., 2000; Smit et al., 2005). Мутации в генах DMI1, DMI2 и DMI3 приводят к изменению формирования клубенька, но также и формирования микоризы, указывая па то, что эти три гена DMI участвуют в пути сигналинга, общем для образования клубеньков и микоризации (Catoira et al., 2000). Напротив, мутации в гене NSP1 приводят к дефекту образования клубеньков, но не затрагивают микоризацию (Catoira et al., 2000). Это открытие привело к появлению гипотезы, согласно которой симбиотические сигналы микоризации, факторы Мус, активизируют микоризную программу растения через путь DMI (Catoira et al., 2000). Невозможно определить, участвуют ли гены DMI в стимуляции формирования AM факторами Мус, потому что мутанты dmi дефектны по формированию микоризы. Поэтому для изучения вопроса о возможном участии симбиотических генов растения в ответе на факторы Мус использовали тест на формирование боковых корней (ФБК) у М. truncatula, описанный в Примерах 3 и 5.
Сульфатированные факторы Мус демонстрируют некоторое структурное сходство с Nod-факторами Sinorhizobium meliloti. Во избежание возможного перекрестного влияния между путями сигналинга Nod-факторов и факторов Мус, использовали несульфатированные синтетические факторы Мус. Авторы данного изобретения изучили ответ на стимуляцию ФБК на M.truncatula у линии дикого типа А17, в качестве контроля, и у мутантов dmil (Y6), dmi2 (TR25), dmi3 (TRV25) и nspl (В85).
Как уже описано в Примере 5, обработка линии дикого типа 10-8 M несульфатированных факторов Мус приводила к явной стимуляции формирования боковых корней. Напротив, у дефектных по микоризе мутантов dmil, dmi2 и dmi3 факторы Мус не вызывали стимуляцию ФБК (см. Фиг.13). У мутанта nspl, который является дефектным по образованию клубеньков, но имеет нормальный микоризный фенотип, и у которого Nod-факторы неспособны стимулировать ФБК, факторы Мус вызывали хорошо заметную стимуляцию ФБК (Фиг.13). Эти данные указывают на то, что факторы Мус вызывают ответы растения на этапах, следующих за действием генов DMI, через специфичный для микоризы путь сигналинга, отличный от пути сигналинга Nod-фактора (NSP1).
Выводы: способность факторов Мус стимулировать ФБК блокирована у мутантов dmi1, dmi2 и dmi3. Этот факт указывает на то, что связанные с развитием ответы, вызываемые факторами Мус, реализуются через симбиотический путь сигналинга DMI, дополнительно подтверждая, что факторы Мус представляют собой подлинные симбиотические сигналы.
Специфичный для образования клубеньков ген NSP1 не требуется для ответа на стимуляцию ФБК, указывая на то, что факторы Мус вызывают этот связанный с развитием ответ через особый специфичный для них путь сигналинга, действующий независимо от генов DMI и позже них и независимый от специфичного сигнального пути образования клубеньков (NSP1). Это является дополнительным доказательством того, что обнаруженные нами факторы Мус представляют собой подлинные сигналы микоризации.
ПРИМЕР 7: СТИМУЛЯЦИЯ ФОРМИРОВАНИЯ AM В ВЫРЕЗАННЫХ ТРАНСФОРМИРОВАННЫХ КОРНЯХ МОРКОВИ КАК СИСТЕМА ДЛЯ ПРОИЗВОДСТВА ПРОМЫШЛЕННЫХ МИКОРИЗНЫХ ИНОКУЛЯНТОВ
АМ-грибы являются облигатными симбионтами: они не способны размножаться и образовывать споры в чистой культуре. Для роста им необходимо колонизировать корни растений-хозяев. Эта жесткая потребность являлась препятствием как для фундаментального исследования AM симбиоза, так и для возможности крупномасштабного производства инокулянтов АМ-грибов в садоводческих и сельскохозяйственных целях. Важный прорыв был достигнут благодаря использованию культур вырезанных трансформированных корней для культивации АМ-грибов, сделав возможным производство больших количеств стерильных грибных спор (Becard and Fortin, 1988). Система, которая использовалась в течение долгого времени (Chabot et al., 1992), предусматривала совместное культивирование штамма DAOM 197198 АМ-гриба Glomus intraradices с клоном вырезанного корня моркови, трансформированного Agrobacterium rhizogenes. Эта система совместного культивирования используется, в частности, биотехнологической компанией Premier Tech (Quebec) для производства коммерческих инокулянтов АМ-грибов. Авторы данного изобретения обратились к вопросу, может ли использование факторов Мус в низких концентрациях, в качестве добавки к питательной среде, стимулировать микоризацию вырезанных корней.
Первоначально была использована смесь сульфатированных и несульфатированных факторов Мус, полученных из соответствующих мутантов ризобий (см. Материалы и Методы), которую добавляли в питательную среду в концентрации 10-8 M. Аксенические вырезанные корни моркови были инокулированы стерильными спорами G. intraradices. Процент длины корня, колонизированной АМ-грибом, оценивали методом пересечения решетки (Giovannetti and Mosse, 1980). Было сделано пять повторений. Подсчет проводили спустя восемь недель с использованием бинокулярной лупы двойным слепым методом.
На Фиг.14 видно, что добавление смеси сульфатированных и несульфатированных факторов Мус в концентрации 10-8 М в питательную среду приводило к очень сильному увеличению процента колонизации (+68,6%).
Во втором эксперименте смесь сульфатированных и несульфатированных синтетических факторов Мус была добавлена в питательную среду в концентрации 10-8 M. Было проведено пятнадцать повторностей. Как показано на Фиг.14b, после восьми недель эффект факторов Мус на стимуляцию формирования AM был весьма существенным (+20,5%.).
Выводы: Смесь сульфатированных и несульфатированных факторов Мус активно стимулирует формирование AM в корнях моркови, которая не относится к семейству бобовых. Это служит дополнительным доказательством того, что идентифицированные нами и синтезированные факторы Мус являются подлинными сигналами микоризации.
Как синтетические факторы Мус, полученные биохимическими методами, так и факторы Мус, полученные из мутантных штаммов ризобий, эффективно стимулировали формирование микоризы, свидетельствуя о том, что эти два типа стратегий являются подходящими для крупномасштабного производства факторов Мус.
Эти данные открывают возможность применения факторов Мус в качестве добавок к питательным средам для производства AM инокулянтов в биотехнологической промышленности с использованием вырезанных трансформированных корней.
ПРИМЕР 8: ЭФФЕКТ ФАКТОРОВ МУС НА ФОРМИРОВАНИЕ AM У НЕБОБОВОГО РАСТЕНИЯ TAGETES PATULA
Tagetes patula, растение из семейства Asteraceae, было выбрано в качестве небобового растения-хозяина. T.patula (бархатцы мелкоцветные) является очень популярным садовым растением. Этот вид используется в качестве растения-спутника для многих овощных культур. Сообщают, что корневые выделения этого растения способны уничтожать нематод в почве, а само оно отпугивает вредных насекомых, например таких, какой является белокрылка для томатов. Во время цветения это растение можно собирать целиком и использовать для получения эфирного масла, которое применяется в парфюмерии. T.patula используется в тестах на микоризацию, потому что оно представляет собой небольшое растение, легкое в обращении и демонстрирующее быструю колонизацию корня АМ-грибами. Нами был использован сорт "Legion d'honneur". Тесты на микоризацию проводили, выращивая рассаду на субстрате, составленном из частиц обожженной глины. Рассаду инокулировали стерильными спорами G.intraradices и добавляли факторы Мус в концентрации 10-8 M.
В первой серии экспериментов использовали смесь сульфатированных и несульфатированных синтетических факторов Мус. Степень микоризации оценивали спустя четыре недели после инокуляции путем подсчета числа единиц инфекции. У обработанных фактором Мус ростков наблюдалось очень существенное, на 153,5%, увеличение числа единиц инфекции на растение (Фиг.15a1). Факторы Мус могли увеличивать число инфекционных участков путем стимуляции развития корневой системы, либо путем повышения плотности инфекции. Действительно, обработка факторами Мус приводила как к увеличению на 49,1% длины корня (Фиг.15a2), так и к увеличению на 30,9% плотности инфекции (Фиг.15a3).
Во втором эксперименте инокулированные растения обрабатывали чистыми сульфатированными или несульфатированными факторами Мус, либо смесью обоих. Спустя четыре недели после инокуляции уровень колонизации оценивали методом пересечения решетки. Результаты представлены на Фиг.15b. Обработка смесью сульфатированных и несульфатированных факторов Мус вызывала существенное удвоение уровня колонизации корня (+104,5%), тогда как обработка чистыми сульфатированными и чистыми несульфатированными факторами Мус приводила к увеличению этого уровня, соответственно, на 42,3% и 75,4%.
Выводы:
Факторы Мус стимулируют формирование AM у не относящегося к бобовым растения, предоставляя дополнительные доказательства того, что факторы Мус, идентифицированные нами, являются подлинными сигналами микоризации.
Как сульфатированные, так и несульфатированные факторы Мус активны, но их смесь по активности явно превосходит отдельные группы факторов.
Тот факт, что факторы Мус эффективно стимулируют формирование AM и развитие корня у небобовых растений, открывает возможности для чрезвычайно широкого их применения в садоводстве, сельском хозяйстве и лесоводстве.
ПРИМЕР 9: ЭФФЕКТ ФАКТОРОВ MYC НА ПРОРАСТАНИЕ СЕМЯН НЕБОБОВОГО РАСТЕНИЯ ТОМАТА.
В предыдущих примерах авторы данного изобретения показали, что факторы Мус являются не только симбиотическими сигналами, активизирующими микоризную программу растения, но могут также действовать как регуляторы роста растения и стимулировать развитие корневой системы на очень ранней стадии развития проростков. Поэтому исследовали возможное влияние факторов Мус на прорастание семян небобовых растений. Сорт томата Heinz 1706 был выбран нами, потому что эта линия хорошо охарактеризована и была использована в проекте секвенирования генома томата в США. Кроме того, для нее созданы ДНК-микрочипы, что делает возможным изучение профиля экспрессии генов у этой линии томата.
В этих экспериментах использовали очищенные синтетические факторы Мус: сульфатированные, несульфатированные или их смесь. Факторы Мус добавляли в агаровую среду для прорастания и разливали в чашки Петри. Семена располагали на поверхности чашек с агаром и инкубировали в темноте при 14°С, 20°С и 28°С. Процент прорастания оценивали ежедневно.
В экспериментах использовали семена, которые были яровизированы хранением в 4°C в течение по меньшей мере восьми недель. Присутствие факторов Мус в среде для прорастания в диапазоне концентраций от 10-8 M до 10-10 M приводило к сильно выраженной стимуляции прорастания при 14°C и 20°C (см. Фиг.16). Каждый тип факторов Мус, сульфатированные или несульфатированные, проявлял активность, но что интересно, смесь обоих типов была явно более активной. При самой высокой температуре, 28°C, нам не удалось обнаружить какой-либо существенный эффект факторов Мус на прорастание семян (данные не приводятся). Эти результаты указывают на то, что данный эффект стимуляции проявляется при температурах, соответствующих диапазону обычных температур почвы. Можно выдвинуть гипотезу о том, что коэволюция растений и их AM-грибных симбионтов затрагивала не только формирование микоризы в развивающихся корнях, но также и очень раннюю стадию их взаимодействия - стадию прорастания. Оба партнера могли получать преимущество от объединения эффективности прорастания семени и раннего развития корня с присутствием грибного партнера. Стимуляция прорастания была связана с последующим лучшим развитием проростков, как показано на Фиг.16b.
Тот факт, что семена реагируют на факторы Мус, показывает, что компоненты растения, требуемые для восприятия фактора Мус (рецепторы) и трансдукции сигнала, присутствуют и функционируют в семенах. Этот результат открывает возможность обработки семян сельскохозяйственных культур факторами Мус в условиях сельского хозяйства. Наблюдение, что факторы Мус оказывают эффект на прорастание семян в чрезвычайно низких концентрациях (10-10 M), открывает возможность создания технологии обработки семян, отличающейся низкой стоимостью (низкое требуемое количество активного материала) и экологичностью (использование крайне низких концентраций естественных соединений).
Выводы:
Как сульфатированные, так и несульфатированные факторы Мус стимулируют прорастание семян томата, небобового растения, но их смесь является заметно более активной. Поэтому данные два типа факторов Мус представляют собой не только симбиотические сигналы, но также и мощные регуляторы роста растений, действующие как на бобовые, так и на небобовые растения.
С сельскохозяйственной точки зрения эти результаты открывают путь для важных приложений в садоводстве, сельском хозяйстве и лесоводстве: обработка семян факторами Мус, предпочтительно смесью сульфатированных и несульфатированных факторов, может улучшить процент и уровень прорастания и стимулировать развитие молодых проростков у наиболее культивируемых растений, большинство из которых способны к установлению такого эндомикоризного симбиоза.
СПИСОК ЛИТЕРАТУРЫ
Akiyama К, Matsuzaki К, Hayashi Н (2005) Plant sesquiterpenes induce hyphal branching in arbuscular mycorrhizal fungi. Nature, 435: 824-827.
Andriakaja A, Boisson-Dernier A, Frances L, Sauviac L, Jauncau A, Barker DG, Carvalho-Niebel F (2007) AP2-ERF transcription factors mediate Nod factor dependent Mt ENOD11 activation in root hairs via a novel cis-regulatory motif. Plant Cell, 19:2866-2885.
Ardourel M, Demont N, Debelle F, Maillet F, de Billy F, Promc JC, Denarie J, Truchet G (1994) Rhizobium meliloti lipooligosaccharide nodulation factors: Different structural requirements for bacterial entry into target root hair cells and induction of plant symbiotic developmental responses. Plant Cell, 6:1357-1374.
Becard G, Fortin JA (1988) Early events of vesicular-arbuscular mycorrhiza formation in Ri T-DNA transformed roots. New Phytol., 108:211-218.
Benamor B, Shaw S, Oldroyd G, Maillet F, Penmetsa RV, Cook D, Long S, Denarie J, Gough С (2003). The NFP locus of Medicago truncatula controls an early step of Nod factor signal transduction upstream of a rapid calcium flux and root hair deformation. Plant.J., 34: 495-506.
Bcsscrer A, Puech-Pages V, Kiefer P, Gomez-Roldan V, Jauneau A, Roy S, Portais JC, Roux C, Becard G, Sejalon-Delmas N (2006) Strigolactones stimulate arbuscular mycorrhizal fungi by activating mitochondria. PLoS Biol., 4(7):e226.
Catoira R, Galera C, De Billy F, Penmetsa RV, Journet EP, Maillet F, Rosenberg C, Cook D, gough C, Denarie J (2000) Four genes of Medicago truncatula controlling components of a Nod factor transduction pathway. Plant Cell, 12: 1647-1666.
Chabot S, Becard G, Piche Y (1992) The life cycle of Glomus intraradices in root organ culture. Mycologia, 84: 315-321.
Demont N, Debelle F, Aurelle H, Denarie J, Prome JC (1993) Role of the Rhizobium meliloti nodF and nodE genes in the biosynthesis of lipo-oligosaccharidic nodulation factors../ Biol. Chem., 268: 20134-20142.
Denarie J, Debelle F, Prome JC (1996) Rhizobium lipo-chilooligosaccharidc nodulalion factors: signaling molecules mediating recognition and morphogenesis. Annu. Rev. Biochem., 65: 503-535.
D'Haeze W, Holsters M (2002) Nod factor structures, responses, and perception during initiation of nodule development. Glycobiology, 12: 79R-105R.
Doner LW, Becard G (1991) Solubilization of gellan gels by chelation of cations. Biotechnol Tech., 1991; 5:25-28.
Giovanetti M, Mosse В (1980) An evaluation of techniques for measuring vesicular-arbuscular mycorrhizal infection in roots. New Phytologist, 84:489-500.
Grenouillat N, Vauzeilles B, Bono J.T, Samain E, Beau JM. (2004) Simple synthesis of nodulation-factor analogues exhibiting high affinity towards a specific binding protein. Angew Chem Int Ed Engl, 43:4644-4646.
Harrison M (2005) Signaling in the arbuscular mycorrhizal symbiosis. Annu. Rev. Microbiol, 59: 19-42.
Hewitt, E.J (1966) Sand and water culture methods used in the study of plant nutrition. Technical Communication No. 22 (revised 2nd edn). Com. Bur. of Horticul and Plant Crops East Mailing, Maidstore, Kent, UK.
Journet EP, El-Gachtouli N, Vernoud V, de Billy F, Pichon M, Dedieu A, Arnould C, Morandi D, Barker D, Gianinazzi-Pearson V (2001) Medicago truncatula ENOD11: a novel RPRP-encoding early nodulin gene expressed during mycorrhization in arbusculc-containing cells. Mol. Plant Microbe Interact., 14: 737-748.
Kosuta S, Chabaud M, Lougnon G, Go ugh C, Denarie.1, Barker DG, Becard G (2003) A diffusible factor from arbuscular mycorrhizal fungi induces symbiosis-specific MtENODl 1 expression in roots of Medicago truncatula. Plant Physiol, 131: 952-962.
Navazio L, Moscatiello R, Genre A, Novero M, Baldan B, Bonfante P, Mariani P (2007) A diffusible signal from arbuscular mycorrhizal fungi elicits a transient cytosolic calcium elevation in host plant cells. Plant Physiol. 144: 673-681.
Olah В, Briere С, Becard G, Denarie J, Gough С (2005) Nod factors and a diffusible factor from arbuscular mycorrhizal fungi stimulate lateral root formation in Medicago truncatula via the DM11/DMI2 signalling pathway. Plant.!., 44: 195-207.
Ohsten Rasmussen M, Hogg B, Bono JJ, Samain E, Drigucz H (2004) New access to lipo-chitooligosaccharide nodulation factors. Org. Biomol. Chem.,2: 1908-1910.
Price NPJ, Relic B, Talmont F, Lewin A, Prome D, Pueppke SG, Maillet F, Denarie J, Prome JC, Broughton WJ (1992) Broad-host-range Rhizobium species strain NGR234 secretes a family of carbamoylated, and fucosylated, nodulation signals that are O-acctylated or sulphated. Mol. Microbiol, 23: 3575-3584.
R Development Core Team (2009) R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0, URL http://www.R-http://project.org.
Rcmy W, Taylor TN, Hass IT, Kerp H (1994) Four hundred-million-ycar-old vesicular arbuscular mycorrhizae. Proc. Natl. Acad. Sci. USA, 91:11841-43.
Roche P, Debelle F, Maillet F, Lerouge P, Faucher C, Truchet G,.-Denarie J, Prome JC (1991a) Molecular basis of symbiotic host specificity in Rhizobium meliloti: nodli and nodPQ genes encode the sulfation of lipo-oligosaccharide signals. Cell, 61: 1131-1143.
Roche P, Lerouge P, Ponthus C, Prome JC (1991b) Structural determination of bacterial nodulation factors involved in the Rhizobium meliloti-a\ia\ia symbiosis../. Biol. Chem., 266: 10933-10940.
Samain E, Drouillard S, Heyraud A, Drigucz H, Gram-scale synthesis of recombinant chitooligosaccharides in Escherichia coli. Carbohydrate Research, 302: 35-42.
Samain E, Chazalet V, Geremia RA (1999), Production of (9-acetylated and sulphated chitooligosaccharides by recombinant Escherichia coli strains harboring different combinations of nod genes. Journal of Biotechnology, 72: 33-47.
Smit P, Racdts J, Portyanko V, Debelle F, Gough C, Bisscling T, Geurts R (2005) NSP1 of the GRAS protein family is essential for rhizobial Nod factor-induced transcription. Science, 308:1789-91.
Smith SE, Read DJ (2008) Mycorrhizal symbiosis. 787 pp., Academic Press.
Stacey G, Libault M, Brechenmacher L, Wan J, May G (2006) Genetics and functional genomics of legume nodulation. Curr. Opin. Plant Biol., 9:110-121.
Spaink HP, Wijfjes AHM, van der Drift KMGM, llaverkamp.1, Thomas-Oates JE, Lugtcnberg BJJ (1994) Structural identification of metabolites produced by the NodB and NodC proteins of Rhizobium leguminosarum. Mol. Microbiol., 13:821-831.
Spaink HP, Wijfjes AHM, Lugtenberg BJJ (1995) Rhizobium Nodi and NodJ proteins play a role in the efficiency of secretion of lipochitin oligosaccharides. J. Bacteriol., Ml: 6276 6281.
Vierheilig H, Coughlan AP, Wyss U, Piche Y (1998) Ink and vinegar, a simple staining technique for arbuscular-mycorrhizal fungi. Appl. Environm. Microbiol., 64:5004-5007.
Weidmann S, Sanchez L, Descombin J, Chatagnier O, Gianinazzi S, Gianinazzi-Pcarson V (2004) Fungal elicitation of signal transduction-related plant genes precedes mycorrhiza establishment and requires the dmi3 gene in Medicago truncatula. Mol. Plant Microbe Interact., 17: 1385-1393.
Реферат
Группа изобретений относится к использованию липохитоолигосахарида формулы (I) для стимуляции микоризации растения, где n= 2 или 3, Rпредставляет собой липидный заместитель, который является цепью жирной кислоты, содержащей от 16 до 18 атомов углерода, которая может быть насыщенной или моно- или диненасыщенной, a Rпредставляет собой H или SOH. Предложена также смесь липохитоолигосахаридов для стимуляции арбускулярно-микоризного симбиоза растения, для стимуляции прорастания семян растения или для стимуляции развития корневой системы растения и содержащая в эффективном количестве липохитоолигосахарид формулы (I), где Rпредставляет собой H, и липохитоолигосахарид формулы (I), где Rпредставляет собой SOH. Группа изобретений эффективно стимулирует прорастание семян растений, арбускулярно-микоризный симбиоз растения и развитие корневой системы растения. 2 н. и 7 з.п. ф-лы, 16 ил., 9 пр.
Формула

где n = 2 или 3, R1 представляет собой липидный заместитель, который является цепью жирной кислоты, содержащей от 16 до 18 атомов углерода, которая может быть насыщенной или моно- или диненасыщенной, a R2 представляет собой H или SO3H, для стимуляции микоризации растения.
- липохитоолигосахарида формулы (I), где n=2 или 3, R1 представляет собой насыщенную или мононенасыщенную цепь жирной кислоты, содержащей 16 атомов углерода, a R2 представляет собой Н или SO3H,
- липохитоолигосахарида формулы (I), где n=2 или 3, R1 представляет собой насыщенную или мононенасыщенную цепь жирной кислоты, содержащей 18 атомов углерода, a R2 представляет собой H или SO3H.

Комментарии