Комбинированная терапия с использованием антител к клаудину 18.2 для лечения рака - RU2662066C2
Код документа: RU2662066C2
Чертежи


















































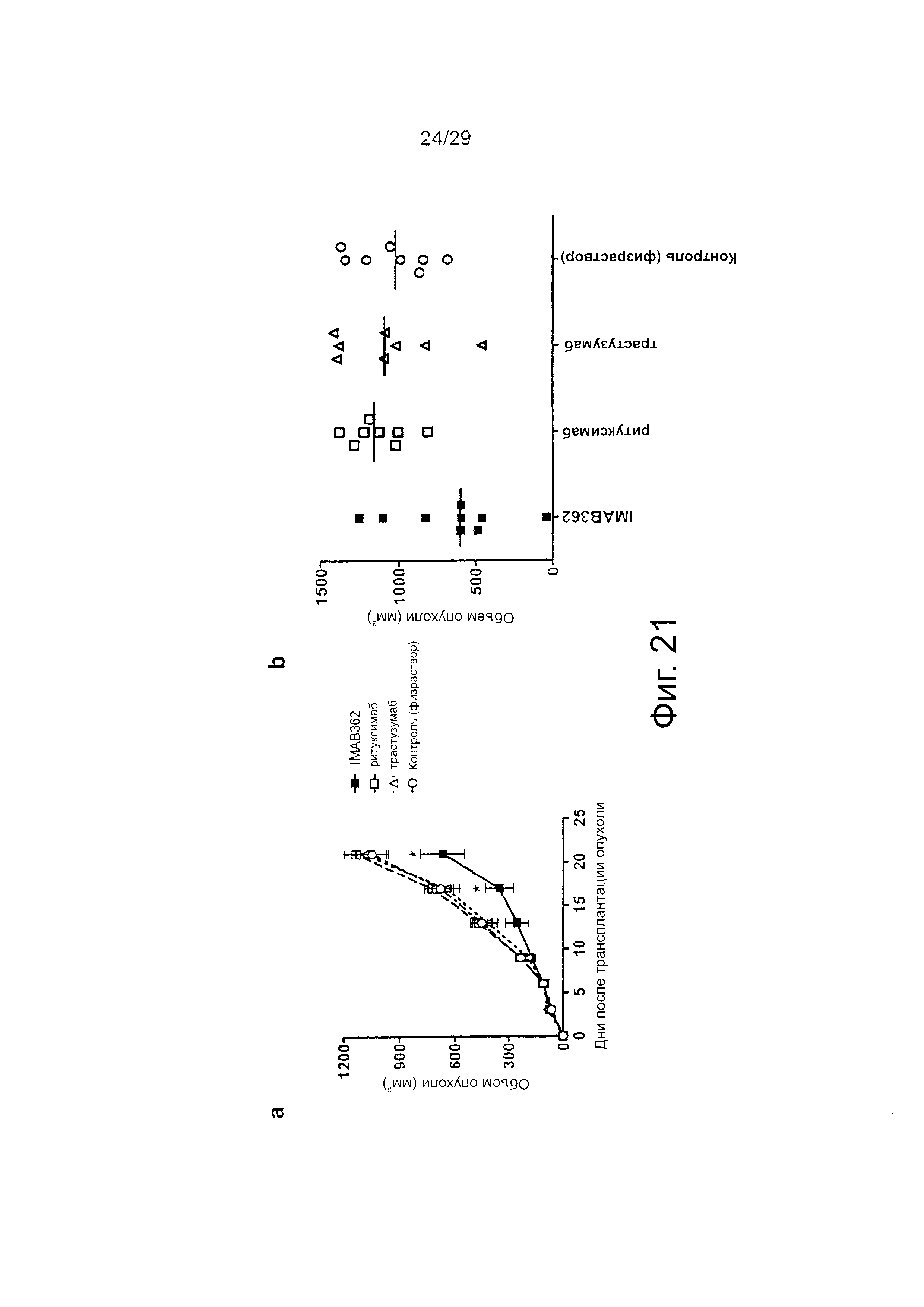



Описание
Раки желудка и пищевода (гатроэзофагеальные раки; GE) принадлежат к числу злокачественных новообразований, с которыми связана самая высокая нереализованная потребность медицины. Рак желудка является второй причиной смерти от рака во всем мире. Частота случаев возникновения эзофагеального рака увеличилась за последние десятилетия, совпадая с изменением гистологического типа и первичной локализации опухоли. В настоящее время аденокарцинома пищевода является более распространенной в Соединенных штатах и Западной Европе, чем плоскоклеточная карцинома, при этом большинство опухолей располагается в дистальном пищеводе. Уровень общей 5-летней выживаемости для GE рака составляет 20-25%, несмотря на агрессивность установленного стандартного лечения, связанного с существенными побочными эффектами.
У большинства пациентов обнаруживается местнораспространенная или метастазирующая опухоль, после чего они подвергаются первой линии химиотерапии. Режимы лечения, основанные на сочетании платины и производных фторпиримидина, обычно комбинируют с третьим соединением (например, таксаном или антрациклинами). Однако медиана выживаемости без прогрессирования от 5 до 7 месяцев и медиана общей выживаемости от 9 до 11 месяцев - это самое лучшее, что можно ожидать.
Отсутствие существенной пользы от различных режимов комбинированной химиотерапии нового поколения в отношении этих видов рака стимулировало исследования, связанные с использованием таргентных (нацеленных на мишень) препаратов. В последнее время для лечения Her2/neu-положительных гастроэзофагеальных видов рака был одобрен трастузумаб. Однако, данный вид лечения подходит только ~20% пациентов, у которых экспрессируется данная мишень, поэтому потребность медицины в препаратах остается по-прежнему высокой.
Молекула плотных контактов клаудин 18 сплайс-вариант 2 (клаудин 18.2 (CLDN18.2)) является членом семейства белков клаудина - белков плотных контактов. CLDN18.2 представляет собой трансмембранный белок (27.8 kDa), содержащий четыре трансмембранных домена с двумя небольшими внеклеточными петлями.
В нормальных тканях отсутствует обнаружимая посредством RT-PCR экспрессия CLDN18.2, за исключением желудка. Проведение иммуногистохимического анализа с помощью CLDN18.2-специфических антител показывает, что желудок является единственной положительной тканью в отношении этого белка.
CLDN18.2 является высокоселективным гастральным антигеном, экспрессированным исключительно на короткоживущих дифференцированных эпителиальных клетках желудка. CLDN18.2 сохраняется в ходе злокачественной трансформации, и поэтому часто обнаруживается на поверхности клеток рака желудка человека. Более того, этот панопухолевый антиген эктопически активирован на значимых уровнях в аденокарциномах пищевода, поджелудочной железы и легких. Белок CLDN18.2 также локализуется в метастазах аденокарциномы желудка в лимфатических узлах и в отдаленных метастазах, в частности, в яичниках (так называемая опухоль Крукенберга).
Химерное IgG1 антитело IMAB362, направленное против CLDN18.2, было разработано компанией Ganymed Pharmaceuticals AG. IMAB362 распознает первый внеклеточный домен (ECD1) CLDN18.2 с высокой аффинностью и специфичностью. IMAB362 не связывается с каким-либо другим членом семейства клаудинов, включая близкородственный сплайс-вариант 1 клаудина 18 (CLDN18.1). IMAB362 демонстрирует узкую специфичность к опухолевым клеткам и сочетает в себе четыре независимых высокоактивных механизма действия. После связывания с мишенью IMAB362 опосредует уничтожение клеток с помощью ADCC, CDC и индукции апоптоза, вызванного перекрестным связыванием мишени на поверхности опухолевой клетки, и прямого ингибирования пролиферации. Таким образом, IMAB362 эффективно вызывает лизис CLDN18.2-положительных клеток, включая линию клеток рака желудка человека in vitro и in vivo. У мышей, несущих CLDN18.2-положительную линию клеток рака, наблюдается благоприятное действие на выживаемость, и вплоть до 40% мышей демонстрирует регрессию опухоли при лечении IMAB362.
Токсичность и РК/TK профиль IMAB362 были тщательно исследованы на мышах и яванских макаках (cynomolgus), включая определение диапазона доз, 28-дневное исследование токсичности многократного применения препарата на макаках и 3-месячное исследование токсичности многократного применения препарата на мышах. Было показано, что при внутривенном введении (i.v.) многократные дозы IMAB362 хорошо переносятся и мышами (самая большая продолжительность еженедельного введения 3 месяца, самый высокий уровень доз 400 мг/кг) и яванскими макаками (до 5 еженедельных применений вплоть до 100 мг/кг). Не выявлено признаков системной или местной токсичности. В частности, ни в одном исследовании токсичности не наблюдалось токсического действия на желудок. IMAB362 не вызывает активацию иммунитета и высвобождение цитокинов. Не было отмечено неблагоприятных эффектов на репродуктивные органы самцов или самок. IMAB362 не связывается с тканями, не имеющими мишени. Исследование биораспределения на мышах показало, что причиной отсутствия гастральной токсичности вероятнее всего является компартментализация плотных контактов в месте просвета в здоровом эпителии желудка, которая, по-видимому, значительно уменьшает доступность IMAB362 эпитопа. Эта компартментализация пропадает после злокачественной трансформации, что приводит эпитоп в состояние, поддающееся воздействию IMAB362.
IMAB362 находится на ранней стадии клинических испытаний. Фаза I клинических испытаний проводится на людях. 5 дозовых групп (33 мг/м2, 100 мг/м2, 300 мг/м3, 600 мг/м2, 1000 мг/м2) по 3 пациента в каждой получали одно внутривенное введение IMAB362, наблюдение проводили в течение 28 дней. IMAB362 хорошо переносился, при этом не проводилось соответствующего исследования безопасности для пациентов. У одного пациента все измеренные опухолевые маркеры были значительно понижены в пределах 4 недель после лечения. В продолжающейся фазе IIа клинических исследований IMAB362 назначается повторно.
Представленные в этом документе данные показывают, что бисфосфонаты, такие как золедроновая кислота (ZA), в частности, при введении в сочетании с рекомбинантным интерлейкином-2 (IL-2), увеличивают активность анти-CLDN18.2 антитела, такого как IMAB362. Основным механизмом является активация и размножение высокоцитотоксической популяции иммунных клеток (γ9δ2 Т-клетки).
Кроме того, мы представляем результаты, демонстрирующие, что химиотерапевтические средства могут стабилизировать или увеличивать экспрессию CLDN18.2 на поверхности раковых клеток, что приводит к повышению доступности CLDN18.2 для анти-CLDN18.2 антитела, такого как ΙΜΑΒ362. Наблюдалось синергическое действие анти-CLDN18.2 антитела, такого как IMAB362, с определенными химиотерапевтическими режимами, в частности, химиотерапевтическими режимами, используемыми при лечении рака желудка или лечении солидных опухолей человека. Клетки рака человека, предварительно обработанные химиотерапевтическими средствами, являются более подверженными лизису, индуцированному мишень-специфическим антителом. На мышиных опухолевых моделях подавление опухоли с использованием анти-CLDN18.2 антитела в сочетании с химиотерапией превосходит применение анти-CLDN18.2 антитела в виде монотерапии.
Раскрытие изобретения
В общем, настоящее изобретение предоставляет комбинированную терапию для эффективного лечения и/или предотвращения заболеваний, связанных с клетками, экспрессирующими CLDN18.2, включая раковые заболевания, такие как рак желудка, рак пищевода, рак поджелудочной железы, рак легких, такой как немелкоклеточный рак легкого (NSCLC), рак яичников, рак толстой кишки, рак печени, рак головы и шеи, рак желчного пузыря и их метастазы, в частности, метастазы рака желудка, такие как опухоль Крукенберга, метастазы в брюшину и/или лимфатические узлы. В частности, предпочтительными раковыми заболеваниями являются аденокарциномы желудка, пищевода, протока поджелудочной железы, желчевыводящих путей, легких и яичников.
В одном аспекте настоящее изобретение предоставляет способ лечения или предотвращения ракового заболевания, включающий введение пациенту антитела, обладающего способностью связываться с CLDN18.2, в комбинации со средством, стимулирующим γδ Т-клетки. Средство, стимулирующее γδ Т-клетки, может быть введено до, одновременно с или после введения антитела, обладающего способностью связываться с CLDN18.2, или его комбинации.
В одном варианте осуществления γδ Т-клетки являются Vγ9Vδ2 Τ клетками. В одном варианте осуществления средство, стимулирующее γδ Т-клетки, является бисфосфонатом, таким как азотсодержащий бисфосфонат (аминобисфосфонат). В одном варианте осуществления средство, стимулирующее γδ Т-клетки, выбирают из группы, состоящей из золедроновой кислоты, клодроновой кислоты, ибандроновой кислоты, памидроновой кислоты, ризедроновой кислоты, минодроновой кислоты, олпадроновой кислоты, алендроновой кислоты, инкадроновой кислоты и их солей. В одном варианте осуществления средство, стимулирующее γδ Т-клетки, вводят в комбинации с интерлейкином-2.
В одном варианте осуществления способ изобретения дополнительно включает введение средства, стабилизирующего или увеличивающего экспрессию CLDN18.2. Экспрессия CLDN18.2 предпочтительно происходит на поверхности раковой клетки.
Средство, стабилизирующее или увеличивающее экспрессию CLDN18.2, может быть цитотоксическим и/или цитостатическим средством. В одном варианте осуществления средство, стабилизирующее или увеличивающее экспрессию CLDN18.2, включает средство, вызывающее остановку клеточного цикла или накопление клеток в одной или более фазах клеточного цикла, предпочтительно в одной или более фазах клеточного цикла, отличных от G1-фазы. Средство, стабилизирующее или увеличивающее экспрессию CLDN18.2, может включать препарат, выбранный из группы, состоящей из антрациклинов, соединений платины, аналогов нуклеозидов, таксанов и аналогов камптотецина или его пролекарств, и их комбинаций. Средство, стабилизирующее или увеличивающее экспрессию CLDN18.2, может включать препарат, выбранный из группы, состоящей из эпирубицина, оксалиплатина, цисплатина, 5-фторурацила или его пролекарств, таких как капецитабин, доцетаксел, иринотекан, и их комбинаций. Средство, стабилизирующее или увеличивающее экспрессию CLDN18.2, может включать комбинацию оксалиплатина и 5-фторурацила или его пролекарств, комбинацию цисплатина и 5-фторурацила или его пролекарств, комбинацию, по меньшей мере, одного антрациклина и оксалиплатина, комбинацию, по меньшей мере, одного антрациклина и цисплатина, комбинацию, по меньшей мере, одного антрациклина и 5-фторурацила или его пролекарств, комбинацию, по меньшей мере, одного таксана и оксалиплатина, комбинацию, по меньшей мере, одного таксана и цисплатина, комбинацию, по меньшей мере, одного таксана и 5-фторурацила или его пролекарств, или комбинацию, по меньшей мере, одного аналога камптотецина и 5-фторурацила или его пролекарств. Средство, стабилизирующее или увеличивающее экспрессию CLDN18.2, может быть средством, вызывающим иммуногенную гибель клеток. Средство, вызывающее иммуногенную гибель клеток, может включать средство, выбранное из группы, состоящей из антрациклинов, оксалиплатина и их комбинаций. Средство, стабилизирующее или увеличивающее экспрессию CLDN18.2, может включать комбинацию эпирубицина и оксалиплатина. В одном варианте осуществления способ изобретения включает введение, по меньшей мере, одного антрациклина, по меньшей мере, одного соединения платины и, по меньшей мере, одного 5-фторурацила и его пролекарств. Антрациклин можно выбрать из группы, состоящей из эпирубицина, доксорубицина, даунорубицина, идарубицина и валрубицина. Предпочтительно, антрациклин является эпирубицином. Соединение платины можно выбрать из группы, состоящей из оксалиплатина и цисплатина. Нуклеозидный аналог может быть выбран из группы, состоящей из 5-фторурацила и его пролекарства. Таксан можно выбрать из группы, состоящей из доцетаксела и паклитаксела. Аналог камптотецина может быть выбран из группы, состоящей из иринотекана и топотекана. В одном варианте осуществления способ изобретения включает введение (i) эпирубицина, оксалиплатина и 5-фторурацила, (ii) эпирубицина, оксалиплатина и капецитабина, (iii) эпирубицина, цисплатина и 5-фторурацила, (iv) эпирубицина, цисплатина и капецитабина, или (v) фолиниевой кислоты, оксалиплатина и 5-фторурацила.
Способ изобретения может дополнительно включать введение, по меньшей мере, одного дополнительного химиотерапевтического средства, которое может быть цитотоксическим средством.
Антитело, обладающее способностью связываться с CLDN18.2, может связываться с нативными эпитопами CLDN18.2, присутствующими на поверхности живых клеток. В одном варианте осуществления антитело, обладающее способностью связываться с CLDN18.2, связывается с первой внеклеточной петлей CLDN18.2. В одном варианте осуществления антитело, обладающее способностью связываться с CLDN18.2, опосредует уничтожение клетки с помощью одного или более из числа опосредованного комплементзависимой цитотоксичностью (CDC) лизиса, опосредованного антителозависимой клеточноопосредованной цитотоксичностью (ADCC) лизиса, индукции апоптоза и ингибирования пролиферации. В одном варианте осуществления антитело, обладающее способностью связываться с CLDN18.2, является моноклональным, химерным или гуманизированным антителом или фрагментом антитела. В одном варианте осуществления антитело, обладающее способностью связываться с CLDN18.2, является антителом, выбранным из группы, состоящей из (i) антитела, продуцированного и/или полученного от клона, депонированного под учетным номером DSM АСС2737, DSM АСС2738, DSM АСС2739, DSM АСС2740, DSM АСС2741, DSM АСС2742, DSM АСС2743, DSM АСС2745, DSM АСС2746, DSM АСС2747, DSM АСС2748, DSM АСС2808, DSM АСС2809 или DSM АСС2810, (ii) антитела, которое является химерной или гуманизированной формой антитела согласно (i), (iii) антитела, обладающего специфичностью антитела согласно (i) и (iv) антитела, содержащего антигенсвязывающий участок или антигенсвязывающий сайт, в частности, вариабельную область, антитела согласно (i) и предпочтительно обладающего специфичностью антитела согласно (i). В одном варианте осуществления антитело соединено с терапевтическим средством, таким как токсин, радиоизотоп, лекарственное средство или цитотоксическое средство.
В одном варианте осуществления способ изобретения включает введение антитела, обладающего способностью связывания с CLDN18.2, в дозе вплоть до 1000 мг/м2 В одном варианте осуществления способ изобретения включает введение антитела, обладающего способностью связывания с CLDN18.2, повторно в дозе от 300 до 600 мг/м2.
В одном варианте осуществления рак является CLDN18.2-положительным. В одном варианте осуществления раковое заболевание выбирают из группы, состоящей из рака желудка, рака пищевода, рака поджелудочной железы, рака легких, рака яичников, рака толстой кишки, рака печени, рака головы и шеи, рака желчного пузыря и их метастазов. Раковое заболевание может быть опухолью Крукенберга, метастазами в брюшину и/или лимфатические узлы. В одном варианте осуществления рак представляет собой аденокарциному, в частности, прогрессирующую аденокарциному. В одном варианте осуществления рак выбирают из группы, состоящей из рака желудка, рака пищевода, в частности, нижнего отдела пищевода, рака гастроэзофагиального соединения и гастроэзофагиального рака. Пациент может быть пациентом с отрицательным статусом по HER2/neu или пациентом с положительным статусом по HER2/neu, но не подходящим для лечения трастузумабом.
Согласно изобретению CLDN18.2 предпочтительно имеет аминокислотную последовательность в соответствии с SEQ ID NO: 1.
В дополнительном аспекте настоящее изобретение предоставляет медицинский препарат, содержащий антитело, обладающее способностью связываться с CLDN18.2, и средство, стимулирующее γδ Т-клетки. Медицинский препарат настоящего изобретения может дополнительно включать средство, стабилизирующее или увеличивающее экспрессию CLDN18.2. Антитело, обладающее способностью связываться с CLDN18.2, и средство, стимулирующее γδ Т-клетки, и необязательно средство, стабилизирующее и увеличивающее экспрессию CLDN18.2, могут присутствовать в медицинском препарате в виде смеси или отдельно друг от друга. Медицинский препарат может представлять собой набор, включающий первый контейнер, содержащий антитело, обладающее способностью связывания с CLDN18.2, и контейнер, содержащий средство, стимулирующее γδ Т-клетки, и необязательно контейнер, содержащий средство, стабилизирующее и увеличивающее экспрессию CLDN18.2. Медицинский препарат может дополнительно включать напечатанные инструкции по применению препарата для лечения рака, в частности, для применения препарата в способе изобретения. Различными вариантами осуществления медицинского препарата и, в частности, средства, стимулирующего γδ Т-клетки, и средства, стабилизирующего или увеличивающего экспрессию CLDN18.2, являются описанные выше в отношении способа изобретения.
Настоящее изобретение также предоставляет описанные здесь средства, такие как антитело, обладающее способностью связывания с CLDN18.2, для применения в описанных здесь способах, например, для введения в комбинации со средством, стимулирующим γδ Т-клетки, и необязательно средством, стабилизирующим или увеличивающим экспрессию CLDN18.2.
Другие признаки и преимущества данного изобретения станут понятны из следующего подробного описания и пунктов формулы изобретения.
Краткое описание чертежей
Фигура 1. Действие химиотерапии на клетки рака желудка. Культивирование клеток KatoIII в течение 96 часов приводит к остановке клеточного цикла в G0/G1-фазе и отрицательной регуляции CLDN18.2. Цитостатические соединения, вызывающие остановку клеточного цикла в разных фазах клеточного цикла (S-фаза (5-FU) или G2-фаза (эпирубицин)), стабилизируют CLDN18.2-экспрессию.
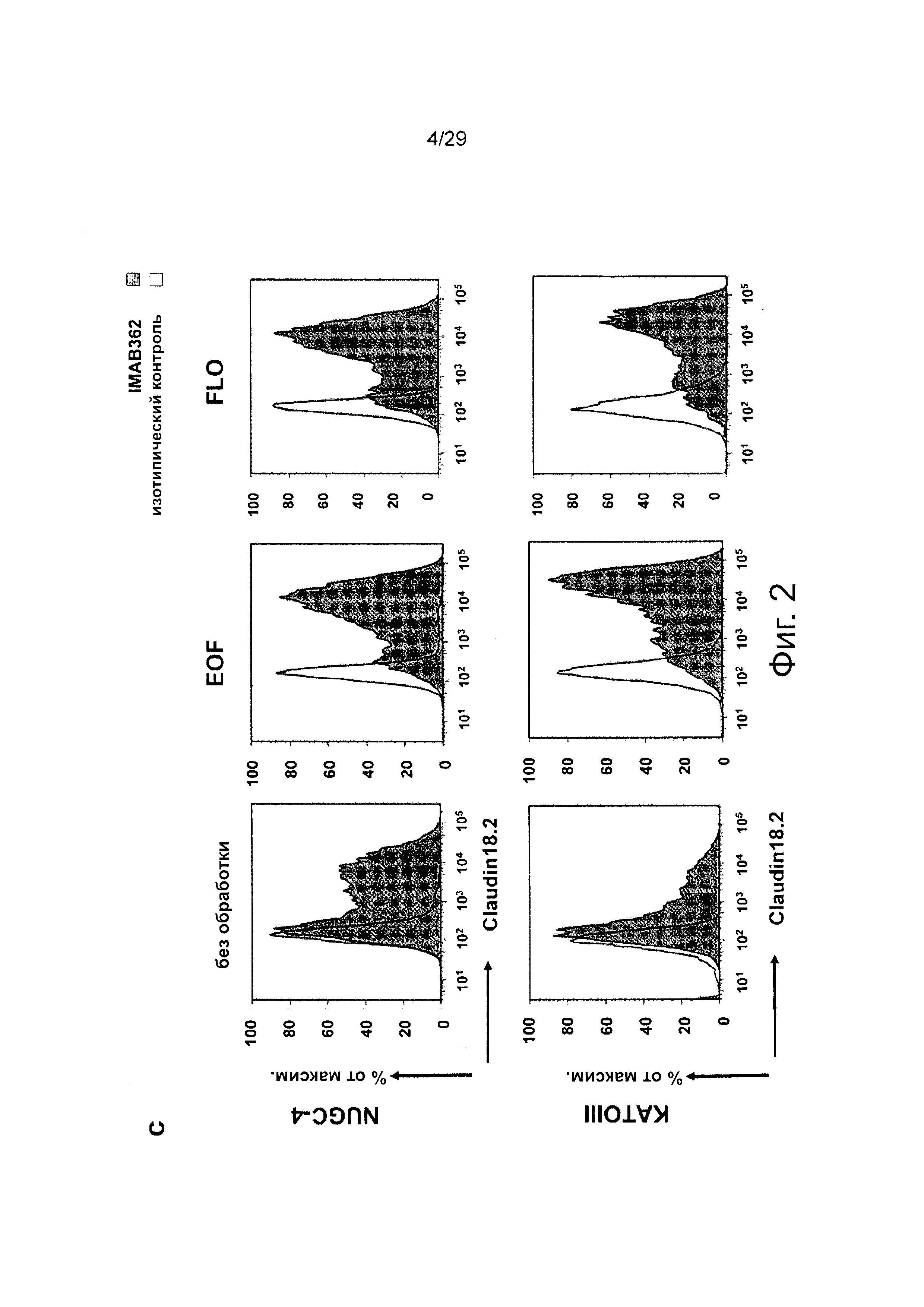
Фигура 2. Действие химиотерапии на клетки рака желудка. a/b: Действие химиотерапии на уровни транскрипта и белка CLDN18.2 в клетках рака желудка, с: Результаты исследования с помощью проточной цитометрии внеклеточного связывания IMAB362 на клетках рака желудка, обработанных химиотерапевтическими средствами.
Фигура 3. Действие химиотерапии на клетки рака желудка. Цитостатические соединения, вызывающие остановку клеточного цикла в разных фазах клеточного цикла (S/G2-фаза (иринотекан) или G2-фаза (доцетаксел)).
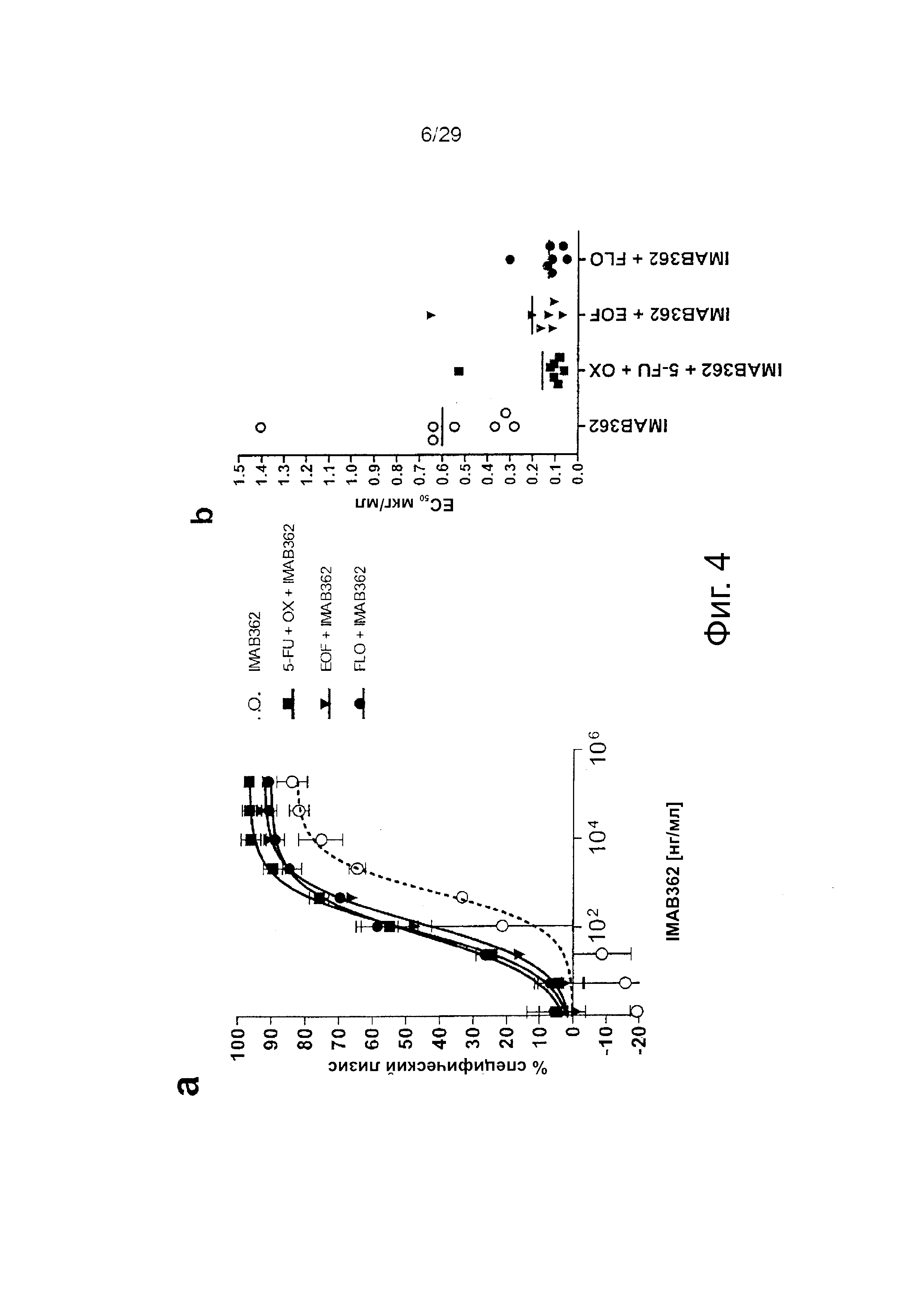
Фигура 4. IMAB362-индуцированный ADCC опосредует уничтожение клеток рака желудка после предварительной обработки химиотерапевтическими средствами.
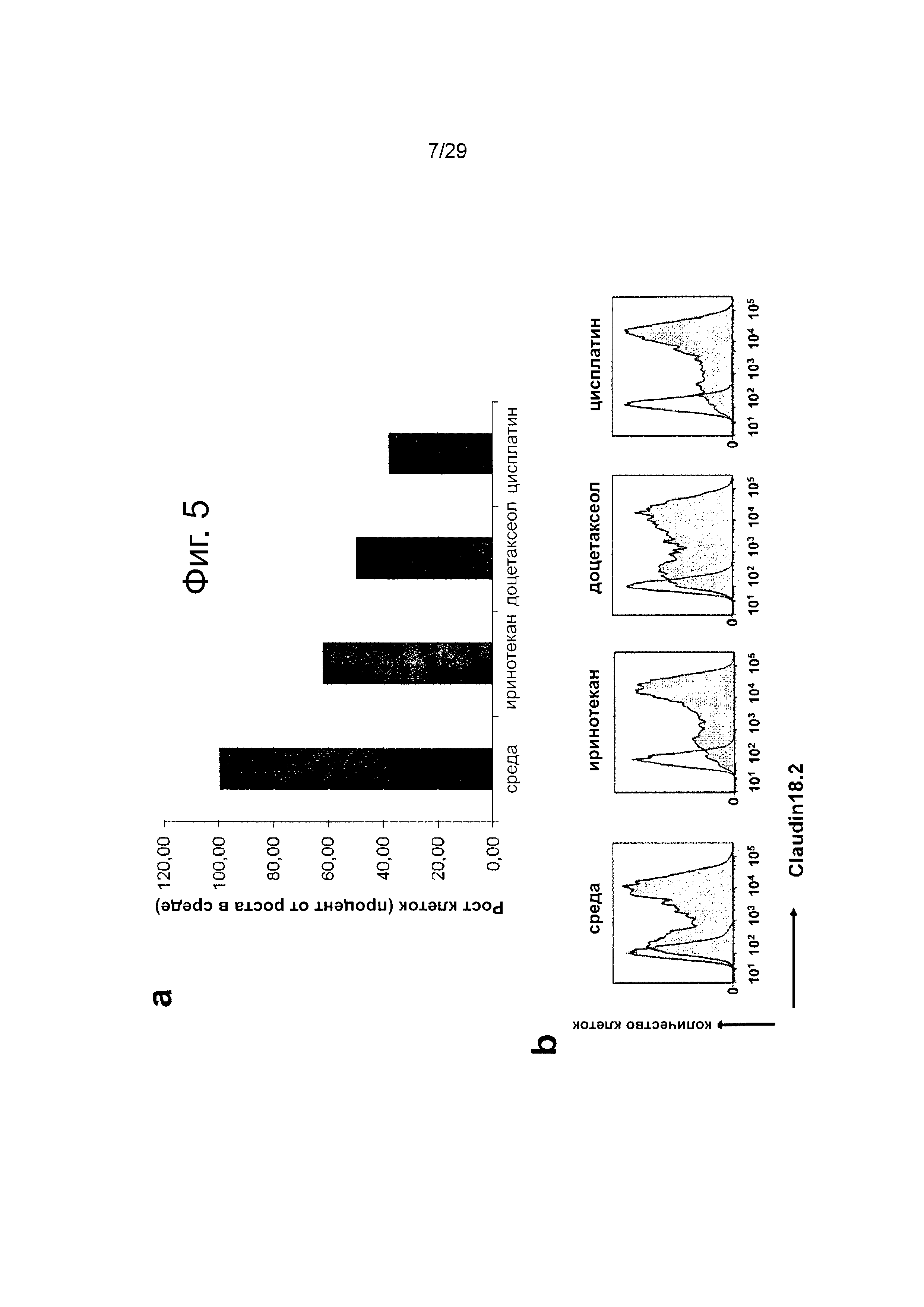
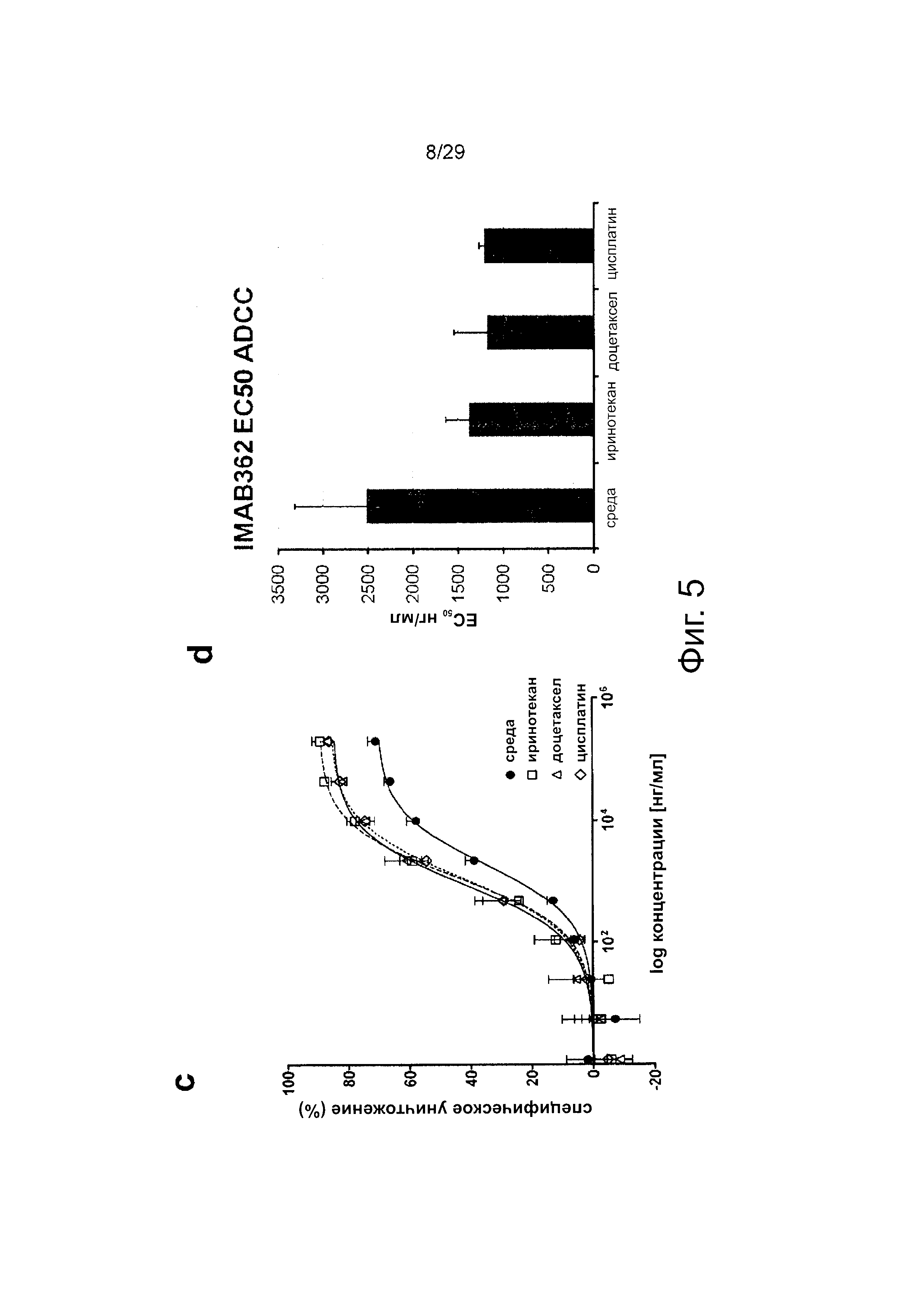
Фигура 5. Действие химиотерапии на клетки рака желудка, а: Клетки, обработанные иринотеканом, доцетакселем или цисплатином, демонстрируют более низкий уровень жизнеспособных клеток по сравнению с клетками, культивированными в среде, b: CLDN18.2 экспрессия в клетках, обработанных иринотеканом, доцетакселем или цисплатином, является повышенной по сравнению с клетками, культивированными в среде, c/d: Обработка клеток иринотеканом, доцетакселем или цисплатином увеличивает потенциальную возможность IMAB362 вызывать ADCC.
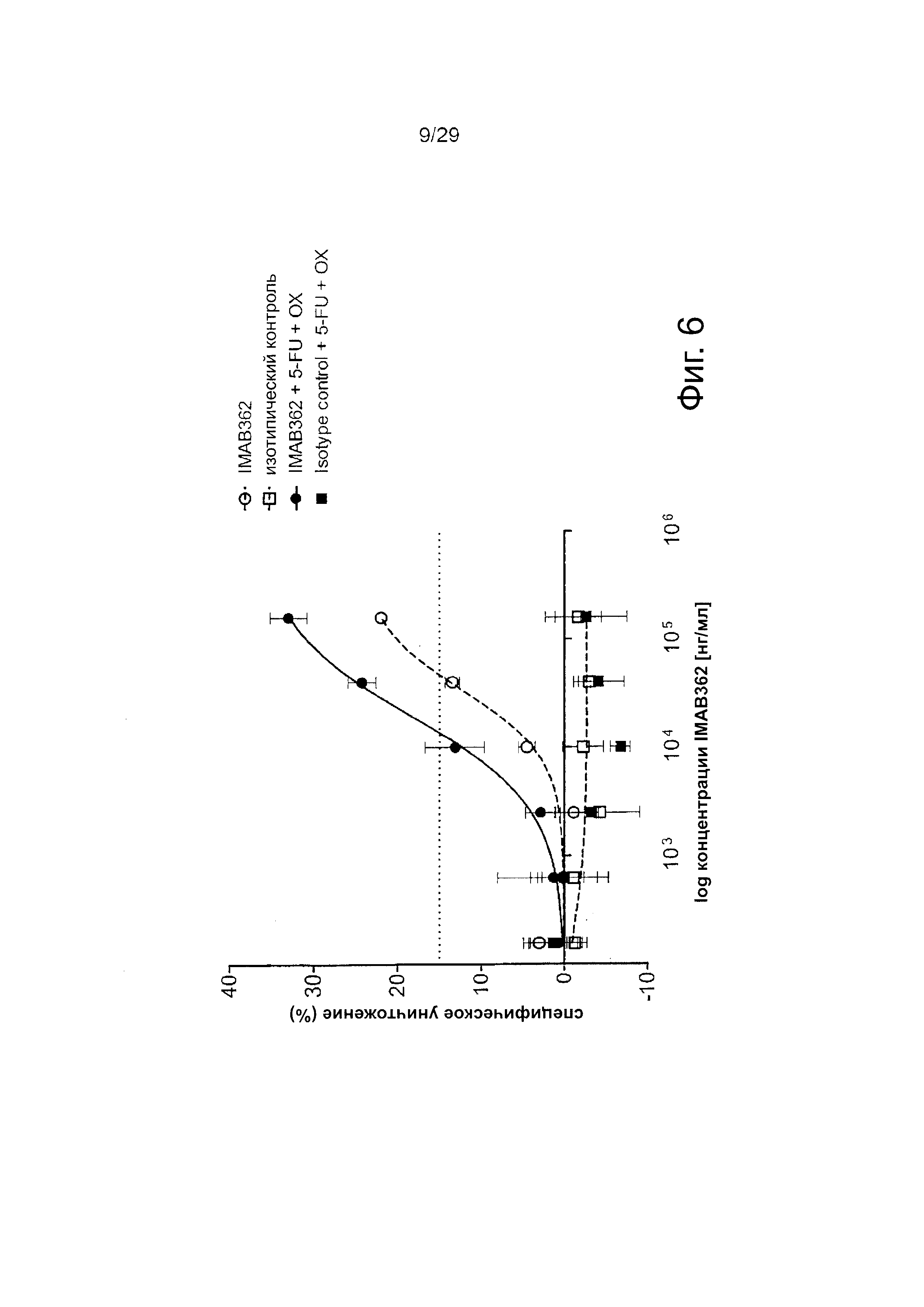
Фигура 6. Эффекты химиотерапии на CDC, индуцированный IMAB362.
Фигура 7. Эффекты химиотерапии на эффекторные клетки.
Фигура 8. Размножение РВМС в культурах с добавлением ZA/IL-2.
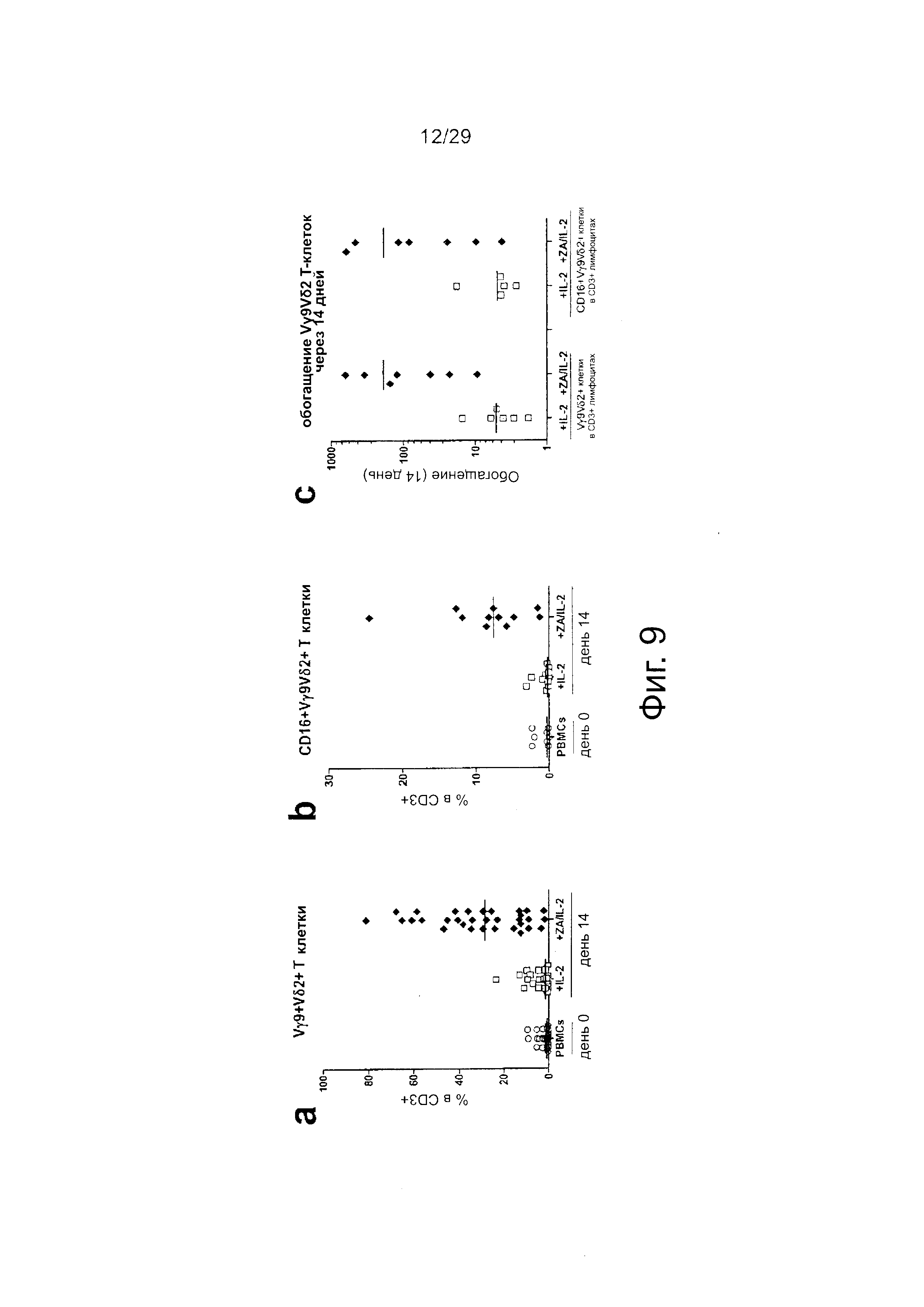
Фигура 9. Обогащение Vγ9Vδ2 Т-клеток в РВМС культурах с добавлением ZA/IL-2. Фигура 10. Обогащение Vγ9Vδ2 Т-клеток в среде с добавлением ΖА и увеличивающейся дозы IL-2.
Фигура 11. Размножение и цитотоксическая активность Vγ9Vδ2 Т-клеток после совместной инкубации с ZA-активированными моноцитами и клетками рака человека.
Фигура 12. ZA-зависимое развитие различных типов клеток в РВМС-культурах.
Фигура 13. Поверхностные маркеры на Vγ9Vδ2 Т-клетках после ZA/IL-2 обработки.
Фигура 14. ADCC активность Vγ9Vδ2 Т-клеток в сочетании с IMAB362 на CLDN18.2-положительных NUGC-4 клетках рака желудка.
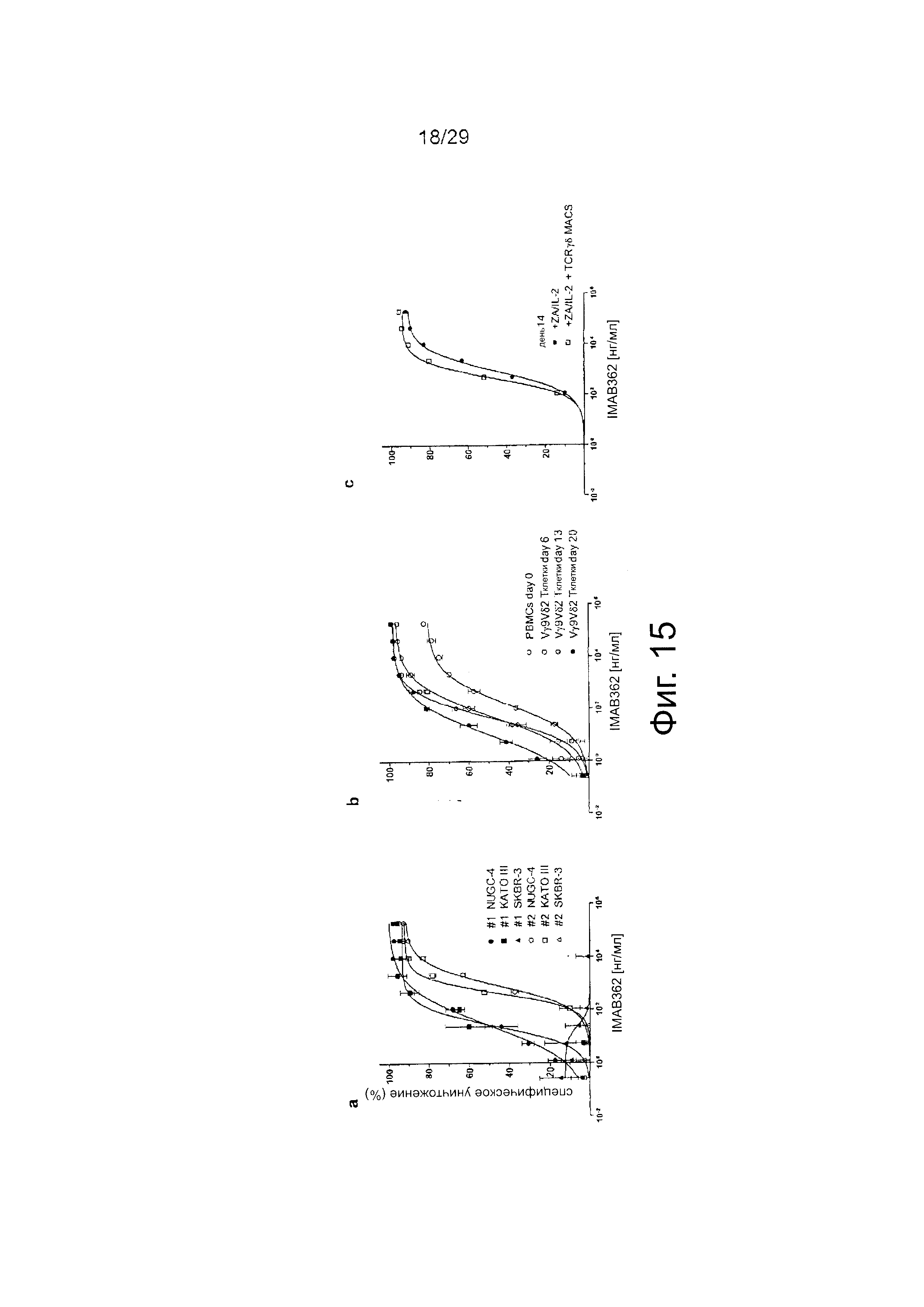
Фигура 15. ADCC активность IMAB362 с использованием Vγ9Vδ2 Т-клеток в качестве эффекторных клеток.
Фигура 16. Действие ZA на поверхностное расположение CLDN18.2 на клетках-мишенях.
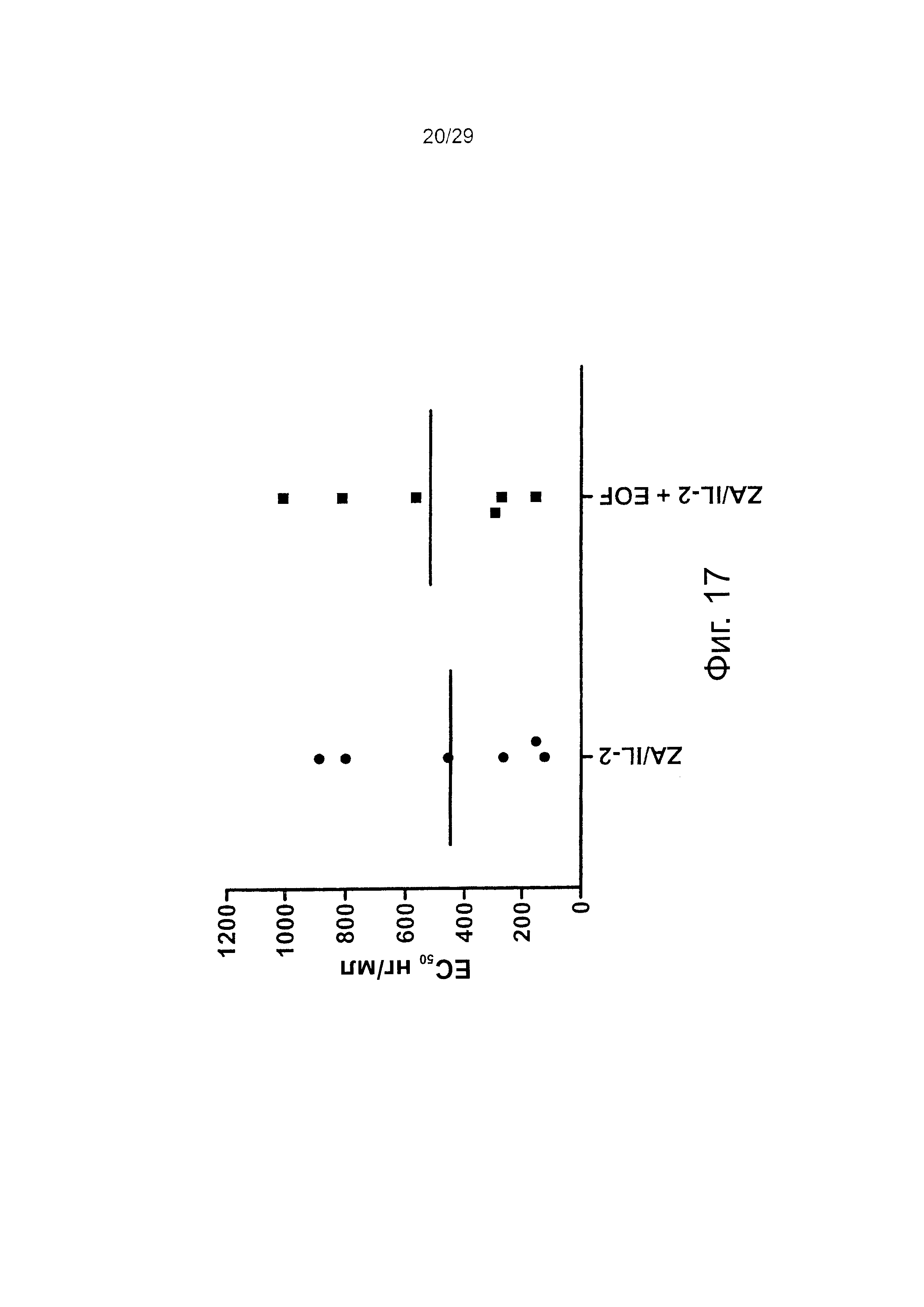
Фигура 17. Эффекты химиотерапии и ZA/IL-2- обработки на эффекторные клетки.
Фигура 18. Исследование биораспределения конъюгированных антител у мышей.
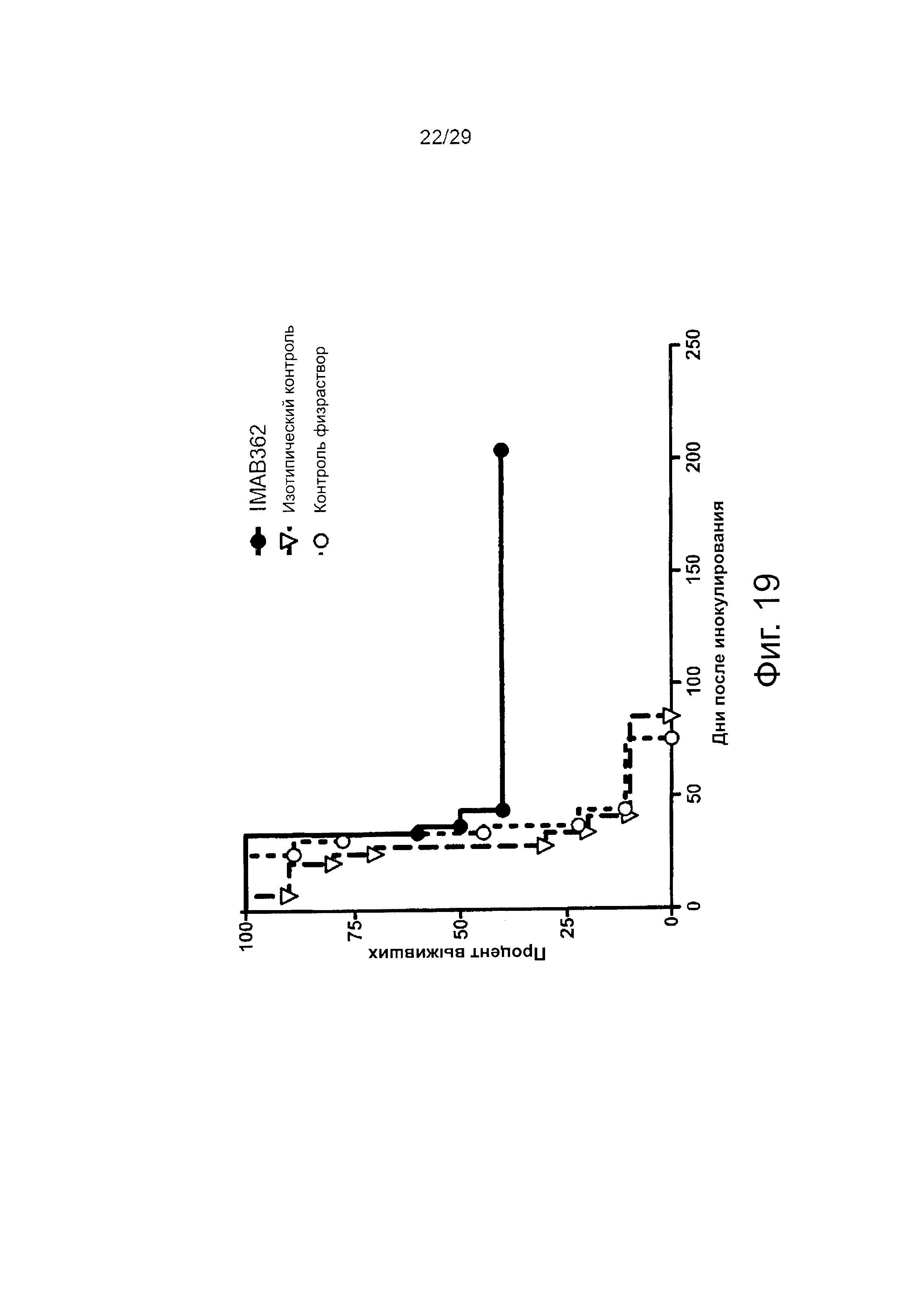
Фигура 19. Раннее лечение HEK293~CLDN18.2 ксенотрансплантатов опухоли.
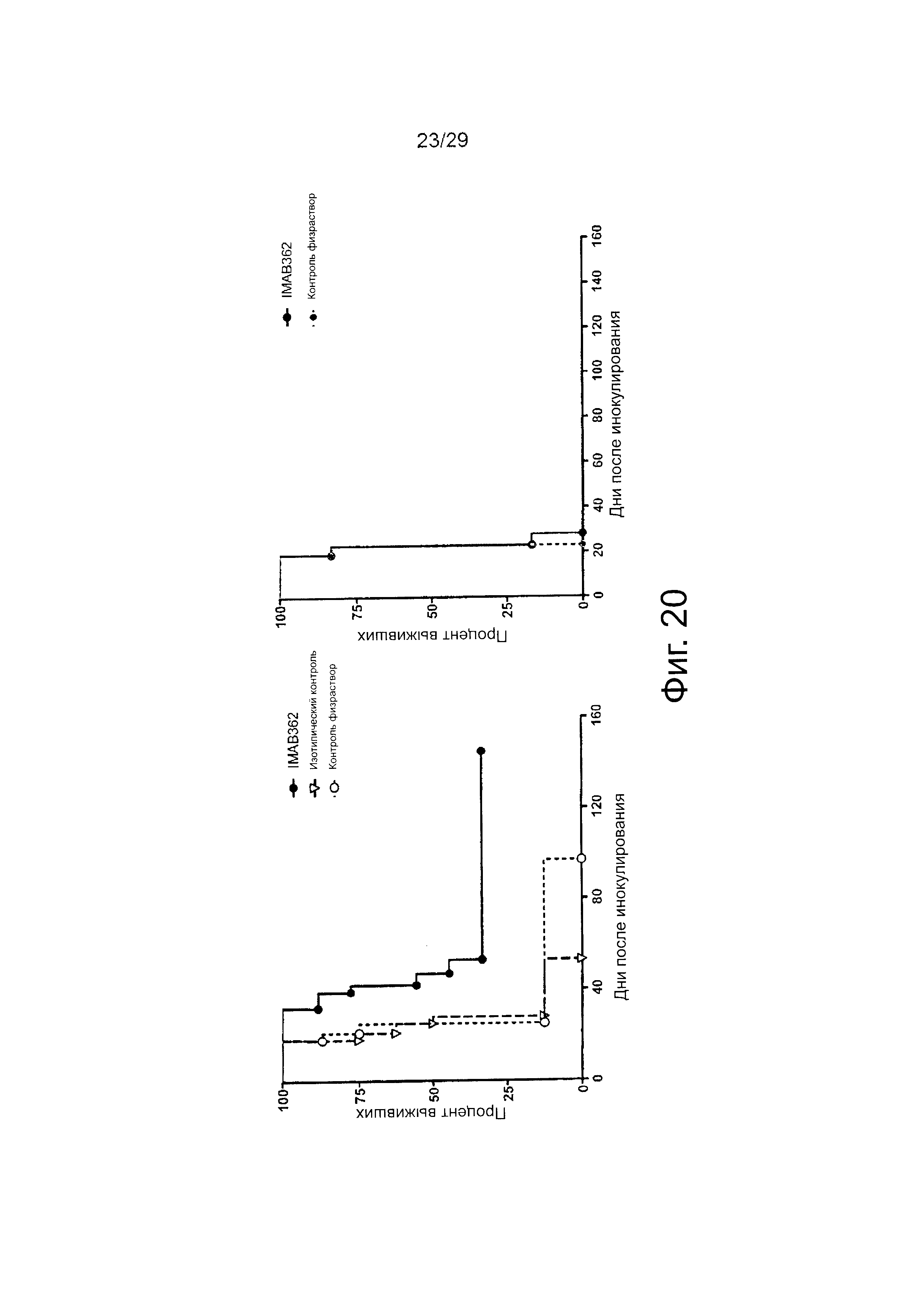
Фигура 20. Лечение развитых HEK293~CLDN18.2 ксенотрансплантатов опухоли.
Фигура 21. Действие IMAB362 на рост подкожных ксенотрансплантатов рака желудка.
Фигура 22. Эффекты иммунотерапии IMAB362 на NCI-N87~CLDN18.2 ксенотрансплантаты карциномы желудка.
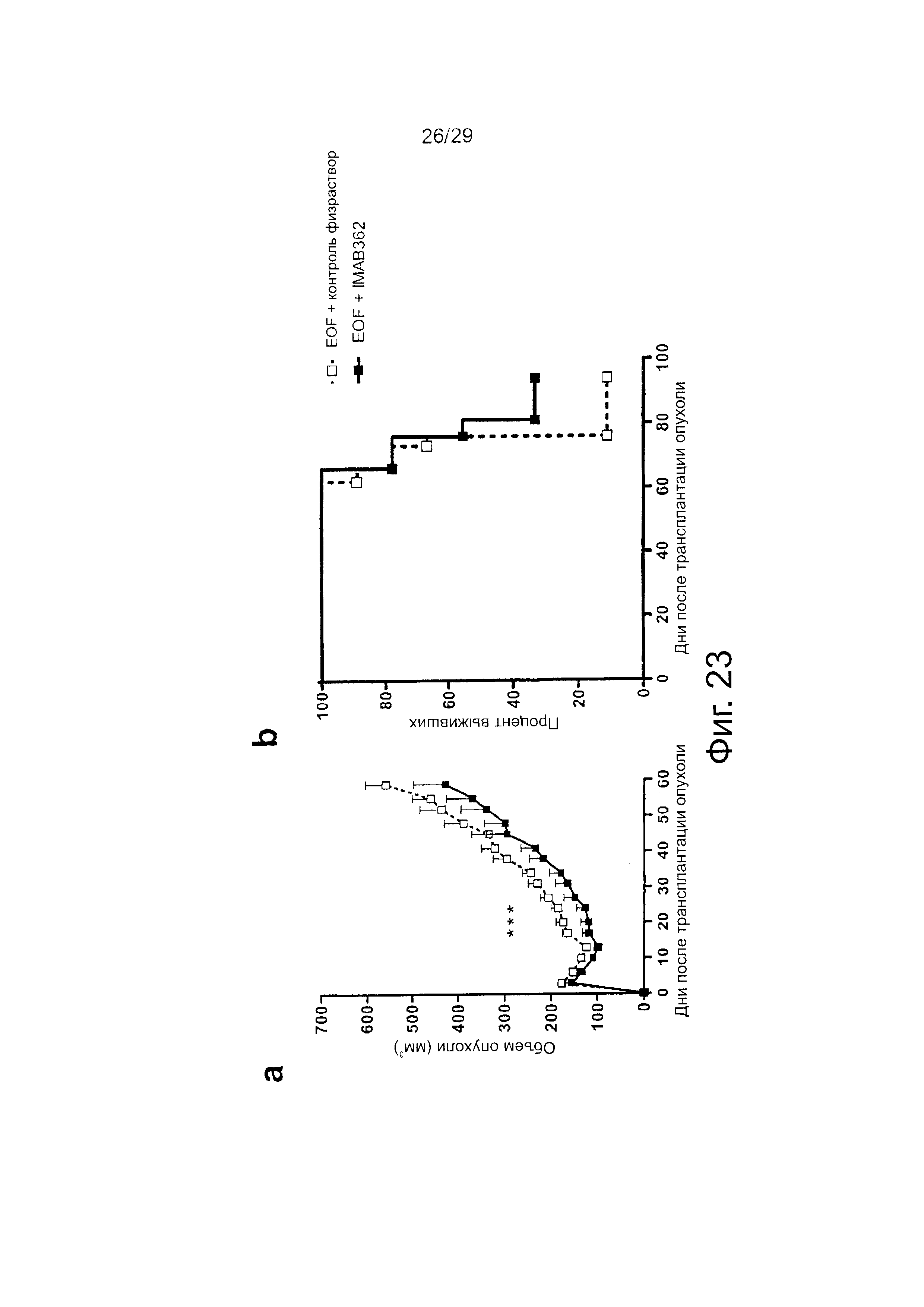
Фигура 23. Эффекты комбинированной терапии IMAB362 и режима EOF на NCI-N87~CLDN18.2 ксенотрансплантаты.
Фигура 24. Эффекты комбинированной терапии IMAB362 и EOF режима на NUGC-4~CLDN18.2 ксенотрансплантаты.
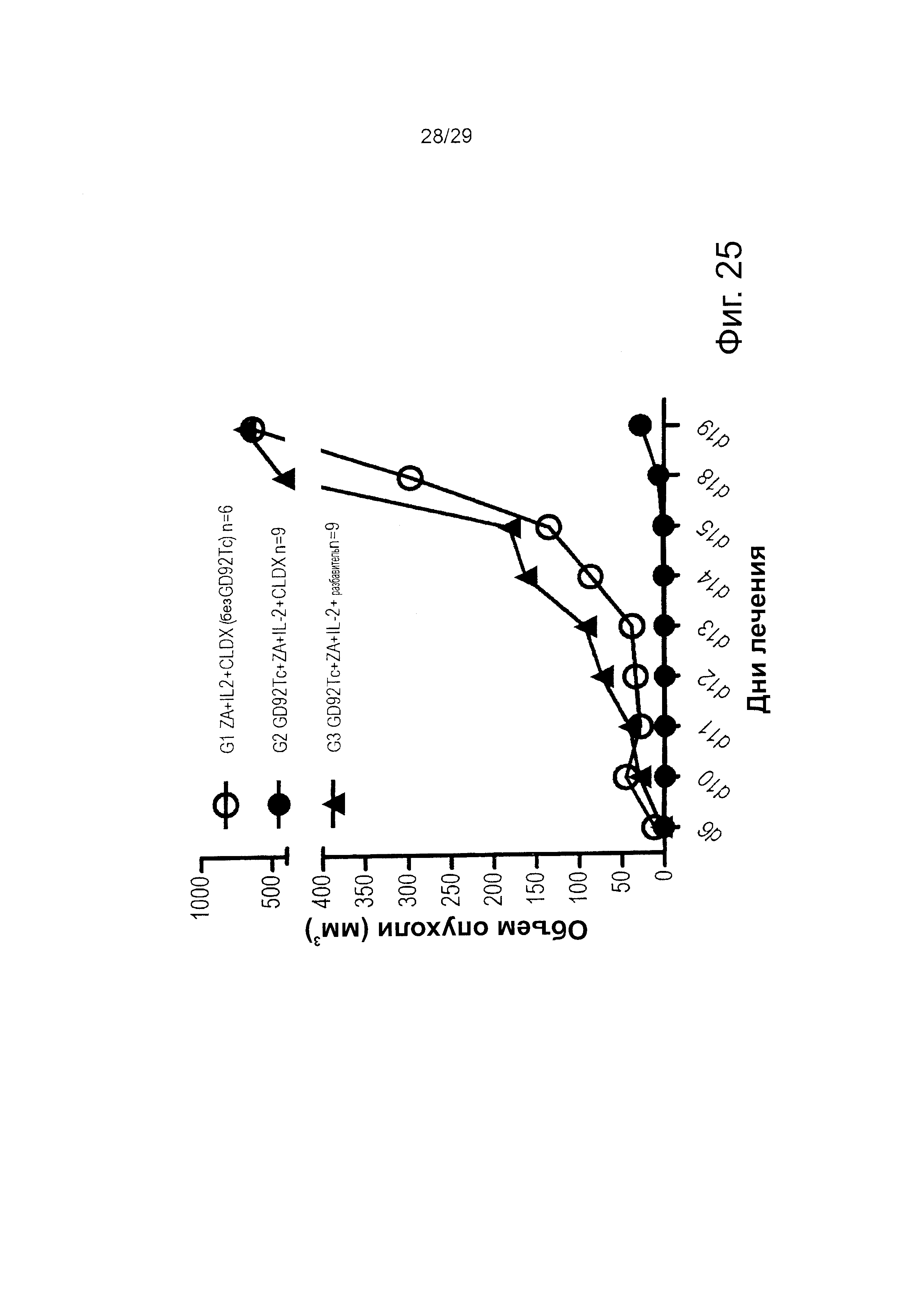
Фигура 25. Действие ZA/IL-2-индуцированных Vγ9Vδ2 Т-клеток на контроль макроскопических опухолей с использованием IMAB362 у мышей NSG.
Фигура 26. Эффекты комбинированной терапии IMAB362 и EOF режима на CLS-103~cldn18.2 аллотрансплантаты опухолей.
Подробное описание изобретения
Несмотря на то, что настоящее изобретение подробно описано далее, понятно, что это изобретение не ограничивается конкретными методиками, протоколами и реагентами, описанными здесь, поскольку они могут отличаться. Также следует понимать, что использованная в описании терминология предназначается только для описания отдельных вариантов осуществления и не предназначается для ограничения объема настоящего изобретения, который будет ограничиваться только прилагаемыми пунктами формулы изобретения. Если не указано иначе, все технические и научные термины, использованные в описании, имеют те же самые значения, которые обычно понятны среднему специалисту в данной области техники.
В дальнейшем будут описаны элементы настоящего изобретения. Эти элементы перечисляются в конкретных вариантах осуществления, однако, должно быть понятно, что они могут объединяться любым образом и в любом количестве для создания дополнительных вариантов осуществления. Различным образом описанные примеры и предпочтительные варианты осуществления не должны истолковываться как ограничивающие настоящее изобретение только точно описанными вариантами осуществления. Следует понимать, что это описание поддерживает и рассматривает варианты осуществления, которые объединяют точно описанные варианты осуществления с любым числом раскрытых и/или предпочтительных элементов. Более того, любые перестановки и комбинации всех описанных элементов в этой заявке следует рассматривать как раскрытые описанием настоящей заявки, если контекст не диктует иначе.
Предпочтительно, использованные в описании термины определяются так, как описано в "A multilingual glossary of biotechnological terms: (IUPAC Recommendations)", H.G.W. Leuenberger, B. Nagel, и H. Kölbl, Eds., Helvetica Chimica Acta, CH-4010 Basel, Switzerland, (1995).
При осуществлении настоящего изобретения используются, если не указано иначе, обычные методы химии, биохимии, клеточной биологии, иммунологии и методы рекомбинантных ДНК, которые объясняются в литературе, посвященной данной области техники (смотри, например, Molecular Cloning: A Laboratory Manual, 2nd Edition, J. Sambrook et al. eds., Cold Spring Harbor Laboratory Press, Cold Spring Harbor 1989).
На всем протяжении этого подробного описания и последующих пунктов формулы изобретения, если контекст не требует иного, следует понимать, что слово "содержать" и его варианты, такие как "содержит" и "содержащий", предполагает включение определенного члена, целого числа или стадии или группы членов, целых чисел или стадий, а не исключение любого другого члена, целого числа или стадии или группы членов, целых чисел или стадий, хотя в некоторых вариантах осуществления такой другой член, целое число или стадия или группа членов, целых чисел или стадий может исключаться, т.е. объект изобретения заключается во включении установленного члена, целого числа или стадии или группы членов, целых чисел или стадий. Термины "a" и "an" и "the" и подобные ссылки, использованные в контексте описания изобретения (особенно в контексте формулы изобретения), следует истолковывать как включающие и единственное и множественное число, если в описании не указано иначе или иное явно не продиктовано контекстом. Перечисление пределов значений в описании служит только как способ сокращения упоминания в отдельности каждого отдельного значения, попадающего в предел. Если не указано иное, каждое индивидуальное значение включается в подробное описание, как если бы оно было отдельно перечислено в описании. Все описанные здесь методы могут осуществляться в любом подходящем порядке, если в описании не указано иначе или иным образом явно не противоречит контексту. Использование всех без исключения примеров или характерных выражений (например, "такой как"), предоставленных в описании, предназначается только для лучшей иллюстрации изобретения и не ограничивает рамки изобретения, заявленные в иной форме. Формулировки подробного описания не должны быть истолкованы, как означающие какой-либо незаявленный элемент, существенный для осуществления изобретения на практике.
На протяжении текста данной заявки процитировано несколько документов. Каждый из приведенных в описании документов (включая все патенты, патентные заявки, научные публикации, спецификации производителя, инструкции и т.д.), будь то выше или ниже, полностью включается в описание путем отсылки. Ничто в описании не следует рассматривать как допущение, что изобретение не имеет права датировать такое раскрытие в соответствии с предшествующим изобретением.
Термин "CLDN18" относится к клаудину 18 и включает любые варианты, включая клаудин 18 сплайс-вариант 1 (клаудин 18.1 (CLDN18.1)) и клаудин 18 сплайс-вариант 2 (клаудин 18.2 (CLDN18.2)).
Термин "CLDN18.2" предпочтительно имеет отношение к человеческому CLDN18.2 и, в частности, к белку, содержащему, предпочтительно состоящему из аминокислотной последовательности в соответствии с SEQ ID NO: 1 из списка последовательностей или варианта указанной аминокислотной последовательности.
Термин "CLDN18.1" предпочтительно имеет отношение к человеческому CLDN18.1 и, в частности, к белку, содержащему, предпочтительно состоящему из аминокислотной последовательности в соответствии с SEQ ID NO: 2 из списка последовательностей или варианта указанной аминокислотной последовательности.
Термин "вариант" согласно изобретению имеет отношение, в частности, к мутантам, сплайс-вариантам, изоформам, аллельным вариантам, видовым вариантам и видовым гомологам, в частности, имеющимся в природе. Аллельный вариант имеет отношение к изменению в нормальной последовательности гена, значение которого часто непонятно. Полное генетическое секвенирование часто устанавливает многочисленные аллельные варианты для данного гена. Видовым гомологом является последовательность нуклеиновых кислот или аминокислот, происходящая от другого вида, отличающегося от вида происхождения данной последовательности нуклеиновых кислот или аминокислот. Термин "вариант" будет включать любые посттрансляционно модифицированные варианты и конформационные варианты.
Согласно изобретению термин "CLDN18.2-положительный рак" означает рак с участием раковых клеток, экспрессирующих CLDN18.2, предпочтительно на поверхности указанных раковых клеток.
Термин "поверхность клетки" используется в соответствии с его обычным значением в данной области и таким образом включает внешнюю поверхность клетки, доступную для связывания с белками и другими молекулами.
CLDN18.2 экспрессируется на поверхности клеток в том случае, если он располагается на поверхности указанных клеток, и является доступным для связывания CLDN18.2-специфическими антителами при добавлении их к клеткам.
Согласно изобретению CLDN18.2 является незначительно экспрессированным в клетке, если уровень экспрессии является более низким по сравнению с экспрессией в клетках желудка или ткани желудка. Предпочтительно, уровень экспрессии составляет менее чем 10%, предпочтительно менее чем 5%, 3%, 2%, 1%, 0,5%, 0,1% или 0,05% экспрессии в клетках желудка или ткани желудка или даже ниже. Предпочтительно, CLDN18.2 является незначительно экспрессированным в клетке, если уровень экспрессии превышает уровень экспрессии в нераковой ткани, отличной от ткани желудка, не больше чем в 2 раза, предпочтительно в 1,5 раза, и предпочтительно не превышает уровень экспрессии в указанной нераковой ткани. Предпочтительно, CLDN18.2 является незначительно экспрессированным в клетке, если уровень экспрессии ниже предела обнаружения, и/или если уровень экспрессии является слишком низким, чтобы обеспечить возможность связывания CLDN18.2 - специфическими антителами при добавлении их к клеткам.
Согласно изобретению CLDN18.2 экспрессируется в клетке, если уровень экспрессии превышает уровень экспрессии в нераковой ткани, отличной от ткани желудка, предпочтительно более, чем в 2 раза, предпочтительно в 10 раз, в 100 раз, в 1000 раз или в 10000 раз. Предпочтительно, CLDN18.2 экспрессируется в клетке, если уровень экспрессии выше предела обнаружения, и/или если уровень экспрессии является достаточно высоким, чтобы обеспечить возможность связывания CLDN18.2-специфическими антителами при добавлении их к клеткам. Предпочтительно, экспрессированный в клетке CLDN18.2 экспрессируется или экспонируется на поверхности указанной клетки.
Согласно изобретению термин "болезнь" относится к любому патологическому состоянию, включая рак, в частности, к описанным в данном документе формам рака. Любые упоминания рака или конкретные формы рака в данном документе также включают его метастазы. В предпочтительном варианте осуществления болезнь, которую необходимо лечить в соответствии с настоящей заявкой, затрагивает клетки, экспрессирующие CLDN18.2.
"Болезни, связанные с клетками, экспрессирующими CLDN18.2," или сходные выражения означают согласно изобретению, что CLDN18.2 экспрессируется в клетках больной ткани или органа. В одном варианте осуществления экспрессия CLDN18.2 в клетках больной ткани или органа является повышенной по сравнению с состоянием в здоровой ткани или органе. Повышение имеет в виду повышение по меньшей мере на 10%, в частности по меньшей мере на 20%, по меньшей мере на 50%, по меньшей мере на 100%, по меньшей мере на 200%, по меньшей мере на 500%, по меньшей мере на 1000%, по меньшей мере на 10000% или даже более. В одном варианте осуществления экспрессия обнаружена только в больной ткани, тогда как экспрессия в здоровой ткани подавлена. Согласно изобретению, болезни, связанные с клетками, экспрессирующими CLDN18.2, включают раковые заболевания. Кроме того, согласно изобретению раковыми заболеваниями предпочтительно являются те, в которых раковые клетки экспрессируют CLDN18.2.
При использовании в описании термин "раковая болезнь" или "рак" включает болезнь, характеризующуюся неправильно регулируемым клеточным ростом, пролиферацией, дифференцировкой, адгезией и/или миграцией. Под "раковой клеткой" имеется в виду аномальная клетка, которая растет посредством быстрой, неконтролируемой клеточной пролиферации и продолжает расти после стимула (воздействия), инициирующего прекращение нового роста. Предпочтительно "раковая болезнь" характеризуется клетками, экспрессирующими CLDN18.2, а раковая клетка экспрессирует CLDN18.2. Клетка, экспрессирующая CLDN18.2, предпочтительно является раковой клеткой, предпочтительно описанных здесь видов раков.
"Аденокарцинома" представляет собой рак, возникающий в железистой ткани. Эта ткань к тому же является частью большой группы тканей, известных как эпителиальная ткань. Эпителиальная ткань включает кожу, железы и целый ряд других тканей, выстилающих полости и органы тела. С точки зрения эмбриологии эпителий происходит из эктодермы, эндодермы и мезодермы. Чтобы относиться к аденокарциноме, клетки необязательно должны быть частью железы, при условии, что они обладают секреторными свойствами. Эта форма карциномы может возникать у некоторых высших животных, включая людей. Хорошо дифференцированные аденокарциномы имеют тенденцию походить на железистую ткань, из которой они происходят, в то время как плохо дифференцированные могут не походить на железистую ткань. С помощью окрашивания клеток, полученных из биопсийного материала, патолог определяет, является ли опухоль аденокарциномой или другим типом рака. Аденокарциномы могут возникать во многих тканях организма вследствие повсеместного распространения желез в организме. Наряду с тем, что каждая железа не может секретировать одно и то же вещество, когда у клетки существует внешнесекреторная функция, она считается железистой, и поэтому ее злокачественная форма называется аденокарциномой. Злокачественные аденокарциномы вторгаются в другие ткани и дают метастазы, также проникающие в другие ткани. Аденокарцинома яичника является наиболее распространенным типом карциномы яичника. Сюда включаются серозные и слизистые аденокарциномы, светлоклеточная аденокарцинома и эндометриоидная аденокарцинома.
Под "метастазированием" имеется в виду распространение раковых клеток из первоначального местоположения в другую часть организма. Образование метастаза является очень сложным процессом и зависит от отделения злокачественных клеток от первичной опухоли, вторжения (инвазии) во внеклеточный матрикс, проникания в эндотелиальные базальные мембраны для проникновения в полость тела и сосудов, а затем, после транспортировки кровотоком, инфильтрации в органы-мишени. Наконец, рост новой опухоли в месте-мишени зависит от ангиогенеза. Метастазы опухоли могут возникать даже после удаления первичной опухоли, так как опухолевые клетки или компоненты могут остаться и развить метастатический потенциал. В одном варианте осуществления термин "метастаз" согласно изобретению имеет отношение к "отдаленному метастазу", т.е. метастазу, удаленному от первичной опухоли и системы региональных лимфатических узлов. В одном варианте осуществления термин "метастаз" согласно изобретению относится к метастазу в лимфатический узел. Одной конкретной формой метастаза, который поддается лечению с помощью терапии изобретения, является метастаз, берущий начало от рака желудка как первичного очага. В предпочтительных вариантах осуществления такой метастаз рака желудка является опухолью Крукенберга, метастазами в брюшину и/или метастазами в лимфатические узлы.
Опухоль Крукенберга является редкой метастатической опухолью яичника, насчитывающей от 1% до 2% от всех опухолей яичника. Прогноз опухоли Крукенберга остается плохим, при этом не существует общепринятого лечения для опухоли Крукенберга. Опухоль Крукенберга является метастатической перстневидноклеточной аденокарциномой яичника. Желудок является первичным очагом для большинства случаев опухоли Крукенберга (70%). Следующими по распространенности первичными локализациями являются карциномы толстой кишки, аппендикса и молочной железы (в основном инвазивная дольковая карцинома). Сообщалось о единичных случаях опухоли Крукенберга, происходящих из карциномы желчного пузыря, желчных протоков, поджелудочной железы, тонкого кишечника, Фатерова сосочка, шейки матки и мочевого пузыря/мочевого протока. Интервал между постановкой диагноза первичной карциномы и последующим обнаружением поражения яичника составляет обычно 6 месяцев или меньше, однако сообщалось и о более длительных сроках. Во многих случаях, первичная опухоль является очень маленькой и может остаться незамеченной. Предшествующая карцинома желудка или другого органа в анамнезе наблюдается только в 20-30% случаев.
Опухоль Крукенберга является примером селективного распространения рака, чаще всего в направлении желудок - яичник. Эта «ось» распространения опухоли исторически привлекает внимание многих патоморфологов, в частности, когда было обнаружено, что новообразования в желудке селективно метастазируют в яичники, не задействуя другие ткани. Путь метастазов карциномы желудка в яичники был загадкой в течение длительного времени, однако теперь очевидно, что ретроградное распространение по лимфатическим сосудам представляет собой наиболее вероятный путь метастазирования.
Опухоли Крукенберга появляются у молодых женщин, что необычно для пациентов с метастатической карциномой, которая наблюдается в большинстве случаев на пятом десятке жизни, со средним возрастом 45 лет. Этот ранний возраст распространения может быть отчасти связан с повышенной частотой случаев перстневидноклеточной карциномы желудка у молодых женщин. Часто встречающиеся симптомы, как правило, связаны с вовлечением в процесс яичников, наиболее распространенными из которых являются боль в животе и вздутие живота (в основном, вследствие двусторонней большой массы яичников). У остальной части пациентов наблюдаются неспецифические желудочно-кишечные симптомы или симптомы отсутствуют. В дополнение к этому, опухоль Крукенберга по имеющимся данным связана с маскулинизацией, являющейся результатом выработки гормонов стромой яичников. В 50% случаев у пациентов имеется асцит, обычно содержащий злокачественные клетки.
Опухоль Крукенберга является двусторонней более чем в 80% известных случаев. Как правило, яичники увеличены асимметрично и имеют бугристый контур. Поверхности срезов желтого или белого цвета; обычно это солидные опухоли, хотя иногда бывают кистовидными. Что важно, поверхность капсулы яичников с опухолью Крукенберга в большинстве случаев гладкая и не имеет спаек или брюшинных отложений. Следует отметить, что другие метастатические опухоли в яичник, как правило, связаны с поверхностными имплантатами. Это может объяснять, почему макроскопическое патоморфологическое исследование опухоли Крукенберга может производить обманчивое впечатление первичной опухоли яичника. Однако двусторонняя симметрия опухоли Крукенберга находится в соответствии с его метастатической природой.
Следует отметить высокий процент общей летальности среди пациентов с опухолью Крукенберга. Большинство пациентов умирает в течение 2 лет (медиана выживаемости 14 месяцев). Некоторое количество исследований показывает, что прогноз является плохим, в том случае, когда первичная опухоль установлена после обнаружения метастазов в яичниках, при этом прогноз становится еще хуже, если первичная опухоль остается необнаруженной.
В литературе оптимальная стратегия лечения опухоли Крукенберга четко не установлена. Вопрос осуществления хирургического удаления недостаточно урегулирован. Химиотерапия или радиотерапия не оказывает значительного действия на прогноз пациентов с опухолью Крукенберга.
Под термином "лечить" имеется в виду введение субъекту соединения или композиции или комбинации соединений или композиций с целью предотвращения или устранения болезни, включая уменьшение размеров опухоли или количества опухолей у субъекта; задержку или замедление болезни у субъекта; ингибирование или замедление развития новой болезни у субъекта; уменьшение частоты и тяжести симптомов и/или рецидивов у субъекта, имеющего в настоящее время или ранее имевшего заболевание; и/или удлинение, т.е. увеличение продолжительности жизни субъекта.
В частности, термин "лечение болезни" включает излечение, уменьшение продолжительности, облегчение, предотвращение, замедление или ингибирование прогрессирования или ухудшения, или предотвращение или задержку начала болезни или ее симптомов.
Согласно изобретению термин "пациент" означает субъекта, нуждающегося в лечении, в частности, больного субъекта, включая людей, нечеловекообразных приматов или других животных, в частности, млекопитающих, таких как коровы, лошади, свиньи, овцы, козы, собаки, кошки, или грызунов, таких как мыши и крысы. В особенно предпочтительном варианте осуществления пациент является человеком.
γδ Т-клетки (гамма дельта Т-клетки) представляют небольшую подгруппу Т-клеток, которые имеют разные Т-клеточные рецепторы (TCR) на поверхности. Большинство Т-клеток имеют TCR, состоящие из двух цепей гликопротеинов, называемых α- и β-TCR цепи. В противоположность этому, у γδ Т-клеток TCR состоит из одной γ-цепи и одной δ-цепи. Эта группа Т-клеток еще менее распространена, чем αβ Т-клетки. У человека γδ Τ клетки играют важную роль в ответах, связанных с надзором за стрессом, подобным инфекционным болезням и аутоиммунным реакциям. Кроме того, считается, что индуцированные трансформацией изменения в опухолях вызывают ответы, связанные с надзором за стрессом, которые опосредуются γδ Т-клетками, и увеличивают противоопухолевый иммунитет. Важно отметить, что после захвата антигена активированные γδ Т-клетки в местах повреждений обеспечивают цитокины (например, ΙΝΡγ, TNFα) и/или хемокины, опосредующие привлечение других эффекторных клеток, и демонстрируют непосредственные эффекторные функции, такие как цитотоксичность (посредством рецепторов клеточной смерти и цитолитических гранул) и ADCC.
Большая часть γδ Т-клеток в периферической крови экспрессирует Υγ9Υδ2 Τ-клеточный рецептор (TCRγδ). Vγ9Vδ2 Т-клетки характерны только для людей и приматов и, как полагают, играют заблаговременную и существенную роль в ощущении "опасности" в отношении инвазивных патогенов, поскольку их количество резко увеличивается при многих острых инфекциях и может превышать количество всех других лимфоцитов в пределах нескольких дней, например, при туберкулезе, сальмонеллезе, эрлихиозе, бруцеллезе, туляремии, листериозе, токсоплазмозе и малярии.
γδ Т-клетки реагируют на небольшие непептидные фосфорилированные антигены (фосфоантигены), такие как пирофосфаты, синтезированные бактериями, и изопентенил пирофосфат (ΙΡΡ), продуцированный клетками млекопитающих посредством мевалонатного пути. Тогда как выработки ГРР в нормальных клетках недостаточно для активации γδ Т-клеток, дисрегуляция мевалонатного пути в опухолевых клетках приводит к накоплению ΙΡΡ и активации γδ Т-клеток. ΙΡΡ также может быть терапевтически повышен с помощью аминобисфосфонатов, которые ингибируют фермент мевалонатного пути фарнезил пирофосфат синтазу (FPPS). В числе других золедроновая кислота (ΖΑ, золедронат, Zometa™, Novartis) представляет собой такого рода аминобисфосфонат, который уже вводится пациентам в клинике для лечения остеопороза и метастатического заболевания костей. После обработки PBMCs in vitro, ΖΑ поглощается исключительно моноцитами. ΙΡΡ накапливается в моноцитах, и они видоизменяются в антиген-презентирующие клетки, стимулирующие развитие γδ Т-клеток. В данном контексте предпочтительным является добавление интерлейкина-2 (IL-2) в качестве фактора роста и выживаемости для активированных γδ Т-клеток. И наконец, сообщалось, что некоторые алкилированные амины активируют Vγ9Vδ2 Т-клетки in vitro, однако, только в миллимолярных концентрациях.
Согласно изобретению термин "средство, стимулирующее γδ Т-клетки," имеет отношение к соединениям, стимулирующим развитие γδ Т-клеток, в частности, Vγ9Vδ2 Т-клеток, in vitro и/или in vivo, в частности путем индукции активации и размножения γδ Т-клеток. Предпочтительно, термин имеет отношение к соединениям, увеличивающим, in vitro и/или in vivo, выработку изопентенил пирофосфата (IPP) в клетках млекопитающих, предпочтительно путем ингибирования фермента мевалонатного пути фарнезил пирофосфат синтазы (FPPS).
Одной отдельной группой соединений, стимулирующих γδ Т-клетки, являются бисфосфонаты, в частности азотсодержащие бисфосфонаты (N-бисфосфонаты; аминобисфосфонаты).
Например, подходящие для использования в изобретении бисфосфонаты могут включать одно или более из следующих соединений, включая их аналоги и производные, фармацевтические соли, гидраты, сложные эфиры, конъюгаты и пролекарства:
[1-гидрокси-2-(1Н-имидазол-1-ил)этан-1,1-диил]бис(фосфоновая кислота), золедроновая кислота, например, золедронат;
(дихлор-фосфоно-метил) фосфоновая кислота, например, клодронат
{1-гидрокси-3-[метил(пентил)амино]пропан-1,1-диил}бис(фосфоновая кислота), ибандроновая кислота, например, ибандронат
(3-амино-1-гидроксипропан-1,1-диил)бис (фосфоновая кислота), памидроновая кислота, например, памидронат;
(1-гидрокси-1-фосфоно-2-пиридин-3-ил-этил) фосфоновая кислота, ризедроновая кислота, например, ризедронат;
(1-Гидрокси-2-имидазо[1,2-а]пиридин-3-ил-1-фосфоноэтил) фосфоновая кислота, минодроновя кислота;
[3-(диметиламино)-1-гидроксипропан-1,1-диил]бис(фосфоновая кислота), олпадроновая кислота.
[4-амино-1-гидрокси-1-(гидрокси-оксидо-фосфорил)-бутил]фосфоновая кислота, алендроновая кислота, например, алендронат;
[(Циклогептиламино)метилен]бис(фосфоновая кислота), инкадрновая кислота;
(1-гидроксиэтан-1,1-диил)бис(фосфоновая кислота), этидроновая кислота, например, этидронат; и
{[(4-хлорфенил)тио]метилен}бис(фосфоновая кислота), тилудроновая кислота.
Согласно изобретению золедроновая кислота (INN) или золедронат (продаваемый компанией Novartis под торговыми названиями Zometa, Zomera, Aclasta и Reclast) является особенно предпочтительным бисфосфонатом. Zometa используется для предотвращения переломов костей скелета у пациентов с такими видами рака, как множественная миелома и рак предстательной железы, а также для лечения остеопороза. Препарат также используется для лечения гиперкальциемии при злокачественных новообразованиях и может быть полезен при лечении боли, являющейся результатом костных метастазов.
В одном особенно предпочтительном варианте осуществления средство, стимулирующее γδ Т-клетки, согласно изобретению вводят в комбинации с IL-2. Показано, что такая комбинация, в частности, является эффективной при опосредовании размножения и активации γ9δ2 Т-клеток.
Интерлейкин-2 (IL-2) - это интерлейкин, тип цитокина - сигнальной молекулы в иммунной системе. Это белок, который «притягивает» лимфоциты и является частью природного иммунного ответа на микробную инфекцию, и играет роль при проведении различий между «чужой» («не свой») и «свой». IL-2 опосредует свои эффекты путем связывания с IL-2 рецепторами, которые экспрессируются лимфоцитами.
IL-2, используемый согласно изобретению, может быть любым IL-2, содействующим или обеспечивающим возможность стимулирования γδ Т-клеток, и может происходить от любых видов, предпочтительно, от человека. IL-2 может быть изолированным, полученным рекомбинантным путем или синтетическим IL-2, может быть интерлейкином природного происхождения или модифицированным IL-2.
Термин "средство, стабилизирующее или увеличивающее экспрессию CLDN18.2," относится к средству или комбинации средств, обеспечение наличия которых в клетках приводит к повышению уровней РНК и/или белка CLDN18.2, предпочтительно повышению уровней белка CLDN18.2 на клеточной поверхности, по сравнению с условием, когда клетки не обеспечиваются данным средством или комбинацией средств. Предпочтительно, клетка является раковой клеткой, в частности, раковой клеткой, экспрессирующей CLDN18.2, такой как клетки описанных здесь видов рака. Термин "средство, стабилизирующее или увеличивающее экспрессию CLDN18.2," относится, в частности, к средству или комбинации средств, обеспечение наличия которых в клетках приводит к более высокой плотности CLDN18.2 на поверхности указанных клеток по сравнению с условием, когда клетки не обеспечиваются данным средством или комбинацией средств. "Стабилизация экспрессии CLDN18.2" включает, в частности, ситуацию, когда данное средство или комбинация средств предотвращает снижение или уменьшает снижение экспрессии CLDN18.2, например, экспрессия CLDN18.2 могла бы снижаться без обеспечения наличия средства или комбинации средств, а обеспечение наличия средства или комбинации средств предотвращает указанное снижение или уменьшает снижение CLDN18.2 экспрессии. "Увеличение экспрессии CLDN18.2" включает, в частности, ситуацию, когда данное средство или комбинация средств увеличивает экспрессию CLDN18.2, например, экспрессия CLDN18.2 могла бы снижаться, оставаться в основном постоянной или увеличиваться без обеспечения наличия средства или комбинации средств, а обеспечение наличия средства или комбинации средств увеличивает CLDN18.2 экспрессию по сравнению с условием без обеспечения наличия средства или комбинации средств, так что получаемая в результате экспрессия является более высокой по сравнению с ситуацией, при которой экспрессия CLDN18.2 могла понижаться, оставаться в основном постоянной или увеличиваться без обеспечения наличия средства или комбинации средств.
Согласно изобретению термин "средство, стабилизирующее или увеличивающее экспрессию CLDN18.2," включает химиотерапевтические средства или комбинации химиотерапевтических средств, таких как цитостатические средства. Химиотерапевтические средства могут оказывать воздействие на клетки одним из следующих способов: (1) могут повреждать ДНК клеток, так что они не способны более воспроизводиться, (2) ингибировать синтез новых нитей ДНК, так что становится невозможной клеточная репликация, (3) останавливать митотические процессы в клетках, так что клетки не могут делиться на две клетки.
Согласно изобретению термин "средство, стабилизирующее или увеличивающее экспрессию CLDN18.2," предпочтительно относится к средству или комбинации средств, такому как цитостатическое соединение или комбинация цитостатических соединений, обеспечение наличия которых в клетках, в частности, раковых клетках, приводит к остановке или накоплению клеток в одной или более фазах клеточного цикла, предпочтительно в одной или более фазах клеточного цикла, отличных от G1- и G0-фаз, предпочтительно отличных от G1-фазы, предпочтительно в одной или более из G2- или S-фазы клеточного цикла, такой как G1/G2-, S/G2-, G2- или S-фаза клеточного цикла. Термин "остановка или накопление клеток в одной или более фазах клеточного цикла" означает, что процент клеток, находящихся в указанной одной или более фазах клеточного цикла, увеличивается. Для самовоспроизведения каждая клетка проходит через цикл, включающий четыре фазы. Первая фаза называется G1-фаза, в этой фазе клетка готовится к удвоению своих хромосом. Вторая фаза называется S-фаза, в этой фазе происходит синтез и удвоение ДНК. Следующая фаза - это G2-фаза, в ней происходит удвоение РНК и белка. Заключительная фаза - это М-фаза, являющаяся фазой фактического деления клетки. В этой конечной стадии удвоенные ДНК и РНК расходятся и перемещаются к разным концам клетки, и клетка действительно делится на две идентичные, функциональные клетки. Химиотерапевтические средства, являющиеся ДНК-повреждающими средствами, как правило, приводят к накоплению клеток в фазе G1 и/или G2. Химиотерапевтические средства, препятствующие клеточному росту, вмешиваясь в синтез ДНК, например, антиметаболиты, как правило, приводят к накоплению клеток в S-фазе. Примерами этих лекарственных средств являются 6-меркаптопурин и 5-фторурацил.
Согласно изобретению термин "средство, стабилизирующее или увеличивающее экспрессию CLDN18.2," включает антрациклины, такие как эпирубицин, соединения платины, такие как оксалиплатин и цисплатин, аналоги нуклеозидов, такие как 5-фторурацил или его пролекарства, таксаны, такие как доцетаксел, и аналоги камптотецина, такие как иринотекан и топотекан, и комбинации лекарственных препаратов, такие как комбинации лекарственных средств, содержащие один или более антрациклинов, таких как эпирубицин, оксалиплатин, и 5-фторурацил, такие как комбинация лекарственных средств, содержащая оксалиплатин и 5-фторурацил, или другие описанные здесь лекарственные комбинации.
В одном предпочтительном варианте осуществления "средство, стабилизирующее или увеличивающее экспрессию CLDN18.2," представляет собой "средство, вызывающее иммуногенную гибель клеток".
При особых обстоятельствах раковые клетки могут вступать на путь летального стресса, связанного с выделением определенной с пространственно-временной точки зрения комбинации сигналов, которая преобразуется иммунной системой в активацию опухоль-специфических иммунных ответов (Zitvogel L. et al. (2010) Cell 140: 798-804). При таком развитии событий раковые клетки начинают выделять сигналы, которые воспринимаются врожденными иммунными эффекторами, такими как дендритные клетки, чтобы инициировать когнатный (cognate) иммунный ответ, затрагивающий CD8+ Т-клетки и IFN-γ сигнальный путь, так что гибель опухолевой клетки может вызвать эффективный противоопухолевый иммунный ответ. Эти сигналы включают предапоптотическую экспозицию белка-шаперона эндоплазматического ретикулума (ER) калретикулина (CRT) на клеточной поверхности, предапоптотическую секрецию АТФ и постапоптотическое высвобождение ядерного белка HMGB1. В совокупности эти процессы составляют молекулярные детерминанты иммуногенной гибели клеток (ICD). Антрациклины, оксалиплатин и γ-облучение способны индуцировать все сигналы, определяющие ICD, в то время как одного цисплатина, например, недостаточно для индукции перемещения CRT от ER к поверхности погибающих клеток - процесс, предусматривающий стресс ER, - и требуется добавление тапсигаргина, индуктора ER-стресса.
Согласно изобретению термин "средство, вызывающее иммуногенную гибель клеток," относится к средству или комбинации средств, наличие которых в клетках, в частности раковых клетках, позволяет стимулировать клетки к вступлению на путь летального стресса, который в конечном итоге влечет за собой опухоль-специфические иммунные ответы. В частности, "средство, вызывающее иммуногенную гибель клеток" (при обеспечении его наличия в клетках), вызывает выделение клетками определенных с пространственно-временной точки зрения комбинации сигналов, включая, в частности, предапоптотическую экспозицию белка-шаперона эндоплазматического ретикулума (ER) калретикулина (CRT) на клеточной поверхности, предапоптотическую секрецию АТФ и постапоптотическое высвобождение ядерного белка HMGB1.
Согласно изобретению термин "средство, вызывающее иммуногенную гибель клеток," включает антрациклины и оксалиплатин.
Антрациклины - это класс лекарственных средств, обычно используемых в химиотерапии опухолей, также известный под названием антрациклиновых антибиотиков. В структурном отношении все антрациклины имеют общую структуру содержащего четыре кольца 7,8,9,10-тетрагидротетрацен-5,12-хинона и обычно нуждаются в гликозилировании в специфических сайтах.
Антрациклины предпочтительно осуществляют один или более из следующих механизмов действия: 1. Ингибирование синтеза ДНК и РНК путем интеркаляции между парами оснований ДНК/РНК цепочки, что предотвращает репликацию быстрорастущих раковых клеток. 2. Ингибирование фермента топоизомеразы II, что предотвращает релаксацию суперспиральной ДНК и таким образом блокирует транскрипцию и репликацию ДНК. 3. Образование железо-опосредованных свободных кислородных радикалов, повреждающих ДНК и мембраны клеток.
Согласно изобретению термин "антрациклин" предпочтительно имеет отношение к препарату, предпочтительно противоопухолевому препарату, предназначенному для индукции апоптоза, предпочтительно путем ингибирования повторного связывания (rebinding) ДНК с топоизомеразой.
Предпочтительно, согласно изобретению термин "антрациклин" в основном относится к классу соединений, имеющих следующую кольцевую структуру

включая аналоги и производные, фармацевтические соли, гидраты, сложные эфиры, конъюгаты и их пролекарства.
Примеры антрациклинов и аналогов антрациклинов включают, но не ограничиваются этим, даунорубицин (дауномицин), доксорубицин (адриамицин), эпирубицин, идарубицин, родомицин, пирарубицин, валрубицин, N-трифтор-ацетил доксорубицин-14-валерат, аклациномицин, морфолинодоксорубицин (морфолино-DOX), цианоморфолино-доксорубицин (цианоморфолино-DOX), 2-пирролино-доксорубицин (2-PDOX), 5-иминодауномицин, митоксантрон и аклациномицин А (акларубицин). Митоксантрон является членом класса антрацендионов, аналогов антрациклинов, утративших сахарный компонент антрациклинов, но сохранивших плоскую полициклическую структуру ароматических колец, которая обеспечивает возможность интеркаляции в ДНК.
Особенно предпочтительным антрациклином согласно изобретению является соединение следующей формулы:

в которой
R1 выбирают из группы, состоящей из Н и ОН, R2 выбирают из группы, состоящей из Н и ОМе, R3 выбирают из группы, состоящей из Н и ОН, и R4 выбирают из группы, состоящей из Н и ОН.
В одном варианте осуществления R1 представляет собой Н, R2 представляет собой OMe, R3 представляет собой Н, и R4 представляет собой ОН. В другом варианте осуществления R1 представляет собой ОН, R2 представляет собой OMe, R3 представляет собой Н, и R4 представляет собой ОН. В другом варианте осуществления R1 представляет собой ОН, R2 представляет собой OMe, R3 представляет собой OH, и R4 представляет собой Н. В другом варианте осуществления R1 является Н, R2 является Н, R3 является Н, и R4 представляет собой ОН.
В частности, предусмотренным в качестве антрациклина в контексте настоящего изобретения является эпирубицин. Эпирубицин является антрациклиновым препаратом, имеющим следующую формулу:

и продается под торговым названием элленс в США и под торговым названием фарморубицин или эпирубицин (Ebewe) в других странах. В частности, термин "эпирубицин" относится к соединению (8R,10S)-10-[(2S,4S,5R,6S)-4-амино-5-гидрокси-6-метил-оксан-2-ил]окси-6,11-дигидрокси-8-(2-гидроксиацетил)-1-метокси-8-метил-9,10-дигидро-7Н-тетрацен-5,12-диону. Эпирубицин является более предпочтительным по сравнению с доксорубицином, наиболее популярным антрациклином, в некоторых химиотерапевтических режимах, так как, по-видимому, он вызывает меньше побочных эффектов.
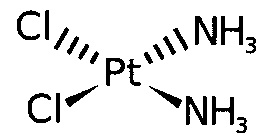
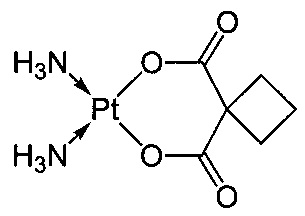
Согласно изобретению термин "соединение платины" имеет отношение к соединениям, содержащим платину в своих структурах, таким как платиновые комплексы, и включает такие соединения, как цисплатин, карбоплатин и оксалиплатин.
Термин "цисплатин" относится к соединению цис-диамминодихлороплатины (II) (CDDP), имеющему следующую формулу:
Термин "карбоплатин" относится к соединению цис-диаммино(1,1-циклобутандикарбоксилато)платины(II), имеющему следующую формулу:
Термин "оксалиплатин" относится к соединению платины, которое образует комплекс с диаминоциклогексаном, имеющему следующую формулу:

В частности, термин "оксалиплатин" относится к соединению [(1R,2R)-циклогексан-1,2-диамин](этандиоато-O,O')платина(II). Оксалиплатин для инъекций также продается под торговым названием элоксатин.
Термин "нуклеозидный аналог" относится к структурному аналогу нуклеозида, включая и аналоги пурина и аналоги пиримидина. В частности, термин "нуклеозидный аналог" относится к производным фторпиримидина, которые включают фторурацил и его пролекарства.
Термин "фторурацил" или "5-фторурацил" (5-FU или f5U) (продается под торговыми наименованиями Адруцил, Сагас, Эфудикс, Эфудекс и Флюороплекс) относится к соединению, являющемуся аналогом пиримидина и имеющему следующую формулу:
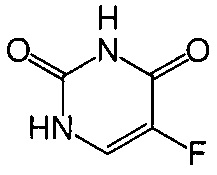
В частности, термин относится к соединению 5-фтор-1Н-пиримидин-2,4-дион.
Термин "капецитабин" (Xeloda, Roche) относится к химиотерапевтическому средству, являющемуся пролекарством, которое превращается в 5-FU в тканях. Капецитабин может вводиться перорально и имеет следующую формулу:

В частности, термин относится к соединению пентил [1-(3,4-дигидрокси-5-метилтетрагидрофуран-2-ил)-5-фтор-2-оксо-1Н-пиримидин-4-ил]карбамат.
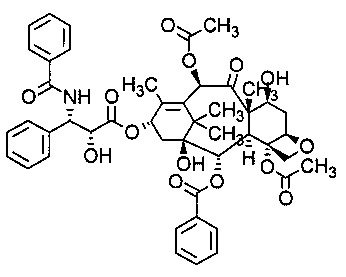
Таксаны представляют собой класс дитерпеновых соединений, которые первоначально были получены из природных источников, таких как растения рода Taxus, а некоторые были синтезированы искусственно. Основным механизмом действия лекарственных препаратов класса таксанов является нарушение функции микротрубочек, и таким образом ингибирование процесса клеточного деления. Таксаны включают доцетаксел (таксотер) и паклитаксел (таксол).
Согласно изобретению термин "доцетаксел" относится к соединению, имеющему следующую формулу:

Согласно изобретению термин "паклитаксел" относится к соединению, имеющему следующую формулу:
Согласно изобретению термин "аналог камптотецина" относится к производным соединения камптотецина (СРТ; (S)-4-этил-4-гидрокси-1Н-пирано[3',4':6,7]индолизино [1,2-b] хинолин-3,14-(4Н,12Н)-дион). Предпочтительно, термин "аналог камптотецина" относится к соединениям, содержащим следующую структуру:
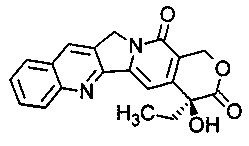
Согласно изобретению предпочтительными аналогами камптотецина являются ингибиторы фермента ДНК-топоизомеразы I (topo I). Предпочтительными аналогами камптотецина согласно изобретению являются иринотекан и топотекан.
Иринотекан является лекарственным средством, предотвращающим раскручивание ДНК путем ингибирования топоизомеразы I. С точки зрения химии, он является полусинтетическим аналогом природного алкалоида камптотецина, имеющим следующую формулу:
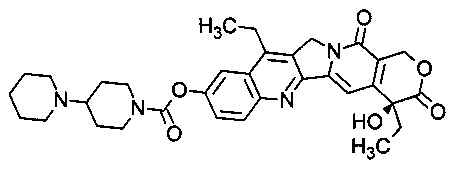
В частности, термин "иринотекан" относится к соединению (S)-4,11-диэтил-3,4,12,14-тетрагидро-4-гидрокси-3,14-диоксо 1Н-пирано[3',4': 6,7]-индолизино[1,2-b]хинолин-9-ил-[1,4'бипиперидин]-1'-карбоксилат.
Топотекан является ингибитором топоизомеразы, имеющим формулу:
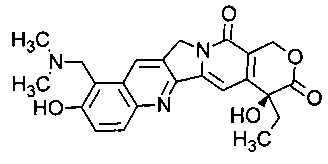
В частности, термин "топотекан" относится к соединению (S)-10-[(диметиламино)метил]-4-этил-4,9-дигидрокси-1Н-пирано[3',4':6,7]индолизино[1,2-b]хинолин-3,14(4Н,12Н)-дион моногидрохлорид.
Согласно изобретению средство, стабилизирующее или увеличивающее экспрессию CLDN18.2, может быть химиотерапевтическим средством, в частности, химиотерапевтическим средством, признанным в противоопухолевой терапии, может быть частью комбинации лекарственных средств, такой как комбинация лекарственных средств, общепринятая для применения при лечении рака. Такой комбинацией лекарственных средств может быть комбинация лекарственных средств, используемых в химиотерапии, и может быть комбинация лекарственных средств, используемых в химиотерапевтическом режиме, выбранном из группы, состоящей из ЕОХ химиотерапии, ECF химиотерапии, ЕСХ химиотерапии, EOF химиотерапии, FLO химиотерапии, FOLFOX химиотерапии, FOLFIRI химиотерапии, DCF химиотерапии и FLOT химиотерапии.
Комбинация лекарственных средств, используемых в режиме ЕОХ химиотерапии, включает эпирубицин, оксалиплатин и капецитабин. Комбинация лекарственных средств, используемых в режиме ECF химиотерапии, включает эпирубицин, цисплатин и 5-фторурацил. Комбинация лекарственных средств, используемых в режиме ЕСХ химиотерапии, включает эпирубицин, цисплатин и капецитабин. Комбинация лекарственных средств, используемых в режиме EOF химиотерапии, включает эпирубицин, оксалиплатин и 5-фторурацил.
Эпирубицин обычно назначают в дозе 50 мг/м2, цисплатин в дозе 60 мг/м2, оксалиплатин в дозе 130 мг/м2, длительная венозная инфузия 5-фторурацила в дозе 200 мг/м2/день и перорально капецитабин 625 мг/м2два раза в день, всего восемь 3-недельных циклов.
Комбинация лекарств, используемых в режиме химиотерапии FLO, включает 5-фторурацил, фолиновую кислоту и оксалиплатин (обычно 5-фторурацил 2,600 мг/м2 24-часовая инфузия, фолиновая кислота 200 мг/м2 и оксалиплатин 85 мг/м2, каждые 2 недели).
FOLFOX - это режим химиотерапии, состоящий из фолиновой кислоты (лейковорин), 5-фторурацила и оксалиплатина. Рекомендованный режим дозирования каждые две недели выглядит следующим образом: День 1: Оксалиплатин 85 мг/м2, внутривенная (IV) инфузия и лейковорин 200 мг/м2 IV инфузия, затем 5-FU 400 мг/м2 IV введение, затем 5-FU 600 мг/м2 IV введение в виде 22-часового непрерывного вливания; День 2: Лейковорин 200 мг/м2 IV вливание в течение 120 минут, затем 5-FU 400 мг/м2 IV введение в течение 2-4 минут, затем 5-FU 600 мг/м2 IV вливание в виде 22-часового непрерывного вливания.
Комбинация лекарств, используемых в режиме химиотерапии FOLFIRI, включает 5-фторурацил, лейковорин и иринотекан.
Комбинация лекарств, используемых в режиме химиотерапии DCF, включает доцетаксел, цисплатин и 5-фторурацил.
Комбинация лекарств, используемых в режиме химиотерапии FLOT, включает доцетаксел, оксалиплатин, 5-фторурацил и фолиновую кислоту.
Термин "фолиновая кислота" или "лейковорин" относится к соединению, используемому в синергической комбинации с химиотерапевтическим препаратом 5-фторурацилом. Фолиновая кислота имеет следующую формулу:
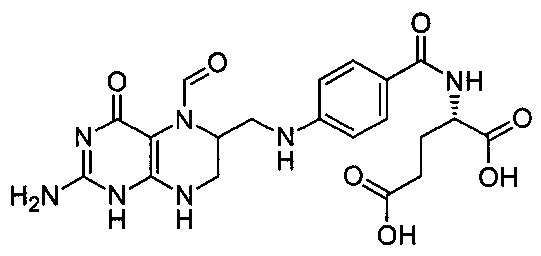
В частности, термин относится к соединению (2S)-2-{[4-[(2-амино-5-формил-4-оксо-5,6,7,8-тетрагидро-1Н-птеридин-6-ил)метиламино]бензоил]амино}пентандиовая кислота.
В одном варианте осуществления настоящего изобретения стандартная химиотерапия в соответствии с ЕОХ режимом в комбинации с антителом, обладающим способностью связываться с CLDN18.2, в частности IMAB362, проводится максимум в течение 8 циклов. Дозы и режимы могут быть такими, как указано далее:
- 50 мг/м2 эпирубицина вводится внутривенно (i.v.) в виде 15-минутного вливания в 1 день каждого цикла в течение ЕОХ фазы.
- 130 мг/м2оксалиплатина вводится i.v. в виде 2-часового вливания в 1 день каждого цикла в течение ЕОХ фазы.
- 625 мг/м2капецитабина назначается для перорального приема (р.о.) два раза в день в течение 21 дня утром и вечером, начиная с вечера первого дня каждого цикла в течение ЕОХ фазы.
- 1000 мг/м2 антител вводится i.v. в виде 2-часового вливания в 1 день цикла 1. После этого 600 мг/м2 антитело вводится i.v. в виде 2-часового вливания в 1 день каждого следующего цикла после завершения вливания оксалиплатина.
- После завершения химиотерапии пациент продолжает прием 600 мг/м2 антител в виде 2-часового вливания каждые 3 или 4 недели.
В одном варианте осуществления настоящего изобретения стандартная химиотерапия в соответствии с ЕОХ-режимом в комбинации с ZA/IL-2 и антителом, обладающим способностью связываться с CLDN18.2, в частности IMAB362, проводится вплоть до 8 циклов (24 недели).
Термин "антиген" имеет отношение к агенту, такому как белок или пептид, содержащему эпитоп, на который направлен или должен быть направлен иммунный ответ. В предпочтительном варианте осуществления антиген является опухолеассоциированным антигеном, таким как CLDN18.2, т.е., компонентом раковых клеток, происходящим от цитоплазмы, клеточной поверхности и клеточного ядра, в частности, тех антигенов, которые вырабатываются, предпочтительно в большом количестве, внутриклеточно или как поверхностные антигены на раковых клетках.
В контексте настоящего изобретения термин "опухолеассоциированный антиген" предпочтительно имеет отношение к белкам, которые в нормальных условиях специфически экспрессируются в ограниченном числе тканей и/или органов или во время конкретных стадий развития и экспрессируются или ненормально экспрессируются в одной или более опухолевых или раковых тканях. В контексте настоящего изобретения опухолеассоциированный антиген предпочтительно связан с клеточной поверхностью раковой клетки и предпочтительно не экспрессируется или только крайне редко эксспрессируется в нормальных тканях.
Термин "эпитоп" относится к антигенной детерминанте в молекуле, т.е. части в молекуле, которая распознается иммунной системой, например, которая распознается антителом. Например, эпитопы являются отдельными, трехмерными участками на антигене, которые распознаются иммунной системой. Обычно эпитопы состоят из химически активных поверхностных группировок молекул, таких как аминокислоты или боковые цепи сахаров, и обычно имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Конформационные и неконформационные эпитопы различаются тем, что связывание с первым, но не со вторым, утрачивается в присутствии денатурирующих растворителей. Эпитоп белка, такого как CLDN18.2, предпочтительно содержит непрерывную или прерывистую часть указанного белка и составляет предпочтительно от 5 до 100, предпочтительно от 5 до 50, более предпочтительно от 8 до 30, наиболее предпочтительно от 10 до 25 аминокислот в длину, например, эпитоп может иметь предпочтительно 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 аминокислот в длину.
Термин "антитело" относится к гликопротеину, содержащему по меньшей мере две тяжелые (Н) цепи и две легкие (L) цепи, взаимно-соединенные дисульфидными связями, и включает любую молекулу, содержащую антигенсвязывающий участок. Термин "антитело" включает моноклональные антитела и фрагменты или производные антител, включая, без ограничения, человеческие антитела, гуманизированные антитела, химерные антитела, одноцепочечные антитела, например, scFv's и антигенсвязывающие фрагменты антител, такие как Fab и Fab1 фрагменты, а также включает все рекомбинантные формы антител, например, антитела, экспрессированные в прокариотах, негликозилированные антитела и любые антигенсвязывающие фрагменты антител и производные, как описывается здесь. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (обозначается в описании VH) и константной области тяжелой цепи. Каждая легкая цепь состоит из вариабельной области легкой цепи (обозначается в описании VL) и константной области легкой цепи. Области VH и VL можно дополнительно подразделить на области гипервариабельности (сверхизменчивости), называемые гипервариабельными участками (CDR), чередующиеся с участками, являющимися более консервативными, называемыми каркасными участками (FR). Каждая VH и VL состоит из трех CDR и четырех FR, располагающихся от аминоконца до карбоксиконца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепи содержат домен связывания, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканью или факторами «хозяина», включая разные клетки иммунной системы (например, эффекторные клетки) и первый компонент (Clq) классической системы комплемента.
Антитела, описанные в данном документе, могут быть человеческими антителами. Использованный в описании термин "человеческое антитело" включает антитела, имеющие вариабельную и константную области, происходящие от человеческих зародышевых последовательностей иммуноглобулина. Человеческие антитела, описанные в данном документе, могут содержать остатки аминокислот, некодированные человеческими зародышевыми последовательностями иммуноглобулина (например, мутации, введенные путем случайного или сайт-специфического мутагенеза in vitro или путем соматических мутаций in vivo).
Термин "гуманизированное антитело" относится к молекуле, имеющей участок связывания антигена, полученный в основном от иммуноглобулина вида животного, не являющегося человеком, при этом остальная часть молекулы иммуноглобулина основывается на структуре и/или последовательности иммуноглобулина человека. Участок связывания антигена может содержать или полные вариабельные домены, присоединенные к константным доменам, или только гипервариабельные участки (CDR), присоединенные к подходящим каркасным участкам в вариабельных доменах. Участки связывания антигена могут быть дикого типа или модифицированными с помощью одной или более аминокислотных замен, например, модифицированными для того, чтобы быть более похожими на человеческий иммуноглобулин. Некоторые формы гуманизированных антител сохраняют все CDR-последовательности (например, гуманизированное мышиное антитело, содержащее все шесть CDR от мышиного антитела). Другие формы имеют один или более CDR, измененных относительно первоначального антитела.
Термин "химерное антитело" относится к антителам, в которых одна часть каждой из аминокислотных последовательностей тяжелой и легкой цепей является гомологичной соответствующим последовательностям в антителе, полученном от конкретного вида или принадлежащего к определенному классу, тогда как остальной сегмент цепи является гомологичным соответствующим последовательностям другого вида. Обычно вариабельный участок и легкой и тяжелой цепей копирует вариабельные участки антител, полученных от одного вида млекопитающих, тогда как константные части являются гомологичными последовательностям антител, полученных от другого вида. Одним очевидным преимуществом таких химерных форм является то, что вариабельный участок можно легко получить от известных в настоящее время источников, используя легкодоступные В-клетки или гибридомы от организмов-хозяев, не являющихся человеком, в комбинации с константными областями, полученными, например, из препаратов клеток человека. Притом, что вариабельная область имеет преимущество, заключающееся в легкости получения, а специфичность не подвергается влиянию источника, константная область, будучи человеческой, менее вероятно вызовет иммунный ответ у человека при введении антител, чем вызвала бы константная область из источника, не являющегося человеком. Однако данное определение не ограничивается этим отдельным примером.
Термины "антигенсвязывающий участок" антитела (или просто "участок связывания") или "антигенсвязывающий фрагмент" антитела (или просто "связывающий фрагмент") или сходные термины относятся к одному или более фрагментам антитела, которые сохраняют способность к специфическому связыванию с антигеном. Показано, что антигенсвязывающая функция антитела может осуществляться фрагментами полноразмерного антитела. Примеры связывающих фрагментов, охваченные термином "антигенсвязывающий участок" антитела, включают (i) Fab фрагменты, одновалентные фрагменты, состоящие из VL, VH, CL и СН доменов; (ii) F(ab')2 фрагменты, двухвалентные фрагменты, содержащие два Fab-фрагмента, соединенные дисульфидным мостиком в шарнирной области; (iii) Fd фрагменты, состоящие из VH и СН доменов; (iv) Fv фрагменты, состоящие из VL и VH доменов одноцепочечных антител, (v) dAb фрагменты (Ward et al, (1989) Nature 341: 544-546), состоящие из VH домена; (vi) изолированные гипервариабельные участки (CDR) и (vii) комбинации двух или более изолированных CDR, которые необязательно могут соединяться синтетическим линкером. Кроме того, хотя два домена Fv фрагмента, VL и VH, кодируются отдельными генами, их можно соединить, используя рекомбинантные методы, с помощью синтетических линкеров, что дает им возможность представлять собой единую белковую цепь, в которой VL и VH области располагаются парами, чтобы образовать одновалентные молекулы (известные как одноцепочечный Fv (scFv); смотри, например, Bird et al. (1988) Science 242: 423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Такие одноцепочечные антитела также включаются в термин "антигенсвязывающий участок" антитела. Дополнительным примером являются домен-связывающие гибридные иммуноглобулины, содержащие (i) полипептидный домен связывания, который присоединяется к шарнирной области иммуноглобулина, (ii) константную область СН2 тяжелой цепи иммуноглобулина, присоединенную к шарнирной области, и (iii) константную область СН3 тяжелой цепи иммуноглобулина, присоединенную к константной области СН2. Связывающий домен полипептида может быть вариабельной областью тяжелой цепи или вариабельной областью легкой цепи. Домен-связывающие иммуноглобулиновые гибридные белки дополнительно раскрываются в США 2003/0118592 и США 2003/0133939. Эти фрагменты антител получают с помощью обычных методов, известных специалистам в данной области техники, при этом фрагменты подвергаются скринингу в отношении пригодности, так же, как и интактные антитела.
Термин "биспецифическая молекула" включает любой агент, например, белок, пептид или белковый или пептидный комплекс, который имеет две разные специфичности связывания. Например, молекула может связываться с или взаимодействовать с (а) антигеном клеточной поверхности, и (b) Fc-рецептором на поверхности эффекторной клетки. Термин "мультиспецифическая молекула" или "гетероспецифическая молекула" включает любой агент, например, белок, пептид или белковый или пептидный комплекс, который имеет более чем две разные специфичности связывания. Например, молекула может связываться с или взаимодействовать с (а) антигеном клеточной поверхности и (b) Fc-рецептором на поверхности эффекторной клетки и (с), по меньшей мере, с одним другим компонентом. Соответственно, изобретение включает, но не ограничивается этим, биспецифические, триспецифические, тетраспецифические и другие мультиспецифические молекулы, направленные к CLDN18.2, и к другим мишеням, таким как Fc-рецепторы на эффекторных клетках. Термин "биспецифические антитела" также включает диабоди (diabodies). Диабоди являются двухвалентными биспецифическими антителами, в которых VH и VL домены экспрессируются на одной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы дать возможность располагаться парами между двумя доменами на одной и той же цепи, таким образом, вынуждая домены образовывать пару с комплементарными доменами другой цепи и порождая два антигенсвязывающих участка (смотри, например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448; Poljak, R.J., et al. (1994) Structure 2: 1121-1123).
Антитело может быть конъюгировано с терапевтической молекулой или агентом, таким как цитотоксин, лекарственным средством (например, иммуносупрессорным средством) или радиоизотопом. Цитотоксин или цитотоксическое средство включает любое средство, которое наносит ущерб и, в частности, уничтожает клетки. Примеры включают таксол, цитохалазин В, грамицидин D, этидиум бромид, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин и их аналоги или гомологи. Подходящие для образования конъюгатов с антителами терапевтические средства включают, но не ограничиваются этим, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, флударабин, 5-фторурацил декарбазин), алкилирующие средства (например, мехлорэтамин, тиотепа, хлорамбуцил, мелфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусулфан, дибромманнитол, стрептозотоцин, митомицин С, и цис-дихлородиамин платина (II) (DDP) цисплатин), антрациклины (например, даунорубицин (раньше даунорубицин) и доксорубицин), антибиотики (например, дактиномицин (раньше актиномицин), блеомицин, митрамицин и антрамицин (АМС), и антимитотические средства (например, винкристин и винбластин). В предпочтительном варианте осуществления терапевтическое средство является цитотоксическим средством или радиотоксическим средством. В другом варианте осуществления терапевтическое средство является иммуносупрессорным средством. В другом варианте осуществления терапевтическое средство является GM-CSF. В предпочтительном варианте осуществления терапевтическое средство представляет собой доксорубицин, цисплатин, блеомицин, сульфат, кармустин, хлорамбуцил, циклофосфамид или рицин А.
Антитела также могут быть конъюгированы с радиоизотопом, например, иодом-131, иттрием- 90 или индием-111, для получения цитотоксических радиофармацевтических средств.
Конъюгаты антител изобретения можно использовать для того, чтобы модифицировать данный биологический ответ, при этом лекарственная частица (drug moiety) не должна рассматриваться как ограничивающая классические химические терапевтические лекарственные средства. Например, лекарственная частица может быть белком или полипептидом, обладающим желательной биологической активностью. Такой белок может включать, например, ферментативно активный токсин, или его активный фрагмент, такой как абрин, рицин А, экзотоксин синегнойной палочки или дифтерийный токсин; белок, такой как фактор некроза опухоли или интерферон-γ; или модификаторы биологического ответа такие как, например, лимфокины, интерлейкин-1 ("IL-1"), интерлейкин-2 ("IL-2"), интерлейкин-6 ("IL-6"), гранулоцитарно-моноцитарный колониестимулирующий фактор ("GM-CSF"), гранулоцитарный колониестимулирующий фактор ("G-CSF") или другие факторы роста.
Методы конъюгирования такой терапевтической частицы с антителом хорошо известны, смотри, например, Arnon et al, "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", in Monoclonal Antibodies and Cancer Therapy, Reisfeld et al. (eds.), pp. 243-56 (Alan R. Liss, Inc. 1985); Hellstrom et al., "Antibodies For Drug Delivery", in Controlled Drug Delivery (2nd Ed.), Robinson et al. (eds.), pp. 623-53 (Marcel Dekker, Inc. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", in Monoclonal Antibodies '84: Biological and Clinical Applications, Pincheraet al. (eds.), pp. 475-506 (1985); "Analysis, Results, and Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy", in Monoclonal Antibodies For Cancer Detection and Therapy, Baldwin et al. (eds.), pp. 303-16 (Academic Press 1985) и Thorpe et al., "The Preparation and Cytotoxic Properties Of Antibody-Toxin Conjugates", Immunol. Rev., 62: 119-58 (1982).
При использовании в описании антитело "происходит от" отдельной зародышевой последовательности, если антитело получено из системы путем иммунизирования животного или путем скрининга библиотеки генов иммуноглобулинов, и при этом выбранное антитело является по меньшей мере на 90%, более предпочтительно по меньшей мере на 95%, даже более предпочтительно по меньшей мере на 96%, 97%, 98% или 99% аналогичным по последовательности аминокислот относительно последовательности аминокислот, кодированной зародышевым геном иммуноглобулина. Как правило, антитело, происходящее от отдельной зародышевой последовательности, будет демонстрировать не более чем 10 аминокислотных различий, более предпочтительно не более чем 5, или даже более предпочтительно не более чем 4, 3, 2 или 1 аминокислотное различие от аминокислотной последовательности, кодированной зародышевым геном иммуноглобулина.
При использовании в описании термин "гетероантитела" относится к двум или более антителам, их производным или антигенсвязывающим участкам, соединенным вместе, по меньшей мере два из которых имеют разные специфичности. Эти разные специфичности включают специфичность связывания для Fc-рецептора на эффекторной клетке и специфичность связывания для антигена или эпитопа на клетке-мишени, например, опухолевой клетке.
Описанные в данном документе антитела могут быть моноклональными антителами. Использованный в описании термин "моноклональное антитело" относится к препарату молекул антител с единообразным молекулярным составом. Моноклональное антитело обладает одной специфичностью связывания и сродством к отдельному эпитопу. В одном варианте осуществления моноклональные антитела вырабатываются с помощью гибридомы, которая включает В-клетку, полученную от животного, не являющегося человеком, например, мыши, соединенную с иммортализованной клеткой.
Описанные в данном документе антитела могут быть рекомбинантными антителами. Использованный в описании термин "рекомбинантное антитело" включает все антитела, которые получаются, экспрессируются, создаются или выделяются с помощью рекомбинантных способов, например, (а) антитела, выделенные из животного (например, мыши), являющегося трансгенным или трансхромосомным в отношении генов иммуноглобулинов или гибридомы, полученной из них, (b) антитела, выделенные из клетки-хозяина, трансформированной для того, чтобы она экспрессировала антитела, например, из трансфектомы, (с) антитела, выделенные из комбинаторной библиотеки рекомбинантных антител, и (d) антитела полученные, экспрессированные, созданные или выделенные любыми другими способами, которые затрагивают сплайсинг последовательностей генов иммуноглобулинов с другими ДНК-последовательностями.
Описанные в данном документе антитела могут происходить от разных видов, включая, но не ограничиваясь этим, мышь, крысу, кролика, морскую свинку и человека.
Описанные в данном документе антитела включают поликлональные и моноклональные антитела и включают IgA, такие как IgA1 или IgA2, IgG1, IgG2, IgG3, IgG4, IgE, IgM, и IgD антитела. В различных вариантах осуществления антитело представляет собой IgG1 антитело, конкретнее IgG1, каппа или IgG1, лямбда изотип (т.е. IgG1, κ, λ), IgG2a антитело (например, IgG2a, κ, λ), IgG2b антитело (например, IgG2b, κ, λ), IgG3 антитело (например, IgG3, κ, λ) или IgG4 антитело (например, IgG4, κ, λ).
Термин "трансфектома" при использовании в описании включает рекомбинантные эукариотические клетки-хозяева, экспрессирующие антитело, такие как клетки СНО, клетки NS/0, клетки НЕК293, клетки НЕК293Т, растительные клетки или клетки грибов, включая клетки дрожжей.
При использовании в описании "гетерологичное антитело" определяется с точки зрения трансгенного организма, продуцирующего такое антитело. Этот термин относится к антителу, имеющему аминокислотную последовательность или кодированному нуклеиновокислотной последовательностью, соответствующей последовательности, обнаруженной в организме, не содержащем трансгенный организм, и как правило, полученному от вида иного, чем трансгенный организм.
При использовании в описании "гетерогибридное антитело" относится к антителу, имеющему легкую и тяжелую цепи от разных организмов. Например, антитело, имеющее человеческую тяжелую цепь, соединенную с мышиной легкой цепью, является гетерогибридным антителом.
Изобретение включает все антитела и производные антител, описанные здесь, которые для целей изобретения охватываются термином "антитело". Термин "производные антител" относится к любой модифицированной форме антитела, например, конъюгату антитела и другого агента или антитела или фрагмента антитела.
Описанные здесь антитела предпочтительно являются изолированными. "Изолированное антитело" при использовании в описании относится к антителу, которое в основном свободно от других антител, имеющих другие антигенные специфичности (например, изолированное антитело, которое специфично связывается с CLDN18.2, является в основном свободным от антител, специфично связывающих антигены, отличные от CLDN18.2). Однако, изолированное антитело, которое специфически связывается с эпитопом, изоформой или вариантом человеческого CLDN18.2, может иметь перекрестную реактивность к другим родственным антигенам, например, от других видов (например, видовыми гомологами CLDN18.2). Более того, изолированное антитело может быть в основном свободно от другого клеточного материала и/или химических веществ. В одном варианте осуществления изобретения комбинация "изолированных" моноклональных антител имеет отношение к антителам, имеющим разные специфичности и объединенным в четко определенную композицию или смесь.
Термин "связывание" согласно изобретению предпочтительно имеет отношение к специфическому связыванию.
Согласно настоящему изобретению антитело является способным связываться с предопределенной мишенью, если оно имеет значительное сродство с указанной предопределенной мишенью и связывается с указанной предопределенной мишенью в стандартных методах исследования. "Сродство" или "сродство связывания" часто оценивается равновесной константой диссоциации (KD). Предпочтительно термин "значительное сродство" относится к связыванию с предопределенной мишенью с константой диссоциации (KD) 10-5 M или ниже, 10-6 M или ниже, 10-7 M или ниже, 10-8 M или ниже, 10-9 M или ниже, 10-10 M или ниже, 10-11 M или ниже или 10-12 M или ниже.
Антитело не является способным (значительно) связываться с мишенью, если оно не обладает значительным сродством к указанной мишени и не связывается значительно, в частности, не связывается поддающимся обнаружению образом, с указанной мишенью в стандартных методах анализа. Предпочтительно антитело необнаружимо связывается с указанной мишенью, если присутствует в концентрации до 2, предпочтительно 10, более предпочтительно 20, в частности 50 или 100 мкг/мл или выше. Предпочтительно антитело не имеет значительного сродства к мишени, если оно связывается с указанной мишенью с KD, которая является по меньшей мере в 10-раз, 100-раз, 103-раз, 104-раз, 105-раз или 106-раз выше, чем KD связывания с предопределенной мишенью, с которой способно связываться антитело. Например, если бы KD связывания антитела с мишенью, с которой способно связываться антитело, составляло 10-7 М, тогда KD связывания с мишенью, к которой антитело не имеет значительного сродства, составляло бы по меньшей мере 10-6 Μ, 10-5 M, 10-4 M, 10-3 M, 10-2 M или 10-1 M.
Антитело является специфическим для предопределенной мишени, если оно способно связываться с указанной предопределенной мишенью, тогда как оно не способно связываться с другими мишенями, т.е. обладает незначительным сродством к другим мишеням и незначительно связывается с другими мишенями при стандартных методах анализа. Согласно изобретению антитело является специфическим к CLDN18.2, если оно способно связываться с CLDN18.2, но (практически) неспособно связываться с другими мишенями. Предпочтительно, антитело является специфическим к CLDN18.2, если сродство и связывание с другими мишенями не превышает значительно сродство к или связывание с белками, неродственными с CLDN18.2, такими как бычий сывороточный альбумин (BSA), казеин, человеческий сывороточный альбумин (HSA) или трансмембранные белки, не являющиеся клаудинами, такие как молекулы МНС или рецептор трансферрина или любой другой специфический полипептид. Предпочтительно антитело является специфическим для предопределенной мишени, если оно связывается с указанной мишенью с KD, являющейся по меньшей мере в 10-раз, 100-раз, 103-раз, 104-раз, 105-раз или 106-раз ниже, чем KD связывания с мишенью, не являющейся специфической. Например, если KD связывания антитела с мишенью, являющейся специфической, составляет 10-7 М, тогда KD связывания с мишенью, не являющейся специфической, должно быть по меньшей мере 10-6 Μ, 10-5 Μ, 10-4 М, 10-3 М, 10-2 M или 10-1 М.
Связывание антитела с мишенью можно определить экспериментально, используя любой подходящий метод, смотри, например, Berzofsky et al., "Antibody-Antigen Interactions" In Fundamental Immunology, Paul, W.E., Ed., Raven Press New York, Ν Y (1984), Kuby, Jam's Immunology, W.H. Freeman и Company New York, Ν Y (1992), и описанные здесь методы. Сродство можно легко определить с помощью обычных методов, таких как равновесный диализ; с помощью прибора BIAcore 2000, используя общие методики, предложенные производителем; с помощью радиоиммунологического анализа с использованием меченого радиоактивным изотопом целевого антигена или другими методами, известными специалистам. Данные по сродству можно проанализировать, например, с помощью метода Scatchard et al., Ann Ν.Y. Acad. ScL, 51:660 (1949). Измеренное сродство отдельного взаимодействия антитело-антиген может варьировать, если измерение проводилось при разных условиях, например, концентрации соли, pH. Таким образом, измерения сродства и других параметров связывания антигена, например, KD, IC50, предпочтительно проводятся с помощью стандартизированных растворов антитела и антигена и стандартизированного буфера.
При использовании в описании "изотип" относится к классу антител (например, IgM или IgG 1), которые кодируются генами константной области тяжелой цепи.
При использовании в описании "переключение изотипа" относится к явлению, посредством которого класс или изотип антитела изменяется от одного класса Ig к одному из других классов Ig.
Термин "природный" при использовании в описании применительно к объекту относится к тому обстоятельству, что объект может быть найден в природе. Например, последовательность полипептида или полинуклеотида, присутствующая в организме (включая вирусы), которая может быть выделена из природного источника и которая не была намеренно модифицирована человеком в лаборатории, является природной.
Термин "перегруппированная" при использовании в описании относится к конфигурации тяжелой цепи или легкой цепи иммуноглобулинового локуса, в котором V сегмент располагается непосредственно рядом с D-J или J сегментом в конформации, кодирующей фактически полный VH или VL домен, соответственно. Перегруппированный генный локус иммуноглобулина (антитела) может быть установлен путем сравнения с зародышевой ДНК; перегруппированный локус будет иметь по меньшей мере один рекомбинированный семичленный/девятичленный гомологичный элемент.
Термин "перегруппированная" или "зародышевая конфигурация" при использовании в описании в отношении V сегмента относится к конфигурации, в которой V сегмент является нерекомбинированным для того, чтобы быть непосредственно рядом с D или J сегментом.
Согласно изобретению антитело, обладающее способностью связываться с CLDN18.2, является антителом, способным связываться с эпитопом, присутствующим на CLDN18.2, предпочтительно эпитопом, расположенным в пределах внеклеточных доменов CLDN18.2, в частности первом внеклеточном домене, предпочтительно в положениях аминокислот от 29 до 78 CLDN18.2. В отдельных вариантах осуществления антитело, обладающее способностью связываться с CLDN18.2, является антителом, способным связываться с (i) эпитопом на CLDN18.2, не присутствующим на CLDN18.1, предпочтительно SEQ ID NO: 3, 4 и 5, (ii) эпитопом, расположенным на CLDN18.2-петля1, предпочтительно SEQ ID NO: 8, (iii) эпитопом, расположенным на CLDN18.2-петля2, предпочтительно SEQ ID NO: 10, (iv) эпитопом, расположенным на CLDN18.2-петляD3, предпочтительно SEQ ID NO: 11, (v) эпитопом, который содержит CLDN18.2-петлю1 и CLDN18.2-петлюD3, или (vi) негликозилированным эпитопом, расположенным на CLDN18.2-петляD3, предпочтительно SEQ ID NO: 9.
Согласно изобретению антитело, обладающее способностью связываться с CLDN18.2, предпочтительно является антителом, способным связываться CLDN18.2, но не с CLDN18.1. Предпочтительно, антитело, обладающее способностью связываться с CLDN18.2, является специфическим к CLDN18.2. Предпочтительно, антитело, обладающее способностью связываться с CLDN18.2, предпочтительно является антителом, обладающим способностью связываться с CLDN18.2, экспрессированным на клеточной поверхности. В отдельных предпочтительных вариантах осуществления антитело, обладающее способностью связываться с CLDN18.2, связывается с нативными эпитопами CLDN18.2, присутствующими на поверхности живых клеток. Предпочтительно, антитело, обладающее способностью связываться с CLDN18.2, связывается с одним или более пептидами, выбранными из группы, состоящей из SEQ ID №:1, 3-11, 44, 46, и 48-50. Предпочтительно, антитело, обладающее способностью связываться с CLDN18.2, является специфическим для упомянутых выше белков, пептидов или иммуногенных фрагментов или их производных. Антитело, обладающее способностью связываться с CLDN18.2, может быть получено способом, включающим стадию иммунизации животного белком или петидом, содержащим аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID №:1, 3-11, 44, 46, и 48-50, или нуклеиновую кислоту или клетку-хозяина, экспрессирующую указанный белок или пептид. Предпочтительно, антитело связывается с раковыми клетками, в частности клетками упомянутых выше типов рака и, предпочтительно, практически не связывается с нераковыми клетками.
Предпочтительно связывание антитела, обладающего способностью связываться с CLDN18.2, с клетками, экспрессирующими CLDN18.2, вызывает или опосредует уничтожение клеток, экспрессирующих CLDN18.2. Клетки, экспрессирующие CLDN18.2, предпочтительно являются раковыми клетками, и, в частности, их выбирают из группы, состоящей из злокачественных клеток рака желудка, пищевода, поджелудочной железы, легкого, яичника, толстой кишки, печени, головы и шеи и желчного пузыря. Предпочтительно, антитело вызывает или опосредует уничтожение клеток, индуцируя один или более из числа опосредованного комплементзависимой цитотоксичностью (CDC) лизиса, опосредованного антителозависимой клеточноопосредованной цитотоксичностью (ADCC) лизиса, апоптоза и ингибирования пролиферации клеток, экспрессирующих CLDN18.2. Предпочтительно, ADCC-опосредованный лизис происходит в присутствии эффекторных клеток, которые в отдельных вариантах осуществления выбирают из группы, состоящей из моноцитов, мононуклеарных клеток, NK-клеток и PMNs. Ингибирование пролиферации клеток можно измерить in vitro путем определения пролиферации клеток методом анализа с применением бромдезоксиуридина (5-бром-2-дезоксиуридин, BrdU). BrdU является синтетическим нуклеозидом, аналогом тимидина и может встраиваться во вновь синтезированную ДНК воспроизводящихся путем клеточного деления клеток (в ходе S фазы клеточного цикла), заменяя тимидин во время репликации ДНК. Обнаружение «включенного» химического вещества с помощью, например, антител, специфических к BrdU, указывает на клетки, которые активно воспроизводили свою ДНК.
В предпочтительных вариантах осуществления описанные в данном документе антитела могут быть охарактеризованы одним или более из следующих свойств:
a) специфичность к CLDN18.2;
b) аффинность связывания с CLDN18.2 около 100 нМ или менее, предпочтительно, около 5-10 нМ или менее и более предпочтительно около 1-3 нМ или менее,
c) способность вызывать или опосредовать CDC CLDN18.2-положительных клеток;
d) способность вызывать или опосредовать ADCC CLDN18.2-положительных клеток;
e) способность ингибировать рост CLDN18.2-положительных клеток;
f) способность вызывать апоптоз CLDN18.2-положительных клеток.
В отдельном предпочтительном варианте осуществления антитело, обладающее способностью связываться с CLDN18.2, вырабатывается гибридомой, депонированной в DSMZ (Mascheroder Weg 1b, 31824 Braunschweig, Germany; new address: Inhoffenstr. 7B, 31824 Braunschweig, Germany) и имеющей следующее обозначение и учетный номер:
a. 182-D1106-055, учетный номер DSM АСС2737, депонированная 19 октября 2005
b. 182-D1106-056, учетный номер DSM АСС2738, депонированная 19 октября 2005
c. 182-D1106-057, учетный номер DSM АСС2739, депонированная 19 октября 2005
d. 182-D1106-058, учетный номер DSM АСС2740, депонированная 19 октября 2005
e. 182-D1106-059, учетный номер DSM АСС2741, депонированная 19 октября 2005
f. 182-D1106-062, учетный номер DSM АСС2742, депонированная 19 октября 2005
g. 182-D1106-067, учетный номер DSM АСС2743, депонированная 19 октября 2005
h. 182-D758-035, учетный номер DSM АСС2745, депонированная 17 ноября 2005
i. 182-D758-036, учетный номер DSM АСС2746, депонированная 17 ноября 2005
j. 182-D758-040, учетный номер DSM АСС2747, депонированная 17 ноября 2005
k. 182-D1106-061, учетный номер DSM АСС2748, депонированная 17 ноября 2005
l. 182-D1106-279, учетный номер DSM АСС2808, депонированная 26 октября 2006
m. 182-D1106-294, учетный номер DSM ACC2809, депонированная 26 октября 2006
n. 182-D1106-362, учетный номер DSM АСС2810, депонированная 26 октября 2006.
Предпочтительными антителами согласно изобретению являются антитела, вырабатываемые или получаемые с помощью вышеупомянутых гибридом; т.е. 37G11 в случае 182-D1106-055, 37Н8 в случае 182-D1106-056, 38G5 в случае 182-D1106-057, 38Н3 в случае 182-D1106-058, 39F11 в случае 182-D1106-059, 43А11 в случае 182-D1106-062, 61С2 в случае 182-D1106-067, 26В5 в случае 182-D758-035, 26D12 в случае 182-D758-036, 28D10 в случае 182-D758-040, 42Е12 в случае 182-D1106-061, 125Е1 в случае 182-D1106-279, 163Е12 в случае 182-D1106-294, и 175D10 в случае 182-D1106-362; и их химерные и гуманизированные формы.
Предпочтительные химерные антитела и их последовательности показаны в следующей таблице.
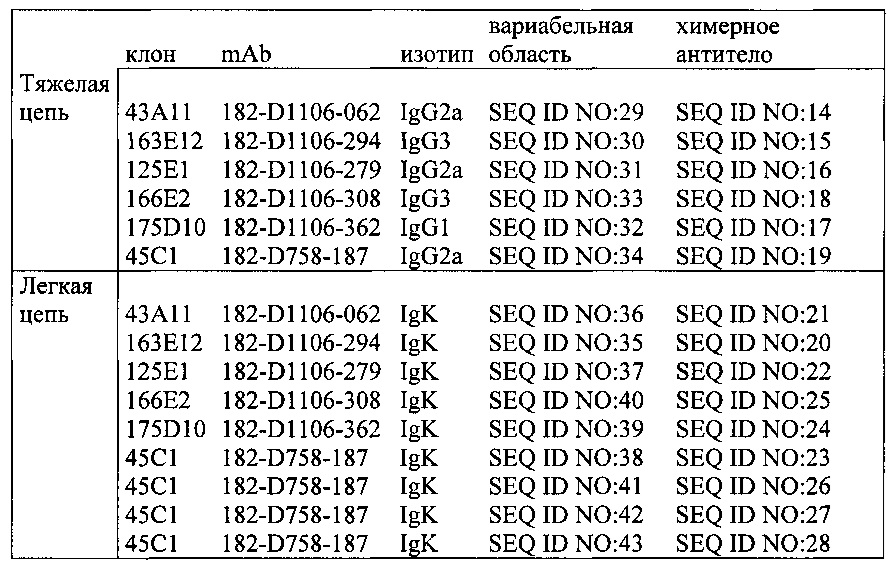
В предпочтительных вариантах осуществления антитела, в частности, химерные формы антител согласно изобретению, включают антитела, содержащие константную область тяжелой цепи (СН), включающую аминокислотную последовательность, происходящую из человеческой константной области тяжелой цепи, такую как аминокислотная последовательность, представленная SEQ ID NO: 13, или ее фрагмент. В дополнительных предпочтительных вариантах осуществления, антитела, в частности, химерные формы антител согласно изобретению, включают антитела, содержащие константную область легкой цепи (CL), включающую аминокислотную последовательность, происходящую из человеческой константной области легкой цепи, такую как аминокислотная последовательность, представленная SEQ ID NO: 12, или ее фрагмент. В отдельном предпочтительном варианте осуществления антитела, в частности, химерные формы антител согласно изобретению, включают антитела, которые содержат СН, включающую аминокислотную последовательность, происходящую от человеческой СН, такую как аминокислотная последовательность, представленная SEQ ID NO: 13, или ее фрагмент, и которые содержат CL, включающую аминокислотную последовательность, происходящую от человеческой CL, такую как аминокислотная последовательность, представленная SEQ ID NO: 12, или ее фрагмент.
В одном варианте осуществления антитело, обладающее способностью связываться с CLDN18.2, является химерным мышь/человек IgG1 моноклональным антителом, содержащим мышиную каппа вариабельную область легкой цепи, человеческую каппа константную область легкой цепи аллотип Km(3), мышиную вариабельную область тяжелой цепи, константную область человеческого IgG1, аллотип G1m(3).
В некоторых предпочтительных вариантах осуществления химерные формы антител включают антитела, содержащие тяжелую цепь, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 14, 15, 16, 17, 18, 19, и ее фрагмента, и/или содержащие легкую цепь, включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 20, 21, 22, 23, 24, 25,26, 27, 28, и ее фрагмента.
В некоторых предпочтительных вариантах осуществления химерные формы антител включают антитела, содержащие комбинацию тяжелых цепей и легких цепей, выбранных из следующих возможных вариантов (i) - (ix):
(i) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 14, или ее фрагмент, и легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 21, или ее фрагмент,
(ii) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 15, или ее фрагмент, и легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 20, или ее фрагмент,
(iii) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 16, или ее фрагмент, и легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 22, или ее фрагмент,
(iv) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 18, или ее фрагмент, и легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 25 или ее фрагмент,
(v) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 17, или ее фрагмент, и легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 24, или ее фрагмент,
(vi) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 19, или ее фрагмент, и легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 23, или ее фрагмент,
(vii) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 19, или ее фрагмент, и легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 26, или ее фрагмент,
(viii) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 19, или ее фрагмент, и легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 27, или ее фрагмент, и
(ix) тяжелая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 19, или ее фрагмент, и легкая цепь содержит аминокислотную последовательность, представленную SEQ ID NO: 28, или ее фрагмент.
"Фрагмент" или "фрагмент аминокислотной последовательности" при использовании в описании имеет отношение к части последовательности антитела, т.е. последовательности, которая представляет собой последовательность антитела, укороченную на N- и/или С-концах, и которая, в том случае, когда она заменяет указанную последовательность антитела в антителе, сохраняет способность связывания указанного антитела с CLDN18.2 и предпочтительно функции указанного антитела, описанные здесь, например, CDC-опосредованный лизис или ADCC-опосредованный лизис. Предпочтительно, фрагмент аминокислотной последовательности содержит, по меньшей мере, 80%, предпочтительно, по меньшей мере, 90%, 95%, 96%, 97%, 98% или 99% аминокислотных остатков от указанной аминокислотной последовательности. Фрагмент аминокислотной последовательности, выбранный из группы, состоящей из SEQ ID NOs: 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27 и 28, предпочтительно имеет отношение к указанной последовательности, в которой 17, 18, 19, 20, 21, 22 или 23 аминокислоты удалены на N-конце.
В предпочтительном варианте осуществления антитело, обладающее способностью связываться с CLDN18.2, содержит тяжелую цепь вариабельной области (VH), включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 29, 30, 31, 32, 33, 34 и их фрагмента.
В предпочтительном варианте осуществления антитело, обладающее способностью связываться с CLDN18.2, содержит легкую цепь вариабельной области (VH), включающую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 35, 36, 37, 38, 39, 40, 41, 42, 43 и их фрагмента.
В некоторых предпочтительных вариантах осуществления антитело, обладающее способностью связываться с CLDN18.2, содержит комбинацию тяжелой цепи вариабельной области (VH) и легкой цепи вариабельной области (VL), выбранную из следующих возможных вариантов (i) - (ix):
(i) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 29, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 36, или ее фрагмент,
(ii) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 30, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 35, или ее фрагмент,
(iii) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 31, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 37, или ее фрагмент,
(iv) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 33, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 40, или ее фрагмент,
(v) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 32, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 39, или ее фрагмент,
(vi) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 34, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 38, или ее фрагмент,
(vii) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 34, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 41, или ее фрагмент,
(viii) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 34, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 42, или ее фрагмент,
(ix) VH содержит аминокислотную последовательность, представленную SEQ ID NO: 34, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную SEQ ID NO: 43, или ее фрагмент.
В предпочтительном варианте осуществления антитело, обладающее способностью связываться с CLDN18.2, содержит VH, включающую набор гипервариабельных участков CDR1, CDR2 и CDR3, выбранных из следующих вариантов осуществления (i) - (vi):
(i) CDR1: положения 45-52 SEQ ID NO: 14, CDR2: положения 70-77 SEQ ID NO: 14, CDR3: положения 116-125 SEQ ID NO: 14,
(ii) CDR1: положения 45-52 SEQ ID NO: 15, CDR2: положения 70-77 SEQ ID NO: 15, CDR3: положения 116-126 SEQ ID NO: 15,
(iii) CDR1: положения 45-52 SEQ ID NO: 16, CDR2: положения 70-77 SEQ ID NO: 16, CDR3: положения 116-124 SEQ ID NO: 16,
(iv) CDR1: положения 45-52 SEQ ID NO: 17, CDR2: положения 70-77 SEQ ID NO: 17, CDR3: положения 116-126 SEQ ID NO: 17,
(v) CDR1: положения 44-51 SEQ ID NO: 18, CDR2: положения 69-76 SEQ ID NO: 18, CDR3: Положения 115-125 SEQ ID NO: 18, и
(vi) CDR1: положения 45-53 SEQ ID NO: 19, CDR2: положения 71-78 SEQ ID NO: 19, CDR3: положения 117-128 SEQ ID NO: 19.
В предпочтительном варианте осуществления антитело, обладающее способностью связываться с CLDN18.2, содержит VL, включающую набор гипервариабельных участков CDR1, CDR2 и CDR3, выбранных из следующих вариантов осуществления (i) - (ix):
(i) CDR1: положения 47-58 SEQ ID NO: 20, CDR2: положения 76-78 SEQ ID NO: 20, CDR3: положения 115-123 SEQ ID NO: 20,
(ii) CDR1: положения 49-53 SEQ ID NO: 21, CDR2: положения 71-73 SEQ ID NO: 21, CDR3: положения 110-118 SEQ ID NO: 21,
(iii) CDR1: положения 47-52 SEQ ID NO: 22, CDR2: положения 70-72 SEQ ID NO: 22, CDR3: положения 109-117 SEQ ID NO: 22,
(iv) CDR1: положения 47-58 SEQ ID NO: 23, CDR2: положения 76-78 SEQ ID NO: 23, CDR3: положения 115-123 SEQ ID NO: 23,
(v) CDR1: положения 47-58 SEQ ID NO: 24, CDR2: положения 76-78 SEQ ID NO: 24, CDR3: положения 115-123 SEQ ID NO: 24,
(vi) CDR1: положения 47-58 SEQ ID NO: 25, CDR2: положения 76-78 SEQ ID NO: 25, CDR3: положения 115-122 SEQ ID NO: 25,
(vii) CDR1: положения 47-58 SEQ ID NO: 26, CDR2: положения 76-78 SEQ ID NO: 26, CDR3: положения 115-123 SEQ ID NO: 26,
(viii) CDR1: положения 47-58 SEQ ID NO: 27, CDR2: положения 76-78 SEQ ID NO: 27, CDR3: положения 115-123 SEQ ID NO: 27, и
(ix) CDR1: положения 47-52 SEQ ID NO: 28, CDR2: положения 70-72 SEQ ID NO: 28, CDR3: положения 109-117 SEQ ID NO: 28.
В предпочтительном варианте осуществления антитело, обладающее способностью связываться с CLDN18.2, содержит комбинацию VH и VL, каждая из которых включает набор гипервариабельных участков CDR1, CDR2 и CDR3, выбранных из следующих вариантов осуществления (i) - (ix):
(i) VH: CDR1: положения 45-52 SEQ ID NO: 14, CDR2: положения 70-77 SEQ ID NO: 14, CDR3: положения 116-125 SEQ ID NO: 14, VL: CDR1: положения 49-53 SEQ ID NO: 21, CDR2: положения 71-73 SEQ ID NO: 21, CDR3: положения 110-118 SEQ ID NO: 21,
(ii) VH: CDR1: положения 45-52 SEQ ID NO: 15, CDR2: положения 70-77 SEQ ID NO: 15, CDR3: положения 116-126 SEQ ID NO: 15, VL: CDR1: положения 47-58 SEQ ID NO: 20, CDR2: положения 76-78 SEQ ID NO: 20, CDR3: положения 115-123 SEQ ID NO: 20,
(iii) VH: CDR1: положения 45-52 SEQ ID NO: 16, CDR2: положения 70-77 SEQ ID NO: 16, CDR3: положения 116-124 SEQ ID NO: 16, VL: CDR1: положения 47-52 SEQ ID NO: 22, CDR2: положения 70-72 SEQ ID NO: 22, CDR3: положения 109-117 SEQ ID NO: 22,
(iv) VH: CDR1: положения 44-51 SEQ ID NO: 18, CDR2: положения 69-76 SEQ ID NO: 18, CDR3: положения 115-125 SEQ ID NO: 18, VL: CDR1: положения 47-58 SEQ ID NO: 25, CDR2: положения 76-78 SEQ ID NO: 25, CDR3: положения 115-122 SEQ ID NO: 25,
(v) VH: CDR1: положения 45-52 SEQ ID NO: 17, CDR2: положения 70-77 SEQ ID NO: 17, CDR3: положения 116-126 SEQ ID NO: 17, VL: CDR1: положения 47-58 SEQ ID NO: 24, CDR2: положения 76-78 SEQ ID NO: 24, CDR3: положения 115-123 SEQ ID NO: 24,
(vi) VH: CDR1: положения 45-53 SEQ ID NO: 19, CDR2: положения 71-78 SEQ ID NO: 19, CDR3: положения 117-128 SEQ ID NO: 19, VL: CDR1: положения 47-58 SEQ ID NO: 23, CDR2: положения 76-78 SEQ ID NO: 23, CDR3: положения 115-123 SEQ ID NO: 23,
(vii) VH: CDR1: положения 45-53 SEQ ID NO: 19, CDR2: положения 71-78 SEQ ID NO: 19, CDR3: положения 117-128 SEQ ID NO: 19, VL: CDR1: положения 47-58 SEQ ID NO: 26, CDR2: положения 76-78 SEQ ID NO: 26, CDR3: положения 115-123 SEQ ID NO: 26,
(viii) VH: CDR1: положения 45-53 SEQ ID NO: 19, CDR2: положения 71-78 SEQ ID NO: 19, CDR3: положения 117-128 SEQ ID NO: 19, VL: CDR1: положения 47-58 SEQ ID NO: 27, CDR2: положения 76-78 SEQ ID NO: 27, CDR3: положения 115-123 SEQ ID NO: 27, и
(ix) VH: CDR1: положения 45-53 SEQ ID NO: 19, CDR2: положения 71-78 SEQ ID NO: 19, CDR3: положения 117-128 SEQ ID NO: 19, VL: CDR1: положения 47-52 SEQ ID NO: 28, CDR2: положения 70-72 SEQ ID NO: 28, CDR3: положения 109-117 SEQ ID NO: 28.
В дополнительных предпочтительных вариантах осуществления антитело, обладающее способностью связываться с CLDN18.2, предпочтительно содержит один или более гипервариабельных участков (CDRs), предпочтительно, по меньшей мере, CDR3 вариабельный участок, вариабельной области тяжелой цепи (VH) и/или вариабельной области легкой цепи (VL) моноклонального антитела к CLDN18.2, предпочтительно моноклонального антитела к CLDN18.2, описанного в данном документе, и предпочтительно содержит один или более гипервариабельных участков (CDRs), предпочтительно, по меньшей мере, CDR3 вариабельный участок, вариабельных областей тяжелой цепи (VH) и/или вариабельных областей легкой цепи (VL), описанных здесь. В одном варианте осуществления указанный один или более гипервариабельных участков (CDRs) выбирают из набора гипервариабельных участков CDR1, CDR2 и CDR3, описанных здесь. В особенно предпочтительном варианте осуществления антитело, обладающее способностью связываться с CLDN18.2, предпочтительно содержит гипервариабельные участки CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи (VH) и/или вариабельной области тяжелой цепи (VL) моноклонального антитела к CLDN18.2, предпочтительно моноклонального антитела к CLDN18.2, описанному здесь, и предпочтительно содержит гипервариабельные участки CDR1, CDR2 и CDR3 вариабельных областей тяжелой цепи (VH) и/или вариабельных областей легкой цепи (VL), описанных здесь.
В одном варианте осуществления антитело, содержащее один или более CDRs, набор CDRs или комбинацию наборов CDRs, как описано здесь, включает указанные CDRs вместе с их промежуточными каркасными участками. Предпочтительно, данный участок будет также включать, по меньшей мере, около 50% любого или обоих из первого и четвертого каркасных участков, причем будучи на 50% C-концевыми 50% первого каркасного участка и N-концевыми 50% четвертого каркасного участка. Создание антител методами рекомбинантных ДНК может приводить к введению N- или C-концевых остатков в вариабельные участки, кодированные линкерами, введенными для облегчения клонирования или других стадий манипуляции, включая введение линкеров для соединения вариабельных областей изобретения с дополнительными белковыми последовательностями, включая тяжелые цепи иммуноглобулинов, другие вариабельные домены (например, при получении диабоди) или белковые метки.
В одном варианте осуществления антитело, содержащее один или более CDRs, набор CDRs или комбинацию наборов CDRs, как описано здесь, содержит указанные CDRs в каркасном участке антитела человека.
Ссылка в данном документе на антитело, содержащее в его тяжелой цепи конкретную цепь или конкретную область (участок) или последовательность, предпочтительно относится к ситуации, в которой все тяжелые цепи указанного антитела содержат указанную конкретную цепь, область или последовательность. Это соответственно применимо к легкой цепи антитела.
Использованный в описании термин "нуклеиновая кислота" включает ДНК и РНК. Нуклеиновая кислота может быть одноцепочечной или двухцепочечной, но предпочтительно является двухцепочечной ДНК.
Согласно изобретению термин "экспрессия" используется в его наиболее общем значении и включает выработку РНК или РНК и белка/пептида. Термин также включает частичную экспрессию нуклеиновых кислот. Кроме того, экспрессия может протекать временно или постоянно.
Следует учитывать, что изложенная в документе идея в отношении специфических аминокислотных последовательностей, например, указанных в списке последовательностей, также имеет отношение к вариантам указанных специфических последовательностей, приводящим к образованию последовательностей, которые являются функционально эквивалентными указанным специфическим последовательностям, например аминокислотным последовательностям, демонстрирующим свойства, идентичные или подобные, свойствам специфических аминокислотных последовательностей. Одним важным свойством является сохранение связывания антитела с его мишенью или подтверждение эффекторных функций антитела. Предпочтительно, последовательность, которая является вариантом относительно специфической последовательности, в том случае, когда она заменяет специфическую последовательность в антителе, сохраняет способность связывания указанного антитела с CLDN18.2 и предпочтительно функции указанного антитела, как описано здесь, например CDC-опосредованный лизис или ADCC-опосредованный лизис.
Специалистам в данной области ясно, что последовательности CDR, гипервариабельных и вариабельных областей могут быть модифицированы без потери способности связываться с CLDN18.2. Например, CDR участки будут являться или идентичными или высокогомологичными участкам антитела, определенного в описании. Под "высокогомологичным" имеется в виду, что может быть сделано от 1 до 5, предпочтительно от 1 до 4, например от 1 до 3 замен или 1 или 2 замены в CDRs. Кроме того, гипервариабельные и вариабельные области могут быть модифицированы так, чтобы они показывали значительную гомологию с областями антитела, в частности, раскрытого в описании.
Для целей настоящего изобретения "варианты" аминокислотной последовательности включают варианты с вставками аминокислот, варианты с добавками аминокислот, варианты с делециями аминокислот и/или варианты с заменами аминокислот. Варианты с делециями аминокислот, содержащие делецию на N-конце и/или С-конце белка, также называются N-концевыми и/или C-концевыми укороченными вариантами.
Варианты со вставкой аминокислот включают вставки одной или двух или более аминокислот в отдельную аминокислотную последовательность. В случае имеющих вставку вариантов аминокислотной последовательности в отдельный участок аминокислотной последовательности вставляется один или более аминокислотных остатков, хотя при соответствующем скрининге полученного продукта также можно обнаружить случайные вставки.
Варианты аминокислотных добавок включают амино- и/или карбокси-концевые слияния с одной или более аминокислотами, например с 1, 2, 3, 5, 10, 20, 30, 50 или более аминокислотами.
Варианты с делецией аминокислот характеризуются удалением одной или более аминокислот из последовательности, например удалением 1, 2, 3, 5, 10, 20, 30, 50 или более аминокислот. Делеции могут происходить в любом месте белка.
Варианты с заменами аминокислот характеризуются, по меньшей мере, удалением одного остатка в последовательности и вставкой другого остатка на его место. Предпочтение отдается модификациям, находящимся в положениях аминокислотной последовательности, которые не являются консервативными между гомологичными белками или пептидами, и/или заменам аминокислот на другие аминокислоты, имеющие сходные свойства. Предпочтительно аминокислотные изменения в белковых вариантах являются консервативными аминокислотными изменениями, т.е. заменами аналогично заряженных или незаряженных аминокислот. Консервативное изменение аминокислоты имеет отношение к замене одной из семейства аминокислот, которые являются родственными по структуре боковой цепи. Природные аминокислоты подразделяются на четыре семейства: кислые (аспартат, глутамат), основные (лизин, аргинин, гистидин), неполярные (аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан) и незаряженные полярные (глицин, аспарагин, глутамин, цистеин, серии, треонин, тирозин) аминокислоты. Фенилаланин, триптофан и тирозин иногда классифицируются вместе как ароматические аминокислоты.
Предпочтительно степень сходства, предпочтительно идентичности между данной аминокислотной последовательностью и аминокислотной последовательностью, которая является вариантом указанной данной аминокислотной последовательностью, будет составлять, по меньшей мере, около 60%, 65%, 70%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99%. Степень сходства или идентичность предпочтительно предоставляется для аминокислотной области, которая составляет, по меньшей мере, около 10%, по меньшей мере, около 20%, по меньшей мере, около 30%, по меньшей мере, около 40%, по меньшей мере, около 50%, по меньшей мере, около 60%, по меньшей мере, около 70%, по меньшей мере, около 80%, по меньшей мере, около 90% или около 100% полной длины эталонной аминокислотной последовательности. Например, если эталонная аминокислотная последовательность состоит из 200 аминокислот, степень сходства или идентичность предпочтительно предоставляется, по меньшей мере, примерно для 20, по меньшей мере, примерно 40, по меньшей мере, примерно 60, по меньшей мере, примерно 80, по меньшей мере, примерно 100, по меньшей мере, примерно 120, по меньшей мере, примерно 140, по меньшей мере, примерно 160, по меньшей мере, примерно 180 или примерно для 200 аминокислот, предпочтительно последовательных аминокислот. В предпочтительных вариантах осуществления предоставляется степень сходства или идентичность с полной длиной эталонной аминокислотной последовательности. Выравнивание для определения степени сходства последовательности, предпочтительно идентичности последовательности, можно выполнить известными в данной области техники способами, предпочтительно с использованием самого лучшего способа выравнивания последовательности, например, Align с использованием стандартных настроек, предпочтительно EMBOSS::needle, Matrix: Blosum62, Gap Open 10.0, Gap Extend 0.5.
"Сходство последовательности" указывает процент аминокислот, которые или являются идентичными, или представляют собой консервативные аминокислотные замены.
"Идентичность последовательности" между двумя аминокислотными последовательностями указывает процент аминокислот, которые являются идентичными между данными последовательностями.
Термин "процент идентичности" предназначается для обозначения процента аминокислотных остатков, идентичных между двумя сравниваемыми последовательностями после выполнения наиболее оптимального выравнивания, этот процент является чисто статистическим, а различия между двумя последовательностями распределяются случайно и в пределах их полной длины. Сравнение последовательностей между двумя аминокислотными последовательностями обычно осуществляется путем сравнения этих последовательностей после их оптимального выравнивания, указанное сравнение проводится посредством сегмента или "окна сравнения" для того, чтобы установить и сравнить локальные области сходства последовательности. Оптимальное выравнивание последовательностей для сравнения может быть проведено, кроме способа «вручную», посредством алгоритма локальной гомологии Smith и Waterman, 1981, Ads Арр. Math. 2, 482, посредством алгоритма локальной гомологии Neddleman и Wunsch, 1970, J. Mol. Biol. 48, 443, посредством метода поиска сходства Pearson and Lipman, 1988, Proc. Natl Acad. Sci. USA 85, 2444, или посредством компьютерных программ с применением этих алгоритмов (GAP, BESTFIT, FASTA, BLAST Ρ, BLAST Ν и TFASTA in Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Drive, Madison, Wis.).
Процент идентичности вычисляется путем определения числа идентичных положений между двумя последовательностями при сравнении, делением этого числа на число сравниваемых положений и умножением полученного результата на 100 для того, чтобы получить процент идентичности между этими двумя последовательностями.
Термин "трансгенное животное" относится к животному, имеющему геном, содержащий один или более трансгенов, предпочтительно трансгенов тяжелой и/или легкой цепи, или трансхромосом (или интегрированных или неинтегрированных в природную геномную ДНК животного), предпочтительно способных экспрессировать трансгены. Например, трансгенная мышь может иметь трансген человеческой легкой цепи и или трансген человеческой тяжелой цепи или трансхромосому человеческой тяжелой цепи, так что мышь продуцирует человеческие анти-CLDN18.2 антитела, когда она иммунизирована CLDN18.2-антигеном и/или клетками, экспрессирующими CLDN18.2. Трансген человеческой тяжелой цепи может быть интегрирован в хромосомную ДНК мыши, как в случае трансгенной мыши, например HuMAb мыши, например НСо7 или HCol2 мыши, или трансген человеческой тяжелой цепи может быть сохранен экстрахромосомно, как в случае трансхромосомных (например, КМ) мышей, как описано в WO 02/43478. Такие трансгенные и трансхромосомные мыши могут быть способны продуцировать множество изотипов человеческих моноклональных антител к CLDN18.2 (например, IgG, IgA и/или IgE) при проведении V-D-J рекомбинации и переключения изотипа.
"Уменьшать", "снижать" или "ингибировать" при использовании в описании означает способность вызывать общее уменьшение, предпочтительно на 5% или больше, 10% или больше, 20%» или больше, более предпочтительно 50% или больше и наиболее предпочтительно на 75% или больше уровня, например уровня экспрессии или уровня пролиферации клеток.
Такие термины как "увеличение" или "усиление" предпочтительно относятся к увеличению или усилению, по меньшей мере, примерно на 10%, предпочтительно, по меньшей мере, на 20%, предпочтительно, по меньшей мере, на 30%, более предпочтительно, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 50%, даже более предпочтительно, по меньшей мере, на 80%, и наиболее предпочтительно, по меньшей мере, на 100%, по меньшей мере, на 200%, по меньшей мере, на 500%, по меньшей мере, на 1000%, по меньшей мере, на 10000% или даже более.
Механизмы действия mAb
Несмотря на то, что следующее описание предоставляет обсуждение, касающееся механизма, лежащего в основе терапевтической эффективности антител изобретения, оно не должно рассматриваться как ограничивающее изобретение каким бы то ни было образом.
Описанные здесь антитела предпочтительно взаимодействуют с компонентами иммунной системы, предпочтительно через ADCC или CDC. Описанные здесь антитела также могут использоваться для «целевой нагрузки» (например, радиоизотопами, лекарственными средствами или токсинами), для того, чтобы непосредственно убивать опухолевые клетки, или могут использоваться синергически вместе с традиционными химиотерапевтическими средствами, воздействуя на опухоли с помощью дополнительных механизмов действия, включая противоопухолевые иммунные ответы, которые могут быть нарушены из-за побочных цитотоксических эффектов химиотерапевтических препаратов на Т-лимфоциты. Однако описанные здесь антитела также могут оказывать действие просто путем связывания с CLDN18.2 на клеточной поверхности, таким образом, например, блокируя пролиферацию клеток.
Антителозависимая клеточноопосредованная цитотоксичность
ADCC описывает способность эффекторных клеток, как описано здесь, в частности лимфоцитов, убивать клетки, при этом необходимо, чтобы клетка-мишень была помечена предпочтительно антителом.
Предпочтительно ADCC наблюдается, когда антитела связываются с антигенами на опухолевых клетках, а Fe-домены антител связывают Fc-рецепторы (FcR) на поверхности иммунных эффекторных клеток. Было установлено несколько семейств Fc-рецепторов, при этом характерно, что специфические популяции клеток экспрессируют определенные Fc-рецепторы. ADCC можно рассматривать как механизм прямого разрушения (различной степени) опухоли, который приводит к презентации антигена и индукции Т-клеточных ответов, направленных на опухоль. Предпочтительно индукция ADCC in vivo будет приводить к Т-клеточному ответу, направленному на опухолевые клетки, и ответу антител хозяина.
Комплементзависимая цитотоксичность.
Другим способом уничтожения клеток, который может опосредоваться антителами, является CDC. Самым эффективным изотипом для активации комплемента является IgM. Также очень эффективными при направлении CDC через классический путь активации комплемента являются IgG1 и IgG3. Предпочтительно, образование комплексов антиген-антитело в этом каскаде приводит к «раскрытию» многочисленных мест связывания Clq в непосредственной близости на СН2 доменах участвующих молекул антител, например молекул IgG (Clq является одним из трех субкомпонентов комплемента Cl). Предпочтительно эти «раскрытые» места связывания Clq превращают взаимодействие Clq-IgG до этого с низким сродством в сродство с высокой авидностью, что запускает каскад событий, вовлекающих ряд других белков комплемента, и приводит к протеолитическому высвобождению хемотаксических/активирующих агентов эффекторных клеток С3а и С5а. Предпочтительно каскад комплемента оканчивается образованием мембрано-атакующего комплекса, который создает поры в клеточной мембране, что способствуют свободному прохождению воды и растворенных веществ в клетки и из клеток.
Описанные в этом документе антитела можно получить с помощью ряда методов, включая обычную методику получения моноклональных антител, например методом гибридизации стандартных соматических клеток Kohler и Milstein, Nature 256: 495 (1975). Несмотря на то, что методы гибридизации соматических клеток являются предпочтительными, в принципе можно использовать другие методы получения моноклональных антител, например, путем вирусной или онкогенной трансформации В-лимфоцитов, или метод фагового дисплея с использованием библиотек генов антител.
Предпочтительной животной системой для получения гибридомы, секретирующей моноклональные антитела, является мышиная система. Получение гибридомы в мыши является общепринятым методом. Протоколы иммунизации и методики выделения иммунизированных спленоцитов для слияния хорошо известны в данной области техники. Сливающиеся клетки (например, мышиные клетки миеломы) и процедуры слияния также хорошо известны.
Другими предпочтительными животными системами для получения гибридом, секретирующих моноклональные антитела, являются крысы или кролики (например, система, описанная в Spieker-Polet et al., Proc. Natl. Acad. Sci. U.S.A. 92:9348 (1995), смотри также Rossi et al., Am. J. Clin. 35 Pathol. 124:295(2005)).
В другом предпочтительном варианте осуществления человеческие моноклональные антитела можно получить с помощью трансгенных или трансхромосомных мышей, несущих части человеческой иммунной системы, а не мышиной системы. Эти трансгенные или трансхромосомные мыши включают мышей, известных как мыши HuMAb и мыши KM, соответственно, и вместе упоминаются в описании как "трансгенные мыши". Получение человеческих антител в таких трансгенных мышах можно осуществить, как подробно описано для CD20 в WO 2004 035607.
Другой стратегией получения моноклональных антител является прямое выделение генов, кодирующих антитела, из лимфоцитов, продуцирующих антитела, например, см. Babcock et el., 1996; A novel strategy for generating monoclonal antibodies from single, isolated lymphocytes producing antiboies of defined strategy. Подробности разработки рекомбинантных антител смотри также в Welschof и Kraus, Recombinant antibodes for cancer therapy ISBN-0-89603-918-8 и Benny K.C. Lo Antibody Engineering ISBN 1-58829-092-1.
Для получения антител мышей можно иммунизировать конъюгированными с носителем пептидами, полученными из последовательности антигена, т.е. последовательности, против которой направлены антитела, обогащенным препаратом рекомбинантно экспрессированного антигена или его фрагментов и/или клетками, экспрессирующими антиген, как описано. Альтернативно, мышей можно иммунизировать ДНК, кодирующей антиген или его фрагменты. В том случае, когда иммунизация с использованием очищенного или обогащенного препарата антигена не приводит к образованию антител, мышей также можно иммунизировать клетками, экспрессирующими антиген, например, клеточной линией, чтобы содействовать иммунному ответу.
Иммунный ответ можно контролировать на протяжении выполнения протокола иммунизации, отбирая образцы плазмы и сыворотки из хвостовой вены или ретроорбитального кровотечения. Мыши с достаточным титром иммуноглобулина могут использоваться для слияния. Мышей можно подвергнуть стимуляции внутрибрюшинно и внутривенно клетками, экспрессирующими антиген, за 3 дня до забоя и удаления селезенки для того, чтобы увеличить скорость секретирования специфических антител гибридомами.
Для получения гибридом, продуцирующих моноклональные антитела, из лимфатических узлов или селезенки, полученных от иммунизированных мышей, могут быть выделены клетки и слиты с подходящей иммортализованной клеточной линией, например линией клеток миеломы мыши. Затем полученные гибридомы можно отобрать по выработке антиген-специфических антител. Затем с помощью метода ELISA можно отобрать отдельные лунки с гибридомами, секретирующими антитела. С помощью иммунофлуоресценции и FACS-анализа с использованием клеток, экспрессирующих антиген, можно установить антитела со специфичностью к антигену. Гибридомы, секретирующие антитела, можно вновь высеять, провести отбор и положительные по моноклональным антителам можно субклонировать с помощью серийного разведения. Затем стабильные субклоны культивируют in vitro в среде для культуры ткани, чтобы получить и охарактеризовать антитела.
Антитела также можно получить в клетках-хозяевах, таких как трансфектомы, используя, например, комбинацию методов рекомбинантных ДНК и методов трансфекции генов, хорошо известных в данной области техники (Morrison, S. (1985) Science 229: 1202).
Например, в одном варианте осуществления представляющие интерес гены(ген), например гены антител, могут быть лигированы в вектор экспрессии, такой как эукариотическая экспрессирующая плазмида, например, используемая системой экспрессии гена GS, раскрытой в WO 87/04462, WO 89/01036 и ЕР 338 841, или другие системы экспрессии, хорошо известные в данной области. Очищенная плазмида с клонированными генами антитела может быть введена в эукариотическую клетку-хозяина, такую как СНО клетки (клетки яичников китайского хомячка), NS/0 клетки, HEK293T клетки или HEK293 клетки или альтернативно другие эукариотические клетки, подобные клеткам растений, грибов или дрожжей. Для введения этих генов могут использоваться методы, описанные в данной области техники, такие как электропорация, липофектин, липофектамин или другие. После введения этих генов антител в клетки-хозяева, клетки, экспрессирующие антитело могут быть опознаны и отобраны. Эти клетки представляют собой трансфектомы, которые затем можно амплифицировать и масштабировать для выработки антител. Рекомбинантные антитела могут быть изолированы и очищены из этих культуральных супернатантов и/или клеток.
Альтернативно, клонированные гены антитела могут быть экспрессированы в других системах экспрессии, включая прокариотические клетки, такие как микроорганизмы, например, Е. coli. Более того, антитела могут продуцироваться в трансгенных организмах, не являющихся человеком, и присутствовать, например, в молоке овец и кроликов или в яйцах кур, или в трансгенных растениях; смотри, например, Verma, R., et al. (1998) J. Immunol. Meth. 216: 165-181; Pollock, et al. (1999) J. Immunol. Meth. 231: 147-157; и Fischer, R., et al. (1999) Biol. Chem. 380: 825-839.
Химеризация
Мышиные моноклональные антитела могут использоваться как терапевтические антитела для людей, в том случае, когда к ним прикрепляется токсин, или когда их метят радиоактивными изотопами. При повторном применении немеченые мышиные антитела являются высокоиммуногенными для человека, что приводит к уменьшению терапевтического эффекта. Основная иммуногенность опосредуется константными областями тяжелой цепи. Иммуногенность мышиных антител у человека можно уменьшить или полностью ее избежать, если соответствующие антитела сделать химерными или гуманизированными. Химерные антитела являются антителами, разные части которых происходят от разных видов животных, например, антитела имеют вариабельную область, полученную от мышиного антитела, и константную область человеческого иммуноглобулина. Химеризация антител достигается соединением вариабельных областей тяжелой и легкой цепей мышиных антител с человеческой константной областью тяжелой и легкой цепи (например, как описано Kraus et al., в Methods in Molecular Biology series, Recombinant antibodies for cancer therapy ISBN-0-89603-918-8). В предпочтительном варианте осуществления химерные антитела получают соединением человеческой константной области каппа-легкой цепи с мышиной вариабельной областью легкой цепи. В еще одном предпочтительном варианте осуществления химерные антитела получают соединением человеческой константной области лямбда-легкой цепи с мышиной вариабельной областью легкой цепи. Предпочтительными константными областями тяжелой цепи для получения химерных антител являются IgG1, IgG3 и IgG4. Другими предпочтительными константными областями тяжелой цепи для получения химерных антител являются IgG2, IgA, IgD и IgM.
Гуманизация
Антитела взаимодействуют с целевыми антигенами преимущественно через аминокислотные остатки, расположенные в шести гипервариабельных участках (CDR) тяжелой и легкой цепи. По этой причине аминокислотные последовательности в CDR являются более разными между отдельными антителами, чем последовательности вне CDR. Поскольку CDR-последовательности отвечают за большинство взаимодействий антитело-антиген, является возможной экспрессия рекомбинантных антител, подражающих свойствам специфических природных антител, путем конструирования векторов экспрессии, которые включают CDR-последовательности от специфических природных антител, пересаженные на каркасные последовательности от другого антитела с другими свойствами (см., например, Riechmann, L. et al. (1998) Nature 332: 323-327; Jones, P. et al. (1986) Nature 321: 522-525; и Queen, С. et al. (1989) Proc. Natl. Acad. Sci. U.S.Α. 86: 10029-10033). Такие каркасные последовательности можно получить из публичных баз данных ДНК, которые включают зародышевые последовательности генов антител. Эти зародышевые последовательности будут отличаться от зрелых последовательностей генов антител, так как они не включают полностью собранные изменчивые гены, которые формируются при V (D) J соединении во время созревания В-клетки. Зародышевые генные последовательности также будут отличаться от последовательностей высокоаффинного антитела из вторичного репертуара отдельной равномерной вариабельной областью.
Способность антитела связываться с CLDN6 можно определить с помощью стандартных методов анализа связывания (например, ELISA, вестерн-блоттинг, иммунофлуоресценция и проточная цитометрия).
С целью очистки моноклональных антител отобранные гибридомы выращивают в двухлитровой роллерной колбе. Альтернативно антитела можно получить в биореакторе на основе диализа. При необходимости супернатанты можно профильтровать, концентрировать перед проведением аффинной хроматографии с протеин-G-сефарозой или протеин-A-сефарозой. Чистоту элюированного IgG можно проконтролировать с помощью гель-электрофореза и высокоэффективной жидкостной хроматографии. Буферный раствор можно поменять на PBS, а концентрацию можно определить при OD280 с использованием коэффициента экстинции 1,43. Моноклональные антитела можно разделить на аликвоты и хранить при -80°С.
Для того чтобы определить, связываются ли отобранные моноклональные антитела с единственным эпитопом, может быть применен сайт-направленный или мульти-сайт-направленный мутагенез.
Для установления изотипа очищенных антител проводили анализ ELISA с разными коммерческими наборами (например, Zymed, Roche Diagnostics). Лунки титрационных микропланшетов покрывают антимышиным Ig. После блокировки (ингибирования) проводили реакцию с моноклональными антителами или очищенными изотопными контролями при комнатной температуре в течение двух часов. Затем проводили реакцию или с мышиным IgG1, IgG2a, IgG2b или IgG3, IgA, или со специфическим мышиным IgM, конъюгированным с пероксидазой. После промывки планшеты обрабатывают ABTS субстратом (1 мг/мл) и исследуют при OD 405-650. Альтернативно, можно использовать набор для изотипирования IsoStrip Mouse Monoclonal Antibody Isotyping Kit (Roche, Cat. No. 1493027), как описано производителем.
Для того чтобы продемонстрировать наличие антител в сыворотке иммунизированных мышей или связывание моноклональных антител с живыми клетками, экспрессирующими антиген, можно использовать проточную цитометрию. Линии клеток, экспрессирующие антиген в норме или после трансфекции, и отрицательные контроли, утратившие экспрессию антигена (выращенные при стандартных условиях), смешивают с разными концентрациями моноклональных антител в супернатантах от гибридомы или в PBS, содержащем 1% FBS, и инкубируют при 4°С в течение 30 мин. После промывки меченные АРС или Alexa647 анти-IgG антитела могут связываться с антиген-связанными моноклональными антителами при таких же условиях, как условия для окрашивания первичных антител. Образцы можно проанализировать с помощью проточной цитометрии на приборе FACS, используя параметры прямого и бокового рассеяния света, чтобы пропускать отдельные живые клетки. Для того чтобы отличить антиген-специфические моноклональные антитела от неспецифических связующих веществ в одном измерении, можно использовать метод котрансфекции. Клетки временно трансфицированные плазмидами, кодирующими антиген, и флуоресцентным маркером, можно окрасить, как описано выше. Трансфицированные клетки можно обнаружить в другом диапазоне флуоресценции, чем антитело-окрашенные клетки. Так как большинство трансфицированных клеток экспрессирует оба трансгена, антиген-специфические моноклональные антитела связываются предпочтительно с клетками, экспрессирующими флуоресцентный маркер, тогда как неспецифические антитела связываются в сравнимом соотношении с нетрансфицированными клетками. Можно применять альтернативный метод анализа с использованием флуоресцентной микроскопии в дополнение к или вместо проточной цитометрии. Клетки можно окрасить так, как описано выше, и исследовать с помощью флуоресцентной микроскопии.
Для того чтобы продемонстрировать наличие антител в сыворотке иммунизированных мышей или связывание моноклональных антител с живыми клетками, экспрессирующими антиген, можно использовать иммунофлуоресцентную микроскопию. Например, клеточные линии, экспрессирующие антиген или спонтанно или после трансфекции, и отрицательные контроли, утратившие экспрессию антигена, выращивают в предметных стеклах с лунками при стандартных условиях роста в среде DMEM/F12 с добавлением 10% эмбриональной телячьей сыворотки (FCS), 2 мМ L-глутамина, 100 мкг/мл пенициллина и 100 мкг/мл стрептомицина. Затем клетки фиксируют метанолом или параформальдегидом или оставляют необработанными. Затем проводят реакцию клеток с моноклональными антителами к антигену в течение 30 минут при 25°С. После промывки проводят реакцию клеток с мечеными Alexa555 антимышиными IgG вторичными антителами (Molecular Probes) при тех же самых условиях. После этого можно исследовать клетки с помощью флуоресцентной микроскопии.
Из клеток, экспрессирующих антиген, и соответствующих отрицательных контролей можно приготовить клеточные экстракты, а затем провести электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS). После электрофореза отделенные антигены переносят на нитроцеллюлозные мембраны, ингибируют и исследуют с помощью тестируемых моноклональных антител. IgG-связывание можно определить с помощью антимышь IgG меченного пероксидазой и обнаружить с помощью ECL субстрата.
Антитела можно дополнительно протестировать на реакционную способность с антигеном с помощью иммуногистохимического анализа хорошо известным специалисту в данной области способом, например, с использованием криосрезов, фиксированных параформальдегидом или ацетоном, или фиксированных параформальдегидом парафиновых срезов образцов нераковых тканей или раковых тканей, взятых у пациента во время обычных хирургических процедур, или у мышей с ксенотрансплантатом опухолей, инокулированных с помощью линий клеток, экспрессирующих антиген спонтанно или после трансфекции. Для иммуноокрашивания антитела, реагирующие с антигеном, могут быть проинкубированы, а затем конъюгированы с меченными пероксидазой хрена козьими антимышь или козьими антикролик антителами (DAKO) согласно инструкциям продавца.
Антитела можно протестировать в отношении их способности опосредовать фагоцитоз и уничтожение клеток, экспрессирующих CLDN18.2. Проверка активности моноклональных антител in vitro обеспечивает первоначальный скрининг до тестирования на моделях in vivo.
Антителозависимая клеточноопосредованная цитотоксичность (ADCC):
Коротко, полиморфноядерные клетки (PMN), NK-клетки, моноциты, мононуклеарные клетки или другие эффекторные клетки от здоровых доноров можно очистить центрифугированием в градиенте плотности фиколл-гипака, с последующим разрушением загрязняющих эритроцитов. Промытые эффекторные клетки суспендируют в RPMI с добавлением 10% инактивированной нагреванием эмбриональной телячьей сыворотки или альтернативно с 5% инактивированной нагреванием человеческой сыворотки и смешивают с51Cr-мечеными клетками-мишенями, экспрессирующими CLDN18.2, в различных соотношениях эффекторных клеток к клеткам-мишеням. Альтернативно, клетки-мишени можно пометить лигандом, усиливающим флуоресценцию (BATDA). Высокофлуоресцентный хелат европия с усиливающим лигандом, который высвобождается из мертвых клеток, можно определить с помощью флуориметра. В другом альтернативном способе может использоваться трансфекция клеток-мишеней с использованием люциферазы. При этом добавленный люцифер желтый может окисляться только живыми клетками. Затем можно добавить очищенные анти-CLDN18.2 IgGs в разных концентрациях. В качестве отрицательного контроля можно использовать нерелевантный человеческий IgG. Исследование проводится в течение от 4 до 20 часов при 37°С в зависимости от типа используемых эффекторных клеток. Цитолиз в образцах можно оценить путем измерения высвобождения51Cr или наличия хелата EuTDA в культуральном супернатанте. Альтернативно, можно измерить люминесценцию живых клеток, являющуюся результатом окисления люцифера желтого.
Также можно проверить различные комбинации анти-CLDN18.2 моноклональных антител, чтобы определить усиливается ли цитолиз при действии составов моноклональных антител.
Комплементзависимая цитотоксичностъ (CDC):
Моноклональные анти-CLDN6 антитела можно проверить на их способность опосредовать CDC с помощью ряда известных методов. Например, сыворотку для получения комплемента можно получить из крови известным специалистам способом. Для определения CDC-активности моноклональных антител можно использовать разные методы. Например, можно измерить высвобождение51Cr или можно оценить повышенную проницаемость мембран с помощью метода исключения пропидиум иодида (PI). Коротко, целевые клетки промывают и 5×105/мл инкубируют с разными концентрациями mMAb в течение 10-30 минут при комнатной температуре или при 37°С. Затем добавляют сыворотку или плазму до окончательной концентрации 20% (об./об.) и клетки инкубируют при 37°С в течение 20-30 минут. Ко всем клеткам каждого образца добавляют раствор PI в пробирку для FACS-анализа. После этого смесь немедленно анализируют с помощью проточной цитометрии, используя FACS-набор.
В альтернативном способе исследования индукцию CDC можно установить на прикрепленных клетках. В одном варианте осуществления этого метода анализа клетки высевают за 24 часа до исследования с плотностью 3×104/лунку в плоскодонные титрационные микропланшеты для культур тканей. На следующий день ростовую среду удаляют и клетки инкубируют с антителами (три повтора). Контрольные клетки инкубируют в ростовой среде или ростовой среде, содержащей 0,2% сапонина для определения фонового лизиса и максимального лизиса, соответственно. После инкубации в течение 20 минут при комнатной температуре супернатант удаляют и добавляют к клеткам 20% (об./об.) человеческой плазмы или сыворотки в DMEM (предварительно нагретой до 37°С) и инкубируют в течение следующих 20 минут при 37°С. К клеткам каждого образца добавляют раствор пропидий иодида (10 мкг/мл). Затем супернатанты заменяют PBS, содержащим 2,5 мкг/мл этидиум бромида, и измеряют испускание флуоресценции после возбуждения при 520 нм при 600 нм с помощью Tecan Satire. Процент специфического лизиса вычисляют, как указано далее: процент специфического лизиса = (флуоресценция образца - фоновая флуоресценция) / (флуоресценция при максимальном лизисе - фоновая флуоресценция)×100.
Индукция апоптоза и ингибирование клеточной пролиферации моноклональными антителами
Например, чтобы проверить способность моноклональных анти-CLDN18.2 антител инициировать апоптоз, их инкубируют с опухолевыми клетками, положительными по CLDN18.2, например, SNU-16, DAN-G, KATO-III или CLDN18.2-трансфицированными опухолевыми клетками при 37°С в течение 20 часов. Клетки собирают, промывают в аннексин-V связывающем буфере (BD biosciences) и инкубируют с аннексином V, соединенным с FITC или АРС (BD biosciences), в течение 15 минут в темноте. Ко всем клеткам каждого образца добавляют раствор PI (10 мкг/мл в PBS) в пробирку для FACS-анализа и сразу оценивают с помощью проточной цитометрии (как описано выше). Альтернативно, общее ингибирование клеточной пролиферации моноклональными антителами можно определить с помощью коммерчески доступных наборов. С помощью набора для определения клеточной пролиферации DELFIA (Perkin-Elmer, Cat. No. AD0200) можно провести неизотопный иммуноанализ в микропланшетах, основанный на измерении включения 5-бром-2'-дезоксиуридина (BrdU) во время синтеза ДНК пролиферирующими клетками. Включенный BrdU определяют с помощью меченных европием моноклональных антител. Чтобы сделать возможным обнаружение антител, клетки фиксируют и проводят денатурацию ДНК, используя Fix (фиксирующий) раствор. Несвязанные антитела смывают и добавляют в раствор индуктор DELFIA, чтобы отделить ионы европия от меченых антител, где они образуют высокофлуоресцентные хелаты с компонентами индуктора DELFIA. Флуоресценция, измеренная в каждой лунке с помощью флуориметрии с временным разрешением, является пропорциональной синтезу ДНК в клетке.
Доклинические исследования
Моноклональные антитела, которые связываются с CLDN18.2, также могут быть проверены на модели in vivo (например, на иммунодефицитных мышах с ксенотрансплантатами опухолей, инокулированных клеточными линиями, экспрессирующими CLDN18.2, например DAN-G, SNU-16 или KATO-III, или после трансфекции, например, HEK293) для установления их эффективности при контролировании роста CLDN18.2-экспрессирубщих опухолевых клеток.
Исследование антител изобретения in vivo можно провести после ксенотрансплантации опухолевых клеток, экспрессирующих CLDN18.2, иммунодефицитным мышам или другим животным. Чтобы определить действие антител на предотвращение образования опухолей или симптомов, связанных с опухолью, антитела можно ввести мышам, свободным от опухоли, с последующей инъекцией опухолевых клеток. Чтобы установить терапевтическую эффективность соответствующих антител в отношении уменьшения опухолевого роста или симптомов, связанных с опухолью, антитела можно ввести мышам-опухоленосителям. Применение антител можно комбинировать с применением других веществ, таких как цитостатические средства, ингибиторы факторов роста, блокаторы клеточного цикла, ингибиторы ангиогенеза или другими антителами, чтобы определить синергическую эффективность и потенциальную токсичность комбинаций. Чтобы проанализировать токсичные побочные явления, опосредованные антителами, животным можно инокулировать антитела или контрольные реагенты и тщательно изучить симптомы, возможно связанные с терапией антителами к CLDN18.2. В частности, возможные побочные явления от применения in vivo CLDN18.2-антител включают токсическое влияние на ткани, экспрессирующие CLDN18.2, включая желудок. Антитела, распознающие CLDN18.2 у человека и у других видов, например мышей, являются, в частности, пригодными для предсказания возможных побочных явлений, опосредованных применением моноклональных CLDN18.2 - антител, у людей.
Картирование эпитопов, распознаваемых антителами, можно провести, как подробно описано в "Epitope Mapping Protocols (Methods in Molecular Biology) by Glenn E. Morris ISBN-089603-375-9 и в "Epitope Mapping: A Practical Approach" Practical Approach Series, 248 by Olwyn M.R. Westwood, Frank C. Hay.
Соединения и средства, описанные в данном документе, могут быть введены в виде любой подходящей фармацевтической композиции.
Фармацевтические композиции в большинстве случаев предоставляются в стандартной лекарственной форме и могут быть получены хорошо известным способом. Например, фармацевтическая композиция может иметь форму раствора или суспензии.
Фармацевтическая композиция может содержать соли, буферные вещества, консервирующие вещества, носители, разбавители и/или эксципиенты, все из которых предпочтительно являются приемлемыми с точки зрения фармацевтики. Термин "фармацевтически приемлемый" относится к нетоксичному веществу, которое не вмешивается в действие активного компонента фармацевтической композиции.
Соли, не являющиеся фармацевтически приемлемыми, могут использоваться для получения фармацевтически приемлемых солей и включаются в изобретение. Фармацевтически приемлемые соли этого типа включают, без ограничения, соли, полученные из следующих кислот: хлористоводородной, бромистоводородной, серной, азотной, фосфорной, малеиновой, уксусной, салициловой, лимонной, муравьиной, малоной, янтарной и тому подобных. Фармацевтически приемлемые соли также могут быть получены в виде солей щелочных или щелочноземельных металлов, таких как соли натрия, соли калия и соли кальция.
Подходящие для использования в фармацевтической композиции буферные вещества включают уксусную кислоту в виде соли, лимонную кислоту в виде соли, борную кислоту в виде соли и фосфорную кислоту в виде соли.
Подходящие для использования в фармацевтической композиции консервирующие вещества включают бензалкония хлорид, хлорбутанол, парабен и тимеросал.
Предназначенная для инъекций композиция может содержать фармацевтически приемлемый эксципиент, такой как лактат Рингера.
Термин "носитель" имеет отношение к органическому или неорганическому компоненту, природного или синтетического происхождения, с которым активный компонент объединяется, для того чтобы облегчить, усилить или способствовать применению. Согласно изобретению термин "носитель" также включает один или более совместимых твердых или жидких наполнителей, разбавителей или инкапсулирующих веществ, пригодных для введения пациенту.
Приемлемыми для парентерального введения веществами-носителями являются, например, стерильная вода, раствор Рингера, лактат Рингера, стерильный раствор хлорида натрия, полиалкиленгликоли, гидрогенезированные нафталины и, в частности, биологически совместимые полимеры лактида, сополимеры лактида с гликолидом или сополимеры полиоксиэтилена с полиоксипропиленом.
Использованный в описании термин "эксципиент" означает все вещества, которые могут присутствовать в фармацевтической композиции и не являются активными ингредиентами, такие как, например, носители, связывающие вещества, смазывающие вещества, сгущающие вещества, поверхностно-активные вещества, консервирующие вещества, эмульгирующие вещества, буферные вещества, ароматизирующие вещества или красители.
Средства и композиции, описанные в данном документе, могут вводиться любым обычным способом, например парентеральным путем, включая инъекцию или инфузию. Предпочтительно введение осуществляется парентерально, например внутривенно, внутриартериально, подкожно, внутрикожно или внутримышечно.
Композиции, пригодные для парентерального введения, обычно включают стерильные водные или неводные препараты активного соединения, предпочтительно изотонические относительно крови реципиента. Примерами совместимых носителей и растворителей являются раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные, жирные масла используются в качестве среды для раствора или суспензии.
Средства и композиции, описанные в данном документе, вводятся в эффективных количествах. "Эффективное количество" относится к количеству, с помощью которого достигается желательная реакция или желательный эффект отдельно или в сочетании с дополнительными дозировками. В случае лечения конкретной болезни или конкретного состояния желательная реакция предпочтительно имеет отношение к ингибированию развития болезни. Сюда включается замедление развития болезни и, в частности, прерывание или обратное развитие болезни. Желательной реакцией при лечении болезни или состояния также может быть задержка начала или предотвращение начала указанной болезни или указанного состояния.
Эффективное количество средства или композиции, описанной в данном документе, будет зависеть от состояния, которое необходимо лечить, тяжести заболевания, индивидуальных характеристик пациента, включая возраст, физиологическое состояние, размер и вес, продолжительность лечения, тип сопутствующего лечения (если оно имеется), конкретный способ введения и подобные факторы. Соответственно, вводимые дозировки описанных здесь средств могут зависеть от тех или иных подобных характеристик. В том случае, когда ответ пациента является недостаточным при использовании первоначальной дозировки, могут использоваться более высокие дозы (или эффективно более высокие дозы достигаются с помощью другого более локального способа введения).
Средства и композиции, описанные в этом документе, могут вводиться пациентам, например, in vivo, для лечения или предотвращения целого ряда заболеваний, таких как описанные здесь. Предпочтительными пациентами являются люди, имеющие заболевания, которые могут быть исправлены или улучшены введением средств и композиций, описанных здесь. Сюда включаются заболевания, затрагивающие клетки, которые характеризуются измененным профилем CLDN18.2.
Например, в одном варианте осуществления описанные здесь антитела могут использоваться для лечения пациента с раковой болезнью, например раковой болезнью, как описано здесь, отличающейся наличием раковых клеток, экспрессирующих CLDN18.2.
Фармацевтические композиции и способы лечения, описанные в соответствии с изобретением, также могут использоваться для иммунизации или вакцинации с целью предотвращения описанной здесь болезни.
Настоящее изобретение дополнительно иллюстрируется следующими примерами, которые не следует рассматривать как ограничивающие рамки изобретения.
ПРИМЕРЫ
Пример 1: Экспрессия CLDN18.2 в линии клеток рака желудка человека стабилизируется при обработке химиотерапевтическими препаратами in vitro
Клетки KatoIII, линия клеток рака желудка человека, культивировали в среде RPMI 1640 (Invitrogen), содержащей 20% FCS (Perbio) и 2 мМ Glutamax (Invitrogen) при 37°С и 5%) СО2 с или без цитостатических соединений. Эпирубицин (Pfizer) был проверен при концентрации 10 или 100 нг/мл, 5-FU (Neofluor от компании NeoCorp AG) был проверен при концентрации 10 или 100 нг/мл, и оксалиплатин (Hospira) был проверен при концентрации 50 или 500 нг/мл. Также использовали комбинацию всех 3 соединений (EOF; эпирубицин 10 нг/мл, оксалиплатин 500 нг/мл, 5-FU 10 нг/мл). 8×105 клеток KatoIII культивировали в течение 96 часов, не меняя среду, или в течение 72 часов с последующим культивированием в течение 24 часов в стандартной среде, чтобы «высвободить» клетки из остановки клеточного цикла, в 6-луночных культуральных планшетах при 37°С, 5% CO2. Клетки собирали, используя EDTA/трипсин, промывали и исследовали.
Для обнаружения внеклеточного CLDN18.2 клетки окрашивали моноклональными анти-CLDN18.2 антителами IMAB362 (Ganymed) или родственными по изотипу контрольными антителами (Ganymed). В качестве вторичного реагента использовали козьи-анти-huIgG-APC от компании Dianova.
Определение стадий клеточного цикла основывалось на измерении содержания ДНК в клетках. Это давало возможность различить клетки, находящиеся в фазах G1, S или G2 клеточного цикла. В S-фазе происходит удвоение ДНК, тогда как в G2-фазе клетки растут и готовятся к митозу. Анализ клеточного цикла был сделан с использованием набора CycleTEST PLUS DNA Reagent от компании BD Biosciences в соответствии с протоколом производителя. Проточную цитометрию и ее анализ проводили с помощью программного обеспечения BD FACS CantoII (BD Biosciences) и FlowJo (Tree Star).
Столбцы на фигуре 1a и b показывают соответствующий процент клеток в G1-, S-или G2-фазе клеточного цикла. Клетки KatoIII, культивированные в среде, демонстрируют остановку клеточного цикла преимущественно в G1-фазе. Клетки, обработанные 5-FU, преимущественно блокируются в S-фазе. Клетки KatoIII, обработанные эпирубицином или EOF, демонстрируют остановку клеточного цикла преимущественно в G2-фазе. При обработке клеток оксалиплатином наблюдается накопление клеток преимущественно в G1- и G2-фазах. Как видно на фигуре 1с, остановка клеточного цикла в S-фазе или G2-фазе приводит к стабилизации или повышению экспрессии CLDN18.2. Сразу после того, как клетки выходят из какой-либо фазы клеточного цикла (фигура 1b), экспрессия CLDN18.2 на клеточной поверхности клеток KatoIII повышается (фигура 1d).
Клетки NUGC-4 и KATO III обрабатывали 5-FU + ОХ (10 нг/мл 5-FU и 500 нг/мл оксалиплатина), EOF (10 нг/мл эпирубицина, 500 нг/мл оксалиплатина и 10 нг/мл 5-FU) или FLO (10 нг/мл 5-FU, 50 нг/мл фолиновой кислоты и 500 нг/мл оксалиплатина) в течение 96 часов. РНК предварительно обработанных химиотерапевтическими препаратами NUGC-4 и KATO III клеток была выделена и преобразована в кДНК. Уровень CLDN18.2 транскрипта анализировали с помощью количественной ПЦР в реальном времени. Результаты показаны на фигуре 2а в виде относительной экспрессии в сравнении с уровнем транскрипта конститутивного гена HPRT. На фигуре 2b показан вестерн-блоттинг CLDN18.2 и «нагруженных» актином контрольных необработанных и обработанных клеток NUGC-4. Интенсивность сигнала люминесценции показана в процентах относительно актина.
Предварительная обработка NUGC-4 и KATO III клеток EOF, FLO, а также комбинацией 5-FU + ОХ химиотерапевтических препаратов приводила к увеличению уровней РНК и белка CLDN18.2, что показано с помощью количественной ПЦР в реальном времени (фигура 2а) и вестерн-блоттинга (фигура 2b).
Связывание IMAB362 на NUGC-4 и KATO III клетках рака желудка, обработанных EOF (10 нг/мл эпирубицина, 500 нг/мл оксалиплатина и 10 нг/мл 5-FU) или FLO (10 нг/мл 5-FU, 50 нг/мл фолиновой кислоты и 500 нг/мл оксалиплатина) в течение 96 часов анализировали с помощью проточной цитометрии. Наблюдалось повышение количества белка CLDN18.2, на который нацеливается IMAB362 на поверхности клеток рака желудка, как видно на фигуре 2с. Этот эффект наиболее выражен на клетках, предварительно обработанных EOF или FLO.
Клетки KatoIII предварительно обрабатывали в течение 4 дней иринотеканом или доцетакселем и анализировали экспрессию CLDN18.2 и остановку клеточного цикла. Обработка клеток иринотеканом приводила к зависящему от дозы ингибированию клеточного роста и остановке клеточного цикла в S/G2-фазе (фигура 3). Обработка клеток доцетакселем приводила к дозозависимому ингибированию клеточного роста и остановке клеточного цикла в G2-фазе (фигура 3).
Пример 2: Предварительная обработка клеток рака желудка человека химиотерапевтическими препаратами дает в результате более высокую эффективность IMAB362-опосредованного ADCC
IMAB362-опосредованный ADCC изучали, используя в качестве мишеней клетки рака желудка NUGC-4, которые предварительно обрабатывали 10 нг/мл 5-FU и 500 нг/мл оксалиплатина (5-FU + ОХ), 10 нг/мл эпирубицина, 500 нг/мл оксалиплатина и 10 нг/мл 5-FU (EOF) или 10 нг/мл 5-FU, 50 нг/мл фолиновой кислоты и 500 нг/мл оксалиплатина (FLO) в течение 96 часов (отношение эффектор: мишень 40:1) или ничем не обрабатывали. Значения ЕС50 были получены от 7 здоровых доноров для необработанных и предварительно обработанных EOF, FLO или 5-FU + ОХ клеток NUGC-4.
Как показано на фигуре 4а, кривая зависимости доза-эффект в отношении предварительно обработанных клеток сдвинута вверх и влево по сравнению с необработанными клетками-мишенями. В результате этого наблюдался более высокий максимальный лизис и уменьшение значений ЕС50 до одной трети значения необработанных клеток (фигура 4b).
Мононуклеарные клетки периферической крови (PBMCs), включая NK-клетки, моноциты, мононуклеарные клетки или другие эффекторные клетки от здоровых людей-доноров выделяли центрифугированием в градиенте плотности фиколл-гипака. Промытые эффекторные клетки высевали в Х-Vivo среду. При такой постановке задачи в качестве клеток-мишеней использовали KatoIII клетки гастрального происхождения, эндогенно экспрессирующие CLDN18.2. Только живые клетки окисляют люцифер желтый с помощью фермента люциферазы, который стабильно экспрессируется клетками-мишенями. Очищенное анти-CLDN18.2 антитело IMAB362 добавляли в разных концентрациях, а в качестве изотипического контрольного антитела использовали нерелевантное химерное huIgG1 антитело. Цитолиз в образцах оценивали путем измерения люминесценции, являющейся результатом окисления люцифера желтого, что является показателем количества живых клеток, оставшихся после IMAB362-индуцированной цитотоксичности. KatoIII клетки, предварительно обработанные в течение 3 дней иринотеканом (1000 нг/мл), доцетакселем (5 нг/мл) или цисплатином (2000 нг/мл), сравнивали с клетками-мишенями, культивированными в среде без обработки препаратами, и оценивали IMAB362-индуцированный ADCC.
При предварительной обработке в течение 3 дней иринотеканом, доцетакселем или цисплатином клеток KatoIII наблюдался более низкий уровень живых клеток по сравнению с клетками-мишенями, культивированными в среде (фигура 5а), при этом экспрессия клаудина 18.2 в клетках, предварительно обработанных иринотеканом, доцетакселем или цисплатином, была повышена по сравнению с клетками, культивированными в среде (фигура 5b).
Кроме того, предварительная обработка клеток KatoIII иринотеканом, доцетакселем или цисплатином увеличивала потенциальную возможность IMAB362 вызывать ADCC (фигура 5с, d).
Пример 3: Химиотерапия приводит к более высокой эффективности IMAB362-индуцированного CDC
Эффекты химиотерапевтических средств на IMAB362-индуцированный CDC исследовали с помощью предварительной обработки клеток рака желудка KatoIII комбинацией 5-FU 10 нг/мл и оксалиплатина 500 нг/мл (5-FU + ОХ) в течение 48 часов. Типичные кривые доза-эффект IMAB362-индуцированного CDC с использованием предварительно обработанных химиотерапевтическими препаратами клеток KatoIII показаны на фигуре 6. Предварительная обработка опухолевых клеток в течение 48 часов увеличивала потенциальную возможность IMAB362 вызывать CDC, что приводило к более высокому максимальному лизису предварительно обработанных опухолевых клеток по сравнению с необработанными клетками.
Пример 4: Способность иммунных эффекторных клеток осуществлять IMAB362-опосредованный ADCC не нарушается обработкой химиотерапевтическими препаратами
Химиотерапевтические средства, использованные в режимах EOF или FLO, являются сильнодействующими при ингибировании пролиферации клеток-мишеней. Для изучения отрицательного действия химиотерапии на эффекторные клетки, РВМС от здоровых доноров обрабатывали 10 нг/мл эпирубицина, 500 нг/мл оксалиплатина и 10 нг/мл 5-FU (EOF) или 10 нг/мл 5-FU, 50 нг/мл фолиновой кислоты и 500 нг/мл оксалиплатина (FLO) в течение 72 часов до проведения ADCC-анализов. Фигура 7а показывает значения ЕС50 4х здоровых доноров, а фигура 7b показывает характерные кривые зависимости доза-эффект IMAB362-индуцированного ADCC с использованием эффекторных клеток, предварительно обработанных EOF или FLO. IMAB362-индуцированный ADCC клеток рака желудка NUGC-4 не нарушается в связи с химиотерапией EOF или FLO.
Пример 5: Комбинация обработки ZA/IL-2 приводит к оптимизированному увеличению культивированных мононуклеарных клеток периферической крови (РВМС)
Действие ZA/IL-2 на пролиферацию культивируемых РВМС была оценена in vitro. РВМС получали от здоровых людей-доноров, и культуры обрабатывали однократной дозой ZA. IL-2 добавляли каждые 3-4 дня. Конкретно, полученные от 3 разных здоровых доноров РВМС (#1, #2, #3) культивировали в среде RPMI (1×106 клеток/мл) в течение 14 дней с 1 мкМ ZA плюс высокая (300 U/мл) или низкая (25 U/мл) доза IL-2; см. фигуру 8а. РВМС одних и тех же доноров культивировали дополнительно в среде RPMI в течение 14 дней с 300 U/мл IL-2 плюс ZA или без ZA; см. фигуру 8b. Увеличение количества клеток определяли, подсчитывая живые клетки в дни 6, 8, 11 и 14.
В среде с добавлением высокой дозы IL-2 количество клеток увеличивалось примерно в 2-5 раз по сравнению с культурами с добавлением низкой дозы IL-2 (фигура 8а). Рост клеток в среде без ZA был приблизительно в 2 раза ниже по сравнению с клетками, растущими в среде с ZA (фигура 8b). Эти результаты показывают необходимость использования двух соединений ZA и IL-2 в комбинации для обеспечения надлежащего размножения клеток.
Пример 6: Обработка ZA/IL-2 приводит к повышенному росту Vγ9Vδ2 Т-клеток в РВМС-культурах
РВМС культивировали в течение 14 дней в среде RPMI с добавлением 300 U/мл IL-2 и с или без 1 мклМ ZA. Процент Vγ9+Vδ2+ Т-клеток в пределах популяции лимфоцитов CD3+ (фигура 9а) и процент CD16+ клеток в пределах CD3+Vγ9+Vδ2+ Т-клеточной популяции (фигура 9b) определяли с помощью многоцветного FACS-анализа в дни 0 и 14. Результаты для каждого донора оценивали в диаграмме рассеяния. На фигуре 9 с представлена диаграмма рассеяния, показывающая увеличение в течение времени (обогащение) количества CD3+ Vγ9+Vδ2+ и CD3+CD16+ Vγ9+Vδ2+ Т-клеток в пределах популяции лимфоцитов. Учитывали количество клеток, высеянных в день 0, и количество клеток, собранных в 14 день.
Добавление IL-2 в РВМС-культуры необходимо для выживания и роста лимфоцитов. Они эффективно растут в культурах с добавлением 300 U/мл IL-2. FACS-анализ с использованием Vγ9 и Vδ2 специфических антител показал, что добавление ZA/IL-2 специфически вызывает накопление Vγ9Vδ2 Т-клеток (фигура 9а). Через 14 дней CD3+ популяция лимфоцитов может содержать до 80% Vγ9Vδ2 Т-клеток. Часть Vγ9Vδ2 Т-клеток экспрессирует CD16, тогда как обогащение этих клеток в пределах CD3+ популяции лимфоцитов является 10-700-кратным в зависимости от донора (фигуры 9b и 9с). Обогащение CD16+Vγ9+Vδ2+ Τ клеток в культурах в 10-600 раз выше по сравнению с культурами, растущими без ΖΑ (фигура 9с). Мы сделали вывод, что обработка ZA/IL-2 PBMCs in vitro приводит к усилению экспрессии ADCC-опосредующего FcγIII рецептора CD16 в значительной части γδ Т-клеток.
Пример 7: IL-2 влияет на рост Vγ9Vδ2 Т-клеток дозозависимым образом
Добавление ΖΑ в культуры является наиболее важным фактором стимулирования развития Vγ9Vδ2 Т-клеток. Хорошо известно, что для роста и выживания Т-клеток требуется IL-2.
РВМС культивировали в течение 14 дней в среде RPMI с добавлением 1 мкМ ZA и возрастающих концентраций IL-2. IL-2 добавляли в дни 0 и 4. Обогащение CD16+Vγ9+Vδ2+ Т-клеток в пределах популяции лимфоцитов CD3+ определяли с помощью многоцветного FACS анализа в дни 0 и 14. Для сравнения разных доноров количество CD16+Vγ9+Vδ2+ Т-клеток, собранных после культивирования с 600 U/мл IL-2, было взято за 100%; см. Фигуру 10, слева. Кроме того, была проверена ADCC-активность изолированных культур, выращенных за 14 дней в увеличивающихся концентрациях IL-2; см. фигуру 10, справа.
Проведение дозозависимого анализа подтвердило, что IL-2 также стимулируют рост и выживаемость подгруппы Vγ9Vδ2 Т-клеток. При добавлении низких концентраций IL-2 в среду была обнаружена корреляция между дозой IL-2 и процентом CD16+Vγ9Vδ2 Т-клеток в пределах популяции лимфоцитов CD3+ (фигура 10, слева). ADCC-активность клеток, выращенных при более высоких концентрациях IL-2 (150-600 U/мл), лучше по сравнению с клетками, выращенными при низких концентрациях IL-2 (фигура 10, справа).
Пример 8: ZA вызывает выработку IPP в моноцитах и раковых клетках, стимулируя увеличение Vγ9Vδ2 Т-клеток
Свежие PBMCs (Exp. #1) или 14-дневные, стимулированные ZA/IL-2 культуры Vγ9Vδ2 Т-клеток (Ехр. #2-5), инкубировали или без моноцитов (отношение эффектор: моноцит 1:0), с 0.2-кратным (4:1), или 5-кратным (отношение 1:4) количеством моноцитов ± 1 мкМ ZA. Увеличение Vγ9Vδ2 Т-клеток в совместных культурах через 14 дней определяли с помощью многоцветного FACS-анализа, при этом увеличение культуры учитывали при подсчете. Коэффициент обогащения Vγ9Vδ2 Т-клеток, культивированных с моноцитами в соотношении 1:4, был взят за 100% для каждого эксперимента. Увеличение моноцитов в культуре приводило к обогащению Vγ9Vδ2 Т-клеток более чем в 10 раз. Этот эффект был явно ZA-зависимым; см. фигуру 11а.
Кроме того, клетки рака желудка человека (NUGC-4-люцифераза) и мышиные клетки рака желудка (окрашенные кальцеином CLS103) были предварительно обработаны с или без 5 мкМ ZA в течение 2 дней. Человеческие Vγ9Vδ2 Т-клетки, выделенные с помощью MACS (день 14), совместно культивировали с раковыми клетками в течение 24 часов. Цитотоксичность Vγ9Vδ2 Т-клеток по отношению к необработанным и ZA-обработанным клеткам-мишеням определяли путем измерения оставшейся активности люциферазы или флуоресценции кальцеина; см. фигуру 11b. Клетки-мишени (NUGC-4 и CLS103) предварительно обрабатывали с или без 5 мкМ ZA в течение 2 дней и потом инкубировали в течение 4 часов с митомицином С (50 MI) для остановки пролиферации. MACS-очищенные человеческие 14-дневные находящиеся в покое Vγ9Vδ2 Т-клетки и3Н-тимидин добавили к клеткам-мишеням и совместные культуры инкубировали в течение 48 часов при 37°С. Пролиферацию определяли, измеряя включение3Н тимидина в ДНК с помощью сцинтилляционного счетчика MicroBeta. Пролиферация клеток-мишеней, не обработанных ZA и без Vγ9Vδ2 Т-клеток, была принята за 100%; см. фигуру 11с.
Как видно на фигурах 11b и 11с, ZA-активированные клетки рака человека активировали Vγ9Vδ2 Т-клетки, имея в виду цитотоксичность (5-10 раз) и пролиферацию (1,4-1,8 раз), тогда как линия раковых клеток мыши CLS103 не оказывала таких воздействий на Vγ9Vδ2 Τ- клетки.
Пример 9: Обработка ZA/IL-2 влияет на состав культур РВМС
Рост и дифференцировка специфических типов клеток в РВМС культурах зависит от присутствия цитокинов. Эти компоненты или добавляют к среде (например, факторы роста, присутствующие в сыворотке, IL-2), или их секретируют сами иммунные клетки. Какой тип клеток развивается, также зависит от исходного состава PBMCs и генетической базы. Чтобы проанализировать общее увеличение эффекторных клеток (NK клетки и Vγ9Vδ2 Т-клетки), РВМС 10 разных доноров выращивали в присутствии 300 U/мл IL-2 вместе с или без 1 мкМ ΖΑ в течение 14 дней. Количество эффекторных клеток в популяции лимфоцитов было установлено с помощью многоцветного FACS окрашивания с использованием CD3, CD16, CD56, Vγ9 и Vδ2 антител. CD3-CD56+CD16+ клетки представляют NK-клетки, и CD3+Vγ9+Vδ2+ представляют Vγ9Vδ2 Т-клетки.
Многоцветный FACS-анализ показал, что после обработки IL-2 развиваются в основном NK-клетки, тогда как в культурах, обработанных ZA/IL-2, преимущественно увеличивается количество Vγ9Vδ2 Т-клеток (фигура 12).
Пример 10: ZA/IL-2 обработка порождает Vγ9Vδ2+ эффекторные клетки памяти
Субпопуляции Τ лимфоцитов могут быть разграничены с помощью двух поверхностных маркеров, изоформы с высоким молекулярным весом антигена лимфоцитов CD45RA и рецептора хемокинов CCR7. CCR7+ наивные и Т-клетки центральной памяти (СМ) отличаются способностью многократно циркулировать в лимфатические узлы и наталкиваться на антиген. В противоположность этому, эффекторные клетки памяти (ЕМ) и эффекторные Т-лимфоциты RA+ (TEMRA) подавляют CCR7 и, по-видимому, специализируются в миграции к периферическим нелимфоидным тканям, например в инфицированные участки или опухолевые участки. Клетки ЕМ можно дополнительно подразделить, исходя из характерной CD27 и CD28 экспрессии. Прогрессирующая потеря CD28 и CD27 поверхностной экспрессии сопровождается активизацией цитолитической способности клеток. Кроме того, уровень CD57 коррелирует с экспрессией гранзимов и перфоринов и таким образом представляет собой третий маркер, показывающий цитотоксичность/созревание клетки.
РВМС культивировали с или без 1 мкМ ZA и 300 U/мл IL-2 в течение 14 дней. Экспрессию различных поверхностных маркеров определяли с помощью многоцветного FACS-анализа на день 0 (PBMCs) и день 14. Наивные клетки являются CD45RA+ CCR7+, клетки центральной памяти (СМ) являются CD45RA- CCR7+, TEMRA являются CD45RA+ CCR7-, и эффекторные клетки памяти (ЕМ) являются отрицательными в отношении обоих маркеров; см. фигуру 13а. Кроме того, цитолитическая активность Vγ9Vδ2 Т-клеток была определена окрашиванием в отношении CD27 и CD57 маркеров; см. фигуру 13b, с. В дополнение к этому, развитие NK-подобных свойств, важных для ADCC-активности, было проанализировано окрашиванием CD3+ клеток CD16 (связывание антитела) и CD56 (адгезия); см. фигуру 13d.
Многоцветный FACS-анализ Vγ9Vδ2 Т-клеток показал, что ZA/IL-2 обработка явно стимулирует развитие Vγ9Vδ2 Т-клеток ЕМ типа, которые представляют собой CD27- и CD57+ (фигура 13b-с). В дополнение к увеличенной цитолитической активности в популяции CD3+ наблюдалось увеличение уровня CD16 и CD56, которые, как известно, происходят от NK-клеток (CD3-CD16+CD56+) и являются вовлеченными в ADCC, (фигура 13d).
Взятые вместе, эти данные означают, что ZA-обработка PBMCs приводит к развитию CD16+Vγ9+Vδ2+ эффекторных клеток памяти, которые способны мигрировать к периферическим нелимфоидным тканям и которые демонстрируют маркеры высокой цитолитической активности. В комбинации с IMAB362, нацеленными на опухоль антителами, эти клетки являются очень хорошо приспособленными для того, чтобы мигрировать, нацеливаться и уничтожать опухолевые клетки.
Пример 11: выращенные в присутствии ZA/IL-2 Vγ9Vδ2 Т-клетки являются сильными эффекторами для IMAB362-опосредованного CLDN18.2-зависимого ADCC
Подобно NK-клеткам, выращенные в присутствии ZA/IL-2 Vγ9Vδ2 Т-клетки являются положительными в отношении CD16 (смотри фигуры 9 и 13), рецептор FcγRIII, через который антитело, связанное с клеткой, запускает ADCC. Чтобы оценить, способны ли Vγ9Vδ2 Т-клетки вызывать сильный ADCC в сочетании с IMAB362, была проведена серия экспериментов.
РВМС, полученные от 2 разных доноров (#1 и #2), культивировали в среде с 300 U/мл IL-2 и с или без 1 мкМ ZA. Через 14 дней клетки собирали и добавляли увеличивающиеся концентрации (0,26 нг/мл - 200 мкг/мл) IMAB362 к NUGC-4 клеткам, экспрессирующим CLDN18.2. Специфическое уничтожение определяли с помощью люциферазного анализа; см. фигуру 14а. Фигура 14b, с дает общее представление о ADCC-анализах, проведенных с использованием клеток от 27 доноров, выросших в 300 U/мл IL-2 и с или без ZA. NUGC-4 служили клетками-мишенями. Для каждого донора значения ЕС50 (b) вычисляли из дозозависимых кривых, и уровни максимального специфического уничтожения в дозе от 200 мкг/мл IMAB362 (с) отмечали в диаграммах рассеяния.
Сильная IMAB362-зависимая ADCC активность наблюдалась в отношении CLDN18.2-положительных NUGC-4 клеток при использовании РВМС, культивированных в течение 14 дней с ZA/IL-2 (фигура 14а). При использовании ZA/IL-2-обработанных РВМС культур ADCC зависит от присутствия Vγ9Vδ2 Т-клеток (фигуры 12 и 15). Если клетки культивировали без ZA, ADCC активность понижалась в культурах от большинства доноров. В этих культурах остаточная ADCC-активность является зависящей от NK-клеток (фигуры 11 и 14). При тестировании более 20 доноров ADCC-анализ показал, что ZA/IL-2 обработка PBMCs улучшает ЕС50 и уровень максимального специфического уничтожения по сравнению с РВМС, культивированными только с IL-2.
Кроме того, РВМС двух разных доноров (#1 + #2) культивировали с 1 мкМ ZA и 300 U/мл IL-2. Эти культуры эффекторных клеток использовали в ADCC-анализах с использованием CLDN18.2-положительных (NUGC-4, Kato III) и отрицательных (SK-BR-3) линий клеток-мишеней человека (Е:Т отношение 40:1). Были добавлены увеличивающиеся количества (0,26 нг/мл - 200 мкг/мл) IMAB362 антител. ADCC измеряли, используя люциферазный метод; см. фигура 15а. Такой же эксперимент, как описанный в (а), был проведен с NUGC-4 клетками-мишенями и эффекторными клетками, собранными из культур, обработанных ZA/IL-2 в разные моменты времени; см. фигуру 15b. Такой же эксперимент, как описанный в (а), был проведен с использованием NUGC-4 в качестве клеток-мишеней; см. фигуру 15с. Выращенные в присутствии ZA/IL-2 клетки или использовали непосредственно, или Vγ9Vδ2 Т-клетки были выделены из культур с использованием TCRγδ MACS сортировки (Miltenyi Biotech). Степень чистоты Vγ9Vδ2 Т-клеток в лимфоцитах составляла более чем 97,0%.
Наблюдалась сильная ADCC активность в отношении CLDN18.2-положительных линий опухолевых клеток человека, но не наблюдалась в отношении CLDN18.2-отрицательных линий опухолевых клеток (фигура 15а). Кроме того, не была обнаружена ADCC-активность при использовании изотипических контрольных антител (не показано). В процессе ZA/IL-2 обработки ADCC литическая активность увеличивается в течение времени для фракции доноров (фигура 15b). Кривая доза-эффект IMAB362 сдвигается вверх и влево, показывая лучшие значения ЕС50 и уровни максимального лизиса с течением времени. По сравнению с необработанными РВМС, Vγ9Vδ2 эффекторные Т-клетки, обогащенные с помощью ZA/IL-2обработки, способны достигать более высокого уровня уничтожения CLDN18.2-положительных клеток-мишеней, кроме того, они требуют более низких концентраций IMAB362 для того же самого уровня уничтожения.
Чтобы подтвердить, что Vγ9Vδ2 Т-клетки являются резервуаром литической активности, эти клетки изолировали со степенью чистоты >97% с помощью магнитной сортировки клеток из популяций РВМС, культивированных с ZA/IL-2, на 14 день. ADCC-активность в сочетании с IMAB362 сохраняется и отчасти улучшается вследствие более высокой чистоты. Эти результаты подтверждают, что Vγ9Vδ2 Т-клетки несут основную ответственность за ADCC-активность, исследованную при использовании 14-дневных РВМС культур (фигура 15с).
Пример 12: ZA/IL-2-обработка линий клеток-мишеней не влияет на поверхностную экспрессию CLDN18.2
Инициированные IMAB362 механизмы действия строго зависят от присутствия и количества внеклеточного обнаружимого CLDN18.2. Поэтому влияние обработки ZA/IL-2 на плотность CLDN18.2 на поверхности было проанализировано с помощью проточной цитометрии с использованием клеточных линий NUGC-4 и Kato III с эндогенной экспрессией CLDN18.2. В частности, был проведен проточный цитометрический анализ связывания IMAB362 на непермеабилизированных клетках NUGC-4 рака желудка, предварительно обработанных ZA/IL-2 или ZA/IL-2+EOF или ZA/IL-2+5-FU/OX в течение 72 часов.
ZA/IL-2 обработка in vitro не вызывает изменения количества поверхностно локализованного CLDN18.2; см. фигуру 16.
Пример 13: Увеличение ADCC, опосредованного IMAB362, с помощью ZA/IL-2-обработки РВМС не нарушается предварительной обработкой EOF
Химиотерапевтические средства нарушают пролиферацию клеток. В противоположность этому ZA/IL2-обработка инициирует увеличение количества Vγ9Vδ2 Т-клеток. Чтобы проанализировать влияние этих противоположных воздействий на эффекторные клетки, РВМС от 6 здоровых доноров культивировали с ZA/IL-2 или ZA/IL-2+EOF в течение 8 дней до использования в ADCC-анализах (Е:Т отношение 15:1). Были определены IMAB362 концентрации, приводящие к 50% ADCC-опосредованному лизису необработанных NUGC-4 клеток-мишеней (ЕС50).
Значительного изменения (прироста) ADCC, вызванного IMAB362, NUGC-4-клеток вследствие обработки РВМС ZA/IL-2 не наблюдается при комбинированной обработке с EOF (фигура 17).
Пример 14: In vivo нацеливание IMAB362 на CLDN18.2-положительные опухоли и противоопухолевые эффекты IMAB362 на ксенотрансплантатах опухолевых клеток на «голых» мышах
Для исследования in vivo IMAB362-нацеливания на опухолевые клетки 80 мкг Dyelight® 680-меченого антитела вводили внутривенно «голым» мышам с подкожными ксенотрансплантатами клеток рака желудка человека NUGC-4. NUGC-4 клетки демонстрируют поверхностную экспрессию CLDN18.2, а также HER2/neu (мишень трастузумаба), но являются отрицательными в отношении CD20. В контрольных исследованиях группам мышей с NUGC-4-ксенотрансплантатами вводили или Dyelight 680-меченый трастузумаб (группа положительный контроль) или Dyelight® 680-меченый ритуксимаб (отрицательный контроль). IMAB362 накапливается выраженно и исключительно в ксенотрансплантатах опухолей, что показано визуализацией на живых мышах с использованием флуоресцентной системы визуализации Xenogen® через 24 часа после внутривенной инъекции антител (фигура 18). IMAB362 эффективно удерживается в мишень-положительной опухоли и обнаруживается с соизмеримой интенсивностью даже через 120 часов (фигура 18). Трастузумаб также обнаруживается исключительно в ксенотрансплантатах через 24 часа после инъекции. Сигнал трастузумаба быстро «размывается» в пределах 120 часов после инъекции. При использовании ритуксимаба сигнал не обнаруживается.
Кроме того, IMAB362 использовали для лечения мышей с ксенотрансплантатами CLDN18.2-положительных опухолей. Было проведено исследование, связанное с ранним лечением модели опухоли (с началом введения IMAB362 через 3 дня после инокулирования опухолевых клеток). Более того, эксперименты, связанные с лечением развитых опухолей, начинали через 9 дней после инокулирования опухолевых клеток, когда опухоли достигали объемов около 60-120 мм3.
«Голым» мышам подкожно инокулировали 1×107 HEK293~CLDN18.2 трансфектантов. Через 3 дня после инокулирования опухоли начинали лечение мышей (10 на группу). Мышам вводили 200 мкг IMAB362, инфликсимаб (в качестве изотипического контроля) и PBS два раза в неделю в течение 6 недель, чередуя внутривенный и внутрибрюшинный способы введения. В то время как все мыши в группах, получавших или PBS или изотипический контроль, погибали в пределах 70-80 дней, животные, леченные IMAB362, имели преимущество по продолжительности жизни (фигура 19). Наблюдалось не только увеличение времени до гибели, а кроме того, 4 из 10 мышей оставались живыми в течение всего периода наблюдения 210 дней.
Лечение 9-10 мышей на группу начинали, когда средние объемы опухоли достигали 88 мм3 (62-126 мм3). До лечения мыши были разделены на тестируемые группы с целью обеспечения сравнимых размеров опухолей во всех группах. Мышей лечили 200 мкг IMAB362, изотипическим контролем или PBS два раза в неделю в течение 6 недель, чередуя внутривенное и внутрибрюшинное введение. Все мыши в группах, которых обработали или PBS или изотипическим контролем, погибли в пределах 50-100 дней. Животные, леченные IMAB362, имели преимущество в выживаемости, при этом среднее время выживания почти удваивалось (47 против 25 дней). Три из этих мышей оставались живы в течение полного периода наблюдения (фигура 20). Важно отметить, что противоопухолевая эффективность in vivo зависит от присутствия мишени на опухолевых клетках. Противоопухолевые эффекты IMAB362-обработки не были отмечены на мышах с ксенотрансплантатами CLDN18.2-отрицательных HEK293 опухолевых клеток.
Для изучения эффективности IMAB362 в отношении раковых клеток с эндогенной экспрессией CLDN18.2 использовали NUGC-4-модель рака желудка. Наблюдался агрессивный рост клеток NUGC-4 у «голых» мышей.
1×107 клеток NUGC-4 рака желудка вводили подкожно в левый бок бестимусных «голых» мышей (n=9 для ΙΜΑΒ362 группы; n=8 для контрольных групп). ΙΜΑΒ362 (200 мкг на инъекцию) и контроли вводили два раза в неделю, чередуя i.v. и i.p., начиная через 6 дней после инокулирования опухоли с помощью внутривенной инъекции. Размеры опухоли определяли два раза в неделю. Представленные на фигуре 21а результаты показаны вместе с SEM. Рост опухолей у мышей, леченных IMAB362, был существенно ингибирован по сравнению с контрольными группами мышей (*p<0,05). Фигура 21b показывает объемы опухолей на 21 день после инокуляции опухоли. Объемы опухолей у мышей, которых лечили IMAB362, были значительно меньше, чем объемы опухолей у контрольных мышей (*p<0,05).
При инокулировании мышам 1×107 опухолевых клеток средняя продолжительность жизни нелеченных мышей не составляла больше 25 дней. Лечение IMAB362, цетуксимабом, трастузумабом или изотипическим контролем и буферным контролем начинали, когда объемы опухоли достигали среднего размера около 109 мм3 (63-135 мм3). Мышей разделили на лечебные группы с разными дозами (фигура 21). Было показано, что IMAB362 значительно уменьшает скорость роста опухоли. Значительного уменьшения роста опухоли по сравнению с контролями (физраствор или антитело) не наблюдалось в отношении этой агрессивно растущей модели опухоли. Замедление роста опухоли было связано с незначительным увеличением среднего времени выживания у IMAB362-леченых мышей (31 день против 25 дней).
Противоопухолевую активность IMAB362 исследовали на двух моделях ксенотрансплантатов рака желудка человека с использованием NCI-N87 или NUGC-4 клеток с использованием лентивирусной трансдукции IMAB362 мишени CLDN18.2 (NCI-N87~CLDN18.2 и NUGC-4~CLDN18.2).
NCI-N87~CLDN18.2 опухолевые ксенотрансплантаты инокулировали подкожной инъекций 1×107 NCI-N87~CLDN18.2 клеток в бок 8 «голых» мышей (самки, 6-недельного возраста) на лечебную группу. Обработку начинали на 5 день после инокулирования опухоли с помощью внутривенной инъекции 800 мкг ΙΜΑΒ362 или 200 мкл 0,9% NaCl в контрольной группе (физраствор). Внутривенное введение проводили еженедельно в течение всего периода наблюдения. Размер опухоли и состояние здоровья животных регистрировали два раза в неделю. Фигура 22а показывает эффекты обработки IMAB362 на рост опухоли. Размер подкожных опухолей измеряли два раза в неделю (среднее + SEM, ***p<0,001). Фигура 22b показывает графики выживаемости Каплана-Мейера. Мышей забивали, когда опухоли достигали размера 1400 мм3.
Таким образом, длительная IMAB362-обработка высокозначимо ингибировала (p<0,001) опухолевый рост NCI-N87~CLDN18.2 ксенотрансплантатов рака желудка (фигура 22а). Задержка роста опухоли была значимо (p<0,05) связана с более длительным временем выживания мышей, леченных ΙΜΑΒ362 (фигура 22b).
ΙΜΑΒ362 иммунотерапия быстрорастущих NUGC-4~CLDN18.2 ксенотрансплантатов приводила к значимому (p<0,05) уменьшению размеров опухолей на 14 день лечения. После первых двух недель IMAB362-лечения развитие NUGC-4~CLDN18.2 опухоли было очень агрессивным. Однако ингибирование роста NUGC-4~CLDN18.2 опухоли до 14 дня лечения приводило к значимо (p<0,05) более длительной выживаемости мышей, леченых IMAB362.
В итоге, IMAB362 было высокоэффективно при лечении ксенотрансплантатов карциномы желудка, демонстрируя значимую задержку развития опухоли и длительное выживание на опухолевых моделях, положительных в отношении эндогенного CLDN18.2. На моделях очень агрессивных опухолей эти противоопухолевые эффекты IMAB362 являются менее выраженными, но, тем не менее, значительными, что подчеркивает сильные противоопухолевые свойства IMAB362.
Пример 15: Противоопухолевые эффекты IMAB362 в сочетании с химиотерапией на мышиных моделях опухолей
In vitro, IMAB362-опосредованный ADCC является более эффективным на клетках рака желудка человека, предварительно обработанных комбинациями химиотерапевтических средств, включая EOF и 5-FU + ОХ. Поэтому противоопухолевое действие комбинации этих соединений с IMAB362 было исследовано на мышиных опухолевых моделях in vivo.
NCI-N87~CLDN18.2 ксенотрансплантаты опухолей инокулировали с помощью подкожной инъекции 1×107 NCI-N87~CLDN18.2 клеток в бок 9 мышей в каждой лечебной группе. Мышей-опухоленосителей лечили в соответствии с режимом EOF - 1,25 мг/кг эпирубицина, 3,25 мг/кг оксалиплатина и 56,25 мг/кг 5-фторурацила внутрибрюшинно в дни 4, 11, 18 и 25 после инокулирования опухоли, с последующей внутривенной инъекцией 800 мкг IMAB362 через 24 часа после введения химиотерапии. IMAB362-обработку продолжали еженедельно. Размер опухоли и состояние здоровья животных контролировали два раза в неделю. Фигура 23а показывает эффекты комбинированного лечения на рост опухоли. Размер подкожных опухолей измеряли два раза в неделю (среднее значение + SEM; *p<0,05). Фигура 23b показывает графики выживаемости Каплана-Мейера. Мышей забивали, когда объем опухоли достигал 1400 мм3.
У «голых» мышей с опухолью NCI-N87~CLDN18.2 при лечении IMAB362 или EOF режимом наблюдалось высокозначимое подавление роста опухоли по сравнению с контрольными мышами. Дополнительное IMAB362 лечение в комбинации с EOF химиотерапией приводило к значимо (p<0,05) более сильному ингибированию роста опухоли, чем лечение EOF режимом в отдельности (фигура 23а). Медиана выживаемости мышей в контрольной группе (физраствор) составляла 59 дней. Еженедельное IMAB362-лечение мышей значительно увеличивало медиану выживаемости до 76 дней, подобно выживаемости мышей в EOF группе с медианой выживаемости тоже 76 дней. Однако комбинированное лечение IMAB362 и EOF увеличивало медиану выживаемости до 81 дня (фигура 23b).
Ксенотрансплантаты опухолей инокулировали подкожной инъекцией 1×107 NUGC-4~CLDN18.2 клеток в бок 10 «голым» мышам (самки, 6-недельного возраста) на лечебную группу. Мышей лечили в дни 3, 10, 17 и 24 химиотерапевтическими средствами. IMAB362-обработку проводили еженедельно. Фигура 24а показывает кривые роста подкожных ксенотрансплантатов NUGC-4~CLDN18.2 опухолей (среднее + SEM). Фигура 24b представляет графики выживаемости Каплана-Мейера (логарифмический ранговый (Кокса-Мантеля) тест, **p<0,01).
Подкожные ксенотрансплантаты NUGC-4-CLDN18.2 опухолей развивались очень агрессивно. Тем не менее, IMAB362-лечение мышей-опухоленосителей значительно ингибировало рост опухоли по сравнению с контрольной группой с введением физраствора. При использовании комбинированной терапии EOF эффекты IMAB362 на рост опухоли NUGC-4~CLDN18.2 были скрыты ингибированием роста вследствие EOF-лечения, не показывая увеличения ингибирования роста опухоли по сравнению с лечением EOF в отдельности (фигура 24а). Однако медиана выживаемости мышей, леченных IMAB362 и EOF режимом, была увеличена с высокой значимостью (p<0,01) по сравнению с выживаемостью мышей, которых лечили только EOF (фигура 24b).
Пример 16: Выращенные в присутствии ZA/IL-2 Vγ9Vδ2 Т-клетки улучшают IMAB362-опосредованный контроль развитых опухолей in vivo
Для исследования комбинированной активности IMAB362 и полученных в результате обработки ZA/IL-2 γδ Т-клеток в мышиных системах мы использовали мышей NSG. У мышей NSG отсутствуют зрелые Т-клетки, В-клетки, натуральные киллеры (ΝΚ), сигнальные пути многих цитокинов, и они имеют множество дефектов врожденного иммунитета, при том, что ниши в первичной и вторичной иммунологических тканях являются доступными для колонизации человеческими иммунными клетками.
NSG мышам подкожно инокулировали 1×107 CLDN18.2-трансфицированных HEK293 клеток. В тот же день мыши получали 8×106 человеческих PBMCs, обогащенных Vγ9Vδ2 Т-клетками, культивированными в течение 14 дней в среде с добавлением ZA. Более того, мышам вводили 50 мкг/кг ZA и 5000 U IL-2 (Proleukin). Для сохранения человеческих Т-клеток в функциональном состоянии IL-2 вводили два раза в неделю, а ZA - еженедельно. Когда HEK293~CLDN18.2 опухоли становились макроскопически видимыми, начинали лечение 200 мкг IMAB362 два раза в неделю. В дополнение к группе из 9 леченых мышей, были взяты также две контрольные группы мышей. Одна группа не получала человеческие γδ Т-клетки, другую группу лечили изотипическими контрольными антителами вместо ΙΜΑΒ362. Рост CLDN18.2-положительных опухолей у мышей, которых лечили ΙΜΑΒ362 в присутствии человеческих γδ Т-клеток и ΖΑ, был значимо ингибирован и практически прекращен, в то время как у мышей, которых лечили или изотипическими контрольными антителами, или у мышей, лишенных человеческих Т-клеточных эффекторов, опухоли росли агрессивно, и поэтому мышей забивали раньше положенного времени (фигура 25).
Пример 17: Противоопухолевые эффекты ΙΜΑΒ362 в комбинации с химиотерапией на мышиных опухолевых моделях
Противоопухолевая активность ΙΜΑΒ362 в комбинации с химиотерапией была исследована на подкожных аллотрансплантатах карциномы желудка у иммунокомпетентных беспородных NMRI мышей с использованием CLS-103 клеток с лентивирусной трансдукцией мышиного cldn18.2 (CLS-103~cldn18.2).
CLS-103~cldn18.2 аллотрансплантат опухоли инокулировали с помощью подкожной инъекции 1×106 CLS-103~cldn18.2 клеток в бок NMRI-мышей (10 мышей на каждую лечебную группу). Мышей-опухоленосителей лечили внутрибрюшинным введением 1,25 мг/кг эпирубицина, 3,25 мг/кг оксалиплатина и 56,25 мг/кг 5-фторурацила (EOF) в дни 3, 10, 17 и 24 после инокулирования опухоли, с последующей внутривенной инъекцией 800 мкг IMAB362 через 24 часа после введения химиотерапии. IL-2 вводили два раза в неделю с помощью подкожной инъекции 3000 IE. После завершения химиотерапии обработку IMAB362 и IL-2 продолжали в течение всего периода наблюдения. Размер опухоли и состояние здоровья животных контролировали два раза в неделю. Мышей забивали, когда опухоль достигала объема 1400 мм или когда появлялось изъязвление опухоли.
Как видно на фигуре 26, у NMRI мышей с CLS-103~cldn18.2 опухолями, лечеными IMAB362 или EOF по отдельности, не наблюдалось значимого ингибирования роста опухоли по сравнению с контрольной группой (физраствор). В противоположность этому, комбинация EOF химиотерапии и IMAB362-лечения приводила к значительно более высокому ингибированию роста опухоли и длительному выживанию мышей-опухоленосителей. Это наблюдения показывают наличие аддитивных (совокупных) или даже синергических (взаимно усиливающих) эффектов при комбинации EOF химиотерапии и IMAB362 иммунотерапии. Обработка IL-2 не оказывала действия на рост опухоли.


New International Patent Application
Ganymed Pharmaceuticals AG, et al.
“COMBINATION THERAPY INVOLVING ANTIBODIES AGAINST CLAUDIN 18.2 FOR TREATMENT OF CANCER”
Our Ref.: 342-75 PCT

Дополнительный лист по поводу биологического материала
Установление дополнительных депозитов:
1) Название и адрес депозитного учреждения для депозитов (DSM АСС2738, DSM АСС2739, DSM АСС2740, DSM АСС2741, DSM АСС2742, DSM АСС2743, DSM АСС-2745, DSM АСС2746, DSM АСС2747, DSM АСС2748):
DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH
Mascheroder Weg 1b
38124 Braunschweig
DE
2) Название и адрес депозитного учреждения для депозитов (DSM АСС2808, DSM АСС2809, DSM АСС2810):
DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH
Inhoffenstr. 7 В
38124 Braunschweig
DE
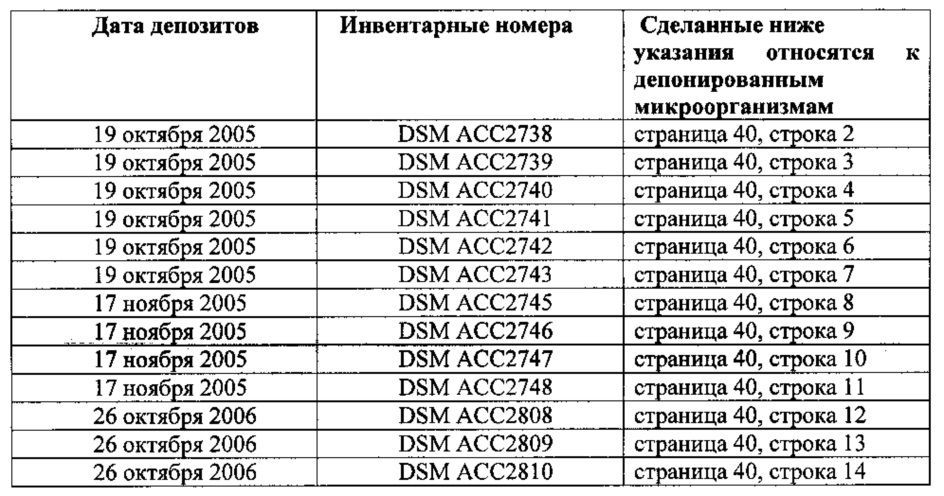
Дополнительные указания для всех вышеупомянутых депозитов:
- Мышиная (Mus musculus) миелома P3X63Ag8U.1, слитая с мышиными (Mus museulus) спленоцитами
- Гибридома, секретирующая антитело к человеческому клаудину-18А2
3) Вкладчик:
Все вышеупомянутые депозиты были сделаны:
Ganymed Pharmaceuticals AG
Freiligrathstraβe 12
55131 Mainz
DE
Реферат
Группа изобретений относится к медицине и касается способа лечения или предотвращения ракового заболевания, где раковые клетки экспрессируют CLDN18.2, включающего введение пациенту антитела, обладающего способностью связываться с CLDN18.2, в комбинации со средством, стимулирующим γδ Т-клетки и интерлейкин-2, где средство, стимулирующее γδ Т-клетки, представляет собой бисфосфонат. Группа изобретений также касается медицинского препарата для лечения или предотвращения ракового заболевания, содержащего указанные вещества; набора для лечения или предотвращения ракового заболевания. Группа изобретений обеспечивает значительное увеличение общей ADCC-активности. 3 н. и 32 з.п. ф-лы, 26 ил., 1 табл., 17 пр.

Комментарии