Способ получения дициклоплатина - RU2676269C1
Код документа: RU2676269C1
Чертежи
Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому способу получения противоопухолевого производного комплекса удвоенной дикарбоновой кислоты и диаминоплатины, названного дициклоплатином.
УРОВЕНЬ ТЕХНИКИ
Цисплатин широко используется в клинической медицине в качестве противоопухолевого лекарственного средства, с тех пор как был обнаружен противоопухолевый эффект цис-дихлордиаминоплатины. Rosenberg et al. Nature, 1965, 205: 698; Nature, 1972, 222: 385. Несмотря на то, что лекарственное средство такого типа проявляет терапевтические эффекты при раковых заболеваниях, таких как рак мочеполовой системы, рак носоглотки, цефалоциркулярный рак и рак легких, он является токсичным и приводит к серьезным побочным эффектам. Некоторые нежелательные эффекты, такие как нефротоксичность, нейротоксичность, ототоксичность, тошнота и рвота, являются препятствиями для его рекомендуемой дозировки и длительного использования. Карбоплатин, один из противоопухолевых препаратов второго поколения аналогов платины, имеет противоопухолевый спектр, подобный спектру цисплатина, и вызывает перекрестную лекарственную устойчивость. Терапевтический эффект карбоплатина несколько ниже, чем у цисплатина. Несмотря на то, что токсичность и связанные с ней побочные эффекты карбоплатина значительно меньше, чем у цисплатина, миелосуппрессия тем не менее существует, и цисплатин нестабилен в виде водного раствора. В результате, активные исследования в поисках сильнодействующих противоопухолевых препаратов из аналогов платины с низкой токсичностью и широким спектром действия были продолжены.
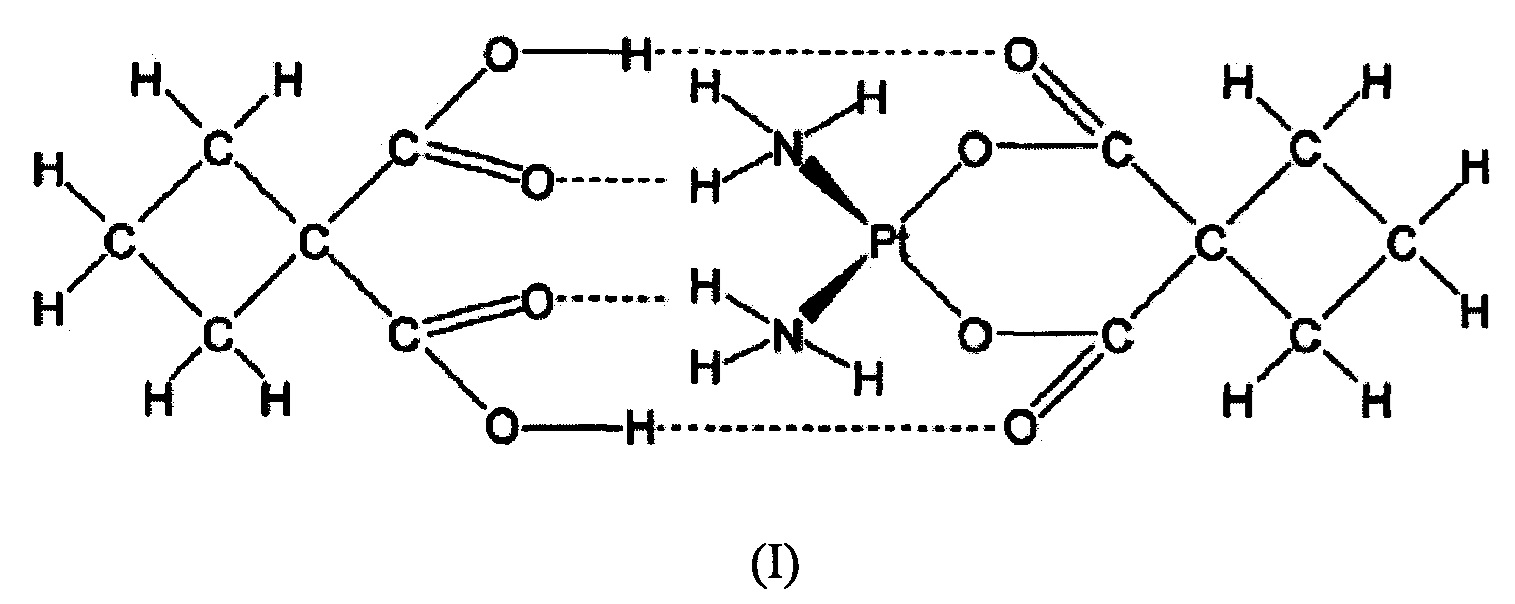
Дициклоплатин (DCP) представляет собой супермолекулу, состоящую из карбоплатина (СВР) и 1,1-циклобутандикарбоксилата (CBDCA), соединенных вместе водородными связями. Растворимость и стабильность комплексов платины имеют прямое отношение к их активности, токсичности и фармакокинетике. Доклинические исследования показали, что DCP решает проблему нестабильности СВР в водном растворе при сохранении противораковых эффектов СВР. Клиническая оценка в Фазе 1 исследования с увеличением дозы у пациентов с опухолями показала, что DCP был переносим при дозах от 100 до 550 мг/м2 и показывал потенциальную эффективность у китайцев, больных раком. DCP показывал благоприятную биодоступность и стабильность in vivo, при этом рекомендуемая доза для Фазы II химиотерапии, включающей DCP, составляла 450 мг/м2. DCP в настоящее время исследуют в качестве монотерапии в нескольких типах рака, таких как рак предстательной железы, и в сочетании с паклитакселом в Фазе II исследования немелкоклеточного рака легкого. Химическая структура DCP показана в виде формулы I:
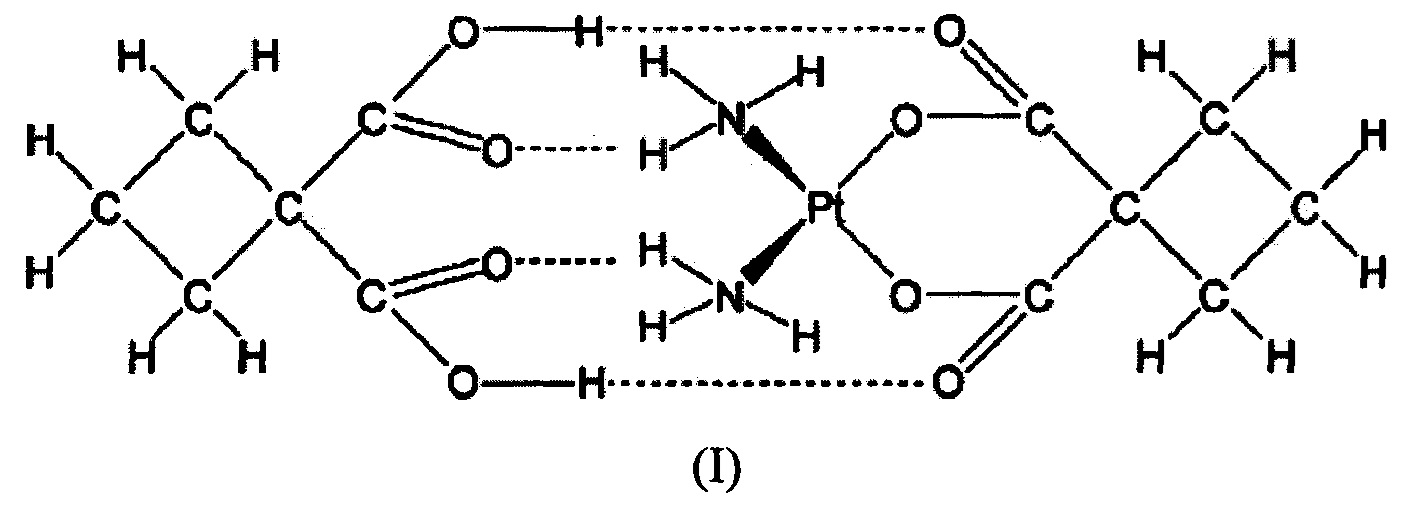
Дициклоплатин (DCP) впервые был описан в патенте США 6699901, который раскрывал химическую структуру и способ получения DCP.
Кристаллическая структура DCP была определена и описана в "Structural studies of dicycloplatin-an antitumor supramolecule." Yang X. et al., Science China Chemistry, 40(5): 485-491 (2010), где показан дициклоплатин в виде сокристалла, состоящего из карбоплатина и 1,1-циклобутандикарбоксилата.
Однако, способы, раскрытые в патенте США 6699901, которые были протестированы изобретателями по настоящему изобретению, не могут обеспечить удовлетворительных результатов и их трудно расширить до масштабов промышленного производства. Получение дициклоплатина в соответствии со способом, описанным в патенте США 6699901, обеспечивало смесь карбоплатина и дициклоплатина, приводя к высокой токсичности и неприемлемым продуктам.
Поэтому, желательно обеспечить надежные и простые для расширения способы кристаллизации для эффективного получения чистого дициклоплатина с высоким выходом.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к неожиданно обнаруженному новому способу получения дициклоплатина, обладающему преимуществами легкого осуществления, мягких реакционных условий, короткого времени реакции и высокой воспроизводимости.
Соответственно, настоящее изобретение относится к способу получения дициклоплатина, включающему: суспендирование на единицу карбоплатина в соответствующей пропорции 1,1-циклобутандикарбоновой кислоты и растворителя (растворителей); с последующей кристаллизацией или осаждением дициклоплатина путем перемешивания, испарения растворителя (растворителей) и/или охлаждения.
Одним аспектом изобретения является способ получения дициклоплатина формулы (I),
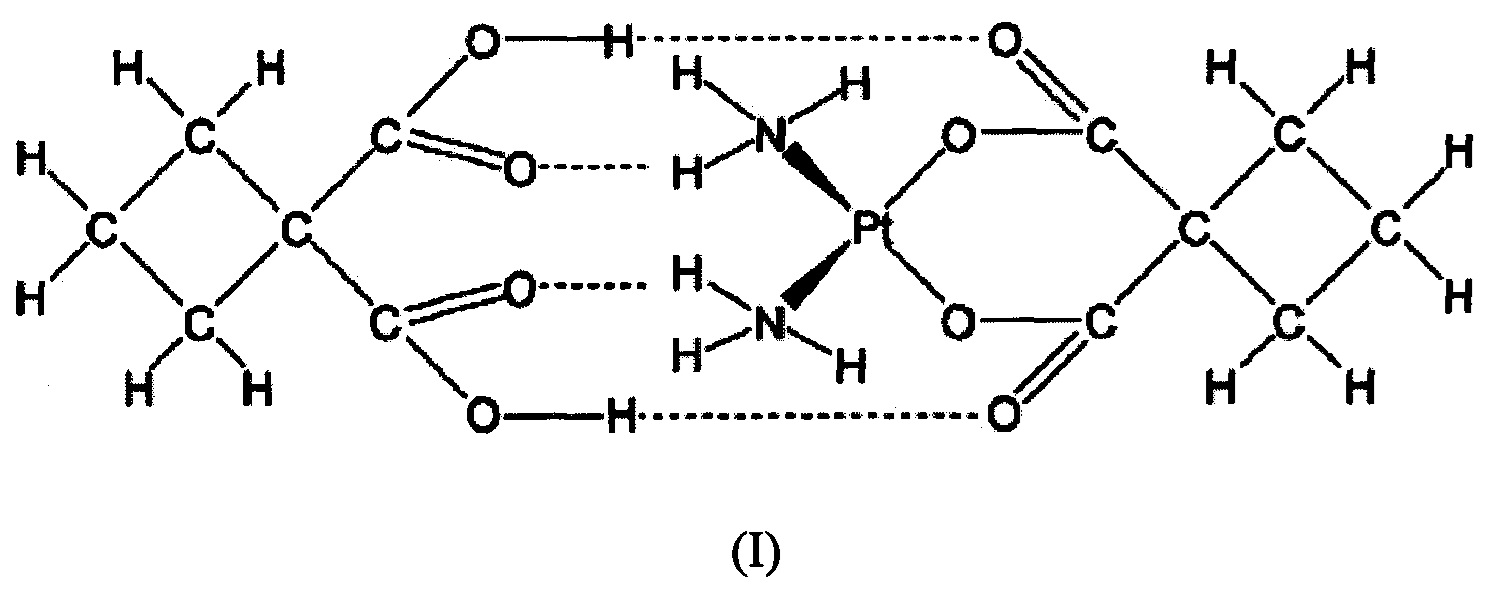
включающий: объединение карбоплатина с соответствующей пропорцией 1,1-циклобутандикарбоновой кислоты и растворителя с образованием суспензии; отделение сформированной осажденной твердой фазы от суспензии; и сушку твердой фазы, где твердая фаза содержит дициклоплатин формулы (I) без какого-либо количества карбоплатина, обнаруживаемого с помощью порошковой рентгеновской дифракции (XRPD).
Согласно одному варианту реализации, способ дополнительно включает охлаждение осаждающейся твердой фазы до этапа разделения.
Согласно одному варианту реализации, способ дополнительно включает перемешивание суспензии после этапа объединения и перед стадией разделения.
Согласно одному варианту реализации, твердая фаза состоит по существу из дициклоплатина.
Согласно одному варианту реализации, твердая фаза состоит состоит из дициклоплатина.
Согласно одному варианту реализации, растворитель, используемый в способе, представляет собой воду.
Согласно одному варианту реализации, молярное соотношение карбоплатина и 1,1-циклобутандикарбоновой кислоты на стадии объединения составляет от примерно 1:15 до примерно 1:50.
Согласно одному варианту реализации, молярное соотношение карбоплатина и 1,1-циклобутандикарбоновой кислоты на стадии объединения, составляет от примерно 1:1,15 до 1:2.
Согласно одному варианту реализации, молярное соотношение карбоплатина и 1,1-циклобутандикарбоновой кислоты на стадии объединения составляет от 1:3 до примерно 1:50.
Согласно одному варианту реализации, молярное соотношение карбоплатина и 1,1-циклобутандикарбоновой кислоты на стадии объединения составляет от 1:5 до 1:10.
Согласно одному варианту реализации, пропорция массы карбоплатина в граммах и объема растворителя в мл на стадии объединения составляет от примерно 1:2 до примерно 1:50.
Согласно одному варианту реализации, пропорция массы карбоплатина в граммах и объема растворителя в мл на стадии объединения составляет от примерно 1:3 до примерно 1:5.
Согласно одному варианту реализации, дициклоплатин имеет картину рентгеновской порошковой дифракции, по существу, как показано на Фиг. 2.
Согласно одному варианту реализации, температура реакции на стадии объединения составляет от 0°С до 80°С.
Согласно одному варианту реализации, температура реакции на стадии объединения составляет от 10 до 25°С.
Согласно одному варианту реализации, растворитель представляет собой органический растворитель, выбранный из группы, состоящей из тетрагидрофурана (ТГФ), дихлорметана (ДХМ), изопропанола, этанола, этилацетата (EtOAc), диметилформамида (ДМФА), 1,4-диоксана, ацетона, толуола, изобутилацетата, изопропилацетата, хлороформа, 2-метоксиэтанола, метилизобутилкетона (МИБК), метил-трет-бутилового эфира (МТБЭ), 1,2-дихлорэтана и их смеси.
Согласно одному варианту реализации, растворитель представляет собой смесь воды и органического растворителя, выбранного из группы, состоящей из: ТГФ, ДХМ, изопропанола, этанола, EtOAc, ДМФА, 1,4-диоксана, ацетона, толуола, изобутилацетата, изопропилацетата, хлороформа, 2-метоксиэтанола, МИБК, МТБЭ, 1,2-дихлорэтана и их смеси.
Согласно одному варианту реализации, температура реакции на стадии объединения составляет от 0°С до 80°С.
Согласно одному варианту реализации, температура реакции на стадии объединения составляет от 20 до 35°С.
Согласно некоторым вариантам реализации, конечный продукт не содержит карбоплатина в количестве, обнаруживаемом с помощью рентгеновской порошковой дифракции (XRPD).
Согласно некоторым вариантам реализации, конечный продукт не содержит карбоплатина в количестве, обнаруживаемом с помощью дифференциальной сканирующей калориметрии (DSC).
Согласно некоторым вариантам реализации, конечный продукт не содержит карбоплатина в количестве, обнаруживаемом с помощью или XRPD, или DSC.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Нижеследующие фигуры основаны на Примерах 7-9, описанных в настоящем документе, и использованы только в качестве иллюстраций конкретных вариантов реализации настоящего изобретения и без намерения ограничивать объем изобретения.
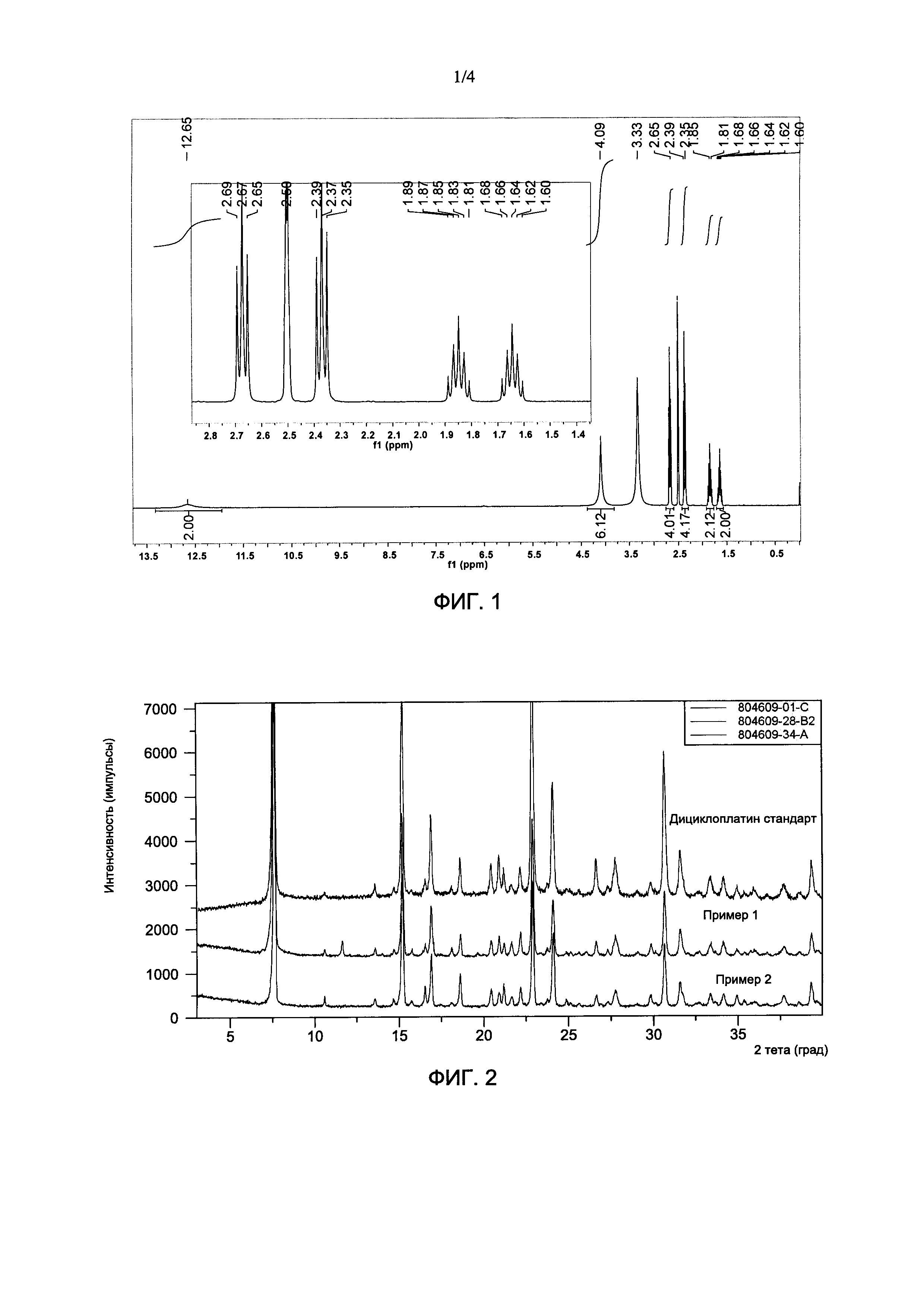
На Фиг. 1 показан типичный1H-ЯМР-спектр продукта, где продукт содержит дициклоплатин и растворен в ДМСО-d6.
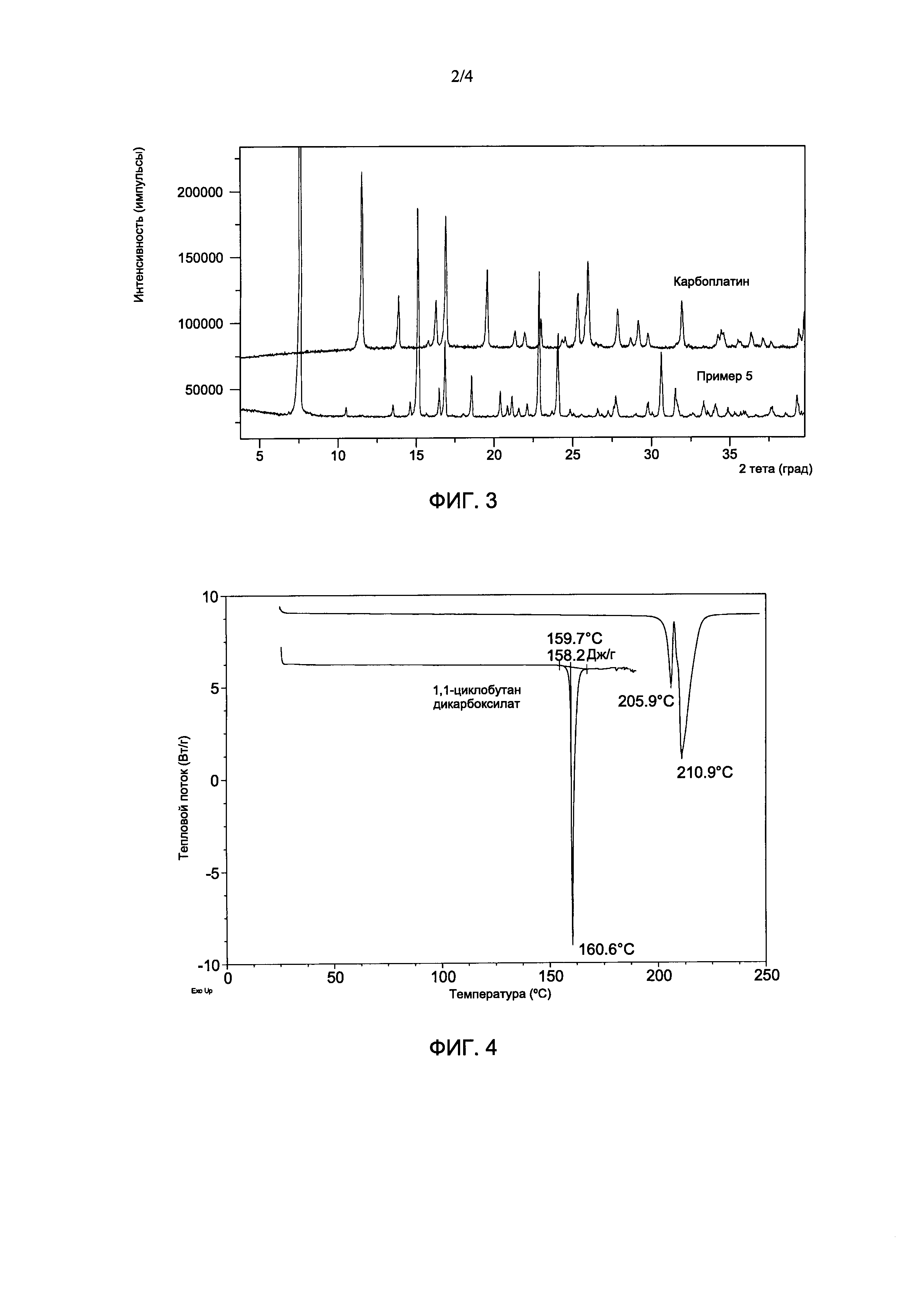
На Фиг. 2 показана типичная картина рентгеновской порошковой дифракции (XRPD) продукта, где продукт содержит дициклоплатин, (нижняя дифрактограмма) и она сопоставлена со стандартной картиной XRPD дициклоплатина (верхняя дифрактограмма).
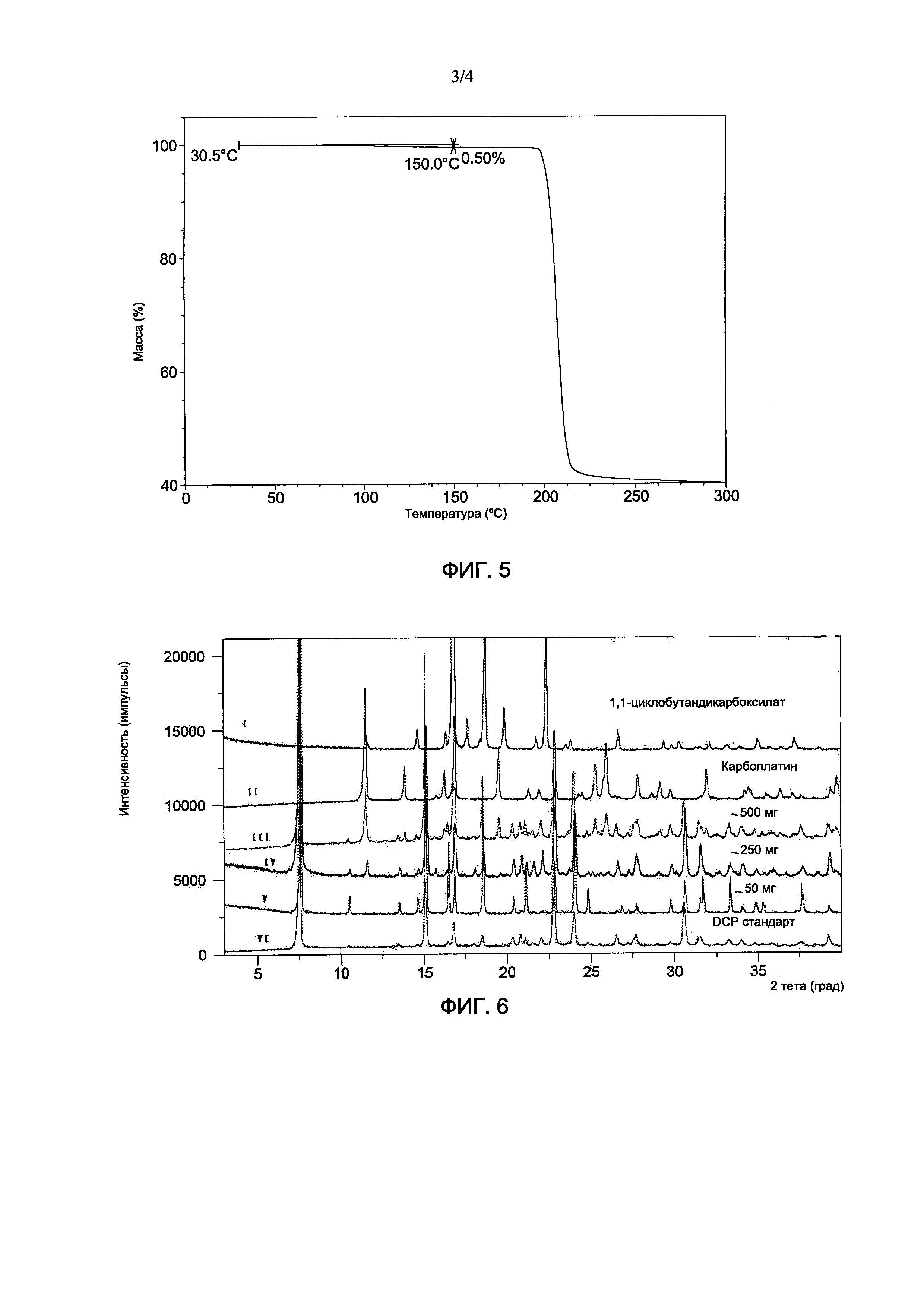
На Фиг. 3 показана типичная картина XRPD продукта, где продукт содержит дициклоплатин (нижняя дифрактограмма), и она сопоставлена с картиной XRPD карбоплатина (верхняя дифрактограмма).
На Фиг. 4 показана типичная термограмма продукта, полученная методом дифференциальной сканирующей калориметрии (DSC), где продукт содержит дициклоплатин (нижняя дифрактограмма), и она сопоставлена с DSC-термограммой 1,1-циклобутана дикарбоксилата (верхняя дифрактограмма).
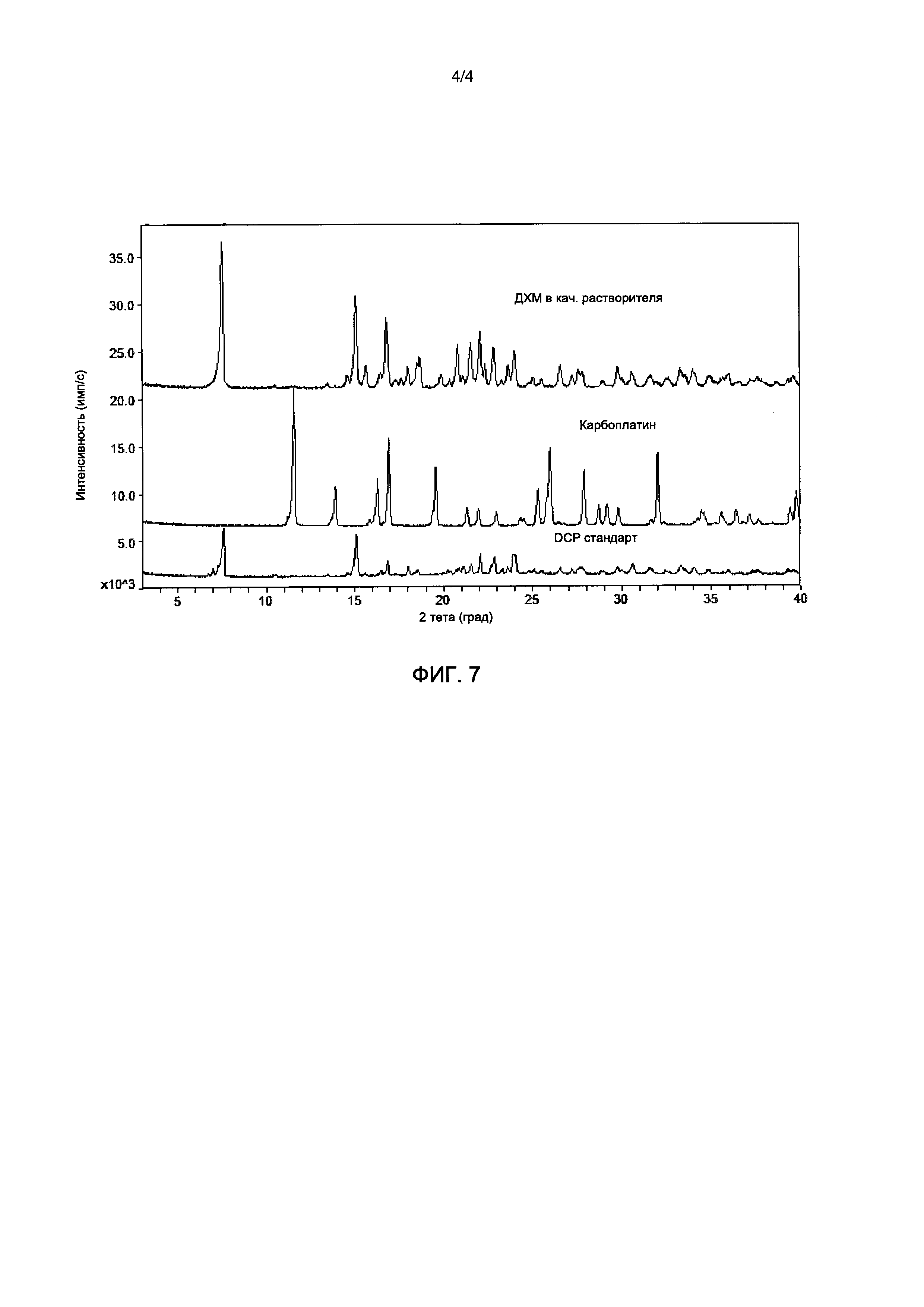
На Фиг. 5 показана типичная термограмма продукта, полученная методом термогравиметрического анализа (ТГА), где продукт содержит дициклоплатин (нижняя фигура).
На Фиг. 6 показаны типичные картины XRPD продукта, и картины сопоставлены со стандартными картинами для дициклоплатина и карбоплатина.
На Фиг. 7 показана типичная картина XRPD продукта, где продукт содержит дициклоплатин, и она сопоставлена со стандартной картиной XRPD дициклоплатина и карбоплатина.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Нижеследующее описание некоторых вариантов (вариантов) является только иллюстративным по своей природе и никоим образом не предназначено для ограничения изобретения, его применения или использования. Использованные по всему описанию диапазоны, использованы как условное обозначение для описания всякого и каждого значения, находящегося в пределах диапазона. Любое значение в пределах диапазона может быть выбрано как граничная точка диапазона. Кроме того, все ссылки, приведенные в настоящем документе, включены в настоящее описание посредством ссылки во всей их полноте. В случае конфликта в определении в настоящем описании и в цитированной ссылке, настоящее изобретения описание доминирует.
Согласно настоящему изобретению, предложен новый способ получения дициклоплатина, который прост в применении, включает умеренные условия реакции и имеет короткое время реакции. Новый способ является воспроизводимым и легко расширяемым для промышленного применения. В некоторых вариантах реализации в качестве растворителя используют только воду (то есть не органический растворитель). В некоторых вариантах реализации используют только один органический растворитель или смесь органических растворителей. В некоторых вариантах реализации используют смесь органического растворителя и воды.
В иллюстративном варианте реализации настоящее изобретение относится к способу получения дициклоплатина, включающему суспендирование карбоплатина в соответствующей пропорции 1,1-циклобутандикарбоновой кислоты и растворителя с образованием суспензии; перемешивание суспензии с образованием осажденной твердой фазы; и сушку твердой фазы, где твердая фаза содержат дициклоплатин формулы I и не содержит карбоплатин.
В некоторых вариантах реализации способ дополнительно включает охлаждение осаждающейся твердой фазы. В некоторых вариантах реализации способ дополнительно включает фильтрацию осаждающейся твердой фазы. В некоторых вариантах реализации способ дополнительно включает перекристаллизацию твердой фазы.
В некоторых вариантах реализации растворитель представляет собой воду.
В некоторых вариантах реализации молярное соотношение карбоплатина и 1,1-циклобутандикарбоновой кислоты меньше, чем 1:1. В некоторых вариантах реализации молярное соотношение карбоплатина и 1,1-циклобутандикарбоновой кислоты меньше чем 1:1,5, 1:2, 1:2,5, 1:3, 1:3,5, 1:4, 1:4,5, 1:5, 1:5,5, 1:6, 1:6,5, 1:7, 1:7,5, 1:8, 1:8,5, 1:9, 1:9,5, 1:10, 1:11, 1:12, 1:13, 1:14, 1:15, 1:20, 1:25, 1:30, 1:35, 1:40, 1:45 или 1:50.
В некоторых конкретных вариантах реализации молярное соотношение карбоплатина и 1,1-циклобутандикарбоновой кислоты находится в диапазоне от при мерно 1:1,15 до примерно 1:2, от примерно 1:1,15 до примерно 1:3, от примерно 1:1,15 до примерно 1:4, от примерно 1:1,15 до примерно 1:5 от примерно 1:1,15 до примерно 1:6 от примерно 1:1,15 до примерно 1:7 от примерно 1:1,15 до примерно 1:8 от примерно 1: От 1,15 до 1:9, от примерно 1:1,15 до примерно 1:10, от примерно 1:1,15 до примерно 1:15, от примерно 1:1,15 до примерно 1:20, от примерно 1:1,15 до примерно 1:25, от примерно 1:1,15 до примерно 1:30, от примерно 1:1,15 до примерно 1:40, от примерно 1:1,15 до примерно 1:50.
В некоторых вариантах реализации пропорция карбоплатина (масса, г) и растворителя (объем, мл) находится в пределах от примерно 1:2 до примерно 1:50. В некоторых конкретных вариантах реализации пропорция карбоплатина (масса, г) и растворителя (объем, мл) находится в пределах от примерно 1:3 до примерно 1:5.
В некоторых вариантах реализации конечный продукт дициклоплатина не содержит карбоплатина в количестве более чем 5%, 3%, 1%, 0,5%, 0,1%, 0,05%, 0,01%, 0,005% или 0,001% конечного продукта по массе.
В некоторых вариантах реализации конечный продукт дициклоплатина является по меньшей мере на 95%, 96%, 97%, 98%, 99% или 99,9% чистым.
Реакции обычно проводят при умеренной температуре. Однако реакции можно также проводить при высоких температурах или низких температурах. Реакции обычно проводят при нормальном давлении. Однако реакции можно также проводить при повышенном давлении или пониженном давлении.
В некоторых вариантах реализации в качестве растворителя могут быть использованы органические растворители для получения желаемых продуктов. Примеры органических растворителей включают, но не ограничиваются ими, ТГФ, ДХМ, изопропанол, этанол, EtOAc, ДМФА, 1,4-диоксан, ацетон, толуол, изобутилацетат, изопропилацетат, хлороформ, 2-метоксиэтанол, МИБК, МТБЭ, 1,2-дихлорэтан и смеси двух или более растворителей или смесей воды и органических растворителей. В некоторых конкретных вариантах реализации органический растворитель представляет собой ДХМ.
Следующие неограничивающие примеры дополнительно иллюстрируют некоторые аспекты настоящего изобретения.
ПРИМЕРЫ
Рентгеновская порошковая дифрактометрия (XRPD)
Аналитический инструмент: Panalytical Empyrean. Рентгеновскую порошковую дифрактометрию проводили путем установки образца в держатель для кристаллических материалов из монокристаллического кремния Si с низким фоном и распределения образца тонким слоем с помощью предметного стекла микроскопа. Угол 2-тета (2-θ) был откалиброван по порошковому стандарту Si 640 от компании Panalytical. Образец облучали рентгеновскими лучами, создаваемыми медной острофокусной рентгеновской трубкой работающей при 45 кВ и 40 мА с длиной волны Kα1 = 1,540589 ангстрем, и Kα2 = 1,544426 ангстрем (отношение интенсивности Kα2/Kα1 равно 0,50). Коллимированный пучок рентгеновских лучей пропускали через запрограммированную щель расходимости, установленную на 10 мм, и отраженное излучение направляли через анти-рассеивающую щель 5,5 мм. Образец экспонировали в течение 16,3 секунд на 0,013° 2-тэта-инкремент (режим непрерывного сканирования) в диапазоне от 3 до 40 градусов 2-тета в тета-тета-режиме. Время работы составляло 3 минуты и 57 секунд. Прибор был оснащен детектором RTMS (X'Celerator). Управление и сбор данных осуществляли с помощью Dell Optiplex 780 ХР, работающего с программным обеспечением для сбора данных.
В данной области техники известно, что на относительные интенсивности пиков могут влиять, например, зерна размером более 30 микрон, и что неравномерные соотношения сторон могут влиять на анализ образцов. Также известно, что на положение отражений может влиять точная высота, на которой образец находится на дифрактометре, и калибровка нуля дифрактометра. Плоскостность поверхности образца также может иметь ограниченный эффект. В результате, представленные данные дифракционной картины не должны ограничиваться абсолютными значениями.
Дифференциальная сканирующая калориметрия (DSC)
Дифференциальную сканирующую калориметрию (DSC) использовали в качестве термоаналитического метода для измерения разницы в количестве тепла, необходимого для повышения температуры образца, и эталон измеряли как функцию температуры. Общий процесс DSC является известным, и конкретные инструменты и условия, используемые в описанных Примерах, были следующими:
Аналитический прибор: Дифференциальный сканирующий калориметр (DSC) Q2000 от компании ТА Instruments
Скорость нагрева: 10°С в минуту; а также
Газ для продувки: азот.
Термальный гравиметрический анализ (TGA)
TGA использовали для измерения изменений физических и химических свойств образцов в зависимости от повышения температуры (с постоянной скоростью нагрева) или в зависимости от времени (с постоянной температурой и/или постоянной потерей массы). Общий процесс TGA известен, и конкретные инструменты и условия в описанных Примерах были следующими:
Аналитический прибор: Термальный гравиметрический анализатор (TGA) Q5000 от компании ТА Instruments;
Скорость нагрева: 10°С в минуту; а также
Газ для продувки: азот.
1Н Ядерный магнитный резонанс (1Н ЯМР)
Общий процесс1Н-ЯМР-спектроскопии известен, и конкретные инструменты и условия, используемые в описанных Примерах, были следующими: раствор ЯМР собирали на спектрометре ЯМР Bruker 400М с использованием DMSO-d6.
Пример 1. Методы получения дициклоплатина
1. Загружали 5,0 г карбоплатина (13,47 ммоль) и 2,232 г 1,1-циклобутандикарбоновой кислоты (15,50 ммоль) в стеклянный сосуд емкостью 20 мл.
2) Добавляли 12,5 мл деионизированной воды в один флакон и перемешивали смесь при RT (комнатная температура) с образованием однородной суспензии, удерживая флакон вдали от света.
3) Охлаждали смесь до 5°С со скоростью 0,33°С/мин и выдерживали при 5°С в течение 20 часов для образования осадка.
4) Фильтровали вод вакуумом и промывали осадок 5 мл деионизированной воды, а затем высушивали под вакуумом влажный осадок.
5) Собирали твердую фазу из высушенного осадка и измеряли количество дициклоплатина.
6) Получали 6,49 г дициклоплатина с общим выходом 93,2%.
Продукт анализировали с помощью XRPD, DSC, TGA и1Н ЯМР.
Результаты1Н-ЯМР: (400 МГц, ДМСО-d6) δ 12,63 (с, 2Н), 4,09 (с, 6Н), 2,67 (т, J=7,9 Гц, 4Н), 2,37 (т, J=8,0 Гц, 4Н), 1,95-1,76 (м, 2Н), 1,73-1,55 (м, 2Н). Данные XRPD приведены в Таблице 1.

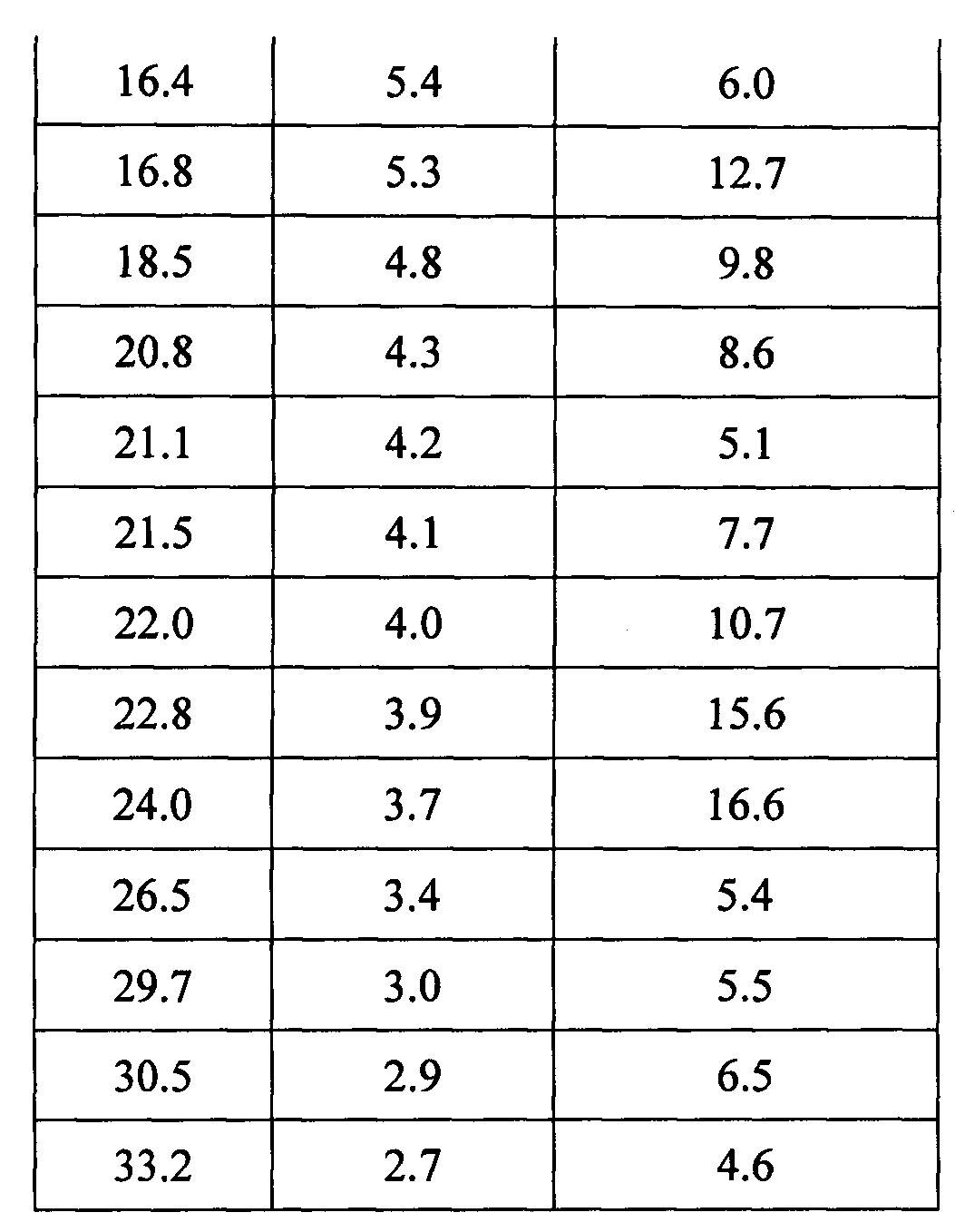
Пример 2. Методика получения дициклоплатина
1) Загружали 1,0 г карбоплатина (2,69 ммоль) и 776,4 мг 1,1-циклобутандикарбоновой кислоты (5,39 ммоль) в стеклянный сосуд емкостью 20 мл.
2) Добавляли 5 мл деионизированной воды в один флакон и перемешивали суспензию при комнатной температуре в течение 6 часов, удерживая флакон вдали от света для образования осадка.
3) Фильтровали под вакуумом и быстро промывали осадок 2,8 мл деионизированной воды, а затем высушивали под вакуумом влажный осадок.
4) Собирали твердую фазу из высушенного осадка и измеряли количество дициклоплатина.
Продукт анализировали с помощью XRPD, DSC, TGA и1Н ЯМР.
Результаты1Н-ЯМР: (400 МГц, ДМСО-d6) δ 12,65 (с, 2Н), 4,09 (с, 6Н), 2,67 (т, J=7,9 Гц, 4Н), 2,37 (т, J=8,0 Гц, 4Н), 1,92-1,77 (м, 2Н), 1,72-1,57 (м, 2Н).
Данные XRPD приведены в Таблице 2.
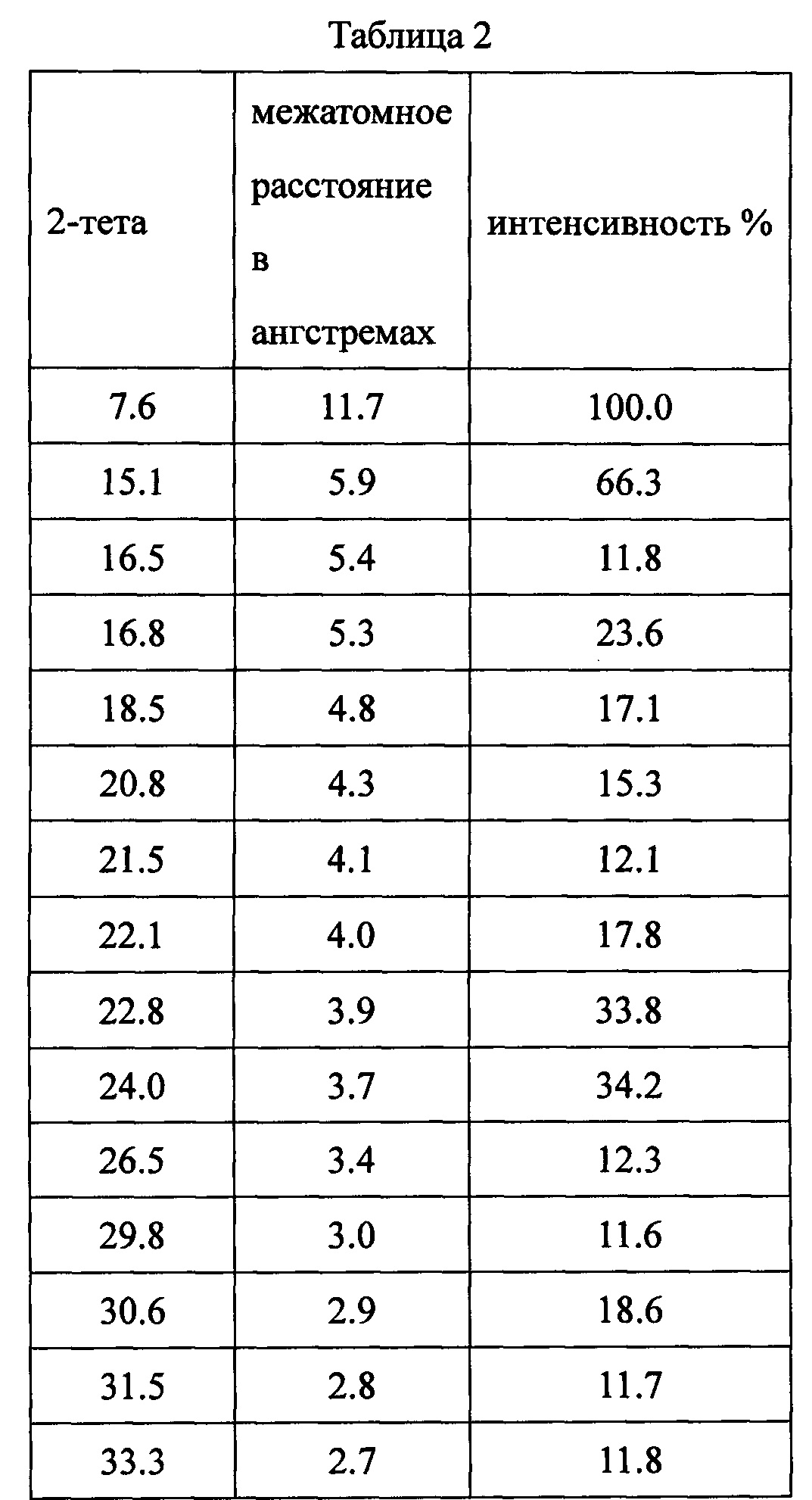
Пример 3. Методы получения дициклоплатина
1) Загружали 5,0 г карбоплатина (13,47 ммоль) и 2,523 г 1,1-циклобутандикарбоновой кислоты (17,52 ммоль) в 100-миллилитровьш стеклянный флакон.
2) Добавляли 25 мл деионизированной воды в тот же флакон и перемешивали суспензию при комнатной температуре в течение 5 часов, удерживая флакон вдали от света, для образования осадка.
3) Фильтровали под вакуумом и быстро промывали осадок 5 мл деионизированной воды, а затем высушивали под вакуумом влажный осадок.
4) Собирали твердую фазу из высушенного осадка и измеряли количество дициклоплатина.
5) получали 5,88 г дициклоплатина с общим выходом 84,2%.
Продукт анализировали с помощью XRPD, DSC, TGA и1Н ЯМР.
Результаты1Н-ЯМР: (400 МГц, ДМСО-d6) δ 12,63 (с, 2Н), 4,09 (с, 6Н), 2,67 (т, J=7,9 Гц, 4Н), 2,37 (т, J=8,0 Гц, 4Н), 1,90-1,80 (м, 2Н), 1,70-1,59 (м, 2Н).
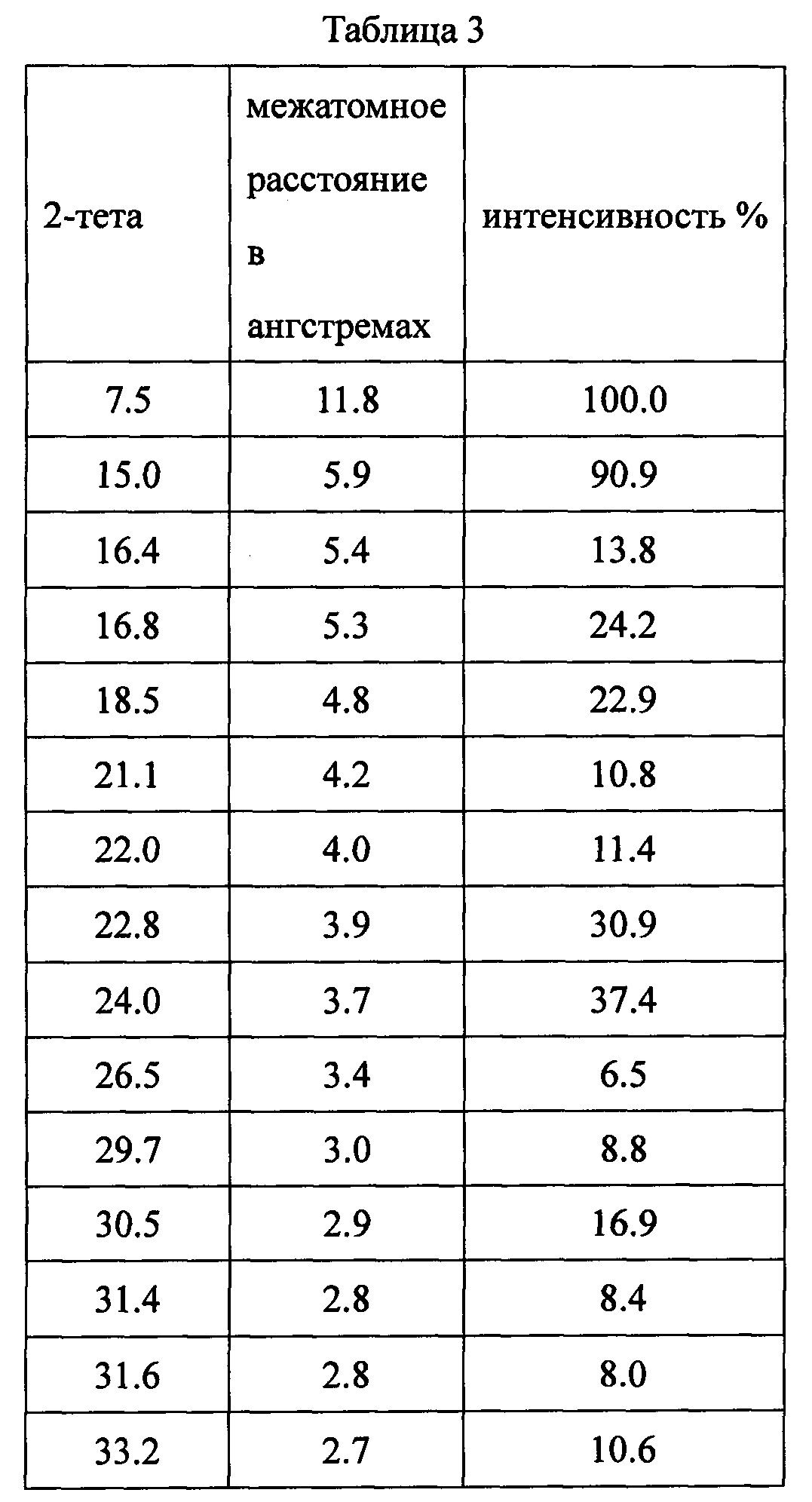
Данные XRPD приведены в Таблице 3.
Пример 4. Методы получения дициклоплатина
1) Взвешивали 5,0 г карбоплатина (13,47 ммоль) и 2,523 г 1,1-циклобутандикарбоновой кислоты (17,52 ммоль) в 100-миллилитровый стеклянный флакон.
2) Добавляли 25 мл деионизированной воды в тот же флакон и перемешивали смесь при комнатной температуре с образованием однородной суспензии, удерживая флакон вдали от света.
3) Охлаждали смесь до 5°С со скоростью 0,33°С/мин и выдерживали при 5°С в течение 19 часов для образования осадка.
4) Фильтровали под вакуумом и высушивали влажный осадок.
5) Собирали твердую фазу из высушенного осадка и измеряли количество дициклоплатина.
6) Получали 6,11 г дициклоплатина с общим выходом 87,1%.
Продукт анализировали с помощью XRPD, DSC, TGA и1Н ЯМР.
Результаты1Н-ЯМР: (400 МГц, ДМСО-d6) δ 12,65 (с, 2Н), 4,09 (с, 6Н), 2,67 (т, J=7,9 Гц, 4Н), 2,37 (т, J=8,0 Гц, 4Н), 1,94-1,77 (м, 2Н), 1,74-1,51 (м, 2Н).
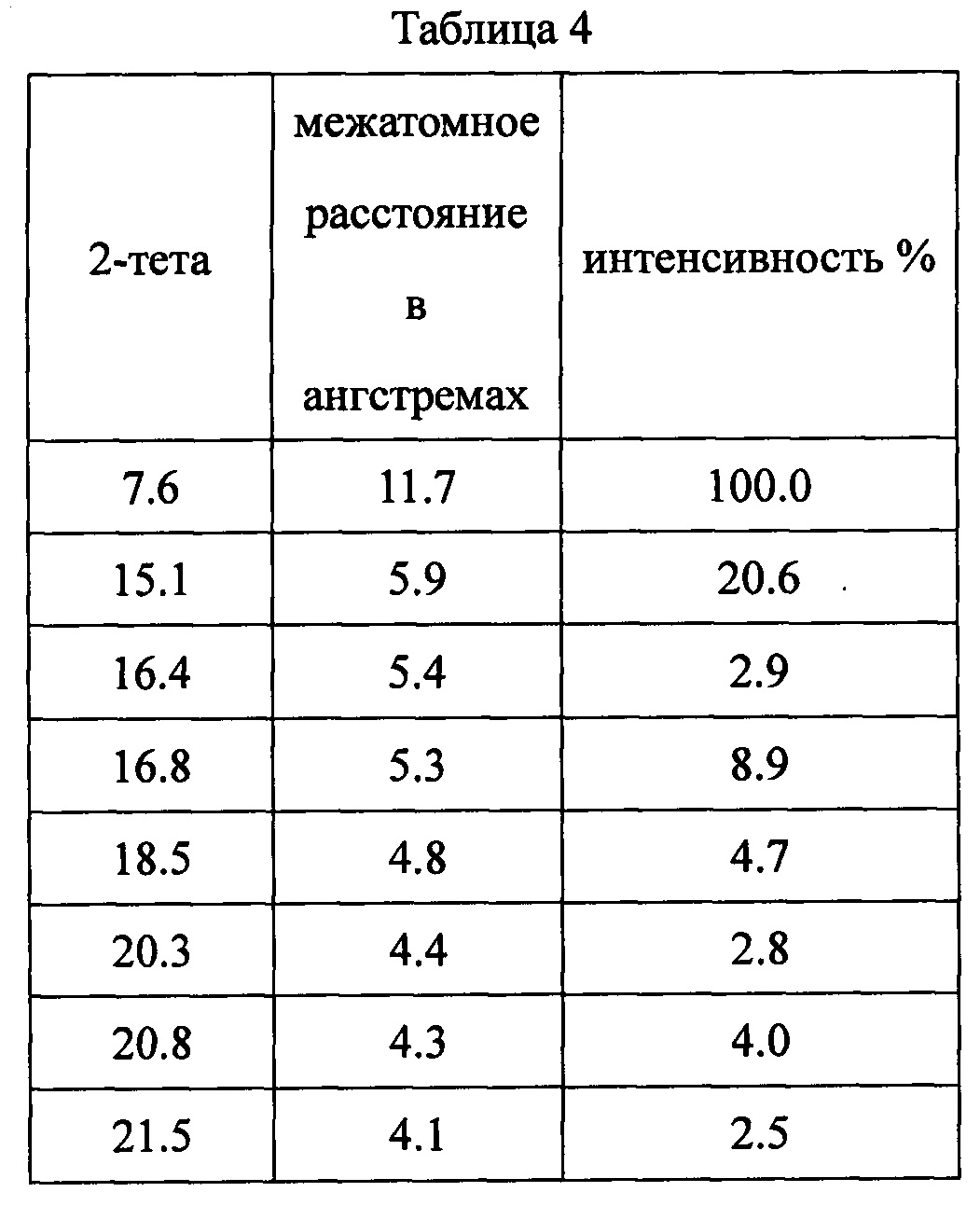
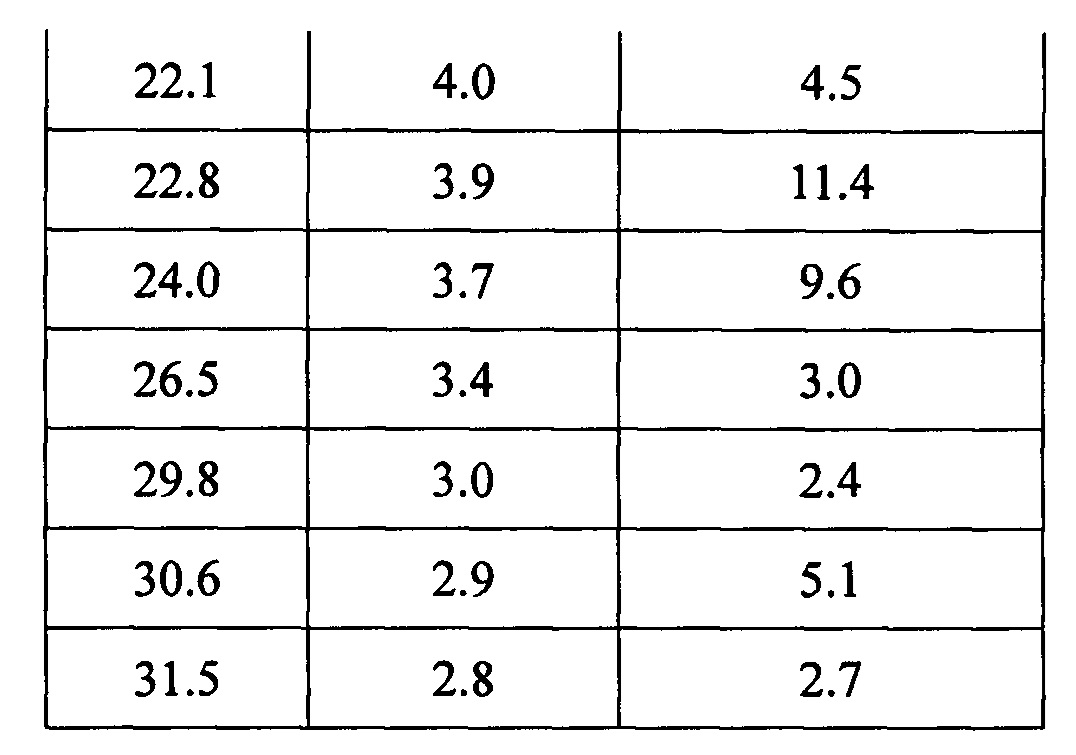
Данные XRPD приведены в Таблице 4.
Пример 5. Методы получения дициклоплатина
1) Добавляли 60,08 г 1,1-циклобутандикарбоновой кислоты (417,22 ммоль) и 593 мл деионизированной воды в 1-L кристаллизатор из темного стекла.
2) Загружали 118,6 г карбоплатина (319,46 ммоль) в тот же кристаллизатор, и перемешивали смесь в течение 6 часов при комнатной температуре.
3) Охлаждали смесь до 5°С со скоростью 0,33°С/мин и выдерживали при 5°С в течение 19 часов для образования осадка.
4) Фильтровали под вакуумом и промывали осадок 120 мл деионизированной воды, а затем высушивали под вакуумом влажный осадок.
5) Собирали твердую фазу из высушенного осадка и измеряли количество дициклоплатина.
6) Получали 148,52 г дициклоплатина с общим выходом 90,2%.
Продукт анализировали с помощью XRPD, DSC, TGA и1Н ЯМР.
Результаты1H-ЯМР: (400 МГц, ДМСО-d6) δ 12,63 (с, 2Н), 4,09 (с, 6Н), 2,67 (т, J=7,9 Гц, 4Н), 2,37 (т, J=8,0 Гц, 4Н), 1,95-1,77 (м, 2Н), 1,73-1,55 (м, 2Н).
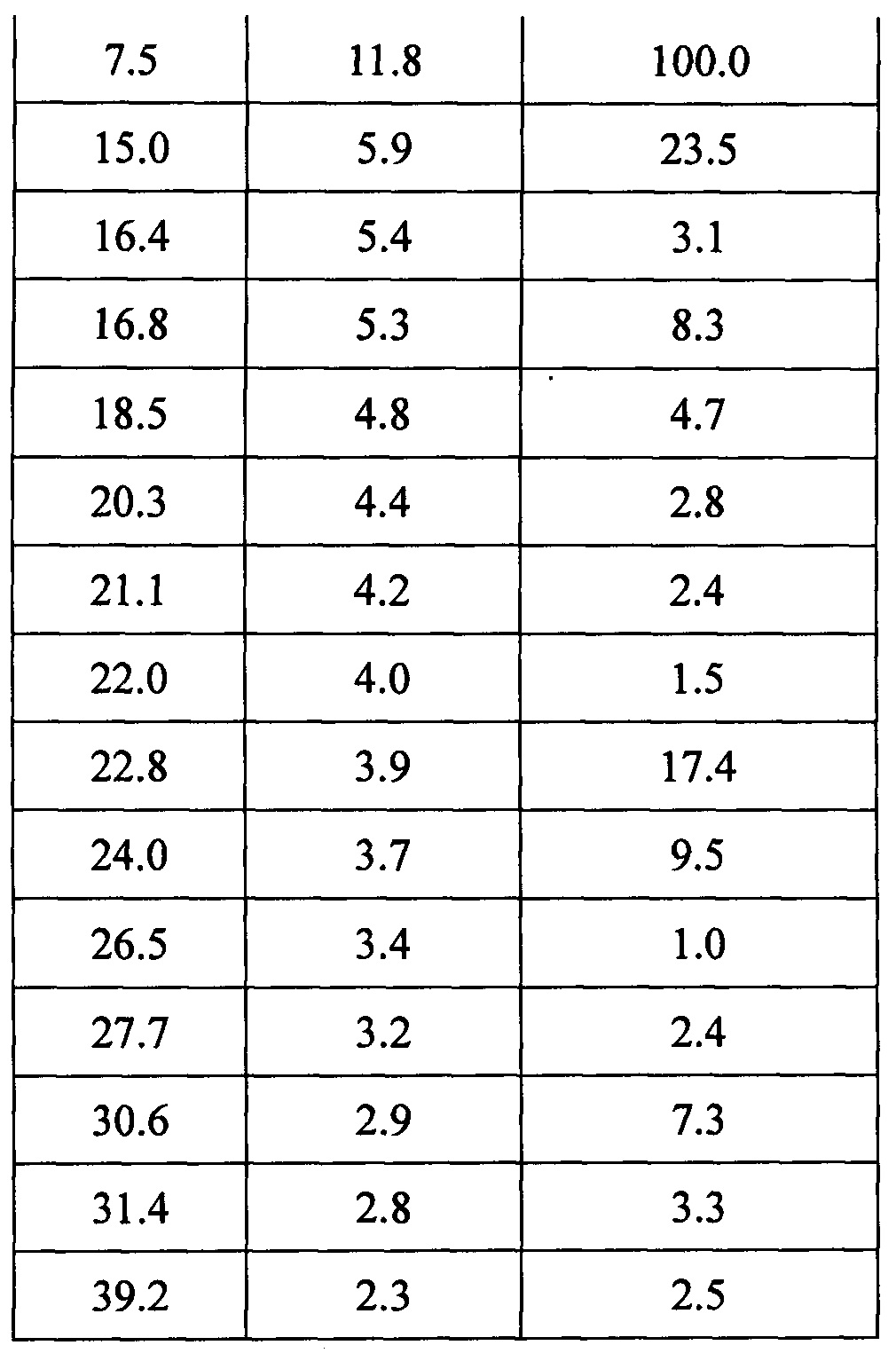
Данные XRPD приведены в Таблице 5.
Пример 6. Методы получения дициклоплатина
1) Добавляли 2,239 г 1,1-циклобутандикарбоновой кислоты (15,55 ммоль) и 15 мл деионизированной воды в стеклянный сосуд емкостью 20 мл.
2) Загружали 5,0 г карбоплатина (13,47 ммоль) в тот же флакон и перемешивали смесь при комнатной температуре.
3) Охлаждали смесь до 5°С со скоростью 0,33°С/мин и выдерживали при 5°С в течение 19 часов для образования осадка.
4) Фильтровали под вакуумом и промывали осадок 5 мл деионизированной воды, а затем высушивали под вакуумом влажный осадок.
5) Собирали твердую фазу и измеряли количество циклоплатина.
6) Получали 6,40 г дициклоплатина с общим выходом 92,2%.
Продукт анализировали с помощью XRPD, DSC, TGA и1H ЯМР.
Результаты1Н-ЯМР: (400 МГц, ДМСО-d6) δ 12,63 (с, 2Н), 4,09 (с, 6Н), 2,67 (т, J=7,9 Гц, 4Н), 2,37 (т, J=8,0 Гц, 4Н), 1,93-1,75 (м, 2Н), 1,74-1,51 (м, 2Н).
Данные XRPD приведены в Таблице 6.
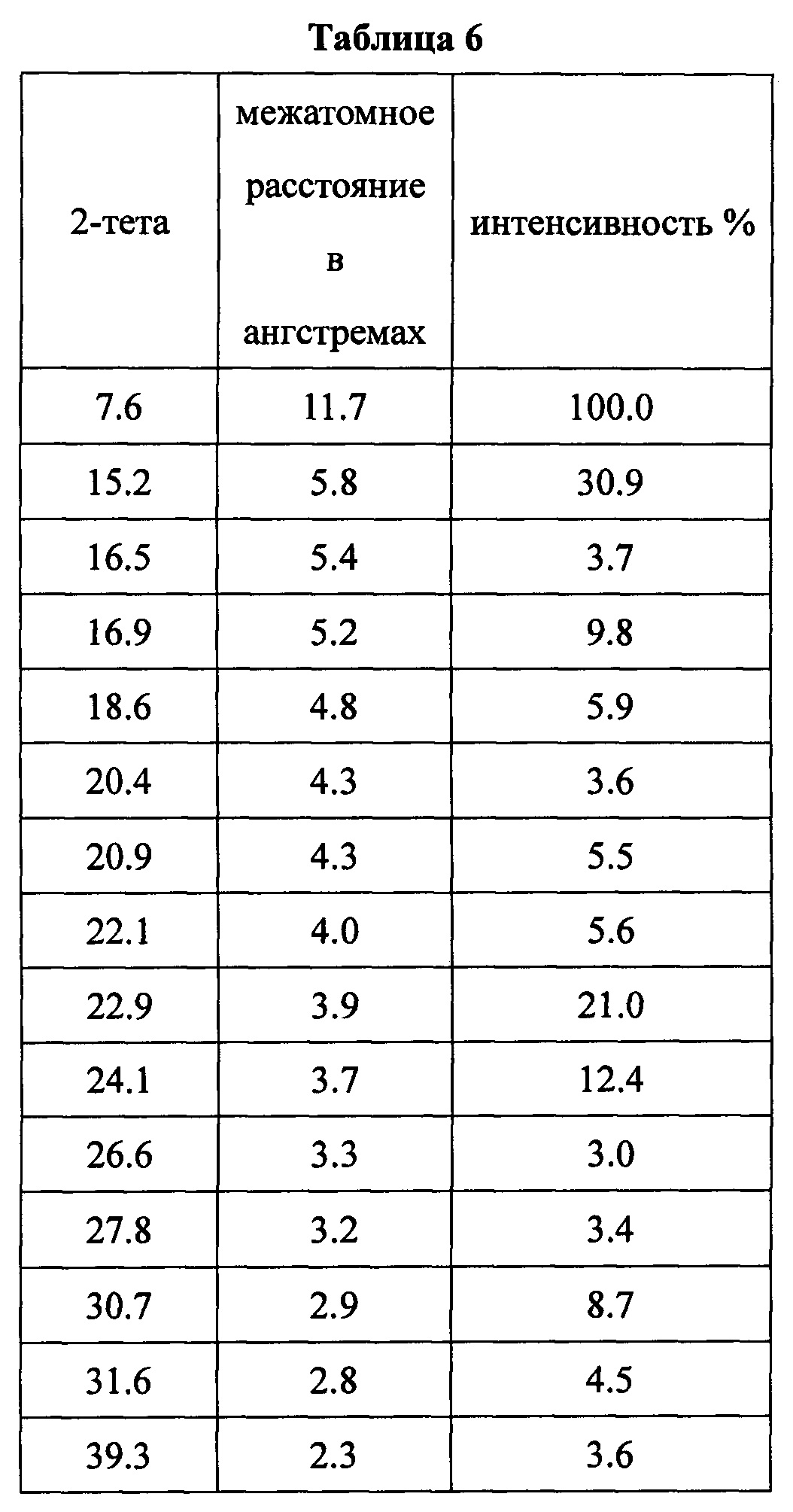
Типичные Результаты из Примеров 1-6
Спектры1Н-ЯМР из Примеров 1-6 очень схожи. На Фиг. 1 показан типичный1H-ЯМР-спектр продукта, полученного в Примере 1. Спектр1H-ЯМР показывает, что продукт содержит дициклоплатин, и что молярное соотношение двух компонентов (1,1-циклобутандикарбоновой кислоты и карбоплатина) в дициклоплатине составляет 1:1.
Картины рентгеновской порошковой дифракции (XRPD) из Примеров 1-6 также являются очень похожими. На Фиг. 2 показана типичная картина XRPD продукта, полученного в Примерах 1 и 2, по сравнению со стандартной картиной XRPD дициклоплатина (из Yang et al., Science China Chemistry, 40 (5): 485-491 (2010)), что указывает на то, что образец представлял собой дициклоплатин.
На Фиг. 3 показана типичная картина XRPD продукта, полученного в Примере 5, по сравнению со стандартной картиной XRPD карбоплатина, что указывает на отсутствие выявляемого карбоплатина в образце, полученном в приведенных выше Примерах.
Термограммы дифференциальной сканирующей калориметрии (DSC) из Примеров 1-6 также очень схожи. На Фиг. 4 показана типичная DSC-термограмма дициклоплатина, полученная в Примере 5, показывающая что, что не было обнаружено присутствия 1,1-циклобутандикарбоновой кислоты (то есть не было сигнала о температуре плавления 1,1-циклобутандикарбоновой кислоты при 159,7°С), в продуктах, полученных в приведенных выше Примерах.
Типичные термограммы термогравиметрического анализа (ТГА) из Примеров 1-6 являются также очень похожими. На Фиг. 5 показана типичная TGA термограмма продукта, полученного в Примере 5. Дициклоплатин имеет TGA термограмму, содержащую примерно 0,5% потерю массы до 150°С.
Пример 7. Методы получения дициклоплатина
1) Растворяли 50,0 мг карбоплатина (135 мкмоль) в 2,8 мл воды в стеклянном флаконе объемом 3 мл при комнатной температуре.
2) Добавляли 19,4 мг 1,1-циклобутандикарбоновой кислоты (135 мкмоль) в тот же флакон.
3) Перемешивали суспензию при комнатной температуре, для получения прозрачного раствора.
4) Переносили прозрачный раствор в круглодонную колбу емкостью 25 мл и выпаривали на роторном испарителе при температуре от 50 до 55°С для получения белой кристаллической твердой фазы.
5) Высушивали на воздухе твердую фазу, для получения продукта. Продукт анализировали с помощью XRPD, DSC и TGA.
Данные XRPD приведены в Таблице 7.
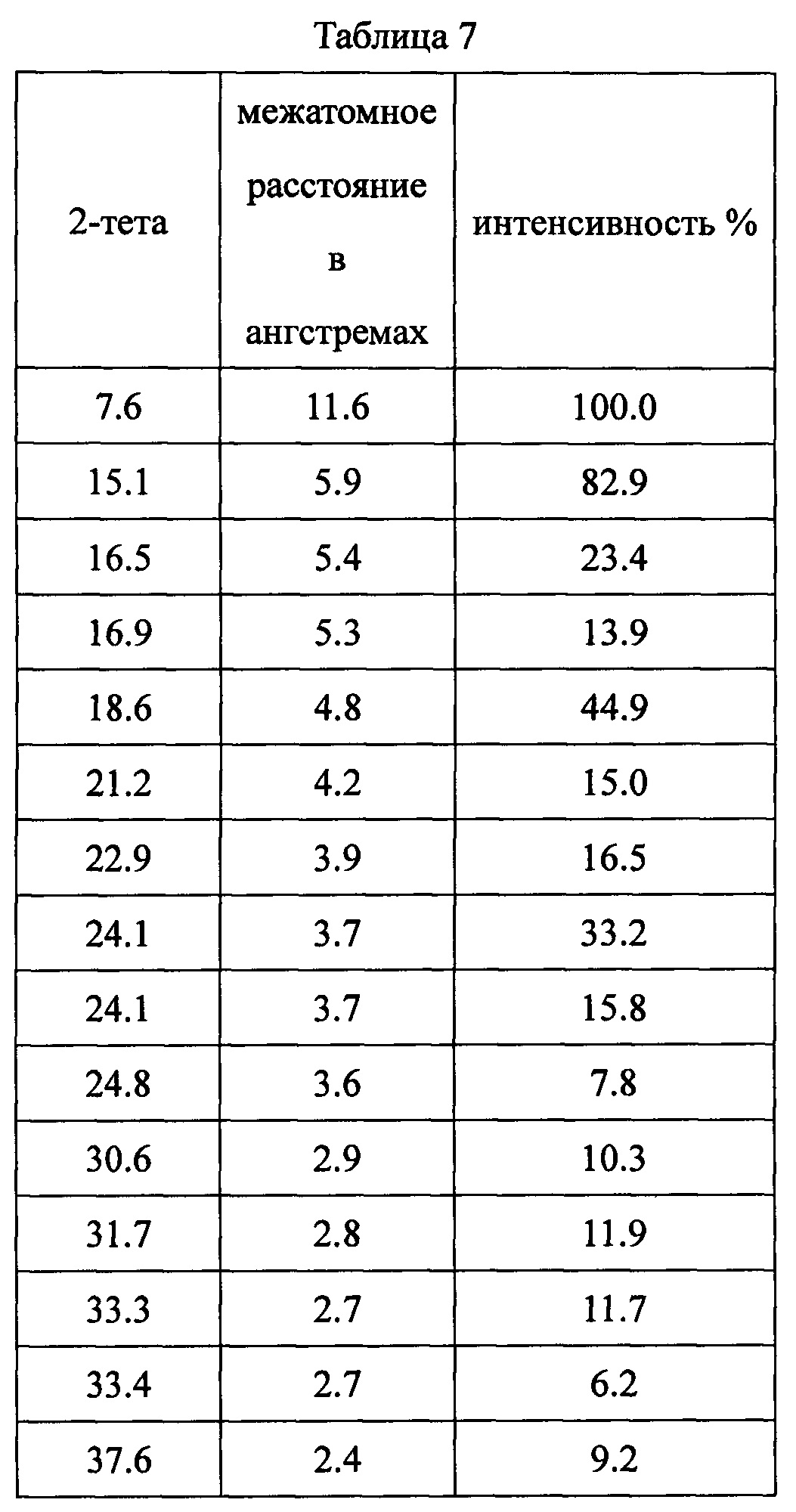
Пример 8. Методы получения дициклоплатина
1) Растворяли 15,1 мг карбоплатина (41 мкмоль) и 5,9 мг 1,1-циклобутандикарбоновой кислоты (41 мкмоль) в 1,0 мл воды, в стеклянном флаконе объемом 3 мл.
2) После фильтрования через фильтровальную мембрану 0,45 мкм, фильтрат переносили в 4-мл флакон. Закрывали флакон алюминиевой фольгой, чтобы держать раствор вдали от света и оставляли для свободного испарения раствора при комнатной температуре.
Продукт анализировали с помощью XRPD, DSC и TGA.
Данные XRPD приведены в Таблице 8.
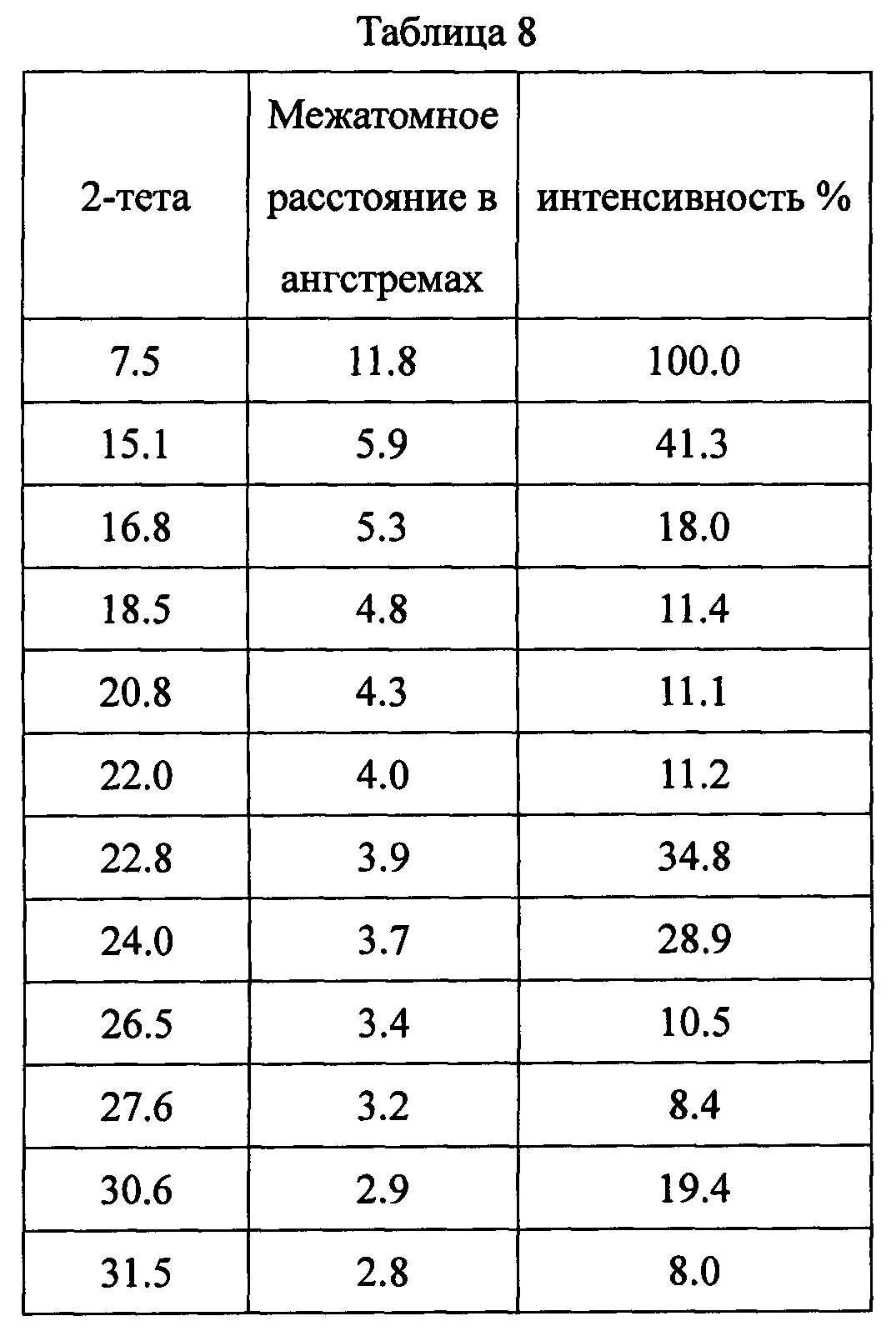
Пример 9. Способы получения дициклоплатина
1) Загружали 49,7 мг карбоплатина (134 мкмоль) в 2,8 мл воды, в 3 мл флакон и перемешивали суспензию с получением прозрачного раствора при комнатной температуре.
2) Добавляли 19,4 мг 1,1-циклобутандикарбоновой кислоты (135 мкмоль) в тот же флакон.
3) Перемешивали раствор во флаконе, обернутом алюминиевой фольгой при комнатной температуре.
4) Осаждение твердой фазы из суспензии наблюдали в течение примерно 15 мин и отделяли центрифугированием.
Продукт анализировали с помощью XRPD, DSC и TGA.
Данные XRPD приведены в Таблице 9.
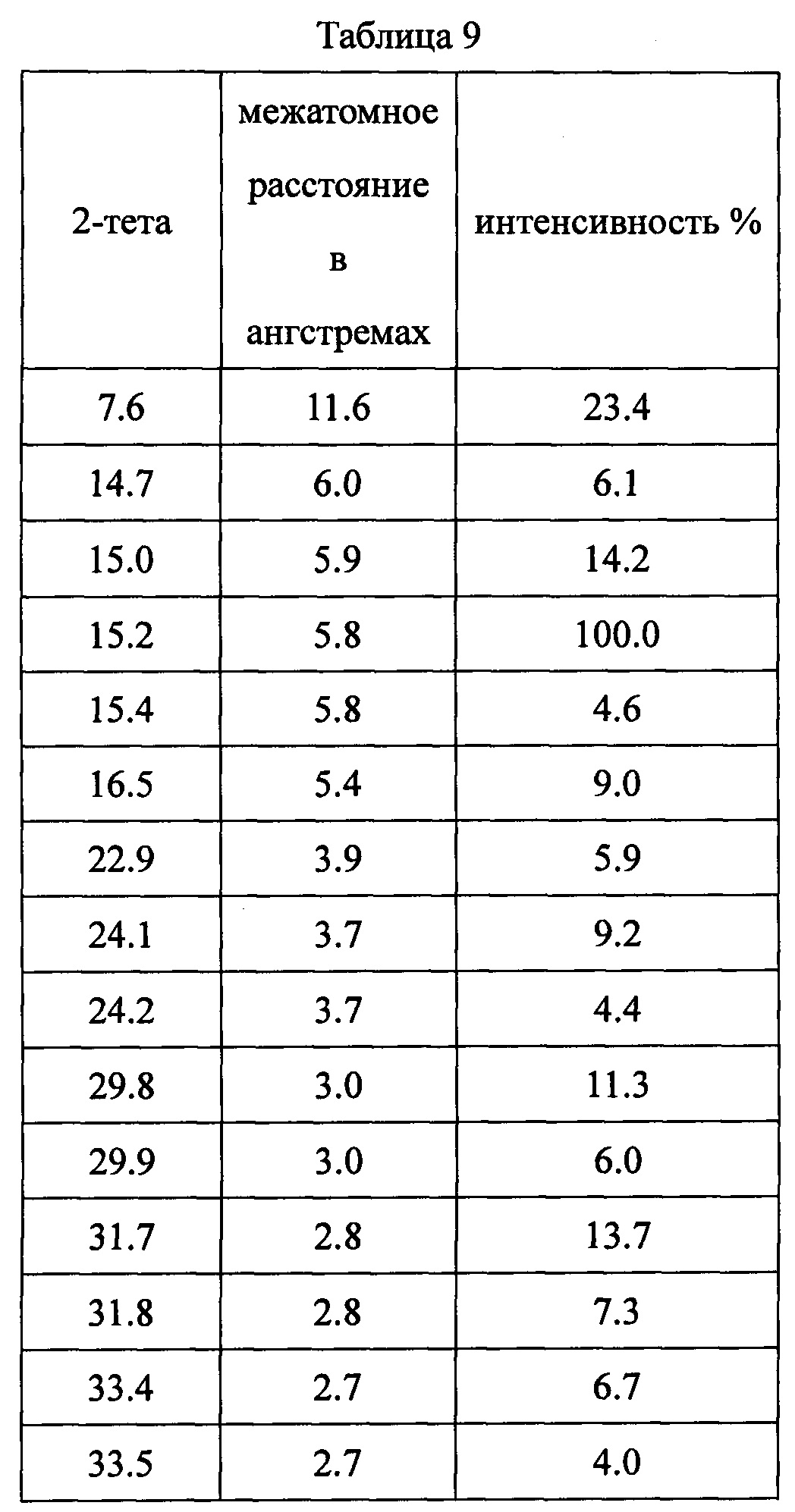
Испытание в соответствии с описанным способом.
Примеры 7-9 представляют эксперименты, проведенные в соответствии со способом, заявленным в патенте США 6699901. Кратко, карбоплатин растворяли в воде и к раствору добавляли циклобутандикарбоновую кислоту при перемешивании. Молярное соотношение карбоплатина и циклобутандикарбоновой кислоты составляло 1:1. Смесь полностью растворяли и раствор выпаривали с получением высушенного продукта. Результаты картины XRPD для продукта показаны на Фиг. 6.
Результаты XRPD показаны на Фиг. 6. По шкале соответствующей или выше, чем примерно 250 мг, конечный продукт содержал не только дициклоплатин, но также значительное количество карбоплатина, демонстрируемое картинами XRPD на Фиг. 6, где картины XRPD продукта иллюстрируют аналогичные пики по сравнению со стандартным XRPD карбоплатина. Кроме того, оказалось, что карбоплатин трудно удалить, что делает весь продукт непригодным для использования.
Высокий уровень карбоплатина, присутствующего в конечном продукте, может быть обусловлен несколькими причинами. Использование молярного соотношения 1:1 может быть одной из причин того, что карбоплатин все еще присутствует. Поскольку в описанном способе необходимо испарение, дициклоплатин разрушался в продукте, поскольку он чувствителен к высокой температуре.
Кроме того, в дополнительных исследованиях полиморфных форм дициклоплатина было установлено, что использование более коротких алифатических спиртов (описанных в патенте США 6699901), таких как метанол, этанол, изопропанол и бутанол, приводило к тому, что значительное количество карбоплатина оставалось в продукте из-за диспропорционирования. Кроме того, растворимость дициклоплатина в воде является ограниченной (40 мг/мл при комнатной температуре), и было отмечено, что суспензия дициклоплатина в горячей воде вызывает частичный гидролиз). Таким образом, перекристаллизация в воде была неэффективной и ее трудно было увеличить.
Как видно из результатов текущих Примеров, описанный способ не был полноценным и его трудно было расширить.
Пример 10. Получение дициклоплатина с использованием дихлорметана (ДХМ) в качестве растворителя.
1) Загружали 500 мг карбоплатина (1,347 ммоль) в 20 мл ДХМ в колбу на 50 мл и перемешивали суспензию для получения прозрачного раствора при комнатной температуре.
2) В эту же колбу добавляли 582 мг 1,1-циклобутандикарбоновой кислоты (4,038 ммоль).
3) Перемешивали раствор во флаконе, обернутом алюминиевой фольгой при температуре 20~35°С.
4) Перемешивали в течение 12 часов, а затем фильтровали, промывали DSM.
Продукт, полученный в этом Примере, анализировали с помощью XRPD, DSC и TGA.
На Фиг. 7 показана типичная картина XRPD для продукта, полученного в соответствии со способом Примера 10. Результаты показывают, что продукт содержит дициклоплатин, и не содержит карбоплатин в выявляемом количестве.
Пример 11. Получение дициклоплатина с использованием различных растворителей. Для приготовления дициклоплатина использовали различные растворители, включая органические растворители. Сводная информация о продуктах приведена в Таблице 10.
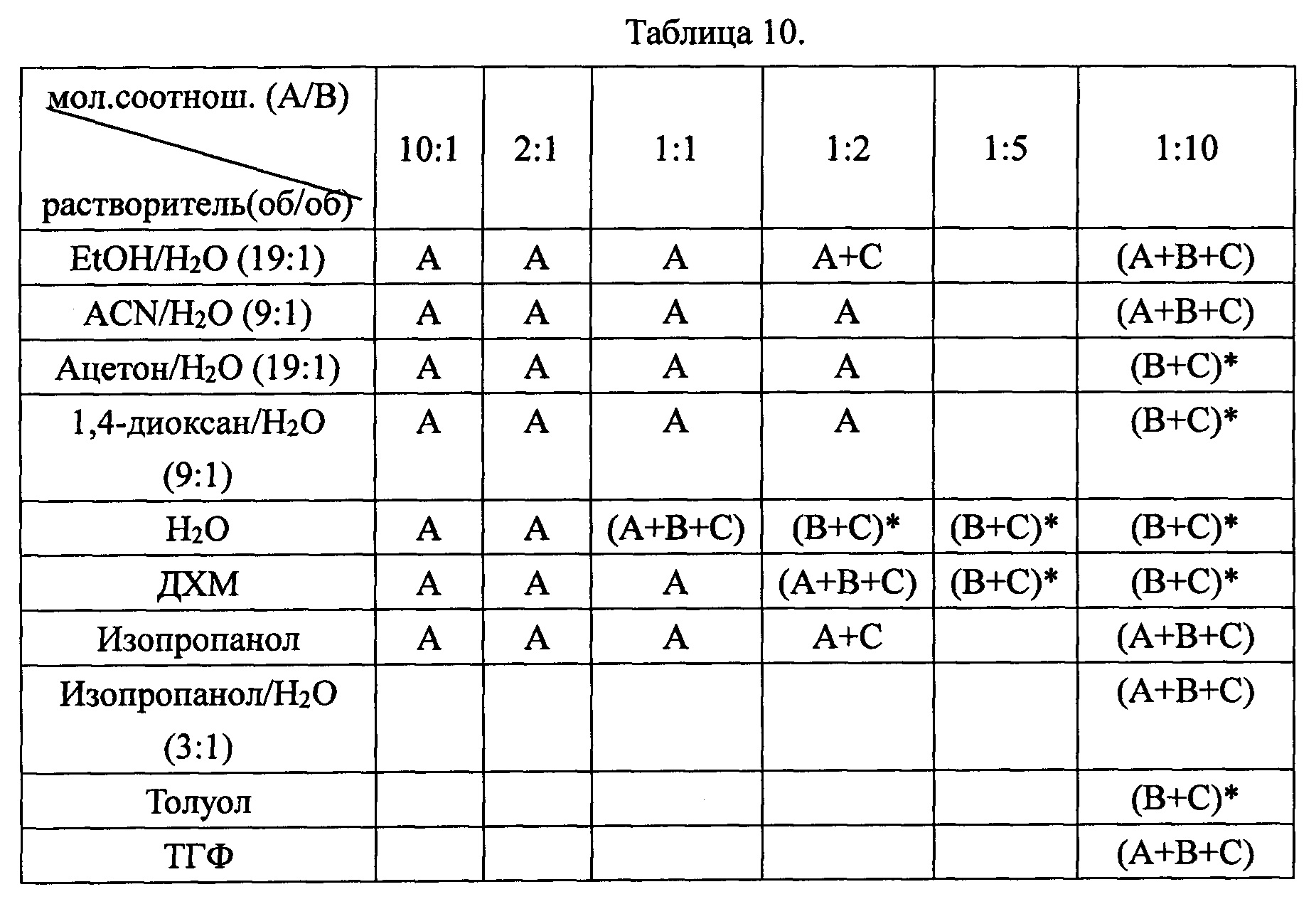
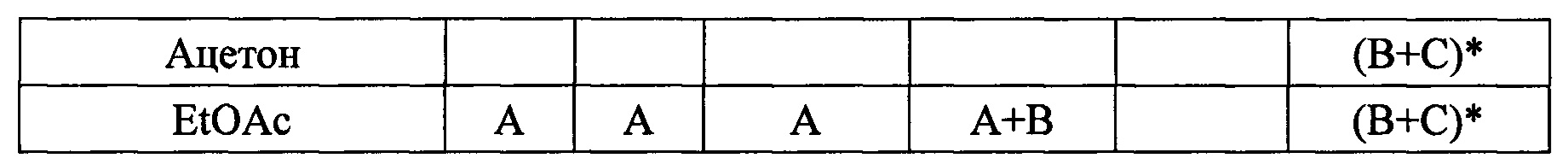
(1) А: карбоплатин; В: 1,1-циклобутанкарбоновая кислота; С: дициклоплатин
(2) * указывает, что по существу чистый дициклоплатин был получен в значительном количестве после дополнительной обработки, такой как фильтрование, промывка и сушка.
Таблица 10 показывает исходный продукт после осаждения. 1,1-циклобутанкарбоновая кислота может быть легко удалена, но карбоплатин не может быть удален. Поэтому для получения чистого дициклоплатина следует предотвращать совместное осаждение карбоплатина.
Реферат
Изобретение относится к способу получения дициклоплатина формулы (I).Способ включает объединение карбоплатина с соответствующей пропорцией 1,1-циклобутандикарбоновой кислоты и растворителя с образованием суспензии, отделение образовавшейся осажденной твердой фазы от суспензии и сушку твердой фазы, где твердая фаза содержит дициклоплатин формулы (I) без присутствия обнаруживаемого количества карбоплатина. Молярное соотношение карбоплатина и 1,1-циклобутандикарбоновой кислоты на стадии объединения составляет от примерно 1:1,15 до примерно 1:50. Способ по изобретению прост в применении, включает умеренные условия, быстрое время реакции, высокую воспроизводимость и позволяет получить продукт, не содержащий карбоплатин в выявляемом количестве. 13 з.п. ф-лы, 7 ил., 10 табл., 11 пр.
Формула
Документы, цитированные в отчёте о поиске
Получение комплексов платины(ii)
Комплексные соединения платины (ii), способ их получения, промежуточные соединения и способы их получения

Комментарии