Наносоединения платины и способы их применения - RU2538199C2
Код документа: RU2538199C2
Чертежи









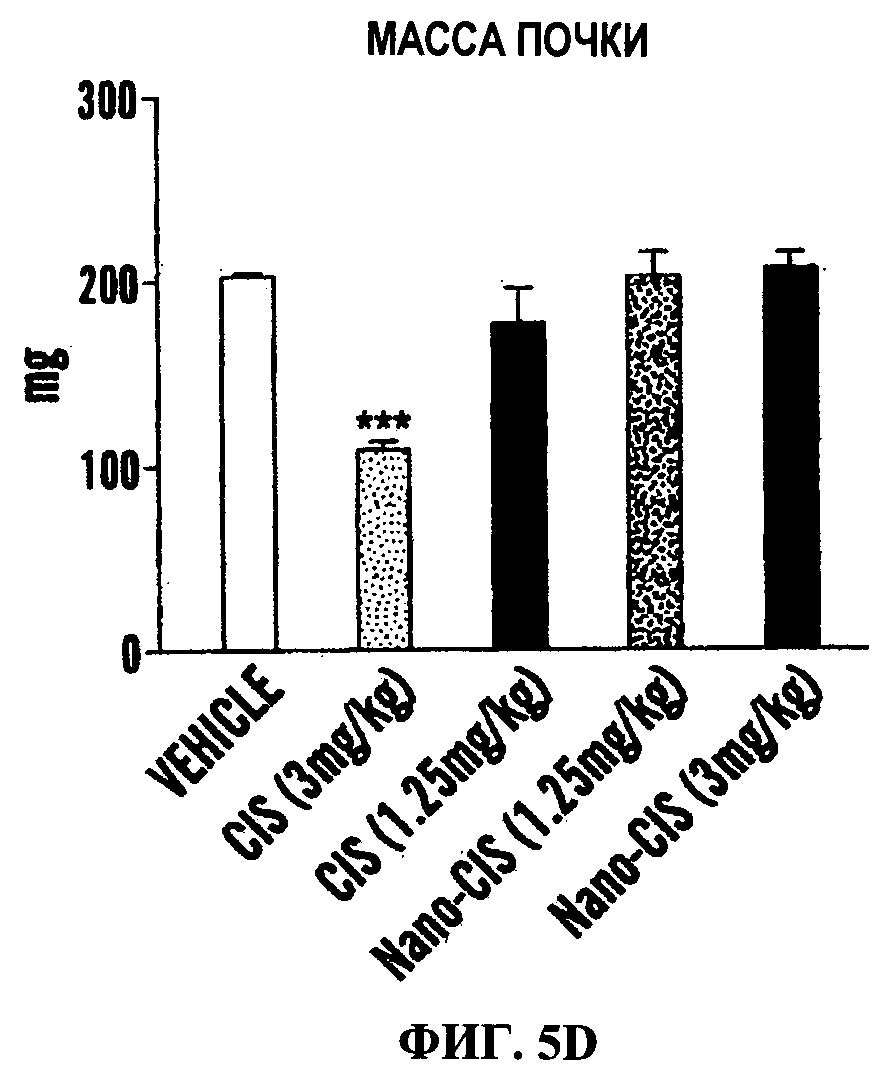













































Описание
По настоящей заявке испрашивается приоритет и преимущество согласно 35 U.S.С. 119(е) Американской предварительной заявки 61/149,725, поданной 4 февраля 2009 года и 61/240,007, поданной 4 сентября 2009 года, содержание которых во всей своей полноте вводится в настоящее описание посредством ссылки.
Настоящее изобретение осуществлено по гранту «Era of Hope Scholar Award» от Министерства обороны США с номером W81XWH-07-1-0482 и гранду «Postdoctoral Award» от Министерства обороны США с номером W81XWH-09-1-0728. Правительство США имеет определенные права на данное изобретение.
Область техники, к которой относится изобретение
Настоящее изобретение относится к биосовместимым конъюгированным полимерным наночастицам, включающим основную цепь сополимера, множество боковых цепей, ковалентно связанных с основной цепью, и множество соединений платины, диссоциируемо связанных с основной цепью.
Уровень техники
Рак является второй ведущей причиной смертности в США с прогнозируемыми 1444180 новыми случаями и 565650 смертельными исходами в 2008 году. Цитотоксические средства, которые применяются в стандартной химиотерапии, неизбирательно воздействуют на любые клетки, находящиеся в процессе деления, что вызывает дозолимитирующие токсические эффекты. Существует острая потребность в развитии новых стратегий, более избирательно воздействующих на опухоль.
Применение нановекторов содержит в себе потенциал для качественного изменения химиотерапии раковых заболеваний путем избирательного воздействия на опухоль. Ряд полимерных нановекторов находятся в настоящее время в разработке или на стадии клинических испытаний, и сильно изменяют фармакодинамический и фармакокинетический профиль активного агента. Однако большинство этих полимерных структур снижают эффективность конъюгированного активного агента, основанную на увеличении поглощения опухолью для повышения терапевтического индекса.
Цисплатин является одним из основных направлений в режимах химиотерапии для большинства видов рака (Kelland L. The resurgence of platinum-based cancer chemotherapy. Nat Rev Cancer. 2007 Aug; 7(8):573-84). Однако его применение ограничено из-за сильной нефротоксичности. К тому же нановекторный состав на основе цисплатина, являющегося терапией первой линии для многих видов рака, представляет собой проблему, требующую усилий.
Раскрытие изобретения
Представлено рациональное конструирование полимерной структуры для химиотерапевтического средства на основе платины, такого как цисплатин и оксалиплатин, которая вызывает самосборку в наночастицу. Наночастица поддерживает эффективность активного агента и по сравнению с цисплатином, или оксалиплатином, или карбоплатином оказывает повышенное противоопухолевое действие с пониженной системной и нефротоксичностью при внутривенном введении мышам, несущим опухоль. Данное повышение терапевтического индекса цисплатина или оксалиплатина, возможное благодаря нанотехнологии, может быть использовано для применения наноплатинатов в клиническом лечении многих видов рака.
Изобретение направлено на биосовместимую конъюгированную полимерную наночастицу, включающую основную цепь сополимера, множество боковых цепей, ковалентно связанных с указанной основной цепью, и множество соединений платины, диссоциируемо связанных с указанной основной цепью. В целом, соединение платины диссоциируемо связано с основной цепью посредством связи через боковую цепь. В некоторых вариантах соединение платины связано с боковой цепью, по меньшей мере, через одну координационную связь.
Другой аспект изобретения направлен на биосовместимые конъюгированные полимерные наночастицы, включающие основную цепь полималеиновой кислоты (РМА), такую как основная цепь поли(изобутилен-alt-малеиновой кислоты) (PIMA). Основная цепь включает от 25 до 50 мономеров. Также включенными являются множество боковых цепей PEG, ковалентно связанных с указанной основной цепью. Боковые цепи PEG имеют молекулярную массу от 200 до 3000 дальтон. Количество боковых цепей PEG составляет от 50% до 100% включительно количества мономерных звеньев основной цепи полимера. Также включенными являются множество боковых групп цисплатина или оксалиплатина, диссоциируемо связанных с основной цепью. Количество боковых групп цисплатина составляет от 25% до 75% включительно количества мономерных звеньев основной цепи полимера.
Еще другой аспект изобретения направлен на биосовместимые конъюгированные полимерные наночастицы, включающие основную цепь поли(изобутилен-alt-малеиновой кислоты). Основная цепь состоит примерно из 40 мономеров. Также включенными являются множество боковых цепей PEG, ковалентно связанных с основной цепью. Боковые цепи PEG имеют молекулярную массу примерно 2000 дальтон. Количество боковых цепей PEG больше чем 90% мономерных звеньев указанной основной цепи полимера. Также включенными являются множество боковых групп цисплатина или оксалиплатина, диссоциируемо связанных с основной цепью. Количество боковых групп цисплатина или оксалиплатина составляет от 25% до 75% включительно количества мономерных звеньев основной цепи полимера.
Еще другой аспект изобретения направлен на биосовместимые конъюгированные полимерные наночастицы, включающие основную цепь поли(изобутилен-alt-малеиновой кислоты). Основная цепь включает от 25 до 50 мономеров. Также включенными являются множество боковых цепей глюкозамина, ковалентно связанных с указанной основной цепью. Количество боковых цепей глюкозамина составляет от 50% до 100% включительно мономерных звеньев указанной основной цепи полимера. Также включенными являются множество боковых групп цисплатина или оксалиплатина, диссоциируемо связанных с основной цепью. Количество боковых групп цисплатина или оксалиплатина составляет от 25% до 75% включительно количество мономерных звеньев основной цепи полимера.
Другой аспект изобретения направлен на биосовместимые конъюгированные полимерные наночастицы, включающие основную цепь поли(изобутилен-alt-малеиновой кислоты). Основная цепь содержит от 25 до 50 мономеров. Также включенными являются множество боковых цепей глюкозамина, ковалентно связанных с указанной основной цепью. Количество боковых цепей глюкозамина больше чем 75% мономерных звеньев указанной основной цепи полимера. Также включенными являются множество боковых групп цисплатина или оксалиплатина, диссоциируемо связанных с основной цепью. Количество боковых групп цисплатина или оксалиплатина составляет от 25% до 75% включительно количества мономерных звеньев основной цепи полимера.
Еще другой аспект изобретения направлен на наночастицы, конъюгированные с комплексом карбоновая кислота-платина II (Pt(II)), включающие комплекс карбоновая кислота-(Pt(II)) и множество липид-полимерных цепей. Карбоновая часть указанного комплекса карбоновая кислота-цисплатин/оксалиплатин является ковалентно связанной с указанными липид-полимерными цепями.
Другой аспект изобретения направлен на везикулярное, мицеллярное или липосомное соединение, включающее множество наночастиц формулы, как описано здесь.
Еще другой аспект изобретения направлен на фармацевтические композиции, включающие любые наночастицы или соединения, описанные здесь, и фармацевтически приемлемый носитель.
Еще другой аспект изобретения направлен на способ лечения рака или метастаз. Способ включает выбор субъекта, нуждающегося в лечении рака или метастаз, и введение субъекту эффективного количества любых наночастиц, соединений или композиций, описанных здесь.
Перечень фигур
Фигура 1 представляет схему синтеза РМА-Цисплатин. Нагрузка разного количества цисплатина на полимер влияет на размер наночастиц, как измерено методом DLS или ТЕМ. Показан график исследования цитотоксичности носителя полиизобутилен-малеиновой кислоты (PIMA) 2 и конъюгата (Р1МА-ЦИСПЛАТИН) (6).
Фигура 2 показывает схему дериватизации РМА с помощью EDA. Дериватизированный полимер использовали для синтеза комплекса цисплатина. График показывает действие разных обработок на жизнеспособность клеток LLC через 48 часов инкубирования.
Фигура 3 показывает схему синтеза PMA-GA-Цисплатин. Образование комплекса с цисплатином проводили в течение 48 часов. Это вызвало образование наночастиц с размером в диапазоне примерно 100 нм, как видно из измерений DLS.
Фигура 4. График слева показывает количество активного цисплатина, который высвобождается из наночастицы PMA-GA-Цисплатин при инкубировании с лизатом LLC. График справа «концентрация-эффект» показывает действие разных обработок на жизнеспособность клеток карциномы легкого Льюис при инкубировании с активными агентами в течение 48 часов. Жизнеспособность клеток измеряли с помощью MTS анализа.
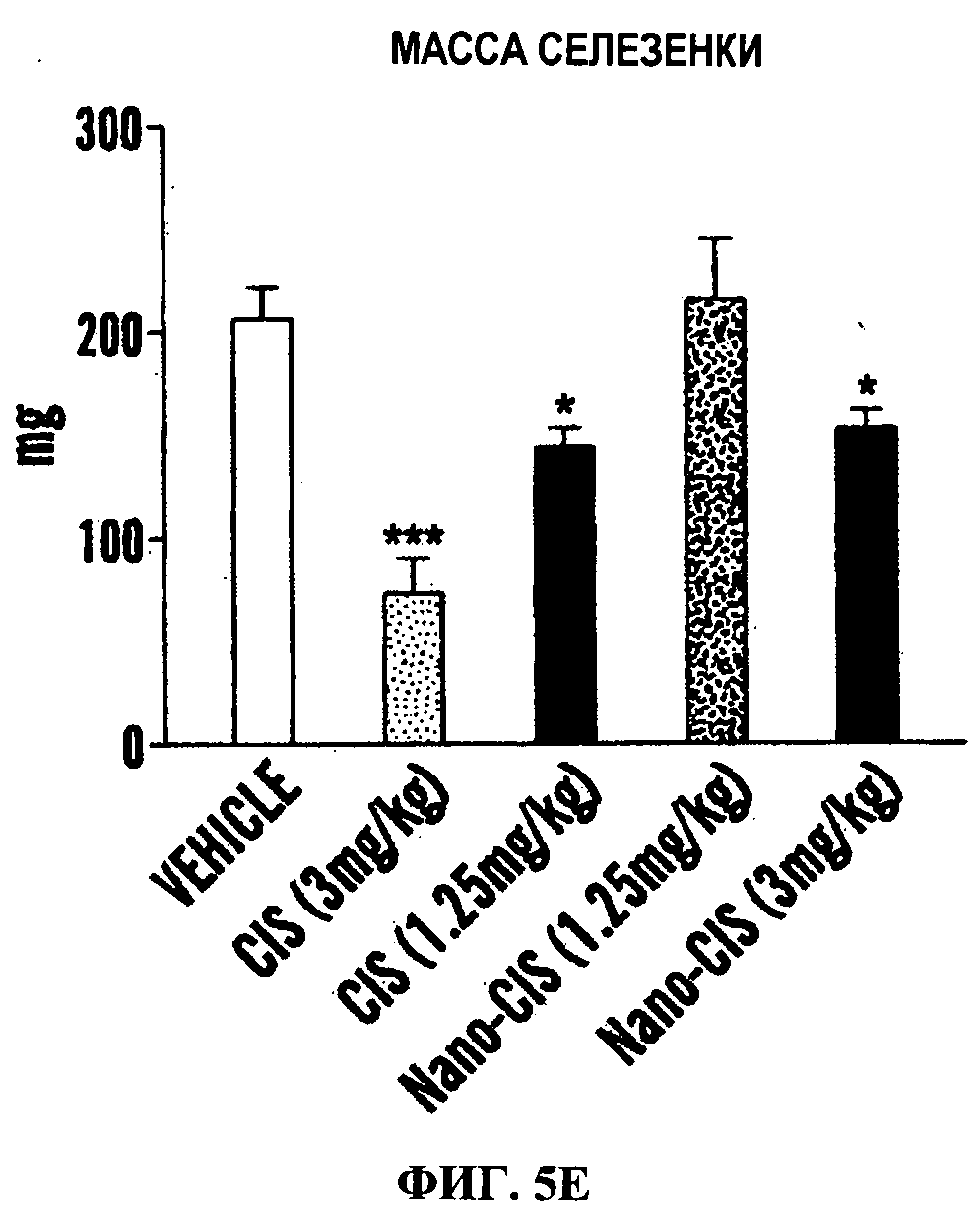
Фигуры 5А-5Е являются линейными графиками (Фиг.5А и 5В) и гистограммами (Фиг.5С-5Е), показывающими эффективность и профиль токсичности свободного цисплатина и наночастицы цисплатина в модели карциномы легкого Льюис. Опухоли индуцировали путем инъекции клеток LLC мышам c57/BL6. Показано действие обработок на объем опухоли (Фиг.15А) и массу тела (Фиг.5В) в течение периода обработки. Животным трижды вводили дозу (показано стрелками на оси X). Данные представлены как среднее±станд.откл., n=4-8. Также показано действие обработки на массу почек (Фиг.5С) и селезенки (Фиг.5D) как маркер нефротоксичности и гематологической токсичности (n=4-6). Изображения в верхней части каждого графика показывают иллюстративные органы от каждой обрабатываемой группы. Фиг.5Е показывает биораспределение Pt в почках и опухоли, измеренное с использованием ICP-спектроскопии через 24 ч после ведения свободного цисплатина или наночастиц цисплатина (доза цисплатина 8 мг/кг).
Фигура 6 представляет собой схему, показывающую синтез PMA-GA-Цисплатин (8).
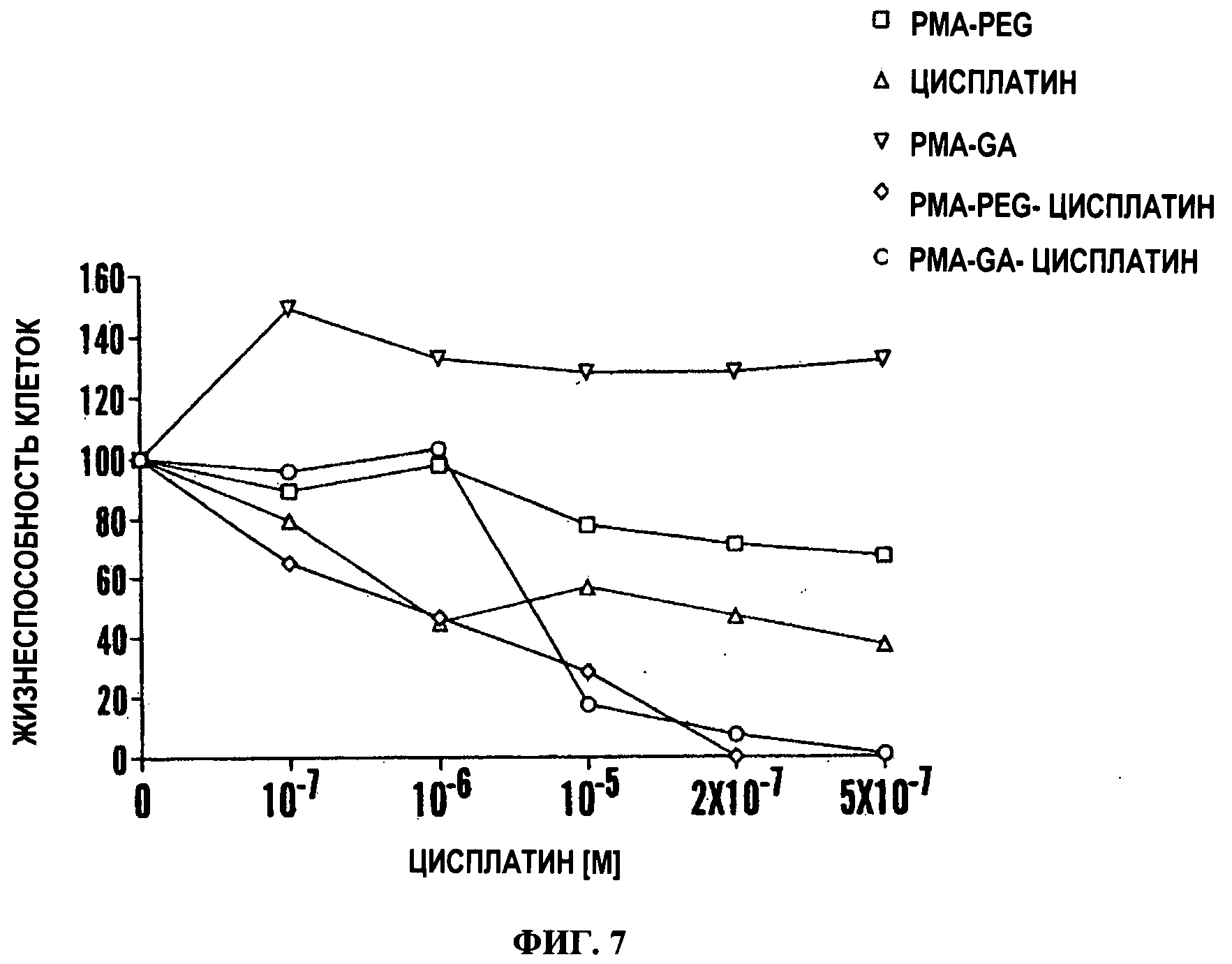
Фигура 7. Действие PMA-GA-Цисплатин на карциному легкого Льюис. Клетки инкубировали в течение 48 часов с лекарственными средствами или носителями и затем тестировали на жизнеспособность с использованием MTS анализа.
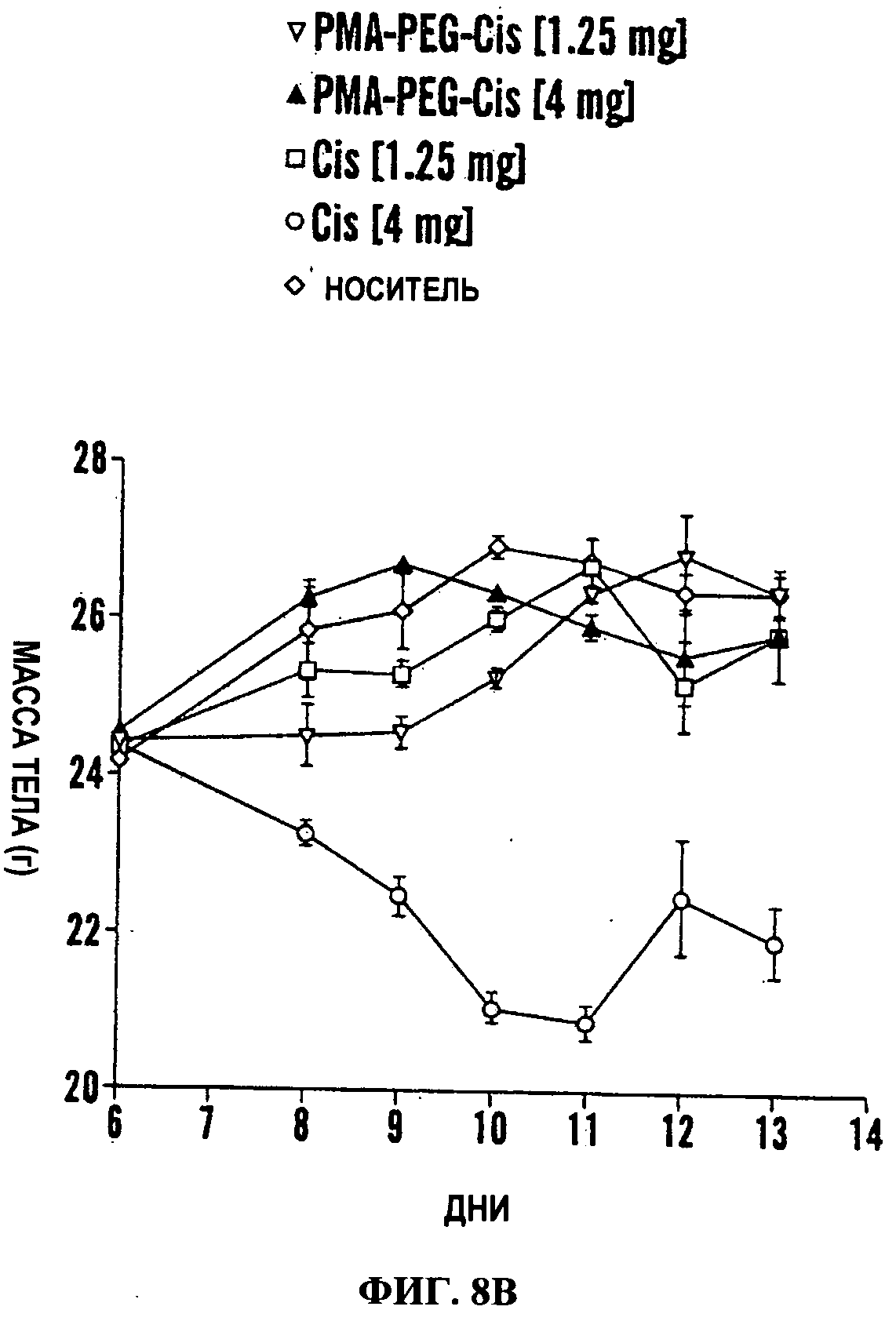
Фигура 8. Действие разных обработок на рост опухоли и массу тела in vivo. Опухоли индуцировали путем инъекции LLC клеток мышам c57/BL6.
Фигура 9 представляет собой график количества платины, нагруженной в полимер, которое было рассчитано с использованием метода UV-VIS спектроскопии.
Фигура 10. Схема, показывающая синтез липидного комплекса малеиновая кислота-цисплатин, который может образовывать мицеллы в воде.
Фигуры 11А и 11В являются схемами, показывающими конструирование наночастицы цисплатина на основе SAR. Фиг.11А показывает механизм, лежащий в основе внутриклеточной активации цисплатина посредством гидратирования. Уходящие группы цисплатина и аналогов (показано синими линиями) заменены ОН до ДНК-связывания. Фиг.11В показывает химический синтез PIMA-цисплатин и комплекса PIMA-глюкозамин (PIMA-GA)-цисплатин. Трансформация полималеинового ангидрида (n=40) (I) в полималеиновую кислоту [PIMA] (2) делает возможным комплексообразование [NH2]2Pt[OH]2 через дикарбоксилато связь (6). Дериватизация одного фрагмента PIMA глюкозамином (4) и образование комплекса с [NH2]2Pt[OH]2 может привести к образованию двух изомеров (8) и (10), в зависимости от рН, характеризующихся уникальными ЯМР спектрами Pt (Фиг.11В).
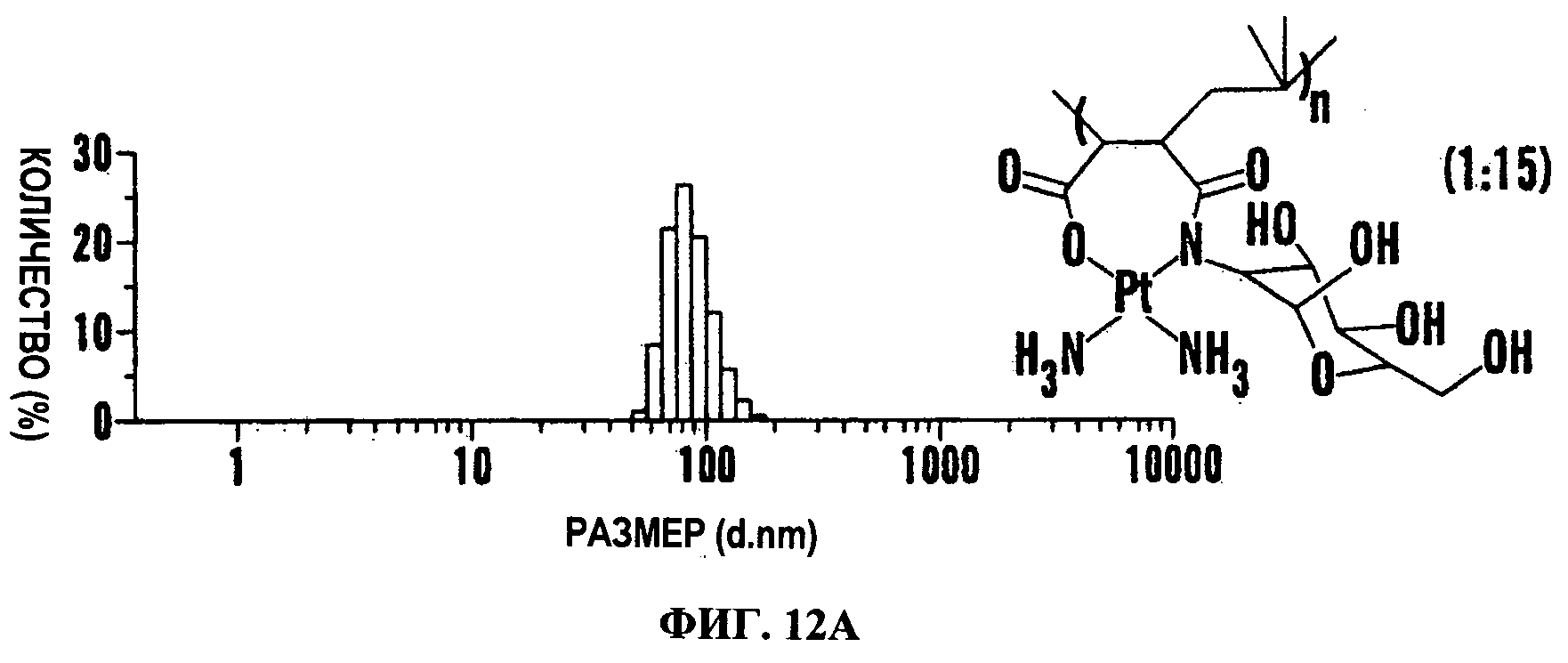
Фигуры 12А и 12В представляют характеристику наночастиц цисплатина. Повышение количества Pt на основной цепи PIMA (n=40) увеличивает размер образующейся наночастицы. При оптимальном соотношении Pt к полимеру авторы изобретения получили наночастицы меньше чем 150 нм, размер отсечен ниже, что делает возможным преимущественный хоминг в опухоли. На Фиг.12А показано, что при дериватизации всех мономерных звеньев PIMA глюкозамином и последовательном комплексообразовании с Pt образуются наночастицы меньше чем 150 нм. На Фиг.12В показано общее количество платины, нагруженное на мг полимера при данном соотношении.
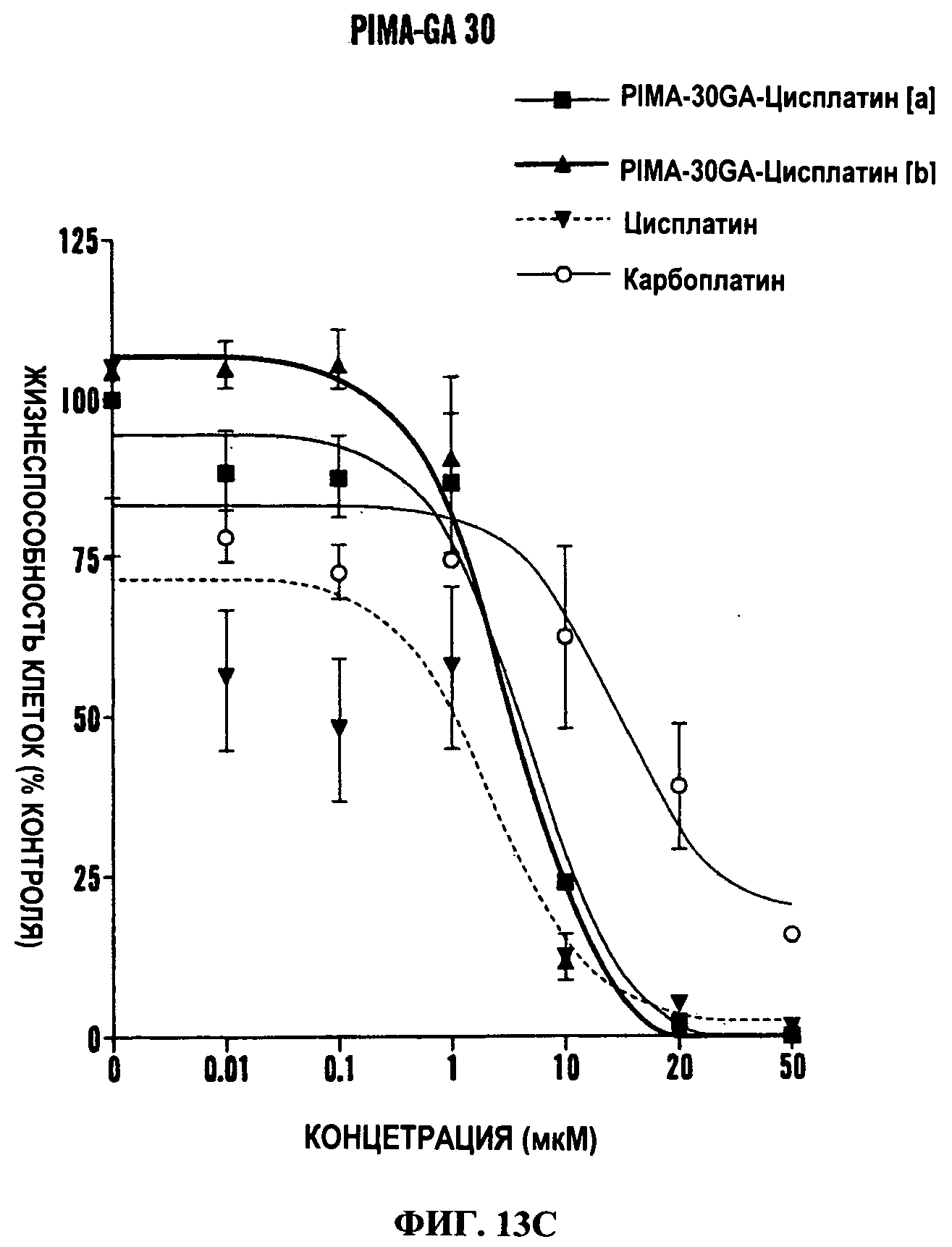
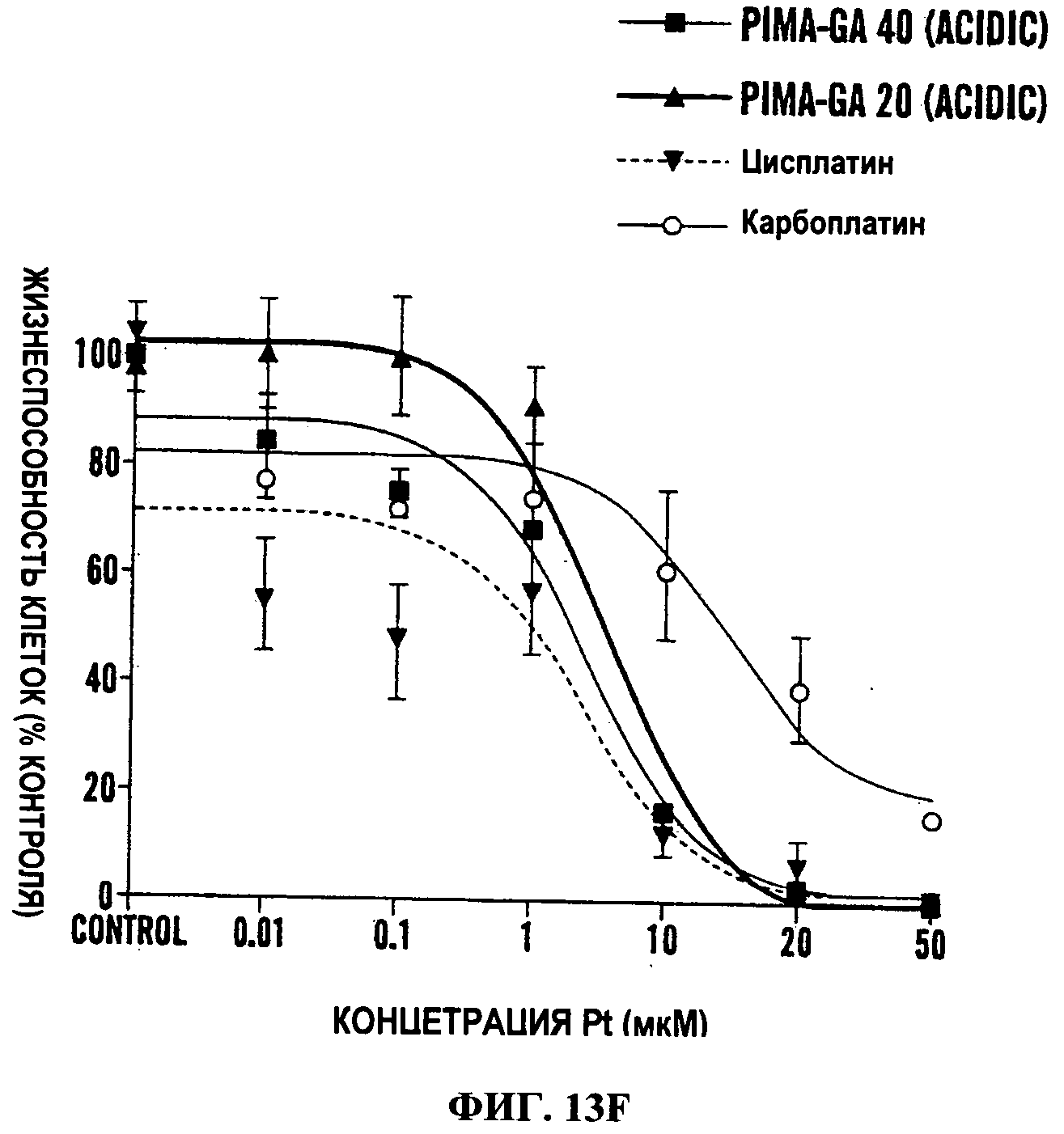
Фиг.13А-13Е представляют собой линейные графики, показывающие in vitro характеристику наночастиц цисплатина. На Фиг.13А и 13В показана зависимость «концентрация-эффект» разных обработок на жизнеспособность клеток, как измерено с использованием MTS анализа. Ось Х показывает эквивалентные концентрации цисплатина. При использовании полимерных контролей доза используемого полимера была эквивалентна дозе, которую использовали для доставки этой конкретной дозы цисплатина в комплексную форму. PIMA также был дериватизирован этилендиамином для образования PIMA-EDA, что обеспечивает среду для образования комплекса с платиной, аналогичную PIMA-GA. В отличие от PIMA-GA, PIMA-EDA проявляет внутреннюю токсичность. PIMA-GA-Цисплатин [кислый] относится к изомеру, образованному в кислой среде комплексообразования, в то время как PIMA-GA-Цисплатин [щелочной] относится к изомеру, образованному в щелочной среде. На Фиг.13С-13Е показано действие наночастиц PIMA-GA-Цисплатин на жизнеспособность LLC клеток, когда основная цепь PIMA (40 мономерных звеньев) является дериватизированной до разной степени. PIMA-GA-Цисплатин содержит 30 из 40 мономерных звеньев, дериватизированных глюкозамином, в то время как все мономерные звенья PIMA-GA-40 и PIMA-GA-200 являются дериватизированными. [а] и [b] относятся к изомерам, образованным в кислой и щелочной средах, когда полимеры образуют комплекс с цисплатином. В Таблице 1 представлены соответствующие значения IC50.
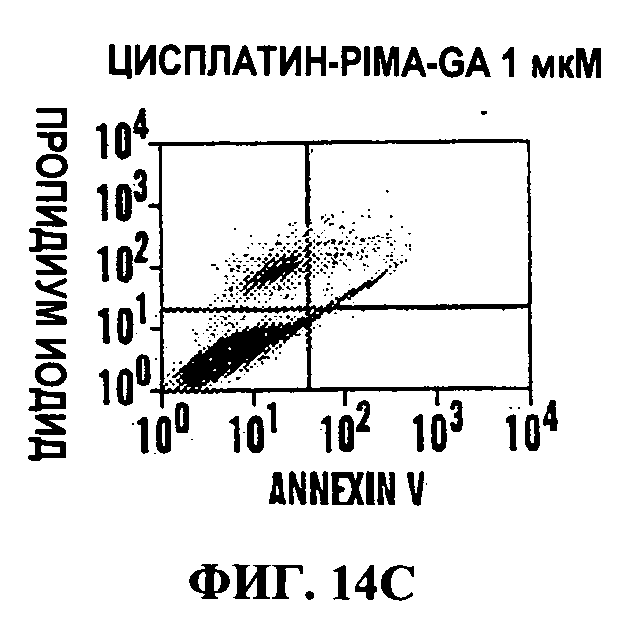
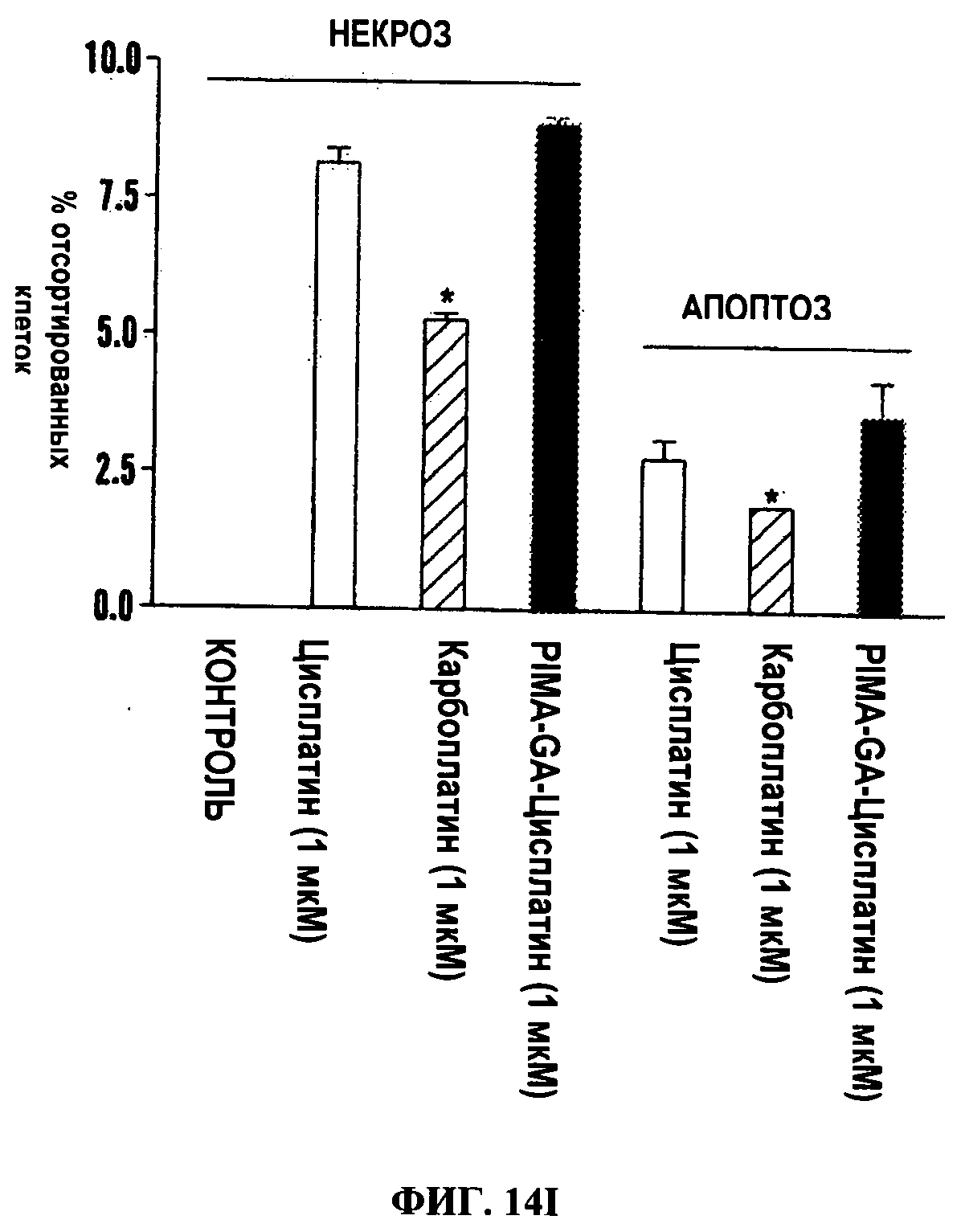
Фигуры 14A-14J представляют FACS изображения (Фиг.14А-14Н) и гистограммы (Фиг.14I и 14J), на которых показано, что обработка PIMA-GA-Цисплатин индуцирует гибель клеток. Иллюстративные FACS изображения клеток 4Т1 (Фиг.14A-14D) и LLC (Фиг.14Е-14Н) показывают процент в каждом квадранте после обработок свободным цисплатином или наночастицами цисплатина. Карбоплатин использовали в качестве контроля для сравнения (Фиг.14D и 14Н). Клетки инкубировали с лекарственными средствами в течение 24 ч, после чего метили Annexin-V FITC и окрашивали пропидиум иодидом.
Фигура 15 представляет собой схему, показывающую мечение полимера PIMA-GA с помощью FITC для отслеживания клеточного поглощения наночастиц.
Фигура 16 представляет собой линейный график, показывающий действие рН и среды комплексообразования Pt на кинетику высвобождения. Наночастицы инкубировали при рН 5.5 или рН 8.5 в диализном мешке и количественно определяли высвобождение в динамике по времени. Использующиеся наночастицы [PIMAGA-Цисплатин (O->Pt)] были генерированы путем образования комплекса полимера и цисплатина в условиях кислого рН [6.4], за исключением PIMA-GA-Цисплатин (Pt->N), когда образование комплекса проходило в условиях щелочного рН с образованием стабильного изомера [PIMA-GA-Цисплатин (N->Pt)]. Данные представлены как среднее±станд. откл. от n=3.
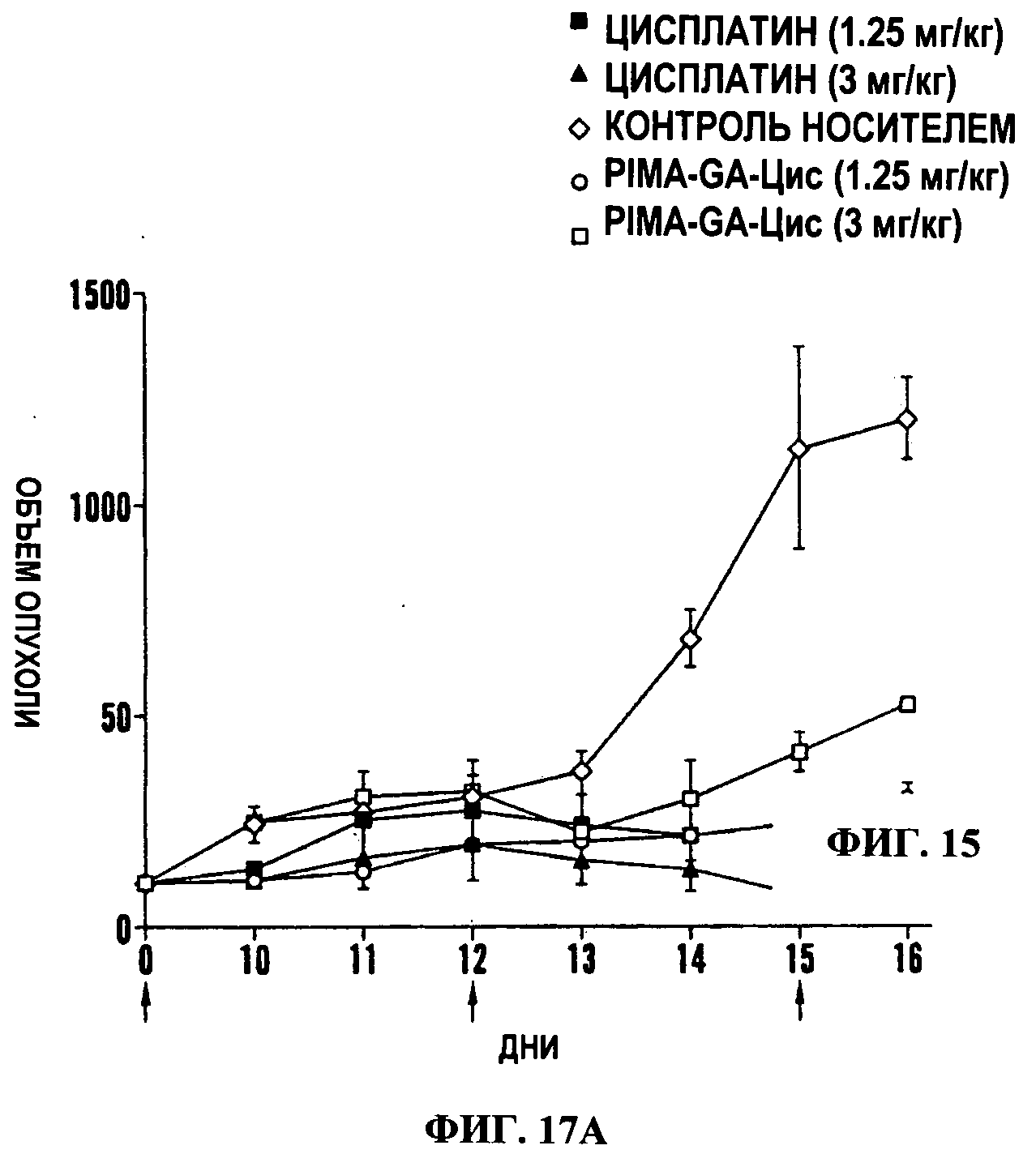
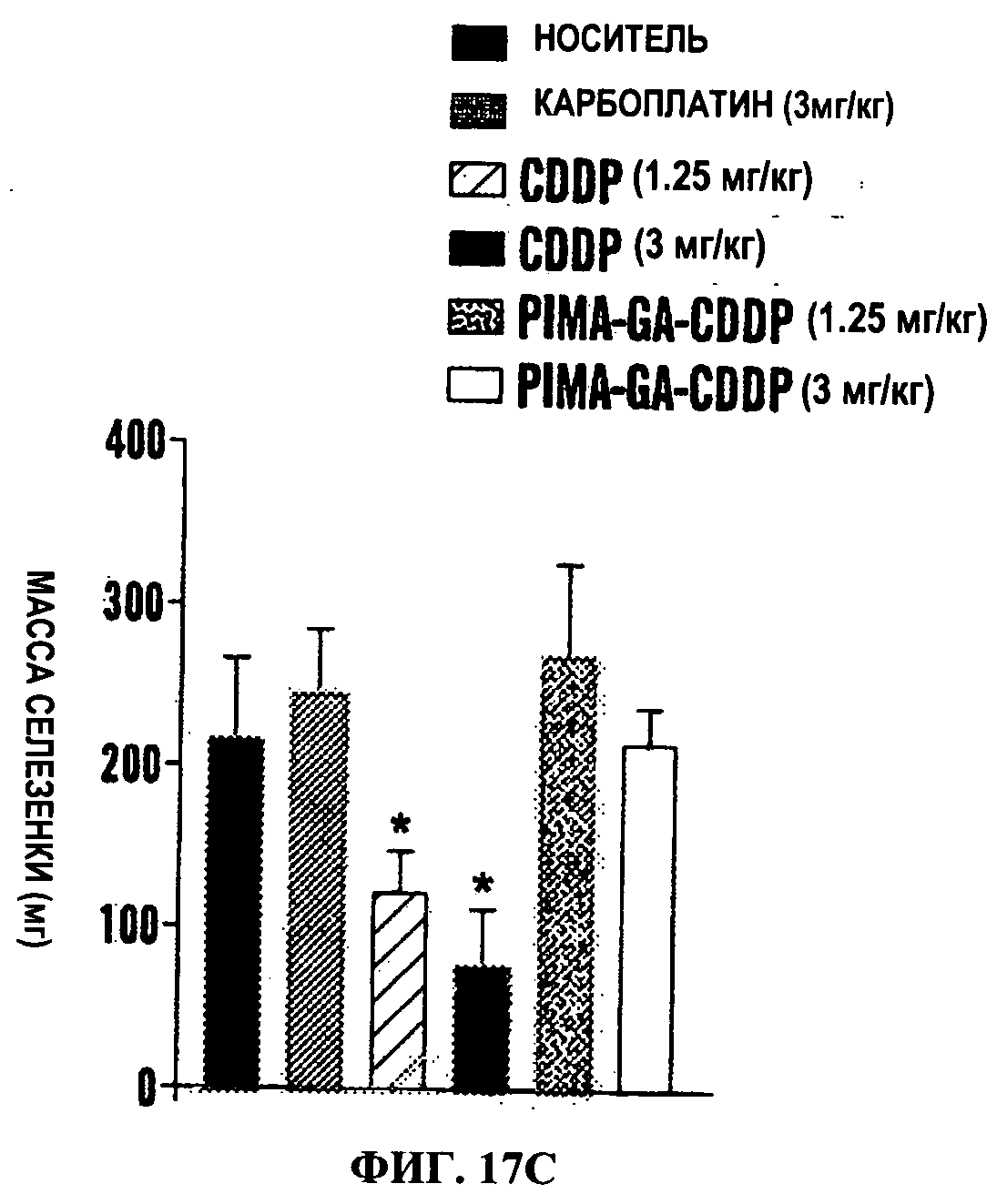
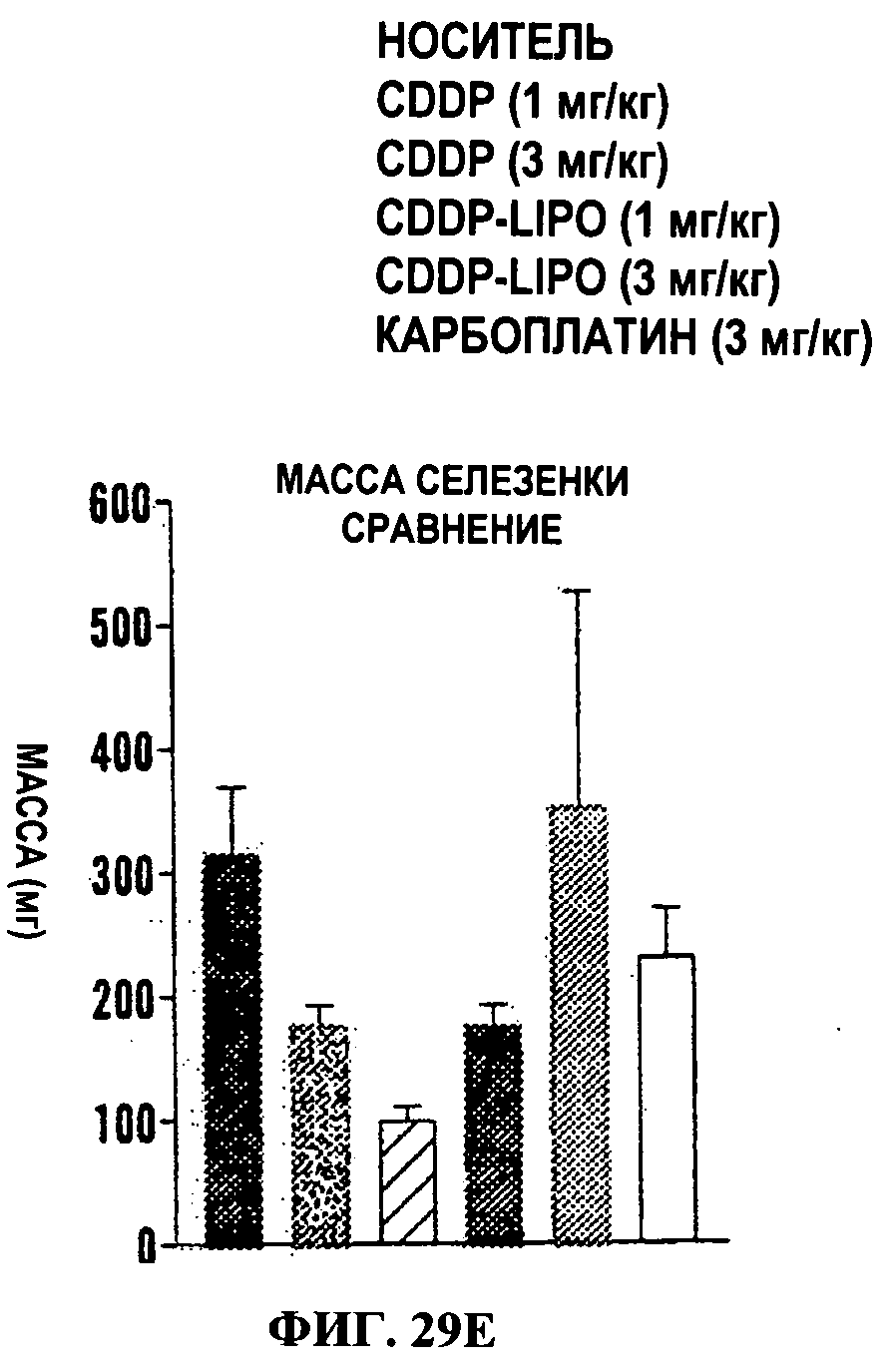
Фигуры 17A-17D представляют собой линейные графики (Фиг.17А и 17 В) и гистограммы (Фиг.17С и 17D), на которых показано, что наночастицы PIMA-GA-цисплатин проявляют сходное противоопухолевое действие с пониженной системной токсичностью по сравнению со свободным цисплатином в модели рака молочной железы 4Т1. Линейные графики показывают действие обработок на объем опухоли (Фиг.17А) и массу тела (Фиг.17В) в течение периода обработки. Животным трижды вводили дозу (показано стрелками на оси X). Данные представлены как среднее±станд. откл., n=4-8. Гистограммы показывают действие обработки на массу селезенки (Фиг.18С) и почек (Фиг.17D) как маркер нефротоксичности и гематологической токсичности (n=4-6)*Р<0.05 в сравнении с группой, обработанной носителем [ANOVA с последующим апостериорным сравнением по критерию Ньюмана Кеулса]. Карбоплатин [3 мг/кг] использовали в качестве контроля.
Фигуры 18А и 18В представляют собой гистограмму (Фиг.18А) и линейный график (Фиг.18В), на которых показано ингибирование наночастицами PIMA-GA-цисплатин роста опухоли в модели K-rasLSL/PtenfI/fI рака яичников. Как видно на Фиг.18А, количественная оценка биолюминесценции показала значительно уменьшенный сигнал от люциферазы опухоли мышей, обработанных наночастицей цисплатина по сравнению с носителем (р<0.05, однофакторный дисперсионный анализ ANOVA). На Фиг.18В показана токсичность лекарственного средства, оцененная путем измерения общей массы тела. Ежедневные записи массы тела показали значительную потерю массы тела в группе, обработанной свободным цисплатином по сравнению с обеими группами, обработанными наночастицей цисплатина (1.25 мг/кг и 3 мг/кг) (Р<0.05, двухфакторный дисперсионный анализ ANOVA).
Фигуры 19А и 19 В представляют собой гистограммы, на которых показано распределение Pt после введения цисплатина, наночастиц цисплатина [PIMA-GA-Цисплатина (O->Pt)] или карбоплатина в раке молочной железы или раке яичников. Обработки проводили, как описано на Фиг.17 и 18. Уровень Pt в разных тканях, взятых после вскрытия, количественно оценивали методом масс-спектрометрии с индуктивно связанной плазмой (ICP).
Фигуры 20А и 20В представляют собой схемы, на которых показан SAR-инспирированный конструирование наночастицы оксалиплатина. На Фигуре 20А показан механизм, лежащий в основе внутриклеточной активации оксалиплатина посредством гидратирования. На Фигуре 20В показан химический синтез комплекса PIMA- оксалиплатин и PIMA-глюкозамин (PIMA-GA)-оксалиплатин. Оксалиплатин-ОН может образовывать комплекс с PIMA посредством дикарбоксилато связей. Дериватизация одного фрагмента PIMA глюкозамином и образование комплекса с оксалиплатином могут привести к образованию двух изомеров в зависимости от рН.
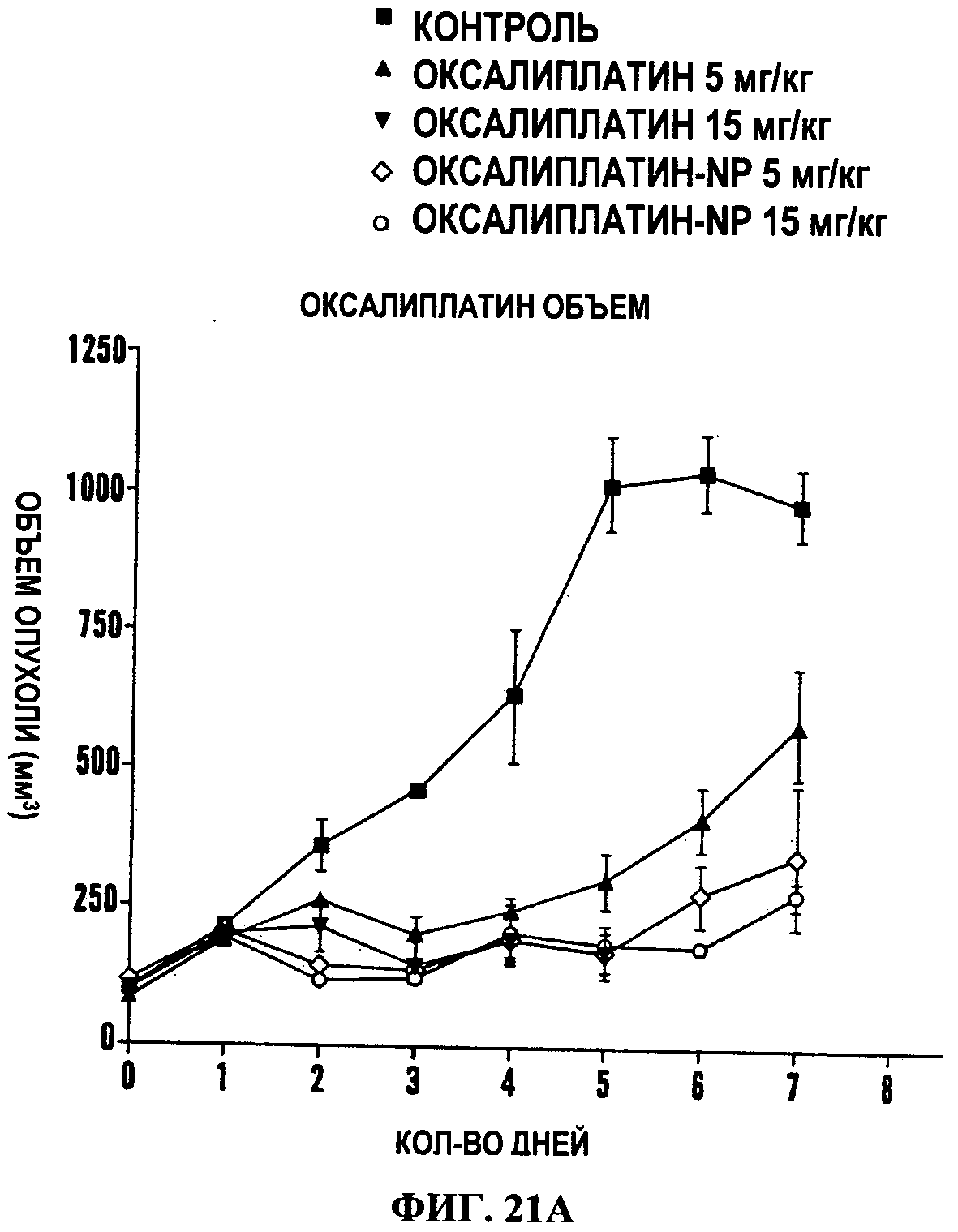
Фигуры 21А и 21В представляют собой линейные графики, на которых показана зависимость «концентрация-эффект» разных обработок на жизнеспособность клеток, как измерено с помощью MTS анализа. Для этого исследования использовали клеточную линию рака молочной железы, клеточные линии рака легкого Льюис (Фиг.21А) и 4Т1 (Фиг.21В). Ось Х показывает эквивалентные концентрации платины. При использовании полимерных контролей доза полимера была эквивалентна дозе, которую использовали для доставки данной конкретной дозы оксалиплатина в комплексную форму. PIMA-GA-ox относится к изомеру [PIMA-GA-Оксалиплатин (O->Pt)], образованному в кислой среде комплексообразования. Кривая PIMA-GA-оксалиплатин сдвинута влево, что указывает на более высокую эффективность наночастиц в отношении противоопухолевой активности по сравнению со свободным оксалиплатином.
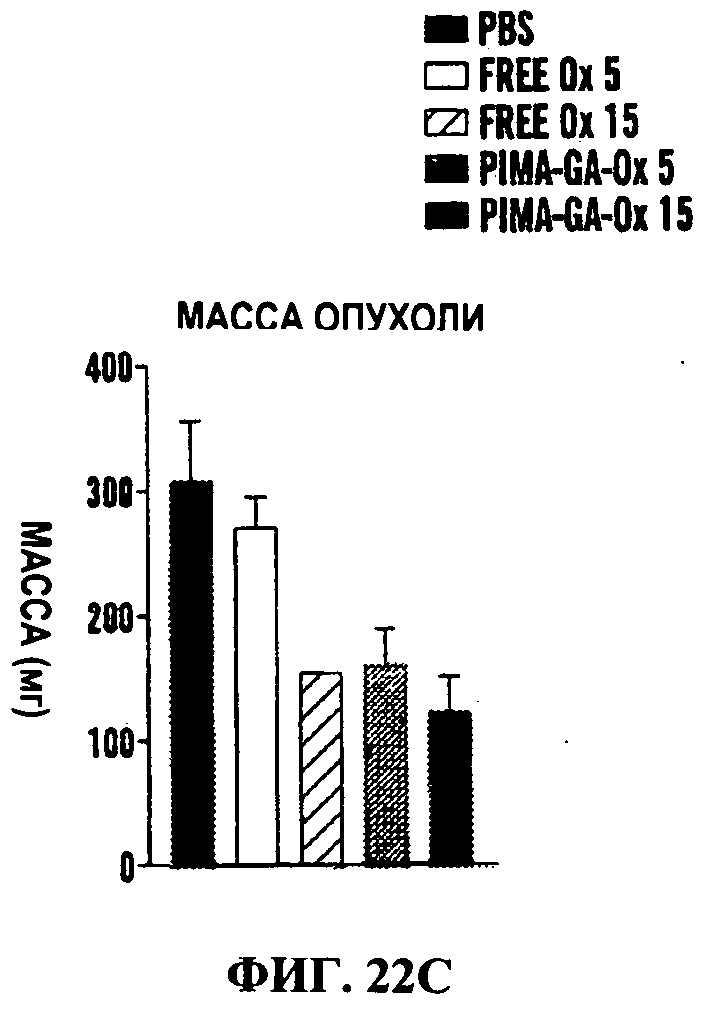
Фигуры 22А-22Е представляют собой линейные графики (Фиг.26А и 26В) и гистограммы (Фиг.22С-22Е), на которых показано, что наночастицы PIMA-GA-оксалиплатин проявляют аналогичный противоопухолевый эффект с уменьшенной системной токсичностью по сравнению со свободным оксалиплатином в модели рака молочной железы 4Т1. Линейные графики показывают действие обработок на объем опухоли (Фиг.22А) и массу тела (Фиг.22 В) в течение периода обработки. Животным вводили дозу три раза. Данные представлены как среднее±станд. откл., n=4-8. Гистограммы показывают действие обработки на массу опухоли (Фиг.22С), почек (Фиг.22D) и селезенки (Фиг.22Е) как маркер нефротоксичности и гематологической токсичности (n=4-6).
Фигура 23 является линейным графиком, на котором показана завсимость «концентрация-эффект» разных комплексов оксалиплатина на жизнеспособность клеток, как измерено с помощью MTS анализа.
Фигура 24 является линейным графиком, на котором показано действие цисплатина, карбоплатина и PIMA-GA-200(A) на жизнеспособность клеток.
Фигура 25А является схемой, на которой показан синтез конъюгата холестерин-янтарная кислота и образование комплекса Pt с конъюгатом.
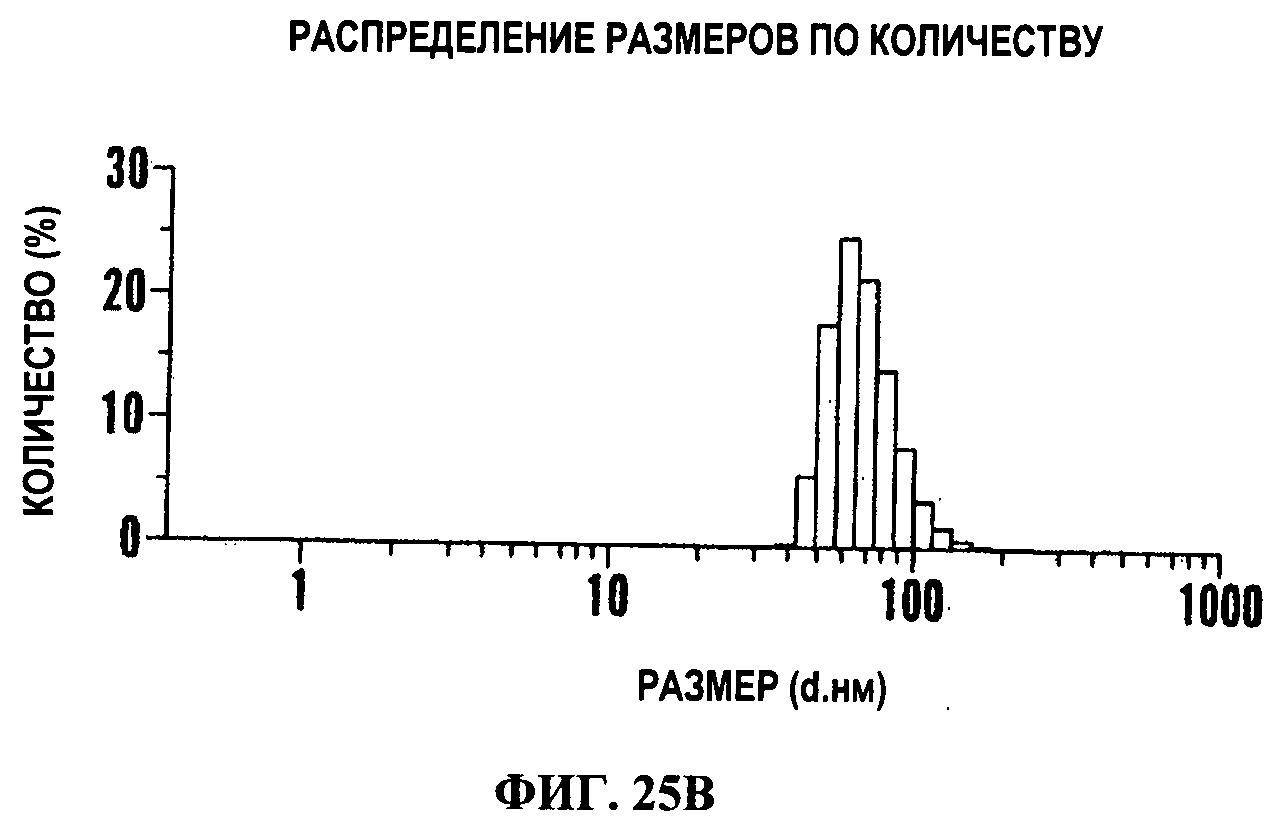
Фигура 25В показывает динамическое рассеяние лазерного излучения липонаночастиц. Размер липонаночастиц составляет меньше чем 150 нм.
Фигура 26 является линейным графиком, показывающим кинетику высвобождения Pt из липонаночастицы с течением времени и влияние рН. Скорость высвобождения выше в условиях кислого рН, соответствующего кислому рН внутри опухоли, что способствует селективному высвобождению активного платината в опухоли.
Фигуры 27А-27С представляют собой линейные графики, на которых показано действие липонаночастицы цисплатина на жизнеспособность клеток 4Т1 рака молочной железы. Выживаемость клеток измеряли при помощи MTS анализа. Обработка липонаночастицами привела к быстрой гибели клеток в течение 12 часов по сравнению с цисплатином или карбоплатином (Фиг.27А). Было обнаружено, что во все три момента времени липонаночастица цисплатина была более эффективной, чем цисплатин. Карбоплатин является наименее эффективным из всех тестированных платинатов (Фиг.27А-27С).
Фигуры 28А и 28В представляют собой линейные графики, на которых показано действие липонаночастицы цисплатина на жизнеспособность устойчивой к цисплатину линии клеток (СР20) гепатоцеллюлярного рака и линии клеток рака легкого Льюис (LLC). Цисплатин действует на СР20 только при самой высокой концентрации, тогда как клетки являются восприимчивыми к липонаночастице цисплатина (Фиг.28А). Карбоплатин не оказывает действия в этом диапазоне концентраций (Фиг.28А и 28В). Липонаночастица цисплатина показала противораковый эффект выше, чем свободный цисплатин на LLC (Фиг.28В).
Фигуры 29А-29Е представляют собой линейные графики (Фиг.29А и 29В) и гистограммы (Фиг.29С-29Е), на которых показана эффективность липонаночастицы цисплатина в синергической модели опухоли 4Е1 in vivo. Линейные графики показывают действие разных обработок на рост опухоли (Фиг.29А и 29С) и массу тела (как маркер системной токсичности, Фиг.29В). Гистограммы показывают массу почки (Фиг.29D) и селезенки (Фиг.29Е) как маркеры нефротоксичности и гематологической токсичности. Как видно из фигур, липонаночастица цисплатина индуцировала большую противоопухолевую активность при пониженной системной и нефротоксичности.
Осуществление изобретения
Изобретение направлено на биосовместимые конъюгированные полимерные наночастицы, включающие основную цепь сополимера, множество боковых цепей, ковалентно связанных с указанной основной цепью, и множество соединений платины, диссоциируемо связанных с указанной основной цепью. В целом, соединения платины связаны с основной цепью посредством связи с боковыми цепями.
В одном варианте сополимер включает мономеры малеиновой кислоты.
В предпочтительном варианте сополимер представляет собой поли(изобутилен-alt-малеиновую кислоту) (PIMA или РМА).
В некоторых вариантах сополимер содержит от 2 до 100 мономерных звеньев. В некоторых вариантах сополимер содержит от 25 до 50 мономерных звеньев.
В некоторых вариантах боковые цепи являются выбранными из группы, состоящей из полимеров, моносахаридов, карбоновых кислот, дикарбоновых кислот, амидов и их комбинаций.
В предпочтительных вариантах боковые цепи представляет собой полиэтиленгликоль (PEG). Боковые цепи PEG могут быть представлены формулой -C(O)-NH-PEG.
В некоторых вариантах боковые цепи PEG имеют молекулярную массу от 100 до 5000 дальтон. В некоторых вариантах боковые цепи PEG имеют молекулярную массу от 1000 до 3000 дальтон. В предпочтительном варианте боковые цепи PEG имеют молекулярную массу примерно 2000 дальтон.
В некоторых вариантах боковыми цепями являются моносахариды. В предпочтительном варианте моносахаридами является глюкозамин. Моносахаридные боковые цепи могут быть представлены как -С(0)-сахарид.
В изобретении могут применяться любые соединения платины. Предпочтительно, чтобы соединением платины являлось соединение платины (II) или платины (IV). В некоторых вариантах соединение платины (II) является выбранным из группы, состоящей из цисплатина, оксалиплатина, карбоплатина, параплатина, сартраплатина и их комбинаций. В предпочтительном варианте боковой группой соединения платины (II) является цисплатин или оксалиплатин.
В некоторых вариантах соединение платины (II) является выбранными из
группы, включающей Pt(NH3)2, Pt(NH3)(2-метилпиридин), и

В некоторых вариантах соединением платины (II) является

В некоторых вариантах соединение платины (II) включает, по меньшей мере, два атома азота, при этом указанные атомы азота напрямую связаны с платиной. В другом варианте два атома азота связаны друг с другом через факультативно замещенный линкер, например ациклический или циклический линкер. Циклический линкер означает связующий фрагмент, который содержит, по меньшей мере, одну кольцевую структуру. Циклическими линкерами могут являться арил, гетероарил, циклил или гетероциклил.
В некоторых вариантах, по меньшей мере, один атом азота, который связан с платиной, является кольцевым атомом гетероарила или гетероциклила. В предпочтительном варианте гетероарил представляет собой факультативно замещенный пиридин, например 2-метилпиридин.
В некоторых вариантах множество боковых цепей соответствует количеству от 50% до 100% включительно количества мономерных звеньев указанной полимерной основной цепи. Это означает, что от 50% до 100% мономерных звеньев имеют, по меньшей мере, одну боковую цепь, связанную с мономерным звеном. Общее количество боковых цепей может быть больше, чем общее количество мономерных звеньев. Например, две боковых цепи могут быть присоединены к мономеру малеиновой кислоты.
В некоторых вариантах множество боковых цепей соответствует количеству больше чем 90% количества мономерных звеньев указанной основной цепи полимера.
В некоторых вариантах множество соединений платины соответствует количеству от 10% до 100% включительно количества мономерных звеньев указанной основной цепи полимера. В целом, существует взаимно однозначное соответствие между соединениями платины и мономерными субъединицами. Таким образом, процент относится к отношению количества мономерных звеньев, которые связаны с соединением платины, к общему количеству мономерных звеньев, присутствующих в основной цепи полимера.
В некоторых вариантах множество соединений платины соответствует количеству от 25% до 75% включительно количества мономерных звеньев указанной основной цепи полимера.
В целом, от 10 до 500 мкг соединения платины может быть нагружено на 1 мг полимера. Предпочтительно, чтобы от 50 до 250 мкг, более предпочтительно от 150 до 200 мкг соединения платины было нагружено на 1 мг полимера. В некоторых вариантах авторы изобретения получили нагрузку 175±5 мкг/мг полимера.
В некоторых вариантах боковые цепи содержат дикарбоновые кислоты. В некоторых вариантах дикарбоновые кислоты имеют формулу HOOC-R-COOH, где R представляет собой а C1-С6 алкил, С3-С6 алкенил или С2-С6 алкинил. В предпочтительном варианте дикарбоновой кислотой является малеиновая кислота.
В некоторых вариантах сополимер содержит, по меньшей мере, один мономер, имеющий формулу -CH(CO2H)-R-CH(C(O)R')-, где R представляет собой связь, C1-С6 алкилен, где алкилен может включать одну или более двойных или тройных связей; и R' является замещенным атомом азота. Предпочтительно, чтобы R представлял собой связь.
В некоторых вариантах от 50% до 100% включительно мономерных субъединиц в основной цепи полимера представляют собой -CH(CO2H)-R-CH(C(O)R')-, где R представляет собой связь, C1-С6 алкилен, где алкилен может включать одну или более двойных или тройных связей; и R' является факультативно замещенным атомом азота.
В некоторых вариантах, по меньшей мере, 90% или более мономерных субъединиц в основной цепи полимера представляют собой -CH(CO2H)-R-CH(C(O)R')-, где R является связью, C1-С6 алкиленом, при этом алкилен может включать одну или более двойных или тройных связей; и R' является замещенным атомом азота.
В некоторых вариантах сополимер включает, по меньшей мере, один мономер, имеющий формулу -CH(CO2H)-R-CH(C(O)R')CH2C(Me2)- или -CH(C(O)R')-R-СН(CO2H)- СН2С(Ме2)-, где R является связью, C1-С6 алкиленом, при этом алкилен может включать одну или более двойных или тройных связей; и R' является замещенным атомом азота. Предпочтительно, чтобы R представлял собой связь.
В некоторых вариантах сополимер содержит от 50% до 100% включительно мономеров, имеющих формулу -CH(CO2H)-R-CH(C(O)R')CH2C(Me2)- или -CH(C(O)R')-R-CH(CO2H)-CH2C(Me2)-, где R является связью, C1-С6 алкиленом, при этом алкилен может включать одну или более двойных или тройных связей; и R' является замещенным атомом азота.
В некоторых вариантах сополимер содержит, по меньшей мере, 90% мономеров, имеющих формулу -CH(CO2H)-R-CH(C(O)R')CH2C(Me2)- или -CH(C(O)R')-R-СН(CO2H)-СН2С(Ме2)-, где R является связью, C1-С6 алкиленом, при этом алкилен может содержать одну или более двойных или тройных связей; и R' является замещенным атомом азота.
В одном варианте R' представляет собой

В некоторых вариантах, по меньшей мере, один мономер полимера содержит две боковые цепи, выбранные из группы, состоящей из карбоновой кислоты, амида и сложного эфира. Указанные боковые цепи отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные амидные и эфирные боковые цепи были отделены друг от друга двумя атомами углерода. Предпочтительно, чтобы, по меньшей мере, одна из боковых цепей не являлись карбоновой кислотой.
В некоторых вариантах, по меньшей мере, один мономер полимера содержит две боковые цепи карбоновой кислоты. Указанные боковые цепи карбоновой кислоты отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные боковые цепи карбоновой кислоты были отделены друг от друга двумя атомами углерода. Указанные атомы углерода могут быть связаны друг с другом посредством простой или двойной связи.
В некоторых вариантах, по меньшей мере, один мономер полимера содержит боковые цепи карбоновой кислоты и амида. Указанные боковые цепи карбоновой кислоты и амида отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные боковые цепи карбоновой кислоты и амида были отделены друг от друга двумя атомами углерода. Указанные атомы углерода могут быть связаны друг с другом посредством простой или двойной связи.
В некоторых вариантах, по меньшей мере, один мономер полимера содержит боковые цепи карбоновой кислоты и сложного эфира. Указанные боковые цепи карбоновой кислоты и сложного эфира отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные боковые цепи карбоновой кислоты и сложного эфира были отделены друг от друга двумя атомами углерода. Указанные атомы углерода могут быть связаны друг с другом посредством простой или двойной связи.
В некоторых вариантах, по меньшей мере, один мономер полимера содержит боковые цепи амида и сложного эфира. Указанные боковые цепи амида и сложного эфира отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные боковые цепи амида и сложного эфира были отделены друг от друга двумя атомами углерода. Указанные атомы углерода могут быть связаны друг с другом посредством простой или двойной связи.
В некоторых вариантах, по меньшей мере, один мономер полимера содержит две боковые цепи амида. Указанные боковые цепи амида отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные боковые цепи амида и сложного эфира были отделены друг от друга двумя атомами углерода.
В некоторых вариантах, по меньшей мере, один мономер полимера содержит две боковые цепи сложного эфира. Указанные боковые цепи сложного эфира отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные боковые цепи амида и эфира были отделены друг от друга двумя атомами углерода.
В некоторых вариантах полимер включает две боковых цепи, выбранные из группы, состоящей из карбоновой кислоты, амида и сложного эфира. Указанные боковые цепи отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные боковые цепи амида и сложного эфира были отделены друг от друга двумя атомами углерода. Предпочтительно, чтобы, по меньшей мере, одна из боковых цепей не являлась карбоновой кислотой.
В некоторых вариантах полимер содержит, по меньшей мере, две боковые цепи карбоновой кислоты. Указанные боковые цепи карбоновой кислоты отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные боковые цепи карбоновой кислоты были отделены друг от друга двумя атомами углерода.
В некоторых вариантах полимер содержит боковые цепи карбоновой кислоты и амида. Указанные боковые цепи карбоновой кислоты и боковые цепи амида отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные боковые цепи карбоновой кислоты и амида были отделены друг от друга двумя атомами углерода.
В некоторых вариантах полимер содержит боковые цепи карбоновой кислоты и сложного эфира. Указанные боковые цепи карбоновой кислоты и сложного эфира отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные боковые цепи карбоновой кислоты и сложного эфира были отделены друг от друга двумя атомами углерода.
В некоторых вариантах полимер содержит боковые цепи амида и сложного эфира. Указанные боковые цепи амида и сложного эфира отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные боковые цепи амида и сложного эфира были отделены друг от друга двумя атомами углерода. Указанные атомы углерода могут быть связаны друг с другом посредством простой или двойной связи.
В некоторых вариантах полимер содержит две боковые цепи амида. Указанные боковые цепи амида отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные боковые цепи амида и сложного эфира были отделены друг от друга двумя атомами углерода.
В некоторых вариантах полимер содержит две боковые цепи сложного эфира. Указанные боковые цепи сложного эфира отделены друг от друга 1, 2, 3, 4, 5, 6, 7, 8, 9 или десятью атомами углерода, кислорода, азота, серы или их комбинацией. Предпочтительно, чтобы указанные боковые цепи амида и сложного эфира были отделены друг от друга двумя атомами углерода.
Размер наночастиц изобретения может изменяться в диапазоне 25-250 нм, предпочтительно 50-200 нм, более предпочтительно 80-160 нм и наиболее всего предпочтительно 90-110 нм. Без привязки к какой-либо теории, преимущественный хоминг наночастиц размером в диапазоне 80-160 нм в опухоли происходит в результате увеличенной проницаемости и задержания. Смотри, например, Moghimi, et al., Pharmacol Rev. 2001 Jun; 53(2):283-318.
В некоторых вариантах соединение платины диссоциируемо связано с указанной основной цепью посредством, по меньшей мере, одной координационной связи. Без привязки к какой-либо теории, координационная связь является более доступной и, таким образом, более легко высвобождает соединение платины.
В некоторых вариантах связывание соединения платины с основной цепью биополимера, кроме того, включает карбоксилато связь. В некоторых вариантах соединение платины связано с основной цепью посредством координационной связи и карбоксилато связи.
Должно быть понятно, что, несмотря на описание связи с основной цепью, опытному в данной области специалисту будет очевидно, что соединение платины, в целом, связано с одной или более боковыми цепями, которые само по себе связаны с основной цепью. Таким образом, любое описание связывания соединения платины с основной цепью включает случаи, когда соединение платины связано с боковой цепью, которая, кроме того, связана с основной цепью.
В некоторых вариантах координационная связь находится между атомом платины соединения платины и кислородом боковой цепи. Предпочтительно, чтобы координационная связь находилась между платиной и карбонильным кислородом.
В некоторых вариантах координационная связь находится между атомом платины соединения платины и амидным кислородом боковой цепи. В некоторых вариантах координационная связь находится между атомом платины соединения платины и карбонильным кислородом сложного эфира боковой цепи.
В некоторых вариантах сополимер содержит, по меньшей мере, один мономер малеиновой кислоты, в котором, по меньшей мере, одна карбоновая кислота, указанной, по меньшей мере, малеиновой кислоты является дериватизированной в амид.
В некоторых вариантах, от 50% до 100% включительно мономерных звеньев в основной цепи полимера являются мономером малеиновой кислоты и при этом, по меньшей мере, одна карбоновая кислота указанного мономера малеиновой кислоты является дериватизированной в амид.
В некоторых вариантах, по меньшей мере, 90% мономерных звеньев в основной цепи полимера являются мономером малеиновой кислоты и при этом, по меньшей мере, одна карбоновая кислота указанного мономера малеиновой кислоты является дериватизированной в амид.
Нагрузка соединения платины на полимер может быть представлена в виде процента мг соединения платины на мг полимера. Например, на полимер PIMA-GA может быть нагружено максимум 0.375 мг цисплатина, поэтому нагрузка в 37.5% представляет максимальную нагрузку для этого конкретного полимера. Нагрузка может изменяться примерно от 1% до теоретической общей нагрузки для полимера.
В некоторых вариантах нагрузка соединения платины составляет 1%-37.5%. Процентная нагрузка представляет мг соединения платины, связанного с мг полимера.
В некоторых вариантах нагрузка соединения платины составляет 1%-6%. В некоторых вариантах нагрузка соединения Pt(II) составляет от 0.01% до 1%.
Другой аспект изобретения направлен на биосовместимые конъюгированные полимерные наночастицы, включающие основную цепь поли(изобутилен-alt-малеиновой кислоты). Основная цепь содержит 25-50 мономеров. Также включенными являются множество боковых цепей PEG, ковалентно связанных с указанной основной цепью. Боковые цепи PEG имеют молекулярную массу от 1000 до 3000 дальтон. Количество боковых цепей PEG составляет от 50% до 100% включительно количества мономерных звеньев основной цепи полимера. Также включенными являются множество боковых групп цисплатина, диссоциируемо связанных с основной цепью. Количество боковых групп цисплатина составляет от 25% до 75% включительно количества мономерных звеньев основной цепи полимера.
Еще другой аспект изобретения направлен на биосовместимые конъюгированные полимерные наночастицы, включающие основную цепь поли(изобутилен-alt-малеиновой кислоты). Основная цепь состоит из 40 мономеров. Также включенными являются множество боковых цепей PEG, ковалентно связанных с указанной основной цепью. Боковые цепи PEG имеют молекулярную массу 2000 дальтон. Число боковых цепей PEG больше чем 90% мономерных звеньев указанной основной цепи полимера. Также включенными являются множество боковых групп цисплатина, диссоциируемо связанных с основной цепью. Количество боковых групп цисплатина составляет от 25% до 75% включительно количества мономерных звеньев основной цепи полимера.
Еще другой аспект изобретения направлен на биосовместимые конъюгированные полимерные наночастицы, включающие основную цепь поли(изобутилен-alt-малеиновой кислоты). Основная цепь включает от 25 до 50 мономеров. Также включенными являются множество боковых цепей глюкозамина, ковалентно связанных с указанной основной цепью. Количество боковых цепей глюкозамина составляет от 50% до 100% включительно мономерных звеньев указанной основной цепи полимера. Также включенными являются множество боковых групп цисплатина, диссоциируемо связанных с основной цепью. Количество боковых групп цисплатина составляет от 25% до 75% включительно количества мономерных звеньев основной цепи полимера.
Другой аспект изобретения направлен на биосовместимые конъюгированные полимерные наночастицы, включающие основную цепь поли(изобутилен-alt-малеиновой кислоты). Основная цепь включает от 25 до 50 мономеров. Также включенными являются множество боковых цепей глюкозамина, ковалентно связанных с указанной основной цепью. Количество боковых цепей глюкозамина больше чем 90% мономерных звеньев указанной основной цепи полимера. Также включенными являются множество боковых групп цисплатина, диссоциируемо связанных с основной цепью. Количество боковых групп цисплатина составляет от 25% до 75% включительно количества мономерных звеньев основной цепи полимера.
Еще другой аспект изобретения направлен на конъюгированные наночастицы комплекса карбоновая кислота-соединение платины, включающие комплекс карбоновая кислота-соединение платины и множество липид-полимерных цепей. Карбоновая часть указанного комплекса карбоновая кислота-соединение платины является ковалентно связанной с указанными липид-полимерными цепями.
В предпочтительном варианте карбоновой кислотой является малеиновая кислота. В некоторых вариантах полимером является PEG.
В определенных вариантах нагрузка соединения платины составляет 1%-37.5%. В определенных вариантах нагрузка соединения платины составляет 1%-6%.
Соединением платины может являться соединение Pt(II) или соединение Pt(IV). В некоторых вариантах соединение Pt(II) является выбранным из группы, состоящей из цисплатина, оксалиплатина, карбоплатина, параплатина, сартраплатина и их комбинаций. В предпочтительном варианте соединением Pt(II) является цисплатин.
Другой аспект изобретения направлен на соединение в виде везикул, мицелл или липосом, включающее множество наночастиц по формуле, как описано здесь.
Еще другой аспект изобретения направлен на фармацевтическую композицию, включающую любые наночастицы или соединения, описанные здесь, и фармацевтически приемлемый носитель.
Еще другой аспект изобретения направлен на способ лечения рака или метастаз. Способ включает выбор субъекта, нуждающегося в лечении рака или метастаз, и введение эффективного количества любых наночастиц, соединений или композиций, описанных здесь.
В некоторых вариантах рак или метастаз является выбранным из группы, состоящей из восприимчивых или устойчивых к платине опухолей, которые включают опухоль молочной железы, головы и шеи, яичника, яичка, поджелудочной железы, орального отдела пищевода, желудочно-кишечного тракта, печени, желчного пузыря, легкого, меланому, рак кожи, саркому, злокачественные заболевания кроветворной системы, опухоли мозга, включая глиобластомы, и опухоли нейроэктодермального происхождения.
В еще другом аспекте изобретение обеспечивает способ составления полимерных наночастиц соединения платины, при этом способ включает конъюгирование соединения платины с биосовместимым полимером или биосовместимым сополимером. Без привязки к теории, конъюгирование соединения платины с биосовместимым полимером в условиях кислого pH приводит к образованию наночастиц, которые являются более активными in vivo, чем в случае, когда конъюгирование проводится в условиях щелочного pH.
Таким образом, в некоторых вариантах конъюгирование выполнено при pH ниже 7, предпочтительно, чтобы величина pH находилась в диапазоне от 1 до 6.9. В некоторых более предпочтительных вариантах конъюгирование проводили при pH 6.5.
Авторы изобретения наблюдали, что конъюгирование в щелочных условиях способствует образованию изомерного комплекса PIMA-GA-Цисплатин с монокарбоксилато и более стабильной Pt<->N координационной связью. Напротив, образование комплекса PIMA-GA и цисплатина в условиях кислого рН создает изомерное состояние, характеризующееся монокарбоксилато связью и Pt<->O координационной связью. Таким образом, условия конъюгирования, которые приводят к образованию Pt<->O координационной связи через Pt<->N координационную связь, являются предпочтительными для конъюгирования.
В целом, для полимера использовали избыток соединения Pt(II). В некоторых вариантах для полимера использовали 5-25 молей избыточного количества соединения Pt(II). Предпочтительно использовать для полимера 10-20 молей избыточного количества соединения Pt(II). В одном предпочтительном варианте для полимера использовали 15 молей избыточного количества соединения Pt(II).
В еще другом аспекте изобретение обеспечивает дикарбонильную молекулу, связанную с липидной молекулой. Такое соединение может быть представлено структурой липид-линкер-дикарбонил. Эти молекулы могут быть использованы для образования комплекса с соединениями платины, такими как цисплатин, оксалиплатин или другими платинатами и соединениями платины, описанными здесь, посредством карбоксилато связи и/или координационных связей. Данные соединения могут быть смешаны с соответствующими липидами/фосфолипидами в наночастицы размером менее чем 150 нм, которые высвобождают Pt рН-зависимым образом. После составления эти наночастицы проявляют улучшенную эффективность и профиль токсичности по сравнению с карбоплатином и цисплатином и являются активными в устойчивом к цисплатину раке.
Данные наночастицы могут быть составлены с включением фармацевтически активных агентов для доставки.
Термин «Липид» применяется в общепринятом значении для обозначения молекул, которые растворимы в большей или меньшей степени в органических растворителях, таких как спирты, и относительно нерастворимы в водной среде. Таким образом, термин «липид» включает соединения с изменяющейся длиной цепи от короткой, содержащей 2 атома углерода, до длинной, содержащей примерно 28 атомов углерода. К тому же, соединения могут быть насыщенными или ненасыщенными, и в форме прямых или разветвленных цепей, или в форме неконденсированных или конденсированных кольцевых структур. Примеры липидов включают, но без ограничения, жиры, воски, стеролы, стероиды, желчные кислоты, жирорастворимые витамины (такие как A, D, Е и К), моноглицериды, диглицериды, фосфолипиды, гликолипиды, сульфолипиды, аминолипиды, хромолипиды (липохромы), глицерофосфолипиды, сфинголипиды, пренол-липиды, сахаролипиды, поликетиды и жирные кислоты. В некоторых вариантах липидом является холестерин или дистеароилфосфатидилэтаноламин.
В целом, может использоваться любая молекула, которая содержит две карбонильные группы. В некоторых вариантах дикарбонильной молекулой является дикарбоновая кислота или кето-карбоновая кислота. В некоторых предпочтительных вариантах дикарбонильной молекулой является янтарная кислота.
В некоторых вариантах дикарбонильной молекулой является R'OC(O)-R-C(O)-, где R представляет собой C1-С6 алкилен, при этом алкилен может содержать одну или более двойных или тройных связей, и/или основная цепь алкилена может прерываться одним или более из О, S, S(O), SO2, NH, С(O); и R' представляет собой Н, алкил, алкенил, алкинил, арил, гетероарил, гетероциклил, каждый из которых может быть факультативно замещенным. Предпочтительно, чтобы R представлял собой СН2, -CH2CH2-, -СН2СН2-СН2- или СН=СН-. Предпочтительно, чтобы R' представлял собой Н.
Дикарбонильная молекула может быть связана с липидной молекулой напрямую или посредством линкерной молекулы. Термин «линкер» означает органический фрагмент, который соединяет две части соединения. Линкеры обычно включают прямую связь или атом, такой как кислород или сера, звено, такое как NH, С(O), C(O)NH, SO, SO2, SO2NH, или цепь атомов, таких как замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арилалкил, арилалкенил, арилалкинил, гетероарилалкил, гетероарилалкенил, гетероарилалкинил, гетероциклилалкил, гетероциклилалкенил, гетероциклилалкинил, арил, гетероарил, гетероциклил, циклоалкил, циклоалкенил, алкиларилалкил, алкиларилалкенил, алкиларилалкинил, алкениларилалкил, алкениларилалкенил, алкениларилалкинил, алкиниларилалкил, алкиниларилалкенил, алкиниларилалкинил, алкилгетероарилалкил, алкилгетероарилалкенил, алкилгетероарилалкинил, алкенилгетероарилалкил, алкенилгетероарилалкенил, алкенилгетероарилалкинил, алкинилгетероарилалкил, алкинилгетероарилалкенил, алкинилгетероарилалкинил, алкилгетероциклилалкил, алкилгетероциклилалкенил, алкилгетероциклилалкинил, алкенилгетероциклилалкил, алкенилгетероциклилалкенил, алкенилгетероциклилалкинил, алкинилгетероциклилалкил, алкинилгетероциклилалкенил, алкинилгетероциклилакинил, алкиларил, алкениларил, алкиниларил, алкилгетероарил, алкенилгетероарил, алкинилгетероарил, где один или более метиленов могут прерываться или оканчиваться О, S, S(O), SO2, NH, C(O). Следует понимать, что дикарбонильная молекула и/или липид может быть модифицирована для включения функциональных групп для связывания друг с другом или с линкером.
В некоторых вариантах линкером является диамин, такой как этилендиамин. В некоторых вариантах линкером является PEG-NH2.
В одном предпочтительном варианте линкером является -NHCH2CH2C(O)-. В другом предпочтительном варианте линкером является -CH2CH2NHC(O)-[OCH2CH2]z-NH-, где z равно 1-50. Предпочтительно, чтобы z был равен 45.
В некоторых вариантах липид-дикарбонильное соединение является таким, которое показано на Фиг.10 (соединение 2) и 25 (соединение 5).
В другом аспекте изобретение обеспечивает биосовместимый полимер, включающий, по меньшей мере, один мономер, имеющий формулу -CH(CO2H)-R-CH(C(O)R')-, где R является связью, C1-С6 алкиленом, при этом алкилен может содержать одну или более двойных или тройных связей; и R' является замещенным атомом азота. Предпочтительно, чтобы R являлся связью.
В некоторых вариантах полимер содержит от 2 до 100 мономерных звеньев, имеющих формулу -CH(CO2H)-R-CH(C(O)R')-, где R является связью, C1-С6 алкиленом, при этом алкилен может содержать одну или более двойных или тройных связей; и R' является замещенным атомом азота.
В некоторых вариантах полимер содержит от 25 до 50 мономерных звеньев, имеющих формулу -CH(CO2H)-R-CH(C(O)R')-, где R является связью, C1-С6 алкиленом, при этом алкилен может содержать одну или более двойных или тройных связей; и R' является замещенным атомом азота.
В некоторых вариантах от 50% до 100% включительно мономерных субъединиц в полимерной основной цепи представляют собой -CH(CO2H)-R-CH(C(O)R')-, где R является связью, C1-С6 алкиленом, при этом алкилен может содержать одну или более двойных или тройных связей; и R' является замещенным атомом азота.
В некоторых вариантах, по меньшей мере, 90% или более мономерных субъединиц в полимерной основной цепи представляют собой -CH(CO2H)-R-CH(C(O)R')-, где R является связью, C1-С6 алкиленом, при этом алкилен может содержать одну или более двойных или тройных связей; и R' является замещенным атомом азота.
В некоторых вариантах сополимер включает, по меньшей мере, один мономер, имеющий формулу -CH(CO2H)-R-CH(C(O)R')CH2C(Me2)- или -CH(C(O)R')-R-СН(CO2H)-СН2С(Ме2)-, где R является связью, C1-С6 алкиленом, при этом алкилен может содержать одну или более двойных или тройных связей; и R' является замещенным атомом азота. Предпочтительно, чтобы R являлся связью.
В некоторых вариантах сополимер содержит от 50% до 100% включительно мономеров, имеющих формулу -CH(C02H)-R-CH(C(O)R')CH2C(Me2)- или -CH(C(O)R')-R-CH(CO2H)-CH2C(Me2)-, где R является связью, C1-С6 алкиленом, при этом алкилен может содержать одну или более двойных или тройных связей; и R' является замещенным атомом азота.
В некоторых вариантах сополимер содержит, по меньшей мере, 90% мономеров, имеющих формулу -CH(CO2H)-R-CH(C(O)R')CH2C(Me2)- или -CH(C(O)R')-R-СН(CO2H)-СН2С(Ме2)-, где R является связью, C1-С6 алкиленом, при этом алкилен может содержать одну или более двойных или тройных связей; и R' является замещенным атомом азота.
В некоторых вариантах R' представляет собой

Данные полимеры могут использоваться для составления наночастиц и гелей, которые могут применяться для доставки лекарственного средства. Таким образом, изобретение также обеспечивает наночастицы, включающие полимер, описанный здесь, и один или более биоактивных агентов («биоактивный агент»).
Описанные здесь композиции могут применяться в способах для замедленного высвобождения биоактивных агентов. В одном варианте способ включает: (а) обеспечение или введение субъекту композиции, описанной здесь, при этом композиция содержит биоактивный агент. Использующийся здесь термин «биоактивный агент» относится к природным биологическим материалам, например материалам внеклеточного матрикса, таким как фибронектин, витронектин и ламинин; цитокинам; и факторам роста и факторам дифференцировки. «Биоактивные агенты» также относятся к искусственно синтезированным материалам, молекулам или соединениям, которые обладают биологическим действием на биологические клетки, ткани или органы.
Пригодные факторы роста и цитокины включают, но без ограничения, фактор стволовых клеток (SCF), гранулоцитарный колониестимулирующий фактор (G-CSF), гранулоцитарно-моноцитарный колониестимулирующий фактор (GM-CSF), фактор роста стромальных клеток-1, стальной фактор, сосудистый эндотелиальный фактор роста (VEGF), трансформирующий фактор роста - бета (TGFp), фактор роста тромбоцитов (PDGF), ангиопоэтины (Ang), эпидермальный фактор роста (EGF), основной фактор роста фибробластов (bFGF), гепатоцитарный ядерный фактор (HNF), фактор роста нервов (NGF), костный морфогенетический белок (BMP), фактор роста фибробластов (FGF), фактор роста гепатоцитов, инсулиноподобный фактор роста (IGF-1), интерлейкин (IL)-3, IL-1α, IL-1β, IL-6, IL-7, IL-8, IL-11 и IL-13, колониестимулирующие факторы, тромбопоэтин, эритропоэтин, fit3-лиганд и фактор некроза опухоли-α (TNFα). Другие примеры описаны в Dijke et а1., "Growth Factors for Wound Healing", Bio/Technology, 7:793-798 (1989); Mulder GD, Haberer PA, Jeter KF, eds. Clinicians' Pocket Guide to Chronic Wound Repair. 4th ed. Springhouse, PA: Springhouse Corporation; 1998:85; Ziegler T.R., Pierce, G.F., and Herndon, D.N., 1997, International Symposium on Growth Factors and Wound Healing: Basic Science & Potential Clinical Applications (Boston, 1995, Serono Symposia USA), Publisher: Springer Verlag.
В некоторых вариантах пригодные биоактивные агенты включают, но без ограничения, терапевтические агенты. Использующийся здесь термин «терапевтический агент» относится к субстанции, которая используется в диагностике, лечении или профилактике заболевания. Любой терапевтический агент, известный для специалиста среднего уровня в данной области как полезный в диагностике, лечении или профилактике заболевания, рассматривается как терапевтический агент в контексте настоящего изобретения. Терапевтические агенты включают фармацевтически активные соединения, гормоны, факторы роста, ферменты, ДНК, плазмидные ДНК, РНК, миРНК, вирусы, белки, липиды, противовоспалительные молекулы, антитела, антибиотики, противовоспалительные агенты, антисмысловые нуклеотиды и трансформирующиеся нуклеиновые кислоты или их комбинации. Любые терапевтические агенты могут быть объединены при условии, что такая комбинация является биологически совместимой.
Иллюстративные терапевтические агенты включают, но без ограничения, такие, которые можно найти в Harrison's Principles of Internal Medicine, 13th Edition, Eds. T.R. Harrison et al. McGraw-Hill N.Y., NY; Physicians Desk Reference, 50th Edition, 1997, Oradell New Jersey, Medical Economics Co.; Pharmacological Basis of Therapeutics, 8thEdition, Goodman and Oilman, 1990; United States Pharmacopeia, The National Formulary, USP XII NF XVII, 1990; current edition of Goodman and Oilman's The Pharmacological Basis of Therapeutics; and current edition of The Merck Index, полное содержание которых включено здесь посредством отсылки.
Примеры терапевтических агентов, которые могут быть включены в композицию, включают, но без ограничения, наркотические анальгетические лекарственные средства; соли золота; кортикостероиды; гормоны; противомалярийные средства; производные индола; фармацевтические средства для лечения артрита; антибиотики, включающие тетрациклины, пенициллин, стрептомицин и ауреомицин; антигельминтики и лекарственные средства против собачьей чумы, применяемые для домашних животных и большого скота, такие как, например, фенотиазин; лекарственные средства на основе серы, такие как сульфиоксазол; противоопухолевые лекарственные средства; фармацевтические контролирующие зависимость средства, такие как агенты, контролирующие алкогольную зависимость и агенты, контролирующие никотиновую зависимость; антагонисты привыкания к лекарственным средствам, такие как метадон; лекарственные средства, контролирующие вес; лекарственные средства, контролирующие щитовидную железу; анальгетики; лекарственные средства, контролирующие фертилизацию или гормональные контрацептивы; амфетамины; антигипертензивные лекарственные средства; противовоспалительные агенты; противокашлевые средства; седативные средства; миорелаксанты; противоэпилептические лекарственные средства; антидепрессанты; антиаритмические лекарственные средства; сосудорасширяющие средства; противогипертонические диуретики; антидиабетические средства; антикоагулянты; противотуберкулезные агенты; антипсихотические агенты; гормоны и пептиды. Должно быть понятно, что указанный выше перечень является неполным и только показывает широкое разнообразие терапевтических агентов, которые могут быть включены в композиции. В некоторых вариантах терапевтическим агентом является митоксантрон, белок (например, VEGF) или плазмидная ДНК.
Количество терапевтического агента, распределенного в композиции, зависит от разных факторов, включающих, например, специфический агент; функцию, которую он будет выполнять; требуемый период времени для высвобождения агента; количество, подлежащее введению. В целом, дозировка терапевтического агента, т.е. количество терапевтического агента в композиции, является выбранной из диапазона примерно от 0.001% (масса/масса) до 95% (масса/масса), предпочтительно примерно от 5% (масса/масса) до 75% (масса/масса) и более всего предпочтительно примерно от 10% (масса/масса) до 60% (масса/масса).
Цисплатин [цис-дихлордиаминплатина(П)] (CDDP) является важным классом противоопухолевых агентов и широко применяется для лечения многих злокачественных опухолей, включающих опухоль яичка, яичника, шейки матки, головы и шеи, и немелкоклеточный рак легкого (Jamieson, et al, Chem. Rev. (1999), 99(9); 2467-2498). Также он проявил активность в тройном негативном раке молочной железы (Leong, et al., J. Clin. Invest. (2007), 117(5):1370-80). Однако его применение является дозоограниченным, главным образом по причине нефротоксичности или токсичности для почек (Madias, NE and Harrington, JT, Am. J. (1978), 65(2):307-14). Для изучения этого ограничения было выделено два направления, первое направлено на синтез аналогов платины, второе на конструирование новых систем нанодоставки как способа доставки лекарственного средства непосредственно в место опухоли. В настоящее время установлено, что преимущественный хоминг наночастиц размером в диапазоне 80-120 нм в опухоли происходит в результате эффекта увеличенной проницаемости и задержания (EPR) (Moghimi, et al., Pharmacol. Rev. (2001), 53(2): 283-318). Это может уменьшить системные побочные эффекты и увеличить внутриопухолевую доставку. Было обнаружено, что нанолипосомальный состав цисплатина доставляет в 50-200 раз больше лекарственного средства в опухоль по сравнению с введением свободного цисплатина (Harrington, et al. Ann. Oncol. (2001) 12:493-496). Несмотря на наличие минимальной токсичности, нанолипосомальный состав обладает умеренной противоопухолевой активностью по сравнению с цисплатином; отражая проблемы не только доставки платины в относительно неактивной форме, но последующую необходимость достижения значительного высвобождения и активации внутри опухоли. Вторая стратегия инкапсулирования цисплатина в полимерные системы имела проблему, связанную с его нерастворимостью в органических растворителях и частичной растворимостью в воде, что приводило к недостаточной нагрузке или неспособности поддерживать замедленное высвобождение. Это вызвало необходимость разработки пролекарств платины (IV), которые можно модифицировать для повышения гидрофобности и повышения нагрузки в наночастицы на основе сополимера полиактид-полигликолид (Dhar et al., 2009). Или же, цисплатин конъюгировали с N-(2-гидроксипропил)метакриламидом (НРМА) через пептидильные боковые цепи и была доказана его биологическая активность (Lin X, Zhang Q, Rice JR, Stewart DR, Nowotnik DP, Howell SB). Улучшенное направленное воздействие химиотерапии на основе платины. Противоопухолевая активность платинового агента АР5280 сополимера НРМА в мышиных моделях опухоли. Eur J Cancer. 2004 Jan; 40(2):291-7). Однако такие подходы требуют прохождения через ферментативное расщепление или внутриклеточное восстановление для активации лекарственного средства. Аналогично, было обнаружено, что комплекс РАМАМ дендримеры-платина, который увеличивал нагрузку лекарственного средства, был в 200-550 раз менее токсичным, чем цисплатин, благодаря прочным связям, образованным между полимером и Pt (Haxton KJ, Burt HM. Polymeric drug delivery of platinum-based anticancer agents. J Pharm Sci. 2009 Jul; 98(7):2299-316).
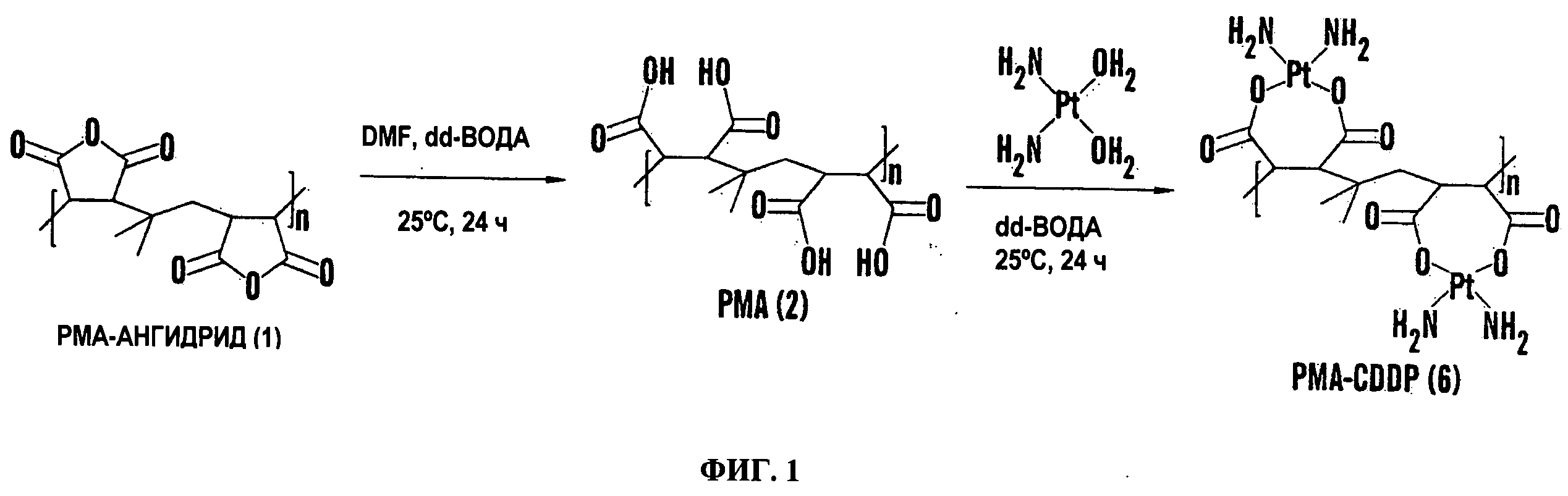
Для конструирования наносостава на основе цисплатина, который не является сложным, но решает проблемы, связанные с настоящими подходами, авторы изобретения объединили имеющуюся информацию по биотрансформации цисплатина и понимание зависимости активности от структуры, которое возникло при разработке аналогов цисплатина. Цисплатин активируется в результате внутриклеточного гидратирования одной или двух уходящих групп хлорида с образованием [Pt(NH3)2Cl(OH2)]+ и [Pt(NH3)2(OH2)]2+, после чего Pt образует ковалентные связи с пуриновыми основаниями по положению N7 с формированием межнитевых поперечных сшивок (Huifang Huang, Leiming Zhu, Brian R. Reid, Gary P. Drobny, Paul B. Hopkins. Solution Structure of a Cisplatin-Induced DNA Interstrand Cross-Link. Science 1995: 270. 1842-1845). Для сравнения, карбоплатин и оксалоплатин содержат циклобутан-1,1-декарбоксилат и оксалат соответственно в качестве уходящих групп, которые хелатируют платину более сильно, тем самым придавая большую стабильность комплексу уходящая группа-Pt, и в результате проявляют меньше побочных эффектов, чем цисплатин, но также и более низкую эффективность, чем цисплатин (Richard J. Knox, Frank Friedlos, David A. Lydall and John J. Roberts Mechanism of Cytotoxicity of Anticancer Platinum Drugs: Evidence That cis-Diamminedichloroplatinum(II) and c?,s-Diammine-(1,1-cyclobutanedicarboxylato) platinum(II) Differ Only in the Kinetics of Their Interaction with DNA. Cancer Research 46, 1972-1979, April 1, 1986; and Ronald S. Go, Alex A. Adjei. Review of the Comparative Pharmacology and Clinical Activity of Cisplatin and Carboplatin. Journal of Clinical Oncology, Vol 17, Issue 1 (January), 1999: 409). Авторы изобретения в качестве полимера выбрали 40-мерный поли(изобутилен-alt-малеиновую кислоту) (PIMA или РМА), так как каждый мономер имеет дикарбоксилатные группы, способные образовывать комплекс с цисплатин(ОН)2, делая возможным нагрузку молекулы цисплатина. Кроме того, при гидрировании малеиновой кислоты образуется янтарная кислота, которая является компонентом цикла Кребса. Поли(изобутилен-alt-малеиновую кислоту) 2 синтезировали из поли(изобутилен-alt-малеинового ангидрида) 1 с помощью реакции с водой в DMF одной стадией, как показано на Фигуре 1. Последующее конъюгирование цисплатина с поли(изобутилен-alt-малеиновой кислотой) (PIMA) 2 достигали путем перемешивания гидратированного цисплатина в течение 48 часов с образованием РМА-Цисплатин 6. Неконъюгированный цисплатин удаляли путем диализа, и количество нагрузки определяли с помощью ЯМР и спектрофотометрии. Удивительно, что процесс комплексообразования привел к генерации наночастиц путем процесса самосборки, с размером, определяемым количеством молекул цисплатина, нагруженных на полимер. Измерения с использованием динамического рассеяния лазерного излучения показали, что насыщение всех сайтов комплексообразования цисплатином приводит к образованию геля, в то время как нагрузка 15 молекул цисплатина на полимер приводит к образованию наночастиц размером 100 нм. Это было установлено с помощью трансмиссионной электронной микроскопии (данные не показаны).
Цисплатин является терапией первой линии для лечения рака легкого и таким образом авторы изобретения исследовали действие РМА-Цисплатин на жизнеспособность клеток рака легких Льюис. Обработка цисплатином и РМА-цисплатин вызывала одинаковую гибель клеток (Фиг.1C). Однако РМА также индуцировал гибель клеток опухоли. Авторы изобретения открыли, что данную проблему можно решить с помощью дериватизации РМА. Авторы изобретения дериватизировали полимер этилендиамином в щелочных условиях (Фиг.2). Удивительно, что, несмотря на то, что дериватизация не убрала цитотоксичность РМА, цитотоксичность комплекса РМА-цисплатин повысилась. Это возможно из-за того, что уходящая группа менее прочно связана по сравнению с недериватизированным РМА. Более того, такой эффект наблюдали в случае карбоплатина, который имеет более низкую константу скорости гидратирования, чем цисплатин, и в результате также является менее цитотоксичным. Исходный РМА-цисплатин может прочно удерживаться по сравнению с PMA-EDA из-за сильного хелатирования двумя карбоксигруппам. Для того, чтобы сделать полимер более биосовместимым, авторы изобретения модифицировали полимер глюкозамином (GA). PMA-GA-цисплатин синтезировали, начиная с РМА (1) с помощью реакции с глюкозамином и затем с водным раствором цисплатина (Фиг.3 и 11В). Все синтезированные полимеры-носители платинировали в водной фазе при комнатной температуре 25°С в течение 2 дней с гидратированным цисплатином в качестве агента платинирования, что привело к образованию конъюгатов. В разные моменты времени авторы изобретения брали аликвоты мелких фракций и рассчитывали общую нагрузку цисплатина на полимер. Авторы изобретения наблюдали, что эффективность нагрузки составила ~60% через 5 часов комплексообразования, ~80% через 30 часов и 100% через 48 часов платинирования. Общая нагрузка лекарственного средства составила 6 мг/15 мг полимера. Гидратирование цисплатина достигали с помощью эквимолярного количества цисплатина и AgNOs в условиях темноты в течение 48 ч. Все носители разделяли на фракции по стандартной методике путем диализа и изолировали с помощью сублимационной сушки для снятия спектроскопических характеристик. Использование DBU позволило синтезировать конъюгат глюкозамин-РМА, как видно на различных пиках полимера и сахара в результатах ЯМР, которые совпадают с ожидаемыми результатами ЯМР. Однако обработки основаниями, триэтиламином или DIPEA не позволили получить ожидаемый продукт, но представленные следовые количества в спектрах ЯМР являлись ключом к определению конечного функционального продукта.
Образование комплекса цисплатина с PMA-GA привело к самосборке комплекса в наночастицы. В определенных случаях прохождение наночастиц через фильтр 0.22 микрон приводит к генерации наночастиц, которые находятся в суб-100 нм диапазоне, который является критическим для преимущественного хоминга частиц в опухоль с помощью EPR эффекта. Удивительно, что исследования жизнеспособности клеток показали, что производное PMA-GA было свободно от внутренней токсичности для клеток. Напротив, оно поддерживало эффективность гидратированного цисплатина (Фиг.4В). Более того, дериватизация РМА полиэтилегликолем также способствовала удалению присущей токсичности, ассоциированной с РМА. Кроме того, цель может быть достигнута путем конъюгирования малеиновой кислоты в полимерную основную цепь, которая является биосовместимой.
Повышенная эффективность дериватизированных хелатированных полимеров по сравнению с исходным полимером указывает на то, что монокарбоксилато-хелатированные значительно легче высвобождают лекарственное средство и показали лучшую активность, чем дикарбоксилато-хелатированные (6). Авторы изобретения открыли, что полимерные монокарбоксилато-хелатированные платиновые соединения обладают значительным преимуществом перед конъюгатами, в которых металл соединен через дикарбоновую кислоту. Равномерное гидролитическое освобождение лекарственного средства из носителя в монокарбоксилато-хелатированных дериватизированных РМА конъюгатах по сравнению с более замедленным гидролитическим расщеплением дикарбоксилато-хелатированных в РМА может объяснить значительное различие в гибели клеток. Для дальнейшего изучения авторы изобретения инкубировали конъюгат лекарственное средство-полимер с лизатом клеток рака легкого Льюис в камере для диализа и количественно определяли высвобождение свободного лекарственного средства с использованием калориметрического анализа. Авторы изобретения получили быстрое и устойчивое высвобождение активного агента (Фиг.4А). Следует отметить, что такой же состав подвергали диализу в воде в течение 48 часов для удаления любого свободного цисплатина и авторы изобретения получили 100% эффективность нагрузки, предполагая, что активный агент не высвобождается в нейтральных условиях, но быстро высвобождается в присутствии лизата опухолевых клеток.
Описанные здесь композиции могут быть составлены в виде гелей и применяться для доставки с замедленным высвобождением биоактивных агентов в специфические места у субъекта. Например, композиция может применяться для доставки с замедленным высвобождением соединений платины в сайте расположения опухоли. В некоторых вариантах композиция применяется для доставки с замедленным высвобождением соединения платины после того, как опухоль была удалена.
Фармацевтические композиции
Для введения субъекту, связанные с полимером соединения платины могут быть обеспечены в виде фармацевтически приемлемых композиций. Данные фармацевтически приемлемые композиции включают терапевтически эффективное количество одного или более соединений платины, описанных здесь, составленных вместе с одним или более фармацевтически приемлемыми носителями (добавками) и/или разбавителями. Как описано подробно ниже, фармацевтические композиции настоящего изобретения могут быть специально разработаны для введения в твердой или жидкой форме, включающей такие, которые адаптированы для следующих режимов введения: (1) оральное введение, например, дозы лекарства (водные или неводные растворы или суспензии), таблетки для рассасывания, драже, капсулы, пилюли, таблетки (например, такие, которые предназначены для буккальной, сублингвальной и системной абсорбции), болюсы, порошки, гранулы, пасты для нанесения на язык; (2) парентеральное введение, например, путем подкожной, внутримышечной, внутривенной или эпидуральной инъекции, например, стерильного раствора или суспензии, или состава с замедленным высвобождением; (3) местное применение, например, в виде крема, мази или пластыря, или спрея с замедленным высвобождением, применяемое на кожу; (4) интравагинальное или интраректальное, например, в виде пессария, крема или пены; (5) сублингвальное; (6) окулярное; (7) трансдермальное; (8) трансмукозальное; или (9) назальное. К тому же, соединения могут быть имплантированы пациенту или инъецированы с помощью систем доставки лекарственных средств. Смотри, например, Urquhart, et al., Ann. Rev. Pharmacol. Toxicol. 24: 199-236 (1984); Lewis, ed. "Controlled Release of Pesticides and Pharmaceuticals" (Plenum Press, New York, 1981); U.S. Pat. No. 3,773,919; and U.S. Pat. No. 35 3,270,960.
Использующийся здесь термин «фармацевтически приемлемый» относится к таким соединениям, материалам, композициям и/или лекарственным формам, которые, в пределах тщательной медицинской проверки, являются пригодными для применения в контакте с тканями человека и животных без избыточной токсичности, раздражения, аллергической реакции или других проблем или жалоб, сопоставимых с допустимым соотношением польза/риск.
Использующийся здесь термин «фармацевтически приемлемый носитель» означает фармацевтически приемлемый материал, композицию или носитель, такой как жидкость или твердый наполнитель, разбавитель, вспомогательное вещество, добавка, облегчающая производство (например, лубрикант, тальк, стеарат магния, кальция или цинка или стеариновая кислота), или материал для инкапсулирования растворителя, вовлеченный в перенос или перемещение испытуемого соединения из одного органа или части тела в другой орган или часть тела. Каждый носитель должен быть «приемлемым», то есть быть совместимым с другими ингредиентами состава и не быть вредным для пациента. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натрий-карбоксиметилцеллюлоза, метилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза и ацетат целлюлозы; (4) порошковый трагакант; (5) мальзтозу; (6) желатин; (7) лубриканты, такие как стеарат магния, лаурилсульфат натрия, и тальк; (8) вспомогательные вещества, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиоли, такие как глицерин, сорбит, манит и полиэтиленгликоль (PEG); (12) эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные вещества, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический раствор; (18) раствор Рингера; (19) этиловый спирт; (20) рН буферных растворов; (21) полиэфиры, поликарбонаты и/или полиангидриды; (22) наполнители, такие как полипептиды и аминокислоты; (23) компонент сыворотки, такой как сывороточный альбумин, HDL и LDL; (22) С2-С12 спирты, такие как этанол; и (23) другие нетоксичные совместимые вещества, использующиеся в фармацевтических составах. Смачивающие агенты, красители, агенты высвобождения, покрывающие агенты, подсластители, ароматизаторы, отдушки, консерванты и антиоксиданты могут также быть представлены в составе. Термины, такие как «вспомогательное вещество», «носитель», «фармацевтически приемлемый носитель» или подобные используются здесь взаимозаменяемо.
Использующееся здесь выражение «терапевтически эффективное количество» означает, что количество соединения, материала или композиции, включающей соединение настоящего изобретения, которое является эффективным для получения желаемого терапевтического эффекта, по меньшей мере, в субпопуляции клеток у животного, при допустимом соотношении польза/риск, применимо к любому лекарственному лечению. Например, количество соединения, вводимого субъекту, которое является достаточным для получения статистически значимого, измеряемого изменения, по меньшей мере, одного симптома рака или метастаз.
Определение терапевтически эффективного количества находится в компетенции опытных специалистов в данной области. В целом, терапевтически эффективное количество может изменяться в зависимости от истории субъекта, возраста, состояния, пола, а также тяжести и типа состояния здоровья субъекта, и введения других фармацевтически активных агентов.
Использующийся здесь термин «введение» относится к помещению композиции в субъект способом или режимом, в результате которого происходит, по меньшей мере, частичная локализация композиции в требуемом месте для получения требуемого эффекта. Соединение или композиция, описанная здесь, может вводиться любым соответствующим режимом, известным в данной области, включающим, но без ограничения, оральный или парентеральный режимы, включающие внутривенное, внутримышечное, подкожное, трансдермальное, воздушное (аэрозоль), пульмональное, назальное, ректальное и местное (включая буккальное и сублингвальное) введение.
Примеры режимов введения включают, но без ограничения, инъекцию, вливание, инстилляцию, ингаляцию или прием внутрь. «Инъекция» включает, без ограничения, внутривенную, внутримышечную, внутриартериальную, интратекальную, интравентикулярную, интракапсулярную, интраорбитальную, интракардиальную, интрадермальную, интраперитонеальную, транстрахеальную, подкожную, внутрикожную, интраартикулярную, субкапсулярную, субарахиоидальную, интраспинальную, интрацереброспинальную и надчревную инъекцию и вливание. В предпочтительных вариантах композиции вводятся путем внутривенного вливания или инъекции.
«Лечение», «предупреждение», или «ослабление» заболевания, или нарушения означают задержку или предупреждение начала такого заболевания или нарушения, реверсию, частичное снятие симптомов, улучшение, ингибирование, замедление или остановку прогрессирования, аггравации или ухудшения прогрессирования или тяжести состояния, ассоциированного с таким заболеванием или нарушением. В одном варианте, по меньшей мере, один из симптомов заболевания или нарушения является частично снятым, по меньшей мере, на 5%, по меньшей мере, на 10%, по меньшей мере, на 20%, по меньшей мере, на 30%, по меньшей мере, на 40% или, по меньшей мере, на 50%.
Использующийся здесь термин «субъект» означает человека или животное. Как правило, животным является позвоночное животное, такое как примат, грызун, домашнее животное или охотничье-промысловое животное. Приматы включают шимпанзе, яванский макак, паукообразную обезьяну и макак, например макак-резус. Грызуны включают мышей, крыс, сурков, хорьков, кроликов и хомяков. Домашние и охотничье-промысловые животные включают коров, лошадей, свиней, оленей, бизонов, буйволов, разновидности кошек, например домашних кошек, разновидности собак, например собак, лис, волков, разновидности птиц, например цыплят, эму, страусов, и рыбу, например форель, сома и лосося. Пациент или субъект включает любое подмножество из изложенных выше, например все из вышеперечисленных, но за исключением одной или более групп или видов, таких как человек, приматы или грызуны. В определенных вариантах субъектом является млекопитающее, например примат, например человек. Термины «пациент» и «субъект» используются здесь взаимозаменяемо.
Предпочтительно, чтобы субъектом было млекопитающее. Млекопитающее может быть человеком, нечеловеческим приматом, мышью, крысой, собакой, кошкой, лошадью или коровой, но не ограничивается данными примерами. Млекопитающие, отличные от человека, могут быть предпочтительно использованы в качестве субъектов, которые представляют животные модели нарушений, ассоциированных с воспалением.
К тому же, способы, описанные здесь, могут быть использованы для лечения одомашненных животных и/или домашних животных. Субъект может быть мужского или женского пола. Субъектом может являться субъект, который ранее был диагностирован или идентифицирован как страдающий или имеющий нарушение, рак или метастазы, но еще не подвергшийся терапии.
Использующийся здесь термин «рак» включает, но без ограничения, солидные опухоли и опухоли кроветворной системы. Термин «рак» относится к заболеваниям кожи, тканей, органов, костей, хрящей, крови и сосудов. Термин «рак», кроме того, включает первичный и метастатический рак. Примеры рака, которые можно лечить с помощью соединений изобретения, включают, но без ограничения, карциному, включающую карциному мочевого пузыря, молочной железы, толстой кишки, почки, легкого, яичника, поджелудочной железы, желудка, шейки матки, щитовидной железы и кожи, включая плоскоклеточную карциному; гематопоэтические опухоли лимфоидного происхождения, включающие, но без ограничения, лейкемию, острый лимфоцитарный лейкоз, острый лимфобластный лейкоз, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, неходжскинскую лимфому, волосатоклеточный лейкоз и лимфому Беркитта; гематопоэтические опухоли миелоидного происхождения, включающие, но без ограничения, острый и хронический миелобластный лейкоз и промиелоцитарный лейкоз; опухоли мезенхимального происхождения, включающие, но без ограничения, фибросаркому, рабдомиосаркому и остеосаркому; другие опухоли, включающие меланому, семиному, тетратокарциному, нейробластому и глиому; опухоли центральной и периферической нервной системы, включающие, но без ограничения, астроцитому, нейробластому, глиому и невриному; и другие опухоли, включающие, но без ограничения, пигментную ксеродерму, кератоакантому, фолликулярный рак щитовидной железы и тератокарциному. Соединения изобретения являются эффективными для лечения пациентов, которые ранее подвергались, а также не подвергались противораковой терапии. Без сомнения, способы и композиции данного изобретения могут применяться в качестве противоопухолевой терапии первой и второй линии.
Соединения изобретения также являются эффективными в комбинации с известными противораковыми терапиями, включающими облучение. Способы изобретения являются особенно эффективными в комбинации с противораковыми терапиями, которые включают введение второго лекарственного средства, действующего в другой фазе клеточного цикла, например S фазе, отличной от эпотилонов Формулы (Ia) или (Ib), которые проявляют свое действие в G2-M фазе.
Определения
Если не указано иное или подразумевается из контекста, следующие термины и выражения имеют значения, представленные далее. Если особо не указано иное или очевидно из контекста, термины и выражения, представленные далее, не исключают значения, которое термин или выражение имеет в области, к которой оно относится. Определения представлены для облегчения описания конкретных вариантов и не предусматривают ограничения изобретения, описанного в формуле изобретения, так как объем изобретения ограничен только формулой. Кроме того, если контекстом не требуется иное, термины в единственном числе будут включать множественное число, и термины в множественном числе будут включать единственное число.
Использующийся здесь термин «включающий» или «включает» используется в отношении композиций, способов и их соответствующего компонента(ов), которые являются существенными для изобретения, однако же открытые для включения неуказанных элементов, являющихся существенными или нет.
Отличные от рабочих примеров или в случаях, когда указано иное, все числа, выражающие количества ингредиентов или условия реакции, использующиеся здесь, следует понимать как измененные во всех случаях термином «примерно». Термин «примерно», при использовании в отношении процентов, может означать среднее ±1%.
Термин, обозначающий единственное число, «a», «an» и «the» включает множественное число, если в контексте четко не указано иное. Аналогично, слово «или» предполагает включение «и», если в контексте четко не указано иное.
Далее представлено описание пригодных способов и материалов, хотя при осуществлении на практике или проверке данного раскрытия могут применяться способы и материалы, аналогичные или эквивалентные описанным здесь. Термин «содержит» означает «включает». Сокращение «e.g.» происходит от латинского «например» и используется здесь для указания неограничивающего примера. Таким образом, аббревиатура «e.g.» является синонимом термина «например».
Термин «алкил» относится к насыщенным неароматическим углеводородным цепям, которые могут представлять собой прямую или разветвленную цепь, содержащую указанное количество атомов углерода (к их числу относится без ограничения метил, этил, пропил, изопропил, бутил, 2-метил-этил, t-бутил, аллил или пропаргил), в которую могут быть факультативно включены N, О или S. Например, C1-С6 указывает, что группа может содержать от 1 до 6 (включительно) атомов углерода.
Термин «алкенил» относится к алкилу, который содержит, по меньшей мере, одну двойную связь. Примеры алкенильных групп включают, например, но без ограничения, этенил, пропенил, бутенил, 1-метил-2-бутен-1-ил и подобные.
Термин «алкинил» относится к алкилу, который содержит, по меньшей мере, одну тройную связь.
Термин «арил» относится к моноциклической, бициклической или трициклической ароматической кольцевой системе, в которой 0, 1, 2, 3 или 4 атома каждого кольца могут быть замещенными заместителем. Примеры арильных групп включают, но без ограничения, бензил, фенил, нафтил, антраценил, азуленил, фторенил, инданил, инденил, нафтил, фенил, тетрагидронафтил и подобные.
Термин «циклил» или «циклоалкил» относится к насыщенным и частично ненасыщенным циклическим углеводородным группам, содержащим от 3 до 12 атомов углерода, например от 3 до 8 атомов углерода и, например, от 3 до 6 атомов углерода, при этом циклоалкильная группа дополнительно может быть факультативно замещенной. Примеры циклоалкильной группы включают, но без ограничения, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил, циклоокил и подобные.
Термин «гетероарил» относится к ароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, содержащей 1-3 гетероатомов в случае моноциклической, 1-6 гетероатомов в случае бициклической или 1-9 гетероатомов в случае трициклической системы, при этом указанные гетероатомы являются выбранными из О, N или S (например, атомы углерода и 1-3, 1-6 или 1-9 гетероатомов О, N или S в случае моноциклической, бициклической или трициклической системы, соответственно), при этом 0, 1, 2, 3 или 4 атомов каждого кольца могут быть замещенными заместителем. Примеры гетероарильных групп включают, но без ограничения, пиридил, фурил или фуранил, имидазолил, бензимидазолил, пиримидинил, тиофенил или тиенил, пиридазинил, пиразинил, хинолинил, индолил, тиазолил, нафтиридинил и подобные.
Термин «гетероциклил» относится к неароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, содержащей 1-3 гетероатомов в случае моноциклической, 1-6 гетероатомов в случае бициклической или 1-9 гетероатомов в случае трициклической системы, при этом указанные гетероатомы являются выбранными из О, N или S (например, атомы углерода и 1-3, 1-6 или 1-9 гетероатомов О, N или S в случае моноциклической, бициклической или трициклической соответственно), при этом 0, 1, 2 или 3 атома каждого кольца могут быть замещенными заместителем. Примеры гетероциклильных групп включают, но без ограничения, пиперазинил, пирролидинил, диоксанил, морфолинил, тетрагидрофуранил и подобные.
Термин «факультативно замещенный» означает, что определенная группа или фрагмент, такая как алкильная группа, алкенильная группа и подобные, является незамещенной или замещенной одним или более заместителями (как правило, 1-4 заместителей), независимо выбранными из группы заместителей, приведенной ниже в определении «заместители» или указаны иначе.
Термин «заместители» относится к группе, «замещенной» на алкильную, алкенильную, алкинильную, циклоалкильную, арильную, гетероциклильную или гетероарильную группу в любом атоме данной группы. Пригодные заместители включают, без ограничения, галоген, гидрокси, оксо, нитро, галоалкил, алкил, алкенил, алкинил, алкарил, арил, аралкил, алкокси, арилокси, амино, ациламино, алкилкарбоноил, арилкарбаноил, аминоалкил, алкоксикарбонил, карбокси, гидроксиалкил, алкансульфонил, аренсульфонил, алкансульфонамидо, аренсульфонамидо, аралкилсульфонамидо, алкилкарбонил, ацилокси, циано или уреидо. В некоторых случаях два заместителя вместе с атомами углерода, к которым они присоединены, могут образовывать кольцо.
Использующийся здесь термин «полимер» относится к продукту реакции полимеризации и включает гомополимеры, сополимеры, терполимеры, тетраполимеры и т.п. Термин «полимер» также включает рэндом-полимеры, блок-полимеры, графт-полимеры, сополимеры, блок-сополимеры и графт-сополимеры. Использующийся здесь термин «сополимер» относится к полимерам, образованным путем реакции полимеризации, по меньшей мере, двух разных мономеров.
Использующийся здесь термин «основная цепь сополимера» относится к той части полимера, которая является непрерывной цепью, включающей связи, образованные между мономерами при полимеризации. Композиция основной цепи сополимера может быть описана с точки зрения идентичности мономеров, из которых она образована, без учета композиции ветвей или боковых цепей основной цепи полимера. Термин «боковая цепь» относится к частям мономера, которые после полимеризации образуют удлинение основной цепи сополимера.
Использующийся здесь термин «биосовместимый» относится к материалу, который способен взаимодействовать с биологической системой без вызывания цитотоксичности, нежелательного белка или модификации нуклеиновой кислоты, или активации нежелательной иммунной реакции. Также «биосовместимость» включает главным образом отсутствие взаимодействия с распознающими белками, например, антителами природного происхождения, клеточными белками, клетками и другими компонентами биологических систем.
Использующиеся здесь эфирные боковые цепи означают боковые цепи формулы -R'”C(O)-ORE, где RE независимо представляет собой C1-С6 алкил, C1-С6 алкенил, C1-С6 алкинил, циклил, гетероциклил, арил или гетероарил, каждый из которых может быть факультативно замещенным; и R'” представляет собой связь или C1-С6 алкилен, при этом алкилен может включать одну или более двойных или тройных связей и/или основная цепь алкилена может прерываться О, S, S(O), NH или С(O). Предпочтительно, чтобы R'” являлся связью.
Использующиеся здесь амидные боковые цепи означают боковые цепи формулы - R”C(O)-N(RA), где RA независимо представляет собой Н, C1-С6 алкил, C1-С6 алкенил, C1-С6 алкинил, циклил, гетероциклил, арил, гетероарил, сахарид, дисахарид или трисахарид, каждый из которых может быть факультативно замещенным; и R" представляет собой связь или C1-С6 алкилен, при этом алкилен может содержать одну или более двойных или тройных связей и/или основная цепь алкилена может прерываться О, S, S(O), NH или С(O). Предпочтительно, чтобы R” являлся связью.
Использующаяся здесь цепь карбоновой кислоты означает боковые цепи формулы -R””C(O)OH, где R”” представляет собой связь или C1-С6 алкилен, при этом алкилен может содержать одну или более двойных или тройных связей, и/или основная цепь алкилена может прерываться О, S, S(O), NH или С(O). Предпочтительно, чтобы R" являлся связью.
Некоторые неисчерпывающие примеры биосовместимых полимеров включают полиамиды, поликарбонаты, полиалкилены, полиалкиленовые гликоли, полиалкиленовые оксиды, полиалкиленовые терефталаты, поливиниловые спирты, поливинилэфиры, поливиниловые сложные эфиры, поливинилгалогениды, поливинилпирролидон, полигликолиды, полисилоксаны, полиуретаны и их сополимеры, алкилцеллюлозу, гидроксиалкилцеллюлозу, эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, полимеры акрилового и метакрилового эфиров, метилцеллюлозу, этилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксибутилметилцеллюлозу, ацетат целлюлозы, пропионат целлюлозы, ацетатбутират целлюлозы, ацетат фталат целлюлозы, карбоксиэтилцеллюлозу, триацетат целлюлозу, натриевая соль сульфат целлюлозы, поли(метилметакрилат), поли(этилметакрилат), поли(бутилметакрилат), поли(изобутилметакрилат), поли(гексилметакрилат), поли(изодецилметакрилат), поли(лаурилметакрилат), поли(фенилметакрилат), поли(метакрилат), поли(изопропакрилат), поли(изобутакрилат), поли(октадекакрилат), полиэтилен, полипропилен поли(этиленгликоль), поли(этиленоксид), поли(этилентерефталат), поли(виниловый спирт), поли(винилацетат), поливинилхлорид, полистирол, полигиалуроновые кислоты, казеин, желатин, глютен, полиангидриды, полиакриловая кислота, альгинат, хитозан, любые их сополимеры, и любые их комбинации. К тому же, биосовместимые полимеры и сополимеры, которые были модифицированы для требуемого ферментативного расщепления или изменены при воздействии света, ультразвука, облучения, изменения температуры, рН, осмотических свойств, концентрации жидкой фазы или растворителя, также включены в настоящее изобретение.
Настоящее изобретение может быть определено любым из следующих пронумерованных абзацев:
1. Биосовместимая конъюгированная полимерная наночастица, включающая: основную цепь сополимера;
множество боковых цепей, ковалентно связанных с указанной основной цепью; и
множество соединений платины, диссоциируемо связанных с указанными боковыми цепями.
2. Наночастица по п.1, отличающаяся тем, что указанное множество соединений платины является выбранным из соединений Pt(II), соединений Pt(IV) и любой их комбинации.
3. Наночастица по п.1 или 2, отличающаяся тем, что, по меньшей мере, одно из указанного множества соединений платины является связанным с указанной боковой цепью, по меньшей мере, через одну координационную связь.
4. Наночастица по п.3, отличающаяся тем, что указанная координационная связь находится между кислородом боковых цепей и атомом платины соединения платины.
5. Наночастица по п.4, отличающаяся тем, что указанным кислородом является карбонильный кислород.
6. Наночастица по п.4, отличающаяся тем, что указанным кислородом является амидный кислород.
7. Наночастица по любому из пп.1-6, отличающаяся тем, что указанный полимер содержит мономеры малеиновой кислоты.
8. Наночастица по п.7, отличающаяся тем, что, по меньшей мере, одна карбоновая кислота малеиновой кислоты является дериватизированной в амид.
9. Наночастица по любому из пп.1-8, отличающаяся тем, что указанный сополимер представляет собой поли(изобутилен-alt-малеиновую кислоту) (PIMA).
10. Наночастица по любому из пп.1-9, отличающаяся тем, что указанный сополимер содержит от 2 до 100 мономерных звеньев.
11. Наночастица по любому из пп.1-9, отличающаяся тем, что указанный сополимер содержит от 25 до 50 мономерных звеньев.
12. Наночастица по любому из пп.1-11, отличающаяся тем, что указанные боковые цепи являются выбранными из группы, состоящей из полимеров, моносахаридов, дикарбоновых кислот и их комбинаций.
13. Наночастица по любому из пп.1-12, отличающаяся тем, что указанные боковые цепи представляют собой полиэтиленгликоль (PEG).
14. Наночастица по п.13, отличающаяся тем, что указанные боковые цепи PEG имеют молекулярную массу от 100 до 5000 дальтон.
15. Наночастица по п.13, отличающаяся тем, что указанные боковые цепи PEG имеют молекулярную массу от 1000 до 3000 дальтон.
16. Наночастица по п.13, отличающаяся тем, что указанные боковые цепи PEG имеют молекулярную массу примерно 2000 дальтон.
17. Наночастица по любому из пп.1-12, отличающаяся тем, что указанными боковыми цепями являются моносахариды.
18. Наночастица по п.17, отличающаяся тем, что указанными моносахаридами является глюкозамин.
19. Наночастица по любому из пп.1-18, отличающаяся тем, что указанное соединение платины представляет собой соединение Pt(II), выбранное из группы, состоящей из цисплатина, оксалиплатина, карбоплатина, параплатина, сартраплатина и их комбинаций.
20. Наночастица по п.19, отличающаяся тем, что указанным соединением платины (II) является цисплатин.
21. Наночастица по п.19, отличающаяся тем, что указанным соединением платины является оксалиплатин.
22. Наночастица по любому из пп.1-21, отличающаяся тем, что количество боковых цепей составляет от 50% до 100% количества мономерных звеньев указанной основной цепи полимера.
23. Наночастица по любому из пп.1-22, отличающаяся тем, что количество боковых цепей больше чем 90% количества мономерных звеньев указанной основной цепи полимера.
24. Наночастица по любому из пп.1-23, отличающаяся тем, что количество указанных соединений платины составляет от 10% до 100% количества мономерных звеньев указанной основной цепи полимера.
25. Наночастица по любому из пп.1-24, отличающаяся тем, что количество указанных соединений платины составляет от 25% до 75% количества мономерных звеньев указанной основной цепи полимера.
26. Наночастица по любому из пп.1-25, отличающаяся тем, что указанные боковые цепи включают дикарбоновые кислоты.
27. Наночастица по п.26, отличающаяся тем, что указанные дикарбоновые кислоты имеют формулу HOOC-R-COOH, где R представляет собой C1-С6 алкил, С1-С6 алкенил или С2-С6 алкинил.
28. Наночастица по п.27, отличающаяся тем, что указанной дикарбоновой кислотой является малеиновая кислота.
29. Биосовместимая конъюгированная полимерная наночастица, включающая:
основную цепь поли(изобутилен-alt-малеиновой кислоты), отличающуюся тем, что указанная основная цепь содержит от 25 до 50 мономерных звеньев;
множество боковых цепей PEG, ковалентно связанных с указанной основной цепью, при этом указанные боковые цепи PEG имеют молекулярную массу от 1000 до 3000 дальтон, и при этом количество указанных боковых цепей PEG составляет от 50% до 100% количества мономерных звеньев указанной основной цепи полимера; и
множество боковых групп цисплатина, диссоциируемо связанных с указанной основной цепью, при этом количество указанных боковых групп цисплатина составляет от 25% до 75% количества мономерных звеньев указанной основной цепи полимера.
30. Биосовместимая конъюгированная полимерная наночастица, включающая:
основную цепь поли(изобутилен-alt-малеиновой кислоты), отличающуюся тем, что указанная основная цепь состоит из 40 мономеров;
множество боковых цепей PEG, ковалентно связанных с указанной основной цепью, при этом указанные боковые цепи PEG имеют молекулярную массу 2000 дальтон, и при этом количество указанных боковых цепей PEG больше чем 90% мономерных звеньев указанной основной цепи полимера; и
множество боковых групп цисплатина, диссоциируемо связанных с указанной основной цепью, при этом количество указанных боковых групп цисплатина составляет от 25% до 75% количества мономерных звеньев указанной основной цепи полимера.
31. Биосовместимая конъюгированная полимерная наночастица, включающая:
основную цепь поли(изобутилен-alt-малеиновой кислоты), отличающуюся тем, что указанная основная цепь содержит от 25 до 50 мономеров;
множество глюкозаминовых боковых цепей, ковалентно связанных с указанной основной цепью, и при этом количество указанных глюкозаминовых боковых цепей составляет от 50% до 100% мономерных звеньев указанной основной цепи полимера; и
множество боковых групп цисплатина, диссоциируемо связанных с указанной основной цепью, при этом количество указанных боковых групп цисплатина составляет от 25% до 75% количества мономерных звеньев указанной основной цепи полимера.
32. Биосовместимая конъюгированная полимерная наночастица, включающая:
основную цепь поли(изобутилен-alt-малеиновой кислоты), отличающуюся тем, что указанная основная цепь содержит от 25 до 50 мономеров;
множество глюкозаминовых боковых цепей, ковалентно связанных с указанной основной цепью, и при этом количество указанных глюкозаминовых боковых цепей больше чем 90% мономерных звеньев указанной основной цепи полимера; и
множество боковых групп цисплатина, диссоциируемо связанных с указанной основной цепью, при этом количество указанных боковых групп цисплатина составляет от 25% до 75% включительно количества мономерных звеньев указанной основной цепи полимера.
33. Конъюгированная наночастица комплекса карбоновая кислота-соединение платины, включающая:
комплекс карбоновая кислота-соединение платины; и
множество липид-полимерных цепей, при этом карбоновая часть указанного комплекса карбоновая кислота-соединение платины является ковалентно связанной с указанными липид-полимерными цепями.
34. Наночастица по п.33, отличающаяся тем, что карбоновой кислотой является малеиновая кислота.
35. Наночастица по любому из пп.33-34, отличающаяся тем, что полимером является PEG.
36. Наночастица по любому из пп.33-35, отличающаяся тем, что соединением платины является соединение Pt(II), выбранное из группы, состоящей из цисплатина, оксалиплатина, карбоплатина, параплатина, сартраплатина и их комбинаций.
37. Наночастица по п.36, отличающаяся тем, что соединение Pt(II) представляет собой цисплатин.
38. Наночастица по любому из пп.33-37, отличающаяся тем, что нагрузка соединения платины составляет от 1% до 30%.
39. Наночастица по любому из пп.33-38, отличающаяся тем, что нагрузка соединения платины составляет от 1% до 6%.
40. Везикулярное, мицеллярное или липосомное соединение, включающее множество наночастиц по любому из пп.33-39.
41. Дикарбонил-липидное соединение, имеющее структуру

42. Везикулярное, мицеллярное, липосомное или наносоединение, включающее дикарбонил-липидное соединение по п.41 и соединение платины, отличающееся тем, что соединение платины является диссоциируемо связанным с соединением по п.41.
43. Наночастица по п.42, отличающаяся тем, что соединение платины является выбранным из соединений Pt(II), соединений Pt(IV) и любых их комбинаций.
44. Наночастица по п.43, отличающаяся тем, что указанным соединением платины является соединений Pt(II), выбранное из группы, состоящей из цисплатина, оксалиплатина, карбоплатина, параплатина, сартраплатина и их комбинаций.
45. Наночастица по п.43, отличающаяся тем, что указанным соединением платины (II) является цисплатин.
46. Наночастица по п.43, отличающаяся тем, что указанным соединением платины является оксалиплатин.
47. Наносоединение, включающее биосовместимый полимер, отличающееся тем, что полимер включает, по меньшей мере, один мономер, имеющий формулу -CH(CO2H)-R-CH(C(O)R')-, где R является связью, C1-С6 алкиленом, при этом алкилен может содержать одну или более двойных или тройных связей; и R' является замещенным атомом азота. Предпочтительно, чтобы R являлся связью.
48. Наночастица по п.47, отличающаяся тем, что полимер содержит от 2 до 100 мономерных звеньев, имеющих формулу CH(CO2H)-R-CH(C(O)R')-.
49. Наночастица по любому из пп.47-48, отличающаяся тем, что полимер содержит от 25 до 50 мономерных звеньев, имеющих формулу CH(CO2H)-R-CH(C(O)R')-.
50. Наночастица по любому из пп.47-49, отличающаяся тем, что R' представляет собой
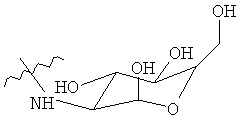
51. Наночастица по любому из пп.47-50, кроме того включающая биоактинвй агент.
52. Фармацевтическая композиция, включающая:
наночастицу или соединение по п.1-51; и фармацевтически приемлемый носитель.
53. Способ лечения рака или метастаз, включающий:
введение субъекту, нуждающемуся в этом, эффективного количества композиции по любому из пп.1-52.
54. Способ по п.53, отличающийся тем, что рак или метастазы является выбранным из группы, состоящей из опухолей, восприимчивых или устойчивых к платине.
55. Способ по п.54, отличающийся тем, что указанный рак или метастазы является выбранным из группы, состоящей из рака молочной железы, головы и шей, яичников, яичка, поджелудочной железы, орального отдела пищевода, желудочно-кишечного рака, печени, мочевого пузыря, легкого, меланомы, рака кожи, саркомы, рака крови, опухолей мозга, глиобластомы, опухолей нейроэктодермального происхождения и любых их комбинаций.
56. Способ замедленного высвобождения соединения платины в определенном месте у субъекта, включающий: обеспечение месторасположения композиции по любому из пп.1-52.
57. Способ по п.56, отличающийся тем, что композиция находится в форме геля.
58. Способ по любому из пп.56-57, отличающийся тем, что месторасположением является опухоль.
59. Способ по п.58, отличающийся тем, что опухоль была удалена до обеспечения композиции.
В неуказанных случаях средним специалистам в данной области должно быть понятно, что любой из разных вариантов, описанных и проиллюстрированных здесь, может быть в дальнейшем изменен для включения признаков, показанных в любых других вариантах, раскрытых здесь.
Осуществление изобретения
Следующие примеры иллюстрируют некоторые варианты и аспекты изобретения. Специалистам в данной области будет очевидно, что разные изменения, добавления, замещения и подобные могут быть выполнены без отступления от сущности или объема изобретения, и такие изменения и варианты включены в объем изобретения, как определено в последующей формуле. Следующие примеры не ограничивают изобретение каким-либо образом.
ПРИМЕРЫ
Материалы и способы
Реагент CellTiter 96 AQueous One Solution Cell Proliferation Assay [3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолий, внутренняя соль; MTS] получали от компании Promega (Madison, WI). Все полимерные растворы подвергали диализу с использованием диализных трубок с целлюлозной мембраной Spectra/Por 4 и Spectra/Por 6 (влажная трубка), с порогами отсечения среднемассовой молекулярной массы 1000 и 3500, соответственно. Процесс выполняли против нескольких партий перемешанной деионизированной H2O. Коммерчески приобретенные (Sigma, Fluka AG, Aldrich Chemie GmbH) химические вещества со степенью чистоты выше технической использовали в том виде, в котором были получены. К их числу относятся N,N-диметилформамид (DMF), поли(изобутилен-alt-малеиновый ангидрид), глюкозамин. HCl, mPEG2000NH2, диаза(1,3)бицикло[5.4.0]ундекан (DBU), триэтиламин.1Н ЯМР и13С ЯМР измеряли при 300 и 400 МГц соответственно с использованием спектрометра Varion-300 или Brucker-400. Химические сдвиги1Н ЯМР представлены как 8 величины в частях на миллион (м.д.) относительно тетраметилсилана (0.0 м.д.) или оксида дейтерия (4.8 м.д.). Данные представлены в следующем виде: химический сдвиг, мультиплетность (s=синглет, d=дублет, t=триплет, q=квартет, m=мультиплет, b=широкий), константы взаимодействия (герцы) и интегрирование. Химические сдвиги углерода-13 представлены в м.д. относительно CDCl3 (76.9 м.д.) или относительно DMSOd6 (39.5 м.д.). Химические сдвиги195Pt ЯМР представлены как 5 в м.д. относительно Na2PtCl6 (0.0 м.д.). В некоторых экспериментах1Н ЯМР и13С ЯМР были измерены при 500 и 125 МГц соответственно с использованием спектрометра Varion 500 или Brucker-400.
Исходные материалы обезвоживали азеотропной перегонкой до начала реакции по мере необходимости, и все воздухо- и/или влагочувствительные реакции проводили в высушенной в пламени горелки и/или сушильном шкафу стеклянной посуде в безводной атмосфере азота с применением стандартных мер предосторожности для исключения влаги.
Клеточная культура и анализ жизнеспособности клеток
Клеточные линии карциномы легкого Льюис (LLC) и клеточная линия рака молочной железы (4Т1) были приобретены у компании American Type Culture Collection (ATCC, Rockville, MD, США). Клетки карциномы легкого Льюис культивировали в модифицированной по способу Дульбекко среде Игла, дополненной 10% FBS, 50 единиц/мл пенициллина и 50 единиц/мл стрептомицина. Клетки 4Т1 культивировали в среде RPMI, дополненной 10% FBS, 50 единиц/мл пенициллина и 50 единиц/мл стрептомицина. Обработанные трипсином культивированные клетки LLC и 4Т1 дважды отмывали PBS и засевали в 96-луночные планшеты с плоским дном при плотности 2×103 клеток в 100 мкл среды. Разные концентрации конъюгатов тестировали с трехкратным повторением в таких же 96-луночных планшетах для каждого эксперимента. Среду хранили в качестве негативного контроля и CDDP в качестве положительного контроля. Планшеты затем инкубировали в течение 48 ч в атмосфере 5% СО2 при 37°С. Клетки отмывали и инкубировали с 100 мкл среды без фенолового красного (без FBS), содержащей 20 мкл CellTiter 96 Aqueous One Solution reagent (Promega, WI, США). Этот анализ с помощью [3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолий, внутренняя соль] (MTS) является колориметрическим методом определения числа жизнеспособных клеток в тестах на пролиферацию или цитотоксичность. Через 2 ч инкубации в атмосфере 5% CO2 при 37°С поглощение в каждой лунке записывали при 490 нм с использованием планшет-ридера VERSA max (Molecular Devices, Sunnyvale, CA, США).
Поглощение отражает число выживших клеток. Контрольные пробы вычитались из всех данных, и результаты анализировали с использованием программного обеспечения Origin software (OriginLab Corporation, Northampton, США). Среднее значение данных поглощения в трехкратном повторении для каждой тестируемой дозы делили на среднее значение для необработанных контрольных клеток. Логарифм отношения использовали для построения графика как функции заданной дозы, т.е. Y=(среднее значение поглощения тестированных образцов - фон)/(среднее значение поглощения необработанных образцов - фон) в зависимости от Х=тестируемая доза.
Измерение размера частиц
ТЕМ изображения с высоким разрешением были получены на высококонтрастном цифровом ТЕМ JEOL 2011. Образцы готовили на покрытых углеродом медных сетках 300 меш (Electron Microscopy Sciences) путем добавления капель водных растворов наночастиц при разных концентрациях и оставляли сушиться на воздухе. Распределение наночастиц по размеру изучали с помощью метода динамического рассеяния света (DLS), которое выполняли при 25°С на DLS-системе (Malvem NanoZetasizer), оснащенной He-Ne лазером.
Исследование кинетики физикохимического высвобождения PIMA-GA-CDDP суспендировали в 1 мл лизата гипоксических клеток клеточной линии LLC и герметично закрывали в диализном мешке (MWCO~1000 Da). Диализный мешок инкубировали в 1 мл PBS буфера при комнатной температуре при энергичном встряхивании. Аликвоты в 10 мкл отбирали из инкубационной среды через заранее определенные интервалы времени, обрабатывали 90 мкл раствора 1,2-фенилендиамина (1.2 мг в 1 мл DMF) и инкубировали в течение 3 ч при 100°С. Высвобожденную Pt(IV) количественно оценивали с помощью UV-VIS спектроскопии при характеристической длине волны Х=704 нм комплекса Pt(IV)-1,2-фенилендиамин. После отбора каждой аликвоты инкубационную среду пополняли 10 мкл свежего PBS.
Или же, концентрированный конъюгат PIMA-GA-цисплатин ресуспендировали в 100 мкл бидистиллированной воды при рН, доведенном до 8.5 или 5.5 с помощью IN гидроксида натрия или IN азотной кислоты, и переносили в диализную трубку (MWCO: 1000 KD, Spectrapor). Диализную трубку помещали в трубку, содержащую магнитный стакан и 2 мл фосфатно-солевых буферных растворов с разным рН. Высвобождение цисплатина изучали путем энергичного перемешивания диализного мешка при 300 об/мин с использованием мешалки IKA при 25°С. Из внешнего раствора диализного мембранного мешка отбирали аликвоты по 10 мкл через заранее установленные интервалы времени, после чего подвергали следующей реакции образования активного комплекса с использованием UV-Vis путем добавления 100 мкл орто-фенилдиамина (1.2 мг/мл в DMF) и нагревания полученного раствора в течение 3 ч. 10 мкл свежеприготовленного раствора добавляли обратно во внешний раствор диализного мембранного мешка для сохранения одинакового объема. Количество высвобождаемого лекарственного средства оценивали с помощью УФ-спектрофотометра (Shimadzu UV 2450) при 706 нм.
FACS-анализ апоптоза
Клетки выращивали в 6-луночных планшетах, инкубировали в присутствии наночастиц цисплатина или свободного цисплатина при 37°С в течение 24 ч. Через 24 ч клетки отмывали PBS и собирали при 0°С. Затем клетки обрабатывали конъюгатом аннексии V-Alexa Fluor 488 (Molecular Probes, Invitrogen) и инкубировали в темноте при комнатной температуре в течение 15 мин. Клетки затем отмывали PBS и инкубировали с раствором пропидия иодида (PI) (50 г/мл; Sigma), содержащим RNase (1 мг/мл; Sigma). Клеточные суспензии затем переносили в FACS трубки и анализировали на окрашивание на Аннексии V/PI на проточном цитофлуориметре BD FACS Calibur. Данные анализировали с помощью программного обеспечения CellQuestPro (BD Biosciences).
Исследование клеточного поглощения
Клетки LLC и 4Т1 высевали на покровные стекла в 24-луночные планшеты, 50000 клеток на лунку. После достижения 70% заселенности клетки обрабатывали флуоресцеинизотиоцианат (PITC)-конъюгированными наночастицами цисплатина в течение разных периодов времени, равных 30 мин, 2 ч, 6 ч, 12 ч и 24 ч соответственно. Для изучения колокализации в указанные моменты времени клетки отмывали PBS и инкубировали с Lysotracker Red (Molecular Probes) при 37°С в течение 30 мин для интернализации. Клетки затем фиксировали 4% параформальдегидом в течение 20 мин при комнатной температуре, затем дважды отмывали PBS и помещали на предметные стекла с использованием реагента Prolong Gold Antifade Reagent (Molecular Probes). Изображения были получены с помощью флуоресцентного микроскопа Nikon Eclipse ТЕ2000, оснащенного зеленым и красным фильтрами для FITC и Lysotracker Red соответственно.
In Vivo мышиные модели опухоли рака легкого LLC и рака молочной железы 4Т1 Клетки рака легкого LLC и клетки рака молочной железы 4Т1 (3×105) были имплантированы подкожно в боковую область 4-недельных мышей С57/BL6 и BALB/c (масса 20 г, Charles River Laboratories, MA) соответственно. Лекарственную терапию начинали после достижения объема опухоли 50 мм3. Терапия опухоли заключалась в введении наночастицы цисплатина и свободного цисплатина или оксалиплатина и свободного оксалиплатина. Составы были приготовлены и валидизированы таким образом, что 100 мкл наночастицы цисплатина и свободного цисплатина содержали 1.25 и 3 мг/кг цисплатина, или 100 мкл наночастицы оксалиплатина и свободного оксалиплатина содержали 5 и 15 мг/кг оксалиплатина. Введение проводили инъекцией в хвостовую вену. PBS (100 мкл), введенный инъекцией в хвостовую вену, использовали в качестве контроля лекарственной терапии. Объемы опухолей и массы тела контролировали на ежедневной основе. Животных умерщвляли, когда средний размер опухоли превышал 2000 мм3 в контрольной группе. Опухоли извлекали немедленно после умерщвления и хранили в 10% формалине для дальнейшего анализа. Все операции с животными были утверждены Harvard institutional IUCAC.
In Vivo мышиная модель опухоли рака яичников
Аденокарциному яичника индуцировали у генетически-созданных мышей К-rasLSL/PtenfI/fI путем интрабурсальной доставки аденовируса, несущего Cre-рекомбиназу, как описано ранее. Клетки опухоли были созданы для экспрессии люциферазы после активации адено-Cre для возможности проведения сцинтиграфии опухоли до и после лекарственной терапии. После развития у мышей опухолей среднего или большого размера, мышей распределяли по четырем обрабатываемым группам (контроли, цисплатин NP 1.25 мг/кг, цисплатин NP-3 мг/кг и свободный цисплатин), при этом все лекарственные средства вводили внутривенно (i.v.).
Сцинтиграфия опухолей и оценка эффективности лекарственной терапии
Сцинтиграфию опухолей in vivo выполняли с помощью системы визуализации IVIS Lumina II Imaging System. Количественную оценку биолюминесценции получали с помощью программного обеспечения Living Image Software 3.1 (Caliper Life Sciences). Мыши получали 150 мг/кг калиевой соли D-люциферазы светлячка путем интраперитонеальной (i.p.) инъекции до визуализации. Через пять минут после инъекции люциферина животных анестезировали в индукционной камере с 2.5% изофлураном. После анестезии мышей помещали в камеру для визуализации, где их содержали под общим наркозом путем подачи изофлурана, и температуру их тел поддерживали при 37°С. Биолюминесцентный сигнал регистрировали через 15 минут после введения люциферина в течение времени экспозиции тридцать секунд. Изображения делали за день до обработки (день 0, базовый), в середине цикла обработки и на следующий день после конечной обработки. Эффективность обработки оценивали количественно путем изучения кратного прироста сигнала биолюминесценции после обработки по сравнению с базовым сигналом. Статистический анализ данных токсичности анализировали с использованием однофакторного дисперсионного анализа ANOVA с помощью программного обеспечения Prism 5™ software.
Биораспределение цисплатина
Для изучения распределения мышам внутривенно i.v. инъецировали наночастицы цисплатина и свободный цисплатин (доза эквивалентна 8 мг/кг цисплатина). Через 24 часа после инъекций животных умерщвляли и вскрытие выполняли для извлечения опухоли и почки. В другом исследовании животных дозировали несколько раз согласно протоколам изучения эффективности и умерщвляли в конце исследования многократного введения доз. Органы затем взвешивали и растворяли в конц. HNO3 (приблизительно 10 мл) путем встряхивания в течение 24 часов при комнатной температуре и последующего нагревания при 100°С в течение 12 часов. В полученные смеси добавляли 30% H2O2, растворы перемешивали в течение 24 часов при комнатной температуре и затем нагревали еще 12 часов для выпаривания жидкостей. Все твердые остатки заново растворяли в 1 мл воды и затем измеряли количество платины методом масс-спектрометрии с индуктивно связанной плазмой (ICP).
Гиспатологический и TUNEL анализ (анализ апоптоза)
Ткани фиксировали в 10% формалине, заливали в парафине, разрезали на секции и окрашивали Н&Е в Harvard Medical School Core Facility. Парафиновые срезы опухоли и почки депарафинировали и обрабатывали при помощи TUNEL (Terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling) - TMR окрашивания (красный) согласно протоколу производителя (In Situ Cell Death Detection Kit, TMR Red, Roche). Изображения были получены с использованием флуоресцентного микроскопа Nikon Eclipse TE2000, оснащенного красным фильтром.
Оценка токсичности лекарственной терапии
Для оценки токсичности ежедневно записывали массу тела. К тому же, в конце обработки печени и селезенки удаляли для записи массы и выполнения обширного анатомо-патологического исследования для оценки токсичности жизненно важных органов. Клеточный апоптоз в жизненно важных органах был измерен с помощью метода TUNEL. Статистический анализ данных токсичности выполняли с использованием двухфакторного дисперсионного анализа ANOVA с помощью программного обеспечения Prism 5™ software.
Статистический анализ
Данные представлены как среднее±станд.откл. от, по меньшей мере, n=3. Статистический анализ выполняли с использованием программного обеспечения GraphPad Prism software (GraphPad, San Diego, CA). Статистический анализ полученных данных проводили с помощью дисперсионного анализа ANOVA с последующим апостериорным сравнением по критерию Ньюмана-Кеулса или t-тестом Стьюдента. р<0.05 предназначалось для указания значительных различий.
Пример 1 - Синтез полимерных носителей
Поли(изобутилен-alt-малеиновая кислота) PIMA (2)
Поли(изобутилен-alt-малеиновый ангидрид) 1 (1 г) растворяли в 5 мл сухого DMF в 10 мл колбе с круглым дном, в которую добавляли бидистиллированную воду (1 мл), и затем полученную реакционную смесь перемешивали при 80°С в течение 48 ч. Растворитель удаляли в вакууме и низкомолекулярные примеси удаляли путем диализа. Водный полимерный раствор подвергали диализу в течение 3 дней в трубке с целлюлозной мембраной Spectra/Por 4 и с порогом отсечения среднемассовой молекулярной массы 1000. Бесцветный раствор затем лиофилизировали для получения 732 мг белого полимера поли(изобутилен-alt-малеиновой кислоты) PIMA (2).1Н ЯМР (300 МГц, D2O) δ 3.3-3.5 (m), 2.8 (s), 2.6-2.7 (m), 2.5 (s), 2.2-2.3 (m), 0.8-0.9 (m).
PIMA-EDA (3)
В 10 мл колбу с круглым дном, оснащенную магнитной мешалкой и баллоном с сухим азотом, загружали поли(изобутилен-alt-малеиновый ангидрид) PIMA 1 (1 г), сухой DMF (5 мл), триэтиламин (0.1 мл) и избыточный этилендиамина дигидрохлорид (1 г). Полученную смесь перемешивали при 25°С в течение 48 ч. Растворитель удаляли в вакууме и полимер очищали путем удаления низкомолекулярных примесей, таких как избыточный этилендиамин, с использованием диализного мешка с отсекаемой молекулярной массой 3.5 кДа в течение 3 дней. Полимерный раствор затем лиофилизировали для получения 0.89 г PIMA-EDA (3).1Н-ЯМР (300 МГц, D2O) 5 3.1-3.2 (m), 2.9-3.0 (m), 2.6-2.8 (m), 2.5 (m), 0.8-1.0 (m).
Полимер PIMA-GA (4)
Поли(изобутилен-alt-малеиновый ангидрид) PIMA 1 (0.0064 г, 0.001 ммоль) растворяли в DMF (5 мл) и затем добавляли DBU (0.032 мл, растворенный в 1 мл сухого DMF, 0.21 ммоль) и смесь перемешивали при 25°С в течение 1 ч. В этот раствор напрямую добавляли глюкозамин (0.046 г, 0.21 ммоль). Полученную реакционную смесь оставляли перемешиваться при комнатной температуре в течение 48 ч и затем осаждали путем добавления бидистиллированной воды (1 мл). Органический растворитель выпаривали в вакууме в течение 12 часов. Полученное бледно-желтое твердое вещество очищали путем диализа в течение 3 дней с использованием диализного мешка, полученного от компании Pierce (Thermoscientific) с отсекаемой молекулярной массой 3.5 кДа, до бесцветного раствора. Лиофилизация позволила получить 104 мг полимера PIMA-GA белого цвета (4).1Н-ЯМР (300 МГц, CDC13) δ 7.54-7.65 (m, 2 H), 7.33-7.45 (m, 2 H), 7.02-7.19 (m, 14 H), 6.93-6.97 (m, 2 H), 6.83-6.89 (m, 2H), 6.55 (s, 2H), 6.15-6.19 (m, 2H), 3.90 (s, 2 H), 3.58 (s, 6 H).1H-ЯМР (300 МГц, D2O) δ 8.2-8.3 (m), 7.0-7.1 (m), 5.0-5.1 (m), 3.0-3.9 (m), 2.1-2.3 (m), 1.1-1.9 (m), 0.7-1.0 (m).
В другом эксперименте PIMA (0.045 г) растворяли в DMF (5 мл) и затем добавляли раствор DBU (0.23 мл) и глюкозамин (0.323 г растворяли в 5 мл сухого DMF). Полученную реакционную смесь оставляли перемешиваться при комнатной температуре в течение 48 ч и затем осаждали путем добавления бидистиллированной воды (1 мл). Органический растворитель выпаривали в вакууме. Полученное бледно-желтое твердое вещество очищали путем диализа в течение 3 дней с использованием диализного мешка с номинально отсекаемой молекулярной массой 3.5 кДа. Лиофилизация позволила получить 104 мг слегка желтого полимера PIMA-GA.1Н-ЯМР (300 МГц, D2O) δ 8.2-8.3 (m), 7.07.1 (m), 5.0-5.1 (m), 3.0-3.9 (m), 2.1-2.3 (m), 1.1-1.9 (m), 0.7-1.0 (m).
Полимер PIMA-PEG (5)
Поли(изобутилен-alt-малеиновый ангидрид) PIMA 1 (3 мг, 0.0005 ммоль) и DBU (0.0023 мл, 0.015 ммоль) растворяли в сухом DMF (10 мл) в 25 мл колбе с круглым дном в атмосфере N2 в течение 1 ч и затем добавляли PEG-NH2 (20 мг, 0.01 ммоль), полученный реакционный раствор затем нагревали при 80°С при непрерывном перемешивании в течение 3 дней. Реакционную смесь оставляли охлаждаться до комнатной температуры и затем добавляли воду (1 мл) и продолжали перемешивание в течение 1 ч. Растворители удаляли в вакууме и непрореагировавший PEG-NH2 с MW 2 кДа удаляли из требуемого полимера путем диализа. Диализ проводили в течение 5 дней с использованием мембраны с отсекаемой молекулярной массой 3.5 кДа, полученной от компании Pierce (Thermoscientific), с образованием бесцветного раствора, который затем лиофилизировали для получения 19 мг белого PIMA-PEG (5).1Н-ЯМР (300 МГц, D20) δ 3.5-3.7 (m), 3.0-3.1 (m), 2.5-2.8 (m), 0.7-1.0 (m).
Пример 2 - Синтез конъюгатов
Гидратирование CDDP
CDDP (30 мг) и AgNOa (17 мг) добавляли в 10 мл бидистиллированной воды. Полученный раствор перемешивали в темноте при комнатной температуре в течение 24 ч. После завершения реакции был обнаружен осадок AgCl. Осадок AgCl удаляли центрифугированием при 10000 об/мин в течение 10 мин. Супернатант далее очищали пропусканием через 0.2 мкм фильтр.
PIMA-CDDP (6}
Поли(изобутилен-alt-малеиновую кислоту) PIMA 2 (0.006 г, 0.001 ммоль) растворяли в 1 мл бидистиллированной воды, содержащей CDDP (0.00084 г, 0.0028 ммоль), в 10 мл колбе с круглым дном и затем полученную реакционную смесь перемешивали при комнатной температуре (25°С) в течение 48 ч. Конъюгат PIMA-CDDP (6) затем очищали путем дизализа в трубке из целлюлозной мембраны Spectra/For 4 и с порогом отсечения среднемассовой молекулярной массы 1000. Полученный непрозрачный раствор затем лиофилизировали для получения белого конъюгата PIMA-CDDP (6). Конъюгат ресуспендировали для экспериментов с клеточной культурой.
PIMA-EDA-CDDP (7}
В 10 мл колбу с круглым дном загружали полимер PIMA-EDA 3 (0.007 г, 0.001 ммоль), в который добавляли CDDP (0.0084 г, 0.0028 ммоль), растворенный в бидистиллированной воде (1 мл). Раствор затем перемешивали при комнатной температуре (25°С) в течение 48 ч. Диализ с использованием целлюлозной мембраны с порогом отсекаемой молекулярной массы 1000 и лиофилизация позволили получить желтоватый конъюгат PIMA-EDA-CDDP (7).
PIMA-GA-CDDP (8)
В 10 мл колбу с круглым дном, оснащенную магнитной мешалкой, отмеряли PIMA-GA 4 (0.0036 г, 0.0003 ммоль), добавляли 1 мл бидистиллированной воды, содержащей CDDP (0.001 г, 0.0033 ммоль), после чего раствор перемешивали при комнатной температуре (25°С) в течение 48 ч. Образовавшийся в растворе конъюгат PIMA-GA-CDDP (8) очищали путем диализа для удаления неприсоединенного CDDP с порогом отсечения среднемассовой молекулярной массы 1000 в течение 2-3 часов. Лиофилизация диализированного раствора позволила получить слегка желтый конъюгат PIMA-GA-CDDP (8).
PIMA-PEG-CDDP (9}
Щеточный полимер PIMA-PEG 5 (0.019 г, 0.00007 ммоль) помещали в 10 мл колбу с круглым дном, смешивали с CDDP (0.0002 г, 0.0007 ммоль), растворенным в 0.3 мл бидистиллированной воды. После перемешивания в течение 3 дней при комнатной температуре (25°С) полученную непрозрачную реакционную смесь подвергали диализу. Раствор, содержащий конъюгат PIMA-PEG-CDDP (2), затем очищали путем диализа в трубке из целлюлозной мембраны Spectra/For 4 и с порогом отсечения среднемассовой молекулярной массы 1000 в течение 2-3 часов для удаления свободного CDDP. Конъюгат PIMA-PEG-CDDP (9) затем лиофилизировали для получения белого твердого вещества. Конъюгат ресуспендировали в бидистиллированной воде для экспериментов с клеточной культурой.
FITC-меченный PIMA-GA-CDDP
Поли(изобутилен-alt-малеиновый ангидрид) PIMA (0.006 г) растворяли в DMF (5 мл) и затем добавляли раствор DBU (0.0053 мл в DMF) и глюкозамин (0.0075 г растворяли в 5 мл сухого DMF), смесь перемешивали при 25°С в течение 1 ч. Полученную реакционную смесь оставляли перемешиваться при 25°С в течение 48 ч и затем добавляли 0.0022 г FITC-EDA (FITC-EDA был синтезирован путем перемешивания флуоресцеинизотиоцианата в избытке этилендиамина при 25°С в течение 12 ч в DMSO), и перемешивание продолжали еще в течение 12 ч, после чего реакционную смесь осаждали путем добавления бидистиллированной воды (1 мл). Органический растворитель выпаривали в вакууме. Полученное оранжевое твердое вещество очищали путем диализа в течение 3 дней с использованием диализного мешка с порогом отсечения молекулярной массы 3.5 кДа. Лиофилизация позволила получить флуоресцентный оранжевый полимер PIMA-GA-FITC. В этот FITC-меченный полимер (PIMA-GA-FITC, 0.004 г) добавляли 1 мл бидистиллированной воды, содержащей цисплатин (0.001 г) и затем раствор перемешивали при комнатной температуре (25°С) в течение 48 ч. Конъюгат PIMA-GA-FITC-цисплатин, образовавшийся в растворе, затем очищали путем диализа для удаления неприсоединенного цисплатина с порогом отсечения среднемассовой молекулярной массы 1000. Лиофилизация диализованного раствора позволила получить оранжевые наночастицы конъюгата FITC-меченный PIMA-GA FITC-цисплатин.
PIMA-Оксалиплатин
Поли(изобутилен-alt-малеиновую кислоту) (PIMA) (6 мг) растворяли в 1 мл бидистиллированной воды, содержащей оксалиплатин-ОН (1 мг), в колбе с круглым дном и затем полученную реакционную смесь перемешивали при комнатной температуре (25°С) в течение 48 ч. Конъюгат PIMA-оксалиплатин далее очищали путем диализа в трубке из целлюлозной мембраны Spectra/Por 4 и с порогом отсечения среднемассовой молекулярной массы 1000. Полученный непрозрачный раствор затем лиофилизировали для получения конъюгата PIMA-оксалиплатин. Конъюгат ресуспендировали для экспериментов с клеточной культурой.
PIMA-GA-Оксалиплатин
В PIMA-GA (12 мг), отмеренный в 10 мл колбу с круглым дном, оснащенную магнитной мешалкой, добавляли 1 мл бидистиллированной воды, содержащей оксалиплатин-ОН (1 мг), и затем раствор перемешивали при комнатной температуре (25°С) в течение 48 ч. Конъюгат PIMA-GA-оксалиплатин, образовавшийся в растворе, очищали путем диализа для удаления неприсоединенного оксалиплатина с порогом отсечения среднемассовой молекулярной массы 1000. Лиофилизация диализированного раствора позволила получить желтый конъюгат PIMA-GA-оксалиплатин.
Пример 3 - ЯМР анализ синтеза полимера PIMA-GA с использованием разных оснований
Синтез PIMA-GA с использованием DBU в качестве основания
Глюкозамина гидрохлорид (360 мг, 1.66 ммоль, 200 экв.) суспендировали в 5 мл DMF и обрабатывали DBU (250 мкл, 1.66 ммоль, 200 экв.) при комнатной температуре в течение 1 ч. Через 1 ч раствор глюкозамин/DBU (в DMF) добавляли по каплям в раствор поли(изобутилен-alt-малеинового ангидрида) (50 мг, 0.008 ммоль, 1 экв.) в 5 мл DMF и реакционную смесь перемешивали в течение 72 ч при комнатной температуре. Реакционную смесь осаждали 3 мл бидистиллированной воды. Конъюгат PIMA-GA очищали путем диализа с использованием диализного мешка MWCO 2000 в течение 72 ч. Продукт лиофилизировали в течение 48 ч для получения 100 мг кремово-желтого порошка. Продукт анализировали с помощью спектроскопии1Н ЯМР (300 МГц). Растворимость: продукт был растворим в воде, но не растворим в органическом растворителе, например ацетоне, метаноле или ацетонитриле.1Н ЯМР (300 МГц): 5 (м.д.)=5.2-5.3 (m, 0.14 Н, протон сахара), 5.0-5.1 (m, 0.4 Н, протон сахара), 3.6-4.0 (m, 13.07 Н, протон сахара), 3.25-3.5 (m, 15.48 Н, протон сахара), 3.0-3.2 (m, 6.98 И, протон сахара), 2.5-2.6 (m, 6.97 Н, PIMA протон), 1.4-1.7 (m, 19.86 Н, PIMA протон), 0.7-1.2 (m, 23.77 Н, PIMA протон). Общее число протонов сахара: общее число PIMA протонов=36.07: 50.6=0.71. Результат хорошо согласуется с предполагаемой структурой, если все остатки являются дериватизированными протонами сахара и PIMA протонами в мономере конъюгата PIMA-GA.
Синтез PIMA-GA с использованием диизопропилэтиламина (DIPEA) в качестве основания
Глюкозамина гидрохлорид (179 мг, 0.83 ммоль, 100 экв.) суспендировали в 2 мл DMF и обрабатывали DIPEA (145 мкл, 0.83 ммоль, 100 экв.) при комнатной температуре в течение 1 ч. Через 1 ч в реакционную смесь добавляли раствор поли(изобутилен-alt-малеинового ангидрида) (50 мг, 0.008 ммоль, 1 экв.) (растворенного в 3 мл DMF) и перемешивали в течение 24 ч при комнатной температуре. Реакционную смесь осаждали добавлением 3 мл бидистиллированной воды. Конъюгат PIMA-GA очищали путем диализа с использованием диализного мешка MWCO 1000 в течение 24 ч. Продукт лиофилизировали в течение 48 ч для получения 106 мг белого порошка. Продукт анализировали с помощью спектроскопии1Н ЯМР (300 МГц). Растворимость: продукт был растворим в воде, но не растворим в органическом растворителе, например ацетоне, метаноле или ацетонитриле.1Н ЯМР (300 МГц): δ (м.д.)=5.2-5.3 (m, 0.4Н, протон сахара), 4.9-5.1 (m, 2.0Н, протон сахара), 3.4-3.6 (m, 21.86Н, протон сахара), 3.2-3.3 (m, 6.16 Н, протон сахара), 2.9-3.1 (m, 3.81Н, протон сахара), 2.4-2.7 (широкий, 4.39Н, PIMA протон), 2.1-2.4 (широкий, 4.54 Н, PIMA протон), 1.7-2.0 (широкий, 3.13Н, PIMA протон), 1.3-1.5 (широкий, 1.58Н, PIMA протон), 1.1-1.2 (m, 24.12 Н, PIMA протон), 0.6-0.9 (m, 27.94Н, PIMA протон). Всего протонов сахара: всего PIMA протонов=39.21:61.11=0.64.
Синтез PIMA-GA с использованием триэтиламина в качестве основания
Глюкозамина гидрохлорид (143 мг, 0.66 ммоль, 80 экв.) суспендировали в 2 мл DMF и обрабатывали триэтиламином (100 мкл, 0.66 ммоль, 80 экв.) при комнатной температуре в течение 1 ч. Через 1 ч в реакционную смесь добавляли поли(изобутилен-alt-малеиновый ангидрид) (50 мг, 0.008 ммоль, 1 экв.) и перемешивали в течение 24 ч при комнатной температуре. Реакционную смесь осаждали добавлением 3 мл бидистиллированной воды. Конъюгат PIMA-GA очищали путем диализа с использованием диализного мешка MWCO 1000 в течение 24 ч. Продукт лиофилизировали в течение 48 ч с получением 100 мг белого порошка. Продукт анализировали с помощью спектроскопии1Н ЯМР (300 МГц). Растворимость: продукт был растворим в воде, но не растворим в органическом растворителе, например ацетоне, метаноле или ацетонитриле.1Н ЯМР (300 МГц): δ (м.д.)=5.2-5.3 (m, 0.44 Н, протон сахара), 4.9-5.1 (m, 1.51H, протон сахара), 3.7-3.8 (m, 19.01Н, протон сахара), 3.3-3.4 (m, 6.43Н, протон сахара), 3.1-3.2 (m, 11.82, протон сахара), 2.93-2.94 (m, 2.23Н, PIMA протон), 2.6-2.7 (m, 5.84 Н, PIMA протон), 2.2-2.5 (широкий, 4.91Н, PIMA протон), 1.8-2.1 (широкий, 3.83Н, PIMA протон), 1.4-1.6 (широкий, 2.52Н, PIMA протон), 1.8-1.2 (m, 18.04Н, PIMA протон), 0.9-1.0 (m, 23.77Н, PIMA протон). Общее число протонов сахара: общее число PIMA протонов=34.31:65.7=0.52.
Пример 4 - Зависяшая от времени эффективность нагрузки PIMA-GA-CDDP
Способ: конъюгат PIMA-GA (50 мг, 0.004 ммоль) растворяли в 1 мл бидистиллированной воды с последующим добавлением (NH2)2Pt(ОН)2 (3 мл, 0.057 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 48 ч. Аликвоты в 200 мкл отбирали из реакционной смеси через заранее установленные интервалы времени (5 ч, 31 ч и 48 ч). Аликвоты фильтровали через центрифужное фильтрационное устройство Microcon, содержащее мембрану из регенерированной целлюлозы MWCO 3000, для отделения конъюгата PIMA-GA-CDDP. Полимер тщательно промывали (200 мкл х 2) бидистиллированной водой для удаления платиновых реагентов. Содержание платины в полимере определяли способом, описанным ранее.
Результат: Изменение в эффективности нагрузки Pt в конъюгате PIMA-GA определяли способностью конъюгирования 1,2-фенилендиамина с Pt, вызывая увеличение UV-VIS спектра при длине волны λ=706 нм. Ни полимер, ни 1,2-фенилдиамин не имели характеристического пика при этой длине волны. Изменение содержания Pt со временем в реакции между PIMA-GA и гидрокси-платиной наблюдали с помощью UV-VIS спектра. В заранее установленные моменты времени (5 ч, 31 ч и 48 ч) из реакционной смеси отбирали аликвоты по 200 мкл и определяли нагрузку Pt в конъюгате полимера. График показывает, что нагрузка платины в конъюгате полимера увеличивается со временем от 190 мкг/мг (5 ч) до 210 мкг/мг (31 ч) и достигает максимальной 347 мкг/мг при 48 ч. Это указывает на то, что почти 100% Pt образует комплекс с полимером в этот момент времени, так как максимальная теоретически вычисленная нагрузка составляет 37.5% на звено полимера, и достигнутая нагрузка составила 34.7% Pt на полимер.
Пример 5 - Рациональная оптимизация полимера, основанная на зависимости активности от структуры
Для улучшения эффективности наночастиц авторы изобретения дериватизировали один луч каждого мономера полимера биосовместимым глюкозамином для образования конъюгата PIMA-глюкозамин (PIMA-GA) (Фиг.11В). Это превращало дикарбоксилато связи с Pt в монокарбоксилато связь и координационную связь, которая легче высвобождает Pt, так как является менее стабильной, чем монокарбоксилато связь (Фиг.11В).
Анализ методом ядерного магнитного резонанса (ЯМР) среды Pt показал, что комплексообразование PIMA-GA и цисплатина при кислом рН (рН 6.5) генерировало изомерное состояние [PIMA-GA-Цисплатин (O->Pt)] (8), характеризующееся монокарбоксилато и O->Pt координационным комплексом, как видно по одному пику Pt ЯМР спектра при -1611.54 (Фиг.11В). Удивительно, что образование комплекса цисплатина с PIMA-GA при щелочном рН (рН 8.5) способствует образованию изомерного комплекса PIMA-GA-Цисплатин (N->Pt) (10), в котором комплексообразование Pt происходит через монокарбоксилато и более стабильную N->Pt координационную связь, характеризующуюся единственным пиком при -2210 (Фиг.11В). Удивительно, что существование этих двух зависимых от рН состояний позволило авторам изобретения также проанализировать влияние среды Pt, в особенности уходящих групп, на биологическую эффективность.
Комплексообразование цисплатина с полимером PIMA-глюкозамин (PIMA-GA) при соотношении 15:1 вызвало самосборку в наночастицы в требуемом узком размерном диапазоне, составляющем 80-150 нм, что было подтверждено электронной микроскопией высокого разрешения (данные не показаны) и DLS (Фиг.12А). Кроме того, авторы изобретения достигли нагрузки 175±5 мкг/мг полимера (Фиг.12В), которая значительно превышала нагрузку, возможную при использовании традиционных наносоставов (Avgoustakis К, Beletsi A, Panagi Z, Klepetsanis P, Karydas AG, Ithakissios DS. PLGA-mPEG nanoparticles of cisplatin: in vitro nanoparticle degradation, in vitro drug release and in vivo drug residence in blood properties. J Control Release. 2002 Feb 19;79(1-3):123-35).
Пример 6 - Характеристика поглощения и эффективность наночастиц in vitro
Мечение полимера флуоресцеином (Фиг.15) позволило отследить во времени поглощение наночастиц клетками, которые были совместно мечены флуоресцентным красителем LysoTracker-Red для мечения эндолизосомных компартментов. Быстрое поглощение наночастиц наблюдали в клетках LLC в течение 15 мин обработки с интернализацией в эндолизосомный компартмент, как видно по колокализации FITC-меченных наночастиц и красителя LysoTracker-Red (данные не показаны). Напротив, поглощение клетками 4Т1 было замедленным с интернализацией в эндолизосомный компартмент, выраженное только через 2 часа после инкубации. На протяжении 12-часового периода флуоресцентные сигналы от лизосомного компартмента и FITC-конъюгированного разделяются, что предполагает цитозольное распределение полимера после обработки внутри лизосомы (данные не показаны).
Для тестирования эффективности наночастиц PIMA-GA-цисплатин in vitro, авторы изобретения провели анализ жизнеспособности клеток с использованием клеточных линий карциномы легкого Льюис (LLC) и рака молочной железы 4Т1. Жизнеспособность клеток количественно оценивали с использованием MTS анализа через 48 часов после инкубации. Удивительно, что клетки LLC (Фиг.13А) были более восприимчивы к наночастицам цисплатина, чем клетки рака молочной железы 4Т1 (Фиг.13В). Удивительно, что наночастицы PIMA-GA-цисплатин (O->Pt) (8) показали значительную гибель клеток LLC со значениями IC50 (4.25±0.16 мкМ), аналогичными (Р>0.05) цисплатину (IC50=3.87±0.37 мкМ), и лучше, чем карбоплатин (IC50=14.75±0.38 мкМ), что являлось подтвержением гипотезы о том, что скорость гидратирования является критически важной для эффективности (Фиг.13). Аналогичную эффективность наблюдали, когда авторы изобретения заменили гликозамин этилендиамином, создав аналогичную глюкозамину среду комплексообразования Pt (Фиг.13А). Это, кроме того, подтверждалось наблюдением, что наночастицы PIMA-GA-цисплатин (N->Pt) (1C 50=6.36±0.19 мкМ) были значительно менее активными, чем цисплатин, предполагая, что среда платины является критически важной для определения скорости гидратирования. Для дальнейшей оценки роли среды комплексообразования авторы изобретения создали PIMA-GA(20), в котором только 20 из 40 мономеров, включающих полимер PIMA, были дериватизированы глюкозамином, вводя тем самым дикарбоксилато связи и сокращая монокарбоксилато и координационные связи, образующие комплекс Pt с PIMA-GA. Как показано на Фиг.16F, кривая концентрация-эффективность сдвинута вправо с PIMA-GA(20)-цисплатин (ЕС50=5.85±0.13 мкМ) по сравнению с наночастицами PIMA-GA-цисплатин (O->Pt), где все 40 мономеров дериватизированы глюкозамином. Ненагруженный полимер PIMA-GA не оказывает действия на жизнеспособность клеток. В таблице приведены значения ЕС50.
Как показано на Фиг.13А, в то время как полимер, взятый отдельно, индуцирует гибель клеток при самых высоких концентрациях, образование комплекса с цисплатином значительно сдвигает кривую концентрация-эффект влево, что указывает на то, что наночастица PIMA-цисплатин индуцирует клеточную гибель. Однако даже при концентрации 50 мкМ PIMA-цисплатин не вызывает полную гибель клеток. Напротив, цисплатин вызывает полную гибель клеток при концентрации больше чем 20 мкМ. Это уменьшение эффективности платината при комплексообразовании с PIMA может быть объяснено дикарбоксилато связью между платиной и мономерами малеиновой кислоты, которая прочно связывает Pt, аналогично связи, существующей в карбоплатине, который аналогично является менее эффективным, чем цисплатин.
Мечение клеток для экспрессии фосфатидилсерина на клеточной поверхности показало, что обработка цисплатином может индуцировать апоптопическую гибель клеток, при этом клетки LLC являются более чувствительными, чем клетки 4Т1 (Фиг.14).
Пример 7 - Высвобождение активного цисплатина из наночастиц является рН-зависимым
При условии, что наночастицы локализованы в лизосомном компартменте, авторы изобретения протестировали высвобождение Pt из наночастиц при рН 5.5, имитируя кислый рН эндолизосомного компартмента опухоли (Lin, et al., Eur. J. Cancer, 2004 40(2):291-297). Также авторы изобретения выбрали рН 8.5 в качестве рН сравнения в щелочном диапазоне. Как показано на Фиг.16, при рН5.5 наночастицы PIMA-GA-цисплатин (O->Pt) вызывают замедленное, но значительное высвобождение цисплатина, наблюдаемое в течение 70-часового периода. Напротив, высвобождение при рН8.5 было значительно ниже, что указывало на рН-зависимое высвобождение Pt. Удивительно, что PIMA-GA-цисплатин (N->Pt) высвобождал значительно меньшие количества Pt даже при рН5.5, что согласовывалось с тем фактом, что N->Pt координационная связь является более сильной, чем O->Pt связь. Как предполагалось, авторы изобретения наблюдали, что наночастицы PIMA-цисплатин проявляли значительно более низкие скорости высвобождения Pt по сравнению с PIMA-GA-цисплатин (N->Pt) и PIMA-GA-цисплатин (O->Pt), так как Pt удерживалась более стабильными дикарбоксилато связями вместо монокарбоксилато и координационной связями.
Пример 8 - Наночастицы индуцируют замедление роста и регрессию опухоли с пониженной нефротоксичностью
Так как наночастицы PIMA-GA-цисплатин (O->Pt) показали требуемые скорости высвобождения для платины, а также проявили in vitro эффективность, сравнимую с цисплатином, авторы изобретения установили терапевтическую эффективность наночастиц in vivo. Мышей, несущих установленную карциному легкого Льюис или рак молочной железы 4Т1, произвольно распределяли на пять групп соответственно и каждую группу обрабатывали следующими дозами в трехкратном повторении: (i) PBS (контроль); (ii) Цисплатин (1.25 мг/кг); (iii) Цисплатин (3 мг/кг); (iv) наночастицы PIMA-GA-Цисплатин (O->Pt) (1.25 мг/кг); (v) наночастицы PIMA-GA-Цисплатин (O->Pt) (3 мг/кг). Мыши, инъецированные PBS, формировали большие опухоли на 16 день (день после последней инъекции) и, следовательно, были эвтаназированы. Животных в других группах также умерщвляли в это же время для оценки действия обработок на патологию опухоли. Как показано на Фиг.5, цисплатин индуцировал дозозависимое ингибирование опухоли, и при дозе, эквивалентной 1.25 мг/кг цисплатина, введение состава наночастиц приводило к большему ингибированию прогрессирования карциномы легкого по сравнению со свободным лекарственным средством. Однако при дозе, эквивалентной 3 мг/кг, свободный цисплатин вызывал значительное уменьшение массы тела, что указывало на системную токсичность. Напротив, животные, обработанные наночастицами, эквивалентными 3 мг/кг цисплатина, показали увеличение массы, хотя ингибирование опухоли было аналогичным в обеих обрабатываемых группах (данные не показаны). К тому же, вскрытие показало, что обработка свободным цисплатином вызывает значительное уменьшение массы почки и селезенки (Фиг.5D и 5Е), что указывает на нейротоксичность и гематотоксичность, сопоставимые с предыдущими заключениями. Удивительно, что наночастицы цисплатина не оказывают действия на массу почек и уменьшают размер селезенки только при самых высоких дозах (Фиг.5D и 5Е). Это было также установлено с помощью патологического анализа окрашивания Н&Е поперечных разрезов почек, который показал значительный тубулярный некроз у животных, обработанных свободным цисплатином по сравнению с наночастицами цисплатина. Для выяснения механизма, лежащего в основе ингибирования опухоли, авторы изобретения метили поперечные срезы опухоли для анализа TUNEL, который установил значительную индукцию апоптоза после обработки свободным цисплатином и наночастицами PIMA-GA цисплатин (O->Pt) (данные не показаны). Удивительно, что мечение срезов почек для анализа TUNEL показало значительный апоптоз у животных, обработанных свободным цисплатином, в противоположность минимальной нефротоксичности в группе, обработанной наночастицами (данные не показаны). Безусловно, исследования биораспределения с использованием масс-спектрометрии с индуктивно связанной плазмой (ICP) установили, что концентрация Pt в почке после введения наночастиц цисплатина составляет 50% концентрации, достигнутой после введения свободного лекарственного средства (Фиг.5Е), что может объяснить уменьшение нефротоксичности.
Обработка цисплатином (1.25 мг/кг) показала только минимальное ингибирование роста опухоли по сравнению с контролем; напротив, обработка наночастицами цисплатина в той же дозе показало значительный рост противоопухолевой эффективности (Фиг.5А). Это согласуется с фактом, что наночастицы позволяют значительно более высоким концентрациям активного агента удерживаться внутри опухоли по сравнению со свободным лекарственным средством. При более высокой дозе противоопухолевая эффективность свободного лекарственного средства и наночастицы является аналогичной (Фиг.5А), возможно представляя собой теоретический предел для лекарственного средства. Однако свободное лекарственное средство при этой дозе приводит к более чем 20%-ной потере массы тела (Фиг.5В), что является показателем неспецифической токсичности. Безусловно, это вызывает значительную нефротоксичность, как видно по потере массы почки (Фиг.5D). Кроме того, несмотря на то, что анализ крови не отличался в разных обрабатываемых группах (Фиг.5С), присутствовала значительная потеря массы селезенки при самой высокой дозе свободного цисплатина (Фиг.5Е). Напротив, наночастица цисплатина не проявила такой токсичности даже при самой высокой дозе, делая возможным дозирование при более высоких уровнях или на протяжении более продолжительных периодов времени, что может оказывать значительное влияние на противоопухолевые результаты. Кроме того, простота производства, низкая стоимость материалов и повышение терапевтической эффективности, а также снижение токсичности могут стать примером нанотехнологии, влияющей на всемирную охрану здоровья. Без привязки к теории, увеличенный терапевтический индекс может быть обусловлен преимущественным накоплением наночастиц в опухолях благодаря хорошо изученному EPR эффекту и не затрагивать почку из-за превышения предельного размер для клиренса, который, как было показано в предыдущем исследовании, составляет менее чем 5 нм (Choi HS, Liu W, Misra P, Tanaka E, Zimmer JP, Itty Ipe B, Bawendi MG, Frangioni JV. Renal clearance of quantum dots. Nat Biotechnol. 2007; 25:1165-70).
Свободный цисплатин и наночастицы PIMA-GA-цисплатин(O->Р1) вызывают аналогичные уровни ингибирования роста опухоли в модели рака молочной железы 4Т1 (Фиг.17). Удивительно, что 1.25 мг/кг и 3 мг/кг свободного цисплатина индуцировали значительную потерю массы по сравнению группой, обработанной наночастицей цисплатина. Согласно данным наблюдения модели рака легкого, в то время как свободный цисплатин индуцировал значительный апоптоз в почке, группа, обработанная наночастицей цисплатина, показала минимальный апоптоз в почке, но значительные уровни апоптоза в опухоли.
Дополнительно к моделям рака легкого и молочной железы авторы изобретения также оценивали наночастицу PIMA-GA-цисплатин(O->Р1) в модели рака яичников. Эпителиальный рак яичников является смертельным злокачественным новообразованием женского репродуктивного цикла. Открытие частых соматических мутаций в гене PTEN и потеря гетерозиготности в 10q23 локусе PTEN в эндометриодном раке яичника включает ключевую роль PTEN в этиологии этого субтипа эпителиального рака яичников (Obata, К. et al. Frequent PTEN/MMAC1 mutations in endometrioid but not serous or mucinous epithelial ovarian tumors. Cancer Res. 58, 2095-2097 (1998) and Sato, et al., Cancer Res. 2000, 60: 7052-7056 and Sato, et al., Cancer Res. 2000, 60: 7052-7056). Similarly, K-RAS oncogene is also mutated in endometrioid ovarian cancer, albeit at a lesser frequency (Cuatrecasas, et al.. Cancer (1998) 82: 1088-1095). В недавнем исследовании было обнаружено, что комбинация этих двух мутаций в покровном эпителии яичника индуцирует инвазивную и широко метастазирующую эндометриоидную аденокарциному яичника с полной пенетрантностью, делая ее хорошей моделью для имитации прогрессирования человеческой опухоли. В этой трансгенной модели обработанные носителем животные проявляли быстрое прогрессирование опухоли, которое количественно оценивали по уровню экспрессии люциферазы. Обработка наночастицами цисплатина вызвала дозозависимое ингибирование прогрессии опухоли с более низкой дозой, эквивалентой 1.25 мг/кг, вызывая ингибирование аналогично дозе 3 мг/кг свободного цисплатина (Фиг.18). Обработка более высокой дозой наночастицы цисплатина (эквивалентной 3 мг/кг цисплатина) привела к большему ингибированию опухоли без значительной потери массы тела, наблюдаемой при такой же дозе свободного цисплатина, который является утвержденным для клинического применения при раке яичника (Фиг.18). Кроме того, TUNEL окрашивание показало значительный апоптоз в почке при 3 мг/кг свободного цисплатина, в то время как наночастицы цисплатина при эквивалентной концентрации Pt не индуцировали апоптоз нефронов.
Пример 9 - Биораспределение наночастиц цисплатина после многократного введения доз
Для изучения биораспределения наночастиц цисплатина авторы изобретения извлекали опухоли в конце экспериментов по многократному введению доз, в которых каждое животное получало три дозы свободного лекарственного средства или наночастицу цисплатина. Как показано на Фиг.19, присутствовало преимущественное накопление Pt в опухолях молочной железы и яичника при введении в виде наночастицы, в отличие от случая доставки в виде свободного цисплатина.
Пример 10 - Оценка токсичности обработки PIMA-GA-оксалиплатина
Как видно на Фиг.23В, при дозе 15 мг/кг свободного оксалиплатина все животные умирали из-за системной токсичности. Напротив, в случае наночастиц оксалиплатина токсичность отсутствовала даже при этой дозе.
Пример 11 - Схема синтеза конъюгата липид-цисплатин
Дополнительно к конъюгату PMA-GA-цисплатин, авторы изобретения также разработали аналог, в котором малеиновая кислота конъюгирована с концом PEG пегилированного липида (PEG2000-DSPE). Авторы изобретения образовали комплекс Pt с малеиновой кислотой, что вызвало образование платинированного липидного производного, в котором Pt находится в гидрофильном конце и липид образует гидрофобный конец. Это формирует мицеллы в воде, и эффективность нагрузки составляет 45 мкг/мг липидного производного. Это может быть увеличено с помощью использования PEG более низкой молекулярной массы или липида. Смотри Фиг.10.
Пример 12 - Цисплатин-липонаночастицы
Материалы и способ
Все реакции проводили в инертных условиях, если не указано иначе. Все коммерчески полученные соединения использовали без дополнительной очистки. DCM, сухой DCM, метанол, холестерил хлороформат, холестерин, этилендиамин, янтарный ангидрид, нитрат серебра, сульфат натрия, пиридин, цисплатин, L-a-фосфатидилхолин, сефадекс G-25 и 1,2-фенилендиамин были получены от компании Sigma-Aldrich. 1,2-Дистеароил-sn-глицеро-3-фосфоэтаноламин-N-[амино) полиэтиленгликоль)2000], и ручной мини набор Extruder (включающий мембранный фильтр 0.2 мкм Whatman Nucleopore Track-Etch Membrane, опору фильтра Whatman и 1.0 мл шприцы Hamilton) был приобретен у компании Avanti Polar Lipids Inc. Безводный растворитель DMF был получен от компании Acros Organics. Фосфовольфрамовая кислота была получена от компании Ted Pella, Inc. Аналитическую тонкослойную хроматографию (ТСХ) выполняли с использованием пластин из силикагеля 60 F254 на алюминиевой подложке, полученных от компании EMD Laboratories. Пятна на TLC-пластинах визуализировали с использованием перманганата щелочного металла или 6% раствора нингидрина в ацетоне. 1Н ЯМР спектры (300 МГц) были получены на спетрофотометре Varian Mercury 300. Химические сдвиги выражены в частях на миллион (м.д.) с использованием пригодных дейтерированных растворителей для ЯМР-спектроскопии относительно TMS при О м.д.. Реагент MTS был получен от компании Promega. Анализ жизнеспособности клеток и данные кинетики высвобождения были нанесены на график с использованием программного обеспечения GraphPad Prism. Анализ каждого образца был сделан в трехкратном повторении.
Синтез (11):
1044 мкл (15 экв.) этилендиамина (12) растворяли в 5.0 мл безводного DCM с последующим охлаждением до 0-5°С с помощью льда. 500.0 мг (1.0 экв.) холестерил хлороформата растворяли в 5.0 мл безводного DCM и добавляли в реакционную смесь по каплям в течение 15 минут при энергичном перемешивании и перемешивание продолжали в течение ночи до тех пор, пока температура не станет комнатной. Реакционную смесь обрабатывали водой (50 мл×3) и DCM (50 мл), с последующей промывкой насыщенным солевым раствором. Органический слой высушивали над безводным сульфатом натрия и выпаривали с помощью роторного испарителя. Чистый маслянистый продукт светло-желтого цвета (13) разделяли с выходом 99.1%. 1Н-ЯМР (300 МГц) d(M.a.)=5.37 (s, 1Н), 5.06 (S, 1Н), 4.49 (bs, 1Н), 3.22-3.20 (m, 2H), 2.82-2.81 (m, 2H), 2.34-2.26 (m, 2H), 2.02-1.83 (m, 6H), 1.54-0.84 (m, 37H).
Синтез 15:
350 мг (0.74 ммоль, 1 экв.) исходного материала (13) растворяли в 5.0 мл безводного DCM. Добавляли 370.0 мг (3.7 ммоль, 5 экв.) янтарного ангидрида (14) и каталитическое количество пиридина. Перемешивали в течение 1 дня с последующей обработкой 0.1 (N) HC1 и DCM несколько раз. Органический слой высушивали над сульфатом натрия и выпаривали для получения белого аморфного твердого соединения (15). Выход: 95%. 1Н-ЯМР (300 МГц) d(м.д.) - 7.72-7.70 (m, 1H), 7.54-7.53 (m, 1H), 5.37 (s, 1H), 5.07 (s, 1H), 4.49 (bs, 1H), 4.22-4.19 (m, 2H), 3.36-3.30 (m, 4H), 2.68-2.33 (m, 4H), 2.02-1.83 (m, 6H), 1.54-0.84 (m, 37H).
Синтез 16:.
50 мг (0.166 ммоль, 1 экв.) цисплатина (16) частично растворяли в 10.0 мл Н2О. Добавляли 28.0 мг (0.166 ммоль, 1 экв.) нитрата серебра и полученную реакционную смесь перемешивали при комнатной температуре в течение 1 дня. Смесь выглядела молочно-белой и хлорид серебра удаляли с помощью центрифугирования при 25000 Х г в течение 1 ч. Полученный продукт 5 в соотношении 7:200 мг (0.35 ммоль, 1.0 экв.) растворяли в 5.0 мл DMF. Добавляли 20.0 мл продукта 6 (конц. 5.0 мг/мл, 1.0 экв.) и перемешивали в течение 1 дня. Реакционную смесь высушивали при помощи лиофилизатора. Высушенный продукт (17) использовали для синтеза липонаночастицы без дальнейшей очистки.
Общая методика синтеза липонаночастиц:
10.0 мг L-a-фосфатидилхолина, 5.0 мг холестерина (или конъюгата Pt(II)-холестерин) и 1.0 мг 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин-М-[амино(полиэтиленгликоль)2000] растворяли в 10.0 мл DCM. Продукт выпаривали в тонкую и однородную пленку при помощи роторного испарителя. После тщательной сушки с помощью насоса гидратировали 1.0 мл H2O в течение 2 ч при 60°С. Гидратированные липонаночастицы имели цвет от светло-желтого до белого, с немного вязкой текстурой. Продукт пропускали через колонку с Sephadex G-25 и экструдировали при 65°С.
Общая методика количественной оценки Pt(II) в липонаночастицах
Измеренное количество экструдированных липонаночастиц нагревали при 100°С в 1.2 мг/мл 1,2-фенилендиамина в DMF в течение 2 ч. Количество Pt(II) рассчитывали с помощью УФ спектрофотометрии (Shimadzu 2450).
Кинетика высвобождения
Концентрированные нагруженные лекарственным средством липонаночастицы суспендировали в буфере (или клеточном лизате) и герметично закрывали в диализной мембране (отсекаемая молекулярная масса 1000, Spectrum Lab). Диализные мешки инкубировали в 1.0 мл PBS буфера при комнатной температуре при энергичном встряхивании. Аликвоту в 10 мкл отбирали из инкубационной среды через заранее установленные интервалы времени и высвобожденное лекарственное средство количественно оценивали с помощью УФ спектрофотометра (Shimadzu 2450). Результаты наносили на график в виде процента высвобождения.
Приготовление образцов для ТЕМ
ТЕМ изображения с высоким разрешением были получены на высококонтрастном цифровом ТЕМ Jeol 2011. Для приготовления образца покрытые кружевным углеродом медные сетки 300 меш (Electron microscopy Science) погружали в водный раствор липонаночастицы. После сушки на воздухе окрашивали 2% водным раствором фосфовольфрамовой кислоты. Распределение липонаночастиц по размерам исследовали методом динамического рассеяния света (DLS), которое выполняли при 26°С на DLS-системе Malvem Zetasizer, оснащенной He-Ne лазером.
Анализ жизнеспособности клеток
Высевали 2×103 клеток в 96-луночные планшеты. Через 4 ч клетки обрабатывали разными концентрациями свободного лекарственного средства или липонаночастицами. Клетки без обработки хранили в качестве контроля. Через 48 ч жизнеспособность клеток оценивали с использованием стандартного MTS анализа согласно инструкциям производителя.
Изучение in vivo эффективности и токсичности
Мыши линии BALB/c были инокулированы опухолевыми клетками молочной железы 4Т1 подкожно в количестве 1×105 в 100 мкл PBS в правый бок. Обработку разными противораковыми агентами, свободными или заключенными в наночастицы, начинали в тот день, когда объем опухоли достигал 200 мм3. Как правило, животные получали только свободное лекарственное средство или в виде наночастиц посредством внутривенного введения через день в общем объеме, равном трем дозам. После того как объем опухоли достигал 2000 мм3 в контрольной группе, мышей умерщвляли. Опухоль, почки, селезенку, легкие, печень извлекали и обрабатывали для заливки в парафин и приготовления срезов.
Все патенты и публикации, размещенные здесь, включены здесь полностью посредством отсылки.
Реферат
Изобретение относится к биосовместимой конъюгированной полимерной наночастице, дикарбонил-липидному соединению, соединению в виде везикул, мицелл или липосом, содержащих множество наночастиц, включающих указанное дикарбонил-липидное соединение, способу лечения рака или метастаз, биосовместимому полимеру, а также к конъюгату. Биосовместимая конъюгированная полимерная наночастица включает основную цепь сополимера, причем по меньшей мере один мономер полимера содержит две боковые цепи, выбранные из группы, состоящей из карбоновой кислоты, амида и сложного эфира, и указанные боковые цепи отделены друг от друга 1-10 атомами углерода, атомами кислорода или атомами серы, или любыми их комбинациями. Далее вышеуказанная наночастица содержит множество боковых цепей, ковалентно связанных с указанной основной цепью, причем указанные боковые цепи выбраны из группы, состоящей из моносахаридов, дикарбоновых кислот, полиэтиленгликоля и их комбинаций; и множество соединений платины, диссоциируемо связанных с указанной основной цепью. Множество соединений платины связано с указанной основной цепью через по меньшей мере одну координационную связь между карбонильным кислородом карбонильной или амидной группы основной цепи и атомом платины соединения платины. Указанное соединение платины выбрано из соединений Pt(II), соединений Pt (IV) и любых их комбинаций. Также изобретение направлено на дикарбонил-липидные соединения, в которых соединение платины диссоциируемо связано с дикарбонильным соединением. Изобретение также направлено на способы лечения рака и метастаз. Способы включают отбор субъекта, нуждающегося в лечен�
Формула
основную цепь сополимера, причем по меньшей мере один мономер полимера содержит две боковые цепи, выбранные из группы, состоящей из карбоновой кислоты, амида и сложного эфира, и указанные боковые цепи отделены друг от друга 1-10 атомами углерода, атомами кислорода, или атомами серы, или любыми их комбинациями;
множество боковых цепей, ковалентно связанных с указанной основной цепью, причем указанные боковые цепи выбраны из группы, состоящей из моносахаридов, дикарбоновых кислот, полиэтиленгликоля (PEG) и их комбинаций; и
множество соединений платины, диссоциируемо связанных с указанной основной цепью, где по меньшей мере одно из множества соединений платины связано с указанной основной цепью через по меньшей мере одну координационную связь между карбонильным кислородом карбонильной или амидной группы основной цепи и атомом платины соединения платины, причем указанное соединение платины выбрано из соединений Pt(II), соединений Pt(IV) и любых их комбинаций.
комплекс карбоновая кислота-соединение платины, в котором указанная карбоновая кислота представлена формулой HOOC-R-COOH, где R представляет собой связь или C1-С6 алкил, С2-С6 алкенил, или С2-С6 алкинил и где указанное соединение платины выбрано из соединений Pt(II), соединений Pt(IV) и любых их комбинаций; и
множество липид-полимерных цепей, при этом карбоновая часть указанного комплекса карбоновая кислота-соединение платины является ковалентно связанной с указанными липид-полимерными цепями, где соединение платины в комплексе связано с карбоновой кислотой через по меньшей мере одну координационную связь между карбонильным кислородом карбонильной кислоты и атомом платины соединения платины.

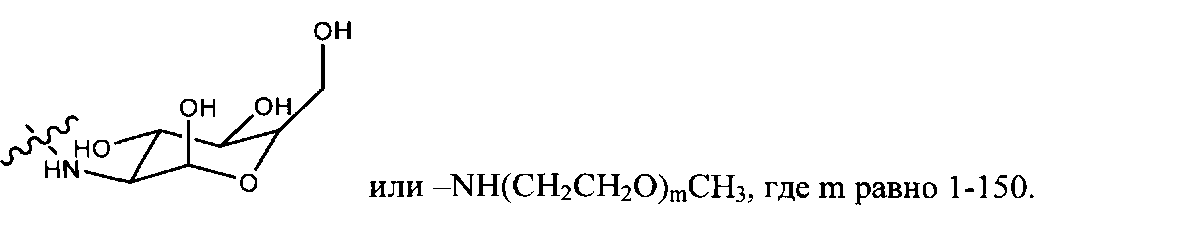
введение субъекту, нуждающемуся в этом, эффективного количества наночастицы по п.1.
основную цепь сополимера, причем по меньшей мере один мономер полимера содержит две боковые цепи, выбранные из группы, состоящей из карбоновой кислоты, амида и сложного эфира, и указанные боковые цепи отделены друг от друга 1-10 атомами углерода, атомами кислорода, или атомами серы, или любыми их комбинациями;
множество боковых цепей, ковалентно связанных с указанной основной цепью, причем указанные боковые цепи выбраны из группы, состоящей из моносахаридов, дикарбоновых кислот, полиэтиленгликоля (PEG) и их комбинаций; и
множество соединений платины, диссоциируемо связанных с указанной основной цепью, где по меньшей мере одно из указанного множества соединений платины является связанным с основной цепью по меньшей мере через одну координационную связь, которая находится между кислородом основной цепи и атомом платины соединения платины, причем указанное соединение платины выбрано из соединений Pt(II), соединений Pt(IV) и любых их комбинаций.
основную цепь, поли(изобутилен-alt-малеиновой кислоты), которая содержит от 25 до 50 мономерных звеньев;
множество полиэтиленгликолевых (PEG) или глюкозаминовых боковых цепей, ковалентно связанных с указанной основной цепью, при этом боковые цепи PEG имеют молекулярную массу от 1000 до 3000 дальтон и количество боковых цепей PEG или глюкозаминовых боковых цепей составляет от 50% до 100% мономерных звеньев указанной основной цепи полимера, и
множество боковых групп цисплатина, диссоциируемо связанных с указанной основной цепью, при этом количество указанных боковых групп цисплатина составляет от 25% до 75% количества мономерных звеньев указанной основной цепи полимера.
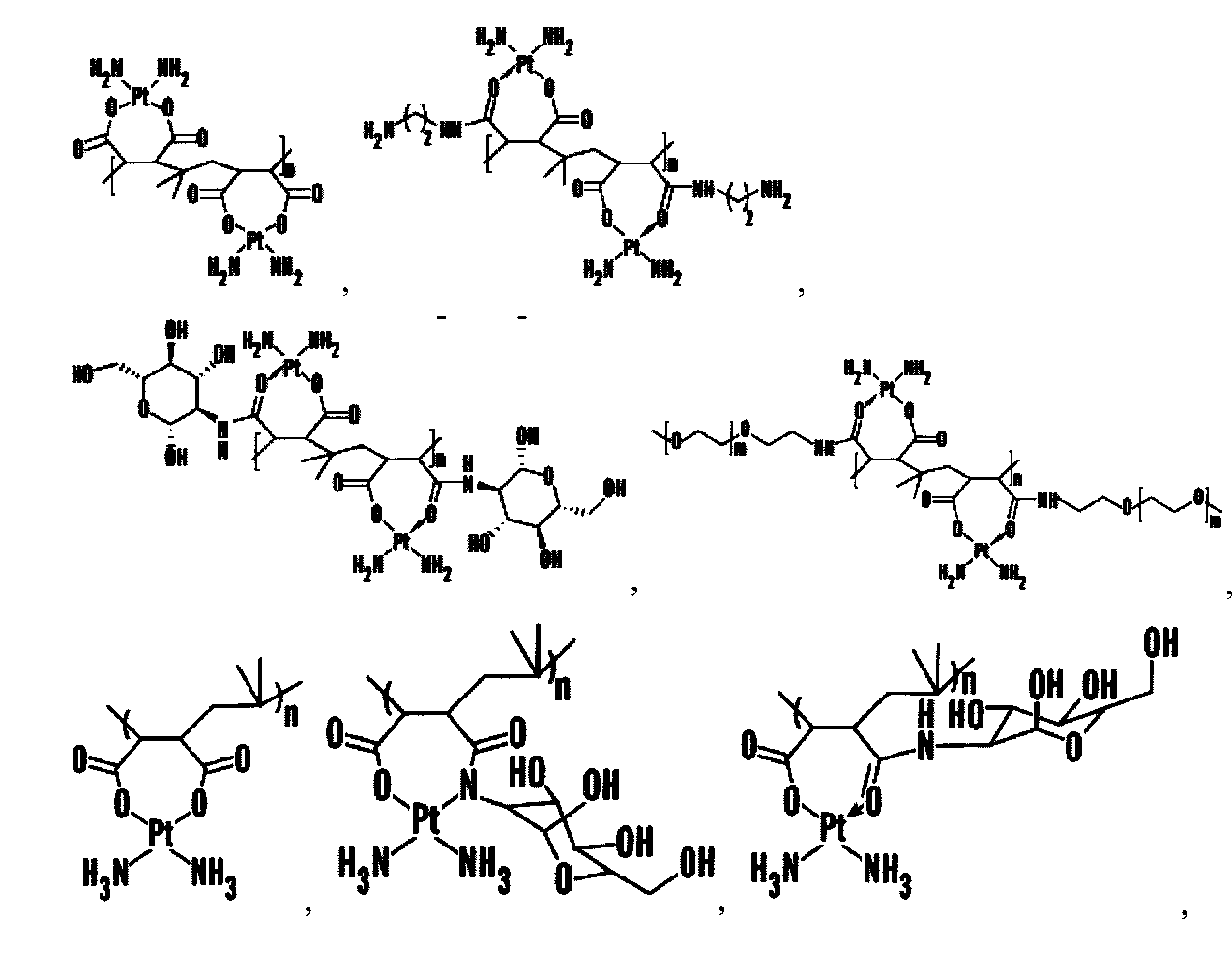
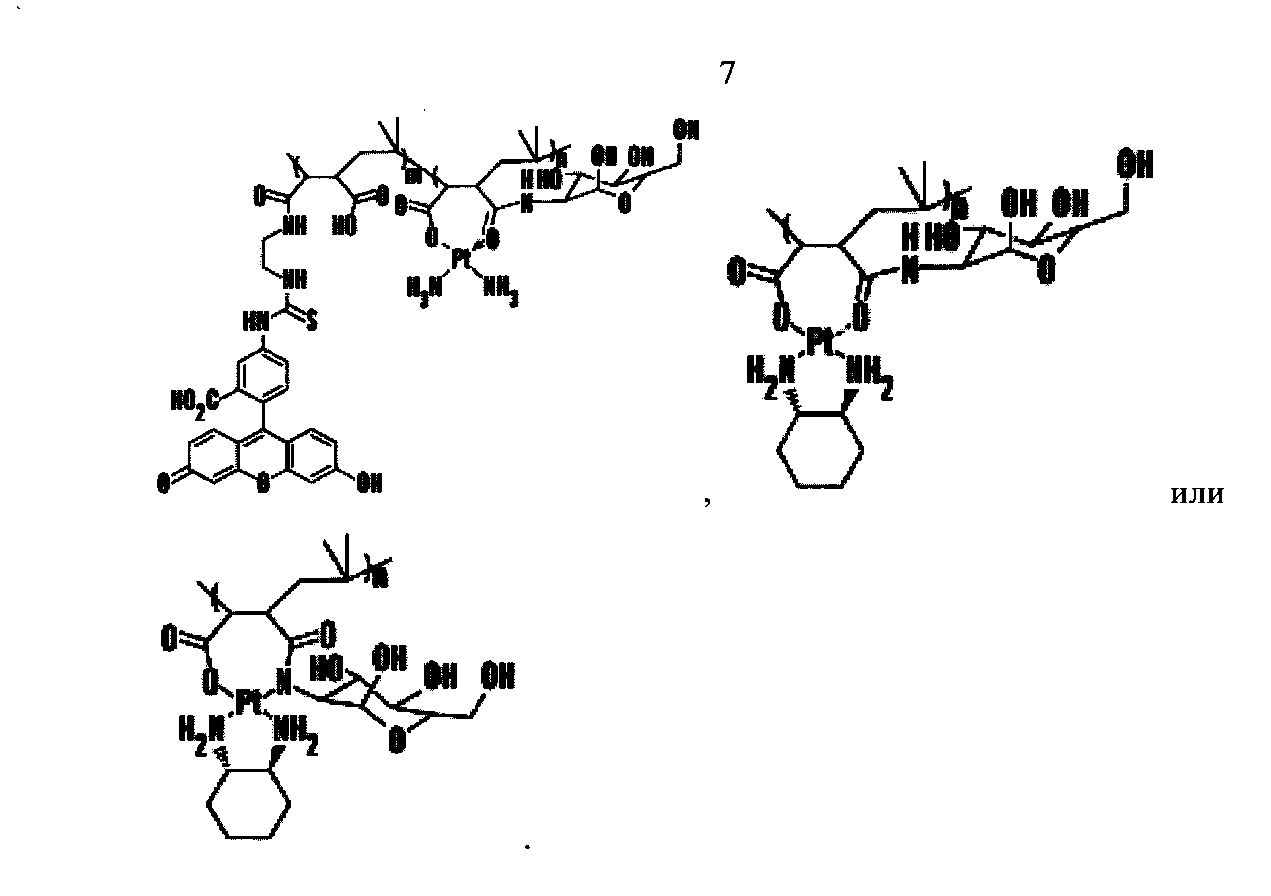
дикарбонильную молекулу, где соединение платины является диссоциируемо связанным с дикарбонильной молекулой R′OC(O)-R-C(O)-, где R представляет собой C1-С6 алкилен, где алкилен может содержать одну или более двойных или тройных связей, и/или основная цепь алкилена может прерываться одним или более из О, S, S(O), SO2, NH, С(О); и R′ представляет собой Н, алкил, алкенил, алкинил, арил, гетероарил, циклил, гетероциклил, каждый из которых может быть необязательно замещенным, и где указанное соединение платины выбрано из соединений Pt(II), соединений Pt(IV) и любых их комбинаций; и
липидную молекулу, причем дикарбонильная молекула ковалентно связана с липидной молекулой.


Комментарии