Активатор сигнального пути жасмоновой кислоты - RU2728472C2
Код документа: RU2728472C2
Чертежи






Описание
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0001] Настоящее изобретение относится к производству белка в растениях. Данное изобретение также относится к применению активатора сигнального пути жасмоновой кислоты для увеличения производства гетерологичного белка в растении или части растения.
УРОВЕНЬ ТЕХНИКИ
[0002] Растения все чаще используются в качестве «биологических фабрик» для производства клинически применимых рекомбинантных белков. Преимущества, связанные с экспрессией рекомбинантного белка, производимого растениями, включают сходное с происходящим у млекопитающих посттрансляционное созревание остовов белков, низкие затраты на инфраструктуру (по сравнению с классическими системами на основе ферментеров промышленного масштаба) и уменьшение связанных с биобезопасностью проблем в отношении загрязнения продукта микробными токсинами или человеческими патогенами.
[0003] Подходы к обогащению рекомбинантных белков в растительных экстрактах часто зависят от выбора правильного значения рН или ионной силы буфера для экстракции с тем, чтобы предпочтительно удалить белки организма-хозяина и облегчить дальнейшую очистку. Осаждение сульфатом аммония и экстракция при низком значении рН применяются в экстрактах зеленых клеточных тканей для осаждения загрязняющих примесей, таких как остатки клеток и фотосинтетические пигменты. Данные процедуры могут также применяться для осаждения присуствующего в больших количествах фермента рибулозо-1,5-бифосфаткарбоксилазы/оксигеназы (ribulose 1,5-bisphosphate carboxylase oxygenase (RuBisCO)) (Peckham et al., 2006), который составляет до 50% от общего растворимого белка (total soluble proteins (TSP)) в листьях и часто усложняет получение высокоочищенного белкового продукта (например, Gaeda et al., 2007).
[0004] Метилжасмонат (Methyl jasmonate (MeJA)) представляет собой летучее производное гормона стресса - жасмоновой кислоты (Okada et al., 2015). Сообщалось о том, что индуцирующие MeJA и жасмоновую кислоту сигналы, такие как ранения, поедание растения или выделения насекомых, воздействуют по механизму понижающей регуляции на транскрипцию генов, связанных с фотосинтезом (Hermsmeier et al., 2001; Jung et al., 2007; Bilgin et al., 2010; Zubo et al., 2011; Duceppe et al., 2012). Было также показано, что MeJA способствует повышенной экспрессии рибосомных генов в листьях, что, по-видимому, важно для поддержания активного механизма биосинтеза белка в клетках, реагирующих на сигналы жасмонатного сигнального пути (Noir et ah, 2013).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0005] Настоящее изобретение относится к производству белка в растениях. Данное изобретение также относится к применению активатора сигнального пути жасмоновой кислоты для увеличения производства белка в растении или части растения.
[0006] Целью настоящего изобретения является создание улучшенного способа получения представляющего интерес гетерологичного белка в растении или части растения.
[0007] Описывается способ (А) увеличения экспрессии представляющего интерес гетерологичного белка в растении или части растения. Данный способ содержит:
i) обработку растения или части растения активатором жасмонатного сигнального пути;
ii) введение нуклеотидной последовательности, содержащей нуклеиновую кислоту, кодирующую представляющий интерес гетерологичный белок и функционально связанную с регуляторной областью, полученной из ДНК-вируса растений; в растение или часть растения; а также
iii) инкубирование растения или части растения в условиях, обеспечивающих экспрессию нуклеотидной последовательности, кодирующей представляющий интерес гетерологичный белок, увеличение в экспрессии наблюдалось, когда количество представляющего интерес гетерологичного белка, экстрагированного из растения или части растения, сравнивают с представляющим интерес гетерологичным белком, полученным во втором растении или части второго растения, которое содержит ту же самую нуклеотидную последовательность и не было обработано активатором жасмонатного сигнального пути.
[0008] ДНК-вирус растений, описанный в способе (А), изложенном выше, может представлять собой ДНК-вирус растений насекомого происхождения. Кроме того, активатор жасмонатного сигнального пути, описанный выше в способе (А), может представлять собой метилжасмонат, жасмоновую кислоту, коронатин или любое биологически активное производное метилжасмоната, жасмоновой кислоты или коронатина.
[0009] Настоящее изобретение также относится к способу (А), как определено выше, в котором на стадии обработки (стадия i) активатор жасмонатного сигнального пути применяют к растению или части растения в виде газа или жидкости и опрыскивают растение или часть растения или добавляют в ростовые среды, поддерживающие растение или часть растения. Альтернативно, стадии обработки (стадия i) и введения (стадия ii) могут быть объединены так, что активатор жасмонатного сигнального пути вводят в растение или часть растения вместе с нуклеотидной последовательностью.
[0010] Применение активатора жасмонатного сигнального пути в вышеописанном способе (А) может представлять собой применение в виде газа или жидкости.
[0011] Кроме того, настоящее изобретение относится к способу (А), как определено выше, в котором нуклеотидную последовательность вводят в растение или в часть растения в переходном режиме с использованием жидкой среды, в которую погружают растение или часть растения, и активатор жасмонатного сигнального пути вводят в жидкую среду на стадии обработки (стадия i). Альтернативно, стадии обработки (стадия i) и введения (стадия ii) могут быть объединены так, что активатор жасмонатного сигнального пути вводят в жидкую среду вместе с нуклеотидной последовательностью, и активатор жасмонатного сигнального пути и нуклеотидная последовательность попадают в растение или часть растения вместе.
[0012] Настоящее изобретение также относится к способу (В) уменьшения количества общего хозяйского растворимого белка в растении или части растения, включающему
i) обработку растения или части растения активатором жасмонатного сигнального пути;
ii) введение нуклеотидной последовательности, содержащей нуклеиновую кислоту, кодирующую представляющий интерес гетерологичный белок и функционально связанную с регуляторной областью, полученной из ДНК-вируса растений, в растение или часть растения; а также
iii) инкубирование растения или части растения в условиях, обеспечивающих экспрессию нуклеотидной последовательности, кодирующей представляющий интерес гетерологичный белок, уменьшение содержания общего хозяйского белка наблюдалось, когда количество общего хозяйского белка, экстрагированного из растения или части растения, сравнивают с общим хозяйским белком, полученным во втором растении или части второго растения, которое содержит ту же самую нуклеотидную последовательность, но не было обработано активатором жасмонатного сигнального пути.
[0013] ДНК-вирус растений, описанный в вышеизложенном способе (В), может может представлять собой ДНК- вирус растений насекомого происхождения. Кроме того, активатор жасмонатного сигнального пути, описанный в вышеизложенном способе, может представлять собой метилжасмонат, жасмоновую кислоту, коронатин или любое биологически активное производное метилжасмоната, жасмоновой кислоты или коронатина.
[0014] Настоящее изобретение также относится к способу (В), как определено выше, в котором на стадии обработки (стадия i) активатор жасмонатного сигнального пути применяют к растению или части растения в виде газа или жидкости и опрыскивают растение или часть растения, или добавляют в ростовые среды, поддерживающие растение или часть растения. Альтернативно, стадии обработки (стадия i) и введения (стадия ii) могут быть объединены так, что активатор жасмонатного сигнального пути вводят в жидкую среду вместе с нуклеотидной последовательностью.
[0015] Применение активатора жасмонатного сигнального пути в вышеописанном способе (В) может представлять собой применение в виде газа или жидкости.
[0016] Кроме того, настоящее изобретение относится к способу (В), как определено выше, в котором нуклеотидную последовательность вводят в растение или в часть растения в переходном режиме с использованием жидкой среды, в которую погружают растение или часть растения, и активатор жасмонатного сигнального пути вводят в жидкую среду на стадии обработки (стадия i). Альтернативно, стадии обработки (стадия i) и введения (стадия ii) могут быть объединены так, что активатор жасмонатного сигнального пути вводят в жидкую среду вместе с нуклеотидной последовательностью, и активатор жасмонатного сигнального пути и нуклеотидная последовательность попадают в растение или часть растения вместе.
[0017] В дополнение, настоящее изобретение относится к способу (С) увеличения экспрессии представляющего интерес гетерологичного белка в трансгенном растении или части трансгенного растения, включающему
i) обработку трансгенного растения или части трансгенного растения активатором жасмонатного сигнального пути, причем трансгенное растение или часть трансгенного растения содержит нуклеотидную последовательность, кодирующую представляющий интерес гетерологичный белок, функционально связанную с регуляторной областью, полученной из ДНК-вируса растений; а также
ii) инкубирование трансгенного растения или части трансгенного растения в условиях, обеспечивающих экспрессию нуклеотидной последовательности, кодирующей представляющий интерес гетерологичный белок, увеличение в экспрессии наблюдалось, когда количество представляющего интерес гетерологичного белка, экстрагированного из трансгенного растения или части трансгенного растения, сравнивают с интересующим гетерологичным белком, полученным во втором трансгенном растении или части второго трансгенного растения, которое содержит ту же самую нуклеотидную последовательность и не было обработано активатором жасмонатного сигнального пути.
[0018] Активатор жасмонатного сигнального пути, описанный выше в способе (С), может представлять собой метилжасмонат, жасмоновую кислоту, коронатин или любое биологически активное производное метилжасмоната, жасмоновой кислоты или коронатина.
[0019] Настоящее изобретение также относится к способу (С), как определено выше, в котором на стадии обработки (стадия i) активатор жасмонатного сигнального пути применяют к трансгенному растению или части трансгенного растения в виде газа или жидкости и опрыскивают трансгенное растение или часть трансгенного растения или добавляют в ростовые среды, поддерживающие трансгенное растение или часть трансгенного растения.
[0020] Настоящее изобретение также относится к применению активатора жасмонатного сигнального пути, например, метилжасмоната (MeJA), с тем чтобы добиться обогащения рекомбинантного, представляющего интерес гетерологичного белка. Общая эффективность последующей обработки гетерологичных белков, экспрессируемых в растении, включая выход после очистки и загрязнение конечного продукта белками клетки-хозяина или их протеолитическими фрагментами, уменьшение деградации белка в неочищенных экстрактах или культуральной среде, а также оптимизацию схем извлечения в целях обогащения белка, может быть улучшена путем регулирования соотношения рекомбинантных и хозяйских (нативных) белков. Как описано в настоящем изобретении, было обнаружено, что применение активатора жасмонатного сигнального пути приводит к изменению протеома в листьях растений. Не желая связывать себя теорией, данное изменение может влиять на специфические и относительные выходы при производстве представляющего интерес гетерологичного белка в растительной ткани. Обработка с MeJA вызывала истощение пулов больших и малых субъединиц RuBisCO и увеличение уровней индуцируемых жасмонатом защитных белков (например, тионинов, Ser-протеазных ингибиторов и антимикробных гидролаз). Увеличение уровней индуцируемых жасмонатом защитных белков снижалось при агроинфильтрации. Тем не менее, в агроинфильтрированных листьях сохранялась RuBisCO-обедненная клеточная среда, что обеспечивало эффективное обогащение представляющих интерес гетерологичных белков.
[0021] По сравнению с растениями, которые не были обработаны активатором жасмонатного сигнального пути, обработка с использованием активатора жасмонатного сигнального пути приводит к увеличению экспрессии представляющего интерес гетерологичного белка. Кроме того, обработка с использованием активатора жасмонатного сигнального пути приводит к приблизительно пятикратному обогащению транзиентно экспрессируемого представляющего интерес гетерологичного белка по отношению к RuBisCO. Пятикратное обогащение представляющего интерес гетерологичного белка является результатом более чем двукратного истощения RuBisCO и приблизительно двукратного увеличения количества транскриптов мРНК представляющего интерес гетерологичного белка, и приблизительно двукратного увеличения количества представляющего интерес гетерологичного белка в пересчете на сырую массу ткани.
[0022] Следовательно, обработка растения или части растения активатором жасмонатного сигнального пути приводит к общему увеличению выхода представляющего интерес гетерологичного белка и относительному увеличению выхода представляющего интерес гетерологичного белка по сравнению с уровнями RuBisCO. Уменьшая уровни RuBisCO, экстракцию и очистку представляющего интерес гетерологичного белка также можно упростить из-за уменьшения загрязнения фоновым белком в процессе экстракции.
[0023] Данное краткое изложение сущности изобретения не обязательно описывает все признаки изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0024] Данные и другие признаки изобретения станут более очевидными из нижеследующего описания, в котором делается ссылка на прилагаемые чертежи, причем:
[0025] На фигурах 1a-1d показаны общий растворимый белок (TSP), 1-D протеомный профиль и уровни субъединиц RuBisCO в агроинфильтрированных и контрольных листьях N. benthamiana, обработанных стрессовым фактором MeJA за 24 часа до заражения. Фигура 1а показывает TSP в пересчете на сырую массу ткани, в листьях, обработанных 0, 0,5, 1 или 2 мМ MeJA. Фигура 1b показывает профиль окрашенного Кумасси-синим белка в контрольных и MeJA-обработанных листьях после SDS-PAGE. Mr, коммерческие маркеры молекулярной массы; PR, патогенез-зависимые белки с повышенным уровнем экспрессии в агроинфильтрированных листьях; RbcL и RbcS, большая и малая субъединицы RuBisCO, соответственно; прямоугольники А, В и С, области геля, содержащие MeJA-индуцируемые белки в неинфильтрированных растениях (см. таблицу 2 для идентификации белков). Фигуры 1с и 1d показывают относительные количества большой (RbCl; фигура 1с) и малой (RbsS; фигура 1d) субъединиц RuBisCO в MeJA-обработанных листьях, как определено путем денситометрии после иммунодетекции с соответствующими антителами. Сигналы от белков на иммуноблотах определяли количественно с использованием программного обеспечения Phoretix 2-D Expression v. 2005 (NonLinear USA, Durham NC, USA) после сканирования нитроцеллюлозных мембран с помощью устройства Microtek ScanMaker II digitalizer (Microtek Laboratory, Torrance CA, U.S.A.). Данные выражены как относительные уровни по сравнению с необработанными контрольными образцами, которым присвоен произвольный уровень 1.0. Каждый столбик на панелях (а) и (с) представляет собой среднее значение трех независимых (повторные опыты с разными листьями) значений ± SE. Инфильтрированные листья трансфицировали клетками A. tumefaciens через 24 часа после обработки с MeJA. Все образцы растений собирали через семь дней после обработки с MeJA (т.е. через 6 дней после агроинфильтрации в случае трансфицированных растений).
[0026] Фигуры 2а-2 с демонстрируют эффект обработки MeJA на накопление белка PR-2, число агробактерий и число транскриптов двух A. tumefaciens вирулентных белков VirB1 и VirE1 в листьях N. benthamiana. Фигура 2а показывает эффекты обработки с MeJA на накопление патоген-индуцируемого белка PR-2 с молекулярной массой 33 кД в контрольных и агроинфильтрированных листьях, как проанализировано денситометрией после иммунодетекции. Сигналы на иммуноблотах определяли количественно с использованием программного обеспечения Phoretix 2-D Expression v. 2005 (Nonlinear USA) после сканирования нитроцеллюлозных мембран с помощью микропиксера Microtek ScanMaker II (Microtek Laboratory). Данные представляют собой среднее значение для трех повторных листьев ± SE. Произвольное значение 1,0 было присвоено уровню PR-2 для контрольных здоровых листьев. Фигура 2b показывает бактерии, полученные из листьев N. benthamiana через 0, 2, 4 или 6 дней после агроинфильтрации. Данные выражены в виде десятичного логарифма числа колониеобразующих единиц (КОЕ) на агаровых пластинах, и каждая точка представляет собой среднее значение пяти независимых (повторные опыты с разными листьями) значений ± SE. Фигура 2 с показывает количества транскриптов мРНК для VirB1 и VirE1 в агроинфильтрированных листьях, обработанных 0 или 1 мМ MeJA, как проанализировано с помощью полимеразной цепной реакции с обратной транскрипцией (RT PCR) в реальном времени с соответствующими ДНК-праймерами. Каждое значение представляет собой среднее значение пяти биологических (повторные опыты с разными листьями) значений ± SE. Звездочка указывает на значительно меньшее значение для транскриптов VirB1 в листьях, обработанных с MeJA, по сравнению с контрольными листьями (t-критерий Стьюдента, Р<0,05).
[0027] Фигуры 3а-3с показывают протеазные активности в неочищенных белковых экстрактах контрольных и агроинфильтрированных листьев N. benthamiana, обработанных 0, 0,5, 1 или 2 мМ MeJA за 24 часа до инфильтрации. Анализы протеазных активностей проводили in vitro с использованием флуорогенных пептидных субстратов, специфичных для катепсин-L-подобных (С1А) Cys-протеаз (фигура 3а), трипсин-подобных (S1) Ser-протеаз (фигура 3b) и катепсин-D/Е-подобных (А1) Asp-протеаз (фигура 3с). Пробы листьев собирали через семь дней после обработки с MeJA. Каждый столбик представляет собой среднее значение трех независимых (повторные опыты с разными листьями) значений ±SE.
[0028] Фигуры 4a-4d показывают выход и экспрессию антитела С5-1 в агроинфильтрированных листьях N. benthamiana, обработанных 0, 0,5, 1 или 2 мМ MeJA. Фигура 4а показывает полные (стрелка) и частичные комплексы тяжелых и легких цепей С5-1, определенные иммунодетекцией после SDS-PAGE в невосстанавливающих условиях. Mr, коммерческие маркеры молекулярной массы. Фигура 4b показывает С5-1, проанализированное с помощью ELISA, в MeJA-обработанных листьях. Данные выражены на основе массы (квадратичная кривая, r2=0,885) или на относительной основе по сравнению с общими растворимыми белками (гистограмма). Фигура 4с показывает транскрипты мРНК для легких (LC) и тяжелых (НС) цепей С5-1 в листьях, обработанных 0 или 1 мМ MeJA, как проанализировано с помощью PCR с обратной транскрипцией (RT PCR) в реальном времени. Фигура 4d показывает С5-1, проанализированное с помощью ELISA, в листьях, обработанных 0, 0,5 или 1 мМ MeJA через 24 часа после инфильтрации или обработанных 1 мМ арахидоновой кислоты за 24 часа до инфильтрации или через 24 ч после инфильтрации. Каждый столбик или точка на панелях (b), (с) и (d) является средним значением пяти независимых (повторные опыты с разными листьями) значений ± SE.
[0029] На фигуре 5 показана иммунодетекция белка PR-2 с молекулярной массой 33 кДа из N. benthamiana в неочищенных белковых экстрактах из контрольных и агроинфильтрированных листьев, обработанных с 0, 0,5 или 1 мм MeJA, или с 1 мМ арахидоновой кислоты (АА), за 24 ч до (верхняя панель) агроинфильтрации или через 24 ч после (нижняя панель) агроинфильтрации. Mr, маркеры молекулярной массы. Агроинфильтации включали в себя обработки с A. tumefaciens, содержащей либо «пустой вектор» pcambia2300, либо вектор, кодирующий С5-1.
[0030] На фигуре 6 показан выход антитела С5-1 в агроинфильтрированных листьях N. benthamiana, обработанных 0 или 1 мМ MeJA. Кодирующие последовательности легких и тяжелых цепей С5-1-антитела экспрессировали под контролем промотора пластоцианина люцерны (US 7,125,978, который включен в настоящее изобретение посредством ссылки). Данные представлены на основе массы листа. Каждый столбик представляет собой среднее значение пяти независимых значений (повторные опыты с разными листьями) ± se.
ПОДРОБНОЕ ОПИСАНИЕ
[0031] Нижеследующее описание представляет собой предпочтительный вариант осуществления.
[0032] Настоящее изобретение относится к производству белка в растениях. Данное изобретение также относится к применению активатора пути жасмоновой кислоты для увеличения производства белка в растении или части растения.
[0033] Используемые в настоящем изобретении термины «содержащий», «имеющий», «включающий» и «содержащий», и их грамматические вариации являются инклюзивными или открытыми и не исключают дополнительных, неперечисленных элементов и/или стадий способа. Термин «состоящий в основном из», когда он используется в настоящем изобретении в связи с применением или способом, означает, что могут присутствовать дополнительные элементы и/или стадии способа, но данные добавления не оказывают существенного влияния на то, каким образом упомянутый способ или применение осуществляются. Термин «состоящий из», при использовании в настоящем изобретении в связи с применением или способом, исключает наличие дополнительных элементов и/или стадий способа. Применение или способ, описанные в настоящем изобретении как содержащие определенные элементы и/или стадии, также могут состоять в основном из данных элементов и/или стадий в определенных вариантах осуществления и состоять из данных элементов и/или стадий в других вариантах осуществления, независимо от того, упоминаются ли данные варианты осуществления конкретно или нет. Кроме того, использование единственного числа включает в себя множественное число и «или» означает «и/или», если не указано иное. Используемый в настоящем изобретении термин «множественность» означает более одного, например, два или более, три или более, четыре или более и т.п. Если не указано иное, все технические и научные термины, используемые в настоящем изобретении, имеют то же значение, которое обычно понимается специалистом в данной области техники. Используемый в настоящем изобретении термин «около» относится к приблизительно +/-10%-ному отклонению от заданного значения. Следует понимать, что такое отклонение всегда включено в любое заданное значение, представленное в настоящем изобретении, независимо от того, упоминается ли оно конкретно или нет. Использование неопределенной формы «а» или «an» при ее использовании в сочетании с термином «содержащий» может означать «один», но оно также соответствует значению «один или более», «по меньшей мере один» и «один или более одного».
[0034] Как описано более подробно ниже, настоящее изобретение относится к способу увеличения экспрессии представляющего интерес гетерологичного белка в растении или части растения. Данный способ содержит:
i) обработку растения или части растения активатором жасмонатного сигнального пути;
ii) введение нуклеотидной последовательности, содержащей нуклеиновую кислоту, кодирующую представляющий интерес гетерологичный белок, и функционально связанную с регуляторной областью, полученной из ДНК-вируса растений; в растение или часть растения; а также
iii) инкубирование растения или части растения в условиях, обеспечивающих экспрессию нуклеотидной последовательности, кодирующей представляющий интерес гетерологичный белок, увеличение экспрессии наблюдалось, когда количество представляющего интерес гетерологичного белка, экстрагированного из растения или части растения, сравнивают с представляющим интерес гетерологичным белком, полученным во втором растении или части второго растения, которое содержит ту же самую нуклеотидную последовательность и не было обработано активатором жасмонатного сигнального пути.
[0035] Стадии обработки (стадия i) и введения (стадия ii) могут быть объединены таким образом, что активатор жасмонатного сигнального пути вводится в растение или часть растения одновременно с нуклеотидной последовательностью.
[0036] Кроме того, настоящее изобретение относится к способу снижения содержания общего растворимого хозяйского белка в растении или части растения, с тем чтобы уменьшить количество фонового хозяйского белка и упростить очистку представляющего интерес гетерологичного белка. Данный способ содержит
i) обработку растения или части растения активатором жасмонатного сигнального пути;
ii) введение нуклеотидной последовательности, содержащей нуклеиновую кислоту, кодирующую представляющий интерес гетерологичный белок и функционально связанную с регуляторной областью, полученной из ДНК-вируса растений, в растение или часть растения; и
iii) инкубирование растения или части растения в условиях, обеспечивающих экспрессию нуклеотидной последовательности, кодирующей представляющий интерес гетерологичный белок, уменьшение содержания общего хозяйского белка наблюдалось, когда количество общего хозяйского белка, экстрагированного из растения или части растения, сравнивают с общим хозяйским белком, полученным во втором растении или части второго растения, которое содержит ту же самую нуклеотидную последовательность, но не было обработано активатором жасмонатного сигнального пути.
[0037] Стадии обработки (стадия i) и введения (стадия ii) могут быть объединены таким образом, что активатор жасмонатного сигнального пути вводится в растение или часть растения одновременно с нуклеотидной последовательностью.
[0038] Дополнительно, настоящее изобретение относится к способу увеличения экспрессии представляющего интерес гетерологичного белка в трансгенном растении или части трансгенного растения. Данный способ содержит:
i) обработку трансгенного растения или части трансгенного растения активатором жасмонатного сигнального пути, причем трансгенное растение или часть трансгенного растения содержит нуклеотидную последовательность, кодирующую представляющий интерес гетерологичный белок, функционально связанную с регуляторной областью, полученной из ДНК-вируса растений; а также
ii) инкубирование трансгенного растения или части трансгенного растения в условиях, обеспечивающих экспрессию нуклеотидной последовательности, кодирующей представляющий интерес гетерологичный белок, увеличение экспрессии наблюдалось, когда количество представляющего интерес гетерологичного белка, экстрагированного из трансгенного растения или части трансгенного растения, сравнивают с представляющим интерес гетерологичным белком, полученным во втором трансгенном растении или части второго трансгенного растения, которое содержит ту же самую нуклеотидную последовательность и было обработано аналогичным образом, но не было обработано активатором жасмонатного сигнального пути.
[0039] Стадии обработки (стадия i) и введения (стадия ii) могут быть объединены таким образом, что активатор жасмонатного сигнального пути вводится в растение или часть растения одновременно с нуклеотидной последовательностью.
[0040] Под «функционально связанным» подразумевается, что конкретные последовательности взаимодействуют либо непосредственно, либо косвенно, для осуществления намеченной функции, такой как посредничество или модуляция экспрессии последовательности нуклеиновой кислоты. Взаимодействие функционально связанных последовательностей может, например, опосредоваться белками, которые взаимодействуют с функционально связанными последовательностями.
[0041] Известно, что сигнальные молекулы-жасмонаты регулируют ответы растений на различные экологические стрессы, например, ранение, вызванный засухой стресс, патогенная атака или нападение вредителей. Жасмонатный сигнальный путь включает в себя несколько событий сигнальной трансдукции. После первичной стимуляции в результате ранения или стресса возникает локальный и системный сигнал, который индуцирует биосинтез жасмоната. Жасмонат взаимодействует с выходными сигналами от сигнального пути салициловой кислоты (уменьшая салицилатный сигнальный путь), сигнального пути этилена и от других сигнальных путей. Передача сигнала в жасмонатном сигнальном пути включает белковые взаимодействия, которые ведут к образованию комплекса SCF(COI1) (Е3-убиквитин-лигаза) и комплекса CSN (СОР9 Signalosome). SCF(COI1) взаимодействует с CSN для контроля наиболее хорошо охарактеризованных реакций жасмоната. Например, комплекс CSN/SCF(COI1) нацелен на транскрипционные репрессоры, включая белки JAZ, для полиубиквитинирования и их модификации или деструкции под действием протеасомы 26S.
[0042] Например, известно, что сигналы, индуцирующие MeJA и родственную жасмоновую кислоту, такие как раны, поедание растения или выделения насекомых, подавляют транскрипцию генов, связанных с фотосинтезом (Hermsmeier et al, 2001; Jung et al., 2007; Bilgin et al., 2010; Zubo et al., 2011; Duceppe et al, 2012). Такие подавляющие эффекты могут быть связаны с накоплением связанных со стрессом белков и ферментов, метаболизирующих углерод в листьях, и могут приводить к снижению уровней RuBisCO (Giri et al., 2006; Wei et al., 2009; Duceppe et al., 2012; Ullmann-Zeunert et al., 2013; Mahajan et al., 2014; Leuzinger et al., 2013).
[0043] Под «активатором жасмонатного сигнального пути» подразумевается любое соединение, которое может активировать жасмонатный сигнальный путь внутри растения. Не желая связывать себя теорией, активатор жасмонатного сигнального пути может привести к деградации jasmonate ZIM-domain (JAZ) белков, которые связывают и подавляют активность транскрипционных факторов, которые модулируют транскрипцию жасмонат-зависимых генов. Взаимодействие между репрессорами SCF(COI1) и JAZ может привести к деградации JAZ-белков и последующему восстановлению активности транскрипционных факторов, таких как MYC2.
[0044] Активатор может быть жидкостью или газом. В качестве примера, который не следует считать ограничивающим, активатором жасмонатного сигнального пути может быть метилжасмонат:

жасмоновая кислота:

или коронатин:

[0045] Коронатин представляет собой фитотоксин, продуцируемый растительным патогеном Pseudomonas syringae, который структурно связан с метилжасмонатом (MeJA) и действует подобным образом при применении к растениям (Feys et al., 1994).
[0046] Другие примеры активаторов жасмонатного сигнального пути включают функциональные эквиваленты MeJA, например, но не ограничиваясь ими, биологически активные производные, аналоги или предшественники жасмоновой кислоты, такие как жасмоновая кислота (свободная), коронатин (микробный), предшественники полиненасыщенных жирных кислот (ПНЖК) (например, альфа-линоленовая кислота) или продукты их окисления, производные жасмоновой кислоты (за исключением MeJA), например, цис-жасмон, жасмоноил-изолейцин (JA-Ile), жасмоноил-АСС. Кроме того, могут быть использованы синтетические аналоги жасмоната, например, BLUSh™ (прогидроасмон(пропил-3-оксо-2-пентилциклопентилацетат, доступный от Fine Agrochemicals Ltd.) и Compound I (5,7,9,10-тетрабромопроизводное метилжасмоната, активное производное).
[0047] Активатор жасмонатного сигнального пути может применяться к растению или части растения путем подвергания растения или части растения воздействию активатора (или предварительно обрабатывая активатором) в течение определенного периода времени, например, от около 0 часов до 14 дней или в любое время между упомянутыми моментами времени, до введения нуклеотидной последовательности, кодирующей представляющий интерес белок. Например, растение часть или растения может быть предварительно обработано соединением активатора от около 0, 0,5, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,0, 6,0, 7,0, 8,0, 9,0, 10,0, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 552, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84 часов или в любое время между упомянутыми моментами времени, или активатор может применяться от около 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 дней или в любое время между упомянутыми моментами времени, перед введением нуклеиновой кислоты, кодирующей представляющий интерес белок, в растение или часть растения.
[0048] Активатор жасмонатного сигнального пути также может применяться к трансгенному растению или части трансгенного растения, содержащему нуклеотидную последовательность, кодирующую представляющий интерес белок, путем подвергания трансгенного растения или части трансгенного растения воздействию активатора в течение определенного периода времени, например, от около 0 часов до 14 дней или в любое время между упомянутыми моментами времени, до экстрагирования представляющего интерес белка. Например, трансгенное растение или часть трансгенного растения можно обработать соединением активатора от около 0, 0,5, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,0, 6,0, 7,0, 8,0, 9,0, 10,0, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 552, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84 часов или в любое время между упомянутыми моментами времени, или активатор может быть применен от около 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 дней или в любое время между упомянутыми моментами времени до экстрагирования представляющего интерес белка из трансгенного растения или части трансгенного растения.
[0049] Если активатор находится в виде жидкости, его можно распылять на листья и другие органы растения по желанию, так чтобы активатор мог взаимодействовать с растением или частью растения до стадии введения нуклеотидной последовательности, кодирующей представляющий интерес белок, в растение или часть растения, или перед экстрагированием представляющего интерес белка из трансгенного растения или части трансгенного растения, содержащего гетерологичную нуклеотидную последовательность, кодирующую представляющий интерес гетерологичный белок. Если активатор представляет собой газ, то растение или часть растения могут быть помещены в герметичную среду, так что газ может взаимодействовать с растением или частью растения до стадии введения нуклеотидной последовательности, кодирующей представляющий интерес белок, в растение или часть растения, или до экстрагирования представляющего интерес белка из трансгенного растения или части трансгенного растения, экспрессирующего представляющий интерес гетерологичный белок.
[0050] Альтернативно, если нуклеотидная последовательность вводится в растение или в часть растения транзиентным образом с применением жидкой среды, в которую погружают растение или часть растения в течение периода времени до введения нуклеиновой кислоты, кодирующей представляющий интерес белок, в растение или часть растения, тогда активатор жасмонатного сигнального пути может быть введен в жидкую среду. Например, растение или часть растения может быть предварительно обработано от около 0 часов до около 24 часов или в любое время между упомянутыми моментами времени, перед введением нуклеиновой кислоты, кодирующей представляющий интерес белок, в растение или часть растения. Альтернативно, стадия воздействия (обработки) растения или части растения и стадия введения нуклеотидной последовательности, кодирующей представляющий интерес белок, в растение или часть растения могут быть объединены таким образом, что активатор жасмонатного сигнального пути вводят в жидкую среду наряду с нуклеотидной последовательностью, так что активатор жасмонатного сигнального пути и нуклеотидная последовательность попадают в растение или часть растения вместе.
[0051] Как описано в настоящем изобретении, активатор жасмонатного сигнального пути может также быть применен к трансгенному растению или части трансгенного растения, содержащему гетерологичную нуклеотидную последовательность, функционально связанную с регуляторной областью, полученной из ДНК-вируса растений, и которая кодирует представляющий интерес гетерологичный белок, с тем чтобы повысить экспрессию представляющего интерес гетерологичного белка в трансгенном растении или части трансгенного растения. Согласно данному способу, трансгенное растение или часть трансгенного растения, экспрессирующее гетерологичную нуклеотидную последовательность, обрабатывают активатором жасмонатного сигнального пути и инкубируют в течение некоторого периода времени в условиях, обеспечивающих экспрессию гетерологичной нуклеотидной последовательности, кодирующей представляющий интерес гетерологичный белок. Возрастание экспрессии представляющего интерес гетерологичного белка можно наблюдать, сравнивая выход представляющего интерес гетерологичного белка, экстрагированного из трансгенного растения или части трансгенного растения, по сравнению с представляющим интерес гетерологичным белком, полученным во втором трансгенном растении или части второго трансгенного растения, которое содержит ту же самую нуклеотидную последовательность и было обработано аналогичным образом, но оно не было обработано активатором жасмонатного сигнального пути.
[0052] Не желая быть связанными теорией, при применении соединения, которое является селективным для индукции жасмонатного сигнального пути (т.е. активатора жасмонатного сигнального пути), могут быть активированы ингибиторы эндогенных протеаз, тем самым уменьшая in vivo деградацию представляющего интерес гетерологичного белка. Например, транскрипционный фактор MYC2, который участвует в передаче сигналов в жасмонатном сигнальном пути, позитивно регулирует гены, участвующие в ответах на ранение, но негативно регулирует гены, участвующие в защите от патогенов (Lorenzo et al., 2004). Кроме того, путем активации жасмонатного сигнального пути может быть подавлен сигнальный путь салициловой кислоты. Активация сигнального пути салициловой кислоты может привести к увеличению активности эндогенных протеаз. Таким образом, с помощью понижающего регулирования сигнального пути салициловой кислоты снижается активность эндогенных протеаз в растениях.
[0053] Используя описанные в настоящем изобретении способы, выход после очистки и степень загрязнения представляющего интерес гетерологичного белка хозяйскими белками, их протеолитическими фрагментами или как хозяйскими белками, так и их протеолитическими фрагментами, а также снижение деградации белка в неочищенных экстрактах могут быть улучшены путем регулирования соотношения представляющего интерес гетерологичного белка и хозяйских (родных) белков. Было обнаружено, что применение активатора жасмонатного сигнального пути изменяет протеом в листьях растений и вызывает обогащение рекомбинантного, представляющего интерес гетерологичного белка. Не желая быть связанными с теорией, данное изменение может повлиять на специфические и относительные выходы при производстве представляющего интерес гетерологичного белка в растительной ткани. Обработка растения или части растения активатором жасмонатного сигнального пути вызывала истощение пулов больших и малых субъединиц RuBisCO, а также повышение уровней жасмонат-индуцируемых защитных белков (например, тионины, ингибиторы сериновых протеаз и антимикробные гидролазы). Увеличение количества жасмонат-индуцируемых защитных белков было снижено при агроинфильтрации. Тем не менее, в агроинфильтрированных листьях сохранялось RuBisCO-обедненное клеточное окружение, что позволяло достичь эффективного обогащения представляющих интерес гетерологичных белков.
[0054] По сравнению с растениями, которые не обрабатывали активатором жасмонатного сигнального пути (но которые обрабатывали аналогичным образом), обработка с применением активатора жасмонатного сигнального пути привела к повышенной экспрессии представляющего интерес гетерологичного белка. Кроме того, обработка с применением активатора жасмонатного сигнального пути привела к приблизительно пятикратному обогащению транзиентно экспрессируемого гетерологичного белка, по сравнению с RuBisCO. Пятикратное обогащение представляющего интерес гетерологичного белка является результатом более чем двухкратного истощения RuBisCO и двукратного увеличения в числе мРНК транскриптов представляющего интерес гетерологичного белка, и двукратного увеличения уровней представляющего интерес гетерологичного белка в пересчете на сырую массу ткани.
[0055] Таким образом, обработка растения или части растения с активатором жасмонатного сигнального пути приводит к общему увеличению выхода представляющего интерес гетерологичного белка и к относительному увеличению выхода представляющего интерес гетерологичного белка, по сравнению с уровнями RuBisCO. При снижении уровней RuBisCO, экстракция и очистка представляющего интерес гетерологичного белка также может быть упрощена за счет уменьшения загрязнения фоновым белком во время процесса экстракции.
[0056] Как описано в настоящем изобретении, наблюдалось увеличение экспрессии гетерологичной нуклеотидной последовательности, кодирующей представляющий интерес белок, когда нуклеиновая кислота, кодирующая представляющий интерес белок, была функционально связана с регуляторной областью, содержащей промотор, полученный из ДНК-содержащего вируса растений, например, промотор 35S. Такое увеличение экспрессии нуклеотидной последовательности не наблюдалось, когда была использована регуляторная область фотосинтетического гена (например пластоцианиновый промотор). Не желая быть связанными теорией, условия, которые вызывают активацию жасмонатного сигнального пути, активатора жасмонатного сигнального пути, или оба условия, которые вызывают активацию жасмонатного сигнального пути и активатора жасмонатного сигнального пути, также могут оказывать благопрятное действие на активность регуляторной области, содержащей промотор, полученный из ДНК-содержащего вируса растений. Условия, которые вызывают активацию жасмонатного сигнального пути, активатора жасмонатного сигнального пути, или оба условия, которые вызывают активацию жасмонатного сигнального пути и активатора жасмонатного сигнального пути, могут включать в себя состояния стресса или атаку патогенов, включая поедание растения насекомыми, и передачу любых связанных с растениями ДНК-содержащих вирусов от насекомого растению.
[0057] Регуляторная область, содержащая промотор, который предназначен для использования в способах, описанных в настоящем изобретении, может быть получена из любого ДНК-вируса растений, включая вирусы семейств Caulimoviridae, Geminiviridae и Nanoviridae. Примеры промоторов, которые не должны рассматриваться как ограничивающие, включают промоторы, полученные из гена вируса семейства Caulimoviridae, включая промотор 35S вируса мозаики цветной капусты (Odell et al., 1985, Nature, 313: 810-812). Аналогично, примеры промоторов из вируса семейств Geminiviridae и Nanoviridae включают промоторы генов Rep и CP вируса Burewala курчавости листьев хлопка (Khan et al., 2015, PLoS ONE 10(3): e0121656) и промоторы генов C1-C11 вируса карликовости астрагала каролинского (Shirasawa-Seo et al., 2005, J Gen Virol 86: 1851-1860), соответственно.
[0058] Как описано в настоящем изобретении, обеспечивается экспрессионная кассета, содержащая, последовательно, промотор или регуляторную область растения, полученный из ДНК-содержащего вируса растений, функционально связанный с представляющей интерес нуклеотидной последовательностью, последовательностью 3'UTR и терминирующую последовательность. Как должно быть понятно специалисту в данной области техники, терминирующая (терминатор) последовательность может представлять собой любую последовательность, которая является активной последовательностью растения-хозяина, например, терминирующая последовательность может представлять собой терминатор NOS. «Экспрессионная кассета» относится к нуклеотидной последовательности, содержащей представляющую интерес нуклеиновую кислоту, под контролем соответствующего промотора или других регуляторных элементов и оперативно (или функционально) связанной с соответствующим промотором или другими регуляторными элементами, для транскрипции представляющей интерес нуклеиновой кислоты в клетке-хозяине.
[0059] Регуляторная область может также содержать дополнительные регуляторные элементы, например, но не ограничиваясь ими, усилители (энхансеры) экспрессии. Подходящие энхансеры экспрессии включают энхансеры, полученные из CPMV 5'UTR, как описано в Sainsbury et. al. 2008 (Plant Physiol. 148:1212-1218); WO 2009/087391, PCT/CA2015/050009, PCT/CA2015/050240 (каждый из которых включен в данное описание посредством ссылки). Энхансер экспрессии может быть функционально связан на 5'-конце энхансерной последовательности с регуляторной областью, которая является активной в растении, и функционально связан с представляющей интерес нуклеотидной последовательностью, на 3'-конце последовательности энхансера экспрессии, для того, чтобы управлять экспрессией нуклеотидной последовательности, представляющей интерес, в растении-хозяине.
[0060] Под «нуклеотидной (или нуклеиновокислотной) последовательностью, представляющей интерес», «кодирующей областью, представляющей интерес», или представляющим интерес белком подразумевают любую нуклеотидную последовательность или кодирующую область (данные термины могут быть взаимозаменяемы), которая экспрессируется в организме-хозяине, например, в растении, для получения представляющего интерес белка. Такая нуклеотидная последовательность, представляющая интерес, может кодировать, но не ограничиваясь ими, гетерологичные белки, модифицированные гетерологичные белки, промышленный фермент или модифицированный промышленный фермент, сельскохозяйственный белок или модифицированный сельскохозяйственный белок, вспомогательный белок, белковую добавку, фармацевтически активный белок, нутрицевтик, продукт с добавленной стоимостью или их фрагмент для применения в качестве кормовых, пищевых продуктов или для применения в качестве как кормовых, так и пищевых продуктов, промышленный фермент, например, целлюлазу, ксиланазу, протеазу, пероксидазу, субтилизин.
[0061] Представляющая интерес нуклеотидная последовательность или представляющая интерес кодирующая область может также включать в себя нуклеотидную последовательность, которая кодирует фармацевтически активный белок, например, факторы роста, регуляторы роста, антитела, антигены и их фрагменты или их производное, применимые для иммунизации или вакцинации, и тому подобное. Такие белки включают, но не ограничиваются ими, белок, который является человеческим патогеном, вирусный белок, например, но не ограничиваясь ими, один или более белков из респираторно-синцитиального вируса (Respiratory syncytial virus (RSV)), ротавируса, вируса гриппа, вируса иммунодефицита человека (ВИЧ), вируса бешенства, вируса папилломы человеческой (ВПЧ), энтеровируса 71 (EV71), или интерлейкины, например, один или более чем один из от IL-1 до IL-24, IL-26 и IL-27, цитокины, эритропоэтин (ЕРО), инсулин, G-CSF, GM-CSF, hPG-CSF, M-CSF или их комбинации, интерфероны, например, интерферон-альфа, интерферон-бета, интерферон-гамма, факторы свертывания крови, например, фактор VIII, фактор IX или tPA hGH, рецепторы, агонисты рецепторов, антитела, например, но не ограничиваясь им, Ритуксан, нейрополипептиды, инсулин, вакцины, факторы роста, например, но не ограничиваясь ими, эпидермальный фактор роста, фактор роста кератиноцитов, трансформационный фактор роста, регуляторы роста, антигены, аутоантигены, их фрагменты или их комбинации, моноклональное антитело, химерное моноклональное антитело, одноцепочечное моноклональное антитело, вирусоподобную частицу (ВПЧ, virus like particle (VLP)) или их комбинации.
[0062] Представляющий интерес белок может также включать гемагглютинин вируса гриппа (НА, см. в WO 2009/009876, которая включена в настоящее описание посредством ссылки). НА представляет собой гомотримерный мембранный гликопротеин типа I, как правило, содержащий сигнальный пептид, домен НА1 и домен НА2, содержащий трансмембранный якорный участок на С-конце и небольшой цитоплазматический хвостовой участок. Нуклеотидные последовательности, кодирующие НА, хорошо известны и доступны (см, например, BioDefense and Public Health Database (Influenza Research Database; Squires et al., 2008 Nucleic Acids Research 36:D497-D503) см. URL: biohealthbase.org/GSearch /home.do?decorator=Influenza; или базы данных, поддерживаемые в Национальном Центре биотехнологической информации (см. URL: ncbi.nlm.nih.gov), оба из которых включены в настоящее описание посредством ссылки).
[0063] Белок НА может быть белком НА вируса гриппа типа А, вируса гриппа типа В, или он является подтипом белка НА вируса гриппа типа А, выбранным из группы, состоящей из H1, Н2, Н3, Н4, Н5, Н6, Н7, Н8, Н9, Н10, H11, Н12, Н13, Н14, Н15 и Н16. В некоторых аспектах настоящего изобретения НА может быть от вируса гриппа типа А, выбранным из группы H1, Н2, Н3, Н5, Н6, Н7 и Н9. Фрагменты белков НА, перечисленных выше, также могут рассматриваться как представляющий интерес белок. Кроме того, домены от белка типа НА или подтипа, приведенного выше, могут быть объединены для получения химерного НА (см., например, WO2009/076778, которая включена в данное описание посредством ссылки).
[0064] Примеры подтипов, содержащих белки НА, включают в себя A/New Caledonia/20/99 (H1N1), A/Indonesia/5/2006 (H5N1), A/chicken/New York/1995, A/herring gull/DE/677/88 (H2N8), A/Texas/32/2003, A/mallard/MN/33/00, A/duck/Shanghai/1/2000, A/northern pintail/TX/828189/02, A/Turkey/Ontario/6118/68(H8N4), A/shoveler/Iran/G54/03, A/chicken/Germany/N/1949(H10N7), A/duck/England/56(H11N6), A/duck/Alberta/60/76(H12N5), A/Gull/Maryland/704/77(H13N6), A/Mallard/Gurjev/263/82, A/duck/Australia/341/83 (H15N8), A/black-headed gull/Sweden/5/99(H16N3), B/Lee/40, C/Johannesburg/66, A/PuertoRico/8/34 (H1N1), A/Brisbane/59/2007 (H1N1), A/Solomon Islands 3/2006 (H1N1), A/Brisbane 10/2007 (H3N2), A/Wisconsin/67/2005 (H3N2), B/Malaysia/2506/2004, B/Florida/4/2006, A/Singapore/1/57 (H2N2), A/Anhui/1/2005 (H5N1), A/Vietnam/1194/2004 (H5N1), A/Teal/HongKong/W312/97 (H6N1), A/Equine/Prague/56 (H7N7), A/HongKong/1073/99 (H9N2)).
[0065] Белок НА может быть подтипа H1, Н2, Н3, Н5, Н6, Н7 или Н9. Так, например, белок H1 может быть от штамма A/New Caledonia/20/99 (H1N1), A/PuertoRico/8/34 (H1N1), A/Brisbane/59/2007 (H1N1), A/Solomon Islands 3/2006 (H1N1), A/California/04/2009 (H1N1) или A/California/07/2009 (H1N1). Белок Н3 также может быть от штамма A/Brisbane 10/2007 (H3N2), A/Wisconsin/67/2005 (H3N2), A/Victoria/361/2011 (H3N2), A/Texas/50/2012 (H3N2), A/Hawaii/22/2012 (H3N2), A/New York/39/2012 (H3N2) или A/Perth/16/2009 (H3N2). В еще одном аспекте изобретения, белок Н2 может быть от штамма A/Singapore/1/57 (H2N2). Белок Н5 может быть от штамма A/Anhui/1/2005 (H5N1), A/Vietnam/1194/2004 (H5N1) или A/Indonesia/5/2005. В одном аспекте настоящего изобретения белок Н6 может быть от штамма A/Teal/HongKong/W312/97 (H6N1). Белок Н7 может быть от штамма A/Equine/Prague/56 (H7N7) или от штамма Н7 A/Hangzhou/1/2013, A/Anhui/1/2013 (H7N9) или A/Shanghai/2/2013 (H7N9). В одном аспекте настоящего изобретения белок Н9 взят от штамма A/HongKong/1073/99 (H9N2). В еще одном аспекте изобретения белок НА может быть от вируса гриппа, который может быть вирусом типа В, включая B/Malaysia/2506/2004, B/Florida/4/2006, B/Brisbane/60/08, B/Massachusetts/2/2012-подобный вирус (линия Yamagata), или B/Wisconsin/1/2010 (линия Yamagata). Неограничивающие примеры аминокислотных последовательностей белков НА из подтипов H1, Н2, Н3, Н5, Н6, Н7, Н9 или В включают последовательности, как описано в WO 2009/009876, WO 2009/076778, WO 2010/003225 (которые включены в данное описание посредством ссылки). Белок НА вируса гриппа может быть Н5 Indonesia.
[0066] НА также может представлять собой химерный НА, в котором нативный трансмембранный домен НА заменен гетерологичным трансмембранным доменом. Трансмембранный домен из белков НА является высококонсервативным (см., например, фигуру 1С в WO 2010/148511; которая включена в данное описание посредством ссылки). Гетерологичный трансмембранный домен может быть получен из любого трансмембранного домена НА, например, но не ограничиваясь ими, трансмембранного домена из H1 California, B/Florida/4/2006 (GenBank, номер доступа ACA33493.1), B/Malaysia/2506/2004 (GenBank, номер доступа ABU99194.1), H1/Bri (номер доступа в базе данных GenBank ADE28750.1), H1 A/Solomon Islands/3/2006 (номер доступа в базе данных GenBank ABU99109.1), H1/NC (номер доступа в базе данных GenBank ААР34324.1), Н2 A/Singapore/1/1957 (номер доступа в базе данных GenBank ААА64366.1), Н3 A/Brisbane/10/2007 (номер доступа в базе данных GenBank ACI26318.1), Н3 A/Wisconsin/67/2005 (номер доступа в базе данных GenBank АВ037599.1), Н5 A/Anhui/1/2005 (номер доступа в базе данных GenBank ABD28180.1), Н5 A/Vietnam/1194/2004 (номер доступа в базе данных GenBank ACR48874.1), H5-Indo (номер доступа в базе данных GenBank ABW06108.1). Трансмембранный домен может быть также определен следующей консенсусной аминокислотной последовательностью:
iLXiYystvAiSslXlXXmlagXsXwmcs (SEQ ID NO:1)
[0067] Если интересующий белок представляет собой ВПЧ, то тогда ВПЧ может содержать форму предшественника НА0 или домены НА1 или НА2, удерживаемые вместе образующимися дисульфидными мостиками. ВПЧ может иметь средний размер от около 20 нм до 1 мкм, или какой угодно между ними, например, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 110, 120, 130, 140, 150 160, 170, 180, 190 или 200 нм, или какой угодно между ними, например, 100 нм, и может включать липидную мембрану. ВПЧ может быть заключен в оболочку или не заключен в оболочку, например, из вирусного оболочечного белок, вирусного структурного белка, вирусного капсидного белка или белка вирусной оболочки. ВПЧ может дополнительно содержать один или более липидов, фосфолипидов, нуклеиновых кислот, мембран или тому подобного.
[0068] Термин «вирусоподобная частица» («virus like particle (VLP)» (ВПЧ)), или «вирусоподобные частицы» или «ВПЧ» относится к структурам, которые собираются самостоятельно и содержат структурные белки, такие как белок НА вируса гриппа. ВПЧ, как правило, морфологически и антигенно похожи на вирионы, образующиеся при инфекции, но не несут генетическую информацию, достаточную для репликации и, следовательно, не являются инфекционными. В некоторых примерах ВПЧ могут содержать один вид белка или более одного вида белка. В случае ВПЧ, содержащих более одного вида белка, виды белков могут быть из одного и того же вида вируса или могут содержать белок из другого вида, рода, подсемейства или семейства вируса (как обозначено по номенклатуре ICTV). В других примерах один или более из видов белков, содержащихся в ВПЧ, может быть модифицирован из природной последовательности. ВПЧ могут быть получены в подходящих клетках-хозяевах, включая клетки растений-хозяев и насекомых-хозяев. После экстракции из клетки-хозяина и после выделения и дополнительной очистки в подходящих условиях, ВПЧ могут быть очищены в виде интактных структур.
[0069] ВПЧ, полученные из белков, происходящих из вирусов гриппа, в соответствии с настоящим изобретением, не содержат белок M1. Белок M1, как известно, связывается с РНК (Wakefield and Brownlee, 1989), которая является загрязнителем препарата ВПЧ. Наличие РНК является нежелательным при получении нормативного утверждения для ВПЧ-продукта, поэтому препарат ВПЧ, в котором отсутствует РНК, может быть предпочтительным.
[0070] НА может содержать нативный или ненативный сигнальный пептид; ненативный сигнальный пептид может быть растительного происхождения. Например, сигнальный пептид может представлять собой сигнальный пептид белка дисульфид-изомеразы (protein disulfide isomerase (PDI)). Нативный сигнальный пептид может соответствовать сигнальному пептиду экспрессируемого гемагглютинина или может соответствовать второму гемагглютинину.
[0071] Настоящее изобретение также относится к молекулам нуклеиновых кислот, содержащим последовательности, кодирующие белок НА. Молекулы нуклеиновой кислоты могут дополнительно включать одну или более регуляторные области, функционально связанные с последовательностью, кодирующей белок НА. Молекулы нуклеиновой кислоты могут содержать последовательность, кодирующую H1, Н2, Н3, Н4, Н5, Н6, Н7, Н8, Н9, Н10, H11, Н12, Н13, Н14, H15, Н16 или НА из вируса гриппа типа В. Так, например, белок НА, кодируемый молекулой нуклеиновой кислоты, может быть белком НА подтипа H1, Н2, Н3, Н5, Н6, Н7, Н9 от типа В. Белок H1, кодируемый нуклеиновой кислотой, может быть от штамма A/New Caledonia/20/99 (H1N1), A/PuertoRico/8/34 (H1N1), A/Brisbane/59/2007 (H1N1), A/Solomon Islands 3/2006 (H1N1), A/California/04/2009 (H1N1) или A/California/07/2009 (H1N1). Белок Н3, кодируемый молекулой нуклеиновой кислоты, может быть от штамма A/Brisbane 10/2007 (H3N2), А/Wisconsin/67/2005 (H3N2), A/Victoria/361/2011 (H3N2), A/Texas/50/2012 (H3N2), A/Hawaii/22/2012 (H3N2), A/New York/39/2012 (H3N2) или A/Perth/16/2009 (H3N2). Белок H2, кодируемый молекулой нуклеиновой кислоты, может быть от штамма A/Singapore/1/57 (H2N2). Белок Н5, кодируемый молекулой нуклеиновой кислоты, может быть от штамма A/Anhui/1/2005 (H5N1), A/Vietnam/1194/2004 (H5N1) или A/Indonesia/5/2005. Белок Н6, кодируемый молекулой нуклеиновой кислоты, может быть от штамма A/Teal/HongKong/W312/97 (H6N1). Белок Н7, кодируемый молекулой нуклеиновой кислоты, может быть от штамма A/Equine//Prague/56 (H7N7) или штамма Н7 A/Hangzhou/1/2013, A/Anhui/1/2013 (H7N9), или штамма A/Shanghai/2/2013 (H7N9). Кроме того, белок Н9, кодируемый молекулой нуклеиновой кислоты, может быть от штамма A/HongKong/1073/99 (H9N2). Белок НА, кодируемый молекулой нуклеиновой кислоты, может быть из вируса гриппа типа В, включая B/Malaysia/2506/2004, B/Florida/4/2006, B/Brisbane/60/08, B/Massachusetts/2/2012-подобный вирус (линия Yamagata) или B/Wisconsin/1/2010 (линия Yamagata). Неограничивающие примеры аминокислотных последовательностей белков НА из подтипов H1, Н2, Н3, Н5, Н6, Н7, Н9 или В включают последовательности, как описано в WO 2009/009876, WO 2009/076778, WO 2010/003225 (которые включены в данное описание посредством ссылки). Белок НА вируса гриппа может представлять собой Н5 Indonesia.
[0072] Представляющий интерес белок (или представляющая интерес кодирующая область) может включать в себя нативный или ненативный сигнальный пептид; ненативный сигнальный пептид может быть растительного происхождения или получен из животного или бактериального полипептида. Нативный сигнальный пептид может соответствовать таковому из представляющего интерес белка, который должен экспрессироваться, кроме того, сигнальный пептид может быть из структурного белка или гемагглютинина вируса, отличного от вируса гриппа. Неограничивающими примерами сигнального пептида, который может быть использован, является сигнальный пептид белка дисульфид-изомеразы люцерны (PDISP; нуклеотиды 32-103 из последовательности с номером доступа Z11499), или сигнальный пептид пататин (PatA SP; нуклеотиды 1738-1806 из последовательности в базе данных GenBank с номером доступа А08215). Нуклеотидная последовательность PatA SP для данного номера доступа представляет собой:

аминокислотная последовательность сигнального пептида пататин А представляет собой:
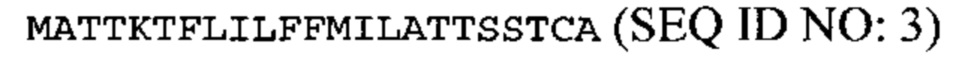
[0073] Представляющая интерес кодирующая область или представляющая интерес нуклеотидная последовательность могут быть экспрессированы в любом подходящем растении-хозяине, который является трансформированным или содержит нуклеотидные последовательности, или молекулы нуклеиновых кислот, или генетические конструкции, или векторы по настоящему изобретению. Примеры подходящих растений-хозяев включают в себя, но не ограничиваются ими, Arabidopsis, сельскохозяйственные культуры, включая, например, рапс, Brassica spp., кукурузу, Nicotiana spp., (табак), например, Nicotiana benthamiana, люцерну, картофель, сладкий картофель (Ipomoea batatus), женьшень, горох, овес, рис, соевые бобы, пшеницу, ячмень, подсолнечник, хлопок, кукурузу, рожь (Secale cereale), сорго (Sorghum bicolor, Sorghum vulgare), сафлор (Carthamus tinctorius).
[0074] Термины «биомасса», «растительный материал» или «часть растения», используемые в настоящем изобретении, относятся к любому материалу растительного происхождения. Биомасса или растительный материал может включать в себя целое растение или часть растения, включая лист, корень, стебель, цветок, семя, она может также включать в себя любую растительную ткань, любые растительные клетки или любую фракцию растения, части или растения, ткани или клетки. Кроме того, биомасса или растительный материал может содержать внутриклеточные растительные компоненты, внеклеточные растительные компоненты, жидкие или твердые экстракты из растений или их комбинацию. Кроме того, биомасса или растительный материал может содержать растения, растительные клетки, ткани, жидкий экстракт или их комбинацию из листьев, стеблей, плодов, корней растений, или их комбинацию. Часть растения может включать растительный материал или биомассу.
[0075] Представляющий интерес белок может быть экстрагирован и очищен из растения или части растения с применением известных способов очистки, включая осаждение в присутствии соли или ПЭГ, хроматографию, включая эксклюзионную, ионнообменную, аффинную или их комбинацию, фильтрацию и тому подобное (см. Wilken, L.R. and Nikolov, Z.L. 2012, Biotechnol. Adv. 30, 419-433). Применение экстракционного буфера при 4°С и имеющего рН 7,0 или выше, может также уменьшить любую эндогенную протеолитическую активность во время экстракции.
[0076] Термины «процент сходства», или «процент идентичности», когда речь идет об определенной последовательности, используются, например, как изложено в программном обеспечении GCG Университета штата Висконсин, или при простом сравнении последовательностей и визуальном наблюдении (см., например, Current Protocols in Molecular Biology, Ausubel et al., eds. 1995 supplement). Способы выравнивания последовательностей для сравнения хорошо известны в данной области техники. Оптимальное выравнивание последовательностей для сравнения можно проводить, используя, например, алгоритм Smith & Waterman (1981, Adv. Appl. Math. 2:482), с помощью алгоритма выравнивания Needleman & Wunsch (1970, J. Mol. Biol 48: 443), с помощью способа поиска сходства Pearson & Lipman (1988, Proc. Nat'l. Acad. Sci. USA 85:2444), с помощью компьютеризованных вариантов данных алгоритмов (например: GAP, BESTFIT, FASTA и TFASTA в програмном обеспечении Wisconsin Genetics Software Package, Genetics Computer Group (GCG), 575 Science Dr., Madison, Wis.).
[0077] Примером алгоритма, подходящего для определения процента идентичности последовательностей и сходства последовательностей, являются алгоритмы BLAST и BLAST 2.0, которые описаны в Altschul et al., (1977, Nuc. Acids Res. 25:3389-3402) и Altschul et al., (1990, J. Mol. Biol. 215:403-410), соответственно. BLAST и BLAST 2.0 используются с параметрами, описанными в настоящем изобретении, для определения процента идентичности последовательностей для нуклеиновых кислот и белков по настоящему изобретению. Например, программа BLASTN (для нуклеотидных последовательностей) может использовать в качестве значения по умолчанию длину слова (W), равную 11, ожидание (Е), равное 10, М=5, N=-4 и сравнение обеих нитей. Для сравнения аминокислотных последовательностей программа BLASTP может использовать в качестве значения по умолчанию длину слова, равную 3, и ожидание (Е), равное 10, и матрица для оценки BLOSUM62 (см. Henikoff & Henikoff, 1989, Proc. Natl. Acad. Sci. USA 89:10915) использует выравнивание (В), равное 50, ожидание (Е), равное 10, М=5, N=-4 и сравнение обеих нитей. Программное обеспечение для осуществления анализов BLAST является общедоступным через Национальный центр биотехнологической информации (см. URL: ncbi.nlm.nih.gov/).
[0078] Под «регуляторной областью» «регуляторным элементом» или «промотором» понимается часть нуклеиновой кислоты, обычно, но не всегда расположенной перед областью гена, кодирующей белок, которая может состоять либо из ДНК, либо из РНК, или из ДНК и РНК одновременно. Когда регуляторная область является активной и находится в функциональном взаимодействии или функционально связана с представляющим интерес геном, это может привести к экспрессии представляющего интерес гена. Регуляторный элемент может обладать способностью опосредования органной специфичности или контролирования активации гена на определенной стадии развития или временной активации гена. «Регуляторная область» включает в себя элементы промотора, коровые элементы промотора, демонстрирующие базовую активность промотора, элементы, индуцируемые в ответ на внешние раздражители, элементы, которые способствуют активности промотора, например отрицательные регуляторные элементы или усилители транскрипции. Используемая в настоящем описании «регуляторная область» также включает в себя элементы, являющиеся активными, следуя за транскрипцией, например, регуляторные элементы, модулирующие экспрессию генов, такие как энхансеры (усилители) трансляции и транскрипции, репрессоры трансляции и транскрипции, вышележащие активирующие последовательности, а также детерминанты нестабильности мРНК. Последние из указанных элементов могут быть расположены близко к области кодирования.
[0079] В контексте настоящего описания термин «регуляторный элемент» или «регуляторная область» обычно относится к последовательности ДНК, чаще, не всегда, расположенной перед (5'-концом) кодирующей последовательностью структурного гена, контролирующего экспрессию области кодирования путем обеспечения распознавания полимеразы РНК и/или другие факторы, необходимые для инициирования транскрипции в конкретном сайте. Однако, следует понимать, что другие нуклеотидные последовательности, расположенные внутри интронов или 3'-конца последовательности, могут также участвовать в регулировании экспрессии кодирующей области, представляющей интерес. Примером регуляторного элемента, обеспечивающего распознавание полимеразы РНК или прочих транскрипционных факторов определенного сайта с целью инициирования конкретного сайта, является элемент промотора. Большинство, но не все, эукариотические промоторные элементы содержат ТАТА-бокс, консервативную последовательность нуклеиновой кислоты, состоящей из пар нуклеотидов, аденозин и тимидин, обычно расположенную на удалении приблизительно в 25 пар нуклеотидов перед сайтом инициирования транскрипции. Элемент промотора может содержать основный элемент промотора, отвечающий за инициацию транскрипции, а также другие регуляторные элементы, модифицирующие экспрессию генов.
[0080] Существует несколько типов регуляторных областей, включая регулируемые в зависимости от стадии развития, индуцированные или конститутивные. Регуляторная область, регулируемая в зависимости от стадии развития, или контролирующая дифференциальную экспрессию контролируемого гена, активируется внутри определенных органов или тканей органа в конкретные промежутки времени в период развития данного органа или ткани. Однако, некоторые регуляторные области, которые регулируются в зависимости от стадии развития, могут в предпочтительном случае быть активными в определенных органах или тканях на определенных стадиях развития, кроме того, они могут быть также активными в режиме регулирования определенных стадий развития или также на основном уровне в других органах или тканях растения. Примеры тканеспецифичных регуляторных областей, например, смотри конкретную регуляторную область, относятся промотор напина, а также промотор круциферина (Rask et al., 1998, J. Plant Physiol. 152: 595-599; Bilodeau et al., 1994, Plant Cell 14: 125-130). Пример специфичного к листьям промотора включает в себя промотор пластоцианина (см. патент США 7,125,978, который включен в настоящее описание посредством ссылки).
[0081] Если представляющая интерес последовательность нуклеиновой кислоты кодирует продукт, который непосредственно или косвенно токсичен для растений, то такая токсичность может быть снижена путем селективной экспрессии представляющей интерес нуклеотидной последовательности в нужной ткани или на требуемой стадии развития растений. В качестве альтернативы, промотор, индуцируемый в присутствии метилжасмоната или другого активатора жасмонатного сигнального пути, также может быть использован для экспрессии нуклеотидной последовательности, представляющей интерес, как описано в настоящем изобретении.
[0082] Индуцируемой регуляторной областью является область, способная напрямую или опосредованно активировать транскрипцию одной или более последовательностей ДНК или генов в ответ на индуктор. В отсутствие индуктора последовательности ДНК или гены транскрибироваться не будут. Обычно, белковый фактор, присоединяющийся конкретно к индуцируемой регуляторной области для активирования транскрипции, может присутствовать в неактивной форме, которая затем может быть прямо или косвенно преобразована индуктором в активную форму. Как бы то ни было, индукция может осуществляться и без белкового фактора. Индуктором может выступать химическое вещество, например, белок, метаболит, регулятор роста, гербицид, или фенольное соединение, или же физиологический стресс, вызванный непосредственно теплом, холодом, солью или токсичными элементами, или косвенно, через воздействие патогенным или болезнетворным веществом, например вирусом. Растительная клетка, содержащая индуцируемую регуляторную область, может попасть под воздействие индуктора при внешнем приложении индуктора к клетке или растению, например, опрыскиванием, увлажнением, нагревом или иными способами. Индуцируемые регуляторные элементы могут быть получены из генов как растительного, так и нерастительного происхождения (например, Gatz, С. and Lenk, I.R.P., 1998, Trends Plant Sci. 3, 352-358; статья включена в настоящее изобретение посредством ссылки). Примеры потенциальных индуцированных промоторов включают пример, но, не ограничиваясь этим, индуцируемый тетрациклином промотор (Gatz, С., 1997, Ann. Rev. Plant Physiol. Plant Mol. Biol. 48, 89-108; статья включена в настоящее изобретение посредством ссылки), промотор, индуцируемый стероидом (Aoyama, Т. and Chua, N.H., 1997, Plant J. 2, 397-404; статья включена в настоящее изобретение посредством ссылки) и промотор, индуцируемый этанолом (Salter, M.G., et al, 1998, Plant Journal 16, 127-132; Caddick, M.X., et al, 1998, Nature Biotech. 16, 177-180, статьи включены в настоящее изобретение посредством ссылки) индуцируемые цитокинином гены IB6 и CK11 (Brandstatter, I. and Kieber, J.J., 1998, Plant Cell 10, 1009-1019; Kakimoto, Т., 1996, Science 274, 982-985; статьи включены в настоящее изобретение посредством ссылки) и элемент DR5, индуцируемый ауксином (Ulmasov, Т., et al., 1997, Plant Cell 9, 1963-1971; статья включена в настоящее изобретение посредством ссылки).
[0083] Конститутивная регуляторная область направляет экспрессию гена через различные части растения и непрерывно в течение всего развития растения. Примеры известных конститутивных регуляторных элементов включают промоторы, связанные с транскриптом CaMV 35S (p35S; Odell et al., 1985, Nature, 313: 810-812), или промотор вируса мозаики маниока (Cassava Vein Mosaic Virus), pCAS (Verdaguer et al., 1996).
[0084] Термин «конститутивная», как он используется в настоящем изобретении, не обязательно означает, что контролируемая конститутивной регуляторной областью нуклеотидная последовательность экспрессируется на одном уровне во всех типах клетки, но, что данная последовательность экспрессируется в широком диапазоне типов клетки, даже, несмотря на то, что часто наблюдается различие в уровне его экспрессии.
[0085] Конструкции экспрессии, как описано в настоящем изобретении, могут находиться в векторе. Вектор может содержать пограничные последовательности, которые позволяют осуществлять перенос и интеграцию экспрессионной кассеты в геном организма или хозяина. Конструкция может быть растительным бинарным вектором, например, бинарным трансформационным вектором на основе pPZP (Hajdukiewicz, et al. 1994). Другие примеры конструкций включают в себя pBin19 (см. Frisch, D.A., L.W. Harris-Haller, et al. 1995, Plant Molecular Biology 27: 405-409).
[0086] Конструкции по настоящему изобретению могут дополнительно содержать 3'-нетранслируемую область (untranslated region (UTR)). 3'-нетранслируемая область содержит сигнал полиаденилирования и любые другие регуляторные сигналы, способные осуществлять процессинг мРНК или экспрессию генов. Сигнал полиаденилирования обычно характеризуется осуществлением добавления треков полиадениловой кислоты к 3'-концу предшественника мРНК. Сигналы полиаденилирования обычно распознаются по наличию гомологии к канонической форме 5'ААТААА-3' (SEQ ID NO: 4), хотя вариации не являются обычным явлением. Неограничивающими примерами подходящих 3'-областей являются 3' транскрибируемые нетранслируемые области, содержащие сигнал полиаденилирования генов индуцирующей развитие опухоли (tumor inducing (Ti)) плазмиды Agrobacterium, например, ген нопалин-синтазы (ген Nos), и растительных генов, например, гены запасного белка сои, ген малой единицы рибулозы-1, ген 5-бифосфаткарбоксилазы (ssRUBISCO; патент США 4,962,028; который включен в данное изобретение посредством ссылки), промотор, использующийся для регулирования экспрессии пластоцианина (Pwee and Gray 1993; статья включена в настоящее описание посредством ссылки). Последовательность терминации (терминатор) может быть получена из 3'-UTR гена пластоцианина люцерны.
[0087] При необходимости, конструкции по данному изобретению могут подвергаться дополнительному воздействию для введения селективных маркеров. Однако, это может не потребоваться. К подходящим селективным маркерам относятся ферменты, которые обеспечивают устойчивость к химическим веществам, таким как антибиотик, например, гентамицин, гигромицин, канамицин, или гербицидам, таким как фосфоинотрицин, глифосат, хлоросульфурон и др. Аналогичным образом, могут быть использованы ферменты, обеспечивающие продуцирование соединения, определяемого по изменению цвета, такие как GUS (бета-глюкуронидаза), или по люминесценции, например, люцифераза или зеленый флуоресцентный белок (GFP).
[0088] Вектор может также включать в себя энхансер (усилитель) экспрессии, как описано в настоящем изобретении. Энхансер экспрессии может находиться на Т-ДНК, которая также содержит супрессор сайленсинга генов и NPTII. Полилинкер может также кодировать один или два набора из 6-ти остатков гистидина, чтобы позволить включение N- или С-концевых His-меток в представляющий интерес белок, для облегчения очистки белка.
[0089] Для ограничения экспрессии трансгенов в растениях может иметь значение посттранскрипционный сайленсинг генов (post-transcriptional gene silencing (PTGS)) и для борьбы со специфическим разрушением трансгенных мРНК может применяться коэкспрессия супрессора сайленсинга от картофельного вируса Y (HCPro) (Brigneti et al., 1998, EMBOJ., 17, 6739-6746, статья включена в настоящее описание посредством ссылки). Альтернативные супрессоров сайленсинга хорошо известны в данной области техники и могут использоваться в соответствии с приведенным в данном документе описанием (Chiba et al., 2006, Virology 346:7-14; статья включена в настоящее описание посредством ссылки), например, но не ограничиваясь этим, TEV-p1/HC-Pro (Tobacco etch virus-p1/НС-Pro; p1/НС-Pro вируса гравировки табака), BYV-р21, р19 вируса кустиковой карликовости томата (Tomato bushy stunt virus) (TBSV p19); конструкция p19 описана в описаны в WO 2010/0003225, статья включена в настоящее описание посредством ссылки), капсидный белок вируса морщинистости томата (Tomato crinkle virus) (TCV-CP), 2b вируса мозаики огурца; Cucumber mosaic virus; (CMV-2b), p25 картофельного вируса X (Potato virus X) (PVX-p25), p11 картофельного вируса M (Potato virus M) (PVM-p11), p11 картофельного вируса S (Potato virus S) (PVS-p11), p16 вируса ожога листьев черники (Blueberry scorch virus) (BScV-p16), p23 вируса тристезы лимона (Citrus tristeza virus) (CTV-p23), p24 вируса сворачивания листьев винограда-2 (Grapevine leafroll-associated virus-2) (GLRaV-2 p24), p10 вируса винограда A (Grapevine virus A) (GVA-p10), pl4 вируса винограда В (Grapevine virus В) (GVB-p14), p10 из латентного вируса борщевика (Heracleum latent virus) (HLV-p10) или pi6 обычного латентного вируса чеснока (Garlic common latent virus) (GCLV-p16).
[0090] Следовательно, один или более супрессоров сайленсинга, например, но не ограничиваясь ими, HcPro, TEV-p1/HC-Pro, BYV-p21, TBSV p19, TCV-CP, CMV-2b, PVX-p25, rgscam, белок B2 из FHV, малый оболочечный белок из CPMV и оболочечный белок из TCV, PVM-p11, PVS-p11, BScV-p16, CTV-p23, GLRaV-2 p24, GBV-p14, HLV-p10, GCLV-p16 или GVA-p10, может коэкспрессироваться вместе с экспрессионной кассетой на основе комовируса, полученным из геминивируса элементом амплификации и последовательностью нуклеиновой кислоты, кодирующей представляющий интерес белок, для дополнительного обеспечения высоких уровней производства белка в растении.
[0091] Конструкции по настоящему изобретению могут вводиться в растительные клетки с помощью Ti-плазмид, Ri-плазмид, векторов вирусов растений, прямой трансформации ДНК, микроинъекции, электропорации и т.д. Для ознакомления с данными способами см., например, Weissbach and Weissbach, Methods for Plant Molecular Biology, Academy Press, New York VIII, pp. 421-463 (1988); Geierson and Corey, Plant Molecular Biology, 2d Ed. (1988); и Miki and Iyer, Fundamentals of Gene Transfer in Plants. In Plant Metabolism, 2d Ed. DT. Dennis, DH Turpin, DD Lefebrve, DB Layzell (eds), Addison Wesly, Langmans Ltd. London, pp. 561-579 (1997). Другие способы включают прямой захват ДНК, использование липосом, электропорацию, например, использование протопластов, микроинъекцию, микроснаряды, а также вакуумную инфильтрацию. Смотри, например, Bilang, et al. (1991, Gene 100: 247-250), Scheid et al. (1991, Mol. Gen. Genet. 228: 104-112), Guerche et al. (1987, Plant Science 52: 111-116), Neuhause et al. (1987, Theor. Appl Genet. 75: 30-36), Klein et al., (2987, Nature 327: 70-73); Freeman et al. (1984, Plant Cell Physiol. 29:1353), Howell et al. (1980, Science 208: 1265), Horsch et al. (1985, Science 227: 1229-1231), DeBlock et al., (1989, Plant Physiology 91: 694-701), Methods for Plant Molecular Biology (Weissbach and Weissbach, eds., Academic Press Inc., 1988), Methods in Plant Molecular Biology (Schuler and Zielinski, eds., Academic Press Inc., 1989), WO 92/09696, WO 94/00583, EP 331083, EP 175966, Liu and Lomonossoff (2002, J Virol Meth, 105:343-348), EP 290395; В WO 8706614; патенты США №№4945050; 5036006; и 5100792, заявку на патент США, серийный №08/438666, поданную 10 мая 1995 г., и заявку на патент США, серийный №07/951715, поданную 25 сентября 1992 г. (все из которых включены в данное изобретение посредством ссылки).
[0092] Способы транзиентной экспрессии могут быть использованы для экспрессии конструкций по настоящему изобретению (см. D'Aoust et al., 2009, Methods in molecular biology, Vol 483, pages 41-50; Liu and Lomonossoff, 2002, Journal of Virological Methods, 105:343-348; статья включена в данное изобретение посредством ссылки). Альтернативно, возможно использование вакуумного способа транзиентной экспрессии, описанного Kapila et al., (1997, Plant Sci. 122, 101-108; статья включена в данное изобретение посредством ссылки) или WO 00/063400, WO 00/037663 (которые включены в данное изобретение посредством ссыпки). Данные способы могут включать в себя, например, но не ограничиваясь ими, способ агроинокуляции или агроинфильтрации, инфильтрации при помощи шприца, однако, как было отмечено выше, могут быть также использованы и другие транзиентные способы. При помощи агроинокуляции, агроинфильтрации или инфильтрации с помощью шприца смесь агробактерий Agrobacteria, содержащая искомую нуклеиновую кислоту, проникает в межклеточные пространства ткани растения, например, в листья, надземную часть растения (включая стебель, листья и цветок), в другую часть растения (стебель, корень, цветок) или все растение. После прохождения эпидермиса агробактерии заражают и передают копии тДНК в клетки. Т-ДНК эписомально транскрибируется, а мРНК транслируется, вызывая продуцирование целевого белка в зараженных клетках, однако, проникновение Т-ДНК внутрь ядра является временным (транзиентным).
[0093] Также следует принять во внимание часть изобретения, касающуюся трансгенных растений, растительных клеток и семян, содержащих конструкцию гена по настоящему изобретению, которые могут быть использованы в качестве растения-платформы, подходящего для транзиентной экспрессии белка, описанной в настоящем изобретении. Способы регенерации целых растений из растительных клеток также известны из существующего уровня техники (например, см. Guerineau and Mullineaux (1993, Plant transformation and expression vectors. In: Plant Molecular Biology Labfax (Croy RRD ed) Oxford, BIOS Scientific Publishers, pp 121-148). В целом, трансформированные растительные клетки культивируются в соответствующей среде, которая может содержать селективные агенты, такие как антибиотики, при этом для облегчения идентификации трансформированных растительных клеток используются селектируемые маркеры. После образования каллюса формирование отростков может быть вызвано путем использования соответствующих растительных гормонов в соответствии с известными способами, а отростки помещаются в корнеобразующую среду для регенерации растений. Растения затем могут быть использованы для создания повторных генераций либо из семян, либо путем использования методик вегетативного размножения. Трансгенные растения могут также быть выращены без использования тканевых культур. Способы стабильной трансформации и регенерации таких организмов разботаны в данной области техники и известны специалисту в данной области техники. Доступные способы рассмотрены в Vasil et al. (Cell Culture and Somatic Cell Genetics of Plants, Vol I, II and III, Laboratory Procedures and Their Applications, Academic Press, 1984), и Weissbach and Weissbach, (Methods for Plant Molecular Biology, Academic Press, 1989). Способ получения трансформированных и регенерированных растений не является критическим для настоящего изобретения.
[0094] Если растения, части растений или растительные клетки должны трансформироваться или котрансформироваться двумя или более конструкциями нуклеиновых кислот, то конструкция нуклеиновой кислоты может вводиться в агробактерии посредством единичной трансфекции, когда нуклеиновые кислоты объединены, и бактериальные клетки трансфицируют, как описано. С другой стороны, конструкции могут быть введены последовательно. В данном случае первую конструкцию вводят в агробактерии, как описано, клетки выращивают в селективных условиях (например, в присутствии антибиотика), в которых могут расти только однократно трансформированные бактерии. После данной первой стадии отбора вторую конструкцию нуклеиновой кислоты вводят в агробактерии, как описано выше, и клетки выращивают в условиях двойной селекции, когда могут расти только дважды трансформированные бактерии. Дважды трансформированные бактерии могут затем использоваться для трансформации растений, растения или части растительной клетки, как описано в настоящем изобретении, или могут быть подвергнуты дополнительной стадия трансформации, чтобы ввести третью конструкцию нуклеиновой кислоты.
[0095] В качестве альтернативы, если растения, части растения или растительные клетки должны трансформироваться или котрансформироваться двумя или более конструкциями нуклеиновых кислот, то конструкция нуклеиновой кислоты может вводиться в растение путем коинфильтрации смеси клеток Agrobacterium в растение, часть растения или растительную клетку, причем каждая клетка Agrobacterium может содержать одну или несколько конструкций, которые должны быть введены в растение. Для того, чтобы изменять относительные уровни экспрессии представляющей интерес нуклеотидной последовательности, содержащейся внутри конструкции, во время стадии инфильтрации, в растении, части растения или в растительной клетке, концентрация различных популяций клеток Agrobacterium, содержащих желаемые конструкции, может варьироваться.
[0096] Настоящее изобретение обеспечивает способ получения представляющего интерес белка, включающий следующие стадии: обеспечение растения или части растения, которое экспрессирует экспрессионную систему, описанную в настоящем изобретении, сбор ткани, органа или растения, в которой был экспрессирован представляющий интерес белок, и, необязательно, выделение представляющего интерес белка из ткани, органа или растения.
[0097] Настоящее изобретение будет далее проиллюстрировано в следующих примерах.
Материалы и способы
Отбор проб растительной ткани и обработки активатором
[0098] Сорок два однодневных растения N. benthamiana, выращенные в теплице, были использованы для экспериментов. Каждое растение равномерно опрыскивали 50 мл 0,5 мМ, 1 мМ или 2 мМ MeJA в воде, содержащей 0,1% (об./об.) Тритона Х-100 (Sigma-Aldrich, Mississauga ON, Canada), или 50 мл 1 мМ арахидоновой кислоты (Girard et al., 2007) в том же растворителе, и переносили на семь дней в ростовую камеру Conviron (Conviron, Winnipeg MB, Canada). Растения, которые опрыскивали 50 мл 0,1% (об./об.) Тритона Х-100 в воде, использовали параллельно в качестве отрицательных контролей, чтобы избежать искажающих эффектов из-за экспериментальных условий. Два или три листовых диска размером 1 см2 собирали от третьего листа главного стебля (см. Robert et al., 2013) через семь дней, в качестве исходного материала для экстракции белка и РНК. Образцы листьев немедленно замораживали в жидком азоте и хранили при -80°С до экстракции белка или РНК. От трех до пяти биологических (растительных) одинаковых образцов использовали для каждой обработки, чтобы обеспечить статистическую обработку данных.
Генные конструкции и агроинфильтрация листьев
[0099] Два генных вектора были использованы для агроинфильтрационных анализов: сконструированный вектор pcambia2300, кодирующий легкие и тяжелые цепи С5-1, слитый с последовательностью N-концевого сигнального пептида для клеточной секреции (см. Goulet et al., 2012 подробнее о генной конструкции); и оригинальный («пустой») бинарный вектор pcambia2300 (CAMBIA, Канберра, Австралия) в качестве контроля агроинфекции. Два бинарных вектора вводили электропорацией в штамм LBA4404 A. tumefaciens, и культуры поддерживали в среде Лурии-Бертани (LB) с добавлением 50 мкг/мл канамицина и 50 мкг/мл рифампицина. Для проведения инфильтрации бактерии выращивали до стабильной фазы при 28°C до величины оптической плотности OD600. равной 1,0, и собирали центрифугированием при 2000 g. Бактериальные осадки ресуспендировали в 10 мМ 2-[N-морфолино]этансульфоновой кислоты] (MES) буфера, рН 5,8, содержащем 100 мкМ ацетосирингона и 10 мМ MgCl2. Инфильтрацию листьев выполняли с помощью безыгольного шприца, как описано ранее (D'Aoust et al., 2009), после смешивания агробактериальной суспензии, содержащей антитело С5-1 (или пустой вектор), с равным объемом бактериальной суспензии, несущей бинарный вектор для супрессора р19 сайленсинга белков (Voinnet et al., 2003). Инфильтрированную ткань для молекулярной характеризации собирали через шесть дней после заражения (то есть через семь дней после обработки с MeJA или арахидонатом), если не указано другое. От трех до пяти биологических (растительных) повторностей использовали для каждой обработки, чтобы позволить проведение статистического анализа.
Экстракция белков, SDS-PAGE и иммуноблоттинг
[00100] Все белки листьев экстрагировали из трех листовых дисков размером 1 см2 в 400 мкл охлажденном льдом 50 мМ Трис-HCl, рН 7,5, содержащем 150 мМ NaCl, разрушая листовые образцы шариками из карбида вольфрама (Qiagen, Mississauga ON, Canada) в устройстве Mini-Beadbeater (BioSpec, Bartlesville OK, USA). Полную «смесь протеазных ингибиторов (protease inhibitor cocktail)» (Roche, Laval QC, Canada) добавляли в буфер для экстракции перед разрушением ткани, как указано поставщиком, за исключением экстрактов, предназначенных для контроля протеазной активности. Неочищенные экстракты листьев осветляли центрифугированием при 20000 g в течение 30 мин при 4°С, и общий растворимый белок анализировали по способу Брэдфорда (1976) с бычьим сывороточным альбумином в качестве стандартного белка (Sigma-Aldrich). Электрофоретическое разделение белков проводили с помощью 10% (масса/объем) SDS-PAGE в восстановительных условиях (Laemmli, 1970), если не указано иное. Разделенные белки окрашивали Кумасси синим, чтобы визуализировать паттерны белковых полос, или переносили электрофоретически на нитроцеллюлозные мембраны для иммунологического анализа с соответствующими первичными и вторичными антителами. Малую субъединицу RuBisCO детектировали с применением поликлональных IgG кролика против синтетического пептида малой субъединицы (Agrisera,

Масс-спектрометрия
[00101] Для идентификации с помощью масс-спектрометрии (MS) участки геля, содержащие белки листьев (соответствующие участкам геля, содержащим белок и выделенным в прямоугольниках А, В и С на фигуре 1b), вырезали вручную из гелей, помещали в 100 мкл воды Милли-Q и посылали в Центр протеомики восточного Квебека (Eastern
Идентификация белков
[00102] Спектральные данные, полученные анализом MS/MS, обрабатывали с использованием программы ExtractMSn из пакета прикладных программ BioWorks компании Thermo, без деконволюции зарядового состояния или деизотопирования. Идентификацию белков проводили с помощью программы Mascot, v. 2.3.02 (Matrix Science, London, U.K.) и общедоступного программного обеспечения X! Тандем (Craig et al., 2004). Оба программных обеспечения были созданы для поиска в пользовательской базе данных, содержащей все известные белковые последовательности видов пасленовых (таксономический ID: 4070, для 39896 белков), белковые последовательности A. tumefaciens (12554 белка) и данные по последовательностям белковых загрязнений, обычно встречаемых в продуктах переваривания трипсином. Поиск по базе данных проводили с допуском (толерантностью) массы фрагментного иона, равной 0,50 Da, и допуском массы родительского иона, равным 2,0 Da. Йодацетамидное производное остатков Cys было указано как в Маскот, так и X! Тандем, в виде фиксированной модификации; цитруллинирование остатков Arg и окисление остатков Met были определены как переменные модификации. Идентификации пептидов и белков на основе анализа MS/MS проверяли с использованием программы Scaffold, v. 3.4.9 (Proteome Software, Portland OR, U.S.A.). Идентификации были приняты, если они включали по меньшей мере четыре пептида и могли быть установлены на уровне более чем 95%-ной вероятности, как указано в алгоритме Prophet algorithm (Keller et al., 2002). Вероятности определения белков были назначены алгоритмом Prophet algorithm, как описано у Nesvizhskii et al. (2003). Белки, которые содержали подобные пептиды и не могли быть дифференцированы на основе данных MS/MS, были сгруппированы для соответствия принципам парсимонии.
RT PCR в режиме реального времени
[00103] Транскрипты мРНК для С5-1 и вирулентных белков VirB1 и VirE1 А. tumefaciens анализировали с помощью полимеразной цепной реакции с обратной транскрипцией (polymerase chain reaction with reverse transcription, RT PCR) в режиме реального времени, используя прибор для проведения полимеразной цепной реакции в режиме реального времени ABI PRISM 7500 Fast real-time PCR apparatus, system version 2.0.1 (Applied Biosystems, Carlsbad CA, U.S.A.). Суммарную РНК экстрагировали из двух листовых дисков размером 1 см2, собранных от третьего листа главного стебля (Robert et al., 2013), с помощью набора Qiagen RNeasy plant mini kit (Qiagen), следуя инструкции производителя. Образцы РНК обрабатывали ДНКазой I (Roche Diagnostics) для удаления контаминантной ДНК и оценивали количество и качество с помощью спектрофотометра Nanodrop® ND-1000 (NanoDrop Technologies, Wilmington DE, USA). Первую нить кДНК синтезировали из 500 нг суммарной РНК с использованием 4 единиц обратной транскриптазы OmniScript (Qiagen) и 1 мкМ олиго-дТ(15) нуклеотидов (Roche). Реакционные смеси для проведения PCR содержали 10 мкл Fast SYBR Green PCR Master Mix (Applied Biosystems), 2 мкл матричной кДНК и 2,5 мкл соответствующего прямого и обратного праймеров при конечной концентрации, равной 625 нМ (таблица 1). Контрольная смесь без матричной кДНК была включена в каждый 96-луночный планшет. Раунды амплификации состояли из стадии денатурации в течение 20 сек при 95°C с последующими 40 двухступенчатыми циклами из 3 сек при 95°С и 30 сек при 60°С. Анализ кривой диссоциации проводили после амплификации с SYBR Green Master Mix, и пороговый цикл для каждого образца затем сравнивали со стандартной кривой ДНК, предназначенной для каждой пары праймеров. Стандартные кривые получали с 2 мкл матричной кДНК, следуя общепризнанному протоколу с полимеразой NEB Taq (New England Biolabs, Pickering ON, Canada). Продукты амплификации очищали с помощью набора Illustra GFX (GE Healthcare), и стандартные кривые ДНК получали с серийными разведениями очищенных продуктов PCR в свободной от нуклеаз воде (от 107 до 102 копий на мкл). Ст-данные представляли графически в виде зависимости от соответствующего количества копий транскриптов. Все амплификации проводили в двух повторах.

Бактериальные подсчеты
[00104] Бактериальные нагрузки в листьях определяли путем подсчета КОЕ на чашках с агаром LB, на которые высевали бактерии, извлеченные в различные моменты времени из третьего листа главного стебля. Каждый повторный образец состоял из двух листовых дисков размером 1 см2, собранных через 0, 2, 4 или 6 дней после агроинфильтрации. Листовые диски гомогенизировали в 10 мМ MES буфера, рН 5,8, содержащего 10 мМ MgCl2, в приборе BioSpec Mini-Beadbeater (см. Разделы Экстракция белков, SDS-PAGE и иммуноблоттинг, выше). Полученные суспензии высевали при различных разбавлениях на среду LB, дополненную канамицином (50 мг/мл), и инкубировали при 28°C до подсчета КОЕ через два дня.
Анализы на протеазные активности
[00105] Протеазные активности анализировали с помощью мониторинга кривых прогресса гидролиза субстрата (Goulet et al., 2012) с использованием следующих синтетических флуорогенных субстратов (Peptides International, Louisville KY, USA): Z-Phe-Arg-метилкумарин (MCA) для катепсин-L-подобных C1A Cys-протеаз, Z-Arg-MCA для трипсиноподобных S1 Ser-протеаз и MOCAc-Gly-Lys-Pro-Ile-Leu-Phe-Phe-Arg-Leu-Lys(Dnp)-D-Arg-NH2 для катепсин-D/E-подобных A1 Asp-протеаз. Гидролиз субстрата протеазами из экстракта листьев (36 нг белка листьев на 1 мкл реакционной смеси) проводили при 25°C в 50 мМ MES, рН 5,8, содержащем 10 мМ L-Cys для субстрата катепсина L. Уровни протеазной активности контролировали с помощью флуориметра Fluostar Galaxy microplate fluorimeter (BMG, Offenburg, Germany) с фильтрами возбуждения и излучения при 360 и 450 нм, соответственно, для субстратов МСА; или при 340 и 400 нм, соответственно, для субстрата МОСАс. Три независимых (биологических) повтора использовали для каждого анализа.
Количественное определение С5-1
[00106] ELISA-планшеты для количественного определения антитела С5-1 (Becton Dickinson, Mississauga ON, Canada) покрывали 3,75 мкг/мл козьего антимышиного, специфического к тяжелой цепи IgG1 (Sigma-Aldrich) в 50 мМ карбонатного буфера (рН 9,0) при 4°C в течение от 16 до 18 ч. Планшеты промывали три раза в 10 мМ фосфатно-солевом буферном растворе, содержащем 0,1% (об./об.) Tween 20 (PBS-T), блокировали посредством 1-часовой инкубации при 37°C в 1% (масс./об.) казеина в фосфатно-солевом буферном растворе (PBS) (Pierce, Rockford IL, USA) и промывали три раза в PBS-T. Стандартную кривую строили для каждого планшета с 0, 4, 8, 16, 24, 32, 40 и 60 нг/мл очищенного мышиного IgG1 (Sigma-Aldrich). Все разведения (контроли и образцы) выполняли в контрольном экстракте, полученном из ткани листьев, инфильтрированной ложным инокулятом с тем, чтобы любой матричный эффект был устранен. Планшеты инкубировали с образцами белка в течение 1 ч при 37°C, промывали три раза в PBS-T, а затем инкубировали с конъюгированными с пероксидазой козьими анти-мышиными IgG (H+L) антителами (0,02 мкг/мл в блокирующем растворе) (Jackson ImmunoResearch) в течение 1 ч при 37°С. После дополнительных промывок с PBS-T планшеты инкубировали с субстратом для пероксидазной реакции Sure Blue 3,3',5,5'-тетраметилбензидином (KPL, Gaithersburg MD, USA). Реакцию останавливали добавлением 1 N HCl и оптическую плотность считывали при длине волны 450 нм. Три независимых (биологических) повтора использовали для каждого анализа.
Статистические анализы
[00107] Статистические анализы проводили с помощью программы SAS v. 9.1 (SAS Institute, Сагу NC, USA). Процедуры ANOVA и PROC GLM использовали для сравнения выходов С5-1 в ходе обработок, денситометрических данных и протеазных активностей. Расчеты с командой Contrast были сделаны, когда ANOVA давала значимость, используя пороговую величину α-ошибки, равную 5%. Тесты с t-критерием Студента проводили, чтобы сравнить число транскриптов мРНКа для вирулентных белков A. tumefaciens и цепей С5-1 в контрольных и обработанных MeJA растениях.
Пример 1: i) MeJA индуцирует перебалансировку протеома листа в N. benthamiana
[00108] Сорок два однодневных растения N. benthamiana обрабатывали 0,5, 1 или 2 мМ MeJA, чтобы определить влияние сигнального пути жасмоновой кислоты на общий белковый профиль в ткани листьев (фигура 1). В пересчете на сырую массу ткани, содержание TSP в зрелых листьях MeJA-обработанных растений уменьшилось через семь дней на от 20 до 30% по сравнению с необработанными контрольными листьями, в зависимости от дозы активатора (ANOVA; Р<0,001) (фигура 1а). Как наблюдалось с другими растениями семейства Solanaceae (Lawrence et al., 2008; Duceppe et al., 2012; Ullman-Zeunert et al., 2013), обработка с MeJA вызывала сильное истощение пулов большой и малой субъединиц RuBisCO в экстрактах листьев (фигура 1b), по оценкам, от на 40% меньше, чем в контрольной группе, для дозы MeJA, равной 0,5 мМ, до более чем на 90% меньше для дозы, равной 2 мМ (ANOVA; Р<0,05 для RbcL; Р<0,001 для RbcS) (фигура 1с). Истощение RuBisCO уравновешивалось повышенной экспрессией нескольких белков, в частности, в диапазонах молекулярной массы ~30 кДа, ~25 кДа и ~6 кДа, как видно на окрашенных Кумасси синим гелях после SDS-PAGE (фигура 1b, прямоугольники А, В и С). С целью выявления наиболее широко представленных белков в этих массовых диапазонах был проведен панорамный протеомный анализ, базируемый на масс-спектральном анализе тандемной масс-спектрометрии (MS/MS) пептидов, полученных из переваренных трипсином белковых полос, выделенных в прямоугольниках А, В и С на фигуре 1b (таблица 2). Большинство идентифицированных белков представляли собой MeJA-индуцируемые стрессовые (или защитные) белки, в частности, включая тионины, хитиназы, семейства ингибиторов Ser-протеаз типа Кунитца и белкового ингибитора II протеиназ, и связанные со стрессом ферменты, такие как супероксиддисмутаза, карбоангидраза и тиоредоксинпероксидаза (см. таблицу 3 для дополнительной информации об установленных анализом MS/MS пептидных последовательностях).
[00109] Ряд растений инфильтрировали через 24 ч после обработки с MeJA клетками A. tumefaciens, несущими «пустой» вектор pCAMBIA2300 (Goulet et al., 2012), чтобы оценить, насколько MeJA-опосредованные изменения протеома листа могут сохраняться в течение обычного периода длительностью от шести до семи дней, остающегося после бактериальной инфекции для экспрессии рекомбинантного белка. Известно, что агроинфильтрация вызывает активную секрецию белков PR, включая белки PR-2 (бета-глюканазы) и PR-3 (хитиназы), в апопласте листьев N. benthamiana, предположительно, с участием индуцируемого патогенами сигнального пути салициловой кислоты (Goulet et al., 2010). Три белковые полосы в диапазоне масс от 25 до 33 кДа (соответствуя белкам PR-2 и PR-3) проявлялись гораздо сильнее в агроинфильтрированных листьях, независимо от примененной дозы MeJA (фигура 1b). В результате антагонистических взаимодействий между жасмонатным и салицилатным сигнальными путями (Derksen et al., 2013), индукция белков PR в инфильтрированных листьях была связана с сильным обращением индукции MeJA-опосредованных стрессовых белков, обнаруженных в незараженных растениях, приводя к очень слабым белковым сигналам, выделенным в прямоугольниках А, В и В, через шесть дней после заражения (фигура 1b). Было найдено, что содержание большой и малой субъединиц из RuBisCO в листьях, обработанных 1 или 2 мМ MeJA, составляет менее чем 50% от их первоначального содержания по сравнению с необработанными растениями (фигура 1b, с).
[00110] Полученные данные демонстрируют эффективность MeJA как мощного, действующего перед инфекцией триггера истощения RuBisCO в листьях N. benthamiana, и его применение в снижении количества RuBisCO, при одновременном увеличении относительного содержания рекомбинантного белка в неочищенных белковых экстрактах на стадии, предшествующей извлечению белка с его последующими обогащением и очисткой.
[00111]





ii) MeJA оказывает незначительное влияние на взаимодействие N. benthamiana-A. tumefaciens
[00112] После агроинфильтрации наблюдали почти полное исчезновение воздействия MeJA на повышение уровня экспрессии защитных белков, что указывает на ограниченное влияние обработки жасмонатом как на способность растения вырабатывать основанный на белках PR защитный ответ на бактериальную инфекцию, так и на способность бактерии к трансфекции клеток растений и сохраняться в ткани листьев. Для дополнительного изучения взаимодействия между растением и бактериями использовали иммуноблоты для белков PR-2 в качестве эталона для индукции белка PR в листьях (Goulet et al., 2010) и число мРНК-транскриптов двух агробактериальных генов вирулентности, регулируемых салицилатом, в качестве маркеров для процесса трансфекции (Yuan et al., 2007) (фигура 2). В некоторых исследованиях сообщалось о сильных антагонистических эффектах, оказываемых салициловой кислотой или функциональными гомологами на жасмонатный сигнальный путь, и о дивергентных регуляторных моделях для индуцируемых салицилатом белков PR и индуцируемых жасмонатом защитных белков при обработке салицилатом или MeJA (Thaler et al., 2012).
[00113] В соответствии с окрашенными Кумасси синим белковыми профилями (фигура 1b), распыление MeJA при концентрации 0,5 или 1 мМ не оказывало значительного влияния на экспрессию конститутивно экспрессированного индуцируемого патогеном белка PR-2 с молекулярной массой 33-кДа в неинфильтрированных листьях (ANOVA; Р>0,05; фигура 2а).
[00114] Известно, что салициловая кислота ослабляет агроинфекцию в листьях (Veena et al., 2003; Yuan et al., 2007; Anand et al., 2008) понижая регуляцию vir-регулона бактерии, влияющего на экспрессию генов вирулентности и интеграцию Т-ДНК в клетки-хозяева (Yuan et al., 2007). Растения, дефектные по салициловой кислоте, как было показано, более восприимчивы к возбудителю, в то время как растения, продуцирующие большие количества данного метаболита, показали повышенную устойчивость к инфекции (Yuan et al., 2007). Были проведены бактериальные подсчеты и анализы RT PCR в режиме реального времени, чтобы сравнить число клеток Agrobacterium и пулы мРНК-транскриптов вирулентных белков в инфильтрированных листьях, с обработкой MeJA или без обработки MeJA, с тем чтобы найти возможный салицилат-подавляющий эффект производного жасмоната, облегчающий рост Agrobacterium и экспрессию генов вирулентности (фигура 2b, с).
[00115] Аналогичное количество бактерий было получено из апопласта контрольных и MeJA-обработанных листьев, как определено из подсчитанного количества бактерий, составляющего от 10 до 100 млн колониеобразующих единиц (КОЕ) в 1 мл экстракта из апопласта до двух дней после инфильтрации, и до менее чем миллион КОЕ через четыре или шесть дней (фигура 2b). Последовательности ДНК, кодирующие VirB1 и VirE1, два белка вирулентности, участвующие в транслокации Т-ДНК в реципиентные клетки-хозяева и в последующей интеграции в ядро, соответственно (Lacroix et al., 2006), были использованы в качестве бактериальных маркеров, чувствительных к салицилату, для анализов RT PCR. Экспрессия VirB1 отрицательно изменялась в MeJA-обработанных листьях, и никакого положительного воздействия на транскрипцию не наблюдалось для обоих генов через семь дней после обработки с MeJA, несмотря на естественный антагонистический эффект жасмонатов, оказываемый на салицилатный сигнальный путь (фигура 2с).
[00116] Полученные данные подтверждают, в целом, появление сильного защитного ответа на бактериальную инфекцию в MeJA-обработанных и контрольных листьях при агроинфильтрации и отсутствие положительного воздействия предварительной обработки с MeJA как на данный ответ, так и на способность бактерии к трансфекции генов.
iii) MeJA оказывает незначительное влияние на активности протеаз в трансфицированных листьях
[00117] Проводили ферментативные анализы с применением синтетических пептидных субстратов с тем, чтобы исследовать влияние обработки с MeJA на протеазную активность в неочищенных экстрактах листьев (фигура 3). Эндогенные протеазы оказывают сильное влияние на выход рекомбинантного белка в растительных системах с учетом их непосредственной роли в белковом обмене либо in planta во время экспрессии, либо ex planta после разрушения ткани с целью извлечения белка (Benchabane et al., 2008). Протеазные профили в N. benthamiana находятся под влиянием различных факторов развития или окружающей среды, включая возраст листьев, агробактериальную инфекцию и экспрессию рекомбинантного белка (Robert et al., 2013). Учитывая сложные взаимоотношения между защитными сигнальными путями (Robert-Seilaniantz et al., 2011), важность секретируемых протеаз при патогенной инфекции (


[00118] Активности протеаз, измеренные в неочищенных экстрактах, представляют результирующие значения, отражающие как относительное количество молекул протеаз и протеазных ингибиторов в экстракционной среде после разрушения ткани, так и ингибиторную специфичность высвобожденных ингибиторов по отношению к эндогенным протеазам (Benchabane et al., 2009). Катепсин-L-подобную Cys-протеазную, трипсин-подобную Ser-протеазную и катепсин-D/E-подобную Asp-протеазную активности анализировали в неочищенных экстрактах контрольных и MeJA-обработанных листьях, собранных через семь дней после обработки с MeJA, чтобы документировать основной долгосрочный эффект жасмонатного сигнального пути, оказываемый на протеазные профили в листьях. MeJA не оказывает никакого влияния на катепсин-L-подобную активность при трех испытанных дозах (ANOVA; Р>0,05) (фигура 3а). Трипсин-подобные ферменты проявляли минимальную активность или не проявляли никакого увеличения активности при дозах в 0,5 и 1 мМ (Р<0,001) (фигура 3b), несмотря на сопутствующую положительную регуляцию Ser-протеазных ингибиторов в листьях (см. таблицу 2). Наблюдалось дозозависимое снижение катепсин-D/E-подобной активности через семь дней после обработки с MeJA в неинфильтрированных растениях (Р<0,001), что также наблюдалось в агроинфильтрированных листьях (фигура 3с). Катепсин-L-подобная (Р<0,05) и трипсин-подобная (Р<0,001) активности увеличивались в инфильтрированных листьях через шесть дней после заражения, независимо от предварительной обработки с MeJA (фигура 3a, b).
[00119] Полученные данные указывают на возможную роль Cys- и Ser-протеаз при бактериальной инфекции и появление определенных паттернов экспрессии для данных ферментов в агроинфильтрированных листьях, независимо от MeJA-опосредованных стимуляций протеазных ингибиторов. Полученные данные также указывают на перебалансировку протеома в MeJA-обработанных листьях через шесть дней после инфильтрации, с существенно обедненным пулом субъединиц RuBisCO; и сильно возросшими количествами индуцируемых патогенами белков PR.
iv) Обработка с MeJA увеличивает накопление транзиентно экспрессируемого рекомбинантного белка
[00120] Агроинфильтрационные анализы проводились с целью определения влияния обработки с MeJA на экспрессию и стационарные уровни клинически применимого рекомбинантного белка, транзиентно экспрессируемого в ткани листьев (фигура 4). Моноклональное антитело С5-1 (антииммуноглобулин) крови человека (Khoudi et al., 1999) было выбрано в качестве модели, учитывая значительное количество имеющейся информации по экспрессии, созреванию и протеолитическому процессингу данного белка в растительных системах (Khoudi et al., 1999; Bardor et al., 2003; Sainsbury et al., 2008;

[00121] Количественный твердофазный иммуноферментный анализ (ИФА; enzyme-linked immunosorbent assay (ELISA)) проводили, чтобы подтвердить очевидный положительный эффект MeJA, оказываемый на накопление антител, и определить возможное соотношение доза-кривая для жасмонат-опосредованного ответа (фигура 4b). Значительно более высокие количества антитела были измерены в MeJA-обработанных листьях, которые достигли стационарных уровней, превышающих от около 1,5 до около 2,5 раз уровни, измеренные в контрольных растениях (ANOVA; Р<0,05). Положительно регулирующее действие MeJA соответствует квадратичной кривой с максимальным значением выхода, равного ~425 мкг/г ткани листьев, измеренного при 1 мМ MeJA, по сравнению с ~325 мкг/г ткани листьев при 2 мМ MeJA или менее 200 мкг/г в контрольных листьях (фигура 4b). Действие MeJA было также подтверждено данными по белку, в соответствии с которыми чистый выход составил 70 нг антитела/мкг растворимых белков (или ~7% TSP) в листьях, обработанных 1 мМ MeJA, что превышает приблизительно в два раза выход, полученный с контрольными листьями (Р<0,05) (фигура 4b). Как вытекает из данных RT PCR в режиме реального времени, полученных для растений, которые опрыскивали 1 мМ MeJA, более высокие выходы С5-1 в MeJA-обработанных листьях были связаны с более высоким числом транскриптов мРНК как для легких, так и для тяжелых цепей, превышая около двух раз число, измеренное в контрольных экстрактах листьев (фигура 4b).
[00122] Увеличение выхода не наблюдали при распылении MeJA через 24 ч после инфильтрации (фигура 4d), или при обработке листьев за 24 ч до инфильтрации с арахидоновой кислотой, функциональным аналогом салициловой кислоты (Girard et al., 2007) (фигура 4d).
[00123] Кроме того, наблюдали более чем двукратное снижение выхода С5-1 в листьях N. benthamiana, которые опрыскивали 1 мМ MeJA за 24 ч до инфильтрации, когда рекомбинантное антитело экспрессировалось под контролем промотора пластоцианина люцерны (патент США 7,125,978, который включен в данное изобретение посредством ссылки).
[00124] Индукция белка PR-2 с молекулярной массой 33 кДа в листьях, трансфицированных пустым вектором pCAMBIA2300 (см. фигуру 2а), была сходной с таковой в листьях, трансфицированных кодирующим антитело вектором (фигура 5), давая основание предполагать наличие ограниченного, если не равного нулю, влияния экспрессии антитела С5-1 на ответ растения-хозяина на агроинфильтрацию. Наблюдения заявителей показывают, в целом, практическую применимость обработки с MeJA перед инфильтрацией для повышения экспрессии рекомбинантного белка в листьях N. benthamiana, через еще не понятый эффект жасмонатного сигнального пути, способствующий транскрипции.
[00125] Все цитаты включены в данное изобретение посредством ссылки.
[00126] Настоящее изобретение было описано в связи с одним или более вариантами осуществления. Тем не менее, специалистам в данной области техники будет очевидно, что ряд вариаций и модификаций могут быть сделаны без отступления от сущности и объема настоящего изобретения, как определено в формуле изобретения. Объем формулы изобретения не должен быть ограничен предпочтительными вариантами осуществления, изложенными в примерах, но должен допускать широкую интерпретацию в соответствии с описанием в целом.
[00127] Ссылки
[00128] Anand, A., Uppalapati, S.R., Ryu, С.М., Allen, S.N., Kang, L., Tang, Y.H. and Mysore, K.S. (2008) Salicylic acid and systemic acquired resistance play a role in attenuating crown gall disease caused by Agrobacterium tumefaciens. Plant Physiol. 146, 703-715.
[00129] Bilgin, D.D., Zavala, J.A., Zhu, J., Clough, S.J., Ort, D.R. and DeLucia, E.H. (2010) Biotic stress globally downregulates photosynthesis genes. Plant Cell Environ. 33, 1597-1613.
[00130] Chen, Y., Pang, Q., Dai, S., Wang, Y., Chen, S. and Yan, X. (2011) Proteomic identification of differentially expressed proteins in Arabidopsis in response to methyl jasmonate. J. Plant Physiol. 168, 995-1008.
[00131] Craig, R., Cortens, J.P. and Beavis, R.C. (2004) Open source system for analyzing, validating, and storing protein identification data. J. Proteome Res. 3, 1234-1242.
[00132] D'Aoust, M.-A., Lavoie, P.-O., Belles-Isles, J., Bechtold, N., Martel, M. and

[00133] Derksen, H., Rampitsch, C. and Daayf, F. (2013) Signaling cross-talk in plant disease resistance. Plant Sci. 207, 79-87.
[00134] Duceppe, M.-O., Cloutier, C. and Michaud, D. (2012) Wounding, insect chewing and phloem sap feeding differentially alter the leaf proteome of potato, Solanum tuberosum L. Proteome Sci. 10, 73.
[00135] Feys, В., Benedetti, C.E., Penfold, C.N., and Turner, J.G. (1994). Arabidopsis mutants selected for resistance to the phytotoxin coronatine are male sterile, insensitive to methyl jasmonate, and resistant to a bacterial pathogen. Plant Cell 6: 751-759.
[00136] Figueiredo, A., Monteiro, F. and Sabastiana, M. (2014) Subtilisin-like proteases in plant-pathogen recognition and immune priming: a perspective. Front. Plant Sci. 5, 739.
[00137] Gaeda, D.,
[00138] Giri, A.P., Wunsche, H., Mitra, S., Zavala, J.A., Muck, A., Svatos, A. and Baldwin, I.T. (2006) Molecular interactions between the specialist herbivore Manduca sexta (Lepidoptera, Sphingidae) and its natural host Nicotiana attenuata. VII. Changes in the plant's proteome. Plant Physiol. 142,1621-1641.
[00139] Gomord, V. and Faye, L. (2004) Posttranslational modification of therapeutic proteins in plants. Curr. Opin. Plant Biol. 7, 171-181.
[00140] Goossens, A., Van Montagu, M. and Angenon, G. (1999) Co-introduction of an antisense gene for an endogenous seed storage protein can increase expression of a transgene in Arabidopsis thaliana seeds. FEBS Lett. 456, 160-164.
[00141] Goulet, C, Khalf, M., Sainsbury, F., D'Aoust, M.-A. and Michaud, D. (2012) A protease activity-depleted environment for heterologous proteins migrating towards the leaf cell apoplast. Plant Biotechnol. J. 10, 83-94.
[00142] Goulet, C, Goulet, C, Goulet, M.-C. and Michaud, D. (2010) 2-DE proteome maps for the leaf apoplast of Nicotiana benthamiana. Proteomics 10, 2536-2544.
[00143] Goulet, M.-C, Dallaire, C, Vaillancourt, L.-P., Khalf, M., Badri, A.M., Preradov, A., Duceppe, M.-O., Goulet, C., Cloutier, C. and Michaud, D. (2008) Tailoring the specificity of a plant cystatin toward herbivorous insect digestive cysteine proteases by single mutations at positively selected amino acid sites. Plant Physiol. 146, 1010-1019.
[00144] Hermsmeier, D., Schittko, U. and Baldwin, I.T. (2001) Molecular interactions between the specialist herbivore Manduca sexta (Lepidoptera, Sphingidae) and its natural host Nicotiana attenuata. I. Large-scale changes in the accumulation of growth- and defense-related plant mRNAs. Plant Physiol. 125, 683-700.
[00145]

[00146]

[00147] Jung, C, Lyou, S.H., Yeu, S., Kim, M.A., Rhee, S., Kim, M., Lee, J.S., Choi, Y.D. and Cheong, J.J. (2007) Microarray-based screening of jasmonate-responsive genes in Arabidopsis thaliana. Plant Cell Rep. 26, 1053-1063.
[00148] Jung, S.-K., Lindenmuth, B.E., McDonald, K.A., Hwang M.S., Nguyen Bui, M.Q., Falk, B.W., Uratsu, S.L., Phu, M.L. and Dandekar, A.M. (2014) Agrobacterium tumefaciens mediated transient expression of plant cell wall-degrading enzymes in detached sunflower leaves. Biotechnol. Progr. 30, 905-915.
[00149] Khoudi, H., Laberge, S., Ferallo, J.M., Bazin, R., Darveau, A., Castonguay, Y., Allard, G., Lemieux, R. and

[00150] Kim, Y.-M., Lee, J.-Y., Lee, Т., Lee, Y.-H., Kim, S.-H., Kang, S.-H., Yoon, U.-H., Ha, S.-H. and Lim, S.-H. (2012) The suppression of the glutelin storage protein gene in transgenic rice seeds results in a higher yield of recombinant protein. Plant Biotechnol. Rep. 6, 347-353.
[00151] Lacroix, В., Li, J., Tzfira, T. and Citovsky, V. (2006) Will you let me use your nucleus? How Agrobacterium gets its T-DNA expressed in the host plant cell. Can. J. Physiol. Pharmacol. 84, 333-345.
[00152] Laemmli, U.K. (1970) Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227, 680-685.
[00153] Leuzinger, K., Dent, M., Hurtado, J., Stahnke, J., Lai, H., Zhou, X. and Chen, Q. (2013) Efficient agroinfiltration of plants for high-level transient expression of recombinant proteins. J. Vis. Exp. 77, e50521.
[00154] Lorenzo, O., Chico, J.M., Sanchez-Serrano, J.J., and Solano, R. (2004). JASMONATE-INSENSITIVE1 encodes a MYC transcription factor essential to discriminate between different jasmonate-regulated defense responses in Arabidopsis. Plant Cell 16: 1938-1950.
[00155] Mahajan, N.S., Mishra, M., Tamhane, V.A., Gupta, V.S. and Giri, A.P. (2014) Stress inducible proteomic changes in Capsicum annuum leaves. Plant Physiol. Biochem. 74, 212-217.
[00156] Merlin, M., Gecchele, E., Capaldi, S., Pezzotti, M. and Avesani, L. (2014) Comparative evaluation of recombinant protein production in different biofactories: The green perspective. Biomed. Res. Int. 2014, ID 136419.
[00157] Noir, S.,

[00158] Okada, K., Abe, H. and Arimura, G. (2015) Jasmonates induce both defense responses and communication in monocotyledonous and dicotyledonous plants. Plant Cell Physiol. 56, 16-27.
[00159] Peckham, G.D., Bugos, R.C. and Su, W.W. (2006) Purification of GFP fusion proteins from transgenic plant cell cultures. Prot. Expres. Purif. 49, 183-189.
[00160] Potenza, C, Aleman, L. and Sengupta-Gopalan, C. (2004) Targeting transgene expression in research, agricultural, and environmental applications: Promoters used in plant transformation. In Vitro Cell Dev. Plant 40, 1-22.
[00161] Ramirez, V., Lopez, A., Mauch-Mani, В., Gil, M.J. and Vera, P. (2013) An extracellular subtilase switch for immune priming in Arabidopsis. PLoS Pathog. 9, e1003445.
[00162] Robert-Seilaniantz, A., Grant, M. and Jones, J.D. (2011) Hormone crosstalk in plant disease and defence: more than just jasmonate-salicylate antagonism. Annu. Rev. Phytopathol. 49, 317-343.
[00163] Sack, M., Hofbauer, A., Fischer, R. and Stoger, E. (2015) The increasing value of plant-made proteins. Curr. Opin. Biotechnol. 32, 163-170.
[00164] Sainsbury, F., Lavoie, P.O., D'Aoust, M.-A., Vezina, L.-P. and Lomonossoff, G.P. (2008) Expression of multiple proteins using full-length and deleted versions of cowpea mosaic virus RNA-2. Plant Biotechnol. J. 6, 82-92.
[00165] Sainsbury, F., Varennes-Jutras, P., Goulet, M.-C, D'Aoust, M.-A. and Michaud, D. (2013) Tomato cystatin S1CYS8 as a stabilizing fusion partner for human serpin expression in plants. Plant Biotechnol. J. 11, 1058-1068.
[00166] Schmidt, M.A. and Herman, E.M. (2008) Proteome rebalancing in soybean seeds can be exploited to enhance foreign protein accumulation. Plant Biotechnol. J. 6, 832-842.
[00167] Shigemitsu, Т., Ozaki, S., Saito, Y., Kuroda, M, Morita, S., Satoh, S. and Masumura, T. (2012) Production of human growth hormone in transgenic rice seeds: co-introduction of RNA interference cassette for suppressing the gene expression of endogenous storage proteins. Plant Cell Rep. 31, 539-549.
[00168] Stanton, M., Ull-ann-Zeunert, L., Wielsch, N., Bartram, S., Svatos, A., Baldwin, I.T. and Groten, K. (2013) Silencing ribulose-1,5-bisphosphate carboxylase/oxygenase expression does not disrupt nitrogen allocation to defense after simulated herbivory in Nicotiana attenuata. Plant Signal. Behav. 8, e27570.
[00169] Thaler, J.S., Humphrey, P.T. and Whiteman, N.K. (2012) Evolution of jasmonate and salicylate signal crosstalk. Trends Plant Sci. 17, 260-270.
[00170] Ullmann-Zeunert, L., Stanton, M.A., Wielsch, N., Bartram, S., Hummert, C, Svatos, A., Baldwin, I.T. and Groten, K. (2013) Quantification of growth-defense trade-offs in a common currency: nitrogen required for phenolamide biosynthesis is not derived from ribulose-1,5-bisphosphate carboxylase/oxygenase turnover. Plant J. 75, 417-429.
[00171]

[00172] Voinnet, O., Rivas, S., Mestre, P. and Baulcombe, D. (2003) An enhanced transient expression system in plants based on suppression of gene silencing by the pi9 protein of tomato bushy stunt virus. Plant J. 33, 949-956.
[00173] Wei, Z., Hu, W., Lin, Q., Cheng, X., Tong, M., Zhu, L., Chen, R. and He, G. (2009) Understanding rice plant resistance to the Brown Planthopper (Nilaparvata lugens): a proteomic approach. Proteomics 9, 2798-2808.
[00174] Yuan, Z.-C, Edlind, M.P., Liu, P., Saenkham, P., Banta, L.M., Wise, A.A., Roznone, E., Binns, A.N., Kerr, K. and Nester, E.W. (2007) The plant signal salicylic acid shuts down expression of the vir regulon and activates quormone-quenching genes in Agrobacterium. Proc. Natl. Acad. Sci. 104, 11790-11795.
[00175] Zubo, Y.O., Yamburenko, M.V., Kusnetsov, V.V. and Borner, T. (2011) Methyl jasmonate, gibberellic acid, and auxin affect transcription and transcript accumulation of chloroplast genes in barley. J. Plant Physiol. 168, 1335-1344.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Медикаго Инк.
<120> Активатор сигнального пути жасмоновой кислоты
<130> V88969WO
<150> US 62/188,182
<151> 2015-07-02
<160> 116
<170> PatentIn version 3.5
<210> 1
<211> 29
<212> PRT
<213> Artificial sequence
<220>
<223> consensus amino acid sequence
<220>
<221> misc_feature
<222> (3)..(3)
<223> Xaa can be any naturally occurring amino acid
<220>
<221> misc_feature
<222> (15)..(15)
<223> Xaa can be any naturally occurring amino acid
<220>
<221> misc_feature
<222> (17)..(18)
<223> Xaa can be any naturally occurring amino acid
<220>
<221> misc_feature
<222> (23)..(23)
<223> Xaa can be any naturally occurring amino acid
<220>
<221> misc_feature
<222> (25)..(25)
<223> Xaa can be any naturally occurring amino acid
<400> 1
Ile Leu Xaa Ile Tyr Tyr Ser Thr Val Ala Ile Ser Ser Leu Xaa Leu
1 5 10 15
Xaa Xaa Met Leu Ala Gly Xaa Ser Xaa Trp Met Cys Ser
20 25
<210> 2
<211> 69
<212> DNA
<213> Artificial Sequence
<220>
<223> nucleotide sequence of PatA SP re GenBank Accession A08215
<400> 2
atggcaacta ctaaaacttt tttaatttta ttttttatga tattagcaac tactagttca 60
acatgtgct 69
<210> 3
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> amino acid sequence of patatin A signal peptide
<400> 3
Met Ala Thr Thr Lys Thr Phe Leu Ile Leu Phe Phe Met Ile Leu Ala
1 5 10 15
Thr Thr Ser Ser Thr Cys Ala
20
<210> 4
<211> 6
<212> DNA
<213> Artificial Sequence
<220>
<223> polyadenylation signal
<400> 4
aataaa 6
<210> 5
<211> 20
<212> DNA
<213> Artificial sequence
<220>
<223> oligonucleotide primer C5-1 antibody heavy chain forward
<400> 5
ccaaaacgac acccccatct 20
<210> 6
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> oligonucleotide primer C5-1 antibody heavy chain reverse
<400> 6
aggtcactgt cactggctca 20
<210> 7
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Oligonucleotide primer C5-1 antibody light chain forward
<400> 7
atcccctcca ggttcagtgg 20
<210> 8
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Oligonucleotide primer C5-1 antibody light chain reverse
<400> 8
cgtgagaggc cagctgttac 20
<210> 9
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Oligonucleotide primer A. tumefaciens VirB1 forward
<400> 9
acgaggcgct aaaatccgaa 20
<210> 10
<211> 20
<212> DNA
<213> Artificial sequence
<220>
<223> Oligonucleotide primer A. tumefaciens VirB1 reverse
<400> 10
gatttgccgt tgtcctggtg 20
<210> 11
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Oligonucleotide primer A.tumefaciens VirE1 forward
<400> 11
gccgatagag agaccggagt 20
<210> 12
<211> 20
<212> DNA
<213> Artificial sequence
<220>
<223> Oligonucleotide primer A.tumefaciens VirE1 reverse
<400> 12
agattgtctt ctgggagcgg 20
<210> 13
<211> 8
<212> PRT
<213> N. tabacum
<400> 13
Gly Pro Ile Gln Leu Thr Asn Arg
1 5
<210> 14
<211> 13
<212> PRT
<213> N. tabacum
<400> 14
Gly Pro Ile Gln Leu Thr Asn Arg Asn Asn Tyr Glu Lys
1 5 10
<210> 15
<211> 7
<212> PRT
<213> N. tabacum
<400> 15
Asn Asp Ala Val Glu Asp Arg
1 5
<210> 16
<211> 12
<212> PRT
<213> N. tabacum
<400> 16
Asn Asp Ala Val Glu Asp Arg Ile Gly Tyr Tyr Arg
1 5 10
<210> 17
<211> 17
<212> PRT
<213> N. tabacum
<400> 17
Gln Gly Ile Gly Ser Ile Val Thr Ser Asp Leu Phe Asn Glu Met Leu
1 5 10 15
Lys
<210> 18
<211> 20
<212> PRT
<213> N. tabacum
<400> 18
Arg Tyr Cys Gly Met Leu Asn Val Ala Pro Gly Glu Asn Leu Asp Cys
1 5 10 15
Tyr Asn Gln Arg
20
<210> 19
<211> 19
<212> PRT
<213> N. Tabacum
<400> 19
Tyr Cys Gly Met Leu Asn Val Ala Pro Gly Glu Asn Leu Asp Cys Tyr
1 5 10 15
Asn Gln Arg
<210> 20
<211> 12
<212> PRT
<213> N. tabacum
<400> 20
Tyr Tyr Gly Arg Gly Pro Ile Gln Leu Thr Asn Arg
1 5 10
<210> 21
<211> 17
<212> PRT
<213> N. tabacum
<400> 21
Tyr Tyr Gly Arg Gly Pro Ile Gln Leu Thr Asn Arg Asn Asn Tyr Glu
1 5 10 15
Lys
<210> 22
<211> 21
<212> PRT
<213> N. benthamiana
<400> 22
Ala Leu Met Asp Leu Pro Glu Asn Gly Ser Glu Ser Thr Asp Phe Ile
1 5 10 15
Glu Asn Trp Val Lys
20
<210> 23
<211> 14
<212> PRT
<213> N. benthamiana
<400> 23
Glu Ile Tyr Asp Lys Asn Pro Glu Leu Ile Asp Glu Leu Lys
1 5 10
<210> 24
<211> 15
<212> PRT
<213> N. benthamiana
<400> 24
Glu Ile Tyr Asp Lys Asn Pro Glu Leu Ile Asp Glu Leu Lys Lys
1 5 10 15
<210> 25
<211> 10
<212> PRT
<213> N. benthamiana
<400> 25
Phe Leu Val Phe Ala Cys Ser Asp Ser Arg
1 5 10
<210> 26
<211> 21
<212> PRT
<213> N. benthamiana
<400> 26
Ile Asp Glu Ile Thr Ala Glu Leu Gln Thr Ser Gly Phe Gln Ser Val
1 5 10 15
His Pro Val Asp Arg
20
<210> 27
<211> 23
<212> PRT
<213> N. benthamiana
<400> 27
Ile Asp Glu Ile Thr Ala Glu Leu Gln Thr Ser Gly Phe Gln Ser Val
1 5 10 15
His Pro Val Asp Arg Ile Lys
20
<210> 28
<211> 10
<212> PRT
<213> N. benthamiana
<400> 28
Ile Lys Thr Gly Phe Asp Tyr Phe Lys Lys
1 5 10
<210> 29
<211> 11
<212> PRT
<213> N. benthamiana
<400> 29
Asn Ile Ala Asn Met Val Pro Pro Tyr Asp Lys
1 5 10
<210> 30
<211> 13
<212> PRT
<213> N. benthamiana
<400> 30
Asn Ile Ala Asn Met Val Pro Pro Tyr Asp Lys Thr Lys
1 5 10
<210> 31
<211> 7
<212> PRT
<213> N. benthamiana
<400> 31
Thr Gly Phe Asp Tyr Phe Lys
1 5
<210> 32
<211> 8
<212> PRT
<213> N. benthamiana
<400> 32
Thr Gly Phe Asp Tyr Phe Lys Lys
1 5
<210> 33
<211> 16
<212> PRT
<213> N. benthamiana
<400> 33
Val Glu Asn Ile Leu Val Ile Gly His Ser Ala Cys Gly Gly Ile Lys
1 5 10 15
<210> 34
<211> 18
<212> PRT
<213> N. benthamiana
<400> 34
Val Ser Pro Ser His Val Leu Asn Phe Gln Leu Gly Glu Ala Phe Met
1 5 10 15
Val Arg
<210> 35
<211> 9
<212> PRT
<213> N. alata
<400> 35
Val Gly Asp Pro Asp Leu Thr Ala Arg
1 5
<210> 36
<211> 7
<212> PRT
<213> N. alata
<400> 36
Phe Val Thr Thr His Ser Arg
1 5
<210> 37
<211> 9
<212> PRT
<213> N. alata
<400> 37
Leu Cys Val Asn Gln Thr Val Trp Lys
1 5
<210> 38
<211> 12
<212> PRT
<213> N. alata
<400> 38
Val Gly Asp Pro Asp Leu Thr Ala Arg Gly Thr Arg
1 5 10
<210> 39
<211> 10
<212> PRT
<213> N. tabacum
<400> 39
Ala Ala Gly Ile Thr Ser Ile Gly Val Arg
1 5 10
<210> 40
<211> 10
<212> PRT
<213> N. tabacum
<400> 40
Glu Gln Glu Ala Ile Asn Phe Leu Glu Lys
1 5 10
<210> 41
<211> 11
<212> PRT
<213> N. tabacum
<400> 41
Gly Lys Asp Ser Val Cys Val Val Thr Gln Lys
1 5 10
<210> 42
<211> 10
<212> PRT
<213> N. tabacum
<400> 42
His Ile Thr Ile Phe Ser Pro Glu Gly Arg
1 5 10
<210> 43
<211> 9
<212> PRT
<213> N. Tabacum
<400> 43
Leu Phe Gln Val Glu Tyr Ala Phe Lys
1 5
<210> 44
<211> 15
<212> PRT
<213> N. tabacum
<400> 44
Leu Leu Asp Gln Thr Ser Val Ser His Leu Phe Pro Ile Thr Lys
1 5 10 15
<210> 45
<211> 7
<212> PRT
<213> N. tabacum
<400> 45
Asn Glu Ala Ala Glu Phe Arg
1 5
<210> 46
<211> 7
<212> PRT
<213> N. tabacum
<400> 46
Thr Leu Val Gln Gln Ala Arg
1 5
<210> 47
<211> 18
<212> PRT
<213> N. tabacum
<400> 47
Val Leu Thr Thr Glu Glu Ile Asp Glu His Leu Thr Ala Ile Ser Glu
1 5 10 15
Arg Asp
<210> 48
<211> 14
<212> PRT
<213> N. tabacum
<400> 48
Tyr Leu Gly Leu Leu Ala Thr Gly Met Thr Ala Asp Ala Arg
1 5 10
<210> 49
<211> 21
<212> PRT
<213> N. plumbaginifolia
<400> 49
Ala Ala Ala Ala Thr Gln Phe Gly Ser Gly Trp Ala Trp Leu Ala Tyr
1 5 10 15
Lys Pro Glu Glu Lys
20
<210> 50
<211> 22
<212> PRT
<213> N. plumbaginifolia
<400> 50
Ala Ala Ala Ala Thr Gln Phe Gly Ser Gly Trp Ala Trp Leu Ala Tyr
1 5 10 15
Lys Pro Glu Glu Lys Lys
20
<210> 51
<211> 8
<212> PRT
<213> N. plumbaginifolia
<400> 51
Ala Tyr Val Asp Asn Leu Asn Lys
1 5
<210> 52
<211> 18
<212> PRT
<213> N. plumbaginifolia
<400> 52
Ala Tyr Val Asp Asn Leu Asn Lys Gln Ile Asp Gly Thr Glu Leu Asp
1 5 10 15
Gly Lys
<210> 53
<211> 10
<212> PRT
<213> N. plumbaginifolia
<400> 53
Asp Phe Gly Ser Tyr Asp Ala Phe Val Lys
1 5 10
<210> 54
<211> 13
<212> PRT
<213> N. plumbaginifolia
<400> 54
Asp Phe Gly Ser Tyr Asp Ala Phe Val Lys Glu Phe Lys
1 5 10
<210> 55
<211> 21
<212> PRT
<213> N. plumbaginifolia
<400> 55
Lys Phe Glu Leu Gln Pro Pro Pro Tyr Pro Met Asp Ala Leu Glu Pro
1 5 10 15
His Met Ser Ser Arg
20
<210> 56
<211> 10
<212> PRT
<213> N. plumbaginifolia
<400> 56
Leu Val Ser Trp Glu Ala Val Ser Ser Arg
1 5 10
<210> 57
<211> 10
<212> PRT
<213> N. plumbaginifolia
<400> 57
Gln Ile Asp Gly Thr Glu Leu Asp Gly Lys
1 5 10
<210> 58
<211> 22
<212> PRT
<213> N. plumbaginifolia
<400> 58
Gln Ile Asp Gly Thr Glu Leu Asp Gly Lys Thr Leu Glu Asp Ile Ile
1 5 10 15
Leu Val Thr Tyr Asn Lys
20
<210> 59
<211> 11
<212> PRT
<213> N. plumbaginifolia
<400> 59
Arg Pro Asp Tyr Ile Ser Ile Phe Met Glu Lys
1 5 10
<210> 60
<211> 12
<212> PRT
<213> N. plumbaginifolia
<400> 60
Thr Leu Glu Asp Ile Ile Leu Val Thr Tyr Asn Lys
1 5 10
<210> 61
<211> 11
<212> PRT
<213> S.lycopersicum
<400> 61
Gly Ala Asp Gly Ser Asp Tyr Ile Thr Leu Arg
1 5 10
<210> 62
<211> 15
<212> PRT
<213> S.lycopersicum
<400> 62
Lys Pro Leu Ser Val Ser Pro Gly Asn Thr Val Leu Tyr Ser Lys
1 5 10 15
<210> 63
<211> 12
<212> PRT
<213> S.lycopersicum
<400> 63
Thr Ala Gly Gly Leu Leu Leu Thr Glu Ala Ala Lys
1 5 10
<210> 64
<211> 9
<212> PRT
<213> S.lycopersicum
<400> 64
Thr Gly Ala Gln Val Ile Tyr Ser Lys
1 5
<210> 65
<211> 8
<212> PRT
<213> S.lycopersicum
<400> 65
Thr Lys Val Asp Ile Ser Val Lys
1 5
<210> 66
<211> 19
<212> PRT
<213> S.lycopersicum
<400> 66
Val Ala Glu Ala Glu Glu Lys Thr Ala Gly Gly Leu Leu Leu Thr Glu
1 5 10 15
Ala Ala Lys
<210> 67
<211> 11
<212> PRT
<213> S.lycopersicum
<400> 67
Val Leu Ile Lys Val Ala Glu Ala Glu Glu Lys
1 5 10
<210> 68
<211> 18
<212> PRT
<213> S.lycopersicum
<400> 68
Tyr Ala Gly Ser Glu Phe Lys Gly Ala Asp Gly Ser Asp Tyr Ile Thr
1 5 10 15
Leu Arg
<210> 69
<211> 12
<212> PRT
<213> S.lycopersicum
<400> 69
Tyr Ala Gly Thr Glu Val Glu Phe Asp Gly Ser Lys
1 5 10
<210> 70
<211> 10
<212> PRT
<213> S.lycopersicum
<400> 70
Tyr Thr Thr Leu Lys Pro Leu Gly Asp Arg
1 5 10
<210> 71
<211> 9
<212> PRT
<213> N. alata
<400> 71
Val Gly Asp Pro Asp Leu Thr Ala Arg
1 5
<210> 72
<211> 7
<212> PRT
<213> N. alata
<400> 72
Phe Val Thr Thr His Ser Arg
1 5
<210> 73
<211> 9
<212> PRT
<213> N. alata
<400> 73
Leu Cys Val Asn Gln Thr Val Trp Lys
1 5
<210> 74
<211> 12
<212> PRT
<213> N. alata
<400> 74
Val Gly Asp Pro Asp Leu Thr Ala Arg Gly Thr Arg
1 5 10
<210> 75
<211> 23
<212> PRT
<213> N. tabacum
<400> 75
Gly Leu Phe Ile Ile Asp Lys Glu Gly Val Ile Gln His Ser Thr Ile
1 5 10 15
Asn Asn Leu Gly Ile Gly Arg
20
<210> 76
<211> 9
<212> PRT
<213> N. tabacum
<400> 76
Gly Ser Lys Glu Tyr Phe Ala Ser Ile
1 5
<210> 77
<211> 18
<212> PRT
<213> N. tabacum
<400> 77
Lys Ser Gly Gly Leu Gly Asp Leu Asn Tyr Pro Leu Ile Ser Asp Val
1 5 10 15
Thr Lys
<210> 78
<211> 7
<212> PRT
<213> N. tabacum
<400> 78
Leu Ser Glu Tyr Ile Gly Lys
1 5
<210> 79
<211> 17
<212> PRT
<213> N. tabacum
<400> 79
Ser Gly Gly Leu Gly Asp Leu Asn Tyr Pro Leu Ile Ser Asp Val Thr
1 5 10 15
Lys
<210> 80
<211> 7
<212> PRT
<213> N. tabacum
<400> 80
Ser Val Asp Glu Thr Leu Arg
1 5
<210> 81
<211> 14
<212> PRT
<213> N. tabacum
<400> 81
Ser Tyr Asn Val Leu Ile Pro Asp Gln Gly Ile Ala Leu Arg
1 5 10
<210> 82
<211> 25
<212> PRT
<213> N. tabacum
<400> 82
Thr Leu Gln Ala Leu Gln Tyr Val Gln Asp Asn Pro Asp Glu Val Cys
1 5 10 15
Pro Ala Gly Trp Lys Pro Gly Glu Lys
20 25
<210> 83
<211> 25
<212> PRT
<213> N. tabacum
<400> 83
Cys Pro Asp Ala Tyr Ser Tyr Pro Gln Asp Asp Pro Thr Ser Leu Phe
1 5 10 15
Thr Cys Pro Ser Gly Thr Asn Tyr Arg
20 25
<210> 84
<211> 10
<212> PRT
<213> N. tabacum
<400> 84
Thr Asn Cys Asn Phe Asp Gly Ser Gly Arg
1 5 10
<210> 85
<211> 20
<212> PRT
<213> N. tabacum
<400> 85
Thr Asn Glu Tyr Cys Cys Thr Asn Gly Pro Gly Ser Cys Gly Pro Thr
1 5 10 15
Asp Leu Ser Arg
20
<210> 86
<211> 13
<212> PRT
<213> N. tabacum
<400> 86
Thr Gln Gly Gly Cys Asn Asn Pro Cys Thr Val Ile Lys
1 5 10
<210> 87
<211> 9
<212> PRT
<213> N. tabacum
<400> 87
Asp Gly Ala Ser Gly Gly Val Val Arg
1 5
<210> 88
<211> 15
<212> PRT
<213> N. tabacum
<400> 88
Ser Gly Ser Ala Ala Asp Ser Gln Ile Val Ser Asp Tyr Val Arg
1 5 10 15
<210> 89
<211> 10
<212> PRT
<213> N. tabacum
<400> 89
Thr Ser Thr Gly Met Tyr Val Ala Asn Arg
1 5 10
<210> 90
<211> 17
<212> PRT
<213> N. tabacum
<400> 90
Tyr Phe Leu His Gln His Thr Ile Gln Leu Gly Gln Pro Ala Thr Val
1 5 10 15
Lys
<210> 91
<211> 21
<212> PRT
<213> N. plumbaginifolia
<400> 91
Ala Ala Ala Ala Thr Gln Phe Gly Ser Gly Trp Ala Trp Leu Ala Tyr
1 5 10 15
Lys Pro Glu Glu Lys
20
<210> 92
<211> 8
<212> PRT
<213> N. plumbaginifolia
<400> 92
Ala Tyr Val Asp Asn Leu Asn Lys
1 5
<210> 93
<211> 18
<212> PRT
<213> N. plumbaginifolia
<400> 93
Ala Tyr Val Asp Asn Leu Asn Lys Gln Ile Asp Gly Thr Glu Leu Asp
1 5 10 15
Gly Lys
<210> 94
<211> 10
<212> PRT
<213> N. plumbaginifolia
<400> 94
Asp Phe Gly Ser Tyr Asp Ala Phe Val Lys
1 5 10
<210> 95
<211> 13
<212> PRT
<213> N. plumbaginifolia
<400> 95
Asp Phe Gly Ser Tyr Asp Ala Phe Val Lys Glu Phe Lys
1 5 10
<210> 96
<211> 21
<212> PRT
<213> N. plumbaginifolia
<400> 96
Lys Phe Glu Leu Gln Pro Pro Pro Tyr Pro Met Asp Ala Leu Glu Pro
1 5 10 15
His Met Ser Ser Arg
20
<210> 97
<211> 10
<212> PRT
<213> N. plumbaginifolia
<400> 97
Leu Val Ser Trp Glu Ala Val Ser Ser Arg
1 5 10
<210> 98
<211> 10
<212> PRT
<213> N. plumbaginifolia
<400> 98
Gln Ile Asp Gly Thr Glu Leu Asp Gly Lys
1 5 10
<210> 99
<211> 22
<212> PRT
<213> N. plumbaginifolia
<400> 99
Gln Ile Asp Gly Thr Glu Leu Asp Gly Lys Thr Leu Glu Asp Ile Ile
1 5 10 15
Leu Val Thr Tyr Asn Lys
20
<210> 100
<211> 11
<212> PRT
<213> N. plumbaginifolia
<400> 100
Arg Pro Asp Tyr Ile Ser Ile Phe Met Glu Lys
1 5 10
<210> 101
<211> 12
<212> PRT
<213> N. plumbaginifolia
<400> 101
Thr Leu Glu Asp Ile Ile Leu Val Thr Tyr Asn Lys
1 5 10
<210> 102
<211> 14
<212> PRT
<213> N. tabacum
<400> 102
Ala Cys Ile Ser Glu Lys Phe Thr Asp Gly His Cys Ser Lys
1 5 10
<210> 103
<211> 8
<212> PRT
<213> N. tabacum
<400> 103
Phe Thr Asp Gly His Cys Ser Lys
1 5
<210> 104
<211> 7
<212> PRT
<213> N. tabacum
<400> 104
Lys Ala Cys Ile Ser Glu Lys
1 5
<210> 105
<211> 15
<212> PRT
<213> N. tabacum
<400> 105
Lys Ala Cys Ile Ser Glu Lys Phe Thr Asp Gly His Cys Ser Lys
1 5 10 15
<210> 106
<211> 14
<212> PRT
<213> N. tabacum
<400> 106
Ala Cys Ile Ser Glu Lys Phe Thr Asp Gly His Cys Ser Lys
1 5 10
<210> 107
<211> 6
<212> PRT
<213> N. tabacum
<400> 107
Ala Cys Ile Ser Glu Lys
1 5
<210> 108
<211> 9
<212> PRT
<213> N. benthamiana
<400> 108
Gly Cys Thr Phe Glu Cys Asp Pro Arg
1 5
<210> 109
<211> 9
<212> PRT
<213> N. benthamiana
<400> 109
Ile Cys Thr Asn Cys Cys Ala Gly Lys
1 5
<210> 110
<211> 10
<212> PRT
<213> N. benthamiana
<400> 110
Leu Cys Thr Asn Cys Cys Ala Gly Thr Lys
1 5 10
<210> 111
<211> 12
<212> PRT
<213> N. benthamiana
<400> 111
Asn Arg Leu Cys Thr Asn Cys Cys Ala Gly Thr Lys
1 5 10
<210> 112
<211> 17
<212> PRT
<213> N. benthamiana
<400> 112
Tyr Phe Ser Asp Asp Gly Thr Phe Val Cys Glu Gly Glu Ser Asp Pro
1 5 10 15
Arg
<210> 113
<211> 20
<212> PRT
<213> N. benthamiana
<400> 113
Tyr Phe Ser Asp Asp Gly Thr Phe Val Cys Glu Gly Glu Ser Asp Pro
1 5 10 15
Arg Asn Pro Lys
20
<210> 114
<211> 24
<212> PRT
<213> N. benthamiana
<400> 114
Tyr Phe Ser Asp Asp Gly Thr Phe Val Cys Glu Gly Glu Ser Asp Pro
1 5 10 15
Arg Asn Pro Lys Pro Cys Pro Arg
20
<210> 115
<211> 9
<212> PRT
<213> N. benthamiana
<400> 115
Ile Ala Tyr Gly Ile Cys Pro Leu Ser
1 5
<210> 116
<211> 8
<212> PRT
<213> N. benthamiana
<400> 116
Ile Ala Tyr Gly Val Cys Pro Arg
1 5
<---
Реферат
Изобретение относится к области биохимии, в частности к способу обогащения представляющего интерес гетерологичного белка в растении или части растения. Способ включает предварительную обработку растения или части растения активатором жасмонатного сигнального пути, введение нуклеотидной последовательности в растение или часть растения и инкубирование растения или части растения в условиях, способных обеспечить экспрессию нуклеотидной последовательности, кодирующей представляющий интерес гетерологичный белок. Изобретение позволяет эффективно осуществлять обогащение представляющего интерес гетерологичного белка в растении или части растения. 6 з.п. ф-лы, 6 ил., 3 табл., 1 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ получения гетерологичного белка в прорастающих семенах двудольных растений

Комментарии