Способы лечения рака с использованием антагонистов, связывающихся с компонентами сигнального пути pd-1, и таксанов - RU2719487C2
Код документа: RU2719487C2
Чертежи







Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка заявляет приоритет по предварительной заявке на патент США №61/917264, поданной 17 декабря 2013 года.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам лечения раковых заболеваний и усиления иммунной функции у индивидуума с раком путем введения антагониста, связывающегося с компонентом сигнального пути PD-1, и таксана.
УРОВЕНЬ ТЕХНИКИ
Предоставление двух различных сигналов Т-клеткам представляет собой широко распространенную модель для лимфоцитарной активации покоящихся Т-лимфоцитов антигенпредставляющими клетками (АПК). Более того, данная модель предусматривает распознавание собственных белков от чужеродных и иммунную толерантность. Первичный сигнал, или антиген-специфический сигнал, преобразовывается через Т-клеточный рецептор (ТКР) после распознавания чужеродного антигенного пептида, представленного в окружении главного комплекса гистосовместимости (ГКГ). Вторичный сигнал, или ко-стимулирующий сигнал, доставляется к Т-клеткам посредством ко-стимуляторных молекул, экспрессирующихся на АПК, и индуцирует Т-клетки для активации клонального роста, секреции цитокинов и эффекторной функции. При отсутствии ко-стимуляции Т-клетки могут становиться невосприимчивыми к антигенной стимуляции, что в результате приводит к толерогенному ответу по отношению либо к чужеродным, либо эндогенным антигенам.
В двухсигнальной модели Т-клетки получают как положительные, так и отрицательные вторичные ко-стимулирующие сигналы. Регулирование таких положительных и отрицательных сигналов имеет решающее значение для максимального усиления защитных иммунных реакций хозяина, сохраняя при этом иммунную толерантность и предотвращая аутоиммунные реакции. Отрицательные вторичные сигналы, по-видимому, являются необходимыми для индукции Т-клеточной толерантности, в то время как положительные сигналы способствуют активации Т-клеток. В то время как простая двухсигнальная модель по-прежнему дает обоснованное объяснение для наивных лимфоцитов, иммунный ответ индивидуума представляет собой динамический процесс, и ко-стимулирующие сигналы также могут подаваться Т-клеткам, экспонирующим антиген.
Механизм ко-стимуляции представляет терапевтический интерес, поскольку манипулирование ко-стимуляторными сигналами предоставляет возможность либо усилить, либо подавить клеточный иммунный ответ. Т-клеточная дисфункция, или анергия, происходит одновременно с индуцированной и устойчивой экспрессией ингибирующего рецептора, полипептида программируемой гибели 1 (PD-1), который связывается с лигандами, включающими PD-L1 и PD-L2. PD-L1 гиперэкспрессируется во многих видах рака и зачастую ассоциируется с плохим прогнозом. Большинство Т-лимфоцитов, инфильтрированных в опухоли, экспрессируют преимущественно PD-1, в отличие от Т-лимфоцитов в нормальных тканях и Т-лимфоцитов периферической крови, указывая на то, что вышележащая регуляция PD-1 в опухоле-реактивных Т-клетках может способствовать ослаблению противоопухолевых иммунных реакций. Это может быть следствием использования PD-L1 сигнального пути, опосредованного PD-L1-экспрессирующими опухолевыми клетками, взаимодействующими с PD-1-экспрессирующими Т-клетками, что в результате приводит к ослаблению активации Т-клеток и уклонению от иммунного контроля. Таким образом, ингибирование взаимодействия PD-L1/PD-1 может усиливать разрушение опухолей, опосредованное CD8+ Т-клеток.
Оптимальное терапевтическое лечение может сочетать блокирование взаимодействия PD-1 рецептора/лиганда с агентом, который непосредственно ингибирует рост опухоли. В данном случае сохраняется потребность в оптимальной терапии для лечения, стабилизации, предотвращения и/или задерживания развития различных видов рака.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам лечения раковых заболеваний и усиления иммунной функции у индивидуума с раком путем введения антагониста, связывающегося с компонентом сигнального пути PD-1, и таксана.
В одном аспекте настоящее изобретение относится к способу лечения или задерживания прогрессирования рака у индивидуума, включающему введение индивидууму эффективного количества антагониста, связывающегося с компонентом человеческого сигнального пути PD-1, и таксана. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, выбран из группы, которая состоит из антагониста, связывающегося с PD-1, антагониста, связывающегося с PD-L1, и антагониста, связывающегося с PD-L2.
В некоторых вариантах реализации изобретения вышеупомянутого аспекта антагонист, связывающийся с компонентом сигнального пути PD-1, представляет собой антагонист, связывающийся с PD-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с его лигандными партнерами по связыванию. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с PD-L1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 как с PD-L1, так и с PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, представляет собой антитело. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, выбран из группы, состоящей из MDX-1106 (nivolumab), МК-3475 (lambrolizumab), СТ-011 (pidilizumab) и АМР-224.
В некоторых вариантах реализации изобретения вышеупомянутого аспекта антагонист, связывающийся с компонентом сигнального пути PD-1, представляет собой антагонист, связывающийся с PD-L1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, ингибирует связывание PD-L1 с PD-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, ингибирует связывание PD-L1 с В7-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, ингибирует связывание PD-L1 как с PD-1, так и с В7-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, представляет собой антитело. В некоторых вариантах реализации изобретения антитело выбрано из группы, состоящей из: YW243.55.S70, MPDL3280A, MDX-1105 и MEDI4736. В некоторых вариантах реализации изобретения антитело содержит тяжелую цепь, которая включает последовательность HVR-H1 из SEQ ID NO: 19, последовательность HVR-H2 из SEQ ID NO: 20 и последовательность HVR-H3 из SEQ ID NO: 21; и легкую цепь, которая включает последовательность HVR-L1 из SEQ ID NO: 22, последовательность HVR-L2 из SEQ ID NO: 23 и последовательность HVR-L3 из SEQ ID NO: 24. В некоторых вариантах реализации изобретения антитело содержит вариабельный участок тяжелой цепи, который включает аминокислотную последовательность SEQ ID NO: 26, и вариабельный участок легкой цепи, который включает аминокислотную последовательность SEQ ID NO: 4.
В некоторых вариантах реализации изобретения вышеупомянутого аспекта антагонист, связывающийся с компонентом сигнального пути PD-1, представляет собой антагонист, связывающийся с PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L2, представляет собой антитело. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L2, представляет собой иммуноадгезин.
В любом из предыдущих вариантов реализации изобретения вышеупомянутого аспекта рак может быть, без ограничения, раком молочной железы (в том числе тройным негативным раком молочной железы (ТНРМЖ)), раком мочевого пузыря (в том числе уротелиальным раком мочевого пузыря (УРМП), мышечно-инвазивным раком мочевого пузыря и БЦЖ-рефрактерным немышечно-инвазивным раком мочевого пузыря), колоректальным раком, раком прямой кишки, раком легких (в том числе немелкоклеточным раком легкого, который может быть плоскоклеточным или неплоскоклеточным), глиобластомой, неходжкинской лимфомой (НХЛ), почечно-клеточным раком (в том числе почечно-клеточной карциномой), раком предстательной железы, раком печени, раком поджелудочной железы, саркомой мягких тканей, саркомой Калоши, карциноидной карциномой, раком головы и шеи, раком желудка, раком пищевода, раком простаты, раком эндометрия, раком почки, раком яичников, мезотелиомой и гем злокачественностью (в том числе миелодиспластическим синдромом (МДС) и множественной миеломой). В конкретных вариантах реализации изобретения рак может быть раком легких (в том числе немелкоклеточным раком легкого, который может быть плоскоклеточным или неплоскоклеточным), раком мочевого пузыря (в том числе УРМП), раком молочной железы (в том числе ТНРМЖ), почечно-клеточной карциномой, меланомой, колоректальным раком и гем злокачественностью (в том числе миелодиспластическим синдромом (МДС) и множественной миеломой). В некоторых вариантах реализации изобретения рак легкого представляет собой немелкоклеточный рак легкого, который может быть плоскоклеточным или неплоскоклеточным. В некоторых вариантах реализации изобретения рак мочевого пузыря представляет собой УРМП. В некоторых вариантах реализации изобретения рак молочной железы представляет собой ТНРМЖ. В некоторых вариантах реализации изобретения гем злокачественность представляет собой МДС или множественную миелому.
В любом из предыдущих вариантов реализации изобретения вышеупомянутого аспекта у индивидуума рак или ему был поставлен диагноз рака. В некоторых вариантах реализации изобретения раковые клетки индивидуума экспрессируют PD-L1.
В любом из предыдущих вариантов реализации изобретения вышеупомянутого аспекта лечение может приводить в результате к ответу у индивидуума. В некоторых вариантах реализации изобретения ответ представляет собой полный ответ. В некоторых вариантах реализации изобретения ответ представляет собой устойчивый ответ после прекращения лечения. В некоторых вариантах реализации изобретения ответ представляет собой полный ответ, который является устойчивым ответом после прекращения лечения.
В любом из предыдущих вариантов реализации изобретения вышеупомянутого аспекта таксан вводят перед введением антагониста, связывающегося с компонентом сигнального пути PD-1, одновременно с антагонистом, связывающимся с компонентом сигнального пути PD-1, или после введения антагониста, связывающегося с компонентом сигнального пути PD-1. В некоторых вариантах реализации изобретения таксан представляет собой наб-паклитаксел (ABRAXANE®), паклитаксел или доцетаксел. В некоторых вариантах реализации изобретения таксан представляет собой наб-паклитаксел (ABRAXANE®). В некоторых вариантах реализации изобретения таксан представляет собой паклитаксел.
В другом аспекте настоящее изобретение относится к способу повышения иммунной функции у индивидуума с раком, данный способ включает введение эффективного количества антагониста, связывающегося с компонентом сигнального пути PD-1, и таксана. В некоторых вариантах реализации изобретения CD8+ Т-клетки индивидуума обладают повышенным примированием, активацией, пролиферацией и/или цитолитической активностью по сравнению с такими до применения антагониста, связывающегося с компонентом сигнального пути PD-1, и таксана. В некоторых вариантах реализации изобретения количество CD8+ Т-клеток повышено по сравнению с таким до введения комбинации. В некоторых вариантах реализации изобретения CD8+ Т-клетка представляет собой антиген-специфическую CD8+ Т-клетку. В некоторых вариантах реализации изобретения функция Т-регуляторной клетки подавлена по сравнению с такой до введения комбинации. В некоторых вариантах реализации изобретения истощение Т-клеток уменьшается по сравнению с таким до введения комбинации. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, выбран из группы, состоящей из антагониста, связывающегося с PD-1, антагониста, связывающегося с PD-L1, и антагониста, связывающегося с PD-L2.
В некоторых вариантах реализации изобретения вышеупомянутого аспекта антагонист, связывающийся с компонентом сигнального пути PD-1, представляет собой антагонист, связывающийся с PD-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с его лигандными партнерами по связыванию. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с PD-L1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 как с PD-L1, так и с PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, представляет собой антитело. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, выбран из группы, состоящей из MDX-1106 (nivolumab), МК-3475 (lambrolizumab), СТ-011 (pidilizumab) и АМР-224.
В некоторых вариантах реализации изобретения вышеупомянутого аспекта антагонист, связывающийся с компонентом сигнального пути PD-1, представляет собой антагонист, связывающийся с PD-L1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, ингибирует связывание PD-L1 с PD-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, ингибирует связывание PD-L1 с В7-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, ингибирует связывание PD-L1 как с PD-1, так и с В7-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, представляет собой антитело. В некоторых вариантах реализации изобретения антитело выбрано из группы, состоящей из: YW243.55.S70, MPDL3280A, MDX-1105 и MEDI4736. В некоторых вариантах реализации изобретения антитело содержит тяжелую цепь, которая включает последовательность HVR-H1 из SEQ ID NO: 19, последовательность HVR-H2 из SEQ ID NO: 20 и последовательность HVR-H3 из SEQ ID NO: 21; и легкую цепь, которая включает последовательность HVR-L1 из SEQ ID NO: 22, последовательность HVR-L2 из SEQ ID NO: 23 и последовательность HVR-L3 из SEQ ID NO: 24. В некоторых вариантах реализации изобретения антитело содержит вариабельный участок тяжелой цепи, который включает аминокислотную последовательность SEQ ID NO: 26, и вариабельный участок легкой цепи, который включает аминокислотную последовательность SEQ ID NO: 4.
В некоторых вариантах реализации изобретения вышеупомянутого аспекта антагонист, связывающийся с компонентом сигнального пути PD-1, представляет собой антагонист, связывающийся с PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L2, представляет собой антитело. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L2, представляет собой иммуноадгезин.
В любом из предыдущих вариантов реализации изобретения вышеупомянутого аспекта рак может быть раком молочной железы (в том числе тройным негативным раком молочной железы (ТНРМЖ)), раком мочевого пузыря (в том числе уротелиальным раком мочевого пузыря (УРМП), мышечно-инвазивным раком мочевого пузыря и БЦЖ-рефрактерным немышечно-инвазивным раком мочевого пузыря), колоректальным раком, раком прямой кишки, раком легких (в том числе немелкоклеточным раком легкого, который может быть плоскоклеточным или неплоскоклеточным), глиобластомой, неходжкинской лимфомой (НХЛ), почечно-клеточным раком (в том числе почечно-клеточной карциномой), раком предстательной железы, раком печени, раком поджелудочной железы, саркомой мягких тканей, саркомой Капоши, карциноидной карциномой, раком головы и шеи, раком желудка, раком пищевода, раком простаты, раком эндометрия, раком почки, раком яичников, мезотелиомой и гем злокачественностью (в том числе миелодиспластическим синдромом и множественной миеломой). В конкретных вариантах реализации изобретения рак может быть раком легких (в том числе немелкоклеточным раком легкого, который может быть плоскоклеточным или неплоскоклеточным), раком мочевого пузыря (в том числе УРМП), раком молочной железы (в том числе ТНРМЖ), почечно-клеточной карциномой, меланомой, колоректальным раком и гем злокачественностью (например, миелодиспластическим синдромом (МДС) и множественной миеломой). В некоторых вариантах реализации изобретения рак легкого представляет собой немелкоклеточный рак легкого, который может быть плоскоклеточным или неплоскоклеточным. В некоторых вариантах реализации изобретения рак мочевого пузыря представляет собой УРМП. В некоторых вариантах реализации изобретения рак молочной железы представляет собой ТНРМЖ. В некоторых вариантах реализации изобретения гем злокачественность представляет собой МДС или множественную миелому.
В некоторых вариантах реализации изобретения раковые клетки индивидуума экспрессируют PD-L1. В некоторых вариантах реализации изобретения таксан представляет собой наб-паклитаксел (ABRAXANE®), паклитаксел или доцетаксел. В некоторых вариантах реализации изобретения таксан представляет собой наб-паклитаксел (ABRAXANE®). В некоторых вариантах реализации изобретения таксан представляет собой паклитаксел.
В некоторых вариантах реализации изобретения любого из вышеупомянутых аспектов антагонист, связывающийся с компонентом сигнального пути PD-1, и/или таксан вводят внутривенно, внутримышечно, подкожно, местно, перорально, трансдермально, внутрибрюшинно, интраорбитально, путем имплантации, путем ингаляции, интратекально, интравентрикулярно или интраназально.
В некоторых вариантах реализации изобретения любого из вышеупомянутых аспектов способ может дополнительно включать введение эффективного количества химиотерапевтического агента. В некоторых вариантах реализации изобретения химиотерапевтический агент представляет собой химиотерапевтический агент на основе платины. В некоторых вариантах реализации изобретения химиотерапевтический агент на основе платины представляет собой карбоплатин.
В другом аспекте настоящее изобретение относится к использованию антагониста, связывающегося с компонентом человеческого сигнального пути PD-1, в производстве лекарственного средства для лечения или задерживания прогрессирования рака у индивидуума, причем лекарственное средство содержит антагонист, связывающийся с компонентом человеческого сигнального пути PD-1, и необязательный фармацевтически приемлемый носитель, и при этом лечение включает введение лекарственного средства в комбинации с композицией, содержащей таксан и необязательный фармацевтически приемлемый носитель.
В другом аспекте настоящее изобретение относится к использованию таксана в производстве лекарственного средства для лечения или задерживания прогрессирования рака у индивидуума, причем лекарственное средство содержит таксан и необязательный фармацевтически приемлемый носитель, и при этом лечение включает введение лекарственного средства в комбинации с композицией, содержащей антагонист, связывающийся с компонентом человеческого сигнального пути PD-1, и необязательный фармацевтически приемлемый носитель.
В другом аспекте настоящее изобретение относится к композиции, содержащей антагонист, связывающийся с компонентом человеческого сигнального пути PD-1, и необязательный фармацевтически приемлемый носитель для применения в лечении или задерживании прогрессирования рака у индивидуума, при этом лечение включает введение указанной композиции в комбинации со второй композицией, причем вторая композиция содержит таксан и необязательный фармацевтически приемлемый носитель.
В другом аспекте настоящее изобретение относится к композиции, содержащей таксан и необязательный фармацевтически приемлемый носитель для применения в лечении или задерживании прогрессирования рака у индивидуума, при этом лечение включает введение указанной композиции в комбинации со второй композицией, причем вторая композиция содержит антагонист, связывающийся с компонентом человеческого сигнального пути PD-1, и необязательный фармацевтически приемлемый носитель.
В другом аспекте настоящее изобретение относится к набору, содержащему лекарственное средство, которое включает антагонист, связывающийся с компонентом сигнального пути PD-1, и необязательный фармацевтически приемлемый носитель, и вкладыш в упаковку, который включает инструкции по введению лекарственного средства в комбинации с композицией, содержащей таксан и необязательный фармацевтически приемлемый носитель для лечения или задерживания прогрессирования рака у индивидуума.
В другом аспекте настоящее изобретение относится к набору, содержащему первое лекарственное средство, которое включает антагонист, связывающийся с компонентом сигнального пути PD-1, и необязательный фармацевтически приемлемый носитель, и второе лекарственное средство, содержащее таксан и необязательный фармацевтически приемлемый носитель. В некоторых вариантах реализации изобретения набор дополнительно содержит вкладыш в упаковку, который включает инструкции по введению первого лекарственного средства и второго лекарственного средства для лечения или задерживание прогрессирования рака у индивидуума.
В другом аспекте настоящее изобретение относится к набору, содержащему лекарственное средство, которое включает таксан и необязательный фармацевтически приемлемый носитель, и вкладыш в упаковку, который включает инструкции по введению лекарственного средства в комбинации с композицией, которая включает антагонист, связывающийся с компонентом сигнального пути PD-1, и необязательный фармацевтически приемлемый носитель, для лечения или задерживания прогрессирования рака у индивидуума.
В любом из предшествующих аспектов антагонист, связывающийся с компонентом сигнального пути PD-1, может быть выбран из группы, состоящей из антагониста, связывающегося с PD-1, антагониста, связывающегося с PD-L1, и антагониста, связывающегося с PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, представляет собой антагонист, связывающийся с PD-L1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с его лигандными партнерами по связыванию. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с PD-L1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, ингибирует связывание PD-1 как с PD-L1, так и с PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, представляет собой антитело. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, выбран из группы, состоящей из MDX-1106 (nivolumab), МК-3475 (lambrolizumab), СТ-011 (pidilizumab) и АМР-224. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, представляет собой антагонист, связывающийся с PD-L1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, ингибирует связывание PD-L1 с PD-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, ингибирует связывание PD-L1 с В7-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, ингибирует связывание PD-L1 как с PD-1, так и с В7-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, представляет собой антитело. В некоторых вариантах реализации изобретения антитело выбрано из группы, состоящей из: YW243.55.S70, MPDL3280A, MDX-1105 и MEDI4736. В некоторых вариантах реализации изобретения антитело содержит тяжелую цепь, которая включает последовательность HVR-H1 из SEQ ID NO: 19, последовательность HVR-H2 из SEQ ID NO: 20 и последовательность HVR-H3 из SEQ ID NO: 21; и легкую цепь, которая включает последовательность HVR-L1 из SEQ ID NO: 22, последовательность HVR-L2 из SEQ ID NO: 23 и последовательность HVR-L3 из SEQ ID NO: 24. В некоторых вариантах реализации изобретения антитело содержит вариабельный участок тяжелой цепи, который включает аминокислотную последовательность SEQ ID NO: 26, и вариабельный участок легкой цепи, который включает аминокислотную последовательность SEQ ID NO: 4.
В любом из предыдущих аспектов таксан представляет собой наб-паклитаксел (ABRAXANE®), паклитаксел или доцетаксел. В некоторых вариантах реализации изобретения таксан представляет собой наб-паклитаксел (ABRAXANE®). В некоторых вариантах реализации изобретения таксан представляет собой паклитаксел.
Следует понимать, что одно, несколько или все свойства различных вариантов реализации изобретения, описанных в данном документе, могут быть объединены с образованием других вариантов реализации настоящего изобретения. Эти и другие аспекты настоящего изобретения будут очевидными для специалиста в данной области техники. Эти и другие варианты реализации настоящего изобретения дополнительно описываются в подробном описании, которое следует ниже.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На ФИГУРЕ 1 представлен график, который иллюстрирует, что комбинированная терапия анти-PD-L1 антитела и паклитаксел + карбоплатин демонстрирует синергический противоопухолевый эффект по сравнению с контролями: только антитело или только паклитаксел + карбоплатин, в сингенной МС38 колоректальной опухолевой модели у мышей C57BL/6. На графике показаны прилаживания кубического сплайна объемов опухолей каждой группы, подвергшейся терапии, как функция времени. Кубическое сплайн прилаживание представляет собой математический алгоритм, который выбирает наилучшим образом сглаженную кривую, которая соответствует всем данным в каждой группе, подвергшейся терапии. Мышам с установленными подкожными МС38 опухолями около 100-200 мм3 вводили единичную дозу карбоплатина из расчета 80 мг/кг путем внутрибрюшинной (ВБ) инъекции, плюс паклитаксел из расчета 10 мг/кг путем внутривенной (ВВ) инъекции и анти-др120 антитело или анти-PD-L1 (клон 25А1 mlgG2a.DANA) из расчета 10 мг/кг, дозируя 3 раза в неделю в течение 3 недель. N=10 мышей/группу.
ФИГУРЫ 2а и 2б представляют собой графики, которые иллюстрируют, что дексаметазон (Dex) аннулирует эффективность монотерапии с использованием анти-PD-L1 антител (αPD-L1) в сингенной МС38 колоректальной опухолевой модели у мышей C57BL/6. На Фигуре 2а проиллюстрировано кубическое сплайн прилаживание объемов опухолей каждой группы, подвергшейся терапии, в то время как на Фигуре 26 проиллюстрированы графики для индивидуальных мышей (диаграммы в решетках) (черные кривые показывают кубическое сплайн прилаживание объемов опухолей для каждой группы, подвергшейся терапии). Каждый график на Фигуре 2б содержит пунктирную линию, представляющую собой кубическое сплайн прилаживание контрольной группы. На Фигуре 2б горизонтальные пунктирные линии около 300 мм3 являются отсчетными точками для прогрессирующего объема (2-кратный от начального объема опухоли). Объем опухоли ниже 32 мм3 (отмечен горизонтальными пунктирными линиями на Фигуре 2б) видимый, но слишком маленький для точного измерения. Мышам с установленными подкожными МС38 опухолями размером около 100-200 мм3 вводили единичную дозу либо физиологического раствора, либо дексаметазона ВВ из расчета 4 мг/кг и через 12 часов вводили либо контрольное анти-gp120 антитело, либо анти-PD-L1 (клон 25A1.mlgG2a.DANA) ВБ из расчета 10 мг/кг 3 раза в неделю в течение 3 недель. N=10 мышей/группу.
ФИГУРА 3 представляет собой график, который иллюстрирует, что дексаметазон ингибирует антиген-специфические Т-клеточные ответы в OTI адоптивном Т-клеточном переносе и модели вакцинации. CD8+ Т-клетки изолировали из мышей OTI Thy1.1 и вводили ВВ из расчета 2,5 миллиона клеток/мышь. На следующий день мышей-реципиентов вакцинировали ВБ с помощью 250 нг анти-DEC205 трансляционно слитого с полноразмерным овальбумином и единичной дозой либо физиологического раствора, либо дексаметазона ВВ из расчета 4 мг/кг. Через два дня мышей усыпляли и подсчитывали общее количество OTI CD8+ клеток из селезенок с помощью проточной цитометрии. N=5 мышей/группу, каждый символ представляет собой отдельную мышь. Значение Р рассчитано по двустороннему непарному t-критерию Стьюдента.
ФИГУРЫ 4а и 4б представляют собой графики, которые иллюстрируют, что комбинированная терапия анти-PD-L1 антитела и наб-паклитаксел a (ABRAXANE®, Abx) + карбоплатина (Carbo) приводила в результате к сильному синергетическому противоопухолевому эффекту, и достигнуты долговременные полные ответы (у 4 из 8 мышей), которые длились более 90 дней в сингенной МС38 колоректальной опухолевой модели у мышей C57BL/6. График иллюстрирует объем опухоли как функцию от времени. Фигура 4а иллюстрирует кубическое сплайн прилаживание объемов опухолей каждой группы, подвергшейся терапии, а Фигура 4б иллюстрирует диаграммы в решетках для отдельных мышей (черные кривые показывают кубическое сплайн прилаживание объемов опухолей для каждой группы, подвергшейся терапии). Каждый график на Фигуре 4б содержит пунктирную линию, представляющую собой кубическое сплайн прилаживание контрольной группы. На Фигуре 4б горизонтальные пунктирные линии около 600 мм3 являются отсчетными точками для прогрессирующего объема (2-кратный от начального объема опухоли). Объем опухоли ниже 32 мм3 (отмечен горизонтальными пунктирными линиями на Фигуре 4б) видимый, но слишком маленький для точного измерения. Мышам с установленными подкожными МС38 опухолями размером около 300 мм3 вводили контрольное анти-др120 антитело или анти-PD-L1 антитело (клон YW243.55.S70 mlgG2a.DANA) путем ВБ инъекции из расчета 10 мг/кг 3 раза в неделю в течение 3 недель, плюс физиологический раствор или карбоплатин из расчета 75 мг/кг ВБ один раз в неделю в течение 3 недель, плюс ABRAXANE® из расчета 15 мг/кг ВВ один раз в неделю в течение 3 недель, как указано. N=8 мышей/группу.
ФИГУРЫ 5а и 5б представляют собой графики, которые иллюстрируют, что у мышей, ранее прошедших курс лечения МС38 первичных опухолей (мышей, достигших полных ответов, описанных на Фигуре 1а) с помощью анти-PD-L1 антитело и наб-паклитаксел (ABRAXANE®) + карбоплатин терапии, генерировались ответы противоопухолевой Т-клеточной памяти. После вторичного заражения новыми МС38 опухолевыми клетками опухоли не росли в 100% случаев (у 4 из 4) у прошедших курс лечения мышей. Фигура 5а иллюстрирует, что спленоциты, собранные через 7 дней после вторичного заражения, имеют сравнимые значения CD4+ и CD8+ Т-клеток с такими у первично стимулированных наивных мышей. На Фигуре 5б проиллюстрированы результаты анализа методом проточной цитометрии, которые показывают, что после in vitro стимуляции при помощи ФМА и иономицина Т-клетки мышей, прошедших курс лечения, имеют повышенное образование интерферона гамма (ИФН-гамма) по сравнению с такими у первично зараженных мышей, как было оценено путем внутриклеточного окрашивания цитокинов. Планки погрешностей показывают стандартное отклонение n=5 (первично зараженные мыши) или n=4 (прошедшие курс лечения мыши, вторичное заражение), а точечные участки проточной цитометрии являются репрезентативными для одной мыши из каждой группы. Значения Р были рассчитаны по двустороннему непарному t-критерию Стьюдента.
ФИГУРЫ 6а и 6б представляют собой графики, которые иллюстрируют результаты клинического пробного тестирования фазы 1b эффективности комбинированной терапии при помощи анти-PD-L1 антитела (MPDL3280A) с таксаном и карбоплатином. Фигура 6а представляет собой график, который иллюстрирует изменения размера опухоли с течением времени после терапии при помощи MPDL3280A, наб-паклитаксела (ABRAXANE®) и карбоплатина. Частота объективного ответа (ЧОО) была у 9 из 14 пациентов, из них у 3 - с полными ответами (ПО) и у 6 - с частичными ответами (40). Фигура 6б представляет собой график, который иллюстрирует изменения размера опухоли с течением времени после терапии при помощи MPDL3280A с паклитакселом + карбоплатином. ЧОО была у 2 из 6 пациентов (33%), из них у 2 - с частичными ответами.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
I. Определения
Перед описанием изобретения в деталях следует осмыслить, что данное изобретение не ограничено конкретными композициями или биологическими системами, которые могут, конечно, варьировать. Кроме того, следует понимать, что терминология, используемая в настоящем документе, предоставляется исключительно с целью описания конкретных вариантов реализации изобретения и не подразумевает ограничения изобретения.
Используемые в данном описании изобретения и прилагаемой формуле изобретения, формы единственного числа включают в себя и множественное число, если в содержании четко не указано иное. Таким образом, например, упоминание "молекула" необязательно включает комбинацию двух или более таких молекул, и тому подобное.
Термин "около", используемый в данном документе, относится к обычному диапазону ошибок для соответствующего значения и хорошо известный специалисту в данной области техники. Упоминание "около" возле значения или параметра в данном документе включает (и описывает) варианты реализации изобретения, которые направлены непосредственно к этому значению или параметру.
Следует понимать, что аспекты и варианты реализации изобретения, описанные в данном документе, включают "включающий", "состоящий" и "состоящий, по существу, из" аспектов и вариантов реализации изобретения.
Термин "антагонист, связывающийся с компонентом сигнального пути PD-1" относится к молекуле, которая ингибирует взаимодействие партнера, связывающегося с компонентом сигнального пути PD-1, либо одного, либо более из своих партнеров по связыванию, с тем, чтобы устранить Т-клеточную дисфункцию, которая происходит вследствие передачи сигналов по сигнальному пути PD-1, с результатом в том, чтобы восстановить или усилить Т-клеточную функцию (например, пролиферацию, продукцию цитокинов, и/или уничтожение клеток-мишеней). Как используется в данном документе, антагонист, связывающийся с компонентом сигнального пути PD-1, включает антагонист, связывающийся с PD-1, антагонист, связывающийся с PD-L1, и антагонист, связывающийся с PD-L2.
Термин "антагонист, связывающийся с PD-1" относится к молекуле, которая уменьшает, блокирует, ингибирует, аннулирует или препятствует трансдукции сигнала, который является следствием взаимодействия PD-1 с одним или более из своих партнеров по связыванию, таким как PD-L1 и/или PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, представляет собой молекулу, которая ингибирует связывание PD-1 с одним или более из своих партнеров по связыванию. В конкретном аспекте антагонист, связывающийся с PD-1, ингибирует связывание PD-1 с PD-L1 и/или PD-L2. Например, антагонисты, связывающиеся с PD-1, включают анти-PD-1-антитела, их антиген-связывающие фрагменты, иммуноадгезины, слитые белки, олигопептиды и другие молекулы, которые уменьшают, блокируют, ингибируют, аннулируют или препятствуют трансдукции сигнала, который является следствием взаимодействия PD-1 с PD-L1 и/или PD-L2. В одном варианте реализации изобретения антагонист, связывающийся с PD-1, уменьшает отрицательный ко-стимуляторный сигнал, опосредованный путем или через поверхностные белки клетки, экспрессированные на Т-лимфоцитах, опосредующих передачу сигнала через PD-1 таким образом, что переводят дисфункциональную Т-клетку в менее дисфункциональную (например, усиливая эффекторные ответы на распознавание антигена). В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, представляет собой анти-PD-1-антитело. В конкретном аспекте антагонист, связывающийся с PD-1, представляет собой MDX-1106 (nivolumab), описанный в данном документе. В другом конкретном аспекте антагонист, связывающийся с PD-1, представляет собой МК-3475 (lambrolizumab), описанный в данном документе. В другом конкретном аспекте антагонист, связывающийся с PD-1, представляет собой СТ-011 (pidilizumab), описанный в данном документе. В другом конкретном аспекте антагонист, связывающийся с PD-1, представляет собой АМР-224, описанный в данном документе.
Термин "антагонист, связывающийся с PD-L1" относится к молекуле, которая уменьшает, блокирует, ингибирует, аннулирует или препятствует трансдукции сигнала, который является следствием взаимодействия PD-L1 с одним или более из своих партнеров по связыванию, таким как PD-1 и/или В7-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, представляет собой молекулу, которая ингибирует связывание PD-L1 со своими партнерами по связыванию. В конкретном аспекте антагонист, связывающийся с PD-L1, ингибирует связывание PD-L1 с PD-1 и/или В7-1. В некоторых вариантах реализации изобретения антагонисты, связывающиеся с PD-L1, включают анти-PD-L1 антитела, их антиген-связывающие фрагменты, иммуноадгезины, слитые белки, олигопептиды и другие молекулы, которые уменьшают, блокируют, ингибируют, аннулируют или препятствуют трансдукции сигнала, который является следствием взаимодействия PD-L1 с одним или более своих из партнеров по связыванию, таких как PD-1 и/или В7-1. В одном варианте реализации изобретения антагонист, связывающийся с PD-L1, уменьшает отрицательный ко-стимуляторный сигнал, опосредованный путем или через поверхностные белки клетки, экспрессированные на Т-лимфоцитах, опосредующих передачу сигнала через PD-L1 таким образом, что переводят дисфункциональную Т-клетку в менее дисфункциональную (например, усиливая эффекторные ответы на распознавание антигена). В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, представляет собой анти-PD-L1 антитело. В конкретном аспекте анти-PD-L1 антитело представляет собой YW243.55.S70, описанное в данном документе. В другом конкретном аспекте анти-PD-L1 антитело представляет собой MDX-1105, описанное в данном документе. В еще одном конкретном аспекте анти-PD-L1 антитело представляет собой MPDL3280A, описанное в данном документе. В еще одном конкретном аспекте анти-PD-L1 антитело представляет собой MEDI4736, описанное в данном документе.
Термин "антагонист, связывающийся с PD-L2" относится к молекуле, которая уменьшает, блокирует, ингибирует, аннулирует или препятствует трансдукции сигнала, который является следствием взаимодействия PD-L2 с одним или более из своих партнеров по связыванию, таким как PD-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L2, представляет собой молекулу, которая ингибирует связывание PD-L2 с одним или более из своих партнеров по связыванию. В конкретном аспекте антагонист, связывающийся с PD-L2, ингибирует связывание PD-L2 с PD-1. В некоторых вариантах реализации изобретения антагонисты, связывающиеся с PD-L2, включают анти-PD-L2 антитела, их антиген-связывающие фрагменты, иммуноадгезины, слитые белки, олигопептиды и другие молекулы, которые уменьшают, блокируют, ингибируют, аннулируют или препятствуют трансдукции сигнала, который является следствием взаимодействия PD-L2 с одним или более из своих партнеров по связыванию, такого как PD-1. В одном варианте реализации изобретения антагонист, связывающийся с PD-L2, уменьшает отрицательный ко-стимуляторный сигнал, опосредованный путем или через поверхностные белки клетки, экспрессированные на Т-лимфоцитах, опосредующих передачу сигнала через PD-L2 таким образом, что переводят дисфункциональную Т-клетку в менее дисфункциональную (например, усиливая эффекторные ответы на распознавание антигена). В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L2, представляет собой иммуноадгезин.
"Таксан", используемый в данном документе, представляет собой дитерпен, который может связываться стубулином, способствуя сборке микротрубочек и стабилизации и/или предотвращению деполимеризации микротрубочек. Таксаны, включенные в данный документ, включают таксоид 10-дезацетилбаккатин III и/или его производные. Типичные таксаны включают, но не ограничиваются этими, паклитаксел (то есть TAXOL®, CAS # 33069-62-4), доцетаксел (то есть TAXOTERE®, CAS# 114977-28-5), larotaxel, кабазитаксел, milataxel, tesetaxel и/или orataxel. В некоторых вариантах реализации изобретения таксан представляет собой наночастицы, покрытые альбумином, (например, нано-альбумин связанный (наб)-паклитаксел, то есть ABRAXANE® и/или наб-доцетаксел, ABI-008). В некоторых вариантах реализации изобретения таксан представляет собой наб-паклитаксел (ABRAXANE®). В некоторых вариантах реализации изобретения таксан изготовлен в CREMAPHOR® (например, TAXOL®) и/или в Tween, таким как полисорбат 80 (например, TAXOTERE®). В некоторых вариантах реализации изобретения таксан представляет собой таксан, инкапсулированный в липосомы. В некоторых вариантах реализации изобретения таксан представляет собой форму пролекарства и/или конъюгированную форму таксана (например, ДГК, ковалентно конъюгированная с паклитакселом, паклитаксел полиглюмекс и/или linoleyl carbonate-paclitaxel). В некоторых вариантах реализации изобретения паклитаксел по существу изготовлен без поверхностно-активного вещества (например, в отсутствие CREMAPHOR и/или Tween, такой как TOCOSOL® паклитаксел).
Термин "дисфункция" в контексте дисфункции иммунной системы, относится к состоянию пониженной иммунологической чувствительности на антигенную стимуляцию. Термин включает общие элементы как "истощения", так и/или "анергии", в которых может произойти распознавание антигена, но последующий иммунный ответ является неэффективным для контроля инфекции или роста опухоли.
Термин "дисфункциональный", используемый в данном документе, также включает рефрактерность или невосприимчивость к распознаванию антигена, в частности, нарушенную способность транслировать распознавание антигена в нижележащие эффекторные функции Т-клеток, такие как пролиферация, продуцирование цитокинов (например, ИЛ-2) и/или уничтожение клеток-мишеней.
Термин "анергия" относится к состоянию невосприимчивости к антигенной стимуляции в следствие неполных или недостаточных сигналов, которые передаются посредством Т-клеточного рецептора (например, увеличение внутриклеточного Са+2 при отсутствии Ras-активации). Т-клеточная анергия также может ответной реакцией на стимуляцию антигеном при отсутствии ко-стимуляции, в результате чего клетки становятся рефрактерными к последующей активации антигеном даже при условии ко-стимуляции. Состояние толерантности часто может быть отменено при наличии интерлейкина-2. Анергические Т-клетки не подвергаются клональному росту и/или приобретению эффекторных функций.
Термин "истощение" относится к истощению Т-клеток как к состоянию Т-клеточной дисфункции, которая возникает из-за непрерывной передачи сигнала через ТКР, что случается при многих хронических инфекциях и раке. Оно отличается от анергии тем, что оно возникает не из-за неполной или недостаточной передачи сигналов, а вследствие непрерывной передачи сигнала. Оно определяется слабой эффекторной функцией, непрерывной экспрессией ингибиторных рецепторов и транскрипционным состоянием отличным от функционального эффектора или Т-клеток памяти. Истощение препятствует наилучшему контролю инфекции и опухоли. Истощение может быть результатом как внешних негативных регуляторных путей (например, иммунорегуляторных цитокинов), а также внутриклеточных негативных регуляторных (ко-стимуляторных) путей (PD-1, В7-Н3, В7-Н4 и т.д.).
"Усиление Т-клеточной функции" означает индукцию, побуждение или стимулирование Т-клетки для получения пролонгированной или усиленной биологической функции, либо обновление или реактивирование истощенных или неактивных Т-клеток. Примеры усиления Т-клеточной функции включают: повышение секреции гамма-интерферона из CD8+ Т-клеток, усиление пролиферации, увеличение антиген реактивности (например, вирусной, патогенной или клиренс опухолевой) по отношению к таким уровням до вмешательства. В одном варианте реализации изобретения уровень усиления представляет собой по меньшей мере 50%, в альтернативном варианте 60%, 70%, 80%, 90%, 100%, 120%, 150% или 200% усиление. Способ измерения такого усиления известен обычному специалисту в данной области техники.
"Т-клеточное дисфункциональное расстройство" представляет собой нарушение или состояние Т-клеток, характеризующееся пониженной чувствительностью к антигенной стимуляции. В конкретном варианте реализации изобретения Т-клеточное дисфункциональное расстройство представляет собой нарушение, которое в особенности ассоциируется с несоответствующим увеличением передачи сигнала через PD-1. В другом варианте реализации изобретения Т-клеточное дисфункциональное расстройство представляет собой такое, в котором Т-клетки являются энергическими или имеют пониженную способность к секреции цитокинов, пролиферации или осуществлению цитолитической активности. В конкретном аспекте пониженная чувствительность приводит в результате к неэффективному контролю патогена или опухоли, которая экспрессирует иммуноген. Примеры Т-клеточных дисфункциональных расстройств, характеризующихся дисфункцией Т-клеток, включают неподдающуюся лечению острую инфекцию, хроническую инфекцию и опухолевый иммунитет.
"Опухолевый иммунитет" относится к процессу, в котором опухоли уклоняются от иммунного распознавания и клиренса. Таким образом, согласно терапевтическому понятию, опухолевый иммунитет является "пролеченным", если такое уклонение ослабляется, а опухоли распознаются и поддаются действию иммунной системы. Примеры распознавания опухоли включают связывание опухоли, уменьшение размеров опухоли и клиренс опухоли.
"Иммуногенность" относится к способности конкретного вещества вызвать иммунный ответ. Опухоли являются иммуногенными, а усиление опухолевой иммуногенности помогает в клиренсе опухолевых клеток посредством иммунного ответа. Примеры усиления опухолевой иммуногенности включают терапию с использованием антагониста, связывающегося с компонентом сигнального пути PD-1, и таксана.
"Устойчивый ответ" относится к продолжительному воздействию на снижение роста опухоли после прекращения терапии. Например, размер опухоли может остаться неизменным или уменьшиться по сравнению с размером в начале фазы применения. В некоторых вариантах реализации изобретения устойчивый ответ имеет продолжительность по меньшей мере такую же, как продолжительность терапии, по меньшей мере 1,5х, 2,0х, 2,5х или 3,0х протяженность продолжительности терапии.
Используемый в данном документе термин "уменьшение или ингибирование рецидива рака" означает уменьшить или ингибировать рецидив опухоли или рака, или прогрессирование опухоли или рака. Как раскрыто в данном документе рецидив рака и/или прогрессирования рака включает, без ограничения, метастазы рака.
Используемый в данном документе термин "полный ответ" или "ПО" относится к исчезновению всех целевых патологических изменений.
Используемый в данном документе термин "частичный ответ" или "ЧО" относится к уменьшению по меньшей мере на 30% суммы длинных диаметров (СДД) целевых патологических изменений, принимая в качестве точки отсчета базовую линию СДД.
Используемый в данном документе термин "стабильное заболевание" или "СЗ" означает отсутствие достаточного сокращения целевых патологических изменений, чтобы претендовать на 40, и отсутствие достаточного увеличения, чтобы претендовать на П3, принимая в качестве точки отсчета наименьшую СДД с момента начала терапии.
Используемый в данном документе термин "прогрессирующее заболевание" или "П3" относится к увеличению по меньшей мере на 20% СДД целевых патологических изменений, принимая в качестве точки отсчета наименьшую СДД, зарегистрированную с момента начала терапии, или наличие одного или более новых патологических изменений.
Используемый в данном документе термин "выживаемость без прогрессирования" (ВБП) относится к отрезку времени, во время и после лечения, в течение которого заболевание, подлежащее лечению (например, рак), не ухудшается. Выживаемость без прогрессирования может включать количество времени, в течение которого пациенты испытывали полный ответ или частичный ответ, а также количество времени, в течение которого пациенты испытывали стабильное заболевание.
Используемый в данном документе термин "частота общего ответа" или "частота объективного ответа" (ЧОО) относится к сумме частоты полного ответа (ПО) и частоты частичного ответа (ЧО).
Используемый в данном документе термин "общая выживаемость" (ОВ) относится к проценту индивидуумов в группе, которые, вероятно, будут в живых после определенного периода времени.
Термин "фармацевтическая композиция" относится к лекарству, которое находится в такой форме, чтобы обеспечить эффективную биологическую активность действующего ингредиента, и которое не содержит дополнительных компонентов, которые неприемлемо токсичны для субъекта, к которому композиция должна быть применена. Такие композиции являются стерильными. "Фармацевтически приемлемые" наполнители (переносчики, добавки) представляют собой такие, которые могут быть разумно применены к млекопитающему субъекту для обеспечения употребления эффективной дозы активного ингредиента.
Используемый в данном документе термин "терапия" относится к клиническому вмешательству, спланированному на изменение естественного хода событий у индивидуума или клетки, к которым применяется терапия в течение хода клинической патологии. Желательные эффекты терапии включают уменьшение скорости прогрессирования заболевания, улучшение или облегчение болезненного состояния, и ремиссию или улучшение прогноза. Например, индивидуум успешно "прошел курс терапии", если один или более симптомов, связанных с раком, облегчены или устранены, включая, но не ограничиваясь этими, уменьшение пролиферации (или разрушение) раковых клеток, уменьшение симптомов, возникающих из-за заболевания, повышение качества жизни тех, кто страдает от заболевания, уменьшение дозы других лекарственных средств, необходимых для лечения заболевания, и/или увеличение продолжительности жизни индивидуумов.
Используемый в данном документе термин "задерживание прогрессирования" болезни означает задерживать, препятствовать, замедлять, тормозить, стабилизировать и/или оттягивать развитие заболевания (такого как рак). Это задерживание может быть различной продолжительности по времени, в зависимости от истории болезни и/или индивидуума, который подвергается терапии. Как очевидно для специалиста в данной области техники, достаточное или значительное задерживание может в действительности охватывать профилактику, в том смысле, чтобы у индивидуума не развивалась болезнь. Например, рак на поздней стадии, такой как развитие метастазов, может быть задержан.
"Эффективное количество" представляет собой по меньшей мере минимальное количество, необходимое для осуществления измеримого улучшения или предотвращения конкретного нарушения. Эффективное количество в данном документе может варьировать в зависимости от таких факторов, как состояние болезни, возраст, пол и вес пациента, а также от способности агента вызывать желаемый ответ у индивидуума. Эффективное количество также является таким, при котором любые токсические или вредные эффекты терапии перевешиваются терапевтически благоприятными эффектами. При профилактическом применении благоприятные или желаемые результаты включают такие результаты, как устранение или снижение риска, уменьшения степени тяжести или задержки начала заболевания, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточные патологические фенотипы, представленные в процессе развития заболевания. Для терапевтического применения благотворные или желаемые результаты включают в себя такие клинические результаты, как снижение одного или более симптомов, возникающих из-за заболевания, повышение качества жизни людей, страдающих болезнью, уменьшение дозы других лекарственных средств, необходимых для лечения заболевания, и усиление эффекта другого лекарственного средства, как например, с помощью нацеливания, задерживания прогрессирования болезни, и/или увеличения продолжительности жизни. В случае рака или опухоли эффективное количество лекарственного средства может иметь эффект снижения количества раковых клеток, уменьшение размера опухоли, ингибирования (то есть замедления до некоторой степени или желательно до остановки) инфильтрации раковых клеток в периферические органы, ингибирования (то есть замедления до некоторой степени или желательно до остановки) метастазирования опухоли, ингибирования до некоторой степени роста опухоли и/или облегчения до некоторой степени одного или более симптомов, связанных с нарушением. Эффективное количество может быть введено в один или более приемов. Для целей данного изобретения эффективное количество лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для совершения профилактического или терапевтического лечения либо непосредственно, либо опосредованно. Как понятно из клинического контекста, эффективное количество лекарственного средства, соединения или фармацевтической композиции, может быть или не быть достигнуто в сочетании с другим лекарственным средством, соединением или фармацевтической композицией. Таким образом, "эффективное количество" может рассматриваться в контексте применения одного или более терапевтических агентов, и единичный агент может рассматриваться как данный в эффективном количестве, если в сочетании с одним или более другими агентами, желаемый результат может быть достигнут или уже имеется.
Используемый в данном документе термин "в сочетании с" относится к применению одного метода лечения в дополнение к другому методу лечения. Таким образом, "в сочетании с" относится к применению одного метода лечения до, во время или после применения другого метода лечения к индивидууму.
"Нарушение" представляет собой любое состояние, которое бы получило пользу от лечения, включая, но не ограничиваясь этими, хронические и острые расстройства или заболевания, включая такие как, патологические состояния, которые предрасполагают млекопитающее к рассматриваемому нарушению.
Термины "нарушение клеточной пролиферации" и "пролиферативное нарушение" относятся к расстройствам, которые связаны с определенной степенью аномальной клеточной пролиферации. В одном варианте реализации изобретения нарушение клеточной пролиферации представляет собой рак. В одном варианте реализации изобретения нарушение клеточной пролиферации представляет собой опухоль.
Термин "опухоль", используемый в данном документе, относится ко всему неопластическому росту клеток и пролиферации, как злокачественной или доброкачественной, и ко всем предраковым и раковым клеткам и тканям. Термины "рак", "раковый", "нарушение клеточной пролиферации", "пролиферативное нарушение" и "опухоль" не являются взаимоисключающими, как указано в данном документе.
Термины "рак" и "раковый" означают или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется неконтролируемым ростом клеток. Примеры рака включают, но не ограничиваются этими, карциному, лимфому, бластому, саркому и лейкоз или лимфоидные злокачественные новообразования. Более конкретные примеры таких раков включают, но не ограничиваются этими, плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легкого, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого, рак брюшной полости, гепатоцеллюлярный рак, рак желудочно-кишечного тракта или желудка, включая рак желудочно-кишечного тракта и рак стромы желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря (например, уротелиальный рак мочевого пузыря (УРМП), мышечно-инвазивный раком мочевого пузыря (МИРМП) и БЦЖ-рефрактерный немышечно-инвазивный рак мочевого пузыря (НМИРМП)), рак мочевыводящих путей, гепатому, рак молочной железы (например, HER2-положительный рак молочной железы и тройной негативный рак молочной железы (ТНРМЖ), которые являются эстрогеновыми рецепторами (ЭР-), прогестероновыми рецепторами (ПР-) и HER2 (HER2-) отрицательными), рак толстой кишки, рак прямой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнных желез, рак почек (например, почечно-клеточную карциному (ПКК), рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, анальную карциному, карциному полового члена, меланому, поверхностно распространяющуюся меланому, меланому типа злокачественного лентиго, акральную лентигинозную меланому, узловую меланому, множественную миелому и В-клеточную лимфому (включая низкосортную/фолликулярную неходжкинскую лимфому (НХЛ), мелкоклеточную лимфоцитарную (МЛ) НХЛ, фолликулярную НХЛ промежуточной тяжести, диффузную НХЛ промежуточной тяжести; агрессивную иммунобластную НХЛ; агрессивную лимфобластную НХЛ, агрессивную мелкоклеточную НХЛ с нерассеченными ядрами, НХЛ с массивным поражением лимфоузлов, мантийноклеточную лимфому, лимфому, связанную со СПИДом и макроглобулинемию Вальденстрема); хронический лимфолейкоз (ХЛЛ), острый лимфобластный лейкоз (ОЛЛ); острый миелоидый лейкоз (ОМЛ); лейкоз ворсистых клеток; хронический миелобластный лейкоз (ХМЛ); и посттрансплантационный лимфопролиферативный синдром (ПТЛС), миелодиспластические синдромы (МДС), а также аномальную пролиферацию сосудов, связанную с факоматозами, отек (как например, связанный с опухолями головного мозга), синдром Мейгса, рак головного мозга, а также головы и шеи, и связанные с ними метастазы. В некоторых вариантах реализации изобретения раковые заболеваний, которые поддаются терапии с помощью способов и композиций по данному изобретению, включают рак молочной железы (например, тройной негативный рак молочной железы), рак мочевого пузыря (например, УРМП, МИРМП и НМИРМП), колоректальный рак, рак прямой кишки, рак легкого (например, немелкоклеточный рак легкого, который может быть плоскоклеточный или неплоскоклеточным), глиобластому, неходжкинскую лимфому (НХЛ), почечно-клеточный рак (например, ПКК), рак предстательной железы, рак печени, рак поджелудочной железы, саркому мягких тканей, саркому Капоши, карциноидную карциному, рак головы и шеи, рак яичников, мезотелиому, и гем злокачественности (например, МДС и множественной миеломы). В некоторых вариантах реализации изобретения рак выбран из: мелкоклеточного рака легкого, глиобластомы, нейробластомы, меланомы, рака молочной железы, рака желудка, колоректального рака (КРР) и гепатоцеллюлярной карциномы. В других вариантах реализации изобретения рак выбран из: немелкоклеточного рака легкого, колоректального рака, глиобластомы и карциномы молочной железы, в том числе и метастатических форм этих видов рака. В конкретных вариантах реализации изобретения рак выбран из рака легкого (например, немелкоклеточного рака легкого, который может быть плоскоклеточным или неплоскоклеточным), рака мочевого пузыря (например, УРМП), рака молочной железы (например, ТНРМЖ), РКК, меланомы, колоректального рака и гем злокачественности (например, МДС и множественной миеломы). В некоторых вариантах реализации изобретения рак легкого представляет собой немелкоклеточный рак легкого, который может быть плоскоклеточным или неплоскоклеточным. В некоторых вариантах реализации изобретения рак мочевого пузыря представляет собой УРМП. В некоторых вариантах реализации изобретения рак молочной железы представляет собой ТНРМЖ. В некоторых вариантах реализации изобретения гем злокачественность представляет собой МДС или множественную миелому.
Термин "цитотоксический агент", используемый в данном документе, относится к любому агенту, который является вредным для клеток (например, вызывает гибель клеток, ингибирует пролиферацию или иным образом препятствует клеточной функции). Цитотоксические агенты включают, но не ограничиваются этими, радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты; агенты, ингибирующие рост; ферменты и их фрагменты, такие как нуклеолитические ферменты; и токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или их варианты. Иллюстративные цитотоксические агенты могут быть выбраны из антимикротрубочковых агентов, координационных комплексов платины, алкилирующих агентов, антибиотических агентов, ингибиторов топоизомеразы II, антиметаболитов, ингибиторов топоизомеразы I, гормонов и гормональных аналогов, ингибиторов путей трансдукции сигнала, ингибиторов нерецепторного тирозинкиназного ангиогенеза, иммунотерапевтических агентов, проапоптических агентов, ингибиторов ЛДГ-А, ингибиторов биосинтеза жирных кислот, ингибиторов сигнала клеточного цикла, ГДАЦ ингибиторов, ингибиторов протеасом и ингибиторов метаболизма рака. В одном варианте реализации изобретения цитотоксический агент представляет собой химиотерапевтический агент на основе платины. В одном варианте реализации изобретения цитотоксический агент представляет собой антагонист EGFR. В одном варианте реализации изобретения цитотоксический агент представляет собой N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амин (например, эрлотиниб, TARCEVA™). В одном варианте реализации изобретения цитотоксический агент представляет собой RAF ингибитор. В одном варианте реализации изобретения RAF ингибитор представляет собой BRAF и/или CRAF ингибитор. В одном варианте реализации изобретения RAF ингибитор представляет собой вемурафениб. В одном варианте реализации изобретения цитотоксический агент представляет собой ингибитор PI3K.
Используемый в данном документе термин "химиотерапевтический агент" включает соединения, полезные при лечении рака. Примеры химиотерапевтических агентов включают эрлотиниб (TARCEVA®, Genentech/OSI Pharm.), бортезомиб (VELCADE®, Millennium Pharm.), дисульфирам, эпигаллокатехин галлат, салиноспорамид А, карфилзомиб, 17-AAG (гелданамицин), радицикол, лактатдегидрогеназу А (ЛДГ-А), фулвестрант (FASLODEX®, AstraZeneca), сунитиниб (SUTENT®, Pfizer/Sugen), летрозол (FEMARA®, Novartis), иматиниб мезилат (GLEEVEC®, Novartis), finasunate (VATALANIB®, Novartis), оксалиплатин (ELOXATIN®, Sanofi), 5-ФУ (5-фторурацил), лейковорин, рапамицин (сиролимус, RAPAMUNE®, Wyeth), лапатиниб (TYKERB®, GSK572016, Glaxo Smith Kline), lonafamib (SCH 66336), сорафениб (NEXAVAR®, Bayer Labs), гефитиниб (IRESSA®, AstraZeneca), AG1478, алкилирующие агенты, такие кактиотепа и CYTOXAN® циклофосфамид; алкилсульфонаты, такие как бусульфан, improsulfan и пипосульфан; азиридины, такие как benzodopa, carboquone, meturedopa и uredopa; этиленимины и метилмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и trimethylomelamine; ацетогенины (особенно bullatacin и bullatacinone); камптотецин (включая топотекан и иринотекан); бриостатин; каллистатин; СС-1065 (включая его adozelesin, carzelesin и синтетические аналоги бизелезина); криптофицины (в частности, криптофицин 1 и криптофицин 8); адренокортикостероиды (включая преднизон и преднизолон); ципротерона ацетат; 5α-редуктазы включая финастерид и дутастерид); вориностат, ромидепсин, панобиностат, вальпроевая кислота, mocetinostat доластатин; алдеслейкин, тальк дуокармицин (включая синтетические аналоги, KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; хлорметины, такие как хлорамбуцил, chlomaphazine, хлорофосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамин оксид гидрохлорид, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как ендииновые антибиотики (например, калихеамицин, особенно калихеамицин γ1I и калихеамицин ω1I (Angew Chem. Intl. Ed. Engl. 33:183-186 (1994)); динемицин, включая динемицин А; бисфосфонаты, такие как клодронат; эсперамицин; а также неокарциностатиновый хромофор и родственные хромопротеиновые ендииновые антибиотические хромофоры), aclacinomysins, актиномицин, authramycin, азасерин, блеомицины, кактиномицин, carabicin, caminomycin, карцинофилин, хромомицин, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, ADRIAMYCIN® (доксорубицин), morpholino-doxorubicin, цианоморфолино-доксорубицин, 2-pyrrolino-doxorubicin и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, marcellomycin, митоцины, такие как митомицин С, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, rodorubicin, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатитин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-ФУ); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, epitiostanol, mepitiostane, тестолактон; анти-адреналины, такие как аминоглютетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фолиновая кислота; aceglatone; алдофосфамид гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; bestrabucil; бисантрен; эдатрексат; defofamine; демеколцин; диазиквон; elfomithine; elliptinium acetate; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; lonidainin; майтанзиноиды, такие как маитанзин и ансамитоцины; митогуазон; митоксантрон; mopidamnol; nitraerine; пентостатин; phenamet; пирарубицин; лозоксантрон; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; PSK® полисахаридный комплекс (JHS Natural Products, Eugene, Oreg.); разоксан; rhizoxin; sizofuran; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2"- трихлортриэтиламин; трихотецены (особенно Т-2 токсин, verracurin А, роридин А и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; gacytosine; арабинозид ("Ara-С"); циклофосфамид; тиотепа; таксаны; хлорамбуцил; GEMZAR® (гемцитабин); 6-тиогуанин; меркаптопурин; метотрексат; винбластин; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; NAVELBINE® (винорелбин); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; капецитабин (XELODA®); ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДФМО); ретиноиды, такие как ретиноевая кислота; и фармацевтически приемлемые соли, кислоты и производные любого из перечисленных выше веществ.
Химиотерапевтические агенты также включают химиотерапевтические агенты "на основе платины", которые содержат органическое соединение, содержащее платину в качестве составной части молекулы. Как правило, химиотерапевтические агенты на основе платины представляют собой координационные комплексы платины. В данной области техники химиотерапевтические агенты на основе платины иногда называют "препараты платины". Примеры химиотерапевтических агентов на основе платины включают, но не ограничиваются этими, карбоплатин, цисплатин и оксалиплатин.
Химиотерапевтические агенты также включают (I) антигормональные средства, которые действуют как регуляторы или ингибиторы действие гормонов на опухоли, такие как антиэстрогены и селективные модуляторы эстрогенового рецептора (СМЭР), в том числе, например, тамоксифен (включая NOLVADEX®; тамоксифен цитрат), ралоксифен, дролоксифен, йодоксифен, 4-гидрокситамоксифен, trioxifene, кеоксифен, LY117018, онапристон и FARESTON® (торемифен цитрат); (ii) ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует выработку эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглютетимид, MEGASE® (мегестрол ацетат), AROMASIN® (экземестан; Pfizer), formestanie, фадрозол, RIVISOR® (ворозол), FEMARA® (летрозол; Novartis) и ARIMIDEX® (анастрозол; AstraZeneca); (iii) антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; бусерелин, трипторелин, медроксипрогестерона ацетат, диэтилстилбестрол, премарин, флюоксиместерон, all transretionic acid, фенретинид, а также троксацитабин (аналог 1,3-диоксолан нуклеозида цитозина); (iv) ингибиторы протеинкиназы; (v) ингибиторы липидной киназы; (vi) антисмысловые олигонуклеотиды, в частности, те, которые ингибируют экспрессию генов сигнальных путей, вовлеченных в аберрантную клеточную пролиферацию, таких как, например, РКС-альфа, Ralf и Н-Ras; (vii) рибозимы, такие как ингибиторы VEGF экспрессии (например, ANGIOZYME®) и ингибиторы HER2 экспрессии; (viii) вакцины, такие как вакцины для генной терапии, например, ALLOVECTIN®, LEUVECTIN® и VAXID®, PROLEUKIN®, rlL-2; ингибитор топоизомеразы 1, такой как LURTOTECAN®; ABARELIX® rmRH; и (ix) фармацевтически приемлемые соли, кислоты и производные любого из перечисленных выше веществ.
Химиотерапевтические агенты также включают антитела, такие как алемтузумаб (Campath), бевацизумаб (AVASTIN®, Genentech), цетуксимаб (ERBITUX®, Imclone), панитумумаб (VECTIBIX®, Amgen), ритуксимаб (RITUXAN®, Genentech/Biogen Idee), пертузумаб (OMNITARG®, 2С4, Genentech), трастузумаб (HERCEPTIN®, Genentech), тозитумомаб (Bexxar, Corixia) и конъюгат антитела с лекарственным препаратом - гемтузумаб озогамицин (MYLOTARG®, Wyeth). Дополнительные гуманизированные моноклональные антитела с терапевтическим потенциалом как агенты для комбинации с соединениями по данному изобретению включают: аполизумаб, aselizumab, atlizumab, бапинейзумаб, bivatuzumab mertansine, cantuzumab mertansine, cedelizumab, цертолизумаб пегол, cidfusituzumab, cidtuzumab, даклизумаб, экулизумаб, эфализумаб, эпратузумаб, erlizumab, felvizumab, фонтолизумаб, гемтузумаб озогамицин, инотузумаб озогамицин, ипилимумаб, labetuzumab, линтузумаб, матузумаб, меполизумаб, мотавизумаб, motovizumab, натализумаб, нимотузумаб, nolovizumab, numavizumab, окрелизумаб, омализумаб, паливизумаб, пасколизумаб, pecfusituzumab, pectuzumab, пекселизумаб, ralivizumab, ранибизумаб, reslivizumab, реслизумаб, resyvizumab, rovelizumab, ruplizumab, sibrotuzumab, сиплизумаб, sontuzumab, tacatuzumab tetraxetan, tadocizumab, тализумаб, tefibazumab, тоцилизумаб, toralizumab, tucotuzumab celmoleukin, tucusituzumab, umavizumab, urtoxazumab, устекинумаб, visilizumab и анти-интерлейкин-12 (ABT-874/J695, Wyeth Research and Abbott Laboratories), который является рекомбинантным исключительно из сиквенса человека, полноразмерное IgG1 λ антитело, генетически модифицированное для распознавания белка интерлейкина-12 р40.
Химиотерапевтические агенты также включают «ингибиторы EGFR», которые относятся к соединениям, которые связываются или иным образом непосредственно взаимодействуют с EGFR и предотвращают или уменьшают его сигнальную активность, а как альтернативный вариант называют «антагонистом EGFR». Примеры таких агентов включают антитела и малые молекулы, которые связываются с EGFR. Примерами антител, которые связываются с EGFR, включают MAb 579 (АТСС CRL НВ 8506), MAb 455 (АТСС CRL НВ8507), MAb 225 (АТСС CRL 8508), MAb 528 (АТСС CRL 8509) (см., патент США №4943533) и их варианты, такие как химерное 225 (С225 или цетуксимаб; ERBUTIX®) и реконструированное человеческое 225 (Н225) (см., например, WO 96/40210, Imclone Systems Inc.); IMC-11F8, полностью человеческое, EGFR-направленное антитело (Imclone); антитела, которые связываются с мутантным EGFR II типа (патент США №5212290); гуманизированные и химерные антитела, которые связываются с EGFR, как описано в патенте США №5891996; и человеческие антитела, которые связываются с EGFR, такие как ABX-EGF или панитумумаб (см. WO 98/50433, Abgenix/Amgen); EMD 55900 (Stragliotto et al,. Eur. J. Cancer 32A:636-640 (1996)); EMD7200 (матузумаб) гуманизированное EGFR антитело, направленное против EGFR, которое конкурирует как с EGF, так и с TGF-альфа за связывание с EGFR (EMD/Merck); человеческое антитело к EGFR, HuMax-EGFR (GenMab); полностью человеческие антитела, известные как Е1.1, Е2.4, Е2.5, Е6.2, Е6.4, Е2.11, Е6.3 и Е7.6.3 и описаны в патенте США 6235883; MDX-447 (Medarex Inc); и mAb 806 или гуманизированное mAb 806 (Johns et al., J. Biol. Chem. 279(29):30375-30384 (2004)). Анти-EGFR антитела могут быть конъюгированы с цитотоксическим агентом, таким образом, генерируя иммуноконъюгат (см., например, ЕР659439А2, Merck Patent GmbH). Антагонисты EGFR включают низкомолекулярные, такие как соединения, описанные в патентах США №№: 5616582, 5457105, 5475001, 5654307, 5679683, 6084095, 6265410, 6455534, 6521620, 6596726, 6713484, 5770599, 6140332, 5866572, 6399602, 6344459, 6602863, 6391874, 6344455, 5760041, 6002008 и 5747498, а также следующие РСТ публикации: WO 98/14451, WO 98/50038, WO 99/09016 и WO 99/24037. Конкретные низкомолекулярные антагонисты EGFR включают OSI-774 (СР-358774, эрлотиниб, TARCEVA® Genentech/OSI Pharmaceuticals); PD 183805 (CI 1033, 2-пропенамид, N-[4-[(3-хлор-4-фторфенил)амино]-7-[3-(4-морфолинил)пропокси]-6-хиназолинил]-, дигидрохлорид, Pfizer Inc.); ZD1839, гефитиниб (IRESSA®) 4-(3'-хлор-4'-фторанилино)-7-метокси-6-(3-морфолинопропокси)хиназолин, AstraZeneca); ZM 105180 ((6-амино-4-(3-метилфенил-амино)-хиназолин, Zeneca); BIBX-1382 (N8-(3-хлор-4-фтор-фенил)-N2(1-метил-пиперидин-4-ил)-пиримидо[5,4-d]пиримидин-2,8-диамин, Boehringer Ingelheim); PKI-166 ((R)-4-[4-[(1-фенилэтил)амино]-1Н-пирроло[2,3-d]пиримидин-6-ил]-фенол), (R)-6-(4-гидроксифенил)-4-[(1-фенилэтил)амино]-7Н-пирроло[2,3-d]пиримидин); CL-387785 (N-[4-[(3-бромфенил)амино]-6-хиназолинил]-2-бутинамид); EKB-569 (N-[4-[(3-хлор-4-фторфенил)амино]-3-циано-7-етокси-6-хинолинил]-4-(диметиламино)-2-бутенамид) (Wyeth); AG1478 (Pfizer); AG1571 (SU 5271; Pfizer); двойные ингибиторы EGFR/HER2 тирозинкиназы, такие как лапатинибом (TYKERB®, GSK572016 или N-[3-хлор-4-[(3 фторфенил)метокси]фенил]-6[5[[[2метилсульфонил)этил]амино]метил]-2-фуранил]-4-хиназолинамин).
Химиотерапевтические агенты также включают "ингибиторы тирозин киназы", включая EGFR-направленные лекарственные препараты, упомянутые в предыдущем абзаце; низкомолекулярный ингибитор HER2 тирозинкиназы, такой как ТАК165, имеющийся у Takeda; СР-724714, пероральный селективный ингибитор ErbB2 рецептора тирозинкиназы (Pfizer и OSI); двойные ингибиторы HER, такие как ЕКВ-569 (имеющийся у Wyeth), которые предпочтительно связываются с EGFR, но ингибируют как HER2-, так и EGFR-гиперэкспрессирующие клетки; лапатиниб (GSK572016, имеющийся у Glaxo-SmithKline), пероральный ингибитор HER2 и EGFR тирозинкиназы; PKI-166 (имеющийся у Novartis); pan-HER ингибиторы, такие как канертиниб (CI-1033; Pharmacia); ингибиторы Raf-1, такие как антисмысловой агент ISIS-5132, имеющийся у ISIS Pharmaceuticals, которые ингибируют передачу сигнала через Raf-1; ингибиторы не-HER-направленной тирозинкиназы, такие как иматиниб мезилат (GLEEVEC®, имеющийся у Glaxo SmithKline); мультинаправленные ингибиторы тирозинкиназы, такие как сунитиниб (SUTENT®, имеющийся у Pfizer); ингибиторы VEGF рецептора с тирозинкиназной активностью, такие как vatalanib (PTK787/ZK222584, имеющийся у Novartis/Schering AG); ингибитор МАРК внеклеточно регулируемой киназы I CI-1040 (имеющийся у Pharmacia); хиназолины, такие как PD 153035,4-(3-хлоранилино) хиназолин; пиридопиримидины; пиримидопиримидины; пирролопиримидины, такие как CGP 59326, CGP 60261 и CGP 62706; пиразолопиримидины, 4-(фениламино)-7Н-пирроло[2,3-d] пиримидины; куркумин (диферулоил-метан, 4,5-бис(4-фторанилино)фталимид); тирфостины, содержащие нитротиофеновые фрагменты; PD-0183805 (Warner-Lamber); антисмысловые молекулы ("например,, те, которые связываются с HER-кодирующей нуклеиновой кислотой); хиноксалины (патент США №5804396); tryphostins (патент США №5804396); ZD6474 (Astra Zeneca); PTK-787 (Novartis/Schering AG); pan-HER ингибиторы, такие как CI-1033 (Pfizer); Affinitac (ISIS 3521, Isis/Lilly); иматиниб мезилат (GLEEVEC®); PKI 166 (Novartis); GW2016 (Glaxo SmithKline); CI-1033 (Pfizer); EKB-569 (Wyeth); семаксиниб (Pfizer); ZD6474 (AstraZeneca); PTK-787 (Novartis/Schering AG); INC-1C11 (Imclone), рапамицин (сиролимус, RAPAMUNE®); или те, которые описаны в любой из следующих патентных публикаций: патент США №5804396; WO 1999/09016 (American Cyanamid); WO 1998/43960 (American Cyanamid); WO 1997/38983 (Warner Lambert); WO 1999/06378 (Warner Lambert); WO 1999/06396 (Warner Lambert); WO 1996/30347 (Pfizer, Inc); WO 1996/33978 (Zeneca); WO 1996/3397 (Zeneca) и WO 1996/33980 (Zeneca).
Химиотерапевтические агенты также включают дексаметазон, интерфероны, колхицин, метоприн, циклоспорин, амфотерицин, метронидазол, алемтузумаб, алитретиноин, аллопуринол, амифостин, триоксид мышьяка, аспарагиназу, живые микобактерии вакцинного штамма БЦЖ, bevacuzimab, бексаротен, кладрибин, клофарабин, дарбэпоэтин альфа, денилейкин, дексразоксан, эпоэтин альфа, elotinib, филграстим, гистрелин ацетат, ибритумомаб, интерферон альфа-2а, интерферон альфа-2b, леналидомид, левамизол, месну, метоксален, нандролон, неларабин, nofetumomab, опрелвекин, палифермин, памидронат, pegademase, пэгаспаргазу, пэгфилграстим, пеметрексед динатрия, пликамицин, порфимер натрия, акрихин, расбуриказу, сарграмостим, темозоломид, VM-26, 6-TG, торемифен, третиноин, ATRA, валрубицин, золедронат и золедроновую кислоту, и их фармацевтически приемлемые соли.
Химиотерапевтические агенты также включают гидрокортизон, гидрокортизона ацетат, кортизона ацетат, тиксокортол пивалат, триамцинолона ацетонид, триамцинолона спирт, мометазон, амцинонид, будесонид, дезонид, флуоцинонид, фторцинолон ацетонид, бетаметазон, бетаметазона натрия фосфат, дексаметазон, дексаметазона натрия фосфат, флуокортолон, гидрокортизона 17-бутират, гидрокортизона 17-валерат, аклометазон дипропионат, бетаметазона валерат, бетаметазона дипропионат, предникарбат, клобетазона 17-бутират, клобетазола 17-пропионат, флуокортолона капроат, флуокортолона пивалат и флупредниден ацетат; иммунные селективные противовоспалительные пептиды (ИмСПВП), такие как фенилаланин-глутамин-глицин (FEG) и его D-изомерные формы (feG) (IMULAN BioTherapeutics, LLC); противоревматические лекарственные препараты, такие как азатиоприн, циклоспорин (циклоспорин А), D-пеницилламин, соли золота, гидроксихлорохин, leflunomideminocycline, сульфасалазин, блокаторы фактора некроза опухоли альфа (ФНО-α), такие как этанерцепт (Enbrel), инфликсимаб (Remicade), адалимумаб (Humira), цертолизумаб пегол (Cimzia), голимумаб (Simponi), блокаторы интерлейкина 1 (ИЛ-1), такие каканакинра (Kineret), блокаторы Т-клеточной ко-стимуляции, такие как абатацепт (Orencia), блокаторы интерлейкина 6 (ИЛ-6), такие как тоцилизумаб (ACTEMERA®); блокаторы интерлейкина 13 (ИЛ-13), такие как лебрикизумаб; блокаторы интерферона альфа (ИФН), такие как rontalizumab; блокаторы бета-7 интегрина, такие как rhuMAb Beta7; блокаторы IgE пути, такие как Anti-M1 prime; блокаторы сектетируемого гомотримера LTa3 и мембраносвязанного гетеротримера LTa1/S2, такие как анти-лимфотоксин альфа (LTa); радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); разнообразные исследуемые агенты, такие как thioplatin, PS-341, фенилбутират, ЕТ-18- ОСН3 или ингибиторы фарнезилтрансферазы (L-739749, L-744832); полифенолы, такие как кверцетин, ресвератрол, пикеатаннол, галлат эпигаллокатехина, теафлавины, флавонолы, процианидины, бетулиновую кислоту и их производные; ингибиторы автофагии, такие как хлорохин; дельта-9-тетрагидроканнабинол (дронабинол, MARINOL®); бета-лапахон; лапахол; колхицины; бетулиновую кислоту; acetylcamptothecin, scopolectin и 9-аминокамптотецин); подофиллотоксин; тегафур (UFTORAL®); бексаротен (TARGRETIN®); бисфосфонаты, такие как клодронат (например, BONEFOS® или OSTAC®), этидронат (DIDROCAL®), NE-58095, золедроновую кислоту/золедронат (ZOMETA®), алендронат (FOSAMAX®), памидронат (AREDIA®), тилудронат (SKEL1D®) или ризедронат (ACTONEL®); и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина THERATOPE®; перифосин, ингибитор СОХ-2 (например, целекоксиб или эторикоксиб), ингибитор протеосомы (например, PS341); CCI-779; типифарниб (R11577); orafenib, АВТ510; ингибитор Bcl-2, такой как облимерсен натрия (GENASENSE®); pixantrone; ингибиторы фарнезилтрансферазы, такие как lonafarnib (SCH 6636, SARASAR™); и фармацевтически приемлемые соли, кислоты или производные любого из перечисленных выше веществ; а также комбинации двух или более любого из перечисленных выше веществ, таких как CHOP, аббревиатура для комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном; и FOLFOX, аббревиатура для схемы лечения с оксалиплатином (ELOXATIN™) в сочетании с 5-ФУ и лейковорином.
Химиотерапевтические агенты также включают нестероидные противовоспалительные препараты с болеутоляющим, жаропонижающим и противовоспалительным эффектами. НПВП (нестероидные противовоспалительные препараты) включают неселективные ингибиторы фермента циклооксигеназы. Конкретные примеры НПВП включают аспирин, производные пропионовой кислоты, такие как ибупрофен, фенопрофен, кетопрофен, флурбипрофен, оксапрозин и напроксен, производные уксусной кислоты, такие как индометацин, сулиндак, этодолак, диклофенак, производные эноловой кислоты, такие как пироксикам, мелоксикам, теноксикам, дроксикам, лорноксикам и изоксикам, производные фенаминовой кислоты, такие как мефенамовая кислота, меклофенамовая кислота, флуфенамовая кислота, толфенамовую кислоту, ингибиторы СОХ-2, такие как целекоксиб, эторикоксиб, лумиракоксиб, парекоксиб, рофекоксиб, рофекоксиб и вальдекоксиб. НПВП могут быть предписаны для облегчения симптомов таких заболеваний, как ревматоидный артрит, остеоартрит, воспалительные артропатии, ревматоидный спондилит, псориатический артрит, синдром Рейтера, острая подагра, дисменорея, метастатическая боль в костях, головная боль и мигрень, послеоперационная боль, боль из-за воспаления и повреждения тканей от легкой до умеренной степени тяжести, гипертермия, непроходимость кишечника и почечная колика.
Как используется в данном документе термин "агент, ингибирующий рост" относится к соединению или композиции, которая ингибирует рост клетки либо in vitro, либо in vivo. В одном варианте реализации изобретения агент, ингибирующий рост, представляет собой антитело, ингибирующее рост, которое предотвращает или уменьшает пролиферацию клеток, экспрессирующих антиген, с которым связывается антитело. В другом варианте реализации изобретения агент, ингибирующий рост, может быть таким, который значительно уменьшает процент клеток в S-фазе. Примеры агентов, ингибирующих рост, включают препараты, которые блокируют прохождение по клеточному циклу (в отличающемся от S-фазы положении), такие как препараты, которые индуцируют остановку G1 и М-фазы. Классические М-фазными блокаторы включают алкалоиды барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Те агенты, которые останавливают G1, также приводят к остановке S-фазы, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-С. Дополнительную информацию можно найти в Mendelsohn and Israel, eds., The Molecular Basis of Cancer, глава 1, озаглавленная "Cell cycle regulation, oncogenes, and antineoplastic drugs" от Murakami et al. (W.B. Saunders, Philadelphia, 1995), например, с. 13.
Под термином "лучевая терапия" подразумевают использование направленных гамма-лучей или бета-лучей для индуцирования достаточного повреждения клетки таким образом, чтобы ограничить ее способность нормально функционировать, или уничтожить клетку целиком. Следует принимать во внимание, что будет много способов, известных в данной области техники, для определения дозировки и продолжительность лечения. Типичные терапии назначаются в качестве одноразового применения и типичных дозировок в диапазоне от 10 до 200 единиц (Грей) в сутки.
"Субъект" или "индивидуум" для целей терапии относится к любому животному, классифицируемому как млекопитающее, включая человека, домашних и сельскохозяйственных животных, а также животных из зоопарков, спортивных или домашних животных, таких как собаки, лошади, кошки, коровы и т.д. Предпочтительно млекопитающее представляет собой человека. Субъект или индивидуум может быть пациентом.
Термин "антитело" используется в данном документе в самом широком смысле и конкретно охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, если они проявляют желаемую биологическую активность.
"Изолированное" антитело представляет собой антитело, которое было идентифицировано и отделено и/или извлечено из составной части его природного окружения. Примесные компоненты его природного окружения представляют собой материалы, которые будут мешать научно-исследовательским, диагностическим или терапевтическим применениям антитела, и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В некоторых вариантах реализации изобретения антитело очищают 1) до более чем 95% веса антитела, как определено, например, методом Лоури, а в некоторых вариантах реализации изобретения, до более чем 99% веса; 2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности, например, с использованием секвенатора с вращающимся стаканом, или 3) до гомогенности с помощью ДСН-ПААГ электрофореза в восстанавливающих или невосстанавливающих условиях с использованием окрашивания, например, кумасси голубым или серебром. Изолированное антитело включает антитело in situ в рекомбинантных клетках, после того как по меньшей мере один компонент природного окружения антитела не будет присутствовать. Однако обычно изолированное антитело будет получено по меньшей мере после одной стадии очистки.
"Нативные антитела", как правило, представляют собой гетеротетрамерные гликопротеины около 150000 дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, в то время как число дисульфидных связей варьирует среди тяжелых цепей различных изотипов иммуноглобулина. Также каждая тяжелая и легкая цепь имеет регулярно расположенные внутрицепочечные дисульфидные мостики. Каждая тяжелая цепь на одном конце имеет вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь имеет вариабельный домен на одном конце (VL) и константный домен на другом своем конце; константный домен легкой цепи располагается рядом с первым константным доменом тяжелой цепи, а вариабельный домен легкой цепи располагается рядом с вариабельным доменом тяжелой цепи. Как полагают, определенные аминокислотные остатки образуют область контакта между вариабельными доменами легкой цепи и тяжелой цепи.
Термин "константный домен" относится к части молекулы иммуноглобулина, которая имеет более консервативную аминокислотную последовательность по отношению к другой части иммуноглобулина, вариабельному домену, который содержит сайт связывания антигена. Константный домен содержит CH1, CH2 и CH3 домены (собирательно СН) тяжелой цепи и CH1, (или CL) домен легкой цепи.
"Вариабельный участок" или "вариабельный домен" антитела относится к амино-концевым доменам тяжелой или легкой цепи антитела. Вариабельный домен тяжелой цепи может упоминаться как "VH". Вариабельный домен легкой цепи может упоминаться как" VL". Эти домены в большинстве случаев наиболее вариабельные части антитела и содержат антиген-связывающие сайты.
Термин "вариабельный" относится к тому факту, что некоторые части вариабельных доменов в значительной степени различаются по последовательности среди антител и используются для связывания и специфичности каждого конкретного антитела в отношении своего конкретного антигена. Однако вариабельность неравномерно распределена по длине вариабельных доменов антител. Она сконцентрирована в трех сегментах, называемых гипервариабельные участки (HVR), в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высоко консервативные участки вариабельных доменов называются каркасными участками (FR). Вариабельные домены нативных тяжелых и легких цепей содержат по четыре FR участка, в основном принимающих конфигурацию бета-листа, соединенные тремя HVR, которые формируют петли, соединяющие структуру бета-листа, а в некоторых случаях образующие ее часть. HVR каждой цепи удерживаются совместно в непосредственной близости от FR областей и вместе с HVR из другой цепи способствуют образованию антигенсвязывающего участка антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, Md. (1991)). Константные домены не вовлечены непосредственно в связывание антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антитело-зависимой клеточной токсичности.
"Легкие цепи" антител (иммуноглобулинов) любого из видов млекопитающих могут быть отнесены к одному из двух четко различающихся типов, называемых каппа ("κ") и лямбда ("λ"), на основании аминокислотных последовательностей их константных доменов.
Используемый в данном документе термин "изотип" или "подкласс" IgG означает любой из подклассов иммуноглобулинов, определенных по химическим и антигенным характеристикам своих константных участков.
В зависимости от аминокислотных последовательностей константных доменов своих тяжелых цепей, антитела (иммуноглобулины), могут быть отнесены к различным классам. Существуют пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, а некоторые из них могут быть дополнительно подразделены на подклассы (изотипы), например, lgG1, lgG2, lgG3, lgG4, IgA1 и lgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются α, γ, ε, γ и μ, соответственно. Субъединичные структуры и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны и описаны в общих чертах, например, в Abbas et al. Cellular and Mol. Immunology, 4th ed. (W.B. Saunders, Co., 2000). Антитело может быть частью более крупной трансляционно слитой молекулы, образованной путем ковалентной или нековалентной связи антитела с одним или более другими белками или пептидами.
Используемые в данном документе взаимозаменяемые термины "полноразмерное антитело", "интактное антитело" и "полное антитело" относятся к антителу в его по существу интактной форме, а не к фрагментам антитела, как это определено ниже. В частности, термины относятся к антителу с тяжелыми цепями, которые содержат Fc участок.
"Неконъюгированное антитело" для целей данного документа представляет собой антитело, которое не конъюгировано с цитотоксической частью или радиометкой.
"Фрагменты антитела" включают часть интактного антитела, предпочтительно содержащую его антиген-связывающий участок. В некоторых вариантах реализации изобретения фрагмент антитела, описанный в данном документе, представляет собой антиген-связывающий фрагмент. Примеры фрагментов антител включают фрагменты Fab, Fab', F(ab')2 и Fv, димерные антитела, линейные антитела, молекулы одноцепочечных антител и мультиспецифические антитела, образованные из фрагментов антител.
Расщепление антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых "Fab" фрагменты, каждый из которых имеет один антигенсвязывающий сайт, и остаточного фрагмента "Fc", чье название отражает его способность легко кристаллизоваться. Обработка пепсином дает F(ab')2 фрагмент, который имеет два антиген-совмещенных сайта и все еще способен к перекрестному связыванию антигена.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный антиген-связывающий сайт. В одном варианте реализации изобретения двухцепочечная Fv разновидность состоит из димера вариабельного домена одной тяжелой и одной легкой цепи в тесной нековалентной связи. В одноцепочечной Fv (scFv) разновидности вариабельный домен одной тяжелой и одной легкой цепи могут быть ковалентно связаны посредством гибкого пептидного линкера таким образом, что легкие и тяжелые цепи могут ассоциироваться в "димерную" структуру, аналогичную такой в двухцепочной Fv разновидности. Именно в такой конфигурации три HVR каждого вариабельного домена взаимодействуют с образованием антиген-связывающего сайта на поверхности димера VH-VL. В совокупности эти шесть HVR придают антигенсвязывающую специфичность антителу. Тем не менее даже единичный вариабельный домен (или половина Fv, содержащая только три HVR, специфичные к антигену) обладает способностью распознавать и связывать антиген, хотя и со сниженной аффинностью, чем полный сайт связывания.
Фрагмент Fab содержит вариабельные домены тяжелой и легкой цепи, а также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab' фрагменты отличаются от Fab фрагментов из-за добавления нескольких остатков на карбоксильном конце тяжелой цепи СН1 домена, включая один или более цистеинов из шарнирной области антитела. В данном документе Fab'-SH представляет собой обозначение Fab', в котором цистеиновый остаток(и) константных доменов несут свободную тиольную группу. Фрагменты антитела F(ab')2 первоначально были получены как пары фрагментов Fab', которые имеют между собой шарнирные цистеины. Также известны другие химические соединения фрагментов антитела.
"Одноцепочечные Fv» или фрагменты антител "scFv" включают домены антитела VH и VL, причем эти домены присутствуют в одной полипептидной цепи. Как правило, полипептид scFv дополнительно включает полипептидный линкер между доменами VH и VL, который предоставляет возможность scFv формировать желаемую структуру для связывания антигена. Для обзора scFv, см., например,

Термин "димерные антитела" относится к фрагментам антитела с двумя антигенсвязывающими участками, причем фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в той же полипептидной цепи (VH-VL). При использовании линкера, который является слишком коротким, чтобы позволить спаривание между двумя доменами на одной и той же цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и создавать два антиген-связывающих сайта. Димерные антитела могут быть бивалентными или биспецифическими. Димерные антитела более подробно описаны, например, в ЕР 404097; WO 1993/01161; Hudson etal., Nat. Med. 9:129-134 (2003); и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Тримерные антитела и тетрамерные антитела также описаны в Hudson et al., Nat. Med. 9:129-134 (2003).
Используемый в данном документе термин "моноклональное антитело" относится к антителу, полученному из популяции по существу гомогенных антител, например, индивидуальные антитела, составляющие популяцию, представляют собой идентичные за исключением возможных мутаций, например, встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Таким образом, модифицированный "моноклональный" указывает на характер антитела, как не являющегося смесью дискретных антител. В некоторых вариантах реализации изобретения такое моноклональное антитело, как правило, включает антитело, содержащее полипептидную последовательность, которая связывается с мишенью, причем полипептидная последовательность, связывающаяся с мишенью, была получена с помощью способа, который включает выбор единичной полипептидной последовательности, которая связывается с мишенью, из множества полипептидных последовательностей. Например, селекционный процесс может заключатся в отборе уникального клона из множества клонов, таких как пул гибридомных клонов, фаговых клонов или рекомбинантных клонов ДНК. Следует понимать, что выбранная последовательность, связывающаяся с мишенью, может быть дополнительно изменена, например, для улучшения аффиности с мишенью, для гуманизирования последовательности, связывающейся с мишенью, для улучшения ее продукции в клеточной культуре, для уменьшения ее иммуногенности in vivo, для создания мультиспецифического антитела и т.д., и что антитело, содержащее измененную последовательность, связывающуюся с мишенью, также представляет собой моноклональное антитело по данному изобретению. В отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело в препарате моноклональных антител направлено против единичной детерминанты на антигене. В дополнение к своей специфичности, препараты моноклональных антител преимущественны в том, что они, как правило, не имеют примесей других иммуноглобулинов.
Модификатор "моноклональный" указывает на характер антитела, как полученного в основном из гомогенной популяции антител, и не должно быть истолковано как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, которые будут использоваться в соответствии с данным изобретением, могут быть получены различными способами, в том числе, например, способом гибридом (например, Kohler and Milstein, Nature, 256:495-97 (1975); Hongo et al., Hybridoma, 14 (3): 253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981)), способами с использованием рекомбинантной ДНК (см., например, патент США №4816567), фаг-дисплейными технологиями (см., например, Clackson et al., Nature, 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); и Lee et al., J. Immunol. Methods 284(1-2): 119-132 (2004), а также технологии для производства человеческих или человекоподобных антител в животных, которые имеют части или все локусы иммуноглобулина человека или гены, кодирующие последовательности иммуноглобулина человека (см., например, WO 1998/24893, WO 1996/34096, WO 1996/33735, WO 1991/10741, Jakobovits et al., Proc. Natl. Acad. Sci. USA 90: 2551 (1993); Jakobovits et al., Nature 362: 255-258 (1993); Bruggemann et al., Year in Immunol. 7:33 (1993); патенты США №№5545807; 5545806; 5569825; 5625126; 5633425 и 5661016; Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-813 (1994); Fishwild et al., Nature Biotechnol. 14: 845-851 (1996); Neuberger, Nature Biotechnol. 14: 826 (1996); и Lonberg et al., Intern. Rev. Immunol. 13: 65-93 (1995).
В данном документе моноклональные антитела конкретно включают "химерные" антитела, в которых часть тяжелой и/или легкой цепи является идентичной или гомологичной соответствующим последовательностям в антителах, полученных из конкретного вида или принадлежащих к конкретному классу или подклассу антител, тогда как оставшаяся часть цепи (цепей) является идентичной или гомологичной соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют желаемую биологическую активность (см., например, патент США №4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)). Химерные антитела включают PRIMATTZED® антитела, причем антиген-связывающий участок антитела получают из антитела, продуцируемого, например, в результате иммунизации обезьян макак целевым антигеном.
"Гуманизированные" формы нечеловеческих антител (например, мышиных) представляют собой химерные антитела, которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. В одном варианте реализации изобретения гуманизированное антитело представляет собой человеческий иммуноглобулин (реципиентное антитело), в котором остатки HVR реципиента заменены остатками HVR нечеловеческого вида (донорное антитело), такого как мышь, крыса, кролик или нечеловекообразный примат, обладающими желаемой специфичностью, аффинностью и/или производительностью. В некоторых случаях, остатки FR человеческого иммуноглобулина заменены соответствующими нечеловеческими остатками. Кроме того, гуманизированные антитела могут содержать остатки, которые не обнаруживаются в реципиентном антителе или в донорном антителе. Эти модификации могут быть сделаны для дополнительного улучшения проявления антитела. В общем, гуманизированное антитело будет содержать по существу всего по меньшей мере один, а обычно два вариабельных домена, в которых все или по существу все гипервариабельные петли соответствуют таковым из нечеловеческого иммуноглобулина, и все или по существу все FR являются таковыми из последовательности человеческого иммуноглобулина. Также гуманизированное антитело необязательно будет содержать по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, человеческого иммуноглобулина. Для дополнительной подробной информации, см., например, Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). Смотрите также, например, Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994); и. патенты США №№6982321 и 7087409.
"Человеческое антитело" представляет собой такое, которое имеет аминокислотную последовательность, которая соответствует таковой антитела, продуцируемого человеком и/или созданного с использованием любого из способов для получения антител человека, как описано в данном документе. Это определение человеческого антитела специфически исключает гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки. Человеческие антитела могут быть получены с использованием различных способов, известных в данной области техники, включая фаг-дисплейные библиотеки. Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991). Также доступными для получения моноклональных человеческих антител являются методы, описанные в Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boemer et al., J. Immunol., 147(1):86-95 (1991). Смотрите также van Dijk and van de Winkel, Curr. Opin. Pharmacol., 5: 368-74 (2001). Человеческие антитела могут быть получены путем введения антигена трансгенному животному, которое было модифицировано с целью получения таких антител в ответ на антигенный вызов, но чьи эндогенные локусы были деактивированы, например, иммунизированные ксено-мыши (xenomice) (см., например, патенты США №№6075181 и 6150584 касательно XENOMOUSE™ technology). Смотрите также, например, Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006) касательно человеческих антител, полученных с помощью технологии гибридом В-клеток человека.
"Видоспецифическое антитело" представляет собой такое, которое обладает более сильной аффинностью связывания с антигеном из одного вида млекопитающего, чем с гомологом этого антигена из другого вида млекопитающего. Обычно видоспецифическое антитело "специфически связывается" с человеческим антигеном (например, имеет значение аффинности связывания (Kd) не более чем около 1×10-7 М, предпочтительно не более чем около 1×10-8 М и предпочтительно не более чем около 1×10-9 М), но имеет аффинность связывания с гомологом антигена из другого нечеловеческого вида млекопитающих, которая по меньшей мере в около 50 раз, или по меньшей мере в около 500 раз, или по меньшей мере в около 1000 раз слабее, чем его аффинность связывания с человеческим антигеном. Видоспецифическое антитело может быть любым из различных типов антител, как это определено выше, но предпочтительно представляет собой гуманизированное или человеческое антитело.
Используемый в данном документе термин "гипервариабельный участок", "HVR" или "HV" относится к участкам вариабельного домена антитела, которые являются гипервариабельными по аминокислотной последовательности и/или формируют структурно определенные петли. Как правило, антитела содержат шесть HVR; три в VH (Н1, Н2, Н3) и три в VL (L1, L2, L3). В нативных антителах Н3 и L3 отображают наибольшее разнообразие из шести HVR, и, как полагают, Н3, в частности, играет уникальную роль в придании тонкой специфичности антителам. См., например, Xu et al., Immunity 13:37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, N.J., 2003). Действительно, встречающиеся в природе антитела верблюдовых, состоящие только из тяжелой цепи, функциональны и стабильны в отсутствие легкой цепи. См., например, Hamers-Casterman et al., Nature 363:446-448 (1993); Sheriff et al., Nature Struct. Biol. 3:733-736 (1996).
Ряд HVR очерчиваний используются и охватываются данным документом. Участки, определяющие комплементарность, (CDR) по Kabat, основаны на вариабельности аминокислотной последовательности и наиболее часто используются (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Chothia ссылается вместо этого на расположение структурных петель (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). HVRs AbM представляют собой компромисс между HVR Kabat и структурными петлями Chothia и используются программным обеспечением Oxford Molecular AbM для моделирования антител. "Контактирующие" HVR базируются на анализе имеющихся комплексных кристаллических структур. Аминокислотные остатки каждого из этих HVR отмечены ниже.

HVR могут содержать "расширенные HVR", изложенные ниже: 24-36 или 24-34 (L1), 46-56 или 50-56 (L2) и 89-97 или 89-96 (L3) в VL, и 26-35 (Н1), 50-65 или 49-65 (Н2) и 93-102, 94-102 или 95-102 (Н1) в VH. Аминокислотные остатки вариабельного домена пронумерованы в соответствии с Kabat et al., ранее, для каждого из этих определений.
Как определено в данном документе, "каркасные" или "FR" аминокислотные остатки вариабельного домена представляют собой те, которые не входят в аминокислотные остатки HVR.
Термин "нумерация аминокислотных остатков в вариабельном домене по Kabat" или "нумерация положения аминокислоты по Kabat" и их вариации относится к системе нумерации, используемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи, при компиляции антител по Kabat et al., ранее. Используя эту систему нумерации, реальная линейная аминокислотная последовательность может содержать меньшее число аминокислот или дополнительные аминокислоты, что соответствующие укорачиванию или вставке в FR или HVR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать единичную аминокислотную вставку (остаток 52а в соответствии с Kabat) после остатка 52 в Н2 и вставленные аминокислотные остатки (например, остатки 82а, 82b и 82с и т.д. в соответствии с Kabat) после FR аминокислотного остатка 82 тяжелой цепи. Нумерация аминокислотных остатков по Kabat может быть определена для данного антитела путем выравнивания гомологичных областей последовательности антитела со "стандартной" пронумерованной последовательностью по Kabat.
Система нумерации по Kabat, как правило, используется при рассмотрении аминокислотного остатка вариабельного домена (приблизительно аминокислотные остатки 1-107 легкой цепи и аминокислотные остатки 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). "Система нумерации EU" или "индекс EU", как правило, используется при рассмотрении аминокислотного остатка в константном участке тяжелой цепи иммуноглобулина (например, индекс EU представленный в Kabat et al., ранее). "Индекс EU по Kabat" относится к нумерации аминокислотного остатка антитела человека lgG1 EU.
Выражение "линейные антитела" относится к антителам, описанным в Zapata et al. (1995 Protein Eng, 8(10): 1057-1062). Кратко, эти антитела содержат пару тандемных сегментов Fd (VH-CH1-VH-CH1), которые совместно с комплементарными полипептидами легкой цепи формируют пару антигенсвязывающих участков. Линейные антитела могут быть биспецифическими или моноспецифическими.
Используемый в данном документе термин "связывается", "специфически связывается с" или "специфический для" относится к измеримым и воспроизводимым взаимодействиям, таким как связывание между мишенью и антителом, который является решающим фактором присутствия мишени в присутствии гетерогенной популяции молекул, включая биологические молекулы. Например, антитело, которое связывается или специфически связывается с мишенью (которая может быть эпитопом) представляет собой антитело, которое связывает эту мишень с большей аффинностью, авидностью, более легко и/или на более длительное время, чем оно связывается с другими мишенями. В одном варианте реализации изобретения степень связывания антитела с несоотносимой мишенью составляет менее чем около 10% от связывания антитела с мишенью, как измерено, например, путем радиоиммуноанализа (РИА). В некоторых вариантах реализации изобретения антитело, которое специфически связывается с мишенью, имеет константы диссоциации (Кд) ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ или ≤0,1 нМ. В некоторых вариантах реализации изобретения антитело специфически связывается с эпитопом белка, который является консервативным для белков из различных видов. В другом варианте реализации изобретения специфическое связывание может включать, но не является необходимым, ограничивающее связывание.
II. Антагонисты, связывающиеся с компонентами сигнального пути PD-1
В данном документе предлагаются способы терапии или задерживания прогрессирования рака у индивидуума, которые включают введение индивидууму эффективного количества антагониста, связывающегося с компонентом сигнального пути PD-1, и таксана. Также в данном документе предлагаются способы повышения иммунной функции у индивидуума с раком, которые включают введение индивидууму эффективного количества антагониста, связывающегося с компонентом сигнального пути PD-1, и таксана. Например, антагонист, связывающийся с компонентом сигнального пути PD-1, включает антагонист, связывающийся с PD-1, антагонист, связывающийся с PD-L1, и антагонист, связывающийся с PD-L2. В данной области техники PD-1 (белок программируемой смерти 1) также называют "белком программируемой клеточной гибели 1", "PDCD1", "CD279" и "SLEB2". Пример человеческого PD-1 показан на UniProtKB/Swiss-Prot Accession No. Q15116. В данной области техники PD-L1 (лиганд 1 белка программируемой смерти) также называют "лигандом 1 белка программируемой клеточной гибели 1", "PDCD1LG1", "CD274", "В7-Н" и "PDL1". Пример человеческого PD-L1 показан на UniProtKB/Swiss-Prot Accession No.Q9NZQ7.1. В данной области техники PD-L2 (лиганд 2 белка программируемой смерти) также называют "лигандом 2 белка программируемой клеточной гибели 1", "PDCD1LG2", "CD273", "В7-DC", "Btdc" и "PDL2". Пример человеческого PD-L2 показан на UniProtKB/Swiss-Prot Accession No. Q9BQ51. В некоторых вариантах реализации изобретения PD-1, PD-L1 и PD-L2 представляют собой человеческий PD-1, PD-L1 и PD-L2.
В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, представляет собой молекулу, которая ингибирует связывание PD-1 с его лигандными партнерами по связыванию. В конкретном аспекте лиганд-связывающие партнеры PD-1 представляют собой PD-L1 и/или PD-L2. В другом варианте реализации изобретения антагонист, связывающийся с PD-L1, представляет собой молекулу, которая ингибирует связывание PD-L1 сего партнерами по связыванию. В конкретном аспекте партнеры PD-L1 по связыванию представляют собой PD-1 и/или В7-1. В другом варианте реализации изобретения антагонист, связывающийся с PD-L2, представляет собой молекулу, которая ингибирует связывание PD-L2 с его партнерами по связыванию. В конкретном аспекте партнер PD-L2 по связыванию представляет собой PD-1. Антагонист может представлять собой антитело, его антиген-связывающий фрагмент, иммуноадгезин, трансляционно слитый белок или олигопептид.
В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, представляет собой анти-PD-l антитело (например, человеческое антитело, гуманизированное антитело или химерное антитело). В некоторых вариантах реализации изобретения анти-PD-1 антитело выбрано из группы, состоящей из MDX-1106 (nivolumab), МK-3475 (lambrolizumab) и СТ-011 (pidilizumab). В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, представляет собой иммуноадгезин (например, иммуноадгезин, содержащий внеклеточную или PD-1 связывающую часть PD-L1 или PD-L2, трансляционно слитую с константным участком (например, с Fc участком последовательности иммуноглобулина). В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-1, представляет собой АМР-224. В некоторых вариантах реализации изобретения антагонист, связывающийся с PD-L1, представляет собой анти-PD-L1 антитело. В некоторых вариантах реализации изобретения анти-PD-L1 антитело выбрано из группы, состоящей из YW243.55.S70, MPDL3280A, MDX-1105 и MEDI4736. Антитело YW243.55.S70 представляет собой анти-PD-L1, описанное в WO 2010/077634. MDX-1105, также известное как BMS-936559, представляет собой анти-PD-L1 антитело, описанное в WO 2007/005874. MEDI4736 представляет собой анти-PD-L1 моноклональное антитело, описанное в WO 2011/066389 и US 2013/034559. MDX-1106, также известное как MDX-1106-04, ONO-4538, BMS-936558 или nivolumab представляет собой анти-PD-l антитело, описанное в WO 2006/121168. МК-3475, также известное как lambrolizumab, представляет собой анти-PD-1 антитело, описанное в WO 2009/114335. СТ-011, также известное как hBAT, hBAT-1 или pidilizumab, представляет собой анти-PD-l антитело, описанное в WO 2009/101611. АМР-224, также известный как B7-DCIg, представляет собой PD-L2-FC трансляционно слитый растворимый рецептор, описанный в WO 2010/027827 и WO 2011/066342.
В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, представляет собой анти-PD-L1 антитело. В некоторых вариантах реализации изобретения анти-PD-L1 антитело способно ингибировать связывание между PD-L1 и PD-1 и/или между PD-L1 и В7-1. В некоторых вариантах реализации изобретения анти-PD-L1 антитело представляет собой моноклональное антитело. В некоторых вариантах реализации изобретения анти-PD-L1 антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab'-SH, Fv, scFv и (Fab')2 фрагментов. В некоторых вариантах реализации изобретения анти-PD-L1 антитело представляет собой гуманизированное антитело. В некоторых вариантах реализации изобретения анти-PD-L1 антитело представляет собой человеческое антитело.
Примеры анти-PD-L1 антител, используемые в способах данного изобретения, а также способы их получения описаны в патентной заявке РСТ WO 2010/077634, WO 2007/005874, WO 2011/066389 и США 2013/034559, которые включены в данный документ посредством ссылки. Анти-PD-L1 антитела, используемые в данном изобретении, в том числе композиции, содержащие такие антитела, могут быть использованы в комбинации с таксаном для терапии рака.
Анти-PD-1 антитела
В некоторых вариантах реализации изобретения анти-PD-l антитело представляет собой MDX-1106. Альтернативные названия для "MDX-1106" включают MDX-1106-04, ONO-4538, BMS-936558 или Nivolumab. В некоторых вариантах реализации изобретения анти-PD-1 антитело представляет собой nivolumab (CAS регистрационный номер: 946414-94-4). В еще одном дополнительном варианте реализации изобретения предлагается изолированное анти-PD-1 антитело, содержащее вариабельный участок тяжелой цепи, который включает аминокислотную последовательность вариабельного участка тяжелой цепи из SEQ ID NO: 1, и/или вариабельный участок легкой цепи, который включает аминокислотную последовательность вариабельного участка легкой цепи из SEQ ID NO: 2. В еще одном дополнительном варианте реализации изобретения предлагается изолированное анти-PD-1 антитело, содержащее последовательность тяжелой цепи и/или легкой цепи, при этом:
а) последовательность тяжелой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичности последовательности к последовательности тяжелой цепи:


б) последовательность легкой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичности последовательности с последовательностью легкой цепи:

Анти-PD-L1 антитела
В некоторых вариантах реализации изобретения антитело в композиции содержит по меньшей мере один триптофан (например, по меньшей мере два, по меньшей мере три или по меньшей мере четыре) в последовательности тяжелой и/или легкой цепи. В некоторых вариантах реализации изобретения аминокислота триптофан находится в HVR участках, каркасных участках и/или константных участках антитела. В некоторых вариантах реализации изобретения антитело включает два или три остатка триптофана в HVR участках. В некоторых вариантах реализации изобретения антитело в композиции представляет собой анти-PD-L1 антитело. PD-L1 (лиганд 1 белка программируемой смерти), также известный как PDL1, В7-Н1, В7-4, CD274 и В7-Н, представляет собой трансмембранный белок, и его взаимодействие с PD-1 ингибирует Т-клеточную активацию и продукцию цитокинов. В некоторых вариантах реализации изобретения анти-PD-L1 антитело, описанное в данном документе, связывается с человеческим PD-L1. Примеры анти-PD-L1 антител, которые могут быть использованы в способах, описанных в данном документе, описаны в патентной заявке РСТ WO 2010/077634 А1 и США 8217149, которые включены в данный документ в полном объеме посредством ссылки.
В некоторых вариантах реализации изобретения анти-PD-L1 антитело способно ингибировать связывание между PD-L1 и PD-1 и/или между PD-L1 и В7-1. В некоторых вариантах реализации изобретения анти-PD-L1 антитело представляет собой моноклональное антитело. В некоторых вариантах реализации изобретения анти-PD-L1 антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab'-SH, Fv, scFv и (Fab')2 фрагментов. В некоторых вариантах реализации изобретения анти-PD-L1 антитело представляет собой гуманизированное антитело. В некоторых вариантах реализации изобретения анти-PD-L1 антитело представляет собой человеческое антитело.
Анти-PD-L1 антитела, описанные в патентной заявке РСТ WO 2010/077634 А1 и США 8217149, могут быть использованы в способах, описанных в данном документе. В некоторых вариантах реализации изобретения анти-PD-L1 антитело содержит последовательность вариабельного участка тяжелой цепи из SEQ ID NO: 3 и/или последовательность вариабельного участка легкой цепи из SEQ ID NO: 4. В еще одном дополнительном варианте реализации изобретения предлагается изолированное анти-PD-L1 антитело, содержащее последовательность вариабельного участка тяжелой цепи и/или вариабельного участка легкой цепи, при этом:
а) последовательность тяжелой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичности последовательности к последовательности тяжелой цепи:

б) последовательность легкой цепи имеет по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичности последовательности к последовательности легкой цепи:

В одном варианте реализации изобретения анти-PD-L1 антитело содержит вариабельный участок тяжелой цепи, который включает последовательности HVR-H1, HVR-H2 и HVR-H3, причем:
а) последовательность HVR-H1 представляет собой GFTFSX1SWIH (SEQ ID NO: 5);
б) последовательность HVR-H2 представляет собой AWIX2PYGGSX3YYADSVKG (SEQ ID NO: 6);
в) последовательность HVR-H3 представляет собой RHWPGGFDY (SEQ ID NO: 7); дополнительно при этом: Х1 представляет собой D или G; Х2 представляет собой S или L; Х3 представляет собой Т или S. В одном конкретном аспекте X, представляет собой D; Х2 представляет собой S и Х3 представляет собой Т.
В другом аспекте полипептид дополнительно содержит каркасные последовательности вариабельных участков тяжелой цепи, помещенные между HVR согласно формуле: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4). В еще одном аспекте каркасные последовательности являются производными человеческих консенсусных каркасных последовательностей. В дополнительном аспекте каркасные последовательности представляют собой консенсусную каркасную последовательность подгруппы III VH. В еще одном дополнительном аспекте по меньшей мере одна из каркасных последовательностей представляет собой следующую:
HC-FR1 представляет собой EVQLVESGGGLVQPGGSLRLSCAAS (SEQ ID NO: 8)
HC-FR2 представляет собой WVRQAPGKGLEWV (SEQ ID NO: 9)
HC-FR3 представляет собой
RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR (SEQ ID NO: 10)
HC-FR4 представляет собой WGQGTLVTVSA (SEQ ID NO: 11).
В еще одном дополнительном аспекте полипептид тяжелой цепи дополнительно объединен с вариабельным участком легкой цепи, которая содержит HVR-L1, HVR-L2 и HVR-L3, причем:
а) последовательность HVR-L1 представляет собой RASQX4X5X6TX7X8A (SEQ ID NO: 12);
6) последовательность HVR-L2 представляет собой SASX9LX10S (SEQ ID NO: 13);
в) последовательность HVR-L3 представляет собой QQX11X12X13X14PX15T (SEQ ID NO: 14); при этом Х4 представляет собой D или V; Х5 представляет собой V или I; Х6 представляет собой S или N; Х7 представляет собой А или F; Х8 представляет собой V или L; Х9 представляет собой F или Т; Х10 представляет собой Y или А; Х11 представляет собой Y, G, F или S; Х12 представляет собой L, Y, F или W; Х13 представляет собой Y, N, А, Т, G, F или I; Х14 представляет собой Н, V, Р, Т или I; Х15 представляет собой A, W, R, Р или Т. В еще одном дополнительном аспекте Х4 представляет собой D; Х5 представляет собой V; Х6 представляет собой S; Х7 представляет собой А; Х8 представляет собой V; Х9 представляет собой F; Х10 представляет собой Y; Х11 представляет собой Y; Х12 представляет собой L; Х13 представляет собой Y; Х14 представляет собой Н; Х15 представляет собой А.
В еще одном дополнительном аспекте легкая цепь дополнительно содержит каркасные последовательности вариабельного участка легкой цепи, помещенные между HVR согласно формуле: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном дополнительном аспекте каркасные последовательности являются производными человеческих консенсусных каркасных последовательностей. В еще одном дополнительном аспекте каркасные последовательности представляют собой консенсусную каркасную последовательность каппа I VL. В еще одном дополнительном аспекте по меньшей мере одна из каркасных последовательностей представляет собой следующую:
LC-FR1 представляет собой DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 15)
LC-FR2 представляет собой WYQQKPGKAPKLL1Y (SEQ ID NO: 16)
LC-FR3 представляет собой
GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 17)
LC-FR4 представляет собой FGQGTKVEIKR (SEQ ID NO: 18).
В другом варианте реализации изобретения предлагается изолированное анти-PD-L1 антитело или антиген-связывающий фрагмент, который включает последовательность вариабельного участка тяжелой цепи и легкой цепи, причем:
(a) тяжелая цепь включает HVR-H1, HVR-H2 и HVR-H3, при этом дополнительно:
(i) последовательность HVR-H1 представляет собой GFTFSX1SWIH (SEQ ID NO: 5),
(ii) последовательность HVR-H2 представляет собой AWIX2PYGGSX3YYADSVKG (SEQ ID NO: 6),
(iii) последовательность HVR-H3 представляет собой RHWPGGFDY и (SEQ ID NO: 7),
(b) легкая цепь включает HVR-L1, HVR-L2 и HVR-L3, при этом дополнительно:
(i) последовательность HVR-L1 представляет собой RASQX4X5X6TX7X8A (SEQ ID NO: 12),
(ii) последовательность HVR-L2 представляет собой SASX9LX10S и (SEQ ID NO: 13),
(iii) последовательность HVR-L3 представляет собой QQX11X12X13X14PX15T (SEQ ID NO: 14),
при этом: Х1 представляет собой D или G; X2 представляет собой S или L; X3 представляет собой T или S; X4 представляет собой D или V; Х5 представляет собой V или I; Х6 представляет собой S или N; Х7 представляет собой А или F; Х8 представляет собой V или L; Х9 представляет собой F или Т; Х10 представляет собой Y или А; Х11 представляет собой Y, G, F или S; Х12 представляет собой L, Y, F или W; Х13 представляет собой Y, N, А, Т, G, F или I; Х14 представляет собой Н, V, Р, Т или I; Х15 представляет собой A, W, R, Р или Т. В конкретном аспекте X1 представляет собой D; Х2 представляет собой S и Х3 представляет собой Т. В другом аспекте Х4 представляет собой D; Х5 представляет собой V; Х6 представляет собой S; Х7 представляет собой А; Х8 представляет собой V; Х9 представляет собой F; Х10 представляет собой Y; Х11 представляет собой Y; Х12 представляет собой L; Х13 представляет собой Y; Х14 представляет собой Н; Х15 представляет собой А. Еще в одном аспекте X1 представляет собой D; Х2 представляет собой S и Х3 представляет собой Т, Х4 представляет собой D; Х5 представляет собой V; Х6 представляет собой S; Х7 представляет собой А; Х8 представляет собой V; Х9 представляет собой F; Х10 представляет собой Y; Х11 представляет собой Y; Х12 представляет собой L; Х13 представляет собой Y; Х14 представляет собой Н и Х15 представляет собой А.
В дополнительном аспекте вариабельный участок тяжелой цепи включает одну или более каркасных последовательностей, помещенных между HVR как: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), а вариабельные участки легкой цепи включают одну или более каркасных последовательностей, помещенных между HVR как: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном дополнительном аспекте каркасные последовательности являются производными человеческих консенсусных каркасных последовательностей. Еще в дополнительном аспекте каркасные последовательности тяжелой цепи являются производными последовательности подгруппы I, II или III по Kabat. Еще в дополнительном аспекте каркасная последовательность тяжелой цепи представляет собой консенсусную последовательность подгруппы III VH. Еще в дополнительном аспекте одна или более каркасных последовательностей тяжелой цепи предлагаются как SEQ ID NO №8, 9, 10 и 11. Еще в дополнительном аспекте каркасные последовательности легкой цепи являются производными каппа последовательности из подгруппы I, II, II или IV по Kabat. Еще в дополнительном аспекте каркасные последовательности легкой цепи представляют собой консенсусную каркасную последовательность каппа I VL. Еще в дополнительном аспекте одна или более каркасных последовательностей легкой цепи предлагаются как SEQ ID NO: №15, 16, 17 и 18.
Еще в дополнительном конкретном аспекте антитело дополнительно содержит человеческий или мышиный константный участок. Еще в дополнительном аспекте человеческий константный участок выбран из группы, состоящей из lgG1, lgG2, lgG2, lgG3, lgG4. Еще в дополнительном конкретном аспекте человеческий константный участок представляет собой lgG1. Еще в дополнительном аспекте мышиный константный участок выбран из группы, состоящей из lgG1, lgG2A, lgG2B, lgG3. Еще в дополнительном аспекте мышиный константный участок представляет собой lgG2A. Еще в дополнительном конкретном аспекте антитело обладает уменьшенной или минимальной эффекторной функцией. Еще в дополнительном конкретном аспекте минимальная эффекторная функция является результатом "Fc мутации отсутствия эффекторной функции" или агликозилирования. Еще в дополнительном варианте реализации изобретения Fc мутация отсутствия эффекторной функции представляет собой замену N297A или D265A/N297A в константном участке.
Еще в одном варианте реализации изобретения предлагается анти-PD-L1 антитело, содержащее последовательность вариабельного участка тяжелой цепи и легкой цепи, при этом:
(a) тяжелая цепь дополнительно содержит последовательность HVR-H1, HVR-H2 и HVR-H3, которая имеет по меньшей мере 85% идентичности с последовательностью GFTFSDSWIH (SEQ ID NO: 19), AWISPYGGSTYYADSVKG (SEQ ID NO: 20) и RHWPGGFDY (SEQ ID NO: 21), соответственно, или
(b) легкая цепь дополнительно содержит последовательность HVR-L1, HVR-L2 и HVR-L3, которая имеет по меньшей мере 85% идентичности с последовательностью RASQDVSTAVA (SEQ ID NO: 22), SASFLYS (SEQ ID NO: 23) и QQYLYHPAT (SEQ ID NO: 24), соответственно.
В конкретном аспекте идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%.
В другом аспекте вариабельный участок тяжелой цепи включает одну или более каркасных последовательностей, помещенных между HVR как: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), а вариабельные участки легкой цепи включают одну или более каркасных последовательностей, помещенных между HVR как: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном аспекте каркасные последовательности являются производными человеческих консенсусных каркасных последовательностей. Еще в дополнительном аспекте каркасные последовательности тяжелой цепи являются производными последовательности подгруппы I, II или III по Kabat. Еще в дополнительном аспекте каркасная последовательность тяжелой цепи представляет собой консенсусную последовательность подгруппы III VH. Еще в дополнительном аспекте одна или более каркасных последовательностей тяжелой цепи предлагаются как SEQ ID NO:№8, 9, 10 и 11. Еще в дополнительном аспекте каркасные последовательности легкой цепи являются производными каппа последовательности из подгруппы I, II, II или IV по Kabat. Еще в дополнительном аспекте каркасные последовательности легкой цепи представляют собой консенсусную каркасную последовательность каппа I VL. Еще в дополнительном аспекте одна или более каркасных последовательностей легкой цепи предлагаются как SEQ ID NO: №15, 16, 17 и 18.
Еще в дополнительном конкретном аспекте антитело дополнительно содержит человеческий или мышиный константный участок. Еще в дополнительном аспекте человеческий константный участок выбран из группы, состоящей из lgG1, lgG2, lgG2, lgG3, lgG4. Еще в дополнительном конкретном аспекте человеческий константный участок представляет собой lgG1. Еще в дополнительном аспекте мышиный константный участок выбран из группы, состоящей из lgG1, lgG2A, lgG2B, lgG3. Еще в дополнительном аспекте мышиный константный участок представляет собой lgG2A. Еще в дополнительном конкретном аспекте антитело обладает уменьшенной или минимальной эффекторной функцией. Еще в дополнительном конкретном аспекте минимальная эффекторная функция является результатом "Fc мутации отсутствия эффекторной функции" или агликозилирования. Еще в дополнительном варианте реализации изобретения Fc мутация отсутствия эффекторной функции представляет собой замену N297A или D265A/N297A в константном участке.
В другом дополнительном варианте реализации изобретения предлагается изолированное анти-PD-L1 антитело, содержащее последовательность вариабельного участка тяжелой цепи и легкой цепи, при этом:
а) последовательность тяжелой цепи имеет по меньшей мере 85% идентичности с последовательностью тяжелой цепи:

б) последовательность легкой цепи имеет по меньшей мере 85% идентичности с последовательностью легкой цепи:

В конкретном аспекте идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%. В другом аспекте вариабельный участок тяжелой цепи включает одну или более каркасных последовательностей, помещенных между HVR как: (HC-FR1)-(HVR-H1)-(HC-FR2HHVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), а вариабельные участки легкой цепи включают одну или более каркасных последовательностей, помещенных между HVR как: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном аспекте каркасные последовательности являются производными человеческих консенсусных каркасных последовательностей. В дополнительном аспекте каркасные последовательности тяжелой цепи являются производными последовательности подгруппы I, II или III по Kabat. Еще в дополнительном аспекте каркасная последовательность тяжелой цепи представляет собой консенсусную последовательность подгруппы III VH. Еще в дополнительном аспекте одна или более каркасных последовательностей тяжелой цепи предлагаются как SEQ ID NO: №8, 9, 10 и WGQGTLVTVSS (SEQ ID NO: 27).
Еще в дополнительном аспекте каркасные последовательности легкой цепи являются производными каппа последовательности из подгруппы I, II, II или IV по Kabat. Еще в дополнительном аспекте каркасные последовательности легкой цепи представляют собой консенсусную каркасную последовательность каппа I VL. Еще в дополнительном аспекте одна или более каркасных последовательностей легкой цепи предлагаются как SEQ ID NO: №15, 16, 17 и 18.
Еще в дополнительном конкретном аспекте антитело дополнительно содержит человеческий или мышиный константный участок. Еще в дополнительном аспекте человеческий константный участок выбран из группы, состоящей из lgG1, lgG2, lgG2, lgG3, lgG4. Еще в дополнительном конкретном аспекте человеческий константный участок представляет собой lgG1. Еще в дополнительном аспекте мышиный константный участок выбран из группы, состоящей из lgG1, lgG2A, lgG2B, lgG3. Еще в дополнительном аспекте мышиный константный участок представляет собой lgG2A. Еще в дополнительном конкретном аспекте антитело обладает уменьшенной или минимальной эффекторной функцией. Еще в дополнительном конкретном аспекте минимальная эффекторная функция является результатом продуцирования в прокариотических клетках. Еще в дополнительном конкретном аспекте минимальная эффекторная функция является результатом "Fc мутации отсутствия эффекторной функции" или агликозилирования. Еще в дополнительном варианте реализации изобретения Fc мутация отсутствия эффекторной функции представляет собой замену N297A или D265A/N297A в константном участке.
В дополнительном аспекте вариабельный участок тяжелой цепи включает одну или более каркасных последовательностей, помещенных между HVR как: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), а вариабельные участки легкой цепи включают одну или более каркасных последовательностей, помещенных между HVR как: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном дополнительном аспекте каркасные последовательности являются производными человеческих консенсусных каркасных последовательностей. Еще в дополнительном аспекте каркасные последовательности тяжелой цепи являются производными последовательности подгруппы I, II или III по Kabat. Еще в дополнительном аспекте каркасная последовательность тяжелой цепи представляет собой консенсусную последовательность подгруппы III VH. Еще в дополнительном аспекте одна или более каркасных последовательностей тяжелой цепи представляют собой следующие:
HC-FR1 EVQLVESGGGLVQPGGSLRLSCAASGFTFS (SEQ ID NO: 29),
HC-FR2 WVRQAPGKGLEWVA (SEQ ID NO: 30),
HC-FR3 RFTISADTSKNTAYLQMNSLRAEDTAVYYCAR (SEQ ID NO: 10),
HC-FR4 WGQGTLVTVSS (SEQ ID NO: 27).
Еще в дополнительном аспекте каркасные последовательности легкой цепи являются производными каппа последовательности из подгруппы I, II, II или IV по Kabat. Еще в дополнительном аспекте каркасные последовательности легкой цепи представляют собой консенсусную каркасную последовательность каппа I VL. Еще в дополнительном аспекте одна или более каркасных последовательностей легкой цепи представляют собой следующие:
LC-FR1 DIQMTQSPSSLSASVGDRVTITC (SEQ ID NO: 15),
LC-FR2 WYQQKPGKAPKLLIY (SEQ ID NO: 16),
LC-FR3 GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (SEQ ID NO: 17),
LC-FR4 FGQGTKVEIK (SEQ ID NO: 28).
Еще в дополнительном конкретном аспекте антитело дополнительно содержит человеческий или мышиный константный участок. Еще в дополнительном аспекте человеческий константный участок выбран из группы, состоящей из lgG1, lgG2, lgG2, lgG3, lgG4. Еще в дополнительном конкретном аспекте человеческий константный участок представляет собой lgG1. Еще в дополнительном аспекте мышиный константный участок выбран из группы, состоящей из lgG1, lgG2A, lgG2B, lgG3. Еще в дополнительном аспекте мышиный константный участок представляет собой lgG2A. Еще в дополнительном конкретном аспекте антитело обладает уменьшенной или минимальной эффекторной функцией. Еще в дополнительном конкретном аспекте минимальная эффекторная функция является результатом "Fc мутации отсутствия эффекторной функции" или агликозилирования. Еще в дополнительном варианте реализации изобретения Fc мутация отсутствия эффекторной функции представляет собой замену N297A или D265A/N297A в константном участке.
Еще в одном варианте реализации изобретения предлагается анти-PD-L1 антитело, содержащее последовательность вариабельного участка тяжелой цепи и легкой цепи, при этом:
(с) тяжелая цепь дополнительно содержит последовательность HVR-H1, HVR-H2 и HVR-H3, которая имеет по меньшей мере 85% идентичности с последовательностью GFTFSDSWIH (SEQ ID NO: 19), AWISPYGGSTYYADSVKG (SEQ ID NO: 20) и RHWPGGFDY (SEQ ID NO: 21), соответственно, и/или
(d) легкая цепь дополнительно содержит последовательность HVR-L1, HVR-L2 и HVR-L3, которая имеет по меньшей мере 85% идентичности с последовательностью RASQDVSTAVA (SEQ ID NO: 22), SASFLYS (SEQ ID NO: 23) и QQYLYHPAT (SEQ ID NO: 24), соответственно.
В конкретном аспекте идентичность последовательности составляет 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%.
В другом аспекте вариабельный участок тяжелой цепи включает одну или более каркасных последовательностей, помещенных между HVR как: (HC-FR1)-(HVR-H1)-(HC-FR2)-(HVR-H2)-(HC-FR3)-(HVR-H3)-(HC-FR4), а вариабельные участки легкой цепи включают одну или более каркасных последовательностей, помещенных между HVR как: (LC-FR1)-(HVR-L1)-(LC-FR2)-(HVR-L2)-(LC-FR3)-(HVR-L3)-(LC-FR4). В еще одном аспекте каркасные последовательности являются производными человеческих консенсусных каркасных последовательностей. Еще в дополнительном аспекте каркасные последовательности тяжелой цепи являются производными последовательности подгруппы I, II или III по Kabat. Еще в дополнительном аспекте каркасная последовательность тяжелой цепи представляет собой консенсусную последовательность подгруппы III VH. Еще в дополнительном аспекте одна или более каркасных последовательностей тяжелой цепи предлагаются как SEQ ID NO:№8, 9, 10 и WGQGTLVTVSSASTK (SEQ ID NO: 31).
Еще в дополнительном аспекте каркасные последовательности легкой цепи являются производными каппа последовательности из подгруппы I, II, II или IV по Kabat. Еще в дополнительном аспекте каркасные последовательности легкой цепи представляют собой консенсусную каркасную последовательность каппа I VL. Еще в дополнительном аспекте одна или более каркасных последовательностей легкой цепи предлагаются как SEQ ID NO: №15, 16, 17 и 18. Еще в дополнительном конкретном аспекте антитело дополнительно содержит человеческий или мышиный константный участок. Еще в дополнительном аспекте человеческий константный участок выбран из группы, состоящей из lgG1, lgG2, lgG2, lgG3, lgG4. Еще в дополнительном конкретном аспекте человеческий константный участок представляет собой IgGl Еще в дополнительном аспекте мышиный константный участок выбран из группы, состоящей из lgG1, lgG2A, lgG2B, lgG3. Еще в дополнительном аспекте мышиный константный участок представляет собой lgG2A. Еще в дополнительном конкретном аспекте антитело обладает уменьшенной или минимальной эффекторной функцией. Еще в дополнительном конкретном аспекте минимальная эффекторная функция является результатом "Fc мутации отсутствия эффекторной функции" или агликозилирования. Еще в дополнительном варианте реализации изобретения Fc мутация отсутствия эффекторной функции представляет собой замену N297A или D265A/N297A в константном участке.
Еще в дополнительном варианте реализации изобретения предлагается изолированное анти-PD-L1 антитело, содержащее последовательность вариабельного участка тяжелой цепи и легкой цепи, в котором:
а) последовательность тяжелой цепи имеет по меньшей мере 85% идентичности с последовательностью тяжелой цепи:


б) последовательность легкой цепи имеет по меньшей мере 85% идентичности с последовательностью легкой цепи:

В некоторых вариантах реализации изобретения предлагается изолированное анти-PD-L1 антитело, содержащее последовательность вариабельного участка тяжелой цепи и легкой цепи, причем последовательность вариабельного участка легкой цепи имеет по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичности последовательности с аминокислотной последовательностью из SEQ ID NO: 4. В некоторых вариантах реализации изобретения предлагается изолированное анти-PD-L1 антитело, содержащее последовательность вариабельного участка тяжелой цепи и легкой цепи, причем последовательность вариабельного участка тяжелой цепи имеет по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичности последовательности с аминокислотной последовательностью из SEQ ID NO: 26. В некоторых вариантах реализации изобретения предлагается изолированное анти-PD-L1 антитело, содержащее последовательность вариабельного участка тяжелой цепи и легкой цепи, причем последовательность вариабельного участка легкой цепи имеет по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичности последовательности с аминокислотной последовательностью из SEQ ID NO: 4; и последовательность вариабельного участка тяжелой цепи имеет по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичности последовательности с аминокислотной последовательностью из SEQ ID NO: 26. В некоторых вариантах реализации изобретения один, два, три, четыре или пять аминокислотных остатков на N-конце тяжелой и/или легкой цепи могут быть удалены, замещены или модифицированы.
Еще в одном дополнительном варианте реализации изобретения предлагается изолированное анти-PD-L1 антитело, содержащее последовательность тяжелой цепи и легкой цепи, при этом:
а) последовательность тяжелой цепи имеет по меньшей мере 85% идентичности с последовательностью тяжелой цепи:

б) последовательность легкой цепи имеет по меньшей мере 85% идентичности с последовательностью легкой цепи:

В некоторых вариантах реализации изобретения предлагается изолированное анти-PD-L1 антитело, содержащее последовательность тяжелой цепи и легкой цепи, причем последовательность легкой цепи имеет по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с аминокислотной последовательностью из SEQ ID NO: 33. В некоторых вариантах реализации изобретения предлагается изолированное анти-PD-L1 антитело, содержащее последовательность тяжелой цепи и легкой цепи, причем последовательность тяжелой цепи имеет по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с аминокислотной последовательностью из SEQ ID NO: 32. В некоторых вариантах реализации изобретения предлагается изолированное анти-PD-L1 антитело, содержащее последовательность тяжелой цепи и легкой цепи, причем последовательность легкой цепи имеет по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с аминокислотной последовательностью из SEQ ID NO: 33 и последовательность тяжелой цепи имеет по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичности последовательности с аминокислотной последовательностью из SEQ ID NO: 32.
В некоторых вариантах реализации изобретения изолированное анти-PD-L1 антитело представляет собой агликозилированное. Гликозилирование антител представляет собой, как правило, либо N-гликозилирование, либо О-гликозилирование. N-гликозилирование относится к присоединению остатка сахара к боковой цепи аспарагинового остатка. Трипептидные последовательности аспарагин-Х-серин и аспарагин-Х-треонин, где X представляет собой любую аминокислоту, за исключением пролина, представляют собой последовательности распознавания для ферментативного присоединения остатка сахара к боковой цепи аспарагина. Таким образом, наличие любой из этих трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. О-связанное гликозилирование относится к присоединению одного из Сахаров N-ацетилгалактозамина, галактозы или ксилозы к гидроксиаминокислоте, чаще всего к серину или треонину, хотя также могут использоваться 5-гидроксипролин или 5-гидроксилизин. Удаление сайтов гликозилирования, формирующих антитело, удобно осуществлять путем изменения аминокислотной последовательности таким образом, что одна из вышеуказанных последовательностей трипептида (для сайтов N-связанного гликозилирования) удаляется. Изменение может быть сделано путем замены аспарагиновых, сериновых или треониновых остатков в пределах сайта гликозилирования другим аминокислотным остатком (например, глицином, аланином или консервативным замещением).
В любом варианте реализации изобретения в данном документе изолированное анти-PD-L1 антитело может связываться с человеческим PD-L1, например, с человеческим PD-L1, показанным на UniProtKB/Swiss-Prot Accession No.Q9NZQ7.1, или его вариантом.
Еще в дополнительном варианте реализации изобретения предлагается изолированная нуклеиновая кислота, кодирующая любое из антител, описанных в данном документе. В некоторых вариантах реализации изобретения нуклеиновая кислота дополнительно содержит вектор, подходящий для экспрессии нуклеиновой кислоты, кодирующей любое из ранее описанных анти-PD-L1 антител. Еще в дополнительном конкретном аспекте вектор представляет собой клетку-хозяина, подходящую для экспрессии нуклеиновой кислоты. Еще в дополнительном конкретном аспекте клетка-хозяин представляет собой эукариотическую клетку или прокариотическую клетку. Еще в дополнительном конкретном аспекте эукариотическая клетка представляет собой клетку млекопитающего, такую как яичник китайского хомячка (СНО).
Антитело или его антиген-связывающий фрагмент могут быть получены с использованием способов, известных в данной области техники, например, по способу, включающему культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую любое из вышеупомянутых анти-PD-L1 антител или антиген-связывающий фрагмент, в форме, подходящей для экспрессии, в условиях, подходящих для получения такого антитела или фрагмента, и выделение антитела или фрагмента.
III. Получение антител
Антитела, описанные в данном документе, получали с использованием способов, доступных в области техники получения антител, примеры которых детально описаны в последующих разделах.
Антитело направлено против целевого антигена (например, PD-L1 (такой как человеческий PD-L1), PD1 (такой как человеческий PD-L1), PD-L2 (такой как человеческий PD-L2), и т.д.). Предпочтительно антиген является биологически важным полипептидом и введение антитела страдающему болезнью млекопитающему может иметь терапевтический эффект для этого млекопитающего.
В определенных вариантах реализации изобретения представленное в данном документе антитело имеет константы диссоциации (Kd)≤1 мкМ, ≤150 нМ, ≤100 нМ, ≤50 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М).
В одном варианте реализации изобретения Кд измеряли способом связывания радиоактивной метки (РИА), проводимого с использованием версии Fab целевого антитела и его антигена, как описано в последующем анализе. Аффинность связывания Fab с антигеном в растворе измеряли путем уравновешивания Fab с минимальной концентрацией антигена, меченого (125I)-меткой, в присутствии серии титрований немеченного антигена, и последующего сбора связанного антигена плашкой, покрытой анти-Fab антителом (см., например, Chen et al., J. Mol. Biol. 293:865-881(1999)). Для подготовки условий для анализа многолуночные плашки MICROTITER® (Thermo Scientific) заполняли 5 мкг/мл покрывным анти-Fab антителом (Cappel Labs) в 50 мМ хлорида натрия (рН 9,6) в течение ночи, после чего блокировали 2% (масс/об.) бычьим сывороточным альбумином в PBS два-пять часов при комнатной температуре (около 23°С) В неадсорбентной плашке (Nunc #269620) смешивали 100 пМ или 26 пМ [125I]-антигена с серией растворов целевого Fab. После этого целевой Fab инкубировали в течение ночи; хотя инкубирование могло продолжаться больший период времени (например, около 65 часов), чтобы удостовериться в установлении равновесия. После этого смеси переносили на плашки для сбора и инкубировали при комнатной температуре (например, в течение часа). После этого раствор убирали и плашку промывали восемь раз 0,1% полисорбатом 20 (TWEEN-20®) в PBS. После высыхания плашек добавляли 150 мкл/лунку сцинтиллянта (MICROSCINT-20™, Packard) и плашки анализировали на измерителе гамма-излучения TOPCOUNT™ (Packard) в течение десяти минут. Концентрации каждого Fab, показывавшего 20% или менее от максимального связывания, выбирались для использования в конкурентных анализах связывания.
Согласно еще одному варианту реализации изобретения Кд измеряется с помощью метода поверхностного плазмонного резонанса с использованием BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Piscataway, NJ) при 25°C с чипами с иммобилизованным антигеном СМ5 при около 10 единицах ответа (ЕО). Вкратце, биосенсорные чипы на основе карбоксиметилированного декстрана (СМ5, BIACORE, Inc.) активируются N-этил-N'-(3-диметиламинопропил)карбодиимид гидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями изготовителя. Антиген растворяли 10 мМ ацетатом натрия, рН 4,8, до 5 мкг/мл (около 0,2 мкМ) перед введением при расходе 5 мкл/мин для достижения 10 единиц ответа (ЕО) связанного белка. После введения антигена, вводили 1 М этаноламина для блокирования не прореагировавших групп. Для измерений кинетики двукратные серии разведений Fab (от 0,78 нМ до 500 нМ) вводили в PBS с 0,05% полисорбат 20 (TWEEN-20™) сурфактантом (PBST) при 25°С при расходе около 25 мкл/мин. Скорости ассоциации (kon) и диссоциации (koff) рассчитывались как простые однозначные модели связывания Лангмюра (BIACORE® Evaluation Software version 3.2) путем одновременного фитирования сенсограмм ассоциации и диссоциации. Равновесная константа диссоциации (Кд) рассчитывалась как отношение koff/kon См., например, Chen et al., J. Mol. Biol. 293:865-881 (1999). Если скорость превышает 106 М-1 s-1 из вышеописанного способа поверхностного плазмонного резонанса, то скорости прямой реакции могуть быть определены с помощью метода затухания флуоресценции, который измеряет повышение или понижение интенсивности флуоресцентного излучения (возбуждение = 295 нм; излучение = 340 нм, 16 нм фильтр) при 25°С 20 нМ анти-антиген антитела (Fab форма) в PBS, рН 7,2, в присутствии увеличивающихся концентраций антигена, что измеряется спектрометром, таким как stop-flow спектрометром (Aviv Instruments) или спектрометром 8000-series SLM-AMINCO™ (ThermoSpectronic) с перемешивающей кюветой.
(i) Приготовление антигенов
Растворимые антигены или их фрагменты, опционально конъюгированные с другими молекулами, могут быть использованы для создания антител. Для трансмембранных молекул, таких как рецепторы, их фрагменты (например, внеклеточный домен рецептора) могут быть использованы как иммуноген. В альтернативном варианте клетки, экспрессирующие трансмембранную молекулу, могут быть использованы как иммуноген. Такие клетки могут быть получены из природного источника (например, линии раковых клеток) или могут быть клетками, трансформированными рекомбинантными методами для экспрессирования трансмембранной молекулы. Другие антигены и их формы, пригодные для приготовления антител, будут очевидными для специалистов в данной области техники.
(ii) Определенные способы на основе антител
Поликлональные антитела предпочтительно получали в животных путем множественных подкожных или внутрибрюшных инъекций соответствующего антигена и адъюванта. Может быть полезно связать соответствующий антиген, например, гемоцианин улитки, сывороточный альбумин, бычий тироглобулин, или соевый трипсиновый ингибитор, используя, например, мелеимидобензоил-сульфосуксукцинимид-эстер (связывание через остатки цистеина), N-гидроксисукцинимид (через остатки лизина), глютаральдегид, сукциновый ангидрид, SOCl2 или R1N=C=NR, где R и R1 представляют собой разные алкильные группы.
Животных иммунизировали против антигена, иммуногенных конъюгатов или производных, путем комбинирования, например, 100 мкг или 5 мкг белка или конъюгата (для кроликов или мышей, соответственно) с 3 объемами полного адъюванта Фрейнда и введение раствора подкожно в различных участках. Месяц спустя животным добавляли от 1/5 до 1/10 от начального количества пептида или конъюгата в полном адъюванте Фрейнда путем подкожных инъекций в различных участках. От 7 до 14 дней спустя у животных собирали кровь и сыворотку анализировали на титр антител. Животных продолжали иммунизировать до достижения титром уровня плато. Предпочтительно, животное иммунизировали конъюгатом того же антигена, но связанным с другим белком и/или через другой связывающий реагент. Конъюгаты также могут быть получены в культуре рекомбинантных клеток как слитые белки. Также удобно использовать агрегирующие агенты, такие как квасцы, для повышения иммунного ответа.
Моноклональные антитела данного изобретения могут быть получены с использованием способа гибридомы, впервые описанного Kohler et al., Nature, 256.495 (1975), и далее описанном, например, в Hongo et al., Hybridoma, 14 (3): 253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981), и Ni, Xiandai Mianyixue, 26(4):265-268 (2006) относительно гибридом типа человек-человек. Дополнительные способы включают, например, описанные в патенты США №7189826 относительно получения моноклональных человеческих природных антител IgM из клеточных линий гибридомы. Технология гибридомы человека (технология триома) описана в Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3): 185-91 (2005).
Для различных других техник гибридомы, см., например, публикации патентов США №№2006/258841, 2006/183887 (полностью человеческие антитела), 2006/059575, 2005/287149, 2005/100546 и 2005/026229; и патентах США №№7078492 и 7153507. Пример протокола для получения моноклональных антител с использованием способа гибридомы описывается следующим образом. В одном варианте реализации изобретения мышь, или другое подходящее животное, такое как хомяк, иммунизируется для образования лимфоцитов, которые производят, или способны производить, антитела, которые будут специфично связывать белок, используемый в иммунизации. Антитела получали в животных путем множественных подкожных (ПК) или внутрибрюшных (ВБ) инъекций полипептида из данного изобретения, или его фрагмента, и адъюванта, такого как монофосфорил-липид А (МФЛ)/трегалоза дикриномиколат (ТДМ) (Ribi Immunochem. Research, Inc., Hamilton, MT). Полипептид по данному изобретению (например, антиген) или его фрагмент могут быть получены с использованием способов, хорошо известных в данной области техники, таких как рекомбинантные методы, некоторые из которых в дальнейшем описываются в данном документе. Сыворотку из иммунизированных животных анализировали на анти-антиген антитела и опционально проводили дополнительные иммунизации. Изолировали лимфоциты из животных, производящих анти-антиген антитела. В альтернативном варианте лимфоциты могут быть иммунизированы in vitro.
После этого лимфоциты сливали с клетками миеломы, используя подходящий фактор слияния, такой как полиэтиленгликоль, для образования клетки гибридомы. См., например, Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986). Могут быть использованы клетки миеломы, которые эффективно сливаются, поддерживают устойчивый высокий уровень производства антител выбранными клетками для производства антител и чувствительны к среде, такой как среда HAT. Примеры клеток миеломы включают, но не ограничиваются этими, мышиные линии миеломы, такие как полученные из мышиных опухолей МОРС-21 и МРС-11, имеющихся в Salk Institute Cell Distribution Center, Сан Диего, Калифорния. США, и клеток SP-2 или Х63-Ag8-653, имеющихся в American Type Culture Collection, Роквилль, Мэриленд, США. Также были описаны клеточные линии миеломы человека и мышино-человеческой гетеромиеломы для получения моноклональных антител человека (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
Полученные таким образом клетки гибридомы высевают и выращивают в подходящей культуральной среде, например, среде, которая содержит одно или несколько веществ, которые ингибируют рост или выживание не слитых исходных клеток миеломы. Например, если в родительских клетках миеломы отсутствует фермент гипоксантин-гуанин-фосфорибозилтрансферазы (HGPRT или HPRT), культуральная среда для гибридом обычно будет включать гипоксантин, аминоптерин и тимидин (среда HAT), которые предотвращают рост HGPRT-дефицитных клеток. Предпочтительно использовать способы культивирования бессывороточных клеток гибридомы для снижения использования сыворотки животного происхождения, такой как эмбриональная телячья сыворотка, как описано, например, в Even et al., Trends in Biotechnology, 24(3), 105-108 (2006).
Олигопептиды, используемые в качестве инструментов для повышения продуктивности культур клеток гибридомы, описаны в Franek, Trends in Monoclonal Antibody Research, 111-122 (2005). В частности, стандартные культуральные среды обогащены некоторыми аминокислотами (аланином, серином, аспарагином, пролином), или фракциями гидролизата белка, и апоптоз может быть существенно подавлен синтетическими олигопептидами, состоящими из от трех до шести аминокислотных остатков. Эти пептиды присутствуют в миллимолярных или более высоких концентрациях.
Культуральная среда, в которой выращивают клетки гибридомы, может быть изучена на предмет продуцирования моноклональных антител, которые связываются с антителом из данного изобретения. Специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, может быть определена с помощью иммунопреципитации или с помощью анализа связывания in vitro, такого как радиоиммуноанализ (РИА) или твердофазный иммуноферментный анализ (ИФА). Аффинность связывания моноклонального антитела можно определить, например, с помощью анализа Скэтчарда. См., например, Munson et al., Anal. Biochem., 107:220 (1980).
После идентификации гибридомных клеток, которые продуцируют антитела требуемой специфичности, аффинности и/или активности, клоны могут быть субклонированы путем ограничения процедур разбавления и выращены стандартными способами. См., например, Goding, ранее. Подходящие для этой цели культуральные среды включают, например, среду D-MEM или RPMI-1640. Дополнительно, гибридомные клетки могут быть выращены in vivo в виде асцитных опухолей у животного. Моноклональные антитела, секретируемые субклонами, соответствующим образом отделяют от культуральной среды, асцитной жидкости или сыворотки обычными способами очистки иммуноглобулинов, такими как, например, белок А-сефароза, хроматография на гидроксиапатите, гель-электрофорез, диализ или аффинная хроматография. Одна процедура выделения белков из клеток гибридомы описана в патенте США 2005/176122 и патенте США №6919436. Данный способ включает использование минимального количества солей, таких как лиотропных солей, в процессе связывания и также предпочтительное использование небольших количеств органических растворителей в процессе элюирования.
(iii) Антитела, полученные с помощью библиотек
Антитела из данного изобретения могут быть выделены путем скрининга комбинаторных библиотек антител с желаемой активностью или деятельностью. Например, в данной области техники известны различные способы генерации библиотек фагов и скрининга таких библиотек на наличие антител, обладающих желательными характеристиками связывания. Дополнительные методы рассматриваются, например,, в Hoogenboom et al., в Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, 2001) и дополнительно описаны, например, в McCafferty et al., Nature 348:552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222. 581-597 (1992); Marks and Bradbury, в Methods in Molecular Biology 248:161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); и Lee etal., J. Immunol. Methods 284(1-2): 119-132(2004).
В некоторых способах фагового дисплея, репертуары генов VH и VL клонируют отдельно с помощью полимеразной цепной реакции (ПЦР) и рекомбинируют случайным образом в фаговых библиотеках, которые затем могут быть подвергнуты скринингу на антиген-связывающий фаг, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Фаги обычно отображают фрагменты антител, либо в виде одноцепочечных Fv (scFv) фрагментов, либо в виде Fab-фрагментов. Библиотеки из иммунизированных источников предоставляют высокоафинные антитела к иммуногену без необходимости построения гибридом. В альтернативном варианте наивный репертуар может быть клонирован (например, от человека), чтобы обеспечить единый источник антител к широкому спектру чужих и своих антигенов без какой-либо иммунизации, как описано у Griffiths et al., EMBO J, 12: 725-734 (1993). И, наконец, наивные библиотеки также могут быть созданы синтетически с помощью клонирования нереаранжированных сегментов V-гена из стволовых клеток, а также с использованием ПЦР-праймеров, содержащих случайную последовательность для кодирования высоко вариабельных областей CDR3 и осуществления реранжирования in vitro, как описано у Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Публикации патентов, описывающие библиотеки фаговых антител человека, включают, например: патент США №5750373 и патенты США №№: 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
В данном документе человеческими антителами или фрагментами человеческих антител считаются антитела или фрагменты антител, выделенные из библиотек антител человека.
(iv) Химерные, гуманизированные и человеческие антитела
В некоторых вариантах реализации изобретения антитело, предложенное в данном документе, представляет собой химерное антитело. Определенные химерные антитела описаны, например, в патенте США №4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984). В одном примере химерное антитело содержит вариабельный участок нечеловеческого происхождения (например, вариабельный участок, полученный от мыши, крысы, хомяка, кролика или нечеловекообразного примата, такого как обезьяна) и человеческий константный участок. В дополнительном примере химерное антитело представляет собой антитело с "переключенным классом", в котором был изменен класс или подкласс исходного антитела. Химерные антитела включают свои антигенсвязывающие фрагменты.
В некоторых вариантах реализации изобретения химерное антитело представляет собой гуманизированное антитело. Как правило, антитело нечеловеческого происхождения гуманизируют для снижения иммуногенности для человека, сохраняя при этом специфичность и аффинность родительского антитела нечеловеческого происхождения. Как правило, гуманизированное антитело содержит один или более вариабельных доменов, в которых HVR, например, CDR (или их части) получают из антитела нечеловеческого происхождения, и FR (или их части) получают из человеческих последовательностей антитела. Гуманизированное антитело также необязательно будет содержать по меньшей мере часть человеческого константного участка. В некоторых вариантах реализации изобретения некоторые FR остатки гуманизированного антитела замещены соответствующими остатками из антитела нечеловеческого происхождения (например, антитела, из которого получены остатки HVR), например, для восстановления или улучшения специфичности антитела или аффинности.
Гуманизированные антитела и способы их получения рассматриваются, например, в Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008), и дополнительно описаны, например, в Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Nat'l Acad. Sci. USA 86:10029-10033 (1989); патентах США №№5821337, 7527791, 6982321 и 7087409; Kashmiri et al., Methods 36:25-34 (2005) (описание SDR (a-CDR) трансплантации); Padlan, Mol. Immunol. 28:489-498 (1991) (описание "изменения поверхности"); Dall'Acqua et al., Methods 36:43-60 (2005) (описание "FR shuffling"); и Osbourn et al., Methods 36:61-68 (2005) и Klimka et al., Br. J. Cancer, 83:252-260 (2000) (описание подхода "направленной селекции" к FR shuffling).
Человеческие каркасные участки, которые могут быть использованы для гуманизации, включают, но не ограничиваются этими каркасные области выбраные с помощью метода "наилучшего соответствия" (см., например, Sims et al. J. Immunol. 151:2296 (1993)); каркасные области, полученные из консенсусного участка человеческих антител отдельной подгруппы вариабельных участков легкой или тяжелой цепи (см., например, Carter et al. Proc. Natl. Acad. Sci. USA, 89:4285 (1992); и Presta et al. J. Immunol., 151:2623 (1993)); зрелые человеческие (соматические мутированные) каркасные участки каркасных участков зародышевой линии человека (см., например, Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)); и каркасные участки, полученные в результате скрининга библиотек FR (см., например, Baca et al., J. Biol. Chem. 272:10678-10684 (1997) и Rosok et al., J. Biol. Сhеm. 271:22611-22618 (1996)).
В некоторых вариантах реализации изобретения антитело, предложенное в данном документе, представляет собой человеческое антитело. Человеческие антитела могут быть получены с использованием различных способов, известных в данной области техники. Человеческие антитела описаны в общем смысле в van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5: 368-74 (2001) и Lonberg, Curr. Opin. Immunol. 20:450-459 (2008).
Человеческие антитела могут быть получены путем введения иммуногена в трансгенное животное, которое было модифицированно для производства интактных человеческих антител, или интактных антител с человеческими вариабельными участками, в ответ на появление антигена. Такие животные обычно содержат весь или часть человеческого иммуноглобулинового локуса, который заменяет эндогенный иммуноглобулиновый локус, или который присутствует внехромосомно или встроен случайным образом в хромосомы животного. У таких трансгенных мышей эндогенные иммуноглобулиновые локусы, как правило, были инактивированы. Для обзора способов получения человеческих антител из трансгенных животных, см. Lonberg, Nat. Biotech. 23:1117-1125 (2005). См. также, например, патенты США №№6075181 и 6150584, описывающие технологию XENOMOUSE™; патент США №5770429, описывающий технологию HUMAB®; патент США №7041870, описывающий технологию К-М MOUSE®, и публикацию заявки на патент США №US 2007/0061900, описывающую технологию VELOCIMOUSE®). Человеческие вариабельные участки из интактных антител, образованных этими животными, могут еще быть модифицированными, например, путем объединения с разными человеческими консервативными участками.
Человеческие антитела также могут быть получены с помощью способов на основе гибридом. Были описаны клеточные линии человеческой миеломы и мышино-человеческой гетеромиеломы для получения человеческих моноклональных антител. (См., например, Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J. Immunol., 147: 86 (1991).) Человеческие антитела, образованные через технологию гибридомы человеческой В-клетки, также описаны в Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006). Дополнительные способы включают, например, описанные в патенте США №7189826 (описывающем получение моноклональных антител IgM из клеточных линий гибридомы) и Ni, Xiandai Mianyixue, 26(4):265-268 (2006) (описывающем гибридомы типа человек-человек). Технология гибридомы человека (технология триома) также описана в Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3): 185-91 (2005).
Человеческие антитела также могут быть образованы путем изолирования последовательностей вариабельного домена Fv клона, отобранных из библиотек отображений фагов, полученных от человека. Потом эти вариабельные домены могут быть объединены с желаемым консервативным доменом человека. Ниже описаны техники отбора человеческих антител из библиотек антител.
(v) Фрагменты антител
Фрагменты антитела могут быть получены традиционными способами, такими как ферментативный гидролиз, или рекомбинантными способами. В определенных случаях имеются преимущества при использовании фрагментов антител, а не целых антител. Меньший размер фрагментов обеспечивает быстрый клиренс и может привести к улучшению доступа к плотным опухолям. Для обзора определенных фрагментов антител см. Hudson et al. (2003) Nat. Med. 9:129-134.
Для получения фрагментов антител разработаны различные методы. Традиционно такие фрагменты получали путем протеолитического гидролиза интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако, сейчас такие фрагменты могут быть получены непосредственно с помощью рекомбинантных клеток-хозяев. Все фрагменты антител, Fab, Fv и scFv, могут быть экспрессированы и выделены из Е. coli, тем самым позволяя облегчить получение больших количеств этих фрагментов. Фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых ранее. В альтернативном варианте Fab'-SH фрагменты можно выделить непосредственно из Е. coli и химически связать для образования F(ab')2 фрагментов (Carter et al., Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом F(ab')2 фрагменты могут быть изолированы непосредственно из культуры клеток рекомбинантных хозяев. Fab и F(ab')2 фрагменты с увеличенным временем полужизни in vivo, содержащие остатки рецепторсвязывающей антигенной детерминанты, ответственной за время полужизни, описаны в патенте США №5869046. Специалисту в данной области техники будут очевидны и другие способы получения фрагментов антител. В некоторых вариантах реализации изобретения антитело представляет собой одноцепочечный Fv-фрагмент (scFv). См., например, WO 93/16185, патенты США №№5571894 и 5587458. Fv и scFv являются единственными видами с интактными участками связывания, которые лишены константных участков; таким образом, они могут быть подходящими для уменьшения неспецифического связывания при их использовании in vivo. scFv трансляционно слитые белки могут быть сконструированы для получения трансляционно слитого с scFv эффекторного белка либо на амино-, либо карбоксиконце. См. Antibody Engineering, ed. Borrebaeck, ранее. Фрагмент антитела также может представлять собой "линейное антитело", например, как описано в патенте США №5641870, например. Такие линейные антитела могут быть моноспецифическими или биспецифическими.
(vi) Мультиспецифические антитела
Мультиспецифические антитела обладают связывающей специфичностью по меньшей мере к двум различным эпитопам, причем эпитопы, как правило, из различных антигенов. Хотя такие молекулы обычно будут связывать только два различных зпитопа (т.е. биспецифические антитела, BsAbs), антитела с дополнительными специфичностями, такие как триспецифические антитела, охватываются этим выражением, когда используется в данном документе. Биспецифические антитела могут быть получены как полноразмерные антитела или как фрагменты антител (например, F(ab')2 биспецифические антитела).
Способы получения биспецифических антител известны в данной области техники. Традиционное получение полноразмерных биспецифических антител основано на коэкспрессии двух пар тяжелых цепей-легких цепей иммуноглобулинов, причем две цепи обладают различной специфичностью (см., например, Millstein et al., Nature, 305:537-539 (1983)). По причине случайной сортировки тяжелых и легких цепей иммуноглобулина, эти гибридомы (квадромы) продуцируют потенциальную смесь из 10 различных молекул антител, из которых только одна имеет правильную биспецифичную структуру. Очистка правильной молекулы, которую обычно осуществляют через стадии аффинной хроматографии, является довольно трудоемкой, а выход продукта низкий. Аналогичные способы описаны в WO 93/08829 и в Traunecker et al., EMBO J., 10:3655-3659 (1991).
Один из способов, известных в данной области техники для получения биспецифических антител, представляет собой способ "выступы во впадины" или "выпячивания в полости" (см., например, патент США №5731168). В этом способе каждый из двух иммуноглобулиновых полипептидов (например, полипептиды тяжелой цепи) содержит область контакта. Область контакта одного иммуноглобулинового полипептида взаимодействует с соответствующей областью контакта на другом иммуноглобулиновом полипептиде, таким образом позволяя двум иммуноглобулиновым полипептидам соединяться. Эти области контакта могут быть сконструированы таким образом, что "выступ" или "выпячивание" (эти термины могут быть использованы взаимозаменяемо в данном документе), расположенный в области контакта одного иммуноглобулинового полипептида, соответствует "впадине" или "полости" (эти термины могут быть использованы взаимозаменяемо в данном документе), расположенной в области контакта другого полипептида иммуноглобулина. В некоторых вариантах реализации изобретения впадина идентичная или сходная по размеру с выступом и расположена подходящим образом так, что, когда две области контакта взаимодействуют между собой, выступ одной области контакта может расположиться в соответствующей впадине другой области контакта. Не желая быть связанными с теорией, авторы полагают, что это стабилизирует гетеромультимер и способствует формированию гетеромультимера по сравнению с другими видами, например гомомультимерами. В некоторых вариантах реализации изобретения этот способ может быть использован для содействия гетеромультимеризации двух различных иммуноглобулиновых полипептидов, создающих биспецифическое антитело, включающее два иммуноглобулиновых полипептида со связывающей специфичностью для различных эпитопов.
В некоторых вариантах реализации изобретения выступ может быть создан путем замещения короткой боковой цепи аминокислоты на более длинную боковую цепь. В некоторых вариантах реализации изобретения впадина может быть создана путем замещения длинной боковой цепи аминокислоты с более короткую боковую цепь. Выступы или впадины могут существовать в исходной области контакта или же они могут быть введены искусственно. Например, выступы или впадины могут быть введены искусственно путем изменения нуклеотидной последовательности, кодирующей область контакта, замещением по меньшей мере одного "исходного" аминокислотного остатка на по меньшей мере один "внесенный" аминокислотный остаток. Способы изменения нуклеотидных последовательностей могут включать стандартные молекулярно-биологические методы, хорошо известные в данной области техники. Объемы боковой цепи различных аминокислотных остатков показаны в нижеследующей таблице. В некоторых вариантах реализации изобретения исходные аминокислотные остатки имеют малый объем боковой цепи (например, аланин, аспарагин, аспарагиновая кислота, глицин, серии, треонин или валин), а внесенные аминокислотные остатки для формирования выступа представляют собой природные аминокислоты и могут включать аргинин, фенилаланин, тирозин и триптофан. В некоторых вариантах реализации изобретения исходные аминокислотные остатки имеют большой объем боковой цепи (например, аргинин, фенилаланин, тирозин и триптофан), а внесенные аминокислотные остатки для формирования впадины представляют собой природные аминокислоты и могут включать аланин, серии, треонин и валин.


В некоторых вариантах реализации изобретения исходные остатки для формирования выступа или впадины определяются на основании трехмерной структуры гетеромультимера. Методы, известные в данной области техники для получения трехмерной структуры, могут включать рентгеноструктурный анализ и ЯМР. В некоторых вариантах реализации изобретения область контакта представляет собой СН3 домен константного домена иммуноглобулина. В этих вариантах реализации изобретения область контакта СН3/СН3 человеческого IgG1 включает шестнадцать аминокислотных остатков на каждом домене, расположенных на четырех антипараллельных бета-складках. Не желая быть связанными с теорией, мутированные аминокислотные остатки предпочтительно расположены на двух центральных антипараллельных бета-складках для сведения к минимальному риску того, что выступы будут находиться скорее в окружающем растворителе, чем в компенсаторных впадинах в СН3 участке партнера. В некоторых вариантах реализации изобретения мутации, образующие соответствующие выступы и впадины в двух иммуноглобулиновых полипептидах, соответствуют одной или более парам, приведенным в нижеследующей таблице.


В некоторых вариантах реализации изобретения иммуноглобулиновый полипептид содержит СН3 домен, который включает одно или более аминокислотных замещений, перечисленных в таблице 2 ранее. В некоторых вариантах реализации изобретения биспецифическое антитело содержит первый иммуноглобулиновый полипептид, который содержит домен СН3, который включает одно или более аминокислотных замещений, перечисленных в левой колонке таблицы 2, и второй иммуноглобулиновый полипептид, который содержит домен СН3, который включает одно или более соответствующих аминокислотных замещений, перечисленных в правой колонке таблицы 2.
Вслед за мутацией ДНК, описанной ранее, полинуклеотиды, кодирующие модифицированные иммуноглобулиновые полипептиды с одной или более соответствующими мутациями, формирующими выступ или впадину, могут быть экспрессированы и очищены с использованием стандартных рекомбинантных методов и клеточных систем, известных в данной области техники. См., например, патенты США №№5731168, 5807706, 5821333, 7642228, 7695936, 8216805, публикация США №2013/0089553; и Spiess et al., Nature Biotechnology 31: 753-758, 2013. Модифицированные иммуноглобулиновые полипептиды могут быть получены с использованием прокариотических клеток-хозяев, таких как Е. coli, или эукариотических клеток-хозяев, таких как клетки СНО. Соответствующие иммуноглобулиновые полипептиды несущие выступы и впадины могут быть экспрессированы в клетках-хозяевах при кокультивировании и очищены совместно как гетеромультимер, или они могут быть экспрессированы в отдельных культурах, обособленно очищены и собраны in vitro. В некоторых вариантах реализации изобретения два штамма бактериальных клеток-хозяев (один, который экспрессирует иммуноглобулиновый полипептид с выступом, а другой, который экспрессирует иммуноглобулиновый полипептид со впадиной) кокультивируются с использованием стандартных способов бактериального культивирования, известных в данной области техники. В некоторых вариантах реализации изобретения два штамма могут быть смешаны в определенном соотношении, например, для достижения равных уровней экспрессии в культуре. В некоторых вариантах реализации изобретения два штамма могут быть смешаны в соотношении 50:50, 60:40 или 70:30. После экспрессии полипептида клетки могут быть лизированы совместно и может быть экстрагирован белок. Стандартные способы, известные в данной области техники, которые позволяют измерять относительное содержание гомомультимерных видов против гетеромультимерных могут включать вытеснительную хроматографию. В некоторых вариантах реализации изобретения каждый модифицированный иммуноглобулиновый полипептид экспрессируется отдельно с использованием стандартных рекомбинантных способов, и они могут быть собраны вместе in vitro. Сборка может быть достигнута, например, путем очистки каждого модифицированного иммуноглобулинового полипептида, смешивания и инкубирования их совместно в равных массах, уменьшения дисульфидов (например, с помощью обработки дитиотреитолом), концентрирования и повторного оксидирования полипептидов. Сформированные биспецифические антитела могут быть очищены с использованием стандартных методик, включая катионообменную хроматографию, и измерены с использованием стандартных методик, включая вытеснительную хроматографию. Более подробное описание этих методов см. в Speiss et al., Nat. Biotechnol. 31:753-8, 2013. В некоторых вариантах реализации изобретения модифицированные иммуноглобулиновые полипептиды могут быть экспрессированы по отдельности в клетках СНО и собраны in vitro с использованием способов, описанных ранее.
В соответствии с другим способом вариабельные домены антител с желаемыми специфичностями связывания (антитело-антиген связывающие сайты) трансляционно сливают с последовательностями константных доменов иммуноглобулина. Трансляционное слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, содержащим по меньшей мере часть шарнирной области, СН2 и СН3 участки. Обычно присутствует первый константный участок тяжелой цепи (СН1), содержащий сайт, необходимый для связывания легкой цепи, присутствующего по меньшей мере одном из трансляционных слияний. ДНК, кодирующие слияния тяжелых цепей иммуноглобулина и, если необходимо, легкую цепь иммуноглобулина, встраивают в отдельные экспрессионные векторы и совместно трансфицируют в подходящий организм-хозяин. Это предоставляет большую гибкость при прилаживании взаимных соотношений трех полипептидных фрагментов в вариантах реализации изобретения, когда неравные соотношения трех полипептидных цепей, используемых в конструкции, дают оптимальные выходы. Однако возможно встроить кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессионный вектор, когда экспрессия по меньшей мере двух полипептидных цепей в равных соотношениях приводит с высокими выходами, или когда соотношения не имеют особого значения.
В одном варианте реализации изобретения по данному методу биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном плече, и гибридной пары тяжелой цепи - легкой цепи иммуноглобулина (обеспечивающей вторую специфичность связывания) на другом плече. Было обнаружено, что эта асимметричная структура облегчает выделение целевого биспецифического соединения из нежелательных комбинаций иммуноглобулиновых цепей, поскольку присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает легкий способ выделения. Этот метод раскрыт в WO 94/04690. Для дополнительной информации о получении биспецифических антител см., например, Suresh et al., Methods in Enzymology, 121:210 (1986).
Согласно другому способу, описанному в WO 96/27011, область контакта между парой молекул антител может быть сконструирована для максимального увеличения процента гетеродимеров, которые выделяют из культуры рекомбинантных клеток. Одна область контакта содержит по меньшей мере часть CH3 домена константного домена антитела. В данном способе одну или более коротких боковых цепей аминокислот из области контакта первой молекулы антитела заменяют на более длинные боковые цепи (например, на тирозин или триптофан). Компенсирующие "полости" идентичные или сходные по размеру с длинной боковой цепью(ями) создаются в области контакта второй молекулы антитела путем замещения длинных боковых цепей аминокислот на короткие боковые цепи (например, аланин или треонин). Это обеспечивает механизм для повышения количества гетеродимера по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
Биспецифические антитела включают перекрестно-сшитые или "гетероконъюгированные" антитела. Например, одно из антител в гетероконъюгате может быть связано с авидином, а другое - с биотином. Такие антитела предложены, например, для нацеливания клеток иммунной системы на нежелательные клетки (патент США №4676980), а также для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373 и ЕР 03089). Гетероконъюгированные антитела могут быть получены с использованием любых подходящих методов перекрестного сшивания. Пригодные перекрестно-сшивающие агенты хорошо известны в данной области техники и описаны в патенте США №4676980, наряду с рядом методов перекрестного сшивания.
В литературе также описаны способы получения биспецифических антител из фрагментов антител. Например, биспецифические антитела могут быть получены с использованием химической связи. Brennan et al., Science, 229: 81 (1985) описывают способ, в котором интактные антитела гидролизируют путем протеолиза с получением F(ab')2 фрагментов. Эти фрагменты восстанавливают в присутствии дитиольного комплексообразующего агента - мышьяковистокислого натрия - для стабилизации соседних дитиолов и предотвращения образования межмолекулярных дисульфидных связей. Затем полученные Fab'-фрагменты преобразовывают в производные тионитробензоата (TNB). Затем одно из производных Fab'-TNB преобразовывают в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNB для образования биспецифического антитела. Полученные биспецифические антитела могут быть использованы в качестве агентов для селективной иммобилизации ферментов.
Недавний прогресс облегчили прямым восстановлением Fab'-SH фрагментов из Е. coli, которые могут быть химически связаны для образования биспецифических антител. Shalaby et al., J. Exp. Med., 175: 217-225 (1992) описывают получение полностью гуманизированной F(ab')2 молекулы биспецифического антитела. Каждый Fab' фрагмент отдельно секретировали из Е. coli и подвергали прямому химическому связыванию in vitro для образования биспецифического антитела.
Также описаны различные способы получения и изолирования фрагментов биспецифических антител непосредственно из культуры рекомбинантных клеток. Например, биспецифические антитела были получены с использованием лейциновой молнии. Kostelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды лейциновой молнии из белков Fos и Jun были связаны с Fab' частями двух различных антител путем слияния генов. Гомодимеры антител восстанавливали в шарнирной области для образования мономеров, а затем повторно оксидировали для образования гетеродимеров антител. Этот способ также может быть использован для получения гомодимеров антител. Технология "димерных антител", описанная Hollingeretal., Proc. Natl. Acad. Sci. США, 90:6444-6448 (1993), предлагает альтернативный механизм получения фрагментов биспецифических антител. Фрагменты включают вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) с использованием линкера, который является слишком коротким для того, чтобы позволить спаривание между двумя доменами на одной и той же цепи. Соответственно, VH и VL домены одного фрагмента вынуждены спариваться с комплементарными VL и VH доменами другого фрагмента, тем самым образуя два антигенсвязывающих сайта. Также сообщалось о другой стратегии для получения фрагментов биспецифических антител с использованием одноцепочечных Fv (sFv) димеров. См. Gruber et al., J. Immunol, 152:5368 (1994).
Другой способ получения фрагментов биспецифических антител представляет собой "биспецифический активатор Т-клеток" или BiTE® подход (см., например, WO 2004/106381, WO 2005/061547, WO 2007/042261 и WO 2008/119567). Этот подход использует два вариабельных домена антител, расположенных на одном полипептиде. Например, единая полипептидная цепь включает два фрагмента одноцепочечных Fv (scFv), каждый из которых имеет вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL), разделенных полипептидным линкером такой длины, которая достаточная для обеспечения внутримолекулярного соединения между двумя доменами. Этот единый полипептид дополнительно содержит полипептидную спейсерную последовательность между двумя scFv фрагментами. Каждый scFv распознает разный эпитоп, и эти эпитопы могут быть специфическими для различных типов клеток, таким образом, что клетки двух различных типов клеток доставляются в непосредственную близость или связываются, когда каждый scFv вступает в контакт со своим сопряженным эпитопом. В конкретном варианте реализации изобретения такой подход включает scFv распознавание антигена клеточной поверхности, который экспрессируется иммунной клеткой, например, CD3 полипептида на Т-клетке, связанного с другим scFv, который распознает антиген клеточной поверхности, который экспрессируется клеткой-мишенью, такой как злокачественная или опухолевая клетка.
Поскольку это единый полипептид, биспецифический активатор Т-клеток может быть экспрессирован с помощью любой прокариотической или эукариотической клеточной системы экспрессии, известной в данной области техники, например, клеточная линия СНО. Однако для отделения мономерных биспецифических активаторов Т-клеток от других мультимерных видов, которые могут иметь биологическую активность отличную от предполагаемой активности мономера, могут быть необходимы конкретные методы очистки (см., например, ЕР 1691833). В одной типовой схеме очистки, раствор, содержащий секретируемые полипептиды, сначала подвергают металл-аффинной хроматографии, а полипептиды элюируют градиентом концентраций имидазола. Полученый элюат дополнительно очищают с помощью анионообменной хроматографии, и полипептиды элюируют с использованием градиента концентрации хлорида натрия. В заключение полученный элюат подвергают вытеснительной хроматографии для отделения мономеров от мультимерных видов.
Рассматриваются антитела с более чем двумя валентностями. Например, могут быть получены триспецифические антитела. Tuft et al. J. Immunol. 147: 60 (1991).
(vii) Однодоменные антитела
В некоторых вариантах реализации изобретения антитело по изобретению представляет собой однодоменное антитело. Однодоменное антитело представляет собой единичную полипептидную цепь, содержащую весь или часть вариабельного домена тяжелой цепи, или весь или часть вариабельного домена легкой цепи антитела. В некоторых вариантах реализации изобретения однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc. Waltham, Mass.; см., например, патент США №6248516 В1). В одном варианте реализации изобретения однодоменное антитело состоит из всего или части вариабельного домена тяжелой цепи антитела.
(viii) Модификации антител
В некоторых вариантах реализации изобретения рассматриваются модификация(и) аминокислотных последовательностей антител, описанных в данном документе. Например, может быть желательно улучшение аффинности связывания и/или других биологических свойств антитела. Модификации аминокислотной последовательности антитела могут быть получены путем внесения соответствующих изменений в нуклеотидную последовательность, кодирующую антитело, или путем пептидного синтеза. Такие модификации включают, например, делеции и/или вставки, и/или замещения аминокислотных остатков в аминокислотных последовательностях антитела. Любая комбинация делеции, вставки и замещения может быть сделана для достижения конечной конструкции, при условии, что конечная конструкция обладает желаемыми характеристиками. Изменения аминокислот могут быть внесены в аминокислотную последовательность исследуемого антитела, в то время, когда последовательность готова.
(ix) Варианты замещения, вставки и делеции
В некоторых вариантах реализации изобретения предлагаются модификации антител, имеющие одно или более аминокислотных замещений. Сайты, представляющие интерес для мутагенеза с замещением, включают HVR и FR. Консервативные замещения представлены в таблице 1 под названием "консервативные замещения". Более существенные изменения представлены в таблице 1 под названием "иллюстративные замещения", и как дополнительно описано ниже со ссылкой на классы аминокислотных боковых цепей. Аминокислотные замены могут быть введены в целевое антитело и проводится скрининг продуктов на желаемую активность, например, задержанное/улучшенное связывание антигена, снижение иммуногенности или улучшенные ADCC или КЗЦ.
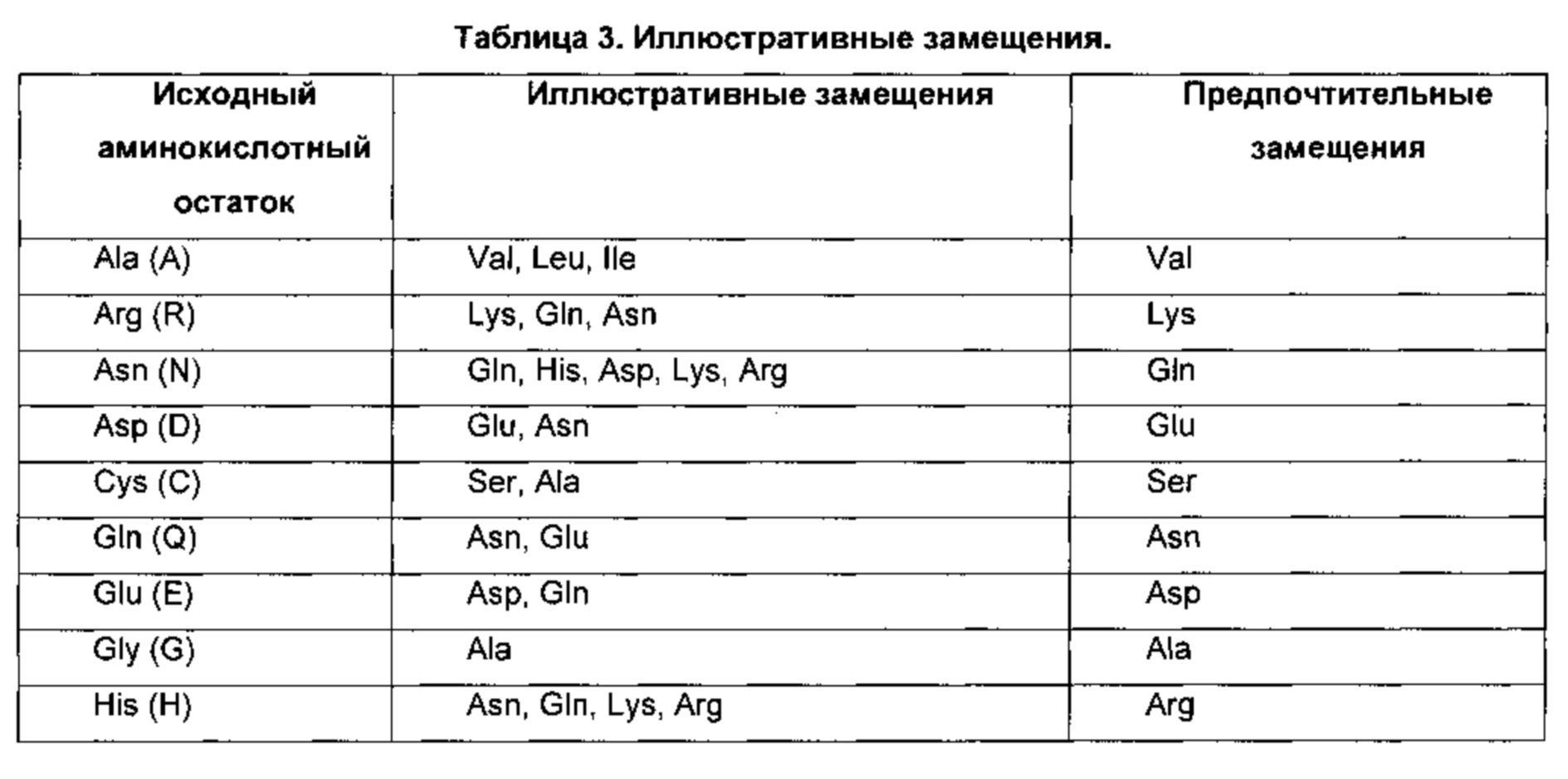
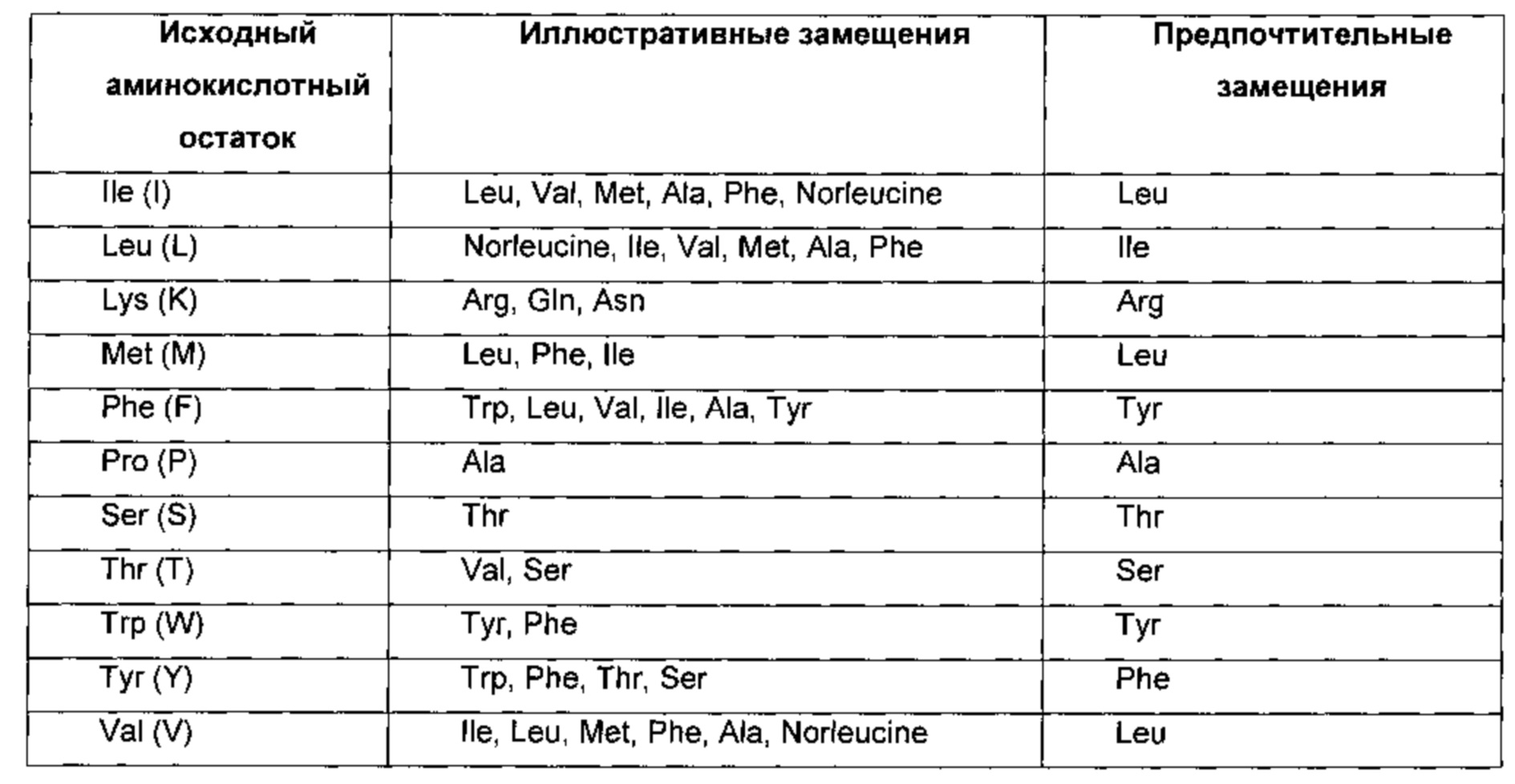
Аминокислоты могут быть сгруппированы в соответствии с общими свойствами боковой цепи:
a) гидрофобные: Norleucine, Met, Ala, Val, Leu, Ile;
b) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
c) кислые: Asp, Glu;
d) основные: His, Lys, Arg;
e) аминокислотные остатки, которые влияют на ориентацию цепи: Gly, Pro;
f) ароматические: Trp, Tyr, Phe.
Неконсервативные замещения повлекут за собой замену одного члена из этих классов на другой класс.
Один из вариантов замещения включает замещение одного или более аминокислотных остатков гипервариабельного участка исходного антитела (например, гуманизированного или человеческого антитела). Как правило, результирующий вариант(ы), выбранный для дальнейшего изучения, будет иметь модификации (например, улучшения) по определенным биологическим свойствам (например, повышенную аффинность, пониженную иммуногенность) по отношению к исходному антителу и/или будет иметь по существу сохраненные определенные биологические свойства исходного антитела. Иллюстративный вариант замещения представляет собой аффинное зрелое антитело, которое может быть легко образовано, например, с использованием методов аффинного созревания на основе фаг-дисплея, таких как те, которые описаны в данном документе. Вкратце один или более аминокислотных остатков HVR подвергают мутации и модифицированные антитела обнаруживают на поверхности фага и подвергают скринингу на конкретную биологическую активность (например, аффинность связывания).
Изменения (например, замещения) могут быть сделаны в HVR, например, для улучшения аффинности антитела. Такие изменения могут быть сделаны в "горячих точках" HVR, то есть аминокислотных остатках, которые кодируются кодонами, подвергающимися мутации с высокой частотой в течение соматического процесса созревания (см., например, Chowdhury, Methods Mol. Biol. 207:179-196 (2008)), и/или SDR (a-CDR), с результирующей модификацией VH или VL, котороая будет испытываться на аффиность связывания. Аффиное созревание путем конструирования и повторного выбора из вторичных библиотек было описано, например, в Hoogenboom et al. in Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, (2001)). В некоторых вариантах реализации изобретения аффинного созревания, разнообразие вводится в вариабельные гены, выбранные для созревания, с помощью любого из множества способов (например, ПЦР пониженной точности, перестановкой цепи или олигонуклеотид-направленного мутагенеза). Затем создается вторичная библиотека. Затем эту библиотеку скринируют для идентифицирования любых модификаций антител с желаемой аффинностью. Другой способ для внесения разнообразия включает подходы, направленные на HVR, в которых несколько аминокислотных остатков HVR (например, 4-6 аминокислотных остатков подряд) представляют собой рандомизированные. Аминокислотные остатки HVR, участвующие в связывании антигена, могут быть идентифицированы, например, с помощью аланин-сканирующего мутагенеза или моделирования. В частности, CDR-H3 и CDR-L3 часто становятся мишенями.
В некоторых вариантах реализации изобретения замещения, вставки или делеции могут совершаться внутри одного или более HVR при условии, что такие изменения существенно не снижают способность антитела связывать антиген. Например, консервативные изменения (например, консервативные замещения, предложенные в данном документе), которые, по существу, не снижают аффинность связывания, могут быть сделаны в HVR. Такие изменения могут быть за пределами «горячих точек» HVR или SDR. В некоторых вариантах реализации изобретения в вариантах последовательностей VH и VL приведенных ранее, каждый HVR либо не изменен, либо содержит не более одной, двух или трех аминокислотных замен.
Полезный способ идентификации аминокислотных остатков или участков антитела, которые могут быть прицельными для мутагенеза, называется "аланин-сканирующий мутагенез", описанный в Cunningham and Wells (1989) Science, 244:1081-1085. В этом способе аминокислотный остаток или группу целевых аминокислотных остатков (например, заряженные аминокислотные остатки, такие как Arg, Asp, His, Lys и Glu) идентифицируют и заменяют нейтральной или отрицательно заряженной аминокислотой (например, аланином или полиаланином) для определения влияния на взаимодействие антитела с антигеном. Дополнительные замещения могут быть внесены в те расположения аминокислот, которые проявляли функциональную чувствительность к начальным замещениям. В альтернативном варианте или дополнительно кристаллическая структура комплекса антиген-антитело для идентификации точек контакта между антителом и антигеном. Такие контактные аминокислотные остатки и расположенные рядом аминокислотные остатки могут быть прицельными или исключатся как кандидаты для замещения. Модификации могут быть скринированы для определения наличия в них желаемых свойств.
Вставки аминокислотных последовательностей включают амино- и/или карбокситерминальные слияния длиной от одного аминокислотного остатка до полипептидов, содержащих сотню или более аминокислотных остатков, а также вставки из одного или множества аминокислотных остатков внутри последовательностей. Примеры терминальных вставок включают антитело с N-терминальным остатком метионина. Другие инсерционные модификаиии молекулы антитела включают слияние N- или С-конца антитела с ферментом (например, для ADEPT) или полипептидом, который увеличивает время полужизни антитела в сыворотке.
(х) Варианты гликозилирования
В некоторых вариантах реализации изобретения антитело, предложенное в данном документе, измененно с целью увеличения или уменьшения степени гликозилирования антитела. Добавление или удаление сайтов гликозилирования в антителе, может быть легко выполнено путем изменения аминокислотной последовательности таким образом, что один или более сайтов гликозилирования создается или удаляется.
В случае, если антитело содержит Fc-участок, могут быть изменены присоединенным к нему сахара. Нормальные антитела, продуцируемые клетками млекопитающих, как правило, содержат разветвленный, биантенный олигосахарид, который, как правило, прикреплен через N-связь к Asn297 СН2-домена Fc-участка. См., например, Wright et al. TIBTECH 15:26-32 (1997). Олигосахарид может включать различные моносахариды, например, маннозу, N-ацетил-глюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к "коровому" GlcNAc биантенной олигосахаридной структуры. В некоторых вариантах реализации изобретения модификации олигосахаридов в антителе по данному изобретению могут быть сделаны для создания модифицированного антитела с определенными улучшенными свойствами.
В одном варианте реализации изобретения предлагаются модификации антитела, включающие Fc-участок, в котором олигосахаридная структура, присоединенная к Fc-участку, имеет сниженное содержание фукозы или в ней отсутствует фукоза, что может улучшить ADCC функцию. Конкретнее, антитела, рассматриваемые в данном документе, имеют пониженное содержание фукозы по отношению к количеству фукозы на таком же антителе, полученном в СНО клетке дикого типа. То есть они характеризуются наличием меньшего количества фукозы, по сравнению с тем, какое бы они бы имели в случае, если бы производились нативными СНО клетками (например, СНО клеткой, которая продуцируют нативную структуру гликозилирования, такая как СНО клетка, содержащая нативный ген FUT8). В некоторых вариантах реализации изобретения антитело представляет собой такое, в котором меньше чем около 50%, 40%, 30%, 20%, 10% или 5% N-связанных гликанов включают в себя фукозу. Например, количество фукозы в таком антителе может быть от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. В некоторых вариантах реализации изобретения антитело представляет собой такое, в котором ни один из N-связанных с ним гликанов не включает фукозу, т.е., где антитело полностью без фукозы, или не имеет фукозы или нефукозилированное. Количество фукозы определяется путем подсчитывания среднего количества фукозы в сахарной цепи в Asn297, по отношению к сумме всех гликоструктур, прикрепленных к Asn297 (например, сложные, гибридные и структуры с высоким содержанием маннозы), как измерено с помощью масс-спектрометрии MALDI-TOF, описанной, например, в WO 2008/077546. Asn297 относится к остатку аспарагина, расположенного примерно в положении 297 в Fc-области (EU нумерация Fc-участков аминокислотных остатков); тем не менее Asn297 также может быть расположен около ±3 аминокислоты, выше или ниже позиции 297, т.е. между позициями 294 и 300, в связи с незначительными вариациями последовательностей в антителах. Такие модификации фукозилирования могут иметь улучшенную ADCC функцию. См., например, патенты США №№US 2003/0157108 (Presta, L); US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Примеры публикаций, относящихся к "дефукозилированным" или "недостаточным по содержанию фукозы" модификациям антител, включают: US 2003/0157108, WO 2000/61739, WO 2001/29246, US 2003/0115614, US 2002/0164328, US 2004/0093621, US 2004/0132140, US 2004/0110704, US 2004/0110282, US 2004/0109865, WO 2003/085119, WO 2003/084570, WO 2005/035586, WO 2005/035778, WO 2005/053742, WO 2002/031140, Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki etal. Biotech. Bioeng. 87: 614 (2004). Примеры клеточных линий, способных производить дефукозилированные антитела, включают Lec13 СНО клетки с недостаточным фукозилированием белка (Ripka et al. Arch. Biochem. Biophys. 249: 533-545 (1986); заявка на патент США US 2003/0157108 А1; и WO 2004/056312 А1, особенно в примере 11), и нокаутные клеточные линии, такие как СНО клетки, нокаутные по гену альфа-1,6-фукозилтрансферазе, FUT8 (см., например, Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4):680-688 (2006) и WO 2003/085107).
Дополнительно предлагаются модификации антитела с разделенными олигосахаридами, например, в которых биантенный олигосахарид, присоединенный к Fc-области антитела, делится на части с помощью GlcNAc. Такие модифицированные антитела могут иметь пониженное фукозилирование и/или улучшенную ADCC функцию. Примеры таких модификаций антитела описаны, например, в WO 2003/011878, патенте США №6602684, US 2005/0123546 и Ferrara et al., Biotechnology and Bioengineering, 93(5): 851-861 (2006). Также предлагаются модификации антитела с по меньшей мере одним остатком галактозы в олигосахариде, присоединенном к Fc-участку. Такие модификации антитела могут иметь улучшенную функцию КЗЦ. Такие модификации антитела описаны, например, в WO 1997/30087, WO 1998/58964 и WO 1999/22764.
В некоторых вариантах реализации изобретения модифицированные антитела, включающие Fc-участок, описанный в данном документе, способны связываться с FcyRIII. В некоторых вариантах реализации изобретения модифицированные антитела, включающие Fc-участок, описанный в данном документе, обладают ADCC активностью в присутствии эффекторных клеток человека или имеют повышенную ADCC активность в присутствии эффекторных клеток человека по сравнению с таким же антителом, включающим Fc-участок дикого типа lgG1 человека.
(xi) Модификации Fc-участка
В некоторых вариантах реализации изобретения одна или более аминокислотных модификаций могут быть введены в Fc-участок антитела, предложенного в данном документе, создавая тем самым модифицированный Fc-участок. Модифицированный Fc-участок может содержать последовательность человеческого Fc-участка (например, Fc-участок человеческого lgG1, lgG2, lgG3 или lgG4), содержащую аминокислотную модификацию (например, замену) в одном или более положениях аминокислот.
В некоторых вариантах реализации данное изобретение предполагает модификацию антитела, которая обладает некоторыми, но не всеми эффекторными функциями, что делает ее подходящим кандидатом для практических применений, в которых период полураспада антитела in vivo представляется важным, при этом определенные эффекторные функции (такие как комплемент и ADCC) представляются ненужными или вредными. Цитотоксические анализы могут быть проведены in vitro и/или in vivo для подтверждения уменьшения/истощения КЗЦ и/или ADCC активности. Например, анализы связывания с Fc-рецептором (FcR) могут быть проведены с целью подтверждения того, что антитело не может связываться с FcγR (следовательно, вероятно, из-за недостаточности ADCC активности), но при этом сохраняет способность связываться с FcRn. NK клетки, первичные клетки, опосредующие ADCC, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках суммирована в таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol. 9:457-492 (1991). He ограничивающие примеры анализов для оценки ADCC активности целевой молекулы in vitro описаны в патенте США №5500362 (см., например, Hellstrom et al. Proc. Nat'l Acad. Sci. USA 83:7059-7063 (1986)) и Hellstrom, I et al., Proc. Nat'l Acad. Sci. USA 82:1499-1502 (1985); 5821337 (см. Bruggemann et al., J. Exp. Med. 166:1351-1361 (1987)). В альтернативном варианте могут быть использованы нерадиоактивные методы анализа (см., например, ACTI™ нерадиоактивный анализ цитотоксичности для проточной цитометрии (CellTechnology, Inc. Mountain View, CA; и CytoTox 96® нерадиоактивный анализ цитотоксичности (Promega, Madison, Wl). Подходящие эффекторные клетки для таких анализов включают мононуклеарные клетки периферической крови (МКПК) и клетки естественные киллеры (NK). В альтернативном варианте или дополнительно ADCC активность целевой молекулы может быть оценена in vivo, например, в животной модели, такой как описанная в Clynes et al. Proc. Nat'l Acad. Sci. USA 95:652-656 (1998). Также могут быть проведены анализы C1q связывания для подтверждния того, что антитело не может связаться с C1q и, следовательно, имеет недостаточность КЗЦ активности. См., например, C1q и С3с связывание методом ИФА в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента может быть выполнен анализ КЗЦ (см., например, Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996); Cragg et al., Blood 101:1045-1052 (2003); и Cragg et al., Blood 103:2738-2743 (2004)). FcRn связывание и определение выведения/времени полужизни in vivo также могут быть выполнены с использованием способов, известных в данной области техники (см., например, Petkova et al., Int'l. Immunol. 18(12): 1759-1769 (2006)).
Антитела с пониженной эффекторной функцией включают те, у которых имеется замещение в Fc-участке одного или более аминокислотных остатков 238, 265, 269, 270, 297, 327 и 329 (патент США №6737056). Такие Fc-мутанты включают Fc-мутанты с заменами в двух или более положениях аминокислот 265, 269, 270, 297 и 327, включая так называемый "DANA" Fc-мутант с заменой аминокислотных остатков 265 и 297 на аланин (патент США №7332581).
Описаны некоторые модификации антитела с улучшенным или уменьшенным связывания с FcRs. (См., например, патент США №6737056; WO 2004/056312, и Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001).)
В некоторых вариантах реализации изобретения модификация антитела включает Fc-участок с одной или более аминокислотными заменами, которые улучшают ADCC, например, замены в положениях 298, 333 и/или 334 Fc-участка (EU нумерация аминокислотных остатков). В типовом варианте реализации изобретения антитело содержит следующие аминокислотные замены в своем Fc-участке: S298A, Е333А и К334А.
В некоторых вариантах реализации изобретения изменения сделаны в Fc-участке, которые приводят к измененному (т.е. либо улучшенному, либо уменьшенному) C1q связыванию и/или комплемент-зависимой цитотоксичности (КЗЦ), например, как описано в патенте США №6194551, WO 99/51642 и Idusogie et al. J. Immunol. 164: 4178-4184 (2000).
Антитела с увеличенным временем полужизни и улучшенным связыванием с неонатальным Fc рецептором (FcRn), который отвечает за перенос материнских IgG к плоду (Guyeretal., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)), описаны в US 2005/0014934 A1 (Hinton et al.)). Такие антитела содержат Fc-участок с одной или более заменами в них, которые улучшают связывание Fc-участка с FcRn. Такие модификации Fc включают те, в которых имеются замены в Fc-участке одного или более аминокислотных остатков: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замена аминокислотного остатка 434 в Fc-участке (патент США №7371826). См. также Duncan & Winter, Nature 322:738-40 (1988); патент США №5648260; патент США №5624821; и WO 94/29351, касающиеся других примеров модификаций Fc-участка.
(xii) Производные антител
Антитела по данному изобретению могут быть дополнительно модифицированы для включения дополнительных небелковых фрагментов, которые известны в данной области техники и легкодоступны. В некоторых вариантах реализации изобретения фрагменты, пригодные для получения производных антитела представляют собой водорастворимые полимеры. Не ограничивающие примеры водорастворимых полимеров включают, но не ограничиваются этими, полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена с малеиновым ангидридом, полиаминокислоты (либо гомополимеры, либо статистические сополимеры) и декстран или поли(n-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксида с этиленоксидом, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их комбинации. Полиэтиленгликоль пропиональдегид может иметь преимущества в производстве благодаря его стабильности в воде. Полимер может быть любой молекулярной массы и может быть разветвленным или неразветвленным. Количество полимеров, присоединенных к антителу может варьировать, и в случае присоединения более чем одного полимера, молекулы могут быть одинаковыми или разными. В целом количество и/или тип полимеров, используемых для получения производных, может быть определено на основе соображений включающих, но не ограничивающихся этими, улучшение конкретных свойств или функций антитела, возможное использование производного антитела в терапии при определенные условиях и т.д.
(xiii) Векторы, клетки-хозяева и рекомбинантные способы
Антитела могут быть также получены с помощью рекомбинантных способов. Для рекомбинантного получения анти-антиген антитела, нуклеиновую кислоту, кодирующую антитело, выделяют и встраивают в репликативный вектор для дальнейшего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующая антитело, может быть легко выделена и секвенирована с использованием общепринятых процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела). Многие векторы доступны. Компоненты вектора, как правило, включают, но не ограничиваются этими, один или более из следующего: сигнальную последовательность, ориджин репликации, один или более маркерных генов, энхансер элемент, промотор и последовательность терминации транскрипции.
(а) Компонент сигнальной последовательности
Антитело по данному изобретению может быть получено рекомбинантными способами не только само по себе, но также в виде полипептида, трансляционно слитого с гетерологическим полипептидом, который предпочтительно представляет собой сигнальную последовательность или другой полипептид, имеющий специфический сайт расщепления на N-конце зрелого белка или полипептида. Гетерологическая сигнальная последовательность, которая выбирается предпочтительно, представляет собой такую, которая распознается и процессируется (например, расщепляется сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не распознают и не процессируют нативную сигнальную последовательность антитела, сигнальная последовательность может быть заменена на прокариотическую сигнальную последовательность, выбранную, например, из группы из лидерных последовательностей щелочной фосфатазы, пенициллиназы, Ipp или термостабильного энтеротоксина II. Для секреции в дрожжах нативная сигнальная последовательность может быть замещена, например, лидерной последовательностью дрожжевой инвертазы, лидерной последовательностью фактора (в том числе Saccharomyces и Kluyveromyces α-факторные лидерные последовательности), или лидерной последовательностью кислой фосфатазы, лидерной последовательностью глюкоамилазы С. albicans или сигналом, описанным в WO 90/13646. При экспрессии в клетках млекопитающих, доступны сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например, gD сигнал вируса простого герпеса.
(б) Ориджин репликации
Как экспрессирующие, так и клонирующие векторы содержат последовательность нуклеиновой кислоты, которая обеспечивает репликацию вектора в одной или более выбранных клетках-хозяевах. Как правило, в клонирующих векторах эта последовательность представляет собой последовательность, которая обеспечивает репликацию вектора независимо от хромосомной ДНК хозяина, и включает ориджины репликации или автономно реплицирующиеся последовательности. Такие последовательности хорошо известны для различных бактерий, дрожжей и вирусов. Ориджин репликации из плазмиды pBR322 является пригодным для большинства грамотрицательных бактерий, ориджин 2 мкм плазмиды пригоден для дрожжей, а различные вирусные ориджины (SV40, полиомы, аденовируса, ВВС или BPV) пригодны для клонирования векторов в клетках млекопитающих. В целом для экспрессирующих векторов млекопитающих компонент ориджина репликации не требуется (как правило, ориджин SV40 можно использовать только потому, что он содержит ранний промотор).
(в) Выбор компонента гена
Экспрессирующие и клонирующие векторы могут содержать селективный ген, также называемый селективным маркером. Типичные селективные гены кодируют белки, которые: а) придают устойчивость к антибиотикам или другим токсинам, например, к ампициллину, неомицину, метотрексату или тетрациклину; б) комплементируют ауксотрофные недостаточности; или в) снабжают незаменимыми питательными веществами, не доступными из сложных питательных сред, например, ген, кодирующий D-аланинрацемазу для Bacilli.
В одном из примеров селекционной схемы используют лекарственное средство для задержки роста клетки-хозяина. Те клетки, которые успешно трансформированы гетерологическим геном, продуцируют белок, придающий устойчивость к лекарственному средству, и, таким образом, выживают в режиме селекции. В примерах такой доминантной селекции используют лекарственные средства неомицин, микофеноловую кислоту и гигромицин.
В другом примере подходящие селективные маркеры для клеток млекопитающих, которые позволяют идентифицировать клетки, представляют собой те, что компетентно совмещены с нуклеиновой кислотой, кодирующей антитело, такие как ДГФР, глутаминсинтетаза (ГС), тимидинкиназа, металлотионеин-I и II, предпочтительно металлотиониновые гены приматов, аденозиндезаминаза, орнитиндекарбоксилаза и т.д.
Например, клетки, трансформированные геном ДГФР, идентифицируют путем культивирования трансформантов в культуральной среде, содержащей метотрексат (МТТ), конкурентный антагонист ДГФР. В таких условиях ген ДГФР амплифицируется вместе с любой другой котрансформированой нуклеиновой кислотой. Может быть использована клеточная линия яичников китайского хомячка (СНО) с недостаточной эндогенной активностью ДГФР (например, АТСС CRL-9096).
В альтернативном варианте клетки, трансформированные геном ГС идентифицируются путем культивирования трансформантов на культуральной среде, содержащей L-метионина сульфоксимин (MSX), ингибитор ГС. В таких условиях ген ГС амплифицируется вместе с любой другой котрансформированой нуклеиновой кислотой. Система селекции/амплификации ГС может быть использована в сочетании с системой селекции/амплификации ДГФР, описанной ранее.
В альтернативном варианте клетки-хозяева (в частности, хозяева дикого типа, которые содержат эндогенную ДГФР), трансформированные или котрансформированные последовательностями ДНК, кодирующими целевое антитело, ДГФР ген дикого типа и другой селективный маркер, такой как аминогликозид 3'-фосфотрансферазу (АРН), могут быть отобраны по росту клеток на питательной среде, содержащей селективный агент для селективного маркера, такого как аминогликозидный антибиотик, например, канамицин, неомицин или G418. См. патент США №4965199.
Подходящий селективный ген для использования в дрожжах представляет собой frp1 ген, присутствующий в дрожжевой плазмиде YRp7 (Stinchcomb et al., Nature, 282:39 (1979)). Ген trp1 относится к селективному маркеру для мутантного штамма дрожжей, лишенного способности расти в отсутствие триптофана, например, АТСС №44076 или РЕР4-1. Jones, Genetics, 85:12 (1977). Наличие trp1 повреждения в геноме дрожжевой клетки-хозяина создает эффективную среду для обнаружения трансформации по росту в отсутствие триптофана. Аналогичным образом Leu2 дефектные штаммы дрожжей (АТСС 20622 или 38626) комплементируются известными плазмидами, несущими Leu2 ген.
В дополнение, для трансформации Kluyveromyces дрожжей могут быть использованы векторы, полученные из 1,6 мкм кольцевой плазмиды pKD1. В альтернативном варианте сообщалось об экспрессионной системе для крупномасштабной продукции рекомбинантного химозина теленка в K. lactis. Van den Berg, Bio/Technology, 8:135 (1990). Также были раскрыты стабильные мультикопийные экспрессионные векторы для секреции зрелого рекомбинантного сывороточного альбумина человека промышленными штаммами Kluyveromyces. Fleer et al., Bio/Technology 9:968-975 (1991).
(г) Компонент промотора
Экспрессирующие и клонирующие векторы обычно содержат промотор, который распознается организмом-хозяином и функционально связан с нуклеиновой кислотой, кодирующей антитело. Промоторы, подходящие для использования в прокариотических хозяевах, включают phoA промотор, β-лактамазную и лактозную промоторные системы, промотор щелочной фосфатазы, триптофановую (trp) промоторную систему и гибридные промоторы, такие как tac промотор. Однако, подходящими являются и другие известные бактериальные промоторы. Промоторы для использования в бактериальных системах также будут содержать последовательность Шайна-Дальгарно (S.D.), функционально связанную с ДНК, кодирующей антитело.
Известны промоторные последовательности для эукариот. Практически все эукариотические гены имеют АТ-богатую область, расположенную на около 25-30 оснований выше сайта инициации транскрипции. Другая последовательность, находящаяся на 70-80 оснований выше начала транскрипции многих генов, представляет собой CNCAAT область, где N может быть любым нуклеотидом. На 3'-конце большинства эукариотических генов находится последовательность ААТААА, которая может быть сигналом для добавления поли-А хвоста к 3'-концу кодирующей последовательности. Все эти последовательности соответствующим образом вставлены в эукариотические экспрессирующие векторы.
Примеры подходящих промоторных последовательностей для использования в дрожжевых хозяевах включают промоторы 3-фосфоглицераткиназы или других гликолитических ферментов, таких как энолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфат-изомераза, 3-фосфоглицератмутаза, пируваткиназа, триозофосфатизомераза, фосфоглюкоизомераза и глюкокиназа.
Другие дрожжевые промоторы, которые являются индуцибельными промоторами, имеющие дополнительное преимущество транскрипции, контролируемой условиями роста, представляют собой промоторные области алкогольдегидрогеназы 2, изоцитохрома С, кислой фосфатазы, разрушающих ферментов, связанных с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфатдегидрогеназы и ферментов, ответственных за усваивание мальтозы и галактозы. Подходящие векторы и промоторы, используемые для экспрессии в дрожжах, дополнительно описаны в ЕР 73657. Дрожжевые энхансеры также преимущественно используются с дрожжевыми промоторами.
Транскрипция антитела с векторов в клетках млекопитающих хозяев может регулироваться, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, вирус оспы птиц, аденовирус (такой как аденовирус 2-го типа), бычий папилломавирус, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита В, обезьяний вирус 40 (SV40), или гетерологическими промоторами млекопитающих, например, актиновым промотором или иммуноглобулиновый промотором, промоторами теплового шока, при условии, что такие промоторы совместимы с системами клетки-хозяина.
Промоторы ранних и поздних генов вируса SV40 легко получают в виде рестрикционного фрагмента SV40, который также содержит SV40 вирусный ориджин репликации. Предранний промотор цитомегаловируса человека легко получают в виде фрагмента рестрикции HindIII Е. Система для экспрессии ДНК в млекопитающих хозяевах, с использованием бычьего папилломавируса в качестве вектора, описана в патенте США №4419446. Модификация этой системы описана в патенте США №4601978. См. также Reyes et al., Nature 297:598-601 (1982) про экспрессию кДНК β-интерферона человека в клетках мышей под контролем промотора тимидинкиназы из вируса простого герпеса. В альтернативном варианте в качестве промотора может быть использован длинный концевой повтор вируса саркомы Рауса.
(д) Компонент энхансерного элемента
Транскрипцию ДНК, кодирующей антитело по данному изобретению, у высших эукариот часто повышают путем введения последовательности энхансера в вектор. В настоящее время известно много энхансерных последовательностей из генов млекопитающих (глобина, эластазы, альбумина, а-фетопротеина и инсулина). Однако, как правило, специалист будет использовать энхансер из вируса эукариотической клетки. Примеры включают энхансер SV40 на поздней стороне сайта инициации репликации (100-270 п. н.), энхансер промотора ранних генов цитомегаловируса, энхансер полиомы на поздней стороне сайта инициации репликации и аденовирусные энхансеры. См. также Yaniv, Nature 297:17-18 (1982) об энхансерных элементах для активации эукариотических промоторов. Энхансер может быть встроен в вектор в положении 5' или 3' по отношению к кодирующей последовательности антитела, но предпочтительно расположен в 5'-позиции от промотора.
(е) Компонент терминации транскрипции
Экспрессионные векторы, используемые в эукариотических клетках-хозяевах (дрожжей, грибов, насекомых, растений, животных, человека или ядросодержащих клетках из других многоклеточных организмов), также будут содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Такие последовательности обычно доступны из 5'- и иногда 3'-нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, которые транскрибируются в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей антитело. Один подходящий компонент терминации транскрипции представляет собой область полиаденилирования бычьего гормона роста. См. WO 94/11026 и экспрессионый вектор, раскрытый в этом документе.
(ж) Выбор и трансформация клеток-хозяев
В данном документе подходящие клетки-хозяева для клонирования или экспрессии ДНК в векторах представляют собой прокариотические, дрожжевые или высшие эукариотические клетки, описанные ранее. Подходящие для этой цели прокариоты включают эубактерии, такие как грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как Escherichia, например, Е. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans, и Shigella, а также Bacilli, тате как В. subtilis, и В. licheniformis (например, В. licheniformis 41Р, раскрытых в DD 266710, опубликованном 12 апреля 1989 года), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Один из предпочтительных хозяев для клонирования в Е. coli представляет собой Е. coli 294 (АТСС 31446), хотя подходят и другие штаммы, такие как E. coli В, E. coli Х1776 (АТСС 31537) и E. coli W3110 (АТСС 27325). Эти примеры являются иллюстративными, а не ограничивающими.
Полноразмерное антитело, трансляционно слитые с антителом белки и фрагменты антител могут быть получены в бактериях, в частности, когда не нужны гликозилирование и эффекторная функция Fc, например, когда терапевтическое антитело конъюгировано с цитотоксическим агентом (например, токсином), который сам по себе демонстрирует эффективность в уничтожении опухолевых клеток. Полноразмерные антитела имеют большее время полужизни при циркуляции. Производство в Е. coli представляет собой более быстрое и экономичное. Для экспрессии фрагментов антител и полипептидов в бактериях, см., например, патент США №5648237 (Carter et. al.), патент США №5789199 (Joly et al.), патент США №5840523 (Simmons et al.), которые описывают область инициации трансляции (TIR) и сигнальные последовательности для оптимизации экспрессии и секреции. См. также Charlton, Methods in Molecular Biology, Vol. 248 (В.K. C. Lo, ed., Humana Press, Totowa, N.J., 2003), pp. 245-254, описывающие экспрессию фрагментов антител в E. coli. После экспрессии указанное антитело может быть изолировано из клеточной массы Е. coli в растворимой фракции и может быть очищено, например, с помощью колонки с белком А или G в зависимости от изотипа. Окончательная очистка может быть проведена аналогично способу очистки антител, экспрессированных, например, в клетках СНО.
В дополнение к прокариотам, подходящие для клонирования или экспрессии векторов, кодирующих антитела, хозяева представляют собой эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи. Saccharomyces cerevisiae, или обычные пекарские дрожжи, представляют собой наиболее часто используемые среди низших эукариотических микроорганизмов-хозяев. Тем не менее, ряд других родов, видов и штаммов являются общедоступными и используются в данном документе, такие как Schizosaccharomyces pombe; хозяева Kluyveromyces, такие как, например, K. lactis, К. fragilis (АТСС 12424), K. bulgaricus (АТСС 16045), K. wickeramii (АТСС 24178), K. waltii (АТСС 56500), К. drosophilarum (АТСС 36906), K. thermotolerans и К. marxianus; Yarrowia (ЕР 402226); Pichia pastoris (ЕР 183070); Candida; Trichoderma reesia (ЕР 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и мицелиальные грибы, такие как, например, Neurospora, Penicillium, Tolypocladium, и хозяева Aspergillus, такие как A. nidulans и A. niger. Для обзора, обсуждающего использование дрожжей и мицелиальных грибов для производства терапевтических белков, см., например, Gerngross, Nat. Biotech. 22:1409-1414 (2004).
Могут быть выбраны некоторые грибы и штаммы дрожжей, в которых были "гуманизированны" пути гликозилирования, в результате чего получают антитела с частично или полностью характерным для человека гликозилированием. См., например, Li et al., Nat. Biotech. 24: 210-215 (2006) (описание гуманизирования пути гликозилирования в Pichia pastoris); и Gerngross et al., ранее.
Подходящие клетки-хозяева для экспрессии гликозилированного антитела также получают из многоклеточных организмов (беспозвоночных и позвоночных). Примеры беспозвоночных клеток включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие пермиссивные клетки насекомых-хозяев от таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Разнообразные вирусные штаммы для трансфекции являются общедоступными, например, L-1 вариант Autographa californica ВЯП и штамм Bm-5 Bombyx mori ВЯП, и такие вирусы могут быть использованы в качестве вируса в данном документе в соответствии с изобретением, в частности, для трансфекции клеток Spodoptera frugiperda.
Как хозяева также могут быть использованы культуры растительных клеток хлопка, кукурузы, картофеля, сои, петунии, томатов, ряски (Leninaceae), люцерны (М. truncatula) и табака. См., например, патенты США №№5959177, 6040498, 6420548, 7125978 и 6417429 (описывающие PLANTIBODIES™ технологию для получения антител в трансгенных растениях).
В качестве хозяев могут быть использованы клетки позвоночных, а размножение клеток позвоночных в культуре (культура ткани) стало обычной процедурой. Примеры подходящих клеточных линий млекопитающих-хозяев представляют собой CV1 линию почки обезьяны, трансформированную SV40 (COS-7, АТСС CRL 1651); линию человеческой эмбриональной почки (293 или 293 клетки, субклонированные для роста в суспензионной культуре, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки новорожденного хомяка (ВНК, АТСС CCL 10); клетки Сертоли мыши (ТМ4, Mather, Biol. Reprod. 23: 243-251 (1980)); клетки почки обезьяны (CV1 АТСС CCL 70); клетки почки африканской зеленой мартышки (VERO-76, АТСС CRL-1587); клетки рака шейки матки человека (HeLa, АТСС CCL 2); клетки почек собаки (MDCK, АТСС CCL 34); клетки печени крысы Buffalo (BRL 3А, АТСС CRL 1442); клетки легкого человека (W138, АТСС CCL 75); клетки печени человека (Hep G2, НВ 8065); опухоль молочной железы мыши (ММТ 060562, АТСС CCL51); TRI клетки (Mather et al., Annals N.Y. Acad. Sci. 383: 44-68 (1982)); клетки MRC 5; клетки FS4; и линия гепатомы человека (Hep G2). Другие подходящие клеточные линии млекопитающих-хозяев включают клетки яичников китайского хомячка (СНО), в том числе клетки DHFR- СНО (Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); и клеточные линии миеломы, такие как NS0 и Sp2/0. Для обзора известных клеточных линий млекопитающих-хозяев, подходящих для продуцирования антител, см., например, Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (В.К.C. Lo, ed., Humana Press, Totowa, N.J., 2003), pp. 255-268.
Клетки-хозяева трансформируют вышеописанными экспрессирующими или клонирующими векторами для продуцирования антител и культивируют на стандартных питательных средах, модифицированных соответствующим образом для индукции промоторов, отбора трансформантов или амплификации генов, кодирующих целевые последовательности.
(з) Культивирование клеток-хозяев
Клетки-хозяева, используемые для получения антитела по данному изобретению, могут быть культивированы в различных питательных средах. Для культивирования клеток-хозяев подходят коммерчески доступные питательные среды, такие как F10 Хэма (Sigma), минимальная среда Игла ((MEM), (Sigma)), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла ((DMEM), Sigma)). В дополнение, любая из питательных сред, описанных в Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), патентах США №№4767704, 4657866, 4927762, 4560655 или 5122469; WO 90/03430, WO 87/00195 или патенте США Re. 30985, может быть использована в качестве культуральной среды для клеток-хозяев. Любая из этих сред может быть дополнена при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальция, магния и фосфат), буферами (таким как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственный препарат GENTAMYCIN™), следовыми элементами (определенными как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки также могут быть включены в соответствующих концентрациях, которые должны быть известны специалистам в данной области техники. Условия культивирования, такие как температура, рН и т.п., являются теми же, которые ранее использовались для клетки-хозяина, выбранной для экспрессии, и будут очевидны обычному специалисту.
(xiv) Очистка антител
При использовании рекомбинантных технологий антитело может быть получено внутриклеточно, в периплазматическом пространстве или непосредственно секретироваться в среду. Если антитело получают внутриклеточно, на первом этапе удаляют частицы дебриса от клеток-хозяев или лизированных фрагментов, например, путем центрифугирования или ультрафильтрации. Carter et al., Bio/Technology 10:163-167 (1992) описывают способ изолирования антител, которые секретируются в периплазматическое пространство Е. coli. Вкратце, клеточную массу оттаивают в присутствии ацетата натрия (рН 3,5), EDTA и фенилметилсульфонилфторида (ФМСФ) в течение около 30 мин. Клеточный дебрис может быть удален путем центрифугирования. Если антитело секретируется в среду, супернатанты от таких систем экспрессии, как правило, сначала концентрируют с использованием коммерчески доступного фильтра для концентрирования белков, например, Amicon или Millipore Pellicon ультрафильтрационных кассет. Ингибитор протеазы, такой как ФМСФ, может быть включен в любую из предыдущих стадий для ингибирования протеолиза, а антибиотики могут быть включены для предотвращения роста непредусмотренных контаминантов.
Композиция антител, полученная из клеток, может быть очищена с использованием, например, хроматографии на гидроксилапатите, хроматографии с гидрофобным взаимодействием, гель-электрофореза, диализа и аффинной хроматографии, при этом аффинная хроматография, как правило, является одной из предпочтительных стадий очистки. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, который присутствует в антителе. Белок А можно использовать для очистки антител на основе человеческих γ1, γ2 или γ4 тяжелых цепей (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Белок G рекомендуется для всех мышиных изотипов и для человеческого γ3 (Guss et al., EMBO J. 5:15671575 (1986)). Матрикс, к которому присоединен аффинный лиганд, наиболее часто представляет собой агарозу, но имеются и другие матриксы. Механически стабильные матриксы, такие как стекло с контролируемым размером пор или поли(стиролдивинил)бензол, обеспечивают более высокие скорости потока и сокращение времени технологического процесса, чем то, что может быть достигнуто с агарозой. В случае, когда антитело содержит CH3 домен, для очистки используют смолу Bakerbond АВХ™ (J.Т. Baker, Phillipsburg, N.J.). В зависимости от антитела, которое должно быть выделено, доступны также и другие способы для очистки белка, такие как фракционирование на ионообменной колонке, осаждение этанолом, ВЭЖХ с обращенной фазой, хроматография на силикагеле, хроматография на heparin SEPHAROSE™, хроматография на анионо- или катионообменной смоле (такой как колонка с полиаспарагиновой кислотой), хроматофокусирование, ДСН-ПААГ электрофорез и осаждение с помощью сульфата аммония.
В целом различные методики получения антител для использования в исследованиях, апробациях и клинике хорошо разработаны в данной области техники, согласуются с вышеописанными методиками и/или считаются подходящими специалистом в данной области техники для конкретного целевого антитела.
(xv) Выбор биологически активных антител
Антитела, полученные, как описано ранее, могут подвергаться одному или более анализам "биологической активности" для отбора антитела с полезными свойствами с терапевтической точки зрения или для подбора композиций и условий, которые сохраняют биологическую активность антитела. Антитело может быть проверено на его способность связываться с тем антигеном, против которого оно было выработано. Например, могут быть использованы способы, известные в данной области техники (такие как ELISA, вестерн-блоттинг и т.д.).
Например, для анти-PD-L1 антитела антигенсвязывающие свойства антитела могут быть оценены с помощью анализа, определяющего способность связываться с PD-L1. В некоторых вариантах реализации изобретения связывание антитела может быть определено путем насыщения участков связывания, ELISA, и/или конкурентными методами (например, РИА), например. Кроме того, антитело может подвергаться другим анализам биологической активности, например, для оценивания его эффективности в качестве терапевтического средства. Такие анализы известны в данной области техники и зависят от целевого антигена и предполагаемого использования антитела. Например, биологические эффекты блокирования PD-L1 с помощью антитела могут быть оценены по CD8+ Т-клеткам, на модели вируса лимфоцитарного хориоменингита (ВЛХ) мыши и/или сингенной модели опухоли, как описано, например, в патенте США 8217149.
Для скрининга антител, которые связываются с конкретным эпитопом на целевом антигене (например, тех, которые блокируют связывание анти-PD-L1 антитела с примерным PD-L1), может быть выполнен обычный эпитоп перекрестный конкурентный анализ, такой, как описанный в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). В альтернативном варианте картирование эпитопов, например, как описано в Champe et al., J. Biol. Chem. 270:1388-1394 (1995), может быть выполнено для определения связывания антитела с целевым эпитопом.
IV. Фармацевтические композиции и препараты
Также в данном документе предлагаются фармацевтические композиции и препараты, содержащие антагонист, связывающийся с компонентом сигнального пути PD-1, и/или антитело, описанное в данном документе (например, анти-PD-L1 антитело) и фармацевтически приемлемый носитель. Изобретение также относится к фармацевтическим композициям и препаратам, содержащим таксаны, например, наб-паклитаксел (ABRAXANE®), паклитаксел или доцетаксел.
Фармацевтические композиции и препараты, описанные в данном документе, могут быть получены путем смешивания активных ингредиентов (например, антагониста, связывающегося с компонентом сигнального пути PD-1, и/или таксана), имеющих требуемую степень чистоты, с одним или более необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в виде лиофилизированных композиций или водных растворов. Фармацевтически приемлемые носители, как правило, нетоксичны для реципиентов в используемых дозах и концентрациях и включают, но не ограничиваются этими: буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; бензетониума хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (менее чем около 10 аминокислотных остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). Примеры фармацевтически приемлемых носителей в данном описании дополнительно включают средства диспергирования лекарственных средств в межклеточном пространстве, такие как растворимые нейтрально-активные гликопротеины гиалуронидазы (рГПГА), например, растворимые гликопротеины гиалуронидазы человека РН-20, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые примеры рГПГА и способы применения, в том числе rHuPH20, описаны в публикациях патентов США №№2005/0260186 и 2006/0104968. В одном аспекте изобретения рГПГА комбинируют с одним или более дополнительными гликозаминогликаназами, такими как хондроитиназы.
Примеры препаратов лиофилизированных антител описаны в патенте США №6267958. Водные препараты антител включают те, которые описаны в патенте США №6171586 и WO 2006/044908, последние препараты, в том числе гистидин-ацетатный буфер.
Композиции и препараты, описанные в данном документе, также могут содержать более одного активного ингредиента, если это необходимо для конкретного показания, подлежащего лечению, предпочтительно такие ингридиенты, которые обладают комплементарными действиями, не оказывающими отрицательного влияния друг на друга. Такие активные ингредиенты предпочтительно присутствуют в комбинации в количествах, которые эффективны для поставленной задачи.
Активные ингредиенты могут быть заключены в микрокапсулы, полученные, например, способами коацервации или путем межфазной полимеризации, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметакрилат)-микрокапсулы соответственно, в коллоидных системах доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсиях. Такие способы описаны в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих антитело, где матрицы находятся в виде профилированных изделий, например, пленок или микрокапсул. Препараты для введения in vivo обычно являются стерильными. Стерильность может быть легко достигнута, например, путем фильтрации через стерильные фильтрующие мембраны.
IV. Способы лечения
В данном документе предлагаются способы терапии или задерживания прогрессирования рака у индивидуума, которые включают введение индивидууму эффективного количества антагониста, связывающегося с компонентом сигнального пути PD-1, и таксана (например, наб-паклитаксела (ABRAXANE®) или паклитаксела). В некоторых вариантах реализации изобретения терапия приводит к ответу у индивидуума после лечения. В некоторых вариантах реализации изобретения ответ представляет собой полный ответ. В некоторых вариантах реализации изобретения терапия приводит к устойчивой реакции у индивидуума после прекращения лечения. Способы, описанные в данном документе, могут найти применение условиях лечения, когда желательна усиленная иммуногенность, такая как повышенная опухолевая иммуногенность для лечения рака. Также в данном документе предлагаются способы повышения иммунной функции у индивидуума с раком, которые включают введение индивидууму эффективного количества антагониста, связывающегося с компонентом сигнального пути PD-1, и таксана (например, наб-паклитаксела (ABRAXANE®) или паклитаксела). В этих способах может быть использован любой из антагонистов, связывающихся с компонентами сигнального пути PD-1 и таксанов, известных в данной области техники, или описанных в данном документе. В некоторых вариантах реализации изобретения способы дополнительно включают введение химиотерапевтического агента на основе платины. В некоторых вариантах реализации изобретения химиотерапевтический агент на основе платины представляет собой карбоплатин.
В некоторых вариантах реализации изобретения индивидуум представляет собой человека. В некоторых вариантах реализации изобретения индивидуум болен раком. В некоторых вариантах реализации изобретения рак представляет собой рак молочной железы (например, тройной негативный рак молочной железы), рак мочевого пузыря (например, УРМП, МИРМП и НМИРМП), колоректальный рак, рак прямой кишки, рак легкого (например, немелкоклеточный рак легкого, который может быть плоскоклеточный или неплоскоклеточным), глиобластому, неходжкинскую лимфому (НХЛ), почечно-клеточный рак (например, ПКК), рак предстательной железы, рак печени, рак поджелудочной железы, саркому мягких тканей, саркому Капоши, карциноидную карциному, рак головы и шеи, рак желудка, рак пищевода, рак предстательной железы, рак эндометрия, рак почки, рак яичников, мезотелиому, и гем злокачественности (например, МДС и множественной миеломы). В некоторых вариантах реализации изобретения рак выбран из: мелкоклеточного рака легкого, глиобластомы, нейробластомы, меланомы, рака молочной железы, рака желудка, колоректального рака (КРР) или гепатоцеллюлярной карциномы. В конкретных вариантах реализации изобретения рак выбран из рака легкого (например, немелкоклеточного рака легкого, который может быть плоскоклеточным или неплоскоклеточным), рака мочевого пузыря (например, УРМП), рака молочной железы (например, ТНРМЖ), РКК, меланомы, колоректального рака и гем злокачественности (например, МДС и множественной миеломы). В некоторых вариантах реализации изобретения рак легкого представляет собой немелкоклеточный рак легкого, который может быть плоскоклеточным или неплоскоклеточным. В некоторых вариантах реализации изобретения рак мочевого пузыря представляет собой УРМП. В некоторых вариантах реализации изобретения рак молочной железы представляет собой ТНРМЖ. В некоторых вариантах реализации изобретения гем злокачественность представляет собой МДС или множественную миелому.
В некоторых вариантах реализации изобретения к индивидууму применили онкотерапию перед комбинированной терапией с использованием антагониста, связывающегося с компонентом сигнального пути PD-1, и таксана. В некоторых вариантах реализации изобретения индивидуум имеет рак, который устойчив к одной или более онкотерапий. В некоторых вариантах реализации изобретения устойчивость к онкотерапий включает рецидив рака или рефрактерный рак. Рецидив может относиться к повторному появлению рака в исходном месте или новом месте после лечения. В некоторых вариантах реализации изобретения устойчивость к онкотерапий включает прогрессирование рака во время лечения с применением противораковой терапии. В некоторых вариантах реализации изобретения устойчивость к онкотерапий включает рак, который не реагирует на терапию. Рак может быть устойчивым в начале лечения или может стать устойчивым во время лечения. В некоторых вариантах реализации изобретения рак находится на ранней стадии или на поздней стадии.
В некоторых вариантах реализации изобретения комбинированная терапия из данного изобретения включает введение антагониста, связывающегося с компонентом сигнального пути PD-1, и таксана. Антагонист, связывающийся с компонентами сигнального пути PD-1 и таксан (например, наб-паклитаксел (ABRAXANE®) или паклитаксел), может быть введен любым подходящим способом, известным в данной области техники. Например, антагонист, связывающийся с компонентами сигнального пути PD-1, и таксан может быть введен последовательно (в разное время) или параллельно (одновременно). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, находится в отдельной композиции от таксана. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, находится в одной композиции с таксаном.
Антагонист, связывающийся с компонентами сигнального пути PD-1, и таксан могут быть введены одним и тем же путем введения или разными путями введения. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, вводят внутривенно, внутримышечно, подкожно, местно, перорально, трансдермально, внутрибрюшинно, интраорбитально, путем имплантации, путем ингаляции, интратекально, интравентрикулярно или интраназально. В некоторых вариантах реализации изобретения таксан вводят внутривенно, внутримышечно, подкожно, местно, перорально, трансдермально, внутрибрюшинно, интраорбитально, путем имплантации, путем ингаляции, интратекально, интравентрикулярно или интраназально. Для профилактики или лечения заболеваний может быть введено эффективное количество антагониста, связывающегося с компонентами сигнального пути PD-1, и таксана. Соответствующая доза антагониста, связывающегося с компонентами сигнального пути PD-1, и/или таксана может быть определена на основании типа заболевания, подлежащего лечению, типа антагониста, связывающегося с компонентами сигнального пути PD-1, и таксана, тяжести и протекания заболевания, клиническое состояние индивидуума, истории болезни индивидуума и ответа на лечение, а также по усмотрению лечащего врача.
В качестве общего предложения, терапевтически эффективное количество антитела (например, анти-PD-L1 антитела), введенное человеку, будет в диапазоне от около 0,01 до около 50 мг/кг веса тела пациента, введенное с помощью одного или более введений. В некоторых вариантах реализации изобретения используемое количество антитела составляет, например, от около 0,01 до около 45 мг/кг, от около 0,01 до около 40 мг/кг, от около 0,01 до около 35 мг/кг, от около 0,01 до около 30 мг/кг, от около 0,01 до около 25 мг/кг, от около 0,01 до около 20 мг/кг, от около 0,01 до около 15 мг/кг, от около 0,01 до около 10 мг/кг, от около 0,01 до около 5 мг/кг, или около от 0,01 до около 1 мг/кг в день. В некоторых вариантах реализации изобретения антитело вводят в количестве 15 мг/кг. Тем не менее, могут быть полезны другие режимы приема препаратов. В одном варианте реализации изобретения анти-PD-L1 антитело, описанное в данном документе, вводят человеку в дозе около 100 мг, около 200 мг, около 300 мг, около 400 мг, около 500 мг, около 600 мг, около 700 мг, около 800 мг, около 900 мг, 1000 мг, 1100 мг, 1200 мг, около 1300 мг, около 1400 мг, или около 1500 мг на 1-й день цикла из 21 дня. В некоторых вариантах реализации изобретения анти-PD-L1 антитело MPDL3280A вводят в количестве 1200 мг внутривенно каждые три недели (к3н). Доза может быть введена в виде разовой дозы или в виде множественных доз (например, 2 или 3 дозы), таких как инфузия. Доза вводимого антитела в комбинированной терапии может быть уменьшена по сравнению с однократной обработкой. Прогресс этой терапии легко контролировать обычными методами.
В качестве общего предложения, терапевтически эффективное количество таксана (например, наб-паклитаксела (ABRAXANE®) или паклитаксела), вводимое человеку, будет находиться в диапазоне от около 25 до около 300 мг/м2 (например, около 25 мг/м2, около 50 мг/м2, около 75 мг/м2, около 100 мг/м2, около 125 мг/м2, около 150 мг/м2, около 175 мг/м2, около 200 мг/м2, около 225 мг/м2, около 250 мг/м2, около 275 мг/м2 или около 300 мг/м2), введенное за один или более раз. Например, в некоторых вариантах реализации изобретения вводят около 100 мг/м2 наб-паклитаксела (ABRAXANE®). В некоторых вариантах реализации изобретения наб-паклитаксел (ABRAXANE®) вводят в дозе 100 мг/м2 внутривенно каждую неделю (к1н). В некоторых вариантах реализации изобретения вводят около 200 мг/м2 паклитаксела. В некоторых вариантах реализации изобретения паклитаксел вводят в количестве около 200 мг/м2 внутривенно каждые 3 недели. В некоторых вариантах реализации изобретения таксан (например, наб-паклитаксел (ABRAXANE®) или паклитаксел), может быть введен еженедельно, каждые 2 недели, каждые 3 недели, каждые 4 недели, в дни 1, 8 и 15 каждого 21-дневного цикла, или в дни 1, 8 и 15 каждого 28-дневного цикла.
В некоторых вариантах реализации изобретения способы могут дополнительно включать дополнительную терапию. Дополнительная терапия может представлять собой лучевую терапию, хирургическое вмешательство (например, лампэктомия и мастэктомия), химиотерапию, генную терапию, ДНК-терапию, вирусную терапию, РНК-терапию, иммунотерапию, пересадку костного мозга, нанотерапию, терапию моноклональными антителами, или комбинацию вышеуказанного. Дополнительная терапия может быть в виде адъювантной или неоадъювантной терапии. В некоторых вариантах реализации изобретения дополнительная терапия представляет собой введение низкомолекулярного ферментативного ингибитора или анти-метастатического агента. В некоторых вариантах реализации изобретения дополнительная терапия представляет собой введение агентов, ограничивающих побочные эффекты, например, агенты, предназначенные для уменьшения возникновения и/или тяжести побочных эффектов лечения, таких как противорвотных средств и т.д.). В некоторых вариантах реализации изобретения дополнительная терапия представляет собой радиационную терапию. В некоторых вариантах реализации изобретения дополнительная терапия представляет собой хирургическое вмешательство. В некоторых вариантах реализации изобретения дополнительная терапия представляет собой сочетание радиационной терапии и хирургии. В некоторых вариантах реализации изобретения дополнительная терапия представляет собой гамма-облучение. В некоторых вариантах реализации изобретения дополнительная терапия представляет собой терапию, воздействующую на PI3K/AKT/MPM путь, ингибитор HSP90, ингибитор тубулина, ингибитор апоптоза, и/или химопрофилактический агент. Дополнительная терапия может представлять собой один или более из химиотерапевтических агентов, описанных в данном документе.
В некоторых вариантах реализации изобретения способы дополнительно включают введение химиотерапевтического агента на основе платины с антагонистом, связывающимся с компонентом сигнального пути PD-1, и таксаном. В некоторых вариантах реализации изобретения химиотерапевтический агент на основе платины представляет собой карбоплатин. Дозировки и введение карбоплатина хорошо известны в данной области техники. В типовой дозе карбоплатин вводится при целевой площади под кривой "концентрация в плазме-время" (AUC), равной 6 мг/мл. В некоторых вариантах реализации изобретения карбоплатин вводят внутривенно каждые 3 недели.
В некоторых вариантах реализации изобретения способы включают введение анти-PD-L1 антитела MPDL3280A в количестве 1200 мг внутривенно каждые три недели (к3н), наб-паклитаксела (ABRAXANE®) в количестве 100 мг/м2 внутривенно каждую неделю (к1н) и карбоплатина внутривенно каждые 3 недели (к3н) с целевой AUC 6 мг/мл. В некоторых вариантах реализации изобретения способы включают введение анти-PD-L1 антитела MPDL3280A в количестве 1200 мг внутривенно каждые три недели (к3н), паклитаксела в количестве 200 мг/м2 внутривенно каждые 3 недели и карбоплатина внутривенно каждые 3 недели (к3н) с целевой AUC 6 мг/мл.
V. Другие комбинированные терапии
В данном документе также предлагаются способы терапии или задерживания прогрессирования рака у индивидуума, включающие введение индивидууму человеческого антагониста, связывающегося с компонентом сигнального пути PD-1, и таксана в сочетании с другим противораковым средством или терапией рака. В некоторых вариантах реализации изобретения способы включают введение индивидууму антагониста, связывающегося с компонентом человеческого сигнального пути PD-1, таксана и химиотерапевтического агента на основе платины в сочетании с другим противораковым средством или терапией рака.
В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с химиотерапией или химиотерапевтическим агентом. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с радиационной терапией или радиотерапевтическим средством. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с целевой терапией или целевым терапевтическим агентом. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с иммунотерапией или иммунотерапевтическим агентом, например, моноклональным антителом.
Не желая быть привязанными к теории, полагают, что повышение стимуляции Т-клеток путем стимулирования активирующей костимуляторной молекулы или путем ингибирования отрицательной костимуляторной молекулы может способствовать гибели опухолевых клеток, вызывая таким образом лечение или задержку прогрессирования рака. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с агонистом, направленным против активирующей костимуляторной молекулы. В некоторых вариантах реализации изобретения активирующая костимуляторная молекула может включать CD40, CD226, CD28, ОХ40, GITR, CD137, CD27, HVEM или CD127. В некоторых вариантах реализации изобретения агонист, направленный против активирующей костимуляторной молекулы, представляет собой агонистическое антитело, которое связывается с CD40, CD226, CD28, ОХ40, GITR, CD137, CD27, HVEM или CD127. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антагонистом, направленным против ингибирующей костимуляторной молекулы. В некоторых вариантах реализации изобретения ингибирующая костимуляторная молекула может включать CTLA-4 (также известный как CD152), PD-1, TIM-3, BTLA, VISTA, LAG-3, В7-Н3, В7-Н4, IDO, TIGIT, MICA/В или аргиназу. В некоторых вариантах реализации изобретения антагонист, направленный против ингибирующей костимуляторной молекулы, представляет собой антагонистическое антитело, которое связывается с CTLA-4, PD-1, TIM-3, BTLA, VISTA, LAG-3, В7-Н3, В7-Н4, IDO, TIGIT, MICA/B или аргиназой.
В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антагонистом, направленным против CTLA-4 (также известным как CD152), например, блокирующим антителом. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с ипилимумабом (также известным как MDX-010, MDX-101 или YERVOY®). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с тремелимумабом (также известным как ticilimumab или СР-675,206). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антагонистом, направленным против В7-Н3 (также известным как CD276), например, блокирующим антителом. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с MGA271. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антагонистом, направленным против TGF бета, например, metelimumab (также известный как САТ-192), fresolimumab (также известный как GC1008) или LY2157299.
В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с бработкой, включающей адоптивный перенос Т-клеток (например, цитотоксической Т-клетки или CTL), экспрессирующих химерный антигенный рецептор (ХАР). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с обработкой, включающей адоптивный перенос Т-клетки, содержащей доминантно-негативный TGF бета-рецептор, например, доминантно-негативный TGF бета-рецептор II типа. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с обработкой, включающей протокол HERCREEM (см., например, ClinicalTrials.gov Identifier NCT00889954).
В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с агонистом, направленным против CD137 (также известным как TNFRSF9, 4-1ВВ или ILA), например, активирующим антителом. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с urelumab (также известным как BMS-663513). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с агонистом, направленным против CD40, например, активирующим антителом. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с СР-870893. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с агонистом, направленным против ОХ40 (также известным как CD134), например, активирующим антителом. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с анти-ОХ40 антителом (например, AgonOX). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с агонистом, направленным против CD27, например, активирующим антителом. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с CDX-1127. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антагонистом, направленным против индоламин-2,3-диоксигеназы (ИДО). В некоторых вариантах реализации изобретения антагонист ИДО представляет собой 1-метил-D-триптофан (также известный как 1-D-МТ).
В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с конъюгатом антитело-лекарственное средство. В некоторых вариантах реализации изобретения конъюгат антитело-лекарственное средство включает mertansine или монометиловый ауристатин Е (ММАЕ). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с конъюгатом анти-NaPi2b антитело-ММАЕ (также известным как DNIB0600A или RG7599). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с трастузумаб эмтансином (также известным как Т-DM1, ado-трастузумаб эмтансин или KADCYLA®, Genentech). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с DMUC5754A. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с конъюгатом антитело-лекарственное средство, воздействующим на рецептор В эндотелина В (EDNBR), например, антителом, направленным против EDNBR, конъюгированным с ММАЕ.
В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с ингибитором ангиогенеза. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антителом, направленным против VEGF, например, VEGF-A. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с бевацизумабом (также известным как AVASTIN®, Genentech). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антителом, направленным против ангиопоэтина 2 (также известного как Ang2). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с MEDI3617.
В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с противоопухолевым средством. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании со средством, воздействующим на CSF-1R (также известным как M-CSFR или CD115). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с анти-CSF-1R (также известным как IMC-CS4). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с интерфероном, например, интерфероном альфа или интерфероном гамма. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с рофероном-А (также известным как рекомбинантный интерферон альфа-2а). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с GM-CSF (также известным как рекомбинантный человеческий гранулоцитарный колониестимулирующий фактор макрофагов, Rhu GM-CSF, сарграмостим или LEUKINE®). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с IL-2 (также известным как алдеслейкин или PROLEUKIN®). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с IL-12. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антителом, воздействующим на CD20. В некоторых вариантах реализации изобретения антитело, воздействующее на CD20, представляет собой obinutuzumab (также известный Ga101 или GAZYVA®) или ритуксимаб. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антителом, воздействующим на GITR. В некоторых вариантах реализации изобретения антитело, воздействующие на GITR представляет собой TRX518.
В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с вакциной рака. В некоторых вариантах реализации изобретения вакцина от рака представляет собой пептидную вакцину рака, которая в некоторых вариантах реализации изобретения представляет собой персонализированную пептидную вакцину. В некоторых вариантах реализации изобретения пептидная вакцина рака представляет собой поливалентный длинный пептид, мультипептид, пептидный коктейль, гибридный пептид, или пептид-импульсную вакцину дендритных клеток (см., например, Yamada et al., Cancer Sci, 104:14-21, 2013). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с адъювантом. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с обработкой, включающей агонист TLR, например, Poly-ICLC (также известный как HILTONOL®), LPS, MPL или CpG-ODN. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с фактором некроза опухоли (ФИО) альфа. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с IL-1. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с HMGB1. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антагонистом IL-10. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антагонистом IL-4. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антагонистом IL-13. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антагонистом HVEM. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с антагонистом ICOS, например, путем введения ICOS-L или агонистического антитела, направленного против ICOS. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с обработкой, воздействующей на CX3CL1. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с обработкой, воздействующей на CXCL9. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с обработкой, воздействующей на CXCL10. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с обработкой, воздействующей на CCL5. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с агонистом LFA-1 или ICAM1. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с агонистом селектина.
В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с целевой терапией. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с ингибитором В-Raf. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с вемурафенибом (также известным как ZELBORAF®). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с дабрафенибом (также известным как TAFINLAR®). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с эрлотинибом (также известным как TARCEVA®). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с ингибитором МЕК, таким как МЕК1 (также известным как МАР2К1) или МЕЮ (также известным как МАР2К2). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с кобиметинибом (также известным как GDC-0973 или XL-518). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с траметинибом (также известным как MEKINIST®). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с ингибитором K-Ras. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с ингибитором с-Met. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с онартузумабом (также известным как MetMAb). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с ингибитором Alk. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с AF802 (также известным как СН5424802 или алектиниб). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с ингибитором фосфатидилинозитол-3-киназы (PI3K). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с ВКМ120. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с иделалисибом (также известным как GS-1101 или CAL-101). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с перифосином (также известным как KRX-0401). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с ингибитором Akt. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, может быть введен в сочетании с МК2206. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с GSK690693. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с GDC-0941. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с ингибитором mTOR. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с сиролимусом (также известным как рапамицин). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с темсиролимусом (также известным как CCI-779 или TORISEL®). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с эверолимусом (также известным как RAD001). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с ридафоролимусом (также известным как АР-23573, МК-8669, или deforolimus). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с OSI-027. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с AZD8055. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с INK128. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с двойным ингибитором PI3K/MPM. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с XL765. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с GDC-0980. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с BEZ235 (также известным как NVP-BEZ235). В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с BGT226. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с GSK2126458. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с PF-04691502. В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан могут быть введены в сочетании с PF-05212384 (также известным как PKI-587).
VI. Изделия и наборы
В другом варианте реализации изобретения предложено изделие или набор, антагонист, связывающийся с компонентом сигнального пути PD-1, и/или таксан. В некоторых вариантах реализации изобретения изделие или набор дополнительно содержит листок-вкладыш, содержащий инструкции по использованию антагониста, связывающегося с компонентом сигнального пути PD-1, в сочетании стаксаном для лечения или задерживания прогрессирования рака у индивидуума или для усиления иммунной функции индивидуума, больного раком. Любой из антагонистов, связывающихся с компонентом сигнального пути PD-1, и/или таксанов, описанных в данном документе, могут быть включены в изделие или наборы.
В некоторых вариантах реализации изобретения антагонист, связывающийся с компонентом сигнального пути PD-1, и таксан находятся в одном и том же контейнере, или в отдельных контейнерах. Подходящие контейнеры включают, например, бутылки, флаконы, пакеты и шприцы. Контейнер может быть выполнен из различных материалов, таких как стекло, пластик (такой как поливинилхлорид или полиолефин), или металлического сплава (например, из нержавеющей стали или сплава Hastelloy). В некоторых вариантах реализации изобретения контейнер содержит препарат, и этикетка на нем, или прилагающаяся к нему, может содержать инструкции по применению. Изделие или набор может дополнительно включать другие материалы, предпочтительные с коммерческой и потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы, шприцы и вкладыши с инструкциями по применению. В некоторых вариантах реализации изобретения изделие дополнительно включает один или несколько из других средств (например, химиотерапевтическое средство и противоопухолевое средство). Подходящие контейнеры для одного или нескольких средств включают, например, бутылки, флаконы, пакеты и шприцы.
Спецификация считается достаточной для того, чтобы дать возможность специалисту в данной области техники использовать изобретение. Различные модификации изобретения в дополнение к показанным и описанным в данном документе будут очевидны для специалистов в данной области техники из приведенного выше описания и попадают в объем прилагаемой формулы изобретения.
ПРИМЕРЫ
Данное изобретение будет более понятным со ссылкой на следующие примеры. Однако их не следует рассматривать как ограничивающие объем данного изобретения. Следует понимать, что примеры и варианты реализации изобретения, описанные в данном документе, представлены только в качестве иллюстрации, и что специалистами в данной области техники буду предложены их различные модификации или изменения, которые должны быть включены в сущность и сферу действия этой заявки и объема прилагаемой формулы изобретения.
Пример 1. Комбинированное лечение анти-PD-L1 антителом и наб-паклитакселом (ABRAXANE®) + карбоплатином вызывало долговременные полные ответы в модели ободочной опухоли МС38.
Материалы и способы
Опухолевые модели in vivo
Линию клеток ободочной опухоли МС38 поддерживали на Genentech. 7-10-недельных самок мышей C57BL/6 (Charles River Laboratories; Hollister, CA) прививали подкожно унилатерально в правый бок с помощью 0,1 млн клеток МС38. Когда опухоли достигли среднего объема опухоли около 100-300 мм3, мыши были отобраны и рандомизированы на группы обработки антителом и/или химиообработки, начиная со следующего дня после того, который считался первым днем.
Для анализа повторного измерения объемов опухолей из одних и тех же животных в течение долгого времени был использован подход смешанного моделирования (Pinheiro et al. nmle: Linear and Nonlinear Mixed Effects Models. R. package version 3.1-108 (2013)). Этот подход относится как к повторным измерениям, так и к незначительному выбыванию из исследования до конца исследования. Для построения нелинейного профиля временных изменений log2 (объем опухоли) в разных обработках была использована кубическая регрессия. Регрессионное построение было сделано с помощью линейной модели смешанных эффектов в программной среде R, версия 2.15.2, с использованием пакета nlme, версия 3.1 108 (R Foundation for Statistical Computing; Vienna, Austria).
Для эксперимента с повторным заражением МС38, проиллюстированного на фигурах 5А-5Б, излечившимся мышам, ранее получавшим комбинацию анти-PD-L1 + ABRAXANE® + карбоплатин, подкожно прививали 0,1 млн МС38 клеток в бок, противоположный первому заражению. Параллельно, наивным самкам мышей C57BL/6 также прививали 0,1 млн клеток МС38. Через семь дней все мыши были умерщвлены и селезенки собирали для анализа методом проточной цитометрии. Все исследования на животных были проведены в соответствии с инструкциями и правилами, изложенными методических указаниях Закона об охране животных и Руководства по уходу и использованию лабораторных животных и Комитета по уходу и использованию животных (IACUC).
In vitro стимуляция культур спленоцитов повторно зараженных мышей
Спленоциты культивировали в количестве 1 миллион клеток/лунку в трех повторах в 96-луночной плашке с U-образным дном с форбол-12-миристат-13-ацетатом (ФМА) в концентрации 10 нг/мл и иономицином в концентрации 1 мкг/мл (Sigma-Alrich; St. Louis, МО) plus GOLGIPLUG™ (брефелдин A) (BD Biosciences; San Jose, CA) в течение 4 часов при температуре 37°С. Клетки собирали и окрашивали поверхностными маркерами CD4-FITC (изотиоцианат флуоресцеина), CD3-PE (фикоэритрин), и CD8-PerCP Су5.5 (BD Biosciences) и фиксировали 4% параформальдегидом в течение 30 минут на льду. Клетки были пермеабилизированы 1х пермеабилизационным буфером (BD Biosciences) и окрашены анти-мышиными крысиными анти-интерферон-γ-(IFN-γ)-аллофикоцианин (АПК)-коньюгированными антителами или крысиными контрольными антителами изотипа lgG1-АПК (BD Biosciences) и разогнаны на BD Biosciences LSRII с использованием программного обеспечения FACSDIVA™. Анализ проточной цитометрии был проведен с использованием программного обеспечения FlowJo (TreeStar).
Антитела и методы лечения
Все антитела для лечения были получены в Genentech. Контрольное антитело представляло собой мышиный lgG1 анти-gp120 (mlgG1), клон 10E7.1D2. Анти-PD-L1 представляло собой либо человеческую/мышиную обратную химеру, клон YW243.55.S70 mlgG2a.DANA либо полностью мышиный клон 25А1 mlgG2a.DANA. ABRAXANE® был получен от Abraxis Bioscience, Inc. (принадлежит Celgene; Summit, NJ). Карбоплатин был получен от Hospira, Inc. (Lake Forest, IL). Дексаметазон был получен от West-Ward Pharmaceuticals (Eatontown, NJ). Схемы дозирования и пути введения соответствовали указанным в Кратком описании графических материалов. Антитела разводили либо в PBS, либо в 20 мМ ацетата гистидина, 240 мМ сахарозы, 0,02% полисорбате-20, рН 5,5. Химиотерапии и дексаметазон разводили в физиологическом растворе.
Исследование вакцинации in vivo
Т-клетки OTI Thy1.1 CD8+ выделяли путем негативной селекции с использованием набора для выделения MACS CD8 (Miltenyi Biotec) из женских селезенке и брыжеечных лимфатических узлов донора OTI Thy1.1 (колония Genentech). Очищенные клетки CD8+ метили с помощью КФСЭ (Life Technologies; Grand Island, NY) и в количестве 2,5×106 клеток вводили внутривенно (ВВ), в женских реципиентов C57BL/6 (Charles River Laboratories). На следующий день мышей вакцинировали путем внутрибрюшинной инъекции (ВИ) 250 нг анти-DEC205 гибридного полноразмерного овальбумина (производства Genentech), плюс внутривенно водили физиологический раствором или дексаметазон в количестве в 4 мг/кг. Через два дня после вакцинации мышей умерщвляли и селезенки отбирали для анализа. Общее количество клеток селезенки в суспензии определяли с помощью проточной цитометрии, используя соотношение событий живых клеток к фиксированному количеству флуоресцентных гранул (каталожный №9003-53-6, Polysciences, Inc.; Warrington, РА) известной концентрации. Т-клетки OTI CD8+ были идентифицированы с использованием проточной цитометрии с помощью окрашивания Thy1.1 РЕ-Су7 и CD8 Pacific Blue (BD Biosciences) и разогнаны на BD Biosciences LSRII с использованием программного обеспечения FACSDIVA™. Анализ проточной цитометрии был проведен с использованием программного обеспечения FlowJo (TreeStar).
Результаты
В данном исследовании оценивали эффективность анти-PD-L1 антитела в контексте лечения рака в доклинической модели опухоли мыши. В сингенной модели ободочной опухоли МС38 комбинированное лечение с анти-PD-L1 антителом (клон 25А1 mlgG2a.DANA) и паклитакселом + карбоплатином приводило к синергической противоопухолевой реакции по сравнению с лечением контрольным антителом или паклитакселом + карбоплатином отдельно (Фигура 1). 10% мышей (1 из 10) имели частичный ответ на комбинированное лечение анти-PD-L1 и паклитакселом + карбоплатином по сравнению с отсутствием мышей с частичным ответом в группах с введением отдельно контрольного антитела или паклитаксела + карбоплатина (Фигура 1). Сильные противоопухолевые реакции, которые привели к сокращению размера опухоли, были отмечены как частичные ответы (ЧО), которые определены в данном примере как уменьшение от начального объема опухоли >50% и <100%, или полные ответы, определенные в данном примере как уменьшение объема опухоли на 100%. Комбинированное лечение с анти-PD-L1 антителом и паклитакселом + карбоплатином также вызывало задерживание время до прогрессирования заболевания. Время до прогрессирования (ВДП) (определяется в данном примере как 5-кратный начальный объем опухоли) для контрольного антитела составляло 11 дней, для паклитаксела + карбоплатина составляло 15,5 дня, а для комбинированного лечения с анти-PD-L1 антитела и паклитакселом + карбоплатином составляло 25 дней.
В клинических условиях лечение с паклитакселом (который производится в потенциально токсичном растворителе), как правило, включает в себя премедикацию кортикостероидами, такими как дексаметазон, чтобы снизить вероятность возникновения реакций гиперчувствительности. Тем не менее, кортикостероиды, такие как дексаметазон имеют эффекты иммунодепрессанта и могут ингибировать реакцию Т-клеток, которые могут в свою очередь снижают активность антагонистов, связывающихся с компонентом сигнального пути PD-1, таких как анти-PD-L1 агенты. Введение дексаметазона всегда аннулировало эффективность монотерапии с анти-PD-L1 в сингенной модели ободочной опухоли МС38 (Фигуры 2А и 2Б). Кроме того, дексаметазон ингибировал антиген-специфические реакции Т-клеток в OTI адоптивном Т-клеточном переносе и модели вакцинации (Фигура 3). Поэтому, не желая быть связанными теорией, лечение кортикостероидами, такими как дексаметазон, может ослабить или компенсировать некоторые из преимуществ антагонистов, связывающихся с компонентом сигнального пути PD-1, такие как лечение с анти-PD-L1, уменьшая тем самым усиление функции Т-клеток и ее способность стимулировать противоопухолевые реакции, такие как убийство опухолей, опосредованное Т-клетками CD8+.
В сингенной модели ободочной опухоли МС38 комбинированное лечение с анти-PD-L1 антителом (химерные YW243.55.S70.mlgG2a.DANA) и наб-паклитакселом (ABRAXANE®) + карбоплатином привело к неожиданно сильной синергетической противоопухолевой эффективности по сравнению с обработкой контрольным антителом, монотерапией анти-PD-L1 антитела, или ABRAXANE® + карбоплатином отдельно, в модели (Фигуры 4А и 4Б). Комбинированное лечение с анти-PD-L1 антителом и ABRAXANE® + карбоплатином вызывало долговременные полные ответы продолжительностью более 90 дней у 4 из 8 мышей (Фигуры 4А и 4Б). Этот синергизм был еще сильнее, чем синергизм, наблюдаемый в результате лечения комбинацией анти-PD-L1 и паклитакселом + карбоплатином. ВДП (5-кратный начальный объем опухоли) составило 11,5 дня отдельно контрольного антитела, 9 дней для отдельно анти-PD-L1 антитела, 13,5 дня для отдельно ABRAXANE® + карбоплатин и не применимо для комбинированной терапии анти-PD-L1 антитела и ABRAXANE® + карбоплатина, где 4 из 8 мышей показали полную регрессию. Это указывает на то, что комбинированное лечение с анти-PD-L1 антителом и ABRAXANE® + карбоплатином сильно задерживает время до прогрессирования, в большей степени, чем комбинированное лечение с анти-PD-L1 антителом и паклитакселом + карбоплатином. Кроме того, все излечившиеся мыши (то есть мыши, проявившие полные ответы), проходившие лечение комбинацией анти-PD-L1 и ABRAXANE® + карбоплатин, смогли полностью отторгнуть вторичное заражение той же клеточной линией опухоли МС38, что указывает на то, что лечение вызывает выработку памяти ответа Т-клеток (Фигуры 5А-5Б). Повторное стимулирование спленоцитов in vitro из этих излеченных мышей показало увеличение эффектроной функции Т-клеток, что видно по повышенному вырабатыванию гамма-интерферона (ИФН-гамма) как в CD4+ Т-клетках, так и в CD8+ Т-клетках по сравнению с наивными первично зараженными мышами (Фигуры 5А-5Б).
Неожиданно высокая противоопухолевая синергическая активность и неожиданная способность получать полные ответы и вырабатывать память ответов Т-клеток представляют собой важные терапевтические преимущества комбинированного лечения с антагонистами, связывающимися с компонентом сигнального пути PD-1, и таксанами, такими как наб-паклитаксел (ABRAXANE®). Дополнительно, в отличие от лечения паклитакселом, лечение наб-паклитакселом (ABRAXANE®) обычно не включает премедикацию кортикостероидов, таких как дексаметазон. Результаты, представленные в данном документе, показывают, что комбинированное лечение антагонистом, связывающимся с компонентом сигнального пути PD-1 (таким как анти-PD-L1 антитело) и наб-паклитакселом (ABRAXANE®) также позволяет упростить схему лечения, что позволяет избежать применения кортикостероидов и тем самым уменьшить вероятность потенциальных побочных эффектов.
Пример 2. Комбинированное лечение анти-PD-L1 антителом с наб-паклитакселом (ABRAXANE®) и карбоплатином вызывало полные ответы в фазе 1б клинического исследования у пациентов с немелкоклеточным раком легкого
Фаза 1б клинического исследования была проведена с целью оценки эффективности комбинированного лечения анти-PD-L1 антителом (MPDL3280A) в комбинации с таксаном (наб-паклитакселом (ABRAXANE®) или паклитакселом) и карбоплатином у пациентов с немелкоклеточным раком легкого (НМРЛ).
Протокол дозирования для этого клинического исследования был следующим:
1) Комбинированное лечение MPDL3280A/ABRAXANE®/карбоплатин: а) 1200 мг MPDL3280A ВВ каждые 3 недели (к3н); б) 100 мг/м2 ABRAXANE® ВВ каждую неделю (к1н); и в) карбоплатин ВВ каждые 3 недели (к3н) с целевой площадью под кривой (AUC), 6 мг/мл.
2) Комбинированное лечение MPDL3280A/паклитаксел/карбоплатин: а) 1200 мг MPDL3280A ВВ каждые 3 недели (к3н); б) 200 мг/м2 паклитаксела ВВ каждые 3 недели (к3н); и в) карбоплатин ВВ каждые 3 недели (к3н) с целевой AUC 6 мг/мл.
Таблица 4 демонстрирует результаты исследования 14 пациентов, которые проходили лечение с MPDL3280A в сочетании с ABRAXANE® и карбоплатином. Таблица 5 демонстрирует результаты исследования 6 пациентов, которые проходили лечение с MPDL3280A в сочетании с паклитакселом и карбоплатином.


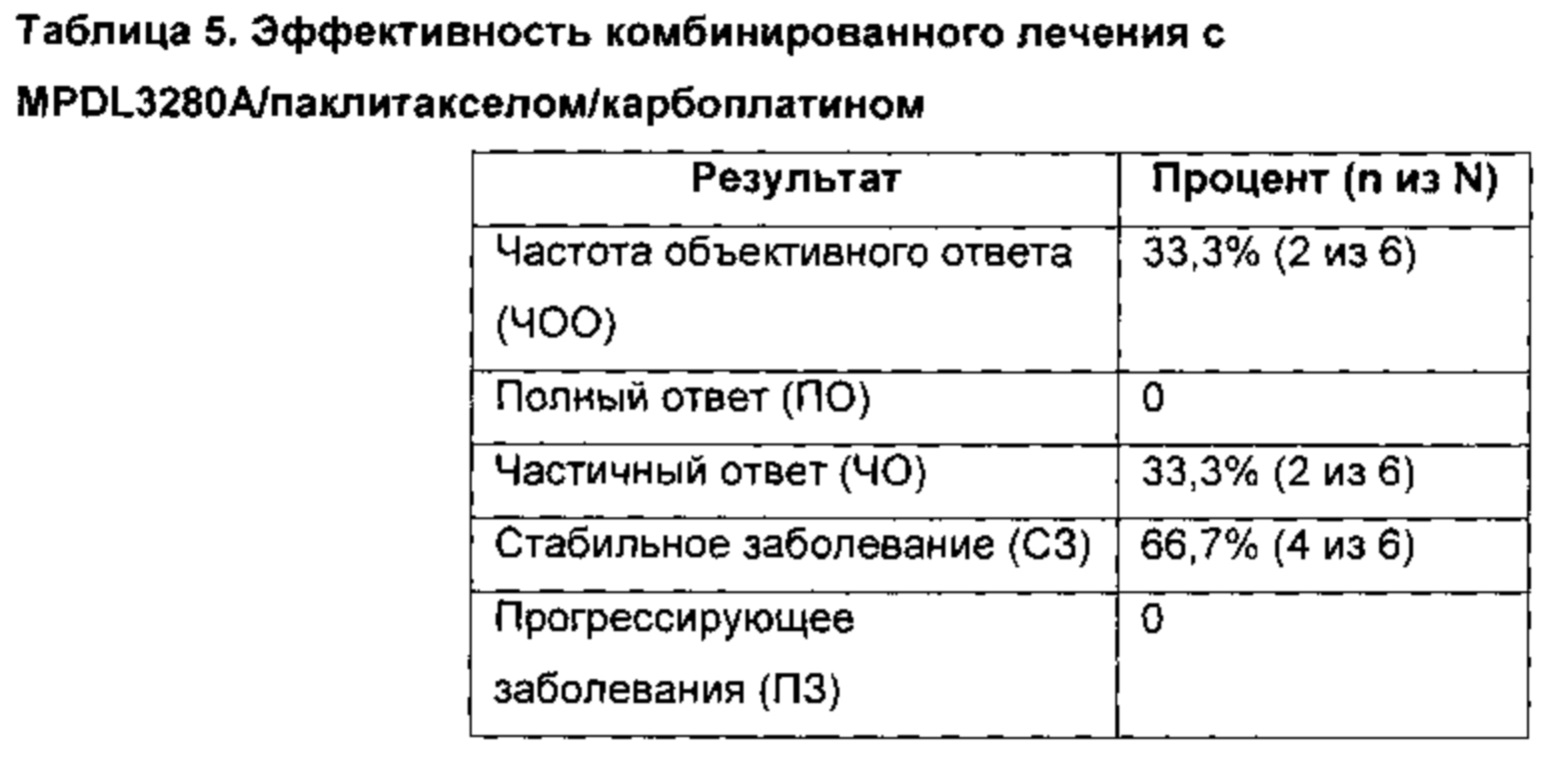
Как показано в Таблице 4 и на Фигуре 6А, комбинированное лечение с MPDL3280A и наб-паклитаксел (ABRAXANE®) + карбоплатином привело к неожиданно сильной противоопухолевой эффективности, с уровнем объективного ответа 64,3% (ЧОО, ПО+ЧО). Неожиданно 21,4% (3 из 14) пациентов, проходивших лечение комбинацией MDPL3280A и наб-паклитакселом (ABRAXANE®) + карбоплатином, достигли полного ответа (то есть полное отсутствие обнаруживаемой массы опухоли). У 42,9% (6 из 14) пациентов наблюдался частичный ответ.
Комбинированное лечение с MPDL3280A и паклитакселом + карбоплатином также привело к противоопухолевой эффективности, хотя этот факт был несколько менее надежными, чем при лечении комбинацией MPDL3280A/наб-паклитаксел (ABRAXANE®) + карбоплатин из за относительно небольших размеров исследуемой выборки. ЧОО для комбинированного лечения с MPDL3280A и паклитакселом + карбоплатином составила 33,3%, при этом оба ответчики испытывают частичный ответ (Таблица 5 и Фигура 6Б).
В соответствии с доклиническими исследованиями, представленными в примере 1, неожиданно сильная противоопухолевая активность и неожиданная возможность получения устойчивых полных ответов представляют собой важные терапевтические преимущества комбинированного лечения с антагонистами, связывающимися с компонентом сигнального пути PD-1, (например, анти-PD-L1 антитела) и таксанами, такими как наб-паклитаксел (ABRAXANE®).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Genentech, Inc.
F. Hoffman-La Roche AG
<120> СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХСЯ С КОМПОНЕНТАМИ СИГНАЛЬНОГО ПУТИ PD-1, И ТАКСАНОВ
<130> 50474-103WO2
<150> US 61/917,264
<151> 2013-12-17
<160> 33
<170> PatentIn version 3.5
<210> 1
<211> 440
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 1
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser
115 120 125
Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys
180 185 190
Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala
210 215 220
Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
225 230 235 240
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
245 250 255
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
260 265 270
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
275 280 285
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
290 295 300
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
305 310 315 320
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
325 330 335
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
340 345 350
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
355 360 365
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
370 375 380
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
385 390 395 400
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
405 410 415
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
420 425 430
Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 2
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 2
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 3
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 3
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 4
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Leu Tyr His Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 5
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> Xaa
<222> (6)..(6)
<223> Xaa is D or G
<400> 5
Gly Phe Thr Phe Ser Xaa Ser Trp Ile His
1 5 10
<210> 6
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> Xaa
<222> (4)..(4)
<223> Xaa is S or L
<220>
<221> Xaa
<222> (10)..(10)
<223> Xaa is T or S
<400> 6
Ala Trp Ile Xaa Pro Tyr Gly Gly Ser Xaa Tyr Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly
<210> 7
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 7
Arg His Trp Pro Gly Gly Phe Asp Tyr
1 5
<210> 8
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 8
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser
20 25
<210> 9
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 9
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
1 5 10
<210> 10
<211> 32
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 10
Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
20 25 30
<210> 11
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 11
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala
1 5 10
<210> 12
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> Xaa
<222> (5)..(5)
<223> Xaa is D or V
<220>
<221> Xaa
<222> (6)..(6)
<223> Xaa is V or I
<220>
<221> Xaa
<222> (7)..(7)
<223> Xaa is S or N
<220>
<221> Xaa
<222> (9)..(9)
<223> Xaa is A or F
<220>
<221> Xaa
<222> (10)..(10)
<223> Xaa is V or L
<400> 12
Arg Ala Ser Gln Xaa Xaa Xaa Thr Xaa Xaa Ala
1 5 10
<210> 13
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> Xaa
<222> (4)..(4)
<223> Xaa is F or T
<220>
<221> Xaa
<222> (6)..(6)
<223> Xaa is Y or A
<400> 13
Ser Ala Ser Xaa Leu Xaa Ser
1 5
<210> 14
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> Xaa
<222> (3)..(3)
<223> Xaa is Y, G, F, or S
<220>
<221> Xaa
<222> (4)..(4)
<223> Xaa is L, Y, F, or W
<220>
<221> Xaa
<222> (5)..(5)
<223> Xaa is Y, N, A, T, G, F, or I
<220>
<221> Xaa
<222> (6)..(6)
<223> Xaa is H, V, P, T, or I
<220>
<221> Xaa
<222> (8)..(8)
<223> Xaa is A, W, R, P, or T
<400> 14
Gln Gln Xaa Xaa Xaa Xaa Pro Xaa Thr
1 5
<210> 15
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 15
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys
20
<210> 16
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 16
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 17
<211> 32
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 17
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
20 25 30
<210> 18
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 18
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
1 5 10
<210> 19
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 19
Gly Phe Thr Phe Ser Asp Ser Trp Ile His
1 5 10
<210> 20
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 20
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly
<210> 21
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 21
Arg His Trp Pro Gly Gly Phe Asp Tyr
1 5
<210> 22
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 22
Arg Ala Ser Gln Asp Val Ser Thr Ala Val Ala
1 5 10
<210> 23
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 23
Ser Ala Ser Phe Leu Tyr Ser
1 5
<210> 24
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 24
Gln Gln Tyr Leu Tyr His Pro Ala Thr
1 5
<210> 25
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 25
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 26
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 26
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120
<210> 27
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 27
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 28
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 28
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 29
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 29
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
20 25 30
<210> 30
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 30
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
1 5 10
<210> 31
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 31
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
1 5 10 15
<210> 32
<211> 447
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 32
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ser
20 25 30
Trp Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Trp Ile Ser Pro Tyr Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg His Trp Pro Gly Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
210 215 220
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
260 265 270
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 33
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 33
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Leu Tyr His Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<---
Реферат
Группа изобретений относится к медицине и касается способа лечения или замедления прогрессирования неплоскоклеточного немелкоклеточного рака легкого (НМРЛ) у индивидуума, включающего введение индивидууму эффективного количества антагониста, связывающегося с компонентом сигнального пути PD-1, таксана и химиотерапевтического агента на основе платины, причем таксан представляет собой наб-паклитаксел или паклитаксел. Группа изобретений также касается способа усиления иммунной функции у индивидуума с неплоскоклеточным НМРЛ, включающего введение антагониста, связывающегося с компонентом сигнального пути PD-1, таксана и химиотерапевтического агента на основе платины; комбинации для лечения или замедления прогрессирования неплоскоклеточного НМРЛ у индивидуума; набора для лечения или задерживания прогрессирования неплоскоклеточного НМРЛ у индивидуума. Группа изобретений обеспечивает сильное противоопухолевое действие, включающее высокую частоту «полной ремиссии», т.е. отсутствие обнаруживаемой опухолевой массы. 13 н. и 82 з.п. ф-лы, 2 пр., 6 ил., 5 табл.

Комментарии