Комбинированная терапия ингибитором ezh2 - RU2754131C1
Код документа: RU2754131C1
Чертежи



Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к комбинированной терапии, применимой для лечения рака. В частности, изобретение относится к комбинированной терапии, которая включает энхансер ингибитора гомолога-2 белка Zeste (EZH2) или его фармацевтически приемлемую соль с химиотерапевтическим средством или его фармацевтически приемлемой солью. Изобретение также относится к связанным с ней способам лечения, фармацевтическим композициям и их фармацевтическим применениям.
УРОВЕНЬ ТЕХНИКИ
Эпигенетические изменения играют важную роль в регуляции клеточных процессов, включая пролиферацию, дифференцировку и выживание клеток. Эпигенетическое подавление экспрессии генов-супрессоров опухолей и активация онкогенов могут происходить через изменение профилей метилирования ДНК, модификации гистонов и дисрегуляцию ДНК-связывающих комплексов ремоделирования хроматина. Гены группы polycomb представляют собой группу эпигенетических эффекторов. EZH2 (энхансер гомолога-2 белка Zeste) является каталитическим компонентом репрессивного комплекса 2 polycomb (PolycombRepressorComplex 2 - PRC2), консервативного мультисубъединичного комплекса, который репрессирует транскрипцию генов посредством метилирования лизина 27 на гистоне H3 (H3K27). EZH2 играет ключевую роль в регулировании профилей экспрессии генов, которые регулируют решения о последующем развитии клетки, таком как дифференцировка и самообновление. EZH2 сверхэкспрессируется в определенных раковых клетках, где он связан с клеточной пролиферацией, клеточной инвазией, химиорезистентностью и метастазированием.
Высокая экспрессия EZH2 коррелирует с плохим прогнозом, высокой степенью развития болезни и высокой стадией развития болезни при нескольких типах рака, включая рак молочной железы, колоректальный рак, рак эндометрия, рак желудка, рак печени, рак почек, рак легкого, меланому, рак яичника, рак поджелудочной железы, рак предстательной железы и рак мочевого пузыря. См. публикацию Crea et al., Crit. Rev. Oncol. Hematol. 2012, 83:184-193, и ссылки, цитируемые в ней; см. также Kleer et al., Proc. Natl. Acad. Sci. USA 2003, 100:11606-11; Mimori et al., Eur. J. Surg. Oncol.2005, 31:376-80; Bachmann et al., J. Clin. Oncol. 2006, 24:268-273; Matsukawa et al., Cancer Sci. 2006, 97:484-491; Sasaki et al. Lab. Invest. 2008, 88:873-882; Sudo et al., Br. J. Cancer 2005, 92(9):1754-1758; Breuer et al., Neoplasia 2004, 6:736-43; Lu et al., Cancer Res. 2007, 67:1757-1768; Ougolkov et al., Clin. Cancer Res. 2008, 14:6790-6796; Varambally et al., Nature 2002, 419:624-629; Wagener et al., Int. J. Cancer 2008, 123:1545-1550; и Weikert et al., Int. J. Mol. Med. 2005, 16:349-353; Jones P.A. et al., Nat. Rev. Genet., 2002, 3(6):415-428; и Ezponda T. et al., Clin. Cancer Res., 2014, 20(19):5001-5008.
Повторяющиеся соматические мутации в EZH2 были идентифицированы при диффузной B-крупноклеточной лимфоме (DLBCL) и фолликулярной лимфоме (FL). Сообщалось, что мутации, изменяющие тирозина 641 EZH2 (например, Y641C, Y641F, Y641N, Y641S и Y641H), наблюдались в 22% герминальных центров В-клеток DLBCL и в 7% FL. Morin et al.,Nat. Genetics 2010, 42(2):181-185. Сообщалось также о мутациях аланина 677 (A677) и аланина 687 (A687). McCabe et al., Proc. Natl. Acad. Sci. USA 2012, 109:2989-2994; Majer et al., FEBS Letters 2012, 586:3448-3451. Предполагается, что активирующие мутации EZH2 изменяют субстратную специфичность, приводя к повышенным уровням триметилированного H3K27 (H3K27Me3) (Sneeringer et al., Proc. Natl. Acad. Sci. USA 2010, 107 (49): 20980-5).
Мелкоклеточный рак легкого (SCLC), известный также как овсяноклеточный рак, составляет приблизительно 10-15% всех видов рака легких. Мелкоклеточный рак легкого обычно проявляется в нижних дыхательных путях и инфильтрирует подслизистую оболочку, приводя к сужению бронхиальных дыхательных путей. У более 70% пациентов с мелкоклеточным раком легкого имеются метастазы; характерные органы и ткани которых включают печень, надпочечники, кости и мозг. SCLC представляет собой слабо дифференцированное новообразование, которое можно отличить по его нейроэндокринным (NE) признакам (Sabari J.K. et al. Nat. Rev. CliniOncol, 2017, 14(9): 549-561). После постановки диагноза SCLC чаще всего классифицируется как локализованная (ограниченная) стадия заболевания ( LD) или как распространенная стадия заболевания (стадия метастазрования) (ED) в зависимости от отсутствия или наличия отдаленных метастазов. Около двух третей всех пациентов с SCLC имеют диагноз ED. Несмотря на позднее обнаружение SCLC, у большинства пациентов наблюдается хороший начальный ответ на химиотерапию и лучевую терапию. Однако, к сожалению, после такого первоначального ответа почти у всех пациентов в течение 6-12 месяцев наступает рецидив резистентного заболевания (Semenova E.A. et al., Genes Dev, 2015, 29(14):1447-1462). Мелкоклеточный рак легкого характеризуется почти одинаковой потерей функции обоих опухолевых супрессоров TP53 (опухолевый белок p53) и RB1 (ретинобластома). Сверхэкспрессия EZH2 наблюдается у всех пациентов с SCLC по сравнению с пациентами, страдающими другими подтипами рака легких, и с нормальными тканях. Снижение содержания RB1 при SCLC тесно связано с повышенной экспрессией EZH2. Следовательно, EZH2 может играть определенную роль в опосредовании прогрессирования SCLC (Poirier J.T. et al., Oncogene, 2015, 34(48): 5869-5878; Gardner E. E. et al., Cancer Cell, 2017, 31(2): 286-299).
По-прежнему существует потребность в совершенствовании методов лечения онкологических заболеваний. Считается, что комбинации по настоящему изобретению обладают одним или несколькими преимуществами, такими как большая эффективность по сравнению с лечением любым одним терапевтическим лекарственным средством; возможность снижения взаимодействия между лекарственными средствами; возможность разработки улучшенной схемы приема; возможность снижения побочных эффектов; возможноть преодоления механизмов резистентности и т.п. Эти и другие преимущества настоящего изобретения очевидны из приведенного ниже описания.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к схемам лечения рака.
Настоящее изобретение относится к способу лечения рака у субъекта, включающему введение субъекту комбинированной терапии, которая включает ингибитор EZH2 или его фармацевтически приемлемую соль и противоопухолевое средство на основе платины или его фармацевтически приемлемую соль.
Настоящее изобретение также относится к комбинации ингибитора EZH2 или его фармацевтически приемлемой соли и противоопухолевого средства на основе платины или его фармацевтически приемлемой соли.
Настоящее изобретение также относится к комбинации ингибитора EZH2 или его фармацевтически приемлемой соли и противоопухолевого средства на основе платины или его фармацевтически приемлемой соли для применения в лечении рака.
Настоящее изобретение также относится к синергической комбинации ингибитора EZH2 или его фармацевтически приемлемой соли и противоопухолевого средства на основе платины или его фармацевтически приемлемой соли.
Настоящее изобретение также относится к синергической комбинации ингибитора EZH2 или его фармацевтически приемлемой соли и противоопухолевого средства на основе платины или его фармацевтически приемлемой соли для применения в лечении рака.
Настоящее изобретение также относится к фармацевтической композиции, включающей ингибитор EZH2 или его фармацевтически приемлемую соль и противоопухолевое средство на основе платины или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Настоящее изобретение также относится к набору, который включает первый контейнер, второй контейнер и листок-вкладыш, где первый контейнер включает по меньшей мере одну дозу ингибитора EZH2 или его фармацевтически приемлемой соли, второй контейнер включает по меньшей мере одну дозу противоопухолевого средства на основе платины или его фармацевтически приемлемой соли, а листок-вкладыш содержит инструкции по лечению у субъекта рака с использованием лекарственных средств.
В одном варианте осуществления настоящего изобретения субъектом является человек.
В одном варианте осуществления настоящего изобретения рак представляет собой мелкоклеточный рак легкого.
В одном варианте осуществления настоящего изобретения рак представляет собой трудно поддающийся лечению (резистентный, рефрактерный) мелкоклеточный рак легкого.
В одном варианте осуществления настоящего изобретения рак представляет собой рецидивирующий мелкоклеточный рак легкого.
В одном варианте осуществления настоящего изобретения рак представляет собой мелкоклеточный рак легкого, который классифицируется как заболевание распространенной стадии (заболевание с отдаленными метастазами, запущенная стадия болезни).
В одном варианте осуществления настоящего изобретения субъектом является пациент, ранее не получавший лечения.
В одном варианте осуществления настоящего изобретения рак представляет собой рецидивирующий мелкоклеточный рак легкого, а субъектом является пациент, ранее не получавший лечения.
В одном варианте осуществления настоящего изобретения рак представляет собой рефрактерный мелкоклеточный рак легкого, а субъектом является пациент, ранее не получавший лечения.
В одном варианте осуществления настоящего изобретения рак представляет распространенный мелкоклеточный рак легкого, а субъектом является пациент, ранее не получавший лечения.
В одном варианте осуществления настоящего изобретения рак представляет собой рефрактерный распространенный мелкоклеточный рак легкого, а субъектом является пациент, ранее не получавший лечения.
В одном варианте осуществления настоящего изобретения рак представляет собой рецидивирующий распространенный мелкоклеточный рак легкого, а субъектом является пациент, ранее не получавший лечения.
В одном варианте осуществления настоящего изобретения ингибитор EZH2 выбран из группы, состоящей из следующих соединений:
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(R)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(S)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
5-бром-8-хлор-2-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-(1,4-диметил-1H-1,2,3-триазол-5-ил)-3,4-дигидроизохинолин-1(2H)-он;
5,8-дихлор-7-(3,5-диметил-1,2-оксазол-4-ил)-2-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-5-[этил(тетрагидро-2H-пиран-4-ил)амино]-4-метил-4'-(морфолин-4-илметил)бифенил-3-карбоксамид;
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-5-[этил(тетрагидро-2H-пиран-4-ил)амино]-4-метил-4'-(морфолин-4-илметил)бифенил-3-карбоксамид;
N-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-2-метил-1-[(1R)-1-[1-(2,2,2-трифторэтил)пиперидин-4-ил]этил]-1H-индол-3-карбоксамид-4-ил;
N-(4,6-диметил-2-оксо-1,2-дигидропиридин-3-илметил)-1-изопропил-3-метил-6-[6-(4-метилпиперазин-1-ил)пиридин-3-ил]-1H-индол-4-карбоксамид;
N-[(6-метил-2-оксо-4-пропил-1,2-дигидропиридин-3-ил)метил]-6-[2-(4-метилпиперазин-1-ил)пиридин-4-ил]-1-(пропан-2-ил)-1H-индазол-4-карбоксамид;
или их фармацевтически приемлемые соли.
В одном варианте осуществления настоящего изобретения ингибитор EZH2 представляет собой 5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(R)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он или его фармацевтически приемлемую соль.
В одном варианте осуществления настоящего изобретения противоопухолевое средство на основе платины выбрано из группы, состоящей из цисплатина и карбоплатина.
В одном варианте осуществления настоящего изобретения противоопухолевое средство на основе платины представляет собой цисплатин.
В одном варианте осуществления настоящего изобретения противоопухолевое средство на основе платины представляет собой карбоплатин.
В одном варианте осуществления настоящего изобретения ингибитор EZH2 представляет собой 5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(R)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он или его фармацевтически приемлемую соль, и противоопухолевое средство на основе платины представляет собой цисплатин.
В одном варианте осуществления настоящего изобретения ингибитор EZH2 представляет собой 5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(R)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он или его фармацевтически приемлемую соль, и противоопухолевое средство на основе платины представляет собой карбоплатин.
В одном варианте осуществления настоящего изобретения дополнительно вводится этопозид.
Каждый из вариантов осуществления настоящего изобретения, описанных ниже, может объединяться с одним или несколькими другими вариантами осуществления настоящего изобретения, описанными в настоящем документе, если он не противоречит варианту (вариантам), с которым(и) объединяется. Кроме того, каждый из приведенных ниже вариантов осуществления, описывающих изобретение, включает в свой объем фармацевтически приемлемые соли, сольваты, гидраты и комплексы, а также сольваты, гидраты и комплексы солей, включая полиморфы, стереоизомеры и изотопно-меченные варианты соединения по настоящему изобретению. Соответственно, фраза «или его фармацевтически приемлемая соль» подразумевается в описании всех соединений, описанных в настоящем документе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
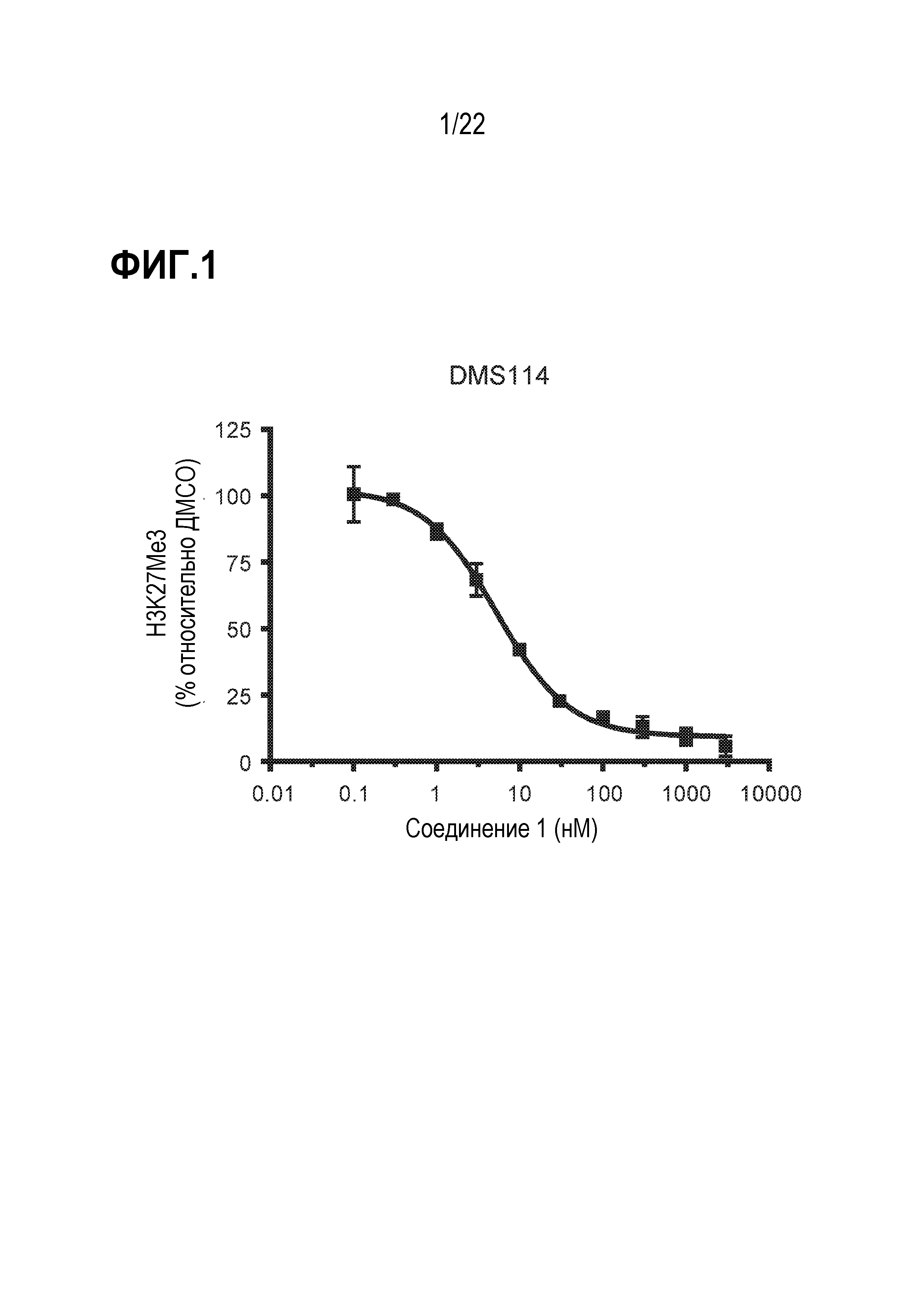
Фигура1: Ингибирование H3K27Me3 соединением 1 в SCLC клетках DMS114. SCLCклетки DMS114 обрабатывали соединением 1 в различных концентрациях в течение 3 дней и оценивали уровни H3K27Me3 с использованием вестерн-блот-анализа. Каждая точка данных представляет содержание H3K27Me3 в % при данной концентрации соединения, нормализованное по ДМСО (среднее значение ± SD; n=2 технических повтора). Фигура представляет экспериментальные данные 5 независимых биологических повторов.
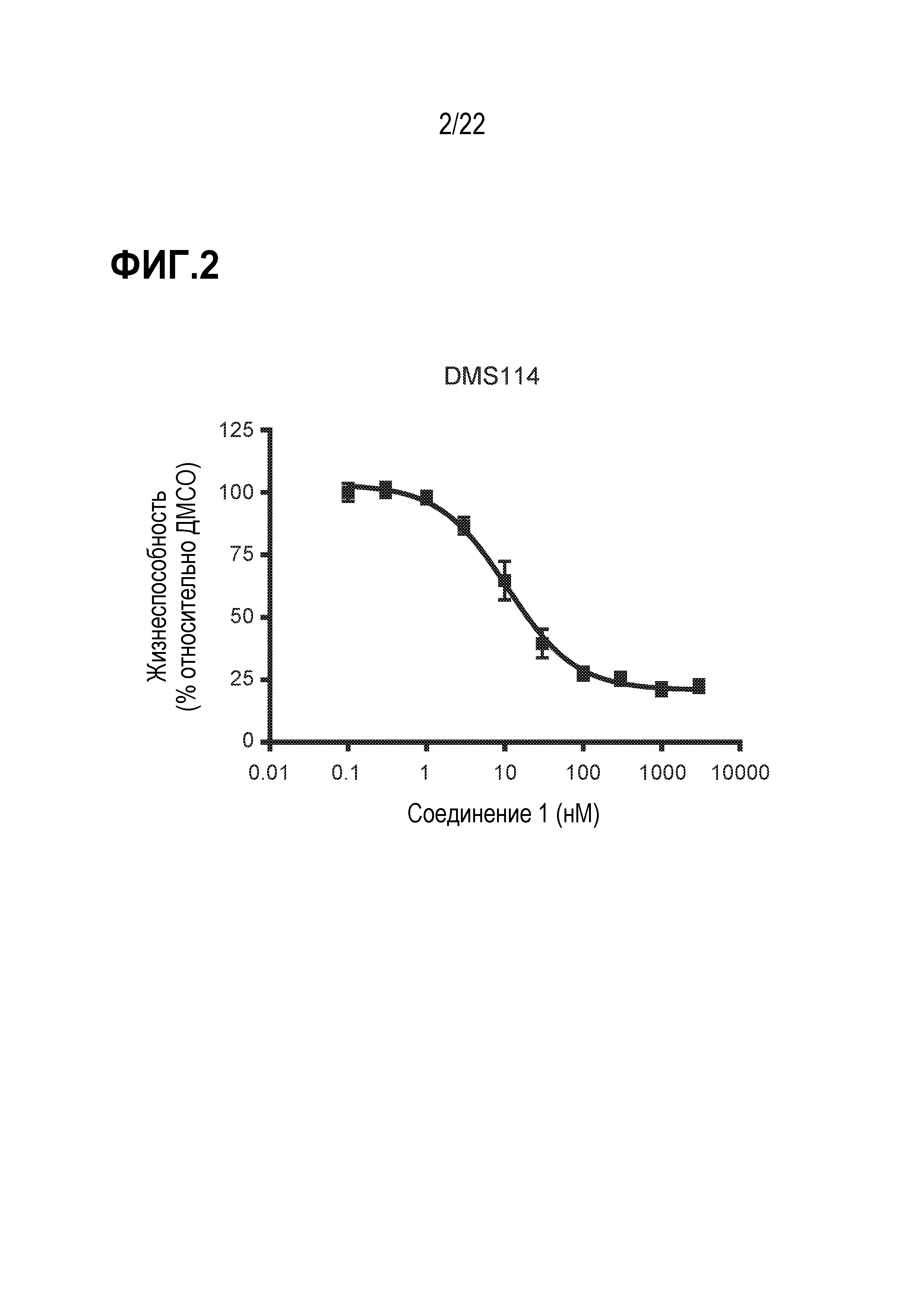
Фигура 2: Ингибирование соединением 1 пролиферации SCLC клеток DMS114. SCLC клетки DMS114 обрабатывали соединением 1 в различных концентрациях в течение 19 дней. Каждая точка данных представляет количество жизнеспособных клеток в % при обработке соединением в данной концентрации, нормализованное по ДМСО (среднее значение ± SD; n=6). Фигура представляет экспериментальные данные 6 независимых биологических повторов.
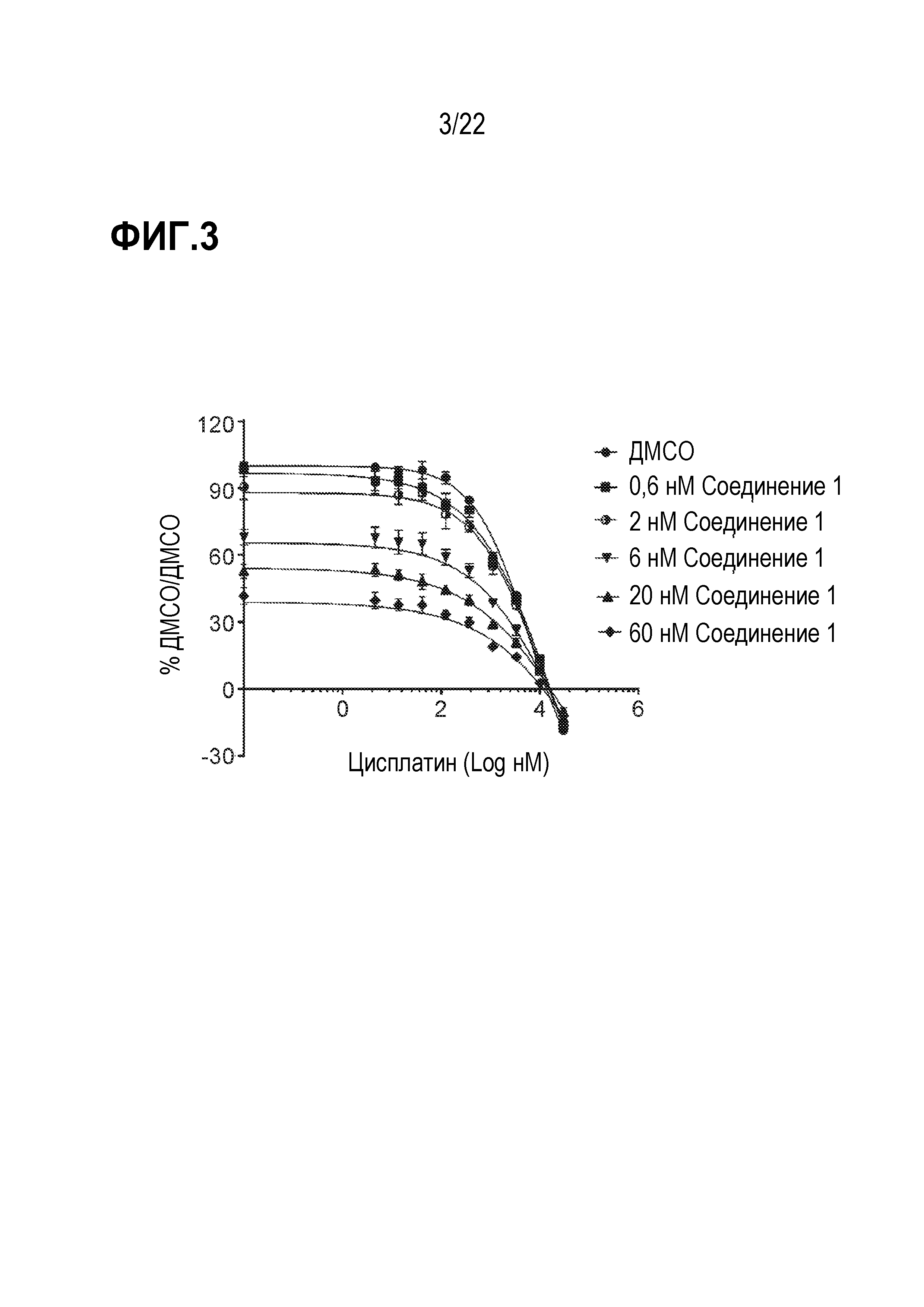
Фигура 3: Соединение 1 в сочетании с цисплатином проявляет синергическое действие в SCLC клетках DMS114. Клетки предварительно обрабатывали соединением 1 в течение 9 дней с последующей совместной обработкой цисплатином в течение 4 дней. Данные были нормализованы по необработанному образцу ДМСО/ДМСО и представлены в виде % от необработанного образца. Данные проанализированы с использованием модели комбинированной аддитивности Леве (Loewe).
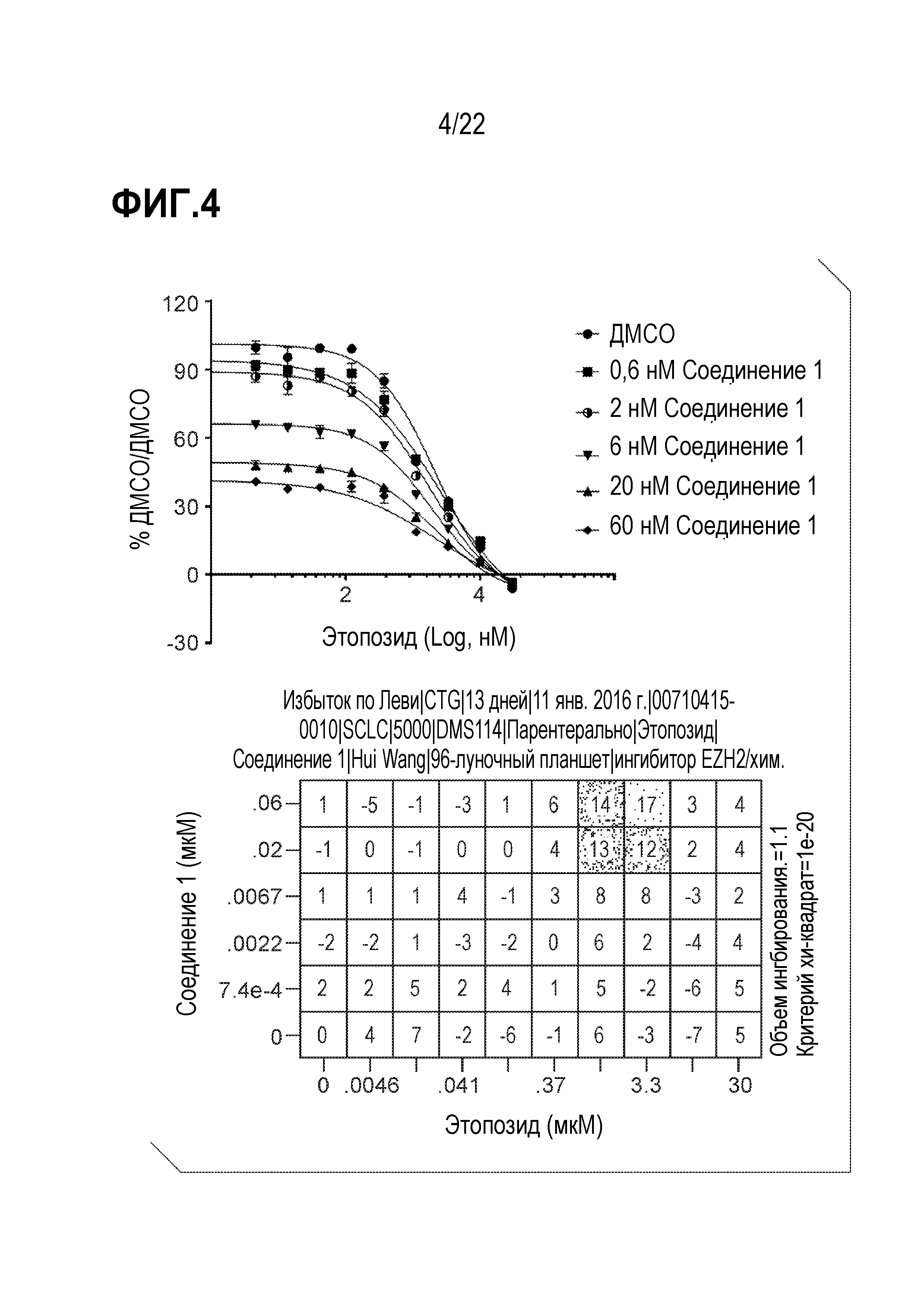
Фигура 4: Соединение 1 проявляет синергический эффект в комбинации с этопозидом в SCLC клетках DMS114. Клетки предварительно обрабатывали соединением 1 в течение 9 дней с последующей совместной обработкой этопозидом в течение 4 дней. Данные были нормализованы по необработанному образцу ДМСО/ДМСО и представлены как % относительно необработанного образца. Анализ данных выполнен с использованием модели аддитивности комбинации Леве (Loewe).
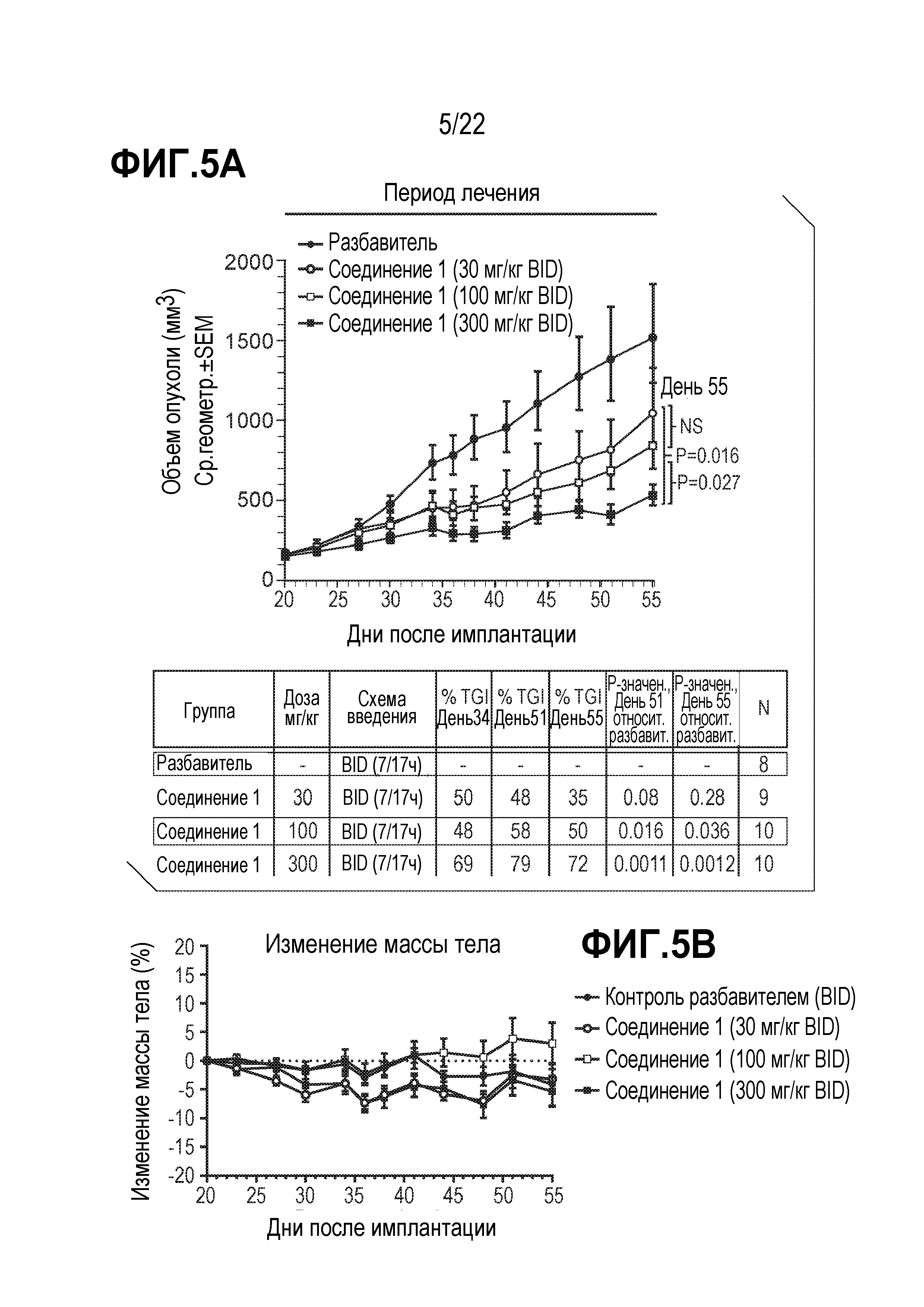
Фигура 5: A.Противоопухолевая эффективность соединения 1 при отдельном применении в модели ксенотрансплантата SCLC клеток DMS114. Кривые роста опухолей клеток DMS114 и значения TGI для групп лечения соединением 1 (среднее геометрическое±SEM). Рандомизацию и начало лечения осуществляли на 20 день после имплантации самкам мышей NOD/SCID. Р значения: двусторонний критерий Стьюдента. В группах, получавших соединение 1 дважды в сутки (BID) в дозах 30 и 100 мг/кг, наблюдался значительно меньший TGI, чем в группе, принимавшей 300 мг/кг. B.Изменение массы тела показано в процентах относительно начала лечения на 20-й день (среднее значение ± SEM).
Фигура 6: Зависимое от дозы ингибирование H3K27Me3 и Me2 соединением 1 в модели SCLC ксенотрансплантата клеточной линии DMS114. Модуляция (A) H3K27Me3 и (B) H3K27Me2 в опухолях DMS114, обработанных различными дозами соединения 1. Гистоны были извлечены из быстрозамороженных опухолей, собранных в день 55, и уровни метилирования были оценены с помощью ELISA анализа (среднее значение ± SEM;*ns P>0,05;*P<0,05;**P<0,01;***P<0,001; ****P<0,0001).
Фиг.7: Преимущество комбинированного действия цисплатина с соединением 1 в модели ксенотрансплантата SCLC клеточной линии DMS114. А. Кривые роста опухолей DMS114 и значения TGI для групп лечения, получавших соединение 1 и цисплатин (среднее геометрическое ± SEM). Рандомизацию и начало лечения осуществляли на 20-й день после введения импланта самкам мышей NOD/SCID. Значения P: двусторонний критерий Стьюдента. Группы лечения только соединением 1 в дозе 100 мг/кг BID и только цисплатином показали значительно меньшее TGI, чем группа комбинированного лечения. B. Изменение массы тела в процентах показано относительно начала лечения в 20-й день (среднее значение±SEM). C. Индивидуальные кривые роста опухоли для группы комбинированного лечения. Регрессия объема опухоли относительно начала лечения (показана серыми линиями/незакрашенными кружками) наблюдалась у 50% мышей, которых лечили комбинацией.
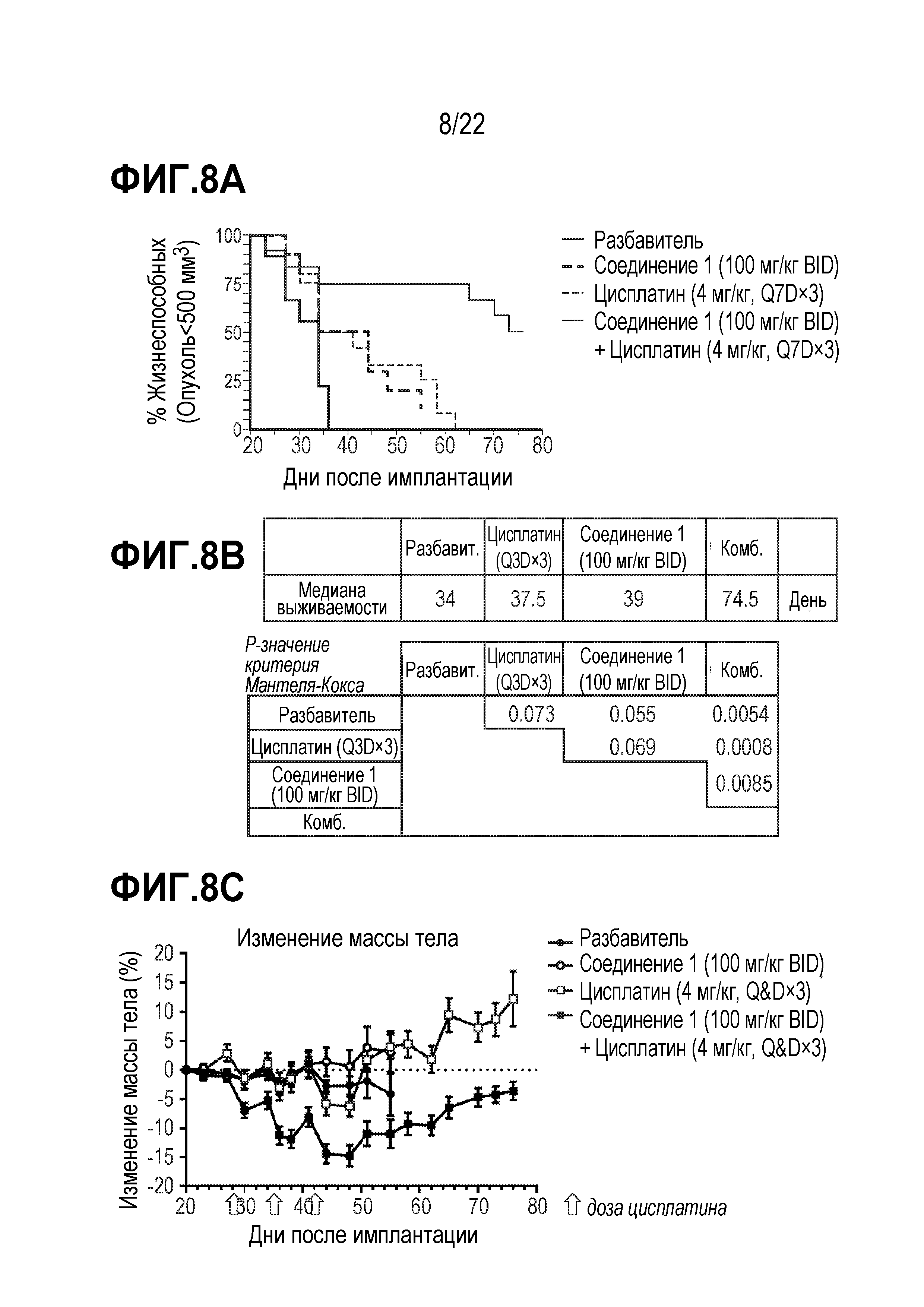
Фигура 8:A.Увеличение продолжительности жизни мышей, обработанных цисплатином в комбинации с соединением 1, в модели подкожного SCLC ксенотрансплантата DMS114 EZH2-wt. Кривая выживаемости Каплана-Мейера, основанная на пределе выживаемости при опухолевой нагрузке 500 мм3. Рандомизация на 20 день после имплантации самкам мышей NOD/SCID. B.Значения P основаны на проверке по логранговому критерию (Mantel-Cox; программное обеспечение Graphpad-Prism). C.Восстановление массы тела в двух группах, получавших цисплатин, после 3-й обработки цисплатином и после 55-го дня.
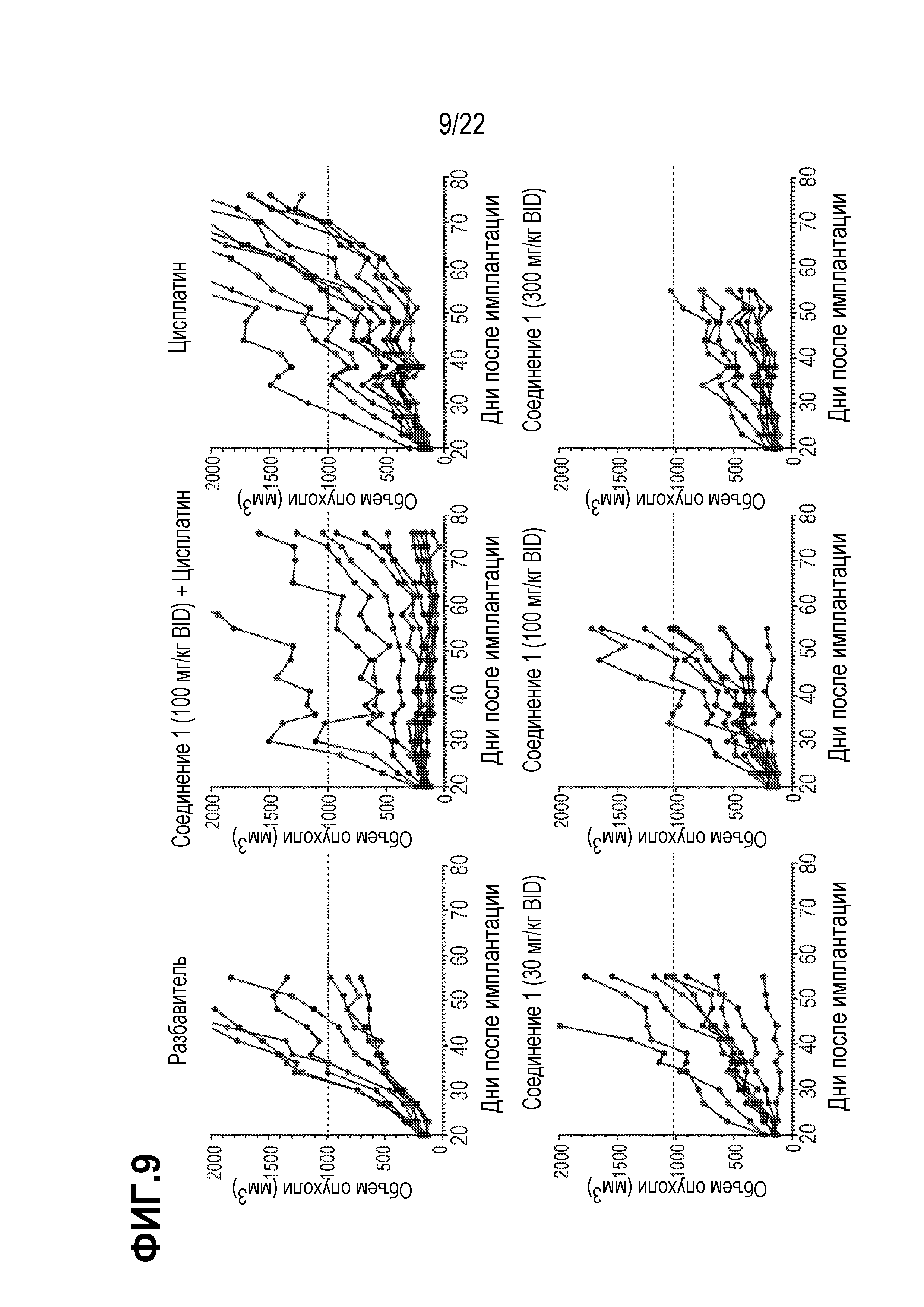
Фигура 9: Индивидуальные кривые роста опухоли в модели SCLC ксенотрансплантата клеток линии DMS114. Рандомизация на 20 день после имплантации (107 клеток в 0,1 мл PBS с 50% матригелем) самкам мышей NOD/SCID.
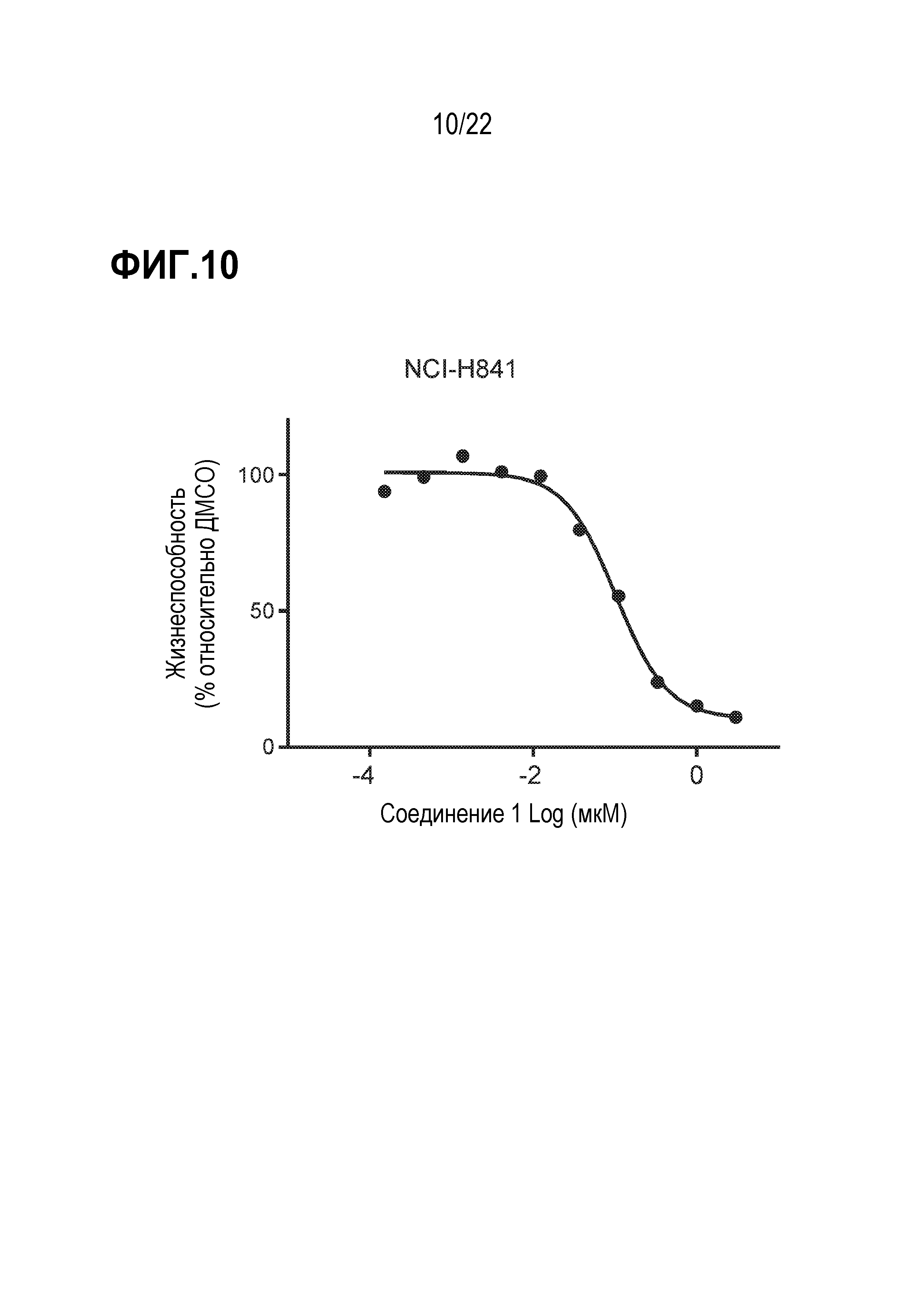
Фигура 10: Ингибирование соединением 1 пролиферации SCLC клеток линии H841. SCLC клетки H841 обрабатывали различными концентрациями соединения 1 в течение 21 дня. Каждая точка данных представляет количество жизнеспособных клеток, выраженное в %, при данной концентрации соединения, нормированное по ДМСО (среднее значение±SEM; n=3 технических повтора). Фигура представляет экспериментальные данные 2 независимых биологических повторов.
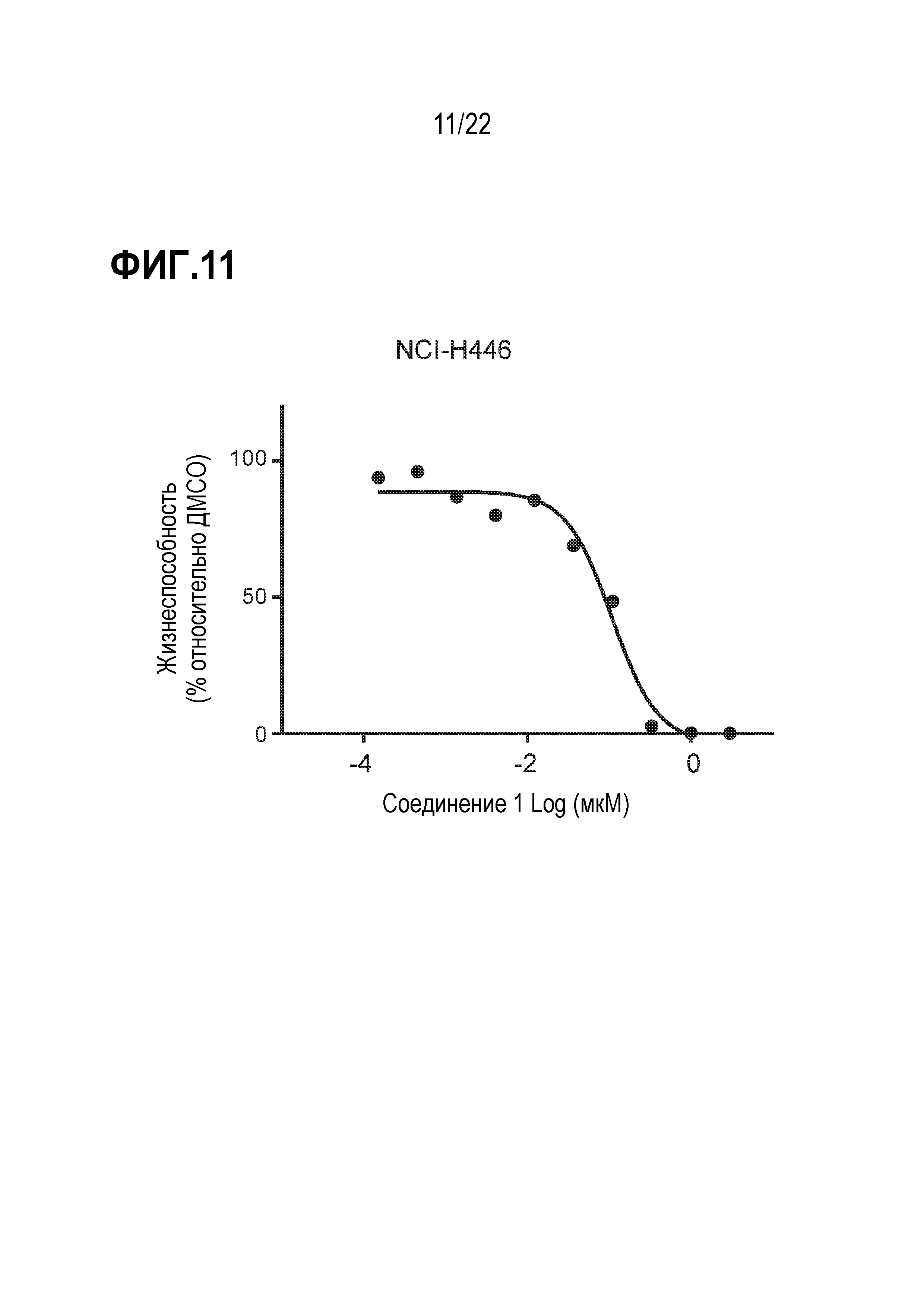
Фигура 11: Ингибирование соединением 1 пролиферации SCLC клеток H446. SCLC клетки H446 обрабатывали различными концентрациями соединения 1 в течение 21 дня. Каждая точка данных представляет количество жизнеспособных клеток, выраженное в %, при данной концентрации соединения, нормированное по ДМСО (среднее значение±SEM; n=3 технических повтора).
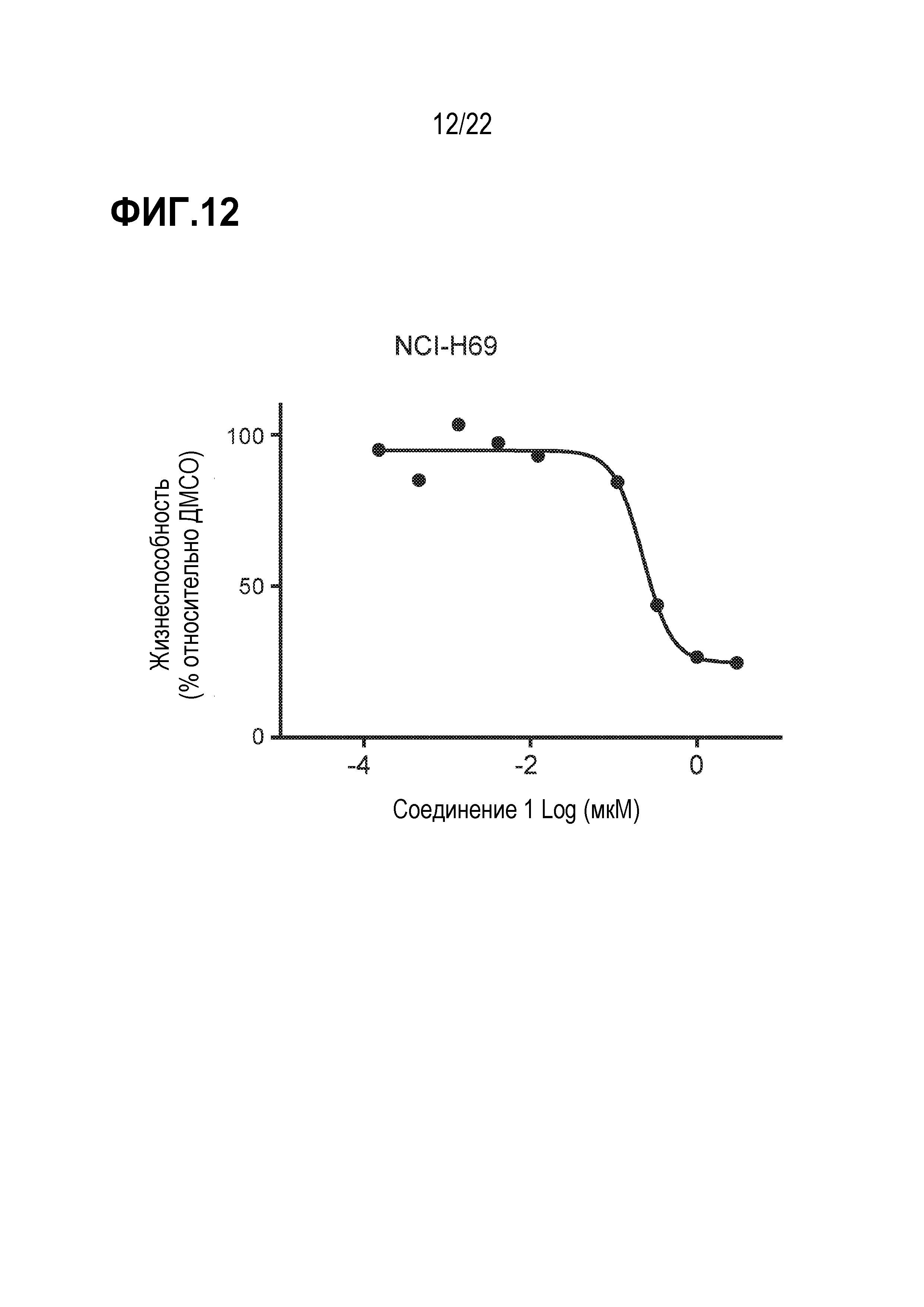
Фигура 12: Ингибирование соединением 1 пролиферации SCLC клеток H69. SCLC клетки 69 клетки обрабатывали различными концентрациями соединения 1 в течение 21 дня. Каждая точка данных представляет количество жизнеспособных клеток, выраженное в %, при данной концентрации соединения, нормированное по ДМСО (среднее значение ± SEM; n=3 технических повтора).
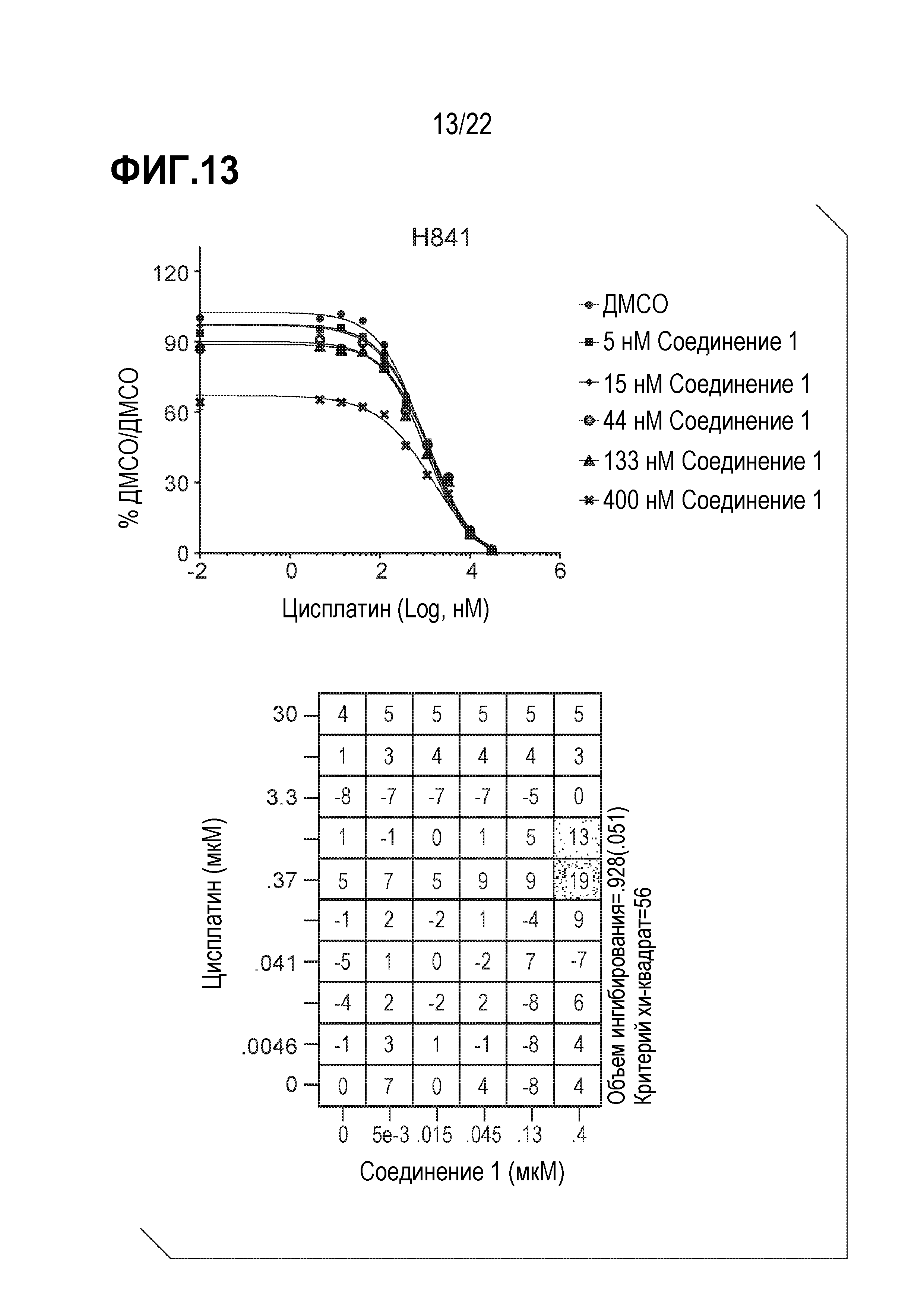
Фигура 13: Соединение 1 проявляет синергические синергические/аддитивные эффекты с цисплатином в SCLC клетках H841. Клетки H841 предварительно обрабатывали соединением 1 в течение 9 дней с последующей совместной обработкой цисплатином в течение 4 дней. Данные были нормализованы по необработанному образцу ДМСО/ДМСО и представлены в виде % относительно необработанного образца. Анализ данных выполнен с использованием модели аддитивности комбинации Леве.
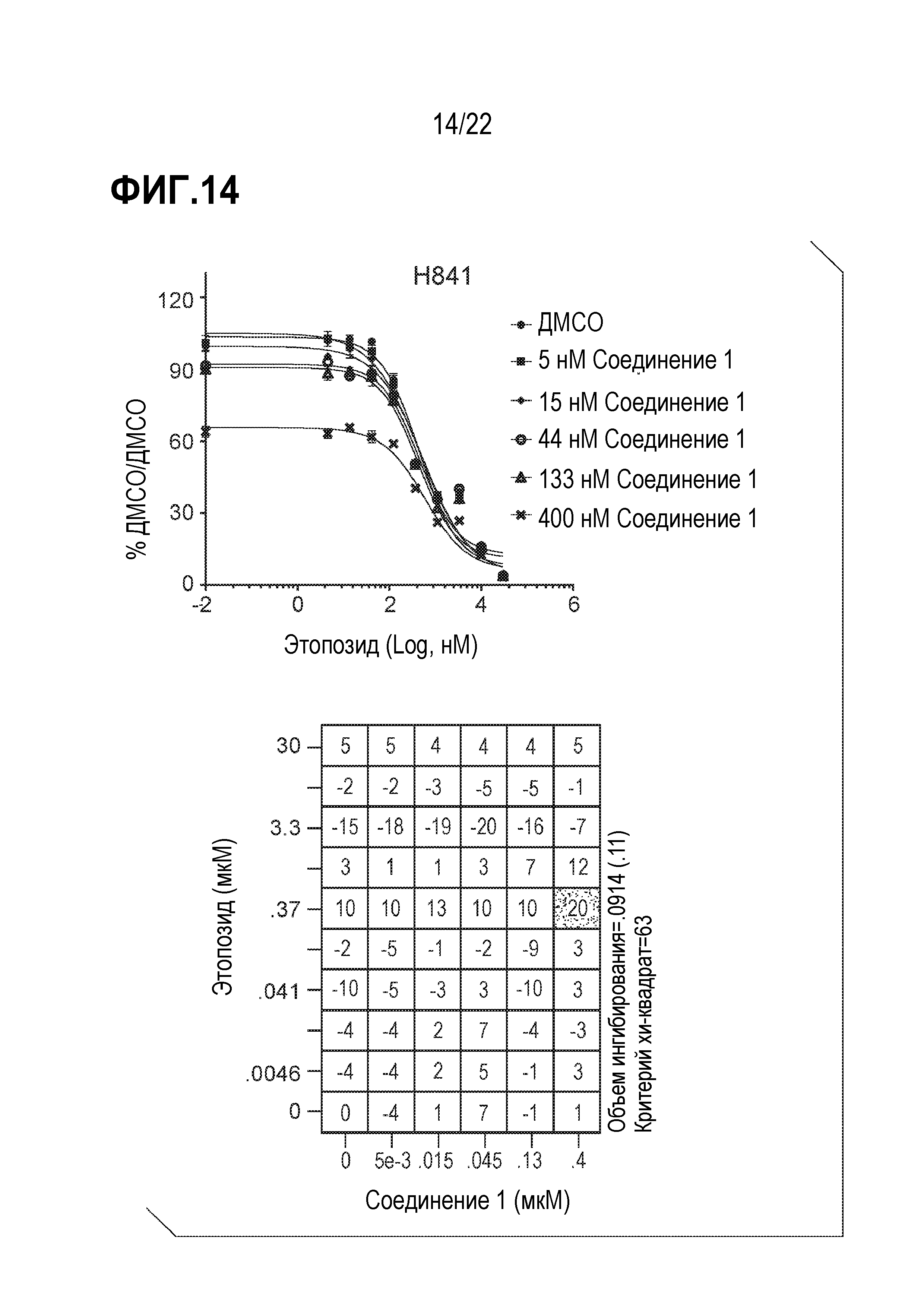
Фигура 14: Соединение 1 проявляет синергические/аддитивные эффекты в комбинации с этопозидом в SCLC клетках H841. Клетки H841 предварительно обрабатывали соединением 1 в течение 9 дней с последующей совместной обработкой этопозидом в течение 4 дней. Данные были нормализованы по необработанному образцу ДМСО/ДМСО и представлены в виде % относительно необработанного образца. Анализ данных выполнен с использованием модели аддитивности комбинации Леве.
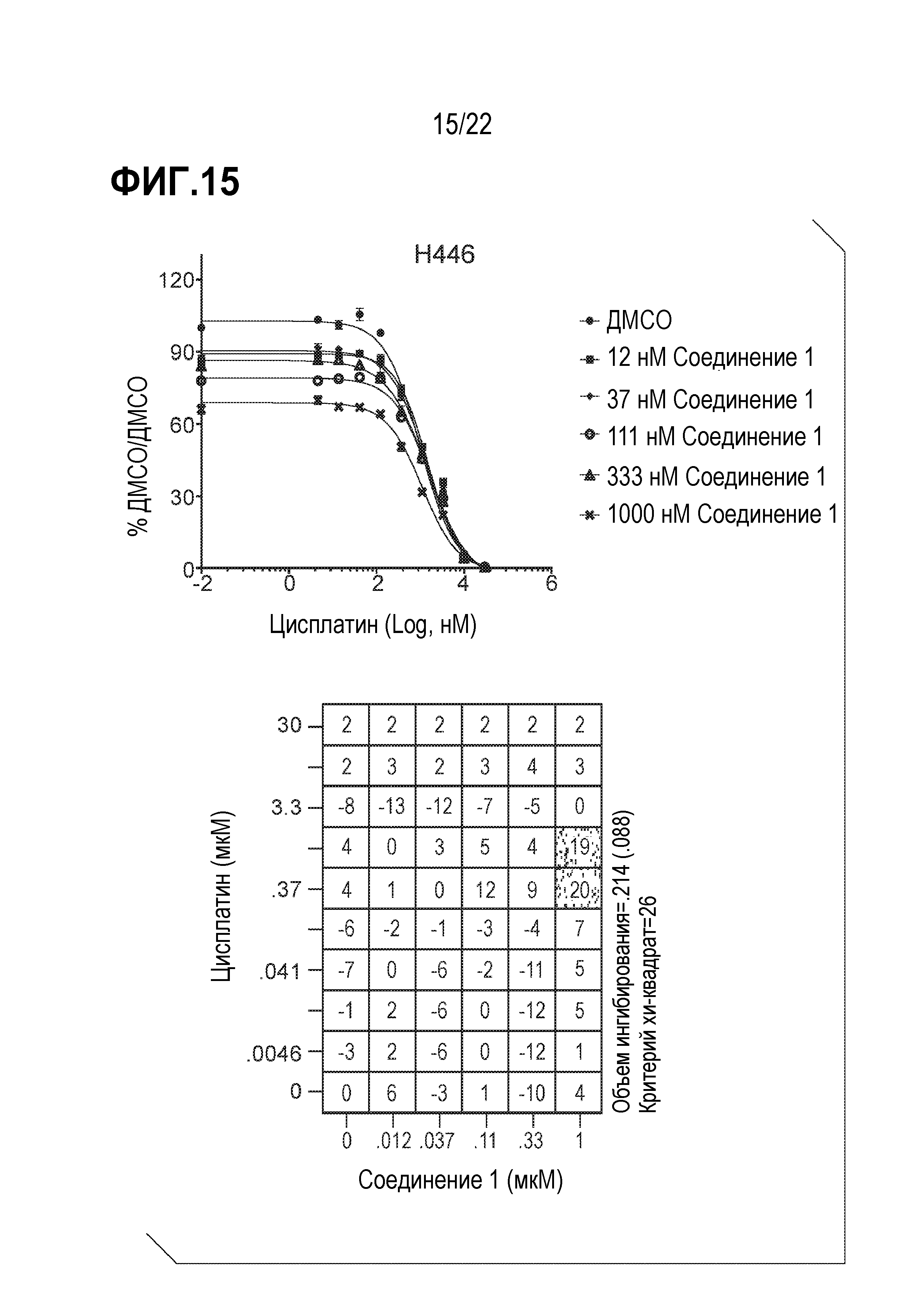
Фигура 15: Соединение 1 проявляет синергический эффект в сочетании с цисплатином в SCLC клетках H446. Клетки H446 предварительно обрабатывали соединением 1 в течение 9 дней с последующей совместной обработкой с цисплатином в течение 4 дней. Данные были нормализованы по необработанному образцу ДМСО/ДМСО и представлены в виде % относительно необработанного образца. Анализ данных выполнен с использованием модели аддитивности комбинации Леве.
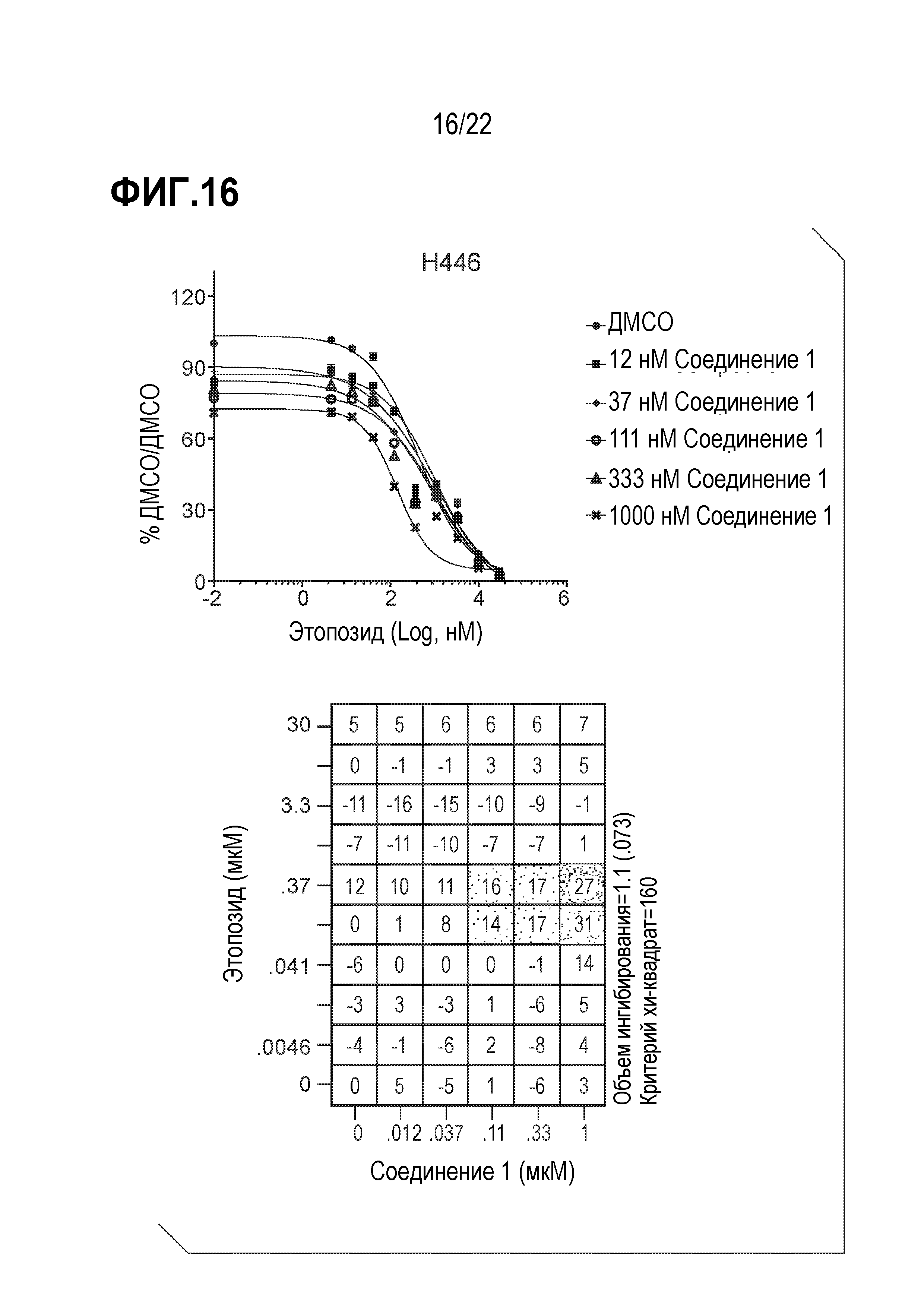
Фигура 16: Соединение 1 проявляет синергические эффекты в сочетании с этопозидом в SCLC клетках H446. Клетки H446 предварительно обрабатывали соединением 1 в течение 9 дней с последующей совместной обработкой с этопозидом в течение 4 дней. Данные были нормализованы по необработанному образцу ДМСО/ДМСО и представлены в виде % относительно необработанного образца. Анализ данных выполнен с использованием модели аддитивности комбинации Леве.
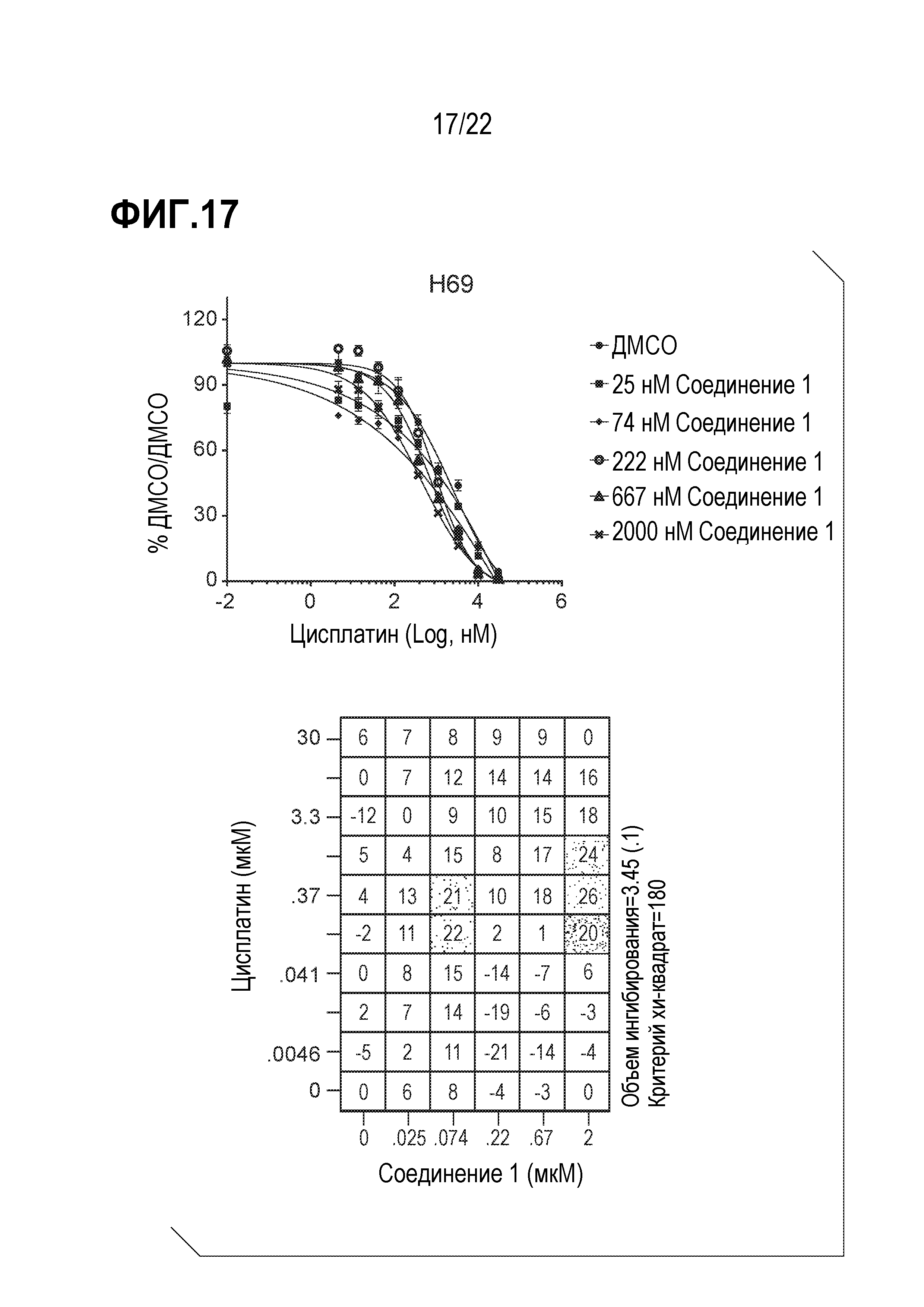
Фигура 17: Соединение 1 проявляет синергический эффект в сочетании с цисплатином в SCLC клетках H69. Клетки H69 предварительно обрабатывали соединением 1 в течение 9 дней с последующей совместной обработкой с цисплатином в течение 4 дней. Данные были нормализованы по необработанному ДМСО/ДМСО образцу и представлены в виде % относительно необработанного образца. Анализ данных выполнен с использованием модели аддитивности комбинации Леве.
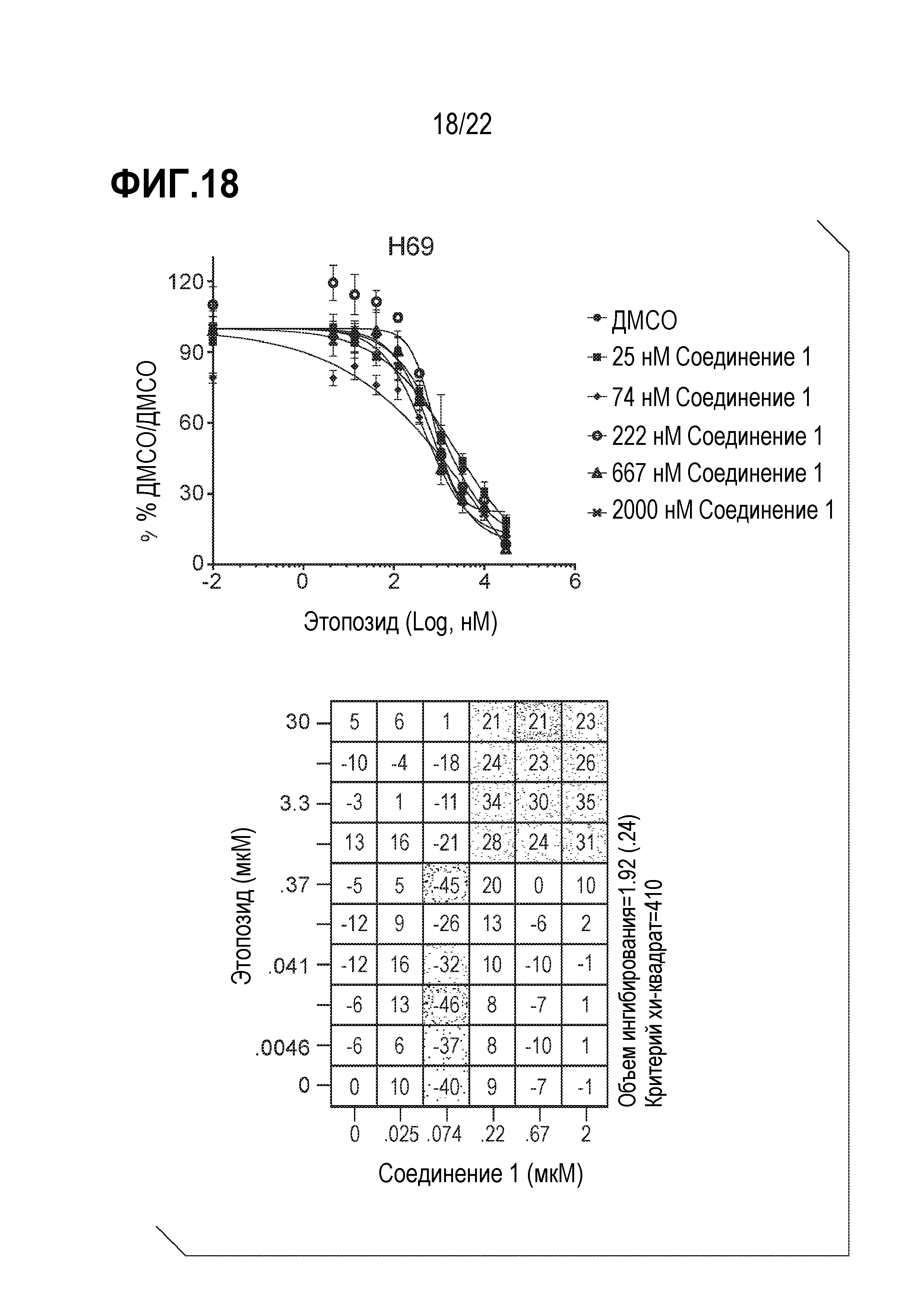
Фигура 18: Соединение 1 проявляет синергический эффект в комбинации с этопозидом в SCLC клетках H69. Клетки H69 предварительно обрабатывали соединением 1 в течение 9 дней с последующей совместной обработкой с этопозидом в течение 4 дней. Данные были нормализованы по необработанному образцу ДМСО/ДМСО и представлены в виде % относительно необработанного образца. Анализ данных выполнен с использованием модели аддитивности комбинации Леве
Фигура 19: Соединение 1 индуцирует экспрессию SLFN11 в клеточных линиях SCLC. Клеточные линии SCLC обрабатывали 500 нМ соединения 1 в течение 7 дней и определяли экспрессию SLFN11 с помощью вестерн-блоттинга.
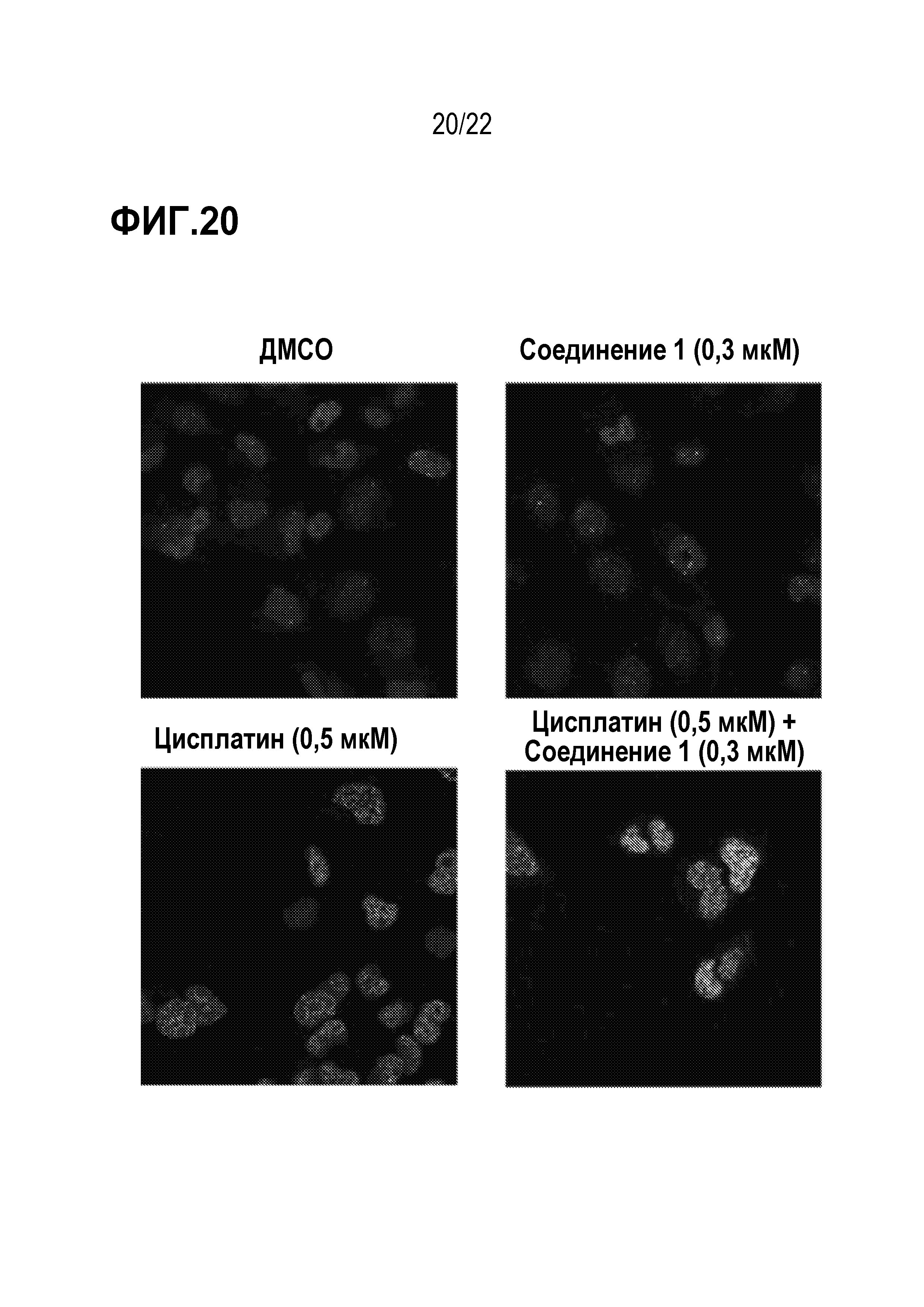
Фигура 20: Соединение 1 в комбинации с цисплатином индуцирует увеличение очагов γ-H2AX в SCLC клеточной линии H841. Клетки H841 предварительно обрабатывали соединением 1 в течение 7 дней с последующей обработкой в комбинации с цисплатинм в течение 16 часов. Затем клетки окрашивали маркером повреждения ДНК γ-H2AX.
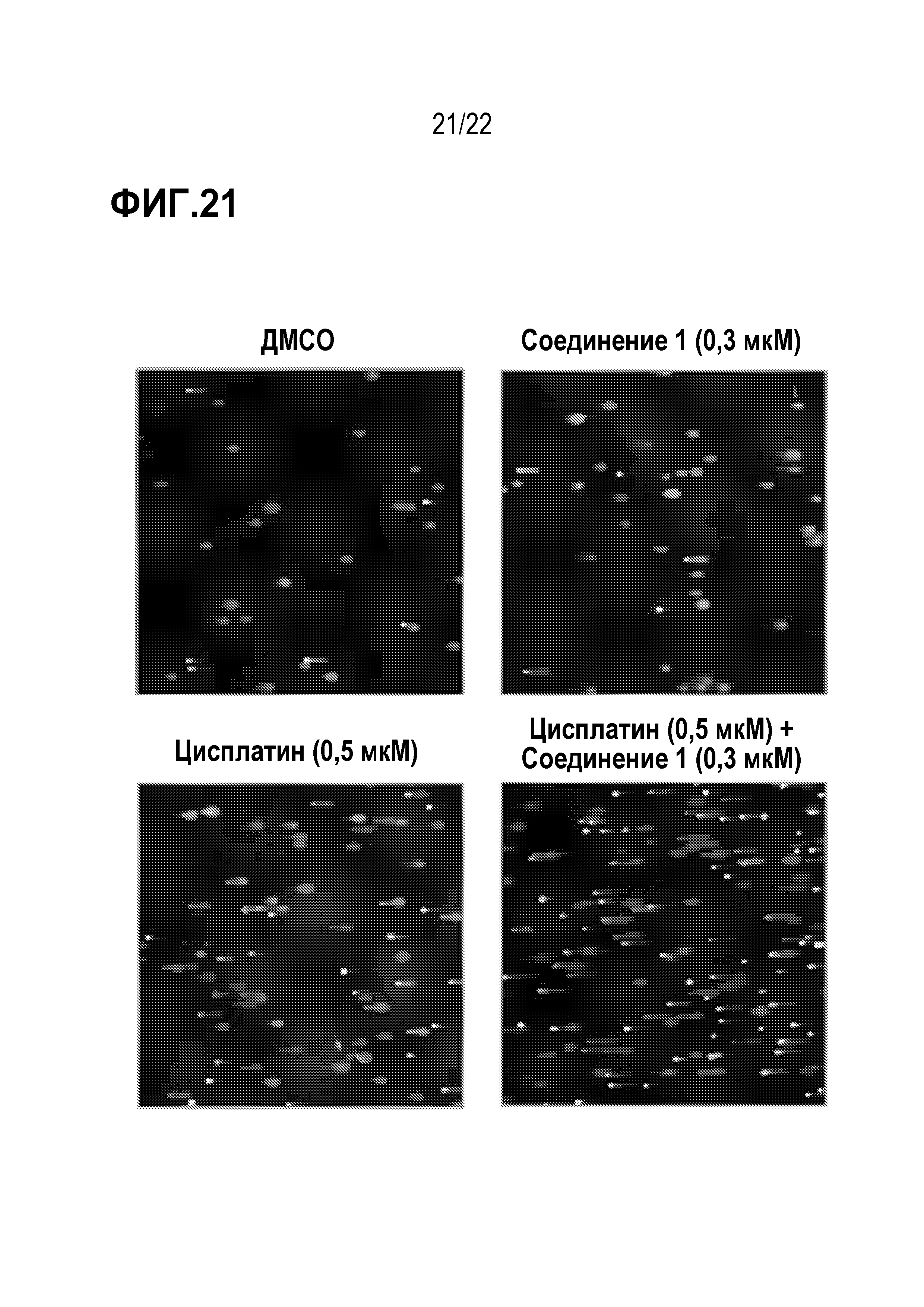
Фигура 21: Соединение 1 в комбинации с цисплатином индуцирует повышенное повреждение ДНК в клеточной линии HLC41 SCLC, как показано кометным анализом. Клетки H841 предварительно обрабатывали соединением 1 в течение 7 дней с последующей совместной обработкой с цисплатином в течение 3 дней. Выявление повреждения ДНК клеток выполнено с использованием кометного анализа.
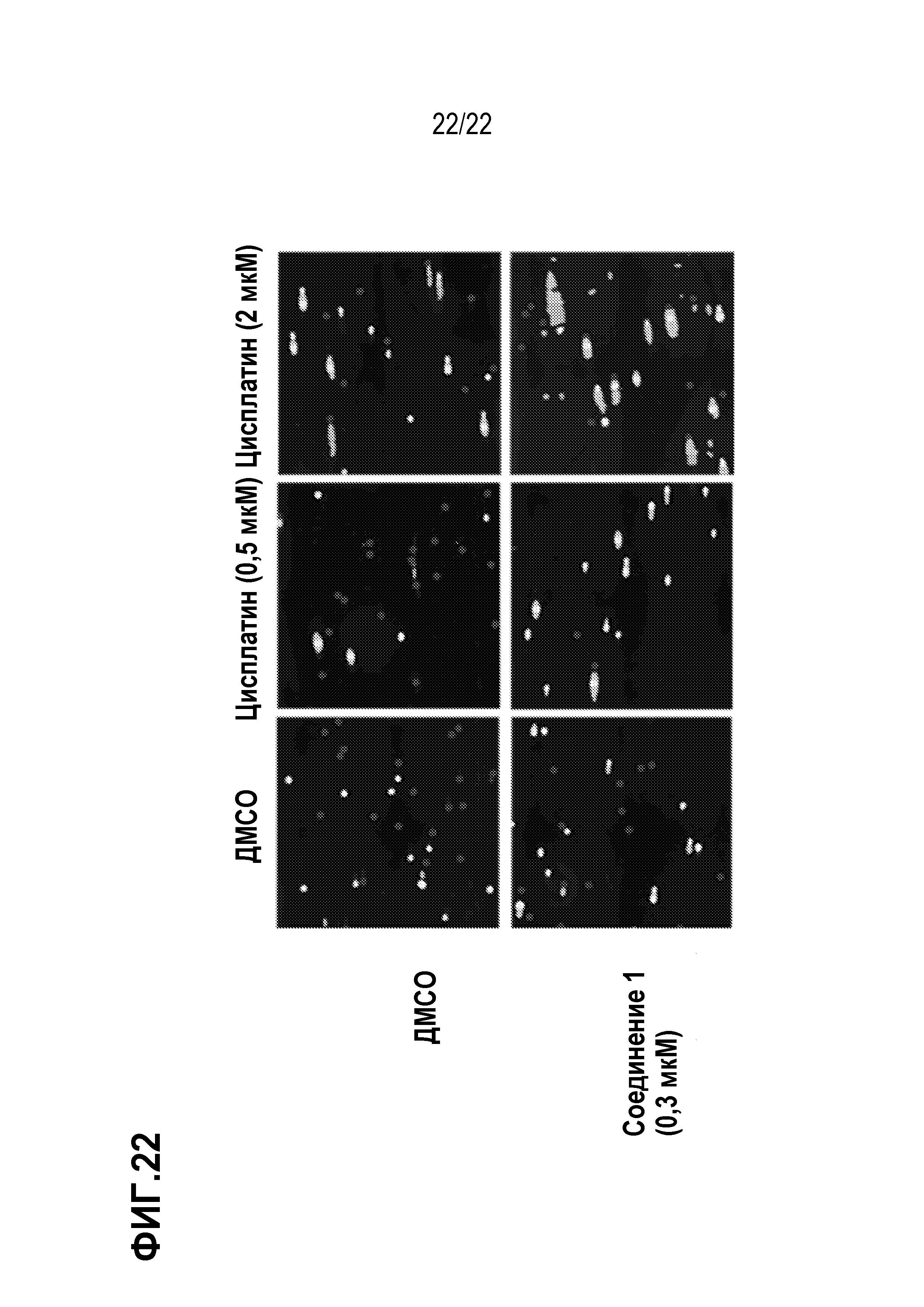
Фигура 22: Соединение 1 в комбинации с цисплатином индуцирует повышенное повреждение ДНК в SCLC клеточной линии H69, как показано кометным анализом. Клетки H69 предварительно обрабатывали соединением 1 в течение 7 дней с последующей совместной обработкой с цисплатином в течение 3 дней. Выявление повреждения ДНК клеток выполнено с использованием кометного анализа.
ПОДРОБНОЕ ОПИСАНИЕ
Далее приведено подробное описание предпочтительных вариантов осуществления настоящего изобретения и примеров, включенных в настоящий документ, что дает возможность легче понять настоящее изобретение. Следует представлять, что используемая здесь терминология предназначена только для описания конкретных вариантов осуществления изобретения, но не предназначена для его ограничения. Кроме того, следует представлять, за исключение особо оговоренных случаев, терминология, используемая в данном документе, должна иметь традиционное значение, известное в соответствующей области техники.
Формы единственного числа когда используются в настоящем описании, включают множественное число упомянутых существительных, если не указано иное. Например, термин «заместитель» включает один или несколько заместителей.
Термин «примерно» при использовании в определении численного параметра (например, дозы ингибитора EZH2, дозы противоопухолевого средства на основе платины, такого как цисплатин, дозы химиотерапевтического средства, такого как этопозид, и т.п.) означает, что параметр может отличаться от указанного числового значения на 10% в большую или меньшую сторону. Например, следует иметь в виду, что фраза «доза примерно 5 мг/кг» означает, что доза может изменяться от 4,5 до 5,5 мг/кг.
Термины «аномальный рост клеток» и «гиперпролиферативное расстройство» используются в данной заявке взаимозаменяемо.
Термин «аномальный рост клеток», когда используется в настоящем описании, если не указано иное, относится к росту клеток, который не зависит от нормальных регуляторных механизмов (например, от потери контактного ингибирования). Аномальный рост клеток может быть доброкачественным (нераковым) или злокачественным (раковым).
Термины «рак», «онкологический», «злокачественный» относятся или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым ростом клеток. Термин «рак», когда используется в настоящем документе, относится к любому злокачественному и/или инвазивному росту или опухоли, вызванному аномальным ростом клеток. Термин «рак», когда используется в настоящем документе, относится к солидным опухолям, названным по типу клеток, которые их образуют, раку крови, раку костного мозга или раку лимфатической системы. Примеры солидных опухолей включают, но без не ограничения, саркомы и карциномы. Примеры раковых заболеваний крови включают, но без ограничения, лейкемии, лимфомы и миеломы. Термин «рак» включает, но без ограничения, первичный рак, который возникает в определенном месте в организме, метастатический рак, который распространился из места, в котором он возник, в другие части тела, рецидив первичного рака после ремиссии и второй первичный рак, который является новым первичным раком у человека с раком в анамнезе, отличным от последнего. Примеры рака включают, но без ограничения, карциному, лимфому, лейкоз, бластому и саркому. Более конкретные примеры таких видов рака включают плоскоклеточный рак, миелому, мелкоклеточный рак легкого, немелкоклеточный рак легкого, глиому, лимфому Ходжкина, неходжкинскую лимфому, фолликулярную лимфому (FL), диффузную В-крупноклеточную лимфому (DLCBCL), острый миелолейкоз (AML), множественную миелому, рак желудочно-кишечного тракта, рак почки, рак яичников, рак печени, рак почки, рак предстательной железы, кастрационно-резистентный рак предстательной железы (CRPC), рак щитовидной железы, меланому, хондросаркому, нейробластому, рак поджелудочной железы, глиоблазому, полиморфный рак, рак шейки матки, рак мозга, рак желудка, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки и рак головы и шеи.
Термин «пациент» или «субъект» относится к любому отдельному субъекту, который нуждается в терапевтическом лечении или который участвует в клиническом испытании, эпидемиологическом исследовании или используется в качестве контроля, включая людей и млекопитающих пациентов, таких как крупный рогатый скот, лошади, собаки и кошки. В определенных предпочтительных вариантах субъектом является человек.
Термин «лечить» или «лечение» рака (в значении действия), когда используется в настоящем документе, означает введение комбинированной терапии по настоящему изобретению субъекту, который страдает раком или у которого диагностирован рак, для достижения по меньшей мере одного положительного терапевтического эффекта, такого как, например, уменьшение количества раковых клеток, уменьшение размера опухоли, уменьшение скорости инфильтрации раковых клеток в периферический орган или уменьшение скорости роста метастазов опухоли или роста опухоли, реверсия, облегчение, ингибирование развития или предотвращение расстройства или состояния, к которому относится такой термин, или нескольких симптомов такого расстройства или состояния. Термин «лечение» (в значении существительного), когда используется в настоящем документе, относится, если не указано иное, к действию лечения «лечение», который определен непосредственно выше. Термин «лечение» также включает адъювантное и неоадъювантное терапевтическое лечение субъекта. Полезные или желательные для целей настоящего изобретения клинические результаты включают, но без ограничения, один или несколько из следующих результатов: уменьшение пролиферации (или разрушение) опухолевых или раковых клеток; ингибирование метастазирования или опухолевых клеток; сокращение или уменьшение размера опухоли; ремиссия рака; уменьшение симптомов, возникающих в результате рака; повышение качества жизни пациентов, страдающих раком; уменьшение дозы других лекарств, необходимых для лечения рака; задержка прогрессирования рака; излечение рака; преодоление одного или нескольких механизмов резистентности рака; и/или продление выживаемости больных раком. Положительные терапевтические эффекты при раке могут быть количественно определены несколькими способами (см., например, W.A. Weber, J. Nucl. Med. 50:1S-10S (200)). В некоторых вариантах осуществления изобретения лечение, достигаемое комбинацией по настоящему изобретению, представляет собой любой ответ, выбранный из частичного ответа (PR), полного ответа (CR), общего ответа (OR), обеспечения жизнеспособности без признаков прогрессирования заболевания (PFS), обеспечения жизнеспособности без признаков заболевания (DFS) и общей выживаемости (OS). Термин «PFS», который также называют «временем до прогрессирования опухоли», относится к периоду времени, в течение которого в процессе лечения и после его завершения рак не развивается, и включает период времени, в течение которого пациенты проявляют CR или PR, а также период времени, в течение которого пациенты проявляют признаки стабилизации заболевания (SD). Термин «DFS» относится к периоду во время лечения и после его завершения, когда пациент остается свободным от заболевания. Термин «OS» относится к увеличению продолжительности жизни по сравнению с субъектами или пациентами, не получавшими лечения. В некоторых вариантах осуществления ответ на комбинацию по настоящему изобретению представляет собой любой из PR, CR
Термины «схема лечения», «протокол введения доз» и «схема введения доз» используются взаимозаменяемо для обозначения дозы и времени введения каждого терапевтического средства в комбинации по настоящему изобретению.
Термин «улучшение состояния» означает уменьшение интенсивности или облегчение одного или нескольких симптомов по сравнению с состоянием без введения терапевтического средства в соответствии со способом или схемой по настоящему изобретению. Термин «улучшение состояния» также включает сокращение или уменьшение продолжительности симптома.
Термин «эффективная доза» или «эффективное количество» лекарственного средства, соединения или фармацевтической композиции, когда используется в настоящем описании, означает количество, достаточное для одного или нескольких полезных или желательных эффектов, включая биохимические, гистологические и/или поведенческие симптомы заболевания, его осложнения и промежуточных патологических фенотипов, возникающих с развитием заболевания. Для терапевтического применения термин «терапевтически эффективное количество» относится к тому количеству вводимого соединения, которое в некоторой степени ослабит один или несколько симптомов расстройства, подлежащего лечению. Что касается лечения рака, терапевтически эффективное количество относится к количеству, которое обладает эффектом (1) уменьшения размера опухоли, (2) ингибирования (то есть замедления до некоторой степени, предпочтительно остановки) метастазирования опухоли, (3) ингибирования до некоторой степени (то есть замедление до некоторой степени, предпочтительно остановки) роста опухоли или инвазивности опухоли, (4) ослабления до некоторой степени (или, предпочтительно, устранение) одного или нескольких признаков или симптомов, связанных с раком, (5) снижения дозы других лекарственных средств, необходимых для лечения заболевания, и/или (6) усиления эффекта применения другого лекарства и/или задержки прогрессирования заболевания у пациентов. Эффективная доза может быть введена за один прием или в несколько приемов. Для целей данного изобретения эффективная доза лекарственного средства, соединения или фармацевтической композиции представляет собой количество, достаточное для осуществления профилактического или терапевтического лечения, прямо или опосредованно. В клиническом контексте понятно, что эффективная доза лекарственного средства, соединения или фармацевтической композиции может достигаться или не достигаться в комбинации с другим лекарственным средством, соединением или фармацевтической композицией.
Термин «опухоль», когда он применяется к субъекту, у которого диагностирован или предполагается рак, относится к злокачественному или потенциально злокачественному новообразованию ткани или массе ткани любого размера и включает первичные опухоли и вторичные новообразования. Солидная опухоль представляет собой аномальный рост ткани или аномальную массу ткани, которая обычно не содержит кист или жидких областей. Примерами солидных опухолей являются саркомы, карциномы и лимфомы. Лейкемия (рак крови) обычно не приводит к образованию солидных опухолей (National Cancer Institute, Dictionary of Cancer Terms).
Термины «масса опухоли» и «опухолевая нагрузка», относится к общему количеству опухолевого материала, распределенного по всему организму. Термин «опухолевая масса» относится к общему количеству раковых клеток или к общему размеру опухоли во всем организме, включая лимфатические узлы и костный мозг. Опухолевая масса может определяться различными методами, известными в данной области, такими как, например, использование каллипера (штангенциркуля), или определение опухолевой массы в организме с помощью визуализации, например ультразвуковым исследованием, сканированием костей, компьютерной томографией (КТ) или магнитно-резонансной томографией (МРТ).
Термин «размер опухоли» относится к общему размеру опухоли, который может быть измерен как длина и ширина опухоли. Размер опухоли может быть определен различными способами, известными в данной области, такими как, например, измерение размеров опухоли (опухолей) после удаления у субъекта, например с использованием штангенциркуля (каллипера), или в организме с использованием методов визуализации, например сканирования костей, УЗИ, КР (компьютерной рентгенографии) или МРТ.
Термин «аддитивный» используется для обозначения того, что результат действия комбинации двух соединений, компонентов или средств направленного действия не превышает результат суммарного действия каждого соединения, компонента или средства направленного действия, используемого в отдельности.
Термин «синергизм» или «синергический» используется для обозначения того, что результат действия комбинации двух соединений, компонентов или средств направленного действия больше суммарного результата действия каждого соединения, компонента или средства направленного действия, используемого в отдельности. Такое улучшение заболевания, состояния или расстройства, которое лечат, является «синергическим» эффектом. «Синергическое количество» представляет собой количество комбинации двух соединений, компонентов или средств направленного действия, которое приводит к эффекту, который определен как «синергетический».
Определяя синергетическое взаимодействие между одним или двумя компонентами, оптимальный диапазон эффекта и диапазоны абсолютных доз каждого компонента для достижения эффекта могут быть окончательно определены введением компонентов в различных дозах и/или в разных соотношениях доз пациентам, нуждающимся в лечение. Однако наблюдение синергии в моделях in vitro или in vivo может предсказывать синергический эффект у людей и других видов, и существуют модели in vitro или in vivo количественного определения синергического эффекта, которые описаны в настоящем документе. Результаты таких исследований также могут быть использованы для прогнозирования диапазонов эффективных доз и концентраций в плазме, а также абсолютных доз и концентраций в плазме, необходимых для людей и других видов, например методы фармакокинетики и/или фармакодинамики.
Термин «нестандартная клиническая схема введения доз», когда используется в настоящем документе, относится к схеме введения вещества, средства, соединения или композиции, которая отличается от количества, дозы или схемы, обычно используемых для этого вещества, средства, соединения или композиции в клинических условиях. Термин «нестандартный клиническая схема введения доз» включает «нестандартную клиническую дозу» или «нестандартная схема приема лекарства».
Используемый здесь термин «схема лечения с низкой дозой» относится к схеме введения дозы, где одно или несколько веществ, средств, соединений или композиций в схеме вводятся в меньшем количестве или в меньшей дозе, чем количество или доза, которые обычно используются в клинических условиях для этого средства, например, когда этот агент вводится как терапевтическое средство однократного введения.
Энхансер ингибитора гомолога-2 белка Zeste
Варианты осуществления настоящего изобретения включают ингибитор EZH2 или его фармацевтически приемлемую соль.
В настоящем документе термины «энхансер ингибитора гомолога-2 белка Zeste (EZH2)» и «ингибитор EZH2» используются взаимозаменяемо, и их следует понимать как относящиеся к ингибитору дикого типа и/или мутанту EZH2. Ингибиторы EZH2 могут быть определены способами, известными специалистам в данной области: так биологическая активность может быть определена с помощью ферментативного анализа EZH2, описанного, например, в публикации Kung, P.P. et al., J. Med. Chem., 2016, 59, 8306-8325.
Примеры специфических ингибиторов EZH2, которые могут применяться в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/IB2015/054272, опубликованной 23 декабря 2015 г. как WO 2015/193765, содержание которых включено в настоящее описание в виде ссылки. Приведенные примеры конкретных ингибиторов EZH2, применимых в качестве ингибитора EZH2 в соответствии с настоящим изобретением, включают, но без ограничения, ингибиторы EZH2, выбранные из группы, состоящей из следующих соединений:
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(R)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(S)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
или их фармацевтически приемлемые соли.
Другие примеры специфических ингибиторов EZH2, которые могут применяться в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/IB2013/060682, опубликованной 26 июня 2014 г. как WO 2014/097041, содержание которых включено в настоящее описание в виде ссылки. Приведенные в указанных публикациях примеры конкретных ингибиторов EZH2, применимых в качестве ингибитора EZH2 в соответствии с настоящим изобретением, включают, но без ограничения, модуляторы EZH2, выбранные из группы, состоящей из следующих соединений:
5-бром-8-хлор-2-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-(1,4-диметил-1H-1,2,3-триазол-5-ил)-3,4-дигидроизохинолин-1(2H)-он;
5,8-дихлор-7-(3,5-диметил-1,2-оксазол-4-ил)-2-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
или их фармацевтически приемлемые соли.
Другие примеры специфических ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/IB2013/058580, опубликованной 3 апреля 2014 г. как WO 2014/049488, содержание которых включено в настоящее описание в виде ссылки. Приведенные в указанных документах примеры конкретных ингибиторов EZH2, которые применимы в качестве ингибитора EZH2 в соответствии с настоящим изобретением, включают, но без ограничения, ингибиторы EZH2, выбранные из группы, состоящей из следующих соединений:
5-[2-(диметиламино)пирмидин-5-ил]-N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-2-метил-3-(1-метил-1H-пиразол-5-ил)бензамид;
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-2-метил-5-[2-(метиламино)пиримидин-5-ил]-3-(1-метил-1H-пиразол-5-ил)бензамид;
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-(1,4-диметил-1H-пиразол-5-ил)-2-метил-5-[2-(метиламино)пиридин-5-ил]бензамид;
5-(6-аминопиридин-3-ил)-N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-2-метил-3-(1-метил-1H-пиразол-5-ил)бензамид;
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-(1,4-диметил-1H-пиразол-5-ил)-2-метил-5-(2-морфолин-4-илпиримидин-5-ил)бензамид;
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-(1,4-диметил-1H-пиразол-5-ил)-2-метил-5-{2-[(1S,4S)-2-окса-5-азабицикло[2.2.1]гепт-5-ил]пиримидин-5-ил}бензамид;
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-(1,4-диметил-1H-пиразол-5-ил)-2-метил-5-{2-[3-окса-8-азабицикло[3.2.1]окт-8-ил]пиримидин-5-ил}бензамид;
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-(1,4-диметил-1H-пиразол-5-ил)-5-[2-(3-фторазетидин-1-ил)пиримидин-5-ил]-2-метилбензамид; и
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-2-метил-5-[6-(4-метилпиперазин-1-ил)пиридин-3-ил]-3-(1-метил-1H-пиразол-5-ил)бензамид;
или их фармацевтически приемлемые соли.
Другие примеры специфических ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/US2011/035336, опубликованной 10 ноября 2011 как WO 2011/140324, содержание которых включено в настоящее описание в виде ссылки.
Другие примеры специфических ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/US2011/035340, опубликованной 10 ноября 2011 как WO 2011/140325, содержание которых включено в настоящее описание в виде ссылки.
Другие примеры специфических ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/US2011/035344, опубликованной 12 января 2012 г. как WO 2012/005805, содержание которых включено в настоящее описание в виде ссылки.
Другие примеры специфических ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/US2012/058188, опубликованной 4 апреля 2013 г. как WO 2013/049770, содержание которых включено в настоящее описание в виде ссылки.
Другие примеры специфических ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/US2013/041115, опубликованной 21 ноября 2013 г. как WO 2013/173441, содержание которых включено в настоящее описание в виде ссылки.
Другие примеры конкретных ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, раскрытые в Международной заявке на патент PCT/US2011/051258, опубликованной 15 марта 2012 г. как WO 2012/034132, содержание которых включено в настоящее описание в виде ссылки.
Другие примеры специфических ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/US2012/026953, опубликованной 7 сентября 2012 г. как WO 2012/118812, содержание которых включено в настоящее описание в виде ссылки.
Другие примеры специфических ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/US2012/033648, опубликованной 18 октября 2012 г. как WO 2012/142504, содержание которых включено в настоящее описание в виде ссылки. Конкретные примеры ингибиторов EZH2, применимых в качестве ингибитора EZH2 в настоящем изобретении, включают
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-5-[этил(тетрагидро-2H-пиран-4-ил)амино]-4-метил-4'-(морфолин-4-илметил)бифенил-3-карбоксамид;
или его фармацевтически приемлемую соль.
Другие примеры специфических ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/US2012/033662, опубликованной 18 октября 2012 г. как WO 2012/142513, содержание которых включено в настоящее описание в виде ссылки.
Другие примеры специфических ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/US2011/061740, опубликованной 24 мая 2012 г. как WO 2012/068589, содержание которых включено в настоящее описание в виде ссылки.
Другие примеры специфических ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/US2013/025639, опубликованной 15 августа 2013 г. как WO 2013/120104, содержание которых включено в настоящее описание в виде ссылки.
Другие примеры специфических ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/US2014/015706, опубликованной 14 августа 2014 г. как WO 2014/124418, содержание которых включено в настоящее описание в виде ссылки.
Другие примеры специфических ингибиторов EZH2, применимых в настоящем изобретении, включают примеры, описанные в Международной заявке на патент PCT/US2013/0651 12, опубликованной 24 августа 2014 г. как WO 2014/062720, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:

5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/IB2015/054272, опубликованной 23 декабря 2015 г. как WO 2015/193765, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:
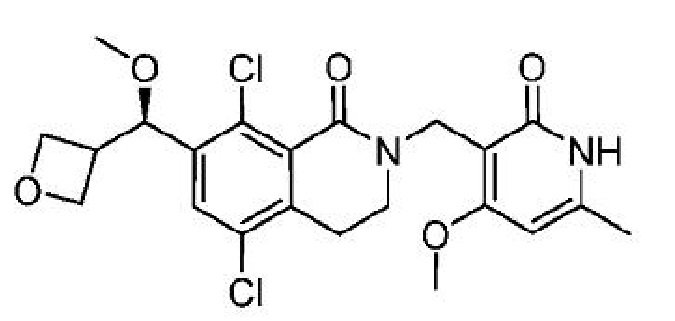
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(R)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/IB2015/054272, опубликованной 23 декабря 2015 г. как WO 2015/193765, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:
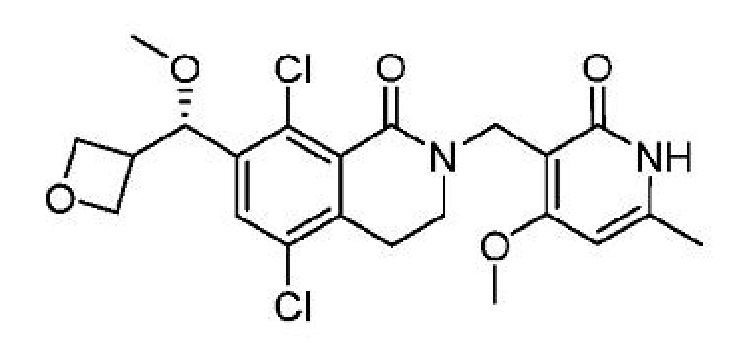
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(S)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/IB2015/054272, опубликованной 23 декабря 2015 г. как WO 2015/193765, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:

5-бром-8-хлор-2-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-(1,4-диметил-1H-1,2,3-триазол-5-ил)-3,4-дигидроизохинолин-1(2H)-он;
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/IB2013/060682, опубликованной 26 июня 2014 г. как WO 2014/097041, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:
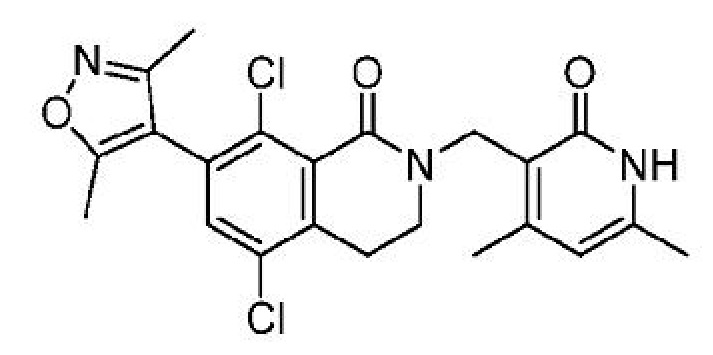
5,8-дихлор-7-(3,5-диметил-1,2-оксазол-4-ил)-2-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/IB2013/060682, опубликованной 26 июня 2014 г. как WO 2014/097041, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:
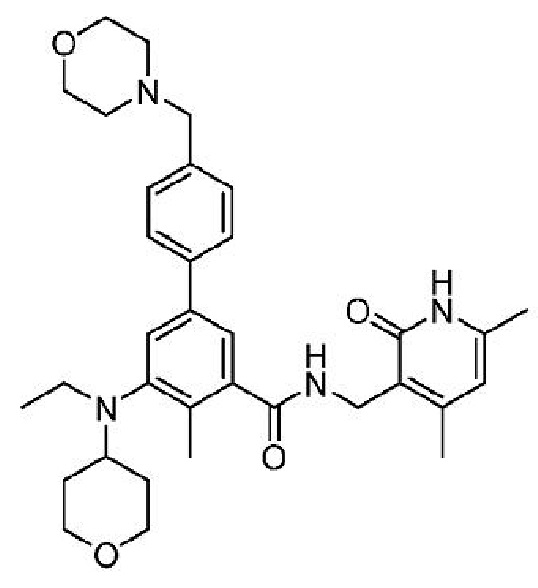
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-5-[этил(тетрагидро-2H-пиран-4-ил)амино]-4-метил-4'-(морфолин-4-илметил)бифенил-3-карбоксамид
или его фармацевтически приемлемую соль, также известный как таземетостат, EPZ-5687 или EPZ-6438, который описан в Международной заявке на патент PCT/US2012/033648, опубликованной 18 октября 2012 г. как WO 2012/142504, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой
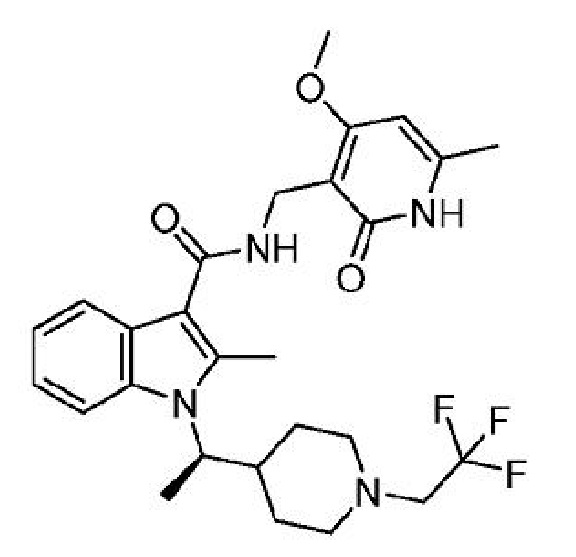
N-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-2-метил-1-[(1R)-1-[1-(2,2,2-трифторэтил)пиперидин-4-ил]этил]-1H-индол-3-карбоксамид-4-ил
или его фармацевтически приемлемую соль, также известный как CPI-1205, который раскрыт в Международной заявке на патент PCT/US2013/025639, опубликованной 15 августа 2013 г. как WO 2013/120104, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:
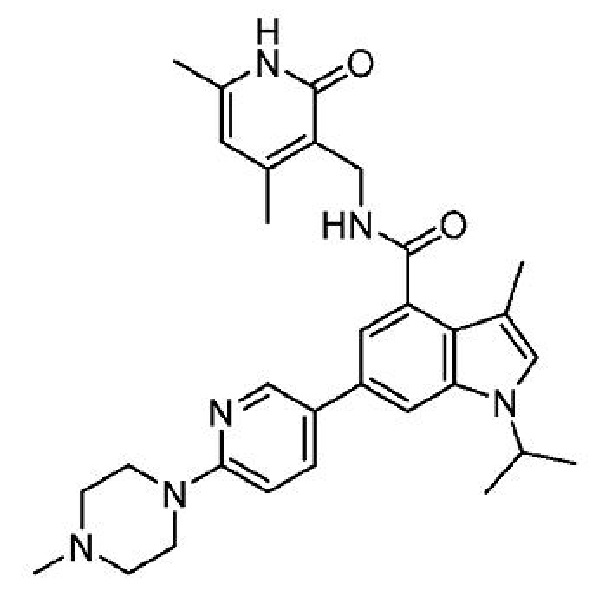
N-(4,6-диметил-2-оксо-1,2-дигидропиридин-3-илметил)-1-изопропил-3-метил-6-[6-(4-метилпиперазин-1-ил)пиридин-3-ил]-1H-индол-4-карбоксамид
или его фармацевтически приемлемую соль, также известный как GSK-503, который раскрыт в Международной заявке на патент PCT/US2011/035336, опубликованной 10 ноября 2011 г. как WO 2011/140324, содержание которых включено в настоящее описание в виде ссылке.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:
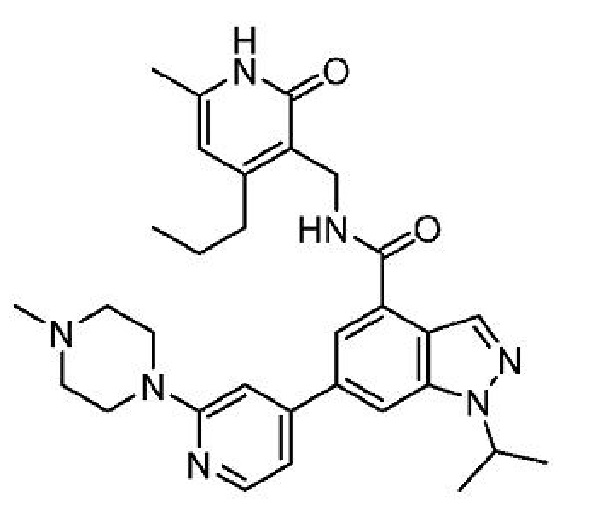
N-[(6-метил-2-оксо-4-пропил-1,2-дигидропиридин-3-ил)метил]-6-[2-(4-метилпиперазин-1-ил)пиридин-4-ил]-1-(пропан-2-ил)-1H-индазол-4-карбоксамид
или его фармацевтически приемлемую соль, также известный как GSK-126, который раскрыт в Международной заявке на патент PCT/US2011/035340, опубликованной 10 ноября 2011 г. как WO 2011/140325, содержание которых включено в настоящее описание в виде ссылке.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:
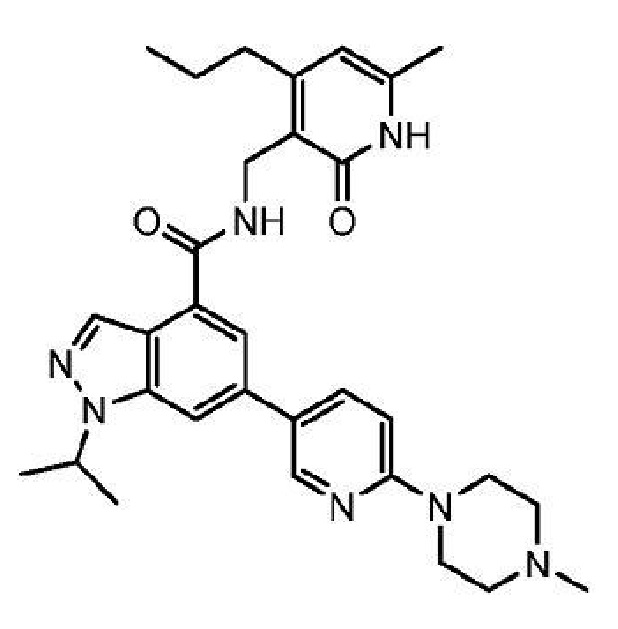
1-изопропил-N-(6-метил-2-оксо-4-пропил-1,2-дигидропиридин-3-илметил)-6-[6-(4-метилпиперазин-1-ил)пиридин-3-ил]-1H-индазол-4-карбоксамид
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/US2011/035340, опубликованной 10 ноября 2011 г. как WO 2011/140325, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:

3-хлор-4-[2-циано-3-(пиридазин-4-ил)фенокси]-N-(2,2,6,6-тетраметилпиперидин-4-ил)бензамид
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/US2011/061740, опубликованной 24 мая 2012 г. как WO 2012/068589, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:

5-хлор-N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(тетрагидро-2H-пиран-4-ил)амино]-2-метилбензамид
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/US2012/033662, опубликованной 18 октября 2012 г. как WO 2012/142513, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:
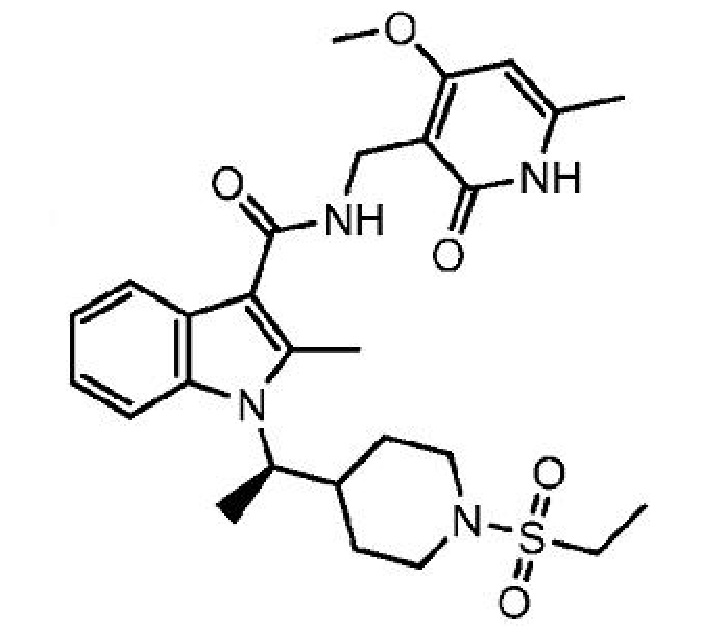
1-[(1R)-1-[1-(этилсульфонил)пиперидин-4-ил]этил]-N-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-2-метил-1H-индол-3-карбоксамид
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/US2013/025639, опубликованной 15 августа 2013 г. как WO 2013/120104, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой
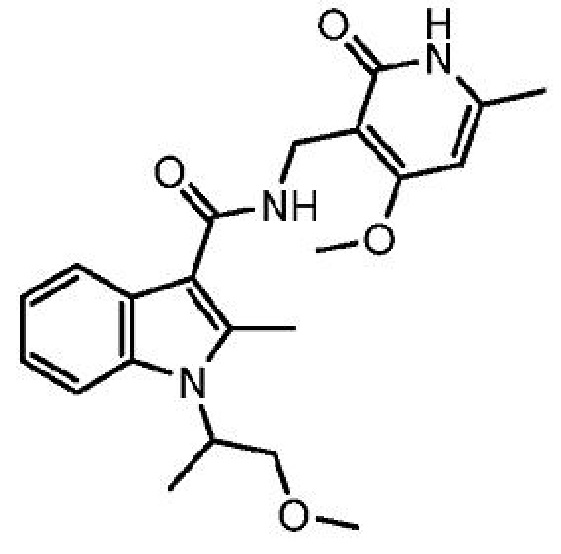
N-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-1-(1-метоксипропан-2-ил)-2-метил-1H-индол-3-карбоксамид
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/US2013/025639, опубликованной 15 августа 2013 г. как WO 2013/120104, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:
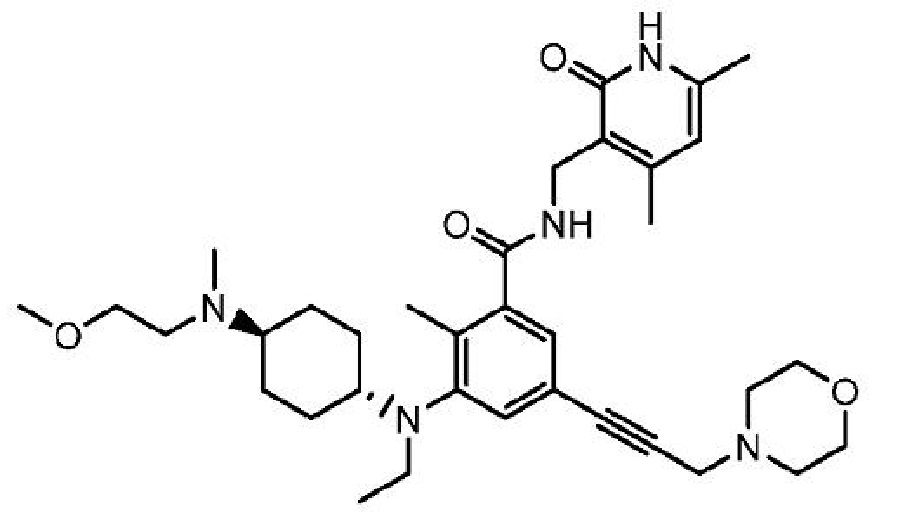
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-(этил[транс-4-[(2-метоксиэтил)(метил)амино]циклогексил]амино)-2-метил-5-[3-(морфолин-4-ил)проп-1-ин-1-ил]бензамид
или его фармацевтически приемлемую соль, необязательно в виде соли винной кислоты, который описан в Международной заявке на патент PCT/US2013/065112, опубликованной 24 апреля 2014 г. как WO 2014/062720, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой
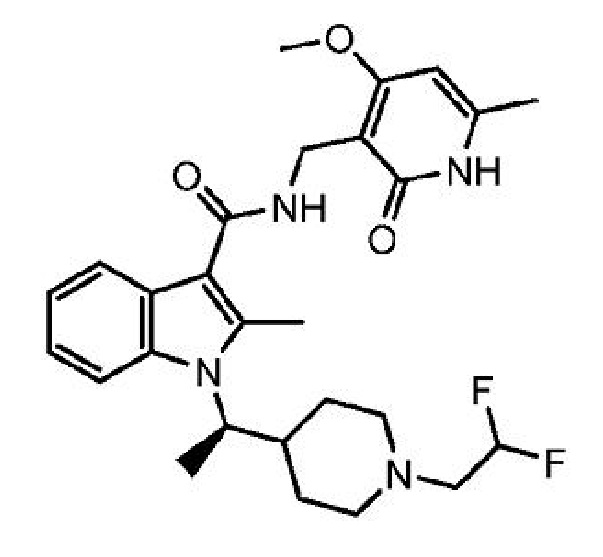
1-[(1R)-1-[1-(2,2-дифторэтил)пиперидин-4-ил]этил]-N-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-2-метил-1H-индол-3-карбоксамид
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/US2014/015706, опубликованной 14 августа 2014 г. как WO 2014/124418, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:
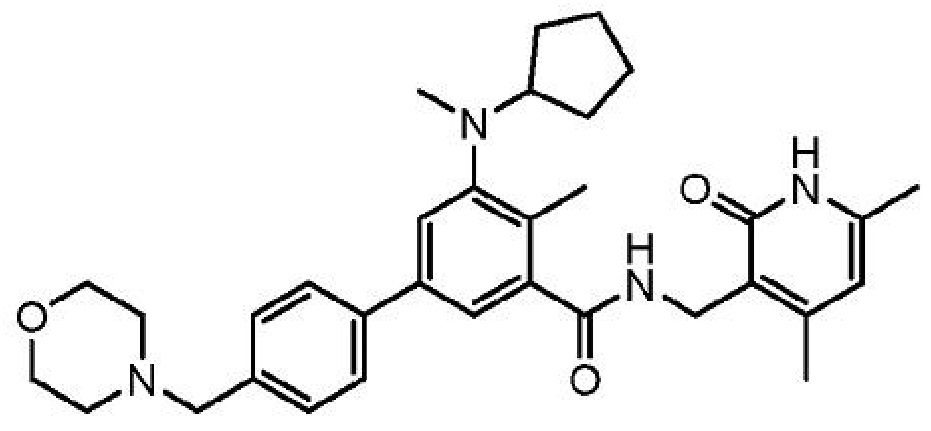
5-[циклопентил(метил)амино]-N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-4-метил-4'-[(морфолин-4-ил)метил][1,1'-бифенил]-3-карбоксамид
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/US2012/033648, опубликованной 18 октября 2012 г. как WO 2012/142504, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:
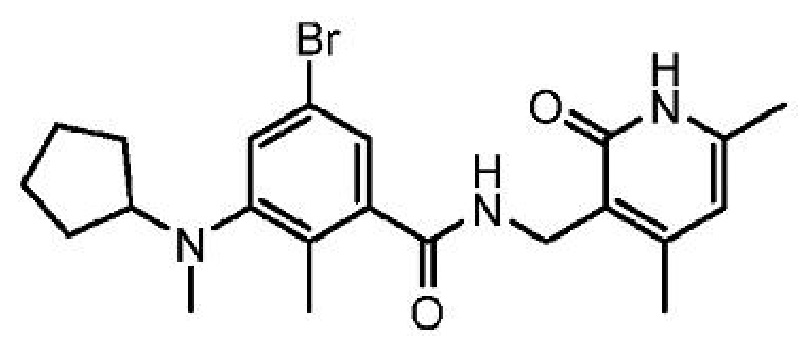
5-бром-3-[циклопентил(метил)амино]-N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-2-метилбензамид
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/US2012/033662, опубликованной 18 октября 2012 г. как WO 2012/142513, содержание которых включено в настоящее описание в виде ссылки.
В одном варианте осуществления ингибитор EZH2, применимый в соответствии с настоящим изобретением, представляет собой:
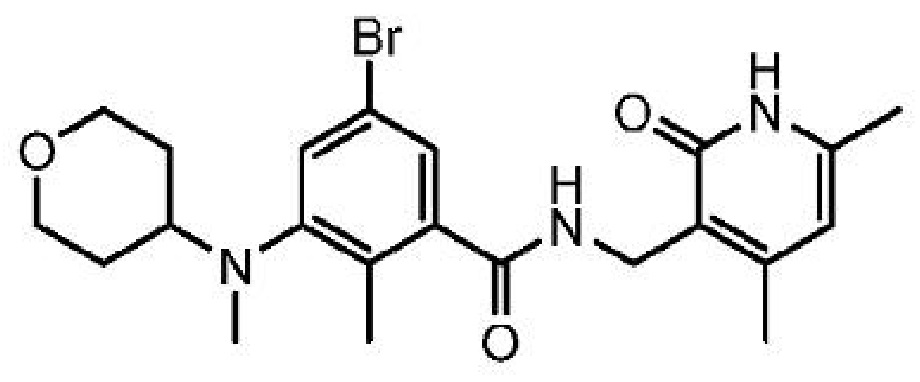
5-бром-N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-2-метил-3-[метил(оксан-4-ил)амино]бензамид
или его фармацевтически приемлемую соль, который описан в Международной заявке на патент PCT/US2012/033662, опубликованной 18 октября 2012 г. как WO 2012/142513, содержание которых включено в настоящее описание в виде ссылки.
Предпочтительные ингибиторы EZH2, применимые в соответствии с настоящим изобретением, выбраны из группы, состоящей из следующих соединений:
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(R)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(S)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
5-бром-8-хлор-2-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-(1,4-диметил-1H-1,2,3-триазол-5-ил)-3,4-дигидроизохинолин-1(2H)-он;
5,8-дихлор-7-(3,5-диметил-1,2-оксазол-4-ил)-2-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-5-[этил(тетрагидро-2H-пиран-4-ил)амино]-4-метил-4'-(морфолин-4-илметил)бифенил-3-карбоксамид;
N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-5-[этил(тетрагидро-2H-пиран-4-ил)амино]-4-метил-4'-(морфолин-4-илметил)бифенил-3-карбоксамид;
N-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-2-метил-1-[(1R)-1-[1-(2,2,2-трифторэтил)пиперидин-4-ил]этил]-1H-индол-3-карбоксамид;
N-(4,6-диметил-2-оксо-1,2-дигидропиридин-3-илметил)-1-изопропил-3-метил-6-[6-(4-метилпиперазин-1-ил)пиридин-3-ил]-1H-индол-4-карбоксамид;
N-[(6-метил-2-оксо-4-пропил-1,2-дигидропиридин-3-ил)метил]-6-[2-(4-метилпиперазин-1-ил)пиридин-4-ил]-1-(пропан-2-ил)-1H-индазол-4-карбоксамид;
или их фармацевтически приемлемые соли.
Более предпочтительные ингибиторы EZH2, применимые в соответствии с настоящим изобретением, выбраны из группы, состоящей из следующих соединений:
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(R)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он;
5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(S)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он; и
5-бром-8-хлор-2-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-(1,4-диметил-1H-1,2,3-триазол-5-ил)-3,4-дигидроизохинолин-1(2H)-он;
или их фармацевтически приемлемые соли.
Если не указано иное, все ссылки в настоящем документе на ингибиторы EZH2 включают ссылки на их фармацевтически приемлемые соли, сольваты, гидраты и комплексы, а также на сольваты, гидраты и комплексы их солей, включая полиморфы, стереоизомеры и их изотопно-меченные варианты.
Химиотерапевтические средства
Варианты осуществления настоящего изобретения относятся к химиотерапевтическим средствам или их фармацевтически приемлемым солям.
В одном варианте осуществления химиотерапевтическое средство представляет собой противоопухолевое средство на основе платины или его фармацевтически приемлемую соль.
В одном варианте осуществления настоящего изобретения химиотерапевтическое средство представляет собой цисплатин.
В одном варианте осуществления настоящего изобретения химиотерапевтическое средство представляет собой карбоплатин.
В одном варианте осуществления настоящего изобретения химиотерапевтическое средство представляет собой этопозид.
В одном варианте осуществления настоящего изобретения химиотерапевтическое средство представляет собой цисплатин и этопозид.
В одном варианте осуществления настоящего изобретения химиотерапевтическое средство представляет собой карбоплатин и этопозид.
Способы терапевтического лечения и терапевтическое применение
Способы и комбинированная терапия по настоящему изобретению могут применяться для лечения рака. В некоторых вариантах осуществления предоставленные способы приводят к одному или нескольким из следующих эффектов: (1) ингибирование пролиферации раковых клеток; (2) ингибирование инвазивности раковых клеток; (3) индуцирование апоптоза раковых клеток; (4) ингибирование метастазирования раковых клеток; (5) ингибирование ангиогенеза; или (6) преодоление одного или нескольких механизмов резистентности, связанных с лечением рака.
В одном варианте осуществления настоящее изобретение относится к способу лечения рака у субъекта, включающему введение субъекту комбинированной терапии, которая включает ингибитор EZH2 или его фармацевтически приемлемую соль и противоопухолевое лекарственное средство на основе платины или его фармацевтически приемлемую соль.
В одном варианте осуществления настоящее изобретение относится к способу лечения рака у субъекта, включающему введение субъекту комбинированной терапии, которая состоит из ингибитора EZH2 или его фармацевтически приемлемой соли и противоопухолевого средства на основе платины или его фармацевтически приемлемой соли.
В одном варианте осуществления настоящее изобретение относится к способу лечения рака у субъекта, включающему введение субъекту комбинированной терапии, которая по существу состоит из ингибитора EZH2 или его фармацевтически приемлемой соли и противоопухолевого средства на основе платины или его фармацевтически приемлемой соли.
В другом аспекте настоящее изобретение относится к ингибитору EZH2 или его фармацевтически приемлемой соли для применения в лечении рака у субъекта, где ингибитор EZH2 используется в комбинации с противоопухолевым средством на основе платины или его фармацевтически приемлемой солью.
В еще одном аспекте настоящее изобретение относится к противоопухолевому средству на основе платины или его фармацевтически приемлемой соли для применения в лечении рака у субъекта, где противоопухолевое средство используется в комбинации с ингибитором EZH2 или его фармацевтически приемлемой солью.
В еще одном аспекте настоящее изобретение относится к комбинации ингибитора EZH2 или его фармацевтически приемлемой соли и противоопухолевого средства на основе платины или его фармацевтически приемлемой соли.
В еще одном аспекте настоящее изобретение относится к комбинации ингибитора EZH2 или его фармацевтически приемлемой соли и противоопухолевого средства на основе платины или его фармацевтически приемлемой соли для применения в качестве лекарственного средства.
В еще одном аспекте настоящее изобретение относится к комбинации ингибитора EZH2 или его фармацевтически приемлемой соли и противоопухолевого средства на основе платины или его фармацевтически приемлемой соли для применения в лечении рака у субъекта.
В еще одном аспекте настоящее изобретение относится к синергической комбинации ингибитора EZH2 или его фармацевтически приемлемой соли и противоопухолевого средства на основе платины или его фармацевтически приемлемой соли.
В еще одном аспекте настоящее изобретение относится к синергической комбинации ингибитора EZH2 или его фармацевтически приемлемой соли и противоопухолевого средства на основе платины или его фармацевтически приемлемой соли для применения в качестве лекарственного средства.
В еще одном аспекте настоящее изобретение относится к синергетической комбинации ингибитора EZH2 или его фармацевтически приемлемой соли и противоопухолевого средства на основе платины или его фармацевтически приемлемой соли для применения в лечении рака у субъекта.
В еще одном аспекте настоящее изобретение относится к применению ингибитора EZH2 или его фармацевтически приемлемой соли и противоопухолевого средства на основе платины или его фармацевтически приемлемой соли в производстве лекарственного средства для лечения рака у субъекта.
В еще одном аспекте настоящее изобретение относится к фармацевтической композиции, включающей ингибитор EZH2 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель для применения в лечении рака у субъекта, где фармацевтическая композиция, включающая ингибитор EZH2, используется в комбинация с фармацевтической композицией, включающей противоопухолевое средство на основе платины или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
В еще одном аспекте настоящее изобретение относится к фармацевтической композиции, включающей противоопухолевое средство на основе платины или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель для применения в лечении рака у субъекта, где фармацевтическая композиция, включающая противоопухолевое средство на основе платины, используется в комбинации с фармацевтической композицией, включающей ингибитор EZH2 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
В еще одном аспекте настоящее изобретение относится к фармацевтической композиции, включающей ингибитор EZH2 или его фармацевтически приемлемую соль и противоопухолевое средство на основе платины или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, для применения в лечении рака у субъекта.
В одном варианте осуществления изобретения субъектом является млекопитающее.
В одном варианте осуществления изобретения субъектом является человек.
В некоторых вариантах осуществления способы и комбинации по настоящему изобретению могут применяться для лечения злокачественных новообразований, включая, без ограничения, следующие злокачественные новообразования:
злокачественные новообразования сердечно-сосудистой системы, например, сердца (саркома [ангиосаркома, фибросаркома, рабдомиосаркома, липосаркома], миксома, рабдомиома фиброма, липома и тератома), средостении и плевры и других внутригрудных органов, сосудистые опухоли и связанные с опухолью сосудистые ткани;
злокачественные новообразования дыхательных путей, например полости носа и среднего уха, придаточных пазух, гортани, трахеи, бронх и легкого, такие как мелкоклеточный рак легкого (SCLC), немелкоклеточный рак легкого (NSCLC), бронхогенный рак (плоскоклеточный, недифференцированный мелкоклеточный, недифференцированный крупноклеточный, аденокарцинома), альвеолярная (бронхиолярная) карцинома, аденома бронхов, саркома, лимфома, хондроматозная гамартома, мезотелиома;
злокачественные образования желудочно-кишечной системы, например, пищевода (плоскоклеточный рак, аденокарцинома, лейомиосаркома, лимфома), желудка (рак, лимфома, лейомиосаркома), рак желудочно-кишечного тракта, поджелудочной железы (протоковая аденокарцинома, инсулинома, глюкагонома, гастринома, карциноидные опухоли, випома) рак тонкого кишечника (аденокарцинома, лимфома, карциноидные опухоли, саркома Карпоши, лейомиома, гемангиома, липома, нейрофиброма, фиброма), рак толстой кишки (аденокарцинома, трубчатая аденома, ворсинчатая аденома, гамартома, лейомиома);
рак мочеполовой системы, например почки (аденокарцинома, опухоль Вильма [нефробластома], лимфома, лейкоз), мочевого пузыря и/или уретры (плоскоклеточный рак, переходно-клеточный рак, аденокарцинома), предстательной железы (аденокарцинома, саркома), семенников (семинома, тератома, эмбриональный рак, тератокарцинома, хориокарцинома, саркома, опухоль из интерстициальных клеток, фиброма, фиброаденома, аденоматоидные опухоли, липома);
рак печени, например гепатома (гепатоцеллюлярная карцинома), холангиокарцинома, гепатобластома, ангиосаркома, гепатоцеллюлярная аденома, гемангиома, эндокринные опухоли поджелудочной железы (такие как феохромоцитома, инсулинома, опухоль вазоактивных интестинальных пептидов, опухоль островков поджелудочной железы и глюкагонома);
рак кости, например остеогенная саркома (остеосаркома), фибросаркома, злокачественная фиброзная гистиоцитома, хондросаркома, саркома Юинга, злокачественная лимфома (ретикулярно-клеточная саркома), множественная миелома, гигантоклеточная саркома, хордома опухолевых клеток, остеохондрома (костно-хрящевые экзостозы), доброкачественная хондрома, хондробластома, хондромиксофиброма, остеоидная остеома и гигантоклеточные опухоли;
рак нервной системы, например, новообразования центральной нервной системы (ЦНС), первичная лимфома ЦНС, рак черепа (остеома, гемангиома, гранулема, ксантома, деформирующий остеит), менинги (менингиома, менингиосаркома, глиоматоз), рак головного мозга (астроцитома, медуллобластома, глиома, эпендимома, герминома [пинеалома], мультиформная глиобластома, олигодендроглиома, шванома, ретинобластома, врожденные опухоли), нейрофиброма спинного мозга, менингиома, глиома, саркома;
новообразования репродуктивной системы, например гинекологические, матки (карцинома эндометрия), шейки матки (рак шейки матки, предопухолевая дисплазия шейки матки), яичников (рак яичника [серозная цистаденокарцинома, слизистая цистаденокарцинома, неклассифицированная карцинома], гранулезно-текальные опухоли, опухоли из клеток Сертоли, дисгерминома, злокачественная тератома), вульвы (плоскоклеточная карцинома, интраэпителиальная карцинома, аденокарцинома, фибросаркома, меланома), влагалища (светлоклеточная карцинома, плоскоклеточная карцинома, ботриоидная саркома (эмбриональная рабдомиосаркома)), маточных труб (карцинома) и другие сайты женских половых органов, плаценты, пениса, предстательной железы, яичек и других сайтов мужских половых органов;
рак кроветворной системы, например крови (миелоидный лейкоз [острый и хронический], острый лимфобластный лейкоз, хронический лимфолейкоз, миелопролиферативные заболевания, множественная миелома, миелодиспластический синдром), болезнь Ходжкина, неходжкинская лимфома [злокачественная лимфома];
рак ротовой полости, например губы, языка, десны, диафрагмы полости рта, неба и других частей рта, примерноушной слюнной железы и другие частей слюнных желез, миндалин, ротоглотки, носоглотки, грушевидного синуса, гортаноглотки и других участков сайтов губы, полости рта и глотки;
рак кожи, например злокачественная меланома, кожная меланома, базальноклеточный рак, плоскоклеточный рак, саркома Карпоши, дисплазия родинок, липома, ангиома, дерматофиброма и келоиды;
рак надпочечников: нейробластома; и
рак других тканей, включая соединительную и мягкую ткань, забрюшинного пространства и брюшины, глаз, внутриглазная меланома и рак придатов, груди, головы или шеи, анальной области, щитовидной железы, примернощитовидной железы, надпочечников и других эндокринных желез и связанных с ними структур, вторичные и неуточненные злокачественные новообразования лимфатических узлов, вторичные злокачественные новообразования дыхательной и пищеварительной систем и вторичные злокачественные новообразования других сайтов.
Еще более конкретно, примеры термина «рак», который используется в описании в связи с настоящим изобретением, включают рак, выбранный из рака легких (NSCLC и SCLC), рака молочной железы (включая тройной негативный рак молочной железы, гормон-положительный рак молочной железы и HER2-положительный рак молочной железы), рака яичников, рака толстой кишки, рака прямой кишки, рака анальной области, рака предстательной железы (включая гормоночувствительный рак предстательной железы и гормонорезистентный рак предстательной железы, также известный как кастрационно-резистентный рак предстательной железы), гепатоцеллюлярной карциномы, диффузной В-крупноклеточной лимфомы, фолликулярной лимфомы, меланомы или комбинации одного или нескольких из вышеуказанных видов рака.
В одном варианте осуществления изобретения рак представляет собой солидную опухоль.
В одном варианте осуществления рак представляет собой рак предстательной железы.
В одном варианте осуществления рак представляет собой гормоночувствительный рак предстательной железы.
В одном варианте осуществления рак представляет собой кастрационно-резистентный рак предстательной железы, также известный как гормонально-рефрактерный рак предстательной железы или андрогеннезависимый рак предстательной железы.
В одном варианте осуществления рак представляет собой неметастатический кастрационно-резистентный рак предстательной железы.
В одном варианте осуществления рак представляет собой метастатический кастрационно-резистетный рак предстательной железы.
В одном варианте осуществления рак представляет собой рак молочной железы.
В одном варианте осуществления рак представляет собой трижды негативный рак молочной железы.
В одном варианте осуществления рак представляет собой гормон-положительный рак молочной железы, включая эстроген-положительный и/или прогестерон-положительный рак молочной железы.
В одном варианте осуществления рак представляет собой HER2-положительный рак молочной железы.
В одном варианте осуществления рак представляет собой гепатоцеллюлярную карциному.
В одном варианте осуществления рак представляет собой мелкоклеточный рак легкого.
В одном варианте осуществления рак представляет собой рефрактерный мелкоклеточный рак легкого.
В одном варианте осуществления рак представляет собой рецидивирующий мелкоклеточный рак легкого.
В одном варианте осуществления рак представляет собой рефрактерный мелкоклеточный рак легкого, и субъект является пациентом, ранее не получавшим лечение.
В одном варианте осуществления рак представляет собой рецидивирующий мелкоклеточный рак легкого, и субъект является пациентом, ранее не получавшим лечение.
В одном варианте осуществления рак представляет собой мелкоклеточный рак легкого, который классифицирован как заболевание локализованной стадии.
В одном варианте осуществления рак представляет собой мелкоклеточный рак легкого, который классифицирован как заболевание распространенной стадии.
В одном варианте осуществления рак представляет собой распространенный мелкоклеточный рак легкого, и субъект является пациентом, ранее не получавшим лечение.
В одном варианте осуществления рак представляет собой рефрактерный распространенный мелкоклеточный рак легкого, и субъект является пациентом, ранее не получавшим лечение.
В одном варианте осуществления рак представляет собой рецидивирующий распространенный мелкоклеточного рака легкого, и субъект является пациентом, ранее не получавшим лечение.
В одном варианте осуществления рак представляет собой мелкоклеточный рак легкого, который характеризуется потерей функции онкосупрессора TP53.
В одном варианте осуществления рак представляет собой мелкоклеточный рак легкого, который характеризуется потерей функции онкосупрессора RB1.
В одном варианте осуществления рак представляет собой мелкоклеточный рак легкого, который характеризуется потерей функции онкосупрессора TP53 и потерей функции онкосупрессора RB1.
В одном варианте осуществления рак представляет собой мелкоклеточный рак легкого, который классифицирован как заболевание локализованной стадии и который характеризуется потерей функции онкосупрессора TP53.
В одном варианте осуществления рак представляет собой мелкоклеточный рак легкого, который классифицирован как заболевание локализованной стадии и характеризуется потерей функции онкосупрессора RB1.
В одном варианте осуществления рак представляет собой мелкоклеточный рак легкого, который классифицирован как заболевание локализованной стадии и характеризуется потерей функции онкосупрессора TP53 и потерей функции онкосупрессора RB1.
В одном варианте осуществления рак представляет собой мелкоклеточный рак легкого, который классифицирован как заболевание распространенной стадии и характеризуется потерей функции онкосупрессора TP53.
В одном варианте осуществления рак представляет собой мелкоклеточный рак легкого, который классифицирован как заболевание распространенной стадии и характеризуется потерей функции онкосупрессора RB1.
В одном варианте осуществления рак представляет собой мелкоклеточный рак легкого, который классифицирован как заболевание распространенной стадии и характеризуется потерей функции онкосупрессора TP53 и потерей функции онкосупрессора RB1.
В одном варианте осуществления рак представляет собой диффузную В-крупноклеточную лимфому.
В одном варианте осуществления рак представляет собой фолликулярную лимфому.
В одном варианте осуществления рак представляет собой меланому.
В одном варианте осуществления рак является ограниченно распространенным.
В одном варианте осуществления рак является неметастатическим.
В одном варианте осуществления рак является метастатическим.
В одном варианте осуществления рак является рефрактерным.
В одном варианте осуществления рак является рецидивирующим.
В одном варианте осуществления рак невозможно лечить стандартными способами лечения.
В другом аспекте изобретение относится к способу ингибирования пролиферации раковых клеток у субъекта, включающему введение субъекту комбинированной терапии, которая включает ингибитор EZH2 или его фармацевтически приемлемую соль и противоопухолевое лекарственное средство на основе платины или его фармацевтически приемлемую соль, в количестве, эффективном для ингибирования пролиферации клеток.
В еще одном аспекте настоящее изобретение относится к способу ингибирования инвазивности раковых клеток у субъекта, включающему введение субъекту комбинированной терапии, которая включает ингибитор EZH2 или его фармацевтически приемлемую соль и противоопухолевое лекарственное средство на основе платины или его фармацевтически приемлемую соль, в количестве, эффективном для ингибирования инвазивности клеток.
В еще одном аспекте изобретение относится к способу ингибирования метастазирования раковых клеток у субъекта, включающему введение субъекту комбинированной терапии, которая включает ингибитор EZH2 или его фармацевтически приемлемую соль и противоопухолевое лекарственное средство на основе платины или его фармацевтически приемлемую соль, в количестве, эффективном для ингибирования метастазирования клеток.
В другом аспекте изобретение относится к способу индуцирования апоптоза в раковых клетках у субъекта, включающему введение субъекту комбинированной терапии, которая включает ингибитор EZH2 или его фармацевтически приемлемую соль и противоопухолевое лекарственное средство на основе платины или его фармацевтически приемлемую соль, в количестве, эффективном для индукцирования апоптоза.
В дополнительном аспекте изобретение относится к способу индукцирования апоптоза у субъекта, включающему введение субъекту комбинированной терапии, которая включает ингибитор EZH2 или его фармацевтически приемлемую соль и противоопухолевое лекарственное средство на основе платины или его фармацевтически приемлемую соль.
Термин «контактирование» относится к приведению в контакт соединения, используемого в настоящем изобретении, или его фармацевтически приемлемой соли и клетки (например, клетки, экспрессирующей EZH2) таким образом, что соединение может проявлять свое действие (например, влиять на активность EZH2), прямо или опосредованно. Контактирование может осуществляться in vitro (т.е. в искусственной среде, например, но без ограничения, в пробирке или культуральной среде) или in vivo (то есть в живом организме, таком как, но без ограничения, мышь, крыса или кролик).
В некоторых вариантах осуществления клетки относятся к клеточной линии, такой как линия раковых клеток. В других вариантах осуществления клетки находятся в ткани или опухоли, а ткань или опухоль могут находиться у субъекта, включая человека.
Лекарственные формы и схемы
Каждое терапевтическое средство в способах применения и комбинированной терапии по настоящему изобретению может вводиться либо само по себе или в лекарственной форме (также называемой в настоящем описании фармацевтической композицией), которая включает терапевтическое средство и один или несколько фармацевтически приемлемых носителей, эксципиентов или разбавителей, в соответствии с фармацевтической практикой.
Термин «комбинированная терапия», когда используется в настоящем описании, относится к введению каждого терапевтического средства комбинированной терапии по настоящему изобретению, отдельно или в форме лекарственного средства, последовательно, одновременно или совместно.
Термин «последовательный» или «последовательно», когда используется в настоящем описании, относится к введению каждого терапевтического средства комбинированной терапии по настоящему изобретению, отдельно или в лекарственной форме, одного за другим, где каждое терапевтическое средство можно вводить в любом порядке. Последовательное введение особенно полезно, когда терапевтические средства комбинированной терапии находятся в разных лекарственных формах, например, одно средство представляет собой таблетку, а другое средство представляет собой стерильную жидкость, и/или вводятся в соответствии с разными схемами лечения, например одно средство вводится ежедневно, а второе средство вводится реже, например раз в неделю.
Термин «одновременно», когда используется в настоящем описании, относится к введению каждого терапевтического средства комбинированной терапии по настоящему изобретению отдельно или в отдельных лекарственных форма, где второе терапевтическое средство вводится сразу после первого терапевтического средства, но терапевтические средства могут вводиться в любом порядке. В предпочтительном варианте осуществления терапевтические средства вводятся одновременно.
Термин «совместно», когда используется в настоящем описании, относится к введению каждого терапевтического средства комбинированной терапии по настоящему изобретению в одной и той же лекарственной форме.
В одном варианте осуществления настоящего изобретения ингибитор EZH2 или его фармацевтически приемлемую соль вводят перед введением противоопухолевого средства на основе платины или его фармацевтически приемлемой соли.
В одном варианте осуществления настоящего изобретения противоопухолевое средство основе платины или его фармацевтически приемлемую соль вводят перед введением ингибитора EZH2 или его фармацевтически приемлемой соли.
В одном варианте осуществления настоящего изобретения ингибитор EZH2 или его фармацевтически приемлемую соль вводят одновременно с противоопухолевым агентом на основе платины или его фармацевтически приемлемой солью.
В одном варианте осуществления настоящего изобретения ингибитор EZH2 или его фармацевтически приемлемую соль вводят совместно с противоопухолевым агентом на основе платины или его фармацевтически приемлемой солью.
Специалистам в данной области будет понятно, что комбинированная терапия может эффективно вводиться субъекту на различных этапах его лечения.
В одном варианте осуществления настоящего изобретения комбинированную терапию вводят субъекту, который ранее не подвергался лечению, т.е. является ранее не получал лечение.
В одном варианте осуществления настоящего изобретения комбинированную терапию вводят субъекту, у которого не достигнут устойчивый ответ после проводимого ранее терапевтического лечения биотерапевтическим или химиотерапевтическим средством, т.е. субъекту, который имеет опыт лечения.
Комбинированная терапия может вводиться до операции по удалению опухоли и/или может использоваться до, во время или после лучевой терапии и/или может использоваться до, во время или после химиотерапии.
Введение соединений по настоящему изобретению может осуществляться любым способом, который позволяет доставлять соединения к сайту действия. Эти способы включают пероральные способы, интрадуоденальные способы, парентеральную инъекцию (включая внутривенную, подкожную, внутримышечную, внутрисосудистую инъекцию или инфузию), местное и ректальное введение.
Схемы приема терапевтического средства могут корректироваться для обеспечения оптимального желаемого ответа. Например, терапевтическое средство комбинированной терапии по настоящему изобретению может вводиться в виде одного болюса, в виде нескольких разделенных доз, вводимых по времени, или дозу можно пропорционально уменьшать или увеличивать в зависимости от терапевтической ситуации. Может быть особенно выгодно приготавливать терапевтическое средство в лекарственной форме стандартной дозы для простоты и равномерного введения. Лекарственная форма стандартной дозы, когда используется в соответствии с настоящим изобретением, относится к физически дискретным единицам, подходящим в качестве разовой дозы для млекопитающих, подлежащих лечению; каждая разовая доза содержит заданное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Спецификация лекарственных форм стандартной дозы по настоящему изобретению может быть определена и напрямую зависеть от (а) уникальных характеристик химиотерапевтического агента и конкретного терапевтического или профилактического эффекта, который должен быть достигнут, и (b) ограничений, присущих уровню техники получения препарата такого активного соединения для лечения чувствительности у отдельных людей.
Таким образом, специалисту в данной области техники должно быть понятно, исходя из раскрытия, приведенного в настоящем документе, что доза и схема лечения корректируются в соответствии со способами, хорошо известными в данной области терапии. То есть максимально допустимая доза может быть легко установлена, и может быть определено эффективное количество, обеспечивающее заметное полезное терапевтическое действие для субъекта, а также временные требования для введения каждого средства для обеспечения заметного полезного терапевтического действия для субъекта. Соответственно, хотя определенные схемы введения терапевтических средств и способы введения приведены здесь в качестве примеров, эти примеры никоим образом не ограничивают дозу и схему введения, которые могут быть назначены субъекту при осуществлении настоящего изобретения.
Следует отметить, что значения доз могут изменяться в зависимости от типа и тяжести состояния, которое должно быть облегчено, и могут включать однократную или множественные дозы. Кроме того, следует иметь в виду, что для любого конкретного субъекта конкретные схемы введения доз должны корректироваться с течением времени в соответствии с индивидуальной потребностью и профессиональным суждением лица, определяющего или контролирующего введение композиций, принимая во внимание такие факторы, как степень тяжести расстройства или состояния, скорость введения, активность соединения и мнение лечащего врача. Диапазоны доз, представленные в настоящем документе, являются только примерными и не предназначены для ограничения объема или практики применения заявленной композиции. Например, дозы могут быть скорректированы на основе фармакокинетических или фармакодинамических параметров, которые могут включать клинические эффекты, такие как токсические эффекты и/или лабораторные показатели. Таким образом, настоящее изобретение охватывает повышение дозы для введения пациенту, определяемое специалистом в данной области. Определение подходящих доз и схем введения химиотерапевтического агента хорошо известно в соответствующей области техники и должно быть понятно специалисту в данной области после изучения настоящего изобретения.
В некоторых вариантах осуществления по меньшей мере одно из терапевтических средств в комбинированной терапии вводят с использованием такой же схемы введения доз (дозы, частоты введения и продолжительности лечения), которая обычно используется, когда средство используется в качестве монотерапии для лечения того же вида рака. В других вариантах субъект получает меньшее общее количество по меньшей мере одного из терапевтических средств в комбинированной терапии, чем при применении указанного средства в качестве монотерапии, например более низкую дозу терапевтического средства, меньшую частоту дозирования и/или или меньшую продолжительность лечения.
Эффективная доза ингибитора EZH2 или его фармацевтически приемлемой соли находится в интервале от примерно 0,001 до примерно 100 мг на кг массы тела в день, предпочтительно от примерно 1 до примерно 35 мг/кг/день, в виде одной дозы или в виде разделенных дозы. Для человека массой 70 кг она составляет от примерно 0,01 до примерно 7 г/день, предпочтительно от примерно 0,02 до примерно 2,5 г/день. В некоторых случаях уровни доз ниже нижнего предела вышеупомянутого диапазона могут быть адекватными, в то время как в других случаях могут использоваться большие дозы, не вызывающие какого-либо вредного побочного эффекта при условии, что такие большие дозы делятся на несколько небольших доз для введения в течение дня.
В одном варианте осуществления ингибитор EZH2 или его фармацевтически приемлемую соль вводят в суточной дозе от примерно 10 до примерно 7000 мг в день, предпочтительно от примерно 20 до примерно 2500 мг в день, более предпочтительно от примерно 50 до 1000 мг в день. В одном варианте осуществления ингибитор EZH2 или его фармацевтически приемлемую соль вводят в суточной дозе примерно 500 мг в день.
В предпочтительном варианте осуществления ингибитор EZH2, который представляет собой 5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(R)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он или его фармацевтически приемлемую соль, вводят в суточной дозе от примерно 50 мг до примерно 2000 мг в день, в дозе примерно 50 мг в день, примерно 100 мг в день, примерно 150 мг в день, примерно 200 мг в день, примерно 250 мг в день, примерно 300 мг в день, примерно 350 мг в день, примерно 400 мг в день, примерно 450 мг в день, примерно 500 мг в день, примерно 550 мг в день, примерно 600 мг в день, примерно 650 мг в день, примерно 700 мг в день, примерно 750 мг в день, примерно 800 мг в день, примерно 850 мг в день, примерно 900 мг в день, примерно 950 мг в день примерно 1000 мг в день, примерно 1100 мг в день, примерно 1200 мг в день, примерно 1300 мг в день, примерно 1400 мг в день или примерно 1500 мг в день. Эту дозу необязательно можно разделить на небольшие дозы, например, дозу 150 мг в день можно вводить как дозу 75 мг два раза в день.
В одном варианте осуществления химиотерапевтическое средство представляет собой этопозид, причем этопозид вводят внутривенно в соответствии с утвержденной инструкцией, например в дозе от 50 до 100 мг/м2 один раз в день в дни с 1 по 5; или от 5 до 100 мг/м2 2 раза в день в дни 1, 3 и 5. В одном примере этопозид можно вводить в дозе от 80 до 120 мг/м2 в дни 1, 2 и 3 каждого 21-дневной цикла для 1, 2, 3, 4, 5 или 6 циклов. В одном варианте осуществления химиотерапевтическое средство (например, этопозид) используется в комбинации с противоопухолевым средством на основе платины (например, циспатином или карбоплатином).
В одном варианте осуществления противоопухолевое средство на основе платины представляет собой цисплатин, который вводят внутривенно в соответствии с утвержденной инструкцией. В одном примере цисплатин можно вводить в дозе 60-80 мг/м2в 1-й день каждого 21-дневного цикла в течение 1, 2, 3, 4, 5, или 6 циклов.
В одном варианте осуществления противоопухолевое средство на основе платины представляет собой карбоплатин, который вводят внутривенно в соответствии с утвержденной инструкцией. В одном примере карбоплатин можно вводить для достижения начальной целевой AUC 5-6 мг/мл/мин. в 1-й день каждого 21-дневного цикла в течение 1, 2, 3, 4, 5 или 6 циклов. В одном примере карбоплатин можно вводить в дозе 400 мг/м2в 1-й день каждого 21-дневного цикла в течение 1, 2, 3, 4, 5 или 6 циклов.
Для достижения желаемого эффекта лечения при необходимости может проводиться повторение введения или схемы лечения либо корректировка введения или схемы лечения. Термин «схема непрерывного дозирования», используемый в настоящем документе, представляет собой введение или режим дозирования без прерываний дозы, например, без выходных дней в лечении. Повторение 21- или 28-дневных циклов лечения без перерывов между циклами лечения является примером непрерывного режима дозирования. В одном варианте осуществления соединения комбинации по настоящему изобретению могут вводиться в режиме непрерывного дозирования.
В одном варианте осуществления настоящего изобретения ингибитор EZH2 или его фармацевтически приемлемая соль и противоопухолевое средство на основе платины или его фармацевтически приемлемая соль дозируются в количествах, которые вместе эффективны в лечении рака.
В одном варианте осуществления настоящего изобретения ингибитор EZH2 или его фармацевтически приемлемая соль и противоопухолевое средство на основе платины или его фармацевтически приемлемая соль дозируются в количествах, которые вместе являются синергетическими.
В одном варианте осуществления настоящего изобретения ингибитор EZH2 или его фармацевтически приемлемая соль и противоопухолевое средство на основе платины или его фармацевтически приемлемая соль дозируются в нестандартном режиме дозирования.
В одном варианте осуществления настоящего изобретения ингибитор EZH2 или его фармацевтически приемлемая соль и противоопухолевое средство на основе платины или его фармацевтически приемлемая соль дозируются в режиме низких доз.
Фармацевтические композиции и способы введения
Термин «фармацевтическая композиция» относится к смеси одного или нескольких терапевтических средств, описанных в настоящем документе, или их фармацевтически приемлемых солей, сольватов, гидратов или пролекарств в качестве активного ингредиента и по меньшей мере одного фармацевтически приемлемого носителя или наполнителя. В некоторых вариантах осуществления фармацевтическая композиция включает два или большее количество фармацевтически приемлемых носителей и/или наполнителей.
Термин «фармацевтически приемлемый носитель», когда используется в настоящем описании, относится к носителю или разбавителю, который не вызывает значительного раздражения в организме и не подавляет биологическую активность и свойства активного соединения или терапевтического средства.
В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей ингибитор EZH2 или его фармацевтически приемлемую соль и противоопухолевое лекарственное средство на основе платины или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Фармацевтически приемлемый носитель может включать любой обычный фармацевтический носитель или эксципиент. Выбор носителя и/или эксципиента будет в значительной степени зависеть от таких факторов, как конкретный способ введения, влияние эксципиента на растворимость и стабильность и природа лекарственной формы.
Подходящие фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители (такие как гидраты и сольваты). Фармацевтические композиции могут, если желательно, содержать дополнительные ингредиенты, такие как вкусовые добавки, связующие вещества, наполнители и т.п. Таким образом, в таблетках для перорального введения различные эксципиенты, такие как лимонная кислота, могут использоваться вместе с различными дезинтегрирующими добавками, такими как крахмал, альгиновая кислота и некоторые сложные силикаты, и связующими агентами, такими как сахароза, желатин и акация. Примеры эксципиентов, но без ограничения, включают карбонат кальция, фосфат кальция, различные сахара и различные типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли. Кроме того, для получения таблеток часто используются смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа также могут использоваться в мягких и твердых желатиновых капсулах. Таким образом, неограничивающие примеры материалов включают лактозу или молочный сахар и полиэтиленгликоли с высокой молекулярной массой. Когда для перорального введения желательны водные суспензии или эликсиры, активное соединение в них может быть объединено с различными подсластителями или вкусовыми добавками, пигментами или красителями и, если желательно, эмульгаторами или суспендирующими агентами, а также с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их комбинации.
Фармацевтическая композиция может быть представлена, например, в форме для перорального введения в виде таблетки, капсулы, пилюли, порошка, композиции с контролируемым высвобождением действующего вещества, раствора или суспензии, в форме для парентерального введения в виде стерильного раствора, суспензии или эмульсии, в форме для местного применения в виде мази или крема или в форме для ректального введения в виде суппозитория.
Типичные формы для парентерального введения включают растворы или суспензии активного соединения в стерильном водном растворе, например, в водных растворах пропиленгликоля или декстрозы. Такие лекарственные формы могут быть подходящим образом буферизованы, если желательно.
Фармацевтическая композиция может быть представлена в лекарственной форме стандартной дозы, подходящей для однократного введения точных количеств.
Фармацевтические композиции, подходящие для доставки терапевтических средств комбинированной терапии по настоящему изобретению, и способы их получения будут очевидны для специалистов в данной области. Такие композиции и способы их получения можно найти, например, в ‘Remington’s Pharmaceutical Sciences’, 19th Edition (Mack Publishing Company, 1995), содержание которого полностью включено в настоящий документ в виде ссылки.
Терапевтические средства комбинированной терапии по настоящему изобретению могут вводиться перорально. Пероральное введение может включать глотание, при котором терапевтическое средство попадает в желудочно-кишечный тракт, или может применяться буккальное или подъязычное введение, при котором терапевтическое средство поступает в кровоток непосредственно из ротовой поости.
Препараты, подходящие для перорального введения, включают твердые препараты, такие как таблетки, капсулы, содержащие частицы, жидкости или порошки, пастилки (включая наполненные жидкостью), жевательные таблетки, мульти- и наночастицы, гели, твердые растворы, липосомы, пленки (включая адгезивные к слизистым оболочкам), яички, спреи и жидкие препараты.
Жидкие препараты включают суспензии, растворы, сиропы и эликсиры. Такие препараты могут использоваться в качестве наполнителей в мягких или твердых капсулах и обычно включают носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, а также один или несколько эмульгаторов и/или суспендирующих агентов. Жидкие композиции также могут быть получены восстановлением твердого вещества, например, из саше.
Терапевтические средства комбинированной терапии по настоящему изобретению могут также использоваться в быстрорастворимых формах для рассасывания, таких как формы, описанные в публикации Expert Opinion in Therapeutic Patents, 11 (6), 981-986, (2001) авторами Liang and Chen, содержание которой полностью включено в настоящий документ в виде ссылки.
В таблетированных лекарственных формах терапевтическое средство может составлять от 1 до 80% масс. лекарственной формы, более типично от 5 до 60% масс. лекарственной формы. В дополнение к активному агенту таблетки обычно содержат дезинтегрирующее вещество. Примеры дезинтегрирующих добавок включают крахмал гликолят натрия, карбоксиметилцеллюлозу натрия, карбоксиметилцеллюлозу кальция, кроскармеллозу натрия, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, низший алкил-замещенную гидроксипропилцеллюлозу, крахмал, предварительно желатинированный крахмал и альгинат натрия. Обычно дезинтегрирующее вещество может составлять от 1 до 25% масс., предпочтительно от 5 до 20% масс., лекарственной формы.
Связующие вещества обычно используются для придания связующих свойств препарату таблетки. Подходящие связующие вещес ва включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, натуральные и синтетические смолы, поливинилпирролидон, предварительно желатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводный и т.п.), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат двухосновного фосфата кальция.
Таблетки могут также необязательно включать поверхностно-активные вещества, такие как лаурилсульфат натрия и полисорбат 80, и глиданты, такие как диоксид кремния и тальк. Поверхностно-активные вещества, когда они присутствуют, обычно составляют от 0,2 до 5% масс. массы таблетки, а глиданты обычно составляют от 0,2 до 1% масс. массы таблетки.
Таблетки также обычно содержат смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Смазывающие вещества обычно составляют от 0,25 до 10% масс., предпочтительно от 0,5 до 3% масс. массы таблетки.
Другие традиционные ингредиенты включают антиоксиданты, красители, вкусовые добавки, консерванты и маскирующие вкус вещества.
Типичные таблетки могут содержать до примерно 80% масс. активного ингредиента, от примерно 10 до примерно 90% масс. связующего вещества, от примерно 0 до примерно 85% масс. разбавителя, от примерно 2 до примерно 10% масс. дезинтегрирующего вещества и от примерно 0,25% масс. до примерно 10% масс. смазывающего вещества.
Смеси для получения таблеток могут быть спрессованы непосредственно или валиком с получением таблеток. Смеси таблеток или порции смесей могут альтернативно подвергаться влажному, сухому гранулированию или гранулированию в расплаве, замораживанию в расплаве или экструдированию перед таблетированием. Конечный препарат может включать один или несколько слоев и может быть покрыт или оставаться без покрытия; или инкапсулироваться.
Препараты в форме таблеток подробно обсуждаются в публикации “Pharmaceutical Dosage Forms: Tablets, Vol. 1”, by H. Lieberman and L. Lachman, Marcel Dekker, N.Y., N.Y., 1980 (ISBN 0-8247-6918-X), содержание которой во всей полноте включено в настоящий документ в виде ссылки.
Твердые препараты для перорального введения могут быть получены для немедленного и/или модифицированного высвобождения действующего вещества. Препараты с модифицированным высвобождением действующего вещества включают отсроченное, длительное, импульсное, контролируемое, целевое и запрограммированное высвобождение действующего вещества.
Подходящие препараты с модифицированным высвобождением действующего вещества описаны в Патенте США № 6106864. Детали других подходящих технологий высвобождения действующего вещества, таких как дисперсии высоких энергий и осмотические частицы и частицы с покрытием, можно найти в публикации Verma et al., Pharmaceutical Technology On-line, 25(2), 1-14 (2001). Использование жевательной резинки для достижения контролируемого высвобождения описано в WO 00/35298. Содержание указанных ссылок включено во всей полноте в настоящее описании в виде ссылки.
Парентеральное введение
Терапевтические средства комбинированной терапии по настоящему изобретению также могут вводиться непосредственно в кровоток, в мышцы или во внутренний орган. Подходящие способы парентерального введения включают внутривенное, внутриартериальное, внутрибрюшинное, интратекальное, интравентрикулярное, интрауретральное, интрастернальное, внутричерепное, внутримышечное и подкожное. Подходящие устройства для парентерального введения включают игольные (включая микроигольные) инъекторы, безыгольные инъекторы и устройства для инфузии.
Препараты для парентерального введения обычно представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные агенты (предпочтительно для рН от 3 до 9), но для некоторых применений они могут быть получены более подходящим образом в виде стерильного неводного раствора или в высушенной форме, предназначенной для использования в сочетании с подходящим разбавителем, таким как стерильная апирогенная вода.
Получение препаратов для парентерального введения в стерильных условиях, например, лиофилизацией, может быть легко осуществлено с использованием стандартных фармацевтических методик, хорошо известных специалистам в данной области.
Растворимость терапевтических средств, используемых при получении растворов для парентерального введения, потенциально может быть повышена путем использования соответствующих методик получения, таких как введение добавок, повышающих растворимость.
Препараты для парентерального введения могут быть представлены в форме для немедленного и/или модифицированного высвобождения действующего вещества. Препараты с модифицированным высвобождением действующего вещества включают препараты с отсроченным, длительным, импульсным, контролируемым, целевым и запрограммированным высвобождением действующего вещества. Таким образом, терапевтические средства комбинированной терапии по настоящему изобретению потенциально могут быть приготовлены в твердой, полутвердой форме или форме тиксотропной жидкости для введения в виде имплантированного депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких препаратов включают стенты, покрытые лекарственным средством, и PGLA микросферы.
Терапевтические средства комбинированной терапии по настоящему изобретению также могут вводиться местно на кожу или слизистую оболочку, то есть дермально или трансдермально. Типичные препараты для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, повязки, пены, пленки, пластыри, вафли, имплантаты, губки, волокна, повязки и микроэмульсии. Также могут использоваться липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут также включаться усилители проникновения; см., например, J. Pharm. Sci., 88 (10), 955-958 by Finnin and Morgan (October 1999). Другие способы местного применения включают доставку путем электропорации, ионофореза, фонофореза, сонофореза и с помощью микроигольной или безыгольной инъекции (например, Powderject™, Bioject™ и т.д.). Содержание этих ссылок включено в настоящее описании в виде ссылки.
Препараты для местного введения могут быть представлены в форме препаратов для немедленного и/или модифицированного высвобождения действующего вещества. Препараты с модифицированным высвобождением включают отсроченное, длительное, импульсное, контролируемое, целевое и запрограммированное высвобождение.
Терапевтические средства комбинированной терапии по настоящем изобретению могут также вводиться назально или ингаляцией, обычно в форме сухого порошка (отдельно или в виде смеси, например в сухой смеси с лактозой, либо в виде части смесевого препарата, например в смеси с фосфолипидами, такими как фосфатидилхолин) из ингалятора сухого порошка или в виде аэрозольного спрея из герметичного контейнера, насоса, пульверизатора, аэрозольного аппарата (предпочтительно аэрозольного аппарата с использованием электрогидродинамика для получения мелкодисперсного тумана) или распылителя с использованием или без использования подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Для интраназального применения порошок может включать биоадгезивную добавку, например хитозан или циклодекстрин.
Герметичный контейнер, насос, пульверизатор, аэрозольный аппарат или распылитель может содержать раствор или суспензию соединения(й) по настоящему изобретению, содержащий, например, этанол, водный этанол или подходящий альтернативный агент для диспергирования, растворения или увеличения высвобождения действующего вещества, пропеллент(ы) в качестве растворителя и необязательно поверхностно-активное вещество, такое как сорбитантриолеат, олеиновая кислота или олиголактиновая кислота.
Перед использованием в препарате форме сухого порошка или суспензии соединение может быть микронизировано до размера, подходящего для доставки путем ингаляции (обычно частицы размером менее 5 микрон). Это может быть достигнуто любым подходящим способом измельчения, таким как спиральное струйное измельчение, струйное измельчение в псевдоожиженном слое, сверхкритическая обработка жидкости с образованием наночастиц, гомогенизация при высоком давлении или распылительная сушка.
Капсулы (изготовленные, например, из желатина или HPMC), блистеры и картриджи для применения в ингаляторе или инсуффляторе могут быть получены так, что они включают порошковую смесь терапевтического средства, подходящую порошковую основу, такую как лактоза или крахмал, и модификатор харатеристики эффективности, такой как как L-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, предпочтительно в форме моногидрата. Другие подходящие жксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу.
Подходящий препарат в форме раствора для применения в распылителе с использованием электрогидродинамики для получения мелкодисперсного тумана может содержать от 1 мкг до 20 мг терапевтического средства на одно нажатие, а объем одного нажатия может изменяться от 1 до 100 мкл. Типичный препарат включает терпевтическое средство, пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые можно использовать вместо пропиленгликоля, включают глицерин и полиэтиленгликоль.
Подходящие вкусовые добавки, такие как ментол и левоментол, или подсластители, такие как сахарин или сахарин натрия, могут быть добавлены к этим препаратам, которые предназначены для ингаляционного/назального введения.
Препараты для ингаляционного/назального введения могут быть получены для немедленного и/или модифицированного высвобождения действующего вещества с использованием, например, сополимера молочной и гликолевой кислоты (poly(DL-lactic-coglycolic acid - PGLA). Препараты с модифицированным высвобождением включают отсроченное, длительное, импульсное, контролируемое, целевое и запрограммированное высвобождение действующего вещества.
В случае ингаляторов и аэрозолей сухого порошка стандартная доза определяется с помощью клапана, который доставляет отмеренное количество. Устройства в соответствии с изобретением обычно расположены для введения отмеренной дозы или «нажатия», содержащего желаемое количество терапевтического средства. Общая суточная доза может вводиться в виде одной дозы или, чаще, разделяться на несколько доз и вводиться в виде разделенных доз в течение дня.
Терапевтические средства комбинированной терапии по настоящему изобретению могут потенциально вводиться ректально или вагинально, например в форме суппозитория, пессария или клизмы. Масло какао является традиционной основой для суппозиториев, но при необходимости могут использоваться и другие вещества.
Препараты для ректального/вагинального введения могут быть получены для немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают отсроченное, длительное, импульсное, контролируемое, целевое и запрограммированное высвобождение.
Терапевтические средства комбинированной терапии по настоящему изобретению также могут потенциально вводиться непосредственно в глаз или ухо, обычно в форме капель микронизированной суспензии или раствора в изотоническом стерильном физиологическом растворе с заданным значением рН. Другие препараты, подходящие для глазного и ушного введения, могут включать мази, биоразлагаемые (например, рассасывающиеся гелевые губки, коллаген) и биологически не разлагаемые (например, силиконовые) имплантаты, пластины, линзы и системы в виде частиц или везикул, такие как ниосомы или липосомы. Полимер, такой как поперечно-сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например гелановая камедь, может быть включен вместе с консервантом, таким как хлорид бензалкония. Такие препараты также могут доставляться с помощью ионтофореза.
В одном варианте осуществления фармацевтическая композиция, применимая для комбинированной терапии по настоящему изобретению, включает только одно терпевтическое средство, например единственное средство, выбранное из (а) ингибитора EZH2 или его фармацевтически приемлемой соли; (b) противоопухолевого средства на основе платины или его фармацевтически приемлемой соли; и (c) химиотерапевтического средства или его фармацевтически приемлемой соли.
В одном варианте осуществления фармацевтическая композиция, применимая для комбинированной терапии по настоящему изобретению, включает два или три терапевтических средства, например два или три средства, выбранных из (а) ингибитора EZH2 или его фармацевтически приемлемой соли; (b) противоопухолевого средства на основе платины или его фармацевтически приемлемой соли; и (c) химиотерапевтического средства или его фармацевтически приемлемой соли.
В одном варианте осуществления фармацевтическая композиция, применимая для комбинированной терапии по настоящему изобретению, включает ингибитор EZH2 или его фармацевтически приемлемую соль и химиотерпевтическое средство или его фармацевтически приемлемую соль.
В одном варианте осуществления фармацевтическая композиция, применимая для комбинированной терапии по настоящему изобретению, включает ингибитор EZH2 или его фармацевтически приемлемую соль и противоопухолевое средство на основе платины или его фармацевтически приемлемую соль.
Наборы
Терапевтические средства комбинированной терапии по настоящему изобретению удобно комбинировать в форме набора, подходящего для совместного введения композиций.
В одном аспекте настоящее изобретение относится к набору, который включает первый контейнер, второй контейнер и листок-вкладыш, где первый контейнер включает по меньшей мере одну дозу ингибитора EZH2 или его фармацевтически приемлемой соли, второй контейнер включает по меньшей мере одну дозу противоопухолевого средства на основе платины или его фармацевтически приемлемой соли, и листок-вкладыш включает инструкции по лечению у субъекта рака с использованием лекарственных средств.
В одном аспекте настоящее изобретение относится к набору, который включает первый контейнер, второй контейнер, третий контейнер и листок-вкладыш, где первый контейнер включает по меньшей мере одну дозу ингибитора EZH2 или его фармацевтически приемлемой соли; второй контейнер включает по меньшей мере одну дозу противоопухолевого средства на основе платины или его фармацевтически приемлемой соли; третий контейнер включает по меньшей мере одну дозу химиотерапевтического средства или его фармацевтически приемлемой соли; и листо-вкладыш включает инструкции для лечения у субъекта рака с использованием лекарственных средств. В одном варианте осуществления набор по настоящему изобретению может включать один или несколько активных ингредиентов в форме фармацевтической композиции, причем эта фармацевтическая композиция включает активный агент или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Набор может содержать средства для отдельного хранения указанного композиции, такие как контейнер, разделенная бутылка или пакет из фольги. Примером такого набора является хорошо известная блистерная упаковка, используемая для расфасовки таблеток, капсул и т.п.
Набор может особенно подходить для введения различных лекарственных форм, например, лекарственных форм для перорального и парентерального введения, для введения отдельных композиций с различными интервалами дозировки или для подбора доз отдельных композиций друг относительно друга. Для обеспечения соответствия набор, как правило, включает инструкции по применению и может быть снабжен вспомогательной памяткой. Набор может дополнительно включать другие материалы, которые могут применяться для введения лекарственных средств, такие как разбавители, фильтры, пакеты для внутривенного вливания и катетеры, иглы и шприцы и т.п.
Дополнительные терапевтические средства
В дополнительном аспекте способы и комбинированная терапия по настоящему изобретению могут дополнительно включать введение дополнительных противораковых средств, таких как противоопухолевые средства, антиангиогенные средства, ингибиторы сигнальной трансдукции и антипролиферативные средства, которые вместе эффективны в лечение указанного рака. В некоторых таких вариантах осуществления противоопухолевое средство выбрано из группы, состоящей из ингибиторов митоза, алкилирующих агентов, антиметаболитов, интеркалирующих антибиотиков, ингибиторов факторов роста, лучевой терапии, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомеразы, модификаторов биологического ответа, антител, цитотоксических средств, антигормонов, средств андрогенной депривационной терапии и антиандрогенов. В некоторых вариантах осуществления противоопухолевое средство выбрано из антител, например антител против PD-1 [например, MDX-1106 (ниволумаб), MK-3475 (пембролизумаб), CT-011 (пидилизумаб), REGN2810 (цемиплимаб), BGB-A317 (тислелизумаб или BGB-A317), mAb7 (RN888 или PF-06801591), mAb15, AMP-224 (B7-DCIg), AGEN-2034w (также известный как AGEN-2034) и спартализумаб], антител против PD-L1 [например, YW243.55.S70, MDX-1105 (BMS-936559), MPDL3280A (атезолизумаб), MEDI4736 (дурвалумаб) и MSB0010718C (авелумаб)] и антител против CTLA-4 [например, ипилимумаб, тремелимумаб и AGEN-1884].
Ниволумаб описан, например, в публикации PCT № WO2006/121168, опубликованной 16 ноября 2006 г. (Международная заявка на патент PCT/JP2006/309606, подана 02 мая 2006 г.). Пембролизумаб описан, например, в PCT № WO2009114335, опубликованной 17 сентября 2009 г. (Международная заявка на патент № PCT/US2009/035825, подана 3 марта 2009 г.). Пидилизумаб раскрыт, например, в PCT № WO2009/101611, опубликованной 20 августа 2009 г. (Международная заявка на патент № PCT/IL2009/000153, подана 11 февраля 2009 г.). Цемиплимаб раскрыт, например, в публикации PCT № WO2011066389, опубликованной 3 июня 2011 г. (Международная заявка на патент № PCT/US2010/058007, подана 24 ноября 2010 г.). BGB-A317 описан, например, в PCT публикации № WO2015035606, опубликованной 19 марта 2015 г. (Международная заявка на патент № PCT/CN2013/083467, подана 13 сентября 2013 г.). mAb7 (RN888 или PF-06801591) описан, например, в PCT публикации № WO2016/092419, опубликованной 16 июня 2016 г. (Международная заявка на патент № PCT/IB2015/059268, подана 02 декабря 2015 г.). mAb15 описан, например, в публикации PCT № WO2016/092419, опубликованной 16 июня 2016 г. (Международная заявка на патент PCT/IB2015/059268, подана 02 декабря 2015 г.). AMP-224 (B7-DCIg) описан, например, в PCT публикации № WO2010/027827, опубликованной 11 марта 2010 г. (Международная заявка на патент № PCT/US2009/054969, подана 25 августа 2009 г.) и PCT публикации № WO2011066342, опубликованной 03 июня 2011 г. (Международная заявка на патент № PCT/US2010/057940, подана 24 ноября 2010 г.). AGEN-2034w (также известный как AGEN-2034) описан, например, в PCT публикации № WO2017040790, опубликованной 09 марта 2017 г. (Международная заявка на патент № PCT/US2016/049913). Спартализумаб описан, например, в PCT публикации № WO/2015112900, опубликованной 30 июля 2015 г. (Международная заявка на патент № PCT/US2015/012754, подана 23 января 2015 г.).
YW243.55.S70 описан, например, в РСТ публикации № WO2010077634, опубликованной 08 июля 2010 г. (Международная заявка на патент PCT/US2009/067104, подана 8 декабря 2009 г.). MDX-1105 (BMS-936559) описан, например, в PCT публикации № WO2018106529, опубликованной 14 июня 2018 г. (Международная заявка на патент № PCT/US2017/064207, подана 01 декабря 2017 г.) и PCT публикации № WO 2007005874, опубликованной 1 января 2007 г. (Международная заявка на патент № PCT/US2006/026046, подана 30 июня 2006 г.). MPDL3280A (атезолизумаб) описан, например, в РСТ публикации № WO2018106529, опубликованной 14 июня 2018 г. (Международная заявка на патент № PCT/US2017/064207, подана 01 декабря 2017 г.). MEDI4736 (дурвалумаб) описан, например, в PCT публикации № WO2011066389, опубликованной 03 июня 2011 г. (Международная заявка на патент № PCT/US2010/058007, подана 24 ноября 2010 г.), и PCT публикации № WO2018106529, опубликованной 14 июня 2018 г. (Международная заявка на патент № PCT/US2017/064207, подана 01 декабря 2017 г.). MSB0010718C (авелумаб) описан, например, в PCT публикации № WO13079174, опубликованной 06 июня 2013 г. (Международная заявка на патент № PCT/EP2012/004822, подана 21 ноября 2012 г.). Ипилимумаб описан, например, в качестве антитела 10D1 в РСТ публикации № WO01/14424, опубликованной 01 марта 2001 г. (Международная заявка на патент № PCT/US00/23356, подана 24 августа 2000 г.), а также в публикации Заявки на патент США № 20150283234, опубликованной 08 октября 2015 г. (Заявка на патент США № 14/437029, подана 20 апреля 2015 г.). Тремелимумаб описан как антитело 11.2.1 в Патенте США № 6682736, выданном 27 января 2004 г. (Заявка на патент США № 09/472087, подана 23 декабря 1999 г.). AGEN-1884 описан, например, в качестве примера 1 в РСТ публикации № WO2016196237, опубликованной 08 декабря 2016 г. (Международная заявка на патент № PCT/US2016/034508, подана 27 мая 2016 г.).
В одном варианте осуществления способов и комбинированной терапии по настоящему изобретению схема лечения включает дополнительное активное средство, где дополнительным активным средством является этопозид.
Эти и другие аспекты изобретения, включая типичные конкретные варианты осуществления, представленные ниже, будут очевидны из приведенного описания.
ПРИМЕРЫ
Соединение 1 представляет собой 5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(R)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он, который описан в Международной заявке на патент PCT/IB2015/054272, опубликованной 23 декабря 2015 как WO 2015/193765.
Соединение 2 представляет собой 5,8-дихлор-7-(3,5-диметил-1,2-оксазол-4-ил)-2-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он, который описан в Заявке на патент PCT/IB2013/060682, опубликованной 26 июня 2014 г. как WO 2014/097041.
Если не указано иное, приготавливают исходные растворы соединения 1 и соединения 2 в качестве исходных растворов в ДМСО для дальнейшего разбавления по мере необходимости.
В настоящем документе используются следующие сокращения:
ANCOVA - ковариационный анализ
BID - два раза в день
BW - масса тела
BWL - потеря массы тела
CR - полный ответ
ДМСО - диметилсульфоксид
IP - интраперитонеальный
N или n - количество субъектов
NOD/SCID - не страдающий ожирением пациент с диабетом/тяжелый комбинированный иммунодефицит
NS - Не имеет значения
NSG - NOD SCID gamma
ПЦР - полимеразная цепная реакция
PO - через рот (перорально)
QD - один раз в день
qRT - количественный анализ в реальном времени
RT - обратная транскрипция
SD - стандартное отклонение
SEM - стандартная ошибка среднего
TGI - ингибирование роста опухоли
WT - дикий тип
Методы и протоколы для примеров с 1 по 9
Клеточная культура: SCLC клеточную линию DMS114 получают из Американской коллекции типовых культур (American Type Culture Collection, ATCC CRL-2066) и выращивают в среде Веймаута (Waymouth's Medium) MB 752/1 (Gibco/Life Technologies Cat. 11220-035), плюс 10% фетальной бычьей сыворотки (Fetal Bovine Serum - FBS) (Gibco/Life Technologies, Cat. 10082-147) и 1% пенициллина/стрептомицина. Клетки COR-L88 (92031917) приобретают у ECACC. H841 (CRL-5845), H446 (HTB-171), NCI-H889 (CRL-5817), DMS79 (CRL2049) и H69 (HTB-1 19) приобретают в Американской коллекции типовых культур и культивируюты в рекомендуемой среде (H841: среда HITES с добавлением 5% FBS; H446, COR-L88, NCI-H889, DMS79 и H69: среда RPMI-1640+10% FBS). RPMI1640 приобретают в Invitrogen (Cat. № 1 1875-093; Lot. № 1694256). Среду HITES приготавливают в соответствии с инструкциями Американской коллекции типовых культур с базовой средой DMEM: среда F12 (Invitrogen, Cat. № 11320-033; Lot. № 1677218), дополненная смесью следующих компонентов: 0,005 мг/мл инсулина и 0,01 мг/мл трансферрина, 30 нМ селенита натрия (ITS-X (Invitrogen, Cat. № 51500-056, Lot. № 1582940), 10 нМ гидрокортизона (Sigma, Cat. № H0888-1 G, Lot. № 061 M1142V), 10 нМ бета-эстрадиола (Sigma, Cat. № E2257-1 мг, Lot. № 107K8630), дополнительно 2 мМ L-глутамина до конечной концентрации 4,5 мМ (Invitrogen, Cat. № 25030-081, Lot. № 1552995), 5% эмбриональной бычьей сыворотки (Invitrogen, Cat. № 10099-141, Lot. № 1565565). Все клетки содержат в увлажненном инкубаторе при 37°С с 5% диоксида углерода (СО2).
Протокол клеточного вестерн-блоттинга: клетки высевают с плотностью 1500 клеток на лунку в 96-луночные черные плоские планшеты с прозрачным дном (Falcon, BD-353219). На следующий день в лунки добавляют соединения в 3-х кратном разведении с конечным диапазоном концентраций от 3 мМ до 0,1 нМ, оставляя некоторые клетки пустыми для контроля: «только ДМСО (1-е и 2-е антитело)» и «только ДМСО (только 2-е антитело)». Через 72 часа носитель удаляют и в течение 20 минут в вытяжном шкафу добавляют 3,7% формальдегида в фосфатно-буферном солевом растворе (PBS, Gibco Life Technologies, Cat. 10010-023) для фиксации. Затем формальдегид удаляют и добавляют 150 мл охлажденного на льду метанола (МеОН) для проницаемости клеток. Тарелки были заворачивают и замораживают в течение ночи. На следующий день MeOH удаляют, добавляют блокирующий буфер (Odyssey blocking buffer (150 мл)) и выдерживают планшеты на вращающемся шейкере (VWR) в течение двух часов. Блокирующий буфер удаляют и добавляют антитело H3K27Me3 (Cell Signaling 9733), которое предварительно разбавляют 1:800 в 50 мл блокирующего буфера Odyssey (LiCor # 927-40000). После этого планшеты помещают на вращающийся шейкер (VWR) в холодной камере и инкубируют в течение ночи при 4°С. На следующий день первичное антитело удаляют, клетки промывают 1×PBS+0,1% Твин 20 (PBST) всего 5 раз по 5 минут каждый. Вторичное антитело (Cell Signaling 5151 anti-rabbit) разбавляют 1:800 в буфере (Odyssey, 50 мл) и затем добавляют в каждую лунку вместе с реагентом DRAQ5 (Cell Signaling # 4084), разбавленном 1:10000 в буфере (Odyssey, 5 мМ) для нормализации. Через 2 часа вторичное антитело удаляют, планшеты снова промывают 5 раз в PBST в течение 5 минут каждый, а затем детектируют флуоресцентный сигнал на приборе Odyssey LiCoR (длина фокуса 3 мм; с использованием 800 нм (для вторичного) и 700 нм фильтров вместе (для DRAQ5). Значения IC50 рассчитывают, используя четырехпараметрическую модель подгонки с помощью 7.02 GraphPad Prism (версия 7.02), и вычисляют среднее арифметическое для всех биологических повторов.
Анализ ингибирования роста SCLS клеток DMS114: клетки SCLS DMS114 высевают в полную среду для культивирования клеток, описанную выше (1 мл/лунку) в 12-луночный прозрачный планшет для культивирования тканей с плоским дном из полистирола (Falcon, Cat. 353225) при плотности 10000 клеток/лунка. Планшеты инкубируют в течение ночи 16 часов при 37°С и 5% СО2. Затем клетки обрабатывают в течение 3 дней соединением 1 с 10 точечным 3-кратным последовательным разведением, начиная с высокой концентрации 3 мМ. Через 3 дня клетки каждой обработки индивидуальной дозой подвергают диссоцииации с помощью трипсина-ЭДТА (0,25%) (Gibco/Life Technologies Cat. 25200-056), снова суспендируют в свежей среде и подсчитывают с использованием счетчика клеток Vi-Cell и анализатора жизнеспособности клеток (Beckman Coulter, cat. 383556). Клетки каждой обработки отдельной дозой затем повторно высевают в полную среду для культивирования клеток, как описано выше (100 мкл/лунку), в 96-луночный планшет с ультранизким связыванием (планшеты с покрытием Ultra Low Attachment - ULA) (Corning Inc, Cat. 7007)) при плотности 500 клеток/лунку. Клетки снова инкубируют в течение ночи 16 часов при 37°С и 5% СО2. На следующий день добавляют соединение 1 в соответствующих дозах, как указано выше, используя 10-точечное 3-кратное последовательное разведение, начиная с высокой концентрации 3 мМ. Затем чашки инкубируют при 37°С и 5% СО2в течение дополнительных 14-18 дней, свежую питательную среду и лекарственное средство пополняют в соответствии с графиком дозирования, описанным выше, каждые 3 дня. Клетки обрабатывают соединением в течение 17-21 дней. В конце периода инкубации в каждую лунку добавляют 19 мкл AlamarBlue (ThermoFisher Cat. DAL102) и планшеты инкубируют при 37°C в течение 16 часов. Затем планшеты считывали в считывающем устройстве для микропланшетов Infinite M200 Pro (Tecan Cat. 396235), используя длину волны возбуждения флуоресценции от 540 нм до 570 нм (пик возбуждения составляет 570 нм) и эмиссию при 580 нм до 61 ом (пик эмиссии составляет 585 нм). Значения IC50 рассчитывают с использованием нелинейного регрессионного метода подгонки кривой доза-ответ с помощью GraphPad Prism (версия 7.02).
Анализ ингибирования роста SCLC клеток линий H446, H69 и H841. Клетки H841, H446 и H69 высевают в рекомендованную полную культуральную среду, описанную выше (1 мл/лунку), с трехкратными повтора в 12-луночные планшеты для каждой клеточной линии при плотности 100000 клеток на лунку. Планшеты инкубируют в течение ночи при 37°С и 5% СО2. Исходный раствор соединения 1 готовили с концентрацией 50 мМ в ДМСО, распределяют по нескольким аликвотам одноразового использования и хранят при -20°С. Для приготовления пластины соединения соединение 1 разбавляют до 3 мМ в ДМСО, а затем проводят 3-кратное последовательное разведение в ДМСО (всего 10 доз). Через 24 часа после высева клеток в соответствующие лунки 12-луночного планшета, содержащего клетки в 1 мл среды, добавляют 1 мл разведений лекарственного средства вместе с контролем ДМСО (1000×разведение). Конечная концентрация лекарственного средства после всех разведений в каждой лунке составляет 3, 1, 0,333, 0,1 11, 0,037, 0,012, 0,004, 0,001, 0,0005, 0,0002 мМ. ДМСО добавляют в контрольные лунки с 3 повторами. Планшеты встряхивают вручную для тщательного перемешивания лекарственного средства. После этого клетки выдерживают в инкубаторе при 37°С. Через 3 или 4 дня клетки разделяют в соотношении 1:2 или 1:3 в зависимости от скорости роста клеток. Для суспензии клеток - клетки тщательно перемешивают с использованием пипетки объемом 1 мл, а затем удаляют 500 мкл (разделение 1:2) или 667 мкл (разделение 1:3) клеток. Для адгезивных клеток - клетки трипсинизируют и разделяют в соотношении 1:2 или 1:3. В каждую лунку добавляют такой же объем свежей среды, чтобы довести объем до 1 мл. Если клетки полуадгезивные, суспензию клеток в супернатанте собирают вместе с трипсинизированными адгезивными клетками. Свежий препарат добавляют в каждую лунку, как описано ранее. Клетки разделяют, и пополнение среда/лекарственное средство аналогично повторяют каждые 3-4 дня до 21-го дня. На 21-й день наблюдают морфологию клеток под микроскопом и регистрируют любые изменения морфологии после обработки соединением. Для суспензии клеток - клетки затем повторно смешивают пипеткой, аспирируют из лунок 3-кратных повторов и переносят в пробирку объемом 15 мл. Для адгезивных клеток -супернатант удаляют и в каждую лунку добавляют 500 мл трипсина. После диссоциации клеток со дна в каждую лунку добавляют 1 мл полной среды. Клетки разделяют на суспензию отдельных клеток, переносят в пробирку объемом 15 мл и центрифугируют со скоростью 1 об./мин. в течение 5 минут. Супернатант удаляют и клетки снова суспендируют из лунок 3-кратного повтора в 1000-3000 мл среды в зависимости от размера пеллетов. 50-100 мл переносили из лунок смеси клетки+среда в 96-луночный черный CTG-планшет с плоским дном (Corning, Cat.CLS3904) и добавляют равный объем CTG реагента (от Promega, Cat.G7571, Lot. № 0000089186). Объем клеточной суспензии регулируют для обеспечения того, чтобы сигнал находился в линейном диапазоне для анализа CTG (клеток не слишком много и не слишком мало). Затем клетки встряхивают в темноте в течение 5 минут. Жизнеспособность клеток измеряют с использованием инструкций производителя.
Для оценки синергического антипролиферативного эффекта комбинации ингибиторов EZH2 со стандартными химиотерапевтическими средствами (цисплатин и этопозид, которые можно использовать отдельно или в комбинации в качестве стандартного лечения при химиотерапии), каждую из клеточных линий, описанных выше, предварительно обрабатывают определенными дозами соединения 1 в культуральных колбах в течение 9 дней с последующей совместной обработкой цисплатином или этопозидом в 96-луночных планшетах в течение 4 дней. Действие на пролиферацию клеток оценивают с использованием анализа пролиферации клеток CellTiter-Glo в соответствии с методами, описанными в настоящем документе, и для обработки результатов и вычисления показателей синергии используют программное обеспечение Chalice Bioinfomatics (Horizon Discovery, версия 1.6). Данные нормализуют по необработанному образцу ДМСО/ДМСО и представляют в виде % относительно необработанного образца. Данные анализируют с использованием модели Леви расчета аддитивности комбининации, а показатель превышения действия показатель используют для оценки величины совместного действия, которая превышает аддитивный эффект, предсказанный для каждой дозы по модели Леве (Loewe).
Протокол вестерн-блоттинга SLFN11: клеточные линии SCLC обрабатывают 500 нМ соединения 1 в ДМСО в течение 7 дней и после этого оценивают изменения уровней белка SLFN11 с использованием вестерн-блоттинга. После обработки лекарственным средством клетки подвергают трипсированию (адгезивные клетки), собирают центрифугированием со скоростью 2000 об./мин. при комнатной температуре, промывают PBS с последующим объединением клеточных пеллет центрифугированием. Клеточные пеллеты снова суспендируют в соответствующем объеме буфера RIPA (Sigma; Catalog # R0278; 100 мкл на 5-10×105 клеток), инкубируют на льду в течение 10-15 минут, центрифугируют при 12000g и 4°C в течение 10 минут и затем собирают супернатант. 15 мкг общих белковых лизатов переносят на 4-12% белковый гель NuPAGE™ Bis-Tris (NP0336Box) в подвижном буфере 1×NuPAGE™ MOPS SDS (NP0001). Гели переносят на лед при 80 В и выдерживают в течение 20 минут, а затем при 150 В в течение 60 минут. Для переноса белка используют систему сухого блоттинга iBlot2 (Cat # IB21001) вместе со стандартными пакетами переноса нитроцеллюлозы iBlot2 (Cat # IB23001) в соответствии с инструкциями производителя. Обычные пакеты для переноса нитроцеллюлозы собирают и помещают в систему сухого блоттинга iBlot2. Перенос осуществляют стандартным методом P3 в соответствии с инструкциями изготовителя при постоянном напряжении 20 В в течение 7 минут. После завершения переноса нитроцеллюлозную мембрану блокируют в 5% обезжиренном молоке в течение 1 часа при комнатной температуре при встряхивании. Раствор первичного антитела готовят с антителом к SLFN11 (E-4) Cat #: sc374339) в 5% обезжиренном молоке, блокирующем буфер, в разведении 1:100. Мембрану инкубируют в течение ночи при 4°С при встряхивании. На следующий день мембрану трижды промывают 1× трис-буферным солевым раствором, 0,1% Tween-20 (TBS-T), приготовленным в лабораторных условиях, в течение 10 минут, каждый раз на шейкере. Мембрану инкубируют во вторичном мышином анти-IgG HRP-связанном Ab (Cat # CST7076S) при разведении 1:2000 в буфере для блокирования 5% обезжиренного молока в течение 1 часа и затем трижды промывают 1×TBST в течение 10 минут на шейкере. Сигнал детектируют с использованием ECL системы (Thermo-34078 и -34096) и визуализируют на аппарате визуализации сигналов ImageQuant LAS400.
Метод ДНК-комет: Суспензионные или адгезивные клеточные линии SCLC высевают при плотности 50000 клеток/мл в колбу Т75 и культивируют в полной среде для культивирования клеток, содержащей соединение 1, с конечной концентрацией 0,3 мМ в ДМСО или с комнтролем ДМСО (0,01%) в течение 7 дней при 37°С и 5% СО2. Свежую питательную среду и лекарственное средство пополняют каждые 3-4 дня. По истечение 7 дней обработки клетки обрабатывают 0,3 мМ соединения 1 или контролем ДМСО в комбинации с различными дозами цисплатина (Sigma-Alderich Cat # P4394) в течение 3 дней. Клетки собирают центрифугированием, клеточные осадки снова суспендируют в суспензиях отдельных клеток при 1×1010клеток/мл в охлажденном на льду 1xPBS (не содержащим Ca++ и Mg++) и хранят при комнатной температуре до использования. LM Agarose (Trevigen 4250-050-02) расплавляют в химическом стакане с кипящей водой в течение 5 минут и затем бутылку с агарозой помещают в инкубатор при 37°C для охлаждения. Клетки в концентрации 1×105/мл, объединенные с агарозой LM (при 37°С) в соотношении 1:10 (об./об.) пипетируют (50 пмкл) непосредственно на CometSlide™ (TREVIGEN 4250-050-03), обеспечивая полное покрытие площади образца. Предметные стекла помещают в на плоскость при 4°С в темноте на 10-20 минут, погружают в охлажденый раствор для лизиса (Trevigen 4250-050-01) и инкубируют в течение ночи при 4°С. После инкубации в растворе для лизиса предметные стекла сушат и погружают в свежеприготовленный щелочной раствор Alkaline Unwinding Solution (20 мМ NaOH, 1 мМ ЭДТА рН>13) и выдерживают в течение 1 часа при 4°С в темноте. Предметные стекла подвергают электрофорезу в системе TREVIGEN CometAssay ES (Trevigen 4250-050-ES) со свежеприготовленным щелочным раствором для электрофореза (20 мМ NaOH, 1 мМ EDTA pH> 13) при 21 В в течение 30 минут. После электрофореза предметные стекла дренируют в избытке раствора для электрофореза и осторожно дважды погружают дважды в H2O на 5 минут каждый раз с последующим добавлением 70% этанола на 5 минут. Предметные стекла сушат на воздухе в темноте в течение ночи и хранят при комнатной температуре. Высушенные предметные стекла окрашивают 100 мкл разведенного SYBR Gold (Invitrogen Cat # S1 1494, 1:10000 в ТЕ-буфере) в течение нескольких минут в темноте. После Изображение окрашенных предметных стекол получают с помощью флуоресцентной микроскопии Nikon (максимальное возбуждение/излучение при 496 нм/522 нм).
Окрашивание y-H2AX: стерильные покровные стекла SLIP-RITE (ThermoScience 22×22#1.5 Cat#152222) помещают на 6-луночные планшеты. 6×104 клеток высевают на каждое покровное стекло и культивируют в 2 мл полных культуральных сред, содержащих 0,3 мМ соединения 1 в ДМСО, или ДМСО-контроль (0,01%) при 37°С и 5% СО2, с добавление свежей питательной среды и лекарственного средства каждые 3-4 дня в течение 7 дней. После 7 дней обработки клетки обрабатывают 0,3 мкМ соединения 1 в ДМСО или ДМСО-контролем в сочетании с различными дозами цисплатина (Sigma-Alderich Cat # P4394) в течение ночи (16 часов). В конце комбинированной обработки клетки промывают 3 раза 1х солевым фосфатнл-буферным раствором (PBS) (свободным от Ca++ и Mg++), фиксируют в 1 мл 4% параформальдегида (Electron Microscopy Sciences Cat # 15710) и хранить в течение ночи при 4°С. После фиксации клетки промывают 3 раза в 1x PBS и пермеабилизировали путем инкубации в 1 мл PBS, содержащем 0,25% Triton X-100 (Sigma, Catalog # T8787) при комнатной температуре в течение 10 минут. После пермеабилизации клетки промывают 3 раза 1xPBS и инкубируют с 10% сывороткой осла (Sigma-Aldrich Cat # D9663, 1:10 разведение в PBS) при комнатной температуре в течение 1 часа для блокирования неспецифического связывания антител. После блокирования клетки инкубируют с мышиным антителом против фосфо-Histone H2A.X (Ser139) (Millipore Cat # 05-636, разведение 1:1000 в 1% BSA) в течение ночи при 4°С. На следующий день клетки промывают 3 раза в 1xPBS и инкубируют с ослиным Alexa Fluor™ 488 (Invitrogen Cat # A21202, разведение 1:2000 в 1% BSA) антителом против мышиного имуноглобулина G в течение 1 часа при комнатной температуре. Затем клетки промывают 3 раза 1x PBS перед монтированием. Покровные стекла помещают на клетки и монтируют с помощью Fluoromount-G™ с DAPI (Invitrogen Cat # 004959-52) на предметное стекло микроскопа COLORFROST PLUS (ThermoSciences Ca # 9991004). Изображения смонтированных предметных стекол получают с помощью конфокальной микроскопии Nikon A1R.
EZH2-WT DMS114 SCLC в in vivo исследованиях ксенотрансплантата:
(i) Препарат соединения: препарат соединения 1 готовят в форме наносуспензии мокрого помола (измельчение в течение 24 часов в 2,5% (мас./об.) поливинилпирролидоне (PVP), 0,5% масс./об. водном Макрогол 15-гидроксистеарате (Kolliphor HS15) с гранулометрическим распределением частиц <1 мкм (PSD; медианный диамтр ~650 нм (d50)) для перорального введения через желудочный зонд.
(ii) Клеточный имплантат, дозирование соединения и сбор тканей: самкам мышей с иммунодефицитом с тяжелой мутацией комбинированного иммунодефицита (SCID) без ожирения с диабетом (NOD SCID; возраст от 6 до 8 недель; NOD.CB17-Prkdcscid/NCrCrl от Charles River Laboratories в правый бок вводят подкожный (SC) имплантат из 7,5×106 клеток DMS114 (в матригеле 1:1 (Trevigen, Cultrex BME Path Clear®, Lot # 30625F14), общий объем 200 мл). Объем опухоли и массу тела измеряют два раза в неделю. На 20-й день после имплантации 64 особи мыши рандомизируют поразмера опухоли при среднем геометрическом значении (geomean) примерно 160 мм3 в 6 группах соответствующих доз (таблица 1). Соединения вводят в дозе 10 мл/кг через желудочный зонд (соединение 1; BID (с интервалом 7/17 часов)) или интреперитонеальной инъекцией (цисплатин), соответственно. Схема приема цисплатина - один раз в неделю в течение 3 недель (Q7Dx3), начало введения - через 7 дней после рандомизации и начала лечения соединением 1.
Таблица 1. Определение групп исследования, доз цисплатина и соединения 1, схем лечения и способов введения
На 55 день исследование в группах 1, 2, 3 и 4 завершают (таблица 1). Образцы опухолей (быстро замороженные) собирают через 4 часа после последней дозы для фармакодинамического (PD) анализа. Исследование групп, получавших цисплатин (5 и 6), продолжают до дня 81 после рандомизации для мониторинга регрессии и роста опухоли. Образцы опухолей из групп 5 и 6 собирают через 3 часа после последней дозы в зависимости от доступных размеров опухоли.
Все манипуляции на этих животных проводят в соответствии с правилами и установленными руководящими принципами и были рассмотрены и одобрены Комитетом по содержанию и использованию животных (Pfizer).
(iii) Интерпретация данных: для каждого эксперимента проводят расчеты и строяты графики с использованием Microsoft Excel и GraphPad Prism version 7.02, соответственно. Объем опухоли рассчитывают по формуле 0,5×длина×ширина2. Ингибирование роста опухоли (TGI) определяют по формуле: % TGI = [1-(Vtx-Vt0/Vcx-Vc0)]×100, где Vc, Vt - средние геометрические значения контрольных и обработанных групп. X=день X исследования, и 0=первый день введения дозы.
Твердофазный иммунофрментный анализ (ELISA)
(i) Экстракция гистонов. Экстракцию гистонов проводит с использованием набора для экстракции гистонов EpiQuick (Epigentek OP0006). Замороженные образцы опухоли разрезают и гомогенизируют с использованием охлажденного раствора и пестика на сухом льду. Гомогенизированную смесь переносят в пробирку объемом 1,5 мл в 1×буфере для предварительного лизиса (200 мг/мл), содержащем фенилметилсульфонилфторид (PMSF). Образцы осторожно перемешивают, инкубируют на льду в течение 15 минут и центрифугируют при 3000 об/мин в течение 5 минут при 4°С. Осадок ткани снова суспендируют в 3 объемах (приблизительно 200 мкл на 100 мг ткани) буфера для лизиса из набора Histone Extraction Kit, инкубируют на льду в течение 30 минут и центрифугируют со скоростью 12000 об./мин. в течение 5 минут при 4°С. Буфер Balance-DTT готовят добавлением раствора дитиотреитола (DTT) для уравновешивания буфера в соотношении 1:500. Супернатант (содержащий растворимые в кислоте белки) переносят в чистую пробирку объемом 1,5 мл, и к каждому образцу быстро добавляют 0,3 объема буфера Balance-дитиотреитол (DTT) из набора для экстракции гистонов Histone Extraction Kit. Лизат опухоли кратковременно обрабатывают ультразвуком в течение 4 циклов (30 секунд обработки и 30 секундного выключения) с высокой интенсивностью, используя Bioruptor Plus (Diagenode # B01020001). Экстракты разделяли на аликвоты и хранят при -20°C (кратковременно) или -80°C (длительно). Концентрацию белка количественно определяют с использованием набора для анализа Coomassie Plus (Bradford) Assay Kit(Thermo #23236).
(ii) Анализ ELISA на H3K27Me3 и Me2: экстракты гистона разбавляют до конечной концентрации 400 нг (или 800 нг) в 100 мл покрывающего буфера (фосфатный буферный раствор - PBS), содержащего 0,05% бычьего сывороточного альбумина (BSA)). Четыреста (400) нг (или 800 нг) каждого образца добавляют в каждую лунку 96-луночного микропланшета для анализа (Corning Costar) - в двух экземплярах, плотно закрывают и инкубируют в течение ночи при 4°С. На следующий день лунки в каждом планшете 3 раза промывают промывочным буфером объемом 300 мл (PBS, 0,05% Твин 20) и затем блокируют 300 мкл блокирующего буфера (PBS, 0,05% Твин 20, 2% BSA) в течение 2 часов при комнатной температуре. После следующего цикла промывания промывочным буфером (PBS, 0,05% Tween 20) 100 мл исследуемого антитела (Cell Signaling # 9733 H3K27Me3, разведение 1:2000 в блокирующем буфере; Cell Signaling # 9728 H3K27Me2, разведение 1:2000 в блокирующем буфере; ABCAM ab1791 общего гистона H3, разведение 1:5000 в блокирующем буфере) добавляют в каждую лунку соответствующих планшетов и инкубируют при комнатной температуре в течение 1,5 часа. После следующего цикла промывок промывочным буфером (PBS, 0,05% Tween 20) 100 мл вторичного антитела (против Rb-IgG-HRP, Cell Signaling 7074) с разбавлением 1:2000 (H3K27Me3 и Me2) или 1:10000 (всего Н3) добавляют в каждую лунку и планшет инкубируют при комнатной температуре в течение 1,5 часов. После очередного цикла промывок буфером для промывки (PBS, 0,05% Tween 20) детектирование проводят добавлением 100 мкл субстрата TMB (Thermo Scientific, N301) в каждую лунку, планшет инкубируют в течение 10 минут, в каждую лунку добавляют 100 мкл останавливающего раствора (0,16 М серная кислота, свежеприготовленная или приобретенный в Thermo Scientific N600), осторожно встряхивая, и считывают поглощение при 450 нм. Данные анализируют с использованием GraphPad Prism version 7.02. Значения P определяют с использованием однофакторного дисперсионного анализа (ANOVA (критерий множественных сравнений Тьюки).
Пример 1 - Антипролиферативное действие соединения 1 в отношении SCLC клеток DMS114
Активность соединения 1 в отношении EZH2 оценивают на SCLC клетках линии DMS114, содержащих EZH2 дикого типа. Активность в качестве ингибитора EZH2 в клетках определяют измерением относительного количества содержания H3K27Me3. Клетки DMS114 обрабатывают указанными концентрациями соединения 1 в течение 3 дней, и уровни содержания H3K27Me3 измеряют с использованием анализа клеточных вестернов (in-cell western assay), описанного выше. Результаты представлены в таблице 2 и на фигуре 1. На фигуре 1 представлены 5 независимых репликаций биологических испытаний. После 3 дней лечения в диапазоне концентраций от 3 мМ до 0,1 нМ соединение 1 продемонстрировало зависимое от дозы ингибирование в клетках H3K27Me3 со средним значением IC50 9,48 нМ.
Активность соединения 1 в ингибировании клеточной пролиферации SCLC клеток EZH2-WT DMS114 также оценивают с использованием анализа клеточной пролиферации для SCLC клеток линии DMS114, описанного выше. Клетки DMS114 обрабатывают различными концентрациями соединения 1 с использованием 10-точечной кривой дозы (разведение 1:3) в интервале от 3 мкМ до 0,1 нМ в течение 17-21 дня и затем оценивают жизнеспособность клеток. Результаты представлены в таблице 2 и на фигуре 2. На фигуре 2 представлены результаты 6 независимых репликаций биологических экспериментов. Результаты показывают, что соединение 1 проявляет эффективное сильное зависимое от дозы ингибирование пролиферации клеток DMS114 со средним значением IC50 18,8 нМ.
Таблица 2. Клеточная активность соединения 1 в ингибировании H3K27Me3 и клеточной пролиферации в клетках DMS114
IC50=половина максимальной ингибирующей концентрации;
SD=стандартное отклонение
Пример 2 - Оценка синергизма антипролиферативного действия комбинации соединения 1 со стандартным лекарственным средством против SCLC - цисплатином или этопозидом
Ввиду высокой эффективности соединения 1 в ингибировании роста SCLC клеточной линии DMS114 исследуют действие соединения 1 в комбинации с действующим стандартом химиотерапевтических средств для лечения SCLC. Эксперименты проводят с использованием анализа ингибирования роста SCLC клеток линии DMS114 в соответствии с методом, описанным выше; полученные результаты представлены на фигурах 3 и 4. На фигуре 3 показана кривая IC50 для соединения 1, введенного отдельно, и для комбинации соединения 1 с цисплатином. На фигуре 4 показана кривая IC50 для соединения 1, введенного отдельно, и для комбинации соединения 1 с этопозидом. Эти эксперименты показывают, что предварительное лечение соединением 1 значительно увеличивает антипролиферативное действие как цисплатина, так и этопозида в клетках DMS114. На фигурах 3 и 4 также показаны результаты дополнительного анализа данных комбинированного применения с использованием модели аддитивности (ADD) Леви (Loewe), которая описана выше. Этот анализ показывает, что уровень ингибирования роста, достигнутый в дозах выше IC50 обоими соединениями, был выше, чем ожидаемый уровень аддитивного действия этих соединений.
Пример 3 - Соединение 1 в качестве единственного средства ингибирует рост опухоли in vivo в модели SCLC ксенотрансплантата DLC114
Противоопухолевую эффективность соединения 1 тестируют in vivo в модели SCLC ксенотрансплантата DMS114 с использованием протокола исследования ксенотрансплантата in vivo, описанного выше. Определение групп исследования, схемы приема и способы введения представлены на фигуре 5. Соединение 1 показывает зависимую от дозы эффективность с максимальным ингибированием роста опухоли (TGI) от 69% до 79% при введении в дозе 300 мг/кг два раза в день (BID). На 20-й день после имплантации опухолевых клеток мышей рандомизируют в группы лечения в зависимости от размера опухоли. Среднее геометрическое для размеров опухоли при рандомизации в каждой группе составляет примерно 160 мм3. Из результатов, представленных на фигуре 5, видно, что соединение 1 при введении в дозе 100 мг/кг и 300 мг/кг два раза в день (BID) показывает в значительной степени более высокое противоопухолевое действие по сравнению с контрольной группой, которой вводят разбавитель. Наибольшая доза 300 мг/кг (BID) показывает значительную эффективность в TGI по сравнению с дозами 30 мг/кг и 100 мг/кг - обе при введении BID (день 55; двусторонний t-критерий). В группах монотерапии соединением 1 полных регрессий опухоли не наблюдается. Соединение 1 хорошо переносится с ограниченной потерей массы тела.
Пример 4. Соединение 1 в качестве монотерапии демонстрирует зависимое от дозы ингибирование биомаркеров H3K27Me3 и Me2 в модели in vivo SCLC ксенотрансплантата клеток DMS114
Активность in vivo соединения 1 против EZH2 в модели SCLC ксенотрансплантата клеток DMS114 определяют измерением относительного количества уровней содержания H3K27Me3 и Me2 в клетках с помощью твердофазного иммуноферментного анализа (enzyme-linked immunosorbent essay - ELISA) с использованием образцов опухолевой ткани, собранных в 55-й день исследования, описанного в примере 3 выше. Результаты представлены на фигуре 6. Соединение 1 показывает зависимое от дозы ингибирование H3K27Me3 и Me2 в образцах опухоли с максимальным ингибированием 96% и 82% для H3K27Me3 и Me2, соответственно, в дозе 300 мг/кг (BID).
Пример 5- Комбинированное применение соединения 1 с цисплатином показывает более высокую противоопухолевую активность в модели SCLC ксенотрансплантата DMS114
Противоопухолевую эффективность соединения 1 в комбинации с цисплатином тестируют in vivo в модели SCLCксенотрансплантата EZH2-WT DMS114 использованием протокола исследования ксенотрансплантата in vivo, описанного выше. Определение групп исследования, схем приема и способов введения представлено в таблице 1. Результаты показаны на фигуре 7. На 55-й день в отдельных группах лечения только цисплатином и только соединением 1 все опухоли прогрессируют и превосходят размер опухоли начала лечения, даже если после введения цисплатина наблюдалось прерывистое уменьшение размера опухоли. В противоположность этому, в группе комбинированного лечения 6 из 12 опухолей регрессируют по сравнению с начальной массой опухоли. К 55 дню при комбинированном лечении наблюдаемое значение TGI составляет 95% и превосходит значение TGI, полученное при монотерапии цисплатином (TGI 51%; P=0,019 в сравнении с цисплатином) и соединением 1 (TGI 50%; P=0,016, в сравнении с 100 мг/кг соединения 1). Лечение цисплатином прекращают после 3-й дозы в группах с одним агентом и в комбинации, поскольку оно вызывает потерю массы тела у мышей (фигура 7). Лечение одним соединением 1 хорошо переносится (фигура 7), в то время как комбинация соединения 1 с цисплатином показывает потерю массы тела, которая превосходит потерю массы в группе, получавшей монотерапию цисплатином (P <0,05 для всех измерений на 27-й день и позднее, двусторонний t-критерий Стьюдента).
Для оценки влияние ингибирования EZH2 на длительность ответа группу монотерапии цисплатином и группу комбинированной терапии оставляют на исследование после 55-го дня. В обеих группах лечения последнее лечение цисплатином проводят в день 42. В комбинированной группе последующее введение в качестве монотерапии соединения 1 продолжают в качестве поддерживающей терапии в течение дополнительных 3 недель (без введения цисплатина). Результаты представлены на фигуре 7. Поддерживающая доза соединения 1 продлевает регрессию опухоли в группе комбинированного лечение еще на 34 дня после прекращения введения цисплатина, в то время как все опухоли в группе монотерапии цисплатином без дальнейшего дополнительного лечения прогрессировали. В комбинированной группе и после прекращения введения цисплатина массы тела полностью восстанавливаются во время поддерживающей дозы соединения 1, что указывает на минимальную токсичность поддерживающей дозы соединения 1 (фигура 7).
Кроме того, из данных, представленных на фигурах 8 и 9, видно, что комбинация цисплатина и соединения 1 обеспечивает значительное преимущество в выживаемости по сравнению с разбавителем или монотерапией соединением 1 или цисплатином. Для определения выживаемости устанавливают максимальную опухолевую нагрузку на уровне 500 мм3. Группа введения 100 мг/кг (BID) соединения 1 и группы монотерапии цисплатином не достигают уровня значимости P<0,05 в логарифмическом тесте (Mantel-Cox) по сравнению с контрольной группой носителя. Медиана выживаемости увеличивается до 74,5 дня в комбинации в сравнении с 34 днями носителя, 39 днями соединения 1 в дозе 100 мг/кг (BID) и 37,5 дней в группах введения цисплатина.
Таким образом, соединение 1 показывает зависимое от дозы ингибирование роста опухоли in vivo в модели SCLC ксенотрансплантата DLC114. Зависимое от дозы ингибирование также коррелирует с сильным ингибированием биомаркеров FI3K27Me3 и Me2. Исследование минимальных наблюдаемых изменений массы тела приводит к выводу, что введение соединения 1 хорошо переносится мышами. Введение комбинации соединения 1 с цисплатином, который представляет собой стандарт первой линии, значительно увеличивает как противоопухолевую эффективность, так и длительность сохранения противоопухолевого ответа по сравнению с монотерапией цисплатином, что приводит к значительному увеличению выживаемости. Кроме того, описанные неклинические исследования показывают, что соединение 1 ингибирует каталитическую активность EZH2 in vivo, что определяется ингибированием FI3K27Me3 и Me2, вызывая значительное ингибирование роста опухоли как в качестве отдельного агента, так и в комбинации с цисплатином в этой модели SCLC ксенотрансплантата DLC114.
Пример 6. Антипролиферативное действие соединения 1 в дополнительныхой клеточной линии SCLC
Исходя из показанной высокой активности соединения 1 в клетках DMS114 (см. пример 1 выше), антипролиферативную активность соединения 1 также тестируют на 3 дополнительных клеточных линиях SCLC, а именно H841, H446 и H69, с использованием анализа пролиферации клеток, описанного выше. Каждую клеточную линию обрабатывают различными концентрациями соединения 1 с использованием 10-точечной кривой дозы (разведение 1:3 в ДМСО) в интервале от 3 мкМ до 0,1 нМ в течение 21 дня, а затем оценивают жизнеспособность клеток. Результаты представлены на фигуре 10 (H841), фигуре 11 (FI446) и фигуре 12 (H69). После 21 дня лечения соединение 1 показывает значительное дозозависимое ингибирование пролиферации клеток со средним значением IC50 73,15 нМ в клеточной линии H841; 108,6 нМ в клеточной линии H446; и 224,1 нМ в клеточной линии H69.
Пример 7- Оценка антипролиферативного синергизма комбинации соединения 1 и стандартного лекарственного средства для лечения SCLC - цисплатина или этопозида - в клеточных линиях H841, H446 и H69
Исходя из показанной высокой активности соединения 1 в ингибировании роста клеточных линий SCLC H841, H446 и H69, исследуют комбинацию соединения 1 с действующим стандартом химиотерапевтических средств лечения SCLC - цисплатином или этопозидом. Эксперименты проводят с использованием анализа ингибирования роста SCLC клеток линий H841, H446 или H69 в соответствии с методом, описанным выше; полученные результаты представлены на фигурах 13 и 14 (клеточная линия H841); фигурах 15 и 16 (клеточная линия H446) и фигурах 17 и 18 (клеточная линия H69). На фигурах 13, 15 и 17 представлена кривая IC50 для соединения 1, вводимого отдельно и в комбинации с цисплатином. На фигурах 14, 16 и 18 показана кривая IC50 для соединения 1, вводимого отдельно и в комбинации с этопозидом. Как и в случае с DMS114, эти эксперименты показывают, что преварительное лечение соединением 1 значительно повышает антипролиферативное действие как цисплатина, так и этопозида в клеточных линиях H841, H446 и H69.
На фигурах 13-18 также представлены результаты дополнительного исследования комбинированного введения с использованием модели аддитивности Леви (ADD), которая описана выше. Этот анализ показывает, что уровень ингибирования роста, достигнутый при дозах выше IC50 для обоих соединений по меньшей мере является таким или превосходит ингибирование, ожидаемое при аддитивном действии комбинаций обоих соединений.
Пример 8. Соединение 1 индуцирует экспрессию SLFN11 в клеточных линиях SCLC
Чтобы понять потенциальные механизмы, ответственные за синергизм EZH2i, наблюдаемый с химиотерапевтическими агентами, оценивают влияние обработки соединением 1 на экспрессию SLFN11, сенсибилизатора к агентам, повреждающим ДНК. Несколько клеточных линий SCLC обрабатывают 500 нМ соединения 1 в течение 7 дней, и изменения содержания белка SLFN1 1 оценивают с использованием вестерн-блоттинга в соответствии с методикой, описанной выше. Результаты представлены на фигуре 19. Полученные результаты показывают, что значительная индукция экспрессии SLFN11 наблюдается в нескольких клеточных линиях после обработки соединением 1.
Пример 9.Комбинация соединения 1 и стандартного средства для лечения SCLC цисплатина вызывает повышение повреждения ДНК в клеточных линиях SCLC
Влияние соединения 1 в комбинации химиотерапевтическим средством цисплатином на повреждение ДНК оценивают с использованием окрашивания y-H2AX маркером повреждения ДНК или оценки повреждения ДНК с помощью кометного анализа (COMET) в соответствии с методикой, описанной выше. Клеточные линии SCLC H841 или H69 предварительно обрабатывают соединением 1 в течение 7 дней с последующей совместной обработкой с цисплатином в течение 16 часов (y-H2AX) или 3 дней (COMET). Результаты представлены на фигурах 20-22. Представленные на фигуре 20 результаты исследования клеточной линии H841 показывают, что значительное повышение образования очагов у-H2AX наблюдается в клетках, обработанных комбинацией, по сравнению с клетками, обработанными любой монотерапией. Представленные на фигуре 21 результаты исследования клеточной линии H841 показывают, что значительное повышение повреждения ДНК (COMET) наблюдается в клетках, обработанных комбинацией, по сравнению с клетками, обработанными любой монотерапией. Аналогичные результаты получают в кометном анализе клеточной линии H69 (см. фигуру 22).
Все публикации и патенты/патентные заявки, которые цитировались в описании, включены в настоящее описание в виде ссылки. Хотя вышеизложенное изобретение описано более подробно с помощью иллюстрации и примера, специалистам в данной области техники будет понятно, что в объем изобретения могут быть внесены определенные изменения и модификации без выделения их из сущности или объема прилагаемой формулы изобретения.
Реферат
Группа изобретений относится к фармацевтической промышленности, а именно к лечению мелкоклеточного рака легких. Способ лечения мелкоклеточного рака легких у субъекта, включающий введение субъекту синергетической комбинированной терапии, которая включает 5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(R)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-он и цисплатин. Синергическая комбинация 5,8-дихлор-2-[(4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил]-7-[(R)-метокси(оксетан-3-ил)метил]-3,4-дигидроизохинолин-1(2H)-она и цисплатина для лечения мелкоклеточного рака легких. Вышеописанные способ и комбинация эффективны для лечения мелкоклеточного рака легких за счет синергической комбинированной терапии. 2 н. и 4 з.п. ф-лы, 22 ил., 2 табл., 9 пр.

Комментарии