Создание гаплоидных растений и усовершенствование селекции растений - RU2571927C2
Код документа: RU2571927C2
Чертежи












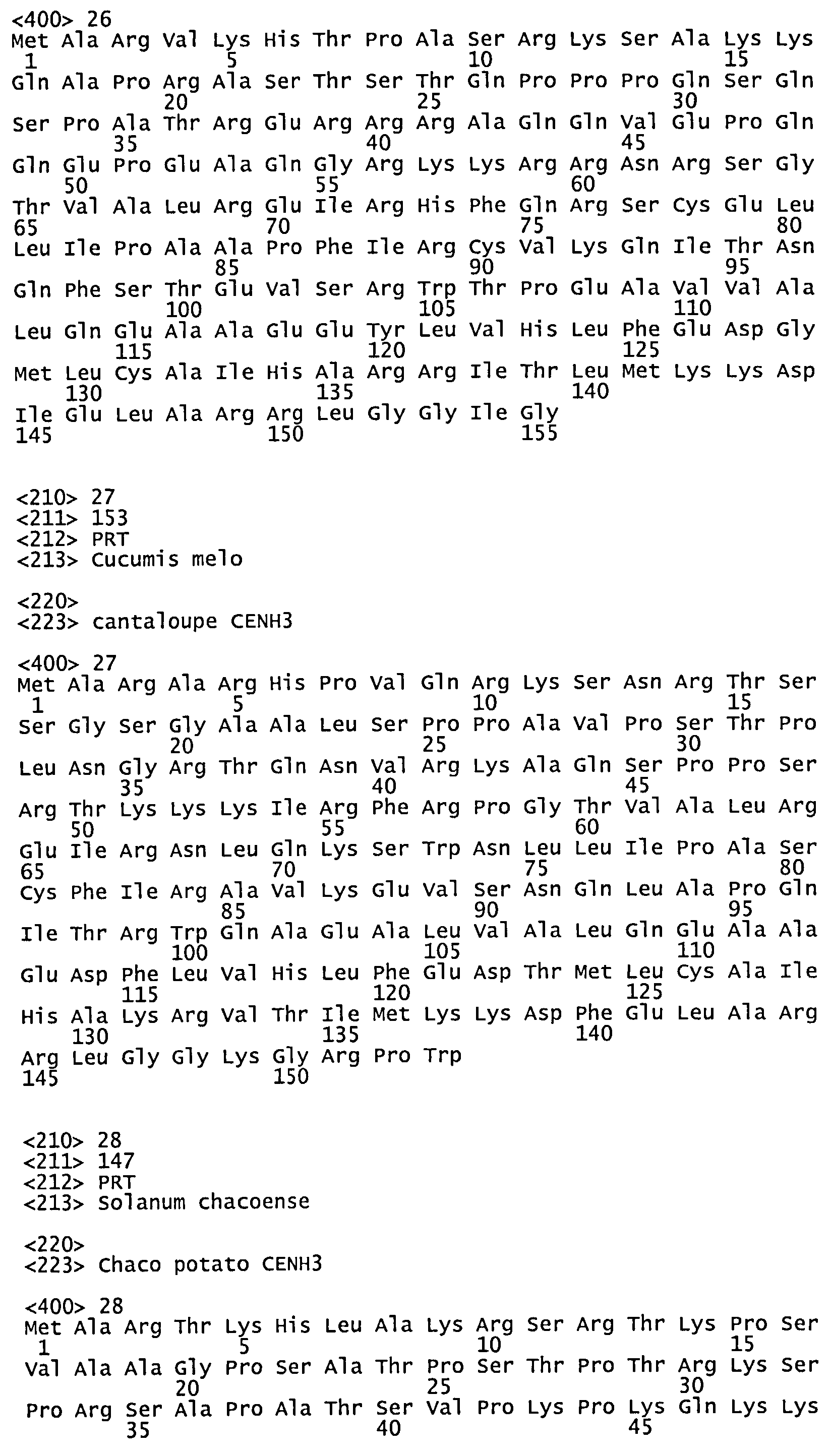


























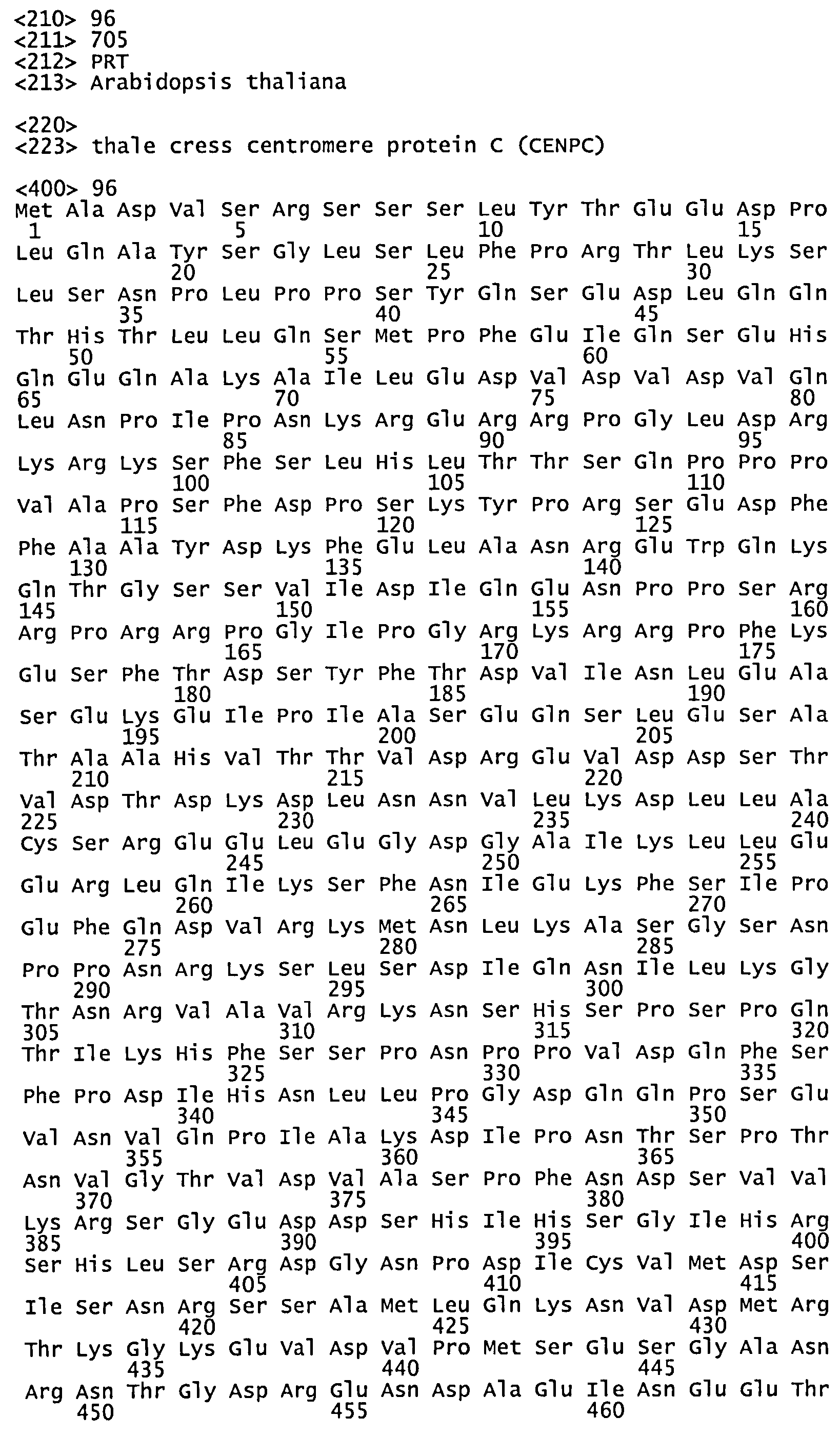







Описание
Перекрестная ссылка на родственные патентные заявки
Настоящая заявка претендует на приоритет от предварительной заявки на патент США N61/248996, поданной 6 октября 2009 г., которая включена путем ссылки.
Уровень техники
Хотя программы по выведению растений по всему миру проделали значительный прогресс, произведя новые сорта культурных растений с большей устойчивостью к болезням, лучшей урожайностью и другими полезными характеристиками, селекция в целом зависит от скрининга множества растений для идентификации новых желательных характеристик. Зачастую нужно за несколько лет вырастить и оценить очень большое количество потомков от скрещивания для того, чтобы отобрать одно или несколько растений с желательной комбинацией признаков.
При стандартной селекции диплоидных растений зачастую требуется проводить скрининг и обратное скрещивание большого числа растений, чтобы получить нужный генотип. Одно из решений проблемы скрининга большого числа потомков заключается в получении гаплоидных растений, хромосомы которых можно удвоить с помощью колхицина или другим способом и незамедлительно получить гомозиготные, дигаплоидные растения.
Таким образом, заметного улучшения в экономике селекции можно достичь путем получения дигаплоидов, так как эффективность селекции и других процедур можно заметно улучшить при использовании чистокровного (гомозиготного) потомства. По системе получения дигаплоидов гомозиготность достигается за одно поколение. При этом производитель может исключить многочисленные циклы инбридинга, необходимые при обычных способах для достижения практического уровня гомозиготности. На самом деле настоящая гомозиготность по всем признакам вообще недостижима при обычных способах селекции.
Сущность изобретения
Настоящим изобретением предусмотрены новые способы получения гаплоидных организмов.
В некоторых воплощениях изобретением предусмотрены трансгенные растения, содержащие экспрессионную кассету для гетерологичного трансгена, причем экспрессионная кассета содержит промотор, функционально связанный с полинуклеотидом, кодирующим рекомбинантно измененный полипептид CENH3, CENPC, MIS 12, NDC80 или NUF2, при этом, если рекомбинантно измененный полипептид экспрессируется в первом растении, содержащем соответствующий инактивированный эндогенный ген CENH3, CENPC, MIS 12, NDC80 или NUF2, и первое растение подвергается скрещиванию с растением дикого типа, то по меньшей мере 0,1% полученного потомства будет гаплоидным.
В некоторых воплощениях у растения один или два аллеля эндогенной геномной кодирующей последовательности CENH3, CENPC, MIS 12, NDC80 или NUF2 инактивированы или нокаутированы. В некоторых воплощениях все аллели эндогенной геномной кодирующей последовательности CENH3, CENPC, MIS 12, NDC80 или NUF2 растения инактивированы или нокаутированы. В некоторых воплощениях растения при скрещивании с растением дикого типа дают по меньшей мере 0,1% (или же 0,5, 1, 2, 5, 10, 20% или больше) гаплоидного потомства.
В некоторых воплощениях полипептид является рекомбинантно измененным полипептидом CENH3. В некоторых воплощениях полипептид содержит гетерологичную аминокислотную последовательность из по меньшей мере 5 аминокислот, соединенную с белком, содержащим домен гистоновой складки CENH3, причем эта аминокислотная последовательность гетерологична домену гистоновой складки CENH3. В некоторых воплощениях гетерологичная последовательность непосредственно соединяется с доменом гистоновой складки CENH3 и в полипептиде отсутствует хвостовой домен CENH3. В некоторых воплощениях гетерологичная аминокислотная последовательность соединяется с доменом гистоновой складки CENH3 через промежуточную белковую последовательность. В некоторых воплощениях промежуточная белковая последовательность содержит хвостовой домен не CENH3, а другого гистона НЗ. В некоторых воплощениях хвостовой домен другого гистона НЗ, чем CENH3, содержит аминокислотную последовательность, которая по меньшей мере на 70% идентична SEQ ID NO: 95 или ее фрагменту длиной по меньшей мере в 20 аминокислот.
В некоторых воплощениях промежуточная белковая последовательность содержит хвостовой домен CENH3. В некоторых воплощениях промежуточная белковая последовательность содержит хвостовой домен гистона НЗ и гетерологичный хвостовой домен гистона CENH3. В некоторых воплощениях хвостовой домен CENH3 гетерологичен домену гистоновой складки CENH3.
В некоторых воплощениях гетерологичная аминокислотная последовательность составляет по меньшей мере 10 аминокислот.В некоторых воплощениях промежуточная белковая последовательность содержит хвостовой домен гистона НЗ и гетерологичный хвостовой домен гистона CENH3, а гетерологичная аминокислотная последовательность содержит зеленый флуоресцентный белок. В некоторых воплощениях гетерологичная аминокислотная последовательность разрушает центромеры. В некоторых воплощениях домен гистоновой складки CENH3 выбирается из группы, состоящей из SEQ ID NO: 49-94.
В некоторых воплощениях полипептид содержит хвостовой другой домен, чем домен CENH3, соединенный с доменом гистоновой складки CENH3.
В некоторых воплощениях полипептид содержит домен гистоновой складки CENH3 и укороченный хвостовой домен CENH3, при этом N-конец хвостового домена укорочен относительно эндогенного хвостового домена растения. В некоторых воплощениях в укороченном хвостовом домене CENH3 отсутствуют три или больше N-концевых аминокислот эндогенного хвостового домена. В некоторых воплощениях гетерологичная аминокислотная последовательность соединяется с N-концом укороченного хвостового домена. В некоторых воплощениях гетерологичная аминокислотная последовательность имеет длину по меньшей мере в 10 аминокислот.В некоторых воплощениях гетерологичная аминокислотная последовательность содержит зеленый флуоресцентный белок. В некоторых воплощениях гетерологичная аминокислотная последовательность разрушает центромеры. В некоторых воплощениях домен гистоновой складки CENH3 выбирается из группы, состоящей из SEQ ID NOs: 49-94.
В некоторых воплощениях полипептид представляет собой рекомбинантно измененный полипептид CENPC, MIS 12, NDC80 или NUF2.
Настоящим изобретением также предусмотрена выделенная нуклеиновая кислота, содержащая полинуклеотид, кодирующий полипептид, причем полипептид содержит:
хвостовой домен не из CENH3, соединенный с доменом гистоновой складки CENH3; или
укороченный хвостовой домен CENH3, соединенный с доменом гистоновой складки CENH3, причем укорочен N-конец хвостового домена.
Настоящим изобретением также предусмотрены растения, содержащие молчащий ген CENH3 или одну или две копии аллеля нокаутированного, инактивированного или мутированного эндогенного гена CENH3.
Настоящим изобретением также предусмотрен способ получения гаплоидных растений, который включает:
скрещивание растения, экспрессирующего эндогенный белок CENH3, с трансгенным растением, содержащим экспрессионную кассету для гетерологичного трансгена, причем экспрессионная кассета содержит промотор, функционально связанный с полинуклеотидом, кодирующим рекомбинантно измененный полипептид CENH3, CENPC, MIS 12, NDC80 или NUF2, при этом, если рекомбинантно измененный полипептид экспрессируется в первом растении, содержащем соответствующий инактивированный эндогенный ген CENH3, CENPC, MIS 12, NDC80 или NUF2, и первое растение подвергается скрещиванию с растением дикого типа, то по меньшей мере 0,1% полученного потомства будет гаплоидным; и
отбор гаплоидного потомства F1, полученного в результате скрещивания.
В некоторых воплощениях растение, экспрессирующее эндогенный белок CENH3, является опылителем (донором пыльцы) при скрещивании.
В некоторых воплощениях растение, экспрессирующее эндогенный белок CENH3, является опыляемым (донором семяпочки) при скрещивании.
В некоторых воплощениях способ дополнительно включает превращение по меньшей мере одного отобранного гаплоидного растения в дигаплоид.
Способ получения трансгенных растений, содержащих экспрессионную кассету для гетерологичного трансгена, включающую промотор, функционально связанный с полинуклеотидом, кодирующим рекомбинантно измененный полипептид CENH3, CENPC, MIS 12, NDC80 или NUF2, при этом, если рекомбинантно измененный полипептид экспрессируется в первом растении, содержащем соответствующий инактивированный эндогенный ген CENH3, CENPC, MIS 12, NDC80 или NUF2, и первое растение подвергается скрещиванию с растением дикого типа, то по меньшей мере 0,1% полученного потомства будет гаплоидным, причем способ включает:
трансформирование растительных клеток нуклеиновой кислотой, содержащей экспрессионную кассету; и
отбор трансформантов, содержащих нуклеиновую кислоту, получая при этом растение.
В некоторых воплощениях настоящим изобретением предусмотрен выделенный полинуклеотид, кодирующий полипептид, причем полипептид содержит:
аминокислотную последовательность по меньшей мере из 5 аминокислот, соединенную с белком, содержащим домен гистоновой складки CENH3, при этом аминокислотная последовательность гетерологична домену гистоновой складки CENH3; или
белок, содержащий домен гистоновой складки CENH3 и укороченный хвостовой домен CENH3, причем укорочен N-конец хвостового домена.
В некоторых воплощениях гетерологичная аминокислотная последовательность непосредственно соединяется с доменом гистоновой складки CENH3. В некоторых воплощениях у полипептида отсутствует хвостовой домен CENH3.
В некоторых воплощениях гетерологичная аминокислотная последовательность соединяется с доменом гистоновой складки через промежуточную белковую последовательность. В некоторых воплощениях промежуточная белковая последовательность содержит хвостовой домен не CENH3, а другого гистона НЗ. В некоторых воплощениях промежуточная белковая последовательность содержит хвостовой домен CENH3. В некоторых воплощениях хвостовой домен CENH3 гетерологичен домену гистоновой складки CENH3. В некоторых воплощениях хвостовой домен другого гистона НЗ, чем CENH3, содержит аминокислотную последовательность, которая по меньшей мере на 70% идентичную SEQ ID NO: 95, или ее фрагмент длиной по меньшей мере в 20 аминокислот. В некоторых воплощениях промежуточная белковая последовательность содержит хвостовой домен гистона НЗ и хвостовой домен гетерологичного гистона CENH3.
В некоторых воплощениях гетерологичная аминокислотная последовательность имеет длину по меньшей мере в 3, 5, 10, 15, 20, 30 или 50 аминокислот, причем у нее необязательно отсутствует фиксированная вторичная структура.
В некоторых воплощениях гетерологичная аминокислотная последовательность содержит зеленый флуоресцентный белок.
В некоторых воплощениях гетерологичная аминокислотная последовательность разрушает центромеры.
В некоторых воплощениях домен гистоновой складки CENH3 выбирается из группы, состоящей из SEQ ID NOs: 49-94.
В некоторых воплощениях полипептид включает белок, содержащий домен гистоновой складки CENH3 и укороченный хвостовой домен CENH3, причем укорочен N-конец хвостового домена.
В некоторых воплощениях в укороченном хвостовом домене CENH3 отсутствует по меньшей мере 1, 2, 3, 4, 5, 6, 10, 15 или 20 N-концевых аминокислот эндогенного хвостового домена. В некоторых воплощениях гетерологичная аминокислотная последовательность соединяется N-концом укороченного хвостового домена. В некоторых воплощениях гетерологичная аминокислотная последовательность имеет длину по меньшей мере в 3, 5, 10, 15, 20, 30 или 50 аминокислот. В некоторых воплощениях гетерологичная аминокислотная последовательность содержит зеленый флуоресцентный белок. В некоторых воплощениях гетерологичная аминокислотная последовательность разрушает центромеры.
В некоторых воплощениях домен гистоновой складки CENH3 выбирается из группы, состоящей из SEQ ID NOs: 49-94.
Настоящим изобретением также предусмотрена экспрессионная кассета, содержащая любой из перечисленных выше полинуклеотидов, причем экспрессионная кассета содержит промотор, функционально связанный с полинуклеотидом, кодирующим полипептид. В некоторых воплощениях изобретением предусмотрен вектор, содержащий экспрессионную кассету.
В некоторых воплощениях изобретением предусмотрено растение, содержащее экспрессионную кассету.
В некоторых воплощениях гетерологичный хвостовой домен содержит хвостовой домен гистона НЗ или хвостовой домен гетерологичного гистона CENH3.
В некоторых воплощениях полипептид содержит хвостовой домен гистона НЗ и хвостовой домен гистона CENH3.
В некоторых воплощениях растение содержит молчащий ген CENH3 либо одну или две копии аллеля нокаутированного или мутированного эндогенного гена CENH3.
В некоторых воплощениях экспрессионная кассета встраивается в хромосому растения.
Настоящим изобретением также предусмотрено растение, содержащее молчащий ген CENH3 либо одну или две копии аллеля нокаутированного или мутированного эндогенного гена CENH3.
Настоящим изобретением также предусмотрен способ получения гаплоидных растений. В некоторых воплощениях способ включает скрещивание растения, экспрессирующего эндогенный белок CENH3, с растением, описанным выше (например, экспрессирующим белок tailswap); и отбор гаплоидного потомства F1, полученного от скрещивания.
В некоторых воплощениях растение, экспрессирующее эндогенный белок CENH3, является опылителем (донором пыльцы) при скрещивании.
В некоторых воплощениях растение, экспрессирующее эндогенный CENH3 белок, является опыляемым (донором семяпочки) при скрещивании.
В некоторых воплощениях способ дополнительно содержит превращение по меньшей мере одного отобранного гаплоидного растения в дигаплоид.
Другие аспекты изобретения станут понятными из приведенного дальнейшего текста.
Определения
"Эндогенная" последовательность гена или белка означает не рекомбинантную последовательность организма в том виде, как она присутствует в организме до вызванной человеком мутации последовательности. "Мутированная" последовательность означает измененную человеком последовательность. Примеры вызванных человеком мутаций включают воздействие на организм высокой дозы химического, радиологического или инсерционного мутагена в целях селекции мутантов, а также рекомбинантные изменения последовательности. Примеры вызванных человеком рекомбинантных изменений могут включать, например, слияния, вставки, делеции и/или изменения последовательности.
Термин "промотор" обозначает участки или последовательности, расположенные до и/или после начала транскрипции и участвующие в распознавании и связывания РНК-полимеразы и других белков для инициации транскрипции. "Растительный промотор" есть такой промотор, который способен инициировать транскрипцию в растительных клетках. Растительный промотор может представлять собой, хотя и необязательно, последовательность нуклеиновой кислоты, исходно выделенную из растения.
Термин "функционально связанный" обозначает функциональную связь между последовательностью, которая контролирует экспрессию нуклеиновой кислоты (как-то промотор или набор сайтов связывания транскрипционных факторов) и последовательностью второй нуклеиновой кислоты, причем последовательность, которая контролирует экспрессию направляет транскрипцию нуклеиновой кислоты, соответствующей второй последовательности.
Термин "растение" включает целые растения, отдельные вегетативные органы/ структуры (например, листья, стебли и клубни), корни, цветки и цветковые органы/структуры (например, прицветники, чашелистики, лепестки, тычинки, плодолистики, пыльники и семяпочки), семена (включая зародыш, эндосперму и семенную оболочку) и плоды (зрелую завязь), растительные ткани (например, проводящую ткань, основную паренхиму и др.) и клетки (например, замыкающие клетки, яйцеклетки, трихомы и др.) и их потомство. Класс растений, которые можно использовать в способе изобретения, в общем так же обширен, как и класс высших и низших растений, поддающихся методам трансформации, включая покрытосемянные (однодольные и двудольные растения), голосемянные, папоротники и многоклеточные водоросли. Сюда входят растения разного уровня плоидности, включая анеуплоидные, полиплоидные, диплоидные, гаплоидные и гемизиготные.
Полинуклеотидная или полипептидная последовательность "гетерологична" организму или второй последовательности, если она происходит из другого вида, а если из того же вида, то она модифицирована от своей первоначальной формы. Например, если промотор функционально связан с гетерологичной кодирующей последовательностью, то кодирующая последовательность взята из другого вида чем тот, из которого был получен промотор, а если из того же вида, то кодирующая последовательность не связана естественным образом с промотором (например, генетически сконструированная кодирующая последовательность либо аллель из другого экотипа или разновидности). В другом примере хвостовой домен CENH3 из первого вида гетерологичен домену гистоновой складки CENH3 из второго вида.
"Рекомбинантный" означает созданный человеком полинуклеотид либо копию или комплемент созданного человеком полинуклеотида. Например, рекомбинантная экспрессионная кассета, содержащая промотор, функционально связанный со вторым полинуклеотидом, может включать промотор, гетерологичный второму полинуклеотиду в результате действий человека (например, методами, описанными в Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York (1989) или Current Protocols in Molecular Biology, vol. 1-3, John Wiley & Sons, Inc. (1994-1998). В другом примере рекомбинантная экспрессионная кассета может содержать полинуклеотиды, скомбинированные таким образом, что их исключительно трудно найти в природе. К примеру, созданные человеком сайты рестрикции или последовательности плазмидных векторов могут фланкировать или отделять промотор от второго полинуклеотида. Специалистам в данной области известно, что полинуклеотиды могут быть созданы множеством способов и не ограничиваются вышеприведенными примерами.
Термин "трансген" известен в данной области и обозначает гетерологичную нуклеиновую кислоту, введенную в клетку человеком методами молекулярной обработки клеточного генома (например, методом молекулярной трансформации). При этом "трансгенное растение" представляет собой растение, содержащее трансген, т.е. это генетически модифицированное растение. Трансгенным растением может быть исходное растение, в которое вводился трансген, а также его потомство, в геноме которого содержится трансген.
Термин "соответствующий" в настоящем изобретении означает то же самое, что и "соответственный". Например, если говорится, что растение содержит рекомбинантно измененную копию белка, выбранного из А, В и С, то растение также содержит "соответствующую" мутантную эндогенную копию гена, выбранного из генов, кодирующих А, В или С, а если растение содержит рекомбинантно измененный белок А, то соответствующая мутантная эндогенная копия также будет А. С другой стороны, если растение содержит рекомбинантно измененный белок В, то соответствующая мутантная эндогенная копия также будет В и т.д.
Выражение "нуклеиновая кислота" или "полинуклеотидная последовательность" относится к одноцепочечным или двухцепочечным полимерам дезоксирибонуклеотидных или рибонуклеотидных оснований, считываемых от 5' к 3' концу. Нуклеиновые кислоты также могут включать и такие модифицированные нуклеотиды, которые позволяют правильное считывание их полимеразой и/или образование двухцепочечных дуплексов и не изменяют существенно экспрессию полипептида, кодируемого этой нуклеиновой кислотой.
Выражение "последовательность нуклеиновой кислоты, кодирующей" относится к нуклеиновой кислоте, направляющей экспрессию определенного белка или пептида. Последовательности нуклеиновой кислоты включают как последовательность нити ДНК, транскрибируемой в РНК, так и последовательность РНК, транслируемой в белок. Последовательности нуклеиновой кислоты включают как последовательности нуклеиновой кислоты полной длины, так и неполные последовательности нуклеиновой кислоты, полученные из полноразмерных последовательностей. Следует также иметь в виду, что последовательность включает вырожденные кодоны природной последовательности или же последовательности, которые могут вводиться для обеспечения предпочтительности кодонов в определенных клетках хозяина.
Выражение "клетки хозяина" относится к клеткам из любого организма. Типичные клетки хозяина происходят из растений, бактерий, дрожжей, грибов, насекомых или других животных. Методы введения полинуклеотидных последовательностей в различные типы клеток хозяина хорошо известны в данной области.
"Экспрессионная кассета" означает конструкцию из нуклеиновой кислоты, которая при введении в клетки хозяина (например, растительные клетки), вызывает транскрипцию и/или трансляцию РНК или полипептида, соответственно. Экспрессионная кассета может вызывать транскрипцию без трансляции, к примеру, когда транскрипции подвергается миРНК или другая не кодирующая белок РНК.
Две последовательности нуклеиновой кислоты или полипептидов считаются - "идентичными", если последовательность нуклеотидов или аминокислотных остатков, соответственно, в двух последовательностях будет одинаковой при выравнивании их на максимальное соответствие, как описано ниже. Термин "комплементарная" означает то, что данная последовательность комплементарна всей или части последовательности контрольного полинуклеотида.
Примерами алгоритмов, подходящих для определения степени идентичности последовательностей и сходства последовательностей, являются алгоритмы BLAST и BLAST 2.0, описанные в Altschul et al., Nuc. Acids Res. 25:3389-3402 (1977), и Altschul et al., J. Mol. Biol. 215:403-410 (1990), соответственно. Программное обеспечение для анализа методом BLAST общедоступно в сети через National Center for Biotechnology Information (www.ncbi.nlm.nih.gov/). Этот алгоритм включает сначала идентификацию получивших высокие баллы пар последовательностей (HSPs) путем идентификации коротких слов длиной W во введенной последовательности, которые либо совпадают, либо удовлетворяют некоему положительному значению порогового показателя Т при выравнивании со словом такой же длины в последовательности из базы данных. Т именуется пороговым показателя близости слов (Altschul et al., supra). Эти найденные близкие слова служат затравками для запуска поисков содержащих их более длинных HSPs. Найденные слова подвергаются удлинению в обоих направлениях вдоль каждой последовательности до тех пор, пока повышается кумулятивный показатель совмещения. Кумулятивный показатель рассчитывается, для нуклеотидных последовательностей, с помощью параметров М (награды за пару совпадающих остатков; она всегда >0) и N (штрафа за несовпадение остатков; он всегда <0). Для расчета кумулятивного показателя для аминокислотных последовательностей используется счетная матрица. Удлинение попавшихся слов в каждом направлении прекращается, когда: кумулятивный показатель совмещения падает на величину Х от своего максимального достигнутого уровня;
кумулятивный показатель доходит до нуля или меньше нуля вследствие накопления дающих отрицательные баллы выравниваний остатков; или по достижении конца любой из последовательностей. Параметры W, Т и Х алгоритма BLAST определяют чувствительность и быстроту выравнивания. В программе BLASTN (для нуклеотидных последовательностей) по умолчанию используется длина слов (W)=11, ожидание (Е)=10, М=5, N=-4 и сравнение обеих нитей. Для аминокислотных последовательностей в программе BLASTP по умолчанию используется длина слов (W)=3, ожидание (Е)=10 и счетная матрица BLOSUM62 (см. Henikoff and Henikoff, Proc. Natl. Acad. Sci. USA 89: 10915, (1989)) совмещения (В)=50, ожидание (Е)=10, М=5, N=-4 и сравнение обеих нитей.
Алгоритм BLAST также осуществляет статистический анализ сходства между двумя последовательностями (например, см. Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5787, (1993)). Одной из мер сходства, предусмотренных алгоритмом BLAST, является наименьшая вероятность суммы (P(N)), которая служит показателем вероятности того, что совпадение между двумя нуклеотидными или аминокислотными последовательностями произойдет случайным образом. Например, нуклеиновая кислота считается сходной с контрольной последовательностью, если при сравнении данной нуклеиновой кислоты с контрольной нуклеиновой кислотой наименьшая вероятность суммы составляет менее 0,2, более предпочтительно менее 0,01 и наиболее предпочтительно менее 0,001.
"Степень идентичности последовательностей" определяется путем сравнения двух оптимально выровненных последовательностей по окошку сравнения, при этом часть последовательности полинуклеотида в окошке сравнения может содержать вставки или делеции (т.е. пробелы) по сравнению с контрольной последовательностью (не содержащей вставок или делеции) для оптимального совмещения этих двух последовательностей. Степень вычисляется в процентах путем определения числа положений, по которым в обеих последовательностях находятся идентичные основания нуклеиновых кислот или аминокислотные остатки, получая число совпадающих положений, деления числа совпадающих положений на общее число положений в окошке сравнения и умножения результата на 100, получая степень идентичности последовательностей в процентах.
Термин "существенная идентичность" последовательностей полинуклеотидов означает то, что полинуклеотид содержит последовательность, которая по меньшей мере на 25% идентична заданной контрольной последовательности. С другой стороны, степень идентичности может составлять любое целое число от 25% до 100%, к примеру, по меньшей мере: 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% при сравнении с контрольной последовательностью с помощью описанных здесь программ, предпочтительно программы BLAST с использованием стандартных параметров, как описано ниже. Специалистам должно быть известно, что приведенные выше значения степени идентичности можно соответствующим образом корректировать для определения идентичности соответствующих белков, кодируемых двумя последовательностями нуклеотидов, принимая во внимание вырожденность кодонов, сходство аминокислот, расположение рамки считывания и др. При этом существенная идентичность аминокислотных последовательностей обычно означает идентичность последовательностей по меньшей мере на 40%. Степень идентичности полипептидов может составлять любое целое число от 40% до 100%, к примеру, по меньшей мере 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99%. В некоторых воплощениях "существенно сходными" являются полипептиды с такими близкими последовательностями, как отмечено выше, за исключением того, что остатки в положениях, не являющихся идентичными, могут отличаться консервативными заменами аминокислот. Консервативная замена аминокислот означает взаимозаменяемость остатков со сходными боковыми цепями. Например, группа аминокислот с алифатическими боковыми цепями представлена глицином, аланином, валином, лейцином и изолейцином;
группа аминокислот с алифатическими гидроксильными боковыми цепями представлена серином и треонином; группа аминокислот с амидосодержащими боковыми цепями представлена аспарагином и глутамином; группа аминокислот с ароматическими боковыми цепями представлена фенилаланином, тирозином и триптофаном; группа аминокислот с основными боковыми цепями представлена лизином, аргинином и гистидином; и группа аминокислот с серосодержащими боковыми цепями представлена цистеином и метионином. Типичные группы консервативных замен аминокислот: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин, аспарагиновая кислота-глутаминовая кислота и аспарагин-глутамин.
Краткое описание фигур
На фиг.1 представлено выравнивание последовательностей различных белков CENH3 (Н3.3 A. thaliana=SEQ ID NO: 1; Н3.3 человека=SEQ ID NO: 2; С.albicans= SEQ ID NO: 106; человек=SEQ ID NO: 107; A. thaliana=SEQ № NO: 10; тополь= SEQ ID NO: 11; рис=SEQ ID NO: 108).
Раскрытие сущности изобретения
I. Введение
Настоящее изобретение основывается, частично, на неожиданном открытии того, что удаление эндогенного CENH3 в сочетании с экспрессией гетерологичного белка, содержащего измененный CENH3, приводит к появлению растений, обладающих полезными свойствами для селекции. Например, когда растение, у которого отсутствует эндогенный белок CENH3 и экспрессируется белок, содержащий (в направлении от N-конца к С-концу) тег GFP, хвостовой домен не CENH3 и домен гистоновой складки CENH3, подвергается скрещиванию с растением, содержащим эндогенный белок CENH3, то у части полученного потомства отсутствуют все хромосомы, полученные от родительского растения, экспрессирующего измененный вариант CENH3. Таким образом, изобретение позволяет получить гаплоидное потомство. Гаплоидные растения полезны, к примеру, для улучшения и ускорения селекции.
CENH3 является представителем кинетохорного комплекса - белковой структуры на хромосомах, к которой прикрепляются волокна митотического веретена во время деления клетки. Не намереваясь ограничивать рамки изобретения, полагаем, что наблюдаемые результаты частично обусловлены образованием такого кинетохорного белка, который действует слабее, чем у дикого типа, при этом образуются функциональные кинетохорные комплексы (к примеру, при митозе), но хромосомы плохо разделяются во время мейоза по сравнению с хромосомами, также содержащими кинетохорные комплексы дикого типа от другого родителя. При этом образуются функциональные кинетохорные комплексы, когда измененный белок является единственной изоформой в клетке, но хромосомы сравнительно плохо разделяются во время митоза, когда родитель с измененными кинетохорами скрещивается с родителем с кинетохорными комплексами дикого типа. Наряду с CENH3, другие кинетохорные белки включают, например, CENPC, MCM21, MIS12, NDC80 и NUF2. Соответственно, настоящим изобретением предусмотрены растения, грибы или животные (или их клетки), которые экспрессируют рекомбинантный мутантный кинетохорный белок (включая, без ограничения, CENH3, CENPC, MCM21, MIS 12, NDC80 и NUF2), который разрушает центромеры, и/или растения, грибы или животные (или их клетки), в которых по меньшей мере одна или обе копии аллеля эндогенного гена CENH3 нокаутированы, мутированы для снижения или устранения его функции или сделаны молчащими. Как разъясняется более подробно ниже, мутантный кинетохорный белок может быть подвергнут мутации многими разными способами, включая, без ограничения, в виде белка "tailswap" (букв. поменяться хвостами), содержащего домен гистоновой складки CENH3 и гетерологичную N-концевую последовательность. Настоящим изобретением также предусмотрены способы получения гаплоидных растений путем скрещивания растений, экспрессирующих мутантный кинетохорный белок (включая, без ограничения, белок tailswap CENH3), но не экспрессирующих эндогенный белок CENH3, с растением, которое экспрессирует эндогенный белок CENH3.
II. Кинетохорные белки
А. Белки CENH3
Белки CENH3 - это хорошо изученный класс белков, которые являются вариантами гистоновых белков НЗ и которые являются специализированными белками, связанными с центромерами. Белки CENH3 характеризуются вариабельным хвостовым доменом, не образующим жесткую вторичную структуру, и консервативным доменом гистоновой складки, состоящим из трех а-спиральных участков, соединенных петлеобразными отрезками. Дополнительные структурные и функциональные свойства белков CENH3 можно найти, например, в Cooper et al., Mol Biol Evol. 21(9): 1712-8 (2004); Malik et al., Nat Struct Biol. 10(11):882-91 (2003); Black et al., Curr Opin Cell Biol. 20(1):91-100 (2008). Белки CENH3 входят в состав кинетохорного комплекса.
Идентифицирован широкий набор белков CENH3. Например, см. SEQ ID NOs: 1-48. Следует иметь в виду, что вышеприведенный список не является исчерпывающим и что имеются и другие последовательности CENH3 из геномных исследований или они могут быть идентифицированы из геномных баз данных или хорошо известными лабораторными методами. Например, если CENH3 определенного растения или другого вида организмов недоступен из баз данных, то его можно идентифицировать или клонировать последовательность гена CENH3 данного организма с помощью праймеров, которые необязательно являются вырожденными, на основе консервативных участков других известных белков CENH3.
В практике настоящего изобретения в общем применяются традиционные методы химии, биохимии, молекулярной биологии, клеточной биологии, генетики, иммунологии и фармакологии, в пределах компетенции специалистов. Такие методы полностью изложены в литературе. Например, см. Gennaro A.R., ed. (1990) Remington's Pharmaceutical Sciences, 18th ed. Mack Publishing Co.; Hardman J.G., Limbird L.E. and Oilman A.G., eds. (2001) The Pharmacological Basis of Therapeutics, 10th ed., McGraw-Hill Co.; Colowick S. et al., eds. Methods in Enzymology, Academic Press, Inc.; Weir D.M. and Blackwell C.C, eds. (1986) Handbook of Experimental Immunology, vols. I-IV, Blackwell Scientific Publications; Maniatis T. et al., eds. (1989) Molecular Cloning: A Laboratory Manual, 2nd edition, vols. I-III, Cold Spring Harbor Laboratory Press; Ausubel F.M. et al., eds. (1999) Short Protocols in Molecular Biology, 4th edition, John Wiley & Sons; Ream et al., eds. (1998) Molecular Biology Techniques: An Intensive Laboratory Course, Academic Press; Newton C.R. and Graham A., eds. (1997) PCR (Introduction to Biotechniques Series), 2nd ed. Springer Verlag.
i. Домен гистоновой складки CENH3
Как отмечено выше, домен гистоновой складки CENH3 является консервативным между белками CENH3 из разных видов. Домен гистоновой складки можно отличить по трем а-спиральным участкам, соединенным петлеобразными отрезками. Хотя известно, что точное местонахождение домена гистоновой складки отличается у белков CENH3 из других видов, но у эндогенного белка CENH3 (дикого типа) он может быть найден на N-конце. Таким образом, в некоторых воплощениях белок CENH3 можно идентифицировать в эндогенном белке по тому, что его N-концевой домен имеет существенное сходство (например, он идентичен по меньшей мере на 30%, 40%, 50%, 60%, 70%, 85%, 90%, 95% или больше) с любой из SEQ ID N0:s 49-94. На фиг.1 представлено выравнивание нескольких белков CENH3 и выделены консервативные зоны в домене гистоновой складки.
Граница между хвостовым доменом и доменом гистоновой складки у белков CENH3 находится в пределах или вблизи (т.е. в пределах 5,10, 15, 20 или 25 аминокислот от "Р") от консервативной последовательности PGTVAL (SEQ ID NO: 114).
Последовательность PGTVAL (SEQ ID NO: 114) отстоит на 81 аминокислоту от N-конца белка CENH3 Arabidopsis, хотя расстояние от N-конца у разных эндогенных белков CENH3 отличается. Например, см. перечень последовательностей. Так, в некоторых воплощениях область гистоновой складки в белках tailswap охватывает все С-концевые аминокислоты эндогенного белка CENH3 (или белка, имеющего существенное сходство с эндогенной последовательностью) вплоть до и включая PGTVAL (SEQ ID NO: 114). В SEQ ID NOs: 49-94 отражена эта возможность. В других воплощениях белки tailswap по изобретению могут содержать большую или меньшую часть последовательности CENH3. Например, в некоторых воплощениях белок tailswap включает С-концевую последовательность белка CENH3, но только до 5, 10, 15, 20 или 25 аминокислот в направлении С-конца от "Р" в консервативной последовательности PGTVAL (SEQ ID NO: 114). В некоторых воплощениях белок tailswap включает С-концевую последовательность белка CENH3, но только до 5,10,15,20 или 25 аминокислот в направлении N-конца от "Р" в консервативной последовательности PGTVAL (SEQ ID NO: 114).
ii. Хвостовой домен CENH3
Несмотря на то, что домен гистоновой складки CENH3 эволюционирует быстрее, чем у обычного НЗ, домены гистоновой складки CENH3 и НЗ все-таки выравниваются. Напротив, N-концевые хвостовые домены CENH3 сильно отличаются даже у близкородственных видов. Хвостовые домены гистонов (включая хвостовые домены CENH3) являются гибкими и бесструктурными, о чем свидетельствует отсутствие у них большой плотности электронов в структуре нуклеосом при определении методом рентгеновской кристаллографии (Luger et al.. Nature 389(6648): 251-60 (1997).
Hi. Мутантные белки CENH3
В белок CENH3 можно вводить любое число мутаций, получая мутантный (в том числе рекомбинантно измененный) белок CENH3, способный давать гаплоидные растения при экспрессии в растениях, не экспрессирующих или с подавленной экспрессией эндогенного белка CENH3, при этом трансгенное растение подвергается скрещиванию с растением, экспрессирующим белок CENH3 дикого типа. Активные мутантные белки CENH3 можно получить, к примеру, методом случайного мутагенеза, методом направленного мутагенеза одной или нескольких аминокислот, путем полной или частичной делеции домена белка, путем слияния с гетерологичными аминокислотными последовательностями или комбинацией этих способов. "Активными" мутантными белками CENH3 именуются белки, которые при экспрессии в растениях, у которых CENH3 нокаутирован или инактивирован, дают жизнеспособные растения, которые при скрещивании с растением дикого типа дают гаплоидное потомство с большей, чем обычно частотой (например, по меньшей мере 0,1, 0,5, 1, 5, 10, 20% или больше). Мутантные белки CENH3 можно легко протестировать путем рекомбинантной экспрессии мутантного белка CENH3 в растении, не имеющем эндогенного белка CENH3, скрещивания трансгенного растения (в качестве мужского или женского, в зависимости от фертильности) с растением, экспрессирующим белок CENH3 дикого типа, а затем скрининга на образование гаплоидного потомства.
В некоторых воплощениях мутантный белок CENH3 идентичен эндогенному белку CENH3, за исключением 1, 2, 3, 4, 5, 6, 7, 8 или больше (например, 1-2, 1-4, 1-7) аминокислот. Например, в некоторых воплощениях эндогенный белок дикого типа из растения идентичен или существенно идентичен любой из SEQ ID NOs: 1-48, а мутантный белок CENH3 отличается от эндогенного белка CENH3 по 1,2, 3, 4, 5, 6, 7, 8 или больше (например, 1-2, 1-4,1-7) аминокислотам.
В некоторых воплощениях мутантный белок CENH3 содержит домен гистоновой складки CENH3, идентичный домену гистоновой складки эндогенного белка CENH3, за исключением 1, 2, 3, 4, 5, 6, 7, 8 или больше (например, 1-2, 1-4, 1-7) аминокислот.Например, в некоторых воплощениях эндогенный домен гистоновой складки CENH3 дикого типа из растения идентичен или существенно идентичен любой из SEQ ID NOs:
49-94, а мутантный белок CENH3 содержит домен гистоновой складки CENH3, который отличается от домена гистоновой складки эндогенного белка CENH3 по 1, 2, 3,4, 5, 6, 7, 8, или больше (например, 1-2,1-4,1-7) аминокислотам.
Полагаем, что активные мутанты CENH3 включают, к примеру, белки, содержащие:
гетерологичную аминокислотную последовательность (включая, без ограничения, и GFP), соединенную с укороченным или полным хвостовым доменом CENH3 или хвостовым доменом не CENH3, каждый из которых соединяется с доменом гистоновой складки CENH3; или
укороченный хвостовой домен CENH3, гетерологичный хвостовой домен CENH3 или хвостовой домен не CENH3, каждый их которых соединяется с доменом гистоновой складки CENH3.
В некоторых воплощениях мутантный белок CENH3 содержит N-концевую гетерологичную аминокислотную последовательность, слитую с доменом гистоновой складки белка CENH3. Обычно домен гистоновой складки идентичен или по меньшей мере существенно идентичен белку CENH3, эндогенному для того организма, в котором мутантный белок CENH3 будет экспрессироваться. В некоторых воплощениях мутантный белок CENH3 включает хвостовой домен гистона, которым может быть, к примеру, хвостовой домен не CENH3 или хвостовой домен CENH3.
Полагаем, что в соответствии с настоящим изобретением для соединения с белком, содержащим домен гистоновой складки CENH3 и последовательность, которая может функционировать как хвостовой домен гистона или замещать его, можно использовать большое число различных аминокислотных последовательностей. В некоторых воплощениях гетерологичная последовательность непосредственно соединяется с доменом гистоновой складки CENH3. В некоторых воплощениях гетерологичная последовательность соединяется с доменом гистоновой складки CENH3 через промежуточную аминокислотную последовательность. В некоторых воплощениях промежуточная аминокислотная последовательность представляет собой интактный или укороченный хвостовой домен CENH3. В некоторых воплощениях для предотвращения летальности, связанной с потерей эндогенного CENH3, будет достаточно гетерологичной аминокислотной последовательности в комбинации с доменом гистоновой складки, но она будет успешно разрушать центромеры, приводя к получению гаплоидного потомства, как уже обсуждалось. Таким образом, в некоторых воплощениях гетерологичная аминокислотная последовательность будет содержать часть, которая представляет собой хвостовой домен гистона или имитирует его функционирование, а также необязательно может содержать громоздкую аминокислотную последовательность, нарушающую функционирование центромер. В некоторых воплощениях по меньшей мере часть гетерологичной аминокислотной последовательности мутантного белка CENH3 содержит любую аминокислотную последовательность из по меньшей мере 10, 20, 30, 40, 50, например, 10-30, 10-50, 20-50, 30-60 аминокислот, у которой необязательно отсутствует устойчивая вторичная структура (например, отсутствуют спирали или р-структуры). В некоторых воплощениях хвостовой домен меньше чем на 90, 80 или 70% идентичен хвостовому домену (например, N-концевым 135 аминокислотам) белка CENH3, эндогенного для того организма, в котором будет экспрессироваться мутантный белок CENH3. В некоторых воплощениях хвостовой домен мутантного белка CENH3 содержит хвостовой домен не белка CENH3, а другого гистона, включая, без ограничения, белок гистона НЗ. В некоторых воплощениях хвостовой домен мутантного белка CENH3 содержит хвостовой домен другого гистона, чем белок CENH3, эндогенного для того организма, в котором будет экспрессироваться мутантный белок CENH3. В некоторых воплощениях хвостовой домен мутантного белка CENH3 содержит хвостовой домен гомологичного или ортологичного (из другого вида растений) белка CENH3. Например, GFP, слитый с хвостовым доменом CENH3 кукурузы и соединенный с доменом гистоновой складки CENH3 Arabidopsis, оказался активным.
Как отмечено выше, в некоторых воплощениях хвостовой домен гистона Н3 (не путать с гистоном CENH3) используется в качестве хвостового домена мутантного белка CENH3 (эти воплощения иногда именуются белками "tailswap", от англ. "поменяться хвостами"). Хвостовые домены НЗ у растений сильно консервативны между различными организмами. Например, общий хвостовой домен Н3 у растений представлен SEQ ID NO: 95. Таким образом, в некоторых воплощениях гетерологичная хвостовая часть белка tailswap будет содержать аминокислотную последовательность, которая существенно идентична (например, идентична по меньшей мере на 70, 80, 90, 95 или 100%) SEQ ID NO: 95 или ее фрагментам длиной по меньшей мере в 15, 20, 25, 30, 35 или 40 аминокислот.
В некоторых воплощениях у мутантных белков CENH3 по изобретению отсутствует по меньшей мере часть (например, по меньшей мере 5, 10, 15, 20, 25, 30 или больше аминокислот) N-концевого участка эндогенного CENH3, поэтому в некоторых воплощениях у них будет укороченный хвостовой домен CENH3 по сравнению с эндогенным белком CENH3 дикого типа. Мутантные белки CENH3 могут быть связаны или не связаны с гетерологичной последовательностью.
Необязательно гетерологичная аминокислотная последовательность может дополнительно содержать одну или несколько аминокислотных последовательностей на N- и/или С-конце и/или соединяющие хвостовой домен и домен гистоновой складки. Например, в некоторых воплощениях мутантный белок CENH3 (например, tailswap или другой мутантный белок CENH3) содержит гетерологичную аминокислотную последовательность, присоединенную по N-концу хвостового домена. В некоторых воплощениях гетерологичная последовательность присоединяется по N-концу белка CENH3 дикого типа, при этом гетерологичная последовательность нарушает функционирование центромер. Так, было обнаружено, что, к примеру, зеленый флуоресцентный белок, присоединенный к CENH3 дикого типа, успешно разрушает центромеры, позволяя получить гаплоидное потомство. Полагаем, что гетерологичная последовательность может представлять собой любую последовательность, нарушающую способность белка CENH3 поддерживать функционирование центромер. Так, в некоторых воплощениях гетерологичная последовательность содержит аминокислотную последовательность по меньшей мере в 5,10,15,20,25, 30, 50 или больше кД.
В некоторых воплощениях мутантный белок CENH3 содержит белковый домен, который действует в качестве детектируемого или селектируемого маркера. Например, типичным селектируемым маркером является флуоресцентный белок или продукт гена устойчивости к антибиотикам или гербицидам. Селектируемые или детектируемые белковые домены применимы для отслеживания наличия или отсутствия мутантного белка CENH3 в организме.
В. Кинетохорные белки помимо CENH3
Полагаем, что и другие белки, входящие в состав кинетохорного комплекса, можно подвергнуть мутагенезу и экспрессировать в растениях, не экспрессирующих соответствующий эндогенный белок кинетохорного комплекса, получая жизнеспособные растения, которые при скрещивании с растением дикого типа, содержащим кинетохорный комплекс дикого типа, будут давать гаплоидное потомство с определенной частотой (например, по меньшей мере 0,1, 0,5, 1, 5, 10, 20%, или больше). Типичными белками кинетохорного комплекса помимо CENH3 являются, например, CENPC, MCM21, MIS 12, NDC80 или NUF2.
Активные мутантные белки кинетохорного комплекса помимо CENH3 (например, CENPC, MCM21, MIS 12, NDC80 или NUF2) можно получить, к примеру, методом случайного мутагенеза, методом направленного мутагенеза одной или нескольких аминокислот, путем полной или частичной делеции домена белка, путем слияния с гетерологичными аминокислотными последовательностями или комбинацией этих способов. "Активными" мутантными белками кинетохорного комплекса помимо CENH3 именуются белки, которые при экспрессии в растениях, у которых соответствующий белок кинетохорного комплекса помимо CENH3 нокаутирован или инактивирован, дают жизнеспособные растения, которые при скрещивании с растением дикого типа дают гаплоидное потомство с большей, чем обычно частотой (например, по меньшей мере 1, 5, 10, 20% или больше). В некоторых воплощениях активные мутантные полипептиды CENPC, MCM21, MIS 12, NDC80 или NUF2 существенно идентичны SEQ ID NOs: 96, 97, 98, 99 или 100, соответственно. Мутантные белки кинетохорного комплекса помимо CENH3 (например, CENPC, MCM21, MIS 12, NDC80 или NUF2) можно легко протестировать путем рекомбинантной экспрессии мутантного белка кинетохорного комплекса помимо CENH3 в растении, не имеющем эндогенного белка кинетохорного комплекса помимо CENH3, скрещивания трансгенного растения (в качестве мужского или женского, в зависимости от фертильности) с растением, экспрессирующим белок кинетохорного комплекса помимо CENH3 дикого типа, а затем скрининга на образование гаплоидного потомства.
В некоторых воплощениях мутантный белок кинетохорного комплекса помимо CENH3 идентичен эндогенному белку кинетохорного комплекса помимо CENH3, за исключением 1, 2, 3, 4, 5, 6, 7, 8 или больше (например, 1-2, 1-4, 1-7) аминокислот. Например, в некоторых воплощениях эндогенный белок дикого типа из растения идентичен или существенно идентичен любой из SEQ ID NOs: 96, 97, 98, 99 или 100, а мутантный белок кинетохорного комплекса помимо CENH3 отличается от эндогенного белка кинетохорного комплекса помимо CENH3 по 1, 2, 3, 4, 5, 6, 7, 8 или больше (например, 1-2,1-4,1-7) аминокислотам.
Необязательно гетерологичная аминокислотная последовательность может содержать одну или несколько аминокислотных последовательностей на N- и/или С-конце и/или соединяющих хвостовой домен и домен гистоновой складки. Например, в некоторых воплощениях мутантный белок кинетохорного комплекса помимо CENH3 содержит гетерологичную аминокислотную последовательность, присоединенную по N-концу белка кинетохорного комплекса помимо CENH3. Гетерологичная последовательность может представлять собой любую последовательность. В некоторых воплощениях гетерологичная последовательность присоединяется по N-концу другого белка кинетохорного комплекса дикого типа помимо CENH3, при этом гетерологичная последовательность нарушает функционирование центромер. В некоторых воплощениях гетерологичная последовательность содержит аминокислотную последовательность по меньшей мере в 5, 10, 15, 20, 25, 30, 50 или больше кД.
В некоторых воплощениях мутантный белок кинетохорного комплекса помимо CENH3 содержит белковый домен, который действует в качестве детектируемого или селектируемого маркера. Например, типичным селектируемым маркером является флуоресцентный белок или продукт гена устойчивости к антибиотикам или гербицидам. Селектируемые или детектируемые белковые домены применимы для отслеживания наличия или отсутствия мутантного белка кинетохорного комплекса помимо CENH3 в организме.
III. Создание организмов по изобретению
Настоящим изобретением предусмотрены организмы, которые не экспрессируют или экспрессируют на сниженном уровне (например, менее 90, 80, 70, 60, 50, 40, 30, 20 или 10% от уровня дикого типа) эндогенный белок CENH3 или белок кинетохорного комплекса помимо CENH3, а также необязательно экспрессируют соответствующий мутантный белок CENH3 или белок кинетохорного комплекса помимо CENH3. Обычно отсутствие белка кинетохорного комплекса является летальным, если оно, по крайней мере частично, не восполняется мутантным белком кинетохорного комплекса, как описано нами. Не намереваясь ограничивать рамки изобретения, полагаем, что имеется несколько способов получения организмов, у которых отсутствует или снижена экспрессия эндогенного белка кинетохорного комплекса, но экспрессируется мутантный вариант этого белка.
В некоторых воплощениях можно вызвать мутацию CENH3 в эндогенном гене CENH3 (или белка кинетохорного комплекса помимо CENH3), которая снижает или устраняет активность или экспрессию CENH3, или нокаутировать ген белка кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS12, NDC80 или NUF2). В этих воплощениях можно получить организм, гетерозиготный по нокаутированному или мутантному гену, и ввести экспрессионную кассету для экспрессии гетерологичного, соответствующего мутантному белка кинетохорного комплекса в организм. Затем можно отобрать потомство от гетерозиготы, которое гомозиготно по мутации или нокауту, но содержит рекомбинантно экспрессированный гетерологичный мутантный белок кинетохорного комплекса. Соответственно, изобретением предусмотрены растения, клетки растений или других организмов, в которых один или оба аллеля гена CENH3 подвергнуты нокауту или мутации таким образом, что у них практически или почти полностью отсутствует активность CENH3, т.е. достаточные для того, чтобы вызвать летальность эмбриона без дополнительной экспрессии мутантного белка кинетохорного комплекса, как описано нами (например, белка tailswap). Изобретением также предусмотрены растения, клетки растений или других организмов, в которых один или оба аллеля гена кинетохорного комплекса помимо CENH3 подвергнуты нокауту или мутации таким образом, что у них практически или почти полностью отсутствует активность соответствующего белка кинетохорного комплекса помимо CENH3, т.е. достаточные для того, чтобы вызвать летальность эмбриона без дополнительной экспрессии мутантного белка кинетохорного комплекса, как описано нами. У растений, содержащих набор хромосом больше диплоидного (например, тетраплоидный), могут быть инактивированы, мутированы или нокаутированы все аллели.
С другой стороны, можно ввести экспрессионную кассету, кодирующую мутантный белок кинетохорного комплекса (например, без ограничения, белок tailswap), в организм с интактным набором аллелей белков кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2), а затем подавить ген эндогенного белка кинетохорного комплекса любым способом, известным в данной области. К примеру, можно ввести в организм или экспрессировать в нем миРНК или микроРНК, которая снижает или устраняет экспрессию эндогенного белка кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2).
В идеале выбирается такая миРНК или иной подавляющий реагент, которые вызывают молчание гена эндогенного белка кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2), но практически не мешают экспрессии мутантного белка кинетохорного комплекса (например, белка tailswap). В тех случаях, когда нужно инактивировать эндогенный CENH3, это осуществляется, к примеру, путем воздействия миРНК на участок мРНК CENH3, кодирующий N-концевой хвост, или на нетранслируемые участки мРНК CENH3, в зависимости от структуры мутантного белка кинетохорного комплекса. С другой стороны, можно сконструировать трансген мутантного белка кинетохорного комплекса используя иные кодоны с тем, чтобы у него не было гомологии с последовательностью гена эндогенного белка кинетохорного комплекса и с данной миРНК.
IV. Снижение или устранение экспрессии эндогенных белков кинетохорного комплекса
Для ингибирования, мутирования или инактивации экспрессии белков кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2) в растениях можно воспользоваться целым рядом способов. Например, для инактивации экспрессии генов удобно использовать антисмысловую технологию. Для этого клонируют сегмент нуклеиновой кислоты из нужного гена и функционально соединяют с промотором так, чтобы транскрибировалась антисмысловая нить РНК. Затем экспрессионной кассетой трансформируют растения и получают антисмысловую нить РНК. Предполагается, что в клетках растений антисмысловая РНК ингибирует экспрессию генов, предотвращая накопление мРНК, кодирующей нужный полипептид, например, см., Sheehy et al., Proc. Nat. Acad. Sci. USA, 85:8805-8809 (1988); Pnueli et al., The Plant Cell 6: 175-186 (1994); и Hiatt et al., U.S. Patent N4801340.
Антисмысловая последовательность нуклеиновой кислоты, вводимая при трансформации в растения, должна быть существенно идентична по меньшей мере части подавляемого эндогенного гена или генов. Для ингибирования экспрессии последовательность вовсе не должна быть абсолютно идентичной. Так, для получения растений, у которых подавлена экспрессия белков кинетохорного комплекса, можно использовать антисмысловые или смысловые молекулы нуклеиновой кислоты, кодирующие только часть белка кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2) или часть мРНК белка кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2) (в том числе нетранслируемые участки мРНК). Вектора настоящего изобретения необязательно разрабатывают таким образом, чтобы ингибирующий эффект относился только к белку кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2) и не затрагивал экспрессию других генов. В тех случаях, когда нужно инактивировать эндогенный CENH3, один из способов достижения этой цели состоит в том, чтобы нацелить антисмысловую 'последовательность на те последовательности CENH3 (например, хвостовые или нетранслируемые последовательности мРНК), которые не встречаются у других белков в пределах семейства генов, проявляющих гомологию или существенно гомологичных гену CENH3.
Для антисмысловой супрессии вводимая последовательность также не обязательно должна иметь полную длину относительно первичного продукта транскрипции либо полностью процессированной мРНК. В общем, чтобы компенсировать использование более короткой последовательности, может применяться более высокая гомология. Более того, вводимая последовательность не обязательно должна иметь такой же паттерн интронов или экзонов, в равной степени может оказаться эффективной и гомология к некодирующим сегментам. Например, можно использовать последовательность длиной от 30 до 40 нуклеотидов, а в некоторых воплощениях следует использовать почти полную последовательность нуклеотидов, хотя можно использовать и последовательность по меньшей мере в 20,50,100,200 или 500 нуклеотидов.
Для ингибирования экспрессии генов белков кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2) можно использовать и каталитические молекулы РНК или рибозимы. Можно сконструировать рибозимы, которые специфически образуют пары практически с любой РНК мишени и расщепляют фосфодиэфирный каркас в определенном положении, тем самым функционально инактивируя РНК мишени. Осуществляя такое расщепление, сам рибозим при этом не изменяется, поэтому он может повторно использоваться и расщеплять другие молекулы, как настоящий фермент.Включение последовательностей рибозимов в антисмысловые РНК придает им РНК-расщепляющую активность, что усиливает активность конструкций.
Установлен ряд классов рибозимов. Один класс рибозимов происходит из числа небольших кольцевых РНК, способных к саморасщеплению и репликации в растениях. РНК реплицируется сама по себе (вироидная РНК) или при помощи хелперного вируса (сателлитная РНК). Примеры включают РНК из вироида солнечной пятнистости авокадо и сателлитные РНК из вируса кольцевой пятнистости табака, вируса временной полосатости люцерны, вируса бархатной пятнистости табака, вируса пятнистости паслена Solanum nodiflorum и вируса подпочвенной пятнистости клевера. Конструирование и применение специфичных к РНК мишени рибозимов описано в Haseloff et al., Nature, 334:585-591 (1988).
Другим способом супрессии является смысловая супрессия (также известная как косупрессия). Введение экспрессионных кассет, в которых нуклеиновая кислота конфигурирована в смысловой ориентации по отношению к промотору, оказалось эффективным средством для блокирования транскрипции генов мишеней. Например, см. применение этого способа для модуляции экспрессии эндогенных генов у Napoli et al., The Plant Cell 2:279-289 (1990); Flavell, Proc. Natl. Acad. Sci., USA 91:3490-3496 (1994); Kooter and Mol, Current Opin. Biol. 4: 166-171 (1993); и U.S. Patents Nos. 5034323, 5231020 и 5283184.
В общем, если нужно ингибировать экспрессию, то происходит некоторая транскрипция введенной последовательности. Эффект может произойти, если введенная последовательность содержит не саму кодирующую последовательность, а только интрон или нетранслируемые последовательности, гомологичные последовательностям, присутствующим в первичном транскрипте эндогенной последовательности. Введенная последовательность обычно существенно идентична эндогенной последовательности, которую нужно подавить. Такая минимальная идентичность обычно составляет более 65% к последовательности белка-мишени кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80, или NUF2), но большая идентичность может вызывать более эффективное подавление экспрессии эндогенных последовательностей. В некоторых воплощениях используются последовательности с существенно большей идентичностью, к примеру, по меньшей мере на 80%, на 95% или на 100%. Как и при антисмысловой регуляции, эффект можно спланировать и протестировать с тем, чтобы существенно не затрагивалась экспрессия других белков из семейства аналогичных генов, проявляющих гомологичность или существенную гомологичность.
Для смыслового подавления вводимая в экспрессионную кассету последовательность, которой не нужна абсолютная идентичность, также не обязательно должна иметь полную длину относительно первичного продукта транскрипции либо полностью процессированной мРНК. Это может быть предпочтительным, чтобы избежать попутного получения некоторых суперэкспрессирующих растений. Более высокая идентичность у более короткой по отношению к полной длине последовательности компенсирует меньшую идентичность у более длинной последовательности. Более того, вводимая последовательность не обязательно должна иметь такой же паттерн интронов и экзонов, в равной степени будет эффективна и идентичность к некодирующим областям. В некоторых воплощениях применяется последовательность того же диапазона размеров, что указан выше для антисмысловой регуляции, т.е. 30-40 или по меньшей мере 20, 50, 100,200, 500 или больше нуклеотидов.
Экспрессия эндогенных генов также может подавляться при помощи РНК-интерференции (RNAi) (так, разновидностью RNAi можно считать косупрессию), при которой применяется двухцепочечная РНК с последовательностью, идентичной или близкой к последовательности гена мишени. RNAi представляет собой феномен, при котором при введении в клетки двухцепочечной РНК с последовательностью, идентичной или близкой к последовательности гена-мишени, подавляется экспрессия и введенного экзогенного гена, и эндогенного гена-мишени. Двухцепочечная РНК может состоять из двух отдельных комплементарных РНК или может представлять собой одноцепочечную РНК с внутренними комплементарными последовательностями, образующими двухцепочечную РНК. Несмотря на то, что известны еще не все детали механизма RNAi, считается, что введенная двухцепочечная РНК сначала расщепляется на небольшие фрагменты, которые затем каким-то образом служат как указатели гена-мишени, при этом ген-мишень разрушается. Известно, что RNAi также эффективна у растений (например, см. Chuang C.F. & Meyerowitz E.M., Proc. Natl. Acad. Sci. USA 97: 4985 (2000); Waterhouse et al., Proc. Natl. Acad. Sci. USA 95: 13959-13964 (1998); Tabara et al. Science 282:430-431 (1998); Matthew, Сотр. Funct. Genom. 5: 240-244 (2004); Lu et al. Nucleic Acids Research 32(21):el71 (2004)). Например, для подавления экспрессии белка кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2) методом RNAi в растение или другой организм, представляющий интерес, вводится двухцепочечная RNA с последовательностью мРНК, кодирующей белок кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2), или существенно сходной последовательностью (включая те, что сконструированы так, чтобы белок не транслировался) либо их фрагменты. Полученные растения/организмы можно затем подвергнуть скринингу на фенотип, связанный с белком-мишенью (необязательно при наличии экспрессии tailswap белка, чтобы избежать летальности), и/или отслеживая стационарный уровень РНК для транскриптов, кодирующих белок. Несмотря на то, что гены, используемые для RNAi, не обязательно должны быть полностью идентичными гену-мишени, они могут быть по меньшей мере на 70%, 80%, 90%, 95% или больше идентичны последовательности гена-мишени (например, последовательности CENH3, как описано нами). Например, см. US Patent Publication N2004/0029283 насчет примера неидентичной последовательности миРНК, используемой для подавления экспрессии генов. Также для ингибирования экспрессии генов мишени можно использовать конструкции, кодирующие молекулы РНК со структурой типа ствол-петля, которые не родственны гену-мишени и располагаются дистально к последовательности, специфичной для данного гена. Например, см. US Patent Publication N2003/0221211.
Полинуклеотиды для RNAi могут охватывать РНК мишени полной длины или могут соответствовать фрагментам РНК мишени. В некоторых случаях фрагмент может содержать менее 100, 200, 300, 400, 500 600, 700, 800, 900 или 1000 нуклеотидов, соответствующих последовательности мишени. Кроме того, в некоторых воплощениях эти фрагменты имеют длину по меньшей мере, например, 10, 15, 20, 50, 100, 150, 200 или более нуклеотидов. В некоторых случаях предназначенные для RNAi фрагменты могут быть по меньшей мере существенно сходными с участками белка-мишени, которые не встречаются в других белках организма, или могут быть выбраны так, чтобы они имели как можно меньше сходства с другими транскриптами организма, например, выбраны при сравнении последовательностей при анализе общедоступных баз данных.
Разработаны экспрессионные вектора, которые непрерывно экспрессируют миРНК при кратковременной и стабильной трансфекции, экспрессируя небольшие шпилечные РНК, которые подвергаются процессингу in vivo в молекулы миРНК, способные осуществить сайленсинг (молчание) определенного гена (Brummelkamp et al., Science 296:550-553 (2002); и Paddison et al. Genes & Dev. 16:948-958 (2002)). Посттрансляционное подавление генов двухцепочечной РНК обсуждается более подробно в Hammond et al. Nature Rev Gen 2: 110-119 (2001); Fire et al. Nature 391:806-811 (1998); и Timmons and Fire, Nature 395: 854 (1998).
Специалистам должно быть известно, что смысловой (в том числе миРНК) или антисмысловой транскрипт должен быть нацелен на последовательности с наибольшей изменчивостью между членами семейства, если целью является воздействие только на одного (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2) представителя семейства гистонов.
Еще один способ подавления экспрессии эндогенных генов растений заключается в рекомбинантной экспрессии микроРНК, подавляющей мишень (например, ген CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2). Искусственная микроРНК представляет собой одноцепочечную РНК (например, 18-25-мерную, обычно 21-мерную), которая в норме не встречается в растениях и подвергается процессингу из эндогенных предшественников микроРНК. Последовательности микроРНК разрабатывают согласно детерминантам отбора растения-мишени микроРНК с тем, чтобы искусственная микроРНК специфически вызывала сайленсинг своего гена-мишень, что в общем описано в Schwab et al., The Plant Cell 18: 1121-1133 (2006), а также в приведенных в Интернете способах разработки таких микроРНК. Также см. US Patent Publication No. 2008/0313773.
Способы введения генетических мутаций в гены растений и отбора растений с нужными признаками хорошо известны и могут применяться для введения мутаций или нокаутирования белка кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2). Например, можно обработать семена или другой растительный материал мутагенным вставочным полинуклеотидом (например, транспозоном, Т-ДНК и т.п.) или химической субстанцией по стандартным методикам. Такими химическими веществами являются, без ограничения, следующие: диэтилсульфат, этиленимин, этилметансульфонат и М-нитрозо-К-этилмочевина. С другой стороны, можно использовать ионизирующую радиацию из таких источников, как рентгеновское излучение или гамма-излучение. Затем можно идентифицировать растения, содержащие мутантный белок кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2), к примеру, по фенотипу или молекулярными методами.
Также легко можно разработать модифицированные белковые цепи с помощью различным методов рекомбинантной ДНК, хорошо известных специалистам в данной области и описанных, к примеру, в Sambrook et al., supra. Для введения мутаций по одному основанию в кодирующий участок гена также можно использовать гидроксиламин (Sikorski et al., Meth. Enzymol., 194:302-318 (1991). Например, цепи могут отличаться от последовательности естественного происхождения на уровне первичной структуры заменой, добавлением, делецией аминокислот и др. Эти модификации могут применяться в различных комбинациях для получения конечной модифицированной белковой цепи.
С другой стороны, для направленной модификации или нокаутирования гена-мишени может применяться гомологическая рекомбинация путем специфического воздействия на ген белка кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2) in vivo (в общих чертах см. Grewal and Klar, Genetics, 146: 1221-1238 (1997); и Xu et al. Genes Dev., 10:2411-2422 (1996)). Гомологическая рекомбинация была продемонстрирована у растений (Puchta et al., Experientia, 50:277-284 (1994); Swoboda et al., EMBO J., 13:484-489 (1994); Offrmga et al., Proc. Natl. Acad. Sci. USA, 90:7346-7350 (1993); и Kempin et al. Nature, 389:802-803 (1997)).
При применении технологии гомологической рекомбинации к генам изобретения в выбранных участках последовательностей генов белков кинетохорного комплекса (включая участки с 5'-стороны, З'-стороны и внутригенные участки) проделываются мутации in vitro типа тех, что описаны здесь, а затем вводятся в нужное растение стандартными методами. Поскольку эффективность гомологической рекомбинации, как известно, зависит от используемых векторов, для повышения эффективности отбора на изменения экспрессии генов CENH3 в трансгенных растениях обычно используются вектора, направленные на дицистронные гены, как описано в Mountford et al., Proc. Natl. Acad. Sci. USA, 91: 4303-4307 (1994); и Vaulont et al., Transgenic Res., 4:247-255 (1995). Мутантный ген будет взаимодействовать с геном мишени дикого типа таким образом, что в клетках трансгенного растения будет происходить гомологическая рекомбинация и прицельное замещение гена дикого типа, вызывая подавление активности белка кинетохорного комплекса.
V. Получение рекомбинантных векторов
Для того, чтобы использовать выделенные последовательности в вышеприведенных методиках, нужно получить вектора с рекомбинантной ДНК, пригодные для трансформации клеток растений. Методы трансформации широкого круга видов высших растений хорошо известны и описаны в технической и научной литературе, например, Weising et al., Ann. Rev. Genet. 22:421-477 (1988). Последовательность ДНК, кодирующей требуемый полипептид, к примеру, слитый белок tailswap, как описано здесь, и/или миРНК, антисмысловые или другие конструкции для сайленсинга объединяются с регуляторными последовательностями инициации транскрипции и трансляции, которые будут направлять транскрипцию последовательности из гена в заданных тканях трансформированного растения.
Например, можно использовать фрагмент растительного промотора, который будет направлять экспрессию гена во всех тканях регенерированного растения. С другой стороны, растительный промотор может направлять экспрессию полинуклеотида изобретения в определенной ткани (тканеспецифичные промоторы), органе (органоспецифичные промоторы) или же под более точным контролем внешней среды (индуцибельные промоторы). Примеры тканеспецифичных промоторов под онтогенетическим контролем включают промоторы, которые инициируют транскрипцию только в определенных тканях, таких как плоды, семена, цветки, пестики или пыльники. Подходящими промоторами являются промоторы генов, кодирующих белки хранения или мембранный белок липидных телец - олеосин.
Если нужна правильная экспрессия полипептида, то следует включить участок полиаденилирования на 3'-конце кодирующей области. Участок полиаденилирования может происходить из природного гена, из многих других генов растений или из Т-ДНК.
Вектор, содержащий последовательности (например, промоторы или кодирующие области) из генов изобретения, также может содержать, к примеру, маркерный ген, придающий селектируемый фенотип клеткам растения. Например, маркер может кодировать устойчивость к биоциду, в частности, устойчивость к антибиотикам, как-то устойчивость к канамицину, G418, блеомицину, гигромицину, или устойчивость к гербицидам, как-то устойчивость к хлорсульфурону или препарату Basta.
Конститутивные промоторы
Можно использовать промотор или его активный фрагмент, который будет направлять экспрессию нуклеиновой кислоты, кодирующей слитый белок изобретения, во всех трансформированных клетках или тканях, например, в регенерированном растении.
Такие промоторы именуются "конститутивными" промоторами, которые активны при большинстве условий внешней среды и стадий развития или дифференцировки клеток. Примеры конститутивных промоторов включают промоторы из вирусов, инфицирующих растения, как-то участок инициации транскрипции 35S вируса мозаичности цветной капусты (CaMV) (например, см. Dagless, Arch. Virol. 142: 183-191 (1997)); Г- или 2'-промотор, полученный из Т-ДНК Agrobacterium tumefaciens (например, см. Mengiste, supra (1997); O'Grady, Plant Mol. Biol. 29:99-108) (1995)); промотор вируса мозаичности табака; промотор вируса мозаичности Figwort (например, см. Maiti, Transgenic Res. 6: 143-156) (1997)); промоторы актина, такие как промотор гена актина Arabidopsis (например, см. Huang, Plant Mol. Biol. 33: 125-139 (1997)); промоторы гена алкогольдегидрогеназы (Adh) (например, см. Millar, Plant Mol. Biol. 31:897-904 (1996)); ACT11 из Arabidopsis (Huang et al.. Plant Mol. Biol. 33: 125-139 (1996)), Cat3 из Arabidopsis (GenBank No. U43147, Zhong et aL, Mol. Gen. Genet. 251: 196-203 (1996)), гена, кодирующего десатуразу белка-переносчика стеароилацила из Brassica napus (Genbank No. X74782, Solocombe et al.. Plant Physiol. 104: 1167-1 176 (1994)), GPcl из кукурузы (GenBank No. X15596, Martinez et al., J. Mol. Biol. 208:551-565 (1989)), Gpc2 из кукурузы (GenBank No. U45855, Manjunath et al., Plant Mol. Biol 33:97-112 (1997)), другие участки инициации транскрипции из различных генов растений, известных специалистам. Также см. Holtorf, "Comparison of different constitutive and inducible promoters for the overexpression of transgenes in Arabidopsis thaliana," Plant Mol. Biol. 29:637-646 (1995). Дополнительные конститутивные промоторы включают, например, промоторы полиубиквитиновых генов из Arabidopsis thaliana, UBQ3 и UBQ10 (Norris et al., Plant Mol. Biol. 21:895 (1993)), также применимые для управления экспрессией генов.
Индуцибельные промоторы
Индуцибельные промоторы могут при желании использоваться для контроля (1) за экспрессией искусственной микроРНК, миРНК или других вызывающих сайленсинг полинуклеотидов и (2) одновременно для запуска экспрессии трансгенного мутантного (например, tailswap) белка или (3) того и другого. Это может дать преимущество наличия нормального растения (например, такого, которое может обладать большей фертильностью) до индукции, которое затем может давать гаметы, готовые к индукции гаплоидов.
Тканеспецифичные промоторы
Альтернатива заключается в понижающей регуляция эндогенного белка (например, путем сайленсинга гена) в определенной ткани (например, по крайней мере в зрелых гаметофитах (пыльце или зародышевом мешке)) и замене его только в этой ткани специфическим промотором, направляющим экспрессию белка tailswap.В некоторых воплощениях такой же тканеспецифичный промотор применяется для запуска искусственной микро-РНК, миРНК или других вызывающих сайленсинг полинуклеотидов и спасения кодирующего tailswap трансгена.
VI. Получение трансгенных растений или растительных клеток
Конструкции из ДНК по изобретению могут вводиться в геном нужного растения-хозяина различными стандартными методами. Например, конструкция из ДНК может вводиться непосредственно в геномную ДНК растительной клетки такими методами, как электропорация и микроинъекция в протопласты растительных клеток, или же конструкции из ДНК могут вводиться прямо в растительную ткань биолистическими методами типа бомбардировки частицами ДНК. С другой стороны, конструкции из ДНК могут комбинироваться с подходящими фланкирующими участками Т-ДНК и вводиться в обычный вектор для Agrobacterium tumefaciens. Вирулентность Agrobacterium tumefaciens будет способствовать включению конструкции и прилегающего маркера в клеточную ДНК растения при инфицировании клеток бактериями.
Способы микроинъекции известны в данной области и хорошо описаны в научной и патентной литературе. Введение конструкций из ДНК методом осаждения полиэтиленгликолем описаны в Paszkowski et al., EMBO J. 3:2717-2722 (1984). Методы электропорации описаны в Fromm et al., Proc. Natl. Acad. Set USA 82:5824 (1985). Биолистические методы описаны в Klein et al. Nature 327:70-73 (1987).
Методы трансформации с помощью Agrobacterium tumefaciens, включающие обезвреживание и применение бинарных векторов, хорошо описаны в научной литературе. Например, см. Horsch et al. Science 233:496-498 (1984) и Fraley et al., Proc. Natl. Acad. Sci. USA 80:4803 (1983).
Трансформированные растительные клетки, полученные любым из описанных выше методов трансформации, можно культивировать для регенерации целого растения, обладающего трансформированным генотипом и, вследствие этого, нужным фенотипом типа повышенной устойчивости к заболеваниям по сравнению с контрольным растением, которое не подвергалось трансформации или трансформировано пустым вектором. Такие методы регенерации зависят от манипуляции определенными фитогормонами в среде для роста культуры и обычно зависят от биоцидного и/или гербицидного маркера, который был введен вместе с нужной нуклеотидной последовательностью. Регенерация растений из культивируемых протопластов описана в Evans et al., Protoplast Isolation and Culture, Handbook of Plant Cell Culture, pp.124-176, MacMillan Publishing Company, New York, 1983; и Binding, Regeneration of Plants, Plant Protoplasts, pp.21-73, CRC Press, Boca Raton, 1985.
Регенерация также может быть получена из каллюса, эксплантатов, органов растений или их частей. Такие методы регенерации в общем описаны в Klee et al., Ann. Rev. Plant Physiol. 38:467-486 (1987).
Нуклеиновые кислоты и кодируемые ими полипептиды изобретения могут использоваться для придания описанных здесь характеристик, включая способность давать гаплоидное потомство, как описано здесь, практически любым растениям. Таким образом, изобретение применимо для широкого круга растений, включая двудольные и однодольные растения, в том числе виды из родов Asparagus, Atropa, Avena, Brassica, Citms, Citrullus, Capsicum, Cucumis, Cucurbita, Daucus, Fragaria, Glycine, Gossypium, Helianthus, Heterocallis, Hordeum, Hyoscyamus, Lactuca, Linum, Lolium, Lycopersicon, Malus, Manihot, Majorana, Medicago, Nicotiana, Oryza, Panicum, Pennisetum, Persea, Pisum, Pyrus, Prunus, Raphanus, Secale, Senecio, Sinapis, Solanum, Sorghum, Trigonella, Triticum, Vitis, Vigna и Zea.
VII. Способы усовершенствования селекции
Скрещивание растений, не имеющих эндогенного белка кинетохорного комплекса и экспрессирующих активный мутантный белок кинетохорного комплекса, как описано нами (например, tailswap или другой мутантный CENH3 или белок кинетохорного комплекса помимо CENH3), в качестве либо мужского (опылителя), либо женского (опыляемого), с растением, экспрессирующим эндогенный белок кинетохорного комплекса (например, белок CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2), даст по крайней мере некоторое количество потомства (например, по меньшей мере 0,1%, 0,5%, 1%, 5%, 10%, 20% или больше), которое будет гаплоидным и будет содержать только хромосомы из того растения, у которого экспрессируется белок кинетохорного комплекса. Таким образом, настоящее изобретение позволяет получать гаплоидные растения, у которых все хромосомы происходят из заданного растения, путем скрещивания данного растения с растением, трансгенно экспрессирующим мутантный белок кинетохорного комплекса, и сбора образующихся гаплоидных семян.
Как отмечено выше, растение, экспрессирующее эндогенный белок CENH3 дикого типа, можно скрещивать как в качестве мужской, так и женской родительской формы. Один из уникальных аспектов настоящего изобретения состоит в том, что оно позволяет получить растение (или другой организм), обладающее только мужским родительским набором ядерных хромосом и женской родительской цитоплазмой вместе с ее митохондриями и пластидами, когда источником tailswap является мужская особь.
Хотя растения, не имеющие эндогенного гена CENH3 и экспрессирующие мутантный белок CENH3, состоящий из GFP, хвостовой части га стона НЗ и домена гистоновой складки CENH3, обладают ограниченной мужской фертильностью, однако оказалось, что растения, не имеющие эндогенного гена CENH3 и экспрессирующие как мутантный белок CENH3, состоящий из GFP, хвостовой части гистона НЗ и домена гистоновой складки CENH3, так и CENH3 дикого типа с GFP, дают растения с более высокой мужской фертильностью, что делает их удобными для применения как в качестве мужской, так и женской родительской формы при скрещивании. В общем, изобретением предусматривается экспрессия двух или нескольких разных мутантных белков кинетохорного комплекса в растении (например, в растении, у которого отсутствует экспрессия соответствующего эндогенного белка кинетохорного комплекса).
После получения гаплоидные растения можно использовать для различных полезных задач, в том числе для получения дигаплоидов, содержащих точную двойную копию хромосом. Такие дигаплоидные растения особенно полезны, к примеру, для ускоренной селекции растений. Известен целый ряд методов для получения дигаплоидных организмов из гаплоидного организма.
Соматические гаплоидные клетки, гаплоидные эмбрионы, гаплоидные семена или гаплоидные растения, полученные из гаплоидных семян, можно обработать средством, вызывающим удвоение хромосом. Из гаплоидных клеток можно регенерировать гомозиготные дигаплоидные растения путем обработки гаплоидных клеток, в том числе гаплоидного каллюса, такими средствами, вызывающими удвоение хромосом, как колхицин, антимикротрубочковые гербициды или закись азота, получая гомозиготные дигаплоидные клетки.
Методы удвоения хромосом описаны, к примеру, в US Patent Nos. 5770788 и 7135615; US Patent Publication No. 2004/0210959 и 2005/0289673; Antoine-Michard S. et al., Plant Cell, Tissue Organ Cult., Cordrecht, the Netherlands, Kluwer Academic Publishers 48(3):
203-207 (1997); Kato A., Maize Genetics Cooperation Newsletter 1997, 36-37; и Wan Y. et al., Trends Genetics 77: 889-892 (1989); Wan Y. et al., Trends Genetics 81: 205-211 (1991), содержание которых включено в виде ссылки. Методы могут включать, к примеру, обработку гаплоидных клеток закисью азота, антимикротрубочковыми гербицидами или колхицином. Необязательно гаплоиды можно подвергнуть трансформации представляющим интерес гетерологичным геном, если нужно.
Далее дигаплоидные растения можно скрещивать с другими растениями, получая Fl, F2 или последующие поколения растений с нужными свойствами.
VIII. Нерастительные организмы
Полагаем, что изобретение также является функциональным и в нерастительных организмах, не имеющих неодинаковых половых хромосом. Таким образом, специалисты могут получить мутантный белок кипетохорного комплекса (в том числе белок tailswap) на основе белковой последовательности белка кинетохорного комплекса (например, CENH3, CENPC, MCM21, MIS 12, NDC80 или NUF2) определенного организма и нокаутировать соответствующий эндогенный ген белка кинетохорного комплекса, как следует для этого организма. Типичными нерастительными организмами, в отношении которых, как можно полагать, изобретение приложимо, являются, без ограничения, дрожжи и другие грибы, а также животные, не имеющие неодинаковых (например, XY) половых или других хромосом, у которых гаплоиды не жизнеспособны.
Примеры
Следующие примеры приводятся для иллюстрации, но не для ограничения заявленного изобретения.
Получение гаплоидных растений, наследующих хромосомы только от одного родителя, может сильно ускорить селекцию растений (Dun-well J.M., Plant Biotechnol J, in press; Forster B.P. et al., Trends Plant Sci 12:368-75 (2007); Forster B.P. & Thomas W.T.B. in Plant Breeding Reviews (ed. Janick J.) 57-88 (John Wiley & Sons, Inc., 2005)). Гаплоиды, полученные из гетерозиготных особей и превращенные в диплоиды, сразу образуют гомозиготные линии, делая ненужным целые поколения инбридинга. Для получения гаплоидов обычно применяются два метода. Во-первых, гаплоидные растения могут быть регенерированы из культивируемых гаметоцитов (Guha S. & Maheshwari S.C., Nature 204:497 (1964)), однако многие виды и генотипы не поддаются этому процессу (Forster B.P. et al. Trends Plant Sci 12:368-75 (2007); Wedzony M. et al. in Advances in Haploid Production in Higher Plants (eds. Touraev A., Forster B.P. & Jain S.M.) 1-33 (Springer, 2009)). Во-вторых, гаплоиды могут возникать при редких межвидовых скрещиваниях, при которых один родительский геном элиминируется после оплодотворения (Bains G.S. & Howard H.W., Nature 166:795 (1950); Barclay I.R., Nature 256:410-411 (1975); Burk L.G. et al. Science 206:585 (1979); Clausen R.E. & Mann M.C., Proc Nati Acad Sci USA 10: 121-124 (1924); Hougas H.W. & Peloquin S.J., Nature 180: 1209-1210 (1957); Kasha K.J. & Kao K.N. Nature 225:874-6 (1970)). Молекулярная основа для элиминации генома непонятна, но одна из теорий гласит, что центромеры из двух родительских видов взаимодействуют с митотическим веретеном неодинаково, вызывая избирательную потерю хромосом (Bennett M.D. et al., Chromosoma 54: 175-200 (1976); Finch R.A., Chromosoma 88:386-393 (1983);
Laurie D.A. & Bennett M.D.» Genome 32:953-961 (1989)). Нами показано, что гаплоидный Arabidopsis thaliana можно легко получить из семян, манипулируя с одним из белков центромер - специфичным к центромерам гистоном CENH3/CENP-A. При скрещивании нулевых мутантов cenh 3, экспрессирующих измененные белки CENH3, с диким типом элиминируются хромосомы из мутанта, давая гаплоидное поколение. Гаплоиды спонтанно превращаются в фертильные диплоиды при нередукционном делении в мейозе, способствующем закреплению их генотипа. При реципрокном скрещивании могут быть получены материнские и отцовские гаплоиды. Опосредованная центромерами элиминация генома также использовалась для превращения природного тетраплоидного Arabidopsis в диплоид, уменьшая его плоидность для упрощения селекции. Поскольку CENH3 является всеобщим у эукариот, наш способ может распространяться на получение гаплоидов у любых видов растений.
Центромеры - это локусы хромосом, которые прикрепляются к микротрубочкам веретена и опосредуют правильное наследование генома в процессе деления клеток. В эпигенезе они определяются включением CENH3 (CENP-A у человека, HTR12 у А. thaliana (Talbert P.B. et al. Plant Cell 14: 1053-66 (2002)), варианта гистона НЗ, который заменяет обычный НЗ в центромерных нуклеосомах (Henikoff S. & Dalai Y., Curr Opin Genet Dev 15: 177-84 (2005)). Из A. thaliana был выделен cenh3-l, эмбриолетальный нулевой мутант, позволяющий нам полностью заменять нативный CENH3 модифицированными вариантами. Растения cenh3-l, восполненные трансгенным CENH3 с тегом из зеленого флуоресцентного белка (GFP-CENH3), имеют фенотип дикого типа. Растения cenh3-l также может спасти трансген "GFP-tailswap", у которого гипервариабельный N-концевой хвостовой домен CENH3 заменен хвостовой частью обычного НЗ с помощью варианта НЗ.З (кодируемого геном At] gl 33 70). GFP-tailswap несет на N-конце тег GF и содержит N-концевой хвост НЗ, слитый с доменом гистоновой складки CENH3 следующим образом:
хвост НЗ: MARTKQSARKSHGGKAPTKQLATKAARKSAPTTGGVKKPHRFR (SEQ ID N0:95), соединеный с доменом гистоновой складки CENH3:
PGTVALKEIRHFQKQTNLLIPAASFIREVRSITHMLAPPQINRWTAEALVALQEAA EDYLVGLFSDSMLCAIHARRVTLMRKDFELARRLGGKGRPW (SEQ ID N0:109).
Растения "GFP-tailswap" (cenh3-l, спасенный трансгеном GFP-tailswap) проявляли правильный митоз, так как анеуплоидия в соматических клетках не обнаруживалась. Однако растения GFP-tailswap оказались стерильными после цветения, что указывает на то, что у них мог быть специфический дефект в мейозе. GFP-tailswap в основном были стерильными с мужской стороны, хотя их можно использовать и как опылителей, если собрать много пыльников. При скрещивании в качестве женских с мужским растением дикого типа растения GFP-tailswap были фертильными на 60-70% от дикого типа.
При опылении GFP-tailswap пыльцой дикого типа у потомства F1 наблюдались некоторые необычные фенотипы. Во-первых, 80-95% оплодотворенных семяпочек прекращали развитие на начальной стадии, давая нежизнеспособные семена (таблица 1).
Во-вторых, хотя ожидалось, что жизнеспособное потомство будет диплоидным и гетерозиготным по cenh3-l и гемизиготным по трансгену GFP-tailswap, 10 из 16 растений содержали только CENH3 дикого типа и не имели GFP-tailswap. Все эти растения были стерильными несмотря на то, что они имели генотип дикого типа. Более того, при скрещивании GFP-tailswap с мужскими растениями мутанта quartet тоже получали стерильное потомство F1 (3/5 растений), которое проявляло фенотип слипания пыльцы мутанта quartet несмотря на то, что quartet рецессивен, а родитель GFP-tailswap должен был передать аллель QUARTET дикого типа. Эти поразительные наблюдения наводят на мысль, что стерильное потомство потеряло хромосомы своего материнского растения GFP-tailswap и поэтому оно содержит меньше хромосом, чем диплоидные A. thaliana (2n=10). Кариотип этих растений проверяли и оказалось, что они гаплоидны и содержат только 5 хромосом.
Поскольку центромеры контролируют наследование хромосом, предположили, что хромосомы, вошедшие в стадию зиготы и содержащие вариант GFP-tailswap CENH3, будут неправильно расходиться и потеряются, давая гаплоидные растения с хромосомами только от родителя дикого типа. Чтобы проверить это, растения GFP-tailswap (на фоне Со1-0) скрещивали с некоторыми полиморфными вариантами и генотипировали гаплоиды F1 по маркерам на всех пяти хромосомах A. thaliana (таблица 1). Независимо от использования родителя дикого типа, гаплоидные растения неизменно содержали только хромосомы дикого типа (гаплоиды мужского родителя), указывая на то, что геном GFP-tailswap подвергался элиминации (всего прогенотипировали 42 гаплоида). Кроме того, наши результаты показывают, что процесс образования гаплоидов путем опосредованной центромерами элиминации генома не зависит от генотипа родителя дикого типа.
Элиминация генома, вызванная изменениями CENH3, не специфична для трансгена GFP-tailswap. При скрещивании мутантов cenh3-1, восполненных GFP-CENH3 до дикого типа, также получали гаплоидные растения, но с меньшей частотой, чем GFP-tailswap (таблица 1). При самооплодотворении растений GFP-tailswap или GFP-CENH3 не наблюдалось гаплоидного потомства (таблица 1). Наши результаты свидетельствуют, что общие нарушения в структуре центромер достаточны для того, чтобы воспрепятствовать сегрегации хромосом во время митоза зиготы, образуя гаплоидный эмбрион, когда хромосомы, содержащие мутантый CENH3, конкурируют с диким типом за одно и то же веретено деления.
Гаплоиды эффективно образуются при скрещивании GFP-tailswapxwmviw. тип, составляя 25-45% жизнеспособного потомства (таблица 1). Остальное потомство составляли либо диплоидные гибриды, либо анеуплоидные гибриды, проявляющие типичный для растений A. thaliana онтогенетический фенотип с более чем 10 хромосомами (Henry I.M. et al.. Genetics 170: 1979-88 (2005)) (таблица 1). Анеуплоидность также могла бы объяснить высокий уровень недоразвития семян при скрещивании GFP-tailswap×дикий тип, так как некоторые эмбрионы с несбалансированным кариотипом могли оказаться нежизнеспособными.
Однородительские гаплоиды могут содержать геном как от женского, так и мужского родителя. Гаплоиды также получали при скрещивании женских растений дикого типа с GFP-tailswap в качестве опылителя (таблица 1). В этом случае гаплоидное потомство имеет чисто материнское происхождение. Генотипирование пластидного генома показало, что и материнские, и отцовские гаплоиды содержали цитоплазму своего материнского родителя. Гаплоиды как материнского, так и отцовского типа получали с использованием растений GFP-tailswap в качестве женского или мужского родителя, соответственно, при скрещивании с диким типом. Соотношение гаплоидов и анеуплоидов было значительно ниже, если женское растение дикого типа скрещивали с мужским растением GFP-taiIswap (таблица 1). Высказано предположение, что если в онтогенезе CENH3 экспрессируется раньше из материнского генома (дикого типа), то CENH3 дикого типа может включаться в отцовские хромосомы, полученные из GFP-taiIswap, предотвращая элиминацю генома при скрещивании дикий типх GFP-taiIswap.
Гаплоидные растения A. thaliana морфологически похожи на диплоиды, но сравнительно меньше их по размеру. На ранней стадии вегетационного развития гаплоиды имели более узкие розеточные листья. После выход в стрелку гаплоиды образовывали больше листьев из вторичной меристемы. Цветки у гаплоидов меньше, чем цветки у диплоидов, следуя общей тенденции в том, что размер цветков у A. thaliana возрастает с увеличением плоидности. Гаплоиды обычно стерильны. Они содержат по одной копии каждой хромосомы и не могут подвергаться гомологичному спариванию в мейозе, давая гаметы, не содержащие полного набора хромосом. Материнские и отцовские гаплоидные растения имели сходную взрослую морфологию. Это согласуется с тем, что весь засвидетельствованный импринтинг у A. thaliana происходит в короткоживущем эндосперме - структуре, заключенной в семени.
Для использования потенциала гаплоидов при улучшении сельскохозяйственных культур их геном следует удвоить с образованием фертильных диплоидов (дигаплоидов) (Forster В.Р. et al.. Trends Plant Sci 12:368-75 (2007)). Тщательный осмотр гаплоидов А. thaliana показал, что взятые наугад стручки содержат одно или двое семян. Каждое гаплоидное растение в целом дает 50-2500 семян в зависимости от фона родителя дикого типа (таблица S1).
Большинство (95%) этих семян имело нормальный вид и давало фертильные диплоиды. Чтобы выяснить, как у гаплоидов получаются диплоидные семена, проанализировали разделение хромосом во время мейоза у мужских растений-гаплоидов. Во время профазы I все пять хромосом оставались разделенными в виде унивалентов, которые правильно выстраивались в метафазе I. В анафазе I большинство мейоцитов проявляло несбалансированную редукционную сегрегацию (4-1, 3-2 и т.д.). Мейоз II в этих случаях давал анеуплоидные тетрады. У небольшого меньшинства клеток в анафазе I все 5 унивалентов перемещались к одному полюсу (сегрегация 5-0). При последующем мейозе II сестринские хроматиды разделялись поровну, образуя гаплоидные диады и жизнеспособные гаметы. Таким образом, предполагается, что случайное нерасхождение во время мейоза у мужских и женских гаплоидов давало дигаплоиды посредством самооплодотворения, в соответствии с предыдущими наблюдениями (Chase S.S., Botanical Review 35: 117-167 (1969); Jauhar P.P. et al. Crop Science 40: 1742-1749 (2000)). В редких случаях наблюдалось спонтанное удвоение хромосом в соматических тканях гаплоидных растений A. thaliana; боковые ответвления от основного соцветия (2 из 78 растений) или взятые наугад стручки (6 из 78 растений) проявляли полный набор семян. Ингибитор полимеризации микротрубочек колхицин также вызывает удвоение соматических хромосом у гаплоидных A. thaliana, а диплоидные побеги, которые регенерируют после обработки, проявляют полный набор семян. Несмотря на то, что гаплоиды A. thaliana уже получали из культуры пыльников (Avetisov V.A., Genetika 12: 17-25 (1976)), спонтанные диплоиды, полученные в этих экспериментах, оказались стерильными (Scholl R. & Amos J.A., Z Pflanzenphysiol 96:407-414 (1980)), и этот способ не получил широкого распространения. Легкость получения гаплоидов через семена посредством изменения CENH3 и превращения гаплоидов в диплоиды дает возможность крупномасштабного получения гаплоидов у A. thaliana.
Многие товарные культуры являются полиплоидными (Udall J.A. & Wendel J.F., Crop Sci 46:S3-S14 (2006)), а генетический анализ полиплоидов трудоемок. Снижение плоидности этих культур должно облегчить селекцию, поэтому протестировали, сможет ли опосредованная центромерами элиминация генома сделать диплоидов из тетраплоидов.. A. thaliana преимущественно диплоидны, но существуют и тетраплоидные разновидности (Henry I.M. et al. Genetics 170: 1979-88 (2005)). GFP-tailswap скрещивали с естественным тетраплоидом Warschau-1 (Wa-1), и несмотря на то, что более 98% семян не выросло, жизнеспособное потомство F1 включало искусственные диплоидные растения, содержащие только хромосомы Wa-1 (таблица 1). Следовательно, можно распространить опосредованную центромерами элиминацию генома и на сокращение плоидности полиплоидов.
Ранее предполагалось, что несовместимость центромер вызывает избирательную элиминацию генома при межвидовых скрещиваниях (Bennett M.D. et al., Chromosoma 54: 175-200 (1976); Finch R.A., Chromosoma 88:386-393 (1983); Laurie D.A. & Bennett M.D., Genome 32:953-961 (1989); Heppich S. et al„ Theor Appi Genet 61: 101-104 (1982); Jin W. et al. Plant Cell 16:571-81 (2004)), однако не было известно, как можно манипулировать центромерами для достижения этого. Была разработана практическая основа для искусственной элиминации генома путем изменения белка CENH3, необходимого для функционирования центромер у всех эукариот.Тот факт, что гаплоиды получались с помощью обоих трансгенов GFP-tails-wap и GFP-CENH3, свидетельствует о том, что многие различные изменения белка могут индуцировать элиминацию генома у других растений. Растения A. thaliana, которые совместно экспрессируют белки дикого типа и белки GFP-tailswap или GFP-CENH3, не вызывают образования гаплоидов. Поэтому наш способ сейчас основывается на замене нативного CENH3 измененным вариантом. Для снижения или устранения функции эндогенного CENH3 у новых видов может применяться мутирование cenh3 или такой метод блокирования генов, как РНК-интерференция.
Индуцирующие гаплоидность линии были описаны у трав (Сое Е.Н., American Naturalist 93:381-382 (1959); Hagberg A. & Hagberg G., Hereditas 93:341-343 (1980); Kermicle J.L., Science 166: 1422-1424 (1969)), но их генетическая основа неизвестна, за исключением неопределенного гаметофита кукурузы (ig) (Evans M.M., Plant Cell 19:46-62 (2007)). Эффект ig может ограничиваться кукурузой, так как мутации ортолога ig у А. thaliana - AS2 не дают фенокопии этого эффекта (On N. et al. Development 127:5523-32 (2000)). Наш процесс обладает ключевыми преимуществами над текущими способами получения гаплоидных растений. 1) Не требуется культивирование ткани, устраняя основной источник зависимости от генотипа. 2) Одни и тот же индуктор дает и материнские, и отцовские гаплоиды. 3) При скрещивании мутанта cenh3 в качестве женского растения ядерный геном мужского родителя переносится в гетерологичную цитоплазму. Это может ускорить получение цитоплазматических линий с мужской стерильность для получения гибридных семян. 4) Элиминация генома происходит между родителями, которые являются изогенными, за исключением изменения CENH3, что устраняет барьеры фертильности, присущие отдаленным скрещиваниям.
Элиминация генома, вызванная изменениями CENH3, вероятно, происходит во время нескольких первых зиготических митозов, когда центромеры от двух родителей нагружаются различными популяциями белков CENH3. Экспрессия как генов дикого типа, так и мутантных генов CENH3 в последующих клеточных циклах должна быстро уравнять количество двух белков в индивидуальных центромерах. У растений GFP-tailswap и GFP-CENH3 зиготический митоз является нормальным, так как гаплоиды от самооплодотворяющихся растений не наблюдались. Более того, растения GFP-CENH3 имеют фенотип полностью дикого типа. Тонкие различия в связывании ДНК центромерами, сборке кинетохоров или соединении с микротрубочками веретена могут быть достаточными, чтобы замедлить разделение хромосом, содержащих измененный CENH3, что приводит к элиминации генома. Контрольные точки клеточного цикла у растений должны быть достаточно расслаблены, способствуя дифференциальному разделению хромосом дикого типа и мутантных хромосом, поэтому предположительно цитокинез протекает без полного разделения хромосом. Точный механизм элиминации генома в наших экспериментах остается неизвестным.
Последовательности ДНК центромер и белка CENH3 быстро эволюционируют, поэтому высказывалось предположение, что различия в центромерах создают барьеры между видами (Henikoff S. et al. Science 293: 1098-102 (2001)). Хотя в наших экспериментах использовались меченые белки, однако они указывают на то, что изменения в CENH3 могут вызывать специфическую потерю хромосом в гибридной зиготе.
Сводка по методам
Растительные материалы
Мутация cenh3-l представляет собой транзицию G на А по нуклеотиду 161 относительно ATG ^+1, которая вызывают мутацию консервативного сплайс-акцептора во втором интроне. Трансгены GFP-CENH3 и GFP-tailswap содержат N-концевой GFP, при этом использовали эндогенный промотор и терминатор CENH3. Расположение трансгена GFP-tailswap определяли методом TAIL-ПНР, что позволяло нам определить, является трансген гомозиготным или гемизиготным. Стерильная мужская линия C24/Ler была предоставлена Dr. Luca Comai (University of California, Davis). Мужская стерильность передавалась А9-барназным трансгеном. Растения выращивали в режиме 16 ч освещения /8 ч темноты при 20°С.
Получение и генотипирование геномной ДНК
Получение геномной ДНК и генотипирование методом ПЦР проводили по стандартным методикам.
Цитогенетический анализ
Для анализа прохождения мейоза и для определения плоидности делали препараты митотических и мейотических хромосом из пыльников по опубликованным методикам.
Растительный материал
Cenh3-l выделяли по методике TILLING (Comai L. & HenikoffS., Plant J 45:684-94 (2006)). Популяцию TILLING получали путем мутагенеза Arabidopsis thaliana на фоне Col-0 с помощью этилметансульфоната по стандартной методике. Cenh3-l выделяли методом расщепления гетеродуплекса CEL1 по методике TILLING с помощью праймеров для ПЦР, специфичных для гена CENH3/HTR12.
Cenh3-1 должен нарушать нормальный сплайсинг CENH3, так как он мутирует консервативный сплайс-акцепторный сайт в начале второго кодирующего экзона. При трансляции мРНК, содержащей первый кодирующий экзон, подвергнутый сплайсингу в неправильном положении внутри CENH3, должно получиться только 18 правильных аминокислот. Поскольку домен гистоновой складки CENH3 начинается с остатка аминокислоты 82, то полагают, что Cenh3-l является нулевым аллелем (что подтверждается его эмбриолетальным фенотипом).
Клонирование трансгенов GFP-CENH3 и GFP-tailswap и конструирование линий Cenh3-1, восполненных GFP-CENH3 или GFP-tailswap, описано в другом месте (Ravi, Comai, Sundaresan, Chan et al., статья в подготовке). Последовательности праймеров и все подробности доступны по требованию. •
При скрещивании дикого типа в качестве женского с GFP-tailswap в качестве мужского растения использовали бинокуляр для прямого наблюдения отложения пыльцы на рыльце (GFP-tailswap в основном является стерильным по мужской линии). Количество жизнеспособной пыльцы в индивидуальных цветках GFP-tailswap варьирует.Отбирали цветки, у которых было четко видно большее количество пыльцы, а при опылении использовали более 60 пыльников (10 цветков GFP-tailswap) на одно рыльце дикого типа для получения набора семян, приведенного в таблице 1. При использовании простой лупы и приблизительно 12 пыльников (2 цветков GFP-tailswap) на одно рыльце дикого типа получали гораздо меньшее количество семян в стручке.
Содержание нормальных семян в процентах определяли визуальным осмотром, используя бинокуляр.
Семена из скрещиваний GFP-tailswap×дикий тип высеивали на чашки IxMS, содержащие 1% сахарозы для максимальной эффективности прорастания, в особенности у семян, имеющих ненормальный вид. Гаплоидными часто были поздно прорастающие семена.
В качестве мутанта quartet использовали qrtl-2 (Francis К.Е. et al. Plant Physiol 142: 1004-13 (2006)).
Мужская стерильность в линии C24/Ler придавалась А9-барназным трансгеном (Bushell С.et al. Plant Cell 15: 1430-42 (2003); Paul W. et al. Plant Mol Biol 19:611-22 (1992)).
В эксперименте GFP-tailswap×Wa-1 потомство от скрещивания GFP-tailswap×Wa-1, которое содержало только хромосомы Wa-1, оказалось диплоидным, судя по препаратам хромосом. Растения, которые были гетерозиготными по некоторым хромосомам (маркеры Со1-0 и Wa-1) и гомозиготными по другим хромосомам (только маркеры Wa-1), считались анеуплоидными. Триплоидного потомства (гетерозиготного по маркерам на все хромосомы) не оказалось. Подгруппу растений далее подвергали кариотипированию на препаратах хромосом для подтверждения анеуплоидности.
Цитогенетический анализ
Препараты митотических и мейотических хромосом из пыльников делали по опубликованным методикам (Ross K.J. et al.. Chromosome Res 4:507-16 (1996)).
Обработка колхицином
При обработке колхицином развивающихся гаплоидных растений использовали ранее опубликованную методику с небольшими модификациями (Josefsson С.et al., Curr Biol 16: 1322-8 (2006)). Готовили раствор 0,25% колхицина, 0,2% Silwet и наносили одну каплю в 20 мкл на меристему перед выходом в стрелку. Растения временно заболевали после обработки колхицином. После восстановления на вторичных меристемах появились фертильные соцветия, указывая на успешное удвоение хромосом. Гаплоидные растения можно обрабатывать и после выхода в стрелку, однако степень успеха будет значительно ниже.
Пример 2
GFP-maizetailswap дает гаплоиды F1 при скрещивании с диким типом
Создавали химеру, в которой хвостовую часть CENH3 A. thaliana заменяли на хвостовой домен CENH3 (SEQ ID NO: 102) из кукурузы (Zea mays), получая при этом слитый белок из хвоста CENH3 кукурузы и домена гистоновой складки CENH3 А. thaliana, которым трансформировали гетерозиготы сепЪ3-1. Как и ожидалось, этот белок GFP-maizetailswap направлялся в кинетохоры и спасал эмбриолетальный фенотип cenh3-1. Восполненные растения оказались более стерильными, чем восполненные GFP-tails-wap растения, но обладали ограниченной фертильностыо при использовании их в качестве женских. При скрещивании женских растений cenh3-l GFP-maizetailswap с мужскими растениями кукурузы дикого типа среди 10 потомков F1 оказались 2 гаплоида, 3 диплоида и 5 анеуплоидов.
mCherry-tailswap дает гаплоиды F1 при скрещивании с диким типом Создавали трансген, в котором тег GFP в GFP-tails-wap заменяли на N-концевой тег mCheny (mCherry (SEQ ID NO: 105) - мономерный вариант красного флуоресцентного белка DsRed). От N-конца к С-концу, этот белок содержит mCherry, хвостовой домен Н3.3 Arabidopsis thaliana и домен гистоновой складки CENH3 Arabidopsis thaliana. Трансгенами mCherry-tailswap трансформировали гетерозиготы cenh3-l. Растения mCherry-tailswap с комплементом cenh3-l скрещивали в качестве женских с мужским растением дикого типа, при этом из 11 потомков F1 отмечены 1 гаплоид, 6 анеуплоидов и 4 диплоида.
Конструкция mCherry-tailswap создавалась как вектор СР169 из pCAMBIA-1300 с промотором HTR. Вставка содержала сайт Mlul, за которым следовал N-концевой фрагмент mCherry SalI-Xbal, а за ним терминатор HTR 12. Фрагмент Tailswap из НЗ синтезировали методом перекрывающихся ПЦР, расщепляли с помощью SalI+Xbal и клонировали в СР169, получая конструкцию mCherry-tailswap.
Трансген tailswap без тега GFP восполняет мутацию cenh3-l. Восполненные растения дают гаплоиды F1 при скрещивании с диким типом
Создавали трансген, в котором тег GFP из GFP-tailswap был удален. От N-конца к С-концу, этот белок содержит хвостовой домен НЗ.З Arabidopsis thaliana и домен гистоновой складки CENH3 Arabidopsis thaliana. Трасгенами tailswap трансформировали гетерозиготы cenh3-l. При скрещивании растений с комплементом cenh3-l tailswap в качестве женских с мужскими растениями дикого типа из 95 потомков F1 отмечены 4 гаплоида, 27 анеуплоидов и 67 диплоидов.
Совместная экспрессия различных вариантов CENH3 дает нужные свойства у штамма с элиминацией генома
Ранее описанные растения GFP-tailswap (мутанты cenh3-l, спасенные трансгеном GFP-tailswap) очень эффективно образуют гаплоиды, но их трудно скрещивать в качестве опылителей, так как они в основном стерильны по мужской линии. Растения GFP-CENH3 (мутанты cenh3-l, спасенные трансгеном GFP-CENH3) слабее образуют гаплоиды, но они гораздо более фертильны. Обнаружено, что совместная экспрессия GFP-CENH3 и GFP-tailswap в растениях cenh3-l дает более жизнеспособную пыльцу, чем GFP-tailswap, и при этом может индуцировать элиминацию генома при скрещивании этих растений с диплоидами или тетраплоидами дикого типа. Действительно, растения cenh3-l, несущие оба трасгена GFP-CENH3 и GFP-tailswap (GEM; Genome Elimination caused by a Mix of cenh3 variants), дают много пыльцы для скрещивания, хотя жизнеспособность пыльцы все-таки была меньше, чем у дикого типа.
При скрещивании женских растений GEM с мужскими дикого типа из 50 потомков F1 оказалось 2 гаплоида. При скрещивании женских растений дикого типа с мужскими GEM из 104 потомков оказался 1 гаплоид.
Растения GEM представляют большое улучшение в сравнении с GFP-tails-wap или GFP-CENH3, когда родитель дикого типа представлен тетраплоидом с диплоидными гаметами. Когда растения GEM скрещивали в качестве мужских или женских с тетраплоидом дикого типа, хромосомы от родителя GEM подвергались элиминации в подгруппе потомков F1 (таблица 3). Растения СЖМ фертильны как в виде мужских, так и женских, и проявляют эффективную элиминацию генома при скрещивании с тетраплоидным родителем с диплоидными гаметами.
Способы конструирования GFP-maizetailswap
Трансген tailswap CENH3 кукурузы конструировали путем слияния в одной рамке считывания N-концевого хвоста CENH3 кукурузы (соответствует аминокислотам 1-61) и домена гистоновой складки CENH3 Arabidopsis (соответствует аминокислотам 82-179) методом перекрывающихся ПЦР. N-концевой хвостовой домен кукурузы (206 п.о.) амплифицировали из кДНК кукурузы с помощью комбинации праймеров СР 384 (5'-NNNNgfcgacATGGCTCGAACCAAGCACCA-3' (SEQ ID NO: 110), сайт Sail выделен курсивом)) и СР 572 (5'-CAACGGTTCCTGGCCTCCAGCGGTGGC-3' (SEQ ID NO: 111)). HFD Arabidopsis (950 п.о.) амплифицировали из геномной ДНК с помощью комбинации праймеров СР 571 (5'-GCCACCGCTGGAGGCCAGGAACCGTTG-3' (SEQ ID NO: 112)) и СР 375 (5'-NNNN/ctogaTCACCATGGTCTGCCTTTTCCTCC-3' (SEQ ID NO: 113), сайт Xbal выделен курсивом)). Полученные фрагменты очищали в геле и использовали в качестве матрицы для их слияния методом перекрывающихся ПЦР с помощью комбинации праймеров СР 384 и СР 375. Полученный фрагмент в 1,15kb клонировали в виде фрагмента SalI-Xbal в бинарный вектор СР 93 (происходящий из pCAMBIA-1300). Вектор СР 93 содержит кодирующую последовательность GFP перед и в одной рамке считывания с сайтом SalI-Xbal, а его экспрессия контролируется 5'- и 3'-регуляторными последовательностями гена CENH3 Arabidopsis.
Подразумевается, что описанные здесь примеры и воплощения предназначены только для иллюстрации и что в их свете специалистами в данной области могут быть предложены различные модификации или изменения, которые должны придерживаться сути и содержания настоящей заявки и объема прилагаемой формулы изобретения. Все публикации, патенты и патентные заявки, процитированные здесь, включены в виде ссылки во всей полноте на все случаи.
Реферат
Изобретение относится к области биохимии, в частности к трансгенному растению для получения гаплоидного потомства. Также раскрыта выделенная экспрессирующая нуклеотидная конструкция, содержащая промотор, функционально соединенный с полинуклеотидом, кодирующем полипептид, где указанный полипептид содержит гетерологичную аминокислотную последовательность из по меньшей мере 5 аминокислот, соединенную с хвостовым доменом гистона, соединенным с N-концом белка, содержащего домен гистоновой складки CENH3, где гетерологичная аминокислотная последовательность гетерологична домену гистоновой складки CENH3, или хвостовой домен гистона, соединенный с N-концом белка, содержащего домен гистоновой складки CENH3, где хвостовой домен гистона гетерологичен домену гистоновой складки CENH3. Изобретение также относится к способу получения растений, которые характеризуются половиной плоидности родительского растения, экспрессирующего эндогенный белок CENH3, а также к способу получения трансгенных растений. Изобретение позволяет эффективно получать гаплоидное потомство. 4 н. и 15 з.п. ф-лы, 1 ил., 4 табл., 2 пр.
Формула
причем экспрессионная кассета содержит промотор, функционально связанный с полинуклеотидом, кодирующим полипептид,
указанный полипептид содержит
(i) гетерологичную аминокислотную последовательность из по меньшей мере 5 аминокислот, соединенную с хвостовым доменом гистона, соединенным с N-концом белка, содержащего домен гистоновой складки CENH3, где гетерологичная аминокислотная последовательность гетерологична домену гистоновой складки CENH3, или
(ii) хвостовой домен гистона, соединенный с N-концом белка, содержащего домен гистоновой складки CENH3, где хвостовой домен гистона гетерологичен домену гистоновой складки CENH3,
в котором по меньшей мере один аллель эндогенной геномной кодирующей CENH3 последовательности растения инактивирован или нокаутирован.
(i) гетерологичную аминокислотную последовательность из по меньшей мере 5 аминокислот, соединенную с хвостовым доменом гистона, соединенным с N-концом белка, содержащего домен гистоновой складки CENH3, где гетерологичная аминокислотная последовательность гетерологична домену гистоновой складки CENH3, или
(ii) хвостовой домен гистона, соединенный с N-концом белка, содержащего домен гистоновой складки CENH3, где хвостовой домен гистона гетерологичен домену гистоновой складки CENH3.
1) получение трансгенного растения путем:
a) трансформирования растительных клеток, в которых один или два аллеля эндогенной геномной кодирующей последовательности CENH3 растения инактивированы или нокаутированы, нуклеотидной конструкцией, где указанная нуклеотидная конструкция содержит промотор, функционально связанный с полинуклеотидом, кодирующим полипептид, указанный полипептид содержит:
(i) гетерологичную аминокислотную последовательность из по меньшей мере 5 аминокислот, соединенную с хвостовым доменом гистона, соединенным с N-концом белка, содержащего домен гистоновой складки CENH3, где гетерологичная аминокислотная последовательность гетерологична домену гистоновой складки CENH3, или
(ii) хвостовой домен гистона, соединенный с N-концом белка, содержащего домен гистоновой складки CENH3, где хвостовой домен гистона гетерологичен домену гистоновой складки CENH3,
b) отбора трансформантов, содержащих указанную нуклеиновую кислоту, и регенерирования растения, содержащего указанную нуклеотидную конструкцию, тем самым получая растение,
2) скрещивание родительского растения с растением по стадии 1,
и 3) получение потомства F1, полученного в результате скрещивания, имеющего половину плоидности родительского растения.
трансформирование растительных клеток, в которых один или два аллеля эндогенной геномной кодирующей последовательности CENH3 растения инактивированы или нокаутированы, нуклеотидной конструкцией, где указанная нуклеотидная конструкция содержит промотор, функционально связанный с полинуклеотидом, кодирующим полипептид, указанный полипептид содержит:
(i) гетерологичную аминокислотную последовательность из по меньшей мере 5 аминокислот, соединенную с хвостовым доменом гистона, соединенным с N-концом белка, содержащего домен гистоновой складки CENH3, где гетерологичная аминокислотная последовательность гетерологична домену гистоновой складки CENH3, или
(ii) хвостовой домен гистона, соединенный с N-концом белка, содержащего домен гистоновой складки CENH3, где хвостовой домен гистона гетерологичен домену гистоновой складки CENH3 и
отбор трансформантов, содержащих указанную нуклеиновую кислоту, и регенерирование растения, содержащего указанную нуклеотидную конструкцию, тем самым получая растение.

Комментарии