Ингибиторы продуцирования / секреции β-амилоидного белка - RU2304140C2
Код документа: RU2304140C2
Описание
Область техники
Данное изобретение относится к новым соединениям, имеющим ингибирующую активность против продуцирования или секреции β-амилоидного белка; и лекарственному средству для лечения различных заболеваний, вызываемых аномальными продуцированием или секрецией β-амилоидного белка, таких как болезнь Альцгеймера, синдром Дауна и другие заболевания, связанные с депонированием амилоида.
Предпосылки изобретения
Болезнь Альцгеймера является нейродегенеративным заболеванием, имеющим патологические признаки, такие как дегенерация или потеря нервных клеток, образование сенильных бляшек и нейрофибриллярных сплетений (клубков). Болезнь Альцгеймера вызывает симптомы деменции, такие как постепенная потеря памяти, познавательной способности, мышления, оценки или т.п., и, в конечном счете, приводит к смерти. До настоящего времени не был известен эффективный способ лечения или предупреждения заболевания.
Основным белком, составляющим сенильную бляшку, депонированную в головном мозге, является β-амилоидный белок, который состоит из 39-43 аминокислот. β-амилоидный белок проявляет цитотоксичность, которая предположительно индуцирует болезнь Альцгеймера (Science, 259, 514 (1993)). Известно, что β-амилоидный белок, секретируемый из клеток, является полипептидом, состоящим в основном из 40 или 42 аминокислот и, в частности, состоящим из 42 аминокислот, быстро депонируется в головном мозге вследствие сильной способности к агрегации и, кроме того, имеет сильную цитотоксичность (Journal of Biological Chemistry, 270, 7013 (1995)). β-амилоидный белок продуцируется повсеместно in vivo, но его функция остается неизвестной.
β-амилоидный белок продуцируется процессингом β-амилоидного белка-предшественника (АРР), который является мембранным белком. Мутация гена АРР наблюдается у пациентов, страдающих от семейной болезни Альцгеймера. Известно, что увеличение количества продуцирования или секреции β-амилоидного белка встречается в клетках, имеющих этот мутированный ген, введенный в них. Это предполагает, что лекарственное средство, ингибирующее продуцирование или секрецию β-амилоидного белка является эффективным для предупреждения или лечения болезни Альцгеймера.
В процессинге АРР, ВАСЕ (расщепляющий АРР в β-сайте фермент) (Science, 286, 735 (1999)) или Asp1 (Molecular and Cellular Neuroscience, 16, 609 (2000)), каждый из которых является аспарагиновой протеазой, представляются в качестве β-секретазы для расщепления N-конца β-амилоидного белка. Со значительной долей уверенности предполагается, что пресенилин участвует в событиях С-концевого расщепления γ-секретазой (Nature, 398, 513 (1999)). Сообщалось об ингибиторах секретазы (Journal of Medicinal Chemistry, 44, 2039 (2001)), но большинство этих ингибиторов являются пептидными соединениями.
В WO00/50391, SMITH, et al., описаны соединения, имеющие сульфонамидный скелет и способные регулировать продуцирование β-амилоидного белка. В WO01/79677 (GB 026827) BELANGER, et al., описаны соединения, имеющие бициклоалкилсульфонамидный скелет и ингибирующие γ-секретазу.
Целью данного изобретения является получение соединений, имеющих структуру, отличающуюся от структуры описанных выше известных соединений, имеющих превосходное ингибирующее действие против продуцирования и секреции β-амилоидного белка и имеющих желательные свойства в качестве фармацевтических средств.
Описание изобретения
Авторы данного изобретения проводили разносторонние исследования. В результате было обнаружено, что производные тиометана, сульфинилметана или сульфонилметана, представленные описанной ниже формулой (1), имеют превосходную ингибирующую активность против продуцирования или секреции β-амилоидного белка и, следовательно, полезны в качестве лекарственного средства для лечения различных заболеваний, являющихся результатом аномального продуцирования или секреции β-амилоидного белка, что привело к созданию данного изобретения.
Таким образом, в данном изобретении предлагается соединение формулы (1):
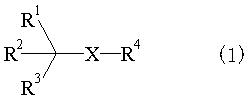
{где:
Х представляет -S-, -SO- или -SO2-;
R1 представляет:
-С(R5)(R6)(R7),
[где R5, R6 и R7, каждый независимо, представляет атом галогена, цианогруппу, нитрогруппу или -Q51-Q52-Q53-Q54 [где Q51 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q52 представляет простую связь, -О-, -O-N(A51)-, -O-N(COA51)-, -N(A51)-, -N(COA51)-, -N(COOA51)-, -N(CON(A51)(A52)-, -N(OA51)-, -N(NA51A52)-, -N(A51)-N(A52)-, -N(COA51)-N(A52)-, -N(A51)-O-, -N(COA51)-O-, -S-, -N=N-, -C(A51)=N-, -C(A51)=N-O-, -C(A51)=N-N(A52)-, -N=C(A51)-, -O-N=C(A51)-, -(NA51)-N=C(A52)- или -С(=NA51)-N(A52)-,
(где А51 и А52, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель),
Q53 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q54 представляет -А53, -ОА53, -N(A53)(A54), -SA53, -NA54-OA53, -NA55-N(A53)(A54) или -О-N(A53)(A54),
(где А53, А54 и А55, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель), или
R5 и R6 могут быть связаны вместе с образованием циклической углеводородной группы, которая может иметь заместитель, или гетероциклической группы, которая может иметь заместитель (когда углеводородная группа или гетероциклическая группа, образованная связыванием R5 и R6, является ненасыщенной, R7 может представлять соответствующую ненасыщенную связь)],
-N(R8)(R9),
[где R8 и R9, каждый независимо, представляет -Q81-Q82-Q83-Q84
[где Q81 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q82 представляет простую связь, -О-, -O-N(A81)-, -O-N(COA81)-, -N(A81)-, -N(COA81)-, -N(COOA81)-, -N(CON(A81)(A82))-, -N(OA81)-, -N(NA81A82)-, -N(A81)-N(A82)-, -N(COA81)-N(A82)-, -N(A81)-O-, -N(COA81)-O-, -S-, -N=N-, -C(A81)=N-, -C(A81)=N-O-, -C(A81)=N-N(A82)-, -N=C(A81)-, -O-N=C(A81)-, -(NA81)-N=C(A82)- или -С(=NA81)-N(A82)-,
(где А81 и А82, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель),
Q83 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q84 представляет -А83, -ОА83, -N(A83)(A84), -SA83, -NA84-OA83, -NA85-N(A83)(A84) или -О-N(A83)(A84),
(где А83, А84 и А85, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель)]],
-Х1R10,
[где Х1 представляет -О- или -S-, и R10 представляет -Q101-Q102-Q103-Q104,
[где Q101 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q102 представляет простую связь, -О-, -O-N(A101)-, -O-N(COA101)-, -N(A101)-, -N(COA101)-, -N(COOA101)-, -N(CON(A101)(A102))-, -N(OA101)-, -N(NA101A102)-, -N(A101)-N(A102)-, -N(COA101)-N(A102)-, -N(A101)-O-, -N(COA101)-O-, -S-, -N=N-, -C(A101)=N-, -C(A101)=N-O-, -C(A101)=N-N(A102)-, -N=C(A101)-, -O-N=C(A101)-, -(NA101)-N=C(A102)- или -С(=NA101)-N(A102)-,
(где А101 и А102, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель),
Q103 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q104 представляет -А103, -ОА103, -N(A103)(A104), -SA103, -NA104-OA103, -NA105-N(A103)(A104) или -О-N(A103)(A104),
(где А103, А104 и А105, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель)]], или
-Х2R11,
[где Х2 представляет -SO- или -SO2- и R11 представляет Q111-Q112-Q113-Q114,
[где Q111 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q112 представляет простую связь, -О-, -O-N(A111)-, -O-N(COA111)-, -N(A111)-, -N(COA111)-, -N(COOA111)-, -N(CON(A111)(A112))-, -N(OA111)-, -N(NA111 A112)-, -N(A111)-N(A112)-, -N(COA111)-N(A112)-, -N(A111)-O-, -N(COA111)-O-, -S-, -N=N-, -C(A111)=N-, -C(A111)=N-O-, -C(A111)=N-N(A112)-, -N=C(A111)-, -O-N=C(A111)-, -(NA111)-N=C(A112)- или -С(=NA111)-N(A112 )-,
(где А111 и А112, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель),
Q113 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q114 представляет -А113, -ОА113, -N(A113)(A114), -SA113, -NA114-OA113, -NA115-N(A113)(A114) или -О-N(A113)(A114),
(где А113, А114 и А115, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель)]],
R2 представляет -Q21-Q22-Q23-Q24,
[где Q21 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q22 представляет простую связь, -О-, -O-N(A21)-, -O-N(COA21)-, -N(A21)-, -N(COA21)-, -N(COOA21)-, -N(CON(A21)(A22))-, -N(OA21)-, -N(NA21 A22)-, -N(A21)-N(A22)-, -N(COA21)-N(A22)-, -N(A21)-O-, -N(COA21)-O-, -S-, -N=N-, -C(A21)=N-, -C(A21 )=N-O-, -C(A21)=N-N(A22)-, -N=C(A21)-, -O-N=C(A21)-, -(NA21)-N=C(A22)- или -С(=NA21)-N(A22)-,
(где А21 и А22, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель),
Q23 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q24 представляет -А23, -ОА23, -N(A23)(A24), -SA23, -NA24-OA23, -NA25-N(A23)(A24) или -O-N(A23)(A24),
(где А23, А24 и А25, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель)], или
R1 и R2 могут быть связаны вместе с образованием циклической углеводородной группы, которая может иметь заместитель, или гетероциклической группы, которая может иметь заместитель, или могут быть связаны вместе с образованием =CR12R13,
[где R12 и R13, каждый независимо, представляет атом галогена, цианогруппу, нитрогруппу или -Q121-Q122-Q123-Q124,
[где Q121 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q122 представляет простую связь, -О-, -O-N(A121)-, -O-N(COA121)-, -N(A121)-, -N(COA121)-, -N(COOA121)-, -N(CON(A121)(A122))-, -N(OA121)-, -N(NA121A122 )-, -N(A121)-N(A122)-, -N(COA121)-N(A122)-, -N(A121)-O-, -N(COA121)-O-, -S-, -N=N-, -C(A121)=N-, -C(A121)=N-O-, -C(A121)=N-N(A122)-, -N=C(A121)-, -O-N=C(A121)-, -(NA121)-N=C(A122)- или -С(=NA121)-N(A122)-,
(где А121 и А122, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель),
Q123 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q124 представляет -А123, -ОА123, -N(A123)(A124), -SA123, -NA124-OA123, -NA125-N(A123)(A124) или -O-N(A123 )(A124),
(где А123, А124 и А125, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель)]];
R3 обозначает -Q31-Q32-Q33-Q34 [где Q31 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q32 представляет простую связь, -О-, -O-N(A31)-, -O-N(COA31)-, -N(A31)-, -N(COA31)-, -N(COOA31)-, -N(CON(A31)(A32))-, -N(OA31)-, -N(NA31A32)-, -N(A31)-N(A32)-, -N(COA31)-N(A32)-, -N(A31)-O-, -N(COA31)-O-, -S-, -N=N-, -C(A31)=N-, -C(A31)=N-O-, -C(A31)=N-N(A32)-, -N=C(A31)-, -O-N=C(A31)-, -(NA31)-N=C(A32)- или -С(=NA31)-N(A32)-,
(где А31 и А32, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель),
Q33 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q34 представляет -А33, -ОА33, -N(A33)(A34), -SA33, -NA34-OA33, -NA35-N(A33)(A34) или -O-N(A33)(A34),
(где А33, А34 и А35, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель)];
R4 представляет -Q41-Q42-Q43-Q44,
[где Q41 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q42 представляет простую связь, -О-, -O-N(A41)-, -O-N(COA41)-, -N(A41)-, -N(COA41)-, -N(COOA41)-, -N(CON(A41)(A42))-, -N(OA41)-, -N(NA41A42)-, -N(A41)-N(A42)-, -N(COA41)-N(A42)-, -N(A41)-O-, -N(COA41)-O-, -S-, -N=N-, -C(A41)=N-, -C(A41)=N-O-, -C(A41)=N-N(A42)-, -N=C(A41 )-, -O-N=C(A41)-, -(NA41)-N=C(A42)- или -С(=NA41)-N(A42)-,
(где А41 и А42, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель),
Q43 представляет простую связь, -СО-, -CS-, -SO-, -SO2-, -CO-CO-, -CO-CS-, -CS-CO- или -CS-CS-,
Q44 представляет -А43, -ОА43, -N(A43)(A44), -SA43, -NA44-OA43, -NA45-N(A43)(A44) или -O-N(A43)(A44),
(где А43, А44 и А45, каждый независимо, представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель)], или
R3 и R4 могут быть связаны вместе с образованием циклической углеводородной группы, которая может иметь заместитель, или гетероциклической группы, которая может иметь заместитель}, N-оксид или S-оксид данного соединения, их соль или сольват описанного выше соединения.
В данном изобретении предлагается также лекарственное средство, содержащее в качестве эффективного ингредиента соединение, представленное формулой (1), его N-оксид или S-оксид или их соль, или их сольват.
В данном изобретении предлагается также фармацевтическая композиция, содержащая соединение, представленное формулой (1), его N-оксид или S-оксид или их соль, или их сольват, и фармацевтически приемлемый носитель.
В данном изобретении предлагается также соединение, представленное формулой (1), его N-оксид или S-оксид, или их соль, или их сольват для изготовления лекарственного средства.
В данном изобретении предлагается также способ лечения заболевания, являющегося результатом аномальных продуцирования или секреции β-амилоидного белка, включающий введение эффективного количества соединения, представленного формулой (1), его N-оксида или S-оксида, или их соли, или их сольвата.
Наилучший способ осуществления изобретения
Далее будет приведено описание соединения, представленного формулой (1).
Термин «углеводородная группа» обозначает в данном контексте группу, состоящую только из атомов углерода и водорода. Эта группа может быть любой из линейной, разветвленной и циклической групп или комбинацией любых из двух или трех из них, и она может быть любой из насыщенной и ненасыщенной групп.
Типичные примеры линейной или разветвленной углеводородной группы включают алкильные, алкенильные и алкинильные группы и их комбинации. Эти линейные или разветвленные углеводородные группы включают группы, имеющие множество двойных или тройных связей, или группы, имеющие как двойную, так и тройную связь.
В качестве алкильной группы предпочтительными являются линейные или разветвленные алкильные группы, имеющие 1-18 атомов углерода, в частности линейные или разветвленные алкильные группы, имеющие 1-12 атомов углерода. Конкретные примеры такой алкильной группы включают группы метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, 2-метилпентил, 2-этилпентил, н-гексил, н-гептил, н-октил, н-нонил, н-децил, н-ундецил и н-децил.
В качестве алкенильной группы предпочтительными являются линейные или разветвленные алкенильные группы, имеющие 2-18 атомов углерода, в частности линейные или разветвленные алкенильные группы, имеющие 2-12 атомов углерода. Конкретные примеры такой алкенильной группы включают группы винил, аллил, пропенил, бутенил и пентенил.
В качестве алкинильной группы предпочтительными являются линейные или разветвленные алкинильные группы, имеющие 2-18 атомов углерода, в частности линейные или разветвленные алкинильные группы, имеющие 2-12 атомов углерода. Конкретные примеры такой алкинильной группы включают группы этинил, 2-бутинил и 3-пентинил.
Типичные циклические углеводородные группы включают циклоалкильные, циклоалкенильные, арильные, спироуглеводородные, циклические углеводородные с поперечными (мостиковыми) связями и конденсированные полициклические углеводородные группы. Применима также их комбинация. Циклические углеводородные группы включают группы, имеющие множество двойных связей или тройных связей, и группы, имеющие как двойную связь, так и тройную связь.
Примеры циклоалкильной группы включают циклоалкильные группы, имеющие 3-7 атомов углерода, такие как циклопропил, циклобутил, циклопентил, циклогексил и циклогептил.
Примеры циклоалкенильной группы включают циклоалкенильные группы, имеющие 4-7 атомов углерода, такие как циклопентенил и циклогексенил. Примеры циклоалкинильной группы включают циклоалкинильные группы, имеющие 4-7 атомов углерода.
Примеры арильной группы включают моноциклические или полициклические ароматические углеводородные группы, имеющие 6-14 атомов углерода. Конкретные примеры включают фенил, инденил, нафтил, антраценил и бифенил.
Примеры спироуглеводородной группы включают спироуглеводородные группы, имеющие 7-11 атомов углерода, такие как группы спиро[3.4]октанил и спиро[4.5]дека-1,6-диенил.
Примеры циклической углеводородной группы с поперечными (мостиковыми) связями включают циклические углеводородные группы с поперечными (мостиковыми) связями, имеющие 7-10 атомов углерода, такие как группы бицикло[2.2.1]гептанил, адамантил, бицикло[3.2.1]октанил, бицикло[2.2.1]гепт-2-енил, трицикло[2.2.1.02.6]гептанил и бицикло[4.3.1]деканил.
Примеры конденсированной полициклической углеводородной группы включают конденсированные полициклические группы, имеющие 8-14 атомов углерода, такие как группы инданил, тетрагидронафталинил, гексагидроинданил и октагидронафталинил.
Термин «гетероциклическая группа обозначает в данном контексте циклическую группу, имеющую один или более гетероатомов (N, O, S и т.д.) в качестве компонента ее циклической структуры, и она может быть любой из насыщенного кольца, ненасыщенного кольца или ароматического кольца, или может быть либо моноциклической, либо полициклической группой. Она включает также группу, полученную из гетероциклического спиросоединения или гетероциклического соединения, имеющего циклическую структуру с поперечными (мостиковыми) связями.
Примеры насыщенной моноциклической гетероциклической группы включают 3-7-членные группы, каждая из которых имеет 1-4 атома, выбранных из атомов азота, кислорода и серы. Конкретные примеры включают группы пирролидинил, тетрагидрофуранил, оксетанил, тетрагидротиенил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, оксиранил, тиоранил, диоксанил, азиридинил, имидазолидинил, пиразолидинил, тетрагидропиранил, тетрагидротиопиранил, тетрагидроксазолил, тетрагидротиазолил, тетрагидроизоксазолил, тетрагидроизотиазолил, диоксоланил и оксатиоранил.
Примеры ненасыщенной моноциклической гетероциклической группы включают 4-7-членные группы, имеющие 1-4 атома, выбранных из атомов азота, кислорода и серы. Конкретные примеры включают группы пирролил, фурил, тиенил, пиразолил, имидазолил, тиазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, дигидрооксазолил, дигидротиазолил, дигидроизоксазолил, дигидроизотиазолил, пиридил, пиримидинил, триазинил, тетразолил, пирролинил, имидазолинил, пиразолинил, тиадиазолил, оксадиазолил, дигидроксазолил, дигидротиазолил, дигидроизоксазолил, дигидроизотиазолил, пиразинил, пиридазинил, пиранил, дигидропиридинил, дигидропирролил, дигидрохинолил, дигидроимидазолил, дигидропиразолил, дигидропиразинил и дигидропиридазинил.
Примеры полициклической гетероциклической группы включают 7-14-членные группы, имеющие 1-4 атома, выбранные из атомов азота, кислорода и серы. Конкретные примеры включают группы бензофуранил, бензотиазолил, индолил, хинолил, изохинолил, бензопиранил, бензоксазолил, бензотиазолил, бензимидазолил, бензодиоксанил, бензотиофенил, бензизотиазолил, бензизоксазолил, хроменил, хроманил, изохроменил, изохроманил, индолинил, индазолил, индолизинил, изоиндолил, изоиндолинил, хинолизинил, хиноксалинил, хиназолил, циннолинил, фталазинил, нафтиридинил, пуринил, карбазолил, ксантенил, акридинил, феназинил, феноксазинил, фенотиазинил и хинуклидинил.
Примеры комбинации циклоалкильной и алкильной групп включают циклоалкилалкильные группы, причем особенно предпочтительными являются группы (С3-7циклоалкил)(С1-12алкил).
В качестве комбинации арильной и алкильной групп предпочтительными являются группы (С6-10арил)(С1-12алкил).
Примеры заместителя для этих углеводородных групп и гетероциклических групп включают -Q201-Q202-Q203-Q204-Q205-Q206-Q207, где Q201 представляет простую связь, алкильную группу, имеющую 1-6 атомов углерода, алкенильную группу, имеющую 2-6 атомов углерода или гетероциклическую группу; Q202 представляет простую связь, -О-, -NH-, -CH=N-, -C(алкил)=N-, -N(алкил)- или -S-; Q203 представляет простую связь, -СО-, -CS-, -SO-, -SO2- или -CONH-; Q204 представляет простую связь, алкильную группу из 1-6 атомов углерода, алкенильную группу, имеющую 2-6 атомов углерода, циклоалкильную группу, циклоалкенильную группу, ароматическую углеводородную группу или гетероциклическую группу; Q205 представляет простую связь, -О-, -NH- или -N(алкил)-; Q206 представляет простую связь, -СО-, -CS-, -SO2-, -SO- или -S-; и Q207 представляет атом водорода, атом галогена, гидроксигруппу,
оксогруппу, С1-6алкильную группу, С2-6алкенильную группу,
С3-8циклоалкильную группу, С1-6алкоксигруппу,
С2-6алкенилоксигруппу, азидогруппу, цианогруппу, аминогруппу,
С1-6алкиламиногруппу, ди(С1-6алкил)аминогруппу,
С2-6алканоиламиногруппу, ди(С2-6алканоил)аминогруппу,
карбоксиаминогруппу, С1-6алкоксикарбониламиногруппу,
ди(С1-6алкокси)карбониламиногруппу, гетероциклическую группу,
ароматическую углеводородную группу,
циклоалкенильную группу, гетероциклилоксигруппу или
ароматический углеводородоксигруппу.
Алкильная группа, имеющая 1-6 атомов углерода, алкенильная группа, имеющая 2-6 атомов углерода, циклоалкильная группа, циклоалкенильная группа, гетероциклическая группа, гетероциклилоксигруппа, ароматическая углеводородная группа или ароматический углеводородоксигруппа могут быть замещены 1-3 заместителями, выбранными из атомов галогена,
С1-6алкильных групп, С1-6алкоксигрупп, С2-6алкенильных групп,
карбоксиамино(С1-6алкильных) групп,
(С1-6алкокси)карбониламино(С1-6алкильных) групп,
формильной группы, С2-6алканоильных групп, оксогруппы,
нитрогруппы, цианогруппы, азидогруппы, амидиногруппы,
С2-6алкенилоксигрупп, гидроксигруппы, карбоксильной группы,
С7-16аралкильных групп, тиоксогруппы, С2-7алканоильных групп,
С2-7тиоалканоильных групп, тиоформильной группы, аминогруппы,
С1-6алкиламиногрупп, ди(С1-6алкил)аминогрупп,
С1-6алкоксикарбонильных групп, карбамоильной группы,
С1-6 алкилкарбамоильных групп, ди(С1-6алкил)карбамоильных групп,
тиокарбамоильной группы, С1-6алкилтиокарбамоильных групп,
ди(С1-6 алкил)тиокарбамоильных групп,
С1-6алкоксикарбамоильных групп,
С1-6алкоксикарбамоил(С1-6алкил)аминогрупп, С2-7 алканоиламиногрупп,
(С2-7алканоил)(С1-6алкил)аминогрупп, тио(С2-7алканоил)аминогрупп,
тио(С2-7алканоил)(С1-6 алкил)аминогрупп, формиламиногруппы,
формил(С1-6алкил)аминогрупп, тиоформиламиногруппы,
тиоформил(С1-6алкил)аминогрупп, С2-7 алканоилоксигрупп,
формилоксигруппы, С1-6алкоксикарбонилоксигрупп,
карбамоилоксигруппы, С1-6алкилкарбамоилоксигрупп,
ди(С1-6алкил)карбамоилоксигрупп, аминокарбониламиногруппы,
(С1-6алкил)аминокарбониламиногрупп,
ди(С1-6алкил)аминокарбониламиногрупп,
аминокарбонил(С1-6алкил)аминогрупп,
(С1-6алкил)аминокарбонил(С1-6алкил)аминогрупп,
ди(С1-6 алкил)аминокарбонил(С1-6алкил)аминогрупп,
меркаптогруппы, С1-6алкилтиогрупп, С1-6алкилсульфинильных групп,
С1-6 алкилсульфонильных групп, аминосульфонильной группы,
С1-6алкиламиносульфонильных групп,
ди(С1-6алкил)аминосульфонильных групп,
С1-6алкилсульфониламиногрупп,
(С1-6алкилсульфонил(С1-6алкил)аминогрупп,
аминосульфониламиногруппы, С1-6 алкиламиносульфониламиногрупп,
ди(С1-6алкил)аминосульфониламиногрупп,
аминосульфонил(С1-6алкил)аминогрупп,
С1-6 алкиламиносульфонил(С1-6алкил)аминогрупп и
ди(С1-6алкил)аминосульфонил(С1-6алкил)аминогрупп.
Примеры ароматических углеводородных групп включают С6-14ароматические углеводородные группы, например группы фенил, нафтил, инденил, антраценил и бифенил. Из них особенно предпочтительными являются фенильная и нафтильная группы. Гетероциклические группы включают вышеописанные насыщенные или ненасыщенные, моноциклические или полициклические гетероциклические группы, например группы пирролидинил, тетрагидрофуранил, оксетанил, тетрагидротиенил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, оксиранил, тиоланил, диоксанил, пирролил, азиридинил, имидазолидинил, пиразолидинил, тетрагидропиранил, тетрагидротиопиранил, тетрагидрооксазолил, тетрагидротиазолил, тетрагидроизоксазолил, тетрагидроизотиазолил, диоксоланил, оксатиоланил, фурил, тиенил, пиразолил, имидазолил, триазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, дигидроксазолил, дигидротиазолил, дигидроизоксазолил, дигидроизотиазолил, пиридил, пиримидинил, триазинил, тетразолил, пирролинил, имидазолинил, пиразолинил, тиадиазолил, оксадиазолил, дигидроксазолил, дигидротиазолил, дигидроизоксазолил, дигидроизотиазолил, пиразинил, пиридазинил, пиранил, дигидропиридинил, дигидропирролил, дигидрохинолил, дигидроимидазолил, дигидропиразолил, дигидропиразинил, дигидропиридазинил, бензофуранил, бензотиазолил, индолил, хинолил, изохинолил, бензопиранил, бензоксазолил, бензотиазолил, бензимидазолил, бензодиоксанил, бензотиофенил, бензизотиазолил, бензизоксазолил, хроменил, хроманил, изохроменил, изохроманил, индолинил, индазолил, индолизинил, изоиндолил, изоиндолинил, хинолизинил, хиноксалинил, хиназолинилл, циннолинил, фталазинил, нафтиридинил, пуринил, карбазолил, ксантенил, акридинил, феназинил, феноксазинил, фенотиазинил и хинуклидинил. Из них особенно предпочтительными являются группы пирролидинил, тетрагидрофуранил, оксетанил, тетрагидротиенил, пиперидинил, дигидрооксазолил, дигидротиазолил, дигидроизоксазолил, дигидроизотиазолил, пиперазинил, морфолинил, тиоморфолинил, оксиранил, диоксанил, пирролил, фурил, тиенил, пиразолил, имидазолил, триазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, пиридил, пиримидинил, триазинил, тетразолил, бензофуранил, бензотиофенил, индолил, хинолил, изохинолил, бензопиранил, бензоксазолил, бензотиазолил, бензимидазолил, бензодиоксанил, диоксоланил, тетрагидропиранил, тетрагидротиопиранил, оксадиазолил, тиадиазолил, пиразинил, пиридазинил, дигидропиридинил, дигидропирролил, дигидрохинолил, дигидроимидазолил, дигидропиразолил, дигидропиразинил, дигидропиридазинил, тетрагидрооксазолил, хроменил, хроманил, изохроменил и изохроманил, причем группы пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, диоксоланил, пиридил, фурил и тиенил являются особенно предпочтительными.
В формуле (1) Х представляет любой радикал из -S-, -SO- и -SO-2. Из них предпочтительными являются -SO- и -SO-2, причем особенно предпочтительным является -SO-2.
В формуле (1) R1 представляет любой радикал из -С(R5)(R6)(R7), -N(R8)(R9), -Х1R10 и -Х2R11. Из них предпочтительным является R1, представляющий -С(R5)(R6)(R7). В частности, предпочтительным является R1, представляющий -С(R5)(R6)(R7), где R5 и R6 могут быть связаны вместе с образованием циклической углеводородной группы, которая может иметь заместитель, или гетероциклической группы, которая может иметь заместитель.
В формуле (1) R2 представляет -Q21-Q22-Q23-Q24, причем предпочтительным является R2, представляющий -Q21-Q22-Q23-Q24, в котором Q21, Q22 и Q23, каждый, представляет простую связь, а Q24 представляет А23, где А23 представляет атом водорода или алкильную группу.
Или R1 и R2 могут быть связаны вместе с образованием циклической углеводородной группы, которая может иметь заместитель, или гетероциклической группы, которая может иметь заместитель, или =С(R12)(R13).
В формуле (1) R3 представляет -Q31-Q32-Q33-Q34, причем предпочтительным является R3, представляющий -А33, -СО-А33 или -СООА33, где А33 представляет атом водорода, углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель.
R4 представляет -Q41-Q42-Q43-Q44, причем предпочтительным является R4, представляющий А43, где А43 представляет циклическую углеводородную группу, которая имеет заместитель, или гетероциклическую группу, которая имеет заместитель.
В данном изобретении особенно предпочтительными являются соединения формулы (1), в которой R1 представляет гетероциклическую группу, которая может иметь заместитель, R2 представляет атом водорода или С1-6алкильную группу, R3 представляет циклическую углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель, и R4 представляет циклическую углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель. Эти соединения представлены следующей формулой (3):
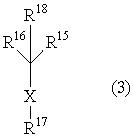
(где R15 представляет гетероциклическую группу, которая может иметь заместитель, R16 представляет циклическую углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель, R17 представляет циклическую углеводородную группу, которая может иметь заместитель, или гетероциклическую группу, которая может иметь заместитель, R18 представляет атом водорода или С1-6алкильную группу, а Х представляет -S-, -SO- или -SO2-).
В качестве гетероциклической группы, представленной R15, R16 или R17, в качестве примеров могут быть приведены описанные выше гетероциклические группы. В качестве циклической углеводородной группы, представленной R16 или R17, в качестве примеров могут быть приведены описанные выше циклические углеводородные группы. В качестве заместителей на этих группах в качестве примеров могут быть приведены описанные выше заместители. В качестве Х предпочтительными являются -SO- или -SO2-, причем особенно предпочтительным является -SO2-.
В качестве гетероциклической группы, представленной R15, R16 или R17, предпочтительными являются 3-7-членные насыщенные или 4-7-членные ненасыщенные моноциклические гетероциклические группы, имеющие 1-4 атома, выбранных из атома азота, атома кислорода и атома серы, и 7-14-членные полициклические гетероциклические группы, имеющие 1-4 атома, выбранных из атома азота, атома кислорода и атома серы.
В качестве циклической углеводородной группы, представленной R16 или R17, предпочтительными являются циклоалкильные группы, имеющие 3-7 атомов углерода, циклоалкенильные группы, имеющие 4-7 атомов углерода, моноциклические или полициклические ароматические углеводородные группы, имеющие 6-14 атомов углерода, спироуглеводородные группы, имеющие 7-11 атомов углерода, циклические углеводородные группы с поперечными (мостиковыми) связями, имеющие 7-10 атомов углерода, и конденсированные углеводородные группы, имеющие 8-14 атомов углерода.
В качестве заместителя для циклической углеводородной группы или гетероциклической группы R15, R16 или R17, в качестве примеров могут быть приведены группы, представленные описанными выше -Q201-Q202 -Q203-Q204-Q205-Q206-Q207.
В качестве циклической углеводородной группы, представленной R16 или R17, предпочтительными являются моноциклические или полициклические ароматические углеводородные группы, имеющие 6-14 атомов углерода, причем более предпочтительными являются группы фенил, нафтил, инденил и антраценил, причем особенно предпочтительной является фенильная группа. Эти углеводородные группы могут иметь 1-3 заместителя, выбранных из атомов галогена, С1-6алкильных групп,
С1-6алкоксигрупп, С2-6алкенильных групп, формильной группы,
С2-6алканоильных групп, карбоксильной группы,
карбоксиамино-С1-6алкильных групп,
С1-6алкоксикарбониламино-С1-6алкильных групп,
оксогруппы, нитрогруппы, цианогруппы, амидиногруппы,
С2-7алкенилоксигрупп, гидроксигруппы, тиоксогруппы, аминогруппы,
С1-6алкиламиногрупп, ди(С1-6алкил)аминогрупп,
С1-6 алкоксикарбонильных групп, карбамоильной группы,
С1-6алкилкарбамоильных групп, ди(С1-6алкил)карбамоильных групп,
тиокарбамоильной группы, С1-6алкилтиокарбамоильных групп,
ди(С1-6алкил)тиокарбамоильных групп, меркаптогруппы,
С1-6алкилтиогрупп, С1-6алкилсульфинильных групп и
С1-6алкилсульфонильных групп.
Примеры гетероциклической группы, представленной R16 или R17, включают пирролидинил, тетрагидрофуранил, оксетанил, тетрагидротиенил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, оксиранил, тиоланил, диоксанил, пирролил, азиридинил, имидазолидинил, пиразолидинил, тетрагидропиранил, тетрагидротиопиранил, тетрагидрооксазолил, тетрагидротиазолил, тетрагидроизоксазолил, тетрагидроизотиазолил, диоксоланил, оксатиоланил, фурил, тиенил, пиразолил, имидазолил, триазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, дигидрооксазолил, дигидротиазолил, дигидроизоксазолил, дигидроизотиазолил, пиридил, пиримидинил, триазинил, тетразолил, пирролинил, имидазолинил, пиразолинил, тиадиазолил, оксадиазолил, дигидроксазолил, дигидротиазолил, дигидроизоксазолил, дигидроизотиазолил, пиразинил, пиридазинил, пиранил, дигидропиридинил, дигидропирролил, дигидрохинолил, дигидроимидазолил, дигидропиразолил, дигидропиразинил, дигидропиридазинил, бензофуранил, бензотиофенил, индолил, хинолил, изохинолил, бензопиранил, бензоксазолил, бензотиазолил, бензимидазолил, бензодиоксанил, бензотиофенил, бензизотиазолил, бензизоксазолил, хроменил, хроманил, изохроменил, изохроманил, индолинил, индазолил, индолизинил, изоиндолил, изоиндолинил, хинолизинил, хиноксалинил, хиназолинил, циннолинил, фталазинил, нафтиридинил, пуринил, карбазолил, ксантенил, акридинил, феназинил, феноксазинил, фенотиазинил и хинуклидинил. Из них предпочтительными являются группы пирролидинил, тетрагидрофуранил, оксетанил, тетрагидротиенил, пиперидинил, дигидроксазолил, дигидротиазолил, дигидроизоксазолил, дигидроизотиазолил, пиперазинил, морфолинил, тиоморфолинил, оксиранил, диоксанил, пирролил, фурил, тиенил, пиразолил, имидазолил, триазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, пиридил, пиримидинил, триазинил, тетразолил, бензофуранил, бензотиофенил, индолил, хинолил, изохинолил, бензопиранил, бензоксазолил, бензотиазолил, бензимидазолил, бензодиоксанил, диоксоланил, тетрагидропиранил, тетрагидротиопиранил, оксадиазолил, тиадиазолил, пиразинил, пиридазинил, дигидропиридинил, дигидропирролил, дигидрохинолил, дигидроимидазолил, дигидропиразолил, дигидропиразинил, дигидропиридазинил, тетрагидрооксазолил, хроменил, хроманил, изохроменил и изохроманил, причем особенно предпочтительными являются группы тетрагидропиранил, пиперидинил, пиридил и пиримидинил. Эти гетероциклические группы могут иметь 1-3 заместителя, выбранных из атомов галогена, С1-6алкильных групп,
С1-6алкоксигрупп, С2-6алкенильных групп, формильной группы,
С2-6алканоильных групп, карбоксильной группы,
карбоксиамино-С1-6алкильных групп,
С1-6алкоксикарбониламино-С1-6алкильных групп,
оксогруппы, нитрогруппы, цианогруппы, амидиногруппы,
С2-7алкенилоксигрупп, гидроксигруппы, тиоксогруппы, аминогруппы,
С1-6алкиламиногрупп, ди(С1-6 алкил)аминогрупп,
С1-6алкоксикарбонильных групп,
карбамоильной группы, С1-6алкилкарбамоильных групп,
ди(С1-6 алкил)карбамоильных групп, тиокарбамоильной группы,
С1-6алкилтиокарбамоильных групп,
ди(С1-6алкил)тиокарбамоильных групп,
меркаптогруппы, С1-6алкилтиогрупп, С1-6алкилсульфинильных групп и
С1-6алкилсульфонильных групп.
Примеры гетероциклической группы, представленной R15, включают пирролидинил, тетрагидрофуранил, оксетанил, тетрагидротиенил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, оксиранил, тиоланил, диоксанил, пирролил, азиридинил, имидазолидинил, пиразолидинил, тетрагидропиранил, тетрагидротиопиранил, тетрагидрооксазолил, тетрагидротиазолил, тетрагидроизоксазолил, тетрагидроизотиазолил, диоксоланил, оксатиоланил, фурил, тиенил, пиразолил, имидазолил, триазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, дигидрооксазолил, дигидротиазолил, дигидроизоксазолил, дигидроизотиазолил, пиридил, пиримидинил, триазинил, тетразолил, пирролинил, имидазолинил, пиразолинил, тиадиазолил, оксадиазолил, дигидроксазолил, дигидротиазолил, дигидроизоксазолил, дигидроизотиазолил, пиразинил, пиридазинил, пиранил, дигидропиридинил, дигидропирролил, дигидрохинолил, дигидроимидазолил, дигидропиразолил, дигидропиразинил, дигидропиридазинил, бензофуранил, бензотиазолил, индолил, хинолил, изохинолил, бензопиранил, бензоксазолил, бензотиазолил, бензимидазолил, бензодиоксанил, бензотиофенил, бензизотиазолил, бензизоксазолил, хроменил, хроманил, изохроменил, изохроманил, индолинил, индазолил, индолизинил, изоиндолил, изоиндолинил, хинолизинил, хиноксалинил, хиназолинил, циннолинил, фталазинил, нафтиридинил, пуринил, карбазолил, ксантенил, акридинил, феназинил, феноксазинил, фенотиазинил и хинуклидинил, которые могут быть замещены описанными выше -Q201-Q202-Q203-Q204-Q205-Q206-Q207. Из этих групп предпочтительными являются группы пирролидинил, тетрагидрофуранил, оксетанил, тетрагидротиенил, пиперидинил, дигидрооксазолил, дигидротиазолил, дигидроизоксазолил, дигидроизотиазолил, пиперазинил, морфолинил, тиоморфолинил, оксиранил, диоксанил, пирролил, фурил, тиенил, пиразолил, имидазолил, триазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, пиридил, пиримидинил, триазинил, тетразолил, бензофуранил, бензотиофенил, индолил, хинолил, изохинолил, бензопиранил, бензоксазолил, бензотиазолил, бензимидазолил, бензодиоксанил, диоксоланил, тетрагидропиранил, тетрагидротиопиранил, оксадиазолил, тиадиазолил, пиперазинил, пиридазинил, дигидропиридинил, дигидропирролил, дигидрохинолил, дигидроимидазолил, дигидропиразолил, дигидропиразинил, дигидропиридазинил, тетрагидрооксазолил, хроменил, хроманил, изохроменил и изохроманил, причем особенно предпочтительными являются группы тетрагидропиранил, тетрагидротиопиранил, пиперидинил, пиридил, пиримидинил, имидазолил, тиазолил, бензимидазолил и хроменил. Эти гетероциклические группы могут быть замещены атомами галогена, С1-6алкильной группой,
С1-6алкоксигруппой, С2-6алкенильной группой,
С2-6алкенилоксигруппой, гидроксигруппой, карбоксильной группой,
карбокси-С1-6алкильной группой,
С1-6алкоксикарбонил-С1-6 алкильной группой,
С1-6алкоксикарбонил-С2-6алкенильной группой,
гидроксил-С1-6алкильной группой,
(С6-14 ароматический углеводород)сульфонил-С1-6алкильной группой,
гетероциклил-С1-6алкиламиногруппой,
гетероциклической группой, гетероциклил-С1-6алкильной группой,
С6-14ароматической углеводородной группой,
(С6-14ароматический углеводород)(С1-6алкильной) группой,
(С6-14ароматический углеводород)тио-С1-6алкильной группой,
азидо-С1-6алкильной группой, амино-С1-6алкильной группой,
С1-6алкиламино-С1-6алкильной группой,
ди(С1-6алкиламино)-С1-8алкильной группой,
гидрокси(С1-8 алкиламино)(С1-6алкильной) группой,
С1-6алкокси(С1-6алкил)амино-С1-6алкильной группой,
(гидрокси-С1-6алкил)(С1-6алкокси-С1-6алкил)амино-С1-6алкильной группой,
С2-6алканоиламино-С1-6алкильной группой,
(С6-14 ароматический углеводород)сульфониламино-С1-6алкильной группой,
(С1-6алкокси)карбониламино-С1-6алкильной группой,
карбамоиламино-С1-6алкильной группой,
N-алкилкарбамоиламино-С1-6алкильной группой,
N,N-диалкилкарбамоиламино-С1-6алкильной группой,
аминосульфониламино-С1-6алкильной группой,
N-алкилсульфониламино-С1-6алкильной группой,
N,N-диалкилсульфониламино-С1-6алкильной группой,
(С6-14ароматический углеводород)(С1-6алкил)аминогруппой,
гетероциклил-С1-6алкиламиногруппой,
карбамоилокси-С1-6алкильной группой,
N-алкилкарбамоилокси-С1-6алкильной группой,
N,N-диалкилкарбамоилокси-С1-6алкильной группой,
(С6-14ароматический углеводород)(С1-6алкил)карбамоилокси-С1-6алкильной группой,
С1-6алкоксикарбонилокси-С1-6алкильной группой,
(С6-14ароматический углеводород)оксикарбонилокси-С1-6алкильной группой,
(С6-14ароматический углеводород)сульфониламино-С1-6 алканоил)амино-С1-6алкильной группой,
С1-6алкоксикарбониламино-С1-6алкиламиногруппой,
амино-С1-6алкиламиногруппой, С1-6алкиламино-С1-6алкиламиногруппой,
ди(С1-6алкил)амино-С1-6алкиламиногруппой,
карбоксиамино(С1-6алкил)группой,
С1-6алкоксикарбониламино-С1-6алкильной группой,
С1-6алкилсульфониламино-С1-6алкильной группой,
амино-С1-6алкилкарбониламино-С1-6алкильной группой,
N-(С1-6алкил)амино-С1-6алкилкарбониламино-С1-6алкильной группой,
N, N-ди(С1-6алкил)амино-С1-6алкилкарбониламино-С1-6алкильной группой,
гетероциклилкарбонильной группой,
гетероциклилкарбониламиногруппой,
(С6-14ароматический углеводород)карбонильной группой,
С6-14ароматической карбониламиногруппой,
гетероциклил-С1-6 алкилкарбониламино-С1-6алкильной группой,
гетероциклил-С2-6алкенилкарбониламино-С1-6алкильной группой,
С6-14ароматический углеводородалкенилкарбониламино-С1-6алкильной группой,
С6-14ароматический углеводородкарбониламино-С1-6алкильной группой,
гетероциклической карбониламино-С1-6алкильной группой,
С1-6алкоксиоксалиламино-С1-6алкильной группой,
карбамоильной группой, N-(С1-6алкил)карбамоильной группой,
N,N-ди(С1-6алкил)карбамоильной группой,
С1-6алкил-С3-8циклоалкилкарбамоильной группой,
С3-8циклоалкил-С1-6алкилкарбамоильной группой,
гетероциклилкарбамоильной группой,
С1-6ароматической карбамоильной группой,
гетероциклической карбонилгидразонометильной группой,
С6-14ароматический углеводородкарбонилгидразонометильной группой,
С1-6 алкилтио-С1-6алкилкарбамоильной группой,
С1-6алкилсульфинил-С1-6алкилкарбамоильной группой,
С1-6алкилсульфонил-С1-6алкилкарбамоильной группой,
гидроксиаминокарбонильной группой,
гидразинокарбонильной группой или
N-С1-6алкилгидразинокарбонильной группой,
тиоформиламино(С6-14ароматический углеводород)тиокарбониламино-С1-6алкильной группой,
тиоформил-С1-6алкиламино-С6-14 ароматический углеводородтиокарбониламино-С1-6алкильной группой,
формиламино-(С6-14ароматический углеводород)карбониламино(С1-6алкильной) группой,
формил-С1-6алкиламино(С6-14ароматический углеводород)карбониламино-С1-6алкильной группой,
С1-6 алканоилгетероциклкарбониламино-С1-6алкильной группой,
ди(С2-6алканоил)амино-С1-6алкильной группой,
ди(С1-6 алкоксикарбонил)амино-С1-6алкильной группой,
С1-6алкилгетероциклкарбонильной группой,
С3-7циклоалкил-С1-6 алкиламинокарбонильной группой,
С1-6алкоксиаминокарбонильной группой,
(гидрокси)(С1-6алкил)аминокарбонильной группой,
(С1-6алкокси)(С1-6алкил)аминокарбонильной группой,
N'-С1-6алкилгидразинокарбонильной группой,
N',N'-ди(С1-6 алкил)гидразинокарбонильной группой,
N,N'-ди(С1-6алкил)гидразинокарбонильной группой,
N,N',N'-три(С1-6алкил)гидразинокарбонильной группой,
N'-(гетероциклкарбонил)гидразинокарбонильной группой,
формильной группой, гидроксииминогруппой,
С1-6алкоксииминогруппой,
бис(С1-6алкокси-С1-6алкил)амино-С1-6алкильной группой,
гидрокси-С1-6алкилгетероциклической группой,
С1-6алкокси-С1-6алкилгетероциклической группой,
С1-6алкоксикарбониламино-С1-6алкилгетероциклической группой,
амино(С1-6алкил)гетероциклической группой,
N-С1-6алкиламино-С1-6алкилгетероциклической группой,
N,N-ди(С1-6алкил)амино-С1-6алкилгетероциклической группой,
гидроксигетероциклической группой,
С1-6алкоксигетероциклической группой,
карбокси-С2-5алкенильной группой или
оксогруппой,
(где приведенная выше С6-14ароматическая углеводородная группа или гетероциклическая группа может быть замещена атомом галогена, С1-6алкильной группой, С1-6алкоксигруппой,
С2-6алкенильной группой, формильной группой,
С2-6алканоильной группой, карбоксильной группой,
группой карбоксиамино(С1-6алкил),
группой С1-6алкоксикарбониламино(С1-6алкил),
оксогруппой, нитрогруппой, цианогруппой, амидиногруппой,
С2-6алкенилоксигруппой, гидроксигруппой, тиоксогруппой,
аминогруппой, С1-6алкиламиногруппой, ди(С1-6алкил)аминогруппой,
амино(С1-6алкильной) группой, С1-6алкоксикарбонильной группой,
карбамоильной группой, С1-6алкилкарбамоильной группой,
ди(С1-6алкил)карбамоильной группой, тиокарбамоильной группой,
С1-6алкилтиокарбамоильной группой,
ди(С1-6алкил)тиокарбамоильной группой,
С2-7алканоиламиногруппой, С2-7алканоил(С1-6алкил)аминогруппой,
тио-С2-7алканоиламиногруппой,
тио-С2-7алканоил-(С1-6алкил)аминогруппой,
формиламиногруппой, формил(С1-6алкил)аминогруппой,
тиоформиламиногруппой, тиоформил(С1-6 алкил)аминогруппой,
С2-7алканоилоксигруппой, формилоксигруппой, меркаптогруппой,
С1-6алкилтиогруппой, С1-6алкилсульфинильной группой,
С1-6алкилсульфонильной группой, аминосульфонильной группой,
С1-6алкиламиносульфонильной группой,
ди-С1-6 алкиламиносульфонильной группой,
С1-6алкилсульфониламиногруппой или
С1-6алкилсульфонил(С1-6алкил)аминогруппой.
Соединения данного изобретения, представленные формулой (1), могут иметь стереоизомер или энантиомер, производные асимметричного углеводорода. Любой из этих стереоизомеров и энантиомеров и их смесь включены в данное изобретение. S-оксид соединения данного изобретения существует, когда гетероциклическая группа содержит атом серы. Любой из моноксида и диоксида включены в S-оксид.
Не существует особого ограничения в отношении соли соединения данного изобретения, представленного формулой (1), пока она является фармацевтически приемлемой солью. Конкретные примеры соли включают соли минеральных кислот, такие как гидрохлорид, гидробромид, гидроиодид, фосфат, нитрат и сульфат, бензоаты, органические сульфонаты, такие метансульфонат, 2-гидроксиэтансульфонат и п-толуолсульфонат, и органические карбоксилаты, такие как ацетат, пропаноат, оксалат, малонат, сукцинат, глутарат, адипат, тартрат, малеат, малат и манделат.
Когда соединение, представленное формулой (1), имеет кислотную группу, эта соль может быть солью иона щелочного металла или иона щелочно-земельного металла. Нет особого ограничения в отношении сольвата, пока он является фармацевтически приемлемым. Конкретные примеры его включают гидраты и сольваты этанола.
Далее будут описаны способы получения соединений данного изобретения, представленных формулой (1).
Соединения данного изобретения, представленные формулой (1), или их соли или их сольваты могут быть получены с использованием общеизвестных химических способов получения в комбинации. Далее будут описаны типичные синтетические способы.
После синтеза каждого соединения данного изобретения такой заместитель, как атом азота, гидроксильная группа или карбоксильная группа, которые нуждаются в защите, могут быть защищены посредством общеизвестной защитной группы, которая может быть удалена в случае необходимости. Эта защитная группа может быть удалена с использованием обычного способа органической химии, если это необходимо.
Сульфидное соединение (1), имеющее S в качестве Х, может быть получено замещением тиольного соединения углеродом или присоединением углерода к этому тиольному соединению (описанные ниже формулы 2, 4 и 5).
Сульфинильное соединение (1), имеющее SO в качестве Х, может быть получено окислением сульфидного соединения (описанная ниже формула 2).
Сульфонильное соединение (1), имеющее SO2 в качестве Х, может быть получено конденсацией сульфонильного соединения (R1, и/или R2, и/или R3=Н) с заместителем (R1, и/или R2, и/или R3) или окислением сульфидного соединения (Х представляет S) или сульфинильного соединения (Х представляет SO) (описанные ниже формулы 1 и 2). Оно может быть также получено замещением производного сульфинильной кислоты углеродом или добавлением углерода к производному сульфинильной кислоты (описанные ниже формулы 3, 4 и 5). Применение этих способов в комбинации может также использоваться для данного получения.
Заместитель соединения (1), полученный таким образом, может быть преобразован и иметь другую структуру. Описанные конкретно, R1, и/или R2, и/или R3, и/или R4 могут быть замещены другим заместителем известным способом.
Например, соединение (1), имеющее в качестве R1, и/или R2, и/или R3, и/или R4 алкильную группу с гидроксильной группой, защищенной винильной или силильной группой, может быть превращено в соединение с соответствующей гидроксиалкильной группой удалением защиты обычным образом. Кроме того, гидроксильная часть может быть введена в функциональную группу, такую как эфир, карбонат, карбамат, галоген или сульфонат, известным способом. Или некоторые из них могут быть введены в заместитель, такой как углеводород, алкокси, амин, амид или сульфид, или в функциональную группу общепринятым образом. Альтернативно, с другими R1, R2, R3 или R4 может быть образована циклическая часть молекулы.
Различные функциональные группы, наряду с гидроксильной группой, могут быть получены посредством такого преобразования, и этот способ преобразования может осуществляться на основе известных методов. Для этих стадий преобразования могут использоваться реагент, растворитель и условия реакции, известные per se в данной области.
Способ получения сульфонильного соединения (1: Х=SO2):
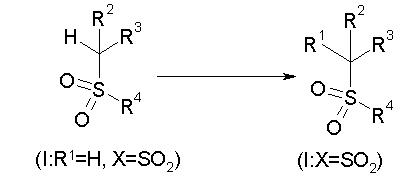
Реакционная схема 1
Например, различные соединения (1), отличающиеся по R1, могут быть получены реакцией соединения (1), имеющего атом водорода в качестве R1 и SO2 в качестве Х, которое является известным или может быть получено известным способом, с электрофильным реагентом в присутствии основания в инертном растворителе. В реакции R1 может быть введен в качестве независимого заместителя с использованием внутримолекулярной реакции с электрофильным реагентом, но альтернативно может быть образована циклическая структура вместе с R2 внутримолекулярной реакцией с R2, имеющим электрофильную функциональную группу в его боковой цепи.
Конкретно, данную реакцию осуществляют добавлением соединения (1: R1=Н, Х=SO2) и по меньшей мере эквивалентного количества основания к, по меньшей мере, эквивалентному количеству электрофильного реагента в инертном растворителе.
Температура реакции обычно составляет от -78°С до 200°С.
Время реакции составляет обычно от 0,5 час до 1 дня.
Примеры инертных растворителей, которые могут быть использованы в описанной выше реакции, включают эфирные растворители, галогенсодержащие растворители, ароматические растворители, нитрильные растворители и амидные растворители. Они могут использоваться по отдельности или в комбинации из двух или более растворителей. Из них предпочтительными являются тетрагидрофуран, диметоксиэтан, диэтиловый эфир, диметилформамид и толуол и т.д.
Примеры электрофильного реагента, используемого в описанной выше реакции, включают R1-Y (где Y представляет элиминирующую группу), карбонильные соединения (такие как альдегид, кетон, сложный эфир и амид) и эпоксисоединения.
Альтернативно, R2, содержащий Y, карбонильная группа или эпоксигруппа могут быть использованы в качестве электрофильной функциональной группы.
Примеры элиминирующей группы, представленной Y, включают атомы галогена (такие как хлор, бром и иод), алкилсульфонилоксигруппы, имеющие 1-6 атомов углерода, которые могут быть галогенированы (например, метансульфонилокси, этансульфонилокси и трифторметансульфонилокси), и арилсульфонилоксигруппы, которые имеют 6-10 атомов углерода и могут иметь заместитель. Заместители для арилсульфонилоксигруппы включают 1-3 атома галогена, алкильные группы, которые имеют 1-6 атомов углерода и могут быть галогенированными, и алкоксигруппы, имеющие 1-6 атомов углерода.
Конкретные примеры элиминирующей группы включают бензолсульфонилокси-, п-толуолсульфонилокси-, 1-нафталинсульфонилокси- и 2-нафталинсульфонилоксигруппы.
Примеры основания, которое может быть использовано для указанной выше реакции, включают алкиллитий (например, н-бутиллитий, втор-бутиллитий и трет-бутиллитий), гидриды щелочного металла или щелочно-земельного металла (такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция), амиды щелочного металла или щелочно-земельного металла (такие как амид лития, амид натрия, диизопропиламид лития, дициклогексиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия и гексаметилдисилазид калия), низшие алкоксиды щелочного металла и щелочно-земельного металла (такие как метоксид натрия, этоксид натрия и трет-бутоксид калия), гидроксиды щелочного металла, щелочно-земельного металла или серебра (такие как гидроксид серебра, гидроксид натрия, гидроксид калия, гидроксид лития и гидроксид бария), карбонаты щелочного металла, щелочно-земельного металла или серебра (карбонат натрия, карбонат калия, карбонат цезия и карбонат серебра), бикарбонаты щелочного металла (такие как бикарбонат натрия и бикарбонат калия) и оксид серебра.
Сульфонильное соединение (1: Х=SO2 ) может быть также получено реакцией соединения (1), которое имеет атом водорода в качестве R1 и SO2 в качестве Х и является известным или может быть получено известным способом, с 1-3 эквивалентами R1-ОН в присутствии конденсирующего агента в инертном растворителе.
Температура реакции обычно составляет от -20°С до 200°С, предпочтительно от 0°С до 150°С.
Время реакции составляет обычно от 0,5 ч до 3 дней.
Примеры инертных растворителей, которые могут быть использованы в описанной выше реакции, включают эфирные растворители, галогенсодержащие растворители и ароматические растворители. Они могут использоваться по отдельности или в комбинации из двух или более растворителей. Из них предпочтительными являются тетрагидрофуран и толуол.
Примеры конденсирующего агента, который может быть использован в описанной выше реакции, включают любой из цианометилентриалкилфосфоранов (такие как цианометилентриметилфосфоран и цианометилен-три-н-бутилфосфоран), триарилфосфинов (такие как трифенилфосфин) и триалкилфосфины (такие как трибутилфосфин) и соединений азодикарбоновых кислот (такие как диэтилазодикарбоксилат, диизопропилазодикарбоксилат, дипиперазинамидазодикарбоксилат и бисдиметиламидазодикарбоксилат).
Способ получения сульфонильного соединения (1: Х=SO2), имеющего SR10 в качестве R1
Сульфонильное соединение (1: Х=SO2), имеющее SR10 в качестве R1, может быть получено реакцией соединения (1), которое имеет атом водорода в качестве R1 и SO2 в качестве Х и является известным или может быть получено известным способом, с 1-3 эквивалентами R10S-Y (Y имеет то же самое значение, которое описано выше) в присутствии 1-3 эквивалентов основания (такого как гидрид натрия) в инертном растворителе.
Температура реакции обычно составляет от -20°С до 150°С.
Время реакции составляет обычно от 0,5 ч до 1 дня.
Примеры инертных растворителей, которые могут быть использованы в описанной выше реакции, включают эфирные растворители, галогенсодержащие растворители, ароматические растворители и амидные растворители. Они могут использоваться по отдельности или в комбинации из двух или более растворителей. Из них предпочтительным является диметилформамид.
Способ получения сульфонильного соединения (1: Х=SO2), в котором R1 и R2 связаны вместе с образованием =CR12R13
Сульфонильное соединение, в котором R1 и R2 связаны вместе с образованием =CR12R13, могут быть получены действием основания на соединение (1), имеющее атом водорода в качестве R1, SO2 в качестве Х и -CYR12 R13 (Y имеет то же самое значение, которое описано выше) в качестве R2.
Более конкретно, соединение, которое имеет атом водорода в качестве R1, SO2 в качестве Х и -CYR12R13 (Y имеет то же самое значение, которое описано выше) и является известным или может быть получено общепринятым способом, обрабатывают по меньшей мере эквивалентным количеством основания в инертном растворителе.
Температура реакции обычно составляет от -78°С до 150°С, предпочтительно от -78°С до 50°С. Время реакции составляет обычно от 0,5 ч до 1 дня.
Примеры инертных растворителей, которые могут быть использованы в описанной выше реакции, включают спиртовые растворители, эфирные растворители, галогенсодержащие растворители, ароматические растворители, нитрильные растворители, амидные растворители, кетонные растворители, сульфоксидные растворители и воду. Они могут использоваться по отдельности или в комбинации из двух или более растворителей. Из них предпочтительными являются метиленхлорид, тетрагидрофуран и диэтиловый эфир и т.д.
Примеры основания, которое может быть использовано для указанной выше реакции, включают гидриды щелочного металла или щелочно-земельного металла (такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция); амиды щелочного металла или щелочно-земельного металла (такие как амид лития, амид натрия, диизопропиламид лития, дициклогексиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия и гексаметилдисилазид калия); низшие алкоксиды щелочного металла и щелочно-земельного металла (такие как метоксид натрия, этоксид натрия и трет-бутоксид калия); гидроксиды щелочного металла, щелочно-земельного металла или серебра (такие как гидроксид серебра, гидроксид натрия, гидроксид калия, гидроксид лития и гидроксид бария); карбонаты щелочного металла, щелочно-земельного металла или серебра (карбонат натрия, карбонат калия, карбонат цезия и карбонат серебра); бикарбонаты щелочного металла (такие как бикарбонат натрия и бикарбонат калия); алкиллитий (такой как н-бутиллитий) или алкилсодержащие реагенты Гриньяра (такие как метилмагнийбромид); неорганические основания, такие как оксид серебра, или амины (такие как триэтиламин, диизопропилэтиламин и N-метилморфолин); и органические основания, например основные гетероциклические соединения (такие как диметиламинопиридин, пиридин, имидазол, 2,6-лутидин, коллидин, 1,8-диазабицикло[5.4.0]ундец-7-ен, 1, 5-диазабицикло[4.3.0]нон-5-ен и 1,4-диазабицикло[2.2.2]октан).
Способ получения сульфидного соединения (1: Х=S), сульфинильного соединения (1: Х=SO), сульфонильного соединения (1: Х=SO2)
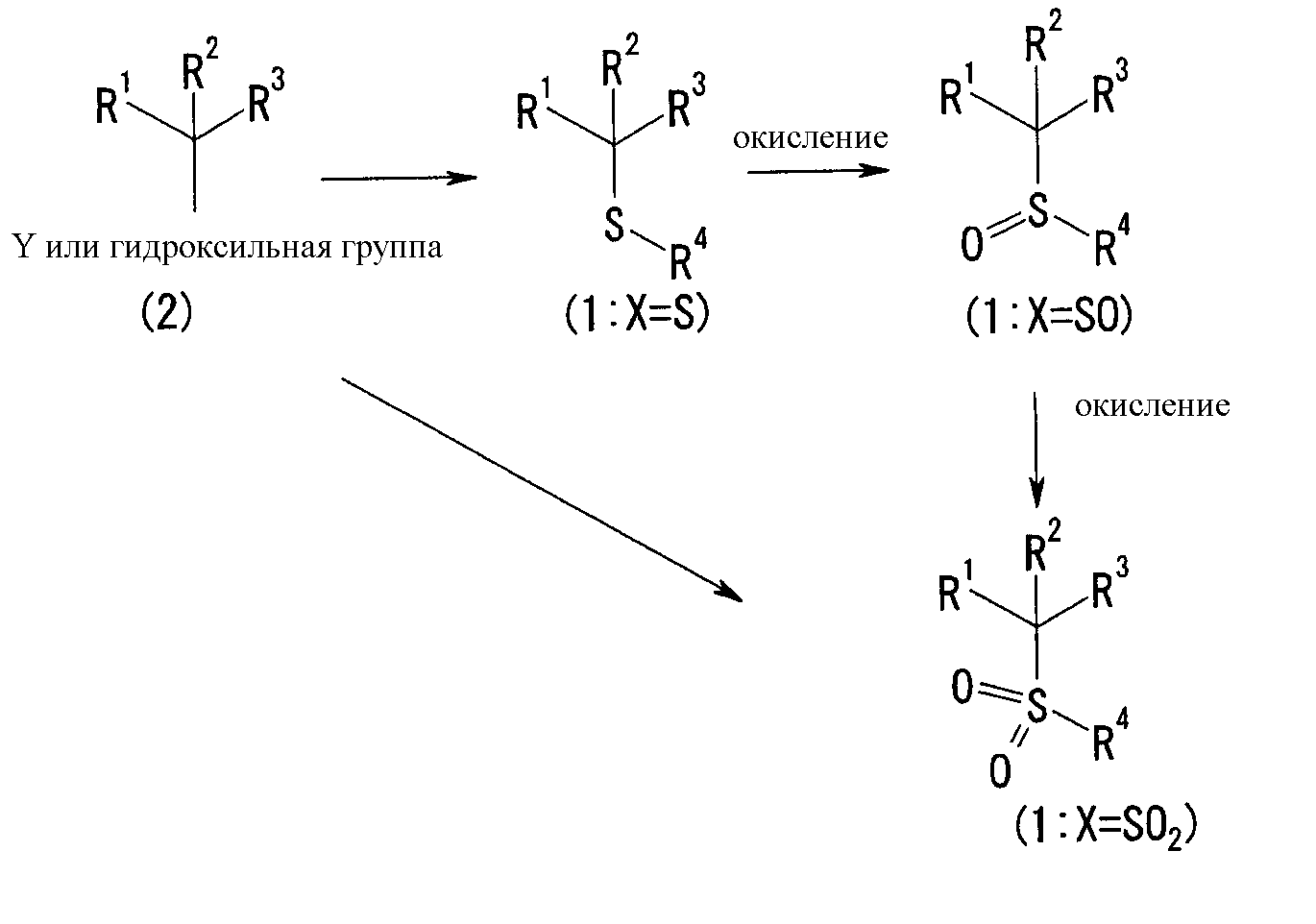
Реакционная схема 2
1) Способ получения сульфидного соединения (1: Х=S)
Соединение (1), имеющее S в качестве Х, может быть получено реакцией соединения (2) с тиольным соединением в присутствии основания в инертном растворителе.
Соединение (2), имеющее гидроксильную группу, может быть получено известным способом. Далее будут описаны различные способы и один пример. Соединение (2), имеющее гидроксильную группу, может быть получено добавлением металлоорганического реагента (в качестве металла обычно используют литиевый или магниевый представитель реагента Гриньяра) в количестве от эквивалентного до избыточного к альдегиду или кетону, представленному формулой R1(С=О)R2, в инертном растворителе, таком как тетрагидрофуран или диэтиловый эфир, для их взаимодействия. Металлоорганический реагент, представленный R3-М, может быть получен, например, когда R3 представляет ароматическое кольцо или ароматический гетероцикл, добавлением реагента алкиллития или алкилсодержащего реагента Гриньяра к арилгалогениду для обмена металлом, как сообщалось в статье H. Gilman, et al., J. Org. Chem. 1951, 16, 1788-1791 или в статье F. Trecourt, et al., Tetrahedron 2000, 56, 1349-1460. Соединение (2), имеющее элиминирующую группу Y, может быть получено превращением гидроксильной группы гидроксилсодержащего соединения (2) в элиминирующую группу известным образом.
Соединение (1), имеющее S в качестве Х, может быть также получено реакцией соединения (2) с солью щелочного металла или щелочно-земельного металла (такого как литий, натрий или калий) тиольного соединения в инертном растворителе.
Температура реакции обычно равна от -20°С до -200°С, предпочтительно от комнатной температуры до 100°С. Когда заместитель R данного соединения является объемным заместителем, предпочтительной является иногда более высокая температура, чем указанная выше, или реакция в запаянной пробирке.
Время реакции обычно находится в диапазоне 0,5 часа - 1 час.
Примеры оснований, которые могут быть использованы для указанной выше реакции, включают гидриды щелочного металла или щелочно-земельного металла (такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция); амиды щелочного металла или щелочно-земельного металла (такие как амид лития, амид натрия, диизопропиламид лития, дициклогексиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия и гексаметилдисилазид калия); низшие алкоксиды щелочного металла и щелочно-земельного металла (такие как метоксид натрия, этоксид натрия и трет-бутоксид калия); гидроксиды щелочного металла, щелочно-земельного металла или серебра (такие как гидроксид серебра, гидроксид натрия, гидроксид калия, гидроксид лития и гидроксид бария); карбонаты щелочного металла, щелочно-земельного металла или серебра (карбонат натрия, карбонат калия, карбонат цезия и карбонат серебра); бикарбонаты щелочного металла (такие как бикарбонат натрия и бикарбонат калия); алкиллитий (такой как н-бутиллитий) или алкилсодержащие реагенты Гриньяра (такие как метилмагнийбромид); неорганические основания, такие как оксид серебра, или амины (такие как триэтиламин, диизопропилэтиламин и N-метилморфолин); и органические основания, например основные гетероциклические соединения (такие как диметиламинопиридин, пиридин, имидазол, 2,6-лутидин, коллидин, 1,8-диазабицикло[5.4.0]ундец-7-ен, 1,5-диазабицикло[4.3.0]нон-5-ен и 1,4-диазабицикло[2.2.2]октан).
Примеры инертных растворителей, которые могут быть использованы в описанной выше реакции, включают спиртовые растворители, эфирные растворители, галогенсодержащие растворители, ароматические растворители, нитрильные растворители, амидные растворители, кетонные растворители, сульфоксидные растворители и воду. Они могут использоваться по отдельности или в комбинации из двух или более растворителей. Из них предпочтительными являются метиленхлорид, тетрагидрофуран и диэтиловый эфир и т.д.
Когда соединение (2) имеет гидроксильную группу, вместо элиминирующей группы Y, конденсат может быть получен с использованием реакции Митсунобу.
Соединение (1) может быть получено реакцией гидроксилсодержащего соединения (2), которое является известным или может быть получено известным образом, с 1-3 эквивалентами соединения тиофенола в присутствии 1-3 эквивалентов триарилфосфина (такого как трифенилфосфин) или триалкилфосфина (такого как трибутилфосфин) и 1-2 эквивалентов производного азодикарбоновой кислоты (такого как диэтилазодикарбоксилат, диизопропилазодикарбоксилат, дипиперидинамиддикарбоксилат или бисдиметиламидазодикарбоксилат) в инертном растворителе.
Температура реакции обычно равна от -20°С до -150°С, предпочтительно от комнатной температуры до 80°С. Когда заместитель R данного соединения является объемным заместителем, предпочтительной является иногда более высокая температура, чем указанная выше, или реакция в запаянной пробирке.
Время реакции обычно находится в диапазоне от 0,5 часа до 1 дня.
Примеры инертных растворителей, которые могут быть использованы в описанной выше реакции, включают эфирные растворители, галогенсодержащие растворители и ароматические растворители. Два или более из этих растворителей могут использоваться в виде смеси. Из них предпочтительным является тетрагидрофуран.
2) Способ получения сульфинильного соединения (1: Х=SO)
Сульфинильное соединение (1: Х=SO) может быть синтезировано окислением сульфидного соединения (1: Х=S), более конкретно, реакцией сульфидного соединения (1) в присутствии окислителя в инертном растворителе.
Температура реакции обычно составляет от -20°С до 200°С, предпочтительно от 0°С до 100°С.
Примеры инертных растворителей, которые могут быть использованы в описанной выше реакции, включают спиртовые растворители, эфирные растворители, галогенсодержащие растворители, ароматические растворители, нитрильные растворители, амидные растворители, кетонные растворители, сульфоксидные соединения и воду. Два или более из этих растворителей могут использоваться в комбинации. Из них предпочтительными являются метиленхлорид, хлороформ, метанол и этанол.
Примеры окисляющих агентов, которые могут быть использованы в описанной выше реакции, включают пероксид водорода, органические перкислотные соединения (такие как перуксусная кислота и метахлорпербензойная кислота), метапериодаты (такие как метапериодат натрия), ацилнитрат, тетроксид азота, галоген, N-галогенпроизводные (такие как N-хлорсукцинимид и N-бромсукцинимид), гидропероксиды (такие как трет-бутилгидропероксид), диацетат иодбензола, дихлорид иодбензола, трет-бутилгипохлорит, сульфурилхлорид, синглетный кислород, озон, оксид селена и селеновая кислота. Оптически активный сульфоксид (1: Х=SO) может быть получен с использованием смесей тетраизопропоксид титана/диэтилтартрат/трет-бутилгидропероксид, тетраизопропоксид титана/диэтилтартрат/перуксусная кислота или т.п.
Конкретно, сульфидное соединение (1: Х=S) и 1-2 эквивалента окислителя, такого как метахлорпербензойная кислота, периодат натрия или пероксид водорода, могут перемешиваться в инертном растворителе, таком как метиленхлорид, тетрагидрофуран-вода, метанол или т.п., при 0-100°С в течение приблизительно от 1 часа до 2 дней.
3) Способ получения сульфонильного соединения (1: Х=SO2)
Сульфонильное соединение (1: Х=SO2) может быть синтезировано окислением сульфидного соединения (1: Х=S) или сульфинильного соединения (1: Х=SO), более конкретно реакцией сульфидного соединения (1: Х=S) или сульфинильного соединения (1: Х=SO) в присутствии окислителя в инертном растворителе.
Температура реакции обычно составляет от -20°С до 150°С, предпочтительно от 0°С до 80°С.
Примеры инертных растворителей, которые могут быть использованы в описанной выше реакции, включают спиртовые растворители, эфирные растворители, галогенсодержащие растворители, ароматические растворители, растворители, являющиеся карбоновыми кислотами, нитрильные растворители, амидные растворители, кетонные растворители, сульфоксидные соединения и воду. Два или более из этих растворителей могут использоваться в комбинации. Из них предпочтительными являются метиленхлорид, хлороформ, метанол, этанол и уксусная кислота.
Примеры окислителей, которые могут быть использованы в описанной выше реакции, включают пероксид водорода, пероксид водорода - катализатор на основе переходного металла (такой как молибдат аммония или хлорид железа (III)), органические перкислотные соединения (такие как перуксусная кислота и метахлорпербензойная кислота), метапериодаты (такие как метапериодат натрия), пероксисульфат калия, перманганаты (такие как перманганат калия), перборат натрия, галоген, N-галогенпроизводные (такие как N-хлорсукцинимид и N-бромсукцинимид), гидропероксиды (такие как трет-бутилгидропероксид), диацетат иодбензола, дихлорид иодбензола, гипохлориты (такие как гипохлорит натрия или трет-бутилгипохлорит), синглетный кислород, озон, оксид селена и селеновая кислота. Предпочтительный пример этих условий реакции включает реакцию сульфидного соединения (1: Х=S) с 2-5 эквивалентами окислителя (такого как метахлорпербензойная кислота, периодат натрия, пероксид водорода или смесь пероксид водорода/молибдат аммония) в метиленхлориде, смеси тетрагидрофуран-вода или метаноле при 0-100°С в течение приблизительно от 1 ч до 2 дней.
Способ получения сульфонильного соединения (1: Х=SO2):
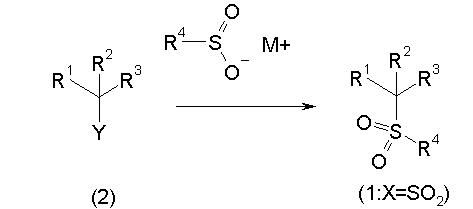
Реакционная схема 3
Сульфонильное соединение (1: Х=SO2) может быть синтезировано введением сульфонильной группы в соединение (2), более конкретно реакцией соединения (2) с солью щелочного металла, щелочно-земельного металла или тетрабутиламмония сульфиновой кислоты.
Конкретно, соединение (2) подвергают взаимодействию с количеством от эквивалентного до избыточного количества сульфиновой кислоты или ее соли в инертном растворителе.
Температура реакции обычно составляет от -20°С до 200°С, предпочтительно от комнатной температуры до 100°С. Когда заместитель R данного соединения является объемным заместителем, предпочтительной является иногда более высокая температура, чем указанная выше, или реакция в запаянной пробирке.
Время реакции обычно находится в диапазоне от 0,5 ч до 1 дня.
Примеры инертных растворителей, которые могут быть использованы в описанной выше реакции, включают спиртовые растворители, эфирные растворители, галогенсодержащие растворители, ароматические растворители, нитрильные растворители, амидные растворители, кетонные растворители, сульфоксидные растворители и воду. Два или более из этих растворителей могут использоваться в комбинации. Из них предпочтительными являются бутанол и диметоксиэтан.
Способ получения сульфидного соединения (1: Х=S):
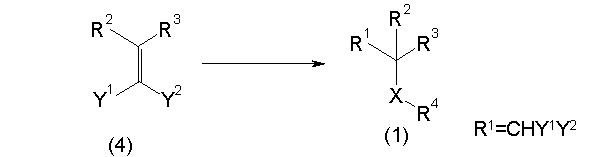
Реакционная схема 4
Способ получения сульфидного соединения (1: Х=S).
(1) когда Y1 и Y2 являются электроноакцепторной группой:
Соединение (1) может быть получено подверганием соединения (4), которое является известным или может быть получено известным способом, реакции Михаэля, более конкретно реакцией соединения (4) с тиолом (R4SH) в присутствии основания.
Конкретно, соединение (4) подвергают взаимодействию с количеством тиола от эквивалентного до избыточного в инертном растворителе в присутствии основания в количестве от каталитического до эквивалентного.
Температура реакции обычно составляет от -20°С до 100°С, предпочтительно при комнатной температуре.
Время реакции обычно находится в диапазоне от 0,5 ч до 1 дня.
Примеры электроноакцепторной группы включают карбонильные группы (такие как ацил, эфир, карбоновая кислота и амид), цианогруппу, нитрогруппу, сульфинильную группу и сульфонильную группу. Примеры инертных растворителей, которые могут быть использованы в описанной выше реакции, включают спиртовые растворители, эфирные растворители, галогенсодержащие растворители, ароматические растворители, нитрильные растворители, амидные растворители, кетонные растворители, сульфоксидные растворители и воду. Два или более из этих растворителей могут использоваться в комбинации. Из них предпочтительными являются метанол, метиленхлорид и тетрагидрофуран и т.п.
(2) Когда R2 представляет алкоксигруппу или сульфидную группу:
Соединение (1) может быть получено обработкой соединения (4), которое является известным или может быть получено известным способом, в присутствии кислотного катализатора, более конкретно, реакцией соединения (4) с тиолом в присутствии кислоты.
Конкретно, соединение (4) подвергают взаимодействию с количеством тиола от эквивалентного до избыточного в инертном растворителе в присутствии кислотного катализатора в количестве от каталитического до эквивалентного.
Температура реакции обычно составляет от -20°С до 100°С, предпочтительно при комнатной температуре.
Время реакции обычно находится в диапазоне от 0,5 ч до 1 дня.
Примеры кислоты, которая может быть использована в описанной выше реакции, включают безводную кислоту, такую как паратолуолсульфоновая кислота, камфорсульфоновая кислота, хлорид водорода и кислотная ионообменная смола; и в качестве катализаторов кислоты Льюиса, такие как триметилсилилтрифторметансульфонат и трифторид бора.
Примеры инертных растворителей, которые могут быть использованы в описанной выше реакции, включают эфирные растворители, галогенсодержащие растворители, ароматические растворители, нитрильные растворители и амидные растворители. Два или более из этих растворителей могут использоваться в комбинации. Из них предпочтительным является метиленхлорид.
Способ получения сульфидного соединения (1: Х=S) и сульфонильного соединения (1: Х=SO2):
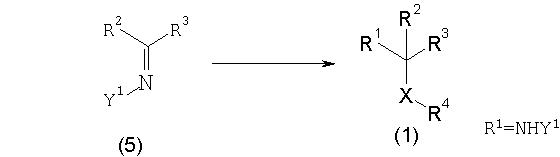
Реакционная схема 5
1) Способ получения сульфидного соединения (1: Х=S)
Соединение (1) может быть получено подверганием имина реакции нуклеофильного замещения, более конкретно, взаимодействием имина или соли иминия, которое является соединением (5), с количеством тиола от эквивалентного до избыточного в присутствии основания или кислоты в количестве от каталитического до эквивалентного. Соединение (5) может быть получено смешиванием карбонильного соединения (R2COR3) c первичным или вторичным амином или амидом в подходящем растворителе.
Температура реакции обычно составляет от 0°С до 100°С, предпочтительно при комнатной температуре.
Время реакции обычно находится в диапазоне от 0,5 часа до 1 дня.
Примеры оснований, которые могут быть использованы для указанной выше реакции, включают гидриды щелочного металла или щелочно-земельного металла (такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция); амиды щелочного металла или щелочно-земельного металла (такие как амид лития, амид натрия, диизопропиламид лития, дициклогексиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия и гексаметилдисилазид калия); низшие алкоксиды щелочного металла и щелочно-земельного металла (такие как метоксид натрия, этоксид натрия и трет-бутоксид калия); гидроксиды щелочного металла, щелочно-земельного металла или серебра (такие как гидроксид серебра, гидроксид натрия, гидроксид калия, гидроксид лития и гидроксид бария); карбонаты щелочного металла, щелочно-земельного металла или серебра (карбонат натрия, карбонат калия, карбонат цезия и карбонат серебра); бикарбонаты щелочного металла (такие как бикарбонат натрия и бикарбонат калия); алкиллитий (такой как н-бутиллитий) или алкилсодержащие реагенты Гриньяра (такие как метилмагнийбромид); неорганические основания, такие как оксид серебра, или амины (такие как триэтиламин, диизопропилэтиламин и N-метилморфолин); и органические основания, например, основные гетероциклические соединения (такие как диметиламинопиридин, пиридин, имидазол, 2,6-лутидин, коллидин, 1,8-диазабицикло[5.4.0]ундец-7-ен, 1,5-диазабицикло[4.3.0]нон-5-ен и 1, 4-диазабицикло[2.2.2]октан).
Примеры кислот, которые могут быть использованы в указанной выше реакции, включают муравьиную кислоту, уксусную кислоту, бензойную кислоту, паратолуолсульфоновую кислоту и хлористо-водородную кислоту.
Примеры инертных растворителей, которые могут быть использованы в описанной выше реакции, включают спиртовые растворители, эфирные растворители, нитрильные растворители, амидные растворители, кетонные растворители, сульфоксидные растворители и воду. Два или более из этих растворителей могут использоваться в виде смеси. Из них предпочтительным является тетрагидрофуран.
2) Способ получения сульфонильного соединения (1: Х=SO2)
Соединение (1) может быть получено подверганием имина реакции нуклеофильного замещения, более конкретно, взаимодействием имина или соли иминия, которое является соединением (5), с количеством сульфиновой кислоты от эквивалентного до избыточного в присутствии кислоты в количестве от каталитического до эквивалентного.
Температура реакции обычно составляет от 0°С до 100°С, предпочтительно при комнатной температуре.
Время реакции обычно находится в диапазоне от 0,5 часа до 1 дня.
Примеры кислот, которые могут быть использованы в указанной выше реакции, включают муравьиную кислоту, уксусную кислоту, бензойную кислоту, паратолуолсульфоновую кислоту и хлористо-водородную кислоту.
Соединение (5) может быть получено смешиванием карбонильного соединения (R2COR3) c первичным или вторичным амином или амидом в подходящем растворителе.
Соединение (1) может быть также получено без выделения соединения (5). Например, оно может быть получено только реакцией альдегида с эквивалентным количеством амида или сульфиновой кислоты в присутствии избыточного количества кислоты в инертном растворителе.
Температура реакции обычно составляет от 0°С до 100°С, предпочтительно при комнатной температуре.
Время реакции обычно находится в диапазоне от 1 часа до 1 дня.
Примеры инертных растворителей, которые могут быть использованы в описанной выше реакции, включают спиртовые растворители, эфирные растворители, нитрильные растворители, амидные растворители, кетонные растворители, сульфоксидные растворители и воду. Два или более из этих растворителей могут использоваться в виде смеси. Из них предпочтительным является тетрагидрофуран.
Соединения (1) данного изобретения, в частности, соединения формулы (3), в сильной степени ингибируют продуцирование или секрецию β-амилоидного белка, так что они полезны в качестве лекарственного средства для предупреждения или лечения заболеваний, являющихся результатом аномального продуцирования или секреции β-амилоидного белка, таких как болезнь Альцгеймера и синдром Дауна, или заболеваний, связанных с депонированием амилоида.
При применении соединения данного изобретения в качестве фармацевтического средства для человека доза находится в диапазоне от 1 мг до 1 г в сутки для взрослого, предпочтительно от 10 мг до 300 мг. При введении животным эта доза варьируется в зависимости от цели введения (лечения или предупреждения), вида или размера животного, подлежащего лечению, вида или степени бактерий, которыми было инфицировано это животное, но обычно суточная доза находится в диапазоне от 0,1 мг до 200 мг, предпочтительно от 0,5 мг до 100 мг на кг массы тела животного. Эту суточную дозу вводят один раз в день или от двух до четырех порций в день. Суточная доза может превышать вышеуказанное количество, если это необходимо.
Фармацевтическая композиция, содержащая соединение данного изобретения, может быть получена в желаемой форме, выбранной в соответствии со способом введения, с использованием различных обычно применяемых способов получения. Примеры форм фармацевтической композиции, содержащей соединение данного изобретения в качестве основного ингредиента, включают перорально вводимые препараты, такие как таблетки, порошки, гранулы, капсулы, жидкости, сиропы, эликсиры, масляные или водные суспензии.
Инъекционные растворы могут содержать стабилизатор, антисептический агент, солюбилизирующий агент или т.п. Можно также восстановить твердый препарат, который был получен заполнением сосуда раствором, содержащим такой агент, и затем его лиофилизацией, перед применением. Количество для одноразового введения, может быть помещено в один сосуд, или количество для множественных введений может быть помещено в один контейнер.
Примеры препарата для наружного применения включают жидкости, суспензии, эмульсии, мази, гели, кремы, лосьоны, спреи и пластыри.
Твердый препарат содержит, вместе с соединением данного изобретения, фармацевтически приемлемые добавки. Он может быть приготовлен смешиванием соединения данного изобретения с добавками, выбранными из наполнителей, разбавителей, связывающих веществ, дезинтеграторов, промоторов солюбилизации, увлажнителей и лубрикантов веществ, если это необходимо.
Примеры жидких препаратов включают растворы, суспензии и эмульсии. Они могут содержать суспендирующий агент или эмульгирующий агент в качестве добавки.
Примеры
Данное изобретение будет описано далее подробно со ссылкой на варианты данного изобретения, но не должно рассматриваться как ограниченное приводимыми вариантами. Кроме того, все соединения, приведенные в качестве примеров ниже, должны рассматриваться как относящиеся к типу Е или типу Z, если нет особых указаний.
Ссылочный пример 1: 1-(2,5-дифторфенил)-1-пентанол
При -78°С в атмосфере аргона н-бутиллитий (1,52 М раствор в гексане, 14,5 мл, 22,0 ммоль) добавляли по каплям к раствору 1,4-дифторбензальдегида (2,84 г, 20,0 ммоль) в тетрагидрофуране (40 мл). При перемешивании температуру реакционной смеси повышали до -20°С на протяжении 2 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Экстракты объединяли, промывали последовательно водой и насыщенным раствором соли, сушили над MgSO4 и затем концентрировали. Полученный таким образом остаток очищали хроматографией на колонке с силикагелем (9% этилацетат-гексан) с получением указанного в заголовке соединения (2,62 г, 66%) в виде бледно-желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ: 0,90 (3H, т, J=7,3 Гц), 1,28-1,50 (4H, м), 1,70-1,82 (2H, м), 1,91-1,95 (1H, шир.м), 4,98 (1H, дд, J=11,7, 5,9 Гц), 6,88-7,00 (2H, м), 7,18 (1H, ддд, J=8,8, 5,6, 3,2 Гц).
Пример 1: 2-[1-[(4-хлорфенил)тио]пентил]-1,4-дифторбензол
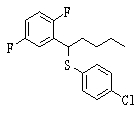
При 0°С 4-хлорбензолтиол (435 мг, 3,00 ммоль), трифенилфосфин (798 мг, 3,00 ммоль) и диизопропилазодикарбоксилат (588 мкл, 3,00 ммоль) последовательно добавляли к раствору 1-(2, 5-дифторфенил)-1-пентанола (300 мг, 1,50 ммоль) в метиленхлориде (6 мл). Реакционную смесь перемешивали при комнатной температуре в течение 5 часов, разбавляли метиленхлоридом и затем промывали последовательно 1 н. водным раствором гидроксида натрия и насыщенным раствором соли. После сушки над MgSO4 смесь концентрировали. Полученный таким образом остаток очищали дважды хроматографией со средним давлением на колонке с силикагелем (первый раз со смесью 1% этилацетат-гексан, и второй раз с гексаном) с получением указанного в заголовке соединения (266 мг, 54%) в виде бесцветного масла.
ИК (ATR) ν: 2958, 2931, 1624, 1595, 1574, 1493, 1475, 1425, 1389, 1234, 1215, 1171, 1095, 1012, 874, 814 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,86 (3H, т, J=7,3 Гц), 1,22-1,41 (4H, м), 1,78-1,88 (1H, м), 1,89-1,99 (1H, м), 4,48 (1H, ддд, J=8,6, 6,6, 1,7 Гц), 6,81-6,86 (1H, м), 6,90 (1H, тд, J=9,0, 4,6 Гц), 7,06 (1H, ддд, J=9,0, 5,8, 3,2 Гц), 7,17 (4H, с).
МС (m/z): 326 (М+).
HRMS (EI): в виде C17H17ClF2S (М+).
Вычислено: 326,0708.
Найдено: 326,0696.
Пример 2: 2-[1-[(4-хлорфенил)сульфинил]пентил]-1,4-дифторбензол (изомер 2-А и изомер 2-В)
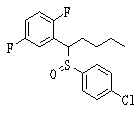
После добавления 3-хлорпербензойной кислоты (301 мг, 1,74 ммоль) к раствору 2-[1-[(4-хлорфенил)тио]пентил]-1,4-дифторбензола (515 мг, 1,58 ммоль) в метиленхлориде (10 мл) при 0°С, смесь перемешивали в течение 18 часов при комнатной температуре. После дополнительного добавления 3-хлорпербензойной кислоты (100 мг, 0,578 ммоль) смесь перемешивали в течение 3 часов при комнатной температуре. Реакционную смесь разбавляли метиленхлоридом, промывали последовательно 1 н. водным раствором гидроксида натрия, водой и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (10% этилацетат-гексан) с получением указанного в заголовке изомера 2-А (низкой полярности) и указанного в заголовке изомера 2-В (высокой полярности) (230 мг, 43%), каждого в виде бесцветного масла. Затем полученный указанный в заголовке изомер 2-А перекристаллизовывали из гексана и получали в виде бесцветных игольчатых кристаллов (79,8 мг, 15%).
Изомер 2-А
Точка плавления: 108,5-109,0°С.
ИК (ATR) ν: 2929, 2854, 1493, 1275, 1132, 1174, 1086, 1043, 1011, 962, 862, 823, 735, 503 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,90 (3H, т, J=7,1 Гц), 1,30-1,50 (4H, м), 1,96-2,06 (1H, м), 2,27-2,36 (1H, м), 4,03 (1H, ддд, J=9,6, 6,1, 1,2 Гц), 6,71 (1H, тд, J=9, 1, 4,4 Гц), 6,85-6,92 (1H, м), 7,07-7,12 (1H, м), 7,10 (2H, д, J=8,6 Гц), 7,28 (2H, д, J=8,6 Гц).
МС (m/z) 343 (М++H).
Элементный анализ для C17 H17ClF2OS.
Вычислено: C 59,56%; H 5,00%; Cl 10,34%; F 11,08%; S 9,35%.
Найдено: C 59,27%; H 4,91%; Cl 10,42%; F 11,05%; S 9,45%.
Изомер 2-В
ИК (ATR) ν: 3078, 2958, 2931, 2862, 1574, 1495, 1425, 1390, 1213, 1090, 1051, 1012, 818, 741 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,83 (3H, т, J=7,1 Гц), 1,17-1,40 (4H, м), 1,94-2,05 (1H, м), 2,24-2,34 (1H, м), 4,03 (1H, дд, J=12,0, 3,2 Гц), 6,87-6,99 (3H, м), 7,26 (2H, д, J=8,3 Гц), 7,35 (2H, д, J=8,3 Гц).
МС (m/z): 343(М++H).
HRMS (FAB) для C17H18OClF2S (М++H).
Вычислено: 343,0735.
Найдено: 343,0750.
Пример 3: 2-[1-[(4-хлорфенил)сульфонил]пентил]-1,4-дифторбензол
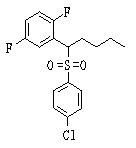
После добавления 3-хлорпербензойной кислоты (98,8 мг, 0,571 ммоль) к раствору 2-[1-[(4-хлорфенил)сульфинил]пентил]-1,4-дифторбензола (изомера 2-В) (150 мг, 0,439 ммоль) в метиленхлориде (5 мл) полученную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь разбавляли метиленхлоридом, промывали последовательно 1 н. водным раствором гидроксида натрия, водой и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (10% этилацетат-гексан) с получением указанного в заголовке соединения (122 мг, 77%) в виде бесцветного масла.
ИК (ATR) ν: 3089, 2958, 2933, 2873, 1583, 1496, 1475, 1427, 1394, 1321, 1279, 1219, 1176, 1149, 1086, 1014, 829, 754 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,85 (3H, т, J=7,3 Гц), 1,15-1,40 (4H, м), 2,03-2,14 (1H, м), 2,38-2,47 (1H, м), 4,51 (1H, дд, J=10,5, 3,7 Гц), 6,83 (1H, тд, J=9,0, 4,6 Гц), 6,94-7,01 (1H, м), 7,25 (1H, ддд, J=8,8, 5,4, 3,2 Гц), 7,38 (2H, д, J=8,5 Гц), 7,53 (2H, д, J=8,5 Гц).
МС (m/z): 359 (М++H).
HRMS (FAB) для C17H18ClF2O2S (М++H).
Вычислено: 359,0684.
Найдено: 359,0688.
Пример 4: 2-[(4-хлорфенил)тиометил]-1,4-дифторбензол
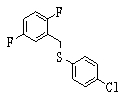
Способ 1: При 0°С 4-хлорбензолтиол (5,45 г, 38,2 ммоль), трифенилфосфин (11,1 г, 41,6 ммоль) и диизопропилазодикарбоксилат (8,16 мл, 41,6 ммоль) добавляли последовательно к раствору 2, 5-дифторбензилового спирта (5,00 г, 34,7 ммоль) в тетрагидрофуране (150 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 дней с последующим концентрированием. Полученный таким образом остаток очищали хроматографией на колонке с силикагелем (1% этилацетат-гексан) с получением указанного в заголовке соединения (2,68 г, 29%) в виде бесцветного масла.
Способ 2: После добавления карбоната калия (4,00 г, 29,0 ммоль) и 2-бромметил-1,4-дифторбензола (5,00 г, 24,2 ммоль) к раствору 4-хлорбензолтиола (3,86 г, 26,6 ммоль) в N,N-диметилформамиде (120 мл) смесь перемешивали в течение 3 часов при комнатной температуре. К реакционной смеси добавляли насыщенный хлорид аммония (50 мл) и воду (20 мл) с последующей экстракцией диэтиловым эфиром. Экстракты объединяли, промывали водой и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Полученный таким образом остаток очищали хроматографией на колонке с силикагелем (1% этилацетат-гексан) с получением указанного в заголовке соединения (6,41 г, 98%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 4,04 (2H, с), 6,85-7, 00 (3H, м), 7,23 (4H, с).
Пример 5: 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол
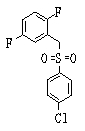
Способ 1: При 0°С 3-хлорпербензойную кислоту (225 мг, 1,30 ммоль) добавляли к раствору 2-[(4-хлорфенил)тиометил]-1,4-дифторбензола (271 мг, 1,00 ммоль) в метиленхлориде (5 мл). Затем смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь разбавляли метиленхлоридом, промывали последовательно водным раствором бикарбоната калия и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Полученный таким образом остаток растворяли в метиленхлориде (5 мл). После охлаждения до 0°С к этому раствору добавляли 3-хлорпербензойную кислоту (450 мг, 2,60 ммоль), и затем смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь разбавляли метиленхлоридом, промывали насыщенным водным раствором бикарбоната калия и насыщенным раствором соли, сушили над MgSO4, затем концентрировали. Полученный таким образом остаток очищали хроматографией на колонке с силикагелем (9% этилацетат-гексан) с получением указанного в заголовке соединения (210 мг, 69%) в виде бесцветного твердого вещества.
Способ 2: После добавления Н2О (16,4 мл), 30% Н2О2 (16,4 мл, 145 ммоль) и тетрагидрата гексааммонийгептамолибдата (425 мг, 0,344 ммоль) к раствору 2-[(4-хлорфенил)тиометил]-1,4-дифторбензола (6,54 г, 24,1 ммоль) в метаноле (100 мл) при 0°С смесь перемешивали в течение 1 часа и затем перемешивали дополнительно в течение 15 часов при комнатной температуре. Осажденное таким образом твердое вещество собирали фильтрованием и фильтрат концентрировали до приблизительно половины его количества. Полученный водный раствор экстрагировали метиленхлоридом. Затем твердое вещество промывали последовательно водой и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Полученный таким образом остаток перекристаллизовывали из гексана с получением указанного в заголовке соединения (6,34 г, 87%) в виде бесцветных игольчатых кристаллов.
Способ 3: После добавления 2-бромметил-1,4-дифторбензола (12,3 мл, 95,5 ммоль) к суспензии 4-хлорбензолсульфината натрия (19,0 г, 95,5 ммоль) в бутаноле (200 мл) смесь нагревали при кипячении с обратным холодильником в течение 5 часов. Осажденное таким образом твердое вещество собирали фильтрованием и растворяли в метиленхлориде. Полученный раствор промывали насыщенным раствором соли, сушили над MgSO4 и концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из гексана с получением указанного в заголовке соединения (12,3 г, 43%) в виде бесцветных игольчатых кристаллов.
ИК (ATR) ν: 3089, 2991, 2943, 1581, 1496, 1315, 1279, 1213, 1149, 1090, 1080, 1012, 958, 816, 779, 756, 729, 708, 646, 517, 469 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,36 (2H, с), 6,91 (1H, тд, J=9,0, 4,4 Гц), 6,99-7,06 (1H, м), 7,11 (1H, ддд, J=8, 3, 5,6, 3,2 Гц), 7,45 (2H, д, J=8,8 Гц), 7,62 (2H, д, J=8,8 Гц).
МС (m/z): 303 (М++H).
Пример 6: Е-2-[1-[(4-хлорфенил)сульфонил]-2-фенилэтенил]-1, 4-дифторбензол
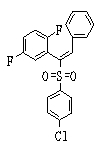
В атмосфере азота и при 0°С гексаметилдисилазид калия (0, 5 М раствор в толуоле, 2,20 мл, 1,10 ммоль) добавляли к раствору в тетрагидрофуране (5 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (303 мг, 1,00 ммоль), полученного в примере 5. Полученную смесь перемешивали при 0°С в течение 1 часа. После добавления бензальдегида (127 мг, 1,20 ммоль) смесь перемешивали при комнатной температуре в течение 15 часов. В реакционную смесь добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Экстракты объединяли, промывали последовательно водой и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (10% этилацетат-гексан) с получением указанного в заголовке соединения (220 мг, 56%) в виде бесцветного твердого вещества. Твердое вещество перекристаллизовывали из метанола с получением бесцветного твердого вещества (111 мг, 28%). На основе теста наблюдения NOE (ядерного эффекта Оверхаузера) было определено, что олефин указанного в заголовке соединения является Е-формой.
Точка плавления: 144,5-145,0°С.
ИК (KBr) ν: 3068, 1637, 1581, 1489, 1450, 1419, 1315, 1246, 1155, 1086, 887, 814, 752, 725, 690, 648, 627, 613, 534, 467 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 6,88 (1H, тд, J=9,1, 4,4 Гц), 7,06-7,18 (4H, м), 7,22-7,28 (2H, м), 7,30-7,36 (1H, м), 7,39 (2H, д, J=8,8 Гц), 7,60 (2H, д, J=8,8 Гц), 8,09 (1H, с).
МС (m/z): 391 (М++H).
Элементный анализ для C20H13ClF2O2S.
Вычислено: C 61,46%; H 3,35%; Cl 9,07%; F 9,72%; S 8,20%.
Найдено: C 61,39%; H 3,28%; Cl 8,95%; F 9,82%; S 8,30%.
Пример 7: 1-[(4-хлорфенил)сульфонил]-1-(2,5-дифторфенил)-2-пентанон
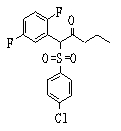
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 1,27 мл, 2,00 ммоль) добавляли к раствору в тетрагидрофуране (10 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (606 мг, 2,00 ммоль), полученного в примере 5. Затем температуру полученной смеси повышали до комнатной температуры. После охлаждения до -78°С к реакционной смеси добавляли по каплям бутирилхлорид (0,218 мл, 2,10 ммоль). Реакционную смесь перемешивали при -78°С в течение 1,5 часов, и добавляли 1 н. хлористо-водородную кислоту (2,0 мл). Затем температуру смеси повышали до комнатной температуры. Реакционную смесь экстрагировали диэтиловым эфиром. Экстракты объединяли, промывали последовательно водой и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (10% этилацетат-гексан). Полученное таким образом твердое вещество перекристаллизовывали из гексана с получением указанного в заголовке соединения (330 мг, 44%) в виде бесцветных игольчатых кристаллов.
Точка плавления: 85,5-86, 0°С.
ИК (ATR) ν: 2968, 1724, 1581, 1491, 1394, 1335, 1323, 1155, 1088, 1034, 1011, 906, 829, 816, 758, 725, 615, 546, 469 см-1.
1 H-ЯМР (400 МГц, CDCl3) δ: 0,90 (3H, т, J=7,6 Гц), 1,52-1,68 (2H, м), 2,62 (1H, ддд, J=18,1, 7,6, 6,8 Гц), 2,84 (1H, ддд, J=18,1, 7,6, 6,8 Гц), 5,66 (1H, с), 6,95 (1H, тд, J=9,0, 4,4 Гц), 7,02-7,08 (1H, м), 7,39-7,43 (1H, м), 7,43 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц).
МС (m/z) 372 (М+).
Элементный анализ для C17H15ClF2O3S.
Вычислено: C 54,77%; H 4,06%; Cl 9,51%; F 10,19%; S 8,60%.
Найдено: C 54,47%; H 3,92%; Cl 9,68%; F 10,26%; S 8,76%.
Пример 8: 2-[(4-хлорфенил)сульфонил]-2-(2,5-дифторфенил)-1-фенил-1-этанон
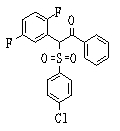
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 0,701 мл, 1,10 ммоль) добавляли к раствору в тетрагидрофуране (5 мл) 2-[(4-хлорфенил)сульфонилметил]-1, 4-дифторбензола (303 мг, 1,00 ммоль), полученного в примере 5. Температуру полученной смеси повышали до комнатной температуры и затем перемешивали в течение 10 минут. После охлаждения до -78°С к реакционной смеси добавляли по каплям бензоилхлорид (0,140 мл, 1,20 ммоль). Реакционную смесь перемешивали при -78°С в течение 30 минут. Затем температуру смеси повышали до 0оС на протяжении 3 часов. После добавления 1 н. хлористо-водородной кислоты (2,0 мл) смесь экстрагировали этилацетатом. Экстракты объединяли, промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Остаток очищали хроматографией среднего давления на колонке с силикагелем (10% этилацетат-гексан). Полученное таким образом твердое вещество промывали гексаном с получением указанного в заголовке соединения (200 мг, 49%) в виде бесцветного твердого вещества.
Точка плавления: 179, 5-180,0°С.
ИК (ATR) ν: 1682, 1595, 1579, 1495, 1475, 1315, 1284, 1240, 1209, 1153, 1082, 991, 874, 766, 708, 687, 607, 547, 509, 453 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 6,54 (1H, с), 7,01-7,10 (2H, м), 7,34-7,38 (1H, м), 7,44-7,50 (4H, м), 7,58-7,65 (1H, м), 7,67 (2H, д, J=8,8 Гц), 7,88-7,93 (2H, м).
МС (m/z): 406 (М+).
HRMS (EI): в виде C20H13ClF2O3S (М+).
Вычислено: 406,0242.
Найдено: 406,0230.
Пример 9: 2-[(4-хлорфенил)сульфонил]-2-(2,5-дифторфенил)-1-фенилэтенилбензоат
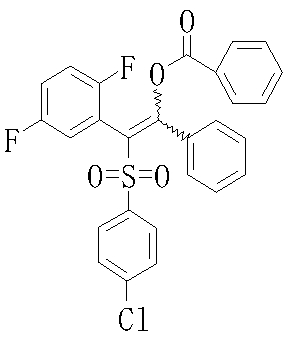
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 0,701 мл, 1,10 ммоль) добавляли к раствору в тетрагидрофуране (5 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (303 мг, 1,00 ммоль), полученного в примере 5. Температуру полученной смеси повышали до комнатной температуры и затем перемешивали в течение 10 минут. После охлаждения до -78°С к реакционной смеси добавляли по каплям бензоилхлорид (0,140 мл, 1,20 ммоль). Реакционную смесь перемешивали при -78°С в течение 30 минут. Температуру смеси повышали до 0°С на протяжении 3 часов. После добавления насыщенного водного раствора хлорида аммония к реакционной смеси смесь экстрагировали диэтиловым эфиром. Экстракты объединяли, промывали последовательно водой и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Остаток очищали хроматографией среднего давления на колонке с силикагелем (10% этилацетат-гексан). Полученное таким образом твердое вещество перекристаллизовывали из этилацетата с получением указанного в заголовке соединения (80 мг, 26%) в виде бесцветного твердого вещества.
Точка плавления: 224,5-227,0°С.
ИК (ATR) ν: 1756, 1610, 1491, 1450, 1325, 1228, 1155, 1092, 1072, 1011, 808, 756, 694, 606, 553, 462 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 6,97 (1H, ддд, J=8,8, 4,4 Гц), 7,02-7,09 (1H, м), 7,15-7,21 (3H, м), 7,23-7,30 (3H, м), 7,34 (2H, д, J=8,5 Гц), 7,51-7,57 (2H, м), 7,77 (2H, д, J=8,5 Гц), 8,02-8,06 (2H, м).
МС (m/z): 528 (М++NH4).
Элементный анализ для C27H17ClF2O4S.
Вычислено: C 63,47%; H 3,35%; Cl 6,94%; F 7,44%; S 6,28%.
Найдено: C 63,04%; H 3,24%; Cl 6,92%; F 7,39%; S 6,44%.
Пример 10: 1-[(4-хлорфенил)сульфонил]-1-(2, 5-дифторфенил)-2-пентанол
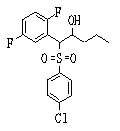
В атмосфере азота и при -78°С н-бутиллитий (1, 6 М раствор в гексане, 0,688 мл, 1,10 ммоль) добавляли к раствору в тетрагидрофуране (5 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (303 мг, 1,00 ммоль), полученного в примере 5. Смесь перемешивали при -78°С в течение 1 часа. После добавления бутаналя (0,108 мл, 1,20 ммоль) смесь перемешивали при -78°С в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Экстракты объединяли, промывали последовательно водой и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Остаток очищали хроматографией среднего давления на колонке с силикагелем (10% этилацетат-гексан). Полученное таким образом твердое вещество промывали гексаном с получением указанного в заголовке соединения (30,5 мг, 8%) в виде бесцветного твердого вещества.
Точка плавления: 134,5-135,0°С.
ИК (ATR) ν: 3502, 2966, 2931, 2873, 1585, 1491, 1309, 1277, 1227, 1173, 1147, 1084, 1083, 1014, 810, 756, 721, 613, 542, 445 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,87 (3H, т, J=7,1 Гц), 1,20-1,65 (4H, м), 3, 06 (1H, д, J=2,2 Гц), 4,48 (1H, с), 4,85-4,90 (1H, м), 6,84 (1H, тд, J=9,1, 4,7 Гц), 6,96-7,02 (1H, м), 7,40 (2H, д, J=8,6 Гц), 7,58 (2H, д, J=8,6 Гц), 7,85 (1H, ддд, J=9,1, 5,4, 3,4 Гц).
МС (m/z): 374 (М+).
HRMS (EI) m/z в виде C17H17O3ClF2S (М+).
Вычислено: 374,0555.
Найдено: 374,0540.
Пример 11: 1-[(4-хлорфенил)сульфонил]-1-(2,5-дифторфенил)-2-пентанол
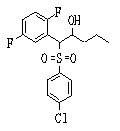
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 7,01 мл, 11,0 ммоль) добавляли к раствору в тетрагидрофуране (50 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (3,03 г, 10,0 ммоль), полученного в примере 5, и смесь перемешивали при -78°С в течение 1 часа. К реакционной смеси добавляли по каплям бутаналь (1,08 мл, 12,0 ммоль). Смесь перемешивали в течение 15 часов с повышением его температуры до комнатной температуры. После охлаждения до 0°С и добавления насыщенного водного раствора хлорида аммония смесь экстрагировали диэтиловым эфиром. Экстракты объединяли, промывали последовательно водой и насыщенным раствором соли, сушили над MgSO4 и затем концентрировали. Осажденное таким образом твердое вещество собирали фильтрованием и промывали гексаном. Фильтрат и гексановые промывки объединяли и затем концентрировали. Остаток очищали хроматографией среднего давления на колонке с силикагелем (10% этилацетат-гексан) в виде изомера высокой полярности с получением бесцветного твердого вещества. Полученное бесцветное твердое вещество перекристаллизовывали из гексана с получением указанного в заголовке соединения (396 мг, 11%) в виде бесцветных игольчатых кристаллов.
Точка плавления: 76,5-78,0°С.
ИК (ATR) ν: 3533, 2960, 1581, 1498, 1394, 1329, 1306, 1242, 1178, 1146, 1082, 987, 887, 754, 712, 644, 594, 515 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,82 (3H, т, J=7,3 Гц), 1,22-1,53 (4H, м), 3,78 (1H, шир.с), 4,55-4,80 (2H, шир.м), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,96-7,04 (1H, м), 7,15-7,26 (1H, шир.с), 7,39 (2H, д, J=8,3 Гц), 7,52 (2H, д, J=8,3 Гц).
МС (m/z): 374 (М+).
Элементный анализ для C17H17ClF2O3S.
Вычислено: C 54,47%; H 4,57%; Cl 9,46%; F 10, 14%; S 8,55%.
Найдено: C 54,27%; H 4,51%; Cl 9,44%; F 10,20%; S 8,70%.
Пример 12: 2-[1-[(4-хлорфенил)сульфонил]-1-пентен-1-ил]-1,4-дифторбензол
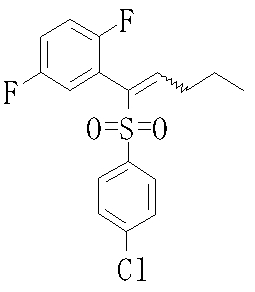
При 0оС триэтиламин (0,131 мл, 0,942 ммоль) и метансульфонилхлорид (0,0665 мл, 0,856 ммоль) добавляли к раствору 1-[(4-хлорфенил)сульфонил]-1-(2,5-дифторфенил)-2-пентанола (204 мг, 0,544 ммоль) в метиленхлориде (10 мл). После перемешивания при 0°С в течение 1 часа реакционную смесь разбавляли метиленхлоридом, промывали последовательно насыщенным водным раствором хлорида аммония, водой и насыщенным раствором соли, сушили над MgSO4 и затем концентрировали. Остаток растворяли в тетрагидрофуране (5 мл). После охлаждения раствора до 0оС добавляли гексаметилсилазид калия (0,5 М раствор в толуоле, 1,30 мл, 0,650 ммоль). Полученную смесь перемешивали при 0°С в течение 3 часов и добавляли к ней насыщенный раствор хлорида аммония. Полученную смесь экстрагировали этилацетатом, промывали последовательно водой и насыщенным раствором соли, сушили над MgSO4 и затем концентрировали. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (15 % этилацетат-гексан). Полученное твердое вещество перекристаллизовывали из гексана с получением указанного в заголовке соединения (33,0 мг, 17%) в виде бесцветных игольчатых кристаллов.
Точка плавления: 95,5-97,0°С.
ИК (ATR) ν: 2960, 1645, 1579, 1489, 1421, 1311, 1252, 1198, 1165, 1140, 1086, 1012, 818, 769, 752, 640, 606, 552, 467 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,89 (3H, т, J=7,3 Гц), 1,45-1,56 (2H, м), 2,00 (2H, шир.с), 6,89 (1H, тд, J=8,3, 4,4 Гц), 7,01-7,08 (2H, м), 7,31 (1H, т, J=8,3 Гц), 7,38 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц).
МС (m/z): 356 (М+).
HRMS (EI): в виде C17H15ClF2O2S (М+).
Вычислено: 356, 0449.
Найдено: 356,0450.
Элементный анализ для C17H15ClF2O2S.
Вычислено: C 57,22%; H 4,24%; Cl 9,94%; F 10, 65%; S 8,99%.
Найдено: C 56,80%; H 4,21%; Cl 10,04%; F 10,65%; S 9,11%.
Пример 13: 1-[(4-хлорфенил)сульфонил]-1-(2,5-дифторфенил)-2-пентилметансульфонат
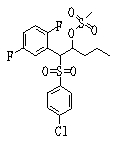
При 0оС триэтиламин (0,300 мл, 2,16 ммоль) и метансульфонилхлорид (0,150 мл, 1,93 ммоль) добавляли к раствору в метиленхлориде (10 мл) 1-[(4-хлорфенил)сульфонил]-1-(2,5-дифторфенил)-2-пентанола (449 мг, 1,20 ммоль), полученного в примере 11. Затем полученную смесь перемешивали при 0°С в течение 2 часов. Реакционную смесь разбавляли метиленхлоридом, промывали последовательно насыщенным водным раствором хлорида аммония, водой и насыщенным раствором соли, сушили над MgSO4 и затем концентрировали. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (15 % этилацетат-гексан) с получением указанного в заголовке соединения (503 мг, 93%) в виде бесцветного твердого вещества.
ИК (ATR) ν: 2966, 1498, 1350, 1176, 1149, 1086, 928, 879, 789, 752, 636, 592, 550, 525, 455 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,86 (3H, т, J=7,1 Гц), 1,33-1,61 (3H, м), 1,88-1,96 (1H, м), 3,21 (3H, д, J=0,7 Гц), 5,03 (1H, д, J=7,7 Гц), 5,58-5, 66 (1H, м), 6,83 (1H, тд, J=9,0, 4,4 Гц), 6,97-7,05 (1H, м), 7,33-7,40 (1H, м, включающая 2H, д, J=8,3 Гц при 7,35 м.д.), 7,54 (2H, д, J=8,3 Гц).
Пример 14: 2-[1-[(4-хлорфенил)сульфонил]-1-пентен-1-ил]-1,4-дифторбензол
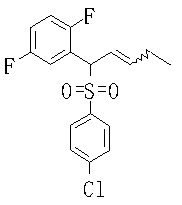
К раствору 1-[(4-хлорфенил)сульфонил]-1-(2,5-дифторфенил)-2-пентилметансульфоната (200 мг, 0,442 ммоль) в метиленхлориде (4 мл) добавляли 1,8-диазабицикло[5,4,0]ундец-7-ен (69,1 мкл, 0,464 ммоль) при комнатной температуре. Смесь перемешивали в течение 15 часов. Реакционную смесь концентрировали. Остаток очищали хроматографией среднего давления на колонке с силикагелем (8 % этилацетат-гексан) с получением указанного в заголовке соединения (72,0 мг, 46%) в виде бесцветного твердого вещества. Полученное твердое вещество перекристаллизовывали из гексана с получением бесцветного твердого вещества (60,0 мг).
Точка плавления: 99,0-100,0°С.
ИК (ATR) ν: 1581, 1496, 1392, 1309, 1279, 1232, 1173, 1149, 1084, 978, 837, 816, 806, 758, 731, 710, 644, 598, 561, 521 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,99 (3H, т, J=7,3 Гц), 2,12 (2H, м), 5,06 (2H, д, J=7,3 Гц), 5,74-5,85 (2H, м), 6,92 (1H, тд, J=9,0, 4,4 Гц), 6,97-7,04 (1H, м), 7,32 (1H, ддд, J=8,5, 5,4, 3,2 Гц), 7,43 (2H, д, J=8,5 Гц), 7,64 (2H, д, J=8,5 Гц).
МС (m/z): 374 (М++NH4).
Элементный анализ для C17H15ClF2O2S.
Вычислено: C 57,22%; H 4,24%; Cl 9,94%; F 10,65%; S 8,99%.
Найдено: C 57,15%; H 4,18%; Cl 9,90%; F 10,74%; S 9,09%.
Пример 15: 2-[5-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]пентил]-1,4-дифторбензол
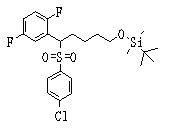
В атмосфере аргона и при -78°С н-бутиллитий (1,5 М раствор в гексане, 0,701 мл, 1,10 ммоль) добавляли к раствору в диметоксиэтане (5 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (303 мг, 1,00 ммоль), полученного в примере 5. Смесь перемешивали при -78°С в течение 1 часа и затем при комнатной температуре в течение 30 минут. Реакционную смесь охлаждали до -78°С с последующим добавлением по каплям 4-(трет-бутилдиметилсилилокси)-1-иодбутана (0,260 мл, 1,00 ммоль). При повышении температуры реакционной смеси до комнатной температуры перемешивание проводили в течение 15 часов. К реакционной смеси добавляли воду с последующей экстракцией диэтиловым эфиром. Экстракты объединяли, промывали последовательно водой и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (8% этилацетат-гексан) с получением указанного в заголовке соединения (401 мг, 82%) в виде бесцветного твердого вещества. Полученное твердое вещество перекристаллизовывали из гексана с получением бесцветных игольчатых кристаллов.
ИК (ATR) ν: 2945, 2927, 2854, 1583, 1496, 1427, 1392, 1321, 1248, 1144, 1082, 1038, 1012, 941, 822, 775, 748, 708, 623, 542, 467 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: -0,02 (3H, с), -0,02 (3H, с), 0,82 (9H, с), 1,23-1,33 (2H, м), 1,42-1,58 (2H, м), 2,06-2,18 (1H, м), 2,39-2,48 (1H, м), 3,53 (2H, т, J=6,3 Гц), 4,52 (1H, дд, J=11,6, 2,6 Гц), 6,83 (1H, тд, J=9,0, 4,4 Гц), 6,94-7,00 (1H, м), 7,22-7,26 (1H, м), 7,38 (2H, д, J=8,5 Гц), 7,53 (2H, д, J=8,5 Гц).
МС (m/z): 489 (М++H).
Элементный анализ для C23H31ClF2O3SSi.
Вычислено: C 56,48%; H 6,39%; Cl 7,25%; F 7,77%; S 6, 56%.
Найдено: C 56,29%; H 6,28%; Cl 7,29%; F 7,75%; S 6,70%.
Пример 16: 2-[5-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]-1-метилпентил]-1,4-дифторбензол
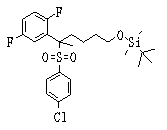
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 0, 294 мл, 0,461 ммоль) добавляли к раствору 2-[5-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]пентил]-1,4-дифторбензола (205 мг, 0,419 ммоль) в тетрагидрофуране (4 мл). Смесь перемешивали при комнатной температуре в течение 1 часа. После охлаждения до -78°С к реакционной смеси добавляли по каплям иодметан (0,339 мл, 0,545 ммоль) и смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли воду с последующей экстракцией диэтиловым эфиром. Экстракты объединяли, промывали последовательно водой и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (6% этилацетат-гексан) с получением указанного в заголовке соединения (168 мг, 80%) в виде бесцветного масла.
ИК (ATR) ν: 2952, 2929, 2856, 1583, 1496, 1473, 1392, 1311, 1255, 1192, 1149, 1090, 1014, 833, 760, 710, 629, 552 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: -0,01 (3H, с), 0,00 (3H, с), 0,84 (9H, с), 1,05-1,18 (1H, м), 1,29-1,41 (1H, м), 1,52-1,60 (2H, м), 1,81 (3H, д, J=2,9 Гц), 1,95-2,05 (1H, м), 2,61-2,71 (1H, м), 3,57 (2H, т, J=6,1 Гц), 6,82-6,88 (1H, м), 6,98-7,07 (2H, м), 7,38 (2H, д, J=9,1 Гц), 7,40 (2H, д, J=9,1 Гц).
МС (m/z): 503 (М+).
HRMS (FAB) для C24H34ClF2O3SSi (М++H).
Вычислено: 503,1655.
Найдено: 503,1704.
Пример 17: 5-(4-хлорфенилсульфонил)-5-(2,5-дифторфенил)-1-гексанол
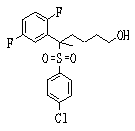
После добавления тетрабутиламмонийфторида (1 М раствор в тетрагидрофуране, 0,978 мл, 0,978 ммоль) к раствору 2-[5-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]-1-метилпентил]-1,4-дифторбензола (164 мг, 0,326 ммоль) в тетрагидрофуране (4 мл) смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь разбавляли диэтиловым эфиром, промывали последовательно насыщенным хлоридом аммония, водой и насыщенным раствором соли, сушили над MgSO4 и затем концентрировали. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (50% этилацетат-гексан) с получением указанного в заголовке соединения (122 мг, 96%) в виде бесцветного масла.
ИК (ATR) ν: 3516, 3089, 2939, 2870, 1583, 1495, 1475, 1412, 1394, 1306, 1279, 1188, 1146, 1088, 1070, 1012, 823, 758, 710, 679, 649, 602, 546, 474 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 2,09-2,20 (1H, м), 1,23 (1H, шир.с), 1,34-1,46 (1H, м), 1,63 (1H, квинтет, J=7,1 Гц), 1,82 (3H, д, J=2,7 Гц), 1,98-2,07 (1H, м), 2,71 (1H, тд, J=13,0, 3,4 Гц), 3,63 (2H, т, J=6,4 Гц), 6,83-6,90 (1H, м), 6,99-7,06 (2H, м), 7,38 (4H, с).
МС (m/z): 389 (М++H).
HRMS (FAB) для C18H20ClF2O3S (М++H).
Вычислено: 389,0790.
Найдено: 389,0795.
Пример 18: 2-[5-(трет-бутилдиметилсилилокси)-1-[4-(трет-бутилдиметилсилилокси)бутил]-1-(4-хлорфенилсульфонил)пентил]-1,4-дифторбензол
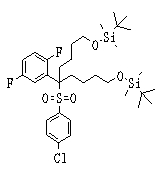
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 0,358 мл, 0,562 ммоль) добавляли к раствору в тетрагидрофуране (4 мл) 2-[5-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]пентил]-1,4-дифторбензола (250 мг, 0,511 ммоль), полученного в примере 15. Темепературу полученной смеси повышали до комнатной температуры. После охлаждения до -78°С к реакционной смеси добавляли по каплям 4-(трет-бутилдиметилсилилокси)-1-иодбутан (0,146 мл, 0,562 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней. К реакционной смеси добавляли воду с последующей экстракцией диэтиловым эфиром. Экстракты объединяли, промывали последовательно водой и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (6% этилацетат-гексан) с получением указанного в заголовке соединения (167 мг, 48%) в виде бесцветного твердого вещества.
ИК (ATR) ν: 3082, 2927, 2856, 1583, 1495, 1462, 1308, 1250, 1146, 1080, 1012, 833, 758, 675, 646, 607, 579, 544, 455 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,03 (12H, с), 0,87 (18H, с), 1,25-1,70 (8H, м), 2, 23-2,34 (2H, м), 2,40-2,48 (2H, м), 3,58-3,68 (4H, м), 6,74-6,82 (1H, м), 6,97-7,06 (2H, м), 7,30 (2H, д, J=8,8 Гц), 7,34 (2H, д, J=8,8 Гц).
МС (m/z): 675 (М++H).
HRMS (FAB) для C33H54ClF2O4SSi2(М++H).
Вычислено: 675,2938.
Найдено: 675,2900.
Элементный анализ для C33H53ClF2O4SSi2.
Вычислено: C 58,68%; H 7,91%; Cl 5,25%; F 5,63%.
Найдено: C 58, 63%; H 7,91%; Cl 5,32%; F 5,69%.
Пример 19: 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-1,9-нонандиол
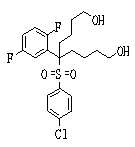
К раствору 2-[5-(трет-бутилдиметилсилилокси)-1-[4-(трет-бутилдиметилсилилокси)бутил]-1-(4-хлорфенилсульфонил)пентил]-1,4-дифторбензола (158 мг, 0,234 ммоль) в тетрагидрофуране (4 мл) добавляли тетрабутиламмонийфторид (1 М раствор в тетрагидрофуране, 0,702 мл, 0,702 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 часов. После концентрирования реакционной смеси остаток растворяли в диэтиловом эфире с последующим последовательным промыванием водой и насыщенным раствором соли, сушкой над MgSO4 и концентрированием. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (5% метанол-метиленхлорид) с получением бесцветного твердого вещества. Полученное твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (97,0 мг, 93%) в виде бесцветного твердого вещества.
Точка плавления: 107,0-108,5°С.
ИК (ATR) ν: 3275, 2939, 1572, 1495, 1414, 1306, 1261, 1140, 1078, 1066, 847, 812, 754, 710, 679, 644, 606, 544, 474, 449 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,36-1,82 (10H, м), 2,24-2,35 (2H, м), 2,47-2,57 (2H, м), 3,70 (4H, т, J=5,9 Гц), 6,79 (1H, ддд, J=12,4, 8,3, 4,6 Гц), 6,97-7,08 (2H, м), 7,29 (2H, д, J=8,8 Гц), 7,34 (2H, д, J=8,8 Гц).
МС (m/z): 447 (М++H).
HRMS (FAB) для C21H26ClF2O4S (М+ +H).
Вычислено: 447,1208.
Найдено: 447,1227.
Элементный анализ для C21H25ClF2O4S·0,25H2 O.
Вычислено: C 55,87%; H 5,69%; Cl 7,85%; F 8,42%; S 7,10%.
Найдено: C 55,62%; H 5,40%; Cl 7,89%; F 8,58%; S 7,26%.
Пример 20: 2-[5-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]-1-бутилпентил]-1,4-дифторбензол
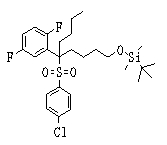
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 0,287 мл, 0,450 ммоль) добавляли к раствору в тетрагидрофуране (4 мл) 2-[5-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]пентил]-1,4-дифторбензола (200 мг, 0,409 ммоль), полученного в примере 15. Темепературу полученной смеси повышали до комнатной температуры. После охлаждения до -78°С к реакционной смеси добавляли по каплям триамид гексаметилфосфорной кислоты (0,214 мл, 1,23 ммоль) и иодбутан (51,1 мкл, 0,450 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 20 часов. К реакционной смеси добавляли изопропанол (0,5 мл) с последующим концентрированием. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (5% этилацетат-гексан) с получением указанного в заголовке соединения (163 мг, 73%) в виде бесцветного масла.
ИК (ATR) ν: 2954, 2929, 2858, 1583, 1495, 1473, 1412, 1394, 1311, 1255, 1192, 1147, 1090, 1014, 833, 756, 710, 677, 606 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,03 (6H, с), 0,87 (9H, с), 0,95 (3H, т, J=7,4 Гц), 1,20-1,45 (5H, м), 1,52-1,70 (3H, м), 2,21-2,32 (2H, м), 2,40-2,49 (2H, м), 3,64 (2H, т, J=6,1 Гц), 6,74-6,82 (1H, м), 6,97-7,07 (2H, м), 7,29 (2H, д, J=8,8 Гц), 7,34 (2H, д, J=8,8 Гц).
МС (m/z): 545 (М+).
HRMS (FAB) для C27H40ClF2O3SSi (М++H).
Вычислено: 545,2124.
Найдено: 545,2087.
Пример 21: 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-1-нонанол
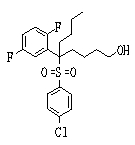
После добавления тетрабутиламмонийфторида (1 М раствора в тетрагидрофуране, 0,532 мл, 0,532 ммоль) к раствору 2-[5-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]-1-бутилпентил]-1,4-дифторбензола (154 мг, 0,283 ммоль) в тетрагидрофуране (4 мл) смесь перемешивали при комнатной температуре в течение 18 часов. Затем реакционную смесь концентрировали. Полученный таким образом остаток растворяли в диэтиловом эфире с последующим последовательным промыванием водой и насыщенным раствором соли, сушкой над MgSO4 и концентрированием. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (50% этилацетат-гексан) с получением указанного в заголовке соединения (122 мг, 0,283 ммоль) в виде бесцветного масла.
ИК (ATR) ν: 3539, 2958, 2873, 1583, 1495, 1412, 1308, 1277, 1192, 1146, 1090, 1014, 829, 758, 710, 675, 606, 548, 463 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,95 (3H, т, J=7,3 Гц), 1,19-1,77 (9H, м), 2,21-2,34 (2H, м), 2,38-2,53 (2H, м), 3,70 (2H, шир.с), 6,75-6,83 (1H, м), 6,98-7,08 (2H, м), 7,29 (2H, д, J=8,8 Гц), 7,34 (2H, д, J=8,8 Гц).
МС (m/z): 431 (М++H).
HRMS (EI): как C21H26ClF2 O3S (М++H).
Вычислено: 431,1259.
Найдено: 431,1237.
Пример 22: 1-[(4-хлорфенил)сульфонил]-1-(2,5-дифторфенил)-3-октанол (изомер 22-А и изомер 22-В)
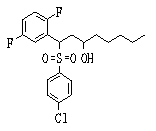
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 0,701 мл, 1,10 ммоль) добавляли к раствору в тетрагидрофуране (5 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (303 мг, 1,00 ммоль), полученного в примере 5. Температуру полученной смеси повышали до комнатной температуры. После охлаждения до -78°С к реакционной смеси добавляли по каплям комплекс трифторборан-эфир (0,133 мл, 1,05 ммоль). Смесь перемешивали при комнатной температуре в течение 2 дней. К реакционной смеси добавляли воду, с последующей экстракцией диэтиловым эфиром. Экстракты объединяли, промывали последовательно насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли, сушили над MgSO4 и концентрировали. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (20% этилацетат-гексан) с получением изомера низкой полярности, смеси изомеров и изомера высокой полярности в качестве первой фракции, второй фракции и третьей фракции, соответственно, в каждом случае в виде бесцветного твердого вещества. Изомер низкой полярности и изомер высокой полярности перекристаллизовывали из гексана с получением указанного в заголовке изомера 22-А (низкой полярности) (98,0 мг, 24%) и указанного в заголовке изомера 22-В (высокой полярности) (199 мг, 48%), каждого в виде бесцветных игольчатых кристаллов.
Изомер 22-А
Точка плавления: 84,0-84, 5°С.
ИК (ATR) ν: 3533, 2933, 2860, 1574, 1495, 1429, 1278, 1240, 1182, 1142, 1092, 1080, 1014, 962, 885, 829, 766, 737, 710, 681, 619, 526, 476 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,88 (3H, т, J=6,8 Гц), 1,20-1,50 (8H, м), 1,57 (1H, д, J=5,1 Гц), 2,07 (1H, ддд, J=14,7, 8,1, 6,8 Гц), 2,70 (1H, ддд, J=14,7, 6,8, 4, 6 Гц), 3,93-4,01 (1H, м), 4,85 (1H, т, J=6,8 Гц), 6,77 (1H, тд, J=9,0, 4,4 Гц), 6,91-6,98 (1H, м), 7,24-7,30 (1H, м), 7,36 (2H, д, J=8,5 Гц), 7,51 (2H, д, J=8,5 Гц).
МС (m/z): 417 (М++H).
HRMS (FAB) для C20H24ClF2O3S (М++H).
Вычислено: 417,1103.
Найдено: 417, 1102.
Элементный анализ для C20H23ClF2O3S·0,25H2O.
Вычислено: C 57,00%; H 5,62%; Cl 8,41%; F 9,02%; S 7, 61%.
Найдено: C 57,18%; H 5,38%; Cl 8,57%; F 9,22%; S 7,79%.
Изомер 22-В
Точка плавления: 123,0-123,5°С.
ИК (ATR) ν: 3502, 2925, 2858, 1583, 1496, 1410, 1304, 1275, 1213, 1184, 1149, 1086, 1045, 1014, 958, 910, 829, 796, 752, 725, 710, 627, 552, 503, 467 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,87 (3H, т, J=7,1 Гц), 1,20-1,60 (9H, м), 2,21-2,30 (1H, м), 2,41 (1H, ддд, J=13,9, 10,5, 3,4 Гц), 3,23-3,32 (1H, м), 4,94 (1H, дд, J=11,7, 2,9 Гц), 6,85 (1H, тд, J=9,0, 4, 4 Гц), 6,96-7,03 (1H, м), 7,23-7,29 (1H, м), 7,39 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц).
МС (m/z) 417 (М++H).
HRMS (FAB) для C20H24 ClF2O3S (М++H).
Вычислено: 417,1103.
Найдено: 417,1122.
Элементный анализ для C20H23ClF2O3S·0,25H2O.
Вычислено: C 57,00%; H 5,62%; Cl 8,41%; F 9,02%; S 7,61%.
Найдено: C 57,16%; H 5,34%; Cl 8,55%; F 9,18%; S 7,82%.
Пример 23: 2-[5-хлор-1-[(4-хлорфенил)сульфонил]пентил]-1,4-дифторбензол
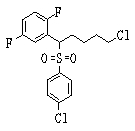
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 3,52 ммоль) добавляли к раствору в диметоксиэтане (30 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (1, 52 г, 5,02 ммоль), полученного в примере 5. Температуру полученной смеси повышали до комнатной температуры, при которой перемешивание продолжали в течение 15 минут. После охлаждения реакционной смеси до -78°С добавляли 4-хлор-1-иодбутан (672 мкл, 5,52 ммоль) и смесь перемешивали при комнатной температуре в течение 24 часов. К реакционной смеси добавляли насыщенный раствор хлорида аммония, с последующей экстракцией диэтиловым эфиром. Экстракты объединяли, промывали последовательно водой, насыщенным водным раствором тиосульфата натрия и насыщенным раствором соли, сушили над MgSO4 и затем перегоняли при пониженном давлении для удаления растворителя. Полученный таким образом остаток перекристаллизовывали из гексана с получением указанного в заголовке соединения (1,64 г, 83%) в виде бесцветных игольчатых кристаллов.
ИК (ATR) ν: 2945, 1583, 1495, 1475, 1311, 1277, 1230, 1149, 1142, 1082, 1014, 872, 822, 793, 752, 708, 629, 557, 532, 465 см-1 .
1H-ЯМР (400 МГц, CDCl3) δ: 1,33-1,48 (2H, м), 1,72-1,87 (2H, м), 2,08-2,18 (1H, м), 2,43-2,52 (1H, м), 3,44-3,53 (2H, м), 4,52 (1H, ддд, J=11,5, 3,9, 1,2 Гц), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,96-7,02 (1H, м), 7,23-7,28 (1H, м), 7,39 (2H, д, J=8,8 Гц), 7,53 (2H, д, J=8,8 Гц).
МС (m/z): 393 (М++H).
Элементный анализ для C17H16Cl2F2O2S.
Вычислено: C 51,92%; H 4,10%; Cl 18,03%; F 9,66%; S 8,15%.
Найдено: C 51,33%; H 4,07%; Cl 17,64%; F 9,72%; S 8,25%.
Пример 24: Гидрохлорид 1-[5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)пентил]пирролидина
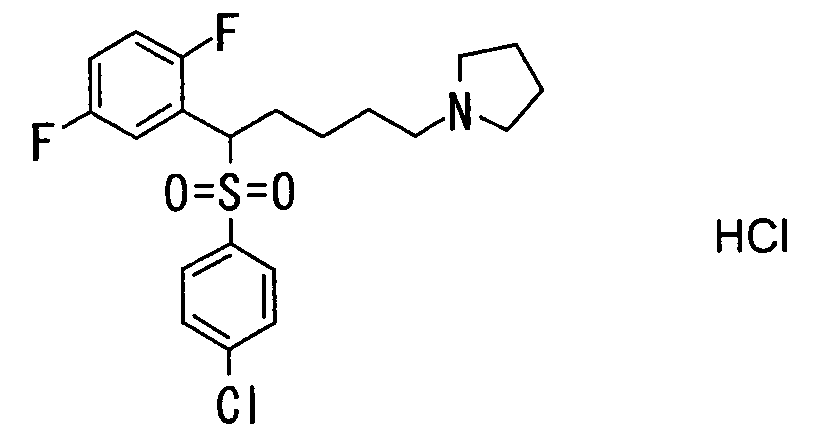
К раствору 2-[5-хлор-1-[(4-хлорфенил)сульфонил]пентил]-1,4-дифторбензола (200 мг, 0,509 ммоль) в ацетонитриле (6 мл) добавляли пирролидин (213 мкл, 2,55 ммоль), карбонат калия (73,7 мг, 0,534 ммоль) и иодид калия (15 мг). Полученную смесь нагревали при 70°С в течение 18 часов. Температуру реакционной смеси охлаждали опять до комнатной температуры. Полученный таким образом остаток распределяли между водой и метиленхлоридом. После отделения органического слоя водный слой экстрагировали метиленхлоридом. Органический слой и экстракт объединяли, промывали водой и насыщенным раствором соли, сушили над MgSO4 и затем концентрировали. Полученный таким образом неочищенный продукт подвергали хроматографии на короткой колонке (SiO2, метиленхлорид-метанол, 10:1). Полученное масло растворяли в этаноле. После добавления смеси 1 н. хлористо-водородная кислота-этанол (2 мл) к полученному раствору смесь концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из этилацетата с получением указанного в заголовке соединения (128 мг, 54%) в виде бледно-желтого твердого вещества.
Точка плавления: 167,0-170,5°С.
ИК (ATR) ν: 2960, 2565, 2453, 1583, 1495, 1321, 1277, 1211, 1173, 1145, 1084, 1011, 879, 820, 787, 754, 721, 708, 627, 557, 540, 467 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,31-1,47 (2H, м), 1,93-2,30 (6H, м), 2,42-2,51 (1H, м), 2,66-2,78 (2H, м), 2,87-3,03 (2H, м), 3,76 (2H, шир.с), 4,51 (1H, дд, J=10,7, 4,4 Гц), 6,85 (1H, тд, J=8,8, 4,4 Гц), 6,96-7,03 (1H, м), 7,22 (1H, ддд, J=8,8, 5,4, 3,2 Гц), 7,40 (2H, д, J=8,3 Гц), 7,54 (2H, д, J=8,3 Гц), 12,54 (1H, шир.с).
МС (m/z): 428 (М++H).
Элементный анализ для C21H24ClF2NO2S·HCl.
Вычислено: C 54, 31%; H 5,43%; Cl 15,27%; F 8,18%; N 3,02%; S 6,90%.
Найдено: C 54,19%; H 5,37%; Cl 15,07%; F 8,10%; N 3,21%; S 6,98%.
Пример 25: Этил-3-[(4-хлорфенил)сульфонил]-3-(2, 5-дифторфенил)пропионат
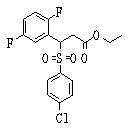
В атмосфере аргона и при -78°С н-бутиллитий (1, 57 М раствор в гексане, 7,01 ммоль) добавляли к раствору в диметоксиэтане (50 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (3,03 г, 10,0 ммоль), полученного в примере 5. Температуру полученной смеси повышали до комнатной температуры, при которой перемешивание продолжали в течение 15 минут. После охлаждения реакционной смеси до -78°С добавляли бромэтилацетат (1,33 мл, 12,0 ммоль). Смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный раствор хлорида аммония, с последующей экстракцией диэтиловым эфиром. Экстракты объединяли, промывали последовательно водой, насыщенным водным раствором тиосульфата натрия и насыщенным раствором соли, сушили над MgSO4 и затем перегоняли при пониженном давлении для удаления растворителя. Полученный таким образом остаток перекристаллизовывали из гексана с получением указанного в заголовке соединения (1,95 г, 50%) в виде бесцветных игольчатых кристаллов.
Точка плавления: 99,5-100,5°С.
ИК (ATR) ν: 3078, 2952, 1734, 1587, 1493, 1419, 1377, 1327, 1279, 1213, 1149, 1047, 1014, 829, 779, 754, 727, 611, 542, 453 см-1.
1H-ЯМР (CDCl3) δ: 1,15 (3H, т, J=7,1 Гц), 3,08 (1H, дд, J=16,6, 10,3 Гц), 3,46 (1H, дд, J=16,6, 4,6 Гц), 3,99-4,12 (2H, м), 5,06 (1H, дд, J=10,3, 4,6 Гц), 6,85 (1H, тд, J=9,0, 4,4 Гц), 6,96-7,02 (1H, м), 7,19 (1H, ддд, J=8,6, 5,4, 3,2 Гц), 7,42 (2H, д, J=8,8 Гц), 7,56 (2H, д, J=8,8 Гц).
МС (m/z): 389 (М+ +H).
Элементный анализ для C17H15ClF2O4S.
Вычислено: C 52,51%; H 3,89%; Cl 9,12%; F 9,77%; S 8,25%.
Найдено: C 52,33%; H 3,86%; Cl 9,10%; F 9,88%; S 8,37%.
Пример 26: 2-[1-[(4-хлорфенил)сульфонил]-5-(метилтио)пентил]-1,4-дифторбензол
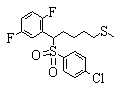
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (0,94 г, 3,1 ммоль), полученный в примере 5, растворяли в толуоле (15 мл). После добавления 4-(метилтио)-1-бутанола (0,25 мл, 2,1 ммоль) и цианометилентри-н-бутилфосфорана (1,0 г, 4,1 ммоль) полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов в атмосфере аргона. Реакционной смеси давали остыть. Затем добавляли 4-(метилтио)-1-бутанол (0,25 мл, 2,1 ммоль) с последующим кипячением с обратным холодильником в течение 6 часов в атмосфере аргона. Реакционной смеси давали остыть и затем концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=10:1) с получением бесцветного масла. Полученное бесцветное масло отверждали гексаном с получением указанного в заголовке соединения (0,55 г, 44%) в виде белого порошка.
Точка плавления: 103-106°С.
ИК (ATR) ν: 3066, 2960, 2935, 1583, 1493, 1147, 1082, 1012, 893, 829, 752, 625, 542, 465 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1, 23-1,45 (2H, м), 1,50-1,75 (2H, м), 2,04 (3H, с), 2,04-2,20 (1H, м), 2,35-2,60 (3H, м), 4,52 (1H, дд, J=11,5, 2,4 Гц), 6,78-6,88 (1H, м), 6,95-7,01 (1H, м), 7,20-7,30 (1H, м), 7,38 (2H, дм, J=8,4 Гц), 7,53 (2H, дм, J=8,4 Гц).
МС (m/z): 405, 407 (М++H).
HRMS (FAB) для C18H20ClF2O2S2(М+ +H).
Вычислено: 405,0561.
Найдено: 405,0581.
Пример 27: 2-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]-1,4-дифторбензол (соединение А) и 2-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфинил)пентил]-1,4-дифторбензол (соединение В)
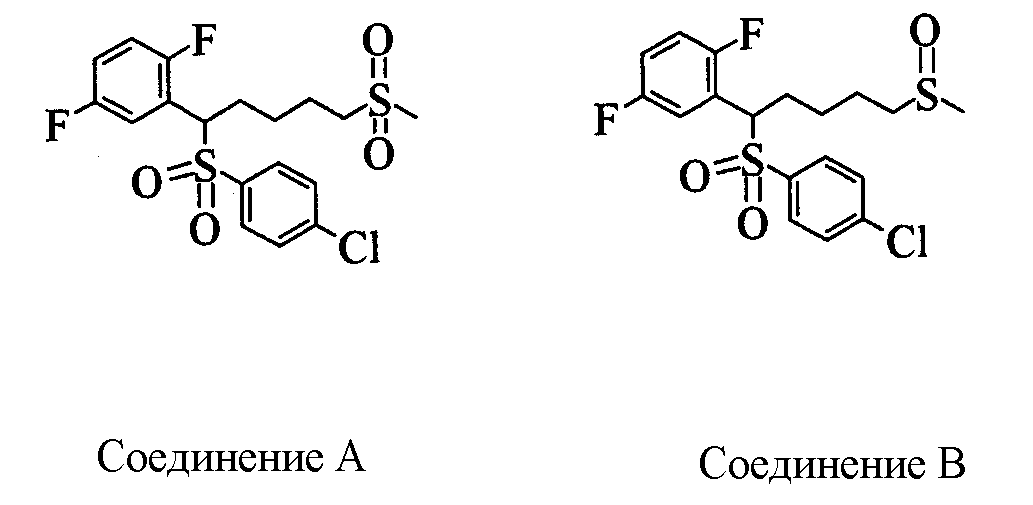
В метиленхлориде (30 мл) растворяли 2-[1-[(4-хлорфенил)сульфонил]-5-(метилтио)пентил]-1,4-дифторбензол (500 мг, 1,23 ммоль). После охлаждения на льду к полученному раствору добавляли 3-хлорпербензойную кислоту (340 мг, 1,97 ммоль). Смесь перемешивали при комнатной температуре в течение 14 часов. После концентрирования реакционной смеси при пониженном давлении остаток подвергали хроматографии на силикагеле. Из фракции, элюированной смесью гексан:этилацетат=10:1, получали белое твердое вещество. Затем твердое вещество промывали смесью диэтиловый эфир/метиленхлорид с получением указанного в заголовке соединения А (211 мг, 30%) в виде белого порошка. Затем из фракции, элюированной смесью метиленхлорид:метанол=40:1, получали белое твердое вещество. Твердое вещество промывали смесью диэтиловый эфир/метиленхлорид с получением указанного в заголовке соединения (144 мг, 30%) в виде белого порошка.
Соединение А
Точка плавления: 145-148° С.
ИК (ATR) ν: 1496, 1317, 1292, 1273, 1149, 1124, 1086, 829, 756, 631, 544, 523, 499, 478, 465 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,38-1,70 (2H, м), 1,80-2,00 (2H, м), 2,05-2,22 (1H, м), 2,45-2,60 (1H, м), 2,88 (3H, с), 2,96 (2H, тм, J=7,0 Гц), 4,51 (1H, дм, J=7,6 Гц), 6,80-6,90 (1H, м), 6,95-7,05 (1H, м), 7,20-7,35 (1H, м), 7,39 (2H, д, J=8,7 Гц), 7,53 (2H, д, J=8,7 Гц).
МС (m/z): 437, 439(М++H).
Элементный анализ для C18H19ClF2O4S2.
Вычислено: C 49,48%; H 4,38%; Cl 8,11%;F 8,70%; S 14,68%.
Найдено: C 49,50%; H 4,28%; Cl 8,05%; F 8,77%; S 14,70%.
Соединение В
Точка плавления: 126-129°С.
ИК (ATR) ν: 1495, 1475, 1277, 1147, 1086, 1012, 833, 752, 625, 540, 465 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,32-1,70 (2H, м), 1,75-1,93 (2H, м), 2,08-2,22 (1H, м), 2,46-2,75 (3H, м), 2,54 (3H, с), 4,52 (1H, дд, J=11,4, 2,4 Гц), 6,80-6,90 (1H, м), 6,94-7,04 (1H, м), 7,20-7, 30 (1H, м), 7,39 (2H, дд, J=8,5, 1,8 Гц), 7,53 (2H, дд, J=8,5, 2,7 Гц).
МС (m/z): 421, 423 (М++H).
Элементный анализ для C18H19ClF2O3S2.
Вычислено: C 51,36%; H 4,55%; Cl 8,42%; F 9,03%; S 15,24%.
Найдено: C 51,36%; H 4,49%; Cl 8,35%; F 9,00%; S 15,24%.
Пример 28: 2-[1-[(4-хлорфенил)сульфонил]-5-винилоксипентил]-1,4-дифторбензол
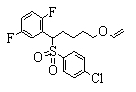
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (0,94 г, 3,1 ммоль), полученный в примере 5, растворяли в толуоле (30 мл). После добавления 4-винилокси-1-бутанола (0,51 мл, 4,2 ммоль) и цианометилентри-н-бутилфосфорана (1,0 г, 4,1 ммоль) полученную смесь нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. Реакционной смеси давали остыть и затем концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=10:1) с получением белого твердого вещества. Полученное белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (0,97 г, 78%) в виде белого порошка.
Точка плавления: 54-56°С.
ИК (ATR) ν: 2943, 1618, 1495, 1475, 1308, 1198, 1147, 1080, 1012, 962, 899, 829, 750, 623, 559, 544, 467 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,25-1,45 (2H, м), 1, 55-1,80 (2H, м), 2,05-2,22 (1H, м), 2,40-2,55 (1H, м), 3,62 (2H, т, J=6,2 Гц), 3,96 (1H, дд, J=6,8, 2,1 Гц), 4,12 (1H, дд, J=14,4, 2,1 Гц), 4,53 (1H, дд, J=11,5, 2,7 Гц), 6,39 (1H, дд, J=14,4, 6,8 Гц), 6,80-6,90 (1H, м), 6,95-7,04 (1H, м), 7,20-7,30 (1H, м), 7,39 (2H, д, J=8,6 Гц), 7,54 (2H, д, J=8,6 Гц).
МС (m/z): 418, 420 (М++NH4).
Элементный анализ для C19H19ClF2O3S.
Вычислено: C 56,93%; H 4,78%; Cl 8,84%; F 9,48%; S 8,00%.
Найдено: C 56,98%; H 4,83%; Cl 8,78%; F 9,51%; S 8,13%.
Пример 29: 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-1-пентанол
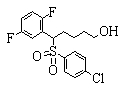
В метаноле (30 мл) растворяли 2-[1-[(4-хлорфенил)сульфонил]-5-винилоксипентил]-1,4-дифторбензол (0,90 г, 2,3 ммоль). После добавления моногидрата п-толуолсульфоновой кислоты (20 мг, 0,11 ммоль) полученную смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:2) с получением белого твердого вещества. Полученное белое твердое вещество промывали диизопропиловым эфиром с получением указанного в заголовке соединения (0,73 г, 85%) в виде белого порошка.
Точка плавления: 84-86°С.
ИК (ATR) ν: 3325, 2941, 2866, 1583, 1496, 1313, 1151, 1084, 825, 752, 629, 534 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,18-1,29 (1H, м), 1,29-1,40 (2H, м), 1,40-1,70 (2H, м), 2,08-2,22 (1H, м), 2,42-2,55 (1H, м), 3,55-3,67 (2H, м), 4,53 (1H, дд, J=11,4, 3,8 Гц), 6,78-6,88 (1H, м), 6,93-7,03 (1H, м), 7,20-7,30 (1H, м), 7,39 (2H, д, J=8,5 Гц), 7,53 (2H, д, J=8,5 Гц).
МС (m/z): 375, 377 (М++H).
Элементный анализ для C17H17ClF2O3S·0,25H2O.
Вычислено: C 53,83%; H 4,65%; Cl 9,35%; F 10,02%; S 8,45%.
Найдено: C 53,73%; H 4, 63%; Cl 9,35%; F 10,03%; S 8,55%.
Пример 30: 2-[1-[(4-хлорфенил)сульфонил]циклопентил]-1,4-дифторбензол
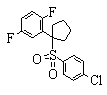
В толуоле (10 мл) растворяли 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-1-пентанол (100 мг, 0,267 ммоль). После добавления цианометилентри-н-бутилфосфорана (130 мг, 0,539 ммоль) полученную смесь нагревали при кипячении с обратным холодильником в течение 2 дней в атмосфере аргона. Реакционной смеси давали остыть, и затем добавляли цианометилентри-н-бутилфосфоран (130 мг, 0,539 ммоль). Смесь кипятили с обратным холодильником в течение 3 дней в атмосфере аргона. Реакционной смеси давали остыть и затем концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=15:1) с получением белого твердого вещества. Полученное белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (35 мг, 37%) в виде белого порошка.
Точка плавления: 153-155°С.
ИК (ATR) ν: 2968, 1581, 1489, 1304, 1277, 1138, 1082, 827, 752, 606, 569, 519, 467 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,70-1,85 (2H, м), 2,05-2,20 (2H, м), 2,22-2,35 (2H, м), 2,88-3,00 (2H, м), 6,75-6,83 (1H, м), 6,95-7,05 (2H, м), 7,35 (4H, с).
МС (m/z): 374, 376(М++NH4).
Элементный анализ для C17H15ClF2O2S.
Вычислено: C 57,22%; H 4,24%; Cl 9,94%; F 10,65%; S 8,99%.
Найдено: C 56,87%; H 4,14%; Cl 10,28%; F 10,44%; S 9,05%.
Пример 31: 2-[6-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]гексил]-1,4-дифторбензол
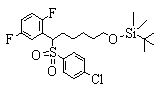
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (0,94 г, 3,1 ммоль), полученный в примере 5, растворяли в толуоле (30 мл) с последующим добавлением 5-(трет-бутилдиметилсилилокси)-1-пентанола (1,1 мл, 4,6 ммоль) и цианометилентри-н-бутилфосфорана (1,0 г, 4,1 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов в атмосфере аргона. Реакционной смеси давали остыть и затем концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=15:1) с получением указанного в заголовке соединения (1,4 г, 87%) в виде бесцветного масла.
ИК (ATR) ν: 2929, 2856, 1583, 1496, 1325, 1151, 1088, 835, 775, 754, 629 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,01 (6H, с), 0,86 (9H, с), 1,18-1,60 (6H, м), 2,04-2,17 (1H, м), 2,38-2,50 (1H, м), 3,54 (2H, т, J=6, 1 Гц), 4,53 (1H, дд, J=11,5, 2,7 Гц), 6,78-6,88 (1H, м), 6,93-7,03 (1H, м), 7,20-7,30 (1H, м), 7,38 (2H, д, J=8,5 Гц), 7,53 (2H, д, J=8,5 Гц).
МС (m/z): 503, 505 (М++H).
Пример 32: 6-[(4-хлорфенил)сульфонил]-6-(2,5-дифторфенил)-1-гексанол
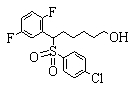
2-[6-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]гексил]-1,4-дифторбензол (0,70 г, 1,4 ммоль) растворяли в тетрагидрофуране (30 мл). При охлаждении на льду добавляли раствор в тетрагидрофуране тетрабутиламмонийфторида (1,0 М, 4,2 мл, 4,2 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. После добавления воды (1,0 мл) к реакционной смеси смесь концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:2) с получением белого твердого вещества. Полученное белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (0,47 г, 86%) в виде белого порошка.
Точка плавления: 98-99°С.
ИК (ATR) ν: 3575, 2929, 1495, 1279, 1146, 1082, 1014, 833, 752, 627, 541, 467 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,18-1,62 (7H, м), 2,04-2,18 (1H, м), 2,40-2,53 (1H, м), 3,59 (2H, дд, J=11,5, 6,4 Гц), 4,52 (1H, дд, J=11,5, 2,7 Гц), 6,78-6,88 (1H, м), 6,94-7,04 (1H, м), 7,20-7,30 (1H, м), 7,38 (2H, д, J=8,4 Гц), 7,53 (2H, д, J=8,4 Гц).
МС (m/z): 389, 391 (М++H).
Элементный анализ для C18H19ClF2O3S.
Вычислено: C 55,60%; H 4,92%; Cl 9,12%; F 9,77%; S 8, 25%.
Найдено: C 55,38%; H 4,75%; Cl 9,09%; F 9,81%; S 8,34%.
Пример 33: 2-[1-[(4-хлорфенил)сульфонил]циклогексил]-1,4-дифторбензол
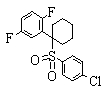
6-[(4-хлорфенил)сульфонил]-6-(2,5-дифторфенил)-1-гексанол (200 мг, 0,514 ммоль) растворяли в толуоле (20 мл). После добавления цианометилентри-н-бутилфосфорана (500 мг, 2,07 ммоль) полученную смесь нагревали при кипячении с обратным холодильником в течение 4 дней в атмосфере аргона. Реакционной смеси давали остыть и затем концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=20:1) с получением белого твердого вещества. Полученное твердое вещество промывали смесью гексан/метиленхлорид с получением указанного в заголовке соединения (97 мг, 51%) в виде белого порошка.
Точка плавления: 137-139°С.
ИК (ATR) ν: см-1, 2933, 2862, 1495, 1309, 1144, 1082, 885, 814, 750, 619, 559, 464 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,10-1,45 (3H, м), 1,61 (1H, дм, J=12,0 Гц), 1,81 (2H, шир.д, J=13,4 Гц), 2,09 (2H, шир.т, J=13,0 Гц), 2,55-2,95 (2H, м), 6,84 (1H, ддд, J=12,2, 9,0, 4,9 Гц), 7,00-7,11 (2H, м), 7,36 (2H, с), 7,36 (2H, с).
МС (m/z): 388, 390 (М++NH4).
Элементный анализ для C18H17ClF2O3S.
Вычислено: C 58,30%; H 4,62%; Cl 9,56%; F 10,25%; S 8,65%.
Найдено: C 58,01%; H 4,49%; Cl 9,58%; F 10,35%; S 8,82%.
Пример 34: 2-[1-[(4-хлорфенил)сульфонил]-3-(2-винилоксиэтокси)пропил]-1,4-дифторбензол
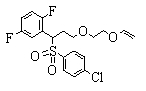
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (520 мг, 1,72 ммоль), полученный в примере 5, растворяли в толуоле (30 мл). После добавления 2,2-(2-винилоксиэтокси)этанола (0,270 мл, 2,10 ммоль) и цианометилентри-н-бутилфосфорана (500 мг, 2,07 ммоль) полученную смесь нагревали при кипячении с обратным холодильником в течение 24 часов в атмосфере аргона. Затем реакционной смеси давали остыть. После добавления 2-(2-винилоксиэтокси)этанола (0,170 мл, 1,25 ммоль) и цианометилентри-н-бутилфосфорана (300 мг, 1,24 ммоль) смесь нагревали при кипячении с обратным холодильником в течение 12 часов в атмосфере аргона. Реакционной смеси давали остыть и затем концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=7:1) с получением белого твердого вещества. Полученное белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (140 мг, 20%) в виде белого порошка.
Точка плавления: 55-56°С.
ИК (ATR) ν: 2927, 2877, 1621, 1496, 1323, 1198, 1144, 1084, 1012, 829, 752, 633, 542, 469 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 2,20-2,35 (1H, м), 2,70-2,85 (1H, м), 3,28 (1H, тд, J=9,5, 4,6 Гц), 3,40-3,50 (1H, м), 3,54-3,68 (2H, м), 3,71 (2H, т, J=4,6 Гц), 3,99 (1H, дд, J=6,7, 2,1 Гц), 4,14 (1H, дд, J=14,3, 2,1 Гц), 4,81 (1H, дд, J=10,9, 4,0 Гц), 6,41 (1H, дд, J=14,3, 6,7 Гц), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,94-7,04 (1H, м), 7,18-7,30 (1H, м), 7,39 (2H, дм, J=8,3 Гц), 7,56 (2H, дм, J=8,3 Гц).
МС (m/z): 417, 419 (М++H).
Элементный анализ для C19H19ClF2O4S.
Вычислено: C 54,74%; H 4,59%; Cl 8, 50%; F 9,11%; S 7,69%.
Найдено: C 54,54%; H 4,46%; Cl 8,46%; F 9,02%; S 7,81%.
Пример 35: 2-[3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропокси]этанол
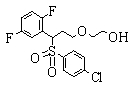
2-[1-[(4-хлорфенил)сульфонил]-3-(2-винилоксиэтокси)пропил]-1,4-дифторбензол (123 мг, 0,295 ммоль) растворяли в метаноле (10 мл). Добавляли моногидрат п-толуолсульфоновой кислоты (2,0 мг, 0,011 ммоль) и смесь перемешивали при комнатной температуре в течение 4 часов. После концентрирования при пониженном давлении остаток очищали хроматографией на силикагеле (метиленхлорид:метанол=50:1) с получением белого твердого вещества. Полученное белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (80 мг, 70%) в виде белого порошка.
Точка плавления: 41-46°С.
ИК (ATR) ν: 3467, 2943, 1495, 1315, 1149, 1086, 1061, 829, 762, 521 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,78-1,80 (1H, м), 2,22-2,36 (1H, м), 2,75-2,88 (1H, м), 3,20-3,40 (2H, м), 3, 42-3,52 (1H, м), 3,57-3,73 (3H, м), 4,81 (1H, дд, J=10,9, 3,8 Гц), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,94-7,04 (1H, м), 7,22-7,30 (1H, м), 7,39 (2H, дм, J=8,4 Гц), 7,55 (2H, дм, J=8,4 Гц).
МС (m/z): 391, 393 (М++H).
Элементный анализ для C17H17ClF2O4S.
Вычислено: C 52,24%; H 4,38%; Cl 9,07%; F 9,72%; S 8,20%.
Найдено: C 52,12%; H 4,36%; Cl 9,11%; F 9,86%; S 8,32%.
Пример 36: 2-[[(4-хлорфенил)сульфонил](циклогексил)метил]-1,4-дифторбензол
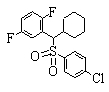
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (240 мг, 0,793 ммоль), полученный в примере 5, растворяли в толуоле (20 мл). К полученному раствору добавляли циклогексанол (0,11 мл, 1,0 ммоль) и цианометилентри-н-бутилфосфоран (250 мг, 1,0 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов в атмосфере аргона. Реакционной смеси давали остыть и затем добавляли циклогексанол (0,22 мл, 2,1 ммоль) и цианометилентри-н-бутилфосфоран (500 мг, 2,08 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение 14 часов в атмосфере аргона. Реакционной смеси давали остыть и концентрировали при пониженном давлении, после чего полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=30:1) с получением белого твердого вещества. Полученное белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (188 мг, 62%) в виде белого порошка.
Точка плавления: 107-109°С.
ИК (ATR) ν: 2927, 2858, 1495, 1240, 1138, 1080, 874, 831, 796, 750, 708, 615, 548, 507, 469, 444 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,92-1,08 (1H, м), 1,08-1,22 (1H, м), 1,22-1,50 (3H, м), 1,60-1,75 (3H, м), 1, 75-1,88 (1H, м), 2,37 (1H, шир.д, J=12,5 Гц), 2,48-2,62 (1H, м), 4,44 (1H, д, J=7,6 Гц), 6,68-6,80 (1H, м), 6,86-6,95 (1H, м), 7,30 (2H, дм, J=8,6 Гц), 7,38-7,52 (1H, м), 7,49 (2H, дм, J=8,6 Гц).
МС (m/z): 402, 404 (М++NH4).
Элементный анализ для C19H19ClF2O2S.
Вычислено: C 59,29%; H 4,98%; Cl 9,21%; F 9,87%; S 8,33%.
Найдено: C 59,11%; H 4,93%; Cl 9,18%; F 9,82%; S 8,49%.
Пример 37: 2-[6-бром-1-[(4-хлорфенил)сульфонил]гексил]-1,4-дифторбензол
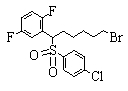
К тетрагидрофурану (10 мл) добавляли гидрид натрия (60% дисперсия в масле, 15 мг, 0, 38 ммоль). При охлаждении на льду добавляли 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (100 мг, 0,330 ммоль), полученный в примере 5. После перемешивания реакционной смеси при комнатной температуре в течение 30 минут добавляли 1,5-дибромпентан (0,10 мл, 0,74 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней с последующим добавлением гидрида натрия (60% дисперсии в масле, 15 мг, 0,38 ммоль) при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 15 минут и затем добавляли 1,5-дибромпентан (0,10 мл, 0,74 ммоль). Смесь перемешивали при комнатной температуре в течение 14 часов и затем концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=10:1) с получением белого твердого вещества. Полученное белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (51 мг, 30%) в виде белого порошка.
Точка плавления: 77-79°С.
ИК (ATR) ν: 2937, 1495, 1147, 1084, 1014, 893, 833, 795, 752, 708, 627, 559, 536, 465 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,20-1,35 (2H, м), 1,37-1,55 (2H, м), 1,74-1,88 (2H, м), 2,05-2,20 (1H, м), 2,40-2,53 (1H, м), 3,34 (2H, тд, J=6,6, 1,3 Гц), 4,51 (1H, дд, J=11, 5, 2,7 Гц), 6,83 (1H, тд, J=9,0, 4,6 Гц), 6,94-7,04 (1H, м), 7,20-7,30 (1H, м), 7,38 (2H, д, J=8,7 Гц), 7,53 (2H, д, J=8,7 Гц).
МС (m/z): 468, 470 (М++NH4).
Элементный анализ для C18H18BrClF2O2S.
Вычислено: C 47,86%; H 4,02%; Br 17,69%; Cl 7,85%; F 8,41%; S 7,10%.
Найдено: C 47,80%; H 3,83%; Br 17,67%; Cl 7,86%; F 8,65%; S 7,25%.
Ссылочный пример 2: 4-(трет-бутилдифенилсилилокси)-1-метил-1-бутанол
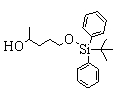
В N,N-диметилформамиде (200 мл) растворяли 1,4-пентандиол (10,0 г, 96,0 ммоль) и имидазол (6,6 г, 96,9 ммоль). При охлаждении на льду добавляли по каплям трет-бутилхлордифенилсилан (25,2 мл, 96,4 ммоль). После завершения добавления по каплям реакционную смесь перемешивали при комнатной температуре в течение 2 дней. К реакционной смеси добавляли диэтиловый эфир с последующим промыванием водой. Органический слой сушили над безводным сульфатом магния. После фильтрования остаток, полученный концентрированием фильтрата при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (32,0 г, 97%) в виде бесцветного масла.
ИК (ATR) ν: 3350, 2929, 2856, 1427, 1105, 822, 739, 698, 609, 501 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,05 (9H, с), 1,19 (3H, д, J=6,3 Гц), 1,46-1,72 (4H, м), 2,02-2,08 (1H, м), 3,69 (2H, т, J=6,0 Гц), 3,78-3,90 (1H, м), 7,30-7,50 (6H, м), 7,62-7,88 (4H, м).
МС (m/z): 343 (М++H).
Пример 38: 2-[5-(трет-бутилдифенилсилилокси)-1-[(4-хлорфенил)сульфонил]-2-метилпентил]-1,4-дифторбензол (изомер 38-А и изомер 38-В)
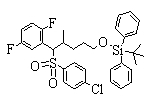
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (0,94 г, 3,1 ммоль), полученный в примере 5, растворяли в толуоле (30 мл) с последующим добавлением 4-(трет-бутилдифенилсилилокси)-1-метил-1-бутанола (1,40 г, 4,1 ммоль) и цианометилентри-н-бутилфосфорана (1,0 г, 4,1 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 2 дней в атмосфере аргона. Реакционной смеси давали остыть и затем добавляли цианометилентри-н-бутилфосфоран (1,0 г, 4,1 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. После остывания реакционной смеси остаток, полученный концентрированием смеси, очищали хроматографией на силикагеле (гексан:этилацетат=60:1) с получением указанного в заголовке изомера 38-А (низкой полярности) (0,71 г, 37%) и указанного в заголовке изомера 38-В (высокой полярности (0,45 г, 23%), каждого в виде бесцветного масла.
Изомер 38-А
ИК (ATR) ν: 2931, 2858, 1495, 1322, 1149, 1109, 1088, 1012, 822, 752, 700, 613, 503, 488, 469 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,02 (9H, с), 1,09 (3H, д, J=6,8 Гц), 1,26-1,42 (1H, м), 1,50-1,80 (3H, м), 2,74-2,86 (1H, м), 3,64 (2H, т, J=5,7 Гц), 4,51 (1H, д, J=5,6 Гц), 6,78 (1H, тд, J=9,1, 4,6 Гц), 6,90-7,00 (1H, м), 7,30-7,48 (8H, м), 7, 50-7,58 (3H, м), 7,60-7,70 (4H, м).
МС (m/z): 627 (М++H).
Изомер 38-В
ИК (ATR) ν: 2931, 2858, 1495, 1147, 1107, 1088, 822, 752, 729, 700, 613, 559, 503, 471 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,94 (9H, с), 1,00-1,20 (1H, м), 1,37 (3H, д, J=6,8 Гц), 1,40-1,64 (3H, м), 2,60-2,74 (1H, м), 3,48-3,60 (2H, м), 4,43 (1H, шир.д, J=9,3 Гц), 6,69 (1H, тд, J=9,0, 4,4 Гц), 6,84-6,93 (1H, м), 7,24-7,45 (9H, м), 7,48 (2H, д, J=8,6 Гц), 7,52-7,62 (4H, м).
МС (m/z): 627 (М++H).
Пример 39: 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-4-метил-1-пентанол
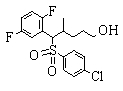
2-[5-(трет-бутилдифенилсилилокси)-1-[(4-хлорфенил)сульфонил]-2-метилпентил]-1,4-дифторбензол (изомер 38-А) (710 мг, 1,13 ммоль), полученный в примере 38, растворяли в метиленхлориде (20 мл). При охлаждении на льду добавляли по каплям смесь фтористый водород-пиридин (0,64 мл). После завершения добавления по каплям реакционную смесь перемешивали при комнатной температуре в течение 14 часов. К реакционной смеси добавляли насыщенный водный раствор (20 мл) бикарбоната натрия с последующей экстракцией диэтиловым эфиром. Органический слой промывали последовательно 1 н. хлористо-водородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=2:1) с получением бесцветного масла. Полученное бесцветное масло отверждали гексаном с получением указанного в заголовке соединения (283 мг, 64%) в виде белого порошка.
Точка плавления: 84-86°С.
ИК (ATR) ν: 3367, 2937, 1496, 1138, 1084, 1051, 1012, 829, 754, 729, 708, 621, 561, 532, 471 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,07 (3H, д, J=6,8 Гц), 1,40-1,85 (5H, м), 2,75-2,90 (1H, м), 3,64-3,75 (2H, м), 4,54 (1H, д, J=6,6 Гц), 6,77 (1H, тд, J=9,0, 4,4 Гц), 6,90-7,00 (1H, м), 7,33 (2H, д, J=8,4 Гц), 7,43-7,60 (1H, м), 7,51 (2H, д, J=8,4 Гц).
МС (m/z): 389, 391 (М++H).
Элементный анализ для C18H19ClF2O3S.
Вычислено: C 55,60%; H 4,92%; Cl 9,12%; F 9,77%; S 8, 25%.
Найдено: C 55,42%; H 4,83%; Cl 9,10%; F 9,85%; S 8,30%.
Пример 40: 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-4-метил-1-пентанол
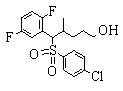
2-[5-(трет-бутилдифенилсилилокси)-1-[(4-хлорфенил)сульфонил]-2-метилпентил]-1,4-дифторбензол (изомер 38-В) (450 мг, 0,717 ммоль), полученный в примере 38, растворяли в метиленхлориде (10 мл). При охлаждении на льду добавляли по каплям смесь фтористый водород-пиридин (0,41 мл). После завершения добавления по каплям реакционную смесь перемешивали при комнатной температуре в течение 14 часов. К реакционной смеси добавляли насыщенный водный раствор (20 мл) бикарбоната натрия с последующей экстракцией диэтиловым эфиром. Органический слой промывали последовательно 1 н. хлористо-водородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом магния. После фильтрования остаток, полученный концентрированием фильтрата при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=2:1) с получением бесцветного масла. Полученное бесцветное масло отверждали гексаном с получением указанного в заголовке соединения (194 мг, 70%) в виде белого порошка.
Точка плавления: 67-69°С.
ИК (ATR) ν: 3537, 2933, 2868, 1481, 1308, 1279, 1240, 1144, 1078, 822, 802, 754, 712, 665, 613, 544, 469 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,08-1,22 (1H, м), 1,23 (1H, т, J=5,2 Гц), 1,36 (3H, д, J=6,8 Гц), 1,45-1,70 (3H, м), 2,67-2,80 (1H, м), 3,50-3,65 (2H, м), 4,45 (1H, д, J=8,3 Гц), 6,73 (1H, тд, J=9,0, 4,6 Гц), 6,88-6,97 (1H, м), 7,31 (2H, д, J=8,8 Гц), 7,34-7,48 (1H, м), 7,49 (2H, д, J=8,8 Гц).
МС (m/z): 389, 391 (М++H).
Элементный анализ для C18H19ClF2O3S.
Вычислено: C 55,60%; H 4,92%; Cl 9,12%; F 9,77%; S 8,25%.
Найдено: C 55,48%; H 4,84%; Cl 9,01%; F 9,76%; S 8, 32%.
Пример 41: 2-[5-бром-1-[(4-хлорфенил)сульфонил]-2-метилпентил]-1,4-дифторбензол
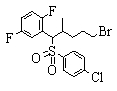
5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-4-метил-1-пентанол (290 мг, 0,746 ммоль), полученный в примере 39, и тетрабромид углерода (290 мг, 0,874 ммоль) растворяли в метиленхлориде (8 мл). При перемешивании на льду раствор, полученный растворением трифенилфосфина (230 мг, 0,877 ммоль) в метиленхлориде (2 мл), добавляли по каплям к полученному раствору. После завершения добавления по каплям реакционную смесь перемешивали при комнатной температуре в течение 3 дней. К реакционной смеси добавляли тетрабромид углерода (290 мг, 0,874 ммоль) и трифенилфосфин (230 мг, 0,877 ммоль) при охлаждении на льду с последующим перемешиванием при комнатной температуре в течение 6 часов. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=15:1) с получением указанного в заголовке соединения (331 мг, 98%) в виде бесцветного масла.
ИК (ATR) ν: 2966, 1495, 1321, 1238, 1147, 1088, 1012, 789, 752, 729, 712, 613, 559, 536, 471 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,07 (3H, д, J=6,8 Гц), 1,46-1,60 (1H, м), 1, 77-2,11 (3H, м), 2,74-2,90 (1H, м), 3,41 (2H, т, J=6,7 Гц), 4,49 (1H, д, J=6,6 Гц), 6,78 (1H, тд, J=9,1, 4,6 Гц), 6,90-7,00 (1H, м), 7,33 (2H, д, J=8,7 Гц), 7,45-7,60 (1H, м), 7,52 (2H, д, J=8,7 Гц).
МС (m/z): 451, 453 (М++H).
Пример 42: 2-[5-бром-1-[(4-хлорфенил)сульфонил]-2-метилпентил]-1,4-дифторбензол
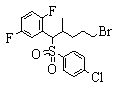
5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-4-метил-1-пентанол (170 мг, 0,437 ммоль), полученный в примере 40, и тетрабромид углерода (170 мг, 0,648 ммоль) растворяли в метиленхлориде (8 мл). При перемешивании при охлаждении на льду к полученному раствору добавляли трифенилфосфин (135 мг, 0,515 ммоль) с последующим перемешиванием при комнатной температуре в течение 14 часов. К реакционной смеси добавляли тетрабромид углерода (170 мг, 0,437 ммоль) и трифенилфосфин (135 мг, 0,515 ммоль) при охлаждении на льду. Реакционную смесь перемешивали при комнатной температуре в течение 6 часов. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (192 мг, 97%) в виде бесцветного масла.
ИК (ATR) ν: 3091, 2966, 1496, 1296, 1246, 1142, 1080, 889, 839, 754, 710, 627, 553, 513, 471 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,18-1,31 (1H, м), 1,37 (3H, д, J=6,8 Гц), 1,50-1,70 (1H, м), 1,78-1,92 (2H, м), 2,62-2,80 (1H, м), 3,20-3,40 (2H, м), 4,44 (1H, д, J=8,5 Гц), 6,73 (1H, тд, J=9,0, 4,5 Гц), 6,88-6,98 (1H, м), 7,30 (2H, д, J=8,6 Гц), 7,30-7,50 (1H, м), 7,49 (2H, д, J=8,6 Гц).
МС (m/z): 451, 453 (М++H).
Пример 43: 2-[1-[(4-хлорфенил)сульфонил]-2-метил-5-(метилтио)пентил]-1,4-дифторбензол (изомер 43-А и изомер 43-В)
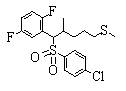
2-[5-бром-1-[(4-хлорфенил)сульфонил]-2-метилпентил]-1,4-дифторбензол (325 мг, 0,719 ммоль), полученный в примере 41, и 2-[5-бром-1-[(4-хлорфенил)сульфонил]-2-метилпентил]-1,4-дифторбензол (185 мг, 0,410 ммоль), полученный в примере 42, растворяли в тетрагидрофуране (25 мл). К полученному раствору добавляли тиометоксид натрия (160 мг, 2,28 ммоль) при охлаждении на льду. После перемешивания при комнатной температуре в течение 14 часов к полученной смеси при охлаждении на льду добавляли тиометоксид натрия (190 мг, 2,71 ммоль). Остаток, полученный концентрированием реакционной смеси при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=30:1) с получением указанного в заголовке изомера 43-А (низкой полярности) (185 мг, 39%) и указанного в заголовке изомера 43-В (высокой полярности) (186 мг, 30%), каждого в виде бесцветного масла.
Изомер 43-А
ИК (ATR) ν: 2916, 1493, 1321, 1238, 1146, 1088, 1012, 789, 752, 712, 613, 559, 536, 469 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,08 (3H, д, J=6,9 Гц), 1,40-1,54 (1H, м), 1,55-1,85 (3H, м), 2,10 (3H, с), 2,50 (2H, т, J=7,2 Гц), 2,75-2,90 (1H, м), 4,51 (1H, д, J=6,1 Гц), 6,78 (1H, тд, J=9,1, 4,4 Гц), 6,90-7,00 (1H, м), 7,33 (2H, д, J=8,6 Гц), 7,45-7,60 (1H, м), 7,52 (2H, д, J=8,6 Гц).
МС (m/z): 419, 421(М++H).
HRMS (FAB) для C19H22ClF2O2S2(М++H).
Вычислено: 419,0718.
Найдено: 419,0733.
Изомер 43-В
ИК (ATR) ν: 2952, 2920, 1493, 1308, 1232, 1176, 1149, 1090, 827, 750, 629, 590, 557, 532, 472 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,10-1,30 (1H, м), 1,37 (3H, д, J=6,6 Гц), 1,50-1,65 (3H, м), 2,03 (3H, с), 2,30-2,50 (2H, м), 2,64-2,78 (1H, м), 4,44 (1H, д, J=8,6 Гц), 6,73 (1H, тд, J=9,0, 4,5 Гц), 6,86-6,98 (1H, м), 7,30 (2H, д, J=8,6 Гц), 7,34-7,46 (1H, м), 7,48 (2H, д, J=8,6 Гц).
МС (m/z): 419, 421(М++H).
HRMS (FAB) для C19H22ClF2O2S2(М++H).
Вычислено: 419,0718.
Найдено: 419,0715.
Пример 44: 2-[1-[(4-хлорфенил)сульфонил]-2-метил-5-(метилсульфинил)пентил]-1,4-дифторбензол
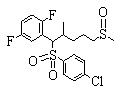
2-[1-[(4-хлорфенил)сульфонил]-2-метил-5-(метилтио)пентил]-1,4-дифторбензол (изомер 43-А) (180 мг, 0, 430 ммоль), полученный в примере 43, растворяли в метиленхлориде (10 мл). При охлаждении на льду добавляли 3-хлорпербензойную кислоту (89 мг, 0,51 ммоль) с последующим перемешиванием при комнатной температуре в течение 14 часов. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, очищали хроматографией на силикагеле (метиленхлорид:метанол=40:1) с получением указанного в заголовке соединения (172 мг, 92%) в виде бесцветного масла.
ИК (ATR) ν: 2920, 1495, 1317, 1279, 1238, 1146, 1086, 1036, 829, 789, 752, 712, 615, 559, 471 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,00-1,10 (3H, м), 1,50-1,75 (1H, м), 1,78-2,10 (3H, м), 2,60 (1,5H, с), 2,60 (1,5H, с), 2,65-2,90 (3H, м), 4,50 (1H, д, J=7,6 Гц), 6,77 (1H, тд, J=9,2, 4,4 Гц), 6,90-7,00 (1H, м), 7,32 (2H, д, J=8,5 Гц), 7,40-7,60 (1H, м), 7,50 (2H, д, J=8,5 Гц).
МС (m/z): 435, 437 (М++H).
HRMS (FAB) для C19H22ClF2O3S2(М++H).
Вычислено: 435,0667.
Найдено: 435,0655.
Пример 45: 2-[1-[(4-хлорфенил)сульфонил]-2-метил-5-(метилсульфинил)пентил]-1,4-дифторбензол
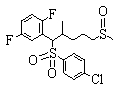
2-[1-[(4-хлорфенил)сульфонил]-2-метил-5-(метилтио)пентил]-1,4-дифторбензол (изомер 43-В) (175 мг, 0,418 ммоль), полученный в примере 43, растворяли в метиленхлориде (10 мл). При охлаждении на льду добавляли 3-хлорпербензойную кислоту (87 мг, 0,50 ммоль) с последующим перемешиванием при комнатной температуре в течение 14 часов. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, очищали хроматографией на силикагеле (метиленхлорид:метанол=40:1) с получением белого твердого вещества. Полученное твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (118 мг, 65%) в виде белого порошка.
Точка плавления: 107-112°С.
ИК (ATR) ν: 3087, 2943, 1496, 1315, 1242, 1178, 1149, 1088, 1028, 829, 731, 623, 584, 538, 457 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,15-1,40 (4H, м), 1,45-2,00 (3H, м), 2,50-2,85 (3H, м), 2,54 (3H, с), 4,46 (1H, д, J=8,1 Гц), 6,78 (1H, тд, J=9,0,4,7 Гц), 6,90-7,00 (1H, м), 7,32 (2H, д, J=8,4 Гц), 7,35-7,50 (1H, м), 7,49 (2H, д, J=8,4 Гц).
МС (m/z): 435, 437 (м++H).
Элементный анализ для C19H21ClF2O3S2.
Вычислено: C 52,47%; H 4,87%; Cl 8,15%; F 8,74%; S 14,74%.
Найдено: C 52,44%; H 4,85%; Cl 8,17%; F 8,79%; S 14,63%.
Пример 46: 2-[1-[(4-хлорфенил)сульфонил]-2-метил-5-(метилсульфонил)пентил]-1,4-дифторбензол
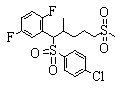
2-[1-[(4-хлорфенил)сульфонил]-2-метил-5-(метилсульфинил)пентил]-1,4-дифторбензол (76 мг, 0,18 ммоль), полученный в примере 44, растворяли в метиленхлориде (5 мл). При охлаждении на льду добавляли 3-хлорпербензойную кислоту (36 мг, 0,21 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Остаток, полученный концентрированием реакционной смеси, очищали хроматографией на силикагеле (метиленхлорид:метанол=100:1) с получением бледного желтовато-коричневого масла. Полученное бледное желтовато-коричневое масло отверждали смесью диэтиловый эфир/метиленхлорид с получением указанного в заголовке соединения (61 мг, 77%) в виде желтого порошка.
Точка плавления: 115-117°С.
ИК (ATR) ν: 3078, 2937, 1493, 1311, 1286, 1230, 1151, 1136, 1086, 831, 754, 729, 712, 623, 542, 519, 471, 459 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,03 (3H, д, J=7,1 Гц), 1,60-1,80 (1H, м), 1,85-2,20 (3H, м), 2,70-2,90 (1H, м), 2,94 (3H, с), 3,07 (2H, т, J=7,8 Гц), 4,49 (1H, д, J=7,8 Гц), 6, 76 (1H, тд, J=9,1, 4,5 Гц), 6,90-7,00 (1H, м), 7,32 (2H, д, J=8,5 Гц), 7,35-7,60 (1H, м), 7,49 (2H, д, J=8,5 Гц).
МС (m/z): 451, 453 (м++H).
Элементный анализ для C19H21ClF2O4S2.
Вычислено: C 50,61%; H 4,96%; Cl 7,86%; F 8,43%; S 14,22%.
Найдено: C 50,57%; H 4,74%; Cl 7,85%; F 8,58%; S 14,25%.
Пример 47: 2-[1-[(4-хлорфенил)сульфонил]-2-метил-5-(метилсульфонил)пентил]-1,4-дифторбензол

2-[1-[(4-хлорфенил)сульфонил]-2-метил-5-(метилсульфинил)пентил]-1,4-дифторбензол (66 мг, 0,15 ммоль), полученный в примере 45, растворяли в метиленхлориде (5 мл). При охлаждении на льду добавляли 3-хлорпербензойную кислоту (32 мг, 0,19 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, очищали хроматографией на силикагеле (метиленхлорид:метанол=100:1) с получением белого твердого вещества. Полученное белое твердое вещество промывали смесью диэтиловый эфир/метиленхлорид с получением указанного в заголовке соединения (52 мг, 76%) в виде белого порошка.
Точка плавления: 142-144°С.
ИК (ATR) ν: 3082, 2937, 1495, 1317, 1290, 1234, 1151, 1130, 1092, 831, 769, 754, 731, 712, 625, 544, 525, 503, 472, 449, 417 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,15-1,40 (1H, м), 1,32 (3H, д, J=6,6 Гц), 1,40-2,05 (3H, м), 2,65-3,10 (3H, м), 2,88 (3H, с), 4,46 (1H, д, J=7,1 Гц), 6,77 (1H, тд, J=9,1, 4,6 Гц), 6,90-7,00 (1H, м), 7,32 (2H, д, J=8,4 Гц), 7,35-7,50 (1H, м), 7,49 (2H, д, J=8,4 Гц).
МС (m/z): 451, 453 (м++H).
Элементный анализ для C19H21ClF2O4S2.
Вычислено: C 50,61%; H 4,69%; Cl 7,86%; F 8,43%; S 14,22%.
Найдено: C 50,48%; H 4,59%; Cl 7,93%; F 8,57%; S 14,09%.
Пример 48: 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)тетрагидропиран
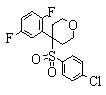
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (1,0 г, 3,30 ммоль), полученный в примере 5, растворяли в тетрагидрофуране (70 мл). При -78°С добавляли по каплям раствор в гексане (1,57 М, 5,3 мл, 8,3 ммоль) н-бутиллития. После завершения добавления по каплям реакционную смесь перемешивали при -78оС в течение 10 минут и затем перемешивали еще в течение 30 минут при охлаждении на льду. При -78°С к реакционной смеси добавляли по каплям 2-бромэтиловый эфир (0,55 мл, 3,9 ммоль). После завершения добавления по каплям температуру реакционной смеси повышали до комнатной температуры на протяжении 14 часов. К реакционной смеси добавляли воду (2 мл). Остаток, полученный концентрированием полученной смеси при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением белого твердого вещества. Полученное белое твердое вещество промывали смесью диизопропиловый эфир/метиленхлорид с получением указанного в заголовке соединения (317 мг, 26%) в виде белого порошка.
Точка плавления: 157-160°С.
ИК (ATR) ν: 2966, 2862, 1496, 1309, 1188, 1149, 1086, 1012, 899, 841, 808, 750, 710, 629, 592, 569, 536, 515, 471 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 2,40-2,80 (4H, м), 3,32 (2H, т, J=12,5 Гц), 4,02 (2H, д т, J=11,8,3,3 Гц), 6,82-6,95 (1H, м), 7,05-7,17 (2H, м), 7,38 (2H, с), 7,39 (2H, с).
МС (m/z): 373, 375 (м++H).
Элементный анализ для C17H15ClF2O3 S.
Вычислено: C 54,77%; H 4,06%; Cl 9,51%; F 10,19%; S 8,60%.
Найдено: C 54,55%; H 4,00%; Cl 9,69%; F 10,33%; S 8,64%.
Пример 49: 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)пентил-1-пирролидинкарбоксилат
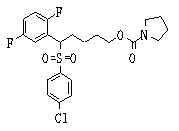
К раствору в метиленхлориде (6 мл) 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-1-пентанола (390 мг, 1,04 ммоль), полученного в примере 29, добавляли триэтиламин (152 мкл, 1,09 ммоль) и 4-нитрофенилхлорформиат (220 мг, 1,09 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь концентрировали с получением неочищенного 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)пентил-4-нитрофенилкарбоната (759 мг). Полученный неочищенный 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)пентил-4-нитрофенилкарбонат (268 мг) растворяли в метиленхлориде (4 мл) с последующим добавлением триэтиламина (76,7 мкл, 0,551 ммоль) и пирролидина (46,0 мкл, 0,551 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь концентрировали и остаток растворяли в диэтиловом эфире. Полученный раствор промывали последовательно насыщенным водным раствором бикарбоната калия, насыщенным водным раствором хлорида аммония, водой и насыщенным раствором соли, сушили над MgSO4 и затем концентрировали. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (40% этилацетат-гексан) с получением указанного в заголовке соединения (128 мг, 74%) в виде бледно-коричневого масла.
ИК (ATR) ν: 3086, 2954, 2875, 1689, 1583, 1496, 1423, 1321, 1176, 1147, 1084, 1012, 874, 752, 536, 467 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,26-1,38 (2H, м), 1,54-1,73 (2H, м), 1,78-1,90 (4H, м), 2,09-2,20 (1H, м), 2,42-2,52 (1H, м), 3,19-3,40 (4H, м), 3,96-4,05 (2H, м), 4,52 (1H, дд, J=11,5, 2,7 Гц), 6,83 (1H, тд, J=9,1, 4,4 Гц), 6,94-7,01 (1H, м), 7,21-7,28 (1H, м), 7,38 (2H, д, J=8, 6 Гц), 7,52 (2H, д, J=8,6 Гц).
МС (m/z) 472 (м++H).
HRMS (FAB) для C22H24ClF2NO4S (м++H).
Вычислено: 472,1161.
Найдено: 472,1124.
Ссылочный пример 3: 4-(метилсульфонил)-1-бутанол
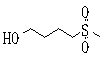
При перемешивании с охлаждением на льду 3-хлорпербензойную кислоту (3,04 г, 17,6 ммоль) добавляли к раствору в метиленхлориде (100 мл) 4-(метилтио)-1-бутанола (1,01 г, 8,40 ммоль). При комнатной температуре смесь перемешивали в течение 20 часов. После подтверждения завершения реакции растворитель концентрировали при пониженном давлении. К остатку добавляли диэтиловый эфир и воду для отделения водного слоя. Полученный водный слой концентрировали при пониженном давлении. К остатку добавляли метиленхлорид. Смесь сушили над безводным сульфатом натрия, и затем растворитель концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем. Из фракции, элюированной смесью метанол:метиленхлорид (=1:20), указанное в заголовке соединение (1,21 г, 95%) получали в виде бледно-желтого масла.
ИК (ATR) ν: 3494, 2931, 2877, 1457, 1413, 1282, 1122, 1054, 1029, 966, 827, 765, 518, 462 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,55-1,91 (3H, м), 1,91-2,11 (2H, м), 2,92 (3H, с), 3,09 (2H, т, J=7,9 Гц), 3,72 (2H, т, J=6,1 Гц).
МС (m/z): 153 (м++H).
Ссылочный пример 4: 4-(метилсульфинил)-1-бутанол
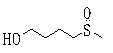
При перемешивании с охлаждением на льду периодат натрия (1,24 г, 5,80 ммоль) добавляли к смешанному раствору 4-(метилтио)-1-бутанола (465 мг, 3,87 ммоль) в тетрагидрофуране (15 мл) и воде (3 мл). При комнатной температуре полученную смесь перемешивали в течение 21,5 часов. После подтверждения завершения реакции реакционную смесь разбавляли метиленхлоридом и затем подвергали фильтрованию через целит. Фильтрат концентрировали при пониженном давлении. К остатку добавляли метиленхлорид. Полученную смесь сушили над безводным сульфатом натрия и затем растворитель концентрировали при пониженном давлении. Полученный таким образом остаток подвергали хроматографии на колонке с силикагелем, и из фракции, элюированной смесью метанол:метиленхлорид (=1:10), получали указанное в заголовке соединение (160 мг, 30%) в виде бледно-желтого масла.
ИК (ATR) ν: 3369, 2937, 2867, 1658, 1452, 1411, 1054, 1006, 941, 694 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,40-1,55 (1H, шир), 1,68-1,83 (2H, м), 1,93-2,08 (2H, м), 2,92 (3H, с), 3,09 (2H, т, J=7,9 Гц), 3,72 (2H, т, J=5,5 Гц).
МС (m/z): 137 (м++H).
Пример 50: 1-хлор-4-(бензилсульфонил)бензол
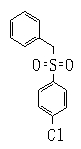
4-хлорбензолсульфинат натрия (306 мг, 1,54 ммоль) и бензилбромид (0,18 мл, 1,54 ммоль) добавляли к н-бутанолу (15 мл). Полученную смесь перемешивали при 70°С в течение 5 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат. Полученную смесь промывали последовательно водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем с получением из фракции, элюированной смесью гексан:этилацетат (=8:1), указанного в заголовке соединения (299 мг, 73%) в виде белого твердого вещества.
Точка плавления: 147,5-148, 5°С.
ИК (ATR) ν: 3060, 3029, 2994, 2942, 1583, 1571, 1492, 1475, 1454, 1396, 1311, 1294, 1274, 1147, 1087, 1014, 977, 917, 831, 773, 757, 696, 642, 532, 462 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,31 (2H, с), 7,23-7,38 (4H, м), 7,38-7,46 (2H, м), 7,49-7,58 (2H, м).
МС (m/z): 267 (м+ +H).
Пример 51: 1-хлор-4-(5-метилсульфонил-1-фенилпентил)сульфонилбензол
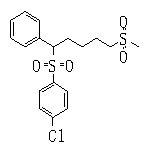
В атмосфере аргона раствор в толуоле (20 мл) 1-хлор-4-(бензилсульфонил)бензола (90 мг, 0,337 ммоль), 4-(метилсульфонил)-1-бутанола (69 мг, 0,453 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (233 мг, 0,965 ммоль) нагревали при кипячении с обратным холодильником в течение 21 часа. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем. Из фракции, элюированной смесью гексан:этилацетат (=2:1), получали указанное в заголовке соединение (44 мг, 33%) в виде белого твердого вещества.
Точка плавления: 151-152°С.
ИК (ATR) ν: 2937, 2867, 1577, 1467, 1396, 1319, 1270, 1203, 1147, 1087, 1058, 1014, 962, 842, 802, 755, 696, 632, 565, 530, 474, 420 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,34-1,52 (2H, м), 1,79-1,97 (2H, м), 2,13-2, 28 (2H, м), 2,45-2,58 (1H, м), 2,86 (3H, с), 2,89-3,00 (2H, м), 4,01 (1H, дд, J=11,2, 3,9 Гц), 7,08 (1H, д, J=8,1 Гц), 7,22-7,47 (8H, м).
МС (m/z): 401 (м++H).
Элементный анализ для C18H21ClO4S2.
Вычислено: C 53,92%; H 5,28%; Cl 8,84%; S 16,00%.
Найдено: C 53,92%; H 5,21%; Cl 9,05%; S 15,88%.
Пример 52: 1-хлор-4-(5-метилсульфинил-1-фенилпентил)сульфонилбензол
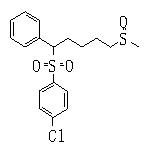
Раствор в толуоле (15 мл) 4-хлор-1-(бензилсульфонил)бензола (122 мг, 0,457 ммоль), полученного в примере 50, 4-(метилсульфинил)-1-бутанола (81 мг, 0,595 ммоль), полученного в ссылочном примере 4, и цианометилентри-н-бутилфосфорана (221 мг, 0,916 ммоль) нагревали при кипячении с обратным холодильником в течение 2 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем с получением из фракции, элюированной смесью метиленхлорид:метанол (=100:1), белого твердого вещества. Полученное белое твердое вещество перекристаллизовывали из диэтилового эфира с получением указанного в заголовке соединения (20 мг, 11%) в виде белых игольчатых кристаллов.
Точка плавления: 98,5-99,5°С.
ИК (ATR) ν: 2935, 2856, 1575, 1473, 1455, 1392, 1309, 1276, 1143, 1081, 1016, 946, 829, 794, 755, 694, 624, 563, 520, 464 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,32-1,50 (2H, м), 1,70-1,90 (2H, м), 2,15-2,28 (1H, м), 2,45-2,70 (2H, м), 2,52 (3H, с), 4,02 (1H, дд, J=11,4, 3,8 Гц), 7,05-7,12 (1H, м), 7,20-7,47 (8H, м).
МС (m/z): 385 (м++H).
Элементный анализ для C18H21ClO3S2.
Вычислено: C 56,16%; H 5,50%; Cl 9,21%; S 16,66%.
Найдено: C 56,03%; H 5,37%; Cl 9,29%; S 16,69%.
Пример 53: 1-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]-2-фторбензол
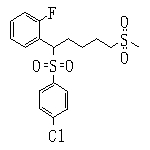
К 4-хлорбензолсульфинату натрия (203 мг, 1,02 ммоль) и 2-фторбензилбромиду (124 мкл, 1,02 ммоль) добавляли н-бутанол (5 мл). Полученную смесь перемешивали при 70°С в течение 5 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли метиленхлорид, и из полученной смеси отфильтровывали нерастворимое вещество. Фильтрат концентрировали при пониженном давлении. Остаток промывали диизопропиловым эфиром с получением белого порошка (111 мг).
Раствор в толуоле (10 мл) полученного белого порошка (35 мг), 4-(метилсульфонил)-1-бутанола (38 мг, 0,250 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (60 мг, 0,246 ммоль) нагревали при кипячении с обратным холодильником в течение 17,5 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем. Из фракции, элюированной смесью гексан:этилацетат (=1:1), получали указанное в заголовке соединение в виде белого твердого вещества (46 мг).
Точка плавления: 167-168°С.
ИК (ATR) ν: 2948, 2867, 1614, 1579, 1488, 1455, 1396, 1319, 1290, 1268, 1230, 1199, 1149, 1126, 1085, 1014, 962, 829, 792, 767, 752, 713, 628, 572, 532, 495, 458, 430 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,38-1,52 (2H, м), 1,80-1,98 (2H, м), 2,16-2,29 (1H, м), 2,48-2,60 (1H, м), 2,87 (3H, с), 2,96 (2H, т, J=7,9 Гц), 4,55 (1H, дд, J=11,0, 4,2 Гц), 6,85 (1H, тд, J=9,1, 1,1 Гц), 7,17-7,39 (4H, м), 7,43-7,58 (3H, м).
МС (m/z): 419 (м++H).
Элементный анализ для C18H20ClFO4S2.
Вычислено: C 51,61%; H 4,81%; Cl 8,46%; F 4,53%; S 15,31%.
Найдено: C 51,65%; H 4,74%; Cl 8,33%; F 4,50%; S 15,20%.
Пример 54: 1-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]-3-фторбензол
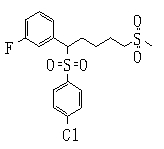
4-хлорбензолсульфинат натрия (216 мг, 1,09 ммоль) и 3-фторбензилбромид (136 мкл, 1,09 ммоль) добавляли к н-бутанолу (5 мл). Полученную смесь перемешивали при 70°С в течение 5 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли метиленхлорид, и из полученной смеси отфильтровывали нерастворимое вещество. Фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток промывали диизопропиловым эфиром с получением белого порошка (208 мг).
Затем раствор в толуоле (10 мл) полученного белого порошка (59 мг), 4-(метилсульфонил)-1-бутанола (65 мг, 0,427 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (100 мг, 0,414 ммоль) нагревали при кипячении с обратным холодильником в течение 29,5 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем с получением из фракции, элюированной смесью гексан:этилацетат (=2:3), указанного в заголовке соединения в виде белого твердого вещества (71 мг).
Точка плавления: 116-117°С.
ИК (ATR) ν: 2942, 2875, 1590, 1469, 1394, 1317, 1295, 1270, 1241, 1201, 1145, 1083, 1012, 964, 875, 840, 798, 769, 752, 705, 686, 634, 592, 541, 530, 512, 491, 464 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,34-1,52 (2H, м), 1,78-1,99 (2H, м), 2,09-2,22 (1H, м), 2,41-2,56 (1H, м), 2,81-3,03 (2H, м), 2,88 (3H, с), 4,01 (1H, дд, J=11,2, 3,9 Гц), 6,83 (1H, д, J=7,6 Гц), 6,90 (1H, д, J=9,3 Гц), 7,03 (1H, тд, J=8,1, 2,2 Гц), 7, 23 (1H, тд, J=7,9, 6,0 Гц), 7,32-7,50 (4H, м).
МС (m/z): 419 (м++H).
Элементный анализ для C18H20ClFO4S2.
Вычислено: C 51,61%; H 4,81%; Cl 8,31%; F 4,53%; S 15,31%.
Найдено: C 51,68%; H 4,72%; Cl 8,31%; F 4,52%; S 15,30%.
Пример 55: 1-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]-4-фторбензол
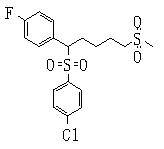
4-хлорбензолсульфинат натрия (183 мг, 0,921 ммоль) и 4-фторбензилбромид (112 мкл, 0,921 ммоль) добавляли к н-бутанолу (5 мл). Полученную смесь перемешивали при 70°С в течение 6 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат, и из полученной смеси отфильтровывали нерастворимое вещество. Фильтрат концентрировали при пониженном давлении. Остаток промывали диизопропиловым эфиром с получением белого порошка (150 мг).
Затем раствор в толуоле (10 мл) полученного белого порошка (57 мг), 4-(метилсульфонил)-1-бутанола (62 мг, 0,407 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (97 мг, 0,400 ммоль) нагревали при кипячении с обратным холодильником в течение 17 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем с получением из фракции, элюированной смесью гексан:этилацетат (=2:3), указанного в заголовке соединения в виде белого твердого вещества (58 мг).
Точка плавления: 141-142°С.
ИК (ATR) ν: 2937, 2865, 1606, 1577, 1508, 1467, 1394, 1317, 1292, 1270, 1236, 1147, 1126, 1085, 1014, 962, 838, 825, 755, 721, 626, 574, 553, 514, 482, 455 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,35-1,50 (2H, м), 1,80-1,97 (2H, м), 2,09-2,21 (1H, м), 2,43-2,56 (1H, м), 2,88 (3H, с), 2,90-3,00 (2H, м), 4, 01 (1H, дд, J=11,2, 3,9 Гц), 6,97 (2H, т, J=8,5 Гц), 7,03-7,11 (2H, м), 7,36-7,48 (4H, м).
МС (m/z): 419 (м++H).
Элементный анализ для C18H20ClFO4S2.
Вычислено: C 51,61%; H 4,74%; Cl 8,46%; F 4,53%; S 15,31%.
Найдено: C 51,74%; H 4,74%; Cl 8,28%; F 4,53%; S 15,36%.
Пример 56: 2-[1-[(4-хлорфенил)сульфонил]-1-метилтио]метил-1,4-дифторбензол
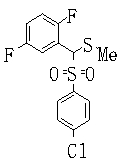
В атмосфере азота 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (82,8 мг, 0,27 ммоль), полученный в примере 5, добавляли к суспензии гидрида натрия (12 мг, 0,30 ммоль) в N, N-диметилформамиде (2,0 мл) при комнатной температуре. Полученную смесь перемешивали в течение 10 минут. К реакционной смеси добавляли метилметантиосульфонат (28,1 мг, 0,27 ммоль), и смесь перемешивали еще в течение 30 минут. В реакционную смесь добавляли насыщенный водный раствор бикарбоната натрия (10 мл) с последующей экстракцией диэтиловым эфиром. Органический слой промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. После фильтрования остаток, полученный концентрированием фильтрата при пониженном давлении, очищали хроматографией на силикагеле (гексан:диэтиловый эфир=4:1) с получением указанного в заголовке соединения (36 мг, 38%) в виде белого твердого вещества.
Точка плавления: 128-129°С.
ИК (ATR) ν: 1489, 1315, 1234, 1147, 1078, 829 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 2,47 (3H, с), 5,22 (1H, с), 6,88 (1H, м), 6,97 (1H, м), 7,13 (1H, м), 7,41 (2H, м), 7,60 (2H, м).
МС (m/z): 173 (м+-SO2Ar).
Элементный анализ для C14H11ClF2O2S2.
Вычислено: C 48,21%; H 3,18%; S 18,39%; Cl 10,16%; F 10,89%.
Найдено: C 48,41%; H 3,28%; S 17,88%; Cl 10,41%; F 10,57%.
Пример 57: 2-[1-[(4-хлорфенил)сульфонил]-1-фенилтио]метил-1,4-дифторбензол
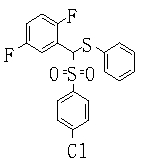
Подобно методике, используемой в примере 56, за исключением применения фенилфенилтиосульфоната, синтезировали указанное в заголовке соединение.
Точка плавления: 84-85°С.
ИК (ATR) ν: 1492, 1319, 1149, 1086, 825 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 5,53 (1H, с), 6,91 (1H, м), 7,01 (1H, м), 7,23-7,31 (4H, м), 7,35-7,40 (4H, м), 7,65 (2H, м), 7,65 (2H, м), 7,40-7,35 (4H, м), 7,31-7,23 (4H, м), 7,01 (1H, м), 6,91 (1H, м), 5,53 (1H, с).
МС (m/z): 235 (M+-SO2 Ar).
Элементный анализ для C19H13ClF2O2S2.
Вычислено: C 55,54%; H 3,19%; S 15,61%; Cl 8,63%; F 9,25%.
Найдено: C 55,50%; H 3,18%; S 15,51%; Cl 8,40%; F 9,03%.
Пример 58: Бензил[(4-хлорфенил)сульфонил-(2,5-дифторфенил)метил]карбамат
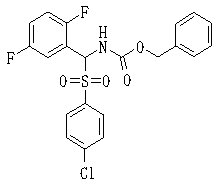
К раствору в тетрагидрофуране (0,4 мл) бензилкарбамата (151 мг, 1,0 ммоль) добавляли воду (1,0 мл), хлорбензолсульфинат натрия (199 мг, 1,0 ммоль), 2,5-дифторбензальдегид (142 мг, 1,0 ммоль) и муравьиную кислоту (0,24 мл). Полученную смесь перемешивали в течение 19 часов при комнатной температуре. К реакционной смеси, имеющей образовавшийся в ней белый осадок, добавляли диэтиловый эфир и воду. Осадок собирали фильтрованием и промывали последовательно диэтиловым эфиром с получением указанного в заголовке соединения (251 мг, 51%).
Точка плавления: 183-184°С.
ИК (ATR) ν: 1726, 1518, 1495, 1319, 1230, 1147, 831 см-1.
1H-ЯМР (400 МГц, ДМСО-d6) δ: 4,91 (1H, д, J=12,4 Гц), 4,97 (1H, д, J=12,4 Гц), 6,25 (1H, д, J=10,4 Гц), 7,2-7,45 (7H, м), 7,70 (2H, д, J=8,4 Гц), 7,71 (1H, м), 7,78 (2H, д, J=8,4 Гц), 9,33 (1H, д, J=10,4 Гц).
МС (m/z): 275 (м+-SO2Ar).
Ссылочный пример 5: Бензил-2,5-дифторфенилакрилат
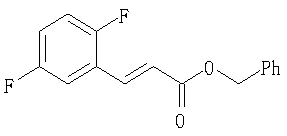
В атмосфере азота дициклогексилкарбодиимид (206 мг, 1,0 ммоль) добавляли к раствору в метиленхлориде (10 мл) 2,5-дифторфенилакриловой кислоты (184 мг, 1 ммоль), бензилового спирта (104 мл, 1 ммоль) и N,N-диметиламинопиридина (36 мг, 0,3 ммоль) при комнатной температуре и полученную смесь перемешивали в течение 17 часов. После концентрирования реакционной смеси при пониженном давлении к остатку добавляли 10 мл смеси гексан-диэтиловый эфир (4:1). Полученный таким образом остаток фильтровали. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (242 мг, 88%).
Точка плавления: 45-46°С.
ИК (ATR) ν: 1712, 1641, 1305, 1167, 692 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 5,24 (c, 2H), 6,54 (д, 1H, J=16,4 Гц), 7,03 (м, 2H), 7,18 (м, 1H), 7,37 (м, 5H), 7,77 (д, 1H, J=16,4 Гц).
Пример 59: Бензил-3-(4-хлорфенилсульфонил)-3-(2,5-дифторфенил)пропионат
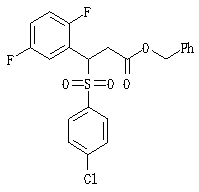
В атмосфере азота раствор в гексане (1,57 М, 0,05 мл) н-бутиллития добавляли к раствору в тетрагидрофуране (10 мл) бензил-2, 5-дифторфенилакрилата (108 мг, 0,39 ммоль) и 4-хлорбензолтиола (57 мг, 0,39 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 1 часа. После концентрирования реакционной смеси при пониженном давлении остаток подвергали хроматографии на силикагеле. Фракцию, элюированную смесью гексан:диэтиловый эфир (=10:1), концентрировали при пониженном давлении.
Затем остаток растворяли в метаноле (10 мл). К полученному раствору добавляли воду (1,0 мл), тетрагидрат гексааммонийгептамолибдата (5,0 мг) и 30% водный пероксид водорода (2 мл) при комнатной температуре с последующим перемешиванием в течение 48 часов. Реакционную смесь разбавляли этилацетатом (50 мл) и затем промывали в достаточном количестве водой и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния и перегоняли при пониженном давлении для удаления растворителя. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=8:1) с получением указанного в заголовке соединения (33 мг, 19%).
Точка плавления: 127-128°С.
ИК (ATR) ν: 1734, 1498, 1317, 1211, 1170, 1149, 748 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 3,12 (дд, 1H, J=10,4, 16,8 Гц), 3,48 (дд, 1H, J=4,4, 16,8 Гц), 4,98 (д, 1H, J=12,0 Гц), 5,02 (м, 1H), 5,03 (д, 1H, J=12,0 Гц), 6,79 (м, 1H), 6,81 (м, 1H), 7,1-7,2 (м, 3H), 7,23 (м, 3H), 7,38 (д, 2H, J=8,4 Гц), 7,52 (д, 2H, J=8,4 Гц).
Элементный анализ для C22H17ClF2 O4S·0,5H2O.
Вычислено: C 57,46%; H 3,91%; S 6,97%; Cl 7,70%; F 8,26%.
Найдено C 57,60%; H 3,89%; S 7,02%; Cl 7,83%; F 8,31%.
МС (m/z): 450 (м+).
HRMS (EI): в виде C22H17ClF2O4S (M+).
Вычислено: 450,0504.
Найдено: 450,0496.
Пример 60: 2-[1-[(4-хлорфенил)сульфонил]-2-пентилциклопропил]-1,4-дифторбензол
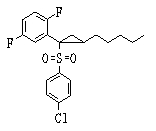
В атмосфере азота триэтиламин (36,4 мкл, 0,262 ммоль) и метансульфонилхлорид (18,6 мкл, 0,240 ммоль) добавляли к раствору в метиленхлориде (4 мл) смеси изомеров (91,0 мг, 0,218 ммоль) 1-[(4-хлорфенил)сульфонил]-1-(2,5-дифторфенил)-3-октанола, полученной в примере 22, при 0оС. Полученную смесь перемешивали при 0°С в течение 2 часов. Реакционную смесь разбавляли метиленхлоридом, промывали водой и насыщенным раствором соли, сушили над MgSO4 и затем концентрировали. Полученный таким образом остаток подвергали хроматографии на короткой колонке силикагеля. Фракцию, элюированную смесью гексан:этилацетат (=3:1), концентрировали при пониженном давлении с получением бесцветного масла.
Полученное бесцветное масло растворяли в тетрагидрофуране (4 мл). В атмосфере аргона и при -78°С к полученному раствору добавляли н-бутиллитий (1,57 М раствор, 0,127 мл, 0,200 ммоль) с последующим перемешиванием при -78°С в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией диэтиловым эфиром. Экстракты объединяли, промывали последовательно водой и насыщенным раствором соли, сушили над MgSO4 и затем концентрировали. Полученный таким образом остаток очищали хроматографией среднего давления на колонке с силикагелем (8% этилацетат-гексан) с получением указанного в заголовке соединения (48,1 мг, 66%) в виде бесцветного масла.
ИК (ATR) ν: 2929, 2925, 2858, 1585, 1496, 1317, 1250, 1176, 1146, 1090, 1014, 889, 827, 796, 760, 715, 602, 565, 478 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,43-0,62 (1H, м), 0,83-0,95 (3H, м), 1,13-1,70 (7,66H, м), 1,82-1,93 (0,33H, м), 1,99 (0,33H, дд, J=9,8, 5,4 Гц), 2,07 (0,66H, дд, J=9,8, 5,9 Гц), 2,26-2,40 (1H, м), 6,74-6,84 (1H, м), 6,91 (0,33H, тд, J=9,0, 4,4 Гц), 6,98-7,05 (1H, м), 7,13 (0,66H, дд д, J=8,6, 5,6, 3,2 Гц), 7,35-7,50 (4H, м).
МС (m/z) 399 (M++H).
HRMS (FAB) для C20H22ClF2O2 S (M++H).
Вычислено: 399,0997.
Найдено: 399,1006.
Пример 61: Трет-бутил-3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропионат
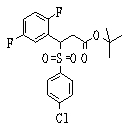
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 7,01 мл) добавляли по каплям к раствору в диметоксиэтане (50 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (3,03 г, 10,0 ммоль), полученного в примере 5. Температуру реакционной смеси повышали до комнатной температуры. Затем реакционную смесь охлаждали до -78°С. После добавления трет-бутилбромацетата (1,48 мл, 10,0 ммоль) полученную смесь перемешивали при комнатной температуре в течение 3 часов. В реакционную смесь добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией диэтиловым эфиром. Экстракты объединяли, промывали последовательно водой и насыщенным раствором соли, сушили над MgSO4 и затем перегоняли для удаления растворителя. Полученный таким образом остаток подвергали хроматографии на короткой колонке силикагеля (гексан-этилацетат 3:1). Полученное таким образом твердое вещество перекристаллизовывали из гексана с получением указанного в заголовке соединения (3,30 г, 79%) в виде бесцветного твердого вещества.
Точка плавления: 140,5-142,5°С.
ИК (ATR) ν: 3074, 2983, 1722, 1585, 1496, 1427, 1396, 1369, 1275, 1257, 1215, 1142, 1086, 955, 835, 781, 750, 712, 665, 606, 559, 467 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,28 (9H, с), 3,00 (1H, дд, J=16,4, 10,7 Гц), 3,37 (1H, дд, J=16,4, 4,4 Гц), 5,00 (1H, дд, J=10,7, 4,4 Гц), 6, 85 (1H, тд, J=9,0, 4,6 Гц), 6,96-7,03 (1H, м), 7,19 (1H, ддд, J=8,8, 5,6, 3,2 Гц), 7,41 (2H, д, J=8,3 Гц), 7,50 (2H, д, J=8,3 Гц).
МС (m/z): 417 (M++H).
HRMS (FAB) для C19H19ClF2O4S (M++H).
Вычислено: 416,0661.
Найдено: 416,0690.
Элементный анализ для C19H19ClF2O4S.
Вычислено: C 54,74%; H 4,59%; Cl 8,50%; F 9,11%; S 7,69%.
Найдено: C 54,67%; H 4,55%; Cl 8,54%; F 9,17%; S 7,80%.
Пример 62: 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропионовая кислота
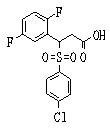
При 0°С трифторуксусную кислоту (10 мл) добавляли к раствору в метиленхлориде (30 мл) трет-бутил-3-[(4-хлорфенил)сульфонил]-3-(2, 5-дифторфенил)пропионата (3,10 г, 7,43 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. К остатку, полученному концентрированием реакционной смеси, добавляли толуол и полученную смесь концентрировали. Полученный таким образом остаток перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (2,29 г, 85%) в виде бесцветных игольчатых кристаллов.
Точка плавления: 152,0-153,0°С.
ИК (ATR) ν: 2956, 1707, 1576, 1496, 1427, 1396, 1321, 1255, 1217, 1115, 1086, 1012, 914, 893, 829, 795, 756, 708, 619, 536, 459 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 3,13 (1H, дд, J=17,1, 10,4 Гц), 3,53 (1H, дд, J=17,1, 4,6 Гц), 5,02 (1H, дд, J=10,4, 4,6 Гц), 6,85 (1H, тд, J=9,0, 4,6 Гц), 6,96-7,03 (1H, м), 7,18 (1H, ддд, J=8,5, 5,4, 3,2 Гц), 7,41 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц).
МС (m/z): 360 (M+).
HRMS (EI): в виде C15H11ClF2O4S (М+).
Вычислено: 360,0035.
Найдено: 360,0026.
Элементный анализ для C15H11ClF2O4S.
Вычислено: C 49,94%; H 3,07%; Cl 9,83%; F 10,53%; S 8,89%.
Найдено: C 49,74%; H 2,99%; Cl 9,88%; F 10,63%; S 8,98%.
Пример 63: 1-хлор-2-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]бензол
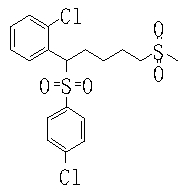
4-хлорбензолсульфинат натрия (205 мг, 1,03 ммоль) и 2-хлорбензилбромид (134 мкл, 1,03 ммоль) добавляли к диметоксиэтану (5 мл). Полученную смесь перемешивали при 70°С в течение 6 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат и из полученной смеси отфильтровывали нерастворимое вещество. Фильтрат концентрировали при пониженном давлении. Остаток промывали гексаном с получением белого порошка (231 мг).
Раствор в толуоле (10 мл) полученного белого порошка (92 мг), 4-(метилсульфонил)-1-бутанола (96 мг, 0,631 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (148 мг, 0,614 ммоль) нагревали при кипячении с обратным холодильником в течение 20 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем с получением из фракции, элюированной смесью гексан:этилацетат (=1:1), указанного в заголовке соединения (74 мг) в виде бесцветного масла.
ИК (ATR) ν: 2931, 2873, 1573, 1475, 1442, 1394, 1313, 1276, 1133, 1083, 1033, 1012, 962, 908, 829, 794, 748, 713, 684, 626, 568, 518, 464 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,33-1,52 (2H, м), 1,79-1,98 (2H, м), 2,15-2,30 (1H, м), 2,50-2,60 (1H, м), 2,86 (3H, с), 2,94 (2H, т, J=7,9 Гц), 4,86 (1H, дд, J=11, 0, 3,9 Гц), 7,17-7,29 (3H, м), 7,29-7,38 (2H, м), 7,41-7,50 (2H, м), 7,67 (1H, д, J=7,8 Гц).
МС (m/z): 435 (M++H).
HRMS (FAB) для C18H21O4Cl2S2(M++H).
Вычислено: 435,0258.
Найдено: 435,0264.
Пример 64: 1-хлор-3-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]бензол
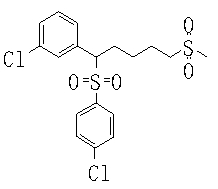
4-хлорбензолсульфинат натрия (219 мг, 1,10 ммоль) и 3-хлорбензилбромид (142 мкл, 1,03 ммоль) добавляли к диметоксиэтану (5 мл). Полученную смесь перемешивали при 70°С в течение 6 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат и из полученной смеси отфильтровывали нерастворимое вещество. Остаток, полученный концентрированием фильтрата при пониженном давлении, промывали гексаном с получением белого порошка (304 мг).
Раствор в толуоле (10 мл) полученного белого порошка (92 мг), 4-(метилсульфонил)-1-бутанола (96 мг, 0,631 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (148 мг, 0,614 ммоль) нагревали при кипячении с обратным холодильником в течение 20 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем с получением из фракции, элюированной смесью гексан:этилацетат (=2:3), указанного в заголовке соединения (51 мг) в виде бесцветного масла.
ИК (ATR) ν: 3089, 3023, 1573, 1475, 1394, 1278, 1195, 1139, 1081, 1012, 962, 885, 829, 804, 750, 694, 626, 578, 530, 462 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,32-1,50 (2H, м), 1,79-1,97 (2H, м), 2,09-2,22 (1H, м), 2,40-2,52 (1H, м), 2,88 (3H, с), 2,90-3,00 (2H, м), 3,98 (1H, дд, J=11,2, 3,9 Гц), 6,96 (1H, д, J=7,6 Гц), 7,10 (1H, с), 7,20 (1H, т, J=7,6 Гц), 7,28-7,32 (1H, м), 7,35-7,47 (4H, м).
МС (m/z): 435 (M++H).
HRMS (FAB): в виде C18H21O4Cl2S2(M+ +H).
Вычислено: 435,0258.
Найдено: 435,0240.
Пример 65: 1-хлор-4-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]бензол
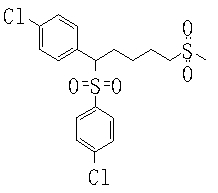
4-хлорбензолсульфинат натрия (211 мг, 1,06 ммоль) и 4-хлорбензилбромид (218 мкл, 1,06 ммоль) добавляли к диметоксиэтану (5 мл). Полученную смесь перемешивали при 70°С в течение 6 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат и из полученной смеси отфильтровывали нерастворимое вещество. Остаток, полученный концентрированием фильтрата при пониженном давлении, промывали гексаном с получением белого порошка (274 мг).
Затем раствор в толуоле (10 мл) полученного белого порошка (61 мг), 4-(метилсульфонил)-1-бутанола (63 мг, 0,414 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (97 мг, 0,403 ммоль) нагревали при кипячении с обратным холодильником в течение 20 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем с получением из фракции, элюированной смесью гексан:этилацетат (=2:3), указанного в заголовке соединения (37 мг) в виде бесцветного масла.
ИК (ATR) ν: 2931, 2871, 1581, 1492, 1475, 1411, 1394, 1276, 1139, 1085, 1012, 962, 908, 827, 752, 713, 661, 620, 566, 518, 470 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,35-1,51 (2H, м), 1,75-1,98 (2H, м), 2,05-2,25 (1H, м), 2,42-2,55 (1H, м), 2,84-3,10 (2H, м), 2,87 (3H, с), 3,99 (1H, дд, J=11,0, 3,9 Гц), 6,99-7,10 (2H, м), 7,20-7,35 (2H, м), 7,35-7,55 (4H, м).
МС (m/z): 435 (M++H).
HRMS (FAB) для C18H21O4Cl2S2(M++H).
Вычислено: 435,0258.
Найдено: 435,0240.
Пример 66: 1-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]нафталин
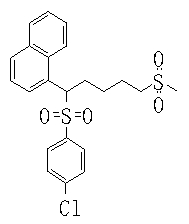
4-хлорбензолсульфинат натрия (183 мг, 0,921 ммоль) и 1-бромметилнафталин (204 мкл, 0,921 ммоль) добавляли к диметоксиэтану (10 мл). Полученную смесь перемешивали при 70°С в течение 6 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат и из полученной смеси отфильтровывали нерастворимое вещество. Остаток, полученный концентрированием фильтрата при пониженном давлении, промывали гексаном с получением белого порошка (175 мг).
Затем раствор в толуоле (10 мл) полученного белого порошка (93 мг), 4-(метилсульфонил)-1-бутанола (92 мг, 0,604 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (142 мг, 0,589 ммоль) нагревали при кипячении с обратным холодильником в течение 18 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем с получением из фракции, элюированной смесью гексан:этилацетат (=1:1), указанного в заголовке соединения (80 мг) в виде белого твердого вещества.
ИК (ATR) ν: 2929, 2869, 1577, 1511, 1475, 1394, 1301, 1276, 1137, 1083, 1012, 962, 906, 863, 808, 763, 709, 640, 622, 574, 532, 457 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,35-1,55 (2H, м), 1,77-1,95 (2H, м), 2,29-2,46 (1H, м), 2,62-2,77 (1H, м), 2,80 (3H, с), 2,83-3,00 (2H, м), 5,07 (1H, дд, J=10,9, 4,0 Гц), 7,10 (2H, д, J=8,3 Гц), 7,22-7,48 (4H, м), 7,51 (1H, т, J=7,7 Гц), 7,59 (1H, д, J=8,6 Гц), 7,67 (1H, д, J=7,3 Гц), 7,78 (1H, д, J=8,1 Гц), 7,83 (1H, д, J=8,3 Гц).
МС (m/z): 451 (M++H).
HRMS (FAB) для C22H24O4ClS2(M++H).
Вычислено: 451,0805.
Найдено: 451,0816.
Пример 67: 2-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]нафталин
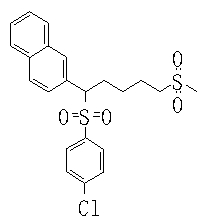
4-хлорбензолсульфинат натрия (211 мг, 1,06 ммоль) и 2-бромметилнафталин (235 мкл, 1,06 ммоль) добавляли к диметоксиэтану (5 мл). Полученную смесь перемешивали при 70оС в течение 5 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат и из полученной смеси отфильтровывали нерастворимое вещество. Остаток, полученный концентрированием фильтрата при пониженном давлении, промывали гексаном с получением белого порошка (90 мг).
Затем раствор в толуоле (10 мл) полученного белого порошка (60 мг), 4-(метилсульфонил)-1-бутанола (59 мг, 0,388 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (91 мг, 0,379 ммоль) нагревали при кипячении с обратным холодильником в течение 21 часа в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем с получением из фракции, элюированной смесью гексан:этилацетат (=2:3), указанного в заголовке соединения (62 мг) в виде белого твердого вещества.
Точка плавления: 146, 0-147,0°С.
ИК (ATR) ν: 2931, 2861, 1581, 1508, 1473, 1457, 1392, 1359, 1309, 1274, 1191, 1147, 1126, 1081, 1010, 968, 902, 869, 819, 752, 734, 703, 646, 624, 566, 522, 472, 453 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,34-1,51 (2H, м), 1,78-1,99 (2H, м), 2,25-2,40 (1H, м), 2,50-2,62 (1H, м), 2,84 (3H, с), 2,89-3,03 (2H, м), 4,19 (1H, дд, J=11,2, 3,9 Гц), 7,18-7,36 (4H, м), 7,39-7,61 (4H, м), 7,69-7,90 (3H, м).
МС (m/z): 451 (M++H).
Элементный анализ для C22 H23ClO4S2.
Вычислено: C 58,59%; H 5,14%; Cl 7,86%; S 14,22%.
Найдено: C 58,46%; H 5,03%; Cl 7,94%; S 14,33%.
Пример 68: 2-хлор-1-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]-4-фторбензол
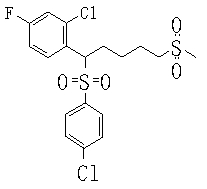
4-хлорбензолсульфинат натрия (197 мг, 0,992 ммоль) и 2-хлор-4-фторбензилбромид (222 мкл, 0,992 ммоль) добавляли к диметоксиэтану (5 мл). Полученную смесь перемешивали при 70°С в течение 6 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат, и из полученной смеси отфильтровывали нерастворимое вещество. Остаток, полученный концентрированием фильтрата при пониженном давлении, промывали гексаном с получением белого порошка (225 мг).
Затем раствор в толуоле (10 мл) полученного белого порошка (61 мг), 4-(метилсульфонил)-1-бутанола (59 мг, 0,394 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (93 мг, 0,384 ммоль) нагревали при кипячении с обратным холодильником в течение 15 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем с получением из фракции, элюированной смесью гексан:этилацетат (=1:1), указанного в заголовке соединения (38 мг) в виде белого твердого вещества.
Точка плавления: 124,0-125,0°С.
ИК (ATR) ν: 2969, 2933, 1604, 1575, 1492, 1475, 1461, 1396, 1315, 1276, 1230, 1130, 1085, 1049, 1014, 973, 902, 850, 823, 782, 748, 659, 630, 588, 549, 501, 457 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,30-1,50 (2H, м), 1,79-1,98 (2H, м), 2,10-2,25 (1H, м), 2,48-2,60 (1H, м), 2,87 (3H, с), 2,95 (2H, т, J=7,7 Гц), 4,79 (1H, дд, J=11,1, 4,0 Гц), 6,98 (1H, дд, J=8,3, 2,7 Гц), 7,05-7,15 (1H, м), 7,38 (2H, д, J=8,3 Гц), 7,48 (2H, д, J=8,5 Гц), 7,60-7,70 (1H, м).
МС (m/z): 453 (M++H).
Элементный анализ для C18H19Cl2FO4S2.
Вычислено: C 47,69%; H 4,22%; Cl 15,64%; F 4,19%; S 14,55%.
Найдено: C 47,44%; H 4,20%; Cl 15,37%; F 4,07%; S 14,33%.
Пример 69: 1, 2-дихлор-4-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]бензол
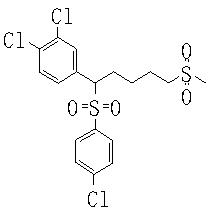
4-хлорбензолсульфинат натрия (208 мг, 1,05 ммоль) и 3,4-дихлорбензилбромид (251 мкл, 1,05 ммоль) добавляли к диметоксиэтану (5 мл). Полученную смесь перемешивали при 70°С в течение 6 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат и из полученной смеси отфильтровывали нерастворимое вещество. Остаток, полученный концентрированием фильтрата при пониженном давлении, промывали гексаном с получением белого порошка (270 мг).
Затем раствор в толуоле (10 мл) полученного белого порошка (66 мг), 4-(метилсульфонил)-1-бутанола (62 мг, 0,407 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (96 мг, 0,397 ммоль) нагревали при кипячении с обратным холодильником в течение 15 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем. Из фракции, элюированной смесью гексан:этилацетат (=2:3), получали указанное в заголовке соединение (70 мг) в виде белого твердого вещества.
Точка плавления: 143,0-144, 0°С.
ИК (ATR) ν: 2929, 2865, 1573, 1459, 1392, 1365, 1317, 1299, 1276, 1186, 1145, 1079, 1031, 1010, 975, 900, 823, 748, 709, 655, 626, 588, 563, 518, 474, 439 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,32-1,49 (2H, м), 1,79-1,96 (2H, м), 2,05-2,19 (1H, м), 2,39-2,50 (1H, м), 2,88 (3H, с), 2,90-3,00 (2H, м), 3,97 (1H, дд, J=11,2, 3,9 Гц), 6,94 (1H, дд, J=8,3, 2,2 Гц), 7,21 (1H, д, J=2,0 Гц), 7,36 (1H, д, J=8,3 Гц), 7,43 (2H, д, J=8,3 Гц), 7,49 (2H, д, J=8,6 Гц).
МС (m/z): 469 (M++H).
Элементный анализ для C18H19Cl3O4S2.
Вычислено: C 46,02%; H 4,08%; Cl 22,64%; S 13,65%.
Найдено: C 45,92%; H 4,06%; Cl 22,35%; S 13,59%.
Пример 70: 2-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]пиридин
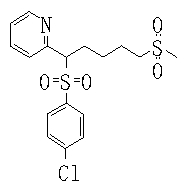
4-хлорбензолсульфинат натрия (200 мг, 1,01 ммоль), гидрохлорид 2-хлорметилпиридина (166 мг, 1,01 ммоль) и ацетат калия (198 мг, 2,02 ммоль) добавляли к н-бутанолу (5 мл). Полученную смесь перемешивали при 70°С в течение 5 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат и из полученной смеси отфильтровывали нерастворимое вещество. Фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем. Из фракции, элюированной смесью гексан:этилацетат (=3:1), получали белое твердое вещество (123 мг).
Затем раствор в толуоле (10 мл) полученного твердого вещества (49 мг), 4-(метилсульфонил)-1-бутанола (57 мг, 0,374 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (88 мг, 0,366 ммоль) нагревали при кипячении с обратным холодильником в течение 2 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем. Из фракции, элюированной смесью метанол:метиленхлорид (=1:50), получали указанное в заголовке соединение (40 мг) в виде белого твердого вещества.
Точка плавления: 140, 0-141,0°С.
ИК (ATR) ν: 3012, 2948, 1587, 1471, 1436, 1392, 1321, 1290, 1263, 1197, 1149, 1089, 1006, 960, 825, 750, 703, 624, 565, 528, 499, 474, 410 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,30-1,52 (2H, м), 1,79-1,99 (2H, м), 2,29-2,49 (2H, м), 2,86 (3H, с), 2,93 (2H, т, J=6,8 Гц), 4,33 (1H, дд, J=11,0, 4,2 Гц), 7, 20-7,30 (1H, м), 7,32-7,52 (5H, м), 7,67-7,78 (1H, м), 8,40 (1H, д, J=4,9 Гц).
МС (m/z): 402 (M++H).
Элементный анализ для C17H20 NClO4S2.
Вычислено: C 50,80%; H 5,02%; N 3,48%; Cl 8,82%; S 15,96%.
Найдено: C 50,67%; H 4,94%; N 3,53%; Cl 8,72%; S 15,90%.
Пример 71: 1,4-дихлор-2-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]бензол
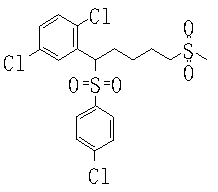
4-хлорбензолсульфинат натрия (38 мг, 0,192 ммоль) и 2,5-дихлорбензилбромид (46 мкл, 0,192 ммоль) добавляли к диметоксиэтану (5 мл). Полученную смесь перемешивали при 70°С в течение 24 часов. После охлаждения до комнатной температуры реакционную смесь подвергали хроматографии на короткой колонке (силикагеля) и фракцию, элюированную диэтиловым эфиром, концентрировали при пониженном давлении. Полученный таким образом остаток растворяли в толуоле (5 мл). К полученному раствору добавляли 4-(метилсульфонил)-1-бутанол (58 мг, 0,381 ммоль), полученный в ссылочном примере 3, и цианометилентри-н-бутилфосфоран (89 мг, 0,370 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 23 часов в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем. Из фракции, элюированной смесью гексан:этилацетат (=1:1), получали указанное в заголовке соединение (32 мг, 35%) в виде бесцветного масла.
ИК (ATR) ν: 2933, 2869, 1581, 1465, 1394, 1313, 1278, 1191, 1133, 1083, 1039, 1012, 962, 887, 821, 752, 713, 630, 588, 532, 464 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,33-1,50 (2H, м), 1,80-1,96 (2H, м), 2,09-2,21 (1H, м), 2,48-2,59 (1H, м), 2,88 (3H, с), 2,90-2,99 (2H, т, J=11,0, 4,2 Гц), 4,79 (1H, дд, J=11,0, 4,2 Гц), 7,15 (1H, д, J=8,6 Гц), 7,20-7,29 (1H, м), 7,34-7,40 (2H, м), 7,46-7,52 (2H, м), 7,63 (1H, д, J=2,5 Гц).
МС (m/z): 469, 471 (M++H).
HRMS (FAB) для C18H20O4Cl3S2 (M++H).
Вычислено: 468, 9869.
Найдено: 468,9907.
Пример 72: 1-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]-3,5-дифторбензол
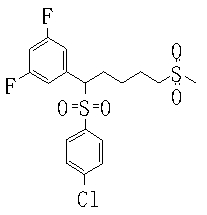
4-хлорбензолсульфинат натрия (49 мг, 0,247 ммоль) и 3,5-дифторбензилбромид (32 мкл, 0,247 ммоль) добавляли к диметоксиэтану (5 мл). Полученную смесь перемешивали при 70°С в течение 24 часов. После охлаждения до комнатной температуры реакционную смесь подвергали хроматографии на короткой колонке (силикагель) и фракцию, элюированную диэтиловым эфиром, концентрировали при пониженном давлении. Полученный таким образом остаток растворяли в толуоле (5 мл). К полученному раствору добавляли 4-(метилсульфонил)-1-бутанол (58 мг, 0,381 ммоль), полученный в ссылочном примере 3, и цианометилентри-н-бутилфосфоран (89 мг, 0,370 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение 23 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем. Из фракции, элюированной смесью гексан:этилацетат (=1:1), получали указанное в заголовке соединение (39 мг, 36%) в виде белого твердого вещества.
Точка плавления: 126,0-127,0°С.
ИК (ATR) ν: 2940, 1623, 1596, 1463, 1392, 1344, 1319, 1270, 1243, 1203, 1145, 1118, 1081, 1010, 987, 952, 863, 823, 752, 707, 680, 624, 539, 501, 478, 449 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,35-1,62 (2H, м), 1,78-1,99 (2H, м), 2,05-2,19 (1H, м), 2,39-2,51 (1H, м), 2,88 (3H, с), 2,90-3,05 (2H, м), 3,98 (1H, дд, J=10,9, 4, 0 Гц), 6,62-6,75 (2H, м), 6,75-6,85 (1H, м), 7,38-7,58 (4H, м).
МС (m/z): 436 (м++H).
Элементный анализ для C18H19F2O4S2.
Вычислено: C 49,48%; H 4,38%; Cl 8,11%; F 8,70%; S 14,68%.
Найдено: C 49,45%; H 4,33%; Cl 8,10%; F 8,88%; S 14,69%.
Пример 73: 3-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]пиридин
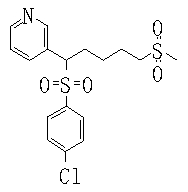
4-хлорбензолсульфинат натрия (207 мг, 1,04 ммоль), гидрохлорид 3-хлорметилпиридина (171 мг, 1,04 ммоль) и ацетат калия (204 мг, 2,08 ммоль) добавляли к н-бутанолу (5 мл). Полученную смесь перемешивали при 70°С в течение 5 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат, и из полученной смеси отфильтровывали нерастворимое вещество. Фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем и из фракции, элюированной смесью гексан:этилацетат (=2:3), получали белое твердое вещество (98 мг).
Затем раствор в толуоле (10 мл) полученного твердого вещества (29 мг), 4-(метилсульфонил)-1-бутанола (102 мг, 0,670 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (156 мг, 0,650 ммоль) нагревали при кипячении с обратным холодильником в течение 2 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. К остатку добавляли смесь 1 н. хлористо-водородная кислота/этанол и смесь концентрировали при пониженном давлении. Остаток промывали диэтиловым эфиром. К остатку добавляли насыщенный водный раствор бикарбоната натрия с последующей экстракцией этилацетатом. После сушки органического слоя над безводным сульфатом натрия растворитель концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем. Из фракции, элюированной смесью метанол:метиленхлорид (=1:50), получали указанное в заголовке соединение (38 мг) в виде бледно-желтого масла.
ИК (ATR) ν: 2929, 2873, 1575, 1477, 1425, 1394, 1276, 1178, 1132, 1083, 1012, 964, 908, 823, 757, 711, 651, 622, 563, 518, 458 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,35-1,52 (2H, м), 1,80-1,99 (2H, м), 2,13-2,26 (1H, м), 2,49-2,59 (1H, м), 2,88 (3H, с), 2,90-2,99 (2H, м), 4,05 (1H, дд, J=11,1, 4,0 Гц), 7,30 (1H, дд, J=7,8, 4,9 Гц), 7,38-7,48 (4H, м), 7,64 (1H, дт, J=8,1,2,0 Гц), 8,16 (1H, д, J=2,0 Гц), 8,57 (1H, дд, J=4,8, 1,6 Гц).
МС (m/z): 402 (M++H).
HRMS (FAB) для C17H21O4NClS2(M++H).
Вычислено: 402,0601.
Найдено: 402, 0596.
Пример 74: 4-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]пиридин
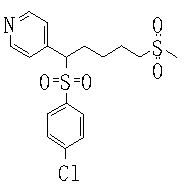
4-хлорбензолсульфинат натрия (207 мг, 1,04 ммоль), гидрохлорид 3-хлорметилпиридина (171 мг, 1,04 ммоль) и ацетат калия (204 мг, 2,08 ммоль) добавляли к н-бутанолу (5 мл). Полученную смесь перемешивали при 70°С в течение 5 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат, и из полученной смеси отфильтровывали нерастворимое вещество. Фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем и из фракции, элюированной смесью гексан:этилацетат (=2:3), получали белое твердое вещество (117 мг).
Затем раствор в толуоле (10 мл) полученного твердого вещества (52 мг), 4-(метилсульфонил)-1-бутанола (90 мг, 0,592 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (140 мг, 0,582 ммоль) нагревали при кипячении с обратным холодильником в течение 2 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. К остатку добавляли смесь 1 н. хлористо-водородная кислота/этанол. После концентрирования при пониженном давлении остаток промывали диэтиловым эфиром. К остатку добавляли насыщенный водный раствор бикарбоната натрия с последующей экстракцией этилацетатом. Органический слой сушили над безводным сульфатом натрия и растворитель концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем и из фракции, элюированной смесью метанол:метиленхлорид (=1:50), получали указанное в заголовке соединение в виде белого твердого вещества (62 мг).
Точка плавления: 181,0-182,0°С.
ИК (ATR) ν: 2942, 2863, 1590, 1467, 1415, 1311, 1272, 1241, 1201, 1147, 1085, 1002, 960, 908, 831, 755, 703, 632, 568, 530, 476, 453 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,30-1, 53 (2H, м), 1,76-1,99 (2H, м), 2,10-2,25 (1H, м), 2,40-2,57 (1H, м), 2,88 (3H, с), 2,90-3,02 (2H, м), 4,00 (1H, дд, J=11,1, 4,0 Гц), 6,95-7,09 (2H, м), 7,32-7,55 (4H, м), 8,43-8,60 (2H, м).
МС (m/z): 402 (M++H).
Элементный анализ для C17H20NClO4S2.
Вычислено: C 50,80%; H 5,02%; N 3,48%; Cl 8,82%; S 15,96%.
Найдено: C 50,70%; H 4,93%; N 3,55%; Cl 8,10%; S 15,83%.
Пример 75: 2-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]хинолин
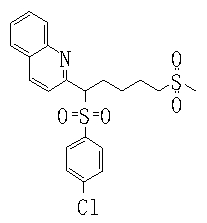
4-хлорбензолсульфинат натрия (196 мг, 0,987 ммоль), гидрохлорид 2-хлорметилхинолина (211 мг, 0,987 ммоль) и ацетат калия (194 мг, 1,97 ммоль) добавляли к н-бутанолу (5 мл). Полученную смесь перемешивали при 70°С в течение 5 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат, и из полученной смеси отфильтровывали нерастворимое вещество. Остаток, полученный концентрированием фильтрата при пониженном давлении, подвергали хроматографии на колонке с силикагелем и из фракции, элюированной смесью гексан:этилацетат (=1:1), получали белое твердое вещество (97 мг).
Затем раствор в толуоле (10 мл) полученного твердого вещества (42 мг), 4-(метилсульфонил)-1-бутанола (104 мг, 0,684 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (160 мг, 0,666 ммоль) нагревали при кипячении с обратным холодильником в течение 2 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии среднего давления на колонке с силикагелем, и из фракции, элюированной смесью гексан:этилацетат (=1:3), получали указанное в заголовке соединение (49 мг) в виде бесцветного масла.
ИК (ATR) ν: 2931, 2869, 1596, 1581, 1504, 1463, 1428, 1394, 1297, 1278, 1133, 1083, 1012, 960, 875, 829, 755, 705, 663, 624, 568, 516, 457 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,30-1,60 (2H, м), 1,79-1,95 (2H, м), 2,40-2,50 (2H, м), 2,83 (3H, с), 2,91 (2H, т, J=7,2 Гц), 4,52 (1H, дд, J=9,9, 5,3 Гц), 7,28-7, 32 (2H, м), 7,39-7,46 (2H, м), 7,55-7,61 (2H, м), 7,67-7,73 (1H, м), 7,77-7,87 (2H, м), 8,19 (1H, д, J=8,6 Гц).
МС (m/z): 452 (M++H).
HRMS (FAB) для C21H23O4NClS2(м++H).
Вычислено: 452,0757.
Найдено: 452,0744.
Пример 76: 4-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]-1,2-дифторбензол
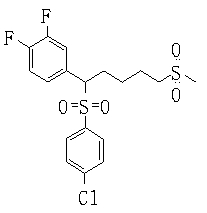
4-хлорбензолсульфинат натрия (45 мг, 0,227 ммоль) и 3,4-дифторбензилбромид (29 мг, 0,227 ммоль) добавляли к диметоксиэтану (5 мл). Полученную смесь перемешивали при 70°С в течение 24 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат и из полученной смеси отфильтровывали нерастворимое вещество. Фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали хроматографии на колонке с силикагелем и фракцию, полученную из эфирного элюата, концентрировали при пониженном давлении. Раствор остатка в толуоле (5 мл), 4-(метилсульфонил)-1-бутанола (71 мг, 0,454 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (110 мг, 0,454 ммоль) нагревали при кипячении с обратным холодильником в течение 16 часов в атмосфере аргона. После охлаждения до комнатной температуры добавляли 4-(метилсульфонил)-1-бутанол (71 мг, 0,454 ммоль), полученный в ссылочном примере 3, и цианометилентри-н-бутилфосфоран (110 мг, 0,454 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=2:3), концентрировали при пониженном давлении с получением указанного в заголовке соединения (12 мг, 12%) в виде белого твердого вещества. Твердое вещество промывали смесью гексан-эфир и собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 122-124°С.
ИК (ATR) ν: 2940, 2873, 1610, 1575, 1519, 1467, 1434, 1394, 1317, 1280, 1268, 1205, 1145, 1126, 1083, 1012, 962, 877, 819, 765, 754, 707, 632, 592, 549, 526, 514, 507, 484, 451, 404 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,32-1,50 (2H, м), 1,79-1,97 (2H, м), 2,03-2,18 (1H, м), 2,40-2,50 (1H, м), 2,88 (3H, c), 2,90-3,00 (2H, м), 3,98 (1H, дд, J=11,0, 3,9 Гц), 6, 77-6,81 (1H, м), 6,99-7,10 (2H, м), 7,38-7,53 (4H, м).
МС (m/z): 437 (М++H).
HRMS (FAB) для C18H20O4ClF2S2(М++H).
Вычислено: 437,0460.
Найдено: 437,0494.
Пример 77: 1-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]-2,3-дифторбензол
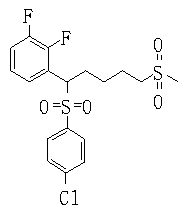
К диметоксиэтану (5 мл) добавляли 4-хлорбензолсульфинат натрия (45 мг, 0,227 ммоль) и 2,3-дифторбензилбромид (29 мкл, 0,227 ммоль). Полученную смесь перемешивали при 70°С в течение 24 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат, и из полученной смеси отфильтровывали нерастворимое вещество. Фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем. Фракцию, полученную из эфирного элюата, концентрировали при пониженном давлении. Раствор остатка в толуоле (10 мл), 4-(метилсульфонил)-1-бутанола (71 мг, 0,454 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (110 мг, 0,454 ммоль) нагревали при кипячении с обратным холодильником в течение 15 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси 55% этилацетат/гексан, концентрировали при пониженном давлении с получением указанного в заголовке соединения (37 мг, 37%) в виде белого твердого вещества. Твердое вещество промывали смесью гексан-эфир и фильтровали с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 141-143°С.
ИК (ATR) ν: 2948, 2867, 1625, 1575, 1484, 1396, 1317, 1272, 1230, 1199, 1149, 1124, 1085, 1012, 966, 935, 894, 808, 761, 717, 659, 628, 584, 547, 518, 472, 443 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,37-1,60 (2H, м), 1,81-1,96 (2H, м), 2,11-2,25 (1H, м), 2,45-2,57 (1H, м), 2,88 (3H, с), 2,96 (2H, т, J=7,9 Гц), 4,53 (1H, дд, J=11,1, 4,0 Гц), 7,10-7,19 (2H, м), 7,22-7, 33 (1H, м), 7,39-7,44 (2H, м), 7,49-7,54 (2H, м).
МС (m/z): 437 (М++H).
Элементный анализ для C18H19ClF2O4S2.
Вычислено: C 49,48%; H 4,38%; Cl 8,11%; F 8,70%; S 14,68%.
Найдено: C 49,38%; H 4,34%; Cl 8,13%; F 8,60%; S 14,56%.
Пример 78: 1-хлор-3-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]-2-фторбензол
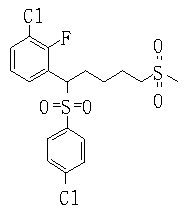
К диметоксиэтану (5 мл) добавляли 3-хлорбензолсульфинат натрия (45 мг, 0,227 ммоль) и 3-хлор-2-фторбензилбромид (51 мг, 0,227 ммоль). Полученную смесь перемешивали при 70°С в течение 24 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат, и из полученной смеси отфильтровывали нерастворимое вещество. Фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем и фракцию, полученную из эфирного элюата, концентрировали при пониженном давлении. Раствор в толуоле (5 мл) полученного остатка, 4-(метилсульфонил)-1-бутанола (71 мг, 0,454 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (110 мг, 0,454 ммоль) нагревали при кипячении с обратным холодильником в течение 5 дней в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли 4-(метилсульфонил)-1-бутанол (71 мг, 0,454 ммоль), полученный в ссылочном примере 3, и цианометилентри-н-бутилфосфоран (110 мг, 0,454 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 12,5 часов в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (42 мг, 41%) в виде белого твердого вещества. Полученное твердое вещество промывали смесью гексан-эфир и собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 131-132°С.
ИК (ATR) ν: 3038, 2938, 1579, 1459, 1392, 1313, 1286, 1234, 1151, 1120, 1085, 1010, 966, 914, 811, 750, 719, 671, 620, 584, 522, 458 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,33-1,60 (2H, м), 1,80-1,98 (2H, м), 2,11-2,25 (1H, м), 2,42-2,56 (1H, м), 2,88 (3H, c), 2,96 (2H, т, J=7,9 Гц), 4,53 (1H, дд, J=11,1, 4,3 Гц), 7,11-7,20 (1H, м), 7,33-7, 46 (4H, м), 7,46-7,56 (2H, м).
МС (m/z): 453 (М++H).
Элементный анализ для C18H19Cl2FO4S2.
Вычислено: C 47,69%; H 4,22%; Cl 15,64%; F 4,19%; S 14,15%.
Найдено: C 47,40%; H 4,18%; Cl 15,42%; F 4,16%; S 14,08%.
Пример 79: 4-хлор-2-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]-1-фторбензол
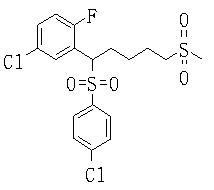
К диметоксиэтану (5 мл) добавляли 4-хлорбензолсульфинат натрия (45 мг, 0,227 ммоль) и 2-бромметил-4-хлор-1-фторбензол (51 мг, 0,227 ммоль). Полученную смесь перемешивали при 70°С в течение 24 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат, и из полученной смеси отфильтровывали нерастворимое вещество. Фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем и фракцию, полученную из эфирного элюата, концентрировали при пониженном давлении. Раствор в толуоле (5 мл) полученного таким образом остатка, 4-(метилсульфонил)-1-бутанола (71 мг, 0,454 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (110 мг, 0,454 ммоль) нагревали при кипячении с обратным холодильником в течение 16 часов в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли 4-(метилсульфонил)-1-бутанол (71 мг, 0, 454 ммоль) и цианометилентри-н-бутилфосфоран (110 мг, 0,454 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (53 мг, 51%) в виде белого твердого вещества. Полученное твердое вещество промывали смесью гексан-эфир и собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 116-117°С.
ИК (ATR) ν : 3097, 2946, 1577, 1490, 1407, 1317, 1278, 1240, 1174, 1147, 1083, 1047, 1012, 956, 916, 881, 823, 754, 711, 649, 626, 566, 538, 474, 433 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,38-1,52 (2H, м), 1,81-1,99 (2H, м), 2,09-2,21 (1H, м), 2,45-2,57 (1H, м), 2,89 (3H, с), 2,91-3,02 (2H, м), 4,48-4,53 (1H, м), 6,83 (1H, т, J=8,9 Гц), 7,23-7,30 (1H, м), 7, 38-7,45 (2H, м), 7,46-7,59 (3H, м).
МС (m/z): 453 (М++H).
Элементный анализ для C18H19Cl2FO4S2.
Вычислено: C 47,69%; H 4,22%; Cl 15,64%; F 4,19%; S 14,15%.
Найдено: C 47,52%; H 4,19%; Cl 15,47%; F 4,24%; S 14,08%.
Ссылочный пример 7: 1-иод-4-(метилсульфонил)бутан
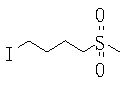
Иод (1,87 г, 7,35 ммоль) добавляли к раствору в метиленхлориде (30 мл) 4-(метилсульфонил)-1-бутанола (746 мг, 4,90 ммоль), полученного в ссылочном примере 3, имидазола (500 мг, 7,35 ммоль), и трифенилфосфина (1,93 г, 7,35 ммоль), и полученную смесь перемешивали в течение 3 часов при комнатной температуре. К реакционной смеси добавляли насыщенный водный раствор тиосульфата натрия. Полученную смесь экстрагировали метиленхлоридом. Экстракт сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси метанол:метиленхлорид (=1:100), концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,18 г, 92%) в виде бледно-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,92-2,08 (4H, м), 2,93 (3H, с), 3,00-3,10 (2H, м), 3,18-3,28 (2H, м).
МС (m/z): 263 (М++H).
Пример 80: 2-(4-хлорфенилсульфонилметил)-1,3-дифторбензол
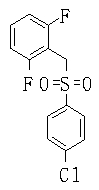
К диметоксиэтану (10 мл) добавляли 4-хлорбензолсульфинат натрия (205 мг, 1,03 ммоль) и 2,6-дифторбензилбромид (214 мг, 1,03 ммоль). Полученную смесь перемешивали при 70°С в течение 18 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат, и из полученной смеси отфильтровывали нерастворимое вещество. Фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из эфирного элюата, концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=10:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (289 мг, 93%) в виде белого твердого вещества.
ИК (ATR) ν: 3097, 2989, 1625, 1575, 1509, 1473, 1407, 1392, 1319, 1272, 1245, 1197, 1182, 1132, 1083, 998, 889, 854, 831, 802, 777, 742, 719, 686, 626, 566, 512, 478, 449, 418 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,48 (2H, с), 6,88 (2H, т, J=7,9 Гц), 7, 29-7,39 (1H, м), 7,47 (2H, д, J=8,6 Гц), 7,68 (2H, д, J=8,6 Гц).
МС (m/z): 303 (М++H).
Пример 81: 2-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]-1, 3-дифторбензол
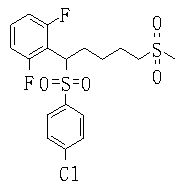
При -78°С бутиллитий (1,57 М раствор в гексане; 0,55 мл, 0,864 ммоль) добавляли по каплям к раствору в диметоксиэтане (10 мл) 2-(4-хлорфенилсульфонилметил)-1,3-дифторбензола (218 мг, 0,720 ммоль). После перемешивания при -78°С в течение 30 минут добавляли по каплям раствор в диметоксиэтане (5 мл) 1-иод-4-(метилсульфонил)бутана (226 мг, 0,864 ммоль), полученного в ссылочном примере 7. Температуру реакционной смеси повышали постепенно до комнатной температуры, и при комнатной температуре смесь перемешивали в течение 15 часов. К реакционной смеси добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли, сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси 55% этилацетат/гексан, концентрировали при пониженном давлении с получением указанного в заголовке соединения (53 мг, 17%) в виде белого твердого вещества. Полученное твердое вещество промывали гексаном и собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 118-119°С.
ИК (ATR) ν: 2946, 1621, 1585, 1471, 1459, 1396, 1355, 1322, 1301, 1274, 1226, 1151, 1132, 1087, 1012, 989, 958, 925, 829, 773, 761, 752, 717, 624, 572, 522, 485, 458, 406 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,35-1,55 (2H, м), 1,81-1,95 (2H, м), 2,48-2,58 (2H, м), 2,88 (3H, с), 2,91-3,10 (2H, м), 2,97 (1H, дд, J=15,8, 6,7 Гц), 6,75-7,00 (2H, м), 7,25-7,35 (1H, м), 7,42 (2H, д, J=8,6 Гц), 8,30 (2H, д, J=8,3 Гц).
МС (m/z): 437 (М++H).
Элементный анализ для C18H19ClF2O4S2.
Вычислено: C 49,48%; H 4,38%; Cl 8,11%; F 8,70%; S 14,68%.
Найдено: C 49,25%; H 4, 32%; Cl 8,02%; F 8,50%; S 14,70%.
Пример 82: 1-(4-хлорфенилсульфонилметил)-3-метоксибензол
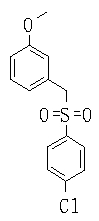
Суспензию в диметоксиэтане (10 мл) 4-хлорбензолсульфината натрия (210 мг, 1,06 ммоль) и 3-метоксибензилхлорида (154 мкл, 1,06 ммоль) перемешивали при 70°С в течение 16 часов. После охлаждения до комнатной температуры добавляли бутанол (2 мл) и тетрабутиламмонийбромид (45 мг), и полученную смесь перемешивали дополнительно при 70°С в течение 16 часов. После охлаждения реакционной смеси до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат. Смесь промывали последовательно водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=5:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (216 мг, 69%) в виде белого твердого вещества.
ИК (ATR) ν: 3064, 2979, 2842, 1598, 1488, 1469, 1434, 1392, 1313, 1268, 1176, 1130, 1085, 1033, 1012, 941, 879, 823, 792, 765, 742, 692, 620, 574, 528, 455 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 3,74 (3H, с), 4,27 (2H, с), 6,59-6,68 (2H, м), 6,82-6,90 (1H, м), 7,17 (1H, т, J=7,8 Гц), 7,42 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц).
МС (m/z): 297 (М++H).
Пример 83: 1-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]-3-метоксибензол
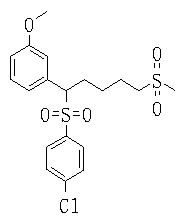
Раствор в толуоле (10 мл) 1-(4-хлорфенилсульфонилметил)-3-метоксибензола (80 мг, 0,269 ммоль), 4-(метилсульфонил)-1-бутанола (62 мг, 0,404 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (98 мг, 0,404 ммоль) нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси этилацетат/гексан (=1:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (61 мг, 52%) в виде белого твердого вещества. Твердое вещество промывали гексаном и собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 91-93°С.
ИК (ATR) ν: 2967, 2929, 1594, 1494, 1469, 1455, 1394, 1315, 1272, 1255, 1222, 1189, 1145, 1132, 1085, 1037, 1012, 970, 879, 850, 804, 759, 705, 688, 632, 603, 532, 493, 464 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,37-1,50 (2H, м), 1,79-1,93 (2H, м), 2,10-2,23 (1H, м), 2,40-2,52 (1H, м), 2,86 (3H, с), 2,89-2,98 (2H, м), 3,73 (3H, с), 3,97 (1H, дд, J=11,1, 3,8 Гц), 6,59-6,67 (2H, м), 6,80-6,89 (1H, м), 7,15 (1H, д, J=8,0 Гц), 7,35 (2H, д, J=8,6 Гц), 7,44 (2H, д, J=8,6 Гц).
МС (m/z): 431 (М++H).
Элементный анализ для C19H23ClO5S2.
Вычислено: C 52,95%; H 5,38%; Cl 8,23%; S 14,88%.
Найдено: C 52,89%; H 5,25%; Cl 8,33%; S 14,87%.
Пример 84: 1-(4-хлорфенилсульфонилметил)-4-метоксибензол
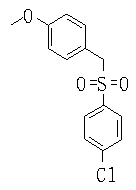
Суспензию в бутаноле (5 мл) 4-хлорбензолсульфината натрия (264 мг, 1,33 ммоль), 4-метоксибензилхлорида (181 мкл, 1,33 ммоль) и тетрабутиламмонийбромида (24 мг) перемешивали при 70°С в течение 3 дней. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат, и смесь промывали последовательно водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=5:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (90 мг, 23%) в виде белого твердого вещества.
ИК (ATR) ν: 3072, 2996, 2942, 2836, 1608, 1583, 1509, 1467, 1396, 1309, 1292, 1240, 1176, 1147, 1089, 1031, 1016, 977, 956, 887, 829, 767, 715, 630, 532, 474, 431 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 3,80 (3H, с), 4,25 (2H, с), 6,80 (2H, д, J=8,8 Гц), 7, 00 (2H, д, J=8,6 Гц), 7,42 (2H, д, J=8,3 Гц), 7,54 (2H, д, J=8,6 Гц).
Пример 85: 1-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]-4-метоксибензол
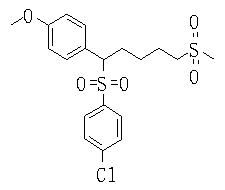
Раствор в толуоле (10 мл) 1-(4-хлорфенилсульфонилметил)-4-метоксибензола (72 мг, 0,243 ммоль), 4-(метилсульфонил)-1-бутанола (70 мг, 0,460 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (111 мг, 0,460 ммоль) нагревали при кипячении с обратным холодильником в течение 15 часов в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли 4-(метилсульфонил)-1-бутанол (70 мг, 0,460 ммоль), полученный в ссылочном примере 3, и цианометилентри-н-бутилфосфоран (111 мг, 0,460 ммоль), и смесь нагревали при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (33 мг, 32%) в виде белого твердого вещества. Полученное белое твердое вещество промывали гексаном и затем собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 136-138°С.
ИК (ATR) ν: 3012, 2937, 1608, 1583, 1511, 1471, 1392, 1319, 1292, 1268, 1253, 1178, 1145, 1130, 1085, 1029, 1012, 964, 833, 823, 771, 754, 723, 628, 574, 551, 530, 497, 472, 439 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,37-1,50 (2H, м), 1,79-1,93 (2H, м), 2,10-2,23 (1H, м), 2,40-2,52 (1H, м), 2,86 (3H, с), 2,89-2,98 (2H, м), 3,73 (3H, с), 3,97 (1H, дд, J=11,1, 3,8 Гц), 6,59-6,67 (2H, м), 6,80-6,89 (1H, м), 7,15 (1H, д, J=8,0 Гц), 7,35 (2H, д, J=8,6 Гц), 7,44 (2H, д, J=8,6 Гц).
МС (m/z): 431 (М++H).
Элементный анализ для C19H23ClO5S2.
Вычислено: C 52,95%; H 5,38%; Cl 8,23%; S 14,88%.
Найдено: C 52,99%; H 5,29%; Cl 8,29%; S 14,82%.
Ссылочный пример 8: Метил-3-(N,N-диметилкарбамоил)бензоат
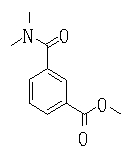
К раствору в метиленхлориде (20 мл) монометилизофталата (317 мг, 1,76 ммоль) добавляли гидрохлорид диметиламина (172 мг, 2,11 ммоль), 1-гидроксибензотриазол (287 мг, 1,76 ммоль), гидрохлорид 1-этил-3-(2-диметиламинопропил)карбодиимида (404 мг, 2,11 ммоль) и N-метилморфолин (0,23 мл, 2,11 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 21 часа. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат. Полученную смесь промывали последовательно 1 н. хлористо-водородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси метанол:метиленхлорид (=1:50), концентрировали при пониженном давлении с получением указанного в заголовке соединения (290 мг, 80%) в виде бесцветного масла.
ИК (ATR) ν: 1720, 1633, 1583, 1500, 1436, 1392, 1286, 1255, 1205, 1112, 1076, 979, 933, 823, 773, 730, 696, 669, 638, 580, 489, 439 см-1 .
1H-ЯМР (400 МГц, CDCl3) δ: 2,99 (3H, с), 3,13 (3H, с), 3,93 (3H, с), 7,49 (1H, т, J=8,2 Гц), 7,63 (1H, т, J=7,6 Гц), 8,05-8,15 (2H, м).
МС (m/z): 208 (М++H).
Ссылочный пример 9: 3-гидроксиметил-N,N-диметилбензамид
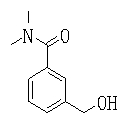
При охлаждении на льду боргидрид натрия (264 мг, 6,97 ммоль) добавляли к раствору в этаноле (15 мл) метил-3-(N,N-диметилкарбамоил)бензоата (289 мг, 1,39 ммоль). Температуре полученной смеси давали повыситься опять до комнатной температуры, и затем перемешивание проводили при 50°С в течение 14 часов. После охлаждения реакционной смеси опять до комнатной температуры охлаждали на льду. Добавляли боргидрид натрия (264 мг, 6,97 ммоль), и смесь перемешивали при 50°С в течение 6 часов. Реакционную смесь охлаждали на льду, и затем добавляли воду с последующим концентрированием при пониженном давлении. К полученному таким образом остатку добавляли воду с последующей экстракцией метиленхлоридом. Экстракт сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси метанол:метиленхлорид (=1:30), концентрировали при пониженном давлении с получением указанного в заголовке соединения (196 мг, 79%) в виде бесцветного масла.
ИК (ATR) ν: 3367, 2929, 2869, 1600, 1583, 1508, 1479, 1452, 1394, 1267, 1236, 1170, 1097, 1079, 1049, 898, 800, 746, 719, 694, 642, 431 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 2,46 (1H, шир.с), 2,97 (3H, с), 3,11 (3H, с), 4,67 (2H, шир.д, J=2,9 Гц), 7,23-7,48 (4H, м).
МС (m/z): 180 (М++H).
Пример 86: 3-(4-хлорфенилсульфонилметил)-N,N-диметилбензамид
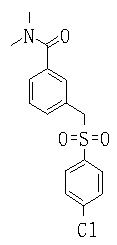
К раствору в метиленхлориде (15 мл) 3-гидроксиметил-N,N-диметилбензамида (184 мг, 1,03 ммоль) добавляли тетрабромид углерода (511 мг, 1,59 ммоль) и трифенилфосфин (404 мг, 1,54 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 4,5 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:1) концентрировали при пониженном давлении с получением бесцветного масла (239 мг).
Суспензию в диметоксиэтане (15 мл) полученного бесцветного масла (239 мг, 0,987 ммоль) и 4-хлорбензолсульфината натрия (234 мг, 1,18 ммоль) перемешивали при 70°С в течение 3 дней. После охлаждения реакционной смеси до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат, и смесь промывали последовательно водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси 70% этилацетат/гексан, концентрировали при пониженном давлении с получением указанного в заголовке соединения (125 мг, 37%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 2,89 (3H, с), 3,09 (3H, с), 4,32 (2H, с), 7,10-7,50 (6H, м), 7,59 (2H, д, J=8,6 Гц).
МС (m/z): 338 (М++H).
Пример 87: 3-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]-N,N-диметилбензамид
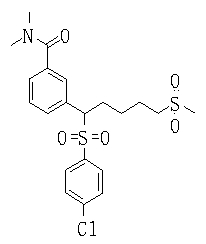
Раствор в толуоле (10 мл) 3-(4-хлорфенилсульфонилметил)-N,N-диметилбензамида (69 мг, 0,204 ммоль), 4-(метилсульфонил)-1-бутанола (62 мг, 0,409 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (99 мг, 0,409 ммоль) нагревали при кипячении с обратным холодильником в течение 15 часов в атмосфере аргона. После охлаждения до комнатной температуры добавляли 4-(метилсульфонил)-1-бутанол (62 мг, 0,504 ммоль), полученный в ссылочном примере 3, и цианометилентри-н-бутилфосфоран (99 мг, 0,504 ммоль). Реакционную смесь нагревали при кипячении с обратным холодильником в течение 23 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси метанол:метиленхлорид (=1:50), концентрировали при пониженном давлении с получением указанного в заголовке соединения (37 мг, 38%) в виде аморфного вещества.
ИК (ATR) ν: 2927, 1625, 1581, 1504, 1475, 1394, 1276, 1172, 1141, 1083, 1012, 964, 908, 819, 754, 705, 626, 551, 516, 468 см-1 .
1H-ЯМР (400 МГц, CDCl3) δ: 1,32-1,49 (2H, м), 1,78-1,92 (2H, м), 2,12-2,28 (1H, м), 2,40-2,50 (1H, м), 2,83 (3H, шир.с), 2,87 (3H, с), 2,90-2,98 (2H, м), 3,08 (3H, шир.с), 4,05 (1H, дд, J=11,1, 3,8 Гц), 7,12 (1H, шир.с), 7,19-7,25 (1H, м), 7,32-7,40 (4H, м), 7,48 (2H, д, J=8,6 Гц).
МС (m/z): 472 (М++H).
HRMS (FAB) для C21H27O5NClS2(М++H).
Вычислено: 472,1019.
Найдено: 472,1010.
Пример 88: 2-(4-хлорфенилсульфонилметил)-N,N-диметилбензамид
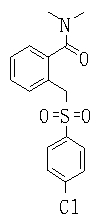
К раствору в метаноле (5 мл) фталида (639 мг, 4,76 ммоль) добавляли 50% водный раствор (2 мл) диметиламина, и смесь перемешивали при 70°С в течение 14 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. К остатку добавляли метиленхлорид. Смесь сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси метанол:метиленхлорид (=1:40), концентрировали при пониженном давлении с получением бесцветного масла (248 мг, 29%). К раствору в метиленхлориде (10 мл) бесцветного масла (238 мг, 1,33 ммоль) добавляли трифенилфосфин (522 мг, 1,99 ммоль) и тетрабромид углерода (660 мг, 1,99 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=3:2), концентрировали при пониженном давлении. Остаток растворяли в бутаноле (10 мл) с последующим добавлением к раствору 4-хлорбензолсульфината натрия (264 мг, 1,33 ммоль). Смесь перемешивали при 70°С в течение 2 дней. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат с последующим последовательным промыванием водой и насыщенным раствором соли и сушкой над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата гексан:этилацетат (=3:2), концентрировали при пониженном давлении с получением указанного в заголовке соединения (216 мг, 48%) в виде аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,97 (3H, с), 3,13 (3H, с), 7, 50 (2H, д, J=8,8 Гц), 7,73 (2H, д, J=8,6 Гц).
ИК (ATR) ν: 2931, 1621, 1598, 1581, 1504, 1475, 1444, 1392, 1317, 1278, 1191, 1151, 1083, 1068, 1012, 879, 827, 777, 757, 740, 705, 636, 607, 566, 536, 466, 447 см-1.
МС (m/z): 338 (М++H).
Пример 89: 2-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]-N, N-диметилбензамид
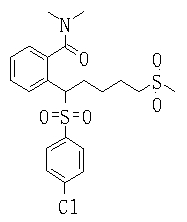
Раствор в толуоле (5 мл) 2-(4-хлорфенилсульфонилметил)-N, N-диметилбензамида (161 мг, 0,477 ммоль), 4-(метилсульфонил)-1-бутанола (100 мг, 0,657 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (159 мг, 0,657 ммоль) нагревали при кипячении с обратным холодильником в течение 17 часов в атмосфере аргона. После охлаждения до комнатной температуры добавляли 4-(метилсульфонил)-1-бутанол (100 мг, 0,657 ммоль), полученный в ссылочном примере 3, и цианометилентри-н-бутилфосфоран (159 мг, 0,657 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение 24 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси 80% этилацетат/гексан, концентрировали при пониженном давлении с получением указанного в заголовке соединения (79 мг, 35%) в виде аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,25-1,49 (2H, м), 1,63-1,80 (1H, м), 1,80-1,93 (1H, м), 2,00-2,20 (2H, м), 2,76-2,95 (2H, м), 2,82 (3H, с), 2,84 (3H, с), 3,11 (3H, с), 4,70-4,82 (1H, м), 7,22 (1H, д, J=7,3 Гц), 7, 32-7,46 (3H, м), 7,49 (2H, д, J=8,6 Гц), 7,63 (2H, д, J=8,6 Гц).
ИК (ATR) ν: 2931, 2873, 1621, 1581, 1506, 1475, 1448, 1394, 1278, 1222, 1182, 1137, 1083, 1012, 962, 823, 755, 707, 630, 561, 518, 460 см-1.
МС: 472 (М++H).
HRMS (FAB) для C21H27O5NClS2(М++H).
Вычислено: 472,1019.
Найдено: 472,1023.
Пример 90: 3-(4-хлорфенилсульфонилметил)бензонитрил
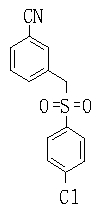
Суспензию в диметоксиэтане (15 мл) 4-хлорбензолсульфината натрия (270 мг, 1,36 ммоль) и 3-бромметилбензонитрила (222 мкл, 1,13 ммоль) перемешивали при 70°С в течение 3 дней. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат. Смесь промывали последовательно водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=3:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (318 мг, 96%) в виде белого твердого вещества.
ИК (ATR) ν: 3087, 2985, 2229, 1581, 1581, 1475, 1432, 1394, 1317, 1282, 1265, 1228, 1145, 1081, 1012, 929, 904, 885, 844, 811, 798, 763, 723, 686, 651, 626, 578, 545, 522, 484, 462 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,32 (2H, с), 7,38-7,52 (5H, м), 7,60 (2H, д, J=8,8 Гц), 7,66 (1H, д, J=7,6 Гц).
МС (m/z): 292 (М++H).
Пример 91: 3-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]бензонитрил
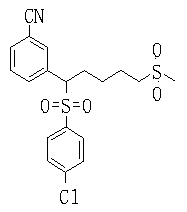
Раствор в толуоле (10 мл) 3-(4-хлорфенилсульфонилметил)бензонитрила (60 мг, 0,204 ммоль), 4-(метилсульфонил)-1-бутанола (62 мг, 0,409 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (99 мг, 0,409 ммоль) нагревали при кипячении с обратным холодильником в течение 15 часов в атмосфере аргона. После охлаждения до комнатной температуры добавляли 4-(метилсульфонил)-1-бутанол (62 мг, 0,504 ммоль), полученный в ссылочном примере 3, и цианометилентри-н-бутилфосфоран (99 мг, 0,504 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 23 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:2), концентрировали при пониженном давлении с получением указанного в заголовке соединения (69 мг, 79%) в виде аморфного вещества.
ИК (ATR) ν: 2931, 2229, 1579, 1475, 1432, 1394, 1278, 1137, 1083, 1051, 1012, 964, 914, 813, 752, 688, 649, 613, 549, 516, 466 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,30-1,50 (2H, м), 1,79-1, 97 (2H, м), 2,10-2,22 (1H, м), 2,40-2,51 (1H, м), 2,89 (3H, с), 2,90-3,00 (2H, м), 4,06 (1H, дд, J=11,1, 4,0 Гц), 7,35-7,50 (7H, м), 7,64 (1H, д, J=7,3 Гц).
МС (m/z): 426 (М++H).
Элементный анализ для C19H20ClNO4S2·0,25H2O.
Вычислено: C 53,02%; H 4,80%; Cl 8,24%; N 3,25%; S 14,90%.
Найдено: C 52,94%; H 4,85%; Cl 8,54%; N 3,25%; S 14,93%.
Пример 92: 2-(4-хлорфенилсульфонилметил)бензонитрил
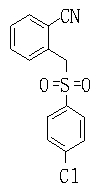
Суспензию в диметоксиэтане (5 мл) 4-хлорбензолсульфината натрия (218 мг, 1,10 ммоль) и 2-бромметилбензонитрила (215 мг, 1,10 ммоль) перемешивали при 70°С в течение 17 часов. После охлаждения реакционной смеси до комнатной температуры растворитель концентрировали при пониженном давлении. Полученный таким образом остаток подвергали хроматографии на короткой колонке силикагеля и фракцию, полученную из эфирного элюата, концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=3:1), концентрировали при пониженном давлении с получением белого твердого вещества. Полученное белое твердое вещество промывали эфиром и собирали фильтрованием с получением указанного в заголовке соединения (226 мг, 70%) в виде белого порошка.
ИК (ATR) ν: 3079, 2979, 2227, 1573, 1488, 1473, 1450, 1425, 1392, 1321, 1299, 1280, 1253, 1209, 1174, 1143, 1081, 1010, 946, 904, 879, 829, 781, 759, 711, 682, 632, 593, 532, 480, 451 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,58 (2H, с), 7,43-7,51 (3H, м), 7,56-7,68 (5H, м).
Пример 93: 2-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]бензонитрил
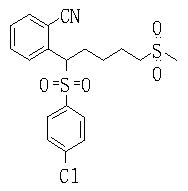
Раствор в толуоле (5 мл) 2-(4-хлорфенилсульфонилметил)бензонитрила (96 мг, 0,329 ммоль), 4-(метилсульфонил)-1-бутанола (100 мг, 0,657 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (159 мг, 0,657 ммоль) нагревали при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси 60% этилацетат/гексан, концентрировали при пониженном давлении с получением указанного в заголовке соединения (139 мг, 99%) в виде аморфного вещества.
ИК (ATR) ν: 3089, 2931, 2225, 1575, 1475, 1448, 1394, 1315, 1295, 1278, 1214, 1176, 1139, 1124, 1083, 1012, 962, 908, 827, 794, 754, 711, 628, 553, 516, 470 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,30-1,54 (2H, м), 1,81-1,98 (2H, м), 2,20-2,31 (1H, м), 2,47-2,59 (1H, м), 2,88 (3H, с), 2,90-3,00 (2H, м), 4,63 (1H, дд, J=11,0, 4,2 Гц), 7,38-7,60 (6H, м), 7,67-7,73 (1H, м), 7,79 (1H, д, J=8,1 Гц).
МС (m/z): 426 (М++H).
HRMS (FAB) для C19H21O4NClS2(М++H).
Вычислено: 426,0601.
Найдено: 426,0636.
Пример 94: 1-хлор-4-(циклогексилметилсульфонил)бензол
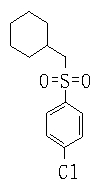
К раствору в ацетонитриле (10 мл) 4-хлорбензолтиола (230 мг, 1,59 ммоль) и циклогексилметилбромида (222 мкл, 1,59 ммоль) добавляли карбонат калия (329 мг, 2,38 ммоль), и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли гексан, и нерастворимое вещество отфильтровывали. Фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток растворяли в метиленхлориде (20 мл) с последующим добавлением 3-хлорпербензойной кислоты (576 мг, 3,34 ммоль). Смесь перемешивали при комнатной температуре в течение 17,5 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат, смесь промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде. К полученному раствору добавляли 1 н. водный раствор гидроксида натрия для отделения органического слоя. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=15:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (301 мг, 69%) в виде белого твердого вещества.
ИК (ATR) ν: 2921, 2850, 1583, 1475, 1446, 1394, 1305, 1274, 1172, 1143, 1083, 1014, 964, 892, 846, 831, 782, 761, 744, 703, 669, 632, 559, 528, 478, 426 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,00-1,35 (5H, м), 1,60-1,76 (3H, м), 1,80-2,08 (3H, м), 2,97 (2H, д, J=6,1 Гц), 7,54 (2H, д, J=8,6 Гц), 7,85 (2H, д, J=8,6 Гц).
МС (m/z): 273 (М++H).
Пример 95: 1-хлор-4-[1-циклогексил-5-(метилсульфонил)пентилсульфонил]бензол
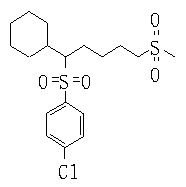
При -78°С бутиллитий (1,57 М раствор в гексане; 0,60 мл, 0,937 ммоль) добавляли по каплям к раствору в диметоксиэтане (3 мл) 1-хлор-4-(циклогексилметилсульфонил)бензола (213 мг, 0,781 ммоль). После перемешивания при -78°С в течение 40 минут добавляли по каплям раствор в диметоксиэтане (5 мл) 1-иод-4-(метилсульфонил)бутана (246 мг, 0,937 ммоль), полученного в ссылочном примере 7. Температуру реакционной смеси повышали постепенно до комнатной температуры, и при комнатной температуре перемешивание проводили в течение 3 часов. К реакционной смеси добавляли воду и затем экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:1), концентрировали при пониженном давлении. Остаток очищали высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота) с получением указанного в заголовке соединения (54 мг, 17%) в виде белого твердого вещества. Полученное твердое вещество промывали гексаном и собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 104-106°С.
ИК (ATR) ν: 2925, 2854, 1583, 1475, 1444, 1423, 1392, 1309, 1288, 1268, 1209, 1176, 1145, 1133, 1128, 1083, 1012, 960, 892, 825, 763, 727, 636, 609, 561, 528, 495, 478, 453, 430 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,02-1,32 (5H, м), 1,44-2,00 (12H, м), 2,76-2,83 (1H, м), 2,89 (3H, с), 2,97 (2H, т, J=7,0 Гц), 7,56 (2H, д, J=8,3 Гц), 7,82 (2H, д, J=8,3 Гц).
МС (m/z): 407 (М++H).
Элементный анализ для C18H27ClO4S2.
Вычислено: C 53,12%; H 6,69%; Cl 8,71%; S 15,76%.
Найдено: C 53,11%; H 6,49%; Cl 8,83%; S 15,73%.
Пример 96: 1-хлор-4-(2-фенилэтилсульфонил)бензол
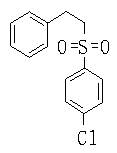
К раствору в ацетонитриле (10 мл) 4-хлорбензолтиола (347 мг, 2,40 ммоль) и (2-бромэтил)бензола (329 мкл, 2,40 ммоль) добавляли карбонат калия (498 мг, 3, 60 ммоль). Смесь перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли гексан, и нерастворимое вещество отфильтровывали. Фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток растворяли в метиленхлориде (20 мл). К полученному раствору добавляли 3-хлорпербензойную кислоту (870 мг, 5,04 ммоль), и смесь перемешивали при комнатной температуре в течение 19 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат. Смесь промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде с последующим добавлением 1 н. водного раствора гидроксида натрия для отделения органического слоя. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=10:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (599 мг, 89%) в виде белого твердого вещества.
ИК (ATR) ν: 3023, 2923, 1600, 1581, 1496, 1473, 1454, 1394, 1299, 1276, 1240, 1145, 1083, 1012, 971, 908, 823, 777, 755, 732, 694, 636, 593, 570, 526, 455 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 2,98-3,10 (2H, м), 3,29-3,42 (2H, м), 7,02-7,32 (5H, м), 7,55 (2H, д, J=8,6 Гц), 7,86 (2H, д, J=8,5 Гц).
МС (m/z): 281 (М++H).
Пример 97: 4-[1-бензил-5-(метиленсульфонил)пентилсульфонил]-1-хлорбензол
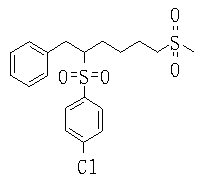
При -78°С бутиллитий (1,57 М раствор в гексане; 0,57 мл, 0,902 ммоль) добавляли по каплям к раствору в диметоксиэтане (3 мл) 1-хлор-4-(2-фенилэтилсульфонил)бензола (211 мг, 0,752 ммоль). После перемешивания при -78°С в течение 1 часа добавляли по каплям раствор в диметоксиэтане (6 мл) 1-иод-4-(метилсульфонил)бутана (236 мг, 0,902 ммоль), полученного в ссылочном примере 7. Температуру реакционной смеси повышали постепенно до комнатной температуры, и при комнатной температуре перемешивание проводили в течение 3 часов. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:1), концентрировали при пониженном давлении. Остаток очищали высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота) с получением указанного в заголовке соединения (72 мг, 23%) в виде белого твердого вещества. Полученное твердое вещество промывали гексаном и собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 68-70°С.
ИК (ATR) ν: 3029, 2937, 2867, 1581, 1496, 1421, 1394, 1303, 1280, 1253, 1187, 1133, 1083, 1041, 1012, 964, 848, 825, 759, 690, 649, 588, 553, 522, 493, 455 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,40-1,77 (5H, м), 1,82-1,96 (1H, м), 2,60-2,70 (1H, м), 2,75-2,91 (2H, м), 2,83 (3H, с), 3,18-3,29 (2H, м), 7,04 (2H, д, J=8,3 Гц), 7,19-7,31 (3H, м), 7,56 (2H, д, J=8,6 Гц), 7,84 (2H, д, J=8,6 Гц).
МС (m/z): 415 (М++H).
Элементный анализ для C19H23ClO4 S2.
Вычислено: C 54,99%; H 5,59%; Cl 8,54%; S 15,45%.
Найдено: C 55,10%; H 5,62%; Cl 8,50%; S 15,56%.
Ссылочный пример 10: (2-хлорпиридин-3-ил)метанол
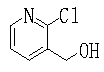
При -78°С диизобутилалюминийгидрид (1,0 М раствор в толуоле; 4,68 мл) добавляли по каплям к раствору в метиленхлориде (10 мл) этил-2-хлорникотината (347 мг, 1,87 ммоль). Спустя тридцать минут реакционную смесь охлаждали на льду с последующим перемешиванием в течение 15 минут. После подтверждения завершения реакции к реакционной смеси добавляли насыщенный раствор соли, и температуре полученной смеси давали повыситься до комнатной температуры. Реакционную смесь фильтровали через целит. Фильтрат сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (211 мг, 79%) в виде белого твердого вещества.
ИК (ATR) ν: 3245, 2827, 1587, 1571, 1452, 1407, 1324, 1251, 1193, 1118, 1087, 1041, 796, 732, 713, 655, 593, 511, 466, 414 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 2,21 (1H, т, J=5,6 Гц), 4,80 (2H, д, J=5,1 Гц), 7,25-7,36 (1H, м), 7,85-7,98 (1H, м), 8,32 (1H, дд, J=4,6, 1,5 Гц).
МС (m/z): 144 (М++H).
Пример 98: 2-хлор-3-(4-хлорфенилсульфонилметил)пиридин
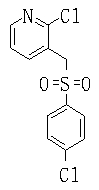
Раствор в хлороформе (10 мл) (2-хлорпиридин-3-ил)метанола (204 мг, 1,42 мл) и тионилхлорида (0,31 мл, 4,26 ммоль) перемешивали при 50оС в течение 8,5 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в бутаноле (15 мл) с последующим добавлением 4-хлорбензолсульфината натрия (423 мг, 2,13 ммоль) и ацетата калия (418 мг, 4,26 ммоль). Смесь перемешивали при 70-80°С в течение 15 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат, смесь промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=2:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (252 мг, 59%) в виде белого твердого вещества.
ИК (ATR) ν: 3093, 2992, 2931, 1579, 1562, 1473, 1450, 1407, 1321, 1278, 1249, 1195, 1153, 1133, 1116, 1083, 1060, 1010, 962, 887, 840, 813, 759, 719, 686, 636, 566, 541, 501, 466, 441 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,54 (2H, с), 7,33 (1H, дд, J=8,8, 4,8 Гц), 7,46 (2H, д, J=8,6 Гц), 7,58 (2H, д, J=8,3 Гц), 7,92 (1H, дд, J=7,7, 1,8 Гц), 8,39 (1H, дд, J=4,8, 1,8 Гц).
МС (m/z): 302 (М++H).
Пример 99: 2-хлор-3-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]пиридин
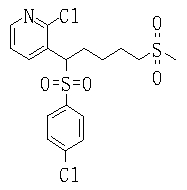
Раствор в толуоле (10 мл) 2-хлор-3-(4-хлорфенилсульфонилметил)пиридина (56 мг, 0, 184 ммоль), 4-(метилсульфонил)-1-бутанола (56 мг, 0,368 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (89 мг, 0,368 ммоль) нагревали при кипячении с обратным холодильником в течение 19 часов в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли 4-(метилсульфонил)-1-бутанол (56 мг, 0,368 ммоль) и цианометилентри-н-бутилфосфоран (89 мг, 0,368 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 5 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:2), концентрировали при пониженном давлении с получением указанного в заголовке соединения (76 мг, 95%) в виде аморфного вещества.
ИК (ATR) ν: 3085, 2931, 1579, 1562, 1475, 1407, 1278, 1184, 1139, 1083, 1012, 962, 908, 821, 752, 732, 690, 626, 574, 520, 466 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,32-1,55 (2H, м), 1,80-1, 99 (2H, м), 2,10-2,25 (1H, м), 2,40-2,63 (1H, м), 2,88 (3H, с), 2,96 (2H, т, J=7,8 Гц), 4,79 (1H, дд, J=11,0, 4,2 Гц), 7,32-7,42 (3H, м), 7,48 (2H, д, J=8,3 Гц), 8,04 (1H, дд, J=7,8, 1,7 Гц), 8,36 (1H, дд, J=4,8, 1,8 Гц).
МС (m/z): 436 (М++H).
HRMS (FAB) для C17H20O4NCl2S2(М++H).
Вычислено: 436,0211.
Найдено: 436,0195.
Ссылочный пример 11: (2-фторпиридин-3-ил)метанол
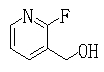
При охлаждении на льду триметилсилилдиазометан (0,72 мл) добавляли к раствору 2-фторникотиновой кислоты (210 мг, 1,49 ммоль) в тетрагидрофуране (15 мл) и метаноле (1 мл), и смесь перемешивали в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=4:1), концентрировали при пониженном давлении.
При -78°С диизобутилалюминийгидрид (1,0 М раствор в толуоле; 1,60 мл) добавляли по каплям к раствору в метиленхлориде (10 мл) остатка (95 мг, 0,612 ммоль). Спустя пятнадцать минут реакционную смесь охлаждали на льду и перемешивали в течение 15 минут. После подтверждения завершения реакции к реакционной смеси добавляли насыщенный раствор соли, и температуре полученной смеси давали повыситься опять до комнатной температуры. Реакционную смесь фильтровали через целит. Фильтрат сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=2:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (55 мг, 71%) в виде белого твердого вещества.
ИК (ATR) ν: 3338, 2873, 1650, 1608, 1430, 1365, 1241, 1176, 1108, 1045, 1020, 858, 800, 775, 744, 619, 572, 539, 520 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,78 (2H, с), 7,18-7,25 (1H, м), 7,85-7,97 (1H, м), 8,14 (1H, д, J=4,9 Гц).
МС (m/z): 128 (М++H).
Пример 100: 3-(4-хлорфенилсульфонилметил)-2-фторпиридин
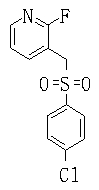
Раствор в хлороформе (10 мл) (2-фторпиридин-3-ил)метанола (49 мг, 0,385 мл) и тионилхлорида (0,14 мл, 1,93 ммоль) перемешивали при 50°С в течение 3,5 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный таким образом остаток растворяли в бутаноле (5 мл) с последующим добавлением 4-хлорбензолсульфината натрия (92 мг, 0,462 ммоль) и ацетата калия (76 мг, 0,770 ммоль). Смесь перемешивали при 70-80°С в течение 12 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат, смесь промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=2:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (59 мг, 54%) в виде белого твердого вещества.
ИК (ATR) ν: 3097, 2989, 2933, 1643, 1606, 1573, 1469, 1434, 1409, 1392, 1321, 1276, 1240, 1184, 1170, 1149, 1083, 1010, 956, 902, 842, 813, 779, 763, 725, 696, 640, 582, 541, 522, 480, 445 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,38 (2H, с), 7,21-7,30 (1H, м), 7,47 (2H, д, J=8,8 Гц), 7,61 (2H, д, J=8,8 Гц), 7,87-7,94 (1H, м), 8,19-8,25 (1H, м).
МС (m/z): 286 (М++H).
Пример 101: 3-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]-2-фторпиридин
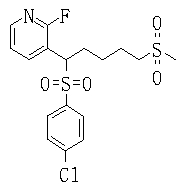
Раствор в толуоле (10 мл) 3-(4-хлорфенилсульфонилметил)-2-фторпиридина (53 мг, 0,185 ммоль), 4-(метилсульфонил)-1-бутанола (56 мг, 0,370 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (89 мг, 0,370 ммоль) нагревали при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:2), концентрировали при пониженном давлении с получением указанного в заголовке соединения (42 мг, 54%) в виде аморфного вещества.
ИК (ATR) ν: 3089, 2950, 2865, 1604, 1573, 1467, 1434, 1394, 1313, 1290, 1270, 1249, 1199, 1147, 1126, 1083, 1012, 960, 906, 854, 815, 757, 738, 703, 628, 576, 536, 464, 437 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,38-1,55 (2H, м), 1,85-1,99 (2H, м), 2,14-2,28 (1H, м), 2,45-2,60 (1H, м), 2,88 (3H, с), 2,96 (2H, т, J=7,8 Гц), 4,46 (1H, дд, J=11,2, 4,2 Гц), 7,25-7,32 (1H, м), 7,41 (2H, д, J=8, 6 Гц), 7,50 (2H, д, J=8,3 Гц), 7,98-8,04 (1H, м), 8,20 (1H, д, J=4,9 Гц).
МС (m/z): 420 (М++H).
HRMS (FAB) для C17H20O4 NClFS2(М++H).
Вычислено: 420,0506.
Найдено: 420,0509.
Пример 102: 2,5-дихлор-3-(4-хлорфенилсульфонилметил)пиридин
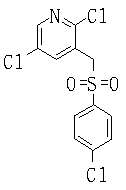
При -78°С диизобутилалюминийгидрид (1 М раствор в гексане; 1,92 мл) добавляли по каплям к раствору в метиленхлориде (10 мл) метил-2,5-дихлорникотината (188 мг, 0,912 ммоль). Полученную смесь перемешивали в течение 30 минут. К реакционной смеси добавляли насыщенный раствор соли и смесь фильтровали через целит. Фильтрат сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=3:1), концентрировали при пониженном давлении. К раствору в хлороформе (10 мл) остатка (128 мг) добавляли тионилхлорид (0,26 мл, 3,60 ммоль) с последующим перемешиванием при 50оС в течение 6,5 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в бутаноле (10 мл). К полученному раствору добавляли 4-хлорбензолсульфинат натрия (171 мг, 0,863 ммоль) и ацетат калия (212 мг, 2,16 ммоль), и смесь перемешивали при 70оС в течение 19 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат, смесь промывали последовательно водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Полученное твердое вещество промывали смесью гексан-диизопропиловый эфир и собирали фильтрованием с получением указанного в заголовке соединения (108 мг, 36%) в виде белого порошка.
ИК (ATR) ν: 3091, 3064, 2998, 2933, 1581, 1550, 1473, 1419, 1392, 1317, 1280, 1255, 1234, 1170, 1135, 1085, 1068, 1010, 910, 833, 821, 767, 727, 709, 646, 582, 539, 507, 464, 430 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,49 (2H, с), 7,49 (2H, д, J=8,6 Гц), 7,62 (2H, д, J=8,8 Гц), 7,90 (1H, д, J=2,5 Гц), 8,35 (1H, д, J=2,5 Гц).
МС (m/z): 336 (М++H).
Пример 103: 2,5-дихлор-3-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]пиридин
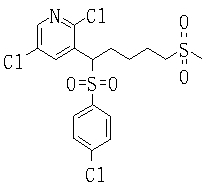
Раствор в толуоле (10 мл) 2,5-дихлор-3-(4-хлорфенилсульфонилметил)пиридина (70 мг, 0,208 ммоль), 4-(метилсульфонил)-1-бутанола (95 мг, 0,624 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (151 мг, 0,624 ммоль) нагревали при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (74 мг, 76%) в виде аморфного вещества.
ИК (ATR) ν: 3091, 3060, 2931, 1581, 1546, 1475, 1413, 1313, 1278, 1209, 1124, 1083, 1049, 1012, 964, 906, 871, 831, 754, 705, 628, 588, 532, 468 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,38-1,52 (2H, м), 1,83-1,98 (2H, м), 2,08-2,20 (1H, м), 2,49-2,60 (1H, м), 2,88 (3H, с), 2,97 (2H, т, J=7,8 Гц), 4,72 (1H, дд, J=10,9, 4,0 Гц), 7,43 (2H, д, J=8,6 Гц), 7,53 (2H, д, J=8,6 Гц), 8,00 (1H, д, J=2,5 Гц), 8,31 (1H, д, J=2,5 Гц).
МС (m/z): 470 (М++H).
Элементный анализ для C17H18Cl3NO4 S2·0,25H2O.
Вычислено: C 42,96%; H 3,92%; Cl 22,38%; N 2,95%; S 13,49%.
Найдено: C 43,02%; H 3,81%; Cl 22,54%; N 3,01%; S 13,50%.
Пример 104: 4-хлор-3-(4-хлорфенилсульфонилметил)пиридин
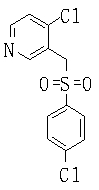
Суспензию в тетрахлориде углерода (15 мл) гидрохлорида 4-хлор-3-метилпиридина (402 мг, 2,45 ммоль), имида N-хлорянтарной кислоты (327 мг, 2,45 ммоль) и 2,2'-азобис(2-метилпропионитрила) (30 мг, 0,183 ммоль) нагревали при кипячении с обратным холодильником в течение 13 часов в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в бутаноле (10 мл) с последующим добавлением 4-хлорбензолсульфината натрия (487 мг, 2,45 ммоль) и ацетата калия (481 мг, 4,90 ммоль). Смесь перемешивали при 70°С в течение 24 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат. Смесь промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и затем сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=2:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (130 мг, 18%) в виде белого твердого вещества.
ИК (ATR) ν: 3060, 2917, 1708, 1573, 1556, 1475, 1413, 1403, 1311, 1280, 1232, 1189, 1155, 1120, 1079, 1012, 933, 890, 854, 833, 817, 777, 744, 721, 694, 632, 574, 557, 514, 460 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,56 (2H, с), 7,28 (1H, д, J=5,4 Гц), 7,48 (2H, д, J=8,3 Гц), 7,63 (2H, д, J=8,5 Гц), 8,49 (1H, д, J=5,4 Гц), 8,54 (1H, с).
МС (m/z): 302 (М++H).
Пример 105: 4-хлор-3-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]пиридин
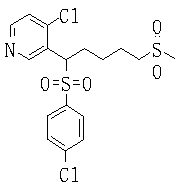
Раствор в толуоле (10 мл) 4-хлор-3-(4-хлорфенилсульфонилметил)пиридина (80 мг, 0,265 ммоль), 4-(метилсульфонил)-1-бутанола (81 мг, 0,529 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (128 мг, 0,529 ммоль) нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:5), концентрировали при пониженном давлении с получением указанного в заголовке соединения (74 мг, 64%) в виде белого твердого вещества. Полученное твердое вещество промывали эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 156-157°С.
ИК (ATR) ν: 3087, 3064, 3018, 2933, 1571, 1473, 1409, 1311, 1270, 1207, 1149, 1076, 1014, 968, 906, 831, 794, 752, 700, 617, 576, 536, 497, 466 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,35-1, 60 (2H, м), 1,80-1,99 (2H, м), 2,20-2,33 (1H, м), 2,51-2,65 (1H, м), 2,88 (3H, с), 2,90-3,00 (2H, м), 4,80 (1H, дд, J=10,9, 3,8 Гц), 7,20 (1H, д, J=5,4 Гц), 7,40 (2H, д, J=8,5 Гц), 7,52 (2H, д, J=8,6 Гц), 8,46 (1H, д, J=5,4 Гц), 8,80 (1H, с).
МС (m/z): 436 (М++H).
Элементный анализ для C17H19Cl2NO4S2 .
Вычислено: C 46,79%; H 4,39%; Cl 16,25%; N 3,21%; S 14,70%.
Найдено: C 46,88%; H 4,40%; Cl 16,14%; N 3,30%; S 14,52%.
Пример 106: 3-[6-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]гексил]-2-хлорпиридин
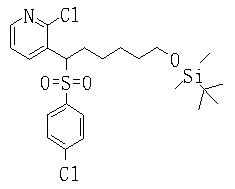
Раствор в толуоле (5 мл) 2-хлор-3-(4-хлорфенилсульфонилметил)пиридина (200 мг, 0,662 ммоль), полученного в примере 98, 5-(трет-бутилдиметилсилилокси)пентанола (288 мг, 1,32 ммоль) и цианометилентри-н-бутилфосфорана (318 мг, 1,32 ммоль) нагревали при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси 15% этилацетат/гексан, концентрировали при пониженном давлении с получением указанного в заголовке соединения (307 мг, 92%) в виде бесцветного масла.
ИК (ATR) ν: 2929, 2856, 1581, 1562, 1473, 1409, 1394, 1359, 1321, 1278, 1253, 1184, 1149, 1083, 1058, 1012, 985, 921, 833, 775, 752, 734, 690, 626, 570, 534, 466 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,01 (6H, с), 0,86 (9H, с), 1,12-1,50 (6H, м), 2,07-2,20 (1H, м), 2,45-2,57 (1H, м), 3,53 (2H, т, J=6,1 Гц), 4,78 (1H, дд, J=11,4, 3,8 Гц), 7,31-7,40 (3H, м), 8,79 (2H, д, J=7,5 Гц), 8,03 (1H, дд, J=7,8, 2,0 Гц), 8,34 (1H, дд, J=4,6, 2,0 Гц).
МС (m/z): 502 (М++H).
Пример 107: 6-(4-хлорфенилсульфонил)-6-(2-хлорпиридин-3-ил)-1-гексанол
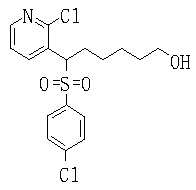
При охлаждении на льду тетрабутиламмонийфторид (1 моль/л раствор в тетрагидрофуране; 0,70 мл) добавляли к раствору в тетрагидрофуране (10 мл) 3-[6-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]гексил]-2-хлорпиридина (294 мг, 0,585 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат, смесь промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (212 мг, 93%) в виде бесцветного масла.
ИК (ATR) ν: 3400, 2933, 2859, 1579, 1562, 1475, 1407, 1394, 1315, 1278, 1184, 1145, 1083, 1058, 1012, 821, 752, 734, 690, 626, 605, 570, 534, 466, 412 см-1.
1 H-ЯМР (400 МГц, CDCl3) δ: 1,15-1,65 (8H, м), 2,07-2,20 (1H, м), 2,47-2,58 (1H, м), 3,59 (2H, т, J=6,4 Гц), 4,79 (1H, дд, J=11,4, 3,8 Гц), 7,30-7,42 (3H, м), 7,48 (2H, д, J=8,8 Гц), 8, 03 (1H, дд, J=7,8, 2,0 Гц), 8,34 (1H, дд, J=4,1, 1,7 Гц).
МС (m/z): 388 (М++H).
HRMS (FAB) для C17H20O3NCl2S (М++H).
Вычислено: 388,0541.
Найдено: 388,0561.
Пример 108: 2-хлор-3-[1-(4-хлорфенилсульфонил)циклогептил]пиридин
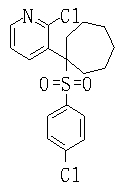
При -78°С бутиллитий (1,57 М раствор в гексане; 0,62 мл, 0,966 ммоль) добавляли по каплям к раствору в диметоксиэтане (5 мл) 2-хлор-3-(4-хлорфенилсульфонилметил)пиридина (146 мг, 0,483 ммоль), полученного в примере 98. При -78°С полученную смесь перемешивали в течение 20 минут с последующим добавлением 1,6-дииодгексана (0,095 мл, 0,580 ммоль). Температуру реакционной смеси повышали постепенно до комнатной температуры, и при комнатной температуре перемешивание проводили в течение 4 часов. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси 15% этилацетат:гексан, концентрировали при пониженном давлении. Полученный таким образом остаток очищали высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота) с получением указанного в заголовке соединения (60 мг, 32%) в виде белого твердого вещества. Полученное твердое вещество промывали смесью гексан-эфир и затем собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 168-169°С.
ИК (ATR) ν: 2929, 2861, 1573, 1558, 1473, 1454, 1394, 1303, 1276, 1139, 1083, 1066, 1008, 840, 800, 748, 711, 646, 613, 574, 522, 470, 412 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1, 30-1,50 (4H, м), 1,50-1,66 (2H, м), 1,85-1,98 (2H, м), 2,33-2,48 (2H, м), 2,94-3,10 (2H, м), 7,28-7,37 (3H, м), 7,40 (2H, д, J=8,8 Гц), 7,93 (1H, дд, J=8,1, 1,7 Гц), 8,38 (1H, дд, J=4,5, 1,8 Гц).
МС (m/z): 384 (М++H).
Элементный анализ для C18H19Cl2NO2S.
Вычислено: C 56,25%; H 4,98%; Cl 18, 45%; N 3,64%; S 8,34%.
Найдено: C 56,20%; H 4,85%; Cl 18,50%; N 3,73%; S 8,46%.
Пример 109: 2-хлор-3-[1-(4-хлорфенилсульфонил)циклогексил]пиридин
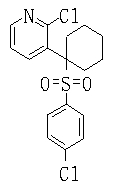
При -78°С бутиллитий (1,57 М раствор в гексане; 0,66 мл, 1,03 ммоль) добавляли по каплям к раствору в диметоксиэтане (5 мл) 2-хлор-3-(4-хлорфенилсульфонилметил)пиридина (156 мг, 0,516 ммоль), полученного в примере 98. При -78°С полученную смесь перемешивали в течение 20 минут с последующим добавлением 1,5-дииодпентана (0,092 мл, 0,619 ммоль). Температуру реакционной смеси повышали постепенно до комнатной температуры, и при комнатной температуре перемешивание проводили в течение 15 часов. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси 15% этилацетат:гексан, концентрировали при пониженном давлении. Полученный таким образом остаток очищали высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота) с получением указанного в заголовке соединения (72 мг, 38%) в виде белого твердого вещества. Полученное твердое вещество промывали смесью гексан-эфир и затем собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 129-131°С.
ИК (ATR) ν: 2929, 2861, 1575, 1558, 1475, 1446, 1392, 1303, 1278, 1143, 1130, 1083, 1054, 1010, 910, 875, 833, 809, 754, 742, 742, 732, 703, 646, 617, 580, 495, 458 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,05-1,30 (2H, м), 1,33-1,50 (1H, м), 1,52-1,70 (1H, м), 1,75-1,90 (2H, м), 2,02-2,30 (2H, м), 2,65-3,60 (2H, м), 7,29-7,39 (3H, м), 7,41 (2H, д, J=8,8 Гц), 8,05 (1H, дд, J=8,1, 1,7 Гц), 8,39 (1H, дд, J=4,5, 1,8 Гц).
МС (m/z): 370 (М++H).
Элементный анализ для C17H17Cl2NO2S.
Вычислено: C 55,14%; H 4,63%; Cl 19,15%; N 3,78%; S 8,66%.
Найдено: C 55,06%; H 4,55%; Cl 19,15%; N 3,87%; S 8,76%.
Пример 110: 4-хлор-3-[1-(4-хлорфенилсульфонил)циклогексил]пиридин
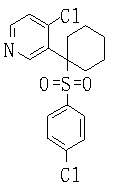
При -78°С бутиллитий (1,57 М раствор в гексане; 0,58 мл, 0,913 ммоль) добавляли по каплям к раствору в диметоксиэтане (5 мл) 4-хлор-3-(4-хлорфенилсульфонилметил)пиридина (138 мг, 0,457 ммоль), полученного в примере 104. При -78°С полученную смесь перемешивали в течение 20 минут и затем добавляли 1,5-дииодпентан (0,068 мл, 0,457 ммоль). Температуру реакционной смеси повышали постепенно до комнатной температуры, и при комнатной температуре перемешивание проводили в течение 17 часов. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=2:1), концентрировали при пониженном давлении. Полученный таким образом остаток очищали высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота) с получением указанного в заголовке соединения (30 мг, 18%) в виде белого твердого вещества. Полученное твердое вещество промывали эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 145-147°С.
ИК (ATR) ν: 2929, 2863, 1579, 1469, 1452, 1392, 1346, 1305, 1280, 1270, 1211, 1143, 1081, 1012, 975, 937, 910, 871, 823, 794, 754, 725, 680, 617, 582, 563, 547, 507, 468 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,10-1,30 (2H, м), 1,32-1,50 (1H, м), 1,60-1,69 (1H, м), 1,78-1,89 (2H, м), 2,01-2,22 (2H, м), 2,70-3,00 (1H, м), 3, 30-3,70 (1H, м), 7,23 (1H, д, J=5,4 Гц), 7,35 (2H, д, J=8,8 Гц), 7,40 (2H, д, J=8,8 Гц), 8,41 (1H, д, J=5,1 Гц), 8,57 (1H, с).
МС (m/z): 370 (М++H).
Элементный анализ для C17H17Cl2NO2S.
Вычислено: C 55,14%; H 4,63%; Cl 19,15%; N 3,78%; S 8,66%.
Найдено: C 54,99%; H 4,61%; Cl 19,06%; N 3,89%; S 8,72%.
Пример 111: 4-(4-хлорфенилсульфонилметил)тиазол
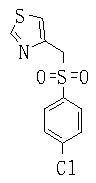
К 1-пропанолу (10 мл) добавляли 4-хлорбензолсульфинат натрия (359 мг, 1,81 ммоль), гидрохлорид 4-(хлорметил)тиазола (307 мг, 1,81 ммоль) и ацетат калия (354 мг, 3,61 ммоль), и смесь перемешивали при 70°С в течение 21 часа. После охлаждения реакционной смеси до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат. Смесь промывали последовательно водой и насыщенным раствором соли и затем сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=3:2), концентрировали при пониженном давлении. Полученное твердое вещество промывали смесью гексан-эфир и затем собирали фильтрованием с получением указанного в заголовке соединения (154 мг, 31%) в виде белого порошка.
ИК (ATR) ν: 3102, 2969, 2917, 1575, 1504, 1473, 1413, 1396, 1334, 1309, 1257, 1220, 1159, 1122, 1081, 1012, 948, 898, 875, 831, 821, 784, 723, 657, 593, 561, 541, 478, 451, 418 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,64 (2H, с), 7,40-7,50 (3H, м), 7,62 (2H, д, J=8,8 Гц), 8,66 (1H, с).
МС (m/z): 274 (М++H).
Пример 112: 4-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]тиазол
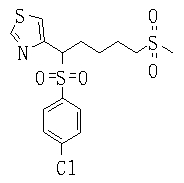
К бутанолу (5 мл) добавляли 4-хлорбензолсульфинат натрия (113 мг, 0,569 ммоль), гидрохлорид 4-(хлорметил)тиазола (97 мг, 0,569 ммоль) и ацетат калия (112 мг, 1,14 ммоль), и полученную смесь перемешивали при 70°С в течение 11 часов. После охлаждения реакционной смеси до комнатной температуры растворитель концентрировали при пониженном давлении. К остатку добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия и затем сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Раствор в толуоле (10 мл) полученного остатка, 4-(метилсульфонил)-1-бутанола (130 мг, 0,853 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (206 мг, 0,853 ммоль) нагревали при кипячении с обратным холодильником в течение 15 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:3), концентрировали при пониженном давлении с получением указанного в заголовке соединения (111 мг, 48%) в виде белого твердого вещества. Белое твердое вещество промывали смесью гексан-эфир и затем собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 123-125°С.
ИК (ATR) ν: 3102, 2937, 1581, 1508, 1475, 1421, 1392, 1311, 1295, 1274, 1234, 1197, 1145, 1130, 1085, 1014, 964, 931, 877, 850, 821, 767, 750, 709, 665, 557, 530, 487, 455, 420 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,35-1,55 (2H, м), 1,80-1,98 (2H, м), 2,24-2,39 (1H, м), 2, 39-2,50 (1H, м), 2,87 (3H, с), 2,91-3,01 (2H, м), 4,48 (1H, дд, J=11,2, 3,9 Гц), 7,38-7,45 (3H, м), 7,47 (2H, д, J=8,6 Гц), 8,65 (1H, с).
МС (m/z): 408 (М++H).
Элементный анализ для C15H18ClNO4S3.
Вычислено: C 44,16%; H 4,45%; Cl 8,69%; N 3,43%; S 23,58%.
Найдено: C 44, 25%; H 4,34%; Cl 8,58%; N 3,54%; S 23,82%.
Пример 113: 5-(4-хлорфенилсульфонилметил)тиазол
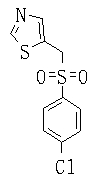
Суспензию в тетрахлориде углерода (15 мл) 5-метилтиазола (380 мг, 3,83 ммоль), имида N-хлорянтарной кислоты (511 мг, 0,383 ммоль), 2, 2'-азобис(2-метилпропионитрила) (62 мг, 0,380 ммоль) и уксусной кислоты (0,22 мл, 3,83 ммоль) нагревали при кипячении с обратным холодильником в течение 18 часов в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Полученный остаток растворяли в бутаноле (10 мл). К полученному раствору добавляли 4-хлорбензолсульфинат натрия (761 мг, 3,83 ммоль) и ацетат калия (376 мг, 3,83 ммоль) с последующим перемешиванием при 70°С в течение 23 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат. Смесь промывали последовательно водой и насыщенным раствором соли и затем сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (76 мг, 7,2%) в виде бледно-желтого твердого вещества.
ИК (ATR) ν: 3085, 2975, 2915, 1671, 1577, 1521, 1473, 1392, 1313, 1253, 1193, 1143, 1081, 1012, 968, 894, 873, 836, 773, 728, 705, 651, 620, 605, 565, 543, 476, 443 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,57 (2H, с), 7,49 (2H, д, J=8,8 Гц), 7,57 (1H, с), 7,65 (2H, д, J=8,6 Гц), 8,81 (1H, с).
МС (m/z): 274 (М++H).
Пример 114: 5-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]тиазол
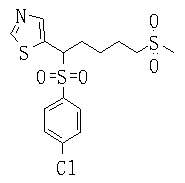
Раствор в толуоле (10 мл) 5-(4-хлорфенилсульфонилметил)тиазола (51 мг, 0,186 ммоль), 4-(метилсульфонил)-1-бутанола (57 мг, 0,372 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (90 мг, 0,372 ммоль) нагревали при кипячении с обратным холодильником в течение 21 часа в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси метиленхлорид:этилацетат (=1:2), концентрировали при пониженном давлении с получением указанного в заголовке соединения (53 мг, 70%) в виде белого твердого вещества. Полученное твердое вещество промывали смесью гексан-эфир и затем фильтровали с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 95-96°С.
ИК (ATR) ν: 3099, 3021, 2942, 1575, 1513, 1473, 1392, 1351, 1299, 1272, 1240, 1201, 1174, 1137, 1085, 1012, 966, 914, 873, 827, 777, 746, 703, 634, 613, 566, 528, 470 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,445-1,60 (2H, м), 1,81-1, 99 (2H, м), 2,00-2,12 (1H, м), 2,50-2,61 (1H, м), 2,89 (3H, с), 2,92-3,01 (2H, м), 4,41 (1H, дд, J=11,1, 3,5 Гц), 7,43 (2H, д, J=8,5 Гц), 7,47 (1H, с), 7,52 (2H, д, J=8,5 Гц), 8,82 (1H, с).
МС (m/z): 408 (М++H).
Элементный анализ для C15H18ClNO4S3.
Вычислено: C 44,16%; H 4,45%; Cl 8,69%; N 3,43%; S 23,58%.
Найдено: C 44,44%; H 4,38%; Cl 8,75%; N 3,53%; S 23,41%.
Ссылочный пример 12: Тиазол-2-метанол
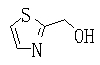
При перемешивании с охлаждением на льду боргидрид натрия (242 мг, 6,40 ммоль) добавляли к раствору в метаноле (10 мл) 2-формилтиазола (483 мг, 4,27 ммоль). После подтверждения завершения реакции к реакционной смеси добавляли воду. Полученную смесь концентрировали при пониженном давлении. К остатку добавляли воду и этилацетат для отделения органического слоя. Органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (324 мг, 66%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 3,30-3,70 (1H, м), 5,14 (2H, с), 7, 32 (1H, д, J=3,4 Гц), 7,74 (1H, д, J=3,2 Гц).
МС (m/z): 116 (М++H).
Пример 115: 2-(4-хлорфенилсульфонилметил)тиазол
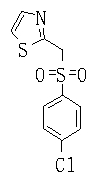
К раствору в хлороформе (15 мл) тиазол-2-метанола (171 мг, 1,49 мл) добавляли тионилхлорид (0,33 мл, 4,47 ммоль) и полученную смесь перемешивали при 50°С в течение 11 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в бутаноле (10 мл). К полученному раствору добавляли 4-хлорбензолсульфинат натрия (296 мг, 1,49 ммоль) и ацетат калия (292 мг, 2,98 ммоль). Смесь перемешивали при 70°С в течение 24 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат. Смесь промывали последовательно водой и насыщенным раствором соли и затем сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (169 мг, 41%) в виде бледно-желтого твердого вещества.
ИК (ATR) ν: 2967, 2913, 1573, 1498, 1475, 1394, 1317, 1280, 1218, 1184, 1147, 1081, 1062, 1012, 966, 887, 825, 775, 763, 730, 700, 630, 599, 563, 549, 478, 447 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,79 (2H, с), 7,42 (1H, д, J=3,2 Гц), 7,47 (2H, д, J=8,6 Гц), 7,64 (2H, д, J=8,8 Гц), 7,72 (1H, д, J=3,4 Гц).
МС (m/z): 274 (М++H).
Пример 116: 2-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]тиазол
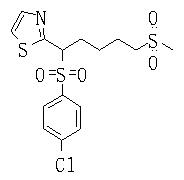
Раствор в толуоле (10 мл) 2-(4-хлорфенилсульфонилметил)тиазола (75 мг, 0,274 ммоль), 4-(метилсульфонил)-1-бутанола (83 мг, 0,548 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (132 мг, 0,548 ммоль) нагревали при кипячении с обратным холодильником в течение 20 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси метиленхлорид:этилацетат (=1:2), концентрировали при пониженном давлении с получением указанного в заголовке соединения (87 мг, 78%) в виде белого твердого вещества. Полученное твердое вещество промывали эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 118-119°С.
ИК (ATR) ν: 3137, 3006, 2913, 1583, 1496, 1471, 1388, 1357, 1315, 1284, 1238, 1203, 1135, 1083, 1043, 1010, 975, 877, 842, 804, 765, 736, 705, 642, 601, 572, 526, 468, 439 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,40-1,62 (2H, м), 1,80-1,99 (2H, м), 2,22-2,35 (1H, м), 2,48-2,58 (1H, м), 2,88 (3H, с), 2,92-3,00 (2H, м), 4,61 (1H, дд, J=11,2, 3,7 Гц), 7,39-7,47 (3H, м), 7,51 (2H, д, J=8,5 Гц), 7,68 (1H, д, J=3,4 Гц).
МС (m/z): 408 (М++H).
Элементный анализ для C15H18ClNO4S3.
Вычислено: C 44,16%; H 4,45%; Cl 8,69%; N 3,43%; S 23,58%.
Найдено: C 44,32%; H 4,40%; Cl 8,74%; N 3,54%; S 24,04%.
Пример 117: 5-(4-хлорфенилсульфонилметил)оксазол
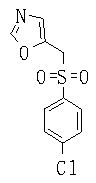
Тионилхлорид (188 мкл, 2,57 ммоль) добавляли к раствору в хлороформе (10 мл) оксалол-5-илметанола (85 мг, 0,858 ммоль). Полученную смесь перемешивали при 50°С в течение 1,5 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный таким образом остаток растворяли в бутаноле (10 мл). К полученному раствору добавляли 4-хлорбензолсульфинат натрия (170 мг, 0,858 ммоль), ацетат калия (252 мг, 2,57 ммоль) и тетрабутиламмонийиодид (15 мг) с последующим перемешиванием при 70°С в течение 3 дней. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат. Смесь промывали последовательно водой и насыщенным раствором соли и затем сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (81 мг, 37%) в виде белого твердого вещества.
ИК (ATR) ν: 3141, 3085, 2983, 2921, 1475, 1506, 1490, 1475, 1396, 1319, 1284, 1263, 1213, 1178, 1151, 1110, 968, 923, 869, 823, 769, 746, 700, 644, 559, 541, 482, 455, 422 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 4,47 (2H, с), 7,02 (1H, с), 7,52 (2H, д, J=8,8 Гц), 7,70 (2H, д, J=8,8 Гц), 7,82 (1H, с).
МС (m/z): 258 (М++H).
Пример 118: 5-[1-(4-хлорфенилсульфонил)-5-(метилсульфонил)пентил]оксазол
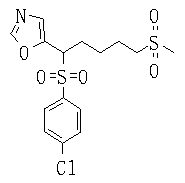
Раствор в толуоле (10 мл) 5-(4-хлорфенилсульфонилметил)оксазола (65 мг, 0,504 ммоль), 4-(метилсульфонил)-1-бутанола (77 мг, 0,504 ммоль), полученного в ссылочном примере 3, и цианометилентри-н-бутилфосфорана (122 мг, 0,504 ммоль) нагревали при кипячении с обратным холодильником в течение 15 часов в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли 4-(метилсульфонил)-1-бутанол (77 мг, 0,504 ммоль), полученный в ссылочном примере 3, и цианометилентри-н-бутилфосфоран (122 мг, 0,504 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 25 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=1:3), концентрировали при пониженном давлении с получением указанного в заголовке соединения (82 мг, 83%) в виде белого твердого вещества. Полученное белое твердое вещество промывали гексаном и затем собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 164-166°С.
ИК (ATR) ν: 3139, 2937, 1583, 1504, 1475, 1394, 1311, 1276, 1193, 1147, 1128, 1108, 1085, 1054, 1012, 968, 946, 919, 871, 854, 831, 771, 754, 707, 649, 622, 553, 532, 491, 462 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,43-1,60 (2H, м), 1,80-1,99 (2H, м), 2,06-2,20 (1H, м), 2,39-2, 49 (1H, м), 2,89 (3H, с), 2,94-3,01 (2H, м), 4,29 (1H, дд, J=11,1, 4,0 Гц), 6,96 (1H, с), 7,48 (2H, д, J=8,3 Гц), 7,57 (2H, д, J=8,6 Гц), 7,79 (1H, с).
МС (m/z): 392 (М+ +H).
Элементный анализ для C15H18ClNO5S2.
Вычислено: C 45,97%; H 4,63%; Cl 9,05%; N 3,57%; S 16,36%.
Найдено: C 45,98%; H 4,79%; Cl 8,96%; N 3,66%; S 16,29%.
Пример 119: 4-(4-хлорфенилсульфонилметил)пиридин
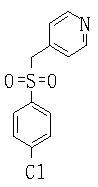
При нагревании раствор в 1-пропаноле (50 мл) гидрохлорида 4-хлорметилпиридина (1,26 г, 7,65 ммоль), 4-хлорбензолсульфината натрия (1,52 г, 7,65 ммоль) и ацетата калия (1,50 г, 15,3 ммоль) перемешивали при 70°С в течение 8 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток фильтровали через короткую колонку (силикагель, этилацетат), и элюат концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=2:3), концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,26 г, 62%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 4,29 (2H, с), 7,06 (2H, д, J=6,1 Гц), 7,47 (2H, д, J=8,8 Гц), 7,59 (2H, д, J=8,5 Гц), 8,57 (2H, д, J=6,1 Гц).
МС (m/z): 268 (М++H).
Пример 120: 4-[1-(4-хлорфенилсульфонил)пентил]пиридин
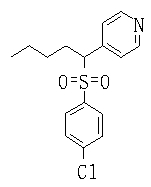
При -78°С бутиллитий (1,57 М раствор в гексане; 0,29 мл, 0,448 ммоль) добавляли по каплям к раствору в тетрагидрофуране (5 мл) 4-(4-хлорфенилсульфонилметил)пиридина (100 мг, 0,374 ммоль). При -78°С полученную смесь перемешивали в течение 10 минут. Затем добавляли иодбутан (51 мкл, 0,448 ммоль). Температуру реакционной смеси повышали постепенно до комнатной температуры, и при комнатной температуре перемешивание проводили в течение 16 часов. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли и затем сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=2:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (76 мг, 63%) в виде белого твердого вещества. Полученное твердое вещество промывали смесью гексан-эфир и затем собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 109-111° С.
ИК (ATR) ν: 2933, 2859, 1596, 1575, 1558, 1473, 1415, 1392, 1322, 1280, 1238, 1209, 1172, 1145, 1083, 1010, 991, 970, 885, 844, 821, 767, 754, 730, 703, 667, 630, 599, 565, 520, 466, 410 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,84 (3H, т, J=7,3 Гц), 1,09-1,40 (4H, м), 2,07-2,10 (1H, м), 2,37-2,49 (1H, м), 3,98 (1H, дд, J=11,6, 3,5 Гц), 7,06 (1H, д, J=6,1 Гц), 7,39 (2H, д, J=8,8 Гц), 7,48 (2H, д, J=8,6 Гц), 8,53 (2H, д, J=6,1 Гц).
МС (m/z): 324 (М++H).
Элементный анализ для C16H18ClNO2S.
Вычислено: C 59,34%; H 5,60%; Cl 10,95%; N 4,33%; S 9,90%.
Найдено: C 59,41%; H 5,54%; Cl 11,18%; N 4,47%; S 10, 09%.
Пример 121: 4-[(4-хлорфенилсульфонил)(циклопентил)метил]пиридин
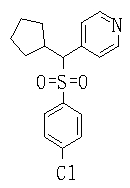
Раствор в толуоле (5 мл) 4-(4-хлорфенилсульфонилметил)пиридина (70 мг, 0,261 ммоль), полученного в примере 119, циклопентанола (49 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфорана (129 мг, 0,538 ммоль) нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли циклопентанол (49 мкл, 0, 538 ммоль) и цианометилентри-н-бутилфосфоран (129 мг, 0,538 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=2:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (77 мг, 88%) в виде белого твердого вещества. Полученное белое твердое вещество промывали смесью гексан-эфир и собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 133-135°С.
ИК (ATR) ν: 2960, 2867, 1594, 1577, 1558, 1473, 1415, 1392, 1342, 1319, 1278, 1224, 1143, 1083, 1010, 993, 954, 902, 840, 821, 767, 750, 705, 642, 592, 551, 507, 464 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 0,92-1,08 (1H, м), 1,44-1,83 (6H, м), 2,33-2,45 (1H, м), 2,78-2,90 (1H, м), 3,88 (1H, д, J=10,3 Гц), 7,03 (2H, д, J=5,1 Гц), 7,32 (2H, д, J=8,6 Гц), 7,43 (2H, д, J=8,6 Гц), 8,46 (2H, д, J=5,6 Гц).
МС (m/z): 336 (М++H).
Элементный анализ для C17H18ClNO2 S.
Вычислено: C 60,80%; H 5,40%; Cl 10,56%; N 4,17%; S 9,55%.
Найдено: C 60,76%; H 5,44%; Cl 10,68%; N 4,20%; S 9,61%.
Пример 122: 4-[(4-хлорфенилсульфонил)(тетрагидропиран-4-ил)метил]пиридин
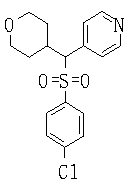
Раствор в толуоле (5 мл) 4-(4-хлорфенилсульфонилметил)пиридина (70 мг, 0,261 ммоль), полученного в примере 119, тетрагидропиран-4-ола (51 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфорана (129 мг, 0,538 ммоль) нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли тетрагидропиран-4-ол (51 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфоран (129 мг, 0,538 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=2:1), концентрировали при пониженном давлении с получением указанного в заголовке соединения (65 мг, 71%) в виде белого твердого вещества. Полученное белое твердое вещество промывали смесью гексан-эфир и собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 208-209°С.
ИК (ATR) ν: 2846, 1594, 1573, 1560, 1475, 1440, 1417, 1394, 1371, 1315, 1278, 1245, 1211, 1180, 1143, 1083, 989, 877, 835, 773, 752, 703, 630, 603, 565, 524, 478, 451 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,22-1,42 (2H, м), 1,60-1,75 (1H, м), 2,30-2,40 (1H, м), 2,78-3,01 (1H, м), 3,41 (1H, тд, J=11,7, 2,4 Гц), 3,51 (1H, тд, J=11,9, 2,0 Гц), 3,80-3,93 (1H, м), 3,87 (1H, д, J=8,6 Гц), 3,98-4,06 (1H, м), 7,00-7,12 (2H, м), 7,30 (2H, д, J=8,8 Гц), 7,43 (2H, д, J=8,6 Гц), 8,47 (2H, д, J=5,4 Гц).
МС (m/z): 352 (М++H).
Пример 123: 4-[(1-бензилпиперидин-4-ил)(4-хлорфенилсульфонил)метил]пиридин
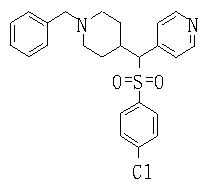
Раствор в толуоле (5 мл) 4-(4-хлорфенилсульфонилметил)пиридина (70 мг, 0,261 ммоль), полученного в примере 119, 1-бензилпиперидин-4-ола (103 мг, 0,538 ммоль) и цианометилентри-н-бутилфосфорана (129 мг, 0,538 ммоль) нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли 1-бензилпиперидин-4-ол (103 мг, 0,538 ммоль) и цианометилентри-н-бутилфосфоран (129 мг, 0,538 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси метанол:метиленхлорид (=1:10), концентрировали при пониженном давлении. Полученный таким образом остаток очищали высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота) с получением указанного в заголовке соединения (40 мг, 35%) в виде аморфного вещества.
ИК (ATR) ν: 2938, 2803, 2763, 1594, 1560, 1475, 1452, 1415, 1367, 1317, 1280, 1218, 1176, 1143, 1085, 1012, 975, 825, 750, 742, 698, 617, 566, 536, 464 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,21-1,37 (2H, м), 1,49-1,70 (1H, м), 1,92-2,01 (1H, м), 2,03-2,14 (1H, м), 2,25-2,35 (1H, м), 2,52-2,65 (1H, м), 2,79-2,85 (1H, м), 2,90-3,00 (1H, м), 3,47 (2H, с), 3,86 (1H, д, J=8,1 Гц), 7,02-7,12 (2H, м), 7,20-7,38 (7H, м), 7,43 (2H, д, J=8,5 Гц), 8,45 (2H, д, J=5,4 Гц).
МС (m/z): 441 (М++H).
HRMS (FAB): в виде C24H26O2N2ClS (М+ +H).
Вычислено: 441,1404.
Найдено: 441,1387.
Пример 124: 4-[(4-хлорфенилсульфонил)(1-метилпиперидин-4-ил)метил]пиридин
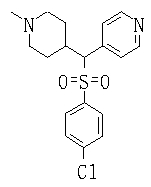
Раствор в толуоле (5 мл) 4-(4-хлорфенилсульфонилметил)пиридина (70 мг, 0,261 ммоль), полученного в примере 119, 1-метилпиперидин-4-ола (62 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфорана (129 мг, 0,538 ммоль) нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли 1-метилпиперидин-4-ол (62 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфоран (129 мг, 0,538 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси метанол:метиленхлорид (=1:50), концентрировали при пониженном давлении. Полученный таким образом остаток очищали высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота) с получением указанного в заголовке соединения (31 мг, 33%) в виде белого твердого вещества. Полученное твердое вещество промывали смесью гексан-эфир и затем собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 176-177°С.
ИК (ATR) ν: 3077, 2935, 2856, 2786, 2740, 1594, 1556, 1465, 1450, 1413, 1380, 1346, 1315, 1280, 1241, 1145, 1085, 1008, 973, 850, 835, 798, 750, 705, 617, 561, 528, 476, 464, 424 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,22-1,38 (2H, м), 1,50-1,68 (1H, м), 1,88-1,99 (1H, м), 2,00-2,10 (1H, м), 2,25 (3H, с), 2,30-2,40 (1H, м), 2,50-2,63 (1H, м), 2,74-2,83 (1H, м), 2,89-2,95 (1H, м), 3,86 (1H, д, J=8,3 Гц), 7,08 (2H, д, J=4,6 Гц), 7,30 (2H, д, J=8,6 Гц), 7,44 (2H, д, J=8,6 Гц), 8,46 (2H, д, J=5,6 Гц).
МС (m/z): 365 (М++H).
Элементный анализ для C18H21ClN2O2S.
Вычислено: C 59,25%; H 5,80%; Cl 9,72%; N 7,68%; S 8,79%.
Найдено: C 59,00%; H 5,76%; Cl 9,75%; N 7,61%; S 8,77%.
Пример 125: 4-(4-хлорфенилсульфонил)-N,N-диметил-4-(пиридин-4-ил)бутиламин
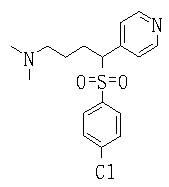
Раствор в толуоле (5 мл) 4-(4-хлорфенилсульфонилметил)пиридина (70 мг, 0,261 ммоль), полученного в примере 119, 3-диметиламино-1-пропанола (62 мкл, 0, 538 ммоль) и цианометилентри-н-бутилфосфорана (129 мг, 0,538 ммоль) нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли 3-диметиламинопропан-1-ол (62 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфоран (129 мг, 0,538 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси метанол:метиленхлорид (=1:10), концентрировали при пониженном давлении. Полученный таким образом остаток очищали высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота) с получением указанного в заголовке соединения (44 мг, 48%) в виде белого твердого вещества. Полученное твердое вещество промывали смесью гексан-эфир и затем собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 78-80°С.
ИК (ATR) ν: 3089, 2985, 2937, 2809, 2757, 2596, 1587, 1455, 1413, 1392, 1322, 1278, 1203, 1145, 1083, 1041, 1010, 991, 962, 846, 821, 767, 754, 703, 628, 578, 539, 514, 472 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 1,38-1,43 (2H, м), 2,05-2,29 (3H, м), 2,11 (6H, с), 2,39-2,50 (1H, м), 4,05-4,13 (1H, м), 7,07 (2H, д, J=6,1 Гц), 7, 40 (2H, д, J=8,5 Гц), 7,48 (2H, д, J=8,6 Гц), 8,53 (2H, д, J=6,1 Гц).
МС (m/z): 353 (М++H).
Элементный анализ для C17H21ClN2O2S.
Вычислено: C 57,86%; H 6,00%; Cl 10,05%; N 7,94%; S 9,09%.
Найдено: C 57,62%; H 5,92%; Cl 9,89%; N 7,91%; S 9,12%.
Пример 126: 3-(4-хлорфенилсульфонил)-N,N-диметил-3-(пиридин-4-ил)пропиламин
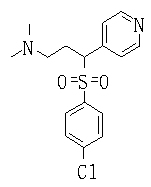
Раствор в толуоле (5 мл) 4-(4-хлорфенилсульфонилметил)пиридина (70 мг, 0,261 ммоль), полученного в примере 119, 2-диметиламиноэтанола (54 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфорана (129 мг, 0,538 ммоль) нагревали при кипячении с обратным холодильником в течение 3 дней в атмосфере аргона. После охлаждения до комнатной температуры к реакционной смеси добавляли 2-диметиламиноэтанол (54 мкл, 0,538 ммоль) и цианометилентри-н-бутилфосфоран (129 мг, 0,538 ммоль) с последующим нагреванием при кипячении с обратным холодильником в течение 22 часов в атмосфере аргона. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси метанол:метиленхлорид (=1:10), концентрировали при пониженном давлении. Полученный таким образом остаток очищали высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота) с получением указанного в заголовке соединения (49 мг, 55%) в виде белого твердого вещества. Полученное твердое вещество промывали смесью гексан-эфир и затем собирали фильтрованием с получением указанного в заголовке соединения в виде белого порошка.
Точка плавления: 91-92°С.
ИК (ATR) ν: 3031, 2975, 2940, 2857, 2821, 2790, 1587, 1575, 1554, 1459, 1413, 1384, 1313, 1280, 1249, 1143, 1083, 1045, 1008, 991, 842, 821, 759, 723, 703, 630, 570, 526, 468 см-1.
1H-ЯМР (400 МГц, CDCl3) δ: 2,05-2,20 (2H, м), 2,11 (6H, с), 2, 59-2,70 (1H, м), 4,35 (1H, дд, J=10,5, 3,2 Гц), 7,11 (2H, д, J=6,1 Гц), 7,39 (2H, д, J=8,6 Гц), 7,59 (2H, д, J=8,6 Гц), 8,53 (2H, д, J=6,1 Гц).
МС (m/z): 339 (М++H).
Элементный анализ для C16H19ClN2O2S.
Вычислено: C 56, 71%; H 5,65%; Cl 10,46%; N 8,27%; S 9,46%,
Найдено: C 56,64%; H 5,61%; Cl 10,51%; N 8,26%; S 9,57%.
Ссылочный пример 13: 2-[(2,5-дифторфенил)гидроксиметил]пиридин
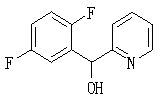
В атмосфере аргона раствор в гексане н-бутиллития (1,53М, 3,92 мл, 6 ммоль) добавляли по каплям к раствору в тетрагидрофуране (10 мл) 2-бромпиридина (572 мкл, 6 ммоль) при -78°С, и смесь перемешивали в течение 30 минут. К полученному коричневому раствору добавляли по каплям 2,5-дифторбензальдегид (655 мкл, 6 ммоль), и температуру смеси постепенно повышали до комнатной температуры. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. После высушивания растворителя остаток, полученный при пониженном давлении, очищали хроматографией на силикагеле с получением указанного в заголовке соединения (120 мг, 9%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 5,45 (1H, шир), 6,08 (1H, с), 6,87-7,15 (3H, м), 7,2-7,3 (2H, м), 7,65 (1H, м), 8,56 (1H, м),
Т.пл.: 65-66°C.
Ссылочный пример 14: Гидрохлорид 2-[хлор-(2,5-дифторфенил)метил]-3-метилпиридина
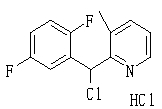
В атмосфере аргона раствор в тетрагидрофуране (1,5 мл, 3 ммоль) изопропилмагнийхлорида добавляли по каплям к раствору в тетрагидрофуране (2 мл) 2-бром-3-метилпиридина (510 мг, 3 ммоль) при охлаждении на льду, и смесь перемешивали при комнатной температуре в течение 60 минут. При охлаждении на льду к полученному коричневому раствору добавляли по каплям 2,5-дифторбензальдегид (328 мкл, 3 ммоль). Затем температуру реакционной смеси постепенно повышали до комнатной температуры. После добавления насыщенного водного раствора хлорида аммония полученную смесь экстрагировали этилацетатом. После высушивания растворителя остаток, полученный концентрированием при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=8:1) с получением смеси, содержащей указанное в заголовке соединение. К полученной смеси добавляли тионилхлорид (2,0 мл) и каплю диметилформамида с последующим перемешиванием при комнатной температуре в течение 14 часов. Дистилляция избытка тионилхлорида при пониженном давлении давала белый осадок. Полученный белый осадок растирали с гексаном и диэтиловым эфиром с получением указанного в заголовке соединения (101 мг, 12%).
1H-ЯМР (400 МГц, CDCl3) δ: 2,37 (3H, с), 6,95-7,10 (2H, м), 7,28 (1H, с), 7,7-7,8 (2H, м), 8,11 (1H, д, J=6,3 Гц), 8,72 (1H, д, J=4,9 Гц).
ИК (ATR) см-1: 1612, 1496, 1294, 1232, 821.
Т.пл.: 118-119°C.
МС m/z: 254 (М++H).
Ссылочный пример 15: 2-[(2,5-дифторфенил)гидроксиметил]-5-метилпиридин
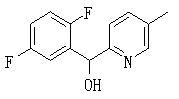
В атмосфере аргона раствор в тетрагидрофуране (1,5 мл, 3 ммоль) изопропилмагнийхлорида добавляли по каплям к раствору в тетрагидрофуране (2 мл) 2-бром-5-метилпиридина (510 мг, 3 ммоль) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 60 минут. При охлаждении на льду к полученному коричневому раствору добавляли по каплям 2,5-дифторбензальдегид (328 мкл, 3 ммоль). Затем температуру реакционной смеси постепенно повышали до комнатной температуры. После добавления насыщенного водного раствора хлорида аммония полученную смесь экстрагировали этилацетатом. После высушивания растворителя остаток, полученный концентрированием при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (130 мг, 18%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 2,31 (3H, с), 5,38 (1H, шир), 6,04 (1H, с), 6,83-7,18 (4H, м), 7,44 (1H, дд, J=2,0, 8,0 Гц), 8,37 (1H, м).
ИК (ATR) см-1: 1485, 1178, 1132, 814.
МС m/z: 236 (М++H).
Ссылочный пример 16: 2-[(2, 5-дифторфенил)гидроксиметил]-4-метилпиридин
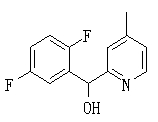
В атмосфере аргона раствор в тетрагидрофуране (1,5 мл, 3 ммоль) изопропилмагнийхлорида добавляли по каплям к раствору в тетрагидрофуране (2 мл) 2-бром-4-метилпиридина (334 мкл, 3 ммоль) при охлаждении на льду, и смесь перемешивали при комнатной температуре в течение 60 минут. При охлаждении на льду к полученному коричневому раствору добавляли по каплям 2,5-дифторбензальдегид (328 мкл, 3 ммоль). Затем температуру реакционной смеси постепенно повышали до комнатной температуры. После добавления насыщенного водного раствора хлорида аммония к реакционной смеси полученную смесь экстрагировали этилацетатом. После высушивания растворителя остаток, полученный концентрированием при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (456 мг, 65%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 2,30 (3H, с), 5,48 (1H, шир.с), 6,02 (1H, с), 6,83-7,13 (5H, м), 8,38 (1H, м).
ИК (ATR) см-1: 3162, 1610, 1481, 1054, 825.
Т.пл.: 105-106°C.
МС m/z: 236 (М++H).
Ссылочный пример 17: 2-бром-3-метоксипиридин
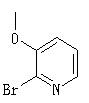
В атмосфере азота 60% масляную дисперсию гидрида натрия (605 мг, 15,1 ммоль) добавляли порциями к метанолу (10 мл) при охлаждении на льду. Спустя двадцать минут к полученной смеси добавляли раствор в диметилформамиде (20 мл) 2-бром-3-гидроксипиридина (2,5 г, 14,4 ммоль). Реакционную смесь отгоняли при пониженном давлении для удаления метанола и к остатку добавляли метилиодид (0,94 мл, 15,1 ммоль). Смесь перемешивали при комнатной температуре в течение 3 часов.
После концентрирования реакционной смеси досуха к остатку добавляли воду (50 мл) и эфир (50 мл). Органический слой, полученный разделением слоев, промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Экстракт сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Затем остаток очищали хроматографией на силикагеле (гексан:этилацетат=8:1) с получением указанного в заголовке соединения (1,51 г, 56%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 3,90 (3H, с), 7,12 (1H, м), 7,21 (1H, дд, J=4,8, 8,0 Гц), 7,97 (1H, м).
ИК (ATR) см-1: 1556, 1410, 1076, 1049, 788.
Т.пл.: 34°C.
Ссылочный пример 18: 3-аллилокси-2-бромпиридин
Подобно методике, используемой для синтеза 2-бром-3-метоксипиридина, указанное в заголовке соединение (2,35 г, 76%) получали в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 4,62 (2H, м), 5,33 (1H, дд, J=1,2, 10,4 Гц), 5,47 (1H, дд, J=1,2, 17,6 Гц), 6,06 (1H, м), 7,11 (1H, дд, J=1,2 Гц, 8,0 Гц), 7,18 (1H, дд, J=4,8, 8,0 Гц), 7,98 (1H, м).
ИК (ATR) см-1: 1562, 1408, 1282, 1052, 790.
МС m/z: 215 (М++H).
Ссылочный пример 19: 2-[(2, 5-дифторфенил)гидроксиметил]-3-метоксипиридин
В атмосфере аргона раствор в тетрагидрофуране (1,5 мл, 3 ммоль) изопропилмагнийхлорида добавляли по каплям к раствору в тетрагидрофуране (2 мл) 2-бром-3-метилпиридина (564 мг, 3 ммоль) при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 60 минут. При охлаждении на льду к полученному коричневому раствору добавляли по каплям 2,5-дифторбензальдегид (328 мкл, 3 ммоль). Затем температуру реакционной смеси постепенно повышали до комнатной температуры. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония с последующей экстракцией этилацетатом. Растворитель сушили с последующим концентрированием при пониженном давлении с получением игольчатых кристаллов. Полученные игольчатые кристаллы растирали с гексаном с получением указанного в заголовке соединения (660 мг, 88%).
1H-ЯМР (400 МГц, CDCl3) δ: 3,71 (3H, с), 5,56 (1H, шир, J=6,0 Гц), 6,16 (1H, д, J=6,0 Гц), 6,75-7,00 (3H, м), 7,14 (1H, м), 7,26 (1H, м), 8,18 (1H, м).
ИК (ATR) см-1: 3384, 1577, 1488, 1284, 810.
Т.пл.: 94-95°C.
МС m/z: 252 (М++H).
Ссылочный пример 20: 3-аллилокси-2-[(2,5-дифторфенил)гидроксиметил]пиридин
В атмосфере аргона раствор в тетрагидрофуране (1,5 мл, 3 ммоль) изопропилмагнийхлорида добавляли по каплям к раствору в тетрагидрофуране (2 мл) 3-аллилокси-2-бромпиридина (642 мг, 3 ммоль) при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 60 минут. При охлаждении на льду к полученному коричневому раствору добавляли по каплям 2,5-дифторбензальдегид (328 мкл, 3 ммоль). Затем температуру реакционной смеси постепенно повышали до комнатной температуры. После добавления насыщенного водного раствора хлорида аммония к реакционной смеси полученную смесь экстрагировали этилацетатом. Растворитель сушили с последующим концентрированием при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=4:1) с получением указанного в заголовке соединения (375 мг, 45%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 4,38 (1H, м), 4,44 (1H, м), 5,16 (1H, м), 5,18 (1H, м), 5,61 (1H, шир., J=6,4 Гц), 5,78 (1H, м), 6,17 (1H, д, J=6,0 Гц), 6,73-6,96 (3H, м), 7,10 (1H, м), 7,22 (1H, м), 8,19 (1H, м).
ИК (ATR) см-1: 3367, 1575, 1490, 1276, 1180, 795.
МС m/z: 278 ( М++H).
Ссылочный пример 21: 3-[(2,5-дифторфенил)гидроксиметил]пиридин
В атмосфере аргона раствор в тетрагидрофуране (1,5 мл, 3 ммоль) изопропилмагнийхлорида добавляли по каплям к раствору в тетрагидрофуране (2 мл) 3-бромпиридина (286 мкл, 3 ммоль) при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 60 минут. При охлаждении на льду к полученному коричневому раствору добавляли по каплям 2,5-дифторбензальдегид (328 мкл, 3 ммоль). Затем температуру реакционной смеси постепенно повышали до комнатной температуры. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, и затем смесь экстрагировали этилацетатом. Растворитель сушили с последующим концентрированием при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (296 мг, 45%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 3, 76 (1H, шир.), 6,10 (1H, с), 6,88-6,98 (2H, м), 7,20-7,30 (2H, м), 7,70 (1H, м), 8,42 (1H, д, J=4,8 Гц), 8,53 (1H, м).
ИК (ATR) см-1: 1486, 1429, 1178, 1130, 739, 707.
Т.пл.: 79-80°C.
Ссылочный пример 22: 4-[(2,5-дифторфенил)гидроксиметил]пиридин
Подобно методике ссылочного примера 21, за исключением использования 4-бромпиридина, указанное в заголовке соединение (79 мг, 8%) получали в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 6,08 (1H, с), 6,90-7,00 (2H, м), 7,15 (1H, м), 7,32 (1H, дд, J=1,6, 8,4 Гц), 8,48 (1H, дд, J=1,6, 8,4 Гц).
ИК (ATR) см-1: 1602, 1489, 1415, 1174, 1049, 711.
Т.пл.: 120-121°C.
МС m/z: 221 (М+).
Ссылочный пример 23: 5-[(2,5-дифторфенил)гидроксиметил]пиримидин
Подобно методике ссылочного примера 21, за исключением использования 5-бромпиримидина, указанное в заголовке соединение (117 мг, 18%) получали в виде масла.
1H-ЯМР (400 МГц, CDCl3 ) δ: 6,12 (1H, с), 6,90-7,02 (2H, м), 7,26 (1H, м), 8,70 (2H, с), 9,04 (1H, с).
ИК (ATR) см-1: 3219, 1566, 1489, 1408, 1180, 715.
МС m/z: 205 (М+-OH).
Пример 127: 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]пиридин
2-[(2,5-дифторфенил)гидроксиметил]пиридин (88 мг, 0,40 ммоль), полученный в ссылочном примере 13, растворяли в тионилхлориде (2,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида с последующим перемешиванием в течение 15 часов.
Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, и смесь концентрировали дополнительно. Остаток растворяли в диметилформамиде (5 мл) с последующим добавлением 4-хлорбензолтиола (79 мг, 0,55 ммоль) и карбоната калия (226 мг, 1,64 ммоль) в атмосфере азота. Полученную смесь перемешивали при 50°С в течение 1 часа. После охлаждения до комнатной температуры к реакционной смеси добавляли диэтиловый эфир (50 мл). Смесь промывали водой и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (128 мг, 92%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 5,89 (1H, с), 6,80-7,27 (7H, м), 7,38 (1H, д, J=7,6 Гц), 7,48 (1H, м), 7,65 (1H, м), 8,63 (1H, м).
ИК (ATR) см-1: 1585, 1488, 1432, 1093, 810.
МС m/z: 348 (М++H).
Пример 128: 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-3-метилпиридин
К раствору в диметилформамиде (5 мл) гидрохлорида 2-[хлор(2,5-дифторфенил)метил]-3-метилпиридина (94 мг, 0,32 ммоль), полученного в ссылочном примере 14, добавляли 4-хлорбензолтиол (70 мг, 0,49 ммоль) и карбонат калия (265 мг, 1,92 ммоль) в атмосфере азота. Полученную смесь перемешивали при 50°С в течение 1 часа. После охлаждения до комнатной температуры к реакционной смеси добавляли диэтиловый эфир (50 мл). Полученную смесь промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (103 мг, 89%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 2,21 (3H, с), 5, 87 (1H, с), 6,77 (1H, м), 7,00-7,19 (5H, м), 7,36 (1H, м), 7,45 (1H, м), 8,45 (1H, дд, J=1,2, 4,8 Гц).
ИК (ATR) см-1: 1572, 1489, 1093, 810.
МС m/z: 362 (М++H).
Пример 129: 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-5-метилпиридин
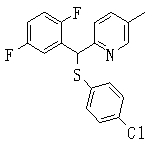
2-[(2,5-дифторфенил)гидроксиметил]-5-метилпиридин (125 мг, 0,53 ммоль), полученный в ссылочном примере 15, растворяли в тионилхлориде (1,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида с последующим перемешиванием в течение 14 часов.
Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, и смесь концентрировали дополнительно. Полученный остаток растворяли в диметилформамиде (5 мл) с последующим добавлением 4-хлорбензолтиола (115 мг, 0,80 ммоль) и карбоната калия (438 мг, 3,18 ммоль) в атмосфере азота. Смесь перемешивали при 50°С в течение 1 часа. После охлаждения до комнатной температуры к реакционной смеси добавляли диэтиловый эфир (50 мл). Смесь промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (120 мг, 66%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 2,29 (3H, с), 5,83 (1H, с), 6,80-6,93 (2H, м), 7,16 (2H, м), 7,20 (2H, м), 7,28 (1H, м), 7,43 (1H, м), 8,41 (1H, д, J=0,8 Гц).
ИК (ATR) см-1: 1475, 1095, 814.
МС m/z: 362 (М++H).
Пример 130: 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-4-метилпиридин
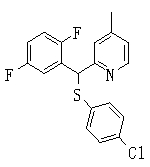
2-[(2,5-дифторфенил)гидроксиметил]-4-метилпиридин (235 мг, 0,53 ммоль), полученный в ссылочном примере 16, растворяли в тионилхлориде (2,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида, и смесь перемешивали в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, и смесь концентрировали дополнительно.
Остаток растворяли в диметилформамиде (10 мл) с последующим добавлением 4-хлорбензолтиола (217 мг, 1,5 ммоль) и карбоната калия (828 мг, 6,0 ммоль) в атмосфере азота. Смесь перемешивали при 50°С в течение 1 часа. После охлаждения до комнатной температуры добавляли диэтиловый эфир (50 мл), и смесь промывали водой и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (290 мг, 80%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 2,31 (3H, с), 5,82 (1H, с), 6,80-7,0 (3H, м), 7,15 (2H, д, J=8,8 Гц), 7,16 (1H, м), 7,21 (2H, д, J=8,8 Гц), 7,45 (1H, м), 8,45 (1H, д, J=5,6 Гц).
ИК (ATR) см-1: 1600, 1489, 1475, 1093, 812.
МС m/z: 362 (М+ +H).
Пример 131: 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-3-метоксипиридин
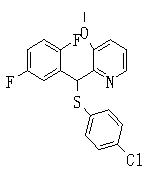
2-[(2,5-дифторфенил)гидроксиметил]-3-метоксипиридин (251 мг, 1,0 ммоль), полученный в ссылочном примере 19, растворяли в тионилхлориде (2,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида, и смесь перемешивали в течение 16 часов.
Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, и смесь концентрировали дополнительно.
Остаток растворяли в диметилформамиде (10 мл) с последующим добавлением 4-хлорбензолтиола (289 мг, 2,0 ммоль) и карбоната калия (1,10 мг, 8,0 ммоль) в атмосфере азота. Полученную смесь перемешивали при 50°С в течение 1 часа. После охлаждения до комнатной температуры к реакционной смеси добавляли диэтиловый эфир (50 мл), и смесь промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (256 мг, 58%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 3,77 (3H, с), 6,25 (1H, с), 6,82 (2H, м), 7,15 (2H, д, J=8,4 Гц), 7,10-7,20 (2H, м), 7,25 (2H, д, J=8,8 Гц), 7,52 (1H, м), 8,24 (1H, м).
ИК (ATR) см-1: 1489, 1423, 1273, 1091, 831.
МС m/z: 378 (М++H).
Пример 132: 3-аллилокси-2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]пиридин
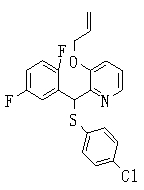
3-аллилокси-2-[(2,5-дифторфенил)гидроксиметил]пиридин (370 мг, 1,33 ммоль), полученный в ссылочном примере 20, растворяли в тионилхлориде (2,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида с последующим перемешиванием в течение 16 часов.
Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, и смесь концентрировали дополнительно.
Остаток растворяли в диметилформамиде (10 мл) с последующим добавлением 4-хлорбензолтиола (217 мг, 1,5 ммоль) и карбоната калия (828 мг, 6,0 ммоль) в атмосфере азота. Смесь перемешивали при 50°С в течение 1 часа. После охлаждения до комнатной температуры к реакционной смеси добавляли диэтиловый эфир (50 мл), и смесь промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (256 мг, 68%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 4,46 (2H, м), 5,24 (1H, д, J=10,6 Гц), 5,28 (1H, д, J=17,2 Гц), 5,90 (1H, м), 6,29 (1H, д, J=1,2 Гц), 6,82 (2H, м), 7,15 (2H, д, J=8,4 Гц), 7,06-7,20 (2H, м), 7,24 (2H, д, J=8,4 Гц), 7,50 (1H, м), 8,24 (1H, м).
ИК (ATR) см-1: 1572, 1489, 1438, 1276, 1093, 814.
МС m/z: 404 (М++H).
Пример 133: 3-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]пиридин
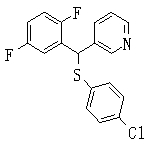
3-[(2,5-дифторфенил)гидроксиметил]пиридин (87 мг, 0,39 ммоль), полученный в ссылочном примере 21, растворяли в тионилхлориде (2,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида, и смесь перемешивали в течение 14 часов.
Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, и смесь концентрировали дополнительно.
Полученный таким образом остаток растворяли в диметилформамиде (5 мл) с последующим добавлением 4-хлорбензолтиола (84 мг, 0,58 ммоль) и карбоната калия (323 мг, 2,34 ммоль) в атмосфере азота. Смесь перемешивали при 50°С в течение 1 часа. После охлаждения до комнатной температуры к реакционной смеси добавляли диэтиловый эфир (50 мл), и смесь промывали водой и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (131 мг, 96%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 5,73 (1H, с), 6,84-6,96 (2H, м), 7,18 (2H, м), 7,19 (2H, м), 7,15-7,22 (2H, м), 7,71 (1H, м), 8,49 (1H, дд, J=1,6, 4,8 Гц), 8,58 (1H, д, J=2,0 Гц).
ИК (ATR) см-1: 1489, 1093, 814, 710.
МС m/z: 348 (М++H).
Пример 134: 5-[[(4-хлорфенил)тио]-(2, 5-дифторфенил)метил]пиримидин
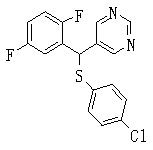
5-[(2,5-дифторфенил)гидроксиметил]пиримидин (111 мг, 0,5 ммоль), полученный в ссылочном примере 23, растворяли в тионилхлориде (1,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида, и смесь перемешивали в течение 16 часов.
Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, и смесь концентрировали дополнительно.
Остаток растворяли в диметилформамиде (5 мл) с последующим добавлением 4-хлорбензолтиола (108 мг, 0,75 ммоль) и карбоната калия (414 мг, 3,0 ммоль) в атмосфере азота. Смесь перемешивали при 50°С в течение 1 часа. После охлаждения до комнатной температуры к реакционной смеси добавляли диэтиловый эфир (50 мл), и смесь промывали водой и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=4:1) с получением смеси (202 мг) указанного в заголовке соединения и неидентифицированного соединения в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 5,66 (1H, с), 6,96 (2H, м), 7,17-7,34 (5H, д), 8,70 (2H, с), 9,09 (1H, с).
МС m/z: 349 (М++H).
Пример 135: 2-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]пиридин
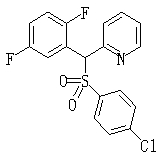
К раствору в метаноле (12 мл) 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]пиридина (120 мг, 0,345 ммоль), полученному в примере 127, добавляли тетрагидрат гексааммонийгептамолибдата (80 мг) с последующим добавлением 30% водного пероксида водорода (6 мл). Полученную смесь перемешивали в течение 24 часов. Полученный таким образом осадок собирали фильтрованием и перекристаллизовывали из этанола с получением указанного в заголовке соединения (96 мг, 73%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 5,93 (1H, с), 6,87-7,00 (2H, м), 7,28 (1H, м), 7,37 (2H, д, J=8,8 Гц), 7,53 (2H, д, J=8,8 Гц), 7,60 (1H, д, J=8,0 Гц), 7,71 (1H, м), 8,00 (1H, м), 8,59 (1H, м).
ИК (ATR) см-1: 1585, 1484, 1434, 1321, 1147, 817.
Т.пл.: 171-172°C.
МС m/z: 380 (М++H),
Элементный анализ. Вычислено для C18H12ClF2NO2S: C 56,92%; H 3,18%; N 3,69%; S 8,44%; Cl 9,33%; F 10,00%. Найдено: C 56,76%; H 3,19%; N 3,77%; S 8,55%; Cl 9,27%; F 10, 02%.
Fab-МС: 380,0309 (вычислено для C18H13ClF2NO2S: 380,0324).
Пример 136: 2-[[(4-хлорфенил)сульфонил]-(2, 5-дифторфенил)метил]-3-метилпиридин
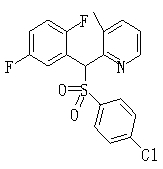
Подобно методике примера 135, указанное в заголовке соединение (35 мг, 35%) получали в виде бесцветных игольчатых кристаллов с использованием 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-3-метилпиридина, полученного в примере 128, и очистки хроматографией на силикагеле (гексан:этилацетат=5:1).
1H-ЯМР (400 МГц, CDCl3) δ: 2,36 (3H, с), 6,18 (1H, с), 6,89-7,02 (2H, м), 7,17 (1H, м), 7,37 (2H, д, J=8,4 Гц), 7,46 (1H, д, J=7,2 Гц), 7,53 (2H, д, J=8,4 Гц), 8,06 (1H, м), 8,53 (1H, д, J=4,0 Гц).
ИК (ATR) см-1: 1571, 1477, 1321, 1151, 1080, 816.
Т.пл.: 142-143°C.
МС m/z: 394 (М++H).
Элементный анализ. Вычислено для C19H14ClF2NO2S: C 57,94%; H 3,58%; N 3,56%; S 8,12%; Cl 9,00%; F 9,65%. Найдено: C 58,03%; H 3,66%; N 3,78%; S 8,12%; Cl 9,13%; F 9,59%.
Пример 137: 2-[[(4-хлорфенил)сульфонил]-(2, 5-дифторфенил)метил]-5-метилпиридин
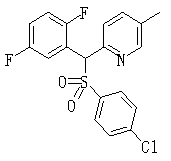
Подобно методике примера 135, за исключением использования 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-5-метилпиридина, полученного в примере 129, указанное в заголовке соединение (91 мг, 73%) получали в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 2,33 (3H, с), 5,89 (1H, с), 6,88-7,01 (2H, м), 7,37 (2H, д, J=8,8 Гц), 7,48-7,56 (2H, м), 7,53 (2H, д, J=8,8 Гц), 7, 99 (1H, м), 8,42 (1H, с).
ИК (ATR) см-1: 1574, 1477, 1319, 1147, 1093, 822.
Т.пл.: 159-160°C.
МС m/z: 394 (М++H).
Элементный анализ. Вычислено для C19H14ClF2NO2S: C 57,94%; H 3,58%; N 3,56%; S 8,12%; Cl 9,00%; F 9,56%. Найдено: C 57,88%; H 3,61%; N 3,68%; S 8, 27%; Cl 9,11%; F 9,70%.
Пример 138: 2-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-4-метилпиридин
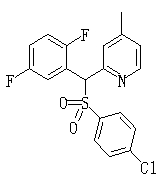
Подобно методике примера 135, указанное в заголовке соединение (140 мг, 95%) получали в виде бесцветных игольчатых кристаллов с использованием 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-4-метилпиридина, полученного в примере 130, и очистки хроматографией на силикагеле (гексан:этилацетат=3:1).
1H-ЯМР (400 МГц, CDCl3) δ: 2,36 (3H, с), 5,88 (1H, с), 6,88-7,02 (2H, м), 7,09 (1H, д, J=5,2 Гц), 7,37 (2H, д, J=8,8 Гц), 7,41 (1H, м), 7,52 (2H, д, J=8,8 Гц), 7,97 (1H, м), 8,43 (1H, д, J=5,2 Гц).
ИК (ATR) см-1: 1600, 1484, 1322, 1149, 1080, 827.
Т.пл.: 116-117°C.
МС m/z: 394 (М++H).
Элементный анализ. Вычислено для C19H14ClF2NO2S: C 57,94%; H 3,58%; N 3,56%; S 8,12%; Cl 9,00%; F 9,65%. Найдено: C 57,80%; H 3,66%; N 3,72%; S 8,29%; Cl 9,05%; F 9, 71%.
Пример 139: 2-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-3-метоксипиридин
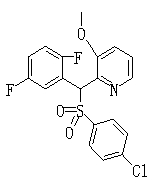
Подобно методике примера 135, указанное в заголовке соединение (71 мг, 87%) получали в виде бесцветных столбчатых кристаллов с использованием 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-3-метоксипиридина, полученного в примере 131, и перекристаллизации из этанола.
1H-ЯМР (400 МГц, CDCl3) δ: 3, 72 (3H, с), 6,62 (1H, с), 6,90-7,04 (2H, м), 7,09 (1H, м), 7,24 (1H, м), 7,35 (2H, д, J=8,8 Гц), 7,53 (2H, д, J=8,8 Гц), 8,18 (1H, м), 8,30 (1H, м).
ИК (ATR) см-1: 1576, 1491, 1429, 1323, 1281, 1147, 796.
Т.пл.: 184-185°C.
МС m/z: 410 (М++H).
Элементный анализ. Вычислено для C19H14ClF2NO3S: C 55,68%; H 3,44%; N 3,42%; S 7,82%; Cl 8,65%; F 9,27%. Найдено: C 55,68%; H 3,45%; N 3,60%; S 7,98%; Cl 8,74%; F 9,23%.
Пример 140: 3-аллилокси-2-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]пиридин
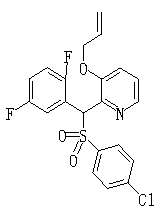
Подобно методике примера 135, указанное в заголовке соединение (135 мг, 80%) получали в виде бесцветных игольчатых кристаллов синтезом с использованием 3-аллилокси-2-[[(4-хлорфенил)тио]-(2, 5-дифторфенил)метил]пиридина, полученного в примере 132, и кристаллизации из этанола.
1H-ЯМР (400 МГц, CDCl3) δ: 4,38 (1H, м), 4,46 (1H, м), 5,29 (1H, дд, J=1,2, 10,4 Гц), 5,35 (1H, дд, J=1,2, 17,2 Гц), 5,93 (1H, м), 6,68 (1H, с), 6,91-7,04 (2H, м), 7,08 (1H, м), 7,22 (1H, дд, J=4,8, 8,4 Гц), 7,34 (2H, д, J=8,8 Гц), 7,53 (2H, д, J=8,8 Гц), 8,17 (1H, м), 8,31 (1H, м).
ИК (ATR) см-1: 1577, 1493, 1319, 1151, 822.
Т.пл.: 119-120°C.
МС m/z: 436 (М++H).
Элементный анализ. Вычислено для C21H16ClF2NO3S: C 57,87%; H 3,70%; N 3,21%; S 7,36%; Cl 8,13%; F 8,72%. Найдено: C 57,90%; H 3,75%; N 3,37%; S 7,51%; Cl 8, 20%; F 8,73%.
Пример 141: 3-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]пиридин
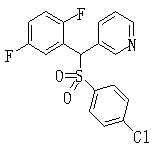
Подобно методике примера 135, указанное в заголовке соединение (118 мг, 86%) получали в виде бесцветных игольчатых кристаллов синтезом с использованием 3-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]пиридина, полученного в примере 133, и очистки хроматографией на силикагеле (гексан:этилацетат=4:1).
1H-ЯМР (400 МГц, CDCl3) δ: 5,68 (1H, с), 6,91-7,07 (2H, м), 7,34 (1H, м), 7,40 (2H, д, J=8,4 Гц), 7,57 (2H, д, J=8,4 Гц), 7,76 (1H, м), 8,04 (1H, м), 8,53 (1H, д, J=2,0 Гц), 8,59 (1H, м).
ИК (ATR) см-1: 1574, 1491, 1421, 1327, 1144, 816.
Т.пл.: 130-131°C.
МС m/z: 380 (М++H).
Элементный анализ. Вычислено для C18H12ClF2NO2S: C 56,92%; H 3,18%; N 3,69%; S 8,44%; Cl 9,33%; F 10,00%, Найдено: C 56,87%; H 3,16%; N 3,74%; S 8,51%; Cl 9,34%; F 10,00%.
Пример 142: 4-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]пиридин
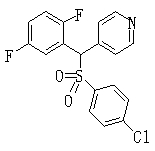
4-[(2, 5-дифторфенил)гидроксиметил]пиридин (75 мг, 0,34 ммоль), полученный в ссылочном примере 22, растворяли в тионилхлориде (1,0 мл). К полученному раствору добавляли каталитическое количество диметилформамида. Полученную смесь перемешивали в течение 14 часов.
Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан, и смесь концентрировали дополнительно.
Остаток растворяли в диметилформамиде (5 мл) с последующим добавлением 4-хлорбензолтиола (74 мг, 0,51 ммоль) и карбоната калия (281 мг, 2,04 ммоль) в атмосфере азота. Смесь перемешивали при 50°С в течение 1 часа. После охлаждения до комнатной температуры к реакционной смеси добавляли диэтиловый эфир (50 мл), и смесь промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=1:1) с получением смеси, содержащей 4-[[(4-хлорфенил)тио]-(2,5-дифторфенил)]пиридин.
К раствору в метаноле (12 мл) полученного соединения добавляли тетрагидрат гексааммонийгептамолибдата (60 мг) с последующим добавлением 30% водного пероксида водорода (6 мл). Полученную смесь перемешивали в течение 65 часов. К реакционной смеси добавляли этилацетат (80 мл). Смесь промывали водой и насыщенным раствором соли и затем сушили над безводным сульфатом магния. Смесь концентрировали при пониженном давлении для удаления растворителя. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=4:1-1:1) с получением указанного в заголовке соединения (51 мг, 39%). Соединение перекристаллизовывали из этанола с получением бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 5,64 (1H, с), 6,91-7,06 (2H, м), 7,40 (2H, д, J=8,0 Гц), 7,45 (2H, д, J=4,8 Гц), 7,58 (2H, д, J=8,0 Гц), 7,70 (1H, с), 8,61 (2H, д, J=4,8 Гц).
ИК (ATR) см-1: 1595, 1493, 1315, 1147, 1082, 823.
Т.пл.: 126-127°C.
МС m/z: 380 (М++H).
Элементный анализ. Вычислено для C18H12ClF2NO2S: C 56,92%; H 3,18%; N 3,69%; S 8,44%; Cl 9,33%; F 10,00%. Найдено: C 56,66%; H 3,16%; N 3,83%; S 8,58%; Cl 9,32%; F 9,99%.
Пример 143: 2-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]пиримидин
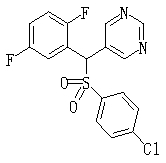
Подобно методике примера 135, указанное в заголовке соединение (71 мг, выход 87%: две стадии из 5-[(2,5-дифторфенил)гидроксиметил]пиримидина ссылочного примера 23) получали в виде бесцветных столбчатых кристаллов с использованием 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]пиримидина, полученного в примере 134, и очистки хроматографией на силикагеле (гексан:этилацетат=5:1).
1H-ЯМР (400 МГц, CDCl3) δ: 5,65 (1H, с), 6,93-7,10 (2H, м), 7,43 (2H, д, J=8,8 Гц), 7,61 (2H, д, J=8,8 Гц), 7,73 (1H, м), 8,90 (2H, с), 9,21 (1H, с).
ИК (ATR) см-1: 1560, 1490, 1141, 1080, 825.
Т.пл.: 136-137°C.
МС m/z: 381 (М++H).
Элементный анализ. Вычислено для C17 H11ClF2N2O2S: C 53,62%; H 2,91%; N 7,36%; S 8,42%; Cl 9,31%; F 9,98%. Найдено: C 53,64%; H 2,83%; N 7,44%; S 8,61%; Cl 9,34%; F 9,96%.
Пример 144: 3-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-4-гидроксихромен-2-он
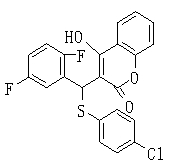
При комнатной температуре ледяную уксусную кислоту (60 мг, 1 ммоль) и пиридин (80,5 мкл, 1 ммоль) добавляли к раствору в этаноле (4 мл) 2,5-дифторбензальдегида (109 мкл, 1 ммоль), 4-гидроксикумарина (162 мг, 1 ммоль) и 4-хлортиофенола (144,6 мг, 1 ммоль), и смесь перемешивали в течение 24 часов. Полученный таким образом осадок собирали фильтрованием и промывали небольшим количеством этанола с получением указанного в заголовке соединения (345 мг, 80%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 6,16 (1H, с), 6,95-7,12 (3H, м), 7,24-7,27 (1H, м), 7,27 (2H, д, J=8,8 Гц), 7,32 (1H, т, J=7,6 Гц), 7,43 (2H, д, J=8,8 Гц), 7,56 (1H, м), 7,94 (1H, дд, J=1,6, 7,6 Гц).
ИК (ATR) см-1: 1668, 1620, 1481, 1194, 818.
Т.пл.: 146-147°C.
МС m/z: 431 (М++H).
Пример 145: 3-[[(4-хлорфенил)сульфонил]-(2, 5-дифторфенил)метил]-4-метоксихромен-2-он (соединение А) и 3-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-2-метоксихромен-4-он (соединение В)
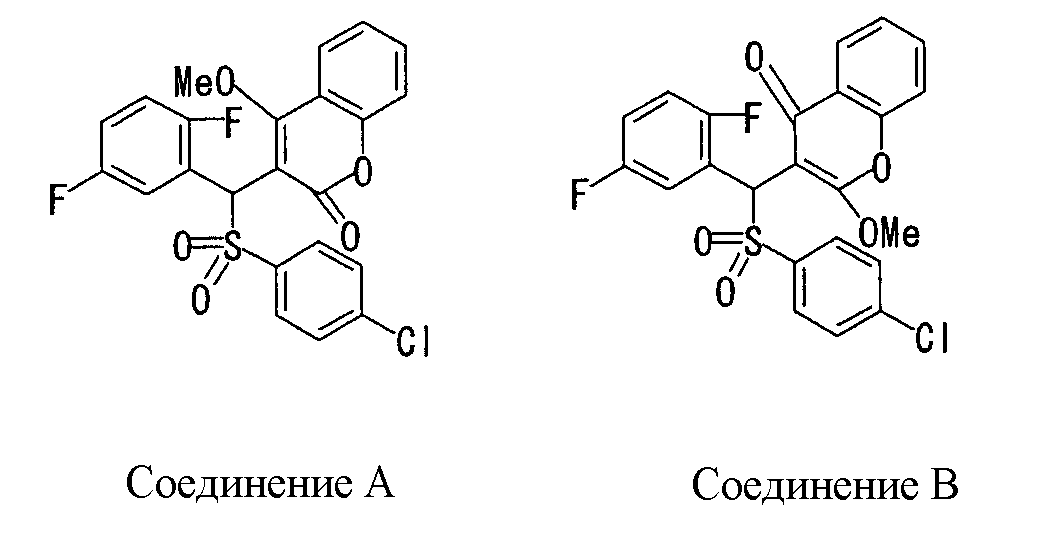
К раствору в смеси бензол-метанол (10:1) 3-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-4-гидроксихромен-2-она (118 мг, 0,274 ммоль) добавляли раствор в гексане (0,41 мл, 0,822 ммоль) 2 н. триметилсилилдиазометана порциями при комнатной температуре, и смесь перемешивали в течение 5 минут. К реакционной смеси добавляли уксусную кислоту до тех пор, пока раствор не становился бесцветным. Затем реакционную смесь концентрировали при пониженном давлении.
Остаток растворяли в метаноле (12 мл) с последующим добавлением 30% водного раствора пероксида водорода (6 мл) и тетрагидрата гексааммонийгептамолибдата (60 мг). Полученную смесь перемешивали в течение 20 часов. К реакционной смеси добавляли этилацетат (50 мл). Смесь промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1-3:1) с получением неполярного соединения (22 мг, 17%) в виде игольчатых кристаллов и полярного соединения (9,0 мг, 7%) в виде белого твердого вещества после отверждения гексаном. В результате NOE-теста (ядерного эффекта Оверхаузера) в неполярном соединении NOE наблюдали между метокси и 5-водородом хроменона. С другой стороны, в полярном соединении NOE не наблюдали между метокси и водородом на ароматическом кольце хроменона, но наблюдали между метокси и 6-водородом на дифторбензольном кольце. Таким образом, структуры неполярного соединения и полярного соединения были определены как 3-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-4-метоксихромен-2-он (соединение А) и 3-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-2-метоксихромен-4-он (соединение В) соответственно.
Соединение А
1H-ЯМР (400 МГц, CDCl3) δ: 4,13 (3H, с), 6,39 (1H, с), 6,88 (1H, м), 6,98 (1H, м), 7,3-7,4 (2H, м), 7,43 (2H, д, J=8,8 Гц), 7,58 (1H, м), 7,70 (2H, д, J=8,8 Гц), 7,73 (1H, м), 8,09 (1H, м).
ИК (ATR) см-1: 1726, 1606, 1493, 1360, 1184, 1085, 768.
Т.пл.: 178-179°C.
МС m/z: 477 (М++H).
Элементный анализ. Вычислено для C23H15ClF2O3S: C 57,93%; H 3,17%; S 6,72%; Cl 7,43%; F 7,97%. Найдено: C 57,59%; H 3,14%; S 6,85%; Cl 7,52%; F 8,01%,
FAB-МС: 477,0393 (вычислено для C23H16ClF2O5S: 477, 0375).
Соединение В
1H-ЯМР (400 МГц, CDCl3) δ: 4,23 (3H, с), 6,54 (1H, с), 6,89 (1H, м), 6,96 (1H, м), 7,41 (2H, д, J=8,4 Гц), 7,4-7,46 (2H, м), 7,63 (1H, м), 7,73 (2H, д, J=8,4 Гц), 8,02 (1H, м), 8,14 (1H, дд, J=1,6, 8,0 Гц).
ИК (ATR) см-1: 1621, 1565, 1461, 1384, 1141, 980.
Т.пл.: 162-163°C.
МС m/z: 477 (М++H).
FAB-МС: 477,0366 (вычислено для C23H16ClF2O5S: 477,0375).
Ссылочный пример 24: 2-[(трет-бутоксикарбонилокси)(2,5-дифторфенил)метил]-1-метил-1Н-бензимидазол
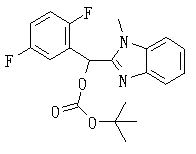
Раствор в ацетонитриле (3 мл) 2,5-дифторбензальдегида (164 мкл, 1,5 ммоль), 1-метилбензимидазола (132 мг, 1 ммоль), ди-трет-бутилдикарбоната (252 мкл, 1, 1 ммоль) перемешивали при комнатной температуре в течение 20 часов. Образовавшийся таким образом осадок собирали фильтрованием и растирали с гексаном с получением указанного в заголовке соединения (310 мг, 83%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (9H, с), 3,86 (3H, с), 6,9-7,0 (2H, м), 7,12 (1H, с), 7,22-7,35 (3H, м), 7, 45 (1H, м), 7,77 (1H, д, J=8,0 Гц).
ИК (ATR) см-1: 1733, 1492, 1270, 1257, 1137, 852.
Т.пл.: 163-164°C.
МС m/z: 375 (М+ +H).
Ссылочный пример 25: 2-[(трет-бутоксикарбонилокси)(2,5-дифторфенил)метил]-1-метил-5-хлор-1Н-бензимидазол
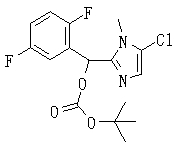
Раствор в ацетонитриле (6 мл) 2,5-дифторбензальдегида (327 мкл, 3 ммоль), 5-хлор-1-метилбензимидазола (187 мкг, 2 ммоль) и ди-трет-бутилдикарбоната (504 мкл, 2,2 ммоль) перемешивали при комнатной температуре в течение 20 часов. Образовавшийся таким образом остаток собирали фильтрованием и растирали с гексаном с получением указанного в заголовке соединения (472 мг, 66%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,48 (9H, с), 3,67 (3H, с), 6,88-7,1 (4H, м), 7,39 (1H, м).
ИК (ATR) см-1: 1739, 1496, 1257, 1149, 1080, 858.
Т.пл.: 125-126°C.
МС m/z: 359 (М++H).
Ссылочный пример 26: 2-[(2,5-дифторфенил)гидроксиметил]тиазол
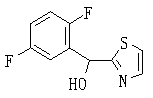
К раствору в тетрагидрофуране (10 мл) 2-бромтиазола (180 мкг, 2 ммоль) добавляли по каплям раствор в гексане н-бутиллития (1,57М, 1,40 мл, 2,2 ммоль) при -78°С. После перемешивания в течение 10 минут добавляли 2,5-дифторбензальдегид (238 мкл, 2,2 ммоль), и при перемешивании температуру смеси постепенно повышали до 0°С. Затем реакцию гасили добавлением водного раствора хлорида аммония с последующим добавлением эфира. Эфирный слой промывали водой и насыщенным раствором соли и затем сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (358 мг, 79%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 3,77 (1H, д, J=4,0 Гц), 6,33 (1H, д, J=4,0 Гц), 6,95-7,10 (2H, м), 7,24 (1H, м), 7,34 (1H, д, J=3,6 Гц), 7,75 (1H, д, J=3,6 Гц).
ИК (ATR) см-1: 3224, 1489, 1238, 1172, 1128, 818.
МС m/z: 228 (М++H).
Ссылочный пример 27: 2-[(трет-бутоксикарбонилокси)(2, 5-дифторфенил)метил]-1-(4-метоксифенил)-1Н-бензимидазол
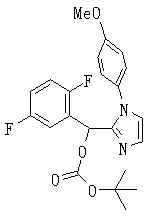
Раствор в ацетонитриле (6 мл) 2,5-дифторбензальдегида (327 мкл, 3 ммоль), 1-(4-метоксифенил)имидазола (348 мг, 2 ммоль), ди-трет-бутилдикарбоната (504 мкл, 2,2 ммоль) перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь концентрировали, и затем остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1-1:1) с получением указанного в заголовке соединения (774 мг, 93%) в виде масла
1H-ЯМР (400 МГц, CDCl3) δ: 1,40 (9H, с), 3,86 (3H, с), 6,76 (1H, с), 6,90-7,00 (4H, м), 7,02 (1H, с), 7,11 (1H, с), 7,26 (2H, м), 7,33 (1H, м).
ИК (ATR) см-1: 1741, 1513, 1494, 1243, 1155, 858, 835.
МС m/z: 417 (М++H).
Пример 146: 2-[[(4-хлорфенил)тио]-(2, 5-дифторфенил)метил]-1-метил-1Н-бензимидазол
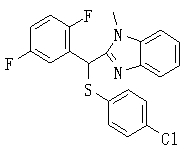
Трифторуксусную кислоту (2,0 мл) добавляли к 2-[(трет-бутоксикарбонилокси)(2,5-дифторфенил)метил]-1-метил-1Н-бензимидазолу (204 мг, 0,545 ммоль), полученному в ссылочном примере 24, и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан с последующим концентрированием при пониженном давлении.
Остаток растворяли в тионилхлориде (1,0 мл). К полученному раствору добавляли каплю диметилформамида, и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан с последующим концентрированием при пониженном давлении.
Остаток растворяли в диметилформамиде (5,0 мл). К полученному раствору добавляли 4-хлорбензолтиол (118 мг, 0,82 ммоль) и карбонат калия (451 мг, 3,27 ммоль), и смесь перемешивали при 50°С в течение 2 часов. Реакционной смеси давали остыть до комнатной температуры. Затем к реакционной смеси добавляли этиловый эфир (60 мл). Смесь промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=10:1-5:1) с получением указанного в заголовке соединения (195 мг, 89%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 3,67 (3H, с), 5,91 (1H, с), 6,87-6,93 (2H, м), 7,19 (2H, д, J=8,8 Гц), 7,27 (2H, д, J=8,8 Гц), 7,25-7,33 (3H, м), 7,60 (1H, м), 7,85 (1H, м).
ИК (ATR) см-1: 1492, 1388, 1238, 193, 820.
МС m/z: 401 (М++H).
Пример 147: 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-1-метил-5-хлор-1Н-имидазол
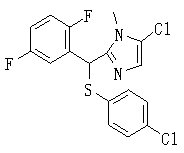
Трифторуксусную кислоту (10 мл) добавляли к 2-[(трет-бутоксикарбонилокси)(2, 5-дифторфенил)метил]-1-метил-5-хлор-1Н-имидазолу (404 мг, 1,13 ммоль), полученному в ссылочном примере 25, и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан с последующим концентрированием при пониженном давлении.
Остаток растворяли в тионилхлориде (2,0 мл). К полученному раствору добавляли каплю диметилформамида, и смесь перемешивали при комнатной температуре в течение 17 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан с последующим концентрированием при пониженном давлении.
Остаток растворяли в диметилформамиде (5,0 мл). К полученному раствору добавляли 4-хлорбензолтиол (244 мг, 1,69 ммоль) и карбонат калия (936 мг, 6,78 ммоль). Смесь перемешивали при 50°С в течение 2 часов. Реакционной смеси давали остыть до комнатной температуры и затем добавляли этиловый эфир (60 мл). Смесь промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=10:1-5:1) с получением указанного в заголовке соединения (195 мг, 89%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 3,57 (3H, с), 5,67 (1H, с), 6,89-6,95 (2H, м), 6,97 (1H, с), 7,20 (2H, д, J=8,4 Гц), 7,21 (2H, д, J=8,4 Гц), 7,54 (1H, м).
ИК (ATR) см-1: 1490, 1473, 1162, 1012, 821, 806.
МС m/z: 386 (М++H).
Пример 148: 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]тиазол
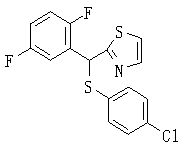
В тионилхлориде (1,5 мл) растворяли 2-[(2,5-дифторфенил)гидроксиметил]тиазол (348 мг, 1,53 ммоль), полученный в ссылочном примере 26. К полученному раствору добавляли каплю диметилформамида, и смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан с последующим концентрированием при пониженном давлении.
Остаток растворяли в диметилформамиде (10,0 мл). К полученному раствору добавляли 4-хлорбензолтиол (332 мг, 2,3 ммоль) и карбонат калия (845 мг, 6,12 ммоль), и смесь перемешивали при 50°С в течение 2 часов. Реакционной смеси давали остыть до комнатной температуры и затем добавляли этиловый эфир (60 мл). Смесь промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=10:1-6:1) с получением указанного в заголовке соединения (130 мг, 24%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 6,04 (1H, с), 6,90-7,06 (2H, м), 7,22 (2H, д, J=8,4 Гц), 7,30 (2H, д, J=8,4 Гц), 7,15-7,35 (2H, м), 7,76 (1H, д, J=3,2 Гц).
ИК (ATR) см-1: 1489, 1475, 1093, 1012, 817, 725.
МС m/z: 354 (М++H).
Пример 149: 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-1-(4-метоксифенил)-1Н-имидазол
Трифторуксусную кислоту (10 мл) добавляли к 2-[(трет-бутоксикарбонилокси)(2,5-дифторфенил)метил]-1-(4-метоксифенил)-1Н-имидазолу (667 мг, 1,6 ммоль), полученному в ссылочном примере 27, и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан с последующим концентрированием при пониженном давлении.
Остаток растворяли в тионилхлориде (2,0 мл), и к полученному раствору добавляли каплю диметилформамида. Смесь перемешивали при комнатной температуре в течение 17 часов. Затем реакционную смесь концентрировали при пониженном давлении. К остатку добавляли диоксан с последующим концентрированием при пониженном давлении.
Остаток растворяли в диметилформамиде (5,0 мл), и к полученному раствору добавляли 4-хлорбензолтиол (347 мг, 2,4 ммоль) и карбонат калия (1,32 мг, 9,6 ммоль). Смесь перемешивали при 50°С в течение 2 часов. Реакционной смеси давали остыть до комнатной температуры и затем добавляли этиловый эфир (60 мл). Смесь промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=10:1-5:1) и кристаллизовали из этанола с получением указанного в заголовке соединения (535 мг, 75%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 3,86 (3H, с), 5,57 (1H, с), 6,8-6,9 (3H, м), 6,91 (2H, д, J=8, 4 Гц), 7,00 (2H, д, J=8,4 Гц), 7,06 (2H, д, J=6,8 Гц), 7,11 (2H, д, J=6,8 Гц), 7,16 (1H, с), 7,81 (1H, м).
ИК (ATR) см-1: 1513, 1475, 1240, 1037, 821.
МС m/z: 443 (М++H).
Пример 150: 2-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]-1-метил-1Н-бензимидазол (соединение А) и 2-[[(4-хлорфенил)сульфинил]-(2, 5-дифторфенил)метил]-1-метил-1Н-бензимидазол (соединение В)
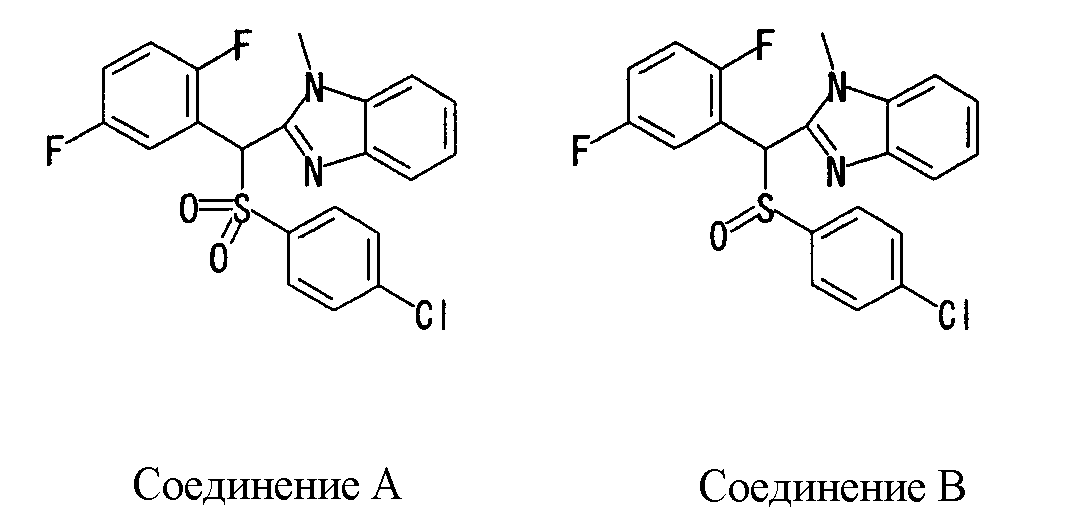
Тетрагидрат гексааммонийгептамолибдата (60 мг) добавляли к раствору в метаноле 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-1-метил-1Н-бензимидазола (190 мг, 0,474 ммоль), полученного в примере 146. К полученной смеси добавляли 30% водный раствор пероксида водорода (6 мл) с последующим перемешиванием в течение 17 часов. К реакционной смеси добавляли этилацетат (60 мл). Полученную смесь промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=6:1-4:1) с получением неполярного соединения (соединения А) (48 мг, 23%) в виде игольчатых кристаллов и полярного соединения (соединения В) (23 мг, 12%) в виде белого твердого вещества.
Соединение А
1H-ЯМР (400 МГц, CDCl3) δ: 3,90 (3H, с), 6,14 (1H, с), 6,9-7,1 (2H, м), 7,26-7,42 (3H, м), 7,39 (2H, д, J=8,8 Гц), 7,46 (2H, д, J=8,8 Гц), 7,81 (1H, д, J=8,0 Гц), 8,16 (1H, м).
ИК (ATR) см-1: 1726, 1606, 1493, 1360, 1184, 1085, 768.
Т.пл.: 213-214°C.
МС m/z: 433 (М++H).
Элементный анализ. Вычислено для C21H15ClF2N2OS: C 58,27%; H 3,49%; N 6,47%; S 7,41%; Cl 8,19%; F 8,78%. Найдено: C 58,08%; H 3,62%; N 6,53%; S 7, 35%; Cl 8,10%; F 8,74%.
Соединение В
1H-ЯМР (400 МГц, CDCl3) δ: 3,35 (1/2*3H, с), 3,78 (1/2*3H, с), 5,52 (1/2*1H, с), 5,57 (1/2*1H, с), 6, 78-7,1 (2H, м), 7,2-7,4 (7H, м), 7,76-7,95 (2H, м).
ИК (ATR) см-1: 1490, 1238, 1054, 820, 731.
Т.пл.: 130-131°C.
МС m/z: 417 (М++H).
FAB-МС: 477,0646 (вычислено для C21H16ClF2N2OS: 477,0640).
Пример 151: 2-[[(4-хлорфенил)сульфонил]-(2, 5-дифторфенил)метил]-1-метил-5-хлор-1Н-имидазол
К раствору в метаноле (12 мл) 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-1-метил-5-хлор-1Н-имидазола (141 мг, 0,37 ммоль), полученного в примере 147, добавляли тетрагидрат гексааммонийгептамолибдата (60 мг). К полученной смеси добавляли 30% водный раствор пероксида водорода (6 мл) с последующим перемешиванием в течение 64 часов. Добавляли этилацетат (60 мл), и смесь промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Затем остаток кристаллизовали из этанола с получением указанного в заголовке соединения (103 мг, 67%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 3,71 (3H, с), 5,88 (1H, с), 6,93-7,08 (2H, м), 7,03 (1H, с), 7,43 (4H, с), 7,98 (1H, м).
ИК (ATR) см-1: 1490, 1467, 1313, 1149, 1079, 818, 729.
Т.пл.: 179-180°C.
МС m/z: 417 (М++H).
Элементный анализ. Вычислено для C17H12Cl2F2N2O2S: C 48,90%; H 2,93%; N 6,71%; S 7,68%; Cl 16,99%; F 9,11%. Найдено: C 48,90%; H 2,93%; N 6,77%; S 7,80%; Cl 17,02%; F 9,19%
Пример 152: 2-[[(4-хлорфенил)сульфонил]-(2,5-дифторфенил)метил]тиазол
К раствору в метаноле (6 мл) 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]тиазола (124 мг, 0,35 ммоль), полученного в примере 148, добавляли тетрагидрат гексааммонийгептамолибдата (30 мг). К полученной смеси добавляли 30% водный раствор пероксида водорода (3 мл) с последующим перемешиванием в течение 15 часов. Затем добавляли этилацетат (60 мл), смесь промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток кристаллизовали из этанола с получением указанного в заголовке соединения (91 мг, 67%) в виде бесцветных столбчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 6,21 (1H, с), 6,92-7,08 (2H, м), 7,41 (2H, д, J=8,8 Гц), 7,45 (1H, д, J=3,6 Гц), 7,56 (2H, д, J=8,8 Гц), 7,86 (1H, д, J=3,6 Гц), 7,94 (1H, м).
ИК (ATR) см-1: 1488, 1319, 1149, 1076, 817, 727.
Т.пл.: 163-164°C.
МС m/z: 386 (М++H).
Элементный анализ. Вычислено для C16H10ClF2NO2S2: C 49,81%; H 2,61%; N 3,63%; S 16,62%; Cl 9,19%; F 9,85%. Найдено: C 49,98%; H 2,61%; N 3,77%; S 16,60%; Cl 9,25%; F 9,87%.
Пример 153: 2-[[(4-хлорфенил)сульфонил]-(2, 5-дифторфенил)метил]-1-(4-метоксифенил)-1Н-имидазол
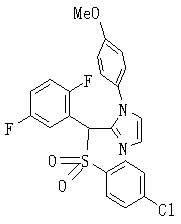
К раствору в метаноле (12 мл) 2-[[(4-хлорфенил)тио]-(2,5-дифторфенил)метил]-1-(4-метоксифенил)-1Н-бензимидазола (118 мг, 0,27 ммоль), полученного в примере 149, добавляли тетрагидрат гексааммонийгептамолибдата (60 мг). К полученной смеси добавляли 30% водный раствор пероксида водорода (6 мл) с последующим перемешиванием в течение 64 часов. Добавляли этилацетат (60 мл), смесь промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток кристаллизовали из этанола с получением указанного в заголовке соединения (76 мг, 60%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 3,89 (3H, с), 5,83 (1H, с), 6,93-7,05 (4H, м), 6,97 (2H, д, J=8,8 Гц), 7,01 (2H, д, J=8,8 Гц), 7,38 (2H, д, J=8,8 Гц), 7,41 (2H, д, J=8,8 Гц), 8,15 (1H, м).
ИК (ATR) см-1: 1513, 1492, 1332, 1155, 836.
Т.пл.: 150-151°C.
МС m/z: 475 (М++H).
Элементный анализ. Вычислено для C23H17ClF2N2O3S: C 58,13%; H 3,61%; N 5,90%; S 6,75%; Cl 7,47%; F 8,00%. Найдено: C 58,09%; H 3,51%; N 5,99%; S 6,88%; Cl 7,48%; F 8,06%.
Ссылочный пример 28: 5-(метилсульфонил)-1-пентанол
К раствору в дихлорметане (25 мл) 5-(метилтио)-1-пентанола (682 мг, 5,08 ммоль) добавляли 3-хлорпербензойную кислоту (2,10 г, 12,2 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 2 часов. После концентрирования при пониженном давлении к остатку добавляли диэтиловый эфир, и смесь экстрагировали водой. После экстракции органического слоя два раза водой водные слои объединяли и концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную из элюата с использованием смеси дихлорметан:метанол=19:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (517 мг, 3,11 ммоль, 61%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,50-1,67 (4H, м), 1,84-1,94 (2H, м), 2,90 (3H, с), 3,03 (2H, т, J=8,0 Гц), 3,68 (2H, т, J=6,1 Гц).
Ссылочный пример 29: 5-(метилсульфонил)пентаналь
К раствору в дихлорметане (15 мл) 5-(метилсульфонил)-1-пентанола (344 мг, 2,07 ммоль), диметилсульфоксида (0,441 мл, 6,21 ммоль) и триэтиламина (1,15 мл, 8,28 ммоль) добавляли комплекс триоксид серы-пиридин (659 мг, 4,14 ммоль) при 0°С, и смесь перемешивали при комнатной температуре в течение 3 часов. После промывания реакционной смеси водой органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием этилацетата, концентрировали при пониженном давлении с получением указанного в заголовке соединения (183 мг, 1,11 ммоль, 54%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1, 76-1,97 (4H, м), 2,55 (2H, т, J=7,1 Гц), 2,91 (3H, с), 3,04 (2H, т, J=7,8 Гц), 9,79 (1H, с).
Ссылочный пример 30: 1-(2,5-дифторфенил)-5-(метилсульфонил)-1-пентанол
Раствор в тетрагидрофуране (5 мл) 1-бром-2,5-дифторбензола (0,151 мл, 1,34 ммоль) перемешивали при -78°С. К полученной смеси добавляли раствор в гексане (0,843 мл, 1,34 ммоль) н-бутиллития. Реакционную смесь добавляли к раствору в тетрагидрофуране (5 мл) 5-(метилсульфонил)пентаналя (183 мг, 1,11 ммоль) при -78°С, и перемешивание продолжали при той же температуре в течение 30 минут. После повышения температуры реакционной смеси до комнатной температуры добавляли диэтиловый эфир. Полученную смесь промывали последовательно насыщенным водным раствором хлорида аммония и насыщенным водным раствором бикарбоната натрия. Затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения (116 мг, 0,42 ммоль, 37%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,49-1,69 (2H, м), 1,71-1,97 (4H, м), 2,89 (3H, с), 3,01 (2H, т, J=8,1 Гц), 5,02 (1H, т, J=6,2 Гц), 6,88-7,01 (2H, м), 7,16-7,22 (1H, м).
МС m/z: 296 (М++NH4).
Ссылочный пример 31: 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфонат
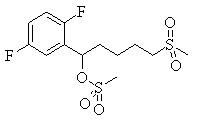
К раствору в дихлорметане (5 мл) 1-(2,5-дифторфенил)-5-(метилсульфонил)-1-пентанола (278 мг, 1,00 ммоль) последовательно добавляли триэтиламин (0,209 мл, 1,50 ммоль) и метансульфонилхлорид (0,115 мл, 1,50 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (278 мг, 0,78 ммоль, 78%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,48-1,71 (2H, м), 1,85-1,98 (3H, м), 2, 03-2,13 (1H, м), 2,90 (3H, с), 2,90 (3H, с), 3,02 (2H, т, J=7,8 Гц), 5,82 (1H, дд, J=8,6, 5,1 Гц), 7,01-7,19 (3H, м).
МС m/z: 374 (М++NH4).
Пример 154: 1,4-дифтор-2-[1-[(4-метоксифенил)сульфонил]-5-(метилсульфонил)пентил]бензол
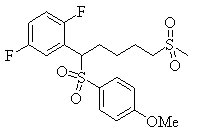
К раствору в N,N-диметилформамиде (2 мл) 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (139 мг, 0,39 ммоль) последовательно добавляли 4-метоксибензолтиол (0,058 мл, 0,47 ммоль) и карбонат калия (81 мг, 0,59 ммоль). Полученную смесь встряхивали при комнатной температуре в течение 15 часов. К остатку добавляли этилацетат. Смесь промывали насыщенным водным раствором хлорида аммония. Затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
Полученный таким образом остаток растворяли в метаноле (2 мл) с последующим добавлением раствора в воде (2 мл) Оксона (соединения пероксимоносульфата калия, 2KHSO5.KHSO4.K2SO4) (480 мг, 0, 78 ммоль) при 0°С. После встряхивания при комнатной температуре в течение 3 часов добавляли дихлорметан, и смесь промывали водой. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота). Полученное твердое вещество промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (86 мг, 0,20 ммоль, 51%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,34-1,52 (2H, м), 1,79-1,95 (2H, м), 2,05-2,16 (1H, м), 2,42-2,52 (1H, м), 2,87 (3H, с), 2,92-2, 99 (2H, м), 3,85 (3H, с), 4,48 (1H, дд, J=11,0, 2,9 Гц), 6,80-6,89 (1H, м), 6,87 (2H, д, J=8,8 Гц), 6,94-7,00 (1H, м), 7,19-7,25 (1H, м), 7,51 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 2951, 1595, 1496, 1271, 1132, 1084, 1022, 970.
Элементный анализ. Вычислено для C19H22F2O5S2: C, 52,76; H, 5,13; F, 8, 79. Найдено: C, 52,57; H, 5,13; F, 8,71.
МС m/z: 433 (М++H).
Пример 155: 1,4-дифтор-2-[5-(метилсульфонил)-1-(фенилсульфонил)пентил]бензол
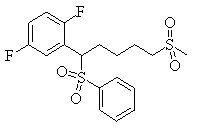
Подобно методике примера 154, за исключением использования 1-(2, 5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль), указанное в заголовке соединение (83 мг, 0,21 ммоль, 58%) получали в виде белого порошка.
1 H-ЯМР (400 МГц, CDCl3) δ: 1,34-1,52 (2H, м), 1,79-1,97 (2H, м), 2,07-2,20 (1H, м), 2,44-2,55 (1H, м), 2,87 (3H, с), 2,90-3,01 (2H, м), 4,51 (1H, дд, J=10,9, 3,6 Гц), 6,75-6,84 (1H, м), 6,92-7,00 (1H, м), 7,19-7,27 (1H, м), 7,38-7,46 (2H, м), 7,55-7,65 (3H, м).
МС m/z: 420 (М++NH4).
Пример 156: 1, 4-дифтор-2-[1-[(4-метилфенил)сульфонил]-5-(метилсульфонил)пентил]бензол
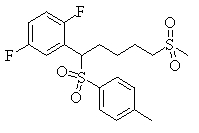
Подобно методике примера 154, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (139 мг, 0,39 ммоль) и п-толуолтиола (58 мг, 0,47 ммоль), указанное в заголовке соединение (65 мг, 0,16 ммоль, 40%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,33-1,51 (2H, м), 1,77-1,96 (2H, м), 2,03-2,16 (1H, м), 2, 37-2,51 (1H, м), 2,40 (3H, с), 2,87 (3H, с), 2,90-3,00 (2H, м), 4,49 (1H, дд, J=11,1, 3,8 Гц), 6,79-6,88 (1H, м), 6,94-7,02 (1H, м), 7,19-7,26 (1H, м), 7,21 (2H, д, J=7,8 Гц), 7,48 (2H, д, J=7,8 Гц).
ИК (ATR) см-1: 2943, 1597, 1498, 1269, 1142, 1084, 957, 868.
Элементный анализ. Вычислено для C19H22F2O4 S2: C, 54,79; H, 5,32; F, 9,12. Найдено: C, 54,67; H, 5,30; F, 9,10.
МС m/z: 417 (М++H).
Пример 157: 2-[1-[(3-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]-1,4-дифторбензол
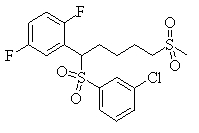
Подобно методике примера 154, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 3-хлорбензолтиола (0,041 мл, 0,36 ммоль), указанное в заголовке соединение (6,3 мг, 0,014 ммоль, 4%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,34-1,54 (2H, м), 1,79-1,97 (2H, м), 2,08-2,21 (1H, м), 2,41-2,56 (1H, м), 2,88 (3H, с), 2,90-3,03 (2H, м), 4,51 (1H, дд, J=10,6, 3,4 Гц), 6,78-6,90 (1H, м), 6,95-7,06 (1H, м), 7,19-7,29 (1H, м), 7,36 (1H, т, J=7,8 Гц), 7,49 (1H, д, J=7,8 Гц), 7, 55 (1H, д, J=7,8 Гц), 7,56 (1H, с).
МС m/z: 437 (М++H).
Пример 158: 1,4-дифтор-2-[1-[(3-метилфенил)сульфонил]-5-(метилсульфонил)пентил]бензол
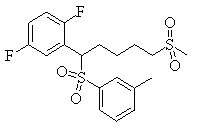
Подобно методике примера 154, за исключением использования 1-(2, 5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и м-толуолтиола (0,043 мл, 0,36 ммоль), указанное в заголовке соединение (26 мг, 0,062 ммоль, 17%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,33-1,52 (2H, м), 1,78-1,96 (2H, м), 2,03-2,19 (1H, м), 2,34 (3H, с), 2,39-2,51 (1H, м), 2,87 (3H, с), 2,91-2,99 (2H, м), 4,50 (1H, дд, J=11,0, 3,4 Гц), 6,78-6,86 (1H, м), 6,93-7,02 (1H, м), 7,19-7,33 (2H, м), 7,36-7,44 (3H, м).
МС m/z: 417 (М++H).
Пример 159: 1, 4-дифтор-2-[1-[(3-метоксифенил)сульфонил]-5-(метилсульфонил)пентил]бензол
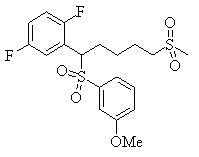
Подобно методике примера 154, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 3-метоксибензолтиола (0,044 мл, 0,36 ммоль), указанное в заголовке соединение (25 мг, 0,059 ммоль, 16%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,34-1,51 (2H, м), 1,79-1,95 (2H, м), 2,06-2,18 (1H, м), 2,42-2,52 (1H, м), 2,87 (3H, с), 2,90-3,00 (2H, м), 3,75 (3H, с), 4,52 (1H, дд, J=11,5, 4,6 Гц), 6,80-6,87 (1H, м), 6,94-7,01 (1H, м), 7,05 (1H, с), 7,10 (1H, д, J=8,1 Гц), 7,21 (1H, д, J=8,1 Гц), 7,21-7,29 (1H, м), 7,32 (1H, т, J=8,1 Гц).
МС m/z: 433 (М++H).
Пример 160: 1,4-дифтор-2-[1-[(4-фторфенил)сульфонил]-5-(метилсульфонил)пентил]бензол
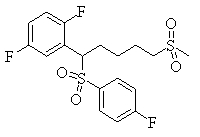
Подобно методике примера 154, за исключением использования 1-(2, 5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 4-фторбензолтиола (0,038 мл, 0,36 ммоль), указанное в заголовке соединение (35 мг, 0,083 ммоль, 23%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,38-1,53 (2H, м), 1,82-1,97 (2H, м), 2,08-2,20 (1H, м), 2,47-2,57 (1H, м), 2,88 (3H, с), 2,92-3,02 (2H, м), 4, 50 (1H, дд, J=11,0, 4,4 Гц), 6,78-6,88 (1H, м), 6,95-7,02 (1H, м), 7,05-7,13 (2H, м), 7,22-7,32 (1H, м), 7,57-7,64 (2H, м).
МС m/z: 438 (М++NH4).
Пример 161: 4-[[1-(2,5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]фенол
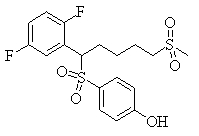
Подобно методике примера 154, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 4-меркаптофенола (45 мг, 0,36 ммоль), указанное в заголовке соединение (63 мг, 0,15 ммоль, 42%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,34-1,52 (2H, м), 1,80-1,93 (2H, м), 2,03-2,18 (1H, м), 2,42-2,52 (1H, м), 2,88 (3H, с), 2,90-3,00 (2H, м), 4,47 (1H, дд, J=10,8, 3,2 Гц), 5,44 (1H, с), 6,78-6,87 (1H, м), 6,81 (2H, д, J=8,8 Гц), 6,94-7,01 (1H, м), 7,19-7,28 (1H, м), 7,48 (2H, д, J=8,8 Гц).
МС m/z: 419 (М++H).
Пример 162: 1-[[1-(2,5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]нафталин
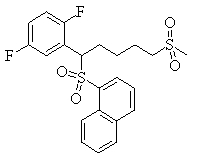
Подобно методике примера 154, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 1-нафталинтиола (57 мг, 0,36 ммоль), указанное в заголовке соединение (48 мг, 0,11 ммоль, 29%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,29-1,46 (2H, м), 1,72-1,90 (2H, м), 2,13-2,26 (1H, м), 2,29-2,40 (1H, м), 2,83 (3H, с), 2,82-2,93 (2H, м), 4,79 (1H, дд, J=11,3, 3,9 Гц), 6,66-6,75 (1H, м), 6,87-6,94 (1H, м), 7,24-7,31 (1H, м), 7,45 (1H, т, J=7,6 Гц), 7,58-7,62 (2H, м), 7,94 (1H, д, J=8,1 Гц), 8,01 (1H, д, J=7,6 Гц), 8,08 (1H, д, J=8,1 Гц), 8,73 (1H, д, J=8,6 Гц).
МС m/z: 453 (М++H).
Пример 163: 2-[[1-(2,5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]-1Н-бензимидазол
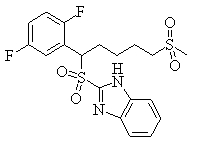
Подобно методике примера 154, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 2-меркаптобензимидазола (54 мг, 0,36 ммоль), указанное в заголовке соединение (62 мг, 0,14 ммоль, 39%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,28-1,53 (2H, м), 1,78-1,96 (2H, м), 2,17-2,30 (1H, м), 2,42-2,53 (1H, м), 2,86 (3H, с), 2,88-3,02 (2H, м), 5,03 (1H, дд, J=11,3, 3,9 Гц), 6,90-7,04 (2H, м), 7,13-7,20 (1H, м), 7,39-7,47 (2H, м), 7,50 (1H, шир.с), 7,90 (1H, шир.с), 10,08 (1H, шир.с).
МС m/z: 443 (М++H).
Пример 164: 4-[[1-(2, 5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]пиридин
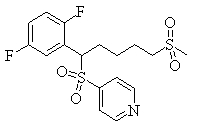
Подобно методике примера 154, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 4-меркаптопиридина (40 мг, 0,36 ммоль), указанное в заголовке соединение (38 мг, 0,093 ммоль, 26%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,27-1,60 (2H, м), 1,70-1,90 (2H, м), 2,00-2,13 (1H, м), 2,35-2,48 (1H, м), 2,88 (3H, с), 2,90-3,04 (2H, м), 4,56 (1H, дд, J=10,6, 4,3 Гц), 6,78-6,85 (1H, м), 6,95-7,03 (1H, м), 7,22-7,30 (1H, м), 7,45 (2H, д, J=5,2 Гц), 8,75 (2H, д, J=5,2 Гц).
МС m/z: 404 (М++H).
Пример 165: 2-[[1-(2,5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]пиридин
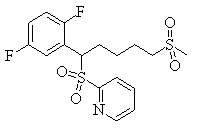
Подобно методике примера 154, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 2-меркаптопиридина (40 мг, 0,36 ммоль), указанное в заголовке соединение (72 мг, 0,18 ммоль, 50%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ : 1,36-1,52 (2H, м), 1,78-1,96 (2H, м), 2,10-2,21 (1H, м), 2,35-2,46 (1H, м), 2,87 (3H, с), 2,90-3,03 (2H, м), 5,11 (1H, дд, J=10,9, 3,8 Гц), 6,82-6,91 (1H, м), 6,92-6,98 (1H, м), 7,24-7,31 (1H, м), 7, 48-7,54 (1H, м), 7,79-7,87 (2H, м), 8,75 (1H, д, J=4,6 Гц).
МС m/z: 404 (М++H).
Пример 166: 2-[[1-(2, 5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]хинолин
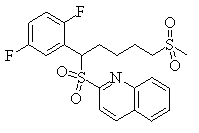
Подобно методике примера 154, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 2-хинолинтиола (58 мг, 0,36 ммоль), указанное в заголовке соединение (90 мг, 0,20 ммоль, 55%) получали в виде бесцветной пены.
1H-ЯМР (400 МГц, CDCl3) δ: 1,39-1,59 (2H, м), 1,80-1,99 (2H, м), 2,13-2,26 (1H, м), 2,42-2,53 (1H, м), 2,86 (3H, с), 2,91-3,02 (2H, м), 5,33 (1H, дд, J=11,1, 3,1 Гц), 6,74-6,82 (1H, м), 6,88-6,96 (1H, м), 7,31-7,36 (1H, м), 7,72 (1H, т, J=7,1 Гц), 7,86-7,92 (3H, м), 8,24 (1H, д, J=8,5 Гц), 8,29 (1H, д, J=8,8 Гц).
МС m/z: 454 (М++H).
Пример 167: 2-[[1-(2,5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]пиримидин
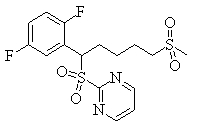
Подобно методике примера 154, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 2-меркаптопиримидина (40 мг, 0,36 ммоль), указанное в заголовке соединение (55 мг, 0,14 ммоль, 38%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,38-1,60 (2H, м), 1,79-1,98 (2H, м), 2,11-2,25 (1H, м), 2,37-2,47 (1H, м), 2,88 (3H, с), 2,90-3,02 (2H, м), 5,31 (1H, дд, J=10,5, 3,4 Гц), 6,89-7,02 (2H, м), 7,33-7,39 (1H, м), 7,52 (1H, т, J=4,9 Гц), 8,91 (2H, д, J=4,9 Гц).
МС m/z: 405 (М++H).
Пример 168: 5-[[1-(2, 5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]-1-метил-1Н-тетразол
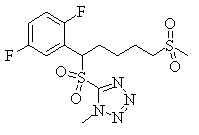
Подобно методике примера 154, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 1-метил-5-меркапто-1,2,3,4-тетразола (42 мг, 0,36 ммоль), указанное в заголовке соединение (75 мг, 0,18 ммоль, 52%) получали в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,43-1,65 (2H, м), 1,82-2,01 (2H, м), 2,18-2,31 (1H, м), 2,49-2,60 (1H, м), 2,90 (3H, с), 2,92-3,06 (2H, м), 4,10 (3H, с), 5,12 (1H, дд, J=11,0, 3,7 Гц), 7,03-7,22 (3H, м).
МС m/z: 409 (М++H).
Пример 169: 2-[[1-(2,5-дифторфенил)-5-(метилсульфонил)пентил]сульфинил]-1-метил-1Н-имидазол (соединение А) и 2-[[1-(2,5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]-1-метил-1Н-имидазол (соединение В)
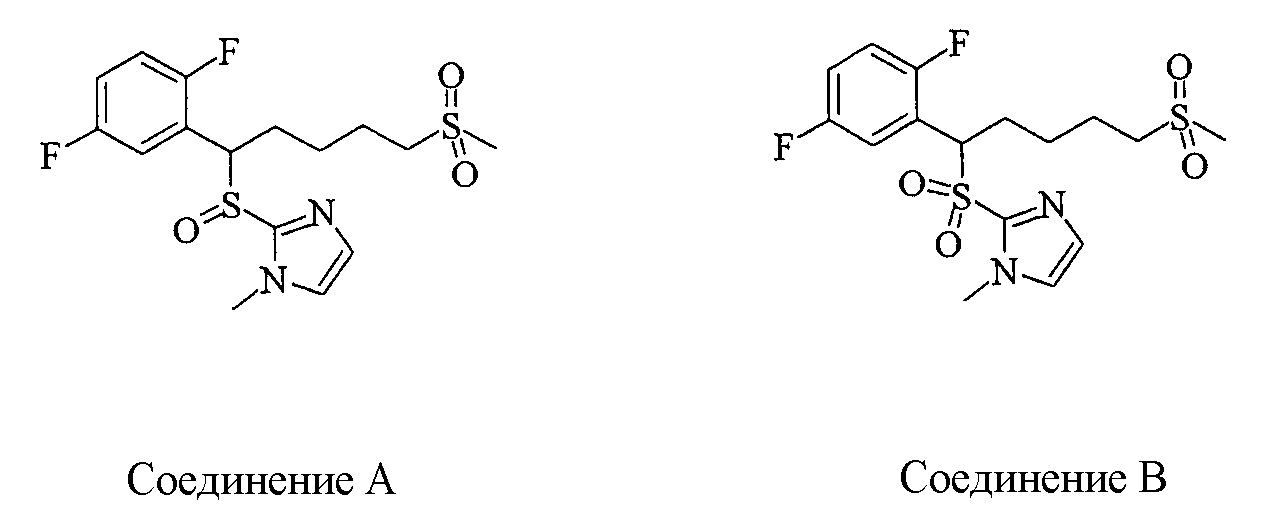
Подобно методике примера 154, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 2-меркапто-1-метилимидазола (41 мг, 0,36 ммоль), указанное в заголовке соединение А (45 мг, 0,12 ммоль, 32%) и указанное в заголовке соединение В (47 мг, 0,11 ммоль, 32%) получали в виде желтого масла и в виде бесцветного масла соответственно.
Соединение А
1H-ЯМР (400 МГц, CDCl3) δ: 1,45-1,67 (2H, м), 1,82-2,02 (2H, м), 2,09-2,21 (1H, м), 2,41-2,52 (1H, м), 2,89 (3H, с), 2,92-3,08 (2H, м), 3,66 (3H, с), 4,91 (1H, дд, J=11,1, 4,5 Гц), 6,78-6, 84 (1H, м), 6,90 (1H, с), 6,93-7,01 (2H, м), 7,12 (1H, с).
МС m/z: 391 (М++H).
Соединение В
1H-ЯМР (400 МГц, CDCl3) δ: 1,37-1,66 (2H, м), 1,81-1,96 (2H, м), 2,12-2,23 (1H, м), 2,45-2,56 (1H, м), 2,88 (3H, с), 2,91-3,03 (2H, м), 3,59 (3H, с), 4,89 (1H, дд, J=10,9, 4,0 Гц), 6,93 (1H, д, J=0,7 Гц), 6,97-7,08 (3H, м), 7,19 (1H, д, J=0,7 Гц).
МС m/z: 407 (М++H).
Пример 170: 2-[[1-(2,5-дифторфенил)-5-(метилсульфонил)пентил]сульфинил]-1,3-бензотиазол
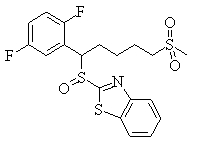
Подобно методике примера 154, за исключением использования 1-(2, 5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 2-меркаптобензотиазола (60 мг, 0,36 ммоль), указанное в заголовке соединение (78 мг, 0,18 ммоль, 49%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,37-1,48 (2H, м), 1,72-1,91 (2H, м), 2,09-2,29 (2H, м), 2,83 (3H, с), 2,85-2,95 (2H, м), 4,66 (1H, дд, J=10,5, 4,1 Гц), 7,01-7,08 (3H, м), 7,48-7,50 (2H, м), 7,87-8,08 (2H, м).
МС m/z: 444 (М++H).
Пример 171: 2-[1-[(2-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]-1, 4-дифторбензол
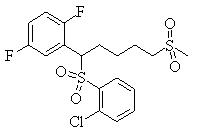
К раствору в N,N-диметилформамиде (2 мл) 1-(2, 5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль), полученного в ссылочном примере 31, последовательно добавляли 2-хлорбензолтиол (0,041 мл, 0,36 ммоль) и карбонат калия (62 мг, 0,45 ммоль). Полученную смесь встряхивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли этилацетат. Смесь промывали водой, и затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
Полученный таким образом остаток растворяли в метаноле (2 мл) с последующим добавлением раствора в воде (2 мл) Оксона (соединения пероксимоносульфата калия, 2KHSO5.KHSO4.K2SO4) (480 мг, 0,78 ммоль) при 0°С. После встряхивания при комнатной температуре в течение 14 часов к реакционной смеси добавляли дихлорметан, и смесь промывали водой. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
Полученный таким образом остаток растворяли в дихлорметане (4 мл), и при 0°С к полученному раствору добавляли 3-хлорпербензойную кислоту (95 мг, 0,36 ммоль). Реакционную смесь встряхивали при комнатной температуре в течение 4 часов и затем промывали 1 н. раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота). Полученное твердое вещество промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (59 мг, 0,14 ммоль, 38%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,39-1,60 (2H, м), 1,82-1,97 (2H, м), 2,10-2,22 (1H, м), 2,37-2,48 (1H, м), 2,87 (3H, с), 2, 91-3,02 (2H, м), 5,13 (1H, дд, J=10,7, 3,7 Гц), 6,79-6,87 (1H, м), 6,90-6,97 (1H, м), 7,23-7,33 (2H, м), 7,46-7,55 (2H, м), 8,75 (1H, дд, J=7,9, 1,6 Гц).
МС m/z: 437 (М+ +H).
Пример 172: 1,4-дифтор-2-[1-[(2-фторфенил)сульфонил]-5-(метилсульфонил)пентил]бензол
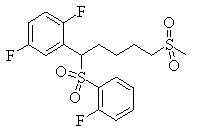
Подобно методике примера 171, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 2-фторбензолтиола (0,040 мг, 0,36 ммоль), указанное в заголовке соединение (71 мг, 0,17 ммоль, 47%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,39-1,60 (2H, м), 1,80-1,98 (2H, м), 2,10-2,22 (1H, м), 2,44-2,54 (1H, м), 2,88 (3H, с), 2,96 (2H, т, J=7,4 Гц), 4,84 (1H, дд, J=10,7, 4,4 Гц), 6,78-6,85 (1H, м), 6,90-6,96 (1H, м), 7,10-7, 21 (2H, м), 7,22-7,29 (1H, м), 7,52-7,60 (2H, м).
МС m/z: 421 (М++H).
Пример 173: 1, 4-дифтор-2-[1-[(2-метилфенил)сульфонил]-5-(метилсульфонил)пентил]бензол
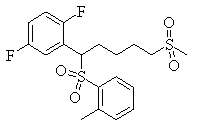
Подобно методике примера 171, за исключением использования 1-(2,5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и о-толуолтиола (0,042 мг, 0,36 ммоль), указанное в заголовке соединение (38 мг, 0,091 ммоль, 25%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,33-1,55 (2H, м), 1,79-1,95 (2H, м), 2,09-2,21 (1H, м), 2,37-2,47 (1H, м), 2,63 (3H, с), 2,87 (3H, с), 2,92-2,98 (2H, м), 4,61 (1H, дд, J=11,2, 3,4 Гц), 6,75-6,82 (1H, м), 6,89-6,97 (1H, м), 7,16 (1H, т, J=7,6 Гц), 7,22-7,31 (2H, м), 7,43 (1H, т, J=7,6 Гц), 7,43 (1H, т, J=8,0 Гц).
МС m/z: 417 (М++H).
Пример 174: 1,4-дифтор-2-[1-[(2-метоксифенил)сульфонил]-5-(метилсульфонил)пентил]бензол
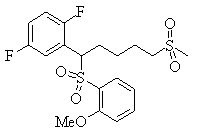
Подобно методике примера 171, за исключением использования 1-(2, 5-дифторфенил)-5-(метилсульфонил)пентилметансульфоната (127 мг, 0,36 ммоль) и 2-метоксибензолтиола (0,044 мг, 0,36 ммоль), указанное в заголовке соединение (52 мг, 0,12 ммоль, 33%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,33-1,55 (2H, м), 1,78-1,96 (2H, м), 2,06-2,17 (1H, м), 2,36-2,47 (1H, м), 2,87 (3H, с), 2,90-3,00 (2H, м), 4, 00 (3H, с), 5,13 (1H, дд, J=11,2, 3,2 Гц), 6,78-6,95 (3H, м), 6,98 (1H, д, J=7,8 Гц), 7,27-7,33 (1H, м), 7,46-7,53 (1H, м), 7,63 (1H, дд, J=8,0, 1,7 Гц).
МС m/z: 433 (М+ +H).
Пример 175: 2-[1-[(4-хлорфенил)сульфонил]-6-(метилсульфонил)гексил]-1,4-дифторбензол
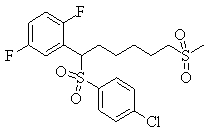
К раствору в толуоле (2 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (100 мг, 0,33 ммоль), полученного в примере 5, и 5-(метилсульфонил)-1-пентанола (110 мг, 0,66 ммоль), полученного в ссылочном примере 28, добавляли раствор в толуоле цианометилентри-н-бутилфосфорана (177 мг, 0,66 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 16 часов. После охлаждения реакционной смеси до комнатной температуры концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:2, концентрировали при пониженном давлении. Полученное твердое вещество промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (140 мг, 0,31 ммоль, 94%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,22-1,38 (2H, м), 1,39-1,56 (2H, м), 1,73-1,86 (2H, м), 2,03-2,16 (1H, м), 2,41-2,52 (1H, м), 2,88 (3H, с), 2,95 (2H, т, J=7,9 Гц), 4,50 (1H, дд, J=11,5, 3,2 Гц), 6,80-6,89 (1H, м), 6,95-7,04 (1H, м), 7,22-7,28 (1H, м), 7,38 (2H, д, J=8,5 Гц), 7,52 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 2949, 1500, 1475, 1317, 1294, 1275, 1136, 1084, 964, 752.
Элементный анализ. Вычислено для C19H21ClF2O4S2: C, 50,61; H, 4,69; Cl, 7,86; F, 8,43; S, 14,22. Найдено: C, 50,59; H, 4, 67; Cl, 8,04; F, 8,39; S, 14,15.
Ссылочный пример 32: 5-хлор-2-пиридинтиол
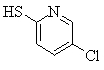
После добавления тиомочевины (152 мг, 2,00 ммоль) к раствору в этаноле (4 мл) 2,5-дихлорпиридина (296 мг, 2,00 ммоль) полученную смесь нагревали при кипячении с обратным холодильником в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры с последующим добавлением раствора в воде (1 мл) гидроксида калия (198 мг, 3,00 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 3 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли воду, и затем смесь промывали дихлорметаном. Водный слой подкисляли до кислой реакции уксусной кислотой с последующей экстракцией дихлорметаном. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Полученное твердое вещество промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (83 мг, 0,57 ммоль, 29%) в виде желтого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 7,35 (1H, дд, J=9,3, 2,4 Гц), 7,46 (1H, д, J=9,3 Гц), 7,64 (1H, д, J=2,4 Гц).
МС m/z: 146 (М++H).
Пример 176: 5-хлор-2-[[1-(2,5-дифторфенил)-5-(метилсульфонил)пентил]тио]пиридин
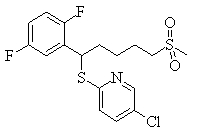
К раствору в дихлорметане (5 мл) 1-(2,5-дифторфенил)-5-(метилсульфонил)-1-пентанола (100 мг, 0,36 ммоль), полученного в ссылочном примере 30, последовательно добавляли триэтиламин (0,060 мл, 0,43 ммоль) и метансульфонилхлорид (0,033 мл, 0,43 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь промывали водой, и органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
К раствору в N, N-диметилформамиде (4 мл) полученного остатка последовательно добавляли 5-хлор-2-пиридинтиол (52 мг, 0,36 ммоль) и карбонат калия (62 мг, 0,45 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли этилацетат. После промывания водой органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (116 мг, 0,29 ммоль, 79%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,39-1,64 (2H, м), 1,83-2,17 (4H, м), 2,88 (3H, с), 2,92-3,06 (2H, м), 5,20 (1H, т, J=7,6 Гц), 6,84-6,92 (1H, м), 6,96-7,02 (1H, м), 7,05 (1H, дд, J=8,6, 0,7 Гц), 7,11-7,18 (1H, м), 7,43 (1H, дд, J=8,6, 2,5 Гц), 8,37 (1H, дд, J=2,5, 0,7 Гц).
МС m/z: 406 (М++H).
Пример 177: 5-хлор-2-[[1-(2,5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]пиридин
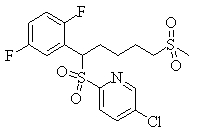
К раствору в метаноле (2 мл) 5-хлор-2-[[1-(2,5-дифторфенил)-5-(метилсульфонил)пентил]тио]пиридина (100 мг, 0,25 ммоль) добавляли раствор в воде (2 мл) Оксона (соединения пероксимоносульфата калия, 2KHSO5.KHSO4.K2SO4) (303 мг, 0,49 ммоль) при 0°С. После встряхивания при комнатной температуре в течение 22 часов к реакционной смеси добавляли дихлорметан, и смесь промывали водой. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (61 мг, 0,14 ммоль, 56%) в виде бесцветной пены.
1H-ЯМР (400 МГц, CDCl3) δ: 1,37-1,53 (2H, м), 1,80-1,97 (2H, м), 2,09-2,20 (1H, м), 2,36-2,48 (1H, м), 2,88 (3H, с), 2,96 (2H, т, J=7,5 Гц), 5,07 (1H, дд, J=11,1, 3,8 Гц), 6,86-7,02 (2H, м), 7, 23-7,31 (1H, м), 7,74 (1H, д, J=8,3 Гц), 7,79 (1H, дд, J=8,3, 2,2 Гц), 8,67 (1H, д, J=2,2 Гц),
Элементный анализ. Вычислено для C17H18ClF2NO4S2·0,25H2O: C, 46,15; H, 4,21; F, 8,59; N, 3,17; S, 14,50. Найдено: C, 46,38; H, 4,11; F, 8,40; N, 3,20; S, 14,22.
МС m/z: 438 (М+ +H).
Ссылочный пример 33: S-(6-хлор-3-пиридил)-О-этил-дитиокарбонат
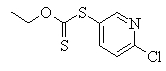
В 1 н. хлористо-водородной кислоте (10 мл) растворяли 5-амино-2-хлорпиридин (643 мг, 3,00 ммоль). Раствор в воде (1 мл) нитрита натрия (207 мг, 3,00 ммоль) добавляли по каплям к полученному раствору при -5°С. После перемешивания реакционной смеси при 60оС в течение 30 минут раствор в воде (1 мл) О-этилдитиокарбоната калия (481 мг, 3,00 ммоль) добавляли по каплям к реакционной смеси при той же температуре. Затем реакционную смесь перемешивали при 80°С в течение 1 часа с последующим охлаждением до комнатной температуры. Добавляли этилацетат, и полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=49:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (148 мг, 0,63 ммоль, 21%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,37 (3H, т, J=7,1 Гц), 4,63 (2H, т, J=7,1 Гц), 7,41 (1H, д, J=8,3 Гц), 7,76 (1H, дд, J=8,3, 2,4 Гц), 8,45 (1H, д, J=2,4 Гц).
МС m/z: 234 (М++H).
Пример 178: 2-хлор-5-[[1-(2, 5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]пиридин
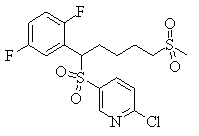
К раствору в этаноле (3 мл) S-(6-хлор-3-пиридил)-О-этилдитиокарбоната (145 мг, 0,62 ммоль) добавляли 1 н. водный раствор (3 мл) гидроксида натрия с последующим перемешиванием при 80°С в течение 2 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли воду, и затем смесь промывали дихлорметаном. Водный слой подкисляли до кислой реакции уксусной кислотой и затем экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении с получением 6-хлор-3-пиридинтиола в виде желтого твердого вещества.
К раствору в дихлорметане (5 мл) 1-(2,5-дифторфенил)-5-(метилсульфонил)-1-пентанола (173 мг, 0,62 ммоль), полученного в ссылочном примере 30, последовательно добавляли триэтиламин (0,130 мл, 0,93 ммоль) и метансульфонилхлорид (0,060 мл, 0,78 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
К раствору в N,N-диметилформамиде (6 мл) остатка последовательно добавляли 6-хлор-3-пиридинтиол и карбонат калия (107 мг, 0,78 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. После добавления этилацетата и промывания водой органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
Остаток растворяли в дихлорметане (5 мл) с последующим добавлением 3-хлорпербензойной кислоты (214 мг, 1,24 ммоль) при 0°С. Смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали 1 н. водным раствором гидроксида натрия, и затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=2:1, концентрировали при пониженном давлении. Полученное твердое вещество промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (187 мг, 0,43 ммоль, 69%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,40-1,57 (2H, м), 1,84-1,98 (2H, м), 2,11-2,22 (1H, м), 2,50-2,60 (1H, м), 2,89 (3H, с), 2,93-3,02 (2H, м), 4,48 (1H, дд, J=10,4, 3,8 Гц), 6,82-6,91 (1H, м), 7, 00-7,07 (1H, м), 7,24-7,29 (1H, м), 7,38 (1H, д, J=8,3 Гц), 7,79 (1H, дд, J=8,3, 2,4 Гц), 8,48 (1H, д, J=2,4 Гц).
ИК (ATR) см-1: 3059, 1566, 1495, 1446, 1279, 1161, 1107, 829.
Элементный анализ. Вычислено для C17H18ClF2NO4S2: C, 46,63; H, 4,14; Cl, 8,10; F, 8,68; N, 3,20; S, 14,64. Найдено: C, 46, 36; H, 4,29; Cl, 8,08; F, 8,65; N, 3,25; S, 14,57.
МС m/z: 438 (М++H).
Пример 179: 2-[1-(циклогексилсульфонил)-5-(метилсульфонил)пентил]-1, 4-дифторбензол
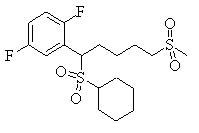
К раствору в дихлорметане (3 мл) 1-(2, 5-дифторфенил)-5-(метилсульфонил)-1-пентанола (100 мг, 0,36 ммоль), полученного в ссылочном примере 30, последовательно добавляли триэтиламин (0,072 мл, 0,52 ммоль) и метансульфонилхлорид (0,033 мл, 0, 43 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
К раствору в ацетонитриле (3 мл) полученного остатка последовательно добавляли циклогексантиол (0,066 мл, 0,54 ммоль) и карбонат цезия (176 мг, 0,54 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли дихлорметан и промывали насыщенным раствором соли, и затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=2:1, концентрировали при пониженном давлении.
Остаток растворяли в дихлорметане (3 мл) с последующим добавлением 3-хлорпербензойной кислоты (113 мг, 0,43 ммоль) при 0°С, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали 1 н. водным раствором гидроксида натрия, и затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:2, концентрировали при пониженном давлении. Полученное твердое вещество промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (53 мг, 0,13 ммоль, 36%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,03-1,27 (3H, м), 1,30-1,70 (5H, м), 1,78-2,10 (7H, м), 2,40-2,60 (2H, м), 2,88 (3H, с), 2,90-3,02 (2H, м), 4,54 (1H, дд, J=11,1, 2,6 Гц), 7,04-7,15 (2H, м), 7,36-7,42 (1H, м).
ИК (ATR) см-1: 2931, 1495, 1273, 1126, 1117, 976.
Элементный анализ. Вычислено для C18H26F2O4S2 : C, 52,92; H, 6,41; F, 9,30; S, 15,70. Найдено: C, 52,85; H, 6,31; F, 9,34; S, 15,53.
МС m/z: 409 (М++H).
Пример 180: 4-[4-[[1-(2, 5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]фенил]морфолин
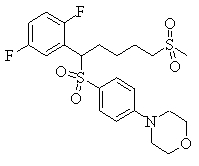
К раствору в диметилсульфоксиде (0,5 мл) 1,4-дифтор-2-[1-[(4-фторфенил)сульфонил]-5-(метилсульфонил)пентил]бензола (40 мг, 0,095 ммоль), полученного в примере 160, последовательно добавляли морфолин (0,012 мл, 0, 14 ммоль) и 1-метилпиперидин (0,17 мл, 0,14 ммоль). Полученной смеси давали стоять при 80оС в течение 24 часов. Реакционную смесь очищали препаративной высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота). Полученное твердое вещество промывали диэтиловым эфиром и собирали фильтрованием с получением указанного в заголовке соединения (43 мг, 0,88 ммоль) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,31-1,51 (2H, м), 1,77-1,94 (2H, м), 2,02-2,14 (1H, м), 2, 38-2,50 (1H, м), 2,88 (3H, с), 2,90-3,00 (2H, м), 3,28 (4H, т, J=4,9 Гц), 3,85 (4H, т, J=4,9 Гц), 4,47 (1H, дд, J=10,6, 3,5 Гц), 6,78 (2H, д, J=9,0 Гц), 6,83-6,90 (1H, м), 6,94-7,01 (1H, м), 7,19-7,24 (1H, м), 7,44 (2H, д, J=9,0 Гц).
ИК (ATR) см-1: 2962, 1591, 1498, 1271, 1131, 1090, 976, 926.
Элементный анализ. Вычислено для C22H27 F2NO5S2: C, 54,19; H, 5,58; F, 7,79; N, 2,87; S, 13,15. Найдено: C, 53,93; H, 5,53; F, 7,90; N, 2,87; S, 13,17.
МС m/z: 488 (М++H).
Пример 181: 1-[4-[[1-(2,5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]фенил]пиперидин
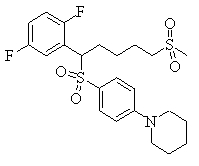
Подобно методике примера 180, за исключением использования 1,4-дифтор-2-[1-[(4-фторфенил)сульфонил]-5-(метилсульфонил)пентил]бензола (100 мг, 0,24 ммоль) и пиперидина (0,035 мл, 0,36 ммоль), указанное в заголовке соединение (83 мг, 0,17 ммоль, 71%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,30-1,51 (2H, м), 1, 56-1,72 (6H, м), 1,76-1,93 (2H, м), 2,01-2,13 (1H, м), 2,36-2,48 (1H, м), 2,87 (3H, с), 2,88-3,00 (2H, м), 3,34 (4H, шир.с), 4,45 (1H, дд, J=11,5, 3,4 Гц), 6,75 (2H, д, J=9,0 Гц), 6,82-6,90 (1H, м), 6, 92-7,00 (1H, м), 7,16-7,23 (1H, м), 7,38 (2H, д, J=9,0 Гц).
ИК (ATR) см-1: 2935, 1591, 1495, 1282, 1122, 1090.
Элементный анализ. Вычислено для C23H29F2NO4S2: C, 56,89; H, 6,02; F, 7,82; N, 2,88; S, 13,21. Найдено: C, 56,73; H, 5,99; F, 7,88; N, 2,93; S, 13,22.
МС m/z: 486 (М++H).
Пример 182: 4-[1-(2,5-дифторфенил)-5-метилсульфонилпентилсульфонил]-N,N-диметиланилин
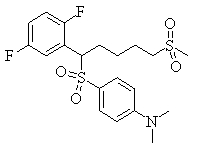
Подобно методике примера 180, за исключением использования 1,4-дифтор-2-[1-[(4-фторфенил)сульфонил]-5-(метилсульфонил)пентил]бензола (100 мг, 0,24 ммоль) и гидрохлорида диметиламина (58 мл, 0,71 ммоль), указанное в заголовке соединение (83 мг, 0,19 ммоль, 78%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,30-1,50 (2H, м), 1,76-1,93 (2H, м), 2,01-2,12 (1H, м), 2,36-2,48 (1H, м), 2,87 (3H, с), 2,88-3,00 (2H, м), 3,03 (6H, с), 4,45 (1H, дд, J=11,2, 2,9 Гц), 6,55 (2H, д, J=9,0 Гц), 6, 82-6,91 (1H, м), 6,93-7,01 (1H, м), 7,18-7,24 (1H, м), 7,38 (2H, д, J=9,0 Гц).
ИК (ATR) см-1: 2941, 1603, 1496, 1284, 1269, 1230, 1138, 1088.
Элементный анализ. Вычислено для C20H25F2NO4S: C, 53,91; H, 5,66; F, 8,53; N, 3,14; S, 14,39. Найдено: C, 53,61; H, 5,61; F, 8,51; N, 3,06; S, 14,35.
МС m/z: 446 (М++H).
Пример 183: 1-[4-[[1-(2,5-дифторфенил)-5-(метилсульфонил)пентил]сульфонил]фенил]-4-метилпиперазин
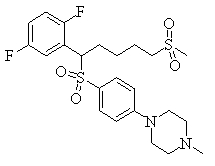
Подобно методике примера 180, за исключением использования 1, 4-дифтор-2-[1-[(4-фторфенил)сульфонил]-5-(метилсульфонил)пентил]бензола (100 мг, 0,24 ммоль) и 1-метилпиперазина (0,040 мл, 0,36 ммоль), указанное в заголовке соединение (68 мг, 0,14 ммоль, 57%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,31-1,51 (2H, м), 1,77-1,94 (2H, м), 2,02-2,13 (1H, м), 2,35 (3H, с), 2,36-2,48 (1H, м), 2,53 (4H, т, J=5,1 Гц), 2,87 (3H, с), 2,88-3,00 (2H, м), 3,34 (4H, т, J=5,1 Гц), 4,46 (1H, дд, J=11,0, 3,7 Гц), 6,77 (2H, д, J=9,0 Гц), 6,82-6,90 (1H, м), 6,92-7,01 (1H, м), 7,18-7,23 (1H, м), 7,41 (2H, д, J=9,0 Гц).
ИК (ATR) см-1: 1595, 1495, 1292, 1134, 1090, 1003, 968.
Элементный анализ. Вычислено для C23H30F2N2 O4S2: C, 55,18; H, 6,04; F, 7,59; N, 5,60; S, 12,81. Найдено: C, 54,92; H, 5,92; F, 7,66; N, 5,60; S, 12,80.
МС m/z: 501 (М++H).
Пример 184: N-бензил-4-[1-(2,5-дифторфенил)-5-метилсульфонилпентилсульфонил]-N-метиланилин
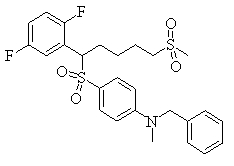
Подобно методике примера 180, за исключением использования 1,4-дифтор-2-[1-[(4-фторфенил)сульфонил]-5-(метилсульфонил)пентил]бензола (100 мг, 0,24 ммоль) и N-бензилметиламина (0,046 мл, 0,36 ммоль), указанное в заголовке соединение (34 мг, 0,065 ммоль, 27%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,30-1,50 (2H, м), 1, 76-1,93 (2H, м), 2,01-2,13 (1H, м), 2,36-2,48 (1H, м), 2,87 (3H, с), 2,88-3,00 (2H, м), 3,11 (3H, с), 4,46 (1H, дд, J=11,4, 3,5 Гц), 4,58 (1H, д, J=17,5 Гц), 4,63 (1H, д, J=17,5 Гц), 6,60 (2H, д, J=9, 0 Гц), 6,78-6,86 (1H, м), 6,89-6,98 (1H, м), 7,12 (2H, д, J=7,1 Гц), 7,13-7,20 (1H, м), 7,24-7,35 (3H, м), 7,35 (2H, д, J=9,0 Гц),
ИК (ATR) см-1: 1593, 1493, 1390, 1281, 1124, 1088.
Элементный анализ. Вычислено для C26H29F2NO4S2: C, 59,86; H, 5,60; F, 7,28; N, 2,69; S, 12,29, Найдено: C, 59,74; H, 5,52; F, 7,35; N, 2,76; S, 12,44.
МС m/z: 522 (М++H).
Пример 185: N-бензил-4-[1-(2,5-дифторфенил)-5-метилсульфонилпентилсульфонил]анилин
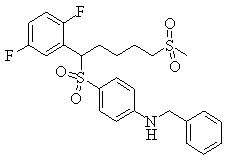
Подобно методике примера 180, за исключением использования 1, 4-дифтор-2-[1-[(4-фторфенил)сульфонил]-5-(метилсульфонил)пентил]бензола (100 мг, 0,24 ммоль) и бензиламина (0,039 мл, 0,36 ммоль), указанное в заголовке соединение (49 мг, 0,097 ммоль, 41%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,31-1,50 (2H, м), 1,78-1,93 (2H, м), 2,01-2,13 (1H, м), 2,37-2,48 (1H, м), 2,87 (3H, с), 2,89-3,00 (2H, м), 4,36 (2H, шир.д, J=3,7 Гц), 4,46 (1H, дд, J=11,2, 3,2 Гц), 4,61 (1H, шир.с), 6,51 (2H, д, J=9,0 Гц), 6,80-6,87 (1H, м), 6,90-6,98 (1H, м), 7,15-7,22 (1H, м), 7,29-7,40 (5H, м), 7,34 (2H, д, J=9,0 Гц).
ИК (ATR) см-1: 3411, 1597, 1495, 1282, 1142, 1086, 870.
Элементный анализ. Вычислено для C25H27F2NO4S2·0,25H2O: C, 58,63; H, 5,41; F, 7,42; N, 2,74; S, 12,52. Найдено: C, 58,59; H, 5,27; F, 7,49; N, 2,78; S, 12,61.
МС m/z: 508 (М++H).
Ссылочный пример 34: 6-(трет-бутилдифенилсилилокси)-1-(2,5-дифторфенил)-1-гексанол
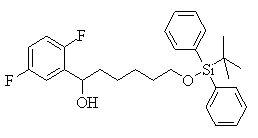
Раствор в тетрагидрофуране (30 мл) 1-бром-2,5-дифторбензола (0,956 мл, 8,46 ммоль) перемешивали при -78°С. К реакционной смеси добавляли раствор в гексане (6,46 мл, 10,2 ммоль) н-бутиллития. Реакционную смесь добавляли к раствору в тетрагидрофуране (20 мл) 6-(трет-бутилдифенилсилилокси)гексаналя (2,50 г, 7,05 ммоль) при -78°С, и смесь перемешивали при той же температуре в течение 30 минут. После повышения температуры реакционной смеси до комнатной температуры добавляли диэтиловый эфир. Смесь промывали насыщенным водным раствором хлорида аммония, и органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=9:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,92 г, 4,65 ммоль, 88%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,04 (9H, м), 1,21-1,90 (8H, м), 3,64 (2H, т, J=6,3 Гц), 4,96 (1H, т, J=6,5 Гц), 6,86-7,01 (2H, м), 7,13-7,20 (1H, м), 7,32-7,45 (6H, м), 7,62-7,70 (4H, м).
Пример 186: 6-[(5-[хлор-2-пиридил)сульфонил]-(2,5-дифторфенил)-1-гексанол
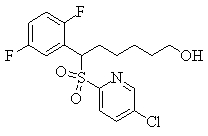
К раствору в дихлорметане (20 мл) 6-(трет-бутилдифенилсилил)окси-1-(2,5-дифторфенил)-1-гексанола (1,04 мг, 2,22 ммоль) последовательно добавляли триэтиламин (0,619 мл, 4,44 ммоль) и метансульфонилхлорид (0,258 мл, 3,33 ммоль) при 0°С. Смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия, и органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
К раствору в N, N-диметилформамиде (20 мл) остатка последовательно добавляли 5-хлор-2-пиридинтиол (323 мг, 2,22 ммоль), полученный в ссылочном примере 32, и карбонат калия (368 мг, 2,66 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли этилацетат. После промывания водой органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
Полученный таким образом остаток растворяли в дихлорметане (20 мл) и добавляли 3-хлорпербензойную кислоту (1,18 г, 4,44 ммоль) при 0°С к полученному раствору. Смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь промывали 1 н. водным раствором гидроксида натрия. Затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
К раствору в тетрагидрофуране (10 мл) остатка добавляли раствор в тетрагидрофуране (3,33 мл, 3,33 ммоль) тетрабутиламмонийфторида и смесь перемешивали при комнатной температуре в течение 8 часов. После концентрирования реакционной смеси при пониженном давлении остаток растворяли в этилацетате с последующим промыванием водой. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=7:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (477 мг, 1,22 ммоль, 55%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,17-1,59 (6H, м), 2,04-2,17 (1H, м), 2,30-2,42 (1H, м), 3,59 (2H, т, J=6,3 Гц), 5,07 (1H, дд, J=11,6, 2,8 Гц), 6,84-6,92 (1H, м), 6,93-7,01 (1H, м), 7,26-7,32 (1H, м), 7,74 (1H, дд, J=8,3, 0,7 Гц), 7,78 (1H, дд, J=8,3, 2,2 Гц), 8,67 (1H, дд, J=2,2, 0,7 Гц).
МС m/z: 390 (М++H).
Пример 187: 5-хлор-2-[[1-(2,5-дифторфенил)циклогексил]сульфонил]пиридин
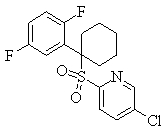
К раствору в толуоле (5 мл) 6-[(5-хлор-2-пиридил)сульфонил]-(2,5-дифторфенил)-1-гексанола (308 мг, 0,79 ммоль) добавляли раствор в толуоле (3 мл) цианометилентри-н-бутилфосфорана (424 мг, 1,58 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 16 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=9:1, концентрировали при пониженном давлении. Полученное твердое вещество промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (96 мг, 0,26 ммоль, 33%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,12-1,42 (3H, м), 1,58-1,66 (1H, м), 1,77-1,86 (2H, м), 2,11-2,25 (2H, м), 2,91 (2H, шир.с), 6,79-6,89 (1H, м), 6,97-7,04 (1H, м), 7,06-7,13 (1H, м), 7,50 (1H, д, J=8,3 Гц), 7,72 (1H, дд, J=8,3, 2,4 Гц), 8,65 (1H, дд, J=2,4 Гц).
ИК (ATR) см-1: 2933, 2862, 1493, 1302, 1190, 1153, 1107, 1012.
Элементный анализ. Вычислено для C17H16ClF2NO2S: C, 54,91; H, 4,34; Cl, 9,53; F, 10,22; N, 3,77; S, 8,62. Найдено: C, 54, 88; H, 4,50; Cl, 9,65; F, 10,35; N, 3,80; S, 8,76.
МС m/z: 372 (М++H).
Ссылочный пример 35: 7-(трет-бутилдифенилсилилокси)-1-(2, 5-дифторфенил)-1-гептанол
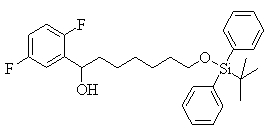
Раствор в тетрагидрофуране (40 мл) 1-бром-2, 5-дифторбензола (1,25 мл, 10,7 ммоль) перемешивали при -78°С с последующим добавлением раствора в гексане (8,50 мл, 13,4 ммоль) н-бутиллития. Реакционную смесь добавляли к раствору в тетрагидрофуране (20 мл) 7-(трет-бутилдифенилсилилокси)гептаналя (3,28 г, 8,90 ммоль) при -78°С, и смесь перемешивали при той же температуре в течение 30 минут. После повышения температуры реакционной смеси до комнатной температуры добавляли диэтиловый эфир. Смесь промывали насыщенным водным раствором хлорида аммония. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=9:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (3,88 г, 8,04 ммоль, 90%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3 ) δ: 1,04 (9H, м), 1,21-1,92 (10H, м), 3,64 (2H, т, J=6,5 Гц), 4,97 (1H, т, J=6,5 Гц), 6,86-7,00 (2H, м), 7,13-7,20 (1H, м), 7,33-7,44 (6H, м), 7,62-7,70 (4H, м).
Пример 188: 7-[(5-хлор-2-пиридил)сульфонил]-(2,5-дифторфенил)-1-гептаналь
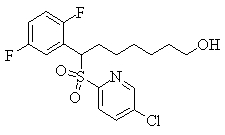
К раствору в дихлорметане (20 мл) 7-(трет-бутилдифенилсилилокси)-1-(2,5-дифторфенил)-1-гептанола (1,04 г, 2,15 ммоль) последовательно добавляли триэтиламин (0,601 мл, 4,31 ммоль) и метансульфонилхлорид (0,250 мл, 3,23 ммоль) при 0оС. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия и затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
К раствору в N,N-диметилформамиде (20 мл) остатка последовательно добавляли 5-хлор-2-пиридинтиол (314 мг, 2,15 ммоль), полученный в ссылочном примере 32, и карбонат калия (357 мг, 2,59 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли этилацетат, и смесь промывали водой. Затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
К раствору в дихлорметане (20 мл) полученного остатка добавляли 3-хлорпербензойную кислоту (1,14 г, 4,31 ммоль) при 0°С, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали 1 н. водным раствором гидроксида натрия. Затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
Полученный остаток растворяли в тетрагидрофуране (10 мл) с последующим добавлением раствора в тетрагидрофуране (3,23 мл, 3,23 ммоль) тетрабутиламмонийфторида. Полученную смесь перемешивали при комнатной температуре в течение 8 часов. После концентрирования реакционной смеси при пониженном давлении остаток растворяли в этилацетате, и раствор промывали водой. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=7:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (595 мг, 1,47 ммоль, 69%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,14-1,66 (8H, м), 2,03-2,17 (1H, м), 2,29-2,40 (1H, м), 3,60 (2H, т, J=6,6 Гц), 5,06 (1H, дд, J=11,6, 3,1 Гц), 6,84-6,91 (1H, м), 6,92-7,00 (1H, м), 7,25-7,31 (1H, м), 7,74 (1H, дд, J=8,3 Гц), 7,78 (1H, дд, J=8,3, 2,2 Гц), 8,67 (1H, дд, J=2,2 Гц).
МС m/z: 404 (М+ +H).
Пример 189: 5-хлор-2-[[1-(2,5-дифторфенил)циклогептил]сульфонил]пиридин
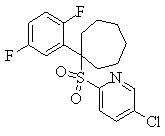
К раствору в толуоле (8 мл) 7-[(5-хлор-2-пиридил)сульфонил]-(2,5-дифторфенил)-1-гептанола (436 мг, 1,08 ммоль) добавляли раствор в толуоле (3 мл) цианометилентри-н-бутилфосфорана (579 мг, 2,16 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=9:1, концентрировали при пониженном давлении. Полученное твердое вещество промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (79 мг, 0,20 ммоль, 19%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,32-1,63 (6H, м), 1,82-1,94 (2H, м), 2,42-2,52 (2H, м), 2,79-2,90 (2H, м), 6,81-6,90 (1H, м), 6,97-7,07 (2H, м), 7,48 (1H, д, J=8,6 Гц), 7,71 (1H, дд, J=8,6, 2,5 Гц), 8,65 (1H, дд, J=2,5 Гц),
ИК (ATR) см-1: 2933, 2864, 1493, 1308, 1188, 1159, 1107, 1011.
Элементный анализ. Вычислено для C18H18ClF2NO2S: C, 56,03; H, 4,70; Cl, 9,19; F, 9,85; N, 3,63; S, 8,31. Найдено: C, 55,92; H, 4,77; Cl, 9,23; F, 9,90; N, 3,67; S, 8,41.
МС m/z: 386 (М++H).
Ссылочный пример 36: 2,5-дифторфенил-4-пиридилметанол
Раствор в тетрагидрофуране (30 мл) 1-бром-2,5-дифторбензола (1,08 мл, 9,60 ммоль) перемешивали при -78°С с последующим добавлением раствора в гексане (7,32 мл, 11,5 ммоль) н-бутиллития. К полученной смеси добавляли раствор в тетрагидрофуране (10 мл) 4-пиридинкарбоксальдегида (0,764 мл, 8,00 ммоль) при -78°С, и смесь перемешивали при той же температуре в течение 30 минут. После повышения температуры реакционной смеси до комнатной температуры добавляли диэтиловый эфир. Смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=7:3, концентрировали при пониженном давлении. Полученное твердое вещество промывали диизопропиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (1,15 г, 5,20 ммоль, 65%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 4,25 (1H, шир.c), 6,09 (1H, с), 6, 89-7,05 (2H, м), 7,14-7,23 (1H, м), 7,34 (2H, д, J=5,4 Гц), 8,44 (2H, д, J=5,4 Гц).
Пример 190: 5-хлор-2-[(2,5-дифторфенил-4-пиридилметил)тио]пиридин
К раствору в дихлорметане (10 мл) (2,5-дифторфенил-4 пиридилметанола (221 мг, 1,00 ммоль) последовательно добавляли триэтиламин (0,279 мл, 2,00 ммоль) и метансульфонилхлорид (0,116 мл, 1,50 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия и затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении.
К раствору в N,N-диметилформамиде (10 мл) полученного остатка последовательно добавляли 5-хлор-2-пиридинтиол (145 мг, 1,00 ммоль), полученный в ссылочном примере 32, и карбонат калия (166 мг, 1,20 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. К смеси добавляли этилацетат, и смесь промывали водой. Затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=17:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (267 мг, 0,77 ммоль, 77%) в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 6,52 (1H, с), 6,92-6,98 (1H, м), 6,99-7,06 (1H, м), 7,48 (1H, дд, J=8,5,0,7 Гц), 7,17-7,23 (1H, м), 7,34 (2H, д, J=6,1 Гц), 7,47 (1H, дд, J=8,5, 2,4 Гц), 8,33 (1H, дд, J=2,4, 0,7 Гц), 8,54 (2H, д, J=6,1 Гц).
МС m/z: 349 (М++H).
Пример 191: 5-хлор-2-[(2, 5-дифторфенил-4-пиридилметил)сульфонил]пиридин
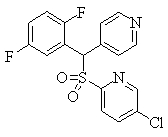
К раствору в метаноле (6 мл) 5-хлор-2-[[1-(2,5-дифторфенил-4-пиридилметил)тио]пиридина (239 мг, 0,68 ммоль) добавляли раствор в воде (12 мл) Оксона (соединения пероксимоносульфата калия, 2KHSO5.KHSO4.K2SO4) (631 мг, 1,03 ммоль) при 0°С. После перемешивания при комнатной температуре в течение 3 дней к реакционной смеси добавляли дихлорметан, и смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота). Полученное твердое вещество промывали смесью гексан/диизопропиловый эфир и затем собирали фильтрованием с получением указанного в заголовке соединения (67 мг, 0,18 ммоль, 26%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 6, 44 (1H, с), 6,96-7,08 (2H, м), 7,48 (2H, д, J=6,3 Гц), 7,70-7,77 (1H, м), 7,79 (1H, дд, J=8,3, 2,2 Гц), 7,84 (1H, дд, J=8,3, 0,7 Гц), 8,61 (2H, д, J=6,3 Гц), 8,67 (1H, дд, J=2,2, 0,7 Гц).
ИК (ATR) см-1: 1591, 1493, 1329, 1161, 1107, 1014.
Элементный анализ. Вычислено для C17H11ClF2N2O2S: C, 53, 62; H, 2,91; F, 9,98; N, 7,36; S, 8,42. Найдено: C, 53,55; H, 2,87; F, 10,10; N, 7,40; S, 8,55.
МС m/z: 381 (М++H).
Пример 192: 5-(4-хлорбензолсульфонилметил)-1Н-тетразол
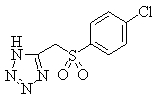
К раствору в N,N-диметилформамиде (100 мл) 4-хлорфенилсульфонилацетонитрила (2,81 г, 13,0 ммоль) и гидрохлорида триэтиламина (4,24 г, 65,2 ммоль) добавляли азид натрия (10,8 г, 78,2 ммоль), и смесь перемешивали при 80°С в течение 16 часов. Затем реакционную смесь охлаждали до комнатной температуры. Добавляли этилацетат, и смесь промывали насыщенным водным раствором хлорида аммония. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Полученное твердое вещество промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (2,53 г, 9,78 ммоль, 75%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CD3OD) δ: 5,02 (2H, с), 7,62 (1H, д, J=8,6 Гц), 7,73 (2H, д, J=8,6 Гц).
МС m/z: 300 (М++H+CH3CN).
Пример 193: 1-бензил-5-(4-хлорбензолсульфонилметил)-1Н-тетразол (изомер 193-А) и 2-бензил-5-(4-хлорбензолсульфонилметил)-2Н-тетразол (изомер 193-В)
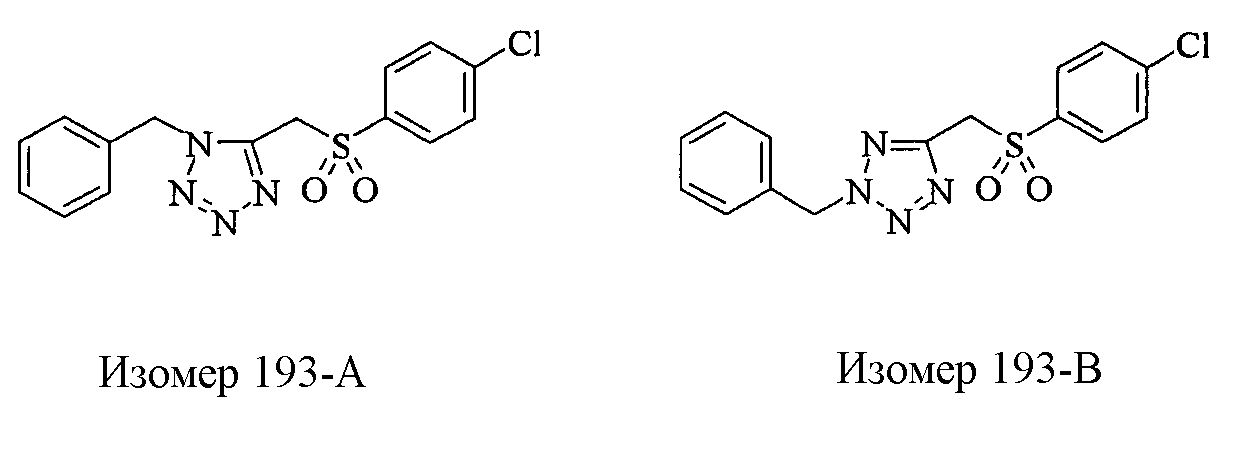
К раствору в смеси дихлорметан/тетрагидрофуран (1:1) (20 мл) 5-(4-хлорфенилсульфонилметил)-1Н-тетразола (837 мг, 3,24 ммоль) и бензилового спирта (0,335 мл, 3,24 ммоль) добавляли трифенилфосфин (849 мг, 3,24 ммоль) при охлаждении на льду. Затем добавляли по каплям азодикарбоксилат (0,510 мл, 3,24 ммоль) при той же температуре. Реакционную смесь перемешивали при комнатной температуре в течение 16 часов с последующим концентрированием при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке изомера 193-А (406 мг, 1,16 ммоль, 36%) и указанного в заголовке изомера 193-В (317 мг, 0,91 ммоль, 28%), каждого в виде белого твердого вещества.
На основании испытания NOE (ядерного эффекта Оверхаузера) была определена структура каждого из изомера 193-А и изомера 193-В.
Изомер 193-А
1H-ЯМР (400 МГц, CDCl3) δ: 4,46 (2H, с), 5,88 (2H, с), 7,22-7,43 (5H, м), 7,51 (2H, д, J=8,7 Гц), 7,57 (2H, д, J=8,7 Гц).
МС m/z: 349 (М++H).
Изомер 193-В
1H-ЯМР (400 МГц, CDCl3) δ: 4,68 (2H, с), 5,72 (2H, с), 7,22-7,45 (5H, м), 7,33 (2H, д, J=8,6 Гц), 7, 55 (2H, д, J=8,6 Гц).
МС m/z: 349 (М++H).
Пример 194: 6-(1-бензил-1Н-тетразол-5-ил)-6-[(4-хлорфенил)сульфонил]-1-гексанол
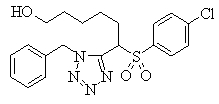
К раствору в толуоле (5 мл) 1-бензил-5-(4-хлорбензолсульфонилметил)-1Н-тетразола (изомера 193-А) (174 мг, 0,50 ммоль) и 5-(трет-бутилдиметилсилилокси)-1-пентанола (146 мг, 0,60 ммоль) добавляли цианометилентри-н-бутилфосфоран (161 мг, 0,60 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 8 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=87:13, концентрировали при пониженном давлении.
Остаток растворяли в тетрагидрофуране (5 мл) с последующим добавлением раствора в тетрагидрофуране (0,410 мл, 0,41 ммоль) тетра-н-бутиламмонийфторида. Полученную смесь перемешивали при комнатной температуре в течение 4 часов. После концентрирования реакционной смеси при пониженном давлении к остатку добавляли этилацетат. Смесь промывали насыщенным водным раствором хлорида аммония. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (115 мг, 0,26 ммоль, 54%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3 ) δ: 0,54-0,67 (1H, м), 0,79-1,02 (3H, м), 1,08 (1H, т, J=5,9 Гц), 1,19-1,32 (2H, м), 1,94-2,05 (1H, м), 2,06-2,16 (1H, м), 3,43 (2H, кв, J=5,9 Гц), 4,21 (1H, дд, J=11,5, 3,4 Гц), 5,72 (1H, д, J=15,5 Гц), 6,04 (1H, д, J=15,5 Гц), 7,21-7,28 (2H, м), 7,37-7,44 (3H, м), 7,42 (2H, д, J=8,5 Гц), 7,50 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3402, 2935, 1581, 1456, 1321, 1151, 1084, 1012, 725.
МС m/z: 435 (М++H).
FAB-МС: 435,1240 (вычислено для C20H24ClN4O3S: 435,1258).
Пример 195: 1-бензил-5-[1-(4-хлорбензолсульфонил)циклогексил]-1Н-тетразол
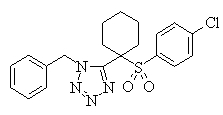
К раствору в толуоле (3 мл) 6-(1-бензил-1Н-тетразол-5-ил)-6-[(4-хлорфенил)сульфонил)-1-гексанола (104 мг, 0,24 ммоль) добавляли раствор в толуоле (2 мл) цианометилентри-н-бутилфосфорана (128 мг, 0,48 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 7 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=4:1, концентрировали при пониженном давлении. Полученное твердое вещество промывали смесью гексан/диэтиловый эфир и затем собирали фильтрованием с получением указанного в заголовке соединения (51 мг, 0,12 ммоль, 51%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 0,45-0,93 (2H, м), 1,07-1,21 (1H, м), 1,31-1,50 (3H, м), 2,07-2,20 (2H, м), 2,58-2,68 (2H, м), 6,13 (2H, с), 7,21 (2H, д, J=8,8 Гц), 7,28-7,39 (5H, м), 7,41 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 2941, 1574, 1460, 1392, 1302, 1282, 1142, 1080, 1011, 831.
Т.пл.: 154-155°C.
Элементный анализ. Вычислено для C20H21ClN4O2S: C, 57,62; H, 5,08; Cl, 8,50; N, 13,44. Найдено: C, 57,47; H, 5,07; Cl, 8,53; N, 13,45.
МС m/z: 417 (М++H).
Пример 196: 6-(2-бензил-2Н-тетразол-5-ил)-6-[(4-хлорфенил)сульфонил]-1-гексанол
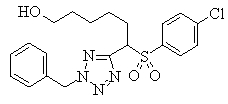
К раствору в толуоле (5 мл) 2-бензил-5-(4-хлорбензолсульфонилметил)-2Н-тетразола (изомера 193-В) (174 мг, 0,50 ммоль), полученного в примере 193, и 5-(трет-бутилдиметилсилилокси)-1-пентанола добавляли цианометилентри-н-бутилфосфоран (161 мг, 0,60 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 8 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=17:3, концентрировали при пониженном давлении.
Полученный таким образом остаток растворяли в тетрагидрофуране (5 мл) с последующим добавлением раствора в тетрагидрофуране (0,574 мл, 0,57 ммоль) тетра-н-бутиламмонийфторида, и смесь перемешивали при комнатной температуре в течение 4 часов. После концентрирования реакционной смеси при пониженном давлении к остатку добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором хлорида аммония. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (155 мг, 0,36 ммоль, 71%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,12-1, 64 (7H, м), 2,22-2,34 (1H, м), 2,36-2,48 (1H, м), 3,56 (2H, шир.с), 4,21 (1H, дд, J=11,4, 3,8 Гц), 5,69 (1H, д, J=14,4 Гц), 5,73 (1H, д, J=14,4 Гц), 7,20 (2H, д, J=8,3 Гц), 7,28-7,48 (5H, м), 7,37 (2H, д, J=8,3 Гц).
ИК (ATR) см-1: 3543, 2933, 1581, 1475, 1394, 1321, 1149, 1088, 1012, 723.
МС m/z: 435 (М++H).
FAB-МС: 435,1252 (вычислено для C20H24ClN4O3S: 435,1258).
Пример 197: 2-бензил-5-[1-(4-хлорбензолсульфонил)циклогексил]-2Н-тетразол
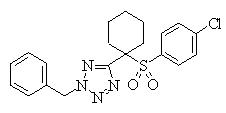
К раствору в толуоле (3 мл) 6-(2-бензил-2Н-тетразол-5-ил)-6-[(4-хлорфенил)сульфонил)-1-гексанола (145 мг, 0,33 ммоль) добавляли раствор в толуоле (3 мл) цианометилентри-н-бутилфосфорана (179 мг, 0,67 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 7 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=4:1, концентрировали при пониженном давлении. Полученное твердое вещество промывали смесью гексан/диэтиловый эфир и затем собирали фильтрованием с получением указанного в заголовке соединения (78 мг, 0,19 ммоль, 56%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 0,99-1,14 (2H, м), 1,21-1,36 (1H, м), 1,52-1,62 (1H, м), 1,75-1,82 (2H, м), 2,15-2,25 (2H, м), 2,69-2,76 (2H, м), 5,72 (2H, с), 7,07 (2H, д, J=8,8 Гц), 7,11 (2H, д, J=8,8 Гц), 7,34-7,47 (5H, м).
ИК (ATR) см-1: 2939, 1579, 1477, 1396, 1317, 1144, 1084, 1012, 756.
Т.пл.: 133-134°C.
Элементный анализ. Вычислено для C20H21ClN4 O2S: C, 57,62; H, 5,08; Cl, 8,50; N, 13,44. Найдено: C, 57,74; H, 5,14; Cl, 8,51; N, 13,37.
МС m/z: 417 (М++H).
Пример 198: 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)-1-(1-пирролидинил)-1-пропанон
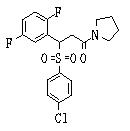
В дихлорметане (6 мл) растворяли 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропионовую кислоту (200 мг, 0,554 ммоль), полученную в примере 62. К полученному раствору добавляли тионилхлорид (162 мкл, 2,22 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 часов. Затем реакционную смесь концентрировали досуха. Полученный таким образом остаток растворяли в дихлорметане (6 мл) и к полученному раствору добавляли пирролидин (185 мкл, 2,22 ммоль) и триэтиламин (309 мкл, 2,22 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли дихлорметаном, промывали последовательно водой, насыщенным водным раствором хлорида аммония и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали. Полученное таким образом бесцветное твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (192 мг, 0,463 ммоль, 84%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (CDCl3) δ: 1,80-1,90 (2H, м), 1,96-2,03 (2H, м), 3,06 (1H, дд, J=16,4, 9,8 Гц), 3,28-3,57 (5H, м), 5,25 (1H, дд, J=9,8, 3,7 Гц), 6,81 (1H, тд, J=9,1, 4,4 Гц), 6,91-6,98 (1H, м), 7,18 (1H, ддд, J=8,6, 5,4, 3,2 Гц), 7,38 (2H, д, J=8,6 Гц), 7,53 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2949, 1633, 1583, 1495, 1442, 1396, 1346, 1308, 1277, 1211, 1147, 1014, 822, 769, 708, 615, 536, 472.
Т.пл.: 122-125°C.
MC m/z: 414 (M++H).
FAB-MC: 414,0769 (вычислено для C19H19ClF2NO3S: 414,0742).
Элементный анализ. Вычислено для C19H18ClF2NO3S: C, 55,14; H, 4,38; Cl, 8,57; F, 9,18; N, 3,38; S, 7,75. Найдено: C, 55,22; H, 4,50; Cl, 8,44; F, 9,00; N, 3,39; S, 7,78.
Пример 199: Трет-бутил-4-[(4-хлорфенил)сульфонил]-4-(2, 5-дифторфенил)бутират
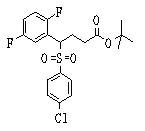
В N,N-диметилформамиде (4 мл) растворяли 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (101 мг, 0,333 ммоль), полученный в примере 5. После добавления к раствору трет-бутилакрилата (146 мкл, 1,00 ммоль) и 1,8-диазабицикло[5,4, 0]ундец-7-ена (151 мкл, 1,00 ммоль) перемешивание проводили при комнатной температуре в течение 1 недели. Затем реакционную смесь концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=4:1, концентрировали с получением указанного в заголовке соединения (142 мг, 0,329 ммоль, 99%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,40 (9H, с), 2,10-2,20 (1H, м), 2,23-2,35 (2H, м), 2,65-2,76 (1H, м), 4,67 (1H, дд, J=10, 3, 4,4 Гц), 6,85 (1H, тд, J=10,3, 4,4 Гц), 6,96-7,03 (1H, м), 7,24 (1H, ддд, J=8,6, 5,4, 3,2 Гц), 7,40 (2H, д, J=8,3 Гц), 7,56 (2H, д, J=8,3 Гц).
ИК (ATR) см-1: 2978, 1724, 1583, 1496, 1367, 1321, 1232, 1146, 1084, 1014, 829, 756, 710, 642, 629, 555, 471.
МС m/z: 431 (М++H).
FAB-МС: 431,0904 (вычислено для C20H22ClF2O4S: 431,0895).
Пример 200: 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)масляная кислота
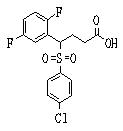
К раствору в дихлорметане (10 мл) трет-бутил-4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)бутирата (1,25 г, 3,33 ммоль) добавляли трифторуксусную кислоту (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 4 часов. Твердое вещество, полученное концентрированием реакционной смеси, перекристаллизовывали из этилацетата с получением указанного в заголовке соединения (595 мг, 1,59 ммоль, 48%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 2, 32-2,50 (3H, м), 2,71-2,81 (1H, м), 4,68 (1H, дд, J=9,3, 4,9 Гц), 6,86 (1H, тд, J=9,3, 4,4 Гц), 6,97-7,04 (1H, м), 7,21-7,27 (1H, м), 7,40 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2942, 1710, 1571, 1495, 1427, 1327, 1240, 1151, 1084, 1012, 916, 831, 789, 752, 710, 636, 555, 528, 463, 417.
Т.пл.: 157-158°C.
МС m/z: 375 (М++H).
Элементный анализ. Вычислено для C16H13ClF2O4S: C, 51,27; H, 3,50; Cl, 9,46; F, 10,14; S, 8,56. Найдено: C, 51, 18; H, 3,47; Cl, 9,45; F, 10,32; S, 8,60.
Пример 201: 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)-1-(1-пирролидинил)-1-бутанон
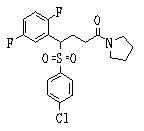
К раствору в тетрагидрофуране (4 мл) 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)масляной кислоты (150 мг, 0,400 ммоль) добавляли пирролидин (40,1 мкл, 0,480 ммоль), триэтиламин (61,2 мкл, 0,440 ммоль), 4-диметиламинопиридин (10,0 мг, 0,0820 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (84,5 мг, 0, 440 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. Растворитель отгоняли. Полученный таким образом остаток промывали в этилацетате. Полученный раствор промывали насыщенным водным раствором хлорида аммония и насыщенным раствором соли, сушили над безводным сульфатом натрия и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:7, концентрировали. Полученное твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (97,0 мг, 0,227 ммоль, 57%) в виде бесцветных пластинчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,78-1,93 (4H, м), 2,20-2,43 (3H, м), 2,69-2,78 (1H, м), 3,15-3,21 (1H, м), 3,25-3,30 (1H, м), 3,41 (2H, т, J=6,8 Гц), 4,84 (1H, дд, J=8,5, 5,6 Гц), 6,86 (1H, тд, J=9,0, 4,6 Гц), 6,95-7,02 (1H, м), 7,24 (1H, ддд, J=8,8, 5,6, 3,4 Гц), 7,40 (2H, д, J=8,5 Гц), 7,59 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3072, 2973, 2875, 1635, 1496, 1444, 1421, 1317, 1234, 1173, 1146, 1082, 1011, 877, 760, 737, 619, 559, 509, 469,
Т.пл.: 134-135°C.
МС m/z: 428 (М++H).
Элементный анализ. Вычислено для C20H20 ClF2NO3S: C, 56,14; H, 4,71; Cl, 8,29; F, 8,88; N, 3,27; S, 7,49. Найдено: C, 56,01; H, 4,68; Cl, 8,03; F, 8,64; N, 3,35; S, 7,63.
Пример 202: 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-1-валериановая кислота
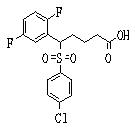
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 578 мкл, 0,908 ммоль) добавляли к раствору в диметоксиэтане (5 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (250 мг, 0,825 ммоль), полученного в примере 5. После повышения температуры реакционной смеси до комнатной температуры смесь опять охлаждали до -78°С. Добавляли этил-4-бромбутират (142 мг, 0,990 ммоль), и смесь перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси добавляли воду с последующей экстракцией дихлорметаном. Экстракты объединяли, промывали водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток растворяли в тетрагидрофуране (4 мл). К полученной смеси добавляли водный раствор (2 мл) гидроксида лития (19,8 мг, 0,825 ммоль). Смесь перемешивали при комнатной температуре в течение 15 часов. После добавления 1 н. хлористо-водородной кислоты для подкисления смеси до кислой реакции экстрагировали дихлорметаном. Экстракты объединяли, промывали насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученное твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (139 мг, 0,357 ммоль, 43%) в виде бесцветного твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ : 1,53-1,55 (2H, м), 2,12-2,23 (1H, м), 2,32-2,54 (3H, м), 4,52 (1H, дд, J=11,5, 3,7 Гц), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,96-7,02 (1H, м), 7,23-7,28 (1H, м), 7,38 (2H, д, J=8,3 Гц), 7,53 (2H, д, J=8,3 Гц).
ИК (ATR) см-1: 2945, 1693, 1585, 1495, 1427, 1323, 1296, 1238, 1211, 1153, 1086, 1012, 949, 829, 750, 708, 628, 542, 463,
Т.пл: 151-152°C.
МС m/z: 389 (М++H).
Элементный анализ. Вычислено для C17H15ClF2O4S: C, 52,51; H, 3,89; Cl, 9,12; F, 9,77; S, 8,25. Найдено: C, 52,36; H, 3,88; Cl, 9,14; F, 9,75; S, 8,37.
Пример 203: 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-1-(1-пирролидинил)-1-пентанон
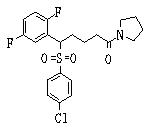
В атмосфере аргона и при -15оС N-метилморфолин (38,5 мкл, 0,351 ммоль) и изобутилхлорформиат (45,8 мкл, 0,351 ммоль) добавляли к раствору в тетрагидрофуране (4 мл) 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-1-валериановой кислоты (130 мг, 0,334 ммоль). Смесь перемешивали в течение 5 минут при -15°С. Добавляли пирролидин (33,5 мкл, 0,401 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли дихлорметаном, промывали насыщенным водным раствором хлорида аммония и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:2, концентрировали. Полученное твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (128 мг, 0,290 ммоль, 87%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,52-1,66 (2H, м), 1,80-1,88 (2H, м), 1,91-1,98 (2H, м), 2,15-2,34 (3H, м), 2,41-2,50 (1H, м), 3,34 (2H, тд, J=6,8,2,4 Гц), 3,41 (2H, т, J=6,8 Гц), 4,55 (1H, дд, J=11,7, 2,9 Гц), 6,81 (1H, тд, J=9,0, 4,4 Гц), 6,93-7,00 (1H, м), 7,22-7,28 (1H, м), 7,38 (2H, д, J=8,5 Гц), 7,52 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 2941, 2883, 1635, 1583, 1496, 1441, 1315, 1277, 1244, 1215, 1180, 1146, 1082, 1038, 1014, 829, 787, 752, 710, 631, 548, 519, 480, 440.
Т.пл.: 125-126°C.
МС m/z: 442 (М++H).
Элементный анализ. Вычислено для C21H22ClF2NO3S: C, 57,07; H, 5,02; Cl, 8,02; F, 8,60; N, 3,17; S, 7,26. Найдено: C, 57,04; H, 5,13; Cl, 8,03; F, 8,64; N, 3, 29; S, 7,39.
Ссылочный пример 37: 5-бром-1-(1-пирролидинил)-1-пентанон
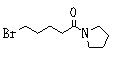
В атмосфере аргона N-метилморфолин (606 мкл, 5,52 ммоль) и изобутилхлорформиат (757 мкл, 5,80 ммоль) добавляли к раствору в тетрагидрофуране (35 мл) 6-бромвалериановой кислоты (1,00 г, 5,52 ммоль) при -15оС. Полученную смесь перемешивали в течение 5 минут при -15°С. Добавляли пирролидин (484 мкл, 5,80 ммоль), и полученную смесь перемешивали при -15°С в течение 5 минут и затем при комнатной температуре в течение 1 часа. Добавляли ледяную воду, и смесь экстрагировали дихлорметаном. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:2, концентрировали с получением указанного в заголовке соединения (1,18 г, 5,04 ммоль, 91%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,77-2,00 (8H, м), 2,29 (2H, т, J=7,3 Гц), 3,39-3,48 (6H, м).
МС m/z: 234 (М++H).
Пример 204: 6-[(4-хлорфенил)сульфонил]-6-(2,5-дифторфенил)-1-гексанон
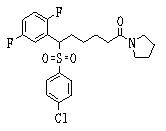
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 701 мкл, 1,10 ммоль) добавляли к раствору в диметоксиэтане (6 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (303 мг, 1,00 ммоль), полученного в примере 5. После повышения температуры реакционной смеси до комнатной температуры смесь опять охлаждали до -78°С. После добавления 5-бром-1-(1-пирролидинил)-1-пентанона (281 мг, 1,20 ммоль) полученную смесь перемешивали при комнатной температуре в течение 20 часов. К реакционной смеси добавляли воду и затем разбавляли дихлорметаном. Полученный таким образом раствор промывали последовательно водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:2, концентрировали. Полученное твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (385 мг, 0,844 ммоль, 84%) в виде бесцветного твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,25-1,37 (2H, м), 1,58-1,75 (2H, м), 1,80-1,88 (2H, м), 1,91-1,97 (2H, м), 2,07-2,16 (1H, м), 2, 20 (2H, тд, J=7,6, 3,2 Гц), 2,41-2,50 (1H, м), 3,35 (2H, т, J=6,8 Гц), 3,43 (2H, т, J=6,8 Гц), 4,50-4,56 (1H, м), 6,83 (1H, тд, J=9,0, 4,4 Гц), 6,94-7,01 (1H, м), 7,24 (1H, ддд, J=8,8, 5,4, 3,2 Гц), 7, 38 (2H, д, J=8,8 Гц), 7,53 (2H, д, J=8,8 Гц),
ИК (ATR) см-1: 2952, 1626, 1493, 1441, 1321, 1232, 1149, 1086, 1014, 820, 768, 631, 528, 469.
Т.пл.: 135-136°C.
МС m/z: 456 (М++H).
Элементный анализ. Вычислено для C22H24ClF2NO3S: C, 57,95; H, 5,31; Cl, 7, 78; F, 8,33; N, 3,07; S, 7,03. Найдено: C, 57,73; H, 5,20; Cl, 7,76; F, 8,31; N, 3,13; S, 7,14.
Пример 205: 7-[(4-хлорфенил)сульфонил]-7-(2,5-дифторфенил)гептановая кислота
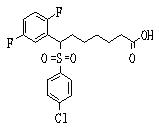
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 2,31 мл, 3,63 ммоль) добавляли к раствору в диметоксиэтане (20 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (1,00 мг, 3,30 ммоль), полученного в примере 5. После повышения температуры реакционной смеси до комнатной температуры опять охлаждали до -78°С. К реакционной смеси добавляли этил-6-бромгексаноат (706 мкл, 3,96 ммоль) с последующим перемешиванием полученной смеси при комнатной температуре в течение 18 часов. К реакционной смеси добавляли воду, и затем смесь экстрагировали дихлорметаном. Экстракты объединяли, промывали насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали с получением эфирного соединения в качестве неочищенного продукта. Полученное эфирное соединение растворяли в тетрагидрофуране (20 мл). К полученному раствору добавляли водный раствор (6 мл) гидроксида лития (96,0 мг, 4,00 ммоль). Смесь перемешивали при комнатной температуре в течение 18 часов. После подкисления реакционной смеси до кислой реакции 1 н. хлористо-водородной кислотой кислую смесь экстрагировали дихлорметаном. Экстракты объединяли, промывали насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученное твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (931 мг, 2,23 ммоль, 68%) в виде бесцветного твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,22-1,90 (7H, м), 2,30 (2H, т, J=7,3 Гц), 2,40-2,48 (1H, м), 4,51 (1H, дд, J=11,7, 2,9 Гц), 6,83 (1H, тд, J=9,0,4,4 Гц), 6,94-7,01 (1H, м), 7,22-7,26 (1H, м), 7,38 (2H, д, J=8,5 Гц), 7,53 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3487, 2941, 2860, 1728, 1496, 1414, 1321, 1217, 1176, 1149, 1086, 1014, 818, 787, 756, 633, 536, 478.
Т.пл.: 72-76°C.
МС m/z: 417 (М++H).
Элементный анализ. Вычислено для C19H19ClF2O4S·0, 5H2O: C, 53,59; H, 4,73; Cl, 8,32; F, 8,92; S, 7,53. Найдено: C, 53,83; H, 4,67; Cl, 8,39; F, 8,94; S, 7,72.
Пример 206: 7-[(4-хлорфенил)сульфонил]-7-(2, 5-дифторфенил)-1-(1-пирролидинил)-1-гептанон
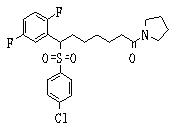
В атмосфере аргона и при -15оС N-метилморфолин (53,9 мкл, 0,491 ммоль) и изобутилхлорформиат (64,1 мкл, 0,491 ммоль) добавляли к раствору в тетрагидрофуране (5 мл) 7-[(4-хлорфенил)сульфонил]-7-(2, 5-дифторфенил)гептановой кислоты (195 мг, 0,468 ммоль). Полученную смесь перемешивали в течение 5 минут при -15°С. Добавляли пирролидин (46,9 мкл, 0,562 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли дихлорметаном, промывали последовательно насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:7, концентрировали. Полученное твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (171 мг, 0,364 ммоль, 78%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,21-1,43 (4H, м), 1,54-1,67 (2H, м), 1,80-1,98 (4H, м), 2,03-2,15 (1H, м), 2,19 (2H, т, J=7,6 Гц), 2, 38-2,46 (1H, м), 3,36 (2H, т, J=6,8 Гц), 3,44 (2H, т, J=6,8 Гц), 4,51 (1H, дд, J=11,5, 2,9 Гц), 6,83 (1H, тд, J=9,0, 4,4 Гц), 6,94-7,01 (1H, м), 7,23 (1H, ддд, J=8,8, 5,4, 3,2 Гц), 7,38 (2H, д, J=8,8 Гц), 7,53 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 2960, 1630, 1583, 1496, 1442, 1315, 1228, 1196, 1149, 1086, 1011, 872, 841, 822, 787, 756, 633, 536, 467.
Т.пл.: 106-106°C.
МС m/z: 470 (М++H).
Элементный анализ. Вычислено для C23H26ClF2NO3S: C, 58,78; H, 5,58; Cl, 7,54; F, 8,08; N, 2,98; S, 6,82. Найдено: C, 58,53; H, 5,49; Cl, 7,66; F, 8,19; N, 3,06; S, 8,82.
Пример 207: 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)-1-пропанол
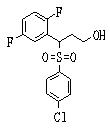
Способ 1: При 0°С литийалюминийгидрид (1,0 М раствор в тетрагидрофуране, 6, 74 мл, 6,74 ммоль) добавляли по каплям к раствору в тетрагидрофуране (10 мл) этил-3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропионата (1,31 г, 3,37 ммоль), полученного в примере 25. Затем смесь перемешивали при комнатной температуре в течение 3 часов. После охлаждения реакционной смеси до 0°С и добавления насыщенного водного раствора хлорида аммония смесь перемешивали при комнатной температуре в течение 15 часов. Осажденное таким образом твердое вещество отфильтровывали. Полученный таким образом раствор разбавляли эфиром, промывали насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (397 мг, 1,14 ммоль, 34%) в виде бесцветного твердого вещества.
Способ 2: В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 4,62 мл, 7,26 ммоль) добавляли к раствору в диметоксиэтане (50 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (2,00 мг, 6,60 ммоль), полученного в примере 5. Температуру полученной смеси повышали до комнатной температуры и перемешивание выполняли в течение 15 минут. После охлаждения реакционной смеси до -78°С добавляли раствор в диметоксиэтане (5 мл) трет-бутил-(2-иодэтилокси)диметилсилана (2,08 г, 7,26 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 15 часов. К реакционной смеси добавляли воду с последующей экстракцией эфиром. Экстракты объединяли, промывали последовательно водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали укороченной хроматографии на силикагеле (гексан-этилацетат=7:1) для удаления примесей высокой полярности. Полученное масло растворяли в тетрагидрофуране (50 мл), и к полученному раствору добавляли тетрабутиламмонийфторид (1 М раствор в тетрагидрофуране, 14,5 мл, 14,5 ммоль). После перемешивания в течение 2 дней растворитель отгоняли. Полученный таким образом остаток растворяли в дихлорметане с последующим последовательным промыванием 1 н. хлористо-водородной кислотой, водой и насыщенным раствором соли, сушкой над сульфатом магния и концентрированием. Полученный таким образом остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали с получением указанного в заголовке соединения (2,07 г, 5,82 ммоль, 88%) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ 2,27 (1H, дд д, J=19,3, 10,3, 5,1 Гц), 2,72 (1H, дд д, J=19,3, 9,0, 3,9 Гц), 3,48 (1H, тд, J=10,5, 4,4 Гц), 3,85 (1H, тд, J=10,5, 5,1 Гц), 4,85 (1H, дд, J=10,3, 3,9 Гц), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,95-7,02 (1H, м), 7,23-7,27 (1H, м), 7,31 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3519, 3043, 2964, 2922, 2875, 1576, 1495, 1427, 1396, 1308, 1186, 1147, 1084, 1036, 957, 895, 818, 786, 752, 708, 625, 521, 467.
Т.пл.: 147-149°C.
МС m/z: 347 (М++H).
Элементный анализ. Вычислено для C15H13ClF2O3S: C, 51,95; H, 3,78; Cl, 10,22; F, 10,96; S, 9,25. Найдено: C, 51,89; H, 3,75; Cl, 10,15; F, 10,90; S, 9,36.
Пример 208: 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил-1-пирролидинкарбоксилат
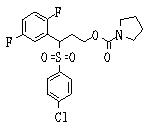
В дихлорметане (4 мл) растворяли 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)-1-пропанол (150 мг, 0,432 ммоль) с последующим добавлением триэтиламина (63,2 мкл, 0,454 ммоль) и 4-нитрофенилхлорформиата (91,7 мг, 0,454 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 20 часов. Добавляли пирролидин (43,2 мкл, 0,518 ммоль) и триэтиламин (72,1 мкл, 0,518 ммоль), и смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:2, концентрировали. Полученное бесцветное твердое вещество перекристаллизовывали из гексана с получением указанного в заголовке соединения (84,0 мг, 0,189 ммоль, 44%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,77-1,88 (4H, м), 2,37-2,47 (1H, м), 2,75-3,84 (1H, м), 3,09-3,20 (2H, м), 3,28-3,34 (2H, м), 3,89 (1H, дд д, J=11,3, 8,3, 4,4 Гц), 4,22 (1H, дт, J=11,3, 5,6 Гц), 4,70 (1H, дд, J=11,3, 3,6 Гц), 6,83 (1H, тд, J=9,1, 4,4 Гц), 6,95-7,02 (1H, м), 7, 20-7,26 (1H, м), 7,39 (2H, д, J=8,6 Гц), 7,54 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2974, 2879, 1685, 1585, 1496, 1427, 1373, 1306, 1178, 1149, 1091, 816, 766, 754, 710, 631, 553, 523, 467, 444.
Т.пл.: 109-110°C.
МС m/z: 444 (М++H).
Элементный анализ. Вычислено для C20H20ClF2NO4S: C, 54,12; H, 4,54; Cl, 7,99; F, 8,56; N, 3,16; S, 7,37. Найдено: C, 53,93; H, 4,49; Cl, 8,00; F, 8,50; N, 3,22; S, 7,37.
Пример 209: Гидрохлорид 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил-4-бензил-1-пиперазинкарбоксилата
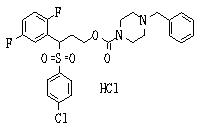
3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)-1-пропанол (150 мг, 0,432 ммоль), полученный в примере 207, растворяли в дихлорметане (4 мл) с последующим добавлением триэтиламина (63,2 мкл, 0,454 ммоль) и 4-нитрофенилхлорформиата (91,7 мг, 0,454 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли N-бензилпиперазин (90,3 мкл, 0, 518 ммоль) и триэтиламин (72,1 мкл, 0,518 ммоль), и смесь перемешивали при комнатной температуре в течение 24 часов. Затем реакционную смесь концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали. Полученное бесцветное твердое вещество растворяли в этаноле с последующим добавлением 1 н. хлористо-водородной кислоты (0,5 мл). Затем смесь концентрировали досуха. Полученное твердое вещество перекристаллизовывали из этанола с получением указанного в заголовке соединения (132 мг, 0,226 ммоль, 52%) в виде бесцветного твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,35-2,45 (1H, шир.м), 2,56-2,72 (2H, шир.м), 2,79-2,88 (1H, м), 3,28-3,40 (2H, м), 3,63-4,28 (8H, м), 4,60 (1H, дд, J=10,8, 3,9 Гц), 6,82 (1H, тд, J=9,1, 4,4 Гц), 6,96-7,02 (1H, м), 7,18-7,26 (1H, шир.м), 7,39 (2H, д, J=8,6 Гц), 7,45-7, 53 (5H, м), 7,58-7,64 (2H, шир).
ИК (ATR) см-1: 2958, 2708, 2675, 1701, 1583, 1495, 1423, 1321, 1255, 1217, 1153, 1142, 1092, 951, 827, 752, 700, 627, 555, 525, 468.
Т.пл.: 184-189°C.
МС m/z: 549 (М++H).
Элементный анализ. Вычислено для C27H27ClF2N2O4S·HCl: C, 55,39; H, 4,82; Cl, 12,11; F, 6,49; N, 4,78; S, 5,48. Найдено: C, 55,11; H, 4,80; Cl, 11,92; F, 6,36; N, 4,85; S, 5,54.
Пример 210: 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил-N-(2-гидроксиэтил)-N-метилкарбамат
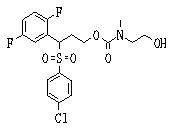
В дихлорметане (4 мл) растворяли 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)-1-пропанол (150 мг, 0,432 ммоль), полученный в примере 207, с последующим добавлением триэтиламина (63,2 мкл, 0,454 ммоль) и 4-нитрофенилхлорформиата (91,7 мг, 0,454 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 20 часов. К реакционной смеси добавляли N-метилэтаноламин (41,6 мкл, 0,518 ммоль) и триэтиламин (72,1 мкл, 0,518 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 24 часов. Затем реакционную смесь концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:2, концентрировали с получением указанного в заголовке соединения (136 мг, 0,304 ммоль, 70%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 2,33-2,48 (1H, шир.м), 2,77-2,97 (4H, м), 3,27-3,43 (2H, шир.м), 3,68-3,78 (2H, шир.с), 3,87-3,98 (1H, шир.м), 4,19-4,30 (1H, шир.м), 4,65-4,77 (1H, шир.м), 6,84 (1H, тд, J=9,1, 4,4 Гц), 6,95-7,02 (1H, м), 7,21-7,26 (1H, м), 7,39 (2H, д, J=8,8 Гц), 7,54 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 3423, 2943, 1685, 1583, 1495, 1317, 1279, 1215, 1147, 1080, 1012, 827, 754, 708, 627, 555, 467.
МС m/z: 448 (М++H).
EI-МС: 447,0699 (вычислено для C19H20ClF2NO5S: 447,0719).
Пример 211: 3-[(4-хлорфенил)сульфонил]-3-(2, 5-дифторфенил)пропил-4-морфолинкарбоксилат
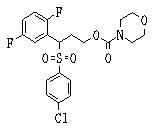
В дихлорметане (4 мл) растворяли 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)-1-пропанол (150 мг, 0,432 ммоль), полученный в примере 207, с последующим добавлением триэтиламина (63,2 мкл, 0,454 ммоль) и 4-нитрофенилхлорформиата (91, 7 мг, 0,454 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 20 часов. К реакционной смеси добавляли морфолин (45,1 мкл, 0,518 ммоль) и триэтиламин (72,1 мкл, 0,518 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли дихлорметаном, промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:2, концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (123 мг, 0,267 ммоль, 62%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 2,39-2,48 (1H, м), 2,79-2,88 (1H, м), 3,19-3,47 (4H, шир.), 3,52-3,70 (4H, шир.с), 3,97 (1H, дд д, J=11,2, 8,3, 5,1 Гц), 4,23 (1H, дт, J=11,2, 5,6 Гц), 4,65 (1H, дд, J=11,2, 3,4 Гц), 6,84 (1H, тд, J=9,0, 4,6 Гц), 6,97-7,03 (1H, м), 7,22-7,26 (1H, м), 7,40 (2H, д, J=8,5 Гц), 7,53 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3086, 2864, 1684, 1576, 1498, 1469, 1427, 1311, 1281, 1240, 1221, 1178, 1142, 1080, 837, 773, 752, 710, 633, 557, 528, 471.
Т.пл.: 140-141°C.
МС m/z: 460 (М++H).
Элементный анализ. Вычислено для C20H20ClF2NO5S: C, 52,23; H, 4,38; Cl, 7,71; F, 8,26; N, 3,05; S, 6,97. Найдено: C, 51,95; H, 4,29; Cl, 7,80; F, 8,32; N, 3,12; S, 7,12.
Пример 212: 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил-4-фенил-1-пиперазинкарбоксилат
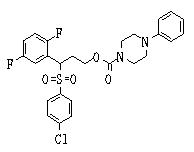
3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)-1-пропанол (150 мг, 0,432 ммоль), полученный в примере 207, растворяли в дихлорметане (6 мл) с последующим добавлением триэтиламина (63,2 мкл, 0,454 ммоль) и 4-нитрофенилхлорформиата (91,7 мг, 0,454 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли N-фенилпиперазин (79,1 мкл, 0, 518 ммоль) и триэтиламин (72,1 мкл, 0,518 ммоль), и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь разбавляли дихлорметаном, промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=4:1, концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (158 мг, 0,295 ммоль, 68%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 2,40-2,50 (1H, м), 2,80-2,89 (1H, м), 3,00-3,15 (4H, шир.с), 3,37-3,65 (4H, м), 3,98 (1H, ддд, J=11,2, 8,3, 5,1 Гц), 4,24 (1H, дт, J=11,2, 5,6 Гц), 4,67 (1H, дд, J=11,2, 3,9 Гц), 6,84 (1H, тд, J=9,0, 4,6 Гц), 6,89-6,93 (3H, м), 6,95-7,03 (1H, м), 7,23-7,32 (3H, м), 7,39 (2H, д, J=8,3 Гц), 7,54 (2H, д, J=8,3 Гц).
ИК (ATR) см-1: 2829, 1687, 1599, 1581, 1495, 1437, 1321, 1223, 1151, 1130, 1084, 1001, 930, 814, 758, 692, 634, 552, 469.
Т.пл.: 127-129°C.
МС m/z: 535 (М++H).
Элементный анализ. Вычислено для C26H25ClF2N2O4S: C, 58,37; H, 4,71; Cl, 6,63; F, 7,10; N, 5,24; S, 5,99. Найдено: C, 58,28; H, 4,86; Cl, 6,56; F, 7,17; N, 5,30; S, 6,13.
Пример 213: Гидрохлорид 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил-4-метил-1-пиперазинкарбоксилата
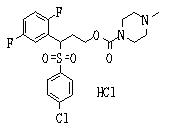
3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)-1-пропанол (150 мг, 0,432 ммоль), полученный в примере 207, растворяли в дихлорметане (4 мл) с последующим добавлением триэтиламина (63,2 мкл, 0,454 ммоль) и 4-нитрофенилхлорформиата (91,7 мг, 0,454 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли N-метилпиперазин (57,4 мкл, 0,518 ммоль) и триэтиламин (72,1 мкл, 0,518 ммоль), и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь разбавляли дихлорметаном, промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над сульфатом натрия и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси дихлорметан:метанол=30:1, концентрировали. Полученное таким образом твердое вещество растворяли в этаноле. После добавления смеси 1 н. хлористо-водородная кислота-этанол (2 мл) полученную смесь концентрировали досуха. Полученное таким образом твердое вещество промывали этилацетатом с получением указанного в заголовке соединения (96,9 мг, 0,189 ммоль, 44%) в виде бледно-желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3 ) δ: 2,37-2,47 (1H, м), 2,60-2,92 (8H, м), 3,20-4,30 (6H, м), 4,62 (1H, дд, J=10,0, 3,4 Гц), 6,85 (1H, тд, J=9,0, 4,4 Гц), 6,98-7,05 (1H, м), 7,19-7,28 (1H, м), 7,39 (2H, д, J=8,8 Гц), 7,51 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 2387, 1699, 1583, 1496, 1473, 1425, 1317, 1255, 1232, 1176, 1149, 1084, 978, 829, 758, 710, 629, 555, 467.
МС m/z: 473 (М++H).
Элементный анализ. Вычислено для C21H23ClF2N2O4S·HCl·0,25H2O: C, 49,08; H, 4,81; Cl, 13,80; F, 7,39; N, 5,45; S, 6,24. Найдено: C, 49,03; H, 5,01; Cl, 13,31; F, 7,31; N, 5,54; S, 6,28.
Пример 214: 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропилкарбамат
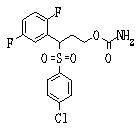
3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)-1-пропанол (200 мг, 0,576 ммоль), полученный в примере 207, растворяли в дихлорметане (4 мл) с последующим добавлением триэтиламина (84,2 мкл, 0,605 ммоль) и 4-нитрофенилхлорформиата (122 мг, 0,605 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли концентрированный водный аммиак (2,5 мл), и смесь перемешивали интенсивно при комнатной температуре в течение 3 часов. После отделения водного слоя органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (156 мг, 0,353 ммоль, 61%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 2,34-2,44 (1H, м), 2,77-2,86 (1H, м), 3,89 (1H, ддд, J=11,0, 9,0, 5,1 Гц), 4,19 (1H, дт, J=11,0, 5,6 Гц), 4,53 (2H, шир.с), 4,69 (1H, дд, J=11,0, 3,9 Гц), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,97-7,03 (1H, м), 7,24 (1H, ддд, J=8,8, 5,4, 3,2 Гц), 7,40 (2H, д, J=8,5 Гц), 7,54 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3452, 3263, 1734, 1606, 1493, 1396, 1313, 1230, 1144, 1080, 1051, 957, 829, 795, 752, 623, 553, 465.
Т.пл.: 139-140°C.
МС m/z: 390 (М++H).
Элементный анализ. Вычислено для C16H14ClF2NO4S: C, 49,30; H, 3,62; Cl, 9,10; F, 9,75; N, 3,59; S, 8,23. Найдено: C, 49,13; H, 3,53; Cl, 9,19; F, 9,86; N, 3,68; S, 8,35.
Пример 215: 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил-N-метилкарбамат
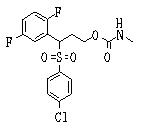
3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)-1-пропанол (200 мг, 0,576 ммоль), полученный в примере 207, растворяли в дихлорметане (4 мл) с последующим добавлением триэтиламина (84, 2 мкл, 0,605 ммоль) и 4-нитрофенилхлорформиата (122 мг, 0,605 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 15 часов. После добавления метиламина (2,00 М раствор в тетрагидрофуране, 2,0 мл, 4,00 ммоль) смесь перемешивали при комнатной температуре в течение 24 часов. Добавляли метиламин (2,00 М раствор в тетрагидрофуране, 3,0 мл, 4,00 ммоль), и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь разбавляли дихлорметаном, промывали последовательно насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:2, концентрировали. Полученный концентрат очищали дополнительно высокоэффективной жидкостной хроматографией (с использованием смешанного растворителя вода/ацетонитрил/муравьиная кислота) с получением указанного в заголовке соединения (62,1 мг, 0,154 ммоль, 27%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 2,32-2,45 (1H, м), 2,60-2,85 (4H, м), 3,83-3,90 (1H, м), 4,19 (1H, дт, J=11,0, 5,4 Гц), 4,49 (1H, шир.c), 4,68 (1H, м), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,96-7,02 (1H, м), 7,20-7,26 (1H, м), 7,39 (2H, д, J=8,5 Гц), 7,54 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3403, 1709, 1527, 1496, 1477, 1317, 1248, 1147, 1086, 1012, 827, 754, 629, 555, 467.
МС m/z: 404 (М++H).
FAB-МС: 404,0551 (вычислено для C17H17ClF2NO4S: 404,0535).
Пример 216: 3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил-N, N-диметилкарбамат
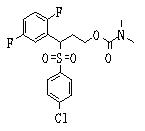
3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)-1-пропанол (200 мг, 0,576 ммоль), полученный в примере 207, растворяли в дихлорметане (4 мл) с последующим добавлением триэтиламина (84,2 мкл, 0,605 ммоль) и 4-нитрофенилхлорформиата (122 мг, 0,605 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 6 часов. К реакционной смеси добавляли 50% водный раствор диметиламина (2 мл). Смесь перемешивали при комнатной температуре в течение 15 часов. После дополнительного добавления 50% водного раствора диметиламина (1 мл) перемешивание продолжали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли дихлорметаном, промывали 1 н. гидроксидом натрия, водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:2, концентрировали с получением указанного в заголовке соединения (151 мг, 0,362 ммоль, 63%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 2,38-2,46 (1H, м), 2,70-2,88 (7H, м), 3,89 (1H, ддд, J=11,2, 8,3, 4,9 Гц), 4,21 (1H, дт, J=11,2, 5,6 Гц), 4,69 (1H, дд, J=11,2, 3,9 Гц), 6,83 (1H, тд, J=9,0, 4,4 Гц), 6,95-7,02 (1H, м), 7,23 (1H, ддд, J=8,8, 5,4, 3,4 Гц), 7,39 (2H, д, J=8,5 Гц), 7,54 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 2943, 1697, 1583, 1495, 1402, 1319, 1279, 1223, 1180, 1147, 1082, 1012, 829, 754, 710, 623, 555, 525, 467.
МС m/z: 418 (М++H).
FAB-МС: 418,0692 (вычислено для C18H19ClF2NO4S: 418,0691).
Пример 217: 2-[1-[(4-хлорфенил)сульфонил]-2-фенилэтил]-1,4-дифторбензол
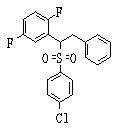
В атмосфере аргона и при -78°С н-бутиллитий (1,60 М раствор гексана, 459 мкл, 0,734 ммоль) добавляли к раствору в диметоксиэтане (50 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (202 мг, 0,667 ммоль), полученного в примере 5. Затем температуру полученной смеси повышали до комнатной температуры. После охлаждения реакционной смеси до -78°С добавляли по каплям бензилбромид (87,2 мкл, 0,734 ммоль). При повышении температуры реакционной смеси до комнатной температуры перемешивание продолжали в течение 15 часов. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Экстракты объединяли, промывали насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=6:1, концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (125 мг, 0,318 ммоль, 48%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 3,32 (1H, дд, J=13,9, 11,7 Гц), 3,84 (1H, дд, J=13,9, 3,4 Гц), 4,81 (1H, дд, J=11,7, 3,4 Гц), 6,69 (1H, тд, J=9,3, 4,4 Гц), 6,87-6,94 (1H, м), 7,00-7,05 (2H, м), 7,12-7,20 (3H, м), 7,38-7,43 (3H, м), 7,57 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 1574, 1493, 1303, 1279, 1219, 1144, 1083, 1011, 879, 825, 785, 742, 698, 633, 555, 526, 467.
Т.пл.: 160-161°C.
МС m/z: 393 (М++H).
Элементный анализ. Вычислено для C20H15ClF2NO2S: C, 61,15; H, 3,85; Cl, 9,02; F, 9,67; S, 8,16. Найдено: C, 61,07; H, 3,87; Cl, 8,95; F, 9,95; S, 8,30.
Пример 218: 2-[2-[(4-хлорфенил)сульфонил]-2-(2,5-дифторфенил)этил]пиридин
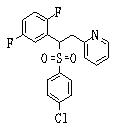
В атмосфере аргона 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (150 мг, 0,495 ммоль), полученный в примере 5, и 2-пиридилметанол (95,5 мкл, 0,990 ммоль) растворяли в толуоле (5 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (239 мг, 0,990 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 18 часов в атмосфере аргона. Затем реакционную смесь концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (96,6 мг, 0,245 ммоль, 49%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 3,49 (1H, дд, J=14,7, 10,7 Гц), 3,95 (1H, дд, J=14,7, 4,6 Гц), 5,37 (1H, дд, J=11,0, 4,2 Гц), 6,73 (1H, тд, J=9,0, 4,4 Гц), 6,86-6,94 (1H, м), 7,03-7,07 (2H, м), 7,33 (1H, ддд, J=8,8, 5,4, 3,2 Гц), 7,39 (2H, д, J=8,5 Гц), 7,49 (1H, тд, J=7,8, 1,7 Гц), 7,60 (2H, д, J=8,5 Гц), 8,41 (1H, д, J=4,4 Гц).
ИК (ATR) см-1: 3041, 1585, 1496, 1433, 1321, 1277, 1149, 1086, 910, 825, 779, 746, 644, 536, 461, 436.
Т.пл.: 105-107°C.
МС m/z: 394 (М++H).
Элементный анализ. Вычислено для C19H14ClF2NO2S: C, 57,94; H, 3,58; Cl, 9,00; F, 9,65; N, 3,56; S, 8,14. Найдено: C, 57, 85; H, 3,59; Cl, 8,97; F, 9,52; N, 3,69; S, 8,28.
Пример 219: 3-[2-[(4-хлорфенил)сульфонил]-2-(2,5-дифторфенил)этил]пиридин
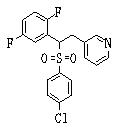
В атмосфере аргона 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (120 мг, 0,396 ммоль), полученный в примере 5, и 3-пиридилметанол (50,1 мкл, 0,515 ммоль) растворяли в толуоле (4 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (124 мг, 0,515 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 18 часов в атмосфере аргона. Затем реакционную смесь концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:7, концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (90,3 мг, 0,229 ммоль, 58%) в виде бесцветных столбчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 3,35 (1H, дд, J=14,4, 11,7 Гц), 3,85 (1H, дд, J=14,4, 3,9 Гц), 4,77 (1H, дд, J=11,7, 3,2 Гц), 6,71 (1H, тд, J=9,0, 4,4 Гц), 6,90-6,97 (1H, м), 7,13 (1H, дд, J=8,1, 4,9 Гц), 7,37-7,45 (4H, м), 7,57 (2H, д, J=8,8 Гц), 8,30 (1H, д, J=2,0 Гц), 8,41 (1H, дд, J=4, 9, 1,5 Гц).
ИК (ATR) см-1: 3078, 1577, 1495, 1427, 1313, 1279, 1217, 1144, 1082, 1012, 823, 775, 752, 706, 646, 557, 532, 464.
Т.пл.: 162-163°C.
МС m/z: 394 (М++H).
Элементный анализ. Вычислено для C19H14ClF2NO2S: C, 57,94; H, 3,58; Cl, 9,00; F, 9,65; N, 3,56; S, 8,14. Найдено: C, 57,80; H, 3,51; Cl, 9,06; F, 9,53; N, 3,71; S, 8,22.
Пример 220: 4-[2-[(4-хлорфенил)сульфонил]-2-(2,5-дифторфенил)этил]пиридин
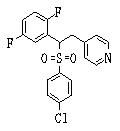
В атмосфере аргона 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (200 мг, 0,660 ммоль), полученный в примере 5, и 4-пиридилметанол (144 мг, 1,32 ммоль) растворяли в толуоле (6 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (318 мг, 1,32 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 15 часов в атмосфере аргона. Затем реакционную смесь концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием из этилацетата, концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (81,4 мг, 0,207 ммоль, 31%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 3,34 (1H, дд, J=14,2, 12, 0 Гц), 3,84 (1H, дд, J=14,2, 3,4 Гц), 4,81 (1H, дд, J=12,0, 3,4 Гц), 6,72 (1H, тд, J=9,0, 4,6 Гц), 6,91-6,96 (1H, м), 6,97 (2H, д, J=6,1 Гц), 7,34-7,39 (1H, м), 7,40 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 8,42 (2H, дд, J=4,4, 1,5 Гц).
ИК (ATR) см-1: 1597, 1493, 1417, 1301, 1277, 1219, 1174, 1144, 1082, 1012, 985, 883, 850, 808, 754, 706, 631, 606, 557, 524, 469.
Т.пл.: 129°C.
МС m/z: 394 (М++H).
Элементный анализ. Вычислено для C19H14ClF2NO2S: C, 57,94; H, 3,58; Cl, 9,00; F, 9,65; N, 3,56; S, 8,14. Найдено: C, 57,67; H, 3,45; Cl, 9,00; F, 9,78; N, 3,64; S, 8,31.
Пример 221: 2-[3-(4-хлорфенилсульфонил)-3-(2, 5-дифторфенил)пропил]тиофен
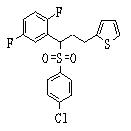
В атмосфере аргона 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (100 мг, 0,330 ммоль), полученный в примере 5, и 2-(2-тиенил)этанол (144 мкл, 1,32 ммоль) растворяли в толуоле (3 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (159 мг, 0,660 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 15 часов в атмосфере азота. Затем реакционную смесь концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=12:1, концентрировали с получением указанного в заголовке соединения (90,0 мг, 0,218 ммоль, 53%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 2,42-2,52 (1H, м), 2,68-2,83 (2H, м), 2, 85-2,92 (1H, м), 4,54 (1H, дд, J=11,2, 2,4 Гц), 6,70 (1H, д, J=2,7 Гц), 6,86 (1H, тд, J=9,0, 4,4 Гц), 6,90 (1H, дд, J=5,1, 3,4 Гц), 6,97-7,05 (1H, м), 7,14 (1H, дд, J=5,1, 1,2 Гц), 7,24-7,29 (1H, м), 7,38 (2H, д, J=8,5 Гц), 7,51 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3086, 1583, 1495, 1425, 1394, 1317, 1277, 1147, 1084, 1012, 827, 754, 694, 627, 555, 465.
МС m/z: 413 (М++H).
FAB-МС: 413,0251 (вычислено для C19H16ClF2O2S: 413,0248).
Пример 222: Этил-N-[3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил]карбамат
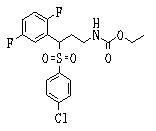
В атмосфере азота и при 0оС триэтиламин (81,5 мкл, 0,586 ммоль) и азид дифенилфосфорной кислоты (126 мкл, 0,586 ммоль) добавляли к раствору в толуоле (5 мл) 4-[(4-хлорфенил)сульфонил]-4-(2, 5-дифторфенил)масляной кислоты (200 мг, 0,533 ммоль), полученной в примере 200, с последующим перемешиванием при 0°С в течение 2 часов. Реакционную смесь нагревали при кипячении с обратным холодильником в течение 3 часов. После охлаждения до комнатной температуры и добавления этанола (2 мл) смесь нагревали при кипячении с обратным холодильником еще в течение 2 часов. Затем реакционную смесь концентрировали. Полученный таким образом остаток растворяли в дихлорметане. Полученный раствор промывали последовательно насыщенным водным раствором бикарбоната калия, водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:3, концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (129 мг, 0,309 ммоль, 58%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,21 (3H, т, J=7,1 Гц), 2,24-2,36 (1H, м), 2,60-2,70 (1H, м), 3, 10-3,33 (2H, м), 4,06 (2H, кв, J=7,1 Гц), 4,60 (1H, дд, J=11,0, 4,6 Гц), 4,70 (1H, шир.с), 6,83 (1H, тд, J=9,0, 4,4 Гц), 6,95-7,02 (1H, м), 7,21-7,26 (1H, м), 7,38 (2H, д, J=8,3 Гц), 7,52 (2H, д, J=8, 3 Гц).
ИК (ATR) см-1: 3394, 1691, 1576, 1525, 1496, 1396, 1304, 1281, 1250, 1225, 1149, 1086, 1028, 1012, 974, 885, 829, 791, 766, 752, 629, 553, 465.
Т.пл.: 121-122°C.
МС m/z: 418 (М++H).
Элементный анализ. Вычислено для C18H18ClF2NO4S: C, 51,74; H, 4,34; Cl, 8,48; F, 9,09; N, 3,35; S, 7,67. Найдено: C, 51,49; H, 4,43; Cl, 8,55; F, 9,13; N, 3,61; S, 7,75.
Пример 223: Этил-N-[3-[(4-хлорфенил)сульфонил]-3-(2, 5-дифторфенил)пропил]-N-метилкарбамат
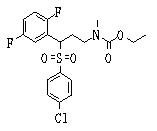
В тетрагидрофуране (4 мл) растворяли этил-N-[3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил]карбамат (100 мг, 0,239 ммоль) с последующим добавлением гидрида натрия (60% дисперсии в минеральном масле, 11,5 мг, 0,287 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли иодметан (17,8 мкл, 0,287 ммоль), и смесь перемешивали при комнатной температуре в течение 15 часов. Добавляли гидрид натрия (60% дисперсия в минеральном масле, 5,00 мг, 0,125 ммоль) и иодметан (10,0 мкл, 0,161 ммоль) с последующим перемешиванием при комнатной температуре в течение 24 часов. Добавляли воду (5 мл), и смесь концентрировали. Полученный таким образом остаток экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:1, концентрировали с получением указанного в заголовке соединения (83,2 мг, 0,193 ммоль, 81%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,11-1,27 (3H, шир.м), 2,20-2,35 (1H, шир.м), 2,68-2,90 (4H, м), 3,18-3,35 (2H, м), 3,93-4,12 (2H, шир.м), 4,51 (1H, шир.с), 6,82 (1H, тд, J=9,0, 4,6 Гц), 6,96-7,04 (1H, шир.м), 7,21-7,27 (1H, шир.м), 7,38 (2H, д, J=8,5 Гц), 7,51 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 2983, 1693, 1583, 1495, 1319, 1182, 1147, 1084, 1012, 883, 827, 754, 710, 629, 555, 467.
МС m/z: 432 (М++H).
FAB-МС: 432,0838 (вычислено для C19H21ClF2NO4S: 432,0848).
Пример 224: 2-иодэтил-N-[4-[(4-хлорфенил)сульфонил]-4-(2, 5-дифторфенил)бутил]карбамат
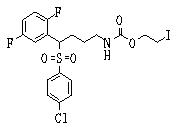
В атмосфере азота и при 0оС триэтиламин (157 мкл, 1,13 ммоль) и азид дифенилфосфорной кислоты (243 мкл, 1,13 ммоль) добавляли к раствору в толуоле (5 мл) 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)валериановой кислоты (400 мг, 1,03 ммоль), полученной в примере 202. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь нагревали при кипячении с обратным холодильником в течение 3 часов. После охлаждения до комнатной температуры и добавления 2-иодэтанола (160 мкл, 2,06 ммоль) смесь нагревали при кипячении с обратным холодильником еще в течение 1,5 часов. Реакционную смесь разбавляли этилацетатом и затем промывали последовательно насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:1, концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (300 мг, 0,538 ммоль, 52%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,44-1,60 (2H, м), 2,05-2,17 (1H, м), 2,44-2,55 (1H, м), 3,19 (2H, кв, J=6,4 Гц), 3,28 (2H, т, J=6,8 Гц), 4,29 (2H, т, J=6,8 Гц), 4,57 (1H, шир.м), 4, 76 (1H, шир.с), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,95-7,02 (1H, м), 7,23-7,28 (1H, м), 7,39 (2H, д, J=8,5 Гц), 7,53 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3406, 1722, 1585, 1516, 1493, 1306, 1238, 1147, 1009, 872, 822, 781, 752, 708, 627, 546, 525, 463.
Т.пл.: 100-101°C.
МС m/z: 558 (М++H).
Элементный анализ. Вычислено для C19H19ClF2INO4S: C, 40,91; H, 3,43; Cl, 6,36; F, 6,81; N, 2,51; S, 5,75. Найдено: C, 40,79; H, 3,40; Cl, 6,41; F, 6,96; N, 2,61; S, 5,85.
Пример 225: 3-[4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)бутил]-2-оксазолидинон
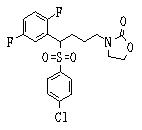
В атмосфере азота и при 0оС гидрид натрия (60% дисперсия в минеральном масле, 13,6 мг, 0,340 ммоль) добавляли к раствору в тетрагидрофуране (5 мл) 2-иодэтил-N-[4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)бутил]карбамата (158 мг, 0,283 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:2, концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (52,1 мг, 0,121 ммоль, 43%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,52-1,63 (2H, м), 2,05-2,16 (1H, м), 2,42-2,51 (1H, м), 3,18-3,35 (2H, м), 3,50 (2H, т, J=8,3 Гц), 4,31 (2H, дд, J=8,8, 7,1 Гц), 4,60 (1H, дд, J=10,3, 4,9 Гц), 6, 85 (1H, тд, J=9,0, 4,4 Гц), 6,96-7,02 (1H, м), 7,22-7,28 (1H, м), 7,39 (2H, д, J=8,5 Гц), 7,54 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 2918, 1734, 1583, 1487, 1425, 1308, 1265, 1182, 1130, 1086, 1012, 895, 804, 758, 708, 594, 577, 538, 478, 444.
Т.пл.: 156-159°C.
МС m/z: 430 (М++H).
Элементный анализ. Вычислено для C19H18ClF2NO4S: C, 53,09; H, 4,22; Cl, 8,25; F, 8,84; N, 3,26; S, 7,46. Найдено: C, 52,84; H, 4,15; Cl, 8,40; F, 8,96; N, 3,33; S, 7,58.
Пример 226: трет-бутил-N-[4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)бутил]карбамат
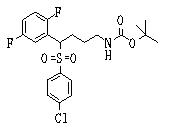
В атмосфере азота триэтиламин (126 мкл, 0,907 ммоль) и азид дифенилфосфорной кислоты (195 мкл, 0,907 ммоль) добавляли к раствору в толуоле (6 мл) 5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)валериановой кислоты (294 мг, 0,533 ммоль), полученной в примере 202. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь нагревали при кипячении с обратным холодильником в течение 3 часов. После охлаждения до комнатной температуры и добавления 2-метил-2-пропанола (1 мл) смесь нагревали при 80°С еще 18 часов. Затем реакционную смесь концентрировали, и полученный таким образом остаток растворяли в дихлорметане. Полученный раствор промывали последовательно насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=4:1, концентрировали с получением указанного в заголовке соединения (171 мг, 0,383 ммоль, 51%) в виде белого твердого вещества. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,40-1,49 (11H, с), 2,05-2,14 (1H, м), 2,43-2,52 (1H, м), 3,07-3,17 (2H, м), 4,48-4,60 (2H, м), 6,83 (1H, тд, J=9,0, 4,4 Гц), 6,94-7,01 (1H, м), 7,24 (1H, ддд, J=8,8, 5,4, 3,2 Гц), 7,38 (2H, д, J=8,5 Гц), 7,53 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3392, 2960, 1695, 1583, 1514, 1493, 1365, 1313, 1248, 1174, 1147, 1084, 999, 827, 752, 644, 548, 528, 451.
Т.пл.: 119-120°C.
МС m/z: 460 (М++H).
Элементный анализ. Вычислено для C21H24ClF2NO4S: C, 54, 84; H, 5,26; Cl, 7,71; F, 8,26; N, 3,05; S, 6,97. Найдено: C, 54,84; H, 5,31; Cl, 7,06; F, 8,36; N, 3,16; S, 7,14.
Пример 227: Гидрохлорид 4-[(4-хлорфенил)сульфонил]-4-(2, 5-дифторфенил)бутиламина
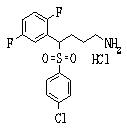
Концентрированную хлористо-водородную кислоту (2 мл) добавляли к раствору в этаноле (2 мл) трет-бутил-N-[4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)бутил]карбамата (104 мг, 0,226 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 часов. Затем реакционную смесь концентрировали. Полученный таким образом остаток перекристаллизовывали из смеси этанол-этилацетат с получением указанного в заголовке соединения (78,9 мг, 0, 199 ммоль, 88%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,51-1,60 (1H, м), 1,63-1,75 (1H, м), 2,18-2,28 (1H, м), 2,45-2,54 (1H, м), 2,95 (2H, ддд, J=8,5, 6,8, 3,2 Гц), 4,76 (1H, дд, J=11,0, 4,6 Гц), 6,98 (1H, тд, J=9,3, 4,4 Гц), 7,09-7,17 (1H, м), 7,32 (1H, ддд, J=9,0, 5,6, 3,4 Гц), 7,52 (2H, д, J=8,8 Гц), 7,60 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 2951, 2871, 1583, 1496, 1427, 1396, 1311, 1279, 1219, 1147, 1081, 1011, 870, 825, 742, 706, 629, 536, 463.
Т.пл.: 232-233°C.
МС m/z: 360 (М++H).
Элементный анализ. Вычислено для C16H16ClF2NO2S·HCl: C, 48,49; H, 4,32; Cl, 17,89; F, 9, 59; N, 3,53; S, 8,09. Найдено: C, 48,20; H, 4,27; Cl, 17,84; F, 9,61; N, 3,63; S, 8,15.
Пример 228: Гидрохлорид N-[4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)бутил]никотинамида
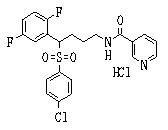
В атмосфере азота и при 0°С N-метилморфолин (44,6 мкл, 0,406 ммоль) и гидрохлорид хлорангидрида никотиновой кислоты (36,1 мг, 0,203 ммоль) добавляли к раствору в дихлорметане (4 мл) гидрохлорида 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)бутиламина (67,0 мг, 0,169 ммоль). После перемешивания при комнатной температуре в течение 3 часов реакционную смесь разбавляли дихлорметаном, промывали последовательно насыщенным водным раствором хлорида аммония и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:3, концентрировали. Полученное твердое вещество растворяли в этаноле. К полученному раствору добавляли смесь 1 н. хлористо-водородная кислота-этанол (0,5 мл). Полученное таким образом твердое вещество перекристаллизовывали из смеси этанол-этилацетат с получением указанного в заголовке соединения (67,1 мг, 0,134 ммоль, 79%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CD3OD) δ: 1,58-1,67 (2H, м), 2,18-2,28 (1H, м), 2,42-2,52 (1H, м), 3,40 (1H, дт, J=13,7, 6,6 Гц), 3,51 (1H, дт, J=13,7, 6,8 Гц), 4,81 (1H, м), 6,98 (1H, тд, J=9,3, 4,4 Гц), 7,08-7, 15 (1H, м), 7,30 (1H, ддд, J=9,0, 5,6, 3,4 Гц), 7,50 (2H, д, J=8,8 Гц), 7,62 (2H, д, J=8,8 Гц), 8,18 (1H, дд, J=8,1, 5,9 Гц), 8,92 (1H, дд, J=8,1, 1,5 Гц), 8,99 (1H, д, J=5,9 Гц), 9,22 (1H, д, J=1,2 Гц).
ИК (ATR) см-1: 3282, 2457, 2096, 1977, 1666, 1547, 1493, 1302, 1234, 1173, 1147, 1092, 1016, 883, 829, 760, 733, 673, 623, 528.
Т.пл.: 154-157° C.
МС m/z: 465 (М++H).
Элементный анализ. Вычислено для C22H19ClF2N2O3S·HCl: C, 52,70; H, 4, 02; Cl, 14,14; F, 7,58; N, 5,59; S, 6,40. Найдено: C, 52,59; H, 4,01; Cl, 14,19; F, 7,72; N, 5,73; S, 6,56.
Пример 229: 1-[4-(4-хлорфенилсульфонил]-4-(2, 5-дифторфенил)бутил]-2-пирролидинон
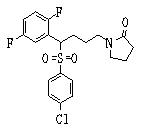
К раствору в дихлорметане (6 мл) гидрохлорида 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)бутиламина (120 мг, 0,303 ммоль), полученного в примере 227, добавляли N-метилморфолин (250 мкл, 2,69 ммоль) и хлорангидрид 4-хлормасляной кислоты (40,7 мкл, 0,364 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь разбавляли дихлорметаном, промывали последовательно насыщенным водным раствором хлорида аммония, водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток растворяли в тетрагидрофуране (5 мл) с последующим добавлением гидрида натрия (60% дисперсии в минеральном масле, 14,2 мг, 0,356 ммоль) и N,N-диметилформамида (2 капли). Полученную смесь перемешивали при комнатной температуре в течение 24 часов. Добавляли воду, и полученную смесь экстрагировали этилацетатом. Экстракты объединяли, промывали насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали с получением указанного в заголовке соединения (105 мг, 0,245 ммоль, 82%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,43-1,65 (2H, м), 1,97-2,12 (3H, м), 2,32-2,43 (3H, м), 3,16 (1H, дт, J=13,7, 6,8 Гц), 3,28-3,42 (3H, м), 4,67 (1H, дд, J=10,9, 3,4 Гц), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,95-7,02 (1H, м), 7,22-7,28 (1H, м), 7,39 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 2941, 1676, 1583, 1495, 1425, 1394, 1319, 1279, 1147, 1084, 1012, 827, 754, 707, 625, 555, 467.
МС m/z: 428 (М++H).
FAB-МС: 428, 0885 (вычислено для C20H21ClF2NO3S: 428,0899).
Пример 230: N-[4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)бутил]метансульфонамид
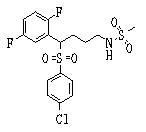
В атмосфере азота N-метилморфолин (51,0 мкл, 0,465 ммоль) и метансульфонилхлорид (18,8 мкл, 0,242 ммоль) добавляли к раствору в дихлорметане (4 мл) гидрохлорида 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)бутиламина (80,0 мг, 0,202 ммоль), полученного в примере 227. После перемешивания при комнатной температуре в течение 15 часов добавляли N-метилморфолин (156 мкл, 1,42 ммоль) и метансульфонилхлорид (10,0 мкл, 0,129 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. После разбавления дихлорметаном смесь последовательно промывали насыщенным водным раствором хлорида аммония, водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (71,5 мг, 0,163 ммоль, 81%) в виде бесцветных пластинчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,50-1,67 (2H, м), 2,09-2,20 (1H, м), 2,50-2,59 (1H, м), 2,95 (3H, с), 3,12-3,21 (2H, м), 4,30 (1H, т, J=6,3 Гц), 4,56 (1H, дд, J=10,7, 4,4 Гц), 6,84 (1H, тд, J=9,0, 4,6 Гц), 6,96-7,03 (1H, м), 7,23-7,28 (1H, м), 7,39 (2H, д, J=8,0 Гц), 7,53 (2H, д, J=8,0 Гц).
ИК (ATR) см-1: 3269, 1585, 1498, 1308, 1252, 1217, 1140, 1090, 1082, 976, 870, 787, 750, 627, 517, 467.
Т.пл.: 128°C.
МС m/z: 438 (М++H).
Элементный анализ. Вычислено для C17H18ClF2NO4S2: C, 46,63; H, 4,14; Cl, 8,10; F, 8,68; N, 3,20; S, 14,64. Найдено: C, 46,62; H, 4,08; Cl, 8,15; F, 8,69; N, 3,27; S, 14,71.
Пример 231: 2-[1-(4-хлорфенилсульфонил)-5-фторпентил]-1,4-дифторбензол
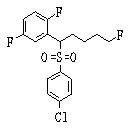
5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-1-пентанол (152 мг, 0,404 ммоль), полученный в примере 29, растворяли в дихлорметане (4 мл) с последующим добавлением N-метилморфолина (58,0 мкл, 0,528 ммоль) и метансульфонилхлорида (37,8 мкл, 0,487 ммоль) при 0°С. Полученную смесь перемешивали при 0°С в течение 2 часов и затем при комнатной температуре в течение дополнительных 3 часов. После разбавления дихлорметаном смесь последовательно промывали насыщенным водным раствором хлорида аммония, водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток растворяли в тетрагидрофуране (4 мл). К полученному раствору добавляли раствор в тетрагидрофуране (1,0 М, 0,487 мл, 0,487 ммоль) тетрабутиламмонийфторида при комнатной температуре. Полученную смесь перемешивали при 60°С в течение 4 часов. После охлаждения до комнатной температуры и разбавления этилацетатом смесь промывали водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=9:1, концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из гексана с получением указанного в заголовке соединения (30,3 мг, 0,0804 ммоль, 20%) в виде бесцветных пластинчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,34-1,42 (2H, м), 1,64-1,80 (2H, м), 2,09-2,20 (1H, м), 2,45-2,53 (1H, м), 4,39 (2H, дт, J=47,1, 5,9 Гц), 4,52 (1H, дд, J=11,2, 2,9 Гц), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,96-7,02 (1H, м), 7,23-7,28 (1H, м), 7,38 (2H, д, J=8,5 Гц), 7,53 (2H, д, J=8,5 Гц).
Т.пл.: 77-78°C.
ИК (ATR) см-1: 2941, 1585, 1495, 1429, 1396, 1321, 1279, 1242, 1186, 1149, 1092, 1084, 962, 874, 829, 777, 752, 710, 633, 557, 536, 474.
МС m/z: 377 (М++H).
Элементный анализ. Вычислено для C17H16ClF3O2S: C, 54,19; H, 4,28; Cl, 9,41; F, 15,13; S, 8,51. Найдено: C, 54,27; H, 4,22; Cl, 9,44; F, 14,90; S, 8,68.
Пример 232: 2-[1-[(4-хлорфенил)сульфонил]-1-метилэтил]-1,4-дифторбензол
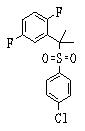
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 450 мкл, 0,707 ммоль) добавляли к раствору в тетрагидрофуране (4 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (200 мг, 0,660 ммоль), полученного в примере 5. После перемешивания в течение 5 минут добавляли иодметан (103 мкл, 1,65 ммоль). Полученную смесь перемешивали еще в течение 10 минут и затем добавляли н-бутиллитий (1,57 М раствор в гексане, 474 мкл, 0,744 ммоль). После повышения температуры реакционной смеси до комнатной температуры перемешивание проводили в течение 2 часов. Добавляли воду с последующей экстракцией этилацетатом. Экстракты объединяли, промывали насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (163 мг, 0,492 ммоль, 75%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,87 (3H, с), 1,88 (3H, с), 6,86 (1H, ддд, J=11,9, 9,0, 4,9 Гц), 6,98-7,05 (1H, м), 7,10 (1H, ддд, J=9,8, 6,6, 3,4 Гц), 7,39 (2H, д, J=8,5 Гц), 7,44 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 1574, 1489, 1475, 1412, 1304, 1219, 1184, 1155, 1124, 1068, 1011, 887, 867, 827, 756, 712, 660, 623, 600, 571, 532, 511, 474, 432.
Т.пл.: 147-148°C.
МС m/z: 331 (М++H).
Элементный анализ. Вычислено для C15H13ClF2O2S: C, 54,47; H, 3,96; Cl, 10,72; F, 11,49; S, 9,69. Найдено: C, 54,39; H, 3,92; Cl, 10,68; F, 11,51; S, 9,78.
Пример 233: 2-[1-[(4-хлорфенил)сульфонил]циклопропил]-1,4-дифторбензол
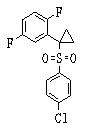
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 600 мкл, 0,942 ммоль) добавляли к раствору в тетрагидрофуране (4 мл) 3-[(4-хлорфенил)сульфонилметил]-3-(2, 5-дифторфенил)-1-пропанола (300 мг, 0,865 ммоль), полученного в примере 207. После перемешивания в течение 5 минут добавляли метансульфонилхлорид (70,6 мкл, 0,908 ммоль). Полученную смесь перемешивали еще в течение 5 минут и затем добавляли н-бутиллитий (1,57 М раствор в гексане, 601 мкл, 0,944 ммоль). Температуру реакционной смеси повышали до комнатной температуры и при этой температуре перемешивание проводили в течение 18 часов. После охлаждения до -78°С добавляли н-бутиллитий (1,57 М раствор в гексане, 400 мкл, 2,255 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Добавляли воду с последующей экстракцией этилацетатом. Экстракты объединяли, промывали насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=19:1, концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (161 мг, 0,489 ммоль, 57%) в виде бесцветных пластинчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,31 (2H, дд, J=7,6, 5,1 Гц), 2,02 (2H, дд, J=7,6, 5,1 Гц), 6,83 (1H, тд, J=9,0, 4,4 Гц), 6,97-7,03 (1H, м), 7,06 (1H, ддд, J=8,3, 5,4, 3,2 Гц), 7,41 (2H, д, J=8,6 Гц), 7,49 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3089, 1583, 1496, 1477, 1429, 1308, 1279, 1252, 1211, 1184, 1142, 1086, 1012, 893, 827, 769, 758, 737, 663, 625, 596, 559, 546, 492, 476, 451, 411.
Т.пл.: 177-179°C.
МС m/z: 329 (М++H).
Элементный анализ. Вычислено для C15H11ClF2O2S: C, 54,80; H, 3,37; Cl, 10,78; F, 11,56; S, 9,75. Найдено: C, 54,72; H, 3,31; Cl, 10,71; F, 11,58; S, 9,87.
Ссылочный пример 38: 5-(трет-бутилдиметилсилилокси)пентаналь
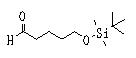
В атмосфере азота и при 0о С диметилсульфоксид (7,81 мл, 110 ммоль), триэтиламин (9,60 мл, 69,0 ммоль) и комплекс триоксид серы-пиридин (4,39 г, 27,6 ммоль) добавляли к раствору в дихлорметане (80 мл) 5-(трет-бутилдиметилсилилокси)пентанола (3,00 г, 13,8 ммоль). Полученную смесь перемешивали при 0°С в течение 30 минут, и затем при комнатной температуре в течение еще 3 часов. После охлаждения до 0°С добавляли насыщенный водный раствор хлорида аммония. Дихлорметан дистиллировали при пониженном давлении. К остатку добавляли этилацетат. После отделения водного слоя органический слой промывали водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=20:1, концентрировали с получением указанного в заголовке соединения (2,42 г, 11,2 ммоль, 81%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 0,05 (3H, с), 0,05 (3H, с), 0,89 (9H, с), 1,50-1,60 (2H, м), 1,65-1,75 (2H, м), 2,46 (2H, т, J=6,8 Гц), 3,63 (2H, т, J=6,3 Гц), 9,77 (1H, с).
МС m/z: 217 (М++H).
Пример 234: 6-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]-1-(2,5-дифторфенил)-2-гексанол (изомер 234-А и изомер 234-В)
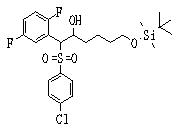
В атмосфере аргона и при -78°С н-бутиллитий (1,57 М раствор в гексане, 1,40 мл, 2,20 ммоль) добавляли к раствору в дихлорметане (10 мл) 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (606 мг, 2,00 ммоль), полученного в примере 5. После добавления по каплям 5-(трет-бутилдиметилсилилокси)пентаналя (475 мг, 2,20 ммоль) полученную смесь перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь охлаждали до 0°С. К полученной смеси добавляли воду и затем этилацетат. После отделения водного слоя органический слой промывали последовательно насыщенным водным раствором хлорида аммония, водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=10:1, концентрировали с получением указанного в заголовке изомера 234-А (низкой полярности) (43,1 мг, 0,102 ммоль, 5%) и указанного в заголовке изомера 234-В (высокой полярности) (120 мг, 0,231 ммоль, 12%), каждого в виде бесцветного масла.
Изомер 234-А
1H-ЯМР (400 МГц, CDCl3) δ: 0,00 (3H, с), 0,00 (3H, с), 0,85 (9H, с), 1,25-1,70 (6H, м), 3,12 (1H, д, J=3,2 Гц), 3,55 (2H, т, J=5,9 Гц), 4,48 (1H, с), 4,83-4,88 (1H, м), 6,83 (1H, тд, J=9,0, 4,6 Гц), 6,95-7,02 (1H, м), 7,39 (2H, д, J=8,5 Гц), 7,57 (2H, д, J=8,5 Гц), 7,84 (1H, ддд, J=9,0, 5,9, 3,4 Гц).
МС m/z: 519 (М++H).
Изомер 234-В
1H-ЯМР (400 МГц, CDCl3) δ: -0,04 (3H, с), -0,01 (3H, с), 0,85 (9H, с), 1,30-1,54 (6H, м), 3,50-3,57 (2H, м), 3,81 (1H, шир.с), 4,58-4,80 (2H, м), 6,84 (1H, тд, J=9,0, 4,6 Гц), 6,96-7,06 (1H, м), 7,15-7,27 (1H, м), 7,39 (2H, д, J=8,5 Гц), 7,52 (2H, д, J=8,5 Гц).
МС m/z: 519 (М++H).
Пример 235: 6-[(4-хлорфенил)сульфонил]-6-(2,5-дифторфенил)-1,5-гександиол
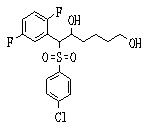
6-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]-1-(2,5-дифторфенил)-2-гексанол (изомер 234-А) (42,0 мг, 0,0809 ммоль), полученный в примере 234, растворяли в тетрагидрофуране (2 мл) с последующим добавлением смеси фтористый водород-пиридин (0,2 мл). Полученную смесь перемешивали при комнатной температуре в течение 6 часов. Раствор разбавляли этилацетатом, промывали водой и насыщенным раствором соли, сушили над сульфатом магния. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (16,7 мг, 0,0412 ммоль, 51%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,25-1,70 (7H, м), 3,15 (1H, с), 3,55-3,65 (2H, м), 4,49 (1H, с), 4,86-4,90 (1H, м), 6,85 (1H, тд, J=9,0, 4,4 Гц), 6,97-7,03 (1H, м), 7,40 (2H, д, J=8,8 Гц), 7,58 (2H, д, J=8,8 Гц), 7,85 (1H, ддд, J=9,0, 5,9, 3,4 Гц).
ИК (ATR) см-1: 3232, 1576, 1491, 1396, 1306, 1236, 1217, 1147, 1093, 1012, 891, 814, 756, 719, 615, 548, 467.
Т.пл.: 108-109°C.
МС m/z: 405 (М++H).
FAB-МС: 405,0756 (вычислено для C18H19ClF2O4S: 405, 0739).
Элементный анализ. Вычислено для C18H19ClF2O4S·0,5H2O: C, 52,24; H, 4,87; S, 7,75. Найдено: C, 52,33; H, 4,84; S, 7,83.
Пример 236: 6-[(4-хлорфенил)сульфонил]-6-(2,5-дифторфенил)-1,5-гександиол
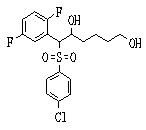
6-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]-1-(2,5-дифторфенил)-2-гексанол (изомер 234-В) (120 мг, 0,231 ммоль), полученный в примере 234, растворяли в тетрагидрофуране (5 мл) с последующим добавлением смеси фтористый водород-пиридин (0,5 мл). Полученную смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь разбавляли этилацетатом, промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (51,3 мг, 0,127 ммоль, 55%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,25-1,67 (7H, м), 3,53-3,63 (2H, м), 3,91 (1H, шир.с), 4,59-4,78 (2H, м), 6,85 (1H, тд, J=9,0, 4,4 Гц), 6,96-7,03 (1H, м), 7,16-7,27 (1H, шир.м), 7,39 (2H, д, J=8,5 Гц), 7,52 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3496, 2956, 1579, 1496, 1425, 1392, 1305, 1275, 1180, 1144, 1080, 1011, 966, 922, 833, 810, 756, 737, 650, 536, 521, 461.
Т.пл.: 105-107°C.
МС m/z: 405 (М++H).
Элементный анализ. Вычислено для C18H19ClF2O4S: C, 53,40; H, 4,73; Cl, 8,76; F, 9,39; S, 7,92. Найдено: C, 53,20; H, 4,61; Cl, 8,77; F, 9,20; S, 8,03.
Ссылочный пример 39: 4-(трет-бутилдиметилсилилокси)-2-бутанол
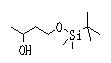
В N,N-диметилформамиде (30 мл) растворяли 1,3-бутандиол (3,00 г, 33,3 ммоль) с последующим добавлением по каплям раствора в N,N-диметилформамиде (30 мл) имидазола (2,72 г, 40,0 ммоль) и трет-бутилхлордиметилсилана (5,29 г, 35,0 ммоль). После перемешивания при комнатной температуре в течение 24 часов к реакционной смеси добавляли эфир, и осажденное таким образом белое твердое вещество отфильтровывали. Полученный эфирный раствор промывали водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=5:1, концентрировали с получением указанного в заголовке соединения (5,43 г, 26,6 ммоль, 80%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 0,08 (6H, с), 0,90 (9H, д, J=1,0 Гц), 1,19 (3H, д, J=6,4 Гц), 1,59-1,73 (2H, м), 3,78-3,93 (2H, м), 3,98-4,07 (1H, шир.м).
МС m/z: 205 (М++H).
Пример 237: 2-[4-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]-2-метилбутил]-1,4-дифторбензол (соединение А (изомер А) и соединение А (изомер В)) и 2-[4-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]пентил]-1,4-дифторбензол (соединение В)
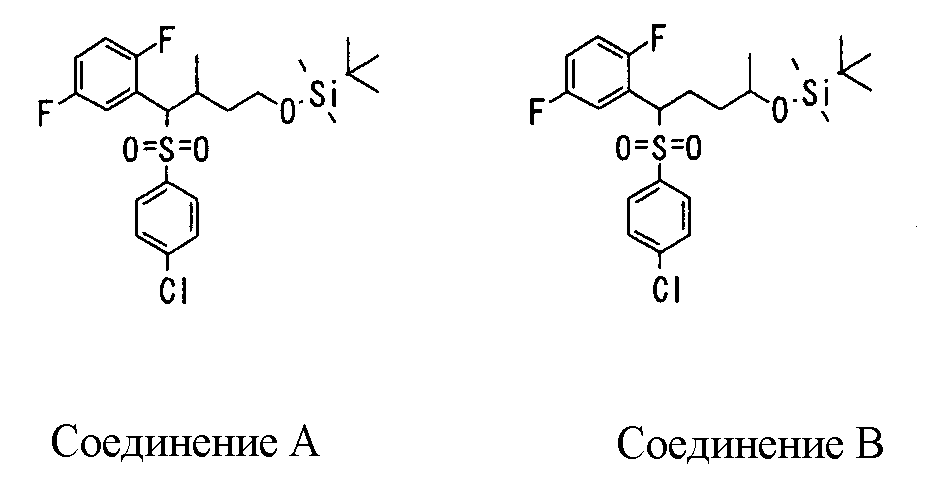
В атмосфере азота 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (303 мг, 1,00 ммоль), полученный в примере 5, и 4-(трет-бутилдиметилсилилокси)-2-бутанол (408 мг, 2,00 ммоль) растворяли в толуоле (4 мл). После добавления цианометилентри-н-бутилфосфорана (482 мг, 2,00 ммоль) полученную смесь нагревали при кипячении с обратным холодильником в течение 15 часов в атмосфере азота. Затем реакционную смесь концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем (гексан:этилацетат=50:1) с получением указанного в заголовке соединения А (изомера А) (низкой полярности) (109 мг, 0,222 ммоль, 22%), указанного в заголовке соединения А (изомера В) (высокой полярности) (102 мг, 0,209 ммоль, 21%), указанного в заголовке соединения В (234 мг, 0,479 ммоль, 48%), каждого в виде бесцветного масла.
Соединение А (изомер А)
1H-ЯМР (400 МГц, CDCl3) δ: 0,05 (3H, с), 0,05 (3H, с), 0,89 (9H, с), 1,14 (3H, д, J=6,8 Гц), 1,38-1,47 (1H, м), 1,79-1,89 (1H, м), 2,91-3,02 (1H, м), 3,63-3,73 (2H, м), 4,56 (1H, д, J=5,9 Гц), 6,81 (1H, тд, J=9,0, 4,6 Гц), 6,92-6,98 (1H, м), 7,34 (2H, д, J=8,3 Гц), 7,51-7,57 (1H, м), 7,55 (2H, д, J=8,3 Гц).
МС m/z: 489 (М++H).
Соединение А (изомер В)
1H-ЯМР (400 МГц, CDCl3) δ: -0,01 (3H, с), 0,00 (3H, с), 0,85-0,93 (9H, м), 1,19-1,28 (1H, м), 1,38 (3H, д, J=6,6 Гц), 1,64-1,73 (1H, м), 2,78-2,88 (1H, м), 3,61 (2H, дд, J=7,6, 4,9 Гц), 4,46 (1H, д, J=9,0 Гц), 6,72 (1H, тд, J=9,0, 4,4 Гц), 6,87-6,93 (1H, м), 7,30 (2H, д, J=8,3 Гц), 7,34-7,41 (1H, м), 7,49 (2H, д, J=8,3 Гц).
МС m/z: 489 (М++H).
Соединение В
1H-ЯМР (400 МГц, CDCl3) δ: -0,01 (1,5H, с), 0,01 (1,5H, с), 0,02 (1,5H, с), 0,04 (1,5H, с), 0,84 (4,5H, м), 0,86 (4,5H, м), 1,04-1,10 (3H, м), 1,15-1,40 (2H, м), 1,99-2,11 (0,5H, м), 2,11-2,22 (0,5H, м), 2,35-2,53 (1H, м), 3,72-3,82 (1H, м), 4,44-4,52 (1H, м), 6,82-6,88 (1H, м), 6,93-7,02 (1H, м), 7,16-7,26 (1H, м), 7,37-7,42 (2H, м), 7, 51-7,58 (2H, м).
МС m/z: 489 (М++H).
Пример 238: 4-(4-хлорфенилсульфонил]-4-(2,5-дифторфенил)-3-метил-1-бутанол
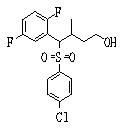
2-[4-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]-2-метилбутил]-1,4-дифторбензол (соединение А (изомер А)) (109 мг, 0,223 ммоль), полученный в примере 237, растворяли в тетрагидрофуране (3 мл) с последующим добавлением смеси фтористый водород-пиридин (0,5 мл). Полученную смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь разбавляли этилацетатом, промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над сульфатом магния. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (61,1 мг, 0,163 ммоль, 73%) в виде бесцветных столбчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,08 (3H, д, J=7,1 Гц), 1,59-1,62 (1H, м), 1,74-1,84 (1H, м), 1,96-2,05 (1H, м), 2,93-3,05 (1H, м), 3,75-3,89 (2H, м), 4,68 (1H, д, J=6,8 Гц), 6,77 (1H, тд, J=9,0, 4,6 Гц), 6,91-6,97 (1H, м), 7,33 (2H, д, J=8,3 Гц), 7,45-7,51 (1H, м), 7,51 (2H, д, J=8,3 Гц).
ИК (ATR) см-1: 3527, 2935, 2897, 1583, 1487, 1315, 1267, 1232, 1188, 1144, 1086, 1068, 1049, 1012, 889, 864, 829, 789, 750, 715, 654, 611, 551, 490, 467.
Т.пл.: 111-112°C.
МС m/z: 375 (М++H).
Элементный анализ. Вычислено для C17H17ClF2O3S: C, 54,47; H, 4,57; Cl, 9,46; F, 10,14; S, 8,55. Найдено: C, 54,44; H, 4, 55; Cl, 9,44; F, 10,08; S, 8,75.
Пример 239: 4-(4-хлорфенилсульфонил]-4-(2,5-дифторфенил)-3-метил-1-бутанол
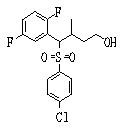
2-[4-(трет-бутилдиметилсилилокси)-1-[(4-хлорфенил)сульфонил]-2-метилбутил]-1,4-дифторбензол (соединение А (изомер В)) (102 мг, 0,209 ммоль), полученный в примере 237, растворяли в тетрагидрофуране (3 мл) с последующим добавлением смеси фтористый водород-пиридин (0,5 мл). Полученную смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным раствором соли и затем сушили над сульфатом магния. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (36,1 мг, 0,0963 ммоль, 46%) в виде бесцветных столбчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,23-1,40 (2H, м), 1,35 (3H, д, J=6,6 Гц), 1,81-1,90 (1H, м), 2,84-2,93 (1H, м), 3,63-3,78 (2H, м), 4,51 (1H, д, J=8,1 Гц), 6,75 (1H, тд, J=9,0, 4,6 Гц), 6,89-6,96 (1H, м), 7,31 (2H, д, J=8, 5 Гц), 7,40-7,47 (1H, м), 7,51 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3525, 2954, 1655, 1493, 1477, 1427, 1394, 1306, 1279, 1240, 1180, 1144, 1080, 1055, 1014, 943, 887, 822, 754, 712, 665, 609, 559, 542, 453.
Т.пл.: 65-67°C.
МС m/z: 375 (М++H).
Элементный анализ. Вычислено для C17H17 ClF2O3S·0,5H2O: C, 53,20; H, 4,73; Cl, 9,24; F, 9,90; S, 8,35. Найдено: C, 53,17; H, 4,86; Cl, 9,29; F, 10,00; S, 8,50.
Пример 240: 1-[(4-хлорфенил)сульфонил]-1-(2,5-дифторфенил)-4-пентанол (изомер 240-А и изомер 240-В)
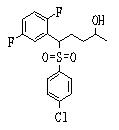
2-[4-(трет-бутилдиметилсилилокси)-1-(4-хлорфенилсульфонил)пентил]-1,4-дифторбензол (соединение В) (230 мг, 0,470 ммоль), полученное в примере 237, растворяли в тетрагидрофуране (4 мл) с последующим добавлением раствора в тетрагидрофуране (1,0 М, 0,564 мл, 0,564 ммоль) тетрабутиламмонийфторида. Полученную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем (гексан:этилацетат=2:1) с получением изомера низкой полярности и высокой полярности, каждого в виде белого твердого вещества. Полученный изомер низкой полярности перекристаллизовывали из гексана с получением указанного в заголовке изомера 240-А (низкой полярности) (48,0 мг, 0,128 ммоль, 27%) в виде бесцветных игольчатых кристаллов. С другой стороны, полученный изомер высокой полярности перекристаллизовывали из гексана с получением указанного в заголовке изомера 240-В (высокой полярности) (48,8 мг, 0,130 ммоль, 28%) в виде бесцветных игольчатых кристаллов.
Изомер 240-А
1H-ЯМР (400 МГц, CDCl3) δ: 1,17 (3H, д, J=6,1 Гц), 1,28-1,48 (3H, м), 2,18-2,29 (1H, м), 2,47-2,56 (1H, м), 3, 77-3,85 (1H, м), 4,53-4,58 (1H, м), 6,83 (1H, тд, J=9,0, 4,4 Гц), 6,95-7,01 (1H, м), 7,22-7,28 (1H, м), 7,38 (2H, д, J=8,5 Гц), 7,53 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3370, 3087, 2925, 1587, 1574, 1496, 1475, 1423, 1396, 1311, 1279, 1234, 1178, 1149, 1128, 1086, 1014, 949, 874, 827, 789, 760, 735, 710, 679, 631, 584, 559, 525, 469.
Т.пл.: 97-98° C.
МС m/z: 375 (М++H).
Элементный анализ. Вычислено для C17H17ClF2NO3S: C, 54,47; H, 4,57; Cl, 9,46; F, 10,14; S, 8,55. Найдено: C, 54,35; H, 4,69; Cl, 9,64; F, 10,31; S, 8,80.
Изомер 240-В
1H-ЯМР (400 МГц, CDCl3) δ: 1,17 (3H, д, J=6,1 Гц), 1,29-1, 45 (3H, м), 2,07-2,18 (1H, м), 2,58-2,67 (1H, м), 3,77-3,85 (1H, м), 4,59 (1H, дд, J=11,2, 2,9 Гц), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,95-7,02 (1H, м), 7,23-7,27 (1H, м), 7,38 (2H, д, J=8,5 Гц), 7,54 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3504, 3390, 2960, 2925, 1585, 1493, 1475, 1427, 1396, 1302, 1275, 1227, 1174, 1146, 1082, 1036, 1014, 823, 752, 723, 708, 625, 555, 530, 463.
Т.пл.: 89°C.
МС m/z: 375 (М++H).
Элементный анализ. Вычислено для C17H17ClF2NO3S: C, 54,47; H, 4,57; Cl, 9,46; F, 10,14; S, 8,55. Найдено: C, 54,25; H, 4,46; Cl, 9,51; F, 10,41; S, 8,66.
Пример 241: Трет-бутил-N-[5-[(4-хлорфенил)сульфонил]-5-(2, 5-дифторфенил)пентил]-N-метилсульфонилкарбамат
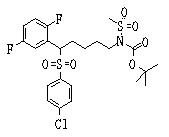
5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-1-пентанол (115 мг, 0,307 ммоль), полученный в примере 29, трет-бутил-N-метилсульфонилкарбамат (120 мг, 0,614 ммоль) и трифенилфосфин (163 мг, 0,614 ммоль) растворяли в тетрагидрофуране (3 мл). При комнатной температуре к полученному раствору добавляли диизопропилазодикарбоксилат (120 мкл, 0,614 ммоль). После перемешивания полученной смеси в течение 18 часов при комнатной температуре реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:1, концентрировали с получением указанного в заголовке соединения (168 мг, 0,304 ммоль, 99%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,22-1,35 (2H, м), 1,50 (9H, м), 1,58-1, 73 (2H, м), 2,08-2,18 (1H, м), 2,39-2,49 (1H, м), 3,22 (3H, с), 3,59 (2H, ддд, J=8,1, 6,6, 3,9 Гц), 4,53 (1H, дд, J=11,2, 2,9 Гц), 6,83 (1H, тд, J=9,0, 4,4 Гц), 6,95-7,01 (1H, м), 7,22-7,27 (1H, м), 7,39 (2H, д, J=8,5 Гц), 7,54 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 1722, 1583, 1496, 1350, 1321, 1281, 1149, 1087, 1012, 966, 831, 754, 710, 629, 517.
МС m/z: 452 (М+-Boc), 496 (М+-т-Bu), 574 (М++Na).
FAB-МС: 574,0932 (вычислено для C23H28ClF2NO6S2Na: 574,0912).
Пример 242: N-[5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)пентил]метансульфонамид
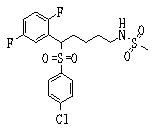
В дихлорметане (4 мл) растворяли трет-бутил-N-[5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)пентил]-N-метилсульфонилкарбамат (108 мг, 0,196 ммоль) с последующим добавлением трифторуксусной кислоты (1 мл) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь разбавляли дихлорметаном, промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали, полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (75,5 мг, 0,167 ммоль, 85%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,28-1,38 (2H, м), 1,55-1,68 (2H, м), 2,06-2,18 (1H, м), 2,43-2,52 (1H, м), 2,92 (3H, с), 3,09 (2H, дд, J=13,4, 6,8 Гц), 4,15-4,24 (1H, м), 4,51 (1H, дд, J=11,5, 3,4 Гц), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,96-7,03 (1H, м), 7,22-7,28 (1H, м), 7,39 (2H, д, J=8,5 Гц), 7,52 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3219, 2871, 1583, 1495, 1425, 1300, 1248, 1167, 1144, 1084, 1068, 978, 893, 835, 752, 725, 706, 629, 545, 525, 471.
Т.пл.: 106-107°C.
МС m/z: 452 (М++H).
Элементный анализ. Вычислено для C18H20ClF2NO4S2: C, 47,84; H, 4,46; Cl, 7,84; F, 8,41; N, 3,10; S, 14,19. Найдено: C, 47,75; H, 4,47; Cl, 7,94; F, 8,54; N, 3,14; S, 14,25.
Пример 243: Трет-бутил-N-[4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)-3-метилбутил]-N-метилсульфонилкарбамат
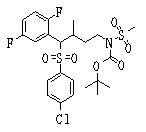
4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)-3-метил-1-бутанол (97,2 мг, 0,259 ммоль), полученный в примере 239, трет-бутил-N-метилсульфонилкарбамат (101 мг, 0,518 ммоль) и трифенилфосфин (138 мг, 0,518 ммоль) растворяли в тетрагидрофуране (3 мл) с последующим добавлением диизопропилазодикарбоксилата (102 мкл, 0, 518 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь разбавляли этилацетатом, промывали насыщенным водным раствором хлорида аммония, водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:2, концентрировали с получением указанного в заголовке соединения (136 мг, 0,246 ммоль, 95%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,33 (3H, д, J=6,8 Гц), 1,35-1,45 (1H, м), 1,52 (9H, с), 1,99-2,08 (1H, м), 2,70-2,78 (1H, м), 3,27 (3H, с), 3,65-3, 76 (2H, м), 4,45 (1H, д, J=7,6 Гц), 6,77 (1H, тд, J=9,0, 4,6 Гц), 6,91-6,97 (1H, м), 7,32 (2H, д, J=8,5 Гц), 7,38-7,45 (1H, м), 7,50 (2H, д, J=8,5 Гц).
МС m/z: 552 (М++H), 574 (М++Na).
FAB-МС: 552,1070 (Вычислено для C23H29ClF2NO6S2: 552,1093), 574,0875 (Вычислено для C23H28ClF2NO6S2Na: 574,0912).
Пример 244: N-[4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)-3-метилбутил]метансульфонамид
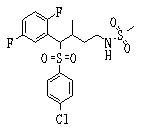
Трет-бутил-N-[4-[(4-хлорфенил)сульфонил]-4-(2, 5-дифторфенил)-3-метилбутил]-N-метилсульфонилкарбамат (136 мг, 0,246 ммоль), полученный в примере 243, растворяли в дихлорметане (4 мл) с последующим добавлением трифторуксусной кислоты (1 мл) при комнатной температуре. После перемешивания при комнатной температуре в течение 6 часов реакционную смесь разбавляли дихлорметаном, промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (99,5 мг, 0,220 ммоль, 89%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 1,27 (3H, д, J=6,8 Гц), 1,35-1,44 (1H, м), 1,95-2,05 (1H, м), 2,82-2,88 (1H, м), 2,95 (3H, с), 3,10-3,19 (1H, м), 3,22-3,30 (1H, м), 4,21-4,28 (1H, шир.м), 4,49 (1H, т, J=6,6 Гц), 6,81 (1H, тд, J=9,0, 4,4 Гц), 6, 93-7,00 (1H, м), 7,34 (2H, д, J=8,5 Гц), 7,42-7,48 (1H, м), 7,52 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3251, 3076, 1581, 1495, 1473, 1317, 1244, 1140, 881, 837, 781, 750, 729, 710, 665, 617, 553, 521, 465.
Т.пл.: 163°C.
МС m/z: 452 (М++H).
Элементный анализ. Вычислено для C18H20 ClF2NO4S2: C, 47,84; H, 4,46; Cl, 7,84; F, 8,41; N, 3,10; S, 14,19. Найдено: C, 47,88; H, 4,45; Cl, 7,91; F, 8,51; N, 3,16; S, 14,23.
Пример 245: N-[3-(4-хлорфенилсульфонил)-3-(2,5-дифторфенил)пропил]метансульфонамид
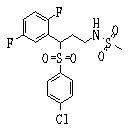
3-(4-хлорфенилсульфонил)-3-(2,5-дифторфенил)-1-пропанол (120 мг, 0,307 ммоль), полученный в примере 207, трет-бутил-N-метилсульфонилкарбамат (101 мг, 0,519 ммоль) и трифенилфосфин (138 мг, 0,519 ммоль) растворяли в тетрагидрофуране (3 мл) с последующим добавлением диизопропилазодикарбоксилата (102 мкл. 0,519 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученный таким образом остаток подвергали хроматографии на колонке с силикагелем (гексан:этилацетат=4:1) для удаления побочного продукта высокой полярности. Полученный таким образом неочищенный продукт растворяли в дихлорметане (4 мл) с последующим добавлением трифторуксусной кислоты (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь разбавляли дихлорметаном, промывали последовательно водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над сульфатом магния и затем концентрировали. Полученное таким образом твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (90,2 мг, 0,213 ммоль, 62%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 2,29-2,39 (1H, м), 2,69-2,78 (1H, м), 2,93 (3H, с), 3,10-3,20 (1H, м), 3,35-3,44 (1H, м), 4,44-4,50 (1H, шир.м), 4,74 (1H, дд, J=9,0, 6,1 Гц), 6,84 (1H, тд, J=9,0, 4,6 Гц), 6,97-7,04 (1H, м), 7,23 (1H, ддд, J=8,5, 5,4, 3,2 Гц), 7,39 (2H, д, J=8,5 Гц), 7,52 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3257, 3087, 2947, 1587, 1496, 1475, 1308, 1090, 1279, 1147, 1086, 1014, 962, 879, 827, 760, 737, 679, 621, 523, 463, 413.
Т.пл.: 131-134°C.
МС m/z: 424 (М++H).
Элементный анализ. Вычислено для C16H16ClF2NO4S2: C, 45,34; H, 3,80; Cl, 8,36; F, 8,96; N, 3,30; S, 15,13. Найдено: C, 45,22; H, 3,67; Cl, 8,34; F, 8,98; N, 3,38; S, 15,16.
Ссылочный пример 40: 4-(трет-бутилдифенилсилилокси)-2-бутен-1-ол
В смеси дихлорметан/N,N-диметилформамид (200 мл/200 мл) растворяли 2-бутен-1,4-диол (10,0 г, 113 ммоль) и имидазол (4,70 г, 69,0 ммоль) с последующим добавлением по каплям трет-бутилхлордифенилсилана (30,0 мл, 115 ммоль) при комнатной температуре. После завершения добавления по каплям смесь перемешивали при комнатной температуре в течение 4 дней. К остатку, полученному концентрированием реакционной смеси при пониженном давлении, добавляли диэтиловый эфир. Из полученной смеси отфильтровывали нерастворимое вещество. Слой диэтилового эфира промывали водой и затем органический слой сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (15,3 г, 46,9 ммоль, 42%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,06 (9H, с), 4,01 (0,5H, шир.д, J=6,1 Гц), 4,15 (1,5H, шир.д, J=4,9 Гц), 4, 18-4,26 (1,5H, м), 4,26 (0,5H, дм, J=5,9 Гц), 5,60-5,75 (1H, м), 5,78 (3H, дм, J=15,4 Гц), 7,34-7,52 (5H, м), 7,64-7,76 (4H, м).
МС m/z: 327 (М++H).
Пример 246: (Z)-2-[5-(трет-бутилдифенилсилилокси)-1-[(4-хлорфенил)сульфонил]-3-пентенил]-1,4-дифторбензол (изомер 246-А) и (Е)-2-[5-(трет-бутилдифенилсилилокси)-1-[(4-хлорфенил)сульфонил]-3-пентенил]-1, 4-дифторбензол (изомер 246-В)
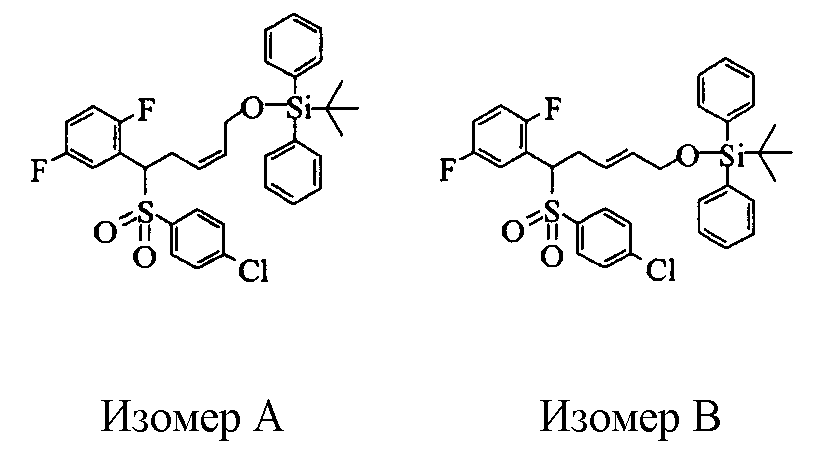
2-[(4-хлорфенил)сульфонилметил]-1, 4-дифторбензол (400 мг, 1,32 ммоль), полученный в примере 5, и 4-(трет-бутилдифенилсилилокси)-2-бутен-1-ол (660 мг, 2,02 ммоль) растворяли в толуоле (6 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (480 мг, 1,99 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 6 часов. После остывания реакционной смеси остаток, полученный концентрированием реакционной смеси при пониженном давлении, отделяли и очищали флэш-хроматографией на силикагеле (гексан:этилацетат=80:1) с получением указанного в заголовке изомера 246-А (низкой полярности) (149 мг, 0,244 ммоль, 18%) и указанного в заголовке изомера 246-В (высокой полярности) (468 мг, 0,766 ммоль, 58%), каждого в виде бесцветного масла.
Изомер 246-А
1H-ЯМР (400 МГц, CDCl3) δ: 1,04 (9H, с), 2,64-2,78 (1H, м), 2,95-3,08 (1H, м), 4,09 (1H, ддм, J=13,5, 5,6 Гц), 4,15 (1H, ддм, J=13,5, 6,3 Гц), 4,45 (1H, ддм, J=11,0, 3,4 Гц), 5,12 (1H, дтм, J=11,0, 7,3 Гц), 5,62 (1H, дтм, J=11,0, 6,3 Гц), 6,80-6,88 (1H, м), 6,90-7,00 (1H, м), 7,02-7,21 (1H, м), 7,30-7,60 (10 H, м), 7,60-7,72 (4H, м).
ИК (ATR) см-1: 2931, 2856, 1583, 1496, 1473, 1427, 1327, 1151, 1111, 1088, 823, 754, 702, 615, 505.
МС m/z: 611 (М++H), 633 (М++Na).
Изомер 246-В
1H-ЯМР (400 МГц, CDCl3) δ: 0,93 (9H, с), 2,80-2,92 (1H, м), 3,14-3,26 (1H, м), 3,98-4,05 (2H, м), 4,01 (1H, дд, J=11,5, 3,7 Гц), 5, 43 (1H, дтм, J=15,0,7,3 Гц), 5,59 (1H, дтм, J=15,0, 4,4 Гц), 6,75-6,88 (1H, м), 6,92-7,01 (1H, м), 7,22-7,50 (9H, м), 7,50-7,65 (6H, м).
ИК (ATR) см-1: 2931, 2856, 1583, 1496, 1427, 1321, 1149, 1111, 1084, 1012, 822, 754, 700, 503.
МС m/z: 611 (М++H), 633 (М++Na).
Пример 247: (Z)-5-[(4-хлорфенил)сульфонил]-5-(2, 5-дифторфенил)-2-пентен-1-ол
В тетрагидрофуране (5 мл) растворяли (Z)-2-[5-(трет-бутилдифенилсилилокси)-1-[(4-хлорфенил)сульфонил]-3-пентенил]-1,4-дифторбензол (изомер 246-А) (145 мг, 0,237 ммоль). После добавления по каплям раствора в тетрагидрофуране (1,0 М, 0,5 мл, 0,5 ммоль) тетрабутиламмонийфторида смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли воду (0,2 мл) с последующим концентрированием при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (51 мг, 0,137 ммоль, 58%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,35 (1H, шир.с), 2,82-2,95 (1H, м), 3,22-3,32 (1H, м), 4,08-4,18 (1H, м), 4,18-4,28 (1H, м), 4,56 (1H, ддм, J=10,6,4,5 Гц), 5,29 (1H, дтм, J=11,0,7,5 Гц), 5,67 (1H, дтм, J=11,0,6,6 Гц), 6,77-6,88 (1H, м), 6,92-7,02 (1H, м), 7,22-7,32 (1H, м), 7,39 (2H, д, J=8,7 Гц), 7,54 (2H, д, J=8,7 Гц).
ИК (ATR) см-1: 3560, 3016, 1585, 1495, 1475, 1427, 1396, 1308, 1277, 1218, 879, 827, 789, 752, 708, 679, 627, 467, 420.
Т.пл.: 60-63°C.
МС m/z: 390 (М+ +NH4).
Элементный анализ. Вычислено для C17H15ClF2O3S: C, 54,77; H, 4,06; Cl, 9,51; F, 10,19; S, 8,60. Найдено: C, 54,57; H, 4, 08; Cl, 9,41; F, 10,27; S, 8,74.
Пример 248: (Е)-5-[(4-хлорфенил)сульфонил]-5-(2,5-дифторфенил)-2-пентен-1-ол
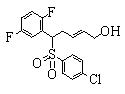
(Е)-2-[5-(трет-бутилдифенилсилилокси)-1-[(4-хлорфенил)сульфонил]-3-пентенил]-1,4-дифторбензол (изомер 246-В) (465 мг, 0,761 ммоль), полученный в примере 246, растворяли в тетрагидрофуране (10 мл) с последующим добавлением по каплям раствора в тетрагидрофуране (1,0 М, 1,5 мл, 1,5 ммоль) тетрабутиламмонийфторида. Смесь перемешивали при комнатной температуре в течение 1 часа. После добавления воды (0,2 мл) остаток, полученный концентрированием полученной смеси при пониженном давлении, подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (225 мг, 0,605 ммоль, 80%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,21 (1H, шир.т, J=5,5 Гц), 2,80-2,92 (1H, м), 3,18-3,28 (1H, м), 3,96-4,06 (2H, м), 4,57 (1H, ддм, J=11,2,3,9 Гц), 5,44 (1H, дтм, J=15,2,7,3 Гц), 5,70 (1H, дтм, J=15,2,5,4 Гц), 6,78-6,88 (1H, м), 6,95-7,03 (1H, м), 7,22-7,30 (1H, м), 7,39 (2H, д, J=8,7 Гц), 7,54 (2H, д, J=8,7 Гц).
ИК (ATR) см-1: 3552, 3087, 1583, 1495, 1427, 1396, 1309, 1281, 1219, 1186, 1142, 1082, 1016, 984, 874, 831, 775, 756, 710, 619, 553, 534, 467.
Т.пл.: 108-109°C.
МС m/z: 395 (М++Na).
Элементный анализ. Вычислено для C17 H15ClF2O3S: C, 54,77; H, 4,06; Cl, 9,51; F, 10,19; S, 8,60. Найдено: C, 54,59; H, 4,03; Cl, 9,53; F, 10,17; S, 8,71.
Ссылочный пример 41: 2-[2-(трет-бутилдифенилсилилокси)этилтио]этанол
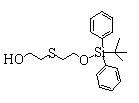
В дихлорметане (200 мл) растворяли 2,2'-тиодиэтанол (10,0 г, 81,8 ммоль) и имидазол (4,70 г, 60,0 ммоль) с последующим добавлением по каплям трет-бутилхлордифенилсилана (15,0 мл, 57,7 ммоль) при комнатной температуре. После завершения добавления по каплям реакционную смесь перемешивали при комнатной температуре в течение 14 часов. После концентрирования при пониженном давлении к остатку добавляли диэтиловый эфир. Затем нерастворимое вещество отфильтровывали. Остаток, полученный концентрированием фильтрата при пониженном давлении, подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (11,3 г, 31,3 ммоль, 54%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,06 (9H, с), 2,19 (1H, шир.с), 2,62-2,72 (4H, м), 3,63 (2H, шир.т, J=5,5 Гц), 3,80 (2H, т, J=6,8 Гц), 7,32-7,52 (6H, м), 7,66-7,75 (4H, м).
ИК (ATR) см-1: 3400, 2929, 2856, 1427, 1105, 822, 735, 700, 611, 503.
МС m/z: 383 (М++Na).
Пример 249: 2-[3-[2-(трет-бутилдифенилсилиокси)этилтио]-1-[(4-хлорфенил)сульфонил]пропил]-1,4-дифторбензол
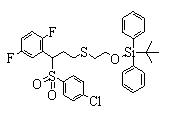
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (900 мг, 2,97 ммоль), полученный в примере 5, и 2-[2-(трет-бутилдифенилсилилокси)этилтио]этанол (1,64 г, 4,45 ммоль) растворяли в толуоле (20 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (1,26 г, 5,22 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 9 часов. После остывания реакционной смеси добавляли 2-{2-(трет-бутилдифенилсилилокси)этилтио]этанол (500 мг, 1,39 ммоль) и цианометилентри-н-бутилфосфоран (400 мг, 1,66 ммоль). В атмосфере аргона смесь нагревали при кипячении с обратным холодильником в течение 14 часов. После остывания реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=10:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,82 г, 2,82 ммоль, 95%) в виде бледного желтовато-коричневого масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,02 (9H, с), 2,20-2,35 (2H, м), 2,50-2,74 (4H, м), 3,65-3,80 (2H, м), 4,72-4, 80 (1H, м), 6,77-6,85 (1H, м), 6,92-7,00 (1H, м), 7,15-7,23 (1H, м), 7,35-7,48 (8H, м), 7,52 (2H, д, J=8,8 Гц), 7,64 (4H, д, J=8,1 Гц).
ИК (ATR) см-1: 2931, 2858, 1583, 1496, 1323, 1149, 1105, 1084, 754, 700, 503.
МС m/z: 667 (М++Na).
Пример 250: 2-[3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропилтио]этанол
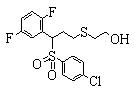
В тетрагидрофуране (30 мл) растворяли 2-[3-[2-(трет-бутилдифенилсилиокси)этилтио]-1-[(4-хлорфенил)сульфонил]пропил]-1,4-дифторбензол (1,81 г, 2,80 ммоль). При охлаждении на льду к полученному раствору добавляли по каплям раствор в тетрагидрофуране (1,0 М, 8,0 мл, 8,0 ммоль) тетрабутиламмонийфторида с последующим перемешиванием при комнатной температуре в течение 2 часов. К реакционной смеси добавляли воду (3 мл) с последующим концентрированием при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (977 мг, 2,40 ммоль, 86%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,97 (1H, т, J=6,1 Гц), 2,30-2,45 (2H, м), 2,60-2,80 (4H, м), 3,60-3,78 (2H, м), 4,81 (1H, дд, J=9,6, 3,5 Гц), 6,80-6,90 (1H, м), 6,96-7,05 (1H, м), 7,20-7,30 (1H, м), 7,39 (2H, д, J=8,8 Гц), 7,54 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 3564, 3072, 1583, 1496, 1275, 1144, 1082, 835, 810, 762, 627, 534, 480.
Т.пл.: 108-110°C.
МС m/z: 424 (М++NH4).
Элементный анализ. Вычислено для C17H17ClF2O3S2: C, 50,18; H, 4,21; Cl, 8,71; F, 9,34; S, 15,76. Найдено: C, 49,94; H, 4,20; Cl, 8,84; F, 9,41; S, 15,70.
Пример 251: 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)тетрагидротиопиран
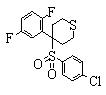
В толуоле (50 мл) растворяли 2-[3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропилтио]этанол (800 мг, 2,00 ммоль) с последующим добавлением цианометилентри-н-бутилфосфорана (1,50 г, 6,22 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. После остывания реакционную смесь концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=15:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (504 мг, 1,28 ммоль, 64% в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,46 (2H, шир.т, J=13,4 Гц), 2,57-2,78 (4H, м), 3,09 (2H, шир.с), 6,85-6,95 (1H, м), 7,02-7,15 (2H, м), 7,37 (2H, д, J=8,7 Гц), 7,40 (2H, д, J=8,7 Гц).
ИК (ATR) см-1: 2927, 1574, 1495, 1306, 1267, 1147, 1080, 877, 825, 750, 710, 619, 561, 472.
Т.пл.: 188-190°C.
МС m/z: 389 (М++H).
Элементный анализ. Вычислено для C17H15ClF2O2S2·0,25H2O: C, 51,90; H, 3,97; Cl, 9,01; F, 9,66; S, 16,30. Найдено: C, 52,20; H, 3,91; Cl, 9,20; F, 9,85; S, 16,36.
Пример 252: 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)тетрагидротиопиран-1-он
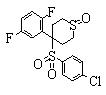
В дихлорметане (30 мл) растворяли 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)тетрагидротиопиран (200 мг, 0,508 ммоль). При охлаждении на льду добавляли 3-хлорпербензойную кислоту (106 мг, 0,614 ммоль). После перемешивания при комнатной температуре в течение 14 часов реакционную смесь концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (163 мг, 0,403 ммоль, 79%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,30-3,55 (8H, м), 6,85-7,04 (1H, м), 7,05-7,20 (2H, м), 7,33 (0,8H, д, J=8,3 Гц), 7,40 (0,8H, д, J=8,3 Гц), 7,44 (1,2H, д, J=8,8 Гц), 7,47 (1,2H, д, J=8,8 Гц).
ИК (ATR) см-1: 3095, 1576, 1491, 1308, 1279, 1146, 1082, 879, 818, 800, 752, 712, 621, 565, 474.
Т.пл.: 173-182°C.
МС m/z: 405 (М++H).
Элементный анализ. Вычислено для C17H15ClF2O3S2: C, 50,43; H, 3,73; Cl, 8,76; F, 9, 38; S, 15,85. Найдено: C, 50,60; H, 3,76; Cl, 8,81; F, 9,48; S, 15,92.
Пример 253: 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)тетрагидротиопиран-1,1-диоксид
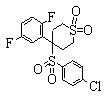
4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)тетрагидротиопиран (100 мг, 0,254 ммоль), полученный в примере 251, растворяли в дихлорметане (15 мл) с последующим добавлением 3-хлорпербензойной кислоты (110 мг, 0,637 ммоль) при охлаждении на льду. После перемешивания при комнатной температуре в течение 5 часов добавляли диэтиловый эфир. Полученную смесь промывали 1 н. водным раствором гидроксида натрия и органический слой сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (89 мг, 0,211 ммоль, 83%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,80-3,02 (4H, м), 3,02-3,24 (4H, м), 6,91-7,01 (1H, м), 7,06-7,13 (1H, м), 7, 14-7,22 (1H, м), 7,39 (2H, д, J=8,7 Гц), 7,44 (2H, д, J=8,7 Гц).
ИК (ATR) см-1: 1577, 1496, 1473, 1415, 1311, 1201, 1149, 1122, 1080, 874, 854, 822, 754, 708, 623, 567, 474.
Т.пл.: 204-206°C.
МС m/z: 421 (М++H).
Элементный анализ. Вычислено для C17H15ClF2O4 S2: C, 48,51; H, 3,59; Cl, 8,42; F, 9,03; S, 15,24. Найдено: C, 48,61; H, 3,60; Cl, 8,44; F, 9,05; S, 15,21.
Пример 254: 2-[3-[(4-хлорфенил)сульфонил]-3-(2, 5-дифторфенил)пропилсульфинил]этанол
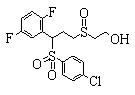
2-[3-[(4-хлорфенил)сульфонил]-3-(2, 5-дифторфенил)пропилтио]этанол (65 мг, 0,16 ммоль), полученный в примере 250, растворяли в дихлорметане (5 мл) с последующим добавлением 3-хлорпербензойной кислоты (33 мг, 0,19 ммоль) при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси дихлорметан:метанол=30:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (50 мг, 0,12 ммоль, 74%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2, 52-2,65 (2H, м), 2,80-3,02 (5H, м), 4,11-4,22 (2H, м), 4,68-4,78 (1H, м), 6,80-6,90 (1H, м), 6,97-7,04 (1H, м), 7,21-7,30 (1H, м), 7,38-7,44 (2H, м), 7,50-7,58 (2H, м).
ИК (ATR) см-1: 3421, 3259, 1585, 1496, 1319, 1147, 1086, 1028, 989, 833, 756, 555, 534, 480, 463.
Т.пл.: 124-132°C.
МС m/z: 423 (М++H).
Элементный анализ. Вычислено для C17H17ClF2O4S2: C, 48,28; H, 4,05; Cl, 8,42; F, 9,03; S, 15,24. Найдено: C, 48,03; H, 4,01; Cl, 8,33; F, 8,93; S, 15,06.
Пример 255: 2-[3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропилсульфонил]этанол
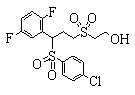
2-[3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропилтио]этанол (65 мг, 0,16 ммоль), полученный в примере 250, растворяли в дихлорметане (5 мл) с последующим добавлением 3-хлорпербензойной кислоты (66 мг, 0,38 ммоль) при охлаждении на льду. При комнатной температуре смесь перемешивали в течение 14 часов. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан-этилацетат=1:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (53 мг, 0,12 ммоль, 76%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,19 (1H, т, J=5,1 Гц), 2,56-2,70 (1H, м), 2,97-3,10 (1H, м), 3,12-3,28 (4H, м), 4,12 (2H, кв, J=5,1 Гц), 4,77 (1H, дд, J=9,4, 5,7 Гц), 6,82-6,92 (1H, м), 6,98-7,07 (1H, м), 7,20-7,30 (1H, м), 7,41 (2H, д, J=8,7 Гц), 7,54 (2H, д, J=8,7 Гц).
ИК (ATR) см-1: 3525, 3076, 1576, 1496, 1315, 1279, 1146, 1128, 1082, 1034, 1011, 997, 835, 758, 631, 559, 542, 523, 488, 467, 430.
Т.пл.: 111-113°C.
МС m/z: 439 (М++H).
Элементный анализ. Вычислено для C17H17ClF2O5S2: C, 46,52; H, 3,90; Cl, 8,08; F, 8,66; S, 14,61. Найдено: C, 46,46; H, 3,82; Cl, 8,15; F, 8,66; S, 14,55.
Ссылочный пример 42: Трет-бутил-N-[2-(терт-бутилдифенилсилилокси)этил]-N-(2-гидроксиэтил)карбамат
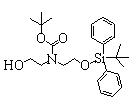
В смеси дихлорметан/N,N-диметилформамид (70 мл/70 мл) растворяли трет-бутил-N,N-бис(2-гидроксиэтил)карбамат (9,00 г, 43,8 ммоль) и имидазол (2,60 г, 38, 2 ммоль) с последующим добавлением по каплям трет-бутилхлордифенилсилана (8,1 мл, 31 ммоль) при комнатной температуре. После завершения добавления по каплям реакционную смесь перемешивали при комнатной температуре в течение 14 дней. К остатку, полученному концентрированием реакционной смеси при пониженном давлении, добавляли диэтиловый эфир. Полученную смесь промывали водой, и органический слой сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (7,41 г, 16,7 ммоль, 54%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,05 (9H, c), 1,30-1,60 (9H, м), 3,30-3,52 (4H, м), 3,68-3,90 (4H, м), 7,34-7,50 (6H, м), 7,60-7,72 (4H, м).
ИК (ATR) см-1: 2931, 2858, 1693, 1670, 1408, 1365, 1171, 1144, 1105, 1051, 933, 822, 737, 700, 613, 501.
МС m/z: 444 (М++H).
Пример 256: Трет-бутил-N-[2-(терт-бутилдифенилсилилокси)этил]-N-[3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил]карбамат
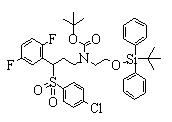
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (500 мг, 1,65 ммоль), полученный в примере 5, и трет-бутил-N-[2-(терт-бутилдифенилсилилокси)этил]-N-(2-гидроксиэтил)карбамат (950 мг, 2,14 ммоль) растворяли в толуоле (20 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (600 мг, 2,49 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 9 часов. После остывания реакционной смеси добавляли трет-бутил-N-[2-(терт-бутилдифенилсилилокси)этил]-N-(2-гидроксиэтил)карбамат (500 мг, 1,13 ммоль) и цианометилентри-н-бутилфосфоран (300 мг, 1,24 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. После остывания реакционной смеси остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=15:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,14 г, 1,57 ммоль, 95%) в виде бледного желтовато-коричневой пены.
1H-ЯМР (400 МГц, CDCl3) δ: 0,97 (9H, c), 1,20-1,50 (9H, м), 2,29 (1H, шир.с), 2,62-2, 78 (1H, м), 3,05-3,50 (4H, м), 3,66 (2H, шир.с), 4,40-4,60 (1H, м), 6,81 (1H, шир.с), 6,98 (1H, шир.с), 7,18-7,70 (15H, м).
ИК (ATR) см-1: 2931, 1689, 1585, 1496, 1473, 1323, 1149, 1086, 737, 700, 613, 467, 426.
МС m/z: 726 (М++H).
Пример 257: Трет-бутил-N-[3-[(4-хлорфенил)сульфонил]-3-(2, 5-дифторфенил)пропил]-N-(2-гидроксиэтил)карбамат
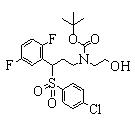
В тетрагидрофуране (20 мл) растворяли трет-бутил-N-[2-(терт-бутилдифенилсилилокси)этил]-N-[3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил]карбамат (1,13 г, 1,55 ммоль). При охлаждении на льду добавляли по каплям раствор в тетрагидрофуране (1,0 М, 5,0 мл, 5,0 ммоль) тетрабутиламмонийфторида. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду. Остаток, полученный концентрированием полученной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (651 мг, 1,32 ммоль, 85%) в виде белой пены.
1H-ЯМР (400 МГц, CDCl3) δ: 1,39 (9H, с), 2,28-2,42 (1H, м), 2,70-2,80 (1H, м), 3,15-3,32 (3H, м), 3,40 (1H, шир.с), 3,68-3,80 (2H, м), 4,54 (1H, шир.с), 6,78-6,88 (1H, м), 6,95-7,03 (1H, м), 7,20-7,31 (1H, м), 7,39 (2H, д, J=8,7 Гц), 7, 52 (2H, д, J=8,7 Гц).
ИК (ATR) см-1: 3438, 2976, 2933, 1685, 1583, 1496, 1475, 1319, 1279, 1147, 1084, 1012, 827, 756, 710, 629, 555, 525, 467.
МС m/z: 490 (М++H), 512 (М++Na).
Элементный анализ. Вычислено для C22H26ClF2NO5S·0,25H2O: C, 53,44; H, 5,40; Cl, 7,17; F, 7,68; N, 2,83; S, 6,48. Найдено: C, 53,39; H, 5,45; Cl, 7,21; F, 7,48; N, 2,95; S, 6,51.
Пример 258: Гидрохлорид 2-[3-[(4-хлорфенил)сульфонил]-3-(2, 5-дифторфенил)пропиламино]этанола
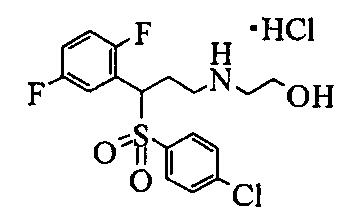
В дихлорметане (5 мл) растворяли трет-бутил-N-[3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил]-N-(2-гидроксиэтил)карбамат (300 мг, 0,607 ммоль), и трифторуксусную кислоту (0,5 мл) добавляли по каплям к полученному раствору при охлаждении на льду. После перемешивания при комнатной температуре в течение 2 часов реакционную смесь концентрировали при пониженном давлении. К осадку добавляли 1н раствор (5 мл) хлористоводородной кислоты в этаноле с последующим концентрированием при пониженном давлении с получением белого твердого вещества. Полученное таким образом твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (249 мг, 0,579 ммоль, 95%) в виде белого порошка.
1H-ЯМР (400 МГц, CD3OD) δ: 2,42-2,58 (1H, м), 2,77-2,90 (1H, м), 2,96 (1H, тд, J=11,8, 4,8 Гц), 3,06-3,15 (2H, м), 3,22 (1H, тд, J=11,8, 5,1 Гц), 3,75 (2H, дд, J=5,7, 4,5 Гц), 4,89 (1H, дд, J=9,6, 5,3 Гц), 6,98 (1H, тд, J=9,3, 4,4 Гц), 7,10-7,20 (1H, м), 7,26-7,34 (1H, м), 7,54 (2H, д, J=8,8 Гц), 7,61 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 3535, 2956, 2902, 2677, 1576, 1496, 1306, 1232, 1192, 1146, 1084, 1016, 822, 754, 710, 633, 548, 521, 472, 442.
Т.пл.: 216-220°C.
МС m/z: 390 (М++H).
Элементный анализ. Вычислено для C17H18ClF2NO3S·HCl·0,25H2O: C, 47,40; H, 4,56; Cl, 16,46; F, 8,82; N, 3,25; S, 7,44. Найдено: C, 47,52; H, 4,47; Cl, 16,47; F, 9,06; N, 3,36; S, 7,58.
Пример 259: Трет-бутил-4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)-1-пиперидинкарбоксилат
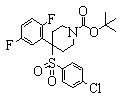
Трет-бутил-N-[3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил]-N-(2-гидроксиэтил)карбамат (200 мг, 0,404 ммоль), полученный в примере 257, растворяли в толуоле (10 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (200 мг, 0,829 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 8 часов. После остывания реакционной смеси добавляли цианометилентри-н-бутилфосфоран (200 мг, 0,829 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. После остывания реакционной смеси остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (140 мг, 0,297 ммоль, 74%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,43 (9H, с), 2,27 (2H, шир.т, J=14,2 Гц), 2,67 (4H, шир.с), 4,18 (2H, шир.с), 6,82-6,92 (1H, м), 7,03-7,16 (2H, м), 7,36 (2H, д, J=8,7 Гц), 7,40 (2H, д, J=8,7 Гц).
ИК (ATR) см-1: 2979, 1682, 1583, 1410, 1315, 1244, 1188, 1144, 1088, 831, 754, 623, 563, 534, 474.
Т.пл.: 101-106°C.
МС m/z: 472 ( М++H).
Элементный анализ. Вычислено для C22H24ClF2 NO4S: C, 55,99; H, 5,13; Cl, 7,51; F, 8,05; N, 2,97; S, 6,79. Найдено: C, 55,89; H, 5,19; Cl, 7,35; F, 7,97; N, 3,02; S, 6,80.
Пример 260: Гидрохлорид 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидина
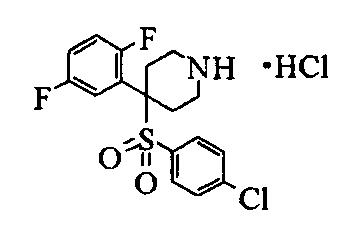
В дихлорметане (100 мл) растворяли трет-бутил-4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)-1-пиперидинкарбоксилат (3,17 г, 6,72 ммоль) с последующим добавлением по каплям трифторуксусной кислоты (10,0 мл) при охлаждении на льду. После перемешивания при комнатной температуре в течение 2 часов реакционную смесь концентрировали при пониженном давлении. К полученному таким образом остатку добавляли 1 н. раствор (30 мл) хлористо-водородной кислоты в этаноле. Полученную смесь концентрировали при пониженном давлении с получением белого твердого вещества. Полученное таким образом белое твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (2,74 г, 6,71 ммоль, выход количественный) в виде белого порошка.
1H-ЯМР (400 МГц, CD3 OD) δ: 2,57 (2H, тм, J=14,1 Гц), 2,85 (2H, тм, J=12,6 Гц), 2,98 (2H, шир.с), 3,54 (2H, дм, J=13,7 Гц), 7,02-7,12 (1H, м), 7,22-7,31 (2H, м), 7,43 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 3338, 2943, 2713, 1579, 1495, 1469, 1311, 1196, 1144, 1082, 1012, 893, 818, 750, 623, 567.
Т.пл.: 239-246°C (разл.).
МС m/z: 372 (М++H).
Элементный анализ. Вычислено для C17H16ClF2NO2S·HCl·0,75H2O: C, 48,41; H, 4,42; Cl, 16, 81; F, 9,01; N, 3,32; S, 7,60. Найдено: C, 48,60; H, 4,31; Cl, 16,33; F, 9,16; N, 3,46; S, 7,80.
Пример 261: 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)-1-метилпиперидин
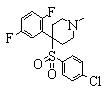
К дихлорметану (5 мл) добавляли гидрохлорид 4-[(4-хлорфенил)сульфонил]-4-(2, 5-дифторфенил)пиперидина (100 мг, 0,245 ммоль), триэтиламин (0,070 мл, 0,50 ммоль) и 37% водный раствор формальдегида (0,060 мл, 0,739 ммоль) с последующим добавлением триацетоксиборгидрида (220 мг, 1, 04 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 14 часов добавляли 1 н. водный раствор гидроксида натрия (6,0 мл). Смесь перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли диэтиловый эфир, и смесь промывали 1 н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата дихлорметан:метанол=30:1, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное таким образом белое твердое вещество промывали диизопропиловым эфиром с получением указанного в заголовке соединения (70 мг, 0,18 ммоль, 74%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,90 (2H, тм, J=12,5 Гц), 2,17 (3H, с), 2,42 (2H, тм, J=11,8 Гц), 2, 50-2,90 (2H, м), 2,89 (2H, дт, J=12,0,2,9 Гц), 6,82-6,92 (1H, м), 7,03-7,16 (2H, м), 7,38 (2H, д, J=9,0 Гц), 7,42 (2H, д, J=9,0 Гц).
ИК (ATR) см-1: 3084, 3006, 2943, 2850, 2796, 1577, 1496, 1462, 1313, 1281, 1184, 1147, 1086, 814, 752, 712, 631, 571, 534, 474, 440.
Т.пл.: 172-175°C.
МС m/z: 386 (М++H).
Элементный анализ. Вычислено для C18H18ClF2NO2S: C, 56,03; H, 4,70; Cl, 9,19; F, 9,85; N, 3,63; S, 8,31. Найдено: C, 55,92; H, 4,72; Cl, 9,10; F, 9,91; N, 3, 67; S, 8,39.
Пример 262: 1-бензил-4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидин
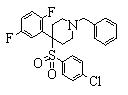
Гидрохлорид 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидина (100 мг, 0,245 ммоль), полученный в примере 260, триэтиламин (0,070 мл, 0,50 ммоль) и бензальдегид (0,050 мл, 0,428 ммоль) добавляли к дихлорметану (5 мл) с последующим добавлением триацетоксиборгидрида натрия (110 мг, 0,500 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Затем добавляли 1 н. водный раствор гидроксида натрия (3,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 30 минут. После добавления диэтилового эфира полученную смесь промывали 1 н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата дихлорметан:метанол=50:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (87 мг, 0,19 ммоль, 77%) в виде белой пены.
1H-ЯМР (400 МГц, CDCl3) δ: 1,93 (2H, шир.т, J=12,5 Гц), 2,46 (2H, шир.т, J=11,6 Гц), 2,65 (2H, шир.с), 2,93 (2H, дм, J=12,5 Гц), 3,36 (2H, с), 6,81-6,94 (1H, м), 7,00-7,15 (2H, м), 7,20-7,34 (5H, м), 7,37 (4H, с).
ИК (ATR) см-1: 2812, 2769, 1583, 1495, 1313, 1259, 1188, 1144, 1088, 810, 752, 698, 629, 571, 542, 469.
МС m/z: 462 (М++H).
Элементный анализ. Вычислено для C24H22ClF2NO2S: C, 62,40; H, 4,80; Cl, 7,67; F, 8,23; N, 3,03; S, 6,94. Найдено: C, 62,50; H, 4,98; Cl, 7,50; F, 8,05; N, 3,04; S, 6,90.
Пример 263: 1-[4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидино]-1-этанон
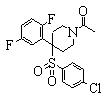
Гидрохлорид 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидина (90 мг, 0,22 ммоль), полученный в примере 260, и триэтиламин (0,092 мл, 0,66 ммоль) растворяли в дихлорметане (4 мл) с последующим добавлением ацетилхлорида (0,024 мл, 0,34 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 14 часов добавляли насыщенный водный раствор бикарбоната натрия (0,5 мл). Остаток, полученный концентрированием полученной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси дихлорметан:метанол=30:1, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное таким образом твердое вещество промывали гексаном с получением указанного в заголовке соединения (48 мг, 0,12 ммоль, 53%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,08 (3H, с), 2,20-2,42 (2H, м), 2,49 (1H, шир.т, J=13,0 Гц), 2,60-2,75 (1H, м), 2,75-2,90 (1H, м), 3,01 (1H, шир.т, J=13,2 Гц), 3,92 (1H, дм, J=13,4 Гц), 4,70 (1H, дм, J=13,9 Гц), 6,85-6,94 (1H, м), 7,50-7,60 (2H, м), 7,36 (2H, д, J=8,8 Гц), 7,40 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 3084, 1653, 1496, 1427, 1309, 1279, 1244, 1144, 1088, 993, 754, 627, 563, 474.
Т.пл.: 159-160°C.
МС m/z: 414 (М++H).
Элементный анализ. Вычислено для C19H18ClF2NO3S: C, 55,14; H, 4,38; Cl, 8,57; F, 9,18; N, 3,38; S, 7,75. Найдено: C, 55,07; H, 4,49; Cl, 8,69; F, 9,30; N, 3,41; S, 7,77.
Пример 264: [4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидино](4-пиридил)метанон
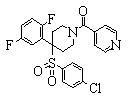
Подобно методике примера 263, за исключением использования гидрохлорида 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидина (80 мг, 0,20 ммоль), полученного в примере 260, и гидрохлорида изоникотиноилхлорида (60 мг, 0,34 ммоль) указанное в заголовке соединение (84 мг, 0,18 ммоль, 90%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,24-2,55 (2H, м), 2,60-2,90 (3H, м), 2,90-3,10 (1H, м), 3,70-3,82 (1H, м), 4, 74-4,90 (1H, м), 6,84-6,92 (1H, м), 7,04-7,14 (2H, м), 7,18-7,25 (2H, м), 7,34 (2H, д, J=8,5 Гц), 7,39 (2H, д, J=8,5 Гц), 8,70 (2H, д, J=5,9 Гц).
ИК (ATR) см-1: 3032, 1630, 1496, 1439, 1311, 1279, 1146, 1086, 1013, 810, 752, 625, 561, 505.
Т.пл.: 245-248°C.
МС m/z: 477 (М++H).
FAB-МС: 477,0839 (вычислено для C23H20ClF2N2O3S: 477,0851).
Пример 265: [4-[(4-хлорфенил)сульфонил]-4-(2, 5-дифторфенил)пиперидино](3-пиридил)метанон
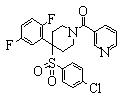
Подобно методике примера 263, за исключением использования гидрохлорида 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидина (90 мг, 0,22 ммоль), полученного в примере 260, и гидрохлорида никотиноилхлорида (60 мг, 0,34 ммоль) указанное в заголовке соединение (75 мг, 0,16 ммоль, 71%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,20-4,90 (8H, м), 6,85-6,95 (1H, м), 7,08-7,18 (2H, м), 7,32-7,43 (1H, м), 7,35 (2H, д, J=8,9 Гц), 7,40 (2H, д, J=8,9 Гц), 7,73 (1H, дт, J=7,8,2,0 Гц), 8,62 (1H, дд, J=2,0, 1,0 Гц), 8,68 (1H, дд, J=4,9, 2,0 Гц).
ИК (ATR) см-1: 1631, 1585, 1493, 1444, 1315, 1144, 1088, 831, 756, 625, 557, 505, 474.
Т.пл.: 119-124°C.
МС m/z: 477 (М++H).
Элементный анализ. Вычислено для C23H19ClF2N2O3S: C, 57,92; H, 4,02; Cl, 7,43; F, 7,97; N, 5,87; S, 6,72. Найдено: C, 57,69; H, 4,08; Cl, 7,33; F, 7,97; N, 5,94; S, 6,78.
Пример 266: [4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидино](2-пиридил)метанон
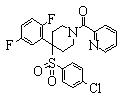
Подобно методике примера 263, за исключением использования гидрохлорида 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидина (80 мг, 0,22 ммоль), полученного в примере 260, и гидрохлорида пиколиноилхлорида (60 мг, 0,34 ммоль) указанное в заголовке соединение (77 мг, 0,16 ммоль, 82%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,35-2,52 (2H, м), 2,60-2,90 (3H, м), 3,09 (1H, шир.т, J=13,1 Гц), 4,21 (1H, дм, J=13,5 Гц), 4,83 (1H, дм, J=14,0 Гц), 6,82-6,95 (1H, м), 7,04-7,18 (2H, м), 7,30-7,45 (5H, м), 7,65 (1H, дм, J=7,8 Гц), 7,80 (1H, тд, J=7,8, 1,7 Гц), 8,55 (1H, дм, J=4,9 Гц).
ИК (ATR) см-1: 3084, 1635, 1496, 1311, 1146, 1086, 1007, 843, 804, 752, 629, 555, 467.
Т.пл.: 193-196°C.
МС m/z: 477 (М++H).
Элементный анализ. Вычислено для C23H19ClF2N2O3S: C, 57,92; H, 4,02; Cl, 7,43; F, 7,97; N, 5,87; S, 6,72. Найдено: C, 57,94; H, 4,08; Cl, 7,48; F, 7,99; N, 5,92; S, 6,81.
Пример 267: Метил-4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)-1-пиперидинкарбоксилат
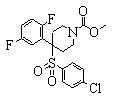
Подобно методике примера 263, за исключением использования гидрохлорида 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидина (90 мг, 0,22 ммоль), полученного в примере 260, и метилхлорформиата (0,026 мл, 0,34 ммоль) указанное в заголовке соединение (62 мг, 0,14 ммоль, 65%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,29 (2H, тм, J=12,1 Гц), 2,55-2,85 (4H, м), 3,68 (3H, с), 4,22 (2H, шир.с), 6,82-6,92 (1H, м), 7,05-7,15 (2H, м), 7,36 (2H, д, J=8,8 Гц), 7,40 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 1695, 1493, 1450, 1400, 1248, 1188, 1142, 1090, 901, 825, 623, 565, 534, 474.
Т.пл.: 123-126°C.
МС m/z: 430 (М++H).
Элементный анализ. Вычислено для C19H18ClF2NO4S: C, 53,09; H, 4,22; Cl, 8,25; F, 8,84; N, 3,26; S, 7,46. Найдено: C, 52,89; H, 4,20; Cl, 8,27; F, 8,90; N, 3,35; S, 7,58.
Пример 268: N,N-диметил-4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)-1-пиперидинкарбоксамид
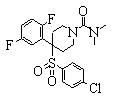
Подобно методике примера 263, за исключением использования гидрохлорида 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидина (90 мг, 0,22 ммоль), полученного в примере 260, и N,N-диметилкарбамоилхлорида (0,031 мл, 0,34 ммоль) указанное в заголовке соединение (81 мг, 0,18 ммоль, 83%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,40 (2H, шир.т, J=12,1 Гц), 2,60-2,80 (4H, м), 2,81 (6H, с), 3,72 (2H, дм, J=13,7 Гц), 6,82-6,92 (1H, м), 7,04-7,14 (2H, м), 7,35 (2H, д, J=9,0 Гц), 7,39 (2H, д, J=9,0 Гц).
ИК (ATR) см-1: 1651, 1576, 1496, 1469, 1365, 1308, 1190, 1146, 1074, 1034, 914, 814, 758, 752, 617, 561, 474.
Т.пл.: 143-146°C.
МС m/z: 443 (М++H).
Элементный анализ. Вычислено для C20H21ClF2N2O3S: C, 54, 24; H, 4,78; Cl, 8,00; F, 8,58; N, 6,32; S, 7,24. Найдено: C, 53,96; H, 4,73; Cl, 8,14; F, 8,64; N, 6,34; S, 7,32.
Пример 269: 4-[(4-хлорфенил)сульфонил]-4-(2, 5-дифторфенил)-1-(метилсульфонил)пиперидин
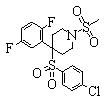
Подобно методике примера 263, за исключением использования гидрохлорида 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидина (90 мг, 0,22 ммоль), полученного в примере 260, и метансульфонилхлорида (0,026 мл, 0,34 ммоль) указанное в заголовке соединение (72 мг, 0,16 ммоль, 73%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,48 (2H, шир.т, J=12,1 Гц), 2,60-2,90 (4H, м), 2,72 (3H, с), 3,88 (2H, дм, J=12,9 Гц), 6,88-6,96 (1H, м), 7,04-7,14 (2H, м), 7,37 (2H, д, J=8,9 Гц), 7,42 (2H, д, J=8,9 Гц).
ИК (ATR) см-1: 1579, 1495, 1308, 1257, 1138, 966, 814, 752, 623, 565, 513.
Т.пл.: 176-178°C.
МС m/z: 450 (М++H).
Элементный анализ. Вычислено для C18H18 ClF2NO3S: C, 48,05; H, 4,03; Cl, 7,88; F, 8,45; N, 3,11; S, 14,25. Найдено: C, 48,02; H, 4,00; Cl, 7,91; F, 8,52; N, 3,22; S, 14,28.
Пример 270: N, N-диметил-4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)-1-пиперидинсульфонамид
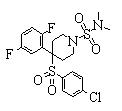
Подобно методике примера 263, за исключением использования гидрохлорида 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидина (90 мг, 0,22 ммоль), полученного в примере 260, и N, N-диметилсульфамоилхлорида (0,036 мл, 0,34 ммоль) указанное в заголовке соединение (84 мг, 0,18 ммоль, 80%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3 ) δ: 2,45 (2H, шир.т, J=12,5 Гц), 2,68-2,90 (4H, м), 2,79 (6H, с), 3,73 (2H, дм, J=13,4 Гц), 6,80-6,92 (1H, м), 7,05-7,14 (2H, м), 7,34 (2H, д, J=8,8 Гц), 7,40 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 1576, 1493, 1469, 1315, 1144, 984, 904, 808, 742, 621, 553, 519, 472.
Т.пл.: 125-129°C.
МС m/z: 479 (М++H).
Элементный анализ. Вычислено для C19H21ClF2N2O4S2: C, 47,65; H, 4,42; Cl, 7,40; F, 7,93; N, 5,85; S, 13,39. Найдено: C, 47,62; H, 4,40; Cl, 7,42; F, 8,03; N, 5,95; S, 13,43.
Пример 271: 1-[4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидино]-2-(диметиламино)-1-этанон
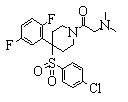
Гидрохлорид 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидина (100 мг, 0,245 ммоль), полученный в примере 260, N,N-диметилглицин (40 мг, 0,39 ммоль) и N-метилморфолин (0,142 мл, 1,29 ммоль) растворяли в дихлорметане (5 мл) с последующим добавлением 1-этил-3-(3-диметиламинопропил)карбодиимида (80 мг, 0,42 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 14 часов добавляли насыщенный водный раствор (0,5 мл) бикарбоната натрия. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием дихлорметан:метанол=30:1, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное твердое вещество промывали диизопропиловым эфиром с получением указанного в заголовке соединения (70 мг, 0,15 ммоль, 62%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,15-2,40 (2H, м), 2,25 (6H, с), 2,50 (1H, шир.т, J=12,9 Гц), 2,60-2,85 (2H, м), 2,93 (1H, шир.т, J=12,0 Гц), 3,03 (1H, д, J=13,2 Гц), 3,13 (1H, д, J=13,2 Гц), 4,32 (1H, шир.д, J=14,4 Гц), 4,67 (1H, шир.д, J=13,7 Гц), 6,83-6,93 (1H, м), 7,02-7,16 (2H, м), 7, 36 (2H, д, J=8,8 Гц), 7,40 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 2829, 2773, 1635, 1460, 1313, 1142, 1090, 827, 806, 754, 625, 561, 523, 474.
Т.пл.: 88-92°C.
МС m/z: 457 (М++H).
Элементный анализ. Вычислено для C21H23ClF2N2O3S: C, 55,20; H, 5, 07; Cl, 7,76; F, 8,32; N, 6,13; S, 7,02. Найдено: C, 55,15; H, 5,18; Cl, 7,76; F, 8,40; N, 6,13; S, 7,13.
Пример 272: N-этил-4-[(4-хлорфенил)сульфонил]-4-(2, 5-дифторфенил)-1-пиперидинкарбоксамид
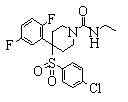
Гидрохлорид 4-[(4-хлорфенил)сульфонил]-4-(2,5-дифторфенил)пиперидин (80 мг, 0,20 ммоль), полученный в примере 260, и триэтиламин (0,092 мл, 0,66 ммоль) растворяли в дихлорметане (4 мл) с последующим добавлением этилизоцианата (0,027 мг, 0,34 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 6 часов добавляли насыщенный водный раствор бикарбоната натрия (0,5 мл). Остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата дихлорметан:метанол=50:1, концентрировали при пониженном давлении с получением белого твердого вещества. Полученное твердое вещество промывали диизопропиловым эфиром с получением указанного в заголовке соединения (74 мг, 0,17 ммоль, 85%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,12 (3H, т, J=7,2 Гц), 2,33 (2H, шир.т, J=11,8 Гц), 2,72 (4H, шир.т, J=12,0 Гц), 3,18-3,30 (2H, м), 3,99 (2H, дм, J=13,4 Гц), 4,30-4,40 (1H, м), 6,84-6,95 (1H, м), 7,05-7,15 (2H, м), 7,37 (2H, д, J=8,8 Гц), 7,40 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 3286, 1622, 1496, 1309, 1265, 1144, 1090, 889, 825, 752, 629, 567, 542, 474.
Т.пл.: 172-174°C.
МС m/z: 443 (М++H).
Элементный анализ. Вычислено для C20 H21ClF2N2O3S: C, 54,24; H, 4,78; Cl, 8,00; F, 8,58; N, 6,32; S, 7,24. Найдено: C, 54,18; H, 4,76; Cl, 8,15; F, 8,70; N, 6,41; S, 7,39.
Пример 273: 2-[7-(трет-бутилдифенилсилилокси)-1-[(4-хлорфенил)сульфонил]гептил]-1,4-дифторбензол
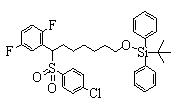
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (470 мг, 1,55 ммоль), полученный в примере 5, и 6-(терт-бутилдифенилсилилокси)-1-гексанол (740 мг, 2,08 ммоль) растворяли в толуоле (20 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (500 мг, 2,07 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 7 часов. После остывания реакционной смеси остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат=10:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (786 мг, 1,23 ммоль, 79%) в виде бледного желтовато-коричневого масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,02 (9H, с), 1,10-1,40 (6H, м), 1,42-1,55 (2H, м), 2,00-2,14 (1H, м), 2,35-2,48 (1H, м), 3,60 (2H, т, J=6,5 Гц), 4,49 (1H, дд, J=11,6, 2,6 Гц), 6,76-6,89 (1H, м), 6,94-7,03 (1H, м), 7,20-7,30 (1H, м), 7,34-7,50 (8H, м), 7,53 (2H, д, J=8,6 Гц), 7,64 (4H, дм, J=8,1 Гц).
ИК (ATR) см-1: 2931, 2856, 1583, 1496, 1427, 1323, 1149, 1105, 1084, 822, 700, 627, 613, 503, 486, 467.
МС m/z: 641 (М++H).
Пример 274: 7-[(4-хлорфенил)сульфонил]-7-(2, 5-дифторфенил)-1-гептанол
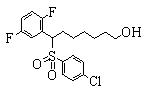
В тетрагидрофуране (20 мл) растворяли 2-[7-(трет-бутилдифенилсилилокси)-1-[(4-хлорфенил)сульфонил]гептил]-1,4-дифторбензол (786 мг, 1,23 ммоль) с последующим добавлением по каплям при охлаждении на льду раствора в тетрагидрофуране (1,0 М, 4,0 мл, 4,0 ммоль) тетрабутиламмонийфторида. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. После добавления воды (2 мл) смесь концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (403 мг, 1,00 ммоль, 81%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,10-1,75 (9H, м), 2,02-2,20 (1H, м), 2,38-2,52 (1H, м), 3,60 (2H, т, J=6,4 Гц), 4,50 (1H, дд, J=11,7, 3,2 Гц), 6,78-6,90 (1H, м), 6,92-7,05 (1H, м), 7,20-7,35 (1H, м), 7,38 (2H, д, J=8,4 Гц), 7,53 (2H, д, J=8,4 Гц).
ИК (ATR) см-1: 3338, 2935, 2860, 1583, 1495, 1325, 1149, 1082, 1012, 752, 631, 542, 467.
Т.пл.: 77-79°C.
МС m/z: 403 (М++H), 420 (М++NH4).
Элементный анализ. Вычислено для C19H21ClF2 O3S: C, 56,64; H, 5,25; Cl, 8,80; F, 9,43; S, 7,96. Найдено: C, 56,16; H, 5,18; Cl, 8,80; F, 9,36; S, 8,00.
Пример 275: 2-[1-[(4-хлорфенил)сульфонил]циклогептил-1, 4-дифторбензол
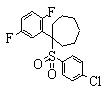
В толуоле (5 мл) растворяли 7-[(4-хлорфенил)сульфонил]-7-(2, 5-дифторфенил)-1-гептанол (200 мг, 0,496 ммоль) с последующим добавлением цианометилентри-н-бутилфосфорана (400 мг, 2,07 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. После остывания реакционной смеси остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат=10:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (111 мг, 0,288 ммоль, 58%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,34-1,50 (4H, м), 1,50-1,68 (2H, м), 1,82-1,98 (2H, м), 2,36 (2H, тм, J=12,5 Гц), 2,65-2,78 (2H, м), 6,84-6,94 (1H, м), 6,97-7,08 (2H, м), 7,34 (2H, д, J=9,0 Гц), 7,37 (2H, д, J=9,0 Гц).
ИК (ATR) см-1: 2931, 2856, 1577, 1493, 1473, 1308, 1277, 1186, 1140, 1086, 1012, 881, 818, 748, 710, 615, 559, 467.
Т.пл.: 101-103°C.
МС m/z: 402 (М++NH4 ).
Элементный анализ. Вычислено для C19H19ClF2O2S: C, 59,29; H, 4,98; Cl, 9,21; F, 9,87; S, 8,33. Найдено: C, 59,21; H, 4,86; Cl, 9,25; F, 9,96; S, 8,48.
Пример 276: 2-[2-[2-[(трет-бутилдифенилсилилокси)метил]фенил]-1-[(4-хлорфенил)сульфонил]этил]-1,4-дифторбензол
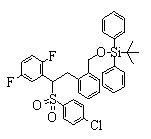
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (600 мг, 1,98 ммоль), полученный в примере 5, и [2-[(терт-бутилдифенилсилилокси)метил]фенил]метанол (1,00 г, 2,66 ммоль) растворяли в толуоле (20 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (640 мг, 2,65 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. После остывания реакционной смеси добавляли [2-[(терт-бутилдифенилсилилокси)метил]фенил]метанол (400 мг, 1, 06 ммоль) и цианометилентри-н-бутилфосфоран (400 мг, 1,66 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. После остывания реакционной смеси остаток, полученный концентрированием смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат=15:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,13 г, 1,71 ммоль, 86%) в виде бледного желтовато-коричневого масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,09 (9H, с), 3,30 (1H, дд, J=14,7, 11,2 Гц), 3,80 (1H, дд, J=14,7, 3,4 Гц), 4,65 (1H, д, J=12,9 Гц), 4,70-4,85 (2H, м), 6,64-6,74 (1H, м), 6,82 (1H, д, J=6,8 Гц), 6, 85-6,94 (1H, м), 7,03 (1H, тд, J=7,5, 1,4 Гц), 7,15 (1H, тд, J=7,5, 1,2 Гц), 7,20-7,55 (12H, м), 7,65-7,76 (4H, м).
ИК (ATR) см-1: 2931, 2856, 1583, 1496, 1473, 1427, 1319, 1149, 1111, 1082, 822, 740, 700, 634, 501.
МС m/z: 661 (М++H), 683 (М++Na).
Пример 277: [2-[2-[(4-хлорфенил)сульфонил]-2-(2, 5-дифторфенил)этил]фенил]метанол
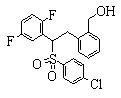
В тетрагидрофуране (20 мл) растворяли 2-[2-[2-[(трет-бутилдифенилсилилокси)метил]фенил]-1-[(4-хлорфенил)сульфонил]этил]-1,4-дифторбензол (1,10 г, 1,66 ммоль) с последующим добавлением по каплям раствора в тетрагидрофуране (1,0 М, 5,0 мл, 5,0 ммоль) тетрабутиламмонийфторида при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. После добавления воды (3 мл) остаток, полученный концентрированием полученной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали диизопропиловым эфиром с получением указанного в заголовке соединения (595 мг, 1,41 ммоль, 85%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,92 (1H, дд, J=6,1, 4,9 Гц), 3,35 (1H, дд, J=14,1, 10,0 Гц), 4,00 (1H, дд, J=14,1, 3,4 Гц), 4,66 (1H, дд, J=12, 3, 4,9 Гц), 4,81 (1H, дд, J=12,3, 6,1 Гц), 5,10 (1H, дм, J=10,0 Гц), 6,66-6,75 (1H, м), 6,82 (1H, д, J=7,5 Гц), 6,89-6,98 (1H, м), 7,06 (1H, тд, J=7,5, 1,5 Гц), 7,17 (1H, тд, J=7,5, 1,2 Гц), 7,29 (1H, дд, J=7,5, 1,2 Гц), 7,38 (2H, д, J=8,7 Гц), 7,50 (1H, шир.с), 7,58 (2H, д, J=8,7 Гц).
ИК (ATR) см-1: 3506, 1576, 1493, 1313, 1279, 1213, 1144, 1080, 1014, 829, 750, 708, 634, 536, 471.
Т.пл.: 107-108°C.
МС m/z: 422 (М+).
Элементный анализ. Вычислено для C21H17ClF2 O3S: C, 59,65; H, 4,05; Cl, 8,38; F, 8,99; S, 7,58. Найдено: C, 59,46; H, 3,97; Cl, 8,41; F, 9,05; S, 7,67.
Пример 278: 2-[(4-хлорфенил)сульфонил]-2-(2, 5-дифторфенил)индан
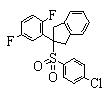
В толуоле (5 мл) растворяли [2-[2-[(4-хлорфенил)сульфонил]-2-(2,5-дифторфенил)этил]фенил]метанол (80 мг, 0,19 ммоль) с последующим добавлением цианометилентри-н-бутилфосфорана (140 мг, 0,580 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 8 часов. После остывания реакционной смеси остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=5:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали диизопропиловым эфиром с получением указанного в заголовке соединения (32 мг, 0,079 ммоль, 42%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 3,72 (2H, дм, J=17,6 Гц), 4,18 (2H, дд, J=17,6, 2,9 Гц), 6,95-7,04 (1H, м), 7,04-7,12 (4H, м), 7,12-7,21 (1H, м), 7,21-7,30 (1H, м), 7,23 (2H, д, J=8,7 Гц), 7,45 (2H, д, J=8,7 Гц).
ИК (ATR) см-1: 1572, 1495, 1306, 1138, 1078, 821, 754, 656, 598, 571, 525, 478, 451.
Т.пл.: 209-210°C (разл.).
МС m/z: 422 (М++NH4).
Пример 279: 2-[1-[(4-хлорфенил)сульфонил]-2-метилциклопентил]-1,4-дифторбензол
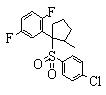
2-[5-(трет-бутилдифенилсилилокси)-1-[(4-хлорфенил)сульфонил]-2-метилпентил]-1,4-дифторбензол (смесь изомеров) (1,40 г, 2,23 ммоль), полученный в примере 38, растворяли в тетрагидрофуране (30 мл) с последующим добавлением раствора в тетрагидрофуране (1,0 М, 5,0 мл, 5,0 ммоль) тетрабутиламмонийфторида при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. После добавления воды (3 мл) остаток, полученный концентрированием полученной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением 5-[(4-хлорфенил)сульфонил]-5-(2, 5-дифторфенил)-4-метил-1-пентанола (смеси изомеров) (879 мг, выход количественный) в виде бесцветного масла.
Полученный 5-[(4-хлорфенил)сульфонил]-5-(2, 5-дифторфенил)-4-метил-1-пентанол (смесь изомеров) растворяли в толуоле (10 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (1,00 г, 4,14 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. После остывания реакционной смеси остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат=20:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (423 мг, 1,14 ммоль, 51%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 0,85 (1H, д, J=6,8 Гц), 1,50-1,80 (1,67H, м), 1,72 (2H, д, J=7,1 Гц), 1,84-2,50 (3H, м), 2,62-3,05 (2H, м), 3,30-3,45 (0,33H, м), 6,72-6,92 (1,33H, м), 6,92-7,06 (1H, м), 7,12-7,22 (0,67H, м), 7,27-7,40 (4H, м).
ИК (ATR) см-1: 1579, 1493, 1300, 1263, 1190, 1136, 1092, 1080, 1012, 839, 823, 756, 746, 712, 638, 600, 579, 546, 517, 472.
Т.пл.: 105-109°C.
МС m/z: 393 (М++Na).
Элементный анализ. Вычислено для C18H17ClF2O2S: C, 58,30; H, 4,57; Cl, 9, 71; F, 10,15; S, 8,79. Найдено: C, 58,27; H, 4,57; Cl, 9,71; F, 10,15; S, 8,79.
Ссылочный пример 43: (2-бромметилбензилокси)трет-бутилдифенилсилан
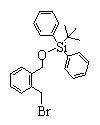
В дихлорметане (50 мл) растворяли [2-[(трет-бутилдифенилсилилокси)метил]фенил]метанол (3,00 г, 7, 97 ммоль) и тетрабромид углерода (3,40 г, 10,3 ммоль). При охлаждении льдом добавляли по каплям раствор в дихлорметане (5 мл) трифенилфосфина (2,70 г, 10,3 ммоль). После перемешивания при комнатной температуре в течение 14 часов реакционную смесь концентрировали при пониженном давлении. Полученный таким образом остаток подвергали хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат=30:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (3,12 г, 7,10 ммоль, 89%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,05 (9H, с), 4,51 (2H, с), 4,88 (2H, с), 7,20-7,51 (10H, м), 7,68 (4H, дд, J=7,6, 1,2 Гц).
ИК (ATR) см-1: 2929, 2856, 1427, 1105, 1068, 822, 739, 698, 607, 501.
Пример 280: Трет-бутил-[[2-[[(4-хлорфенил)сульфонил]метил]бензил]окси]дифенилсилан
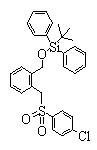
В пропаноле (20 мл) растворяли (2-бромметилбензилокси)-трет-бутилдифенилсилан (3,10 г, 7,05 ммоль) с последующим добавлением 4-хлорбензолсульфината натрия (1,80 г, 9,06 ммоль). При 90оС полученную смесь перемешивали в течение 14 часов. После остывания реакционной смеси к остатку, полученному концентрированием реакционной смеси при пониженном давлении, добавляли этилацетат. Полученную смесь промывали водой и органический слой сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (3,90 г, выход количественный) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,03 (9H, с), 4,43 (2H, с), 4,47 (2H, с), 7,20-7,28 (1H, м), 7,28-7,37 (4H, м), 7,37-7,52 (9H, м), 7,60 (4H, дд, J=7,8, 1,5 Гц).
МС m/z: 535 (М++H).
Пример 281: Трет-бутил-[[2-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]бензил]окси]дифенилсилан
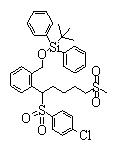
В толуоле (5 мл) растворяли трет-бутил-[[2-[[(4-хлорфенил)сульфонил]метил]бензил]окси]дифенилсилан (350 мг, 0,654 ммоль) и 4-(метилсульфонил)-1-бутанол (200 мг, 1,31 ммоль), полученный в ссылочном примере 3, с последующим добавлением цианометилентри-н-бутилфосфорана (350 мг, 1,45 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. После остывания реакционной смеси добавляли цианометилентри-н-бутилфосфоран (300 мг, 1,24 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. Затем реакционной смеси давали остыть. Остаток, полученный концентрированием смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=3:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения (175 мг, 0,261 ммоль, 40%) в виде бледного желтовато-коричневого масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,05 (9H, с), 1,18-1,30 (1H, м), 1,30-1,44 (1H, м), 1,70-1,84 (2H, м), 2,08-2,24 (1H, м), 2,35-2,48 (1H, м), 2,74-2,85 (2H, м), 2,80 (3H, с), 4,13 (1H, д, J=12,7 Гц), 4,35 (1H, д, J=12,7 Гц), 4,51 (1H, дд, J=10,8, 4,4 Гц), 7,18-7,25 (3H, м), 7,25-7,45 (8H, м), 7,45-7,53 (3H, м), 7,55-7,68 (4H, м).
ИК (ATR) см-1: 2929, 2856, 1583, 1473, 1321, 1147, 1105, 1088, 833, 775, 741, 702, 623, 569, 503.
МС m/z: 669 (М++H), 691 (М+ +Na).
Пример 282: [2-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]фенил]метанол
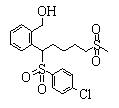
В тетрагидрофуране (5 мл) растворяли трет-бутил-[[2-[1-[(4-хлорфенил)сульфонил]-5-(метилсульфонил)пентил]бензил]окси]дифенилсилан (175 мг, 0,261 ммоль). При охлаждении на льду к полученному раствору добавляли по каплям раствор в тетрагидрофуране (1,0 М, 0,6 мл, 0,6 ммоль) тетрабутиламмонийфторида. Затем полученную смесь перемешивали при комнатной температуре в течение 1 часа. После добавления воды (0,5 мл) остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси дихлорметан:метанол=30:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (87 мг, 0,20 ммоль, 61%) в виде бледного желтовато-коричневого масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,20-1,60 (2H, м), 1,65-1,95 (2H, м), 2,10-2,40 (3H, м), 2,70-3,00 (2H, м), 2,82 (3H, с), 4,43 (2H, д, J=4,9 Гц), 4,81 (1H, дд, J=11,1, 4,0 Гц), 7,15-7,30 (1H, м), 7,30-7,50 (5H, м), 7,56 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3506, 2931, 1579, 1475, 1394, 1277, 1138, 1084, 1012, 964, 829, 798, 756, 712, 629, 563, 519, 463.
МС m/z: 448 (М++NH4), 453 (М++Na).
Пример 283: Трет-бутил-[[6-[2-[(трет-бутилдифенилсилилокси)метил]фенил]-6-[(4-хлорфенил)сульфонил]гексил]окси]диметилсилан
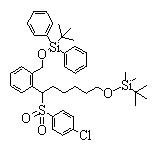
Трет-бутил-[[2-[[(4-хлорфенил)сульфонил]метил]бензил]окси]дифенилсилан (1,00 г, 1,87 ммоль), полученный в примере 280, и 5-(трет-бутилдифенилсилилокси)-1-пентанол (0,68 мл, 2,8 ммоль) растворяли в толуоле (7 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (650 мг, 2,69 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. После остывания реакционной смеси добавляли 5-(трет-бутилдифенилсилилокси)-1-пентанол (0,34 мл, 1,4 ммоль) и цианометилентри-н-бутилфосфоран (300 мг, 1,24 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 10 часов. Затем реакционной смеси давали остыть. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=15:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (932 мг, 1,27 ммоль, 68%) в виде бледного желтовато-коричневого масла.
1H-ЯМР (400 МГц, CDCl3) δ: 0,00 (6H, с), 0,80-1,60 (6H, м), 0,86 (9H, с), 1,04 (9H, с), 2,04-2,20 (1H, м), 2,28-2,40 (1H, м), 3,48 (2H, т, J=6,3 Гц), 4,10 (1H, д, J=12,9 Гц), 4,35-4,48 (2H, м), 7,16-7,23 (2H, м), 7,23-7,55 (12H, м), 7,55-7,70 (4H, м).
ИК (ATR) см-1: 2929, 2856, 1583, 1473, 1321, 1147, 1103, 1088, 1014, 831, 775, 741, 700, 623, 567, 503.
МС m/z: 735 (М++H), 757 (М++Na).
Пример 284: 6-[2-(трет-бутилдифенилсилилокси)метилфенил]-6-[(4-хлорфенил)сульфонил]-1-гексанол
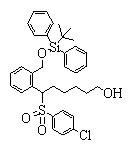
В метаноле (30 мл) растворяли трет-бутил-[[6-[2-[(трет-бутилдифенилсилилокси)метил]фенил]-6-[(4-хлорфенил)сульфонил]гексил]окси]диметилсилан (830 мг, 1,13 ммоль) с последующим добавлением моногидрата п-толуолсульфоновой кислоты (25 мг, 0,13 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли триэтиламин (0,080 мл, 0,57 ммоль), и затем остаток, полученный концентрированием смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси дихлорметан:метанол=100:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (580 мг, 0,934 ммоль, 83%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1, 04 (9H, с), 1,10-1,50 (7H, м), 2,08-2,20 (1H, м), 2,30-2,42 (1H, м), 3,45-3,56 (2H, м), 4,11 (1H, д, J=12,7 Гц), 4,40 (1H, д, J=12,7 Гц), 4,44 (1H, дд, J=11,0, 4,2 Гц), 7,15-7,22 (2H, м), 7,22-7,36 (5H, м), 7,36-7,51 (7H, м), 7,58 (2H, дд, J=8,1, 1,5 Гц), 7,63 (2H, дд, J=8,1, 1,5 Гц).
МС m/z: 621 (М++H), 638 (М++Na).
Пример 285: 6-[(4-хлорфенил)сульфонил]-6-(2-гидроксиметилфенил)-1-гексанол
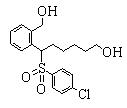
В тетрагидрофуране (5 мл) растворяли 6-[2-(трет-бутилдифенилсилилокси)метилфенил]-6-[(4-хлорфенил)сульфонил]-1-гексанол (200 мг, 0,322 ммоль) с последующим добавлением по каплям раствора в тетрагидрофуране (1,0 М, 0,7 мл, 0,7 ммоль) тетрабутиламмонийфторида при охлаждении на льду. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем добавляли воду (0,2 мл). Остаток, полученный концентрированием полученной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат=30:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (86 мг, 0,23 ммоль, 70%) в виде бесцветного масла.
1H-ЯМР (400 МГц, CDCl3 ) δ: 1,10-1,60 (7H, м), 2,08-2,30 (2H, м), 2,37 (1H, шир.с), 3,45-3,60 (2H, м), 4,44-4,60 (2H, м), 4,78 (1H, дд, J=11,0, 4,2 Гц), 7,28-7,50 (4H, м), 7,43 (2H, д, J=8,8 Гц), 7,60 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 3367, 2935, 2862, 1579, 1475, 1392, 1308, 1277, 1142, 1082, 1012, 756, 631, 565, 461.
МС m/z: 735 (М++H), 757 (М+ +Na).
FAB-МС: 383,1098 (вычислено для C19H24ClO4S: 383,1084).
Пример 286: [2-[1-[(4-хлорфенил)сульфонил]циклогексил]фенил]метанол
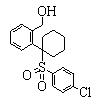
6-[2-(трет-бутилдифенилсилилокси)метилфенил]-6-[(4-хлорфенил)сульфонил]-1-гексанол (447 мг, 0,719 ммоль), полученный в примере 284, растворяли в толуоле (5 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (350 мг, 0,145 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. Затем реакционной смеси давали остыть. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат=15:1, концентрировали при пониженном давлении с получением бесцветного масла (190 мг).
Полученное бесцветное масло растворяли в тетрагидрофуране (5 мл). При охлаждении на льду добавляли по каплям раствор в тетрагидрофуране (1,0 М, 0,6 мл, 0,6 ммоль) тетрабутиламмонийфторида. При комнатной температуре полученную смесь перемешивали в течение 2 часов. Затем к реакционной смеси добавляли воду (1,0 мл). Остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (40 мг, 0,11 ммоль, 15%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,15-1,45 (3H, м), 1,45-1,80 (2H, м), 1,80-1,98 (1H, м), 2, 00-2,25 (2H, м), 2,40-2,60 (1H, м), 3,05-3,25 (2H, м), 4,70-4,90 (1H, м), 5,03-5,20 (1H, м), 6,85 (1H, дм, J=7,6 Гц), 7,09 (1H, тм, J=7,7 Гц), 7,24-7,40 (5H, м), 7,62 (1H, дд, J=7,7, 1,6 Гц).
ИК (ATR) см-1: 3575, 2925, 1574, 1471, 1448, 1389, 1296, 1275, 1136, 1082, 1011, 989, 835, 785, 706, 615, 577, 467.
Т.пл.: 148-150°C (разл.).
МС m/z: 382 (М++NH4).
Элементный анализ. Вычислено для C19H21ClO3S: C, 62,54; H, 5,80; Cl, 9,72; S, 8,79. Найдено: C, 62,54; H, 5,73; Cl, 9,70; S, 8,93.
Пример 287: 4-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]тетрагидропиран
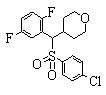
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (200 мг, 0,661 ммоль), полученный в примере 5, и тетрагидро-4Н-пиран-4-ол (0,13 мл, 1, 36 ммоль) растворяли в толуоле (10 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (330 мг, 1,37 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. После остывания реакционной смеси добавляли цианометилентри-н-бутилфосфоран (200 мг, 0,829 ммоль). В атмосфере аргона смесь нагревали при кипячении с обратным холодильником в течение 14 часов. Затем реакционной смеси давали остыть. Остаток, полученный концентрированием смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (157 мг, 0,406 ммоль, 61%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,28-1,48 (2H, м), 1,71 (1H, дд д, J=25,3, 11,7,4,3 Гц), 2,37 (1H, шир.д, J=12,7 Гц), 2,70-2,88 (1H, м), 3,40 (1H, тд, J=11,7, 2,5 Гц), 3,50 (1H, тд, J=12,0, 2,2 Гц), 3,91 (1H, дм, J=11,2 Гц), 4,02 (1H, дм, J=11,7 Гц), 4,46 (1H, д, J=8,8 Гц), 6,68-6,80 (1H, м), 6,88-6,98 (1H, м), 7,31 (2H, д, J=8,5 Гц), 7,36-7,45 (1H, м), 7,49 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 2952, 2833, 1576, 1495, 1308, 1275, 1236, 1144, 1082, 879, 829, 788, 752, 733, 710, 615, 602, 559, 519, 465, 447.
Т.пл.: 150-152°C.
МС m/z: 387 (М++H).
Элементный анализ. Вычислено для C18H17ClF2O3S: C, 55,89; H, 4,43; Cl, 9,16; F, 9,82; S, 8,29. Найдено: C, 55,64; H, 4,27; Cl, 9,41; F, 9,89; S, 8,28.
Ссылочный пример 44: Тетрагидротиопиран-4-ол
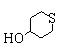
Тетрагидротиопиран-4-он (5,00 г, 43,0 ммоль) растворяли в метаноле (100 мл). При охлаждении на льду добавляли боргидрид натрия (1,6 г, 42,3 ммоль), и полученную смесь перемешивали при комнатной температуре в течение 14 часов. К остатку, полученному концентрированием реакционной смеси при пониженном давлении, добавляли воду (50 мл). Полученную смесь делали слабокислой с использованием 1 н. хлористо-водородной кислоты и затем экстрагировали диэтиловым эфиром. Экстракт промывали последовательно 1 н. хлористо-водородной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (4,40 г, 37,2 ммоль, 87%) в виде бледного желтовато-коричневого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,47 (1H, шир.с), 1,64-1,80 (2H, м), 2,10-2,24 (2H, м), 2,55-2,70 (2H, м), 2,73-2,88 (2H, м), 3,60-3,75 (1H, м).
МС m/z: 119 (М++H).
Пример 288: 4-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]тетрагидротиопиран
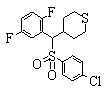
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (500 мг, 1,65 ммоль), полученный в примере 5, и тетрагидротиопиран-4-ол (400 мг, 3,38 ммоль) растворяли в толуоле (20 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (800 мг, 3,31 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. После остывания реакционной смеси добавляли цианометилентри-н-бутилфосфоран (400 мг, 1,66 ммоль). В атмосфере аргона смесь нагревали при кипячении с обратным холодильником в течение 14 часов. Затем реакционной смеси давали остыть. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=15:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали смесью гексан-диизопропиловый эфир с получением указанного в заголовке соединения (404 мг, 1,0 ммоль, 61%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,47 (1H, ддд, J=23,4, 10,0, 3,3 Гц), 1,68 (1H, ддд, J=25,0, 11,4, 3,3 Гц), 2,13 (1H, дм, J=11,4 Гц), 2,50-2,78 (5H, м), 2,82 (1H, тд, J=12,8, 2,6 Гц), 4,47 (1H, д, J=7,3 Гц), 6,72-6,82 (1H, м), 6,90-7,00 (1H, м), 7,31 (2H, д, J=8,8 Гц), 7,40-7,60 (1H, м), 7,49 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 2939, 2887, 1576, 1493, 1425, 1317, 1281, 1240, 1142, 1084, 1012, 866, 831, 781, 750, 731, 710, 631, 615, 548, 467.
Т.пл.: 150-152°C.
МС m/z: 403 (М++H).
Элементный анализ. Вычислено для C18H17ClF2O2S2: C, 53,66; H, 4,25; Cl, 8,80; F, 9,43; S, 15,92. Найдено: C, 53,52; H, 4,21; Cl, 9,00; F, 9,54; S, 15,88.
Пример 289: 4-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]тетрагидротиопиран-1,1-диоксид (соединение А) и 4-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]тетрагидротиопиран-1-оксид (соединение В (изомер А) и соединение В (изомер В))
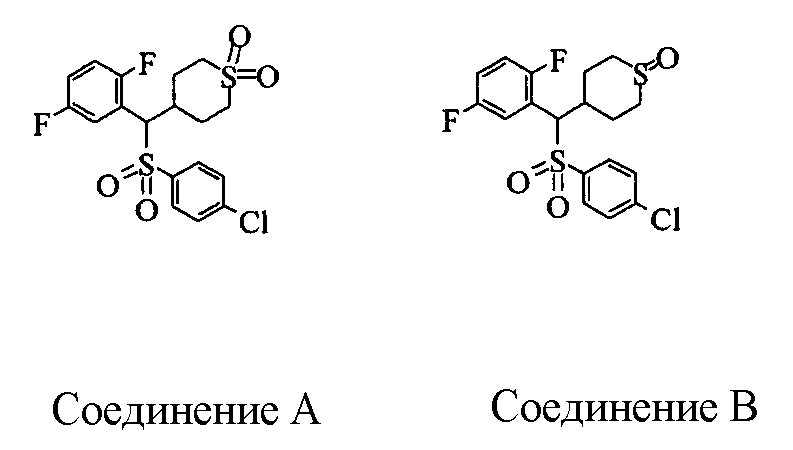
В дихлорметане (15 мл) растворяли 4-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]тетрагидротиопиран (360 мг, 0,893 ммоль). При охлаждении на льду к раствору добавляли 3-хлорпербензойную кислоту. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество растворяли в дихлорметане. Полученный раствор промывали последовательно 1 н. водным раствором гидроксида натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения А (187 мг, 0,430 ммоль, 48%) в виде белого порошка. Фракцию, полученную из элюата с использованием дихлорметан:метанол=50:1, концентрировали при пониженном давлении с получением смеси указанного в заголовке соединения В (изомера А) и указанного в заголовке соединения В (изомера В) в виде белого твердого вещества. Полученную смесь отделяли и очищали флэш-хроматографией на силикагеле (дихлорметан:метанол=80:1). Белые твердые вещества промывали (каждое) диэтиловым эфиром с получением указанного в заголовке соединения В (изомера А) (низкой полярности) (78 мг, 0,19 ммоль, 21%) и указанного в заголовке соединения В (изомера В) (высокой полярности) (69 мг, 0,17 ммоль, 19%) в виде белого порошка.
Соединение А
1H-ЯМР (400 МГц, CDCl3) δ: 1,85-2,00 (1H, м), 2,18-2,35 (2H, м), 2,68-2,91 (2H, м), 2,98-3,10 (2H, м), 3,10-3,28 (2H, м), 4,54 (1H, шир.д, J=7,1 Гц), 6,74-6,90 (1H, м), 6,94-7,06 (1H, м), 7,33 (2H, д, J=8,7 Гц), 7,35-7,55 (1H, м), 7,49 (2H, д, J=8,7 Гц).
ИК (ATR) см-1: 1576, 1493, 1290, 1146, 1120, 1080, 874, 829, 752, 735, 710, 631, 623, 592, 552, 530, 498, 471, 424.
Т.пл.: 245-248°C.
МС m/z: 435 (М++H).
Элементный анализ. Вычислено для C18H17ClF2O4S2: C, 49,71; H, 3,94; Cl, 8,15; F, 8, 74; S, 14,75. Найдено: C, 49,38; H, 3,87; Cl, 8,50; F, 8,86; S, 14,62.
Соединение В (изомер А)
1H-ЯМР (400 МГц, CDCl3) δ: 1,76 (1H, шир.д, J=13,4 Гц), 2,18 (1H, ддм, J=25,4,12,5 Гц), 2,32-2,70 (4H, м), 2,74-2,90 (1H, м), 2,98 (1H, дм, J=14,0 Гц), 3,09 (1H, дм, J=14,4 Гц), 4,53 (1H, д, J=7,3 Гц), 6,72-6,86 (1H, м), 6,90-7,02 (1H, м), 7, 32 (2H, д, J=8,5 Гц), 7,40-7,60 (1H, м), 7,49 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 1585, 1495, 1315, 1300, 1242, 1220, 1147, 1086, 1049, 997, 874, 831, 752, 733, 625, 596, 553, 525, 482.
Т.пл.: 255-256°C.
МС m/z: 419 (М++H).
Элементный анализ. Вычислено для C18H17ClF2O3S2: C, 51,61; H, 4,09; Cl, 8,46; F, 9,07; S, 15,31. Найдено: C, 51,51; H, 4,04; Cl, 8,69; F, 9,15; S, 15,20.
Соединение В (изомер В)
1 H-ЯМР (400 МГц, CDCl3) δ: 1,42 (1H, ддм, J=22,3,11,7 Гц), 1,92 (1H, ддм, J=11,7, 11,0 Гц), 2,14-2,27 (1H, м), 2,66 (1H, тд, J=12,2, 2,7 Гц), 2,70-2,90 (3H, м), 3,10-3,24 (1H, м), 3, 32-3,44 (1H, м), 4,49 (1H, д, J=8,1 Гц), 6,72-6,85 (1H, м), 6,90-7,02 (1H, м), 7,32 (2H, д, J=8,5 Гц), 7,34-7,50 (1H, м), 7,48 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 2912, 1574, 1496, 1298, 1246, 1144, 1080, 1001, 800, 752, 735, 714, 619, 561, 552, 517, 469.
Т.пл.: 184-187°C.
МС m/z: 419 (М++H).
Элементный анализ. Вычислено для C18H17ClF2O3S2: C, 51,61; H, 4,09; Cl, 8,46; F, 9,07; S, 15,31. Найдено: C, 51,82; H, 4,23; Cl, 8,42; F, 9,12; S, 15,07.
Пример 290: Трет-бутил-4-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]-1-пиперидинкарбоксилат
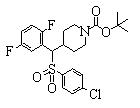
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (1,25 г, 4,13 ммоль), полученный в примере 5, и трет-бутил-4-гидрокси-1-пиперидинкарбоксилат (1,70 г, 8, 44 ммоль) растворяли в толуоле (50 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (2,00 мг, 8,21 ммоль). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. Реакционной смеси давали остыть. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (1,68 г, 3,46 ммоль, 84%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,10-1,25 (1H, м), 1,40-1,70 (2H, м), 1,44 (9H, с), 2,30-2,50 (1H, м), 2,60-2,95 (3H, м), 4,00-4,25 (2H, м), 4,45 (1H, д, J=7,8 Гц), 6,69-6,80 (1H, м), 6,88-6,98 (1H, м), 7,31 (2H, д, J=8,6 Гц), 7,35-7,50 (1H, м), 7,49 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2979, 2935, 1682, 1583, 1493, 1421, 1319, 1281, 1240, 1165, 1122, 1078, 881, 835, 793, 752, 634, 534, 472.
Т.пл.: 193-196°C.
МС m/z: 486 (М++H), 508 (М++Na).
Элементный анализ. Вычислено для C23H26ClF2NO4S: C, 56,84; H, 5,39; Cl, 7,30; F, 7,82; N, 2,88; S, 6,60. Найдено: C, 56,41; H, 5,43; Cl, 7,77; F, 7,61; N, 2,99; S, 6,58.
Пример 291: Гидрохлорид 4-[(4-хлорфенил)сульфонил](2, 5-дифторфенил)метил]пиперидина
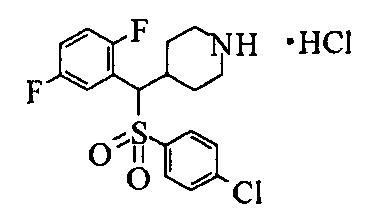
В дихлорметане (50 мл) растворяли трет-бутил-4-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]-1-пиперидинкарбоксилат (1,56 г, 3,21 ммоль). При охлаждении на льду к полученному раствору добавляли по каплям трифторуксусную кислоту. После перемешивания при комнатной температуре в течение 2 часов реакционную смесь концентрировали при пониженном давлении. Добавляли дихлорметан (10 мл) и 1 н. раствор в этаноле (10 мл) хлористо-водородной кислоты с последующим концентрированием при пониженном давлении с получением белого твердого вещества. Полученное твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (1,36 г, 3,12 ммоль, 97%) в виде белого порошка.
1H-ЯМР (400 МГц, CD3OD) δ: 1,38-1,52 (1H, м), 1,70-1,92 (2H, м), 2,73 (1H, шир.д, J=14,2 Гц), 2,86-3,00 (1H, м), 3,05 (1H, тд, J=12,9, 3,1 Гц), 3,13 (1H, тд, J=13,1, 3,1 Гц), 3,30-3,40 (1H, м), 3,48 (1H, дм, J=13,0 Гц), 4,72 (1H, д, J=8,6 Гц), 6,82-6,98 (1H, м), 7,04-7, 12 (1H, м), 7,40-7,55 (1H, м), 7,44 (2H, д, J=8,6 Гц), 7,57 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2950, 2719, 1583, 1491, 1317, 1146, 1084, 831, 752, 617, 596, 552, 470.
Т.пл.: 184-190°C.
МС m/z: 386 (М++H).
Элементный анализ. Вычислено для C18H18ClF2NO2S· HCl·0,75H2O: C, 49,61; H, 4,74; Cl, 16,27; F, 8,72; N, 3,21; S, 7,36. Найдено: C, 49,57; H, 4,75; Cl, 15,79; F, 9,16; N, 3,34; S, 7,25.
Пример 292: 2-[1-[(4-хлорфенил)сульфонил]-2-метилпентил]-1,4-дифторбензол (изомер 292-А и изомер 292-В)
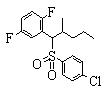
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (200 мг, 0,661 ммоль), полученный в примере 5, и 2-пентанол (0,144 мл, 1,33 ммоль) растворяли в толуоле (3 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (0,320 мл). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. Затем реакционной смеси давали остыть. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, отделяли и очищали флэш-хроматографией на силикагеле (гексан:этилацетат=50:1) с получением указанного в заголовке изомера 292-А (низкой полярности) (67 мг, 0,18 ммоль, 27%) в виде белого порошка и указанного в заголовке изомера 292-В (высокой полярности) (45 мг, 0,12 ммоль, 19%) в виде белого твердого вещества.
Изомер 292-А
1H-ЯМР (400 МГц, CDCl3) δ: 0,91 (3H, т, J=7,1 Гц), 1,08 (3H, д, J=6,9 Гц), 1,20-1,52 (3H, м), 1,52-1,68 (1H, м), 2, 72-2,90 (1H, м), 4,51 (1H, д, J=5,9 Гц), 6,73-6,85 (1H, м), 6,88-6,99 (1H, м), 7,32 (2H, д, J=8,6 Гц), 7,46-7,60 (1H, м), 7,52 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2970, 2866, 1583, 1496, 1475, 1394, 1303, 1277, 1234, 1176, 1140, 1078, 1014, 883, 831, 790, 752, 727, 708, 621, 598, 561, 534, 472.
Т.пл.: 85-87°C.
МС m/z: 373 (М++H), 395 (М++Na).
Элементный анализ. Вычислено для C18H19ClF2O2S: C, 57,89; H, 5,14; Cl, 9,51; F, 10,19; S, 8,61. Найдено: C, 57,96; H, 5,14; Cl, 9,44; F, 10,19; S, 8,75.
Изомер 292В
1H-ЯМР (400 МГц, CDCl3) δ: 0,81 (3H, т, J=7,2 Гц), 1,00-1,12 (1H, м), 1,15-1,45 (3H, м), 1,34 (3H, д, J=6,6 Гц), 2,60-2,72 (1H, м), 4,43 (1H, д, J=8,8 Гц), 6,67-6,78 (1H, м), 6,88-6,95 (1H, м), 7,29 (2H, д, J=8,6 Гц), 7,36-7,45 (1H, м), 7,48 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2976, 2933, 1585, 1495, 1394, 1323, 1238, 1178, 1149, 1086, 1014, 868, 829, 783, 754, 729, 710, 625, 559, 528, 472.
Т.пл.: 47-50°C.
МС m/z: 373 (М++H), 395 (М++Na).
Элементный анализ. Вычислено для C18H19ClF2O2S: C, 57,89; H, 5,14; Cl, 9, 51; F, 10,19; S, 8,61. Найдено: C, 57,97; H, 5,11; Cl, 9,45; F, 10,21; S, 8,69.
Пример 293: 2-[1-[(4-хлорфенил)сульфонил]-2-этилпентил]-1,4-дифторбензол (изомер 293-А и смесь изомеров)
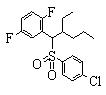
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (200 мг, 0,661 ммоль), полученный в примере 5, и 3-гексанол (0,150 мл, 1,35 ммоль) растворяли в толуоле (3 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (0,320 мл). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. Затем реакционной смеси давали остыть. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, отделяли и очищали флэш-хроматографией на силикагеле (гексан:этилацетат=200:1) с получением указанного в заголовке изомера 293-А (низкой полярности) (37 мг, 0,096 ммоль, 15%) и указанной в заголовке смеси изомеров (44 мг, 0,11 ммоль, 17%) в виде белого порошка.
Изомер 293-А
1H-ЯМР (400 МГц, CDCl3) δ: 0,84 (3H, т, J=7,5 Гц), 0,95 (3H, т, J=7,3 Гц), 1,00-1,16 (1H, м), 1,30-1,50 (2H, м), 1,55-1,90 (3H, м), 2,50-2,63 (1H, м), 4,59 (1H, д, J=7,6 Гц), 6,69-6,80 (1H, м), 6,88-6,95 (1H, м), 7,31 (2H, д, J=8,4 Гц), 7,40-7,50 (1H, м), 7,50 (2H, д, J=8,4 Гц).
ИК (ATR) см-1: 2966, 1583, 1496, 1475, 1306, 1277, 1242, 1176, 1140, 1086, 881, 831, 802, 752, 725, 710, 621, 561, 538, 478, 462, 451.
Т.пл.: 85-89°C.
МС m/z: 387 (М++H), 409 (М++Na).
Элементный анализ. Вычислено для C19H21ClF2O2 S: C, 58,98; H, 5,47; Cl, 9,16; F, 9,82; S, 8,29. Найдено: C, 59,18; H, 5,65; Cl, 9,16; F, 9,83; S, 8,38.
Смесь изомеров
1H-ЯМР (400 МГц, CDCl3) δ: 0,84 (3H, т, J=7,5 Гц), 0,90-1,00 (3H, м), 1,00-1,16 (1H, м), 1,20-1,50 (2H, м), 1,55-1,90 (3H, м), 2,50-2,63 (1H, м), 4,55-4,65 (1H, м), 6,69-6,80 (1H, м), 6,88-6,95 (1H, м), 7,31 (2H, д, J=8,4 Гц), 7,40-7,50 (1H, м), 7,50 (2H, д, J=8,4 Гц).
ИК (ATR) см-1: 2956, 1583, 1572, 1495, 1479, 1319, 1298, 1279, 1230, 1142, 1090, 1016, 887, 812, 752, 715, 660, 615, 563, 534, 469.
Т.пл.: 95-99°C.
МС m/z: 387 (М++H), 409 (М++Na).
Элементный анализ. Вычислено для C19H21ClF2O2S: C, 58,98; H, 5,47; Cl, 9,16; F, 9,82; S, 8,29. Найдено: C, 58,99; H, 5,37; Cl, 9,19; F, 9,88; S, 8,43.
Пример 294: 2-[2-[(4-хлорфенил)сульфонил]-2-(2,5-дифторфенил)этил]тетрагидрофуран (изомер 294-А и изомер 294-В)
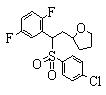
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (200 мг, 0,661 ммоль), полученный в примере 5, и тетрагидрофурфуриловый спирт (0,13 мл, 1,34 ммоль) растворяли в толуоле (3 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (0,320 мл). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. Затем реакционной смеси давали остыть. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, отделяли и очищали флэш-хроматографией на силикагеле (с использованием смешанного растворителя гексан:этилацетат) с получением белого твердого вещества. Белое твердое вещество промывали гексаном с получением указанного в заголовке изомера 294-А (низкой полярности) (102 мг, 0,264 ммоль, 40%) и указанного в заголовке изомера 294-В (высокой полярности) (39 мг, 0,10 ммоль, 15%), каждый в виде белого порошка.
Изомер 294-А
1H-ЯМР (400 МГц, CDCl3) δ: 1,50-1,65 (1H, м), 1,75-2,05 (3H, м), 2,26 (1H, тм, J=12,9 Гц), 2,48 (1H, тм, J=10,4 Гц), 3,50-3,60 (1H, м), 3,60-3,70 (1H, м), 3,76-3,88 (1H, м), 4,86 (1H, дм, J=12,2 Гц), 6,78-6, 90 (1H, м), 6,92-7,01 (1H, м), 7,20-7,30 (1H, м), 7,38 (2H, д, J=8,6 Гц), 7,54 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2960, 2852, 1576, 1493, 1309, 1281, 1194, 1132, 1084, 1065, 1012, 903, 831, 810, 775, 746, 727, 708, 596, 575, 536, 471, 436.
Т.пл.: 99-105°C.
МС m/z: 387 (М++H).
Элементный анализ. Вычислено для C18H17ClF2O3S: C, 55,89; H, 4,43; Cl, 9,16; F, 9,82; S, 8,29. Найдено: C, 56,28; H, 4,80; Cl, 8,94; F, 9,63; S, 8,19.
Изомер 294-В
1H-ЯМР (400 МГц, CDCl3) δ: 1,42-1,58 (1H, м), 1,76-1,04 (3H, м), 2,22-2,33 (1H, м), 2,58-2,70 (1H, м), 3,60-3,70 (1H, м), 3,70-3,80 (1H, м), 3,88-3,99 (1H, м), 4,64-4,73 (1H, м), 6,75-6,88 (1H, м), 6,92-7,01 (1H, м), 7,20-7,30 (1H, м), 7,38 (2H, д, J=8,7 Гц), 7,52 (2H, д, J=8,7 Гц).
ИК (ATR) см-1: 2976, 1585, 1496, 1311, 1277, 1221, 1153, 1088, 1061, 922, 879, 829, 779, 752, 712, 629, 607, 561, 532, 472.
Т.пл.: 98-105°C.
МС m/z: 387 (М++H).
Элементный анализ. Вычислено для C18H17ClF2O3S: C, 55,89; H, 4,43; Cl, 9,16; F, 9,82; S, 8,29. Найдено: C, 55,88; H, 4,54; Cl, 9,22; F, 9,96; S, 8,42.
Пример 295: 2-[2-[(4-хлорфенил)сульфонил]-2-(2,5-дифторфенил)этил]тиофен
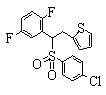
2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (100 мг, 0,330 ммоль), полученный в примере 5, и 2-тиофенметанол (0,065 мл, 0,69 ммоль) растворяли в толуоле (3 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (1,160 мл). В атмосфере аргона полученную смесь нагревали при кипячении с обратным холодильником в течение 14 часов. Затем реакционной смеси давали остыть. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, отделяли и очищали флэш-хроматографией на силикагеле (с использованием смеси растворителей гексан:этилацетат) с получением белого твердого вещества. Полученное белое твердое вещество промывали гексаном с получением указанного в заголовке соединения (92 мг, 0,23 ммоль, 70%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 3,60 (1H, дд, J=15,1, 11,9 Гц), 4,02 (1H, дм, J=15,1 Гц), 4,80 (1H, дд, J=11,9, 2,5 Гц), 6,69 (1H, дд, J=3,5, 1,1 Гц), 6,70-6,84 (2H, м), 6,92-7, 00 (1H, м), 7,04 (1H, дд, J=5,3, 1,1 Гц), 7,32-7,44 (1H, м), 7,39 (2H, д, J=8,8 Гц), 7,57 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 1496, 1319, 1244, 1219, 1149, 1084, 1014, 881, 825, 775, 758, 694, 629, 532, 467.
Т.пл.: 127-130°C.
МС m/z: 399 (М++H).
Элементный анализ. Вычислено для C18H13ClF2O2S2: C, 54,20; H, 3,29; Cl, 8,89; F, 9,53; S, 16,08. Найдено: C, 54,19; H, 3,31; Cl, 9,20; F, 9,51; S, 16,24.
Пример 296: 2-[2-[(4-хлорфенил)сульфонил]-2-(2,5-дифторфенил)этил]фуран
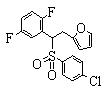
Подобно методике примера 295, за исключением использования 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (100 мг, 0,330 ммоль), полученного в примере 5, и фурфурилового спирта (0,060 мл, 0,69 ммоль) указанное в заголовке соединение (26 мг, 0,068 ммоль, 21%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 3,43 (1H, дд, J=15,4, 11,6 Гц), 3,78 (1H, дд, J=15,4, 3,7 Гц), 4,93 (1H, дд, J=11,6, 3,7 Гц), 5,89-5,91 (1H, м), 6,14 (1H, дд, J=3,2, 1,7 Гц), 6,73-6,82 (1H, м), 6,90-6,99 (1H, м), 7,19 (1H, дд, J=1,7, 0,7 Гц), 7,25-7,34 (1H, м), 7,40 (2H, д, J=8, 8 Гц), 7,58 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 1585, 1495, 1319, 1151, 1086, 1014, 926, 831, 762, 613, 594, 573, 552, 532, 472.
Т.пл.: 90-93°C.
МС m/z: 383 (М++H).
Элементный анализ. Вычислено для C18H13ClF2O3S: C, 56,48; H, 3,42; Cl, 9,26; F, 9,93; S, 8,38. Найдено: C, 56,53; H, 3,39; Cl, 9,17; F, 9,92; S, 8,55.
Пример 297: 1-[3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил]-1Н-пиррол
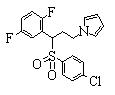
Подобно методике примера 295, за исключением использования 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (100 мг, 0,330 ммоль), полученного в примере 5, и 1-(2-гидроксиэтил)пиррола (0,070 мл, 0,67 ммоль) указанное в заголовке соединение (46 мг, 0,12 ммоль, 35%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,42-2,57 (1H, м), 2,88-3,00 (1H, м), 3,79 (1H, дд д, J=14,3, 8,5, 5,9 Гц), 4,06 (1H, дтм, J=14,3, 7,1 Гц), 4,34 (1H, дд, J=10,0, 3,9 Гц), 6,11 (2H, т, J=2,2 Гц), 6,49 (2H, т, J=2,2 Гц), 6,80-6,88 (1H, м), 6,98-7,06 (1H, м), 7,18-7,24 (1H, м), 7,36 (2H, д, J=8,8 Гц), 7,47 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 1576, 1493, 1325, 1306, 1271, 1236, 1176, 1146, 1082, 877, 827, 764, 737, 714, 677, 621, 588, 553, 519, 463, 428.
Т.пл.: 108-113°C.
МС m/z: 396 (М++H).
Элементный анализ. Вычислено для C19H16ClF2NO2S: C, 57,65; H, 4,07; Cl, 8,96; F, 9,60; N, 3,54; S, 8,10. Найдено: C, 57,82; H, 4,05; Cl, 9,05; F, 9,69; N, 3,69; S, 8,23.
Пример 298: 4-[3-[(4-хлорфенил)сульфонил]-3-(2,5-дифторфенил)пропил]морфолин
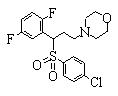
Подобно методике примера 295, за исключением использования 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (100 мг, 0,330 ммоль), полученного в примере 5, и 4-(2-гидроксиэтил)морфолина (0,080 мл, 0,66 ммоль) указанное в заголовке соединение (89 мг, 0,21 ммоль, 65%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,08-2,28 (4H, м), 2,30-2,48 (3H, м), 2,62-2,77 (1H, м), 3,61 (4H, т, J=4,6 Гц), 4,80 (1H, дм, J=9,8 Гц), 6,78-6,87 (1H, м), 6,94-7,03 (1H, м), 7,21-7,30 (1H, м), 7,39 (2H, д, J=8,7 Гц), 7,54 (2H, д, J=8,7 Гц).
ИК (ATR) см-1: 2827, 2792, 1585, 1495, 1477, 1313, 1279, 1238, 1151, 1117, 1084, 1014, 868, 839, 752, 636, 559, 536, 468.
Т.пл.: 149-151°C.
МС m/z: 416 (М++H).
FAB-МС: 416,0903 (вычислено для C19H21ClF2O3S: 416, 0899).
Пример 299: 2-[1-[(4-хлорфенил)сульфонил]-2-фенилпропил]-1,4-дифторбензол (изомер 299-А и изомер 299-В)
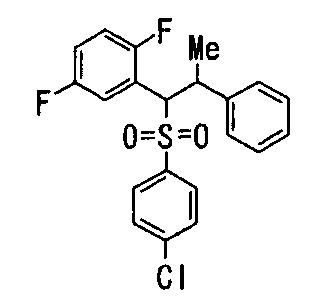
В атмосфере аргона 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензол (100 мг, 0,330 ммоль), полученный в примере 5, и DL-1-фенилэтиловый спирт (79,9 мкл, 0,661 ммоль) растворяли в толуоле (3 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (159 мкл, 0,661 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 13 часов в атмосфере аргона. Затем реакционную смесь концентрировали. Полученный таким образом остаток отделяли и очищали флэш-хроматографией на колонке с силикагелем (гексан:этилацетат=85:15). Каждое из полученных таким образом твердых веществ промывали гексаном с получением указанного в заголовке изомера 299-А (соединения низкой полярности) (53 мг, 0, 130 ммоль, 40%) в виде белого порошка и указанного в заголовке изомера 299-В (соединения высокой полярности) (20 мг, 0,0492 ммоль, 15%) в виде бесцветных столбчатых кристаллов.
Изомер 299-А
1H-ЯМР (400 МГц, CDCl3) δ: 1,80 (3H, д, J=6,6 Гц), 3,83-3,94 (1H, м), 4,81-4,92 (1H, м), 6,40-6,51 (1H, м), 6,63-6,72 (1H, м), 7,02-7,26 (6H, м), 7, 28 (2H, д, J=8,6 Гц), 7,50 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3087, 2931, 1575, 1492, 1452, 1427, 1394, 1315, 1282, 1243, 1195, 1174, 1137, 1089, 1012.
Т.пл.: 160-161°C.
МС m/z: 407 (М++H).
Элементный анализ. Вычислено для C21H17ClF2O2S: C, 61,99; H, 4,21; Cl, 8,71; F, 9,34; S, 7,88. Найдено: C, 61,77; H, 4,23; Cl, 8,83; F, 9,24; S, 7,98.
Изомер 299-В
1H-ЯМР (400 МГц, CDCl3) δ: 1,25 (3H, д, J=7,1 Гц), 3,87 (1H, кв, J=7,3 Гц), 4,89 (1H, д, J=8,1 Гц), 6,89 (1H, тд, J=8,9, 4,6 Гц), 6,99-7,05 (1H, м), 7,11-7,23 (6H, м), 7,20 (2H, д, J=8,8 Гц), 7,36 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 3062, 2929, 1583, 1496, 1475, 1454, 1394, 1321, 1276, 1243, 1176, 1143, 1085, 1012.
Т.пл.: 145-146°C.
МС m/z: 407 (М++H).
FAB-МС: 407,0690 (вычислено для C21H18ClF2O2S: 407,0684).
Пример 300: 2-[1-(4-хлорфенилсульфонил)-2-метил-3-фенилпропил]-1, 4-дифторбензол (изомер 300-А и изомер 300-В)
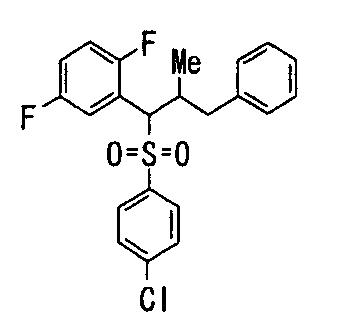
Подобно методике примера 299, за исключением использования 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (200 мг, 0,660 ммоль), полученного в примере 5, DL-1-фенил-2-пропанола (182 мкл, 1,32 ммоль) и цианометилентри-н-бутилфосфорана (318 мкл, 1,32 ммоль) получали указанный в заголовке изомер 300-А (соединение низкой полярности) (32 мг, 0,0760 ммоль, 12%) и указанный в заголовке изомер 300-В (соединение высокой полярности) (25 мг, 0,0594 ммоль, 9%), каждый в виде белого порошка.
Изомер 300-А
1H-ЯМР (400 МГц, CDCl3) δ: 1,01 (3H, д, J=6,9 Гц), 2,46 (1H, дд, J=13,3, 8,6 Гц), 2,10-3,13 (2H, м), 4,56 (1H, дд, J=8,9, 4,6 Гц), 6,82 (1H, тд, J=8,9, 4,6 Гц), 6,94-6,99 (1H, м), 7,14-7,28 (6H, м), 7,32 (2H, д, J=8,6 Гц), 7,50 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3079, 2977, 1583, 1492, 1452, 1423, 1394, 1321, 1278, 1232, 1172, 1147, 1085, 1012.
Т.пл.: 81-83°C.
МС m/z: 421 (М++H).
Элементный анализ. Вычислено для C22H19ClF2O2S: C, 62,78; H, 4,55; Cl, 8,42; F, 9,03; S, 7,62. Найдено: C, 62, 72; H, 4,59; Cl, 8,53; F, 9,21; S, 7,82.
Изомер 300-В
1H-ЯМР (400 МГц, CDCl3) δ: 1,24 (3H, д, J=6,6 Гц), 2,22 (1H, дд, J=13,1, 10,4 Гц), 2,90-2,98 (2H, м), 4,51 (1H, д, J=7,8 Гц), 6,77 (1H, тд, J=9,1, 4,4 Гц), 6,92-6,97 (1H, м), 7,06-7,28 (6H, м), 7,32 (2H, д, J=8,6 Гц), 7,52 (2H, д, J=8,6 Гц).
ИК (ATR) см-1 : 2962, 1585, 1492, 1454, 1425, 1384, 1309, 1278, 1240, 1143, 1093.
Т.пл.: 116-117°C.
МС m/z: 421 (М++H).
Элементный анализ. Вычислено для C22H19ClF2O2S: C, 62,78; H, 4,55; Cl, 8,42; F, 9,03; S, 7,62. Найдено: C, 62,74; H, 4,70; Cl, 8,55; F, 9,23; S, 7,77.
Пример 301: 2-[1-(4-хлорфенилсульфонил)-3-фенилбутил]-1,4-дифторбензол (изомер 301-А и изомер 301-В)
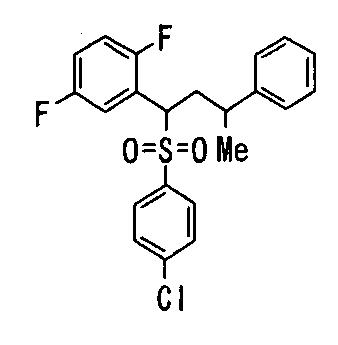
Подобно методике примера 299, за исключением использования 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (200 мг, 0,660 ммоль), полученного в примере 5, DL-2-фенил-1-пропанола (180 мкл, 1,32 ммоль) и цианометилентри-н-бутилфосфорана (318 мкл, 1,32 ммоль) получали указанный в заголовке изомер 301-А (соединение низкой полярности) (51 мг, 0,121 ммоль, 18%) и указанный в заголовке изомер 301-В (соединение высокой полярности) (84 мг, 0,200 ммоль, 30%) в виде белого порошка.
Изомер 301-А
1H-ЯМР (400 МГц, CDCl3) δ: 1,24 (3H, д, J=6,4 Гц), 2,31-2,40 (1H, м), 2,62-2,73 (2H, м), 4,59-4,67 (1H, м), 6,74 (1H, тд, J=9,1,4,5 Гц), 6,89-6,95 (1H, м), 7,06-7,25 (6H, м), 7,35 (2H, д, J=8,6 Гц), 7,48 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3085, 2964, 1581, 1490, 1427, 1394, 1309, 1276, 1228, 1174, 1143, 1083, 1010.
Т.пл.: 89-90°C.
МС m/z: 421 (М++H).
Элементный анализ. Вычислено для C22H19ClF2O2S: C, 62,78; H, 4,55; Cl, 8,42; F, 9,03; S, 7,62. Найдено: C, 62,56; H, 4, 59; Cl, 8,53; F, 9,28; S, 7,80.
Изомер 301-В
1H-ЯМР (400 МГц, CDCl3) δ: 1,28 (3H, д, J=6,6 Гц), 2,37-2,64 (3H, м), 4,13 (1H, д, J=12,0 Гц), 6,81 (1H, тд, J=8,9, 4,4 Гц), 6,91 (2H, д, J=6,6 Гц), 6,97-7,03 (1H, м), 7,19-7,27 (4H, м), 7,32 (2H, д, J=8,6 Гц), 7,41 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3070, 2960, 1583, 1490, 1455, 1427, 1392, 1319, 1309, 1276, 1224, 1143, 1087, 1012.
Т.пл.: 127-129°C.
МС m/z: 421 (М++H).
Элементный анализ. Вычислено для C22H19ClF2O2S: C, 62,78; H, 4,55; Cl, 8,42; F, 9,03; S, 7,62. Найдено: C, 62,52; H, 4,53; Cl, 8,51; F, 9,31; S, 7,81.
Пример 302: 2-[1-(4-хлорфенилсульфонил)-2-метил-4-фенилбутил]-1,4-дифторбензол (изомер 302-А и изомер 302-В)
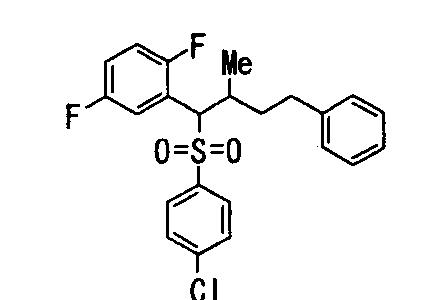
Подобно методике примера 299, за исключением использования DL-4-фенил-2-бутанола (101 мкл, 0,661 ммоль), получали указанный в заголовке изомер 302-А (соединение низкой полярности) (30 мг, 0,0690 ммоль, 21%) и указанный в заголовке изомер 302-В (соединение высокой полярности) (33 мг, 0,0759 ммоль, 23%), каждый в виде белого порошка.
Изомер 302-А
1H-ЯМР (400 МГц, CDCl3) δ: 1,21 (3H, д, J=7,1 Гц), 1,38-1,58 (2H, м), 1,99-2,09 (1H, м), 2,24-2,33 (1H, м), 2,61-2,71 (1H, м), 4, 41 (1H, дд, J=11,5, 3,0 Гц), 6,83 (1H, тд, J=9,1, 4,5 Гц), 6,94-7,00 (1H, м), 7,03-7,28 (6H, м), 7,35 (2H, д, J=8,8 Гц), 7,47 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 2933, 2867, 1583, 1494, 1475, 1461, 1427, 1394, 1344, 1315, 1278, 1228, 1141, 1085, 1012.
Т.пл.: 133-135°C.
МС m/z: 435 (М++H).
FAB-МС: 435, 1101 (вычислено для C23H22ClF2O2S: 435,0997).
Элементный анализ. Вычислено для C23H21ClF2O2S: C, 63,52; H, 4,87; Cl, 8,15; F, 8,74; S, 7,37. Найдено: C, 63,98; H, 4,88; Cl, 8,14; F, 8,82; S, 7,58.
Изомер 302-В
1H-ЯМР (400 МГц, CDCl3) δ: 1,19 (3H, д, J=6,8 Гц), 1,38-1,59 (2H, м), 1,83-1,93 (1H, м), 2,26-2,35 (1H, м), 2,61-2,68 (1H, м), 4,47 (1H, дд, J=11,2, 3,2 Гц), 6,84 (1H, тд, J=8,9, 4,6 Гц), 6,95-7,28 (7H, м), 7,35 (2H, д, J=8,5 Гц), 7,48 (2H, д, J=8,5 Гц).
ИК (ATR) см-1: 3082, 2965, 2931, 2869, 1583, 1494, 1475, 1425, 1394, 1315, 1278, 1224, 1182, 1151, 1081, 1012.
Т.пл.: 112-114°C.
МС m/z: 435 (М++H).
Элементный анализ. Вычислено для C23H21ClF2O2S: C, 63,52; H, 4,87; Cl, 8, 15; F, 8,74; S, 7,37. Найдено: C, 63,34; H, 4,85; Cl, 8,41; F, 8,75; S, 7,53.
Пример 303: 2-[1-(4-хлорфенилсульфонил)-4-фенилпентил]-1,4-дифторбензол (изомер 303-А и изомер 303-В)
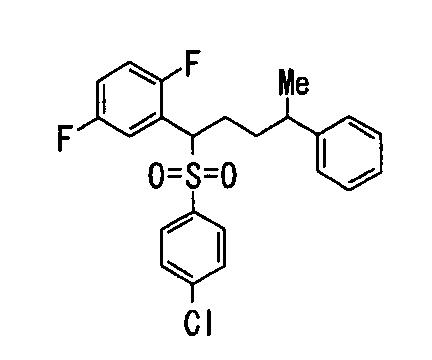
Подобно методике примера 299, за исключением использования 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (150 мг, 0,496 ммоль), полученного в примере 5, DL-3-фенил-1-бутанола (153 мкл, 0,991 ммоль) и цианометилентри-н-бутилфосфорана (239 мкл, 0,991 ммоль) получали указанный в заголовке изомер 303-А (соединение низкой полярности) (44 мг, 0,101 ммоль, 21%) и указанный в заголовке изомер 303-В (соединение высокой полярности) (45 мг, 0,103 ммоль, 21%) в виде белого порошка.
Изомер 303-А
1H-ЯМР (400 МГц, CDCl3) δ: 1,21 (3H, д, J=6,7 Гц), 1,38-1,61 (2H, м), 2,03-2,09 (1H, м), 2,24-2,33 (1H, м), 2,64-2,69 (1H, м), 4,40 (1H, дд, J=11,3, 3,9 Гц), 6,83 (1H, тд, J=9,1, 4,4 Гц), 6,94-7,28 (7H, м), 7,35 (2H, д, J=8,6 Гц), 7,47 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2933, 1494, 1475, 1427, 1394, 1315, 1276, 1228, 1141, 1085, 1012.
Т.пл.: 135-137°C.
МС m/z: 435 (М++H).
Элементный анализ. Вычислено для C23H21ClF2O2S: C, 63,52; H, 4,87; Cl, 8,15; F, 8,74; S, 7,37. Найдено: C, 63,37; H, 4,79; Cl, 8,18; F, 8,82; S, 7,61.
Изомер 303-В
1H-ЯМР (400 МГц, CDCl3) δ: 1,19 (3H, д, J=6,8 Гц), 1,37-1,59 (2H, м), 1,83-1,93 (1H, м), 2,26-2,34 (1H, м), 2,61-2,68 (1H, м), 4,47 (1H, дд, J=11,8, 2,7 Гц), 6, 83 (1H, тд, J=8,9, 4,3 Гц), 6,93-7,28 (7H, м), 7,34 (2H, д, J=8,6 Гц), 7,47 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3083, 2933, 1494, 1475, 1425, 1394, 1315, 1278, 1224, 1182, 1151, 1012.
Т.пл.: 111-113°C.
МС m/z: 435 (М++H).
Элементный анализ. Вычислено для C23H21ClF2O2S: C, 63,52; H, 4,87; Cl, 8,15; F, 8,74; S, 7,37. Найдено: C, 63,39; H, 4,84; Cl, 8,50; F, 8,82; S, 7,51.
Пример 304: 2-[1-(4-хлорфенилсульфонил)-3-фенилпропил]-1, 4-дифторбензол
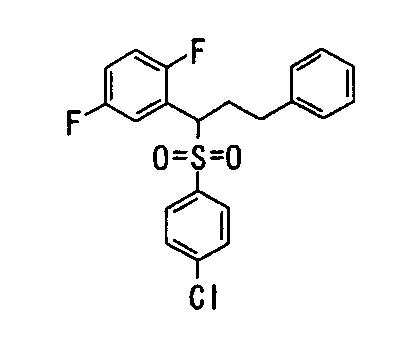
В атмосфере аргона 2-[(4-хлорфенил)сульфонилметил]-1, 4-дифторбензол (100 мг, 0,330 ммоль), полученный в примере 5, и 2-фенилэтиловый спирт (79,9 мкл, 0,661 ммоль) растворяли в толуоле (3 мл) с последующим добавлением цианометилентри-н-бутилфосфорана (159 мкл, 0,661 ммоль). Полученную смесь нагревали при кипячении с обратным холодильником в течение 13 часов в атмосфере аргона. Затем реакционную смесь концентрировали. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем (гексан:этилацетат=93:7). Полученное таким образом твердое вещество промывали гексаном с получением указанного в заголовке соединения (100 мг, 0,246 ммоль, 74%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,37-2,52 (2H, м), 2,60-2,78 (2H, м), 4,44-4,49 (1H, м), 6,85 (1H, тд, J=9,0, 4,5 Гц), 6,77-7,29 (7H, м), 7,36 (2H, д, J=8,6 Гц), 7,49 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3068, 1583, 1496, 1477, 1457, 1423, 1394, 1315, 1278, 1214, 1176, 1147, 1081, 1012.
Т.пл.: 111-113°C.
МС m/z: 407 (М++H).
Элементный анализ. Вычислено для C21H17ClF2O2S: C, 61,99; H, 4,21; Cl, 8,71; F, 9,34; S, 7,88. Найдено: C, 61,76; H, 4,16; Cl, 8,88; F, 9,37; S, 8,02.
Пример 305: 2-[1-(4-хлорфенилсульфонил)-3-(2-метилфенил)пропил]-1, 4-дифторбензол
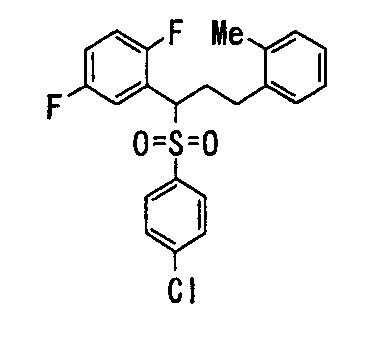
Подобно методике примера 304, за исключением использования 2-(2-метилфенил)этанола (89,0 мкл, 0,661 ммоль), указанное в заголовке соединение (108 мг, 0,257 ммоль, 78%) получали в виде бесцветных пластинчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 2,18 (3H, с), 2,29-2,39 (1H, м), 2,46-2,62 (2H, м), 2,67-2,75 (1H, м), 4,53 (1H, дд, J=11,1, 2,6 Гц), 6,86 (1H, тд, J=9,0, 4,4 Гц), 6,96-7,12 (5H, м), 7,28 (1H, дд д, J=8,7, 5,4, 3,2 Гц), 7,37 (2H, д, J=8,6 Гц), 7,51 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3091, 2946, 1583, 1573, 1496, 1425, 1392, 1311, 1276, 1213, 1151, 1143, 1083, 1010.
Т.пл.: 105-106°C.
МС m/z: 421 (М++H).
Элементный анализ. Вычислено для C22H19ClF2O2S: C, 62,78; H, 4,55; Cl, 8,42; F, 9,03; S, 7,62. Найдено: C, 62,48; H, 4,63; Cl, 8,52; F, 9,16; S, 7,75.
Пример 306: 2-[1-(4-хлорфенилсульфонил)-3-(3-метилфенил)пропил]-1,4-дифторбензол
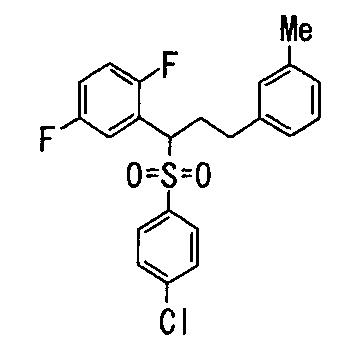
Подобно методике примера 304, за исключением использования 2-(3-метилфенил)этанола (90,0 мкл, 0,661 ммоль), указанное в заголовке соединение (115 мг, 0,273 ммоль, 83%) получали в виде бесцветных столбчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 2,29 (3H, с), 2,35-2,48 (2H, м), 2,56-2,64 (1H, м), 2,68-2,77 (1H, м), 4,46-4,49 (1H, м), 6,83-6,88 (3H, м), 6,97-7,03 (2H, м), 7,14 (1H, т, J=7,8 Гц), 7,26 (1H, дд д, J=8,7, 5,4, 3,3 Гц), 7,36 (2H, д, J=8,6 Гц), 7,49 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3072, 2969, 1581, 1496, 1475, 1423, 1394, 1319, 1276, 1211, 1147, 1081, 1012.
Т.пл.: 87-88°C.
МС m/z: 421 (М++H).
Элементный анализ. Вычислено для C22H19ClF2O2S: C, 62,78; H, 4,55; Cl, 8,42; F, 9,03; S, 7,62. Найдено: C, 62,58; H, 4,60; Cl, 8,49; F, 9,21; S, 7,77.
Пример 307: 2-[1-(4-хлорфенилсульфонил)-3-(4-метилфенил)пропил]-1,4-дифторбензол
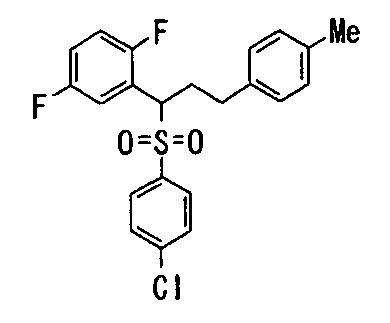
Подобно методике примера 304, за исключением использования 2-(4-метилфенил)этанола (91,9 мкл, 0,661 ммоль), указанное в заголовке соединение (106 мг, 0,251 ммоль, 76%) получали в виде бесцветных столбчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 2,31 (3H, с), 2,34-2,46 (2H, м), 2,57-2,65 (1H, м), 2,67-2,72 (1H, м), 4,45-4,48 (1Н, м), 6,85 (1H, тд, J=9,0, 4,5 Гц), 6,92 (2H, д, J=8,1 Гц), 6,97-7,03 (1H, м), 7,06 (2H, д, J=8,1 Гц), 7, 25 (2H, ддд, J=8,7, 5,3, 3,3 Гц), 7,35 (2H, д, J=8,6 Гц), 7,45 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3070, 2935, 1585, 1496, 1423, 1394, 1321, 1292, 1278, 1216, 1182, 1147, 1083, 1014.
Т.пл.: 82-84°C.
МС m/z: 421 (М++H).
Элементный анализ. Вычислено для C22H19ClF2O2S: C, 62,78; H, 4,55; Cl, 8,42; F, 9,03; S, 7,62. Найдено: C, 62,67; H, 4,60; Cl, 8,31; F, 8,95; S, 7,79.
Пример 308: 2-[1-(4-хлорфенилсульфонил)-3-(4-метоксифенил)пропил]-1, 4-дифторбензол
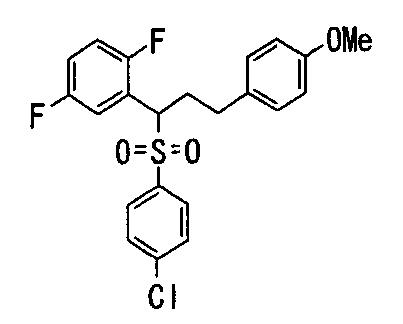
Подобно методике примера 304, за исключением использования 2-(4-метоксифенил)этанола (100 мг, 0,661 ммоль), указанное в заголовке соединение (86 мг, 0,197 ммоль, 60%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3 ) δ: 2,36-2,44 (2H, м), 2,57-2,75 (2H, м), 3,79 (3H, с), 4,36-4,47 (1H, м), 6,78 (2H, д, J=8,3 Гц), 6,84 (1H, тд, J=8,8, 4,3 Гц), 6,93 (2H, д, J=8,3 Гц), 6,97-7,03 (1H, м), 7,24-7,28 (1H, м), 7, 35 (2H, д, J=8,1 Гц), 7,47 (2H, д, J=8,1 Гц).
ИК (ATR) см-1: 3089, 2954, 2836, 1612, 1583, 1513, 1494, 1459, 1427, 1394, 1322, 1270, 1245, 1222, 1180, 1153, 1083, 1031, 1012.
Т.пл.: 118-120°C.
МС m/z: 436 (М+).
FAB-МС: 436,0717 (вычислено для C22H19ClF2O3 S: 436,0712).
Элементный анализ. Вычислено для C22H19ClF2O3S: C, 60,48; H, 4,38; Cl, 8,11; F, 8,70; S, 7,34. Найдено: C, 60,00; H, 4,34; Cl, 8,39; F, 8,99; S, 7,60.
Пример 309: 2-[1-(4-хлорфенилсульфонил)-3-(4-фторфенил)пропил]-1,4-дифторбензол
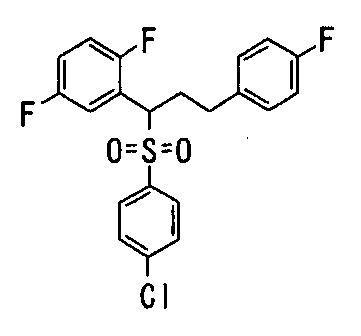
Подобно методике примера 304, за исключением использования 2-(4-фторфенил)этанола (82,5 мкл, 0,661 ммоль), указанное в заголовке соединение (70 мг, 0, 165 ммоль, 50%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,34-2,50 (2H, м), 2,61-2,76 (2H, м), 4,43 (1H, дд, J=11,2, 2,9 Гц), 6,83 (1H, тд, J=8,9, 4,4 Гц), 6,92-7,03 (5H, м), 7,24-7,28 (1H, м), 7,35 (2H, д, J=8,6 Гц), 7,47 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3079, 1583, 1509, 1492, 1477, 1423, 1394, 1317, 1276, 1251, 1216, 1176, 1145, 1081, 1012.
Т.пл.: 131-132°C.
МС m/z: 425 (М+).
Элементный анализ. Вычислено для C21H16ClF3O2S: C, 59,37; H, 3,80; Cl, 8,34; F, 13,41; S, 7,55. Найдено: C, 59,41; H, 3,85; Cl, 8,64; F, 13,33; S, 7,67.
Пример 310: 2-[3-(4-хлорфенил)-1-(4-хлорфенилсульфонил)пропил]-1,4-дифторбензол
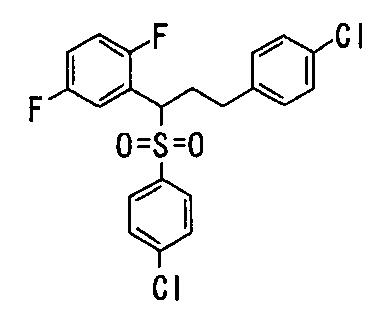
Подобно методике примера 304, за исключением использования 2-(4-хлорфенил)этанола (89,3 мкл, 0,661 ммоль), указанное в заголовке соединение (103 мг, 0,233 ммоль, 71%) получали в виде белого порошка
1H-ЯМР (400 МГц, CDCl3) δ: 2,35-2,50 (2H, м), 2,62-2,77 (2H, м), 4,42-4,43 (1H, м), 6,84 (1H, тд, J=9,0, 4,4 Гц), 6,97 (2H, д, J=8,6 Гц), 6,96-7,04 (1H, м), 7, 22 (2H, д, J=8,6 Гц), 7,23-7,28 (1H, м), 7,36 (2H, д, J=8,6 Гц), 7,48 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3079, 2931, 1581, 1492, 1475, 1461, 1425, 1394, 1317, 1274, 1214, 1178, 1139, 1083, 1012.
Т.пл.: 124-126°C.
МС m/z: 441 (М++H).
Элементный анализ. Вычислено для C21H16Cl2F2O2S: C, 57,15; H, 3,65; Cl, 16,07; F, 8,61; S, 7,27. Найдено: C, 56,96; H, 3,68; Cl, 16,28; F, 8,78; S, 7,44.
Пример 311: 2-[3-(4-бромфенил)-1-(4-хлорфенилсульфонил)пропил]-1,4-дифторбензол
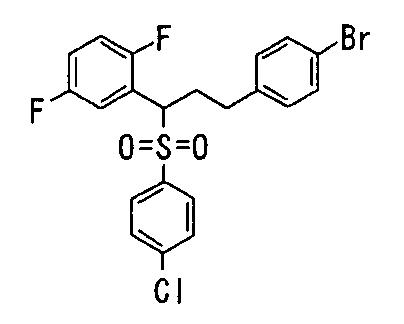
Подобно методике примера 304, за исключением использования 2-(4-бромфенил)этанола (89,7 мкл, 0,661 ммоль), указанное в заголовке соединение (97 мг, 0,200 ммоль, 61%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,34-2,49 (2H, м), 2,58-2,76 (2H, м), 4,42-4,45 (1H, м), 6,84 (1H, тд, J=9,0, 4,3 Гц), 6,92 (2H, д, J=8,1 Гц), 6,98-7,04 (1H, м), 7, 26 (1H, дд д, J=8,3, 5,5, 3,4 Гц), 7,36 (2H, д, J=8,3 Гц), 7,38 (2H, д, J=8,1 Гц), 7,48 (2H, д, J=8,3 Гц).
ИК (ATR) см-1: 3081, 2927, 1573, 1486, 1459, 1425, 1396, 1317, 1272, 1247, 1216, 1178, 1139, 1083, 1010.
Т.пл.: 122-124°C.
МС m/z: 486 (М++H).
FAB-МС: 485,9728 (вычислено для C21H16ClBrF2O2S: 485,9690).
Пример 312: 2-[1-(4-хлорфенилсульфонил)-4-фенилбутил]-1,4-дифторбензол
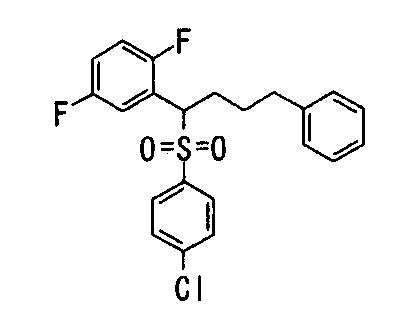
Подобно методике примера 304, за исключением использования 3-фенил-1-пропанола (90,0 мкл, 0,661 ммоль), указанное в заголовке соединение (106 мг, 0,251 ммоль, 76%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,50-1,65 (2H, м), 2,06-2,16 (1H, м), 2,40-2,49 (1H, м), 2,53-2,69 (2H, м), 4,52 (1H, дд, J=11,4, 3,1 Гц), 6,83 (1H, тд, J=9,0, 4,5 Гц), 6,94-7,00 (1H, м), 7,05-7,26 (6H, м), 7,37 (2H, д, J=8,6 Гц), 7,52 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3070, 2956, 2861, 1914, 1583, 1488, 1461, 1423, 1392, 1319, 1278, 1249, 1207, 1174, 1143, 1081, 1012.
Т.пл.: 107-108°C.
МС m/z: 421 (М+ +H).
FAB-МС: 421,0834 (вычислено для C22H20ClF2O2S: 421,0841).
Пример 313: 2-[1-(4-хлорфенилсульфонил)-5-фенилпентил]-1, 4-дифторбензол
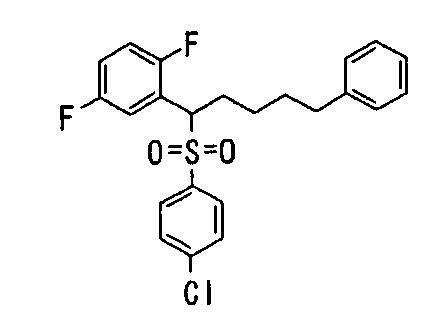
Подобно методике примера 304, за исключением использования 4-фенил-1-бутанола (102 мкл, 0,661 ммоль), указанное в заголовке соединение (107 мг, 0,246 ммоль, 75%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,26 (2H, кв, J=7,6 Гц), 1,57-1,67 (2H, м), 2,06-2,16 (1H, м), 2,40-2,62 (3H, м), 4,49 (1H, дд, J=12,0, 3,3 Гц), 6,81 (1H, тд, J=9,0, 4,5 Гц), 6,94-7,00 (1H, м), 7,08-7,26 (6H, м), 7,37 (2H, д, J=8,3 Гц), 7,52 (2H, д, J=8,3 Гц).
ИК (ATR) см-1: 2942, 2856, 1583, 1494, 1475, 1463, 1427, 1394, 1324, 1276, 1240, 1211, 1182, 1151, 1083, 1049, 1014.
Т.пл.: 88-90°C.
МС m/z: 435 (М++H).
Элементный анализ. Вычислено для C23H21ClF2O2S: C, 63,52; H, 4,87; Cl, 8,15; F, 8,74; S, 7,37. Найдено: C, 63,32; H, 4,74; Cl, 8,19; F, 8,93; S, 7,65.
Пример 314: 2-[1-(4-хлорфенилсульфонил)-2-(4-фторфенил)этил]-1,4-дифторбензол
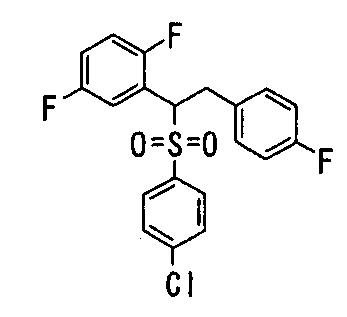
Подобно методике примера 304, за исключением использования 4-фторфенилбензилового спирта (71,2 мкл, 0,661 ммоль), указанное в заголовке соединение (118 мг, 0,287 ммоль, 87%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 3,29 (1H, дд, J=14,0, 12,0 Гц), 3,81 (1H, дд, J=14,0, 3,7 Гц), 4,75 (1H, дд, J=12,0, 3,7 Гц), 6,70 (1H, тд, J=9,0, 4,5 Гц), 6,84-7,00 (6H, м), 7,38 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 3079, 2964, 1600, 1573, 1511, 1492, 1427, 1392, 1307, 1278, 1220, 1172, 1143, 1081, 1010.
Т.пл.: 151-153°C.
МС m/z: 411 (М++H).
Элементный анализ. Вычислено для C20H14ClF3O2S: C, 58,47; H, 3,43; Cl, 8,63; F, 13,87; S, 7,80. Найдено: C, 58,27; H, 3,39; Cl, 8,80; F, 13,80; S, 8,00.
Пример 315: 2-[1-(4-хлорфенилсульфонил)-3-циклопентилпропил]-1,4-дифторбензол
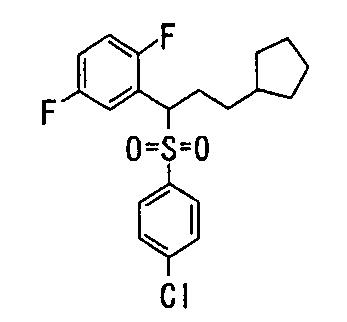
Подобно методике примера 304, за исключением использования 2-циклопентанэтанола (81,9 мкл, 0,661 ммоль), указанное в заголовке соединение (79 мг, 0,186 ммоль, 60%) получали в виде бесцветных пластинчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 0,94-1,07 (4H, м), 1,09-1,18 (1H, м), 1,23-1,33 (1H, м), 1,45-1, 59 (3H, м), 1,67-1,79 (2H, м), 2,03-2,14 (1H, м), 2,41-2,50 (1H, м), 4,49 (1H, дд, J=12,2, 2,9 Гц), 6,82 (1H, тд, J=9,0, 4,4 Гц), 6,94-7,00 (1H, м), 7,22-7,26 (1H, м), 7,37 (2H, д, J=8,8 Гц), 7,52 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 2952, 2852, 1583, 1494, 1475, 1427, 1396, 1313, 1278, 1214, 1176, 1147, 1081, 1014.
Т.пл.: 93-94°C.
МС m/z: 399 (М++H).
FAB-МС: 399,1004 (вычислено для C20H22ClF2O2S: 399,0997).
Пример 316: 2-[1-(4-хлорфенилсульфонил)-3-циклогексилпропил]-1,4-дифторбензол
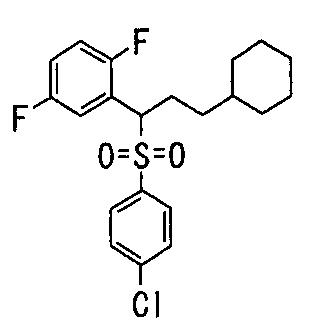
Подобно методике примера 304, за исключением использования 2-циклогексанэтанола (92,0 мкл, 0,661 ммоль), указанное в заголовке соединение (86 мг, 0,208 ммоль, 63%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 0,75-0,89 (2H, м), 0,97-1,25 (6H, м), 1,61-1,68 (5H, м), 2,01-2,12 (1H, м), 2,42-2,50 (1H, м), 4,46 (1H, дд, J=11,5, 2,9 Гц), 6,82 (1H, тд, J=9,3, 4,4 Гц), 6,94-7,00 (1H, м), 7,20-7,26 (1H, м), 7,37 (2H, д, J=8,1 Гц), 7,52 (2H, д, J=8,1 Гц).
ИК (ATR) см-1: 2925, 2842, 1581, 1496, 1450, 1423, 1392, 1315, 1276, 1238, 1176, 1149, 1085, 1010.
Т.пл.: 82-83°C.
МС m/z: 413 (М++H).
Элементный анализ. Вычислено для C21H23ClF2O2S: C, 61,08; H, 5,61; Cl, 8,59; F, 9,20; S, 7,77. Найдено: C, 60,80; H, 5,58; Cl, 8,79; F, 9,45; S, 7,92.
Пример 317: 2-[1-(4-хлорфенилсульфонил)-4-циклогексилбутил]-1,4-дифторбензол
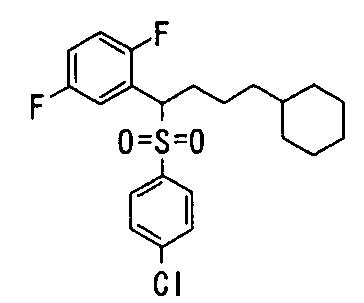
Подобно методике примера 304, за исключением использования 3-циклогексил-1-пропанола (103 мкл, 0,661 ммоль), указанное в заголовке соединение (96 мг, 0,224 ммоль, 68%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 0,72-1,73 (15H, м), 2,01-2,12 (1H, м), 2,33-2,41 (1H, м), 4,51 (1H, д, J=9,0 Гц), 6,80-6,86 (1H, м), 6,94-7,00 (1H, м), 7,22-7,26 (1H, м), 7,38 (2H, д, J=7,8 Гц), 7,53 (2H, д, J=7,8 Гц).
ИК (ATR) см-1: 2919, 2852, 1583, 1496, 1488, 1475, 1425, 1394, 1317, 1274, 1236, 1207, 1149, 1081, 1012.
Т.пл.: 47-49°C.
МС m/z: 427 (М++H).
FAB-МС: 427,1342 (вычислено для C22H26ClF2O2S: 427, 1310).
Пример 318: 2-[3-(4-хлорфенилсульфонил)-3-(2,5-дифторфенил)пропил]пиридин
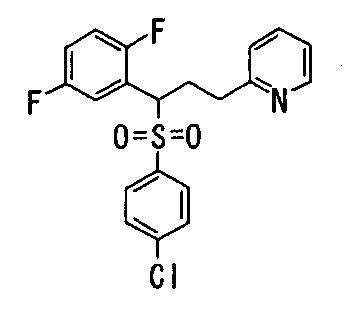
Подобно методике примера 304, за исключением использования 2-(2-гидроксиэтил)пиридина (74,5 мкл, 0,661 ммоль), указанное в заголовке соединение (74 мг, 0,181 ммоль, 55%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,49-2,58 (1H, м), 2,68-2,93 (3H, м), 4,60 (1H, дд, J=10,9, 3,3 Гц), 6,84 (1H, тд, J=8,9, 4,5 Гц), 6,95-7,00 (1H, м), 7,03 (1H, д, J=7,6 Гц), 7,11 (1H, дд, J=6,9, 5,1 Гц), 7,29-7,38 (1H, м), 7,39 (2H, д, J=8,6 Гц), 7,54 (2H, д, J=8,6 Гц) 7,51-7,58 (1H, м), 8,48 (1H, д, J=3,9 Гц).
ИК (ATR) см-1: 3075, 1585, 1569, 1496, 1473, 1425, 1394, 1311, 1278, 1205, 1145, 1081, 1012.
Т.пл.: 129-131°C.
МС m/z: 408 (М+ +H).
FAB-МС: 408,0649 (вычислено для C20H17ClF2NO2S: 408,0637).
Элементный анализ. Вычислено для C20H16ClF2NO2S: C, 58,90; H, 3,95; Cl, 8,69; F, 9,32; N, 3,42; S, 7,86. Найдено: C, 58,57; H, 3,87; Cl, 8,90; F, 9,34; N, 3,53; S, 7,96.
Пример 319: 5-[3-(4-хлорфенилсульфонил)-3-(2,5-дифторфенил)пропил]-4-метил-1,3-тиазол
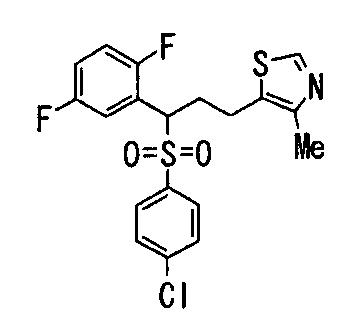
Подобно методике примера 304, за исключением использования 5-(2-гидроксиэтил)-4-метилтиазола (78,9 мкл, 0,661 ммоль), указанное в заголовке соединение (87 мг, 0,203 ммоль, 62%) получали в виде бесцветного твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,21 (3H, с), 2,36-2,47 (1H, м), 2,70-2,87 (3H, м), 4,49 (1H, дд, J=10,9, 2,6 Гц), 6,86 (1H, тд, J=9,1, 4,4 Гц), 6,99-7,05 (1H, м), 7,24-7,28 (1H, м), 7,39 (2H, д, J=8,8 Гц), 7,51 (2H, д, J=8,8 Гц) 8,57 (1H, с).
ИК (ATR) см-1: 3085, 2933, 1583, 1571, 1494, 1477, 1405, 1315, 1278, 1220, 1147, 1083, 1012.
Т.пл.: 183-184°C.
МС m/z: 428 (М++H).
FAB-МС: 428,0355 (вычислено для C19H17ClF2NO2S2: 428,0357).
Пример 320: 1-[3-(4-хлорфенилсульфонил)-3-(2,5-дифторфенил)пропил]пиперидин
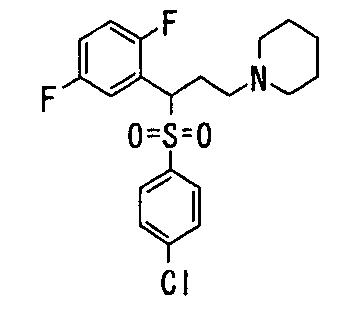
Подобно методике примера 304, за исключением использования 1-пиперидинэтанола (87,3 мкл, 0,661 ммоль), указанное в заголовке соединение (32 мг, 0,0773 ммоль, 23%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,34-1,40 (2H, м), 1,44-1,49 (4H, м), 2,09-2,34 (7H, м), 2,59-2,67 (1H, м), 4,76-4,79 (1H, м), 6,83 (1H, тд, J=9,0, 4,3 Гц), 6,94-7,00 (1H, м), 7,23 (1H, ддд, J=8,9, 5,8, 3,7 Гц), 7,39 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц).
ИК (ATR) см-1: 2942, 2800, 2761, 1579, 1492, 1427, 1396, 1355, 1309, 1284, 1243, 1189, 1118, 1085, 1014.
Т.пл.: 106-107°C.
МС m/z: 414 (М+ +H).
FAB-МС: 414,1118 (вычислено для C20H23ClF2NO2S: 414,1106).
Элементный анализ. Вычислено для C20H22ClF2NO2S: C, 58,04; H, 5,36; Cl, 8,57; F, 9,18; N, 3,38; S, 7,75. Найдено: C, 57,76; H, 5,34; Cl, 8,79; F, 9,44; N, 3,39; S, 7,89.
Пример 321: 2-[3-(4-хлорфенилсульфонил)-3-(2,5-дифторфенил)пропил]-5,5-диметил-1,3-диоксан
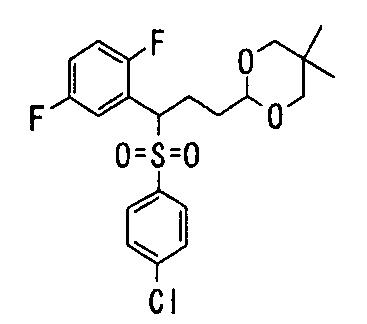
Подобно методике примера 304, за исключением использования 5,5-диметил-1,3-диоксан-2-этанола (103 мкл, 0,661 ммоль), указанное в заголовке соединение (72 мг, 0,162 ммоль, 49%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 0,70 (3H, с), 1,12 (3H, с), 1,53-1,58 (2H, м), 2,15-2,25 (1H, м), 2,55-2,65 (1H, м), 3,35 (2H, д, J=10,7 Гц), 3,55 (2H, д, J=10,7 Гц), 4,39 (1H, т, J=4,4 Гц), 4,64 (1H, дд, J=11,2, 3,4 Гц), 6,83 (1H, тд, J=8,9, 4,6 Гц), 6,94-7,00 (1H, м), 7,21-7,26 (1H, м), 7,38 (2H, д, J=8,6 Гц), 7,55 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2958, 2842, 1583, 1498, 1467, 1396, 1317, 1278, 1214, 1147, 1130, 1081, 1041, 1012.
Т.пл.: 69-71°C.
МС m/z: 445 (М++H).
FAB-МС: 445,1031 (вычислено для C21H24ClF2O4S: 445,1052).
Элементный анализ. Вычислено для C21H23ClF2O4S: C, 56,69; H, 5,21; Cl, 7,97; F, 8,54; S, 7,21. Найдено: C, 56,29; H, 5,16; Cl, 8,09; F, 8,73; S, 7,43.
Пример 322: 2-[1-(4-хлорфенилсульфонил)гексил]-1,4-дифторбензол
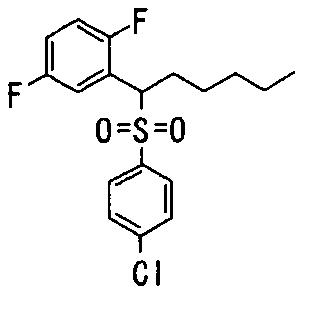
Подобно методике примера 304, за исключением использования 1-пентанола (71,8 мкл, 0,661 ммоль), указанное в заголовке соединение (88 мг, 0,236 ммоль, 72%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 0,83-0,45 (2H, м), 1,18-1,31 (7H, м), 2,03-2,12 (1H, м), 2,37-2,46 (1H, м), 4,50 (1H, дд, J=11,4, 3,3 Гц), 6,82 (1H, тд, J=9,0, 4,5 Гц), 6,95-7,00 (1H, м), 7,22-7, 26 (1H, м), 7,37 (2H, д, J=8,6 Гц), 7,52 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2946, 2923, 2867, 1585, 1494, 1477, 1425, 1396, 1317, 1278, 1247, 1211, 1176, 1149, 1081, 1014.
Т.пл.: 68-69°C.
МС m/z: 373 (М++H).
Элементный анализ. Вычислено для C18H19ClF2O2 S: C, 57,98; H, 5,14; Cl, 9,51; F, 10,19; S, 8,60. Найдено: C, 57,71; H, 5,14; Cl, 9,65; F, 10,31; S, 8,73.
Пример 323: 2-[1-(4-хлорфенилсульфонил)гептил]-1,4-дифторбензол
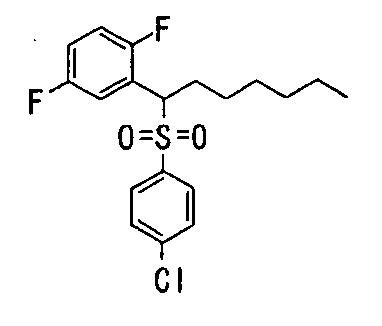
Подобно методике примера 304, за исключением использования 1-гексанола (82,2 мкл, 0,661 ммоль), указанное в заголовке соединение (69 мг, 0,178 ммоль, 54%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 0,84 (3H, т, J=7,0 Гц), 1,17-1,31 (8H, м), 2,03-2,13 (1H, м), 2,38-2,46 (1H, м), 4,50 (1H, дд, J=11,1, 3,0 Гц), 6,81 (1H, тд, J=9,0, 4,5 Гц), 6,94-7,00 (1H, м), 7,23 (1H, дд д, J=8,6, 5,3, 3,1 Гц), 7,37 (2H, д, J=8,6 Гц), 7, 52 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2962, 2925, 2856, 1583, 1492, 1477, 1425, 1394, 1315, 1276, 1243, 1214, 1174, 1149, 1081, 1012.
Т.пл.: 77-78° C.
МС m/z: 387 (М++H).
Элементный анализ. Вычислено для C19H21ClF2O2S: C, 58,98; H, 5,47; Cl, 9,16; F, 9,82; S, 8,29. Найдено: C, 58,82; H, 5,54; Cl, 9,31; F, 9,86; S, 8,44.
Пример 324: 2-[1-(4-хлорфенилсульфонил)октил]-1,4-дифторбензол
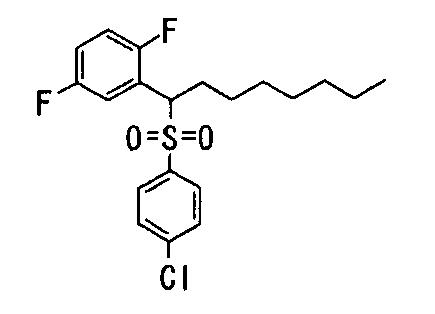
Подобно методике примера 304, за исключением использования 1-гептанола (93,5 мкл, 0,661 ммоль), указанное в заголовке соединение (107 мг, 0,267 ммоль, 81%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 0,85 (3H, т, J=7,0 Гц), 1,15-1,27 (10H, м), 2,03-2,12 (1H, м), 2,38-2,46 (1H, м), 4,50 (1H, дд, J=11,5, 2,7 Гц), 6,82 (1H, тд, J=9,0, 4,6 Гц), 6,94-7,00 (1H, м), 7,24 (1H, дд д, J=8,7, 5,3, 3,1 Гц), 7,38 (2H, д, J=8,6 Гц), 7,53 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2925, 2859, 1583, 1496, 1475, 1469, 1425, 1394, 1322, 1274, 1241, 1205, 1147, 1081, 1012.
Т.пл.: 47-48°C.
МС m/z: 401 (М++H).
Элементный анализ. Вычислено для C20H23ClF2O2S: C, 59,92; H, 5,78; Cl, 8,84; F, 9,48; S, 8,00. Найдено: C, 59,63; H, 5,61; Cl, 8,96; F, 9,59; S, 8,17.
Пример 325: 2-[1-(4-хлорфенилсульфонил)-5-метилгексил]-1,4-дифторбензол
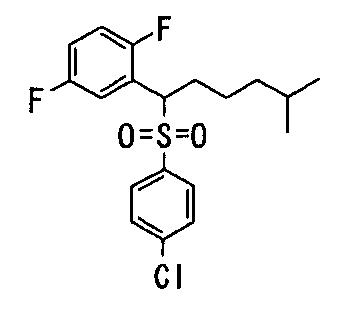
Подобно методике примера 304, за исключением использования 4-метил-1-пентанола (83,2 мкл, 0,661 ммоль), указанное в заголовке соединение (122 мг, 0,315 ммоль, 96%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 0,78 (3H, д, J=6,6 Гц), 0,81 (3H, д, J=6,6 Гц), 1,14-1,25 (4H, м), 1,41-1,52 (1H, м), 2,02-2,12 (1H, м), 2,35-2, 41 (1H, м), 4,51 (1H, дд, J=11,6, 2,6 Гц), 6,83 (1H, тд, J=9,0, 4,4 Гц), 6,95-7,00 (1H, м), 7,24 (1H, ддд, J=8,9, 5,6, 3,2 Гц), 7,38 (2H, д, J=8,6 Гц), 7,53 (2H, д, J=8,6 Гц).
ИК (ATR) см-1: 2962, 2925, 2898, 2861, 1583, 1492, 1465, 1427, 1394, 1315, 1278, 1247, 1211, 1176, 1147, 1081, 1014.
Т.пл.: 79-80°C.
МС m/z: 387 (М++H).
Элементный анализ. Вычислено для C19H21ClF2O2S: C, 58,98; H, 5,47; Cl, 9,16; F, 9,82; S, 8,29. Найдено: C, 58,92; H, 5,42; Cl, 9,28; F, 10,00; S, 8,45.
Пример 326: 2-[1-(4-хлорфенилсульфонил)-4-метилгексил]-1,4-дифторбензол
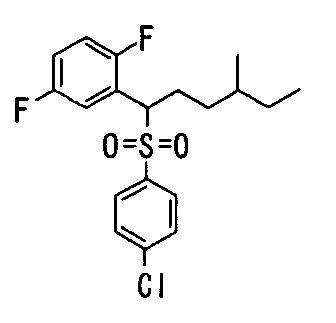
Подобно методике примера 304, за исключением использования 2-[(4-хлорфенил)сульфонилметил]-1,4-дифторбензола (200 мг, 0,660 ммоль), полученного в примере 5, 3-метил-1-пентанола (180 мкл, 1,32 ммоль) и цианометилентри-н-бутилфосфорана (163 мкл, 1,32 ммоль) указанное в заголовке соединение (217 мг, 0,561 ммоль, 85%) получали в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 0,77-0,85 (6H, м), 1,07-1,15 (2H, м), 1,21-1,33 (3H, м), 1,98-2,15 (1H, м), 2,39-2,52 (1H, м), 4,44-4,49 (1H, м), 6,82 (1H, тд, J=8,9, 4,1 Гц), 6,94-7,00 (1H, м), 7,23-7,26 (1H, м), 7,38 (2H, д, J=8,3 Гц), 7,53 (2H, д, J=8,3 Гц).
ИК (ATR) см-1: 2960, 2919, 2873, 1583, 1496, 1473, 1461, 1425, 1394, 1319, 1278, 1216, 1153, 1083, 1012.
Т.пл.: 56-58°C.
МС m/z: 387 (М++H).
Элементный анализ. Вычислено для C19H21ClF2O2S: C, 58,98; H, 5,47; Cl, 9,16; F, 9,82; S, 8,29. Найдено: C, 58,87; H, 5,55; Cl, 9,12; F, 9,93; S, 8,42.
Ссылочный пример 45: 5-дибромметил-2-(2, 5-дифторбензоил)пиридин (соединение А) и 5-бромметил-2-(2,5-дифторбензоил)пиридин (соединение В)
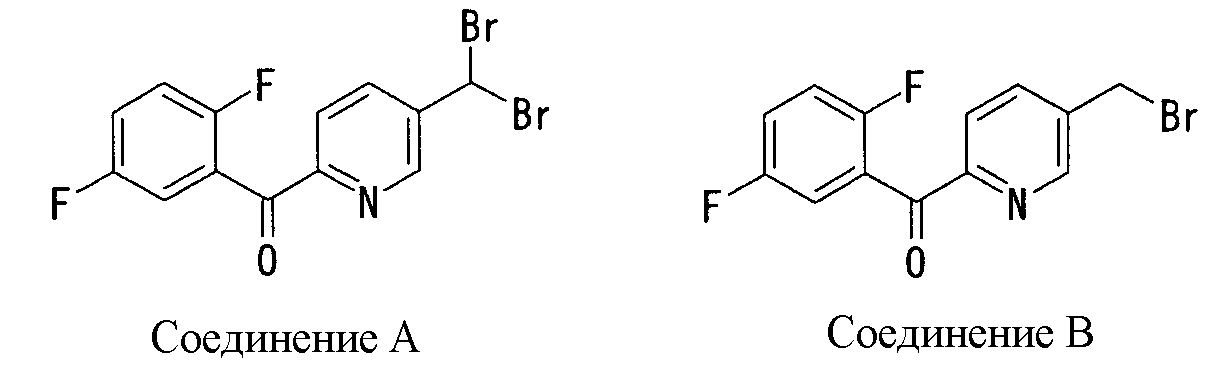
При кипячении с обратным холодильником N-бромсукцинимид (17,0 г, 95,7 ммоль) и каталитическое количество 2,2'-азобис(2-метилпропионитрила) добавляли к раствору 2-[(2, 5-дифторфенил)гидроксиметил]-5-метилпиридина (7,50 г, 31,9 ммоль), который получали в ссылочном примере 15, в тетрахлориде углерода (100 мл). Затем смесь перемешивали. После кипячения с обратным холодильником в течение 24 часов реакционную смесь охлаждали до комнатной температуры. Полученный таким образом остаток отделяли фильтрованием. Затем осадок добавляли к водному раствору тиосульфата натрия и полученную смесь экстрагировали хлороформом. Раствор промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и затем сушили над сульфатом натрия. Остаток, полученный концентрированием раствора при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения А (3,91 г, 31%) и указанного в заголовке соединения В (3,34 г, 34%) в виде масел.
Соединение А
1H-ЯМР (400 МГц, CDCl3) δ: 6,70 (1H, с), 7,12 (1H, м), 7,24 (1H, м), 7, 39 (1H, м), 8,12 (1H, д, J=8,4 Гц), 8,19 (1H, дд, J=2,0, 8,4 Гц), 8,77 (1H, д, J=2,0 Гц).
ИК (ATR) см-1: 1676, 1487, 1421, 1311, 1193, 827.
МС m/z: 392 (М++H).
Соединение В
1H-ЯМР (400 МГц, CDCl3) δ: 4,52 (2H, с), 7,12 (1H, м), 7,21 (1H, м), 7,39 (1H, м), 7,94 (1H, дд, J=2,0, 8, 0 Гц), 8,08 (1H, д, J=8,0 Гц), 8,67 (1H, д, J=2,0 Гц).
МС m/z: 313 (М++H).
Ссылочный пример 46: [6-(2,5-дифторфенилкарбонил)пиридин-3-ил]метилацетат
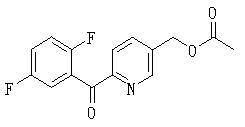
При кипячении с обратным холодильником N-бромсукцинимид (6,0 г, 33,6 ммоль) и каталитическое количество 2,2'-азобис(2-метилпропионитрила) добавляли к раствору 2-[(2,5-дифторфенил)гидроксиметил]-5-метилпиридина (2,64 г, 11,2 ммоль), который получали в ссылочном примере 15, в тетрахлориде углерода (60 мл). Затем смесь перемешивали. После кипячения с обратным холодильником в течение 7 часов реакционную смесь охлаждали до комнатной температуры и добавляли к водному раствору тиосульфата натрия. Смесь экстрагировали эфиром. Раствор промывали водой и насыщенным раствором соли и затем сушили над сульфатом натрия. Остаток, полученный концентрированием раствора при пониженном давлении, растворяли в толуоле, и полученный раствор снова концентрировали. Остаток растворяли в N,N-диметилформамиде (20 мл). К полученному раствору (4,59 г, 56 ммоль) добавляли ацетат натрия (4,59 г, 56 ммоль), и смесь перемешивали при 70оС в течение 17 часов. После охлаждения реакционную смесь растворяли в этилацетате (100 мл) с последующим промыванием водой и насыщенным раствором соли. Раствор сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (600 мг, 18%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 2,12 (3H, с, 5,19 (2H, с, 7,10 (1H, м), 7,19 (1H, м), 7,37 (1H, с, 7,88 (1H, дд, J=2,4, 8,0 Гц), 8,07 (1H, д, J=8,0 Гц), 8,62 (1H, д, J=2,4 Гц).
ИК (ATR) см-1: 1739, 1678, 1489, 1222, 821.
МС m/z: 292 (М++H).
Пример 327: 2-[(4-хлорфенилтио)(2,5-дихлорфенил)метил]-5-[(4-хлорфенилтио)метил]пиридин
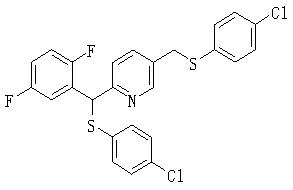
Суспензию боргидрида натрия (33 мг, 0,88 ммоль) в этаноле (15 мл) охлаждали до -78°С. При перемешивании раствор в этаноле (10 мл) [6-(2, 5-дифторфенилкарбонил)пиридин-3-ил]метилацетата (510 мг, 1,75 ммоль) добавляли порциями. После перемешивания в течение 30 минут добавляли водный раствор хлорида аммония, и полученной смеси давали стоять, пока температура смеси не повышалась до комнатной температуры. Полученную смесь экстрагировали этилацетатом (100 мл) с последующим промыванием водой и насыщенным раствором соли, и сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде (30 мл), и при охлаждении на льду к раствору добавляли триэтиламин (270 мкл) и метансульфонилхлорид (270 мкл). Полученную смесь перемешивали при комнатной температуре в течение 3 дней. Добавляли воду, и смесь экстрагировали этилацетатом (60 мл). Раствор промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали при пониженном давлении.
Остаток растворяли в N,N-диметилформамиде (25 мл). В атмосфере азота добавляли 4-хлорбензолтиол (751 мг, 5,3 ммоль) и карбонат калия (718 мг, 5,2 ммоль), и смесь перемешивали при 60°С в течение 1 часа. После охлаждения реакционной смеси до комнатной температуры добавляли диэтиловый эфир (80 мл). Полученную смесь промывали водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (237 мг, 27%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 3,99 (2H, с, 5,81 (1H, с, 6,90 (2H, м), 7,15 (2H, д, J=8,8 Гц), 7,16 (2H, д, J=8,8 Гц), 7,19 (4H, д, J=8,8 Гц), 7,20 (1H, д, J=7,6 Гц), 7,38(1H, м), 7,49 (1H, дд, J=2,0, 7,6 Гц), 8,38 (1H, шир.).
ИК (ATR) см-1: 1473, 1385, 1092, 1010, 814.
Т.пл.88°C.
Пример 328: 2-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]-5-[(4-хлорфенилсульфонил)метил]пиридин
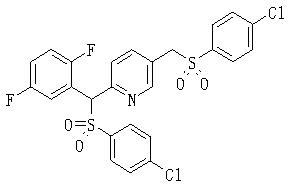
К раствору 2-[(4-хлорфенилтио)(2,5-дихлорфенил)метил]-5-[(4-хлорфенилтио)метил]пиридина (75 мг, 0,15 ммоль) в метаноле (6,0 мл) последовательно добавляли тетрагидрат гексааммонийгептамолибдата (30 мг) и 30% водный раствор пероксида водорода (3 мл). Полученную смесь перемешивали в течение 22 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали водой, водным раствором тиосульфата натрия и насыщенным раствором соли. После сушки раствор концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (2% МеОН/CHCl3) с получением указанного в заголовке соединения (70 мг, 62%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 4,29 (2H, с, 5,91 (1H, с, 6,90-7,08 (2H, м), 7,39 (2H, дд, J=1,6, 6,8 Гц), 7,45 (2H, дд, J=1,6, 6,8 Гц), 7,51 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц), 7,60 (1H, д, J=8,0 Гц), 7,65 (1H, дд, J=2,4, 8,0 Гц), 7,91 (1H, м), 8,23 (1H, с).
ИК (ATR) см-1: 1495, 1322, 1149, 1087, 615.
Т.пл.: 186-187°C.
МС m/z: 568 (М++H).
Элементный анализ. Вычислено для C25H17Cl2F2NO4S2: C, 52,82%; H, 3,01%; N, 2,46%; S, 11,28%; Cl, 12,47%; F, 6,68%. Найдено: C, 52,88%; H, 3,10%; N, 2,63%; S, 11,38%; Cl, 12,40%; F, 6,83%.
Ссылочный пример 47: 2-[(2,5-дифторфенил)гидроксиметил]-5-(1,3-диоксолан-2-ил)пиридин
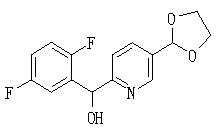
К раствору в пиридине (60 мл) 5-дибромметил-2-(2,5-дифторбензоил)пиридина (соединения А) (3,91 г, 10 мл), полученного в ссылочном примере 45, добавляли этиленгликоль (6,2 г, 100 ммоль). При нагревании при 90оС смесь перемешивали в течение 17 часов. Реакционную смесь концентрировали при пониженном давлении, и остаток растворяли в эфире (200 мл). Полученный раствор промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом магния. Раствор концентрировали при пониженном давлении. Остаток растворяли в этаноле (60 мл). К полученному раствору при охлаждении на льду добавляли боргидрид натрия (190 мг, 5 ммоль) с последующим перемешиванием при комнатной температуре в течение 1 часа. После добавления воды смесь экстрагировали этилацетатом. Раствор промывали насыщенным раствором соли и затем сушили над безводным сульфатом магния. Остаток, полученный концентрированием раствора при пониженном давлении, очищали хроматографией на силикагеле (гексан:этилацетат=5:1-1:1) с получением указанного в заголовке соединения (1,52 г, 52%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 4,0-4,2 (4H, м), 5,84 (1H, с), 6,10 (1H, с), 6,91 (1H, м), 6,99 (1H, м), 7,09 (1H, м), 7,26 (1H, д, J=8,0 Гц), 7,76 (1H, дд, J=2,0, 8,0 Гц), 8,64 (1H, д, J=2,0 Гц).
ИК (ATR) см-1: 1489, 1086, 1026, 818, 715.
МС m/z: 294 (М++H).
Пример 329: 2-[(4-хлорфенилтио)(2,5-дифторфенил)метил]-5-(1,3-диоксолан-2-ил)пиридин
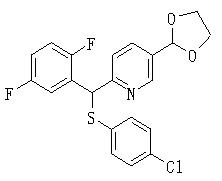
В атмосфере азота триэтиламин (1,08 мл, 7,8 ммоль) и метансульфонилхлорид (0,52 мл, 6,8 ммоль) добавляли к раствору в метиленхлориде (30 мл) 2-[(2,5-дифторфенил)гидроксиметил]-5-(1, 3-диоксолан-2-ил)пиридина (1,52 г, 5,2 ммоль) при охлаждении на льду, и полученную смесь перемешивали при комнатной температуре в течение 3 часов. После добавления насыщенного водного раствора бикарбоната натрия полученную смесь экстрагировали эфиром. Раствор промывали насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали при пониженном давлении.
Остаток растворяли в диметилформамиде (30 мл). К полученному раствору добавляли хлорбензолтиол (901 мг, 6,2 ммоль) и карбонат калия (1,08 г, 7,8 ммоль), и смесь перемешивали при 60оС в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь разбавляли эфиром. Раствор промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (1,56 г, 71%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 4,0-4,15 (4H, м), 5,84 (1H, с), 5,92 (1H, с), 6,85-6,96 (2H, м), 7,19 (2H, д, J=8,8 Гц), 7,25 (2H, д, J=8,8 Гц), 7,43 (1H, д, J=8,0 Гц), 7,43 (1H, м), 7,77 (1H, дд, J=2,0, 8,0 Гц), 8,70 (1H, д, J=2,0 Гц).
ИК (ATR) см-1: 1489, 1475, 1091, 814.
Т.пл.: 70-73°C.
МС m/z: 420 (М++H).
Пример 330: 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(1,3-диоксолан-2-ил)пиридин
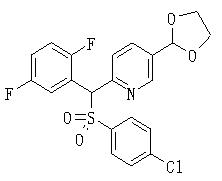
Тетрагидрат гексааммонийгептамолибдата (150 мг) добавляли к раствору 2-[(4-хлорфенилтио)(2, 5-дифторфенил)метил]-5-(1,3-диоксолан-2-ил)пиридина (1,54 г, 3,67 ммоль) в метаноле (30 мл). К полученной смеси добавляли 30% водный раствор пероксида углерода (15 мл) с последующим перемешиванием в течение 24 часов. Реакционную смесь разбавляли этилацетатом. Раствор промывали водой и насыщенным раствором соли и концентрировали при пониженном давлении. Остаток кристаллизовали из этанола с получением указанного в заголовке соединения (1,22 г, 74%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 4,02-4,10 (4H, м), 5,85 (1H, с), 5,97 (1H, с), 6,91 (1H, м), 6,96 (1H, м), 7,38 (2H, д, J=8,4 Гц), 7,53 (2H, д, J=8,4 Гц), 7,63 (1H, д, J=7,6 Гц), 7,82 (1H, д, J=8,0 Гц), 7,94 (1H, м), 8,67 (1H, шир.с).
ИК (ATR) см-1: 1488, 1319, 1232, 1149, 823.
Т.пл.: 167-168°C.
МС m/z: 452 (М++H).
FAB-МС: 452,0544 (вычислено для C21 H17ClF2NO4S: 452,0535).
Пример 331: 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(гидроксиметил)пиридин
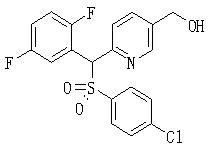
К раствору в 1,4-диоксане (30 мл) 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(1, 3-диоксолан-2-ил)пиридина (295 мг, 0,54 ммоль) добавляли 1 н. хлористо-водородную кислоту (30 мл) и полученную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь экстрагировали этилацетатом. Экстракт промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали при пониженном давлении.
Остаток растворяли в этаноле (10 мл). К полученному раствору добавляли боргидрид натрия (10 мг, 0,27 ммоль) при охлаждении на льду с последующим перемешиванием в течение 1 часа. Добавляли воду, и смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (3% метанол/хлороформ) с получением указанного в заголовке соединения (205 мг, 93%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 4,74 (2H, с), 5,94 (1H, с), 6,91 (1H, м), 6,99 (1H, м), 7,38 (2H, д, J=8,4 Гц), 7,53 (2H, д, J=8,4 Гц), 7,62 (1H, д, J=8,0 Гц), 7,76 (1H, дд, J=2,0, 8,0 Гц), 7,98 (1H, м), 8,58 (1H, д, J=2,0 Гц).
ИК (ATR) см-1: 3410, 1489, 1321, 1240, 1147, 1012, 818.
Т.пл.: 151-152°C.
МС m/z: 410 (М++H).
FAB-МС: 410,0444 (вычислено для C19H15ClF2NO3S: 410,0429).
Пример 332: Метил-3-[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]акрилат
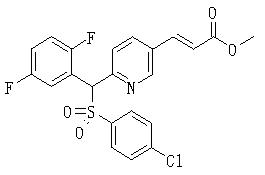
К раствору в диоксане (10 мл) 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(1,3-диоксолан-2-ил)пиридина (212 мг, 0,47 ммоль), полученного в примере 330, добавляли 1 н. хлористо-водородную кислоту (10 мл), и смесь перемешивали при комнатной температуре в течение 19 часов. Раствор экстрагировали этилацетатом. Экстракт промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали при пониженном давлении.
Полученный таким образом остаток растворяли в тетрагидрофуране (15 мл), и в атмосфере азота к полученному раствору добавляли метил(трифенилфосфоранилиден)ацетат (188 мг, 0,56 ммоль). Смесь перемешивали в течение 17 часов. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (187 мг, 86%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 3,80 (3H, с), 5,94 (1H, с), 6,50 (1H, д, J=16,0 Гц), 6,91 (1H, м), 6,99 (1H, м), 7,38 (2H, д, J=8,8 Гц), 7,53 (2H, д, J=8,8 Гц), 7,63 (1H, д, J=8,0 Гц), 7,63 (1H, д, J=16,0 Гц), 7,84 (1H, дд, J=2,0, 8,0 Гц), 7,98 (1H, м), 8,70 (1H, д, J=2,0 Гц).
ИК (ATR) см-1: 1710, 1496, 1389, 1327, 1149, 1084, 816, 760.
Т.пл.: 145-146°C.
МС m/z: 464 (М++H).
Пример 333: Метил-3-[6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]пропионат
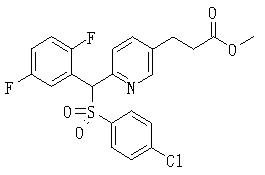
Метил-3-[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]акрилат (160 мг, 0,34 ммоль) растворяли в этаноле (15 мл). Добавляли палладий на угле (30 мг), и полученную смесь интенсивно перемешивали в атмосфере водорода (1 атм) в течение 24 часов. Реакционную смесь фильтровали и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (94 мг, 58%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 2,63 (2H, т, J=7,6 Гц), 2,95 (2H, т, J=7,6 Гц), 3,65 (3H, с), 5,89 (1H, с), 6,90 (1H, м), 6,97 (1H, м), 7,36 (2H, д, J=8,4 Гц), 7,53 (2H, д, J=8,4 Гц), 7,55 (2H, м), 8,00 (1H, м), 8,45 (1H, д, J=1,6 Гц).
ИК (ATR) см-1: 1731, 1489, 1319, 1225, 1147, 821.
Т.пл.: 121-123°C.
МС m/z: 466 (М++H).
Пример 334: 3-[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]пропионовая кислота
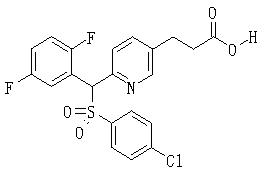
В тетрагидрофуране (5 мл) растворяли метил-3-[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]пропионат (92 мг, 0,20 ммоль). Добавляли водный раствор (3 мл) гидроксида лития (23 мг, 0,5 ммоль), и смесь перемешивали в течение 2 часов. После добавления 10% бисульфита натрия смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении. Полученный таким образом остаток кристаллизовали из этанола с получением указанного в заголовке соединения (67 мг, 75%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 2,69 (2H, т, J=7,6 Гц), 2,96 (2H, т, J=7,6 Гц), 5,92 (1H, с), 6,90 (1H, м), 6,98 (1H, м), 7,36 (2H, д, J=8,4 Гц), 7,52 (2H, д, J=8,4 Гц), 7,56 (2H, м), 7,99 (1H, м), 8,47 (1H, д, J=2,4 Гц).
ИК (ATR) см-1: 1704, 1489, 1309, 1216, 1149, 1081, 827.
Т.пл.: 158-160°C.
МС m/z: 452 (М++H).
Элементный анализ. Вычислено для C21H16ClF2NO4S: C, 55,82%; H, 3,57%; N, 3,10%; S, 7,10%; Cl, 7,85%; F, 8,41%. Найдено: C, 55,70%; H, 3,75%; N, 3,19%; S, 7,12%; Cl, 8,64%; F, 8,11%.
Пример 335: [6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]карбальдегид
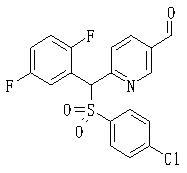
К раствору в 1,4-диоксане (30 мл) 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(1,3-диоксолан-2-ил)пиридина (602 мг, 1,3 ммоль), полученного в примере 330, добавляли 1 н. хлористо-водородную кислоту (30 мл). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. Раствор экстрагировали этилацетатом с последующим последовательным промыванием водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Раствор сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (530 мг, 98%) в виде игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 6,01 (1H, с), 6,94 (1H, м), 7,01 (1H, м), 7,40 (2H, д, J=8,4 Гц), 7,54 (2H, д, J=8,4 Гц), 7,81 (1H, д, J=8,4 Гц), 7,97 (1H, м), 8,20 (1H, дд, J=2,0, 8,4 Гц), 9,05 (1H, д, J=2,0 Гц), 10,12 (1H, с).
ИК (ATR) см-1: 1708, 1489, 1376, 1322, 1151, 1117, 756.
Пример 336: 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(пиперидин-1-илметил)пиридин
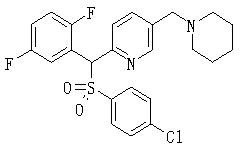
К раствору в метиленхлориде (5 мл) [6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]карбальдегида (82 мг, 0,2 ммоль) и пиперидина (40 мкл, 0,4 ммоль) добавляли уксусную кислоту (23 мкл, 0,4 ммоль) и триацетоксиборгидрид натрия (85 мг, 0,4 ммоль) при комнатной температуре. Смесь перемешивали в течение 3 часов. После гашения реакции добавлением насыщенного водного раствора бикарбоната натрия смесь разбавляли этилацетатом (80 мл). Органический слой, полученный отделением, промывали водой и насыщенным раствором соли, сушили и затем концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с последующей кристаллизацией из этанола с получением указанного в заголовке соединения (89 мг, 93%).
1H-ЯМР (400 МГц, CDCl3) δ: 1, 5-1,6 (6H, м), 2,3-2,4 (4H, м), 3,45 (2H, с), 5,91 (1H, с), 6,90 (1H, м), 6,98 (1H, м), 7,35 (2H, д, J=8,4 Гц), 7,52 (2H, д, J=8,4 Гц), 7,53 (1H, м), 7,7 (1H, шир.), 8,02 (1H, м), 8,49 (1H, д, J=2,4 Гц).
ИК (ATR) см-1: 1583, 1487, 1321, 1149, 827, 725.
Т.пл.: 113-114°C.
МС m/z: 477 (М++H).
Элементный анализ. Вычислено для C24H23ClF2N2O2S: C, 60,44%; H, 4,86%; N, 5,87%; S, 6,72%; Cl, 7,43%; F, 7,97%. Найдено: C, 59,87%; H, 4,81%; N, 5,83%; S, 6, 87%; Cl, 7,55%; F, 8,02%.
Пример 337: 4-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]морфолин
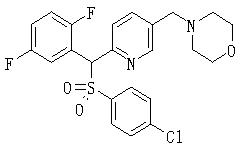
К раствору в метиленхлориде (5 мл) [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегида (82 мг, 0,2 ммоль), полученного в примере 335, и морфолина (35 мкл, 0,4 ммоль) добавляли уксусную кислоту (23 мкл, 0,4 ммоль) и триацетоксиборгидрид натрия (85 мг, 0,4 ммоль) при комнатной температуре. Смесь перемешивали в течение 3 часов. После добавления насыщенного водного раствора бикарбоната натрия для гашения реакции добавляли этилацетат (80 мл) для разбавления реакционной смеси. Органический слой, полученный отделением, промывали водой и насыщенным раствором соли, сушили и концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с последующей кристаллизацией из этанола с получением указанного в заголовке соединения (90 мг, 94%).
1H-ЯМР (400 МГц, CDCl3) δ: 2,4 (4H, м), 3,49 (2H, с), 3,6 (4H, м), 5,92 (1H, с), 6,90 (1H, м), 6,98 (1H, м), 7,36 (2H, д, J=8,4 Гц), 7,53 (2H, д, J=8,4 Гц), 7,57 (1H, д, J=8,0 Гц), 7,71 (1H, шир.д, J=8,0 Гц), 8,02 (1H, м), 8,53 (1H, д, J=2,0 Гц).
ИК (ATR) см-1: 1583, 1484, 1321, 1149, 1116, 827, 725.
Т.пл.: 120-121°C.
МС m/z: 479 (М++H).
Элементный анализ. Вычислено для C22H21ClF2N2O3S: C, 57,68%; H, 4,42%; N, 5,85%; S, 6,70%; Cl, 7,40%; F, 7,93%. Найдено: C, 57,41%; H, 4,43%; N, 5,90%; S, 6, 82%; Cl, 7,52%; F, 7,91%.
Пример 338: [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновая кислота
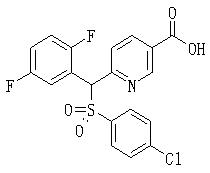
К раствору в трет-бутаноле (3,0 мл) [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегида (110 мг, 0,27 ммоль), полученного в примере 335, добавляли 2-метил-2-бутен (143 мкл, 1,35 ммоль). К полученной суспензии добавляли последовательно водный раствор (0,6 мл) дигидрофосфата натрия (32,4 мг, 0,27 ммоль) и хлорит натрия (98 мг, 1,08 ммоль) в течение 2 часов. К реакционной смеси добавляли воду (30 мл) и уксусную кислоту (1 мл). Смесь экстрагировали этилацетатом (100 мл). Экстракт промывали насыщенным раствором соли, сушили и подвергали дистилляции при пониженном давлении. Полученный таким образом остаток кристаллизовали из этанола с получением указанного в заголовке соединения (71 мг, 62%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 6,03 (1H, с), 6,96 (1H, м), 7,03 (1H, м), 7,42 (2H, д, J=8,4 Гц), 7,56 (2H, д, J=8,4 Гц), 7, 73 (1H, д, J=8,4 Гц), 7,97 (1H, м), 8,35 (1H, дд, J=2,0, 8,4 Гц), 9,20 (1H, д, J=2,0 Гц).
ИК (ATR) см-1: 1685, 1596, 1498, 1322, 1153, 1085, 754.
Т.пл.: >230°C.
МС m/z: 424(М++H).
Элементный анализ. Вычислено для C19H12ClF2NO4S: C, 53,84%; H, 2,85%; N, 3,30%; S, 7,57%; Cl, 8,37%; F, 8,97%. Найдено: C, 53,47%; H, 2,81%; N, 3,46%; S, 7,65%; Cl, 8,49%; F, 9,00%.
Пример 339: 3-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-N-оксид
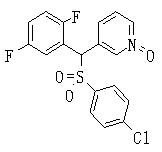
К раствору в метиленхлориде (15 мл) 3-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридина (162 мг, 0,427 ммоль), полученного в примере 141, добавляли 3-хлорпербензойную кислоту (81 мг, 0,47 ммоль), и смесь перемешивали в течение 24 часов. Реакционную смесь разбавляли эфиром (60 мл) с последующим промыванием насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли. После сушки раствор фильтровали и фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали хроматографии на силикагеле (этилацетат) с получением указанного в заголовке соединения (68 мг, 40%). Соединение кристаллизовали из этанола с получением бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 5,58 (1H, с), 6,95 (1H, м), 7,03 (1H, м), 7,29 (1H, дд, J=6,6, 8,0 Гц), 7,42 (2H, д, J=8,6 Гц), 7,57 (1H, д, J=8,0 Гц), 7,62 (2H, д, J=8,4 Гц), 7,66 (1H, м), 8,10 (1H, д, J=6,6 Гц), 8,29 (1H, с).
ИК (ATR) см-1: 1573, 1492, 1438, 1329, 1248, 1151, 1081, 820.
Т.пл.: 183-184°C.
МС m/z: 396(М++H).
Элементный анализ. Вычислено для C18 H12ClF2NO3S: C, 54,62%; H, 3,06%; N, 3,54%; S, 8,10%; Cl, 8,96%; F, 9,60%. Найдено: C, 54,19%; H, 2,99%; N, 3,67%; S, 8,27%; Cl, 8,92%; F, 9,53%.
Пример 340: 4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-N-оксид
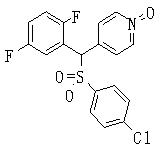
К раствору в метиленхлориде (15 мл) 4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридина (221 мг, 0,58 ммоль), полученного в примере 142, добавляли 3-хлорпербензойную кислоту (100 мг, 0,58 ммоль), и смесь перемешивали в течение 20 часов. Реакционную смесь разбавляли эфиром (60 мл) с последующим промыванием насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли. Раствор сушили и затем фильтровали. Затем фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали хроматографии на силикагеле (этилацетат) с получением указанного в заголовке соединения (183 мг, 80%). Соединение кристаллизовали из этанола с получением бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 5,62 (1H, с), 6,97 (1H, м), 7,06 (1H, м), 7,42 (2H, д, J=7,2 Гц), 7,44 (2H, д, J=8,8 Гц), 7,60 (2H, д, J=8,8 Гц), 7,68 (1H, м), 8,17 (2H, д, J=7,2 Гц).
ИК (ATR) см-1: 1479, 1322, 1263, 1149, 1081, 813.
Т.пл.: 211-212°C.
МС m/z: 396(М++H).
Элементный анализ. Вычислено для C18H12ClF2NO3S: C, 54,62%; H, 3,06%; N, 3,54%; S, 8,10%; Cl, 8,96%; F, 9,60%. Найдено: C, 54,19%; H, 2,92%; N, 3,65%; S, 8,26%; Cl, 8,99%; F, 9,61%.
Ссылочный пример 48: 3-хлор-4-[(2,5-дифторфенил)гидроксиметил]пиридин
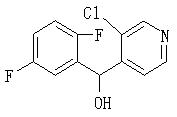
К раствору в тетрагидрофуране (14 мл) диизопропиламина (1,4 мл, 10 ммоль) добавляли н-бутиллитий (6,3 мл, 1,59 М раствор в гексане) при -78°С, и смесь перемешивали в течение 10 минут. Затем к полученной смеси добавляли 3-хлорпиридин (1,13 г, 10 ммоль). Спустя тридцать минут к смеси добавляли 2,5-дифторбензальдегид (1,09 мл, 10 ммоль). Смесь нагревали постепенно до 0°С, и перемешивание проводили при этой температуре еще в течение 10 минут. Добавляли водный раствор хлорида аммония, и смесь разбавляли этилацетатом (80 мл). Органический слой, полученный разделением, промывали насыщенным раствором соли и затем сушили. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный таким образом осадок растирали с этанолом с получением указанного в заголовке соединения (1,33 г, 52%).
1H-ЯМР (400 МГц, CDCl3) δ: 4,87 (1H, шир.), 6,26 (1H, с), 6,90-7,02 (3H, м), 7,58 (1H, д, J=4,8 Гц), 8,47 (1H, с), 8,48 (1H, д, J=4,8 Гц).
ИК (ATR) см-1: 3178, 1592, 1490, 1174, 1039.
Т.пл.: 169-170°C.
МС m/z: 255(М+).
Ссылочный пример 49: 2,5-дихлор-4-[(2,5-дифторфенил)гидроксиметил]пиридин
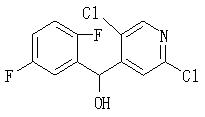
К раствору в тетрагидрофуране (14 мл) диизопропиламина (1,4 мл, 10 ммоль) добавляли н-бутиллитий (6,3 мл, 1,59 М раствор в гексане) при -78°С. После перемешивания в течение 10 минут добавляли 2, 5-дихлорпиридин (1,48 г, 10 ммоль). Спустя тридцать минут к смеси добавляли 2,5-дифторбензальдегид (1,09 мл, 10 ммоль). Полученную смесь нагревали постепенно до 0°С, и перемешивание проводили при этой температуре еще в течение 10 минут. Добавляли водный раствор хлорида аммония, и смесь разбавляли этилацетатом (80 мл). Органический слой отделяли, промывали насыщенным раствором соли и сушили. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный таким образом осадок растирали с этанолом с получением указанного в заголовке соединения (1,93 г, 67%).
1H-ЯМР (400 МГц, CDCl3) δ: 2,64 (1H, д, J=4,0 Гц), 6,28 (1H, д, J=4,0 Гц), 6,89 (1H, м), 7,02 (2H, м), 7,64 (1H, с), 8,30 (1H, с).
ИК (ATR) см-1: 3226, 1579, 1492, 1243, 1110, 1062.
Т.пл.: 160-161°C.
МС m/z: 289(М+).
Пример 341: 3-хлор-4-[(4-хлорфенилтио)(2, 5-дифторфенил)метил]пиридин
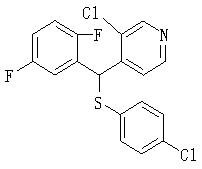
После растворения 3-хлор-4-[(2, 5-дифторфенил)гидроксиметил]пиридина (511 мг, 2,0 ммоль), полученного в ссылочном примере 48, в тионилхлориде (3,0 мл) добавляли каталитическое количество диметилформамида. Полученную смесь перемешивали в течение 17 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли толуол, и смесь концентрировали дополнительно.
Остаток растворяли в диметилформамиде (10 мл) с последующим добавлением 4-хлорбензолтиола (375 мг, 2,6 ммоль) и карбоната калия (414 мг, 3 ммоль) в атмосфере азота. Полученную смесь перемешивали при 60°С в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры добавляли диэтиловый эфир (60 мл). Смесь промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=8:1) с получением указанного в заголовке соединения (196 мг, 26%) в виде твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 6,07 (1H, с), 6,95-7,08 (2H, м), 7,18 (1H, м), 7,23 (2H, д, J=8,8 Гц), 7,26 (2H, д, J=8,8 Гц), 7,58 (1H, д, J=5,2 Гц), 8,51 (1H, д, J=5,2 Гц), 8,58 (1H, с).
ИК (ATR) см-1: 1577, 1473, 1211, 1089, 1012, 817.
Т.пл.: 70-72°C.
МС m/z: 382(М+ +1).
Пример 342: 2,5-дихлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин
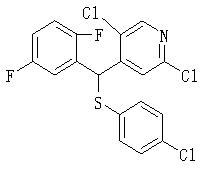
После растворения 2,5-дихлор-4-[(2,5-дифторфенил)гидроксиметил]пиридина (580 мг, 2,0 ммоль), полученного в ссылочном примере 49, в тионилхлориде (3,0 мл) добавляли каталитическое количество диметилформамида, и полученную смесь перемешивали в течение 17 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли толуол, и смесь концентрировали дополнительно.
Остаток растворяли в диметилформамиде (10 мл) с последующим добавлением 4-хлорбензолтиола (375 мг, 2,6 ммоль) и карбоната калия (414 мг, 3 ммоль) в атмосфере азота. Полученную смесь перемешивали при 60°С в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры добавляли диэтиловый эфир (60 мл). Смесь промывали водой и насыщенным раствором соли. Органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=10:1) с получением указанного в заголовке соединения (484 мг, 58%) в виде твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 5,96 (1H, с), 6,95-7,04 (2H, м), 7,01 (1H, м), 7,23 (2H, д, J=8, 8 Гц), 7,26 (2H, д, J=8,8 Гц), 7,54 (1H, с), 8,33 (1H, с).
ИК (ATR) см-1: 1570, 1495, 1473, 1326, 1207, 1090, 1012, 816.
Т.пл.: 128-129°C.
МС m/z: 416 (М++1).
Пример 343: 3-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин
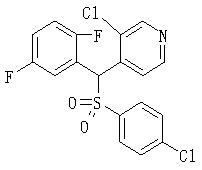
Тетрагидрат гексааммонийгептамолибдата (6-мг) и 30% водный раствор пероксида натрия (6 мл) последовательно добавляли к раствору 3-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (122 мг, 0,32 ммоль), полученного в примере 341, в метаноле (12 мл). Полученную смесь перемешивали в течение 24 часов. Реакционную смесь разбавляли этилацетатом. Раствор промывали водой и насыщенным раствором соли и концентрировали при пониженном давлении. Остаток кристаллизовали из этанола с получением указанного в заголовке соединения (103 мг, 78%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 6,23 (1H, с), 6,94 (1H, м), 7,06 (1H, м), 7,41 (2H, д, J=8,0 Гц), 7,53 (1H, м), 7,59 (2H, д, J=8,0 Гц), 8,11 (1H, д, J=5,2 Гц), 8,55 (1H, с), 8,60 (1H, д, J=5,2 Гц).
ИК (ATR) см-1: 1577, 1490, 1321, 1311, 1151, 1083, 821.
Т.пл.: 160-161°C.
МС m/z: 414(М++H).
Элементный анализ. Вычислено для C18H11Cl2F2NO2S: C, 52,19%; H, 2,68%; N, 3,38%; S, 7,74%; Cl, 17,12%; F, 9,17%. Найдено: C, 52,17%; H, 2,69%; N, 3,44%; S, 7,96%; Cl, 17,12%; F, 9,00%.
Пример 344: 3-хлор-4-[(4-хлорфенилсульфинил)(2,5-дифторфенил)метил]пиридин
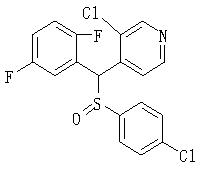
После добавления 3-хлорпербензойной кислоты (33 мг, 0,20 ммоль) к раствору 3-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (75 мг, 0,20 ммоль), полученного в примере 341, в метиленхлориде (10 мл), смесь перемешивали в течение 3 часов при охлаждении на льду. Реакционную смесь разбавляли эфиром (80 мл). Раствор промывали водой и насыщенным раствором соли и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (48 мг, 60%) в виде дистереомерной смеси (1:1).
1H-ЯМР (400 МГц, CDCl3) δ: 5,53 (1/2H, с), 5,66 (1/2H, с), 6,83 (1/2H, с), 6,95-7,08 (3/2H, м), 7,23 (1/2H, м), 7,25 (1H, д, J=8,4 Гц), 7,26 (1H, д, J=8,4 Гц), 7,34 (1H, д, J=8, 4 Гц), 7,36 (1H, д, J=8,4 Гц), 7,37 (1/2H, м), 7,76 (1/2H, д, J=5,2 Гц), 7,98 (1/2H, д, J=5,2 Гц), 8,47 (1/2H, с), 8,56 (1/2H, д, J=5,2 Гц), 8,60 (1/2H, с), 8,61 (1/2H, д, J=5,2 Гц).
ИК (ATR) см-1: 1577, 1490, 1396, 1168, 1049, 1033, 817.
МС m/z: 398 (М++H).
FAB-МС: 397,9992 (вычислено для C18H12Cl2F2NOS: 397,9985).
Пример 345: 0,5 гидрат 2,5-дихлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридина
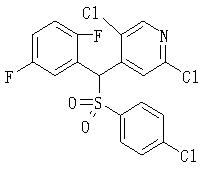
После добавления 3-хлорпербензойной кислоты (62 мг, 0,36 ммоль) к раствору 2,5-дихлор-4-[(4-хлорфенилтио)(2, 5-дифторфенил)метил]пиридина (60 мг, 0,14 ммоль), полученного в примере 342, в метиленхлориде (3,0 мл), смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь разбавляли эфиром (80 мл). Раствор промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) и кристаллизовали из гексана с получением указанного в заголовке соединения (55 мг, 88%).
1H-ЯМР (400 МГц, CDCl3) δ: 6, 15 (1H, с), 6,93 (1H, м), 7,05 (1H, м), 7,44 (2H, д, J=8,8 Гц), 7,50 (1H, м), 7,59 (2H, д, J=8,8 Гц), 8,13 (1H, с), 8,55 (1H, с), 8,33 (1H, с).
ИК (ATR) см-1: 1569, 1492, 1321, 1147, 1118, 1083, 821.
Т.пл.: 147-148°C.
МС m/z: 448(М++H).
Элементный анализ. Вычислено для C18H10 Cl3F2NO2S.0,5H2O: C, 47,23%; H, 2,42%; N, 3,06%; S, 7,01%; Cl, 23,24%; F, 8,30%. Найдено: C, 47,25%; H, 2,24%; N, 3,21%; S, 7,19%; Cl, 23,25%; F, 8,32%.
FAB-МС: 447,9572 (вычислено для C18H11Cl3F2NO2S: 447,9544).
Пример 346: 4-[5-хлор-4-[(4-хлорфенилтио)(2, 5-дифторфенил)метил]пиридин-2-ил]морфолин
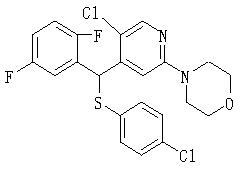
Раствор 2, 5-дихлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (100 мг, 0,24 ммоль), полученного в примере 342, и морфолина (200 мкл) в 1,4 диоксане (1,0 мл) перемешивали в атмосфере азота при 100° С в течение 2 дней. Реакционную смесь охлаждали до комнатной температуры. После разбавления этилацетатом (40 мл) раствор промывали водой и насыщенным раствором соли, сушили и концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (100 мг, 89%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 3,48 (4H, м), 3,82 (4H, м), 6,00 (1H, с), 6,94 (1H, с), 6,94-7,04 (2H, м), 7,09 (1H, м), 7,23 (2H, д, J=8,4 Гц), 7,24 (2H, д, J=8,4 Гц), 8,12 (1H, с).
МС m/z: 467(М++H).
Пример 347: 4-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]морфолин
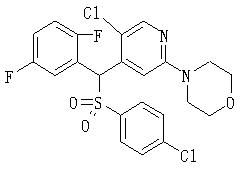
К раствору 4-[5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]морфолина (90 мг, 0,19 ммоль) в метаноле (12 мл) добавляли тетрагидрат гексааммонийгептамолибдата (60 мг) с последующим добавлением 30% водного раствора пероксида водорода (6 мл). Полученную смесь перемешивали в течение 8 часов. После разбавления этилацетатом раствор промывали водой и насыщенным раствором соли и затем концентрировали при пониженном давлении. Остаток подвергали хроматографии на силикагеле (гексан:этилацетат=3:1) и затем кристаллизовали из этанола с получением указанного в заголовке соединения (80 мг, 83%) в виде бесцветных игольчатых кристаллов.
1H-ЯМР (400 МГц, CDCl3) δ: 3,54 (4H, м), 3,84 (4H, м), 6,12 (1H, с), 6,90 (1H, м), 7,02 (1H, м), 7,42 (2H, д, J=8,4 Гц), 7,45 (1H, с), 7,46(1H, м), 7,58 (2H, д, J=8,4 Гц), 8,06 (1H, с).
ИК (ATR) см-1: 1585, 1494, 1475, 1317, 1240, 1145, 1091, 831.
Т.пл.: 180-181°C.
МС m/z: 499(М++H).
Элементный анализ. Вычислено для C22H18Cl2F2N2O3S: C, 52,92%; H, 3,63%; N, 5,61%; S, 6,42%; Cl, 14,20%; F, 7,61%. Найдено: C, 52,68%; H, 3,56%; N, 5,69%; S, 6,70%; Cl, 14,32%; F, 7,97%.
Пример 348: 4-[2-[5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]аминоэтил]морфолин
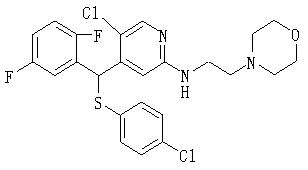
В атмосфере азота раствор 2,5-дихлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (100 мг, 0,24 ммоль), полученного в примере 342, и 4-(2-аминоэтил)морфолина (200 мкл) в 1,4 диоксане (1,0 ил) перемешивали при 100°С в течение 2 дней. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом (40 мл). Раствор промывали водой и насыщенным раствором соли, сушили и затем концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (3% метанол/хлороформ) с получением указанного в заголовке соединения (12 мг, 10%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 2,42 (4H, м), 2,54 (2H, д, J=6,0 Гц), 3,27 (2H, кв, J=6,0 Гц), 3,67 (4H, м), 5,12 (шир, 1H), 5,90 (1H, с), 6,61 (1H, с), 6,86-7,0 (2H, м), 7,06 (1H, м), 7,15 (2H, д, J=8,4 Гц), 7,16 (2H, д, J=8,4 Гц), 7,95 (1H, с).
МС m/z: 510 (М++H).
Пример 349: 4-[2-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]аминоэтил]морфолин-N-оксид
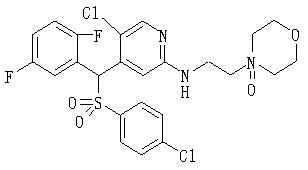
К раствору 4-[2-[5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]аминоэтил]морфолина (11 мг, 0,032 ммоль) в метаноле (12 мл) добавляли тетрагидрат гексааммонийгептамолибдата (10 мг). К полученной смеси добавляли 30% водный раствор пероксида водорода (1 мл) с последующим перемешиванием в течение 8 часов. Реакционную смесь разбавляли этилацетатом. Раствор промывали водой и насыщенным раствором соли. После концентрирования раствора при пониженном давлении остаток очищали хроматографией на силикагеле (3% метанол, раствор 3% трет-бутиламин/хлороформ) с получением указанного в заголовке соединения (5,0 мг, 42%).
1H-ЯМР (400 МГц, CDCl3) δ: 3,2-3,4 (4H, м), 3,54 (2H, м), 3,81 (2H, м), 3,91 (2H, м), 4,44 (2H, м), 6,09 (1H, с), 6,88 (1H, м), 6,98 (1H, м), 7,22 (1H, с), 7,40 (2H, д, J=8,4 Гц), 7,51 (1H, м), 7,60 (2H, д, J=8,4 Гц), 7,94 (1H, с).
ИК (ATR) см-1: 1600, 1494, 1324, 1151, 1085, 754.
МС m/z: 558(М++H).
FAB-МС: 558,0837 (вычислено для C24H24Cl2F2N3O4S: 558,0833).
Пример 350: 5-азидометил-2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин
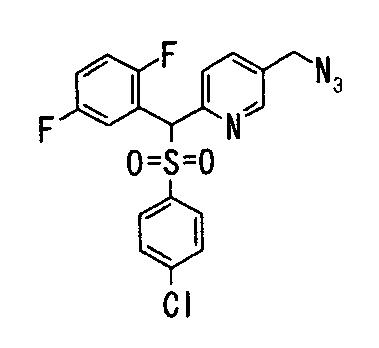
В смеси тетрахлорида углерода (4 мл) и N,N-диметилформамида (16 мл) растворяли 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(гидроксиметил)пиридин (471 мг, 1,15 ммоль), полученный в примере 331. Добавляли азид натрия (112 мг, 1,72 ммоль) и трифенилфосфин (451 мг, 1,72 ммоль), и смесь перемешивали при 90°С в течение 3 часов. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Затем органический слой промывали последовательно водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный таким образом остаток подвергали хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (244 мг, 0,561 ммоль, 49%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 4,42 (2H, с), 5,96 (1H, с), 6,94 (1H, м), 6,99-7,05 (1H, м), 7,40 (2H, д, J=8,8 Гц), 7,55 (2H, д, J=8,8 Гц), 7,60 (1H, д, J=8,1 Гц), 7,72 (1H, дд, J=8,1, 2,0 Гц), 8,02 (1H, м), 8,57 (1H, д, J=2,0 Гц).
МС m/z: 435 (М++H).
Пример 351: [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламин
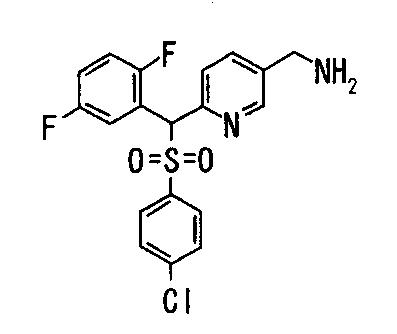
В атмосфере аргона 5-азидометил-2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин (77 мг, 0,177 ммоль), палладий на угле (14 мг) и этилацетат (2 мл) добавляли к этанолу (10 мл). Полученную смесь перемешивали в течение 50 минут в атмосфере водорода (1 атм). После фильтрования фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси дихлорметан:метанол=10:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (28 мг, 0, 0685 ммоль, 39%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,84 (2H, шир.с), 3,92 (2H, с), 5,94 (1H, с), 6,92 (1H, м), 7,03-6,98 (1H, м), 7,39 (2H, д, J=8,3 Гц), 7,56 (2H, д, J=8,3 Гц), 7,60 (1H, д, J=8,1 Гц), 7,74 (1H, д, J=8,1 Гц), 8,01 (1H, м), 8,57 (1H, с).
МС m/z: 409 (М++H).
Пример 352: Трет-бутил-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]карбамат
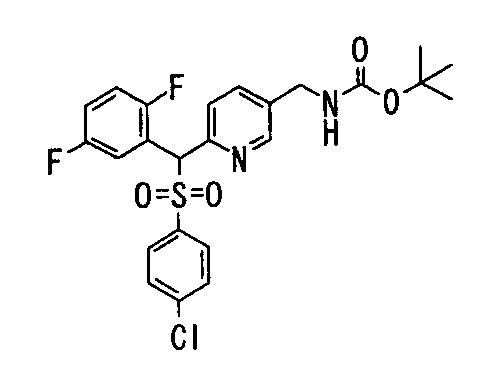
5-азидометил-2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин (230 мг, 0,529 ммоль), полученный в примере 350, и палладий на угле (46 мг) добавляли к смеси этилацетата (15 мл) и этанола (15 мл). Полученную смесь перемешивали в течение 45 минут в атмосфере водорода (1 атм). После фильтрования фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток растворяли в дихлорметане (5 мл). К полученному раствору добавляли триэтиламин (70 мкл, 0,499 ммоль) и ди-трет-бутилкарбонат (174 мг, 0,996 ммоль). Смесь перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (78 мг, 0,153 ммоль, 37%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,45 (9H, с), 4,34 (2H, д, J=5,6 Гц), 4,91 (1H, шир.с), 5,93 (1H, с), 6,91 (1H, м), 6,98-7,04 (1H, м), 7,39 (2H, д, J=8,8 Гц), 7, 54 (2H, д, J=8,8 Гц), 7,59 (1H, д, J=7,8 Гц), 7,67 (1H, дд, J=7,8, 2,2 Гц), 7,99 (1H, м), 8,53 (1H, д, J=2,2 Гц).
ИК (ATR) см-1: 1700, 1573, 1492, 1394, 1365, 1322, 1276, 1241, 1149, 1087, 1047, 1014.
МС m/z: 509 (М++H).
Пример 353: Трет-бутил-[6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]метил]-N-(трет-бутоксикарбонил)карбамат
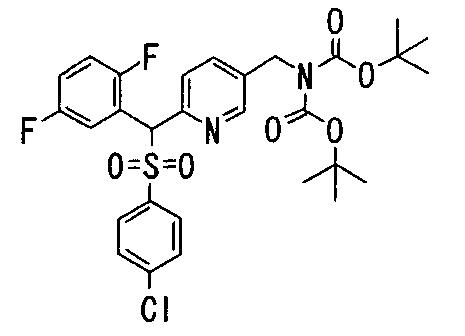
В атмосфере азота диизопропилазодикарбоксилат (128 мкл, 0,653 ммоль) добавляли к раствору 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(гидроксиметил)пиридина (178 мг, 0,435 ммоль), полученного в примере 331, ди-трет-бутилиминодикарбоксилата (142 мг, 0,653 ммоль) и трифенилфосфина (171 мг, 0,653 ммоль) в тетрагидрофуране (5 мл), и полученную смесь перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Затем органический слой промывали последовательно водой и насыщенным раствором соли. Полученный таким образом органический слой сушили над сульфатом натрия и концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (78 мг, 0,128 ммоль, 32%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,48 (18H, с), 4,78 (2H, с), 5,94 (1H, с), 6,93 (1H, тд, J=9,0, 4,4 Гц), 6,98-7,04 (1H, м), 7,38 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 7,58 (1H, д, J=8,1 Гц), 7,71 (1H, дд, J=8,1, 2,4 Гц), 7,96-8,00 (1H, м), 8,57 (1H, д, J=2,4 Гц).
ИК (ATR) см-1: 2979, 1795, 1727, 1695, 1492, 1392, 1367, 1328, 1255, 1224, 1132, 1087, 1033.
МС m/z: 609 (М++H).
Пример 354: Гидрохлорид [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина
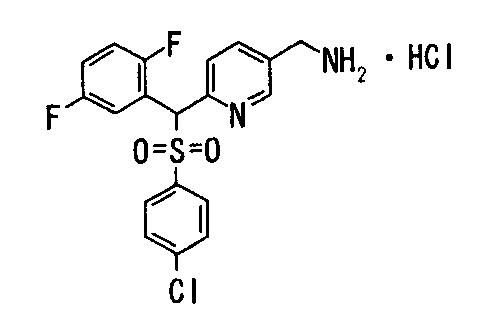
Концентрированную хлористо-водородную кислоту (2 мл) добавляли к раствору трет-бутил-[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-N-(трет-бутоксикарбонил)карбамата (70 мг, 0,115 ммоль) в этаноле (2 мл), и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этанол, и смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (51 мг, 0,115 ммоль, 100%) в виде белого порошка.
1H-ЯМР (400 МГц, CD3OD) δ: 4,18 (2H, с), 6,22 (1H, с), 7,03 (1H, тд, J=9,3, 4,4 Гц), 7,11-7,17 (1H, м), 7,52 (2H, д, J=8,8 Гц), 7,64 (2H, д, J=8,8 Гц), 7,79 (1H, д, J=8,3 Гц), 7,92 (1H, дд, J=8,3, 2,2 Гц), 8,05-8,09 (1H, м), 8,71 (1H, д, J=2,2 Гц).
ИК (ATR) см-1: 1600, 1571, 1492, 1394, 1349, 1313, 1278, 1232, 1170, 1147, 1079, 1037, 1012.
МС (m/z): 409 (М++H).
Элементный анализ. Вычислено для C20H15 ClF2N2O2S·HCl: C, 51,25; H, 3,62; Cl, 15,92; F, 8,53; N, 6,29. Найдено: C, 51,11; H, 3,57; Cl, 15,50; F, 8,39; N, 5,83.
Пример 355: N-ацетил-N-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]ацетамид (соединение А) и N-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]ацетамид (соединение В)
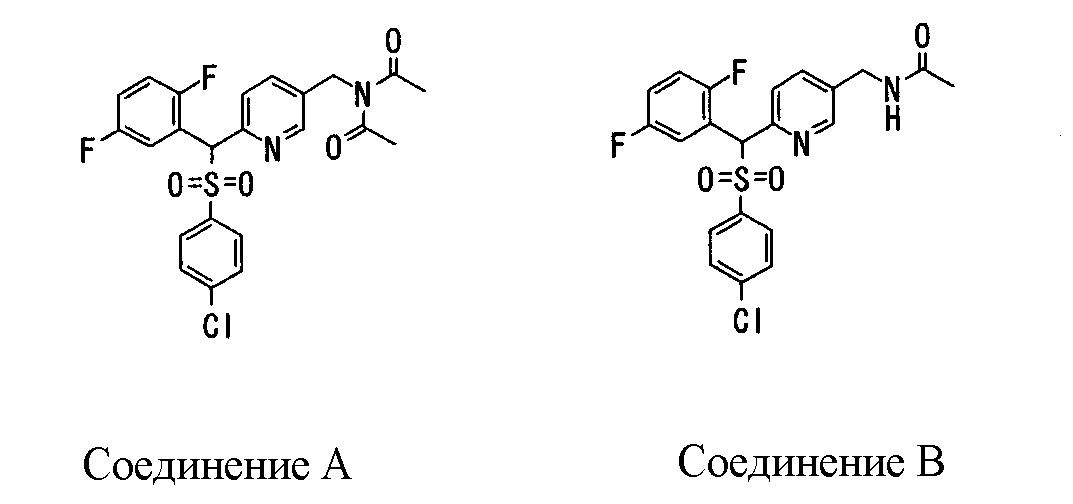
При охлаждении на льду N-метилморфолин (26 мкл, 0,234 ммоль) и ацетилхлорид (16 мкл, 0,234 ммоль) добавляли к раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (40 мг, 0,0978 ммоль), полученного в примере 351, в дихлорметане (3 мл). Полученную смесь перемешивали при комнатной температуре в течение 16 часов. К реакционной смеси добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали последовательно водой и насыщенным раствором соли, сушили над сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=2:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения А (соединения низкой полярности) (15 мг, 0,0304 ммоль, 40%) и указанного в заголовке соединения В (соединения высокой полярности) (12 мг, 0,0266 ммоль, 27%) в виде белого порошка.
Соединение А
1H-ЯМР (400 МГц, CDCl3) δ: 2,43 (6H, с), 4,96 (2H, с), 5,93 (1H, с), 6,91 (1H, м), 6,98-7,03 (1H, м), 7,39 (2H, д, J=8,5 Гц), 7,54-7,61 (2H, м), 7,55 (2H, д, J=8,5 Гц), 8,02 (1H, м), 8,51 (1H, д, J=1, 7 Гц).
ИК (ATR) см-1: 1712, 1689, 1573, 1492, 1423, 1369, 1319, 1267, 1201, 1149, 1079, 1029.
Т.пл.: 60-64°C.
МС m/z: 493 (М++H).
Соединение В
1H-ЯМР (400 МГц, CDCl3) δ: 2,03 и 2,04 (3H, ротамеры), 4,42-4,50 (2H, м), 5,89 (1H, шир.с), 5,93 (1H, с), 6,92 (1H, тд, J=9,1, 4,4 Гц), 6,97-7,02 (1H, м), 7,41 (2H, д, J=8,1 Гц), 7,57 (2H, д, J=8,1 Гц), 7,61 (1H, д, J=8,1 Гц), 7,71 (1H, д, J=8,1 Гц), 7,98-8,03 (1H, м), 8,54 (1H, с).
ИК (ATR) см-1: 1650, 1673, 1525, 1486, 1430, 1396, 1355, 1319, 1280, 1230, 1147, 1085, 1016.
Т.пл.: 177-178°C.
МС m/z: 451 (М++H).
Пример 356: N-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-N',N'-диметилсульфамид
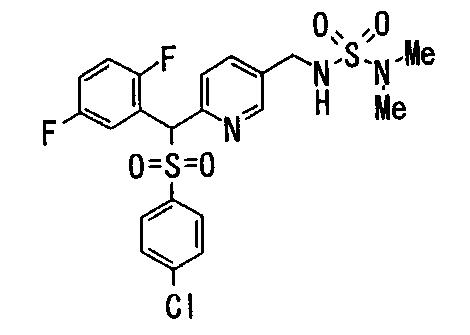
К раствору гидрохлорида 6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (60 мг, 0,135 ммоль) в дихлорметане (5 мл) добавляли N-метилморфолин (180 мкл, 1,62 ммоль), 4-диметиламинопиридин (10 мг, 0,0819 ммоль) и N,N-диметилсульфамоилхлорид (66 мкл, 0,609 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 часов. К реакционной смеси добавляли воду с последующей экстракцией дихлорметаном. Органический слой промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Полученный органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=3:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения (48 мг, 0,0930 ммоль, 70%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,76 (6H, с), 4,29 (2H, д, J=6,4 Гц), 4,43 (1H, т, J=6,4 Гц), 5,94 (1H, с), 6,92 (1H, м), 6, 98-7,04 (1H, м), 7,41 (2H, д, J=8,6 Гц), 7,58 (2H, д, J=8,6 Гц), 7,66 (1H, д, J=8,1 Гц), 7,79 (1H, дд, J=8,1, 2,5 Гц), 8,02 (1H, м), 8,61 (1H, д, J=2,5 Гц).
Т.пл.: 177-178° C.
МС m/z: 516 (М++H).
Пример 357: Этил-2-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламино]-2-оксоацетат
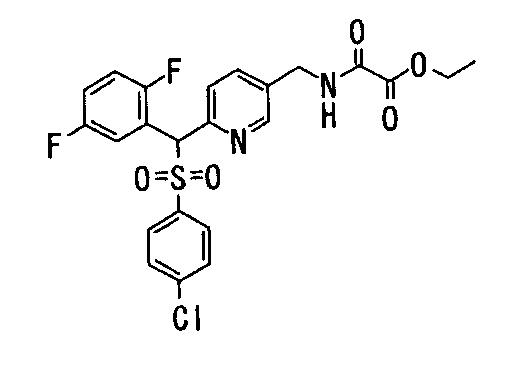
При охлаждении на льду N-метилморфолин (10 мкл, 0,0881 ммоль) и этилхлорглиоксилат (9 мкл, 0,0807 ммоль) добавляли к [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламину (30 мг, 0,0734 ммоль), полученному в примере 351, в дихлорметане (4 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду. Затем органический слой промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=3:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения (28 мг, 0,0550 ммоль, 76%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 1,39 (3H, т, J=7,1 Гц), 4,37 (2H, кв, J=7,1 Гц), 4,55 (2H, д, J=5,9 Гц), 5,94 (1H, с), 6,89-6,94 (1H, м), 6,98-7,05 (1H, м), 7,40 (2H, д, J=8,3 Гц), 7,56 (2H, д, J=8,3 Гц), 7,53 (1H, шир.с), 7,62 (1H, д, J=8,1 Гц), 7,72 (1H, д, J=8,1 Гц), 7,97-8,03 (1H, м), 8,58 (1H, с).
Т.пл.: 193-194°C.
МС m/z: 509 (М++H).
Пример 358: N-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-2-(4-метилфенилсульфониламино)ацетамид
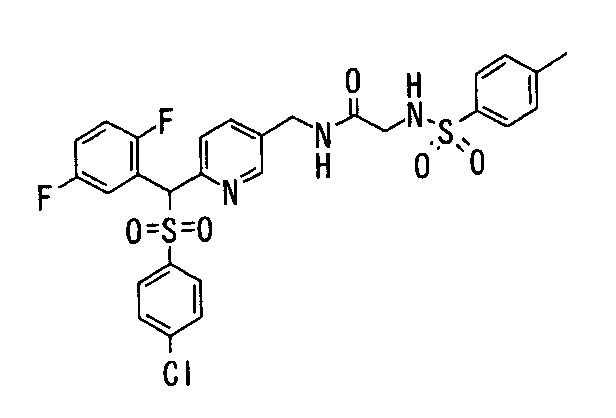
Триэтиламин (45 мкл, 0,324 ммоль), 4-диметиламинопиридин (5 мг, 0,0449 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (21 мг, 0,108 ммоль) и N-п-тозилглицин (25 мг, 0,108 ммоль) добавляли к раствору гидрохлорида [6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]метиламина (40 мг, 0,0898 ммоль), полученного в примере 354, в дихлорметане (6 мл). Полученную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли дихлорметаном с последующим последовательным промыванием водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Полученный таким образом органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=2:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (41 мг, 0,0661 ммоль, 73%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,44 (3H, с), 3,59 (2H, д, J=6,4 Гц), 4,44 (2H, дд, J=6,1, 2,8 Гц), 5,42 (1H, т, J=6,1 Гц), 5,95 (1H, с), 6,91 (1H, м), 6,96-7,03 (2H, м), 7,33 (2H, д, J=8,3 Гц), 7,41 (2H, д, J=8,6 Гц), 7,57 (2H, д, J=8,6 Гц), 7,58 (1H, д, J=8,1 Гц), 7,66 (1H, дд, J=8,1, 2,4 Гц), 7,74 (2H, д, J=8,3 Гц), 8,01 (1H, м), 8,49 (1H, д, J=2,4 Гц).
Т.пл.: 217-218°C.
МС m/z: 620 (М++H).
Пример 359: N-[[6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]метил]-2-диметиламиноацетамид
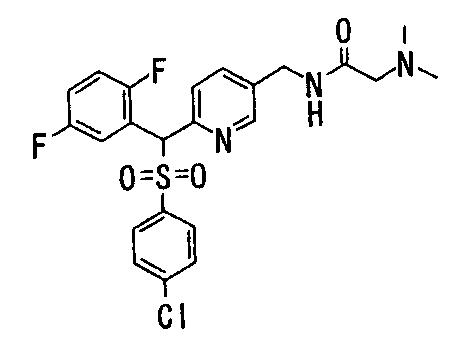
Триэтиламин (12 мкл, 0,0881 ммоль), 4-диметиламинопиридин (5 мг, 0,0367 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (17 мг, 0,0881 ммоль) и N,N-диметилглицин (9 мг, 0,0881 ммоль) добавляли к раствору гидрохлорида [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (30 мг, 0,0734 ммоль), полученного в примере 351, в дихлорметане (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь разбавляли дихлорметаном с последующим последовательным промыванием водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Полученный таким образом органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=1:4, концентрировали при пониженном давлении с получением указанного в заголовке соединения (21 мг, 0,0425 ммоль, 58%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,30 (6H, с), 3,01 (2H, с), 4,50 (2H, д, J=6,1 Гц), 5,93 (1H, с), 6,91 (1H, м), 6,98-7,04 (1H, м), 7,40 (2H, д, J=8,6 Гц), 7,55 (2H, д, J=8,6 Гц), 7,60 (1H, д, J=8,1 Гц), 7,62 (1H, шир.с), 7,69 (1H, дд, J=8,1, 2,4 Гц), 8,02 (1H, м), 8,56 (1H, д, J=2,4 Гц).
Т.пл.: 177-179°C.
МС m/z: 494 (М++H).
Пример 360: N-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-4-(формилметиламино)бензамид
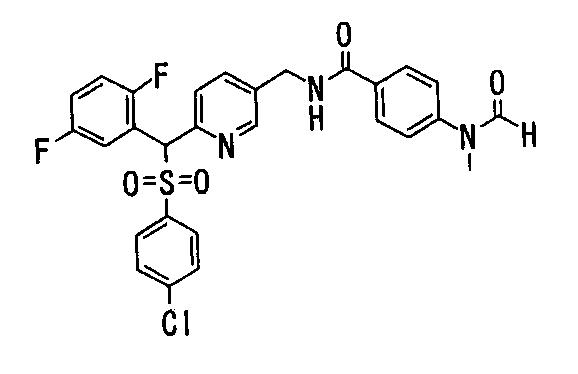
Триэтиламин (21 мкл, 0,147 ммоль), 4-диметиламинопиридин (7 мг, 0,0610 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (28 мг, 0,147 ммоль) и N-формил-4-(метиламино)бензойную кислоту (26 мг, 0,147 ммоль) добавляли к раствору гидрохлорида [6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]метиламина (30 мг, 0,0734 ммоль), полученного в примере 351, в дихлорметане (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли дихлорметаном с последующим последовательным промыванием водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Полученный таким образом органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=3:7, концентрировали при пониженном давлении с получением указанного в заголовке соединения (60 мг, 0,105 ммоль, 87%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 3,35 (3H, с), 4,67-4,71 (2H, м), 5,94 (1H, с), 6,53 (1H, шир.с), 6,90 (1H, м), 6,97-7,03 (1H, м), 7,25 (2H, д, J=8,6 Гц), 7,40 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 7,63 (1H, д, J=8,1 Гц), 7,78 (1H, дд, J=8,1, 2,2 Гц), 7,86 (2H, д, J=8,6 Гц), 8,03 (1H, м), 8,61 (1H, с), 8,64 (1H, д, J=2,2 Гц).
МС m/z: 570 (М++H).
Пример 361: N-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-4-(метилтиоформиламино)тиобензамид
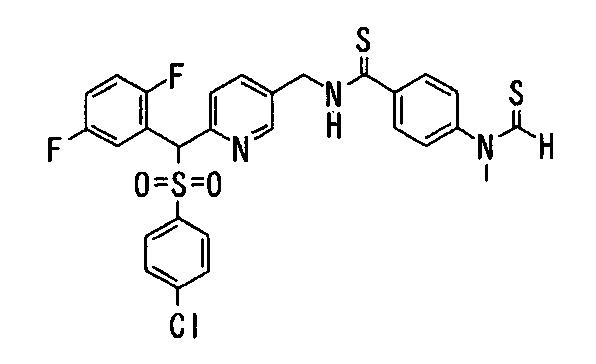
В атмосфере аргона реагент Лавессона (69 мг, 0,169 ммоль) добавляли к раствору N-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-4-(формилметиламино)бензамида (46 мг, 0,0807 ммоль) в толуоле (5 мл), и смесь нагревали при кипячении с обратным холодильником в течение 12 часов. После охлаждения при комнатной температуре реакционную смесь концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=4:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (40 мг, 0,0664 ммоль, 83%) в виде желтого аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 3,72 (3H, с), 5,08 (2H, д, J=4,4 Гц), 5,92 (1H, с), 6,89 (1H, тд, J=9,0, 4,4 Гц), 6,98-7,05 (1H, м), 7,25 (2H, д, J=8,6 Гц), 7,40 (2H, д, J=8,6 Гц), 7,55 (2H, д, J=8,6 Гц), 7,60 (1H, д, J=8,1 Гц), 7,81 (1H, д, J=8,1 Гц), 7,87 (2H, д, J=8,6 Гц), 8,02-8,06 (1H, м), 8,20 (1H, шир.с), 8,62 (1H, с), 9,70 (1H, с).
МС m/z: 602 (М++H).
Пример 362: N-[[6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]метил]-2-(пиридин-3-ил)ацетамид
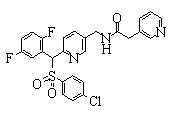
[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламин (30 мг, 0,073 ммоль), полученный в примере 351, гидрохлорид 3-пиридилуксусной кислоты (16 мг, 0,092 ммоль), 4-(диметиламино)пиридин (5 мг, 0,04 ммоль) и триэтиламин (0,025 мл, 0,18 ммоль) растворяли в дихлорметане (5 мл). К полученному раствору добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (17 мг, 0,089 ммоль). После перемешивания при комнатной температуре в течение 14 часов к реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия (0,1 мл). Остаток, полученный концентрированием реакционной смеси при пониженном давлении, подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из части элюата с использованием смеси дихлорметан:метанол=30:1, концентрировали при пониженном давлении с получением белого твердого вещества. Белое твердое вещество промывали эфиром с получением указанного в заголовке соединения (35 мг, 0,066 ммоль, 90%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 3,59 (2H, с), 4,45 (2H, дд, J=5,9, 1,5 Гц), 5,92 (1H, с), 5,96-6,10 (1H, м), 6, 86-6,98 (1H, м), 6,99-7,05 (1H, м), 7,24-7,35 (1H, м), 7,39 (2H, д, J=8,8 Гц), 7,55-7,60 (3H, м), 7,60-7,71 (2H, м), 7,96-8,06 (1H, м), 8,50 (2H, д, J=1,6 Гц), 8,55 (1H, д, J=4,8, 1,6 Гц).
МС m/z: 528 (М++H).
Пример 363: [6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метилдиметилкарбамат
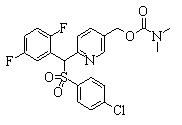
К раствору 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(гидроксиметил)пиридина (20 мг, 0,049 ммоль), полученного в примере 331, в дихлорметане (0,3 мл) добавляли N-метилморфолин (0,011 мл, 0,10 ммоль) и п-нитрофенилхлорформиат (15 мг, 0,074 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 30 минут. При 0°С дополнительно добавляли N-метилморфолин (0,033 мл, 0,30 ммоль) и затем п-нитрофенилхлорформиат (15 мг, 0,074 ммоль) и смесь перемешивали при комнатной температуре в течение 30 минут. К смеси добавляли гидрохлорид диметиламина (20 мг, 0,25 ммоль) при 0°С. После перемешивания при комнатной температуре в течение 13 часов реакционную смесь промывали насыщенным водным раствором хлорида аммония. Затем органический слой сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=7:3, концентрировали при пониженном давлении. Полученное твердое вещество промывали гексаном и фильтровали с получением указанного в заголовке соединения (13 мг, 0,027 ммоль, 55%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3 ) δ: 2,94 (6H, с), 5,14 (2H, с), 5,94 (1H, с), 6,87-7,07 (2H, м), 7,39 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,62 (1H, д, J=7,8 Гц), 7,75 (1H, дд, J=7,8, 2,0 Гц), 7,99-8,07 (1H, м), 8,63 (1H, д, J=2,0 Гц).
МС m/z: 481 (М++H).
Пример 364: [6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метил-4-нитрофенилкарбонат
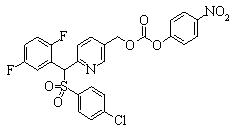
К раствору 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(гидроксиметил)пиридина (41 мг, 0,10 ммоль), полученного в примере 331, в дихлорметане (0,5 мл) добавляли N-метилморфолин (0,033 мл, 0,30 ммоль) и 4-нитрофенилхлорформиат (40 мг, 0,20 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь промывали водой. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=4:1, концентрировали при пониженном давлении. Полученное таким образом твердое вещество промывали гексаном и собирали фильтрованием с получением указанного в заголовке соединения (52 мг, 0,090 ммоль, 90%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 5,33 (2H, с), 5,97 (1H, с), 6,87-6,95 (1H, м), 6,98-7,06 (1H, м), 7,39 (2H, д, J=9,0 Гц), 7,40 (2H, д, J=8,5 Гц), 7,57 (2H, д, J=8,5 Гц), 7,71 (1H, д, J=7,6 Гц), 7,85 (1H, дд, J=7,6, 2,0 Гц), 7,97-8,05 (1H, м), 8,29 (2H, д, J=9,0 Гц), 8,72 (1H, д, J=2,0 Гц).
МС m/z: 575 (М++H).
Пример 365: [6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метилбензилкарбамат
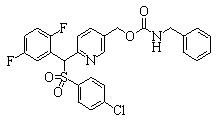
К раствору [6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метил-4-нитрофенилкарбоната (51 мг, 0,089 ммоль) в дихлорметане (1 мл) последовательно добавляли N-метилморфолин (0,020 мл, 0,18 ммоль) и бензиламин (0,012 мл, 0,11 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь промывали насыщенным водным раствором хлорида аммония. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=4:1, концентрировали при пониженном давлении. Полученное таким образом твердое вещество промывали диизопропиловым эфиром и собирали фильтрованием с получением указанного в заголовке соединения (33 мг, 0,060 ммоль, 68%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 4,38 (2H, шир.д, J=5,4 Гц), 5,06 (1H, шир.с), 5,16 (2H, с), 5,94 (1H, с), 6,87-7,04 (2H, м), 7,22-7,38 (5H, м), 7,39 (2H, д, J=8,3 Гц), 7,54 (2H, д, J=8,3 Гц), 7,62 (1H, д, J=8,3 Гц), 7,74 (1H, д, J=8,3 Гц), 7,96-8,03 (1H, м), 8,61 (1H, с).
МС m/z: 543 (М++H).
Пример 366: N-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метил]-3-цианобензолсульфонамид
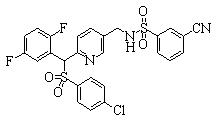
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (28 мг, 0,068 ммоль), полученного в примере 351, в дихлорметане (0,5 мл) последовательно добавляли N-метилморфолин (0,015 мл, 0,14 ммоль) и 3-цианобензолсульфонилхлорид (22 мг, 0,10 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 6 часов. После промывания 1 н. хлористо-водородной кислотой органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=7:3, концентрировали при пониженном давлении. Полученное таким образом твердое вещество промывали гексаном и собирали фильтрованием с получением указанного в заголовке соединения (23 мг, 0,040 ммоль, 59%) в виде белого твердого вещества.
1 H-ЯМР (400 МГц, CDCl3) δ: 4,26 (2H, д, J=6,4 Гц), 5,08 (1H, т, J=6,4 Гц), 5,91 (1H, с), 6,86-7,06 (2H, м), 7,40 (2H, д, J=8,1 Гц), 7,55 (2H, д, J=8,1 Гц), 7,57-7,70 (3H, м), 7,81 (1H, д, J=7,4 Гц), 7,94-8,05 (2H, м), 8,11 (1H, с), 8,46 (1H, с).
МС m/z: 574 (М++H).
Пример 367: N-[[6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метилпиридин-3-ил]метил]-3-циано-N-метилбензолсульфонамид
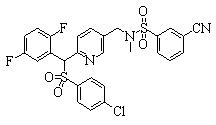
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метил]-3-цианобензолсульфонамида (21 мг, 0,037 ммоль) в тетрагидрофуране (0,5 мл) последовательно добавляли метанол (0,003 мл, 0, 073 ммоль), трифенилфосфин (19 мг, 0,073 ммоль) и диизопропилазодикарбоксилат (0,014 мл, 0,073 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (13 мг, 0,021 ммоль, 58% в виде белого твердого вещества.
1 H-ЯМР (400 МГц, CDCl3) δ: 2,70 (3H, с), 4,25 (2H, д, J=6,4 Гц), 5,95 (1H, с), 6,87-7,05 (2H, м), 7,40 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 7,66 (1H, д, J=8,1 Гц), 7,73 (1H, т, J=7,8 Гц), 7,81 (1H, дд, J=8,1, 2,2 Гц), 7,91 (1H, д, J=7,8 Гц), 7,99-8,09 (2H, м), 8,12 (1H, с), 8,53 (1H, т, J=2,2 Гц).
МС m/z: 588 (М++H).
Пример 368: 3-[[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метил]-1,1-диметилмочевина
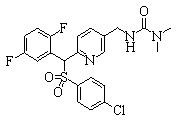
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (31 мг, 0,076 ммоль), полученного в примере 351, в дихлорметане (1 мл) последовательно добавляли триэтиламин (0,032 мл, 0,23 ммоль) и N,N-диметилкарбамоилхлорид (0,014 мл, 0,15 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 17 часов. К реакционной смеси дополнительно добавляли триэтиламин (0,032 мл, 0,23 ммоль) и N,N-диметилкарбамоилхлорид (0,014 мл, 0,15 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 29 часов. После промывания реакционной смеси насыщенным водным раствором бикарбоната натрия, органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из части элюата с использованием этилацетата, концентрировали при пониженном давлении. Полученное твердое вещество промывали гексаном и собирали фильтрованием с получением указанного в заголовке соединения (18 мг, 0,036 ммоль, 48%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,93 (6H, с), 4,44 (2H, д, J=4,2 Гц), 4,76 (1H, т, J=4,2 Гц), 5,93 (1H, с), 6,85-7,04 (2H, м), 7,39 (2H, д, J=8,3 Гц), 7,56 (2H, д, J=8,3 Гц), 7,58 (1H, д, J=8,5 Гц), 7,74 (1H, дд, J=8,5, 2,0 Гц), 7,98-8,06 (1H, м), 8,57 (1H, д, J=2,0 Гц).
МС m/z: 480 (М++H).
Пример 369: Метил-[6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метилкарбамат
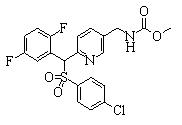
Подобно методике примера 368, за исключением использования [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (34 мг, 0,082 ммоль), полученного в примере 351, и метилхлоркарбоната (0,019 мл, 0,25 ммоль), указанное в заголовке соединение (16 мг, 0,034 ммоль, 42%) получали в виде желтого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 3,71 (3H, с), 4,40 (2H, д, J=6,1 Гц), 5,07 (1H, шир.с), 5,93 (1H, с), 6,87-7,04 (2H, м), 7,39 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,60 (1H, д, J=7,8 Гц), 7,70 (1H, д, J=7,8 Гц), 7,97-8,04 (1H, м), 8,55 (1H, с).
МС m/z: 467 (М++H).
Пример 370: N-[[6-(4-хлорфенилсульфонил)(2, 5-дифторфенил)метилпиридин-3-ил]метил]метансульфонамид
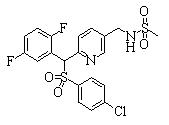
Подобно методике примера 368, за исключением использования [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (34 мг, 0,082 ммоль), полученного в примере 351, и метансульфонилхлорида (0,019 мл, 0, 25 ммоль), указанное в заголовке соединение (20 мг, 0,040 ммоль, 49%) получали в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,97 (3H, с), 4, 37 (2H, д, J=6,1 Гц), 4,70 (1H, шир.с), 5,95 (1H, с), 6,88-7,07 (2H, м), 7,40 (2H, д, J=8,3 Гц), 7,56 (2H, д, J=8,3 Гц), 7,65 (1H, д, J=8,1 Гц), 7,80 (1H, д, J=8,1 Гц), 7,97-8,07 (1H, м), 8,61 (1H, с).
МС m/z: 487 (М++H).
Пример 371: N-[[6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метил]-1-ацетил-4-пиперидинкарбоксамид
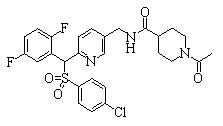
Подобно методике примера 368, за исключением использования [6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]метиламина (34 мг, 0,082 ммоль) и 1-ацетил-4-пиперидинкарбонилхлорида (56 мг, 0,25 ммоль), указанное в заголовке соединение (24 мг, 0,043 ммоль, 52%) получали в виде бесцветной пены.
1H-ЯМР (400 МГц, CDCl3) δ: 1,58-1,79 (2H, м), 1,82-1,95 (2H, м), 2,09 (3H, с), 2,30-2,41 (1H, м), 2,59-2,70 (1H, м), 3,03-3,13 (1H, м), 3, 82-3,92 (1H, м), 4,41-4,53 (2H, м), 4,55-4,63 (1H, м), 5,90-5,98 (2H, м), 6,85-6,94 (1H, м), 6,97-7,04 (1H, м), 7,40 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,60 (1H, д, J=8,1 Гц), 7,66 (1H, д, J=8, 1 Гц), 7,98-8,05 (1H, м), 8,53 (1H, с).
МС m/z: 562 (М++H).
Пример 372: [6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]метилметилкарбонат
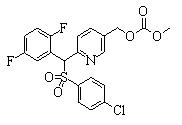
Пиридин (0,040 мл, 0,49 ммоль) и метилхлорформиат (0,019 мл, 0,24 ммоль) последовательно добавляли к раствору 2-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-5-(гидроксиметил)пиридина (50 мг, 0,12 ммоль), полученного в примере 331, в дихлорметане (2 мл) при 0°С, и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли метилхлорформиат (0,019 мл, 0,24 ммоль) при 0°С с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционную смесь промывали 1 н. хлористо-водородной кислотой. Органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=4:1, концентрировали при пониженном давлении. Полученное таким образом твердое вещество промывали гексаном и собирали фильтрованием с получением указанного в заголовке соединения (50 мг, 0,11 ммоль, 88%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 3,81 (3H, с), 5,18 (2H, с), 5,95 (1H, с), 6,89-7,04 (2H, м), 7,40 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,65 (1H, д, J=8,1 Гц), 7,78 (1H, дд, J=8,1, 2,2 Гц), 7,97-8,03 (1H, м), 8,64 (1H, д, J=2,2 Гц).
МС m/z: 468 (М++H).
Пример 373: Оксим [6-(4-хлорфенилсульфонил)(2,5-дифторфенил)метилпиридин-3-ил]карбальдегида (изомер 373-А и изомер 373-В)
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегида (100 мг, 0,25 ммоль), полученного в примере 335, в дихлорметане (3 мл) добавляли N-метилморфолин (32 мкл, 0,29 ммоль) и гидрохлорид гидроксиламина (26 мг, 0,36 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь разбавляли дихлорметаном с последующим последовательным промыванием водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Полученный таким образом органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=3:2, концентрировали при пониженном давлении с получением указанного в заголовке изомера 373-А (соединения низкой полярности) (79 мг, 0,19 ммоль, 72%) в виде белого порошка и указанного в заголовке изомера 373-В (соединения высокой полярности) (17 мг, 0,040 ммоль, 17% в виде белого порошка.
Изомер 373-А
1H-ЯМР (400 МГц, CDCl3) δ: 5,97 (1H, с), 6,91-6,96 (1H, м), 6,99-7,05 (1H, м), 7,40 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 7,66 (1H, д, J=8,1 Гц), 7,78 (1H, с), 7,96-8,02 (2H, м), 8,14 (1H, с), 8,75 (1H, д, J=1,7 Гц).
ИК (ATR) см-1: 3237, 1589, 1594, 1475, 1428, 1394, 1322, 1280, 1236, 1151, 1083, 1014.
Т.пл.: 187-188°C.
МС m/z: 423 (М++H).
Изомер 373-В
1H-ЯМР (400 МГц, CDCl3) δ: 5,98 (1H, с), 6,91-6,97 (1H, м), 7,00-7,06 (1H, м), 7,40 (1H, с), 7,41 (2H, д, J=8,6 Гц), 7,57 (2H, д, J=8,6 Гц), 7,71 (1H, д, J=8,3 Гц), 7,90-8,02 (2H, м), 8,41 (1H, дд, J=8,3, 2,1 Гц), 9,00 (1H, с).
ИК (ATR) см-1: 3037, 1569, 1492, 1430, 1394, 1324, 1276, 1236, 1153, 1081, 1012.
Т.пл.: 194-196°C.
МС m/z: 423 (М++H).
Пример 374: 6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]-N-циклогексилметилникотинамид
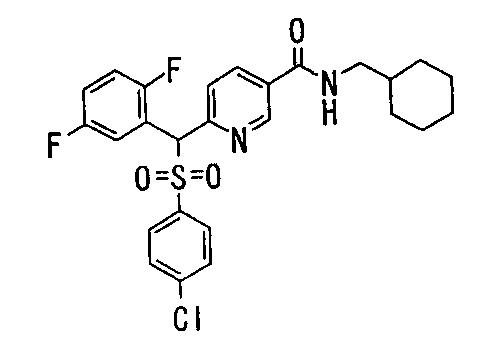
Триэтиламин (32 мкл, 0,23 ммоль), 4-диметиламинопиридин (12 мг, 0,085 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (44 мг, 0,23 ммоль) и аминометилциклогексан (30 мкл, 0,23 ммоль) добавляли к раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (80 мг, 0,19 ммоль), полученной в примере 338, в дихлорметане (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 4,5 часов. Реакционную смесь разбавляли дихлорметаном с последующим последовательным промыванием водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Полученный таким образом органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (58 мг, 0,11 ммоль, 59%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 0,95-1,80 (11H, м), 3,32 (2H, д, J=6,4 Гц), 5,98 (1H, с), 6,13-6,16 (1H, м), 6,90-6,96 (1H, м), 7,00-706 (1H, м), 7,40 (2H, д, J=8,6 Гц), 7,55 (2H, д, J=8,6 Гц), 7,69 (1H, д, J=8,3 Гц), 7,97-8,02 (1H, м), 8,13 (1H, дд, J=8,3, 2,2 Гц), 8,94 (1H, д, J=2,2 Гц).
МС m/z: 519 (М++H).
Пример 375: 6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-N-(5-хлорпиридин-2-ил)никотинамид
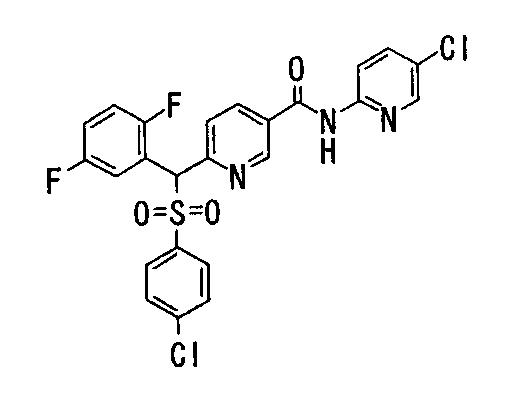
Триэтиламин (32 мкл, 0,23 ммоль), 4-диметиламинопиридин (12 мг, 0,095 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (44 мг, 0,23 ммоль) и 2-амино-5-хлорпиридин (29 мкл, 0,23 ммоль) добавляли к раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (80 мг, 0,19 ммоль), полученной в примере 338, в дихлорметане (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь разбавляли дихлорметаном с последующим последовательным промыванием водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Полученный таким образом органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=3:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (27 мг, 0,051 ммоль, 27%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 6,04 (1H, с), 6,92-6,97 (1H, м), 7,01-707 (1H, м), 7,42 (2H, д, J=8,6 Гц), 7,57 (2H, д, J=8,6 Гц), 7,75 (1H, дд, J=9,1, 2,4 Гц), 7,80 (1H, д, J=8,1 Гц), 7,97-8,01 (1H, м), 8,26 (1H, дд, J=8,1, 2,2 Гц), 8,28 (1H, д, J=2,4 Гц) 8,33 (1H, д, J=9, 1 Гц), 8,51 (1H, с), 9,12 (1H, д, J=2,2 Гц).
МС m/z: 534 (М++H).
Пример 376: N',N'-диметилгидразид 6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]никотиновой кислоты
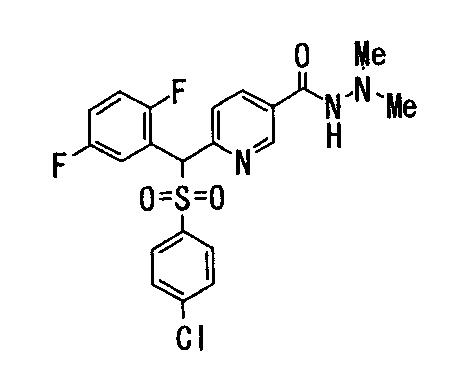
Триэтиламин (32 мкл, 0,23 ммоль), 4-диметиламинопиридин (12 мг, 0,095 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (44 мг, 0,23 ммоль) и 1,1-диметилгидразин (21 мкл, 0,23 ммоль) добавляли к раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (80 мг, 0,19 ммоль), полученной в примере 338, в дихлорметане (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 7 часов. Реакционную смесь разбавляли дихлорметаном с последующим последовательным промыванием водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Полученный таким образом органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из части элюата с использованием смеси дихлорметан:метанол=50:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (60 мг, 0,13 ммоль, 68%) в виде бесцветного аморфного вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,57 (0,9H, с), 2,72 (5,1H, с), 5,98 (1H, с), 6,48 (0,15H, с), 6,90-7,06 (2,85H, м), 7,41 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 7,68 (1H, д, J=8,1 Гц), 7,97-8,04 (1H, м), 8,13-8,17 (1H, м), 8,94 (0,85H, с), 9,07 (0,15H, с).
МС m/z: 466 (М++H).
Пример 377: N'-(фуран-2-карбонил)гидразид 6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]никотиновой кислоты
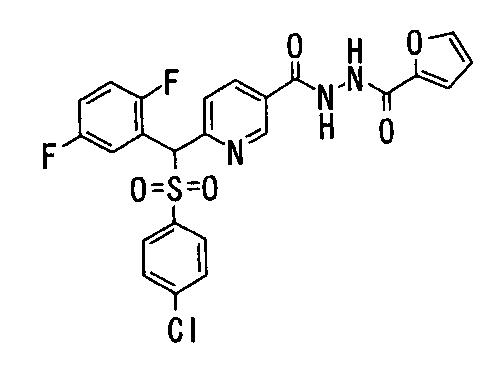
Триэтиламин (32 мкл, 0,23 ммоль), 4-диметиламинопиридин (12 мг, 0,095 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (44 мг, 0,23 ммоль) и гидразид 2-фуранкарбоновой кислоты (29 мкл, 0,23 ммоль) добавляли к раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (80 мг, 0,19 ммоль), полученной в примере 338, в дихлорметане (5 мл). Полученную смесь перемешивали при комнатной температуре в течение 7,5 часов. Реакционную смесь разбавляли дихлорметаном с последующим последовательным промыванием водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Полученный таким образом органический слой сушили над сульфатом магния и затем концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из части элюата с использованием смеси дихлорметан:метанол=50:1, концентрировали при пониженном давлении. Полученное твердое вещество перекристаллизовывали из смеси дихлорметан-гексан с получением указанного в заголовке соединения (58 мг, 0,11 ммоль, 58%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 6,01 (0,7H, с), 6,02 (0,3H, с), 6,55 (0,7H, дд, J=3,4, 1,7 Гц), 6,91-6,96 (1H, м), 6,99-7,04 (1H, м), 7,21 (0,7H, д, J=3,4 Гц), 7,41 (2H, д, J=8,6 Гц), 7,53 (0,3H, дд, J=1,7, 0,7 Гц), 7,56-7,60 (3H, м), 7,74 (1H, д, J=8,3 Гц), 7,77 (0,3H, д, J=8,8 Гц), 7,95-7,99 (1H, м), 8,15-8,19 (1H, м), 8,99 (0,3H, с), 9,03 (1H, д, J=2,2 Гц), 9,14 (0,7H, шир.с), 9,67 (0,7H, шир.с), 9,98 (0,3H, шир.с).
МС m/z: 532 (М++H).
Пример 378: N-[[6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]метил]-(Е)-3-(пиридин-4-ил)акриламид
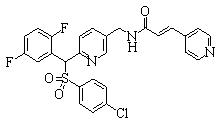
К раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]метиламина (41 мг, 0,10 ммоль), полученного в примере 351, (Е)-3-(пиридин-4-ил)акриловой кислоты (15 мг, 0,10 ммоль), бензотриазол-1-ола (14 мг, 0,10 ммоль) и N-метилморфолина (0,011 мл, 0,10 ммоль) в дихлорметане (1 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (19 мг, 0,10 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 19 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Полученный таким образом органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из части элюата этилацетатом, концентрировали при пониженном давлении. Полученное таким образом твердое вещество промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения (35 мг, 0,065 ммоль, 65%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 4,53-4,66 (2H, м), 5,93 (1H, с), 6, 09-6,17 (1H, м), 6,57 (1H, д, J=15,6 Гц), 6,86-6,93 (1H, м), 6,96-7,04 (1H, м), 7,34 (2H, д, J=5,9 Гц), 7,40 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 7,60 (1H, д, J=15,6 Гц), 7,61 (1H, д, J=8,1 Гц), 7,74 (1H, дд, J=8,1, 2,2 Гц), 7,99-8,06 (1H, м), 8,59 (1H, д, J=2,2 Гц), 8,64 (2H, д, J=5,9 Гц).
МС m/z: 540 (М++H).
Пример 379: [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил](тиоморфолин-4-ил)метанон
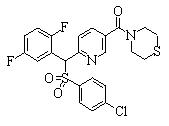
Подобно методике примера 378, за исключением использования [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (212 мг, 0,50 ммоль), полученной в примере 338, и тиоморфолина (0,047 мл, 0,50 ммоль), указанное в заголовке соединение (240 мг, 0,47 ммоль, 94%) получали в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 2,61 (2H, шир.с), 2,74 (2H, шир.с), 3,69 (2H, шир.с), 4,04 (2H, шир.с), 5,97 (1H, с), 6,88-6,95 (1H, м), 6,98-7,06 (1H, м), 7,41 (2H, д, J=8,5 Гц), 7,57 (2H, д, J=8,5 Гц), 7,73 (1H, д, J=8,1 Гц), 7,79 (1H, дд, J=8,1, 2,2 Гц), 7,95-8,02 (1H, м), 8,64 (1H, д, J=2,2 Гц).
МС m/z: 509 (М++H).
Пример 380: [6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил](1,1-диоксо-1λ6-тиоморфолин-4-ил)метанон (соединение А) и [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил](1-оксо-1λ6 -тиоморфолин-4-ил)метанон (соединение В)
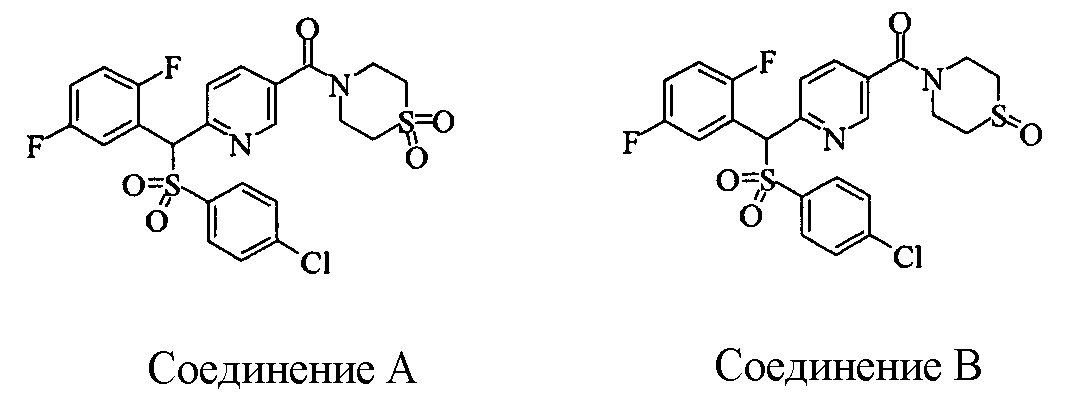
При охлаждении на льду 3-хлорпербензойную кислоту (96 мг, 0,36 ммоль) добавляли к раствору [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил](тиоморфолин-4-ил)метанона (153 мг, 0,30 ммоль) в дихлорметане (3 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли дихлорметаном с последующим последовательным промыванием 1 н. водным раствором гидроксида натрия и насыщенным раствором соли. Полученный таким образом органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=1:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения А (соединения низкой полярности) (81 мг, 0,15 ммоль, 50%) в виде белого порошка. Фракцию, полученную из части элюата с использованием смеси дихлорметан:метанол=10:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения В (соединения высокой полярности) (73 мг, 0,14 ммоль, 46%) в виде белого порошка.
Соединение А
1H-ЯМР (400 МГц, CDCl3) δ: 3,10 (4H, шир.с), 4,13 (4H, шир.с), 5,99 (1H, с), 6,88-6,93 (1H, м), 7,00-7,06 (1H, м), 7,42 (2H, д, J=8,5 Гц), 7,58 (2H, д, J=8,5 Гц), 7,79 (1H, д, J=8,1 Гц), 7,86 (1H, дд, J=8,1, 1,7 Гц), 7,97-8,02 (1H, м), 8,71 (1H, д, J=1,7 Гц).
МС m/z: 541 (М++H).
Соединение В
1H-ЯМР (400 МГц, CDCl3) δ: 2,70-3,00 (4H, м), 3,74 (1H, шир.с), 4,10 (2H, шир.с), 4,63 (1H, шир.с), 5,98 (1H, с), 6,88-6,94 (1H, м), 7,00-7,06 (1H, м), 7,42 (2H, д, J=8,6 Гц), 7,58 (2H, д, J=8,6 Гц), 7,77 (1H, д, J=8,1 Гц), 7,84 (1H, дд, J=8,1, 2,2 Гц), 7,98-8,02 (1H, м), 8,70 (1H, д, J=2,2 Гц).
МС m/z: 525 (М++H).
Пример 381: N-(3-метилтиопропил)-6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]никотинамид
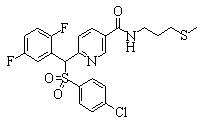
Подобно методике примера 378, за исключением использования [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (212 мг, 0,50 ммоль), полученной в примере 338, и 3-метилтиопропиламина (0,055 мл, 0,50 ммоль), указанное в заголовке соединение (238 мг, 0,47 ммоль, 93%) получали в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,92-2,01 (2H, м), 2,14 (3H, с), 2,63 (2H, т, J=6,8 Гц), 3,58-3,64 (2H, м), 5,99 (1H, с), 6,57-6,64 (1H, м), 6,90-6,97 (1H, м), 6,99-7,06 (1H, м), 7,41 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 7,71 (1H, д, J=8,1 Гц), 7,96-8,03 (1H, м), 8,16 (1H, дд, J=8,1, 2,2 Гц), 8,96 (1H, д, J=2,2 Гц).
МС m/z: 511 (М++H).
Пример 382: N-(3-метилсульфонилпропил)-6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]никотинамид (соединение А) и N-(3-метилсульфинилпропил)-6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]никотинамид (соединение В)
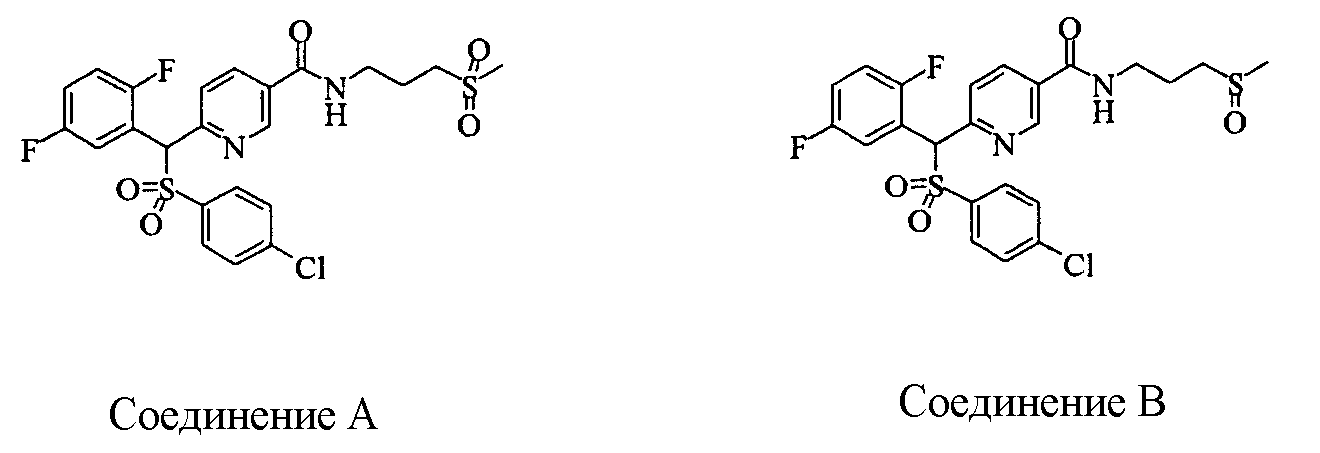
К раствору N-(3-метилтиопропил)-6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]никотинамида (153 мг, 0,30 ммоль) в дихлорметане (3 мл) добавляли 3-хлорпербензойную кислоту (чистота: 65% или более) (96 мг, 0,36 ммоль) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь промывали 1 н. водным раствором гидроксида натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из части элюата этилацетатом, концентрировали при пониженном давлении. Полученное таким образом твердое вещество промывали диэтиловым эфиром и затем собирали фильтрованием с получением указанного в заголовке соединения А (53 мг, 0,098 ммоль, 32%) в виде белого твердого вещества. Затем фракцию, полученную из части элюата с использованием смеси дихлорметан:метанол=15:1, концентрировали при пониженном давлении. Полученное таким образом твердое вещество промывали диэтиловым эфиром и собирали фильтрованием с получением указанного в заголовке соединения В (68 мг, 0,13 ммоль, 43%) в виде белого твердого вещества.
Соединение А
1H-ЯМР (400 МГц, CDCl3) δ: 2,20-2,30 (2H, м), 2,98 (3H, с), 3,17 (2H, т, J=6,8 Гц), 3,65-3,72 (2H, м), 5,99 (1H, с), 6,82-6,88 (1H, м), 6,90-6,97 (1H, м), 6,99-7,06 (1H, м), 7,41 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 7,72 (1H, д, J=8,1 Гц), 7,96-8,02 (1H, м), 8,16 (1H, дд, J=8,1, 2,2 Гц), 9,00 (1H, д, J=2,2 Гц).
МС m/z: 543 (М++H).
Соединение В
1H-ЯМР (400 МГц, CDCl3) δ: 2,11-2,23 (1H, м), 2,26-2,37 (1H, м), 2,63 (3H, с), 2,78-2,86 (1H, м), 2,92-3,00 (1H, м), 3,51-3,61 (1H, м), 3,66-3,75 (1H, м), 5,99 (1H, с), 6,90-6,98 (1H, м), 6,99-7,06 (1H, м), 7,40 (2H, д, J=8,5 Гц), 7,55 (2H, д, J=8,5 Гц), 7,69 (1H, д, J=8,1 Гц), 7,88-8,01 (2H, м), 8,22 (1H, дд, J=8,1, 2,2 Гц), 9,08 (1H, д, J=2,2 Гц).
МС m/z: 527 (М++H).
Пример 383: 2-хлор-5-[(3-хлорпиридин-4-ил)(2,5-дифторфенил)метилтио]пиридин
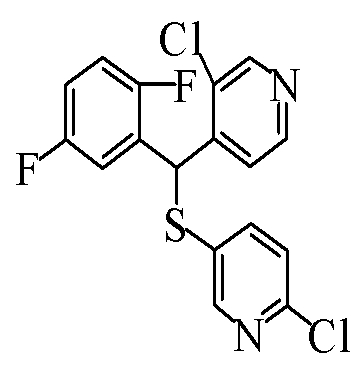
1 н. водный раствор гидроксида натрия (7 мл) добавляли к раствору S-(6-хлор-3-пиридил)-О-этилдитиокарбоната (164 мг, 0,70 ммоль), полученного в ссылочном примере 33, и смесь перемешивали при 80°С в течение 3 часов. После охлаждения реакционной смеси до комнатной температуры добавляли 1 н. хлористо-водородную кислоту с последующей экстракцией дихлорметаном. Органический слой сушили над безводным сульфатом натрия и затем фильтровали. Фильтрат концентрировали при пониженном давлении с получением 6-хлор-3-пиридинтиола в виде желтого твердого вещества.
К раствору 3-хлор-4-[(2,5-дифторфенил)гидроксиметил]пиридина (153 мг, 0,60 ммоль), полученного в ссылочном примере 48, в дихлорметане (3 мл) добавляли триэтиламин (0,167 мл, 1,20 ммоль) и метансульфонилхлорид (0,070 мл, 0,90 ммоль) при 0°С, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
Раствор 6-хлор-3-пиридинтиола в N,N-диметилформамиде (2 мл) и карбонат калия (100 мг, 0,72 ммоль) добавляли последовательно к раствору полученного остатка в N,N-диметилформамиде (3 мл). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли этилацетат. Полученную смесь промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=17:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (111 мг, 0,29 ммоль, 48%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 6,04 (1H, с), 6,95-7,05 (2H, м), 7,10-7,20 (1H, м), 7,25 (1H, д, J=8,1 Гц), 7,57 (1H, д, J=5,1 Гц), 7,60 (1H, дд, J=8,1, 2,5 Гц), 8,31 (1H, д, J=2,5 Гц), 8,54 (1H, д, J=5,1 Гц), 8,59 (1H, с).
МС m/z: 383 (М++H).
Пример 384: 2-хлор-5-[(3-хлорпиридин-4-ил)(2,5-дифторфенил)метилсульфонил]пиридин
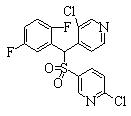
31% водный раствор пероксида водорода (2 мл) и тетрагидрат гексааммонийгептамолибдата (30 мг) добавляли к раствору 2-хлор-5-[(3-хлорпиридин-4-ил)(2,5-дифторфенил)метилтио]пиридина (109 мг, 0,28 ммоль) в метаноле (4 мл), и смесь перемешивали при комнатной температуре в течение 17 часов. К реакционной смеси добавляли этилацетат с последующим промыванием насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=17:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (108 мг, 0,26 ммоль, 92%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 6,26 (1H, с), 6,94-7,03 (1H, м), 7,06-7,15 (1H, м), 7,44 (1H, д, J=8,3 Гц), 7,50-7,56 (1H, м), 7, 89 (1H, дд, J=8,3, 2,7 Гц), 8,12 (1H, д, J=5,1 Гц), 8,59 (1H, д, J=2,7 Гц), 8,61 (1H, с), 8,66 (1H, д, J=5,1 Гц).
МС m/z: 415 (М++H).
Пример 385: 5-[(3-хлорпиридин-4-ил)(2,5-дифторфенил)метилсульфонил]-2-фторпиридин
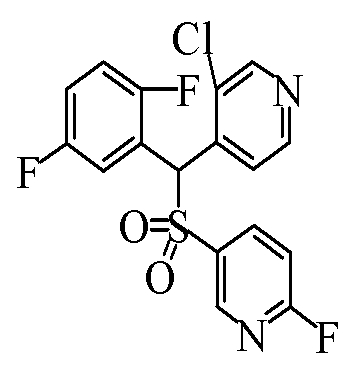
Фторид калия (94 мг, 1,60 ммоль) и тетрафенилфосфонийбромид (134 мг, 0,32 ммоль) добавляли к раствору 2-хлор-5-[(3-хлорпиридин-4-ил)(2,5-дифторфенил)метилсульфонил]пиридина (66 мг, 0,16 ммоль) в ацетонитриле (2 мл). Полученную смесь нагревали при кипячении с обратным холодильником в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры. Добавляли дихлорметан, и смесь промывали водой. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем и фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=17:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (4,5 мг, 0,011 ммоль, 7%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 6,26 (1H, с), 6,93-7,13 (3H, м), 7,50-7,56 (1H, м), 8,01-8,08 (1H, м), 8,13 (1H, д, J=5,1 Гц), 8,48 (1H, д, J=2,2 Гц), 8,60 (1H, с), 8,66 (1H, д, J=5,1 Гц).
МС m/z: 440 (М++H+MeCN).
Пример 386: N'-[6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-илметилиден]-2-тиофенкарбогидразид
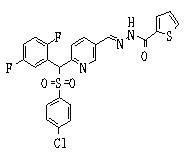
[6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегид (100 мг, 0,245 ммоль), полученный в примере 335, и 2-тиофенкарбогидразид (41,7 мг, 0,294 ммоль) растворяли в этаноле (3 мл). Полученный раствор перемешивали при комнатной температуре в течение 3 дней. Осажденное таким образом твердое вещество собирали фильтрованием и промывали этанолом. Полученное твердое вещество перекристаллизовывали из этанола с получением указанного в заголовке соединения (91,0 мг, 0,171 моль, 70%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3 /ДМСО-d6) δ: 5,98 (1H, с), 6,93-7,01 (1H, м), 7,02-7,09 (1H, м), 7,14-7,20 (1H, шир.м), 7,42 (2H, д, J=8,5 Гц), 7,57 (2H, д, J=8,5 Гц), 7,62-7,73 (2H, шир.м), 8,02-8,20 (3H, м), 8,95 (1H, с), 11,5 (1H, с).
ИК (ATR) см-1: 3302, 1655, 1597, 1541, 1489, 1419, 1394, 1321, 1279, 1149, 1078, 1016, 966, 889, 831, 822, 762, 725, 710, 611, 552, 509, 465.
МС m/z: 532 (М++H).
Пример 387: 6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]никотинамид
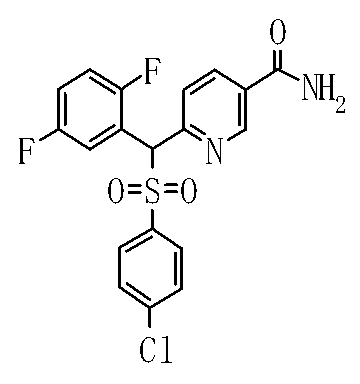
Тионилхлорид (1,00 мл) и N,N-диметилформамид (одна капля) добавляли к суспензии [6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (100 мг, 0,236 ммоль), полученной в примере 338, в дихлорметане (4 мл). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали досуха. Затем остаток растворяли в дихлорметане (6 мл) с последующим добавлением 28% водного аммиака (2 мл). После перемешивания реакционной смеси при комнатной температуре в течение 3 часов подкисляли 1 н. хлористо-водородной кислотой. Полученную смесь концентрировали и полученное таким образом твердое вещество собирали фильтрованием. Твердое вещество промывали водой и этанолом и затем перекристаллизовывали из этанола с получением указанного в заголовке соединения (47,9 мг, 0,113 ммоль, 46%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3/ДМСО-d6) δ: 6,00 (1H, с), 6,38 (1H, шир.с), 6,94-6,99 (1H, м), 7,02-7,08 (1H, м), 7,43 (2H, д, J=8,5 Гц), 7,56 (2H, д, J=8,5 Гц), 7,67 (1H, д, J=7,6 Гц), 7,65-7,75 (1H, шир.м), 7,99-8,04 (1H, м), 8,26 (1H, дд, J=8,1, 2,4 Гц), 9,12 (1H, д, J=1,7 Гц).
ИК (ATR) см-1: 3442, 3165, 2954, 1670, 1624, 1595, 1496, 1410, 1373, 1313, 1279, 1232, 1176, 1147, 1086, 1012, 831, 816, 754, 710, 667, 606, 552, 499, 465.
МС m/z: 423 (М++H).
Пример 388: 6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]-N-(4-метилциклогексил)никотинамид
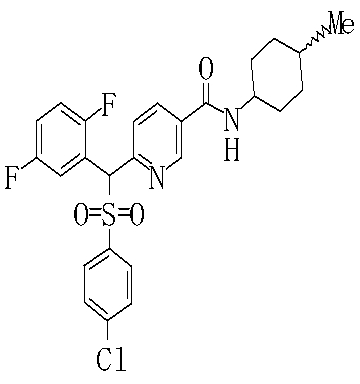
Тионилхлорид (1,00 мл) и N,N-диметилформамид (одна капля) добавляли к суспензии [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (100 мг, 0,236 ммоль), полученной в примере 338, в дихлорметане (4 мл). Полученную смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь концентрировали досуха. Затем остаток растворяли в дихлорметане (6 мл) с последующим добавлением N-метилморфолина (51,8 мкл, 0,472 ммоль) и 4-метилциклогексиламина (37,4 мкл, 0,283 ммоль). После перемешивания реакционной смеси при комнатной температуре в течение 18 часов смесь разбавляли дихлорметаном. Раствор промывали последовательно 1 н. хлористо-водородной кислотой, водой и насыщенным раствором соли, сушили над сульфатом магния и концентрировали. Остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=3:1, концентрировали с получением белого твердого вещества. Полученное твердое вещество перекристаллизовывали из смеси этилацетат-гексан с получением указанного в заголовке соединения (70,3 мг, 0,135 ммоль, 57%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 0,92 (1,8H, д, J=6,6 Гц), 0,96 (1,2H, д, J=6,4 Гц), 1,05-1,30 (3H, м), 1,32-1,43 (0,6H, м), 1,55-1,83 (4,4H, м), 2,03-2,12 (1H, м), 3,86-3,97 (0,6H, м), 4,20-4,28 (0,4H, м), 5,88 (0,6H, д, J=7,1 Гц), 5,98 (1H, с), 6,18 (0,4H, д, J=7,3 Гц), 6,90-6,96 (1H, м), 6,98-7,06 (1H, м), 7,41 (1,2H, д, J=8,1 Гц), 7,41 (0,8H, д, J=8,1 Гц), 7,56 (1,2H, д, J=8,1 Гц), 7,57 (0,8H, д, J=8,1 Гц), 7,67-7,72 (1H, м), 7,97-8,05 (1H, м), 8,10-8,18 (1H, м), 8,93 (0,6H, д, J=2,2 Гц), 8,96 (0,4H, д, J=2,2 Гц).
ИК (ATR) см-1: 3381, 2935, 1643, 1595, 1525, 1489, 1394, 1317, 1281, 1234, 1171, 1147, 1078, 1016, 966, 897, 831, 823, 764, 729, 609, 548, 469, 413.
МС m/z: 519 (М++H).
Пример 389: 6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-N-метоксиникотинамид
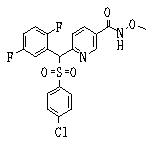
К суспензии [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (100 мг, 0,236 ммоль), полученной в примере 338, в дихлорметане (6 мл) добавляли N-метилморфолин (77,7 мкл, 0, 708 ммоль), гидрохлорид О-метилгидроксиламина (23,6 мг, 0,283 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (54,3 мг, 0,283 ммоль). После перемешивания при комнатной температуре в течение 1 часа к смеси добавляли тетрагидрофуран (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Затем смесь разбавляли дихлорметаном и промывали водой и насыщенным раствором соли. Полученный таким образом органический слой сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на колонке с силикагелем, и фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=1:1, концентрировали с получением белого твердого вещества. Твердое вещество промывали этилацетатом с получением указанного в заголовке соединения (55,1 мг, 0,122 ммоль, 52%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 3,90 (2,4H, с), 3,97 (0,6H, с), 5,97 (0,2H, с), 5,98 (0,8H, с), 6,90-7,07 (2H, м), 7,39-7,46 (2H, м), 7,54-7,59 (2H, м), 7,63 (0,2H, д, J=8,3 Гц), 7,73 (0,8H, д, J=8,1 Гц), 7,94-8,00 (1H, м), 8,10-8,15 (1H, м), 8,76 (1H, шир.с), 8, 92 (0,8H, д, J=1,7 Гц), 9,01 (0,2H, д, J=1,5 Гц).
МС m/z: 453 (М++H).
Пример 390: N,N-диметил-6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]метиламин
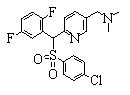
После растворения [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегида (100 мг, 0,245 ммоль), полученного в примере 335, раствора в тетрагидрофуране (2,0 М, 0,25 мл, 0,50 ммоль) диметиламина и уксусной кислоты (0,029 мл, 0,51 ммоль) в 1,2-дихлорэтане (5 мл) к полученному раствору добавляли триацетоксиборгидрид натрия (115 мг, 0,515 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 3 дней. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и этилацетат. Смесь разделяли, и полученный таким образом органический слой промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле и фракцию, полученную из части элюата с использованием смеси дихлорметан:метанол=40:1, концентрировали при пониженном давлении с получением белого твердого вещества. Твердое вещество промывали гексаном с получением указанного в заголовке соединения (88 мг, 0,20 ммоль, 82%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,23 (6H, с), 3,43 (2H, с), 5,94 (1H, с), 6,88-6,98 (1H, м), 6,98-7,06 (1H, м), 7,38 (2H, д, J=8,6 Гц), 7,52-7,62 (3H, м), 7,71 (1H, дд, J=8,1, 2,1 Гц), 7,98-8,08 (1H, м), 8,51 (1H, д, J=2,1 Гц).
МС m/z: 437 (М++H).
Пример 391: N-[[6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]метил]бис(2-метоксиэтил)амин
После растворения [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбальдегида (100 мг, 0,245 ммоль), полученного в примере 335, бис(2-метоксиэтил)амина (70 мг, 0,53 ммоль) и уксусной кислоты (0,029 мл, 0,51 ммоль) в 1,2-дихлорэтане (5 мл) к полученному раствору добавляли триацетоксиборгидрид натрия (115 мг, 0,515 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 3 дней. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия и этилацетат. Смесь разделяли, и полученный таким образом органический слой промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом магния. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=3:2, концентрировали при пониженном давлении с получением белого твердого вещества. Твердое вещество промывали гексаном с получением указанного в заголовке соединения (101 мг, 0,192 ммоль, 78%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,73 (4H, т, J=5,8 Гц), 3,31 (6H, с), 3,47 (4H, д, J=5,8 Гц), 3,75 (2H, с), 5,93 (1H, с), 6,88-6,97 (1H, м), 6,97-7,07 (1H, м), 7,38 (2H, д, J=8,8 Гц), 7,50-7,60 (3H, м), 7, 76 (1H, дд, J=8,1, 2,0 Гц), 7,98-8,08 (1H, м), 8,54 (1H, д, J=2,0 Гц).
МС m/z: 525 (М++H).
Пример 392: 6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-N, N-диметилникотинамид
После растворения [6-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (90 мг, 0,21 ммоль), полученной в примере 338, раствора в тетрагидрофуране (2,0 М, 0,21 мл, 0,42 ммоль) диметиламина, 4-(диметиламино)пиридина (15 мг, 0,12 ммоль) и триэтиламина (0,045 мл, 0,32 ммоль) в дихлорметане (5 мл) к полученному раствору добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (61 мг, 0,32 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Реакционную смесь концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=2:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (35 мг, 0,066 ммоль, 90%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 3,01 (3H, с), 3,14 (3H, с), 5,97 (1H, с), 6,88-6,99 (1H, м), 6,99-7, 08 (1H, м), 7,40 (2H, д, J=8,7 Гц), 7,57 (2H, д, J=8,7 Гц), 7,70 (1H, дд, J=8,0, 0,7 Гц), 7,82 (1H, дд, J=8,0, 2,2 Гц), 7,93-8,04 (1H, м), 8,68 (1H, дд, J=2,2, 0,7 Гц).
МС m/z: 451 (М++H).
Пример 393: [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил](4-метилпиперазин-1-ил)метанон
После растворения [6-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-3-ил]карбоновой кислоты (90 мг, 0,21 ммоль), полученной в примере 338, N-метилпиперазина (0,036 мл, 0,33 ммоль), 4-(диметиламино)пиридина (15 мг, 0,12 ммоль) и триэтиламина (0,045 мл, 0,32 ммоль) в дихлорметане (5 мл) к полученному раствору добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (61 мг, 0,32 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 14 часов. К реакционной смеси добавляли дополнительно N-метилпиперазин (0,036 мл, 0,33 ммоль), триэтиламин (0,045 мл, 0,32 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (61 мг, 0,32 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 14 часов с последующим концентрированием при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле, и фракцию, полученную из части элюата с использованием смеси дихлорметан:метанол=25:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения (86 мг, 0,17 ммоль, 80%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,33 (3H, с), 2,38 (2H, шир.с), 2,50 (2H, шир.с), 3,44 (2H, шир.с), 3,81 (2H, шир.с), 5,97 (1H, с), 6,87-6, 98 (1H, м), 6,98-7,08 (1H, м), 7,40 (2H, д, J=8,8 Гц), 7,57 (2H, д, J=8,8 Гц), 7,71 (1H, дд, J=8,1, 0,7 Гц), 7,81 (1H, дд, J=8,1, 2,2 Гц), 7,94-8,04 (1H, м), 8,66 (1H, дд, J=2,2, 0,7 Гц).
МС m/z: 506 (М++H).
Пример 394: 4-[2-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]аминоэтил]морфолин
4-[2-[5-хлор-4-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-2-ил]аминоэтил]морфолин-N-оксид (78 мг, 0,14 ммоль), полученный в примере 349, растворяли в смешанном растворителе, состоящем из уксусной кислоты (2,0 мл) и воды (2,0 мл). Полученную смесь нагревали до 60оС. Добавляли порошок железа (40 мг, 0,72 ммоль), и смесь перемешивали в течение 30 минут. После охлаждения реакционную смесь выливали в насыщенный водный раствор карбоната калия с последующей экстракцией этилацетатом (60 мл). Раствор промывали насыщенным раствором соли, сушили и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (раствор 3% метанол/хлороформ) с получением указанного в заголовке соединения (30 мг, 40%).
1H-ЯМР (400 МГц, CDCl3) δ: 2,5-2, 8 (6H, м), 3,59 (2H, шир.), 3,81 (4H, шир.), 5,45 (1H, шир.), 6,10 (1H, с), 6,88 (1H, м), 7,01 (1H, м), 7,25 (1H, с), 7,42 (2H, д, J=8,8 Гц), 7,49 (1H, м), 7,60 (2H, д, J=8,4 Гц), 7,97 (1H, с).
МС m/z: 542(М++H).
Пример 395: Трет-бутил-2-[N-[5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]-N-метиламино]этилметилкарбамат
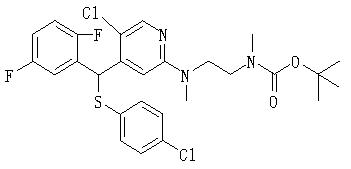
Раствор 2,5-дихлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (78 мг, 0,19 ммоль), полученного в примере 342, и N,N'-диметилендиамина (400 мкл) в 1,4 диоксане (2,0 мл) перемешивали при 100°С в течение 2 дней в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом (40 мл). Раствор промывали водой и насыщенным раствором соли и затем концентрировали при пониженном давлении.
Полученный таким образом остаток растворяли в тетрагидрофуране (10 мл) с последующим добавлением триэтиламина (31 мкл, 0,22 ммоль) и ди-трет-бутилдикарбоната (49 мг, 0,22 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 15 часов. После концентрирования раствора при пониженном давлении остаток очищали хроматографией на силикагеле (гексан:этилацетат=4:1) с получением указанного в заголовке соединения (68 мг, 64%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,26 и 1,32 (9H, шир.с, ротамер), 2,75 и 2,78 (3H, шир.с, ротамер), 2,95 (3H, шир.с), 3, 30 (2H, м), 3,65 (2H, м), 5,92 (1H, с), 6,6-6,8 (1H, м), 6,84-6,97 (2H, м), 7,05 (1H, м), 7,14 (2H, д, J=8,8 Гц), 7,17 (2H, д, J=8,4 Гц), 7,98 (1H, с).
МС m/z: 568(М+ +H).
Пример 396: Трет-бутил-2-[N-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]-N-метиламино]этилметилкарбамат
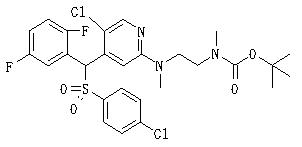
К раствору трет-бутил-2-[N-[5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]-N-метиламино]этилметилкарбамата (67 мг, 0,12 ммоль) в метаноле (6 мл) добавляли тетрагидрат гексааммонийгептамолибдата (30 мг). Затем добавляли 30% водный раствор пероксида водорода (3 мл), и смесь перемешивали в течение 17 часов. После разбавления этилацетатом раствор промывали водой и насыщенным раствором соли и концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (64 мг, 91%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,33 и 1,38 (9H, шир.с, ротамер), 2,87 и 2,89 (3H, шир.с, ротамер), 3,11 (3H, шир.с), 3,3-3,4 (2H, м), 3,6-3,9 (2H, м), 6,12 (1H, с), 6,89 (1H, м), 7,00 (1H, м), 7,26 (1H, м), 7,41 (2H, д, J=8,4 Гц), 7,53 (1H, м), 7,59 (2H, д, J=8,4 Гц), 8,00 (1H, с).
МС m/z: 600 (М++H).
EI-МС: 599,1204 (вычислено для C27H29Cl2F2N3O4S: 599,1224).
Пример 397: 5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-2-[N-метил-N-[2-(метиламино)этил]амино]пиридин
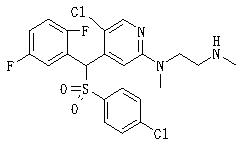
В метиленхлориде (2,0 мл) растворяли трет-бутил-2-[N-[5-хлор-4-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-2-ил]-N-метиламино]этилметилкарбамат (61 мг, 0,10 ммоль) с последующим добавлением анизола (40 мкл) и трифторуксусной кислоты (200 мкл) при комнатной температуре. Полученную смесь перемешивали в течение 1 часа. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, очищали хроматографией на силикагеле (3% метанол/хлороформ→3% метанол, 3% тетрабутиламин/хлороформ) с получением указанного в заголовке соединения (21 мг, 41%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 2,51 (3H, с), 2, 90 (2H, д, J=6,0 Гц), 3,14 (3H, с), 3,72 (2H, м), 6,13 (1H, с), 6,89 (1H, м), 7,00 (1H, м), 7,36 (1H, м), 7,41 (2H, д, J=8,4 Гц), 7,52 (1H, м), 7,60 (2H, д, J=8,4 Гц), 8,00 (1H, с).
МС m/z: 500 (М++H).
FAB-МС: 500,0770 (вычислено для C22H22Cl2F2N3O2S: 500,0778).
Пример 398: (2'S)-5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]-2-[2'-(гидроксиметил)пирролидин-1'-ил]пиридин
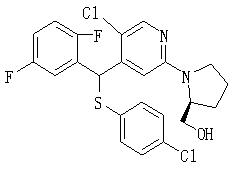
Раствор 2,5-дихлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (78 мг, 0,19 ммоль), полученного в примере 342, и (S)-2-пирролидинметанола (200 мкл) в 1,4 диоксане (1,0 мл) перемешивали при 100оС в течение 3 дней в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом (50 мл). Раствор промывали водой и насыщенным раствором соли и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (40 мг, 58%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,78 (1H, м), 2,06 (3H, м), 3,29 (1H, м), 3,50 (1H, м), 3,66 (1H, м), 3,72 (1H, м), 4,33 (1H, м), 5,97 и 5,98 (1H, с, ротамер), 6,73 и 6,77 (1H, с, ротамер), 6,92-7,15 (3H, м), 7,25 (4H, м), 7,98 (1H, с).
МС m/z: 481(М++H).
Пример 399: (2'S)-5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-2-[2'-(гидроксиметил)пирролидин-1'-ил]пиридин
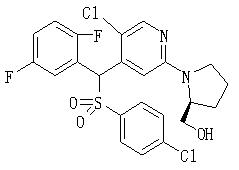
Тетрагидрат гексааммонийгептамолибдата (30 мг) добавляли к раствору (2'S)-5-хлор-4-[(4-хлорфенилтио)(2, 5-дифторфенил)метил]-2-[2'-(гидроксиметил)пирролидин-1'-ил]пиридина (39 мг, 0,08 ммоль) в метаноле (6 мл). К полученной смеси добавляли 30% водный раствор пероксида водорода (3 мл), и смесь перемешивали в течение 17 часов. Реакционную смесь разбавляли этилацетатом (60 мл). Раствор промывали водой и насыщенным раствором соли и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=1:1) с получением указанного в заголовке соединения (33 мг, 79%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,75 (1H, м), 2,02 (3H, м), 3,3-3,5 (1H, м), 3,52-3,75 (3H, м), 4,2-4,35 (1H, м), 6,05 (1H, шир.с), 6,84 (1H, м), 6,96 (1H, м), 7,36 (1H, с), 7,36 и 7,37 (2H, д, J=8,8 Гц, ротамер), 7,43 (1H, м), 7,53 и 7,54 (2H, д, J=8,8 Гц, ротамер), 7,89 и 7,90 (1H, с, ротамер).
МС m/z: 513 (М++H).
FAB-МС: 513,0627 (вычислено для C23H21Cl2F2N2O3S: 513,0618).
Пример 400: Трет-бутил-[4-[5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]морфолин-2-ил]метилкарбамат
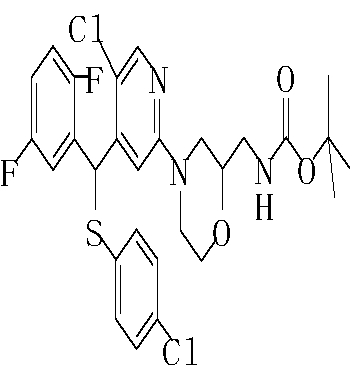
Раствор 2,5-дихлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (60 мг, 0,14 ммоль), полученного в примере 342, и трет-бутил-(морфолин-2-ил)метилкарбамата (200 мкл) в 1,4 диоксане (1,0 мл) перемешивали при 100°С в течение 2 дней в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом (50 мл). Раствор промывали водой и насыщенным раствором соли и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=5:1) с получением указанного в заголовке соединения (45 мг, 52%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,46 (9H, с), 2,72 (1H, м), 3,00 (1H, м), 3,22 (1H, м), 3,44 (1H, м), 3,6-3,75 (2H, м), 3,9-4,1 (3H, м), 4,95 (1H, шир.), 5,99 и 6,00 (1H, с, ротамер), 6,96 и 6,97 (1H, с, ротамер), 6,9-7,1 (3H, м), 7, 24 (4H, с), 8,11 (1H, с).
МС m/z: 596(М++H).
Пример 401: Трет-бутил-[4-[5-хлор-4-[(4-хлорфенилсульфонил)(2, 5-дифторфенил)метил]пиридин-2-ил]морфолин-2-ил]метилкарбамат
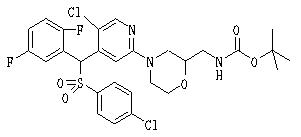
Тетрагидрат гексааммонийгептамолибдата (30 мг) добавляли к раствору трет-бутил-[4-[5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридин-2-ил]морфолин-2-ил]метилкарбамата (44 мг, 0,074 ммоль) в метаноле (6 мл). К полученной смеси добавляли 30% водный раствор пероксида водорода (3 мл), и смесь перемешивали в течение 17 часов. Реакционную смесь разбавляли этилацетатом (60 мл). Раствор промывали водой и насыщенным раствором соли и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (31 мг, 67%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,40 (9H, с), 2,69 (1H, м), 3,02 (1H, м), 3,18 (1H, м), 3,41 (1H, шир.), 3,6-3,75 (2H, м), 3,92 (1H, м), 4,02 (1H, м), 4,13 (1H, м), 4,91 (1H, шир.), 6,07 (1H, с), 6,85 (1H, м), 6,99 (1H, м), 7,37 (2H, д, J=8,4 Гц), 7,35-7,45 (2H, м), 7,53 (2H, д, J=8,4 Гц), 8,17 (1H, с).
МС m/z: 628(М+ +H).
FAB-МС: 628,1255 (вычислено для C28H30Cl2F2N3O5S: 628,1251).
Пример 402: 2-аминометил-4-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]морфолин
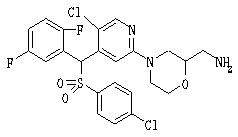
В метиленхлориде (1,5 мл) растворяли трет-бутил-[4-[5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]пиридин-2-ил]морфолин-2-ил]метилкарбамат (30 мг, 0,05 ммоль). После добавления анизола (30 мкл) и трифторуксусной кислоты (150 мкл) при комнатной температуре смесь перемешивали в течение 1 часа. Остаток, полученный концентрированием реакционной смеси при пониженном давлении, очищали хроматографией на силикагеле (3% метанол/хлороформ→3% метанол, 3% трет-бутиламин/хлороформ) с получением указанного в заголовке соединения (17 мг, 67%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 2,77 (1H, м), 2,9-3,3 (2H, м), 3,5-3,85 (3H, м), 3,97 (1H, м), 4,04-4,25 (2H, м), 6,12 (1H, с), 6,90 (1H, м), 7,02 (1H, м), 7,42 (2H, д, J=8,4 Гц), 7,4-7,55 (2H, м), 7,58 (2H, д, J=8,4 Гц), 8,05 (1H, с).
МС m/z: 528(М++H).
FAB-МС: 528,0695 (вычислено для C23H22Cl2F2N3O3S: 528,0727).
Пример 403: 5-хлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]-2-(4'-гидроксипиперидин-1'-ил)пиридин
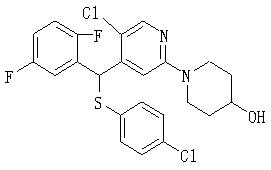
Раствор 2,5-дихлор-4-[(4-хлорфенилтио)(2,5-дифторфенил)метил]пиридина (60 мг, 0,14 ммоль), полученного в примере 342, и 4-гидроксипиперидина (200 мкл) в 1,4 диоксане (1,0 мл) перемешивали при 100оС в течение 1 дня в атмосфере азота. После охлаждения до комнатной температуры реакционную смесь разбавляли этилацетатом (50 мл). Раствор промывали водой и насыщенным раствором соли, сушили и затем концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=3:1) с получением указанного в заголовке соединения (30 мг, 43%) в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ: 1,62 (2H, м), 2,05 (2H, м), 3,30 (2H, м), 3,98 (3H, м), 5,97 (1H, с), 6,96-7,12 (3H, м), 7,23 (4H, м), 7,26 (1H, с), 8,10 (1H, с).
МС m/z: 481(М++H).
Пример 404: 5-хлор-4-[(4-хлорфенилсульфонил)(2,5-дифторфенил)метил]-2-(4'-гидроксипиперидин-1'-ил)пиридин
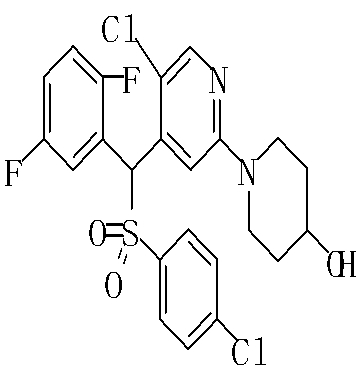
Тетрагидрат гексааммонийгептамолибдата (30 мг) добавляли к раствору 5-хлор-4-[(4-хлорфенилтио)(2, 5-дифторфенил)метил]-2-(4'-гидроксипиперидин-1'-ил)пиридина (29 мг, 0,06 ммоль) в метаноле (6 мл). К полученной смеси добавляли 30% водный раствор пероксида водорода (3 мл), и смесь перемешивали в течение 17 часов. После разбавления этилацетатом (60 мл) раствор промывали водой и насыщенным раствором соли и концентрировали при пониженном давлении. Полученный таким образом остаток очищали хроматографией на силикагеле (гексан:этилацетат=2:1) и кристаллизовали из эфира с получением указанного в заголовке соединения (17 мг, 55%) в виде твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 1,64 (2H, м), 2,02 (2H, м), 3,33 (2H, м), 3,98 (1H, м), 4,08 (2H, м), 6,11 (1H, с), 6,92 (1H, м), 7,02 (1H, м), 7,42 (2H, д, J=8,8 Гц), 7,45 (1H, м), 7,53 (1H, с), 7,58 (2H, д, J=8,8 Гц), 8,05 (1H, с).
МС m/z: 513 (М++H).
ИК (ATR) см-1: 3359, 1589, 1495, 1317, 1234, 1081, 829.
Т.пл.: 146-148°C.
FAB-МС: 513,0588 (вычислено для C23H21Cl2F2N2O3S: 513,0618).
Ссылочный пример 50: (3,6-дихлорпиридин-2-ил)(пиридин-4-ил)метанол
При перемешивании при -78°С трет-бутиллитий (1,51 М раствор в пентане: 4,6 мл) добавляли по каплям к раствору 2,5-дихлорпиридина (1,02 г, 6,89 ммоль) в эфире (20 мл). После перемешивания при -78°С в течение 2 часов к реакционной смеси добавляли пиридин-4-карбальдегид (0,65 мл, 6,89 ммоль). Полученную смесь перемешивали при -78°С в течение 1 часа. К реакционной смеси добавляли воду и температуру повышали до комнатной температуры. Смесь экстрагировали метиленхлоридом. Экстракт сушили над безводным сульфатом натрия и фильтровали. Затем фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали хроматографии на колонке с силикагелем. Полученный таким образом остаток подвергали флэш-хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси метанол:метиленхлорид (1:50), концентрировали при пониженном давлении. Полученное таким образом твердое вещество промывали эфиром и собирали фильтрованием с получением указанного в заголовке соединения (819 мг, 3,21 ммоль, 47%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 4,64 (1H, шир.д, J=6,3 Гц), 6,00 (1H, шир.д, J=6,3 Гц), 7,27 (1H, д, J=8,6 Гц), 7,31 (2H, д, J=5,8 Гц), 7,67 (1H, д, J=8,6 Гц), 8,57 (2H, д, J=5,8 Гц).
МС (m/z): 254 (М+).
Пример 405: 3, 6-дихлор-2-[(4-хлорфенилсульфонил)(пиридин-4-ил)метил]пиридин
Триэтиламин (208 мкл, 1,89 ммоль) и тионилхлорид (138 мкл, 1,89 ммоль) добавляли к раствору (3,6-дихлорпиридин-2-ил)(пиридин-4-ил)метанола (161 мг, 0,631 ммоль) в метиленхлориде (10 мл). После перемешивания при комнатной температуре в течение 4 часов реакционную смесь концентрировали при пониженном давлении. К полученному таким образом остатку добавляли этилацетат. Полученную смесь промывали последовательно насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом натрия. После фильтрования фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток растворяли в ацетонитриле (10 мл) с последующим добавлением 4-хлорбензолтиола (137 мг, 0,947 ммоль) и карбоната калия (131 мг, 0,947 ммоль). В атмосфере азота реакционную смесь перемешивали при комнатной температуре в течение 2 дней и затем при 60°С в течение 4 дней. Реакционную смесь охлаждали до комнатной температуры и затем концентрировали при пониженном давлении. К полученному таким образом остатку добавляли этилацетат. Смесь промывали последовательно водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии. Фракцию, полученную из элюата с использованием смеси 40% этилацетат/гексан, концентрировали при пониженном давлении. Полученный таким образом остаток растворяли в метаноле (10 мл), и к полученному раствору добавляли 30% водный раствор пероксида водорода и тетрагидрат гексааммонийгептамолибдата (73 мг). Реакционную смесь перемешивали при комнатной температуре в течение 5 часов. Метанол отгоняли при пониженном давлении. Насыщенный водный раствор бикарбоната натрия добавляли к полученному таким образом концентрированному раствору с последующей экстракцией метиленхлоридом. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии. Фракцию, полученную из элюата с использованием смеси метанол:метиленхлорид (=1:80), концентрировали при пониженном давлении с получением указанного в заголовке соединения (49 мг, 0,118 ммоль, 19%) в виде белого твердого вещества.
1H-ЯМР (400 МГц, CDCl3) δ: 6,08 (1H, с), 7,31 (1H, д, J=8,3 Гц), 7,41 (2H, д, J=8,8 Гц), 7,45 (2H, д, J=6,0 Гц), 7,51 (2H, д, J=8,8 Гц), 7,69 (1H, д, J=8,3 Гц), 8,58 (2H, д, J=6,0 Гц).
ИК (ATR) ν см-1: 3068, 2923, 1594, 1562, 1475, 1415, 1394, 1313, 1280, 1213, 1184, 1132, 1089, 1035, 1012, 993, 838, 813, 784, 744, 703, 595, 572, 536, 485, 458.
МС (m/z): 413, 415 (М++H).
Пример 406: 2-[1-(4-хлорфенилсульфонил)-1-(2,5-дифторфенил)этил]-5-метилпиридин
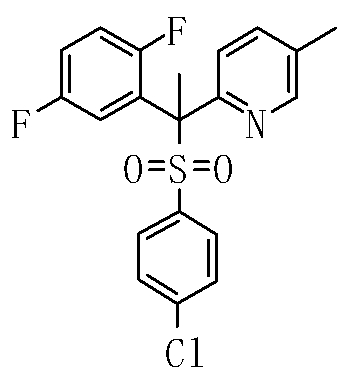
При охлаждении на льду раствор 2-[[(4-хлорфенил)сульфонил](2,5-дифторфенил)метил]-5-метилпиридина (52 мг, 0,132 ммоль), полученного в примере 137, в N,N-диметилформамиде (5 мл) добавляли по каплям к суспензии гидрида натрия (60% масляной дисперсии, 30 мг, 0,75 ммоль) в N,N-диметилформамиде (5 мл). Реакционную смесь перемешивали в течение 15 минут при охлаждении на льду и затем добавляли метилиодид (12 мкл, 0,198 ммоль). После перемешивания при комнатной температуре в течение 1 часа к реакционной смеси добавляли воду при охлаждении на льду с последующим концентрированием при пониженном давлении. К остатку добавляли воду с последующей экстракцией этилацетатом. Органический слой промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали хроматографии на колонке с силикагелем. Фракцию, полученную из элюата с использованием смеси гексан:этилацетат (=8:1), концентрировали при пониженном давлении. Полученный таким образом остаток отверждали гексаном и собирали фильтрованием с получением указанного в заголовке соединения (50 мг, 0,122 ммоль, 93%) в виде белого порошка.
1H-ЯМР (400 МГц, CDCl3) δ: 2,14 (3H, с), 2,33 (3H, с), 6,80-7,10 (2H, м), 7,23-7,34 (4H, м), 7,39-7,51 (2H, м), 7, 88-8,00 (1H, м), 8,15 (1H, с).
МС (m/z): 408 (М++H).
Пример 407: 3,6-дихлор-2-[(6-хлорпиридин-3-илтио)(пиридин-4-ил)метил]пиридин
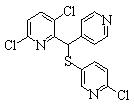
1 н. водный раствор гидроксида натрия (7 мл) добавляли к раствору S-(6-хлор-3-пиридил)-О-этилдитиокарбоната (164 мг, 0,70 ммоль), полученного в ссылочном примере 33, в этаноле (7 мл) и смесь перемешивали при 80оС в течение 3 часов. После охлаждения до комнатной температуры к реакционной смеси добавляли 1 н. хлористо-водородную кислоту. Смесь экстрагировали дихлорметаном. Органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении с получением 6-хлор-3-пиридинтиола в виде желтого твердого вещества.
Триэтиламин (0,167 мл, 1,20 ммоль) и затем метансульфонилхлорид (0,07 мл, 0,90 ммоль) добавляли к раствору (3,6-дихлорпиридин-2-ил)(пиридин-4-ил)метанола (153 мг, 0,60 ммоль), полученного в ссылочном примере 50, в дихлорметане (3 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия. Затем органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
Раствор 6-хлор-3-пиридинтиола в N,N-диметилформамиде (2 мл) и карбонат калия (100 мг, 0,72 ммоль) последовательно добавляли к раствору полученного остатка в N,N-диметилформамиде (3 мл). Полученную смесь перемешивали при комнатной температуре в течение 18 часов. К реакционной смеси добавляли этилацетат. После промывания насыщенным водным раствором бикарбоната натрия органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=7:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (83 мг, 0,22 ммоль, 36%) в виде желтого масла.
1H-ЯМР (400 МГц, CDCl3) δ: 5,69 (1H, с), 7,20 (1H, д, J=8,3 Гц), 7,24 (1H, д, J=8,3 Гц), 7,35 (2H, д, J=6,1 Гц), 7,52 (1H, дд, J=8,3, 2,4 Гц), 7,62 (1H, д, J=8,3 Гц), 8,32 (1H, д, J=2,4 Гц), 8,55 (2H, д, J=6,1 Гц).
МС m/z: 382 (М++H).
Пример 408: 3,6-дихлор-2-[(6-хлорпиридин-3-илсульфонил)(пиридин-4-ил)метил]пиридин (соединение А) и 3,6-дихлор-2-[(6-хлорпиридин-3-илсульфинил)(пиридин-4-ил)метил]пиридин (соединение В (изомер А) и соединение В (изомер В))
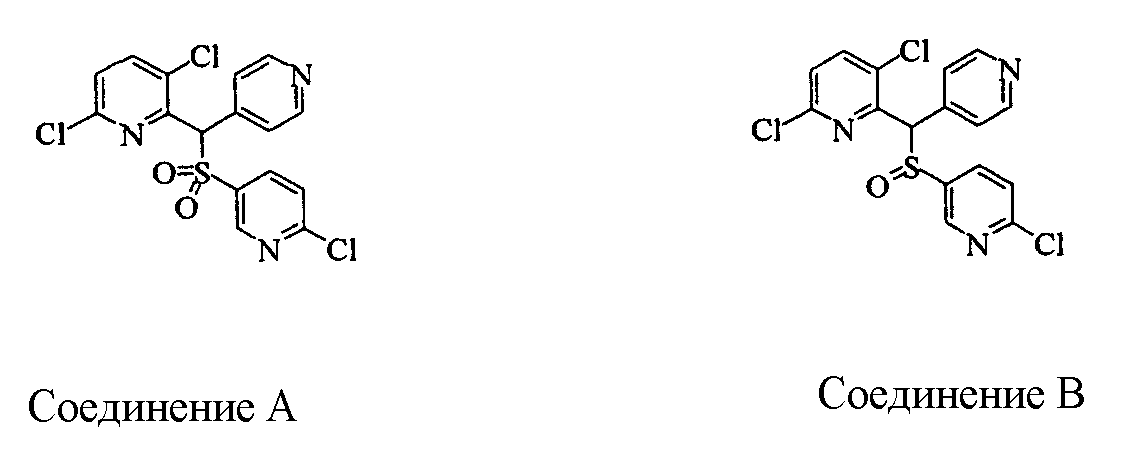
31% водный раствор пероксида водорода (2 мл) и тетрагидрат гексааммонийгептамолибдата (30 мг) добавляли к раствору 3,6-дихлор-2-[(6-хлорпиридин-3-илтио)(пиридин-4-ил)метил]пиридина (82 мг, 0,24 ммоль) в метаноле (4 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли этилацетат. После промывания насыщенным водным раствором бикарбоната натрия органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=3:2, концентрировали при пониженном давлении с получением указанного в заголовке соединения А (41 мг, 0,098 ммоль, 46%). Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=1:1, концентрировали при пониженном давлении с получением указанного в заголовке соединения В (изомера А) (низкой полярности) (8 мг, 0,020 ммоль, 9%) и указанного в заголовке соединения В (изомера В) (высокой полярности) (8 мг, 0,020 ммоль, 9%), каждого, соответственно, в виде белого твердого вещества.
Соединение А
1H-ЯМР (400 МГц, CDCl3) δ: 6,11 (1H, с), 7,35 (1H, д, J=8,3 Гц), 7,36 (2H, д, J=6,1 Гц), 7,40 (1H, д, J=8,3 Гц), 7,73 (1H, д, J=8,3 Гц), 7,78 (1H, дд, J=8,3, 2,4 Гц), 8,48 (1H, д, J=2,4 Гц), 8, 61 (2H, д, J=6,1 Гц).
МС m/z: 414 (М++H).
Соединение В (изомер А)
1H-ЯМР (400 МГц, CDCl3) δ: 5,54 (1H, с), 6, 99 (2H, д, J=6,1 Гц), 7,27 (1H, д, J=8,3 Гц), 7,37 (1H, д, J=8,3 Гц), 7,55 (1H, дд, J=8,3, 2,2 Гц), 7,73 (1H, д, J=8,3 Гц), 8,47 (1H, д, J=2,2 Гц), 8,51 (2H, д, J=6,1 Гц).
МС m/z: 398 (М++H).
Соединение В (изомер В)
1H-ЯМР (400 МГц, CDCl3) δ: 5,40 (1H, с), 7,26 (1H, д, J=8,5 Гц), 7,42 (1H, д, J=8,3 Гц), 7,53 (2H, д, J=6,1 Гц), 7,57 (1H, д, J=8,5 Гц), 7,96 (1H, дд, J=8,3, 2,4 Гц), 8,34(1H, д, J=2,4 Гц), 8,68 (2H, д, J=6,1 Гц).
МС m/z: 398 (М++H).
Пример 409: 2-[[(3-хлорпиридин-4-ил)(2,5-дифторфенил)метил]сульфонил]пиримидин
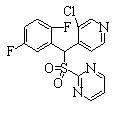
Триэтиламин (0,112 мл, 0,80 ммоль) и метансульфонилхлорид (0,046 мл, 0,60 ммоль) добавляли последовательно к раствору 3-хлор-4-[(2,5-дифторфенил)гидроксиметил]пиридина (102 мг, 0,40 ммоль), полученного в ссылочном примере 48, в дихлорметане (4 мл) при 0°С. Полученную смесь перемешивали при комнатной температуре в течение 17 часов. После промывания насыщенным водным раствором бикарбоната натрия органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
К раствору полученного остатка в N, N-диметилформамиде (4 мл) добавляли 2-пиримидинтиол (45 мг, 0,40 ммоль), и затем карбонат калия (83 мг, 0,60 ммоль) и смесь перемешивали при комнатной температуре в течение 23 часов. К реакционной смеси добавляли этилацетат. После промывания водой органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении.
К раствору полученного остатка в дихлорметане (4 мл) добавляли 3-хлорпербензойную кислоту (чистота: 65% или более) (212 мг, 0,80 ммоль) при 0°С, и полученную смесь перемешивали при комнатной температуре в течение 3 часов. После промывания 1 н. водным раствором гидроксида натрия органический слой сушили над безводным сульфатом натрия и фильтровали. Фильтрат концентрировали при пониженном давлении. Полученный таким образом остаток подвергали флэш-хроматографии на силикагеле. Фракцию, полученную из части элюата с использованием смеси гексан:этилацетат=2:3, концентрировали при пониженном давлении с получением указанного в заголовке соединения (19 мг, 0,049 ммоль, 12%) в виде бесцветной пены.
1H-ЯМР (400 МГц, CDCl3) δ: 6,26 (1H, с), 6,93-7,13 (3H, м), 7,50-7,56 (1H, м), 8,01-8,08 (1H, м), 8,13 (1H, д, J=5,1 Гц), 8,48 (1H, д, J=2,2 Гц), 8,60 (1H, с), 8,66 (1H, д, J=5,1 Гц).
МС m/z: 382 (М++H).
Тест-пример
Анализ на основе клеток для скрининга соединения, которое ингибирует продуцирование или секрецию β-амилоидного белка
Клетки Е35, которые были выявлены по трансфекции гена АРР751, продукт которого является человеческим β-амилоидным белком-предшественником дикого типа, в клетках глиомы человека (клетки Н4), использовали для анализа ингибирующей активности соединения против продуцирования β-амилоида. Количество β-белка (Аβ), секретируемого в культуральную среду, измеряли твердофазным иммуноферментным анализом (типа сэндвич-анализа).
Клетки Е35 высевали в модифицированной по способу Дульбекко среде Игла, содержащей 10% инактивированную фетальную телячью сыворотку, на 96-луночных планшетах и культивировали в увлаженном воздухе с 5% СО2 при 37°С в СО2-термостате. Спустя двадцать четыре часа после посева клеток в эту среду добавляли тестируемое соединение, растворенное в ДМСО. Раствор в ДМСО соединения готовили таким образом, чтобы конечная концентрация ДМСО в данной среде была 0,05%. Клетки культивировали в течение дополнительных двадцати четырех часов и затем культуральную среду собирали. Собранную среду наносили в 96-луночный планшет ELISA, на котором было иммобилизовано моноклональное антитело 25-1, которое узнавало Аβ25-35, с последующим инкубированием при 4°С в течение 16-20 часов. После промывания фосфатным буфером (рН 7,4) в планшет добавляли биотинилированное моноклональное антитело МА32-40, которое узнает Аβ1-8, и этот планшет инкубировали при 4°С в течение 2 часов. Затем в планшет добавляли конъюгированный со щелочной фосфатазой стрептавидин. Активность щелочной фосфатазы измеряли колориметрическим анализом с использованием BlouPhos (изготовляемого KPL) в качестве субстрата. Количество Аβ в среде рассчитывали с использованием отдельно полученной калибровочной кривой. EC50 тестируемого соединения представляли в виде концентрации, которая дает 50% ингибирующую активность в сравнении с контрольными клетками, которые не обрабатывали данным соединением.
С другой стороны, цитотоксичность данного соединения анализировали следующим образом. Данное соединение добавляли к культивируемым клеткам Н4 и после инкубирования в течение 72 часов выполняли колориметрический анализ с использованием красителя AlamarBlue (изготовляемого BIOSOURCE) и измеряли оптическую плотность лунок. Концентрация тестируемых соединений, которая дает 80% или более высокую оптическую плотность в сравнении с оптической плотностью контрольных клеток, была определена как концентрация, при которой появляется цитотоксичность. Когда наблюдали значимое различие между EC50 и концентрацией, при которой появлялась цитотоксичность, данное соединение оценивается как активное соединение.
Результаты оценки соединения (1) с использованием описанного выше анализа показаны в таблице 1. Соединения, проявляющие EC50 не более чем 50 нМ, оценивали как +++, соединения, проявляющие EC50 в диапазоне от 50 нМ до 500 нМ, оценивали как ++, и соединения, проявляющие EC50 в диапазоне от 500 нМ до 5 мкМ, оценивали как +.
Промышленная применимость
Соединения, представленные формулой (1), их соли, N-оксиды и S-оксиды и сольваты любых из них имеют ингибирующее действие против продуцирования или секреции β-амилоидного белка. Таким образом, они являются фармацевтически эффективными для предупреждения и лечения различных заболеваний, таких как болезнь Альцгеймера, синдром Дауна и другие заболевания, связанные с депонированием амилоида.
Реферат
Описывается соединение общей формулы (3):
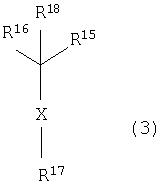
где R15 представляет гетероциклическую группу, выбранную из 3-7-членной насыщенной или 4-7-членной ненасыщенной моноциклической гетероциклической группы, имеющей 1-4 атома, выбранных из атома азота, атома кислорода и атома серы, или 7-14-членной полициклической гетероциклической группы, имеющей 1-4 атома, выбранных из атома азота, атома кислорода и атома серы, которая может иметь заместитель; R16представляет циклоалкильную группу, имеющую 3-7 атомов углерода, моноциклическую ароматическую углеводородную группу, имеющую 6-14 атомов углерода, или гетероциклическую группу, выбранную из 3-7-членной насыщенной или 4-7-членной ненасыщенной моноциклической гетероциклической группы, имеющей 1-4 атома, выбранных из атома азота, атома кислорода и атома серы, которая может иметь заместитель; R17представляет моноциклическую ароматическую углеводородную группу, имеющую 6-14 атомов углерода, или гетероциклическую группу, выбранную из 4-7-членной ненасыщенной моноциклической гетероциклической группы, имеющей 1-4 атома, выбранных из атома азота, атома кислорода и атома серы, которая может иметь заместитель, R18 представляет атом водорода или С1-6алкильную группу; Х представляет -S-, -SO- или -SO2-; или N-оксид или S-оксид данного соединения; их соль; или сольват описанного выше соединения. Предложенные соединения обладают ингибирующей активностью против продуцирования/секреции β-амилоидного белка и могут быть использованы для лечения таких болезней, как болезнь Альцгеймера, синдром Дауна и другие заболевания, связанные с депонированием амилоида. 6 з.п. ф-лы, 1 табл.
Формула
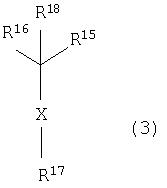

Комментарии