Гидрохлориды замещенных 2-[(диметиламино)метил]арилдиметилкарбаматов, обладающие антихолинэстеразной активностью - RU2754133C1
Код документа: RU2754133C1
Описание
Изобретение относится к медицине, в частности к получению солей замещенных 2-[(диметиламино)метил]арилдиметилкарбаматов общей формулы I (Ia-о) и применению их в качестве обратимых ингибиторов холинэстеразы (ОИХЭ), способствуя таким образом ее восстановлению в процессе декарбамилирования.


Заявляемые третичные карбаматы замещенных о-диметиламинометилфенолов являются активными и малотоксичными соединениями, способными к обратимому взаимодействию с холинэстеразами. Четыре представителя заявляемого ряда (Ia, г, е и к) заявлены в качестве инсектицидов еще в 1958 году [US 2.843.519].
Задачей настоящего изобретения является оценка и возможность применения заявляемых карбаматов по новому назначению, в качестве ОИХЭ центрального действия, крайне необходимых при лечении отравлений фосфорорганическими соединениями, холиноблокаторамии и антидепрессантами.
Центральные эффекты карбаматов коррелируют со степенью ингибирования холинэстеразы мозга, приводя к частичному восстановлению холинэргической передачи, что и позволяет ОИХЭ устранять интоксикацию атропином. [Медицинская токсикология: национальное руководство / под ред. Е.А. Лужникова. - М. ГЭОТАР -Медиа, 2014, с. 507-530); Wiezorek W. L., Rashner I. Arch. Toxicol. 1982, Suppl. 5, p. 133-135; IPCS Int. Progr. Chem. Safety., Carbamate Pesticides: a general introduction., World Health Organ., 1986].
Антихолинэстеразные средства, проникающие в ЦНС, оказывают терапевтическое действие при миастении, двигательных нарушениях и болезни Альцгеймера, уменьшая выраженность когнитивных расстройств. [Лемина Е. Ю., Чурюканов В. В., Эксп. клинич. фармакол., 2019, т. 82, №5, с. 40-44].
Близкие по строению и проявлению ингибирующих свойств соединения представляют собой 2-диметиламинометилкарбаматы 3-оксипиридина [US 2.512.732]. Преимуществом заявляемых соединений является более простое техническое решение, поскольку общепринятая схема синтеза исходит из более доступных замещенных о-аминофенолов, в отличие от аналогичных производных 3-гидроксипиридина.
Одно из запатентованных соединений - N,N-диметил-(2-1 N,N-диметиламинопиридил-3)-карбамат дигидрохлорид был разработан в СССР под названием «аминостигмин» (АС) как ОИХЭ. [Прозоровский В. Б., Павлова Л.В., Панов П. А. и др. Хим.-фарм. журнал, т. 25, №1. 1991, с. 87-88; Тонкопий В. Д., Прозоровский В. Б., Консторум М. Г., Бюлл. экспер. биол. и мед., т. 80, №8, 1975, с. 120-122]. В связи с вышесказанным фармакологические свойства заявляемых соединений представлены в сравнении с аминостигмином.

Аминостигмин, входящий в состав принятого на вооружение профилактического антидота против отравлений фосфорорганическими соединениями, в настоящее время не производится [Гладких В.Д. Острые отравления аварийно-опасными химическими веществами. Диагностика и лечение. Руководство / М.: «Комментарий», 2018, 264 с.]. С целью получения доступных, эффективных, менее токсичных, с широким спектром действия препаратов и были синтезированы заявляемые соединения.
Все соединения синтезировали по единой схеме в две стадии.
Первая стадия представляет собой реакцию Манниха соответствующего замещенного фенола или нафтола с диметиламином и формальдегидом по Терентьеву А.П. с соавт.[Терентьев А.П., Рухадзе Е.Г., Заенолова С.Ф. В сб. Проблемы органического синтеза. М., Наука, 1965, 122 с.]. Полученный таким образом (о-диметиламинометил)замещенный фенол (или нафтол) на второй стадии в реакции с N,N-диметиламинокарбамоилхлоридом в среде пиридина дает целевые продукты, которые затем выделяют в виде гидрохлоридов.
Пример 1. Синтез 2-[(диметиламино)метил]фенил диметилкарбамата.
В трехгорлую колбу, снабженную мешалкой, обратным холодильником и термометром, загружают 19 г (0.2М) фенола и 40 мл 33% водного раствора (0.3М) диметиламина. Перемешивают 30 мин при 40°С, после чего медленно добавляют 20 мл формалина (37% водного раствора формальдегида, 0.25М). Реакционную смесь нагревают до 90°С, добавляют 0.5 г KOH в 5 мл воды и кипятят 4 часа, а затем переносят в делительную воронку. Экстрагируют горячим толуолом дважды по 20 мл, толуол отгоняют. Остаток перегоняют в вакууме водоструйного насоса, собирая фракцию с 130-143°С/10 мм. Получают продукт в виде 16.45 г бесцветного масла (54% от теории).
В трехгорлой колбе, снабженной мешалкой и обратным холодильником, растворяют полученное основание Манниха (17.1 г, 0.11 М) в 60 мл пиридина, медленно по каплям прибавляют при охлаждении льдом с водой диметилкарбамоилхлорид (18.3 г, 16 мл, 0.17 М). Реакционную смесь выдерживают при комнатной температуре 4.5 часа. Пиридин испаряют в вакууме водоструйного насоса. Остаток дважды обрабатывают 20 мл толуола, толуольные экстракты объединяют, после чего также испаряют толуол в вакууме водоструйного насоса. К полученному остатку добавляют воду (60 мл), подщелачивают 10% раствором соды и экстрагируют эфмиром (2×40 мл). Эфирный раствор сушат над безводным сульфатом магния, эфир испаряют, а остаток перегоняют в вакууме, собирая фракцию с Тпл, 130-143°С/4 мм. Продукт в виде масла (16.0 г) с помощью спиртового раствора HCl переводят в гидрохлорид. В итоге получают белый кристаллический продукт (14.3 г, 44%) с Тпл 178-179.5°С (ацетон).
Все остальные карбаматы заявляемого ряда (таблица 1) были получены аналогичным образом из соответствующих фенолов (нафтолов), их выделяли и характеризовали в виде гидрохлоридов.
Индивидуальность соединений контролировалась методом ТСХ и подтверждена данными спектроскопии1Н ЯМР (разрешение 500 Мгц, ДМСО).
Физико-химические характеристики и спектральные данные представлены в таблице 1.

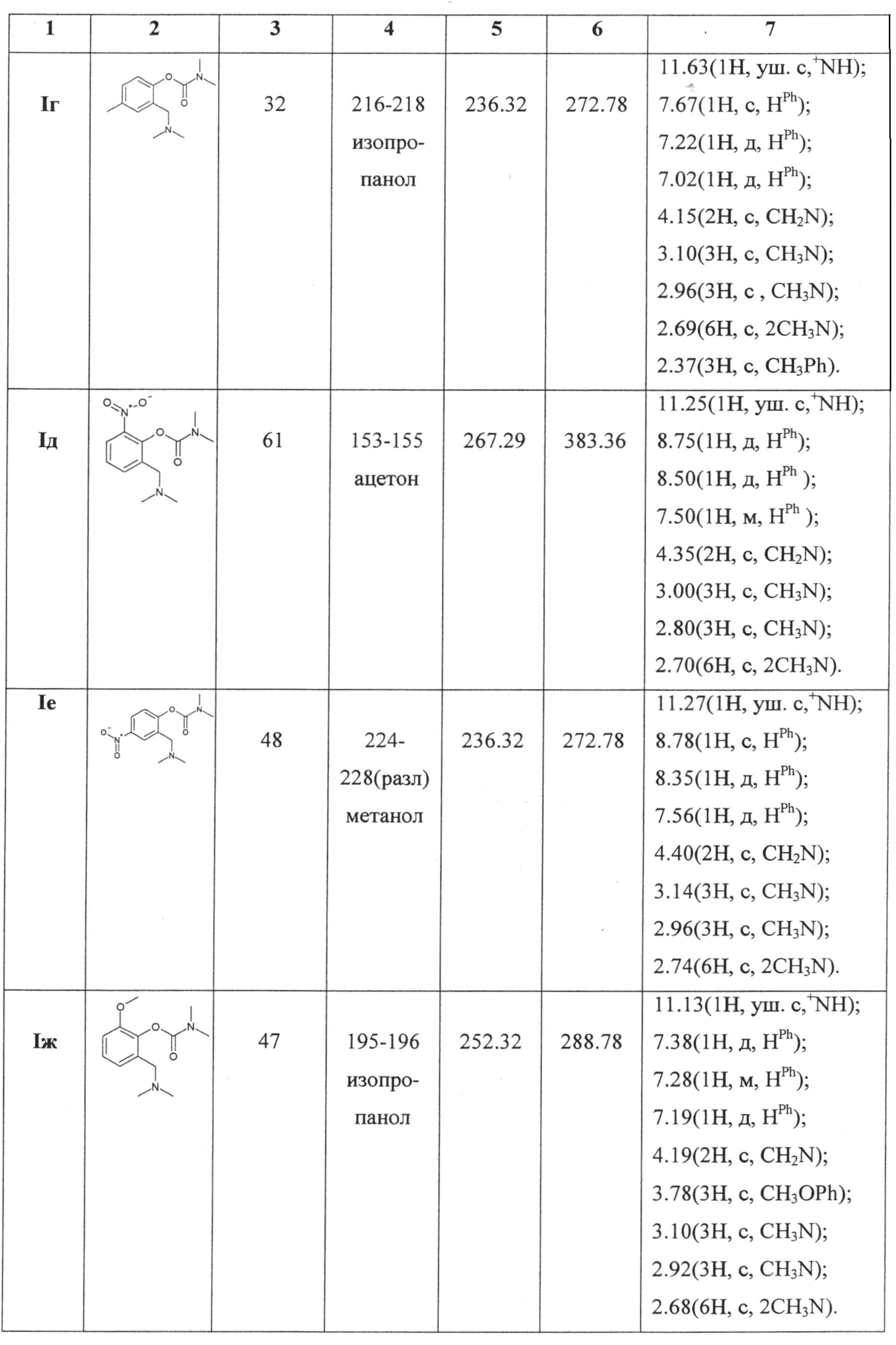

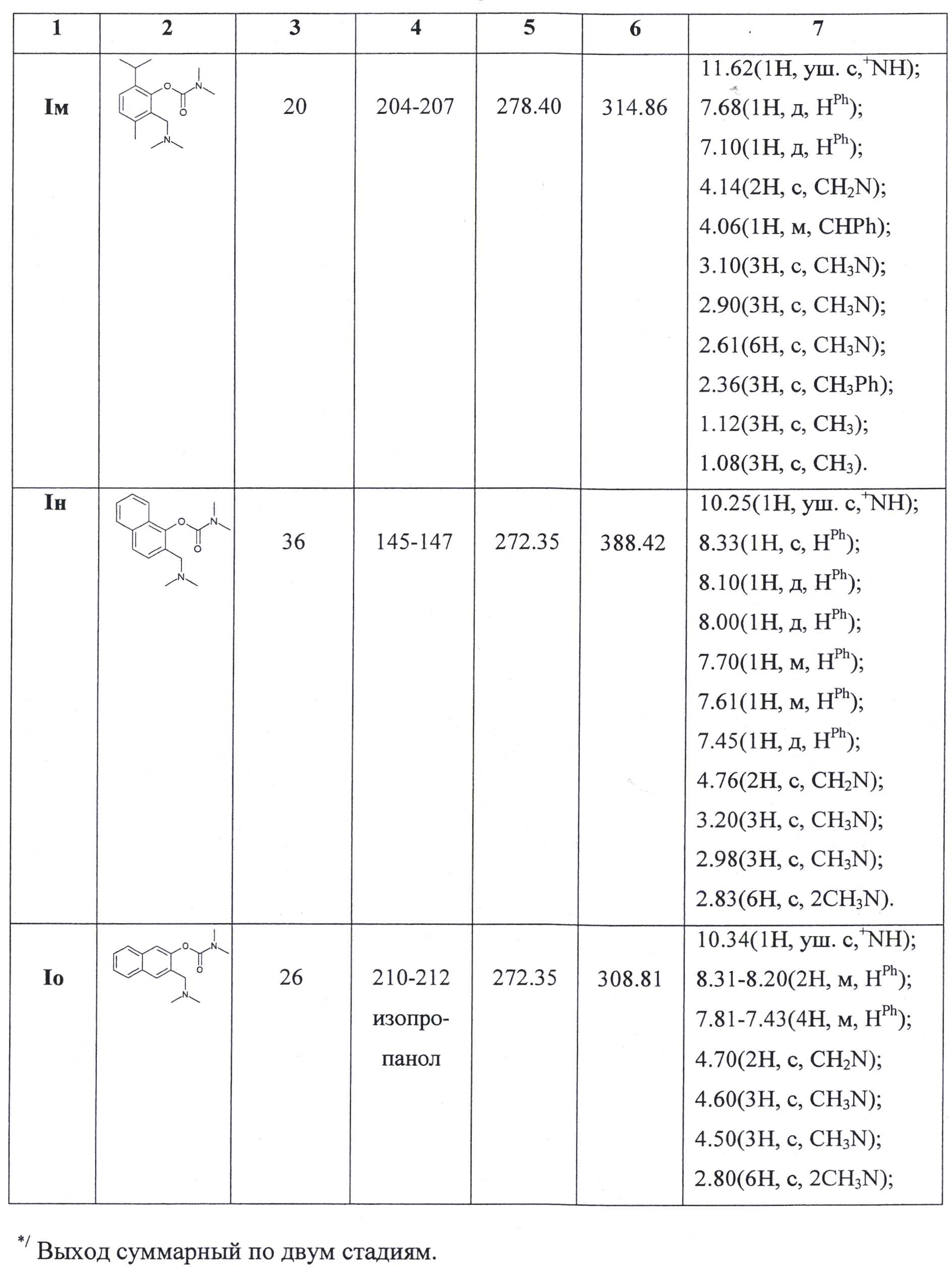
Для подтверждения целевого назначения заявляемых карбаматов необходимо было выявить и определить их антихолинэстеразную активность в сравнении с аминостигмином в опытах in vitro и in vivo (см. табл. 2)
Пример 2.
Определение антихолинэстеразной активности заявляемых соединений и аминостигмина в условиях in vitro.
Антихолинэстеразную активность замещенных 2-[(диметиламино)метил]арил диметилкарбаматов (соединения Ia-о) и аминостигмина определяли при взаимодействии последних с частично очищенной (удельная активность 2,3 мкмоль/мин на 1 мг белка) АХЭ эритроцитов человека (производитель - ФГУП "Пермское НПО "Биомед", Россия). Обратимое ингибирование характеризовали константой ингибирования (К;), определяемой графически методом Лайнуивера-Берка [А. Ленинджер, Биохимия. Мир, М. 1974, с. 191.; Корниш-Бодуэн Э. Основы ферментативной кинетики. Мир, М. 1979, с. 45-46.; IPCS Int. Progr. Chem. Safety., Carbamate Pesticides: a general introduction., World Health Organ., 1986, p.37]
Концентрации добавляемого в раствор АХЭ ацетилхолина (АХ) варьируют в пределах (1-8)⋅10-4 М.
Скорость гидролиза АХ определяют в условиях постоянства субстрата и рН=7.0, при температуре 37°С, ионной силе 0,225 на автотитраторе «Радиометр» в токе аргона.
Полученные значения констант (K1), подтверждающие ингибирующую активность карбаматов приведены в таблице 2.
Защитный эффект заявляемых соединений и аминостигмина в качестве ОИХЭ на фоне необратимого фосфорилирования АХЭ S-диметиламиноэтилового O-2-метилпропилового эфира метилтиофосфоновой кислоты (далее - ФОС) или фосфакола определяли in vitro, по активностям АХЭ аналогично примеру 2.
Конкурентное ингибирование с ФОС определяли в опытах in vitro и in vivo (примеры 3-4). Опыты in vivo связаны с расчетом индекса защиты, определяемом на фоне введения животным ОИХЭ в стандартной дозе

Пример 3.
Способность обратимых ингибиторов уменьшать степень необратимого фосфорилирования активных центров АХЭ ФОС.
Эксперименты выполняли при 37°С, рН 7,0 и ионной силе - 0,225. Активность холинэстеразы определяли по вышеуказанной методике (пример 2). Полученные результаты величин констант декарбамилирования (кгидр.) и индексов защиты представлены в табл. 2.
Пример 4.
Скорость декарбамилирования АХЭ.
Полученные константы кгидр определены в условиях частичного угнетения активности АХЭ (на 50-70%) с последующим разведением ингибированного фермента в 50-100 раз. Полученный раствор АХЭ выдерживали при 37°С, рН 7.0 и значении ионной силы 0.225. Затем через равные промежутки времени (1, 2, 3, 5, 10, 60 мин) отбирали необходимое количество раствора и определяли активность восстановленного фермента -АХЭ. Значения кгидр приведены в Табл. 2
Токсичность заявляемых соединений и аминостигмина.
Пример 5.
Острую токсичность заявляемых соединений и аминостигмина определяли в экспериментах на белых мышах-самцах массой 16-20 грамм, содержащихся в стандартных условиях вивария. Исследуемые препараты разводили в физиологическом растворе, готовя различные концентрации. Экспериментальным животным тестируемые соединения вводили внутримышечно в увеличивающихся дозах (от ЛД0 до ЛД100) из расчета 0,1 мл раствора на 10 грамм массы животного. На каждую дозу брали 6 животных. Наблюдение за животными осуществляли в течение суток, после истечения суток учитывали результат (выжило/погибло). Расчет ЛД50 проводили по методу Прозоровского В.Б. с соавторами [Прозоровский В.Б., Прозоровская М.П., Демченко В.М. Фармакология и токсикология, 1978, т. XLI, №4, с. 497-592.]
Результаты представлены в табл. 2:

Реферат
Изобретение относится к области медицины, в частности к применению гидрохлоридов замещенных 2-[(диметиламино)метил]арилдиметилкарбаматов общей формулы I в качестве обратимых ингибиторов ацетилхолинэстеразы центрального действия, которые могут найти применение при лечении отравлений антидепрессантами, фосфорорганическими и холинотропными соединениями. Изобретение относится также к новым замещенным гидрохлоридам 2-[(диметиламино)метил]арилдиметилкарбаматов. 2 н.п. ф-лы, 2 табл., 5 пр.
Формула



Комментарии