Конъюгат антитела и лекарственного средства, композиции на его основе и способы их получения - RU2728235C2
Код документа: RU2728235C2
Чертежи












Описание
Ссылка на родственную заявку
Согласно настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США №62/011534, поданной 12 июня 2014 г., которая полностью включена в настоящий документ посредством ссылки.
Предшествующий уровень техники настоящего изобретения
Терапевтические средства на основе антител сыграли важную роль в таргетной терапии для различных нарушений, таких как злокачественные опухоли и иммунологические заболевания. В последние годы конъюгаты антитела и лекарственного средства (ADC) подвергали обширным исследованиям в отношении эффективной доставки лекарственных средств к местам назначения. Например, широко использовали химическую модификацию для конъюгирования лекарственных средств с антителами либо посредством аминов боковой цепи лизина, либо посредством сульфгидрильных групп цистеина. Тем не менее, указанные способы конъюгации зачастую давали в результате гетерогенную смесь конъюгатов, характеризующихся различными молярными отношениями лекарственного средства к антителу, неспецифическими сайтами конъюгации, а также различной эффективностью, безопасностью и фармакокинетикой. См. Tanaka et al, FEBS Letters 579:2092-2096 (2005). Кроме того, были получены реакционноспособные остатки цистеина, сконструированные на конкретных сайтах антител для конъюгации с конкретным лекарственным средством с определенной стойхиометрией. См. Junutula et al., Nature Biotechnology, 26: 925-932 (2008). Тем не менее, экспрессия и конъюгация таких модифицированных цистеином антител и конъюгатов антитела и лекарственного средства требуют продолжительных и сложных процедур реакции. См., например, Gomez et al., Biotechnology and Bioengineering, 105(4): 748-760 (2009). Кроме того, в процессе получения модифицированных цистеином антител и конъюгатов антитела и лекарственного средства можно создать агрегаты антител. Кроме того, неприродные аминокислотные остатки встраивали в антитела в качестве химических стеблей для сайт-специфической конъюгации. См. Axupa et al., PNAS, 109: 16101-16106 (2012). Для осуществления такой методики ортогональная пара амбер-супрессорной тРНК и аминоацил-тРНК-синтазы должна быть интегрирована вначале в хозяина экспрессии. Затем мутантное антитело можно экспрессировать в этом конкретном хозяине с умеренной добавкой неприродной аминокислоты. Указанный способ не только требует временных затрат, но также характеризуется очень низким выходом экспрессии антитела.
Недавно проанализировали ферментативные подходы в получении ADC с использованием трансглутаминазы. Трансглутаминазы (ТГазы) переносят фрагмент, содержащий донорную группу амина на акцепторный остаток глутамина посредством трансглутаминирования. Полноразмерные антитела IgG человеческого изотипа содержат консервативный остаток глутамина в положении 295 тяжелой цепи (Q295). Поскольку указанный остаток глутамина расположен в непосредственной близости от сайта N-гликозилирования (N297), как правило, считают, что Q295 на полноразмерном антителе является недоступным ТГазе, когда антитело является N-гликозилированным. Чтобы позволить ТГазе действовать на полноразмерные антитела, область Fc антитела дегликозилировали или мутировали для удаления сайта N-гликозилирования перед опосредованной ТГазой конъюгации. См. международную патентную публикацию WO 2013/092998. Альтернативно, "метки" глутамин-содержащей последовательности вводили в легкие или тяжелые цепи антител для обеспечения акцепторных сайтов глутамина. См. международную патентную публикацию WO 2012059882. Следовательно, все современные технологии сайт-специфических ADC основаны на сконструированных мутантах антител, которые могут приводить к потенциальной иммуногенности и in vivo нестабильности. Существует настоятельная потребность в эффективном инструменте сайт-специфической конъюгации антител, при котором можно напрямую использовать интактное антитело.
Все публикации, патенты и патентные заявки, процитированные в настоящем документе, тем самым полностью включены посредством ссылки в настоящий документ.
Краткое раскрытие настоящего изобретения
Настоящее изобретение согласно одному аспекту относится к Fc-содержащему полипептидному конъюгату, содержащему Fc-содержащий полипептид, сайт-специфически конъюгированный с конъюгируемым фрагментом, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования, и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина.
Согласно некоторым вариантам осуществления акцепторный остаток глутамина фланкирован сайтом N-гликозилирования в положении +2 относительно остатка глутамина. Согласно некоторым вариантам осуществления N-гликозилированная область Fc содержит аминокислоты 290-300 тяжелой цепи иммуноглобулин, причем нумерацию осуществляют согласно индексу Kabat. Согласно некоторым вариантам осуществления N-гликозилированная область Fc представляет собой область Fc встречающейся в природе тяжелой цепи иммуноглобулина.
Согласно некоторым вариантам осуществления согласно любому из представленных выше вариантов осуществления иммуноглобулин выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. Согласно некоторым вариантам осуществления Fc-содержащий полипептид представляет собой тяжелую цепь иммуноглобулина. Согласно некоторым вариантам осуществления Fc-содержащий полипептид представляет собой полноразмерное антитело. Согласно некоторым вариантам осуществления антитело представляет собой человеческое или гуманизированное антитело. Согласно некоторым вариантам осуществления обе тяжелых цепи антитела являются конъюгированными с конъюгируемым фрагментом. Согласно некоторым вариантам осуществления акцепторный остаток глутамина находится в положении 295, и сайт N-гликозилирования находится в положении 297, причем нумерацию осуществляют согласно индексу Kabat.
Согласно некоторым вариантам осуществления согласно любому из представленных выше вариантов осуществления конъюгируемый фрагмент содержит активный фрагмент, выбранный из группы, состоящей из следующего: фрагмент, который улучшает фармакокинетическое свойство Fc-содержащего полипептида, терапевтический фрагмент и диагностический фрагмент. Согласно некоторым вариантам осуществления активный фрагмент представляет собой токсин.
Согласно некоторым вариантам осуществления согласно любому из представленных выше вариантов осуществления Fc-содержащий полипептид и конъюгируемый фрагмент являются конъюгированными посредством такого линкера, как расщепляемый линкер или нерасщепляемый линкер.
Согласно некоторым вариантам осуществления предусмотрена композиция, содержащая любой описанный выше Fc-содержащий полипептидный конъюгат, причем по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно любое значение из 60%, 70%, 80%, 90% или 95%) Fc-содержащих полипептидных конъюгатов в композиции являются гликозилированными в области Fc. Согласно некоторым вариантам осуществления по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно любое значение из 60%, 70%, 80%, 90% или 95%) Fc-содержащих полипептидных конъюгатов характеризуются молярным отношением Fc-содержащего полипептида к конъюгируемому фрагменту, составляющим 1:1 или 1:2.
Согласно одному аспекту предусмотрен конъюгат антитела и лекарственного средства, содержащий антитело, конъюгированное с конъюгируемым фрагментом через эндогенный акцепторный остаток глутамина на антителе, причем конъюгат антитела и лекарственного средства является гликозилированным в области Fc. Согласно некоторым вариантам осуществления конъюгат антитела и лекарственного средства является N-гликозилированным в области Fc. Согласно некоторым вариантам осуществления антитело представляет собой антитело человека. Согласно некоторым вариантам осуществления антитело представляет собой гуманизированное антитело.
Согласно некоторым вариантам осуществления согласно любому из описанных выше конъюгатов антитела и лекарственного средства обе тяжелых цепи антитела являются конъюгированными с конъюгируемым фрагментом.
Согласно некоторым вариантам осуществления согласно любому из описанных выше конъюгатов антитела и лекарственного средства конъюгируемый фрагмент содержит активный фрагмент, выбранный из группы, состоящей из следующего: фрагмент, который улучшает фармакокинетическое свойство антитела, терапевтический фрагмент и диагностический фрагмент. Согласно некоторым вариантам осуществления активный фрагмент представляет собой токсин.
Согласно некоторым вариантам осуществления согласно любому из описанных выше конъюгатов антитела и лекарственного средства антитело и конъюгируемый фрагмент являются конъюгированными через линкер. Согласно некоторым вариантам осуществления линкер представляет собой расщепляемый линкер. Согласно некоторым вариантам осуществления линкер представляет собой нерасщепляемый линкер.
Согласно некоторым вариантам осуществления предусмотрена композиция, содержащая любой из описанных выше конъюгатов антитела и лекарственного средства, причем по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно любое значение из 60%, 70%, 80%, 90% или 95%) конъюгатов антитела и лекарственного средства в композиции являются гликозилированными в области Fc. Согласно некоторым вариантам осуществления по меньшей мере 80% конъюгатов антитела и лекарственного средства в композиции характеризуются молярным отношением антитела к конъюгируемому фрагменту, составляющим 1:1 или 1:2.
Согласно одному аспекту предусмотрен способ получения Fc-содержащего полипептидного конъюгата, содержащего Fc-содержащий полипептид, специфически конъюгированный с конъюгируемым фрагментом, предусматривающий следующее: проведение реакции Fc-содержащего полипептида с конъюгируемым фрагментом в присутствии трансглутаминазы при условии, которое является достаточным для создания Fc-содержащего полипептидного конъюгата, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования, и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина.
Согласно некоторым вариантам осуществления предусмотрен способ получения Fc-содержащего полипептидного конъюгата, содержащего Fc-содержащий полипептид, специфически конъюгированный с конъюгируемым фрагментом, содержащим низкомолекулярный стебель и активный фрагмент, предусматривающий следующее: a) проведение реакции Fc-содержащего полипептида с низкомолекулярным стеблем в присутствии трансглутаминазы при условии, которое является достаточным для создания промежуточного конъюгата, содержащего Fc-содержащий полипептид, специфически конъюгированный с низкомолекулярным стеблем, и b) соединение промежуточного конъюгата с активным фрагментом, тем самым получая Fc-содержащий полипептидный конъюгат, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования, и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина. Согласно некоторым вариантам осуществления трансглутаминаза представляет собой трансглутаминазу дикого типа, характеризующуюся аминокислотной последовательностью согласно SEQ ID NO: 16. Согласно некоторым вариантам осуществления трансглутаминаза представляет собой сконструированную трансглутаминазу, такую как сконструированная трансглутаминаза, содержащая аминокислотную последовательность, характеризующуюся по меньшей мере приблизительно 80% (например, по меньшей мере приблизительно 85%, 90%, 95% или 99%) идентичностью относительно SEQ ID NO: 16. Согласно некоторым вариантам осуществления молярное отношение трансглутаминазы к Fc-содержащему полипептиду составляет приблизительно 10:1 - приблизительно 1:100. Согласно некоторым вариантам осуществления трансглутаминаза иммобилизирована на твердой подложке. Согласно другим вариантам осуществления Fc-содержащий полипептид иммобилизирован на твердой подложке.
Согласно некоторым вариантам осуществления согласно любому из описанных выше способов акцепторный остаток глутамина фланкирован сайтом N-гликозилирования в положении +2 относительно остатка глутамина. Согласно некоторым вариантам осуществления N-гликозилированная область Fc содержит аминокислоты 290-300 тяжелой цепи иммуноглобулина, причем нумерацию осуществляют согласно индексу Kabat. Согласно некоторым вариантам осуществления N-гликозилированная область Fc представляет собой область Fc тяжелой цепи иммуноглобулина дикого типа. Согласно некоторым вариантам осуществления иммуноглобулин выбран из группы, состоящей из IgG1, IgG2, IgG3 и IgG4. Согласно некоторым вариантам осуществления Fc-содержащий полипептид представляет собой тяжелую цепь иммуноглобулина, такого как полноразмерное антитело, например, антитело человека или гуманизированное антитело. Согласно некоторым вариантам осуществления обе тяжелых цепи антитела являются конъюгированными с конъюгируемым фрагментом. Согласно некоторым вариантам осуществления акцепторный остаток глутамина находится в положении 295, и сайт N-гликозилирования находится в положении 297, причем нумерацию осуществляют согласно нумерации Kabat.
Согласно некоторым вариантам осуществления согласно любому из описанных выше способов конъюгируемый фрагмент содержит активный фрагмент, выбранный из группы, состоящей из следующего: фрагмент, который улучшает фармакокинетическое свойство Fc-содержащего полипептида, терапевтический фрагмент и диагностический фрагмент. Согласно некоторым вариантам осуществления активный фрагмент представляет собой токсин.
Согласно одному аспекту предусмотрен способ получения конъюгата антитела и лекарственного средства, предусматривающий приведение в контакт композиции антитела с конъюгируемым фрагментом в присутствии трансглутаминазы при условии, достаточном для создания конъюгата антитела и лекарственного средства, причем по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно любое значение из 60%, 70%, 80%, 90% или 95%) антитела в композиции являются гликозилированными в Fc-области, и причем конъюгируемый фрагмент является конъюгированным с эндогенным акцепторным остатком глутамина на антителе.
Согласно одному аспекту предусмотрен способ получения конъюгата антитела и лекарственного средства, содержащего антитело, специфически конъюгированное с конъюгируемым фрагментом, содержащим низкомолекулярный стебель и активный фрагмент, предусматривающий: a) приведение в контакт композиции антитела с низкомолекулярным стеблем в присутствии трансглутаминазы при условии, достаточном для создания промежуточного конъюгата, содержащего антитело, специфически конъюгированное с низкомолекулярным стеблем, и b) приведение в контакт промежуточного конъюгата с активным фрагментом, тем самым получая конъюгат антитела и лекарственного средства, причем по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно любое значение из 60%, 70%, 80%, 90% или 95%) антитела в композиции являются гликозилированными в Fc-области, и причем конъюгируемый фрагмент является конъюгированным с эндогенным акцепторным остатком глутамина на антителе.
Согласно некоторым вариантам осуществления согласно любому из описанных выше способов получения конъюгата антитела и лекарственного средства трансглутаминаза представляет собой трансглутаминазу дикого типа. Согласно некоторым вариантам осуществления трансглутаминаза дикого типа характеризуется аминокислотной последовательностью согласно SEQ ID NO: 16.
Согласно некоторым вариантам осуществления согласно любому из описанных выше способов получения конъюгата антитела и лекарственного средства трансглутаминаза представляет собой сконструированную трансглутаминазу. Согласно некоторым вариантам осуществления сконструированная трансглутаминаза содержит аминокислотную последовательность, характеризующуюся по меньшей мере приблизительно 80% (например, по меньшей мере приблизительно 85%, 90%, 95% или 99%) идентичностью относительно SEQ ID NO: 16.
Согласно некоторым вариантам осуществления согласно любому из описанных выше способов получения конъюгата антитела и лекарственного средства трансглутаминаза характеризуется чистотой, составляющей по меньшей мере приблизительно 90% (например, по меньшей мере приблизительно любое значение из 95%, 98% или 99%).
Согласно некоторым вариантам осуществления согласно любому из описанных выше способов получения конъюгата антитела и лекарственного средства молярное отношение трансглутаминазы к композиции антитела составляет приблизительно 10:1 - приблизительно 1:10.
Согласно некоторым вариантам осуществления согласно любому из описанных выше способов получения конъюгата антитела и лекарственного средства трансглутаминаза иммобилизирована на твердой подложке.
Согласно некоторым вариантам осуществления согласно любому из описанных выше способов получения конъюгата антитела и лекарственного средства антитело иммобилизировано на твердой подложке.
Согласно некоторым вариантам осуществления согласно любому из описанных выше способов получения конъюгата антитела и лекарственного средства антитело представляет собой человеческое или гуманизированное антитело.
Согласно некоторым вариантам осуществления согласно любому из описанных выше способов получения конъюгата антитела и лекарственного средства конъюгируемый фрагмент содержит активный фрагмент, выбранный из группы, состоящей из следующего: фрагмент, который улучшает фармакокинетическое свойство композиции антитела, терапевтический фрагмент и диагностический фрагмент. Согласно некоторым вариантам осуществления активный фрагмент представляет собой токсин.
Согласно одному аспекту предусмотрены сконструированные трансглутаминазы. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, способная конъюгировать Fc-содержащий полипептид (такой как антитело) с конъюгируемым фрагментом, причем Fc-содержащий полипептид (такой как антитело) содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования, причем при реакции конъюгируемый фрагмент конъюгируется с Fc-содержащим полипептидом (таким как антитело) через акцепторный остаток глутамина, и причем конъюгация является по меньшей мере приблизительно на 10% (например, по меньшей мере приблизительно на любое значение из 20%, 30%, 40%, 50% или больше) более активной, чем трансглутаминаза дикого типа при одинаковых условиях реакции. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, характеризующуюся по меньшей мере приблизительно 80% (например, по меньшей мере приблизительно 85%, 90%, 95% или 99%) идентичностью относительно SEQ ID NO: 16, причем трансглутаминаза содержит делению, выбранную из группы, состоящей из: D1-Е4; Р244-Р247 и N282-L285.
Кроме того, предусмотрены способы получения Fc-содержащих полипептидных конъюгатов (таких как конъюгаты антитела и лекарственного средства) с использованием сконструированных трансглутаминаз согласно приведенному в настоящем документе описанию.
Согласно некоторым вариантам осуществления предусмотрен способ получения конъюгата антитела и лекарственного средства, содержащего антитело, специфически конъюгированное с конъюгируемым фрагментом, предусматривающий: приведение в контакт композиции антитела с конъюгируемым фрагментом в присутствии любой из описанных выше сконструированных трансглутаминаз при условии, достаточном для создания конъюгата антитела и лекарственного средства, причем конъюгируемый фрагмент является конъюгированным с эндогенным акцепторным остатком глутамина на антителе.
Согласно некоторым вариантам осуществления предусмотрен способ получения конъюгата антитела и лекарственного средства, содержащего антитело, специфически конъюгированное с конъюгируемым фрагментом, содержащим низкомолекулярный стебель и активный фрагмент, предусматривающий: a) приведение в контакт композиции антитела с низкомолекулярным стеблем в присутствии любой из описанных выше сконструированных трансглутаминаз при условии, достаточном для создания промежуточного конъюгата, содержащего антитело, специфически конъюгированное с низкомолекулярным стеблем, и b) приведение в контакт промежуточного конъюгата с активным фрагментом, тем самым получая конъюгат антитела и лекарственного средства, причем конъюгируемый фрагмент является конъюгированным с эндогенным акцепторным остатком глутамина на антителе.
Следует понимать, что одно, несколько или все свойства различных вариантов осуществления, описанных в настоящем документе, можно комбинировать с образованием других вариантов осуществления настоящего изобретения. Указанные и другие аспекты настоящего изобретения будут очевидными специалисту в настоящей области техники.
Краткое описание фигур
На фигуре 1 представлены выравнивания последовательностей домена СН2 различных типов IgG человека, мыши и крысы. Эндогенный глутамин (Q295) для опосредованной ТГазой реакции и сайт N-гликозилирования (N297) заключены в рамку.
На фигуре 2 представлено выравнивание аминокислотной последовательности ТГаз из Strep Ladakanum (TG_SL, SEQ ID NO: 16) и Strep Mobaraensis (TG_SM, SEQ ID NO: 18)
На фигуре 3 представлены последовательности делеционных мутантов на основе ТГаз из Strep Ladakanum. Показана последовательность рекомбинантной TG_SL дикого типа (SEQ ID NO: 17).
На фигуре 4 представлена диаграмма, на которой показан одностадийный способ конъюгации антитела и лекарственного средства.
На фигуре 5 представлена диаграмма, на которой показан двухстадийный способ конъюгации антитела и лекарственного средства.
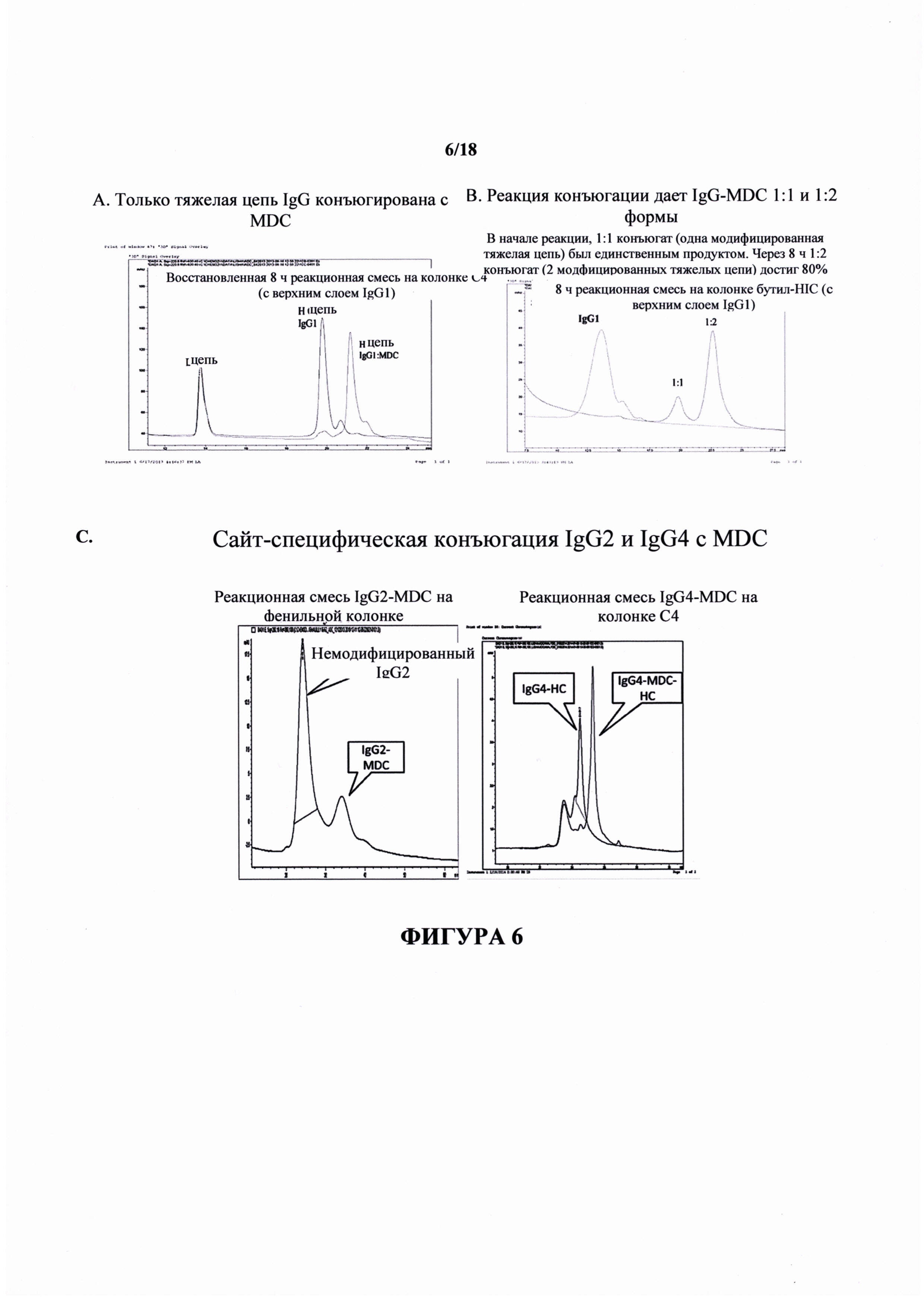
На фигуре 6 представлены хроматограммы ВЭЖХ для IgG1, 2 и 4, конъюгированных с MDC. На фигуре 6А показана конъюгация только тяжелой цепи IgG1 с MDC. На фигуре 6В показана конъюгация IgG1 с MDC в молярном отношении, составляющем 1:1 и 1:2. На фигуре 6С показан сайт-специфическая конъюгация IgG2 (слева) и IgG4 (справа) с MDC.
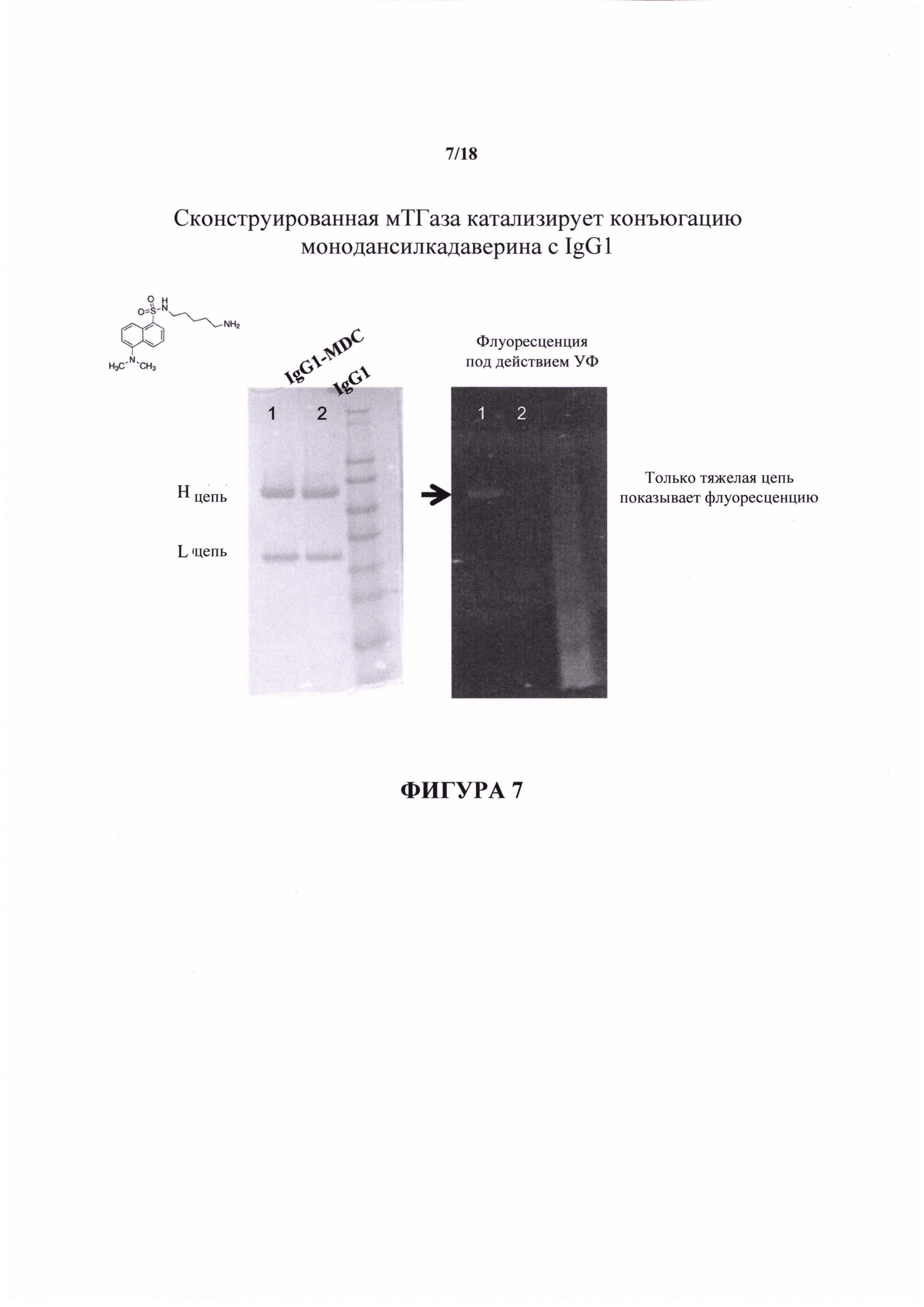
На фигуре 7 представлен анализ SDS PAGE конъюгатов IgG1-MDC.
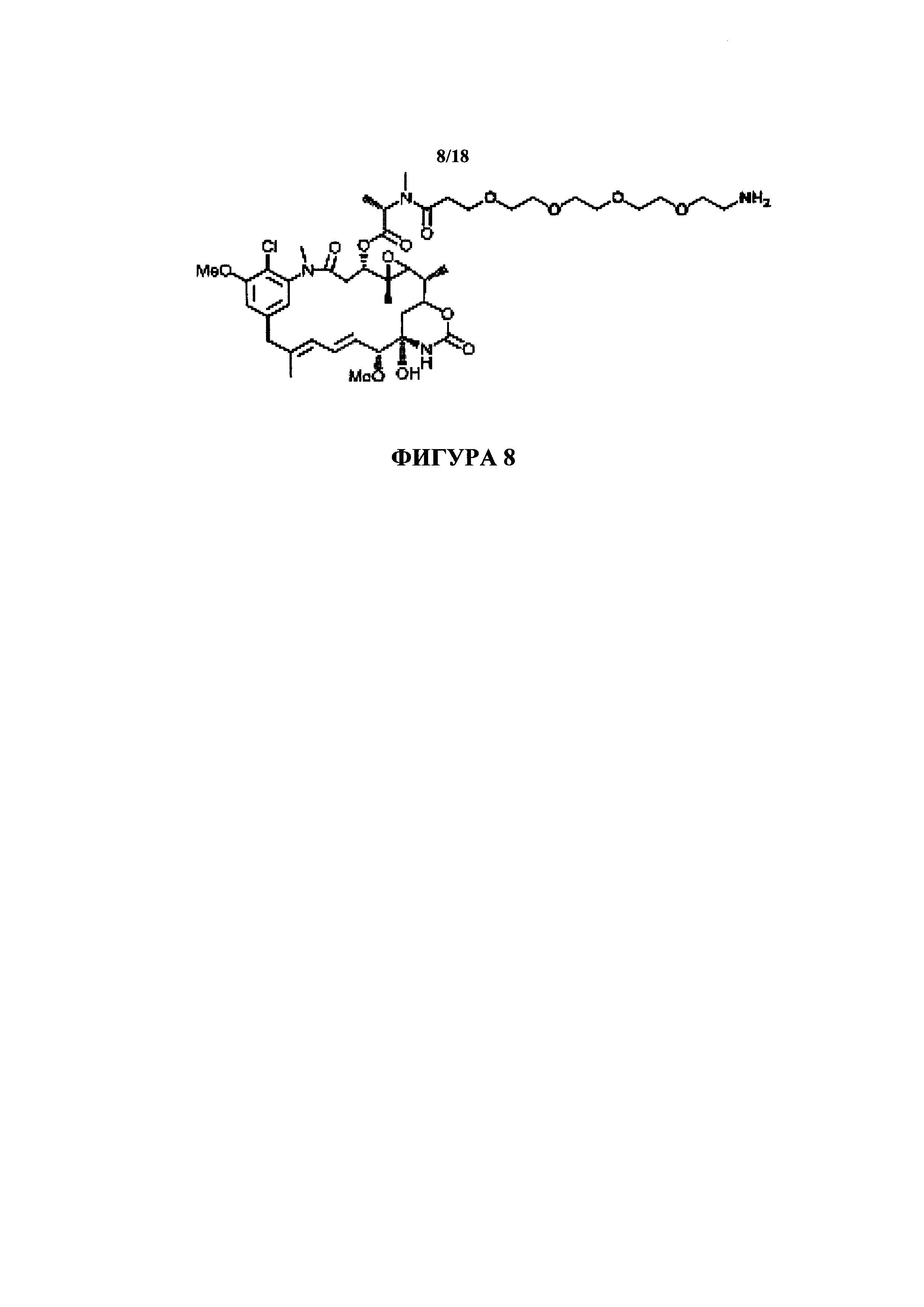
На фигуре 8 представлено производное майтансина, содержащее удлиненный, нерасщепляемый неразветвленный PEG-линкер с группой первичного амина с молекулярной массой, составляющей. 896,42 Да, обозначенное в настоящем документе как MAY-PEG4.
На фигуре 9 представлено производное майтансина, содержащее расщепляемый линкер с саморасщепляющимся спейсером и концевым лизином с молекулярной массой, составляющей 1224,58 Да, обозначенное в настоящем документе как MAY-PVCL.
На фигуре 10 представлены спектры MALDI-TOF для DAR0 (т.е. свободный IgG1, верхняя панель), DAR 1 (средняя панель) и DAR 2 (нижняя панель) IgG1-MAY-PEG4.
На фигуре 11 представлены спектры MALDI-TOF для свободного IgG1 (левая панель) и IgG1, конъюгированного с MAY-PVCL (правая панель).
На фигуре 12 представлены производные монометилауристатина Е (ММАЕ), содержащие нерасщепляемый линкер с изменяющимся количеством структурных единиц полиэтиленгликоля (PEG) (верхняя панель), обозначенные в настоящем документе как PEGx-MMAE, где x представляет собой 2, 4, 6, 8, 10, 12, 16, 20 или 24; и производное ММАЕ, содержащее расщепляемый линкер (нижняя панель), обозначенное в настоящем документе как PEG3c-MMAE.
На фигуре 13 представлена in vivo эффективность конъюгатов трастузумаб-PEGx-ММАЕ, полученных с помощью ТГазы, у мышей с ксенотрансплантатом ВТ474.
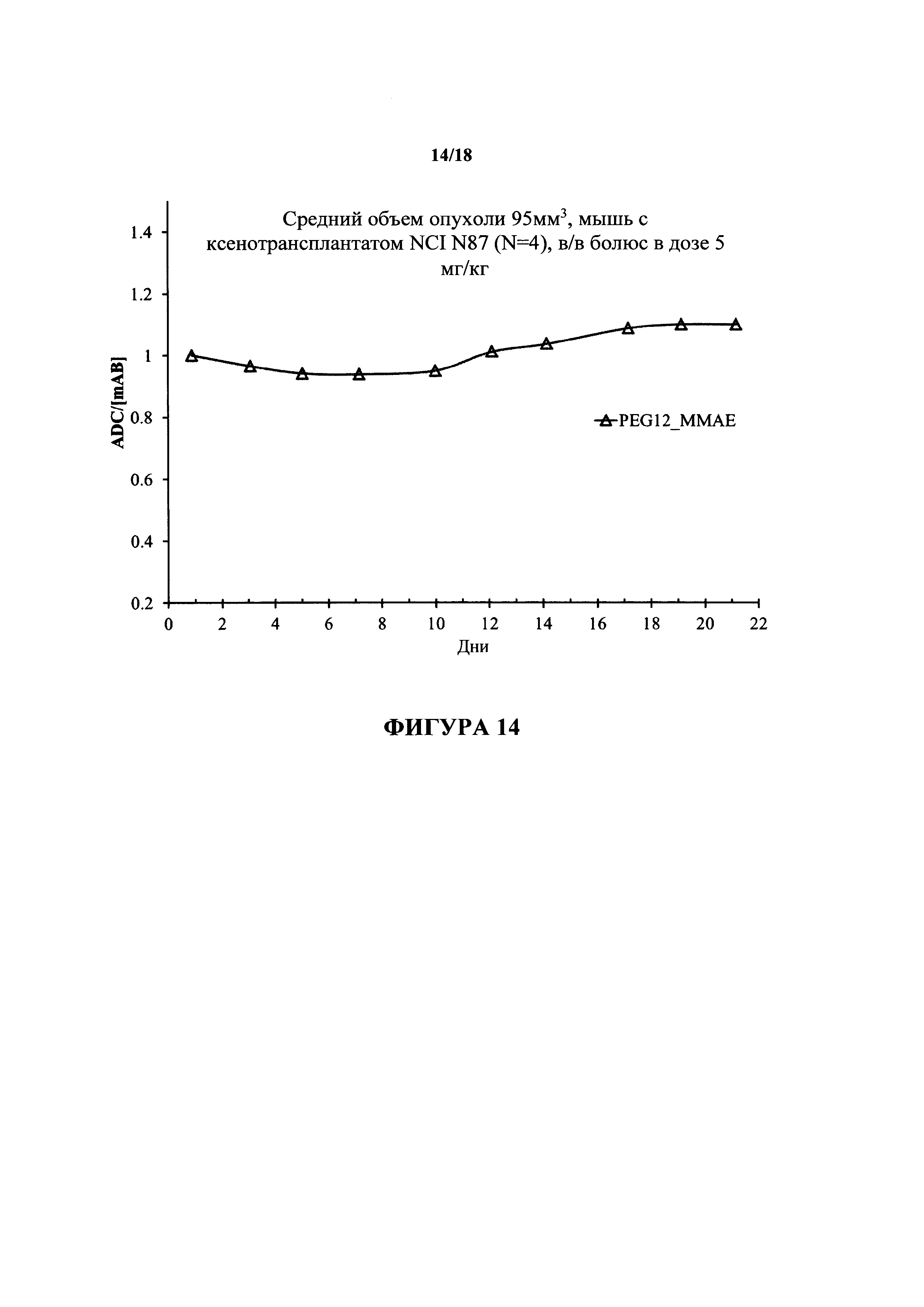
На фигуре 14 представлена in vivo стабильность конъюгата трастузумаб-РЕG12-ММАЕ, полученного с помощью ТГазы, у мышей с ксенотрансплантатом NCI N87.
На фигуре 15 представлено сравнение in vivo эффективности конъюгата трастузумаб-PEG3c-ММАЕ (DAR2, обозначенного в настоящем документе как TP3cE) и конъюгата TDM-1 (Genentech) у мышей с ксенотрансплантатом NCI N87.
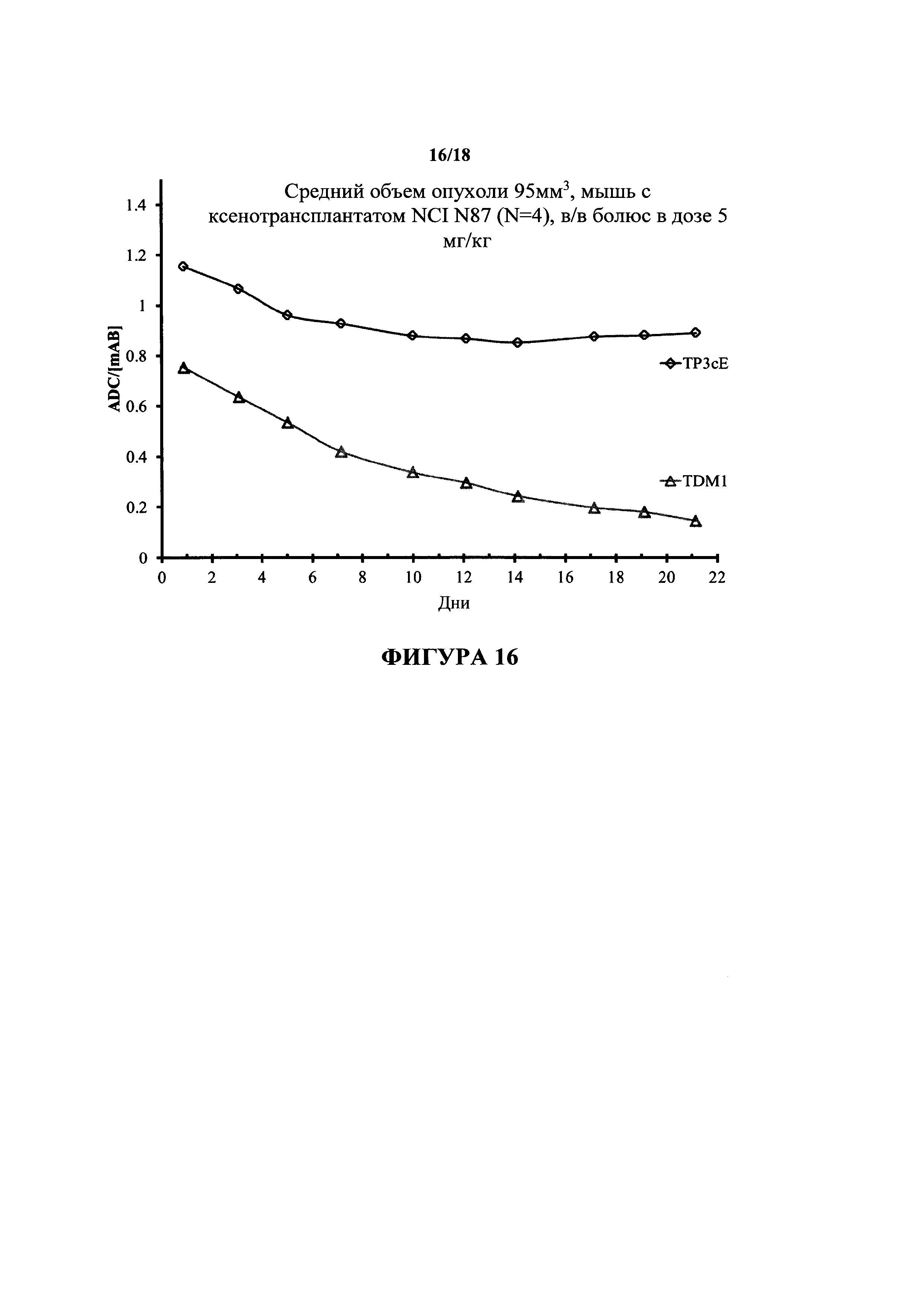
На фигуре 16 представлено сравнение in vivo стабильности конъюгата трастузумаб-PEG3c-ММАЕ (DAR2, обозначенного в настоящем документе как TP3cE) и конъюгата TDM-1 (Genentech) у мышей с ксенотрансплантатом NCI N87.
На фигуре 17 представлено сравнение in vivo эффективности конъюгат трастузумаб-PEG3c-ММАЕ (DAR2, обозначенного в настоящем документе как TP3cE) и конъюгата TDM-1 (Genentech) у мышей с ксенотрансплантатом SK_Ov3. Стрелками на графике показаны временные точки для введения доз конъюгатов антитела и лекарственного средства.
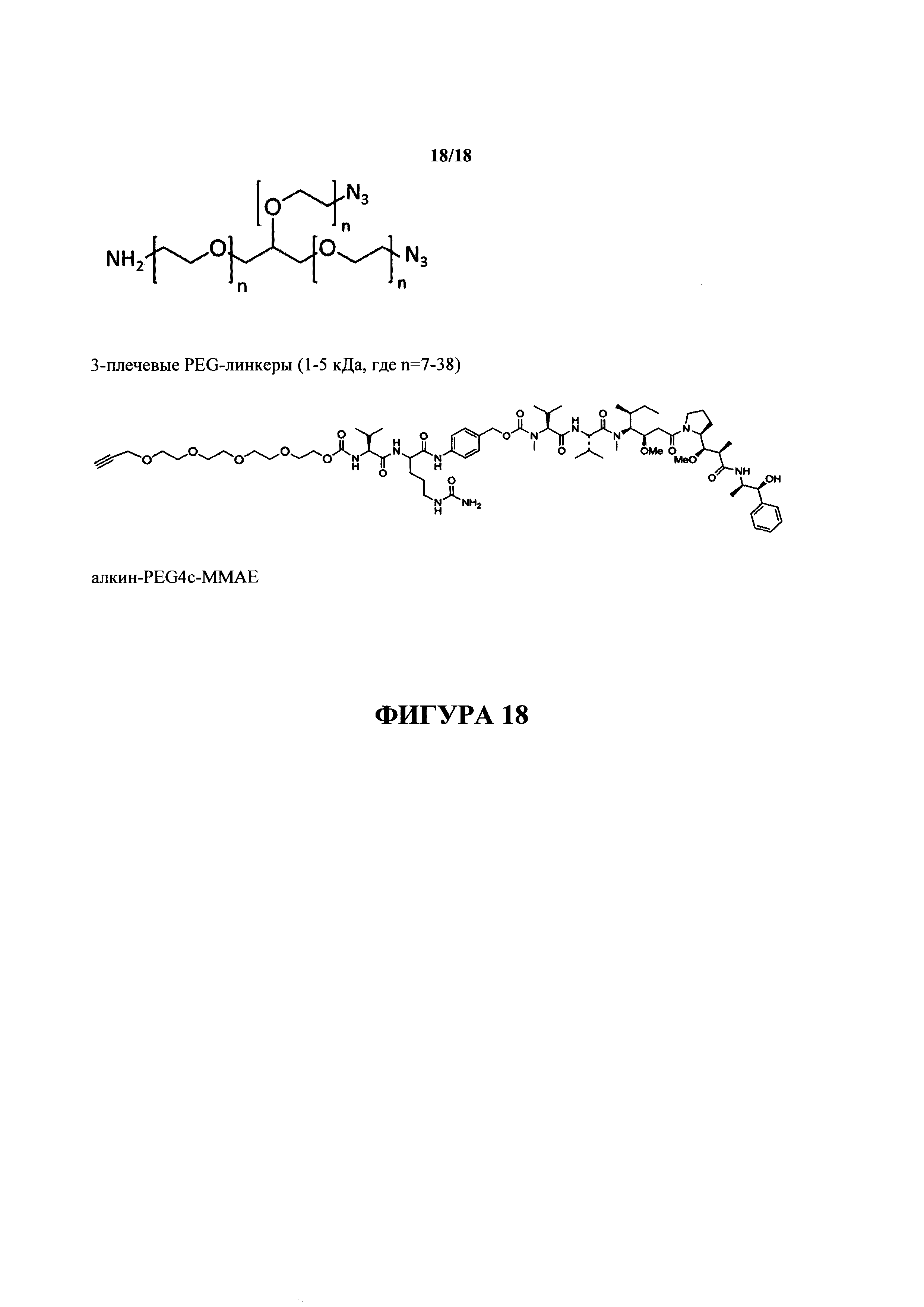
На фигуре 18 представлена группа PEG-линкеров с 3 плечами (верхняя панель; 1-5 кДа), каждый из которых характеризуется одной аминогруппой и двумя азидными группами, и алкин-PEG4c-MMAE (нижняя панель), используемый в получении DAR4 ADC.
Подробное раскрытие настоящего изобретения
Во-первых, согласно настоящей заявке предусмотрены способы прикрепления конъюгируемого фрагмента (такого как лекарственное средство) к интактному, немодифицированному (например, в котором конфигурация гликозилирования осталась неизмененной) антителу сайт-специфическим и стойхиометрическим образом. Это осуществляют или путем использования ТГазы дикого типа при специфическом условии реакции и/или посредством сконструированной ТГазы, которую специально разрабатывают для проведения сайт-специфической конъюгации на эндогенном остатке глутамина в области Fc. Способы согласно настоящей заявке обеспечивают получение гомогенного сайт-специфического и стойхиометрического конъюгата антитела и лекарственного средства, который будет обеспечивать превосходный фармакокинетический профиль, широкий терапевтический индекс и оптимальную эффективность. Способы обеспечивают конъюгацию лекарственного средства с интактным антителом без введения мутаций и/или дегликозилирования антитела, таким образом минимизируя иммуногенность, введенную такими дополнительными стадиями манипуляций. Гликаны на интактном антителе, если они присутствуют, защищают антитело от разложения, давая в результате более стабильные конъюгаты антитела и лекарственного средства. Поскольку перед реакциями трансглутаминирования необходима манипуляция с антителом, описанные в настоящем документе способы конъюгации антител на основе ТГазы являются значительно более эффективными, чем способы, о которых сообщалось ранее.
Таким образом, настоящая заявка согласно одному аспекту относится к Fc-содержащим полипептидным конъюгатам (таким как конъюгат антитела и лекарственного средства), содержащим Fc-содержащий полипептид (такой как антитело), конъюгированный с конъюгируемым фрагментом, причем Fc-содержащий полипептид (такой как антитело) содержит N-гликозилированную область Fc, содержащую акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования, и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом (таким как антитело) через акцепторный остаток глутамина.
Согласно одному аспекту предусмотрены способы получения Fc-содержащих полипептидных конъюгатов (таких как конъюгаты антитела и лекарственного средства) с использованием трансглутаминазы дикого типа или сконструированной трансглутаминазы.
Кроме того, предусмотрены сконструированные трансглутаминазы, специфически разработанные для проведения таких реакций.
Определения
Термин "трансглутаминаза", используемый взаимозаменяемо в настоящем документе с термином "ТГаза", относится к ферменту, способному к проведению реакций трансглутаминирования. Используемый в настоящем документе термин "трансглутаминирование" относится к реакции, при которой γ-глутаминил акцепторного остатка глутамина из белка/пептида переносится на группу амина, такую как первичный амин или ε-аминогруппа лизина.
Термин "акцепторный остаток глутамина" при ссылке на аминокислотный остаток полипептида или белка относится к остатку глутамина, который при подходящих условиях, распознается ТГазой и может быть поперечно сшит с конъюгируемым фрагментом, содержащим донорную аминогруппу, ТГазой посредством реакции между глутамином и донорной аминогруппой (такой как лизин или структурно родственный первичный амин, такой как группа аминопентила).
Используемый в настоящем документе "эндогенный акцепторный остаток глутамина на антителе" относится к акцепторному остатку глутамина в области Fc встречающегося в природе антитела. Такой эндогенный акцепторный остаток глутамина, как правило, представляет собой Q275 согласно нумерации Kabat и фланкирован сайтом N-гликозилирования в положении Asn297.
Используемый в настоящем документе "Fc-содержащий полипептид" относится к полипептиду (например, антителу или Fc-слитому белку), содержащему область Fc тяжелой цепи иммуноглобулина. Используемый в настоящем документе термин "полипептид" включает в себя как отдельную полипептидную цепь, так и многокомпонетные полипептиды. Например, Fc-содержащий полипептид может представлять собой полноразмерное антитело (такое как интактное антитело) или он может представлять собой отдельную цепь полноразмерного антитела.
Используемый в настоящем документе термин "область Fc" относится к полипептиду, содержащему константную область тяжелой цепи антитела, за исключением первого домена константной области иммуноглобулина. Для IgG область Fc может содержать домены иммуноглобулина СН2 и СН3 и шарнир между СН1 и СН2.
Используемый в настоящем документе термин "полноразмерное антитело" относится к молекуле, которая образует природную биологическую форму антитела, включая в себя вариабельные и константные области. Например, у большинства млекопитающих, включая в себя людей и мышей, полноразмерное антитело изотипа IgG представляет собой тетрамер и состоит из двух идентичных пар их двух цепей иммуноглобулина, причем каждая пара характеризуется одной легкой и одной тяжелой цепью, причем каждая легкая цепь содержит домены иммуноглобулина VL и CL, и каждая тяжелая цепь содержит домены иммуноглобулина VH, CH1, СН2 и СН3. У некоторых млекопитающих, например, у верблюдов и лам, антитела IgG могут состоять только из двух тяжелых цепей, причем каждая тяжелая цепь содержит вариабельный домен, прикрепленный к области Fc.
Под "аминокислотной модификацией" в настоящем документе подразумевают аминокислотную замену, вставку и/или делецию в полипептидной последовательности. Под "аминокислотной заменой" или "заменой" в настоящем документе подразумевают замещение аминокислоты в данном положении в белковой последовательности другой аминокислотой. "Вариант" полипептида относится к полипептиду, характеризующемуся аминокислотной последовательностью, которая является по существу идентичной эталонному полипептиду, как правило, нативному или "исходному" полипептиду. Полипептидный вариант может обладать одной или несколькими аминокислотными заменами, делециями и/или вставками в определенных положениях внутри нативной аминокислотной последовательности.
"Консервативные" аминокислотные замены представляют собой замены, в которых аминокислотный остаток замещен аминокислотным остатком, характеризующимся боковой цепью со сходными физико-химическими свойствами. Семейства аминокислотных остатков, характеризующихся сходными боковыми цепями, известны в настоящей области техники и включают в себя аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, акцепторный глутамин, серии, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин).
Термин "защитная группа" относится к группе, которая временно защищает или блокирует, т.е. предусмотрена для предотвращения реакции функциональной группы, например, аминогруппы, гидроксильной группы или карбоксильной группы, во время трансформации первой молекулы во вторую молекулу.
Фраза "фрагмент, который улучшает фармакокинетические свойства" относится к фрагменту, который изменяет фармакокинетические свойства молекулы, к которой прикреплен указанный фрагмент, таким образом, чтобы мог быть достигнут лучший терапевтический или диагностический эффект. Например, фрагмент, может увеличивать растворимость в воде, увеличивать время циркуляции в кровотоке или снижать иммуногенность.
Фраза "линкер" относится к структурному элементу соединения, который соединяет один структурный элемент указанного соединения с одним или несколькими другими структурными элементами того же указанного соединения.
Используемый в настоящем документе термин "осуществление лечения" или "лечение" представляет собой подход для получения благоприятных или требуемых результатов, включая в себя клинические результаты. Для целей настоящего изобретения благоприятные или требуемые клинические результаты включают в себя без ограничения один или несколько из следующего: облегчение одного или нескольких симптомов, являющихся результатом заболевания, уменьшение степени заболевания, стабилизация заболевания (например, предотвращение или задержка ухудшения заболевания), профилактика или задержка рецидива заболевания, задержка или замедление прогрессирования заболевания, улучшение болезненного состояния, обеспечение ремиссии (частичной или полной) заболевания, уменьшение дозы одного или нескольких других лекарственных средств, требуемых для лечения заболевания, задержка прогрессирования заболевания и/или повышение качества жизни.
Термин "индивидуум" относится к млекопитающему и включает в себя без ограничения человека, корову, лошадь, кошку, собаку, грызуна или примата. Согласно некоторым вариантам осуществления индивидуум представляет собой человека.
Следует понимать, что аспекты и варианты осуществления настоящего изобретения, описанные в настоящем документе, включают в себя "состоящие из" и "состоящие по существу из" аспектов и вариантов осуществления.
Ссылка на "приблизительно" значение или параметр в настоящем документе включает в себя (и описывает) отклонения, которые относятся к этому значению или параметру как таковому. Например, описание со ссылкой на "приблизительно X" включает в себя описание "X." Используемый в настоящем документе термин "приблизительно X-Y" имеет такое же значение, как и "приблизительно X - приблизительно Y."
Используемые в настоящем документе и в прилагаемой формуле изобретения формы единственного числа включают в себя ссылки на формы множественного числа, если только контекст ясно не диктует иное.
Fc-содержащие полипептидные конъюгаты
Настоящая заявка согласно одному аспекту относится к Fc-содержащему полипептидному конъюгату (такому как конъюгат антитела и лекарственного средства), содержащему Fc-содержащий полипептид (такой как антитело), сайт-специфически конъюгированный с конъюгируемым фрагментом. Fc-содержащий полипептид (такой как антитело) содержит N-гликозилированную область Fc. N-гликозилированная область Fc содержит акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования, и конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом (такими как антитело) через акцепторный остаток глутамина.
Область Fc иммуноглобулина согласно некоторым вариантам осуществления содержит часть или всю шарнирную область. Согласно некоторым вариантам осуществления Fc-содержащий полипептид содержит область Fc встречающегося в природе иммуноглобулина. Согласно некоторым вариантам осуществления Fc-содержащий полипептид, содержащий область Fc подтипов IgG1, IgG2, IgG3, IgG4 или из IgA, IgE, IgD или IgM. Согласно некоторым вариантам осуществления область Fc происходит из IgG человека, и область Fc происходит из аминокислотного остатка в положении Glu216 или Ala231 относительно его карбокси-конца согласно системе нумерации Kabat.
Согласно некоторым вариантам осуществления Fc-содержащий полипептид представляет собой Fc-содержащий слитый полипептид, в котором один или нескольких функциональных полипептидов слиты с областью Fc. Такие функциональные полипептиды включают в себя без ограничения области связывания с мишенью рецептора, адгезионную молекулу, лиганд, фермент, цитокин и хемокин.
Описанные в настоящем документе области Fc могут являться N-гликозилированными. Например, согласно некоторым вариантам осуществления полисахаридная цепь, прикрепленная на сайте N-гликозилирования, содержит по меньшей мере приблизительно любое количество из 1, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 структурных единиц.
Сайт N-гликозилирования фланкирует акцепторный остаток глутамина, к которому прикреплен конъюгируемый фрагмент. Автор настоящего изобретения впервые продемонстрировал, что посредством способов, описанных в дальнейшем в настоящем документе, возможно прикрепить конъюгируемый фрагмент к акцепторному остатку глутамина, фланкированному сайтом N-гликозилирования в Fc-области. Согласно некоторым вариантам осуществления сайт N-гликозилирования и акцепторный остаток глутамина отделены 5 или меньше аминокислотными остатками. Согласно некоторым вариантам осуществления сайт N-гликозилирования и акцепторный глутамин отделены 5, 4, 3, 2 или 1 аминокислотой. Согласно некоторым вариантам осуществления сайт N-гликозилирования и акцепторный глутамин расположены друг за другом. Согласно некоторым вариантам осуществления акцепторный остаток глутамина фланкирован сайтом N-гликозилирования в положении +2 относительно остатка глутамина. Согласно некоторым вариантам осуществления акцепторный остаток глутамина фланкирован сайтом N-гликозилирования в положении +1, +2, +3, +4 или +5 относительно остатка глутамина. Согласно некоторым вариантам осуществления акцепторный остаток глутамина фланкирован сайтом N-гликозилирования в положении -1, -2, -3, -4 или -5 относительно остатка глутамина.
Таким образом, согласно некоторым вариантам осуществления предусмотрен Fc-содержащий полипептидный конъюгат, содержащий Fc-содержащий полипептид, сайт-специфически конъюгированный с конъюгируемым фрагментом, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования, и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина.
Согласно некоторым вариантам осуществления предусмотрен Fc-содержащий полипептидный конъюгат, содержащий Fc-содержащий полипептид, сайт-специфически конъюгированный с конъюгируемым фрагментом, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит акцепторный остаток глутамина, который отделен 5 или меньше аминокислотами (включая в себя, например, 4, 3, 2 или 1 аминокислоту) от сайта N-гликозилирования, и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина.
Согласно некоторым вариантам осуществления предусмотрен Fc-содержащий полипептидный конъюгат, содержащий Fc-содержащий полипептид, сайт-специфически конъюгированный с конъюгируемым фрагментом, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем акцепторный остаток глутамина фланкирован сайтом N-гликозилирования в положении +2 относительно остатка глутамина, и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина. Согласно некоторым вариантам осуществления предусмотрен Fc-содержащий полипептидный конъюгат, содержащий Fc-содержащий полипептид, сайт-специфически конъюгированный с конъюгируемым фрагментом, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит аминокислотную последовательность согласно SEQ ID NO: 1 (KPREEQX1NSTX2R, где X1 представляет собой Y или F и Х2 представляет собой Y или F), и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина в положении 6 SEQ ID NO: 1, и при этом N-гликозилирование находится в положении 8 SEQ ID NO: 1. Согласно некоторым вариантам осуществления предусмотрен Fc-содержащий полипептидный конъюгат, содержащий Fc-содержащий полипептид, специфически конъюгированный с конъюгируемым фрагментом, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит аминокислотную последовательность согласно SEQ ID NO: 2 (KPREEQYNSTYR), и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина в положении 6 SEQ ID NO: 2, и при этом N-гликозилирование находится в положении 8 SEQ ID NO: 2.
Согласно некоторым вариантам осуществления предусмотрен Fc-содержащий полипептидный конъюгат, содержащий Fc-содержащий полипептид, сайт-специфически конъюгированный с конъюгируемым фрагментом, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит аминокислотную последовательность согласно SEQ ID NO: 3 (последовательность СН2 IgG1 человека, см. фигуру 1), и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина в положении 65 SEQ ID NO: 3, и при этом N-гликозилирование находится в положении 67 SEQ ID NO: 3 (см. остатки в рамке, показанной на фигуре 1).
Согласно некоторым вариантам осуществления предусмотрен Fc-содержащий полипептидный конъюгат, содержащий Fc-содержащий полипептид, специфически конъюгированный с конъюгируемым фрагментом, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит аминокислотную последовательность согласно SEQ ID NO: 4 (последовательность СН2 IgG2 человека, см. фигуру 1), и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина в положении 64 SEQ ID NO: 4, и при этом N-гликозилирование находится в положении 66 SEQ ID NO: 4 (см. остатки в рамке, как показано на фигуре 1).
Согласно некоторым вариантам осуществления предусмотрен Fc-содержащий полипептидный конъюгат, содержащий Fc-содержащий полипептид, специфически конъюгированный с конъюгируемым фрагментом, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит аминокислотную последовательность согласно SEQ ID NO: 5 (последовательность СН2 IgG3 человека, см. фигуру 1), и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина в положении 65 SEQ ID NO: 5, и при этом N-гликозилирование находится в положении 67 SEQ ID NO: 5 (см. остатки в рамке, как показано на фигуре 1).
Согласно некоторым вариантам осуществления предусмотрен Fc-содержащий полипептидный конъюгат, содержащий Fc-содержащий полипептид, специфически конъюгированный с конъюгируемым фрагментом, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит аминокислотную последовательность согласно SEQ ID NO: 6 (последовательность СН2 IgG4 человека, см. фигуру 1), и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина в положении 65 SEQ ID NO: 6, и при этом N-гликозилирование находится в положении 67 SEQ ID NO: 6 (см. остатки в рамке, показанной на фигуре 1).
Согласно некоторым вариантам осуществления предусмотрен конъюгат антитела и лекарственного средства, содержащий антитело, специфически конъюгированное с конъюгируемым фрагментом, причем антитело содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования, и при этом конъюгируемый фрагмент является конъюгированным с антителом через акцепторный остаток глутамина. Согласно некоторым вариантам осуществления антитело представляет собой антитело человека. Согласно некоторым вариантам осуществления антитело представляет собой гуманизированное антитело. Согласно некоторым вариантам осуществления антитело представляет собой химерное антитело. Согласно некоторым вариантам осуществления антитело представляет собой биспецифическое или мультиспецифическое антитело. Согласно некоторым вариантам осуществления антитело представляет собой трастузумаб.
Согласно некоторым вариантам осуществления предусмотрено полноразмерное антитело, конъюгированное с конъюгируемым фрагментом, причем полноразмерное антитело содержит N-гликозилированную область Fc, и при этом конъюгируемый фрагмент является конъюгированным с полноразмерным антителом через акцепторный остаток глутамина в положении 295 тяжелых цепей антитела, причем нумерацию осуществляют согласно индексу EU, как в Kabat. Согласно некоторым вариантам осуществления предусмотрено антитело, конъюгированное с конъюгируемым фрагментом, причем антитело содержит N-гликозилированную область Fc, причем конъюгируемый фрагмент является конъюгированным с антителом через акцепторный остаток глутамина в положении 295 тяжелых цепей антитела, и при этом N-гликозилирование находится в положении 297 тяжелой цепи, причем нумерацию осуществляют согласно индексу EU, как в Kabat.
Согласно некоторым вариантам осуществления предусмотрен конъюгат антитела и лекарственного средства, содержащий антитело, конъюгированное с конъюгируемым фрагментом через эндогенный акцепторный остаток глутамина на антителе, причем конъюгат антитела и лекарственного средства является гликозилированным (например, N-гликозилированным) в области Fc. Согласно некоторым вариантам осуществления антитело представляет собой антитело человека. Согласно некоторым вариантам осуществления антитело представляет собой гуманизированное антитело. Согласно некоторым вариантам осуществления антитело представляет собой химерное антитело. Согласно некоторым вариантам осуществления антитело представляет собой биспецифическое или мультиспецифическое антитело. Согласно некоторым вариантам осуществления антитело представляет собой трастузумаб.
Согласно некоторым вариантам осуществления предусмотрен конъюгат антитела и лекарственного средства, содержащий трастузумаб, который является N-гликозилированным в области Fc, причем трастузумаб является конъюгированным с конъюгируемым фрагментом через эндогенный акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования. Согласно некоторым вариантам осуществления предусмотрен конъюгат антитела и лекарственного средства, содержащий трастузумаб, который является N-гликозилированным в положении 297, причем трастузумаб является конъюгированным с конъюгируемым фрагментом через эндогенный акцепторный остаток глутамина в положении 295, причем нумерацию осуществляют согласно индексу EU, как в Kabat.
Согласно некоторым вариантам осуществления предусмотрена композиция, содержащая Fc-содержащий слитый полипептид, описанный в настоящем документе, причем по меньшей мере несколько (но не обязательно все) Fc-содержащих слитых полипептидов в композиции являются гликозилированными (например, N-гликозилированными) в области Fc. Например, согласно некоторым вариантам осуществления предусмотрена композиция, содержащая конъюгат антитела и лекарственного средства, причем конъюгат антитела и лекарственного средства содержит антитело, конъюгированное с конъюгируемым фрагментом через эндогенный акцепторный остаток глутамина на антителе, и при этом по меньшей мере несколько (например, по меньшей мере приблизительно любое значение из 50%, 60%, 70%, 80%, 90% или 95%) конъюгатов антитела и лекарственного средства в композиции являются гликозилированными (например, N-гликозилированными) в области Fc. Согласно некоторым вариантам осуществления антитело представляет собой антитело человека. Согласно некоторым вариантам осуществления антитело представляет собой гуманизированное антитело. Согласно некоторым вариантам осуществления антитело представляет собой химерное антитело. Согласно некоторым вариантам осуществления антитело представляет собой биспецифическое или мультиспецифическое антитело. Согласно некоторым вариантам осуществления антитело представляет собой трастузумаб.
Описанные в настоящем документе способы конъюгации обеспечивают возможность получения Fc-содержащих полипептидных конъюгатов (таких как конъюгат антитела и лекарственного средства), которые являются конъюгированными с конъюгируемым фрагментом специфическим и стойхиометрически контролируемым образом. Используемый в настоящем документе термин "специфически конъюгированный" относится к специфической конъюгации или образованию поперечных связей конъюгируемого фрагмента на конкретном сайте Fc-содержащего полипептида (такого как антитело), а именно, на акцепторном остатке глутамина в области Fc, который фланкирован сайтом N-гликозилирования. Сайт-специфичность можно подтвердить с помощью различных техник, включая в себя без ограничения пептидное картирование и секвенирование белков. Согласно некоторым вариантам осуществления молярное отношение конъюгируемого фрагмента к Fc-содержащему полипептиду (такому как антитело) в Fc-содержащем полипептидном конъюгате (таком как конъюгат антитела и лекарственного средства) составляет приблизительно 1:1. Согласно некоторым вариантам осуществления молярное отношение конъюгируемого фрагмента к Fc-содержащему полипептиду (такому как антитело) в Fc-содержащем полипептидном конъюгате (таком как конъюгат антитела и лекарственного средства) составляет приблизительно 2:1. Согласно некоторым вариантам осуществления по меньшей мере приблизительно 80% (например, по меньшей мере приблизительно любое значение из 85%, 90%, 95% или больше) Fc-содержащего полипептидного конъюгата (такого как конъюгат антитела и лекарственного средства) в композиции характеризуются молярным отношением Fc-содержащего полипептида (такого как антитело) к конъюгируемому фрагменту, составляющим приблизительно 1:1. Согласно некоторым вариантам осуществления по меньшей мере приблизительно 80% (например, по меньшей мере приблизительно любое значение из 85%, 90%, 95% или больше) Fc-содержащего полипептидного конъюгата (такого как конъюгат антитела и лекарственного средства) в композиции характеризуются молярным отношением Fc-содержащего полипептида (такого как антитело) к конъюгируемому фрагменту, составляющим приблизительно 1:2. Согласно некоторым вариантам осуществления по меньшей мере приблизительно 80% (например, по меньшей мере приблизительно любое значение из 85%, 90%, 95% или больше) Fc-содержащего полипептидного конъюгата (такого как конъюгат антитела и лекарственного средства) в композиции характеризуются молярным отношением Fc-содержащего полипептида (такого как антитело) к конъюгируемому фрагменту, составляющим приблизительно 1:1 или приблизительно 1:2.
Описанный в настоящем документе конъюгируемый фрагмент может представлять собой любой фрагмент, который может быть конъюгирован с акцепторным остатком глутамина, либо напрямую, либо посредством низкомолекулярного стебля, как дополнительно описано в настоящем документе. Конъюгацию между конъюгируемым фрагментом и акцепторным остатком глутамина проводят путем конъюгирования донорной группы амина конъюгируемого фрагмента или низкомолекулярного стебля с акцепторным остатком глутамина. Таким образом, любой конъюгируемый фрагмент, содержащий донорную группу амина, может быть напрямую конъюгирован с Fc-содержащим полипептидом. Любой конъюгируемый фрагмент, не содержащий донорную группу амина, может быть опосредованно конъюгирован с Fc-содержащим полипептидом через низкомолекулярный стебель, который содержит донорную группу амина.
Используемый в настоящем документе термин "донорная группа амина" относится к реакционноспособной группе, содержащей один или несколько реакционноспособных аминов (например, первичных аминов). Например, конъюгируемый фрагмент может содержать донорную группу амина (например, первичный амин -NH2), необязательный линкер и активный фрагмент (например, низкомолекулярную молекулу). Конъюгируемый фрагмент также может представлять собой полипептид или биосовместимый полимер, содержащий реакционноспособный Lys (например, эндогенный Lys). Донорная группа амина согласно некоторым вариантам осуществления представляет собой первичный амин (-NH2), который обеспечивает субстрат для трансглутаминазы для обеспечения конъюгации фрагмента-средства с Fc-содержащим полипептидом через акцепторный глутамин. Соответственно, связь между акцепторным глутамином и донорной группой амина может представлять собой формулу -СН2-СН2-СО-NH-.
Согласно некоторым вариантам осуществления Fc-содержащий полипептид и конъюгируемый фрагмент связаны посредством линкера. Согласно некоторым вариантам осуществления линкер представляет собой нерасщепляемый линкер. Подходящие нерасщепляемые линкеры включают в себя без ограничения NH2-R-X, NH2NH-R-X и NH2-О-R-X, где R представляет собой группу алкила или полиэтиленгликоля (которая также называется PEG), где X представляет собой активный фрагмент. Группа полиэтиленгликоля, или группа PEG, может характеризоваться формулой -(CH2CH2O)n-, где n представляет собой целое число, составляющее по меньшей мере 1. Согласно некоторым вариантам осуществления n представляет собой любое число из 2, 4, 6, 8, 10, 12, 16, 20 или 24.
Согласно некоторым вариантам осуществления Fc-содержащий полипептид и конъюгируемый фрагмент связаны посредством расщепляемого линкера. Подходящие расщепляемые линкеры включают в себя без ограничения Lys-Phe-X, Lys-Val-Cit-РАВС-X, NH2-(CH2CH2O)n-Val-Cit-PABC-X и NH2-(CH2CH2O)n-(Val-Cit-PABC-X)2, где X представляет собой активный фрагмент, и n представляет собой целое число, составляющее по меньшей мере 1 (такое как любое из 2, 4, 6, 8, 10, 12, 16, 20 или 24). РАВС относится к п-аминобензилоксикарбонилу. Cit относится к цитруллину.
Другие иллюстративные линкеры донорной группы амина включают в себя без ограничения Ac-Lys-Gly, аминокапроновую кислоту, Ac-Lys-бета-Ala, амино-PEG2 (полиэтиленгликоль)-С2, амино-PEG3-С2, амино-PEG6-C2, Ac-Lys-Val (валин)-Cit (цитруллин)-РАВС (п-аминобензилоксикарбонил), аминокапроил-Val-Cit-PABC, путресцин и Ac-Lys-путресцин.
Согласно некоторым вариантам осуществления конъюгируемый фрагмент связан с акцепторным остатком глутамина через линкер -NH-(C)n-, где (C)n представляет собой замещенную или незамещенную алкильную или гетероалкильную цепь, где n представляет собой целое число от приблизительно 1 до приблизительно 60. Согласно некоторым вариантам осуществления углерод цепи является замещенным алкоксилом, гидроксилом, алкилкарбонилокси, алкил-S-, тиолом, алкил-С(O)S-, амином, алкиламином, амидом или алкиламидом. Согласно некоторым вариантам осуществления n составляет приблизительно 2 - приблизительно 20.
Согласно некоторым вариантам осуществления линкер является разветвленным. Согласно некоторым вариантам осуществления линкер является неразветвленным. Согласно некоторым вариантам осуществления линкер содержит больше одного (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше) сайтов прикрепления активных фрагментов. Указанные активные фрагменты могут являться одинаковыми или отличаться друг от друга. Например, конъюгируемый фрагмент может содержать полимер на основе полиацеталя или производного полиацеталя, связанный с множеством активных фрагментов (таких как молекулы лекарственного средства).
Согласно некоторым вариантам осуществления конъюгируемый фрагмент выбран из группы, состоящей из следующего: Alexa 488 кадаверин, 5-FITC кадаверин, Alexa 647 кадаверин, Alexa 350 кадаверин, 5-TAMRA кадаверин, 5-FAM кадаверин, SR101 кадаверин, 5,6-TAMRA кадаверин, 5-FAM лизин, Ac(ацетил)-LysGly-MMAD (монометилауристатин D), амино-PEG3 (полиэтиленгликоль)-С2-MMAD, амино-PEG6 C2-MMAD, амино-PEG3-С2-амино-нонаноил-MMAD, аминокапроил-Val(валин)-Cit(цитруллин)-РАВС(р-аминобензилоксикарбонил)-MMAD, Ac-Lys-Val-Cit-PABC-MMAD, аминокапроил-MMAD, Ac-Lys-бета-Ala-MMAD, амино-PEG2-C2-MMAE (монометилауристатин Е), аминокапроил-ММАЕ, амино-PEG3-С2-ММАЕ, аминокапроил-MMAF (монометилауристатин F), аминокапроил-Val-Cit-PABC-MMAE, аминокапроил-Val-Cit-PABC-MMAF, путресцинил-гелданамицин и Ac-Lys-путресцинил-гелданамицин. ММАЕ относится к монометилауристатину Е или его производным.
Согласно некоторым вариантам осуществления конъюгируемый фрагмент представляет собой соединение, содержащее диамин. Согласно некоторым вариантам осуществления соединение выбрано из группы, состоящей из следующего: путресцин (бутан-1,4-диамин), этилендиамин, кадаверин (пентан-1,5-диамин), спермидин, спермин, гидразин, 1,3-диаминопропан, гексаметилендиамин, фенилендиамин, ксилилендиамин, дифенилэтилендиамин, 1,8-диаминонафталин и их стереоизомеры, изостеры, аналоги или производные.
Согласно некоторым вариантам осуществления конъюгируемый фрагмент представляет собой такое производное майтансина, как MAY-PEG4, показанное на фигуре 8, или MAY-PVCL, показанное на фигуре 9.
Согласно некоторым вариантам осуществления конъюгируемый фрагмент представляет собой производное ММАЕ, содержащее нерасщепляемый линкер (такой как линкер амино-(CH2CH2O)n-, например, PEGx-MMAE, как показано на фигуре 12). Согласно некоторым вариантам осуществления конъюгируемый фрагмент представляет собой производное ММАЕ, содержащее расщепляемый линкер (такой как PEG3c-ММАЕ, показанный на фигуре 12).
Согласно некоторым вариантам осуществления предусмотрен конъюгат антитела и лекарственного средства, содержащий трастузумаб, который является N-гликозилированным в области Fc, причем трастузумаб является конъюгированным с конъюгируемым фрагментом, содержащим по меньшей мере один ММАЕ (например, 1, 2 или больше), посредством акцепторного остатка глутамина, фланкированного сайтом N-гликозилирования. Согласно некоторым вариантам осуществления конъюгируемый фрагмент представляет собой PEGx-MMAE, как показано на фигуре 12, где x представляет собой целое число, выбранное из 2, 4, 6, 8, 10, 12, 16, 20 и 24. Согласно некоторым вариантам осуществления конъюгация фрагмент представляет собой PEG3c-ММАЕ, как показано на фигуре 12. Согласно некоторым вариантам осуществления конъюгация фрагмент содержит два ММАЕ и 3-плечевой PEG-линкер.
Согласно некоторым вариантам осуществления предусмотрена композиция, содержащая любой описанный выше конъюгат антитела и лекарственного средства, содержащий трастузумаб. Согласно некоторым вариантам осуществления среднее молярное отношение активного фрагмента (такого как лекарственное средство, например, ММАЕ) в конъюгируемом фрагменте к трастузумабу в композиции составляет приблизительно любое значение, составляющее 1:1, 2:1 или 4:1. Согласно некоторым вариантам осуществления по меньшей мере приблизительно 80% (например, по меньшей мере приблизительно любое значение из 85%, 90%, 95% или больше) конъюгата антитела и лекарственного средства, содержащего трастузумаб, в композиции характеризуются молярным отношением активного фрагмента (такого как лекарственное средство, например, ММАЕ) в конъюгируемом фрагменте к трастузумабу составляет приблизительно 2:1. Согласно некоторым вариантам осуществления по меньшей мере приблизительно 80% (например, по меньшей мере приблизительно любое значение из 85%, 90%, 95% или больше) конъюгата антитела и лекарственного средства, содержащего трастузумаб, в композиции характеризуются молярным отношением активного фрагмента (такого как лекарственное средство, например, ММАЕ) в конъюгируемом фрагменте к трастузумабу составляет приблизительно 4:1.
Согласно некоторым вариантам осуществления Fc-содержащий полипептидный конъюгат присутствует в организме индивидуума (например, млекопитающего) в количестве, составляющем приблизительно 50% или больше по меньшей мере через приблизительно 1 день при введении in vivo. Согласно некоторым вариантам осуществления Fc-содержащий полипептидный конъюгат) присутствует в организме индивидуума (например, млекопитающего) количестве, составляющем приблизительно любое значение, составляющее 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% или больше по меньшей мере через приблизительно любое значение из следующего: 2 часа, 2-6 часов, 6-12 часов, 12-18 часов, 18-24 часа, 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 1 неделя или 2 недели, при введении in vivo.
Активные фрагменты
Описанные в настоящем документе конъюгируемые фрагменты согласно некоторым вариантам осуществления содержат активный фрагмент. Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит активный фрагмент, который представляет собой пептид или полипептид. Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит активный фрагмент, который представляет собой биосовместимый полимер.
Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит активный фрагмент, который представляет собой цитотоксическое средство, иммуносупрессор или визуализирующее средство (например, флуорофор). Согласно некоторым вариантам осуществления цитотоксическое средство представляет собой химиотерапевтическое средство. Согласно некоторым вариантам осуществления активный фрагмент представляет собой любое из следующего: фрагмент, который улучшает фармакокинетическое свойство Fc-содержащего полипептида, терапевтический фрагмент и диагностический фрагмент. Согласно некоторым вариантам осуществления активный фрагмент представляет собой низкомолекулярную молекулу.
Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит активный фрагмент, который представляет собой цитотоксическое средство. Примеры цитотоксического средства включают в себя без ограничения следующее: антрациклин, ауристатин, доластатин, СС-1065, дуокармицин, ендиин, гелданамицин, майтансин, пуромицин, таксан, алкалоид барвинка, SN-38, тубулизин, гемиастерлин и их стереоизомеры, изостеры, аналоги или производные. Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит монодансилкадаверин (MDC). Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит ТАМ1. Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит монометилауристатин Е (ММАЕ).
Антрациклины получают из бактерий Streptomyces и их использовали для лечения широкого диапазона злокачественных опухолей, таких как лейкозы, лимфомы, злокачественные опухоли молочной железы, матки, яичников и легких. Иллюстративные антрациклины включают в себя без ограничения даунорубицин, доксорубицин (т.е. адриамицин), эпирубицин, идарубицин, валрубицин и митоксантрон.
Доластатины и их пептидные аналоги и производные, ауристатины, являются высокоэффективными антимитотическими средствами, которые, как было показано, характеризуются противораковой и противогрибковой активностью. См., например, патент США №5663149 и Pettit et al., Antimicrob. Agents Chemother. 42:2961-2965 (1998). Иллюстративные доластатины и ауристатины включают в себя без ограничения ауристатин Е, ауристатин ЕВ (АЕВ), ауристатин EFP (AEFP), MMAD, MMAF, ММАЕ и сложный эфир 5-бензоилвалериановой кислоты-АЕ (AEVB).
Дуокармицин и СС-1065 представляют собой алкилирующие ДНК средства с цитотоксическим действием. См. Boger and Johnson, PNAS 92:3642-3649 (1995). Иллюстративные доластатины и ауристатины включают в себя без ограничения (+)-дуокармицин А и (+)-дуокармицин SA, и (+)-СС-1065.
Ендиины представляют собой класс противораковых бактериальных продуктов, характеризующихся или девяти- и десяти-членными кольцами, или наличием циклической системы конъюгированных тройных-двойных-тройных связей. Иллюстративные ендиины включают в себя без ограничения калихеамицин, эсперамицин и динемицин.
Гелданамицины представляют собой бензохиноновый ансамициновый антибиотик, который связывается с Hsp90 (белком теплового шока 90), и его использовали как противораковые лекарственные средства. Иллюстративные гелданамицины включают в себя без ограничения 17-AAG (17-N-аллиламино-17-деметоксигелданамицин) и 17-DMAG (17-диметиламиноэтиламино-17-деметоксигелданамицин).
Майтансины или их производные, майтансиноиды, ингибируют клеточную пролиферацию путем ингибирования образование микротрубочек во время митоза посредством ингибирования полимеризации тубулина. См. Remillard et al., Science 189:1002-1005 (1975). Иллюстративные майтансины и майтансиноиды включают в себя без ограничения мертансин (DM1) и его производные, а также ансамитоцин.
Таксаны представляют собой дитерпены, которые действуют в качестве антитубулиновых средств или ингибиторов митоза. Иллюстративные таксаны включают в себя без ограничения паклитаксел (например, TAXOL®) и доцетаксел (TAXOTERE®).
Алкалоиды барвинка также представляют собой антитубулиновые средства. Иллюстративные алкалоиды барвинка включают в себя без ограничения винкристин, винбластин, виндезин и винорелбин.
Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит активный фрагмент, который представляет собой иммуносупресор. Примеры иммуносупрессора включают в себя без ограничения ганцикловир, этанерцепт, такролимус, сиролимус, воклоспорин, циклоспорин, рапамицин, циклофосфамид, азатиоприн, микофенолат мофетил, метотрексат и глюкокортикоид и его аналоги.
Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит активный фрагмент, который представляет собой визуализирующее средство (например, флуорофор), такой как флуоресцеин, родамин, люминофоры на основе комплексов лантанидов и их производные. Примеры флуорофоров включают в себя без ограничения флуоресцеинизотиоцианат (FITC) (например, 5-FITC), флуоресцеинамидит (FAM) (например, 5-FAM), эозин, карбоксифлуоресцеин, эритрозин, Alexa Fluor® (например, Alexa 350, 405, 430, 488, 500, 514, 532, 546, 555, 568, 594, 610, 633, 647, 660, 680, 700 или 750), карбокситетраметилродамин (TAMRA) (например, 5,-TAMRA), тетраметилродамин (TMR) и сульфородамин (SR) (например, SR101).
Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит активный фрагмент, который представляет собой полипептид. Согласно некоторым вариантам осуществления полипептид представляет собой антитело, такое как гуманизированное, человеческое, химерное или мышиное моноклональное антитело.
Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит активный фрагмент, который представляет собой полипептид-токсин (или белок-токсин). Примеры полипептида-токсина включают в себя без ограничения цепь А дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, цепь А экзотоксина, цепь А рицина, цепь А абрина, цепь А модесцина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и РАР-S), ингибитор Momordica charantia, курцин, кротин, ингибитор Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин, трихотецены, пептиды ингибиторного цистинового узла (ICK) (например, цератотоксины) и конотоксин (например, KIIIA или SmIIIa).
Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит такую метку, как радиоактивный изотоп. Примеры радиоактивного изотопа или других меток включают в себя без ограничения3Н,14С,15N,35S,18F,32Р,33Р,64Cu,68Ga,89Zr,90Y,99Tc,123I,124I,125I,131I,111In,131In,153Sm,186Re,188Re,211At,212Bi и153Pb.
Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит активный фрагмент, который выбран из группы, состоящей из следующего: Alexa 488 кадаверин, 5-FITC кадаверин, Alexa 647 кадаверин, Alexa 350 кадаверин, 5-TAMRA кадаверин, 5-FAM кадаверин, SR101 кадаверин, 5,6-TAMRA кадаверин, 5-FAM лизин, Ac-Lys-Gly-MMAD, амино-PEG3-C2-MMAD, амино-PEG6-C2-MMAD, амино-PEG3-С2-амино-нонаноил-MMAD], аминокапроил-Val-Cit-PABC-MMAD, Ac-Lys-бета-Ala-MMAD, аминокапроил-MMAD, Ac-Lys-Val-Cit-PABC-MMAD, аминокапроил-MMAE, амино-PEG3-C2-MMAE, амино-PEG2-C2-MMAE, аминокапроил-MMAF, аминокапроил-Val-Cit-PABC-MMAE, аминокапроил-Val-Cit-PABC-MMAF, амино-PEG2-C2-MMAF, амино-PEG3-C2-MMAF, путресцинил-гелданамицин и Ac-Lys-путресцинил-гелданамицин. Согласно некоторым вариантам осуществления аминное донорное средство представляет собой аминокапроил-Val-Cit-PABC-MMAE, аминокапроил-Val-Cit-PABC-MMAF, Ac-Lys-путресцинил-гелданамицин, Ac-Lys-бета-Ala-MMAD, Ac-Lys-Val-Cit-PABC-MMAD, аминокапроил-Val-Cit-PABC-MMAD и амино-PEG6-C2-MMAD.
Согласно некоторым вариантам осуществления конъюгируемый фрагмент содержит активный фрагмент, который представляет собой биосовместимый полимер. Fc-содержащий полипептид можно конъюгировать с биосовместимым полимером для улучшения биологических характеристик Fc-содержащего полипептида, например, для увеличения периода полужизни в сыворотке и биоактивности и/или для увеличения периодов полужизни in vivo. Примеры биосовместимых полимеров включают в себя такой растворимый в воде полимер, как полиэтиленгликоль (PEG) или его производные и содержащие цвиттер-ион биосовместимые полимеры (например, содержащий фосфорилхолин полимер).
Способы получения Fc-содержащих полипептидных конъюгатов
Согласно одному аспекту настоящая заявка относится к способам получения Fc-содержащих полипептидных конъюгатов (таких как конъюгаты антитела и лекарственного средства) с использованием трансглутаминазы дикого типа или сконструированной трансглутаминазы.
Автор настоящего изобретения создал сконструированные ТГазы, которые разработаны для специфического конъюгирования конъюгируемого фрагмента с акцепторным остатком глутамина на области Fc Fc-содержащего полипептида (такого как антитело), который фланкирован сайтом N-гликозилирования. В отличие от существующего ранее представления о том, что остаток глутамина на области Fc, фланкированный сайтом N-гликозилирования, будет недоступен действию ТГазы, автор настоящего изобретения дополнительно неожиданно обнаружил, что при использовании специфического условия реакции (например, специфической концентрации фермента), ТГазы дикого типа также способны конъюгировать конъюгируемый фрагмент с акцепторным остатком глутамина на области Fc, который фланкирован сайтом N-гликозилирования, сайт-специфическим и стойхиометрическим образом.
Описанные в настоящем документе способы согласно некоторым вариантам осуществления предусматривают одну стадию конъюгации. Такой способ, в частности, является подходящим, например, когда выход конъюгации, составляющий 20-98%, является достаточным для создания существенного количества Fc-содержащего полипептидного конъюгата. Одностадийный способ является также применимым, когда размер линкера необходимо минимизировать, когда существует большое количество источников Fc-содержащего полипептида, когда растворимость лекарственного средства является умеренной (например, приблизительно 100 мг/л), и когда экономия времени представляет собой более важную задачу, чем получение высокого выхода.
Согласно некоторым вариантам осуществления способ предусматривает две стадии. Вначале низкомолекулярный стебель конъюгируют с Fc-содержащим полипептидом посредством ТГазы для создания промежуточного конъюгата. Впоследствии, активный фрагмент соединяют с промежуточным конъюгатом через низкомолекулярный стебель, или ковалентно, или нековалентно. Низкомолекулярный стебель можно специально разработать так, чтобы адаптировать связывание активного фрагмента, таким образом, это обеспечивает конъюгацию любого типа активного фрагмента с Fc-содержащим полипептидом. Двухстадийный способ является особенно применимым, если источник Fc-содержащего полипептида и/или активного фрагмента ограничен, и если активный фрагмент (такой как токсин) характеризуется низкой растворимостью в воде и/или индуцирует агрегацию полипептида. Путем использования низкомолекулярного стебля первая стадия ферментативного связывания может обеспечить высокий выход в конъюгации. Вторая стадия хемоселективного связывания затем требует только соотношения реагентов, активного фрагмента к Fc-содержащему полипептиду, составляющего 1,2-1,5. Это может дать в результате более высокий общий выход конъюгации, чем одностадийный способ.
Таким образом, согласно некоторым вариантам осуществления предусмотрен способ получения Fc-содержащего полипептидного конъюгата, содержащего Fc-содержащий полипептид, специфически конъюгированный с конъюгируемым фрагментом, предусматривающий: приведение в контакт Fc-содержащего полипептида с конъюгируемым фрагментом в присутствии трансглутаминазы при условии, которое является достаточным для создания Fc-содержащего полипептидного конъюгата, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования, и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина. Согласно некоторым вариантам осуществления предусмотрен способ получения Fc-содержащего полипептидного конъюгата, содержащего Fc-содержащий полипептид, специфически конъюгированный с конъюгируемым фрагментом, предусматривающий: приведение в контакт композиции, содержащей Fc-содержащие полипептиды с конъюгируемым фрагментом в присутствии трансглутаминазы при условии, которое является достаточным для создания Fc-содержащего полипептидного конъюгата, причем по меньшей мере несколько (например, по меньшей мере приблизительно 50%, 60%, 70%, 80%, 90% или больше) Fc-содержащих полипептидов содержат N-гликозилированную Fc область, причем область Fc содержит акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования, и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина.
Согласно некоторым вариантам осуществления предусмотрен способ получения конъюгата антитела и лекарственного средства, содержащего антитело, специфически конъюгированное с конъюгируемым фрагментом, предусматривающий: приведение в контакт антитела с конъюгируемым фрагментом в присутствии трансглутаминазы при условии, которое является достаточным для создания конъюгата антитела и лекарственного средства, причем антитело является гликозилированным (например, N-гликозилированным) в Fc-области, и при этом конъюгируемый фрагмент является конъюгированным с эндогенным акцепторным остатком глутамина на антителе. Согласно некоторым вариантам осуществления предусмотрен способ получения конъюгата антитела и лекарственного средства, содержащего антитело, специфически конъюгированное с конъюгируемым фрагментом, предусматривающий: приведение в контакт композиции антитела с конъюгируемым фрагментом в присутствии трансглутаминазы при условии, достаточном для создания конъюгата антитела и лекарственного средства, причем по меньшей мере приблизительно некоторое количество (например, по меньшей мере приблизительно 50%, 60%, 70%, 80%, 90% или больше) антитела в композиции является гликозилированным в Fc-области, и при этом конъюгируемый фрагмент является конъюгированным с эндогенным акцепторным остатком глутамина на антителе.
Согласно некоторым вариантам осуществления предусмотрен способ получения Fc-содержащего полипептидного конъюгата, содержащего Fc-содержащий полипептид, специфически конъюгированный с конъюгируемым фрагментом, содержащим низкомолекулярный стебель и активный фрагмент, предусматривающий: a) приведение в контакт Fc-содержащего полипептида с низкомолекулярным стеблем в присутствии трансглутаминазы при условии, которое является достаточным для создания промежуточного конъюгата, содержащего Fc-содержащий полипептид, специфически конъюгированный с низкомолекулярным стеблем, и b) приведение в контакт промежуточного конъюгата с активным фрагментом, тем самым получая Fc-содержащий полипептидный конъюгат, причем Fc-содержащий полипептид содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования, и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина. Согласно некоторым вариантам осуществления предусмотрен способ получения Fc-содержащего полипептидного конъюгата, содержащего Fc-содержащий полипептид, специфически конъюгированный с конъюгируемым фрагментом, содержащим низкомолекулярный стебель и активный фрагмент, предусматривающий: a) приведение в контакт композиции, содержащей Fc-содержащие полипептиды с низкомолекулярным стеблем в присутствии трансглутаминазы при условии, которое является достаточным для создания промежуточного конъюгата, содержащего Fc-содержащий полипептид, специфически конъюгированный с низкомолекулярным стеблем, и b) приведение в контакт промежуточного конъюгата с активным фрагментом, тем самым получая Fc-содержащий полипептидный конъюгат, причем по меньшей мере несколько (например, 50%, 60%, 70%, 80%, 90% или больше) Fc-содержащих полипептидов содержат N-гликозилированную область Fc, причем область Fc содержит акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования, и при этом конъюгируемый фрагмент является конъюгированным с Fc-содержащим полипептидом через акцепторный остаток глутамина.
Согласно некоторым вариантам осуществления предусмотрен способ получения конъюгата антитела и лекарственного средства, содержащего антитело, специфически конъюгированное с конъюгируемым фрагментом, содержащим низкомолекулярный стебель и активный фрагмент, предусматривающий: a) приведение в контакт антитела с низкомолекулярным стеблем в присутствии трансглутаминазы при условии, которое является достаточным для создания промежуточного конъюгата, содержащего антитело, специфически конъюгированное с низкомолекулярным стеблем, и b) приведение в контакт промежуточного конъюгата с активным фрагментом, тем самым получая конъюгат антитела и лекарственного средства, причем антитело является гликозилированным (например, N-гликозилированным) в Fc-области, и при этом конъюгируемый фрагмент является конъюгированным с эндогенным акцепторным остатком глутамина на антителе. Согласно некоторым вариантам осуществления предусмотрен способ получения конъюгата антитела и лекарственного средства, содержащего антитело, специфически конъюгированное с конъюгируемым фрагментом, содержащим низкомолекулярный стебель и активный фрагмент, предусматривающий: a) приведение в контакт композиции антитела с низкомолекулярным стеблем в присутствии трансглутаминазы при условии, достаточном для создания промежуточного конъюгата, содержащего антитело, специфически конъюгированное с низкомолекулярным стеблем, и b) приведение в контакт промежуточного конъюгата с активным фрагментом, тем самым получая конъюгат антитела и лекарственного средства, причем по меньшей мере некоторое количество (например, по меньшей мере приблизительно любое значение из 50%, 60%, 70%, 80%, 90% или больше) антитела в композиции является гликозилированным (например, N-гликозилированным) в Fc-области, и при этом конъюгируемый фрагмент является конъюгированным с эндогенным акцепторным остатком глутамина на антителе.
Описанный в настоящем документе низкомолекулярный стебель, как правило, характеризуется структурой -NH2-R, где R представляет собой фрагмент, который обеспечивает возможность прикрепления активного фрагмента. Введение низкомолекулярного стебля в описанные в настоящем документе способы значительно увеличивает эксплуатационную гибкость способов. В частности, структуру низкомолекулярного стебля можно адаптировать для прикрепления требуемого активного фрагмента. Например, согласно некоторым вариантам осуществления R представляет собой лиганд, который специфически связывается с партнером по связыванию. Это обеспечивает возможность прикрепления любой молекулы (такой как белок), которая содержит партнер по связыванию. Подходящие пары лиганд/партнер по связыванию включают в себя без ограничения следующее: антитело/антиген, антиген/антитело, авидин/биотин, биотин/авидин, стрептавидин/биотин, биотин/стрептавидин, глутатион/GST, GST/глутатион, связывающий мальтозу белок/амилоза, амилоза/связывающий мальтозу белок, связывающий целлюлозу белок и целлюлоза, целлюлоза/связывающий целлюлозу белок и т.д.
Другие подходящие низкомолекулярные стебли, описанные в настоящем документе, включают в себя без ограничения NH2-СН2-СН(ОН)-СН2-NH2, NH2-R-(OR')2, NH2-R=O, NH2-R-SH, NH2-R-азид. Указанные низкомолекулярные стебли позволяют прикрепить конъюгируемый фрагмент посредством подходящих линкеров, таких как NH2-О-R-X, малеимид-R-X и циклооктин-R-(R'-Х)2, где X представляет собой активный фрагмент, и R и R' представляют собой независимо такие линкерные группы, как линкерные группы, содержащие алкильные или полиэтиленгликольные группы. Согласно некоторым вариантам осуществления низкомолекулярный стебель представляет собой 3-плечевой PEG-линкер с аминогруппой и двумя азидными группами (такой как 3-плечевой PEG-линкер, изображенный на фигуре 18, верхняя панель), где каждая из азидных групп может быть конъюгирована с активным фрагментом.
Катализируемую ТГазой реакцию можно проводить от нескольких часов до одних суток (например, в течение ночи). Реакцию конъюгируемого фрагмента или низкомолекулярного стебля с Fc-содержащим полипептидом (например, 1 мг/мл) проводят при концентрациях лиганда, составляющих 400-600 мкмоль/л, обеспечивая 60-90-кратный избыток субстратов по сравнению с Fc-содержащим полипептидом, или необязательно с более низким избытком субстратов, например, 1-20-кратным или 10-20-кратным. Реакции можно провести в не содержащем калий физиологическом растворе с фосфатным буфером (PBS; pH 8) при 37°С. Через 4 ч - несколько дней достигаются равновесные условия. Избыточный лиганд и фермент затем удаляют с использованием центрифугирования-диализа (VIVASPIN® MWCO 50 кДа, Vivascience, Винкель, Швейцария) или диафильтрации (PELLICON® MWMCO 50 кДа, Millipore). Реакции можно подвергнуть мониторингу с помощью ВЭЖХ.
Полученные Fc-содержащие полипептидные конъюгаты можно проанализировать с использованием любого подходящего способа. Например, стойхиометрию конъюгированного полипептида можно охарактеризовать с помощью масс-спектрометрии с жидкостной хроматографией (ЖХ/МС) с использованием принципа нисходящего анализа для оценки числа конъюгируемого фрагмента или низкомолекулярного стебля, конъюгированного с антителами, и, в частности, гомогенности композиции. Конъюгаты можно восстановить перед анализом ЖХ/МС и легкие цепи и тяжелые цепи измерить отдельно.
Согласно одному варианту осуществлению продукт анализируют в отношении содержания лекарственного средства (например, количества активного фрагмента в конъюгате на один Fc-содержащий полипептид). Такие способы можно использовать для определения среднего количества конъюгатов или активных фрагментов (таких как лекарственное средство) на Fc-содержащий полипептид, а также распределение количества конъюгатов или активных фрагментов (таких как лекарственное средство) на антитело в композиции, т.е. процентное отношение общего количества антитела с любым данным уровнем содержания лекарственного средства или DAR. Можно определить соотношение антител, характеризующихся заданным количеством (n) конъюгированных акцепторных глутаминов (например, n=1, 2, 3, 4, 5, 6 и т.д.). Одна техника, адаптированная к такому определению и более конкретно к определению содержания лекарственного средства, представляет собой хроматографию с гидрофобным взаимодействием (HIC), HIC можно провести, как описано, например, в Hamblett et al. (2004) Cancer Res. 10: 7063-7070; Wakankar et al. (2011) mAbs 3(2): 161-172; и Lyon et al (2012) Methods in Enzymology, Vol. 502: 123-138, раскрытие которых включено в настоящий документ посредством ссылки.
Молярное отношение между трансглутаминазой и Fc-содержащим полипептидом в реакции конъюгация можно контролировать для обеспечения эффективной реакции трансглутаминирования. Например, согласно некоторым вариантам осуществления молярное отношение трансглутаминазы к Fc-содержащему полипептиду (такому как антитело или композиция антитела) составляет приблизительно 10:1 - приблизительно 1:100, включая в себя любое значение из следующего: приблизительно 10:1 - приблизительно 9:1, приблизительно 9:1 - приблизительно 8:1, приблизительно 8:1 - приблизительно 7:1, приблизительно 7:1 - приблизительно 6:1, приблизительно 6:1 - приблизительно 5:1, приблизительно 5:1 - приблизительно 4:1, приблизительно 4:1 - приблизительно 3:1, приблизительно 3:1 - приблизительно 2:1, приблизительно 2:1 - приблизительно 1:1, приблизительно 1:1 - приблизительно 1:2, приблизительно 1:2 - приблизительно 1:3, приблизительно 1:3 - приблизительно 1:4, приблизительно 1:4 - приблизительно 1:5, приблизительно 1:5 - приблизительно 1:6, приблизительно 1:6 - приблизительно 1:7, приблизительно 1:7 - приблизительно 1:8, приблизительно 1:8 - приблизительно 1:9, приблизительно 1:9 - приблизительно 1:10, приблизительно 1:10 - приблизительно 1:20, приблизительно 1:20 - приблизительно 1:30, приблизительно 1:30 - приблизительно 1:40, приблизительно 1:40 - приблизительно 1:50, приблизительно 1:50 - приблизительно 1:60, приблизительно 1:60 - приблизительно 1:70, приблизительно 1:70 - приблизительно 1:80, приблизительно 1:80 - приблизительно 1:90 или приблизительно 1:90 - приблизительно 1:100.
Количество трансглутаминазы в реакционной смеси можно контролировать для обеспечения эффективной реакции трансглутаминазы. Например, согласно некоторым вариантам осуществления концентрация трансглутаминазы в реакционной смеси составляет приблизительно любое значение из приблизительно 0,01 мг/мл - приблизительно 5 мг/мл, включая в себя, например, любое значение из следующего: приблизительно 0,01 мг/мл - приблизительно 0,02 мг/мл, приблизительно 0,02 мг/мл - приблизительно 0,03 мг/мл, приблизительно 0,03 мг/мл - приблизительно 0,04 мг/мл, приблизительно 0,04 мг/мл - приблизительно 0,05 мг/мл, приблизительно 0,05 мг/мл - приблизительно 0,06 мг/мл, приблизительно 0,06 мг/мл - приблизительно 0,07 мг/мл, приблизительно 0,07 мг/мл - приблизительно 0,08 мг/мл, приблизительно 0,08 mg.ml - приблизительно 0,09 мг/мл, приблизительно 0,09 мг/мл - приблизительно 0,1 мг/мл, приблизительно 0,1 мг/мл - приблизительно 0,2 мг/мл, приблизительно 0,2 мг/мл - приблизительно 0,3 мг/мл, приблизительно 0,3 мг/мл - приблизительно 0,4 мг/мл, приблизительно 0,4 мг/мл - приблизительно 0,5 мг/мл, приблизительно 0,5 мг/мл - приблизительно 0,6 мг/мл, приблизительно 0,6 мг/мл - приблизительно 0,7 мг/мл, приблизительно 0,7 мг/мл - приблизительно 0,8 мг/мл, приблизительно 0,8 мг/мл - приблизительно 0,9 мг/мл, приблизительно 0,9 мг/мл - приблизительно 1 мг/мл, приблизительно 1 мг/мл - приблизительно 2 мг/мл, приблизительно 2 мг/мл - приблизительно 3 мг/мл, приблизительно 3 мг/мл - приблизительно 4 мг/мл, приблизительно 4 мг/мл - приблизительно 5 мг/мл. Согласно некоторым вариантам осуществления концентрация трансглутаминазы в реакционной смеси составляет приблизительно 0,05 мг/мл - приблизительно 1 мг/мл, например, приблизительно 0,2 мг/мл - приблизительно 1 мг/мл.
Согласно некоторым вариантам осуществления реакцию трансглутаминазы проводят на твердой подложке. Например, Fc-содержащий полипептид (такой как антитело) можно прикрепить к твердой подложке. Оставшиеся компоненты реакции конъюгации затем приводят в контакт с Fc-содержащим полипептидом на твердой подложке и впоследствии удаляют. Альтернативно, к твердой подложке можно прикрепить трансглутаминазу. Оставшиеся компоненты реакции конъюгации затем приводят в контакт с трансглутаминазой на твердой подложке и впоследствии отделяют от трансглутаминазы на твердой подложке.
Твердые подложки, которые является применимыми для описанных в настоящем документе способов включают в себя, например, планшеты, пробирки, сосуды, колбы, магнитные микроносители, магнитные листы, пористые матрицы или любые твердые поверхности и подобное. Средства или молекулы, которые можно использовать для связывания ТГазы или Fc-содержащего полипептида с твердой подложкой, включают в себя без ограничения лектины, авидин/биотин, неорганические или органические связывающие молекулы. Физическое разделение можно осуществить, например, путем фильтрации, выделения, магнитного поля, центрифугирования, отмывки и т.д.
Согласно некоторым вариантам осуществления твердая подложка представляет собой гранулу, мембрану, картридж, фильтр, микротитрационный планшет, пробирку для анализа, твердый порошок, полученный путем литья без давления или экструзионного формования модуль, сито, волокно, смесь магнитного порошка или любые другие твердые материалы. На твердую подложку можно нанести такое вещество, как полиэтилен, полипропилен, поли(4-метилбутен), полистирол, полиакрилат, полиэтилентерфталат, вискоза, нейлон, поли(винилбутират), поливинилидендифторид (PCDF), силиконы, полиформальдегид, целлюлозу, ацетат целлюлозы, нитроцеллюлозу и подобное. Согласно некоторым вариантам осуществления на твердую подложку можно нанести лиганд или ее можно пропитать лигандом.
Согласно некоторым вариантам осуществления материал подложки представляет собой магнитный микроноситель. Согласно некоторым вариантам осуществления магнитные микроносители характеризуются средним размером, составляющим приблизительно 1-200 мкм, таким как любое значение, составляющее приблизительно 1-2 мкм, 2-10 мкм, 10-30 мкм, 30-50 мкм, 50-100 мкм и 10-200 мкм. Согласно некоторым вариантам осуществления магнитные микроносители являются монодисперсными. Согласно некоторым вариантам осуществления на магнитные микроносители нанесен, например, белок А.
Другие твердые подложки, которые можно использовать в описанных в настоящем документе способах включают в себя без ограничения желатин, стекло, сефарозные макрогранулы, такие микроносители из декстрана, как CYTODES® (Pharmacia, Уппсала, Швеция). Кроме того, предусмотрен такой полисахарид, как агароза, альгинат, каррагинан, хитин, целлюлоза, декстран или крахмал, полиакриламид, полистирол, полиакролеин, поливиниловый спирт, полиметилакрилат, перфторуглерод, такие неорганические соединения, как кремний, стекло, диатомит, глинозем, оксид железа или другие оксиды металлов, или сополимеры, состоящие из любой комбинации двух или больше встречающихся в природе полимеров, синтетических полимеров или неорганических соединений.
Количество трансглутаминазы в реакционной смеси (т.е. количество на мл смолы при использовании смолы в качестве твердой подложки) можно контролировать для обеспечения эффективной реакции трансглутаминазы. Например, согласно некоторым вариантам осуществления концентрация трансглутаминазы в реакционной смеси (количество на мл смолы) составляет приблизительно любое значение из приблизительно 0,01 мг/мл - приблизительно 1 мг/мл, включая в себя, например, любое значение из приблизительно 0,01 мг/мл - приблизительно 0,02 мг/мл, приблизительно 0,02 мг/мл - приблизительно 0,03 мг/мл, приблизительно 0,03 мг/мл - приблизительно 0,04 мг/мл, приблизительно 0,04 мг/мл - приблизительно 0,05 мг/мл, приблизительно 0,05 мг/мл - приблизительно 0,06 мг/мл, приблизительно 0,06 мг/мл - приблизительно 0,07 мг/мл, приблизительно 0,07 мг/мл - приблизительно 0,08 мг/мл, приблизительно 0,08 mg.ml - приблизительно 0,09 мг/мл, приблизительно 0,09 мг/мл - приблизительно 0,1 мг/мл, приблизительно 0,1 мг/мл - приблизительно 0,2 мг/мл, приблизительно 0,2 мг/мл - приблизительно 0,3 мг/мл, приблизительно 0,3 мг/мл - приблизительно 0,4 мг/мл, приблизительно 0,4 мг/мл - приблизительно 0,5 мг/мл, приблизительно 0,5 мг/мл - приблизительно 0,6 мг/мл, приблизительно 0,6 мг/мл - приблизительно 0,7 мг/мл, приблизительно 0,7 мг/мл - приблизительно 0,8 мг/мл, приблизительно 0,8 мг/мл - приблизительно 0,9 мг/мл, приблизительно 0,9 мг/мл - приблизительно 1 мг/мл.
Согласно некоторым вариантам осуществления отношение концентраций между конъюгируемым фрагментом и Fc-содержащим полипептидом (таким как антитело) составляет приблизительно 2:1 - приблизительно 800:1, включая в себя без ограничения приблизительно любое значение из следующего: 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, 15:1, 20:1, 25:1, 30:1, 35:1, 40:1, 45:1, 50:1, 60:1, 70:1, 80:1, 90:1, 100:1, 200:1, 300:1, 400:1, 500:1, 600:1, 700:1 и 800:1.
Согласно некоторым вариантам осуществления эффективность конъюгации Fc-содержащего полипептида (такого как антитело) и конъюгируемого фрагмента составляет по меньшей мере приблизительно 30%. Используемый в настоящем документе термин "эффективность конъюгации" или "эффективность образования поперечных связей" представляет собой отношение между экспериментально измеренным количеством сконструированного полипептидного конъюгата, деленным на максимальное предполагаемое количество сконструированного полипептидного конъюгата. Эффективность конъюгации или эффективность образования поперечных связей можно измерить с помощью различных техник, хорошо известных специалистам в настоящей области техники, таких как хроматография с гидрофобным взаимодействием. Эффективность конъюгации также можно определить при различной температуре, такой как комнатная температура или 37°С. Согласно некоторым вариантам осуществления эффективность конъюгации Fc-содержащего полипептида и конъюгируемого фрагмента составляет по меньшей мере приблизительно любое значение из 30%-35%, 35%-40%, 45%-50%, 50%-55%, 56%-60%, 61%-65%, 66%-70%, 71%-75%, 76%-80%, 81%-85%, 86%-90%, 91%-95% или 96%-99%. Согласно некоторым вариантам осуществления эффективность конъюгации Fc-содержащего полипептида и конъюгируемого фрагмента составляет по меньшей мере приблизительно любое значение из 32%, 34%, 36%, 38%, 40%, 42%, 44%, 46%, 48%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99%.
ТГазы
ТГазы катализируют ковалентное образование поперечных связей в белке путем образования устойчивых к протеиназам изопептидных связей между донорным остатком лизина одного белка и акцепторным остатком глутамина другого белка, что сопровождается высвобождением аммиака. Предполагают, что каталитический механизм трансглутаминаз является следующим. После того, как глутамин-содержащий первый субстрат (акцептор или Q-субстрат) связывается с ферментом, он образует сложный гамма-глутамилтиоэфир с цистеиновым остатком в активном центре ТГазы, известном как промежуточный ацилфермент, что сопровождается высвобождением аммиака. Второй субстрат (донор или K-субстрат) затем связывается с промежуточным ацилферментом и атакует тиоэфирную связь. Продукт (два белка, поперечно сшитых с помощью Nepsilon (гамма-глутамил)лизинового изопептидного мостика) образуется и высвобождается. Это восстанавливает остаток Cys активного центра фермента в его исходной форме и позволяет ему принимать участие в другом цикле катализа. Полагают, что образование ковалентного промежуточного ацилфермента является ограничивающей скорость реакции стадией в указанных реакциях. Каталитическая триада многих трансглутаминаз является папаиноподобной, содержащей Cys-His-Asp (где His представляет собой гистидин, и Asp представляет собой аспарагиновую кислоту) и, что принципиально важно, остаток триптофана (Trp), удаленный на 36 остатков от Cys активного центра. Напротив, бактериальные ТГазы, выделенные из Streptoverticillium sp (см. выше) характеризуются атипичной каталитической триадой и не демонстрируют гомологию последовательностей относительно подобной папаину каталитической триады других ТГаз.
О нескольких типах трансглутаминаз сообщалось в различных живых организмах, включая в себя микроорганизмы. Примеры представляют собой ТГазу из печени морских свинок (GТГаза), печени рыб (FТГаза) и микроорганизмов (мТГаза) и любую рекомбинантную ТГазу (рТГазу). Другие ТГазы, отличные от перечисленных в настоящем документе, также можно использовать согласно настоящему изобретению. Примеры применимых ТГаз включают в себя трансглутаминазы микроорганизмов, такие как например, из Streptomyces mobaraense, Streptomyces cinnamoneum и Streptomyces griseocarneum, раскрытые в патенте США №5156956, и Streptomyces lavendulae, раскрытая в патенте США №5252469, и Streptomyces ladakanum, раскрытая в патенте Японии № JP 2003199569. Другие применимые трансглутаминазы микроорганизмов были выделены из Bacillus subtilis (раскрытые в патенте США №5731183) и из различных Myxomycetes. Другие примеры применимых трансглутаминаз микроорганизмов раскрыты в международной патентной публикации № WO 96/06931 (например, трансглутаминаза из Bacilus lydicus) и WO 96/22366. Применимые немикробные трансглутаминазы включают в себя трансглутаминазу печени морских свинок и трансглутаминазы из различных морских источников, таких как камбала Pagrus major (раскрытая в ЕР-0555649), и японская устрица Crassostrea gigas (раскрытая в патенте США №5736356). Иллюстративная ТГаза представляет собой бактериальную трансглутаминазу (BTG) (см., например, ЕС 2.3.2.13, протеин-глутамин-гамма-глутамилтрансфераза). Согласно другому иллюстративному варианту осуществления ТГаза происходит из S. mobaraense. Согласно другому варианту осуществления ТГаза представляет собой мутантную (например, сконструированную) ТГазу, характеризующуюся по меньшей мере 80% гомологией последовательности относительно нативной ТГазы. Пример представляет собой рекомбинантная бактериальная трансглутаминаза, полученная из Streptomyces mobaraensis (доступная от Zedira, Дармштадт, Германия).
Streptomyces ladakanum АТСС 27441 или NRRL3191 мТГаза экспрессируется как пре-про-мТГаза (регистрационный номер GenBank AY241675). В пре-про-мТГазе 410 аминокислотных остатков, 331 в зрелом фермент, а также 30 остатков пре-пептида и 49 остатков про-пептида. Про-пептид представляет собой сильный ингибитор зрелого фермента. Праймеры, разработанные в соответствии с AY241675, использовали для клонирования про-мТГазы из АТСС 27441DNA в сайты Nde I и Xho I вектора pET29b(+). Активную ТГазу можно получить либо путем обработки про-мТГазы легкой цепью энтерокиназы (EKL), или рефолдинга зрелой мТГазы. мТГаза из Strep Ladakanum (TG_SL) является очень сходной с мТГазой из Strep. mobaraensis (TG_SM, продаваемой Ajinomoto в виде ACTIVA®) с несколькими различиями в аминокислотах (выравнивание показано на фигуре 2).
Трансглутаминазу, используемую в описанных в настоящем документе способах, можно получить или произвести из различных источников. Согласно некоторым вариантам осуществления трансглутаминаза представляет собой кальций-зависимую трансглутаминазу, которая нуждается в кальции для индукции конформационных изменений в ферменте и обеспечении ферментативной активности. Например, трансглутаминаза может происходить из печени морских свинок и ее можно приобрести из коммерческих источников (например, Sigma-Aldrich (Сент-Луис, Миссури) и MP Biomedicals (Ирвин, Калифорния)). Согласно некоторым вариантам осуществления трансглутаминаза представляет собой кальций-независимую трансглутаминазу, которая не нуждается в кальции для индукции конформационных изменений фермента и обеспечения ферментативной активности. Согласно некоторым вариантам осуществления трансглутаминаза представляет собой трансглутаминазу микроорганизма, происходящую из генома микроорганизма, такую как трансглутаминаза из Streptoverticillium или Streptomices (например, Streptomyces mobarensis или Streptoverticillium mobarensis). Согласно некоторым вариантам осуществления трансглутаминаза представляет собой белок млекопитающего (например, трансглутаминазу человека), бактериальный белок, растительный белок, белок грибка (например, трансглутаминазы Oomycetes и Actinomicetes) или прокариотический белок. Согласно некоторым вариантам осуществления трансглутаминаза происходит из Micrococcus, Clostridium, Turolpsis, Rhizopus, Monascus или Bacillus.
Подходящие ТГазы включают в себя без ограничения бактериальную трансглутаминазу (BTG), такую как фермент, характеризующийся индексом в классификации ЕС: ЕС 2.3.2.13 (протеин-глутамин-γ-глутаминалтрансфераза). Согласно некоторым вариантам осуществления ТГаза происходит из Strep Ladakanum (TG_SL, SEQ ID NO: 16, см. фигуру 2). Согласно некоторым вариантам осуществления ТГаза происходит из Strep Mobaraensis (TG-SM, SEQ ID NO: 18, см. фигуру 2). Согласно некоторым вариантам осуществления ТГаза представляет собой рекомбинантную ТГазу на основе ТГазы из Strep Ladakanum (TG_SL, SEQ ID NO: 17, см. фигуру 3).
Согласно некоторым вариантам осуществления трансглутаминаза, используемая в описанных в настоящем документе способах представляет собой рекомбинантный белок, полученный с использованием рекомбинантных техник.
Согласно некоторым вариантам осуществления трансглутаминаза представляет собой ТГазу дикого типа, например, ТГазу, характеризующуюся последовательностью согласно SEQ ID NO: 16. Согласно некоторым вариантам осуществления трансглутаминаза представляет собой рекомбинантную ТГазу дикого типа, содержащую ТГазу дикого типа, характеризующуюся последовательностью согласно SEQ ID NO: 16, причем рекомбинантная ТГаза дикого типа дополнительно содержит дополнительный пролин на N-конце и необязательно метку для очистки (такую как полигистидиновая метка). Согласно некоторым вариантам осуществления трансглутаминаза представляет собой рекомбинантную ТГазу дикого типа, характеризующуюся последовательностью согласно SEQ ID NO: 17, как показано на фигуре 3. В отличие от общего понимания, существующего в настоящей области техники, о том, что трансглутаминаза дикого типа не способна катализировать реакцию трансглутаминирования до акцепторного глутамина, фланкированного сайтом N-гликозилирования, неожиданно было обнаружено, что такую реакцию можно провести со значительной эффективностью и специфичностью при определенных условиях, описанных в настоящем документе.
Согласно некоторым вариантам осуществления трансглутаминаза является сконструированной. Согласно некоторым вариантам осуществления трансглутаминаза представляет собой сконструированную трансглутаминазу, специально разработанную для проведения реакций трансглутаминирования до акцепторного глутамина, проксимального по отношению к сайту N-гликозилирования. Такие сконструированные трансглутаминазы дополнительно описаны ниже подробно.
Согласно некоторым вариантам осуществления трансглутаминаза представляет собой очищенный белок. Например, согласно некоторым вариантам осуществления трансглутаминаза является по меньшей мере приблизительно на 50% чистой. Используемый в настоящем документе "чистый" или "очищенный" белок относится к белку (например, трансглутаминазе), не содержащему другие белковые примеси. Согласно некоторым вариантам осуществления очищенная трансглутаминаза является чистой по меньшей мере приблизительно на любое значение из 55%-60%, 60%-65%, 65%-70%, 70%-75%, 75%-80%, 80%-85%, 85%-90%, 90%-95%, 95%-98% или 99%. Согласно некоторым вариантам осуществления очищенная трансглутаминаза является чисто по меньшей мере приблизительно на любое значение из 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100%.
Сконструированная трансглутаминаза
Настоящая заявка согласно другому аспекту относится к сконструированной трансглутаминазе, специально разработанной для проведения реакций трансглутаминирования до акцепторного глутамина, проксимального по отношению к сайту N-гликозилирования. Авторы настоящего изобретения ремоделировали связывающий субстрат карман ТГазы для увеличения доступности остатка глутамина на области Fc (Q295, в частности) для каталитического остатка ТГазы Cys64 (фигура 3), и получили сконструированные ТГазы, которые специфически проводят реакции трансглутаминирования на Q295.
Согласно некоторым вариантам осуществления сконструированная ТГаза основана на ТГазе дикого типа из Strep ladalanum (SEQ ID NO: 16 или SEQ ID NO: 17). Согласно некоторым вариантам осуществления сконструированная ТГаза основана на ТГазе дикого типа из Strep Mobaraensis (SEQ ID NO: 18). Последовательность ТГазы, выделенной из Strep ladakanum, характеризуется аминокислотной последовательностью, которая является идентичной последовательности из Strep mobaraensis за исключением в общем 22 различий в аминокислотах между двумя последовательностями (Yi-Sin Lin et al., Process Biochemistry 39(5), 591-598 (2004).
Согласно некоторым вариантам осуществления сконструированная трансглутаминаза специфически проводит реакцию трансглутаминирования на сайте акцепторного глутамина на N-гликозилированной области Fc. Используемый в настоящем контексте термин "специфически" описывает предпочтение ТГазы для проведения реакции с одним или несколькими специфическими остатками глутамина на N-гликозилированной области Fc по сравнению с другими специфическими остатками глутамина на Fc-содержащем полипептиде (таком как антитело).
Таким образом, например, согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, способная конъюгировать Fc-содержащий полипептид (такой как антитело) с конъюгируемым фрагментом, причем Fc-содержащий полипептид (такой как антитело) содержит N-гликозилированную область Fc, причем N-гликозилированная область Fc содержит акцепторный остаток глутамина, фланкированный сайтом N-гликозилирования, причем при реакции конъюгируемый фрагмент конъюгируется с Fc-содержащим полипептидом (таким как антитело) через акцепторный остаток глутамина, и при этом конъюгация является по меньшей мере приблизительно на 10% более активной, чем трансглутаминаза дикого типа при одинаковых условиях реакции. Согласно некоторым вариантам осуществления сконструированная ТГаза характеризуется по меньшей мере приблизительно 80% идентичностью по отношению к SEQ ID NO: 16 и дополнительно содержит по меньшей мере одну мутация (такую как замена, делеция или вставка).
Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, характеризующуюся по меньшей мере приблизительно 80% (включая в себя, например, по меньшей мере приблизительно любое значение из 85%, 90%, 95% или 95%) идентичностью по отношению к SEQ ID NO: 16, причем трансглутаминаза содержит делецию, выбранную из группы, состоящей из: D1-E4; Р244-Р247 и Н279-Н289. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 16 за исключением одной или нескольких делеций, выбранных из группы, состоящей из: D1-Е4; Р244-Р247 и Н279-Н289.
Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, характеризующуюся по меньшей мере приблизительно 80% (включая в себя, например, по меньшей мере приблизительно любое значение из 85%, 90%, 95% или 95%) идентичностью по отношению к SEQ ID NO: 17, причем трансглутаминаза содержит делецию, выбранную из группы, состоящей из: Р1-Е5; Р245-Р248 и Н280-Н290. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 17 за исключением одной или нескольких делеций, выбранных из группы, состоящей из: PIES; Р245-Р248 и Н280-Н290.
Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, характеризующуюся по меньшей мере приблизительно 80% (включая в себя, например, по меньшей мере приблизительно любое значение из 85%, 90%, 95% или 95%) идентичностью SEQ ID NO: 16, причем трансглутаминаза содержит мутацию, выбранную из группы, состоящей из следующего: делеция D1-E4; делеция Р244-Р247; делеция N282-L285; замена Н279-А287 на G; и замена А280-Н289 на G. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 16 за исключением одной или нескольких делеций, выбранных из группы, состоящей из мутации, выбранной из группы, состоящей из следующего: делеция D1-E4; делеция Р244-Р247; делеция N282-L285; замена Н279-А287 на G и замена А280-Н289 на G.
Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, характеризующуюся по меньшей мере приблизительно 80% (включая в себя, например, по меньшей мере приблизительно любое значение из 85%, 90%, 95% или 95%) идентичностью по отношению к SEQ ID NO: 17, причем трансглутаминаза содержит мутацию, выбранную из группы, состоящей из следующего: делеция Р1-Е5; делеция Р245-Р248; делеция N283-L286; замена Н280-А288 на G и замена А281-Н290 на G. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 17 за исключением одной или нескольких делеций, выбранных из группы, состоящей из мутации, выбранной из группы, состоящей из следующего: делеция Р1-Е5; делеция Р245-Р248; делеция N283-L286; замена Н280-А288 на G и замена А281-Н290 на G.
Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 16 за исключением делеций D1-E4. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 16 за исключением делеций Р244-Р247. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 16 за исключением делеций Н279-Н289. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 16 за исключением делеций N282-L285. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 16 за исключением делеций D1-E4 и делеций N282-L285. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 16 за исключением делеций D1-E4, делеций Р244-Р247 и делеций N282-L285. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 16 за исключением делеций D1-E4 и замены Н280-А288 на G. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 16 за исключением делеций D1-E4 и замены А280-Н289 на G.
Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 17 за исключением делеций Р1-Е5. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 17 за исключением делеций Р245-Р248. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 17 за исключением делеций Н280-Н290. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 17 за исключением делеций N283-N286. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 17 за исключением делеций Р1-Е5 и делеций N283-N286. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 17 за исключением делеций Р1-Е5, делеций Р245-Р248 и делеций N283-N286. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 17 за исключением делеций Р1-Е5 и замены Н280-А288 на G. Согласно некоторым вариантам осуществления предусмотрена сконструированная трансглутаминаза, содержащая аминокислотную последовательность, которая является на 100% идентичной SEQ ID NO: 17 за исключением делеций Р1-Е5 и замены А281-Н290 на G.
Используемые взаимозаменяемо в настоящем документе термины "идентичность последовательности" или "идентичный" относятся к степени родства последовательностей между пептидами, что определяют по количеству совпадений между строковыми последовательностями двух или больше аминокислотных остатков. Идентичность последовательности можно измерить, например, по процентному отношению идентичных совпадений между меньшей из двух или более последовательностей с выравниванием делеций (если они присутствуют), полученному с помощью конкретной математической модели или компьютерной программы (т.е. "алгоритмов"). Некоторые способы определения идентичности разработаны для получения наибольшего совпадения между исследуемыми последовательностями. Способы определения идентичности описаны в общедоступных компьютерных программах. Иллюстративные компьютерные программы для осуществления способов определения идентичности между двумя последовательностями включают в себя программный пакет GCG, включая в себя GAP (Devereux et al., Nucl. Acid. Res. 12, 387 (1984); Genetics Computer Group, University of Wisconsin, Мадисон, Висконсин.), BLASTP, BLASTN и FASTA (Altschul et al., J. Mol. Biol. 215, 403-410 (1990)). Программа BLASTX является общедоступной от Национального центра биотехнологической информации (National Center for Biotechnology Information (NCBI)) и других источников (BLAST Manual, Altschul et al. NCB/NLM/NIH Bethesda, Md. 20894; Altschul et al., ранее). Хорошо известный алгоритм Smith Waterman также можно использовать для определения идентичности.
Согласно некоторым вариантам осуществления сконструированная трансглутаминаза характеризуется более высокой трансглутаминазной активностью, чем таковая у ТГазы, кодируемой SEQ ID NO: 16 или SEQ ID NO: 18. Согласно некоторым вариантам осуществления специфическая активность сконструированной трансглутаминазы по меньшей мере приблизительно в 1,25, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5, 5,0, 5,5, 6,0, 6,5, 7,0, 7,5, 8,0, 8,5, 9,0, 9,5 или 10,5 раз выше, чем таковая у ТГазы дикого типа (такой как ТГаза, кодируемая SEQ ID NO: 16 или SEQ ID NO: 17).
Описанные в настоящем документе сконструированные ТГазы можно проанализировать в отношении активности ТГазы с использованием анализов, известных в настоящей области техники. Например, в патенте США №5156956 описано, что измерение активности данного пептида проводят путем проведения реакции с использованием бензилоксикарбонил-L-глутаминилглицина и гидроксиламина в качестве субстратов при отсутствии Ca2+, образуя комплекс железа с полученной гидроксамовой кислотой в присутствии трихлоруксусной кислоты, измеряя поглощение при 525 нм и определяя количество гидроксамовой кислоты с помощью калибровочной кривой для расчета активности. Для цели настоящего описания изобретения считают, что пептид, который проявляет трансглутаминазную активность в указанном анализе, характеризуется трансглутаминазной активностью. В частности, пептиды согласно настоящему изобретению проявляют активность, которая превышает на 30%, например, больше чем на 50%, например, больше чем на 70%, например, больше чем на 90% активность ТГазы из S. ladakanum, характеризующейся аминокислотной последовательностью согласно SEQ ID No. 16.
Кроме того, в настоящем документе предусмотрены нуклеиновые кислоты (такие как выделенные нуклеиновые кислоты), кодирующие любую из сконструированных ТГаз, описанных в настоящем документе. Предусмотрено, что используемый в настоящем документе термин "нуклеиновая кислота" указывает на любую молекулу нуклеиновой кислоты, происходящую из кДНК, геномной ДНК, синтетической ДНК или РНК. Нуклеиновая кислота может являться одно- или двухцепочечной и может быть основана на полной или частичной встречающейся в природе нуклеотидной последовательности, кодирующей представляющей интерес белок. Нуклеиновая кислота может необязательно содержать другие нуклеиновокислотные сегменты.
Кроме того, в настоящем документе предусмотрены рекомбинантные векторы (такие как амплификационные векторы и/или экспрессионные векторы), содержащие нуклеиновые кислоты, кодирующие сконструированные ТГазы, описанные в настоящем документе. Согласно некоторым вариантам осуществления предусмотрена клетка-хозяин, содержащая рекомбинантный вектор.
Рекомбинантный вектор, содержащий нуклеиновую кислоту, кодирующую сконструированную ТГазу, может представлять собой любой вектор, который можно без труда подвергнуть процедурам рекомбинантной ДНК, и выбор вектора может зависеть от клетки-хозяина, в которую он должен быть введен. Таким образом, вектор может представлять собой автономно реплицирующийся вектор, т.е. вектор, который существует как внехромосомная единица, репликация которой является независимой от хромосомной репликации, например, плазмида. Альтернативно, вектор может представлять собой вектор, который, будучи введенным в клетку-хозяина, интегрируется в геном клетки-хозяина и реплицируется вместе с хромосомой(ами), в которую(ые) он интегрирован. Вектор согласно некоторым вариантам осуществления представляет собой экспрессионный вектор, в котором последовательность ДНК, кодирующая сконструированную ТГазу, функционально связана с дополнительными сегментами, необходимыми для транскрипции ДНК. Термин "функционально связанный" указывает на то, что сегменты расположены так, что они функционируют совместно для их предусмотренных целей, например, транскрипция инициируется в промоторе и продолжается через последовательность ДНК, кодирующую белок. Промотор может представлять собой последовательность ДНК, которая демонстрирует транскрипционную активность в выбранной клетке-хозяине и может происходить из генов, кодирующих белки, либо гомологичные, либо гетерологичные клетке-хозяину. Последовательность ДНК, кодирующая сконструированную ТГазу, также при необходимости может являться функционально связанной с подходящим терминатором.
Согласно некоторым вариантам осуществления рекомбинантный вектор дополнительно содержит последовательность(и) ДНК, обеспечивающую(ие) способность вектора реплицироваться в данной клетке-хозяине, и/или селективный маркер, например, ген, продукт которого восполняет дефект в клетке-хозяине, такой как ген, кодирующий дигидрофолатредуктазу (DHFR) или ген TPI Schizosaccharomyces pombe (описанный P.R. Russell, Gene 40, 125-130 (1985)), или ген, который придает устойчивость к лекарственному средству, например, ампициллину, канамицину, тетрациклину, хлорамфениколу, неомицину, гигромицину или метотрексату. Для For мицелиальных грибов селективные маркеры включают в себя amdS, pyrG, argB, niaD и sC.
Клетка-хозяин, в которую вводят вектор, содержащий нуклеиновую кислоту, кодирующую сконструированную ТГазу, может представлять собой любую клетку, которая способна производить сконструированную ТГазу и включает в себя клетки бактерий, дрожжей, грибов и высших эукариот. Трансформированную или трансфектированную клетку-хозяина, описанную выше, затем культивируют в подходящей питательной среде при условиях, обеспечивающих возможность экспрессии пептида согласно настоящему изобретению, после чего полученный белок выделяют из культуры. Согласно некоторым вариантам осуществления клетка-хозяин представляет собой прокариотическую клетку. Согласно некоторым вариантам осуществления клетка-хозяин представляет собой S. ladakanum. Согласно некоторым вариантам осуществления клетка-хозяин представляет собой S. mobaraensis. Согласно некоторым вариантам осуществления клетка-хозяин представляет собой Е. coli.
В настоящем документе дополнительно предусмотрены способы получения сконструированных ТГаз, описанных в настоящем документе. Сконструированные ТГазы, описанные в настоящем документе, можно получить различными путями. Например, согласно некоторым вариантам осуществления сконструированную ТГазу получают путем культивирования клетки-хозяина, содержащей вектор, содержащий нуклеиновую кислоту, кодирующую сконструированную ТГазу, и выделения сконструированной ТГазу из клеток.
Для направления белка согласно настоящему изобретению в секреторный путь клеток-хозяев секреторная сигнальная последовательность (также известная как лидерная последовательность, препро-последовательность или пре-последовательность) может быть предусмотрена в рекомбинантном векторе. Секреторную сигнальную последовательность соединяют с последовательностью ДНК, кодирующей белок в правильной рамке считывания. Секреторные сигнальные последовательности, как правило, расположены 5' по отношению к последовательности ДНК, кодирующей белок. Секреторная сигнальная последовательность может представлять собой последовательность, в норме ассоциированную с белком, или может происходить из гена, кодирующего другой секретируемый белок. Альтернативно, белок можно экспрессировать во включении и впоследствии получать его посредством денатурации/ренатурации.
Среда, используемая для культивирования клеток, может представлять собой любую общепринятую среду, подходящую для выращивания клеток-хозяев, такую как минимальные или сложные среды, содержащие соответствующие добавки. Белок, произведенный клетками, затем можно выделить из среды для культивирования с помощью общепринятых процедур, включая в себя отделение клеток-хозяев от среды с помощью центрифугирования или фильтрации, осаждения белковых компонентов супернатанта или фильтрата посредством соли, например, сульфата аммония, очистки с помощью разнообразных хроматографических процедур, например, ионообменной хроматографии, гель-фильтрации, аффинной хроматографии или подобного, в зависимости от типа заданного белка.
Согласно некоторым вариантам осуществления предусмотрены способы очистки ТГазы, такой как любой из ТГаз, описанных в настоящем документе. Согласно некоторым вариантам осуществления способ предусматривает (a) предоставление клетки-хозяина, которая экспрессирует ТГазу; (b) культивирование указанной клетки-хозяина (такой как прокариотическая клетка), при этом ТГаза экспрессируется в виде включения; (c) разрушение указанной клетки-хозяина для получения клеточного лизата, характеризующегося растворимой фракцией и нерастворимой фракцией; и (d) отделение указанной растворимой фракции от указанной нерастворимой фракции, причем указанная нерастворимая фракция содержит ТГазу. Согласно некоторым вариантам осуществления способ дополнительно предусматривает приведение в контакт нерастворимой фракции, содержащей ТГазу, с денатурирующим средством (таким как мочевина). Согласно некоторым вариантам осуществления способ дополнительно предусматривает содержание денатурированной ТГазы в буфере для ренатурации (таком как буфер, содержащий DTT). Согласно некоторым вариантам осуществления способ дополнительно предусматривает очистку ТГазы с помощью хроматографии (такой как аффинная хроматография или ионообменная хроматография). Согласно некоторым вариантам осуществления ТГазу метят (например, с помощью как гистидиновой метки) для облегчения очистки.
Согласно некоторым вариантам осуществления предусмотрен способ очистки ТГазы, предусматривающий (а) культивирование клетки-хозяина (такой как прокариотическая клетка), содержащей вектор, содержащий нуклеиновую кислоту, кодирующую про-фермент ТГазы, и (b) получение зрелой ТГазы путем расщепления про-последовательности про-фермента (например, с помощью легкой цепи эндокиназы).
Описанные в настоящем документе мутантные ТГазы можно использовать для получения Fc-содержащих полипептидных конъюгатов (таких как конъюгаты антитела и лекарственного средства). Например, согласно некоторым вариантам осуществления предусмотрен способ получения конъюгата антитела и лекарственного средства, содержащего антитело, специфически конъюгированное с конъюгируемым фрагментом, предусматривающий следующее: приведение в контакт антитела с конъюгируемым фрагментом в присутствии мутантной трансглутаминазы (такой как любая из мутантной трансглутаминазы, описанной в настоящем документе) при условии, которое является достаточным для создания конъюгата антитела и лекарственного средства, причем конъюгируемый фрагмент является конъюгированным с акцепторным остатком глутамина на антителе. Согласно некоторым вариантам осуществления предусмотрен способ получения конъюгата антитела и лекарственного средства, содержащего антитело, специфически конъюгированное с конъюгируемым фрагментом, предусматривающий следующее: приведение в контакт антитела с конъюгируемым фрагментом в присутствии мутантной трансглутаминазы (такой как любая из мутантной трансглутаминазы, описанной в настоящем документе) при условии, которое является достаточным для создания конъюгата антитела и лекарственного средства, причем антитело является гликозилированным (например, N-гликозилированным) в Fc-области, и при этом конъюгируемый фрагмент является конъюгированным с эндогенным акцепторным остатком глутамина на антителе. Согласно некоторым вариантам осуществления предусмотрен способ получения конъюгата антитела и лекарственного средства, содержащего антитело, специфически конъюгированное с конъюгируемым фрагментом, предусматривающий следующее: приведение в контакт композиции, содержащей антитело, с конъюгируемым фрагментом в присутствии мутантной трансглутаминазы (такой как любая из мутантной трансглутаминазы, описанной в настоящем документе) при условии, которое является достаточным для создания Fc-содержащего полипептидного конъюгата, причем по меньшей мере некоторое количество (например, 50%, 60%, 70%, 80%, 90% или больше) антитела в композиции является гликозилированным (например, N-гликозилированным) в Fc-области, и при этом конъюгируемый фрагмент является конъюгированным с эндогенным акцепторным остатком глутамина на антителе.
Согласно некоторым вариантам осуществления предусмотрен способ получения конъюгата антитела и лекарственного средства, содержащего антитело, специфически конъюгированное с конъюгируемым фрагментом, содержащим низкомолекулярный стебель и активный фрагмент, предусматривающий следующее: a) приведение в контакт антитела с низкомолекулярным стеблем в присутствии трансглутаминазы (такой как любая из мутантной трансглутаминазы, описанной в настоящем документе) при условии, которое является достаточным для создания промежуточного конъюгата, содержащего антитело, специфически конъюгированное с низкомолекулярным стеблем, и b) приведение в контакт промежуточного конъюгата с активным фрагментом, тем самым получая конъюгат антитела и лекарственного средства, причем конъюгируемый фрагмент является конъюгированным с акцепторным остатком глутамина на антителе. Согласно некоторым вариантам осуществления предусмотрен способ получения конъюгата антитела и лекарственного средства, содержащего антитело, специфически конъюгированное с конъюгируемым фрагментом, содержащим низкомолекулярный стебель и активный фрагмент, предусматривающий следующее: a) приведение в контакт антитела с низкомолекулярным стеблем в присутствии трансглутаминазы (такой как любая из мутантной трансглутаминазы, описанной в настоящем документе) при условии, которое является достаточным для создания промежуточного конъюгата, содержащего антитело, специфически конъюгированное с низкомолекулярным стеблем, и b) приведение в контакт промежуточного конъюгата с активным фрагментом, тем самым получая конъюгат антитела и лекарственного средства, причем антитело является гликозилированным (например, N-гликозилированным) в Fc-области, и при этом конъюгируемый фрагмент является конъюгированным с эндогенным акцепторным остатком глутамина на антителе. Согласно некоторым вариантам осуществления предусмотрен способ получения конъюгата антитела и лекарственного средства, содержащего антитело, специфически конъюгированное с конъюгируемым фрагментом, содержащим низкомолекулярный стебель и активный фрагмент, предусматривающий следующее: a) приведение в контакт композиции, содержащей антитело, с низкомолекулярным стеблем в присутствии трансглутаминазы (такой как любая из мутантной трансглутаминазы, описанной в настоящем документе) при условии, которое является достаточным для создания промежуточного конъюгата, содержащего антитело, специфически конъюгированное с низкомолекулярным стеблем, и b) приведение в контакт промежуточного конъюгата с активным фрагментом, тем самым получая конъюгат антитела и лекарственного средства, причем по меньшей мере некоторое количество (например, 50%, 60%, 70%, 80%, 90% или больше) антитела в композиции является гликозилированным (например, N-гликозилированным) в Fc-области, и при этом конъюгируемый фрагмент является конъюгированным с эндогенным акцепторным остатком глутамина на антителе.
Фармацевтические композиции, унифицированные дозы и наборы Кроме того, предусмотрены фармацевтические композиции, содержащие Fc-содержащие полипептидные конъюгаты (такие как конъюгаты антитела и лекарственного средства), описанные в настоящем документе. Согласно некоторым вариантам осуществления фармацевтическая композиция дополнительно содержит фармацевтически приемлемый носитель. Согласно некоторым вариантам осуществления по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно любое значение из 60%, 70%, 80%, 90%, 95% или 99%) Fc-содержащих полипептидных конъюгатов (таких как конъюгаты антитела и лекарственного средства) в фармацевтической композиции содержат один конъюгируемый фрагмент, прикрепленный к Fc-содержащему полипептиду (такому как антитело). Согласно некоторым вариантам осуществления по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно любое значение из 60%, 70%, 80%, 90%, 95% или 99%) Fc-содержащих полипептидных конъюгатов (таких как конъюгаты антитела и лекарственного средства) в фармацевтической композиции содержат два конъюгируемых фрагмента, прикрепленных к Fc-содержащему полипептиду (такому как антитело). Согласно некоторым вариантам осуществления по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно любое значение из 60%, 70%, 80%, 90%, 95% или 99%) Fc-содержащих полипептидных конъюгатов (таких как конъюгат антитела и лекарственного средства) в фармацевтической композиции содержат или один, или два конъюгируемых фрагмента, прикрепленных к Fc-содержащему полипептиду (такому как антитело).
Используемый в настоящем документе термин "фармацевтически приемлемый носитель" описывает любой ингредиент, отличный от соединения(й) согласно настоящему изобретению. Выбор вспомогательного(ых) вещества(веществ) в большой степени зависит от таких факторов, как конкретный способ введения, эффект вспомогательного вещества на растворимость и стабильность и природа лекарственной формы. Используемый в настоящем документе термин "фармацевтически приемлемый носитель" включает в себя любой или все растворители, дисперсионные среды, оболочки, антибактериальные и противогрибковые средства, изотонические и замедляющие абсорбцию средства и подобное, которые являются физиологически совместимыми. Некоторые примеры фармацевтически приемлемых вспомогательных веществ представляют собой воду, физиологический раствор, физиологический раствор с фосфатным буфером, декстрозу, глицирол, этанол и подобное, а также их комбинации. Согласно некоторым вариантам осуществления изотонические средства, включая в себя без ограничения сахара, многоатомные спирты (например, маннит, сорбит) или хлорид натрия, включены в фармацевтическую композицию. Дополнительные примеры фармацевтически приемлемых веществ включают в себя без ограничения смачивающие средства или минорные количества дополнительных веществ, таких как смачивающие или эмульгирующие средства, консерванты или буферы, которые увеличивают срок хранения или усиливают эффективность антитела.
Согласно некоторым вариантам осуществления Fc-содержащие полипептидные конъюгаты (такие как конъюгаты антитела и лекарственного средства), описанные в настоящем документе, можно деиммунизировать для снижения иммуногенности при введении субъекту с использованием известных техник, таких как техники, описанные, например, в международных патентных публикациях согласно РСТ №№ WO 98/52976 и WO 00/34317.
Описанные в настоящем документе фармацевтические композиции можно получить, упаковать или продавать не расфасованными, в виде единичной унифицированной дозы или в виде множества единичных унифицированных доз. Используемый в настоящем документе термин "унифицированная доза" представляет собой дискретное количество фармацевтической композиции, содержащей заданное количество активного ингредиента. Количество активного ингредиента, как правило, равно дозировке активного ингредиента, которая подлежит введению субъекту, или подходящей части такой дозировке, такой как, например, половина или одна третья такой дозировки. Любой способ введения пептидов, белков или антител, принятый в настоящей области техники, можно соответствующим образом использовать для Fc-содержащих полипептидных конъюгатов, раскрытых в настоящем документе.
Описанные в настоящем документе фармацевтические композиции согласно некоторым вариантам осуществления являются подходящими для парентерального введения. Парентеральное введение фармацевтической композиции включает в себя любой путь введения, характеризующийся физическим нарушением целостности ткани субъекта и введением фармацевтической композиции через отверстие в ткани, таким образом, как правило, приводя в результате к прямому введению в кровоток, в мышцу или во внутренний орган. Например, парентеральное введение включает в себя без ограничения введение фармацевтической композиции с помощью инъекции композиции, путем нанесения композиции через хирургический разрез, путем нанесения композиции через проникающую в ткани нехирургическую рану и подобное. В частности, предусмотрено, что парентеральное введение включает в себя без ограничения подкожные, интраперитонеальные, внутримышечные, интрастернальные, внутривенные, интраартериальные, интратекальные, интравентрикулярные, интрауретральные, интракраниальные, интрасиновиальные инъекции или инфузии; и техники инфузии для проведения почечного диализа. Согласно некоторым вариантам осуществления парентеральное введение представляет собой внутривенный или подкожный путь.
Составы фармацевтической композиции, подходящие для парентерального введения, можно получить, упаковать или продавать в форме, подходящей для болюсного введения или для непрерывного введения. Инъекционные составы можно получить, упаковать или продавать в унифицированной лекарственной форме, например, в ампулах или в многодозовых контейнерах, содержащих консервант. Составы для парентерального введения включают в себя без ограничения суспензии, растворы, эмульсии в масле или водных носителях, пасты и подобное. Такие составы могут дополнительно содержать один или несколько дополнительных ингредиентов, включая в себя без ограничения суспендирующие, стабилизирующие или диспергирующие средства. Согласно одному варианту осуществления состава для парентерального введения активный ингредиент предусмотрен в сухой (т.е. порошкообразной или гранулированной) форме для разведения с помощью подходящего носителя (например, стерильной апирогенной воды) перед парентеральным введением разведенной композиции. Парентеральные составы также включают в себя водные растворы, которые могут содержать вспомогательные вещества, такие как соли, углеводы и буферные средства (предпочтительно до значения pH, составляющего 3-9), но для некоторых применений они могут быть более надлежащим образом составлены в виде стерильного неводного раствора или в виде высушенной формы, подлежащей применению вместе с таким подходящим носителем, как стерильная, апирогенная вода. Иллюстративные формы для парентерального введения включают в себя растворы или суспензии в стерильных водных растворах, например, водных растворах пропиленгликоля или декстрозы. Такие лекарственные формы можно надлежащим образом забуферить при необходимости. Другие вводимые парентерально составы, которые являются применимыми, включают в себя составы, которые содержат активный ингредиент в микрокристаллической форме или в липосомном препарате. Составы для парентерального введения могут быть составлены для немедленного и/или предусмотренного высвобождения. Составы предусмотренного высвобождения включают в себя составы контролируемого, отсроченного, замедленного, импульсного, нацеленного и программируемого высвобождения. Например, согласно одному аспекту стерильные инъекционные растворы можно получить путем введения Fc-содержащего полипептидного конъюгата, например, конъюгата антитела и лекарственного средства или конъюгата биспецифического антитела и лекарственного средства, в требуемом количестве в соответствующий растворитель с одним или комбинацией ингредиентов, перечисленных выше, при необходимости, с последующей фильтрационной стерилизацией. Как правило, дисперсии получают путем введения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и другие требуемые ингредиенты из перечисленных выше. В случае стерильных порошков для получения стерильных инъекционных растворов иллюстративные способы получения представляют собой вакуумную сушку и лиофильную сушку, которая дает в результате порошок активного ингредиента вместе с любым дополнительным требуемым ингредиентом из его полученного ранее стерильного отфильтрованного раствора. Правильную текучесть раствора можно поддержать, например, путем использования такой оболочки, как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем использования поверхностно-активных веществ. Пролонгированную абсорбцию инъекционных композиций можно осуществить путем включения в композицию средства, которое замедляет абсорбцию, например, солей моностеарата и желатина.
Иллюстративная, неограничивающая фармацевтическая композиция Fc-содержащего полипептидного конъюгата (такого как конъюгат антитела и лекарственного средства) представляет собой состав в виде стерильного водного раствора, характеризующегося pH, который находится в диапазоне, составляющем приблизительно 5,0 - приблизительно 6,5, и содержащего приблизительно 1 мг/мл - приблизительно 200 мг/мл сконструированного полипептидного конъюгата, раскрытого в настоящем документе, приблизительно 1 млмоль - приблизительно 100 млмоль гистидинового буфера, приблизительно 0,01 мг/мл - приблизительно 10 мг/мл полисорбата 80, приблизительно 100 млмоль - приблизительно 400 млмоль трегалозы и приблизительно 0,01 млмоль - приблизительно 1,0 млмоль дегидрата EDTA динатрия.
Схемы дозировки можно отрегулировать для обеспечения оптимального требуемого ответа. Например, можно ввести однократный болюс, несколько разделенных доз можно ввести в течение определенного промежутка времени или дозу можно пропорционально уменьшить или увеличить сообразно потребностям терапевтической ситуации. Особенно предпочтительно составлять парентеральные композиции в форме дозированной единицы для простоты введения и однородности дозировки. Используемая в настоящем документе форма дозированной единицы относится к физически дискретным единицам, подходящим в качестве единичных дозировок для подлежащего лечению пациента/субъекта; причем каждая единица содержит заданного количество активного соединения, рассчитанного так, чтобы производить требуемый терапевтический эффект в ассоциации с требуемым фармацевтическим носителем. Определение форм дозированных единиц согласно настоящему изобретению, как правило, продиктовано и напрямую зависит от (a) уникальных характеристик фрагмента-средства (например, низкомолекулярных соединений, таких как цитотоксическое средство) и конкретного терапевтического или профилактического эффекта, который необходимо достичь, и (b) ограничений, свойственных настоящей области техники получения такого активного соединения для лечения чувствительности у индивидуумов.
Специалисту в настоящей области техники понятно, что на основании раскрытия, представленного в настоящем документе, дозу и схему дозировки регулируют в соответствии со способами, хорошо известными в терапевтической области техники. Иными словами, можно легко установить максимальную переносимую дозу и эффективное количество, обеспечивающее обнаруживаемый терапевтический результат для пациента, можно легко определить, как и требования в отношении времени введения каждого средства для обеспечения обнаруживаемого терапевтического результата для пациента. Соответственно, несмотря на то, что в настоящем документе проиллюстрирована определенная доза и схемы введения, указанные примеры ни в коей мере не ограничивают дозу и схему введения, которые могут предоставить пациенту в применении на практике настоящего изобретения.
Следует отметить, что величины дозировок могут варьировать в зависимости от типа и тяжести состояния, подлежащего облегчению, и могут включать в себя однократные или многократные дозы. Кроме того, следует понимать, что для любого конкретного субъекта конкретные схемы дозировки следует регулировать с течением времени сообразно потребностям индивидуума и профессиональному решению лица, вводящего или контролирующего введение композиций, и что диапазоны дозировок, приведенные в настоящем документе, являются исключительно иллюстративными, и не предусмотрено, что они ограничивают объем или осуществление на практике заявленной композиции. Кроме того, схема дозирования композиций согласно настоящему изобретению может быть основана на разнообразных факторах, включая в себя тип заболевания, возраст, массу тела, пол, медицинское состояние пациента, тяжесть состояния, путь введения и конкретное используемое антитело. Таким образом, схема дозировки может варьировать в широком диапазоне, но ее можно определить рутинно с использованием стандартных способов. Например, дозы можно регулировать на основании фармакокинетических или фармакодинамических параметров, которые могут включать в себя такие клинические эффекты, как токсические эффекты и/или лабораторные значения. Таким образом, согласно настоящему изобретению предусмотрено повышение дозы для одного пациента, что определяет специалист в настоящей области техники. Определение соответствующих дозировок и схем хорошо известно в соответствующей области техники, и следует понимать, что это сможет осуществить специалист в настоящей области техники на основании идей, раскрытых в настоящем документе.
Согласно настоящему изобретению также предусмотрены наборы (или готовые изделия) для применения в лечении описанных выше нарушений. Наборы согласно настоящему изобретению включают в себя один или несколько контейнеров, содержащих Fc-содержащий полипептидный конъюгат (такой как конъюгат антитела и лекарственного средства) для лечения заболевания. Например, инструкции содержат описание введения сконструированного Fc-содержащего полипептидного конъюгата (такого как конъюгат антитела и лекарственного средства) для лечения такого заболевания, как злокачественная опухоль (например, злокачественная опухоль поджелудочной железы, яичника, толстой кишки, молочной железы, предстательной железы или легкого). Набор может дополнительно содержать описание выбора индивидуума, подходящего для лечения, на основании идентификации того, характеризуется ли индивидуум наличием заболевания и стадии заболевания. Инструкции, относящиеся к применению сконструированного Fc-содержащего полипептидного конъюгата (такого как конъюгат антитела и лекарственного средства), как правило, включают в себя информацию в отношении дозировки, схемы дозировки и пути введения для назначенного лечения. Контейнеры могут представлять собой унифицированные дозы, многодозовые упаковки или субунифицированные дозы. Инструкции, сопровождающие наборы согласно настоящему изобретению, представляют собой как правило письменные инструкции на этикетке или листке-вкладыше (например, лист бумаги, вложенный в набор), но также приемлемы машиночитаемые инструкции (например, инструкции на магнитном или оптическом дисковом запоминающем устройстве). Наборы согласно настоящему изобретению находятся в подходящей упаковке. Подходящая упаковка включает в себя без ограничения флаконы, колбы, сосуды, гибкую упаковку (например, запаянные майларовые или пластиковые пакеты) и подобное. Кроме того, предусмотрены упаковки для применения в комбинации с конкретным устройством, таким как ингалятор, устройство для назального введения (например, аэрозольный ингалятор) или устройство для инфузии, такое как мининасос. Набор может содержать стерильный порт доступа (например, контейнер может представлять собой пакет с раствором для внутривенного введения или флакон, содержащий крышку, поддающуюся прокалыванию иглой для подкожной инъекции). Контейнер также может содержать стерильный порт доступа (например, контейнер может представлять собой пакет с раствором для внутривенного введения или флакон, содержащий крышку, поддающуюся прокалыванию иглой для подкожной инъекции). По меньшей мере одно активное средство в композиции представляет собой сконструированный полипептид согласно приведенному в настоящем документе описанию. Контейнер может дополнительно содержать второе фармацевтически активное средство. Наборы могут необязательно содержать дополнительные компоненты, такие как буферы и информацию по интерпретации. Как правило, набор содержит контейнер и этикетку или листок-вкладыш(листки-вкладыши) на или прикрепленный к контейнеру.
Согласно некоторым вариантам осуществления предусмотрен набор, содержащий ТГазу (такую как сконструированная ТГаза, такая как любая из сконструированной ТГазы, описанной в настоящем документе). Согласно некоторым вариантам осуществления набор дополнительно содержит другие реагенты для проведения реакции трансглутаминирования. Согласно некоторым вариантам осуществления набор дополнительно содержит инструкции по проведению любого из описанных в настоящем документе способов конъюгации. Согласно некоторым вариантам осуществления набор дополнительно содержит твердую подложку для иммобилизации ТГазы (такой как сконструированная ТГаза) или Fc-содержащего полипептида (такого как антитело). Согласно некоторым вариантам осуществления ТГаза (такая как сконструированная ТГаза) в наборе иммобилизирована на твердой подложке.
ПРИМЕРЫ
Настоящее изобретение можно лучше понять посредством ссылки на последующие примеры, которые предусмотрены для иллюстрации и не предусмотрены стать ограничивающими.
Пример 1. Получение мутантов ТГазы
В настоящем примере описано получение мутантов ТГазы. Со ссылкой на фигуру 3 три области, которые расположены вблизи доступа к активному сайту, удаляли или мутировали для увеличения кармана связывания с субстратом. TG_SL дикого типа клонировали в вектор рЕТ39+ с использованием NdeI и XhoI с дополнительным пролином (SEQ ID NO: 17). Следующих делеционных мутантов получали на основании докинга IgG1 и TG_SM: мутант 1: делеция из Р1-Е5; мутант 2: делеция из Р245-Р248; мутант 3: делеция из N283-L286; мутант 4: делеций Р1-Е5 и N283-L286; мутант 5: делеция всех трех областей, определенных мутантами 1, 2 и 3; мутант 6: делеция Р1-Е5 и замещение Н280-А288 на G; мутант 7: делеция Р1-Е5 и замещение А281-Н290 на G. Область делеций выделена серым, подчеркнута или зачеркнута, как показано на фигуре 3. Указанные мутанты являются более активными по отношению к IgG1.
С использованием ДНК, очищенной из S. ladakanum (АТСС27441) в качестве матрицы ПЦР, последовательности ДНК, кодирующие про- или зрелую мТГазу дикого типа (TG_SL дикого типа) и ее мутантов 1-3 (см. выше) клонировали в вектор pET39b на сайтах NdeI и BamHI. Включения зрелой TG_SL дикого типа и мутантов 1-3 получали из клеток Е. coli BL21 (DE3), трансформированных соответствующими векторами. После солюбилизации в 8 М мочевине TG_SL дикого типа и мутанты подвергали рефолдингу путем разбавления в буфере для ренатурации (1 мМ DTT, 50 мМ Tris, pH 8,0). Ферменты дополнительно очищали с помощью Ni-NTA и катионообменных колонок. Альтернативно, про-мТГазу экспрессировали в виде растворимого неактивного профермента в Е. coli. Затем активный фермент получали после расщепления про-домена с помощью легкой цепи эндокиназы (EKL).
Пример 2. Конъюгация IgG1 с монодансилкадаверином (MDC), катализируемая мТГазой
MDC выбрали для настоящего эксперимента, поскольку он содержит первичный амин и его флуоресценцию можно легко подвергнуть мониторингу. MDC использовали в настоящем эксперименте для демонстрации его конъюгации с mAB. К очищенному IgG1 (1-10 мг/мл) в Tris-буфере (pH 6,5-8,5) добавляли MDC (Sigma-Aldrich) в DMSO до конечных концентраций 1-5 мМ (конечная концентрация DMSO 2-10%). Добавляли очищенную TG_SL дикого типа или ее мутант до конечной концентрации, составляющей 0,05-1,0 мг/мл. Инкубировали реакционные смеси при 37°С. После реакции проводили ВЭЖХ с использованием фенильной колонки с гидрофобным взаимодействием (PHIC, Tosoh Bioscience LLC). В начале реакции в продукте преобладал DAR1, где только одна тяжелая цепь IgG1 была соединена с MDC. С течением реакции DAR 2, где обе тяжелых цепи IgG1 соединялись с MDC, становился основным продуктом. Ближе к концу реакции (8 часов при концентрации, составляющей 0,2 мг/мл мТГазы при pH 7), выход конъюгации достигал 80% для DAR2 с оставшимися 20% DAR1 или 90% для тяжелой цепи (НС), когда образец восстанавливали с помощью 10 мМ ТСЕР и анализировали на колонке С4-1000А (Vydac) (см. фигуру 6). Селективную конъюгацию MDC с НС визуализировали на SDS PAGE (фигура 7). Кроме того, анализировали другие мТГазы, такие как TG_SM из S. mobaraensis (очищенную из Ajinomoto Activa TI). Мутанты являлись более активными, чем ТГаза дикого типа по отношению к IgG1, хотя ТГаза дикого типа также могла катализировать реакцию ADC в высокой концентрации (>0,1 мг/мл). Кроме того, было обнаружено, что TG_SM (продаваема Ajinomoto и используемая Pfizer и Innate Pharma) также работает в высокой концентрации, но характеризовалась только приблизительно 30% активностью по сравнению с TG_SL.
Пример 3. Пегилирование IgG1 с помощью 1 кДа mPEG-NH2 посредством катализа мТГазой
Настоящий эксперимент проводили в основном согласно представленному в примере 2 описанию. Ацил-акцепторный MDC замещали с помощью 1 кДа метокси-PEG-амина (JenKem, США) в pH 7,0 до конечной концентрации, составляющей 1-2 мМ, получали пегилированный IgG1. Анализ образцов реакции в течение ночи при 37°С на колонке С4 после восстановления с помощью ТСЕР показал 90% модификацию тяжелых цепей.
Пример 4. Конъюгация IgG1 с монодансил кадаверином (MDC), катализируемая с помощью иммобилизованной мТГазы
Для упрощения удаления ТГазы и обеспечения повторного использования фермента в катализе использовали иммобилизованную мТГазу. При приготовлении колонки иммобилизованной мТГазы 1 мл 15 мг/мл мТГазы в карбонатном буфере (pH 8,3) использовали для каждой активированной NHS колонки HITRAP® HP 1,0 мл (GE) согласно протоколу производителя. 0,5 мл очищенного IgG1 в концентрации 1-10 мг/мл в Tris-буфере (pH 6-8,0) с 1-5 мМ MDC вводили на колонку HITRAP®-мТГазы. Колонку запаивали с обоих концов и инкубировали при 37°С в течение ночи. На следующий день реакционную смесь элюировали с помощью Tris-буфера. Колонку восстанавливали с помощью 1-20 мМ ТСЕР для следующей реакции конъюгации. Не наблюдали потерю активности иммобилизованной мТГазы после каждого применения. Выход, составляющий 90% НС, достигали при каждом анализе, сходный с выходом, полученным со свободной мТГазой.
Пример 5. Конъюгация IgG1, 2 и 4 с цитотоксинами, катализируемая с помощью мТГазы
Токсины с аминным линкером можно конъюгировать с IgG1 в одностадийном протоколе точно так же, как MDC (фигура 4). Хотя линкер является простым -(СН2)n-NH2 (где n≥4 как в боковой цепи лизина), использование каркаса этиленгликоля могло увеличить растворимость комплекса линкер-лекарственное средство и облегчить реакции конъюгации. Указанный пример демонстрирует конъюгацию MAY-PEG4 (нерасщепляемый линкер, фигура 8) и MAY-PVCL (расщепляемый линкер, фигура 9) с IgG1.
Производное майтансина, содержащее удлиненный, нерасщепляемый неразветвленный PEG-линкер с группой первичного амина, с молекулярной массой, составляющей 896,42 Да, изображено на фигуре 8. MAY-PEG4 в DMSO добавляли к IgG1 (1-10 мг/мл в pH 8,0 Tris-буфере) до конечной концентрации, составляющей 1-2 мМ. мТГазу добавляли до конечной концентрации, составляющей 0,2-1,0 мг/мл и реакции инкубировали при 37°С. Реакцию подвергали мониторингу с помощью анализа ВЭЖХ, как описано в примере 2. По прошествии ночи получали выход, составляющий 60% модифицированных тяжелых цепей. Наблюдали оба продукта DAR 1 и DAR 2 (фигура 10).
Производное майтансина, содержащее расщепляемый линкер с саморасщепляющимся спейсером и концевым лизином, с молекулярной массой, составляющей 1224,58 Да, показано на фигуре 9. Реакцию конъюгацию проводили таким же путем, как приведено выше, заменяя MAY-PEG4 на MAY-PVCL (1,0 мг/мл). После инкубации при 37°С в течение 8 часов модифицировали 40% тяжелой цепи (фигура 11). Низкий выход обусловлен низкой растворимостью лекарственного средства.
Пример 6. Определение отношения лекарственного средства к антителу (DAR) и картирование сайта конъюгации на IgG1
Вследствие гетерогенности гликановых цепей IgG1 будет проявлять множественные пики на своих масс-спектрах. Для упрощения масс-спектрометрического анализа все конъюгаты mAB дегликозилировали перед масс-спектрометрическим анализом с использованием PNGaseF (Promega, Мадисон, Висконсин, поэтому отдельный пик можно было наблюдать для каждой частицы с одинаковым зарядом. Таким образом, исходный связанный с гликаном аспарагин (N) изменился на аспартат (D).
Подтверждение массы DAR1 и DAR2. Предполагаемые DAR 1 и DAR 2 IgG1-MAY-PEG4 из примера 5 очищали на фенильной колонке HIC. После дегликозилирования образцы наносили пятнами на 196-луночный стальной планшет и анализировали на MALDI-TOF (ABI 4700, Applied Biosystems, Редвуд-Сити, Калифорния). В качестве контроля использовали свободный IgG1 (DAR0). Масс-спектры получали в линейном режиме положительной масс-спектрометрии высокого разрешения и многочисленные заряженные частицы (двойные и тройные) использовали для расчета молекулярной массы. MAY-PEG4-лекарственное средство характеризовался молекулярной массой, составляющей 896 Да. Следовательно, конъюгация одной молекулы MAY-PEG4 с IgG1 (DAR1) будет давать в результате предполагаемую разницу масс, составляющую 879 Да (896 - 17 потери NH3=879 Да), тогда как конъюгация двух молекул с IgG1 (DAR2) будет давать в результате предполагаемую разницу масс, составляющую 1758 Да. Спектры MALDI-TOF на фигуре 10 подтверждали DAR1 и DAR2.
Подтверждение конъюгации только на тяжелой цепи. Для подтверждения того, что молекула лекарственного средства являлась конъюгированной с тяжелой цепью IgG1 (НС), но не с легкой цепью (LC), очищенный DAR2 IgG1-MAY-PVCL из примера 5 дегликозилировали и восстанавливали с помощью 20 мМ DTT в течение 30 мин при 37°С. Масс-спектры получали в линейном режиме положительной масс-спектрометрии высокого разрешения с использованием ABI4700. MAY-PVCL-лекарственное средство характеризовался молекулярной массой, составляющей 1224 Да. Следовательно, конъюгация одной молекулы MAY-PVCL с тяжелой цепью будет давать в результате предполагаемую разницу масс, составляющую 1207 Да (1224-17=1207 Да) и отсутствие разницы в молекулярной массе легких цепей (фигура 11). С другой стороны DAR1 характеризуется пиками как свободной НС, так и HC-MAY-PVCL на своем масс-спектре, указывая на то, что DAR1 содержит только одну конъюгированную НС.
Пептидное картирование для верификации сайт-специфической конъюгации на Q295. Очищенный DAR2 из примера 2 (обе тяжелых цепи IgG1, содержащих MDC) и свободный IgG1 дегликозилировали, восстанавливали, алкилировали, обрабатывали до пептидов с использованием трипсина и/или химотрипсина (Promega, Мадисон, Висконсин) и разделяли с помощью обратно-фазовой хроматографии (С 18) перед масс-спектрометрическим анализом. Обработанные пептиды подвергали мониторингу на ВЭЖХ с помощью поглощения УФ при 328 нм (kmax MDC). Только один пик при 328 нм идентифицировали в образцах DAR2, тогда как ни одного пика не обнаружили в контрольном антителе. Анализ MALDI-TOF идентифицировал, что пик в виде отдельного заряженного пептида EEQYDSTYR из обработки трипсином или NAKTKPREEY из обработки химотрипсином, содержащие глутамин 298 (Q298 в последовательности и представляет собой Q295 по системе нумерации Kabat) точно с одним MDC (1508,7 (наблюдаемая) - 1190,5 (пептид) + 335 MDC - 17 NH3 = 318 Да; 1681,9 (наблюдаемая) - 1363,6 (пептид) = 318) (серые ряды в таблице 1). Для исключения других глутаминов (отличных от Q298) в качестве дополнительных сайтов конъюгации эксперименты по полному пептидному картированию проводили с использованием немодифицированного IgG1 и конъюгата IgG1-MDC. Обработанные образцы напрямую анализировали без очистки для идентификации всех глутамин-содержащих пептидов на тяжелой цепи. Из всех 16 глутаминов Q298 являлся единственным сайтом конъюгации с прикрепленным MDC (таблица 1), тогда как все другие глутамин-содержащие пептиды остались неизменными.

Для подтверждения Q298 в качестве специфического сайта конъюгации на IgG1 при использовании настоящих цитотоксинов конъюгаты IgG1 MAY-PEG4 и ТАМ1 (производное тубулизина А с аминным линкером) дегликозилировали, восстанавливали, алкилировали, обрабатывали до пептидов с использованием трипсина и разделяли с помощью обратно-фазовой хроматографии перед масс-спектрометрическим анализом. Тот же пептид EEQYNSTYR, содержащий Q298, идентифицировали как в IgG1-ТАМ1, так и IgG1-MAY-PEG4 конъюгатах с массой, соответствующей одной прикрепленной молекуле лекарственного средства: 2134,0 (1190,5+960,5-17) и 2069,8 (1190,5+895,5-17), соответственно (таблица 2).


Пример 7. Конъюгация подклассов IgG, катализируемая мТГазой
Очищенный IgG 2 или IgG 4 человека в концентрации, составляющей 1-10 мг/мл в Tris-буфере (pH 7,0-8,0) приводили в реакцию с 2-5 мМ MDC после добавления 0,1-1 мг/мл очищенной мТГазы. Смесь инкубировали при 37°С в течение 8-16 часов и затем анализировали на фенильной колонки с гидрофобным взаимодействием или восстанавливали с помощью 10 мМ ТСЕР на колонке С4. Аналогично IgG1, IgG2 и IgG4 конъюгировали с MDC, чтобы показать накопление DAR1 и DAR2 с течением времени (фигура 6).
Пример 8. Двухстадийный протокол получения конъюгатов антитела и лекарственного средства с использованием мТГазы
Наряду с тем, что одностадийная реакция конъюгации является простой и не вызывающей затруднений, на ее выход оказывает влияние растворимость лекарственного средства. Если концентрация лекарственного средства является низкой, может быть значительным побочный продукт деамидирования. Для подавления деамидирования амин-содержащий химический стебель с высокой растворимостью использовали в избытке (молярное отношение химического соединения к mAB>10) на первой стадии конъюгации, катализируемой мТГазой. Затем молекулы лекарственного средства поперечно сшивали с mAB на второй стадии посредством реакций хемоселективного лигирования (фигура 5). Можно использовать многие хемоселективные пары:
Амино-окси-/альдегид или кетон
Сульфгидрил/малеимид
Азид/алкин
Конъюгация IgG1 с PEG с помощью мТГазы через аминопропилацеталь. К 1-10 мг/мл IgG1 в pH 7,0-8,0 Tris-буфере добавляли 3-аминопропиональдегиддиэтилацеталь (№ по кат. CAS 41365-75-7) до конечной концентрации, составляющей 2-50 мМ и мТГазу до концентрации, составляющей 0,05-0,5 мг/мл. Реакционную смесь инкубировали при 37°С в течение 2-16 часов до достижения завершения реакции. После диафильтрации для удаления избытка ацеталя доводили pH до 2-4 в течение 2-10 часов при комнатной температуре с помощью муравьиной кислоты или HCl для регенерации альдегидной группы. Доводили pH IgG1-альдегида с помощью карбоната натрия обратно до 5-8. Добавляли амино-окси-PEG (20 кДа) к 3-4-кратному количеству IgG1 (молярное отношение) вместе с катализатором 50-100 мМ анилином или 10 мМ 5-метоксиантраниловой кислотой. После инкубации в течение ночи при комнатной температуре IgG1-(PEG20k)2 достигал выхода, составляющего 95%.
Конъюгация IgG1 с лекарственным средством с помощью мТГазы через амин-азид. К 1-10 мг/мл IgG1 в pH 7,0-8,0 Tris-буфере добавляли 3-азидо-1-пропанмин (№ по кат. CAS 88192-19-2) до конечной концентрации, составляющей 2-50 мМ и мТГазу до концентрации, составляющей 0,05-0,5 мг/мл. Реакционную смесь инкубировали при 37°С в течение 2-16 часов. Выход достигал 100%. После диафильтрации для удаления избытка азидопропиламина, DBCO-майтансин добавляли к 3-кратному количеству IgG (по молям). Выход IgG1-(майтансина)2 достигал свыше 95%.
Пример 9. In vitro клеточный анализ для оценки эффективности ADC, полученного с помощью мТГазы
Клетки SK-BR-3 высеивали в 96-луночные планшеты с темным прозрачным дном с плотностью 103 клеток/лунка и культивировали в течение 24 часов. Клетки обрабатывали в течение 96 часов с помощью 2-кратно серийно разведенных конъюгатов антитело-лекарственное средство в трех параллелях. Жизнеспособность клеток определяли с помощью анализа для определения жизнеспособности клеток CELLTITER™ Blue Cell Viability Assay (Promega, Мадисон, Висконсин). Относительную жизнеспособность клеток определяли в виде процентного отношения необработанного контроля. IC50 рассчитывали с использованием четырехпараметрической логистической модели из XLfit. В таблице 3 показано отношение лекарственного средства к антителу и IC50 в клетках SK-BR-3 с использованием различных конъюгатов трастузумаб-лекарственное средство.

Пример 10. Сайт-специфические ADC, полученные с помощью мТГазы со стабильными нерасщепляемыми линкерами, являются в высокой степени стабильными и эффективными у мышей с ксенотрансплантатом
Трастузумаб (10 мг/мл) и монометилауристатин Е (ММАЕ) каждый с 9 нерасщепляемыми PEG-линкерами (CH2CH2O)x (x=2, 4, 6, 8, 10, 12, 16, 20 и 24, фигура 12) конъюгировали соответственно, как описано в примере 5. ADC очищали с помощью содержащей белок А колонки для удаления мТГазы и избытка ММАЕ. Средние DAR составляли ~1,9, когда восстановленные образцы ADC анализировали на ВЭЖХ с использованием колонки С4. В Анализе на основе клеток SK-BR-3 указанные ADC являются эффективными со значением IC50 от 38 до 148 пМ (таблица 4).
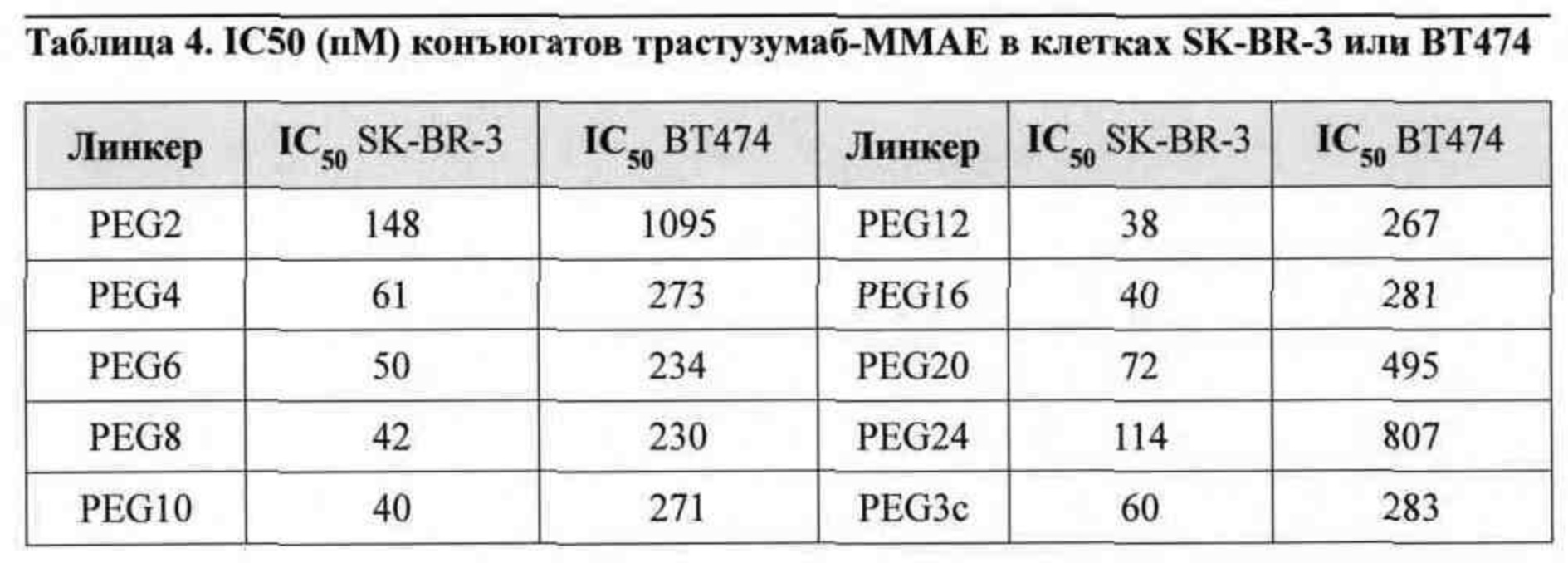
Шесть из конъюгатов трастузумаб-ММАЕ выбрали для in vivo исследования с использованием мышей с ксенотрансплантатом ВТ474. Каждой самке бестимусной мыши с мутацей nude (в возрасте 4 недели, 18-22 г; Harlan) имплантировали одну таблетку эстрогена 3 мм (60-дневноге медленное высвобождение, Innovative Research of America) за 2-3 дня до инъекции клеток. Клетки ВТ474 ресуспендировали до конечной концентрации 50-60 миллионов клеток/мл и смешивали 1:1 с матригелем, затем 200 мкл инъецировали подкожно в боковую область каждой мыши. Лечение начинали, когда объем опухоли (1/2 × длина × ширина × высота) достигал приблизительно 200 мм3 через 3 недели. ADC разбавляли в буфере PBS до конечной концентрации, составляющей 1 мг/мл и вводили внутривенно в хвосты мышей в объеме, составляющем приблизительно 200 мкл до достижения дозы, составляющей 10 мг/кг. Размер опухоли измеряли ежедневно с использованием цифрового штангенциркуля. Даже если линкер PEG6 и 8 показались оптимальными в анализе на основе клеток ВТ474 (таблица 4), разница в in vivo эффективности является очень малой (фигура 13).
Поскольку все 6 ADC являлись эффективными, авторы настоящего изобретения проанализировали только один ADC с линкером PEG 12 в отношении его стабильности в крови. Мышей с ксенотрансплантатом NCI N87 получали путем, аналогичным тому, которым получали мышей с ксенотрансплантатом ВТ474, с ~5 миллионами клеток на мышь за исключением того, что не использовали таблетку эстрогена. После введения ADC образцы крови по 20 мкл забирали каждые 1-2 дней вплоть до 21 дня путем прокола хвостов мышей и смешивали с 120 мкл буфера для хранения (PBS с 10 мМ EDTA и 0,1 М NH4Cl). Затем общий трастузумаб и ADC анализировали с помощью сэндвич-ELISA. На черные 96-луночные планшеты NUNC® Maxisorp наносили белок Her2 в концентрации 100 нг/лунка. Образцы дополнительно разбавляли с помощью PBS при необходимости для попадания в линейный диапазон обнаружения, составляющий 10 пг - 2 нг (либо для трастузумаба, либо ADC). После нанесения образцов (свежие разведения ADC использовали в качестве стандартов как общего mAb, так и ADC) и отмывки, кроличье поликлональное антитело к трастузумабу (для общего mAb) или к ММАЕ (для общего ADC) наносили в качестве вторичных антител, при этом козье антитело к IgG-HRP кролика (Life-Technologies) использовали в качестве антитела обнаружения. Смесь AMPLEX® Red (Cayman Chemical)/4-йодфенола (Sigma)/Н2О2 использовали в качестве субстрата флуоресценции. Планшеты считывали на SpectraMax GEMINI™ с помощью 555 нм Ех и 585 нм Em. Отношение ADC/mAb с течением времени наносили на график на фигуре 14. Видно, что сайт-специфический ADC со стабильным нерасщепляемым линкером является полностью стабильным в крови.
Пример 11. DAR 2 сайт-специфический ADC, полученный с помощью мТГазы с расщепляемым линкером, является более стабильным и эффективным, чем коммерческий TDM-1 в ксенотрансплантатных моделях
Трастузумаб (10 мг/мл) и ММАЕ с расщепляемым линкером PEG3c (фигура 12) конъюгировали и очищали, как описано в примере 10. Этот ADC, названный ТР3сЕ, характеризуется DAR, составляющим 1,9, и высокой эффективностью in vitro (таблицае 4). In vivo исследования проводили в сравнении с TDM-1 (Genentech) как в NCI N87 и SK_Ov3 ксенотрансплантатных моделях. В модели NCI N87 ТР3сЕ является в 4 раза более эффективным, чем TDM-1 при одной внутривенной инъекции (фигура 15). Анализ образцов крови показал, что ТР3сЕ является полностью стабильным в крови в течение вплоть до 21 дня, тогда как TDM-1 потерял 50% своего токсина через 5 дней (фигура 16). В ксенотрансплантатах SK_Ov3 ТР3сЕ в 3 еженедельных дозах, составляющих или 15, или 8 мг/кг, приводил к полной ремиссии опухоли, при этом TDM-1 показал эффективность только в дозе, составляющей 15 мг/кг (фигура 17).
Пример 12. DAR4 сайт-специфический ADC, полученный с помощью мТГазы в двухстадийном способе
Трастузумаб (10 мг/мл) и каждая группа 3-плечевых PEG-линкеров (1-5 кДа) с одной аминогруппой и двумя азидными группами (фигура 18, сверху; зонд Conju и Jenkem) (4-8 мг/мл) конъюгировали и очищали соответственно, как описано в примере 10. Реакции конъюгации антитело-линкер достигали >90% превращения при анализе восстановленных с помощью ВЭЖХ с использованием колонки С4.
Пятикратный молярный избыток алкин-PEG4c-MMAE (фигура 18, нижняя панель) затем связывали с одним из описанных выше продуктов, трастузумаб-3-плечевой-PEG (1 кДа) (1-10 мг/мл), в присутствии 0,1-1 мМ CuSO4 и 1-5 мМ аскорбата натрия в течение 10-300 мин. Конечный продукт DAR 4 ADC, обозначенный как ТР6ТР4сЕ, затем очищали с помощью белка А, как описано в примере 10 и фактический DAR составлял 3,8, что определяли с помощью ВЭЖХ с использованием колонки С4. In vitro активность ТР6ТР4сЕ является выше, чем ТР3сЕ DAR2, как показано в таблице 5.

Реферат
Изобретение относится к области биотехнологии, конкретно к получению конъюгата, включающего трастузумаб и конъюгируемый фрагмент, состоящий из монометилауристатина Е (ММАЕ) и PEG-линкера. Получаемый конъюгат может быть использован для лечения злокачественной опухоли. 4 н. и 10 з.п. ф-лы, 5 табл., 12 пр., 18 ил.
Формула

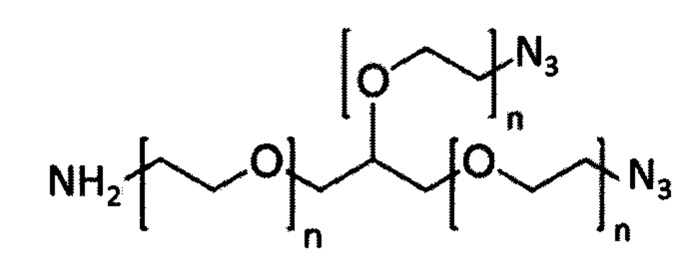
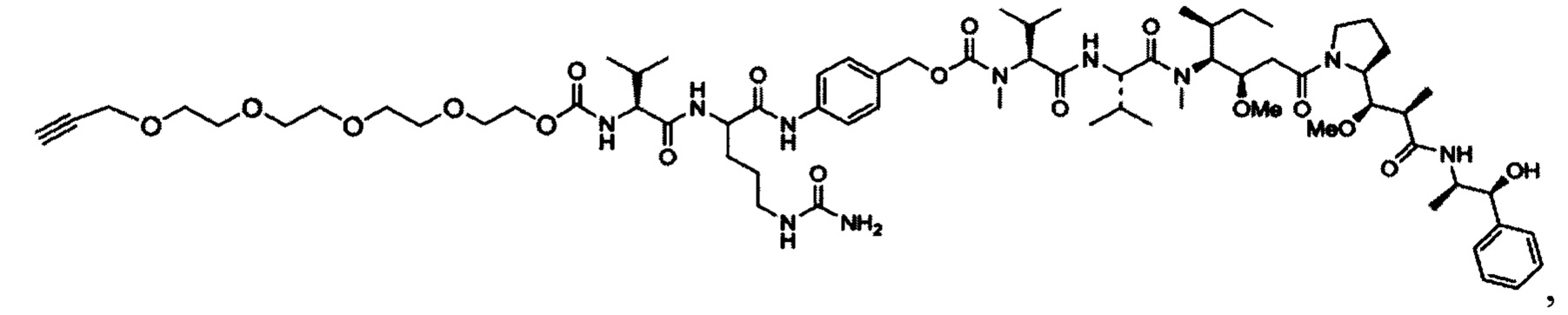
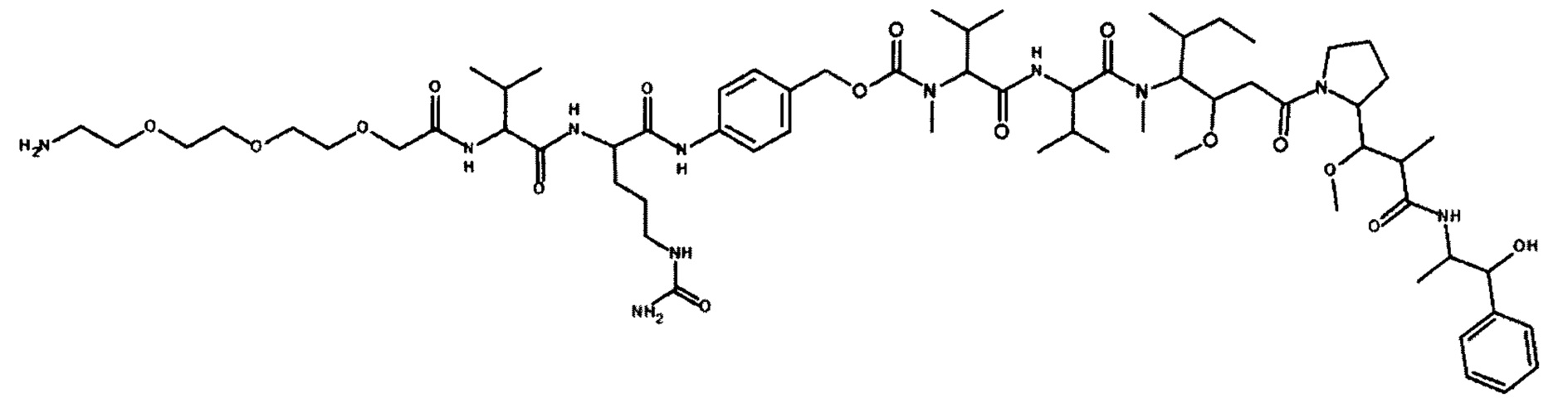


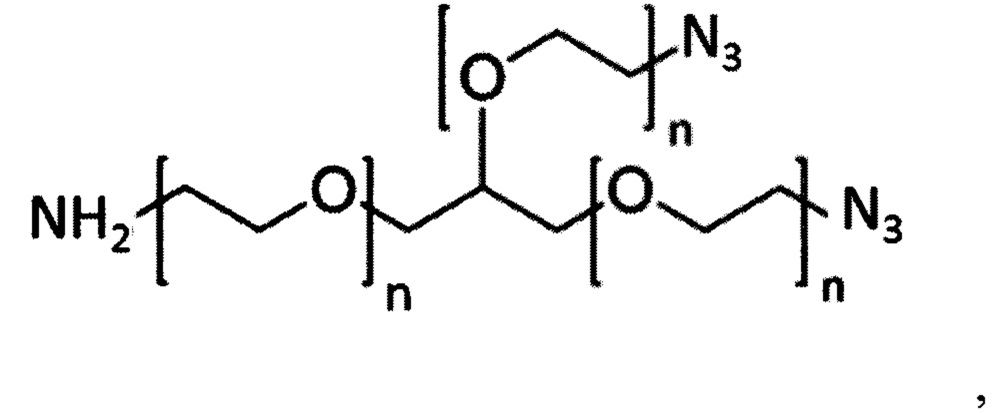
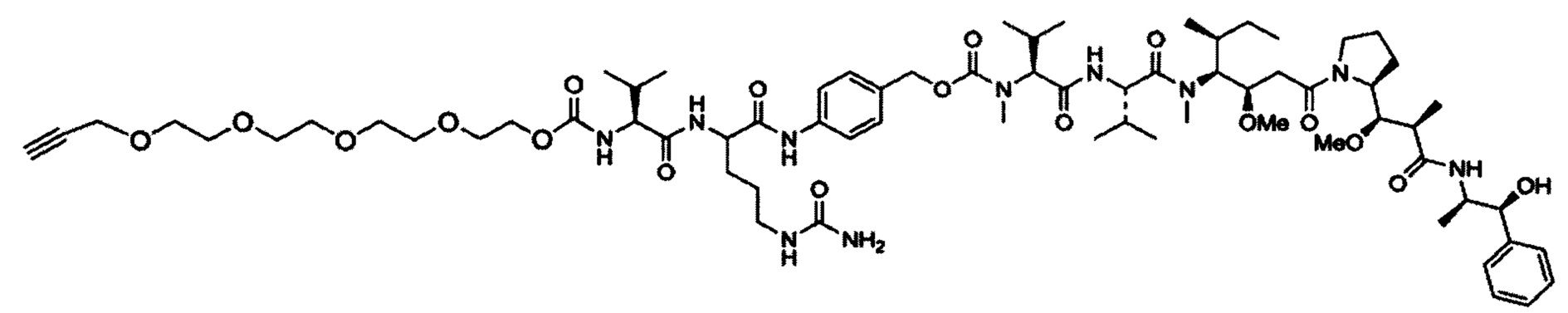

Комментарии