Новые соединения - RU2480453C2
Код документа: RU2480453C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к 2-(замещенная сера, сульфон или сульфоксид)-3-(замещенный фенил)-производным пропионовой кислоты, 2-(замещенный кислород)-3-(замещенный фенил)-производным пропионовой кислоты, производным бензойной кислоты и производным 2-метил-2-(фенокси или фенилтио)пропионовой кислоты и 2-(метил или этил)-2-(фенокси или фенилтио)бутановой кислоте, к способам получения таких соединений, к их применению в лечении воспалительных заболеваний, а также к содержащим их фармацевтическим композициям.
Уровень техники
Воспалительные заболевания кишечника (ВЗК) включают патологические состояния, при которых пациенты страдают от воспаления в желудочно-кишечном тракте (ЖКТ). Некоторые из них, как полагают, имеют хроническую природу, например болезнь Крона и язвенный колит, и потребность в их лечении является высокой. Пациенты страдают от лихорадки, боли, диареи или запора и, кроме того, геморрагического стула. Лечение ограничивается облегчением симптомов, снятием воспаления и, в тяжелых случаях, оперативным вмешательством, при этом все существующие способы лечения связаны с относительно серьезными побочными эффектами. Противовоспалительная терапия с пероральным применением агонистов глюкокортикоидных рецепторов (ГКР) (например, будесонида, преднизолона или флутиказона) может вызвать диабет, синдром Кушинга, дефекты кожи. Кроме того, лечение агонистами ГКР подавляет жизненно важную иммуноактивацию при заражении вирусами, бактериями или другими патогенными микроорганизмами, что дополнительно снижает качество жизни пациента и увеличивает риск повторного заболевания. Также обычно используются нестероидные противовоспалительные средства (НПВС) и притивомикробные средства (например, 5-АСК, сульфасалазин и метронидазол), однако с ограниченным эффектом. Подобные рассуждения, как приведенные выше, также актуальны для других воспалительных заболеваний, таких как астма и хроническая обструктивная болезнь легких (ХОБЛ). Таким образом, существует большая потребность в более эффективных противовоспалительных средствах, обладающих меньшими или, предпочтительно, не обладающих побочными эффектами.
Ядерные гормональные рецепторы (ЯГР) включают ряд растворимых белковых комплексов, которые при модуляции лигандов и комплексообразовании, кофакторов перемещаются в ядро клетки с последующим связыванием со специфичными областями ДНК. Такое связывание индуцирует или редуцирует каскады экспрессии белков и, для нескольких ЯГР, влечет за собой иммунную активацию или дезактивацию. Например, рецепторы эстрогенов (Steffan et al, 2006), X рецепторы печени (LXR) (Tontonoz et al, US2004/0259948; Zelcer & Tontonoz, 2006) и рецептор, активирующий пролиферацию пероксисом (PPAR) α, γ и/или δ (Desreumaux et al, 2001; Tanaka et al, 2001; Lewis et al, 2001; Patel et al; 2003), как предположили, проявляют подобные иммунномодуляторные эффекты посредством низкомолекулярных модуляторов. ЯГР в целом являются многофункциональными в том смысле, что они регулируют несколько важных физиологических явлений, одновременно или последовательно, в зависимости от типа клеток или ткани, в которой происходит модуляция. Это может также являться причиной нежелательных эффектов указанных модуляторов ЯГР, которые параллельны механизму, связанному с побочными эффектами, наблюдаемыми в отношении модуляторов ГКР.
Регулирование воспалительных ответов PPAR, как предположили, включает перекрестную репрессию активации воспалительных генов за счет блокирования нескольких сигнальных путей факторов транскрипции NFkB, STAT-1, NFAT и AP-1. В результате указанного взаимодействия затрагивается ряд нижеследующих метаболических путей. Эти пути включают супрессию провоспалительных цитокинов (например, IL-1β, IL-6, TNF) или хемокинов (например, MCP-1, IL-8), снижение экспрессии адгезионных молекул (например, V-CAM), что приводит к снижению рекрутинга лейкоцитов. Другие противовоспалительные эффекты включают снижение экспрессии маркеров окислительного стресса (например, iNOS, COX-2), репрессирование экспрессии внеклеточных матриксных компонентов (например, MMP, TGF-β), а также индуцированный апоптоз в клетках различных типов (Belvisi M et al., 2006; Duboquoy L et al., 2006; Cunard R 2005). В дополнение к своему противовоспалительному действию PPAR, как также предположили, обладают антипролиферативными свойствами, возможно в результате индуцирования блокировки клеточного цикла и/или апоптоза (Galli A et al., 2006).
Соединения, вводимые пациентам перорально, первоначально воздействуют на ЖКТ, а при вдыхании соединения воздействуют на дыхательные органы. Учитывая вышеуказанные доводы, было бы предпочтительно, в случае пациента с воспалением ЖКТ, чтобы соединение обладало такими свойствами, что оно воздействовало бы на ЖКТ, но при этом было разработано так, чтобы оно выводилось или метаболизировалось прежде, чем достигнет клеток, ткани или области тела, где оно может вызвать нежелательные эффекты. Способ достижения этого был представлен Bodor и коллегами (Bodor et al, 1995; Bodor & Buchwald, 2006; Bodo & Bodor, WO 9200988), которые назвали это "мягкими лекарствами" ("soft-drugs"), подразумевая лекарственное средство, которое проявляет свои фармакологические или лечебные эффекты в течение регулируемого промежутка времени в контролируемом компартменте и поэтому является "мягким" в том смысле, что оно предназначено к выведению посредством метаболизма ожидаемым способом.
Определение термина "мягкое лекарство" варьирует. В настоящей заявке на патент термин "мягкое лекарство" означает химическое соединение, которое проявляет свою активность в целевом органе, а последующая инактивация или изменение в результате метаболизма таковы, что модуляция рецептора в других компартментах (например, системном эффекте) исключена, а нежелательные эффекты и/или побочные эффекты, которые являются неблагоприятными или бесполезными для пациента, снижены.
В US 2003/0236227 описано применение мягких лекарств для лечения диабета, гиперлипидемии, гиперхолестеринемии и атеросклероза. Однако указанные мягкие лекарства проявляют системную активность и, таким образом, они не соответствуют определению термина "мягкие лекарства" в настоящей заявке на патент. Кроме того, в US 2003/0236227 не упомянуты соединения, имеющие противовоспалительные свойства.
Как описано выше, сохраняется потребность в соединениях, обладающих противовоспалительными свойствами. В частности, существует потребность в соединениях с противовоспалительным действием, которые также обладают таким свойством, что являются локально активными в целевом органе и при этом проявляют небольшие или не проявляют никаких эффектов в других компартментах (например, системном эффекте).
Таким образом, настоящее изобретение обеспечивает соединения с противовоспалительными свойствами, которые, как предполагают, действуют в соответствии с определением термина "мягкое лекарство" в настоящей заявке на патент.
Термин "модулятор PPAR", используемый в настоящем описании, относится к способности соединения модулировать биологическую активность PPARα и/или PPARγ, и/или PPARδ посредством повышения или снижения функции и/или экспрессии PPARα и/или PPARγ, и/или PPARδ, где функция PPARα и/или PPARγ, и/или PPARδ может включать регуляторную активность в отношении транскрипции и/или связывания белков. Модуляция может происходить in vitro или in vivo. Модуляция, описанная в настоящем документе, включает антагонизм, агонизм, частичный антагонизм и/или частичный агонизм относительно функции или характеристики, связанной с PPARα и/или PPARγ, и/или PPARδ прямо или опосредованно, и/или повышение или ингибирование экспрессии PPARα и/или PPARγ, и/или PPARδ, прямое или опосредованное. Более конкретно, такой модулятор PPAR либо усиливает, либо ингибирует биологические действия PPAR через функцию и/или экспрессию PPAR. Если такой модулятор частично или полностью усиливает биологическую активность PPAR через функцию и/или экспрессию PPAR, то он является частичным или полным агонистом PPAR, соответственно. Целью настоящего изобретения является обеспечение модуляторов PPAR. Другая цель настоящего изобретения состоит в том, чтобы обеспечить соединения-модуляторы PPAR, которые являются агонистами PPAR.
В целях облегчения понимания терминов "локальный" и "системный" для перорального введения локальным компартментом является ЖКТ (то есть желудочно-кишечный тракт); когда соединение проходит за пределы/через печень, оно достигает системного эффекта. Для вдыхаемых соединений легкие являются локальным компартментом, и за пределами легких эффект является системным.
Под системным эффектом подразумевается воздействие на любую ткань или орган, в которые попадает введенное соединение после того, как оно прошло за пределы/через другую ткань или орган, в котором проходит некоторая часть (например, 90%, но также включающая 100%) выведения или метаболизма соединения.
Цель мягких лекарств PPAR в отношении ВЗК состоит в том, чтобы не допускать ожидаемого системного воздействия на человека, превышающего некоторый коэффициент (например, 10), который ниже соответствующего воздействия, которое приводило бы к ожидаемому фармакологическому эффекту у пациентов с дислипидемией.
Необходимо отметить, что для того, чтобы продемонстрировать активность в конкретных методах испытания, описанных в настоящей заявке, соединение-модулятор PPAR должно связаться с лигандсвязывающим доменом PPAR и привлечь один или несколько кофакторов ядерных гормональных рецепторов, присутствующих в способе, основанном на клетках U-2 OS, описанном в настоящей заявке. Соединения настоящего изобретения, которые образуют комплекс PPAR с соединением-модулятором, могут привлекать, по меньшей мере, один или несколько других >80 известных различных кофакторов ядерных гормональных рецепторов в любом другом способе на основе клеток, полученных и проанализированных согласно известным методикам. Соединения согласно формуле I, XI, CI и MI, которые не привлекают ни один из кофакторов, присутствующих в основанном на клетках способе, описанном в настоящей заявке, как однако ожидают, связываются с PPAR, а комплекс PPAR с соединением-модулятором, образованный таким образом, привлекает, по меньшей мере, один или несколько других >80 известных различных кофакторов ядерных рецепторов, присутствующих в других клеточных системах. Комплекс PPAR с соединением-модулятором может также вытеснять корепрессоры вместе с одновременным привлечением коактиватора или, в альтернативе, вытеснять корепрессор без привлечения коактиватора, что приводит к частичной активации некоторых регуляторных генов PPAR. Пептиды, полученные из любого указанного другого кофактора ядерного гормонального рецептора, могут быть аналогично получены и проанализированы согласно известным методикам.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следующие определения должны применяться по всему тексту настоящего описания и прилагаемой формулы, если конкретно не указано иное.
Термин "С1алкил" обозначает алкильную группу, включающую 1 атом углерода. Примером "С1алкила" является метил.
Термин "С2алкил" обозначает алкильную группу, включающую 2 атома углерода. Примерами "С2алкила" является этил.
Термин "C1-С2алкил" обозначает алкильную группу, включающую 1 или 2 атома углерода. Примером "C1-С2алкила" является метил или этил.
Термин "C1-С3алкил" обозначает линейную или разветвленную насыщенную алкильную группу, включающую 1-3 атома углерода. Примеры указанного алкила включают, помимо прочих, метил, этил, пропил и изопропил.
Термин "C1-С4алкил" обозначает линейную или разветвленную насыщенную алкильную группу, включающую 1-4 атома углерода. Примеры указанного алкила включают, помимо прочих, метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил.
Термин "разветвленный C3-С4алкил" обозначает разветвленную, насыщенную алкильную группу, включающую 3-4 атома углерода. Примеры указанного алкила включают изопропил, изобутил, втор-бутил и трет-бутил.
Термин "C1-С6алкил" обозначает линейную или разветвленную насыщенную алкильную группу, включающую 1-6 атомов углерода. Примеры указанного алкила включают, помимо прочих, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил и гексил.
Термин "C2-С3алкенил" обозначает линейную или разветвленную ненасыщенную алкенильную группу, включающую 2-3 атома углерода. Примеры указанного алкила включают, помимо прочих, винил и аллил.
Термин "C1-С2алкокси" обозначает алкильную группу, содержащую один или два атома углерода, связанную с атомом кислорода. Примеры указанного C1-С2алкокси включают метокси и этокси.
Термин "C1-С3алкиларил" обозначает алкильную цепь, содержащую один-три атома углерода, связанные с арильной группой. Следует понимать, что когда R2 в соединениях формулы I, XI, CI, MI обозначает C1-С3алкиларил, он присоединен к X через алкильную цепь.
Термин "C1-С3алкилгетероарил" обозначает алкильную цепь, содержащую один-три атома углерода, связанные с гетероарильной группой. Следует понимать, что когда R2 в соединениях формулы I, XI, CI, MI обозначает C1-С3алкилгетероарил, он присоединен к X через алкильную цепь.
Термин "галоген" обозначает группы фтор, хлор, бром и йод.
Термин "арил" обозначает ароматическое моноциклическое кольцо, состоящее из 6 атомов углерода, или полностью ароматическую бициклическую кольцевую систему, состоящую из 10 атомов углерода. Примеры указанного "арила" включают, помимо прочих, фенил, нафталин и азулен.
Термин "гетероарил" обозначает ароматическое 5- или 6-членное моноциклическое кольцо или ароматическое 9- или 10-членное бициклическое кольцо, в котором один или несколько атомов в моноциклическом кольце или бициклической кольцевой системе являются атомами элемента, отличного от углерода, независимо выбранного из одного или более, например, азота, кислорода или серы. Термин "сера", как необходимо понимать, включает сульфоксид (S(O)) и сульфон (SO2). Термин "азот", как необходимо понимать, включает оксид азота (NO). Примеры указанного "гетероарила" включают, помимо прочих, фуран, пиррол, пиразин, пиразол, имидазол, триазол, пиримидин, пиридазин, пиридин, пиридин-1-оксид, изоксазол, оксазол, изотиазол, тиазол, тиофен, 1,2,4-триазол, фуразан, 1,2,3-оксадиазол, 1,2,4-оксадиазол, 1,2,5-оксадиазол, 1,3,4-оксадиазол, 1,2,5-тиадиазол, 1,2,4-тиадиазол 1,2,3-тиадиазол, бензофуран, изобензофуран, индол, изоиндол, бензотиофен, бензо[c]тиофен, бензимидазол, пурин, индазол, бензоксазол, бензизоксазол, бензтиазол, хинолин, хиноксалин, хиназолин, циннолин и изохинолин.
Термин "циклоалкил" обозначает насыщенное или ненасыщенное неароматическое монокарбоциклическое кольцо, состоящее из 3, 4, 5, 6, 7 или 8 атомов углерода, или насыщенную или ненасыщенную неароматическую бициклическую кольцевую систему, состоящую из 8, 9 или 10 атомов углерода. Примеры указанного "циклоалкила" включают, помимо прочих, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктанил, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил, циклопентадиенил, циклогексадиенил, циклооктадиенил, декалин и гидриндан.
Термин "гетероциклил" обозначает насыщенные или ненасыщенные неароматические 3, 4, 5, 6, 7, 8, 9 или 10-членное моноциклическое кольцо или насыщенную или ненасыщенную неароматическую или частично ароматическую 9- или 10-членную бициклическую кольцевую систему, в которой один или несколько атомов в моноциклическом кольце или бициклической кольцевой системе являются атомами элемента, отличного от углерода, независимо выбранного из одного или нескольких, например, азота, кислорода или серы. Термин "сера", как необходимо понимать, включает сульфоксид (S(O)) и сульфон (SO2). Термин "азот", как необходимо понимать, включает оксид азота (NO). Примеры указанного "гетероциклила" включают, помимо прочих, азиридин, азетидин, 2-пирролин, 3-пирролин, пирролидин, имидазолин, пиперидин, пиперазин, 2-пиразолин, оксиран, оксетан, тетрагидрофуран, фуран, тетрагидропиран, 1,4-диоксан, 1,3-диоксолан, 1,2-оксатиолан, морфолин, 3-пиразолин, пиразолидин, 2H-пиран, 4H-пиран, 1,4-дитиан, 1,4-оксатиан, тиоморфолин, индолин, хроман, изохроман, 2,3-дигидробензофуран, фталан и изоиндолин.
Ra независимо обозначает H либо линейную или разветвленную, насыщенную или ненасыщенную C1-С4алкильную цепь, необязательно замещенную одним или несколькими F.
Rb независимо обозначает линейную или разветвленную, насыщенную или ненасыщенную C1-С4алкильную цепь, необязательно замещенную одним или несколькими F.
Следует понимать, что когда заместитель содержит больше одного из Ra или Rb, то тогда каждый из них может быть одинаковым или различным. Например, NRaRa включает амино, алкиламино и диалкиламино. Кроме того, следует понимать, что когда различные заместители в одном и том же соединении содержат больше одного из Ra или Rb, то тогда каждый из них может быть одинаковым или различным.
Согласно одному из аспектов изобретение обеспечивает соединение формулы (I):

формула I
в которой
R1 обозначает H, F, CH3 или CF3;
X обозначает S, S(O) или SO2;
R2 обозначает линейный C1-С6алкил или разветвленный C3-С4алкил, каждый из которых необязательно замещен одним или несколькими F,
или R2 является C1-С3алкиларилом или C1-С3алкилгетероарилом, где каждый из арил или гетероарил необязательно замещен одним или несколькими следующими заместителями: галоген, ОН, OSO2Rb, C1-С2алкокси, C1-С4алкил, где каждый из заместителей C1-С2алкокси или C1-С4алкил необязательно замещен одним или несколькими F;
R3 расположен в орто-, мета- или пара-положении и является F, C1-С4алкилом или C1-С2алкокси, где каждый из заместителей C1-С4алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
или R3 является CH2Ph или NHC(O)OC(CH3)3;
p обозначает целое число 0-4;
L расположено в мета- или пара-положении и представляет собой (CH2)nC(O)O(CH2)i, (CH2)nC(O)S(CH2)i, (CH2)nOC(O)(CH2)i или (CH2)nSC(O)(CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним или несколькими следующими заместителями, независимо выбранными из: F, C2-С3алкенила, C1-С3алкила, C1-С2алкокси, где каждый из заместителей C1-С3алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
n обозначает целое число 0-3;
i обозначает целое число 0-3;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, OSO2Rb, NO2, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, моноциклический циклоалкил, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкил (который необязательно замещен одним или несколькими F); моноциклический арил, моноциклический гетероарил, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F),
или A является циклоалкилом или гетероциклилом, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим гетероциклилом, моноциклическим циклоалкилом, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкил (который необязательно замещен одним или несколькими F); моноциклическим арилом, моноциклическим гетероарилом, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, OS(O)Rb, S(O)Rb, SO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F);
или его фармацевтически приемлемую соль.
Далее приведены другие значения R1, X, R2, R3, p, n, i, L и А в соединениях формулы I. Следует понимать, что такие значения могут использоваться при необходимости с любым из определений, пунктов формулы или вариантов осуществления, определенных выше или далее.
В первом варианте осуществления изобретения обеспечивается класс соединений формулы I, в которой
R1 обозначает H, F, CH3 или CF3;
X обозначает S, S(O) или SO2;
R2 обозначает линейный C1-С6алкил или разветвленный C3-С4алкил, каждый из которых необязательно замещен одним или несколькими F,
или R2 является C1-С3алкиларилом или C1-С3алкилгетероарилом, где каждый арил или гетероарил необязательно замещен одним или несколькими следующими заместителями: галогеном, ОН, OSO2Rb, C1-С2алкокси, C1-С4алкилом, где каждый из заместителей C1-С2алкокси или C1-С4алкил необязательно замещен одним или несколькими F;
R3 расположен в орто-, мета- или пара-положении и обозначает F, C1-С4алкил или C1-С2алкокси, каждый из которых необязательно замещен одним или несколькими F;
или R3 является CH2Ph или NHC(O)OC(CH3)3;
p обозначает целое число 0-4;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i, (CH2)nC(O)S(CH2)i, (CH2)nOC(O)(CH2)i или (CH2)nSC(O)(CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним или несколькими следующими заместителями, независимо выбранными из: F, C2-С3алкенила, C1-С3алкила, C1-С2алкокси, где каждый из заместителей C1-С3алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
n обозначает целое число 0-3;
i обозначает целое число 0-3;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, OSO2Rb, NO2, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, моноциклический циклоалкил, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический арил, моноциклический гетероарил, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F), или А является циклоалкилом или гетероциклилом, каждый из которых необязательно замещен один или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим гетероциклилом, моноциклическим циклоалкилом, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим арилом, моноциклическим гетероарилом, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, OS(O)Rb, S(O)Rb, SO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F).
Во втором варианте осуществления изобретения обеспечивается класс соединений формулы I, в которой:
R2 обозначает C1-С3алкиларил или C1-С3алкилгетероарил, где каждый арил или гетероарил необязательно замещен одним или несколькими следующими заместителями: галогеном, ОН, OSO2Rb, C1-С2алкокси, C1-С4алкилом, где каждый из заместителей C1-С2алкокси или C1-С4алкил необязательно замещен одним или несколькими F;
R1, X, R3, p, L, n, i и A являются такими же, как и в первом варианте осуществления.
В третьем варианте осуществления изобретения обеспечивается класс соединений формулы I, в которой:
R2 обозначает C1-С3алкиларил или C1-С3алкилгетероарил, где каждый арил или гетероарил необязательно замещен одним или несколькими следующими заместителями: галогеном, ОН, OSO2Rb, C1-С2алкокси, C1-С4алкилом, где каждый из заместителей C1-С2алкокси или C1-С4алкил необязательно замещен одним или несколькими F;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, OSO2Rb, NO2, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, моноциклический циклоалкил, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический арил, моноциклический гетероарил, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила, который необязательно замещен одним или несколькими F,
или A является гетероциклилом, необязательно замещенным одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим гетероциклилом, моноциклическим циклоалкилом, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим арилом, моноциклическим гетероарилом, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, OS(O)Rb, S(O)Rb, SO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F);
R1, X, R3, p, L, n и i такие, как и в первом варианте осуществления.
В четвертом варианте осуществления изобретения обеспечивается класс соединений формулы I, в которой:
R1 обозначает H;
X обозначает S или SO2;
R2 обозначает С2алкиларил, где арил необязательно замещен одним или несколькими F;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i, (CH2)nOC(O)(CH2)i или (CH2)nSC(O)(CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним С1алкилом;
n обозначает целое число 0-2;
i обозначает целое число 0-3;
p обозначает 0;
A обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями: ORb, OSO2Rb, C1-С4алкилом (который необязательно замещен одним или несколькими F); моноциклический арил;
или A является гетероциклилом, который необязательно замещен С1алкилом, где С1алкил необязательно замещен одним или несколькими F.
В пятом варианте осуществления изобретения обеспечивается класс соединений формулы I, в которой:
R1 обозначает H;
X обозначает S;
R2 обозначает С2алкиларил, где арил замещен одним F;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i или (CH2)nOC(O)(CH2)i;
n обозначает целое число 0-1;
i обозначает целое число 0-1;
p обозначает 0;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями: ORb, OSO2Rb, С1алкил (который необязательно замещен одним или несколькими F); моноциклический арил;
или A является гетероциклилом, который необязательно замещен С1алкилом, где С1алкил необязательно замещен одним или несколькими F.
Согласно другому аспекту изобретение обеспечивает соединение формулы (XI):

формула XI
в которой
R1 обозначает H, F, CH3 или CF3;
X обозначает O;
R2 обозначает линейный C1-С6алкил или разветвленный C3-С4алкил, каждый из которых необязательно замещен одним или несколькими F,
или R2 является C1-С3алкиларилом или C1-С3алкилгетероарилом, где каждый арил или гетероарил необязательно замещен одним или несколькими следующими заместителями: галогеном, ОН, OSO2Rb, C1-С2алкокси, C1-С4алкилом, где каждый из заместителей C1-С2алкокси или C1-С4алкил необязательно замещен одним или несколькими F;
R3 расположен в орто-, мета- или пара-положении и обозначает F, C1-С4алкил или C1-С2алкокси, где каждый из заместителей C1-С4алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
или R3 является CH2Ph или NHC(O)OC(CH3)3;
p обозначает целое число 0-4;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i, (CH2)nC(O)S(CH2)i, (CH2)nOC(O)(CH2)i или (CH2)nSC(O)(CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним или несколькими следующими заместителями, независимо выбранными из: F, C2-С3алкенила, C1-С3алкила, C1-С2алкокси, где каждый из заместителей C1-С3алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
n обозначает целое число 0-3;
i обозначает целое число 0-3;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, OSO2Rb, NO2, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, моноциклический циклоалкил, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический арил, моноциклический гетероарил, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F),
или A является циклоалкилом или гетероциклилом, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим гетероциклилом, моноциклическим циклоалкилом, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим арилом, моноциклическим гетероарилом, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F);
или его фармацевтически приемлемую соль.
Далее приведены другие значения R1, X, R2, R3, p, n, i, L и А в соединениях формулы XI. Следует понимать, что такие значения могут использоваться при необходимости с любым из определений, пунктов формулы или вариантов осуществления, определенных выше или далее.
В шестом варианте осуществления изобретения обеспечивается класс соединений формулы XI, в которой:
R1 обозначает H, F, CH3 или CF3;
X обозначает O;
R2 обозначает линейный C1-С6алкил или разветвленный C3-С4алкил, каждый из которых необязательно замещен одним или несколькими F,
или R2 является C1-С3алкиларилом или C1-С3алкилгетероарилом, где каждый арил или гетероарил необязательно замещен одним или несколькими следующими заместителями: галогеном, ОН, OSO2Rb, C1-С2алкокси, C1-С4алкил, где каждый из заместителей C1-С2алкокси или C1-С4алкил необязательно замещен одним или несколькими F;
R3 расположен в орто-, мета- или пара-положении и обозначает F, C1-С4алкил или C1-С2алкокси, где каждый из заместителей C1-С4алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
или R3 является CH2Ph или NHC(O)OC(CH3)3;
p обозначает целое число 0-4;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i, (CH2)nC(O)S(CH2)i, (CH2)nOC(O)(CH2)i или (CH2)nSC(O)(CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним или несколькими следующими заместителями, независимо выбранными из: F, C2-С3алкенила, C1-С3алкила, C1-С2алкокси, где каждый из заместителей C1-С3алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
n обозначает целое число 0-3;
i обозначает целое число 0-3;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, OSO2Rb, NO2, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, моноциклический циклоалкил, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический арил, моноциклический гетероарил, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F),
или A является циклоалкилом или гетероциклилом, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим гетероциклилом, моноциклическим циклоалкилом, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим арилом, моноциклическим гетероарилом, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F);
или его фармацевтически приемлемая соль.
В седьмом варианте осуществления изобретения обеспечивается класс соединений формулы XI, в которой:
R2 обозначает линейный C1-С6алкил или разветвленный C3-С4алкил, каждый из которых необязательно замещен одним или несколькими F;
R1, X, R3, p, L, n, i и A такие, как и в шестом варианте осуществления.
В восьмом варианте осуществления изобретения обеспечивается класс соединений формулы XI, в которой:
R2 обозначает линейный C1-С6алкил или разветвленный C3-С4алкил, каждый из которых необязательно замещен одним или несколькими F,
A обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, OSO2Rb, NO2, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, моноциклический циклоалкил, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический арил, моноциклический гетероарил, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F),
R1, X, R3, p, L, n и i такие, как и в шестом варианте осуществления.
В девятом варианте осуществления изобретения обеспечивается класс соединений формулы XI, в которой:
R1 обозначает H;
R2 обозначает С2алкил;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i или (CH2)nOC(O)(CH2)i;
n обозначает целое число 0-1;
i обозначает целое число 0-1;
p обозначает 0;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: моноциклического арила, C1-С4алкила (который необязательно замещен одним или несколькими F), NRaC(O)ORb, OSO2Rb;
X такой, как и в шестом варианте осуществления.
В десятом варианте осуществления изобретения обеспечивается класс соединений формулы XI, в которой:
R1 обозначает H;
R2 обозначает С2алкил;
L расположено в мета- или пара-положении и представляет (CH2)nOC(O)(CH2)i;
n обозначает целое число 1;
i обозначает целое число 0;
p обозначает 0;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: моноциклического арила, NRaC(O)ORb;
X такой, как и в шестом варианте осуществления.
Согласно дополнительному аспекту изобретение обеспечивает соединение общей формулы (CI):

формула CI
в которой
R1 обозначает F;
w обозначает целое число 0-4;
М расположено в орто- или мета-положении и обозначает COOH;
Q обозначает C1-С2алкил или XC1-С2алкил;
X обозначает S или O;
R2 расположен в орто-, мета- или пара-положении и обозначает F;
p обозначает целое число 0-4;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i, (CH2)nC(O)S(CH2)i, (CH2)nOC(O)(CH2)i или (CH2)nSC(O)(CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним или несколькими следующими заместителями, независимо выбранными из: F, C2-С3алкенила, C(O)OC1-С3алкила, гетероарила, C1-С3алкила, C1-С2алкокси, где каждый из заместителей C1-С3алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
n обозначает целое число 0-3;
i обозначает целое число 0-3;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, OSO2Rb, NO2, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, моноциклический циклоалкил, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический арил, моноциклический гетероарил, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F),
или A является циклоалкилом или гетероциклилом, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим гетероциклилом, моноциклическим циклоалкилом, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим арилом, моноциклическим гетероарилом, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F);
или его фармацевтически приемлемую соль.
Далее приведены другие значения R1, w, М, Q, X, R2, p, L, n, i и А в соединениях формулы CI. Следует понимать, что такие значения могут использоваться при необходимости с любым из определений, пунктов формулы или вариантов осуществления выше или далее.
В 11-м варианте осуществления изобретения обеспечивается класс соединений формулы CI, в котором:
R1 обозначает F;
w обозначает целое число 0-4;
М расположен в орто- или мета-положении и обозначает COOH;
Q обозначает C1-С2алкилХ или XC1-С2алкил;
X обозначает S или O;
R2 расположен в орто-, мета- или пара-положении и обозначает F;
p обозначает целое число 0-4;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i, (CH2)nC(O)S(CH2)i, (CH2)nOC(O)(CH2)i или (CH2)nSC(O)(CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним или несколькими следующими заместителями, независимо выбранными из: F, C2-С3алкенила, C(O)OC1-С3алкила, гетероарила, C1-С3алкила, C1-С2алкокси, где каждый из заместителей C1-С3алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
n обозначает целое число 0-3;
i обозначает целое число 0-3;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, OSO2Rb, NO2, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, моноциклический циклоалкил, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический арил, моноциклический гетероарил, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F),
или A является циклоалкилом или гетероциклилом, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим гетероциклилом, моноциклическим циклоалкилом, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим арилом, моноциклическим гетероарилом, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F).
В 12-м варианте осуществления изобретения обеспечивается класс соединений формулы CI, в которой:
Q обозначает XC1-С2алкил;
X обозначает S или O;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i или (CH2)nOC(O)(CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним или несколькими следующими заместителями, независимо выбранными из: F, C2-С3алкенила, C(O)OC1-С3алкила, гетероарила, C1-С3алкила, C1-С2алкокси, где каждый из заместителей C1-С3алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
R1, w, М, R2, p, n, i и A такие, как и в 11-м варианте осуществления.
В 13-м варианте осуществления изобретения обеспечивается класс соединений формулы CI, в которой:
Q обозначает XC1-С2алкил;
X обозначает S или O;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i или (CH2)nOC(O)(CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним или несколькими следующими заместителями, независимо выбранными из: F, C2-С3алкенила, C(O)OC1-С3алкила, гетероарила, C1-С3алкила, C1-С2алкокси, где каждый из заместителей C1-С3алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
А обозначает арил, необязательно замещенный одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, OSO2Rb, NO2, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, моноциклический циклоалкил, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический арил, моноциклический гетероарил, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F);
R1, w, М, R2, p, n и i такие, как и в 11-м варианте осуществления.
В 14-м варианте осуществления изобретения обеспечивается класс соединений формулы CI, в которой:
w обозначает целое число 0;
М расположен в орто-положении и обозначает COOH;
Q обозначает ХС1алкил;
X обозначает S;
p обозначает целое число 0;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i или (CH2)nOC(O)(CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним или несколькими следующими заместителями, независимо выбранными из: C2-С3алкенила, C1-С3алкила, C(O)OC1-С3алкила, гетероарила;
n обозначает целое число 1-2;
i обозначает целое число 1;
А обозначает арил, необязательно замещенный одним или несколькими следующими заместителями, независимо выбранными из: ORb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклического гетероарила.
В 15-м варианте осуществления изобретения обеспечивается класс соединений формулы CI, в которой:
w обозначает целое число 0;
М расположен в орто-положении и обозначает COOH;
Q обозначает ХС1алкил;
X обозначает S;
p обозначает целое число 0;
L расположено в мета- или пара-положении и обозначает (CH2)nOC(O)(CH2)i;
n обозначает целое число 1-2;
i обозначает целое число 1;
А обозначает фенил, необязательно замещенный одним или несколькими С1алкилами (каждый из которых необязательно замещен одним или несколькими F).
В 16-м варианте осуществления изобретения обеспечивается класс соединений формулы CI, в которой:
R1 обозначает F;
w обозначает целое число 0-4;
М расположен в орто- или мета-положении и обозначает COOH;
Q обозначает C1-С2алкилХ или XC1-С2алкил;
X обозначает S или O;
R2 расположен в орто-, мета- или пара-положении и обозначает F;
p обозначает целое число 0-4;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i, (CH2)nC(O)S(CH2)i, (CH2)nOC(O)(CH2)i или (CH2)nSC(O)(CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним или несколькими следующими заместителями, независимо выбранными из: F, C2-С3алкенила, C(O)OC1-С3алкила, гетероарила, C1-С3алкила, C1-С2алкокси, где каждый из заместителей C1-С3алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
n обозначает целое число 0-3;
i обозначает целое число 0-3;
A обозначает арил или гетероарил, каждый из которых необязательно замещен одним галогеном и/или одним или несколькими следующими заместителями, независимо выбранными из: ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, OSO2Rb, NO2, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, моноциклический циклоалкил, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический арил, моноциклический гетероарил, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F),
или A является циклоалкилом или гетероциклилом, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим гетероциклилом, моноциклическим циклоалкилом, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим арилом, моноциклическим гетероарилом, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F).
Согласно дополнительному аспекту изобретение обеспечивает соединение формулы (MI):

формула MI
в которой
R1 обозначает C1-С2алкил, необязательно замещенный одним или несколькими F;
R2 обозначает C1-С2алкил, необязательно замещенный одним или несколькими F;
X обозначает O или S;
R3 расположен в орто-, мета- или пара-положении и обозначает F, C1-С4алкил или C1-С2алкокси, где каждый из заместителей C1-С4алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
или R3 является CH2Ph или NHC(O)OC(CH3)3;
p обозначает целое число 0-4;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i, (CH2)nC(O)S(CH2)i, (CH2)nOC(O)(CH2)i или (CH2)nSC(O)(CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним или несколькими следующими заместителями, независимо выбранными из: F, C2-С3алкенила, C1-С3алкила, C1-С2алкокси, где каждый из заместителей C1-С3алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
n обозначает целое число 0-3;
i обозначает целое число 0-3;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, OSO2Rb, NO2, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, моноциклический циклоалкил, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический арил, моноциклический гетероарил, каждый где указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F),
или A является циклоалкилом или гетероциклилом, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим гетероциклилом, моноциклическим циклоалкилом, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим арилом, моноциклическим гетероарилом, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F);
или его фармацевтически приемлемую соль.
Далее приведены другие значения R1, R2, X, R3, p, L, n, i и А в соединениях формулы MI. Следует понимать, что такие значения могут использоваться при необходимости с любым из определений, пунктов формулы или вариантов осуществления, определенных выше или далее.
В 17-м варианте осуществления изобретения обеспечивается класс составов формулы MI, в которой:
R1 обозначает C1-С2алкил, необязательно замещенный одним или несколькими F;
R2 обозначает C1-С2алкил, необязательно замещенный одним или несколькими F;
X обозначает O или S;
R3 расположен в орто-, мета- или пара-положении и обозначает F, C1-С4алкил или C1-С2алкокси, где каждый из заместителей C1-С4алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
или R3 является CH2Ph или NHC(O)OC(CH3)3;
p обозначает целое число 0-4;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i, (CH2)nC(O)S(CH2)i, (CH2)nOC(O)(CH2)i или (CH2)nSC(O)(CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним или несколькими следующими заместителями, независимо выбранными из: F, C2-С3алкенила, C1-С3алкила, C1-С2алкокси, где каждый из заместителей C1-С3алкил или C1-С2алкокси необязательно замещен одним или несколькими F;
n обозначает целое число 0-3;
i обозначает целое число 0-3;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, OSO2Rb, NO2, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, моноциклический циклоалкил, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический арил, моноциклический гетероарил, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F),
или A является циклоалкилом или гетероциклилом, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклическим гетероциклилом, моноциклическим циклоалкилом, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который является необязательно замещен одним или несколькими F); моноциклическим арилом, моноциклическим гетероарилом, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F).
В 18-м варианте осуществления изобретения обеспечивается класс соединений формулы MI, в которой:
R1 обозначает С1алкил, необязательно замещенный одним или несколькими F;
R2 обозначает С1алкил, необязательно замещенный одним или несколькими F;
X обозначает O;
R3, p, L, n, i и A такие, как и в 17-м варианте осуществления.
В 19-м варианте осуществления изобретения обеспечивается класс соединений формулы MI, в которой:
R1 обозначает С1алкил, необязательно замещенный одним или несколькими F;
R2 обозначает С1алкил, необязательно замещенный одним или несколькими F;
X обозначает O;
L расположено в мета- или пара-положении и обозначает (CH2)nOC(O)(CH2)i;
n обозначает целое число 1;
i обозначает целое число 0;
R3, p и A такие, как и в 17-м варианте осуществления.
В 20-м варианте осуществления изобретения обеспечивается класс соединений формулы MI, в которой:
R1 обозначает С1алкил, необязательно замещенный одним или несколькими F;
R2 обозначает С1алкил, необязательно замещенный одним или несколькими F;
X обозначает O;
p обозначает целое число 0;
L расположено в мета- или пара-положении и обозначает (CH2)nOC(O)(CH2)i;
n обозначает целое число 1;
i обозначает целое число 0;
А обозначает гетероарил, необязательно замещенный одним или несколькими следующими заместителями, независимо выбранными из: галогена, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C(O)NRaRa, NRaC(O)Rb, C(O)ORa, OC(O)Rb, SO2NRaRa, NRaSO2Rb, NRaC(O)ORb, OC(O)NRaRa, NRaC(O)NRaRa, OSO2Rb, NO2, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, моноциклический циклоалкил, где каждый указанный моноциклический гетероциклил или моноциклический циклоалкил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, ОН, оксо, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический арил, моноциклический гетероарил, где каждый указанный моноциклический арил или моноциклический гетероарил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогенов, ОН, CN, NRaRa, ORb, SRb, SiRbRbRb, S(O)Rb, SO2Rb, OSO2Rb, NO2, C(O)Rb, C1-С4алкила (который необязательно замещен одним или несколькими F).
Соединения формулы I, XI, CI и MI обладают активностью как лекарственные средства.
Конкретные соединения изобретения являются одним или несколькими соединениями, выбранными из следующих:
4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензиловый эфир 4-метансульфонилоксибензойная кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-метансульфонилоксифенил)ацетоксиметил]фенил}пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-[4-(4-трифторметилбензилоксикарбонилметил)фенил]пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-[4-(4-метансульфонилоксибензилоксикарбонилметил)фенил]пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-(4-{2-[2-(4-метансульфонилоксифенил)ацетокси]этил}фенил)пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-(4-{3-[2-(4-метансульфонилоксифенил)ацетокси]пропил}фенил)пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-[4-(2-фенилпропионилоксиметил)фенил]пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-метоксилфенил)ацетоксиметил]фенил}пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-изобутилфенил)пропионилоксиметил]фенил}пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-[4-(2-пиридин-2-илацетоксиметил)фенил]пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-метилпиперазин-1-ил)ацетоксиметил]фенил}пропионовая кислота;
2-фенил-5-трифторметилоксазол-4-илметиловый эфир 4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензойная кислота;
4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензиловый эфир 2-фенил-5-трифторметилоксазол-4-карбоновая кислота;
2-(5-метил-2-фенилоксазол-4-ил)этиловый эфир 4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензойная кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(5-метил-2-фенилоксазол-4-ил)ацетоксиметил]фенил}пропионовая кислота;
4-метансульфонилоксибензиловый эфир 4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензойная кислота;
2-[2-(4-фторфенил)этансульфонил]-3-[4-(4-трифторметилбензилоксикарбонилметил)фенил]пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-метансульфонилоксифенил)этилсульфанилкарбонил]фенил}пропионовая кислота;
(-)-2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(5-метил-2-фенилоксазол-4-ил)ацетоксиметил]фенил}пропионовая кислота;
2-(5-метил-2-фенилоксазол-4-ил)этиловый эфир 4-{(-)-2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензойная кислота;
(S)-2-этокси-3-{4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}пропионовая кислота;
(S)-3-{4-[2-(4-трет-бутоксикарбониламинофенил)ацетокси]фенил}-2-этоксипропионовая кислота;
3-{3-бензил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}-2-этокси-пропионовая кислота;
3-{3-бензил-4-[2-(4-трет-бутоксикарбониламинофенил)ацетокси]фенил}-2-этоксипропионовая кислота;
2-этокси-3-{3-метил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}пропионовая кислота;
3-{4-[2-(4-трет-бутоксикарбониламинофенил)ацетокси]-3-метилфенил}-2-этоксипропионовая кислота;
4-метансульфонилоксибензиловый эфир 4-(2-карбокси-2-этоксиэтил)бензойная кислота;
2-[3-(4-трифторметилбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота;
2-{4-[2-(4-трифторметилфенил)ацетоксиметил]фенилсульфанилметил}бензойная кислота;
2-[4-(4-трифторметилбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота;
2-{3-[1-(4-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота;
2-{3-[2-(4-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота;
2-[4-(2,6-диметилбензилоксикарбонилметил)фенилсульфанилметил]бензойная кислота;
2-[4-(1-фенилбут-3-енилоксикарбонилметил)фенилсульфанилметил]бензойная кислота;
2-[3-(1-метоксикарбонил-2-фенилэтоксикарбонилметил)фенилсульфанилметил]бензойная кислота;
2-{4-[2-(3,4-диметоксифенил)этоксикарбонилметил]фенилсульфанилметил}бензойная кислота;
2-[4-(1-метоксикарбонил-2-фенилэтоксикарбонилметил)фенилсульфанилметил]бензойная кислота;
2-{3-[2-(2-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота;
2-[4-(оксазол-2-илфенилметоксикарбонилметил)фенилсульфанилметил]бензойная кислота;
2-{4-[2-(2-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота;
2-[3-(2,6-диметилбензилоксикарбонилметил)фенилсульфанилметил]бензойная кислота;
2-[3-(4-пиразол-1-илбензилоксикарбонилметилфенилсульфанилметил]бензойная кислота;
2-[4-(4-пиразол-1-илбензилоксикарбонилметилфенилсульфанилметил]бензойная кислота;
2-{3-[2-(3,4-диметоксифенил)этоксикарбонилметил]фенилсульфанилметил}бензойная кислота;
4-метил-2-(4-трифторметилфенил)тиазол-5-илметиловый эфир 4-(1-карбокси-1-метилэтокси)бензойная кислота, или их фармацевтически приемлемой солью.
Конкретные соединения настоящего изобретения могут существовать в форме таутомеров или стереоизомеров (например, рацемата, энантиомера, диастереомера или E- или Z-изомера). Необходимо понимать, что настоящее изобретение охватывает все подобные таутомеры или стереоизомеры.
Конкретные соединения настоящего изобретения могут существовать в форме сольватов или гидратов. Необходимо понимать, что настоящее изобретение охватывает все подобные сольваты или гидраты.
Соединения настоящего изобретения могут также содержать неприродные соотношения атомных изотопов в одном или нескольких атомах, которые составляют подобные соединения. Например, соединения могут быть помечены радиоактивными изотопами, например, такими как тритий (3H), йод-125 (125I) или углерод-14 (14C). Все изотопные варианты соединений настоящего изобретения, радиоактивные или нет, включены в объем настоящего изобретения.
Подходящая фармацевтически приемлемая соль соединения изобретения является, например солью присоединения кислоты соединения изобретения, которое является достаточно основным, например солью присоединения кислоты, полученной, например, с минеральной или органической кислотой, например, хлороводородной, бромоводородной, азотной, метансульфоновой, серной, фосфорной, трифторуксусной, пара-толуолсульфоновой, 2-мезитиленсульфоновой, лимонной, уксусной, винной, фумаровой, молочной, янтарной, оксиянтарной, малоновой, малеиновой, 1,2-этандисульфоновой, адипиновой, аспарагиновой, бензолсульфоновой, бензойной, этансульфоновой или никотиновой кислотой. Кроме того, подходящая фармацевтически приемлемая соль соединения изобретения является, например, солью присоединения основания соединения изобретения, которое является достаточно кислотным, например солью металла, например натрия, калия, кальция, магния, цинка или алюминия, солью аммония, солью с органическим основанием, которое дает физиологически приемлемый катион, включающим гидроксиды четвертичного аммония, например метиламин, этиламин, диэтиламин, триметиламин, трет-бутиламин, триэтиламин, дибензиламин, N,N-дибензилэтиламин, циклогексилэтиламин, трис-(2-гидроксиэтил)-амин, гидроксиэтилдиэтиламин, (1R,2S)-2-гидроксиинден-1-амин, морфолин, N-метилпиперидин, N-этилпиперидин, пиперазин, метилпиперазин, адамантиламин, гидроксид холина, гидроксид тетрабутиламмония, гидроксид трис-(гидроксиметил)метиламина, L-аргинин, N-метил-D-глюкамин, лизин или аргинин.
В другом аспекте настоящее изобретение обеспечивает применение соединения формул I, XI, CI и MI в качестве лекарственного средства.
Способы получения соединений формулы I
Соединения формулы I изобретения могут быть получены, как описано на схемах I-IV ниже. Однако изобретение не ограничено указанными способами. Соединения могут быть также получены, как описано для близких по структуре соединений из предыдущего уровня техники. Реакции могут быть проведены согласно стандартным методикам или как описано в экспериментальном разделе.
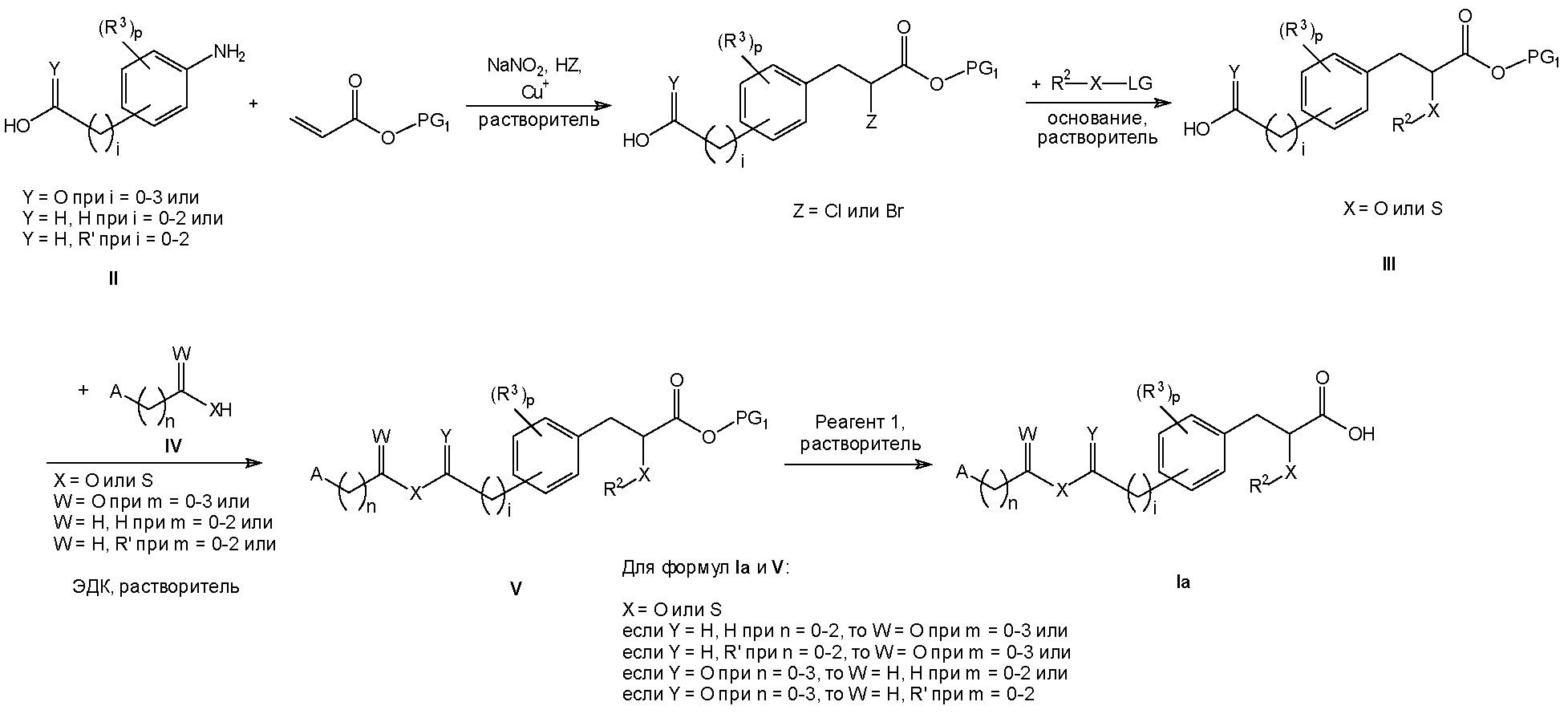
Схема I

Схема II

Схема III

Схема IV
На схемах I-IV A, R2, R3, p, n и I такие, как определено выше для соединений формулы (I). На схемах I-IV V, W, X и Y такие, как определено выше.
На схемах I-III R' обозначает любой заместитель, который инертен к условиям реакции, используемым для показанных промежуточных соединений. Такими заместителями являются, например, алкильные группы или алкоксигруппы.
На схемах I-IV выше сокращения "PG" означают защитную группу. PG1 обозначает защитную группу для карбоксильных гидроксигрупп, которая выдерживает необходимые условия реакции для синтеза показанных промежуточных соединений, но может быть удалена с использованием соответствующего реагента для снятия защиты. PG2 обозначает защитную группу для спиртовых гидроксигрупп, которая выдерживает необходимые условия реакции для синтеза показанных промежуточных соединений, но может быть удалена с использованием соответствующего реагента для снятия защиты. Примеры таких защитных групп описаны в стандартном пособии "Protective Groups in the Organic Synthesis", 3rd Edition (1999), T.W. Greene and P.G.M. Wuts.
На схемах I-IV выше термин "реагент" означает реагент, который вызывает селективное отщепление защитной группы. Реагент 1 представляет собой любой реагент, который позволяет удалить защитную группу PG1, реагент 2 представляет собой любой реагент, который позволяет удалить защитную группу PG2. Примеры таких реагентов описаны в стандартном пособии "Protective Groups in the Organic Synthesis", 3rd Edition (1999), T.W. Greene and P.G.M. Wuts.
На схемах I-IV выше сокращения "LG" означают уходящую группу. Примерами таких уходящих групп являются, например, Cl, Br, I, метансульфонат (OMs), ацетат (Ac) или просто протон (H).
На схемах II и III термин "окисл. агент" означает окислитель. Окисл. агент 1 представляет собой любой реагент, который обеспечивает превращение первичного спирта в соответствующую карбоновую кислоту. Примерами таких реагентов являются, например, перманганат калия, дихромат пиридиния или тетраоксид рутения. Окисл. агент 2 представляет собой любой реагент, который обеспечивает превращение тиоэфира в соответствующий сульфон. Примерами таких реагентов являются, например, метахлорпербензойная кислота (MCPBA) или пероксимоносульфат калия (Oxone™).
На схеме II показан альтернативный многоступенчатый синтез промежуточного соединения формулы III.
На схеме IV показан синтез некоммерческих первичных спиртов из коммерчески доступных карбоновых кислот. Термин "алкилирующий реагент" в данной схеме означает любой реагент плюс основание или кислоту, если необходимо, который превращает карбоновую кислоту в соответствующий алкиловый эфир. Примерами такого алкилирующего реагента являются, например, йодметан, метанол или триметилсилилдиазометан.
На схемах I-IV выше понятие "растворитель" относится к растворителю, который не взаимодействует с исходными веществами, реагентами, промежуточными соединениями или продуктами таким образом, который неблагоприятно воздействует на выход целевого продукта. Примерами таких растворителей являются, например, диметилформамид, метиленхлорид и ацетонитрил.
Следует понимать, что Cu+ на схемах I и II представляет собой любую соль Cu(I), например Cu(I)O или Cu(I)I.
Следует понимать, что гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (ЭДК) на схемах I, II и III может быть заменен эквивалентными реагентами.
Следует также понимать, что отдельные стадии реакции на схемах I-IV выше могут требовать температуры реакции, которая отличается от комнатной температуры. Нагревание может быть проведено при использовании обычных методов, таких как нагревание реакционной смеси на масляной бане или нагревание реакционной смеси в микроволновой печи. Охлаждение может быть проведено при использовании обычных методов, таких как охлаждение реакционной смеси в ледяной бане или охлаждение сухим льдом в соответствующем растворителе или при использовании криостатического терморегулятора.
Следует понимать, что для соединений формулы Ib и формулы X на схеме II атомы X в одной молекуле могут быть одинаковыми, но это не обязательно должно быть именно так. X может быть только кислородом или только серой в одной молекуле, но он также может быть кислородом в одном положении и серой в другом положении.
Замещенные анилиновые производные формулы II и VI, сложные эфиры акриловой кислоты, спирты или тиолы, несущие R2, а также карбоновые кислоты, спирты или тиолы, несущие A на схемах I-IV выше, коммерчески доступны или могут быть получены, как описано в экспериментальной части в настоящей заявке на патент, или способами, известными специалистам в данной области техники.
Соединения изобретения могут быть выделены из своих реакционных смесей с использованием стандартных методик.
Следует понимать, что энантиомерно чистые или обогащенные соединения формулы Ia и формулы Ib на схемах I-IV выше могут быть получены либо посредством разделения рацемической смеси любого из показанных рацемических промежуточных соединений, либо путем стереоселективного синтеза, если позволяет стадия реакции.
Способы получения соединений формулы (XI)
Соединения формулы XI изобретения могут быть получены, как показано на схеме V ниже. Однако изобретение не ограничено указанными способами. Соединения могут быть также получены, как описано для близких по структуре соединений из предыдущего уровня техники. Реакции могут быть проведены согласно стандартным методикам или как описано в экспериментальном разделе.

Схема V
На схеме V A, R2, R3, n, i и p такие, как определено для соединений формулы (XI) выше. На схеме V символы V, W, X и Y такие, как определено на схеме V.
На схеме V R' обозначает любой заместитель, который инертен к условиям реакции, используемым для показанных промежуточных соединений. Такими заместителями являются, например, алкильные группы или алкоксигруппы. Z в формуле III относится к любым заместителям, которые могут быть присоединены к фосфору и позволяют использовать соединение формулы III в показанной реакции Виттига или Хорнера-Уодсворта-Эммонса. Примерами таких заместителей являются, например, Z=Ph3 (трифенил) или Z=O(OEt)2.
На схеме V выше сокращение "PG" означает защитную группу. PG1 и PG2 обозначают защитные группы для карбоксильных гидроксигрупп и/или спиртовых гидроксигрупп, которые выдерживают необходимые условия реакции для синтеза показанных промежуточных соединений, но могут быть селективно удалены с использованием соответствующего реагента для снятия защиты. Примеры таких защитных групп описаны в стандартном пособии "Protective Groups in the Organic Synthesis", 3rd Edition (1999), T.W. Greene and P.G.M. Wuts.
На схеме V выше термин "реагент" означает реагент, который вызывает селективное отщепление защитной группы. Реагент 1 представляет собой любой реагент, который обеспечивает селективное удаление защитной группы PG1, а реагент 2 представляет собой любой реагент, который обеспечивает селективное удаление защитной группы PG2. Примеры таких реагентов описаны в стандартном пособии "Protective Groups in the Organic Synthesis", 3rd Edition (1999), T.W. Greene and P.G.M. Wuts.
На схеме V термин "основание" относится к любому основанию, которое подходит для показанной стадии реакции.
На схеме V выше понятие "растворитель" относится к растворителю, который не взаимодействует с исходными веществами, реагентами, промежуточными соединениями или продуктами таким образом, который неблагоприятно воздействует на выход целевого продукта. Примерами таких растворителей являются, например, диметилформамид, метиленхлорид и ацетонитрил.
Следует понимать, что гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (ЭДК) на схеме V может быть заменен эквивалентными реагентами.
Следует также понимать, что отдельные стадии реакции на схеме V выше могут потребовать температуры реакции, отличающейся от комнатной температуры. Нагревание может быть проведено при использовании обычных методов, таких как нагревание реакционной смеси на масляной бане или нагревание реакционной смеси в микроволновой печи. Охлаждение может быть проведено при использовании обычных методов, таких как охлаждение реакционной смеси в ледяной бане или охлаждение сухим льдом в соответствующем растворителе, или при использовании криостатического терморегулятора.
Следует понимать, что для соединений формулы XIb и формулы X на схеме V атомы X в одной молекуле могут быть одинаковыми, но это не обязательно должно быть именно так. В одной молекуле X может быть только кислородом или только серой, но он также может быть кислородом в одном положении и серой в другом положении.
Замещенные альдегиды формулы II, α-замещенные производные сложного эфира карбоновой кислоты формулы III, производные фенола или тиофенола формулы VI, производные карбоновой кислоты формулы VII, а также карбоновые кислоты, спирты или тиолы формулы IV на схеме V выше коммерчески доступны или могут быть получены, как описано в экспериментальной части настоящей заявки на патент, или способами, известными специалисту в данной области техники.
Соединения изобретения могут быть выделены из своих реакционных смесей с использованием стандартных методик.
Следует понимать, что энантиомерно чистые или обогащенные соединения формулы XIa и формулы XIb на схеме V выше могут быть получены посредством разделения рацемата любого из показанных рацемических промежуточных соединений либо путем стереоселективного синтеза, если позволяет стадия реакции.
Способы получения соединений формулы CI
Соединения формулы CI изобретения могут быть получены, как показано на схемах VI и VII ниже. Однако изобретение не ограничено указанными способами. Соединения могут быть также получены, как описано для близких по структуре соединений из предыдущего уровня техники. Реакции могут быть проведены согласно стандартным методикам или как описано в экспериментальном разделе.

Схема VI

Схема VII
На схемах VI и VII R1, R2, A, w и p такие, как определено для соединений формулы (CI) выше. Кроме того, следует понимать, что на схемах VI и VII "Y'-X-Y" соответствует "Q" в соединениях формулы (CI).
На схемах VI и VII выше сокращение "PG" означает защитную группу. PG обозначает защитную группу для карбоксильных гидроксигрупп, которая выдерживает необходимые условия реакции для синтеза показанных промежуточных соединений, но может быть удалена с использованием соответствующего реагента для снятия защиты. Примеры таких защитных групп описаны в стандартном пособии "Protective Groups in the Organic Synthesis", 3rd Edition (1999), T.W. Greene and P.G.M. Wuts.
На схемах VI и VII выше термин "реагент" означает реагент, который вызывает селективное отщепление защитной группы. Указанный реагент представляет собой любой реагент, который позволяет удалить защитную группу PG. Примеры таких реагентов описаны в стандартном пособии "Protective Groups in the Organic Synthesis", 3rd Edition (1999), T.W. Greene and P.G.M. Wuts.
На схеме VII термин "Восст. агент" означает восстановитель. Указанный восстановитель представляет собой любой реагент, который обеспечивает восстановление карбоновой кислоты до первичного спирта без восстановления какой-либо другой функциональной группы. Примерами такого реагента являются, например, BH3×ТГФ.
На схемах VI и VII выше понятие "растворитель" относится к растворителю, который не взаимодействует с исходными веществами, реагентами, промежуточными соединениями или продуктами таким образом, который неблагоприятно воздействует на выход целевого продукта. Примерами таких растворителей являются, например, диметилформамид, метиленхлорид и ацетонитрил.
Следует понимать, что в соединениях формулы CI, V, VII, VIII и X на схемах VI и VII атомы X в одной молекуле могут быть одинаковыми, но это не обязательно должно быть именно так. В одной молекуле X может быть только кислородом или только серой, но также он может быть кислородом в одном положении и серой в другом положении.
Следует понимать, что на схемах VI и VII 1-этил-3-(3-диметиламинопропил)карбодиимид (ЭДК) может быть заменен эквивалентными реагентами.
Следует также понимать, что отдельные стадии реакции на схемах VI и VII выше могут потребовать температуры реакции, отличающейся от комнатной температуры. Нагревание может быть проведено при использовании обычных методов, таких как нагревание реакционной смеси на масляной бане или нагревание реакционной смеси в микроволновой печи. Охлаждение может быть проведено при использовании обычных методов, таких как охлаждение реакционной смеси в ледяной бане или охлаждение сухим льдом в соответствующем растворителе, или при использовании криостатического терморегулятора.
Замещенные производные бензойной кислоты формулы II, структурные звенья формулы IV и структурные звенья формулы IX на схемах VI и VII выше коммерчески доступны или могут быть получены, как описано в экспериментальной части настоящей заявки на патент, или способами, известными специалистам в данной области техники.
Соединения изобретения могут быть выделены из своих реакционных смесей с использованием стандартных методик.
Некоторые промежуточные соединения на схемах VI и VII выше, как полагают, являются новыми и заявлены в настоящей заявке в качестве промежуточных соединений, которые могут применяться в получении соединений формулы CIa и CIb.
Способы получения соединений формулы MI
Соединения формулы MI изобретения могут быть получены, как показано на схеме VIII ниже. Однако изобретение не ограничено указанным способом. Соединения могут быть также получены, как описано для близких по структуре соединений из предыдущего уровня техники. Реакции могут быть проведены согласно стандартным методикам или как описано в экспериментальном разделе.

Схема VIII
На схеме VIII R1, R2, X, R3, p, n, i и A определены для соединений формулы MI выше.
На схеме VIII R' обозначает любой заместитель, который инертен к условиям реакции, используемым для показанных промежуточных соединений. Такими заместителями являются, например, алкильные группы или алкоксигруппы.
На схеме VIII выше сокращение "PG" означает защитную группу. PG1 и PG2 обозначают защитные группы для карбоксильных гидроксигрупп и/или спиртовых гидроксигрупп, которые выдерживают необходимые условия реакции для синтеза показанных промежуточных соединений, но могут быть селективно удалены с использованием соответствующего реагента для снятия защиты. Примеры таких защитных групп описаны в стандартном пособии "Protective Groups in the Organic Synthesis", 3rd Edition (1999), T.W. Greene and P.G.M. Wuts.
На схеме VIII выше термин "реагент" означает реагент, который вызывает селективное отщепление защитной группы. Реагент 1 представляет собой любой реагент, который обеспечивает селективное удаление защитной группы PG1, реагент 2 представляет собой любой реагент, который обеспечивает селективное удаление защитной группы PG2. Примеры таких реагентов описаны в стандартном пособии "Protective Groups in the Organic Synthesis", 3rd Edition (1999), T.W. Greene and P.G.M. Wuts.
На схеме VIII термин "основание" относится к любому основанию, которое является подходящим для показанной стадии реакции.
На схеме VIII выше понятие "растворитель" относится к растворителю, который не взаимодействует с исходными веществами, реагентами, промежуточными соединениями или продуктами таким образом, который неблагоприятно воздействует на выход целевого продукта. Примерами таких растворителей являются, например, диметилформамид, метиленхлорид и ацетонитрил.
Следует понимать, что на схеме VIII 1-этил-3-(3-диметиламинопропил)карбодиимид (ЭДК) может быть заменен эквивалентными реагентами.
Следует также понимать, что отдельные стадии реакции на схеме VIII выше могут потребовать температуры реакции, отличающейся от комнатной температуры. Нагревание может быть проведено при использовании обычных методов, таких как нагревание реакционной смеси на масляной бане или нагревание реакционной смеси в микроволновой печи. Охлаждение может быть проведено при использовании обычных методов, таких как охлаждение реакционной смеси в ледяной бане или охлаждение сухим льдом в соответствующем растворителе, или при использовании криостатического терморегулятора.
Следует понимать, что на схеме VIII в соединениях формулы MI и формулы V атомы X в одной молекуле могут быть одинаковыми, но это не обязательно должно быть именно так. В одной молекуле X может быть только кислородом или только серой, но он также может быть кислородом в одном положении и серой в другом положении.
Фенольные или тиофенольные производные формулы II, производные карбоновой кислоты формулы III, а также карбоновые кислоты, спирты или тиолы формулы IV на схеме VIII выше коммерчески доступны или могут быть получены, как описано в экспериментальной части настоящей заявки на патент, или способами, известными специалисту в данной области техники.
Соединения изобретения могут быть выделены из своих реакционных смесей с использованием стандартных методик.
Следует понимать, что энантиомерно чистые или обогащенные соединения формулы MI могут быть получены посредством разделения рацемата любого из показанных рацемических промежуточных соединений либо путем стереоселективного синтеза, если позволяет стадия реакции.
Некоторые промежуточные соединения на схемах I-VIII выше, как полагают, являются новыми и заявлены в настоящей заявке в качестве промежуточных соединений, которые могут применяться в получении соединений формулы I, XI, CI или MI.
Специалисты, квалифицированные в данной области техники, сумеют понять, что с целью получения соединений изобретения в альтернативе и в некоторых случаях, более удобным способом, вышеуказанные отдельные стадии процесса могут быть выполнены в другом порядке и/или отдельные реакции могут быть выполнены на другой стадии методики.
Фармацевтические препараты
Согласно одному аспекту изобретение обеспечивает фармацевтическую композицию, включающую любое из соединений изобретения или его фармацевтически приемлемые производные, в смеси с фармацевтически приемлемыми инертными наполнителями, разбавителями и/или носителями.
Эффект соединения со свойствами мягкого лекарства может быть также повышен посредством подходящей фармацевтической композиции. Такие композиции могут включать, помимо прочего, композиции с замедленным или контролируемым высвобождением. Такая композиция может также предусматривать соответствующее пероральное, трансдермальное или ректальное введение.
Фармакологические свойства
Соединения формулы I, XI, CI и MI обладают активностью в качестве фармацевтических средств, в особенности в качестве модуляторов активности PPAR, и могут применяться для профилактики и/или лечения (профилактического или терапевтического) патологических состояний/заболеваний с воспалительными ответами у людей или животных.
Соединения формулы I, XI, CI и MI эффективны благодаря своему противовоспалительному действию на локальную выработку цитокинов и хемокинов, например, макрофагами, активизированными T-клетками, эпителиальными клетками, благодаря репрессии молекул адгезии, ингибированию экспрессии других воспалительных маркеров, таких как активные формы азота и циклооксигеназы (ЦОГ), индуцированию апоптоза во многих типах клеток, включая T-клетки и макрофаги, репрессии экспрессии молекул адгезии, а также ингибированию продукции компонентов внеклеточного матрикса. Вследствие указанных свойств соединения формулы I, XI, CI и MI, как ожидают, будут улучшать состояние при воспалительных заболеваниях кишечника, таких как болезнь Крона, язвенный колит, проктит, воспаление желудка, глютеновая энтеропатия, аппендицит, микроскопический колит, дистальный проктит, недифференцируемый неспецифический колит. Противовоспалительный эффект соединения формулы I, XI, CI или MI направлен на улучшение клинических симптомов заболевания и качества жизни пациентов. Соединения формулы I, XI, CI и MI, как также ожидают, предотвращают или снижают риск клинического рецидива заболевания.
Соединения формулы I, XI, CI и MI эффективны также в ингибировании высвобождения провоспалительных цитокинов, например, активированными макрофагами, эпителиальными клетками дыхательных путей, ингибируют нейтрофилию, эозинофилию и ассоциированные с ними хемоаттрактанты/факторы выживаемости, ингибируют пролиферацию гладкомышечных клеток сосудов, вызывают апоптоз в многих типах клеток, включая эндотелиальные клетки, T-клетки и макрофаги, а также ингибируют продукцию компонентов внеклеточного матрикса. В качестве эффекта указанных свойств соединения формулы I, XI, CI и MI, как ожидают, будут оказывать противовоспалительное действие при респираторных заболеваниях, таких как аллергическая астма, хроническая обструктивная болезнь легких (ХОБЛ), синдром острой дыхательной недостаточности (СОДН) и легочный фиброз.
Соединения формулы I, XI, CI и MI, кроме того, эффективны в первичном ингибировании высвобождения, например, активированными T-клетками и макрофагами, провоспалительных цитокинов, а также оказывают воздействие на рост/терминацию клеток эпидермиса. В качестве эффекта указанных свойств соединения формулы I, XI, CI и MI, как ожидают, будут оказывать противовоспалительное действие и эпидермальную регуляцию при воспалительных заболеваниях кожи, таких как псориаз, псориатический артрит и атопический дерматит.
Соединения формулы I, XI, CI и MI могут служить противовоспалительными агентами, ингибируя высвобождение провоспалительных цитокинов, хемокинов, активных форм азота, ЦОГ. Вследствие указанных свойств соединения формулы I, XI, CI и MI, как ожидается, будут оказывать противовоспалительное действие при ревматоидном артрите, если соединение сможет доставляться посредством, например, трансдермальной композиции.
Соединения формулы I, XI, CI и MI, кроме того, эффективны в индуцировании подавления клеточного цикла, а также оказывают противовоспалительное действие посредством ингибирования провоспалительных агентов, таких как ЦОГ и СОА. Как следствие, соединение формулы I, XI, CI и MI может оказывать антипролиферативное и противовоспалительное действие при аденокарциномах или других онкологических заболеваниях в желудочно-кишечном тракте (например, при раке желудка, колоректальном раке), дыхательных путях (мелкоклеточный рак легкого), коже или области носа.
В другом аспекте настоящее изобретение обеспечивает применение соединения формулы I, XI, CI и MI для производства лекарственного средства для лечения и/или профилактики болезни Крона.
В другом аспекте настоящее изобретение обеспечивает применение соединения формулы I, XI, CI и MI для производства лекарственного средства для лечения и/или профилактики язвенного колита.
В другом аспекте настоящее изобретение обеспечивает применение соединения формулы I, XI, CI и MI для производства лекарственного средства для лечения и/или профилактики проктита.
В другом аспекте настоящее изобретение обеспечивает применение соединения формулы I, XI, CI и MI для производства лекарственного средства для лечения и/или профилактики воспаления желудка.
В другом аспекте настоящее изобретение обеспечивает применение соединения формулы I, XI, CI и MI для производства лекарственного средства для лечения и/или профилактики глютеновой энтеропатии.
В другом аспекте настоящее изобретение обеспечивает применение соединения формулы I, XI, CI и MI для производства лекарственного средства для лечения и/или профилактики аппендицита.
В дальнейшем аспекте настоящее изобретение обеспечивает применение соединения формулы I, XI, CI и MI для производства лекарственного средства для лечения и/или профилактики микроскопического колита.
В другом аспекте настоящее изобретение обеспечивает применение соединения формулы I, XI, CI и MI для производства лекарственного средства для лечения и/или профилактики дистального проктита.
В другом аспекте настоящее изобретение обеспечивает применение соединения формулы I, XI, CI и MI для производства лекарственного средства для лечения и/или профилактики недифференцируемого неспецифического колита.
В дополнительном аспекте настоящее изобретение обеспечивает способ лечения и/или профилактики болезни Крона, включающий введение эффективного количества соединения формулы I, XI, CI и MI млекопитающему (в частности, человеку), нуждающемуся в этом.
В дополнительном аспекте настоящее изобретение обеспечивает способ лечения и/или профилактики язвенного колита, включающий введение эффективного количества соединения формулы I, XI, CI и MI млекопитающему (в частности, человеку), нуждающемуся в этом.
В дополнительном аспекте настоящее изобретение обеспечивает способ лечения и/или профилактики проктита, включающий введение эффективного количества соединения формулы I, XI, CI и MI млекопитающему (в частности, человеку), нуждающемуся в этом.
В дополнительном аспекте настоящее изобретение обеспечивает способ лечения и/или профилактики воспаления желудка, включающий введение эффективного количества соединения формулы I, XI, CI и MI млекопитающему (в частности, человеку), нуждающемуся в этом.
В дополнительном аспекте настоящее изобретение обеспечивает способ лечения и/или профилактики глютеновой энтеропатии, включающий введение эффективного количества соединения формулы I, XI, CI и MI млекопитающему (в частности, человеку), нуждающемуся в этом.
В дополнительном аспекте настоящее изобретение обеспечивает способ лечения и/или профилактики аппендицита, включающий введение эффективного количества соединения формулы I, XI, CI и MI млекопитающему (в частности, человеку), нуждающемуся в этом.
В дополнительном аспекте настоящее изобретение обеспечивает способ лечения и/или профилактики микроскопического колита, включающий введение эффективного количества соединения формулы I, XI, CI и MI млекопитающему (в частности, человеку), нуждающемуся в этом.
В дополнительном аспекте настоящее изобретение обеспечивает способ лечения и/или профилактики дистального проктита, включающий введение эффективного количества соединения формулы I, XI, CI и MI млекопитающему (в частности, человеку), нуждающемуся в этом.
В дополнительном аспекте настоящее изобретение обеспечивает способ лечения и/или профилактики недифференцируемого неспецифического колита, включающий введение эффективного количества соединения формулы I, XI, CI и MI млекопитающему (в частности, человеку), нуждающемуся в этом.
Комбинированная терапия
Соединения или их фармацевтически приемлемая соль, или сольват, или сольват такой соли, в соответствии с настоящим изобретением, могут быть объединены с другими противовоспалительными или иммунодепрессивными терапевтическими соединениями, схемами лечения, соединениями и агентами, подходящими для лечения заболеваний, в результате чего достигается повышение эффективности и/или снижение побочных эффектов.
Таким образом, изобретение включает способы комбинированного лечения, где соединения или их фармацевтически приемлемая соль, или сольват, или сольват такой соли в соответствии с настоящим изобретением применяются совместно с другими терапевтическими веществами, используемыми для лечения заболеваний, таких как воспалительные заболевания кишечника (ВЗК), например, болезнь Крона, язвенный колит, проктит, воспаление желудка, глютеновая энтеропатия, аппендицит, микроскопический колит, дистальный проктит, недифференцируемый неспецифический колит, аллергическая астма, хроническая обструктивная болезнь легких (ХОБЛ), синдром острой дыхательной недостаточности (СОДН), легочный фиброз, псориаз, псориатический артрит, атопический дерматит, ревматоидный артрит, либо аденокарциномы или другие онкологические заболевания желудочно-кишечного тракта, дыхательных путей, кожи или области носа.
В данном аспекте настоящего изобретения соединения формулы I, XI, CI и MI или их фармацевтически приемлемая соль, или сольват, или сольват такой соли могут быть введены совместно с соединением-агонистом ГКР, например, будесонидом, флутиказоном или преднизолоном.
В другом аспекте настоящего изобретения соединения формулы I, XI, CI и MI или их фармацевтически приемлемая соль, или сольват, или сольват такой соли могут быть введены совместно с 5-АСК соединением или подходящим НПВС. Подходящим 5-АСК соединением является, например, месалазин.
В другом аспекте настоящего изобретения соединения формулы I, XI, CI и MI или их фармацевтически приемлемая соль, или сольват, или сольват такой соли могут быть введены совместно с антибиотиками, например метронидазолом, триметопримом/сульфаметоксазолом, ципрофлоксацином и тетрациклином.
В другом аспекте настоящего изобретения соединения формулы I, XI, CI и MI или их фармацевтически приемлемая соль, или сольват, или сольват такой соли могут быть введены совместно с противовоспалительными антителами, действующими против, например, фактора некроза опухоли (ФНО), например, инфликсимабом.
В другом аспекте настоящего изобретения соединения формулы I, XI, CI и MI или их фармацевтически приемлемая соль, или сольват, или сольват такой соли могут быть введены совместно с ингибитором дигидрофолатредуктазы.
ПРИМЕРЫ
Соединения в настоящей заявке на патент называли, используя функцию AutoNom в ISIS Draw v2.4.
Сокращения
Общие экспериментальные методики для примеров 1-20
Использовали фазовый разделитель от IST. В колоночной флеш-хроматографии использовали нормальнофазовый силикагель 60 (0,040-0,063 мм, Merck) или колонки IST Isolute®SPE с нормальнофазовым силикагелем или ВЭФХ систему Biotage Horizon™ с использованием картриджей с силикагелем FLASH+™ HPFC™. Очистку ВЭЖХ выполняли на препаративной ВЭЖХ системе Gilson с коллектором фракций, запускаемым УФ-детектором, оборудованной колонкой ACE C8 5 мкм 250×20 мм, или на колонке Kromasil C18, или на препаративной ВЭЖХ системе Waters, оборудованной колонкой Kromasil C8 10 мкм 250×21,2 мм, или на препаративной ВЭЖХ системе Waters, оборудованной колонкой ACE C8 5 мкм 250×50 мм или ACE C8 5 мкм 250×20 мм, или на ВЭЖХ системе Waters FractionLynx с коллектором фракций, запускаемым масс-детектором, оборудованной колонкой ACE C8 5 мкм 100×21,2 мм; или на колонке Sunfire C18 5 мкм 19×100 мм, используя буферную систему MeCN/NH4OAc с градиентом от 100% подвижной фазы А (5% MeCN+95% 0,1 М NH4OAc) до 100% подвижной фазы B (100% MeCN), если не указано иное. Спектры1H-ЯМР и13C-ЯМР получали на спектрометре BRUKER ACP 300 или на Varian Unity Plus 400, 500 или 600, работающих на1H частотах 300, 400, 500, 600 МГц, соответственно, и13C частотах 75, 100, 125 и 150 МГц, соответственно. Химические сдвиги даны в значениях δ (м.д.) с растворителями, используемыми в качестве внутреннего стандарта, если не указано иное. Данные масс-спектрометрии получали, используя микросистему Micromass LCT или Waters Q-Tof, при необходимости, регистрируя данные положительных ионов или данные отрицательных ионов. Нагревание микроволновым излучением выполняли с помощью одного узла нагрева, используя системы Smith Creator™ или Emrys Optimizer™ от Personal Chemistry, Uppsala, Sweden. Вращение плоскости поляризации измеряли на поляриметре Perkin Elmer Model 341.
Общие экспериментальные методики для примеров 21-27
Использовали фазовый разделитель от IST. В колоночной флеш-хроматографии использовали нормально-фазовый силикагель 60 (0,040-0,063 мм, Merck) или колонки IST Isolute®SPE с нормально-фазовым силикагелем или ВЭФХ систему Biotage Horizon™ с использованием картриджей с силикагелем FLASH+™ HPFC™. Очистку ВЭЖХ выполняли на препаративной ВЭЖХ системе Gilson с коллектором фракций, запускаемым УФ-детектором, оборудованной колонкой ACE C8 5 мкм 250×20 мм, или на колонке Kromasil C18, или на препаративной ВЭЖХ системе Waters, оборудованной колонкой Kromasil C8 10 мкм 250×21,2 мм, или на препаративной ВЭЖХ системе Waters, оборудованной колонкой ACE C8 5 мкм 250×50 мм или ACE C8 5 мкм 250×20 мм, или на ВЭЖХ системе Waters FractionLynx с коллектором фракций, запускаемым масс-детектором, оборудованной колонкой ACE C8 5 мкм 100×21,2 мм; или на колонке Sunfire C18 5 мкм 19×100 мм, используя буферную систему MeCN/NH4OAc с градиентом от 100% подвижной фазы А (5% MeCN+95% 0,1 М NH4OAc) до 100% подвижной фазы B (100% MeCN), если не указано иное. Спектры1H-ЯМР и13C-ЯМР получали на спектрометре BRUKER ACP 300 или на Varian Unity Plus 400, 500 или 600, работающих на1H частотах 300, 400, 500, 600 МГц, соответственно, и13C частотах 75, 100, 125 и 150 МГц, соответственно. Химические сдвиги даны в значениях δ (м.д.) с растворителями, используемыми в качестве внутреннего стандарта, если не указано иное. Данные масс-спектрометрии получали, используя микросистему Micromass LCT или Waters Q-Tof, при необходимости, регистрируя данные положительных ионов или данные отрицательных ионов. Нагревание микроволновым излучением выполняли с помощью одного узла нагрева, используя системы Smith Creator™ или Emrys Optimizer™ от Personal Chemistry, Uppsala, Sweden.
Общие экспериментальные методики для примеров 28-44
Использовали фазовый разделитель от IST. Флеш-хроматографию выполняли, используя стандартные стеклянные колонки с нормально-фазовым силикагелем 60 (0,040-0,063 мм, Merck). Очистку ВЭЖХ выполняли на ВЭЖХ системе Waters FractionLynx с фракционным коллектором, запускаемым масс-детектором, на колонке Sunfire С18 5 мкм 19×150 мм с использованием буферной системы MeCN/HCO2H с градиентом от 100% подвижной фазы А (5% MeCN+95% 0,1 М HCO2H, pH 3) до 100% подвижной фазы B (100% MeCN). Спектры1H-ЯМР получали на спектрометрах Varian Inova 400 и 600, работающих на1H частотах 400 и 600 МГц. Химические сдвиги приведены в значениях δ (м.д.) с растворителем, используемым в качестве внутреннего стандарта. Объяснение plate-ЯМР: растворы готовили из концентрированного образца, растворенного в (CH3)2SO, и разбавляли (CD3)2SO. Так как в образце присутствует значительное количество (CH3)2SO, сначала выполняли предварительное сканирование, и анализировали, автоматически заглушая пики (CH3)2SO (2,54 м.д.) и H2O (3,3 м.д.). Это означает, что в данном так называемом wet1D эксперименте интенсивность пиков, которые находятся в указанных областях, приблизительно 3,3 м.д. и 2,54 м.д., понижены. Кроме того, в спектре замечены примеси, которые приводят к появлению триплета при 1,12 м.д., синглета при 2,96 м.д. и двух мультиплетов между 2,76-2,70 м.д. и 2,61-2,55 м.д. Данные масс-спектрометрии получали, используя микросистему Micromass LCT или Waters Q-Tof, при необходимости, регистрируя данные положительных ионов или данные отрицательных ионов.
Общие экспериментальные методики для примера 45
Использовали фазовый разделитель от IST. В колоночной флеш-хроматографии использовали нормально-фазовый силикагель 60 (0,040-0,063 мм, Merck) или колонки IST Isolute®SPE с нормально-фазовым силикагелем или ВЭФХ систему Biotage Horizon™ с использованием картриджей с силикагелем FLASH+™ HPFC™. Очистку ВЭЖХ выполняли на препаративной ВЭЖХ системе Gilson с коллектором фракций, запускаемым УФ-детектором, оборудованной колонкой ACE C8 5 мкм 250×20 мм, или на колонке Kromasil C18, или на препаративной ВЭЖХ системе Waters, оборудованной колонкой Kromasil C8 10 мкм 250×21,2 мм, или на препаративной ВЭЖХ системе Waters, оборудованной колонкой ACE C8 5 мкм 250×50 мм или ACE C8 5 мкм 250×20 мм, или на ВЭЖХ системе Waters FractionLynx с коллектором фракций, запускаемым масс-детектором, оборудованной колонкой ACE C8 5 мкм 100×21,2 мм; или на колонке Sunfire C18 5 мкм 19×100 мм, используя буферную систему MeCN/NH4OAc с градиентом от 100% подвижной фазы А (5% MeCN+95% 0,1 М NH4OAc) до 100% подвижной фазы B (100% MeCN), если не указано иное. Спектры1H-ЯМР и13C-ЯМР получали на спектрометре BRUKER ACP 300 или на Varian Unity Plus 400, 500 или 600, работающих на1H частотах 300, 400, 500, 600 МГц, соответственно, и13C частотах 75, 100, 125 и 150 МГц, соответственно. Химические сдвиги даны в значениях δ (м.д.) с растворителями, используемыми в качестве внутреннего стандарта, если не указано иное. Данные масс-спектрометрии получали, используя микросистему Micromass LCT или Waters Q-Tof, при необходимости, регистрируя данные положительных ионов или данные отрицательных ионов. Нагревание микроволновым излучением выполняли с помощью одного узла нагрева, используя системы Smith Creator™ или Emrys Optimizer™ от Personal Chemistry, Uppsala, Sweden.
Синтез исходных веществ и промежуточных соединений для примеров 1-20
(5-метил-2-фенилоксазол-4-ил)уксусная кислота
Названное соединение коммерчески доступно.
2-(5-метил-2-фенилоксазол-4-ил)этанол
Названное соединение коммерчески доступно.
2-фенил-5-трифторметилоксазол-4-карбоновая кислота
Названное соединение коммерчески доступно.
2-фенилпропионовая кислота
Названное соединение коммерчески доступно.
(4-метоксифенил)уксусная кислота
Названное соединение коммерчески доступно.
2-(4-изобутилфенил)пропионовая кислота
Названное соединение коммерчески доступно.
Пиридин-2-илуксусная кислота
Названное соединение коммерчески доступно.
(4-метилпиперазин-1-ил)уксусная кислота
Названное соединение коммерчески доступно.
Метиловый эфир (4-метансульфонилоксифенил)уксусной кислоты
Названное соединение получали, как описано в следующей ссылке:
Organic Letters 2006, 8(5), 987-990.
2-(4-фторфенил)этиловый эфир метансульфоновой кислоты
Названное соединение получали, как описано в следующей ссылке:
US2005/0261341A1.
S-[2-(4-фторфенил)этиловый] эфир тиоуксусной кислоты
Названное соединение получали, как описано в следующей ссылке:
WO03/051826A1.
4-(2-метансульфонилоксиэтил)фениловый эфир метансульфоновой кислоты
Названное соединение получали, как описано в следующей ссылке:
WO2001040169.
(2-фенил-5-трифторметилоксазол-4-ил)метанол
В атмосфере азота 2-фенил-5-трифторметил-оксазол-4-карбоновую кислоту (288 мг, 1,12 ммоль) растворяли в смеси 4:1 сухого ДХМ и MeOH (12,5 мл) и по каплям добавляли триметилсилил-диазометан (134 мг, 1,176 ммоль; 2,0 M раствор в н-гексане). После перемешивания при комнатной температуре в течение 10 мин избыток триметилсилилдиазометана удаляли, добавив несколько капель уксусной кислоты. Растворитель выпаривали с получением неочищенного метилового эфира в виде желтого твердого вещества, которое повторно растворяли в сухом ТГФ в атмосфере азота. LiAlH4 (50 мг, 1,34 ммоль) добавляли несколькими небольшими порциями и перемешивали полученную смесь при комнатной температуре в течение 1,5 ч. Смесь охлаждали до 0°C, а лишний LiAlH4 был гидролизовали, добавив MeOH (5 мл), H2O (10 мл) и 2 н. водн. HCl (5 мл). После экстрагирования ДХМ объединенные органические слои осушали (MgSO4) и выпаривали при пониженном давлении, получая названное соединение в виде масла.1H-ЯМР (400 МГц, CDCl3): δ 8,05-8,09 (д, 2H), 7,43-7,58 (м, 3H), 4,75 (с, 2H).
2-(4-фторфенил)этантиол
S-[2-(4-фторфенил)этиловый] эфир тиоуксусной кислоты (9,9 г, 50 ммоль) растворяли в безводном ТГФ (300 мл), и добавляли несколькими небольшими порциями LiAlH4 (7,5 г, 200 ммоль). После того как добавление закончили, смесь перемешивали в течение 2 ч при комнатной температуре, затем охлаждали до 0°C и гидролизовали избыток LiAlH4, добавив H2O (10 мл) и водн. HCl (2 н., 200 мл). Полученный прозрачный раствор экстрагировали EtOAc (3×200 мл), объединенные органические слои осушали (MgSO4) и выпаривали при пониженном давлении. Неочищенный продукт с неприятным запахом (8,17 г, 104%) использовали на следующей стадии без дополнительной очистки.1H-ЯМР (400 МГц, CDCl3): δ 7,17 (дд, 2H), 7,02 (т, 2H), 2,89 (т, 2H), 2,78 (дд, 2H), 1,38 (т, 1H).
S-[2-(4-метансульфонилоксифенил)этиловый] эфир тиоуксусной кислоты
Тиоуксусную кислоту (0,28 г, 3,73 ммоль) растворяли в безводном MeOH (3 мл) и добавляли Cs2CO3 (1,10 г, 3,39 ммоль). После перемешивания в течение 15 мин при комнатной температуре MeOH выпаривали при пониженном давлении, и оставшееся масло повторно растворяли в безводном ДМФА (3 мл). По каплям добавляли 4-(2-метансульфонилоксиэтил)фениловый эфир метансульфоновой кислоты (1,00 г, 3,39 ммоль), растворенный в безводном ДМФА (2 мл), и перемешивали реакционную смесь при комнатной температуре в течение 4 ч. Затем к реакционной смеси добавляли дополнительное количество тиоуксусной кислоты (0,14 г, 1,86 ммоль). После 30 мин перемешивания смесь распределяли между EtOAc и солевым раствором. Отделенный органический слой осушали (Na2SO4) и, наконец, концентрировали при пониженном давлении. Неочищенный материал очищали с помощью флеш-хроматографии на силикагеле 60 с использованием н-гептана/EtOAc 7:3 в качестве элюента, получая названное соединение в виде масла.1H-ЯМР (400 МГц, CDCl3): δ 7,17-7,25 (м, 4H), 3,10 (с, 3H), 3,05-3,08 (т, 2H), 2,83-2,86 (т, 2H), 2,30 (с, 3H).
4-(2-меркаптоэтил)фениловый эфир метансульфоновой кислоты
S-[2-(4-метансульфонилоксифенил)этиловый] эфир тиоуксусной кислоты (250 мг, 0,91 ммоль) растворяли в безводном ТГФ (2,5 мл), и по частям добавляли LiAlH4 (38 мг, 1,0 ммоль). После окончания добавления смесь нагревали до 50°C и перемешивали в течение 1,5 ч. Смесь охлаждали до 0°C и гидролизовали избыток LiAlH4, добавив H2O (0,8 мл), 2 н. водн. NaOH (1,0 мл) и ТГФ (10 мл). Затем реакционную смесь нагревали с обратным холодильником в течение 30 минут, отфильтровывали выпавшие в осадок соли, а полученный фильтрат разбавляли EtOAc. После экстракции солевым раствором и сушкой над Na2SO4 выпаривали растворитель при пониженном давлении, получая неочищенный продукт в виде масла (232 мг, 94,9%).1H-ЯМР (400 МГц, CDCl3): δ 7,29-7,31 (д, 2H), 7,21-7,23 (д, 2H), 3,31 (с, 3H), 2,81-2,85 (м, 2H), 2,68-2,73 (м, 2H).
Метиловый эфир 4-метансульфонилоксибензойной кислоты
Метиловый эфир 4-гидроксибензойной кислоты (2,29 г, 20 ммоль) растворяли вместе с пиридином (2,02 мл, 25 ммоль) в безводном ТГФ (20 мл), и после охлаждения до 0°C по каплям добавляли метансульфонилхлорид (2,16 мл, 21 ммоль). После добавления ледяную баню убирали, и перемешивали смесь при комнатной температуре в течение 5 ч. Суспензию разбавляли ДХМ и экстрагировали H2O и водн. HCl (2 н.). Наконец, отделенный органический слой осушали (MgSO4) и выпаривали, получая неочищенный продукт в виде масла (4,38 г, 95%).1H-ЯМР (400 МГц, CDCl3): δ 8,07-8,09 (д, 2H), 7,32-7,34 (д, 2H), 3,90 (с, 3H), 3,16 (с, 3H).
4-Гидроксиметилфениловый эфир метансульфоновой кислоты
Метиловый эфир 4-метансульфонилоксибензойной кислоты (330 мг, 1,43 ммоль) растворяли в безводном ТГФ (10 мл) и добавляли LiAlH4 (109 мг, 2,86 ммоль). Полученную суспензию перемешивали при комнатной температуре до тех пор, пока исходного вещества не осталось. Избыток LiAlH4 гидролизовали водн. HCl (2 н.) и экстрагировали оставшуюся суспензию EtOAc. Органический слой отделяли, осушали (MgSO4) и выпаривали, а оставшийся неочищенный продукт очищали с помощью флеш-хроматографии, используя н-гептан/EtOAc 3:7 в качестве элюента, получая названное соединение в виде масла (202 мг, 93%).1H-ЯМР (400 МГц, CDCl3): δ 7,37-7,40 (д, 2H), 7,23-7,25 (д, 2H), 4,67 (шир.с, 2H), 3,10 (с, 3H).
(4-Метансульфонилоксифенил)уксусная кислота
Метиловый эфир (4-метансульфонилоксифенил)уксусной кислоты (615 мг, 2,51 ммоль) растворяли в смеси 1:1 диоксана и воды (6 мл), добавляли водн. раствор LiOH (2 экв., 5,05 мл, 1 н.), и перемешивали смесь при температуре окружающей среды в течение 15 минут. После добавления водн. HCl (3 н.) и EtOAc фазы разделяли, органический слой осушали (MgSO4), фильтровали и выпаривали при пониженном давлении. Названное соединение получали без дополнительной очистки в виде твердого вещества (497 мг, 85,7%).1H-ЯМР (400 МГц, CDCl3): δ 7,35-7,38 (д, 2H), 7,25-7,29 (д, 2H), 3,64 (с, 2H), 3,19 (с, 3H).
Метиловый эфир 2-хлор-3-(4-гидроксиметилфенил)пропионовой кислоты
К раствору (4-аминофенил)метанола (18,47 г, 0,15 моль) в ацетоне (400 мл) и метанол (200 мл) добавляли конц. HCl (54,69 г, 1,5 моль) с последующим добавлением по каплям водного раствора NaNO2 (11,38 г, 0,165 моль) в воде (50 мл) при охлаждении в ледяной бане. Смесь перемешивали в течение 1 ч при 0°C. Ледяную баню убирали и добавляли метилакрилат (64,56 г, 0,75 моль), а затем CuI (4,28 г, 0,022 моль). После перемешивания в течение 6 ч при температуре окружающей среды смесь разбавляли насыщенным водн. раствором NaHCO3 и экстрагировали EtOAc. Объединенные органические слои осушали (MgSO4), а затем выпаривали растворитель при пониженном давлении. Оставшийся неочищенный продукт очищали с помощью хроматографии. Неочищенный продукт очищали с помощью флеш-хроматографии, используя смесь ДХМ/MeOH 95:5 в качестве элюента, получая продукт в виде масла (13,8 г, 32%).1H-ЯМР (400 МГц, CDCl3): δ 7,24 (д, 2H), 7,19 (д, 2H), 4,59-4,63 (м, 2H), 4,42 (т, 1H), 3,72 (с, 3H), 3,36-3,31 (дд, 1H), 3,17-3,12 (дд, 1H), 1,87 (с, 1H).
2,2,2-трихлорэтиловый эфир 2-хлор-3-[4-(2-гидроксиэтил)фенил]пропионовой кислоты
Названное соединение получали из 2-(4-аминофенил)этанола (6,68 г, 48,7 ммоль) и коммерчески доступного 2,2,2-трихлорэтилового эфира акриловой кислоты (19,82 г, 97,44 ммоль) таким же способом, как описано для метилового эфира 2-хлор-3-(4-гидроксиметилфенил)пропионовой кислоты. Неочищенный продукт очищали с помощью многократной флеш-хроматографии, используя ДХМ/MeOH 95:5 в качестве элюента, в результате чего продукт получали в виде масла (1,87 г, 10,7%).1H-ЯМР (300 МГц, CDCl3): δ 7,15-7,29 (м, 4H), 4,54-4,59 (т, 1H), 3,82-3,85 (м, 3H), 3,38-3,45 (дд, 1H), 3,18-3,25 (дд, 1H), 2,79-2,87 (м, 3H).
2,2,2-трихлорэтиловый эфир 2-хлор-3-[4-(3-гидроксипропил)фенил]пропионовой кислоты
Названное соединение получали из 3-(4-аминофенил)пропан-1-ола (1,02 г, 6,72 ммоль) и 2,2,2-трихлорэтилового эфира акриловой кислоты (4,55 г, 22,17 ммоль) таким же способом, как описано для метилового эфира 2-хлор-3-(4-гидроксиметилфенил)пропионовой кислоты. Неочищенный продукт очищали с помощью флеш-хроматографии, используя ДХМ/iPrOH 95:5 в качестве элюента, в результате чего продукт получали в виде масла (0,74 г, 29,4%).1H-ЯМР (300 МГц, CDCl3): δ 7,08-7,30 (м, 4H), 4,56-4,60 (т, 1H), 3,63-3,65 (м, 3H), 3,35-3,43 (дд, 1H), 3,18-3,25 (дд, 1H), 2,63-2,68 (м, 3H), 1,84-1,86 (м, 2H).
2,2,2-трихлорэтиловый эфир 3-(4-карбоксиметилфенил)-2-хлорпропионовой кислоты
Названное соединение получали из 2-(4-аминофенил)уксусной кислоты (1,00 г, 6,61 ммоль) и 2,2,2-трихлорэтилового эфира акриловой кислоты (6,73 г, 33,08 ммоль), как описано для метилового эфира 2-хлор-3-(4-гидроксиметилфенил)пропионовой кислоты. Неочищенный продукт очищали с помощью флеш-хроматографии, используя ДХМ/MeOH 95:5 в качестве элюента, получая продукт в виде масла (1,17 г, 47,3%).1H-ЯМР (300 МГц, CDCl3): δ 7,17-7,33 (м, 4H), 4,73 (с, 2H), 4,52-4,56 (т, 1H), 3,60-3,63 (м, 2H), 3,37-3,42 (дд, 1H), 3,17-3,23 (дд, 1H).
Метиловый эфир 3-[4-(трет-бутилдиметилсиланилоксиметил)-фенил]-2-хлорпропионовой кислоты
Метиловый эфир 2-хлор-3-(4-гидроксиметилфенил)пропионовой кислоты (10,6 г, 46,5 ммоль) растворяли вместе с имидазолом (3,8 г, 55,8 ммоль) в безводном ДХМ (200 мл), и несколькими порциями при 0°C добавляли трет-бутилдиметилсилилхлорид (7,0 г, 46,5 ммоль). После добавления охлаждающую баню убирали, и продолжали перемешивание при температуре окружающей среды в течение 17 ч. Смесь разбавляли водой (100 мл) и водн. HCl (50 мл, 2 н.), а затем экстрагировали. После многократной промывки водой (100 мл) органический слой осушали (MgSO4) и выпаривали при пониженном давлении, получая неочищенный продукт в виде масла (15,8 г, 84%).1H-ЯМР (400 МГц, CDCl3): δ 7,17 (д, 2H), 7,08 (д, 2H), 4,63 (с, 2H), 4,34 (т, 1H), 3,64 (с, 3H), 3,27 (дд, 1H), 3,07 (дд, 1H), 0,84 (с, 9H), 0,00 (с, 6H).
Метиловый эфир 3-[4-(трет-бутилдиметилсиланилоксиметил)-фенил]-2-[2-(4-фторфенил)этилсульфанил]пропионовой кислоты
К раствору метилового эфира 3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-хлорпропионовой кислоты (6,56 г, 42 ммоль) в безводном ДМФА (200 мл) при 0°C добавляли Cs2CO3 (14,34 г, 44 ммоль). После перемешивания в течение 30 минут, по каплям добавляли 2-(4-фторфенил)этантиол (13,72 г, 40 ммоль), растворенный в безводном ДМФА (100 мл), и полученную смесь перемешивали в течение 18 ч, не убирая охлаждающую баню. Смесь разбавляли Et2O и трижды экстрагировали H2O. Органическую фазу концентрировали при пониженном давлении, а остаток снова растворяли в Et2O и многократно экстрагировали H2O. После высушивания отделенного органического слоя над MgSO4 растворитель удаляли при пониженном давлении, получая неочищенный продукт в виде оранжевого масла, которое очищали с помощью хроматографии, используя н-гептан/EtOAc 20:1 в качестве элюента. Целевой продукт получали в виде масла (4,93 г, 25,4%).1H-ЯМР (400 МГц, CDCl3): δ 7,16 (д, 2H), 7,06-6,99 (м, 4H), 6,88 (т, 2H), 4,62 (с, 2H), 3,58 (с, 3H), 3,41 (дд, 1H), 3,10 (дд, 1H), 2,82 (дд, 1H), 2,74-2,76 (м, 4H), 0,85 (с, 9H), 0,00 (с, 6H).
3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-[2-(4-фторфенил)этилсульфанил]пропионовая кислота
Метиловый эфир 3-[4-(трет-бутилдиметилсиланилоксиметил)-фенил]-2-[2-(4-фторфенил)-этилсульфанил]пропионовой кислоты (4,93 г, 10,66 ммоль) растворяли в ТГФ (100 мл) и воде (50 мл), а затем охлаждали до 0°C. Добавляли NaOH (6,39 г, 159,88 ммоль) и перемешивали полученную суспензию в течение 1 ч, не убирая охлаждающую баню, а затем дополнительные 28 ч при температуре окружающей среды. 2 н. HCl добавляли, пока pH не достигал 2, и экстрагировали смесь EtOAc (3×100 мл). Объединенные органические слои осушали (MgSO4) и выпаривали при пониженном давлении, получая неочищенный продукт, который непосредственно использовали на следующей стадии (4,79 г, 95,3%).1H-ЯМР (400 МГц, CDCl3): δ 7,16 (д, 2H), 7,06 (д, 2H), 6,99 (м, 2H), 6,85 (т, 2H), 4,62 (с, 2H), 3,38 (т, 1H), 3,09 (дд, 1H), 2,71-2,82 (м, 5H), 0,844 (с, 9H), 0,00 (с, 6H). Масс-спектр: M-H+ 447,10.
2,2,2-трихлорэтиловый эфир 3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-[2-(4-фторфенил)этилсульфанил]пропионовой кислоты
К раствору 3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-[2-(4-фторфенил)этилсульфанил]пропионовой кислоты (4,79 г, 10,68 ммоль) и 2,2,2-трихлорэтанола (1,67 г, 11,22 ммоль) в безводном ДХМ (300 мл) сначала добавляли ЭДК×HCl (2,66 г, 13,89 ммоль), а затем ДМАП (13 мг, 0,1 ммоль) в атмосфере азота при 0°C. После добавления убирали охлаждающую баню, и перемешивали реакционную смесь при температуре окружающей среды, пока исходного вещества не оставалось. Смесь разбавляли водой и водн. HCl (2 н.), и экстрагировали ДХМ. Объединенные органические слои осушали (MgSO4), а растворитель выпаривали при пониженном давлении, получая неочищенный продукт, который непоредственно использовали на следующей стадии (5,47 г, 88,3%).1H-ЯМР (400 МГц, CDCl3): δ 7,16 (т, 2H), 7,10 (д, 2H), 7,01 (т, 2H), 6,87 (т, 2H), 4,61 (кв., 4H), 3,48 (дд, 1H), 3,12 (дд, 1H), 2,73-2,89 (м, 5H), 0,85 (с, 9H), 0,00 (с, 6H). Масс-спектр: M-H+ 579,03.
2,2,2-трихлорэтиловый эфир 2-[2-(4-фторфенил)этилсульфанил]-3-(4-гидроксиметилфенил)пропионовой кислоты
К раствору 2,2,2-трихлорэтилового эфира 3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-[2-(4-фторфенил)этилсульфанил]пропионовой кислоты (5,47 г, 9,43 ммоль) в безводном ацетонитриле (200 мл) при 0°C по каплям добавляли BF3×Et2O (1,10 мл, 9,43 ммоль). Смесь перемешивали в течение 30 мин, добавляли 2 н. водн. HCl (50 мл) и H2O (100 мл), и экстрагировали смесь ДХМ. Объединенные органические слои осушали (MgSO4) и выпаривали с получением неочищенного продукта, который очищали с помощью флеш-хроматографии, используя ДХМ/MeOH 95:5 в качестве элюента. Продукт получали как (3,62 г, 82,5%).1H-ЯМР (400 МГц, CDCl3): δ 7,19 (д, 2H), 7,10 (д, 2H), 7,01 (м, 2H), 6,87 (т, 2H), 4,65 (д, 1H), 4,56 (м, 3H), 3,48 (дд, 1H), 3,12 (дд, 1H), 2,73-2,91 (м, 5H). Масс-спектр: M-H+ 464,90.
2,2,2-трихлорэтиловый эфир 2-[2-(4-фторфенил)этилсульфанил]-3-[4-(2-гидроксиэтил)фенил]пропионовой кислоты
Названное соединение получали из 2,2,2-трихлорэтилового эфира 2-хлор-3-[4-(2-гидроксиэтил)фенил]пропионовой кислоты (2,57 г, 7,14 ммоль) и 2-(4-фторфенил)этантиола (1,23 г, 7,85 ммоль), как описано для метилового эфира 3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-[2-(4-фторфенил)этилсульфанил]пропионовой кислоты. После очистки с помощью флеш-хроматографии с использованием н-гептана/EtOAc 5:1 в качестве элюента продукт получали в виде масла (1,0 г, 29,2%).1H-ЯМР (300 МГц, CDCl3): δ 7,10-7,14 (м, 6H), 6,93-6,99 (т, 2H), 4,65-4,76 (кв., 2H), 3,82-3,86 (т, 2H), 3,55-3,60 (дд, 2H), 3,17-3,25 (дд, 2H), 2,81-3,00 (м, 7H).
2,2,2-трихлорэтиловый эфир 2-[2-(4-фторфенил)этилсульфанил]-3-[4-(3-гидроксипропил)фенил]пропионовой кислоты
Названное соединение получали из 2,2,2-трихлорэтилового эфира 2-хлор-3-[4-(3-гидроксипропил)фенил]пропионовой кислоты (0,74 г, 1,98 ммоль) и 2-(4-фторфенил)этантиола (0,34 г, 2,17 ммоль), как описано для метилового эфира 3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-[2-(4-фторфенил)этилсульфанил]пропионовой кислоты. После многократной очистки с помощью флеш-хроматографии с использованием н-гептана/EtOAc 9:1 в качестве элюента продукт получали в виде масла (94 мг, 9,6%).1H-ЯМР (300 МГц, CDCl3): δ 7,10-7,11 (м, 6H), 6,94-6,98 (т, 2H), 4,65-4,75 (кв., 2H), 3,64-3,68 (т, 2H), 3,58-3,61 (дд, 2H), 3,17-3,23 (дд, 2H), 2,80-2,97 (м, 5H), 2,65-2,70 (т, 2H), 1,86-1,89 (м, 2H).
2,2,2-трихлорэтиловый эфир 3-(4-карбоксиметилфенил)-2-[2-(4-фторфенил)этилсульфанил]пропионовой кислоты
Названное соединение получали из 2,2,2-трихлорэтилового эфира 3-(4-карбоксиметилфенил)-2-хлорпропионовой кислоты (1,17 г, 3,13 ммоль) и 2-(4-фторфенил)этантиола (0,53 г, 3,44 ммоль), как описано для метилового эфира 3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-[2-(4-фторфенил)этилсульфанил]пропионовой кислоты. После очистки с помощью флеш-хроматографии с использованием н-гептана/EtOAc 10:1 в качестве элюента продукт получали в виде твердого вещества (611 мг, 39,6%).1H-ЯМР (300 МГц, CDCl3): δ 7,09-7,23 (м, 6H), 6,94-6,99 (м, 2H), 4,65-4,77 (кв., 2H), 3,56-3,61 (м, 3H), 3,18-3,28 (дд, 1H), 2,78-3,02 (м, 5H).
4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойная кислота
2,2,2-трихлорэтиловый эфир 2-[2-(4-фторфенил)этилсульфанил]-3-(4-гидроксиметилфенил)пропионовой кислоты (0,81 г, 1,74 ммоль) растворяли в ацетоне (75 мл) и добавляли перманганат калия (0,33 г, 2,09 ммоль). Полученный фиолетовый раствор перемешивали в течение 18 ч. Затем сначала добавляли насыщенным водн. Na2SO3 (15 мл), а после перемешивания в течение 5 мин также добавляли 2 н. водн. HCl (30 мл). Полученный прозрачный и бесцветный раствор экстрагировали EtOAc и CH2Cl2, объединенные органические слои осушали (MgSO4) и выпаривали при пониженном давлении, получая неочищенный продукт, который очищали с помощью флеш-хроматографии на силикагеле, используя ДХМ/MeOH 95:5 в качестве элюента. Названный продукт получали в виде твердого вещества (556 мг, 66,6%).1H-ЯМР (400 МГц, CDCl3): δ 8,02 (д, 2H), 7,29 (д, 2H), 7,07-7,10 (м, 2H), 6,94 (т, 2H), 4,70 (кв., 2H), 3,57 (дд, 1H), 3,29 (дд, 1H), 3,05 (дд, 1H), 2,81-2,91 (м, 4H). Масс-спектр: M-H+ 478,93.
2,2,2-трихлорэтиловый эфир 3-(4-карбоксиметилфенил)-2-[2-(4-фторфенил)этансульфонил]пропионовой кислоты
Раствор 2,2,2-трихлорэтилового эфира 3-(4-карбоксиметилфенил)-2-[2-(4-фторфенил)этилсульфанил]пропионовой кислоты (400 мг, 0,81 ммоль) в безводном ДХМ охлаждали до 0°C, и добавляли несколькими порциями 3-хлорпербензойную кислоту (294 мг, 1,70 ммоль). После 15 мин перемешивания ледяную баню убирали и продолжали реакцию при температуре окружающей среды в течение 36 ч. К реакции добавляли ТГФ, вызвавший выпадение белого осадка. Негомогенную реационную смесь фильтровали через фазовый разделитель, наполненный NaHCO3. Фильтрат осушали (Na2SO4) и выпаривали при пониженном давлении, получая слегка желтоватое твердое вещество, которое растворяли в EtOAc и экстрагировали насыщенным водн. NaHCO3 и солевым раствором. После высыхания органической фазы над Na2SO4 растворитель снова выпаривали, и получали названное соединение в виде твердого вещества (372 мг, 87,2%). Дополнительную очистку не проводили.1H-ЯМР (400 МГц, CDCl3): δ 6,71-6,79 (м, 6H), 6,56-6,60 (т, 2H), 4,28 (д, 2H), 3,05-3,17 (м, 6H), 2,90-2,98 (м, 3H), 2,73-2,77 (т, 2H).
2-фенил-5-трифторметил-оксазол-4-илметиловый эфир 4-[2-[2-(4-фторфенил)-этилсульфанил]-2-(2,2,2-трихлор-этоксикарбонил)-этил]-бензойной кислоты
К раствору 4-[2-[2-(4-фторфенил)-этилсульфанил]-2-(2,2,2-трихлор-этоксикарбонил)-этил]-бензойной кислоты (278 мг, 0,58 ммоль) и (2-фенил-5-трифторметил-оксазол-4-ил)-метанола (155 мг, 0,64 ммоль) в безводном ДХМ (20 мл) сначала добавляли ЭДК×HCl (144 мг, 0,75 ммоль), а затем в атмосфере азота при 0°C ДМАП (1,0 мг, 0,006 моль). После добавления убирали охлаждающую баню, и перемешивали реакционную смесь при температуре окружающей среды, пока исходного вещества не оставалось. Смесь разбавляли водой и водн. HCl (2 н.), и экстрагировали ДХМ. Объединенные органические слои осушали (MgSO4), а растворитель выпаривали при пониженном давлении. Неочищенный продукт очищали с помощью флеш-хроматографии, используя н-гептан/EtOAc 4:1 в качестве элюента, получая конечный продукт в виде масла (289 мг, 56,6%).1H-ЯМР (400 МГц, CDCl3): δ 8,02 (д, 2H), 7,93 (д, 1H), 7,40-7,47 (м, 2H), 7,19-7,29 (м, 4H), 7,02 (дт, 2H), 6,89 (дт, 2H), 5,34 (д, 2H), 4,64 (кв., 2H), 3,50 (дд, 1H), 3,18-3,24 (дд, 1H), 2,73-2,98 (м, 5H), 1,1 (с, 2H). Масс-спектр: M-H+ 703,91.
4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензиловый эфир 2-фенил-5-трифторметилоксазол-4-карбоновой кислоты
Названное соединение получали из 2,2,2-трихлорэтилового эфира 2-[2-(4-фторфенил)этилсульфанил]-3-(4-гидроксиметилфенил)пропионовой кислоты (675 мг, 1,45 ммоль) и 2-фенил-5-трифторметилоксазол-4-карбоновой кислоты (410 мг, 1,59 ммоль) таким же способом, как описано для 2-фенил-5-трифторметилоксазол-4-илметилового эфира 4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты. Неочищенный продукт получали в виде масла, которое использовали на следующей стадии без дополнительной очистки (892 мг, 79,4%).1H-ЯМР (500 МГц, CDCl3): δ 8,15 (д, 2H), 7,57 (д, 1H), 7,52 (т, 2H), 7,41 (д, 2H), 7,12 (т, 2H), 6,97 (т, 2H), 5,42 (с, 2H), 4,72 (кв., 2H), 3,59 (дд, 1H), 3,25 (дд, 1H), 2,78-3,05 (м, 5H). Масс-спектр: M+H+ 705,9.
2-(5-метил-2-фенилоксазол-4-ил)этиловый эфир 4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты
Названное соединение получали из 4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты (220 мг, 0,46 ммоль) и 2-(5-метил-2-фенилоксазол-4-ил)этанола (103 мг, 0,50 ммоль) таким же способом, как описано для 2-фенил-5-трифторметилоксазол-4-илметилового эфира 4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты. Неочищенный продукт очищали с помощью флеш-хроматографии, используя н-гептан/EtOAc 7:3 в качестве элюента, получая конечный продукт в виде масла (280 мг, 83,5%).1H-ЯМР (400 МГц, CDCl3): δ 7,91-7,96 (м, 3H), 7,39-7,41 (м, 3H), 7,22-7,25 (м, 3H), 7,06-7,09 (м, 2H), 6,94 (т, 2H), 4,71 (м, 1H), 4,64 (м, 1H), 4,56 (т, 1H), 3,88-3,92 (м, 2H), 3,55 (м, 1H), 3,29 (м, 1H), 2,69-2,04 (м, 6H), 2,32 (с, 3H). Масс-спектр: M+H+ 666,14, M-H+ 664,39.
2,2,2-трихлорэтиловый эфир 2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(5-метил-2-фенилоксазол-4-ил)ацетоксиметил]фенил}пропионовой кислоты
Названное соединение получали из 2,2,2-трихлорэтилового эфира 2-[2-(4-фторфенил)этилсульфанил]-3-(4-гидроксиметилфенил)пропионовой кислоты (512 мг, 1,1 ммоль) и 2-(5-метил-2-фенилоксазол-4-ил)уксусной кислоты (261 мг, 1,2 ммоль) таким же способом, как описано для 2-фенил-5-трифторметилоксазол-4-илметилового эфира 4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты. Продукт получали без дополнительной очистки в виде масла (751 мг, 94,1%).1H-ЯМР (500 МГц, CDCl3): δ 8,06 (д, 2H), 7,44 (м, 3H), 7,29 (м, 2H), 7,20 (д, 2H), 7,10-7,13 (м, 2H), 6,98 (т, 2H), 5,16 (с, 2H), 4,73 (кв., 2H), 3,58 (дд, 1H), 3,22 (дд, 1H), 2,84-3,00 (м, 5H). Масс-спектр: M+H+ 666,00.
4-метансульфонилоксибензиловый эфир 4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты
Названное соединение получали из 4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты (65 мг, 0,135 ммоль) и 4-гидроксиметилфенилового эфира метансульфоновой кислоты (27,4 мг, 0,136 ммоль) таким же способом, как описано для 2-фенил-5-трифторметилоксазол-4-илметилового эфира 4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты. Неочищенный продукт очищали с помощью флеш-хроматографии, используя в качестве элюента н-гептан/EtOAc 7:3, получая конечный продукт в виде масла (47,6 мг, 45%).1H-ЯМР (400 МГц, CDCl3): δ 7,95-7,97 (д, 2H), 7,47-7,49 (д, 2H), 7,24-7,29 (м, 4H), 7,07-7,08 (м, 2H), 6,91-6,95 (м, 2H), 5,33 (с, 2H), 4,62-4,75 (дд, 2H), 3,55 (т, 1H), 3,25 (т, 1H), 3,13 (с, 3H), 2,79-3,04 (м, 6H). Масс-спектр: M-H+ 663,04.
2,2,2-трихлорэтиловый эфир 2-[2-(4-фторфенил)этансульфонил]-3-[4-(4-трифторметилбензилоксикарбонилметил)фенил]пропионовой кислоты
2,2,2-трихлорэтиловый эфир 3-(4-карбоксиметилфенил)-2-[2-(4-фторфенил)этансульфонил]пропионовой кислоты (121 мг, 0,23 ммоль) растворяли в безводном ДМФА (2,0 мл), и в атмосфере азота добавляли TBTU (147 мг, 0,46 ммоль), N-метилморфолин (46,5 мг, 0,46 ммоль) и 4-(трифторметил)бензиловый спирт (81,06 мг, 0,46 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 18 ч. Затем добавляли EtOAc, и смесь экстрагировали водой и солевым раствором. После высушивания органического слоя над Na2SO4, растворитель выпаривали при пониженном давлении, получая неочищенный продукт в виде масла (161 мг, 102,3%). Дополнительной очистки не проводили.1H-ЯМР (400 МГц, CDCl3): δ 7,44-7,62 (м, 6H), 7,12-7,23 (м, 4H), 6,97-7,02 (т, 2H) 5,14 (с, 2H), 4,74 (с, 2H), 4,69 (д, 1H), 3,62 (с, 2H), 3,34-58 (м, 4H), 3,15-3,19 (т, 2H).
2,2,2-трихлорэтиловый эфир 2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-метансульфонилоксифенил)этилсульфанилкарбонил]фенил}-пропионовой кислоты
4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойную кислоту (60 мг, 0,125 ммоль) растворяли в безводном ДХМ и добавляли оксалилхлорид (0,14 ммоль) с последующим добавлением каталитического количества ДМФА. После перемешивания в течение 30 мин при температуре окружающей среды реакционную смесь концентрировали, выпаривая растворитель при пониженном давлении. Оставшееся масло снова растворяли в безводном ДХМ, и в атмосфере азота добавляли ДМАП (1,0 мг). Затем по каплям добавляли 4-(2-меркаптоэтил)фениловый эфир метансульфоновой кислоты, растворенный в безводном ДХМ, и перемешивали реакционную смесь в течение 18 ч при температуре окружающей среды. Добавляли EtOAc, и смесь экстрагировали водн. KHSO4, водн. Na2CO3 и солевым раствором. Органический слой осушали (Na2SO4), фильтровали и, наконец, концентрировали при пониженном давлении с получением неочищенного названного соединения в виде масла (78 мг, 89,9%). Дополнительной очистки не проводили.1H-ЯМР (400 МГц, CDCl3): δ 7,06-7,24 (м, 10H), 6,93-6,95 (т, 2H), 4,65-4,70 (дд, 2H), 3,58 (м, 2H), 3,18 (м, 2H), 3,10 (с, 3H), 2,87-2,95 (м, 4H), 2,74-2,82 (м, 3H).
Синтез исходных веществ и промежуточных соединений для примеров 21-27
(5-метил-2-фенилоксазол-4-ил)уксусная кислота
Названное соединение коммерчески доступно.
(4-трет-бутоксикарбониламинофенил)уксусная кислота
Названное соединение коммерчески доступно.
Метиловый эфир 4-гидроксибензойной кислоты
Названное соединение коммерчески доступно.
3-бензил-4-бензилоксибензальдегид
Названное соединение синтезировали согласно следующей ссылке:
WO2001040172A1
4-бензилокси-3-метилбензальдегид
Названное соединение синтезировали согласно следующей ссылке:
Bioorganic & Medicinal Chemistry Letters 13 (3), 399-403, 2003.
Этиловый эфир (диэтоксифосфорил)этоксиуксусной кислоты
Названное соединение синтезировали согласно следующей ссылке:
Organic Process Research & Development 7 (1), 82-88, 2003.
4-(трет-бутилдиметилсиланилоксиметил)бензальдегид
Bioorganic & Medicinal Chemistry Letters 5 (4), 363-366, 1995.
Этиловый эфир (S)-2-этокси-3-(4-гидроксифенил)пропионовой кислоты
Названное соединение получали согласно следующей ссылке:
WO2001040159A1
Метиловый эфир 4-метансульфонилоксибензойной кислоты
Метиловый эфир 4-гидроксибензойной кислоты (3,19 г, 21 ммоль) растворяли вместе с пиридином (1,97 г, 25 ммоль) в сухом ТГФ (20 мл) и после охлаждения до 0°C по каплям добавляли метансульфонилхлорид (2,29 г, 20 ммоль). Ледяную баню убирали и перемешивали смесь при комнатной температуре в течение 5 ч. После разбавления ДХМ и экстракции водой и водн. HCl (2 н.) органический слой осушали (MgSO4) и выпаривали, получая не подвергавшийся очистке, но при этом очень чистый продукт в виде твердого вещества, которое использовали на следующей стадии без дополнительной очистки (4,38 г, 95,1%).1H-ЯМР (400 МГц, CDCl3): δ 8,07-8,09 (д, 2H), 7,32-7,34 (д, 2H), 3,90 (с, 3H), 3,16 (с, 3H).
4-гидроксиметилфениловый эфир метансульфоновой кислоты
В атмосфере азота метиловый эфир 4-метансульфонилоксибензойной кислоты (2,3 г, 10 ммоль) растворяли в безводном ТГФ (50 мл), и добавляли LiAlH4 (0,28 г, 10 ммоль) при 0°C. После добавления ледяную баню убирали, и продолжали перемешивание при комнатной температуре в течение 2 ч. Смесь снова охлаждали до 0°C, а избыток LiAlH4 гидролизовали, добавив MeOH, H2O и водн. HCl (2 н.). После экстрагирования ДХМ объединенные органические слои осушали (MgSO4) и выпаривали при пониженном давлении, получая не подвергавшийся очистке, но при этом достаточно чистый продукт в виде масла, которое использовали на следующей стадии без дополнительной очистки (1,95 г, 96,4%).1H-ЯМР (400 МГц, CDCl3): δ 7,35-7,37 (д, 2H), 7,21-7,23 (д, 2H), 4,65 (с, 2H), 3,09 (с, 3H).
Бензиловый эфир (S)-2-этокси-3-(4-гидроксифенил)пропионовой кислоты
Этиловый эфир (S)-2-этокси-3-(4-гидроксифенил)пропионовой кислоты (8,1 г, 34 ммоль) растворяли в бензиловом спирте (14,7 г, 135 ммоль), и в атмосфере азота осторожно добавляли только что промытый гидрид натрия (1,63 г, 41 ммоль). Полученную смесь нагревали до 50°C в вакууме, через 6 ч добавляли толуол, и экстрагировали смесь водн. KHSO4 (2 н.). Объединенные органические слои осушали и выпаривали в высоком вакууме при 70°C, получая названное соединение в виде масла (9,51 г, 93,1%).1H-ЯМР (400 МГц, CDCl3): δ 7,19-7,40 (м, 5H), 7,03-7,06 (д, 2H), 6,68-6,71 (д, 2H), 5,14 (с, 2H), 4,03-4,06 (т, 1H), 3,57-3,61 (м, 1H), 3,36-3,40 (м, 1H), 2,97 (с, 1H), 1,14-1,18 (т, 3H).
Бензиловый эфир (S)-3-{4-[2-(4-трет-бутоксикарбониламинофенил)ацетокси]фенил}-2-этоксипропионовой кислоты
К раствору (4-трет-бутоксикарбониламинофенил)уксусной кислоты (100 мг, 0,39 ммоль), N,N'-диизопропилкарбодиимида (60 мг, 0,47 ммоль) и ДМАП (15 мг, 0,12 ммоль) в сухом ацетонитриле (15 мл) добавляли бензиловый эфир (S)-2-этокси-3-(4-гидроксифенил)пропионовой кислоты (120 мг, 0,39 ммоль). Смесь перемешивали в течение 3 ч при комнатной температуре, затем растворитель выпаривали, а оставшийся неочищенный продукт непосредственно очищали с помощью ВЭЖХ. Названное соединение получали в виде твердого вещества (48 мг, 22,6%).1H-ЯМР (400 МГц, CDCl3): δ 7,25-7,36 (м, 9H), 7,16-7,18 (д, 2H), 6,91-6,93 (д, 2H), 5,12 (с, 2H), 4,00-4,03 (дд, 1H), 3,77 (с, 2H), 3,55-3,29 (м, 1H), 3,30-3,36 (м, 1H), 2,97-2,99 (м, 2H), 1,51 (с, 9H), 1,11-1,14 (т, 3H).
Бензиловый эфир (S)-2-этокси-3-{4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}пропионовой кислоты
К раствору (5-метил-2-фенилоксазол-4-ил)уксусной кислоты (3,29 г, 15,2 ммоль) и бензилового эфира (S)-2-этокси-3-(4-гидроксифенил)пропионовой кислоты (4,56 г, 15,2 ммоль) в сухом ДХМ (70 мл) в атмосфере азота добавляли ЭДК×HCl (3,49 г, 18,22 ммоль) и ДМАП (0,37 г, 3,03 ммоль). После перемешивания в течение 1 ч при температуре окружающей среды, смесь экстрагировали насыщенным водн. NaHCO3, водн. HCl (0,05 н.) и снова насыщенным водн. NaHCO3. Органический слой осушали, а оставшийся неочищенный продукт очищали с помощью ВЭЖХ. Названное соединение получали в виде масла (4,15 г, 54,7%).1H-ЯМР (400 МГц, CDCl3): δ 7,99-7,80 (д, 2H), 7,25-7,43 (м, 8H), 7,18-7,20 (д, 2H), 6,99-7,01 (д, 2H), 5,12 (с, 2H), 4,01-4,04 (м, 1H), 3,80 (с, 2H), 3,57-3,61 (м, 1H), 3,31-3,35 (м, 1H), 2,98-3,00 (м, 2H), 2,41 (с, 3H), 1,11-1,15 (т, 3H).
Этиловый эфир (E/Z)-3-(3-бензил-4-бензилоксифенил)-2-этоксиакриловой кислоты
В атмосфере азота только что полученный KOtBu (5,01 г, 44,6 ммоль) суспендировали в трет-бутилметиловом эфире (150 мл) и по каплям добавляли этиловый эфир (диэтоксифосфорил)этоксиуксусной кислоты (7,98 г, 29,7 ммоль). Через 60 мин перемешивания смесь охлаждали до 0°C, и небольшими порциями добавляли 3-бензил-4-бензилоксибензальдегид (4,50 г, 14,88 ммоль). Ледяную баню убирали, и перемешивали гомогенные смеси при комнатной температуре в течение дополнительных 60 мин перед разбавлением водой и диэтиловым эфиром. Фазы разделяли, и повторно экстрагировали водный слой диэтиловым эфиром. Объединенные органические слои осушали (Na2SO4) и выпаривали, а оставшийся неочищенный продукт очищали с помощью хроматографии на колонке, используя н-гептан/EtOAc (4:1) в качестве элюента. Названное соединение получали в виде масла, являющегося смесью E/Z изомеров (3,96 г, 51,2%).1H-ЯМР (400 МГц, CDCl3): δ 7,60-7,63 (м, 2H), 7,18-7,39 (м, 10H), 6,91 (с, 1H), 5,10 (с, 2H), 4,22-4,30 (кв., 2H), 4,09 (с, 2H), 3,89-3,95 (кв., 2H), 1,33-1,39 (т, 3H), 1,27-1,31 (т, 3H).
Этиловый эфир (E/Z)-3-(4-бензилокси-3-метилфенил)-2-этоксиакриловой кислоты
Названное соединение получали из этилового эфира (диэтоксифосфорил)этоксиуксусной кислоты (9,53 г, 35,53 ммоль) и 4-бензилокси-3-метилбензальдегида (2,68 г, 11,85 ммоль) таким же способом, как описано для этилового эфира 3-(3-бензил-4-бензилоксифенил)-2-этоксиакриловой кислоты. Неочищенный продукт очищали с помощью флеш-хроматографии, используя в качестве элюента смесь н-гептан/EtOAc/ДХМ (8:1:1). Названное соединение получали в виде масла, являющегося смесью E/Z изомеров (2,70 г, 53,6%).1H-ЯМР (400 МГц, CDCl3): δ 7,69 (с, 1H), 7,61 (с, 1H), 7,29-7,48 (м, 10Н), 6,99-7,02 (м, 2H), 6,96 (с, 1H), 6,88 (д, 1H), 6,78 (д, 1H), 6,08 (с, 1H), 5,11 (с, 2H), 5,09 (с, 2H), 4,27-4,33 (кв., 2H), 4,12-4,19 (кв., 2H), 3,96-4,02 (кв., 2H), 3,87-3,94 (кв., 2H), 2,32 (с, 3H), 2,25 (с, 3H), 1,31-1,42 (м, 9H), 1,10-1,18 (т, 3H).
Этиловый эфир (E/Z)-3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-этоксиакриловой кислоты
Названное соединение получали из 4-(трет-бутилдиметилсиланилоксиметил)бензальдегида (5,88 г, 23,5 ммоль) и 4-бензилокси-3-метилбензальдегида (12,6 г, 47 ммоль) таким же способом, как описано для этилового эфира 3-(3-бензил-4-бензилоксифенил)-2-этоксиакриловой кислоты. Неочищенный продукт использовали в виде смеси E/Z изомеров на следующей стадии без дополнительной очистки (8,85 г, 103%).1H-ЯМР (400 МГц, CDCl3): δ 7,65-7,67 (д, 2H), 7,07-7,24 (3д, 6H), 6,89 (с, 1H), 6,01 (с, 1H), 4,65 (с, 2H), 4,62 (с, 2H), 3,82-4,22 (5 м, 8H), 1,18,1,28 (м, 12H), 0,86 (с, 9H), 0,85 (с, 9H), 0,02 (с, 6H), 0,00 (с, 6H).
Этиловый эфир 3-(3-бензил-4-гидроксифенил)-2-этоксипропионовой кислоты
В атмосфере азота этиловый эфир (E/Z)-3-(3-бензил-4-бензилоксифенил)-2-этоксиакриловой кислоты (2,3 г, 5,5 ммоль) растворяли в EtOH (50 мл), добавляли и Pd/C (10% Pd, 0,1 г). Реакционную емкость закрывали, вакуумировали и подсоединяли к линии подачи водорода. Через 24 ч перемешивания при комнатной температуре в атмосферном давлении, катализатор удаляли фильтрованием, многократно промывали EtOH, после чего объединенные фильтраты концентрировали в вакууме, получая неочищенный продукт, который очищали с помощью колоночной хроматографии, используя н-гептан/EtOAc (7:3) в качестве элюента. Названное соединение получали как (2,02 г, 90%).1H-ЯМР (400 МГц, CDCl3): δ 7,19-7,25 (м, 5H), 6,96-6,99 (м, 2H), 6,66-6,68 (д, 1H), 4,09-4,15 (кв., 2H), 3,94-3,97 (м, 3H), 3,56-3,59 (м, 1H), 3,31-3,36 (м, 1H), 2,91-2,92 (д, 2H), 1,12-1,16 (т, 3H), 1,18-1,22 (т, 3H). Масс-спектр: M-H+ 327,08.
Этиловый эфир 2-этокси-3-(4-гидрокси-3-метилфенил)пропионовой кислоты
Названное соединение получали из этилового эфира (E/Z)-3-(4-бензилокси-3-метилфенил)-2-этоксиакриловой кислоты (2,7 г, 7,93 ммоль) таким же способом, как описано для этилового эфира 3-(3-бензил-4-гидроксифенил)-2-этоксипропионовой кислоты. Неочищенный продукт использовали на следующей стадии без дополнительной очистки (1,9 г, 85%).1H-ЯМР (400 МГц, CDCl3): δ 6,96 (с, 1H), 6,88-6,92 (д, 1H), 6,64-6,67 (д, 1H), 4,13-4,20 (кв., 2H), 3,96-4,00 (т, 1H), 3,56-3,62 (м, 1H), 3,34-3,39 (м, 1H), 2,90-2,92 (д, 2H), 2,19 (с, 3H), 1,14-1,28 (м, 6H).
Этиловый эфир 3-[4-(трет-бутилдиметилсиланилоксиметил)-фенил]-2-этоксипропионовой кислоты
Названное соединение получали из этилового эфира (E/Z)-3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-этоксиакриловой кислоты (8,7 г, 23,8 ммоль) таким же способом, как описано для этилового эфира 3-(3-бензил-4-гидроксифенил)-2-этоксипропионовой кислоты. Неочищенный продукт использовали на следующей стадии без дополнительной очистки (7,78 г, 89%).1H-ЯМР (400 МГц, CDCl3): δ 7,10-7,19 (м, 4H), 4,62 (с, 2H), 4,04-4,10 (кв., 2H), 3,89-3,92 (т, 1H), 3,48-3,53 (м, 1H), 3,23-3,27 (м, 1H), 2,89-2,91 (м, 2H), 1,08 (т, 3H), 1,05 (т, 3H), 0,85 (с, 9H), 0,00 (с, 6H).
3-(3-бензил-4-гидроксифенил)-2-этоксипропионовая кислота
К раствору этилового эфира 3-(3-бензил-4-гидроксифенил)-2-этоксипропионовой кислоты (0,38 г, 1,16 ммоль) в MeOH (5 мл) добавляли раствор KOH (1,62 г, 29 ммоль) в H2O (5 мл). Смесь перемешивали в течение 2 ч при комнатной температуре, затем подкисляли водн. HCl (10%) и экстрагировали дихлорметаном. Объединенные органические слои осушали и выпаривали, а оставшийся неочищенный продукт очищали с помощью колоночной хроматографии, получая названное соединение в виде масла (0,35 г, 74,8%). Масс-спектр: M+H+ 300,94, M-H+ 298,99.
2-этокси-3-(4-гидрокси-3-метилфенил)пропионовая кислота
Названное соединение получали из этилового эфира 2-этокси-3-(4-гидрокси-3-метилфенил)пропионовой кислоты (0,85 г, 2,28 ммоль) таким же способом, как описано для 3-(3-бензил-4-гидроксифенил)-2-этоксипропионовой кислоты. Неочищенный продукт использовали на следующей стадии без дополнительной очистки (0,71 г, 85%).1H-ЯМР (400 МГц, CDCl3): δ 6,98 (с, 1H), 6,90-6,93 (д, 1H), 6,64-6,66 (д, 1H), 4,03-4,07 (дд, 1H), 3,57-3,65 (м, 1H), 3,41-3,46 (м, 1H), 2,88-3,05 (дд, 2H), 2,20 (с, 3H), 1,15-1,20 (т, 3H).
3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-этоксипропионовая кислота
Названное соединение получали из этилового эфира 3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-этоксипропионовой кислоты (1,1 г, 3,0 ммоль) таким же способом, как описано для 3-(3-бензил-4-гидроксифенил)-2-этоксипропионовой кислоты. Неочищенный продукт получали в виде твердого вещества и использовали на следующей стадии без дополнительной очистки (0,73 г, 65%).1H-ЯМР (400 МГц, CDCl3): δ 7,11-7,18 (м, 4H), 4,63 (с, 2H), 3,96-3,99 (м, 1H), 3,48-3,52 (м, 1H), 3,31-3,37 (м, 1H), 3,01-3,05 (дд, 1H), 2,87-2,92 (дд, 1H), 1,07 (т, 3H), 0,85 (с, 9H), 0,00 (с, 6H).
Бензиловый эфир 3-(3-бензил-4-гидроксифенил)-2-этоксипропионовой кислоты
Оксалилхлорид (0,364 г, 2,87 ммоль) по каплям добавляли к смеси 3-(3-бензил-4-гидроксифенил)-2-этоксипропионовой кислоты (0,345 г, 1,15 ммоль) и каталитического количества ДМФА в сухом ДХМ (2,0 мл). Смесь перемешивали в течение 17 ч при комнатной температуре с последующей отгонкой оксалилхлорида в вакууме. Оставшийся хлорангидрид карбоновой кислоты повторно растворяли в сухом ДХМ (3,0 мл), и в атмосфере азота добавляли бензиловый спирт (0,15 г, 1,38 ммоль). После перемешивания в течение 24 ч при комнатной температуре растворитель удаляли в вакууме, а полученное масло очищали с помощью колоночной хроматографии, используя ДХМ/MeOH (96:4) в качестве элюента, получая названное соединение в виде масла (0,22 г, 36,8%). Масс-спектр: М-H+ 388,94.
Бензиловый эфир 2-этокси-3-(4-гидрокси-3-метилфенил)пропионовой кислоты
Названное соединение получали из 2-этокси-3-(4-гидрокси-3-метилфенил)пропионовой кислоты (0,71 г, 3,15 ммоль) таким же способом, как описано для бензилового эфира 3-(3-бензил-4-гидроксифенил)-2-этоксипропионовой кислоты. Неочищенный продукт очищали с помощью колоночной хроматографии, используя н-гептан/EtOAc (3:2) в качестве элюента, и получали названное соединение в виде масла (0,51 г, 51,6%).1H-ЯМР (400 МГц, CDCl3): δ 7,26-7,38 (м, 5H), 6,96 (с, 1H), 6,97-6,91 (д, 1H), 6,65-6,67 (д, 1H), 5,16 (с, 2H), 4,08-4,12 (т, 1H), 3,61-3,66 (м, 1H), 3,39-3,44 (м, 1H), 2,96-2,99 (д, 2H), 2,20 (с, 3H), 1,17-1,22 (т, 3H).
2,2,2-трихлорэтиловый эфир 3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-этоксипропионовой кислоты
В атмосфере азота 3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-этоксипропионовую кислоту (0,135 г, 0,4 ммоль) и 2,2,2-трихлорэтанол (0,06 г, 0,4 ммоль) растворяли в сухом ДХМ (5 мл) и добавляли ДМАП (2 мг, 0,02 ммоль) с последующим добавлением ЭДК×HCl (0,092 г, 0,48 ммоль) при 0°C. Смесь перемешивали в течение 18 ч при температуре окружающей среды, а затем разбавляли ДХМ и экстрагировали водн. HCl (2 н.) и водой. Органический слой отделяли, осушали (MgSO4) и выпаривали, получая неочищенный продукт, который использовали на следующей стадии без дополнительной очистки (0,176 г, 93,6%).1H-ЯМР (400 МГц, CDCl3): δ 7,12-7,19 (м, 4H), 4,62-4,71 (кв., 2H), 4,63 (с, 2H), 4,05-4,08 (м, 1H), 3,55-3,59 (м, 1H), 3,27-3,31 (м, 1H), 2,92-3,03 (м, 2H), 1,08 (т, 3H).
2,2,2-трихлорэтиловый эфир 2-этокси-3-(4-гидроксиметилфенил)пропионовой кислоты
К раствору 2,2,2-трихлорэтилового эфира 3-[4-(трет-бутилдиметилсиланилоксиметил)фенил]-2-этоксипропионовой кислоты (0,07 г, 0,15 ммоль) в ацетонитриле добавляли BF3×Et2O (0,02 мл, 0,15 ммоль) при 0°C. Смесь перемешивали в течение 30 мин при указанной температуре, а затем вливали водн. HCl (2 н.) и экстрагировали ДХМ. Отделенный органический слой промывали водой, осушали (MgSO4) и выпаривали при пониженном давлении, получая названное соединение, которое использовали на следующей стадии без очистки (0,044 г, 83%).1H-ЯМР (400 МГц, CDCl3): δ 7,24-7,29 (м, 4H), 4,70-4,80 (кв., 2H), 4,65 (с, 2H), 4,13-4,16 (дд, 1H), 3,63-3,67 (м, 1H), 3,35-3,39 (м, 1H), 3,01-3,13 (м, 2H), 1,16 (т, 3H).
4-[2-этокси-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойная кислота
2,2,2-прихлорэтиловый эфир 2-этокси-3-(4-гидроксиметилфенил)пропионовой кислоты (0,044 г, 0,125 ммоль) растворяли в ацетоне (3 мл), добавляли KMnO4 (0,039 г, 0,247 ммоль), и перемешивали фиолетовый раствор в течение 4 ч при комнатной температуре. Затем добавляли насыщенный водн. раствор Na2SO3, и после 2 мин перемешивания смесь разбавляли EtOAc и водн. HCl (2 н.), получая в результате две прозрачных и бесцветных фазы. Органический слой отделяли, осушали (MgSO4) и выпаривали, получая требуемую карбоновую кислоту, которую использовали на следующей стадии без дополнительной очистки (0,034 г, 75%).1H-ЯМР (400 МГц, CDCl3): δ 8,01-8,03 (д, 2H), 7,36-7,38 (д, 2H), 4,73-4,83 (кв., 2H), 4,15-4,18 (м, 1H), 3,65-3,69 (м, 1H), 3,33-3,37 (м, 1H), 3,07-3,20 (м, 2H), 1,14 (т, 3H).
Бензиловый эфир 3-{3-бензил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}-2-этоксипропионовой кислоты
К раствору бензилового эфира 3-(3-бензил-4-гидроксифенил)-2-этоксипропионовой кислоты (45 мг, 0,11 моль) и (5-метил-2-фенилоксазол-4-ил)уксусной кислоты (25 мг, 0,11 ммоль) в сухом ДХМ (2,0 мл) добавляли сначала ДМАП (2,8 мг, 0,02 ммоль), а затем ЭДК×HCl (26,5 мг, 0,13 ммоль), после чего смесь перемешивали в атмосфере азота при комнатной температуре в течение 17 ч. Растворитель удаляли в вакууме, а продукт выделяли из оставшегося масла с помощью колоночной хроматографии, используя н-гептан/EtOAc (4:1) в качестве элюента. Названное соединение получали в виде масла (56,1 мг, 82,6%).1H-ЯМР (400 МГц, CDCl3): δ 7,95 (м, 2H), 7,40 (м, 2H), 7,32 (м, 2H), 7,25 (м, 2H), 6,98-67,20 (м, 10H), 5,08, (д, 2H), 3,97 (т, 1H), 3,85 (с, 2H), 3,70 (с, 2H), 3,55 (м, 1H), 3,28 (м, 1H), 2,93 (д, 2H), 2,32 (с, 3H), 1,1 (т, 3H).
Бензиловый эфир 3-{3-бензил-4-[2-(4-трет-бутоксикарбониламинофенил)ацетокси]фенил}-2-этоксипропионовой кислоты
Названное соединение получали из бензилового эфира 3-(3-бензил-4-гидроксифенил)-2-этоксипропионовой кислоты (48 мг, 0,123 моль) и (4-трет-бутоксикарбониламинофенил)уксусной кислоты (31 мг, 0,123 ммоль) таким же способом, как описано для бензилового эфира 3-{3-бензил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}-2-этоксипропионовой кислоты. Неочищенный продукт очищали с помощью колоночной хроматографии с использованием н-гептан/EtOAc (7:3) в качестве растворителя, получая продукт в виде масла (65,1 мг, 72,2%).1H-ЯМР (400 МГц, CDCl3): δ 6,90-7,32 (м, 17H), 6,42 (шир.с, 1H), 5,08 (д, 2H), 3,97-3,98 (м, 1H), 3,73 (с, 2H), 3,67 (с, 2H), 3,51-3,60 (м, 1H), 3,22-3,32 (м, 1H), 2,92-2,94 (м, 2H), 1,51 (с, 9H), 1,06-1,10 (т, 3H). Масс-спектр: M-H+ 622,87.
Бензиловый эфир 2-этокси-3-{3-метил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}пропионовой кислоты
Названное соединение получали из бензилового эфира 2-этокси-3-(4-гидрокси-3-метилфенил)пропионовой кислоты (311 мг, 0,98 ммоль) и (5-метил-2-фенилоксазол-4-ил)уксусной кислоты (215 мг, 0,98 ммоль) таким же способом, как описано для бензилового эфира 3-{3-бензил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}-2-этоксипропионовой кислоты. Неочищенный продукт очищали с помощью колоночной хроматографии, используя ДХМ/iPrOH (95:5) в качестве элюента, получая чистый продукт в виде твердого вещества (480 мг, 94,5%).1H-ЯМР (400 МГц, CDCl3): δ 7,98-8,02 (м, 2H), 7,26-7,44 (м, 8H), 6,91-7,05 (м, 3H), 5,12 (с, 2H), 4,01-4,05 (т, 1H), 3,82 (с, 2H), 3,56-3,59 (м, 1H), 3,34-3,37 (м, 1H), 2,95-2,97 (д, 2H), 2,43 (с, 3H), 2,11 (с, 3H), 1,12-1,17 (т, 3H).
Бензиловый эфир 3-{4-[2-(4-трет-бутоксикарбониламинофенил)ацетокси]-3-метилфенил}-2-этоксипропионовой кислоты
Названное соединение получали из бензилового эфира 2-этокси-3-(4-гидрокси-3-метилфенил)пропионовой кислоты (38 мг, 0,15 ммоль) и (4-трет-бутоксикарбониламинофенил)уксусной кислоты (47 мг, 0,15 ммоль) таким же способом, как описано для бензилового эфира 3-{3-бензил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}-2-этоксипропионовой кислоты. Неочищенный продукт очищали с помощью колоночной хроматографии, используя н-гептан/EtOAc (2:3) в качестве элюента, получая продукт в виде твердого вещества (32 мг, 85%).1H-ЯМР (400 МГц, CDCl3): δ 7,26-7,38 (м, 9H), 6,99-7,02 (м, 2H), 6,83-6,86 (д, 1H), 6,49 (шир.с, 1H), 5,12 (с, 2H), 4,00-4,05 (т, 1H), 3,80 (с, 2H), 3,58-3,61 (м, 1H), 3,31-3,36 (м, 1H), 2,94-2,96 (д, 2H), 1,98 (с, 3H), 1,52 (с, 9H), 1,12-1,16 (т, 3H).
4-метансульфонилоксибензиловый эфир 4-[2-этокси-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты
Названное соединение получали из 4-[2-этокси-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты (0,032 г, 0,087 ммоль) и 4-гидроксиметилфенилового эфира метансульфоновой кислоты (0,018 г, 0,09 ммоль) таким же способом, как описано для бензилового эфира 3-{3-бензил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}-2-этоксипропионовой кислоты. Неочищенный продукт очищали с помощью колоночной хроматографии, используя н-гептан/EtOAc (2:3) в качестве элюента, получая названное соединение в виде твердого вещества (0,023, 47%).1H-ЯМР (400 МГц, CDCl3): δ 7,96-7,98 (д, 2H), 7,47-7,49 (д, 2H), 7,33-7,35 (д, 2H), 7,27-7,29 (д, 2H), 5,33 (с, 2H), 4,68-4,81 (кв., 2H), 4,15 (м, 1H), 3,65 (м, 1H), 3,32 (м, 1H), 3,08-3,15 (м, 2H), 3,13 (с, 3H), 1,13 (т, 3H).
Синтез исходного вещества и промежуточных соединений для примеров 28-44
2,2,2-трихлорэтиловый эфир 2-бромметилбензойной кислоты
К суспензии 2-(бромметил)бензойной кислоты (1,0 г, 4,65 ммоль), β-трихлорэтанола (0,54 мл, 5,58 ммоль) и ДМАП (0,057 г, 0,465 ммоль) в ДХМ (20 мл) добавляли ЭДК×HCl (1,34 г, 6,98 ммоль) при 0°C. Раствор перемешивали при 0°C в течение 0,5 ч, после чего давали возможность нагреться до комнатной температуры и перемешивали в течение ночи. Добавляли воду, и разделяли фазы через фазовый разделитель. Органическую часть концентрировали и в неочищенном виде подвергали флеш-хроматографии с использованием гептана и EtOAc (90/10) в качестве элюента, получая названное соединение (0,80 г, 50%) в виде масла;1H-ЯМР (400 МГц, CDCl3): δ 4,99 (с, 2H), 5,08 (с, 2H), 7,46 (м, 1H), 7,60 (м, 2H), 8,13 (д, 1H).
2,2,2-трихлорэтиловый эфир 2-(3-карбоксиметилфенилсульфанилметил)бензойной кислоты
Карбонат цезия (1,69 г, 5,20 ммоль) добавляли к смеси 3-меркаптофенилуксусной кислоты (0,73 г, 4,33 ммоль) и 2,2,2-трихлорэтилового эфира 2-бромметилбензойной кислоты (1,50 г, 4,33 ммоль) в ДМФА (25 мл). Смесь перемешивали в течение 1 ч при комнатной температуре. Затем добавляли воду, и промывали смесь диэтиловым эфиром. Водную фазу подкисляли (pH 5-3) 2 M HCl, после чего экстрагировали диэтиловым эфиром. Объединенные органические фазы осушали (Na2SO4) и концентрировали с получением указанного в заголовке соединения (1,88 г, 100%);1H-ЯМР (400 МГц, CDCl3): δ 3,50 (с, 2H), 4,46 (с, 2H), 4,88 (с, 2H), 7,01-7,08 (м, 1H), 7,10-7,16 (м, 4H), 7,22-7,35 (м, 2H), 8,00 (д, 1H); масс-спектр: M-H+ 432.
2,2,2-трихлорэтиловый эфир 2-[3-(4-трифторметилбензилоксикарбонилметил)фенилсульфанилметил]-бензойной кислоты
(4-трифторметилфенил)метанол (58 мг, 0,332 ммоль) добавляли к перемешиваемой смеси 2,2,2-трихлорэтилового эфира 2-(3-карбоксиметилфенилсульфанилметил)бензойной кислоты (120 мг, 0,277 ммоль), ЭДК×HCl (80 мг, 0,415 ммоль), ДМАП (3,4 мг, 0,028 ммоль) и ДХМ (4 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем добавляли дополнительное количество ДХМ, промывали смесь 0,25 M HCl, органическую фазу осушали с помощью фазового разделителя и концентрировали. Неочищенный продукт подвергали флеш-хроматографии с использованием в качестве элюента гептана и EtOAc (90/10), получая указанное в заголовке соединение (105 мг, 64%) в виде бесцветного масла;1H-ЯМР (400 МГц, CDCl3): δ 3,62 (с, 2H), 4,54 (с, 2H), 4,96 (с, 2H), 5,18 (с, 2H), 7,09-7,15 (м, 1H), 7,18-7,24 (м, 4H), 7,30-7,43 (м, 4H), 7,60 (д, 2H), 8,08 (д, 1H); масс-спектр: M-H+ 590.
2,2,2-трихлорэтиловый эфир 2-(4-карбоксифенилсульфанилметил)бензойной кислоты
Названное соединение получали в соответствии с методикой, описанной выше для 2,2,2-трихлорэтилового эфира 2-(3-карбоксиметилфенилсульфанилметил)бензойной кислоты, из 4-меркаптобензойной кислоты (60 мг, 0,389 ммоль), 2,2,2-трихлорэтилового эфира 2-бромметилбензойной кислоты (135 мг, 0,389 ммоль), карбоната цезия (152 мг, 0,467 ммоль) и ДМФА (2 мл). Неочищенный материал (85 мг, 52%) использовали на следующей стадии без дополнительной очистки;1H-ЯМР (400 МГц, CDCl3): δ 4,70 (с, 2H), 5,15 (с, 2H), 7,40 (д, 2H), 7,44-7,60 (м, 3H), 7,82 (д, 2H), 7,96 (д, 1H), 12,9 (шир.с, 1H); масс-спектр: M-H+ 418.
2,2,2-трихлорэтиловый эфир 2-(4-гидроксиметилфенилсульфанилметил)бензойной кислоты
К раствору 2,2,2-трихлорэтилового эфира 2-(4-карбоксифенилсульфанилметил)бензойной кислоты (80 мг, 0,191 ммоль) в ТГФ (1 мл) при 0°C по капелям добавляли BH3-ТГФ (0,4 мл, 1,0 M раствор в ТГФ). Реакционную смесь перемешивали при 0°C в течение 0,5 ч после завершения добавления, затем охлаждающую баню убирали, и перемешивали реакционную смесь в течение 2 ч при комнатной температуре. Реакцию останавливали при 0°C, осторожно вливая смесь ТГФ/H2O 80/20 с последующим добавлением 2 M HCl по каплям. Смесь перемешивали в течение дополнительных 10 минут, после чего разбавляли водой. ТГФ удаляли, и экстрагировали водную фазу ДХМ, объединенную органическую фазу осушали с помощью фазового разделителя и концентрировали, получая указанное в заголовке соединение (70 мг, 91%) в виде масла;1H-ЯМР (400 МГц, CDCl3): δ 4,53 (с, 2H), 4,64 (с, 2H), 4,94 (с, 2H), 7,19-7,30 (м, 5H), 7,30-7,36 (м, 1H), 7,37-7,44 (м, 1H), 8,06 (д, 1H).
2,2,2-трихлорэтиловый эфир 2-{4-[2-(4-трифторметилфенил)ацетоксиметил]фенилсульфанилметил}бензойной кислоты
2,2,2-трихлорэтиловый эфир 2-(4-гидроксиметилфенилсульфанилметил)бензойной кислоты (70 мг, 0,173 ммоль) добавляли к перемешиваемой смеси (4-трифторметилфенил)уксусной кислоты (39 мг, 0,190 ммоль), ЭДК×HCl (50 мг, 0,259 ммоль), ДМАП (2,1 мг, 0,017 ммоль) и ДХМ (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи, при этом согласно анализу ЖХ-МС реакция не была завершена полностью. После этого добавляли дополнительное количество ЭДК×HCl (50 мг, 0,259 ммоль), ДМАП (2,1 мг, 0,017 ммоль) и 2,2,2-трихлорэтилового эфира 2-(4-гидроксиметилфенилсульфанилметил)бензойной кислоты (70 мг, 0,173 ммоль), и перемешивали смесь в течение 3 ч. Затем добавляли дополнительное количество ДХМ, и промывали смесь 0,25 M HCl, органическую часть осушали с помощью фазового разделителя и концентрировали, получая указанное в заголовке соединение (112 мг, 100%); масс-спектр: М-H+ 590.
2,2,2-трихлорэтиловый эфир 2-(4-карбоксиметилфенилсульфанилметил)бензойной кислоты
Названное соединение получали в соответствии с методикой, описанной выше для 2,2,2-трихлорэтилового эфира 2-(3-карбоксиметилфенилсульфанилметил)бензойной кислоты, из 4-меркаптофенилуксусной кислоты (0,73 г, 4,33 ммоль), 2,2,2-трихлорэтилового эфира 2-бромметилбензойной кислоты (1,50 г, 4,33 ммоль), карбоната цезия (1,69 г, 5,20 ммоль) и ДМФА (25 мл). Неочищенный материал (1,88 г, 100%) использовали на следующей стадии без дополнительной очистки; масс-спектр: M-H+ 432.
2,2,2-трихлорэтиловый эфир 2-[4-(4-трифторметилбензилоксикарбонилметил)фенилсульфанилметил]-бензойной кислоты
Названное соединение получали в соответствии с методикой, описанной выше для 2,2,2-трихлорэтилового эфира 2-[3-(4-трифторметилбензилоксикарбонилметил)фенилсульфанилметил]-бензойной кислоты, из 2,2,2-трихлорэтилового эфира 2-(4-карбоксиметилфенилсульфанилметил)бензойной кислоты (155 мг, 0,357 ммоль), (4-трифторметилфенил)метанола (157 мг, 0,893 ммоль), ЭДК×HCl (206 мг, 1,072 ммоль), ДМАП (4,4 мг, 0,036 ммоль) и ДХМ (3 мл). Неочищенный продукт подвергали флеш-хроматографии с использованием гептана и EtOAc (90/10) в качестве элюента, получая указанное в заголовке соединение (74 мг, 35%) в виде масла;1H-ЯМР (400 МГц, CDCl3): δ 3,64 (дд, 2H), 4,54 (с, 2H), 4,96 (с, 2H), 5,17 (с, 2H), 7,16 (д, 2H), 7,18-7,28 (м, 3H), 7,31-7,44 (м, 4H), 7,60 (д, 2H), 8,08 (д, 1H); масс-спектр: M-H+ 590.
2,2,2-трихлорэтиловый эфир 2-{3-[1-(4-трифторметилфенил)этоксикарбонилметил]фенилсульфанилметил}-бензойной кислоты
Названное соединение получали в соответствии с методикой, описанной выше для 2,2,2-трихлорэтилового эфира 2-[3-(4-трифторметилбензилоксикарбонилметил)фенилсульфанилметил]-бензойной кислоты, из 2,2,2-трихлорэтилового эфира 2-(3-карбоксиметилфенилсульфанилметил)бензойной кислоты (168 мг, 0,387 ммоль), 1-(4-трифторметилфенил)этанола (88 мг, 0,465 ммоль), ЭДК×HCl (111 мг, 0,581 ммоль), ДМАП (4,7 мг, 0,039 ммоль) и ДХМ (5 мл). Неочищенный продукт подвергали флеш-хроматографии с использованием гептана и EtOAc (90/10) в качестве элюента, получая указанное в заголовке соединение (157 мг, 67%) в виде масла;1H-ЯМР (400 МГц, CDCl3): δ 1,52 (д, 3H), 3,59 (дд, 2H), 4,52 (с, 2H), 4,96 (с, 2H), 5,90 (м, 2H), 7,09-7,12 (м, 1H), 7,17-7,23 (м, 4H), 7,30-7,42 (м, 4H), 7,57 (д, 2H), 8,08 (д, 1H); масс-спектр: M-H+ 604.
2,2,2-трихлорэтиловый эфир 2-{3-[2-(4-трифторметилфенил)этоксикарбонилметил]фенилсульфанилметил}-бензойной кислоты
Названное соединение получали в соответствии с методикой, описанной выше для 2,2,2-трихлорэтилового эфира 2-[3-(4-трифторметилбензилоксикарбонилметил)фенилсульфанилметил]-бензойной кислоты, из 2,2,2-трихлорэтилового эфира 2-(3-карбоксиметилфенилсульфанилметил)бензойной кислоты (168 мг, 0,387 ммоль), 1-(4-трифторметилфенил)этанола (88 мг, 0,465 ммоль), ЭДК×HCl (111 мг, 0,581 ммоль), ДМАП (4,7 мг, 0,039 ммоль) и ДХМ (4 мл). Неочищенный продукт подвергали флеш-хроматографии с использованием гептана и EtOAc (90/10) в качестве элюента, получая указанное в заголовке соединение (160 мг, 68%) в виде масла;1H-ЯМР (400 МГц, CDCl3): δ 2,67 (дд, 2H), 3,23 (с, 2H), 4,03 (дд, 2H), 4,27 (с, 2H), 4,67 (с, 2H), 6,74 (шир.д, 1H), 6,85-6,99 (м, 6H), 7,06 (дд, 1H), 7,13 (дд, 1H), 7,22 (д, 2H), 7,79 (д, 1H); масс-спектр: M-H+ 604.
Синтез исходных веществ и промежуточных соединений для примера 45
Бензиловый эфир 4-гидроксибензойной кислоты
Названное соединение коммерчески доступно.
Трет-бутиловый эфир 2-бром-2-метилпропионовой кислоты
Названное соединение коммерчески доступно
5-хлорметил-4-метил-2-(4-трифторметилфенил)тиазол
Названное соединение коммерчески доступно.
Бензиловый эфир 4-(1-трет-бутоксикарбонил-1-метилэтокси)бензойной кислоты
Гидрид натрия (0,664 г, 26,28 ммоль) добавляли к раствору бензилового эфира 4-гидроксибензойной кислоты (5,0 г, 21,90 ммоль) и трет-бутилового эфира 2-бром-2-метилпропионовой кислоты (5,86 г, 26,28 ммоль) в ДМФА (50 мл). Полученную смесь нагревали до 80°C и перемешивали в течение 1 ч, после чего добавляли дополнительное количество трет-бутилового эфира 2-бром-2-метилпропионовой кислоты (5,86 г, 26,28 ммоль) и гидрида натрия (0,664 г, 26,28 ммоль). Через 18 ч при 80°C с помощью ЖХ-МС детектировали приблизительно 50% продукта. Реакционную смесь разбавляли водой и экстрагировали Et2O. Объединенные органические слои осушали (MgSO4) и выпаривали, а целевой продукт выделяли от оставшейся смеси посредством ВЭЖХ. Названное соединение получали в виде масла (2,5 г, 30,8%).1H-ЯМР (500 МГц, CDCl3): δ 7,96 (д, 2H), 7,43 (д, 2H), 7,37 (т, 2H), 7,33 (д, 1H), 6,82 (д, 2H), 5,32 (с, 2H), 1,60 (с, 6H), 1,40 (с, 9H).
4-(1-трет-бутоксикарбонил-1-метилэтокси)бензойная кислота
Бензиловый эфир 4-(1-трет-бутоксикарбонил-1-метилэтокси)бензойной кислоты (2,75 г, 7,42 ммоль) растворяли в EtOAc, и добавляли Pd/C (10% Pd, приблизительно 100 мг). Реакционную емкость вакуумировали и подсоединяли с линией подачи водорода. Через 3 ч перемешивания при комнатной температуре в атмосфере H2 катализатор удаляли фильтрованием, а фильтрат выпаривали. Неочищенный продукт использовали на следующей стадии без дополнительной очистки (2,0 г, 96,1%).1H-ЯМР (500 МГц, CDCl3): δ 7,99 (д, 2H), 6,84 (д, 2H), 1,62 (с, 6H), 1,41 (с, 9H).
4-метил-2-(4-трифторметилфенил)тиазол-5-илметиловый эфир 4-(1-трет-бутоксикарбонил-1-метилэтокси)бензойной кислоты
Смесь 4-(1-трет-бутоксикарбонил-1-метилэтокси)бензойной кислоты (0,112 г, 0,4 ммоль) и 5-хлорметил-4-метил-2-(4-трифторметилфенил)тиазола (0,117 г, 0,4 ммоль), Cs2CO3 (0,261 г, 0,8 ммоль) и KI (7 мг, 0,04 ммоль) в ДМФА (5 мл) нагревали до 50°C и перемешивали в течение 30 минут. После разбавления H2O смесь экстрагировали Et2O, после чего объединенные органические слои осушали (Na2SO4) и выпаривали. Неочищенный продукт использовали на следующей стадии без дополнительной очистки, несмотря на то, что в нем оставалось существенное количество ДМФА (0,535 мг, 40,8%).1H-ЯМР (500 МГц, CDCl3): δ 7,99 (д, 2H), 7,92 (д, 2H), 7,64 (д, 2H), 6,80 (д, 2H), 5,44 (с, 2H), 2,54 (с, 3H), 1,58 (с, 6H), 1,38 (с, 9H).
Синтез примеров
Пример 1
4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензиловый эфир 4-метансульфонилоксибензойной кислоты

Стадия 1: К раствору 2,2,2-трихлорэтилового эфира 2-[2-(4-фторфенил)этилсульфанил]-3-(4-гидроксиметилфенил)пропионовой кислоты (70 мг, 0,15 ммоль) и (4-метансульфонилоксифенил)уксусной кислоты (32,5 мг, 0,15 ммоль) в безводном ДХМ (3,0 мл) добавляли ЭДК×HCl (37,5 мг, 0,195 ммоль) и ДМАП (0,18 мг, 0,002 ммоль) в атмосфере азота при 0°C. После завершения добавления охлаждающую баню убирали, и перемешивали гомогенную смесь при температуре окружающей среды до тех пор, пока исходного вещества не оставалось. Смесь разбавляли водой и 2 н. водн. HCl и экстрагировали ДХМ. Объединенные органические слои осушали (MgSO4), а затем отгоняли растворитель при пониженном давлении, получая требуемое эфирное промежуточное соединение, которое использовали на следующей стадии без дополнительной очистки.
Стадия 2: Неочищенный 2,2,2-трихлорэтиловый эфир (68,7 мг, 0,10 ммоль) растворяли в ДХМ (5,0 мл) и добавляли цинк (135 мг, 2,0 ммоль), а затем уксусную кислоту (0,6 мл, 10 ммоль). Полученную суспензию перемешивали при температуре окружающей среды до тех пор, пока исходного вещества не оставалось. После отфильтровывания и промывки цинка MeOH и EtOAc объединенные органические слои экстрагировали водой, осушали (MgSO4) и выпаривали при пониженном давлении. Названное соединение получали путем очистки неочищенного продукта с помощью колоночной хроматографии, используя CH2Cl2/MeOH 95:5 в качестве элюента. Чистый продукт получали в виде масла (19,7 мг, 35,8%).1H-ЯМР (400 МГц, CD3OD): δ 8,09-8,11 (д, 2H), 7,31-7,34 (м, 4H), 7,19-7,21 (д, 2H), 7,04-7,07 (м, 2H), 6,90-6,94 (т, 2H), 5,31 (с, 2H), 3,44-3,46 (т, 1H), 3,12-3,18 (т, 1H), 3,15 (с, 1H), 2,79-2,92 (м, 5H). Масс-спектр: M+H- 531,04.
Пример 2
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-метансульфонилоксифенил)ацетоксиметил]фенил}пропионовая кислота

Названное соединение получали из 2,2,2-трихлорэтилового эфира 2-[2-(4-фторфенил)этилсульфанил]-3-(4-гидроксиметилфенил)пропионовой кислоты (33 мг, 0,072 ммоль) и (4-метансульфонилоксифенил)уксусной кислоты (15 мг, 0,065 ммоль) таким же способом, как описано в примере 1. Неочищенный продукт очищали с помощью флеш-хроматографии (выход: 2,0 мг, 5,6%). Масс-спектр: M+H+ 547,10.
Пример 3
2-[2-(4-фторфенил)этилсульфанил]-3-[4-(4-трифторметилбензилоксикарбонилметил)фенил]пропионовая кислота
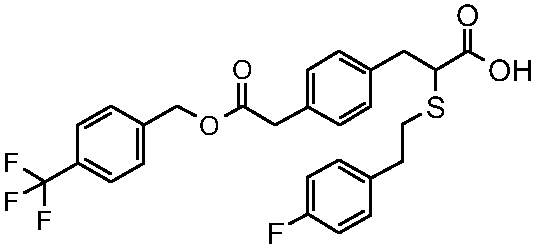
Названное соединение получали из 2,2,2-трихлорэтилового эфира 3-(4-карбоксиметилфенил)-2-[2-(4-фторфенил)этилсульфанил]пропионовой кислоты (30 мг, 0,061 ммоль) и 4-трифторметилбензилового спирта (12 мг, 0,067 ммоль) таким же способом, как описано в примере 1. Неочищенный продукт очищали с помощью ВЭЖХ (выход: 3,0 мг, 9,4%).1H-ЯМР (400 МГц, CDCl3): δ 7,56 (д, 2H), 7,36 (д, 2H), 7,08-7,19 (м, 6H), 6,90-7,04 (м, 2H), 5,14 (с, 2H), 3,63 (с, 2H), 3,45 (дд, 2H), 3,15 (дд, 2H), 2,80-2,92 (м, 3H).
Пример 4
2-[2-(4-фторфенил)этилсульфанил]-3-[4-(4-этансульфонилоксибензилоксикарбонилметил)фенил]пропионовая кислота
Названное соединение получали из 2,2,2-трихлорэтилового эфира 3-(4-карбоксиметилфенил)-2-[2-(4-фторфенил)этилсульфанил]пропионовой кислоты (30 мг, 0,01 ммоль) и 4-гидроксиметилфенилового эфира метансульфоновой кислоты (14 мг, 0,067 ммоль) таким же способом, как описано в примере 1. Неочищенный продукт очищали с помощью ВЭЖХ (выход: 0,47 мг, 1,4%). Масс-спектр: M-H+ 545,50.
Пример 5
2-[2-(4-фторфенил)этилсульфанил]-3-(4-{2-[2-(4-метансульфонилоксифенил)ацетокси]этил}фенил)пропионовая кислота

Названное соединение получали из 2,2,2-трихлорэтилового эфира 2-[2-(4-фторфенил)этилсульфанил]-3-[4-(2-гидроксиэтил)фенил]пропионовой кислоты (34 мг, 0,072 ммоль) и метансульфоновой кислоты (4-метансульфонилоксифенил)уксусной кислоты (15 мг, 0,065 ммоль) таким же способом, как описано в примере 1. Неочищенный продукт очищали с помощью ВЭЖХ (выход: 3,0 мг, 8,2%).1H-ЯМР (400 МГц, CDCl3): δ 7,17-7,24 (м, 4H), 7,00-7,10 (м, 6H), 6,89-6,93 (м, 2H), 4,26 (т, 2H), 3,80 (т, 2H), 3,46-3,50 (дд, 2H), 3,11 (с, 3H), 2,77-2,91 (м, 8H).
Пример 6
2-[2-(4-фторфенил)этилсульфанил]-3-(4-{3-[2-(4-метансульфонилоксифенил)ацетокси]пропил}фенил)пропионовая кислота
Названное соединение получали из 2,2,2-трихлорэтилового эфира 2-[2-(4-фторфенил)этилсульфанил]-3-[4-(3-гидроксипропил)фенил]пропионовой кислоты (45 мг, 0,091 ммоль) и (4-метансульфонилоксифенил)уксусной кислоты (19 мг, 0,083 ммоль) таким же способом, как описано в примере 1. Неочищенный продукт очищали с помощью ВЭЖХ (выход: 3,0 мг, 4,2%).1H-ЯМР (400 МГц, CDCl3): δ 7,30-7,32 (д, 2H), 7,21-7,23 (д, 2H), 7,05-7,08 (м, 4H), 6,98-7,00 (д, 2H), 6,90-6,94 (т, 2H), 4,04-4,07 (т, 2H), 3,63 (м, 2H), 3,46 (м, 2H), 3,08 (с, 3H), 2,79-2,90 (м, 5H), 2,54-2,58 (т, 2H), 1,87-1,90 (т, 2H).
Пример 7
2-[2-(4-фторфенил)этилсульфанил]-3-[4-(2-фенилпропионилоксиметил)фенил]пропионовая кислота
Стадия 1: Навеску 2-фенилпропионовой кислоты (0,112 г, 0,1 ммоль) помещали в пробирку, добавляли 2,2,2-трихлорэтиловый эфир 2-[2-(4-фторфенил)этилсульфанил]-3-(4-гидроксиметилфенил)пропионовой кислоты (0,516 г, 0,065 ммоль), растворенный в 1,0 мл ДХМ, с последующим добавлением ЭДК×HCl (0,020 г, 0,1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, затем добавляли 3,0 мл воды, и отделяли органический слой через фазовый разделитель.
Стадия 2: К органической фазе сначала добавляли цинк (0,085 г, 1,3 ммоль), затем уксусную кислоту (2 мл, 33 ммоль), и перемешивали полученную гетерогенную смесь при комнатной температуре в течение 4 ч. Цинк отфильтровывали и промывали ДХМ. Объединенные органические слои выпаривали, а оставшийся неочищенный продукт очищали с помощью ВЭЖХ, получая чистый продукт (6,5 г, 21%).1H-ЯМР (300 МГц, CDCl3): δ 1,51 (д, 3H), 2,75-2,96 (м, 5H), 3,12-3,23 (м, 1H), 3,42-3,51 (м, 1H), 3,71-3,82 (м, 1H), 5,01-5,13 (м, 2H), 6,91-6,99 (м, 2H), 7,04-7,11 (м, 2H), 7,13-7,16 (м, 4H), 7,26-7,32 (м, 5H); масс-спектр: M-H+ 465.
Пример 8
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-метоксилфенилацетоксиметил]фенил}пропионовая кислота
Названное соединение получали из 4-метоксифенилуксусной кислоты и 2,2,2-трихлорэтилового эфира 2-[2-(4-фторфенил)этилсульфанил]-3-(4-гидроксиметилфенил)пропионовой кислоты таким же способом, как описано в примере 7 (выход: 6,3 мг, 20%).1H-ЯМР (300 МГц, CDCl3): δ 2,76-2,99 (м, 5H), 3,13-3,25 (м, 1H), 3,43-3,53 (м, 1H), 3,60 (с, 2H), 3,79 (с, 3H), 5,09 (с, 2H), 6,82-6,89 (м, 2H), 6,91-7,00 (м, 2H), 7,05-7,12 (м, 2H), 7,14-7,30 (м, 6H); масс-спектр: M-H+ 481.
Пример 9
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-изобутилфенил)пропионилоксиметил]фенил}пропионовая кислота
Названное соединение получали из 2-(4-изобутилфенил)пропионовой кислоты и 2,2,2-трихлорэтилового эфира 2-[2-(4-фторфенил)этилсульфанил]-3-(4-гидроксиметилфенил)пропионовой кислоты таким же способом, как описано в примере 7 (выход: 5,6 мг, 17%).1H-ЯМР (300 МГц, CDCl3): δ 0,90 (д, 6H), 1,50 (д, 3H), 1,77-1,92 (м, 1H), 2,45 (д, 2H), 2,75-2,96 (м, 5H), 3,12-3,23 (м, 1H), 3,41-3,50 (м, 1H), 3,74 (кв., 1H), 5,00-5,13 (м, 2H), 6,91-6,99 (м, 2H), 7,04-7,23 (м, 10H); масс-спектр: M-H+ 521.
Пример 10
2-[2-(4-фторфенил)этилсульфанил]-3-[4-(2-пиридин-2-илацетоксиметил)фенил]пропионовая кислота
Названное соединение получали из 2-пиридинуксусной кислоты (в виде гидрохлорида) и 2,2,2-трихлорэтилового эфира 2-[2-(4-фторфенил)этилсульфанил]-3-(4-гидроксиметилфенил)пропионовой кислоты таким же способом, как описано в примере 7 (выход: 8,6 мг, 29%).1H-ЯМР (300 МГц, CDCl3): δ 2,83-3,16 (м, 6H), 3,54-3,71 (м, 1H), 3,64 (с, 2H), 5,06-5,20 (м, 2H), 6,91-7,00 (м, 2H), 7,09-7,35 (м, 7H), 7,66 (шир.д, 1H), 8,06 (шир.с, 1H), 8,45 (шир.д, 1H); масс-спектр: M+H+ 455.
Пример 11
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-метилпиперазин-1-ил)ацетоксиметил]фенил}пропионовая кислота
Названное соединение получали из N-метилпиперазинуксусной кислоты и 2,2,2-трихлорэтилового эфира 2-[2-(4-фторфенил)этилсульфанил]-3-(4-гидроксиметилфенил)пропионовой кислоты таким же способом, как описано в примере 7 (выход: 7,9 мг, 26%).1H-ЯМР (300 МГц, CDCl3): δ 2,28-2,54 (м, 4H), 2,42 (с, 3H), 2,63-2,88 (м, 4H), 2,88-3,29 (м, 10H), 3,60-3,67 (м, 1H), 5,00-5,21 (м, 2H), 6,91-7,00 (м, 2H), 7,13-7,20 (м, 2H), 7,22-7,33 (м, 4H); масс-спектр: M+H+ 475.
Пример 12
2-фенил-5-трифторметилоксазол-4-илметиловый эфир 4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензойной кислоты
2-фенил-5-трифторметил-оксазол-4-илметиловый эфир 4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты (289 мг, 0,41 ммоль) растворяли в ДХМ (30 мл) и добавляли цинк (530 мг, 8,l ммоль) с последующим добавлением уксусной кислоты (2,5 мл, 41,6 ммоль). Полученную суспензию перемешивали в течение 6 ч при температуре окружающей среды. После фильтрования и промывки цинка MeOH и EtOAc, объединенные органические слои экстрагировали водой, осушали (MgSO4) и выпаривали при пониженном давлении. Оставшийся неочищенный продукт очищали с помощью флеш-хроматографии, используя Et2O/ДХМ/EtOAc 6:3:1 в качестве элюента, получая названное соединение в виде твердого вещества (выход: 24 мг, 10%).1H-ЯМР (400 МГц, CDCl3): δ 8,07 (д, 2H), 7,98 (д, 2H), 7,43-7,55 (м, 3H), 7,24 (д, 2H), 7,07 (м, 2H), 6,92 (т, 2H), 5,39 (с, 2H), 3,43 (т, 1H), 3,22 (дд, 1H), 2,75-2,99 (м, 5H). Масс-спектр: M+H+ 574,14, M-H+ 572,24.
Пример 13
4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензиловый эфир 2-фенил-5-трифторметилоксазол-4-карбоновой кислоты
Названное соединение получали из 4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензилового эфира 2-фенил-5-трифторметилоксазол-4-карбоновой кислоты (892 мг, 1,26 ммоль) таким же способом, как описано в примере 12. Время реакции составляло 17 ч, неочищенный продукт очищали с помощью флеш-хроматографии, используя н-гептан/EtOAc 1:1 в качестве элюента. Чистый продукт получали в виде твердого вещества (выход: 275 мг, 38%).1H-ЯМР (400 МГц, CDCl3): δ 8,05 (д, 2H), 7,44-7,58 (м, 3H), 7,37-7,40 (д, 2H), 7,19-7,23 (д, 2H), 7,07 (дт, 2H), 6,92 (дт, 2H), 5,38 (с, 2H), 3,48 (т, 1H), 3,17-3,22 (дд, 1H), 2,76-2,96 (м, 5H). Масс-спектр: M-H+ 572,02.
Пример 14
2-(5-метил-2-фенилоксазол-4-ил)этиловый эфир 4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензойной кислоты
Названное соединение получали из 2-(5-метил-2-фенилоксазол-4-ил)этилового эфира 4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты (37 мг, 0,056 ммоль) таким же способом, как описано в примере 12. Время реакции составляло 4 ч, неочищенный продукт очищали с помощью ВЭФХ, используя н-гептан/EtOAc 4:1 в качестве элюента. Чистый продукт получали в виде твердого вещества (выход: 10,5 мг, 35,4%).1H-ЯМР (400 МГц, CDCl3): δ 7,90-7,99 (м, 4H), 7,39 (м, 3H), 7,25 (д, 2H), 7,08 (м, 2H), 6,92 (т, 2H), 4,50 (т, 2H), 3,48 (т, 1H), 3,21 (дд, 1H), 2,78-3,00 (м, 7H), 2,36 (с, 3H). Масс-спектр: M+H+ 534,18, M-H+ 532,33.
Пример 15
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(5-метил-2-фенилоксазол-4-ил)ацетоксиметил]фенил}пропионовая кислота
Названное соединение синтезировали из 2,2,2-трихлорэтилового эфира 2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(5-метил-2-фенилоксазол-4-ил)ацетоксиметил]фенил}пропионовой кислоты (751 мг, 1,23 ммоль) таким же способом, как описано в примере 12. Время реакции составляло 17 ч, неочищенный продукт очищали перекристаллизацией из iPrOH/iPr2O/н-гептан. Чистый продукт получали в виде твердого вещества (выход: 184 мг, 31%).1H-ЯМР (400 МГц, CDCl3): δ 7,96 (м, 2H), 7,38-7,41 (м, 3H), 7,23-7,28 (д, 2H), 7,15-7,19 (д, 2H), 7,03-7,10 (м, 2H), 6,89-6,96 (дт, 2H), 5,08 (с, 2H), 3,59 (с, 2H), 3,42-3,37 (т, 1H), 3,12-3,20 (дд, 1H), 2,77-2,95 (м, 5H), 2,32 (с, 2H). Масс-спектр: M+H+ 535,03, M-H+ 532,08.
Пример 16
4-метансульфонилоксибензиловый эфир 4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензойной кислоты
Названное соединение получали из 4-метансульфонилоксибензилового эфира 4-[2-[2-(4-фторфенил)этилсульфанил]-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты (43,8 мг, 0,066 ммоль) таким же способом, как описано в примере 12. Время реакции составляло 5 ч, неочищенный продукт очищали с помощью флеш-хроматографии, используя ДХМ/MeOH 95:5 в качестве элюента. Чистый продукт получали в виде масла (выход: 14,3 мг, 40,7%).1H-ЯМР (400 МГц, CDCl3): δ 7,95 (д, 2H), 7,47 (д, 2H), 7,22-7,28 (м, 4H), 7,03 (м, 2H), 6,90 (м, 2H), 5,32 (с, 2H), 3,42-3,46 (т, 1H), 3,18-3,23 (дд, 1H), 3,12 (с, 3H), 2,75-2,97 (м, 5H). Масс-спектр: M+H+ 532,96; M-H+ 531,01
Пример 17
2-[2-(4-фторфенил)этансульфонил]-3-[4-(4-трифторметилбензилоксикарбонилметил)фенил]пропионовая кислота
Названное соединение получали из 2,2,2-трихлорэтилового эфира 2-[2-(4-фторфенил)этансульфонил]-3-[4-(4-трифторметилбензилоксикарбонилметил)фенил]пропионовой кислоты (170 мг, 0,25 ммоль) таким же способом, как описано в примере 12. Время реакции составляло 2 ч, а неочищенный продукт очищали с помощью ВЭЖХ. Чистый продукт получали в виде твердого вещества (выход: 100 мг, 73%).1H-ЯМР (400 МГц, CDCl3) δ 7,48-7,56 (м, 2H), 7,38-7,46 (м, 2H), 7,00-7,17 (м, 6H), 6,91-6,83 (т, 2H), 5,06 (с, 2H), 3,92-4,00 (м, 1H), 3,56 (с, 2H), 3,33-3,44 (м, 1H), 3,10-3,27 (м, 3H), -2,91-3,01 (м, 2H). Масс-спектр: M-H+ 551,11.
Пример 18
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-метансульфонилоксифенил)этилсульфанилкарбонил]фенил}пропионовая кислота
Названное соединение получали из 2,2,2-трихлорэтилового эфира 2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-метансульфонилоксифенил)этилсульфанилкарбонил]фенил}пропионовой кислоты (выход: 100 мг, 0,144 ммоль) таким же способом, как описано в примере 12. Время реакции составляло 18 ч, неочищенный продукт очищали с помощью ВЭЖХ. Чистый продукт получали в виде твердого вещества (выход: 5,0 мг, 6,2%).1H-ЯМР (400 МГц, CDCl3) δ 7,14-7,16 (м, 8H), 7,04-7,07 (м, 2H), 6,89-6,94 (м, 2H), 3,43-3,45 (м, 1H), 3,12-3,17 (дд, 1H), 3,09 (с, 3H), 3,02-3,06 (т, 2H), 2,78-2,91 (м, 7H).
Пример 19
(-)-2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(5-метил-2-фенилоксазол-4-ил)ацетоксиметил]фенил}пропионовая кислота
Два энантиомера (±)-2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(5-метил-2-фенилоксазол-4-ил)ацетоксиметил]фенил}пропионовой кислоты (200 мг, 0,375 ммоль) разделяли с помощью хиральной хроматографии, используя колонку Chiralpak AD™ 250×20 мм (температура колонки: 40°C) с подвижной фазой EtOH/муравьиная кислота 100/0,1. Энантиомер с отрицательным вращением плоскости поляризации получали с энантиомерным избытком 99,1% и выходом 87% (87 мг). [α]D20=-37,3 (с 0,6 г/мл, MeOH).1H-ЯМР (400 МГц, CDCl3): δ 8,45 (с, 1H), 7,94 (м, 2H), 7,37-7,38 (м, 3H), 7,23-7,25 (д, 2H), 7,15-7,17 (д, 2H), 7,02-7,05 (м, 2H), 6,88-6,92 (т, 2H), 5,08 (с, 2H), 3,60 (с, 2H), 3,43-3,47 (м, 1H), 3,13-3,18 (дд, 1H), 2,76-2,90 (м, 5H), 2,30 (с, 2H).13C-ЯМР (400 МГц, CDCl3): δ 176,09, 170,06, 162,71, 160,27, 159,69, 145,89, 137,94, 135,54, 134,22, 130,11, 129,96, 129,88, 129,17, 128,98, 128,64, 128,38, 127,09, 126,08, 115,25, 115,04, 66,60, 47,77, 36,97, 34,77, 33,16, 31,72, 10,20. Масс-спектр: M+H+ 534,17.
Пример 20
2-(5-метил-2-фенилоксазол-4-ил)этиловый эфир 4-{(-)-2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензойной кислоты
Два энантиомера 2-(5-метил-2-фенилоксазол-4-ил)этилового эфира 4-{(±)-2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензойной кислоты (200 мг, 0,375 ммоль) разделяли с помощью хиральной хроматографии, используя колонку Chiralpak AD™ 250×20 мм (температура колонки: 40°C) с подвижной фазой EtOH/муравьиная кислота 100/0,1. Энантиомер с отрицательным вращением плоскости поляризации получен с энантиомерным избытком 99,0% и выходом 99% (99 мг). [α]D20=-30,0 (с 1 г/мл, MeOH).1H-ЯМР (400 МГц, CDCl3): δ 8,75 (с, 1H), 7,89-7,94 (м, 4H), 7,36-7,38 (м, 3H), 7,24-7,26 (д, 2H), 7,04-7,06 (м, 2H), 6,88-6,92 (т, 2H), 4,46-4,49 (т, 2H), 3,48 (т, 1H), 3,22 (дд, 1H), 2,77-2,97 (м, 7H), 2,30 (с, 3H).13C-ЯМР (400 МГц, CDCl3): δ 175,70, 166,20, 162,70, 160,27, 159,77, 145,03, 143,27, 135,50, 135,47, 131,93, 130,10, 129,93, 129,85, 129,73, 129,06, 128,72, 128,66, 127,06, 126,03, 115,26, 115,05, 63,52, 47,56, 37,31, 34,82, 33,21, 25,31, 10,05. Масс-спектр: M+H+ 534,17.
Пример 21
(S)-2-этокси-3-{4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}пропионовая кислота

Бензиловый эфир (S)-2-этокси-3-{4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}пропионовой кислоты (0,1 г, 0,2 ммоль) растворяли в EtOAc (4 мл) и добавляли 10% Pd/C (0,04 г, 0,037 ммоль). После вакуумирования реакционную емкость подключали к линии подачи водорода и проводили гидрирование при атмосферном давлении и комнатной температуре в течение 3 ч. Катализатор удаляли фильтрованием, промывали EtOAc, а объединенные органические фильтраты выпаривали при пониженном давлении, получая продукт в виде твердого вещества (0,079 г, 96,4%)1H-ЯМР (400 МГц, CDCl3): δ 7,98-7,99 (д, 2H), 7,42 (м, 3H), 7,23-7,25 (д, 2H), 7,02-7,04 (м, 2H), 6,71 (шир.с, 1H), 4,01-4,02 (м, 1H), 3,80 (с, 2H), 3,57-3,60 (м, 1H), 3,36-3,39 (м, 1H), 3,07-3,10 (м, 1H), 2,94-2,99 (м, 1H), 2,40 (с, 3H), 1,11-1,14 (т, 3H).
Пример 22
(S)-3-{4-[2-(4-трет-бутоксикарбониламинофенил)ацетокси]-фенил}-2-этоксипропионовая кислота

Названное соединение получали из бензилового эфира (S)-3-{4-[2-(4-трет-бутоксикарбониламинофенил)ацетокси]фенил}-2-этоксипропионовой кислоты (0,048 г, 0,09 ммоль) таким же способом, как описано в примере 1 (выход: 0,028 г, 70,2%).1H-ЯМР (500 МГц, CD3OD): δ 7,37-7,39 (д, 2H), 7,25-7,28 (м, 4H), 6,92-6,94 (д, 2H), 3,84-3,86 (дд, 1H), 3,80 (с, 2H), 3,57-3,59 (м, 1H), 3,23-3,27 (м, 1H), 2,97-3,03 (дд, 1H), 2,79-2,87 (дд, 1H), 1,51 (с, 9H), 1,07-1,10 (т, 3H).
Пример 23
3-{3-бензил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}-2-этоксипропионовая кислота

Названное соединение получали из бензилового эфира 3-{3-бензил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}-2-этоксипропионовой кислоты (0,054 г, 0,09 ммоль) таким же способом, как описано в примере 1, с тем различием, что в качестве растворителя использовали EtOH вместо EtOAc. Неочищенный продукт очищали с помощью колоночной хроматографии, используя ДХМ/MeOH (95:5) в качестве элюента, целевое соединение получали в виде масла (0,019 г, 41,3%).1H-ЯМР (400 МГц, CDCl3): δ 7,93-7,96 (м, 2H), 7,39-7,41 (м, 3H), 7,02-7,19 (м, 8H), 3,99 (м, 1H), 3,86 (с, 2H), 3,69 (с, 2H), 3,48 (м, 1H), 3,32 (м, 1H), 3,03-3,09 (дд, 1H), 2,90-2,93 (дд, 1H), 2,29 (с, 3H), 1,04-1,07 (т, 3H).
Пример 24
3-{3-бензил-4-[2-(4-трет-бутоксикарбониламинофенил)-ацетокси]фенил}-2-этоксипропионовая кислота

Названное соединение получали из бензилового эфира 3-{3-бензил-4-[2-(4-трет-бутоксикарбониламинофенил)ацетокси]фенил}-2-этоксипропионовой кислоты (0,06 г, 0,096 ммоль) таким же способом, как описано в примере 1, с тем различием, что в качестве растворителя использовали EtOH вместо EtOAc. Неочищенный продукт очищали с помощью колоночной хроматографии, используя ДХМ/MeOH (9:1) в качестве элюента, названное соединение получали в виде масла (0,047 г, 24,2%).1H-ЯМР (400 МГц, CDCl3): δ 9,28 (с, 1H), 7,38-7,29 (д, 2H), 7,02-7,21 (м, 9H), 6,88-6,91 (д, 1H), 3,79 (с, 2H), 3,50-3,55 (м, 1H), 3,15-3,19 (м, 1H), 2,85-2,87 (дд, 1H), 2,64-2,69 (м, 1H), 2,48-2,50 (м, 1H), 1,45 (с, 9H), 0,91-0,95 (т, 3H). Масс-спектр: M-H+ 531,93.
Пример 25
2-этокси-3-{3-метил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}пропионовая кислота

Названное соединение получали из бензилового эфира 2-этокси-3-{3-метил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}пропионовой кислоты (0,63 г, 1,22 ммоль) таким же способом, как описано в примере 1, с тем различием, что в качестве растворителя использовали MeOH вместо EtOAc. Неочищенный продукт очищали с помощью колоночной хроматографии, используя ДХМ/iPrOH (95:5) в качестве элюента, названное соединение получали в виде твердого вещества (0,303 г, 58,3%).1H-ЯМР (500 МГц, CDCl3): δ 7,99-8,02 (м, 2H), 7,43-7,46 (м, 3H), 7,08-7,11 (м, 2H), 6,96-6,97 (д, 1H), 4,01-4,03 (м, 1H), 3,85 (с, 2H), 3,61 (м, 1H), 3,37 (м, 1H), 3,04-3,07 (дд, 1H), 2,95-2,97 (дд, 1H), 2,43 (с, 3H), 2,13 (с, 3H), 1,12-1,14 (т, 3H).
Пример 26
3-{4-[2-(4-трет-бутоксикарбониламинофенил)ацетокси]-3-метилфенил}-2-этоксипропионовая кислота
Названное соединение получали из бензилового эфира 3-{4-[2-(4-трет-бутоксикарбониламинофенил)ацетокси]-3-метилфенил}-2-этоксипропионовой кислоты (0,035 г, 0,064 ммоль) таким же способом, как описано в примере 1, с тем различием, что в качестве растворителя использовали MeOH вместо EtOAc. Неочищенный продукт очищали с помощью колоночной хроматографии, используя ДХМ/iPrOH (95:5) в качестве элюента, названное соединение получали в виде твердого вещества (0,02 г, 68,4%).1H-ЯМР (500 МГц, CD3OD): δ 7,40-7,42 (д, 2H), 7,29-7,31 (д, 2H), 7,10-7,15 (м, 2H), 6,86-6,87 (д, 1H), 3,84-3,88 (м, 3H), 3,60-3,62 (м, 1H), 3,26-3,29 (м, 1H), 2,96-3,02 (дд, 1H), 2,80-2,86 (дд, 1H), 1,53 (с, 9H), 1,10-1,13 (т, 3H).
Пример 27
4-метансульфонилоксибензиловый эфир 4-(2-карбокси-2-этоксиэтил)бензойной кислоты
К раствору 4-метансульфонилоксибензилового эфира 4-[2-этокси-2-(2,2,2-трихлорэтоксикарбонил)этил]бензойной кислоты (0,02 г, 0,036 ммоль) в сухом ДХМ (2 мл) добавляли сначала цинковую пыль (0,047 г, 0,722 ммоль), а затем уксусную кислоту (1,08 мл, 18,06 ммоль) при 0°C. Полученную негомогенную смесь перемешивали в течение 17 ч, не убирая ледяную баню. Цинк удаляли фильтрованием и промывали ДХМ и MeOH, а оставшиеся фильтраты объединяли и выпаривали при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии, используя ДХМ/MeOH (92:8) в качестве элюента. Названное соединение получали в виде масла (0,005 г, 36%).1H-ЯМР (400 МГц, CDCl3): δ 7,91-7,93 (д, 2H), 7,42-7,44 (д, 2H), 7,19-7,24 (м, 4H), 5,27 (с, 2H), 4,03 (м, 1H), 3,52 (м, 1H), 3,37 (м, 1H), 2,99-3,14 (м, 2H), 3,08 (с, 3H), 2,63 (т, 3H). Масс-спектр: M-H+ 421,23.
Пример 28
2-[3-(4-трифторметилбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота

2,2,2-трихлорэтиловый эфир 2-[3-(4-трифторметилбензилоксикарбонилметил)фенилсульфанилметил]-бензойной кислоты (105 мг, 0,177 ммоль) растворяли в ДХМ (8 мл) и добавляли цинк (232 мг, 3,55 ммоль). После перемешивания в течение 5 минут по каплям добавляли HOAc 97% (1 мл, 18 ммоль). Полученную суспензию перемешивали в течение 1,5 ч, после чего цинк удаляли фильтрованием и промывали ДХМ. Органическую фазу промывали водой, осушали с помощью фазового разделителя и концентрировали. Неочищенный продукт подвергали флеш-хроматографии, используя гептан и EtOAc (70/30-60/40) в качестве элюента, получая названное соединение (57 мг, 70%) в виде масла;1H-ЯМР (400 МГц, CDCl3): δ 3,64 (с, 2H), 4,56 (с, 2H), 5,18 (с, 2H), 7,09-7,14 (м, 1H), 7,16-7,21 (м, 2H), 7,22-7,34 (м, 3H), 7,36-7,43 (м, 3H), 7,60 (д, 2H), 8,00 (д, 1H); масс-спектр: M-H+ 459.
Пример 29
2-{4-[2-(4-трифторметилфенил)ацетоксиметил]-фенилсульфанилметил}бензойная кислота

Названное соединение получали в соответствии с методикой, описанной выше в примере 1, из 2,2,2-трихлорэтилового эфира 2-{4-[2-(4-трифторметилфенил)ацетоксиметил]фенилсульфанилметил}-бензойной кислоты (112 мг, 0,189 ммоль), цинка (247 мг, 3,79 ммоль), 97% HOAc (1,08 мл, 18,9 ммоль) и ДХМ (9 мл). Неочищенный продукт подвергали флеш-хроматографии, используя гептан и EtOAc (70/30-60/40) в качестве элюента, получая укзанное в заголовке соединение (60 мг, 69%) в виде твердого вещества;1H-ЯМР (400 МГц, CDCl3): δ 3,72 (с, 2H), 4,57 (с, 2H), 5,09 (с, 2H), 7,18 (д, 2H), 7,24-7,30 (м, 3H), 7,31-7,46 (м, 4H), 7,48 (д, 2H), 8,05 (д, 1H); масс-спектр: M-H+ 459.
Пример 30
2-[4-(4-трифторметилбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота

Названное соединение получали в соответствии с методикой, описанной выше в примере 1, из 2,2,2-трихлорэтилового эфира 2-[4-(4-трифторметилбензилоксикарбонилметил)фенилсульфанилметил]-бензойной кислоты (74 мг, 0,125 ммоль), цинка (164 мг, 2,50 ммоль), 97% HOAc (0,72 мл, 12,5 ммоль) и ДХМ (5 мл). Неочищенный продукт подвергали флеш-хроматографии, используя гептан и EtOAc (70/30-60/40) в качестве элюента, получая указанное в заголовке соединение (36 мг, 63%) в виде твердого вещества;1H-ЯМР (400 МГц, CDCl3): δ 3,64 (с, 2H), 4,54 (с, 2H), 5,18 (с, 2H), 7,16 (д, 2H), 7,23-7,29 (м, 3H), 7,29-7,35 (м, 3H), 7,37-7,43 (м, 3H), 7,60 (д, 2H), 8,03 (д, 1H); масс-спектр: M-H+ 459.
Пример 31
2-{3-[1-(4-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметилбензойная кислота

Названное соединение получали в соответствии с методикой, описанной выше в примере 1, из 2,2,2-трихлорэтилового эфира 2-{3-[1-(4-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметил}бензойной кислоты (157 мг, 0,259 ммоль), цинка (339 мг, 5,18 ммоль), 97% HOAc (1,48 мл, 25,9 ммоль) и ДХМ (12 мл). Неочищенный продукт подвергали флеш-хроматографии, используя гептан и EtOAc (70/30-60/40) в качестве элюента, получая указанное в заголовке соединение (94 мг, 77%) в виде масла;1H-ЯМР (400 МГц, CDCl3): δ 1,53 (с, 3H), 3,60 (дд, 2H), 4,54 (дд, 2H), 5,91 (м, 1H), 7,07-7,12 (м, 1H), 7,15-7,20 (м, 2H), 7,21-7,32 (м, 3H), 7,35-7,42 (м, 3H), 7,58 (д, 2H), 7,98 (д, 1H); масс-спектр: M-H+ 473.
Пример 32
2-{3-[2-(4-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота
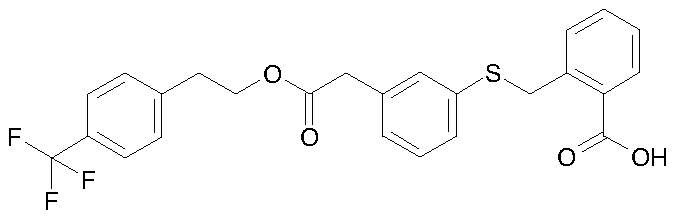
Названное соединение получали в соответствии с методикой, описанной выше в примере 1, из 2,2,2-трихлорэтилового эфира 2-{3-[2-(4-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметил}бензойной кислоты (160 мг, 0,264 ммоль), цинка (345 мг, 5,28 ммоль), 97% HOAc (1,51 мл, 26,4 ммоль) и ДХМ (12 мл). Неочищенный продукт подвергали флеш-хроматографии, используя гептан и EtOAc (70/30-60/40) в качестве элюента, получая указанное в заголовке соединение (87 мг, 69%) в виде масла;1H-ЯМР (400 МГц, CDCl3): δ 2,97 (дд, 2H), 3,54 (с, 2H), 4,34 (дд, 2H), 4,58 (с, 2H), 7,00-7,06 (м, 1H), 7,12-7,18 (м, 2H), 7,21-7,34 (м, 5H), 7,42 (дд, 1H), 7,52 (д, 2H), 7,98 (д, 1H); масс-спектр: M-H+ 473.
Общая методика 1 (ОМ1)
Стадия 1
К коммерчески доступным спиртам (0,288 ммоль), помещенным во флаконы (20 мл), снабженные колпачками с резьбой, добавляли раствор 2,2,2-трихлорэтилового эфира 2-(4-карбоксиметилфенилсульфанилметил)бензойной кислоты (125 мг, 0,288 ммоль), ЭДК×HCl (83 мг, 0,435 ммоль), ДМАП (3,5 мг, 0,029 ммоль) и ДХМ (4 мл). Реакционные смеси перемешивали при комнатной температуре в течение ночи. В смеси вливали 0,25 M HCl (4 мл), и разделяли две образовавшиеся фазы с помощью фазовых разделителей. Органические фазы концентрировали и использовали без дополнительной очистки на следующей стадии.
Стадия 2
Неочищенный продукт стадии 1 растворяли в ДХМ (10 мл) и добавляли цинк (377 мг, 5,76 ммоль) к каждой из реакционных смесей с последующим добавлением 97% HOAc (1,65 мл). Реакционные смеси перемешивали в течение 4 ч, если не указано иное. Цинк удаляли фильтрованием через фазовые разделители. Фильтраты, собранные в чистые флаконы (40 мл), промывали водой, и разделяли две образовавшиеся фазы с помощью фазовых разделителей. ДХМ удаляли, а неочищенный продукт растворяли в ДМСО (1,8 мл) перед очисткой посредством ВЭЖХ.
Общая методика 2 (ОМ2)
Стадия 1
К коммерчески доступным спиртам (0,288 ммоль), помещенным во флаконы (20 мл), снабженные колпачками с резьбой, добавляли раствор 2,2,2-трихлорэтиловый эфир 2-(3-карбоксиметилфенилсульфанилметил)бензойной кислоты (125 мг, 0,288 ммоль), ЭДК×HCl (83 мг, 0,435 ммоль), ДМАП (3,5 мг, 0,029 ммоль) и ДХМ (4 мл). Реакционные смеси перемешивали при комнатной температуре в течение ночи. В смеси вливали 0,25 M HCl (4 мл), и разделяли две образовавшиеся фазы с помощью фазовых разделителей. Органические фазы концентрировали и использовали без дополнительной очистки на следующей стадии.
Стадия 2
Неочищенный продукт стадии 1 растворяли в ДХМ (10 мл) и добавляли цинк (377 мг, 5,76 ммоль) к каждой из реакционных смесей с последующим добавлением 97% HOAc, (1,65 мл). Реакционные смеси перемешивали в течение 4 ч, если не указано иное. Цинк удаляли фильтрованием через фазовые разделители. Фильтраты, собранные в чистые флаконы (40 мл), промывали водой, и разделяли две образовавшиеся фазы с помощью фазовых разделителей. ДХМ удаляли, а неочищенный продукт растворяли в ДМСО (1,8 мл) перед очисткой посредством ВЭЖХ.
Пример 33
2-[4-(2,6-диметилбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота
Названное соединение получали в соответствии с ОМ1. Стадия 1: В качестве спирта использовали (2,6-диметилфенил)метанол. Стадия 2: Время реакции составляло 2 дня. Выход: 37 мг (31%).1H-ЯМР (600 МГц, (CD3)2SO, (CH3)2SO): δ 2,24 (с, 6H), 3,61 (с, 2H), 4,54 (с, 2H), 5,10 (с, 2H), 7,00 (д, 2H), 7,08-7,14 (м, 3H), 7,22 (д, 2H), 7,27-7,34 (м, 2H), 7,36-7,40 (м, 1H), 7,82 (д, 1H); масс-спектр: M-H+ 419.
Пример 34
2-[4-(1-фенилбут-3-енилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота
Названное соединение получали в соответствии с ОМ1. Стадия 1: В качестве спирта использовали 1-фенилбут-3-ен-1-ол. Выход: 32 мг (26%).1H-ЯМР (600 МГц, (CD3)2SO, (CH3)2SO): δ 3,64 (с, 2H), 4,54 (с, 2H), 4,94-5,20 (м, 2H), 5,58-5,66 (м, 1H), 5,72 (т, 1H), 7,13 (д, 2H), 7,20-7,33 (м, 9H), 7,36-7,39 (м, 1H), 7,81 (д, 1H); масс-спектр: M-H+ 431.
Пример 35
2-[3-(1-метоксикарбонил-2-фенилэтоксикарбонилметил)-фенилсульфанилметил]бензойная кислота
Названное соединение получали в соответствии с ОМ2. Стадия 1: В качестве спирта использовали метиловый эфир 2-гидрокси-3-фенилпропионовой кислоты. Стадия 2: Время реакции составляло 2 дня. Выход: 43 мг (33%).1H-ЯМР (600 МГц, (CD3)2SO, (CH3)2SO): δ 2,99-3,10 (м, 2H), 3,59 (с, 3H), 3,64 (с, 2H), 4,54 (с, 2H), 5,14-5,18 (м, 1H), 6,94-6,97 (м, 1H), 7,11-7,25 (м, 8H), 7,29-7,34 (м, 2H), 7,36-7,40 (м, 1H), 7,81 (д, 1H); масс-спектр: M-H+ 463.
Пример 36
2-{4-[2-(3,4-диметоксифенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота
Названное соединение получали в соответствии с ОМ1. Стадия 1: В качестве спирта использовали 2-(3,4-диметоксифенил)этанол. Стадия 2: Время реакции составляло 10 дней. Выход: 41 мг (30%).1H-ЯМР (600 МГц, (CD3)2SO, (CH3)2SO): δ 2,76 (т, 2H), 3,58 (с, 2H), 3,68 (с, 6H), 4,18 (т, 2H), 4,54 (с, 2H), 6,65 (д, 1H), 6,78-6,80 (м, 2H), 7,10 (д, 2H), 7,21 (д, 2H), 7,29-7,34 (м, 2H), 7,38-7,42 (м, 1H), 7,82 (д, 1H); масс-спектр: M-H+ 465.
Пример 37
2-[4-(1-метоксикарбонил-2-фенилэтоксикарбонилметил)-фенилсульфанилметил]бензойная кислота
Названное соединение получали в соответствии с ОМ1. Стадия 1: В качестве спирта использовали метиловый эфир 2-гидрокси-3-фенилпропионовой кислоты. Выход: 45 мг (34%).1H-ЯМР (600 МГц, (CD3)2SO, (CH3)2SO): δ 2,98-3,10 (м, 2H), 3,60 (с, 3H), 3,63 (с, 2H), 4,54 (с, 2H), 5,15 (т, 1H), 7,05 (д, 2H), 7,12 (д, 2H), 7,18-7,24 (м, 5H), 7,30-7,34 (м, 2H), 7,38-7,42 (м, 1H), 7,82 (д, 1H); масс-спектр: M-H+ 463.
Пример 38
2-{3-[2-(2-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота
Названное соединение получали в соответствии с ОМ2. Стадия 1: В качестве спирта использовали 2-(2-трифторметилфенил)этанол. Выход: 54 мг (40%).1H-ЯМР (600 МГц, (CD3)2SO, (CH3)2SO): δ 3,02 (т, 2H), 3,58 (с, 2H), 4,26 (т, 2H), 4,54 (с, 2H), 7,0 (д, 1H), 7,15-7,21 (м, 3H), 7,29-7,33 (м, 2H), 7,36-7,44 (м, 3H), 7,52-7,56 (м, 1H), 7,66 (д, 1H), 7,81 (д, 1H); масс-спектр: M-H+ 473.
Пример 39
2-[4-(оксазол-2-илфенилметоксикарбонилметил)-фенилсульфанилметил]бензойная кислота
Названное соединение получали в соответствии с ОМ1. Стадия 1: В качестве спирта использовали оксазол-2-илфенилметанол. Выход: 55 мг (42%).1H-ЯМР (600 МГц, (CD3)2SO, (CH3)2SO): δ 3,77 (д, 2H), 4,53 (с, 2H), 6,82 (с, 1H), 7,16 (д, 2H), 7,21 (с, 1H), 7,23 (д, 2H), 7,28-7,33 (м, 2H), 7,34-7,41 (м, 6H), 7,81 (д, 1H), 8,09 (с, 1H); масс-спектр: M-H+ 458.
Пример 40
2-{4-[2-(2-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота
Названное соединение получали в соответствии с ОМ1. Стадия 1: В качестве спирта использовали 2-(2-трифторметилфенил)этанол. Стадия 2: Время реакции составляло 2 дня. Выход: 41 мг (30%).1H-ЯМР (600 МГц, (CD3)2SO, (CH3)2SO): δ 3,02 (дд, 2H), 3,57 (с, 2H), 4,24 (дд, 2H), 4,54 (с, 2H), 7,09 (д, 2H), 7,21 (д, 2H), 7,30-7,34 (м, 2H), 7,38-7,43 (м, 3H), 7,53 (дд, 1H), 7,66 (д, 1H), 7,82 (д, 2H); масс-спектр: M-H+ 473.
Пример 41
2-[3-(2,6-диметилбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота
Названное соединение получали в соответствии с ОМ2. Стадия 1: В качестве спирта использовали (2,6-диметилфенил)метанол. Выход: 38 мг (31%).1H-ЯМР (600 МГц, (CD3)2SO, (CH3)2SO): δ 2,45 (с, 6H), 3,62 (с, 2H), 4,52 (с, 2H), 5,11 (с, 2H), 7,0 (д, 2H), 7,13 (д, 1H), 7,08-7,12 (м, 1H), 7,14-7,21 (м, 3H), 7,27-7,34 (м, 2H), 7,36-7,40 (м, 1H), 7,81 (д, 1H); масс-спектр: M-H+ 419.
Пример 42
2-[3-(4-пиразол-1-илбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота
Названное соединение получали в соответствии с ОМ2. Стадия 1: В качестве спирта использовали (4-пиразол-1-илфенил)метанол. Выход: 56 мг (43%); масс-спектр: M-H+ 457.
Пример 43
2-[4-(4-пиразол-1-илбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота
Названное соединение получали в соответствии с ОМ1. Стадия 1: В качестве спирта использовали (4-пиразол-1-илфенил)метанол. Выход: 52 мг (40%); масс-спектр: M-H+ 457.
Пример 44
2-{3-[2-(3,4-диметоксифенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота
Названное соединение получали в соответствии с ОМ2. Стадия 1: В качестве спирта использовали 2-(3,4-диметоксифенил)этанол. Выход: 47 мг (35,3%); масс-спектр: M-H+ 465.
Пример 45
4-метил-2-(4-трифторметилфенил)тиазол-5-илметиловый эфир 4-(1-карбокси-1-метилэтокси)бензойной кислоты

К раствору 4-метил-2-(4-трифторметилфенил)тиазол-5-илметилового эфира 4-(1-трет-бутоксикарбонил-1-метилэтокси)бензойной кислоты (0,175 г, 0,327 ммоль) в ДХМ (4 мл) добавляли трифторуксусную кислоту (0,745 г, 6,53 ммоль) и перемешивали смесь в течение 18 ч при комнатной температуре. После разбавления Et2O смесь экстрагировали насыщенным водн. NaHCO3. Органический слой осушали (Na2SO4) и выпаривали, а полученный неочищенный продукт очищали с помощью ВЭЖХ. Названное соединение получали в виде твердого вещества (10 мг, 6,4%).1H-ЯМР (500 МГц, CDCl3): δ 7,99 (д, 2H), 7,96 (д, 2H), 7,64 (д, 2H), 6,89 (д, 2H), 5,46 (с, 2H), 2,55 (с, 3H), 1,66 (с, 6H).
Биологическая активность
Трансактивационный анализ
Векторы экспрессии получали, встраивая кДНК (комплементарную ДНК) лиганд-связывающего домена PPARalpha человека (аминокислота 168-468) и PPARgamma человека (аминокислота 205-505), к 3'-концу и внутри рамки с ДНК-связывающим доменом дрожжевого фактора транскрипции GAL4 и сигналом ядерной локализации из T-антигена вируса полиомы в вектор pSG5 (Stratagene) для экспрессии в клетках млекопитающих. Полученные экспрессионные векторы pSGGAL-PPARalpha и pSGGAL-PPARgamma использовали в экспериментах по совместной трансфекции вместе с модифицированной pGL3 промоторной плазмидой (Promega), содержащей пять копий UAS GAL4 сайта узнавания. 2,5 мкг pSGGAL-PPARalpha или pSGGAL-PPARgamma смешивали с 25 мкг pGL3p 5×UAS и 22,5 мкг pBluescript (Stratagene) в 0,95 мл ледяного PBS, содержащего 9-12 миллионов клеток U-2 OS (остеосаркомы человека). Смесь клеток и ДНК инкубировали на льду в течение 5 минут, а затем разделяли в две кюветы 0,4 см и проводили электропорацию (960 мкФ, 230 В), используя электропоратор BioRad. Две смеси после электропорации смешивали в аналитической среде [среде Игла, модифицированной по способу Дульбекко без фенолового красного, (Gibco 11880-028), содержащей 10% FBS (эмбриональная бычья сыворотка), 1% PEST (пенициллин и стрептомицин), 20 мМ HEPES, 2 мМ L-глутамин и 0,36% глюкозы (Gibco 31966-021)] при плотности 0,32 миллиона клеток/мл. 25 мкл разведенных клеток после электропорации сеяли в 384-луночные планшеты и давали возможность закрепиться в течение 3-4 ч при 37°C и 5% CO2 в инкубаторе клеточных культур. Тестируемые соединения в ДМСО разбавляли в 40 раз в аналитической среде. 7 мкл разбавленного соединения добавляли к закрепившимся после электропорации клеткам и продолжали инкубацию в течение 40 ч в инкубаторе клеточных культур. Клетки лизировали, добавив 32 мкл/лунку LucLite (Packard) и инкубировали при комнатной температуре в течение 15 минут. Люциферазную активность измеряли с использованием люминометрического метода на планшет-ридере Wallac Victor2. 16 мкМ ETYA использовали в качестве 100% контроля активности PPARalpha человека, и 16 мкМ пиоглитазона использовали в качестве 100% контроля активности PPARgamma человека.
Анализ in vivo
Определение плазменного клиренса и биодоступности при пероральном введении у хомяка или мыши
Плазменный клиренс и биодоступность при пероральном введении оценивали на самцах сирийских хомяков или самках мыши С57В1/6.
Хомяков за 2 дня до введения дозы подготавливали посредством введения катетера в левую сонную артерию для забора крови и, при необходимости, посредством введения катетера в правую яремную вену для внутривенного введения. Катетеры заполняли гепарином (100 МЕ/мл), выводили на затылке и закрывали. Операцию выполняли под анестезией изофлураном (Forene®, Abbott). После операции и в ходе опыта хомяков размещали отдельно и обеспечивали свободный доступ к пище и воде.
Мышам также обеспечивали свободный доступ к пище и воде до и во время эксперимента. Внутривенное введение производили в хвостовую вену. В определенные моменты времени мышей анестезировали изофлураном и отбирали кровь из вены.
Соединение растворяли в смеси ТЭГ:ДМА:вода (1:1:1) или в другой подходящей среде. Для определения плазменного клиренса соединение вводили путем внутривенного (в/в) болюсного введения в дозе ~2 мкмоль/кг. Образцы крови отбирали через короткие интервалы, по меньшей мере, до 6 часов после введения лекарственного средства. С целью оценки биодоступности соединение вводили перорально при дозировке ~8 мкмоль/кг через зонд, и часто отбирали образцы крови, по меньшей мере, до 6 часов после введения.
Образцы крови собирали в гепаринизированные пробирки, помещали в лед и центрифугировали не позднее чем через 30 минут в течение 5 минут при 10000 g и 4°C. Аликвоту 50 мкл плазмы переносили в 96-луночный планшет и хранили при -20°C. Для анализа образцы осаждали 150 мкл холодного ацетонитрила и центрифугировали в течение 20 минут при 2900 g. Супернатант разбавляли 1:1 водой и анализировали с помощью ЖХ/МС/МС. Концентрации мягкого лекарства и, если возможно, по меньшей мере, одного из ожидаемых метаболитов определяли, используя стандартные кривые. Концентрации соединения в композиции подтверждали с помощью ЖХ/МС/МС.
Площадь под кривой зависимости концентрации в плазме от времени после перорального и внутривенного введения, AUC(0-t), вычисляли, используя комбинацию линейной и логарифмической формулы трапеции от времени введения до времени забора с последней измеряемой концентрацией в плазме. Для внутривенной болюсной дозы концентрацию в нулевой момент времени, C(0), оценивали путем логарифмической регрессии первых двух точек на кривой зависимости концентрация-время. AUC(0-t) экстраполировали до AUC, вводя Ct/k. Ct представляет собой теоретическую концентрацию в плазме в момент забора последнего образца плазмы с определяемой концентрацией, а k является константой выведения. Ct и k были получены путем логарифмической регрессии наименьших квадратов логарифма последних 3-5 концентраций в плазме от времени. Период полувыведения (t½) вычисляли как ln 2/k.
Биодоступность (F) вычисляли как
(AUCp.o.×Дозав/в, средняя/AUCв/в, средняя×Дозар.o.)×100%.
Значения общего плазменного клиренса и объемов распределения вычисляли на основе данных по концентрации в плазме, полученных после внутривенного введения тестируемого продукта. Общий плазменный клиренс, CL, вычисляли как Дозав/в/AUCв/в, а кажущийся объем распределения, Vz, Дозав/в/(kв/в×AUCв/в). Объем распределения в стационарном состоянии, Vss, вычисляли как MRTв/в×CL. Среднее время пребывания после внутривенного введения, MRTв/в, вычисляли как AUMC/AUC для болюсного введения. После внутривенного введения среднее время пребывания вычисляли как (AUMC/AUC)-tinf/2. AUMC - площадь под кривой зависимости первого момента от времени.
Определение стабильности in vitro
Микросомы печени получали из образцов печени человека в соответствии с внутренними стандартными методиками (SOP), а микросомы печени самцов сирийских хомяков закупали (Biopredic). Соединения инкубировали при 37°C при суммарной концентрации микросомальных белков 0,5 мг/мл в калийфосфатном буфере (0,1 моль/л, pH 7,4) в присутствии кофактора NADPH (1,0 ммоль/л). Начальная концентрация соединения составляла 1,0 мкмоль/л. Пробы для анализа отбирали в 5 точках времени - через 0, 7, 15, 20 и 30 минут после начала инкубирования. Ферментативную активность в отобранной пробе немедленно останавливали, добавляя ацетонитрил (1:3,5), после чего пробу разбавляли водой 1:1. Концентрацию соединения, оставшуюся в каждой из отобранных проб, определяли посредством ЖХ/МС/МС. Константу скорости элиминации (k) мягкого лекарства вычисляли как угол наклона графика ln[мягкого лекарства] от времени инкубирования (мин). Затем константу скорости элиминации использовали для вычисления периода полувыведения (T1/2) мягкого лекарства, который впоследствии использовали для вычисления собственного клиренса (CLint) мягкого лекарства в микросомах печени как:
CLint=(ln2×инкубируемый объем)/(T1/2×концентрация белка)=мкл/мин/мг
Активность in vitro
EC50 соединений формулы I, XI, CI, MI составляет менее 30 мкмоль/л для PPARα и/или γ в анализах с репортерным геном (таблица I). Например, в анализах с репортерным геном EC50 соединений примера 1 и примера 14 для PPARα составляет 0,24 мкмоль/л и 1,4 мкмоль/л, соответственно, а для PPARγ - 1,8 мкмоль/л и 0,11 мкмоль/л, соответственно.
Специалист в данной области осведомлен, что при измерении активности соединений формулы (I), (XI), (CI), (MI) в анализе с использованием клеток, содержащих эндогенные эстеразы, необходимо проявлять осторожность. Наблюдаемая низкая активность может быть обусловлена не отсутствием у соединений собственной активности, а влиянием на соединения в ходе анализа определенных факторов, например гидролиза сложноэфирных связей в ходе применения соединений или чувствительности к инактивации в процессе длительного инкубирования.
В случае необходимости квалифицированный специалист способен адаптировать раскрытые условия анализа с целью проведения правильной оценки активности соединений, например, посредством регулировки времени инкубирования. Кроме того, ожидается, что соединения формулы (I), (XI), (CI), (MI) будут обладать активностью в бесклеточном анализе, например в анализе связывания.
Пример анализа связывания
Анализ связывания может являться сцинтилляционным анализом сближения (SPA). В SPA белок нанесен на гранулы, включающие сцинтиллятор. Меченный радиоактивной меткой лиганд, который может связываться с белком, вызывает испускание сигнала гранулами. Аффинность связывания немеченых лигандов может быть определена посредством конкурентного вытеснения радиолиганда. Указанные анализы не требуют разделения свободных и связанных радиолигандов.
Рекомбинантный, меченный 6-гистидиновым тагом, белок PPARLBD может быть экспрессирован и выделен из E.coli.
Иммобилизацию белка PPAR на гранулах можно выполнить посредством электростатических взаимодействий, используя SPA гранулы силиката иттрия, предварительно покрытые полилизином. Анализы могут быть выполнены в многолуночном формате. Реакционные смеси могут содержать покрытые полилизином SPA гранулы, фиксированную концентрацию меченного тритием лиганда PPAR, рекомбинантный 6-His PPAR и аналитический буфер. Количества и концентрации компонентов реакционной смеси и время инкубирования определяют экспериментально.
Формирование комплекса радиолиганд/PPAR может быть определено сцинтилляционным счетчиком. Аффинности тестируемых соединений могут быть определены путем включения в анализ увеличивающихся концентраций немеченого тестируемого соединения, что приводит к вытеснению меченного радиоизотопом лиганда из комплекса, что определяют по потере радиоактивного сигнала. Кривые конкурентного связывания могут быть построены на основе зависимости % связывания от концентрации и определенных равновесных констант диссоциации.
Реферат
Изобретение относится к соединениям формулы (I), формулы (XI), формулы (CI) и формулы (MI):значения R, R, R, Х, L, А, М, Q, n, i, р, w представлены в пп.1, 4, 10, 16 формулы, а также к способам получения таких соединений и к их применению при лечении воспалительных заболеваний. 8 н. и 14 з.п. ф-лы, 1 табл., 45 пр.
Формула

в которой
R1 обозначает Н;
Х обозначает S;
R2 обозначает C1-С3алкилфенил, где фенил необязательно замещен одним или несколькими следующими заместителями: галоген, С1-С4алкил, где С1-С4алкильный заместитель необязательно замещен одним или несколькими F;
R3 является CH2Ph;
p обозначает целое число 0-1;
L расположено в мета- или пара-положении и представляет собой (CH2)nC(O)O(CH2)i, (CH2)nOC(O) (CH2)i или (CH2)nSC(О)(СН2)i;
n обозначает целое число 0-3;
i обозначает целое число 0-3;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: ORb, OSO2Rb, С1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический гетероциклил, где каждый указанный моноциклический гетероциклил необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: F, С1-С4алкила (который необязательно замещен одним или несколькими F); моноциклический арилС1-С4алкил;
при этом в вышеуказанных определениях:
C1-С3алкилфенил присоединен к Х через алкильную цепь;
Rb независимо обозначает линейную или разветвленную, насыщенную или ненасыщенную С1-С4алкильную цепь, необязательно замещенную одним или несколькими F;
или его фармацевтически приемлемая соль.
n обозначает целое число 0-2;
i обозначает целое число 0-3;
p обозначает 0;
или его фармацевтически приемлемая соль.
4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}-бензиловый эфир 4-метансульфонилоксибензойной кислоты;
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-метансульфонилоксифенил)ацетоксиметил]фенил}пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-[4-(4-трифторметилбензилоксикарбонилметил)фенил]пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-[4-(4-метансульфонилокси-бензилоксикарбонилметил)фенил]пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-(4-{2-[2-(4-метансульфонилоксифенил)ацетокси]этил}фенил)пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-(4-{3-[2-(4-метансульфонилоксифенил)ацетокси]пропил}фенил)пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-[4-(2-фенилпропионилоксиметил)фенил]пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-метоксилфенилацетоксиметил]фенил}пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-изобутилфенил)-пропионилоксиметил]фенил}пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-[4-(2-пиридин-2-илацетоксиметил)фенил]пропионовая кислота;
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(4-метилпиперазин-1-ил)ацетоксиметил]фенил}пропионовая кислота;
2-фенил-5-трифторметилоксазол-4-илметиловый эфир 4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензойной кислоты;
4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензиловый эфир 2-фенил-5-трифторметилоксазол-4-карбоновой кислоты;
2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(5-метил-2-енилоксазол-4-ил)ацетоксиметил]фенил}пропионовая кислота;
4-метансульфонилоксибензиловый эфир 4-{2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензойной кислоты;
2-[2-(4-фторфенил)этансульфонил]-3-[4-(4-трифторметил-бензилоксикарбонилметил)фенил]пропионовая кислота;
2-[2-(4-фторфенил )этилсульфанил]-3-{4-[2-(4-метансульфонилоксифенил)этилсульфанилкарбонил]фенил}пропионовая кислота;
(-)-2-[2-(4-фторфенил)этилсульфанил]-3-{4-[2-(5-метил-2-фенилоксазол-4-ил)ацетоксиметил]фенил}пропионовая кислота;
2-(5-метил-2-фенилоксазол-4-ил)этиловый эфир 4-{(-)-2-карбокси-2-[2-(4-фторфенил)этилсульфанил]этил}бензойной кислоты;
или его фармацевтически приемлемая соль.

в которой
R1 обозначает Н;
Х обозначает О;
R2 обозначает линейный C1-С6алкил или разветвленный С3-С4алкил, каждый из которых необязательно замещен одним или несколькими F;
R3 является CH2Ph;
p обозначает целое число 0-1;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i;
n обозначает целое число 0-3;
i обозначает целое число 0-3;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: NRaC(O)ORb, С1-С4алкила (который необязательно замещен одним или несколькими F), моноциклического арила;
Ra независимо обозначает Н; и
Rb независимо обозначает линейную или разветвленную, насыщенную или ненасыщенную С1-C4алкильную цепь, необязательно замещенную одним или несколькими F;
или его фармацевтически приемлемая соль.
n обозначает целое число 0-1;
i обозначает целое число 0-1;
p обозначает 0;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими NRaC(O)ORb;
или его фармацевтически приемлемая соль.
R2 обозначает С2алкил;
p обозначает 0;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими NRaC(O)ORb;
или его фармацевтически приемлемая соль.
(S)-2-этокси-3-{4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]-фенил}пропионовая кислота;
(S)-3-{4-[2-(4-трет-бутоксикарбониламинофенил)ацетокси]-фенил}-2-этоксипропионовая кислота;
3-{3-бензил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]-фенил}-2-этоксипропионовая кислота;
3-{3-бензил-4-[2-(4-трет-бутоксикарбониламинофенил)-ацетокси]фенил}-2-этоксипропионовая кислота;
2-этокси-3-{3-метил-4-[2-(5-метил-2-фенилоксазол-4-ил)ацетокси]фенил}пропионовая кислота;
3-{4-[2-(4-трет-бутоксикарбониламинофенил)ацетокси]-3-метилфенил}-2-этоксипропионовая кислота;
4-метансульфонилоксибензиловый эфир 4-(2-карбокси-2-этоксиэтил)бензойной кислоты;
или его фармацевтически приемлемая соль.

в котором Х обозначает кислород, a Y обозначает кислород, когда W обозначает Н,Н (или Y обозначает Н,Н, когда W обозначает кислород), PG2 обозначает защитную группу, такую как бензильная, при использовании гидрирующего реагента, такого как водород (Н2) в присутствии палладия на угле (Pd-C).

в которой
R1 обозначает F;
w обозначает целое число 0-1;
М расположено в орто- или мета-положении и обозначает СООН;
Q обозначает C1-С2алкил Х или ХС1-С2алкил;
Х обозначает S;
R2 расположен в орто-, мета- или пара-положении и обозначает F;
р обозначает целое число 0-2;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i, (CH2)nOC(O) (CH2)i, каждый из которых необязательно замещен по любому доступному атому углерода одним или несколькими следующими заместителями, независимо выбранными из: С(O)ОС1-С3алкила, гетероарила, C1-С3алкила;
n обозначает целое число 0-3;
i обозначает целое число 0-3;
А обозначает арил или гетероарил, каждый из которых необязательно замещен одним или несколькими следующими заместителями, независимо выбранными из: галогена, ORb, C1-С4алкила (который необязательно замещен одним или несколькими F);
моноциклический гетероарил;
или его фармацевтически приемлемая соль.
Q обозначает ХС1-С2алкил;
Х обозначает S;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i;
или его фармацевтически приемлемая соль.
Q обозначает ХС1-С3алкил;
Х обозначает S;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i;
А обозначает арил, необязательно замещенный одним или несколькими галогенами;
или его фармацевтически приемлемая соль.
w обозначает целое число 0;
М расположено в орто-положении и обозначает СООН;
Q обозначает ХС1алкил;
Х обозначает S;
p обозначает целое число 0;
L расположено в мета- или пара-положении и обозначает (CH2)nC(O)O(CH2)i;
n обозначает целое число 1-2;
i обозначает целое число 1;
А обозначает арил, необязательно замещенный одним или несколькими С1-С4алкилами (которые необязательно замещены одним или несколькими F);
или его фармацевтически приемлемая соль.
w обозначает целое число 0;
М расположено в орто-положении и обозначает СООН;
Q обозначает ХС1алкил;
Х обозначает S;
p обозначает целое число 0;
L расположено в мета- или пара-положении и обозначает (CH2)nOC(O) (CH2)i;
n обозначает целое число 1-2;
i обозначает целое число 1;
А обозначает фенил, необязательно замещенный одним или несколькими С1алкилами (которые необязательно замещены одним или несколькими F);
или его фармацевтически приемлемая соль.
2-[3-(4-трифторметилбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота;
2-{4-[2-(4-трифторметилфенил)ацетоксиметил]-фенилсульфанилметил}бензойная кислота;
2-[4-(4-трифторметилбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота;
2-{3-[1-(4-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота;
2-{3-[2-(4-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота;
2-[4-(2,6-диметилбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота;
2-[4-(1-фенилбуг-3-енилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота;
2-[3-(1-метоксикарбонил-2-фенилэтоксикарбонилметил)фенилсульфанилметил]бензойная кислота;
2-{4-[2-(3,4-диметоксифенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота;
2-[4-(1-метоксикарбонил-2-фенилэтоксикарбонилметил)фенилсульфанилметил]бензойная кислота;
2-{3-[2-(2-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота;
2-[4-(оксазол-2-илфенилметоксикарбонилметил)-фенилсульфанилметил]бензойная кислота;
2-{4-[2-(2-трифторметилфенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота;
2-[3-(2,6-диметилбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота;
2-[3-(4-пиразол-1-илбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота;
2-[4-(4-пиразол-1-илбензилоксикарбонилметил)-фенилсульфанилметил]бензойная кислота;
2-{3-[2-(3,4-диметоксифенил)этоксикарбонилметил]-фенилсульфанилметил}бензойная кислота;
или его фармацевтически приемлемая соль.

в которой
R1 обозначает C1-С2алкил, необязательно замещенный одним или несколькими F;
R2 обозначает С1-С2алкил, необязательно замещенный одним или несколькими F;
Х обозначает О;
p обозначает 0;
L расположено в мета- или пара-положении и обозначает (CH2)nOC(O) (CH2)i;
n обозначает целое число 0-1;
i обозначает целое число 0;
А обозначает тиазол (который необязательно замещен одним или несколькими моноциклическими арилами, где каждый указанный моноциклический арил необязательно замещен С1-С4алкилом (который необязательно замещен одним или несколькими F));
или его фармацевтически приемлемая соль.
R1 обозначает С1алкил, необязательно замещенный одним или несколькими F;
R2 обозначает С1алкил, необязательно замещенный одним или несколькими F;
Х обозначает О;
L расположено в мета-положении и обозначает (СН2)nOC(O) (СН2)i;
n обозначает целое число 1;
i обозначает целое число 0;
или его фармацевтически приемлемая соль.
4-метил-2-(4-трифторметилфенил)тиазол-5-илметиловым эфиром 4-(1-карбокси-1-метилэтокси)бензойной кислоты
или его фармацевтически приемлемой солью.

Комментарии