Производное транс-2-деценовой кислоты и содержащее его фармацевтическое средство - RU2584163C2
Код документа: RU2584163C2
Чертежи
Описание
Область техники
Настоящее изобретение относится к новому производному транс-2-деценовой кислоты или его фармацевтически приемлемой соли и к фармацевтическому средству, содержащему указанное соединение в качестве активного ингредиента. Более конкретно, оно относится к новому производному транс-2-деценовой кислоты или его фармацевтически приемлемой соли, обладающим активностью, подобно нейротрофическому фактору, такому как фактор роста нервов (NGF) или нейротрофический фактор головного мозга (BDNF), или оказывающий облегчающее действие на побочные эффекты, вызванные введением противораковых средств, и к фармацевтическому средству, содержащему указанное соединение в качестве активного ингредиента.
Уровень техники
Нервные клетки представляют собой клетки, выполняющие функцию передачи сигналов, и их повреждение выражается в виде тяжелой потери функции черепно-мозговых нервов. В центральных нервах головного мозга и спинного мозга трудно ожидать регенерации аксонов, и, когда нервные клетки повреждаются или денатурируются, необходимо защитить и активировать нервные клетки. В виде биофизической функции как таковой, роль нейротрофических факторов, ответственных за дифференциацию нервных клеток, существенным является поддержание выживания, стимуляция функции синапсов и регенерации/восстановления поврежденных нервных аксонов.
В нейротрофических факторах фактор роста нервов (NGF), нейротрофический фактор головного мозга (BDNF), нейтрофин-3 (NT-3), нейтрофин-4/5 (NT-4/5) и т.д. составляют семейство нейтрофинов, имеющих гомологию последовательностей не менее чем 50%, где фактор роста нервов (NGF) является прототипом. Когда нейтрофин, секретируемый наружу из клеток, связан с высоко аффинными рецепторами (Trk) на мембранах нервных клеток, сигналы передаются в трех направлениях в нервных клетках. Путем активации пути передачи сигналов MAP киназы, включая активацию (фосфорилирование) MAP киназы (митоген-активированный белок (MAP) киназы/регулируемые внеклеточными сигналами протеинкиназы 1/2 (ERK 1/2)) являются одними из них, активируется CREB (белок, связывающий элемент цАМФ-реакции) фактора транскрипции, вследствие чего регулируется экспрессия многих генов. Соответственно, когда передача сигналов через путь передачи сигналов MAP киназы способен активироваться, существует возможность ее клинического применения при нервных расстройствах, вызванных денатурацией нервных клеток и гибелью клеток. Имеются также сообщения о связи между нейротрофическим фактором головного мозга (BDNF) и некоторыми заболеваниями.
В результате исследований генетического полиморфизма нейротрофического фактора головного мозга (BDNF), были сообщения о том, что специфический полиморфизм относится к болезни Паркинсона (см. непатентный документ 1), к болезни Альцгеймера (см. непатентный документ 2), к депрессии (см. непатентный документ 3), к биполярной депрессии (см. непатентный документ 4) и к тревожным расстройствам (см. непатентный документ 5). Были также сообщения о том, что снижение синаптической функции у мышей с генной мутацией при болезни Хантингтона восстанавливается введением нейротрофического фактора головного мозга (BDNF) (см. непатентный документ 6), и что введение ингибитора фосфорилирования MAP киназы вызывает депрессивное состояние (см. непатентный документ 7).
Как будет отмечено из примеров указанного выше нейротрофического фактора головного мозга (BDNF), нейротрофический фактор проявляет терапевтический эффект при определенных нервных заболеваниях и оказывает действие в виде прорастания и удлинения аксонов. Однако поскольку нейротрофический фактор представляет собой высокомолекулярный белок, проблема заключается в том, что даже когда он вводится с периферии, он неспособен пройти через гематоэнцефалический барьер и вряд ли достигает мозга. В таких условиях предпринимались попытки разработки фармацевтических средств, которые представляют собой низкомолекулярные соединения и обладают подобной нейротрофической активностью, активирующей нервные клетки, и фармацевтических средств, которые стимулируют продукцию и секрецию нейротрофического фактора.
До настоящего времени были предложены средства, обладающие активностью, подобно нейротрофическому фактору, содержащие соединения заданных общих формул (патентные документы 1 и 2). Были также предложены средства для ускорения продукции/секреции нейротрофического фактора, содержащие соединения заданных общих формул (см. патентные документы 3-5) и стимуляторы регенерации нервов, содержащие соединения жирных кислот, их соль или пролекарство (см. патентный документ 6).
Было также предложено лекарственное средство, которое содержит соединение, имеющее заданную общую формулу, и улучшает снижение реакции на рецептор ГАМК A астроцитов для предотвращения/лечения нейродегенеративных заболеваний и т.д. (см. патентный документ 7).
Был также предложен индуктор дифференциации нервных клеток, в котором активным ингредиентом является среднецепочечная жирная кислота, имеющая 6-10 атомов углерода, или метиловый, этиловый, пропиловый или н-бутиловый сложный эфир среднецепочечной жирной кислоты, имеющей 6-10 цепей (см. патентный документ 8).
Указывалось также, что жирная кислота или сложный эфир жирной кислоты обладает активностью, подобно нейротрофическому фактору (см. патентный документ 9).
Был также описан амид жирной кислоты, имеющий третичную аминогруппу, в качестве предшественника поверхностно-активных веществ (см. патентный документ 10).
Документы уровня техники
Патентные документы
Патентный документ 1: Выложенный патент Японии № 2000-7568
Патентный документ 2: Выложенный патент Японии № 2003-113085
Патентный документ 3: Выложенный патент Японии № 2002-80467
Патентный документ 4: Выложенный патент Японии № 2003-261545
Патентный документ 5: Публикация Международного патента № WO 2003/084542
Патентный документ 6: Публикация Международного патента № WO 2005/032535
Патентный документ 7: Выложенный патент Японии № Hei-07-316092
Патентный документ 8: Выложенный патент Японии № 2007-217311
Патентный документ 9: Публикация Международного патента № WO 2009-038110
Патентный документ 10: Выложенный патент Японии № 2010-505893
Непатентные документы
Непатентный документ 1: Ann. Neurol. 2002 Jan; 51(1):133-6
Непатентный документ 2: J. Neural Transm. 2005 May; 112(5):703-11. Epub 2004 Sep 14
Непатентный документ 3: Neuropsychopharmacology. 2003 Feb; 28(2):397-401. Epub 2002 Aug 29
Непатентный документ 4: Br. J. Psychiatry. 2006 Oct; 189:317-23
Непатентный документ 5: Psychopharmacology (Berl). 2005 Jun; 180(1):95-9. Epub 2005 Jan 26
Непатентный документ 6: J. Neurosci. 2007 Apr 18; 27(16):4424-34
Непатентный документ 7: BIOL. PSYCHIATRY 2007; 61:661-670
Краткое описание сущности изобретения
Проблемы, решаемые изобретением
Однако в средствах, обладающих активностью, подобно нейротрофическому фактору, или средствах, стимулирующих продукцию/секрецию нейротрофического фактора, указанного в патентных документах 1-5, ни жирная кислота, ни производное жирной кислоты не являются активным ингредиентом. В стимуляторе регенерации нервов, указанном в патентном документе 6, описанный обладающий фармакологической активностью в отношении регенерации нервов активный ингредиент представляет собой (2R)-2-пропилоктановую кислоту. В лекарственном препарате, который предотвращает/лечит нейродегенеративные заболевания и т.д., указанный в патентом документе 7, активным ингредиентом является насыщенная жирная кислота, имеющая 10 атомов углерода (C10) или менее, ненасыщенная жирная кислота или сложный эфир насыщенной жирной кислоты, имеющий 5 атомов углерода (C5) или тому подобное. В индукторе дифференциации нервных клеток, указанном в патентом документе 8, активным ингредиентом является среднецепочечная насыщенная жирная кислота или сложный эфир среднецепочечной насыщенной жирной кислоты, имеющие 6-10 атомов углерода. В патентном документе 9 активным ингредиентом является жирная кислота или сложный эфир жирной кислоты. В патентном документе 10 нет конкретного описания производного деценовой кислоты, и, кроме того, нет описания активности, подобно нейротрофическому фактору.
Задачей настоящего изобретения является получение нового производного транс-2-деценовой кислоты или его фармацевтически приемлемой соли и получение фармацевтического средства, которое содержит указанное соединение в качестве активного ингредиента и имеет высоко безопасную активность, подобную нейротрофическому фактору, или обладает активностью облегчения побочного эффекта, вызванного введением противораковых средств.
Средства для решения задач
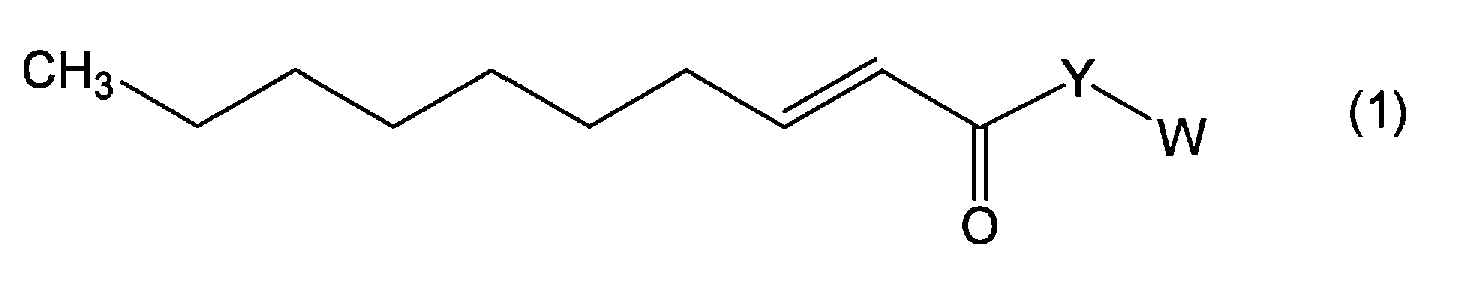
В результате интенсивных исследований для решения указанных выше задач, авторы настоящего изобретения обнаружили, что новое производное транс-2-деценовой кислоты, представленное следующей формулой (1), или его фармацевтически приемлемая соль обладает превосходной подобной нейротрофическому фактору активностью или облегчающим действием (включая профилактическое и лечебное действие при настоящем применении; далее, этот термин имеет такое же значение) против побочного эффекта, вызванного введением противораковых средств. В результате дальнейших исследований на основании таких данных было создано настоящее изобретение.
Таким образом, настоящее изобретение относится к следующему соединению (производному деценовой кислоты), а также относится к фармацевтическому средству (в частности, средству, обладающему активностью, подобно нейротрофическому фактору, и средству для облегчения побочного эффекта, вызванного введением противораковых средств), содержащему указанное соединение.
[1] Производное транс-2-деценовой кислоты, представленное следующей формулой (1'), или его фармацевтически приемлемая соль:

[где
Y' представляет собой -O-, -NR'- или -S-;
W' представляет собой W1', когда Y' представляет собой -O-, W2', когда Y' представляет собой -NR'-, или W3', когда Y' представляет собой -S-;
(1) W1' представляет собой диалкиламиноалкильную группу, алкилтиоалкильную группу, алкоксиалкильную группу, диалкоксиалкильную группу или диалкиламиноалкоксиалкильную группу;
(2-1) W2' представляет собой атом водорода, алкильную группу или диалкиламиноалкильную группу, когда R' представляет собой диалкиламиноалкильную группу;
(2-2) W2' представляет собой алкильную группу, которая является такой же или отлична от R', когда R' представляет собой алкильную группу (кроме случая, когда и R', и W2' представляют собой этильную группу); или
(2-3) W2' представляет собой алкильную группу (кроме 2-метилпропильной группы и 2-метилбутильной группы), циклогексильную группу или пирролидиналкильную группу, когда R' представляет собой атом водорода; и
(3) W3' представляет собой алкильную группу, циклоалкильную группу, фенилалкильную группу или диалкиламиноалкильную группу.]
[2] Производное транс-2-деценовой кислоты или его фармацевтически приемлемая соль по пункту [1], где Y' представляет собой -O-, и W1' представляет собой диалкиламиноалкильную группу, алкилтиоалкильную группу, алкоксиалкильную группу, диалкоксиалкильную группу или диалкиламиноалкоксиалкильную группу.
[3] Производное транс-2-деценовой кислоты или его фармацевтически приемлемая соль по пункту [1], где Y' представляет собой -NR'-.
[4] Производное транс-2-деценовой кислоты или его фармацевтически приемлемая соль по пункту [3], где R' представляет собой диалкиламиноалкильную группу, и W2' представляет собой атом водорода, алкильную группу или диалкиламиноалкильную группу.
[5] Производное транс-2-деценовой кислоты или его фармацевтически приемлемая соль по пункту [3], где R' представляет собой алкильную группу, и W2' представляет собой алкильную группу, которая является такой же или отлична от R' (кроме случая, где и R', и W2' представляют собой этильную группу).
[6] Производное транс-2-деценовой кислоты или его фармацевтически приемлемая соль по пункту [3], где R' представляет собой атом водорода, и W2' представляет собой алкильную группу (кроме 2-метилпропильной группы и 2-метилбутильной группы), циклогексильную группу или пирролидиналкильную группу.
[7] Производное транс-2-деценовой кислоты или его фармацевтически приемлемая соль по пункту [1], где Y' представляет собой -S-, и W3' представляет собой алкильную группу, циклоалкильную группу, фенилалкильную группу или диалкиламиноалкильную группу.
[8] Фармацевтическое средство, содержащее транс-2-деценовую кислоту, представленную следующей формулой (1), или его фармацевтически приемлемую соль в качестве активного ингредиента:

[где
Y представляет собой -O-, -NR- или -S-;
W представляет собой W1, когда Y представляет собой -O-, W2, когда Y представляет собой -NR-, или W3, когда Y представляет собой -S-;
(1) W1 представляет собой диалкиламиноалкильную группу, алкилтиоалкильную группу, алкоксиалкильную группу, диалкоксиалкильную группу или диалкиламиноалкоксиалкильную группу;
(2-1) W2 представляет собой атом водорода, алкильную группу или диалкиламиноалкильную группу, когда R представляет собой диалкиламиноалкильную группу;
(2-2) W2 представляет собой алкильную группу, которая является такой же или отлична от R, когда R представляет собой алкильную группу; или
(2-3) W2 представляет собой алкильную группу, циклоалкильную группу, пирролидиналкильную группу, фенильную группу или фенилалкильную группу, когда R представляет собой атом водорода; и
(3) W3 представляет собой алкильную группу, циклоалкильную группу, фенилалкильную группу или диалкиламиноалкильную группу.]
[9] Фармацевтическое средство по пункту [8], где Y представляет собой -O-, и W1 представляет собой диалкиламиноалкильную группу, алкилтиоалкильную группу, алкоксиалкильную группу, диалкоксиалкильную группу или диалкиламиноалкоксиалкильную группу.
[10] Фармацевтическое средство по пункту [8], где Y представляет собой -NR-.
[11] Фармацевтическое средство по пункту [10], где R представляет собой диалкиламиноалкильную группу, и W2 представляет собой атом водорода, алкильную группу или диалкиламиноалкильную группу.
[12] Фармацевтическое средство по пункту [10], где R представляет собой алкильную группу, и W2 представляет собой алкильную группу, которая является такой же или отлична от R.
[13] Фармацевтическое средство по пункту [11], где R представляет собой атом водорода, и W2 представляет собой алкильную группу, циклоалкильную группу, пирролидиналкильную группу, фенильную группу или фенилалкильную группу.
[14] Фармацевтическое средство по пункту [8], где Y представляет собой -S-, и W3 представляет собой алкильную группу, циклоалкильную группу, фенилалкильную группу или диалкиламиноалкильную группу.
[15] Фармацевтическое средство по любому из пунктов [8]-[14], где фармацевтическое средство представляет собой средство, обладающее активностью, подобно нейротрофическому фактору.
[16] Фармацевтическое средство по любому из пунктов [8]-[14], где фармацевтическое средство представляет собой профилактическое или лечебное средство против нервного расстройства.
[17] Фармацевтическое средство по пункту [16], где нервное расстройство представляет собой нейродегенеративное заболевание.
[18] Фармацевтическое средство по пункту [17], где нейродегенеративное заболевание представляет собой деменцию, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз (ALS), болезнь Хантингтона, прогрессирующий супрануклеарный паралич (PSP) или диабетическую нейропатию.
[19] Фармацевтическое средство по пункту [16], где нервное расстройство представляет собой психическое заболевание.
[20] Фармацевтическое средство по пункту [19], где психическое заболевание представляет собой депрессию.
[21] Фармацевтическое средство по пункту [19], где психическое заболевание представляет собой тревожное расстройство (невроз).
[22] Фармацевтическое средство по любому из пунктов [8]-[14], где фармацевтическое средство представляет собой лечебное средство или восстанавливающее средство против травмы спинного мозга.
[23] Фармацевтическое средство по любому из пунктов [8]-[14], где фармацевтическое средство представляет собой средство для облегчения побочного эффекта, вызванного введением противораковых средств.
[24] Фармацевтическое средство по пункту [23], где побочный эффект, вызванный введением противораковых средств, представляет собой поражение периферических нервов.
[25] Соединение или его фармацевтически приемлемая соль по любому из пунктов [8]-[14], предназначенное для лечения заболевания по любому из пунктов [16]-[22].
[26] Соединение или его фармацевтически приемлемая соль по любому из пунктов [8]-[14], предназначенное для лечения побочного эффекта (в частности, поражения периферических нервов), вызванного введением противораковых средств.
[27] Способ лечения заболевания по любому из пунктов [16]-[22], где соединение или его фармацевтически приемлемую соль по любому из пунктов [8]-[14] в активной дозе вводят пациенту, страдающему заболеванием по любому из пунктов [16]-[22].
[28] Способ лечения побочного эффекта, вызванного введением противораковых средств, где соединение или его фармацевтически приемлемую соль по любому из пунктов [8]-[14] в активной дозе вводят пациенту, у которого имеется побочный эффект (в частности, поражение периферических нервов), вызванный введением противораковых средств.
[29] Применение соединения или его фармацевтически приемлемой соли по любому из пунктов [8]-[14] при получении фармацевтического средства для лечения заболевания по любому из пунктов [16]-[22].
[30] Применение соединения или его фармацевтически приемлемой соли по любому из пунктов [8]-[14] при получении фармацевтического средства для лечения побочного эффекта (в частности, поражения периферических нервов), вызванного введением противораковых средств.
Преимущества изобретения
Поскольку соединение по настоящему изобретению обладает высокой активностью, подобно нейротрофическому фактору, оно применяется в качестве средства, обладающего активностью, подобно нейротрофическому фактору. Благодаря активности, подобно нейротрофическому фактору, данное средство, обладающее активностью, подобно нейротрофическому фактору, активирует передачу сигналов через путь передачи сигналов MAP киназы и полезно в качестве высоко безопасного профилактического или лечебного средства против нервного расстройства.
Среди нервных расстройств, данное средство особенно полезно в качестве профилактического или лечебного средства (средства, улучшающего состояние) против таких нейродегенеративных заболеваний как деменция, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз (ALS), болезнь Хантингтона, прогрессирующий супрануклеарный паралич (PSP), диабетическая нейропатия или глаукома, которая представляет собой заболевание зрительного нерва.
Кроме того, настоящее средство особенно полезно в качестве профилактического/улучшающего состояние средства против психических заболеваний при нервных расстройствах. Среди психических заболеваний, настоящее средство особенно полезно в качестве профилактического или улучшающего состояние средства против депрессии и тревожного расстройства (невроза) и, в частности, достигает быстро наступающего антидепрессантного и противотревожного эффекта в качестве профилактического или лечебного средства (средства, улучшающего состояние) против депрессии и тревожного расстройства (невроза).
Кроме того, средство по настоящему изобретению, обладающее активностью, подобно нейротрофическому фактору, полезно в качестве лечебного средства (восстанавливающего средства) против повреждения спинного мозга и может применяться для восстановления повреждения спинного мозга, в частности, посредством введения в организм.
Кроме того, соединение по настоящему изобретению оказывает превосходное фармакологическое действие, которое облегчает побочный эффект, вызванный введением противораковых средств. Оно особенно полезно в качестве средства, облегчающего расстройства периферических нервов, при побочном эффекте, сопровождающем введение противораковых средств.
Краткое описание фигур
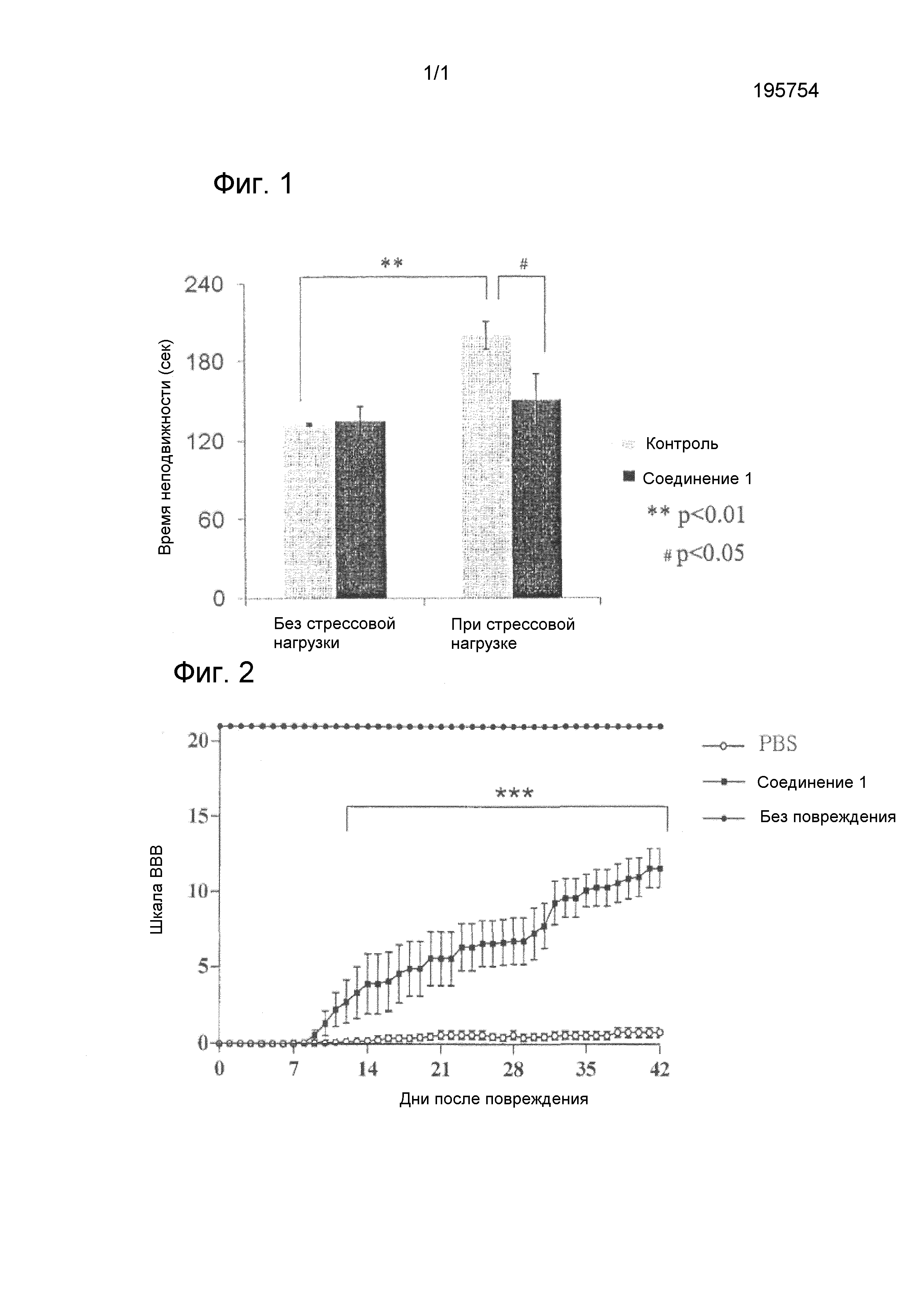
На фиг.1 представлен график, показывающий время неподвижности мышей в примерах со стрессовой нагрузкой и снятием стресса при контроле и при введении соединения 1 на тринадцатый день после стрессовой нагрузки вынужденным плаванием в примере тестирования 3.
На фиг.2 представлен график, показывающий улучшение двигательной функции по шкале BBB на модели повреждения спинного мозга у крыс в течение шести недель у групп, получавших соединение 1 или забуференный фосфатом солевой раствор (PBS), в примере тестирования 4.
Способ осуществления изобретения
Настоящее изобретение относится к новому производному транс-2-деценовой кислоты, представленному следующей формулой (1'), или его фармацевтически приемлемой соли:

где
Y' представляет собой -O-, -NR'- или -S-;
W' представляет собой W1', когда Y' представляет собой -O-, W2', когда Y' представляет собой -NR'-, или W3', когда Y' представляет собой -S-;
(1) W1' представляет собой диалкиламиноалкильную группу, алкилтиоалкильную группу, алкоксиалкильную группу, диалкоксиалкильную группу или диалкиламиноалкоксиалкильную группу;
(2-1) W2' представляет собой атом водорода, алкильную группу или диалкиламиноалкильную группу, когда R' представляет собой диалкиламиноалкильную группу;
(2-2) W2' представляет собой алкильную группу, которая является такой же или отлична от R', когда R' представляет собой алкильную группу (кроме случая, где и R', и W2' представляют собой этильную группу); или
(2-3) W2' представляет собой алкильную группу (кроме 2-метилпропильной группы и 2-метилбутильной группы), циклогексильную группу или пирролидиналкильную группу, когда R' представляет собой атом водорода; и
(3) W3' представляет собой алкильную группу, циклоалкильную группу, фенилалкильную группу или диалкиламиноалкильную группу.
«Алкил» в «аминоалкиле», когда W1' представляет собой «диалкиламиноалкильную группу» в заместителе указанной выше формулы (1'), представляет собой предпочтительно линейную или разветвленную алкильную группу, имеющую 1-10 атомов углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, диметилпропил, гексил, изогексил, гептил, изогептил, октил, изооктил, нонил, изононил, децил или изодецил, и, более предпочтительно, линейную или разветвленную алкильную группу, имеющую 1-6 атомов углерода.
Каждый из «алкила», когда и R', и W2' представляют собой алкильную группу, является одинаковым или различным и предпочтительно представляет собой линейную или разветвленную алкильную группу, имеющую 1-10 атомов углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, гексил, изогексил, гептил, изогептил, октил, изооктил, нонил, изононил, децил или изодецил, и, более предпочтительно, линейную или разветвленную алкильную группу, имеющую 1-7 атомов углерода. Однако случай, где и R', и W2' представляют собой этил, исключается.
«Алкил», когда R' представляет собой атом водорода, и W2' представляет собой алкильную группу, представляет собой предпочтительно линейную или разветвленную алкильную группу, имеющую 1-10 атомов углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, гексил, изогексил, гептил, изогептил, 1-пропилбутил, октил, изооктил, 1-этилгексил, 1,1,3,3-тетраметилбутил, нонил, изононил, децил или изодецил, и, более предпочтительно, линейную или разветвленную алкильную группу, имеющую 1-8 атомов углерода. Однако исключается случай, где он представляет собой 2-метилпропильную группу или 2-метилбутильную группу.
«Алкил», когда W3' представляет собой алкильную группу, представляет собой предпочтительно линейную или разветвленную алкильную группу, имеющую 1-12 атомов углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, гексил, изогексил, гептил, изогептил, октил, изооктил, нонил, изононил, децил, изодецил, ундецил, изоундецил, додецил или изододецил и, более предпочтительно, линейную или разветвленную алкильную группу, имеющую 4-10 атомов углерода.
«Циклоалкильная группа» представляет собой предпочтительно циклоалкильную группу, имеющую 3-8 атомов углерода, такую как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил, и, более предпочтительно, циклоалкильную группу, имеющую 5 или 6 атомов углерода.
«Алкил», который отличается от определенных выше, представляет собой предпочтительно линейную или разветвленную алкильную группу, имеющую 1-4 атома углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил.
«Алкокси» в заместителе указанной выше формулы (1') представляет собой предпочтительно линейную или разветвленную алкоксигруппу, имеющую 1-4 атома углерода, такую как метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси или трет-бутокси.
Предпочтительные примеры соединения, представленного указанной выше формулой (1'), включают такие, где Y' представляет собой -O-, и W1' представляет собой диалкиламиноалкильную группу.
Другие предпочтительные примеры включают такие, где Y' представляет собой -O-, и W1' представляет собой алкилтиоалкильную группу.
Другие предпочтительные примеры включают такие, где Y' представляет собой -O-, и W1' представляет собой алкоксиалкильную группу.
Другие предпочтительные примеры включают такие, где Y' представляет собой -O-, и W1' представляет собой диалкоксиалкильную группу.
Другие предпочтительные примеры включают такие, где Y' представляет собой -O-, и W1' представляет собой диалкиламиноалкоксиалкильную группу.
Другие предпочтительные примеры включают такие, где Y' представляет собой -NR'-, R' представляет собой диалкиламиноалкильную группу, и W2' представляет собой атом водорода.
Другие предпочтительные примеры включают такие, где Y' представляет собой -NR'-, R' представляет собой диалкиламиноалкильную группу, и W2' представляет собой алкильную группу.
Другие предпочтительные примеры включают такие, где Y' представляет собой -NR'-, R' представляет собой диалкиламиноалкильную группу, и W2' представляет собой диалкиламиноалкильную группу.
Другие предпочтительные примеры включают такие, где Y' представляет собой -NR'-, R' представляет собой алкильную группу, и W2' представляет собой алкильную группу, которая является такой же или отлична от R' (кроме случая, где и R', и W2' представляют собой этильную группу).
Другие предпочтительные примеры включают такие, где Y' представляет собой -NR'-, R' представляет собой атом водорода, и W2' представляет собой алкильную группу (кроме 2-метилпропильной группы и 2-метилбутильной группы).
Другие предпочтительные примеры включают такие, где Y' представляет собой -NR'-, R' представляет собой атом водорода, и W2' представляет собой циклогексильную группу.
Другие предпочтительные примеры включают такие, где Y' представляет собой -NR'-, R' представляет собой атом водорода, и W2' представляет собой пирролидиналкильную группу.
Другие предпочтительные примеры включают такие, где Y' представляет собой -S-, и W3' представляет собой алкильную группу.
Другие предпочтительные примеры включают такие, где Y' представляет собой -S-, и W3' представляет собой циклоалкильную группу.
Другие предпочтительные примеры включают такие, где Y' представляет собой -S-, и W3' представляет собой фенилалкильную группу.
Другие предпочтительные примеры включают такие, где Y' представляет собой -S-, и W3' представляет собой диалкиламиноалкильную группу.
Настоящее изобретение также относится к фармацевтическому средству, такому как средство, обладающее активностью, подобно нейротрофическому фактору, или средство для облегчения побочного эффекта, вызванного введением противораковых средств, где фармацевтическое средство содержит по меньшей мере один член в виде нового производного транс-2-деценовой кислоты, представленный следующей формулой (1), и его фармацевтически приемлемой соли в качестве активного ингредиента. Соединение, представленное формулой (1), охватывает соединение, представленное указанной выше формулой (1'):
где
Y представляет собой -O-, -NR- или -S-;
W представляет собой W1, когда Y представляет собой -O-, W2, когда Y представляет собой -NR-, или W3, когда Y представляет собой -S-;
(1) W1 представляет собой диалкиламиноалкильную группу, алкилтиоалкильную группу, алкоксиалкильную группу, диалкоксиалкильную группу или диалкиламиноалкоксиалкильную группу;
(2-1) W2 представляет собой атом водорода, алкильную группу или диалкиламиноалкильную группу, когда R представляет собой диалкиламиноалкильную группу;
(2-2) W2 представляет собой алкильную группу, которая является такой же или отлична от R, когда R представляет собой алкильную группу;
(2-3) W2 представляет собой алкильную группу, циклоалкильную группу, пирролидиналкильную группу, фенильную группу или фенилалкильную группу, когда R представляет собой атом водорода; и
(3) W3 представляет собой алкильную группу, циклоалкильную группу, фенилалкильную группу или диалкиламиноалкильную группу.
«Алкил» в «аминоалкиле», когда W1 представляет собой «диалкиламиноалкильную группу» в заместителе указанной выше формулы (1), является таким же как «алкил» в «аминоалкиле», когда W1' представляет собой «диалкиламиноалкильную группу» в заместителе указанной выше формулы (1').
Каждый из «алкила», когда и R, и W2 представляют собой алкильную группу, которая является одинаковой или различной и представляет собой предпочтительно линейную или разветвленную алкильную группу, имеющую 1-10 атомов углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, гексил, изогексил, гептил, изогептил, октил, изооктил, нонил, изононил, децил или изодецил, и, более предпочтительно, линейную или разветвленную алкильную группу, имеющую 1-7 атомов углерода.
«Алкил», когда R представляет собой атом водорода, и W2 представляет собой алкильную группу, представляет собой предпочтительно линейную или разветвленную алкильную группу, имеющую 1-10 атомов углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, гексил, изогексил, гептил, изогептил, 1-пропилбутил, октил, изооктил, 1-этилгексил, 1,1,3,3-тетраметилбутил, нонил, изононил, децил или изодецил, и, более предпочтительно, линейную или разветвленную алкильную группу, имеющую 1-8 атомов углерода.
«Алкил», когда W3 представляет собой алкильную группу, является таким как «алкил», когда W3' в заместителе указанной выше формулы (1') представляет собой алкильную группу.
«Циклоалкильная группа» является такой как «циклоалкильная группа» в заместителе указанной выше формулы (1').
«Алкил» в заместителе указанной выше формулы (1), который отличается от определенных выше, представляет собой предпочтительно линейную или разветвленную алкильную группу, имеющую 1-4 атома углерода, такую как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил.
«Алкокси» в заместителе указанной выше формулы (1) является такой как «алкокси» в заместителе указанной выше формулы (1').
Предпочтительные примеры соединения, представленного указанной выше формулой (1), включают такие, где Y представляет собой -O-, и W1 представляет собой диалкиламиноалкильную группу.
[0091]
Другие предпочтительные примеры включают такие, где Y представляет собой -O-, и W1 представляет собой алкилтиоалкильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -O-, и W1 представляет собой алкоксиалкильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -O-, и W1 представляет собой диалкоксиалкильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -O-, и W1 представляет собой диалкиламиноалкоксиалкильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -NR-, R представляет собой диалкиламиноалкильную группу, и W2 представляет собой атом водорода.
Другие предпочтительные примеры включают такие, где Y представляет собой -NR-, R представляет собой диалкиламиноалкильную группу, и W2 представляет собой алкильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -NR-, R представляет собой диалкиламиноалкильную группу, и W2 представляет собой диалкиламиноалкильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -NR-, R представляет собой алкильную группу, и W2 представляет собой алкильную группу, которая является такой же или отлична от R.
Другие предпочтительные примеры включают такие, где Y представляет собой -NR-, R представляет собой атом водорода, и W2 представляет собой алкильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -NR-, R представляет собой атом водорода, и W2 представляет собой циклоалкильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -NR-, R представляет собой атом водорода, и W2 представляет собой пирролидиналкильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -NR-, R представляет собой атом водорода, и W2 представляет собой фенильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -NR-, R представляет собой атом водорода, и W2 представляет собой фенилалкильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -S-, и W3 представляет собой алкильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -S-, и W3 представляет собой циклоалкильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -S-, и W3 представляет собой фенилалкильную группу.
Другие предпочтительные примеры включают такие, где Y представляет собой -S-, и W3 представляет собой диалкиламиноалкильную группу.
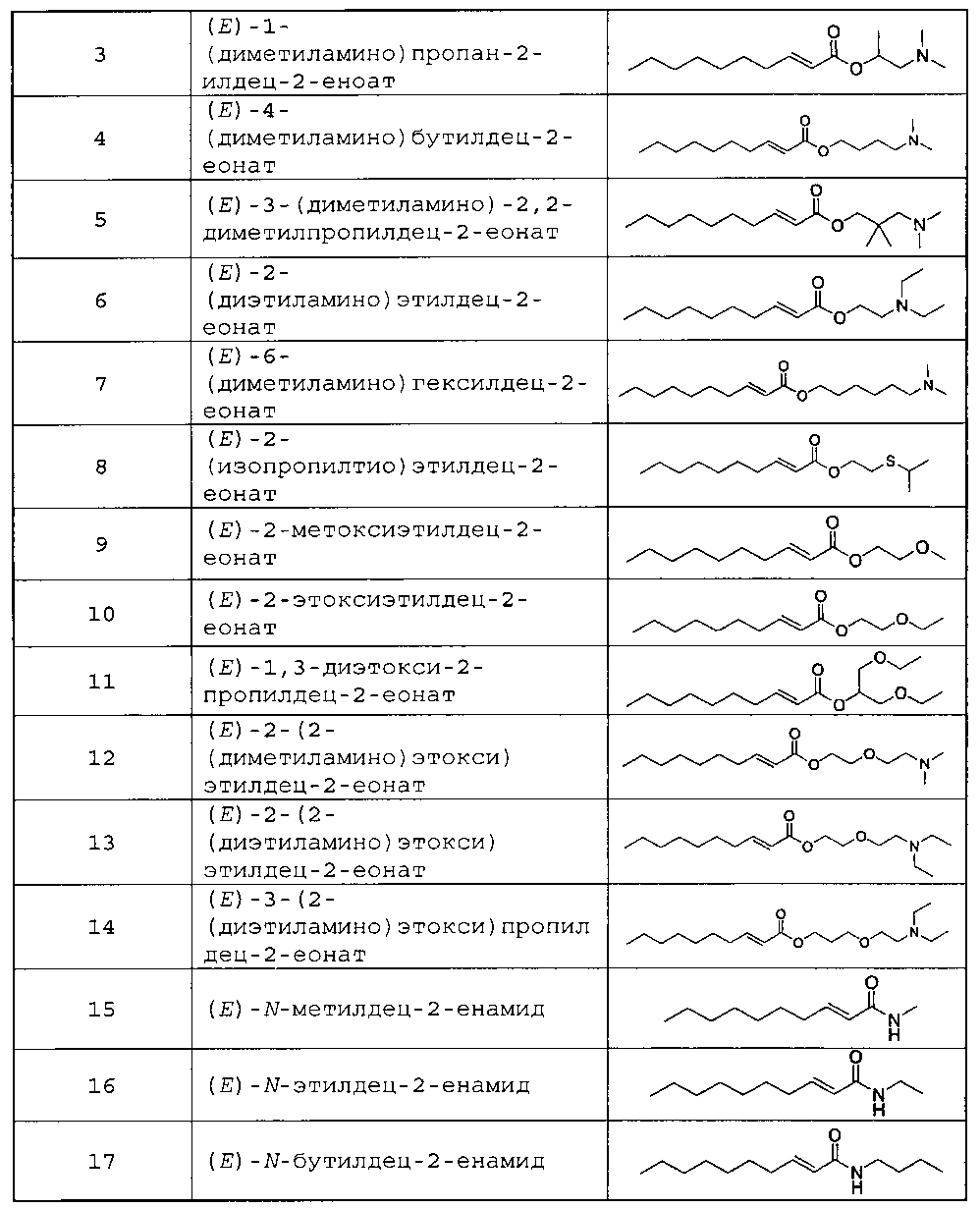
Предпочтительные соединения по настоящему изобретению показаны в таблицах 1-4.

Соединение по настоящему изобретению, представленное формулой (1) (включая также соединение, представленное формулой (1'); является таким же, как в следующем описании может быть получено с использованием транс-2-деценовой кислоты в качестве исходного соединения. Соединение, представленное формулой (1), может быть получено, например, как показано в следующих реакционных формулах.

(где Y и W являются такими, как указано выше.)
Соединение, представленное формулой (1), может быть получено путем реакции дегидратации-конденсации соединения, представленного формулой (2), и соединения, представленного формулой (3). Реакция дегидратации-конденсации может быть осуществлена общеизвестными способами.
Например, соединение, представленное формулой (2), может быть подвергнуто взаимодействию с соединением, представленным формулой (3), в присутствии соответствующего конденсирующего агента (такого как дициклогексилкарбодиимид (DCC) или N-(3-диметиаминопропил-N'-этилкарбодиимид HCl). Реакцию можно обычно проводить в обычном растворителе (таком как дихлорметан). Обычно, используемое количество соединения, представленного формулой (3), составляет от 0,5 до 2 моль (предпочтительно, от 1 до 1,5 моль) на 1 моль соединения, представленного формулой (2).
Альтернативно, соединение, представленное формулой (2), может быть, например, сначала преобразовано в карбоксильное галоидное соединение, и затем подвергнуто взаимодействию с соединением, представленным формулой (3), в присутствии или в отсутствие основания. Преобразование карбоксильного галоидного соединения можно проводить, например, с использованием галоидирующего агента, такого как тионилхлорид, сульфирилхлорид, трихлорид фосфора, пентахлорид фосфора, оксалилхлорид или трихлорид фосфорной кислоты. Примеры основания включают триэтиламин и пиридин. Обычно, используемое количество соединения, представленного формулой (3), составляет от 0,5 до 2 моль (предпочтительно, от 1 до 1,5 моль) на 1 моль соединения, представленного формулой (2). Когда используют основание, используемое количество основания составляет обычно примерно от 1 до 5 моль на 1 моль соединения, представленного формулой (2).
После завершения указанной выше реакции, целевое соединение может быть получено с использованием известных методов очистки и выделения (таких как экстракция, хроматография, отгонка или перекристаллизация).
Соединение по настоящему изобретению, представленное формулой (1), включает не только естественно указанную выше свободную форму, но также формы соли, сольвата и пролекарства. При образовании соли, форма фармацевтически приемлемой соли имеет преимущество при использовании в качестве фармацевтического средства. Примеры соли включают соль с неорганической кислотой, такой как фосфорная кислота, хлористоводородная кислота, серная кислота или азотная кислота, и соли с органической кислотой, такой как лимонная кислота, винная кислота, молочная кислота или гликолевая кислота.
Примеры сольвата включают гидрат и сольват со спиртом.
Когда соединение по настоящему изобретению, представленное формулой (1), содержит асимметричный атом(ы) углерода, то оно включает различные виды изомеров, такие как оптический изомер, рацемическое вещество или диастереомер. Когда соединение по настоящему изобретению становится кристаллическим, то оно также включает различные виды кристаллических форм (кристаллический полиморфизм), способных образовываться посредством этого.
Поскольку соединение по настоящему изобретению, представленное формулой (1), обладает активностью, подобно нейротрофическому фактору, оно полезно в качестве средства, обладающего активностью, подобно нейротрофическому фактору. Средство, обладающее активностью, подобно нейротрофическому фактору, согласно настоящему изобретению, полезно для профилактики или лечения нервных расстройств. Термин «нервное расстройство» означает патологическое состояние, при котором функция нервных клеток нарушена в результате дегенерации нервных клеток или гибели клеток, и включает нейродегенеративное заболевание и психическое заболевание. Под нейродегенеративным заболеванием подразумевается деменция, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз (ALS), болезнь Хантингтона, прогрессирующий супрануклеарный паралич (PSP), диабетическая нейропатия или глаукома, которая является заболеванием зрительного нерва. Под психическим заболеванием подразумевается депрессия (включая биполярную депрессию), тревожное расстройство (невроз), шизофрения и т.д. При применении против депрессии, необходимо по меньшей мере от трех до четырех недель принимать обычное терапевтическое средство от депрессии, такое как трициклический антидепрессант, тетрациклический антидепрессант, селективный ингибитор обратного захвата серотонина (SSRI) или ингибитор обратного захвата серотонина-норадреналина (SNRI), до появления эффекта, и в течение этого периода следует периодически вводить средство по изобретению. Однако можно ожидать, что средство, обладающее активностью, подобно нейротрофическому фактору, согласно настоящему изобретению, окажет более быстрый эффект, чем обычные средства.
Обладающее активностью, подобно нейротрофическому фактору, средство согласно настоящему изобретению полезно в качестве лечебного средства или восстанавливающего средства против повреждения спинного мозга. Не было эффективного способа лечения против повреждения спинного мозга, при котором спинной мозг претерпевает физическое повреждение вследствие автодорожного происшествия, спортивной травмы, компрессионного перелома и подобных причин, и исследовались способы лечения посредством регенеративной терапии. Активным ингредиентом обладающего активностью, подобно нейротрофическому фактору, средства по настоящему изобретению является высоко безопасный сложный эфир ненасыщенной жирной кислоты, и ожидается, что возможно лечение или восстановление повреждения спинного мозга его введением в организм.
Кроме того, соединение по настоящему изобретению, представленное формулой (1), оказывает профилактическое или облегчающее действие против побочных эффектов, вызванных введением противораковых средств, и оно особенно эффективно в качестве облегчающего средства при поражении периферических нервов. В настоящем изобретении, противораковое средство, вызывающее развитие повреждения периферических нервов, представляет собой противораковое средство, которое специфически повреждает микротрубочки, вызывая поражение периферических нервов. Примеры таких лекарственных средств включают таксановые лекарственные средства, такие как паклитаксел или доцетаксел, и препараты из алкалоидов винки, такие как винкристин, винбластин, виндезин или винорелбин. Кроме того, примеры лекарственного средства, которое повреждает нервные клетки и вызывает аксонопатию, и затем вызывает повреждение периферических нервов, включают препараты платины, такие как оксалиплатин, карбоплатин, цисплатин или недаплатин.
Примеры поражений периферических нервов, вызванных противораковыми средствами, включают боль, такую как колющая боль и жгучая боль, парестезию, такую как онемение конечностей и ощущение жжения, гиперестезию, такую как гиперчувствительность к холодовым раздражителям, дизестезию, такую как потеря чувствительности, сенсорный паралич, сенсорная атаксия и мышечная слабость. Вызванное противораковым средством расстройство периферических нервов, которое предполагается лечить соединением по настоящему изобретению, включает поражение периферических нервов, вызванное монотерапией с использованием одного типа противоракового средства, а также поражение периферических нервов, вызванное терапией множеством лекарственных препаратов, при которой вводится множество лекарственных средств, имеющих различные механизмы действия, или биохимической модуляцией, при которой комбинация лекарственных средств и способ введения подбираются так, чтобы лекарственные средства, имеющие различные механизмы действия, могли обеспечить максимальную эффективность.
Нет конкретного ограничения в отношении лекарственной формы, поскольку в настоящем изобретении приемлемы любые лекарственные формы для перорального и парентерального путей введения фармацевтических средств. Кроме того, может использоваться соответствующая лекарственная форма, в зависимости от формы введения, и, например, фармацевтические средства могут быть получены в различных видах фармацевтических препаратов, включая препарат для инъекций, препарат для перорального введения, такой как капсулы, таблетки, гранулы, порошки, пилюли или мелкие гранулы, препараты для ректального применения, масляные суппозитории и водные суппозитории.
Различные препараты могут быть получены добавлением к ним фармакологически приемлемых и обычно используемых разбавителей, связующего агента, лубриканта, дезинтегранта, поверхностно-активного вещества, флюидизатора и т.д. Примеры разбавителей включают лактозу, фруктозу, глюкозу, кукурузный крахмал, сорбит и кристаллическую целлюлозу; примеры связующего агента включают метилцеллюлозу, этилцеллюлозу, аравийскую камедь, желатин, гидроксипропилцеллюлозу и поливинилпирролидон; примеры лубриканта включают тальк, стеарат магния, полиэтиленгликоль и гидрогенизированное растительное масло; примеры дезинтегранта включают крахмал, альгинат натрия, желатин, карбонат кальция, цитрат кальция, декстрин, карбонат магния и синтетический силикат магния; примеры поверхностно-активного вещества включают лаурилсульфат натрия, лецитин сои, сложный эфир сахарозы и жирной кислоты и полисольват 80; примеры флюидизатора включают легкую безводную силициловую кислоту, высушенный гель гидроксида алюминия, синтетический силикат алюминия и силикат магния; и примеры других эксципиентов включают сироп, вазелин, глицерин, этанол, пропиленгликоль, лимонную кислоту, хлорид натрия, нитрит натрия и фосфат натрия.
Доза соединения по настоящему изобретению может быть соответствующим образом увеличена или уменьшена с учетом схемы введения, возраста, пола, симптомов у пациента т.д., и может, как правило, вводиться в количестве от 1 до 1000 г или, предпочтительно, от 5 до 300 мг для взрослого при однократном или при нескольких дробных введениях в день.
Примеры
Теперь настоящее изобретение будет проиллюстрировано ссылкой на примеры, но настоящее изобретение не ограничивается следующими примерами.
Пример 1-1
Синтез (E)-2-(диметиламино)этилдец-2-еноата [соединение 1]
Транс-2-деценовую кислоту (170 мг, 1 ммоль) и N,N-диметиламиноэтанол (90 мг, 1 ммоль) растворяли в безводном дихлорметане (10 мл) и при перемешивании на ледяной бане к ним добавляли гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (211 мг, 1,1 ммоль) (Sigma-Aldrich). После перемешивания на ледяной бане в течение 1 часа и затем при комнатной температуре в течение 8 часов, реакционный раствор выливали в разведенный раствор хлористоводородной кислоты с последующей экстракцией хлороформом. Хлороформный слой концентрировали, с получением целевого соединения в виде светло-коричневого маслянистого продукта.
C14H27NO2 ММ (молекулярная масса) 242, положительный ион HR-FABMS m/z: 242,2118 [M+H]+ (вычислено для C14H28NO2: 242,2120), положительный ион FABMS m/z: 242 [M+H]+,
1H-ЯМР (400 МГц, CDCl3) δ: 0,88 (3H, т, J=6,8 Гц), 1,29 (8H, ушир.с), 1,45 (2H, м), 2,19 (2H, м), 2,29 (6H, с), 2,60 (2H, т, J=5,9 Гц), 4,23 (2H, т, J=5,9 Гц), 5,85 (1H, дт, J=15,6, 1,5 Гц), 6,98 (1H, дт, J=15,6, 6,9 Гц).
Пример 1-2
Синтез (E)-2-(диметиламино)этилдец-2-еноата [соединение 1] (Другой способ)
Тионилхлорид (8 мл) добавляли к транс-2-деценовой кислоте (3,4 г, 0,02 моль) с последующим кипячением с обратным холодильником на горячей водяной бане в течение 2 часов. Избыточный тионилхлорид выпаривали в вакууме, с получением хлорида 2-деценовой кислоты. Пиридин (1 мл) добавляли к раствору N,N-диметиламиноэтанола (2,0 г, 0,022 моль) в тетрагидрофуране (30 мл) с последующим добавлением по каплям раствора хлорида 2-деценовой кислоты в тетрагидрофуране (20 мл). Реакционный раствор нагревали при кипячении с обратным холодильником на горячей водяной бане в течение 3 часов, тетрагидрофуран выпаривали в вакууме, к остатку добавляли воду и этилацетат для разделения, и отбирали этилацетатный слой. Этилацетатный слой промывали водой и выпаривали с последующей очисткой колоночной хроматографией на силикагеле (проявитель: хлороформ), с получением целевого соединения в виде светло-коричневого маслянистого продукта.
Его спектральные данные являются такими, как в примере 1-1.
Пример 2
(E)-3-(Диметиламино)пропилдец-2-еноат [соединение 2]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 3-диметиламино-1-пропанол в качестве исходных веществ, с получением целевого соединения.
Бесцветный маслянистый продукт, C14H27NO2, ММ 255, HREIMS m/z: 255,2195 [M+H]+ (вычислено для C14H27NO2: 255, 2198), EIMS m/z (отн. инт.): 255 (M+, 4), 153 (4),]+,
1H-ЯМР (400 МГц, CDCl3) δ: 0,88 (3H, т, J=6,8 Гц), 1,29 (8H, ушир.с), 1,45 (2H, м), 1,83 (2H, м), 2,18 (2H, м), 2,24 (6H, с), 2,36 (2H, т, J=7,2 Гц), 4,16 (2H, т, J=6,6 Гц), 5,81 (1H, дт, J=16,0, 1,7 Гц), 6,96 (1H, дт, J=16,0, 7,0 Гц).
Пример 3
(E)-1-(диметиламино)пропан-2-илдец-2-еноат [соединение 3]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 1-диметиламино-2-пропанол в качестве исходных веществ, с получением целевого соединения.
Светло-коричневый маслянистый продукт, C15H30NO2,ММ 256, положительный ион HR-FABMS m/z: 256,2284 [M+H]+ (вычислено для C15H30NO2: 256,2277), положительный ион FABMS m/z: 256 [M+H]+,
1H-ЯМР (400 МГц, CDCl3) δ: 0,88 (3H, т, J=6,8 Гц), 1,22 (3H, д, J=10,0 Гц), 1,25 (8H, ушир.с), 1,44 (2H, м), 2,18 (2H, м), 2,26 (6H, с), 2,31 (1H, дд, J=13,2, 5,2 Гц), 2,53 (1H, дд, J=13,2, 7,4 Гц), 5,10 (1H, м), 5,81 (1H, дт, J=15,8 Гц), 6,95 (1H, дт, J=15,8, 7,8 Гц).
Пример 4
(E)-4-(диметиламино)бутилдец-2-еноат [соединение 4]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 4-диметиламино-1-бутанол в качестве исходных веществ, с получением целевого соединения.
Бесцветный маслянистый продукт, C16H31NO2ММ 269, HREIMS m/z: 269.2347 [M+H]+ (вычислено для C16H31NO2: 269,2355), EIMS m/z (отн. инт.): 269 (M+, 5), 116 (5),
1H-ЯМР (400 МГц, CDCl3) δ: 0,88 (3H, т, J=6,8 Гц), 1,29 (8H, ушир.с), 1,45 (2H, м), 1,56 (2H, м), 1,68 (2H, м), 2,18 (2H, м), 2,23 (6H, с), 2,29 (2H, т, J=7,6 Гц), 4,14 (2H, т, J=6,4 Гц), 5,80 (1H, дт, J=15,8, 1,6 Гц), 6,96 (1H, дт, J=15,8, 7,0 Гц).
Пример 5
(E)-3-(диметиламино)-2,2-диметилпропилдец-2-еноат [соединение 5]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 3-диметиламино-2,2-диметил-1-пропанол в качестве исходных веществ, с получением целевого соединения.
Бесцветный маслянистый продукт, C17H33NO2 ММ 283, HREIMS m/z: 283,2506 [M+H]+ (вычислено для C17H33NO2: 283,2511), EIMS m/z (отн. инт.): 283 (M+, 2), 153 (2),
1H-ЯМР (400 МГц, CDCl3) δ: 0,87 (3H, т, J=7,0 Гц), 0,90 (6H, с), 1,28 (8H, ушир.с), 1,45 (2H, м), 2,16 (2H, с), 2,18 (2H, м), 2,26 (6H, с), 3,92 (2H, с), 5,81 (1H, дт, J=15,8 Гц), 6,94 (1H, дт, J=15,8, 6,8 Гц).
Пример 6
(E)-2-(диэтиламино)этилдец-2-еноат [соединение 6]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 2-(диэтиламино)этанол в качестве исходных веществ, с получением целевого соединения.
Бесцветный маслянистый продукт, C16H32NO2,ММ 270, положительный ион HR-FABMS m/z: 270,2424 [M+H]+ (вычислено для C16H32NO2: 270,2433), положительный ион FABMS m/z: 270 [M+H]+,
1H-ЯМР (400 МГц, CDCl3) δ: 0,87 (3H, т, J=7,2 Гц), 1,04 (6H, т, J=7,3 Гц), 1,29 (8H, ушир.с), 1,45 (2H, м), 2,19 (2H, м), 2,60 (4H, кв, J=7,3 Гц), 2,74 (2H, т, J=6,3 Гц), 4,20 (2H, т, J=6,3 Гц), 5,83 (1H, дт, J=16,0 Гц), 6,97 (1H, дт, J=16,0, 7,8 Гц).
Пример 7
(E)-6-(диметиламино)гексилдец-2-еноат [соединение 7]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 6-диметиламино-1-гексанол в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C18H35NO2 ММ 297, HR-EIMS (режим анализа положительных ионов): m/z 298,2761 [M+H]+ (вычислено для C18H35NO2, 298,2741),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц), 1,29 (8H, м), 1,33 (4H, м), 1,44 (2H, м), 1,51 (2H, м), 1,68 (2H, м), 2,19 (2H, м), 2,27 (6H, с), 2,33 (2H, т, J=7,7 Гц), 4,11 (2H, т, J=6,6 Гц), 5,81 (1H, д, J=15,8 Гц), 6,96 (1H, дт, J=15,8, 7,0 Гц).
Пример 8
(E)-2-(изопропилтио)этилдец-2-еноат [соединение 8]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 2-(изопропилтио)этанол в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C15H28O2S, ММ 272,
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,6 Гц), 1,28 (8H, м), 1,28 (6H, д, J=6,6 Гц), 1,45 (2H, м), 2,20 (2H, м), 2,78 (2H, т, J=7,2 Гц), 3,00 (1H, м), 4,27 (2H, т, J=7,2 Гц), 5,82 (1H, д, J=14,6 Гц), 6,98 (1H, дт, J=14,6, 6,8 Гц).
Пример 9
(E)-2-метоксиэтилдец-2-еноат [соединение 9]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и метилцеллосольв в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C13H24O3, ММ 228, DART-MS: m/z 230 [M+2H]+,
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц), 1,26-1,31 (8H, м), 1,43-1,46 (2H, м), 2,20 (2H, дт, J=7,5, 6,9 Гц), 3,40 (3H, с), 3,63 (2H, м), 4,28 (2H, м), 5,86 (1H, д, J=15,8 Гц), 7,00 (1H, дт, J=15,8, 6,9 Гц).
Пример 10
(E)-2-этоксиэтилдец-2-еноат [соединение 10]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и этилцеллосольв в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C14H26O3, ММ 242, HR-ESIMS (режим анализа положительных ионов): m/z 243,1961 [M+H]+ (вычислено для C14H27O3, 243,1955),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц), 1,21-1,24 (3H, м) 1,27-1,30 (8H, м), 1,42-1,46 (2H, м), 2,17-2,22 (2H, дт, J=7,5, 6,9 Гц), 3,52-3,57 (2H, м), 3,65-3,67 (2H, м), 4,27-4,29 (2H, м), 5,86 (1H, д, J=16,1 Гц), 7,00 (1H, дт, J=16,1, 6,9 Гц).
Пример 11
(E)-1,3-диэтокси-2-пропилдец-2-еноат [соединение 11]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 1,3-диэтокси-2-пропанол в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C17H32O4 ММ 300, HR-ESIMS (режим анализа положительных ионов): m/z 323,2193 (вычислено для C17H32O4Na, 323,2188),
1H-ЯМР (500 МГц, CDCl3) δ: 0,87 (3H, м), 1,18 (6H, м), 1,27 (8H, м), 1,44 (2H, м), 2,19 (2H, м), 3,52 (4H, м), 3,60 (4H, м), 5,15 (1H, м), 5,86 (1H, м), 6,98 (1H, м).
Пример 12
(E)-2-(2-(диметиламино)этокси)этилдец-2-еноат [соединение 12]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 2-(2-(диметиламино)этокси)этанол в качестве исходных веществ, с получением целевого соединения.
Бесцветный маслянистый продукт, C16H31NO3, ММ 285, HREIMS m/z: 285,2298 [M+H]+для (вычислено для C16H31NO3: 285,2304), EIMS m/z (отн. инт.): 285 (M+, 2), 116 (5),
1H-ЯМР (400 МГц, CDCl3) δ: 0,88 (3H, т, J=6,8 Гц), 1,28 (8H, ушир.с), 1,46 (2H, м), 2,20 (2H, м), 2,28 (6H, с), 2,54 (2H, т, J=5,3 Гц), 3,61 (2H, т, J=5,2 Гц), 3,70 (2H, т, J=5,2 Гц), 4,29 (2H, т, J=5,3 Гц), 5,85 (1H, дт, J=15,8 Гц), 7,00 (1H, дт, J=15,8 Гц).
Пример 13
(E)-2-(2-(диэтиламино)этокси)этилдец-2-еноат [соединение 13]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 2-(2-(диэтиламино)этокси)этанол в качестве исходных веществ, с получением целевого соединения.
Светло-коричневый маслянистый продукт, C18H35NO3, ММ 313, HREIMS m/z: 313,2614 [M+H]+ (вычислено для C18H35NO3: 313,2617), EIMS m/z (отн. инт.): 313 (M+, 2), 298 (2),
1H-ЯМР (400 МГц, CDCl3) δ: 0,88 (3H, т, J=6,6 Гц), 1,03 (6H, т, J=7,3 Гц), 1,28 (8H, ушир.с), 1,44 (2H, м), 2,19 (2H, м), 2,57 (4H, кв, J=7,3 Гц), 2,66 (2H, т, J=6,3 Гц), 3,58 (2H, т, J=6,3 Гц), 3,69 (2H, т, J=4,8 Гц), 4,28 (2H, т, J=4,8 Гц), 5,84 (1H, дт, J=16,0 Гц), 6,99 (1H, дт, J=16,0, 7,2 Гц).
Пример 14
(E)-3-(2-(диэтиламино)этокси)пропилдец-2-еноат [соединение 14]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 3-(2-(диэтиламино)этокси)пропан-1-ол в качестве исходных веществ, с получением целевого соединения. Соединение 14 получали очисткой с использованием колоночной хроматографии на силикагеле.
Пример 15
(E)-N-метилдец-2-енамид [соединение 15]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и метиламин в качестве исходных веществ, с получением целевого соединения.
Белый порошок, точка плавления: 60-63°C, C11H21NO, EIMS m/z: 183 (M+),
1H−ЯМР (CDCl3, 500 МГц) δ: 0,88 (3H, т, J=7,0 Гц), 1,22−1,33 (8H, м), 1,40−1,46 (2H, м), 2,14−2,19 (2H, м), 2,88 (3H, д, J=5,0 Гц), 5,41 (1H, ушир.с), 5,72−5,76 (1H, м), 6,83 (1H, дт, J=15,3, 7,0 Гц).
Пример 16
(E)-N-этилдец-2-енамид [соединение 16]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и этиламин в качестве исходных веществ, с получением целевого соединения.
Белый порошок, точка плавления: 38-40°C, C12H23NO, EIMS m/z: 197 (M+),
1H−ЯМР (CDCl3, 500 МГц) δ: 0,88 (3H, т, J=7,0 Гц), 1,17 (3H, т, J=7,3 Гц), 1,23−1,32 (8H, м), 1,41−1,46 (2H, м), 2,14−2,19 (2H, м), 3,33−3,39 (2H, м), 5,40 (1H, ушир.с), 5,71−5,75 (1H, м), 6,83 (1H, дт, J=15,3, 7,1 Гц).
Пример 17
(E)-N-бутилдец-2-енамид [соединение 17]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и бутиламин в качестве исходных веществ, с получением целевого соединения.
Белый порошок, точка плавления: 31-32°C, C14H27NO, EIMS m/z: 225 (M+),
1H−ЯМР (CDCl3, 500 МГц) δ: 0,88 (3H, т, J=7,0 Гц), 0,93 (3H, т, J=7,4 Гц), 1,23−1,32 (8H, м), 1,32−1,40 (2H, м), 1,40−1,46 (2H, м), 1,48−1,54 (2H, м), 2,14−2,19 (2H, м), 3,30−3,34 (2H, м), 5,42 (1H, ушир.с), 5,72−5,76 (1H, м), 6,83 (1H, дт, J=15,2, 7,0 Гц).
Пример 18
(E)-N-изобутилдец-2-енамид [соединение 18]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и изобутиламин в качестве исходных веществ, с получением целевого соединения.
Белый порошок, точка плавления: 42-45°С, C14H27NO, EIMS m/z: 225 (M+),
1H−ЯМР (CDCl3, 500 МГц) δ: 0,88 (3H, т, J=7,0 Гц), 0,93 (6H, д, J=6,7 Гц), 1,23−1,32 (8H, м), 1,41−1,47 (2H, м), 1,74−1,84 (1H, м), 2,15−2,19 (2H, м), 3,14−3,17 (2H, м), 5,45 (1H, ушир.с), 5,74−5,77 (1H, м), 6,84 (1H, дт, J=15,2, 7,0 Гц).
Пример 19
(E)-N-пентилдец-2-енамид [соединение 19]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и амиламин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C15H29NO ММ 239, HR-ESIMS (режим анализа положительных ионов): m/z 240,2305 [M+H]+ (вычислено для C15H30NO, 240,2322),
1H-ЯМР (500 МГц, CDCl3) δ: 0,86-0,93 (6H, м), 1,26-1,33 (12H, м), 1,41-1,45 (2H, м), 1,51-1,54 (2H, м), 2,14-2,19 (2H, м), 3,29-3,33 (2H, м), 5,76 (1H, д, J=15,2 Гц), 6,83 (1H, дт, J=15,2, 6,9 Гц).
Пример 20
(E)-N-изопентилдец-2-енамид [соединение 20]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и изоамиламин в качестве исходных веществ, с получением целевого соединения.
Белый порошок, точка плавления: 28-31°C, C15H29NO EIMS m/z: 239 (M+),
1H−ЯМР (CDCl3, 500 МГц) δ: 0,88 (3H, т, J=7,0 Гц), 0,92 (6H, д, J=6,7 Гц), 1,23−1,32 (8H, м), 1,40−1,46 (4H, м), 1,59−1,67 (1H, м), 2,14−2,19 (2H, м), 3,32−3,36 (2H, м), 5,37 (1H, ушир.с), 5,71−5,75 (1H, м), 6,82 (1H, дт, J=15,3, 7,1 Гц).
Пример 21
(E)-N-трет-пентилдец-2-енамид [соединение 21]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и трет-амиламин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C15H29NO ММ 239, HR-ESIMS (режим анализа положительных ионов): m/z 240,2311 [M+H]+ (вычислено для C15H30NO, 240,2322),
1H-ЯМР (500 МГц, CDCl3) δ: 0,85 (3H, т, J=7,5 Гц), 0,87 (3H, т, J=6,9 Гц), 1,26-1,31 (8H, м), 1,32 (6H, с), 1,40-1,45 (2H, м), 1,74-1,78 (2H, м), 2,12-2,16 (2H, м), 5,70 (1H, д, J=14,9 Гц), 6,95 (1H, дт, J=14,9, 6,9 Гц).
Пример 22
(E)-N-гексилдец-2-енамид [соединение 22]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и гексиламин в качестве исходных веществ, с получением целевого соединения.
Белый порошок, C16H31NO ММ 253, HR-ESIMS (режим анализа положительных ионов): m/z 254,2468 [M+H]+ (вычислено для C16H32NO, 254,2478),
1H-ЯМР (500 МГц, CDCl3) δ: 0,86-0,89 (6H, м), 1,25-1,34 (14H, м), 1,41-1,45 (2H, м), 1,49-1,55 (2H, м), 2,14-2,18 (2H, м), 3,28-3,32 (2H, м), 5,76 (1H, д, J=15,2 Гц), 6,81 (1H, дт, J=15,2, 6,9 Гц).
Пример 23
(E)-N-гептилдец-2-енамид [соединение 23]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и гептиламин в качестве исходных веществ, с получением целевого соединения.
Белый порошок, C17H33NO ММ 267, HR-ESIMS (режим анализа положительных ионов): m/z 268,2627 [M+H]+ (вычислено для C17H34NO, 268,2635),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (6H, т, J=6,9 Гц), 1,27-1,31 (16H, м), 1,40-1,45 (2H, м), 1,49-1,53 (2H, м), 2,14-2,17 (2H, м), 3,28-3,32 (2H, м), 5,76 (1H, д, J=14,2 Гц), 6,82 (1H, дт, J=14,2, 6,9 Гц).
Пример 24
(E)-N-(гептан-4-ил)дец-2-енамид [соединение 24]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 4-гептиламин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C17H33NO ММ 267, HR-ESIMS (режим анализа положительных ионов): m/z 268,2626 [M+H]+ (вычислено для C17H34NO, 268,2635),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=7,4 Гц), 0,90 (6H, т, J=7,4 Гц), 1,33 (12H, м), 1,46 (4H, м), 1,74 (2H, м), 2,16 (2H, дт, J=6,9 Гц), 4,02 (1H, ушир.с), 5,16 (1H, ушир.с), 5,74 (1H, д, J=14,6 Гц), 6,82 (1H, дт, J=14,6, 6,9 Гц).
Пример 25
(E)-N-(октан-3-ил)дец-2-енамид [соединение 25]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 2-этилгексиламин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C18H35NO ММ 281, HR-ESIMS (режим анализа положительных ионов): m/z 282,2778 [M+H]+ (вычислено для C18H36NO, 282,2791),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=7,5 Гц), 0,90 (6H, т, J=7,5 Гц), 1,32 (16H, м), 1,44 (4H, м) 2,16 (2H, дт, J=6,9 Гц), 3,26 (1H, м), 5,40 (1H, ушир.с), 5,75 (1H, д, J=14,9 Гц), 6,82 (1H, дт, J=14,9, 6,9 Гц).
Пример 26
(E)-N-(2,4,4-триметилпентан-2-ил)дец-2-енамид [соединение 26]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 1,1,3,3-тетраметилбутиламин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C18H35NO ММ 281, HR-ESIMS (режим анализа положительных ионов): m/z 282,2778 [M+H]+ (вычислено для C18H36NO, 282,2791),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=7,0 Гц), 1,00 (9H, с), 1,28 (8H, м), 1,43 (6H, с), 1,67 (2H, м), 1,78 (2H, с), 2,14 (2H, дт, J=6,9 Гц), 5,24 (1H, ушир.с), 5,66 (1H, д, J=14,9 Гц), 6,75 (1H, дт, J=14,9, 6,9 Гц).
Пример 27
(E)-N-циклогексилдец-2-енамид [соединение 27]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и циклогексиламин в качестве исходных веществ, с получением целевого соединения.
Белый порошок, точка плавления: 94-96°C, C16H29NO, EIMS m/z: 251 (M+),
1H−ЯМР (CDCl3, 500 МГц) δ: 0,88 (3H, т, J=7,0 Гц), 1,09−1,21 (3H, м), 1,23−1,32 (8H, м), 1,34−1,46 (4H, м), 1,59−1,74 (3H, м), 1,92−1,97 (2H, м), 2,13−2,18 (2H, м), 3,80−3,88 (1H, м), 5,23−5,31 (1H, м), 5,70−5,73 (1H, м), 6,81 (1H, дт, J=15,3, 7,0 Гц).
Пример 28
(E)-N-фенилдец-2-енамид [соединение 28]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и анилин в качестве исходных веществ, с получением целевого соединения.
Желтовато-белый порошок, точка плавления: 54-55°C, C16H23NO, EIMS m/z: 245 (M+),
1H−ЯМР (CDCl3, 500 МГц) δ: 0,89 (3H, т, J=7,0 Гц), 1,23−1,36 (8H, м), 1,45−1,51 (2H, м), 2,21−2,26 (2H, м), 5,89−5,93 (1H, м), 7,00 (1H, дт, J=15,2, 7,1 Гц), 7,09−7,15 (2H, м), 7,33 (2H, м), 7,53−7,60 (2H, м).
Пример 29
(E)-N-фенетилдец-2-енамид [соединение 29]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 2-фенилэтанамин в качестве исходных веществ, с получением целевого соединения. Соединение 29 получали очисткой с использованием колоночной хроматографии на силикагеле.
Пример 30
(E)-N-(2-пирролидин-1-илэтил)дец-2-енамид [соединение 30]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 1-(2-аминоэтил)пирролидин в качестве исходных веществ, с получением целевого соединения.
Светло-оранжевый порошок, точка плавления: 56-58°C, C16H30N2O, EIMS m/z (%): 266 (M+),
1H−ЯМР (CDCl3, 500 МГц) δ: 0,88 (3H, т, J=7,0 Гц), 1,22−1,32 (8H, м), 1,41−1,47 (2H, м), 1,78−1,83 (4H, м), 2,14−2,18 (2H, м), 2,53−2,58 (4H, м), 2,65 (2H, т, J=5,9 Гц), 3,42−3,46 (2H, м), 5,78−5,82 (1H, м), 6,22 (1H, ушир.с), 6,84 (1H, дт, J=15,3, 7,0 Гц).
Пример 31
(E)-N,N-диэтилдец-2-енамид [соединение 31]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и диэтиламин в качестве исходных веществ, с получением целевого соединения.
Бесцветный маслянистый продукт, C14H27NOММ 225, EIMS m/z: 225 (M+, 21), 196 (5), 182 (5), 168 (5), 153 (35), 140 (6), 126 (100), 100 (6), 83 (6), 69 (13), 58 (27).
Пример 32
(E)-N,N-дибутилдец-2-енамид [соединение 32]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и дибутиламин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C18H35NO ММ 281, HR-ESIMS (режим анализа положительных ионов): m/z 282,2780 [M+H]+ (вычислено для C18H36NO, 282,2791),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц), 0,92 (3H, т, J=7,4 Гц), 0,95 (3H, т, J=7,4 Гц), 1,32 (14H, м), 1,45 (2H, м), 1,54 (4H, м), 2,19 (2H, дт, J=6,9 Гц), 3,28 (2H, т, J=7,5 Гц), 3,36 (2H, т, J=7,5 Гц), 6,18 (1H, д, J=14,9 Гц), 6,89 (1H, дт, J=14,9, 6,9 Гц).
Пример 33
(E)-N,N-дипентилдец-2-енамид [соединение 33]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и диамиламин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C20H39NO ММ 309, HR-ESIMS (режим анализа положительных ионов): m/z 310,3097 [M+H]+ (вычислено для C20H40NO, 310,3104),
1H-ЯМР (500 МГц, CDCl3) δ: 0,85-0,95 (9H, м), 1,25-1,39 (16H, м), 1,45 (2H, м), 1,56 (2H, м), 2,20 (2H, м), 3,28 (2H, м), 3,35 (2H, м), 6,18 (1H, д, J=14,9 Гц), 6,90 (1H, дт, J=14,9, 7,3 Гц).
Пример 34
(E)-N,N-дигексилдец-2-енамид [соединение 34]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и дигексиламин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C22H43NO ММ 337, HR-ESIMS (режим анализа положительных ионов): m/z 338,3421 [M+H]+ (вычислено для C22H44NO, 338,3417),
1H-ЯМР (500 МГц, CDCl3) δ: 0,89 (9H, м), 1,23-1,34 (20H, м), 1,44 (2H, м), 1,55 (4H, м), 2,19 (2H, м), 3,29 (2H, т, J=7,4 Гц), 3,34 (2H, т, J=7,4 Гц), 6,18 (1H, м), 6,90 (1H, м).
Пример 35
(E)-N-этил-N-гептилдец-2-енамид [соединение 35]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и N-этил-N-гептиламин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C19H37NO ММ 295 HR-ESIMS (режим анализа положительных ионов): m/z 296,294 [M+H]+ (вычислено для C19H37NO, 296,2948),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (6H, м), 1,14 (1H, т, J=6,9 Гц), 1,18 (1H, т, J=6,9 Гц), 1,23-1,34 (17H, м), 1,45 (2H, м), 1,56 (2H, м), 2,19 (2H, м), 3,27 (1H, т, J=7,7 Гц), 3,36 (2H, м), 3,42 (1H, м), 6,17 (1H, д, J=15,3 Гц), 6,89 (1H, дт, J=15,3, 6,7 Гц).
Пример 36
(E)-N-2-(диметиламино)этилдец-2-енамид [соединение 36]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и N,N-диметилэтан в качестве исходных веществ, с получением целевого соединения.
Бесцветный маслянистый продукт, C14H28N2O ММ 240, положительный ион HR-FABMS m/z: 241,2284 [M+H]+ (вычислено для C14H29N2O: 241,2280), положительный ион FABMS: m/z 241 [M+H]+, DART-MS m/z: 241,2 [M+H]+,
1H-ЯМР (400 МГц, CDCl3) δ: 0,88 (3H, т, J=6,8 Гц), 1,28 (8H, ушир.с), 1,43 (2H, м), 2,14 (2H, м), 2,23 (6H, с), 2,43 (2H, т, J=5,8 Гц), 3,40 (2H, т, J=5,8 Гц), 5,79 (1H, дт, J=15,6 Гц), 6,17 (1H NH), 6,82 (1H, дт, J=15,6, 7,2 Гц).
Пример 37
(E)-N-2-(диэтиламино)этилдец-2-енамид [соединение 37]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и N,N-диэтилэтан-1,2-диамин в качестве исходных веществ, с получением целевого соединения.
Бесцветный маслянистый продукт, C16H32N2O ММ 268, положительный ион HR-FABMS m/z: 269,2602 [M+H]+ (вычислено для C16H33N2O: 269,2593), положительный ион FABMS m/z: 269 [M+H]+,
1H-ЯМР (400 МГц, CDCl3) δ: 0,89 (3H, т, J=6,8 Гц), 1,01 (6H, т, J=7,1 Гц), 1,28 (8H, ушир.с), 1,43 (2H, м), 2,16 (2H, м), 2,54 (4H, кв, J=7,1 Гц), 2,56 (2H, т, J=7,6 Гц), 3,36 (2H, т, J=7,6 Гц), 5,79 (1H, дт, J=15,4 Гц), 6,26 (1H of NH), 6,81 (1H, дт, J=15,4, 7,6 Гц).
Пример 38
(E)-N-3-(диметиламино)пропилдец-2-енамид [соединение 38]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и N,N-диметилпропан-1,3-диамин в качестве исходных веществ, с получением целевого соединения.
Коричневый маслянистый продукт, C15H30N2O ММ 254, HR-IT-TOFMS m/z: 255,2455 [M+H]+ (вычислено для C15H31N2O: 255,2431),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц, H-10'), 1,28 (8H, м, H-6'-9'), 1,43 (2H, квинтет, J=6,9 Гц, H-5'), 1,69 (2H, кв., J=6,3 Гц, H-3), 2,16 (2H, ддт, J=7,5, 7,2, 1,5 Гц, H-4'), 2,25 (6H, с, H-6, 7), 2,41 (2H, т, J=6,3 Гц, H-4), 3,40 (2H, дт, J=6,3, 5,8 Гц, H-2), 5,73 (1H, дт, J=15,2, 1,5 Гц, H-2'), 6,77 (1H, дт, J=15,2, 6,9 Гц, H-3'), 6,98 (1H, ушир.с, H-1).
Пример 39
(E)-N-3-(диэтиламино)пропилдец-2-енамид [соединение 39]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и N,N-диэтилпропан-1,3-диамин в качестве исходных веществ, с получением целевого соединения.
Коричневый маслянистый продукт, C17H24N2O ММ 296, HR-IT-TOFMS m/z: 297,2935 [M+H]+ (вычислено для C17H25N2O: 297,2900),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц, H-10'), 1,05 (6H, т, J=7,3 Гц, H-7, 9), 1,28 (8H, м, H-6'-9'), 1,43 (2H, кв., J=7,1 Гц, H-5'), 1,67 (2H, кв., J=6,1 Гц, H-3), 2,15 (2H, дт, J=7,3, 7,3 Гц, H-4'), 2,53 (6H, квин., J=6,7 Гц, H-4, 6, 8), 3,41 (2H, дд, J=11,5, 5,4 Гц, H-2), 5,71 (1H, д, J=15,3 Гц, H-2'), 6,76 (1H, квинт., J=7,3 Гц, H-3'), 7,59 (1H, ушир.с, H-1).
Пример 40
(E)-N-2-(диизопропиламино)этилдец-2-енамид [соединение 40]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и N,N-диизопропилэтан-1,2-диамин в качестве исходных веществ, с получением целевого соединения.
Коричневый маслянистый продукт, C18H36N2O, ММ 296, HR-IT-TOFMS m/z: 297,2935 [M+H]+ (вычислено для C18H37N2O: 297,2935),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц, H-10'), 1,02 (12H, т, J=6,1 H-6, 7,9, 10), 1,28 (8H, м, H-6'-9'), 1,43 (2H, квинт., J=7,3 Гц, H-5'), 2,16 (2H, ддт, J=6,9, 6,9, 1,5 Гц, H-4'), 2,61 (2H, т, J=5,7 Гц, H-3), 3,02 (2H, секст., J=6,6 Гц, H-5, 8), 3,29 (2H, дд, J=10,7, 5,4 Гц, H-2), 5,74 (1H, д, J=15,3 Гц, H-2'), 6,79 (1H, квинт., J=7,3 ГЦ, H-3').
Пример 41
(E)-N-2-(дибутиламино)этилдец-2-енамид [соединение 41]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и N,N-дибутилэтан-1,2-диамин в качестве исходных веществ, с получением целевого соединения.
Коричневый маслянистый продукт, C20H40N2O ММ 324, HR-IT-TOFMS m/z: 325,3244 [M+H]+ (вычислено для C20H41N2O: 325,3213),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц, H-10'), 0,91 (6H, т, J=7,3 Гц, H-8, 12), 1,29 (12H, м, H-7, 11, 6'-9'), 1,40 (6H, м, H-6, 10, 5'), 2,17 (2H, ддт, J=7,1, 7,1, 1,5 Гц, H-4'), 2,42 (4H, т, J=7,3 Гц, H-5, 9), 2,54 (2H, т, J=5,7 Гц, H-3), 3,34 (2H, дд, J=11,5, 5,7 Гц, H-2), 5,76 (1H, дт, J=15,3, 1,5 Гц, H-2'), 6,16 (1H, ушир.с, H-1), 6,80 (1H, дт, J=6,9 Гц, H-3').
Пример 42
(E)-N-(2-(диметиламино)этил)-N-метилдец-2-енамид [соединение 42]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и N,N',N'-триметилэтилендиамин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C15H30N20O, ММ 254, HR-ESIMS (режим анализа положительных ионов): m/z 255,2433 [M+H]+ (вычислено для C15H31N2O, 255,2431),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц), 1,27-1,30 (8H, м), 1,45 (2H, кв., J=6,9 Гц), 2,20 (2H, дт, J=6,9, 13,8 Гц), 2,28 (6H, с), 2,49 (2H, т, J=7,5 Гц), 3,09 (3H, с), 3,55 (2H, т, J=6,9 Гц), 6,23 (1H, д, J=15,2 Гц), 6,89 (1H, дт, J=6,9, 15,2 Гц).
Пример 43
(E)-N-(2-(диметиламино)этил)-N-этилдец-2-енамид [соединение 43]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и N-этил-N',N'-диметилэтилендиамин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C16H32N20O, ММ 268, HR-ESIMS (режим анализа положительных ионов): m/z 269,2597 [M+H]+ (вычислено для C16H33N2O, 269,2587),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=7,5 Гц), 1,19 (3H, т, J=6,9 Гц), 1,27-1,30 (8H, м), 1,45 (2H, квинт., J=7,5 Гц), 2,19 (2H, дт подобный кв., J=6,9, 7,5 Гц), 2,32(6H, с), 2,54 (2H, т, J=7,4 Гц), 3,90-3,54 (4H, м), 6,19 (1H, д, J=14,9 Гц), 6,91 (1H, дт, J=6,9, 14,9 Гц).
Пример 44
(E)-N-(2-(диэтиламино)этил)-N-этилдец-2-енамид [соединение 44]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и N,N',N'-триэтилэтилендиамин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C18H36N20O, ММ 296, HR-ESIMS (режим анализа положительных ионов): m/z 297,2912 [M+H]+ (вычислено для C18H37N2O, 297,2900),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц), 1,05 (6H, т, J=7,5 Гц), 1,20 (3H, т, J=7,5 Гц), 1,26-1,31 (8H, м), 1,45 (2H, квинт, J=6,9 Гц), 2,20 (2H, дт подобный кв., J=7,5 Гц), 2,53-2,64 (6H, м), 3,37-3,47 (4H, м), 6,19 (1H, д, J=14,9 Гц), 6,91 (1H, д, J=14,9, 7,5 Гц).
Пример 45
(E)-N,N-бис(2-(диметиламино)этил)дец-2-енамид [соединение 45]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и N-(2-(диметиламино)этил)-N',N'-диметилэтан-1,2-диамин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C18H37N30O, ММ 311, HR-ESIMS (режим анализа положительных ионов): m/z 312,2997 [M+H]+ (вычислено для C18H38N3O, 312,3009),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц), 1,26-1,31 (8H, м), 1,45 (2H, квинт., J=6,9 Гц), 2,19 (2H, дт подобный кв., J=6,9 Гц), 2,28 (12H, с), 2,46 (2H, т, J=7,4 Гц), 2,49 (2H, т, J=7,5 Гц), 3,47 (2H, т, J=7,5 Гц), 3,51 (2H, т, J=7,5 Гц), 6,20 (1H, д, J=15,2 Гц), 6,92 (1H, дт, J=6,9, 15,2 Гц).
Пример 46
(E)-N,N-бис(2-(диэтиламино)этил)дец-2-енамид [соединение 46]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и N-(2-(диэтиламино)этил)-N',N'-диэтилэтан-1,2-диамин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C22H45N30O, ММ 367, HR-ESIMS (режим анализа положительных ионов): m/z 368,3640 [M+H]+ (вычислено для C22H46N3O, 368,3635),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц), 1,04 (6H, т, J=7,5 Гц), 1,04 (6H, т, J=7,5 Гц), 1,26-1,31 (8H, м), 1,45 (2H, квинт, J=6,9 Гц), 2,19 (2H, дт подобный кв., J=7,6, 7,8 Гц), 2,53-2,64 (8H, м), 3,45 (4H, т, J=7,5 Гц), 3,47 (4H, т, J=7,5 Гц), 6,23 (1H, д, J=14,9 Гц), 6,91 (1H, дт, J=6,9, 14,9 Гц).
Пример 47
(E)-N,N-бис(3-(диметиламино)пропил)дец-2-енамид [соединение 47]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и N-(3-(диметиламино)пропил)-N',N'-диметилпропан-1,3-диамин в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C20H41N30O, ММ 339, HR-ESIMS (режим анализа положительных ионов): m/z 340,3301 [M+H]+ (вычислено для C20H42N3O, 340,3322),
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц), 1,22-1,30 (8H, м), 1,45 (2H, квинт., J=6,9 Гц), 1,74 (4H, кв., J=7,5 Гц), 2,19 (2H, дт подобный кв., J=6,9, 6,9 Гц), 2,22 (6H, с), 2,25 (6H, с), 2,27 (2H, т, J=6,9 Гц), 2,33 (2H, т, J=6,9 Гц), 3,39 (2H, т, J=7,5 Гц), 3,40 (2H, т, J=7,5 Гц), 6,27 (1H, д, J=14,9 Гц), 6,91 (1H, дт, J=6,9, 14,9 Гц).
Пример 48
(E)-S-пентилдец-2-ентиоат [соединение 48]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 1-пентантиол в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C15H28OS, ММ 256, DART-MS: m/z 258 [M+2H]+,
1H-ЯМР (500 МГц, CDCl3) δ: 0,89 (3H, т, J=6,9 Гц), 0,90 (3H, т, J=6,9 Гц), 1,20-1,40 (12H, м), 1,46 (2H, м), 1,60 (2H, м), 2,18 (2H, м), 2,93 (2H, т, J=6,9 Гц), 6,10 (1H, д, J=15,5 Гц), 6,89 (1H, дт, J=15,5, 6,9 Гц).
Пример 49
(E)-S-изопентилдец-2-ентиоат [соединение 49]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и изоамилмеркаптан в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C15H28OS, ММ 256, DART-MS: m/z 256 [M]+,
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=5,7 Гц), 0,92 (6H, д, J=6,3 Гц), 1,28 (8H, м), 1,47 (4H, м), 1,66 (1H, м), 2,18 (2H, м), 2,93 (2H, т, J=7,4 Гц), 6,10 (1H, д, J=16,3 Гц), 6,88 (1H, дт, J=16,3, 6,9 Гц).
Пример 50
(E)-S-гексилдец-2-ентиоат [соединение 50]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и н-гексилмеркаптан в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C16H30OS, ММ 270, DART-MS: m/z 272 [M+2H]+,
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (6H, т, J=6,9 Гц), 1,27-1,31 (12H, м), 1,38 (2H, м), 1,45 (2H, м), 1,60 (2H, м), 2,17 (2H, дт, J=7,5, 6,9 Гц), 2,93 (2H, т, J=7,2 Гц), 6,10 (1H, д, J=15,5 Гц), 6,89 (1H, дт, J=15,5, 6,9 Гц).
Пример 51
(E)-S-гептилдец-2-ентиоат [соединение 51]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 1-гептантиол в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C17H32OS, ММ 284, DART-MS: m/z 286 [M+2H]+,
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (6H, т, J=6,9 Гц), 1,27-1,31 (12H, м), 1,38 (2H, м), 1,45 (2H, м), 1,60 (2H, м), 2,17 (2H, дт, J=7,5, 6,9 Гц), 2,93 (2H, т, J=7,2 Гц), 6,10 (1H, д, J=15,5 Гц), 6,89 (1H, дт, J=15,5, 6,9 Гц).
Пример 52
(E)-S-децилдец-2-ентиоат [соединение 52]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 1-декантиол в качестве исходных веществ, с получением целевого соединения.
C20H38OS, ММ 326, DART-MS: m/z 328 [M+2H]+,
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (6H, т, J=7,2 Гц), 1,26 (20H, ушир.с), 1,36 (2H, м), 1,46 (2H, м), 1,59 (2H, тт, J=7,5 Гц), 2,18 (2H, дт, J=7,5, 6,9 Гц), 2,93 (2H, т, J=7,5 Гц), 6,10 (1H, д, J=15,5 Гц), 6,89 (1H, дт, J=15,5, 6,9 Гц).
Пример 53
(E)-S-циклопентилдец-2-ентиоат [соединение 53]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и циклопентантиол в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C15H20OS, ММ 254, DART-MS: m/z 256 [M+2H]+,
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц), 1,28 (8H, м), 1,45 (2H, м), 1,56 (2H, м), 1,63 (2H, м), 1,71 (2H, м), 2,11 (2H, дт, J=7,4, 5,7 Гц), 2,18 (2H, дт, J=7,5, 6,9 Гц), 3,78 (1H, тт, J=7,4 Гц), 6,07 (1H, д, J=15,5 Гц), 6,86 (1H, дт, J=15,5, 6,9 Гц).
Пример 54
(E)-S-фенетилдец-2-ентиоат [соединение 54]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 2-фенилэтантиол в качестве исходных веществ, с получением целевого соединения.
Маслянистый продукт, C18H26OS, ММ 290, DART-MS: m/z 290 [M]+,
1H-ЯМР (500 МГц, CDCl3) δ: 0,88 (3H, т, J=6,9 Гц), 1,29 (8H, м) 1,46 (2H, м), 2,18 (2H, м), 2,89 (2H, т, J=7,7 Гц), 3,18 (2H, т, J=7,7 Гц), 6,10 (1H, д, J=15,2 Гц), 6,98 (1H, дт, J=15,2, 6,8 Гц).
Пример 55
(E)-S-2-(диметиламино)этилдец-2-ентиоат [соединение 55]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 2-(диметиламино)этантиол в качестве исходных веществ, с получением целевого соединения.
Светло-коричневый маслянистый продукт, C14H27NOS, ММ 257, положительный ион HR-FABMS m/z: 258.1895 [M+H]+ (вычислено для C14H28NOS: 258,1892), положительный ион FABMS m/z: 258 [M+H]+,
1H-ЯМР (400 МГц, CDCl3) δ: 0,88 (3H, т, J=6,4 Гц), 1,29 (8H, ушир.с), 1,45 (2H, м), 2,19 (2H, м), 2,34 (6H, с), 2,59 (2H, т, J=7,5 Гц), 3,09 (2H, т, J=7,5 Гц), 6,10 (1H, дт, J=15,6 Гц), 6,90 (1H, дт, J=15,6, 7,6 Гц).
Пример 56
(E)-S-2-(диэтиламино)этилдец-2-ентиоат [соединение 56]
Осуществляли методику, аналогично примеру 1-1 или 1-2, используя транс-2-деценовую кислоту и 2-(диэтиламино)этантиол в качестве исходных веществ, с получением целевого соединения.
Светло-коричневый маслянистый продукт, C16H31NOS, ММ 285, положительный ион HR-FABMS m/z: 286,2198 [M+H]+ (вычислено для C16H32NOS: 286,2205), положительный ион FABMS m/z: 286 [M+H]+,
1H-ЯМР (400 МГц, CDCl3) δ: 0,88 (3H, т, J=5,6 Гц), 1,15 (6H, т, J=7,3 Гц), 1,28 (8H, ушир.с), 1,45 (2H, м), 2,18 (2H, м), 2,80 (4H, кв, J=7,3 Гц), 2,82 (2H, м), 3,11 (2H, т, J=8,2 Гц) 5,83 (1H, дт, J=15,6 Гц), 6,89 (1H, дт, J=7,8 Гц).
Пример тестирования 1 (Оценка активации (фосфорилирования) MAP киназы)
В отношении соединения 1 ((E)-2-(диметиламино)этилдец-2-еноата), активацию MAP киназы измеряли следующим вестерн иммуноблоттингом.
Нервные клетки диспергировали из коры головного мозга плодов крыс в возрасте 17 дней, и указанные нервные клетки культивировали в течение одного дня в модифицированной по способу Дульбекко среде Игла (DMEM), содержащей 5% фетальную телячью сыворотку. Культуральную среду заменяли бессывороточной средой (средой B27 с добавкой Neurobasal; Invitrogen), и нервные клетки культивировали при плотности 20000-40000 клеток на см2в чашке для культивирования, покрытой полиорнитином.
Через три дня добавляли соединение 1, и культивирование продолжали в течение 30 минут. После этого, клетки извлекали на льду, используя раствор, содержащий ингибитор фосфатазы, где основой был буфер Трис-HCl. Концентрацию белка в полученном клеточном экстракте количественно определяли, используя набор для анализа белка BCA (Takara Bio KK), и количество белка цертина (3 мкг для измерения MAP киназы и 5 мкг для измерения фосфорилированной MAP киназы) подвергали электрофорезу на полиакриламидном геле. Белок транскрибировали из геля после электрофореза на мембрану из PVDF (поливинидилендифторид) и проводили вестерн иммуноблоттинг, используя каждое из антитела против MAP киназы (технология клеточной передачи сигнала), и антитела против фосфорилированной MAP киназы (технология клеточной передачи сигнала) первичного антитела.
Затем проводили реакцию с меченным щелочной фосфатазой анти-кроличьим IgG антителом (Promega) вторичного антитела так, что ферментативная активность приобретала цветность, после чего измеряли содержание MAP киназы и фосфорилированной MAP киназы.
Периодически концентрацию соединения 1 доводили до 10 мкг/мл, 30 мкг/мл, 100 мкг/мл и 300 мкг/мл растворением в 0,1% ДМСО (диметилсульфокисд). В качестве контроля добавляли 0,1% ДМСО.
Рассчитывали и количественно определяли интенсивность концентрации полученной выше полосы геля, подвергнутого электрофорезу, используя программу Image J (K. K. Bioarts). Числовую величину содержания MAP киназы при использовании соединения 1 делили на числовую величину содержания MAP киназы в контроле, и, кроме того, числовую величину содержания фосфорилированной MAP киназы при использовании соединения 1 делили на числовую величину содержания фосфорилированной MAP киназы в контроле, затем определяли отношение содержания MAP киназы при использовании соединения 1 к контролю и отношение содержания фосфорилированной MAP киназы при использовании соединения 1 к контролю.
Затем отношение содержания фосфорилированной MAP киназы при использовании соединения 1 к контролю делили на полученное содержание MAP киназы к контролю для определения отношения содержания фосфорилированной MAP киназы к содержанию MAP киназы (см. таблицу 5). В таблице 5 «MAPK» означает MAP киназу и «pMAPK» означает фосфорилированую MAP киназу. «0», «30», «100» и «300» в таблице 5 показывают примеры, где использовали 10 мкг/мл, 30 мкг/мл, 100 мкг/мл и 300 мкг/мл соединения 1.
В таблице 5 показано, что, по сравнению с контролем, соединение 1 имеет высокую активацию (фосфорилирование) MAP киназы. В частности, в примере введения 300 мкг/мл, показана активность, примерно в 4 раза превышающая активность в контроле, и было высказано предположение, что соединение 1 обладает активностью, подобно нейротрофическому фактору.
Пример тестирования 2 (Оценка активации (фосфорилирования) MAP киназы)
Содержание MAP киназы и фосфорилированной MAP киназы измеряли для соединения 6 ((E)-2-(диэтиламино)этилдец-2-еноата) и соединения 13 ((E)-2-(2-(диэтиламино)этокси)этилдец-2-еноата) способом, как в примере тестирования 1.
Каждое из соединений 6 и 13 растворяли в 0,1% ДМСО для доведения концентрации до 250 мкг/мл. В качестве контроля, добавляли 0,1% ДМСО. В отношении концентрации полученной полосы геля, подвергнутого электрофорезу, ее интенсивность рассчитывали таким же способом, как в примере тестирования 1, используя программу Image J (K. K. Bioarts), и отношение содержания фосфорилированной MAP киназы к контролю делили на полученное отношение содержания MAP киназы к контролю, затем определяли отношение содержания фосфорилированной MAP киназы к содержанию MAP киназы (см. таблицу 6).
В таблице 6 показано, что соединения 6 и 13 вызывают более высокую активацию (фосфорилирование) MAP киназы, чем в контроле, свидетельствуя о том, что они обладают активностью, подобно нейротрофическому фактору.
Пример тестирования 3 (Оценка подавляющего эффекта в отношении депрессивного симптома в результате стрессовой нагрузки)
Самцов мышей линии ddY в возрасте 7 недель подвергали стрессовой нагрузке в виде вынужденного плавания по 6 минут ежедневно в течение 2 недель и проводили оценку подавляющего эффекта в отношении симптома депрессии.
Так, с начала стрессовой нагрузки соединение 1, растворенное в 0,1% ДМСО, внутрибрюшинно вводили каждый день в дозе 100 мкг/кг массы тела и измеряли время неподвижности мышей после начала теста вынужденного плавания (n=5). В качестве контроля, мышам в течение двух недель внутрибрюшинно вводили забуференный фосфатом физиологический солевой раствор (PBS) и измеряли время неподвижности (n=4).
Мышам, у которых не проводили стрессовой нагрузки, также вводили каждое из соединения 1 и забуференный фосфатом физиологический солевой раствор (PBS), как в случаях со стрессовой нагрузкой. Измеряли время неподвижности на тринадцатый день от начала стрессовой нагрузки, и результат показан на фиг. 1. Периодически проводили тест статистически значимого различия посредством двустороннего ANOVA (дисперсионного анализа), критерия Бонферрони.
Как видно из фиг. 1, соединение 1 значимо укорачивало время неподвижности и подавляло депрессию, по сравнению с контролем, после стрессовой нагрузки.
Пример тестирования 4 (Оценка восстанавливающего действия при повреждении спинного мозга)
Получали модель повреждения спинного мозга у крыс и исследовали восстанавливающее действие соединения 1 в отношении повреждения спинного мозга. Соединение 1 растворяли в забуференном фосфатом физиологическом солевом растворе (PBS) и внутрибрюшинно вводили каждой крысе с моделированным повреждением спинного мозга один раз в день в дозе 100 мкг/кг массы тела. В качестве контроля, аналогичным образом вводили PBS.
(1) Получение модели повреждения спинного мозга у крыс
Самок крыс линии Wistar в возрасте семи недель наркотизировали пентобарбиталом (40 мг/кг), обнажали позвоночник, иссекали позвонковую арку девятого грудного позвонка и спинной мозг на уровне десятого грудного позвонка (T10) полностью перерезали, используя острый нож. После зашивания мышц спины и кожи, подтверждали паралич задних конечностей как свидетельство получения модели повреждения спинного мозга у крыс.
(2) Улучшение двигательной функции
У каждой из групп, получавших соединение 1 и PBS, ежедневно в течение шести недель оценивали улучшение двигательной функции на крысиной модели повреждения спинного мозга по шкале BBB (Basso DM, et al., J. Neurotrauma, 12:1-21 (1995)) (0 для состояния непосредственно после повреждения до 21 при отсутствии повреждения). Результат показан на фиг. 2. Периодически проводили тест статистически значимого различия посредством двустороннего ANOVA (дисперсионного анализа), критерия Бонферрони.
Через шесть недель у группы, которой вводили соединение 1, восстановление было достигнуто в такой степени, что после отдыха масса тела поддерживалась упором на ступни конечностей, посредством чего была возможна координированная ходьба с участием правой и левой задних конечностей (средняя величина в баллах по шкале BBB±SE (стандартная ошибка средней)=11,60±2,2 (n=6)). Кроме того, в группе, которой вводили соединение 1, наблюдали некоторых крыс, которые вставали на задние конечности. Как показано на фиг. 2, соединение 1 проявило значимое отличие от PBS контроля и значимое улучшение двигательной функции.
Пример тестирования 5 (Оценка с использованием клеток PC12; способ иммуноокрашивания)
Клетки PC12 стимулировали, используя соединение по настоящему изобретению, и фосфорилирование MAPK оценивали посредством иммуноокрашивания клеток. Использовали следующую определенную методику.
Покровное стекло помещали на 24-луночный планшет с последующим покрытием поли-L-лизином. Клетки PC12 высевали при плотности клеток 50000 клеток/лунка. (Количество среды составило 400 мкл). В первый день после высевания клеток среду заменяли средой DMEM, содержащей 1% фетальную телячью сыворотку (FBS) и 0,06% L-глутамин.
Соединение, которое было предварительно разведено ДМСО, растворяли в 100 мкл среды. Через 12-16 часов от момента замены среды, 100 мкл из 400 мкл среды удаляли из каждой лунки, и вместо них добавляли 100 мкл среды, содержащей соединение.
Через 30 минут от момента добавления, проводили фиксацию, используя 4% параформальдегид (PFA) в течение 10 минут. Фиксированные клетки промывали солевым раствором с Трис-буфером (TBS), и к нему добавляли TBS, содержащий 0,3% Triton X, с последующей инкубацией при 37°C в течение 30 минут. Клетки промывали TBS и блокировали TBS, содержащим 3% снятое молоко, в течение 30 минут (при комнатной температуре).
Клетки промывали один раз TBS, и к ним добавляли первичное антитело (анти-фосфо-p42/44 MAPK антитело; клеточные передачи сигналов; #9102, 1000-кратно разбавленные TBS) с последующим подверганием реакции при 4°C в течение одной ночи. Первичное антитело удаляли и три раза промывали TBS. После этого к ним добавляли вторичное антитело (козье анти-кроличье антитело Alexa 488; Invitrogen: разведенное в 1000 раз с использованием TBS, содержащего 1% блокирующий реагент Block Ace), и реакцию проводили при комнатной температуре в течение 3 часов. Вторичное антитело удаляли и после промывания TBS проводили фиксацию 4% PFA в течение 1 часа.
Клетки промывали TBS, к ним добавляли краситель, выпускаемый компанией Hoechst (разведенный TBS в 2000 раз), и проводили ядерное окрашивание. Клетки промывали и помещали на предметное стекло.
Фотографирование и подсчет положительных клеток проводили следующим образом. Использовали универсальный микроскоп (выпускаемый компанией Keyence), время экспозиции для pMAPK (зеленых) устанавливали на 1/2,8 с, участок съемки соответственно выбирали на окрашенном красителем Hoechst изображении и фотографировали. Делали четыре фотографии на одно предметное стекло.
Использовали программу Photoshop (Adobe), и клетки, имеющие яркость окрашивания, превышающую определенный уровень, считали положительными. Все клетки метили, используя метку Hoechst 33342, выпускаемую компанией Invitrogen, и рассчитывали частоту pMAPK-положительных клеток в Hoechst-положительных клетках (см. таблицу 7)
Данными, представленными в таблице 7, было подтверждено, что при оценке с использованием клеток PC12, соединения по настоящему изобретению оказывают стимулирующее действие в отношении фосфорилирования (активности, подобно нейротрофическому фактору).
Пример тестирования 6 (Оценка активации (фосфорилирования) MAP киназы)
Измеряли активацию MAP киназы соединениями по настоящему изобретению, как в примере тестирования 1.
Каждое соединение растворяли в 0,1% ДМСО для доведения концентрации до 30 мкг/мл, 60 мкг/мл, 125 мкг/мл и 250 мкг/мл. В качестве контроля, добавляли 0,1% ДМСО.
Рассчитывали и количественно определяли интенсивность концентрации указанной выше полосы геля, подвергнутого электрофорезу, с использованием программы Image J (K. K. Bioarts). Числовую величину содержания MAP киназы при использовании тестируемого соединения делили на числовую величину содержания MAP киназы в контроле, и, кроме того, числовую величину содержания фосфорилированной MAP киназы при использовании тестируемого соединения, делили на числовую величину содержания фосфорилированной MAP киназы в контроле, после чего определяли отношение содержания MAP киназы при использовании тестируемого соединения к контролю и отношение содержания фосфорилированной MAP киназы при использовании тестируемого соединения к контролю.
После этого, полученное отношение содержания фосфорилированной MAP киназы к контролю делили на полученное отношение содержания MAP киназы к контролю для определения отношения содержания фосфорилированной MAP киназы к содержанию MAP киназы (см. таблицу 8).
По данным, представленным в таблице 8, ясно, что соединения по настоящему изобретению проявляют более высокую активацию MAP киназы (фосфорилирование), по сравнению с контролем, и что они обладают высокой активностью, подобно нейротрофическому фактору.
Периодически в примерах тестирования 1, 2 и 6 использовали культивированные нервные клетки из коры головного мозга, в примере тестирования 5, использовали клетки PC12, которые представляют собой закончившие начальный рост клетки, происходящие из хромаффинных клеток мозгового слоя надпочечников, ввиду чего можно сделать вывод, что в примере тестирования 6 представлены результаты оценки в условиях, которые близки к условиям in vivo.
Пример тестирования 7 (Оценка суппрессивного эффекта на симптомы депрессии в результате легкой стрессовой нагрузки)
Самок мышей линии ddY в возрасте семи недель(n=8-12) подвергали (A) тесту вынужденного плавания в течение 15 минут и затем обычному содержанию в течение двух дней, (B) подвергали содержанию в наклоненных клетках в течение двух дней и затем обычному содержанию в течение двух дней, (C) подвергали содержанию в течение одного дня, когда пол увлажняли, и затем содержали в течение одного дня в обычных условиях содержания и (D) подвергали содержанию в течение одного дня с использованием клетки, которая вращалась со скоростью 180 оборотов/минуту, и затем в условиях обычного содержания в течение одного дня. Кроме того, содержание в условиях (B)-(D) повторяли два раза, и стрессовую нагрузку всего продолжали в течение трех недель, с получением мышиной модели вызванной легким стрессом депрессии. В течение этого времени, один раз в день в течение трех недель перорально вводили соединения по настоящему изобретению, растворенные в PBS или в растворителе PBS, содержащем ДМСО, и т.д., и затем оценивали суппрессивный эффект в отношении симптома депрессии посредством теста подвешивания за хвост. Так, захватывали рукой хвост мыши в области на 1 см от его кончика, и мышь держали на высоте 10 см от пола и проводили наблюдение в течение шести минут с измерением длительности времени неподвижности, которая является показателем симптома депрессии. Периодически проводили тест статистической значимости различий односторонним ANOVA (анализом дисперсии), с использованием критерия множественного сравнения Tukey.
В результате описанного выше теста подвешивания за хвост, время неподвижности у контрольной группы (которой перорально вводили PBS) составило 103,18±15,96 секунд, тогда как время неподвижности у группы, которой вводили соединение 55 по настоящему изобретению в дозе 1500 мкг/кг, составило 63,72±10,13 секунд, и, таким образом, был отмечен значимый подавляющий эффект в отношении симптома депрессии. Кроме того, время неподвижности у группы, которой вводили соединение 6 по настоящему изобретению в дозе 1500 мкг/кг, составило 80,67±23,94 секунд, и, таким образом, было отмечено подавление симптома депрессии.
Пример тестирования 8 (Оценка подавляющего эффекта на симптомы тревоги в результате легкой стрессовой нагрузки)
Проводили такую же операцию, как в описанном выше примере тестирования 7, с получением мышиной модели депрессии, вызванной хроническим легким стрессом (n=8-12). В это время один раз в день в течение трех недель перорально вводили соединение по настоящему изобретению, растворенное в PBS или в растворителе PBS, содержащем ДМСО, и т.д., затем оценивали подавляющий эффект на симптом тревоги посредством теста в приподнятом лабиринте. Таким образом, измеряли время, когда мышь оставалась в открытом плече приподнятого лабиринта, и частоту (количественную подвижность) входов и выходов мыши и в открытое плечо, и в закрытое плечо. При усилении симптома тревоги, укорачивалось время пребывания в открытом плече. В это время было подтверждено, что в разных случаях нет разницы частот входа и выхода из плеч лабиринта, когда имеется или отсутствует стрессовая нагрузка. Периодически проводили тест статистической значимой различий односторонним дисперсионным анализом ANOVA с использованием критерия множественного сравнения Tukey.
Результат описанного выше теста в приподнятом лабиринте показал, что время пребывания в открытом плече в контрольной группе составило 25,37±4,13 секунд, тогда как время пребывания в открытом плече у группы, которой вводили соединение 6 по настоящему изобретению в дозе 1500 мкг/кг, составило 53,57±7,00 секунд, так что был отмечен значимый подавляющий эффект в отношении симптома тревоги. Кроме того, время пребывания в открытом плече у группы, которой вводили соединение 55 по настоящему изобретению в дозе 1500 мкг/кг, составило 47,24±7,52 секунд, так что был отмечен подавляющий эффект в отношении симптома тревоги.
Пример тестирования 9 (Оценка поведения обучения и запоминания на модели депрессии, вызванной хроническим легким стрессом у мышей)
Проводили такую же операцию, как в описанном выше примере 7, с получением мышиной модели депрессии, вызванной хронических легким стрессом (n=8-12). В это время один раз в день в течение трех недель перорально вводили соединение по настоящему изобретению, растворенное в PBS, или в растворителе PBS, содержащем ДМСО, и т.д., затем проводили оценку поведения обучения и запоминания посредством теста спонтанного поведения чередования (теста в Y-образном лабиринте). Так, животное помещали в передний конец любого рукава в Y-образном лабиринте и давали возможность свободно передвигаться в лабиринте в течение десяти минут; рукава, в которые входило животное, последовательно регистрировали, и контролировали количества входов животного в каждый рукав лабиринта в пределах времени измерения (обще число входов в рукав лабиринта) и комбинированные числа входов в непрерывно различные три рукава (количественные характеристики поведения чередования). Частоту поведения чередования (%) рассчитывали следующим выражением, и спонтанное поведение чередования оценивали как показатель краткосрочной памяти. Периодически проводили тест статистически значимых различий односторонним дисперсионным анализом ANOVA, с использованием критерия множественного сравнения Tukey.
Частота поведения чередования (%)=количественные характеристики поведения чередования/(Общее число входов в рукав-2)×100
В результате описанного выше теста спонтанного поведения чередования было установлено, что частоты поведения чередования у группы, которой вводили соединение по настоящему изобретению, составили 75,40±3,22% для группы, которой вводили соединение 6 по настоящему изобретению (300 мкг/кг) (частоты поведения чередования контрольной группы: 60,21±2,39%) и 71,52±2,50% для группы, которой вводили соединение 36 по настоящему изобретению (1500 мкг/кг) (частоты поведения чередования контрольной группы: 61,76±2,01%), так что был отмечен значимый эффект улучшения функции краткосрочной памяти.
В последние годы предполагалось, что когда продолжается секреция гормонов коры надпочечников, вызванная хроническим стрессом или депрессией, то в мозге погибают клетки гиппокампа, участвующие в функции памяти, и расстройство памяти вызывает деменцию. В описанном выше тесте активации MAP киназы было показано, что соединение по настоящему изобретению оказывает действие, подобно нейротрофическому фактору, и его можно применять против нейродегенеративных заболеваний, таких как деменция и болезнь Альцгеймера. В соответствии с настоящим тестом на животных, также было установлено, что соединение по настоящему изобретению оказывает улучшающее действие на способность к обучению и запоминанию.
Пример тестирования 10 (Оценка подавляющего эффекта на депрессивный симптом, вызванный введением кортикостерона)
Кортикостерон, суспендированный в масле, подкожно инъецировали самцам мышей в возрасте семи недель (n=3-5) в дозе 20 мкг/кг/день ежедневно в течение трех недель. В то же время, соединение по настоящему изобретению, растворенное в PBS или в растворителе PBS, содержащем ДМСО, и т.д., перорально вводили ежедневно в течение трех недель. Через одну, две и три недели оценивали суппрессивный эффект в отношении депрессивного симптома тестом подвешивания за хвост таким же образом как в описанном выше примере тестирования 7. Периодически проводили тестирование статистической значимости различий с использованием t-критерия Стьюдента.
В результате указанного выше теста подвешивания, измерение через две недели показало, что время неподвижности в контрольной группе составило 141,15 секунд, тогда как время неподвижности в группе, получавшей соединение по настоящему изобретению, составило 60,37 секунд в группе, которой вводили соединение 6 по настоящему изобретению (300 мкг/кг), 41,63 секунды в группе, которой вводили соединение 36 по настоящему изобретению (300 мкг/кг), и 86,71 секунд в группе, которой вводили соединение 55 по настоящему изобретению (1500 мкг/кг), так что было отмечено подавление депрессивного симптома.
Пример тестирования 11 (Оценка восстанавливающего действия при повреждении спинного мозга)
(1) Получение модели инвалидизации у крыс с пересечением половины спинного мозга и введение тестируемых лекарственных средств
Самок крыс линии Wistar в возрасте семи недель (масса тела: 120-140 г) наркотизировали пентобарбиталом (40 мг/кг), грудные позвонки отделяли для обнажения грудного отдела спинного мозга, и его левую половину разрезали на уровне десятого грудного позвонка с использованием острой бритвы. Затем мышцы и кожу зашивали, с получением модели инвалидизации у крыс с пересечением половины спинного мозга.
Соединение по настоящему изобретению растворяли в PBS или в растворителе PBS, содержащем ДМСО, и т.д., и перорально вводили один раз в день в течение от 21 до 31 дня.
(2) Оценка улучшения двигательной функции
У группы, которой вводили соединение по настоящему изобретению (n=3-6), и контрольной группы (n=3-6), улучшение двигательной функции на модели инвалидизации у крыс с пересечением половины спинного мозга оценивали по шкале BBB (Basso DM, et al., J. Neurotrauma 12:1-21(1995)). Так, оценку двигательной функции проводили по задним конечностям крыс для определения, имелось ли движение в суставах, подавалась ли на стопу нагрузка массы тела, осуществлялась ли ходьба с участием конечности, вовлеченной в поражение, при этом движение задних конечностей делили на 21 точку от отсутствия подвижности до нормального состояния. Периодически проводили тест статистической значимости различий, с использованием ретроспективного критерия Бонферрони.
В результате описанного выше теста улучшения двигательной функции балльные оценки по шкале BBB соединения по настоящему изобретению составили 8,3 через девять дней в группе, которой вводили соединение 6 по настоящему изобретению (100 мкг/кг) (бальная оценка по шкале BBB через 9 дней в контрольной группе: 3,5), 12,3 через пятнадцать дней в группе, которой вводили соединение 36 по настоящему изобретению (500 мкг/кг) (бальная оценка по шкале BBB через 15 дней в контрольной группе: 9,8) и 5,3 и 12,3 через семь дней и четырнадцать дней, соответственно, в группе, которой вводили соединение 55 по настоящему изобретению (500 мкг/кг) (бальные оценки по шкале BBB через 7 дней и 14 дней в контрольной группе составили соответственно 1,8 и 8,5), так что был отмечен значимый эффект улучшения двигательной функции.
Пример тестирования 12 (Оценка расстройства периферических нервов у крыс, вызванного паклитакселом)
Тестировали эффект соединения по настоящему изобретению при поражении периферических нервов, что является побочным эффектом, вызванным введением паклитаксела (противоракового средства), таком как гиперестезия, включая аллодинию (сильную боль, вызванную такими тактильными раздражителями, которые обычно не вызывают боль). Соединение по настоящему изобретению вводили внутрибрюшинно крысам в качестве тестируемого лекарственного средства для проведения теста фон Фрея.
(1) Получение модели вызванного паклитакселом поражения периферических нервов у крыс и введение тестируемых лекарственных средств
Самцов крыс линии SD в возрасте шести недель (одна группа включала шесть крыс) использовали в качестве экспериментальных животных, и паклитаксел (2 мг/кг) внутрибрюшинно вводили через день всего 4 раза, с получением вызванного паклитакселом поражения периферических нервов у крыс. В течение 18 и 25 дней или в течение 20-27 дней после начала введения паклитаксела тестируемое лекарственное средство вводили внутрибрюшинно одной дозой 300 мкг/кг и проводили следующий тест фон Фрея
(2) Тест фон Фрея
Крыс по описанному выше пункту (1) помещали в прозрачную акриловую клетку с полом из проволочной сетки, и животным давали возможность адаптироваться в течение примерно трех минут, и затем измеряли пороговые величины 50% реакции на механическое раздражение правой задней конечности перед введением тестируемого лекарственного средства и через 1, 5 и 24 часа от начала введения.
Измерение проводили, используя волокна фон Фрея (выпускаемые компанией North Coast Medical Inc.), в соответствии со способами, описанными в публикациях Chaplan, et al. (Journal of Neuroscience Methods, vol. 53, no. 1, pages 55 to 63, 1994) и Dixon, et al. (Annual Review of Pharmacology and Toxicology, vol. 20, pages 441 to 462, 1980). При восьми волокнах [нагрузки при раздражении (г): 0,4; 0,6; 1,0; 2,0; 4,0; 6,0; 8,0 и 15,0], тест начинали с волокна 2,0 г, волокно вертикально прикрепляли к подошве на 2-3 секунды с такой силой, чтобы волокно было слегка согнуто, и случай, когда проявлялась реакция одергивания задней конечности, называли положительной реакцией. Когда отмечали положительную реакцию, то раздражение проводили аналогичным образом с использованием волокна, вызывающего на один ранг более слабое раздражение, тогда как если реакция не отмечалась, то раздражение проводили аналогичным образом с использованием волокна, оказывающего на один ранг более сильное раздражение, и когда реакция изменялась с отрицательной на положительную или с положительной на отрицательную, это называли первыми двумя реакциями. После этого, раздражение проводили непрерывно 4 раза таким же способом повышения и понижения силы раздражения. 50% пороговую величину реакции на механическое раздражение измеряли, используя реакцию в сумме на шесть раздражений, и затем для каждой группы рассчитывали (среднюю величину)±(стандартную ошибку). В случае, когда раздражитель достигал величины 15,0 г без положительной реакции, или когда положительная реакция продолжалась до 0,4 г, то 15,0 г или 0,25 г соответственно принимали за пороговую величину. В отношении более высокой 50% пороговой величины реакции от 50% пороговых величин через 1 час и 5 часов от момента введения тестируемого лекарственного средства, частоту восстановления (%) 50% пороговой величины реакции рассчитывали следующим выражением, в котором величина 15 была принята в качестве нормальной пороговой величины. Пример результатов описанного выше теста показан в таблице 9.
Частота восстановления (%) 50% пороговой величины реакции=[(50% пороговая величина реакции через 1 час или 5 часов после введения тестируемого лекарственного средства)-(50% пороговая величина реакции перед введением тестируемого лекарственного средства)]/[(Нормальная пороговая величина)-(50% пороговая величина реакции перед введением тестируемого лекарственного средства)]
Данные, представленные в таблице 9, показывают, что соединения по настоящему изобретению проявляют превосходный улучшающий эффект при гиперестезии, вызванной введением паклитаксела, и, таким образом, оказывают облегчающее действие при побочном эффекте, вызванном введением противораковых средств. Кроме того, соединения по настоящему изобретению также проявляют превосходное улучшающее действие при гиперестезии, когда оксалиплатин из препаратов платины применяется таким же образом как применяется паклитаксел из препаратов таксана.
Промышленная применимость
Как очевидно из результатов, описанных выше, фармакологических тестов, соединения по настоящему изобретению проявили выраженное фосфорилирующее MAP киназу действие (активность, подобную нейротрофическому фактору) при оценке с использованием нервных клеток, культивированных из коры головного мозга крыс, или клеток PC12. Кроме того, в экспериментах на животных введение соединений по настоящему изобретению также проявило действие, которое подавляет депрессивный симптом, и улучшение способности к обучению/запоминанию в различных тестах с использованием стрессовой нагрузки у мышей. Кроме того, в тестах двигательной функции с использованием модели повреждения спинного мозга у крыс было показано значимое улучшение двигательной функции, и было подтверждено восстанавливающее действие при повреждении спинного мозга. Соответственно, ожидается, что соединения по настоящему изобретению могут применяться в качестве профилактического или лечебного средства против деменции, болезни Альцгеймера, болезни Паркинсона, депрессии и т.д., и в качестве восстанавливающего средства против повреждения спинного мозга, и они могут применяться в качестве фармацевтического средства.
Кроме того, установлено, что соединения по настоящему изобретению оказывают превосходный лечебный эффект при поражении периферических нервов в тесте, проводимом с использованием повреждения периферических нервов, являющегося побочным эффектом, вызванным введением паклитаксела, который представляет собой противораковое средство, или, другими словами, гиперестезии, вызванной механическим раздражением, как показателя поражения периферических нервов. Соответственно, соединения по настоящему изобретению эффективны в качестве фармацевтического средства для облегчения побочного эффекта, такого как неврологическое расстройство периферической нервной системы, вызванное противораковыми средствами, такое как онемение в концевых отделах четырех конечностей людей и животных, и гиперальгезия, такая как боль, ввиду чего соединения по настоящему изобретению могут иметь достаточно широкую сферу применения.
Реферат
Изобретение относится к новым производным транс-2-деценовой кислоты, представленным формулой (1′), или к их фармацевтически приемлемым солям, в которой значения для групп Y′, W′ определены в формуле изобретения. Изобретение также относится к фармацевтическому средству, обладающему активностью, подобно нейротрофическому фактору, и/или облегчающим действием на побочный эффект, вызванный введением противораковых средств, содержащему производное транс-2-деценовой кислоты, представленное формулой (1), или его фармацевтически приемлемую соль в качестве активного ингредиента, в которой значения для групп Y и W определены в формуле изобретения. Фармацевтическое средство имеет достаточно широкую сферу применения, такого как профилактическое или лечебное средство против деменции, болезни Альцгеймера, болезни Паркинсона, депрессии и т.д., лечебного или восстанавливающего средства против повреждения спинного мозга или облегчающего средства против побочного эффекта, вызванного введением противораковых средств.2 н. и 21 з.п. ф-лы, 9 табл., 68 пр., 2 ил.
Формула
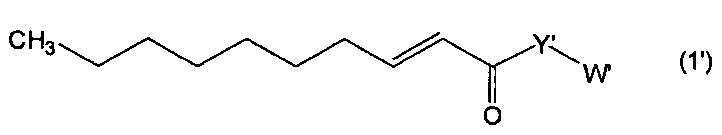
где
Y′ представляет собой -O-, -NR′- или -S-;
W представляет собой W1′, когда Y′ представляет собой -O-, W2′, когда Y′ представляет собой -NR′-, или W3′, когда Y′ представляет собой -S-;
(1) W1′ представляет собой диалкиламиноалкильную группу, алкилтиоалкильную группу, алкоксиалкильную группу, диалкоксиалкильную группу или диалкиламиноалкоксиалкильную группу;
(2-1) W2′ представляет собой атом водорода, алкильную группу или диалкиламиноалкильную группу, когда R′ представляет собой диалкиламиноалкильную группу;
(2-2) W2′ представляет собой алкильную группу, которая является такой же или отлична от R′, когда R′ представляет собой алкильную группу (кроме случая, когда и R′, и W2′ представляют собой этильную группу и метильную группу); или
(2-3) W2′ представляет собой алкильную группу (кроме 2-метилпропильной группы и 2-метилбутильной группы), циклогексильную группу или пирролидиналкильную группу, когда R′ представляет собой атом водорода; и
(3) W3′ представляет собой алкильную группу, циклоалкильную группу, фенилалкильную группу или диалкиламиноалкильную группу.

где
Y представляет собой -О-, -NR- или -S-;
W представляет собой W1, когда Y представляет собой -О-, W2, когда Y представляет собой -NR-, или W3, когда Y представляет собой -S-;
(1) W1 представляет собой диалкиламиноалкильную группу, алкилтиоалкильную группу, алкоксиалкильную группу, диалкоксиалкильную группу или диалкиламиноалкоксиалкильную группу;
(2-1) W2 представляет собой атом водорода, алкильную группу или диалкиламиноалкильную группу, когда R представляет собой диалкиламиноалкильную группу;
(2-2) W2 представляет собой алкильную группу, которая
является такой же или отлична от R, когда R представляет собой алкильную группу; или
(2-3) W2 представляет собой алкильную группу, циклоалкильную группу, пирролидиналкильную группу, фенильную группу или фенилалкильную группу, когда R представляет собой атом водорода; и
(3) W3 представляет собой алкильную группу, циклоалкильную группу, фенилалкильную группу или диалкиламиноалкильную группу.
Документы, цитированные в отчёте о поиске
Композиция для снижения количества жира в организме







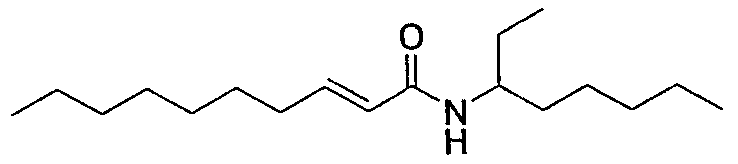


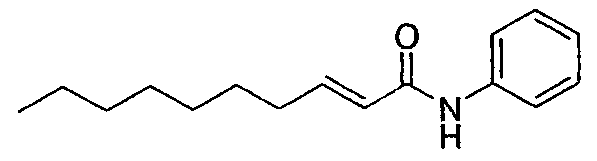


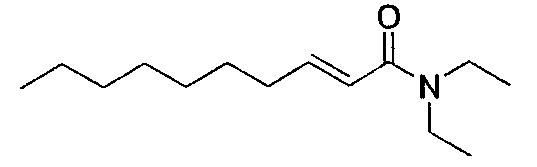


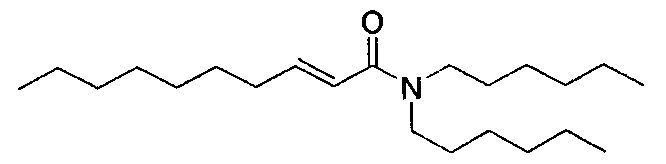





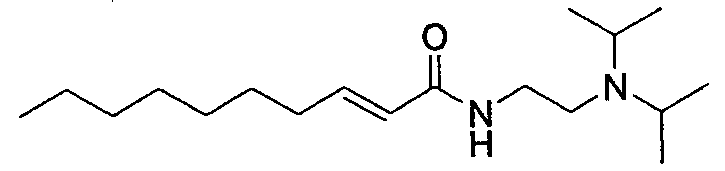
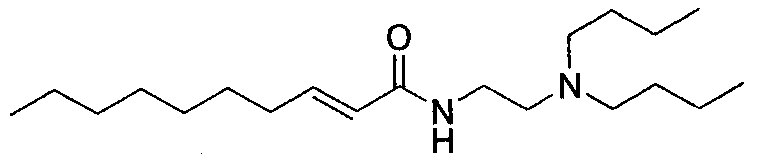
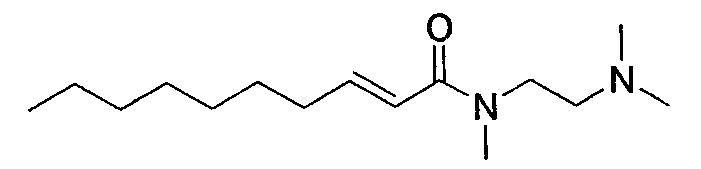
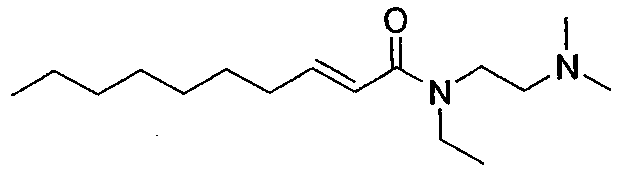
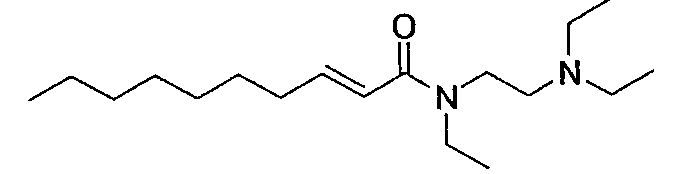





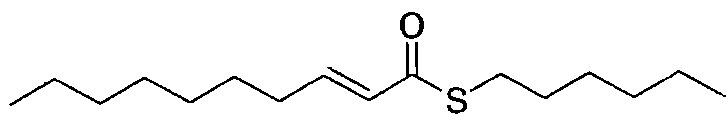







Комментарии