Средство для лечения желудочно-кишечных опухолей - RU2269510C2
Код документа: RU2269510C2
Описание
Настоящее изобретение относится к новым лекарствам, используемым при мочевых расстройствах, и в частности к средствам для лечения желудочно-кишечных опухолей. Эти расстройства обычно группируются в один отдельный класс, функциональной патологии и характеризуются несколькими симптомами, включающими изменения в мочеиспускании (как, например, недержание), изменения в выработке мочи (как, например, полиурия, олигурия, анурия), изменения в образовании мочи (как, например, гематурия), отек (как, например, анасарка), боль (как, например, боль в мочевом пузыре).
Изобретение относится к новым соединениям, имеющим превосходную эффективность при лечении некоторых форм недержания мочи (соединения против недержания мочи) или отека (диуретики), и которые, по-видимому, хорошо переносятся организмом.
В частности, известно, что недержание мочи может быть рассмотрено как нарушение в контроле мочеиспускания из-за повреждения или дисфункции нижних мочевых путей. В особенности, затронуты гладкая мышца мочевого пузыря, называемая сжимателем, и внутренний (гладкая мышца) и внешний (поперечно-полосатая мышца) сфинктеры мочеиспускательного канала (уретры). Смотри, например, Ferguson D. и Christopher N., Urinary bladder function and drug development. Trends in Pharmacological Sciences, 1996, 17, 161-165. Эта публикация раскрывает существование различных видов недержания, характеризующихся разными причинами и симптомами. В особенности, следующие могут быть упомянуты:
- стрессовое недержание, которое представляет собой выделение малых количеств мочи из-за увеличения внутрибрюшного давления, вызванного, например, кашлем или усилием. Стрессовое недержание обусловлено изменением угла между мочевым пузырем и уретрой и ослаблением мышцы сфинктера уретры. Стрессовое недержание мочи чаще наблюдается у женщин, в особенности у повторнородящих женщин;
- вынужденное недержание представляет собой неспособность контролировать мочевой пузырь и проявляется как внезапный и принудительный позыв к мочеиспусканию. Позыв мочеиспускания обусловлен перемежающимся сокращением мышцы мочевого пузыря по неизвестной причине (нестабильности сжимателя) или вызван межуточным циститом или другим воспалительным явлением, которое приводит к повышенной возбудимости мочевого пузыря. По-видимому, во всех этих случаях присутствуют изменения в возбуждении мочевого пузыря;
- недержание из-за перерастяжения мочевого пузыря, которое происходит в случае хронической задержки мочи, обусловленной причинами, препятствующими ее продвижению. Мочевой пузырь никогда не опорожняется полностью, что приводит к непрерывному выделению малых количеств мочи;
- общее недержание, представляющее собой полную потерю контроля за мочевым пузырем из-за неспособности контролирования сфинктеров. Это является результатом некоторых неврологических повреждений.
В известном уровне техники пригодные терапии основаны на трех различных подходах, смотри, например, вышеуказанную публикацию и Anderson К.Е., Pharmacology of lower urinary tract smooth muscles and penile erectile tissues. Pharmacological Reviews, 1993, 45, 253-308:
- снижение активности сжимателя,
- изменение чувствительности передачи нервного импульса,
- изменение устойчивости мочеиспускательного канала.
Согласно первому подходу сокращение сжимателя стимулируется парасимпатической системой и основным медиатором является ацетилхолин. Поэтому антихолинергические агенты используются для снижения повышенной активности мочевого пузыря. Однако эти агенты являются эффективными, но ограниченно используемыми из-за системных антихолинергических побочных эффектов, включающих, например, сухость во рту, запор и тахикардию. Учитывая, что чувствительность мочевого пузыря часто связана с его заболеванием, вызванным нарушениями в проходимости, применение антихолинергических агентов создает угрозу резкого задерживания мочи.
Другой фармакологический подход уменьшения активности сжимателя включает использование лекарств, которые помогают открыванию калиевых каналов, или кальциевых антагонистов, которые ослабляют гладкую мышцу. Однако существуют недостатки, такие как значительное гипотензивное действие, обусловленное неспецифическим вазодилаторным (сосудорасширяющим) эффектом, производимым этими агентами.
Дополнительной фармакологической мерой для уменьшения активности сжимателя является применение простагландиновых синтетических ингибиторов, которые были испытаны в некоторых случаях повышенной активности сжимателя и энуреза с перспективными результатами, однако они дают значительные побочные эффекты. Их применение основано на том факте, что многочисленные простагландины, как было установлено, синтезируются в мочевом пузыре после нервной стимуляции и некоторые из них, по-видимому, действуют как медиаторы сокращения сжимателя. Кроме того, некоторые простагландины могут участвовать в ряде случаев вынужденного недержания и повышенной активности мочевого пузыря при некоторых воспалительных заболеваниях мочевых путей.
Следовательно, нестероидные противовоспалительные лекарства являются потенциально полезными для снижения порога возбудимости мочевого пузыря и, таким образом, эффективными в случаях нестабильности сжимателя. К сожалению, их недостатком является плохая переносимость организмом в активных дозах, особенно желудочно-кишечным трактом.
Аналогично ингибиторы NO-синтетазы могут предотвращать повышенную возбудимость мочевого пузыря и гипералгезию, возникающие в случаях воспаления, такого как межуточный цистит; смотри Rice A.S.C., Topical spinal administration of a nitric acid synthase inhibitor prevents the hyperreflexia associated with a rat model of persistent visceral pain, Neuroscience Letters, 1995, 187, 11-114. Однако практически не существует агентов этого типа, которые могут быть использованы в терапии из-за неспецифичности их фармакологического профиля.
Второй подход, который заключается в изменении чувствительности передачи нервного импульса (всякий раз, когда недержание мочи является результатом нарушений нервной системы), включает применение лекарств, которые действуют на передачу нервного импульса, например гамма-аминомасляной кислоты (ГАМК), или пептидов, или пуринов, которые являются важнейшими нейромедиаторами в мочевом тракте.
Известны также исследования, в которых применяли капсаицин для введения малыми дозами в мочевой пузырь с некоторыми удовлетворительными результатами. Однако такая обработка имеет ограниченное клиническое применение из-за скоротечности эффекта, который, кроме того, может быть получен только при местном применении.
Третий подход учитывает тот факт, что мышечный тонус в уретре опосредован различными системами передачи нервного импульса, включающими, например, адренергическую систему, и стимуляцией α-рецепторов, поэтому лекарства α-агонисты, которые увеличивают давление, выдерживаемое уретрой, используются для изменения устойчивости мочеиспускательного канала, иногда с удовлетворительными результатами. Однако использование этих соединений включает некоторую степень риска, как в случае заболевания мочевого пузыря, вызванного нарушениями в его проходимости, где даже применяются альфа-антагонисты. В этих случаях наблюдается повышенная активность сфинктера, который предотвращает регулярное освобождение мочевого пузыря, обусловленное вынужденным недержанием. В этом случае, так же как и в описанном выше первом методе, наблюдаются некоторые побочные эффекты гипотензивного типа, относящиеся к α-антагонистической активности в системе кровообращения сердца.
Для повышения устойчивости мочеиспускательного канала у женщин со стрессовым недержанием мочи используется терапия, основанная на эстрогене, который, как было найдено, эффективен для повышения внутриуретрального давления и изменения структуры слизистой мембраны и сосудов. Хорошие результаты наблюдались при объединении лечения α-агонистамм с лечением эстрогеном. Однако необходимо отметить хорошо известные побочные эффекты, наблюдаемые при лечении эстрогеном.
До настоящего времени торговые фармацевтические препараты позволяют решать эту проблему только в ограниченном ряде случаев. Кроме того, они обычно вызывают побочные эффекты, иногда даже несколько.
Заявитель неожиданно нашел, что особенные классы соединений, описанные ниже, могут быть выгодно использованы при лечении различных типов недержания мочи, описанных выше, так как эти соединения проявляют фармакологический профиль, превосходящий профиль известных препаратов, используемых для этого типа заболеваний.
Предметом настоящего изобретения является применение для лечения недержания мочи следующих классов соединений, имеющих общую формулу:
А-X1-NO2
или их солей,
где А = RCO(X)t, где t представляет целое число 0 или 1;
Х = О, NH, NR1c, где R1c является линейным или разветвленным алкилом, имеющим от 1 до 10 атомов С;
R выбирают из следующих групп:
*Группа I А), в которой t=1,


где RII5 представляет Н, линейный или когда возможно разветвленный C1-С3алкил;
RII6 имеет те же самые значения, что и RII5, или когда RII5 является Н, RII6 может быть бензилом;
RII1 , RII2 и RII3 - одинаковые или различные и представляют водород, линейный или когда возможно разветвленный C1-С6алкил или C1-С6алкокси, или Cl, F, Br;
RII4 является RII1 или бромом;
предпочтительными являются соединения, в которых RII1, RII2 и RII4 являются Н, и RII3 является Cl, и RII3 находится в орто-положении к NH; RII5 и RII6 представляют Н, Х равен О и X1 является (СН2 -СН2-О)2;
(I Ab) является остатком 2-[[2-метил-3-(трифторметил)фенил]амино]-3-пиридинкарбоновой кислоты и когда -СООН присутствует, он известен как фланиксин;
предпочтительны соединения, в которых Х = О;
*II А) выбирают из следующего:
где, когда t=1, R представляет группу

где R2a и R3а представляют Н, линейный или когда возможно разветвленный замещенный или незамещенный C1-C12алкил, аллил при условии, что когда один из них является аллилом, другой представляет Н; предпочтительно R2а является Н, алкилом, имеющим от 1 до 4 атомов С, R3а представляет водород;
R1a выбирают из:
II Аа)










где:
- в соединениях формулы (IV), остатке кетопрофена:
RIII1 - Н, SRIII3 где RIII3 содержит от 1 до 4 атомов С линейных или, когда возможно, разветвленных;
RIII2 является Н, гидроксилом;
предпочтительными являются соединения, в которых RIII1 и RIII2 представляют Н, R3a - Н, R2a - метил, Х = O;
- в соединениях формулы (XXI), остатке капрофена:
Rxxio - Н, линейный или когда возможно разветвленный алкил, имеющий от 1 до 6 атомов углерода, С1-С6 алкоксикарбонил, присоединенный к С1-С6алкилу, С1-С6карбоксиалкил, С1-С6алканоил, возможно замещенный галогеном, бензил или галобензил, бензоил или галобензоил;
Rxxi - Н, галоген, гидроксил, CN, С1-С6 алкил, возможно содержащий ОН-группы, С1-С6алкокси, ацетил, бензилокси,
SRxxi2, где Rxxi2 - С1-С6алкил; перфторалкил, имеющий от 1 до 3 атомов С, С1-С6карбоксиалкил, возможно содержащий ОН, NO2, сульфамоил, диалкилсульфамоильные группы с алкилом, имеющим от 1 до 6 атомов С, или дифторалкилсульфонил с алкилом, имеющим от 1 до 3 атомов С;
Rxxil является галогеном, CN, С1-С6алкилом, содержащим одну или более ОН-групп, С1 -С6алкокси, ацетил, ацетамидо, бензилокси; SRIII3 таким, как он определен выше, перфторалкилом, имеющим от 1 до 3 атомов С, гидроксилом, карбоксиалкилом, имеющим от 1 до 6 атомов С, NO2, амино, моно- или диалкиламино, имеющим от 1 до 6 атомов С, сульфамоилом, диалкилсульфамоилом, имеющим от 1 до 6 атомов С, или дифторалкилсульфамоилом, как он определен выше; или Rxxi совместно с Rxxi1 представляет алкилендиокси, имеющий от 1 до 6 атомов С;
предпочтительными являются соединения, в которых Rxxio является Н, связывающий мостик находится в положении 2, Rxxi представляет Н, Rxxil является хлором и находится в пара-положении к азоту;
R3а - Н, R2a является метилом и Х представляет О;
- в соединениях формулы (XXXV), остатке тиапрофеновой кислоты:
Ar есть фенил, гидроксифенил, возможно моно- или полизамещенный галогеном, алканоил или алкокси, имеющие от 1 до 6 атомов С, триалалкил, имеющий 1-6 атомов С, предпочтительно 1-3 атомов С, циклопентил, о-гексил, о-гептил, гетероарил, предпочтительно тиенил, фурил, возможно содержащий ОН, пиридил;
предпочтительными соединениями формулы (XXXV) являются те, в которых Ar - фенил, R3а - Н, R2a является метилом и Х = О;
- в соединениях формулы (II), остатке супрофена, показанном выше, в котором предпочтительно, когда R3а= Н, R2a= СН3 и Х = О, могут быть использованы его эквиваленты, описанные и полученные в патенте US 4035376, введенном здесь в качестве ссылки;
- в соединениях формулы (VI),
из которых предпочтительные индопрофен, когда R2а является СН3, или индобуфен, когда R2a равен Н и R3а= СН3 и Х = О, были показаны выше, могут быть использованы их эквиваленты, описанные и полученные согласно патенту US 3997669, введенном здесь в качестве ссылки;
- в соединениях формулы (VIII),
из которых предпочтительный этодолак, когда R3а= R2а= Н и Х = О, уже был показан, могут быть использованы его эквиваленты, описанные и полученные согласно патенту US 3843681, введенном здесь в качестве ссылки;
- в соединениях формулы (VII),
из которых предпочтительный фенопрофен, когда R3а= H, R2а= СН3 и Х = О, показан выше, могут быть использованы его эквиваленты, которые описаны и получены согласно патенту US 3600437, введенном здесь как ссылка;
- в соединениях формулы (III),
из которых предпочтительный фенбуфен, когда R3а= R2a= Н и Х = О, был уже показан, могут быть использованы его эквиваленты, описанные и полученные согласно патенту US 3784701, который включен здесь в качестве ссылки;
- в соединениях формулы (X), остатке толметина, когда R3а= R2a= Н и Х = О, могут быть использованы его эквиваленты, описанные и полученные согласно патенту FR 1574570, который включен здесь в качестве ссылки;
- в соединениях формулы (IX), остатке фларбипрофена, когда R3а= Н, R2a= СН3, Х = О, его эквиваленты, описанные в известном уровне техники, могут быть использованы;
II Ab)







где значения являются следующими:
- когда IIIa) содержит -СН(СН3)-СООН, оно известно как пранопрофен: α -метил-5Н-[1]бензопиран[2,3-b]пиридин-7-уксусная кислота. В предпочтительных соединениях R2a= Н, R3a= СН3 и Х = О;
- когда остаток (XXX) содержит -СН(СН3)-СООН, он известен как бермопрофен: дибенз[b,f]оксепин-2-уксусная кислота. Предпочтительным является соединение, где Х = О, R2a= Н, R3a= СН3;
- остаток (XXXI) известен как CS-670, 2-[4-(2-оксо-1-циклогексилиденметил)фенил]пропионовая кислота, когда радикал является -СН(СН3)-COOH. Предпочтительное соединение имеет R2a= Н, R3а= СН и Х = О;
- остаток (XXXII) происходит от известного пемедолака, который содержит группу -СН2-СООН. Это предпочтительное соединение имеет R2a= R3а= Н и Х = О;
- когда остаток (XXXIII) дополнен группой -СН2СООН, он известен как пиразолак: производные кислоты 4-(4-хлорфенил)-1-(4-фторфенил)-3-пиразолила. В предпочтительных соединениях R2a= R3а= Н и Х = О;
- когда остаток (XXXVI) дополнен группой -СН(СН3 )-СОО-, он известен как залтопрофен. Когда этот остаток дополнен гидрокси- или аминогруппой или солями кислоты, эти соединения известны как производные дибензотиепина. Соединения предпочтительно имеют R2a= Н, R3а= СН3 и Х = О;
- когда в остатке (XXXVII) есть группа -СН2-СООН, он происходит от известного мофезолака: 3, 4-ди(п-метоксифенил)изоксазол-5-уксусная кислота. Предпочтительные соединения включают R2a= R3а= Н, t = 1, Х = О.
*Группа III A), где t = 1,

где RIVd и RIVd1 представляют, по крайней мере, один Н, а другой - линейный или когда невозможно разветвленный С1-С6алкил, предпочтительно C1 и С2, или дифторалкил с алкилом, имеющим от 1 до 6 атомов С, предпочтительно С1, или RIVd и RIVd1 вместе образуют метиленовую группу;
RIV имеет следующее значение:



где соединения III А) имеют следующие значения:
- в соединениях формулы (II):
RIV-II является алкилом, имеющим от 1 до 6 атомов С, циклоалкилом, имеющим от 3 до 7 атомов С, алкоксиметилом, имеющим от 1 до 7 атомов С, трифторалкилом, имеющим от 1 до 3 атомов С, винилом, этинилом, галогеном, алкокси, имеющим от 1 до 6 атомов С, дифторалкокси с алкилом, имеющим от 1 до 7 атомов С, алкоксиметилокси, имеющим от 1 до 7 атомов С, алкилтиометилокси с алкилом, имеющим от 1 до 7 атомов С, алкилметилтио с алкилом, имеющим от 1 до 7 атомов С, циано, дифторметилтио, замещенным фенил- или фенилалкилом с алкилом, имеющим от 1 до 8 атомов С; предпочтительно RIV-II является СН3О, RIVd является Н и RIVd1 - СН3, и известен как остаток напроксена;
Х = NH и X1= (СН2)4 или (СН2СН2О)2; также предпочтительным является такое же соединение, где Х = О;
- в предпочтительных соединениях формулы (X), для которых был показан остаток локсопрофена, остатки, описанные в патенте US 4161538, введенном здесь в качестве ссылки, могут быть использованы как эквиваленты; предпочтительными являются соединения, где RIVd представляет Н и RIVd1 есть СН3, Х = NH и X1= (СН2)4 или (СН2СН2O)2; также предпочтительным является такое же соединение, где Х представляет О;
- в соединениях формулы (III):
RIV-III - С2-С5алкил, разветвленный, когда это возможно, C2 и С3алкокси, аллилокси, фенокси, фенилтио, циклоалкил, имеющий от 5 до 7 атомов С, возможно замещенный в положении 1 C1-C2алкилом;
предпочтительным является соединение, в котором RIV-III представляет

и RIVd= H, RIVd1 является СН3, соединение известно, как остаток ибупрофена; Х = NH и X1= (CH2)4 или (СН2СН2O)2; также предпочтительно такое же соединение с Х = О;
*Группа IV А)

где А = RCOO, t = 1,
в которой остаток известного индометацина был показан, могут быть использованы его эквиваленты, которые описаны и получены в патенте US 3161654, введенном здесь в качестве ссылки.
*Группа V А) выбрана из следующего:
- V Аа) значения выбирают из следующего,
где t=1





- V Ab), производные нифламиновой кислоты, где t=1;

- V Ас), СОХ2, ингибиторы, где t=0 и R означает следующее:;





- V Ad) производные диуретиков, когда где t=1 и R представляет следующие группы:




- V Ае) производные диуретиков, когда где t=0 и R представляет следующие группы:









где значение в группе V А) является следующим:
в V Аа):
- в соединениях (V Аа1) - остатком энфенаминовой кислоты, 2-[(2-фенилэтил)амино]бензойной кислоты, который был показан, где СООН-группа замещена согласно настоящему изобретению.
Он может быть получен согласно патентам Индии 103066 и 114805, включенным здесь в качестве ссылки. Аналогичные продукты, содержащие различные заместители, описанные в указанных патентах могут быть также использованы
- в соединениях (V Аа2) - остатком флуфенаминовой кислоты, 2-[[3-(трифторметил)фенил]амино]бензойной кислоты, где СООН-группа была замещена в соответствии с настоящим изобретением, который показан выше;
Он может быть получен согласно статье Wilkinson, Finar, J.Chem. Soc. 1948, 32, введенной здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в названной статье.
- в соединениях (V Аа3) - остатком меклофенаминовой кислоты, 2-[(2,6-дихлор-3-метилфенил)амино]бензойной кислоты, который показан выше, где СООН-группа замещена согласно настоящему изобретению.
Он может быть получен согласно патенту DE 1149015 и патенту US 3313848, введенным здесь как ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в названных патентах.
- в соединениях (V Аа4) - остатком мефенаминовой кислоты, 2-[(2,3-диметилфенил)амино]бензойной кислоты, который был показан, где СООН-группа замещена согласно настоящему изобретению.
Он может быть получен согласно патенту Бельгии 605302, введенному здесь в качестве ссылки. Может быть использован также любой аналогичный продукт, содержащий разнообразные заместители, как описано в названном патенте.
- в соединениях (V Аа5) - остатком толфенаминовой кислоты, 2-[(3-хлор-2-метилфенил)амино]бензойной кислоты, который был показан, где группа СООН была замещена согласно настоящему изобретению.
Он может быть получен согласно патенту US 3313848, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в названном патенте.
В V Ab):
- в соединениях (V Ab1) остатком нифламиновой кислоты, 2-[[3-(трифторметил)фенил]амино]-3-карбоксипиридина, который был показан выше, где группа СООН была замещена согласно настоящему изобретению.
Он может быть получен согласно патенту US 3415834, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в названном патенте.
В V Ас):
- в соединениях (V Ас1)Rvас1 к атому кислорода в положении 2 бензольного кольца N-(4-нитрофенил)метансульфонамида может быть присоединен фенил или циклогексан. Когда Rvac1 является фенилом, остаток представляет собой остаток нимсулида. Он может быть получен согласно патенту US 3840597, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанном патенте.
- в соединениях (V Ас2) - остатком 3-формиламино-7-метилсульфониламино-6-фенокси-4Н-1-бензопиран-4-она, который был замещен согласно настоящему изобретению и показан выше. Он может быть получен согласно патенту DE 3834204, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанном патенте.
- в соединениях (V Ас3) атом Х4, который присоединен к радикалу 2,4-дифтортиофенила в положения 6 кольца инданона остатка 5-метансульфонамидо-1-инданона, может быть серой или кислородом.
Он может быть получен согласно заявке WO 9413635, введенной здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанной заявке.
- в соединениях (V Ас4) - остатком селекоксиба, 4-{5-(4-метилфенил)-3-(трифторметил)пиразол-1-ил]бензенсульфонамида, который был замещен согласно настоящему изобретению и показан выше;
Он может быть получен согласно заявке WO 9427980, введенной здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, например, WO 9515315-9515318, как описано в указанных заявках.
- в соединениях (V Ас5) - остатком 6-[2-(3-этил-2,3-дигидротиазолил)тио-5-метансульфонамидо-3Н-изобензофуран-1-она, замещенным согласно настоящему изобретению, который был показан выше;
Он может быть получен согласно заявке WO 9623786, введенной здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанной заявке.
- в соединениях (V Ad1) - остатком буметанида, 3-(аминосульфонил)-5-(бутиламино)-4-феноксибензойной кислоты, замещенным согласно настоящему изобретению и который показан выше;
Он может быть получен согласно патенту US 3806534, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанном патенте.
- в соединениях (V Ad2) - остатком тикрунафена, [2,3-дихлор-4-(2-тиенилкарбонил)фенокси]уксусной кислоты, замещенным согласно настоящему изобретению, который показан выше;
Он может быть получен согласно патенту US 3758506, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанном патенте.
- в соединениях (V Ad3) - остатком этакриновой кислоты, [2, 3-дихлор-4-(2-метилен-1-оксобутил)фенокси]уксусной кислоты, замещенным согласно настоящему изобретению, который показан выше;
Он может быть получен согласно патенту US 3255241, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанном патенте.
- в соединениях (V Ad4) - остатком пиретанида, 3-(аминосульфонил)-4-фенокси-5-(1-пирролидинил)бензойной кислоты, замещенным согласно настоящему изобретению, который показан выше;
Он может быть получен согласно патенту US 4010273, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанном патенте.
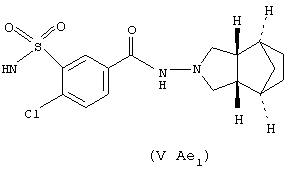
- в соединениях (V Ae1) - остатком трипамида, (3аα, 4α, 7α, 7аα)-3-(аминосульфонил)-4-хлор-N-(октагидро-4,7-метано-2Н-изоиндол-2-ил)бензамида, который был замещен согласно настоящему изобретению и показан выше;
Он может быть получен согласно патенту JP 7305585, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий различные заместители, как описано в указанном патенте.
- в соединениях (V Ае2) - остатком торсемида, N-[[(1-метилэтил)амино]карбонил]-4-[(3-метилфенил)амино]-3-пуринсульфонамида, который был замещен согласно настоящему изобретению и показан выше;
Он может быть получен согласно патенту US 4018929, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий различные заместители, как описано в указанном патенте.
- в соединениях (V Ае3) - остатком азосемида, 2-хлор-5-(1Н--тетразол-5-ил)-4-[(2-тиенилметил)амино]бензенсульфонамида, который был замещен согласно настоящему изобретению и показан выше;
Он может быть получен согласно патенту US 3665002, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанном патенте.
- в соединениях (V Ае4) - остатком бендрофлуметиазида, 1,1-диоксида 3,4-дигидро-3-(фенилметил)-6-(трифторметил)-2Н-1,2,4-бензотиадиазин-7-сульфонамида, который замещен согласно настоящему изобретению и показан выше;
Он может быть получен согласно патенту US 3392168, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разные заместители, как описано в указанном патенте.
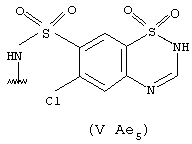
- в соединениях (V Ае5) - остатком хлортиазида, 1,1-диоксида 6-хлор-2Н-1,2, 4-бензотиадиазин-7-сульфонамида, который замещен согласно настоящему изобретению и показан выше;
Он может быть получен согласно патентам US 2809194, US 2937169, введенным здесь в качестве ссылок. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанных патентах.
- в соединениях (V Ае6) - остатком дихлотиазида, 1,1-диоксида 6-хлор-3,4-дигидро-2Н-1,2,4-бензотиадиазин-7-сульфонамида, который замещен согласно настоящему изобретению и показан выше;
Он может быть получен согласно патентам DE 1163332, US 3043840, введенным здесь в качестве ссылок. Может быть использован также любой эквивалентный продукт, содержащий различные заместители, как описано в указанных патентах.
- в соединениях (V Ае7) - остатком метихлотиазида, 1,1-диоксида (6-хлор-3-(хлорметил)-3,4-дигидро-2-метил-2Н-1,2,4-бензотиадиазин-7-сульфонамида, который замещен согласно настоящему изобретению и показан выше;
Он может быть получен согласно статье Close et al., J. Am. Chem. Society, 82, 1132 (1960), введенной здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанной статье.
- в соединениях (V Ае8) - остатком хлорсалидона, 2-хлор-5-(2, 3-дигидро-1-гидрокси-3-оксо-1Н-изоиндол-1-ил)бензенсульфонамида, замещенным согласно настоящему изобретению и который показан выше;
Он может быть получен согласно патенту US 3055904, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанном патенте.
- в соединениях (V Ае9) - остатком индапамида, 3-(аминосульфонил)-4-хлор-N-(2,3-дигидро-2-метил-1Н-индол-1-ил)бензамида, замещенным согласно настоящему изобретению, и который был показан выше;
Он может быть получен согласно патенту US 3565911, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанном патенте.
- в соединениях (V Ae10) - остатком метолазона, 7-хлор-1,2,3,4-тетрагидро-2-метил-3-(2-метилфенил)-4-оксо-6-хинозалинсульфонамида, замещенным согласно настоящему изобретению, и который показан выше;
Он может быть получен согласно патенту US 3360518, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано в указанном патенте.
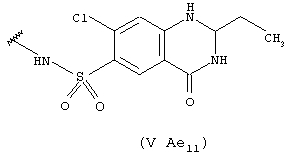
- в соединениях (V Аe11) - остатком хинетазона, 7-хлор-2-этил-1,2,3,4-тетрагидро-4-оксо-6-хинозалинсульфонамида, который был замещен согласно настоящему изобретению и показан выше;
Он может быть получен согласно патенту US 2976289, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий разнообразные заместители, как описано к указанном патенте.
- в соединениях (V Ае12) - остатком фуросемида, 5-(аминосульфонил)-4-хлор-2-[(2-фуранилметил)амино]бензойной кислоты, который замещен согласно настоящему изобретению и показан выше;
Он может быть получен согласно патенту US 3058882, введенному здесь в качестве ссылки. Может быть использован также любой эквивалентный продукт, содержащий различные заместители, как описано в указанном патенте.
Соединения V Ad/V Ae особенно удобны для лечения мочевых заболеваний, в особенности энуреза.
X1 в формуле A-X1-NO2 является двухвалентным связующим мостиком, выбранным из следующего:
-YO-,
где Y является линейным или когда возможно разветвленным C1-С20алкиленом, предпочтительно имеющим от 2 до 5 атомов углерода, или возможно замещенным циклоалкиленом, имеющим от 5 до 7 атомов углерода;
-

где n3 является целым числом от 0 до 3;
-

-

где nf' является целым числом от 1 до 6, предпочтительно от 2 до 4;
-

где R1f=Н, СН3 и nf является целым числом от 1 до 6, предпочтительно от 2 до 4.
Способы получения соединений, которые содержат радикал R из групп I А - IV А, описаны в заявке WO 95/30641, включенной здесь в качества ссылки.
Способы получения соединений класса V А являются такими, как описаны в заявке WO 95/30641.
Продукты настоящего изобретения терапевтически полезны при лечении различных форм недержания мочи при более низких дозах, чем соответствующими предшественниками без NO донорной группы, обладают более широким спектром активности и лишены недостатков прежде описанных для этого вида предшественников.
Заявитель неожиданно обнаружил, что продукты изобретения, в основном, не показывают снижения фармакологической активности в сравнении с предшественниками. Напротив, они имеют более широкую область фармакологического действия, так как неожиданно обнаружен синергизм между ингибирующим эффектом циклооксигеназы и миорелаксантным эффектом в отношении открывания калиевых каналов и/или освобождения окиси азота в нижнем мочевом тракте. Вещества настоящего изобретения более безопасны и не вызывают тахифилаксию.
Кроме того, заявитель установил, что вещества настоящего изобретения проявляют фармакотерапевтическую активность в разнообразных подходящих экспериментальных моделях, описанных ниже:
- воспаление конечностей (сочленений) (мыщечно-скелетная болезнь) у крыс; смотри Winter С. et al., Caraggeenin-induced edema in hind paw of the rat as an assay lor antiinflammatory drags. Proceedings of the Society for Experimental Biology and Medicine 1962, 111, 544-47;
- дыхательное заболевание, например бронхоспазм от брадикинина у морских свинок (Del Soldato P. et al., The anesthetized Guinea pig as a versatile pharmacological test object, Jour. of Pharmacological Methods, 1981, 5, 279-285);
- заболевание сосудов, такое как рестеноз, индуцируемый у крыс (Role of kinins and nitric oxide in the effects of anigiotensin converting enzyme inhibitors on neointima formation, Fahry-RD et al., CIRC-RES. 72/6 (1202-1210) 1983);
- гинекологические и родовспомогательные заболевания:
как показано при повышенных возбудимых состояниях на изолированном миометрии крыс (Izumi H. et al., Gestational changes in L-arginine-induced relaxation of pregnant rat and nonpregnant myometrial contractility. Am. J. Obstet. Gynecol., 1993, 169, 1327-1337);
- свертывание крови у женщин в состоянии преэклампсии (позднего токсикоза, беременности) (Janes Sl et al., Flow cytometric detection of circulating activated platelets and platelet hyperresponsiveness in pre-eclampsia and pregnancy, Clin. Science, 86, 731-739, 1994);
- кишечные опухоли, такие как, например, экспериментальная аденокарцинома у крыс (Dubois R. et al., Increased cyclooxigenase-2 levels in carcinogen-induced rat colonic tumors, Gastroenterology, 110, 1259-1262, 1996).
Поэтому, с учетом полученных экспериментальных результатов, вышеуказанные вещества могут быть терапевтически полезны, в дополнение к лечению недержания мочи, при следующих заболеваниях:
- мышечно-скелетная болезнь воспалительной природы: соединения группы V А;
- дыхательные заболевания, например бронхит, в особенности астма, и т.п.: соединения групп от I A до V А;
- гинекологические и родовспомогательные заболевания, включая преждевременные роды, преэклампсию и дисменорею: соединения групп от I А до V А и дополнительно соединения группы VI А, как определено ниже;
- заболевания сосудов, такие как рестеноз: соединения от группы I А до VI А;
- желудочно-кишечная опухоль: соединения от группы I А до VI А.
Соединения в группе VI А, где t=1, включают следующее:


где R1 является группой OCOR3; где R3 - метил, этил или линейный или разветвленный С3-С5алкил, или остаток однокольцевого гетероцикла, имеющего 5 или 6 атомов, который может быть ароматическим, частично или полностью гидрогенированным, содержащим один или более гетероатомов, независимо выбранных из О, N и S;
R2 = Н, гидроксил, галоген, линейный или когда возможно разветвленный алкил, имеющий от 1 до 4 атомов С, линейный или когда возможно разветвленный алкоксил, имеющий от 1 до 4 атомов С; линейный или когда возможно разветвленный перфторалкил, имеющий от 1 до 4 атомов С, например трифторметил, нитро, амино, моно- или ди(С1-4)алкиламино;
или R1 и R2 вместе представляют диоксиметиленовую группу при условии, что, когда Х = NH, то X1 - этилен и R2= Н; R1 не может быть OCOR3 в положении 2, когда R3 является метилом; n1 является целым числом от 0 до 1;
предпочтительно в Ia) Х = О или NH, R1 - ацетокси, предпочтительно в положении 3 или 4, наиболее предпочтительно в орто-положении к СО; X1 является этиленом или (CH2CH2O)2, R2 - водород или галоген, наиболее предпочтительными являются следующие A-X1-NO2 соединения: 3-ацетокси-N-(2-нитроксиэтил)бензамид, 4-ацетокси-N-(2-нитроксиэтил)бензамид, 3-ацетокси-N-(5-нитроксипентил)бензамид, 2-ацетокси-N-(5-нитроксипентил)бензамид, N-(2-нитроксиэтил)-2-пропионоксибензамид, 2-ацетокси-2-нитроксиэтилбензоат, 2-ацетокси-N- (цис-2-нитроксициклогексил)бензамид, 2-ацетокси-4-хлор-N-(2-нитроксиэтил)бензамид, N-(2-нитроксиэтил)-2-((4-тиазолидинил)карбонилокси)бензамида гидрохлорид, 2-никотиноилокси-N-(2-нитроксиэтил)бензамид, 2-ацетокси-5-нитроксипентилбензоат;
предпочтительно в Ib) R3= СН3, nI = 0;
Х = О, X1 - этилен; в этом случае Ib) является остатком ацетилсалицилсалициловой кислоты.
Способы получения соединений, содержащих радикал R группы VI А, описаны в заявке WO 95/30641, введенной здесь в качестве ссылки.
Нижеприведенные примеры предназначены для пояснения, но не ограничения настоящего изобретения.
ПРИМЕРЫ
Примеры 1, 2, 3 и от 1А до 1F (сравнительные)
Химический синтез
Следующие соединения были получены: NO-индометацин (NO-I), NO-флуфенаминовая кислота (NO-F), NO-нимулид (NO-M), NO-напроксен (NO-N).
Получение NO-индометацина (NO-I)
подвергают взаимодействию и раствор оставляют реагировать на всю ночь при комнатной температуре, концентрируют до малого объема и фильтруют. Фильтрат сушат и пропускают через содержащую гель колонку, используя в качестве элюирующей системы хлороформ/этилацетат в соотношении 14:1. Головную фракцию таким образом отделяют и очищают хроматографически, используя 2-миллиметровые пластинки с двуокисью кремния. Через каждую пластинку три раза пропускают подвижную фазу из циклогексана/этилацетата в соотношении 6:1.
С выходом 85% получают индометацин-NO из группы IV А, где R представляет остаток (IV) индометацина; t=1; X=О и X1 является связующим мостиком, изображенным после YO, где n3=0, и имеет общую формулу:
Получение NO-флуфенаминовой кислоты (NO-F)
подвергают взаимодействию и оставляют регировать на всю ночь, концентрируют до малого объема и отфильтровывают дициклогексилмочевину. Фильтрат сушат и пропускают через колонку, содержащую двуокись кремния, используя СН2Cl2, в качестве элюента. Таким образом отделяют головную фракцию. Эту фракцию очищают хроматографически, используя 2-миллиметровые пластинки с двуокисью кремния и систему циклогексан/этилацетат в соотношении 6:1. Через каждую пластинку пропускают указанную систему последовательно три раза. Головную фракцию получают обратно экстракцией этиловым эфиром. Эфирный экстракт высушивают и получают желтое масло с выходом 80% флуфенаминовой кислоты-NO.
1H ЯМР-спектр (CDCl3, МГц) дает следующие данные: 5,5 (2Н, с); 6,9 (1Н, т); 7,4 (10Н, м); 8,2 (1Н, д).
Полученный продукт имеет формулу:

Получение NO-нимсулида (NO-M)
Получение бромпроизводного
N-[(2-ФЕНОКСИ-4-НИТРО)ФЕНИЛ]-N-(6-БРОМ)ГЕКСАНОИЛМЕТАНСУЛЬФОНАМИД
4,85 г 6-бромгексаноилхлорида (23 ммоль) добавляют по каплям к смеси, хранящейся при 0°С, 7 г нимсулида (23 ммоль) и 6,4 мл триэтиламина (46 ммоль) в дихлорметане (80 мл). После перемешивания в течение 1 часа при 0°С тонкослойный хроматографический анализ (элюент: толуол/этилацетат 9:1) показал присутствие непрореагировавшего нимсулида. 1 г ацилхлорида (4,7 ммоль) и 3 мл триэтиламина (22 ммоль) добавляют к реакционной смеси, температуру поднимают до комнатной и реакционную смесь перемешивают всю ночь. Хроматографический контроль показал, что реакция завершилась. Реакционную массу обрабатывают водой (50 мл), затем реакционную массу промывают три раза водой (50 мл для каждой промывки), затем разбавленным NaOH (5% в/о), затем сушат над безводным сульфатом натрия (10 г). После упаривания растворителя при уменьшенном давлении остается желтый твердый остаток, который дважды промывают двумя порциями этилового эфира (50 мл каждая). Высушенный на воздухе продукт весит 8,3 г, что соответствует 74% выходу, и имеет точку плавления 98°С.
Получение NO-нимсулида (NO-M)
N-[(2-ФЕНОКСИ-4-НИТРО)ФЕНИЛ]-N-(6-НИТРОКСИ)ГЕКСАНОИЛМЕТАНСУЛЬФОНАМИД
Раствор 4 г N-[(2-фенокси-4-нитро)фенил]-N-(6-бром)гексаноилметансульфонамида (8,24 ммоль) м 2,8 г нитрата серебра (16,48 ммоль) в безводном ацетонитриле (20 мл) подвергают взаимодействию при перемешивании в течение 2 дней. Затем еще 1 г нитрата серебра (6 ммоль) добавляют и продолжают перемешивание в течение следующего дня. Осадок удаляют фильтрованием и растворитель выпаривают из фильтрата при пониженном давлении. Остаток растворяют в смеси равных частей этилацетата и изопропилового эфира и перемешивают несколько минут с силикагелем хроматографического сорта (5 г). Твердое вещество удаляют фильтрованием и растворитель фильтрата удаляют при пониженном давлении. Остаток представляет собой желтое масло, которое со временем затвердевает (2,6 г). Это твердое вещество промывают этиловым эфиром и сушат, его точка плавления составляет 96°С.
1Н ЯМР-спектр (CDCl3) показал следующие сигналы: 8,05 (1 Н, м); 7,62 (2 Н, м); 7,48 (2 Н, м); 7,32 (1 Н, м); 7,08 (2 Н, м); 4,40 (2 Н, т); 3,40 (3 Н, с); 2,24 (2 Н, т); 2,18 (3 Н, с); 1,70 (4 Н, м); 1,45 (2 Н, м).
Получение соединения NO-напроксена (NO-N)
Соединение NO-напроксен был получен согласно примеру 1h (пример 1) в заявке WO 95/30641.
Фармакологические исследования
Продукты использовали в суспензии карбоксиметилцеллюлозы в экспериментах in vivo, а при исследованиях in vitro их растворяли в диметилсульфоксиде.
Для контрольных групп всегда использовали тот же растворитель (разбавитель), что и для соответствующих лечебных групп.
Острую токсичность грубо определяли введением соединения орально в дозе 50 мг/кг группам из 10 мышей. Быстроту наступления смерти и появления токсических симптомов оценивали в течение 14 дней после введения дозы: никаких токсических эффектов не наблюдалось при введенной дозе.
Ингибирующая сокращение активность на изолированном сжимателе крысы
Использовали самцов крыс Wistar весом 200-300 г. Применяемый метод описан Zhou Q. et al. (1995) (смотри пример 13). После умерщвления крыс отсечением головы выделяют мочевой пузырь и из его срединной области получают горизонтальные полоски сжимателя (мышцы) около 2 мм шириной и около 5 мм длиной. Полоски помещают в ванны для изолированных органов, содержащие раствор Кребса, и подвергают растяжению в 1 г. Изменения растяжения во время опыта измеряют изометрически, используя преобразователь давления, присоединенный к полиграфу. Ингибирующий эффект от обработки с испытываемыми производными на сокращение, индуцируемое 40 мМ KCl, определяют в сравнении с лекарствами, имеющими активность открывания калиевых каналов (кромакалин, никорандил), нитропроизводными (нитроглицерин, никорандил) и противовоспалительными средствами (индометацин, напроксен, нимсулид). Результаты представлены в таблице 1.
Все новые нитропроизводные (примеры 1-3), как показано, являются более активными, чем вещества, используемые для сравнения.
Примеры 4-5 и 4А-4С (сравнительные)
Исследования in vivo на нормальном мочевом пузыре крыс, находящихся в сознании
Цистометрограммы находящихся в сознании крыс определены согласно методу, описанному Home В.В. el al. (1995) (смотри пример 9).
Использовали самцов крыс Wistatr весом около 500 г. Крыс анестизировали нембуталом. После вскрытия брюшной полости и экспозиции их мочевого пузыря катетер, наполненный физиологическим раствором, имплантировали в мочевой пузырь и выводили на спину животных. Брюшную мышцу и кожу затем зашили. Через 38 часов после операции животных помещали в метаболические клетки и катетеры присоединяли к перфузионному насосу, который прокачивал через мочевой пузырь 0,18 мл/мин физиологического раствора, и к преобразователю давления для измерения давления внутри мочевого пузыря. После стабилизации в течение 60 минут животным орально вводили испытываемые вещества и частоту мочеиспускания затем измеряли в течение 4 часов после дозировки. Таблица 2 показывает полученные результаты, представленные как отношение к базовой частоте, установленной перед дозировкой (IC = интервал между сокращениями).
Показано, что оба новых производных (примеры 4-5) являются более активными, чем вещества, использованные для сравнения.
Примеры 5-6 и 5А-5В (сравнительные)
Исследования in vivo на нормальном мочевом пузыре анестезированных крыс
40 крыс Sprague Dawley весом около 300 г произвольно разделили на 4 группы и орально обрабатывали дважды в день в течение 4 дней согласно следующей экспериментальной схеме:
Через 18 часов после последней обработки эффекты на рефлекс опорожнения мочевого пузыря были оценены с использованием метода, описанного Maggy С.A. et al., Prostanoids modulate reflex micturition by acting through capsaicin-sensitive afferenrs, European Journal of Pharmacology, 105-112, 1988.
Животных анестезировали с помощью уретана, и мочевой пузырь был подготовлен для измерения внутрипросветного давления. После стабилизационного периода с пустым мочевым пузырем он был постепенно заполнен физиологическим раствором при медленном его введении (0,046 мл/мин). Сокращение мочевого пузыря наблюдали по рефлексу спуска.
Измеряли объем физиологического раствора и внутрипросветное давление, требуемые для вызова рефлекса (пороги объема и давления). Таблица 3 показывает пороговые величины объема и давления после обработки, причем при вычислениях за 100 принимались величины, полученные для контрольных животных. Все испытанные вещества увеличивают указанные пороги и могут, следовательно, рассматриваться полезными в случае нестабильности сжимателя.
Примеры 7-8 (7A-7D для сравнения)
Исследования in vitro при нестабильном мочевом пузыре
Модель гипертрофии мочевого пузыря, производной от наличия препятствия в мочеиспускательном канале у крыс, описанная Malmgren A. et al.: Cystometrical evoluation of bladder instability in rats with intravesical outflow obstruction. The Journal of Urology, 1987, 137, 1291-1294, была использована для оценки действия лекарств на мышцу мочевого пузыря с повышенной активностью.
Использовали самцов крыс Spague Dawley весом около 250 г. Для того чтобы получить частичную непроходимость уретры, крыс анестизировали нембуталом и мочевой пузырь и уретру экспонировали разрезанием брюшной полости. Мочеиспускательный канал перевязывали в присутствии находящейся в его просвете трубки (каннюли) диаметром 1 мм. После сшивания брюшной стенки животных стабилизировали в течение 6 недель для того, чтобы создать гипертрофию мочевого пузыря.
Эксперименты in vitro были проведены с параллельным использованием полосок (образцов), полученных от нормальных крыс и крыс с гипертрофией пузыря.
Полоски из мочевого пузыря in vitro были приготовлены, как описано выше, и было измерено вызванное лекарствами ингибирование сокращения, индуцированного электрической стимуляцией 1/7 Гц с выдержкой 1 мсек, верхнее максимальное напряжение, производимое двумя платиновыми электродами.
Следующая таблица 4 показывает процент сокращения, индуцированного электрической стимуляцией, в нормальных и гипертрофированных мочевых пузырях в присутствии испытываемых лекарств.
Было найдено, что в отличие от индометацина, вещества с активностью открывания калиевых каналов и новые соединения являются более активными при ингибировании сокращения гипертрофированного мочевого пузыря, чем нормального мочевого пузыря.
Примеры 9-10 и 9А-9В (для сравнения)
Исследования in vivo на нормальном мочевом пузыре находящихся в сознании собак
Цистометрограмма находящихся в сознании собак была определена в соответствии с Howe В.В. et al., ZENECA ZD 6169: а NOVEL КАТР Channel opener with in vivo selectivity for urinary bladder. Journal of Pharmacology and Experimental Therapeutics, 274, 884-890, 1995.
Использовали самок собак Beagle с катетером, введенным в мочевой пузырь через уретру операцией в стерильных условиях. Катетеры присоединены к перфузионному насосу, который вводит в мочевой пузырь физиологический раствор, и к преобразователю давления для измерения давления внутри мочевого пузыря. После 15-минутной стабилизации, 30-миллилитровую порцию физиологического раствора вводили в мочевой пузырь для того, чтобы измерить повышенное давление внутри пузыря, и серию меньших порций затем вводили до тех пор, пока не стали наблюдаться спонтанные сокращения. После периода стабилизации сокращений сократительную активность регистрировали в течение 60 минут. Животным затем орально вводили испытываемые продукты и частоту мочеиспускания измеряли затем у контрольных и обработанных лекарствами собак в течение 4 часов после дозировки. Таблица 5 показывает полученные результаты, выраженные как отношение к базовой частоте, зарегистрированной до дозировки (IC = интервал между сокращениями).
Примеры 11-12 и 11А-11D (сравнительные)
Релаксационный эффект в уретральной гладкой мышце свиньи
Метод, описанный Werkstrom et al. Factors involved in the relaxation of female pig urethra evoked by electrical field stimulation, British Journal of Pharmacology, 116, 1599-1604, 1995, был применен для получения образца. Образцы уретры были удалены у самок свиней в возрасте около 6 месяцев.
Уретру открывали продольно и образцы гладкой мышцы размером около 1×2×6 мм удаляли с площади около 4 мм под уретральными отверстиями. Образцы гладкой мышцы помещали в ванну для изолированных органов, инкубировали при 37°С, подвергали 10 мН растяжению и присоединяли к силовому датчику для измерения механической активности. После периода уравновешивания около 60 минут приготовленные образцы обработали раствором Кребса без Са++ для определения наибольшего уровня релаксации. Нормальный тонус затем был восстановлен добавлением раствора Кребса. Затем было измерено релаксационное действие испытываемых соединений. Опыт был повторен два раза последовательно для каждого полученного образца для того, чтобы оценить возможные тахифилаксические эффекты. Таблица 6 показывает проценты релаксации, полученные подле двух обработок с каждым испытанным продуктом, при этом за 100% принят наибольший уровень релаксации, определенный в среде без Са++.
Результаты показывают, что в то время как лекарства с противовоспалительной активностью, такие как индометацин, были практически неактивны, за исключением флуфенаминовой кислоты, которая сама обладает миорелаксантной активностью, а обычные NO доноры, такие как нитроглицерин и аргенин, были активны, но индуцировали тахифилаксию, новые производные, которые являются предметом настоящего изобретения, были активны и не вызывали никакой тахифилаксии.
Примеры 13-15 и 13А-13В (сравнительные)
Релаксационная активность на сосудистой и гладкой мышце
Использовали самцов крыс Wistar весом 200-300 г. Применяемый метод описан Zhou Q. et al. The inhibitory mechanism of nicorandil in isolated rat urinary bladder and femoral artery, European Journal of Pharmacology, 153-159, 1995. После умерщвления крысы отсечением головы бедренные артерии были выделены для приготовления геликоидальных полосок размером около 1×15 мм, из которых был удален эндотелий. Приготовленные полоски помещают в ванну для изолированных органов, содержащую жидкость Кребса, и подвергают нагрузке 0,5 г. Изменения растяжения во время опыта мерили изометрически посредством преобразователя давления, связанного с полиграфом. Измеряли ингибирующий эффект на сокращения, индуцируемые 3×10-5 М фенилэфрина, от обработки опытными производными относительно известных препаратов, обладающих активностью открывания калиевых каналов и/или NO доноров. Результаты включены в таблицу 7.
Все новые соединения, как показано, менее активны, чем кромакалин и никорандил, даже при использовании в более высоких концентрациях, чем они показали на специфических моделях (смотри, например, таблицу 6).
Примеры 16-17 и 16А-126В (сравнительные)
Исследования in vivo на желудочно-кишечную безопасность
Сорок крыс Sprague Dawley весом около 300 г произвольно разделили на 4 группы и орально обрабатывали дважды в день в течение 4 дней согласно следующей экспериментальной схеме:
1. Контроли: карбоксиметилцеллюлоза(0,5% вес.): 5 мл/кг
Через 18 часов после последней обработки крыс умерщвляли для определения каких-либо желудочно-кишечных повреждений. Никаких заметных изменений не наблюдалось в желудочно-кишечном тракте контрольных животных.
У животных, обработанных индометацином, наблюдались изъязвления в желудках и, кроме того, у большинства животных (7/19) - в кишках, а в некоторых случаях (3/10) - даже диффузное сращение. В группе, обработанной NO-I, только желудочные язвы наблюдались у одного животного, и в группе, обработанной NO-F, найдено одно животное с желудочной язвой и животное с язвой двенадцатиперстной кишки.
Примеры 18-18А и 18В (для сравнения)
Изучение активности нитроксисинтетазы
Ингибирование активности нитроксисинтетазы, вызванной липополисахаридом (LPS), определяли в нейтрофилах крысы после введения любого из испытываемых соединений и сравнивали с активностью, полученной после обработки одним разбавителем в виде суспензии (0,5% карбоксиметилцеллюлоза, 5 мг/кг) и веществом, используемым для сравнения. Кратко, крысы Wistar, голодавшие 24 часа перед обработкой, получали одно из испытываемых соединений (10 мг/кг) внутрибрюшинно или разбавитель LPS (5 мг/кг) внутривенно (хвостовая вена).
Через 4 часа животных умерщвляли. Кровь собирали для выделения нейтрофилов.
Ферментативную активность определяли согласно методу, описанному Assreuy J. et al. Feedback inhibition of nitric oxide sinthase activity by nitric oxide, British Journal of Pharmacology, 883-837, 1993.
Как показано в таблице 8, найдено, что испытанный продукт является очень эффективным при ингибировании нитроксисинтетазы по сравнению с группой, обработанной одним разбавителем и отличается от флуфенаминовой кислоты, приведенной в ссылке.
Заключение на основе всех опытов
Установлено, что производные настоящего изобретения являются активными в некоторых тестах, используемых для обнаружения потенциальной фармакологической активности контролирования мочеиспускания.
Необходимо также отметить, что производные по изобретению, как было найдено, являются эффективными в более широкой серии опытов, чем те, в которых известное лекарство, как было установлено, является активным, согласуясь с гипотезой, что данные производные обладают превосходно полной фармакологической активностью при контролировании недержания мочи.
Более того, производные по изобретению, как найдено, являются более переносимыми, чем известные вещества. По-видимому, они менее вредны для желудка, чем соответствующие противовоспалительные агенты, и меньше снижают давление, чем стандартные агенты с сосудорасширяющей активностью.
Комбинация характеристик, упомянутых выше, делает вещества настоящего изобретения превосходящими известные агенты.
Ингибирование соединениями по изобретению образования предраковых клеток in vivo и роста раковых клеток in vitro
ЭКСПЕРИМЕНТ 1
Исследование ингибирующей активности соединений по изобретению в отношении образования предраковых клеток in vivo
Очаги аберрантных углублений (ACF) представляют собой предраковые повреждения, которые постоянно наблюдались в ряде экспериментальных моделей канцерогенеза толстой кишки. Кроме того, ACF присутствуют на слизистой оболочке при раке толстой кишки человека, и предполагается, что эти повреждения являются предшественниками развития аденом и карцином.
Поскольку для ACF характерны мутации арс гена и ras онкогена, считается, что эти повреждения являются ранним сигналом развития рака толстой кишки.
В данном тесте исследовали следующие соединения:
3-(нитроксиметил)фениловый эфир 2-(ацетилокси)бензойной кислоты,
данное соединение было получено в соответствии с примером 1 WO 00/44705 (NO-Asp-1),
- аспирин
В начале эксперимента самцов крыс wistar (массой 200-250 г) произвольно разделили на 3 группы по 8-9 животных в каждой.
Аденокарциному толстой кишки индуцировали путем последовательной обработки (внутривенная инъекция) тринитробензолсульфокислотой (TNBS) и азоксиметаном (АОМ) согласно экспериментальной модели D'argenio et al. Gastroenterology 110, 1727-1734, 1996.
Тестируемые лекарственные вещества растворили в диметилсульфоксиде (DMSO), разбавленном 0,5% карбоксиметилцеллюлозой.
Опытным группам вводили соответственно дневную дозу аспирина (10 мг/кг) и эквимолярную дозу (18 мг/кг) NO-Asp-1.
Контрольной группе вводили носитель.
Обработка TNBS и АОМ длилась 28 дней. Продолжали пероральное введение лекарственных веществ. Через шесть недель после окончания эксперимента животных умертвили сверхдозой пентобарбитала. Затем путем проведения лапаротомии полностью извлекли толстую кишку.
После промывки 0,9% рассолом толстую кишку зашили по обоим концам шелковой нитью и заполнили 10% формалином с фосфатным буфером (рН 7,4). Через 2 часа препарат толстой кишки вскрыли путем разрезания вдоль мезентериальной границы и закрепили в распластанном состоянии. Затем погрузили слизистую оболочку толстой кишки в формалин.
После этой обработки и отмывки формалина ткани прокрасили 0,2% метиленовым синим в 0,9% рассоле. Через 15 минут ткани извлекли и исследовали количество ACF во всем препарате толстой кишки, используя препаровальную лупу с 40-кратным увеличением. ACF четко определяли в виде аномально расширенных углублений с множеством соседних углублений, которые часто кажутся соприкасающимися.
Введение TNBS и АОМ в контрольной группе привело к развитию широко распространенного образования предраковых клеток по периферии толстой кишки.
Данные представлены в таблице 9, где число ACF клеток, развившихся в толстой кишке животных контрольной группы, было принято за 100%. Из таблицы 9 видно, что NO-Asp-1 эффективнее, чем аспирин, предотвращает злокачественное повреждение толстой кишки.
ЭКСПЕРИМЕНТЫ 2-А) И 2-В)
Исследование антипролиферативной активности соединений по изобретению в раковых клетках in vitro
Эксперимент 2-А)
Клетки аденокарциномы человека (НТ29), взятые из толстой кишки, пораженной раком, перенесли на планшеты с 24 лунками, содержащими клеточную культуральную среду, состоящей из 10% фетальной бычьей сыворотки, пенициллина (50 ед./мл), трептомицина (50 мг/мл) и PEG 400 (полиэтиленгликоля).
В тесте использовали следующие соединения:
3-(нитроксиметил)фениловый эфир 2-(ацетилокси)бензойной кислоты,
соединение было получено в соответствии с примером 1 WO 00/44705 (NO-Asp-1),
4-(нитроксиметил)фениловый эфир 2-(ацетилокси)бензойной кислоты,
соединение было получено в соответствии с примером 3 WO 00/44705 (NO-Asp-2),
2-(нитроксиметил)фениловый эфир 2-(ацетилокси)бензойной кислоты,
соединение было получено в соответствии с примером 2 WO 00/44705 (NO-Asp-3),
аспирин.
Через 24 часа в часть планшетов инокулировали тестируемые соединения, растворенные в носителе (PEG 400). Через 96 часов после инокуляции соединений измерили клеточный рост при помощи гемоцитометра. Результаты, представленные в таблице 10, выражены в процентах клеточной пролиферации по отношению к контролю.
Полученные результаты свидетельствуют о том, что соединения по изобретению являются намного более эффективными ингибиторами пролиферации раковых клеток, чем соответствующие исходные соединения.
Эксперимент 2-В)
В данном эксперименте использовали (4-нитрокси)бутиловый эфир флурбипрофена (NO-флурбипрофен) и флурбипрофен в качестве справочного соединения.
(4-Нитрокси)бутиловый эфир флурбипрофена был получен в соответствии с примером 1 WO 94/12463.
Клеточные линии аденокарциномы толстой кишки человека НТ-29 и НСТ-15 (American Type Culture Collection) выращивали в виде монослоев в средах McCoy 5A и RPMI 1640 соответственно с добавлением 10% фетальной телячьей сыворотки (FCS), пенициллина (50 ед./мл) и стрептомицина (50 мг/мл). Клетки рассевали с плотностью 1,5 миллионов клеток/100 см2 культуральной чашки и инкубировали при 37°С в атмосфере с 5% СО2 и при относительной влажности 90%. Суспензии одиночных клеток получали при помощи трипсинизации (0,05% трипсин/EDTA) и подсчитывали клетки с использованием гемоцитометра.
Жизнеспособность определяли с помощью метода исключения красителя триптанового синего.
Тестируемые соединения растворяли в растворе диметилсульфоксида (DMSO). Все соединения добавляли в культуральную среду перед посевом. Конечная концентрация DMSO во всех средах была доведена до 1%.
В контрольную группу добавляли соответствующее количество DMSO.
NO-флурбипрофен более эффективно снижал число клеток НТ-29 в культуре, чем флурбипрофен. Аналогичные результаты были получены для клеток НСТ-15.
Через 28 часов после инкубации с тестируемыми соединениями клетки подсчитывали при помощи гемоцитометра. В таблице 11 представлены полученные результаты, выраженные в процентах клеточного роста по сравнению с контрольной группой.
Реферат
Изобретение относится к новому средству для лечения желудочно-кишечных опухолей. Описываются средства для лечения желудочно-кишечных опухолей, имеющие соединения общей формулы:
A-X1-NO2
или их соли, где А = RCO(X)t, где t представляет собой целое число 0 или 1; Х = О; R выбирают из групп IA), IIA), IIIA), IVA), VA), VIA), таких как указано в формуле изобретения; X1 в формуле A-X1-NO2 является двухвалентным связующим мостиком, выбранным из следующего: -YO-, где Y является линейным или когда возможно разветвленным C1-С20алкиленом, предпочтительно имеющим от 2 до 5 атомов углерода, или возможно замещенным циклоалкиленом, имеющим от 5 до 7 атомов углерода;

где n3 является целым числом от 0 до 3;


где nf′ является целым числом от 1 до 6, предпочтительно от 2 до 4;

где R1f = H, СН3 и nf является целым числом от 1 до 6, предпочтительно от 2 до 4. Технический результат - предложено новое лекарственное средство для лечения желудочно-кишечных опухолей. 1 з.п. ф-лы, 11 табл.
Формула














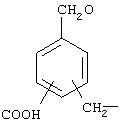



Комментарии