Композиции и способы лечения желудочно-кишечных полипов - RU2749188C2
Код документа: RU2749188C2
Чертежи








Описание
ПРИОРИТЕТ
[0001] В настоящей заявке испрашивается преимущество предварительной заявки на выдачу патента Индии № 201641038684, поданной 11 ноября 2016 года, полное раскрытие которой предназначено для всех целей и включено в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее раскрытие в целом относится к соединениям и композициям для лечения желудочно-кишечных полипов. Более конкретно, настоящее изобретение относится к лечению субъектов фармацевтически приемлемой дозой соединений, кристаллов, сольватов, энантиомера, стереоизомера, сложных эфиров, солей, гидратов, пролекарств или их смесей.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0003] Семейный аденоматозный полипоз (FAP) составляет примерно 1% от всех диагнозов опухолей толстой кишки. Заболевание встречается de novo с частотой приблизительно от 1:8000 до 1:10000 новорожденных, и возраст проявления заболевания довольно значительно варьирует даже между братьями и сестрами.
[0004] Симптомы FAP возникают раньше, чем при наиболее распространенной наследственной предрасположенности к колоректальному раку, синдрому Линча, и обычно начинают проявляться на втором десятилетии жизни. Сообщалось о пациентах возрастом всего 5 лет, и в группе наших наиболее младших пациентов одному было всего 3 года на момент постановки диагноза полипы. Ген APC представляет собой ген-супрессор опухолей, который вовлечен в контроль β-катенина. Потеря функции APC приводит к конститутивной активации β-катенина, что в итоге приводит к пролиферации клеток.
[0005] В настоящее время пациентов с риском развития заболевания обследуют сигмоидоскопией каждые 12 месяцев, начиная с пубертатного периода. Она позволяет обнаружить симптомы задолго до развития инвазивного новообразования. После появления полипов единственной эффективной мерой предупреждения возникновения злокачественного заболевания является хирургическое удаление всей толстой кишки и прямой кишки. Профилактическая колэктомия, проводимая в соответствующем возрасте, продлевает среднюю продолжительность жизни пациентов с FAP в среднем с 45 до свыше 60 лет.
[0006] Для пациентов с FAP была предложена химиопрофилактика с применением NSAID. Первым лекарственным средством, который показал свою эффективность при FAP, был сулиндак. При долгосрочном применении данного лекарственного средства количество колоректальных аденом уменьшалось на >50% в толстой кишке, а также в прямой кишке пациентов после колэктомии, но не при полипозе двенадцатиперстной кишки. Тем не менее, сулиндак не предупреждает развитие аденом при FAP. Было обнаружено, что селективный ингибитор COX-2 (циклооксигеназы-2) под названием целекоксиб, ассоциируемый с меньшим количеством желудочно-кишечных побочных эффектов, чем в случае сулиндака, уменьшает количество колоректальных аденом на 28%, а также уменьшает количество аденом двенадцатиперстной кишки. Однако у пациентов, длительно принимавших другой селективный ингибитор СОХ-2 (рофекоксиб), были описаны сердечно-сосудистые эффекты (инфаркт миокарда или инсульт), и, следовательно, роль этих лекарственных средство остается спорной, и их следует рассматривать только для отдельных пациентов без факторов риска развития сердечно-сосудистых эффектов.
[0007] В настоящее время в области техники существует потребность в новых композициях для лечения или отсрочки появления желудочно-кишечных полипов и прогрессирования связанных с ними осложнений.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] Настоящим изобретением предложены соединения, композиции, содержащие эти соединения, и способы их применения для лечения, предупреждения и/или облегчения эффектов таких патологических состояний, как желудочно-кишечные полипы.
[0009] Настоящим изобретением предложены композиции, содержащие соединение с формулой I или его фармацевтически приемлемые соли. Настоящим изобретением также предложены фармацевтические композиции, содержащие одно или несколько соединений с формулой I или их промежуточные продукты и один или несколько фармацевтически приемлемых носителей, сред для лекарств или разбавителей. Эти композиции можно применять при лечении желудочно-кишечных полипов и связанных с ними осложнений.

Формула I
[0010] В определенных вариантах осуществления настоящее изобретение относится к соединениям с формулой I и содержащим их композициям или их фармацевтически приемлемым солям

Формула I
и их фармацевтически приемлемым солям, гидратам, сольватам, пролекарствам, энантиомерам и стереоизомерам;
[0011] где
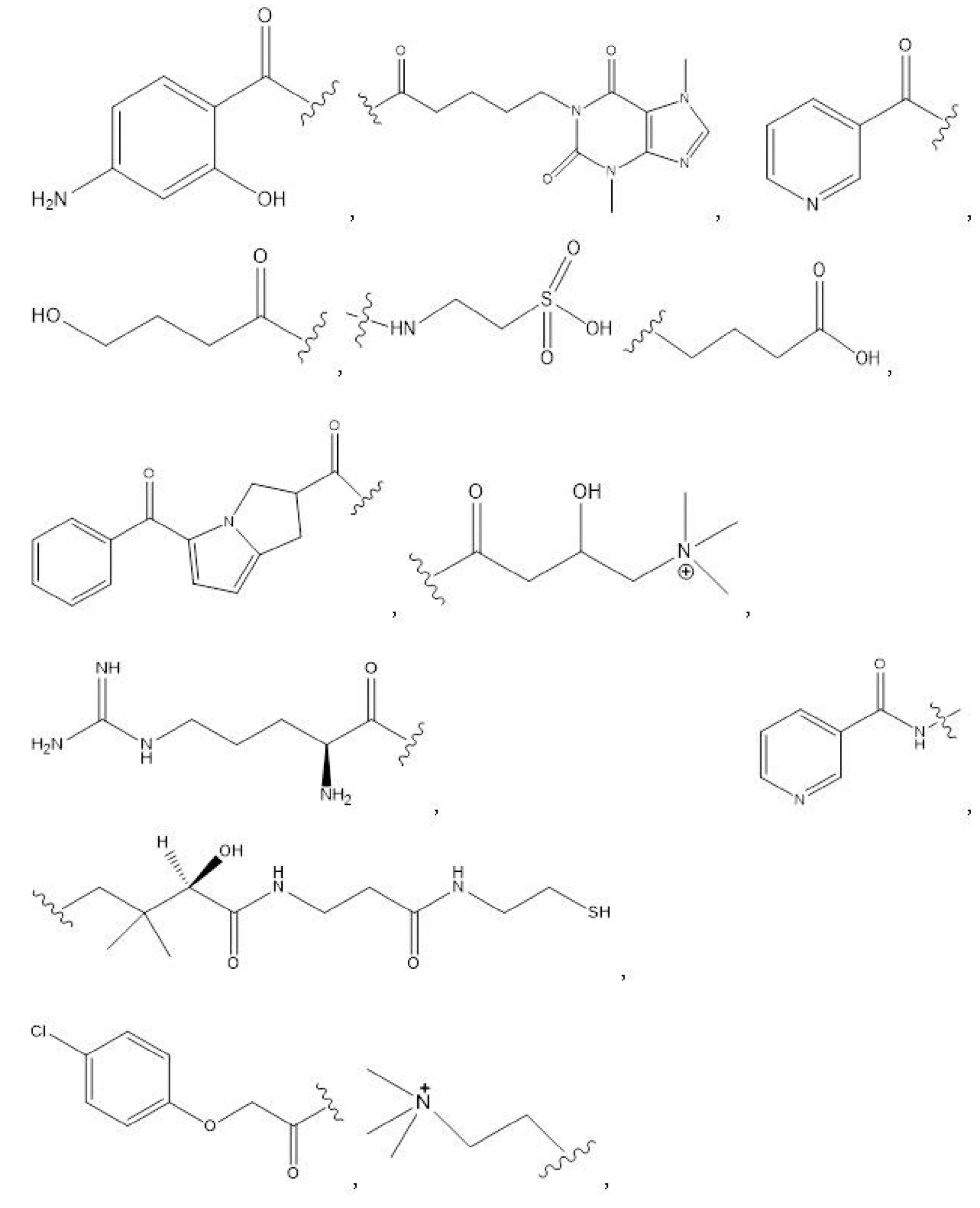
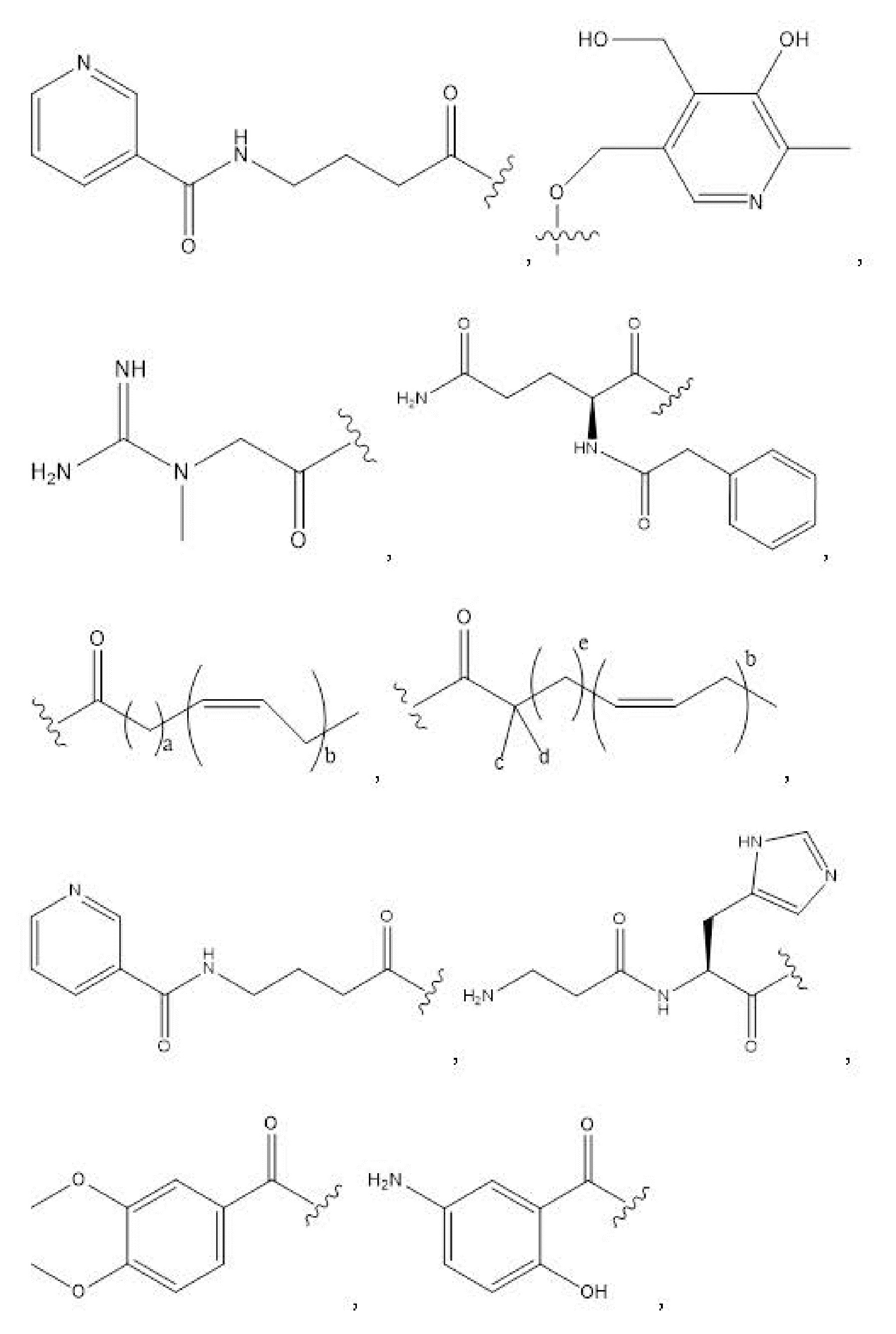
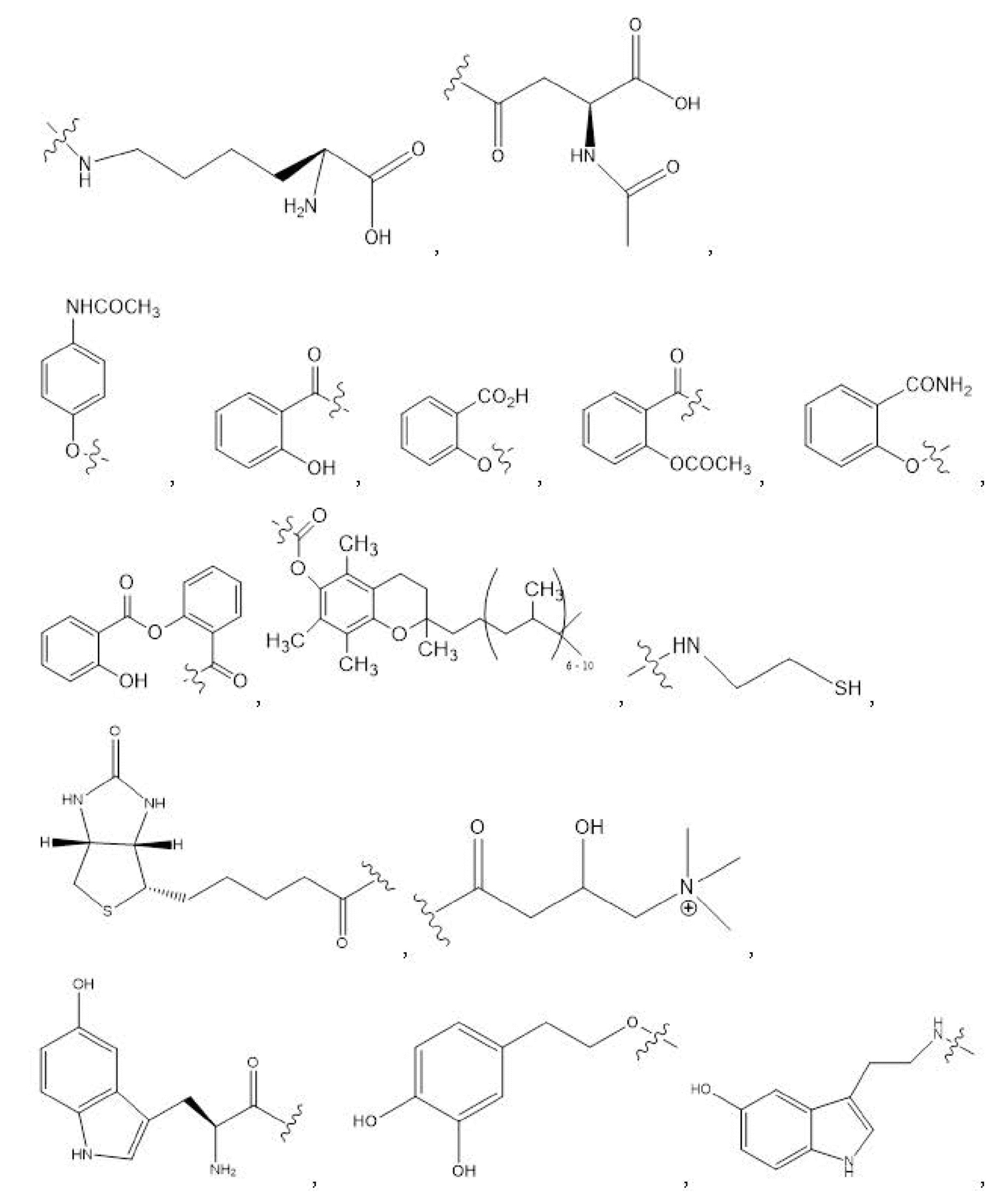
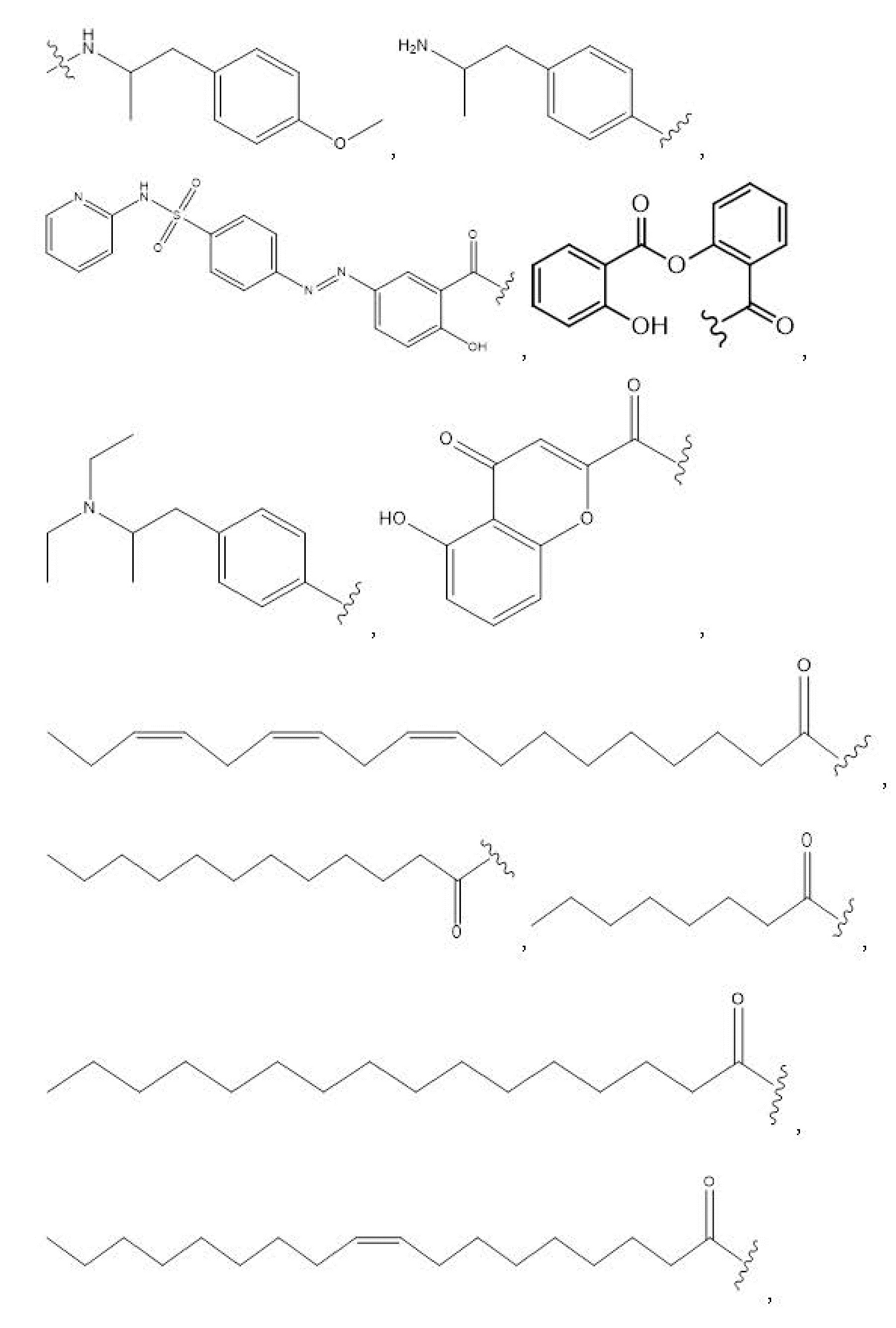
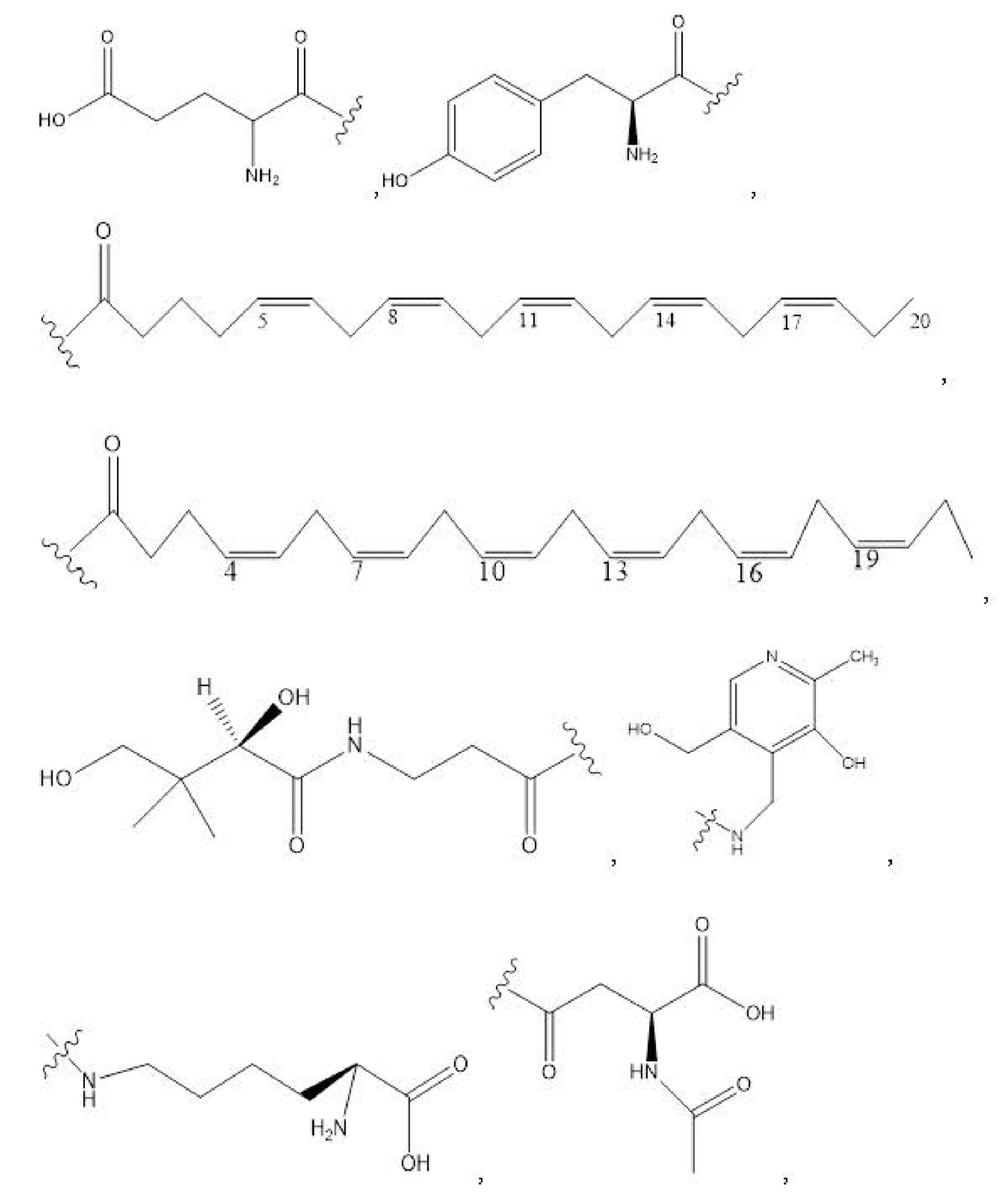
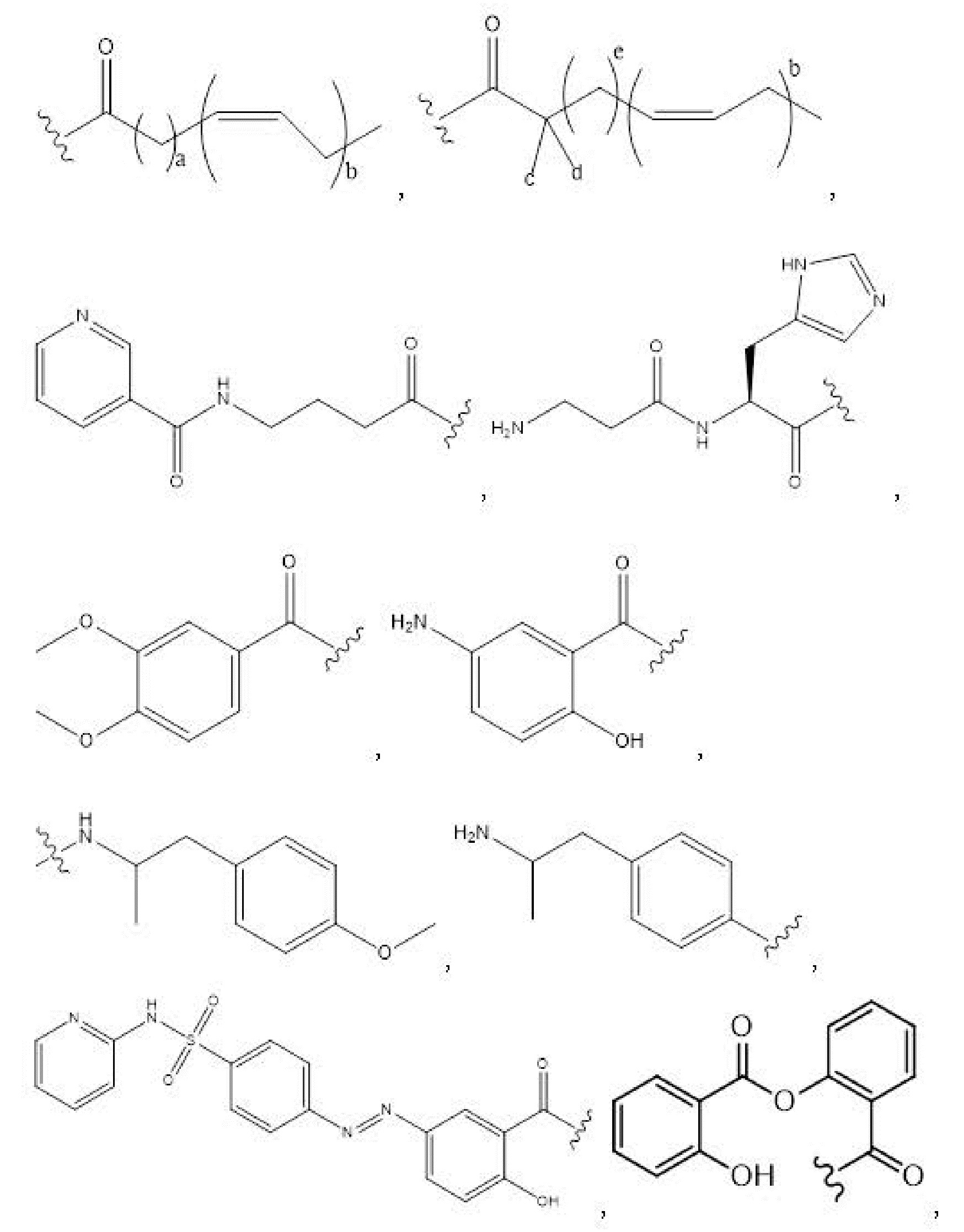
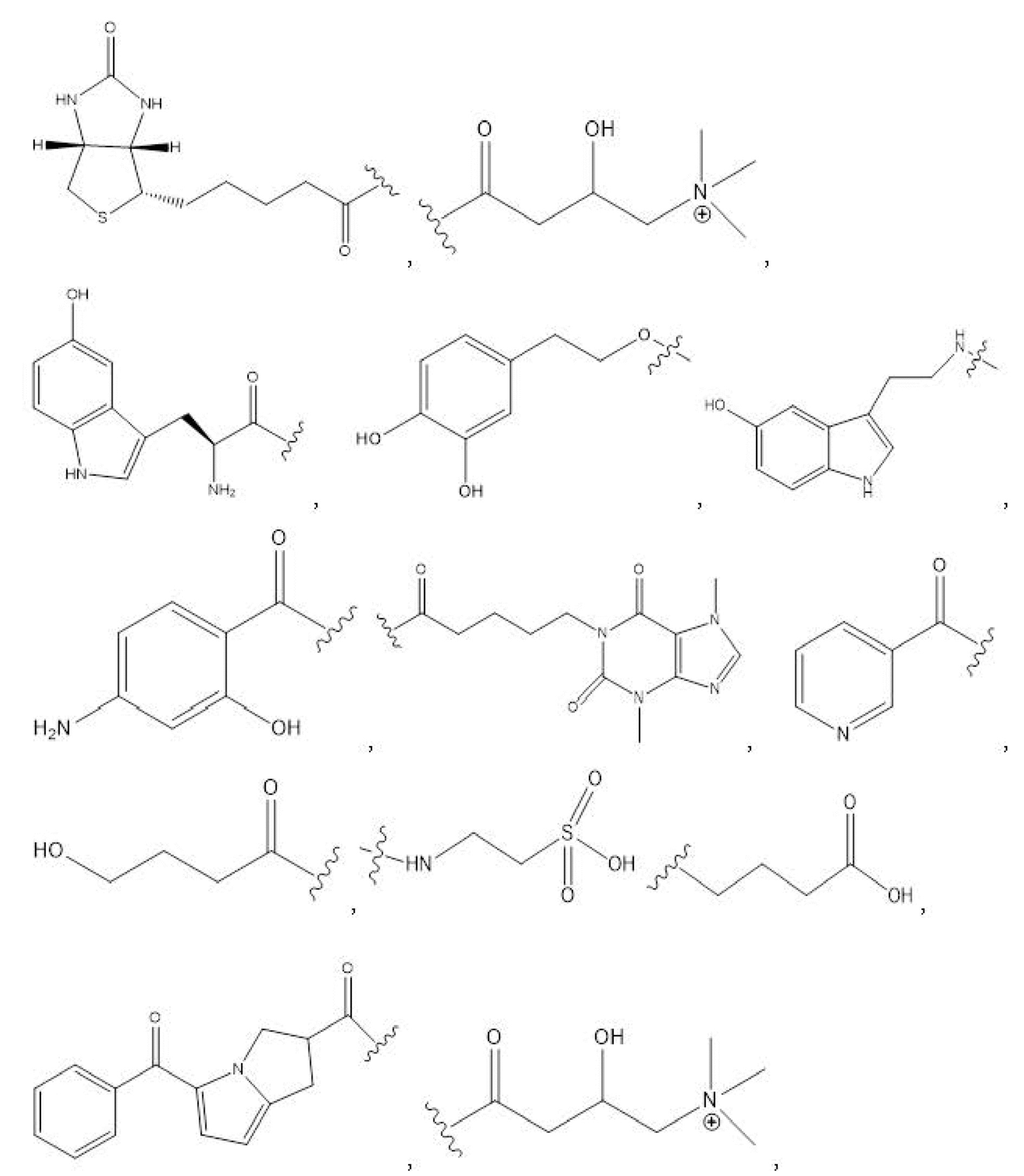
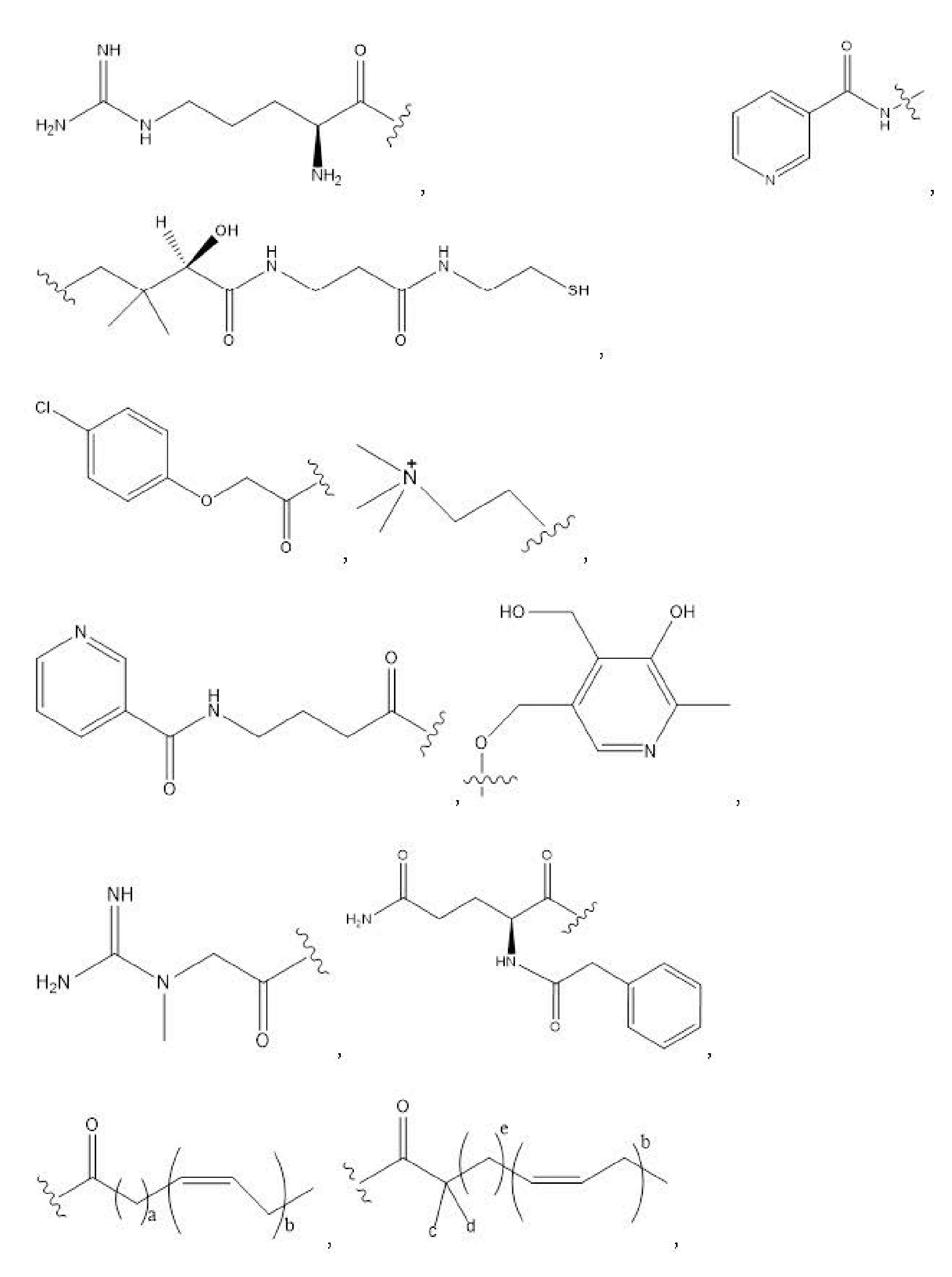
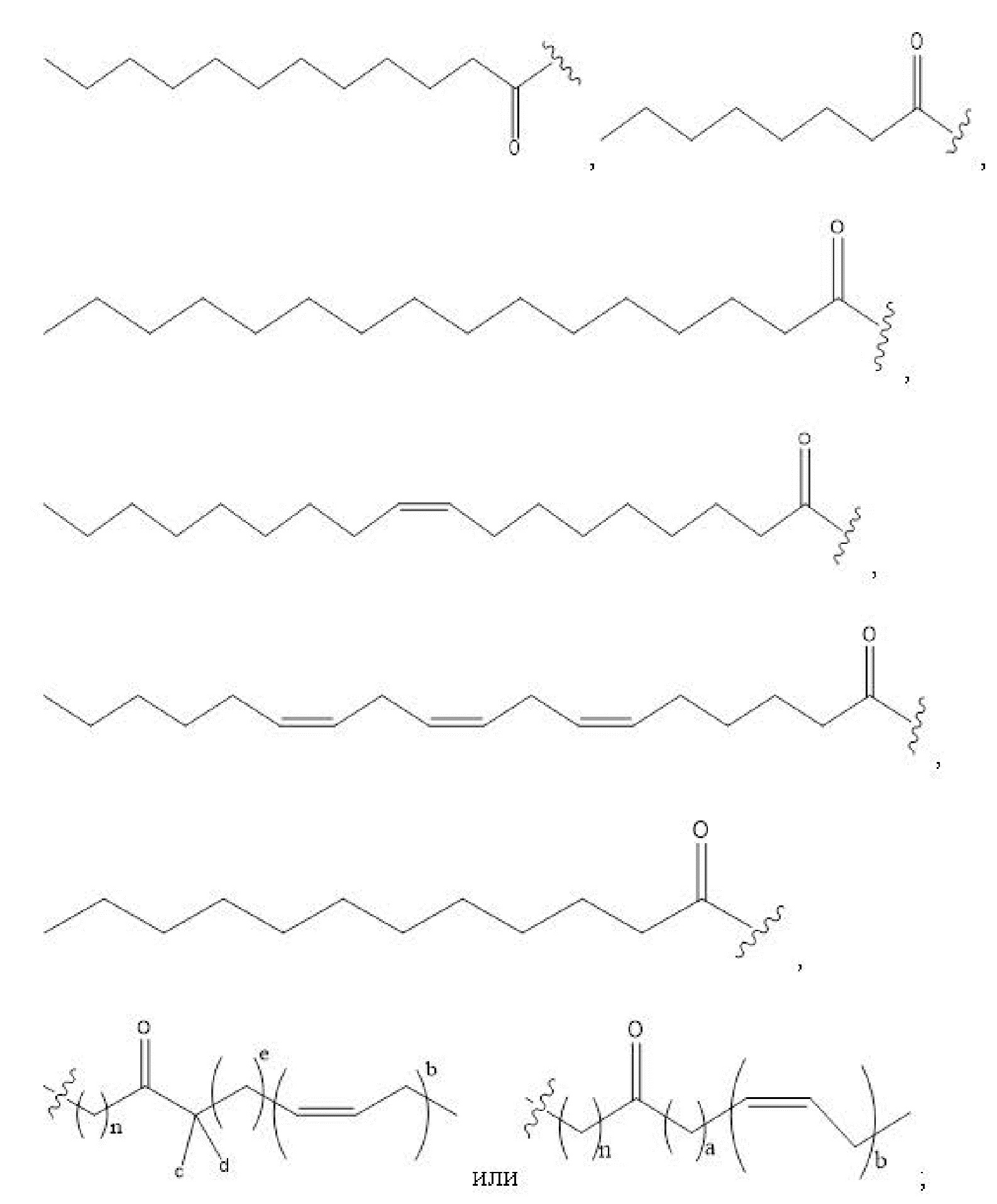
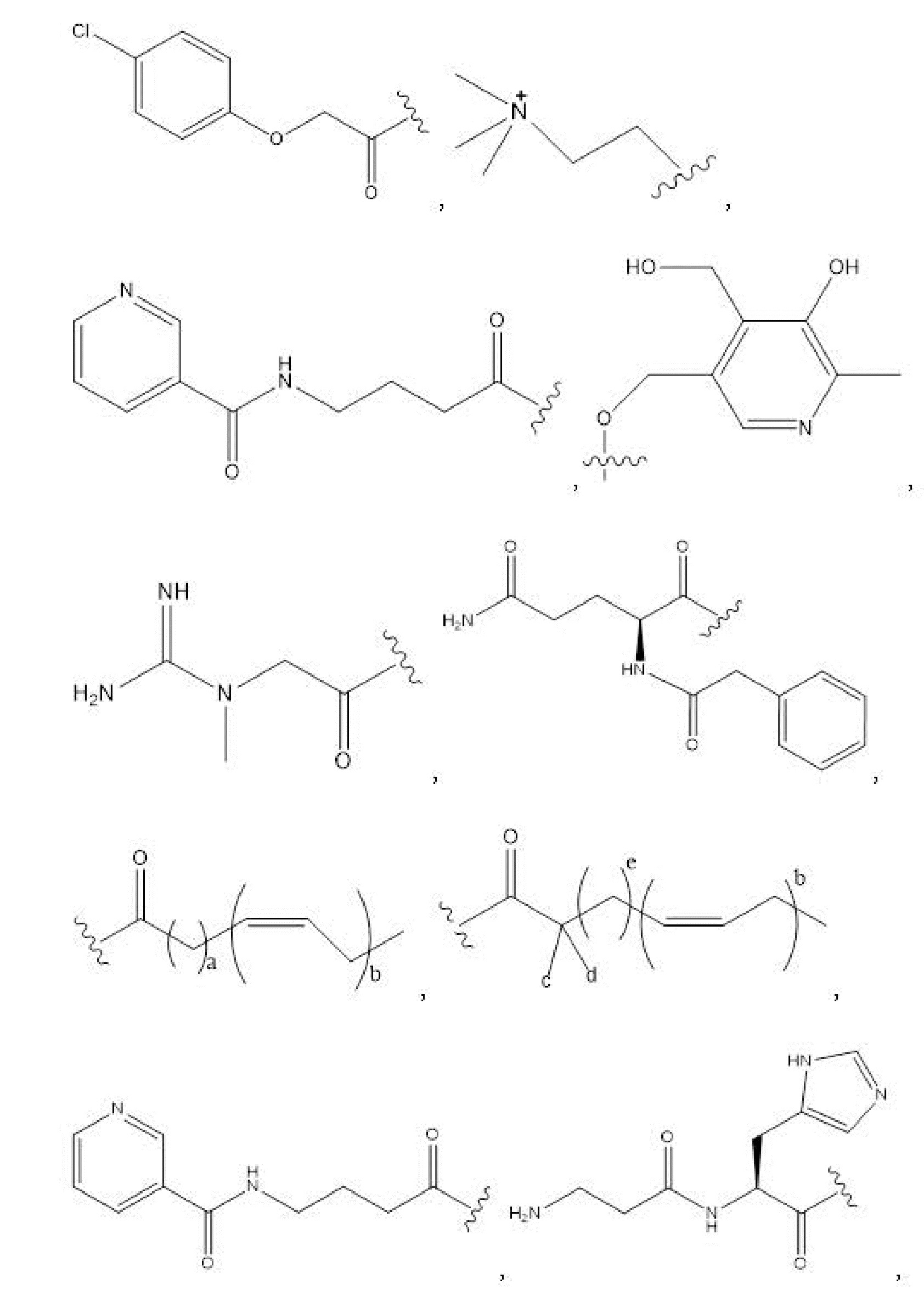
R1, R3, R5 отсутствуют,
каждый из R2, R4, R6 независимо представляет собой
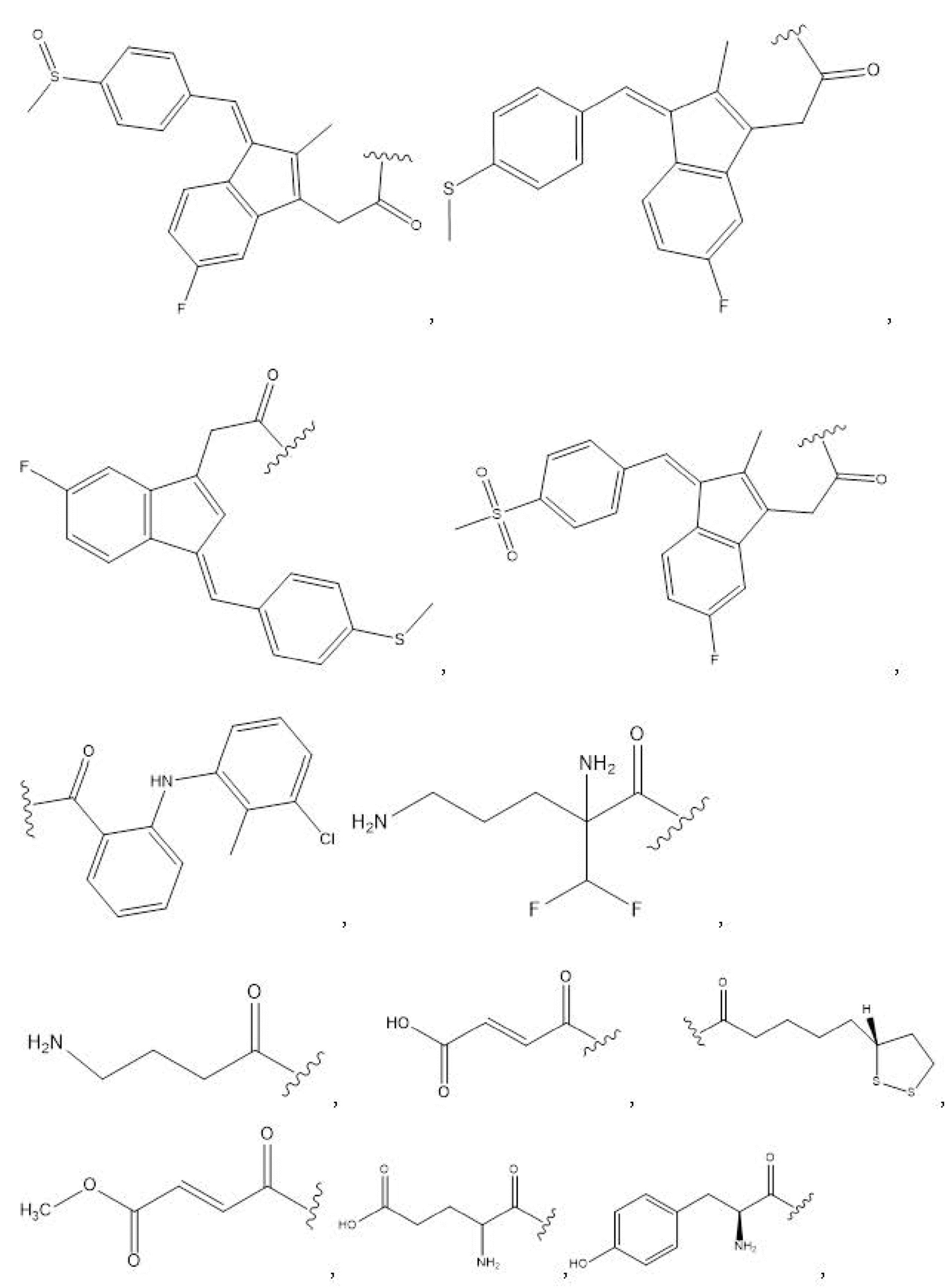
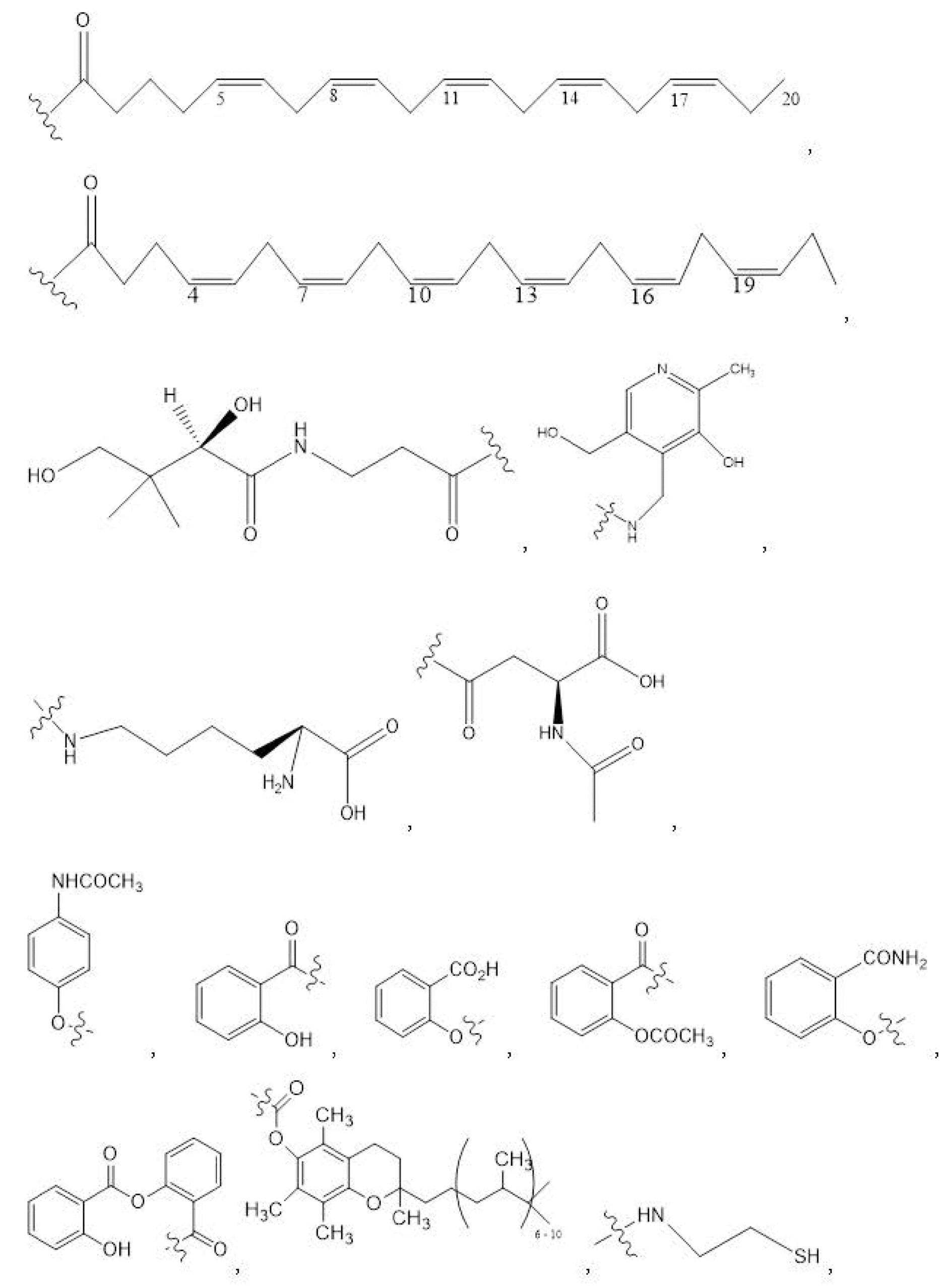
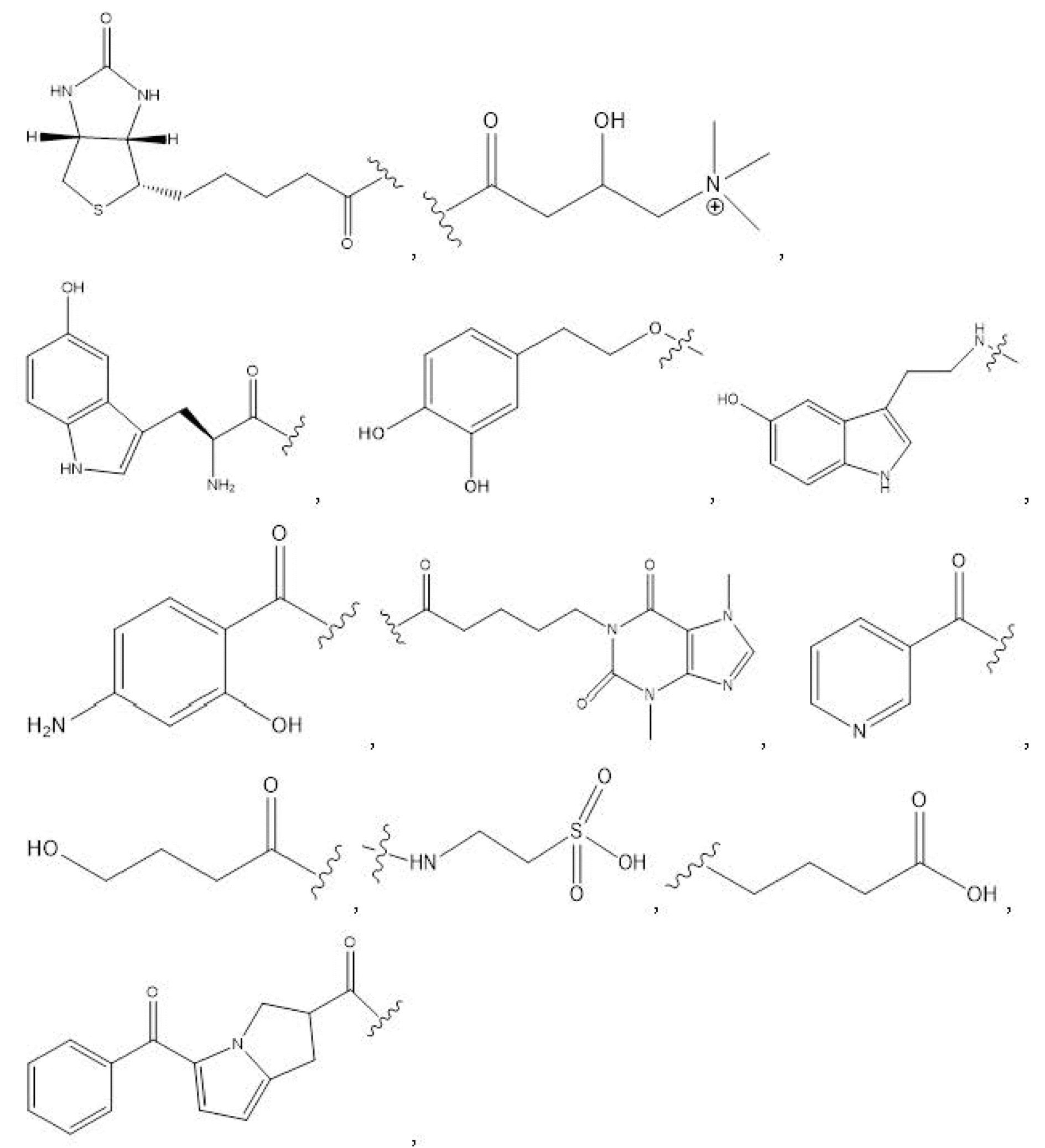


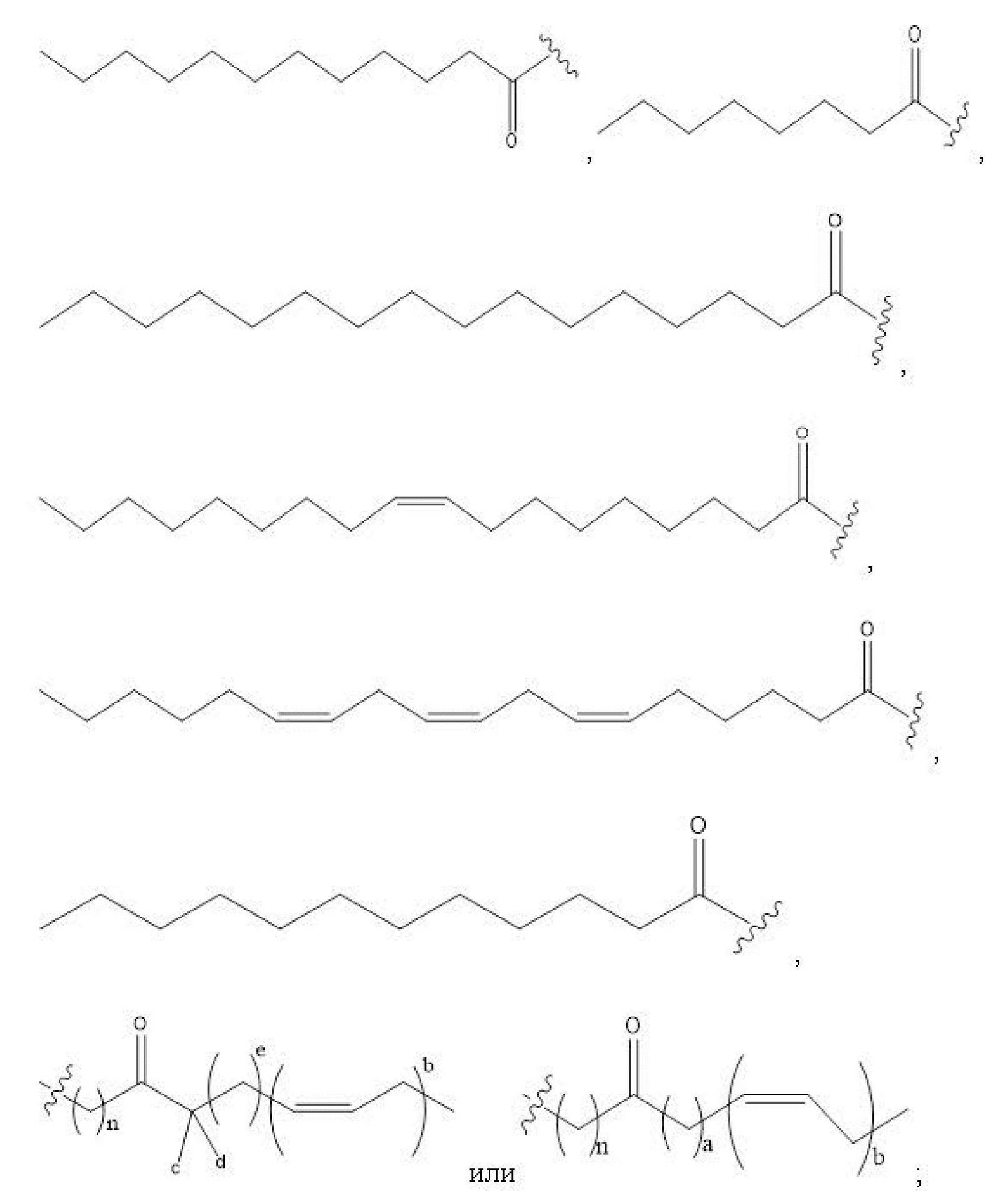
n независимо равен 1, 2, 3, 4 или 5;
a независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
e независимо равен 1, 2 или 6;
каждый из c и d независимо представляет собой H, D, -OH, -OD, C1-C6-алкил, -NH2 или -COCH3.
[0012] В определенных вариантах осуществления описаны соединения с формулой II:

Формула II
и их фармацевтически приемлемые соли, гидраты, сольваты, пролекарства, энантиомеры и стереоизомеры;
[0013] где
R1 отсутствует,
R2 независимо представляет собой




n независимо равен 1, 2, 3, 4 или 5;
a независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
e независимо равен 1, 2 или 6;
каждый из c и d независимо представляет собой H, D, -OH, -OD, C1-C6-алкил, -NH2 или -COCH3.
[0014] В определенных вариантах осуществления описаны соединения с формулой III:

Формула III
и их фармацевтически приемлемые соли, гидраты, сольваты, пролекарства, энантиомеры и стереоизомеры;
[0015] где
R1 отсутствует,
R2 независимо представляет собой




n независимо равен 1, 2, 3, 4 или 5;
a независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
e независимо равен 1, 2 или 6;
каждый из c и d независимо представляет собой H, D, -OH, -OD, C1-C6-алкил, -NH2 или -COCH3.
[0016] В определенных вариантах осуществления описаны соединения с формулой IV:

Формула IV
и их фармацевтически приемлемые соли, гидраты, сольваты, пролекарства, энантиомеры и стереоизомеры;
[0017] где
R1 отсутствует,
R2 независимо представляет собой




n независимо равен 1, 2, 3, 4 или 5;
a независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
e независимо равен 1, 2 или 6;
каждый из c и d независимо представляет собой H, D, -OH, -OD, C1-C6-алкил, -NH2 или -COCH3.
[0018] В определенных вариантах осуществления описаны соединения с формулой V:
Формула V
и их фармацевтически приемлемые соли, гидраты, сольваты, пролекарства, энантиомеры и стереоизомеры;
[0019] где
R1отсутствует,
R2 независимо представляет собой



n независимо равен 1, 2, 3, 4 или 5;
a независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
e независимо равен 1, 2 или 6;
каждый из c и d независимо представляет собой H, D, -OH, -OD, C1-C6-алкил, -NH2 или -COCH3.
[0020] В определенных вариантах осуществления описаны соединения с формулой VI:

Формула VI
и их фармацевтически приемлемые соли, гидраты, сольваты, пролекарства, энантиомеры и стереоизомеры;
[0021] где
R1, R3 отсутствуют,
R2, R4 независимо представляет собой





n независимо равен 1, 2, 3, 4 или 5;
a независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
e независимо равен 1, 2 или 6;
каждый из c и d независимо представляет собой H, D, -OH, -OD, C1-C6-алкил, -NH2 или -COCH3.
[0022] В настоящей заявке также предложен набор, содержащий любую из раскрытых в настоящем документе фармацевтических композиций. Набор может содержать инструкции по применению при лечении желудочно-кишечных полипов или связанных с ними осложнений.
[0023] В настоящей заявке также раскрыта фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и любую из описанных в настоящем документе композиций. В некоторых аспектах фармацевтическая композиция составлена для системного введения, перорального введения, замедленного высвобождения, парентерального введения, инъекции, подкожного введения или трансдермального введения.
[0024] В настоящей заявке дополнительно предложены наборы, содержащие описываемые в настоящем документе фармацевтические композиции. Наборы могут дополнительно содержать инструкции по применению при лечении желудочно-кишечных полипов или связанных с ними осложнений.
[0025] Описываемые в настоящем документе композиции имеют несколько назначений. В настоящей заявке предложены, например, способы лечения пациента, страдающего желудочно-кишечными полипами или связанными с ним осложнениями, которые развились на фоне метаболических или генетических патологических состояний или нарушений, желудочно-кишечными полипами, хроническими заболеваниями или нарушениями; нейродегенеративными нарушениями, гепатологическими, онкологическими, респираторными, гематологическими, ортопедическими, сердечно-сосудистыми, почечными, кожными, сосудистыми или глазными осложнениями.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Варианты осуществления настоящего изобретения далее будут описаны в сочетании с прилагаемыми фигурами, на которых:
На фиг.1 представлены спектры ЯМР соединения CLX-SYN-G157-C01 примера 1.
На фиг.2 представлены спектры ЯМР соединения CLX-SYN-G157-C01 примера 1.
На фиг.3 представлены спектры ЯМР соединения CLX-SYN-G157-C03 примера 2.
На фиг.4 представлены спектры ЯМР соединения CLX-SYN-G157-C03 примера 2.
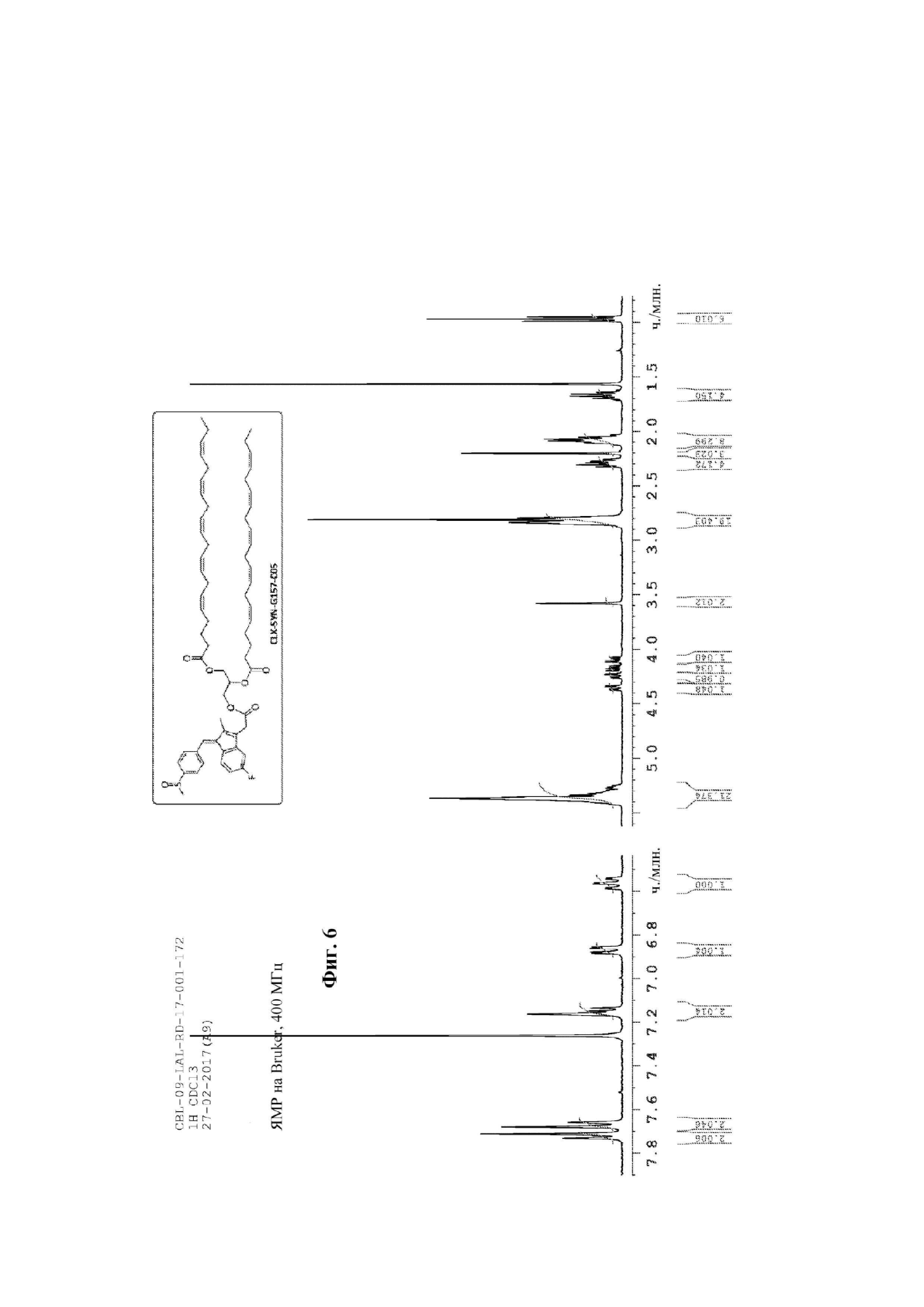
На фиг. 5 представлены спектры ЯМР соединения CLX-SYN-G157-C05 примера 3.
На фиг. 6 представлены спектры ЯМР соединения CLX-SYN-G157-C05 примера 3.
На фиг. 7 представлены спектры ЯМР соединения CLX-SYN-G157-C06 примера 4.
На фиг. 8 представлены спектры ЯМР соединения CLX-SYN-G157-C06 примера 4.
На фиг. 9 представлены спектры ЯМР соединения CLX-SYN-G157-C07 примера 5
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[0026] В контексте настоящего документа приведенные далее термины и фразы должны иметь изложенные ниже значения. Если не определено иное, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понимается рядовым специалистом в настоящей области техники.
[0027] Соединения по настоящему изобретению могут быть представлены в форме фармацевтически приемлемых солей. Соединения по настоящему изобретению также могут быть представлены в форме фармацевтически приемлемых сложных эфиров (т. е. метиловых и этиловых сложных эфиров кислот с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI для применения в качестве пролекарств). Соединения по настоящему изобретению также могут быть сольватированными, т. е. гидратированными. В ходе процесса получения соединение может подвергнуться сольватации, или, иными словами, сольватация может иметь место вследствие гигроскопических свойств первоначально безводного соединения с формулой I, формулой II, формулой III, формулой IV или формулой VI (гидратация).
[0028] Соединения, которые имеют одинаковую молекулярную формулу, но различаются по природе или последовательности связывания их атомов или расположению их атомов в пространстве, называются «изомерами». Изомеры, которые различаются по расположению их атомов в пространстве, называются «стереоизомерами». Диастереомеры представляют собой стереоизомеры с противоположной конфигурацией в одном или нескольких хиральных центрах, которые не являются энантиомерами. Стереоизомеры, которые несут один или несколько центров асимметрии и не являются совпадающими при наложении друг на друга зеркальными изображениями, называются «энантиомерами». Если соединение имеет центр асимметрии, например, если атом углерода связан с четырьмя различными группами, возможна пара энантиомеров. Энантиомер может характеризоваться абсолютной конфигурацией его центра или центров асимметрии и описывается правилами R- и S-последовательности Кана, Ингольда и Прелога или способом, при котором молекула вращает плоскость поляризованного света и обозначается как правовращающая или левовращающая (т. е. как (+)- или (-)-изомеры соответственно). Хиральное соединение может существовать в виде отдельного энантиомера или в виде их смеси. Смесь, содержащая равные доли энантиомеров, называется «рацемической смесью».
[0029] В контексте настоящего документа термин «метаболическое патологическое состояние» обозначает врожденные нарушения метаболизма (или генетические метаболические патологические состояния), которые являются генетическими нарушениями, возникающими в результате дефекта одного или нескольких метаболических путей, в частности, нарушена функция фермента, и она либо недостаточная, либо полностью отсутствует.
[0030] Используемый в настоящем документе термин «полиморф» известен в настоящей области техники и относится к одной кристаллической структуре данного соединения.
[0031] В контексте настоящего документа фразы «парентеральное введение» и «вводимый парентерально» относятся к способам введения, отличным от энтерального и местного введения, таким как инъекции, и включают без ограничения внутривенную, внутримышечную, внутриплевральную, внутрисосудистую, внутриперикардиальную, внутриартериальную, интратекальную, внутрикапсулярную, внутриорбитальную, внутрисердечную, интрадермальную, внутрибрюшинную, транстрахеальную, подкожную, внутрикожную, внутрисуставную, субкапсулярную, субарахноидальную, внутриспинальную и интрастернальную инъекцию и инфузию.
[0032] «Пациент», «субъект» или «организм», подлежащий лечению с помощью рассматриваемого способа, может означать либо человека, либо отличного от человека животного, такого как приматы, млекопитающие и позвоночные.
[0033] Фраза «фармацевтически приемлемый» является общепринятой в настоящей области техники. В определенных вариантах осуществления этот термин включает композиции, полимеры и другие материалы и/или лекарственные формы, которые, с медицинской точки зрения, подходят для применения с приведением в контакт с тканями млекопитающих, людей и животных без чрезмерной токсичности, раздражения, аллергического ответа или другой проблемы или осложнения, в соответствии с разумным соотношением польза/риск.
[0034] Фраза «фармацевтически приемлемый носитель» является общепринятой в данной области техники и включает, например, фармацевтически приемлемые материалы, композиции или среды для лекарств, такие как жидкий или твердый наполнитель, разбавитель, растворитель или инкапсулирующий материал, участвующий в переносе или транспортировке любой рассматриваемой композиции из одного органа или одной части тела в другой орган или в другую часть тела. Каждый носитель должен быть «приемлемым» в смысле того, что быть совместимым с другими ингредиентами рассматриваемой композиции и не причинять вреда пациенту. В определенных вариантах осуществления фармацевтически приемлемый носитель является апирогенным. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) какао-масло и разновидности воска для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные средства, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатные буферные растворы и (21) другие нетоксичные совместимые вещества, используемые в фармацевтических составах.
[0035] Термин «пролекарство» подразумевают как охватывающий соединения, которые в физиологических условиях превращаются в терапевтически активные средства по настоящему изобретению. Стандартный способ получения пролекарства заключается во включении выбранных фрагментов, которые гидролизируются в физиологических условиях с высвобождением требуемой молекулы. В других вариантах осуществления пролекарство превращается под действием ферментативной активности принимающего его животного.
[0036] Термин «профилактическое или терапевтическое» лечение известен в настоящей области техники и включает введение в организм одной или нескольких рассматриваемых композиций. Если ее вводят до клинического проявления нежелательного патологического состояния (например, заболевания или другого нежелательного патологического состояния у принимающего его животного), тогда лечение является профилактическим, т. е. оно защищает организм от развития нежелательного патологического состояния, тогда как если ее вводят после проявления нежелательного патологического состояния, лечение является терапевтическим (т. е. оно предназначено для уменьшения, облегчения или стабилизации существующего нежелательного патологического состояния или его побочных эффектов).
[0037] В контексте настоящего документа термин «прогнозирование» относится к оценке вероятности возникновения сопутствующих заболеваний, при которых пациент пострадает от аномалий или осложнения, и/или заболевания кишечника в терминальной стадии или недостаточности и/или смерти (т. е. летальности) в заданном временном интервале (прогностическом промежутке времени) в будущем. Летальность может быть обусловлена центральной нервной системой или осложнением. Прогностический промежуток времени представляет собой интервал, в котором у субъекта разовьется одно или несколько из указанных осложнений в соответствии с прогнозируемой вероятностью. Прогностический промежуток времени может занимать всю оставшуюся продолжительность жизни субъекта при анализе с помощью способа по настоящему изобретению.
[0038] Термин «лечение» известен в настоящей области техники и включает предупреждение возникновения заболевания, нарушения или патологического состояния у животного, которое может быть предрасположено к развитию заболевания, нарушения и/или патологического состояния, но у него еще не было диагностировано его наличие; подавление заболевания, нарушения или патологического состояния, например, препятствование его прогрессированию; и ослабление заболевания, нарушения или патологического состояния, например, индукцию регресса заболевания, нарушения и/или патологического состояния. Лечение заболевания или патологического состояния включает облегчение по меньшей мере одного симптома конкретного заболевания или патологического состояния, даже если не затрагивается лежащая в основе патофизиология, например, лечение связанных с метаболическим синдромом и диабетом нарушений, охватывает, например, полипы желудочно-кишечного тракта, такие как полипы фундальной железы, гиперпластические полипы, аденомы желудка (индуцированная интраэпителиальная неоплазия), желудочно-кишечные стромальные опухоли, воспалительные фиброзные полипы, нейроэндокринные опухоли желудка (карциноиды), синдром Банаяна - Райли - Рувалькаба, синдром Коудена, семейный аденоматозный полипоз, синдром юношеского полипоза, целиакия, синдром пониженного всасывания фруктозы, легкие инфекции, паразитарные инфекции, такие как лямблиоз, несколько воспалительных заболеваний кишечника, синдром пониженного всасывания желчных кислот, функциональный хронический запор, избыточный бактериальный рост в тонкой кишке и хроническая функциональная боль в животе, а также других сопутствующих заболеваний или любого другого медицинского патологического состояния, хорошо известно в настоящей области техники и предусматривает введение композиции, которая уменьшает частоту или позволяет отсрочить появление симптомов медицинского патологического состояния у субъекта относительно субъекта, который не получает данную композицию, у субъекта путем введения средства, даже если такое средство не лечит причину патологического состояния. Термин «проведение лечения», «лечить» или «лечение» в контексте настоящего документа включает в себя радикальное, превентивное (например, профилактическое), вспомогательное и паллиативное лечение.
[0039] Фраза «терапевтически эффективное количество» является известным в настоящей области техники термином. В определенных вариантах осуществления этот термин относится к количеству соли или композиции, которые раскрыты в настоящем документе, которое дает некоторый требуемый эффект при разумном соотношении польза/риск, применимом к любому медицинскому лечению. В определенных вариантах осуществления термин относится к такому количеству, которое необходимо или достаточно для устранения или уменьшения медицинских симптомов на некоторый период времени. Эффективное количество может варьировать в зависимости от таких факторов, как подвергаемое лечению заболевание или патологическое состояние, какие конкретные целевые конструкции вводят, размер субъекта или тяжесть заболевания или патологического состояния. Рядовой специалист в настоящей области техники может на основе собственного опыта определить эффективное количество конкретной композиции без необходимости постановки неоправданных экспериментов.
[0040] В определенных вариантах осуществления описанные в настоящем документе фармацевтические композиции составлены таким образом, чтобы указанные композиции доставлялись пациенту в терапевтически эффективном количестве как часть профилактического или терапевтического лечения. Требуемое количество подлежащей введению пациенту композиции будет зависеть от скорости всасывания, инактивации и выведения лекарственного средства, а также от скорости доставки солей и композиций из рассматриваемых композиций. Следует отметить, что значения дозировки также могут варьировать в зависимости от тяжести подлежащего смягчению патологического состояния. Дополнительно следует понимать, что для любого конкретного субъекта конкретные схемы приема необходимо корректировать с течением времени в соответствии с индивидуальной потребностью и профессиональным суждением лица, назначающего или контролирующего введение композиций. Как правило, вводимую дозу будут определять с помощью известных специалисту в настоящей области техники методик.
[0041] Кроме того, оптимальную концентрацию и/или нормы или количества любой конкретной соли или композиции можно скорректировать с учетом вариаций в параметрах лечения. К таким параметрам лечения относятся показание к применению, в связи с которым вводят такой препарат, например, подвергаемое лечению место, тип пациента, например человек или не человек, взрослый или ребенок, и природа заболевания или патологического состояния.
[0042] В определенных вариантах осуществления дозировку рассматриваемых композиций, представленных в настоящем документе, можно определить по концентрациям в плазме терапевтической композиции или других инкапсулированных материалов. Например, можно использовать максимальную концентрацию в плазме (Cmax) и площадь под кривой зависимости концентрации в плазме от времени от 0 до бесконечности.
[0043] При использовании в отношении фармацевтической композиции или другого материала термин «замедленное высвобождение» является известным в настоящей области техники. Например, рассматриваемая композиция, которая высвобождает вещество с течением времени, может обладать характеристиками замедленного высвобождения, в отличие от введения струйного типа, при котором все количество вещества одновременно становится биологически доступным. Например, в конкретных вариантах осуществления при контакте с жидкостями организма, в том числе кровью, спинномозговой жидкостью, слизистыми выделениями, лимфой или тому подобным, одно или несколько фармацевтически приемлемых вспомогательных веществ могут подвергаться постепенному или замедленному разложению (например, в результате гидролиза) с одновременным высвобождением любого включенного в него материала, например терапевтической и/или биологически активной соли и/или композиции, в течение длительного или продолжительного периода (по сравнению с высвобождением в результате струйного вливания). Это высвобождение может привести к пролонгированной доставке терапевтически эффективных количеств любого из раскрытых в настоящем документе терапевтических средств.
[0044] Фразы «системное введение», «вводимый системно», «периферическое введение» и «вводимый периферически» известны в настоящей области техники и включают введение рассматриваемой композиции, терапевтического или другого материала в месте, удаленном от очага подлежащего лечению заболевании. Введение средства от подвергаемого лечению заболевания, даже если средство впоследствии распределяется системно, можно назвать «локальным», или «местным», или «регионарным» введением, кроме случаев непосредственного введения в центральную нервную систему, например подкожным введением, таким, чтобы средство попадало в систему пациента и, следовательно, подвергалось метаболизму и другим подобным процессам.
[0045] Фраза «терапевтически эффективное количество» является известным в настоящей области техники термином. В определенных вариантах осуществления этот термин относится к количеству соли или композиции, которые раскрыты в настоящем документе, которое дает некоторый требуемый эффект при разумном соотношении польза/риск, применимом к любому медицинскому лечению. В определенных вариантах осуществления термин относится к такому количеству, которое необходимо или достаточно для устранения или уменьшения медицинских симптомов на некоторый период времени. Эффективное количество может варьировать в зависимости от таких факторов, как подвергаемое лечению заболевание или патологическое состояние, какие конкретные целевые конструкции вводят, размер субъекта или тяжесть заболевания или патологического состояния. Рядовой специалист в настоящей области техники может на основе собственного опыта определить эффективное количество конкретной композиции без необходимости постановки неоправданных экспериментов.
[0046] Настоящим раскрытием также предусмотрены пролекарства из раскрытых в настоящем документе композиций, а также фармацевтически приемлемые соли указанных пролекарств.
[0047] В настоящей заявке также раскрыта фармацевтическая композиция, содержащая фармацевтически приемлемый носитель, и композиция с соединением с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI может быть составлена для системного, или местного, или перорального введения. Фармацевтическая композиция также может быть составлена для перорального введения, в форме перорального раствора, для инъекции, подкожного введения или трансдермального введения. Фармацевтическая композиция может дополнительно содержать по меньшей мере одно из фармацевтически приемлемого стабилизатора, разбавителя, поверхностно-активного вещества, наполнителя, связующего и смазывающего вещества.
[0048] Во многих вариантах осуществления описанные в настоящем документе фармацевтические композиции будут включать раскрываемые соединения и композиции (с формулой I и формулой II) для доставки в количестве, достаточном для доставки пациенту терапевтически эффективного количества соединения с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI или композиции как части профилактического или терапевтического лечения. Требуемая концентрация соединения с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI или его фармацевтически приемлемых солей будет зависеть от скорости всасывания, инактивации и выведения лекарственного средства, а также от скорости доставки солей и композиций из рассматриваемых композиций. Следует отметить, что значения дозировки также могут варьировать в зависимости от тяжести подлежащего смягчению патологического состояния. Дополнительно следует понимать, что для любого конкретного субъекта конкретные схемы приема необходимо корректировать с течением времени в соответствии с индивидуальной потребностью и профессиональным суждением лица, назначающего или контролирующего введение композиций. Как правило, вводимую дозу будут определять с помощью известных специалисту в настоящей области техники методик.
[0049] Кроме того, оптимальную концентрацию и/или нормы или количества любого конкретного соединения с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI можно скорректировать с учетом вариаций в параметрах лечения. К таким параметрам лечения относятся показание к применению, в связи с которым вводят такой препарат, например, подвергаемое лечению место, тип пациента, например человек или не человек, взрослый или ребенок, и природа заболевания или патологического состояния.
[0050] Концентрацию и/или количество любого соединения с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI можно легко выявить с помощью стандартного скрининга на животных, например крысах, путем скрининга диапазона концентраций и/или количеств рассматриваемого материала с помощью соответствующих анализов. Также доступны известные способы анализа локальных концентраций в тканях, скоростей диффузии солей или композиций и локального кровотока до и после введения раскрываемых в настоящем документе терапевтических составов. Одним из таких способов является микродиализ, который рассмотрен у T. E. Robinson et al., 1991, Microdialysis in the Neurosciences, Techniques, volume 7, Chapter 1. Вкратце: способы, рассмотренные у Robinson, можно применять так, как описано далее. Петлю для микродиализа размещают in situ у тестируемого животного. Через петлю прокачивают диализирующий раствор. Если соединения с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI, такие как те, которые раскрыты в настоящем документе, вводить рядом с петлей, высвобождаемые лекарственные средства собираются в диализате пропорционально их локальной концентрации в тканях. Таким образом можно определить прогресс диффузии солей или композиций с помощью подходящих процедур калибровки с применением известных концентраций солей или композиций.
[0051] В определенных вариантах осуществления дозировку рассматриваемых соединений с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI, представленных в настоящем документе, можно определить по концентрациям в плазме терапевтической композиции или других инкапсулированных материалов. Например, можно использовать максимальную концентрацию в плазме (Cmax) и площадь под кривой зависимости концентрации в плазме от времени от 0 до бесконечности.
[0052] Как правило, при осуществлении способов, подробно раскрытых в настоящей заявке, эффективная дозировка соединений с формулой I находится в диапазоне от приблизительно 0,01 мг/кг/сутки до приблизительно 100 мг/кг/сутки в однократных или разделенных дозах, например, от 0,01 мг/кг/сутки до приблизительно 50 мг/кг/сутки в однократных или разделенных дозах. Соединения с формулой I можно вводить дозой, составляющей, например, менее 0,2 мг/кг/сутки, 0,5 мг/кг/сутки, 1,0 мг/кг/сутки, 5 мг/кг/сутки, 10 мг/кг/сутки, 20 мг/кг/сутки, 30 мг/кг/сутки или 40 мг/кг/сутки. Соединения c формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI также можно вводить пациенту-человеку дозой, составляющей, например, от 0,1 до 1000 мг, от 5 до 80 мг или менее 1,0, 9,0, 12,0, 20,0, 50,0, 75,0, 100, 300, 400, 500, 800, 1000, 2000, 5000 мг в сутки. В определенных вариантах осуществления представленные в настоящем документе композиции вводят в количестве, которое составляет менее 95%, 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20% или 10% соединения с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI от необходимого для того же терапевтического эффекта.
[0053] Эффективное количество описываемых в настоящем документе соединений с формулой I, формулой II, формулой III, формулой IV или формулой VI обозначает количество одной из указанных солей или композиций, которое способно подавлять или предупреждать развитие заболевания.
[0054] Эффективное количество может быть достаточным для воспрепятствования, лечения, смягчения, облегчения, остановки, сдерживания, замедления или обращения прогрессирования или уменьшения тяжести осложнения, возникающего в результате повреждения или демиелинизации нервов и/или повышенного количества активных окислительно-нитрозивных частиц и/или аномалий в гомеостазе нейромедиаторов, у пациентов с риском таких осложнений. В связи с этим такие способы предусматривают как терапевтическое (острое), так и/или профилактическое (превентивное) введение, в зависимости от конкретного случая. Количество и продолжительность приема вводимой композиций, конечно, будут зависеть от подвергаемого лечению субъекта, от тяжести болезни, способа введения и решения выписывающего назначение врача. Следовательно, из-за варьирования среди пациентов приведенные выше дозировки являются ориентировочными, и врач может подбирать дозы лекарственного средства для достижения лечения, которое врач считает подходящим для пациента. При рассмотрении требуемой степени лечения врач должен находить оптимальный вариант для ряда факторов, таких как возраст пациента, наличие ранее существовавшего заболевания, а также наличие других заболеваний.
[0055] Композиции, представленные в настоящей заявке, можно вводить нуждающемуся в лечении субъекту различными общепринятыми путями введения, в том числе пероральным, местным, парентеральным, например, внутривенным, подкожным или интрамедуллярным. Кроме того, композиции можно вводить интраназально, в виде ректального суппозитория или с использованием «быстрорастворимого» состава, т. е. позволяющего лекарственному препарату растворяться во рту без необходимости использования воды. Кроме того, композиции можно вводить нуждающемуся в лечении субъекту с помощью лекарственных форм с контролируемым высвобождением, сайт-специфической доставки лекарственного средства, трансдермальной доставки лекарственного средства, опосредованной пластырем (активной/пассивной) доставки лекарственного средства, стереотаксической инъекции или в наночастицах.
[0056] Композиции можно вводить отдельно или в комбинации с фармацевтически приемлемыми носителями, средами для лекарств или разбавителями либо однократной дозой, либо многократными дозами. К подходящим фармацевтическим носителям, средам для лекарств и разбавителям относятся инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Фармацевтические композиции, полученные путем объединения композиций и фармацевтически приемлемых носителей, сред для лекарств или разбавителей, затем легко вводят в различных лекарственных формах, таких как таблетки, порошки, пастилки, сиропы, инъекционные растворы и др. Такие фармацевтические композиции при необходимости могут содержать дополнительные ингредиенты, такие как ароматизаторы, связующие, вспомогательные вещества и др. Так, для перорального введения можно использовать таблетки, содержащие различные вспомогательные вещества, такие как L-аргинин, цитрат натрия, карбонат кальция и фосфат кальция, наряду с различными разрыхлителями, такими как крахмал, альгиновая кислота и некоторые комплексные силикаты, совместно со связующими средствами, такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. Кроме того, для таблетирования зачастую полезны смазывающие средства, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа также можно использовать в качестве наполнителей в мягких и твердых желатиновых капсулах. К подходящим для этого материалам относятся лактоза или молочный сахар и высокомолекулярные полиэтиленгликоли. Если для перорального введения необходимы водные суспензии или настойки, обязательный активный ингредиент в них можно объединить с различными подсластителями или ароматизаторами, красящими веществами или красителями и, при необходимости, эмульгирующими или суспендирующими средствами совместно с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и их комбинации. Соединения с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI также могут иметь энтеросолюбильное покрытие, содержащее различные вспомогательные вещества, которые хорошо известны в области фармацевтики.
[0057] Для парентерального введения растворы композиций можно приготовить (например) в кунжутном или арахисовом масле, водном пропиленгликоле или их можно использовать в стерильных водных растворах. Такие водные растворы должны быть надлежащим образом забуферены, при необходимости, а жидкий разбавитель сначала необходимо сделать изотоническим с помощью достаточного количества солевого раствора или глюкозы. Эти конкретные водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. При этом все используемые стерильные водные среды можно легко получить с помощью стандартных методик, известных специалистам в настоящей области техники.
[0058] Составы, например таблетки, могут содержать, например, от 10 до 100, от 50 до 250, от 150 до 500 мг или от 350 до 800 мг, например, 10, 50, 100, 300, 500, 700, 800 мг соединений с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI, которые раскрыты в настоящем документе, например соединений с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI или фармацевтически приемлемых солей соединений с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI.
[0059] В большинстве случаев описываемую в настоящем документе композицию можно вводить перорально или парентерально (например, внутривенно, внутримышечно, подкожно или интрамедуллярно). Также может быть показано местное введение, например, если пациент страдает желудочно-кишечным нарушением, которое препятствуют пероральному введению, или если лекарственный препарат лучше всего наносить на поверхность ткани или органа, что устанавливается лечащим врачом. Также можно быть показано локализованное введение, например, если необходима высокая доза в целевой ткани или целевом органе. В случае трансбуккального введения активная композиция может иметь форму таблеток или пастилок, составленных традиционным способом.
[0060] Вводимая дозировка будет зависеть от характера неврологического заболевания; типа принимающего ее пациента, включая его возраст, состояние здоровья и масса тела; вида параллельного лечения, если таковое имеет место; частоты лечения и терапевтического индекса.
[0061] Для иллюстрации, уровни дозировки вводимых активных ингредиентов являются следующими: при внутривенном введении — от 0,1 до приблизительно 200 мг/кг; при внутримышечном — от 1 до приблизительно 500 мг/кг; при пероральном — от 5 до приблизительно 1000 мг/кг; при интраназальной инстилляции — от 5 до приблизительно 1000 мг/кг; и при введении в форме аэрозоля — от 5 до приблизительно 1000 мг/кг массы тела принимающего их пациента.
[0062] В пересчете на концентрацию активный ингредиент может присутствовать в композициях по настоящему изобретению для локального применения на коже, интраназального, глоточно-гортанного, бронхиального, интравагинального, ректального или глазного применения в концентрации от приблизительно 0,01 до приблизительно 50% мас./мас. композиции; предпочтительно от приблизительно 1 до приблизительно 20% мас./мас. композиции; и для парентерального применения — в концентрации от приблизительно 0,05 до приблизительно 50% мас./об. композиции и предпочтительно от приблизительно 5 до приблизительно 20% мас./об.
[0063] Композиции по настоящему изобретению предпочтительно представлены для введения людям и животным в стандартных лекарственных формах, таких как таблетки, капсулы, пилюли, порошки, гранулы, суппозитории, стерильные парентеральные растворы или суспензии, стерильные непарентеральные растворы суспензий и пероральные растворы или суспензии и др., содержащие подходящие нормы активного ингредиента. Для перорального введения можно получить либо твердые, либо жидкие стандартные лекарственные формы.
[0064] Как рассмотрено выше, ядро таблетки содержит один или несколько гидрофильных полимеров. К подходящим гидрофильным полимерам относятся без ограничения поддающиеся разбуханию в воде производные целлюлозы, полиалкиленгликоли, термопластичные полиалкиленоксиды, акриловые полимеры, гидроколлоиды, глины, гелеобразующие крахмалы, набухающие сшитые полимеры и их смеси. Примеры подходящих поддающихся разбуханию в воде производных целлюлозы включают без ограничения карбоксиметилцеллюлозу натрия, сшитую гидроксипропилцеллюлозу, гидроксипропилцеллюлозу (HPC), гидроксипропилметилцеллюлозу (HPMC), гидроксиизопропилцеллюлозу, гидроксибутилцеллюлозу, гидроксифенилцеллюлозу, гидроксиэтилцеллюлозу (НЕС), гидроксипентилцеллюлозу, гидроксипропилэтилцеллюлозу, гидроксипропилбутилцеллюлозу и гидроксипропилэтилцеллюлозу, а также их смеси. Примеры подходящих полиалкиленгликолей включают без ограничения полиэтиленгликоль. Примеры подходящих термопластичных полиалкиленоксидов включают без ограничения полиэтиленоксид. Примеры подходящих акриловых полимеров включают без ограничения сополимер метакрилата калия и дивинилбензола, полиметилметакрилат, высокомолекулярные сшитые гомополимеры акриловой кислоты и такие сополимеры, которые коммерчески доступны от компании Noveon Chemicals под торговым названием CARBOPOLTM. Примеры подходящих гидроколлоидов включают без ограничения альгинаты, агар, гуаровую камедь, камедь рожкового дерева, каппа-каррагинан, йота-каррагинан, камедь тары, гуммиарабик, трагакантовую камедь, пектин, ксантановую камедь, геллановую камедь, мальтодекстрин, галактоманнан, пусстулан, ламинарин, склероглюкан, гуммиарабик, инулин, пектин, желатин, велан, рамсан, зооглан, метилан, хитин, циклодекстрин, хитозан и их смеси. Примеры подходящих глин включают без ограничения смектиты, такие как бентонит, каолин и лапонит, трисиликат магния, алюмосиликат магния и их смеси. Примеры подходящих гелеобразующих крахмалов включают без ограничения кислотно-гидролизованные крахмалы, набухающие крахмалы, такие как натрия крахмалгликолат и его производные, а также их смеси. Примеры подходящих набухающих сшитых полимеров включают без ограничения сшитый поливинилпирролидон, сшитый агар и сшитую карбоксиметилцеллюлозу натрия, а также их смеси.
[0065] Носитель может содержать одно или несколько подходящих вспомогательных веществ для составления таблеток. Примеры подходящих вспомогательных веществ включают без ограничения наполнители, адсорбенты, связующие, разрыхлители, смазывающие вещества, вещества, способствующие скольжению, модифицирующие высвобождение вспомогательные вещества, суперразрыхлители, антиоксиданты и их смеси.
[0066] К подходящим связующим относятся без ограничения сухие связующие, такие как поливинилпирролидон и гидроксипропилметилцеллюлоза; влажные связующие, такие как водорастворимые полимеры, в том числе гидроколлоиды, такие как аравийская камедь, альгинаты, агар, гуаровая камедь, камедь бобов рожкового дерева, каррагинан, карбоксиметилцеллюлоза, камедь тары, гуммиарабик, трагакантовая камедь, пектин, ксантан, геллан, желатин, мальтодекстрин, галактоманнан, пусстулан, ламинарин, склероглюкан, инулин, велан, рамсан, зооглан, метилан, хитин, циклодекстрин, хитозан, поливинилпирролидон, целлюлозные соединения, сахароза и крахмалы, а также их смеси. К подходящим разрыхлителям относятся без ограничения натрия крахмалгликолат, сшитый поливинилпирролидон, сшитая карбоксиметилцеллюлоза, крахмалы, микрокристаллическая целлюлоза и их смеси.
[0067] К подходящим смазывающим веществам относятся без ограничения длинноцепочечные жирные кислоты и их соли, такие как стеарат магния и стеариновая кислота, тальк, глицеридные воски и их смеси. К подходящим веществам, способствующим скольжению, относятся без ограничения коллоидный диоксид кремния. К подходящим модифицирующим высвобождение вспомогательным веществам относятся без ограничения нерастворимые пищевые материалы, рН-зависимые полимеры и их смеси.
[0068] К подходящим нерастворимым пищевым материалам для применения в качестве модифицирующих высвобождение вспомогательных веществ относятся без ограничения водонерастворимые полимеры и легкоплавкие гидрофобные материалы, их сополимеры и их смеси. Примеры подходящих водонерастворимых полимеров включают без ограничения этилцеллюлозу, поливиниловые спирты, поливинилацетат, поликапролактоны, ацетат целлюлозы и его производные, акрилаты, метакрилаты, сополимеры акриловой кислоты, их сополимеры и их смеси. К подходящим легкоплавким гидрофобным материалам относятся без ограничения жиры, эфиры жирных кислот, фосфолипиды, разновидности воска и их смеси. Примеры подходящих жиров включают без ограничения гидрогенизированные растительные масла, такие как, например, какао-масло, гидрогенизированное пальмовое масло, гидрогенизированное хлопковое масло, гидрогенизированное подсолнечное масло и гидрогенизированное соевое масло, свободные жирные кислоты и их соли, а также их смеси. Примеры подходящих эфиров жирных кислот включают без ограничения эфиры сахарозы и жирных кислот, моно-, ди- и триглицериды, глицерилбегенат, глицерилпальмитостеарат, глицерилмоностеарат, глицерилтристеарат, глицерилтрилаурилат, глицерилмиристат, GlycoWax-932, глицериды лауроилмакрогола-32, глицериды стеароилмакрогола-32 и их смеси. Примеры подходящих фосфолипидов включают фосфотидилхолин, фосфотидилсерин, фосфотидилэнозитол, фосфотидную кислоту и их смеси. Примеры подходящих разновидностей воска включают без ограничения карнаубский воск, спермацетный воск, пчелиный воск, канделильский воск, шеллаковый воск, микрокристаллический воск и парафиновый воск, такие жиросодержащие смеси, как шоколад, и их смеси. Примеры суперразрыхлителей включают без ограничения кроскармеллозу натрия, натрия крахмалгликолат и сшитый повидон (кросповидон). В одном варианте осуществления ядро таблетки содержит приблизительно до 5 процентов по массе такого суперразрыхлителя.
[0069] Примеры антиоксидантов включают без ограничения токоферолы, аскорбиновую кислоту, пиросульфит натрия, бутилгидрокситолуол, бутилированный гидроксианизол, этилендиаминтетрауксусную кислоту и соли этилендиаминтетрауксусной кислоты, а также их смеси. Примеры консервантов включают без ограничения лимонную кислоту, винную кислоту, молочную кислоту, яблочную кислоту, уксусную кислоту, бензойную кислоту и сорбиновую кислоту, а также их смеси.
[0070] В одном варианте осуществления покрытие для немедленного высвобождения имеет среднюю толщину по меньшей мере 50 микрон, такую как от приблизительно 50 микрон до приблизительно 2500 микрон, например, от приблизительно 250 микрон до приблизительно 1000 микрон. В варианте осуществления покрытие для немедленного высвобождения обычно спрессовывают до плотности более чем приблизительно 0,9 г/см3, которую измеряют по массе и объему такого конкретного слоя.
[0071] В одном варианте осуществления покрытие для немедленного высвобождения содержит первую часть и вторую часть, причем по меньшей мере одна из этих частей содержит второе фармацевтически активное средство. В одном варианте осуществления части контактируют друг с другом по центральной оси таблетки. В одном варианте осуществления первая часть включает в себя первое фармацевтически активное средство, а вторая часть включает в себя второе фармацевтически активное средство.
[0072] В одном варианте осуществления первая часть содержит первое фармацевтически активное средство, а вторая часть содержит второе фармацевтически активное средство. В одном варианте осуществления одна из частей содержит третье фармацевтически активное средство. В одном варианте осуществления одна из частей содержит вторую часть для немедленного высвобождения того же фармацевтически активного средства, что содержится в ядре таблетки.
[0073] В одном варианте осуществления внешнюю часть покрытия готовят в виде сухой смеси материалов перед внесением на покрытое оболочкой ядро таблетки. В другом варианте осуществления в состав внешней части покрытия включен высушенный зернистый материал, включающий фармацевтически активное средство.
[0074] Описанные выше составы с различными механизмами высвобождения лекарственного средства можно объединить в конечную лекарственную форму, содержащую одну или несколько единиц. Примеры множества единиц включают многослойные таблетки, капсулы, содержащие таблетки, сферы или гранулы в твердой или жидкой форме. Как правило, составы с немедленным высвобождением включают прессованные таблетки, гели, пленки, оболочки, жидкости и частицы, которые могут быть инкапсулированы, например, в желатиновой капсуле. Из уровня техники известно много способов получения оболочек, нанесения покрытия или включения лекарственных средств.
[0075] Дозированная единица с немедленным высвобождением в лекарственной форме, т. е. таблетка, множество содержащих лекарственное средство сфер, гранул или частиц или наружный слой лекарственной формы в форме ядра с оболочкой, содержит терапевтически эффективное количество активного средства с традиционными фармацевтическими вспомогательными веществами. Дозированная единица с немедленным высвобождением может быть покрыта или не покрыта оболочкой и может быть смешана или не смешана с дозированной единицей или единицами с отсроченным высвобождением (как и в случае с инкапсулированной смесью содержащих лекарственной средство гранул, частиц или сфер с немедленным высвобождением и содержащих лекарственное средство гранул или сфер с отсроченным высвобождением).
[0076] Составы с продленным высвобождением обычно готовят в виде диффузионных или осмотических систем, например, как описано в "Remington—The Science and Practice of Pharmacy", 20th. Ed., Lippincott Williams & Wilkins, Baltimore, Md., 2000). Диффузионная система обычно состоит из одного из двух типов устройств: емкости и матрицы, которые хорошо известны и описаны в уровне технике. Матричные устройства обычно получают путем спрессовывания лекарственного средства с медленно растворяющимся полимерным носителем в таблетированную форму.
[0077] В систему с продленным высвобождением можно добавить часть с немедленным высвобождением путем нанесения слоя с немедленным высвобождением поверх ядра с продленным высвобождением с помощью способов нанесения покрытия или спрессовывания или в системе с множеством единиц, такой как капсула, содержащая сферы с продленным и немедленным высвобождением.
[0078] Дозированные составы с отсроченным высвобождением получают путем нанесения на твердую лекарственную форму пленки из полимера, которая нерастворима в кислой среде желудка, но растворима в нейтральной среде тонкого кишечника. Дозированные единицы с отсроченным высвобождением можно получить, например, путем нанесения на лекарственное средство или содержащую лекарственное средство композицию выбранного покрывающего материала. Содержащая лекарственное средство композиция может представлять собой таблетку для включения в капсулу, таблетку для применения в качестве внутреннего ядра в лекарственной форме «ядро с покрытием» или множество содержащих лекарственное средство сфер, частиц или гранул для включения либо в таблетку, либо в капсулу.
[0079] Лекарственная форма с импульсным высвобождением представляет собой форму, которая имитирует профиль многократного введения дозы без повторного введения дозы, и, как правило, обеспечивает по меньшей мере двукратное снижение частоты введения дозы по сравнению с лекарственным средством, представленным в виде традиционной лекарственной формы (например, в виде раствора или традиционной твердой лекарственной формы с быстрым высвобождением лекарственного средства). Профиль импульсного высвобождения характеризуется периодом отсутствия высвобождения (время задержки) или уменьшенного высвобождения с последующим быстрым высвобождением лекарственного средства.
[0080] Каждая лекарственная форма содержит терапевтически эффективное количество активного средства. В одном варианте осуществления лекарственных форм, которые имитируют профиль введения доз два раза в сутки, при первом импульсе высвобождается примерно от 30 мас. % до 70 мас. %, предпочтительно от 40 мас. % до 60 мас. % от общего количества активного средства в лекарственной форме, а при втором импульсе высвобождается соответственно примерно от 70 мас. % до 3,0 мас. %, предпочтительно от 60 мас. % до 40 мас. % от общего количества активного средства в лекарственной форме. Для лекарственных форм, имитирующих профиль введения дозы два раза в сутки, второй импульс предпочтительно высвобождается через промежуток времени, составляющий примерно от 3 часов до менее 14 часов и более предпочтительно примерно от 5 часов до 12 часов после введения.
[0081] Другая лекарственная форма содержит спрессованную таблетку или капсулу с содержащей лекарственное средство дозированной единицей с немедленным высвобождением, дозированной единицей с отсроченным высвобождением и необязательной второй дозированной единицей с отсроченным высвобождением. В такой лекарственной форме дозированная единица с немедленным высвобождением содержит множество сфер, гранул и частиц, которые высвобождают лекарственное средство практически сразу после перорального введения, обеспечивая начальную дозу. Дозированная единица с отсроченным высвобождением содержит множество сфер или гранул с покрытием, которые высвобождают лекарственное средство примерно через 3-14 часов после перорального введения, обеспечивая вторую дозу.
[0082] Для трансдермального (например, местного) введения можно приготовить разведенные стерильные водные или частично водные растворы (обычно в концентрации приблизительно от 0,1 до 5%), которые в остальном схожи с вышеуказанными парентеральными растворами.
[0083] Способы получения различных фармацевтических композиций с определенным количеством одного или нескольких соединений с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI или других активных средств специалистам в настоящей области техники известны или станут очевидны в свете настоящего раскрытия. Примеры способов получения фармацевтических композиций см. в Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., 19th Edition (1995).
[0084] Кроме того, в определенных вариантах осуществления рассматриваемые композиции по настоящей заявке можно лиофилизировать или подвергнуть другой подходящей методике сушки, такой как сушка распылением. Рассматриваемые композиции можно вводить за один раз или можно разделить на некоторое количество меньших доз, подлежащих введению через различные интервалы времени, отчасти в зависимости от скорости высвобождения композиций и требуемой дозировки.
[0085] К составам, пригодным в представленных в настоящем документе способах, относятся составы, подходящие для перорального, назального, местного (в том числе трансбуккального и сублингвального), ректального, вагинального, аэрозольного и/или парентерального введения. Композиции для удобства можно представить в стандартной лекарственной форме и можно получить любыми способами, хорошо известными в области фармации. Количество рассматриваемой композиции, которую можно объединять с материалом-носителем для получения однократной дозы, может варьировать в зависимости от подвергаемого лечению субъекта и конкретного способа введения.
[0086] Способы получения этих составов или композиций включают стадию объединения рассматриваемых композиций с носителем и, необязательно, одним или несколькими вспомогательными ингредиентами. В большинстве случаев составы получают путем равномерного и тщательного объединения рассматриваемой композиции с жидкими носителями или тонкоизмельченными твердыми носителями или как первыми, так и вторыми, а затем, при необходимости, придания формы продукту.
[0087] Описываемые в настоящем документе соединения с формулой I, формулой II, формулой III, формулой IV, формулой V или формулой VI можно вводить в ингаляционных или аэрозольных составах. Ингаляционные или аэрозольные составы могут содержать одно или несколько таких средств, как адъюванты, диагностические средства, визуализирующие средства или терапевтические средства, полезные в ингаляционной терапии. Конечный аэрозольный состав может, например, содержать 0,005-90% мас./мас., например, 0,005-50%, 0,005-5% мас./мас. или 0,01-1,0% мас./мас. лекарственного средства от общей массы состава.
[0088] В твердых лекарственных формах для перорального введения (капсулах, таблетках, пилюлях, драже, порошках, гранулах и др.) рассматриваемая композиция смешана с одним или несколькими фармацевтически приемлемыми носителями и/или любым из следующих: (1) наполнителями или сухими разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; (2) связующими, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или аравийская камедь; (3) увлажнителями, такими как глицерин; (4) разрыхляющими средствами, такими как агар-агар, карбонат кальция, картофельный крахмал или крахмал из тапиоки, альгиновая кислота, некоторые силикаты и карбонат натрия; (5) средствами, замедляющими растворение, такими как парафин; (6) ускорителями всасывания, такими как соединения четвертичного аммония; (7) смачивающими средствами, такими как, например, ацетиловый спирт и моностеарат глицерина; (8) абсорбентами, такими как каолин и бентонитовая глина; (9) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси; и (10) красителями. В случае капсул, таблеток и пилюль фармацевтические композиции также могут содержать буферные средства. В качестве наполнителей в мягких и твердых желатиновых капсулах также можно использовать твердые композиции схожего типа с применением лактозы или молочных сахаров, а также высокомолекулярных полиэтиленгликолей и др.
[0089] К жидким лекарственным формам для перорального введения относятся фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и настойки. В дополнение к рассматриваемым композициям жидкие лекарственные формы могут содержать инертные разбавители, традиционно применяемые в настоящей области техники, такие как, например, вода или другие растворители, солюбилизирующие средства и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, кукурузное, арахисовое, подсолнечное, соевое, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и жирнокислотные эфиры сорбитана, а также их смеси.
[0090] Суспензии, помимо рассматриваемых композиций, могут содержать суспендирующие средства, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбита, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакантовая камедь, а также их смеси.
[0091] Составы для ректального или вагинального введения могут быть представлены в виде суппозитория, который можно получить путем смешивания рассматриваемой композиции с одним или несколькими подходящими, не вызывающими раздражение носителями, включая, например, какао-масло, полиэтиленгликоль, воск для суппозиториев или салицилат, и который является твердым при комнатной температуре, но жидким при температуре тела и, следовательно, будет плавиться в соответствующей полости тела и высвобождать инкапсулированные соединение(-я) и композицию(-и). К составам, которые подходят для вагинального введения, также относятся пессарии, тампоны, кремы, гели, пасты, пены или составы в форме спрея, содержащие такие носители, которые из уровня техники известны как подходящие.
[0092] К лекарственным формам для трансдермального введения относятся порошки, аэрозоли, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и лекарственные формы для ингаляции. Рассматриваемую композицию можно смешать в стерильных условиях с фармацевтически приемлемым носителем и с любыми, которые могут понадобиться, консервантами, буферами или газами-вытеснителями. Для трансдермального введения комплексы могут включать липофильные и гидрофильные группы для достижения необходимой растворимости в воде и транспортных свойств.
[0093] Мази, пасты, кремы и гели могут содержать, помимо рассматриваемых композиций, другие носители, такие как животные и растительные жиры, жидкие масла, разновидности воска, парафины, крахмал, трагакантовую камедь, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевая кислота, тальк и оксид цинка или их смеси. Порошки и аэрозоли могут содержать, помимо рассматриваемой композиции, вспомогательные вещества, такие как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и полиамидный порошок или смеси таких веществ. Спреи дополнительно могут содержать традиционные газы-вытеснители, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан.
[0094] Способы доставки композиции или композиций с помощью трансдермального пластыря известны из уровня техники. Иллюстративные пластыри и способы доставки посредством пластыря описаны в патентах США №№ 6974588, 6564093, 6312716, 6440454, 6267983, 6239180 и 6103275.
[0095] В другом варианте осуществления трансдермальный пластырь может включать слой подложки, содержащий композитную пленку, сформированную из смоляной композиции, содержащей 100 частей по массе поливинилхлориднополиуретанового композита и 2-10 частей по массе стирол-этилен-бутилен-стирольного сополимера, первый клеевой слой на одной стороне композитной пленки и полиалкилентерефталатную пленку, приклеенную к одной стороне композитной пленки посредством первого клеевого слоя, грунтовочный слой, который содержит смолу на основе сложного насыщенного полиэфира и сформирован на поверхности полиалкилентерефталатной пленки; и второй клеевой слой, включающий стирол-диен-стирольный блок-сополимер, содержащий фармацевтическое средство, нанесенное слоем на грунтовочный слой. Способ изготовления вышеупомянутого листа подложки включает получение вышеуказанной смоляной композиции, формование смоляной композиции в композитную пленку с помощью каландрового способа, а затем приклеивание полиалкилентерефталатной пленки на одной стороне композитной пленки посредством слоя клея, тем самым формируя слой подложки и формируя грунтовочный слой, содержащий смолу на основе сложного насыщенного полиэфира на внешней поверхности полиалкилентерефталатной пленки.
[0096] Пластырь другого типа предусматривает введение лекарственного средства непосредственно в фармацевтически приемлемый клей и наслаивание содержащего лекарственное средство клея на подходящий основный элемент, например полиэфирную основную мембрану. Лекарственное средство должно присутствовать в концентрации, которая не будет влиять на клеевые свойства и в то же время будет доставлять необходимую клиническую дозу.
[0097] Трансдермальные пластыри могут быть пассивными или активными. Доступные в настоящее время пассивные системы трансдермальной доставки лекарственных средств, такие как никотиновые, эстрогеновые и нитроглицериновые пластыри, доставляют низкомолекулярные лекарственные средства. Многие из недавно разработанных белков и пептидных лекарственных средств слишком велики для доставки посредством пассивных трансдермальных пластырей, и их можно доставлять с помощью такой технологии, как электростимуляция (ионофорез) для лекарственных средств с большими молекулами.
[0098] Ионофорез является методикой, используемой для увеличения потока ионизированных веществ через мембраны под воздействием электрического тока. Один пример ионофоретической мембраны приведен в патенте США № 5080646, Theeuwes. Основными механизмами, с помощью которых ионофорез усиливает молекулярный транспорт через кожу, являются (а) отталкивание заряженного иона от электрода с аналогичным зарядом, (b) электроосмос, конвективное движение растворителя, которое происходит через заряженную пору в ответ на преимущественное прохождение противоионов под воздействием электрического поля, или (с) увеличение проницаемости кожи вследствие воздействия электрического тока.
[0099] В некоторых случаях может быть необходимо введение в форме набора, он может включать емкость, содержащую отдельные композиции, такую как разделенная на секции бутылка или разделенный на секции пакет из фольги. Как правило, набор содержит указания по введению отдельных компонентов. Форма набора особенно предпочтительна, если отдельные компоненты предпочтительно вводить в разных лекарственных формах (например, пероральной и парентеральной), вводить через различные интервалы дозировки или для назначающего врача необходимо подобрать дозу отдельных компонентов комбинации.
[00100] Примером такого набора является так называемая блистерная упаковка. Блистерные упаковки хорошо известны в упаковочной промышленности и широко применяются для упаковки фармацевтических стандартных лекарственных форм (таблеток, капсул и др.). Блистерные упаковки обычно состоят из листа относительно жесткого, покрытого фольгой материала из пластикового материала, который может быть прозрачным.
[00101] Способы и композиции для лечения желудочно-кишечных полипов. Помимо прочего, в настоящем документе предложен способ лечения желудочно-кишечных полипов, включающий введение нуждающемуся в том пациенту терапевтически эффективного количества соединения с формулой I:

Формула I
и его фармацевтически приемлемых солей, гидратов, сольватов, пролекарств, энантиомеров и стереоизомеров;
[00102] где
R1, R3, R5 отсутствуют,
каждый из R2, R4, R6 независимо представляет собой
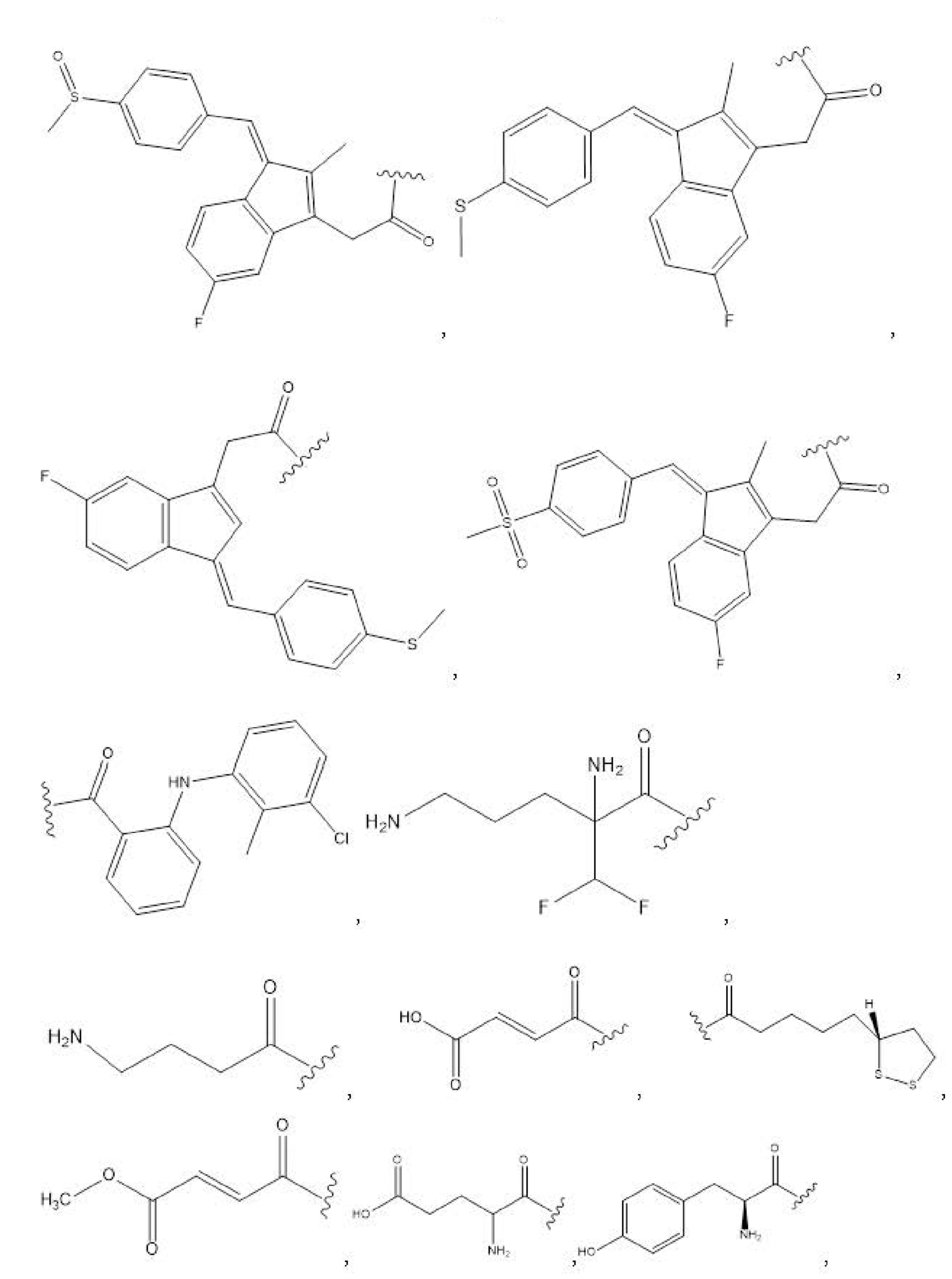
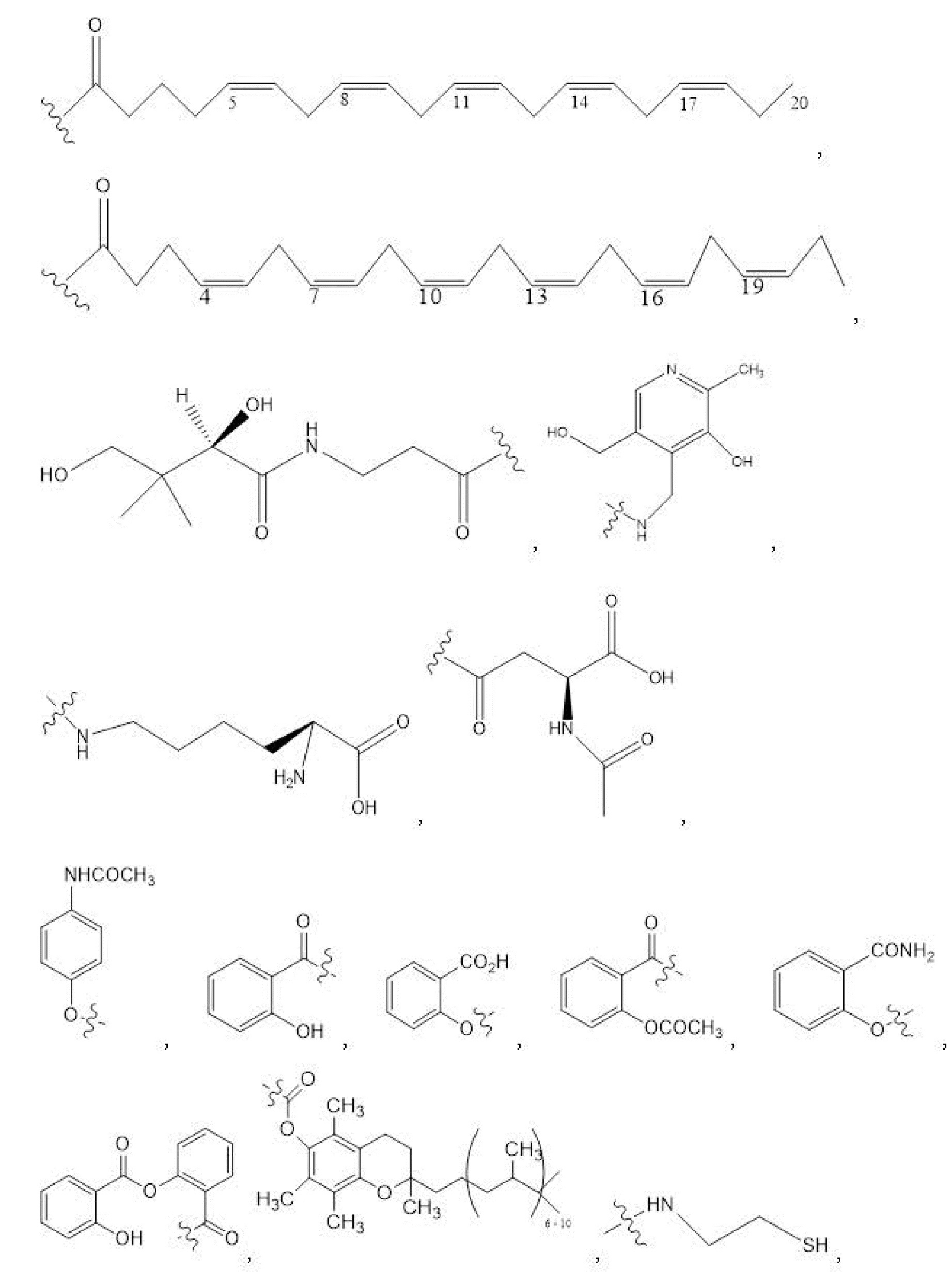

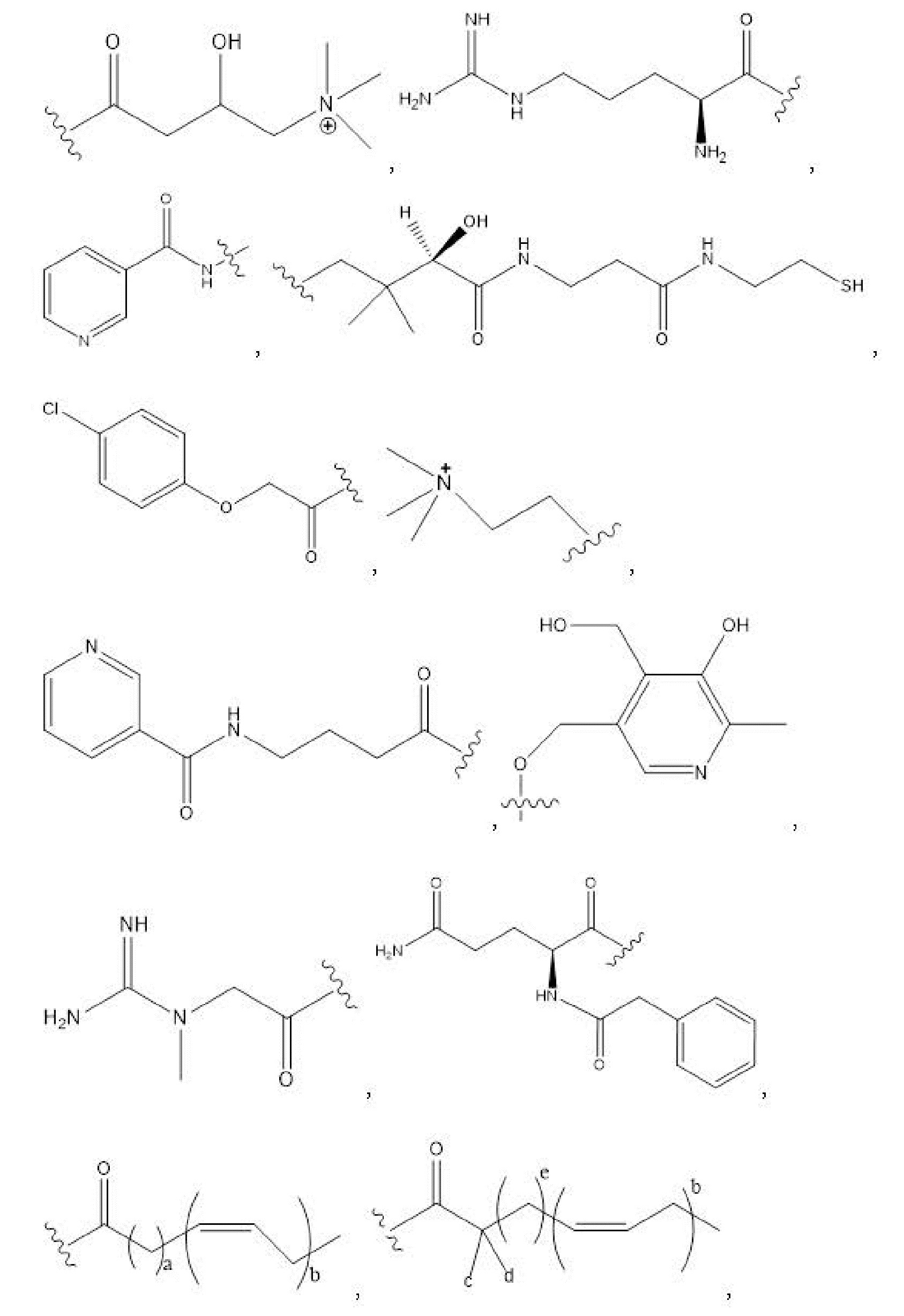

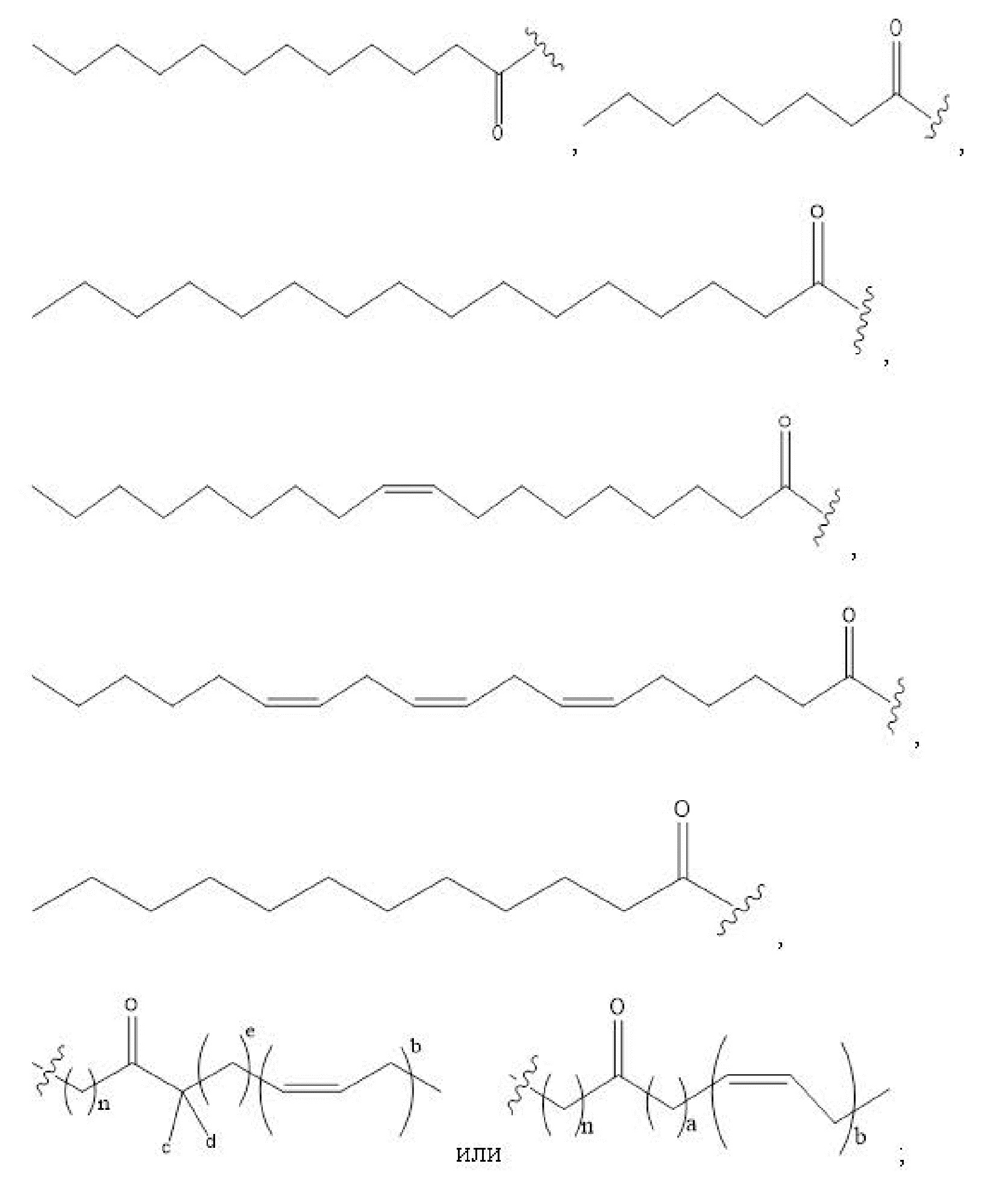
n независимо равен 1, 2, 3, 4 или 5;
a независимо равен 2, 3 или 7;
каждый b независимо равен 3, 5 или 6;
e независимо равен 1, 2 или 6;
каждый из c и d независимо представляет собой H, D, -OH, -OD, C1-C6-алкил, -NH2 или -COCH3.
СПОСОБЫ ПОЛУЧЕНИЯ
[00103] Примеры путей синтеза, пригодных для получения соединений с формулой I, изложены в приведенном ниже примере и обобщены на схеме 1, схеме 2, схеме 3, схеме 4 и схеме 5.
Схема 1

Получение 2-амино-5-((трет-бутоксикарбонил)амино)-2-(дифторметил)пентановой кислоты (стадия 1)
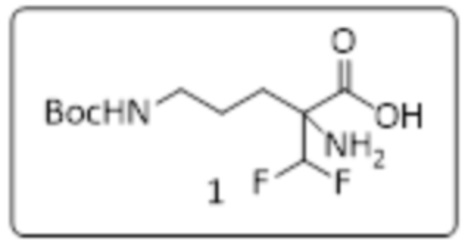
К перемешиваемому раствору эфлорнитина.HCl (30 г, 137,26 ммоль) в THF/H2O (480 мл, 1:1 об./об.) добавляли NaHCO3 (40,3 г, 480,32 ммоль) с последующим добавлением (Boc)2O (3,89 г, 178,34 ммоль) и реакционную смесь перемешивали при RT в течение 48 ч. Ход реакции отслеживали с помощью TLC. Удаляли THF при пониженном давлении; водный слой нейтрализовали с помощью 1 н. HCl и концентрировали при пониженном давлении. Остаток растирали с 15% MeOH/CH2Cl2 и отфильтровывали нерастворимый материал. Фильтрат концентрировали при пониженном давлении с получением 2-амино-5-((трет-бутоксикарбонил)амино)-2-(дифторметил)пентановой кислоты (28 г, 73% выход) в виде белого твердого вещества.
Получение (2,2-диметил-1,3-диоксолан-4-ил)метил-2-амино-5-((трет-бутоксикарбонил)амино)-2-(дифторметил)пентаноата (стадия 2)
К перемешиваемому раствору 2-амино-5-((трет-бутоксикарбонил)амино)-2-(дифторметил)пентановой кислоты (12 г, 42,55 ммоль) в DMF (100 мл) добавляли DIPEA (27,44 г, 212,75 ммоль), солкеталь (5,62 г, 42,55 ммоль) с последующим добавлением HATU (19,40 г, 51,06 ммоль) и реакционную смесь перемешивали при RT в течение 4 ч. Ход реакции отслеживали с помощью TLC. Реакционную смесь выливали в ледяную воду (500 мл), экстрагировали этилацетатом (2×300 мл). Объединенный органический слой промывали водой (3×200 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной хроматографии (силикагель с размером ячейки 100-200 меш, элюировали посредством 15-40% EtOAc в гексане) с получением (2,2-диметил-1,3-диоксолан-4-ил)метил-2-амино-5-((трет-бутоксикарбонил)амино)-2-(дифторметил)пентаноата (5,5 г, 32% выход) в виде бесцветной жидкости.
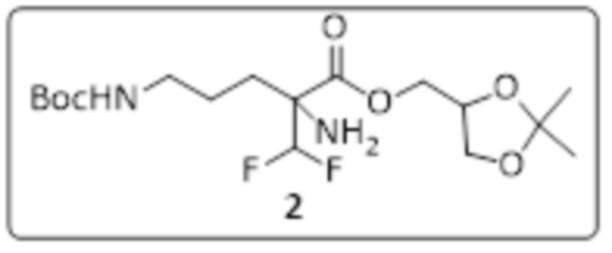
Получение 2,3-дигидроксипропил-2-амино-5-((трет-бутоксикарбонил)амино)-2-(дифторметил)пентаноата (стадия 3)

К перемешиваемому раствору (2,2-диметил-1,3-диоксолан-4-ил)метил-2-амино-5-((трет-бутоксикарбонил)амино)-2-(дифторметил)пентаноата (5,5 г, 13,88 ммоль) в МеОН (60 мл) добавляли PTSA (2,63 г, 13,88 ммоль) и реакционную смесь перемешивали при RT в течение 20 ч. Ход реакции отслеживали с помощью TLC. Реакционную смесь концентрировали при пониженном давлении, остаток разводили посредством H2O (50 мл), подщелачивали насыщенным раствором NaHCO3, экстрагировали посредством 10% MeOH/CH2Cl2 (4×200 мл). Объединенный органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной хроматографии (силикагель с размером ячейки 100-200 меш, элюировали посредством 2-5% MeOH в CH2Cl2) с получением 2,3-дигидроксипропил-2-амино-5-((трет-бутоксикарбонил)амино)-2-(дифторметил)пентаноата (3,7 г, 75% выход) в виде бесцветной жидкости.
Получение (5Z,5'Z,8Z,8'Z,11Z,11'Z,14Z,14'Z,17Z,17'Z)-3-((2-амино-5-((трет-бутоксикарбонил)амино)-2-(дифторметил)пентаноил)окси)пропан-1,2-диил-бис(икоса-5,8,11,14,17-пентаеноата) (стадия 4)

К перемешиваемому раствору 2,3-дигидроксипропил-2-амино-5-((трет-бутоксикарбонил)амино)-2-(дифторметил)пентаноата (3,7 г, 10,38 ммоль) в DMF (32 мл) добавляли EPA (6,90 г, 22,89 ммоль), EDC.HCl (4,78 г, 24,91 ммоль) с последующим добавлением DMAP (506 мг, 4,15 ммоль) и реакционную смесь перемешивали при RT в течение 20 ч. Ход реакции отслеживали с помощью TLC. Реакционную смесь разводили посредством EtOAc (500 мл), промывали посредством H2O (3×200 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной хроматографии (силикагель с размером ячейки 100-200 меш, элюировали посредством 15-20% EtOAc в гексане) с получением (5Z,5'Z,8Z,8'Z,11Z,11'Z,14Z,14'Z,17Z,17'Z)-3-((2-амино-5-((трет-бутоксикарбонил)амино)-2-(дифторметил)пентаноил)окси)пропан-1,2-диил-бис-(икоса-5,8,11,14,17-пентаеноата) (3 г, 31% выход) в виде желтой жидкости.
Получение гидрохлорида (5Z,5'Z,8Z,8'Z,11Z,11'Z,14Z,14'Z,17Z,17'Z)-3-((2,5-диамино-2-(дифторметил)пентаноил)окси)пропан-1,2-диил-бис(икоса-5,8,11,14,17-пентаеноата) (стадия 5)

К перемешиваемому раствору (5Z,5'Z,8Z,8'Z,11Z,11'Z,14Z, 14'Z,17Z,17'Z)-3-((2-амино-5-((трет-бутоксикарбонил)амино)-2-(дифторметил)пентаноил)окси)пропан-1,2-диил-бис(икоса-5,8,11,14,17-пентаеноата) (7 г, 7,56 ммоль) в 1,4-диоксане (50 мл) добавляли HCl в 1,4-диоксане (4 М, 60 мл) и реакционную смесь перемешивали при RT в течение 2 ч. Ход реакции отслеживали с помощью TLC. Реакционную смесь концентрировали, подвергали совместной перегонке с CH2Cl2 с получением гидрохлорида (5Z,5'Z,8Z,8'Z,11Z,11'Z,14Z,14'Z,17Z,17'Z)-3-((2,5-диамино-2-(дифторметил)пентаноил)окси)пропан-1,2-диил-бис(икоса-5,8,11,14,17-пентаеноата) (6,5 г) в виде бурого смолистого твердого вещества с чистотой 99,08% по результатам HPLC.
Схема 2
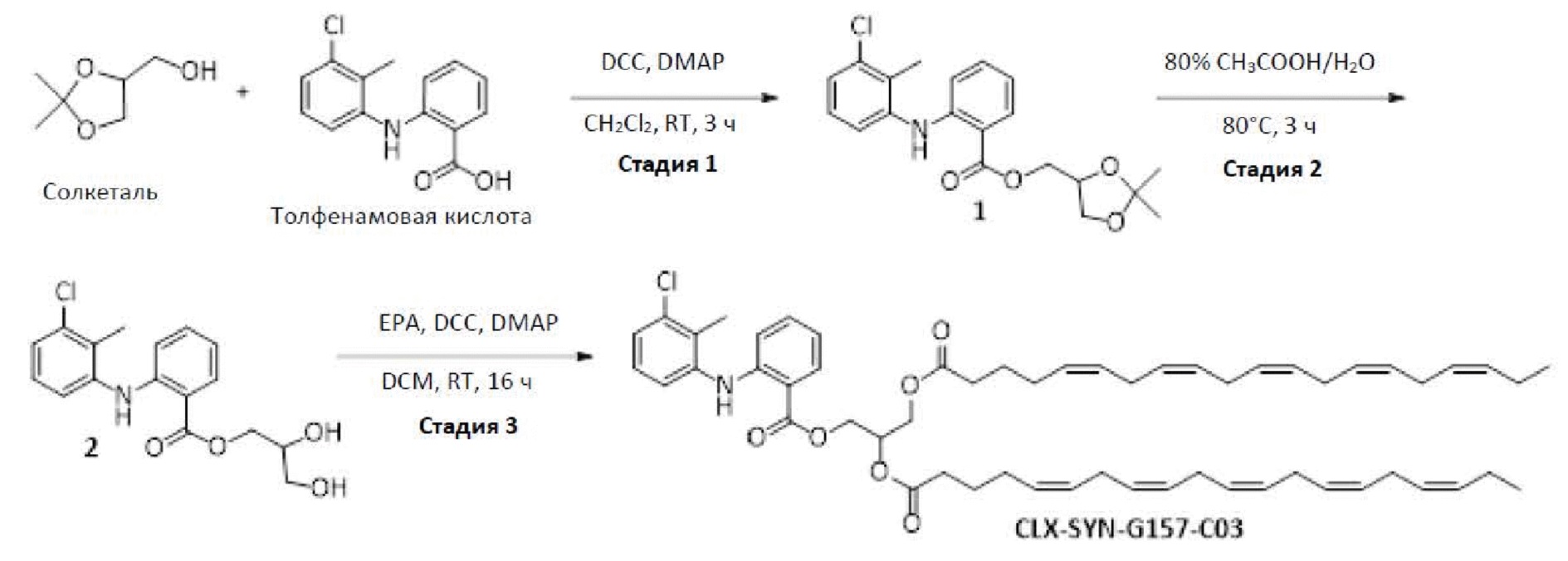
Получение (2,2-диметил-1,3-диоксолан-4-ил)метил-2-((3-хлор-2-метилфенил)амино)бензоата (стадия 1)
К перемешиваемому раствору солкеталя (6 г, 45,93 ммоль), толфенамовой кислоты (13,04 г, 49,97 ммоль) в CH2Cl2 (120 мл) добавляли DCC (11 г, 54 ммоль) с последующим добавлением DMAP (549 мг, 4,50 ммоль) и реакционную смесь перемешивали при RT в течение 3 ч. Ход реакции отслеживали с помощью TLC. Реакционную смесь разводили посредством CH2Cl2 (50 мл), фильтровали через подушку целита, промывали посредством CH2Cl2 (30 мл). Фильтрат концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной хроматографии (силикагель с размером ячейки 100-200 меш, элюировали посредством 1% EtOAc в гексане) с получением (2,2-диметил-1,3-диоксолан-4-ил)метил-2-((3-хлор-2-метилфенил)амино)бензоата (11 г, 64% выход) в виде бледно-желтой жидкости.
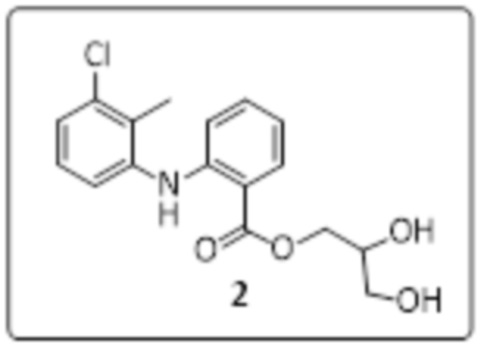
Получение 2,3-дигидроксипропил-2-(3-хлор-2-метилфениламино)бензоата (стадия 2)
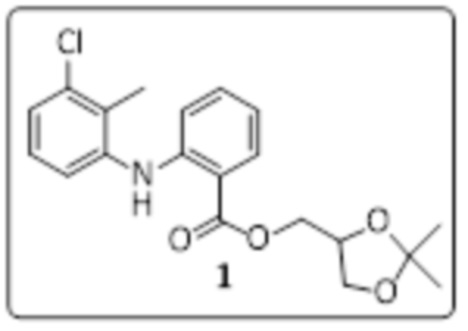
Смесь (2,2-диметил-1,3-диоксолан-4-ил)метил-2-((3-хлор-2-метилфенил)амино)бензоата (8 г, 21,33 ммоль) и 80% уксусной кислоты/H2O (80 мл) перемешивали при 80°C в течение 3 часов. Ход реакции отслеживали с помощью TLC. Реакционную смесь выливали в ледяную воду (800 мл); образовавшееся твердое вещество отфильтровывали и сушили в вакууме с получением 2,3-дигидроксипропил-2-((3-хлор-2-метилфениламино)бензоата (5,4 г, 75% выход) в виде грязно-белого твердого вещества.
Получение (5Z,5'Z,8Z,8'Z,11Z,11'Z,14Z,14'Z,17Z,17'Z)-3-((2-((3-хлор-2-метилфенил)амино)бензоил)окси)пропан-1,2-диил-бис(икоса-5,8,11,14,17-пентаеноата) (стадия 3)

К перемешиваемому раствору 2,3-дигидроксипропил-2-((3-хлор-2-метилфенил)амино)бензоата (3 г, 8,95 ммоль) в CH2Cl2 (60 мл) добавляли EPA (5,95 г, 19,70 ммоль), DCC (4,06 г, 19,70 ммоль) с последующим добавлением DMAP (0,109 г, 0,89 ммоль) и реакционную смесь перемешивали при RT в течение 16 ч. Ход реакции отслеживали с помощью TLC. Реакционную смесь разводили посредством CH2Cl2 (25 мл), фильтровали через подушку целита, промывали посредством CH2Cl2 (25 мл). Фильтрат концентрировали при пониженном давлении и 30°С с получением неочищенного соединения.
Примечание: объединяли 4 партии по 3 г и полученное неочищенное соединение очищали с помощью колоночной хроматографии (несколько раз, силикагель с размером ячейки 100-200 меш, элюировали посредством 2% EtOAc в гексане) с получением (5Z,5'Z,8Z,8'Z,11Z,11'Z,14Z,14'Z,17Z,17'Z)-3-((2-((3-хлор-2-метилфенил)амино)бензоил)-окси)пропан-1,2-диил-бис(икоса-5,8,11,14,17-пентаеноата) (3,3 г, 10% выход) в виде бледно-желтой жидкости с чистотой 98,11% по результатам HPLC.
Схема 3

Получение (Z)-(2,2-диметил-1,3-диоксолан-4-ил)метил-2-(5-фтор-2-метил-1-(4-(метилсульфинил)бензилиден)-1H-инден-3-ил)ацетата (стадия 1)

К перемешиваемому раствору солкеталя (12 г, 90,90 ммоль) в CH2Cl2 (300 мл) добавляли DCC (18,7 г, 90,90 ммоль), DMAP (1,1 г, 9,09 ммоль) с последующим добавлением сулиндака (32,3 г, 90,90 ммоль) и реакционную смесь перемешивали при RT в течение 16 ч. Ход реакции отслеживали с помощью TLC. Реакционную смесь разводили посредством CH2Cl2 (100 мл), фильтровали через подушку целита, промывали посредством CH2Cl2 (100 мл). Фильтрат промывали водой (2×100 мл). Объединенный органический слой сушили над безводным сульфатом натрия, концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной хроматографии (силикагель с размером ячейки 60-120 меш, элюировали посредством 1% МеОН в CH2Cl2) с получением (Z)-(2,2-диметил-1,3-диоксолан-4-ил)метил-2-(5-фтор-2-метил-1-(4-(метилсульфинил)бензилиден)-1H-инден-3-ил)ацетата (22 г, 52% выход) в виде желтого полутвердого вещества.
Получение (Z)-2,3-дигидроксипропил-2-(5-фтор-2-метил-1-(4-(метилсульфинил)бензилиден)-1H-инден-3-ил)ацетата (стадия 2)
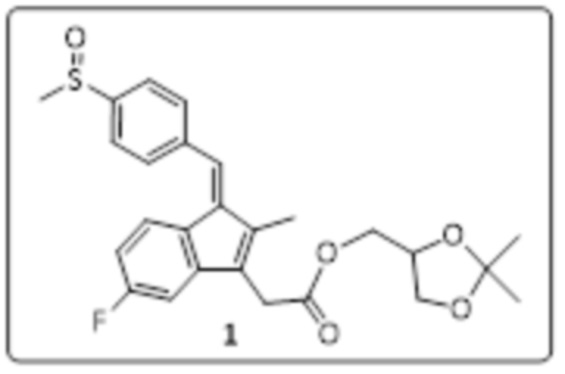
Смесь (Z)-(2,2-диметил-1,3-диоксиолан-4-ил)метил-2-(5-фтор-2-метил-1-(4-(метилсульфинил)бензилиден)-1H-инден-3-ил)ацетата (15 г, 31,91 ммоль) и 80% уксусной кислоты (150 мл) перемешивали при 50°C в течение 2 ч. Ход реакции отслеживали с помощью TLC. Реакционную смесь выливали в ледяную воду (1000 мл), экстрагировали этилацетатом (2×300 мл). Объединенный органический слой промывали насыщенным раствором NaHCO3 (3×200 мл), водой (100 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенное соединение разводили этилацетатом (100 мл), перемешивали при RT 30 мин, фильтровали и сушили в вакууме с получением (Z)-2,3-дигидроксипропил-2-(5-фтор-2-метил-1-(4-(метилсульфинил)бензилиден)-1Н-инден-3-ил)ацетата (9 г, 65% выход) в виде желтого твердого вещества.
Получение (5Z,5'Z,8Z,8'Z,11Z,11'Z,14Z,14'Z,17Z,17'Z)-3-(2-((Z)-5-фтор-2-метил-1-(4-(метилсульфинил)бензилиден)-1H-инден-3-ил)ацетокси)пропан-1,2-диил-бис(икоса-5,8,11,14,17-пентаеноата) (стадия 3)

К перемешиваемому раствору (Z)-2,3-дигидроксипропил-2- (5-фтор-2-метил-1-(4-(метилсульфинил)бензилиден)-1H-инден-3-ил)ацетата (12 г, 27,90 ммоль) в DMF (240 мл) добавляли EPA (18,6 г, 62,39 ммоль), EDC.HCl (11,8 г, 62,39 ммоль) с последующим добавлением DMAP (681 мг, 5,58 ммоль) и реакционную смесь перемешивали при RT в течение 16 ч. Ход реакции отслеживали с помощью TLC. Реакционную смесь фильтровали через подушку целита, промывали этилацетатом (100 мл). Фильтрат разводили этилацетатом (600 мл), промывали ледяной водой (3×250 мл), солевым раствором (150 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении при температуре ниже 30°С. Неочищенное соединение очищали с помощью колоночной хроматографии (несколько раз, силикагель с размером ячейки 60-120 меш, элюировали посредством 4% EtOAc в CH2Cl2) с последующим проведением препаративной HPLC (5% THF в ацетонитриле) с получением (5Z,5'Z,8Z,8'Z,11Z,11'Z,14Z,14'Z,17Z,17'Z)-3-(2-((Z)-5-фтор-2-метил-1-(4-(метилсульфинил)бензилиден)-1Н-инден-3-ил)ацетокси)пропан-1,2-диил-бис(икоса-5,8,11,14,17-пентаеноата) (4,8 г, 17% выход) в виде желтой жидкости с чистотой 98,77% по результатам HPLC.
Схема 4

К перемешиваемому раствору (5Z,8Z,11Z,14Z,17Z)-2,3-дигидроксипропил-эйкоза-5,8,11,14,17-пентаеноата (5 г, 14 ммоль, Int-B) и 2-((3-хлор-2-метилфенил)амино)бензойной кислоты (10,41 г, 30,8 ммоль, сулиндак) в сухом CH2Cl2 (100 мл) добавляли DCC (9,58 г, 49 ммоль) с последующим добавлением DMAP (649 мг, 5,6 ммоль) при 0-5°С. Реакционной смеси давали нагреться до RT и перемешивали в течение 16 ч в атмосфере аргона. Ход реакции отслеживали с помощью TLC. Реакционную смесь фильтровали через подушку целита, промывали посредством CH2Cl2 (30 мл). Фильтрат концентрировали при пониженном давлении. Неочищенное соединение очищали с помощью колоночной хроматографии (силикагель с размером ячейки 230-400 меш, элюировали посредством EtOAc). Полученное соединение снова очищали препаративной HPLC (элюировали ацетонитрилом со степенью чистоты «для HPLC») с получением 2,2 г искомого соединения CLX-SYN-G157-C06, что подтверждали посредством 1Н ЯМР.
Схема 5

К перемешиваемому раствору 4-((3-этинилфенил)амино)хиназолин-6,7-диола (1 г, 4 ммоль, соединения 5) в сухом CH2Cl2 (20 мл) и DMF (5 мл) добавляли EPA (3,27 г, 12 ммоль), реакционную смесь охлаждали до 0-5°C, добавляли EDC.HCl (1,73 г, 10 ммоль). Реакционной смеси давали нагреться до RT и перемешивали в течение 4 ч в атмосфере аргона. Ход реакции отслеживали с помощью TLC. Реакционную смесь гасили холодной водой (30 мл), перемешивали в течение 15 минут. Реакционную массу фильтровали через подушку целита, отделяли органический слой, сушили над Na2SO4 и выпаривали растворитель при пониженном давлении при 30°C. Неочищенное соединение очищали колоночной флэш-хроматографией (элюировали посредством 13% EtOAc в петролейном эфире). Полученное соединение (850 мг) снова очищали препаративной HPLC (элюировали ацетонитрилом с степенью чистоты «для HPLC») с получением 200 мг искомого соединения CLX-SYN-G157-C07, что подтверждали посредством 1Н ЯМР.
ЭКВИВАЛЕНТЫ
[00104] Настоящим раскрытием предложены, помимо прочего, композиции и способы лечения желудочно-кишечных полипов и их осложнений. Несмотря на то, что были рассмотрены конкретные варианты осуществления настоящего раскрытия, приведенное выше описание является иллюстративным, а не ограничивающим. Специалистам в настоящей области техники после изучения настоящего описания станут очевидны многие варианты систем и способов, раскрытых в настоящем документе. Полный объем заявляемых систем и способов будет определяться на основании пунктов формулы изобретения наряду с их полным объемом эквивалентов и описанием вместе с такими вариантами.
ВКЛЮЧЕНИЕ ПО ССЫЛКЕ
[00105] Все упомянутые в настоящем документе публикации и патенты, в том числе перечисленные выше, настоящим включены посредством ссылки во всей своей полноте, как если бы каждая отдельная публикация или каждый отдельный патент были специально и отдельно указаны как включенные посредством ссылки. В случае спора настоящая заявка, в том числе любые определения, приведенные в настоящем документе, будет иметь преимущественную силу.
Реферат
Настоящее изобретение относится к соединению формулы I или его фармацевтически приемлемой соли, энантиомеру или стереоизомеру, которое может быть использовано для лечения желудочно-кишечных полипов, кишечных полипов и воспалительного заболевания кишечника, а также к содержащей его фармацевтической композиции,формула I,где R1, R3, R5отсутствуют;каждый из R2, R4независимо представляет собойR6представляет собой.2 н. и 3 з.п. ф-лы, 9 ил.
Формула



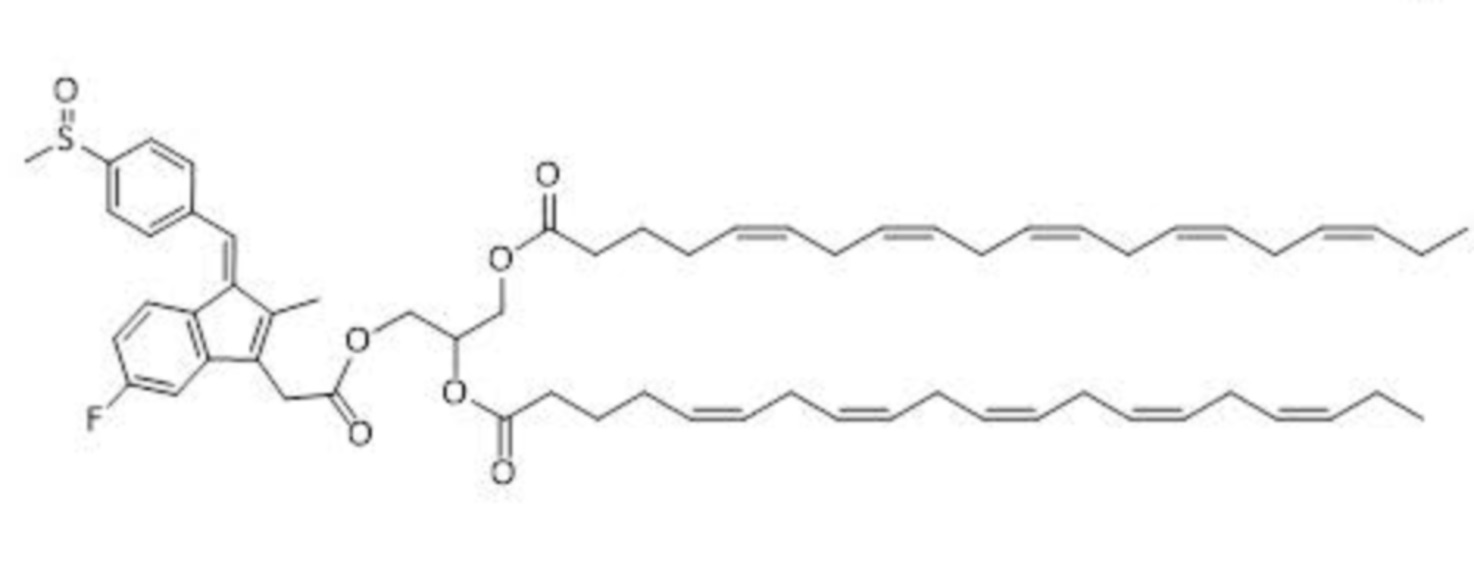
Документы, цитированные в отчёте о поиске
Пролекарства метилгидрофумарата, фармацевтические композиции с ними и способы применения

Комментарии