Применение протатран 4-хлор-2-метилфеноксиацетата (хлоркрезацина) для стимуляции экспрессии матричной рнк триптофанил-трнк-синтетазы - RU2623035C1
Код документа: RU2623035C1
Чертежи
Описание
Изобретение относится к биохимии, фармакологии, биологии, медицине и конкретно может быть использовано, например, для контроля ангиогенеза, при дислипопротеинозах различного происхождения.
Известно, что воспаление действует на обмен липопротеидов в стенках сосудов. При этом в процесс вовлекаются как системы неспецифического (макрофаги моноцитарного происхождения), так и специфического иммунитета (Т-клетки). Моноциты и Т-клетки мигрируют из кровотока в интиму артерий, где они дифференцируются в макрофаги, а затем, поглощая модифицированные липопротеины, трансформируются в тучные клетки (Hansson G.K., Libby P. The immune response in atherosclerosis: a double-edged sword // Nat. Rev. Immunol., 2006, v. 6, p.508-519) [1].
Макрофаги моноцитарного происхождения широко представлены на всех стадиях развития заболевания (Mangge Н., Hubmann Н., Pilz S., Schauenstein К., Renner W., Marz W. Beyond cholesterol-inflammatory cytokines, the key mediators in Atherosclerosis // Clin. Chem. Lab. Med., 2004, v. 42, p. 467-474) [2]. Последние данные по молекулярному механизму атерогенеза через развитие местного воспалительного процесса и экспрессии цитокинов и белковых факторов в атеросклеротических бляшках свидетельствуют, что существует определенный баланс между провоспалительными и антивоспалительными цитокинами и этот баланс критичен для развития повреждения.
В последнее время с целью регуляции цитокиновых функций внимание привлекают другие белковые и ферментные системы, действующие по механизму стимуляции и торможения атерогенеза. Это, в частности, аминоацил -тРНК-синтетазы (АРСазы). Установлено мощное про- и антиангиогенное действие пары: тирозил-тРНК-синтетаза и триптофанил-тРНК-синтетаза (ТРСазы) (Wakasugi К., Slike В.М., Hood J., Otani A., Ewalt K.L., Friedlander M., Cheresh D.A., Schimmel P. A human aminoacyl-tRNA synthetase as a regulator of angiogenesis // Proc. Natl. Acad. Sci. USA. 2002, v. 99(1), p. 173-177) [3]. Причем важной представляется роль ТРСазы, не только в связи с ее антиангиогенной, следовательно, и антиатерогенной активностью (через прорастание «сосудов в сосудах») и способностью подавлять так называемый «shia stress» повреждения в местах разветвления сосудов (Tzima Е., Reader J.S., Irani-Tehrani М., Ewalt K.L., Schwartz М.А., Schimmel P. Biologically active fragment of a human tRNA synthetase inhibits fluid shear stress-activated responses of endothelial cells // Proc. Natl. Acad. Sci. USA. 2003, v. 100(25), p. 14903-14907) [4], но и в связи с участием в синтезе мощных регуляторов функций сердечно-сосудистой системы (ССС) - диаденозинполи-фосфатов (Kisselev L.L., Justesenc J., Wolfson A.V., Frolova L.Yu. Diadenosine oligophosphates (ApnA), a novel class of signalling molecules? // FEBS Letters, 1998, v. 427, № 2, p. 157-163) [5]. С другой стороны, установлено мощное противовоспалительное, антионкогенное и антиатерогенное действие комплекса полифенолов растительного происхождения, причем их действие направлено в том числе и на поддержание оптимального соотношения цитокинов и белковых факторов, и сопровождается заметным увеличением синтеза АРСаз в соответствующих клетках экспериментальных животных (Gaube F., Wolf S., Pusch L., Kroll T.C. and Hamburger M. Gene expression profiling reveals effects of Cimicifuga racemosa (L.) NUTT. (black cohosh) on the estrogen receptor positive human breast cancer cell line MCF-7 // BMC Pharmacology 2007, v. 7, p. 1471-1478) [6].
В последние годы выявлен ряд дополнительных функций у ферментов класса аминоацил-тРНК-синтетаз (АРСаз) - ключевых для обмена веществ. В частности, тирозил-тРНК-синтетаза (ТирРСаза), будучи расщепленной, обладает цитокинной активностью и стимулирует ангиогенез, способствуя тем самым атерогенезу [3, 4]. Гомолог ТирРСазы - триптофанил-тРНК синтетаза (ТРСаза) в клетках существует в двух формах: 1) основной полноразмерной; 2) частично усеченной (миниТРСаза), лишенной N- концевого фрагмента в процессе альтернативного сплайсинга (или эндогенного регулируемого протеолиза) при созревании пре-мРНК (Liu, J., Shue, Е., Ewalt, K.L., Schimmel, P. A new γ-interferon-inducible promoter and splice variants of an anti-angiogenic human tRNA synthetase // Nucleic Acids Res. V. 32, № 2, p. 719-727, 2004) [7]. Образование обеих форм фермента может быть резко ускорено у всех млекопитающих при воздействии ряда факторов, например γ-интерферона. При этом ТРСаза, особенно в виде миниТРСазы, в отличие от ТирРСазы, обладает выраженным антиангиогенным и антиатерогенным действием [3, 4]. Известна также взаимосвязь между высокомолекулярными комплексами АРСаз и белокстимулирующим действием этого важного для регуляции обмена веществ (компонента белоксинтезирующего) аппарата клетки (Lee S.W., Cho В.Н., Park S.G., Kim S. Aminoacyl-tRNA synthetase complexes: beyond translation // J. Cell. Sci. 2004; V. 117, N 17, p. 3725-34) [8].
В литературе имеются сведения об активации ТРСазы различными соединениями как химического, так и природного происхождения (Нурбеков М.К., Фаворова О.О., Дмитренко С.Г., Болотина И.А., Киселев Л.Л. Роль ионов цинка в функционировании бычьей триптофанил-тРНК-синтетазы. //Молекулярная биология, 1981, т. 15, №5, стр. 1000-1010) [9]. Это, в частности, гемин (Wakasugi К. Human tryptophanyl-tRNA synthetase binds with heme to enhance its aminoacylation activity // Biochemistry. 2007, v. 46(40), p. 11291-11298) [10], форболовые эфиры (Забазарных М.Ю., Литвинов Д.Ю. Форболовые эфиры стимулируют экспрессию гена триптофанил-тРНК-синтетазы человека // Биохимия, 2003, т. 68, №4, с. 592-597) [11] и эритропоэтин (Smith K.J., Bleyer A.J., Little W.C., Sane D.C. The cardiovascular effects of erythropoietin.// Cardiovasc Res. 2003, v. 59(3), p. 538-548) [12].
Можно отметить стимулирующее действие эритропоэтина или/и форболовых эфиров на экспрессию мРНК ТРСазы, имеющих частично общий механизм (протеинкиназу С). Однако эти активирующие воздействия имеют свою специфику. В первом случае - общий пролиферативный анаболический эффект, во втором - узкоспецифический эффект по стимуляции возможных защитных реакций организма на воздействия онкостимулирующего препарата - форболовых эфиров (для создания моделей животных с опухолями).
В качестве ближайшего аналога может быть указан источник [13]: Расулов М.М., Нурбеков М.К., Буланова В.В., Караулова Л.К., Сусова М.И., Воронков М.Г. Средство, повышающее активность суммарной триптофанил - тРНК - синтетазы //патент RU №2407526 С 1 от 27 дек. 2010.
Несмотря на то, что возможность использования воздействия на цитокиновую активность аминоацил-тРНК-синтетаз с лечебными или диагностическими целями активно исследуется, в настоящее время отсутствуют готовые препараты, используемые в клинической практике, обладающие указанной активностью. Поэтому с целью расширения арсенала синтетических средств, обладающих стимулирующей цитокинной активностью в отношении триптофанил-тРНК синтетазы, предлагается использовать биологически активное соединение - протатран 4-хлор-2-метилфеноксиацетат (хлоркрезацин), формулы:
[2-СН3-4-Сl-С6Н3ОСН2СОО]-[NH(CH2CH2OH)3]+,
синтезированный ранее и запатентованный (Воронков М.Г., Власова Н.Н., Григорьева О.Ю. Способ получения 2-метил-4-галоген-феноксиацетатов трис-(2-гидроксиэтил) аммония (2-метил-4-галоген-феноксиацетоксипротатранов) // Патент RU 2427568 С2.) [14], а также опубликованный (Софьина З.П., Воронков М.Г., Дьяков М.Г. и др. II Хим.-фарм. журн., 1978. Т. 12, №4. С. 74-77) [15].
Заявляемая биологическая активность хлоркрезацина не была известна.
Возможность осуществления изобретения может быть проиллюстрирована следующими представленными ниже примерами:
Пример 1
К раствору 1.66 г 2-метил-феноксиуксусной кислоты в 10 мл диэтилового (серного) эфира, содержащему 0.01 г порошкообразного А1, при перемешивании прибавляют 1.35 г хлористого сульфурила. Реакционную смесь нагревают до кипения в течение 4 ч и горячей фильтруют. Фильтрат охлаждают до 0-5°С. Выпавший белый кристаллический осадок отсасывают, промывают эфиром и сушат в вакууме. Выход 2-метил-4-хлор-феноксиуксусной кислоты с т.пл. 111-112°С 2.9 г (98%).
Найдено, %: С 53.23; Н 4.31; С117.72. С9Н9O3Сl.
Вычислено, %: С 53.86; Н 4.49; Сl 17.71.
Пример 2
К раствору 4.0 г 2-метил-4-хлор-феноксиуксусной кислоты в 10 мл ацетона при перемешивании прибавляют 3.0 г триэтаноламина. Реакционную смесь выдерживают 0.5 ч, выпавший осадок отфильтровывают, промывают эфиром и сушат в вакууме. Получено 6.8 г (98%) хлоркрезацина с т.пл. 87-88°С [лит. данные 91-92°С Софьина З.П., Воронков М.Г., Дьяков М.Г. и др. // Хим.-фарм. журн., 1978. Т. 12, №4. С. 74-77].
Найдено, %: С 51.43; Н 6.87; N 4.20; С1 10.10. С15Н24O6NCl.
Вычислено, %: С 51.50; Н 6.90; N4.01; Сl 10.16.
Новая физиологическая активность хлоркрезацина - увеличение экспрессии мРНК, одного из ключевых ферментов внерибосомного этапа белкового синтеза триптофанил-тРНК синтетазы (ТРСазы).
ТРСаза запускает каскад последующих регуляторных цитокинных функций, реализуемых в ходе «вызревания» фермента и включения его в контроль ангиогенеза. Сложнейшие процессы в клетке, обеспечивающие регуляции целого спектра дополнительных функций ТРСазы, протекают в 2 стадии:
а) посттранскрипционную,
б) пострансляционную.
Активированный фрагмент ТРСазы обладает активностью, подавляющей патологические процессы аномальной агрессивной пролиферации сосудов. Одновременно он способен стимулировать восстанавливающее физиологическое развитие сосудов, благотворно влияющее на состояние сосудистой системы.
Свойства хлоркрезацина, повышающего цитокинную активность суммарной триптофанил-тРНК синтетазы (ТРСазы) через стимуляцию синтеза специфической мРНК, в литературе не описаны. Возможность осуществления изобретения может быть проиллюстрирована следующим образом.
Пример 3
Эксперименты проводятся «in vitro» для установления стимулирующего эффекта хлоркрезацина на белковый синтез и связанных с ним ведущих систем регуляции процессов развития, дифференцировки, регенерации и поддержания как клеточного, так и тканевого гомеостаза.
Эффекты хлоркрезацина изучают на культуре мононуклеарных клеток периферической крови (МНПК) человека.
Схема опыта включает следующие этапы:
1) получение МНПК;
2) культивирование МНПК в присутствии хлоркрезацина в различных концентрациях;
3) экспресс-выделение через определенные промежутки времени препаратов суммарной РНК;
4) синтез на матрице РНК кДНК;
5) количественное определение специфической мРНК триптофанил-тРНК-синтетазы методом РТ-ПЦР.
1. Получение мононуклеарных клеток. Периферическую кровь из локтевой вены в объеме 10 мл берут в стерильных условиях в пробирку, содержащую гепарин, в конечной концентрации 25 ед в 1 мл крови. Затем кровь стерильно переносят в пластиковую пробирку объемом около 50 мл. Туда же добавляют 10 мл стерильного PBS буфера. Разбавленную кровь аккуратно наслаивают на 3-5 мл градиента фиколл- уротраст в центрифужной пробирке. Соотношение объемов градиент - плазмы выдерживают в пределах 1:2-1:4.
Пробирки центрифугируют в течение 40 мин в бакет-роторе с ускорением 200 g (1500-1800 об/мин) при температуре 20°С. В процессе центрифугирования эритроциты и гранулоциты "проваливаются" в градиент и оседают на дно пробирки. На верхней границе градиента при правильном разделении образуется рыхлое кольцо беловатого цвета, состоящее из мононуклеарных клеток. Супернатант представлен плазмой. Последовательность фракций крови в градиенте: плазма - тромбоциты - мононуклеарные клетки - фиколл - эритроциты (на дне). Плазму удаляют. Остаток фикола с эритроцитами удаляют. Осторожно собирают клетки интерфазы (слой между плазмой - вверху и собственно фиколлом и осадком - внизу) пипеткой в пробирку с небольшим объемом среды, ресуспендируют. Заполняют пробирку PBS, центрифугируют при 800 или 1000 об/мин в течение 8-10 мин. Отсасывают и удаляют надосадок, ресуспендируют осадок в среде или PBS, заполняют пробирку PBS, повторно центрифугируют при 800 (1000) об/мин в течение 8-10 мин. Удаляют надосадок, осадок ресуспендируют в среде и приступают к подсчету клеток. После подсчета готовят рабочую концентрацию МК, содержащую 2×106 клеток в 1 мл.
2. Культивирование клеток. Культивирование проводят в полной культуральной среде: RPMI-1640, 0,01 М HEPES, 10% фетальной бычьей сывороткой (Sigma) 200 мМ L-глутамина, 100 мг/мл гентамицина. Раствор хлоркрезацина фильтруют через фильтры с диаметром пор 0,22 мкМ и вносят культуру мононуклеаров в конечной концентрации 20 мкг/мл (оптимальную дозу определяют предварительно).
Контрольные пробы инкубируют полной культуральной средой без хлоркрезацина. Оптимальное время подбирают экспериментально, отбирая для анализа из отдельных лунок планшеты аликвотных клеток через 1, 2, 3, 4, 6, 12 и 24 ч. Основные этапы выделения и культивирования МНПК проводят, как описано [16, 17]. Концентрации хлоркрезацина в культуральной среде и время инкубации подбирают в отдельной серии опытов.
3. Экспресс-выделение суммарных препаратов РНК. Для выделения суммарных препаратов РНК из аликвот культуры МНПК используют набор фирмы «Силекс-М» «Yellow Solve» и процедуру выделения осуществляют по рекомендуемому протоколу фирмы с учетом специфики экспериментов и поставленных задач. Для выделения суммарной РНК отбирают приблизительно 106 клеток из 12-луночной культуральной планшеты. Суспензию клеток (1-10 млн) гомогенизируют в 1 мл лизирующего раствора Yellow Solve до полного исчезновения комочков клеточного материала. Объем пробы не превышает 10% от объема лизирующего раствора Yellow Solve (т.е. не более 0,1 мл пробы на 1 мл Yellow Solve). Для удаления возможных примесей внеклеточного материала, полисахаридов и т.д. лизат центрифугируют при 10-15 тыс. об/мин в течение 5 мин. Отбирают прозрачный супернатант в стерильную пробирку. Добавляют к супернатанту 0,1 мл хлороформа, энергично перемешивая смесь на вортексе, и оставляют на столе на 20 мин, встряхивая пробирку примерно каждые 5 мин. При стоянии содержимое пробирки расслаивается на две фазы. Если этого не произошло, добавляют еще 0,1 мл хлороформа и повторяют процедуру. Пробирку центрифугируют при 10-15 тыс. об/мин в течение 5 мин. По окончании центрифугирования в пробирке образуются два слоя жидкости. Переносят верхний, содержащий РНК слой жидкости в чистую пробирку, стараясь не захватить белую белковую интерфазу, если таковая присутствует. Нижний слой жидкости, содержащий фенол, удаляют. К отобранному верхнему слою добавляют равный объем депротеинизирующего раствора GreenClean и энергично встряхивают смесь на вортексе 2-3 мин, после чего центрифугируют, как описано выше. Отбирают верхний, содержащий РНК, слой жидкости в чистую пробирку, замеряют его объем, добавляют к нему 2 объема 96%-ного этанола, хорошо перемешивают содержимое пробирки и помещают на 20-30 мин в морозильную камеру при -20°С для формирования осадка РНК. РНК осаждают центрифугированием при 10-15 тыс. об/мин в течение 10-20 мин. Спиртовой супернатант удаляют. К осадку РНК осторожно, по стенке пробирки, добавляют 0,5 мл 80%-ного этанола и центрифугируют при 10-15 тыс. об/мин в течение 15 мин. Следят, чтобы в процессе промывки осадок РНК не был смыт со дна пробирки и утерян. После удаления этанола еще раз откручивают (30 сек) пробирку с осадком РНК для полного удаления остатков спирта со стенок пробирки. Растворяют осадок РНК в воде (теперь - все процедуры при 4°С, т.е. во льду!), концентрацию и нативность полученного препарата РНК определяют спектрофотометрически с последующим электрофорезом в 1,2-1,5%-ной агарозе, приготовленной на однократном трис- боратном буфере (ТБЕ) и содержащем 0.3 мкг/мл бромистого этидия. Хранят препарат РНК при -20°С или ниже, либо в виде спиртового осадка при -20°С.
4. Синтез на матрице РНК кДНК. Для синтеза кДНК с использованием полученных препаратов суммарной РНК применяют реактивы фирмы Силекс М и прилагающиеся протоколы. Для синтеза кДНК в пробирке, помещенной в лед, смешивают следующие компоненты:
а) РНК матрица - 2 мкл (тотальная РНК 0.1-5 мкг) (поли(А)+РНК 10-0,5нг или специфическая РНК - 0.01 пг и меньше).
б) праймер - 1 мкл (специфический 15-20 пмолей, случайный гексапраймер 0,5 нг),
в) вода, свободная от рНаз - до 18 мкл.
1. Перемешивают, осаждают капли кратковременным центрифугированием. Смесь инкубируют 5 мин при 70°С, переносят пробирку в лед и собирают капли кратковременным центрифугированием.
2. Помещают пробирку в лед и добавляют следующие компоненты: - х 10-кратный ОТ буфер (фирма «Силекс-М» - 2,5 мкл;
- 1,5 мМ смесь дезоксинуклеотидтрифосфатов (dNTP) - 4 мкл;
- обратная транскриптаза вируса лейкемии мышей Молони - M-MLV (Moloney Murine Leukemia Virus) - 0,5 мкл.
3. Смесь инкубируют в течение 60 мин при 37°С (при использовании случайных гексапраймеров перед инкубацией при 37°С смесь инкубируют в течение 10 мин при 25°С). Реакцию останавливают прогреванием смеси в течение 10 мин при 70°С.
4. Смесь переносят в лед. Полученную кДНК используют либо сразу же для проведения РТ ПЦР, либо для синтеза второй цепи и последующего клонирования. Хранят полученную кДНК при -20°С, либо при -70°С.
5. Количественный анализ специфической мРНК триптофанил-тРНК-синтетазы. Количественный анализ специфической экспрессии гена ТРСазы проводят через оценку уровня специфической мРНК. При этом критерием оценки уровня мРНК служит количественный анализ суммарной кДНК, проводимый методом РТ-ПЦР. Реакцию РТ ПЦР проводят с использованием наборов реактивов фирмы «Синтол» (Комплект реагентов для проведения ПЦР-РВ в присутствии SYBR Green I Кат. номер R-402). Количественное определение уровня специфических кДНК для ТРСазы проводят на РТ-ПЦР приборе. Условия амплификации: денатурация при 95°С в течение 15 сек, отжиг при 60°С - 15 сек, и полимеризация при 72°С в течение 15 сек (сбор данных осуществляют на стадии полимеризации). Затравки сконструированы с использованием программы «Праймер Экспресс Версия 2.0», с применением дополнительной приставки к РТ-ПЦР прибору ABI Prism 7900НТ:
для β-актина:
- прямая = 5'-CTGGAACGGTGAAGGTGACA-3'
- обратная = 5'-CGGCCACATTGTGAACTTTG-3';
для кДНК копии мРНК ТРСазы:
- прямая = 5'-GAAAGGCATTTTCGGCTTCA-3'
- обратная = 5'-СAGCCTGGATGGCAGGAA-3''.
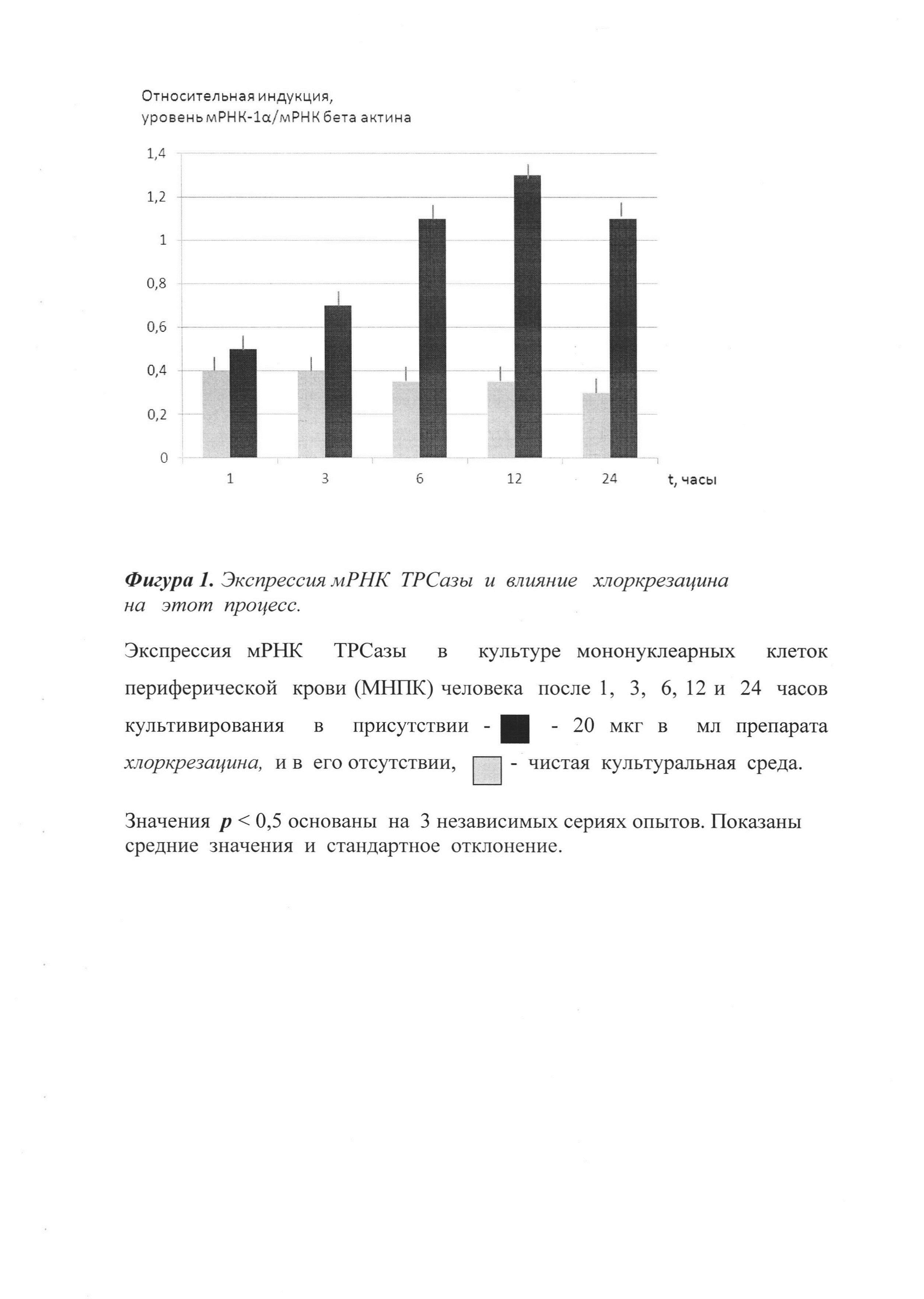
Все реакции проводят в сериях по 3 раза. Анализ полученных данных проводят с тем же пакетом программ (SDS2.1), прилагающихся к прибору ABI Prism 7900НТ. Уровень отклонений рассчитывают по программе с учетом оптимизации. Стандарты получают путем амплификации контрольных образцов в ПЦР реакции с теми же затравками, реактивами и условиями, оптимизированными для РТ-ПЦР. Измерения проводят относительно стандартных значений, при этом делают 4-кратные последовательные разбавления с целью получения стандартной кривой из 8 точек. Результаты представлены на фиг.1 в виде соотношения между изучаемым геном мишенью и мРНК β-актина.
Как следует из представленных графических данных, при введении хлоркрезацина значительно увеличивается экспрессия мРНК ТРСазы. Установлено, что хлоркрезацин повышает активность ТРСазы в дозе 15 мг/кг на 60% (фиг.1). В отличие от этого трекрезан (прототип) повышает активность ТРСазы лишь на 20% по сравнению с контролем, в дозе, почти вдвое большей (25 мг/кг), чем хлоркрезацин.
Таким образом, применение химического соединения - протатран 4-хлор-2-метилфеноксиацетата (хлоркрезацина) - приводит к достоверной активации экспрессии мРНК ТРСазы.
Изобретение позволит создать на его основе новые лекарственные средства для предотвращения склеротических поражений кровеносных сосудов.
ЛИТЕРАТУРА
1. Hansson G.K., Libby P. The immune response in atherosclerosis: a double-edged sword //Nat. Rev. Immunol., 2006, v. 6, p. 508-519.
2. Mangge H., Hubmann H., Pilz S., Schauenstein K., Renner W., Marz W. Beyond cholesterol-inflammatory cytokines, the key mediators in Atherosclerosis // Clin. Chem. Lab. Med., 2004, v. 42, p. 467-474.
3. Wakasugi K., Slike B.M., Hood J., Otani A., Ewalt K.L., Friedlander M., Cheresh D.A., Schimmel P. A human aminoacyl-tRNA synthetase as a regulator of angiogenesis // Proc. Natl. Acad. Sci. USA. 2002, v. 99(1), p. 173-177.
4. Tzima E., Reader J.S., Irani-Tehrani M., Ewalt K.L., Schwartz M.A., Schimmel P. Biologically active fragment of a human tRNA synthetase inhibits fluid shear stress-activated responses of endothelial cells // Proc. Natl. Acad. Sci. U S A. 2003, v. 100(25), p. 14903-14907.
5. Kisselev L.L., Justesenc J., Wolfson A.V., Frolova L.Yu. Diadenosine oligophosphates (ApnA), a novel class of signalling molecules? // FEBS Letters, 1998, v. 427, №2, p. 157-163.
6. Gaube F., Wolf S., Pusch L., Kroll T.C. and Hamburger M. Gene expression profiling reveals effects of Cimicifuga racemosa (L.) NUTT. (black cohosh) on the estrogen receptor positive human breast cancer cell line MCF-7 // BMC Pharmacology 2007, v. 7, p. 1471-1478.
7. Liu, J., Shue, E., Ewalt, K.L., Schimmel, P. A new γ-interferon-inducible promoter and splice variants of an anti-angiogenic human tRNA synthetase // Nucleic Acids Res. V.32, № 2, p.719-727, 2004.
8. Lee S.W., Cho B.H., Park S.G., Kim S. Aminoacyl-tRNA synthetase complexes: beyond translation // J. Cell. Sci. 2004; V. 117, N 17, p. 3725-34.
9. Нурбеков M.K., Фаворова O.O., Дмитренко С.Г., Болотина И.А., Киселев Л.Л. Роль ионов цинка в функционировании бычьей триптофанил-тРНК-синтетазы. // Молекулярная биология, 1981, т. 15, №5, стр. 1000-1010.
10. Wakasugi К. Human tryptophanyl-tRNA synthetase binds with heme to enhance its aminoacylation activity // Biochemistry. 2007, v. 46(40), p. 11291-11298.
11. Забазарных М.Ю., Литвинов Д.Ю. Форболовые эфиры стимулируют экспрессию гена триптофанил-тРНК-синтетазы человека//Биохимия, 2003, т. 68, №4, с. 592-597.
12. Smith K.J., Bleyer A.J., Little W.C., Sane D.C. The cardiovascular effects of erythropoietin.// Cardiovasc Res. 2003, v. 59(3), p. 538-548.
13. Расулов M.M., Нурбеков M.K., Буланова B.B., Караулова Л.К., Сусова М.И., Воронков М.Г. Средство, повышающее активность суммарной триптофанил - тРНК - синтетазы // патент RU №2407526 С1 от 27 дек, 2010.
14. Воронков М.Г., Власова Н.Н., Григорьева О.Ю. Способ получения 2-метил-4-галоген-феноксиацетатов трис-(2-гидроксиэтил)аммония (2-метил-4-галоген- феноксиацетоксипротатранов) // Патент RU 2427568 С2.
15. Софьина З.П., Воронков М.Г., Дьяков М.Г. и др. // Хим.-фарм. журн., 1978. Т. 12, №4. С. 74-77.
16. Смолина Т.П., Запорожец Т.С., Горшкова Р.П., Назаренко Е.Л. Ранняя активация лимфоцитов и моноцитов периферической крови человека компонентами проеобактерий Pseudoalteromonas nigrifaciens // Тихоокеанский медицинский журнал, 2009, №3, С. 45-48.
17. Nair М.Р., Mahajan S., Reynolds J.L., et al. The Flavonoid Quercetin Inhibits Proinflammatory Cytokine (Tumor Necrosis Factor Alpha) Gene Expression in Normal Peripheral Blood Mononuclear Cells via Modulation of the NF-β System // Clinical and Vaccine Immunology, 2006, Vol. 13, No. 3, p. 319-328.
Реферат
Изобретение относится к области биохимии, фармакологии, биологии и медицины. Предложено применение хлоркрезацина для стимуляции экспрессии матричной РНК триптофанил-тРНК-синтетазы. Изобретение обеспечивает создание новых лекарственных средств для предотвращения склеротических поражений кровеносных сосудов. 1 ил., 3 пр.

Комментарии