Способ стимуляции регенерации тканей - RU2480213C2
Код документа: RU2480213C2
Чертежи













Описание
ГОСУДАРСТВЕННАЯ ПОДДЕРЖКА
Изобретение выполнено при частичной поддержке гранта NIH No. CA103846-02 Национального Института Здоровья. Правительство Соединенных Штатов обладает определенными правами на настоящее изобретение.
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по предварительным заявкам на патент США № 60/853351, озаглавленной «Способ модуляции роста стволовых клеток крови», поданной 20 октября 2007 г., и № 60/853202, озаглавленной «Способ стимуляции регенерации тканей», поданной 20 октября 2007 г., а также испрашивается приоритет перед заявкой на международный патент WO 2007/112084 A2, озаглавленной «Способ модуляции роста стволовых клеток крови», поданной 26 апреля 2007 г. Все заявки поданы Леонардом И. Зоном, Тристой Е. Норт и Вольфрамом Гесслингом, полностью включены в настоящую заявку в виде ссылок.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение связано с модуляторами, стимулирующими или ингибирующими развитие или регенерацию тканей in vitro, in vivo и ex vivo. В частности, например, модуляторы, взаимодействующие с сигнальными путями простагландина или wnt, могут использоваться для стимуляции регенерационного ответа тканей в таких органах, как печень, стволовые клетки крови, кожа, сосуды и другие органы, способные к регенерации.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Регенеративная медицина обладает исключительным потенциалом для развития способов лечения, способных изменить будущее пациентов, утративших органы в результате несчастного случая, дефекта или заболевания. Понимание сигнальных путей, связанных с развитием, может оказаться ключом не только к регенерации тканей, но и к ингибированию рака.
Например, в процессе развития ткани печени из разных участков недифференцированного слоя зародышевой энтодермы формируются печень, кишечник, поджелудочная железа и вспомогательные органы благодаря действию различных сигнальных путей. Пластичность энтодермальных предшественников на ранних стадиях развития, а также механизмы, регулирующие судьбу клеток энтодермы и последующий рост органов, полностью не исследованы. Печень сохраняет способность к заживлению и регенерации и во взрослом организме, и, таким образом, исследование сигнальных путей, регулирующих развитие печени, может прояснить механизмы гомеостаза и регенерации тканей. Поскольку ступенчатая прогрессия заболевания включает реакцию базовых клеточных программ пролиферации и дифференцировки, углубленное понимание тканевого органогенеза может привести к обнаружению мишеней для фармацевтического вмешательства, воздействие на которые приведет к ингибированию канцерогенеза или, напротив, к усилению регенерации тканей.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Композиции и способы согласно настоящему изобретению связаны с модуляторами тканевого роста, представляющими собой агенты, стимулирующие рост и развитие тканей либо ингибирующие развитие тканей сообразно конкретным показаниям. Эти модуляторы действуют путем стимуляции или подавления сигнальных путей, играющих важную роль в росте или регенерации.
Например, воздействие на сигнал wnt может привести к стимуляции регенерации тканей, в особенности регенерации печени, репопуляциикрови, роста сосудов и заживления ран. Активаторы сигнального пути wnt могут использоваться для стимуляции этих процессов во время развития и регенерации, такой модулятор может представлять собой синтетический или растворимый лиганд wnt, ингибитор деградации β-катенина или ко-активатор транскрипции.
Сигнальный путь простагландина взаимодействует с сигнальным путем wnt и, таким образом, может использоваться для изменения активности wnt c целью воздействия на развитие и регенерацию тканей. Модулятор согласно изобретению может представлять собой вещество, воздействующее на сигнал простагландина или его низлежащих эффекторов, и может использоваться для модификации сигнала wnt во время развития органов и регенерации. Например, можно напрямую воздействовать на низлежащие эффекторы активации простагландинового рецептора, такие как цикло-АМФ, PIЗ-киназа и протеинкиназа А, с целью воздействия на сигнальный путь wnt.
Модуляторы простагландинового сигнального пути также могут использоваться в качестве механизма регуляции активности wnt, что дает возможность «тонкой настройки» сигналов роста и регенерации. Например, усиление сигнала wnt может стимулировать рост тканей, и для ослабления или прекращения этого эффекта по достижению желаемого результата может использоваться индометацин.
Кроме того, модуляторы сигнальных путей простагландина и wnt могут использоваться совместно для повышения/стимуляции тотальной активности wnt, что позволяет избежать токсических эффектов высоких доз или повторного дозирования вещества/способа, необходимых для прямой активации сигнального пути wnt. Настоящее изобретение подтвердило каждое из этих положений как для эмбрионов рыб, так и для взрослых рыб, а также для взрослых млекопитающих.
Модуляторы сигнальных путей wnt или простагландина могут использоваться для стимуляции регенерации печени после токсического повреждения, такого как отравление ацетаминофеном, после хирургической резекции опухолей или болезненной ткани печени, или после резекции части здоровой печени донора для трансплантации органа. Эти модуляторы могут вводиться системно или путем прямого введения в печень, такого как инфузия в воротную вену. Далее модификаторы простагландина могут использоваться ex vivo и in vitro для стимуляции роста стволовых клеток печени и гепатоцитов в культуре при подготовке трансплантатов гепатоцитов или аппаратов «искусственная печень» для пациентов с фульминантной печеночной недостаточностью.
Далее модуляция сигнала wnt напрямую или с помощью воздействия на сигнальный путь простагландина может использоваться в других тканях для стимуляции заживления и регенерации органов, в особенности для роста и гомеостаза стволовых клеток крови, заживления ран, роста и регенерации сосудов, а также заживления и регенерации других органов, таких как сердце и нервная система.
В общем случае вещества согласно изобретению могут вводиться в организм пациента системно, направленно в конкретный орган или ex vivo в клетки или ткань органа.
Воздействие на сигнальный путь простагландина может осуществляться фармацевтическим способом, таким как направленное применение активаторов или ингибиторов различных компонентов сигнального пути простагландина. В качестве альтернативы может применяться генная терапия требуемого органа с помощью вирусов или других способов с целью регуляции сигнального пути простагландина.
В одном воплощении предоставляется способ стимуляции роста тканей в организме субъекта, включающий введение как минимум одного модулятора и фармацевтически приемлемого носителя.
Например, модуляторы, стимулирующие развитие тканей и гомеостаз тканей во взрослом организме, включают диметилпростагландин-Е2 (dmPGE2) и агенты, стимулирующие сигнальный путь PGE2.
В другом воплощении модулятор развития тканей стимулирует рост путем воздействия на сигнальный путь Wnt. Модуляторы, стимулирующие рост тканей, например регенерацию печени, восстановление стволовых клеток крови, заживление ран или восстановление тканей других органов путем прямого воздействия на сигнальный путь wnt, включают, например, BIO, или LiCl, или другие вещества, воздействующие на сигнальный путь wnt на любом уровне сигнального каскада wnt.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
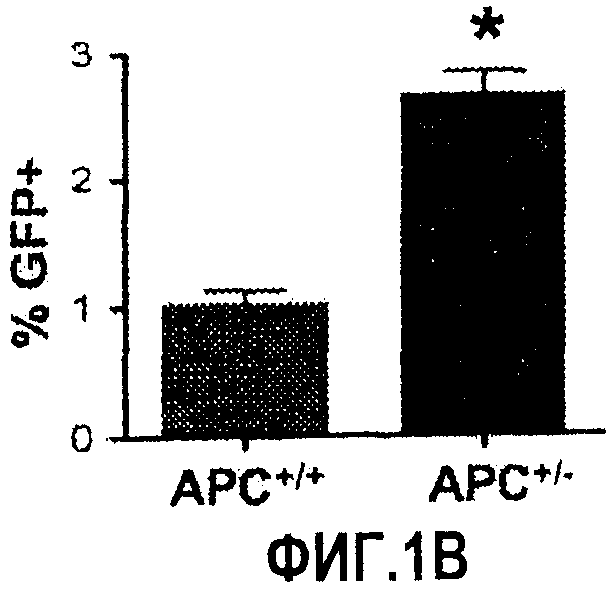
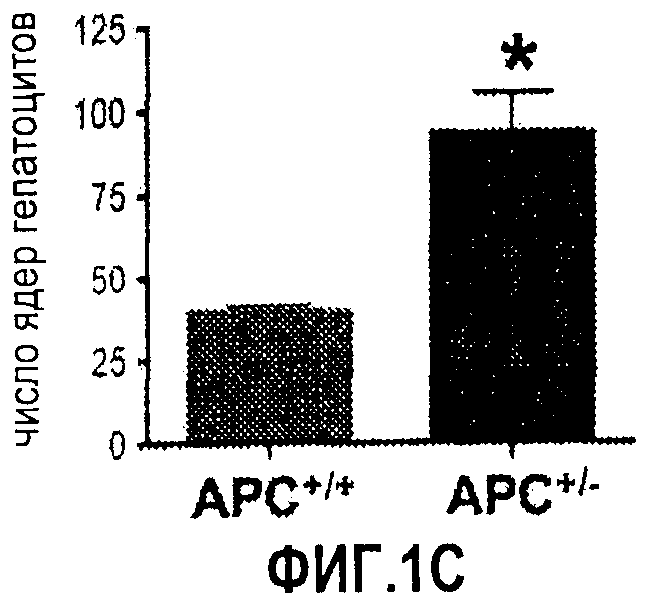
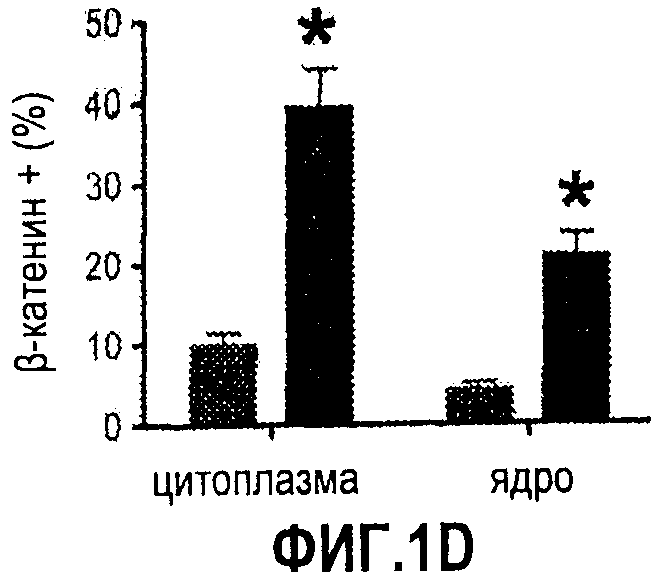
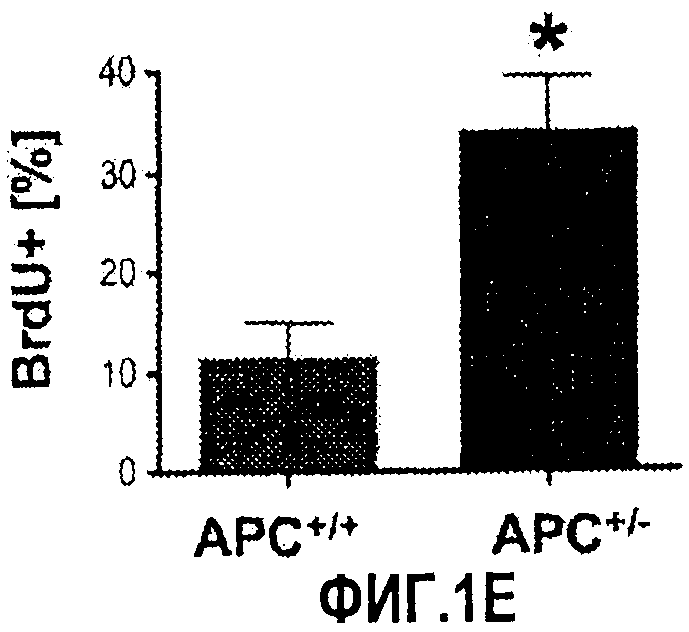
Фиг. 1. Усиление сигнала wnt/β-катенина влияет на размер печени. На фиг. 1А сравнивается размер развивающейся печени у данио рерио дикого типа (нормальных) и мутантов APC+/-. На фиг. 1В сравнивается число GFP-положительных гепатоцитов у гибридов APC+/-/LFABP:GFP по данным цитометрического анализа. Фиг. 1С иллюстрирует увеличение количества гепатоцитов на гистологических срезах мутантов APC+/-по сравнению с контрольными рыбками. На фиг. 1D приведены данные иммуногистохимического анализа β-катенина через 96 часов после оплодотворения (hours post-fertilization, hpf), показывающие усиление как ядерной, так и цитоплазматической окраски в мутантах APC+/-по сравнению с диким типом. На фиг. 1Е показано, что у эмбрионов APC+/- наблюдается усиленное включение BrdU на соответствующих срезах печени. *= статистически достоверная разница.
Фиг. 2. Повышенная активность wnt ускоряет регенерацию печени. На фиг. 2А показаны границы резекции у взрослых данио, подвергнутых частичной гепатэктомии. На фиг. 2B приведен график результатов морфометрического анализа регенерации нижней доли печени, показывающих, что активация wnt дает преимущество в регенерации по сравнению с рыбками дикого типа, а ингибирование wnt ослабляет регенерацию печени.
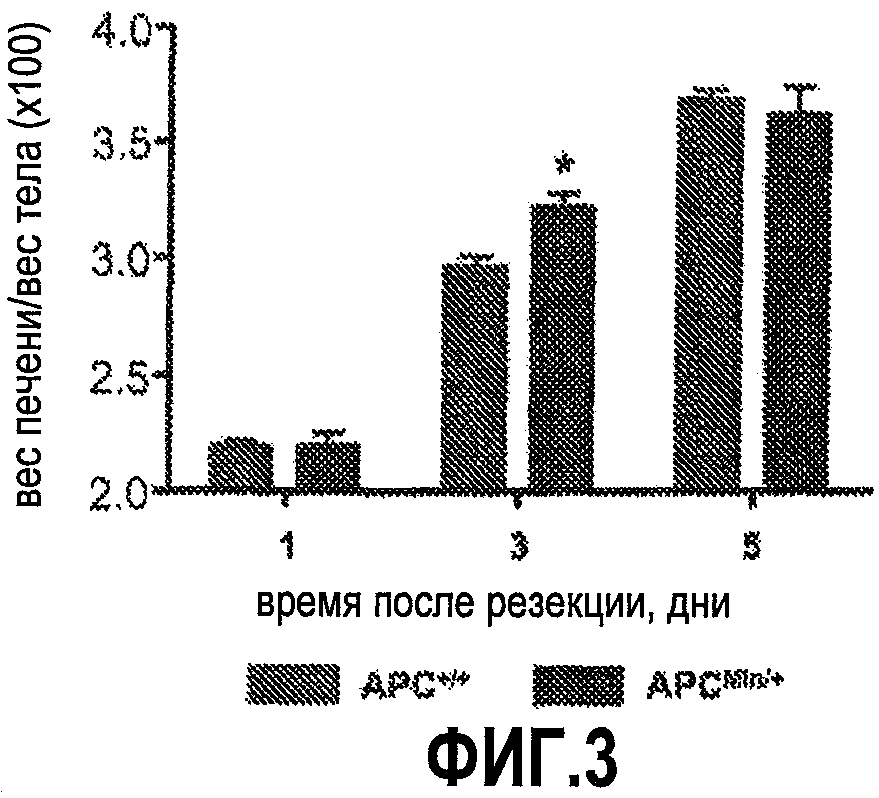
Фиг. 3. Ускорение регенерации печени, опосредованное wnt, является эволюционно консервативным. Гетерозиготность по гену APC у мышей APCMin/+ приводит к преимуществу в росте при регенерации печени после частичной гепатэктомии (2/3 печени). *= статистически достоверная разница.
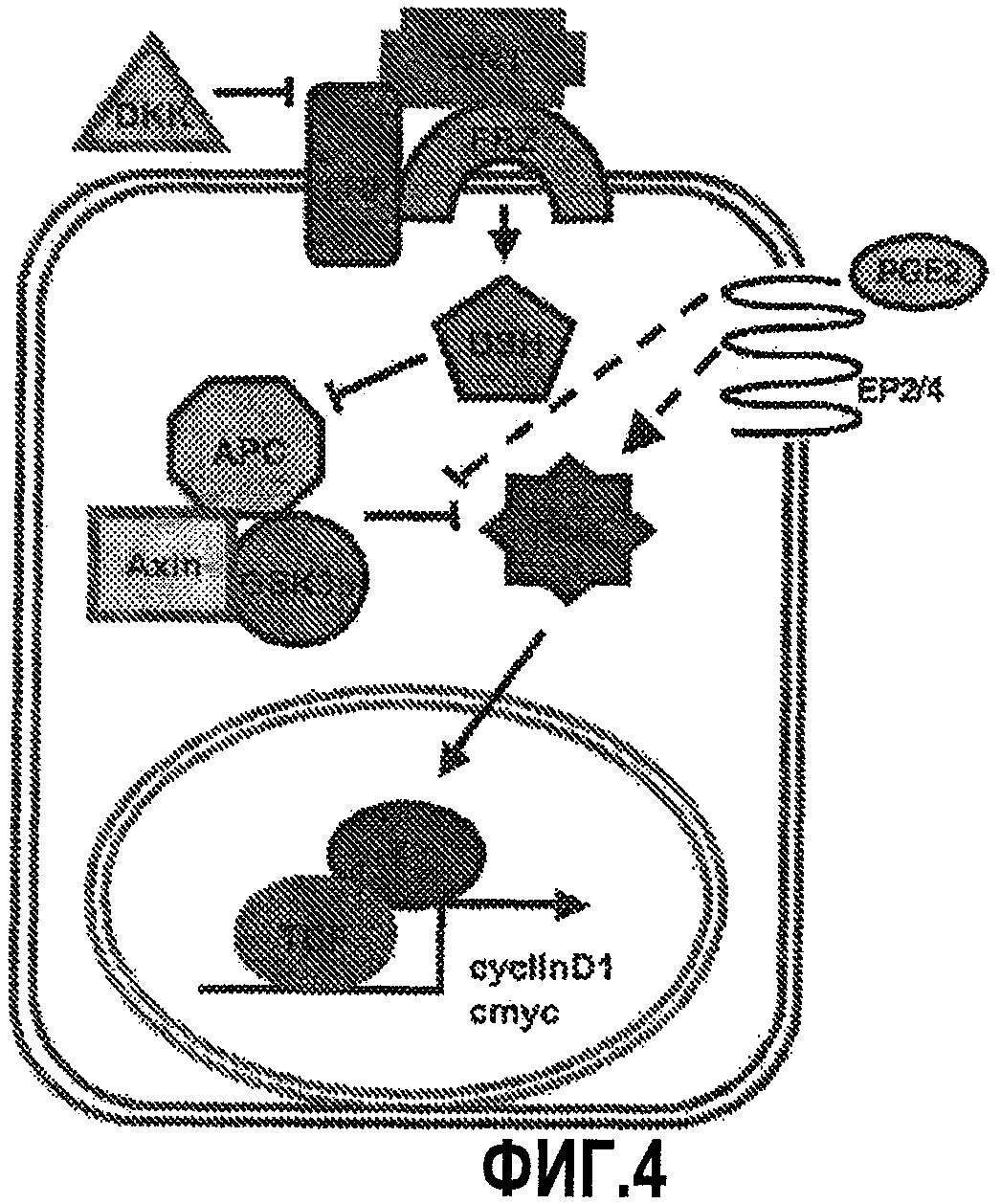
Фиг. 4. Диаграмма сигнального пути wnt, показывающая потенциальные точки взаимодействия с сигнальным путем простагландина.
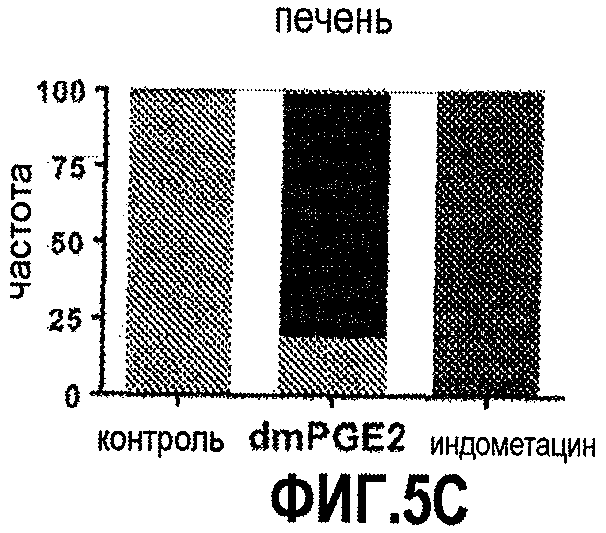
Фиг. 5. Вляние модулирования простагландина на активность wnt у развивающихся данио. На фиг. 5А показана схема эксперимента, позволяющего определить активность wnt у рыбок TOP:dGFP. На фиг. 5B показано усиление активности wnt в мозге после введения PGE2 и ослабление активности wnt после воздействия индометацина. На фиг. 5C и 5D показаны сходные эффекты, наблюдаемые в развивающихся печени и кишечнике, соответственно.
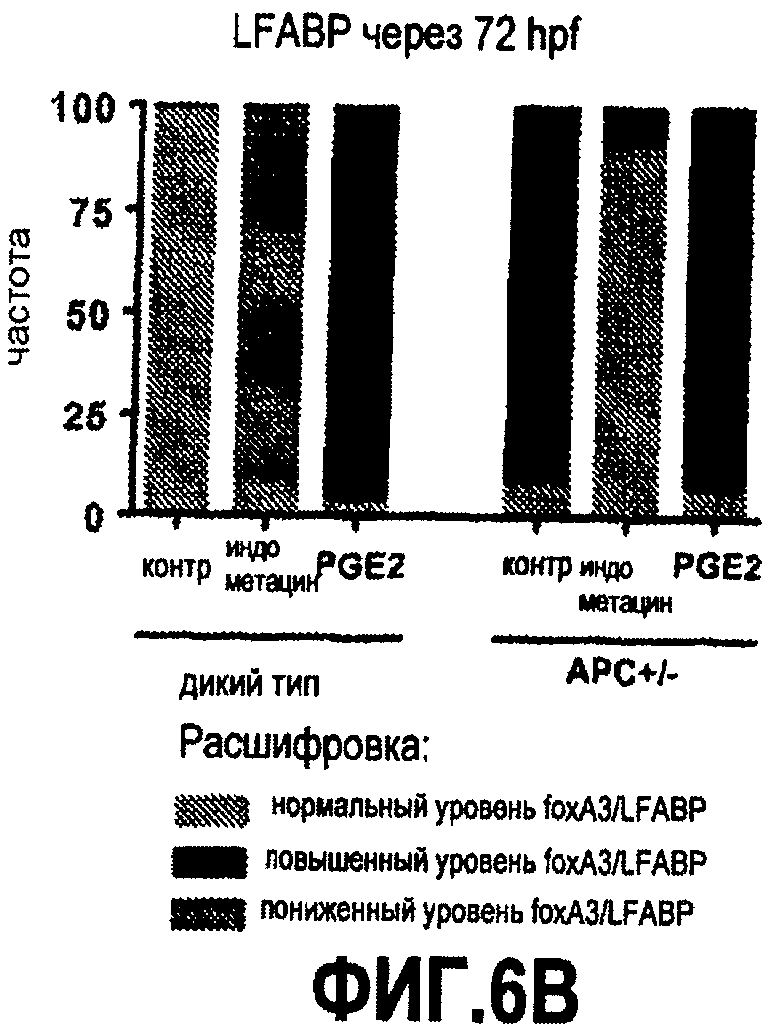
Фиг. 6. Влияние модуляции простагландина, активации цАМФ и активности wnt на развитие энтодермы и печени. На фиг. 6А приведены эффекты индометацина и форсколина (активатора цАМФ) у данио дикого типа и APC+/-на популяцию энтодермальных клеток-предшественников, показывающие, что низлежащие медиаторы сигнала простагландинов могут вызывать эффекты, сходные с эффектами самих простагландинов. Фиг. 6B иллюстрирует влияние PGE2 и индометацина на морфологию печени.
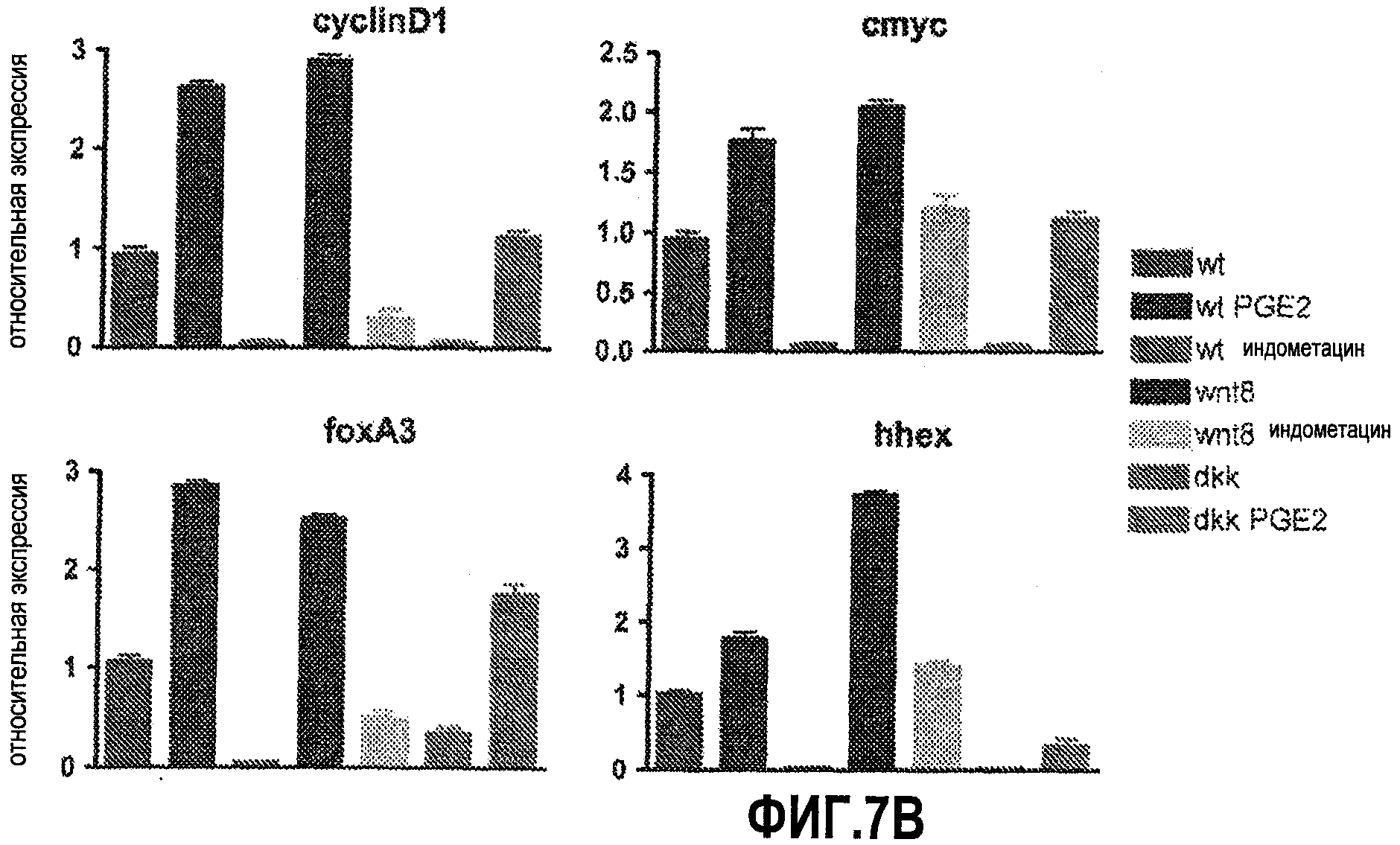
Фиг. 7. Модуляторы сигнального пути простагландина модифицируют влияние активности wnt на экспрессию генов-мишеней. На фиг. 7А показан один подход к анализу модуляторов сигнального пути простагландина с использованием модели данио. Фиг. 7B иллюстрирует влияние модуляторов простагландина на экспрессию мишеней wnt и энтодермальных генов у рыбок дикого типа, wnt8 и dkk по данным количественной ПЦР.
Фиг. 8. Сигнал простагландина модифицирует регенерацию печени. На фиг. 8A и 8B показаны подходы к анализу модуляторов сигнального пути простагландина с использованием модели данио путем измерения размера печени во время регенерации или анализа экспрессии генов, участвующих в этом процессе. На фиг. 8C показано, что ингибирование синтеза простагландинов ослабляет экспрессию мишеней wnt при регенерации печени.
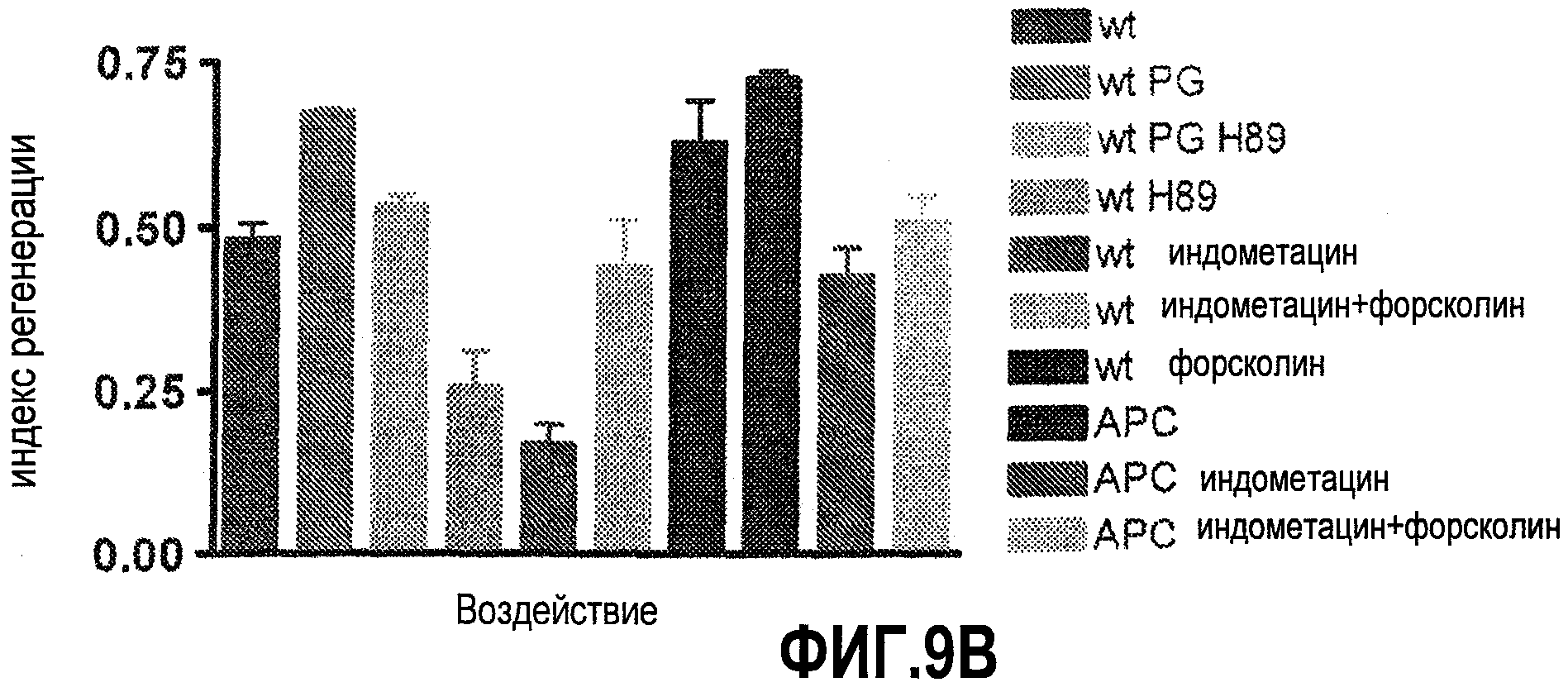
Фиг. 9A и 9B. Модуляция простагландина и активности wnt влияет на регенерацию печени. На этих фигурах показано, как простагландин и активация wnt, а также вещества, воздействующие на эти сигнальные пути и их эффекторы, могут влиять на регенерацию печени у данио.
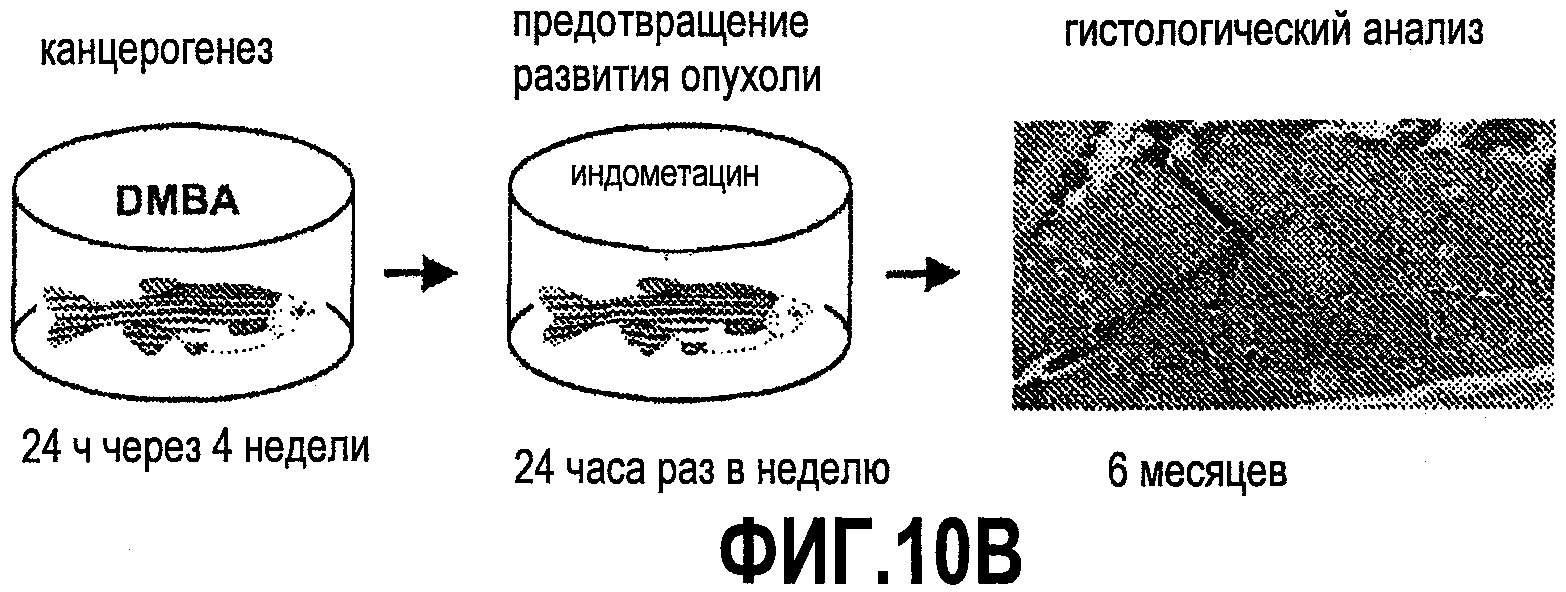
Фиг. 10. Влияние ингибирования простагландинов на рост опухоли печени. На фиг. 10A и 10B показаны подходы к анализу модуляторов сигнального пути простагландина на примере канцерогенеза у данио. На фиг. 10B приведена модель анализа возможного предотвращения формирования опухоли у рыбок APC+/-с помощью ингибирования синтеза простагландинов. На фиг. 10C показано снижение частоты возникновения опухолей, вызванное ингибированием синтеза простагландинов на этой модели.
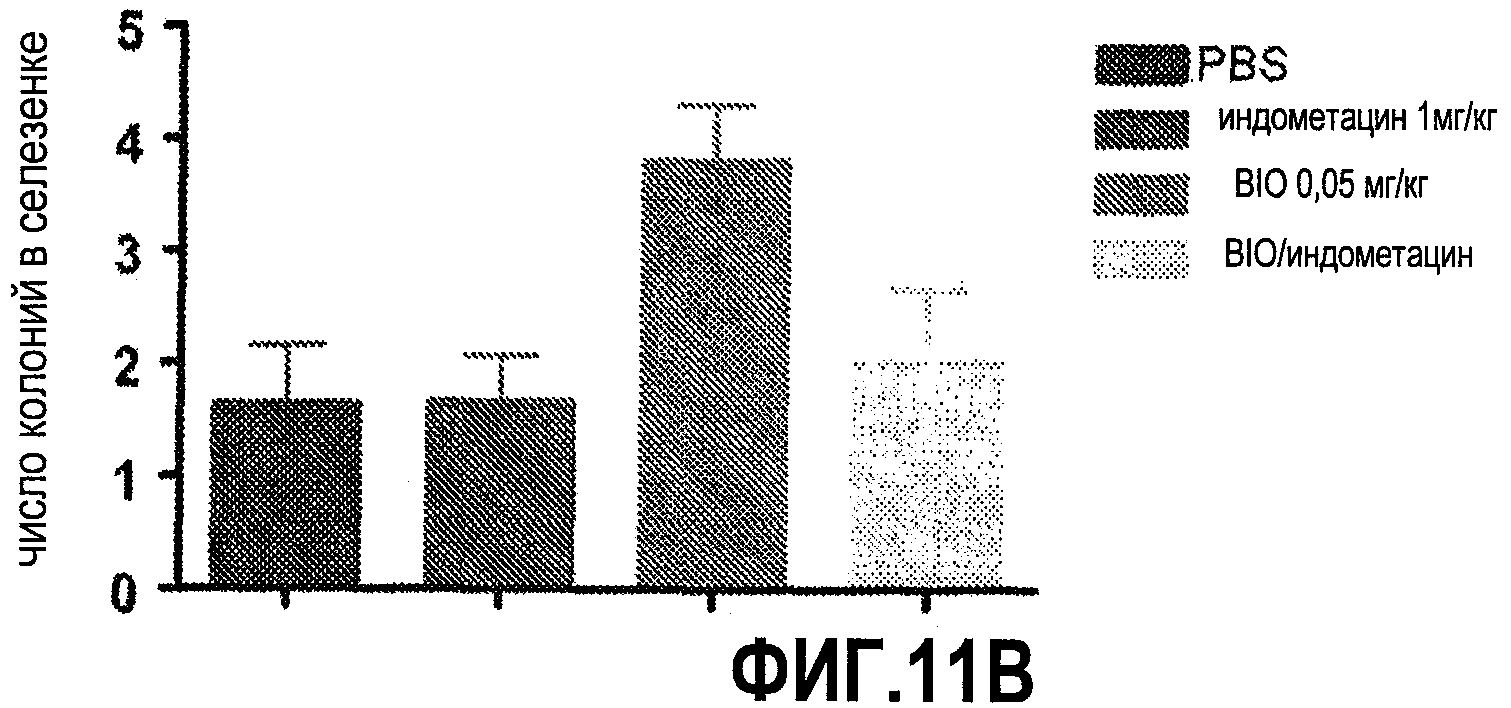
Фиг. 11. Влияние одновременной модуляции сигнальных путей wnt и простагландина на трансплантацию костного мозга мыши. На этой фигуре показано, что активация wnt с помощью BIO усиливала образование ранних колоний в селезенке вслед за трансплантацией костного мозга. Индометацин блокирует этот эффект.
Фиг. 12. Влияние модуляции простагландина и активации wnt на заживление ран у данио. Раны на коже после частичной гепатэктомии заживают быстрее и лучше в присутствии PGE2, а также у рыбок APC+/-. Воздействие индометацина резко угнетает заживление ран.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если в тексте не указано иначе, научные и технические термины, употребляющиеся в связи с настоящей заявкой, имеют значения, общепринятые среди специалистов в уровне техники. Далее, если из контекста не следует иначе, термины в единственном числе могут включать объекты во множественном числе, а термины во множественном числе могут включать объекты в единственном числе.
Следует понимать, что настоящее изобретение не ограничивается конкретной методологией, протоколами, реагентами и т.д., описанными в настоящей заявке, и, следовательно, может варьировать. Приведенная в настоящей заявке терминология используется исключительно для описания конкретных воплощений и не ограничивает намеренно объем настоящего изобретения, который задается исключительно формулой изобретения.
За исключением рабочих примеров или если не указано иначе, все значения, выражающие количества ингредиентов или условия реакции, используемые в тексте настоящей заявки, следует понимать во всех случаях как модифицированные термином «приблизительно». Термин «приблизительно» при употреблении с процентными соотношениями может означать ±1%.
Содержание всех обозначенных патентов и других публикаций включено в текст настоящего документа путем отсылки с целью описания и раскрытия, например, методологий, описанных в таких публикациях, которые могут быть использованы в связи с настоящим изобретением. Эти публикации приведены исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в этой связи не должно истолковываться как признание того, что авторы изобретения не имеют права датировать задним числом такое раскрытие на основании предшествующего изобретения или по каким-либо другим причинам. Все утверждения, касающиеся даты представления или содержания этих документов, основываются на информации, доступной для заявителей и не содержат признания истинности дат или содержания этих документов.
Сигнальные пути, участвующие в развитии, представляют собой ключ к раскрытию возможностей регенерации тканей взрослого организма и ингибирования канцерогенеза. Настоящее изобретение дает представление о регуляции роста стволовых клеток крови у эмбрионов и взрослых организмов. Настоящее изобретение также дает представление о регуляции роста печени у эмбрионов и взрослых организмов, включая рост печени после резекции органа.
В воплощении настоящего изобретения представлена манипуляция генетическим взаимодействием между сигнальными путями PGE2 и wnt/β-катенина, которые регулируют специализацию стволовых клеток во время развития, а также регенерацию. Вкратце, простагландин (PG) E2 необходим для образования и функционирования стволовых клеток крови (hematopoietic stem cells, HSC) in vivo, однако механизм его действия на эти клетки не раскрыт полностью (см. North et al., 447(7147) Nature 1007-11 (2007)). Исходя из клинических наблюдений пациентов с мутациями APC, основного регулятора сигнального пути wnt/β-катенина (Cruz-Correa et al., 122(3) Gastroenterology 641-45 (2002)) и данных, полученных in vitro (Castellone et al., 310 Science 1504-10 (2005)), можно предположить, что сигнальные пути простагландина и wnt/β-катенина взаимодействуют. Сигнальный путь wnt осуществляет положительную регуляцию гомеостатической функции HSC во взрослом организме (Reya et al., 423 Nature 409-14 (2003)), но его роль в формировании HSC не исследована. Чтобы продемонстрировать прямое взаимодействие сигнальных путей PGE2 и wnt in vivo, на эмбрионы данио TOP:dGFP-репортер wnt воздействовали стабильным dmPGE2 (10 мкМ), производным PGE2, и индометацином (10 мкМ), неселективным ингибитором циклооксигеназ (cyclooxygenases, cox). Гибридизация GFP in situ показала резкое повышение активности wnt во всем эмбрионе в ответ на воздействие dmPGE2 (в 99/111 случаев), в особенности в области «аорта-гонады-мезонефрос» (AGM), где формируются дефинитивные HSC (12±3,4 против 3±1,8 клеток). Воздействие индометацина ингибировало активность wnt в области AGM и значительно ослабляло экспрессию GFP во всем эмбрионе (72/87). Эти результаты подтвердились с помощью количественного ПЦР-анализа экспрессии GFP, при котором обнаружилось двукратное повышение активности wnt в экстрактах целых эмбрионов после воздействия dmPGE2, что свидетельствует о прямом влиянии PGE2 на сигнальный путь wnt.
Функциональные следствия взаимодействия PGE2 и wnt во время формирования HSC в эмбриональном развитии исследовали путем анализа экспрессии маркеров HSC runx1 и c-myb. Индукция wnt8, классического лиганда wnt, с помощью теплового шока на стадии десяти сомитов приводила к усиленному образованию HSC через 36 часов после оплодотворения (hpf; 47/54). Если после индукции wnt8 на эмбрионы воздействовали индометацином (10 мкМ, 16-36 hpf), формирование HSC снижалось до уровня дикого типа или ниже (43/46). Эти результаты показывают, что активность PGE2 необходима для проявления влияния активации wnt на развитие HSC.
Для локализации точки взаимодействия сигнальных путей PG и wnt использовались индуцируемые негативные регуляторы активности wnt в комбинации с воздействием dmPGE2. Dkk1 служит антагонистом сигнального пути wnt на уровне связывания с мембраной и инициализацией сигнального каскада wnt. Индукция Dkk в трансгенных эмбрионах hs:dkk1 приводила к ингибированию развития HSC (34/49). Добавление экзогенного dmPGE2 отменяло опосредованное dkk1 воздействие на формирование HSC (28/51, 10 мкМ, 16-36 hpf). Аксин представляет собой основной компонент комплекса деградации β-катенина и, таким образом, является негативным регулятором сигнального каскада wnt в цитозоле. При индукции на стадии десяти сомитов аксин в значительной степени ингибировал формирование HSC (47/52). Кроме того, воздействие dmPGE2 не отменяло этот эффект. Аналогичным образом, доминантно-негативная форма TCF, транскрипционного коактиватора β-катенина, ингибировала формирование HSC (60/62), и воздействие dmPGE2 не отменяло этот эффект. Из этих результатов видно, что сигнальные пути PG и wnt взаимодействуют на уровне комплекса деградации β-катенина, и это взаимодействие регулирует формирование дефинитивных HSC у эмбриона.
Сигнальный путь wnt может активно ускорять пролиферацию HSC путем сигнала в нише HSC, а также в самих HSC. PGE2 регулирует формирование HSC на уровне сосудистой ниши, а также в самих HSC (North et al., 2007). Для идентификации транскрипционных программ, которые регулирует сигнальный путь wnt, с помощью количественного ПЦР анализировали гены, участвующие в развитии HSC. Экспрессия маркеров стволовых клеток runx1 и cmyb значительно усиливалась в результате индукции wnt8, что соответствует данным по экспрессии, полученным способом гибридизации in situ. Напротив, в ответ на индукцию dkk1 наблюдалось значительное ослабление экспрессии runx1 и cmyb. Аналогичным образом уровни неспецифического сосудистого маркера flk1, а также специфического для аорты сосудистого маркера ephB2 повышались в ответ на wnt8 и понижались в ответ на индукцию dkk1. Эти эффекты в отношении сосудистой ниши и развивающихся в ней HSC можно модифицировать путем добавления соответствующего модулятора простагландинового сигнального пути: индометацина для wnt8 и dmPGE2 для dkk1, соответственно. Исходя из этих данных, можно предположить, что взаимодействие PGE2 и wnt, по крайней мере, частично влияет на формирование HSC путем регуляции уровня потенциала развития гематопоэтической ниши. Кроме того, анализ циклина D1, гена-мишени wnt, с помощью гибридизации in situ в области AGM, а также количественный ПЦР, выявил, что взаимодействие wnt и PGE2 также активируется и в самих HSC, что, по всей вероятности, влияет на их пролиферацию и самообновление.
Было высказано предположение, что активация wnt регулирует самообновление и репопуляцию HSC. Однако также считается, что активация wnt участвует в процессе канцерогенеза, что делает концепцию прямого усиления сигнала wnt сомнительной. Путем анализа восстановления кроветворения после облучения у данио определяли, может ли регуляция активности wnt с помощью простагландина эффективно влиять на гомеостаз HSC у взрослых организмов. Ранее было показано, что воздействие PGE2 значительно усиливает регенерацию и что его эффекты в отношении количества стволовых клеток и клеток-предшественников легко обнаруживаются через 10 дней после облучения; отсутствие PGE2 подавляло пролиферацию стволовых клеток и клеток-предшественников. По данным FACS-анализа на рыбках TOP:dGFP-репортер после облучения активность wnt в мозговом веществе почки повышается в 2 раза. Кроме того, индукция wnt8 через 24-36 часов после облучения приводила к 2,5-кратному увеличению популяции стволовых клеток и клеток-предшественников через 10 дней после облучения. Ингибирование cox индометацином значительно ослабляло этот эффект. Консервативность этого взаимодействия у позвоночных была показана на мышиной модели конститутивной активации wnt. У мышей APCMin/+ наблюдается повышенный уровень β-катенина из-за потери функции APC в комплексе деградации. Перед началом эксперимента у таких мышей наблюдается нормальная лейкоцитарная формула, так же как у контрольных сибсов. После воздействия 5-FU у мышей APCMin/+ наблюдалась усиленная регенерация костного мозга по сравнению с контрольной группой. Воздействие индометацина (1 мг/кг каждые 48 часов) значительно уменьшало пролиферативное преимущество у мышей APCMin/+. Эти данные подтверждают, что взаимодействие PG и wnt регулирует гематопоэтический гомеостаз у позвоночных.
Чтобы оценить возможное влияние уровня простагландинов на активность wnt в HSC, проводили трансплантационный анализ на мышах с использованием выделенных HSC. Клетки костного мозга cKit+Sca1+Lineage- (KSL), изолированные с помощью проточной цитометрии, трансплантировали реципиентам, получившим смертельную дозу радиации. На мышей-реципиентов воздействовали BIO (ингибитор GSK; 0,05 мг/кг), индометацином (1 мг/кг и 2,5 мг/кг) или обоими веществами в комбинации для одновременного воздействия на активность wnt и уровень PG. В ответ на воздействие BIO наблюдался статистически значимый прирост CFU-S12 (p=0,03), однако одновременное воздействие индометацина уменьшало количество CFU-S до контрольных значений. Эти результаты свидетельствуют о прямом взаимодействии PGE2 и wnt в HSC.
Чтобы определить, насколько консервативна регуляция популяции стволовых клеток и клеток-предшественников путем взаимодействия сигнальных путей PGE2 и wnt/β-катенина, исследовали энтодермальные клетки и клетки-предшественники печени у развивающихся данио. После воздействия индометацином у эмбрионов данио наблюдалась пониженная экспрессия foxA3 - маркера клеток-энтодермальных предшественников (67/71). В частности, наблюдалось заметное уменьшение развивающегося зачатка печени, что обусловливало меньший размер печени к 72 hpf (51/56), по данным анализа экспрессии белка печени, связывающего жирные кислоты (lfabp). Воздействие dmPGE2 приводило к увеличению популяции foxA3, увеличению зачатка печени (75/83) и увеличению размера печени (88/92), что указывает на неизвестную ранее роль сигнального пути PGE2 в развитии энтодермы. В foxA3-положительных клетках обнаруживаются различные компоненты сигнального пути PGE2, что подтверждает предыдущие данные.
Было показано, что сигнал wnt необходим для развития энтодермы и печени. Чтобы смоделировать конститутивную активацию сигнального пути wnt, использовались данио, мутантные по APC, чтобы охарактеризовать эффекты взаимодействия wnt и PG в foxA3+ энтодермальных предшественниках через 48 hpf. У эмбрионов APC+/- наблюдались повышенная экспрессия foxA3, увеличение зачатка печени (88/93) и увеличенный размер печени (68/75) по сравнению с сибсами дикого типа. Индометацин вызывал уменьшение количества foxA3-положительных клеток-предшественников (33/39) и размера печени (61/67) у эмбрионов APC+/-до уровней, наблюдаемых у необработанных контролей дикого типа, в то время как dmPGE2 чрезмерно увеличивал количество энтодермальных предшественников (47/54) и размер печени (75/81). Использование трансгенных линий с генами, индуцируемыми тепловым шоком, подтвердило, что, как и в HSC, взаимодействие сигнальных путей PG и wnt во время развития энтодермы имеет место на уровне комплекса деградации. Анализ способом количественного ПЦР выявил, что регулируются как маркеры энтодермальных предшественников (foxA3), так и маркеры предшественников печени (hhex), что позволяет предположить, что взаимодействие PG и wnt задействовано в разных популяциях клеток-предшественников во время развития энтодермы. Модуляция сигнального пути PG не влияет на экспрессию инсулина, что показывает, что регуляция PG/wnt не является общим регулятором для различных линий энтодермальной дифференцировки. Циклин D1 и cmyc регулировались во время развития как wnt, так и простагландином, что свидетельствует о том, что PGE2 может влиять на стволовые клетки путем стимуляции клеточного цикла и пролиферации.
На модели резекции печени у данио было четко показано, что и во взрослом организме сигнальные пути PG/wnt продолжают играть важную роль в гомеостазе печени. После частичной гепатэктомии (1/3 органа) печень данио регенерирует в течение 5-7 дней. У рыбок APC+/- этот процесс протекает быстрее. Воздействие индометацина в период 6-18 часов после резекции значительно понизило индекс регенерации как у контрольных рыбок, так и рыбок, мутантных по APC. Иммуногистохимическое окрашивание на β-катенин выявило усиление ядерной окраски у рыбок APC+/- после резекции. Индометацин приводил к падению общего уровня β-катенина а также к отсутствию ядерной окраски у рыбок дикого типа и APC+/-.
Для дальнейшего выяснения механизма влияния PGE2 на уровень β-катенина и подтверждения сохранения этого механизма в регенерации печени млекопитающих проводили опыты по частичной гепатэктомии у мышей дикого типа и APCMin/+. В этом случае мутация APC приводит к повышению уровня тотального и ядерного 2-катенина, в особенности в перипортальной области. Воздействие индометацина (2,5 мг/кг, два раза в день подкожно) приводило к значительному падению уровней β-катенина у обоих генотипов. Исследования клеток в культуре позволяют предположить, что PGE2 может повышать уровни β-катенина путем фосфорилирования и инактивации GSK3b с помощью активации аденилатциклазы и протеинкиназы А (PKA); иммуногистохимический анализ P-GSK3B (по Ser9) выявил понижение уровня фермента после воздействия индометацином у мышей как дикого типа, так и APC+/-. Эти данные были подтверждены с помощью вестерн-блот анализа. β-катенин может усиливать пролиферацию клеток путем воздействия на свою мишень - циклин D1. У мышей APCMin/+ наблюдался повышенный уровень циклина D1 и, следовательно, ускоренная пролиферация клеток, измеренная путем анализа включения BrdU, которые резко падали после воздействия индометацина.
Функциональное взаимодействие сигнальных процессов у данио ниже PG исследовали путем повышения продукции цАМФ с помощью форсколина и ингибирования PKA с помощью H89. Как в HSC, так и в энтодермальных предшественниках форсколин оказывал стимулирующее воздействие, сходное с воздействием dmPGE2. Как у рыбок дикого типа, так и у трансгенных рыбок wnt8 форсколин оказался способным обратить ингибирующий эффект индометацина. Ингибирование PKA с помощью H89 ослабляло усиленное образование HSC, индуцированное dmPGE2. Кроме того, восстановления эффектов dkk dmPGE2 не происходило в присутствии H89. Исходя из этих данных, можно предположить, что действие PGE2 путем активации цАМФ и PKA и последующей инактивации GSK3b приводит к повышению уровня β-катенина в различных популяциях стволовых клеток и клеток-предшественников.
В другом воплощении настоящего изобретения рассматривается роль сигнального пути wnt/β-катенина в процессах развития и роста печени. Вкратце, у эмбрионов, гетерозиготных по гену adenomatous polyposis coli (APC+/-), который является центральным регулятором сигнального пути wnt, развивается печень большего размера. Напротив, у эмбрионов APC-/- печень не закладывалась. Оба APC-фенотипа печени опосредованы усилением сигнала wnt и повышенным внутриклеточным уровнем β-катенина. С помощью трансгенных данио, экспрессирующих индуцируемые активаторы и репрессоры сигнального пути wnt/β-катенина, удалось показать, что зависимость от wnt в процессе эмбриогенеза имеет двухфазный характер: подавление сигнала wnt необходимо после завершения гаструляции для спецификации судьбы клеток печени; напротив, активация сигнала wnt необходима для нормального роста печени. Для выявления функциональной необходимости сигнала wnt при регенерации печени проводили резекцию печени у данио и мышей. Примечательно, что у гетерозигот по APC наблюдалась ускоренная регенерация печени, в то время как ингибирование сигнала wnt резко ослабляло рост органа. В настоящем изобретении описывается эволюционно консервативная роль сигнального пути wnt/β-катенина в процессах закладки энтодермальных органов, роста гепатоцитов и регенерации печени, что может иметь значение для регенеративной медицины.
В другом воплощении настоящего изобретения рассматривается роль сигнального пути простагландина в качестве мощного модулятора роста печени. Инкубация эмбрионов данио с ингибиторами cox1, cox2 или обоих ферментов (например, индометацин) приводила к выраженному уменьшению размера печени через 72 часа после оплодотворения по сравнению с контролем. Напротив, воздействие диметил-простагландина E2 (dmPGE2) стимулировало развитие печени. Нокдаун cox1 или cox2 с помощью морфолино также приводил к ингибированию роста, однако рост полностью возобновлялся при воздействии экзогенного dmPGE2. У взрослых данио, подвергнутых частичной гепатэктомии, в присутствии индометацина регенерация печени значительно ослаблена по сравнению с контролем. При ингибировании cox также не происходило заживления ран. Напротив, воздействие dmPGE2 после резекции вело к усилению регенерации печени с заметно улучшенной васкуляризацией печени по сравнению с контрольными рыбками. У рыбок, обработанных dmPGE2, также наблюдали ускоренное заживление ран. Сходные эксперименты на данио показали, что dmPGE2 может ускорять репопуляцию мозгового вещества почки после травмы. Таким образом, регуляция простагландинового сигнального пути может влиять на заживление и регенерацию в разных типах тканей, таких как сердечная, костная и поврежденная ткани.
Участки недифференцированного энтодермального зародышевого слоя, из которого формируются почки, кишечник, поджелудочная железа и вспомогательные органы, определяются действием различных сигнальных путей (Cui et al., 180 Dev. Biol. 22-34 (1996); Zaret, 3 Nat. Rev. Genet. 499-512 (2002)). Сигнал wnt, передающийся через его главный транскрипционный медиатор β-катенин, играет важную роль в определении характера закладки тканей, судьбы клеток, а также пролиферации клеток во многих эмбриональных контекстах, включая развитие и дифференцировку органов (Clevers, 127 Cell 365-69 (2006)). В отсутствие сигнала wnt β-катенин фосфорилируется комплексом деградации, состоящим из аксина, APC и киназы гликогенсинтазы (GSK) 3β, и направляется на деградацию. Связывание лиганда wnt c поверхностными рецепторами приводит к аккумуляции β-катенина в цитоплазме и транслокации его в ядро, где он регулирует экспрессию генов.
В новообразованиях желудочно-кишечного тракта часто обнаруживаются мутации различных компонентов сигнального пути wnt/β-катенина. Наиболее известны мутации в гене APC, ведущие к развитию рака кишечника в молодом возрасте (Kinzler et al., 251 Sci. 1366-70 (1991)). У детей, несущих мутацию APC, вероятность развития эмбриональной формы рака печени (гепатобластомы) повышена в 1000 раз (Hirschman et al., 147 J. Pediatr. 263-66 (2005)). В гепатоцеллюлярной карциноме (HCC) обнаруживаются мутации β-катенина, а также AXIN-1 и AXIN-2 (Taniguchi et al., 21 Oncogene 4863-71 (2002)). Исходя из распространенности дефектов компонентов сигнального пути wnt, обнаруживаемых как в недифференцированных, так и в дифференцированных новообразованиях печени, можно предположить, что сигнал β-катенина регулирует различные аспекты развития печени.
В процессе эмбриогенеза печень развивается из клеток-предшественников передней энтодермы. Вслед за схождением энтодермальных предшественников к средней линии начинается пролиферация и спецификация клеток энтодермального выроста. У эмбриона данио энтодермальные предшественники, позже развивающиеся в печень, идентифицируются через 22-24 часа после оплодотворения (hpf) в виде утолщения передней энтодермы (Field et al., 253 Dev. Bio. 279-90 (2003)). При дальнейшем развитии энтодермы появляется эмбриональная печень в виде почки, выступающей влево от средней линии поверх желточного мешка. Транскрипция печень-специфических генов начинается в клетках-предшественниках печени между 28 hpf и 30 hpf. К 48 hpf печень сформирована полностью, и в ней экспрессируются гены, специфичные для зрелой печени, такие как ген белка печени, связывающего жирные кислоты (LFABP; Her et al., 538 FEBS Lett 125-33 (2003)). Развитие печени продолжается по мере роста печени данио вперед и влево. Механизмы инициации и регулирования спецификации клеток, формирования зачатка и роста печени высоконсервативны у позвоночных.
Сигнал wnt необходим для развития энтодермы, что впервые было показано для C. Elegans, и это требование является эволюционно консервативным (Lin et al., 83 Cell 599-609 (1995)). Гомозиготная делеция β-катенина у мышей приводила к гибели эмбрионов на ранних стадиях развития, что замедлило прогресс исследования роли сигнального пути Wnt/β-катенина в развитии энтодермы позвоночных (Haegel et al., 121 Devel. 3529-37 (1995)). Мутация APCMin также приводит к гибели эмбрионов мышей-гомозигот, однако гетерозиготы жизнеспособны и склонны к образованию опухолей во взрослом состоянии (Su et al., (1992)). У Xenopus wnt необходим во время гаструляции для правильной закладки органов (Heasman et al., (2000)). Используя индуцируемую инактивацию β-катенина, удалось показать, что сигнальный путь wnt/β-катенина необходим для развития кишечника и формирования архитектуры кишечника (Ireland et a., (2004)). Кроме того, Wnt-зависимая регуляция анатомии кишечных крипт также продолжается и во взрослом состоянии (Pinto et al., (2003)). Результаты недавних исследований роли сигнала Wnt во время развития печени противоречивы. Последние данные, полученные на Xenopus, позволяют предположить, что репрессия wnt в клетках-ранних энтодермальных предшественниках необходима для спецификации печени. Напротив, на данио, несущих мутацию wnt2b (prometheus), была показана необходимость мезодермальных сигналов wnt для регуляции роста печени (Ober et al., (2006)). Гомозиготные мутанты prometheus жизнеспособны, и у них в конечном итоге развивается печень. Это позволяет предположить, что корректная спецификация предшественников печени может происходить и без wnt2b, однако отсутствие сигнала wnt2 в мезодерме ослабляет начальную волну роста печени. Неизвестно, могут ли другие факторы wnt компенсировать отсутствие wnt2b в отношении спецификации печени или wnt не является необходимым для дальнейших фаз пролиферации гепатоцитов.
С помощью метода TILLING (targeting induced local lesion in genomes, направленное индуцирование локальных повреждений генома) ранее были идентифицированы данио, несущие мутацию в гене APC (Hurlstone et al., 425 Nature 633-37 (2003)). Мутанты APC+/-гибнут к 96 hpf, но рыбки APC+/-жизнеспособны, однако имеют повышенную склонность к образованию спонтанных опухолей желудочно-кишечного тракта (Haramis et al., (2006)). Опухоли печени, возникающие у данио, несущих мутацию APC+/-, напоминают гепатобластомы, что позволяет предположить, что мутация APC приводит к дефектной wnt-зависимой дифференцировке предшественников печени.
Путем использования данио, мутантных по APC, а также трансгенных данио, экспрессирующих индуцируемые активатор и репрессоры сигнала wnt/β-катенина, в настоящем изобретении описывается необходимость сигнала wnt/β-катенина в разные периоды времени в течение эмбрионального развития и при поддержании гомеостаза тканей во взрослом организме. Наблюдается дифференциальный эффект потери APC, что обусловливается изменением зависимости гепатогенеза от сигнала wnt в разные периоды времени. Активация Wnt влияет на судьбу энтодермальных предшественников, что приводит к усиленному развитию печени и кишечника за счет тканей поджелудочной железы.
Путем разработки модели частичной гепатэктомии у данио в настоящем изобретении демонстрируется необходимость сигнала wnt во время регенерации печени in vivo. Кроме того, в настоящем изобретении показывается консервативность роли усиленного сигнала wnt в улучшении процесса регенерации у данио и мышей. Из этих данных видно, что сигнал wnt/β-катенина является необходимым, строго регулируется в течение некоторых аспектов развития печени и играет ключевую роль в гомеостазе органа. Таким образом, настоящее изобретение представляет способ кратковременного усиления сигнала Wnt, что может послужить удобным механизмом усиления регенерации печени у млекопитающих и человека.
Скрещивание данио APC+/- с линией LFABD:GFP-репортер и наблюдение за развитием печени с помощью флуоресцентной микроскопии позволили прояснить дифференциальные эффекты потери APC на органогенез печени. К 72 hpf у эмбрионов APC+/- наблюдалось резкое увеличение размеров печени (265/297) по сравнению с сибсами дикого типа. Напротив, ни на одной стадии развития гомозиготных мутантных эмбрионов APC-/-не наблюдалось экспрессии LFABP (134/134). Чтобы убедиться, что наблюдаемые фенотипические изменения в развитии печени не были обусловлены простой вариацией экспрессии LFABP, проводили гибридизацию in situбелка-переносчика стеролов (sterol carrier protein) и трансферрина (transferrin) и получили сходные результаты.
Цитометрический анализ GFP-положительных клеток у потомков близкородственного скрещивания рыбок APC+/-:LFABP:GFP показал троекратное увеличение числа гепатоцитов у эмбрионов APC+/-и подтвердил отсутствие GFP-положительных гепатоцитов у мутантов APC+/-. Подсчет ядер гепатоцитов на соответствующих гистологических срезах подтвердил дифференциальный эффект потери APC на развитие печени; гистологический анализ показал полное отсутствие гепатоцитов у эмбрионов APC-/-, в то время как у эмбрионов APC+/- наблюдалось значительное повышение числа гепатоцитов по сравнению с диким типом. Разницы в общей морфологии клеток между образцами дикого типа и APC+/- не наблюдалось.
Поскольку APC является одним из регуляторов присутствия β-катенина в ядре, с помощью иммуногистохимического анализа (IHC) анализировали внутриклеточные содержание и локализацию β-катенина в гепатоцитах эмбрионов дикого типа и APC+/- через 72 hpf. В печени дикого типа основная масса β-катенина оказывалась связанной с мембраной. В печени эмбрионов APC+/- окрашивание на β-катенин было значительно более сильным, цитоплазматинческое окрашивание усиливалось в 4 раза, а ядерное - в 5 раз. Известно, что во многих тканях сигнал Wnt/β-катенина влияет на клеточный цикл, пролиферацию и апоптоз клеток (Alonso & Fuchs, 17 Genes Devel. 1189-1200 (2003); Pinto et al., 17 Genes Devel. 1709-13 (2003); Reya et al., 243 Nature 409-14 (2003)). Чтобы определить, было ли увеличение числа гепатоцитов у эмбрионов APC+/- обусловлено повышенной пролиферативной активностью, через 72 hpf исследовали включение BrdU. У эмбрионов APC+/- наблюдалось значительное повышение процента BrdU-положительных клеток в печени по сравнению с диким типом. Сходные результаты получали с использованием окраски на PCNA.
Несмотря на то, что отсутствие развития печени препятствовало изучению распределения β-катенина в гепатоцитах эмбрионов, в близлежащих энтодермальных тканях наблюдалось интенсивное окрашивание на β-катенин по всей длине желудочно-кишечного тракта, а также включение BrdU практически в каждой клетке. Аберрантный сигнал wnt, обусловленный потерей APC, в кишечнике и в развивающемся мозге приводит к блоку дифференцировки и, в конечном счете, к апоптозу (Chenn & Walsh, 297 Sci. 365-69 (2002); Sansom et al., 18 Genes Devel. 1385-90 (2004)). Для дальнейшего исследования причины неразвития гепатоцитов у эмбрионов APC+/- несмотря на сильный сигнал wnt, гистологические срезы эмбрионов APC+/- окрашивали по методу TUNEL. Большое количество TUNEL-положительных апоптотических клеток обнаруживалось по всей длине энтодермы, включая участок, на котором не происходило дифференцировки печени. Активность каспаз, которая является маркером апоптоза, была повышена в 2 раза у эмбрионов APC-/- по сравнению с контролем. Эти данные позволяют предположить, что отсутствие печени у мутантов APC+/- обусловлено гибелью энтодермальных предшественников.
Повышенный уровень β-катенина обуславливает дифференциальные фенотипы печени у мутантов APC. Выяснилось, что прогрессирующая потеря APC не связана линейно с размером печени. Чтобы продемонстрировать, что β-катенин обуславливает как увеличение печени у эмбрионов APC-/-, так и отсутствие спецификации печени у мутантов APC+/-, уровень β-катенина понижали с помощью антисмысловых олигонуклеотидов морфолино (MO). MO против сайта старта β-катенина данио (Lyman Gingerich et al., 286 Devel. Bio. 427-39 (2005)) инъецировали потомству от близкородственного скрещивания рыбок APC+/- на стадии одной клетки. При использовании низких концентраций MO (40 мкМ), инъецированные эмбрионы успешно проходили стадию гаструляции и не имели явных морфологических нарушений по сравнению с контрольными эмбрионами, инъецированными MO.
Направленный нокдаун β-катенина приводил к резкому сдвигу распределения фенотипов печени. У большинства эмбрионов (74%) наблюдалась нормальная печень; последующее генотипирование показало, что в этой популяции присутствовали как эмбрионы дикого типа, так и эмбрионы APC+/-. У некоторых эмбрионов APC+/- (15%) по-прежнему наблюдалась увеличенная печень, что скорее всего отражало недостаточный функциональный нокдаун β-катенина из-за низкой дозы MO. Из эмбрионов APC+/-, инъецированных MO и выживавших до 72 hpf, у 43% выявлялась экспрессия LFABP; тем не менее, у этих эмбрионов наблюдались серьезные дефекты развития, и они не выживали дольше чем 120 hpf. Эти данные позволяют предположить, что оба фенотипа печени могут индуцироваться одним только уровнем β-катенина, что указывает на роль сигнального пути wnt/β-катенина в качестве медиатора этих эффектов. Этот вывод подкрепляется тем фактом, что нокдаун канонических wnt2b, wnt3 и wnt8 приводит к уменьшению печени.
Сигнал wnt/β-катенина затрагивает популяцию энтодермальных предшественников. Чтобы выяснить, на какой стадии эмбрионального развития сигнал wnt влияет на дифференцировку энтодермы и размер печени, использовали трансгенных данио, экспрессирующих индуцируемые активаторы или репрессоры сигнала wnt. Рыбки hs:wnt-GFP экспрессируют лиганд wnt8 под контролем промотора, чувствительного к тепловому шоку, а у рыбок hs:dkk-GFP и hs:dnTCF-GFP возможно ингибирование сигнала wnt на уровне рецептора frizzled или ядерного транскрипта, или ядерного комплекса транскрипции, соответственно. Индукция wnt8 во всех тканях до стадии развития хвостовой почки (10 hpf) вызывала грубые нарушения гаструляции и общей структуры эмбриона, что приводило к остановке роста или гибели к 24 hpf. От стадии 1 сомита до стадии 5 сомитов активация wnt приводила к значительному сердечному отеку, уменьшению длины и отсутствию формирования печени у эмбрионов, выживавших до 72 hpf, этот фенотип напоминал мутантов APC-/-. Индукция wnt8 с помощью теплового шока на стадиях 10-18 сомитов приводила к сильному увеличению размеров печени по сравнению с контролями дикого типа, подвергнутыми тепловому шоку. Помимо общего увеличения размеров органа, печень у 50% эмбрионов, подвергнутых тепловому шоку на стадии 10 сомитов, не отделялась полностью от энтодермальной пластинки, что приводило к повышенной экспрессии генов, специфичных для печени, в районе средней линии и вытягиванию клеток печени в направлении задней части тела; этот фенотип подтверждался с помощью конфокальной микроскопии и гистологических срезов. Кратковременная активация wnt в моменты времени между 24 hpf и 36 hpf умеренно влияла на размер печени к 72 hpf. Сходным образом, влияние ингибирования wnt, обусловленного индукцией dkk или dnTCF, на развитие печени, оказалось наиболее выражено на стадиях 10-18 сомитов и более умеренно на более поздних стадиях созревания эмбриона. Ингибирование сигнала wnt/β-катенина во всех тканях до стадии 5 сомитов приводило к ранней гибели эмбрионов.
Экспрессия транскриптов, специфичных для печени, таких как LFABP, начинается примерно через 44 hpf, а сегрегация области, из которой развивается печень, от энтодермальных трубок предположительно происходит к 22 hpf. Результаты, полученные в ходе экспериментов с применением теплового шока, позволяют предположить, что эффекты, опосредованные wnt, на развитие печени начинались до формирования зрелого органа, на уровне или немного ранее стадии, на которой определяется судьба энтодермальных предшественников. Чтобы исследовать эффект активации wnt на популяцию энтодермальных клеток-предшественников, анализировали экспрессию пан-энтодермального маркера foxA3 после индукции wnt8 с помощью теплового шока. Через 48 hpf наблюдали значительное увеличение размеров зародыша печени после активации с помощью теплового шока на стадии 10 сомитов; также наблюдали уменьшение размеров зачатка поджелудочной железы, в то время как эффекты более поздней индукции wnt8 (после 24 hpf) были менее выражены. Также эффект от активации wnt8 на энтодермальных предшественников зависел от дозы: по сравнению с контролем, тепловой шок в течение 5 минут, 20 минут и 60 минут приводил к прогрессивному увеличению размеров печени за счет тканей поджелудочной железы.
Активация β-катенина у мутантов APC меняла судьбу энтодермы. Эксперименты с использованием теплового шока позволяют предположить, что увеличение числа гепатоцитов, опосредованное wnt, происходит на уровне энтодермальных клеток-предшественников. Чтобы оценить эффекты от прогрессирующей потери APC на энтодермальных предшественников, исследовали экспрессию у потомства близкородственного скрещивания APC+/- через 48 hpf. У эмбрионов APC+/-наблюдались увеличенный зародыш печени и уменьшенный зародыш поджелудочной железы по сравнению с диким типом. Этот фенотип подтвердился in vivo с помощью конфокальной микроскопии потомков близкородственного скрещивания APC; gut:GFP и FACS-анализом через 48 hpf. У эмбрионов APC+/- не развивалось четких паттернов организации энтодермы через 48 hpf, а также FACS-анализ показал уменьшение числа предшественников gut:GFP+, что указывает на отсутствие экспансии как дефинитивных органных предшественников, так и клеток-энтодермальных предшественников.
Поскольку потеря APC или активация wnt влияла на все популяции энтодермальных предшественников, исследовали зрелые энтодермальные органы с целью выявить последствия ранних изменений в развитии. Экспрессия инсулина и трипсина, указывающая, соответственно, на эндокринную и экзокринную дифференцировку поджелудочной железы, у эмбрионов APC+/-через 72 hpf оказалась пониженной. У мутантов APC-/- экспрессия трипсина практически не выявлялась; но выявлялась экспрессия инсулина, хотя и пониженная. Эффект потери APC на дифференцированный кишечник, определяемый по экспрессии белка кишечника, связывающего жирные кислоты (IFABP), оказался сходным с таковым для печени: у эмбрионов APC+/- наблюдали усиление окраски на IFABP по сравнению с диким типом, в то время как эмбрионы APC-/- не экспрессировали IFABP. Индукция wnt8 на стадии 10 сомитов оказывала сходное влияние на каждый из этих энтодермальных органов, но приводила к худшей организации тканей, особенно в поджелудочной железе. Эти данные показывают, что возникающий сигнал wnt/β-катенина регулирует развитие энтодермы до спецификации органов и что этот эффект опосредует сдвиг дифференцировки энтодермальных предшественников в пользу печени за счет ткани поджелудочной железы. Кроме того, избыточная активация wnt/β-катенина на стадии хвостовой почки и ранних сомитных стадий приводит к отсутствию спецификации и пролиферации энтодермы, что приводит к повышенному уровню гибели энтодермальных клеток и невозможности развития зрелых энтодермальных органов.
Сигнал wnt/β-катенина стимулирует рост гепатоцитов. Чтобы определить, влияет ли сигнал wnt/β-катенина на рост дифференцированных гепатоцитов, индуцировали экспрессию wnt8 через 48 hpf. Это приводило к двукратному увеличению размера печени у рыбок LFABP:GFP по данным конфокальной микроскопии и количества GFP+ клеток по данным FACS-анализа через 72 hpf. Когда специфические клетки-предшественники начинают пролиферировать, печень резко увеличивается в размерах: между 72 hpf и 120 hpf у эмбрионов дикого типа число клеток печени увеличивается в 2-3 раза. По данным FACS-анализа у эмбрионов с индуцированным wnt8 через 120 hpf также наблюдается увеличение числа гепатоцитов GFP+, хотя это не так очевидно из макроскопического исследования экспрессии LFABP. Ингибирование сигнала wnt с помощью теплового шока через 48 hpf показало, что wnt необходим для оптимального роста печени: как у эмбрионов dkk, так и у эмбрионов dnTCF размер печени был меньше контрольного по данным гибридизации in situ через 72 hpf. Из этих данных видно, что сигнал wnt также важен для пролиферации дифференцированных гепатоцитов.
Сигнал wnt/β-катенина активируется и является необходимым для регенерации печени. Печень позвоночных - динамичный орган, способный к заживлению небольших повреждений на протяжении всей жизни. Для оценки роли сигнального пути wnt/β-катенина в поддержании гомеостаза печени во взрослом организме была разработана модель регенерации печени у данио. Печень взрослых данио имеет трехдольную форму; после частичной гепатэктомии (1/3 органа) >95% данио дикого типа быстро выздоравливают, а их печень полностью регенерирует в течение семи дней. У рыбок, экспрессирующих репортер wnt/β-катенина (TOP:dFGP) флуоресценция GFP наблюдалась на границе резекции через 24 часа после резекции (hours post-resection, hpr), что свидетельствовало об активности сигнального пути wnt на ранних стадиях регенерации печени. Это коррелировало с усиленным ядерным окрашиванием β-катенина в регенерирующей печени по сравнению с ложнооперированным контролем.
Чтобы выявить, дает ли избыточная активация wnt регенеративное преимущество, индуцировали экспрессию wnt8 с помощью теплового шока в течение 6-18 hpr. Это воздействие заметно ускорило рост печени по сравнению с контролем дикого типа через 3 hpr. Сходным образом, у мутантов APC+/- наблюдалась повышенная способность к регенерации по сравнению с контролем. У трансгенных рыбок, экспрессирующих dnTCF, регенерация печени и заживление раны были значительно ослаблены, что показало, что сигнал wnt/β-катенина необходим для регенерации печени у данио. Гистологический анализ подтвердил эти наблюдения для всех стадий регенерации. Уровень β-катенина в ядре и в цитоплазме, а также интенсивность окраски на PCNA повышались у данио с повышенным уровнем сигнала wnt и ускоренной регенерацией. Эти эксперименты подчеркивают важность сигнала wnt/β-катенина для гомеостаза и роста печени на протяжении всей жизни организма.
Важно, что усиленный сигнал β-катенина может ускорять регенерацию печени у млекопитающих. Для проверки предположения, что усиление сигнала wnt/β-катенина может давать эволюционно консервативное преимущество в регенерации после частичной гепатэктомии и у млекопитающих, мышей дикого типа и APCMin/+ подвергали резекции печени. После стандартной частичной гепатэктомии (2/3 органа) определение отношения массы органа к массе тела выявило повышенную способность к регенерации у мышей APCMin/+ по сравнению с контролем, особенно ярко выраженную на ранних стадиях регенерации печени. Для мышей APCMin/+ характерны повышенные базальные уровни β-катенина, в особенности в области портальных трактов, и значительное повышение этих уровней на ранних стадиях регенерации печени. Данные, полученные на мышах APCMin/+, свидетельствуют о том, что активация wnt повышает кинетику регенерации печени, и также позволяют предположить, что фармацевтическая манипуляция сигнала wnt/β-катенина может ускорить регенерацию печени после повреждения.
Раскрытие молекулярных механизмов, регулирующих развитие печени, проливает свет на биологическую основу формирования опухолей печени и одновременно предоставляет мишени для терапевтических манипуляций. Поскольку нарушения сигнала wnt/β-катенина превалируют как в недифференцированных, так и в дифференцированных новообразованиях печени, настоящее изобретение предоставляет роль сигнального пути wnt в регуляции дифференцировки и роста печени. С помощью анализа трансгенных данио, экспрессирующих активаторы и репрессоры сигнального пути wnt, а также мутантных данио с дерегулированной активностью β-катенина, настоящее изобретение предоставляет регуляцию wnt/β-катенина, необходимую для различных аспектов развития печени и гомеостаза ткани во взрослом организме.
Прогрессирующая потеря APC не связана линейно с размером печени во время эмбрионального развития. Потеря APC вела к повышенной аккумуляции β-катенина в ядре и цитоплазме. У эмбрионов APC+/- это приводило к увеличению числа гепатоцитов, а полное отсутствие регуляции β-катенина у мутантов APC-/- приводило к повышенному уровню апоптоза и невозможности развития дифференцированных энтодермальных органов. Использование трансгенных рыб, содержащих промоторы, чувствительные к тепловому шоку, как описано в настоящей заявке, показало, что функциональные требования к сигналу wnt варьируют в течение эмбрионального развития. Интересно, что хотя избыточный сигнал wnt/β-катенина на стадии раннего сомитогенеза (1-5-сомитные стадии) способен ингибировать нормальное развитие печени, активация wnt8 на стадии 10 сомитов вела к увеличению печени. Усиленная пролиферация предшественников, опосредованная усилением сигнала wnt/β-катенина (10 сомитов - 24 hpf) может привести к быстрому экспоненциальному росту пула предшественников, что обуславливает разницу в размерах печени и числе клеток, наблюдаемую у эмбрионов wnt8 и APC+/-. После завершения формирования дифференцированной печени усиление сигнала wnt (48 hpf) также стимулирует пролиферацию гепатоцитов и рост органа. Эти данные в совокупности указывают на различные требования к регуляции сигнала wnt на разных стадиях, необходимых для правильной спецификации и развития печени.
Эти наблюдения подкрепляют модель двухфазного влияния сигнала wnt/β-катенина на энтодермальные предшественники и дифференцированные гепатоциты. Кроме того, это объясняет расхождения между данными по влиянию сигнального пути wnt/β-катенина на развитие энтодермы, в особенности печеночной. В течение раннего сомитогенеза высокий уровень сигнала wnt губителен для дифференцировки и развития печени. Мутантные эмбрионы APC-/- демонстрируют необходимость некоторого подавления сигнала β-катенина в соответствующих энтодермальных предшественниках. После определения судьбы энтодермы wnt необходим для увеличения числа клеток-предшественников и роста органа, как показано в настоящей заявке. Усиленный сигнал β-катенина у эмбрионов APC+/- на этой стадии дает преимущество в росте, что выражается в увеличении числа пролиферирующих гепатобластов и последующем увеличении числа клеток печени.
Также в настоящей заявке представлены интересные данные, свидетельствующие о том, что сигнал wnt/β-катенина может менять судьбу недифференцированных энтодермальных предшественников. Индукция wnt/β-катенина у эмбрионов wnt8 c промотором, чувствительным к тепловому шоку, оказывала поразительный эффект на последующую диффенцировку энтодермальных органов. Сигнал wnt/β-катенина смещал продольную ось дифференцировки печени, а также сдвигал дифференцировку предшественников в сторону клеток печени. В особенности неблагоприятным избыточный сигнал wnt оказывался для развития поджелудочной железы. Область энтодермальных клеток, компетентных для ответа на сигналы, модулируемые печенью, может увеличиваться за счет области, в норме предназначенной для развития поджелудочной железы. В качестве альтернативы, если существуют бипотенциальные гепато-панкреатические предшественники, стимуляция, сдвинутая в пользу дифференцировки в клетки печени, фактически уменьшит число предшественников, могущих развиться в поджелудочную железу. При исследовании эмбриональных эксплантов было показано, что брюшная энтодерма головной кишки активирует программу генов поджелудочной железы в отсутствие сигналов индукции печени, таких как фактор роста фибробластов (fibroblast growth factor, FGF), что позволяет предположить существование бипотенциальных клеток (Deutsch et al., 128 Devel. 871-81 (2001)). Природа этих предшественников может подвергаться терапевтическим манипуляциям. Хотя были описаны печеночные предшественники, способные дифференцироваться как в гепатоциты, так и в холангиоциты (Strick-Marchand et al., 101 P.N.A.S. USA 8360-65 (2004)), нет ни одного завершенного исследования пластичности предшественников в отношении панкреатической дифференцировки.
В настоящем изобретении предлагается частичная гепатэктомия в качестве новой техники работы на данио, удобной для изучения регенерации печени. Печень данио регенерирует до исходных размеров в течение семи дней, что сравнимо с кинетикой регенерации печени мышей. Размер данио и сложности, обусловленные резекцией неинкапсулированного органа, препятствуют точному количественному анализу регенерации печени, основывающемуся на отношении массы печени к массе тела, однако разработка анализа диссекций единым блоком, подробно описанного в настоящей заявке, а также полное гистологическое описание на разных стадиях регенерации дает точную и детальную картину. Например, при использовании рыб, экспрессирующих репортер wnt, в настоящей работе показано in vivo, что сигнал wnt активируется через 24 часа на границе резекции.
Кроме того, настоящее изобретение предоставляет первый пример того, что активация wnt-β-катенина может ускорять регенерацию печени. Анализ рыб, трансгенных по wnt8, и рыб APC+/- показал, что повышение уровня β-катенина в ядре приводило к усилению пролиферации клеток и ускорению регенерации печени. Далее регенеративное преимущество оказалось эволюционно консервативным, поскольку оно также проявляется при гепатэктомии у мышей APCMin/+. (Резекцию печени у мышей проводили по Green & Puder, 16 J. Investigational Surgery 99-102 (2003)). Таким образом в настоящем изобретении предоставлена манипуляция сигнального пути wnt/β-катенина в качестве способа усиления регенерации печени у пациентов после резекции печени, а также после острой печеночной недостаточности, вызванной токсинами, такими как ацетаминофен.
Как показано в настоящей заявке, сигнальный путь wnt/β-катенина влияет на различные популяции энтодермальных клеток и клеток печени, и эта программа реактивируется для регуляции регенерации печени. Хорошо описана роль сигнального пути wnt/β-катенина в различных формах новообразований печени: в гепатобластомах часто обнаруживаются мутации APC, а в холангиокарциномах и гепатоцеллюлярных карциномах - изменения в генах β-катенина, аксина и GSK-3β. Это позволяет предположить, что наряду с регуляцией судьбы клеток печени на разных стадиях развития печени, сигнальный путь wnt/β-катенина может способствовать канцерогенезу в различных популяциях клеток печени. Понимание роли сигнального пути wnt/β-катенина в развитии популяций этих клеток может привести к открытию механизмов канцерогенеза и способов его подавления в каждом типе клеток. Модель данио предоставляет уникальную возможность обнаружения новых терапевтических агентов для модуляции сигнала wnt. В настоящее время проводится генетический скрининг химических веществ в поисках модуляторов wnt-опосредованной регуляции роста клеток в эмбриогенезе; вещества, идентифицированные с помощью этого метода, можно проверять далее на консервативность их влияния на регенерацию печени у взрослых данио и канцерогенез у рыб APC+/-, а также на модели химического канцерогенеза печени данио. Полное исследование роли сигнального пути wnt/β-катенина в развитии печени, пролиферации гепатоцитов и канцерогенеза у данио, т.е. широкомасштабный скрининг химических веществ, повысит возможность более эффективных диагностики и лечения рака.
В другом воплощении настоящего изобретения предоставляются композиции и способы модулирования роста или регенерации тканей позвоночных через сигнальный путь простагландина. Например, простагландин E2 усиливает регенерацию тканей позвоночных. Химический скрининг на данио показал, что сигнальный путь простагландина является мощным регулятором роста печени в эмбриональном развитии. Инкубирование эмбрионов с ингибиторами cox1, cox2 или обоих ферментов приводило к выраженному уменьшению размеров печени через 72 hpf по сравнению с контролем дикого типа, в то время как воздействие диметилпростагландина E2 (dmPGE2) стимулировало развитие печени. Нокдаун cox1 или cox2 с помощью морфолино также приводил к ингибированию роста печени, но воздействие экзогенного dmPGE2 полностью нивелировало этот эффект. Поскольку многие молекулярные сигнальные пути, контролирующие эмбриональное развитие, регулируют тканевый гомеостаз во взрослом организме, исследовали эффекты сигнального пути простагландина во время регенерации печени. Был разработан новый способ, позволяющий постоянно резецировать 1/3 печени живых данио: после введения анестетика трикаина делали небольшой надрез на брюшке непосредственно за областью сердца и удаляли внутреннюю долю трехдольной печени ножницами для микродиссекции. После выхода из наркоза рыбок выпускали в воду.
Для анализа необходимости функционального сигнала простагландина во время регенерации на рыбок воздействовали ингибитором cox, индометацином, обладающим двойной специфичностью, от 6 часов до 18 часов после частичной гепатэктомии. Под воздействием индометацина регенерация печени значительно слабела по сравнению с контролем на день 1 и 3 и не завершалась через 5 дней после резекции. Кроме того, воздействие индометацина изменяло архитектуру печени как непосредственно в области границ резекции, так и в неповрежденных областях органа. Ингибирование cox также препятствовало заживлению раны на месте разреза.
Воздействие dmPGE2 после резекции стимулировало регенерацию печени и улучшало васкуляризацию печени по сравнению с контрольными рыбками. Эффект был заметен уже на первый день после резекции и приводил к более быстрой полной регенерации органа. Кроме того, наблюдалось ускоренное заживление раны на соединительной ткани. Регуляция уровней простагландина E2 может улучшать регенерацию различных типов тканей, таких как ткани сердца и костей, а также ускорять заживление ран.
Кроме того, сигнальный путь простагландина взаимодействует с сигнальным путем wnt: было показано, что dmPGE2, активатор простагландинового сигнального пути, усиливал сигнал wnt в развивающихся мозге, печени и кишечнике, а воздействие индометацина приводило к полному отсутствию сигнала wnt. Далее ингибирование cox могло ослаблять рост-стимулирующий эффект активации wnt на развитие и регенерацию печени. Эти данные позволяют предположить, что сигнальный путь простагландина напрямую влияет на транскрипционную активность β-катенина, цетрального медиатора сигнального пути wnt. Сходным образом, сигнальный путь wnt может также регулировать образование и восстановление стволовых клеток крови, как описано в WO 07/112084. Как и в случае печени, wnt-опосредованное увеличение числа HSC можно блокировать путем ингибирования сигнала простагландина. Это позволяет предположить, что взаимодействие сигнальных путей wnt и простагландина является консервативным в процессе роста и регенерации многих тканей. Сигнальный путь wnt является потенциально привлекательной мишенью для терапевтических манипуляций: активация сигнального пути стимулирует рост и регенерацию тканей после повреждения, и наоборот, его ингибирование может оказаться важным для терапии рака. Однако ингибиторы wnt, обнаруженные на сегодняшний день, не были разработаны для применения в клинике, возможно, из-за их токсичности или побочных эффектов. Использование простагландинов или ингибиторов простагландинов для регуляции сигнального пути wnt предоставляет альтернативный сбалансированный подход: активация wnt может оказаться полезной в первой фазе заживления после повреждения, в то время как ингибирование простагландинов может предотвращать нежелательные последствия сигнала wnt.
Модуляторы роста тканей согласно настоящему изобретению, воздействующие на сигнальный путь простагландина таким образом, что рост тканей угнетается, включают индометацин, NS398, SC560, целекоксиб, сулиндак, фенбуфен, аспирин, напроксен, ибупрофен, AH6809 (антагонист EP1/2) и AH23848 (антагонист EP4).
Модуляторы роста тканей, воздействующие на сигнальный путь простагландина таким образом, что рост тканей стимулируется, включают dmPGE2, PGE2, PGI2, линолевую кислоту, 13(s)-HODE, LY171883, ONO-259, Cay10397, эйкозатриеновую кислоту, эпоксиэйкозатриеновую кислоту и арахидоновую кислоту.
Модуляторы роста тканей, воздействующие на сигнальный путь wnt таким образом, что рост тканей угнетается, включают кенпауллон (влияет на гистондеацетилазу, а не на GSK3b), вальпроевую кислоту (влияет на гистондеацетилазу, а не на GSK3b) и растворимый dkk.
Напротив, модуляторы роста тканей, воздействующие на сигнальный путь wnt таким образом, что рост тканей стимулируется, включают BIO, LiCl и растворимый лиганд wnt.
Кроме того, модуляторы роста тканей, воздействующие на вторичные мессенджеры цАМФ/PI3K/AKT - действующие ниже исходного сигнала простагландина таким образом, что рост тканей угнетается, включают H89, PD98059, KT5720, U0126, LY294002 и вортманнин.
Модуляторы роста тканей, воздействующие на вторичные мессенджеры цАМФ/PI3K/AKT - действующие ниже исходного сигнала простагландина таким образом, что рост тканей стимулируется, включают форсколин, 8-бром-цАМФ и Sp-5,6,-DCI-cBiMPS.
Другие модуляторы роста тканей, вероятно, действующие ниже исходного сигнала простагландина, включают модуляторы вторичного мессенджера Ca2+. Модуляторы, ингибирующие рост тканей, включают BayK 8644 и тиоридазин. Модуляторы, считающиеся стимуляторами роста, включают Bapta-AM, фендилин, никардипин, нифедипин, пимозид, строфантидин и ланатозид.
Согласно настоящему изобретению модуляторы сигнальных путей NO/ангиотензина могут взаимодействовать с сигналами простагландина и wnt. Модуляторы, ингибирующие рост тканей, включают L-NAME, эналаприл, каптоприл, AcSDKP, лозартан, телимазартан, гистамин, амброксол, хризин, циклогексимид, метиленовый синий, эпинефрин, дексаметазон, проадифен, бензилизотиоцианат и эфедрин.
Модуляторы NO/ангиотензина, способные взаимодействовать с сигнальными путями простагландина и wnt и усиливать рост тканей, включают L-Arg, нитропруссид натрия, ванадат натрия и брадикинин.
Предварительные экспериментальные данные позволяют предположить, что рост печени может ингибироваться такими модуляторами тканевого роста, как норэтиндрон, 3-эстрадиол, бета-каротин и BMS189453. Напротив, флурандренолид, полностью транс-ретиноевая кислота, витамин D и ретинол стимулировали рост печени.
Простагландин E2 (PGE2), продукт циклооксигеназы (COX), осуществляет свое действие путем связывания с четырьмя рецепторами, сопряженными с G-белками (EP1-EP4). Таким образом, модуляторы роста тканей согласно настоящему изобретению включают агонисты и антагонисты рецепторов PGE2.
EP4-селективные агонисты включают ONO-AE1-734 (метил-7-[(1R, 2R,3R)-3-гидрокси-2-[(E)-(3S)-3-гидрокси-4-(м-метоксиметилфенил)-1-бутенил]-5-оксоциклопентил]-5-тиагептаноат), ONO-AE1-437, ONO-AE1-329, ONO-4819 (все Ono Pharma. Co, Osaka, Japan), APS-999 Na (Toray Indus. Inc., Tokyo, Japan), AGN205203 - аналог из 8-азапиперидиноновой серии агонистов EP4 (Allergan, Inc. Irvine, CA), L-902688 (Merck Frosst Canada, Ltd.), производные 1,6-дизамещенного пиперидин-2-она, 3,4-дизамещенного 1,3-оксазинан-2-она, 3,4-дизамещенного 1,3-тиазинан-2-она и 4,5-дизамещенного морфолин-3-она, см. Патент США №7053085 (Merck & Co. Inc, Rahway, NJ).
Напротив, EP4-селективные антагонисты включают ONO-AE3-208 (4-{4-циано-2-[2-(4-фторонафтален-1-ил)пропиониламино]фенил}-масляная кислота) (Ono Pharma. Co., Osaka, Japan), CJ-023423 (N-[({2-[4-(2-этил-4,6-диметил-1H-имидазо[4,5-c]пиридин-1-ил)-фенил]этил}амино)карбонил]-4-метилбензенсульфонамид) (Pfizer), BGC20-1531 (BTC Int'l, Ltd.), AH23848, ((4Z)-7-[(rel-1S,2S,5R)-5-((1,1'-бифенил-4-ил)метокси)-2-(4-морфолинил)-3-оксациклопентил]-4-гептеноидная кислота полукальциевая соль гидрат), AH22921 ([1α(Z),2βa,5α]-(±)-7-[5[[(1,1'-бифенил)-4-ил]метокси]-2-(4-морфолинил)-3-оксациклопентил]-5-гептеноевая кислота) (GlaxoSmithKline), L-161982 (N-[[4'-[[3-бутил-1,5-дигидро-5-оксо-1-[2-(трифторметил)фенил]-4H-1,2,4-триазол-4-ил]метил][1,1'-бифенил]-2-ил]сульфонил]-3-метил-2-тиофенкарбоксамид) (Merck Frosst Ltd., Canada).
EP2-селективные агонисты включают ONO-AE1-259, ONO-8815Ly, ONO-8815, (L-лизин(Z)-7-[(1R,2R,3R,5R)-5-хлор-3-гидрокси-2[(E)-(S)-4-(1-этилциклобутил)-4-гидрокси-1-бутенил]циклопентил]-5-гептеноат) (Ono Pharma. Co., Osaka, Japan), AH13205 (транс-2- [4-(1-гидроксигексил)фенил]-5-оксоциклопентан-гептаноевая кислота) (GlaxoSmithKline).
Некоторые производные простагландина также проявляют некоторые способности к стимуляции роста печени, что отражено в таблице:
Также были описаны и другие молекулы, участвующие в сигнальном пути wnt, которые могут служить модуляторами в объеме настоящего изобретения (Barker & Clever, 5 Nature Rev. Drug Discovery 997-1014 (2007); Janssens et al., 24 Investigational New Drugs 263-80 (2006)). Однако следует отметить, что при попытках напрямую подавить сигнал wnt у пациентов с опухолями, наблюдались значительные побочные эффекты. Таким образом, в настоящем изобретении предполагается, что непрямая модуляция сигнального пути wnt с помощью воздействия на сигнальный путь простигландина может оказаться более эффективной для разработки в качестве терапевтического средства.
Модуляторы роста тканей в объеме настоящего изобретения можно идентифицировать различными методами, в том числе с помощью генетической системы данио. Данио (Danio rerio) представляет собой замечательную генетическую систему для изучения развития и заболеваний позвоночных (см., например, Hsia & Zon, 33(9) Exp. Hematol. 1007-14 (2005); de Jong & Zon; 39 Ann. Rev. Genet. 481-501 (2005); Paffett-Lugassy & Zon, 105 Meth. Mol. Med. 171-98 (2005); Haffner & Nusslein-Volhard, 40 Int'l J. Devel. Biol. 221-27 (1996)). Эмбрион, развивающийся в среде, прозрачен, а его органы легко визуализируются. У данио и млекопитающих существует много общих генетических программ, реализующихся в развитии. При спаривании данио производят большое количество (100-200 в неделю) прозрачных эмбрионов. В сравнительно небольшое пространство можно поместить много эмбрионов, кроме того, у данио короткое время генерации (3 месяца). Проводились широкомасштабные скрининги, в результате которых было получено более 2000 генетических мутантов со специфическими дефектами, затрагивающими практически каждый аспект эмбриогенеза (Driever et al., 123 Devel. 37-46 (1996); Eisen, 87 Cell 969-77 (1996)). Многие мутанты крови оказались полезными для описания ключевых событий гематопоэза (Dooley & Zon, 10 Curr. Op. Genet. Devel. 252-56 (2000)). Данио оказались полезными для проведения скрининга мелких молекул на целом организме, поскольку большое количество эмбрионов можно распределить по лункам микропланшетов, содержащим вещества из библиотек химических соединений. Например, Петерсон и соавторы протестировали 1100 соединений на дефекты развития (Peterson et al., 97 P.N.A.S. USA 12965-69 (2000)). В этом скрининге 2% веществ оказались летальными, а 1% индуцировали специфический фенотип. Например, одно вещество подавляло образование структур внутреннего уха, называемых отолитами, но не вызывало никаких других дефектов.
Также возможен скрининг в поисках химических супрессоров мутантных фенотипов (Peterson et al., 22 Nat. Biotech. 595-99 (2004); Stern et al., 1 Nat. Chem. Biol. 366-70 (2005)). В одном таком скрининге были найдены вещества, способные «спасти» мутанта gridlock, модель врожденной коарктации аорты (Peterson et al., 2004). Механизм этого спасения включал индукцию VEGF, корригирующего дефект ангиогенеза. Из этих данных видно, что вещества, обладающие высокой эффективностью и специфичностью, можно обнаружить с использованием данио.
Далее для данио была построена генетическая карта высокой плотности, включающая микросателлитные маркеры, гены и метки экспрессирующихся последовательностей (expressed sequence tags, EST) (Knapuk et al., 18 Nat. Genet. 338-43 (1998); Shimoda et al., 58 Genomic 219-32 (1999); Kelly et al., 10 Genome Res. 558-67 (2000); Woods et al., 20 Genome Res. 1903-14 (2000)). Далее в качестве продолжения проекта EST был начат проект полноразмерной кДНК. Также в Sanger Center была построена плотная карта радиационных гибридов и интегрирована с данными, полученными в ходе проекта секвенирования генома. Также NIH поддерживает важный интернет-ресурс - информационную сеть данио (zebrafish information network, ZFIN), представляющий особенный интерес для сообщества. Также большую роль для исследователей играют информационный центр и лаборатория поддержки Zebrafish International Resource Center (ZIRC). Секвенирование генома данио проводится в Sanger Center.
При использовании техник, описанных в настоящей заявке, данио дикого типа и трансгенных данио можно подвергать воздействиям различных соединений с целью определения эффекта этих соединений в качестве модуляторов сигнальных путей простагландина и/или wnt/β-катенина. Например, можно воздействовать тестируемыми соединениями на трансгенных рыбок, несущих экзогенный конструкт, содержащий экспрессируемую последовательность белка-репортера. Путем сравнения экспрессии белка-репортера у рыбок, на которые воздействовали тестируемым веществом, с экспрессией у контрольных рыбок, можно определить эффект этого соединения в отношении модулирования сигнального пути простагландина. Сходным образом, путем сравнения экспрессии белка-репортера у рыбок, на которые воздействовали тестируемым веществом, с отрицательными контролями, можно определить эффект этого соединения в отношении модулирования сигнального пути wnt/β-катенина. Тестируемые соединения могут стимулировать или ингибировать экспрессию гена-репортера. Важно, что модуляторы отдельных сигнальных путей можно затем комбинировать и приводить в контакт с рыбками, экспрессирующими репортер, а экспрессию репортера сравнивать с соответствующими положительными и отрицательными контролями. Таким способом можно идентифицировать модуляторы, применимые в качестве лекарственных средств для лечения заболеваний, ассоциируемых с сигнальным путем wnt/β-катенина, на который можно воздействовать с помощью модуляторов сигнального пути простагландина, как описано в настоящей заявке.
Модуляторы согласно настоящему изобретению включают вещества, напрямую модулирующие сигнальный путь wnt; модулирующие сигнальные путь просталандина, что приводит к модуляции сигнального пути wnt; или модулирующие низлежащие эффекты простагландина, что приводит к модуляции wnt. Кроме того, эти модуляторы можно комбинировать для «тонкой настройки» сигнала. Например, можно использовать активатор сигнала wnt вплоть до проявления желаемого улучшения, c последующим добавлением ингибитора простагландина для ограничения воздействия активатора wnt. Или, например, можно комбинировать низкодозированный активатор wnt с низкодозированным активатором простагландина во избежание токсичности. Таким образом, взаимодействия модуляторов сигнальных путей wnt и простагландина можно использовать в любом направлении или в любой комбинации для получения желаемого ответа и одновременного избежания токсичности или избыточного роста. Модуляторы можно использовать одновременно или последовательно.
Настоящее изобретение может оказаться полезным для пациентов в разных случаях: например, у пациентов, подвергнутых резекции печени, функция печени может восстанавливаться раньше, уменьшая таким образом вероятность осложнений и время госпитализации. Также вероятно, что у пациентов с пересаженной печенью может наблюдаться повышенный уровень приживаемости органа. Что касается других аспектов регенерации тканей и органов, например, могут наблюдаться положительные сдвиги при заживлении ран, после инфаркта миокарда и после переломов костей. Кроме того, для пациентов, страдающих, например, от травмы, токсичности лекарственных средств, отравления (например, бледной поганкой), промышленных токсинов, хирургических операций, рака, а также последствий донорства органов, пересадки кожи, ожогов, и т.д., модуляторы согласно настоящему изобретению могут быть добавлены в схему лечения. Настоящие модуляторы роста могут применяться на любой ткани, способной к регенерации, заживлению или возобновлению роста, включая стволовые клетки крови, печень, кожу или сосуды.
Прямое воздействие модуляторов ex vivo может индуцировать значительные развитие или регенерацию ткани in vivo, так что меньший объем ткани будет пригоден для трансплантации. Происхождение такой ткани не ограничено. В качестве альтернативы можно брать пробу ткани для пересадки, такой как кожа, и немедленно помещать в среду в присутствии модулятора, такого как PGE2, и инкубировать перед имплантацией в присутствии модулятора перед введением в организм объекта.
Далее для улучшения функционирования трансплантата можно использовать один или более модуляторов. Например, модуляция сигнального пути wnt/PGE2 может ускорить начало выполнения трансплантатом его физиологической функции и, следовательно, к укорочению периода, в течение которого пациент страдает от недостаточности ткани (например, ткани печени) и, следовательно, уменьшению риска осложнений. Кроме того, модулятор может вводиться живому донору после забора ткани, чтобы ускорить заживление.
Модуляторы роста тканей могут использоваться in vivo для улучшения роста тканей и ex vivo для усиления роста тканей. Это достигается путем воздействия одним или более соединениями на организм объекта или на резецированную ткань. Например, при реконструкции матки удаленную ткань можно обработать модулятором роста тканей в контексте биосовместимого каркаса (см. Патент США № 7049057 «Тканево-инженерная матка», выданный Atala et al.) для усиления аутологичного роста ткани перед имплантацией.
Из уровня техники известны различные наборы и приборы для забора, обработки и хранения клеток-источников. Модуляторы согласно настоящему изобретению можно добавлять к клеткам во время забора, обработки и/или хранения. Таким образом, не ограничиваясь конкретными способом забора, схемой лечения или протоколом хранения, воплощение настоящего изобретения предоставляет возможность добавления модулятора, такого как, например, активаторы wnt, PGE2 или dmPGE2, или их аналоги, активаторы цАМФ и т.д. к пробе ткани. Это можно проводить во время забора, подготовки к хранению или при размораживании и перед имплантацией.
Таким образом, способ согласно настоящему изобретению предоставляет следующие преимущества: (1) позволяет проводить трансплантацию пациентам, обычно не рассматриваемым в качестве кандидатов из-за неприемлемо высокого риска отторжения трансплантата или несостоятельности функции первичного трансплантата; (2) уменьшает объем ткани донора, необходимый для формирования минимально необходимого трансплантата; (3) уменьшает вероятность первичного и вторичного отторжения трансплантата путем увеличения размера трансплантата; и (4) укорачивает время, необходимое для первичного трансплантата путем ускорения роста имплантированной ткани.
Модуляторы согласно настоящему изобретению, например модуляторы, ингибирующие рост тканей, также можно использовать при лечении пациентов, страдающих гиперпролиферативными заболеваниями, включающими заболевания гематопоэтической системы или другие раки. В частности, модуляторы могут применяться для лечения заболеваний печени.
Модуляторы согласно настоящему изобретению также включают производные таких модуляторов. Производные, при употреблении в настоящей заявке, включают химически модифицированные вещества, где модификация считается стандартной для специалиста-химика, такая как дополнительные химические соединения (например, сложный эфир или амид кислоты, защитные группы, такие как бензиловая группа для спирта или тиола и трет-бутоксикарбонильная группа для амина). Производные также включают модуляторы с присоединенной радиоактивной меткой, конъюгаты модуляторов (например, с биотином или авидином, с ферментами, такими как пероксидаза хрена и ей подобные, с биолюминесцентными агентами, хемилюминесцентыми агентами или флуоресцентными агентами). Кроме того, к модулятору или его части можно добавить соединения, увеличивающие время полужизни модулятора in vivo. Производные, при употреблении в настоящей заявке, также охватывают аналоги, такие как соединение, содержащее химически модифицированную форму конкретного соединения или класса соединений, и сохраняющее фармацевтическую и/или фармакологическую активность вышеупомянутого соединения или класса соединений, также охватываются настоящим изобретением. Производные, при употреблении в настоящей заявке, также охватывают неактивные формы модуляторов, расщепляющиеся в организме с образованием активной формы, которые усиливают различные желаемые качества фармацевтических агентов (например, растворимость, биодоступность, производство и т.д.).
Соединения или агенты согласно настоящему изобретению могут содержаться в фармацевтически приемлемых композициях. Такая фармацевтически приемлемая композиция может включать фармацевтически приемлемый носитель (носители) и/или формообразующее вещество (вещества). При использовании в настоящей заявке термин «фармацевтически приемлемый носитель» включает все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты, замедляющие адсорбцию и другие физиологически приемлемые агенты. Например, носитель может быть приемлемым для инъекции в спинномозговую жидкость. Формообразующие вещества включают фармацевтически приемлемые стабилизаторы. Настоящее изобретение относится к любым фармацевтически приемлемым композициям, включая синтетические или натуральные полимеры в форме макромолекулярных комплексов, нанокапсул, микросфер или бусин, а также композиций на основе липидов, включая эмульсии липидов в воде, мицеллы, смешанные мицеллы, синтетические мембранные пузырьки и эритроцитарные носители.
При применении агента или композиции пациенту они могут вводиться любым подходящим путем, включая, например, оральный (например, в капсулах, суспензиях или таблетках) или парентерально. Парентеральное введение может включать, например, внутримышечное, внутривенное, включая прямое введение в воротную вену, интраартикулярное, интраартериальное, интратекальное, подкожное или внутрибрюшинное введение. Также агент может вводиться орально, трансдермально, наружно, путем ингаляции (т.е. интрабронхиально, интраназально, с помощью оральной ингаляции или капель в нос) или ректально. Введение может быть локальным или системным в зависимости от показаний. Также агенты могут вводиться с помощью вирусных векторов, известных специалистам в области техники.
В изобретении рассматривается как локальное, так и системное введение. Желательные свойства локального введения включают достижение эффективных локальных концентраций активного вещества, а также избежание нежелательных побочных эффектов системного введения активного вещества. В предпочтительном воплощении антагонист вводится локально. Техники локального введения описываются, например, в 51 J. Biomed. Mat. Res. 96-106 (2000); 100(2) J. Control Release 211-19 (2004); 103(3) J. Control Release 541-63 (2005); 15(3) Vet. Clin. North Am. Equine Pract. 603-22 (1999); 1(1) Semin. Interv. Cardiol. 17-23 (1996).
Фармацевтически приемлемые композиции могут суспендироваться в водных носителях и вводиться с помощью традиционных подкожных игл или инфузионных насосов.
Количество агента, вводимого пациенту, зависит от его характеристик, таких как общее состояние здоровья, возраст, пол, вес и переносимость лекарств, а также степень, выраженность и тип отторжения. Специалист в области техники сможет определить подходящую дозировку, исходя из этих и других факторов.
Ниже будут описаны различные воплощения в неограничивающих примерах.
ПРИМЕРЫ
Пример 1. Техники, связанные с моделью данио
Разведение данио: Данио содержали согласно протоколу IACUC. Использовали трансгенные линии LFABP:GFP (дар G.M. Her & J.L. Wu, Nat'l Cheng Kung Univ., Taiwan), gut:GFP, hs:wnt8-GFP, hs:dnTCF-GFP и hs:dkk-GFP (Dorsky et al., 2002: Her et al., 538 FEBS Lett 125-133 (2003); Lewis et al., 131 Devel. 1299-1308 (2004); Ober et al., 120 Mech. Devel. 5-18 (2003); Stoick-Cooper et al., 134 Devel. 479-89 (2007); Weidingder et al., 15 Curr. 489-500 (2005)). Генотипирование в поисках мутантов APC проводили, как описано в Hurlstone et al., 2003.
Активация/репрессия сигнального пути wnt с помощью теплового шока: эксперименты с воздействием теплового шока на эмбрионы проводились при 38°С в течение 20 минут, если не указано иначе. Генотип определяли по присутствию флуоресценции GFP через три часа после индукции тепловым шоком, нефлуоресцентные сибсы (дикий тип) использовали в качестве контроля.
Нокдаун с помощью морфолино: МО (Gene Tools, LLC, Philomath, OR) против β-катенина, wnt2b, wnt3, wnt5, wnt8 и wnt11 данио (Buckles et al., 121 Mech. Devel. 437-47 (2004); Lekven et al., 1 Cell Devel. 103-14 (2001); Lele et al., 30 Genesis 190-94 (2001); Lyman Gingerich et al., 2004; Ober et al., 442 Nature 688-91 (2006)) или некомплементарные контроли инъецировали в эмбрионы данио на стадии одной клетки в концентрации 40 мкМ.
Гибридизация in situ: эмбрионы, зафиксированные параформальдегидом (PFA) подвергали гибридизации in situ с использованием стандартных протоколов для данио, такие как опубликованные в интернете, например на сайте ZFIN: The Zebrafish Model Organism Database (ресурс Univ. Oregon, Eugene, OR). Использовались следующие пробы РНК для обнаружения изменений в развитии энтодермы и печени: GFP, LFABP, белок-переносчик стеролов, трансферрин, foxA3, инсулин, трипсин и IFABP. Изменения в экспрессии по сравнению с контролями дикого типа приводятся в виде отношения числа измененных к общему числу на генотип; для одного теста проводили не менее трех независимых экспериментов.
Иммуногистохимия: эмбрионов, взрослых рыбок и абдоминальные срезы en bloc фиксировали PFA, заключали в парафин и нарезали на серийные срезы толщиной 40 мкм для гистологического анализа. Чередующиеся срезы окрашивали гематоксилин/эозином с использованием стандартных техник. Антитела к β-катенину (1:100) (BD 610154, BD Transduction Laboratories™, San Jose, CA), TUNEL (Chemicon/Millipore, Billerica, MA), BrdU (1:2000) (clone BU-33, B2531, Sigma-Aldrich, St. Louis, MO) и PCNA (1:80) (Clone PC10, NA03, Calbiochem/EMD Chemicals, Inc., San Diego, CA) визуализировали с помощью DAB и докрашивали гематоксилином или метиленовым зеленым.
Анализ активности каспаз: отдельные эмбрионы вручную разделяли в лизирующем буфере и цетрифугировали. Супернатант (100 мл) использовали для анализа Caspase-Glo® 3/7 Assay System согласно протоколу производителя (Promega Corp., Madison, WI). ДНК, изолированную из клеточного осадка, использовали для подтверждения генотипа APC.
Конфокальная микроскопия: эмбрионы данио, трансгенные по GFP, заключали в 1%-ную легкоплавкую агарозу, содержащую 0,4 мг/мл трикаина-S в культуральных чашках со стеклянным дном для наблюдений с помощью конфокального микроскопа Zeiss LSM Meta (Carl Zeiss MicroImaging, Inc., Thornwood, NY).
Проточная цитометрия: отдельные эмбрионы разделяли в 0,9% PBS и анализировали флуоресценцию GFP и прямое рассеивание. Генотипирование по APC проводили с помощью ПЦР на излишках клеток после FACS-анализа.
Резекция печени: после введения анестетика трикаина взрослых данио подвергали частичной гепатэктомии (1/3 органа) под светлопольным диссекционным микроскопом. С помощью микродиссекционных ножниц делали надрез в левой латеральной части брюшка за областью сердца. Далее с помощью пинцета резецировали внутреннюю дольку печени по всей длине.
Пример 2. Модель опухолей данио
Хотя рыбки данио являются ценной моделью изучения канцерогенеза у позвоночных, неинвазивное наблюдение представляет некоторые трудности, поскольку взрослые данио непрозрачны. Однако опухоли легко обнаружить in vivo с использованием ультразвуковой микроскопии с высоким разрешением. Эта техника позволяет рассчитывать перфузию тканей, аспирировать клетки, анализировать прогрессию опухоли и ответ на терапию. Ультразвуковая биомикроскопия позволяет проводить долговременные исследования развития опухоли и оценку терапевтических эффектов в реальном времени на модели данио. Техники визуализации, применяемые в настоящей заявке, описаны в Goessling et al., 4(7) Nature Methods 551-53 (2007).
Как показано на фиг. 10, на данио в возрасте 3 и 4 недель воздействовали DMBA. За возникновением опухолей наблюдали в течение 5 месяцев. Опухоли обнаруживали с помощью ультразвуковой биомикроскопии. На рыбок с опухолями воздействовали индометацином в течение 12 часов в течение ночи, раз в три дня в течение месяца и визуализировали опухоли, как описано в Goessling et al., 2007. У рыбок с опухолями после трех процедур увеличивался размер и менялась архитектура опухоли. После шести процедур солидная часть опухоли уменьшалась в размерах, и появлялась область разжижения в задней части брюшка, что позволяло предположить развитие некроза опухоли. После десяти процедур опухоль значительно сокращалась и выглядела уменьшенной в размерах по сравнению с контрольным ультразвуком. После месяца лекарственной терапии рыбки выглядели здоровыми, однако их усыпляли с целью подтверждения присутствия опухоли гистологическим путем. Эти данные демонстрируют эффект ингибирования простагландина на рост опухоли печени и успех химиотерапии на рыбках.
В другом эксперименте, приведенном на фиг. 10B и 10C, на рыбок воздействовали раз в неделю для предотвращения развития опухоли. В этих условиях воздействие канцерогена приводило к развитию опухолей печени у рыбок дикого типа и к повышению частоты опухолей в два раза у рыбок APC+/-. Еженедельное воздействие индометацина ослабляло развитие опухолей у рыбок дикого типа и особенно сильно у рыбок APC+/-.
Реферат
Группа изобретений относится к медицине и может быть использована для стимуляции роста или регенерации тканей. Для этого проводят контактирование указанной ткани с активатором сигнального пути простагландина и активатором пути wnt. Активатор сигнального пути простагландина выбран из группы, состоящей из простагландина Е2 (PGE2), простагландина 12 (PG12), 16-фенилтетранор РGЕ2, 16,16-диметил PGE2, 19(R)-гидрокси-РGЕ2, 16,16-диметил РGЕ2 п-(п-ацетамидобензамидо)фенилового эфира, О-дезокси-9-метилен-16,16-диметил PGE2, сложного метилового эфира PGE2, бутрапроста, 15(S)-15-метил PGE2, 15(R)-15-метил PGE2, 20-гидрокси РGЕ2, 11-дезокси-16,16-диметил PGE2, 9-дезокси-9-метилен PGE2, РGЕ2 сериноламида и сулпростона. Активатор пути wnt выбран из группы, состоящей из 6-броминдирубин-3'-оксима (BIO), LiCl и растворимого полипептида Wnt8. Также предложена фармацевтическая композиция для стимуляции роста/регенерации ткани у субъекта. Группа изобретений обеспечивает синергетически увеличенный рост и регенерацию тканей за счет использования комбинации активатора сигнального пути простагландина и активатора пути wnt. 4 н. и 7 з.п. ф-лы, 12 ил., 2 пр.
Формула
где активатор пути wnt выбран из группы, состоящей из 6-броминдирубин-3'-оксима (BIO), LiCl и растворимого полипептида Wnt8.
где активатор пути wnt выбран из группы, состоящей из 6-броминдирубин-3'-оксима (BIO), LiCl и растворимого полипептида Wnt8.

Комментарии