Новое соединение и его применение в медицине - RU2570900C2
Код документа: RU2570900C2
Чертежи
















Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоте, ее солям или ее сольватам и ее кристаллическим формам, которые могут быть использованы для профилактики и/или лечения болезни Паркинсона и/или синдрома Паркинсона.
Уровень техники
Болезнь Паркинсона представляет собой одно из типичных нейродегенеративных заболеваний пожилых людей, вызываемое дегенерацией или потерей дофаминовых нейронов, ее называют специфическим заболеванием (заболеванием, трудно поддающимся лечению). Считается, что распространенность болезни Паркинсона составляет от 100 до 300 человек на 100000 населения, и клинические симптомы можно ориентировочно разделить на моторные симптомы и немоторные симптомы. В качестве моторных симптомов наблюдаются экстрапирамидальные симптомы, такие как тремор, акинезия, ригидность и постуральная неустойчивость, и из них три симптома, а именно тремор, акинезия и ригидность, известны как три основных отличительных признака болезни Паркинсона.
С другой стороны, развиваются немоторные симптомы, например желудочно-кишечные симптомы, такие как запор и слюнотечение, симптомы вегетативной нервной системы, такие как ортостатическая гипотензия, постпрандиальная гипотензия, гипергидроз, жирная кожа, расстройство мочеиспускания и эректильная дисфункция, или психиатрические симптомы, такие как апатия, ангедония, симптомы депрессии, тревожность и зрительные галлюцинации. Кроме того, часто у пациентов с болезнью Паркинсона развивается также нарушение когнитивных функций, такое как деменция.
Кроме того, известно, что в некоторых случаях симптомы, похожие на симптомы болезни Паркинсона, вызываются не болезнью Паркинсона, а такими заболеваниями, как цереброваскулярные нарушения, опухоли мозга и энцефалиты, или побочным действием лекарств, интоксикацией и т.п. Заболевания, вызывающие вторичные симптомы, похожие на симптомы болезни Паркинсона, носят общее название симптоматический паркинсонизм, а симптоматический паркинсонизм и первичный паркинсонизм, такой как болезнь Паркинсона, в некоторых случаях носят общее название синдром Паркинсона.
В качестве типичного способа лечения болезни Паркинсона и/или синдрома Паркинсона используют заместительную дофаминовую терапию. Леводопа (L-DOPA или L-3,4-дигидроксифенилаланин), которая является одним из лекарственных средств для использования в заместительной дофаминовой терапии, представляет собой лекарственное средство, разработанное в конце 1960-х годов, но и в настоящее время его по-прежнему применяют как предпочтительный лекарственный препарат для лечения болезни Паркинсона.
Однако у леводопы имеются фармакокинетические проблемы и, кроме того, леводопа является одним из лекарств, концентрацию которых в крови трудно контролировать вблизи эффективной концентрации. Если леводопу вводят перорально, леводопа быстро поглощается аминокислотными транспортерами, которые находятся в верхней части тонкого кишечника. Концентрация леводопы в крови достигает максимального значения примерно через 30 минут - 2 часа после перорального введения, и период полураспада леводопы в крови очень короткий - около 1 часа. Кроме того, поглощение леводопы зависит от времени ее пребывания в желудке, кислотности желудочного сока и т.п., и поэтому не является постоянным.
Далее 95% или больше поглощенной леводопы метаболизируется декарбоксилазой ароматических L-аминокислот (AADC) в органах, не являющихся частью центральной нервной системы (особенно в печени), и быстро превращается в дофамин. Так как дофамин не может проходить через гематоэнцефалический барьер, дофамин, продуцируемый в других органах, а не в центральной нервной системе, не поступает в мозг. Поэтому считается, что доля леводопы (%), которая распределяется в центральной нервной системе и может проявлять свою эффективность, составляет менее 1% относительно всей поглощенной леводопы.
Как описано выше, поскольку леводопа имеет фармакокинетические проблемы, состоящие в том, что абсорбция леводопы является нестабильной, время удерживания леводопы в крови невелико и доля (%) леводопы, поступающей в центральную нервную систему (показатель поступления в мозг), низка, леводопу требуется принимать 3 раза или более в день, а некоторым пациентам необходимо принимать леводопу не менее 12 раз в день.
Кроме того, еще один недостаток леводопы состоит в том, что ее эффективность постепенно снижается, когда проходит несколько лет после начала лечения. Это происходит потому, что по мере того, как заболевание прогрессирует, способность сохранять дофамин в мозгу уменьшается, следовательно, уменьшается диапазон концентрации леводопы в крови, в котором достигается должный терапевтический эффект. Из-за этого нежелательного свойства леводопы даже в том случае, если в какой-то момент времени терапевтический эффект достигается при приеме леводопы пациентом три раза в день, через несколько лет этому пациенту придется принимать леводопу чаще чем 3 раза в день.
Так как недостаток леводопы, состоящий в том, что «требуется все большее число доз», был выявлен много лет назад, для устранения этого недостатка и получения еще немного более сильного терапевтического эффекта в отношении болезни Паркинсона и/или синдрома Паркинсона исследовались способ введения леводопы в виде большой дозы или способ ингибирования декарбоксилазы ароматических L-аминокислот в периферических тканях. Что касается ингибирования декарбоксилазы ароматических L-аминокислот в периферических тканях, был разработан ингибитор этого фермента (DCI: ингибитор дофа-декарбоксилазы), и в настоящее время препарат, полученный в результате добавления DCI к леводопе (комбинированный препарат леводопа/DCI), используется в клинической практике. В случае комбинированного препарата леводопа/DCI показатель поступления леводопы в мозг улучшается по сравнению с тем случаем, когда принимают только леводопу, и доза леводопы уменьшается приблизительно в пять раз. Однако период полураспада леводопы в крови не изменяется и составляет примерно 1 час или около того, даже при добавлении DCI, и, следовательно, для поддержания концентрации леводопы в крови ничего разработано не было.
С другой стороны, введение леводопы в большой дозе не является целесообразным с точки зрения побочных эффектов. Эффективный диапазон концентраций леводопы в крови узок и близок к токсическому диапазону. В случае, когда лечение пытались проводить путем постоянного введения леводопы в дозе, близкой к верхнему пределу эффективной концентрации в крови или немного превышающей этот предел, развиваются побочные эффекты, такие как желудочные симптомы, ортостатическая гипотензия и учащенное сердцебиение, возникающие на начальной стадии лечения, а через 2-3 месяца после начала лечения развиваются дискинезия и серьезное побочное воздействие на центральную нервную систему, например такое как психиатрические симптомы. Среди пациентов, которым требуется леводопа, имеется немало пациентов, которые не могут принимать леводопу в достаточной дозе из-за таких побочных эффектов.
Недостаток леводопы, который состоит в том, что леводопа требует «большого числа доз», не устраняется даже при использовании комбинации леводопы и ингибитора метаболизма леводопы или при изменении пути введения самой леводопы. К тому же побочные эффекты, такие как дискинезия, развивающиеся при частом воздействии леводопы в концентрации, превышающей эффективную концентрацию в крови, также представляют собой задачи, требующие решения для пациентов, которым необходима леводопа.
С учетом этих обстоятельств сообщалось о многих пролекарствах леводопы, предназначенных для решения таких проблем, связанных с кинетикой леводопы в крови, как «большое число доз» и «частота побочных эффектов, обусловленных частым приемом».
Примеры пролекарств леводопы включают следующие соединения:
конъюгат леводопы и ГАМК, представленный общей формулой (А), описанный в WO 2009/101616:

(где каждый заместитель от R1A до B3A независимо представляет собой атом водорода, 4-аминобутирильную или бутирильную группу; и R4A представляет собой атом водорода, алкильную, бутирилоксиалкильную или 4-аминобутирилоксиалкильную группу) (в данном случае определения соответствующих групп являются цитатами);
4-((S)-2-амино-2-метоксикарбонилэтил)-2-(3,3-диметилбутирилокси)фениловый эфир 3,3-диметилмасляной кислоты, представленный формулой (В), описанный в WO 2009/022098:

соединение, представленное общей формулой (С), описанное в WO 2008/079387:

(где R1C представляет собой С1-8 алкил, замещенный С1-8 алкил, С1-8 алкокси или т.п.; R2C и R3C каждый независимо представляет собой С1-8 алкил, замещенный С1-8 алкил, С1-8 алкокси или т.п.; и R4C и R5C каждый независимо представляет собой атом водорода, С1-8 алкил, замещенный С1-8 алкил или т.п.) (в данном случае определения соответствующих групп представляют собой цитаты);
соединение, представленное общей формулой (D), описанное в WO 2007/104959:

(где R1D и R2D каждый независимо представляет собой -С(=O)R5D или -С(=O)OR5D, или по меньшей мере один из R1D и R2D представляет собой атом водорода, а другой представляет собой -C(=O)R5D или -C(=O)OR5D; R3D и R4D каждый независимо представляет собой атом водорода, С1-С6 алкил, который может быть замещенным, С3-С6 циклоалкил или т.п.; R5D представляет собой атом водорода, С1-6 алкил, который может быть замещенным, или -CH2QD; и QD представляет собой 3-6-членное моноциклическое карбоциклическое кольцо или гетероциклическое кольцо) (в данном случае определения соответствующих групп представляют собой цитаты);
соединение, представленное общей формулой (Е), описанное в WO 2007/109882:

(где XE представляет собой NR7E (где R7E представляет собой атом водорода, ацильную группу или т.п.); R1E представляет собой атом водорода, NH2, С1-10 алкил или т.п.; R2E представляет собой атом водорода, С1-10 алкил или т.п.; R'2E представляет собой атом водорода, С1-10 алкил или т.п.; R3E представляет собой атом водорода, =O, SR8E (где R8E представляет собой атом водорода, С1-10 алкил или т.п.) или т.п.; R4E и R5E каждый независимо представляет собой ОН, NH2, или SH; и R6E представляет собой атом водорода, F, Cl, Br, I или т.п.) (в данном случае определения соответствующих групп представляют собой цитаты);
соединение, представленное общей формулой (F), описанное в WO 2006/119758:

(где R1F и R2F каждый независимо представляет собой -Н, -СО-Н, -СО-CH3 или т.п.; R3F представляет собой -CH2CH2-R5F, -Н, -СН3, -С2Н5 или т.п.; R4F и R5F каждый независимо представляет собой -CO-R6F, -CO-R7F, -Н или т.п.; и R6F и R7F каждый независимо представляет собой линейную алкильную цепь, содержащую 2-25 атомов углерода, разветвленную алкильную цепь, содержащую 2-25 атомов углерода или т.п.) (в данном случае определения соответствующих групп представляют собой цитаты);
соединение, представленное общей формулой (G), описанное в WO 2005/121070:

(где R1G и R2G каждый независимо представляет собой атом водорода, алкил, замещенный алкил, арил, замещенный арил или т.п.; R3G и R4G каждый независимо представляет собой атом водорода, -C(O)OR7G, -C(O)R7G или т.п.; R5G выбран из алкила, замещенного алкила, арила, замещенного арила и т.п.; R7G выбран из алкила, замещенного алкила, циклоалкила, замещенного циклоалкила и т.п.; и nG представляет собой целое число от 1 до 6), (в данном случае определения соответствующих групп представляют собой цитаты);
соединение, представленное общей формулой (Н), описанное в WO 2005/121069:

(где QH выбран из -XH-СО- и -СО-XH-; XH выбран из -О- и -NR6H; R6H выбран из атома водорода, алкила, замещенного алкила, арила, замещенного арила и т.п.; nH представляет собой целое число от 2 до 4; R1H и R2H каждый независимо выбран из атома водорода, алкила, замещенного алкила, арила, замещенного арила и т.п.; R3H и R4H каждый независимо выбран из атома водорода, -C(O)OR7H, -C(O)R7H и т.п.; R5H выбран из а атома водорода, алкила, замещенного алкила, арила, замещенного арила и т.п.; и R7H выбран из алкила, замещенного алкила, циклоалкила, замещенного циклоалкила и т.п.) (в данном случае определения соответствующих групп представляют собой цитаты);
соединение, представленное общей формулой (J), описанное в публикации заявки на европейский патент №728469:

(где X1J представляет собой атом водорода, гидроксил, метокси, этокси, ацетилокси и т.п.; X2J представляет собой гидрокси, метокси, этокси, ацетилокси или т.п.; mJ+nJ равно 5 или меньше; R1J представляет собой карбонил, алкоксикарбонил, бензилоксикарбонил или т.п.; R2J представляет собой атом водорода, алкил, алкилкарбонил, алкилоксикарбонил, бензилоксикарбонил или т.п.; и R3J представляет собой атом водорода, алкильную группу или т.п.) (в данном случае определения соответствующих групп представляют собой цитаты);
Соединение, представленное общей формулой (K), описанное в публикации заявки на патент Японии №S49-061135:

(где nK представляет собой целое число от 0 до 2);
соединение, представленное общей формулой (L), описанное в публикации заявки на патент Германии №2153800:

(где R1L представляет собой С1-7 алкокси, С3-8 алкенилалкокси или фенил С1-7 алкокси; R2L представляет собой атом водорода; R3L представляет собой атом водорода, заместитель, содержащий от 1 до 18 атомов углерода или т.п.; и R4L представляет собой заместитель, содержащий от 1 до 18 атомов углерода или т.п.;) (в данном случае определения соответствующих групп представляют собой цитаты);
соединение, представленное общей формулой (М), описанное в патенте США №4,065,566:

(где RM представляет собой атом водорода, ацильную группу или

R1M представляет собой гидроксильную группу или группу -OM1M; MM представляет собой щелочной металл или ион аммония; и R2M представляет собой

соединение, представленное общей формулой (Р), описанное в публикации заявки на патент Японии №S47-031949:

(где R1P представляет собой атом водорода или остаток сложного эфира; и R2PCO представляет собой органическую ацильную группу) (в данном случае определения соответствующих групп представляют собой цитаты);
соединение, представленное общей формулой (Q), описанное в публикации заявки на патент Японии №S50-029527:
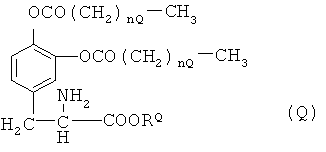
(где nQ представляет собой 0-2; и RQ представляет собой СН3 или С2Н5);
соединение, представленное общей формулой (S), описанное в публикации заявки на патент Японии No. S48-072150;

(где R1S представляет собой атом водорода, низшую алкильную группу или карбоксил-защитную группу; и R2S представляет собой амино-защитную группу);
соединение, представленное общей формулой (Т), описанное в публикации заявки на патент Японии No. S47-031950:

(где R1T представляет собой атом водорода или сложноэфирный остаток; и R2TCO представляет собой органическую ацильную группу) (в данном случае определения соответствующих групп представляют собой цитаты);
соединение, представленное общей формулой (U), описанное в патенте США №3,998,799:
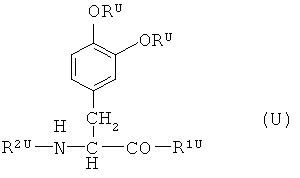
(где RU представляет собой атом водорода, ацильную группу или т.п.; R1U представляет собой гидроксильную группу или группу -OMU; MU выбран из группы, состоящей из щелочного металла и иона аммония; R2U представляет собой -COR3U; и R3U представляет собой N,N-(С1-С2)-диалкиламинокислоту, С4-С6-циклоалкиламинокислоту или т.п.) (в данном случае определения соответствующих групп представляют собой цитаты); и
соединение, представленное формулой (V), описанное в статье Neuropsychobiology, 1988, Vol.19. No.4. PP.180-185:

Однако (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота, ее соли или сольваты и их применение, раскрываемые в настоящем изобретении, не описаны ни в одной из работ предшествующего уровня техники и не могут быть получены в результате комбинирования работ предшествующего уровня техники.
Сущность изобретения
Техническая задача
Целью настоящего изобретения является разработка пролекарства леводопы, которое устраняет фармакокинетические недостатки леводопы для пациентов с болезнью Паркинсона и/или синдромом Паркинсона и может обеспечить эффективную концентрацию леводопы при небольшом числе доз, а более конкретно такого пролекарства леводопы, которое может обеспечить эффективную концентрацию леводопы в крови (эффективную концентрацию в плазме 0,4-1 мкг/мл) человека, с пологой кривой зависимости концентрации леводопы в крови от времени и уменьшает возможность развития побочных эффектов (таких, как дискинезия или «истощение дозы»), насколько это возможно.
Решение задачи
Авторы настоящего изобретения осуществили тщательные исследования для решения вышеуказанной задачи, и в результате показали, что задача может быть решена с помощью (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)-фенил)пропановой кислотой, которая представляет собой новое вещество. Таким образом было сделано настоящее изобретение.
В связи с этим, настоящее изобретение относится к:
[1] (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)-пропановой кислоте, ее соли или сольвату;
[2] соединению по вышеуказанному пункту [1], которое представляет собой (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту, тозилат (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)-пропановой кислоты или гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты;
[3] соединению по вышеуказанному пункту [2], которое представляет собой кристаллическую (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)-фенил)пропановую кислоту;
[4] соединению по вышеуказанному пункту [3], температура плавления которого составляет от около 177,0°С до около 181,9°С;
[5] соединению по вышеуказанным пунктам [3] или [4], на порошковой дифракционной рентгенограмме которого имеются пики по меньшей мере при значениях 29 около 4,03, 7,21; 9,98; 10,72; 17,93 и 19,20 градусов;
[6] соединению по любому из вышеуказанных пунктов [3]-[5], на порошковой дифракционной рентгенограмме которого имеются пики при значениях 20 около 4,03; 7,21; 9,98; 10,72; 11,93; 12,90; 13,48; 14,65; 15,23; 15,99; 16,56; 17,23; 17,93; 19,20; 20,88; 21,66; 22,36; 22,50 и 24,58 градусов;
[7] соединению по любому из вышеуказанных пунктов [3]-[6], которое характеризуется порошковой дифракционной рентгенограммой, показанной на фиг.4;
[8] соединению по любому из вышеуказанных пунктов [3]-[7], которое на кривой дифференциальной сканирующей калориметрии имеет экзотермический пик при температуре около 148,7°С, и эндотермические пики - при температуре около 184,7°С, около 194,7°С, и около 200,3°С;
[9] соединению по любому из вышеуказанных пунктов [3]-[8], которое характеризуется кривой дифференциальной сканирующей калориметрии, показанной на фиг.5;
[10] соединению по любому из вышеуказанных пунктов [3]-[9], в инфракрасном спектре которого имеется поглощение при 1771, 1720, 1632, 1602, 1543, 1506, 1469, 1451, 1387, 1359, 1316, 1287, 1203, 1165, 1093, 1069, 1026, 957, 937, 898, 863, 802, 742, 710, 687, 615, 557, 526, 490, 482, 452, 424, 416 и 408 см-1;
[11] соединению по любому из вышеуказанных пунктов [3]-[10], которое характеризуется инфракрасным спектром поглощения, представленным на фиг.6;
[12] соединению по вышеуказанному пункту [3], температура плавления которого составляет от около 174,7°C до около 179,0°C;
[13] соединению по вышеуказанному пункту [3] или [12], на порошковой дифракционной рентгенограмме которого имеется по меньшей мере пик при значении 29 около 4,62 градусов;
[14] соединению по любому из вышеуказанных пунктов [3], [12] и [13], на порошковой дифракционной рентгенограмме которого имеются пики по меньшей мере при значениях 29 около 4,62; 8,40; 9,54; 12,08; 15,38 и 18,16 градусов;
[15] соединению по любому из вышеуказанных пунктов [3] и [12]-[14], которое характеризуется порошковой дифракционной рентгенограммой, показанной на фиг.7;
[16] соединению по любому из вышеуказанных пунктов [3] и [12]-[15], которое на кривой дифференциальной сканирующей калориметрии имеет экзотермический пик при температуре около 183,3°C и эндотермические пики - при температуре около 192,2°C и около 200,8°C;
[17] соединению по любому из вышеуказанных пунктов [3] и [12]-[16], которое характеризуется кривой дифференциальной сканирующей калориметрии, показанной на фиг.8.
[18] соединению по любому из вышеуказанных пунктов [3] и [12]-[17], в инфракрасном спектре которого имеется поглощение при 1771, 1715, 1608, 1505, 1469, 1452, 1411, 1386, 1368, 1352, 1315, 1288, 1256, 1201, 1166, 1092, 1070, 1026, 955, 895, 865, 803, 744, 711, 675, 617, 605, 472, 444, 432 и 414 см-1;
[19] соединению по любому из вышеуказанных пунктов [3] и [12]-[18], которое характеризуется инфракрасным спектром поглощения, показанным на фиг.9;
[20] соединению по вышеуказанному пункту [2], которое представляет собой кристаллический тозилат (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты;
[21] соединению по вышеуказанному пункту [20], температура плавления которого составляет от около 132,0°C до около 136,0°C.
[22] соединению по вышеуказанному пункту [20] или [21], на порошковой дифракционной рентгенограмме которого имеются пики по меньшей мере при значениях 2θ около 10,97; 11,58; 14,83; 16,36; 16,70; 19,42; 20,58 и 21,69 градусов.
[23] соединению по любому из вышеуказанных пунктов [20]-[22], на порошковой дифракционной рентгенограмме которого имеются пики при значениях 2θ около 5,15, 6,97, 7,46, 10,97, 11,58, 13,74, 14,83, 15,20, 16,10, 16,36, 16,70, 17,35, 18,30, 18,83, 19,42, 19,95, 20,58,21,69,22,63,22,84 и 24,00 градусов.
[24] соединению по любому из вышеуказанных пунктов [20]-[23], которое характеризуется порошковой дифракционной рентгенограммой, показанной на фиг.10;
[25] соединению по любому из вышеуказанных пунктов [20]-[24], которое на кривой дифференциальной сканирующей калориметрии имеет эндотермический пик при температуре около 135,95°C.
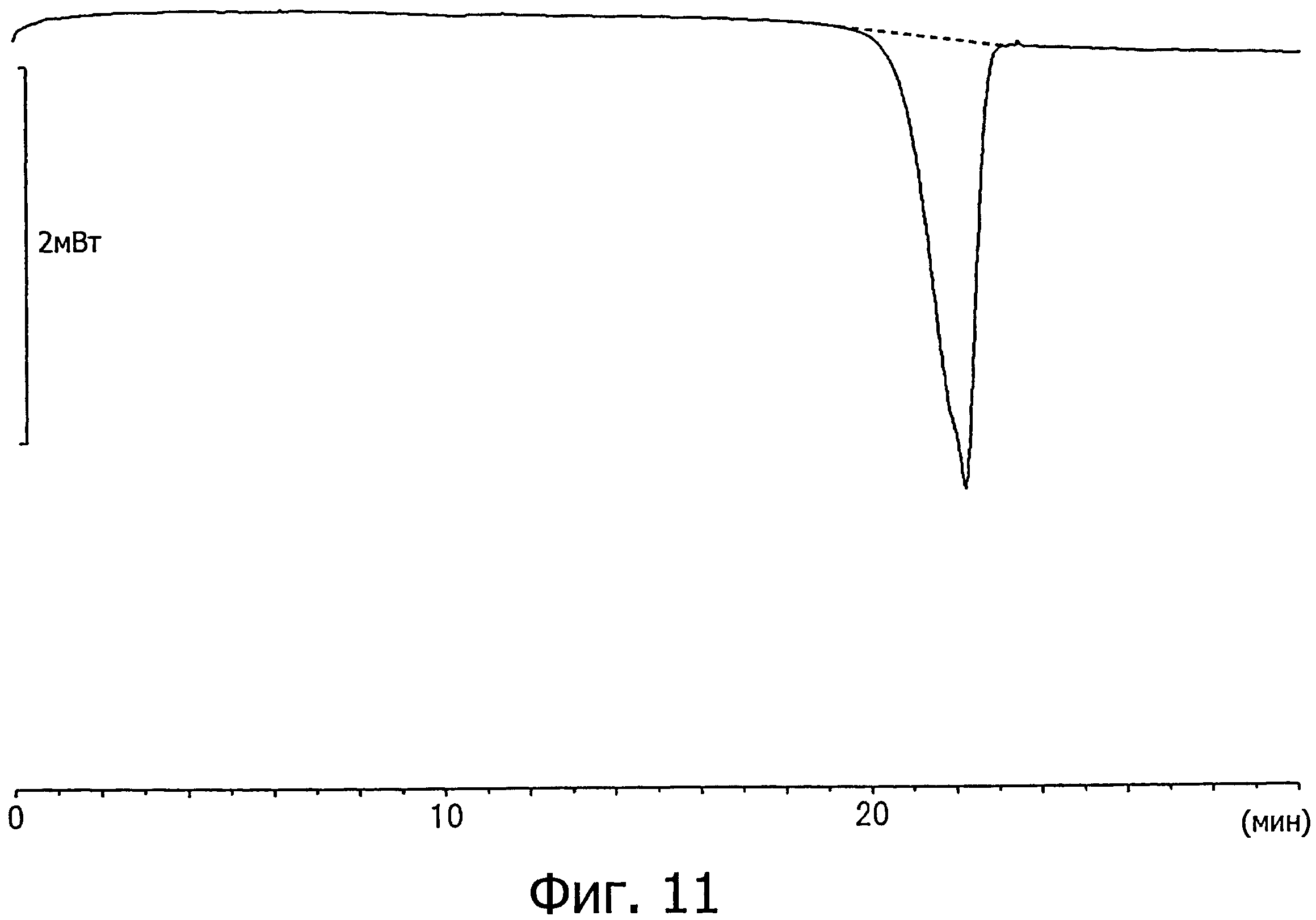
[26] соединению по любому из вышеуказанных пунктов [20]-[25], которое характеризуется кривой дифференциальной сканирующей калориметрии, показанной на фиг.11;
[27] соединению по любому из вышеуказанных пунктов [20]-[26], в инфракрасном спектре которого имеется поглощение при 1780, 1712, 1599, 1508, 1452, 1388, 1316, 1289, 1217, 1166, 1120, 1090, 1071, 1036, 1026, 1010, 957, 900, 864, 817, 742, 713, 680, 622, 567, 550,472 и 440 см-1;
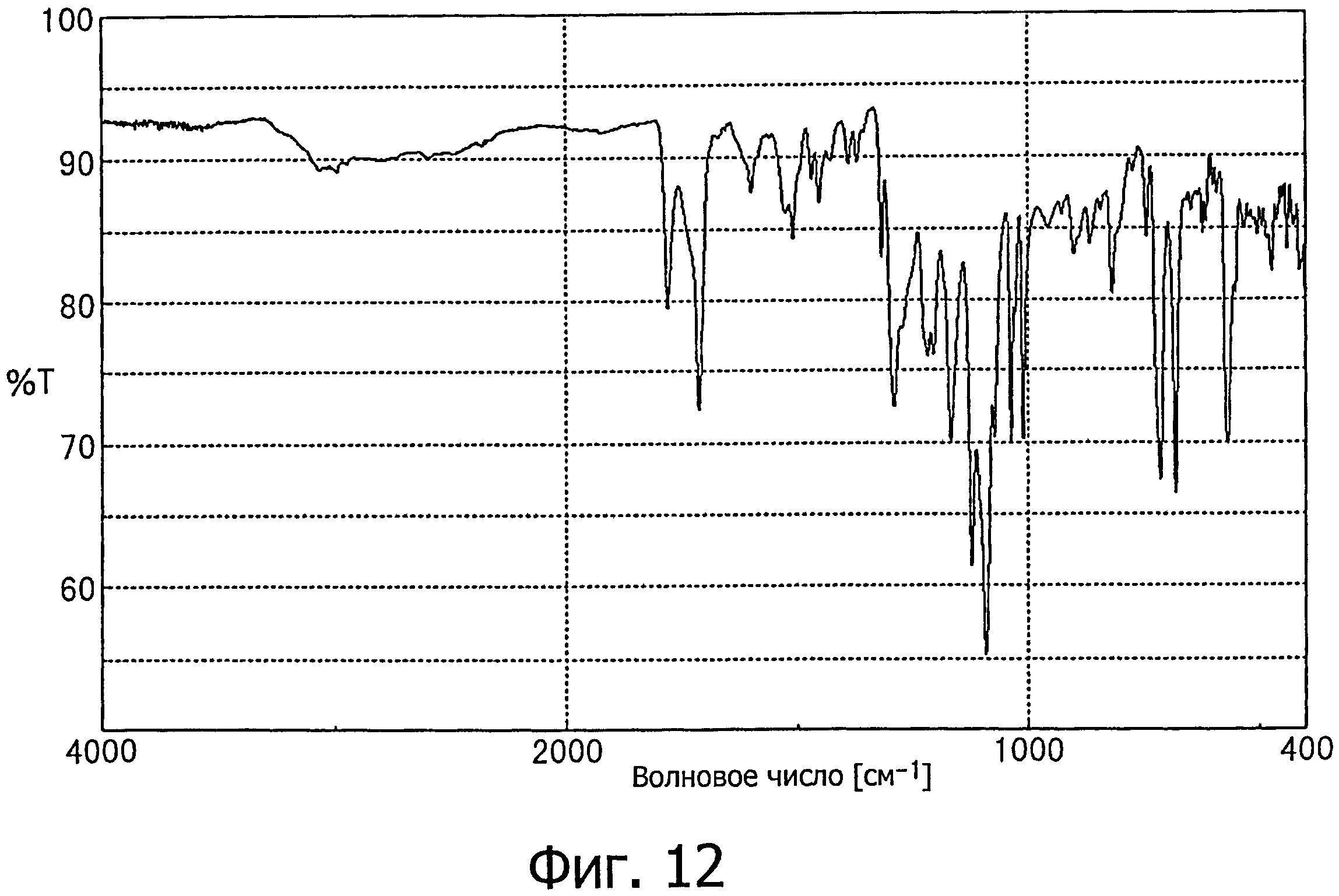
[28] соединению по любому из вышеуказанных пунктов [20]-[27], которое характеризуется инфракрасным спектром поглощения, представленным на фиг.12;
[29] соединению по вышеуказанному пункту [20], температура плавления которого составляет от около 132,3°C до около 135,3°C.
[30] соединению по любому из вышеуказанных пунктов [20]-[29], на порошковой дифракционной рентгенограмме которого имеются пики по меньшей мере при значениях 2θ около 10,01, 11,88, 13,87, 15,01, 15,87, 16,07, 17,81, 18,65, 19,17 и 22,11 градусов;
[31] соединению по любому из вышеуказанных пунктов [20], [29] и [30], на порошковой дифракционной рентгенограмме которого имеются пики по меньшей мере при значениях 2θ около 4,04, 5,04, 5,54, 6,11, 6,60, 7,96, 8,62, 10,01, 10,32, 11,88, 12,88, 13,87, 15,01, 15,87, 16,07, 16,74, 17,17, 17,81, 18,65, 19,17, 19,72, 20,27, 20,93, 21,67, 22,11, 22,56, 23,11, 23,47 и 24,21 градусов;
[32] соединению по любому из вышеуказанных пунктов [20] и [29]-[31], которое характеризуется порошковой дифракционной рентгенограммой, показанной на фиг.13;
[33] соединению по любому из вышеуказанных пунктов [20] и [29]-[32], которое на кривой дифференциальной сканирующей калориметрии имеет эндотермический пик при температуре около 134,54°C;
[34] соединению по любому из вышеуказанных пунктов [20] и [29]-[33], которое характеризуется кривой дифференциальной сканирующей калориметрии, показанной на фиг.14;
[35] соединению по любому из вышеуказанных пунктов [20] и [29]-[34], в инфракрасном спектре которого имеется поглощение при 1781, 1711, 1600, 1507, 1315, 1287, 1220, 1203, 1166, 1119, 1088, 1070, 1036, 1027, 1010, 944, 898, 863, 816, 713, 681, 617, 567, 531, 517, 507, 484, 470, 452, 437, 421 и 413 см-1;
[36] соединению по любому из вышеуказанных пунктов [20] и [29]-[35], которое характеризуется инфракрасным спектром поглощения представленным на фиг.15;
[37] соединению по вышеуказанному пункту [2], которое представляет собой аморфный гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты;
[38] соединению по вышеуказанному пункту [37], температура плавления которого составляет от около 112,0°C до около 117,0°C;
[39] соединению по вышеуказанному пункту [37] или [38], которое характеризуется порошковой дифракционной рентгенограммой, показанной на фиг.16;
[40] соединению по любому из вышеуказанных пунктов [37]-[39], которое на кривой дифференциальной сканирующей калориметрии имеет эндотермический пик при температуре около 82,83°C;
[41] соединению по любому из вышеуказанных пунктов [37]-[40], которое характеризуется кривой дифференциальной сканирующей калориметрии, показанной на фиг.17;
[42] соединению по любому из вышеуказанных пунктов [37]-[41], в инфракрасном спектре которого имеется поглощение при 3409, 2992, 2944, 2865, 2629, 1970, 1774, 1718, 1655, 1601, 1585, 1508, 1470, 1452, 1428, 1388, 1369, 1317, 1290, 1258, 1204, 1168, 1125, 1093, 1070, 1026, 1003, 958, 866, 806, 741, 714, 687, 617, 530, 496, 467, 447 и 419 см-1;
[43] соединению по любому из вышеуказанных пунктов [37]-[42], которое характеризуется инфракрасным спектром поглощения, представленным на фиг.18;
[44] фармацевтической композиции, содержащей (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту, ее соль или сольват;
[45] фармацевтической композиции по вышеуказанному пункту [44], которая является профилактическим и/или терапевтическим средством против болезни Паркинсона и/или синдрома Паркинсона;
[46] лекарственному средству, содержащему комбинацию (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты, ее соли или сольвата и ингибитора декарбоксилазы ароматических L-аминокислот и/или ингибитора катехол-O-метилтрансферазы;
[47] лекарственному средству по вышеуказанному пункту [46], в котором ингибитор декарбоксилазы ароматических L-аминокислот представляет собой гидрат карбидопы или гидрохлорид бензеразида;
[48] лекарственному средству по вышеуказанному пункту [46], в котором ингибитор катехол-O-метилтрансферазы представляет собой энтакапон, толкапон, нитекапон, BIA-3-202 или CGP-28014;
[49] лекарственному средству по любому из [46]-[48], который представляет собой комбинированный препарат;
[50] способу профилактики и/или лечения болезни Паркинсона и/или синдрома Паркинсона, включающему введение млекопитающим эффективного количества (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты, ее соли или сольвата;
[51] способу профилактики и/или лечения по вышеуказанному пункту [50], дополнительно включающему введение эффективного количества ингибитора декарбоксилазы ароматических L-аминокислот и/или ингибитора катехол-O-метилтрансферазы;
[52] (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)-пропановой кислоте, ее соли или сольвату для профилактики и/или лечения болезни Паркинсона и/или синдрома Паркинсона;
[53] (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)-пропановой кислоте, ее соли или сольвату для использования в комбинации с ингибитором декарбоксилазы ароматических L-аминокислот и/или ингибитором катехол-O-метилтрансферазы для профилактики и/или лечения болезни Паркинсона и/или синдрома Паркинсона;
[54] применению (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)-окси)фенил)пропановой кислоты, ее соли или сольвата для изготовления профилактического и/или терапевтического средства против болезни Паркинсона и/или синдрома Паркинсона;
[55] профилактическому и/или терапевтическому средству против болезни Паркинсона и/или синдрома Паркинсона, содержащему (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту, ее соль или сольват;
[56] (S)-((4-(3-(бензилокси)-2-((трет-бутоксикарбонил)амино)-3-оксопропил)-1,2-фенилен)бис(окси))бис(2-метил-1-оксопропан-2,1-диил)дибензоату или его соли; и
[57] (S)-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)-2-((трет-бутоксикарбонил)амино)пропановой кислоте или ее соли.
Полезность изобретения
(2S)-2-Амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота, ее соль или сольват (в данной заявке иногда вместе сокращенно называемые «соединение по настоящему изобретению») представляет собой пролекарство леводопы, которое устраняет фармакокинетические недостатки леводопы и может обеспечивать эффективную концентрацию леводопы в крови при небольшом числе доз. Принимая соединение по настоящему изобретению вместо леводопы, можно поддерживать эффективную концентрацию леводопы в крови в течение около 16 часов при приеме двух доз в день (не больше трех доз в день) у пациентов с болезнью Паркинсона и/или синдрома Паркинсона, которые ранее принимали леводопу, предпочтительно у пациентов с болезнью Паркинсона и/или синдрома Паркинсона, которые ранее принимали леводопу в комбинации с DCI. Так как такая же эффективность может быть получена при приеме двух доз в день, также можно улучшить соблюдение режима пациентами, которым ранее приходилось принимать препарат леводопы в виде 6-12 доз в день.
К тому же, соединение по настоящему изобретению представляет собой пролекарство, способное обеспечивать эффективную концентрацию леводопы в крови человека (эффективная концентрация леводопы в плазме 0,4-1 мкг/мл) в течение длительного периода времени и уменьшает возможность развития побочных эффектов, таких как дискинезия или «истощения дозы», насколько это возможно, обеспечивая пологую кривую зависимости концентрация леводопы в крови - время.
Кроме того, соединение по настоящему изобретению представляет собой лекарство, которое не вызывает вопросов касательно его мутагенности. Исследования, проведенные авторами настоящего изобретения, показали, что среди пролекарств леводопы, особенно среди некоторых соединений с длительным временем удерживания в крови, имеется некоторое количество соединений, для которых доказано, что они обладают мутагенностью, в анализе на мутагенность с использованием клеток млекопитающих. Однако, так как соединение по настоящему изобретению не обладает мутагенностью, даже в том случае, если лекарство приходится принимать в течение нескольких лет или нескольких десятилетий при болезни Паркинсона и/или синдроме Паркинсона, пациенты могут продолжать принимать лекарство и не беспокоиться.
Краткое описание фигур
На фиг.1 показана кривая зависимости концентрация леводопы в плазме - время при введении леводопы или соединения по настоящему изобретению собакам в использовании в комбинации с DCI (карбидопой).
На фиг.2 показана симуляция кривой зависимости концентрация леводопы в плазме - время для человека, построенной с использованием кинетических данных для леводопы или соединения по настоящему изобретению, полученных на собаках при использовании в комбинации с DCI (карбидопой).
На фиг.3 показано изменение во вращательном поведении крыс при введении леводопы или соединения по настоящему изобретению при использовании в комбинации с DCI (бензеразидом) крысам, которым сделана инъекция 6-гидроксидофамина в медиальный пучок переднего мозга.
На фиг.4 показана порошковая дифракционная рентгенограмма кристаллической (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты (кристаллы типа А), полученной в примере 9.
На фиг.5 показана кривая дифференциальной сканирующей калориметрии кристаллической (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)-фенил)пропановой кислоты (кристаллы типа А), полученной в примере 9.
На фиг.6 показан инфракрасный спектр поглощения кристаллической (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты (кристаллы типа А), полученной в примере 9.
На фиг.7 показана порошковая дифракционная рентгенограмма кристаллической (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты (кристаллы типа В), полученной в примере 10.
На фиг.8 показана кривая дифференциальной сканирующей калориметрии кристаллической (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)-фенил)пропановой кислоты (кристаллы типа В), полученной в примере 10.
На фиг.9 показан инфракрасный спектр поглощения кристаллической (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты (кристаллы типа В), полученной в примере 10.
На фиг.10 показана порошковая дифракционная рентгенограмма кристаллического тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)-фенил)пропановой кислоты (кристаллы типа А), полученного в примере 6.
На фиг.11 показана кривая дифференциальной сканирующей калориметрии кристаллического тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)-окси)фенил)пропановой кислоты (кристаллы типа А), полученного в примере 6.
На фиг.12 показан инфракрасный спектр поглощения кристаллического тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты (кристаллы типа А), полученного в примере 6.
На фиг.13 показана порошковая дифракционная рентгенограмма кристаллического тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)-пропановой кислоты (кристаллы типа В), полученного в примере 7.
На фиг.14 показана кривая дифференциальной сканирующей калориметрии кристаллического тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)-окси)фенил)пропановой кислоты (кристаллы типа В), полученного в примере 7.
На фиг.15 показан инфракрасный спектр поглощения кристаллического тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты (кристаллы типа В), полученного в примере 7.
На фиг.16 показана порошковая дифракционная рентгенограмма аморфного гидрохлорида (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)-окси)фенил)пропановой кислоты, полученного в примере 5.
На фиг.17 показана кривая дифференциальной сканирующей калориметрии аморфного гидрохлорида (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты, полученного в примере 5.
На фиг.18 показан инфракрасный спектр поглощения аморфного гидрохлорида (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты, полученного в примере 5.
Осуществление изобретения
В настоящем изобретении (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота является соединением, представленным следующей формулой

Как будет ясно специалистам в данной области техники, в настоящем изобретении, если не оговорено иное, символ

указывает на то, что присоединенный заместитель расположен за плоскостью листа (т.е. α-конфигурация); символ

указывает на то, что присоединенный заместитель расположен перед плоскостью листа (т.е. β-конфигурация); и символ

указывает на то, что присоединенный заместитель находится в α-конфигурации, β-конфигурации, или в виде их смеси с произвольным соотношением.
Настоящее изобретение, если не указано иное, включает все изомеры. Например, изомеры, обусловленные наличием асимметрического атома углерода или им подобные (R-изомер, S-изомер, α-конфигурация, β-конфигурация, энантиомеры и диастереомеры), оптически активные изомеры, обладающие оптической активностью (D-изомер, L-изомер, d-изомер и l-изомер), полярные соединения при хроматографическом разделении (высокополярные соединения и низкополярные соединения), равновесные соединения (такие как таутомеры с амидной связью), вращательные изомеры, их смеси с произвольным соотношением и рацемические смеси, - все они включены в настоящее изобретение.
В настоящем изобретении (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту превращают в соответствующую соль известными способами. В качестве соли предпочтительна растворимая в воде соль. Примеры подходящих солей включают кислотно-аддитивные соли (например, соли неорганических кислот, такие как гидрохлориды, гидробромиды, гидройодиды, сульфаты, фосфаты и нитраты; и соли органических кислот, такие как ацетаты, лактаты, тартраты, бензоаты, цитраты, метансульфонаты, этансульфонаты, бензолсульфонаты, толуолсульфонаты, иора-толуолсульфонаты (тозилаты), изетионаты, глюкоронаты и глюконаты), соли природных кислых аминокислот (такие как аспарагиновая кислота и глутаминовая кислота), соли щелочных металлов (таких как натрий и калий), соли щелочноземельных металлов (таких как кальций и магний), соли аммония, соли тетраметиламмония, соли тетрабутиламмония, соли фармацевтически приемлемых органических аминов, например алкиламинов (таких как метиламин, диметиламин, триметиламин и триэтиламин), гетероциклических аминов (таких как пиридин, пиколин и пиперидин), алканоламинов (таких как этаноламин, диэтаноламин и триэтаноламин), дициклогексиламина, N,N'-дибензилэтилендиамина, циклопентиламина, бензиламина, дибензиламина, фенетиламина, трис(гидроксиметил)метиламина и N-метил-D-глюкамин), и соли природных основных аминокислот (таких как аргинин, лизин, орнитин и гистидин).
(2S)-2-Амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота и ее соль можно также превратить в сольват. Сольват предпочтительно является низкотоксичным и растворимым в воде. Примеры подходящих сольватов включают, например, сольваты с водой или растворителем-спиртом (таким как этанол).
Кроме того, каждый атом, входящий в состав (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты, ее соли или сольвата, может быть при необходимости замещен соответствующим изотопом (таким как2Н,3H,13С,14С,35S или125I) или т.п.
В настоящем изобретении (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота, ее соль или ее сольват, т.е. соединение по настоящему изобретению, не ограничена конкретной кристаллической формой и может быть кристаллической или аморфной или может представлять собой смесь кристаллического соединения и аморфного соединения с произвольным соотношением. Кристаллическую форму соединения по настоящему изобретению можно определить путем проведения измерений с помощью известных аналитических методов, используемых для кристаллографического анализа, таких как порошковая рентгеновская дифракционная спектрометрия, дифференциальная сканирующая калориметрия, инфракрасная абсорбционная спектрометрия и определение температуры плавления соединений в чистом виде или в комбинации.
Доказано, что среди соединений по настоящему изобретению, например, (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота имеет по меньшей мере две кристаллических формы (которые, чтобы их различать, в настоящем описании для удобства называют кристаллами типа А и кристаллами типа В).
Кристаллы типа А (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом порошковой рентгеновской дифракционной спектрометрии они дают пики по меньшей мере при значениях 29 около 4,03; 7,21; 9,98; 10,72; 17,93 и 19,20 градусов, и предпочтительно дают пики при значениях 29 около 4,03; 7,21; 9,98; 10,72; 11,93; 12,90; 13,48; 14,65; 15,23; 15,99; 16,56; 17,23; 17,93; 19,20; 20,88; 21,66; 22,36; 22,50 и 24,58 градусов, более предпочтительно они дают данные, показанные в таблице 3 в описанном ниже примере 9, особенно предпочтительно они дают по существу те же данные, что и на порошковой дифракционной рентгенограмме, показанной на фиг.4.
Кристаллы типа А (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом дифференциальной сканирующей калориметрии они дают экзотермический пик при температуре около 148,7°C, а также имеют экзотермические пики при температуре около 184,7°C, 194,7°C и 200,3°C, предпочтительно дают по существу те же данные, что и на кривой дифференциальной сканирующей калориметрии, показанной на фиг.5.
Кристаллы типа А (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом абсорбционной инфракрасной спектрометрии они поглощают при 1771, 1720, 1632, 1602, 1543, 1506, 1469, 1451, 1387, 1359, 1316, 1287, 1203, 1165, 1093, 1069, 1026, 957, 937, 898, 863, 802, 742, 710, 687, 615, 557, 526, 490, 482, 452, 424, 416 и 408 см-1, и предпочтительно дают по существу те же данные, что и инфракрасный спектр поглощения, показанный на фиг.6.
Кристаллы типа А (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом определения температуры плавления они имеют температуру плавления от около 177,0°C до около 181,9°C.
Кристаллы типа В (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом порошковой рентгеновской дифракционной спектрометрии они дают по меньшей мере пик при значении 2θ равном 4,62 градуса, предпочтительно дают пики при значениях 2θ около 4,62; 8,40; 9,54; 12,08; 15,38, и 18,16 градусов, более предпочтительно дают данные, показанные в таблице 4 в описанном ниже примере 10, особенно предпочтительно дают по существу те же данные, что и на порошковой дифракционной рентгенограмме, показанной на фиг.7.
Кристаллы типа В (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом дифференциальной сканирующей калориметрии они дают экзотермический пик при температуре около 183,3°C, а также экзотермические пики при температуре около 192,2°C и 200,8°C, предпочтительно они дают по существу те же данные, что и на кривой дифференциальной сканирующей калориметрии, показанной на фиг.8.
Кристаллы типа В (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом абсорбционной инфракрасной спектрометрии они поглощают при 1771, 1715, 1608, 1505, 1469, 1452, 1411, 1386, 1368, 1352, 1315, 1288, 1256, 1201, 1166, 1092, 1070, 1026, 955, 895, 865, 803, 744, 711, 675, 617, 605, 472, 444, 432 и 414 см-1, предпочтительно они дают по существу те же данные, что и инфракрасный спектр поглощения, показанный на фиг.9.
Кристаллы типа В (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом определения температуры плавления они имеют температуру плавления от около 174,7°С до около 179,0°C.
Доказано, что среди соединений по настоящему изобретению, например, тозилат (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты имеет по меньшей мере две кристаллических формы (которые, чтобы их различать, в настоящем описании для удобства называют кристаллами типом А и кристаллами типа В).
Кристаллы типа А тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом порошковой рентгеновской дифракционной спектрометрией они дают пики по меньшей мере при значениях 2θ около 10,97; 11,58; 14,83; 16,36; 16,70; 19,42; 20,58 и 21,69 градусов, предпочтительно они дают пики при значениях 26 около 5,15; 6,97; 7,46; 10,97; 11,58; 13,74; 14,83; 15,20; 16,10; 16,36; 16,70; 17,35; 18,30; 18,83; 19,42; 19,95; 20,58; 21,69; 22,63; 22,84 и 24,00 градусов, более предпочтительно дают данные, показанные в таблице 1 в описанном ниже примере 6, особенно предпочтительно дают по существу те же данные, что и на порошковой дифракционной рентгенограмме, показанной на фиг.10.
Кристаллы типа А тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом дифференциальной сканирующей калориметрии они дают эндотермический пик при температуре около 135,95°C, предпочтительно дают по существу те же данные, что и на кривой дифференциальной сканирующей калориметрии, показанной на фиг.11.
Кристаллы типа А тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом абсорбционной инфракрасной спектрометрии они поглощают при 1780, 1712, 1599, 1508, 1452, 1388, 1316, 1289, 1217, 1166, 1120, 1090, 1071, 1036, 1026, 1010, 957, 900, 864, 817, 742, 713, 680, 622, 567, 550, 472 и 440 см-1, предпочтительно дают по существу те же данные, что и инфракрасный спектр поглощения, показанный на фиг.12.
Кристаллы типа А тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом определения температуры плавления их температура плавления составляет около от 132,0 до около 136,0°C.
Кристаллы типа В тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом порошковой рентгеновской дифракционной спектрометрии они дают пики по меньшей мере при значениях 2θ около 10,01; 11,88; 13,87; 15,01; 15,87; 16,07; 17,81; 18,65; 19,17 и 22,11 градусов, предпочтительно дают пики при значениях 29 около 4,04; 5,04; 5,54; 6,11; 6,60; 7,96; 8,62; 10,01; 10,32; 11,88; 12,88; 13,87; 15,01; 15,87; 16,07; 16,74; 17,17; 17,81; 18,65; 19,17; 19,72; 20,27; 20,93; 21,67; 22,11; 22,56; 23,11; 23,47 и 24,21 градусов, более предпочтительно дают данные, показанные в таблице 2 в описанном ниже примере 7, особенно предпочтительно дают по существу те же данные, что и на порошковой дифракционной рентгенограмме, показанной на фиг.13.
Кристаллы типа В тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом дифференциальной сканирующей калориметрии они дают эндотермический пик при температуре около 134,54°C, предпочтительно дают по существу те же данные, что и на кривой дифференциальной сканирующей калориметрии, показанной на фиг.14.
Кристаллы типа В тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе абсорбционной инфракрасной спектрометрией они поглощают при 1781, 1711, 1600, 1507, 1315, 1287, 1220, 1203, 1166, 1119, 1088, 1070, 1036, 1027, 1010, 944, 898, 863, 816, 713, 681, 617, 567, 531, 517, 507, 484, 470, 452, 437, 421, и 413 см-1, предпочтительно дают по существу те же данные, что и инфракрасный спектр поглощения, показанный на фиг.15.
Кристаллы типа В тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличаются тем, что, например, при анализе методом определения температуры плавления их температура плавления составляет от около 132,3°C до около 135,3°C.
Кроме того, доказано, что из соединений по настоящему изобретению, например, гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты имеет аморфную кристаллическую форму.
Аморфный гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличается тем, что, например, в анализе методом порошковой рентгеновской дифракционной спектрометрии не наблюдается пиков кристаллов.
Аморфный гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличается тем, что, например, при анализе методом дифференциальной сканирующей калориметрии он имеет экзотермический пик при температуре около 82,83°C, предпочтительно дают по существу те же данные, что и на кривой дифференциальной сканирующей калориметрии, показанной на фиг.17.
Аморфный гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличается тем, что, например, при анализе методом абсорбционной инфракрасной спектрометрии они поглощает при 3409, 2992, 2944, 2865, 2629, 1970, 1774, 1718, 1655, 1601, 1585, 1508, 1470, 1452, 1428, 1388, 1369, 1317, 1290, 1258, 1204, 1168, 1125, 1093, 1070, 1026, 1003, 958, 866, 806, 741, 714, 687, 617, 530, 496, 467, 447 и 419 см-1, предпочтительно дает по существу те же данные, что и инфракрасный спектр поглощения, показанный на фиг.18.
Аморфный гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты отличается тем, что, например, при анализе методом определения температуры плавления его температура плавления составляет около от 112,0°C до около 117,0°C.
Кристаллическая форма соединения по настоящему изобретению характеризуется физико-химическими свойствами, раскрываемыми в настоящем описании, однако соответствующие данные могут немного варьироваться по своей природе, и поэтому их не следует интерпретировать слишком строго.
Например, данные, полученные методом порошковой рентгеновской дифракционной спектрометрии, например относительная интенсивность, могут немного варьироваться в зависимости от направления роста кристаллов, размера зерна, условий измерения и т.п., что обусловлено их природой, и поэтому для идентификации кристаллических форм важны угол дифракции (2θ) или общая картина дифракции. Кроме того, при определении и идентификации кристаллических форм, если необходимо, из порошковой дифракционной рентгенограммы высчитывают полуширину пика, и она может быть использована в сочетании с углом дифракции (2θ), общей картиной дифракции или относительной интенсивностью.
Кроме того, данные, полученные методом дифференциальной сканирующей калориметрии или инфракрасной абсорбционной спектрометрии, могут немного варьироваться в зависимости от условий измерения и т.п., что обусловлено их природой, и, следовательно, для определения и идентификации кристаллических форм важна общая картина.
Таким образом, все соединения, дающие общую картину в по меньшей мере одном методе из порошковой рентгеновской дифракционной спектрометрии, дифференциальной сканирующей калориметрии и инфракрасной абсорбционной спектрометрии, аналогичную общей картине кристаллической формы соединения по настоящему изобретению, описываемого в настоящем документе, включены в настоящее изобретение.
Далее, хотя специалистам в данной области техники это и так будет понятно, в описанных ниже в настоящем описании чертежах на порошковой дифракционной рентгенограмме угол дифракции (2θ) (в градусах) указан на горизонтальной оси (2-тэта шкала), интенсивность дифракции указана на вертикальной оси (Интенсивность (число отсчетов)); на кривой дифференциальной сканирующей калориметрии время (мин) или температура (°C) указаны на горизонтальной оси, тепловой поток указан на вертикальной оси; а в инфракрасном спектре поглощения на горизонтальной оси указана длина волны (волновое число [см-1]), а на вертикальной оси указан коэффициент пропускания (%Т).
Соединение по настоящему изобретению представляет собой пролекарство леводопы и высвобождает леводопу в результате метаболизма in vivo, проходящего через все или некоторые из следующих интермедиатов (1)-(7):
(1) (S)-2-амино-3-(3-((2-(бензоилокси)-2-метилпропаноил)окси)-4-((2-гидрокси-2-метилпропаноил)окси)фенил)пропановая кислота;
(2) (S)-2-амино-3-(4-((2-(бензоилокси)-2-метилпропаноил)окси)-3-((2-гидрокси-2-метилпропаноил)окси)фенил)пропановая кислота;
(3) (S)-2-амино-3-(3-((2-(бензоилокси)-2-метилпропаноил)окси)-4-гидроксифенил)пропановая кислота;
(4) (S)-2-амино-3-(3,4-бис((2-гидрокси-2-метилпропаноил)окси)фенил)пропановая кислота;
(5) (S)-2-амино-3-(4-((2-(бензоилокси)-2-метилпропаноил)окси)-3-гидроксифенил)пропановая кислота;
(6) (S)-2-амино-3-(4-гидрокси-3-((2-гидрокси-2-метилпропаноил)окси)фенил)пропановая кислота; и
(7) (S)-2-амино-3-(3-гидрокси-4-((2-гидрокси-2-метилпропаноил)окси)фенил)пропановая кислота.
Как описано выше, соединение по настоящему изобретению представляет собой пролекарство, которое способно давать эффективную концентрацию леводопы в крови человека (эффективная концентрация в плазме крови: 0,4-1 мкг/мл) в течение длительного периода времени и уменьшает возможность развития побочных эффектов, таких как дискинезия или «истощение дозы», насколько это возможно, обеспечивая пологую кривую зависимости: концентрация леводопы в крови - время.
Хотя дальнейшее описание будет изложено на следующих ниже примерах, такие свойства соединения по настоящему изобретению обусловлены комбинацией фармакокинетических параметров соединения по настоящему изобретению, например таких, как (1) «площадь под кривой зависимости концентрация в крови - время (площадь под кривой (AUC))», рассчитанная из кривой зависимости концентрации леводопы в крови от времени при введении соединения по настоящему изобретению и (2) «отношение (Cmax/C6hr) максимальной концентрации в плазме (Cmax) и концентрации в плазме через 6 часов после перорального введения (C6hr)», рассчитанное из кривой зависимости концентрации леводопы в крови от времени при введении соединения по настоящему изобретению.
В настоящем изобретении (1) «площадь под кривой зависимости концентрация в крови - время (площадь под кривой (AUC))», рассчитанная из кривой зависимости концентрации леводопы в крови от времени при введении соединения по настоящему изобретению, может быть использована в качестве показателя воздействия леводопы и (2) «отношение (Cmax/C6hr) максимальной концентрации в плазме (Cmax) и концентрации в плазме через 6 часов после перорального введения (C6hr)», рассчитанное из кривой зависимости концентрации леводопы в крови от времени при введении соединения по настоящему изобретению, может быть использовано в качестве показателя «пологости» кривой зависимости концентрации леводопы в крови от времени.
В исследовании на собаках, у которых распределение карбоксиэстеразы в органах в наибольшей степени похоже на распределение карбоксиэстеразы в органах человека, в случае, когда соединение по настоящему изобретению вводят собакам перорально в дозе, например, 3 мг/кг, в пересчете на леводопу, значение показателя AUC, указанного выше в (1), равно, например, 0,6 мкг·ч/мл или больше, предпочтительно 0,7 мкг·ч/мл или больше, более предпочтительно 0,8 мкг·ч/мл или больше, особенно предпочтительно 0,85 мкг·ч/мл или больше. Значения, служащие в качестве верхних пределов соответствующих интервалов, представляют собой значения AUC (как значение 0,96 мкг·ч/мл, описанное в примерах) для леводопы при пероральном введении эквивалентного количества леводопы (здесь 3 мг/кг).
При этом в тех же условиях соединение по настоящему изобретению показывает отношение Cmax/C6hr, указанное выше в (2), например, равное 100 или меньше, предпочтительно 75 или меньше, более предпочтительно 50 или меньше, еще более предпочтительно 20 или меньше, особенно предпочтительно 10 или меньше.
Соединение по настоящему изобретению может представлять собой «пролекарство, способное обеспечивать эффективную концентрацию леводопы в крови человека в течение длительного периода времени», демонстрируя предпочтительные значения AUC, описанные выше в (1), и значения Cmax/C6hr, описанные выше в (2), в комбинации с кинетическими исследованиями на собаках, и может представлять собой «пролекарство, которое уменьшает вероятность развития побочных эффектов, таких как дискинезия или «истощение дозы», насколько это возможно, и дает пологую кривую зависимости концентрации леводопы в крови от времени».
[Способ получения соединения по настоящему изобретению]
Соединение по настоящему изобретению может быть получено способом, показанным в описанных ниже примерах. Кроме того, соединение по настоящему изобретению можно также получать способом, показанным ниже, или способом аналогичным ему, однако способ получения не ограничивается только этими вариантами.
Соединение по настоящему изобретению можно получать, используя в качестве исходного вещества леводопу

по следующей методике: (А) защита аминогруппы → (В) защита карбоксильной группы → (С) ацилирование гидроксильной группы → (D) снятие защитных групп. При этом порядок стадий (А) и (В) может быть и изменен, если это необходимо.
(А) Защита аминогруппы
Реакции для защиты аминогруппы хорошо известны и их примерами могут служить, например, такие реакции, как (1) способы с использованием хлорангидридов кислот, (2) способы с использованием смешанных ангидридов кислот, (3) способы с использованием конденсирующих агентов и т.п.
Указанные способы будут более конкретно описаны ниже.
(1) Способ с использованием хлорангидрида кислоты осуществляют, например, следующим образом. Карбоновую кислоту вводят во взаимодействие с реагентом для получения хлорангидрида кислоты (таким как оксалилхлорид или тионилхлорид) в органическом растворителе (таком как хлороформ, дихлорметан, диэтиловый эфир или тетрагидрофуран) или в отсутствие какого-либо растворителя при температуре от -20°С до температуры кипения; и полученный хлорангидрид кислоты вводят во взаимодействие с амином в присутствии основания (такого как пиридин, триэтиламин, диметиланилин, диметиламинопиридин или диизопропилэтиламин) в органическом растворителе (таком как хлороформ, дихлорметан, диэтиловый эфир, или тетрагидрофуран) при 0-40°C. Кроме того, такой способ можно также осуществить взаимодействием полученного галогенангидрида кислоты с амином, используя водный раствор щелочи (такой как водный раствор бикарбоната натрия или раствор гидроксида натрия) в органическом растворителе (таком как диоксан или тетрагидрофуран) при 0-40°C.
(2) Способ с использованием смешанного ангидрида кислоты, осуществляют, например, следующим образом. Карбоновую кислоту вводят во взаимодействие с хлорангидридом кислоты (таким как пивалоилхлорид, тозилхлорид или мезилхлорид), производным кислоты (таким как этилхлорформиат или изобутилхлорформиат) или производным ангидрида кислоты (таким как ди-трет-бутилдикарбонат) в органическом растворителе (таком как хлороформ, дихлорметан, диэтиловый эфир или тетрагидрофуран) или в отсутствие растворителя в присутствии основания (такого как пиридин, триэтиламин, диметиланилин, диметиламинопиридин или диизопропилэтиламин) при 0-40°C; и полученный смешанный ангидрид кислоты подвергают взаимодействию с амином в органическом растворителе (таком как хлороформ, дихлорметан, диэтиловый эфир или тетрагидрофуран) при 0-40°C.
(3) Способ с использованием конденсирующего агента, осуществляют, например, следующим образом. Карбоновую кислоту вводят во взаимодействие с амином в органическом растворителе (таком как хлороформ, дихлорметан, диметилформамид, диэтиловый эфир или тетрагидрофуран) или без растворителя в присутствии основания (такого как пиридин, триэтиламин, диметиланилин, диметиламинопиридин или диизопропилэтиламин) или в отсутствие основания с использованием конденсирующего агента (такого как 1,3-дициклогексилкарбодиимид (DCC), 1-этил-3-[3-(диметиламино)пропил]карбодиимид (EDC), 1,1'-карбонилдиимилазол (CDI), йодид 2-хлор-1-метилпиридиния или циклический ангидрид 1-пропанфосфоновой кислоты (Т3Р)), используя или не используя 1-гидроксибензотриазол (HOBt) при 0-40°C.
Реакции в указанных способах (1), (2) и (3) предпочтительно проводят в атмосфере инертного газа (такого как аргон или азот) в безводных условиях.
Примеры защитных групп для аминогруппы включают бензилоксикарбонильную (Cbz) группу, трет-бутоксикарбонильную (Boc) группу, арилоксикарбонильную (Alloc) группу, 1-метил-1-(4-бифенил)этоксикарбонильную (Врос) группу, трифторацетильную группу, 9-флуоренилметоксикарбонильную (Fmoc) группу, бензильную (Bn) группу, n-метоксибензильную группу, бензилоксиметильную (ВОМ) группу, 2-(триметилсилил)этоксиметильную (SEM) группу и т.п.
(В) Защита карбоксильной группы
Реакции для защиты карбоксильной группы хорошо известны и их примерами могут служить, например, (1) способы с использованием хлорангидридов кислот, (2) способы с использованием смешанных ангидридов кислот, (3) способы с использованием конденсирующих агентов и т.п.
Указанные способы будут более подробно описаны ниже.
(1) Способ с использованием хлорангидрида кислоты осуществляют, например, следующим образом. Карбоновую кислоту вводят во взаимодействие с реагентом для получения хлорангидрида кислоты (таким как оксалилхлорид или тионилхлорид) в органическом растворителе (таком как хлороформ, дихлорметан, диэтиловый эфир или тетрагидрофуран) или в отсутствие любого растворителя при температуре от -20°C до температуры кипения, и полученный хлорангидрид кислоты подвергают взаимодействию со спиртом в присутствии или в отсутствие основания (такого как пиридин, триэтиламин, диметиланилин, диметиламинопиридин или диизопропилэтиламин) в органическом растворителе (таком как хлороформ, дихлорметан, диэтиловый эфир, или тетрагидрофуран) при температуре от 0°C до температуры кипения используемого растворителя. Кроме того, такой способ можно также осуществлять взаимодействием галогенангидрида кислоты с использованием водного раствора щелочи (такого как водный раствор бикарбоната натрия или раствор гидроксида натрия) в органическом растворителе (таком как диоксан или тетрагидрофуран) при 0-40°C.
(2) Способ с использованием смешанного ангидрида кислоты, осуществляют, например, следующим образом. Карбоновую кислоту вводят во взаимодействие с хлорангидридом кислоты (таким как пивалоилхлорид, тозилхлорид или мезилхлорид) или производным кислоты (таким как этилхлорформиат или изобутилхлорформиат) в органическом растворителе (таком как хлороформ, дихлорметан, диэтиловый эфир или тетрагидрофуран) или без растворителя в присутствии основания (такого как пиридин, триэтиламин, диметиланилин, диметиламинопиридин или диизопропилэтиламин) при 0-40°C, и полученный смешанный ангидрид кислоты вводят во взаимодействие со спиртом в органическом растворителе (таком как хлороформ, дихлорметан, диэтиловый эфир или тетрагидрофуран) при 0-40°C.
(3) Способ с использованием конденсирующего агента, осуществляют, например, следующим образом. Карбоновую кислоту вводят во взаимодействие со спиртом в органическом растворителе (таком как хлороформ, дихлорметан, диметилформамид, диэтиловый эфир или тетрагидрофуран) или без растворителя в присутствии основания (такого как пиридин, триэтиламин, диметиланилин или диметиламинопиридин) или в отсутствие основания, с использованием конденсирующего агента (такого как 1,3-дициклогексилкарбодиимид (DCC), 1-этил-3-[3-(диметиламино)пропил]карбодиимид (EDC), 1,1'-карбонилдиимидазол (CDI), йодид 2-хлор-1-метилпиридинпиридиния или циклический ангидрид 1-пропанфосфоновой кислоты (ТЗР)), используя или не используя 1-гидроксибензотриазол (HOBt) при температуре 0-40°C.
Реакции в указанных способах (1), (2), и (3) предпочтительно осуществляют в атмосфере инертного газа (такого как аргон или азот) в безводных условиях.
Примеры защитных групп для карбоксильной группы включают метил, этил, трет-бутил, трихлорэтил, бензил (Bn), фенацил, n-метоксибензил, тритил, 2-хлортритил и т.п.
(С) Ацилирование гидроксильной группы
Ацилирование гидроксильной группы соединения, полученного в результате защиты аминогруппы и карбоксильной группы леводопы, т.е. ацилирование соединения, представленного формулой

(где R101 представляет собой защитную группу для аминогруппы и R102 представляет собой защитную группу для карбоксильной группы), осуществляют следующим образом. Карбоновую кислоту, представленную формулой
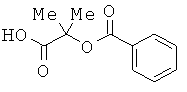
вводят во взаимодействие с реагентом для получения хлорангидрида кислоты (таким как оксалилхлорид или тионилхлорид) в органическом растворителе (таком как хлороформ, дихлорметан, диэтиловый эфир или тетрагидрофуран) или в отсутствие растворителя при температуре от -20°C до температуры кипения; и полученный хлорангидрид кислоты вводят во взаимодействие со спиртом в присутствии основания (такого как пиридин, триэтиламин, диметиланилин, диметиламинопиридин или диизопропилэтиламин) в органическом растворителе (таком как хлороформ, дихлорметан, диэтиловый эфир, тетрагидрофуран или ацетонитрил) при 0-40°C. Кроме того, такой способ может быть также осуществлен реакцией хлорангидрида кислоты с водным раствором щелочи (таким как раствор бикарбоната натрия или раствор гидроксида натрия) в органическом растворителе (таком как диоксан или тетрагидрофуран) при 0-40°C.
(D) Удаление защитных групп
Реакция снятия защиты для удаления защитных групп, обозначенных как R101 и R102, известна и может быть осуществлена следующим способом. Примеры снятия защиты включают:
(1) снятие защиты щелочным гидролизом,
(2) снятие защиты в кислых условиях,
(3) снятие защиты гидрогенолизом,
(4) снятие защиты силильной группы,
(5) снятие защиты с использованием металла, и
(6) снятие защиты с использованием комплекса металла.
Указанные способы будут более подробно описаны ниже.
(1) Снятие защиты щелочным гидролизом проводят, например, в органическом растворителе (таком как метанол, тетрагидрофуран или диоксан), используя гидроксид щелочного металла (такой как гидроксид натрия, гидроксид калия или гидроксид лития), гидроксид щелочноземельного металла (такой как гидроксид бария или гидроксид кальция) или карбонат (такой как карбонат натрия или карбонат калия), или их раствор, или их смесь при 0-40°C.
(2) Снятие защиты в кислых условиях проводят, например, в органическом растворителе (таком как дихлорметан, хлороформ, диоксан, этилацетат или анизол) и в органической кислоте (такой как уксусная кислота, трифторуксусная кислота, метансульфоновая кислота или пара-толуолсульфоновая кислота) или неорганической кислоте (такой как соляная кислота или серная кислота) или в их смеси (такой как смесь бромида водорода и уксусной кислоты) при 0-100°C.
(3) Снятие защиты гидрогенолизом проводят, например, в растворителе (таком как растворитель типа простого эфира (например, тетрагидрофуран, диоксан, диметоксиэтан или диэтиловый эфир), растворитель спиртового типа (таком как метанол или этанол), растворитель бензольного типа (таком как бензол или толуол), растворитель типа кетона (таком как ацетон или метилэтилкетон), растворитель нитрильного типа (таком как ацетонитрил), растворитель амидного типа (таком как диметилформамид), вода, этилацетат, уксусная кислота или смешанный растворитель из двух или более указанных растворителей), в присутствии катализатора (такого как палладий на угле, палладиевая чернь, гидроксид палладия, окись платины или никель Ренея) при нормальном или повышенном давлении в атмосфере водорода или в присутствии формиата аммония при 0-200°C.
(4) Снятие защиты силильных групп проводят, например, в органическом растворителе, способном смешиваться с водой (таком как тетрагидрофуран или ацетонитрил), используя тетрабутиламмонийфторид при 0-40°C.
(5) Снятие защиты с использованием металла проводят, например, в кислом растворителе (таком как уксусная кислота, буферный раствор с pH от 4,2 до 7,2, или смесь такого раствора и органического растворителя, например тетрагидрофурана) в присутствии цинковой пыли при 0-40°C, и, если необходимо, при использовании ультразвуковых волн.
(6) Снятие защиты с использованием комплекса металла проводят, например, в органическом растворителе (таком как дихлорметан, диметилформамид, тетрагидрофуран, этилацетат, ацетонитрил, диоксан или этанол), воде или в смеси этих растворителей в присутствии реагента-ловушки (такого как гидрид трибутилолова, триэтилсилан, димедон, морфолин, диэтиламин или пирролидин), органической кислоты (такой как уксусная кислота, муравьиная кислота или 2-этилгексановая кислота) и/или соли органической кислоты (такой как 2-этилгексаноат натрия или 2-этилгексаноат калия) в присутствии или в отсутствие фосфинового реагента (такого как трифенилфосфин), используя комплекс металла (такой как тетракистрифенилфосфин палладий (0), дихлорид бис(трифенилфосфин)палладия (II), ацетат палладия (II) или хлорид(трифенилфосфин)родия (I) при 0-40°C.
Кроме того, реакция снятия защиты может быть осуществлена другим способом, отличным от описанных выше способов, например, способом, описанным в монографии Protective Groups in Organic Synthesis, Т.W. Greene, John Wiley & Sons, Inc., 1999.
Хотя специалистам в данной области техники это понятно, отметим, что целевое соединение по настоящему изобретению можно легко получить, выбирая подходящую реакцию из вышеописанных реакций снятия защиты.
При этом, как описано выше, соединение по настоящему изобретению не ограничивается его кристаллической формой. Другими словами, соединение по настоящему изобретению может быть кристаллическим или аморфным или может быть смесью кристаллического соединения и аморфного соединения с произвольным соотношением.
Что касается нескольких кристаллических форм соединения по настоящему изобретению, способы их получения подробно раскрываются в описанных ниже примерах, и их получение можно осуществлять в соответствии с указанной методикой. К тому же такое получение можно осуществлять способом, описанным выше, или способом, аналогичным ему, при этом способ получения не ограничивается только этими вариантами.
Например, кристаллический тозилат (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты может быть получен описанным ниже способом, способом, аналогичным ему, или способом, описанным в примерах.
Более конкретно, кристаллический тозилат (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа А может быть получен одним из следующих ниже способов 1 и 2:
(Способ 1) способ, в котором после того, как (2S)-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)-2-((трет-бутоксикарбонил)амино)пропановую кислоту подвергают реакции снятия защиты с использованием пара-толуолсульфоновой кислоты, получают сольват тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты, который, не выделяя из реакционной смеси, сушат при нагревании и пониженном давлении, в результате чего получаются кристаллы типа А; и
(Способ 2) способ, в котором после того, как (2S)-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)-2-((трет-бутоксикарбонил)амино)пропановую кислоту подвергают реакции снятия защиты с использованием пара-толуолсульфоновой кислоты, аморфное соединение извлекают из реакционной смеси, затем перекристаллизовывают, в результате получая кристаллы типа А.
Соответствующие способы подробно будут описаны ниже.
(Способ 1)
Способ 1 представляет собой способ, в котором после того, как (2S)-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)-2-((трет-бутоксикарбонил)амино)пропановую кислоту подвергают реакции снятия защиты, используя пара-толуолсульфоновую кислоту, получают сольват тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты и, не выделяя его из реакционной смеси, сушат при нагревании и пониженном давлении, в результате получая кристаллы типа А.
Реакция снятия защиты для трет-бутоксикарбонильной группы с помощью пара-толуолсульфокислоты известна, и ее можно проводить, например, в органическом растворителе (таком как ацетонитрил, этанол, этилацетат, трет-бутилметиловый эфир, н-гептан, изопропиловый эфир или смешанный растворитель из двух или нескольких из указанных растворителей) или в смешанном растворителе из такого органического растворителя и воды в присутствии 0,5-10 эквивалентов, предпочтительно 0,5-3 эквивалентов, более предпочтительно 0,5-1,5 эквивалентов пара- толуолсульфокислоты или ее моногидрата при температуре от 0°C до температуры кипения используемого растворителя, предпочтительно при 0-90°C.
Затем сольват, полученный в результате перемешивания полученной смеси (в виде суспензии) при температуре от 0°C до температуры кипения используемого растворителя, предпочтительно при 0-90°C, без выделения из реакционной смеси сушат при нагревании и пониженном давлении при 30-100°C, предпочтительно при 30-70°C, в результате чего могут быть получены кристаллы типа А.
При этом в качестве растворителя в способе 1 предпочтительно используют смешанный растворитель из ацетонитрила и трет-бутилметилового эфира, смешанный растворитель из этилацетата и трет-бутилметилового эфира или смешанный растворитель из ацетонитрила и воды.
(Способ 2)
Способ 2 представляет собой способ, в котором после того, как (2S)-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)-2-((трет-бутоксикарбонил)амино)пропановую кислоту подвергают реакции снятия защиты, используя пара-толуолсульфокислоту, из реакционной смеси извлекают аморфное соединение, затем его перекристаллизовывают, в результате чего получают кристаллы типа А.
Аморфное соединение, которое подвергают перекристаллизации, может быть получено в результате удаления используемого растворителя при пониженном давлении после описанной выше реакции снятия защиты (в способе 1).
Полученное аморфное соединение перекристаллизовывают в органическом растворителе (таком как ацетонитрил, этанол, этилацетат, трет-бутилметиловый эфир, н-гептан, изопропиловый эфир или смешанный растворитель из двух или нескольких перечисленных растворителей) или в смешанном растворителе из такого органического растворителя и воды; или полученное аморфное соединение подвергают перемешиванию (в виде суспензии) при температуре от 0°C до температуры кипения используемого растворителя, предпочтительно при 0-90°C, в результате чего получают сольват. Затем полученный сольват сушат, нагревая при пониженном давлении при температуре 30-100°C, предпочтительно при 30-70°C, в результате чего могут быть получены кристаллы типа А.
При этом в качестве растворителя для снятия защиты в способе 2 предпочтительно используют ацетонитрил, этилацетат, смешанный растворитель из ацетонитрила и воды или смешанный растворитель из этилацетата и воды, и особенно предпочтителен смешанный растворитель из ацетонитрила и воды. Далее перекристаллизацию предпочтительно проводят в смешанном растворителе из этилацетата и трет-бутилметилового эфира, смешанном растворителе из ацетонитрила и трет-бутилметилового эфира, в смешанном растворителе из этилацетата и н-гептана или в смешанном растворителе из этанола и изопропилового эфира, и особенно предпочтительно - в смешанном растворителе из ацетонитрила и трет-бутилметилового эфира.
С другой стороны, кристаллы тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа В могут быть получены любым из следующих способов 3 и 4:
(Способ 3) способ в котором после того, как (2S)-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)-2-((трет-бутоксикарбонил)амино)пропановую кислоту подвергают реакции снятия защиты, используя пара-толуолсульфоновую кислоту, получают сольват тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты и, не выделяя его из реакционной смеси, сушат его при нагревании и пониженном давлении, получая в результате кристаллы типа В.
(Способ 4) способ, в котором после того, как вышеописанным способом 1 или 2 получают кристаллы типа А, сольват, полученный перекристаллизацией или перемешиванием суспензии в органическом растворителе (таком как ацетон) или в смешанном растворителе из органического растворителя и воды, сушат нагреванием при пониженном давлении, получая в результате кристаллы типа В.
Соответствующие способы будут подробно описаны ниже.
(Способ 3)
Способ 3 представляет собой способ, в котором после того, как (2S)-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)-2-((трет-бутоксикарбонил)амино)пропановую кислоту подвергают реакции снятия защиты, используя пара-толуолсульфоновую кислоту, получают сольват тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты и, не выделяя его из реакционной смеси, сушат его при нагревании и пониженном давлении, получая в результате кристаллы типа В.
Реакцию снятия защиты для (2S)-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)-2-((трет-бутоксикарбонил)амино)пропановой кислоты проводят в ацетоне или смешанном растворителе из ацетона и воды в присутствии 0,5-10 эквивалентов, предпочтительно 0,5-3 эквивалентов, более предпочтительно 0,5-1,5 эквивалентов пара-толуолсульфоновой кислоты или ее моногидрата при температуре 0-60°C.
Затем сольват, полученный в результате перемешивания полученной реакционной смеси (в виде суспензии) при 0-60°C, не выделяя, сушат нагреванием при пониженном давлении и температуре 30-100°C, предпочтительно при 30-70°C; в результате могут быть получены кристаллы типа В.
При этом в качестве растворителя в способе 3 предпочтительно используют ацетон.
(Способ 4)
Способ 4 представляет собой способ, в котором после того, как вышеописанным способом 1 или 2 получают кристаллы типа А, сольват, полученный перекристаллизацией или перемешиванием суспензии в органическом растворителе (таком как ацетон) или в смешанном растворителе из органического растворителя и воды, сушат нагреванием при пониженном давлении, получая в результате кристаллы типа В.
Сольват, полученный суспендированием кристаллов тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа А, полученных способом 1 или 2, в ацетоне или смешанном растворителе из ацетона и воды и последующим перемешиванием полученной суспензии при 0-60°C, сушат нагреванием при пониженном давлении и температуре 25-100°C, предпочтительно при 25-70°C, в результате чего можно получить кристаллы типа В.
При этом в качестве растворителя в способе 4 предпочтительно используют ацетон.
Кроме того, неочищенная (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота может быть получена способом, описанным ниже, а также способом, аналогичным ему, или способом, описанным в примерах.
Более конкретно, неочищенный продукт может быть получен из гидрохлорида (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты реакцией по любому из следующих ниже способов 5-7 с использованием неорганического основания, органического основания или органического эпоксидного соединения:
(Способ 5) способ, в котором гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты обессоливают неорганическим основанием;
(Способ 6) способ, в котором гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты обессоливают органическим основанием; и
(Способ 7) способ, в котором гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты обессоливают органическим эпоксидным соединением,
или введением тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты в реакцию одного из следующих ниже способов 8 и 9, в которых используют неорганическое основание или органическое основание:
(Способ 8) способ, в котором тозилат (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты обессоливают неорганическим основанием; и
(Способ 9) способ, в котором тозилат (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты обессоливают органическим основанием.
Указанные способы будут подробно описаны ниже.
(Способ 5)
Способ 5 представляет собой способ, в котором гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты обессоливают неорганическим основанием. Реакция обессоливания гидрохлорида аминокислоты неорганическим основанием известна, и обессоливание проводят, например, осуществляя реакцию в растворителе (таком как ацетонитрил, этилацетат, тетрагидрофуран, диоксан, метанол, этанол, вода или смешанный растворитель из двух или нескольких из этих растворителей), используя 0,5-10 эквивалентов, предпочтительно 0,5 to 3 эквивалента, более предпочтительно 0,5-1,5 эквивалента неорганического основания (такого как гидроксид натрия, гидроксид калия или гидроксид бария) или его водного раствора при температуре от 0°C до температуры кипения используемого растворителя, предпочтительно при 0-40°C.
(Способ 6)
Способ 6 представляет собой способ, в котором гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты обессоливают органическим основанием. Реакция обессоливания гидрохлорида аминокислоты органическим основанием известна, и обессоливание проводят, например, осуществляя реакцию в растворителе (таком как ацетонитрил, этилацетат, тетрагидрофуран, диоксан, метанол, этанол, вода или смешанный растворитель из двух или нескольких из этих растворителей), используя 0,5-10 эквивалентов, предпочтительно 0,5-3 эквивалента, более предпочтительно 0,5-1,5 эквивалента органического основания (такого как триэтиламин, диизопропилэтиламин или N-метилпиперидин) при температуре от 0°C до температуры кипения используемого растворителя, предпочтительно при 0-40°C.
(Способ 7)
Способ 7 представляет собой способ, в котором гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты обессоливают органическим эпоксидным соединением. Реакция обессоливания гидрохлорида аминокислоты органическим эпоксидным соединением известна, и обессоливание проводят, например, осуществляя реакцию в растворителе (таком как ацетонитрил, этилацетат, тетрагидрофуран, диоксан, метанол, этанол, вода или смешанный растворитель из двух или нескольких из этих растворителей), используя 0,5-10 эквивалентов органического эпоксидного соединения (такого как эпихлоргидрин, оксид этилена или оксид стирола) при температуре от 0°С до температуры кипения используемого растворителя, предпочтительно при 0-60°C.
(Способ 8)
Способ 8 представляет собой способ, в котором тозилат (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты обессоливают неорганическим основанием. При этом тозилат (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты, используемый в качестве исходного вещества, может быть кристаллическим или аморфным или может быть смесью кристаллического соединения и аморфного соединения с произвольным соотношением. Реакция обессоливания тозилата аминокислоты неорганическим основанием известна, и обессоливание проводят, например, осуществляя реакцию в растворителе (таком как ацетонитрил, этилацетат, тетрагидрофуран, диоксан, метанол, этанол, вода или смешанный растворитель из двух или нескольких из этих растворителей), используя 0,5-10 эквивалентов, предпочтительно 0,5-3 эквивалента, более предпочтительно 0,5-1,5 эквивалента неорганического основания (такого как гидроксид натрия, гидроксид калия или гидроксид бария) или его водный раствор при температуре от 0°C до температуры кипения используемого растворителя, предпочтительно при 0-40°C.
(Способ 9)
Способ 9 представляет собой способ, в котором тозилат (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты обессоливают органическим основанием. При этом тозилат (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты, используемый в качестве исходного вещества, может быть кристаллическим или аморфным или может быть смесью кристаллического соединения и аморфного соединения с произвольным соотношением. Реакция обессоливания тозилата аминокислоты органическим основанием известна, и обессоливание проводят, например, осуществляя реакцию в растворителе (таком как ацетонитрил, этилацетат, тетрагидрофуран, диоксан, метанол, этанол, вода или смешанный растворитель из двух или нескольких из этих растворителей), используя 0,5-10 эквивалентов, предпочтительно 0,5-3 эквивалента, более предпочтительно 0,5-1,5 эквивалента органического основания (такого как триэтиламин, диизопропилэтиламин или N-метилпиперидин) при температуре от 0°C до температуры кипения используемого растворителя, предпочтительно при 0-40°C.
Кроме того, кристаллическую (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту можно получить по способу, описанному ниже, а также по способу, аналогичному ему, или способу, описанному в примерах.
Более конкретно кристаллы (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа А могут быть получены реакцией в соответствии с любым из следующих способов 10 и 11:
(Способ 10) способ, в котором после того как неочищенную (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту получают любым из вышеописанных способов 5-9, кристаллы типа А получают без выделения неочищенного продукта; и
(Способ 11) способ, в котором после того как неочищенную (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту получают любым из вышеописанных способов 5-9, неочищенный продукт выделяют и превращают в кристаллы типа А.
Указанные способы будут подробно описаны ниже.
(Способ 10)
Способ 10 представляет собой способ, в котором после того как неочищенную (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту получают любым из вышеописанных способов 5-9, кристаллы типа А получают без выделения неочищенного продукта; и
Неочищенный продукт, полученный любым из вышеописанных способов 5-9, предпочтительно способом 7 или 9, перемешивают (в виде суспензии) в растворителе, используемом в реакции обессоливания (таком как ацетонитрил) при температуре 0-80°C, предпочтительно 0-50°C, более предпочтительно 0-30°C, с последующей сушкой нагреванием при пониженном давлении и температуре 25-100°C, предпочтительно 25-70°C, в результате чего получают кристаллы типа А.
При этом в качестве растворителя в способе 10 предпочтительно используют ацетонитрил.
(Способ 11)
Способ 11 представляет собой способ, в котором после того как неочищенную (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту получают любым из вышеописанных способов 5-9, неочищенный продукт выделяют и превращают в кристаллы типа А.
Неочищенный продукт, полученный любым из вышеописанных способов 5-9, выделяют и затем суспендируют в органическом растворителе (таком как ацетонитрил). Затем полученную суспензию перемешивают при температуре 0-80°C, предпочтительно 0-50°C, более предпочтительно 0-30°C, затем сушат при нагревании и пониженном давлении при температуре 25-100°C, предпочтительно 25-70°C, в результате могут быть получены кристаллы типа А.
При этом в качестве растворителя в способе 11 предпочтительно используют ацетонитрил.
С другой стороны, кристаллы (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа В могут быть получены реакцией в соответствии с любым из следующих ниже способов 12 и 13:
(Способ 12) способ, в котором после того как неочищенную (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту получают любым из вышеописанных способов 5-9, кристаллы типа В получают без выделения неочищенного продукта; и
(Способ 13) способ, в котором после того как неочищенную (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту получают любым из вышеописанных способов 5-9, неочищенный продукт выделяют и превращают в кристаллы типа В.
Указанные способы будут подробно описаны ниже.
(Способ 12)
Способ 12 представляет собой способ, в котором после того как неочищенную (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту получают любым из вышеописанных способов 5-9, кристаллы типа В получают без выделения неочищенного продукта.
Неочищенный продукт, полученный любым из вышеописанных способов 5-9, перемешивают в смешанном растворителе, состоящем из растворителя, использованного в реакции обессоливания (такого как ацетонитрил), и воды в соотношении от 100:1 до 100:50, предпочтительно от 100:1 до 100:10, более предпочтительно от 100:5 до 100:10 при температуре 0-80°C, предпочтительно 0-60°C, затем перекристаллизовывают, прибавляя органический растворитель (такой как ацетонитрил). Полученные кристаллы затем сушат при нагревании и пониженном давлении при температуре 25-100°С, предпочтительно 25-70°C, в результате чего могут быть получены кристаллы типа В.
При этом в качестве растворителя в способе 12 предпочтительно используют ацетонитрил.
(Способ 13)
Способ 13 представляет собой способ, в котором после того как неочищенную (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту получают любым из вышеописанных способов 5-9, неочищенный продукт выделяют и превращают в кристаллы типа В.
Неочищенный продукт, полученный любым из вышеописанных способов 5-9, выделяют и затем растворяют в смешанном растворителе, состоящем из органического растворителя и воды в соотношении от 100:1 до 100:50, предпочтительно от 100:1 до 100:10, более предпочтительно от 100:5 до 100:10, и полученный раствор перемешивают при температуре 0-80°C, предпочтительно 0-60°C, затем перекристаллизовывают, прибавляя органический растворитель (такой как ацетонитрил). Полученные кристаллы затем сушат при нагревании и пониженном давлении при температуре 25-100°C, предпочтительно 25-70°C, в результате чего могут быть получены кристаллы типа В.
При этом в качестве растворителя в способе 13 предпочтительно используют ацетонитрил.
Возможно также взаимное превращение кристаллов (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа А и типа В друг в друга. То есть, подвергая кристаллы типа А реакции из вышеописанного способа 12 или 13, можно получать кристаллы типа В. При этом, подвергая кристаллы типа В реакции из вышеописанного способа 10 или 11, можно получать кристаллы типа А.
Соединение по настоящему изобретению может быть получено известным способом, который отличается от описанных выше способов, например способом, описанным в Comprehensive Organic Transformations: A Guide to Functional Group Preparations 2nd Edition. Richard С. Larock, John Wiley & Sons. Inc, 1999, или подобным способом, или частично модифицированным известным способом и т.п. или их сочетанием.
В каждой реакции в настоящем описании соединение, используемое в качестве исходного вещества, известно само по себе или может быть легко получено известными способами.
В каждой реакции в настоящем описании реакцию можно проводить с нагреванием, как понятно специалистам в данной области техники, используя водяную баню, масляную баню, песчаную баню или микроволновой нагрев.
В каждой реакции, описанной в настоящем описании, при необходимости может быть использован твердофазный реагент, нанесенный на высокомолекулярный полимер (такой как полистирол, полиакриламид, полипропилен или полиэтиленгликоль).
В каждой реакции, описанной в настоящем описании, продукт реакции можно очищать общепринятыми методами очистки, такими как перегонка при нормальном или пониженном давлении, высокоэффективная жидкостная хроматография с использованием силикагеля или силиката магния, тонкослойная хроматография, ионообменная смола, поглотительная смола или колоночная хроматография, или промывка или перекристаллизация. Очистку можно проводить после каждой реакции или после некоторого количества реакций.
[Токсичность]
Соединение по настоящему изобретению обладает низкой токсичностью и, следовательно, может использоваться в качестве фармацевтического продукта. В частности, так как соединение по настоящему изобретению не обладает мутагенностью, даже в том случае, когда лекарство приходится принимать в течение нескольких лет или нескольких десятилетий при болезни Паркинсона и/или синдроме Паркинсона, пациенты могут продолжать принимать лекарство и не беспокоиться.
[Применение фармацевтического продукта]
Соединение по настоящему изобретению может быть использовано для профилактики и/или лечения болезни Паркинсона и/или синдрома Паркинсона. В данном изобретении профилактика и/или лечение болезни Паркинсона и/или синдрома Паркинсона в буквальном смысле относятся к профилактике или лечению болезни Паркинсона или синдрома Паркинсона, а также включают, например, профилактику развития дискинезии, уменьшение тяжести дискинезии, ингибирование прогрессирования симптомов болезни Паркинсона или синдрома Паркинсона (защитное действие на дофаминовые нейроны) и профилактику и/или лечение немоторных симптомов болезни Паркинсона или синдрома Паркинсона, например нарушения сна (такого как нарушение засыпания, частое пробуждение ночью, нарушение фазы быстрого сна, нарушение дыхания во сне, активация во время сна, синдром «совы», страх сна, ноктурия, сонный паралич и расстройство пищевого поведения, связанное со сном), психиатрические симптомы (такие как симптомы депрессии, тревога, апатия, ангедония, визуальные галлюцинации, бред, расстройство контроля побуждений и дофаминовая дисрегуляция), симптомы вегетативной нервной системы (такие как желудочно-кишечные симптомы, например тошнота, констипация и слюнотечение), ортостатическая гипотензия, постпрандиальная гипотензия, гипергидроз, жирная кожа, расстройство мочеиспускания и эректильная дисфункция), нарушения когнитивных функций, усталость-переутомление, сексуальная дисфункция, онемение и боль). Кроме того, соединение по настоящему изобретению является пролекарством леводопы, и поэтому также применимо для профилактики и/или лечения других заболеваний, для которых в качестве терапевтического средства используют леводопу, или в отношении которых полагают, что леводопа оказывает полезное действие, например болезни телец Леви, депрессии, синдрома дефицита внимания, шизофрении, маниакально-депрессивных психозов, нарушений когнитивных функций, RLS (синдром беспокойных ног), синдрома периодических движений конечностей, поздней дискинезии, болезни Гентингтона, синдрома Туретта, гипертензии, аддиктивного расстройства, застойной сердечной недостаточности, боли, сопровождающей диабетическую невропатию, постгерпетичекой невралгии, фибромиалгии, аутизма, наркотической зависимости, таких заболеваний, как нарколепсия или повышенная сонливость в дневное время, дофа-зависимой дистонии, вегетативного состояния, синдрома Перри, болезни Сегавы, злокачественного синдрома, нарушения эякуляции, гастропареза, болезни Леша-Нихана, амблиопии, легочной гипертензии, кортико-базальной дегенерации, фенилкетонурии, приступов панического расстройства, снижения полового влечения, нарушения глотательного рефлекса и множественной системная атрофия.
Болезнь телец Леви может представлять собой любое заболевание, при условии, что оно является заболеванием, при котором обнаруживаются патологические тельца Леви, и включает, например, деменцию с тельцами Леви и т.п.
Кроме того, соединение по настоящему изобретению применимо также для профилактики и/или лечения заболеваний, которые, как полагают, лечатся стимуляцией дофамином, и заболеваний, которые вызываются уменьшением норадреналина, за исключением описанных выше заболеваний.
В настоящем изобретении примеры заболеваний, на которые, как полагают, положительно влияет стимуляция дофаминовых рецепторов, включают синдром гиперактивности у детей, токсикоз беременных, злокачественную гипертензию и эпилепсию.
Примеры заболеваний, которые вызываются уменьшением норадреналина, включают также ортостатическую гипотензию, субарахноидальное кровоизлияние, церебральный инфаркт, бронхоспазм, сопровождающий бронхиальную астму, коклюш или т.п., симптомы гипогликемии, обусловленные инъекцией инсулина, и заднюю синехию в иридоциклите.
Соединение по настоящему изобретению может быть использовано в комбинации, например, с лекарственным средством, которое применяют для профилактики и/или лечения болезни Паркинсона и/или синдрома Паркинсона для целей, например, (1) комплементации и/или усиления профилактического, терапевтического эффекта и/или симптома, усиления их действия, (2) улучшения их кинетики и поглощения и уменьшения их дозы, и/или (3) уменьшения их побочных эффектов. Примеры лекарственных средств, используемых в комбинации, включают леводопу или ее аналог, ингибитор декарбоксилазы ароматических L-аминокислот, ингибитор катехол-O-метилтрансферазы, комбинированный препарат для дофаминовой заместительной терапии, содержащий такие средства в комбинации, агонист дофаминовых рецепторов, релизер дофамина, ингибитор моноаминоксидазы (МАО), ингибитор поглощения дофамина, антихолинергическое средство, агонист никотиновых холинорецепторов, агонист норадреналиновых рецепторов, антагонист α2 рецепторов, агонист серотониновых рецепторов, селективный агонист 5-НТ1 А/антагонист D2 рецепторов, антагонист аденозиновых рецепторов (А2А), антагонист NMDA рецепторов, агонист каннабиноидных рецепторов (СВ1), антагонист АМРА рецепторов, ингибитор высвобождения глютамата, антигистаминный агент, антиэпилептический агент, антидепрессант, стимулирующее лекарство, ингибитор киназы смешанной линии дифференцировки, аналог эстрогена, нейролептическое средство, нейротрофический фактор, нейропротективное средство, иммунофилиновый лиганд, генно-терапевтический агент, клеточный терапевтический агент и токсин ботулизма.
В данной заявке примеры леводопы или ее аналога включают леводопу, телеводопу, этилеводопу и т.п.
Примеры ингибиторов декарбоксилазы ароматических L-аминокислот включают бензеразид, бензеразида гидрохлорид, карбидопу, гидрат карбидопы и т.п.
Примеры ингибиторов катехол-O-метилтрансферазы включают энтакапон, толкапон, нитекапон, BIA-3-202, CGP-28014 и т.п.
Примеры комбинированных препаратов для дофаминовой заместительной терапии, содержащие такие агенты в комбинации, включают комбинированный препарат леводопа/бенсерамид, комбинированный препарат леводопа/карбидопа, комбинированный препарат леводопа/карбидопа/энтакапон, комбинированный препарат мелеводопа/карбидопа и т.п.
Примеры агонистов дофаминовых рецепторов включают каберголин, перголид, перголида мезилат, бромокриптин, бромокриптина мезилат, прамипексол, прамипексола гидрохлорида гидрат, ропинирол, ропинирола гидрохлорид, талипексол, α-дигидроэргокриптин, апоморфин, апоморфина гидрохлорид, суманирол, тергурид, бифепрунокс, пирибедил, лисурид, лисурида малеат, ротиготин, DAR-0100, SLV-308 и т.п.
Примеры релизера дофамина включают амантадин, амантадина гидрохлорид, бидипин и т.п.
Примеры ингибиторов моноаминоксидазы (МАО) включают селегилин, сафинамид, сафразин, депренил, мофегилин, расагилин, расагилина мезилат, лазабемид, лазабемида гидрохлорид и т.п.
Примеры ингибиторов поглощения дофамина включают модафинил, NS-2330 и т.п.
Примеры антихолинергических средств включают тригексифенидил, тригексифенидила гидрохлорид, бипериден, профенамин, метиксен, метиксена гидрохлорид, пирогептин, пирогептина гидрохлорид, мазатикол, мазатикола гидрохлорид и т.п.
Примеры агонистов никотиновых холинорецепторов включают алтиниклин, алтиниклина малеат и т.п.
Примеры агонистов норадреналиновых рецепторов включают дроксидопу и т.п.
Примеры антагонистов α2 рецепторов включают фипамезол и т.п.
Примеры агонистов серотониновых рецепторов включают АСР-103 и т.п.
Примеры селективного агониста 5-НТ1А/антагониста D2 рецепторов включают саризотан, саризотан гидрохлорид и т.п.
Примеры антагонистов аденозиновых рецепторов (А2А) включают истрадефиллин, Sch-63390, VR-2006 и т.п.
Примеры антагонистов NMDA рецепторов включают ремацемид, ремацемида гидрохлорид и т.п.
Примеры агонистов каннабиноидных рецепторов (СВ1) включают AVE-1625 и т.п.
Примеры антагонистов АМРА рецепторов включают талампанел, Е-2007 и т.п.
Примеры ингибиторов высвобождения глютамата включают рилузол и т.п.
Примеры антигистаминных средств включают прометазин и т.п.
Примеры антиэпилептических средств включают зонисамид и т.п.
Примеры антидепрессантов включают нортриптилин, имипрамин, амитриптилин, кломипрамин, дезипрамин, мапротилин, миансерин, сетиптилин, флуоксетин, флувоксамин, сертралин, пароксетин, миртазапин, дулоксетин и т.п.
Примеры стимулирующих лекарственных средств включают метилфенидат и т.п.
Примеры ингибиторов киназы смешанной линии дифференцировки включают СЕР-1347 и т.п.
Примеры аналогов эстрогена включают MITO-4509 и т.п.
Примеры нейролептических средств включают клозапин, кветиапин, кветиапина фумарат, оланзапин, рисперидон, тиаприд, арипипразол и т.п.
Примеры нейротрофического фактора включают GDNF, PYM-50028, SR-57667, калия летеприним и т.п.
Примеры нейропротективных средств включают ТСН-346 и т.п.
Примеры иммунофиллинового лиганда включают GPI-1485 и т.п.
Примеры генно-терапевтических агентов включают CERE-120, NLX-XI, P63 и т.п.
Примеры клеточных терапевтических агентов включают сферамин и т.п.
В частности, когда соединение по настоящему изобретению вводят в комбинации с карбидопой, гидратом карбидопы, бензеразидом или бензеразида гидрохлоридом, каждый из которых является ингибитором декарбоксилазы ароматических L-аминокислот и/или с энтакапоном, толкапоном, нитекапоном, BIA-3-202 или CGP-28014, каждый из которых является ингибитором катехол-O-метилтрансферазы, установившаяся кривая зависимости концентрации леводопы в крови от времени, обусловленная соединением по настоящему изобретению, является еще более продолжительной. Следовательно, становится возможным поддерживать концентрацию леводопы в крови в интервале от 0,1 до 1,5 мкг/мл, предпочтительно от 0,2 до 1,4 мкг/мл, более предпочтительно от 0,3 до 1,2 мкг/мл, и особенно предпочтительно в интервале от 0,4 до 1 мкг/мл, который рассматривается как эффективная концентрация леводопы в крови, в течение около 12 часов или больше, предпочтительно в течение 14 часов или больше, особенно предпочтительно в течение 16 часов или больше при приеме доз три раза в день, предпочтительно два раза в день.
Комбинированное лекарственное средство на основе соединения по настоящему изобретению и любого из указанных других лекарств можно вводить в виде комбинированного препарата, содержащего оба компонента в одном составе, или можно вводить их в виде отдельных составов. Введение в виде отдельных составов включает одновременное введение и введение с разницей во времени. В случае введения с разницей во времени после введения соединения по настоящему изобретению можно вводить другое лекарство, или соединение по настоящему изобретению можно вводить после введения другого лекарства. Пути введения, соответственно, могут быть одинаковыми или разными.
Дозу другого лекарства можно подобрать надлежащим образом, исходя из клинически используемой дозы. Соотношение соединения по настоящему изобретению и другого лекарства при их смешивании также может быть выбрано надлежащим образом, в зависимости от возраста и веса тела субъекта, получающего лечение, пути введения, периода лечения, заболевания, которое лечат, комбинации и т.п. Например, на одну массовую часть соединения по настоящему изобретению можно использовать 0,01-100 массовых частей другого лекарства. В качестве другого лекарства можно смешивать и вводить два или несколько лекарств при соответствующих соотношениях. Более того, указанное выше другое лекарство включает не только лекарства, открытые к настоящему времени, но также и лекарства, которые будут отрыты в будущем.
Для того, чтобы использовать соединение по настоящему изобретению или комбинированное лекарственное средство на основе соединения по настоящему изобретению и любого другого лекарства для вышеописанной цели, его обычно вводят системно или местно в виде препарата для перорального или парентерального введения.
Доза соединения по настоящему изобретению варьируется в зависимости от возраста, веса тела, симптомов, терапевтического действия, пути введения, времени лечения и т.п., однако соединение по настоящему изобретению обычно вводят перорально в дозе от 100 мг до 3 г для взрослого человека один раз или несколько раз в день или вводят парентерально в дозе от 10 мг до 1 г для взрослого человека один раз или несколько раз в день, или непрерывно вводят внутривенно в течение периода времени от 1 часа до 24 часов в день.
Согласно вышеописанному, само собой разумеется, что дозу варьируют в зависимости от различных условий, и поэтому в некоторых случаях может быть достаточной доза, меньшая вышеописанной, тогда как в некоторых других случаях может потребоваться доза, превышающая вышеуказанный интервал.
При введении соединения по настоящему изобретению или комбинированного лекарственного средства на основе соединения по настоящему изобретению и другого лекарства, их используют в составе твердого препарата для внутреннего применения или жидкого препарата для внутреннего применения для перорального введения, препарата с замедленным высвобождением для перорального введения или препарата для инъекций, препарата для наружного применения, препарата для ингаляции или суппозитория для парентерального введения или т.п.
Примеры твердого препарата для внутреннего применения для перорального введения включают таблетки, пилюли, капсулы, порошки и гранулы. Примеры капсул включают твердые капсулы и мягкие капсулы.
В таком твердом препарате для внутреннего применения одно или несколько активных веществ включены в состав препарата согласно общепринятой методике без перемешивания с какими бы то ни было добавками, или после смешивания с каким-либо эксципиентом (таким как лактоза, маннит, глюкоза, микрокристаллическая целлюлоза или крахмал), связующим (таким как гидроксипропилцеллюлоза, поливинилпирролидон или алюминометасиликат магния), разрыхлителем (таким как кальция гликолат целлюлоза), смазывающим веществом (таким как стеарат магния), стабилизатором, вспомогательным веществом для растворения (таким как глутаминовая кислота или аспарагиновая кислота) или т.п.Затем, если это необходимо, на препарат может быть нанесена оболочка при использовании вещества для покрытия (такого как белый мягкий сахар, желатин, гидроксипропилцеллюлоза или гидроксипропилметилцеллюлозы фталат), или может быть нанесено покрытие из двух или несколько слоев. Кроме того, в изобретение также включены капсулы, изготовленные из рассасывающегося вещества, такого как желатин.
Примеры жидкого препарата для внутреннего применения для перорального введения включают фармацевтически приемлемые жидкие препараты, суспензии, эмульсии, сиропы и эликсиры. В таком жидком препарате одно или несколько активных веществ растворены, суспендированы или эмульгированы в обычно используемом разбавителе (таком как очищенная вода, этанол или смесь этих жидкостей). Кроме того, этот жидкий препарат может содержать смачивающий агент, суспендирующий агент, эмульгирующий агент, подсластитель, вещество, придающее вкус, ароматизатор, консервант или буфер.
Кроме того, препарат с замедленным высвобождением для перорального введения также является эффективным. Гелеобразующее вещество для использования в таком препарате с замедленным высвобождением для перорального введения представляет собой вещество, которое может набухать, поглощая растворитель, и образует желеобразное вещество, в котором текучесть теряется в результате связывания полученных коллоидных частиц друг с другом с образованием трехмерной сетчатой структуры. Гелеобразующие вещества в фармацевтическом производстве используют главным образом в качестве связующего, загустителя и основы для замедленного высвобождения. Могут быть использованы, например, аравийская камедь, агар, поливинилпирролидон, альгинат натрия, сложный эфир пропиленгликоля и альгиновой кислоты, карбоксивиниловый полимер, карбоксиметилцеллюлоза, натрий карбоксиметилцеллюлоза, гуаровая камедь, желатин, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, поливиниловый спирт, метилцеллюлоза или гидроксиэтилметилцеллюлоза.
Примеры препарата для инъекций для парентерального введения включают растворы, суспензии, эмульсии и твердые препараты для инъекций, которые растворяют или суспендируют в растворителе перед использованием. Инъекционные препараты применяют путем растворения, суспендирования или эмульгирования одного или нескольких активных веществ в растворителе. Примеры растворителей включают дистиллированную воду для инъекций, физиологический раствор, растительные масла, пропиленгликоль, полиэтиленгликоль, спирты, такие как этанол, и их комбинации. Препарат для инъекций может содержать стабилизатор, вспомогательное вещество для растворения (такое как глутаминовая кислота, аспарагиновая кислота или Polysorbate 80 (зарегистрированный товарный знак)), суспендирующий агент, эмульгирующий агент, смягчающий агент, буфер, консервант или т.п. Препарат для инъекций получают стерилизацией на конечной стадии или, используя асептическую процедуру. Препарат для инъекций можно также применять в виде асептического твердого препарата (например, получают лиофилизированный продукт и перед использованием растворяют в стерилизованной или асептической дистиллированной воде для инъекций или другом растворителе).
Примеры лекарственных форм препаратов для наружного применения для парентерального введения включают пропелленты, средства для ингаляции, спреи, аэрозоли, мази, гели, кремы, примочки, пластыри, линименты и назальные средства. Такой препарат содержит одно или несколько активных веществ, и его получают в соответствии с известным способом или широко используемым составом.
Пропеллент, средство для ингаляции и спрей могут содержать отличающийся от обычно используемого разбавитель, стабилизатор, такой как гидросульфит натрия, и буфер, который обеспечивает изотоничность, например такой изотонический агент, как хлорид натрия, цитрат натрия или лимонная кислота. Способ получения спрея подробно описан, например, в патентах США №2,868,691 и №3,095,355.
Примеры препаратов для ингаляции для парентерального введения включают аэрозоли, порошки для ингаляции и жидкости для ингаляции. Жидкость для ингаляции может быть в такой форме, что перед использованием ее растворяют или суспендируют в воде или в другой соответствующей среде.
Такое средство для ингаляции получают известными способами.
Например, жидкость для ингаляции получают, подбирая должным образом консервант (такой как бензалконий хлорид или парабен), красящее вещество, буфер (такой как фосфат натрия или ацетат натрия), изотонический агент (такой как хлорид натрия или концентрированный глицерин), загуститель (такой как карбоксивиниловый полимер), способствующее всасыванию вещество или т.п., в зависимости от потребностей.
Порошок для ингаляции получают, подбирая должным образом смазывающее вещество (такое как стеариновая кислота или ее соль), связующее (такое как крахмал или декстрин), эксципиент (такой как лактоза или целлюлоза), красящее вещество, консервант (такой как бензалконий хлорид или парабен), способствующее всасыванию вещество или т.п., в зависимости от потребностей.
При введении жидкости для ингаляции обычно используют распылитель (такой как пульверизатор или ингалятор), а при введении порошка для ингаляции обычно используют ингалятор для порошкообразного препарата.
Мазь получают в соответствии с известными или широко используемыми составами. Например, мазь получают смешиванием или сплавлением одного или нескольких активных веществ в какой-либо основе. Основу для мази выбирают из известных и широко используемых основ. Примеры основ для мазей включают высшие жирные кислоты и сложные эфиры высших жирных кислот (такие как адипиновая кислота, миристиновая кислота, пальмитиновая кислота, стеариновая кислота, олеиновая кислота, адипат, миристат, пальмитат, стеарат и олеат), воски (такие как пчелиный воск, спермацетовый воск и церезин), поверхностно-активные вещества (такие как фосфат простого алкилового эфира полиоксиэтилена), высшие спирты (такие как цетанол, стеариловый спирт и цетостеариловый спирт), силиконовые масла (такие как диметилполисилоксан), углеводороды (такие как гидрофильный вазелин, белый вазелин, очищенный ланолин и жидкий парафин), гликоли (такие как этиленгликоль, диэтиленгликоль, пропиленгликоль, полиэтиленгликоль и Macrogol), растительные масла (такие как касторовое масло, оливковое масло, кунжутное масло и черепаховое масло), животные масла (такие как норковый жир, масло яичного желтка, сквалан и сквален), воду, вещества, усиливающие абсорбцию и средства против сыпи. Из этих основ или выбирают одну основу и используют только ее, или выбирают две или несколько основ и используют их смесь. Мазь может дополнительно содержать увлажняющее средство, консервант, стабилизатор, антиоксидант, ароматизатор или т.п.
Гели получают в соответствии с известными или широко используемыми составами. Например, гель можно получать расплавлением одного или нескольких активных веществ в основе. Основу для геля выбирают из известных или широко используемых основ. Примеры основ для геля включают низшие спирты (такие как этанол и изопропиловый спирт), гелеобразующие агенты (такие как карбоксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и этилцеллюлоза), нейтрализующие агенты (такие как триэтаноламин и диизопропаноламин), поверхностно-активные вещества (такие как полиэтиленгликоль моностеарат), камеди, воду, вещества, усиливающие абсорбцию, средства против сыпи. Из этих основ или выбирают одну основу и используют только ее, или выбирают две или несколько основ и используют их смесь. Гель может дополнительно содержать увлажняющее средство, консервант, стабилизатор, антиоксидант, ароматизатор или т.п.
Кремы получают в соответствии с известными или широко используемыми составами. Например, крем получают плавлением или эмульгированием одного или нескольких активных веществ в основе. Основу для крема выбирают из известных и широко используемых основ. Примеры основ для кремов включают сложные эфиры высших жирных кислот, низшие спирты, углеводороды, многоатомные спирты (такие как пропиленгликоль и 1,3-бутиленгликоль), высшие спирты (такие как 2-гексилдеканол и цетанол), эмульгирующие агенты (такие как алкиловые простые эфиры полиоксиэтилена, сложные эфиры жирных кислот), воду, вещества, усиливающие абсорбцию и средства против сыпи. Из этих основ или выбирают одну основу и используют только ее, или выбирают две или несколько основ и используют их смесь. Крем может дополнительно содержать консервант, антиоксидант, ароматизатор или т.п.
Примочки получают в соответствии с известными или широко используемыми составами. Например, примочки получают плавлением одного или нескольких активных веществ в основе с образованием тестообразного вещества и затем тестообразное вещество наносят и намазывают на подложку. Основу для примочки выбирают из известных и широко используемых основ. Примеры основ для примочек включают загустители (такие как полиакриловая кислота, поливинилпирролидон, аравийская камедь, крахмал, желатин и метилцеллюлоза), смачивающие агенты (такие как мочевина, глицерин и пропиленгликоль), наполнители (такие как каолин, оксид цинка, тальк, соединения кальция и магния), воду, вещества, способствующие растворению, агенты, придающие липкость, и средства против сыпи. Из этих основ или выбирают одну основу и используют только ее, или выбирают две или несколько основ и используют их смесь. Примочки могут дополнительно содержать консервант, антиоксидант, ароматизатор или т.п.
Пластыри получают в соответствии с известными или широко используемыми составами. Например, пластырь получают плавлением одного или нескольких активных веществ в основе и последующим нанесением и намазыванием расплава на подложку. Основу для пластыря выбирают из известных и широко используемых основ. Примеры основ для пластыря включают полимерные основы, масла и жиры, высшие жирные кислоты, агенты, придающие липкость, и средства против сыпи. Из этих основ или выбирают одну основу и используют только ее, или выбирают две или несколько основ и используют их смесь. Пластырь может дополнительно содержать консервант, антиоксидант, ароматизатор или т.п.
Линименты получают в соответствии с известными или широко используемыми составами. Например, линимент получают растворением, суспендированием или эмульгированием одного или нескольких активных веществ в одном или нескольких веществах, выбранных из воды, спирта, (такого как этанол или полиэтиленгликоль), высших жирных кислот, глицерина, мыла, эмульгирующего агента и суспендирующего агента. Линимент может дополнительно содержать консервант, антиоксидант, ароматизатор или т.п.
Другие композиции для парентерального введения включают суппозитории для интраректального введения, пессарии для интравагигального введения и т.п., причем каждая из них содержит одно или несколько активных веществ и составлена в соответствии с общепринятыми методиками.
Содержание всей патентной и непатентной литературы или ссылок, явным образом процитированных в настоящем описании, включено в данный документ посредством отсылки как часть этого описания.
Примеры
Далее настоящее изобретение будет подробно описано со ссылкой на конкретные примеры и биологические примеры, однако настоящее изобретение не ограничивается ими. Соединение по настоящему изобретению и соединения, представленные в примерах, названы с помощью программы ACD/Name (версия 6.00, разработанная Advanced Chemistry Development, Inc.) или программы Chemdraw Ultra (версия 12.0, разработанная Cambridge Soft Corporation).
Растворители в скобках, указанные в разделе, посвященном хроматографическому разделению и ТСХ, обозначают используемые для элюирования или проявления растворители, и их соотношение выражено в единицах по объему. Численные значения, указанные в разделе по ЯМР, дают значения, измеренные методом1Н-ЯМР при использовании указанных растворителей при регистрации спектров.
Пример 1
2-(Бензоилокси)-2-метилпропановая кислота

2-Гидроксиизомасляную кислоту (50 г) растворяют в ацетонитриле (480 мл). К полученному раствору прибавляют пиридин (78 мл) и затем прибавляют бензоилхлорид (56 мл). Полученный раствор перемешивают при комнатной температуре в течение 40 минут. К реакционной смеси прибавляют 2 N соляную кислоту (300 мл) для подкисления раствора и затем проводят экстракцию этилацетатом (400 мл × 2). Органические слои объединяют и сушат над сульфатом магния. После удаления сульфата магния фильтрованием фильтрат концентрируют при пониженном давлении. Полученный остаток перекристаллизовывают из смеси трет-бутилметиловый эфир/н-гептан, в результате получают указанное в заголовке соединение (82 г, 82%), обладающее следующими физическими свойствами.
ТСХ (величина Rf): 0,37 (этилацетат);
ЯМР (300 МГц, CDCl3): δ 8,20-9,40 (ш, 1Н), 8,01-8,06 (м, 2Н), 7,53-7,59 (м, 1Н), 7,40-7,46 (м, 2Н), 1,73 (с, 6Н).
Пример 2
(2S)-Бензил-2-((трет-бутоксикарбонил)амино)-3-(3,4-дигидроксифенил)пропаноат

К (S)-3,4-дигидроксифенилаланину (L-DOPA, 10,0 г), прибавляют очищенную воду (30 мл) в атмосфере аргона с образованием суспензии, прибавляют триэтиламин (14,2 мл), затем раствор ди-трет-бутилдикарбоната (Вос2О, 13,3 г) в тетрагидрофуране (30 мл) при комнатной температуре. Полученный раствор перемешивают при комнатной температуре в течение 14 часов. К реакционной смеси прибавляют 2 N раствор соляной кислоты (61 мл) при охлаждении льдом, чтобы подкислить раствор, и затем проводят экстракцию этилацетатом (200 мл × 2). Органические слои объединяют и промывают насыщенным водным раствором хлорида натрия (200 мл), затем сушат над сульфатом магния. После удаления сульфата магния фильтрованием фильтрат концентрируют при пониженном давлении. Полученный остаток используют на последующей стадии без очистки.
ТСХ (величина Rf): 0,37 (дихлорметан: метанол: уксусная кислота=17:3:1).
Неочищенный продукт, полученный на предшествующей стадии, растворяют в N,N-диметилформамиде (51 мл). К полученному раствору прибавляют гидрокарбонат калия (7,6 г) в атмосфере аргона и затем прибавляют бензилбромид (7,3 мл). Полученный раствор перемешивают при комнатной температуре в течение 7 часов. К реакционной смеси прибавляют 2 N раствор соляной кислоты (61 мл) при охлаждении льдом, чтобы подкислить раствор, и затем проводят экстракцию смешанным раствором н-гептана и этилацетата (1:1) (150 мл × 2). Органические слои объединяют и промывают водой (75 мл × 2) и насыщенным водным раствором хлорида натрия (75 мл), затем сушат над сульфатом магния. После удаления сульфата магния фильтрованием фильтрат концентрируют при пониженном давлении. Полученный остаток перекристаллизовывают из смеси этилацетат/н-гептан, получая указанное в заголовке соединение (16,2 г, выход по 2 стадиям 82%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,64 (н-гексан: этилацетат: уксусная кислота=50:50:1).
ЯМР (300 МГц, CDCl3): δ 7,31-7,40 (м, 5Н), 6,98 (д, J=7,8 Гц, 1Н), 6,44 (дц, J=7,8, 1,8 Гц, 1Н), 6,40 (д, J=1,8 Гц, 1Н), 5,26-5,64 (уш, 2Н), 5,05-5,23 (м, 2Н), 5,00 (д, J=8,1 Гц, 1Н), 4,50-4,58 (м, 1Н), 2,94 (д, J=5,7 Гц, 2Н), 1,41 (с, 9Н).
Пример 3
(2S)-((4-(3-Бензилокси)-2-((трет-бутоксикарбонил)амино)-3-оксопропил-1,2-фенилен)бис(окси))бис(2-метил-1-оксопропан-2,1-диил)дибензоат

К соединению (90,7 г), полученному в примере 1, прибавляют толуол (227 мл) с образованием суспензии, прибавляют N,N-диметилформамид (0,8 мл) в атмосфере аргона и затем прибавляют тионилхлорид (38,2 мл). Реакционную смесь перемешивают при 70°C в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры и затем концентрируют при пониженном давлении. К остатку прибавляют толуол (170 мл) и полученный раствор концентрируют при пониженном давлении. Такую процедуру повторяют два раза, в результате получают хлорангидрид кислоты.
Соединение (76,7 г), полученное в примере 2, растворяют в ацетонитриле (100 мл) в атмосфере аргона. К этому раствору прибавляют триэтиламин (83 мл) при охлаждении льдом, и затем прибавляют хлорангидрид кислоты, полученный в предыдущей реакции, в течение 15 минут. Полученный раствор перемешивают в течение 1 часа при охлаждении льдом. К реакционной смеси прибавляют водный 10% раствор гидрокарбоната натрия (800 мл) и затем проводят экстракцию этилацетатом (800 мл × 2). Органические слои объединяют и промывают насыщенным водным раствором хлорида натрия (800 мл), затем сушат над сульфатом натрия. После удаления сульфата натрия фильтрованием фильтрат концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле (препаративный жидкостный хроматограф среднего давления «Redisep» производства Teledyne Isco, Inc. (колонка: основная колонка 1,5 кг, н-гексан: этилацетат=8:2-7:3, время градиентного элюирования 15 минут), режим фракционирования), получая в результате указанное в заголовке соединение (118 г, 95%) со следующими физическими свойствами.
ТСХ (величина Rf): 0,44 (н-гексан: этилацетат=3:1).
ЯМР (300 МГц, CDCl3): δ 8.01-8,07 (м, 4Н), 7,52-7,60 (м, 2Н), 7,38-7,49 (м, 4Н), 7,25-7,32 (м, 5Н), 7,15 (д, J=8,1 Гц, 1Н), 7,05 (с, 1Н), 6,91 (д, J=8,1 Гц, 1Н), 5,12 (с, 2Н), 5,02 (д, J=7,8 Гц, 1Н), 4,55-4,63 (м, 1Н), 3,09 (д, J=5,4 Гц, 2Н), 1,81-1,85 (м, 12Н), 1,39 (с, 9Н).
Пример 4
(2S)-3-(3,4-бис((2-бензоилокси)-2-метилпропаноил)окси)фенил)-2-((трет-бутоксикарбонил)амино)пропановая кислота

Соединение (134,4 г), полученное в примере 3, растворяют в этаноле (400 мл). К полученному раствору прибавляют 10% палладий на угле (50% влажность, 14,6 г) в атмосфере аргона. Этот раствор перемешивают при комнатной температуре в течение 2 часов в атмосфере водорода. К реакционной смеси прибавляют этилацетат (400 мл) и полученную смесь фильтруют через Celite (товарный знак). Затем фильтрат концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле (препаративный жидкостный хроматограф среднего давления W-prep 2XY производства Yamazen Corporation (колонка: основная колонка 5 л, колонка ввода 3 л, н-гексан: этилацетат=3:7-0:1, время градиентного элюирования 20 минут), режим фракционирования GR), получая в результате указанное в заголовке соединение (110 г, 86%) со следующими физическими свойствами.
ТСХ (величина Rf): 0,38 (н-гексан: этилацетат: уксусная кислота=100:100:1)
ЯМР (300 МГц, CD3OD): δ 8,02-8,07 (м, 4Н), 7,59-7,66 (м, 2Н), 7,46-7,52 (м, 4Н), 7,13-7,21 (м, 3Н), 4,33 (дд, J=9,0, 5,1 Гц, 1Н), 3,18 (дд. J=13,5, 5,1 Гц, 1Н), 2,93 (дд, J=13,5, 9,0 Гц, 1Н), 1,82 (с, 12Н), 1,33 (с, 9Н)
Пример 5
Гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты

К соединению (110 г), полученному в примере 4, прибавляют 4N раствор соляной кислоты в диоксане (500 мл). Полученный раствор перемешивают при комнатной температуре в течение 1 часа. Затем реакционную смесь концентрируют при пониженном давлении, в результате получают указанное в заголовке соединение (93,2 г, 94%), имеющее следующие физические свойства. Полученное указанное в заголовке соединение является аморфным веществом и имеет температуру плавления от около 112,0 до около 117,0°C (измеренную капиллярным методом, описанным в Фармакопее Японии).
ТСХ (величина Rf): 0,64 (этилацетат: уксусная кислота: вода=5:5:1).
ЯМР (300 МГц, CD3OD): δ 8,02-8,06 (м, 4Н), 7,60-7,67 (м, 2Н), 7,46-7,52 (м, 4Н), 7,25-7,30 (м, 3Н), 4,24 (дц. J=8,4; 5,1 Гц, 1Н), 3,37 (дд, J=15,0; 5,1 Гц, 1Н), 3,13 (дд, J=15,0; 8,4 Гц, 1Н), 1.83 (с, 6Н), 1.82 (с, 6Н)
Порошковая дифракционная рентгенограмма, кривая дифференциальной сканирующей калориметрии и инфракрасный спектр поглощения полученного таким образом аморфного гидрохлорида (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты показаны на фиг.16, фиг.17 и фиг.18, соответственно.
(1) Порошковая рентгеновская дифрактометрия
[Условия измерений]
Прибор: BRUKER DISCOVER GADDS (C2)
Мишень: Cu
Фильтр: Не используют
Напряжение: 40 кВ
Ток: 40 мА
Время экспозиции: 180 сек
[Результаты]
В порошковой рентгеновской дифрактометрии с использованием излучения Cu-Кα не наблюдалось пиков кристаллических форм.
(2) Дифференциальная сканирующая калориметрия
[Условия измерений]
Прибор: SEIKO INSTRUMENT DSC 6200
Количество образца: 3,73 мг
Ячейка для образца: Стандартная алюминиевая 40 мкл (имеет крышку с отверстием)
Скорость потока газа-аргона: 40 мл/мин
Скорость повышения температуры: 10°C/мин
Исходная температура до повышения: 25°C
[Результаты]
В результате найдено, что соединение имеет эндотермический пик при температуре около 82,83°C.
(3) Инфракрасная спектроскопия поглощения
[Условия измерений]
Прибор: FTIR-660 Plus/SENSIR DuraScope, JASCO Corporation
Разрешение: 4 см-1
Число сканирований: 32
[Результаты]
ИК (метод нарушенного полного внутреннего отражения (сокращенно называют также «метод НПВО»): 3409, 2992, 2944, 2865, 2629, 1970, 1774, 1718, 1655, 1601, 1585, 1508, 1470, 1452, 1428, 1388, 1369, 1317, 1290, 1258, 1204, 1168, 1125, 1093, 1070, 1026, 1003, 958, 866, 806, 741, 714, 687, 617, 530, 496, 467, 447 и 419 см-1
Ссылочный пример 1
Бензил 3-гидрокси-2,2-диметилпропаноат

2,2-Диметил-3-гидроксипропановую кислоту (10,0 г) растворяют в N,N-диметилформамиде (150 мл). К этому раствору прибавляют гидрокарбонат калия (10,2 г), затем прибавляют бензилбромид (10,7 мл). Полученный раствор перемешивают при комнатной температуре в течение 16 часов. К реакционной смеси прибавляют воду (300 мл) и проводят экстракцию смешанным раствором н-гексана и этилацетата (1:4) (200 мл × 2). Органические слои объединяют и промывают насыщенным водным раствором хлорида натрия (200 мл), затем сушат над сульфатом магния. После удаления сульфата магния фильтрованием фильтрат концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле (препаративный жидкостный хроматограф среднего давления W-prep 2XY производства Yamazen Corporation (колонка: основная колонка 4 л, колонка для ввода 3 л, н-гексан: этилацетат=1:0-1:1 (время градиентного элюирования 15 минут), режим фракционирования GR), в результате получают указанное в заголовке соединение (17,6 г, 100%) со следующими физическими свойствами.
ТСХ (величина Rf): 0,39 (н-гексан: этилацетат=3:1).
ЯМР (CDCl3): δ 7,29-7,41 (м, 5Н), 5,15 (с, 2Н), 3,57 (д, J=6,3 Гц, 2Н), 1,22 (с, 6Н).
Ссылочный пример 2
3-(Бензилокси)-2,2-диметил-3-оксопропилтиофен-2-карбоксилат

Соединение (2,0 г), полученное в ссылочном примере 1, растворяют в дихлорметане (30 мл). К этому раствору прибавляют триэтиламин (2,7 мл) и затем при охлаждении льдом прибавляют хлорид 2-тиофенкарбоновой кислоты (1,5 мл). Полученный раствор перемешивают в течение 2 часов при охлаждении льдом. В реакционную смесь прибавляют насыщенный водный раствор карбоната натрия (30 мл) и затем проводят экстракцию этилацетатом (100 мл × 2). Органические слои объединяют и промывают насыщенным водным раствором хлорида натрия (30 мл), затем сушат над сульфатом магния. После удаления сульфата магния фильтрованием фильтрат концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле (препаративный жидкостный хроматограф среднего давления W-prep 2XY производства Yamazen Corporation (колонка: основная колонка 2 л, колонка для ввода inject column L, н-гексан: этилацетат=1:0-8:2 (время градиентного элюирования 15 минут), режим фракционирования GR), в результате получают указанное в заголовке соединение (3,0 г, 100%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,65 (н-гексан: этилацетат=3:1).
ЯМР (CDCl3): δ 7,67-7,69 (м, 1Н), 7,52-7,55 (м, 1Н), 7,26-7,34 (м, 5Н), 7,05-7,08 (м, 1Н), 5,16 (с, 2Н), 4,34 (с, 2Н), 1,28 (с, 6Н).
Ссылочный пример 3
2,2-Диметил-3-((тиофен-2-карбонил)окси)пропановая кислота

Соединение (3,0 г), полученное в ссылочном примере 2, растворяют в этаноле (20 мл). К этому раствору прибавляют 10% палладия на угле (50% влажность, 500 мг) в атмосфере аргона. Эту смесь перемешивают при комнатной температуре в течение 1 часа в атмосфере водорода. К реакционной смеси прибавляют этилацетат (20 мл) и полученную смесь фильтруют чрез Celite (торговая марка). Затем фильтрат концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле (препаративный жидкостный хроматограф среднего давления W-prep 2XY производства Yamazen Corporation (колонка: основная колонка 2 л, колонка для ввода L, н-гексан: этилацетат=8:2-0:1 (время градиентного элюирования 15 минут), режим фракционирования GR), в результате получают указанное в заголовке соединение (719 мг, 33%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,60 (этилацетат).
ЯМР (CDCl3): δ 7,77-7,79 (м, 1Н), 7,53-7,55 (м, 1Н), 7,06-7,10 (м, 1Н), 4,34 (с, 2Н), 1,33 (с, 6Н).
Ссылочный пример 4
(2S)-((4-(3-(Бензилокси)-2-((трет-бутоксикарбонил)амино)-3-оксопропил)-1,2-фенилен)бис(окси))бис(2,2-диметил-3-оксопропан-3,1-диил)бис(тиофен-2-карбоксилат)

По той же методике, что и в примере 3, используя соединение (735 мг), полученное в примере 2, и соединение (1,3 г), полученное в ссылочном примере 3, вместо соединения, полученного в примере 1, получают указанное в заголовке соединение (1,5 г, 99%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,60 (н-гексан: этилацетат=1:1).
ЯМР (CDCl3): δ 7,79-7,82 (м, 2Н), 7,53-7,58 (м, 2Н), 7,26-7,31 (м, 5Н), 7,06-7,11 (м, 2Н), 7,00 (д, J=8,4 Гц, 1Н), 6,87-6,94 (м, 2Н), 5,10 (с, 2Н), 4,96-5,04 (м, 1Н), 4,52-4,59 (м, 1Н), 4,43 (с, 2Н), 4,42 (с, 2Н), 2,99-3,06 (м, 2Н), 1,34-1,35 (м, 21Н).
Ссылочный пример 5
(2S)-3-(3,4-бис((2,2-диметил-3-((тиофен-2-карбонил)окси)пропаноил)окси)фенил)-2-(трет-бутоксикарбонил)амино)пропановая кислота

По той же методике, что и в примере 4, используя соединение (1,5 г), полученное в ссылочном примере 4, вместо соединения, полученного в примере 3, получают указанное в заголовке соединение (588 мг, 44%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,12 (этилацетат).
ЯМР (CDCl3): δ 7,74-7,85 (м, 2Н). 7,03-7,18 (м, 4Н), 6,99-7,12 (м, 3Н), 4,43 (с, 2Н), 4,42 (с, 2Н), 4,05-4,22 (м, 1Н), 3,06-3,14 (м, 1Н), 2,83-2,91 (м, 1Н), 1,36-1,48 (м, 21Н).
Ссылочный пример 6
Гидрохлорид (2S)-2-амино-3-(3,4-бис((2,2-диметил-3-((тиофен-2-карбонил)окси)пропаноил)окси)фенил)пропановой кислоты

По той же методике, что и в примере 5, используя соединение (580 мг), полученное в ссылочном примере 5, вместо соединения, полученного в примере 4, получают указанное в заголовке соединение (528 мг, 100%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,74 (этилацетат: уксусная кислота: вода=3:1:1).
ЯМР (CD3OD): δ 7,75-7,84 (м, 4Н), 7,14-7,23 (м, 5Н), 4,45 (с, 2Н), 4,44 (с, 2Н), 4,17-4,23 (м, 1Н), 3,35-3,38 (м, 1Н), 3,09 (дд, J=14,4, 8,4 Гц, 1Н), 1,41-1,44 (м, 12Н).
Ссылочный пример 7
3-(Бензилокси)-2,2-диметил-3-оксопропилтиофен-3-карбоксилат
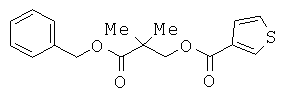
По той же методике, что и в ссылочном примере 2, используя соединение (2,0 г), полученное в ссылочном примере 1, и хлорид 3-тиофенкарбоновой кислоты (2,1 г) вместо хлорида 2-тиофенкарбоновой кислоты, получают указанное в заголовке соединение (3,1 г, 100%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,50 (н-гексан: этилацетат=5:1).
ЯМР (CDCl3): δ 7,89-7,91 (м, 1Н), 7,39-7,42 (м, 1Н), 7,24-7,38 (м, 6Н), 5,16 (с, 2Н), 4,31 (с, 2Н), 1,32 (с, 6Н).
Ссылочный пример 8
2,2-Диметил-3-((тиофен-3-карбонил)окси)пропановая кислота
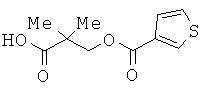
Осуществляя ту же методику, что и в ссылочном примере 3, используя соединение (3,1 г), полученное в ссылочном примере 7, вместо соединения, полученного в ссылочном примере 2, получают указанное в заголовке соединение (354 мг, 16%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,12 (этилацетат).
ЯМР (CDCl3): δ 8,08-8,10 (м, 1Н), 7,48-7,51 (м, 1Н), 7,27-7,31 (м, 1Н), 4,32 (с, 2Н), 1,33 (с, 6Н).
Ссылочный пример 9
(2S)-((4-(3-(Бензилокси)-2-(трет-бутоксикарбонил)амино)-3-оксопропил)-1,2-фенилен)бис(окси))бис(2,2-диметил-3-оксопропан-3,1-диил)бис(тиофен-3-карбоксилат)
По той же методике, что и в примере 3, используя соединение (533 мг), полученное в примере 2, и соединение (785 мг), полученное в ссылочном примере 8, вместо соединения, полученного в примере 1, получают указанное в заголовке соединение (1,1 г, 100%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,47 (н-гексан: этилацетат=2:1).
ЯМР (CDCl3): δ 8,10-8,12 (м, 2Н), 7,49-7,52 (м, 2Н), 7,23-7,33 (м, 7Н), 6,85-6,97 (м, 3Н), 5,10 (с, 2Н), 4,98 (д, J=8,7 Гц, 1Н), 4,52-4,58 (м, 1Н), 4,40 (с, 2Н), 4,41 (с, 2Н), 2,96-3,08 (м, 2Н), 1,32-1,36 (м, 21Н).
Ссылочный пример 10
(2S)-3-(3,4-бис((2,2-диметил-3-((тиофен-3-карбонил)окси)пропаноил)окси)фенил)-2-(трет-бутоксикарбонил)амино)пропановая кислота

По той же методике, что и в примере 4, используя соединение (1,1 г), полученное в ссылочном примере 9, вместо соединения, полученного в примере 3, получают указанное в заголовке соединение (324 мг, 33%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,12 (этилацетат).
ЯМР (CDCl3): δ 8,20-8,24 (м, 2Н), 7,45-7,52 (м, 4Н), 6,99-7,12 (м, 3Н), 4,41 (с, 2Н), 4,40 (с, 2Н), 4,19-4,26 (м, 1Н), 3,06-3,14 (м, 1Н), 2,84-2,90 (м, 1Н), 1,24-1,34 (м, 21Н).
Ссылочный пример 11
Гидрохлорид (2S)-2-амино-3-(3,4-бис((2,2-диметил-3-((тиофен-3-карбонил)окси)пропаноил)окси)фенил)пропановой кислоты

По той же методике, что и в примере 5, используя соединение (323 мг), полученное в ссылочном примере 10, вместо соединения, полученного в примере 4, получают указанное в заголовке соединение (294 мг, 100%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,57 (этилацетат: уксусная кислота: вода=3:1:1).
ЯМР (CD3OD): δ 8,20-8,24 (м, 2Н), 7,46-7,51 (м, 4Н), 7,12-7,21 (м, 3Н), 4,42 (с, 2Н), 4,41 (с, 2Н), 4,14-4,21 (м, 1Н), 3,31-3,35 (м, 1Н), 3,05-3,10 (м, 1Н), 1,41-1,43 (м, 12Н).
Ссылочный пример 12
3-(Бензилокси)-2,2-диметил-3-оксопропил 2-метоксибензоат

По той же методике, что и в ссылочном примере 2, используя соединение (1,5 г), полученное в ссылочном примере 1, и 2-метоксибензоилхлорид (1,6 мл) вместо хлорида 2-тиофенкарбоновой кислоты, получают указанное в заголовке соединение (1,8 г, 72%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,66 (н-гексан: этилацетат=2:1).
ЯМР (CDCl3): δ 7,68 (дд, J=7,5, 2,1 Гц, 1Н), 7,43-7,49 (м, 1Н), 7,25-7,32 (м, 5Н), 6,89-6,96 (м, 2Н), 5,15 (с, 2Н), 4,35 (с, 2Н), 3,84 (с, 3Н), 1,33 (с, 6Н).
Ссылочный пример 13
3-((2-Метоксибензоил)окси)-2,2-диметилпропановая кислота

По той же методике, что и в ссылочном примере 3, используя соединение (1,8 г), полученное в ссылочном примере 12, вместо соединения, полученного в ссылочном примере 2, получают указанное в заголовке соединение (1,3 г, 91%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,12 (н-гексан: этилацетат=3:1).
ЯМР (CDCl3): δ 7,78-7,82 (м, 1Н), 7,43-7,47 (м, 1Н), 6,93-6,99 (м, 2Н), 4,34 (с, 2Н), 3,86 (с, 3Н), 1,34 (с, 6Н).
Ссылочный пример 14
(2S)-((4-(3-(Бензилокси)-2-((трет-бутоксикарбонил)амино)-3-оксопропил)-1,2-фенилен)бис(окси))бис(2,2-диметил-3-оксопропан-3,1-диил)бис(2-метоксибензоат)

По той же методике, что и в примере 3, используя соединение (410 мг), полученное в примере 2, и соединение (800 мг), полученное в ссылочном примере 13, вместо соединения, полученного в примере 1, получают указанное в заголовке соединение (592 мг, 65%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,74 (н-гексан: этилацетат=1:1).
ЯМР (CDCl3): δ 7,76-7,81 (м, 2Н), 7,41-7,50 (м, 2Н), 7,25-7,31 (м, 5Н), 6,82-6,99 (м, 7Н), 5,07 (с, 2Н), 4,94 (д, J=7,8 Гц, 1Н), 4,48-4,55 (м, 1Н), 4,41 (с, 4Н), 3,84 (с, 6Н), 2,94-3,03 (м, 2Н), 1,28-1,39 (м, 21Н).
Ссылочный пример 15
(2S)-3-(3,4-бис((3-((2-метоксибензоил)окси-2,2-диметилпропаноил)окси)фенил)-2-(трет-бутоксикарбонил)амино)пропановая кислота

По той же методике, что и в примере 4, используя соединение (590 мг), полученное в ссылочном примере 14, вместо соединения, полученного в примере 3, получают указанное в заголовке соединение (406 мг, 77%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,12 (н-гексан: этилацетат=1:1).
ЯМР (CDCl3): δ 7,77-7,86 (м, 2Н), 7,44-7,51 (м, 2Н), 6,93-7,05 (м, 7Н), 4,94-5,01 (м, 1Н), 4,32-4,59 (м, 5Н), 3,86 (с, 3Н), 3,84 (с, 3Н), 3,07 (д, J=5,4 Гц, 2Н), 1,34-1,41 (м, 21Н).
Ссылочный пример 16
Гидрохлорид (2S)-2-амино-3-(3,4-бис((3-((2-метоксибензоил)окси-2,2-диметилпропаноил)окси)фенил)пропановой кислоты

По той же методике, что и в примере 5, используя соединение (400 мг), полученное в ссылочном примере 15, вместо соединения, полученного в примере 4, получают указанное в заголовке соединение (360 мг, 98%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,45 (этилацетат: уксусная кислота: вода=5:1:1).
ЯМР (CDCl3): δ 7,70-7,75 (м, 2Н), 7,49-7,53 (м, 2Н), 7,02-7,21 (м, 5Н), 6,95-7,02 (м, 2Н), 4,40 (с, 2Н), 4,38 (с, 2Н), 4,14 (дд, J=8,7, 5,1 Гц, 1Н), 3,82-3,83 (м, 6Н), 3,25-3,30 (м, 1Н), 3,04 (дд, J=14,7, 8,7 Гц, 1Н), 1,37-1,46 (м, 12Н).
Ссылочный пример 17
Гидрохлорид (2S)-2-амино-3-(3,4-бис((2,2-диэтилбутаноил)окси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 2,2-диэтилбутановую кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,45 (этилацетат: уксусная кислота: вода=3:1:1).
ЯМР (CDCl3): δ 7,23 (дд, J=8,4, 1,8 Гц, 1Н), 7,17 (д, J=8,4 Гц, 1Н), 7,13 (д, J=1,8 Гц, 1Н), 4,25 (дд, J=8,1, 5,4 Гц, 1Н), 3,35 (дд, J=14,7, 5,4 Гц, 1Н), 3,14 (дд, J=14,7, 8,1 Гц, 1Н), 1,70-1,79 (м, 12Н), 0,87-0,96 (м, 18Н).
Ссылочный пример 18
Гидрохлорид (2S)-2-амино-3-(3,4-бис((2-этил-2-метилбутаноил)окси)фенил)пропановой кислоты
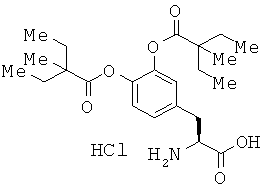
Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 2-этил-2-метилбутановую кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,75 (этилацетат: уксусная кислота: вода=3:1:1).
ЯМР (CDCl3): δ 7,23 (дд, J=8,4, 2,1 Гц, 1Н), 7,15 (д, J=8,4 Гц, 1Н), 7,13 (д, J=2,1 Гц, 1Н), 4,25 (дд, J=8,1, 5,1 Гц, 1Н), 3,36 (дд, J=14,7, 5,1 Гц, 1Н), 3,14 (дд, J=14,7, 8,1 Гц, 1Н), 1,59-1,86 (м, 8Н), 1,25 (с, 3Н), 1,24 (с, 3Н), 0,93-1,03 (м, 12Н).
Ссылочный пример 19
Гидрохлорид (2S)-2-амино-3-(3,4-бис((4,4-диметилпентаноил)окси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 4,4-диметилпентановую кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,63 (этилацетат: уксусная кислота: вода=6:1:1).
ЯМР (CD3OD): δ 7,18-7,24 (м, 3Н), 4,23 (дд. J=8,4, 5,1 Гц, 1Н), 3,38 (дд, J=14,7, 5,1 Гц, 1Н), 3,12 (дд, J=14,7, 8,4 Гц, 1Н), 2,52-2,58 (м, 4Н), 1,61-1,67 (м, 4Н), 0,89-1,17 (м, 18Н).
Ссылочный пример 20
Гидрохлорид (2S)-2-амино-3-(3,4-бис((3,3-диметилпент-4-еноил)окси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 3,3-диметилпентеновую кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,45 (этилацетат: уксусная кислота: вода=6:1:1).
ЯМР (CD3OD): δ 7,13-7,25 (м, 3Н), 5,99 (дд, J=17,4, 10,5 Гц, 1Н), 5,01-5,10 (м, 2Н), 4,23 (дд, J=8,4, 5,1 Гц, 1Н), 3,37 (дд, J=14,7, 5,1 Гц, 1Н), 3,11 (дд, J=14,7, 8,4 Гц, 1Н), 2,57 (с, 2Н), 2,56 (с, 2Н), 1,21-1,22 (м, 12Н).
Ссылочный пример 21
Гидрохлорид (2S)-2-амино-3-(3,4-бис((3-этил-3-метилпентаноил)окси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 3-этил-3-метилпентановую кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,51 (этилацетат: уксусная кислота: вода=5:1:1).
ЯМР (CD3OD): δ 7,15-7,26 (м, 3Н), 4,23 (дд, J=8,4, 5,1 Гц, 1Н), 3,38 (дд, J=14,7, 5,1 Гц, 1Н), 3,17 (дд, J=14,7, 8,4 Гц, 1Н), 2,45 (с, 2Н), 2,44 (с, 2Н), 1,42-1,50 (м, 8Н), 1,04 (с, 3Н), 1,03 (с, 3Н), 0,87-0,92 (м, 12Н).
Ссылочный пример 22
Гидрохлорид (2S)-2-амино-3-(3,4-бис((3-изопропил-4-метилпентаноил)окси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 3-изопропил-4-метилпентановую кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,67 (этилацетат: уксусная кислота=3:1).
ЯМР (CD3OD): δ 7,15-7,26 (м, 3Н), 4.13 (дд, J=8,4, 5,1 Гц, 1Н), 3,20-3,30 (м, 1Н), 3,05-3,13 (м, 1Н), 2,47 (д, J=5,7 Гц, 2Н), 2,46 (д, J=5,7 Гц, 2Н), 1,79-1,90 (м, 4Н), 1,65-1,72 (м, 2Н), 0,89-0,99 (м, 24Н).
Ссылочный пример 23
Гидрохлорид (2S)-2-амино-3-(3,4-бис((2-метилбензоил)окси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 2-метилбензойную кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,79 (этилацетат: уксусная кислота: вода=3:1:1).
ЯМР (CD3OD): δ 7,93-7,97 (м, 2Н), 7,34-7,47 (м, 5Н), 7,15-7,35 (м, 4Н), 4,30-4,36 (м, 1Н), 3,47 (дд. J=14,7, 5,1 Гц, 1Н), 3,25 (дд, J=14,7, 8,4 Гц, 1Н), 2,49 (с, 3Н), 2,48 (с, 3Н).
Ссылочный пример 24
Гидрохлорид (2S)-2-амино-3-(3,4-бис((4-гидроксибензоил)окси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 4-гидроксибензойную кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,62 (этилацетат: уксусная кислота: вода=3:1:1).
ЯМР (CD3OD): δ 7,82-7,88 (м, 4Н), 7,30-7,40 (м, 3Н), 6,73-6,78 (м, 4Н), 4,23 (дд, J=8,7, 4,8 Гц, 1Н), 3,44 (дд, J=14,7, 4,8 Гц, 1Н), 3,16 (дд, J=14,7, 8,7 Гц, 1Н).
Ссылочный пример 25
(2S)-2-Амино-3-(3,4-бис((2-(трифторметил)бензоил)окси)фенил)пропановая кислота

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 2-трифторметилбензойную кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,80 (этилацетат: уксусная кислота: вода=3:1:1).
ЯМР (CD3OD): δ 7,84-7,91 (м, 4Н), 7,65-7,79 (м, 4Н), 7,39-7,49 (м, 3Н), 4,35 (дд, J=7,8, 5,1 Гц, 1Н), 3,43 (дд, J=14,4, 5,1 Гц, 1Н), 3,20-3,27 (м, 1Н).
Ссылочный пример 26
Гидрохлорид (2S)-2-амино-3-(3,4-бис((циклопропанкарбонил)окси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и циклопропанкарбоновую кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,49 (этилацетат: уксусная кислота: вода=3:1:1).
ЯМР (CD3OD): δ 7,17-7,23 (м, 3Н), 4,27 (дд, J=8,7; 5,1 Гц, 1Н), 3,37 (дд, J=14,7, 5,1 Гц, 1Н), 3,12 (дд, J=14,7; 8,7 Гц, 1Н), 1,84-1,90 (м, 2Н), 1,08-1,13 (м, 8Н).
Ссылочный пример 27
Гидрохлорид (2S)-2-амино-3-(3,4-бис((1-метилциклопропанкарбонил)окси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 1-метилциклопропанкарбоновую кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,23 (этилацетат: уксусная кислота: вода=6:1:1).
ЯМР (CD3OD): δ 7,15-7,25 (м, 3Н), 4,26 (дд, J=8,4, 4,8 Гц, 1Н), 3,35 (дд, J=14,7, 4,8 Гц, 1Н), 3,12 (дд, J=14,7, 8,4 Гц, 1Н), 1,33-1,46 (м, 10Н), 0,93-0,97 (м, 4Н).
Ссылочный пример 28
Гидрохлорид (2S)-2-амино-3-(3,4-бис(2-циклопентилацетокси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 2-циклопентилуксусную кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,28 (этилацетат: уксусная кислота: вода=6:1:1).
ЯМР (CD3OD): δ 7,17-7,27 (м, 3Н), 4,27 (дд, J=8,4, 5,1 Гц, 1Н), 3,28 (дд, J=14,7, 5,1 Гц, 1Н), 3,13 (дд, J=14,7, 8,4 Гц, 1Н), 2,56-2,60 (м, 4Н), 2,24-2,35 (м, 2Н), 1,86-1,96 (м, 4Н), 1,54-1,75 (м, 8Н), 1,20-1,32 (м, 4Н).
Ссылочный пример 29
Гидрохлорид (2S)-2-амино-3-(3,4-бис(2-циклогексилацетокси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 2-циклогексилуксусную кислоту вместо соединения полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,30 (этилацетат: уксусная кислота: вода=6:1:1).
ЯМР (CD3OD): δ 7,16-7,56 (м, 3Н), 4,23 (дд, J=8,7, 5,1 Гц, 1Н), 3,37 (дд, J=14,7, 5,1 Гц, 1Н), 3,11 (дд, J=14,7, 8,4 Гц, 1Н), 2,44 (д, J=6,6 Гц, 2H), 2,43 (д, J=6,6 Гц, 2Н), 1,61-1,88 (м, 12Н), 1,01-1,40 (м, 10Н).
Ссылочный пример 30
Гидрохлорид (2S)-2-амино-3-(3,4-бис(2-(1-метилциклогексил)ацетокси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 2-(1-метил)циклогексилуксусную кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,43 (этилацетат: уксусная кислота=3:1).
ЯМР (CD3OD): δ 7,21-7,31 (м, 3Н), 4,28 (дд, J=8,4,4,8 Гц, 1Н), 3,30-3,46 (м, 1Н), 3,17 (дд, J=14,4, 8,4 Гц, 1Н), 2,56 (с, 2H), 2,55 (с, 2H), 1,49-1,70 (м, 20Н), 1,18 (с, 3Н), 1,17 (с, 3Н).
Ссылочный пример 31
Гидрохлорид (2S)-2-амино-3-(3,4-бис(2-(1-метилциклопентил)ацетокси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 2-(1-метилциклопентил)уксусную кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,29 (этилацетат: уксусная кислота=3:1).
ЯМР (CD3OD): δ 7,16-7,26 (м, 3Н), 4,16 (дд, J=8,7, 4,8 Гц, 1Н), 3,22-3,40 (м, 1Н), 3,05-3,13 (м, 1Н), 2,56 (с, 2Н), 2,57 (с, 2Н), 1,50-1,73 (м, 16Н), 1,16 (с, 3Н), 1,15 (с, 3Н).
Ссылочный пример 32
Гидрохлорид (2S)-2-амино-3-(3,4-бис((2-ацетокси-2-метилпропаноил)окси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 2-(ацетокси)-2-метилпропионовую кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,70 (этилацетат: уксусная кислота: вода=3:1:1).
ЯМР (CD3OD): δ 7,18-7,27 (м, 3Н), 4,25 (дд, J=8,4, 5,4 Гц, 1Н), 3,37 (дд, J=14,7, 5,4 Гц, 1Н), 3,13 (дц, J=14,7, 8,4 Гц, 1Н), 2,09 (с, 3Н), 2,07 (с, 3Н), 1,66-1,68 (м, 12Н).
Ссылочный пример 33
Гидрохлорид (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-этилбутаноил)окси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и 2-(бензоилокси)-2-этилбутановую кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,51 (этилацетат: уксусная кислота: вода=5:1:1).
ЯМР (CD3OD): δ 8,01-8,06 (м, 4Н), 7.61-7,64 (м, 2Н), 7,49-7,52 (м, 4Н), 7,25-7,47 (м, 3Н), 4,22 (дд, J=8,4; 5,1 Гц, 1Н), 3,32-3,35 (м, 1Н), 3,05-3,16 (м, 1Н), 2,20-2,37 (м, 8Н), 0,97-1,03 (м, 12Н).
Ссылочный пример 34
Гидрохлорид (2S)-2-амино-3-(3,4-бис(((R)-2-(бензоилокси)пропаноил)окси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и (2S)-2-(бензоилокси)пропановую кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,38 (этилацетат: уксусная кислота: вода=10:2:1).
ЯМР (CD3OD): δ 8,06-8,09 (м, 4Н), 7,61-7,66 (м, 2Н), 7,46-7,52 (м, 4Н), 7,26-7,29 (м, 3Н), 5,61-5,68 (м, 2Н), 4,21 (дд, J=8,4, 5,4 Гц, 1Н), 3,30-3,40 (м, 1Н), 3,13 (дд, J=14,7, 8,1 Гц, 1Н), 1,81 (д, J=7,2 Гц, 3Н), 1,80 (д, J=7,2 Гц, 3Н).
Ссылочный пример 35
Гидрохлорид (2S)-2-Амино-3-(3,4-бис(((R)-2-(бензоилокси)пропаноил)окси)фенил)пропановой кислоты

Осуществляя процедуры из Примера 3 → Примера 4 → Примера 5, используя соединение, полученное в примере 2, и (2R)-2-(бензоилокси)пропановую кислоту вместо соединения, полученного в примере 1, получают указанное в заголовке соединение, имеющее следующие физические свойства.
ТСХ (величина Rf): 0,38 (этилацетат: уксусная кислота: вода=10:2:1).
ЯМР (CD3OD): δ 8,06-8,09 (м, 4Н), 7,61-7,66 (м, 2Н), 7,46-7,52 (м, 4Н), 7,26-7,29 (м, 3Н), 5,61-5,68 (м, 2Н), 4,21 (дд, J=8,4, 5,4 Гц, 1Н), 3,30-3,40 (м, 1Н), 3,13 (дд, J=14,7, 8,1 Гц, 1Н), 1,81 (д, J=7,2 Гц, 3Н), 1,80 (д, J=7,2 Гц, 3Н)
Ссылочный пример 36
3-(Бензилокси)-2,2-диметил-3-оксопропилбензоат

Соединение (8 г), полученное в ссылочном примере 1 растворяют в дихлорметане (40 мл). К этому раствору прибавляют триэтиламин (8 мл), и затем при охлаждении льдом прибавляют бензоилхлорид (5,4 мл). Полученный раствор перемешивают при комнатной температуре в течение 4 часов. К реакционной смеси прибавляют насыщенный водный раствор карбоната натрия (30 мл), затем проводят экстракцию дихлорметаном (100 мл × 2). Органические слои объединяют и промывают насыщенным водным раствором хлорида натрия (30 мл), затем сушат над сульфатом натрия. После удаления сульфата натрия фильтрованием, фильтрат концентрируют при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле (препаративный жидкостный хроматограф среднего давления W-prep 2XY производства Yamazen Corporation (колонка: основная колонка 2 л, колонка для ввода L, н-гексан: этилацетат=1:0-9:1, время градиентного элюирования 10 минут), режим фракционирования GR), в результате получают указанное в заголовке соединение (12 г, 100%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,70 (н-гексан: этилацетат=2:1).
ЯМР (300 МГц, CDCl3): δ 7,89-7,93 (м, 2Н), 7,50-7,57 (м, 1Н), 7,36-7,42 (м, 2Н), 7,23-7,33 (м, 5Н), 5,16 (с, 2Н), 4,37 (с, 2Н), 1,34 (с, 6Н).
Ссылочный пример 37
3-(Бензоилокси)-2,2-диметилпропановая кислота

По той же методике, что и в ссылочном примере 3, используя соединение (12 г), полученное в ссылочном примере 36, вместо соединения, полученного в ссылочном примере 2, получают указанное в заголовке соединение (5,7 г, 67%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,22 (н-гексан: этилацетат=3:1)
ЯМР (CDCl3): δ 7,99-8,03 (м, 2Н), 7,48-7,61 (м, 1Н), 7,38-7,46 (м, 2Н), 4,37 (с, 2Н), 1,35 (с, 6Н).
Ссылочный пример 38
(S)-((4-(3-(Бензилокси)-2-((трет-бутоксикарбонил)амино)-3-оксопропил)-1,2-фенилен)бис(окси))бис(2,2-диметил-3-оксопропан-3,1-диил)дибензоат

По той же методике, что и в примере 3, используя соединение (4,0 г), полученное в примере 2, и соединение (5,7 г), полученное в ссылочном примере 37 вместо соединения, полученного в примере 1, получают указанное в заголовке соединение (7,4 г, 90%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,51 (н-гексан: этилацетат=2:1)
ЯМР (CDCl3): δ 8,00-8,05 (м, 4Н), 7,50-7,59 (м, 2Н), 7,39-7,46 (м, 4Н), 7,23-7,34 (м, 5Н), 6,83-6,97 (м, 3Н), 5,09 (с, 2Н), 4,97 (д, J=8,4 Гц, 1Н), 4,50-4,57 (м, 1Н), 4,45 (с, 4Н), 2,94-3,03 (м, 2Н), 1,39-1,43 (м, 21Н).
Ссылочный пример 39
(S)-3-(3,4-бис((3-(бензоилокси)-2,2-диметилпропаноил)окси)фенил)-2-((трет-бутоксикарбонил)амино)пропановая кислота

По той же методике, что и в примере 4, используя соединение (7,4 г), полученное в ссылочном примере 38, вместо соединения, полученного в примере 3, получают указанное в заголовке соединение (5,2 г, 79%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,12 (н-гексан: этилацетат=2:1)
ЯМР (CDCl3): δ 8,00-8,04 (м, 4Н), 7,54-7,61 (м, 2Н), 7,41-7,48 (м, 4Н), 6,97-7,05 (м, 2Н), 6,91 (д, J=l,8 Гц, 1Н), 4,99 (д, J=7,5 Гц, 1Н), 4,42-4,50 (м, 5Н), 2,98-3,11 (м, 2Н), 1,40-1,42 (м, 21Н).
Ссылочный пример 40
Гидрохлорид (S)-2-амино-3-(3,4-бис((3-(бензоилокси)-2,2-диметилпропаноил)окси)фенил)пропановой кислоты

По той же методике, что и в примере 5, используя соединение (5,2 г), полученное в ссылочном примере 39, вместо соединения, полученного в примере 4, получают указанное в заголовке соединение (4,3 г, 88%), имеющее следующие физические свойства.
ТСХ (величина Rf): 0,34 (этилацетат: уксусная кислота: вода=6:1:1)
ЯМР (CD3OD): δ 7,97-8,02 (м, 4Н), 7,57-7,63 (м, 2Н), 7,43-7,51 (м, 4Н), 7,12-7,18 (м, 3Н), 4,54-4,66 (м, 4Н), 4,09 (дд, J=8,7,4,8 Гц, 1Н), 3,06-3,25 (м, 1Н), 2,99-3,07 (м, 1Н), 1,43-1,44 (м, 12Н).
Пример 6
Кристаллический тозилат (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты (кристаллы типа А)
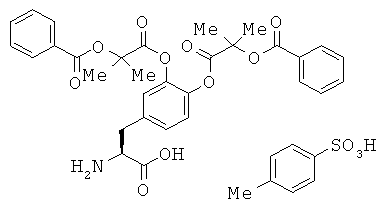
К суспензии моногидрата пара-толуолсульфоновой кислоты (2,82 г) в ацетонитриле (4,2 мл) и воде (1,13 мл) прибавляют раствор соединения (8,32 г), полученного в примере 4, в ацетонитриле (37,8 мл). Полученный раствор перемешивают при 70°C в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры прибавляют трет-бутилметиловый эфир (254 мл). Полученный раствор перемешивают в течение ночи при комнатной температуре. После дополнительного перемешивания раствора при охлаждении льдом в течение 1 часа, получают и отфильтровывают кристаллы, которые затем сушат при пониженном давлении и температуре 50°C в течение 16 часов, в результате получают кристаллический сольват тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты (7,43 г, 79%). Все количество этого кристаллического продукта суспендируют в этилацетате (74 мл) и полученную суспензию перемешивают при 60°C в течение 14 часов, поддерживая в суспендированном состоянии. После того, как суспензию оставляют охлаждаться до комнатной температуры, кристаллы отфильтровывают и сушат при пониженном давлении при температуре 65°С в течение 1 часа, затем при 50°C в течение 16 часов, в результате получают соединение, указанное в заголовке (6,87 г, 92%), в виде белых кристаллов типа А, имеющих следующие физические свойства. Температура плавления кристаллов составляет от около 132,0 до около 136,0°C (измерена капиллярным способом, описанным в Фармакопее Японии).
ТСХ (величина Rf): 0,56 (этилацетат: уксусная кислота: вода=10:1:1).
ЯМР (300 МГц, CD3OD): δ 8,06-8,03 (м, 4Н), 7,71-7,62 (м, 4Н), 7,52-7,48 (м, 4Н), 7,31-7,20 (м, 5Н), 4,27 (дд, J=8,4, 5,1 Гц, 1Н), 3,37 (дд, J=14,7, 5,1 Гц, 1Н), 3,13 (дд, J=14,7, 8,4 Гц, 1Н), 2,36 (с, 3Н), 1,83 (с, 12Н).
Порошковая дифракционная рентгенограмма, кривая дифференциальной сканирующей калориметрии и инфракрасный спектр поглощения полученных таким образом кристаллов тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа А показаны на фиг.10, фиг.11 и фиг.12, соответственно.
(1) Порошковая рентгеновская дифрактометрия
[Условия измерений]
Прибор: BRUKER DISCOVER GADDS (C2)
Мишень: Cu
Фильтр: Не используют
Напряжение: 40 кВ
Ток: 40 мА
Время экспозиции: 180 сек
[Результаты]
Результаты измерений угла дифракции (2θ) (в градусах) и относительной интенсивности (%), полученные методом порошковой рентгеновской дифрактометрии с использованием Cu-Кα излучения, показаны в таблице 1. В данном случае относительную интенсивность получают, рассчитывая высоту (Интенсивность (число отсчетов)) каждого пика, если высоту самого высокого пика принимают равной 100%.
(2) Дифференциальная сканирующая калориметрия
[Условия измерений]
Прибор: SEIKO INSTRUMENT DSC 6200
Количество образца: 4,22 мг
Ячейка для образца: стандартная алюминиевая 40 мкл (имеет крышку с отверстием)
Скорость потока газа-аргона: 40 мл/мин
Скорость повышения температуры: 5°C/мин
Исходная температура до начала повышения: 25°C
[Результаты]
В результате было показано, что соединение имеет эндотермический пик при температуре около 135,95°C.
(3) Инфракрасная абсорбционная спектроскопия
[Условия измерений]
Прибор: FTIR-660 Plus/SENSIR DuraScope, JASCO Corporation
Разрешение: 4 см-1
Число сканирований: 32
[Результаты]
ИК (НПВО способ): 1780, 1712, 1599, 1508, 1452, 1388, 1316, 1289, 1217, 1166, 1120, 1090, 1071, 1036, 1026, 1010, 957, 900, 864, 817, 742, 713, 680, 622, 567, 550, 472 и 440 см-1.
Пример 7
Кристаллический тозилат (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты (кристаллы типа В)

Кристаллы тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа А (8,0 г), полученные в примере 6, суспендируют в ацетоне (80 мл). Суспензию перемешивают при 50°C в течение 16 часов. Реакционную смесь охлаждают до комнатной температуры, перемешивают в течение 30 минут, и затем дополнительно перемешивают на ледяной бане в течение 1 часа. Осажденные кристаллы отфильтровывают, затем сушат при пониженном давлении при температуре 60°C в течение 16 часов, в результате получают соединение, указанное в заголовке (7,1 г, 89%), в виде белых кристаллов типа В. Температура плавления кристаллов составляет от около 132,3 до около 135,3°C (измерена капиллярным способом, описанным в Фармакопее Японии).
Порошковая дифракционная рентгенограмма, кривая дифференциальной сканирующей калориметрии и инфракрасный спектр поглощения полученных таким образом кристаллов тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа В показаны на фиг.13, фиг.14 и фиг.15, соответственно.
(1) Порошковая рентгеновская дифрактометрия
[Условия измерений]
Прибор: BRUKER DISCOVER GADDS (C2)
Мишень: Cu
Фильтр: Не используют
Напряжение: 40 кВ
Ток: 40 мА
Время экспозиции: 180 сек
[Результаты]
Результаты измерений угла дифракции (2θ) (в градусах) и относительной интенсивности (%), полученные методом порошковой дифракционной рентгеновской спектроскопии с использованием Cu-Кα излучения, показаны в таблице 2. В данном случае относительную интенсивность получают, рассчитывая высоту (Интенсивность (число отсчетов)) каждого пика, если высоту самого высокого пика принимают равной 100%.
(2) Дифференциальная сканирующая калориметрия
[Условия измерений]
Прибор: SEIKO INSTRUMENT DSC 6200
Количество образца: 3,08 мг
Ячейка для образца: стандартная алюминиевая 40 мкл (имеет крышку с отверстием)
Скорость потока газа-аргона: 40 мл/мин
Скорость повышения температуры: 5°C/мин
Исходная температура до повышения: 25°C
[Результаты]
В результате было показано, что соединение имеет эндотермический пик при температуре около 134,54°C.
(3) Инфракрасная абсорбционная спектроскопия
[Условия измерений]
Прибор: FTIR-660 Plus/SENSIR DuraScope, JASCO Corporation
Разрешение: 4 см-1
Число сканирований: 32
[Результаты]
ИК (НПВО-метод): 1781, 1711, 1600, 1507, 1315, 1287, 1220, 1203, 1166, 1119, 1088, 1070, 1036, 1027, 1010, 944, 898, 863, 816, 713, 681, 617, 567, 531, 517, 507, 484, 470, 452, 437, 421 и 413 см-1.
Пример 8:
Неочищенная (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота
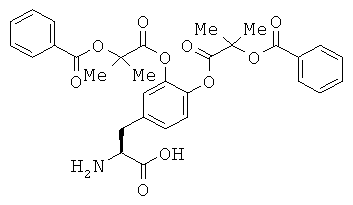
К раствору кристаллов тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа А, полученных в примере 6, или кристаллов тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа В, полученных в примере 7 (167 г), в ацетонитриле (2080 мл) и воде (42 мл) прибавляют по каплям триэтиламин (21,4 г) в ацетонитриле (420 мл). После перемешивания реакционной смеси в течение 16 часов, осажденное твердое вещество отфильтровывают и промывают ацетонитрилом (500 мл). Затем твердое вещество сушат при 50°C в течение 16 часов, получая в результате неочищенный продукт, который представляет собой указанное в заголовке соединение (106 г, 81%), в виде белого твердого вещества.
Пример 9
Кристаллическая (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота (кристаллы типа А)

Неочищенную (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту (31 г), полученную в примере 8, суспендируют в ацетонитриле (470 мл) в атмосфере аргона и полученную суспензию перемешивают при комнатной температуре (внутренняя температура: от 23 до 24°C) в течение 24 часов. Полученные кристаллы отфильтровывают и промывают ацетонитрилом (94 мл). Затем кристаллы сушат при пониженном давлении при 60°C в течение 24 часов, в результате получают указанное в заголовке соединение (31 г, 99%) в виде белых кристаллов типа А. Температура плавления кристаллов составляет от около 177,0 до около 181,9°C (измерена капиллярным способом, описанным в Фармакопее Японии).
Порошковая дифракционная рентгенограмма, кривая дифференциальной сканирующей калориметрии и инфракрасный спектр поглощения полученных таким образом кристаллов (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа А показаны на фиг.4, фиг.5 и фиг.6, соответственно.
(1) Порошковая рентгеновская дифрактометрия
[Условия измерений]
Прибор: BRUKER DISCOVER GADDS (C2)
Мишень: Cu
Фильтр: Не используют
Напряжение: 40 кВ
Ток: 40 мА
Время экспозиции: 180 сек
[Результаты]
Результаты измерений угла дифракции (2θ) (в градусах) и относительной интенсивности (в %), полученные методом порошковой рентгеновской дифрактометрия с использованием Cu-Кα излучения, показаны в таблице 3. В данном случае относительную интенсивность получают, рассчитывая высоту (Интенсивность (число отсчетов)) каждого пика, если высоту самого высокого пика принимают равной 100%.
(2) Дифференциальная сканирующая калориметрия
[Условия измерений]
Прибор: SEIKO INSTRUMENT DSC 6200
Количество образца: 6,07 мг
Ячейка для образца: стандартная алюминиевая 40 мкл (имеет крышку с отверстием)
Скорость потока газа-аргона: 40 мл/мин
Скорость повышения температуры: 10°C/мин
Исходная температура до начала повышения: 25°C
[Результаты]
В результате было обнаружено, что соединение имеет экзотермический пик при температуре около 148,7°C и эндотермические пики при температуре около 184,7°C, 194,7°C и 200,3°C.
(3) Инфракрасная абсорбционная спектроскопия
[Условия измерений]
Прибор: FTIR-660 Plus/SENSIR DuraScope, JASCO Corporation
Разрешение: 4 см-1
Число сканирований: 32
[Результаты]
ИК (НПВО-метод): 1771, 1720, 1632, 1602, 1543, 1506, 1469, 1451, 1387, 1359, 1316, 1287, 1203, 1165, 1093, 1069, 1026, 957, 937, 898, 863, 802, 742, 710, 687, 615, 557, 526, 490, 482, 452, 424, 416 и 408 см-1.
Пример 10
Кристаллическая (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота (кристаллы типа В)

Неочищенную (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту (104 г), полученную в примере 8, растворяют в ацетонитриле (520 мл) и воде (104 мл) при нагревании в атмосфере аргона. Затем к раствору прибавляют ацетонитрил (1560 мл), и после того, как подтверждается осаждение кристаллов, реакционную смесь перемешивают в течение 16 часов. Осажденные кристаллы отфильтровывают и затем промывают ацетонитрилом (312 мл). Затем кристаллы сушат при пониженном давлении и при температуре 60°C в течение 24 часов, в результате получая указанное в заголовке соединение (87 г, 84%) в виде белых кристаллов типа В. Температура плавления кристаллов составляет от около 174,7 до около 179,0°C (измерена капиллярным способом, описанным в Фармакопее Японии).
Порошковая дифракционная рентгенограмма, кривая дифференциальной сканирующей калориметрии и инфракрасный спектр поглощения полученных таким образом кристаллов (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа В показаны на фиг.7, фиг.8 и фиг.9, соответственно.
(1) Порошковая дифракционная рентгеновская спектроскопия
[Условия измерений]
Прибор: дифрактометр BRUKER DISCOVER с GADDS (C2)
Мишень: Cu
Фильтр: Не используют
Напряжение: 40 кВ
Ток: 40 мА
Время экспозиции: 180 сек
[Результаты]
Результаты измерений угла дифракции (2θ) (в градусах) и относительной интенсивности (%), полученные методом порошковой дифракционной рентгеновской спектроскопии с использованием Cu-Кα излучения, показаны в таблице 4. В данном случае относительную интенсивность получают, рассчитывая высоту (Интенсивность (число отсчетов)) каждого пика, когда высоту самого высокого пика принимают равной 100%.
(2) Дифференциальная сканирующая калориметрия
[Условия измерений]
Прибор: SEIKO INSTRUMENT DSC 6200
Количество образца: 5,68 мг
Ячейка для образца: стандартная алюминиевая 40 мкл (имеет крышку с отверстием)
Скорость потока газа-аргона: 40 мл/мин
Скорость повышения температуры: 10°C/мин
Исходная температура до начала повышения: 25°C
[Результаты]
В результате было показано, что соединение имеет экзотермический пик при температуре около 183,3°C и эндотермические пики при температуре около 192,2°C и 200,8°C.
(3) Инфракрасная абсорбционная спектроскопия
[Условия измерений]
Прибор: FTIR-660 Plus/SENSIR DuraScope, JASCO Corporation
Разрешение: 4 см-1
Число сканирований: 32
[Результаты]
ИК (НПВО способ): 1771, 1715, 1608, 1505, 1469, 1452, 1411, 1386, 1368, 1352, 1315, 1288, 1256, 1201, 1166, 1092, 1070, 1026, 955, 895, 865, 803, 744, 711, 675, 617, 605, 472, 444, 432 и 414 см-1.
Пример 11
Кристаллическая (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота (кристаллы типа А)

По той же методике, что и в примере 9, используя кристаллы (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа В, полученные в примере 10, вместо неочищенной (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты, кристаллы типа В превращают в кристаллы (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа А.
Пример 12
Кристаллическая (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота (кристаллы типа В)

По той же методике, что и в примере 10, используя кристаллы (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа А, полученные в примере 9, вместо неочищенной (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты, кристаллы типа А превращают в кристаллы (2S)-2-амино-3 -(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа В.
Биологический пример 1
(1) Кинетические исследования на собаках
Взаимосвязь между концентрацией леводопы в крови и побочными эффектами, возникающими у пациентов, принимающих леводопу, постепенно проясняется. Например, считается, что дискинезия развивается при частом воздействии леводопы в концентрации, превышающей эффективную концентрацию в крови; «истощение дозы» развивается при концентрации леводопы ниже ее эффективной концентрации в крови. С целью уменьшить число доз леводопы и не допустить появления побочных эффектов, таких как дискинезия и «истощение дозы», у пациентов, принимающих леводопу, необходимо как можно дольше поддерживать концентрацию леводопы в крови в границах терапевтического диапазона. Авторы настоящего изобретения провели кинетические исследования для соединения по настоящему изобретению, полученного в примере 5, леводопы, и группы соединений, используемых для сравнения (соединений, полученных в ссылочных примерах 6, 11, 16, 18, 19, 21-23, 25-35, и 40, а также для 4-((S)-2-амино-2-метоксикарбонил-этил)-2-(3,3-диметил-бутирилокси)фенилового эфира 3,3-диметилмасляной кислоты (далее называемого соединением X), описанного в WO 2009/022098) для того, чтобы выяснить, является ли соединение по настоящему изобретению пролекарством леводопы, которое обеспечивает столь пологую кривую зависимости концентрация леводопы в крови - время.
Эти пролекарства леводопы представляют собой пролекарства, содержащие сложноэфирную связь, и по этой причине считается, что из всех ферментов карбоксиэстераза играет наиболее важную роль в процессе получения леводопы в результате метаболизма этих соединений после их введения in vivo. Поэтому в качестве животных, используемых для проведения кинетических исследований, были выбраны собаки, у которых распределение карбоксиэстеразы в органах в наибольшей степени похоже на распределение карбоксиэстеразы в органах человека.
[Приготовление раствора лекарственного средства для введения]
Раствор лекарственного средства для перорального введения получают взвешиванием каждого из следующих соединений: соединения по настоящему изобретению (Пример 5), леводопы, группы соединений, используемых для сравнения (соединений, полученных в ссылочных примерах 6, 11, 16, 18, 19, 21-23, 25-35 и 40, и соединения Х) и растворением навески в носителе в количестве 1 мг/мл в пересчете на леводопу.
[Отбор образца плазмы]
Полученный таким образом раствор лекарственного средства вводят принудительно через желудочный зонд в желудок собак (самцов породы бигль), которым не давали пищу в течение дня перед введением. Через 15 и 30 минут и 1, 2, 4, 6, и 8 часов после введения раствора лекарственного средства гепаринизированным шприцем отбирают 1 мл крови из головной вены. Сразу после отбора отобранную кровь центрифугируют в настольной центрифуге при 14500 об/мин в течение 45 секунд. Затем к полученной таким образом плазме прибавляют ацетонитрил, содержащий 0,1125% муравьиной кислоты, в количестве, в два раза превышающем объем плазмы, перемешивают и затем хранят полученный образец при температуре -20°C до измерений.
[Приготовление аналитического образца и анализ]
Образцу дают оттаять в день измерений, затем перемешивают и центрифугируют при 13000 об/мин в течение 3 минут (при 4°C). Полученный супернатант фильтруют и фильтрат анализируют ЖХ/МС/МС. Анализ осуществляют методом ЖХ/МС/МС в следующих условиях.
[Условия ЖХ/МС/МС]
Прибор для измерений: хромато-масс-спектрометр API-5000 (производства Applied Biosystems, Inc.)
Аналитическая колонка: CAPCELL РАК CR (1:4) (4,6 мм, I.D. × 250 мм, 5 мкм)
Температура аналитической колонки: 40°C
Скорость потока: 1 мл/мин
Подвижная фаза: А: 5 мМ формиата аммония (pH 3,9), В: ацетонитрил (А/В=17/3)
Тип сканирования: MRM
Полярность: отрицательная
Детектирование (леводопа): m/z (предшественник): 196,19, m/z (продукт): 134,99
DP (потециал декластеризации): -60
СЕ (Энергия соударения): -25
СХР (Ускоряющее напряжение): -17
[Результаты]
Результаты кинетических исследований на собаках показаны в таблице 5.
В вышеуказанной таблице 5 в качестве результатов кинетических исследований показаны «площадь под кривой зависимости концентрация в крови - время (площадь под кривой (AUC))», которая служит показателем воздействия леводопы, и «соотношение (Cmax/C6hr) максимальной концентрации в плазме (Cmax) и концентрации в плазме через 6 часов после перорального введения (C6hr)», которое служит показателем пологости кривой зависимости концентрация леводопы в крови - время. При этом численное значение в столбце, где указана доза в пересчете на леводопу, относится к дозе, эквивалентной дозе леводопы. Так как значение AUC при введении леводопы составляло 0,96, по мере того как AUC приближается к этому значению, доля испытываемого соединения, которое обеспечивает воздействие в качестве леводопы, становится выше. Кроме того, указано, что при значениях Cmax/C6hr больше 1, а также близких к 1, кривая зависимости концентрация леводопы в крови - время является более пологой.
Значения AUC и Cmax/C6hr соединения по настоящему изобретению (Пример 5) были более предпочтительными по сравнению со значениями AUC и Cmax/C6hr соединений, полученных в ссылочных примерах 6, 11, 16, 18, 19, 21-23, и 25-35, и соединения Х, и, следовательно, подтвердилось, что соединение по настоящему изобретению представляет собой соединение, которое превращается в леводопу, обеспечивая воздействие значительной доли леводопы, а также дает пологую кривую зависимости концентрация леводопы в плазме - время.
В случае соединений, используемых для сравнения, например соединений, полученных в ссылочных примерах 6, 11, 19, 23, 27-29, 32 и 35, хотя значение AUC составляло 0,5 или больше, даже наименьшее значение Cmax/C6hr составляло около 15, и поэтому соединения не давали пологую кривую зависимости концентрация леводопы в плазме - время.
С другой стороны, в случае соединения, полученного в ссылочном примере 40, значения AUC и Cmax/C6hr были такими же выгодными как и в случае соединения по настоящему изобретению.
На основании вышеуказанных результатов было обнаружено, что среди группы соединений одного и того же типа только соединение по настоящему изобретению и соединение, полученное в ссылочном примере 40, представляют собой соединения, которые превращаются в леводопу после введения и при этом могут обеспечивать относительно высокую концентрацию леводопы в крови в течение длительного периода времени.
(2) Кинетические исследования на собаках (Влияние солевой или кристаллической формы на кинетику в крови)
В целом считается, что для различных солевых или кристаллических форм различия в их растворимости или подобных свойствах влияют на кинетику в крови и иногда вызывают различия в активности и эффективности. В предыдущем разделе (1) было подтверждено, что описанное в примере 5 соединение по настоящему изобретению (аморфный гидрохлорид) может поглощаться при пероральном введении и, следовательно, выяснилось, поглощаются или нет при пероральном введении другие соединения по настоящему изобретению.
[Получение раствора лекарственного средства для введения]
Раствор лекарственного средства для перорального введения получают путем взвешивания следующих соединений: соединения по настоящему изобретению, полученного в примере 6 (кристаллы тозилата (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа А), соединения по настоящему изобретению, полученного в примере 9 (кристаллы (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа А) и соединения по настоящему изобретению, полученного в примере 10 (кристаллы (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты типа В), и его суспендирования в 0,5 мас/об% метилцеллюлозы 400 при 6 мг/3 мл в перерасчете на леводопу.
[Отбор образца плазмы]
Отбор образца плазмы проводят в соответствии с предыдущим разделом (1). Однако дозу устанавливают 6 мг/3 мл/кг.
[Получение аналитического образца и анализ]
Получение аналитического образца и анализ проводят в соответствии с предыдущим разделом (1).
[Результаты]
Результаты кинетических исследований на собаках представлены в таблице 6.
В представленной выше таблице 6 показано изменение концентрации (мкг/мл) леводопы в зависимости от времени, наблюдаемое в плазме, если собакам перорально вводят соединение по настоящему изобретению, полученное в примере 6, соединение по настоящему изобретению, полученное в примере 9, или соединение по настоящему изобретению, полученное в примере 10. Цифры со знаком ± в скобках представляют собой стандартное отклонение.
Аналогично соединению по настоящему изобретению, описанному в примере 5 (аморфный гидрохлорид) и показанному в предыдущем разделе (1), соединение по настоящему изобретению, полученное в примере 6, соединение по настоящему изобретению, полученное в примере 9, и соединение по настоящему изобретению, полученное в примере 10, также могут поглощаться при пероральном введении; кроме того, не наблюдалось значительной разницы, превышающей обычные отклонения, в концентрации леводопы в плазме после введения. На основании вышеуказанных результатов было выявлено, что все соединения по настоящему изобретению можно вводить перорально, независимо от их солевой или кристаллической формы, все они имеют поглощаемость (абсорбционную способность), необходимую для проявления их эффективности и могут быть равным образом использованы в качестве фармацевтических продуктов.
Так как соединение по настоящему изобретению является пролекарством леводопы, если можно подтвердить, что леводопа получается после того, как соединение по настоящему изобретению вводят in vivo, можно гарантировать, что соединение по настоящему изобретению обладает такой же эффективностью, что и леводопа. То есть, кинетические исследования, подтверждающие, что леводопа получается в результате введения соединения по настоящему изобретению, могут рассматриваться как эквивалент фармакологических исследований для оценки их эффективности.
На основании представленных выше результатов было показано, что леводопа получается после введения соединения по настоящему изобретению in vivo, и, следовательно, в фармакологическом исследовании, в котором леводопа проявляет свою эффективность, необходимая эффективность может быть получена также в результате введения соединения по настоящему изобретению в дозе, увеличиваемой или уменьшаемой по мере необходимости.
(3) Кинетические исследования на собаках (использование в комбинации с ингибитором дофа-декарбоксилазы (DCI))
Проверяют, как изменяется пологая кривая зависимости концентрации леводопы в крови (обеспечиваемой введением соединения по настоящему изобретению) от времени, подтвержденная представленными выше в разделе (1) результатами при использовании этого соединения в сочетании с DCI, широко используемым в клинической практике. В качестве DCI использовали карбидопу.
[Отбор образца плазмы]
Раствор лекарственного средства получают взвешиванием следующих соединений:
соединения по настоящему изобретению, полученного в примере 5, и леводопы, и растворением навески в носителе в количестве 1 мг/мл в пересчете на леводопу.
Полученный таким образом раствор лекарственного средства вводят принудительно через желудочный зонд в желудок собак (самцы породы бигль), которым не давали пищу в течение дня перед введением и которым вводят эффективную дозу (60 мг/кг) карбидопы (70566, АК Scientific, Inc.). Доза леводопы составляла 3 мг/кг, а доза соединения по настоящему изобретению (Пример 5) составляла 18,6 мг/кг (6 мг/кг в пересчете на леводопу). Через 15 и 30 минут и 1, 2, 4, 6, и 8 часов после введения раствора лекарственного средства гепаринизированным шприцем отбирают 1 мл крови из головной вены. Сразу после отбора отобранную кровь центрифугируют в настольной центрифуге при 14500 об/мин в течение 45 секунд. Затем к полученной таким образом плазме прибавляют ацетонитрил, содержащий 0,1125% муравьиной кислоты, в количестве, в два раза превышающем объем плазмы, перемешивают и затем полученный образец хранят при -20°C до проведения измерений.
[Приготовление аналитического образца и анализ]
Приготовление аналитического образца и анализ проводят в соответствии со способом, описанным в том же разделе в биологическом примере 1 (1).
[Результаты]
Кривая зависимости концентрация леводопы в плазме - время при введении соединения по настоящему изобретению собакам показана на фиг.1.
В условиях применения комбинации с карбидопой, которая представляет собой широко используемый в клинической практике DCI, кривую зависимости концентрации леводопы в плазме от времени, полученную при введении леводопы, сравнивали с соответствующей кривой, полученной при введении соединения по настоящему изобретению. В результате концентрация леводопы в плазме в случае введения леводопы достигала максимального значения (Cmax) 2,1 мкг/мл через 15 минут после введения, и после этого быстро уменьшалась, однако в случае введения соединения по настоящему изобретению вместо леводопы, концентрация леводопы в плазме постепенно увеличивалась и достигала максимального значения Cmax 1,0 мкг/мл через 4 часа после введения, и затем уменьшалась постепенно, Согласно публикациям эффективная концентрация леводопы в плазме человека, при которой не развиваются вышеописанные побочные эффекты, такие как дискинезия и «истощение дозы», как полагают, находится в интервале от около 0,4 до 1 мкг/мл (Therapeutic Drug Monitoring, 2001, Vol.23, pp.621-629, Manuela Contin et al.; и Clinical Pharmacology & Therapeutics, 2001, Vol.70, pp.33-41, Dietz et al.).
На основании результатов, полученных в этом примере, был рассчитан период времени, в течение которого концентрация леводопы в плазме составляет от 0,4 до 1 мкг/мл, и было показано, что он составляет 0,6 часа в случае введения леводопы и 4,3 часа в случае введения соединения по настоящему изобретению.
На основании вышеуказанных результатов установлено, что соединение по настоящему изобретению обеспечивает установившуюся концентрацию леводопы в плазме после перорального введения также и в условиях его применения в комбинации с карбидопой (широко используемой в клинической практике) и увеличивает длительность периода эффективной концентрации в крови примерно в 7 раз по сравнению со случаем введения леводопы. Как описано выше, так как распределение карбоксиэстеразы в органах собаки аналогично распределению в органах человека, на основании результатов кинетического исследования на собаках, полагают, что соединение по настоящему изобретению может также обеспечивать установившуюся концентрацию леводопы и в плазме человека.
(4) Моделирование кинетики в крови человека, исходя из результатов исследования кинетики на собаках.
Для того, чтобы установить, наблюдается ли и у людей эффект высвобождения леводопы из соединения по настоящему изобретению в течение длительного периода времени, наблюдаемый в кинетическом исследовании на собаках, проводят моделирование кинетики в крови человека, исходя из результатов кинетического исследования на собаках, описанных в предыдущем разделе (3).
[Моделирование кинетики в крови человека]
Используя величины (значения), полученные в кинетических исследованиях на крови собак в вышеизложенном разделе (3), конструируют модель прогнозирования, которая имитирует кинетику в крови человека.
Конкретно кривую зависимости концентрации леводопы в крови от времени, полученную для леводопы или соединения по настоящему изобретению в кинетическом исследовании на собаках, вводили в программу Phoenix WinNonlin версия 6.1 (Pharsight Corporation), которая представляет собой программу для кинетического анализа, и наносили по точкам концентрацию леводопы в плазме, получая в результате прогностическую модель, которая имитирует кинетику леводопы в крови.
В эту прогностическую модель вводили значения кинетики леводопы в крови при введении человеку препарата леводопы, описанные в литературе (Br. J. Clin. Pharm., 1989, Vol.28, pp.61-69, D. R. С. Robertson et al.), и моделировали кинетику соединения по настоящему изобретению в крови человека. [Результаты]
Результаты моделирования кинетики соединения по настоящему изобретению в крови человека и значения, связанные с кинетикой леводопы в крови при приеме 100 мг таблетки (содержащей 100 мг леводопы) коммерчески доступного комбинированного препарата леводопа-карбидопа (SINEMET (зарегистрированный товарный знак)), описанные в литературе (Eur. J. Clin. Pharmacol., 1993, Vol.45, pp.419-423, V.V. Myllyla et al.), показаны на фиг.2.
Известно, что когда концентрация леводопы в плазме увеличивается слишком сильно, в качестве побочного эффекта развивается дискинезия, а когда концентрация леводопы в плазме слишком сильно уменьшается, в качестве побочного эффекта развивается «истощение дозы». Поэтому, если промежуточную концентрацию леводопы в плазме, которая не вызывает таких побочных эффектов, можно поддерживать постоянно, это можно использовать как превосходный метод лечения болезни Паркинсона и/или синдрома Паркинсона.
Аналогично вышеописанному анализу проводят следующий анализ, используя в качестве терапевтического диапазона концентрации леводопы в плазме в пределах диапазона от 0,4 до 1 мкг/мл, который взят из публикации, и при котором не возникают побочные эффекты у человека.
В случае, когда принимают 100 мг таблетку (содержащую 100 мг леводопы) коммерчески доступного комбинированного препарата леводопа-карбидопа (SINEMET (зарегистрированный товарный знак)), концентрация леводопы в плазме быстро увеличивается сразу же после приема таблетки и достигает максимального значения концентрации леводопы в плазме (Cmax), которое превышает верхний лимит терапевтического диапазона, и затем быстро уменьшается. Период времени, в течение которого концентрация леводопы в плазме находится в пределах терапевтического диапазона, был рассчитан, и было найдено, что он составляет 2,3 часа в случае, когда вводят препарат леводопы.
С другой стороны в случае, когда принимают соединение по настоящему изобретению в дозе 600 мг (200 мг в пересчете на леводопу), период времени, в течение которого концентрация леводопы в плазме находится в терапевтическом диапазоне, по расчетам составлял 7,8 часа.
В связи с этим было показано, что соединение по настоящему изобретению может обеспечивать концентрацию леводопы в плазме человека в пределах терапевтического диапазона в течение длительного периода времени, который примерно в 3,4 раза длиннее, чем у доступных в настоящее время препаратов леводопы, и, в частности, в условиях его использования в комбинации с DCI, соединение по настоящему изобретению может обеспечивать концентрацию леводопы в плазме в пределах терапевтического диапазона в течение около 16 часов при приеме два раза в день.
Биологический пример 2
Анализ мутагенности
В лечении болезни Паркинсона и/или синдрома Паркинсона существует вероятность того, что пролекарство леводопы продолжают принимать в течение длительного периода времени от нескольких лет до нескольких десятилетий. Поэтому было проведено исследование с помощью анализа на мутагенность с использованием клеток млекопитающих, чтобы оценить, обладает ли мутагенностью соединение по настоящему изобретению.
[Метод]
Анализ на мутагенность с использованием клеток млекопитающих проводят как приемочное испытание, предпринятое компанией Nissin Foods Holdings Co., Ltd. Настоящий метод также называют методом NESMAGET, он представляет собой метод, в котором экспрессия p53R2, который является репаративным геном ДНК, определяется активностью люциферазы, и конкретный экспериментальный метод описан в заявке на патент Японии JP-A-2005-000024 и патенте Японии №4243716. При определении того, является ли результат этого теста положительным, активность люциферазы гена p53R2 в случае контроля носителем (0,3% диметилсульфоксид) принимают за 100%, и концентрация, при которой относительная активность люциферазы превышает 200% определяется как «концентрация, при которой мутагенность определяется как положительная».
[Результаты]
Результаты анализа на мутагенность для соединения по настоящему изобретению (Пример 5), соединения, полученного в ссылочном примере 6, соединения, полученного в ссылочном примере 11, соединения, полученного в ссылочном примере 16, и соединения, полученного в ссылочном примере 40, представлены а таблице 7.
В случае соединения, полученного в ссылочном примере 6, соединения, полученного в ссылочном примере 11, соединения, полученного в ссылочном примере 16, и соединения, полученного в ссылочном примере 40, которые в кинетических исследованиях на собаках показали кинетическую кривую, такую же выгодную, как кривая соединения по настоящему изобретению, относительная активность люциферазы p53R2 превышала 200%, если их концентрации составляли 2,4; 1,4; 84 и 16 мкг/мл, соответственно, и, поэтому эти соединения определены как имеющие положительный результат анализа на мутагенность. С другой стороны, в случае соединения по настоящему изобретению, мутагенность не наблюдалась даже при концентрации 200 мкг/мл.
На основании этих результатов было показано, что среди пролекарств леводопы, способных обеспечивать концентрацию леводопы в плазме в течение длительного периода времени, имеется некоторое количество пролекарств, которые показали наличие мутагенности в анализе мутагенности с использованием клеток млекопитающих. С другой стороны, соединение по настоящему изобретению не обладает мутагенностью даже при концентрации 200 мкг/мл, и, следовательно, показано, что даже в случае, когда соединение по настоящему изобретению продолжают принимать в течение длительного периода времени от нескольких лет до нескольких десятилетий, как, например, при лечении болезни Паркинсона и/или синдрома Паркинсона, соединение можно продолжать принимать без риска.
Биологический пример 3
Модель, в медиальный пучок переднего мозга которой, вводят инъекцию 6-гидроксидофамина
Для подтверждения того, что соединение по настоящему изобретению метаболизируется, превращаясь в леводопу после перорального введения, и обладает эффективностью против болезни Паркинсона, эффективность соединения по настоящему изобретению оценивают на модели, которой делают инъекцию 6-гидроксидофамина (6-OHDA) в медиальный пучок переднего мозга, такая модель является экспериментальной моделью болезни Паркинсона, в которой используют животных.
[Используемое животное]
В экспериментах используют крыс-самцов Crl:CD(SD)IGS, поставляемых Charles River Japan, Inc. в возрасте 5 недель. Крыс помещают в ECON клетки (4 или меньше крыс на клетку) и выращивают, давая им свободный доступ к твердой пище CRF-1 (Oriental Yeast Co., Ltd.) и водопроводной воде (в сосуде для воды), до тех пор, пока их не подвергают экспериментам.
[Получение модели, в медиальный пучок переднего мозга которой вводят инъекцию 6-OHDA]
Когда завершается акклиматизация после перевозки, каждую из крыс Crl:CD(SD)IGS в возрасте 6 недель анестезируют пентобарбиталом натрия (Somnopentyl (зарегистрированный товарный знак) раствор для инъекций 35 мг/кг, внутрибрюшинная инъекция). Затем с целью не допустить повреждения норэпинефриновых нейронов 6-гидроксидофамином (6-OHDA), делают внутрибрюшинно инъекцию дезипрамина (25 мг/кг), и крысу удерживают и фиксируют устройством, фиксирующим мозг. Небольшое отверстие в кости необходимого размера в нужном месте делают ручной дрелью и вводят 6-OHDA в медиальный пучок переднего мозга в соответствии с Атласом мозга (Paxinos и Watson) с помощью канюли 30 G (Brain Science Idea. Co. Ltd.) с наконечником иглы, срезанным по углом 45° (место инъекции: А=-4,5 мм, L=+1,2 мм, и V=-7,8 мм относительно брегмы, размер инъекции 8 мкг/4 мкл/8 мин/место инъекции в каждом случае). После инъекции для того, чтобы не допустить вытекания раствора, инъекционную иглу оставляют в месте инъекции на 2 минуты или дольше. После этого трепанационное отверстие закрывают мгновенно схватывающимся клеем, затем зашивают и дезинфицируют йодной настойкой.
[Подтверждение индуцирования патологии]
Через две недели после инъекции 6-OHDA отбирают особей, у которых была индуцирована патология. Более конкретно, используют описанный ниже тест на вращение и, когда апоморфин (0,05 мг/кг), который представляет собой агонист дофаминовых рецепторов, вводят подкожно как испытываемое соединение, в качестве крыс с индуцированной патологией отбирают только тех крыс, которые ведут себя таким образом, что число вращений в течение 5 минут через 15-20 минут после введения составляет 20 или больше.
[Тест на вращение]
В тесте на вращение используют устройство, скомпонованное таким образом, что черный пластиковый цилиндр с круглым сечением, имеющий диаметр 30 см и высоту 35 см, помещен вертикально в чашу, окрашенную в черный цвет, имеющую наружный диаметр 35 см и диаметр дна 17 см (высоту кривой от дна чаши до края дна цилиндра устанавливают равной 7 см). Крысу помещают в устройство (одну крысу в одно устройство) и дают акклиматизироваться в устройстве в течение 30 минут. Затем крысе вводят испытуемое вещество, возвращают крысу в то же устройство и осуществляют видеозапись. Затем анализируют видеозапись и измеряют число вращений каждые 5 или 10 минут. Что касается числа вращений, вращение на 360° в одном направлении определяют как одно вращение. В случае, где направление (направление тела при движении или направление движения) во время вращения изменяется, вращение не включают в подсчет.
[Изучение эффекта действия соединения по настоящему изобретению]
Вращательное поведение в случае, когда полученное в примере 5 соединение по настоящему изобретению (100 мг/кг в пересчете на леводопу) перорально вводят через 1 неделю или более после подтверждения индуцирования патологии, оценивают в течение 6 часов после введения (N=11). Кроме того, вращательное поведение в случае, когда таким же образом перорально вводят леводопу (30 мг/кг), также оценивают в течение 6 часов после введения (N=11, перекрестное исследование). При этом в каждом случае одновременно перорально вводят бензерамид, который является ингибитором дофа-декарбоксилазы (8 мг/кг).
[Результаты]
Число вращений (разы), которое в течение 6 часов (360 минут) после введения за 10 минут делают крысы из группы, в которой крыс лечили леводопой (30 мг/кг), и крысы из группы, в которой крыс лечили полученным в примере 5 соединением по настоящему изобретению (100 мг/кг в пересчете на леводопу), показано на фиг.3. На этом чертеже значения для группы крыс, которых лечили леводопой (30 мг/кг), указаны как значения для леводопы (30 мг/кг), а значения для группы крыс, которых лечили полученным в примере 5 соединением по настоящему изобретению (100 мг/кг в пересчете на леводопу), указаны как значения для соединения из примера 5 (100 мг/кг). Кроме того, соответствующие значения представляют собой среднее из значений, полученных при использовании каждой группы (из 11 крыс), и стандартной ошибки.
В случае крыс из группы, в которой крыс лечили леводопой, число вращений быстро увеличивалось после введения леводопы и достигало максимального значения (около 100 вращений) через 20 минут после введения. С другой стороны, в случае крыс из группы, в которой крыс лечили полученным в примере 5 соединением по настоящему изобретению, число вращений начинало постепенно увеличиваться через 60 минут или более после введения, и достигало максимального значения (около 90 вращений или более) через 140 минут после введения. Кроме того, даже в том случае, когда вместо полученного в примере 5 соединения настоящего изобретения использовали соединение по настоящему изобретению, полученное в примере 9, получали такие же результаты.
На основании вышеописанных результатов было показано, что соединение по настоящему изобретению проявляет такую же активность, что и леводопа, по прошествии некоторого периода времени после перорального введения. Указанные результаты согласуются с характерной особенностью соединения по настоящему изобретению, которая состоит в том, что соединение по настоящему изобретению само по себе не проявляет активности, подобной активности леводопы, но оно метаболизируется, превращаясь в леводопу, и так проявляет свою эффективность.
Пример состава 1
Таблетка, содержащая 5 мг (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты.
Соответствующие компоненты, указанные ниже, смешивают в соответствии с общепринятой методикой, затем таблетируют, получая в результате 10000 таблеток, каждая из которых содержит 5 мг активного ингредиента.
(2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая
кислота: 50 г
кальцийкарбоксиметилцеллюлоза (разрыхлитель): 20 г
стеарат магния (смазывающее вещество): 10 г
микрокристаллическая целлюлоза: 920 г
Пример состава 2
Препарат для инъекций, содержащий 20 мг (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоты
Соответствующие компоненты, указанные ниже, смешивают в соответствии с общепринятой методикой и полученный раствор стерилизуют в соответствии с общепринятой методикой. Затем аликвоты (5 мл) загружают в ампулы и лиофилизируют в соответствии с общепринятой методикой, получая в результате 10000 ампул, каждая из которых содержит 20 мг активного ингредиента.
(2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота: 200 г
маннит: 20 г
дистиллированная вода: 50 л
Промышленная применимость
Соединение по настоящему изобретению является пролекарством леводопы и может быть использовано в качестве профилактического и/или терапевтического средства против заболеваний, для которых леводопу используют в качестве терапевтического средства, или против заболеваний, на которые, как полагают, леводопа оказывает действие, таких как болезнь Паркинсона и/или синдром Паркинсона, или заболеваний, состояние при которых, как полагают, улучшается при стимуляции дофамином, или заболеваний, которые вызываются понижением содержания норадреналина.
Реферат
Изобретение относится к (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановой кислоте, ее соли, выбранной из кислотно-аддитивных солей, солей щелочных металлов, солей щелочноземельных металлов, солей аммония, солей тетраметиламмония, солей тетрабутиламмония, солей фармацевтически приемлемых органических аминов и солей природных основных аминокислот, или ее низкотоксичному и растворимому в воде сольвату, которые могут найти применение для профилактики и/или лечения болезни Паркинсона и/или синдрома Паркинсона. Предлагаемая (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановая кислота, ее соль или сольват является пролекарством леводопы, которое позволяет обеспечить эффективную концентрацию леводопы в крови при небольшом числе доз. Изобретение относится также к фармацевтической композиции и лекарственному средству, содержащим (2S)-2-амино-3-(3,4-бис((2-(бензоилокси)-2-метилпропаноил)окси)фенил)пропановую кислоту, ее соль или сольват. 3 н. и 35 з.п. ф-лы, 18 ил., 7 табл., 12 пр.
Формула
Документы, цитированные в отчёте о поиске
Пролекарства леводопа, композиции на их основе и их применения
Патенты аналоги
Пролекарства леводопа, композиции на их основе и их применения

Комментарии