Удаляющее недифференцированные стволовые клетки средство и способ удаления недифференцированных стволовых клеток - RU2735247C1
Код документа: RU2735247C1
Чертежи











Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к удаляющему недифференцированные стволовые клетки средству и к способу удаления недифференцированных стволовых клеток. Настоящее изобретение также относится к культуральной среде, содержащей удаляющее недифференцированные стволовые клетки средство, к способу получения клеток для трансплантации и к фармацевтической композиции.
По настоящей заявке испрашивается приоритет на основании Японской патентной заявки № 2016-203839, поданной 17 октября 2016 г., содержание которой включено в настоящий документ посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Исследования плюрипотентных стволовых клеток, таких как эмбриональные стволовые клетки (ЭС клетки) и индуцированные плюрипотентные стволовые клетки (иПС клетки), достигли определенного прогресса в течение последних лет. Поскольку эти клетки являются плюрипотентными, становится возможным получение клеток, дифференцирующихся в нужном направлении, за счет дифференциации и индукции, и использование полученных клеток для медицинской трансплантации.
Дифференциацию и индукцию эмбриональных стволовых клеток и индуцированных плюрипотентных стволовых клеток, как правило, производят in vitro.
Однако в условиях in vitro сложно добиться дифференциации в нужную клеточную линию для всех стволовых клеток. Вследствие этого, после процедуры дифференциации и индукции может оставаться некоторое количество недифференцированных стволовых клеток. Поскольку такие недифференцированные стволовые клетки обладают пролиферативной активностью и могут дифференцироваться в клетки разных видов, то при трансплантации таких недифференцированных стволовых клеток в живой организм может развиваться тератоидная опухоль (смотри, например, НПЛ 1). По этой причине возникают сложности с прямой трансплантацией популяции клеток, полученной в результате дифференциации и индукции стволовых клеток, в живой организм в ее исходном состоянии, поскольку она предназначена для использования в лечении.
Соответственно, необходимо удалять недифференцированные стволовые клетки для безопасного проведения трансплантации клеток, дифференцированных и индуцированных из стволовых клеток, в живой организм и достижения идеальных терапевтических результатов. Кроме того, если трансплантацию выполняют с остающимися недифференцированными стволовыми клетками, необходимо подавлять пролиферацию недифференцированных стволовых клеток в живом организме.
К настоящему времени появились сообщения о способе, с помощью которого недифференцированные стволовые клетки можно избирательно удалять в условиях культивирования (смотри, например, НПЛ 2-4). Исследовательская группа авторов настоящего изобретения также разработала способ отбора кардиомиоцитов от не-кардиомиоцитов и недифференцированных стволовых клеток (смотри ПЛ 1-6 и НПЛ 5).
Список цитируемой литературы
Патентная литература
[ПЛ 1] Международная PCT публикация № WO2006/022377
[ПЛ 2] Международная PCT публикация № WO2007/088874
[ПЛ 3] Международная PCT публикация № WO2009/017254
[ПЛ 4] Международная PCT публикация № WO2010/114136
[ПЛ 5] Международная PCT публикация № WO2011/052801
[ПЛ 6] Международная PCT публикация № WO2016/010165
Не патентная литература
[НПЛ 1] Miura et al., (2009) Nature Biotech., 8, 743-745.
[НПЛ 2] Ben-David, et al., (2013) Cell Stem Cell, 12, 167-179.
[НПЛ 3] Wang, et al., (2009) Science, 325, 435-439.
[НПЛ 4] Shiraki, et al., (2014) Cell Metabolism, 19, 780-794.
[НПЛ 5] Tohyama, et al., (2016) Cell Metabolism, 23, 663-674.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая проблема
По-прежнему сохраняется потребность в дальнейших исследованиях, посвященных способам удаления недифференцированных стволовых клеток с целью уменьшения остаточного количества недифференцированных стволовых клеток.
Настоящее изобретение было осуществлено с учетом вышеуказанных обстоятельств, и целью настоящего изобретения является предложение удаляющего недифференцированные стволовые клетки средства, способного удалять недифференцированные стволовые клетки с высокой эффективностью, а также способа удаления недифференцированных стволовых клеток.
Решение проблемы
В результате интенсивных исследований для достижения вышеуказанной цели авторы настоящего изобретения установили, что гибель недифференцированных стволовых клеток можно индуцировать путем культивирования недифференцированных стволовых клеток в присутствии ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот или ингибитора синтеза холестерина. На основании этого авторы настоящего изобретения осуществили настоящее изобретение.
Таким образом, настоящее изобретение включает следующие аспекты.
[1] Удаляющее недифференцированные стволовые клетки средство, содержащее по меньшей мере одно средство, выбранное из группы, состоящей из ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот и ингибитора синтеза холестерина.
[2] Удаляющее недифференцированные стволовые клетки средство по п. [1],
при этом ингибитор синтеза жирных кислот ингибирует синтез жирных кислот за счет нацеливания на по меньшей мере один фактор, выбранный из группы, состоящей из АТФ-цитрат-лиазы, синтазы жирных кислот, ацетил-КоА-карбоксилазы и малонил-КоА декарбоксилазы, и
ингибитор утилизации жирных кислот ингибирует утилизацию жирных кислот за счет нацеливания на карнитин-пальмитоилтрансферазу 1.
[3] Удаляющее недифференцированные стволовые клетки средство по п. [1] или [2], при этом концентрация ингибитора синтеза жирных кислот или ингибитора утилизации жирных кислот в среде применения составляет 0,1-500 мкМ.
[4] Удаляющее недифференцированные стволовые клетки средство по п. [1], при этом ингибитор синтеза холестерина ингибирует синтез холестерина за счет нацеливания на по меньшей мере один фактор, выбранный из группы, состоящей из ацетил-КоА-ацетилтрансферазы, ГМГ-КоА-синтазы и ГМГ-КоА-редуктазы.
[5] Удаляющее недифференцированные стволовые клетки средство по п. [1] или [4], при этом концентрация ингибитора синтеза холестерина в среде применения составляет 0,01-50 мкМ.
[6] Удаляющее недифференцированные стволовые клетки средство по любому из пунктов [1] - [5], дополнительно содержащее по меньшей мере одно соединение, выбранное из группы, состоящей из глюкозы, глутамина и метионина.
[7] Удаляющее недифференцированные стволовые клетки средство, содержащее одно, либо два или более средств, выбранных из группы, состоящей из орлистата, C75, LY294002, SB204990, этомоксира, пергексилина и симвастатина, а также их солей.
[8] Культуральная среда, содержащая удаляющее недифференцированные стволовые клетки средство по любому из пунктов [1] - [7].
[9] Способ удаления недифференцированных стволовых клеток, включающий культивирование смеси клеток, содержащей недифференцированную стволовую клетку и дифференцированную клетку, в присутствии удаляющего недифференцированные стволовые клетки средства по любому из пунктов [1] - [7].
[10] Способ удаления недифференцированных стволовых клеток по п. [9], в котором недифференцированная стволовая клетка представляет собой индуцированную плюрипотентную стволовую клетку.
[11] Способ удаления недифференцированных стволовых клеток по п. [9] или [10], в котором дифференцированная клетка представляет собой кардиомиоцит.
[12] Способ получения клеток для трансплантации, включающий следующие этапы (i) и (ii):
этап (i) индукции нужной дифференцированной клетки из недифференцированной стволовой клетки; и
этап (ii) культивирования смеси клеток, полученной на этапе (i), в присутствии удаляющего недифференцированные стволовые клетки средства по любому из пунктов [1] - [7].
[13] Способ получения по п. [12], в котором недифференцированная стволовая клетка представляет собой индуцированную плюрипотентную стволовую клетку.
[14] Способ получения по п. [12] или [13], в котором дифференцированная клетка представляет собой кардиомиоцит.
[15] Фармацевтическая композиция для лечения или предотвращения заболевания, вызываемого пролиферацией недифференцированной стволовой клетки, у субъекта, которому трансплантировали дифференцированную клетку, индуцированную из недифференцированной стволовой клетки, содержащая удаляющее недифференцированные стволовые клетки средство по любому из пунктов [1] - [7].
[16] Фармацевтическая композиция по п. [15], в которой недифференцированная стволовая клетка представляет собой индуцированную плюрипотентную стволовую клетку.
[17] Фармацевтическая композиция по п. [15] или [16], в которой дифференцированная клетка, индуцированная из недифференцированной стволовой клетки, представляет собой кардиомиоцит.
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
За счет применения удаляющего недифференцированные стволовые клетки средства по настоящему изобретению можно с высокой эффективностью удалять недифференцированные стволовые клетки.
За счет применения способа удаления недифференцированных стволовых клеток по настоящему изобретению можно с высокой эффективностью удалять недифференцированные стволовые клетки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
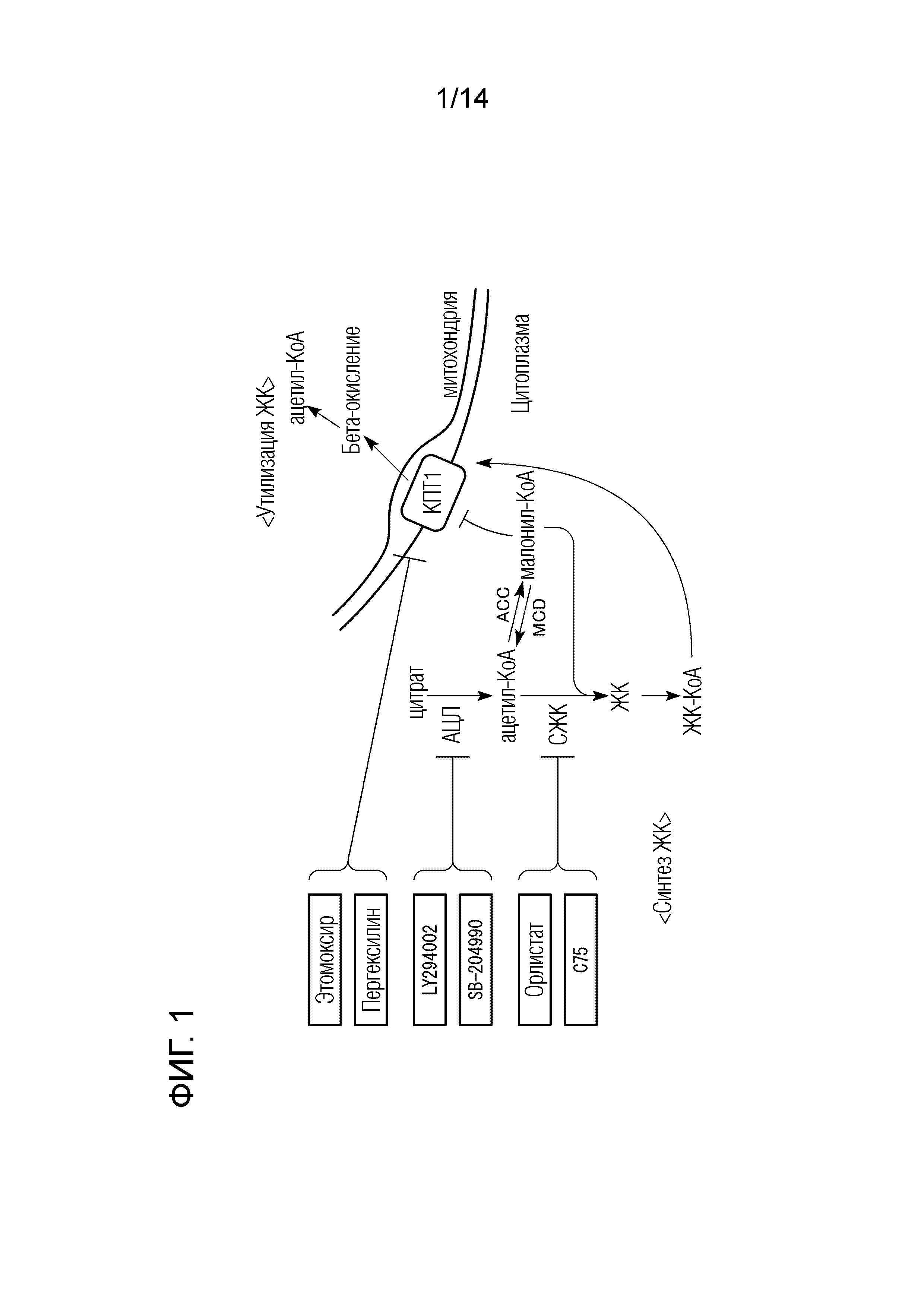
На ФИГ. 1 приведена диаграмма, схематически изображающая путь синтеза жирных кислот в клетке.
На ФИГ. 2 приведены изображения, иллюстрирующие результаты сравнения экспрессии СЖК в кардиомиоцитах, полученных из иПС клеток, и иПС клетках в экспериментальном примере 1.
На ФИГ. 3 приведены изображения линейных недифференцированных стволовых клеток, культивируемых в экспериментальном примере 2.
На ФИГ. 4 приведены изображения линейных недифференцированных стволовых клеток, культивируемых в экспериментальном примере 3.
На ФИГ. 5 приведены изображения очищенных и обогащенных кардиомиоцитов, культивируемых в экспериментальном примере 4.
На ФИГ. 6 приведены изображения фибробластов, культивируемых в экспериментальном примере 5.
На ФИГ. 7 приведены изображения смеси клеток, содержащей кардиомиоциты, полученные из человеческих иПС клеток, и человеческие иПС клетки, культивируемой в экспериментальном примере 6.
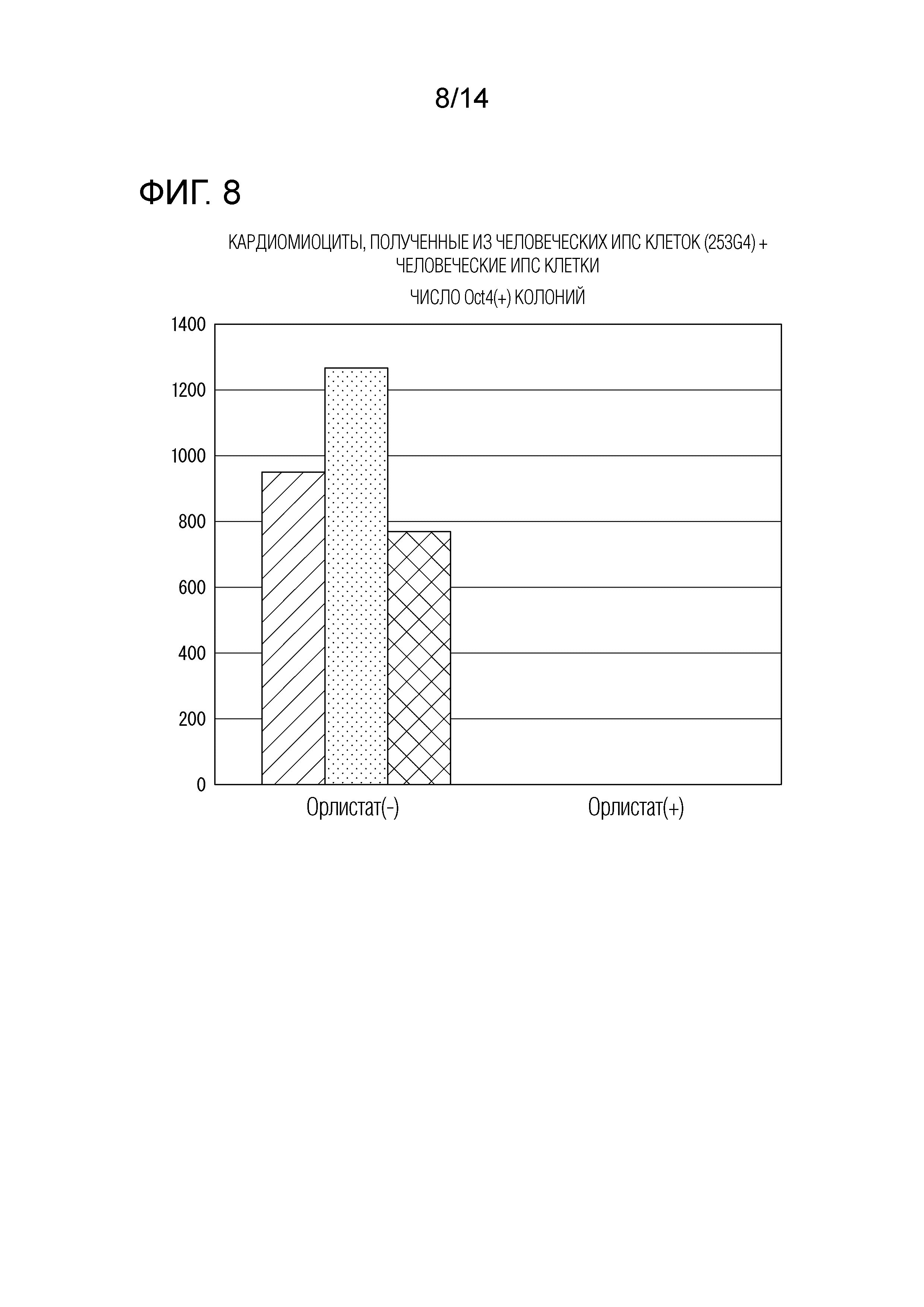
На ФИГ. 8 приведен график, иллюстрирующий результаты сравнения числа Oct4-положительных колоний в смеси клеток, культивируемой в культуральной среде, содержащей ингибитор синтеза жирных кислот, и культуральной среде, не содержащей ингибитор синтеза жирных кислот, в экспериментальном примере 6.
На ФИГ. 9 приведена диаграмма, схематически изображающая путь синтеза холестерина в клетке.
На ФИГ. 10 приведены изображения, иллюстрирующие результаты сравнения экспрессии СЖК в кардиомиоцитах, полученных из человеческих иПС клеток, и человеческих иПС клетках в экспериментальном примере 7.
На ФИГ. 11 приведена фотография вестерн-блота, иллюстрирующая результаты сравнения экспрессии СЖК в кардиомиоцитах, полученных из человеческих иПС клеток, и человеческих иПС клетках в экспериментальном примере 7.
На ФИГ. 12 приведено изображение линейных недифференцированных стволовых клеток, культивируемых в экспериментальном примере 8.
На ФИГ. 13 приведены изображения лунок с человеческими иПС клетками, культивируемыми в культуральной среде (ПК-БСА), содержащей ингибитор синтеза жирных кислот и жирные кислоты, и культуральной среде (БСА), содержащей ингибитор синтеза жирных кислот и не содержащей жирные кислоты, в экспериментальном примере 9.
На ФИГ. 14 приведен график, иллюстрирующий результаты сравнения числа жизнеспособных клеток в человеческих иПС клетках, культивируемых в культуральной среде (ПК-БСА), содержащей ингибитор синтеза жирных кислот и жирные кислоты, и культуральной среде (БСА), содержащей ингибитор синтеза жирных кислот и не содержащей жирные кислоты, в экспериментальном примере 9.
На ФИГ. 15 приведена фотография вестерн-блота, иллюстрирующая результаты сравнения экспрессии СЖК в линейных недифференцированных стволовых клетках, в которые введена киРНК для СЖК, и в линейных недифференцированных стволовых клетках, в которые введена киРНК отрицательного контроля (О/К киРНК), в экспериментальном примере 10.
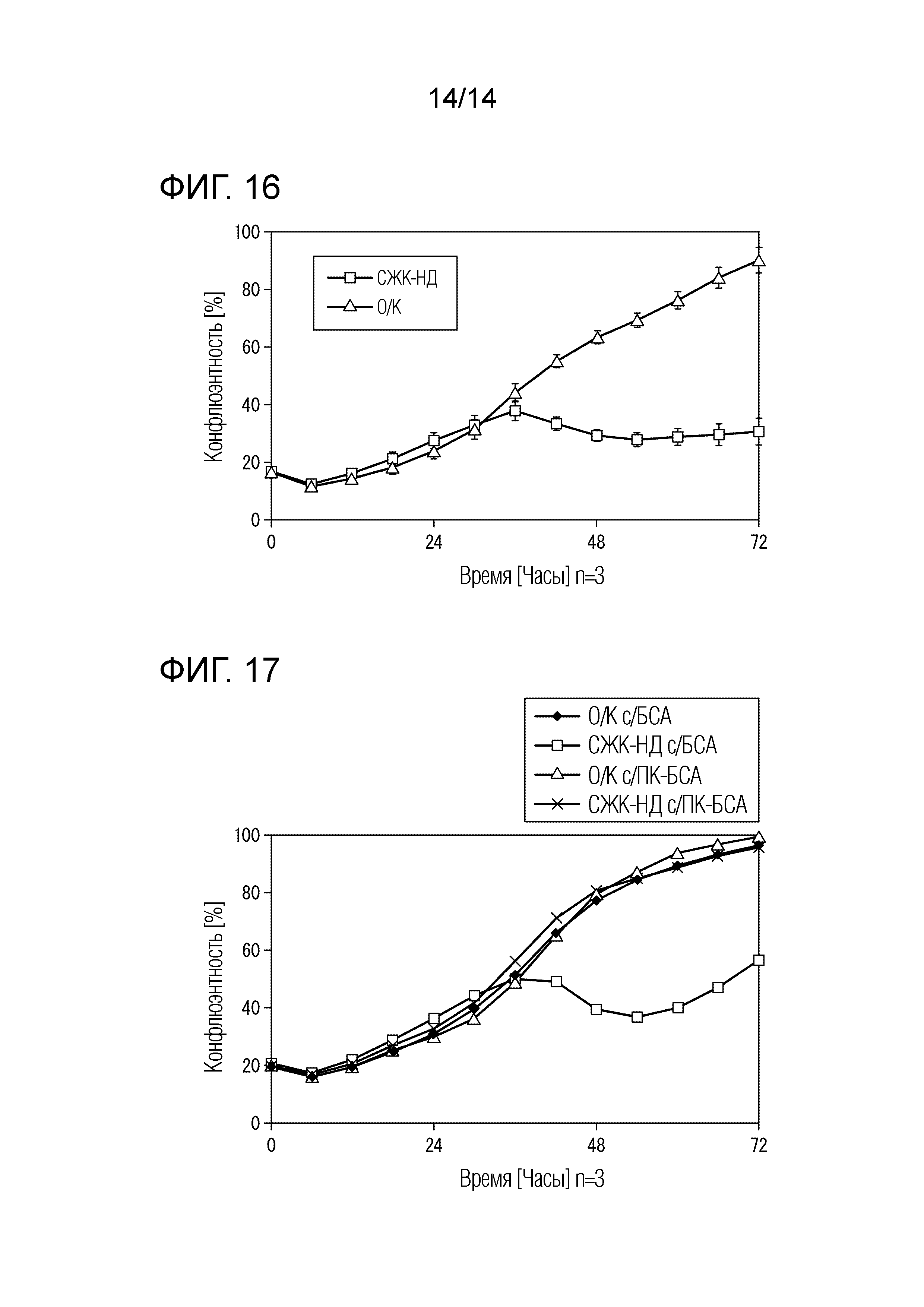
На ФИГ. 16 приведен график, иллюстрирующий результаты сравнения клеточной пролиферации линейных недифференцированных стволовых клеток (СЖК-НД), в которые введена киРНК для СЖК, и линейных недифференцированных стволовых клеток (О/К), в которые введена киРНК отрицательного контроля, в экспериментальном примере 10.
На ФИГ. 17 приведен график, иллюстрирующий результаты сравнения клеточной пролиферации линейных недифференцированных стволовых клеток (СЖК-НД), в которые введена киРНК для СЖК, и линейных недифференцированных стволовых клеток (О/К), в которые введена киРНК отрицательного контроля, при культивировании их в культуральной среде (ПК-БСА), содержащей ингибитор синтеза жирных кислот и жирные кислоты, и культуральной среде (БСА), содержащей ингибитор синтеза жирных кислот и не содержащей жирные кислоты, в экспериментальном примере 11.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Определения и тому подобное
В настоящей спецификации термин «недифференцированная стволовая клетка» используется в качестве концепции, охватывающей плюрипотентные стволовые клетки, обладающие плюрипотентностью дифференциации, и может включать эмбриональные стволовые клетки (ЭС клетки), индуцированные плюрипотентные стволовые клетки (иПС клетки), клетки, обладающие плюрипотентностью дифференциации, индуцированные из этих стволовых клеток, а также различные соматические стволовые клетки. Термин «недифференцированная стволовая клетка» не имеет конкретных ограничений при условии, что речь идет о клетке, обладающей плюрипотентностью дифференциации, и также охватывает неизвестные клетки, обладающие свойствами, эквивалентными свойствам ЭС клеток и иПС клеток, описанных выше.
Определять, являются ли клетки недифференцированными стволовыми клетками, можно на основании наличия или отсутствия свойств, специфических для недифференцированных стволовых клеток, а также экспрессии различных маркеров, специфических для недифференцированных стволовых клеток. Например, примеры свойств, специфических для недифференцированных стволовых клеток, включают такое свойство, как способность к саморепликации и дифференциации в клетку другого типа, имеющую свойство, отличное от свойств недифференцированных стволовых клеток. Кроме того, примеры дополнительно включают способность образовывать тератому, способность придания мышам свойств химерного организма, и тому подобное, то есть, свойства, характерные для недифференцированных стволовых клеток.
Различные маркеры, специфические для недифференцированных стволовых клеток (далее в настоящем документе называемые «маркеры недифференцированных стволовых клеток»), представляют собой факторы, которые специфически экспрессируются в недифференцированных стволовых клетках, и их примеры включают Oct3/4, Nanog, Sox2, SSEA-1, SSEA-3, SSEA-4, TRA1-60, TRA1-81, Lin28, Fbx15 и тому подобное. В случае, если имеет место экспрессия по меньшей мере одного из этих маркеров недифференцированной стволовой клетки, можно утверждать, что данная клетка представляет собой недифференцированную стволовую клетку. Можно использовать маркер недифференцированных стволовых клеток только одного вида, или можно использовать маркеры двух или более видов в сочетании. В одном варианте осуществления клетки, экспрессирующие Oct3/4, можно определять как недифференцированные стволовые клетки. Экспрессию маркера недифференцированных стволовых клеток в клетках можно анализировать с использованием известных способов, таких как ОТ-ПЦР и технология микрочипов.
Недифференцированная стволовая клетка может представлять собой недифференцированную стволовую клетку млекопитающих, недифференцированную стволовую клетку грызунов, недифференцированную стволовую клетку приматов или недифференцированную стволовую клетку человека. Примеры включают полученные от человека недифференцированные стволовые клетки, и более конкретные примеры включают человеческие иПС клетки, человеческие ЭС клетки и тому подобное.
В настоящей спецификации термин «дифференцированная клетка» означает клетку, которая не имеет свойств «недифференцированных стволовых клеток». Дифференцированные клетки могут представлять собой клетки, индуцированные и дифференцированные из недифференцированных стволовых клеток, но не обладающие плюрипотентностью дифференциации. Дифференцированные клетки могут представлять собой, например, клетки, дифференцированные из ЭС клеток, или клетки, дифференцированные из иПС клеток. Примеры дифференцированных клеток включают кардиомиоциты; мышечные клетки; фибробласты; нервные клетки; иммуноциты, такие как лимфоциты; сосудистые клетки; клетки глаза, такие как клетки пигментного эпителия сетчатки; клетки крови, такие как мегакариоциты и эритроциты; и клетки других тканей; а также их клетки-предшественники.
Удаляющее недифференцированные стволовые клетки средство
В одном варианте осуществления настоящее изобретение относится к удаляющему недифференцированные стволовые клетки средству.
Удаляющее недифференцированные стволовые клетки средство по настоящему варианту осуществления содержит по меньшей мере одно средство, выбранное из группы, состоящей из ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот и ингибитора синтеза холестерина.
Далее настоящее изобретение будет описано на основании вариантов осуществления.
Как показано в примерах, описанных далее, авторы настоящего изобретения установили, что гибель клеток может быть индуцирована при контакте ингибитора синтеза жирных кислот или ингибитора деградации жирных кислот (ингибитора утилизации жирных кислот) с недифференцированными стволовыми клетками. Авторы настоящего изобретения установили, что причиной этого является то, что путь синтеза жирных кислот усилен в человеческих иПС клетках (недифференцированных стволовых клетках). Вероятно, путь синтеза жирных кислот и путь их метаболизма являются очень важными для выживания недифференцированных стволовых клеток. По этой причине, похоже, что гибель недифференцированных стволовых клеток индуцируется в результате ингибирования соответствующего синтеза жирных кислот или деградации жирных кислот.
Кроме того, авторы настоящего изобретения установили, что гибель клеток может быть индуцирована за счет создания контакта ингибитора синтеза холестерина с недифференцированными стволовыми клетками. Холестерин является компонентом клеточной мембраны, и путь синтеза холестерина, судя по всему, является очень важным для выживания недифференцированных стволовых клеток. По этой причине, похоже, что гибель недифференцированных стволовых клеток индуцируется в результате ингибирования соответствующего синтеза холестерина.
Кроме того, даже если популяция клеток, в которой остались недифференцированные стволовые клетки, трансплантирована в живой организм, можно избирательно удалять недифференцированные стволовые клетки в живом организме путем введения ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот или ингибитора синтеза холестерина в живой организм.
В настоящей спецификации «ингибитор утилизации жирных кислот» представляет собой ингибитор, который имеет функцию ингибирования реакции метаболического пути, вовлеченного в синтез вещества, утилизирующего жирные кислоты, и/или функцию ингибирования реакции метаболического пути, вовлеченного в деградацию жирных кислот. В настоящей спецификации «ингибитор утилизации жирных кислот» включает «ингибитор деградации жирных кислот», который ингибирует реакцию метаболического пути, вовлеченного в деградацию жирных кислот.
В качестве метаболического пути, вовлеченного в деградацию жирных кислот, предпочтительным является метаболический путь, включающий β-окисление. Ингибитор утилизации жирных кислот предпочтительно представляет собой «ингибитор метаболизма жирных кислот, связанного с β-окислением». Примеры метаболизма жирных кислот, связанного с β-окислением, включают β-окисление, синтез метаболитов жирных кислот, используемых для β-окисления, включение метаболитов жирных кислот, используемых для β-окисления, в митохондрии, и тому подобное.
Кроме того, в качестве метаболического пути, вовлеченного в синтез вещества, утилизирующего жирные кислоты, предпочтительными являются метаболические пути, вовлеченные в синтез триглицеридов и/или фосфолипидов. Предпочтительно, если ингибитор утилизации жирных кислот представляет собой «ингибитор метаболизма жирных кислот, вовлеченного в синтез триглицеридов и/или фосфолипидов».
Тип данных ингибиторов не имеет конкретных ограничений, и можно использовать любое вещество при условии, что оно обладает функцией ингибирования синтеза жирных кислот, ингибирования утилизации жирных кислот или ингибирования синтеза холестерина, и оно может представлять собой органическое вещество или неорганическое вещество. Органическое вещество предпочтительно представляет собой органическое соединение, и примеры включают низкомолекулярное соединение, нуклеиновую кислоту, пептид, белок и тому подобное.
На ФИГ. 1 приведена диаграмма, схематически изображающая путь синтеза жирных кислот и деградации жирных кислот (утилизации жирных кислот) в цитоплазме природных клеток. Ацетил-КоА синтезируется из цитрата за счет действия АТФ-цитрат-лиазы (АЦЛ), и жирная кислота (ЖК) синтезируется из ацетил-КоА и малонил-КоА за счет действия синтазы жирных кислот (СЖК).
Ацетил-КоА карбоксилаза (АКК) катализирует образование малонил-КоА из ацетил-КоА. Малонил-КоА-декарбоксилаза (МКД) катализирует образование ацетил-КоА из малонил-КоА.
Синтезированная жирная кислота становится ацил-КоА жирной кислоты (ЖК-КоА) за счет действия ацил-КоА-синтетазы (АКС), проходит через несколько реакций, и в результате конечный продукт переносится в митохондрии с помощью карнитин-пальмитоилтрансферазы-1 (КПТ1), а затем используется в β-окислении.
Ингибитор синтеза жирных кислот по настоящему варианту осуществления может ингибировать синтез жирных кислот путем полного или частичного ингибирования любых реакций пути синтеза жирных кислот, представленного на ФИГ. 1. Ингибитор синтеза жирных кислот по настоящему варианту осуществления может ингибировать синтез жирных кислот за счет нацеливания на по меньшей мере один фактор, выбранный из группы, состоящей из АТФ-цитрат-лиазы, синтазы жирных кислот, ацетил-КоА-карбоксилазы и малонил-КоА декарбоксилазы. Предпочтительно, ингибитор синтеза жирных кислот по настоящему варианту осуществления может ингибировать синтез жирных кислот за счет нацеливания на по меньшей мере один фактор, выбранный из группы, состоящей из АТФ-цитрат-лиазы, синтазы жирных кислот и ацетил-КоА-карбоксилазы, и может ингибировать синтез жирных кислот за счет нацеливания на по меньшей мере один фактор, выбранный из группы, состоящей из АТФ-цитрат-лиазы и синтазы жирных кислот.
Ингибитор деградации жирных кислот по настоящему варианту осуществления может ингибировать деградацию жирных кислот путем полного или частичного ингибирования любых реакций путей деградации жирных кислот, вовлеченных в β-окисление, представленных на ФИГ. 1. Ингибитор деградации жирных кислот по настоящему варианту осуществления может ингибировать деградацию жирных кислот за счет нацеливания на карнитин-пальмитоилтрансферазу 1.
Помимо использования для β-окисления, жирные кислоты также используются для синтеза триглицеридов и фосфолипидов. Ацил-КоА жирной кислоты используется для синтеза лизофосфатидной кислоты (ЛФК) за счет действия глицерин-3-фосфат-ацилтрансферазы (ГФАТ). Кроме того, ацил-КоА жирной кислоты используется для синтеза фосфатидной кислоты (ФК) за счет действия ацил-глицерин-3-фосфат ацилтрансферазы (АГФАТ). Кроме того, ацил-КоА жирной кислоты используется для синтеза диацилглицерина (ДАГ, ДГ) за счет действия фосфотидат-фосфатазы (ФАФ). Кроме того, ацил-КоА жирной кислоты используется для синтеза триглицеридов за счет действия диацилглицерин-ацилтрансферазы (ДГАТ). Кроме того, ацил-КоА жирной кислоты деградирует до жирных кислот и глицерина за счет действия моноацилглицеринлипазы (МАГЛ). Ингибитор утилизации жирных кислот по настоящему варианту осуществления может ингибировать утилизацию жирных кислот путем полного или частичного ингибирования любых реакций этих путей утилизации жирных кислот.
На ФИГ. 9 приведена диаграмма, схематически изображающая путь синтеза холестерина. Ацетоацетил-КоА синтезируется из ацетил-КоА за счет действия ацетил-КоА-ацетилтрансферазы (АКАТ2). Гидроксиметилглутарил-КоА (ГМГ-КоА) синтезируется из ацетоацетил-КоА за счет действия гидроксиметилглутарил-КоА-синтазы 1 (ГМГ-КоА-синтазы 1). Мевалонат синтезируется из ГМГ-КоА за счет действия гидроксиметилглутарил-КоА-редуктазы (ГМГ-КоА-редуктазы). И затем, после нескольких реакций, в результате синтезируется холестерин.
Ингибитор синтеза холестерина по настоящему варианту осуществления может ингибировать синтез холестерина путем полного или частичного ингибирования любых реакций в пути синтеза холестерина, представленного на ФИГ. 9. Ингибитор синтеза холестерина по настоящему варианту осуществления может ингибировать синтез холестерина за счет нацеливания на по меньшей мере один фактор, выбранный из группы, состоящей из ацетил-КоА-ацетилтрансферазы, ГМГ-КоА-синтазы и ГМГ-КоА-редуктазы. Предпочтительно, ингибитор синтеза холестерина по настоящему варианту осуществления может ингибировать синтез холестерина за счет нацеливания на ГМГ-КоА-редуктазу.
Ингибитор синтеза жирных кислот можно использовать отдельно или в сочетании из ингибиторов двух или более видов. Ингибитор утилизации жирных кислот можно использовать отдельно или в сочетании из ингибиторов двух или более видов. Ингибитор синтеза холестерина можно использовать отдельно или в сочетании из ингибиторов двух или более видов.
Удаляющее недифференцированные стволовые клетки средство может содержать ингибитор синтеза жирных кислот, либо два или более ингибиторов синтеза жирных кислот в сочетании. Удаляющее недифференцированные стволовые клетки средство может содержать один ингибитор утилизации жирных кислот, либо два или более ингибиторов утилизации жирных кислот в сочетании. Удаляющее недифференцированные стволовые клетки средство может содержать один, либо два или более ингибиторов синтеза холестерина в сочетании. Удаляющее недифференцированные стволовые клетки средство может содержать ингибиторы одного вида, либо двух или более видов в сочетании, выбранные из группы, состоящей из ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот и ингибитора синтеза холестерина.
Ингибитор синтеза жирных кислот по настоящему варианту осуществления может ингибировать синтез жирных кислот за счет нацеливания на синтазу жирных кислот. Примеры ингибитора синтеза жирных кислот, который ингибирует синтез жирных кислот за счет нацеливания на синтазу жирных кислот, включают орлистат, C75, флавоноид, эпигаллокатехин-3-галлат (ЭГКГ), и тому подобное, и предпочтительными являются орлистат и C75.
Можно использовать коммерчески доступные препараты орлистата и C75. Кроме того, при условии, что ингибитор синтеза жирных кислот по настоящему варианту осуществления обладает такой же функцией, как орлистат или C75, ингибитор синтеза жирных кислот может представлять собой соль или производное этих соединений.
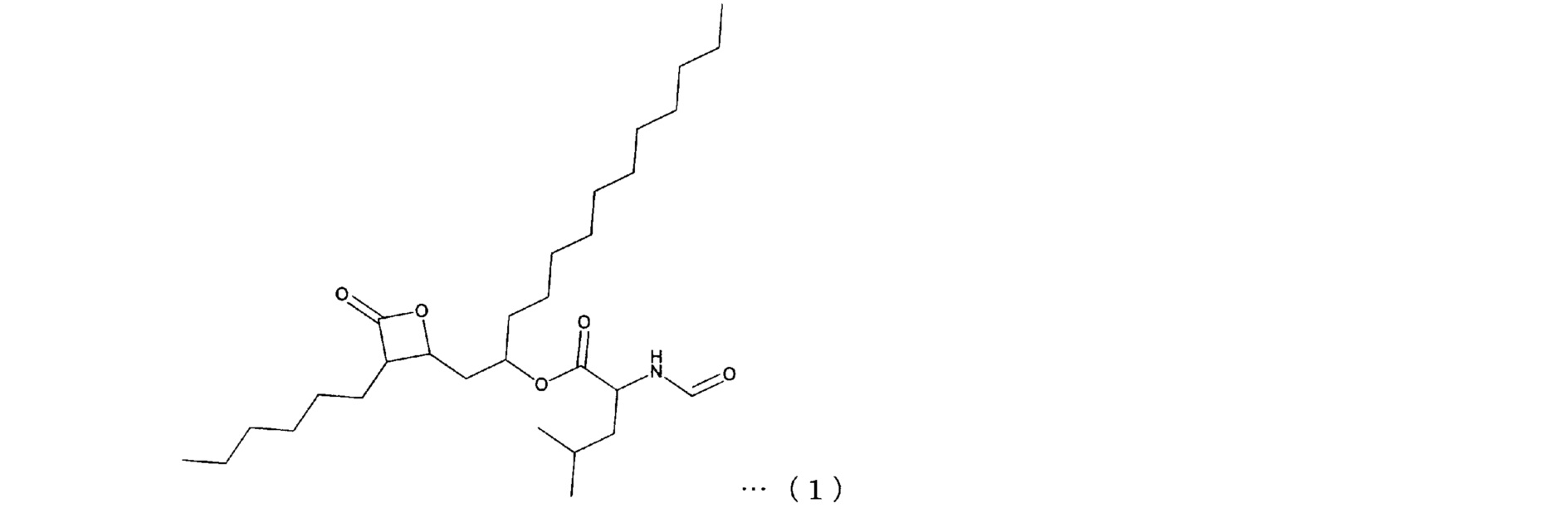
Орлистат известен как соединение, представленное формулой (1), (N-формил-L-лейцин-(1S)-1-[[(2S,3S)-3-гексил-4-оксо-2-оксетанил]метил]додециловый эфир).
C75 известен как соединение, представленное формулой (2), (тетрагидро-4-метилен-2R-октил-5-оксо-3S-фуранкарбоновая кислота).

Ингибитор синтеза жирных кислот по настоящему варианту осуществления может ингибировать синтез жирных кислот за счет нацеливания на АТФ-цитрат-лиазу. Предпочтительные примеры ингибитора синтеза жирных кислот, который ингибирует синтез жирных кислот за счет нацеливания на АТФ-цитрат-лиазу, включают LY294002 и SB204990. Можно использовать коммерчески доступные препараты LY294002 и SB204990. Кроме того, при условии, что ингибитор синтеза жирных кислот по настоящему варианту осуществления обладает такой же функцией, как LY294002 или SB204990, ингибитор синтеза жирных кислот может представлять собой соль или производное этих соединений.
Ингибитор деградации жирных кислот по настоящему варианту осуществления может ингибировать деградацию жирных кислот за счет нацеливания на карнитин-пальмитоилтрансферазу 1. Примеры ингибитора деградации жирных кислот, который ингибирует деградацию жирных кислот за счет нацеливания на карнитин-пальмитоилтрансферазу 1, включают этомоксир, пергексилин, ранолазин и тому подобное, и предпочтительными являются этомоксир и пергексилин. Можно использовать коммерчески доступные препараты этомоксир и пергексилин. Кроме того, при условии, что ингибитор синтеза жирных кислот по настоящему варианту осуществления обладает такой же функцией, как этомоксир или пергексилин, ингибитор синтеза жирных кислот может представлять собой соль или производное этих соединений.
Ингибитор синтеза жирных кислот по настоящему варианту осуществления может ингибировать синтез жирных кислот за счет нацеливания на ацетил-КоА-карбоксилазу. Примеры ингибитора синтеза жирных кислот, который ингибирует синтез жирных кислот за счет нацеливания на ацетил-КоА-карбоксилазу, включают сорафен A, TOFA, A769662, метформин, AICAR и тому подобные, и предпочтительными являются TOFA и A769662. Можно использовать коммерчески доступные препараты TOFA и A769662. Кроме того, при условии, что ингибитор синтеза жирных кислот по настоящему варианту осуществления обладает такой же функцией, как TOFA или A769662, ингибитор синтеза жирных кислот может представлять собой соль или производное этих соединений.
Ингибитор синтеза жирных кислот по настоящему варианту осуществления может ингибировать синтез жирных кислот за счет нацеливания на ацил-КоА-синтетазу. Примеры ингибитора синтеза жирных кислот, который ингибирует синтез жирных кислот за счет нацеливания на ацил-КоА-синтетазу, включают триасцин C, TZD и тому подобное.
Кроме того, SREBP известен как фактор транскрипции, который контролирует экспрессию АТФ-цитрат-лиазы, ацетил-КоА-карбоксилазы, синтазы жирных кислот, глицерин-3-фосфат-ацилтрансферазы, ацил-КоА-синтетазы и тому подобного. Ингибитор синтеза жирных кислот и/или ингибитор утилизации жирных кислот по варианту осуществления может ингибировать функцию SREBP, и примеры таких ингибиторов включают фатостатин, FGH110019 и тому подобное.
Ингибитор синтеза холестерина по настоящему варианту осуществления может ингибировать синтез холестерина за счет нацеливания на ГМГ-КоА-редуктазу. Примеры ингибитора синтеза холестерина, который ингибирует синтез холестерина за счет нацеливания на ГМГ-КоА-редуктазу, включают правастатин, симвастатин, флувастатин, аторвастатин, питавастатин, розувастатин, церивастатин, ловастатин, мевастатин и тому подобное. Предпочтительными являются правастатин, симвастатин, флувастатин, аторвастатин, питавастатин и розувастатин, и более предпочтительным является симвастатин. Можно использовать коммерчески доступные препараты правастатин, симвастатин, флувастатин, аторвастатин, питавастатин и розувастатин. Кроме того, при условии, что ингибитор синтеза холестерина по настоящему варианту осуществления обладает такой же функцией, как правастатин, симвастатин, флувастатин, аторвастатин, питавастатин или розувастатин, ингибитор синтеза холестерина может представлять собой соль или производное этих соединений.
Удаляющее недифференцированные стволовые клетки средство по варианту осуществления может содержать одно, либо два или более средств, выбранных из группы, состоящей из орлистата, C75, LY294002, SB204990, этомоксира, пергексилина и симвастатина, а также их солей.
В удаляющем недифференцированные стволовые клетки средстве по настоящему варианту осуществления концентрация ингибитора синтеза жирных кислот, содержащегося в среде применения, может составлять 0,1-500 мкМ. В настоящей спецификации термин «M» в качестве единиц измерения означает моль/л. Кроме того, в настоящей спецификации термин «в среде применения» означает в культуральной среде или в крови.
Кроме того, в удаляющем недифференцированные стволовые клетки средстве по настоящему варианту осуществления концентрация ингибитора утилизации жирных кислот, содержащегося в среде применения, может составлять 0,1-500 мкМ.
Кроме того, в удаляющем недифференцированные стволовые клетки средстве по настоящему варианту осуществления концентрация ингибитора синтеза жирных кислот, содержащегося в среде применения, может составлять 0,1-500 мкг/мл.
Кроме того, в удаляющем недифференцированные стволовые клетки средстве по настоящему варианту осуществления концентрация ингибитора утилизации жирных кислот, содержащегося в среде применения, может составлять 0,1-500 мкг/мл.
Кроме того, в удаляющем недифференцированные стволовые клетки средстве по настоящему варианту осуществления концентрация ингибитора синтеза холестерина, содержащегося в среде применения, может составлять 0,01-50 мкМ.
Кроме того, в удаляющем недифференцированные стволовые клетки средстве по настоящему варианту осуществления концентрация ингибитора синтеза холестерина, содержащегося в среде применения, может составлять 0,01-50 мкг/мл.
В случае, если ингибитор синтеза жирных кислот по настоящему варианту осуществления представляет собой орлистат, концентрация орлистата в среде применения предпочтительно составляет 0,1-500 мкМ, более предпочтительно 1-50 мкМ, и даже более предпочтительно 3-5 мкМ.
В случае, если ингибитор синтеза жирных кислот по настоящему варианту осуществления представляет собой C75, концентрация C75 в среде применения предпочтительно составляет 0,1-500 мкг/мл, более предпочтительно 1-100 мкг/мл, и даже более предпочтительно 5-50 мкг/мл.
В случае, если ингибитор синтеза жирных кислот по настоящему варианту осуществления представляет собой SB204990, концентрация SB204990 в среде применения предпочтительно составляет 0,1-500 мкМ, более предпочтительно 1-200 мкМ, и даже более предпочтительно 20-100 мкМ.
В случае, если ингибитор синтеза жирных кислот по настоящему варианту осуществления представляет собой LY294002, концентрация LY294002 в среде применения предпочтительно составляет 0,1-500 мкМ, более предпочтительно 1-200 мкМ, и даже более предпочтительно 20-100 мкМ.
В случае, если ингибитор деградации жирных кислот (ингибитор утилизации жирных кислот) по настоящему варианту осуществления представляет собой этомоксир, концентрация этомоксира в среде применения предпочтительно составляет 0,1-500 мкМ, более предпочтительно 1-200 мкМ, и даже более предпочтительно 20-100 мкМ.
В случае, если ингибитор деградации жирных кислот (ингибитор утилизации жирных кислот) по настоящему варианту осуществления представляет собой пергексилин, концентрация пергексилина в среде применения предпочтительно составляет 0,1-500 мкМ, более предпочтительно 1-100 мкМ, и даже более предпочтительно 5-50 мкМ.
В случае, если ингибитор синтеза холестерина по настоящему варианту осуществления представляет собой симвастатин, концентрация симвастатина в среде применения предпочтительно составляет 0,01-50 мкМ, более предпочтительно 0,1-30 мкМ, и даже более предпочтительно 0,1-10 мкМ.
В случае, если ингибитор синтеза жирных кислот по настоящему варианту осуществления приведен в контакт с недифференцированными стволовыми клетками, ингибитор синтеза жирных кислот включается в цитоплазму недифференцированных стволовых клеток и, в результате, полностью или частичного ингибирует любые реакции в пути синтеза жирных кислот, представленном на ФИГ. 1.
В случае, если ингибитор деградации жирных кислот по настоящему варианту осуществления приведен в контакт с недифференцированными стволовыми клетками, ингибитор деградации жирных кислот включается в цитоплазму и/или митохондрии недифференцированных стволовых клеток и, в результате, полностью или частичного ингибирует любые реакции в пути деградации жирных кислот, представленном на ФИГ. 1.
В случае, если ингибитор синтеза холестерина по настоящему варианту осуществления приведен в контакт с недифференцированными стволовыми клетками, ингибитор синтеза холестерина включается в цитоплазму недифференцированных стволовых клеток и, в результате, полностью или частичного ингибирует любые реакции в пути синтеза холестерина, представленном на ФИГ. 9.
При условии, что удаляющее недифференцированные стволовые клетки средство по настоящему варианту осуществления содержит по меньшей мере одно средство, выбранное из группы, состоящей из ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот и ингибитора синтеза холестерина, можно использовать любое удаляющее недифференцированные стволовые клетки средство. Удаляющее недифференцированные стволовые клетки средство по настоящему варианту осуществления может представлять собой любое удаляющее недифференцированные стволовые клетки средство при условии, что удаляющее недифференцированные стволовые клетки средство состоит из по меньшей мере одного средства, выбранного из группы, состоящей из ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот и ингибитора синтеза холестерина, и может содержать другие необязательные компоненты при условии включения средства, способного удалять недифференцированные стволовые клетки.
Другие компоненты не имеют конкретных ограничений, и примеры включают фармацевтически приемлемые носители, ускорители трансфекции, буферы, эксципиенты, стабилизаторы, антиоксиданты, регуляторы осмотического давления, регуляторы pH, хелатирующие агенты и тому подобное.
Форма удаляющего недифференцированные стволовые клетки средства по настоящему варианту осуществления не имеет конкретных ограничений, и средство может иметь разные формы, такие как жидкая субстанция, порошковая субстанция, гранулярная субстанция, гелеобразная субстанция и твердая субстанция. Кроме того, средство также может находиться в форме эмульсии, при этом ингибитор синтеза жирных кислот, ингибитор утилизации жирных кислот, ингибитор синтеза холестерина, или их сочетание, инкапсулирован в мицеллы; или находиться в форме липосом, при этом ингибитор синтеза жирных кислот, ингибитор утилизации жирных кислот, ингибитор синтеза холестерина, или их сочетание, инкапсулирован в липосомах.
Введение пациенту можно осуществлять парентерально или перорально способами, известными специалистам в данной области, например. Способы парентерального введения включают интраназальное введение, трансбронхиальное введение, внутримышечное введение, чрескожное введение и тому подобное, помимо внутриартериальной инъекции, внутривенной инъекции, подкожной инъекции и тому подобного. Доза варьируется в зависимости от массы тела и возраста пациента, способа введения, и тому подобного, однако специалисты в данной области могут соответствующим образом выбирать подходящую дозу.
Например, для пациента, которому проведена трансплантация ткани из дифференцированных клеток, индуцированных из недифференцированных стволовых клеток, можно проводить in vivo удаление недифференцированных стволовых клеток, оставшихся в ткани из дифференцированных клеток, путем введения удаляющего недифференцированные стволовые клетки средства по настоящему варианту осуществления. Соответственно, заболевания, вызываемые пролиферацией недифференцированных стволовых клеток, такие как раковое перерождение трансплантированной ткани, можно предотвращать или лечить.
Удаляющее недифференцированные стволовые клетки средство по настоящему варианту осуществления можно использовать в культуральной среде, в способе удаления недифференцированных стволовых клеток, в способе получения клеток для трансплантации, в фармацевтической композиции для лечения или предотвращения заболеваний, вызываемых пролиферацией недифференцированных стволовых клеток, в способе лечения или предотвращения заболеваний, вызываемых пролиферацией недифференцированных стволовых клеток, и тому подобном, как описано далее.
Недифференцированная стволовая клетка, которую предстоит удалять при помощи удаляющего недифференцированные стволовые клетки средства по настоящему варианту осуществления, не имеет конкретных ограничений, и предпочтительно представляет собой иПС клетку или ЭС клетку, и более предпочтительно иПС клетку.
Культуральная среда
В одном варианте осуществления настоящее изобретение относится к культуральной среде. Культуральная среда по настоящему варианту осуществления содержит удаляющее недифференцированные стволовые клетки средство по вышеуказанному варианту осуществления. Культуральная среда по настоящему варианту осуществления может быть использована для культивирования клеток. В настоящей спецификации термин «культивирование» означает размножение или наращивание клеток вне живого организма (индивидуума) и включает так называемые манипуляции с клетками in vitro. Термин «культуральная среда» относится к жидкой или твердой субстанции, обеспечивающей окружение для культивирования клеток.
Культуральная среда по настоящему варианту осуществления может представлять собой композицию, содержащую, например, необязательный компонент культуральной среды и по меньшей мере одно средство, выбранное из группы, состоящей из ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот и ингибитора синтеза холестерина (далее в настоящем документе называемое «ингибитор синтеза жирных кислот и тому подобное»). Культуральная среда по настоящему варианту осуществления представляет собой композицию, содержащую среду и ингибитор синтеза жирных кислот и тому подобное. Примеры среды включают воду, буферный раствор и тому подобное. Среда может растворять или диспергировать ингибитор синтеза жирных кислот и тому подобное. Компонент культуральной среды может содержать компонент, эффективный для роста клеток, и примеры таких компонентов включают различные компоненты, такие как аминокислоты, витамины, неорганические соли, сахариды и факторы роста. Кроме того, могут содержаться такие компоненты, как антибиотики, буферные растворы, хелатирующие агенты и индикатор феноловый красный.
Компоненты, оставшиеся после удаления ингибитора синтеза жирных кислот и тому подобного из культуральной среды по настоящему варианту осуществления, могут иметь такой же состав, как общепринятый раствор для культивирования клеток, используемый в данной области в качестве культуральной среды [например, культуральный раствор модифицированной по способу Дульбекко среды Игла (DMEM), культуральный раствор MEM (например, α-MEM, MEM [ССР Хэнкса]), культуральный раствор RPMI (например, RPMI 1640 и тому подобное), культуральный раствор F12, StemPro34, mTeSR1 и тому подобное]. Вышеуказанные компоненты могут иметь такой же состав, как общепринятый раствор для культивирования клеток, используемый в качестве культуральной среды для поддержания недифференцированных стволовых клеток [например, среда StemFit, mTeSR (зарегистрированная торговая марка), среда Essential 8 (зарегистрированная торговая марка), среда StemSure (зарегистрированная торговая марка) и тому подобное].
Концентрация ингибитора синтеза жирных кислот и тому подобного в культуральной среде по настоящему варианту осуществления может быть такой же, как концентрация ингибитора синтеза жирных кислот и тому подобного в среде применения вышеуказанного удаляющего недифференцированные стволовые клетки средства. При помощи культуральной среды по настоящему варианту осуществления, содержащей ингибитор синтеза жирных кислот и тому подобное в вышеуказанной концентрации, недифференцированные стволовые клетки могут быть эффективно удалены. Кроме того, если недифференцированные стволовые клетки и дифференцированные клетки присутствуют совместно, недифференцированные стволовые клетки могут быть удалены, при этом рост дифференцированных клеток сохраняется на хорошем уровне.
Культуральная среда по настоящему варианту осуществления предпочтительно не содержит жирную кислоту. Кроме того, культуральная среда предпочтительно не содержит предшественник синтеза жирных кислот (смотри ФИГ. 1), находящийся по ходу процесса после мишени используемого ингибитора синтеза жирных кислот, так что жирные кислоты не синтезируются. Кроме того, культуральная среда предпочтительно не содержит вещества, находящиеся по ходу процесса после мишени используемого ингибитора утилизации жирных кислот, так что жирные кислоты не утилизируются. Кроме того, культуральная среда по настоящему варианту осуществления предпочтительно не содержит холестерин. Кроме того, культуральная среда предпочтительно не содержит предшественник синтеза холестерина, находящийся по ходу процесса после мишени используемого ингибитора синтеза холестерина, так что холестерин не синтезируется.
Культуральная среда по настоящему варианту осуществления может содержать по меньшей мере одно соединение, выбранное из группы, состоящей из глюкозы, глутамина и метионина. При культивировании недифференцированных стволовых клеток в культуральной среде, не содержащей эти соединения, очевидно, что гибель недифференцированных стволовых клеток может быть индуцирована.
Однако поскольку культуральная среда по настоящему варианту осуществления содержит ингибитор синтеза жирных кислот и тому подобное, даже если культуральная среда содержит по меньшей мере одно соединение, выбранное из группы, состоящей из глюкозы, глутамина и метионина, способность к удалению недифференцированных стволовых клеток надлежащим образом проявляется. Кроме того, поскольку культуральная среда может содержать глюкозу, глутамин и метионин, ожидается, что для роста клеток будут созданы более благоприятные условия, чем в случае, если эти компоненты отсутствуют.
Кроме того, в другом аспекте настоящее изобретение относится к применению по меньшей мере одного средства, выбранного из группы, состоящей из ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот и ингибитора синтеза холестерина, в изготовлении удаляющего недифференцированные стволовые клетки средства.
Набор
В одном варианте осуществления настоящее изобретение относится к набору, включающему удаляющее недифференцированные стволовые клетки средство по вышеуказанному варианту осуществления.
Помимо удаляющего недифференцированные стволовые клетки средства по вышеуказанному варианту осуществления набор по настоящему варианту осуществления дополнительно включает реагенты, среды, приспособление для культивирования клеток, руководство пользователя, и тому подобное, для индукции дифференцированных клеток из недифференцированных стволовых клеток. Реагенты для индукции дифференцированных клеток могут быть соответствующим образом выбраны в зависимости от дифференцированных клеток, которые предстоит индуцировать. Примеры реагентов для индукции кардиомиоцитов включают, но без ограничения, деметилирующие средства для хромосомной ДНК, такие как деметилаза, 5-азацитидин и ДМСО; цитокины, такие как PDGF, фактор роста фибробластов 8 (FGF-8), эндотелин 1 (ET1), мидкин и остеогенный фактор 4 (BMP-4), а также G-CSF; молекулы адгезии, такие как желатин, ламинин, коллаген и фибронектин; витамины, такие как ретиноевая кислота; факторы транскрипции, такие как Nkx2.5/Csx, GATA4, MEF-2A, MEF-2B, MEF-2C, MEF-2D, dHAND, eHAND, TEF-1, TEF-3, TEF-5 и MesP1; внеклеточный матрикс, полученный из кардиомиоцитов; антагонисты BMP, такие как ноггин, хордин, фетуин, фоллистатин, склеростин, дан, цербер, гремлин и данте; и тому подобное. Кроме того, примеры сред включают, но без ограничения, культуральный раствор модифицированной по способу Дульбекко среды Игла (DMEM), культуральный раствор MEM (например, α-MEM, MEM [ССР Хэнкса]), культуральный раствор RPMI (например, RPMI 1640 и тому подобное), культуральный раствор F12, StemPro34, MTeSRI, среду StemFit, среду Essential 8, mTeSR, среду StemSure и тому подобное. Кроме того, примеры приспособления для культивирования клеток и тому подобного включают планшет для культивирования клеток и тому подобное, но без ограничения.
Набор по настоящему варианту осуществления может быть соответствующим образом использован в способе удаления недифференцированных стволовых клеток, который будет описан далее, и может дополнительно включать инструкции, поясняющие способ удаления недифференцированных стволовых клеток, и тому подобное. Способ удаления недифференцированных стволовых клеток можно с легкостью осуществлять в короткое время за счет объединения в наборе реагентов, инструкций и тому подобного, используемых в способе удаления недифференцированных стволовых клеток, с удаляющим недифференцированные стволовые клетки средством по вышеуказанному варианту осуществления.
Способ удаления недифференцированных стволовых клеток
В одном варианте осуществления настоящее изобретение относится к способу удаления недифференцированных стволовых клеток, включающему культивирование смеси клеток, содержащей недифференцированную стволовую клетку и дифференцированную клетку, в присутствии удаляющего недифференцированные стволовые клетки средства.
Удаляющее недифференцированные стволовые клетки средство, используемое в способе удаления недифференцированных стволовых клеток по настоящему варианту осуществления, представляет собой удаляющее недифференцированные стволовые клетки средство по вышеуказанному варианту осуществления.
В настоящей спецификации термин «смесь клеток» означает популяцию клеток, содержащую клетки двух или более видов. «Смесь клеток» может включать компоненты культуральной среды и тому подобное, в дополнение к клеткам двух или более видов. «Смесь клеток, содержащая недифференцированные стволовые клетки и дифференцированные клетки», включает одну или более недифференцированных стволовых клеток и одну или более дифференцированных клеток и, необязательно, может включать компоненты культуральной среды и тому подобное. Форма смеси клеток, содержащей недифференцированную стволовую клетку и дифференцированную клетку, не имеет конкретных ограничений, и смесь может находиться в агрегированном состоянии, диспергированном состоянии, состоянии прикрепления к культуральному контейнеру, состоянии прикрепления к адгезионному фактору, такому как внеклеточный матрикс, состоянии пласта, комковатом состоянии, в форме колонии, форме эмбриоидного тельца, форме агглютинированных клеток, форме ткани, форме органа, и тому подобное.
Когда недифференцированные стволовые клетки подвергают процедуре дифференциации и индукции, дифференцированные клетки индуцируются из недифференцированных стволовых клеток. Однако in vitro трудно индуцировать все недифференцированные стволовые клетки в дифференцированные клетки и, как правило, недифференцированные стволовые клетки сохраняются и, вследствие этого, образуется клеточная смесь из недифференцированных стволовых клеток и дифференцированных клеток. В способе по настоящему варианту осуществления только недифференцированные стволовые клетки могут быть избирательно удалены из такой клеточной смеси недифференцированных стволовых клеток и дифференцированных клеток. В способе по настоящему варианту осуществления смесь клеток, содержащая недифференцированные стволовые клетки и дифференцированные клетки, может представлять собой смесь, получаемую путем смешивания недифференцированных стволовых клеток и дифференцированных клеток.
В способе по настоящему варианту осуществления недифференцированная стволовая клетка не имеет конкретных ограничений, и предпочтительно представляет собой иПС клетку или ЭС клетку, и более предпочтительно иПС клетку.
В способе по настоящему варианту осуществления дифференцированная клетка не имеет конкретных ограничений, и предпочтительно представляет собой клетку, дифференцированную и индуцированную из недифференцированных стволовых клеток того же вида, что и совместно присутствующие недифференцированные стволовые клетки. До настоящего времени описано несколько способов дифференциации и индукции недифференцированных стволовых клеток в дифференцированные клетки, и дифференцированные клетки могут быть индуцированы с использованием этих известных способов.
Поскольку эффективность, с которой недифференцированные стволовые клетки в смеси клеток могут быть избирательно удалены, является более высокой, способ становится более предпочтительным. В случае, когда смесь клеток получают путем культивирования смеси клеток, содержащей недифференцированные стволовые клетки и дифференцированные клетки, в присутствии удаляющего недифференцированные стволовые клетки средства по вышеуказанному варианту осуществления, остаточная доля недифференцированных стволовых клеток, рассчитываемая по формуле: число недифференцированных стволовых клеток/(число недифференцированных стволовых клеток+число дифференцированных клеток) × 100, предпочтительно составляет менее 0,1%, более предпочтительно менее 0,01%, и даже более предпочтительно менее 0,001%. Мертвые клетки не включены в число клеток, описанное выше.
Недифференцированные стволовые клетки, сохраняющиеся в смеси клеток, могут быть обнаружены за счет того, что клетки, экспрессирующие различные маркеры, специфичные для недифференцированных стволовых клеток, представляют собой недифференцированные стволовые клетки. С учетом этого, вышеупомянутая остаточная доля недифференцированных стволовых клеток представляет собой долю, определяемую с учетом того, что клетки, экспрессирующие Oct3/4, представляют собой недифференцированные стволовые клетки, и путем обнаружения недифференцированных стволовых клеток, сохраняющихся в смеси клеток. В настоящем изобретении достаточно того, что клетки, демонстрирующие уровень экспрессии, эквивалентный уровню экспрессии Oct3/4 в недифференцированных стволовых клетках положительного контроля, определяют в качестве клеток, экспрессирующих Oct3/4, с использованием недифференцированных стволовых клеток, культивируемых в культуральной среде, не содержащей удаляющее недифференцированные стволовые клетки средство по вышеуказанному варианту осуществления, в качестве положительного контроля.
Примеры дифференцированных клеток могут включать кардиомиоциты, мышечные клетки, фибробласты, нервные клетки, иммуноциты (например, лимфоциты и тому подобное), сосудистые клетки; клетки глаза (например, клетки пигментного эпителия сетчатки и тому подобное), клетки крови (например, мегакариоциты, эритроциты и тому подобное), клетки других тканей, их клетки-предшественники и тому подобное. Среди них предпочтительными являются кардиомиоциты или фибробласты, и более предпочтительными являются кардиомиоциты.
В случае, если кардиомиоциты являются индуцированными из плюрипотентных стволовых клеток, очевидно, что клетки дифференцируются в кардиомиоциты через недифференцированную мезодерму, сердечную мезодерму (или предетерминированные кардиомиоциты) по мере прогрессирования дифференциации в кардиомиоциты. В настоящем документе термин «недифференцированная мезодерма» относится к стадии, на которой имеет место экспрессия белка брахиурии, специфического для недифференцированной мезодермы. В то же время термин «сердечная мезодерма (или предетерминированные кардиомиоциты)» означает клетки, в которых экспрессия белка, специфического для недифференцированной мезодермы, такого как белок брахиурии, имеет место, однако экспрессия белка, специфического для кардиомиоцитов, такого как Nkx2.5 и актинин, отсутствует в той же самой клетке, и клетка обладает способностью дифференцироваться исключительно в кардиомиоциты без необходимости добавления нового вещества в культуральный раствор. Кардиомиоцит означает клетку, выполняющую автономные сокращения. Кардиомиоциты экспрессируют такие маркеры, как Nkx2,5, GATA4 и актинин. В настоящей спецификации термин «кардиомиоцит» используется в качестве концепции, охватывающей кардиомиоциты и сердечную мезодерму (или предетерминированные кардиомиоциты).
Дифференциацию и индукцию из недифференцированных стволовых клеток в кардиомиоциты можно осуществлять способами, описанными, например, в международной PCT публикации № WO01/048151, международной PCT публикации № WO2005/033298, международной PCT публикации № WO2008/150030 и тому подобном. Например, дифференциацию и индукцию в кардиомиоциты можно осуществлять путем добавления вещества, инициирующего дифференциацию в кардиомиоциты, в культуральную среду для культивирования недифференцированных стволовых клеток.
Примеры таких веществ включают деметилирующие средства для хромосомной ДНК, такие как деметилаза, 5-азацитидин и ДМСО; цитокины, такие как PDGF, фактор роста фибробластов 8 (FGF-8), эндотелин 1 (ET1), мидкин и остеогенный фактор 4 (BMP-4), а также G-CSF; молекулы адгезии, такие как желатин, ламинин, коллаген и фибронектин; витамины, такие как ретиноевая кислота; факторы транскрипции, такие как Nkx2.5/Csx, GATA4, MEF-2A, MEF-2B, MEF-2C, MEF-2D, dHAND, eHAND, TEF-1, TEF-3, TEF-5 и MesP1; внеклеточный матрикс, полученный из кардиомиоцитов; антагонисты BMP, такие как ноггин, хордин, фетуин, фоллистатин, склеростин, дан, цербер, гремлин и данте; и тому подобное.
Фибробласт представляет собой клетку, обладающую способностью образовывать волокна. Являются ли клетки фибробластами, можно определять на основании свойств, характерных для фибробластов, таких как способность образовывать волокна, и на основании экспрессии различных маркеров. В качестве маркеров фибробластов известны такие маркеры, как виментин и ER-TR7, и можно определять клетки, положительные по данному маркеры, как фибробласты.
Способ по настоящему варианту осуществления включает этап культивирования смеси клеток, содержащей недифференцированные стволовые клетки и дифференцированные клетки, в присутствии удаляющего недифференцированные стволовые клетки средства. Этот этап можно выполнять путем добавления удаляющего недифференцированные стволовые клетки средства в культуральную среду для культивирования клеток, описанную выше, и культивирования смеси клеток. Альтернативно, удаляющее недифференцированные стволовые клетки средство можно добавлять в культуральную среду, в которой культивируют смесь клеток, содержащую недифференцированные стволовые клетки и дифференцированные клетки.
Количество удаляющего недифференцированные стволовые клетки средства, добавленное в культуральную среду, не имеет конкретных ограничений, однако составляет, например, 0,1-500 мкМ, 1-50 мкМ, 3-15 мкМ, и тому подобное, в качестве конечной концентрации при добавлении средства в культуральную среду.
Культивирование смеси клеток в присутствии удаляющего недифференцированные стволовые клетки средства можно осуществлять при температуре, обычно используемой при культивировании клеток. Например, температура при культивировании может составлять от 20°C до 40°C, предпочтительно от 25°C до 38°C, и более предпочтительно от 30°C до 37°C.
Время культивирования смеси клеток в присутствии удаляющего недифференцированные стволовые клетки средства не имеет конкретных ограничений, и предпочтительно составляет 24 часа или более, и более предпочтительно 48 часов или более. Клетки при необходимости можно субкультивировать. До и после субкультивирования состав культуральной среды может быть одним и тем же или разным при условии, что среда содержит удаляющее недифференцированные стволовые клетки средство.
Плотность клеток в смеси клеток в присутствии удаляющего недифференцированные стволовые клетки средства не имеет конкретных ограничений, и предпочтительно составляет 1×10-1×107 клеток/мл, более предпочтительно 1×103-1×106 клеток/мл, и даже более предпочтительно 1×104-1×106 клеток/мл.
В соответствии со способом по настоящему варианту осуществления смесь клеток, из которой недифференцированные стволовые клетки были удалены, имеет сниженное содержание недифференцированных стволовых клеток и состоит исключительно из дифференцированных клеток. Таким образом, в соответствии со способом удаления недифференцированных стволовых клеток по настоящему варианту осуществления можно получать смесь клеток, в которой недифференцированные стволовые клетки практически отсутствуют, или относительное содержание недифференцированных стволовых клеток снижено. Вследствие этого, смесь клеток, полученную способом по настоящему варианту осуществления, можно успешно использовать в качестве клеток для трансплантации в живой организм.
Кроме того, в другом аспекте настоящее изобретение относится к применению по меньшей мере одного средства, выбранного из группы, состоящей из ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот и ингибитора синтеза холестерина, для удаления недифференцированных стволовых клеток.
Способ получения клеток для трансплантации
В одном варианте осуществления настоящее изобретение относится к способу получения клеток для трансплантации, включающему следующие этапы (i) и (ii):
этап (i) индукции нужной дифференцированной клетки из недифференцированной стволовой клетки; и
этап (ii) культивирования смеси клеток, полученной на этапе (i), в присутствии удаляющего недифференцированные стволовые клетки средства.
Удаляющее недифференцированные стволовые клетки средство, используемое в способе получения клеток для трансплантации по настоящему варианту осуществления, представляет собой удаляющее недифференцированные стволовые клетки средство по вышеуказанному варианту осуществления.
Этап (i) в способе по настоящему варианту осуществления представляет собой этап индукции нужной дифференцированной клетки из недифференцированной стволовой клетки. Недифференцированная стволовая клетка на этапе (i) не имеет конкретных ограничений, и предпочтительно представляет собой иПС клетку или ЭС клетку, и более предпочтительно иПС клетку.
На этапе (i) тип дифференцированных клеток, индуцированных из недифференцированных стволовых клеток, не имеет конкретных ограничений при условии, что недифференцированные клетки индуцируются в нужные дифференцированные клетки. В качестве способа индукции недифференцированной стволовой клетки в дифференцированную клетку можно соответствующим образом выбирать и использовать известный способ в зависимости от целевой дифференцированной клетки. Примеры дифференцированных клеток, индуцированных из недифференцированных стволовых клеток, включают, но без ограничения, кардиомиоциты, мышечные клетки, фибробласты, нервные клетки, иммуноциты (например, лимфоциты и тому подобное), сосудистые клетки; клетки глаза (например, клетки пигментного эпителия сетчатки и тому подобное), клетки крови (например, мегакариоциты, эритроциты и тому подобное), клетки других тканей, их клетки-предшественники и тому подобное. Примеры подходящих дифференцированных клеток включают кардиомиоциты. Индукцию из недифференцированных стволовых клеток в кардиомиоциты можно осуществлять способом, описанным в вышеприведенном разделе «Способ удаления недифференцированных стволовых клеток».
Как правило, in vitro, поскольку сложно индуцировать все недифференцированные стволовые клетки в дифференцированные клетки, недифференцированные стволовые клетки обычно сохраняются в смеси клеток, полученной на этапе (i), и, таким образом, создается смесь недифференцированных стволовых клеток и дифференцированных клеток. Кроме того, смесь клеток может, необязательно, содержать компоненты культуральной среды и тому подобного. Форма смеси клеток, содержащей недифференцированную стволовую клетку и дифференцированную клетку, не имеет конкретных ограничений, и смесь может находиться в агрегированном состоянии, диспергированном состоянии, состоянии прикрепления к культуральному контейнеру, состоянии прикрепления к адгезионному фактору, такому как внеклеточный матрикс, состоянии пласта, комковатом состоянии, в форме колонии, форме эмбриоидного тельца, форме агглютинированных клеток, форме ткани, форме органа, и тому подобное.
Этап (ii) в способе получения по настоящему варианту осуществления представляет собой этап культивирования популяции клеток, полученной на этапе (i), в присутствии удаляющего недифференцированные стволовые клетки средства. Культивирование на данном этапе (ii) можно осуществлять способом, описанным в вышеприведенном разделе «Способ удаления недифференцированных стволовых клеток».
В способ получения по настоящему варианту осуществления можно добавлять другие этапы помимо вышеуказанных этапов (i) и (ii). Примеры других этапов включают этап очистки дифференцированных клеток, этап сбора дифференцированных клеток и тому подобное. В случае добавления этих этапов эти этапы выполняют между этапами (i) и (ii) или после этапа (ii).
На этапе очистки и этапе сбора дифференцированных клеток можно выбирать соответствующий способ в зависимости от типа дифференцированных клеток. Например, если дифференцированная клетка представляет собой кардиомиоцит, на этапе очистки можно использовать способы, описанные в международной PCT публикации № WO2006/022377, международной PCT публикации № WO2007/088874, международной PCT публикации № WO2016/010165 и тому подобном. Кроме того, на этапе сбора можно использовать способ разделения центрифугированием или тому подобный.
В клетках для трансплантации, полученных способом получения по настоящему варианту осуществления, относительное содержание дифференцированной клетки, определяемое по формуле дифференцированная клетка/(недифференцированная стволовая клетка+дифференцированная клетка) × 100, может составлять, например, 50% или более, 70% или более, 80% или более, 90% или более, или 95% или более. Мертвые клетки не включены в число клеток, описанное выше.
В клетках для трансплантации, полученных способом получения по настоящему варианту осуществления, поскольку недифференцированные стволовые клетки были избирательно удалены, относительное содержание недифференцированных стволовых клеток снижено. Вследствие этого, клетки для трансплантации состоят исключительно из дифференцированных клеток. Таким образом, в соответствии со способом получения по настоящему варианту осуществления можно получать клетки для трансплантации, в которых недифференцированные стволовые клетки практически отсутствуют, или относительное содержание недифференцированных стволовых клеток снижено. Вследствие этого, даже если клетки для трансплантации трансплантируют в живой организм, снижен риск образования тератомы и тому подобного.
Кроме того, в другом аспекте настоящее изобретение относится к применению по меньшей мере одного средства, выбранного из группы, состоящей из ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот и ингибитора синтеза холестерина, для получения клетки для трансплантации.
Кроме того, в другом аспекте настоящее изобретение относится к клеткам для трансплантации, полученным способом получения клеток для трансплантации, включающим следующие этапы (i) и (ii):
этап (i) индукции нужной дифференцированной клетки из недифференцированной стволовой клетки; и
этап (ii) культивирования смеси клеток, полученной на этапе (i), в присутствии удаляющего недифференцированные стволовые клетки средства.
Фармацевтическая композиция
В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции для лечения или предотвращения заболевания, вызываемого пролиферацией недифференцированной стволовой клетки, у субъекта, которому трансплантирована дифференцированная клетка, индуцированная из недифференцированной стволовой клетки, при этом фармацевтическая композиция содержит удаляющее недифференцированные стволовые клетки средство.
Удаляющее недифференцированные стволовые клетки средство, содержащееся в фармацевтической композиции по настоящему варианту осуществления, представляет собой такое же средство, как описанное в вышеприведенном разделе «Удаляющее недифференцированные стволовые клетки средство».
Субъект, которому трансплантируют дифференцированные клетки, индуцированные из недифференцированных стволовых клеток, не имеет конкретных ограничений, но может быть человеком или не являющимся человеком животным, которому необходима трансплантация дифференцированных клеток. Например, субъект может быть пациентом, у которого дифференцированная клетка не функционирует нормально, или пациентом, имеющим недостаточность или нарушение, или тому подобное, в ткани, содержащей дифференцированную клетку. Не являющееся человеком животное включает, но без ограничения, млекопитающих. Примеры млекопитающих включают приматов, таких как обезьяны; грызунов, таких как мыши и крысы; животных-компаньонов, таких как собаки и кошки; домашних животных, таких как коровы, лошади, овцы и свиньи; и тому подобное. Субъект, которому трансплантируют дифференцированную клетку, индуцированную из недифференцированной стволовой клетки, предпочтительно является представителем того же биологического вида, что и организм, от которого получена недифференцированная стволовая клетка, и более предпочтительно, является тем же индивидуумом, от которого получена недифференцированная стволовая клетка. Субъект, которому предстоит трансплантация дифференцированных клеток, индуцированных из недифференцированных стволовых клеток, может являться «субъектом, которому необходима трансплантация», описанным в разделе «Способы лечения и тому подобное», приведенном далее.
Содержание ингибитора синтеза жирных кислот и тому подобного в фармацевтической композиции по настоящему варианту осуществления не имеет конкретных ограничений, при условии, что количество представляет собой терапевтически эффективное количество, и в качестве примера можно использовать содержание, описанное в вышеуказанном разделе «Удаляющее недифференцированные стволовые клетки средство» и тому подобном.
Фармацевтическая композиция по настоящему варианту осуществления может содержать другие компоненты помимо удаляющего недифференцированные стволовые клетки средства. Другие компоненты не имеют конкретных ограничений, и в качестве примера можно использовать компоненты, описанные в вышеуказанном разделе «Удаляющее недифференцированные стволовые клетки средство» и тому подобном.
Кроме того, фармацевтическая композиция по настоящему варианту осуществления может содержать иммуностимулирующее средство, такое как адъювант, в дополнение к другим компонентам, описанным в вышеуказанном разделе «Удаляющее недифференцированные стволовые клетки средство». Примеры адъюванта включают, но без ограничения, фосфат алюминия, гидроксид алюминия, квасцы, холерный токсин, токсин Salmonella, неполный адъювант Фрейнда (НАФ), полный адъювант Фрейнда (ПАФ) ISCOMATRIX, GM-CSF, CpG, водно-масляную эмульсию, и тому подобное. Фармацевтическая композиция по настоящему варианту осуществления может содержать другие медицинские препараты, обладающие фармакологической активностью, помимо удаляющего недифференцированные стволовые клетки средства. Примеры других медицинских препаратов включают противовоспалительные средства, анальгетические средства, жаропонижающие средства, соединения, способные индуцировать иммунные реакции против недифференцированных стволовых клеток, и тому подобное.
Лекарственная форма фармацевтической композиции по настоящему варианту осуществления не имеет конкретных ограничений и может представлять собой разные лекарственные формы, например, жидкое средство, порошковое средство, гранулу, таблетку, порошок, суспензию, эмульсию, эмульсионный препарат и липосомный препарат.
Фармацевтическую композицию по настоящему варианту осуществления используют для лечения или предотвращения заболевания, вызываемого пролиферацией недифференцированной стволовой клетки, у субъекта, которому трансплантирована дифференцированная клетка, индуцированная из недифференцированной стволовой клетки. Как правило, поскольку сложно индуцировать все недифференцированные стволовые клетки в дифференцированные клетки in vitro, в некоторых случаях недифференцированные стволовые клетки могут сохраняться среди дифференцированных клеток, полученных в качестве клеток для трансплантации. В случае трансплантации недифференцированных стволовых клеток недифференцированные стволовые клетки пролиферируют в живом организме и могут вызывать такие заболевания, как тератома. Для лечения или предотвращения такого заболевания фармацевтическую композицию по настоящему варианту осуществления вводят субъекту, которому трансплантированы дифференцированные клетки. Заболевания, вызываемые пролиферацией недифференцированных стволовых клеток, не имеют конкретных ограничений, и их примеры включают тератому, рак и тому подобное.
Дифференцированная клетка, трансплантируемая субъекту, которому вводят фармацевтическую композицию по настоящему варианту осуществления, не имеет конкретных ограничений при условии, что она представляет собой дифференцированную клетку, индуцированную из недифференцированной стволовой клетки. Дифференцированные клетки предпочтительно индуцируют из иПС клеток или ЭС клеток, и более предпочтительно индуцируют из иПС клеток. В качестве примера, дифференцированные клетки представляют собой кардиомиоциты, индуцированные из иПС клеток. Кроме того, дифференцированные клетки могут представлять собой клетки для трансплантации, полученные способом, описанным в вышеуказанном разделе «Способ получения клеток для трансплантации».
Путь введения фармацевтической композиции по настоящему варианту осуществления можно соответствующим образом выбирать в зависимости от типа активных ингредиентов, формы препаратов, типа трансплантируемых дифференцированных клеток, зоны, в которую трансплантируют дифференцированные клетки, и тому подобного. Например, путь введения может быть таким же, как способ введения, описанный в вышеуказанном разделе «Удаляющее недифференцированные стволовые клетки средство».
Дозировку и интервал введения фармацевтической композиции по настоящему варианту осуществления можно соответствующим образом выбирать в зависимости от типа трансплантированной дифференцированной клетки, количества трансплантированных клеток, зоны трансплантации и тому подобного; возраста, пола, массы тела и тому подобного, субъекта, которому выполняют трансплантацию; способа введения фармацевтической композиции; и тому подобного. Доза может составлять, например, от 0,001 мг до 1000 мг, от 0,01 мг до 100 мг, от 0,1 мг до 30 мг, от 0,1 мг до 10 мг, от 0,5 мг до 5 мг, и тому подобное. Кроме того, интервал введения может быть следующим: от одного до нескольких раз в сутки, один раз в несколько дней или в несколько месяцев, и тому подобное. В качестве примера можно привести введение с интервалом один раз в сутки, один раз в неделю, или тому подобное.
За счет использования фармацевтической композиции по настоящему варианту осуществления можно осуществлять in vivo избирательное удаление недифференцированных стволовых клеток, даже в том случае, если недифференцированные стволовые клетки сохраняются среди клеток, трансплантированных в живой организм. Вследствие этого, заболевания, вызываемые пролиферацией недифференцированных стволовых клеток в живом организме, могут быть излечены или предотвращены.
В другом аспекте настоящее изобретение относится к применению по меньшей мере одного средства, выбранного из группы, состоящей из ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот и ингибитора синтеза холестерина, в получении фармацевтической композиции для лечения или предотвращения заболевания, вызываемого пролиферацией недифференцированной стволовой клетки, у субъекта, которому трансплантирована дифференцированная клетка, индуцированная из недифференцированной стволовой клетки.
Кроме того, в другом аспекте настоящее изобретение относится к применению по меньшей мере одного средства, выбранного из группы, состоящей из ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот и ингибитора синтеза холестерина, для лечения или предотвращения заболевания, вызываемого пролиферацией недифференцированной стволовой клетки у субъекта, которому трансплантирована дифференцированная клетка, индуцированная из недифференцированной стволовой клетки.
Кроме того, в другом аспекте настоящее изобретение относится к по меньшей мере одному средству, выбранному из группы, состоящей из ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот и ингибитора синтеза холестерина, используемому для лечения или предотвращения заболевания, вызываемого пролиферацией недифференцированной стволовой клетки, у субъекта, которому трансплантирована дифференцированная клетка, индуцированная из недифференцированной стволовой клетки.
Способ лечения и тому подобное
В одном варианте осуществления настоящее изобретение относится к способу лечения или предотвращения заболевания, вызываемого пролиферацией недифференцированной стволовой клетки, включающему введение удаляющего недифференцированные стволовые клетки средства субъекту, которому трансплантирована дифференцированная клетка, индуцированная из недифференцированной стволовой клетки.
Удаляющее недифференцированные стволовые клетки средство, вводимое субъекту в способе по настоящему варианту осуществления, является таким же средством, как описанное в вышеуказанном разделе «Удаляющее недифференцированные стволовые клетки средство». Способ по настоящему варианту осуществления представляет собой способ лечения или предотвращения заболевания, вызываемого пролиферацией недифференцированной стволовой клетки, включающий введение по меньшей мере одного средства, выбранного из группы, состоящей из ингибитора синтеза жирных кислот, ингибитора утилизации жирных кислот и ингибитора синтеза холестерина, субъекту, которому трансплантирована дифференцированная клетка, индуцированная из недифференцированной стволовой клетки.
Кроме того, субъект, которому трансплантированы дифференцированные клетки, индуцированные из недифференцированных стволовых клеток, является таким же субъектом, как описанный в вышеуказанном разделе «Фармацевтическая композиция». Удаляющее недифференцированные стволовые клетки средство можно вводить субъекту в форме фармацевтической композиции, описанной в вышеуказанном разделе «Фармацевтическая композиция». Кроме того, удаляющее недифференцированные стволовые клетки средство можно объединять с ингредиентами, отличными от ингибитора синтеза жирных кислот и тому подобного, для введения субъекту. Другие компоненты не имеют конкретных ограничений, и в качестве примера можно привести компоненты, описанные в вышеуказанных разделах «Удаляющее недифференцированные стволовые клетки средство» и «Фармацевтическая композиция».
Терапевтически эффективное количество ингибитора синтеза жирных кислот и тому подобного в удаляющем недифференцированные стволовые клетки средстве вводят субъекту, которому трансплантированы дифференцированные клетки, индуцированные из недифференцированных стволовых клеток. Терапевтически эффективное количество ингибитора синтеза жирных кислот и тому подобного варьируется в зависимости от типа трансплантированных дифференцированных клеток, количества трансплантированных клеток, зоны трансплантации и тому подобного; возраста, пола, массы тела и тому подобного, субъекта, которому выполняют трансплантацию; способа введения удаляющего недифференцированные стволовые клетки средства; и тому подобного. Количество активного ингредиента ингибитора синтеза жирных кислот и тому подобного может составлять, например, от 0,001 мг до 1000 мг, от 0,01 мг до 100 мг, от 0,1 мг до 30 мг, от 0,1 мг до 10 мг, от 0,5 мг до 5 мг, и тому подобное.
Субъект, которому осуществляют введение, и целевое заболевание могут быть такими же, как описанные в вышеуказанном разделе «Фармацевтическая композиция». Кроме того, способ введения может быть таким же, как описанный в вышеуказанном разделе «Фармацевтическая композиция».
Кроме того, в одном варианте осуществления настоящее изобретение относится к способу трансплантации клеток для трансплантации, включающему следующие этапы (i) - (iii):
этап (i) индукции нужной дифференцированной клетки из недифференцированной стволовой клетки;
этап (ii) культивирования смеси клеток, полученной на этапе (i), в присутствии удаляющего недифференцированные стволовые клетки средства с целью получения клеток для трансплантации; и
этап (iii) трансплантации клеток для трансплантации, полученных на этапе (iii), субъекту, который нуждается в трансплантации.
Этапы (i) и (ii) в способе трансплантации по настоящему варианту осуществления можно выполнять таким же образом, как этапы (i) и (ii), описанные в вышеуказанном разделе «Способ получения клеток для трансплантации». Кроме того, удаляющее недифференцированные стволовые клетки средство, используемое на этапе (ii) способа трансплантации по настоящему варианту осуществления, является таким же, как описанное в вышеуказанном разделе «Удаляющее недифференцированные стволовые клетки средство».
Этап (iii) в способе трансплантации по настоящему варианту осуществления представляет собой этап трансплантации клеток для трансплантации, полученных на этапе (ii), субъекту, который нуждается в трансплантации. «Субъект, который нуждается в трансплантации» является субъектом, у которого в организме возникли дефекты, повреждения или тому подобное в клетках того же типа, что и клетки для трансплантации, полученные на этапе (ii), и за счет трансплантации клеток для трансплантации ожидается, что симптомы, возникающие вследствие дефектов, повреждений или тому подобного в клетках, будут ослаблены. Трансплантацию можно выполнять обычным способом трансплантации клеток.
В способ трансплантации по настоящему варианту осуществления могут быть добавлены другие этапы помимо вышеуказанных этапов (i) - (iii). Примеры других этапов включают этап очистки дифференцированных клеток, этап сбора дифференцированных клеток и тому подобное. В случае добавления этих этапов эти этапы выполняют между этапами (ii) и (iii). Такой этап очистки и этап сбора клеток можно выполнять, как описано в разделе «Способ получения клеток для трансплантации».
В соответствии со способом трансплантации по настоящему варианту осуществления клетки для трансплантации, в которых недифференцированные стволовые клетки практически отсутствуют, или относительное содержание недифференцированных стволовых клеток снижено, можно трансплантировать в живой организм. Таким образом, снижен риск образования тератомы или тому подобного.
Кроме того, в способе трансплантации по настоящему варианту осуществления следующий этап (iv) можно дополнительно выполнять после этапа (iii).
Этап (iv) введения удаляющего недифференцированные стволовые клетки средства субъекту, которому трансплантированы клетки для трансплантации на этапе (iii).
Вышеуказанный этап (iv) можно выполнять таким же образом, как в способе лечения или предотвращения по вышеуказанному варианту осуществления. За счет выполнения этапа (iv), даже если недифференцированные стволовые клетки сохраняются в клетках для трансплантации, можно предотвращать развитие заболеваний, вызываемых пролиферацией недифференцированных стволовых клеток, например, тератом.
Далее настоящее изобретение будет описано с помощью примеров, однако настоящее изобретение не ограничено описанными далее примерами.
ПРИМЕРЫ
Клетки культивировали в инкубаторе в условиях 37°C и 5% CO2.
Культивирование недифференцированных стволовых клеток
Штамм H9, полученный из исследовательского института WiCell, использовали в качестве человеческих эмбриональных стволовых клеток, и человеческие индуцированные плюрипотентные стволовые клетки получали из национальной университетской корпорации от профессора Shinya Yamanaka в Исследовательском институте иПС клеток Университета Киото.
Человеческие эмбриональные стволовые клетки и человеческие индуцированные плюрипотентные стволовые клетки культивировали в условиях поддержания недифференцированного состояния, используя матригель (BD Bioscience каталожный № 354277). В качестве культурального раствора использовали mTeSR1 (STEMCELL Technologies Inc. каталожный № 11875-119). Помимо mTeSR1 можно использовать любой культуральный раствор для поддержания недифференцированного состояния клеток, как правило, используемый в качестве свободной от питающих клеток культуральной среды, например, среду Essential 8 (Life Technologies), TeSR2 (STEMCELL Technologies Inc.) и тому подобное. Кроме того, матрицы содержали витронектин (Life Technologies), iMatrix-511 (Takara № 892001), и тому подобное, помимо матригеля, и можно использовать любую матрицу при условии, что ее обычно используют в качестве свободной от питающих клеток матрицы.
После субкультивирования колонии человеческих эмбриональных стволовых клеток и индуцированных плюрипотентных стволовых клеток выделяли при помощи раствора CTK (Repro CELL) при 37°C в течение 5 минут. Для обработки клеточной дисперсии также можно использовать аккутазу StemPro (Life Technologies № 1110501) и TrypLE Express/Select (Life Technologies), помимо раствора CTK.
Индукция кардиомиоцитов из недифференцированных стволовых клеток
Для дифференциации и индукции из недифференцированных стволовых клеток в кардиомиоциты в данном эксперименте способ дифференциации и индукции кардиомиоцитов использовали следующим образом.
Для дифференциации и индукции в кардиомиоциты, когда человеческие эмбриональные стволовые клетки или человеческие индуцированные плюрипотентные стволовые клетки достигали уровня 50% - 90% конфлюэнтности, культуральную среду заменяли на культуральную среду, в которой 6 мкМ B27 (без инсулина, Invitrogen) и CHIR99021 (Selleckchemor Wako) были добавлены в среду RPMI (Invitrogen) (день 0).
В день 1 и день 2 проводили культивирование в среде RPMI/B27 инсулин(-).
Затем в дни 3-5 проводили культивирование в культуральной среде, в которой 5 мкМ IWP2 или 5 мкМ IWR-1 (Sigma I0161) были добавлены в среду RPMI/B27 инсулин(-).
После этого в день 6 и день 7 проводили культивирование в среде RPMI/B27 инсулин(-).
Кроме того, с дня 8 и далее проводили культивирование в среде RPMI/B27 инсулин(+) (Lian, X., et al., Nat Protocol, 2013, 8, 162-175). На этой стадии в дни 8-11 можно было убедиться в наличии сокращающихся кардиомиоцитов.
Индукция фибробластов из недифференцированных стволовых клеток
Для дифференциации и индукции из недифференцированных стволовых клеток в фибробласты в данном эксперименте способ дифференциации и индукции фибробластов использовали следующим образом.
Когда человеческие эмбриональные стволовые клетки или человеческие индуцированные плюрипотентные стволовые клетки достигали уровня 50% - 90% конфлюэнтности, культуральную среду заменяли на культуральный раствор (не содержащий bFGF), в котором 10% ЭБМ было добавлено в среду MEMα (Invitrogen) для культивирования. Культуральный раствор меняли каждые 2-4 дня. Таким образом, виментин-положительные фибробласты могли быть получены через примерно 10 дней (смотри Tohyama S, Cell Metabolism 2016).
Экспериментальный пример 1. Сравнение экспрессии СЖК в кардиомиоцитах, полученных из человеческих иПС клеток, и иПС клетках
Готовили смесь клеток в таком состоянии, что в ней совместно присутствовали кардиомиоциты, индуцированные из человеческих иПС клеток, и человеческие иПС клетки, способом, описанным выше. OCT4 использовали в качестве маркера недифференцированного состояния. Как показано на ФИГ. 1, СЖК представляет собой ферментный белок, вовлеченный в синтез жирных кислот. Клетки, экспрессирующие OCT4 и СЖК, обнаруживали путем иммунологического окрашивания смеси клеток. Результаты представлены на ФИГ. 2. Кроме того, совместно также показаны результаты окрашивания DAPI.
На основании результатов, представленных на ФИГ. 2, было установлено, что имело место перекрывание клеток, экспрессирующих OCT4 и СЖК. Исходя из вышеуказанного результата, было установлено, что экспрессия СЖК была низкой в кардиомиоцитах, полученных из человеческих иПС клеток, которые не экспрессируют OCT4, в то время как экспрессия СЖК была очень высокой в недифференцированных человеческих иПС клетках, экспрессирующих OCT4.
Экспериментальный пример 2. Культивирование различных линейных недифференцированных стволовых клеток в культуральной среде, содержащей ингибитор синтеза жирных кислот
Орлистат (производства Sigma, O4139) добавляли в среду StemFit (производства AJINOMOTO) или mTeSR1 (производства Stem Cell Technologies) до достижения в каждом случае конечной концентрации, указанной на ФИГ. 3 (2 мкМ, 4 мкМ, 6 мкМ, 8 мкМ и 10 мкМ). Таким образом получали культуральную среду по одному из вариантов осуществления настоящего изобретения. Следующие три линии клеток культивировали в течение 72 часов в каждой из культуральных сред, не содержащих орлистат (0 мкМ), и культуральных сред, содержащих орлистат в каждой из вышеуказанных конечных концентраций.
253G4: линия человеческих индуцированных плюрипотентных стволовых клеток (человеческих иПС клеток)
Ffl14: линия человеческих индуцированных плюрипотентных стволовых клеток (человеческих иПС клеток)
H9: линия человеческих эмбриональных стволовых клеток (человеческих ЭС клеток).
Для определения активности щелочной фосфатазы (ЩФ), которую имеют клетки, через 72 часа культивирования проводили цветовое окрашивание на ЩФ с помощью набора StemTAG (зарегистрированная торговая марка) для окрашивания на щелочную фосфатазу (Sigma 86-R), и клетки, окрашенные в красный цвет, считали живыми клетками. Изображение лунок приведено на ФИГ. 3.
На основании результатов, представленных на ФИГ. 3, было подтверждено, что клеточная гибель в каждой линии недифференцированных стволовых клеток была индуцирована зависимым от концентрации орлистата образом при культивировании в культуральной среде, содержащей орлистат.
Экспериментальный пример 3. Культивирование линейных недифференцированных стволовых клеток в культуральной среде, содержащей различные ингибиторы синтеза жирных кислот или ингибиторы утилизации жирных кислот.
Каждый из шести видов ингибиторов синтеза жирных кислот или ингибиторов утилизации жирных кислоты, приведенных ниже, добавляли в среду StemFit (производства AJINOMOTO CO., LTD.) или среду mTeSR1 (производства Stem Cell Technologies, Inc.) до достижения в каждом случае конечной концентрации, указанной на ФИГ. 4. Таким образом получали культуральную среду по одному из вариантов осуществления настоящего изобретения.
C75: ингибирование СЖК
LY 294002: ингибирование АЦЛ
SB 204990: ингибирование АЦЛ
Этомоксир: ингибирование КПТ1
Пергексилин: ингибирование КПТ1
Клетки 253G4 культивировали в течение 72 часов в каждой из культуральных сред, содержащих вышеуказанные ингибиторы синтеза жирных кислот или ингибиторы утилизации жирных кислот.
Через 72 часа культивирования проводили окрашивание на ЩФ, и клетки, окрашенные в красный цвет, считали живыми клетками. Изображение лунок приведено на ФИГ. 4.
На основании результатов, представленных на ФИГ. 4, было подтверждено, что при культивировании в культуральной среде, содержащей любой из вышеуказанных ингибиторов синтеза жирных кислот или ингибиторов утилизации жирных кислот, клеточная гибель недифференцированных стволовых клеток была индуцирована зависимым от концентрации ингибитора синтеза жирных кислот или ингибитора утилизации жирных кислот образом.
Экспериментальный пример 4. Культивирование очищенных и обогащенных кардиомиоцитов в культуральной среде, содержащей ингибитор синтеза жирных кислот.
Смесь клеток, содержащую кардиомиоциты, индуцированные из человеческих иПС клеток, и человеческие иПС клетки, получали способом, описанным выше. Следуя способу, описанному в литературе (Tohyama, et al., (2016) Cell Metabolism, 23, 663-674.), вышеуказанную смесь клеток культивировали в течение примерно 5 дней в глюкоза(-) глутамин(-) культуральной среде с добавлением молочной кислоты, чтобы убить клетки, отличные от кардиомиоцитов. Таким образом получали очищенные и обогащенные кардиомиоциты. Затем проводили культивирование в течение 16 дней в культуральной среде MEMα+10% ЭБС (орлистат(+)), содержащей орлистат в конечной концентрации 10 мкМ. В качестве контроля аналогичным образом проводили культивирование в культуральной среде MEMα+10% ЭБС (орлистат(-)), не содержащей орлистат. Состояние кардиомиоцитов в день 9 и день 16 показано на ФИГ. 5.
На основании результатов, представленных на ФИГ. 5, созревание (удлинение) кардиомиоцитов было подтверждено в период времени от дня 9 до дня 16, и было показано, что очищенные и обогащенные кардиомиоциты могут быть успешно культивированы с использованием культуральной среды по настоящему варианту осуществления.
Экспериментальный пример 5. Культивирование фибробластов в культуральной среде, содержащей ингибитор синтеза жирных кислот.
Смесь клеток, содержащую фибробласты, индуцированные из человеческих иПС клеток, и человеческие иПС клетки, получали способом, описанным выше. Затем смесь клеток культивировали в течение 9 дней в культуральной среде MEMα+10% ЭБС (орлистат(+)), содержащей орлистат в конечной концентрации 10 мкМ. В качестве контроля смесь клеток культивировали аналогичным образом в культуральной среде MEMα+10% ЭБС (орлистат(-)), не содержащей орлистат. Изображение кардиомиоцитов в день 9 и результаты их окрашивания виментином представлены на ФИГ. 6.
На основании результатов, представленных на ФИГ. 6, было показано, что фибробласты, полученные из человеческих иПС клеток, могут быть успешно культивированы с использованием культуральной среды по одному из вариантов осуществления настоящего изобретения.
Экспериментальный пример 6. Культивирование смеси клеток, содержащей кардиомиоциты, полученные из человеческих иПС клеток, и иПС клетки, в культуральной среде, содержащей ингибитор синтеза жирных кислот.
Смесь клеток в таком состоянии, что в ней совместно присутствовали очищенные и обогащенные кардиомиоциты, индуцированные из человеческих иПС клеток, и человеческие иПС клетки, получали способом, описанным выше. В смеси клеток проводили иммунологическое окрашивание на OCT4. Смесь клеток культивировали в течение 72 часов в среде StemFit (производства AJINOMOTO) или mTeSR1 (производства Stem Cell Technologies), содержащих орлистат в конечной концентрации 10 мкМ (орлистат(+)). В качестве контроля аналогичным образом проводили культивирование в среде StemFit (производства AJINOMOTO) или mTeSR1 (производства Stem Cell Technologies), не содержащих орлистат (орлистат(-)). После культивирования в течение 72 часов клетки, экспрессирующие OCT4, обнаруживали путем иммунологического окрашивания. Результаты двукратно повторенных тестов представлены на ФИГ. 7. Кроме того, совместно также показаны результаты окрашивания DAPI. Результаты трехкратно повторенных тестов, в которых подсчитывали количество колоний клеток, экспрессирующих Oct4, представлены на ФИГ. 8.
На основании результатов, представленных на ФИГ. 7 и 8, было подтверждено, что недифференцированные стволовые клетки, экспрессирующие OCT4, сохранялись, если культивирование проводили в культуральной среде, не содержащей орлистат (орлистат(-)). С другой стороны, если культивирование проводили в культуральной среде, содержащей орлистат (орлистат(+)), не были обнаружены остаточные недифференцированные стволовые клетки, экспрессирующие OCT4.
Исходя из этих результатов, путем культивирования смеси клеток, находящейся в состоянии, в котором совместно присутствуют кардиомиоциты, полученные из человеческих иПС клеток, и человеческие иПС клетки, с удаляющим недифференцированные стволовые клетки средством по одному из вариантов осуществления настоящего изобретения можно специфически индуцировать гибель клеток, находящихся в недифференцированном состоянии, в смеси клеток. Кроме того, показано, что только клетки в дифференцированном состоянии, включающие кардиомиоциты, полученные из человеческих иПС клеток, могут быть селективно отобраны из смеси клеток.
В экспериментальном примере 6 клетки, обладающие свойствами недифференцированных стволовых клеток, были исключены из полученной смеси клеток. Таким образом, степень удаления недифференцированных стволовых клеток также была очень высокой. Смесь клеток предположительно будет использована в таких вариантах применения, как трансплантация в живой организм, и является чрезвычайно и исключительно полезной.
Экспериментальный пример 7. Сравнение экспрессии СЖК в кардиомиоцитах, полученных из человеческих иПС клеток, и иПС клетках.
Получали смесь клеток, в которой совместно присутствовали кардиомиоциты, индуцированные из человеческих иПС клеток, и человеческие иПС клетки, способом, описанным выше. Тропонин I (TnI) использовали в качестве маркера кардиомиоцитов. Как показано на ФИГ. 1, СЖК представляет собой ферментный белок, вовлеченный в синтез жирных кислот. Клетки, экспрессирующие TnI и СЖК, обнаруживали путем иммунологического окрашивания смеси клеток. Результаты представлены на ФИГ. 10. Кроме того, совместно также представлены результаты окрашивания DAPI.
На основании результатов, представленных на ФИГ. 10, было обнаружено, что отсутствует перекрывание клеток, экспрессирующих TnI и СЖК. Исходя из вышеуказанного результата, было установлено, что экспрессия СЖК была низкой в кардиомиоцитах, полученных из человеческих иПС клеток, которые экспрессируют TnI, при этом экспрессия СЖК была очень высокой в недифференцированных человеческих иПС клетках, которые не экспрессируют TnI.
Кроме того, экспрессия СЖК в кардиомиоцитах, индуцированных из человеческих иПС клеток (253G4), и человеческих иПС клетках была подтверждена методом вестерн-блоттинга с использованием анти-СЖК антитела. В качестве отрицательного контроля использовали человеческие фибробласты кожи (ЧФК). Результаты представлены на ФИГ. 11.
На основании результатов, представленных на ФИГ. 11, было показано, что СЖК отсутствовала в кардиомиоцитах, полученных из человеческих иПС клеток, и СЖК экспрессировалась на высоком уровне в человеческих иПС клетках.
Экспериментальный пример 8. Культивирование линейных недифференцированных стволовых клеток в культуральной среде, содержащей ингибитор синтеза холестерина
Симвастатин (S6196: производства Sigma Aldrich) добавляли в среду StemFit (производства AJINOMOTO) или среду mTeSR1 (производства Stem Cell Technologies) до достижения в каждом случае конечной концентрации, указанной на ФИГ. 12 (0,125 мкМ, 0,25 мкМ, 0,5 мкМ, 1 мкМ и 2 мкМ). Таким образом получали культуральную среду по одному из вариантов осуществления настоящего изобретения.
Клетки 253G4 культивировали в течение 72 часов в культуральной среде, не содержащей симвастатин (0 мкМ), и в среде, содержащей симвастатин в каждой из вышеуказанных конечных концентраций.
Через 72 часа культивирования проводили окрашивание на ЩФ, и клетки, окрашенные в красный цвет, считали живыми клетками. Изображение лунок приведено на ФИГ. 12.
На основании результатов, представленных на ФИГ. 12, было подтверждено, что клеточная гибель недифференцированных стволовых клеток также была индуцирована зависимым от концентрации симвастатина образом при культивировании в культуральной среде, содержащей симвастатин.
Экспериментальный пример 9. Культивирование линейных недифференцированных стволовых клеток в культуральной среде, содержащей ингибитор синтеза жирных кислот и пальмитиновую кислоту.
Орлистат (производства Sigma, O4139) добавляли в среду StemFit (производства AJINOMOTO) или mTeSR1 (производства Stem Cell Technologies) до достижения в каждом случае конечной концентрации, указанной на ФИГ. 13 (2 мкМ, 6 мкМ и 8 мкМ). Таким образом получали культуральную среду по одному из вариантов осуществления настоящего изобретения. Готовили среды, полученные путем добавления пальмитиновой кислоты (конечная концентрация 50 мкМ), карнитина (конечная концентрация 0,5 мМ) и БСА (конечная концентрация 8,3 мкМ) в каждую из культуральных сред, не содержащих орлистат (0 мкМ), и в культуральные среды, содержащие орлистат в вышеуказанных конечных концентрациях; а также среды, полученные путем добавления только карнитина (конечная концентрация 0,5 мМ) и БСА (конечная концентрация 8,3 мкМ). Линейные человеческие иПС клетки (253G4) культивировали в течение 72 часов в каждой из вышеуказанных сред.
Через 72 часа культивирования живые клетки обнаруживали при помощи набора для анализа живых/мертвых клеток (L3224, производства Thermo Fisher Scientific). Изображение лунок приведено на ФИГ. 13. Кроме того, результаты подсчета количества жизнеспособных клеток на основании тех же данных, представлены на ФИГ. 14.
На основании результатов, представленных на ФИГ. 13 и 14, было подтверждено, что клеточная гибель человеческих иПС клеток была индуцирована зависимым от концентрации орлистата образом при культивировании в культуральной среде (БСА), в которую добавляли только карнитин и БСА помимо орлистата. С другой стороны, было подтверждено, что клеточная гибель человеческих иПС клеток была подавлена при культивировании в культуральной среде (ПК-БСА), в которую были добавлены пальмитиновая кислота, карнитин и БСА помимо орлистата. На основании того факта, что клеточная гибель человеческих иПС клеток была подавлена в результате добавления пальмитиновой кислоты, которая представляет собой жирную кислоту, было подтверждено, что индукция клеточной гибели человеческих иПС клеток орлистатом являлась следствием ингибирования синтеза жирных кислот.
Экспериментальный пример 10. Культивирование линейных недифференцированных стволовых клеток с нокдауном СЖК.
Линейные недифференцированные стволовые клетки с нокдауном СЖК (линейные недифференцированные стволовые клетки СЖК-НД) получали путем введения киРНК (СЖК киРНК) против СЖК в линейные человеческие иПС клетки (253G4). Кроме того, получали линейные недифференцированные стволовые клетки, в которые была введена киРНК отрицательного контроля (О/К), в качестве линии отрицательного контроля (линейные недифференцированные стволовые клетки О/К). Результаты подтверждения экспрессии СЖК в линейных недифференцированных стволовых клетках СЖК-НД и линейных недифференцированных стволовых клетках О/К методом вестерн-блоттинга с использованием анти-СЖК антитела представлены на ФИГ. 15. На основании результатов, представленных на ФИГ. 15, было подтверждено, что возможно подавление экспрессии СЖК путем введения в клетки СЖК киРНК. Используемые киРНК были следующими.
СЖК киРНК: Applied Biosystems (зарегистрированная торговая марка), киРНК ID: s5030 (производства Thermo Fisher Scientific)
О/К киРНК: Silencer™ Отрицательный контроль № 1 киРНК (AM 4611: производства Thermo Fisher Scientific).
Вышеуказанные линейные недифференцированные стволовые клетки СЖК-НД и линейные недифференцированные стволовые клетки О/К культивировали в течение 72 часов в среде StemFit (производства AJINOMOTO) или mTeSR1 (производства Stem Cell Technologies) для подтверждения пролиферации клеток. Результаты представлены на ФИГ. 16.
На основании результатов, представленных на ФИГ. 16, было подтверждено, что пролиферация клеток была подавлена в линейных недифференцированных стволовых клетках СЖК-НД в сравнении с линейными недифференцированными стволовыми клетками О/К. На основании данного результата было показано, что СЖК является ключевым фактором для выживания и пролиферации недифференцированных стволовых клеток.
Экспериментальный пример 11. Кислотное культивирование линейных недифференцированных стволовых клеток СЖК-НД в культуральной среде, содержащей пальмитиновую кислоту.
Получали среды (среды ПК-БСА) путем добавления пальмитиновой кислоты (конечная концентрация 50 мкМ), карнитина (конечная концентрация 0,5 мМ) и БСА (конечная концентрация 8,3 мкМ) в среду StemFit (производства AJINOMOTO) или mTeSR1 (производства Stem Cell Technologies); и получали среды (среды БСА) путем добавления только карнитина (конечная концентрация 0,5 мМ) и БСА (конечная концентрация 8,3 мкМ) в указанные среды. Линейные недифференцированные стволовые клетки СЖК-НД и линейные недифференцированные стволовые клетки О/К, полученные в экспериментальном примере 11, культивировали в каждой из вышеуказанных культуральных сред в течение 72 часов для подтверждения пролиферации клеток. Результаты представлены на ФИГ. 17.
На основании результатов, представленных на ФИГ. 17, было установлено, что линейные недифференцированные стволовые клетки СЖК-НД, культивируемые в культуральной среде ПК-БСА (СЖК-НД с/ПК-БСА), линейные недифференцированные стволовые клетки О/К, культивируемые в культуральной среде БСА-ПК (О/К с/ПК-БСА), и линейные недифференцированные стволовые клетки О/К, культивируемые в культуральной среде БСА (О/К с/БСА), демонстрировали одинаковые уровни пролиферации клеток. С другой стороны, пролиферация клеток была подавлена в линейных недифференцированных стволовых клетках СЖК-НД, культивируемых в культуральной среде БСА, в сравнении с указанными тремя линиями клеток. На основании этих результатов было показано, что пальмитиновая кислота, синтезируемая с участием СЖК, является ключевым компонентом для выживания и пролиферации недифференцированных стволовых клеток.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Удаляющее недифференцированные стволовые клетки средство по настоящему изобретению, способное удалять недифференцированные стволовые клетки с высокой эффективностью, способ удаления недифференцированных стволовых клеток, и тому подобное, могут быть предоставлены и могут быть широко использованы в области технологий регенеративной медицины, и тому подобного.
Реферат
Изобретение относится к области биотехнологии, а именно к удалению недифференцированных стволовых клеток, удаляющему недифференцированные стволовые клетки средству и культуральной среде на его основе. Способ включает культивирование смеси клеток, содержащей недифференцированную стволовую клетку и дифференцированную клетку, в присутствии удаляющего недифференцированные стволовые клетки средства, содержащего по меньшей мере одно средство, выбранное из группы, состоящей из ингибитора синтеза жирных кислот, который ингибирует синтез жирных кислот за счет нацеливания на по меньшей мере один фактор, выбранный из группы, состоящей из АТФ-цитрат-лиазы, синтазы жирных кислот, ацетил-КоА-карбоксилазы и малонил-КоА декарбоксилазы в концентарции 2-500 мкМ, ингибитора утилизации жирных кислот в концентрации 6-500 мкМ и ингибитора синтеза холестерина в концентрации 0,125-50 мкМ. Средство может содержать одно, два или более средств, выбранных из группы, состоящей из орлистата, C75, LY294002 или их солей в концентрации 2-500 мкм, SB204990, этомоксира или его соли в концентрации 12,5-500 мкМ, пергексилина или его соли в концентрации 2-500 мкМ и симвастатина или его соли в концентрации 0,125-50 мкМ. Изобретение позволяет расширить арсенал технических средств. 5 н. и 7 з.п. ф-лы, 17 ил., 11 пр.

Комментарии