Стерилизация s-нитрозотиолов - RU2754297C2
Код документа: RU2754297C2
Чертежи



Описание
Область изобретения
Данное изобретение относится к стерильным S-нитрозотиолам и стерильным фармацевтическим пре-композициям, содержащим S-нитрозотиолы, из которых могут быть приготовлены стерильные фармацевтические композиции с одним или более стерильными фармацевтическими разбавителями, эксципиентами, носителями, дополнительными активными агентами или любой их комбинацией, по желанию, для фармацевтического или ветеринарного применения. Данное изобретение также относится к способу получения стерильных веществ без существенной потери чистоты S-нитрозотиолов, а также к наборам и способам получения готовых к применению фармацевтических композиций.
Предшествующий уровень техники
S-нитрозотиолы, в частности молекулы, имеющие основную структуру R-S-N=O, где R представляет собой любую органическую группу, например, S-нитрозоглутатион (GSNO), S-NO-цистеин (S-NO-Cys), S-нитрозо-N-ацетилпеницилламин (SNAP) и нитрозо-производные белков, таких как альбумин и гемоглобин (Hb), например, SNO-альбумин и поли-SNO-альбумин, in vivo проявляют активность, подобную оксиду азота. Они вызывают расслабление гладкой мускулатуры артерий и вен, ингибируют агрегацию тромбоцитов и активируют гуанилатциклазу (Rees et al., 1989b; Rees et al., 1989a), (Rees et al., 2001), (Radomski et al., 1992). Они также задействованы, например, в иммуносупрессии, нейротрансмиссии и защитных механизмах.
Известно, что вазоактивные S-нитрозотиолы получают in vivo (Keaney et al., 1993), (Stamler et al., 1992), (Al-Sa'doni et al., 2000). Приводится общее содержание S-нитрозотиолов в плазме человека и грызунов, варьирующее от 40 нМ до 7 мкМ в отсутствие воспаления (Stamler et al., 1992). При необходимости S-нитрозотиольные соединения могут высвобождать оксид азота при реакциях с ионами переходных металлов или другими восстанавливающими агентами. Их рассматривают как буферные системы, регулирующие внутри- и межклеточное действие NO и увеличивающие диапазон его действия. Однажды образовавшись, S-нитрозотиолы могут непосредственно переносить нитрозил-катион (NO+) на другой тиол при т.н. реакции перенитрозирования, что обеспечивает динамическое состояние S-нитрозотиолов in vivo (Singh et al., 1996a; Singh et al., 1996b), (Butler et al., 1997).
Проводят клинические исследования S-нитрозоглутатиона (GSNO)

в качестве фармацевтической композиции для терапии или профилактики у людей и животных.
S-нитрозотиолы чувствительны к воздушной среде, температуре, влажности и электромагнитному излучению и требуют бережного хранения и обращения во избежание деградации (Singh et al., 1995), (Stamler et al., 2002), (Manoj et al., 2009), (Parent et al., 2013). Тем не менее, даже при строгом контроле воздушной среды, излучения и температуры, длительное хранение S-нитрозотиолов, которое требуется для фармацевтических продуктов, приводит к деградации. Указанная нестабильность представляет серьезные проблемы для фармацевтического применения, касающиеся чистоты активного агента и соответствия фармацевтической степени чистоты, а также аккуратности и предсказуемости дозирования активного агента. Согласно опубликованным данным, при хранении в инертной атмосфере (аргон и азот) при -20°С в темноте, S-нитрозоглутатион в виде твердого вещества стабилен только в течение 6 месяцев (Parent et al., 2013). Согласно опубликованным данным, при хранении в условиях дополнительного контроля воздушной среды, излучения и температуры S-нитрозоглутатион, полученный определенным способом, который, как утверждается, придает стабильность твердой форме, остается стабильным в течение всего 9 месяцев (Looker et al., 2008); (WO 2008/153762, Пример 3 ссылки).
Жидкие композиции S-нитрозотиолов еще более нестабильны и подвергаются количественному разложению в течение нескольких часов, так что через 8-12 часов хранения при температуре от 4°С до 25°С остается только приблизительно 85% исходного S-нитрозоглутатиона (Looker et al., 2008); (WO 2008/153762).
Несмотря на то, что S-нитрозотиолы, например, S-нитрозоглутатион, являются привлекательными для лечения различных заболеваний, твердые пероральные дозированные композиции являются неподходящими, поскольку они быстро распадаются в физиологических условиях и не способны обеспечивать продолжительную или регулируемую доставку достаточного количества активной группировки, NO, к необходимому участку. Растворы для парентеральных инъекций обеспечивают удобную форму введения, а непрерывная инфузия позволяет достаточным количествам S-нитрозотиолов быстро достигать целевого участка в течение длительных периодов времени и регулируемым образом. Чрезвычайно лабильная природа S-нитрозотиолов, таких как S-нитрозоглутатион, в растворе не позволяет получать композиции в виде «готовых жидких лекарственных форм». Таким образом, необходимо готовить раствор непосредственно перед введением (ex tempore) из частиц сухого твердого S-нитрозотиола.
Парентеральные лекарственные формы отличаются от всех остальных лекарственных форм тем, что они должны быть стерильными (отсутствие жизнеспособных микроорганизмов) и свободными от физических, химических и биологических примесей, поскольку их вводят путем инъекции, инфузии или имплантации непосредственно в организм человека или животного. Требования фармацевтической степени чистоты, предъявляемые к стерилизации S-нитрозотиольных парентеральных препаратов, представляют значительные проблемы для коммерческого развития.
Так называемые фильтры тонкой очистки для внутривенного (в/в) введения охватывают фильтры, присоединенные к концу трубок устройства для в/в введения для удаления частиц и некоторых микроорганизмов, таких как бактерии или грибы, путем фильтрации непосредственно перед поступлением в иглу для в/в введения. Применение фильтров с размером пор в диапазоне до 0,5 мкм (например, 0,22 мкм) в принципе позволяет удалять бактерии и грибы. Однако, с применением фильтров тонкой очистки связаны определенные проблемы. Во-первых, некоторые бактерии и грибы, которые неоднородны по размеру или не являются одинаково сферичными, могут проходить через мембрану фильтра, как это делают вирусы и микоплазмы. Кроме того, если в растворе для инъекций лекарственное средство присутствует в низких концентрациях, абсорбция лекарственного средства на мембране фильтра может привести к непреднамеренному введению недостаточной дозы лекарственного средства. Помимо этого, фильтры тонкой очистки при увлажнении не пропускают воздух, если только на них не действует высокое давление, что может привести к задержке пузырьков воздуха в трубках в процессе установки и впоследствии риска попадания пациенту воздуха через инъекцию при нагнетании давления. Применение фильтров тонкой очистки повышает стоимость оборудования, поскольку создает необходимость непрерывных поставок специальных расходных материалов и создает необходимость специального обучения постоянного медицинского персонала или приема на работу специалистов. Наконец, контролирующие органы требуют строго контроля данной процедуры и считают ее не обеспечением стерильного парентерального раствора, а всего лишь стадией удаления механических включений.
Европейское агентство по лекарственным средствам (ЕМА. от англ. European Medicines Agency) опубликовало рекомендации по выбору наиболее подходящего способа стерилизации для ряда медицинских препаратов. Для сухих порошков предпочтительным способом согласно рекомендациям, является сухожаровая стерилизация в герметичном окончательном контейнере (стерилизация готовой лекарственной формы); однако, для термочувствительных медицинских препаратов, таких как S-нитрозотиолы, данный способ стерилизации неосуществим, поскольку S-нитрозотиолы будут разлагаться. Альтернативным способом является стерилизация облучением (стерилизация воздействием ионизирующего электромагнитного излучения) (CPMP/QWP/054/98 корр). Стерилизация облучением также позволяет отстаивать интересы правообладателей разработчикам лекарственных средств, поскольку Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA) относит лекарственные средства, стерилизованные облучением, к новым лекарственным препаратам, что означает, что для размещения на рынке требуется одобренная заявка на регистрацию нового лекарственного средства (21 CFR 310.502(а)(11)). Однако, S-нитрозотиолы также чрезвычайно чувствительны к электромагнитному излучению, поскольку становятся высоко лабильными под воздействием свободных радикалов. Действительно, попытка стерилизовать гамма-излучением инъекционную композицию S-нитрозоглутатиона во флаконах, герметизированных колпачком с мембранной перегородкой, оказалась явно безуспешной, поскольку, как стало известно, имело место образование примеси неорганических нитратов (Lin, et al, 2005). Кроме того, были опубликованы данные, что серосодержащие аминокислоты (такие как цистеин в S-нитрозоглутатионе) являются особенно чувствительными к воздействию излучения, что приводит к деградации при уровнях гамма-излучения всего лишь 5 кГр, возможно из-за подверженности воздействию свободных радикалов (Ahn et al., 2002).
Чувствительность S-нитрозотиолов к температуре и ионизирующему электромагнитному излучению, таким образом, не позволяет считать указанные способы выполнимыми или надежными для получения стерильных S-нитрозотиолов фармацевтической степени чистоты. Как и все способы стерилизации, облучение подразумевает компромисс между инактивацией контаминирующих микроорганизмов и повреждением стерилизуемого препарата. Передаваемая энергия в форме гамма-фотонов или электронов, не делает особых различий между молекулами контаминирующих микроорганизмов и молекулами фармацевтического препарата.
По этим и другим причинам эффективная простая стерилизация S-нитрозотиолов, например, таких как S-нитрозоглутатион, до степени чистоты, пригодной для клинического применения, представляла непреодолимый барьер, затруднявший развитие фармацевтического применения этих лекарственных средств, обладающих потенциальной ценностью для медицины и ветеринарии.
В основе данного изобретения лежит неожиданное наблюдение, что ионизирующее излучение эффективно для стерилизации S-нитрозотиолов либо без снижения чистоты, либо со снижением чистоты не более чем приблизительно на 5,0% за счет деградации, чтобы указанные активные агенты, например, в форме твердых частиц, предварительно дозированные по массе, предпочтительно в медицинских флаконах или аналогичных упаковках, могли быть стерилизованы до степени чистоты, подходящей для клинического применения.
Сущность изобретения
Данное изобретение охарактеризовано прилагающейся формулой изобретения.
В первом аспекте изобретения предложены стерильный S-нитрозотиол или стерильная фармацевтическая пре-композиция, содержащая S-нитрозотиол, где S-нитрозотиол находится в сухой твердой форме.
S-нитрозотиол или стерильная фармацевтическая пре-композиция, содержащая S-нитрозотиол, перед применением предпочтительно находится в стерильной сухой окружающей среде, например, в герметичном контейнере. Герметичное средство может представлять собой простое герметичное средство, через которое контейнер можно вскрыть, например, проткнуть в стерильных условиях, чтобы стерильный S-нитрозотиол или стерильную фармацевтическую пре-композицию, содержащую S-нитрозотиол, можно было объединить с одним или более стерильными фармацевтическими разбавителями, эксципиентами, носителями, дополнительными активными агентами или любой их комбинацией, для получения итоговой фармацевтической композиции для введения. Герметичное средство может быть устроено таким образом, чтобы в контейнер можно было ввести стерильную жидкость, например, с помощью шприца, снабженного полой иглой, для растворения или суспендирования в контейнере in situ стерильного сухого твердого S-нитрозотиола или стерильной фармацевтической пре-композиции. Примером такого герметичного средства может быть обычный колпачок с мембранной перегородкой. В этом случае герметичное средство может также позволять извлекать полученный таким образом стерильный фармацевтический раствор или суспензию из контейнера для введения пациенту, например, с помощью шприца, снабженного иглой для подкожных инъекций. Для хранения и транспортировки герметичный контейнер со стерильным сухим твердым S-нитрозотиолом или стерильной фармацевтической пре-композицией может быть снабжен непроницаемым обжимным колпачком. Когда имеется колпачок с мембранной перегородкой или тому подобное, обеспечивающие введение стерильной жидкости и извлечение из герметичного контейнера без потери стерильности содержимого контейнера, для удобства транспортировки и хранения может использоваться непроницаемый обжимной колпачок, стандартным образом покрывающий барьер в виде мембранной перегородки или тому подобное.
Исходя из данного описания станет понятно, что выражение «фармацевтическая пре-композиция», используемое в данном документе, относится, в частности, к предшественнику фармацевтической композиции. Сама фармацевтическая пре-композиция может содержать, помимо одного или более S-нитрозотиолов, один или более фармацевтических разбавителей, эксципиентов, носителей, дополнительных активных агентов или любую их комбинацию. Фармацевтическая пре-композиция можно саму применять как фармацевтическую композицию, если для предполагаемого пути введения достаточно сухой твердой композиции, но чаще предполагают, что фармацевтическую пре-композицию будет использовать для приготовления готовой к применению фармацевтической композиции путем смешивания с одним или более стерильными фармацевтическими разбавителями, эксципиентами, носителями, дополнительными активными агентами или любой их комбинацией, как будет подробно описано ниже.
Согласно первому аспекту данного изобретения, стерильный сухой твердый S-нитрозотиол или стерильную фармацевтическую пре-композицию, содержащую стерильный сухой твердый S-нитрозотиол, предпочтительно получают путем воздействия на сухой твердый S-нитрозотиол или фармацевтическую пре-композицию, содержащую стерильный сухой твердый S-нитрозотиол в нестерильной форме, стерилизующей дозы ионизирующего излучения в окружающей среде, защищенной от внешнего загрязнения. Такой способ является новым и составляет второй аспект данного изобретения. Воздействие ионизирующего излучения, предпочтительно, имеет место, когда S-нитрозотиол или фармацевтическая пре-композиция, содержащая S-нитрозотиол в нестерильной форме, находится в той же самой сухой окружающей среде, в которой она будет храниться и транспортироваться перед применением, например, в такой как герметичный контейнер, описанный применительно к первому аспекту данного изобретения.
Герметичный контейнер и пространство в нем могут быть подготовлены соответствующим образом для минимизации деградации S-нитрозотиола во время хранения или транспортировки перед применением. Например, стенки герметичного контейнера могут быть окрашенными (например, окрашенными в оранжевый цвет) или быть светонепроницаемыми для уменьшения или предотвращения фотодеградации S-нитрозотиола. Сухая стерильная среда внутри герметичного контейнера может содержать или состоять из одного или более из перечисленного: сухой воздух, другой осушенный газ, например, такой как осушенный инертный газ, такой как азот, гелий, аргон, неон, ксенон, криптон или их смесь, и может необязательно находиться под пониженным давлением по сравнению с внешней окружающей воздушной средой, для уменьшения или предотвращения контакта между S-нитрозотиолом и влагой и/или кислородом. Герметичный контейнер может для удобства содержать подходящий осушитель для поддержания сухости известным образом, например, за счет абсорбции любой остаточной влаги, такой как кристаллизационная или атмосферная влага, попавшая с содержимым контейнера. Подходящие осушители, которые можно применять в данном изобретении, являются такими, которые фармацевтически безопасны и включают, например, силикагель, кристаллический алюмосиликат натрия, калия или кальция, коллоидный оксид кремния, безводный сульфат кальция фармацевтической степени чистоты и т.п. Осушитель может присутствовать в количестве от приблизительно 1,0% мас./мас. до 20,0% мас./мас. или от приблизительно 2% мас./мас. до 15% мас./мас. относительно массы S-нитрозотиола.
Герметичный контейнер может содержать один или более известных поглотителей кислорода.
Вещество, содержащее S-нитрозотиол, как до, так и после стерилизации, целесообразно хранить в темноте и как можно меньше подвергать воздействию света. Вещество в сухой форме обычно помещают в окрашенный или светонепроницаемый контейнер, такой, как флаконы из оранжевого стекла. Для большей защиты S-нитрозотиола от деградации можно использовать известным образом внешнюю оболочку или пакеты, не проницаемые для кислорода и света, например, алюминиевые пакеты.
Сухой твердый S-нитрозотиол или фармацевтическая пре-композиция, содержащая сухой твердый S-нитрозотиол, может для удобства находиться в контейнере в заранее отмеренной дозе, как, например, известная масса S-нитрозотиола, выбранная в соответствии со сложившимся медицинским применением. Для удобства могут прилагаться инструкции для смешивания с одним или более стерильными фармацевтическими разбавителями, эксципиентами, носителями, дополнительными активными агентами или любой их комбинацией, например, стерильной жидкостью или пастой, или гелем, таким как стерильный физиологический раствор, или другими твердыми эксципиентами или носителями, для получения фармацевтической композиции в желаемой концентрации для применения. В третьем аспекте данного изобретения предложен набор, содержащий контейнер или контейнеры, содержащие стерильный S-нитрозотиол или стерильную фармацевтическую пре-композицию, содержащую сухой твердый S-нитрозотиол, по первому аспекту изобретения наряду с инструкциями по смешиванию стерильного S-нитрозотиола или стерильной фармацевтической пре-композиции, содержащей S-нитрозотиол, с одним или более стерильными фармацевтическими разбавителями, эксципиентами, носителями, дополнительными активными агентами или любой их комбинацией, для получения фармацевтической композиции для фармацевтического применения, содержащей S-нитрозотиол в желаемой концентрации.
Когда получают стерильный сухой твердый S-нитрозотиол или стерильную фармацевтическую пре-композицию, содержащую стерильный сухой твердый S-нитрозотиол, путем воздействия на сухой твердый S-нитрозотиол или фармацевтическую пре-композицию, содержащую сухой твердый S-нитрозотиол в нестерильной форме, стерилизующей дозы ионизирующего излучения в окружающей среде, защищенной от внешнего загрязнения, получаемое стерильное вещество может содержать мертвые клетки микроорганизмов, убитые ионизирующим излучением, и природа и концентрация любых примесей будет характерна для стерилизованного облучением S-нитрозотиола, где стерилизацию сухого твердого вещества осуществляют в соответствии с изобретением. Таким образом, можно идентифицировать препараты, полученные или получаемые по данному способу, а также итоговые фармацевтические композиции, приготовленные из стерильных веществ.
Стерильный сухой твердый S-нитрозотиол или стерильная фармацевтическая пре-композиция, содержащая стерильный сухой твердый S-нитрозотиол, могут, соответственно, иметь степень чистоты S-нитрозотиола по меньшей мере приблизительно 95,0%, например, по меньшей мере 98,0%, например, по меньшей мере приблизительно 98,5%, например, по меньшей мере приблизительно 99,0%, например, по меньшей мере приблизительно 99,5%. В случае стерильной фармацевтической пре-композиции «чистота S-нитрозотиола» относится к чистоте твердого вещества S-нитрозотиол, без учета любых других компонентов фармацевтической пре-композиции.
Сухой твердый S-нитрозотиол, отдельно или в составе фармацевтической пре-композиции, предпочтительно находится в форме частиц, то есть в виде популяции частиц S-нитрозотиола. Частицы S-нитрозотиола могут, соответственно, содержать кристаллы.
Способ по второму аспекту данного изобретения, включающий воздействие на сухой твердый S-нитрозотиол или фармацевтическую пре-композицию, содержащую сухой твердый S-нитрозотиол в нестерильной форме, стерилизующей дозы ионизирующего излучения в окружающей среде, защищенной от внешнего загрязнения, можно осуществлять в таких условиях, чтобы чистота S-нитрозотиола не снижалась вследствие деградации или чтобы чистота снижалась не более чем приблизительно на 0,5%. Таким образом, например, для исходных веществ, в которых S-нитрозотиол имеет чистоту приблизительно 99,5%, условия способа будут такими, чтобы снижение чистоты S-нитрозотиола не превышало приблизительно 1,5%, чтобы стерильный продукт имел чистоту S-нитрозотиола по меньшей мере приблизительно 98,0%.
Авторы изобретения обнаружили, что чистота S-нитрозотиола в твердом сухом веществе может поддерживаться по меньшей мере приблизительно 95,0% и/или что любое снижение чистоты S-нитрозотиола в твердом сухом веществе может поддерживаться не более чем приблизительно 5,0%, например, не более чем приблизительно 2,0%, например, не более чем приблизительно 1,5%, когда температура S-нитрозотиола поддерживается не выше чем приблизительно 40°С во время воздействия стерилизующего ионизирующего излучения.
Подходящая стерилизующая доза ионизирующего излучения для стерилизации S-нитрозотиола представляет собой поглощаемую дозу не более приблизительно 50 кГр, не более приблизительно 25 кГр, не более приблизительно 15 кГр или не более приблизительно 5 кГр. В способе S-нитрозотиол может быть, например, подвергнут воздействию стерилизующей дозы ионизирующего излучения в течение периода времени менее чем приблизительно 24 часа, например, менее чем приблизительно 18 часов; например, менее чем приблизительно 12 часов; например, менее чем приблизительно 10 часов; например, менее чем приблизительно 6 часов; например, менее чем приблизительно 3 часа; например, менее чем приблизительно 2 часа; например, менее чем приблизительно 1 час; например, менее чем приблизительно 45 минут; например, менее чем приблизительно 30 минут; например, менее чем приблизительно 15 минут; например, менее чем приблизительно 2 минуты; например, менее чем приблизительно 1 минута; например, менее чем приблизительно 45 секунд; например, менее чем приблизительно 30 секунд.
В четвертом аспекте данного изобретения предложен способ получения стерильной фармацевтической композиции для применения у человека или в ветеринарии, включающий смешивание указанного стерильного S-нитрозотиола или стерильной пре-композиции, содержащей S-нитрозотиол, с одним или более стерильными фармацевтическими разбавителями, эксципиентами, носителями, дополнительными активными агентами или любой их комбинацией, например, стерильной жидкостью, пастой или гелем, или другими твердыми эксципиентами или носителями и, необязательно, с одним или более другими ингредиентами, для получения стерильной содержащей S-нитрозотиол фармацевтической композиции для терапевтического или профилактического применения. В следующем аспекте данного изобретения также предложена содержащая S-нитрозотиол фармацевтическая композиция, составленная или составляемая таким образом.
Итоговая содержащая S-нитрозотиол фармацевтическая композиция для терапевтического или профилактического применения может применяться в способе терапии или профилактики человека или животного. Способ терапии или профилактики может, например, включать индукцию расслабления гладкой мускулатуры артерий или вен, снижение индекса аугментации, снижение аугментационного давления, снижение артериальной жесткости, ингибирование агрегации тромбоцитов, индукцию апоптоза Т-клеток и активацию гуанилатциклазы у человека или животного, или может представлять собой способ лечения или предупреждения заболевания или нарушения, которое отвечает на терапию S-нитрозотиолом или NO, например, пре-эклампсии, тяжелой пре-эклампсии, эклампсии, HELLP-синдрома, перфузии органов при трансплантации, диализа органов, послеоперационных состояний после баллонной ангиопластики, острого инфаркта миокарда, нестабильной стенокардии, эмболии мозга, гипертензии, атеросклероза, рестеноза, ишемии и сердечной недостаточности, других сердечнососудистых пролиферативных, воспалительных, контрактильных и гипертензивных нарушений и связанных с прекондиционированием кардиологических и церебральных расстройств, спазма пищевода, спазма билиарного тракта, колик и других расстройств моторики и гладкой мускулатуры желудочно-кишечного тракта, эректильной дисфункции, инсульта, бронхоконстрикции, кистозного фиброза, пневмонии, астмы, фиброза легких и других легочных расстройств, включающих пониженный газообмен или воспаление, а также инфекционных заболеваний вирусного, бактериального и иного происхождения, эритроцитарных нарушений, характеризуемых дефицитом S-нитрозотиола, аномальной реологией или нарушенной вазодилатацией (таких как серповидноклеточная анемия и диатез, связанный с трансфузией консервированной крови) и тромботических нарушений.
Ионизирующее излучение может быть выбрано из электронно-лучевого излучения, гамма-излучения и рентгеновского излучения.
Электронно-лучевое излучение характеризуется низкой проникающей способностью и высокой мощностью дозы излучения и требует наиболее короткого времени воздействия для облучения S-нитрозотиола; время воздействия стерилизующей дозы ионизирующего излучения в случае электронно-лучевого излучения может, например, составлять менее чем приблизительно 1 час; например, менее чем приблизительно 45 минут; например, менее чем приблизительно 30 минут; например, менее чем приблизительно 15 минут; например, менее чем приблизительно 2 минуты; например, менее чем приблизительно 1 минута; например, менее чем приблизительно 45 секунд; например, менее чем приблизительно 30 секунд.
Гамма-излучение характеризуется высокой проникающей способностью и низкой мощностью дозы излучения и обеспечивает гомогенное облучение, которое требует большего времени воздействия; время воздействия стерилизующей дозы ионизирующего излучения в случае гамма-излучения может, например, составлять менее чем приблизительно 24 часа; например, менее чем приблизительно 18 часов; например, менее чем приблизительно 12 часов; например, менее чем приблизительно 10 часов; например, менее чем приблизительно 6 часов; например, менее чем приблизительно 3 часа; например, менее чем приблизительно 2 часа; например, приблизительно 1 час, и обычно по меньшей мере приблизительно 1 час.
Температура S-нитрозотиола или вещества, содержащего S-нитрозотиол, во время воздействия ионизирующего излучения, предпочтительно, находится в диапазоне от приблизительно -100°С до приблизительно +40°С. Температура в диапазоне от приблизительно -80°С до приблизительно +35°С является наиболее подходящей. Допускаются флуктуации температуры во время облучения, при условии, что она не будет превышать (+)40°С, что можно обеспечить, осуществляя облучение в терморегулируемом контейнере. Однако, авторы изобретения обнаружили, что очень хорошие результаты достигаются при дополнительном охлаждении S-нитрозотиола для ограничения повышения температуры во время облучения, например, до температуры в диапазоне от приблизительно -80°С до приблизительно +35°С, например, от приблизительно -80°С до приблизительно +30°С, например, не выше, чем приблизительно 30°С, например, не выше чем приблизительно 28°С, например, не выше, чем приблизительно 20°С, например, не выше, чем приблизительно 15°С, например, не выше, чем приблизительно 10°С, например, не выше, чем приблизительно 0°С, например, не выше, чем приблизительно -30°С, например, не выше, чем приблизительно -60°С, например, не выше, чем приблизительно -70°С, в ходе стерилизующего воздействия ионизирующего излучения.
Способ получения стерильного сухого твердого S-нитрозотиола или стерильной сухой твердой фармацевтической пре-композиции, содержащей S-нитрозотиол, по второму аспекту данного изобретения можно соответствующим образом осуществлять с использованием электронно-лучевого излучения в поглощаемой дозе не более, чем приблизительно 50 кГр, например, приблизительно 5 кГр (например, от приблизительно 3 до приблизительно 7 кГр) или приблизительно 15 кГр (например, от приблизительно 13 до приблизительно 17 кГр) или приблизительно 25 кГр (например, от приблизительно 23 до приблизительно 27 кГр), или приблизительно 35 кГр (например, от приблизительно 33 до приблизительно 37 кГр), или приблизительно 50 кГр (например, от приблизительно 47 до приблизительно 53 кГр), температура стерилизуемого вещества начинается от комнатной температуры (от приблизительно 18 до приблизительно 24°С), но допустимы колебания выше указанных значений, а воздействие электронно-лучевого излучения происходит в течение периода времени менее, чем приблизительно 1 час; например, не более приблизительно 45 минут; например, не более приблизительно 30 минут; например, не более приблизительно 15 минут; например, не более приблизительно 2 минут; например, не более приблизительно 1 минуты; например, не более приблизительно 45 секунд; например, не более приблизительно 30 секунд. Максимальная температура стерилизуемого вещества может соответствующим образом регулироваться, чтобы не превышать приблизительно 40°С, например, не превышать приблизительно 35°С, например, не превышать приблизительно 30°С, например, не превышать приблизительно 28°С, например, не превышать приблизительно 20°С.
В другом воплощении способ получения стерильного сухого твердого S-нитрозотиола или стерильной сухой твердой фармацевтической пре-композиции, содержащей S-нитрозотиол по второму аспекту данного изобретения можно соответствующим образом осуществлять с использованием электронно-лучевого излучения в поглощаемой дозе не более, чем приблизительно 50 кГр, например, приблизительно 5 кГр (например, от приблизительно 3 до приблизительно 7 кГр) или приблизительно 15 кГр (например, от приблизительно 13 до приблизительно 17 кГр) или приблизительно 25 кГр (например, от приблизительно 23 до приблизительно 27 кГр), или приблизительно 35 кГр (например, от приблизительно 33 до приблизительно 37 кГр), или приблизительно 50 кГр (например, от приблизительно 47 до приблизительно 53 кГр), при этом температура стерилизуемого вещества поддерживается ниже приблизительно 35°С, например, ниже приблизительно 30°С, например, ниже приблизительно 28°С, например, ниже приблизительно 20°С, например, ниже приблизительно 15°С, например, ниже приблизительно 5°С, например, ниже приблизительно 0°С, например, ниже приблизительно -30°С, например, ниже приблизительно -60°С, например, ниже приблизительно -70°С, например, приблизительно при -80°С, а воздействие излучения имеет место не более приблизительно 1 часа; например, не более приблизительно 45 минут; например, не более приблизительно 30 минут; например, не более приблизительно 15 минут; например, не более приблизительно 2 минут; например, не более приблизительно 1 минуты; например, не более приблизительно 45 секунд; например, не более приблизительно 30 секунд.
В другом воплощении способ получения стерильного сухого твердого S-нитрозотиола или стерильной сухой твердой фармацевтической пре-композиции, содержащей S-нитрозотиол по второму аспекту данного изобретения можно соответствующим образом осуществлять с использованием гамма-излучения в поглощаемой дозе не более, чем приблизительно 50 кГр, например, приблизительно 5 кГр (например, от приблизительно 3 до приблизительно 7 кГр) или приблизительно 15 кГр (например, от приблизительно 13 до приблизительно 17 кГр) или приблизительно 25 кГр (например, от приблизительно 23 до приблизительно 27 кГр), или приблизительно 35 кГр (например, от приблизительно 33 до приблизительно 37 кГр), или приблизительно 50 кГр (например, от приблизительно 47 до приблизительно 53 кГр), при этом температура стерилизуемого вещества поддерживается ниже 35°С, например, ниже приблизительно 30°С, например, ниже приблизительно 28°С, например, ниже приблизительно 20°С, например, ниже приблизительно 15°С, например, ниже приблизительно 5°С, например, ниже приблизительно 0°С, например, ниже приблизительно -30°С, например, ниже приблизительно -60°С, например, ниже приблизительно -70°С, например, приблизительно при -80°С, а воздействие излучения имеет место не более приблизительно 24 часов; например, не более приблизительно 18 часов; например, не более приблизительно 12 часов; например, не более приблизительно 10 часов; например, не более приблизительно 6 часов; например, не более приблизительно 3 часов; например, не более приблизительно 2 часов; например, в течение приблизительно 1 часа и обычно в течение по меньшей мере 1 часа.
Авторы изобретения обнаружили, что стерилизация с использованием гамма-излучения при температуре стерилизуемого вещества начиная от комнатной температуры (от приблизительно 18 до приблизительно 24°С), но с допустимыми колебаниями выше указанных значений, может требовать воздействия излучения в течение более чем приблизительно 1 час, например, от приблизительно 1 до приблизительно 24 часов; например, не более приблизительно 18 часов; например, не более приблизительно 12 часов; например, не более приблизительно 10 часов; например, не более приблизительно 6 часов; например, не более приблизительно 3 часов; например, не более приблизительно 2 часов. Кроме того, такое длительное воздействие гамма-излучения без регуляции температуры имеет нежелательные последствия в виде возможного повышения температуры выше приблизительно 40°С, например, до приблизительно 60°С, и вследствие этого возможно снижение чистоты S-нитрозотиола, например, на приблизительно 4-10% по сравнению с соответствующим необлученным контролем.
Неожиданно обнаружили, что способ по второму аспекту данного изобретения позволяет стерилизовать S-нитрозотиол, например, S-нитрозоглутатион, без снижения чистоты вследствие деградации более чем на 5,0%. Поскольку деградация S-нитрозотиола происходит в результате гомолитического разрыва связи S-NO с высвобождением N0 с высоким квантовым выходом (от 0,2 до 0,8), и индуцируется электромагнитным излучением с относительно низкой энергией, таким как УФ излучение или солнечное излучение (Manoj et al., 2009), следовало бы ожидать, что при воздействии ионизирующей радиации деградация будет существенной. Однако, обнаружили, что поддержание низкой температуры (дополнительное охлаждение) наряду с короткими временными интервалами облучения и хранением в контейнере, защищающем от воздействия света, подавляет тенденцию молекул к деградации, сохраняя высокую степень чистоты для фармацевтического применения.
Выражения «стерильный», «стерилизовать» и родственные выражения, используемые в данном описании, относятся к уровню стерильности (отсутствию микроорганизмов), который удовлетворяет требованиям Европейского агентства по лекарственным средствам (ЕМА), предъявляемым к стерильности фармацевтических и ветеринарных продуктов. Гарантированный уровень стерильности (SAL, от англ. sterility assurance level) относится к вероятности того, что одна единица продукции (например, внутренняя поверхность и все содержимое флакона, ампулы, пакета или другого контейнера, содержащего вещество, содержащее S-нитрозотиол, и заполненное газом пространство над ним) окажется нестерильной после проведения стерилизации. В данном изобретении единица продукции «является стерильной» или «была стерилизована», если SAL составляет 10-6 или менее, т.е. нестерильной является одна единица продукции или менее на миллион таких единиц продукции.
Сведения, подтверждающие возможность осуществления изобретения
S-нитрозотиолы
S-нитрозотиолы, применяемые в данном изобретении, могут, например, быть выбраны из следующих S-нитрозотиолов или любой комбинации одного или более из следующих S-нитрозотиолов:
S-нитрозоглутатион (GSNO)
S-нитрозо-L-цистеин (CySNO)
S-нитрозо-N-ацетил-цистеин (SNAC)
S-нитрозо-L-цистеинметиловый эфир (CMESNO)
S-нитрозо-D,L-пеницилламин (PSNO)
S-нитрозо-N-ацетил-D,L-пеницилламин (SNAP)
S-нитрозо-N-ацетилцистеамин (ACSNO)
S-нитрозо-бета-меркаптоянтарная кислота
1-S-нитрозотио-бета-D-галактопираноза
S-нитрозотиоглицерин
S-нитрозогомоцистеин
S-нитрозоцистеинглицин
S-нитрозокаптоприл
алкил, циклоалкил или арил тионитриты, например, такие как метил тионитрит, этил тионитрит, n-пропил тионитрит, s-пропил тионитрит, n-бутил тионитрит, s-бутил тионитрит, трет-бутил тионитрит, n-пентил тионитрит, n-гексил тионитрит, циклогексил тионитрит, фенил тионитрит
S-нитрозо-производные цистеин-содержащих белков, олиго- и полипептиды, например, S-нитрозоальбумин, поли-S-нитрозоальбумин или S-нитрозогемоглобин
и любое их производное
и соль любого из вышеперечисленного.
Предпочтительным S-нитрозотиолом, используемым в данном изобретении, является S-нитрозоглутатион (GSNO) или его производное или соль. Синтез S-нитрозоглутатиона и S-нитрозо-L-цистеина из глутатиона и L-цистеина, соответственно, описана Hart (1985).
Выражение «производное», используемое в данном описании применительно к S-нитрозотиолам, в частности, означает соединение, которое сохраняет характерную группировку -S-N=O, но отличается от указанного S-нитрозотиола в одном или более из следующих аспектов и, предпочтительно, только в этом или в этих аспектах:
углеводородная группировка замещена одним или более из следующих заместителей: одним или более атомами галогена; одной или более гидроксильными группами; одной или более C1-8 алкильными группами; одной или более С2-8 алкенильными группами; одной или более C2-8 алкинильными группами; одной или более C1-8 алкокси группами; одной или более трупами простых эфиров енолов -C=C(OR), где предпочтительно R выбран из водорода, алкила, алкенила, алкинила, арила, гетероарила, аралкила, гетероалкила, циклоалкила и гетероциклила; одной или более группами сложных эфиров енолов -C=C(OC(O)R) где предпочтительно R выбран из водорода, алкила, алкенила, алкинила, арила, гетероарила, аралкила, гетероалкила, циклоалкила и гетероциклила; одной или более карбоксилатными группами; одной или более эстерифицированными карбоксилатными группами;
гидроксильная группировка эстерифицирована;
соединение получено в форме гидрата, сольвата или хелата металла или в форме любого пролекарства.
В предыдущем параграфе выражение «эстерифицирована» охватывает без ограничения сложные эфиры, выбранные из алкилового, алкенилового, алкинилового, арилового, гетероарилового, аралкилового, гетероалкилового, циклоалкилового и гетероциклилового эфиров кислотных групп, например, таких как карбоновые кислоты, фосфорные кислоты, фосфиновые кислоты, сульфоновые кислоты, сульфиновые кислоты и бороновые кислоты.
Формы солей S-нитрозотиолов охватывают компоненты, которые отличаются от указанного S-нитрозотиола тем, что кислая группа или группировка S-нитрозотиола присутствует в форме соли, образованной с подходящим основанием, и/или любая основная группа или группировка S-нитрозотиола присутствует в форме соли, образованной с подходящей кислотой. Основания, которые можно использовать для образования солей с S-нитрозотиолами, содержащими подходящие кислые группы включают, например, такие основания, как гидроксид натрия, гидроксид калия, гидроксид лития, гидроксид бария, гидроксид кальция, гидроксид магния, гидроксиды переходных металлов, таких как гидроксид цинка, аммонийные основания, органические амины (например, такие как N,N'-дибензилэтилендиамин, хлорпрокаин, холин, гидроксиалкиламины, такие как диэтаноламин, этилендиамин, N-метилглюкамин, прокаин, N-бензилфенэтиламин, 1-р-хлорбензил-2-пирролидин-1'-ил-метилбензимидазол, алкиламины, такие как диэтиламин, пиперазин и трис(гидроксиметил)аминометан), карбонат натрия и бикарбонат натрия. Кислоты, которые можно использовать для образования солей с S-нитрозотиолами, содержащими подходящие основные группы включают, например, такие кислоты как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, уксусная кислота, лимонная кислота, молочная кислота, малеиновая кислота, аскорбиновая кислота, янтарная кислота, масляная кислота, валериановая кислота, фумаровая кислота, винная кислота и пропионовая кислота.
Перечисленные выше соединения известны или могут быть легко получены из доступных источников стандартными методами химического синтеза, хорошо известными в области техники. Для фармацевтического применения соединения можно вводить животным и человеку в подходящих дозах без токсических эффектов, и они либо являются фармацевтически активными, либо представляют собой пролекарства фармацевтически активных соединений.
Степень чистоты и определение, примеси
S-нитрозотиол, используемый в данном изобретении, может содержать ограниченное количество примесей. Предпочтительно, чтобы S-нитрозотиол, например, S-нитрозоглутатион, имел степень чистоты, превышающую или равную приблизительно 95,0%, определенную известными в области техники способами, например, высокоэффективной жидкостной хроматографией (ВЭЖХ) или непосредственно по поглощению в УФ области (А 210-335 нм).
В одном воплощении S-нитрозотиол, использованный в данном изобретении, например, S-нитрозоглутатион, имеет степень чистоты, варьирующую от приблизительно 95,0% до приблизительно 100,0% или любое другое значение в указанном диапазоне, например, по меньшей мере приблизительно 97,0% или по меньшей мере приблизительно 98,0% или по меньшей мере приблизительно 99,0%.
Способ стерилизации по данному изобретению предпочтительно стерилизует S-нитрозотиол без снижения чистоты вследствие деградации более чем на приблизительно 5,0%. Деградация, если она имеет место, детектируется по увеличению в препарате одного или более мономолекулярных гомолитических разрывов S-нитрозотиола по связи S-N, ферментативной деградации, восстановительной деградации и окислительной деградации (разложения). Такое определение продуктов деградации можно осуществлять известными в области техники способами, например, высокоэффективной жидкостной хроматографией (ВЭЖХ) или непосредственно по поглощению в УФ области (А 210-335 нм).
Примеси, присутствующие в S-нитрозотиоле, обычно могут включать соответствующие денитрозилированные соединения с окислением или восстановлением или без окисления или восстановления. Основные примеси, возникающие в любом конкретном S-нитрозотиоле, могут легко выявляться химическим анализом. Например, типичные примеси S-нитрозоглутатиона включают глутатион (GSH) и дисульфид глутатиона (GSSG). В одном воплощении соединения и композиции, использованные в данном изобретении, имеют общее содержание примесей (включая восстановленный и окисленный L-глутатион), варьирующее в диапазоне от приблизительно 0,0% до приблизительно 5,0%, или любое конкретное значение в указанном диапазоне, например, менее чем приблизительно 3,0% или менее чем приблизительно 2,5% или менее чем приблизительно 2,0%.
Степень чистоты и определение
Дозу излучения для стерилизации S-нитрозотиола можно, установить хорошо известными в области техники способами. ISO 11137-2:2013 описывает способы определения минимальной дозы, необходимой для выполнения указанного требования к стерильности, и способы обосновать использование 25 кГр или 15 кГр в качестве стерилизующей дозы для достижения гарантированного уровня стерильности, SAL, равного 10-6. ISO 11137-2:2013 также описывает способы проверки использованной стерилизующей дозы для демонстрации непрерывной эффективности стерилизующей дозы. ЕМА, Европейская Фармакопея и Фармакопея США обычно указывают дозу излучения большую или равную 25 кГр в качестве референтной стерилизующей дозы для достижения гарантированного уровня стерильности (SAL), равного 10-6.
Подходящая доза излучения для данного изобретения составляет 15-35 кГр. Однако, указанная стерилизующая доза может варьировать в соответствии с рекомендациями ISO 11137-2:2013 (например, при соответствующем обосновании, можно использовать 5-50 кГр).
Доза излучения, использованная в данном изобретении, может быть такой, чтобы достигался гарантированный уровень стерильности (SAL), равный 10-6, а именно, вероятность один на миллион, что после проведения стерилизации один единственный флакон фармацевтического препарата окажется нестерильным.
Ионизирующее излучение и источники
Стерилизация облучением подразумевает компромисс между инактивацией контаминирущих микроорганизмов и повреждением стерилизуемого препарата.
Гамма-излучение характеризуется глубоким проникновением и низкой мощностью дозы излучения. Энергия гамма-излучения, как электромагнитных волн с квантовыми свойствами, схожа со световым излучением, но отличается более высокой энергией фотонов и более короткой длиной волны. Взаимодействие между материей и гамма-излучением с высокой энергией приводит к образованию ионных пар вследствие испускания электронов, что приводит к образованию свободных радикалов и возбуждению. Свободные радикалы являются чрезвычайно реакционноспособными, поскольку каждый имеет неспаренный электрон на одной из своих внешних орбиталей. Свободнорадикальные реакции могут включать высвобождение газа, образование и разрыв двойных связей, реакции обмена, миграции электронов и образования поперечных сшивок. Действительно, любая химическая связь может быть разорвана и любая возможная химическая реакция может иметь место. В кристаллических веществах это может привести к образованию вакансий, межузельных атомов, соударениям, термическим дислокациям и ионизирующим эффектам.
Гамма-излучатели на базе кобальта-60 эффективно уничтожают микроорганизмы во всем препарате и его упаковке. Количество получаемого излучения зависит от типа препарата и необходимой ему дозы.
Электронно-лучевое излучение представляет собой форму ионизирующего излучения, которое характеризуется низкой проникающей способностью и высокой мощностью дозы излучения. «Луч» (концентрированный многозарядный поток электронов) генерируется ускорителями, способными испускать непрерывное или пульсирующее излучение. Поскольку стерилизуемый продукт проходит под или перед электронным лучом, энергия электронов поглощается, модифицируя различные химические и биологические связи и нарушая ДНК и репродуктивные способности микроорганизмов.
Рентгеновское излучение представляет собой еще одну форму ионизирующего электромагнитного излучения. Тогда как гамма-излучение испускается ядром, рентгеновское излучение возникает в электронном поле, окружающем ядро, или генерируется аппаратурой.
Приборы и оборудование для обеспечения ионизирующего излучения для стерилизации химических веществ, например, гамма-излучения, электроннолучевого излучения или рентгеновского излучения, хорошо известны и доступны для приобретения.
Доза излучения, используемая в способе по данному изобретению, предпочтительно регистрируется с помощью дозиметра. Дозиметры доступны для приобретения и хорошо известны специалистам в области техники. Дозиметрический контроль используемого излучения позволяет обрабатывать препараты, осуществлять проверку и немедленно разрешать их отгрузку.
В способе по данному изобретению предпочтительно использовать ионизирующее излучение таким образом, чтобы обеспечивать воспроизводимость стерилизующей дозы. Гамма-излучение хорошо подходит для облучения больших партий в течение нескольких часов. Электронно-лучевое излучение представляет собой непрерывный процесс, который может обеспечить необходимую дозу в несколько секунд по мере прохождения отдельных коробок через электроннолучевой ускоритель.
В частности, авторы данного изобретения обнаружили, что определенные контролируемые условия гамма- и электронно-лучевого излучения приводят к удивительно низкой степени деградации препарата, что позволяет эффективно поддерживать чистоту исходного химического вещества в стерилизуемом препарате, предназначенном для медицинского или иного физиологического применения.
Оборудование и способы осуществления изобретения
Способ стерилизации по данному изобретению удобно осуществлять с использованием оборудования, содержащего:
несущую систему для поддержки стерилизуемого вещества в соответствующей упаковке;
источник ионизирующей радиации, предназначенный для облучения облучаемого поля;
систему приводов, предназначенную для относительного перемещения контейнера, содержащего вещество, в облучаемом поле для более равномерного облучения;
дозиметрическую систему для измерения дозы излучения, поглощенной веществом в контейнере;
систему регулировки температуры для поддержания желаемой температуры вокруг контейнера, содержащего вещество; и
средства для завершения облучения контейнера при достижении необходимой стерилизующей дозы.
Оборудование указанного общего типа доступно для приобретения и не нуждается в подробном описании.
Регулировка температуры
Специалистам в области техники хорошо известно, что излучение может повышать температуру облучаемого вещества. Температуру вещества, содержащего S-нитрозотиол, во время воздействия ионизирующего облучения предпочтительно поддерживают в диапазоне от приблизительно -100°С и не выше, чем приблизительно +40°С. Температура в диапазоне от приблизительно -80°С до приблизительно +35°С является наиболее подходящей. Допускаются флуктуации температуры во время облучения, предпочтительно, без превышения приблизительно (+)40°С, что можно обеспечить, осуществляя облучение в терморегулируемом контейнере. Однако, авторы изобретения обнаружили, что очень хорошие результаты достигаются при поддержании температуры во время облучения в определенном диапазоне благодаря дополнительной терморегуляции или охлаждению вещества, содержащего S-нитрозотиол, например, до температуры в диапазоне от приблизительно -80°С до приблизительно +35°С, например, не выше чем приблизительно 30°С, например, не выше, чем приблизительно 28°С, например, не выше чем приблизительно 20°С, например, не выше, чем приблизительно 15°С, например, не выше, чем приблизительно 10°С, например, не выше, чем приблизительно 5°С, например, не выше, чем приблизительно 0°С, например, не выше, чем приблизительно -30°С, например, не выше, чем приблизительно -60°С, например, не выше, чем приблизительно -70°С, в ходе стерилизующего воздействия ионизирующего излучения.
Для промышленного применения, например, для крупных партий или при непрерывном производственном процессе, при осуществлении данного изобретения для достижения и поддержания желаемых температурных условий при облучении можно использовать стандартные термостатируемые контейнеры с соответствующими охладительными или криогенными системами.
Для небольших партий для установления и поддержания в ходе облучения желаемой температуры в диапазоне от приблизительно +40°С до приблизительно -80°С эффективными будут сухой лед (твердый CO2) с температурой -80°С, водный лед с температурой 0°С, или иные охлаждающие материалы с известными температурами, как проиллюстрировано в Примере 2, приведенном ниже и не являющемся исчерпывающим.
Фармацевтические композиции и составы
Стерильный сухой твердый S-нитрозотиол или стерильная фармацевтическая пре-композиция, используемые в данном изобретении, предпочтительно составлены таким образом, чтобы при смешивании с подходящим стерильным разбавителем, эксципиентом и/или носителем, например, с жидкостью, пастой или гелем или другими твердыми эксципиентами или носителями, для растворения или диспергирования сухого твердого вещества без потери стерильности, и, необязательно, смешивании с одним или более дополнительными ингредиентами, получалась стерильная фармацевтическая композиция, совместимая с предполагаемым лечением или профилактикой и предполагаемым способом введения. Примеры способов введения включают парентеральное (например, внутривенное), внутрикожное, подкожное, ингаляционное, чрескожное (поверхностное), чресслизистое (путем размещения между верхней губой и десной или в полости рта), вагинальное и ректальное введение.
Стерильную фармацевтическую композицию, содержащую S-нитрозотиол, составляемую из: (а) сухого твердого вещества по первому аспекту данного изобретения и (б) стерильной жидкости и любого(ых) дополнительного(ых) ингредиента(ов), готовят из стерилизованного S-нитрозотиола или фармацевтической пре-композиции по первому аспекту данного изобретения. Стерильную фармацевтическую композицию, содержащую S-нитрозотиол, предпочтительно готовить таким образом незадолго до введения больному человеку или животному.
Необходимые ингредиенты для составляемой итоговой композиции, а также их распределение между сухим твердым веществом по первому аспекту данного изобретения, стерильной жидкостью для смешивания с ним и любым(и) необязательным(и) дополнительным(и) ингредиентом(ами), смешиваемым(и) с одним или обоими из перечисленного в способе приготовления итоговой фармацевтической композиции, хорошо известны специалисту в области техники или будут без труда выбраны специалистами в области техники в каждом конкретном случае в соответствии с обычной практикой приготовления составов. Например, как хорошо известно, готовые к применению растворы или суспензии могут включать один или более из следующих компонентов: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиокислители, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетатный, цитратный или фосфатный, и агенты для регулирования тоничности, такие как хлорид натрия или декстроза.
Таким образом, стерильная пре-композиция по данному изобретению или нестерильная пре-композиция, подготовленная для стерилизации в соответствии с данным изобретением, или стерильная композиция после приготовления для введения с использованием стерильного S-нитрозотиола или стерильной пре-композиции по данному изобретению, будут содержать по меньшей мере один S-нитрозотиол в комбинации по меньшей мере с одним фармацевтически приемлемым разбавителем, эксципиентом, носителем, дополнительным активным агентом или любой их комбинацией. В данном описании «фармацевтически приемлемый эксципиент» или «фармацевтически приемлемый носитель» охватывает любые всевозможные растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие абсорбцию агенты и т.п., совместимые с фармацевтическим введением. Подходящие разбавители, эксципиенты и носители описаны в источнике Remington: The Science and Practice of Pharmacy, 22nd Edition, 2012, Pharmaceutical Press, содержание которого включено в данное описание путем ссылки. Примеры таких разбавителей, эксципиентов и носителей включают воду, физиологический раствор, растворы Рингера, раствор декстрозы и 5% альбумин сыворотки человека, но не ограничиваются ими. Также могут применяться липосомы и неводные несущие среды, такие как нелетучие масла. Фармацевтически приемлемые носители также охватывают твердые носители, такие как лактоза, каолин, сахароза, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния, стеариновая кислота и т.п. Примеры жидких носителей включают сироп, арахисовое масло, оливковое масло, воду и т.п.
Эксципиент или носитель может включать замедляющее вещество, известное в области техники, такое как глицерилмоностеарат или глицерилдистеарат, в отдельности или в сочетании с воском, этилцеллюлозой, гидроксипропилметилцеллюлозой, метилметакрилатом или т.п. В стерильную пре-композицию по данному изобретению или нестерильную пре-композицию, подготовленную для стерилизации в соответствии с данным изобретением, или стерильную композицию после приготовления для введения с использованием стерильного S-нитрозотиола или стерильной пре-композиции по данному изобретению, также можно включать другие наполнители, разбавители, корригенты и другие добавки, известные в области техники. Применение таких сред и агентов для фармацевтически активных субстанций хорошо известно в области техники. Их применение в композициях подразумевается за исключением случаев, когда любые стандартные среды или агенты несовместимы с активным соединением. В композициях и пре-композициях могут присутствовать более одного S-нитрозотиола, в соответствии с клинической необходимостью. Один или более дополнительных физиологически активных соединений, относящихся к другому классу, нежели S-нитрозотиолы, также могут быть включены в композиции и пре-композиции.
Приготовленные фармацевтические композиции, подходящие для парентерального применения, обычно включают подходящие носители, выбранные из физиологического раствора, бактериостатической воды, кремофора EL (BASF, Parsippany, NJ.) и фосфатно-солевого буфера (PBS). Во всех случаях вводимая композиция должна быть стерильной и текучей до такой степени, чтобы ее легко было вводить путем инъекции. Носитель может представлять собой растворитель или диспергирующую среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. Для поддержания надлежащей текучести можно, например, использовать покрытия, такие как лецитин, поддерживать необходимый размер частиц в случае дисперсий, а также применять поверхностно-активные вещества. Предотвратить действие микроорганизмов можно при помощи различных антибактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т.п. Во многих случаях в композицию предпочтительно включать изотонические агенты, например, сахара, многоатомные спирты, такие как маннит, сорбит, хлорид натрия. Пролонгированная абсорбция инъекционных композиций может быть достигнута благодаря включению в композиции агента, замедляющего абсорбцию, например, моностеарата алюминия и желатина.
Для введения путем ингаляции приготовленные композиции могут обладать способностью быть доставленными в форме тонкодисперсного порошка или аэрозоля, распыляемого из находящегося под давлением контейнера или диспенсера, содержащего подходящий пропеллент, например, газ, такой как диоксид углерода, или небулайзера.
Для чресслизистого или чрескожного введения в приготовленные композиции включают проникающие агенты, соответствующие барьеру, который необходимо преодолеть. Такие проникающие агенты широко известны в области техники и для чресслизистого введения включают, например, детергенты, соли желчных кислот и производные фузидиевой кислоты. Чресслизистое введение можно осуществлять с использованием назальных спреев или суппозиториев. Для чрескожного введения S-нитрозотиол(ы) и любой(ые) другой(ие) активный(е) ингредиент(ы) целесообразно составлять в мази, бальзамы, гели или кремы, широко известные в области техники.
Итоговые композиции можно получать в форме суппозиториев (например, со стандартной основой для суппозиториев, такой как масло какао и другие глицериды) или удерживающих микроклизм для ректального введения.
Итоговые композиции могут содержать стабилизирующий буфер и могут дополнительно содержать поверхностно-активное вещество. При желании, в стерильной пре-композиции по данному изобретению или нестерильной пре-композиции, подготовленной для стерилизации в соответствии с данным изобретением, могут присутствовать буфер и/или поверхностно-активное вещество или их ингредиенты, или их можно добавлять при приготовлении для введения стерильной итоговой композиции из стерильного S-нитрозотиола или стерильной пре-композиции по данному изобретению. Количество поверхностно-активного вещества, которое может присутствовать, может варьировать от приблизительно 0,1% мас./мас. до приблизительно 10% мас./мас. относительно S-нитрозотиола. В одном воплощении количество присутствующего поверхностно-активного вещества составляет по меньшей мере 1% мас./мас. по отношению к S-нитрозотиолу. В одном воплощении количество присутствующего поверхностно-активного вещества составляет не более чем приблизительно 5% мас./мас. по отношению к S-нитрозотиолу. Примеры подходящих поверхностно-активных веществ включают жирную кислоту, эфиры жирных кислот, включая триглицериды жирных кислот, жирные спирты, соли жирных кислот, олеиловый спирт, сорбитан моноолеат, сорбитан монолаурат, полиоксиэтилен (20) сорбитан монолаурат, полиоксиэтилен (20) сорбитан моноолеат, натуральный лецитин, олеиловый эфир полиоксиэтилена (2), стеариловый эфир полиоксиэтилена (2), лауриловый эфир полиоксиэтилена (4), блок-сополимеры оксиэтилена и оксипропилена, олеиновую кислоту, соли олеиновой кислоты, синтетический лецитин, диолеат диэтиленгликоля, тетрагидрофурфурил олеат, этилолеат, изопропилмиристат, изопропилпальмитат, глицерил моноолеат, глицерил моностеарат, глицерил монорицинолеат, цетиловый спирт, стеариловый спирт, цетилпиридиния хлорид, оливковое масло, глицерил монолаурат, кукурузное масло, масло семян хлопка, масло семян подсолнечника, полиоксиэтилен сорбитан моноолеат, сорбитан триолеат, олигомолочную кислоту, лецитин, (поли)алкокси-производные, включая полиалкокси-содержащие спирты, в частности, 2-(2-этоксиэтокси)этанол, но не ограничиваются ими. Дополнительные (поли)алкокси-производные включают полиоксиалкиловые простые и сложные эфиры, такие как простые и сложные эфиры полиоксиэтилена, включая алкиловые эфиры полиоксиэтилена, полиоксиэтиленовые эфиры сорбита и жирной кислоты и полиоксиэтилена стеараты, но не ограничиваясь ими.
Обычно итоговые композиции могут необязательно содержать дополнительные ингредиенты, такие как добавки, служащие консервантами, антиокислителями, тушителями радикалов, фармацевтически активными агентами, адъювантами, носителями, химическими стабилизаторами и/или полимерами. Такие необязательные дополнительные ингредиенты или некоторые из них могут при желании присутствовать в стерильной пре-композиции по данному изобретению или нестерильной пре-композиции, подготовленной для стерилизации в соответствии с данным изобретением, или их можно добавлять при приготовлении для введения стерильной итоговой композиции из стерильного S-нитрозотиола или стерильной пре-композиции по данному изобретению. Количество дополнительных ингредиентов, включенных в итоговую приготовляемую композицию S-нитрозотиола может, например, составлять от 0% до приблизительно 1% мас./мас.
Для удобства введения и единообразия введения наиболее целесообразно составлять итоговые готовые к применению композиции в виде дозированной лекарственной формы. «Дозированная лекарственная форма» в данном описании относится к физически дискретным единицам, представленным в виде единичных дозировок для субъекта, которому предстоит лечение, каждая единица содержит заранее определенное количество активного агента, рассчитанное для обеспечения желаемого терапевтического эффекта, в сочетании с необходимыми одним или более фармацевтическими носителями, эксципиентами, разбавителями, дополнительными активными агентами или любой их комбинацией. Как хорошо известно специалистам в области техники, инструкции по дозированным лекарственным формам диктуются и напрямую определяются уникальными характеристиками активного S-нитрозотиольного агента и конкретным терапевтическим эффектом, который необходимо достичь, и ограничениями, существующими в области техники, связанными с составлением смесей таких активных агентов для лечения индивидуумов.
Сухое твердое вещество по данному изобретению, то есть стерильный сухой твердый S-нитрозотиол, например, S-нитрозоглутатион, или стерильная сухая твердая пре-композиция, содержащая S-нитрозотиол, например, S-нитрозоглутатион, может присутствовать в дозированной массе, так что после приготовления итоговой стерильной фармацевтической композиции для введения итоговая композиция для введения содержит однократную дозу S-нитрозотиольного активного агента или множество указанных однократных доз, таким образом, чтобы можно было последовательно вводить порции итоговой композиции до тех пор, пока не потребуется приготовление новой композиции из сухого твердого вещества.
Для этой цели дозированную массу сухого твердого вещества, то есть стерильного сухого твердого S-нитрозотиола, например, S-нитрозоглутатиона, или стерильной сухой твердой пре-композиции, содержащей S-нитрозотиол, например, S-нитрозоглутатион, заключают в однодозовые или многодозовые контейнеры, такие как однодозовые или многодозовые флаконы, однодозовые ампулы, однодозовые или многодозовые пакеты или однодозовые одноразовые шприцы, в каждом случае контейнеры могут быть сделаны из стекла или полимерных материалов или их комбинации. Как упоминалось ранее, поскольку S-нитрозотиолы (например, S-нитрозоглутатион) чувствительны к свету, компоненты контейнера для доз имеют подходящие внешние оболочки или защищены от света, например, окрашены или светонепроницаемы. Все манипуляционное оборудование и контейнер для фармацевтических композиций или любые промежуточные составы, направляющиеся на приготовление фармацевтических композиций, такие как стерильные жидкости, содержащие S-нитрозотиол, приготовленные из стерильного сухого твердого вещества в соответствии с данным изобретением, должны быть аналогичным образом окрашены или светонепроницаемы или иметь подходящие внешние оболочки, защищающие их от света. Такое оборудование и контейнер могут, например, включать инфузионные системы и шприцы.
Твердые формы
Сухой твердый S-нитрозотиол (например, S-нитрозоглутатион) или сухая твердая пре-композиция, содержащая S-нитрозотиол (например, S-нитрозоглутатион), перед стерилизацией может подвергаться обработке подходящим для этой цели стандартным образом для получения частиц желаемого размера. Например, сухое твердое вещество можно измельчать или микронизировать с использованием подходящего оборудования, например, воздухоструйной мельницы, молотковой мельницы, шаровой мельницы или микронизатора.
В альтернативном варианте частицы желаемого размера могут быть получены, например, путем лиофилизации, распылительной сушки или методов контролируемой кристаллизации, например, кристаллизации с использованием технологии сверхкритических жидкостей.
Частицы сухого твердого S-нитрозотиола (например, S-нитрозоглутатиона) или сухой твердой пре-композиции, содержащей S-нитрозотиол (например, S-нитрозоглутатион), могут, например, иметь средний диаметр частиц в диапазоне от приблизительно 0,1 мкм до приблизительно 50 мкм, например, от приблизительно 0,2 мкм до приблизительно 20 мкм, или от приблизительно 1 мкм до приблизительно 15 мкм.
Контейнер
Контейнер для сухого твердого S-нитрозотиола (например, S-нитрозоглутатиона) или сухой твердой пре-композиции, содержащей S-нитрозотиол (например, S-нитрозоглутатион), например, в виде сухих твердых частиц, предпочтительно кислородонепроницаема и влагонепроницаема. Контейнер имеет удобный размер, в частности, размер, соответствующий одной дозе или кратный одной дозе. Специалист в области техники может легко определить соответствующий размер контейнера и массу сухого твердого S-нитрозотиола (например, S-нитрозоглутатиона) или сухой твердой пре-композиции, содержащей S-нитрозотиол (например, S-нитрозоглутатион), в зависимости от предполагаемого применения и способа введения. Как описывалось ранее, предпочтительно, чтобы сухой твердый S-нитрозотиол (например, S-нитрозоглутатион) или сухая твердая пре-композиция, содержащая S-нитрозотиол (например, S-нитрозоглутатион) размещались в контейнере, контейнер был герметически закрыт, и содержимое контейнера и внутренние стенки контейнера затем стерилизовались в соответствии с данным изобретением. Таким образом, контейнер содержит стерильный сухой твердый S-нитрозотиол (например, S-нитрозоглутатион) или стерильную сухую твердую пре-композицию, содержащую S-нитрозотиол (например, S-нитрозоглутатион), при хранении и транспортировке до тех пор, пока не потребуется приготовление итоговой фармацевтической композиции.
Сухое твердое вещество может помещаться в контейнер перед стерилизацией способами наполнения, известными специалистам в области техники. Такой контейнер может представлять собой флаконы, пробирки, шприцы, ампулы и т.п., например, для содержания порошковых композиций, и может быть сделан из любого инертного материала, такого как пластмасса, полимеры, стекло и т.п.
Как упоминалось ранее, поскольку S-нитрозотиолы (например, S-нитрозоглутатион) чувствительны к свету, их можно хранить в соответствующих внешних оболочках или контейнерах, которые являются кислородонепроницаемыми и светонепроницаемыми, например, в окрашенном контейнере (например, окрашенной в оранжевый цвет) или алюминиевых пакетах. Специалисты в области техники могут легко определить подходящие контейнеры, внешние оболочки и т.п. для хранения S-нитрозотиола и других компонентов, которые пригодны для поддержания стабильности S-нитрозотиола. Перед герметизацией систему хранения можно обработать по меньшей мере одним инертным газом, например, азотом, аргоном, гелием, неоном, криптоном и ксеноном, для уменьшения содержания кислорода в системе. Герметичные системы хранения (например, флаконы из оранжевого стекла и другие светозащитные контейнеры) с отмеренной дозой S-нитрозотиола могут затем подвергаться стерилизующей обработке в соответствии с данным изобретением. Системы хранения помогают стабилизировать твердые композиции и сохранить уровень чистоты S-нитрозотиола в течение продолжительного периода времени и при нормальной комнатной температуре.
Краткое описание графических материалов
Далее данное изобретение будет описано более подробно ниже, со ссылкой на приведенные графические материалы, которые не ограничивают объем изобретения.
Фиг. 1 демонстрирует влияние стерилизации (а) электронно-лучевым излучением и (б) гамма-излучением в дозе 35 кГр и 15 кГр в Примере 1 на чистоту S-нитрозоглутатиона (GSNO; % снижения чистоты в сравнении с контрольным образцом, не подвергавшимся излучению). Температура достигала приблизительно (~) 27,5°С в случае электронно-лучевого излучения и была ниже или равной (≤) 60°С или 40°С в случае гамма-излучения;
Фиг. 2 демонстрирует влияние стерилизации (а) электронно-лучевым излучением и (б) гамма-излучением в дозе 35 кГр и 15 кГр в Примере 2 на чистоту S-нитрозоглутатиона (GSNO; % снижения чистоты в сравнении с контрольным образцом, не подвергавшимся излучению). Температура была ниже (<) 27,5°С или поддерживалась при -80°С в случае электронно-лучевого излучения в дозе 35 кГр и 15 кГр. Температура была ниже или равной (≤) 32,5°С или поддерживалась при -80°С для дозы 35 кГр или ниже или равной (≤) 27,5° или поддерживалась при -80°С в случае гамма-излучения в дозе 15 кГр.
Фиг. 3 является обобщением Фиг. 1 и 2 и демонстрирует влияние способов стерилизации (а) электронно-лучевым излучением и (б) гамма-излучением согласно Примерам 1 и 2 на чистоту S-нитрозоглутатиона (GSNO; % снижения чистоты при сравнении с контрольным образцом, не подвергавшимся излучению) при различных температурах.
Фиг. 4 является схематичным изображением устройства для электроннолучевого облучения флаконов, содержащих S-нитрозоглутатион (GSNO) в Примере 2, стрелки с обозначением «е» указывают направление электронно-лучевого излучения;
Фиг. 5 является схематичным изображением устройства для гамма-облучения флаконов, содержащих S-нитрозоглутатион (GSNO) в Примере 2. Стрелки с обозначением «γ» указывают направление гамма-излучения.
Описание примеров осуществления изобретения
Для дальнейшей иллюстрации данного изобретения приведены следующие примеры, не ограничивающие объем изобретения.
Пример 1. Стерилизация S-нитрозоглутатиона с помощью электронно-лучевого и гамма-излучения без ограничения по температурному режиму
Образцы гранул S-нитрозоглутатиона из одной производственной серии, находящиеся в стеклянных флаконах (до 250 мг/флакон) хранились до стерилизации на сухом льду (твердый CO2) приблизительно при -80°С. Соответствующие контроли не подвергались облучению, но хранились в аналогичных условиях и при аналогичном температурном режиме до, во время и после облучения, по сравнению со флаконами S-нитрозоглутатиона, которые подвергали облучению. Анализировали контрольный уровень чистоты S-нитрозоглутатиона, уровень специфических примесей глутатиона (GSH), а также содержание окисленного глутатиона (GSSG) и общее содержание примесей. Флаконы подвергали либо электронно-лучевому облучению, либо гамма-облучению. Флаконы вынимали из контейнера с сухим льдом и стерилизовали при двух режимах облучения (15 кГр и 35 кГр), описанных ниже, в условиях более высокой температуры (при температуре окружающего воздуха в диапазоне от приблизительно 18 до 24°С и возможных колебаниях температуры флаконов до более высоких значений). После облучения флаконы немедленно обкладывали сухим льдом с температурой приблизительно -80°С и анализировали любые изменения чистоты после стерилизации по сравнению с контролем.
Электронно-лучевое облучение проводили с использованием подвижной несущей системы, настроенной на проведение облучения в дозе 15 кГр и 35 кГр. Облучение в дозе 15 кГр продолжалось приблизительно 10-15 минут, и температура достигала приблизительно 27,5°С (в Таблицах и на графических материалах обозначена ~27,5°С). Облучение в дозе 35 кГр продолжалось приблизительно 30 минут, и температура достигала приблизительно 27,5°С (в Таблицах и на графических материалах обозначена ~27,5°С). Дозу облучения определяли стандартными дозиметрами.
Гамма-облучение проводили с использованием подвижной несущей системы, настроенной на проведение облучения в дозе 15 кГр и 35 кГр. Облучение в дозе 15 кГр продолжалось приблизительно 8-10 часов, и температура достигала приблизительно 40°С. Облучение в дозе 35 кГр продолжалось приблизительно 18-24 часа и температура достигала приблизительно 60°С. Дозу облучения определяли стандартными дозиметрами.
Результаты показаны на Фиг. 1 и 3 и в Таблице 1.
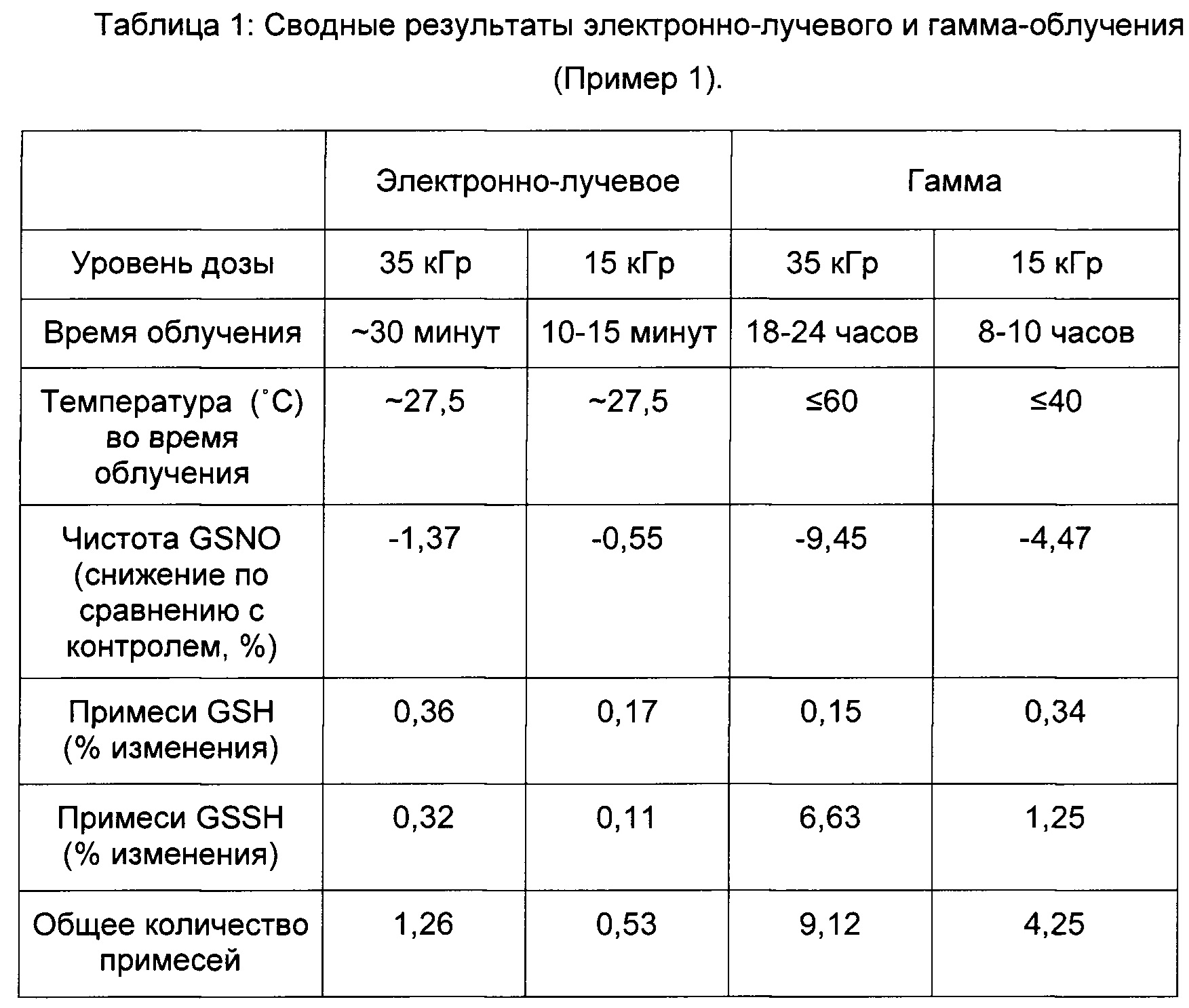

Электронно-лучевое облучение без ограничений по температурному режиму согласно Примеру 1 в дозе 15 кГр и 35 кГр приводило к дозозависимому снижению чистоты S-нитрозоглутатиона по результатам ВЭЖХ. Гамма-облучение без ограничений по температурному режиму согласно Примеру 1 в дозе 15 кГр и 35 кГр приводило к существенному снижению чистоты S-нитрозоглутатиона по результатам ВЭЖХ в зависимости от температуры, времени и дозы облучения. Применение ионизирующего излучения (электронно-лучевого и гамма-излучения) без ограничений по температурному режиму приводило к деградации S-нитрозоглутатиона, о чем свидетельствовало снижение чистоты по сравнению с контролем. При этом, деградация была более выраженной в случае гамма-излучения, чем в случае электронно-лучевого излучения.
Как показывают результаты, уровень специфических примесей GSH и GSSG и общее количество примесей снижалось после электронно-лучевого и гамма-излучения зависимым от температуры, времени и дозы радиации образом.
Пример 2. Стерилизация S-нитрозоглутатиона с помощью электронно-лучевого и гамма-излучения при ограничениях по температурному режиму
Протокол эксперимента в данном Примере имеет своей целью контролируемое исследование влияния температуры стерилизующего излучения на чистоту (а) приблизительно при -80°С и (б) при дополнительном охлаждении (при температуре окружающего воздуха в диапазоне от приблизительно 18 до 24°С и контроле температуры флаконов). Использовали те же дозы излучения, которые описаны в Примере 1.
В данном Примере образцы гранул S-нитрозоглутатиона из той же производственной серии, что и в Примере 1, находящиеся во флаконе из оранжевого стекла (100 мг/флакон), хранили перед стерилизацией приблизительно при -80°С. Температура -80°С в процессе облучения обеспечивалась присутствием сухого льда, который помещали для обеспечения низкой температуры флаконов, при исключении влияния на параметры действующей дозы излучения. Соответствующие контроли не подвергались облучению, но находились в аналогичных температурных условиях до, во время и после облучения, как и флаконы с S-нитрозоглутатионом, которые подвергали облучению.
Способ, использованный для электронно-лучевого облучения в данном эксперименте, был следующим:
Электронно-лучевое облучение проводили с использованием подвижной несущей системы. Флаконы с S-нитрозоглутатионом хранили в морозильной камере при -80°С и перед облучением переносили в контейнер с сухим льдом. Перед началом облучения флаконы с S-нитрозоглутатионом, предназначавшиеся для облучения при комнатной температуре (и контрольные флаконы), вынимали из морозильной камеры с температурой -80°С и переносили в местоположение, где поддерживалась окружающая температура 18°С.
Для флаконов, предназначенных для каждой целевой дозы и режима терморегулирования, использовали отдельные низкотемпературные контейнеры. На дно первого низкотемпературного контейнера помещали вторичную упаковочную коробку с центрированием по горизонтали, в которой находились флаконы в вертикальной ориентации. Положение каждого флакона в схеме расстановки документировали. Флаконы всегда облучали с той же стороны. На фиг. 4 показана возможная расстановка флаконов в контейнере для электронно-лучевого облучения. Стрелки с обозначением «е» указывают направление излучения. Для флаконов с S-нитрозоглутатионом, требующим организации холодовой цепи, вдоль каждой короткой боковой поверхности контейнера помещали сухой лед для обеспечения холодовой цепи в процессе облучения. Каждый контейнер помещали в контейнер для облучения.
Электронно-лучевой облучение в дозе 15 кГр и 35 кГр продолжалось несколько секунд.
После завершения необходимого процесса облучения облученные флаконы, содержащие S-нитрозоглутатион, и соответствующие контроли хранили при -80°С в морозильной камере для последующего анализа.
Способ, использованный для гамма-облучения в данном эксперименте, был следующим:
Гамма-облучение проводили с использованием гамма-излучения, испускаемого радиоактивным источником кобальт-60. Флаконы с S-нитрозоглутатионом хранили в морозильной камере при -80°С и перед облучением переносили в контейнер с сухим льдом. Перед началом облучения флаконы с S-нитрозоглутатионом, предназначавшиеся для облучения при комнатной температуре (и контрольные флаконы), вынимали из морозильной камеры с температурой -80°С и переносили в местоположение, где поддерживалась окружающая температура 18°С.
Для флаконов, предназначенных для каждой целевой дозы и режима терморегулирования, использовали отдельные низкотемпературные контейнеры, как описано выше в данном Примере применительно к электронно-лучевому режиму.
На дно первого низкотемпературного контейнера помещали вторичную упаковочную коробку с центрированием по горизонтали, в которой находились флаконы в вертикальной ориентации. На фиг. 5 показана возможная расстановка флаконов в контейнере для гамма-облучения. Стрелки с обозначением «γ» указывают направление излучения. Для препарата S-нитрозоглутатиона, требующего организации холодовой цепи, вдоль каждой короткой боковой поверхности низкотемпературного контейнера помещали сухой лед для обеспечения холодовой цепи в процессе облучения.
Каждый низкотемпературный контейнер помещали в контейнер для облучения с центрированием по горизонтали.
Облучение в дозе 15 кГр продолжалось 2 часа и 8 минут, тогда как облучение в дозе 35 кГр продолжалось приблизительно 5 часов и 8 минут
При необходимости перед проведением второго облучения добавляли сухой лед.
После завершения процесса облучения облученный продукт S-нитрозоглутатиона помещали в отведенную для этого морозильную камеру с температурой -80°С. После окончания второго облучения контрольные образцы переносили из местонахождения, где поддерживалась температура 18°С, в предназначенную для этого морозильную камеру с температурой -80°С. Регистрировали время переноса.
Результаты показаны на Фиг. 2 и 3 и в Таблице 2.


Электронно-лучевое облучение согласно Примеру 2 в дозе 15 кГр и 35 кГр приводило к незначительному зависимому от температуры, времени и дозы снижению чистоты S-нитрозоглутатиона (GSNO) по данным ВЭЖХ; Фиг. 2 и 3 (обозначенные (2) в Примере 2) и Таблица 2.
Гамма-облучение согласно Примеру 2 в дозе 15 кГр и 35 кГр приводило к незначительному зависимому от температуры, времени и дозы снижению чистоты S-нитрозоглутатиона (GSNO) по данным ВЭЖХ; Фиг. 2 и 3 (обозначенные (2) в Примере 2) и Таблица 6.
Во всех вариантах облучения в Примере 2 уровень специфических примесей GSH и GSSG и общее количество примесей увеличивалось после электронно-лучевого и гамма-облучения, демонстрируя небольшую зависимость от температуры, времени и уровня дозы, как показано в Таблице 2.
Обсуждение
Результаты, полученные в Примерах 1 и 2, обобщены в Таблицах 3 и 4.



Приведенные выше результаты демонстрируют, что существуют определенные оптимизированные условия стерилизации фармацевтических S-нитрозотиолов, например, таких как S-нитрозоглутатион. Исследовали разложение S-нитрозоглутатиона во флаконах после облучения (электронно-лучевого и гамма-облучения) при двух уровнях дозы (15 кГр и 35 кГр) с использованием различных условий (различные флаконы, различная продолжительность и температура облучения) в двух различных экспериментах. Данные исследования подтверждают, что ионизирующее излучение может вызывать разложение S-нитрозоглутатиона; при этом впервые продемонстрировано, что условия с определенной температурой, временем и дозой облучения могут минимизировать его разложение, обеспечивая соответствие нормативным требованиям к фармацевтической продукции. Судя по всему, электронно-лучевое облучение в меньшей степени вызывает разложение S-нитрозоглутатиона по сравнению с эквивалентной дозой гамма-облучения. Разложение минимизируется путем понижения температуры и сокращения продолжительности облучения.
Приведенное выше описание излагает изобретение в общих чертах, без ограничения. Изобретение охватывает варианты и модификации, которые будут очевидны специалистам в области техники. Объем правовой защиты, предоставляемый данному изобретению, определяется приведенной ниже формулой изобретения, истолковываемой в соответствии с законодательством.
Список литературы
В предшествующем описании приведены ссылки на следующие документы:
Ann DU, Lee EJ (2002). Production of off-odor volatiles from liposome-containing aminoacid homopolymers by irradiation. J Food Sci 67: 7.
Al-Sa'doni H, Ferro A (2000). S-Nitrosothiols: a class of nitric oxide-donor drugs. Clin Sci (Lond) 98: 507-520.
Butler AR, Rhodes P (1997). Chemistry, analysis, and biological roles of S-nitrosothiols. Anal Biochem 249: 1-9.
Hart TW (1985). Tetrahedron Letters, 26(16), 1985, 2013 to 2016.
Keaney JF, Jr., Simon DI, Stamler JS, Jaraki O, Scharfstein J, Vita JA, et al. (1993). NO forms an adduct with serum albumin that has endothelium-derived relaxing factor-like properties. J Clin Invest 91: 1582-1589.
Lin C-E, Garvey DS (2005). Identification of the nitrate produced from gamma-radiation sterilization of S-Nitrosoglutathione. Abstract ANYL174, General Papers 1.00pm to 9.00pm, 28 August 2005, Hall A Poster, 230th ACS Meeting, Washington DC, 28 August -1 September 2005.
Looker D, Beyer W (2008). WO 2008/153762 A2 S-nitrosothiol formulations and storage systems.
Manoj VM, Aravind Usha K, Aravindakumar CT (2009). Decomposition of S-Nitrosothiols Induced by UV and Sunlight. Advances in Physical Chemistry 2009: 6.
Parent M, Dahboul F, Schneider R, Clarot I, Maincent P, Leroy P, et al. (2013). A Complete Physicochemical Identity Card of S-nitrosoglutathione. Current Pharmaceutical Analysis 9: 12.
Radomski MW, Rees DD, Dutra A, Moncada S (1992). S-nitroso-glutathione inhibits platelet activation in vitro and in vivo. Br J Pharmacol 107: 745-749.
Rees DD, Palmer RM, Moncada S (1989a). Role of endothelium-derived nitric oxide in the regulation of blood pressure. Proc Natl Acad Sci USA 86: 3375-3378.
Rees DD, Higgs A, Moncada S (2001). Nitric Oxide and the Vessel Wall. In: Wilkins LW (ed). Hemostasis and Thrombosis, edn. р^рр 10.
Rees DD, Palmer RM, Hodson HF, Moncada S (1989b). A specific inhibitor of nitric oxide formation from L-arginine attenuates endothelium-dependent relaxation. Br J Pharmacol 96: 418-424.
Singh RJ, Hogg N, Joseph J, Kalyanaraman В (1995). Photosensitized decomposition of S-nitrosothiols and 2-methyl-2-nitrosopropane. Possible use for site-directed nitric oxide production. FEBS Lett 360: 47-51.
Singh RJ, Hogg N, Joseph J, Kalyanaraman В (1996a). Mechanism of nitric oxide release from S-nitrosothiols. J Biol Chem 271: 18596-18603.
Singh SP, Wishnok JS, Keshive M, Deen WM, Tannenbaum SR (1996b). The chemistry of the S-nitrosoglutathione/glutathione system. Proc Natl Acad Sci U S A 93: 14428-14433.
Stamler JS, Toone EJ (2002). The decomposition of thionitrites. Current opinion in chemical biology 6: 779-785.
Stamler JS, Jaraki O, Osborne J, Simon Dl, Keaney J, Vita J, et al. (1992). Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proc Natl Acad Sci USA89: 7674-7677.
Реферат
Группа изобретений относится к стерильным S-нитрозотиолам и стерильным фармацевтическим предшественникам, содержащим S-нитрозотиолы, из которых могут быть приготовлены стерильные фармацевтические композиции с одним или более стерильными фармацевтическими разбавителями, эксципиентами, носителями, дополнительными активными агентами или любой их комбинацией, по желанию, для фармацевтического или ветеринарного применения. Способ получения стерильного сухого твердого S-нитрозотиола со степенью чистоты S-нитрозотиола по меньшей мере приблизительно 95,0% и гарантированным уровнем стерильности (SAL), равным 10-6или ниже, включает воздействие на сухой твердый S-нитрозотиол стерилизующей дозы ионизирующего излучения в окружающей среде, защищенной от внешнего загрязнения, где температуру сухого твердого вещества во время стерилизующего воздействия ионизирующего излучения поддерживают не выше приблизительно 40ºC. Также раскрывается способ получения стерильного сухого твердого предшественника фармацевтической композиции, стерильный сухой твердый S-нитрозотиол, стерильный сухой твердый предшественник фармацевтической композиции, способ получения стерильной фармацевтической композиции для применения у человека или в ветеринарии, фармацевтическая композиция, содержащая S-нитрозотиол для лечения или профилактики состояния, заболевания или расстройства, которые отвечают на терапию S-нитрозотиолом или NO, набор для получения фармацевтической композиции, содержащей S-нитрозотиол. Группа изобретений обеспечивает получение стерильного S-нитрозотиолам со степенью чистоты, подходящей для клинического применения. 7 н. и 50 з.п. ф-лы, 5 ил., 4 табл., 2 пр.
Формула
Документы, цитированные в отчёте о поиске
Стабильные s-нитрозотиолы, способ получения и применение

Комментарии