Целастрол и его производные для лечения ожирения - RU2706239C2
Код документа: RU2706239C2
Чертежи





















Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет по U.S.S.N. 61/970,839, поданной 26 марта 2014. г, и она является частично продолжением PCT/US2013/061911, поданной 26 сентября 2013 г., по которой испрашивается приоритет и преимущества в соответствии с Предварительной заявкой на патент США № 61/706,153, все из которых полностью включены в данный документ.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение принадлежит к области соединений для регуляции ожирения и способов их получения и применения.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Ожирение является медицинским состоянием, при котором избыточное содержание жира в организме накапливается до степени, которая может оказывать неблагоприятное воздействие на здоровье, приводящее к сниженной продолжительности жизни и/или возрастающим проблемам со здоровьем. Индекс массы тела (ИМТ), показатель, который сравнивает массу тела и рост, определяет людей как имеющих избыточную массу тела (предожирение или избыточная масса тела), если их ИМТ находится между 25 и 30 кг/м2, и имеющих ожирение, когда он превышает 30 кг/м2. Ожирение является ведущей предупреждаемой причиной смерти во всем мире, с увеличивающимся уровнем распространения у взрослых и детей, и государственные органы рассматривают его, как одну из наиболее серьезных проблем здравоохранения 21-го века.
Ожирение увеличивает риск многих физических и умственных состояний. Избыточная масса тела ассоциируется с различными заболеваниями, в частности, сердечно-сосудистыми заболеваниями, сахарным диабетом второго типа, синдромом обструктивного апноэ во сне, некоторыми типами злокачественных новообразований и остеоартритом. В результате, было обнаружено, что ожирение снижает продолжительность жизни. Эти заболевания либо непосредственно вызываются ожирением или косвенно соотносятся посредством механизмов, имеющих общую причину, такую как плохое питание или малоподвижный образ жизни. Одна из сильнейших связей существует с диабетом второго типа. Избыточное содержание жира в организме лежит в основе 64% случаев диабета у мужчин и 77% случаев у женщин. Увеличения содержания жира в организме изменяет ответную реакцию организма на инсулин, возможно, приводящую к резистентности к инсулину.
Ожирение является одной из ведущих предупреждаемых причин смерти во всем мире. Ожирение, как правило, вызывается сочетанием избыточного потребления калорий, недостатком физической активности, и генетической чувствительностью, хотя причиной несколько случаев являются прежде всего гены, эндокринные нарушения, лекарственные терапии или психическая болезнь. Возрастающие степени ожирения на социальном уровне, по-видимому, обусловлены легко доступным и вкусным питанием, увеличенной зависимостью от автомобилей и механизированным производством. Со времени открытия лептина в 1994 г., были установлены многие другие гормональные механизмы, которые участвуют в регуляции аппетита и потреблении пищи, схемах накопления жировой ткани, и развитии резистентности к инсулину, включающие грелин, инсулин, орексин, PYY 3-36, холецистокинин и адипонектин.
Адипокины представляют собой медиаторы, продуцируемые жировой тканью; полагают, что их действие модифицирует многие заболевания, относящиеся к ожирению. Лептин и грелин считаются дополняющими друг друга при их влиянии на аппетит, причем грелин, продуцируемый желудком, модулирует кратковременный контроль над аппетитом (т.е., есть, когда желудок пуст, и остановиться, когда желудок растянут). Лептин продуцируется жировой тканью, чтобы сигнализировать о жировых запасах в организме, и опосредует долговременные аппетитивные контроли (т.е., есть больше, когда жировые запасы являются низкими, и меньше, когда жировые запасы являются высокими). Несмотря на то, что введение лептина может быть эффективным у небольшого подкласса индивидуумов с ожирением, которые являются дефицитными по лептину, полагают, что индивидуумы с наибольшим ожирением являются резистентными к лептину, и обнаруживают высокие уровни лептина. Полагают, что эта резистентность объясняет отчасти, почему введение лептина не продемонстрировало эффективность при угнетении аппетита у людей с наибольшим ожирением.
В то время как лептин и грелин продуцируются периферически, они управляют аппетитом посредством их действий на центральную нервную систему. В частности, они и другие, относящиеся к аппетиту гормоны, действуют на гипоталамус, область мозга, являющуюся центральной для регуляции потребления пищи и расхода энергии. В гипоталамусе существует несколько контуров, которые способствуют его роли при интеграции аппетита, причем путь меланокортина является наиболее понятным. Контур начинается с дугообразного ядра, области гипоталамуса, которая имеет выходы на латеральный гипоталамус и вентромедиальный гипоталамус, мозговые центры кормления и насыщения, соответственно.
Дугообразное ядро содержит две различающиеся группы нейронов. Первая группа коэкспрессирует нейропептид Y (NPY) и агути-связанный пептид (AgRP) и имеет стимулирующие входные воздействия на LH и ингибирующие входные воздействия на VMH. Вторая группа коэкспрессирует про-опиомеланокортин (POMC) и регулируемый кокаином и амфетамином транскрипт (CART) и имеет стимулирующие входные воздействия на VMH и ингибирующие входные воздействия на LH. Следовательно, нейроны NPY/AgRP стимулируют потребление пищи и ингибируют насыщение, в то время, как нейроны POMC/CART стимулируют насыщение и ингибируют потребление пищи. Обе группы нейронов дугообразного ядра частично регулируются лептином. Лептин ингибирует группу NPY/AgRP, в то же время, стимулируя группу POMC/CART. Таким образом, недостаточность сигнального пути лептина, либо через недостаточность лептина или резистентность к лептину, приводит к перееданию. Это может обуславливать некоторые генетические и приобретенные формы ожирения.
Соблюдение диеты и физические упражнения являются основными направлениями лечения ожирения. Для дополнения этих направлений, или в случае неудачи, можно принимать лекарственные средства против ожирения для снижения аппетита или ингибирования всасывания жира. В тяжелых случаях, проводят хирургическое вмешательство или помещают внутрижелудочный баллон для уменьшения объема желудка и/или длины кишечника, приводящие к более раннему насыщению и пониженной способности к всасыванию питательных компонентов из пищи. Поддержание такого снижения массы тела часто является трудным и зачастую требует сделать физические упражнения и низкоэнергетическую диету постоянной частью образа жизни индивидуума. Показатели эффективности поддержания долговременного снижения массы тела при изменении образа жизни являются низкими, в интервале 2-20%.
Для лечения ожирения доступен ограниченный ряд лекарственных терапий. Обеспокоенность в связи с побочными эффектами снизила увлечение угнетающими аппетит лекарственными средствами, конкретно, фенфлурамином, сибутрамином и фентермином, которые несут с собой серьезные риски и были удалены с рынка. Фентермин разрешен только для кратковременного применения. Орлистат (Ксеникал®) представляет собой медицинский препарат, который блокирует всасывание жира, входящего в рацион, и также является разрешенным для длительного применения. Однако он вызывает неприятные побочные эффекты (сальный стул), и требует дополнения жирорастворимыми витаминами.
Несмотря на то, что хирургическое вмешательство (такое как обходной желудочный анастомоз) является последней надеждой для лечения ожирения, оно может быть крайне эффективным. Однако, оно должно проводиться в имеющем такой опыт хирургическом центре, поскольку такие операции могут нести с собой значительные риски, особенно в послеоперационный период. Усредненные рекомендации сводятся к ограничению хирургических терапий для пациентов с патологическим ожирением (ИМТ > 40, ИМТ > 35 плюс сопутствующее заболевание, или ИМТ > 30 с неконтролируемым диабетом).
Ряд средств для похудения является доступным в местных аптеках, супермаркетах или магазинах здоровой пищи. Даже еще больше опций доступно в интернете. Для большинства эффективность не является доказанной, и некоторые могут быть попросту опасными. Таблица 1 (ниже) показывает наиболее часто применяемые средства для похудения, и какое исследование демонстрирует их эффективность и безопасность.
Экстракты лекарственных трав часто являются загрязненными и содержат так много различных веществ, что трудно оценить, является ли смесь в целом эффективной, и тем более, что входит в состав эффективной дозировки. При наличии сотен или более различных соединений в смеси, для активности может требоваться более одного соединения, или одно соединение может ингибировать активность другого соединения, таким образом, источник и обработка исходного сырьевого материала могут приводить в результате к неактивному или даже опасному продукту.
Таблица 1: Отдельные продукты для снижения массы тела. Источники: Администрация США по пищевым продуктам и лекарственным веществам, 2010; Всесторонняя база данных лекарственных средств природного происхождения, 2010
Следовательно, целью настоящего изобретения является предоставить безопасные, хорошо охарактеризованные и эффективные соединения для воздействия на снижение массы тела, и способы их применения.
Дополнительной целью настоящего изобретения является предоставить лекарственную форму для перорального применения для стимуляции снижения массы тела, и способы ее применения.
КРАТКОЕ СОДЕРЖАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем документе описаны активные средства для стимуляции снижения массы тела, а также лекарственные формы, содержащие эти активные средства, и способы их применения.
Иллюстративные соединения включают соединения, определенные Формулой I

Формула I
в которой
пунктирные линии между A и C2, C1 и C2, C1 и C7, C7 и C5, C5 и C6, и C8 и C9 указывают на то, что могут присутствовать одинарная или двойная связь, как позволяет валентность;
R1 представляет собой карбоновую кислоту (-COOH), первичный амид (например, -CONH2), вторичный амид (например, CONHR7), третичный амид (например, -CONR7R7), вторичный карбамат (например, -OCONHR7; NHCOOR7), третичный карбамат (например, -OCONR7R7; -NR7COOR7), мочевину (например, NHCONHR7; NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), карбинол (например, -CH2OH; CHR7OH, -CR7R7OH), простой эфир (например, -OR7), сложный эфир (например, -COOR7), спирт (-OH), тиол (-SH), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин(например, -NR7R7), простой тиоэфир (например, -SR7), сульфинильную группу (например, -SOR7), сульфонильную группу (например, -SOOR7), сульфиногруппу, галоген, нитрит, циано, нитро или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную (например, тетразольную) группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
R2 представляет собой водород; гидрокси (-OH), тиол (-SH), простой эфир (например, -OR7), простой тиоэфир (например, -SR7), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин (например, -NR7R7), первичный амид (например, -CONH2), вторичный амид (например, -NHCOR7), третичный амид (например, -NR7COR7), вторичный карбамат (например, -OCNHR7; -NHCOOR7), третичный карбамат (например, OCONR7R7; NR7COOR7), мочевину (например, -NHCONHR7; -NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), сульфинильную группу (например, SOR7), сульфонильную группу (например, -SOOR7) сульфиногруппу, галоген, нитрит, циано, нитро, или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
A представляет собой азот или кислород, когда двойная связь присутствует между A и C2, или кислород, когда одинарная связь присутствует между A и C2;
R3 представляет собой водород, карбонильную группу (например, -COR7), или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
R4 отсутствует, когда А представляет собой кислород, и двойная связь присутствует между A и C2, гидрокси (-OH) группу, когда A представляет собой азот и двойная связь присутствует между A и C2, или представляет собой водород, карбонильную группу (например, -COR7), или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила, когда А представляет собой кислород, и одинарная связь присутствует между A и C2; или
А представляет собой кислород, одинарная связь присутствует между A и C2, и R3 и R4, взятые вместе с A, C2, C3, и O1, образуют 5-7-членное кольцо, необязательно замещенное одним-четырьмя заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира или карбоновой кислоты;
R5 представляет собой водород; гидрокси (-OH), тиол (-SH), простой эфир (например, -OR7), простой тиоэфир (например, -SR7), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин (например, -NR7R7), первичный амид (например, -CONH2), вторичный амид (например, -NHCOR7), третичный амид (например, -NR7COR7), вторичный карбамат (например, -OCONHR7; -NHCOOR7), третичный карбамат (например, -OCONR7R7; -NR7COOR7), мочевину (например, -NHCONHR7; -NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), сульфинильную группу (например, -SOR7), сульфонильную группу (например, -SOOR7) сульфиногруппу, галоген, нитрит, циано или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
R6 отсутствует, когда двойная связь присутствует между C8 и C9, представляет собой водород; гидрокси (-OH), тиол (-SH), простой эфир (например, -OR7), простой тиоэфир (например, -SR7), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин (например, -NR7R7), первичный амид (например, -CONH2), вторичный амид (например, -NHCOR7), третичный амид (например, -NR7COR7), вторичный карбамат (например, -OCONHR7; -NHCOOR7), третичный карбамат (например, -OCONR7R7; -NR7COOR7), мочевину (например, -NHCONHR7; -NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), сульфинильную группу (например, -SOR7), сульфонильную группу (например, -SOOR7) сульфиногруппу, галоген, нитрит, или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила, когда одинарная связь присутствует между C8 и C9; или
одинарная связь присутствует между C8 и C9, и R5 и R6, взятые вместе с C8 и C9, образуют циклопропильное или эпоксидное кольцо; и
R7, когда присутствует, индивидуально, в каждом случае, представляет собой алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила, или две группы R7берутся вместе для образования циклоалкильной, гетероциклоалкильной, арильной или гетероарильной группы, необязательно замещенной одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты, арила, или O3M, где М представляет собой противоион;
или их фармацевтически приемлемую соль или пролекарство,
где соединение присутствует в терапевтически эффективном количестве, чтобы индуцировать снижение массы тела у пациента с предожирением, ожирением или патологическим ожирением; снизить содержание жира в организме у пациента с предожирением, ожирением или патологическим ожирением; снизить потребление пищи у пациента с предожирением, ожирением или патологическим ожирением; улучшить гомеостаз глюкозы у пациента с предожирением, ожирением или патологическим ожирением; или иметь комбинацию этих воздействий, и где, по меньшей мере, один из R1, R2, R3, R4, R5, R6 и R7, когда присутствует, содержит нитрогруппу.
В нескольких вариантах осуществления формулы I, двойная связь присутствует между A и C2, Cl и C7, C5 и C6, и C8 и C9, и одинарная связь присутствует между C1 и C2, и C7 и C5. В других вариантах осуществления Формулы I, двойная связь присутствует между C1 и C2, C7 и C5, и C8 и C9, и одинарная связь присутствует между A и C2, Cl и C7, и C5 и C6.
В конкретных вариантах осуществления Формулы I, R1 представляет собой карбоновую кислоту, сложный эфир, или амид; R2 представляет собой водород, простой эфир (-OR7) или простой тиоэфир (-SR7); и R7 представляет собой С1-C12, более предпочтительно, C1-C8 алкильную группу, необязательно замещенную одним-тремя заместителями, индивидуально выбранными из алкила, амина, галогена, гидроксила, сложного эфира, амида и карбоновой кислоты (например, R1 представляет собой тетразол).
Соединения изобретения могут вводиться пациенту, нуждающемуся в этом, например, внутрибрюшинно, один раз в день при дозе, равной 10 мкг/кг, 50 мкг/кг или 100 мкг/кг.
В некоторых вариантах осуществления, соединение формулы I представляет собой одно из следующих соединений или его фармацевтически приемлемые соль или пролекарство




В некоторых вариантах осуществления, соединение представляет собой соединение, определенное Формулой II

Формула II
в которой
пунктирные линии между A и C2, Cl и C2, Cl и C7, C7 и C5, C5 и C6, и C8 и C9 указывают на то, что могут присутствовать одинарная или двойная связь, как позволяет валентность;
X представляет собой -O-, -NR7-, -S-, -SO-, или -SO2-;
R1 представляет собой водород, или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира и арила;
R2 представляет собой водород; гидрокси (-OH), тиол (-SH), простой эфир (например, -OR7), простой тиоэфир (например, -SR7), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин (например, -NR7R7), первичный амид (например, -CONH2), вторичный амид (например, -NHCOR7), третичный амид (например, -NR7COR7), вторичный карбамат (например, -OCNHR7; -NHCOOR7), третичный карбамат (например, OCONR7R7; NR7COOR7), мочевину (например, -NHCONHR7; -NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), сульфинильную группу (например, SOR7), сульфонильную группу (например, -SOOR7) сульфиногруппу, галоген, нитрит, циано, нитро, или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
A представляет собой азот или кислород, когда двойная связь присутствует между A и C2, или кислород, когда одинарная связь присутствует между A и C2;
R3 представляет собой водород, карбонильную группу (например, -COR7), или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
R4 отсутствует, когда А представляет собой кислород, и двойная связь присутствует между A и C2, гидрокси (-OH) группу, когда A представляет собой азот, и двойная связь присутствует между A и C2, или представляет собой водород, карбонильную группу (например, -COR7), или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила, когда А представляет собой кислород, и одинарная связь присутствует между A и C2; или
А представляет собой кислород, одинарная связь присутствует между A и C2, и R3 и R4, взятые вместе с A, C2, C3, и O1, образуют 5-7-членное кольцо, необязательно замещенное одним-четырьмя заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира или карбоновой кислоты;
R5 представляет собой водород; гидрокси (-OH), тиол (-SH), простой эфир (например, -OR7), простой тиоэфир (например, -SR7), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин (например, -NR7R7), первичный амид (например, -CONH2), вторичный амид (например, -NHCOR7), третичный амид (например, -NR7COR7), вторичный карбамат (например, -OCONHR7; -NHCOOR7), третичный карбамат (например, -OCONR7R7; -NR7COOR7), мочевину (например, -NHCONHR7; -NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), сульфинильную группу (например, -SOR7), сульфонильную группу (например, -SOOR7) сульфиногруппу, галоген, нитрит, циано или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
R6 отсутствует, когда двойная связь присутствует между C8 и C9, представляет собой водород; гидрокси (-OH), тиол (-SH), простой эфир (например, -OR7), простой тиоэфир (например, -SR7), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин (например, -NR7R7), первичный амид (например, -CONH2), вторичный амид (например, -NHCOR7), третичный амид (например, -NR7COR7), вторичный карбамат (например, -OCONHR7; -NHCOOR7), третичный карбамат (например, -OCONR7R7; -NR7COOR7), мочевину (например, -NHCONHR7; -NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), сульфинильную группу (например, -SOR7), сульфонильную группу (например, -SOOR7) сульфиногруппу, галоген, нитрит, или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила, когда одинарная связь присутствует между C8 и C9; или
одинарная связь присутствует между C8 и C9, и R5 и R6, взятые вместе с C8 и C9, образуют циклопропильное или эпоксидное кольцо; и
R7, когда присутствует, индивидуально, в каждом случае, представляет собой алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила, или две группы R7берутся вместе для образования циклоалкильной, гетероциклоалкильной, арильной или гетероарильной группы, необязательно замещенной одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты, арила, или O3M, где М представляет собой противоион;
или его фармацевтически приемлемую соль или пролекарство.
В нескольких вариантах осуществления формулы II, двойная связь присутствует между A и C2, Cl и C7, C5 и C6, и C8 и C9, и одинарная связь присутствует между C1 и C2, и C7 и C5. В других вариантах осуществления Формулы II, двойная связь присутствует между C1 и C2, C7 и C5, и C8 и C9, и одинарная связь присутствует между A и C2, C1 и C7, и C5 и C6.
В нескольких вариантах осуществления формулы II, X представляет собой O или -NR7-; R1 представляет собой водород или алкильную группу, необязательно замещенную одним-тремя заместителями, индивидуально выбранными из алкила, амина, галогена, гидроксила, сложного эфира, амида и карбоновой кислоты; R2 представляет собой водород, простой эфир (-OR7) или простой тиоэфир (-SR7); и R7 представляет собой индивидуально, для каждого случая, C1-C12, более предпочтительно, C1-C8 алкильную группу, необязательно замещенную одним-тремя заместителями, индивидуально выбранными из алкила, амина, галогена, гидроксила, сложного эфира, амида и карбоновой кислоты.
В некоторых вариантах осуществления, соединение представляет собой соединение, определенное Формулой III.
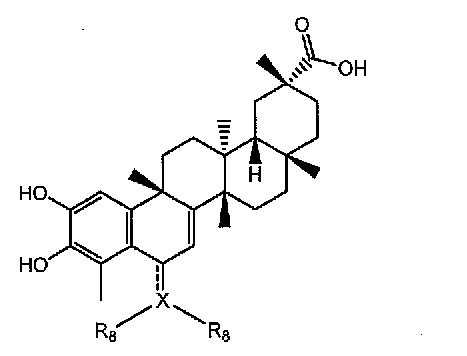
Формула III
В нескольких вариантах осуществления формулы III, X представляет собой C, CH, O, N, или S. R8, когда присутствует, индивидуально, в каждом случае, представляет собой водород или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную, нитро, сложноэфирную, гетероарильную группу, или X и две группы R8 берутся вместе для образования циано или алкинила, необязательно замещенного одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты, арила, или O3M, где М представляет собой противоион, или две группы R8берутся вместе для образования циклоалкильной, гетероциклоалкильной, арильной или гетероарильной группы, необязательно замещенной одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты, арила или O3M, где М представляет собой противоион;
или их фармацевтически приемлемую соль или пролекарство.
В некоторых вариантах осуществления, соединение формулы III представляет собой одно из следующих соединений или его фармацевтически приемлемые соль или пролекарство



В некоторых вариантах осуществления, соединение представляет собой соединение, определенное Формулой IV.

Формула IV,
где X представляет собой C(O) или CH2;
R9 представляет собой водород или алкил, циклоалкил, гетероциклоалкил, алкиларил, алкенил, алкинил, карбоновую кислоту, арильную или гетероарильную группу, необязательно замещенные одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила;
или его фармацевтически приемлемые соль или пролекарство.
В конкретных вариантах осуществления, соединение формулы IV представляет собой одно из следующих соединений или его фармацевтически приемлемые соль или пролекарство

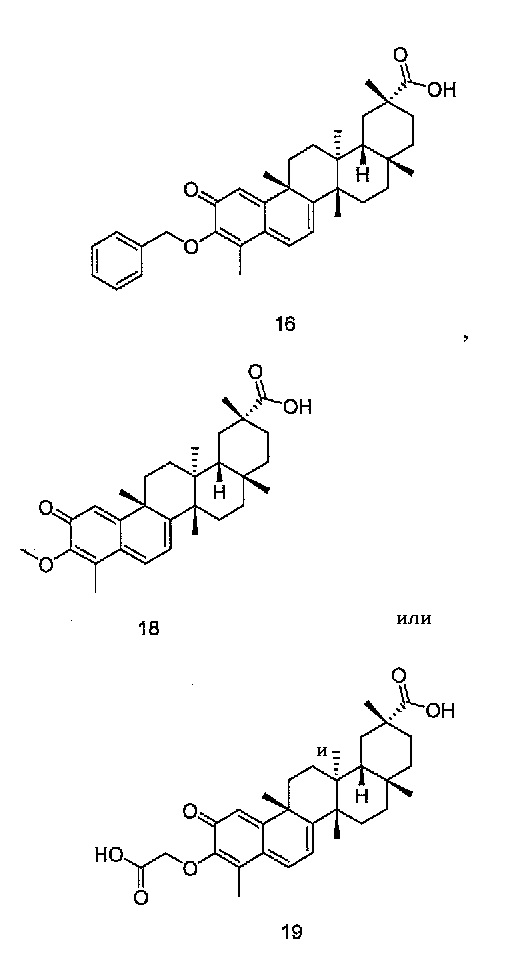
Соединения, описанные выше, могут иметь один или несколько хиральных центров, и, следовательно, могут существовать в виде двух или нескольких уникальных стереоизомеров.
В нескольких вариантах осуществления, соединения, описанные в данном документе, имеют следующую стереохимию:


В конкретных вариантах осуществления, соединение представляет собой одно из следующих соединений
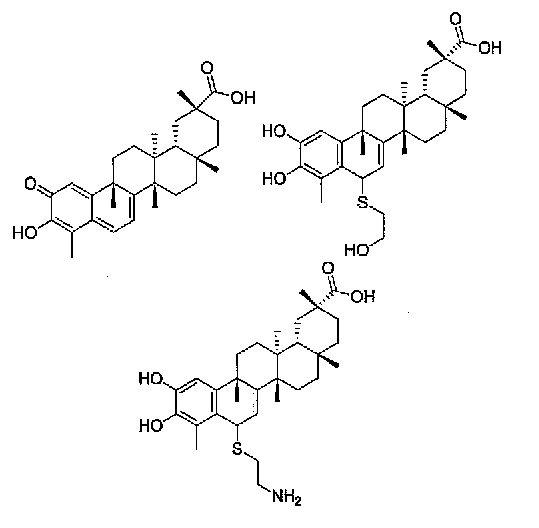


Также предоставлены фармацевтические композиции, содержащие терапевтически эффективное количество соединения, или его фармацевтически приемлемых соли или пролекарства, в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами. Фармацевтические композиции могут вводиться, чтобы индуцировать снижение массы тела у пациента с предожирением, ожирением или патологическим ожирением, снизить содержание жира в организме у пациента с предожирением, ожирением или патологическим ожирением, снизить потребление пищи у пациента с предожирением, ожирением или патологическим ожирением, улучшить гомеостаз глюкозы у пациента с предожирением, ожирением или патологическим ожирением, или иметь комбинацию этих воздействий.
В конкретных вариантах осуществления, соединение вводится совместно с лептином или аналогом лептина, такого как r-метХуЛептин (A-100, МЕТРЕЛЕПТИН®), доступный от Amylin Pharmaceuticals (Сан-Диего, Калифорния).
В нескольких случаях, фармацевтическую композицию, содержащую одно или несколько из соединений, вводят пациенту с предожирением, ожирением или патологическим ожирением в терапевтически эффективном количестве, чтобы индуцировать снижение массы тела, предпочтительно, в терапевтически эффективном количестве и с временем введения, чтобы уменьшить массу тела или содержание жира в организме, по меньшей мере, на 10%, более предпочтительно, по меньшей мере, на 15%, наиболее предпочтительно, по меньшей мере, на 20% или более.
В нескольких случаях, фармацевтическую композицию, содержащую одно или несколько из соединений, вводят пациенту с предожирением, ожирением или патологическим ожирением в терапевтически эффективном количестве, чтобы снизить потребление пищи, аппетит, или их комбинации, предпочтительно в терапевтически эффективном количестве, чтобы снизить среднее ежедневное потребление пищи (с точки зрения учета калорий), по меньшей мере, на 15%, более предпочтительно, по меньшей мере, на 25%, наиболее предпочтительно, по меньшей мере, на 35% или более.
В нескольких случаях, фармацевтическую композицию, содержащую одно или несколько из соединений, вводят пациенту с предожирением, ожирением или патологическим ожирением в терапевтически эффективном количестве, чтобы улучшить гомеостаз глюкозы, предпочтительно, в терапевтически эффективном количестве, чтобы снизить средний уровень глюкозы в плазме крови натощак, по меньшей мере, на 10%, более предпочтительно, по меньшей мере, на 15%, наиболее предпочтительно, по меньшей мере, на 20% или более. В случаях, когда фармацевтические композиции вводят для нормализации сахара в крови, лекарственные формы предпочтительно вводят в количестве, эффективном, чтобы снизить уровни глюкозы в крови до менее, чем приблизительно 180 мг/дл. Лекарственные формы могут вводиться совместно с другими противодиабетическими терапиями, при необходимости, чтобы улучшить гомеостаз глюкозы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ.1 A-D иллюстрируют эффект целастрола, вводимого внутрибрюшинно (в/б), на потребление пищи, массу тела и уровни глюкозы в крови у мышей с ожирением, получавших диету с высоким содержанием жира (диету ВЖД). ФИГ. 1A представляет собой график, на который нанесена масса тела мышей с ожирением, находящихся на диете ВЖД (в граммах), как функция времени (дней) лечения целастролом при различных дозах (контрольный растворитель (кривая с ромбами), 10 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с кругами), 50 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с треугольниками), и 100 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с квадратами)). ФИГ. 1B представляет собой график, на который нанесены процентное снижение массы тела у мышей с ожирением, находящихся на диете ВЖД (в граммах) как функция времени (дней) при лечении целастролом при различных дозах (контрольный растворитель (кривая с ромбами), 10 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с кругами), 50 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с треугольниками), и 100 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с квадратами)). ФИГ. 1C представляет собой гистограмму, иллюстрирующую потребление пищи (в граммах/день) у мышей с ожирением, находящихся на диете ВЖД во время курса лечения целастролом при различных дозах (слева направо, контрольный растворитель, 10 мкг/кг целастрола внутрибрюшинно один раз в день, 50 мкг/кг целастрола внутрибрюшинно один раз в день, и 100 мкг/кг целастрола внутрибрюшинно один раз в день). ФИГ. 1D представляет собой гистограмму, иллюстрирующую уровень глюкозы в крови после 6-часового голодания (в мг/дл) мышей с ожирением на диете ВЖД в конце двухнедельного лечения целастролом при различных дозах (слева направо, контрольный растворитель, 10 мкг/кг целастрола внутрибрюшинно один раз в день, 50 мкг/кг целастрола внутрибрюшинно один раз в день, и 100 мкг/кг целастрола внутрибрюшинно один раз в день). Во всех случаях, n=5 мышей на группу. *, p<0,05; **, p<0,01; ***, p<0,001 по параметрическому t-критерию Стьюдента. Результаты основаны на данных ежедневного потребления пищи, полученные во время первых трех дней.
ФИГ. 2A-2C иллюстрируют эффект целастрола, вводимого внутрибрюшинно (в/б), на потребление пищи, массу тела и уровни глюкозы в крови тощих мышей. ФИГ. 2A представляет собой график, на который нанесена масса тела тощих мышей (в граммах) как функция времени (дней) при лечении целастролом при различных дозах (контрольный растворитель (кривая с ромбами), 50 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с кругами), 100 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с треугольниками), и 500 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с квадратами)). ФИГ. 2B представляет собой гистограмму, иллюстрирующую потребление пищи (в граммах/день) тощих мышей во время курса лечения целастролом при различных дозах (слева направо, контрольный растворитель, 50 мкг/кг целастрола внутрибрюшинно один раз в день, 100 мкг/кг целастрола внутрибрюшинно один раз в день, и 500 мкг/кг целастрола внутрибрюшинно один раз в день). ФИГ. 2C представляет собой гистограмму, иллюстрирующую уровень глюкозы в крови после 6-часового голодания (в мг/дл) тощих мышей в конце двухнедельного лечения целастролом при различных дозах (слева направо, контрольный растворитель, 10 мкг/кг целастрола внутрибрюшинно один раз в день, 50 мкг/кг целастрола внутрибрюшинно один раз в день, и 100 мкг/кг целастрола внутрибрюшинно один раз в день). Во всех случаях, n=5 мышей на группу. *, p<0,05; **, p<0,01; ***, p<0,001 по параметрическому t-критерию Стьюдента.
ФИГ. 3A-3C иллюстрируют эффект целастрола, вводимого внутрибрюшинно (в/б), на потребление пищи, массу тела, и уровни глюкозы в крови дефицитных по лептину (ob/ob) мышей. ФИГ. 3A представляет собой график, на который нанесена масса тела ob/ob мышей (в граммах) как функция времени (дней) при лечении целастролом (контрольный растворитель (кривая с ромбами), 100 мкг/кг целастрола в 25 мкл ДМСО внутрибрюшинно один раз в день (кривая с квадратами)). ФИГ. 3B представляет собой гистограмму, иллюстрирующую потребление пищи (в граммах/день) ob/ob мышей во время курса лечения целастролом (левый столбик, контрольный растворитель; правый столбик, 100 мкг/кг целастрола внутрибрюшинно один раз в день). ФИГ. 3C представляет собой гистограмму, иллюстрирующую уровень глюкозы в крови после 6-часового голодания (в мг/дл) ob/ob мышей в конце двухнедельного лечения целастролом (левый столбик, контрольный растворитель; правый столбик, 100 мкг/кг целастрола внутрибрюшинно один раз в день). Во всех случаях, n=5 мышей на группу. *, p<0,05; **, p<0,01; ***, p<0,001 по параметрическому t-критерию Стьюдента. NS=незначительно.
ФИГ. 4A-4C иллюстрируют эффект целастрола, вводимого внутрибрюшинно (в/б), на потребление пищи, массу тела и уровни глюкозы в крови дефицитных по рецептору лептина (db/db) мышей. ФИГ. 4A представляет собой график, на который нанесена масса тела db/db мышей (в граммах) как функция времени (дней) при лечении целастролом (контрольный растворитель (кривая с ромбами), 100 мкг/кг целастрола в 25 мкл ДМСО внутрибрюшинно один раз в день (кривая с квадратами)). ФИГ. 4B представляет собой гистограмму, иллюстрирующую потребление пищи (в граммах/день) db/db мышей во время курса лечения целастролом (левый столбик, контрольный растворитель; правый столбик, 100 мкг/кг целастрола внутрибрюшинно один раз в день). ФИГ. 4C представляет собой гистограмму, иллюстрирующую уровень глюкозы в крови после 6-часового голодания (в мг/дл) db/db мышей в конце двухнедельного лечения целастролом (левый столбик, контрольный растворитель; правый столбик, 100 мкг/кг целастрола внутрибрюшинно один раз в день). Во всех случаях, n=5 мышей на группу.
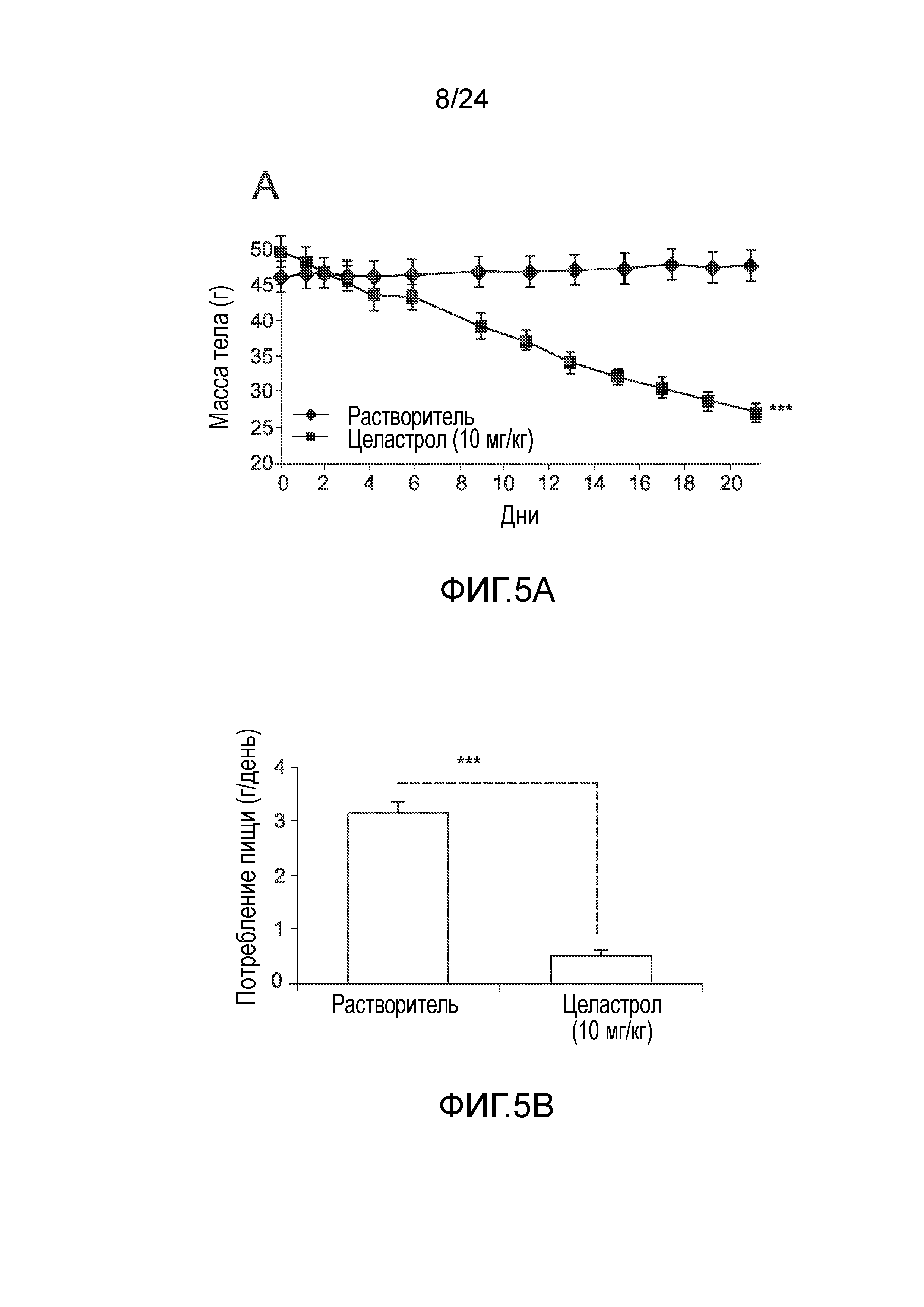
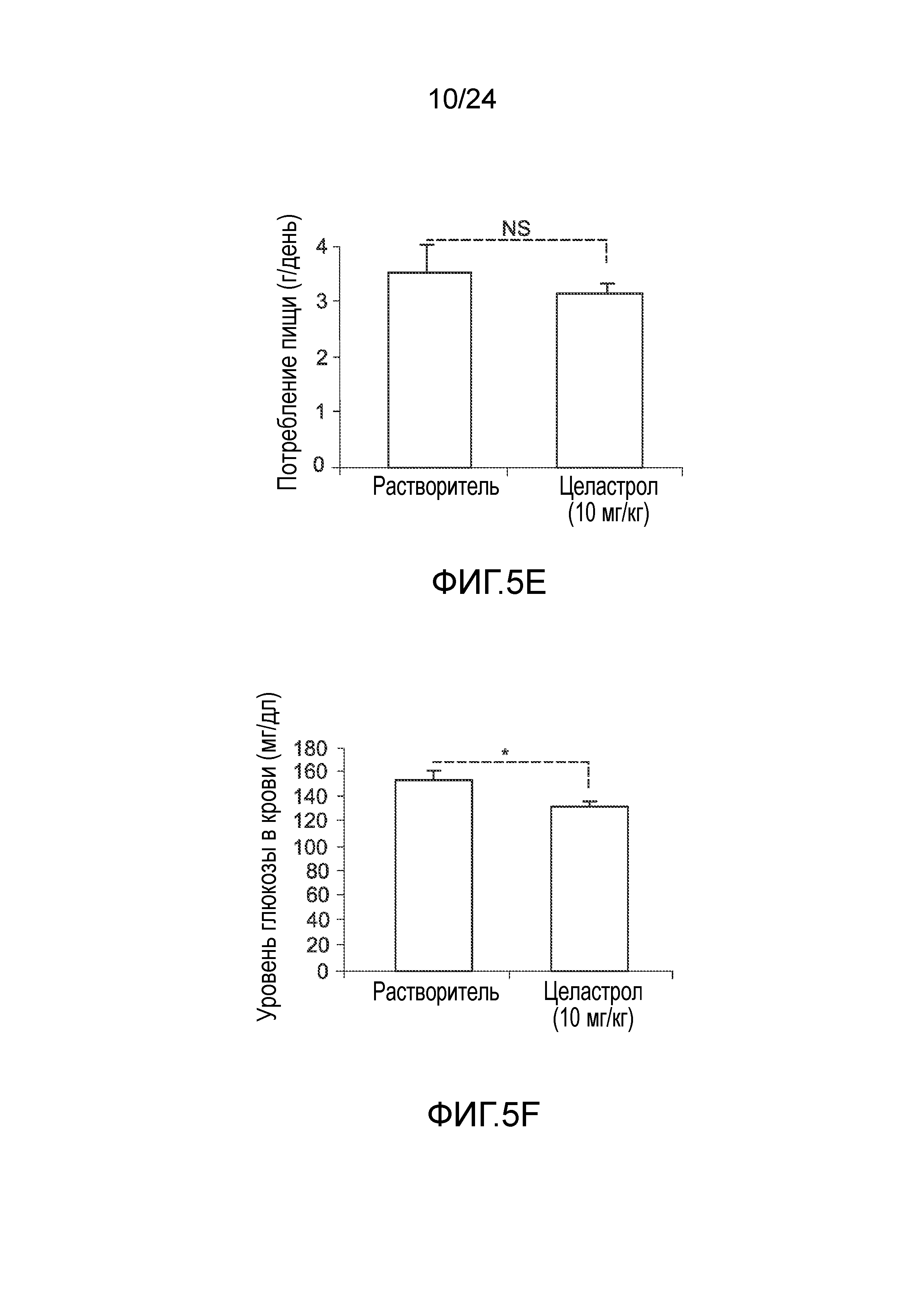
ФИГ. 5A-5F иллюстрируют эффект целастрола, вводимого перорально, на потребление пищи, массу тела и уровни глюкозы в крови мышей с ожирением на диете ВЖД. ФИГ. 5A представляет собой график, на который нанесена масса тела мышей с ожирением на диете ВЖД (в граммах) как функция времени (дней) при лечении целастролом (контрольный растворитель (кривая с ромбами), 10 мг/кг целастрола перорально один раз в день (кривая с квадратами)). ФИГ. 5B представляет собой гистограмму, иллюстрирующую потребление пищи (в граммах/день) мышей с ожирением на диете ВЖД во время курса лечения целастролом (левый столбик, контрольный растворитель; правый столбик, 10 мг/кг целастрола перорально один раз в день). ФИГ. 5C представляет собой гистограмму, иллюстрирующую уровень глюкозы в крови после 6-часового голодания (в мг/дл) мышей с ожирением на диете ВЖД в конце двухнедельного лечения целастролом (левый столбик, контрольный растворитель; правый столбик, 10 мг/кг целастрола перорально один раз в день). ФИГ. 5D представляет собой график, на который нанесена масса тела тощих мышей (в граммах) как функция времени (дней) при лечении целастролом (контрольный растворитель (кривая с ромбами), 10 мг/кг целастрола перорально один раз в день (кривая с квадратами)). ФИГ. SE представляет собой гистограмму, иллюстрирующую потребление пищи (в граммах/день) тощих мышей во время курса лечения целастролом (левый столбик, контрольный растворитель; правый столбик, 10 мг/кг целастрола перорально один раз в день). ФИГ. 5F представляет собой гистограмму, иллюстрирующую уровень глюкозы в крови после 6-часового голодания (в мг/дл) тощих мышей в конце двухнедельного лечения целастролом (левый столбик, контрольный растворитель; правый столбик, 10 мг/кг целастрола перорально один раз в день). Во всех случаях, n=5 мышей на группу. *, p<0,05; **, p<0,01; ***, p<0,001 по параметрическому t-критерию Стьюдента.
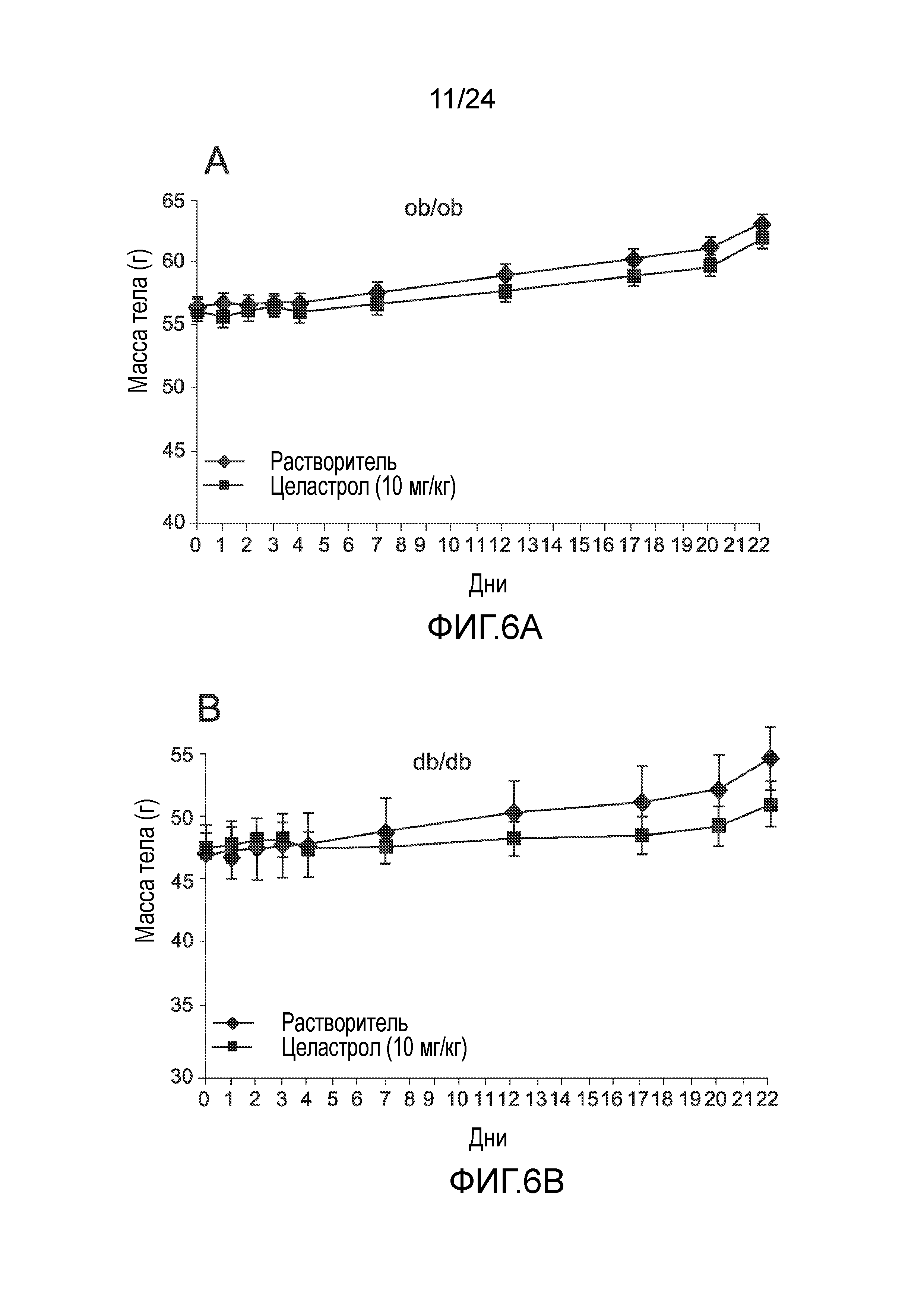
ФИГ. 6A-6D иллюстрируют эффект целастрола, вводимого перорально, на потребление пищи, массу тела и уровни глюкозы в крови ob/ob мышей и db/db. ФИГ. 6A представляет собой график, на который нанесена масса тела ob/ob мышей (в граммах), как функция времени (дней), при лечении целастролом (контрольный растворитель (кривая с треугольниками)), 10 мг/кг целастрола перорально один раз в день (кривая с квадратами)). ФИГ. 6B представляет собой график, на который нанесена масса тела db/db мышей (в граммах) как функция времени (дней) при лечении целастролом (контрольный растворитель (кривая с треугольниками), 10 мг/кг целастрола перорально один раз в день (кривая с квадратами)). ФИГ. 6C представляет собой гистограмму, иллюстрирующую потребление пищи (в граммах/день) ob/ob мышей во время курса лечения целастролом (левый столбик, контрольный растворитель; правый столбик, 10 мг/кг целастрола перорально один раз в день). ФИГ. 6D представляет собой гистограмму, иллюстрирующую потребление пищи (в граммах/день) db/db мышей в конце двухнедельного лечения целастролом (левый столбик, контрольный растворитель; правый столбик, 10 мг/кг целастрола перорально один раз в день).
ФИГ. 7A-7D иллюстрирует эффект совместно вводимых лептина и целастрола на массу тела и потребление пищи мышей. ФИГ. 7A представляет собой график, на который нанесено суммарное потребление пищи мышей с ожирением на диете ВЖД (в граммах), как функция времени (часов) при лечении одним целастролом, одним лептином, и целастролом и лептином в комбинации (контрольный растворитель (ДМСО+физраствор, кривая с ромбами), одним лептином (кривая с квадратами), одним целастролом (кривая с треугольниками), и как целастролом, так и лептином (кривая с крестиками (-x-)). ФИГ. 7B представляет собой гистограмму, на которую нанесено снижение в процентах потребления пищи как у тощих, так и находящихся на диете ВЖД мышей через 6 часов после инъекции лептина (слева направо, тощих мышей без целастрола, тощих мышей без целастрола, мышей с ожирением на диете ВЖД без целастрола, и мышей на диете ВЖД с целастролом). ФИГ. 7C представляет собой график, на который нанесено суммарное потребление пищи тощих мышей (в граммах), как функция времени (часов) при лечении одним целастролом, одним лептином, и целастролом и лептином в комбинации (контрольный растворитель (ДМСО+физраствор, кривая с ромбами), одним лептином (кривая с квадратами), одним целастролом (кривая с треугольниками), и как целастролом, так и лептином (кривая с крестиками (-x-)). ФИГ. 7D представляет собой гистограмму, на которую нанесено изменение массы тела (в граммах) в течение 24-часового периода, как у тощих мышей, так и мышей с ожирением на диете ВЖД при лечении одним целастролом, одним лептином, и целастролом и лептином в комбинации (слева направо, тощие мыши с контрольным растворителем (ДМСО+физраствор), тощие мыши с одним лептином, тощие мыши с одним целастролом, тощие мышей, подвергаемые лечению как целастролом, так и лептином, мыши с ожирением на диете ВЖД с контрольным растворителем (ДМСО+физраствор), мыши с ожирением на диете ВЖД с одним лептином, мыши с ожирением на диете ВЖД с одним целастролом, мыши с ожирением на диете ВЖД, подвергаемые лечению как целастролом, так и лептином). Во всех случаях, n=3 мышей на группу.
ФИГ. 8A-8D иллюстрируют способность целастрола селективно уменьшать массу жира (т.е., содержание жира в организме) мышей, находящихся на диете ВЖД. ФИГ. 8A представляет собой гистограмму, иллюстрирующую безжировую массу (в граммах) мышей с ожирением, находящихся на диете ВЖД, измеренную с использованием двухэмиссионной рентгеновской абсорбциометрии (DEXA) после двух недель лечения целастролом при различных дозах (слева направо, контрольный растворитель, 10 мкг/кг целастрола внутрибрюшинно один раз в день, 50 мкг/кг целастрола внутрибрюшинно один раз в день, и 100 мкг/кг целастрола внутрибрюшинно один раз в день). ФИГ. 8B представляет собой гистограмму, иллюстрирующую массу жира (в граммах) мышей с ожирением, находящихся на диете ВЖД, измеренную с использованием DEXA после двух недель лечения целастролом при различных дозах (слева направо, контрольный растворитель, 10 мкг/кг целастрола внутрибрюшинно один раз в день, 50 мкг/кг целастрола внутрибрюшинно один раз в день, и 100 мкг/кг целастрола внутрибрюшинно один раз в день). ФИГ. 8C представляет собой гистограмму, иллюстрирующую процентное содержание жира в организме мышей с ожирением, находящхся на диете ВЖД, измеренное с использованием DEXA, после двух недель лечения целастролом при различных дозах (слева направо, контрольный растворитель, 10 мкг/кг целастрола внутрибрюшинно один раз в день, 50 мкг/кг целастрола внутрибрюшинно один раз в день, и 100 мкг/кг целастрола внутрибрюшинно один раз в день). ФИГ. 8D представляет собой график, на который нанесен плазменный уровень лептина (в нг/мл), измеренный с использованием лептин-специфичного набора ELISA, как функция времени (дней) лечения целастролом (контрольный растворитель (кривая с ромбами), 100 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с квадратами)).
ФИГ.9A-9D иллюстрируют эффект целастрола на гомеостаз глюкозы у мышей с ожирением, находящихся на диете ВЖД. ФИГ. 9A представляет собой график, на который нанесены уровни глюкозы в плазме крови у мышей, находящихся на диете ВЖД, проходящих тест толерантности к глюкозе (GTT) на день 7, как функция времени (минуты) после инъекции D-глюкозы (контрольный растворитель (кривая с ромбами), 100 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с квадратами)). ФИГ. 9B представляет собой гистограмму, на которую нанесена площадь под кривой (AUC, в мин мг/дл) для кривых на ФИГ. 9A как для контрольного растворителя (левый столбик), так и целастрола (100 мкг/кг целастрола, правый столбик). ФИГ. 9C представляет собой график, на который нанесены уровни глюкозы в плазме крови у мышей, находящихся на диете ВЖД, проходящих тест толерантности к инсулину (ITT) на день 7, как функция времени (минуты) после инъекции инсулина (контрольный растворитель (кривая с ромбами), 100 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с квадратами)). ФИГ. 9D представляет собой гистограмму, на которую нанесена площадь под кривой (AUC, в мин мг/дл) для кривых на ФИГ. 9C как для контрольного растворителя (левый столбик), так и целастрола (100 мкг/кг целастрола, правый столбик). Во всех случаях, n=5 мышей на группу. *, p<0,05; **, p<0,01; ***, p<0,001 по параметрическому t-критерию Стьюдента.
ФИГ. 10A-1°C иллюстрируют эффект введения целастрола на экспрессию печеночной мРНК глюконеогенных ферментов у мышей с ожирением, находящихся на диете ВЖД, определенную посредством количественной ПЦР в конце 3-недельного в/б введения целастрола (100 мкг/кг целастрола внутрибрюшинно один раз в день). ФИГ. 10A представляет собой гистограмму, иллюстрирующую уровень экспрессии печеночной мРНК глюкозо-6-фосфатазы (G6паза, в условных единицах) у мышей с ожирением, находящихся на диете ВЖД, после лечения целастролом в течение трех недель (левый столбик, контрольный растворитель; правый столбик, введение целастрола). ФИГ. 10B представляет собой гистограмму, иллюстрирующую уровень экспрессии печеночной мРНК фосфоенолпируваткарбоксикиназы (PEPCK, в условных единицах) у мышей с ожирением, находящихся на диете ВЖД, после лечения целастролом в течение трех недель (левый столбик, контрольный растворитель; правый столбик, введение целастрола). ФИГ. 1°C представляет собой гистограмму, иллюстрирующую уровень экспрессии печеночной мРНК гамма коактиватора 1-альфа рецептора, активируемого пролифератором пероксисом (PGC1a, в условных единицах) у мышей с ожирением, находящихся на диете ВЖД, после лечения целастролом в течение трех недель (левый столбик, контрольный растворитель; правый столбик, введение целастрола).
ФИГ.11A-11B иллюстрируют эффект введения целастрола на сывороточные уровни аланинтрансаминазы (АЛТ) и аспартаттрансаминазы (АСТ) у мышей с ожирением, находящихся на диете ВЖД, определенные посредством ELISA, в конце 3-недельного в/б введения целастрола (100 мкг/кг целастрола внутрибрюшинно один раз в день). ФИГ. 11A представляет собой гистограмму, на которую нанесен сывороточный уровень АЛТ (U/L) у мышей с ожирением, находящихся на диете ВЖД, после лечения целастролом в течение трех недель (левый столбик, контрольный растворитель; правый столбик, введение целастрола). ФИГ. 11B представляет собой гистограмму, на которую нанесен сывороточный уровень АСТ (U/L) у мышей с ожирением, находящихся на диете ВЖД, после лечения целастролом в течение трех недель (левый столбик, контрольный растворитель; правый столбик, введение целастрола). Во всех случаях, n=5 мышей на группу. *, p<0,05; **, p<0,01; ***, p<0,001 по параметрическому t-критерию Стьюдента.
ФИГ. 12A-12B иллюстрируют эффект введения целастрола на сывороточные уровни тиреоидных гормонов трийодтиронина (T3) и тироксина (T4) у мышей с ожирением, находящихся на диете ВЖД, в конце 3-недельного в/б введения целастрола (100 мкг/кг целастрола внутрибрюшинно один раз в день). ФИГ. 12A представляет собой гистограмму, на которую нанесен сывороточный уровень T3 (нг/мл) у мышей с ожирением, находящихся на диете ВЖД, после лечения целастролом в течение трех недель (левый столбик, контрольный растворитель; правый столбик, введение целастрола). ФИГ. 12B представляет собой гистограмму, на которую нанесен сывороточный уровень of T4 (нг/мл) у мышей с ожирением, находящихся на диете ВЖД, после лечения целастролом в течение трех недель (левый столбик, контрольный растворитель; правый столбик, введение целастрола). Во всех случаях, n=5 мышей на группу. *, p<0,05; **, p<0,01; ***, p<0,001 по параметрическому t-критерию Стьюдента.
ФИГ. 13 представляет собой график, на который нанесена масса тела/первоначальная масса тела мышей с ожирением, находящихся на диете ВЖД, как функция времени (дней), при лечении четырьмя различными производными целастрола, вводимыми при дозе, равной 100 мкг/кг внутрибрюшинно один раз в день (mCS1 (кривая с ромбами), mCS2 (кривая с квадратами), mCS3 (кривая с треугольниками), и mCS4 (кривая с крестиками)).
ФИГ. 14 представляет собой график, на который нанесена масса тела/первоначальная масса тела мышей с ожирением, находящихся на диете ВЖД, как функция времени (дней) при лечении целастролом (контрольный растворитель (кривая с ромбами)), 100 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с квадратами)). Лептин вводили совместно, начиная с дня 17 лечения целастролом, при увеличивающихся дозах (1 мг/кг, 2 мг/кг, и 4 мг/кг), как иллюстрировано столбиком, включенным выше x-оси графика.
ФИГ. 15 представляет собой график, на который нанесены кривые средней массы тела (в граммах) для четырех групп мышей C57BL/6 (мыши, получающие регулярную кормовую диету и контрольный растворитель (кривая с ромбами)), мыши, получающие регулярную кормовую диету и 100 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с квадратами), мыши на диете ВЖД, получающие контрольный растворитель (кривая с треугольниками), и мыши на диете ВЖД, получающие 100 мкг/кг целастрола внутрибрюшинно один раз в день (кривая с крестиками)), как функции времени (дней) лечения. У мышей на диете ВЖД, получавших контрольный растворитель, развивалось ожирение, в то время как у других групп мышей оно не развивалось.
ФИГ. 16A и 16B представляют собой графики, показывающие направления x (ФИГ. 16A) и y (ФИГ. 16B) движения в амбулатории для контроля и целастрола при темновых и световых циклах. Токсичность оценивали, используя систему Columbus Instruments Comprehensive Lab Animal Monitoring, авторы изобретения также измеряли локомоторную активность животных. Как видно на ФИГ., подсчеты движения животных в направлениях x и y в амбулатории во время как темнового, так и светового циклов значительно не отличались.
Этот результат показывает, что мыши, прошедшие лечение лекарственным средством, не являются вялыми, и, таким образом, не показывают каких-либо видимых признаков слабости и токсичности.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
ʺАналогʺ и ʺПроизводноеʺ применяются в данном описании взаимозаменяемо, и относятся к соединению, которое обладает такой же пентациклической центральной структурой, как родоначальное соединение, но отличается от родоначального соединения порядком связей, отсутствием или присутствием одного или нескольких атомов и/или групп атомов и их комбинаций. Производное может отличаться от родоначального соединения, например, одним или несколькими заместителями, присутствующими в пентациклической центральной структуре, которая может включать один или несколько атомов, одну или несколько функциональных групп или подструктур. Производное может также отличаться от родоначального соединения порядком связей между атомами внутри пентациклической центральной структуры. Обычно, можно представить образование производного, по меньшей мере, теориетически, из родоначального соединения посредством химических и/или физических процессов. Например, производные целастрола включают соединения, обладающие одним или несколькими заместителями, присоединенными к пентациклической центральной структуре целастрола.
ʺСовместное введениеʺ, как используется в настоящем описании, включает одновременное и последовательное введение. Соответствующий период действия для последовательного введения может быть выбран лечащим врачом, в соответствии с такими факторами как природа болезни пациента и состояние пациента.
ʺФармацевтически приемлемыеʺ, как используется в настоящем описании, относится к тем соединениям, материалам, композициям и/или лекарственным формам которые, в пределах объема результатов тщательной медицинской оценки, являются подходящими для применения в контакте с тканями людей и животных без избыточной токсичности, раздражения, аллергического ответа или других проблем или осложнений соразмерно с разумным соотношением благоприятный эффект/риск.
"Пролекарство", как используется в настоящем описании, означает производное соединения, описанного в настоящем документе, которое может гидролизовать, окислять или иным образом взаимодействовать при биологических условиях (in vitro или in vivo), чтобы обеспечить соединение изобретения. Пролекарства могут становиться активными в такой реакции только при биологических условиях, или они могут иметь активность в их непрореагировавших формах (например, соединения изобретения могут представлять собой пролекарства целастрола). Примеры пролекарств целастрола, рассматривемых в данном изобретении, включают, но не ограничены перечисленными, аналоги или производные соединений, описанных в настоящем документе, которые содержат биогидролизуемые фрагменты, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые уреиды и биогидролизуемые фосфатные аналоги. Другие примеры пролекарств включают производные соединений любой из формул, раскрытых в данном описании, которые содержат фрагменты -NO, -NO2, -ONO или -ONO2. Пролекарства обычно могут быть получены с использованием хорошо известных методов, таких как методы, описанные в Burgerʹs Medicinal Chemistry and Drug Discovery (1995) 172-178, 949-982 (Manfred E. Wolff ed., 5th ed).
ʺПротивоионʺ, как используется в настоящем описании, относится к катионной или анионной ионной частице, которая присутствует, чтобы сбалансировать заряд соответствующей противоположно заряженных молекулы или атома. Примеры катионных противоионов включают ионы щелочных металлов, таких как моноатомные магний, натрий, кальций или калий.
ʺАлкилʺ, как используется в настоящем описании, относится к радикалу насыщенных или ненасыщенных алифатических групп, включающих прямоцепочечные алкильные, алкенильные или алкинильные группы, алкильные, алкенильные или алкинильные группы с разветвленной цепью, циклоалкильные, циклоалкенильные или циклоалкинильные (алициклические) группы, алкилзамещенные циклоалкильные, циклоалкенильные или циклоалкинильные группы, и циклоалкилзамещенные алкильные, алкенильные или алкинильные группы. Если не указано иначе, алкил с прямой цепью или разветвленной цепью имеет 30 или менее атомов унлерода в его скелете (например, C1-C30 для прямой цепи, C3-C30 для разветвленной цепи), более предпочтительно, 20 или менее атомов углерода, более предпочтительно 12 или менее атомов углерода, и наиболее предпочтительно, 8 или менее атомов углерода. Аналогично, предпочтительные циклоалкилы имеют от 3-10 атомов углерода в их кольцевой структуре, и, более предпочтительно, имеют 5, 6 или 7 углеродов в кольцевой структуре. Интервалы, представленные выше, являются включительными для всех значений между минимальным значением и максимальным значением.
Термин ʺалкилʺ включает как ʺнезамещенные алкилыʺ, так и ʺзамещенные алкилыʺ, последние из которых относятся к алкильным фрагментам, имеющим один или несколько заместителей, замещающим водород на одном или нескольких углеродах углеводородной цепи. Такие заместители включают, но не ограничены перечисленными, галоген, гидроксил, карбонил (такой как карбоксил, алкоксикарбонил, формил или ацил), тиокарбонил (такой как тиосложный эфир, тиоацетат, или тиоформиат), алкоксил, фосфорил, фосфат, фосфонат, фосфинат, амино, амидин, имин, циано, нитро, азидо, сульфгидрил, алкилтио, сульфат, сульфонат, сульфамоил, сульфонамидо, сульфонил, гетероциклил, аралкил, или ароматический или гетероароматический фрагмент.
Если число углеродов устанавливают другим образом, ʺнизший алкилʺ, как используется в настоящем описании, означает алкильную группу, определенную выше, но имеющую от одного до десяти углеродов, более предпочтительно, от одного до шести атомов углерода в ее скелетной структуре. Аналогично, ʺнизший алкенилʺ и ʺнизший алкинилʺ имеют сходные длины цепей. Предпочтительными алкильными группами являются низшие алкилы.
Алкильные группы могут также содержать один или несколько гетероатомов в углеродном скелете. Предпочтительно, гетероатомы включенные в углеродный скелет, представляют собой кислород, азот, серу и их комбинации. В некоторых вариантах осуществления, алкильная группа содержит между одним и четырьмя гетероатомов.
ʺАлкенилʺ и ʺАлкинилʺ, как используется в настоящем описании, относятся к ненасыщенным алифатическим группам, содержащим одну или несколько двойных или тройных связей, аналогичных по длине (например, C2-C30), и возможное замещение алкильных групп, описанное выше.
ʺАрилʺ, как используется в настоящем описании, относится к 5-, 6- и 7-членному ароматическому кольцу. Кольцо может представлять собой карбоциклическую, гетероциклическую, конденсированную карбоциклическую, конденсированную гетероциклическую, бикарбоциклическую или бигетероциклическую кольцевую систему, необязательно замещенную галогенами, алкил-, алкенил- и алкинил-группами. В широком понимании, ʺArʺ, как используется в настоящем описании, включает 5-, 6- и 7-членное однокольцевые ароматические группы, которые могут включать от 0 до 4 гетероатомов, например, бензол, пиррол, фуран, тиофен, имидазол, оксазол, тиазол, триазол, пиразол, пиридин, пиразин, пиридазин и пиримидин и т.п. Эти арильные группы, имеющие гетероатомы в кольцевой структуре, могут также именоваться ʺгетероарильныеʺ, ʺарильные гетероциклыʺ или ʺгетероароматические соединенияʺ. Ароматическое кольцо может быть замещенным по одному или нескольким положениям кольца такими заместителями, как описано выше, например, галогеном, азидом, алкилом, аралкилом, алкенилом, алкинилом, циклоалкилом, гидроксилом, алкоксилом, амино, нитро, сульфгидрилом, имино, амидо, фосфонатом, фосфинатом, карбонилом, карбоксилом, силилом, простым эфиром, алкилтио, сульфонилом, сульфонамидо, кетоном, альдегидом, сложным эфиром, гетероциклилом, ароматическими или гетероароматическими фрагментами, -CF3, -CN, или т.п. Термин ʺArʺ также включает полициклические кольцевые системы, имеющие два или более циклических колец, в которых два или более углеродов являются общими для двух примыкающих колец (кольца являются ʺконденсированными кольцамиʺ) где, по меньшей мере, одно из колец является ароматическими, например, другие циклические кольца могут являться циклоалкилами, циклоалкенилами, циклоалкинилами, арилами и/или гетероциклами. Примеры гетероциклического кольца включают, но не ограничены перечисленными, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензоксазолинил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолинил, карбазолил, 4aH карбазолил, карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2H,6H- 1,5,2-дитиазинил, дигидрофуро[2,3 b] тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил 1H-индазолил, индоленил, индолинил, индолизинил, индолил, 3H-индолил, изатиноил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, метилендиоксифенил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксиндолил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, пиперидонил, 4-пиперидонил, пиперонил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2H-пирролил, пирролил, хиноазолинил, хинолинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, тетразолил, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил и ксантенил.
ʺАлкиларилʺ, как используется в настоящем описании, относится к алкильной группе, замещенной арильной группой (например, ароматической или гетероароматической группой).
ʺГетероциклʺ или ʺгетероциклическийʺ, как используется в настоящем описании, относится к циклическому радикалу, присоединенному через кольцевой углерод или азот моноциклического или бициклического кольца, содержащего 3-10 кольцевых атомов, и, предпочтительно, 5-6 кольцевых атомов, состоящих из углерода и от одного до четырех гетероатомов, каждый из которых выбирают из группы, состоящей из непероксидного кислорода, серы, и N(Y), где Y отсутствует или представляет собой H, O, (C1-4) алкил, фенил или бензил, и необязательно содержащего одну или несколько двойных или тройных связей, и необязательно замещенного одним или несколькими заместителями. Термин ʺгетероциклʺ также охватывает замещенные и незамещенные гетероарильные кольца. Примеры гетероциклического кольца включают, но не ограничены перечисленными, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензоксазолинил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолинил, карбазолил, 4aH-карбазолил, карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2H,6H-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил, индолил, 3H-индолил, изатиноил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, метилендиоксифенил, морфолинил, нафтиридинил, октагидроизохинолинил оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксиндолил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, пиперидонил, 4-пиперидонил, пиперонил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2H-пирролил, пирролил, хиноазолинил, хинолинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, тетразолил, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимиданлил, тиофенил и ксантенил.
ʺГетероарилʺ, как используется в настоящем описании, относится к моноциклическому ароматическому кольцу, содержащему пять или шесть кольцевых атомов, состоящих из углерода и 1, 2, 3, или 4 гетероатомов, каждый из которых выбирают из группы, состоящей из непероксидного кислорода, серы, и N(Y), где Y отсутствует или представляет собой H, O, (C1-C8) алкил, фенил или бензил. Неограничивающие примеры гетероарильных групп включают фурил, имидазолил, триазолил, триазинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, пирролил, пиразинил, тетразолил, пиридил, (или его N-оксид), тиенил, пиримидинил (или его N-оксид), индолил, изохинолил (или его N-оксид), хинолил (или его N-оксид) и т.п. Термин ʺгетероарилʺ может включать радикалы орто-конденсированного бициклического гетероцикла из приблизительно от восьми до десяти кольцевых атомов, являющиеся его производными, в частности, изогнутыми производными или производным, полученным посредством конденсирования к нему пропиленового, триметиленового или тетраметиленового дирадикала. Примерами гетероарила могут быть фурил, имидазолил, триазолил, триазинил, оксазолил, изоксазолил, тиазолил, изотиазолил, пираксолил, пирролил, пиразинил, тетразолил, пиридил (или его N-оксид), тиенил, пиримидинил (или его N-оксид), индолил, изохинолил (или его N-оксид), хинолил (или его N-оксид) и т.п.
ʺГалогенʺ, как используется в настоящем описании, относится к фтору, хлору, брому или йоду.
Термин ʺзамещенныйʺ, как используется в настоящем описании, относится ко всем разрешенным заместителям соединений, описанных в данном документе. В самом широком смысле, разрешенные заместители включают ациклические и циклические, разветвленные и неразветвленные, карбоциклические и гетероциклические, ароматические и неароматические заместители органических соединений. Иллюстративные заместители включают, но не ограничены перечисленными, галогены, гидроксильные группы, или любые другие органические группировки, содержащие любое число атомов углерода, предпочтительно 1-14 атомов углерода, и необязательно включают один или несколько гетероатомов, такие как кислород, сера, или азотная группировка в линейных, разветвленных или циклических структурных форматах. Представительные заместители включают алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, фенил, замещенный фенил, арил, замещенный арил, гетероарил, замещенный гетероарил, галоген, гидроксил, алкокси, замещенный алкокси, фенокси, замещенный фенокси, арокси, замещенный арокси, алкилтио, замещенный алкилтио, фенилтио, замещенный фенилтио, арилтио, замещенный арилтио, циано, изоциано, замещенный изоциано, карбонил, замещенный карбонил, карбоксил, замещенный карбоксил, амино, замещенный амино, амидо, замещенный амидо, сульфонил, замещенный сульфонил, сульфоновую кислоту, фосфорил, замещенный фосфорил, фосфонил, замещенный фосфонил, полиарил, замещенный полиарил, C3-C20 циклический, замещенный C3-C20 циклический, гетероциклический, замещенный гетероциклический, аминокислотные, пептидные и полипептидные группы.
Гетероатомы, такие как азот, могут иметь водородные заместители и/или любые разрешенные заместители органических соединений, описанные в данном документе, которые удовлетворяют валентностям гетероатомов. Понятно, что ʺзамещениеʺ или ʺзамещенныйʺ включает скрытое условие, что такое замещение находится в соответствии с разрешенной валентностью замещенного атома и заместителя, и, что замещение приводит к устойчивому соединению, т.е. соединению, которое самопроизвольно не претерпевает превращения, такого как посредством перегруппировки, циклизации, элиминирования и т.д.
ʺС ожирениемʺ, как используется в настоящем описании, относится к пациенту, имеющему индекс массы тела больший, чем 30 кг/м2. ʺИзбыточная масса телаʺ и ʺс предожирениемʺ, как используются в настоящем описании, относится к пациентам, имеющим индекс массы тела больший, чем 25 кг/м2. ʺСтрадающий от ожиренияʺ, как используется в настоящем описании, относится к пациенту имеющему индекс массы тела больший, чем 40 кг/м2, индекс массы тела больший, чем 35 кг/м2 в комбинации с одним или несколькими сопутствующими заболеваниями, индекс массы тела больший, чем 30 кг/м2 в комбинации с неконтролируемым диабетом или их комбинациям.
ʺЭффективное количествоʺ или ʺтерапевтически эффективное количествоʺ, как используется в настоящем описании, относится к количеству соединения, которое является эффективным, чтобы индуцировать снижение массы тела у пациента с предожирением, ожирением или патологическим ожирением, снизить содержание жира в организме у пациента с предожирением, ожирением или патологическим ожирением, снизить потребление пищи у пациента с предожирением, ожирением или патологическим ожирением, улучшить гомеостаз глюкозы у пациента с предожирением, ожирением или патологическим ожирением, предотвратить набор массы и/или предотвратить увеличение индекса массы тела у нормального пациента, пациента с предожирением, имеющего ожирение, или патологическим ожирением пациента, или получить комбинацию эффектов.
Соединения
В настоящем описании предоставлены пентациклические тритерпены, которые могут вводиться, чтобы стимулировать снижение массы тела, снизить содержание жира в организме, снизить потребление пищи, улучшить гомеостаз глюкозы или иметь комбинацию этих воздействий.
Иллюстративные соединения включают соединения, определенные Формулой I

Формула I
в которой
пунктирные линии между A и C2, C1 и C2, C1 и C7, C7 и C5, C5 и C6, и C8 и C9 указывают на то, что могут присутствовать одинарная или двойная связь, как позволяет валентность;
R1 представляет собой карбоновую кислоту (-COOH), первичный амид (например, -CONH2), вторичный амид (например, CONHR7), третичный амид (например, -CONR7R7), вторичный карбамат (например, -OCONHR7; NHCOOR7), третичный карбамат (например, -OCONR7R7; -NR7COOR7), мочевину (например, NHCONHR7; NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), карбинол (например, -CH2OH; CHR7OH, -CR7R7OH), простой эфир (например, -OR7), сложный эфир (например, -COOR7), спирт (-OH), тиол (-SH), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин(например, -NR7R7), простой тиоэфир (например, -SR7), сульфинильную группу (например, -SOR7), сульфонильную группу (например, -SOOR7), сульфиногруппу, галоген, нитрит, циано, нитро или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную (например, тетразольную) группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
R2 представляет собой водород; гидрокси (-OH), тиол (-SH), простой эфир (например, -OR7), простой тиоэфир (например, -SR7), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин (например, -NR7R7), первичный амид (например, -CONH2), вторичный амид (например, -NHCOR7), третичный амид (например, -NR7COR7), вторичный карбамат (например, -OCNHR7; -NHCOOR7), третичный карбамат (например, OCONR7R7; NR7COOR7), мочевину (например, -NHCONHR7; -NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), сульфинильную группу (например, SOR7), сульфонильную группу (например, -SOOR7) сульфиногруппу, галоген, нитрит, циано, нитро, или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
A представляет собой азот или кислород, когда двойная связь присутствует между A и C2, или кислород, когда одинарная связь присутствует между A и C2;
R3 представляет собой водород, карбонильную группу (например, -COR7), или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
R4 отсутствует, когда А представляет собой кислород, и двойная связь присутствует между A и C2, гидрокси (-OH) группу, когда A представляет собой азот и двойная связь присутствует между A и C2, или представляет собой водород, карбонильную группу (например, -COR7), или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила когда А представляет собой кислород и одинарная связь присутствует между A и C2; или
А представляет собой кислород, одинарная связь присутствует между A и C2, и R3 и R4, взятые вместе с A, C2, C3, и O1, образуют 5-7-членное кольцо, необязательно замещенное одним-четырьмя заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира или карбоновой кислоты;
R5 представляет собой водород; гидрокси (-OH), тиол (-SH), простой эфир (например, -OR7), простой тиоэфир (например, -SR7), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин (например, -NR7R7), первичный амид (например, -CONH2), вторичный амид (например, -NHCOR7), третичный амид (например, -NR7COR7), вторичный карбамат (например, -OCONHR7; -NHCOOR7), третичный карбамат (например, -OCONR7R7; -NR7COOR7), мочевину (например, -NHCONHR7; -NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), сульфинильную группу (например, -SOR7), сульфонильную группу (например, -SOOR7) сульфиногруппу, галоген, нитрит, циано или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
R6 отсутствует, когда двойная связь присутствует между C8 и C9, представляет собой водород; гидрокси (-OH), тиол (-SH), простой эфир (например, -OR7), простой тиоэфир (например, -SR7), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин (например, -NR7R7), первичный амид (например, -CONH2), вторичный амид (например, -NHCOR7), третичный амид (например, -NR7COR7), вторичный карбамат (например, -OCONHR7; -NHCOOR7), третичный карбамат (например, -OCONR7R7; -NR7COOR7), мочевину (например, -NHCONHR7; -NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), сульфинильную группу (например, -SOR7), сульфонильную группу (например, -SOOR7) сульфиногруппу, галоген, нитрит, или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила, когда одинарная связь присутствует между C8 и C9; или
одинарная связь присутствует между C8 и C9, и R5 и R6, взятые вместе с C8 и C9, образуют циклопропильное или эпоксидное кольцо; и
R7, когда присутствует, индивидуально, в каждом случае, представляет собой алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила, или две R7 группы берутся вместе для образования циклоалкильной, гетероциклоалкильной, арильной или гетероарильной группы, необязательно замещенной одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты, арила, или O3M, где М представляет собой противоион;
или их фармацевтически приемлемую соль или пролекарство,
где соединение присутствует в терапевтически эффективном количестве, чтобы индуцировать снижение массы тела у пациента с предожирением, ожирением или патологическим ожирением; снизить содержание жира в организме у пациента с предожирением, ожирением или патологическим ожирением; снизить потребление пищи у пациента с предожирением, ожирением или патологическим ожирением; улучшить гомеостаз глюкозы у пациента с предожирением, ожирением или патологическим ожирением; или оказать комбинированное воздействие, и где, по меньшей мере, один из R1, R2, R3, R4, R5, R6 и R7 когда присутствует, содержит нитрогруппу;
или их фармацевтически приемлемую соль или пролекарство.
В нескольких вариантах осуществления формулы I, двойная связь присутствует между A и C2, Cl и C7, C5 и C6, и C8 и C9, и одинарная связь присутствует между C1 и C2, и C7 и C5. В других вариантах осуществления Формулы I, двойная связь присутствует между C1 и C2, C7 и C5, и C8 и C9, и одинарная связь присутствует между A и C2, Cl и C7, и C5 и C6.
В конкретных вариантах осуществления Формулы I, R1 представляет собой карбоновую кислоту, сложный эфир, или амид; R2 представляет собой водород, простой эфир (-OR7) или простой тиоэфир (-SR7); и R7 представляет собй C1-C12, более предпочтительно, C1-C8 алкильную группу, необязательно замещенную одним-тремя заместителями, индивидуально выбранными из алкила, амина, галогена, гидроксила, сложного эфира, амида и карбоновой кислоты (например, R1 представляет собой тетразол).
В некоторых вариантах осуществления, соединение формулы I представляет собой одно из следующих соединений или его фармацевтически приемлемые соль или пролекарство


,
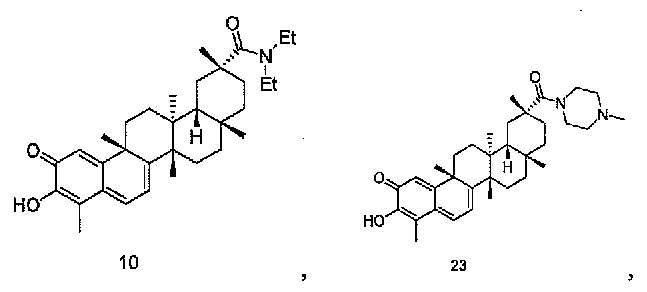
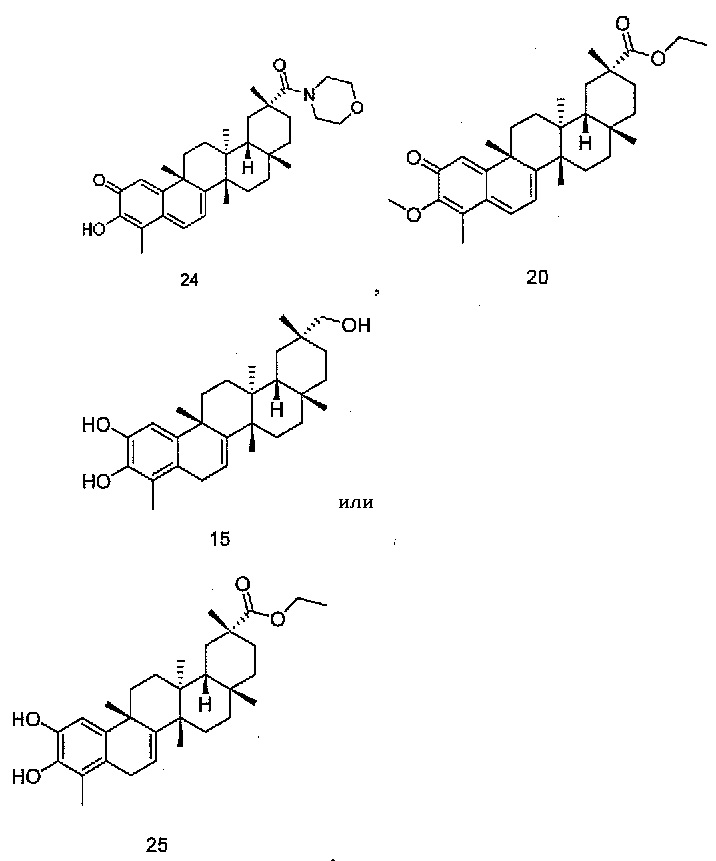
В некоторых вариантах осуществления, соединение представляет собой соединение, определенное Формулой II

Формула II
в которой
пунктирные линии между A и C2, Cl и C2, Cl и C7, C7 и C5, C5 и C6, и C8 и C9 указывают на то, что могут присутствовать одинарная или двойная связь, как позволяет валентность;
X представляет собой -O-, -NR7-, -S-, -SO-, или -SO2-;
R1 представляет собой водород, или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира и арила;
R2 представляет собой водород; гидрокси (-OH), тиол (-SH), простой эфир (например, -OR7), простой тиоэфир (например, -SR7), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин (например, -NR7R7), первичный амид (например, -CONH2), вторичный амид (например, -NHCOR7), третичный амид (например, -NR7COR7), вторичный карбамат (например, -OCNHR7; -NHCOOR7), третичный карбамат (например, OCONR7R7; NR7COOR7), мочевину (например, -NHCONHR7; -NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), сульфинильную группу (например, SOR7), сульфонильную группу (например, -SOOR7) сульфиногруппу, галоген, нитрит, циано, нитро, или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
A представляет собой азот или кислород, когда двойная связь присутствует между A и C2, или кислород, когда одинарная связь присутствует между A и C2;
R3 представляет собой водород, карбонильную группу (например, -COR7), или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
R4 отсутствует, когда А представляет собой кислород, и двойная связь присутствует между A и C2, гидрокси (-OH) группу, когда A представляет собой азот и двойная связь присутствует между A и C2, или представляет собой водород, карбонильную группу (например, -COR7), или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила когда А представляет собой кислород и одинарная связь присутствует между A и C2; или
А представляет собой кислород, одинарная связь присутствует между A и C2, и R3 и R4, взятые вместе с A, C2, C3, и O1, образуют 5-7-членное кольцо необязательно замещенное одним-четырьмя заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира или карбоновой кислоты;
R5 представляет собой водород; гидрокси (-OH), тиол (-SH), простой эфир (например, -OR7), простой тиоэфир (например, -SR7), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин (например, -NR7R7), первичный амид (например, -CONH2), вторичный амид (например, -NHCOR7), третичный амид (например, -NR7COR7), вторичный карбамат (например, -OCONHR7; -NHCOOR7), третичный карбамат (например, -OCONR7R7; -NR7COOR7), мочевину (например, -NHCONHR7; -NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), сульфинильную группу (например, -SOR7), сульфонильную группу (например, -SOOR7) сульфиногруппу, галоген, нитрит, циано или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты или арила;
R6 отсутствует, когда двойная связь присутствует между C8 и C9, представляет собой водород; гидрокси (-OH), тиол (-SH), простой эфир (например, -OR7), простой тиоэфир (например, -SR7), первичный амин (-NH2), вторичный амин (например, -NHR7), третичный амин (например, -NR7R7), первичный амид (например, -CONH2), вторичный амид (например, -NHCOR7), третичный амид (например, -NR7COR7), вторичный карбамат (например, -OCONHR7; -NHCOOR7), третичный карбамат (например, -OCONR7R7; -NR7COOR7), мочевину (например, -NHCONHR7; -NR7CONHR7; -NHCONR7R7; -NR7CONR7R7), сульфинильную группу (например, -SOR7), сульфонильную группу (например, -SOOR7) сульфиногруппу, галоген, нитрит, или CF3; или алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила, когда одинарная связь присутствует между C8 и C9; или
одинарная связь присутствует между C8 и C9, и R5 и R6, взятые вместе с C8 и C9, образуют циклопропильное или эпоксидное кольцо; и
R7, когда присутствует, индивидуально, в каждом случае, представляет собой алкильную, циклоалкильную, гетероциклоалкильную, алкиларильную, алкенильную, алкинильную, арильную или гетероарильную группу, необязательно замещенную одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила, или две R7 группы берутся вместе для образования циклоалкильной, гетероциклоалкильной, арильной или гетероарильной группы, необязательно замещенной одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты, арила, или O3M, где М представляет собой противоион;
или их фармацевтически приемлемую соль или пролекарство.
В нескольких вариантах осуществления формулы II, двойная связь присутствует между A и C2, Cl и C7, C5 и C6, и C8 и C9, и одинарная связь присутствует между C1 и C2, и C7 и C5. В других вариантах осуществления Формулы II, двойная связь присутствует между C1 и C2, C7 и C5, и C8 и C9, и одинарная связь присутствует между A и C2, C1 и C7, и C5 и C6.
В нескольких вариантах осуществления формулы II, X представляет собой O или -NR7-; R1 представляет собой водород или алкильную группу, необязательно замещенную одним-тремя заместителями, индивидуально выбранными из алкила, амина, галогена, гидроксила, сложного эфира, амида и карбоновой кислоты; R2 представляет собой водород, простой эфир (-OR7) или простой тиоэфир (-SR7); и R7 представляет собой индивидуально, для каждого случая, a C1-C12, более предпочтительно C1-C8 алкильную группу, необязательно замещенную одним-тремя заместителями, индивидуально выбранными из алкила, амина, галогена, гидроксила, сложного эфира, амида и карбоновой кислоты.
В некоторых вариантах осуществления, соединение представляет собой соединение, определенное Формулой III или его фармацевтически приемлемые соль или пролекарство

Формула III
В нескольких вариантах осуществления формулы III, X представляет собой C, CH, O, N, или S. R8, когда присутствует, индивидуально, в каждом случае, представляет собой водород или алкил, циклоалкил, гетероциклоалкил, алкиларил, алкенил, алкинил, арил, нитро, сложный эфир, гетероарил групп, или X и две R8 группы берутся вместе для образования циано или алкинил, необязательно замещенные одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты, арила, или O3M, где М представляет собой противоион, или две R8 группы берутся вместе для образования циклоалкильной, гетероциклоалкильной, арильной или гетероарильной группы, необязательно замещенной одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты, арила, или O3M, где М представляет собой противоион;
или их фармацевтически приемлемую соль или пролекарство.
В некоторых вариантах осуществления, соединение формулы III представляет собой одно из следующих соединений или его фармацевтически приемлемые соль или пролекарство



В некоторых вариантах осуществления, соединение представляет собой соединение, определенное Формулой IV

Формула IV,
где X представляет собой C(O) или CH2;
R9 представляет собой водород или алкил, циклоалкил, гетероциклоалкил, алкиларил, алкенил, алкинил, карбонов кислот, арил, или гетероарил групп, необязательно замещенные одним-пятью заместителями, индивидуально выбранными из алкила, циклопропила, циклобутилового простого эфира, амина, галогена, гидроксила, простого эфира, нитрита, циано, нитро, CF3, сложного эфира, амида, мочевины, карбамата, простого тиоэфира, карбоновой кислоты и арила;
или их фармацевтически приемлемую соль или пролекарство.
В конкретных вариантах осуществления, соединение формулы IV представляет собой одно из следующих соединений или его фармацевтически приемлемые соль или пролекарство


Соединения, описанные выше, могут иметь один или несколько хиральных центров, и, следовательно, могут существовать в виде двух или нескольких уникальных стереоизомеров. В нескольких вариантах осуществления, соединения, описанные в данном документе, имеют следующую стереохимию:

В конкретных вариантах осуществления, соединение представляет собой одно из следующих соединений



Соединение может также представлять собой фармацевтически приемлемую соль любого из соединений, описанных выше. В нескольких случаях, может быть желательным получать соль соединения, описанного выше, вследствие одного или нескольких из преимущественных физических свойств соли, таких как увеличенная стабильность или желательный профиль растворимости или растворения.
В целом, фармацевтически приемлемые соли могут быть получены посредством реакции форм свободной кислоты или свободного основания соединения, описанного выше, со стехиометрическим количеством соответствуюших основания или кислоты в воде, в органическом растворителе или в смеси обоих. Как правило, предпочтительными являются неводные среды, включающие простой эфир, этилацетат, этанол, изопропанол или ацетонитрил. Перечни подходящих солей приведены в Remingtonʹs Pharmaceutical Sciences, 20th ed., Lippincott Williams & Wilkins, BАЛТimore, IVID, 2000, p. 704; и ʺHandbook of Pharmaceutical Salts: Properties, Selection, and Use,ʺ P. Heinrich Stahl and Camille G. Wermuth, Eds., Wiley-VCH, Weinheim, 2002.
Подходящие фармацевтически приемлемые кислотно-аддитивные соли включают соли, являющиеся производными неорганических кислот, таких как хлористоводородная, бромистоводородная, фтористоводородная, борная, фтороборная, фосфорная, метафосфорная, азотная, карбоновая, сульфоновая и серная кислоты, и органических кислот, таких как уксусная, бензолсульфоновая, бензойная, лимонная, этансульфоновая, фумаровая, глюконовая, гликолевая, изотионовая, молочная, лактобионовая, малеиновая, яблочная, метансульфоновая, трифторметансульфоновая, янтарная, толуолсульфоновая, винная и трифторуксусная кислоты.
Подходящие органические кислоты обычно включают, например, алифатические, циклоалифатические, ароматические, аралифатические, гетероциклические, карбоновые и сульфоновые классы органических кислот. Конкретные примеры подходящих органических кислот включают ацетат, трифторацетат, формиат, пропионат, сукцинат, гликолат, глюконат, диглюконат, лактат, малат, винную кислоту, цитрат, аскорбат, глюкуронат, малеат, фумарат, пируват, аспартат, глутамат, бензоат, антраниловую кислоту, мезилат, стеарат, салицилат, п-гидроксибензоат, фенилацетат, манделат, эмбонат (памоат), метансульфонат, этансульфонат, бензолсульфонат, пантотенат, толуолсульфонат, 2-гидроксиэтансульфонат, сульфанилат, циклогексиламиносульфонат, альгиновую кислоту, β-гидроксимасляную кислоту, галактарат, гаоактуронат, адипат, альгинат, бутират, камфорат, камфорсульфонат, циклопентанпропионат, додецилсульфат, гликогептаноат, глицерофосфат, гептаноат, гексаноат, никотинат, 2-нафталинсульфонат, оксалат, пальмоат, пектинат, 3-фенилпропионат, пикрат, пивалат, тиоцианат, тозилат и ундеканоат.
В нескольких случаях, фармацевтически приемлемая соль может включать соли щелочных металлов, включая соли натрия или калия; соли щелочно-земельных металлов, например, соли кальция или магния; и соли, образованные с подходящими органическими лигандами, например, соли четвертичнго аммония. Основные соли также могут быть образованы из оснований, которые образуют нетоксичные соли, включающие соли алюминия, аргинина, бензатина, холина, диэтиламина, диоламинаамин, глицина, лизина, меглумина, оламина, трометамина и цинка.
Органические соли могут быть получены из солей вторичных, третичных или четвертичных аминов, таких как трометамин, диэтиламин, N,Nʹ-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглумин (N-метилглюкамин) и прокаин. Основные азот-содержащие группы могут также быть кватернизированы со средствами, такими как галогениды низших алкилов (C1-C6) (например, метил-, этил-, пропил- и бутилхлориды, бромиды и йодиды), диалкилсульфаты (например, диметил-, диэтил-, дибутил- и диамилсульфаты), длинноцепные галогениды (например, децил-, лаурил-, миристил- и стеарилхлориды, бромиды и йодиды), арилалкилгалогениды (например, бензил-и фенэтилбромиды) и другие.
Соединение также может представлять собой фармацевтически приемлемое пролекарство любого из соединений, описанных выше. Пролекарства представляют собой соединения, которые, когда метаболизируются in vivo, претерпевают превращение в соединения, имеющие желательную фармакологическую активность. Пролекарства могут быть получены посредством замены соответствующих функциональностей, присутствующих в соединениях, описанных выше, на ʺпрофрагментыʺ, как описано, например, в H. Bundgaar, Design of Prodrugs (1985). Примеры пролекарств включают производные сложных эфиров, простых эфиров или амидов соединений, описанных выше, полиэтиленгликолевые производные соединений, описанных выше, производные N-ациламинов, производные дигидропиридинпиридина, аминосодержащие производные, конъюгированные с полипептидами, производные 2-гидроксибензамида, производные карбаматов, производные N-оксидов, которые биологически восстанавливаются до активных аминов, и производные N-оснований Манниха. По дополнительному обсуждению пролекарств, см., например, Rautio, J. et al. Nature Reviews Drug Discovery. 7:255-270 (2008).
А. Способы получения
Соединения, описанные выше, могут быть получены с использованием способов, известных в данной области. Представительные методологии для получения некоторых активных средств описаны ниже. Соответствующий путь синтеза данного соединения может быть выбран с учетом структуры соединения, в целом, в смысле ее отношения к совместимости функциональных групп, стратегий введения защитных групп и наличия лабильных связей. В дополнение к синтетическим методологиям, обсуждаемым ниже, альтернативные реакции и стратегии, применимые для получения соединений креатина, раскрытых в данном описании, являются известными в данной области. См., например, March, ʺAdvanced Organic Chemistry,ʺ 5th Edition, 2001, Wiley-lnterscience Publication, New York).
Целастрол может быть получен из коммерческих источников, или выделен из растений, например, Tripterygium wilfordii, методами, известными в данной области. См., например, Kutney, Can. J. Chem. 59:2677 (1981) и Zhang, W., et al., Acta Pharm. Sin.21:592 (1986). Целастрол может служить в качестве удобного исходного вещества для соединений формулы I и Формула II.
Посредством пояснения примером, соединения формулы I, в которых R1 представляет собой сложный эфир, могут быть получены посредством взаимодействия целастрола с подходящим спиртом в присутствии кислотного или основного катализатора. Например, обработка целастрола избытком этанола в присутствии кислотного катализатора позволяет получить соединения формулы I, где R1 представляет собой этиловый сложный эфир (-COOR5). Другие сложноэфирные производные могут быть аналогично получены с использованием соответствующих спиртовых исходных веществ (ACS Chem. Biol. (2012) 7, 928-937). Аналогично, соединения формулы I, в которых R1 представляет собой амид, могут быть получены посредством взаимодействия целастрола с подходящим амином при стандартных условиях образования амидной связи (например, в присутствии карбодиимидного дегидратирующего агента, такого как N,Nʹ-дициклогексилкарбодиимид (DCC), N,Nʹ-Диизопропилкарбодиимид (DIC) или 1-Этил-3-(3-диметиламинопропил)карбодиимид (EDC), и основания, такого как DMAP или триэтиламин).
Соединения формулы I, где R2 отличается от водорода, могут быть получены с использованием реакции Михаэля (J. Am. Chem. Soc. (2011) 133, 19634-19637). Например, соединения формулы I, в которых R2 представляет собой простой тиоэфир, могут быть получены посредством реакции целастрола с подходящим нуклеофильным тиолом.
Способы получения примерного соединения 7 могут включать взаимодействие целастрола с этилйодидом (EtI) (1,1 эквивалента) и карбонатом натрия (Na2CO3)(2 эквивалента) в диметилформамиде (DMF) (3 или 10 мл) при комнатной температуре (КТ), в течение ночи, как показано ниже.
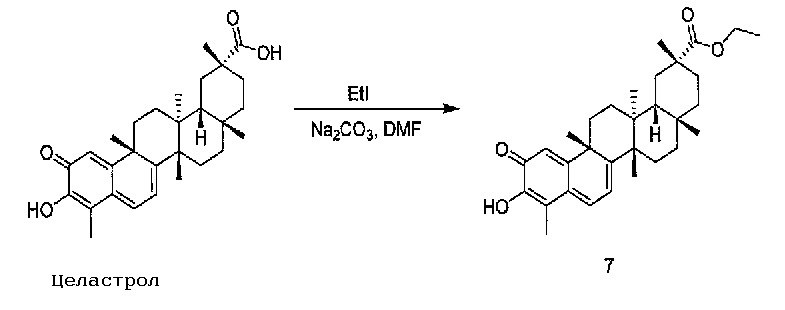
Способы получения примерного соединения 8 могут включать взаимодействие целастрола с трет-бутиловым спиртом (t-BuOH) (2 эквивалента), 1-Этил-3-(3-диметиламинопропил)карбодиимидом (EDC), хлористоводородной кислотой (HCl) (2 эквивалента), диметиламинопиридином (DMAP) (0,1 эквивалента) и триэтиламином (NEt3) (2 эквивалента) в тетрагидрофуране (ТГФ) (3 мл) при комнатной температуре (кт), в течение ночи, как показано ниже (см., например, Tetrahedron Lett.(1993) 34, 7409-7412; US2012/0052019).

Альтернативные способы получения соединения 8 могут включать взаимодействие целастрола с трет-бутилбромидом (t-BuBr) (2 эквивалента), BTEAC (1 эквивалент) и K2CO3 (5 эквивалента) в DMAc (3 мл) в течение ночи при 55°C. В еще одном варианте осуществления, получение соединения 8 может включать взаимодействие целастрола с (Boc)2O (2 эквивалента) и DMAP (0,5 эквивалента) в ТГФ (3 мл) при комнатной температуре. Еще один способ получения соединения 8 может включать взаимодействие с (Boc)2O (2 эквивалента) и Mg(ClO4)2(0,5 эквивалента) в MeNO2(3 мл) при 40°C в течение ночи. В еще одном другом варианте осуществления получение соединения 8 может включать взаимодействие целастрола с (Boc)2O (2 эквивалента) и DMAP (0,5 эквивалента) в ТГФ (3 мл) при комнатной температуре.
Способы получения примерного соединения 9 могут включать взаимодействие целастрола с этиламином (EtNH2) (1,5 эквивалента), гексафторфосфата 3-оксида 1-[Бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиния (HATU) (1,5 эквивалента) и триэтилалюминия (TEA) (3 эквивалента) в тетрагидрофуране (ТГФ) (6 мл) при комнатной температуре, в течение ночи как показано ниже.

Способы получения примерного соединения 11 могут включать восстановление соединения формулы I со сложным эфиром по положению R1 с получением гидроксила R1. Например, целастрол может использоваться для получения примерного соединения 7, как описано выше. Примерное соединение 7 может вступать в реакцию с литийалюминийгидридом (LiAlH4) (2 эквивалента) в тетрагидрофуране (THF) (3 мл) в течение 4 часов при комнатной температуре, как показано ниже. Продукты реакции включают примерные соединения 11 и 15. Примерное соединение 25 может также быть получено таким образом.

Примерное соединение 15 может быть дополнительно восстановлено с получением примерного соединения 11. Условия реакции могут включать взаимодействие примерного соединения 15 с 2,3-Дихлор-5,6-дициано-1,4-бензoхиноном (DDQ) (2 эквивалента) в ДХМ при комнатной температуре в течение ночи. Альтернативно, примерное соединение 15 может вступать в реакцию с O2 в ацетоне (15 мл) при комнатной температуре в течение 2 дней с получением соединения 11. Альтернативно, примерное соединение 15 может вступать в реакцию с Ag2CO3 (2 эквивалента) в ДХМ (2 мл) при комнатной температуре в течение ночи с получением соединения 11. Альтернативно, примерное соединение 15 может вступать в реакцию с O2 в метаноле (15 мл) при комнатной температуре в течение 2 дней с получением соединения 11. Альтернативно, примерное соединение 15 может вступать в реакцию с O2 в ДХМ (15 мл) при комнатной температуре в течение 2 дней с получением соединения 11.
Способы получения примерного соединения 12 могут включать превращение соединения формулы I с амидной группой по положению R1 в цианогруппу. Примерным исходным веществом для реакции с получением соединения 12 может быть соединение формулы I с первичной амидной группой по положению R1. Способы получения соединения 12 могут включать взаимодействие целастрола с HATU (1,5 эквивалента), DIPEA (2 эквивалента) и NH4Cl (2 эквивалента) в DMF (5 мл) при комнатной температуре в течение ночи, как показано ниже.

Альтернативно, целастрол может вступать в реакцию с дифосгеном (2 эквивалента) и TEA (2 эквивалента) в ДХМ.
Способы получения примерного соединения 13 могут включать взаимодействие примерного соединения 12 с триметилсилилазидом (TMS-N3).
Способы получения примерных соединений 16, 18 и 19 могут включать взаимодействие целастрола в качестве исходного вещества, чтобы превратить карбоновую кислоту в положении R1 в метиловый сложный эфир, защищая кислоту от дальнейших реакций. Чтобы получить примерное соединение 16, аналог целастрола с защитой в виде метилового сложного эфира может вступать в реакцию с бензилбромидом (BnBr), затем с омыленным метиловым сложным эфиром для восстановления карбоновой кислоты R1. Для получения примерного соединения 18, аналог целастрола с защитой в виде метилового сложного эфира может вступать в реакцию с метилйодидом (MeI), затем с омыленным метиловым сложным эфиром для восстановления карбоновой кислоты R1. Для получения примерного соединения 19, аналог целастрола с защитой в виде метилового сложного эфира может вступать в реакцию с BrCH2CO2Me, затем с омыленным метиловым сложным эфиром для восстановления карбоновой кислоты R1.
Способы получения примерного соединения 20 могут включать взаимодействие соединения 7 (полученного, как описано выше) с гидридом натрия (NaH) (2 эквивалента) и метилйодидом (MeI) (5 эквивалентов) в тетрагидрофуране (ТГФ) (4 мл), в течение ночи при комнатной температуре. Кроме того, способы получения примерного соединения 18 могут включать взаимодействие соединения 20 с гидроксидом натрия (NaOH) (2 эквивалента) в метаноле (MeOH) (5 мл), как показано ниже.

Альтернативные способы превращения соединения 7 в соединение 20 могут включать взаимодействие соединения 7 с NEt3 (3 эквивалента), MeI (1,5 эквивалента) и DMAP (0,2 эквивалента) в CH2Cl2(2 мл) при комнатной температуре в течение ночи. В еще одном примере, превращение соединения 7 в 20 может включать взаимодействие соединения 2 с K2CO3(2 эквивалента) и MeI (0,5 эквивалента) в ацетоне (2 мл) при 40°C в течение ночи. В еще одном другом варианте осуществления, соединение 7 может вступать в реакцию с NaOH (2 эквивалента) в MeOH (2 мл) при 40°C с получением соединения 20.
Способы получения примерного соединения 23 могут включать взаимодействие целастрола с амином (1,5 эквивалента), HATU (1,5 экв.) и TEA (2 эквивалента) в ТГФ (3 мл) при комнатной температуре в течение ночи как показано ниже.

Способы получения примерного соединения 10 могут включать взаимодействие целастрола с амином (1,5 эквивалента), HATU (1,5 эквивалента) и TEA (2 эквивалента) в ТГФ (3 мл) при комнатной температуре в течение ночи как показано ниже.

Альтернативные способы получения примерного соединения 10 могут включать взаимодействие целастрола с амином (1,5 эквивалента), HATU (2 эквивалента) и TEA (3 эквивалента) в ТГФ (5 мл) при комнатной температуре, в течение ночи.
Способы получения соединения 26 могут включать взаимодействие целастрола с AcCl (1,2 эквивалента) и NEt3 (2 эквивалента) в CH2Cl2(4 мл) при 0°C в течение 30 мин., как показано ниже (см., например, Bioorg. Med. Chem. (2010) 20, 3844-3847).

Способы получения соединения 27 могут включать взаимодействие целастрола с M2SO3 (например, MgSO3 или сульфатом другого противоиона) в присутствии растворителя, как показано ниже (см., например, CN101434635A).
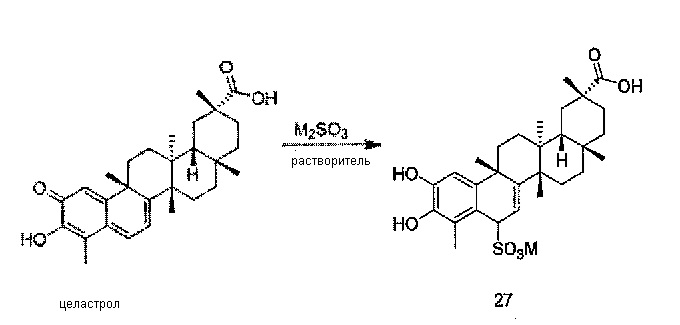
III. Фармацевтические композиции
Предоставлены фармацевтические композиции, содержащие терапевтически эффективное количество соединения, описанного в данном документе, или его фармацевтически приемлемые соль или пролекарство, в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами. Представительные эксципиенты включают растворители, разбавители, модификаторы рН, консерванты, антиоксиданты, суспендирующие средства, увлажняющие средства, модификаторы вязкости, регуляторы тоничности, стабилизаторы и их комбинации. Подходящие фармацевтически приемлемые эксципиенты предпочтительно выбирают из веществ, которые общепризнанно являются безопасными (GRAS), и могут вводиться индивидууму, не вызывая нежелательных биологических побочных эффектов или нежелательных взаимодействий.
A. Дополнительные терапевтические средства
В нескольких случаях, фармацевтическая композиция может дополнительно содержать одно или несколько дополнительных активных средств.
В некоторых вариантах осуществления, фармацевтические композиции дополнительно содержат лептин, аналог лептина или их комбинации.
Лептин представляет собой пептидный гормон, который служит в качестве афферентного сигнала в отрицательной обратной связи, регулирующей потребление пищи и массу тела in vivo. Непроцессированный человеческий лептин синтезируется in vivo как белковый прогормон, состоящий из 167 аминокислот, имеющий молекулярную массу 16 кДа. Непроцессированный лептин включает N-терминальную сигнальную последовательность из 21 аминокислоты, которая отщепляется от остальной части полипептида с генерацией зрелого, циркулирующего лептина (содержащего 146 аминокислот).
Термины ʺлептинʺ и ʺаналог лептинаʺ, как используются в настоящем описании, охватывают природный человеческий лептин, природный лептин, продуцируемый видами, не являющимися человеком, такими как мышь или крыса, рекомбинантно продуцируемый зрелый лептин, такой как метрелептин (т.е., рекомбинантный метионил человеческий лептин или r-метХуЛептин, который представляет собой аналог лептина из 147 аминокислот, генерируемый посредством генетически сконструированного N-концевого присоединения метионина к N-концевой аминокислоте, состоящего из 146 аминокислот, зрелого, циркулирующего, человеческого лептина), а также фрагменты лептина, варианты лептина, гибридных белков лептина и других его производных, известных в данной области, как обладающих биологической активностью.
Иллюстративные аналоги и производные лептина включают его аналоги и производные, описанные в Международных патентных заявках №№ WO 96/05309, WO 96/40912; WO 97/06816, WO 00/20872, WO 97/18833, WO 97/38014, WO 98/08512, WO 98/12224, WO 98/28427, WO 98/46257, WO 98/55139, WO 00/09165, WO 00/47741, WO 2004/039832, WO 97/02004 и WO 00/21574; Международных патентных заявках №№ PCT/US96/22308 и PCT/US96/01471; Патентах США №№ 5,521,283, 5,532,336, 5,552,524, 5,552,523, 5,552,522, 5,935,810, 6,001,968, 6,429,290, 6,350,730, 6,936,439, 6,420,339, 6,541,033, 7,112,659, 7,183,254, и 7,208,577, и Патентных заявках США 2005/0176107, 2005/0163799. Иллюстративные варианты лептина включают варианты, где аминокислота в положении 43 заменена на Asp или Glu; положение 48 замещено Ala; положение 49 замещено Glu, или отсутствует; положение 75 замещено Ala; положение 89 замещено Leu; положение 93 замещено Asp или Glu; положение 98 замещено Ala; положение 117 замещено Ser, положение 139 замещено Leu, положение 167 замещено Ser и любую их комбинацию.
В некоторых вариантах осуществления, фармацевтическая композиция включает r-метХуЛептин (A-100, МЕТРЕЛЕПТИН®), доступный от Amylin Pharmaceuticals (San Diego, Calif.).
Фармацевтические композиции могут также включать один или несколько витаминов, минералов, пищевых добавок, нутрицевтических средств, таких как белки, углеводы, аминокислоты, жирные кислоты, антиоксиданты и растительные или животные экстракты или их комбинации. Подходящие витамины, минералы, нутрицевтические средства и пищевые добавки являются известными в данной области, и раскрыты, например, в Roberts et al, (Nutriceuticals: Complete Encyclopedia of Supplements, Herbs, Vitamins, and Healing Foods, American Nutriceutical Association, 2001). Нутрицевтические средства и пищевые добавки также раскрыты в Physicianʹs Desk Reference for Nutritional Supplements, 1st Ed. (2001) и Physiciansʹ Desk Reference for Herbal Medicines, 1st Ed. (2001).
B. Энтеральные лекарственные формы
Подходящие лекарственные формы для перорального применения включают таблетки, капсулы, растворы, суспензии, сиропы и пастилки. Таблетки могут быть изготовлены с использованием технологий прессования или формования, хорошо известных в данной области. Желатиновые или нежелатиновые капсулы могут быть получены в виде твердых или мягких оболочек капсул, которые могут инкапсулировать жидкие, твердые и полутвердые заполняющие материалы, с использованием технологий, хорошо известных в данной области.
Лекарственные формы могут быть получены с использованием одного или нескольких фармацевтически приемлемых эксципиентов, включая разбавители, консерванты, связывающие вещества, смазки, разрыхлители, агенты, вызывающие набухание, наполнители, стабилизаторы и их комбинации.
Эксципиенты, включая пластификаторы, пигменты, окрашивающие средства, стабилизаторы и глиданты, могут также применяться для формирования покрытых композиций для энтерального введения. Дозированные лекарственные формы с отсроченным высвобождением могут быть получены, как описано в стандартных ссылках, таких как ʺPharmaceutical dosage form tabletsʺ, eds. Liberman et. al. (New York, Marcel Dekker, Inc., 1989), ʺRemington - science and practice of pharmacyʺ, 20th ed., Lippincott Williams & Wilkins, Baltimore, MD, 2000, и ʺPharmaceutical dosage forms and drug delivery systemsʺ, 6th Edition, Ansel et al., (Media, PA: Williams и Wilkins, 1995). Эти ссылки предоставляют информацию по эксципиентам, материалам, оборудованию и процессам получения таблеток и капсул и лекарственных форм с отсроченным высвобождением из таблеток, капсул и гранул.
Примеры подходящих материалов для покрытия включают, но не ограничены перечисленными, полимеры на основе целлюлозы, такие как ацетатфталат целлюлозы, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, фталат гидроксипропилметилцеллюлозы и ацетатсукцинат гидроксипропилметилцеллюлозы; поливинилацетатфталат, полимеры и сополимеры акриловой кислоты, и метакриловые смолы, которые являются доступными для приобретения под торговым наименованием ЭУДРАГИТ®(Roth Pharma, Westerstadt, Germany), зеин, шеллак и полисахариды.
Разбавители, также именуемые ʺнаполнителиʺ, обычно являются необходимыми для увеличения насыпной массы твердой лекарственной формы, таким образом, что обеспечивается практический размер для прессования таблеток или образования микросфер и гранул. Подходящие разбавители включают, но не ограничены перечисленными, дигидрат дикальцийфосфата, сульфат кальция, лактозу, сахарозу, маннит, сорбит, целлюлозу, микрокристаллическую целлюлозу, каолин, хлорид натрия, сухой крахмал, гидролизованные крахмалы, прежелатинизированный крахмал, диоксид кремния, оксид титана, силикат магния алюминия и мелкий сахар.
Связывающие средства применяют для придания свойств сцепления твердой дозируемой композиции, и, таким образом, обеспечивают то, что таблетка или микросфера или гранула остается неповрежденной после образования дозированных лекарственных форм. Подходящие связывающие вещества включают, но не ограничены перечисленными, крахмал, прежелатинизированный крахмал, желатин, сахара (включая сахарозу, глюкозу, декстрозу, лактозу и сорбит), полиэтиленгликоль, воска, природные и синтетические камеди, такие как акация, трагакант, альгинат натрия, целлюлозу, включая гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, этилцеллюлозу и вигум, и синтетические полимеры, такие как сополимеры акриловой кислоты и метакриловой кислоты, сополимеры метакриловой кислоты, сополимеры метилметакрилата, аминоалкилметакрилатные сополимеры, полиакриловая кислота/полиметакриловая кислота и поливинилпирролидон.
Смазки применяют для облегчения изготовления таблеток. Примеры подходящих смазок включают, но не ограничены перечисленными, стеарат магния, стеарат кальция, стеариновую кислоту, бегенат глицерина, полиэтиленгликоль, тальк и минеральное масло.
Разрыхлители применяют для облегчения дезинтеграции лекарственной формы или ʺраспадаʺ после введения и обычно включают, но не ограничены перечисленными, крахмал, крахмала гликолат натрия, карбоксиметилкрахмал натрия, карбоксиметилцеллюлозу натрия, гидроксипропилцеллюлозу, прежелатинизированный крахмал, глины, целлюлозу, альгинин, камеди или сшитые полимеры, такие как сшитый ПВП (Полипласдон® XL от GAF Chemical Corp).
Стабилизаторы применяют для ингибирования или замедления реакций разложения лекарственного средства, которые включают, для иллюстрации, окислительные реакции. Подходящие стабилизаторы включают, но не ограничены перечисленными, антиоксиданты, бутилированный гидрокситолуол (BHT); аскорбиновую кислоту, ее соли и сложные эфиры; Витамин E, токоферол и его соли; сульфиты, такие как метабисульфит натрия; цистеин и его производные; лимонную кислоту; пропилгаллат и бутилированный гидроксианизол (BHA).
1. Лекарственные формы с контролируемым высвобождением
Дозированные формы для перорального применения, такие как капсулы, таблетки, растворы, и суспензии, могут быть составлены для контролируемого высвобождения. Например, одно или несколько соединений и необязательные одно или несколько дополнительных активных средств могут быть составлены в наночастицы, микрочастицы и их комбинации, и инкапсулированы в мягкие или твердые желатиновые или нежелатиновые капсулы или диспергированы в диспергирующей среде для образования пероральных суспензии или сиропа. Частицы могут быть образованы из лекарственного средства и полимера или матрицы с контролируемым высвобождением. Альтернативно, частицы лекарственного средства могут быть покрыты одним или несколькими покрытиями с контролируемым высвобождением перед введением в окончательную дозированную форму.
В еще одном варианте осуществления, одно или несколько соединений и необязательные одно или несколько дополнительных активных средств диспергируют в материале матрицы, который желируется или эмульгируется при контакте с водной средой, такой как физиологические жидкости. В случае гелей, матрица набухает, захватывая активные средства, которые медленно высвобождаются с течением времени посредством диффузии и/или разрушения материала матрицы. Такие матрицы могут быть составлены в виде таблеток или использоваться как наполняющие материалы для жестких и твердых капсул.
В еще одном другом варианте осуществления, одно или несколько соединений и необязательные одно или несколько дополнительных активных средств составляют в твердую дозированную лекарственную форму для перорального применения, такую как таблетка или капсула, и твердую дозированную лекарственную форму покрывают одним или несколькими покрытиями с контролируемым высвобождением, такими как покрытия с отсроченным высвобождением или покрытия с пролонгированным высвобождением. Покрытие или покрытия могут также содержать соединения и/или дополнительные активные средства.
Лекарственные формы с пролонгированным высвобождением
Лекарственные формы с пролонгированным высвобождением обычно получают в виде диффузионных или осмотических систем, например, как описано в ʺRemington - science and practice of pharmacyʺ (20th ed., Lippincott Williams & Wilkins, Baltimore, MD, 2000). Диффузионная система обычно состоит из двух типов устройств, резервуара и матрицы, и является хорошо известной и описанной в данной области. Матричные устройства обычно получают посредством прессования лекарственного средства вместе с медленно растворяющимся полимерным носителем в форму таблетки. Три основных типа материалов, применяемых при получении матричных устройств, представляют собой нерастворимые пластики, гидрофильные полимеры и жирные соединения. Пластические матрицы включают, но не ограничены перечисленными, метилакрилат-метилметакрилат, поливинилхлорид и полиэтилен. Гидрофильные полимеры включают, но не ограничены перечисленными, полимеры на основе целлюлозы, такие как метил- и этилцеллюлоза, гидроксиалкилцеллюлозы, такие как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза натрия и Carbopol® 934, полиэтиленоксиды и их смеси. Жирные соединения включают, но не ограничены перечисленными, различные воска, такие как карнаубский воск и глицерилтристеарат, и воскоподобные вещества, включающие гидрированное касторовое масло или гидрированное растительное масло или их смеси.
В некоторых вариантах осуществления, пластический материал представляет собой фармацевтически приемлемый акриловый полимер, включающий, но не ограниченный перечисленным, сополимеры акриловой кислоты и метакриловой кислоты, метилметакрилат, метилметакрилатные сополимеры, этоксиэтилметакрилаты, цианоэтилметакрилат, аминоалкилметакрилатный сополимер, поли(акриловую кислоту), поли(метакриловую кислоту), сополимер алкиламина метакриловой кислоты с поли(метилметакрилатом), поли(метакриловой кислоты)(ангидрид), полиметакрилат, полиакриламид, поли(метакриловой кислоты ангидрид), и глицидилметакрилатные сополимеры. В некоторых вариантах осуществления, акриловый полимер состоит из одного или нескольких аммониометакрилатных сополимеров. Аммониометакрилатные сополимеры являются хорошо известными в данной области, и описаны в NF XVII в качестве полностью полимеризованных сополимеров сложных эфиров акриловых и метакриловых кислот с низким содержанием четвертичных аммониевых групп.
В одном варианте осуществления, акриловый полимер представляет собой лак на основе акриловой смолы, такой как лак, который является доступным для приобретения от Rohm Pharma под торговым наименованием ЭУДРАГИТ®. В дополнительных предпочтительных вариантах осуществления, акриловый полимер содержит смесь двух лаков на основе акриловой смолы, доступных для приобретения от Rohm Pharma под торговыми наименованиями ЭУДРАГИТ® RL30D и ЭУДРАГИТ® RS30D, соответственно. ЭУДРАГИТ® RL30D и ЭУДРАГИТ® RS30D являются сополимерами акриловых и метакриловых сложных эфиров с низким содержанием четвертичных аммониевых групп, причем молярное отношение аммониевых групп к остальным нейтральным (мет)акриловым сложным эфирам составляет 1:20 в ЭУДРАГИТ® RL3OD и 1:40 в ЭУДРАГИТ® RS30D. Средняя молекулярная масса равна приблизительно 150000. ЭУДРАГИТ® S-100 и ЭУДРАГИТ® L-100 также являются предпочтительными. Кодовые обозначения RL (высокая проницаемость) и RS (низкая проницаемость) относятся к свойствам проницаемости этих средств. Смеси ЭУДРАГИТ® RL/RS являются нерастворимыми в воде и в пищеварительных соках. Однако, системы в виде множества частиц, образованные для включения этих смесей, являются набухаемыми и проницаемыми в водных растворах и пищеварительных соках.
Полимеры, описанные выше, такие как ЭУДРАГИТ® RL/RS могут быть смешаны вместе в любом желательном отношении, чтобы, в конечном счете, получить лекарственную форму с замедленным высвобождением, имеющую желательный профиль растворения. Желательная система с замедленным высвобождением в виде множества частиц, может быть получена, к примеру, из 100% ЭУДРАГИТ®RL, 50% ЭУДРАГИТ® RL и 50% ЭУДРАГИТ® RS и 10% ЭУДРАГИТ® RL и 90% ЭУДРАГИТ® RS. Специалист в данной области сможет понять, что могут также применяться другие акриловые полимеры, такие как, например, ЭУДРАГИТ®L.
Альтернативно, лекарственные формы с пролонгированным высвобождением могут быть получены с использованием осмотических систем или посредством нанесения полупроницаемого покрытия на дозированную форму. В последнем случае, желательный профиль высвобождения лекарственного средства может достигаться посредством объединения низкопроницаемых и высокопроницаемых материалов покрытия в подходящем соотношении.
Устройства с различными механизмами высвобождения лекарственного средства, описанные выше, могут комбинироваться в конечной дозированной форме, содержащей одиночные или множественные единицы. Примеры множественных единиц включают, но не ограничены перечисленными, многослойные таблетки и капсулы, содержащие таблетки, микросферы или гранулы. Часть с немедленным высвобождением может быть добавлена к системе с пролонгированным высвобождением посредством нанесения слоя с немедленным высвобождением либо на верхнюю часть центральной части с пролонгированным высвобождением с использованием процесса нанесения покрытия или прессования или на систему из множества единиц, таких как капсула, содержащая микросферы с пролонгированным и немедленным высвобождением.
Таблетки с пролонгированным высвобождением, содержащие гидрофильные полимеры, получают посредством технологий, обычно известных в данной области, таких как прямое прессование, влажное гранулирование или сухое гранулирование. Их лекарственные формы обычно включают полимеры, разбавители, связывающие вещества и смазки, а также активный фармацевтический ингредиент. Обычные разбавители включают инертные порошковидные вещества, такие как крахмалы, порошковидная целлюлоза, особенно, кристаллическая и микрокристаллическая целлюлоза, сахара, такие как фруктоза, маннит и сахароза, зерновая мука и аналогичные съедобные порошки. Типичные разбавители включают, например, различные типы крахмала, лактозу, маннит, каолин, фосфат или сульфат кальция, неорганические соли, такие как хлорид натрия и порошкообразный сахар. Порошкообразные производные целлюлозы также являются применимыми. Типичные связывающие вещества для таблеток включают вещества, такие как крахмал, желатин, и сахара, такие как лактоза, фруктоза и глюкоза. Природные и синтетические камеди, включающие акацию, альгинаты, метилцеллюлозу и поливинилпирролидон также могут применяться. Полиэтиленгликоль, гидрофильные полимеры, этилцеллюлоза и воска могут также служить в качестве связывающих веществ. Смазка является необходимой в таблетированной лекарственной форме, чтобы предотвратить слипание таблеток и пуансонов в головке. Смазку выбирают из таких антифрикционных твердых веществ, как тальк, стеарат магния и кальция, стеариновая кислота и гидрированные растительные масла.
Таблетки с пролонгированным высвобождением, содержащие восковые материалы, обычно получают с использованием методов, известных в данной области, таких как метод прямой смеси, метод отверждения и метод водных дисперсий. В методе отверждения, лекарственное средство смешивают с восковым материалом и либо отверждают распылением или отверждают и просеивают и обрабатывают.
Лекарственные формы с отсроченным высвобождением
Лекарственные формы с отсроченным высвобождением могут быть созданы посредством покрытия твердой лекарственной формы полимерной пленкой, которая является нерастворимой в кислотном окружении желудка, и растворимой в нейтральном окружении тонкого кишечника.
Дозированные единицы с отсроченным высвобождением могут быть получены, например, посредством покрытия лекарственного средства или композиции, содержащей лекарственное средство, выбранным материалом покрытия. Композиция, содержащая лекарственное средство, может представлять собой, например, таблетку для введения в капсулу, таблетку для применения в качестве внутренней сердцевины в лекарственной форме с ʺпокрытой сердцевинойʺ, или множество содержащих лекарственное средство микросфер, частиц или гранул, для введения либо в таблетку или капсулу. Предпочтительные материалы покрытия включают биоразлагаемые, постепенно гидролизуемые, постепенно водорастворимые и/или ферментативно разрушаемые полимеры, и могут представлять собой традиционные ʺрастворимые в кишечникеʺ полимеры. Растворимые в кишечнике полимеры, как смогут понять специалисты в данной области, становятся растворимыми в окружении при более высоком pH нижней области желудочно-кишечного тракта или медленно разлагаются, по мере того, как лекарственная форма проходит через желудочно-кишечный тракт, в то время как ферментативно разрушаемые полимеры разрушаются бактериальными ферментами, присутствующими в нижней области желудочно-кишечного тракта, конкретно, в толстой кишке. Подходящие материалы покрытия для осуществления отсроченного высвобождения включают, но не ограничены перечисленными, полимеры на основе целлюлозы, такие как гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, гидроксиметилцеллюлоза, гидроксипропилметилцеллюлоза, ацетат сукцинат гидроксипропилметилцеллюлозы, фталат гидроксипропилметилцеллюлозы, метилцеллюлоза, этилцеллюлоза, ацетат целлюлозы, ацетат фталат целлюлозы, ацетат тримеллитат целлюлозы и карбоксиметилцеллюлоза натрия; полимеры и сополимеры акриловой кислоты, предпочтительно образованные из акриловой кислоты, метакриловой кислоты, метилакрилат, этилакрилат, метилметакрилат и/или этилметакрилат, и другие метакриловые смолы, которые являются доступными для приобретения под торговым наименованием ЭУДРАГИТ® (Rohm Pharma; Westerstadt, Germany), включающие ЭУДРАГИТ® L30D-55 и L100-55 (растворимые при pH 5,5 и выше), ЭУДРАГИТ® L-100 (растворимый при pH 6,0 и выше), ЭУДРАГИТ® S (растворимый при pH 7,0 и выше, в результате более высокой степени этерификации), и ЭУДРАГИТ® NE, RL и RS (водонерастворимые полимеры, имеющие различные степени проницаемости и способности к расширению); виниловые полимеры и сополимеры, такие как поливинилпирролидон, винилацетат, винилацетатфталат, сополимер винилацетата и кротоновой кислоты, и сополимер этилена-винилацетата; ферментативно разрушаемые полимеры, такие как азополимеры, пектин, хитозан, амилаза и гуаровая камедь; зеин и шеллак. Могут также применяться комбинации различных материалов покрытия. Могут также наноситься многослойные покрытия с использованием различных полимеров.
Предпочтительные массы покрытия для конкретных материалов покрытия могут быть легко определены специалистами в данной области посредством оценки индивидуальных профилей высвобождения для таблеток, микросфер и гранул, полученных с различными количествами различных материалов покрытия. Комбинация материалов, способ и форма нанесения, которые производят желательные характеристики высвобождения, могут быть определены только при клинических испытаниях.
Композиция покрытия может включать традиционные добавки, такие как пластификаторы, пигменты, окрашивающие средства, стабилизаторы, глиданты и т.д. Пластификатор обычно присутствует для снижения хрупкости покрытия, и будет обычно представлять приблизительно от 10 масс. % до 50 масс. % относительно сухой массы полимера. Примеры типичных пластификаторов включают полиэтиленгликоль, пропиленгликоль, триацетин, диметилфталат, диэтилфталат, дибутилфталат, дибутилсебацат, триэтилцитрат, трибутилцитрат, триэтилaцетилцитрат, касторовое масло и aцетилированные моноглицериды. Стабилизатор предпочтительно применяют для стабилизации частиц в дисперсии. Типичные стабилизаторы представляют собой неионные эмульгаторы, такие как сложные эфиры сорбитана, полисорбаты и поливинилпирролидон. Глиданты рекомендуются для снижения эффектов слипания во время образования пленки и сушки, и будут обычно представлять приблизительно от 25 масс. % до 100 масс. % массы полимера в покрывающем растворе. Одним эффективным глидантом является тальк. Могут также применяться другие глиданты, такие как стеарат магния и моностеараты глицерина. Могут также применяться пигменты, такие как диоксид титана. Небольшие количества пеногасителя, такого как силикон (например, симетикон), также могут добавляться в композицию покрытия.
Пульсирующее высвобождение
Лекарственная форма может обеспечить пульсирующую доставку одного или нескольких соединений, раскрытых в данном описании. Термин ʺпульсирующаяʺ означает, что множество доз лекарственного средства высвобождаются с отстоящими друг от друга интервалами времени. Обычно, при глотании лекарственной формы, высвобождение первоначальной дозы является по существу немедленным, т.е., первый ʺимпульсʺ высвобождения лекарственного средства происходит в пределах приблизительно одного часа от глотания. Этот первоначальный импульс сопровождается первым временным интервалом (периодом задержки), во время которого, очень незначительное количество лекарственного средства высвобождается из лекарственной формы, или вообще не высвобождается, после которого затем высвобождается вторая доза. Аналогично, может быть предусмотрен второй ближайший интервал без высвобождения лекарственного средства между вторым и третьим импульсами высвобождения лекарственного средства. Продолжительность ближайшего интервала без высвобождения лекарственного средства будет варьировать в зависимости от конструкции лекарственной формы, например, профиль дозирования два раза в день, профиль дозирования три раза в день и т.д. Для лекарственных форм, обеспечивающих профиль дозирования два раза в день, ближайший интервал без высвобождения лекарственного средства имеет продолжительность приблизительно от 3 часов до 14 часов между первой и второй дозой. Для лекарственных форм, обеспечивающих профиль три раза в день, ближайший интервал без высвобождения лекарственного средства имеет продолжительность, приблизительно от 2 часов до 8 часов между каждой их трех доз.
В одном варианте осуществления, профиль пульсирующего высвобождения достигается для лекарственных форм, которые являются закрытыми и, предпочтительно, герметически закупоренных капсул, вмещающих, по меньшей мере, две содержащих лекарственное средство ʺдозированных единицыʺ, где каждая дозированная единица внутри капсулы обеспечивает различный профиль высвобождения лекарственного средства. Контроль дозированных единиц(ы) с отсроченным высвобождением осуществляется полимерным покрытием с контролируемым высвобождением на дозированной единице, или посредством введения активного средства в полимерную матрицу с контролируемым высвобождением. Каждая дозированная единица может содержать прессованную или формованную таблетку, где каждая таблетка внутри капсулы обеспечивает различный профиль высвобождения лекарственного средства. Для лекарственных форм, имитирующих профиль дозирования дважды в день, первая таблетка высвобождает лекарственное средство по существу немедленно после глотания лекарственной формы, в то время как вторая таблетка высвобождает лекарственное средство в течение от приблизительно 3 часов до менее, чем 14 часов после глотания лекарственной формы. Для лекарственных форм, имитирующих профиль дозирования три раза в день, первая таблетка высвобождает лекарственное средство по существу немедленно после глотания лекарственной формы, вторая таблетка высвобождает лекарственное средство в течение приблизительно от 3 часов до менее чем 10 часов после глотания лекарственной формы, и третья таблетка высвобождает лекарственное средство, в течение, по меньшей мере, от 5 часов до приблизительно 18 часов после глотания лекарственной формы. Возможно, что лекарственная форма включает более трех таблеток. В то время, как дозированная форма обычно не будет включать более трех таблеток, может использоваться размещение дозированных форм с более чем тремя таблетками.
Альтернативно, каждая дозированная единица в капсуле может включать множество содержащих лекарственное средство микросфер, гранул или частиц. Как известно в данной области, содержащие лекарственное средство ʺмикросферыʺ относится к микросферам, изготовленным вместе с лекарственным средством и одним или несколькими эксципиентами или полимерами. Содержащие лекарственное средство микросферы могут быть получены посредством нанесения лекарственного средства на инертную подложку, например, инертные сахарные микросферы, покрытые лекарственным средством, или посредством создания ʺсердцевиныʺ, содержащей как лекарственное средство, так и один или несколько эксципиентов. Как также известно, содержащие лекарственное средство ʺгранулыʺ и ʺчастицыʺ содержат частицы лекарственного средства, которые могут включать или не включать один или несколько дополнительных эксципиентов или полимеров. В отличие от микросфер, содержащих лекарственное средство, гранулы и частицы не содержат инертной подложки. Гранулы, как правило, содержат частицы лекарственного средства и требуют дополнительной обработки. Обычно, частицы являются более мелкими, чем гранулы, и дополнительно не обрабатываются. Несмотря на то, что микросферы, гранулы и частицы могут быть составлены для обеспечения немедленного высвобождения, микросферы и гранулы, как правило, используются для обеспечения отсроченного высвобождения.
C. Парентеральные лекарственные формы
Соединения могут быть составлены для парентерального введения. ʺПарентеральное введениеʺ, как используется в настоящем описании, означает введение посредством любого метода, отличного от введения через пищеварительный тракт, или неинвазивных местных или областных путей. Например, парентеральное введение может включать введение пациенту внутривенно, внутрикожно, внутрибрюшинно, интраплеврально, интратрахеально, внутримышечно, подкожно, посредством инъекции и посредством инфузии.
Парентеральные лекарственные формы могут быть получены в виде водных композиций с использованием технологий, известных в данной области. Типовым образом, такие композиции могут быть получены как инъекционные лекарственные формы, например, растворы или суспензии; твердые формы, подходящие для использования для получения растворов или суспензий при добавлении среды для восстановления перед инъекцией; эмульсии, такие как эмульсии типа вода-в-масле (в/м), эмульсии типа масло-в-воде (м/в) и их микроэмульсии, липосомы или эмульсомы.
Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, один или несколько полиолов (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), масла, такие как растительные масла (например, арахисовое масло, кукурузное масло, кунжутное масло и т.д.) и их комбинации. Надлежащая текучесть может поддерживаться, например, посредством применения покрытия, такого как лецитин, посредством поддержания требуемого размера частиц в случае дисперсии и/или посредством применения поверхностно-активных веществ. Во многих случая, будет предпочтительным включать изотонические средства, например, сахара или хлорид натрия.
Растворы и дисперсии активных соединений в виде свободной кислоты или свободного основания или их фармакологически приемлемых солей могут быть получены в воде или еще одном растворителе или диспергирующей среде, подходящим образом смешанной с одним или несколькими фармацевтически приемлемыми эксципиентами, включающими, но не ограниченными перечисленными, поверхностно-активные вещества, диспергаторы, эмульгаторы, модификаторы рН и их комбинации.
Подходящие поверхностно-активные вещества могут быть анионными, катионными, амфотерными или неионными поверхностно-активными средствами. Подходящие анионные поверхностно-активные вещества включают, но не ограничены перечисленными, такие вещества, содержащие карбоксилатные, сульфонатные и сульфатные ионы. Примеры анионных поверхностно-активных веществ включают сульфонаты натрия, калия, аммония длинноцепочечных алкил- и алкиларилсульфонатов, такие как додецилбензолсульфонат натрия; диалкилсульфосукцинаты натрия, такие как додецилбензолсульфонат натрия; диалкилсульфосукцинаты натрия, такие как бис-(2-этилтиоксил)-сульфосукцинат натрия; и алкилсульфаты, такие как лаурилсульфат натрия. Катионные поверхностно-активные вещества включают, но не ограничены перечисленными, соединения четвертичного аммония, такие как бензалкония хлорид, бензэтония хлорид, цетримония бромид, хлорид стеарилдиметилбензил аммония, полиоксиэтилен и амин кокосового ореха. Примеры неионных поверхностно-активных веществ включают моностеарат этиленгликоля, миристат пропиленгликоля, глицерилмоностеарат, глицерилстеарат, полиглицерил-4-олеат, ацилат сорбитана, ацилат сахарозы, ПЭГ-150 лаурат, ПЭГ-400 монолаурат, полиоксиэтиленмонолаурат, полисорбаты, октилфениловый простой эфир полиоксиэтилена, цетиловый простой эфир ПЭГ-1000, тридециловый простой эфир полиоксиэтилена, бутиловый простой эфир полипропилен гликоля, Полоксамер® 401, стеароилмоноизопропаноламид, и таллоу-амид гидрированного полиоксиэтилена. Примеры амфотерных поверхностно-активных веществ включают N-додецил-β-аланин натрия, N-лаурил-β-иминодипропионат, миристоамфоацетат натрия, лаурилбетаин и лаурилсульфобетаин.
Композиция может содержать консервант для предотвращения роста микроорганизмов. Подходящие консерванты включают, но не ограничены перечисленными, парабены, хлорбутанол, фенол, сорбиновую кислоту и тимеросал. Композиция может также содержать антиоксидант для предотвращения разрушения активных средств(средства).
Композицию типовым образом забуферивают до pH 3-8 для парентерального введения при восстановлении. Подходящие буферы включают, но не ограничены перечисленными, фосфатные буферы, ацетатные буферы и цитратные буферы.
Водорастворимые полимеры часто применяются в лекарственных формах для парентерального введения. Подходящие водорастворимые полимеры включают, но не ограничены перечисленными, поливинилпирролидон, декстран, карбоксиметилцеллюлозу и полиэтиленгликоль.
Стерильные инъекционные растворы могут быть получены посредством введения активных соединений в требуемом количестве в соответствующие растворитель или дисперсионную среду с одним или несколькими эксципиентами, перечисленными выше, как требуется, с последующей стерилизацией фильтрованием. Обычно, дисперсии получают посредством введения различных стерилизованных активных ингредиентов в стерильную несущую среду, которая содержит основную дисперсионную среду и требуемые другие ингредиенты из тех, что перечислены выше. В случае стерильных порошков для получения стерильных инъекционных растворов, предпочтительными методами получения являются технологии вакуум-сушки и лиофилизации, которые позволяют получить порошок активного ингредиента плюс любой дополнительный желательный ингредиент из ранее стерильно отфильтрованного его раствора. Порошки могут быть получены таким образом, что частицы будут пористыми по природе, что может увеличить растворение частиц. Способы получения пористых частиц являются хорошо известными в данной области.
1. Лекарственные формы с контролируемым высвобождением
Парентеральные лекарственные формы, описанные в настоящем документе, могут быть составлены для контролируемого высвобождения, включающего немедленное высвобождение, отсроченное высвобождение, пролонгированное высвобождение, пульсирующее высвобождение и их комбинации.
Нано- и микрочастицы
Для парентерального введения, соединения, и необязательно одно или несколько дополнительных активных средств, могут быть введены в микрочастицы, наночастицы, или их комбинации, которые обеспечивают контролируемое высвобождение. В вариантах осуществления, в которых лекарственные формы содержат два или более лекарственных средств, лекарственные средства могут быть составлены для такого же типа контролируемого высвобождения (например, отсроченного, пролонгированного, немедленного или пульсирующего) или лекарственные средства могут быть независимо составлены для различных типов высвобождения (например, немедленного и отсроченного, немедленного и пролонгированного, отсроченного и пролонгированного, отсроченного и пульсирующего и т.д.).
Например, соединения и/или одно или несколько дополнительных активных средств могут быть введены в полимерные микрочастицы, которые обеспечивают контролируемое высвобождение лекарственных средства(средств). Высвобождение лекарственных средства(средств) управляется диффузией лекарственных средства(средств) из микрочастиц и/или разрушением полимерных частиц посредством гидролиза и/или ферментативного разрушения. Подходящие полимеры включают этилцеллюлозу и другие природные или синтетические производные целлюлозы.
Полимеры, которые являются медленно растворимыми и образуют гель в водном окружении, такие как гидроксипропилметилцеллюлоза или оксид полиэтилена, могут также подходить в качестве материалов для микрочастиц, содержащих лекарственное средство. Другие полимеры включают, но не ограничены перечисленными, полиангидриды, ангидриды сложных полиэфиров), полигидроксикислоты, такие как полилактид (PLA), полигликолид (PGA), поли(лактид-со-гликолид) (PLGA), поли-3-гидроксибутират (PHB) и их сополимеры, поли-4-гидроксибутират (P4HB) и их сополимеры, поликапролактон и его сополимеры и их комбинации.
Альтернативно, лекарственные средства(средство) могут быть введены в микрочастицы, полученные из материалов, которые являются нерастворимыми в водном растворе или медленно растворимыми в водном растворе, но способны к разрушению в ЖК тракте под действием средств, включающих ферментативное разрушение, поверхностно-активное действие желчных кислот, и/или механическую эрозию. Как используется в настоящем описании, термин ʺмедленно растворимые в водеʺ относится к материалам, которые не растворяются в воде в пределах периода, равного 30 минутам. Предпочтительные примеры включают жиры, жирные вещества, воска, воскоподобные вещества и их смеси. Подходящие жиры и жирные вещества включают жирные спирты (такие как лауриловый, миристиловый, стеариловый, цетиловый или цетостеариловый спирт), жирные кислоты и производные, включающие, но не ограниченные перечисленными, сложные эфиры жирных кислот, глицериды жирных кислот (моно-, ди- и три-глицериды), и гидрированные жиры. Конкретные примеры включают, но не ограничены перечисленными, гидрированное растительное масло, гидрированное хлопковое масло, гидрированное касторовое масло, гидрированные масла, доступные под торговым наименованием Sterotex®, стеариновую кислоту, масло какао и стеариловый спирт. Подходящие воска и воскоподобные материалы включают природные или синтетические воска, углеводороды и обычные воска. Конкретные примеры восков включают пчелиный воск, гликовоск, гидрированное касторовое масло, карнаубский воск, парафины и канделильский воск. Как используется в настоящем описании, воскоподобный материал определяют как любой материал, который в обычно является твердым веществом при комнатной температуре и имеет температуру плавления от приблизительно 30 до 300°C.
В нескольких случаях, может быть желательным изменить скорость проникновения воды в микрочастицы. С этой целью, могут быть составлены контролирующие скорость (капиллярные) средства, наряду с жирами или восками, перечисленными выше. Примеры контролирующих скорость материалов включают некоторые производные крахмала (например, восковидный мальтодекстрин и высушенный в барабанной сушилке кукурузный крахмал), производные целлюлозы (например, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, метилцеллюлоза и карбоксиметилцеллюлоза), альгиновая кислота, лактоза и тальк. Дополнительно, может быть добавлено фармацевтически приемлемое поверхностно-активное вещество (например, лецитин), чтобы облегчить разрушение таких микрочастиц.
Белки, которые являются нерастворимыми в воде, такие как зеин, могут также применяться в качестве материалов для образования микрочастиц, содержащих лекарственное средство. Дополнительно, белки, полисахариды и их комбинации, которые являются водорастворимыми, могут быть составлены вместе с лекарственным средством в микрочастицы и последовательно сшиты с образованием нерастворимого каркаса. Например, циклодекстрины могут образовывать комплексы с индивидуальными молекулами лекарственного средства и впоследствии сшиваться.
Инкапсулирование или введение лекарственного средства в материалы носителей для получения микрочастиц, содержащих лекарственное средство, может достигаться посредством известных технологий составления фармацевтических лекарственных форм. В случае составления в жирах, восках или воскоподобных материалах, материал носителя обычно нагревают выше его температуры плавления, и лекарственное средство добавляют с образованием смеси, содержащей частицы лекарственного средства, суспендированные в материале носителя, лекарственное средство, растворенное в материале носителя, или их смесь. Микрочастицы могут быть последовательно составлены посредством нескольких способов, включающих, но не ограниченных перечисленными, процессы отверждения, экструзии, охлаждения распылением или в водной дисперсии. В предпочтительном процессе, воск нагревают выше его температуры плавления, добавляют лекарственное средство, и расплавленную смесь воск-лекарственное средство отверждают при постоянном перемешивании по мере охлаждения смеси. Альтернативно, расплавленная смесь воск-лекарственное средство может быть экстудирована и окатана с образованием пеллет или микросфер. Подробные описания этих процессов можно найти в ʺRemington-science and practice of pharmacyʺ, 20th Edition, Jennaro et. al., (Phila., Lippencott, Williams, and Wilkens, 2000).
Для нескольких материалов носителя может быть желательным применять метод упаривания растворителя для получения микрочастиц, содержащих лекарственное средство. В этом случае, лекарственное средство и материал носителя совместно растворяют во взаимном растворителе, и микрочастицы могут впоследствии быть получены несколькими методами, включающими, но не ограниченными перечисленными, образование эмульсии в воде или других соответствующих средах, распылительную сушку, или посредством упаривания растворителя из основного объема раствора и измельчения полученного в результате материала.
В нескольких вариантах осуществления, лекарственное средство в форме частиц гомогенно диспергируют в нерастворимом в воде или медленно водорастворимом материале. Чтобы минимизировать размер частиц лекарственного средства в композиции, сам порошок лекарственного средства может быть измельчен для генерации мелких частиц перед составлением. Процесс размола на струйной мельнице, известный в фармацевтической области, может применяться для этой цели. В нескольких вариантах осуществления лекарственное средство в форме частиц гомогенно диспергируют в воске или воскоподобном веществе посредством нагрева воска или воскоподобного вещества выше его точки плавления и добавления частиц лекарственного средства во время перемешивания смеси. В этом случае, фармацевтически приемлемое поверхностно-активное вещество может быть добавлено к смеси, чтобы облегчить диспергирование частиц лекарственного средства.
Частицы могут также быть покрыты одним или несколькими покрытиями с модифицированным высвобождением. Твердые сложные эфиры жирных кислот, которые гидролизуются липазами, могут быть нанесены в виде покрытия распылением на микрочастицы или частицы лекарственного средства. Зеин является примером природного водонерастворимого белка. Они могут быть нанесены в виде покрытия на микрочастицы, содержащие лекарственное средство, или частицы лекарственного средства посредством покрытия распылением или методами влажного гранулирования. В дополнение к природным водонерастворимым материалам, некоторые субстраты пищеварительных ферментов могут быть обработаны с использованием методик сшивки, приводящих в результате к образованию нерастворимых каркасов. Сообщается о многих способах сшивки белков, инициированной как химическими, так и физическими средствами. Одним из наиболее распространенных способов получения сшивки является применение химических сшивающих агентов. Примеры химических сшивающих агентов включают альдегиды (глутаральдегид и формальдегид), эпокси-соединения, карбодиимиды и дженипин. В дополнение к этим сшивающим агентам, окисленные и нативные сахара применяли для сшивки желатина (Cortesi, R., et al., Biomaterials 19 (1998) 1641-1649). Сшивку можно также проводить с использованием ферментативных средств; например, трансглутаминаза была разрешена как вещество GRAS для сшивки морепродуктов. Наконец, сшивка может быть инициирована физическими средствами, такими как термическая обработка, УФ-облучение и гамма-облучение.
Для получения слоя покрытия сшитого белка, окружающего микрочастицы, содержащие лекарственное средство, или частицы лекарственного средства, водорастворимый белок может быть нанесен в виде покрытия напылением на поверхность микрочастиц и впоследствии подвергнут сшивке одним из способов, описанных выше. Альтернативно, микрочастицы, содержащие лекарственное средство, могут быть микроинкапсулированы внутри белка посредством коацервациии-фазового разделения (например, добавлением солей) и последовательно сшиты. Некоторые подходящие белки для этой цели включают желатин, альбумин, казеин и глютен. Полисахариды могут быть также сшиты с образованием водонерастворимого каркаса. Для многих полисахаридов, это может выполняться посредством реакции с солями кальция или многовалентными катионами, которые сшивают основные полимерные цепи. Пектин, альгинат, декстран, амилоза и гуаровая камедь подвергаются сшивке в присутствии многовалентных катионов. Могут также быть образованы комплексы между противоположно заряженными полисахаридами; пектин и хитозан, например, могут образовывать комплекс посредством электростатических взаимодействий.
Депо-лекарственные формы
Активные средства могут быть составлены для инъекции веществ с замедленным всасыванием. При инъекции веществ с замедленным всасыванием, активное средство составляют с одним или несколькими фармацевтически приемлемыми носителями, которые обеспечивают постепенное высвобождение активного средства в течение периода из часов или дней после инъекции. Депо-лекарственная форма может вводиться посредством любых подходящих средств; однако, депо-лекарственную форму обычно вводят посредством подкожной или внутримышечной инъекции.
Различные носители могут вводиться в депо-лекарственную форму для обеспечения контролируемого высвобождения активного средства. В нескольких случаях, депо-лекарственные формы содержат один или несколько биодеградируемых полимерных или олигомерных носителей. Подходящие полимерные носители включают, но не ограничены перечисленными поли(молочную кислоту) (PLA), поли(молочную-со-гликолевую кислоту) (PLGA), блок-сополимеры поли(молочной кислоты)-полиэтиленгликоля (PLA-PEG), полиангидриды, ангидриды сложных полиэфиров), полигликолид (PGA), поли-3-гидроксибутират (PHB) и их сополимеры, поли-4-гидроксибутират (PHB), поликапролактон, целлюлозу, гидроксипропилметилцеллюлозу, этилцеллюлозу, а также смеси, производные, сополимеры и их комбинации.
В депо-лекарственных формах, содержащих полимерный или олигомерный носитель, носитель и активное средство могут быть составлены в виде раствора, эмульсии или суспензии. Одно или несколько соединений, и, необязательно, одно или несколько дополнительных активных средств, могут также вводиться в полимерные или олигомерные микрочастицы, наночастицы или их комбинации.
В нескольких случаях, лекарственная форма является текучей и сконструированной для отверждения или желирования (т.е., образования гидрогеля или органогеля) при инъекции. Это может являться результатом изменения растворимости композиции при инъекции, или например, посредством преполимера, смешанного с инициатором и/или сшивающего агента. Полимерная матрица, раствор полимера или полимерные частицы захватывают активное средство на участке инъекции. По мере того, как полимерный носитель постепенно разрушается, активное средство высвобождается, либо посредством диффузии средства из матрицы и/или диссипации матрицы по мере ее всасывания. Скорость высвобождения активного средства из участка инъекции может контролироваться посредством изменения, например, химического состава, молекулярной массы, плотности сшивки, и/или концентрации полимерного носителя. Примеры таких систем включают системы, описанные в Патентах США №№ 4,938,763, 5,480,656 и 6,113,943.
Депо-лекарственные формы могут также быть получены посредством использования других контролирующих скорость эксципиентов, включающих гидрофобные материалы, включающие приемлемые масла (например, арахисовое масло, кукурузное масло, кунжутное масло, хлопковое масло, и т.д.), и фосфолипиды, ионообменные смолы, и умеренно растворимые носители.
Депо-композиция может дополнительно содержать растворитель или дисперсионную среду содержащую, например, воду, этанол, один или несколько полиолов (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), масла, такие как растительные масла (например, арахисовое масло, кукурузное масло, кунжутное масло и т.д.) и их комбинации. Надлежащая текучесть может поддерживаться, например, посредством применения покрытия, такого как лецитин, посредством поддержания требуемого размера частиц в случае дисперсии и/или посредством применения поверхностно-активных веществ. Во многих случая, будет предпочтительным включать изотонические средства, например, сахара или хлорид натрия.
Растворы и дисперсии активных соединений в виде свободной кислоты или свободного основания или их фармакологически приемлемых солей могут быть получены в воде или еще одном растворителе или диспергирующей среде, подходящим образом смешанной с одним или несколькими фармацевтически приемлемыми эксципиентами, включающими, но не ограниченными перечисленными, поверхностно-активные вещества, диспергаторы, эмульгаторы, модификаторы рН и их комбинации.
Подходящие поверхностно-активные вещества могут быть анионными, катионными, амфотерными или неионными поверхностно-активными средствами. Подходящие анионные поверхностно-активные вещества включают, но не ограничены перечисленными, такие вещества, содержащие карбоксилатные, сульфонатные и сульфатные ионы. Примеры анионных поверхностно-активных веществ включают сульфонаты натрия, калия, аммония длинноцепочечных алкил- и алкиларилсульфонатов, такие как додецилбензолсульфонат натрия; диалкилсульфосукцинаты натрия, такие как додецилбензолсульфонат натрия; диалкилсульфосукцинаты натрия, такие как бис-(2-этилтиоксил)-сульфосукцинат натрия; и алкилсульфаты такие как лаурилсульфат натрия. Катионные поверхностно-активные вещества включают, но не ограничены перечисленными, соединения четвертичного аммония, такие как бензалкония хлорид, бензэтония хлорид, цетримония бромид, хлорид стеарилдиметилбензил аммония, полиоксиэтилен и амин кокосового ореха. Примеры неионных поверхностно-активных веществ включают моностеарат этиленгликоля, миристат пропиленгликоля, глицерилмоностеарат, глицерилстеарат, полиглицерил-4-олеат, ацилат сорбитана, ацилат сахарозы, ПЭГ-150 лаурат, ПЭГ-400 монолаурат, полиоксиэтиленмонолаурат, полисорбаты, октилфениловый простой эфир полиоксиэтилена, цетиловый простой эфир ПЭГ-1000, тридециловый простой эфир полиоксиэтилена, бутиловый простой эфир полипропилен гликоля, Полоксамер® 401, стеароилмоноизопропаноламид, и таллоу-амид гидрированного полиоксиэтилена. Примеры амфотерных поверхностно-активных веществ включают N-додецил-β-аланин натрия, N-лаурил-β-иминодипропионат, миристоамфоацетат натрия, лаурилбетаин и лаурилсульфобетаин.
Композиция может содержать консервант для предотвращения роста микроорганизмов. Подходящие консерванты включают, но не ограничены перечисленными, парабены, хлорбутанол, фенол, сорбиновую кислоту и тимеросал. Композиция может также содержать антиоксидант для предотврашения разрушения активных средств(средства).
Композицию типовым образом забуферивают до pH 3-8 для парентерального введения при восстановлении. Подходящие буферы включают, но не ограничены перечисленными, фосфатные буферы, ацетатные буферы и цитратные буферы.
Водорастворимые полимеры часто применяются в лекарственных формах для парентерального введения. Подходящие водорастворимые полимеры включают, но не ограничены перечисленными, поливинилпирролидон, декстран, карбоксиметилцеллюлозу и полиэтиленгликоль.
Стерильные инъекционные растворы могут быть получены посредством введения активных соединений в требуемом количестве в соответствующие растворитель или дисперсионную среду с одним или несколькими эксципиентами, перечисленными выше, как требуется, с последующей стерилизацией фильтрованием. Обычно, дисперсии получают посредством введения различных стерилизованных активных ингредиентов в стерильную несущую среду, которая содержит основную дисперсионную среду и требуемые другие ингредиенты из тех, что перечислены выше. В случае стерильных порошков для получения стерильных инъекционных растворов, предпочтительными методами получения являются технологии вакуум-сушки и лиофилизации, которые позволяют получить порошок активного ингредиента плюс любой дополнительный желательный ингредиент из ранее стерильно отфильтрованного его раствора. Порошки могут быть получены таким образом, что частицы будут пористыми по природе, что может увеличить растворение частиц. Способы получения пористых частиц являются хорошо известными в данной области.
Имплантаты
Имплантатaция системы с медленным высвобождением или с замедленным высвобождением, таким образом, что поддерживается постоянный уровень дозировки, также предусмотрена в настоящем документе. В таких случаях, активные средство (средства), предоставленные в данном описании, могут быть диспергированы в твердой матрице, необязательно покрытой внешней мембраной, контролирующей скорость. Соединение диффундирует из твердой матрицы (и необязательно через внешнюю мембрану) с замедленным высвобождением с контролируемой скоростью. Твердая матрица и мембрана могут быть образованы из любого подходящего материала, известного в данной области, включающего, но не ограниченного перечисленными, полимеры, биоразлагаемые полимеры и гидрогели.
D. Пульмональные лекарственные формы
Соединения, описанные в данном документе, могут быть составлены для парентерального введения. Фармацевтические композиции и методы пульмонального введения являются известными в данной области.
Дыхательные пути является структурой, вовлеченной в газообмен между атмосферой и кровотоком. Дыхательные пути охватывают верхние дыхательные пути, включающие ротоглотку и гортань, с последующими нижними дыхательными путями, которые включают трахею с последующими бифуркациями в бронхи и бронхиолы. Верхние и нижние дыхательные пути называют дыхательными путями, в которых не происходит газообмен. Терминальные бронхиолы затем разделяются на дыхательные бронхиолы, которые затем приводят к окончательной дыхательной зоне, альвеолам или глубокой области легкого, где происходит газообмен.
Область альвеолярной поверхности является самой крупной в дыхательной системе и областью, где происходит всасывание лекарственного средства. Альвеолы покрыты тонким эпителием без ресничек или слизистым защитным слоем и секретируют поверхностно-активные фосфолипиды. Для эффективной доставки терапевтических средств через пульмональные пути требуется, чтобы активное средство было составлено, чтобы достигать альвеол.
В случае пульмонального введения, лекарственные формы могут разделяться на лекарственные формы в виде сухого порошка и жидкие лекарственные формы. Как сухой порошок, так и жидкие лекарственные формы могут применяться для образования аэрозольных лекарственных форм. Термин аэрозоль, как используется в настоящем описании, относится к любому получению мелкодисперсного тумана из частиц, которые могут находиться в растворе или суспензии, независимо от того получают ли его или не получают с использованием пропеллента. Применимые лекарственные формы, и способы изготовления, описаны Caryalho, et al., J Aerosol Med Pulm Drug Deliv. 2011 Apr;24(2):61-80. Epub 2011 Mar 16 для доставки химиотерапевтических лекарственных средств в легкие.
1. Лекарственные формы в виде сухого порошка
Лекарственные формы в виде сухого порошка представляют собой мелкодисперсные твердые лекарственные формы, содержащие одно или несколько активных средств, которые являются подходящими для пульмонального введения. В лекарственных формах в виде сухого порошка, одно или несколько активных средств могут вводиться в кристаллической или аморфной форме.
Лекарственные формы в виде сухого порошка могут вводиться посредством ингаляции легких пациенту без использования любого носителя, отличного от воздуха или подходящего пропеллента. Предпочтительно, однако, лекарственные формы в виде сухого порошка включают один или несколько фармацевтически приемлемых носителей.
Фармацевтический носитель может включать объемообразующий агент, такой как углеводы (включающие моносахариды, полисахариды и циклодекстрины), полипептиды, аминокислоты и их комбинации. Подходящие объемообразующие агенты включают фруктозу, галактозу, глюкозу, лактит, лактозу, мальтит, мальтозу, маннит, мелецитозу, миоинозит, палатинит, раффинозу, стахиозу, сахарозу, трегалозу, ксилит, их гидраты и их комбинации.
Фармацевтический носитель может включать липид или поверхностно-активное вещество. Природные поверхностно-активные вещества, такие как дипальмитоилфосфатидилхолин (ДПФХ) являются наиболее предпочтительными. Он является доступным для приобретения для лечения респираторного дистресс-синдрома у недоношенных детей. Синтетические и животного происхождения легочные поверхностно-активные вещества включают:
Синтетические Легочные поверхностно-активные вещества
Exosurf® - смесь ДПФХ с гексадеканолом и тилоксаполом, добавляемых в качестве растекающего средства Пумактант (Artificial Lung Expanding Compound или ALEC) - смесь ДПФХ и ФГ
KL-4 - состоящий из ДПФХ, пальмитоил-олеоилфосфатидилглицерина, и пальмитиновой кислоты, в сочетании с синтетическим пептидом из 21 аминокислоты, который имитирует структурные характеристики SP-B.
Venticute - ДПФХ, ФГ, пальмитиновая кислота и рекомбинантный SP-C
Поверхностно-активные вещества животного происхождения
Alveofact® - экстрагированный из промывной жидкости коровьего легкого
Curosurf® - экстрагированный из материала, полученного из размельченного свиного легкого
Infasurf® - экстрагированный из промывной жидкости телячьего легкого
Survanta® - экстрагированный из размельченного коровьего легкого с дополнительными ДПФХ, пальмитиновой кислотой и трипальмитином
Exosurf®, Curosurf®, Infasurf®, и Survanta® являются поверхностно-активными веществами, в настоящее время разрешенными FDA для применения в США.
Фармацевтический носитель может также включать один или несколько стабилизаторов или диспергаторов. фармацевтический носитель может также включать один или несколько регуляторов pH или буферов. Подходящие буферы включают органические соли, полученные из органических кислот и оснований, таких как цитрат натрия или аскорбат натрия. Фармацевтический носитель может также включать одну или несколько солей, таких как хлорид натрия или калия хлорид.
Лекарственные формы в виде сухого порошка обычно получают смешиванием одного или нескольких активных средств с фармацевтическим носителем. Необязательно, в смесь могут быть введены дополнительные активные средства. Смесь затем формируют в частицы, подходящие для пульмонального введения с использованием методов, известных в данной области, таких как лиофилизация, распылительная сушка, агломерация, покрытие напылением, экструзионные процессы, образование частиц из горячего расплава, образование частиц при фазовом разделении (самопроизвольное образование частиц из эмульсии, образование частиц при упаривании растворителя и образование частиц при удалении растворителя), коацервация, низкотемпературное литье, размол, измельчение (например, измельчение приистирании воздухом (струйное измельчение), размол на шаровой мельнице), гомогенизация под высоким давлением и/или кристаллизация из сверхкритической жидкости.
Соответствующий способ образования частиц может быть выбран на основе желательного размера частиц, распределения частиц по размерам и морфологии частиц. В нескольких случаях, способ образования частиц выбирают таким образом, чтобы получать популяцию частиц с желательными размерами частиц, распределением частиц по размерам для пульмонального введения. Альтернативно, способ образования частиц может производить популяцию частиц, из которой выделяют популяцию частиц с желательными размерами частиц, распределением частиц по размерам для пульмонального введения, например, посредством просеивания.
В данной области известно, что морфология частиц оказывает воздействие на глубину проникновения частиц в легкое, а также захват частиц лекарственного средства. Как обсуждается выше, частицы лекарственного средства должны достигать альвеол, чтобы максимизировать терапевтическую эффективность. Соответственно, лекарственные формы в виде сухого порошка перерабатывают в частицы, имеющие соответствующий масс-медианный аэродинамический диаметр (MMAD), насыпную плотность после утряски, и шероховатость поверхности, чтобы достичь доставки одного или нескольких активных средств в глубокую область легкого. Предпочтительные морфологии частиц для доставки в глубокую область легкого являются известными в данной области, и описаны, например, в Патенте США 7,052,678 на имя Vanbever, et al.
Частицы, имеющие масс-медианный аэродинамический диаметр (MMAD) больший, чем приблизительно 5 микронов, обычно не достигают легкого; вместо этого, они имеют тенденцию воздействовать на заднюю стенку глотки и проглатываются. Частицы, имеющие диаметры от приблизительно 3 до приблизительно 5 микронов, являются достаточно мелкими, чтобы достигать областей от верхнего легкого до среднего легкого (дыхательные пути, в которых не происходит газообмен), но могут быть слишком крупными, чтобы достигать альвеол. Более мелкие частицы, (т.е., от приблизительно 0,5 до приблизительно 3 микронов), способны эффективно достигать альвеолярной области. Частицы, имеющие диаметры менее приблизительно 0,5 микронов, могут также осаждаться в альвеолярной области посредством седиментации, несмотря на то, что очень мелкие частицы могут выдыхаться.
Точный диапазон размера частиц, эффективных для достижения доставки в альвеолярную область, будет зависеть от нескольких факторов, включающих насыпную плотность после утряски доставляемых частиц. В общем случае, по мере уменьшения насыпной плотности после утряски, MMAD частиц, способных эффективно достигать альвеолярной области легких, возрастает. Следовательно, в случаях частиц с низкими значениями насыпной плотности после утряски, частицы, имеющие диаметры от приблизительно 3 до приблизительно 5 микронов, от приблизительно 5 до приблизительно 7 микронов или от приблизительно 7 до приблизительно 9,5 микронов, могут эффективно доставляться в легкие. Предпочтительный аэродинамический диаметр для максимального осаждения внутри легких может быть рассчитан. См., например, Патент США 7,052,678 на имя Vanbever, et al.
В нескольких вариантах осуществления, лекарственная форма в виде сухого порошка составлена из множества частиц, имеющих масс-медианный аэродинамический диаметр между приблизительно 0,5 и приблизительно 10 микронов, более предпочтительно между приблизительно 0,5 микронов и приблизительно 7 микронов, наиболее предпочтительно, между приблизительно 0,5 и приблизительно 5 микронов. В нескольких вариантах осуществления, лекарственная форма в виде сухого порошка составлена из множества частиц, имеющих масс-медианный аэродинамический диаметр между приблизительно 0,5 и приблизительно 3 микронов. В нескольких вариантах осуществления, лекарственная форма в виде сухого порошка составлена из множества частиц, имеющих масс-медианный аэродинамический диаметр между приблизительно 3 и приблизительно 5 микронов. В нескольких вариантах осуществления, лекарственная форма в виде сухого порошка составлена из множества частиц, имеющих масс-медианный аэродинамический диаметр между приблизительно 5 и приблизительно 7 микронов. В нескольких вариантах осуществления, лекарственная форма в виде сухого порошка составлена из множества частиц, имеющих масс-медианный аэродинамический диаметр между приблизительно 7 и приблизительно 9,5 микронов.
В нескольких случаях, может быть преимущественной доставка частиц крупнее приблизительно 3 микронов в диаметре. Фагоцитоз частиц альвеолярными макрофагами резко снижается, по мере увеличения диаметра частицы свыше приблизительно 3 микронов. Kawaguchi, H., et al., Biomaterials 7: 61-66 (1986); и Rudt, S. и Muller, R. H., J. Contr. Rel, 22: 263-272 (1992). При введении частиц с аэродинамическим объемом свыше 3 микронов, фагоцитарное поглощение альвеолярными макрофагами и выведение из легких могут быть минимизированы.
В нескольких вариантах осуществления, по меньшей мере, приблизительно 80%, более предпочтительно, по меньшей мере, приблизительно 90%, наиболее предпочтительно, по меньшей мере, приблизительно 95% частиц в лекарственной форме в виде сухого порошка имеют аэродинамический диаметр меньший, чем приблизительно 10 микронов, более предпочтительно, меньший, чем приблизительно 7 микронов, наиболее предпочтительно, приблизительно 5 микронов. В нескольких вариантах осуществления, по меньшей мере, приблизительно 80%, более предпочтительно, по меньшей мере, приблизительно 90%, наиболее предпочтительно, по меньшей мере, приблизительно 95%, частиц в лекарственной форме в виде сухого порошка имеют аэродинамический диаметр больший, чем приблизительно 0,5 микронов, В нескольких вариантах осуществления, по меньшей мере, приблизительно 80%, более предпочтительно, по меньшей мере, приблизительно 90%, наиболее предпочтительно, по меньшей мере, приблизительно 95%, частицы в лекарственной форме в виде сухого порошка имеют аэродинамический диаметр больший, чем приблизительно 0,1 микронов.
В нескольких вариантах осуществления, по меньшей мере, приблизительно 80%, более предпочтительно, по меньшей мере, приблизительно 90%, наиболее предпочтительно, по меньшей мере, приблизительно 95%, частиц в лекарственной форме в виде сухого порошка имеют аэродинамический диаметр больший, чем, приблизительно 0,5 микронов и меньший, чем приблизительно 10 микронов, более предпочтительно больший, чем приблизительно 0,5 микронов и меньший, чем приблизительно 7 микронов, наиболее предпочтительно, больший, чем приблизительно 0,5 микронов, и меньший, чем приблизительно 5 микронов. В нескольких вариантах осуществления, по меньшей мере, приблизительно 80%, более предпочтительно, по меньшей мере, приблизительно 90%, наиболее предпочтительно, по меньшей мере, приблизительно 95% частиц в лекарственной форме в виде сухого порошка имеют аэродинамический диаметр больший, чем приблизительно 0,5 микронов, и меньший, чем приблизительно 3 микрона. В нескольких вариантах осуществления, по меньшей мере, приблизительно 80%, более предпочтительно, по меньшей мере приблизительно 90%, наиболее предпочтительно, по меньшей мере, приблизительно 95% частиц в лекарственной форме в виде сухого порошка имеют аэродинамический диаметр больший, чем приблизительно 3 микронов, и меньший, чем приблизительно 5 микронов. В нескольких вариантах осуществления, по меньшей мере, приблизительно 80%, более предпочтительно, по меньшей мере, приблизительно 90%, наиболее предпочтительно, по меньшей мере, приблизительно 95% частиц в лекарственной форме в виде сухого порошка имеют аэродинамический диаметр больший, чем приблизительно 5 микронов, и меньший, чем приблизительно 7 микронов. В нескольких вариантах осуществления, по меньшей мере, приблизительно 80%, более предпочтительно, по меньшей мере приблизительно 90%, наиболее предпочтительно, по меньшей мере, приблизительно 95% частиц в лекарственной форме в виде сухого порошка имеют аэродинамический диаметр больший, чем приблизительно 7 микронов, и меньший, чем приблизительно 9,5 микронов.
В нескольких вариантах осуществления, частицы имеют насыпную плотность после утряски меньшую, чем приблизительно 0,4 г/см3, более предпочтительно, меньшую, чем приблизительно 0,25 г/см3, наиболее предпочтительно, меньшую, чем приблизительно 0,1 г/см3. Характеристики, которые могут способствовать низкой насыпной плотности после утряски, включают нерегулярную текстуру поверхности и пористую структуру.
В нескольких случаях, частицы являются сферическими или овальными по форме. Частицы могут иметь гладкую или шероховатую текстуру поверхности. Частицы могут также быть покрыты полимером или другим подходящим материалом для контроля высвобождения одного или нескольких активных средств в легких.
Лекарственные формы в виде сухого порошка могут вводиться в виде сухого порошка с использованием подходящих способов, известных в данной области. Альтернативно, лекарственные формы в виде сухого порошка могут быть суспендированы в жидких лекарственных формах, описанных ниже, и вводиться в легкие с использованием способов, известных в данной области для доставки жидких лекарственных форм.
2. Жидкие лекарственные формы
Жидкие лекарственные формы содержат одно или несколько соединений, растворенных или суспендированных в жидком фармацевтическом носителе.
Подходящие жидкие носители включают, но не ограничены перечисленными, дистиллированную воду, деионизированную воду, чистую или ультрачистую воду, физиологический раствор и другие физиологически приемлемые водные растворы, содержащие соли и/или буферы, такие как забуференный фосфатом физраствор (PBS), раствор Рингера и изотонический хлорид натрия, или любой другой водный раствор, приемлемый для введения животному или человеку.
Предпочтительно, жидкие лекарственные формы являются изотоничными относительно физиологических жидких сред и имеют приблизительно такой же pH, в интервале, например, от приблизительно pH 4,0 до приблизительно pH 7,4, более предпочтительно, от приблизительно pH 6,0 до pH 7,0. Жидкий фармацевтический носитель может включать один или несколько физиологически совместимых буферов, таких как фосфатные буферы. Специалист в данной области может легко определить подходящее содержание физраствора и pH для водного раствора для пульмонального введения.
Жидкие лекарственные формы могут включать одно или несколько суспендирующих средств, таких как производные целлюлозы, альгинат натрия, поливинилпирролидон, камедь трагаканта или лецитин. Жидкие лекарственные формы могут также включать один или несколько консервантов, таких как этил- или н-пропил-п-гидроксибензоат.
В нескольких случаях, жидкая лекарственная форма может содержать один или несколько остаточных растворителей, которые являются низкотоксичными органическими (т.е., неводными) соединениями класса 3, такие как этанол, ацетон, этилацетат, тетрагидрофуран, этиловый простой эфир и пропанол. Эти растворители могут быть выбраны, исходя из их способности легко аэрозолизировать лекарственную форму. Любой такой растворитель, включенный в жидкую лекарственную форму, не должен взаимодействовать с вредными последствиями с одним или несколькими активными средствами, присутствующими в жидкой композиции. Растворитель должен быть достаточно летучим, чтобы обеспечить образование аэрозоля из раствора или суспензии. Дополнительные растворители или аэрозолизирующие средства, такие как Фреон, спирт, гликоль, полигликоль, или жирная кислота, могут также быть включены в жидкую лекарственную форму, что является желательным для увеличения летучести и/или изменения аэрозолизирующего поведения раствора или суспензии.
Жидкие лекарственные формы могут также содержать минорные количества полимеров, поверхностно-активных веществ, или других эксципиентов, хорошо известным специалистам в данной области. В этом контексте, ʺминорные количестваʺ означает, отсутствие эксципиентов, которые могли бы неблагоприятно воздействовать на захват одного или нескольких активных средств в легких.
3. Аэрозольные лекарственные формы
Лекарственные формы в виде сухого порошка и жидкие лекарственные формы, описанные выше, могут применяться для образования аэрозольных лекарственных форм для пульмонального введения. Аэрозоли для доставки терапевтических средств в дыхательные пути являются известными в данной области. Термин аэрозоль, как используется в настоящем описании, относится к любому препарату из мелкой дисперсии твердых или жидких частиц, суспендированных в газе. В нескольких случаях, газ может представлять собой пропеллент; однако, данное не требуется. Аэрозоли могут быть получены с использованием ряда стандартных методов, включающих ультразвуковую обработку, или обработку высоким давлением.
Предпочтительно, порошковая или лекарственная форма, описанные выше, составляют в аэрозольные лекарственные формы с использованием одного или нескольких пропеллентов. Подходящие пропелленты включают воздух, углеводороды, такие как пентан, изопентан, бутан, изобутан, пропан и этан, диоксид углерода, хлорфторуглероды, фторуглероды и их комбинации. Подходящие фторуглероды включают 1-6 водородсодержащих фторуглеродов, таких как CHF2CHF2, CF3CH2F, CH2F2CH3 и CF3CHFCF3 а также фторированные простые эфиры, такие как CF3-O-CF3, CF2H-O-CHF2 и CF3-CF2-O-CF2-CH3. Подходящие фторуглероды также включают перфторуглероды, такие как 1-4 углеродные перфторуглероды, включающие CF3CF3, CF3CF2CF3 и CF3CF2CF2CF3.
Предпочтительно, пропелленты включают, но не ограничены приведенными, один или несколько гидрофторалканов (HFA). Подходящие HFA пропелленты, включают, но не ограничены приведенными, 1,1,1,2,3,3,-гептафтор-н-пропан (HFA 227), 1,1,1,2-тетрафторэтан (HFA 134) 1,1,1,2,3,3,3-гептафторпропан (Пропеллент 227), или любую смесь этих пропеллентов.
Предпочтительно, один или несколько пропеллентов имеют достаточное давление паров, чтобы придать им эффективность в качестве пропеллентов. Предпочтительно, один или несколько пропеллентов выбирают таким образом, чтобы плотность смеси совпадала с плотностью частиц в аэрозольной лекарственной форме, чтобы минимизировать осаждение или отстаивание частиц в аэрозольной лекарственной форме.
Пропеллент предпочтительно присутствует в количестве достаточном, чтобы выталкивать множество выбранных доз аэрозольной лекарственной формы из аэрозольного баллончика.
4. Устройства для ингаляционного введения
В нескольких случаях, применяют устройство для введения лекарственных форм в легкие. Подходящие устройства включают, но не ограничены перечисленными, ингаляторы сухого порошка, дозирующие ингаляторы под давлением, распылители и электрогидродинамические аэрозольные устройства.
Ингаляция может осуществляться через нос и/или рот пациента. Введение может происходить посредством самовведения леарственной формы во время вдыхания, или при введении леарственной формы через респиратор пациенту на респиратор.
Ингаляторы сухого порошка
Лекарственные формы в виде сухого порошка, описанные выше, могут вводиться в легкие пациента с использованием ингаляторов сухого порошка (ИСП). В устройствах ИСП обычно применяют механизм, такой как выброс газа, чтобы создать облако сухого порошка внутри контейнера, которое затем может вдыхаться пациентом.
В ингаляторах сухого порошка, дозу для введения сохраняют в форме несдавленного сухого порошка, и, при приведении в действие ингалятора, частицы порошка вдыхаются субъектом. В нескольких случаях, сжатый газ (т.е., пропеллент) может применяться для распределения порошка, аналогично дозирующим ингаляторам под давлением (ДИД). В нескольких случаях, ИСП может приводиться в действие дыханием, означая, что аэрозоль создается при точном ответе на вдыхание. Обычно, ингаляторы сухого порошка вводят дозу меньшую, чем несколько десятков миллиграммов на ингаляцию, чтобы избежать провоцирования кашля.
ИСП функционируют посредством различных механических средств для введения лекарственных форм в легкие. В некоторых ИСП, ножевое устройство или затворные кассеты, проходящие через лекарственную форму в виде сухого порошка, содержащуюся в резервуаре, отбрасывают лекарственную форму в проточную часть, посредством чего пациент может вдыхать порошок за одно дыхание. В других API, лекарственную форму в виде сухого порошка упаковывают в предварительно образованную лекарственную форму, такую как блистер, табулу, таблетку или желатиновую капсулу, которую протыкают, раздрабливают или иным образом вскрывают для высвобождения лекарственной формы в виде сухого порошка в проточную часть для последующей ингаляции. Еще другие ИСП высвобождают лекарственную форму в виде сухого порошка в камеру или капсулу и с использованием механических или электрических перемешивающих устройств поддерживают лекарственную форму в виде сухого порошка суспендированной в воздухе до вдыхания пациентом.
Лекарственные формы в виде сухого порошка могут быть упакованы в различные формы, такие как порошок в виде сыпучей пудры, лепешка или прессованная форма для введения в резервуар ИСП.
Примеры подходящих API для введения лекарственных форм, описанных выше, включают ингалятор Turbohaler® (Astrazeneca, Wilmington, Del.), Clickhaler® ингалятор (Innovata, Ruddington, Nottingham, UK), ингалятор Diskus® (Glaxo, Greenford, Middlesex, UK), EasyHaler® (Orion, Expoo, FI), ингалятор Exubera® (Pfizer, New York, N.Y.), ингалятор Qdose® (Microdose, Monmouth Junction, N.J.) и ингалятор Spiros® (Dura, San Diego, Calif.).
Дозирующие ингаляторы под давлением
Жидкие лекарственные формы, описанные выше, могут вводиться в легкие пациента с использованием дозирующего ингалятора под давлением (ДИД).
Дозирующие ингаляторы под давлением (ДИД) обычно включают, по меньшей мере, два компонента: баллончик, в котором жидкая лекарственная форма содержится под давлением в комбинации с одним или несколькими пропеллентами, и корпус, применяемый для удержания и приведения в действие баллончика. Баллончик может содержать однократную или множество доз лекарственной формы. Баллончик может включать клапан, обычно, дозирующий клапан, из которого содержимое баллончика может нагнетаться. Аэрозолизированное лекарственное средство распределяется из ДИД посредством приложения усилия на баллончик для сдавливания внутри корпуса, таким образом, открывая клапан и вызывая перенос частиц лекарственного средства из клапана через выпускное отверстие корпуса. При нагнетании из баллончика, жидкая лекарственная форма атомизируется, образуя аэрозоль.
В ДИД обычно используют один или несколько пропеллентов для сдавливания содержимого баллончика и для выталкивания жидкой лекарственной формы из выпускного отверстия корпуса, с рассеиванием аэрозоля. Могут использоваться любые подходящие пропелленты, включающие пропелленты, обсуждаемые выше. Пропеллент может принимать различные формы. Например, пропеллент может представлять собой сжатый газ или ожиженный газ. Хлорфторуглероды (ХФУ) ранее широко применялись в качестве жидких пропеллентов, но в настоящее время являются запрещенными. Их в настоящее время заменили широко применяемые гидрофторалкановые (ГФА) пропелленты.
ДИД являются доступными от ряда поставляющих компаний, включающих 3M Corporation, Aventis, Boehringer Ingleheim, Forest Laboratories, Glaxo-Wellcome, Schring Plough и Vectura. В нескольких случаях, пациент вводит аэрозолизированную лекарственную форму посредством нагнетания вручную аэрозолизированной лекарственной формы из ДИД в координации с вдыханием. Таким образом, аэрозолизированная лекарственная форма вовлекается в поток вдыхаемого воздуха и переносится в легкие.
В других случаях, может использоваться активируемый дыхательным усилием триггер, такой как триггер, включенный в ингалятор Tempo® (MAP Pharmaceuticals, Mountain View, Calif.), который одновременно нагнетает дозу лекарственной формы при сенсорном обнаружении вдыхания. Эти устройства, которые нагнетают аэрозольную лекарственную форму, когда пользователь начинает делать вдох, известны, как приводимые в действие дыхательным усилием дозирующие ингаляторы под давлением (ПДДИД).
Распылители
Жидкие лекарственные формы, описанные выше, могут также вводиться с использованием распылителя. Распылители представляют собой генераторы жидких аэрозолей, которые преобразуют жидкую лекарственную форму, описанную выше, обычно лекарственную форму на водной основе, в аэрозоли или облачка из мелких капелек, предпочтительно имеющих диаметры меньше 5 микронов для масс-медианного аэродинамического диаметра, которые могут вдыхаться в нижние дыхательные пути. Данный процесс называют атомизацией. Капельки несут одно или несколько активных средств в нос, верхние дыхательные пути или глубокую область легких, при вдыхании облачка аэрозоля. Для введения лекарственной формы пациенту может применяться любые типы распылителей, включающие, но не ограниченные перечисленными, пневматические (струйные) распылители и электромеханические распылители.
В пневматических (струйных) распылителях применяется подача газа под давлением в качестве движущей силы для атомизации жидкой лекарственной формы. Сжатый газ доставляется через сопло или эжектор для создания области низкого давления, которая вовлекает окружающую лекарственную форму и сдвигает ее в тонкую пленку или нити. Пленку или нити являются нестабильными и разрушаются в мелкие капельки, которые переносятся потоком сжатого воздуха в область вдоха. Перегородки, введенные в струю капелек отсеивают крупные капельки и возвращают их в резервуар с основной жидкостью. Примеры пневматических распылителей включают, но не ограничены перечисленными, PARI LC Plus®, PARI LC Sprint®, Devilbiss PulmoAide®, и Boehringer Ingelheim Respima®.
В электромеханических распылителях используют электрически генерируемое механическое усилие для атомизации жидких лекарственных форм. Может применяться электромеханическая движущая сила, например, посредством создания вибрации лекарственной формы при ультразвуковых частотах, или посредством продавливания объема жидкости через мелкие отверстия в тонкой пленке. Усилия генерируют потоки тонких жидких пленок или нитей, которые разбивают мелкие капельки с образованием медленно движущегося аэрозольного потока, которые могут вовлекаться во вдыхаемый поток.
В нескольких случаях, электромеханический распылитель представляет собой ультразвуковой распылитель, в которой лекарственная форма соединена с вибратором, осциллирующим при частотах в ультразвуковом диапазоне. Соединения достигают, помещая жидкость в прямой контакт с вибратором, таким как пластина или кольцо в удерживающей чашке, или помещая крупные капельки на твердый вибрирующий проектор (рог). Вибрации генерируют круговые стоячие пленки, которые разбиваются на капельки по их краям, чтобы атомизировать жидкую лекарственную форму. Примеры ультразвуковых распылителей включают DuroMist®, Drive Medical Beetle Neb®, Octive Tech Densylogic® и John Bunn Нано-Sonic®.
В нескольких случаях, электромеханический распылитель представляет собой ситовой распылитель, в котором жидкая лекарственная форма направляется через сито или мембрану с мелкими отверстиями в интервале от 2 до 8 микронов в диаметре, для генерации тонких нитей, которые разбиваются на мелкие капельки. В некоторых конструкциях, жидкую лекарственную форму продавливают через сито, оказывая давление с использованием соленоидного штока поршня (например, распылителя AERx®), или посредством создания сэндвич-конфигурации жидкости между пъезоэлектрически вибрирующей пластиной и ситом, что приводит в результате к осцилляторному накачивающему действию (например, распылителей EFlow®, AerovectRx® или TouchSpray®). В других случаях, сито вибрирует назад и вперед через стоящий столб жидкости для прокачивания ее через отверстия. Примеры таких распылителей включают AeroNeb Go®, AeroNeb Pro®, PARI EFlow®, Omron 22UE®; и Aradigm AERx®.
Электрогидродинамические аэрозольные устройства
Жидкие лекарственные формы, описанные выше, могут также вводиться с использованием электрогидродинамического (ЭГД) аэрозольного устройства. В ЭГД аэрозольных устройствам применяют электрическую энергию для аэрозолизации растворов или суспензий жидких лекарственных средств. Примеры ЭГД аэрозольных устройств являются известными в данной области. См., например, Патент США 4,765,539 на имя Noakes et al. и Патент США 4,962,885 на имя Coffee, R.A.
Электрохимические свойства лекарственной формы могут являться важными параметрами для оптимизации при доставке жидкой лекарственной формы в легкие с использованием MD аэрозольного устройства, и такая оптимизация рутинным образом выполняется специалистом в данной области.
V. Способы лечения
Фармацевтические композиции, содержащие одно или несколько из соединений, описанных в данном описании, могут вводиться, чтобы индуцировать снижение массы тела у пациента с предожирением, ожирением или патологическим ожирением, снизить содержание жира в организме у пациента с предожирением, ожирением или патологическим ожирением, снизить потребление пищи у пациента с предожирением, ожирением или патологическим ожирением, улучшить гомеостаз глюкозы у пациента с предожирением, ожирением или патологическим ожирением, предотвратить прирост массы и/или предотвратить увеличение индекса массы тела у пациента с нормой, предожирением, ожирением или патологическим ожирением, или иметь комбинированное воздействие.
В некоторых вариантах осуществления, фармацевтические композиции вводят пациенту, страдающему от ожирения (например, пациенту с предожирением, ожирением или патологическим ожирением), заболевания или нарушения, относящегося к ожирению, диабета, синдрома инсулинорезистентности, липодистрофии, неалкогольного стеатогепатита, сердечно-сосудистого заболевания, синдрома поликистозных яичников или метаболического синдромома.
В случаях, когда фармацевтические композиции вводят для нормализации сахара в крови, лекарственные формы предпочтительно примешивают в количестве, эффективном, чтобы снизить уровни глюкозы в крови до менее, чем приблизительно 180 мг/дл. Лекарственные формы могут вводиться совместно с другими противодиабетическими терапиями, при необходимости, чтобы улучшить гомеостаз глюкозы.
Фармацевтические композиции могут также вводиться пациентам, страдающим от заболевания или расстройства, которое вызывает ожирение или предрасполагает пациента к началу ожирения, такого, как синдром Барде-Бидля или мутация гена, кодирующего белок рецептора меланокортина 4 (MC4R) (т.е., мутация MC4R).
А. Дозировки
Точная дозировка, вводимая пациенту, будет зависеть от многих факторов, включающих физические характеристики пациента (например, массу тела), степень тяжести заболевания или расстройства, подлежащего лечению, и присутствие или отсутствие других осложняющих заболеваний или расстройств, и может быть легко определена лечащим врачом.
В некоторых вариантах осуществления, соединение вводят при дозировке, эквивалентной пероральной дозировке между приблизительно 0,005 мг и приблизительно 500 мг на кг массы тела в день, более предпочтительно, между приблизительно 0,05 мг и приблизительно 100 мг на кг массы тела в день, наиболее предпочтительно, между приблизительно 0,1 мг и приблизительно 10 мг на кг массы тела в день. В конкретных вариантах осуществления, соединение вводят при дозировке, эквивалентной пероральной дозировке, равной от приблизительно 1,0 мг до 5,0 мг на кг массы тела в день.
В нескольких случаях, фармацевтическую композицию, содержащую одно или несколько из соединений, вводят пациенту с предожирением, ожирением или патологическим ожирением в терапевтически эффективном количестве, чтобы индуцировать снижение массы тела. В некоторых вариантах осуществления, фармацевтическую композицию, содержащую одно или несколько из соединений, вводят пациенту с предожирением, ожирением или патологическим ожирением в терапевтически эффективном количестве, чтобы уменьшить массу тела, по меньшей мере, на 10%, более предпочтительно, по меньшей мере, на 15%, наиболее предпочтительно, по меньшей мере, на 20%.
В нескольких случаях, фармацевтическую композицию, содержащую одно или несколько из соединений, вводят пациенту с предожирением, ожирением или патологическим ожирением в терапевтически эффективном количестве, чтобы снизить содержание жира в организме. В некоторых вариантах осуществления, фармацевтическую композицию, содержащую одно или несколько из соединений, вводят пациенту с предожирением, ожирением или патологическим ожирением в терапевтически эффективном количестве, чтобы уменьшить содержание жира в организме, по меньшей мере, на 10%, более предпочтительно, по меньшей мере, на 15%, наиболее предпочтительно, по меньшей мере, на 20%.
В нескольких случаях, фармацевтическую композицию, содержащую одно или несколько из соединений, вводят пациенту с предожирением, ожирением или патологическим ожирением в терапевтически эффективном количестве, чтобы снизить потребление пищи, аппетит, или и то и другое. В некоторых вариантах осуществления, фармацевтическую композицию, содержащую одно или несколько из соединений, вводят пациенту с предожирением, ожирением или патологическим ожирением в терапевтически эффективном количестве, чтобы снизить среднее ежедневное потребление пищи (с точки зрения учета калорий), по меньшей мере, на 15%, более предпочтительно, по меньшей мере, на 25%, наиболее предпочтительно, по меньшей мере, на 35%.
В нескольких случаях, фармацевтическую композицию, содержащую одно или несколько из соединений, вводят пациенту с предожирением, ожирением или патологическим ожирением в терапевтически эффективном количестве, чтобы улучшить гомеостаз глюкозы. В некоторых вариантах осуществления, фармацевтическую композицию, содержащую одно или несколько из соединений, вводят пациенту с предожирением, ожирением или патологическим ожирением в терапевтически эффективном количестве, чтобы снизить средний уровень глюкозы в плазме крови натощак, по меньшей мере, на 10%, более предпочтительно, по меньшей мере, на 15%, наиболее предпочтительно, по меньшей мере, на 20%. В случаях, когда фармацевтические композиции вводят для нормализации сахара в крови, лекарственные формы предпочтительно вводят в количестве, эффективном, чтобы снизить уровни глюкозы в плазме крови натощак до менее, чем приблизительно 180 мг/дл, более предпочтительно, менее, чем приблизительно 160 мг/дл, более предпочтительно, менее, чем приблизительно 140 мг/дл.
B. Терапевтическое введение
Фармацевтические композиции могут вводиться, например, в однократной дозировке, в виде непрерывного дозирования, один или несколько раз ежедневно, или менее часто, таким образом, как один раз в неделю. Фармацевтические композиции могут вводиться один раз в день или более одного раза в день, таким образом, как дважды в день, три раза в день, четыре раза в день или больше. В некоторых вариантах осуществления, лекарственные формы вводят перорально, один раз в день или реже.
Фармацевтические композиции вводят в эффективном количестве и в течение эффективного периода времени, чтобы вызвать желательное терапевтическое благоприятное воздействие. В некоторых вариантах осуществления, фармацевтическую композицию вводят ежедневно, два раза в неделю, еженедельно, два раза в месяц или ежемесячно в течение периода, составляющего, по меньшей мере, одну неделю, две недели, три недели, четыре недели, один месяц, два месяца, три месяца, четыре месяца, пять месяцев, шесть месяцев, семь месяцев, восемь месяцев, девять месяцев, десять месяцев, одиннадцать месяцев, один год или более.
Фармацевтические композиции могут также вводиться профилактически, например, пациентам или субъектам, которые имеют риск развития заболевания или расстройства, такого как диабет или ожирение. Таким образом, способы могут также включать в себя идентификацию субъекта, имеющего риск развития диабета или ожирения перед введением лекарственных форм.
Точное количество требуемых лекарственных форм будет варьировать от субъекта к субъекту, в зависимости от вида, возраста, пола, массы и общего состояния субъекта, степени заболевания у субъекта, пути введения, того, включены ли в режим другие лекарственные средства и т.п. Таким образом, невозможно обозначить точную дозировку для каждой лекарственной формы. Однако соответствующая дозировка может быть определена рядовым специалистом в данной области с использованием только общепринятого экспериментирования. Например, эффективные дозировки и режимы для введения композиций могут быть определены эмпирически, и проведение таких определений находится в объеме квалификации в данной области.
Дозировка может варьировать, и может вводиться при одном или нескольких введений доз ежедневно, в течение одного или нескольких дней. В литературе можно найти руководство по соответствующим дозировкам для данных классов фармацевтических продуктов.
1. Совместное введение вместе с активными средствами
В других вариантах осуществления, соединения, раскрытые в данном описании, могут вводиться совместно с одним или несколькими дополнительными терапевтическими, профилактическими или диагностическими средствами. Совместное введение, как используется в настоящем описании, включает введение в одной и той же лекарственной форме или в различных лекарственных формах. Для тех вариантов осуществления, где соединения, описанные в настоящем документе, и одно или несколько дополнительных терапевтических, профилактических или диагностических средств, вводят в различных лекарственных формах, лекарственные формы могут вводиться одновременно (например, в одно и то же время или по существу в одно и то же время) или последовательно. ʺПо существу в одно и то же времяʺ, как используется в настоящем описании, как правило, означает в интервале десяти минут, предпочтительно, в интервале пяти минут, более предпочтительно, в интервале двух минут, наиболее предпочтительно, в интервале одной минуты. Лекарственные формы, вводимые последовательно, могут вводиться в интервале нескольких часов друг от друга, например, в интервале десяти часов, девяти часов, восьми часов, семи часов, шести часов, пяти часов, четырех часов, трех часов, двух часов, одного часа, 30 минут, 20 минут или 15 минут.
В некоторых вариантах осуществления, соединения, описанные в данном документе, вводят совместно с лептином или аналогом лептина. В этих случаях, лептин или аналог лептина могут вводиться совместно с соединениями в течение части периода лечения или во время полного периода лечения. В предпочтительных вариантах осуществления, соединения вводят совместно с r-метХуЛептином (A-100, МЕТРЕЛЕПТИН®), доступным от Amylin Pharmaceuticals (San Diego, Calif.).
В некоторых вариантах осуществления, пациенты страдают от диабета. В этих случаях, соединения, описанные в данном документе, могут вводиться совместно с одной или несколькими терапиями для лечения диабета.
Примеры
Пример 1: Введение целастрола мышам с ожирением
Целастрол получали из коммерческих источников. Мышей C57B1/6J помещали в условия диеты с высоким содержанием жира (ВЖД; Исследовательские Диеты, D12451, жир 45 ккал%) с кормлением в течение 16 недель. После установления ожирения и резистентности к лептину, мышам первый раз вводили целастрол при различных дозах (10, 50 и 100 мкг/кг), в 25 мкл ДМСО, один раз в день), и растворитель (ДМСО, 25 мкл), посредством внутрибрюшинной (в/б) инъекции. Животные имели свободный доступ к пище и воде, если не было установлено иначе.
Во всех экспериментах, за четыре дня до введения лекарственного средства, животные проходили через период адаптации, в течение которого они получали физраствор (25 мкл) для уменьшения воздействия стресса, создаваемого при внутрибрюшинной инъекции. После четырех дней адаптации, целастрол вводили мышам с ожирением, получавшим ВЖД, ежедневно посредством внутрибрюшинной инъекции при увеличивающихся дозах (10, 50 и 100 мкг/кг) в течение трех недель в 25 мкл ДМСО. Группа контроля получала такой же объем ДМСО посредством внутрибрюшинной инъекции.
Как показано на Фигуре 1A, в/б введение целастрола значительно уменьшало массу тела (ФИГ. 1A, p<0,001, 100 мкг/кг; ФИГ. 1B p<0,05, 10 мкг/кг; p<0,001, 50 и 100 мкг/кг) и потребление пищи (ФИГ. 1C, p< 0,01, в среднем за три дня в пределах первой недели введения лекарственного средства) у мышей с ожирением, получавших ВЖД, дозозависимым образом. На день 14 испытаний, авторы измеряли уровень глюкозы в крови мышей после 6-часового голодания. Как показано на Фигуре 1D, целастрол уменьшал уровень глюкозы в крови мышей с ожирением.
Пример 2: Введение целастрола тощим мышам
Целастрол вводили тощим мышам с кормовой диетой при 50, 100 или 500 мкг/кг в течение трех недель посредством внутрибрюшинных инъекций, применяя такой же протокол, как описанный выше. Как показано на Фигурах 2A и ФИГ. 2B, целастрол индуцировал значительное, но небольшое снижение потребления пищи; однако, он не вызывал снижение массы тела у тощих мышей, даже при введении тощим мышам в дозах, в пять раз превышающих дозы, эффективные для снижения массы тела у мышей с ожирением. Эти результаты позволяют предположить, что анорексигенный эффект целастрола ограничен животными с ожирением. У тощих мышей, только самая высокая тестируемая доза (500 мкг/кг) индуцировала значительное снижение уровня глюкозы в крови (ФИГ. 2C, p<0,05) после 2 недель инъекций лекарственного средства.
Другие соединения изобретения тестировали аналогичным образом.
В сочетании, эти результаты позволяют предположить, что целастрол может вводиться в эффективном количестве (например, 100 мкг/кг в этих исследованиях), чтобы индуцировать снижение массы тела у мышей с ожирением, но не у тощих мышей.
Пример 3: Исследование зависимости активности целастрола от лептина.
Целастрол (100 мкг/кг, один раз в день, в 25 мкл ДМСО) вводили дефицитным по лептину (ob/ob) и дефицитным по рецептору лептина (db/db) мышиным моделям ожирения. Ни одна из этих мышиных моделей не показала значительного снижения аппетита при введении целастрола (мыши ob/ob, ФИГ. 3; мыши db/db, ФИГ. 4). Как у ob/ob мышей, так и у db/db мышей, масса тела продолжала увеличиваться аналогично контрольной (обработанной растворителем) группе (ob/ob, ФИГ. 3A; db/db ФИГ. 4A). В дополнение, целастрол не смог снизить уровень глюкозы в крови после 6-часового голодания ни у ob/ob мышей (ФИГ. 3C), или у db/db мышей (ФИГ. 4C) через 2 недели инъекций лекарственного средства.
Другие соединения изобретения тестируют аналогичным образом.
Также исследовали способность целастрола проявлять эффекты против ожирения, при пероральном введении. Целастрол индуцировал устойчивое и значительное снижение массы тела (ФИГ. 5A, p<0,001), и потребление пищи (ФИГ. 5B, p<0,001) у мышей с ожирением, получавших ВЖД, при пероральном введении при 10 мг/кг в суспензии каптизола. В дополнение, перорально принимаемый целастрол понижал уровни глюкозы в крови мышей с ожирением, получавших ВЖД, после 6-часового голодания (ФИГ. 5C, p<0,001, глюкоза понижалась до гипогликемических уровней). Однако, никакого значительного изменения потребления пищи (ФИГ. 5D) или массы тела (ФИГ. 5E) не наблюдали, когда тощих мышей лечили перорально целастролом. При данной дозе, пероральное введение целастрола приводило к небольшому, но значительному снижению уровней глюкозы в крови тощих мышей после трех недель лечения (ФИГ. SF). Кроме того, ob/ob и db/db мыши были полностью нечувствительны к лечению целастролом, принимаемым перорально (ФИГ. 6A-D).
Тот факт, что целастрол снижал массу тела и потребление пищи у мышей с ожирением, получавших ВЖД, но не у ob/ob или db/db мышей, позволяет предположить, что анорексигенный эффект целастрола опосредован через сигнальный путь лептина. Несмотря на то, что у мышей с ожирением, получавших ВЖД, повышались уровни лептина, у них развивалась резистентность к лептину, и они не реагировали на введение экзогенного лептина. Следовательно, была выдвинута гипотеза, что целастрол проявляет эффекты против ожирения через возрастающую чувствительность к лептину в мозге мышей с ожирением, получавших ВЖД. Чтобы проверить эту гипотезу, лептин вводили животным с ожирением, получавшим диету ВЖД, проходящим лечение целастролом или обработку растворителем. Чтобы избежать любого возможного сенсибилизирующего лептин эффекта снижения массы тела или уменьшенного потребления пищи, создаваемого введением целастрола, инъекции лептина проводили при остром лечении целастролом, как описано ниже.
Тощие мыши и мыши с ожирением, получавшие ВЖД, были разделены на четыре группы: 1) ДМСО+физраствор, 2) ДМСО+лептин, 3) целастрол+физраствор, и 4) целастрол+лептин (n=3 на группу). Мышам вводили посредством инъекции (в/б) 100 мкг/кг целастрола или растворителя (ДМСО) за один час перед темновым циклом (день ноль). 24 часа спустя, мышам во второй раз вводили посредством инъекции целастрол или ДМСО (день 1), и всех животных затем помещали в условия 24-часового голодания. На второй день, при 21 часе голодания, мыши получали окончательные инъекции ДМСО или целастрола. За 30 минут перед темновым циклом, при 23,5 часах голодания, мыши получали однократные в/б инъекции лептина (10 мг/кг, растворенного в физрастворе), или физраствор. Через 30 минут (окончание 24-часового голодания) мышам предоставляли их прежнюю диету (либо постоянный корм или ВЖД) ad libitum. Потребление пищи через 1, 3, 6, 15, и 24 часа и 24-часовое изменение массы тела регистрировали (ФИГ. 7A). На 6-часовой отметке, лептин снижал потребление пищи приблизительно на 40% у группы обработанных ДМСО тощих мышей, получавших ВЖД. Обработанные целастролом тощие мыши показали 60% уменьшение потребления пищи при инъекциях лептина, в то время как мыши, получавшие диету ВЖД, проявляли 80% уменьшение потребления пищи при инъекциях лептина (ФИГ. 7B). Во время 24-часового периода кормления ad libitum все тощие мыши и обработанные растворителем мыши с ожирением, получавшие ВЖД, показали прирост массы, в то время как прошедшие лечение целастролом мыши с ожирением, получавшие ВЖД, продолжали демонстрировать снижение массы тела. Данное снижение массы тела далее увеличивалось (приблизительно в два раза) при введении лептина (ФИГ. 7D). Данный факт становится очевидным, когда потребление пищи у мышей, прошедших лечение целастролом, рассчитывают в процентных значениях (ФИГ. 7B). В дополнение, мыши с ожирением, получавшие ВЖД, были резистентными к эффекту лептина на снижение массы, до тех пор, пока они получали целастрол (ФИГ. 7D). Примечательно, что, целастрол по отдельности, как ожидалось, снижал прирост массы у мышей с ожирением, получавших ВЖД в отсутствии введения экзогенного лептина, вероятно, вследствие уже повышенных уровней лептина у мышей с ожирением, получавших ВЖД.
Чтобы проанализировать изменение состава тела во время лечения целастролом (в/б 100 мкг/кг), безжировую массу и жировую массу мышей измеряли, используя двухэмиссионную рентгеновскую абсорбциометрию (DEXA). Безжировая масса оставалась неизменной после двух недель постоянного введения целастрола (ФИГ. 8A). Данный факт согласуется с тем, что целастрол не имеет токсического воздействия, вызывающего анорексию, поскольку безжировая масса сохранялась. Однако, масса жира и процентное содержание жира снижалось значительно у прошедших лечение целастролом животных, получавших ВЖД (ФИГ. 8B-8C). В соответствии с пониженной адипозной массой, было показано что, уровни лептина постепенно снижались при постоянном введении целастрола (ФИГ. 8D). В дополнение, потребление пищи у мышей с ожирением, получавших ВЖД, постепенно возрастало к концу исследования по мере снижения уровней эндогенного лептина. Этот результат подтверждает гипотезу, что анорексигенный эффект целастрола является зависимым от сигнального пути лептина.
Локомоторная активность также была нормальной у мышей, проходящих лечение целастролом. Данный факт соответствует тому, что целастрол не имеет токсического воздействия, вызывающего анорексию и снижение массы тела, поскольку последнее было бы ассоциировано с уменьшенной локомоторной активностью.
Пример 4: Эффект введения целастрола на гомеостаз глюкозы.
Как описано выше, в/б и пероральное введение целастрола приводит к устойчивому снижению уровней глюкозы в крови у мышей с ожирением, получавших ВЖД. Чтобы проанализировать эффект целастрола на гомеостаз глюкозы, проводили тесты толерантности к глюкозе (GTT) и тесты толерантности к инсулину (ITT) после регулярного в/б введения целастрола (100 мкг/кг).
Для проведения GTT, мышам создавали условия голодания в течение ночи после одной недели лечения целастролом, и утром они получали в/б инъекции D-глюкозы (0,75 г/кг). Для ITT, через 16 дней лечения целастролом, мышам создавали условия голодания в течение 6 часов (от 8 часов утра до 2 часов дня) и посредством внутрибрюшинной инъекции вводили рекомбинантный человеческий инсулин (1 МЕ/кг от Eli Lilly). При проведении обеих методик, измеряли уровни глюкозы в крови, взятой из хвостовой вены, при 0, 15, 30, 60, 90 и 120 минутах после инъекций.
Как показано на Фигуре 9A, через одну неделю лечения целастролом, гомеостаз глюкозы значительно улучшался у мышей, проходящих лечение целастролом, в сравнении с мышами, обработанными растворителем, о чем свидетельствует различие в площадях под кривой (AUC) GTT (ФИГ. 9B, p<0,001). В день 16, проводили ITT. Мыши с ожирением, получавшие ВЖД, также проявляли улучшенную чувствительность к инсулину (ФИГ. 9C-9D, p<0,01). В соответствии с улучшенным гомеостазом глюкозы, мыши, прошедшие лечение целастролом, проявляли пониженную экспрессию печеночной мРНК глюконеогенных ферментов Фосфоенолпируваткарбоксикиназы (PEPCK), Глюкозо-6-фосфатазы (G6Pазы), и гамма коактиватора 1-2альфа рецептора, активируемого пролифератором пероксисом (PGCla) (ФИГ. 10).
Другие соединения изобретения тестировали аналогичным образом.
Пример 5: Эффект введения целастрола на функцию печени, почек и щитовидной железы.
Чтобы исследовать эффект введения целастрола на функцию печени, сывороточные уровни аланинтрансаминазы (АЛТ) и аспартаттрансаминазы (AST) измеряли у мышей после трех недель лечения целастролом (100 мкг/кг, в/б). АЛТ и АСТ измеряли, используя набор для фермент-связанного иммуносорбентного исследования (ELISA) (от Bio Scientific).
Как показано на Фигуре 11, введение целастрола снижает уровни АЛТ и АСТ у мышей с ожирением, получавших ВЖД, что позволяет предположить улучшенную функцию печени. Этот результат был в дальнейшем подтвержден гистологически. Ткань печени, собранную от этих мышей, фиксировали в течение ночи в формалине, секционировали и окрашивали Гематоксилином и Эозином (H&E). Гепатостеатоз у животных с ожирением, получающих ВЖД, снижался при лечении целастролом. Срезы печени, полученные от мышей, подвергнутых лечению целастролом, были практически идентичными срезам печени тощих мышей. Аналогично, у этих мышей не было никакого обнаруживаемого изменения морфологии почек. Эти результаты показывают, что лечение целастролом также уменьшает гепатостеатоз.
Другие соединения изобретения тестировали аналогичным образом.
Известно, что тиреоидные гормоны увеличивают интенсивность основного обмена и, следовательно, увеличивают расход энергии. Известно, что повышенные уровни тиреоидных гормонов снижают массу тела с различными нежелательными побочными эффектами. Чтобы исследовать, могут ли гормоны щитовидной железы играть роль в анорексигенном действии целастрола, плазменные уровни T3 и T4 у мышей с ожирением, получавших ВЖД, измеряли после 3 недель лечения целастролом (100 мкг/кг, в/б). Известно, что тиреоидные гормоны, включая T3 и T4, являются повышенными у животных с ожирением, получающих ВЖД.
Как показано на Фигуре 12, целастрол снижает уровни T3 и T4 у мышей с ожирением, получавших ВЖД. Данное снижение, вероятно, является следствием снижения массы тела, и позволяет предположить, что эффект целастрола на снижение массы не является опосредованным повышенной активностью тиреоидных гормонов.
Пример 6: Получение и активность производных целастрола
Целастрол представляет собой акцептор Михаэля, и может образовывать аддукты Михаэля с нуклеофилами, такими как цистеиновые остатки белков. Получали четыре производных (mCS1-mCS4) целастрола, содержащие заместитель, блокирующий образование аддуктов Михаэля по реакционноспособному положению целастрола (C6-углеродный атом формулы 1). Ожидалось, что эти производные не смогут более функционировать в качестве акцепторов Михаэля.
Получение mCS1
20 мг (0,0378 ммоль) целастрола растворяли в 1 мл этанола при комнатной температуре. Добавляли 50 мкл 2-меркаптоэтанола, и реакционную смесь перемешивали в течение 30 мин. при комнатной температуре. Во время протекания реакции, окраска реакционной смеси изменялась от ярко-оранжевой до бесцветной. Полное израсходование исходного вещества подтверждали посредством ЖХ/МС. Растворитель затем удаляли при пониженном давлении с получением mCS1m1 при количественном выходе в виде бледнооранжевой пленки. Дополнительная очистка может выполняться на силикагеле.
Получение mCS2
10 мг (0,0189 ммоль) целастрола растворяли в 1 мл этанола при комнатной температуре. Добавляли 3 мг цистамина, и реакционную смесь перемешивали. Изменение окраски от ярко-оранжевой до почти бесцветной наблюдали в течение 10 мин. После перемешивания в течение ночи при комнатной температуре, mCS2 осаждали, выделяли фильтрацией и сушили при пониженном давлении.
Получение mCS3
10 мг (0,0189 ммоль) целастрола растворяли в 1 мл этанола при комнатной температуре. Добавляли 5 мкл 3-меркаптопропионовой кислоты, и реакционную смесь перемешивали. Изменение окраски от ярко-оранжевой до почти бесцветной наблюдали в течение 1-часового перемешивания при комнатной температуре. Растворитель удаляли при пониженном давлении, получая mCS3 с количественным выходом в виде бледно-оранжевой пленки.
Получение mCS4
10 мг (0,0189 ммоль) целастрола растворяли в 1 мл этанола при комнатной температуре. Добавляли 5 мг D-цистеина, и реакционную смесь перемешивали при комнатной температуре. Изменение окраски от ярко-оранжевой до почти бесцветной наблюдали в течение 1-часового перемешивания при комнатной температуре. Растворитель удаляли при пониженном давлении, получая mCS4 с количественным выходом в виде почти белого твердого вещества.
Активность mCS1-mCS4
Четыре производных целастрола (mCS1-mCS4) вводили мышам с ожирением, которые получали пищу с высоким содержанием жира (100 мкг/кг/день в течение 25 дней, в/б). Как показано на Фигуре 13, mCSI-mCS4 снижали массу тела и потребление пищи с активностью, сходной с активностью целастрола.
Пример 7: Совместное введение целастрола и лептина
Целастрол и лептин вводили совместно для снижения массы тела мышей с ожирением. Мышей C57B1/6J помещали в условия кормления пищей с высоким содержанием жира в течение 16 недель. В последующем, вводили целастрол (100 мкг/кг/день, в/б) в течение 40-дневного периода.
Другие соединения изобретения тестировали аналогичным образом.
Как показано на Фигуре 14, масса тела мышей, получавших целастрол, постепенно снижалась и достигала плато приблизительно ко дню 17, На данном этапе лептин (1 мг/кг/день, в/б) вводили как контрольной группе, так и группе с целастролом. Как показано на Фигуре 14, мыши, получавшие целастрол, реагировали на лептин снижением массы тела, причем ответ усиливался при увеличении доз лептина.
Пример 8: Введение целастрола для предотвращения ожирения
Четыре группы мышей C57BL/6 в возрасте 3 недель были отобраны в период вскармливания. Две группы переводили на регулярную кормовую диету, и две группы переводили на диету с высоким содержанием жира. Одна группа для каждой из диет получала ежедневно инъекции целастрола (100 мкг/кг/день, в/б), а другая группа для каждой из диет получала инъекции несущей среды (растворителя) (25 мкл ДМСО в день, в/б) в качестве контроля в течение 6 месяцев. Результаты измерений массы тела на протяжении всего исследования приведены на прилагаемых ФИГ. Как показано на ФИГ. 15, у группы, получавшей растворитель-диету с высоким содержанием жира, развивалось ожирение, в то время как у других групп этого не происходило.
Другие соединения изобретения тестировали аналогичным образом.
ФИГ. 16A и 16B представляют собой графики показывающие движение в амбулатории в направлениях x (ФИГ. 16A) и y (ФИГ. 16B) для контроля и целастрола при темновом и 2-х световых циклах. Токсичность оценивали, используя систему Columbus Instruments для всестороннего мониторинга лабораторных животных, по локомоторной активности животных. Как видно на ФИГ., подсчеты движений животных в направлениях x и y в амбулатории во время, как темновых, так и световых циклов, существенно не различаются. Данный результат показывает, что эти мыши, получавшие лекарственное средство, не являются летаргическими, так как они не проявляют каких-либо видимых признаков слабости и токсичности.
Реферат
Изобретение относится к области медицины и фармацевтики, а именно к применению фармацевтической композиции для индуцирования снижения массы тела и/или снижения содержания жира в организме пациента с предожирением, ожирением или патологическим ожирением, где фармацевтическая композиция содержит эффективное количество соединения следующей структуры:,,,,,илиили его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Изобретение обеспечивает расширение арсенала средств для снижения массы тела и/или снижения содержания жира в организме. 12 з.п. ф-лы, 47 ил., 1 табл., 8 пр.
Формула










Документы, цитированные в отчёте о поиске
Средство для снижения резистентности к инсулину

Комментарии