Генетическая модификация mon89788 сои и способы ее определения - RU2411720C2
Код документа: RU2411720C2
Чертежи











Описание
ОПИСАНИЕ
Предпосылки изобретения
Эта заявка притязает на приоритет предварительной заявки США № 60/685,584, зарегистрированной 27 мая, 2005, содержание которой включено в данное описание посредством ссылки.
1. Область изобретения
Настоящее изобретение относится к новому и отличительному образцу трансгенной трансформации сои, обозначенному как генная модификация MON89788, полученному из него культурному сорту сои, частей растений и продуктов. К изобретению также относятся способы определения присутствия молекулы ДНК, специфичной для MON89788, в экстракте частей растения или экстракте семян.
2. Описание связанной области
Соя (Glycine max) представляет собой важную сельскохозяйственную культуру во многих областях мира. Для усовершенствования агрономических свойств и качества продукта к сое были применены способы биотехнологии. Одно такое агрономическое свойство, важное в получении сои, представляет собой устойчивость к гербицидам, в частности устойчивость к гербициду глифосату. Линия сои, устойчивая к гербицидам, была бы полезным свойством при борьбе с сорняками.
N-фосфонометилглицин, также известный как глифосат, представляет собой хорошо известный гербицид, который обладает активностью к широкому спектру видов растений. Глифосат представляет собой активный ингредиент Roundup® (Monsanto Co., St. Louis, MO), безопасный гербицид, имеющий подходящий короткий период полужизни в окружающей среде. При нанесении на поверхность растения, глифосат системно перемещается по растению. Глифосат является фитотоксичным вследствие его подавления пути шикимовой кислоты, который обеспечивает прекурсор в синтезе ароматических аминокислот. Глифосат подавляет фермент 5-енолпирувил-3-фосфошикиматсинтазу (EPSPS), обнаруженную в растениях.
Устойчивость к глифосату может достигаться экспрессией вариантов EPSPS, которые обладают более низким сродством к глифосату и поэтому сохраняют свою каталитическую активность в присутствии глифосата (патенты США № 5633435; 5094945; 4535060 и 6040497). Ферменты, которые разрушают глифосат в тканях растений (патент США № 5463175), также способны придавать клеточную устойчивость к глифосату. Такие гены используют для получения трансгенных сельскохозяйственных культур, которые устойчивы к глифосату, тем самым, позволяя использовать глифосат для эффективной борьбы с сорняками с минимальным опасением повреждения сельскохозяственной культуры. Например, устойчивость к глифосату была генетически сконструирована в кукурузе (патент США № 5554798), пшенице (патент США 6689880), хлопке (патент США 6740488), сое (WO 9200377) и рапсе (патентная заявка США 20040018518). Трансгены устойчивости к глифосату и трансгены устойчивости к другим гербицидам, например, ген bar, (Toki et al., 1992; Thompson et al., 1987; фосфинотрицин ацетилтрансфераза (DeBlock et al., 1987), для устойчивости к гербициду глюфозината) также полезны в качестве селектируемых маркеров или оценивающих маркеров, и могут обеспечить полезный фенотип для отбора растений, связанных с другими агрономически полезными свойствами.
Известно, что экспрессия чужеродных генов в растениях находится под влиянием их хромосомного положения, возможно вследствие структуры хроматина (например, гетерохроматин) или близости элементов регуляции транскрипции (например, энхансеры) вблизи сайта интеграции (Weising et al., 1988). По этой причине это часто является необходимым для скрининга большого числа случаев для того, чтобы идентифицировать случай, характеризующийся оптимальной экспрессией представляющего интерес гена. Например, было обнаружено, что в растениях и в других организмах может существовать значительная разница в уровнях экспрессии внедренного гена среди оцениваемых случаев. Также могут существовать различия в пространственных и временных структурах экспрессии, например различия в относительной экспрессии трансгена в различных тканях растений, которые не могут соответствовать структурам, ожидаемым из элементов регуляции транскрипции, представленным во внедренном генном конструкте. По этой причине принято получать от сотен до тысяч различных генетически модифицированных образцов и производить скрининг таких образцов до единичного варианта, который обладает желательными в коммерческих целях уровнями экспрессии трансгенов и структурами. Образец, который обладает желательными уровнями и структурами экспрессии трансгенов, является полезным для интрогрессии трансгена внутрь других генетических фонов путем случайного полового скрещивания с использованием традиционных способов селекции. Потомство таких скрещиваний поддерживает характеристики экспрессии трансгенов исходного трансформанта. Эта стратегия используется, чтобы обеспечить надежную экспрессию генов в ряде разновидностей, которые хорошо адаптируются к местным условиям произрастания.
Было бы выгодно уметь определять присутствие конкретного образца для того, чтобы определить, содержит ли потомство полового скрещивания интересующий трансген. Кроме того, способ определения конкретного образца был бы полезен для соответствия нормам, требующих предрыночного разрешения и, в частности, для маркировки пищевых продуктов, полученных из растений сельскохозяственных культур. Возможно определить присутствие трансгена любым хорошо известным способом обнаружения полинуклеиновых кислот, таким как полимеразная цепная реакция (PCR) или гибридизация ДНК с использованием полинуклеиновых кислот в качестве зондов. Эти способы определения обычно фокусируются на часто употребляемых генетических элементах, таких как промоторы, терминаторы, маркерные гены и так далее. В результате, такие способы не могут быть полезными для проведения различий между различными генетически модифицированными образцами (линиями), в частности такими, которые получены с использованием того же самого ДНК конструкта за исключением последовательности хромосомной ДНК ("фланкирующая ДНК"), расположенной рядом с включенной трансгенной ДНК. Специфический PCR анализ для линий обсуждается, например, Windels et al. (1999), который идентифицировал линию устойчивых к глифосату сои 40-3-2 путем PCR с использованием набора праймеров, перекрывающих участок соединения между вставленным трансгеном и фланкирующей ДНК, в частности, используя один праймер, который включал в себя последовательность из вставки, и второй праймер, который включал в себя последовательность из фланкирующей ДНК. Способы обнаружения специфической ДНК генетически модифицированного трансгенного растения также были описаны в патентах США № 6893826; 6825400; 6740488; 6733974 и 6689880; 6900014 и 6818807, содержание каждой из которых включено полностью в данное описание посредством ссылки.
Это изобретение относятся к генетически модифицированной глифосатустойчивой сое MON89788 (также названной как MON19788 или GM_A19788) и к молекулам ДНК, содержащимся в этих растениях сои, которые являются полезными в способах определения растения и его потомства, и тканей растения, полученных из MON89788.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к трансгенной генетически модифицированной сое, обозначенной как MON89788 (также названной как MON19788), и ее потомству, имеющему показательные семена, депонированным в American Type Culture Collection (ATCC) под номером PTA-6708. Другим аспектом изобретения являются клетки растений или регенерируемые части растения или семян сои с генной модификацией MON89788. Также изобретение включает в себя части растений сои с генной модификацией MON89788, которые включают, но не ограничиваются перечисленным, клетки, пыльцу, семязачаток, цветы, побеги, корни, листья и продукты, полученные из MON89788, например соевую крупу, муку и масло.
Один аспект изобретения относится к композициям и способам для определения присутствия трансгенной/геномной соединенной области ДНК растения или семени или продуктов, полученных из частей растений или семян сои с генной модификацией MON89788. Представлены молекулы ДНК, которые включают, по меньшей мере, одну молекулу ДНК с трансгенным/геномным участком соединения, выбранную из группы, состоящей из SEQ ID NO:1 и SEQ ID NO:2 (см. последовательности в конце описания изобретения), и их комплементы, где соединенная молекула перекрывает вставленный сайт, который включает гетерологичную ДНК, вставленную в геном клетки сои, и геномную ДНК из клетки сои, фланкирующую вставленный сайт сои с генной модификацией MON89788. Такие соединенные последовательности могут, в одном аспекте изобретения, быть определены как включающие нуклеотиды 1093-1113 или 5396-5416 из SEQ ID NO:9, соответственно. В других аспектах изобретения, соединения могут быть определены как включающие дополнительные участки фланкирующего генома или трансгена, например, и могут быть определены как включающие одну или более последовательностей, представленную нуклеотидами 1073-1113, 1043-1113, 1093-1133, 1093-1163, 1043-1163, 5376-5416, 5346-5416, 5396-5436, 5396-5416, 5396-5466 или 5346-5466 из SEQ ID NO:9. Поэтому такие последовательности и растения, и семена, включающие эти последовательности, являются одним из аспектов изобретения.
Представлена новая молекула ДНК, которая представляет собой трансгенную/геномную область ДНК SEQ ID NO:3 или ее комплемент, из сои с генной модификацией MON89788. Растение сои и семена, включающие SEQ ID NO:3 в своем геноме, представляют собой один из аспектов настоящего изобретения. SEQ ID NO:3 дополнительно включает SEQ ID NO:1 полностью.
Согласно другому аспекту изобретения, представлена молекула ДНК, которая представляет собой трансгенную/геномную область ДНК SEQ ID NO:4, или ее комплемент, в котором эта молекула ДНК является новой для сои с генной модификацией MON89788. Растение сои и семена, включающие SEQ ID NO:4 в своем геноме, представляет собой один из аспектов настоящего изобретения. SEQ ID NO:4 дополнительно включает SEQ ID NO:2 полностью.
Согласно другому аспекту изобретения, представлены две молекулы нуклеиновых кислот для использования в способе обнаружения ДНК, в котором первая молекула нуклеиновой кислоты включает, по меньшей мере, 11 или более смежных полинуклеотидов любого участка трангенного участка молекулы ДНК из SEQ ID NO:3, и вторая нуклеиновая кислота представляет собой молекулу сходной длины любого участка 5' фланкирующей области геномной ДНК сои из SEQ ID NO:3, в которой эти молекулы нуклеиновых кислот при совместном использовании являются полезными в качестве праймеров в способе амплификации ДНК, в котором производят ампликон. Ампликон, полученный с использованием этих праймеров в способе амплификации ДНК, является диагностическим для ДНК генной модификации MON89788. Ампликон, полученный с описанными праймерами, которые гомологичны или комплементарны участку из SEQ ID NO:3, включающему SEQ ID NO:1, является одним из аспектов изобретения.
Согласно другому аспекту изобретения, две молекулы нуклеиновых кислот предоставлены для использования в способе обнаружения ДНК, в котором первая молекула нуклеиновой кислоты включает, по меньшей мере, 11 или больше смежных полинуклеотидов любого участка трансгенной области молекулы ДНК из SEQ ID NO:4, и вторая молекула нуклеиновой кислоты аналогичной длины любого участка 3' фланкирующей геномной ДНК сои из SEQ ID NO:4, в которой эти молекулы нуклеиновых кислот при совместном использовании являются полезными в качестве праймеров в способе амплификации ДНК, в котором производят ампликон. Ампликон, полученный с использованием этих праймеров в способе амплификации ДНК, является диагностическим для ДНК генной модификации MON89788. Ампликон, полученный с описанными праймерами, которые гомологичны или комплементарны участку из SEQ ID NO:4, включающему SEQ ID NO:2, является одним из аспектов изобретения.
Любая пара праймеров нуклеиновых кислот, полученная из SEQ ID NO:3 или SEQ ID NO:4, или SEQ ID NO:9 или их комлементов, которые при использовании в реакции амплификации ДНК, производят диагностический ампликон для ткани из сои с генной модификацией MON89788, такой как ампликон, который включает SEQ ID NO:1 или SEQ ID NO:2 или любой участок из SEQ ID NO:9, соответственно, представляет собой другой вариант осуществления изобретения. В конкретном варианте осуществления, пара праймеров может содержать праймер A (SEQ ID NO:5) и праймер D (SEQ ID NO:8).
Другой аспект изобретения представляет растение сои, или семена, или продукт, полученный из растения или семян, включающих генную модификацию MON89788, в которой геномная ДНК при выделении из растения сои, или семян, или продуктов, производит ампликон в способе амплификации ДНК, который включает SEQ ID NO:1 или SEQ ID NO:2.
Еще один аспект изобретения представляет растение сои, или семена, или продукт, полученный из растения или семян, включающих MON89788, в которых геномная ДНК при выделении из растения сои, или семян, или продуктов, производит ампликон в способе амплификации ДНК, где в способе амплификации ДНК используются молекулы ДНК праймеров SEQ ID NO:5 и SEQ ID NO:6.
Еще один аспект изобретения представляет собой растение сои, семена, продукт или товарный продукт (продукт потребления), полученные из растения или семян, включающих генную модификацию MON89788, в которой геномная ДНК при выделении из растения сои, или семян, или продуктов, производит ампликон в способе амплификации ДНК, где в способе амплификации ДНК используются молекулы ДНК праймеров SEQ ID NO:7 и SEQ ID NO:8. Продукт или товарный продукт может включать в себя, без ограничения, пищевой продукт или продукт питания, включающий или полученный из одного или более следующих продуктов растений сои, включающих генную модификацию MON89788: лецитин, жирные кислоты, глицерин, стерол, пищевое масло, обезжиренные соевые хлопья, соевые крупы, включающие в себя обезжиренные и высушенные соевые крупы, свернувшееся соевое молоко, соевый творог, соевую муку, концентрат соевого белка, выделенный соевый белок, растворенный в воде растительный белок, текстурат сои и соевое белковое волокно.
Согласно другому аспекту изобретения, представлен способ определения в образце присутствия ДНК, соответствующей, в частности, ДНК сои с генной модификацией MON89788. Такой способ включает: (a) контактирование образца, включающего ДНК, с парой ДНК праймеров; (b) осуществление реакции амплификации нуклеиновой кислоты, производящей при этом ампликон; и (c) определение ампликона, в котором вышеупомянутый ампликон включает в себя SEQ ID NO:1 или SEQ ID NO:2. Набор, включающий молекулы ДНК праймеров, которые при использовании в способе амплификации ДНК производят ампликон, включающий SEQ ID NO:1 или SEQ ID NO:2, представляет собой дополнительный аспект изобретения.
Согласно другому аспекту изобретения, представлен способ определения в образце присутствия ДНК, соответствующей, в частности, ДНК сои с генной модификацией MON89788. Такой способ включает: (a) контактирование образца, включающего ДНК с зондом, которая гибридизуется в жестких условиях гибридизации с геномной ДНК из сои с генной модификацией MON89788 и не гибридизуется в жестких условиях гибридизации с ДНК контрольного растения сои; (b) подвергание образца и зонда жестким условиям гибридизации; и (c) определение гибридизации зонда с ДНК сои с генной модификацией MON89788, в котором указанный зонд включает SEQ ID NO:1 или SEQ ID NO:2. Образец может включать в себя семена, растения потомства, или часть растения, включающие генную модификацию сои MON89788, или любой из следующих продуктов, полученных из растения, включающего MON89788: лецитин, жирные кислоты, глицерин, стерол, пищевое масло, обезжиренные соевые хлопья, соевые крупы, включающие в себя обезжиренные и высушенные соевые крупы, свернувшееся соевое молоко, соевый творог, соевую муку, концентрат соевого белка, выделенный соевый белок, растворенный в воде растительный белок, текстурат сои и соевое белковое волокно. Набор, включающий ДНК зонд, содержащий молекулу ДНК, которая гомологична или комплементарна к SEQ ID NO:1 или SEQ ID NO:2, представляет собой один из аспектов изобретения. Набор, содержащий молекулу ДНК, включающую SEQ ID NO:18, SEQ ID NO:19, или SEQ ID NO:20, или их комплементы, также представляют собой один из аспектов изобретения.
Согласно другому аспекту изобретения, представлен способ получения растения сои, которое устойчиво к применению глифосата, который включает в себя стадии: (a) половое скрещивание первого родительского устойчивого к глифосату растения сои, включающего генную модификацию MON89788, и второго родительского растения сои, которые не имеют устойчивость к глифосату, получая при этом множество растений потомства; и (b) выделение растения потомства, которое устойчиво к применению глифосата. Способы селекции могут дополнительно включать в себя стадии скрещивания родительского растения, включающего генную модификацию сои MON89788, со вторым родительским растением сои, которое также устойчиво к глифосату, и выделение устойчивого к глифосату потомства с помощью молекулярной маркерной ДНК, генетически связанной с устойчивым к глифосату фенотипом, обнаруженным у каждого родителя.
Другой аспект изобретения представляет собой способ борьбы с сорняками на поле растений сои, включающих генную модификацию MON89788, в котором указанный способ включает засеивание поля семенами сои, содержащими генную модификацию MON89788, где указанные показательные семена депонированы в ATCC под инвентарным № PTA-6708, обеспечение роста указанных семян и обработку указанных растений эффективной дозой глифосата для борьбы с сорняками на указанных полях.
Изложенные выше и другие аспекты изобретения станут более понятны из следующего подробного описания и прилагаемых чертежей.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1. Организация трансгенной вставки в геном растения сои, включающего генную модификацию MON89788.
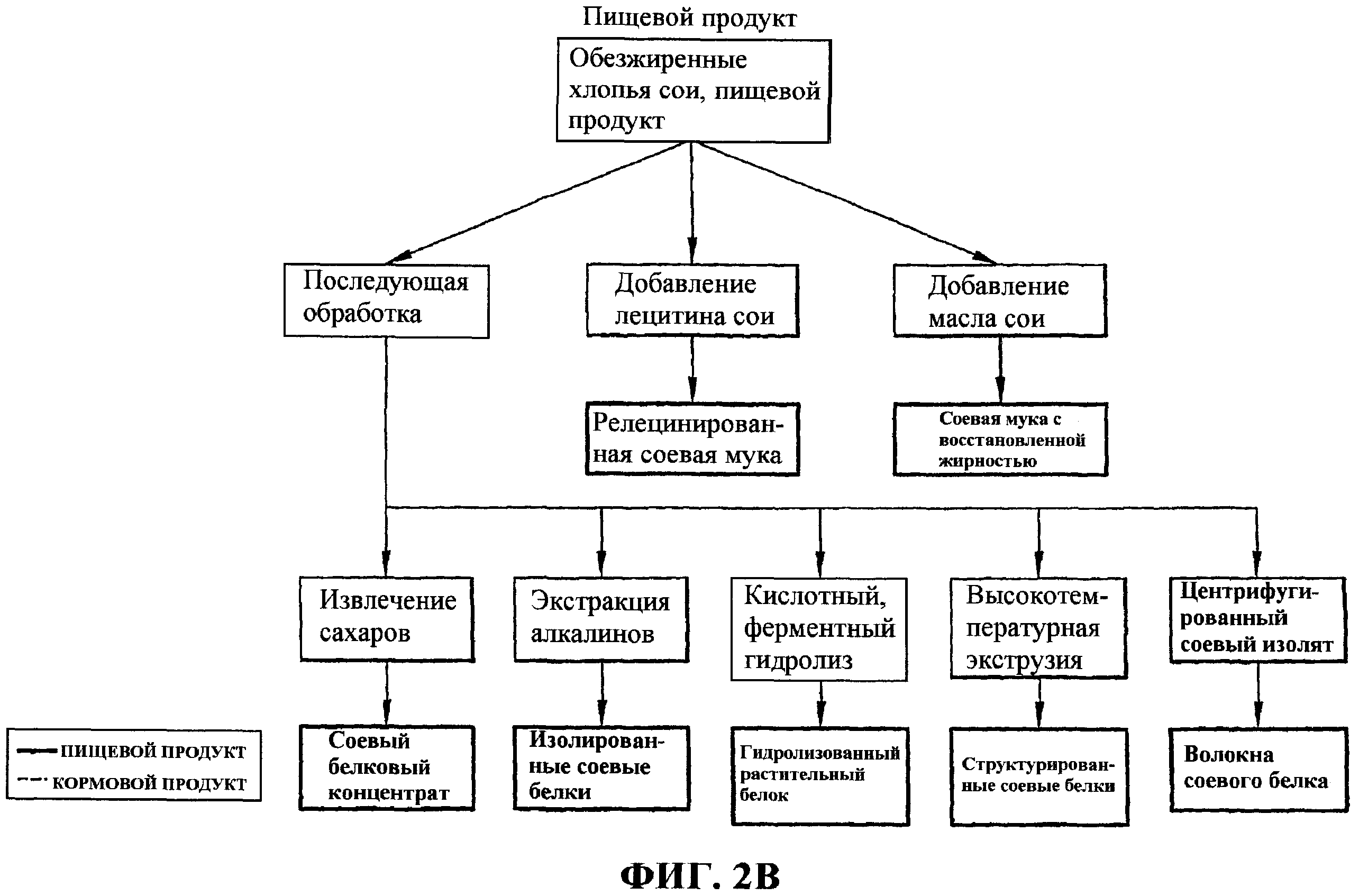
Фиг.2A-2B. Обработка товарных продуктов из сои.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится к новой трансформированной сое с генетической модификацией, обозначенной как MON89788, которая обеспечивает устойчивость к глифосату, и частям растений, и семенам, и продуктам, произведенных из растений, частей растений, семян, и продуктов, включающих указанную генетическую модификацию. Изобретение представляет молекулы ДНК, которые являются новыми в геноме клеток сои, включающем генетическую модификацию MON89788 и молекулы ДНК, которые могут быть использованы в различных способах обнаружения ДНК для идентификации ДНК MON89788 в образце. Изобретение представляет способ борьбы с сорняками в поле растений, содержащих MON89788, путем обработки сорняков в поле, содержащем растения, содержащие генетическую модификацию MON89788, гербицидом глифосатом.
Следующие определения и способы представлены для лучшего описания настоящего изобретения и для инструктирования специалистов в данной области в практике настоящего изобретения. Если не указано особо, термины представлены, чтобы быть понятными специалистам, компетентным в данной области. Определения общих терминов в молекулярной биологии также можно обнаружить в Rieger et al. (1991) и Lewin (1994). Используется номенклатура для оснований ДНК, как представлено в § 1.822 37 CFR.
Для использования в данном описании, термин "соя" означает Glycine max и включает в себя все модификации растения, которые могут быть выведены из сои.
Для использования в данном описании, термин "включающий" означает "включающий, но не ограничивающийся".
"Глифосат" относится к N-фосфонометилглицину и его солям. Глифосат представляет собой активный компонент Roundup® гербицида (Monsanto Co.). Обработка "гербицидом глифосатом" относится к обработкам с использованием гербецидов Roundup®, Roundup Ultra®, Roundup Pro® или любым другим гербицидным соединением, содержащим глифосат. Примеры коммерческих препаратов глифосата включают, без ограничений, препараты, продаваемые Monsanto Company как гербициды ROUNDUP®, ROUNDUP® ULTRA, ROUNDUP® ULTRAMAX, ROUNDUP® CT, ROUNDUP® EXTRA, ROUNDUP® BIACTIVE, ROUNDUP® BIOFORCE, RODEO®, POLARIS®, SPARK® и ACCORD®, все из которых содержат глифосат в виде его соли изопропиламмония; ROUNDUP® WEATHERMAX (калиевая соль глифосата), препараты, продаваемые Monsanto Company как гербициды ROUNDUP® DRY и RIVAL®, которые содержат глифосат в виде его аммонийной соли; препараты, продаваемые Monsanto Company как ROUNDUP® GEOFORCE, которые содержат глифосат в виде его натриевой соли; и препараты, продаваемые Syngenta Crop Protection как гербицид TOUCHDOWN®, который содержит глифосат в виде его триметилсульфониевой соли. Обработка поля, содержащего растения сои, устойчивые к глифосату, включающие линию MON89788, любыми из этих соединений гербицида глифосата будет контролировать рост сорняков на поле и не будет влиять на рост или урожайность растений сои, включающих генетическую модификацию MON89788.
Трансгенную "генетическую модификацию" получают трансформацией клеток растения гетерологичной ДНК, например, нуклеиновокислотным конструктом, который включает в себя интересующий трансген, восстановлением популяции растений, полученных в результате вставки трансгена в геном растения, и селекцией отдельного растения, характеризующегося вставкой в отдельный участок генома. Термин "генетически модифицированный" относится к исходной трансформации и потомству трансформанта, которые включают в себя гетерологичную ДНК. Термин "генетически модифицированный" также относится к потомству, полученному путем полового скрещивания между трансформантом и другой модификацией, который включает в себя гетерологичную трансгенную ДНК и фланкирующую геномную ДНК. Термин “генетически модифицированный" также относится к ДНК исходного трансформанта, включающего вставленную ДНК и фланкирующую геномную последовательность, непосредственно примыкающую к вставленной ДНК, для которой можно было бы ожидать ее перемещение в потомство, которое получает вставленную ДНК, включающую в себя интересующий трансген как результат полового скрещивания одной родительской клеточной линии, которая включает в себя вставленную ДНК (например, исходный трансформант и потомство, полученное в результате самоопыления), и родительской линии, которая не содержит вставленную ДНК.
Растение сои, устойчивое к глифосату, может быть выращено первым половым скрещиванием первого родительского растения сои, состоящего из растения сои, выращенного из трансгенного глифосат-устойчивого растения сои, включающего MON89788, или растение сои, которое является потомством скрещивания такого растения, которое экспрессирует глифосат-устойчивый фенотип, и второго родительского растения сои, которое не обладает устойчивостью к глифосату, получая, таким образом, множество растений первого потомства; и затем отбирая растение потомства, которое устойчиво к применению гербицида глифосата. Эти стадии дополнительно могут включать обратное скрещивание глифосат-устойчивого растения потомства со вторым родительским растением сои или третьим родительским растением сои с последующим отбором потомства путем применения глифосата или идентификацией молекулярных маркеров, связанных со свойством, получая, таким образом, растение сои, которое устойчиво к применению гербицида глифосата. Можно использовать молекулярные маркеры, которые включают соединенные молекулы ДНК, идентифицированные в 5' и 3' участках вставки трансгена в генетическую модификацию MON89788.
Также понятно, что два различных трансгенных растения могут также быть скрещены с получением потомства, которое содержит два независимо выделенных экзогенных трансгена. Также рассмотрено обратное скрещивание с родительским растением и перекрестное скрещивание с нетрансгенным растением, как описано ранее для вегетативного размножения. Описания других способов селекции, которые распространены для различных свойств и сельскохозяйственных культур, можно обнаружить в одной из нескольких ссылок, например, Fehr, (1987).
"Зонд" это выделенная нуклеиновая кислота, к которой прикрепляют обычную детектируемую метку или репортерную молекулу, например, радиоактивный изотоп, лиганд, хемилюминесцентный агент или фермент. Такой зонд комплементарен к цепи мишенной нуклеиновой кислоты, и в случае настоящего изобретения - к цепи геномной ДНК растения сои, включающего генетическую модификацию MON89788, в любом из растения сои или семян, или из образца или экстракта растения или семян, которые включают указанную генетическую модификацию ДНК. Зонды согласно настоящему изобретению включают в себя не только дезоксирибонуклеиновую или рибонуклеиновую кислоты, но также полиамиды и другие материалы зондов, которые связываются специфически с мишенной последовательностью ДНК и могут использоваться для обнаружения присутствия этой мишенной последовательности ДНК.
"Праймеры" представляют собой выделенные полинуклеиновые кислоты, которые отжигаются в комплементарные цепи мишенной полинуклеиновой кислоты путем гибридизации нуклеиновой кислоты с образованием гибрида между праймером и мишенной цепью полинуклеиновой кислоты, с последующим удлинением вдоль мишенной цепи полинуклеиновой кислоты с помощью полимеразы, например, ДНК полимеразы. Пары праймеров настоящего изобретения связаны с использованием их для амплификации молекулы мишенной полинуклеиновой кислоты, например, полимеразной цепной реакцией (PCR) или другими обычными способами амплификации нуклеиновых кислот.
Зонды и праймеры обычно имеют 11 полинуклеотидов или более в длину, предпочтительно 18 полинуклеотидов или более, более предпочтительно 24 полинуклеотидов или 30 полинуклеотидов или более. Такие зонды и праймеры гибридизуются специфически с мишенной молекулой при гибридизации в условиях высокой жесткости. Предпочтительно, зонды и праймеры согласно настоящему изобретению обладают полной идентичностью последовательностей с мишенной молекулой, хотя зонды, отличающие от последовательности мишени и которые сохраняют способность к гибридизации к последовательности мишени в условиях высокой жесткости, могут быть сконструированы стандартными способами.
Способы получения и использования зондов и праймеров описаны, например, в Sambrook et al. (1989); Ausubel et al. (1992); и Innis et al. (1990). Пары PCR-праймеров (набор праймеров) могут быть выведены из известной последовательности, например, используя компьютерные программы, специально предназначенные для этого, такие как Primer (Version 0.5, © 1991, Whitehead Institute for Biomedical Research, Cambridge, MA).
Праймеры и зонды, основанные на фланкирующей геномной ДНК и последовательностях вставки, раскрытые в данном описании (SEQ ID NO:1-4 и 9), могут использоваться для подтверждения и, если необходимо, для исправления раскрытых последовательностей стандартными способами, например, путем выделения соответствующей молекулы ДНК из депонированных семян, включающих MON89788, и для определения последовательности нуклеиновых кислот таких молекул. Дополнительно связанные молекулы ДНК можно выделить из генома клетки, включающей MON89788, который включает трансгенную вставку и геномную фланкирующую область, и фрагменты этих молекул можно использовать в качестве праймеров или зондов.
Зонды и праймеры нуклеиновых кислот настоящего изобретения гибридизируются при жестких условиях с мишенной последовательностью ДНК. Любой обычный способ гибридизации или амплификации нуклеиновых кислот можно использовать для идентификации присутствия ДНК из линии MON89788 в образце. Молекулы нуклеиновых кислот или их фрагменты поддаются специфической гибридизации с другими молекулами нуклеиновых кислот при некоторых обстоятельствах. Как использовано в данном описании, считается, что две молекулы нуклеиновых кислот поддаются специфической гибридизации друг с другом, если две молекулы способны к образованию антипараллельной, двухцепочной структуры нуклеиновых кислот и являются достаточно длинными для сохранения этой структуры в условиях высокой жесткости. Считается, что молекула нуклеиновой кислоты является "комплементарной" другой молекуле нуклеиновой кислоты, если они проявляют полную комплементарность. Как использовано в данном описании, считается, что молекулы проявляют "полную комплементарность", когда каждый нуклеотид одной из молекул комплементарен нуклеотиду другой. Считается, что две молекулы являются "минимально комплементарными", если они могут гибридизоваться друг с другом достаточно стабильно, чтобы позволить им остаться отожженными друг с другом при, по меньшей мере, обычных условиях "низкой жесткости". Аналогично, считается, что молекулы являются "комплементарными", если они могут гибридизоваться друг с другом с достаточной стабильностью, чтобы позволить им остаться отожженными друг с другом при обычных условиях "высокой жесткости". Обычные жесткие условия описаны Sambrook et al., 1989, и Haymes et al. (1985). Таким образом отступления от полной комплементарности позволительны, поскольку такие отступления никогда не предотвращают полностью способность молекул образовывать двухцепочечную структуру. Чтобы молекула нуклеиновых кислот выполняла функцию праймера или зонда, необходима только достаточная комплементарность последовательности, чтобы быть способной к образованию стабильной двухцепочечной структуры в использованных конкретном растворителе и концентрациях соли.
Как использовано в данном описании, значительно гомологичная последовательность представляет собой последовательность нуклеиновых кислот, которая специфически гибридизуется с комплементарной последовательностью нуклеиновых кислот, с которой она сопоставима в условиях высокой жесткости. Подходящие жесткие условия, которые способствуют гибридизации ДНК, например, 6,0 X хлорид натрия/цитрат натрия (SSC) при примерно 45°C, с последующей отмывкой 2,0 x SSC при 50°C, известны специалисту в данной области или могут быть найдены в Current Protocols in Molecular Biology, John Wiley & Sons, N.Y. (1989), 6.3.1-6.3.6. Например, концентрацию соли на стадии отмывки можно выбрать от низкой жесткости, примерно 2,0 x SSC при 50°C, до высокой жесткости, примерно 0,2 x SSC при 50°C. Кроме того, температуру на стадии отмывки можно увеличить от условий низкой жесткости при комнатной температуре, примерно 22°C, до условий высокой жесткости при примерно 65°C. Можно изменять как температуру, так и соль, или можно оставлять постоянными либо температуру, либо концентрацию соли, тогда как оставшийся параметр изменится. В предпочтительном варианте осуществления, нуклеиновая кислота настоящего изобретения специфически гибридизуется с одной или более молекулам нуклеиновых кислот, представленными в SEQ ID NO:1-4 и 9, их комплементами или фрагментами, при умеренно жестких условиях, например, при примерно 2,0 x SSC и примерно 65°C. В частности, в предпочтительном варианте осуществления, нуклеиновая кислота настоящего изобретения специфически гибридизовалась с одной или более молекулам нуклеиновых кислот, представленными в SEQ ID NO:1-4 и 9, их комплементах или фрагментах, при условиях высокой жесткости. В одном аспекте настоящего изобретения, предпочтительная маркерная молекула нуклеиновой кислоты настоящего изобретения включает последовательность нуклеиновой кислоты, как представлено в SEQ ID NO:1 или SEQ ID NO:2 или их комплементах или фрагментах. В другом аспекте настоящего изобретения, предпочтительная маркерная молекула нуклеиновой кислоты настоящего изобретения имеет от 80% до 100% или от 90% до 100% идентичности последовательности с последовательностью нуклеиновых кислот, представленных в SEQ ID NO:1 или SEQ ID NO:2 или их комплементах или фрагментах. Молекулярные маркерные молекулы ДНК, которые включают SEQ ID NO:1 или SEQ ID NO:2, или их комплементы или фрагменты, можно использовать в качестве маркеров в способах селекции растений для идентификации потомства генетического скрещивания, сходного со способами, описанными для простого маркерного анализа повторов последовательности ДНК, в Cregan et al. (1997); каждое из которых полностью включено в данное описание посредством ссылки. Гибридизация зонда с мишенной молекулой ДНК может быть определена любыми способами, известными специалистам в данной области, и они могут включать, но ими не ограничиваться, флуоресцентные метки, радиоактивные метки, метки, основанные на антителах, и хемилюминесцентные метки.
Рассматривая амплификацию мишенной последовательности нуклеиновых кислот (например, PCR) с использованием специфической амплификационной пары праймеров, "жесткие условия" представляют собой условия, которые позволяют паре праймеров гибридизоваться только с мишенной последовательностью нуклеиновых кислот, с которой праймер, имеющий соответствующую последовательность дикого типа (или ее комплемент), может связываться и предпочтительно производить уникальный продукт амплификации, ампликон, в термальной реакции амплификации ДНК.
Термин "специфический для (мишенной последовательности)" показывает, что зонд или праймер гибридизуется в строгих условиях гибридизации только с мишенной последовательностью в образце, включающем мишенную последовательность.
Как использовано в данном описании, "амплифицированная ДНК" или "ампликон" относятся к продукту амплификации нуклеиновых кислот мишенной последовательности нуклеиновых кислот, которая является частью матрицы нуклеиновых кислот. Например, для определения, содержит ли растение сои, полученное половым скрещиванием, трансген с генетической модификацией MON89788, или включает ли образец сои, собранный с поля, MON89788, или экстракт сои, такой как крупа, мука или масло, включает ли MON89788. ДНК, выделенные из образца ткани растения сои или экстракта, может быть подвергнута способу амплификации нуклеиновых кислот с использованием пары праймеров, которые включают в себя праймер, полученный из прилегающей геномной области инсерционного сайта вставленной гетерологичной трансгенной ДНК, и второй праймер, полученный из вставленной гетерологичной трансгеной ДНК для производства ампликона, который является диагностическим для случая присутствия ДНК. Ампликон имеет длину и имеет последовательность, которая также является диагностической для случая. Ампликон может изменять длину от общей длины пары праймеров, плюс одна нуклеотидная пара основания, или плюс примерно пятьдесят пар нуклеотидных оснований, или плюс примерно двести пятьдесят пар нуклеотидных оснований, или плюс примерно триста пятьдесят пар нуклеотидных оснований или больше.
Альтернативно, пару праймеров можно получить из фланкирующей геномной последовательности на обеих сторонах вставленной ДНК, с тем, чтобы получить ампликон, который включает в себя полную вставленную нуклеотидную последовательность. Член пары праймеров, полученной из геномной последовательности растения, может располагаться на расстоянии от вставленной трансгенной молекулы ДНК, это расстояние может изменяться от одной нуклеотидной пары основания выше до примерно двадцати тысяч пар нуклеотидных оснований. В частности, использование термина "ампликон” исключает димеры праймеров, которые могут образовываться в термальной реакции амплификации ДНК.
Амплификация нуклеиновых кислот может проводиться любым из разных способов реакции амплификации нуклеиновых кислот, известных в данной области, включающих в себя полимеразную цепную реакцию (PCR). Множество способов амплификации известны в данной области и описаны, inter alia, в патентах США № 4683195 и 4683202 и в Innis et al. (1990). Способы амплификации PCR были разработаны для увеличения до 22 тыс.п.о. геномной ДНК и до 42 тыс.п.о. ДНК бактериофагов (Cheng et al., 1994). Эти способы, а также другие способы, известные в данной области амплификации ДНК, могут использоваться в практике настоящего изобретения. Последовательность гетерологичной вставки ДНК или фланкирующей последовательности из линии сои MON89788 может быть верифицирована и исправлена, если необходимо, путем амплифицирования таких молекул из генома линии, используя праймеры, полученные из последовательностей, представленных в данном описании, последующими способами стандартного секвенирования ДНК, примененных к PCR ампликону или к выделенной клонированной трансгенной/геномной ДНК.
Ампликон, полученный этими способами, можно обнаружить множеством способов. Один такой способ представляет Genetic Bit Analysis (Nikiforov et al., 1994), где олигонуклеотид ДНК предназначен для перекрывания как примыкающей фланкирующей геномной последовательности ДНК, так и вставленной трансгенной последовательности ДНК. Олигонуклеотид иммобилизован на стенках микролуночного планшета. После PCR интересующей области (используя один праймер во вставленной последовательности и один в примыкающей фланкирующей геномной последовательности) одноцепочечный продукт PCR может гибридизоваться с иммобилизированным олигонуклеотидом и служить в качестве матрицы для реакции удлинения единичного основания с использованием ДНК полимеразы и меченых ddNTPs, специфических для ожидаемого следующего основания. Считывание данных может быть флуоресцентным или основанным на ELISA. Сигнал показывает присутствие вставленной/фланкирующей геномной последовательности, вследствие успешной амплификации, гибридизации и одноосновного удлинения.
Другой способ представляет собой способ пиросеквенирования, как описано Winge (2000). В этом способе олигонуклеотид предназначен для перекрывания соединения перекрывающейся геномной ДНК и ДНК вставки. Олигонуклеотид гибридизуется с одноцепочечным продуктом PCR из интересующей области (один праймер во вставленной последовательности и один во фланкирующей геномной последовательности) и инкубируется в присутствии ДНК-полимеразы, ATP, сульфурилазы, люциферазы, апиразы, аденозин 5' фосфосульфата и люциферина. DNTPs добавляют в отдельности, и включение приводит к световому сигналу, который измеряется. Световой сигнал показывает присутствие трансгенной вставленной/фланкирующей последовательности вследствие успешной амплификации, гибридизации и одно- или многоосновного удлинения.
Поляризация флуоресценции, как описано Chen et al. (1999), представляет собой способ, который можно использовать для определения ампликона настоящего изобретения. При использовании этого способа олигонуклеотид предназначается для перекрывания соединения геномной фланкирующей и вставленной ДНК. Олигонуклеотид гибридизуется с одноцепочечным продуктом PCR из интересующей области (один праймер во вставленной ДНК и один во фланкирующей геномной последовательности ДНК) и инкубируется в присутствии ДНК полимеразы и флуоресцентно-меченого ddNTP. Одноосновное удлинение приводит к включению ddNTP. Включение можно измерить как изменение поляризации с использованием флуориметра. Изменение поляризации показывает присутствие трансгенной вставленной/фланкирующей последовательности вследствие успешной амплификации, гибридизации и одноосновного удлинения.
Taqman® (PE Applied Biosystems, Foster City, CA) описывается как способ определения и количественного измерения присутствия последовательности ДНК и полностью понятен в инструкциях, представленных производителем. Коротко, FRET олигонуклеотидный зонд предназначается для перекрывания соединения геномной фланкирующей и вставленной ДНК. FRET зонд и PCR праймеры (один праймер во вставленной последовательности ДНК и один во фланкирующей геномной последовательности) участвуют в цикле в присутствии термостабильной полимеразы и dNTPs. Гибридизация FRET зонда приводит к расщеплению и высвобождению флуоресцентной частицы из частицы гашения во FRET зонде. Флуоресцентный сигнал показывает присутствие фланкирующей геномной/трансгенной вставленной последовательности вследствие успешной амплификации и гибридизации.
Molecular Beacons был описан для использования в обнаружении последовательностей, как представлено в Tyangi et al. (1996). Коротко, FRET олигонуклеотидный зонд предназначается для перекрывания соединения фланкирующей геномной и вставленной ДНК. Специфическая структура FRET зонда приводит к этой вторичной структуре, которая сохраняет флуоресцентные и гасящие частицы в непосредственной близости. FRET зонд и PCR праймеры (один праймер во вставленной последовательности ДНК и один во фланкирующей геномной последовательности) участвуют в цикле в присутствии термостабильной полимеразы и dNTPs. После успешной PCR амплификации гибридизация FRET зонда с мишенной последовательностью приводит к удалению в зонде вторичной структуры и пространственному разделению флуоресцентных и гасящих частиц. Получают флуоресцентный сигнал. Флуоресцентный сигнал показывает присутствие фланкирующей геномной/трансгенной вставленной последовательности вследствие успешной амплификации и гибридизации.
Другие описанные способы, такие как микрофлюидики (патентная публикация США 2006068398, патент США № 6544734), представляют способы и устройства разделения и амплифицирования образцов ДНК. Оптические красители использовались для определения и количественного измерения специфических молекул ДНК (WO/05017181). Устройства из нанотрубок (WO/06024023), которые включают электронный прибор для молекул ДНК или наногранулы, которые связывают специфические молекулы ДНК и затем могут определяться, являются полезными для определения молекул ДНК настоящего изобретения.
Наборы для обнаружения ДНК могут разрабатываться с использованием композиций, раскрытых в данном описании, и способов, описанных или известных в данной области обнаружения ДНК. Наборы полезны для установления ДНК линии сои в образце и могут применяться в способах селекции растений сои, содержащих ДНК. Наборы могут содержать ДНК праймеры или зонды, которые гомологичны или комплементарны SEQ ID NO:1-4 и 9, или ДНК праймеры или зонды, гомологичные или комплементарные ДНК, содержащейся в трансгенных генетических элементах ДНК, где эти ДНК последовательности могут использоваться в реакциях амплификации ДНК или в качестве зондов в способе гибридизации ДНК. Структура ДНК из трансгенных генетических элементов, содержащихся в геноме сои и проиллюстрированных на фиг.1, включает 5' геномную область генома A3244 сои, фланкирующую трансгенную вставку, вставку, включающую участок правой пограничной области (RB) из Agrobacterium tumefaciens, химерный промотор FMV/Tsf1 и родственные связанные элементы (патент США 6660911; также называемый как FMV/E1F1α), функционально связанный с кодирующей последовательностью хлоропластного трансгенного белка EPSPS из Arabidopsis (названную в данном описании как CTP2 или TS-AtEPSPS CTP2, патент США 5633435, функционально связанный с устойчивым к гликофосату EPSPS (названный в данном описании как CP4 EPSPS или aroA:CP4, выделенный из штамма CP4 Agrobacterium tumefaciens, и кодирующую последовательность, модифицированную для увеличенной экспрессии в клетках растений, патент США 5633435), функционально связанный с 3' терминальной областью из рибулозо-1,5-бисфосфаткарбоксилазы гороха (названную в данном описании как E9 3' или T-Ps.RbcS:E9, Coruzzi et al., (1984), участок левой пограничной области (LB) из Agrobacterium tumefaciens, и 3' геномной областью генома A3244 сои, фланкирующую трансгенную вставку. Молекулы ДНК, полезные в качестве праймеров в способах ДНК амплификации, можно получать из последовательностей генетических элементов трансгенной вставки, содержащей трансгенную модификацию MON89788. Эти праймерные молекулы могут использоваться как часть праймерного набора, который также включает в себя молекулу ДНК праймера, полученную из генома сои, фланкирующего трансгенную вставку. Соя с генетической модификацией MON89788 была получена трансформацией линии сои A3244 (патент США 5659114) способом с использованием Agrobacterium, например, способами, описанными в патентах США 6384301 и 7002058 (включенные в данное описание полностью посредством ссылки).
Авторы настоящего изобретения обнаружили, что линия сои, содержащая геномную область T-типа MON89788 (T-тип представляет собой соединение трансгена и связанной области гаплотипа генома растения) в своем геноме, обладает улучшенной урожайностью по сравнению с линией, содержащей прежнюю 40-3-2 геномную область T-типа. Это было показано в воспроизводимых полевых испытаниях, включающих данные по урожайности, собранные во многих областях США (патентная заявка США 60/685584).
Следующие примеры включают в себя примеры для демонстрации определенных предпочтительных вариантов осуществления изобретения. Специалистам в данной области следует учитывать, что способы, раскрытые в нижеприведенных примерах, представляющие подходы, которые хорошо и функционально обоснованы авторами в практике изобретения, могут рассматриваться с целью создания частных предпочтительных способов осуществления на практике. Однако специалистам в данной области следует понимать в свете настоящего раскрытия, что многие изменения можно производить в специфических вариантах осуществления, которые раскрыты, и получать подобный или сходный результат без отклонения от сущности и объема изобретения.
ПРИМЕРЫ
Пример 1
Получение оценки ампликона для MON89788 геномной ДНК
ДНК из трансгенной линии сои MON89788 выделяют из ткани, включающей семена сои, ткань растительных волокон, или крупу. ДНК выделяют из ткани, используя Qiagen's DNeasy Plant Miniprep Kit, согласно инструкциям изготовителям (Qiagen Corp. Valencia, CA).
Получают PCR продукт, который содержит участок геномной ДНК, фланкирующей 5' конец T-DNA (перенос ДНК, содержащий трансген) вставки в геном растения, содержащего MON89788. Этот ДНК продукт содержит SEQ ID NO:3. PCR можно производить, используя один праймер, разработанный для гибридизации с геномными последовательностями ДНК, фланкирующими 5' конец трансгенной вставки (ДНК праймер A, SEQ ID NO:5; см. фиг.1), спаренный со вторым праймером (ДНК праймер B, SEQ ID NO:6), расположенным в промоторной области трансгена (патент США 6660911, SEQ ID NO:28, включенный в данное описание посредством ссылки и представленный в SEQ ID NO:9).
Продукт PCR получают от 3' конца вставки трансгена, который содержит участок геномной ДНК, фланкирующей 3' конец T-ДНК вставки в геном растения, содержащего MON89788. Этот ДНК продукт содержит SEQ ID NO:4. PCR можно производить, используя один праймер, разработанный для гибридизации с геномными последовательностями ДНК, фланкирующими 3' конец вставки каждого случая (ДНК праймер D, SEQ ID NO:8) и спаренный со вторым праймером (ДНК праймер C, SEQ ID NO:7), расположенным в T-Ps.RbcS:E9 3' транскрипционной терминальной последовательности на 3' конце вставки.
Матрица PCR включает в себя ~50 нг геномной ДНК. В качестве отрицательного контроля используется ~50 нг геномной ДНК не-трансгенного сорта сои. Каждая проба PCR содержит 5 мкл 10 X буфера для REDAccuTaqTM LA DNA Polymerase Mix (Sigma-Aldrich, St Louis, MO), 200 мкМ каждого dNTP (Sigma-Aldrich), 0,4 мкМ каждого праймера, и 2,5 единиц JumpStartTM REDTaqTM DNA Polymerase (Sigma-Aldrich) в 50 мкл общего объема пробы. PCR пробы производят в следующих циклических условиях: 1 цикл при 94°C в течение 3 минут (мин); 32 или 35 циклов при 94°C в течение 30 секунд (с), 58°C в течение 30 сек, 72°C в течение 30 сек или 1 мин; 1 цикл при 72°C в течение 10 мин.
Пары праймеров ДНК линии используют для получения оценки ампликона для геномной ДНК MON89788. Эти пары праймеров линии включают, но ими не ограничиваются, праймеры A и B (SEQ ID NO:5 и 6) и пары праймеров линии C и D (SEQ ID NO:7 и 8), которые используются в описанном способе амплификации ДНК. Вдобавок к этим парам праймеров, любая пара, полученная из SEQ ID NO:3 или SEQ ID NO:4, или их комплементы, которые при использовании в реакции амплификации ДНК производят ампликон, который содержит SEQ ID NO:1 или SEQ ID NO:2, диагностический для ткани, полученной для линии сои MON89788, соответственно, могут использоваться. Условия амплификации ДНК, показанные в таблице 1 и таблице 2, можно использовать для получения диагностического ампликона MON89788, используя подходящие случаю пары праймеров. Любая модификация этих способов, использованная для получения диагностического ампликона для MON89788, находится в пределах знаний специалиста данной области. Предположительно экстракт, содержащий ДНК растения или семян сои MON89788, или продукта, полученного из растения, содержащего MON89788, который при исследовании способом амплификации ДНК производил диагностический ампликон для сои с генной модификацией MON89788, можно использовать в качестве матрицы амплификации для определения, присутствует ли MON89788.
Ампликон образуется использованием, по меньшей мере, одной праймерной последовательности, полученной из SEQ ID NO:3 или SEQ ID NO:4, которые при использовании в способе PCR образуют диагностический ампликон для линии с генной модификацией MON89788. Например, получение ампликонов MON89788 может производиться с использованием Stratagene Robocycler, MJ Engine, Perkin-Elmer 9700, или Eppendorf Mastercycler Gradient thermocycler, как показано в таблице 2, или способами и приборами, известными специалисту в данной области.
Осторожно смешать и, если необходимо (никакого нагревания поверхности термоциклера), добавить 1-2 капли минерального масла на поверхность каждой пробы. Приступить к PCR в термоциклере Stratagene Robocycler (Stratagene, La Jolla, CA), MJ Engine (MJR-Biorad, Hercules, CA), Perkin-Elmer 9700 (Perkin Elmer, Boston, MA), или Eppendorf Mastercycler Gradient (Eppendorf, Hamburg, Germany), используя следующие циклические параметры (таблица 2). Термоциклер MJ Engine или Eppendorf Mastercycler Gradient должен быть установлен в рассчитанном режиме. Запустить термоциклер Perkin-Elrner 9700 с быстро увеличивающейся скоростью, установленной на максимуме.
Пример 2
Определение последовательности трансгенной/геномной области и метод исследования по Саузерну
ДНК секвенирование продуктов PCR обеспечивает ДНК, которую можно использовать для конструирования дополнительных молекул ДНК в качестве праймеров и зондов для идентификации растений и семян сои, включающих генетическую модификацию MON89788. Продукты PCR ожидаемых размеров, представленные 5' и 3' трансгенными/геномными последовательностями, были выделены путем разделения продуктов PCR в 2,0% агарозном геле электрофорезом. Выделяют продукты PCR, которые включают 5' и 3' ДНК области, которые перекрывают вставленное соединение между трансгенной вставкой внутри генома сои. 5' и 3' продукты PCR для MON89788 очищают электрофорезом в агарозном геле, с последующим выделением из агарозного матрикса с использованием набора QIAquick Gel Extraction Kit (catalog # 28704, Qiagen Inc., Valencia, CA). Очищенные продукты PCR затем секвенируют (например, ABI PrismTM 377, PE Biosystems, Foster City, CA) и анализируют (например, DNASTAR программа секвенирования, DNASTAR Inc., Madison, WI).
Определяли последовательность ДНК для сегмента нуклеотидных пар оснований, представляющего собой трансгенную/геномную область генетической модификации MON89788, изображенную на фиг.1 и идентифицированную как SEQ ID NO:9. Геномные и трансгенные элементы, которые содержат SEQ ID NO:9, описаны в таблице 3. 5' и 3' фланкирующие области включены в SEQ ID NO:9 и приведены в SEQ ID NO:21 и 22.
Соединенные последовательности представляют собой сравнительно короткие полинуклеотидные молекулы, которые являются новыми последовательностями ДНК и являются диагностическими для ДНК MON89788 при обнаружении в анализе определения полинуклеиновой кислоты. Соединенные последовательности в SEQ ID NO:1 и SEQ ID NO:2 представляют собой 10 полинуклеотидов на каждой стороне участка вставки трансгенного фрагмента и геномной ДНК сои в MON89788. Более длинные или короткие полинуклеотидные соединенные последовательности можно выбрать из SEQ ID NO:3 или SEQ ID NO:4. Соединенные молекулы (5' связывающая область SEQ ID NO:1 и 3' связывающая область SEQ ID NO:2) полезны в качестве ДНК зондов или в качестве праймерных молекул ДНК в способах обнаружения ДНК.
Праймеры и зонды, использованные в Taqman® способе (Roche Molecular Systems, Inc., Pleasanton, CA) для обнаружения случая специфической молекулы ДНК, были разработаны для генной модификации MON89788. Праймерные молекулы обозначены как SQ2824 (SEQ ID NO:10), SQ2826 (SEQ ID NO:11), SQ1141 (SEQ ID NO:12), SQ1142 (SEQ ID NO:13), SQ5543 (SEQ ID NO:14), и молекулы зондов обозначены как PB871-6FAM (SEQ ID NO:15), PB2191-VIC (SEQ ID NO:16) и PB57-VIC (SEQ ID NO:17). Праймеры и зонды были использованы в способе Taqman® согласно инструкциям изготовителя, чтобы обеспечить диагностический ампликон для ДНК, включающей MON89788. Ткани сои, включающие переработанные продукты, например крупу, являются полезными источниками ДНК для этого способа. Дополнительные праймеры, использованные для получения ампликона из соевой крупы, включают в себя SEQ ID NO:18-20.
Саузерн блот-анализ
Геномную ДНК растения, содержащего MON89788, и контрольную геномную ДНК сои (~15 мкг каждой) обрабатывают различными рестриктазами (140U) в общем объеме 150 мкл, включающем 15 мкл соответствующего буфера изготовителя (NEB, Beverly, MA). Эндонуклеазы рестрикции, например, Bgl11, BamH1, Nco1, Hind111 и Bcl1, используются в Саузерн блот-анализе MON89788. Эндонуклеазные гидролизы проводят при подходящей температуре в течение, по меньшей мере, 6 часов. После инкубации, ДНК осаждают 3M ацетатом натрия и 2,5 объемами этанола. Далее ДНК отмывают 70% этанолом, высушивают и ресуспендируют в 40 мкл TBE. Буфер для образцов (0,2X) добавляют к образцам и затем подвергают электрофорезу в агарозных гелях (0,8%) в течение 16-18 часов при 30 вольтах. Гели окрашивают бромистым этидием, затем обрабатывают депуринизирующим раствором (0,125N HCL) в течение 10 минут, денатурирующим раствором (0,5 M гидроксида натрия, 1,5 M хлорида натрия) в течение 30 минут, и, наконец нейтрализующим раствором (0,5 M Trizma base, 1,5 M хлорида натрия) в течение 30 минут. ДНК переносят на мембрану Hybond-N (Amersham Pharmacia Biotech, Buckingamshire, England), используя Turboblotter (Schleicher and Schuell, Dassel, Germany) в течение 4-6 часов и затем фиксировали мембрану с использованием UV света.
Мембраны предварительно гибридизовали 20 мл раствором DIG Easy Hyb (Roche Molecular Biochemicals, Indianapolis, IN; cat. #1603558) в течение 2-4 часов при 45°C. Радиоактивные ДНК зонды (32P dCTP), гомологичные или комплементарные к SEQ ID NO:1, или SEQ ID NO:2, или SEQ ID NO:3, или SEQ ID NO:4, или их участок получают, используя Radprime DNA Labeling kit (Invitrogen, Carlsbad, CA; cat. #18428-011). Невключенные нуклеотиды удаляют, используя колонки SEPHADEX G-50 (Invitrogen). Раствор для предварительной гибридизации заменяют на 10 мл предварительно нагретого раствора DIG Easy Hyb, содержащего денатурированный зонд до конечной концентрации 1 миллион единиц на мл. Блоты гибридизуют при 45°C в течение 16-18 часов.
Блоты отмывают раствором пониженной жесткости (5X SSC, 0,1X SDS) при 45°C и затем повторно отмывают раствором высокой жесткости (0,1X SSC, 0,1% SDS) при 65єC. Блоты подвергают воздействию люминесцентного экрана (Amersham Biosciences, Piscataway, NJ) в течение >2 часов, и экспонирование оценивают с использованием аппарата Data Storm 860 (Amersham Biosciences). Эти приведенные способы и условия может изменять специалист в данной области определения ДНК в образце.
Пример 3
Борьба с сорняками
Контролирование роста сорняков на поле сои, содержащей MON89788. Поле засаживают семенами сои, содержащей MON89788, семена вырастают в растения, и поле растений обрабатывают гербицидным препаратом, содержащим глифосат. На поле применяют эффективную дозу препарата глифосата в дозах обработки от примерно 0,25 lb ae/A (фунтов эквивалента кислоты глифосата/акр) до 3 или более lb ae/A. Часто применяемые дозы варьируют от примерно 0,75 lb ae/A до 1,5 lb ae/A при частоте одной или более обработок в течение сезона роста по мере необходимости контроля роста сорняков на поле. С обработанных растений собирают урожай семян растений, содержащих MON89788.
Депозит Monsanto Technology LLC, семена сои, представляющие генную модификацию MON89788, раскрытую выше и указанную в формуле изобретения, был выполнен по условиям Будапештского договора в American Type Culture Collection (ATCC), 10801 University Boulevard, Manassas, Va. 20110. Депозитарный номер ATCC для депозита, содержащего линию MON89788 (также известный как MON19788 или GM_A19788), определен как PTA-6708 от 11 мая, 2005. Депозит будет сохраняться в депозитарии в течение 30 лет, или в течение 5 лет после последнего запроса, или в течение срока действия патента, в зависимости от того, что более длительно, и при необходимости будет заменен в течение этого периода.
Имея продемонстрированные и описанные принципы настоящего изобретения, специалисту в данной области должно быть очевидно, что изобретение может быть модифицировано по своей структуре и деталям без отклонения от таких принципов. Авторы заявляют, что все модификации находятся в пределах сущности и объема прилагаемой формулы изобретения.
Все публикации и опубликованные патентные документы, изложенные в этом описании, включены в данное описание посредством ссылки в одинаковой степени, как если бы включение каждой отдельной публикации или патентной заявки было оговорено особо и индивидуально.
ССЫЛКИ
Следующие ссылки, при условии, что они представляют примерные методические или другие детали, дополнительные к изложенным в этом документе, включены в данное описание посредством конкретной ссылки.
Патент США 4535060
Патент США 4683195
Патент США 4683202
Патент США 5094945
Патент США 5463175
Патент США 5554798
Патент США 5633435
Патент США 5633435
Патент США 5659114
Патент США 6040497
Патент США 6384301
Патент США 6544734
Патент США 6660911
Патент США 6660911
Патент США 6689880
Патент США 6689880
Патент США 6733974
Патент США 6740488
Патент США 6740488
Патент США 6818807
Патент США 6825400
Патент США 6893826
Патент США 6900014
Патент США 7002058
Патентная заявка США 60/685584
Публикация США 20040018518
Публикация США 2006068398
Ausubel et al., В: Current Protocols in Molecular Biology, John, Wiley & Sons, Inc, New York, 1992.
Chen et al.,Genome Res., 9:492-498, 1999.
Cheng et al.,Proc. Natl. Acad. Sci USA, 91:5695-5699, 1994.
Coruzzi et al., EMBO J., 3:1671-1679, 1984.
Cregan et al., В: DNA markers: Protocols, applications, and overviews, Wiley-Liss NY, 173-185, 1997.
DeBlock et al., EMBO J., 6:2513-2522, 1987.
Fehr, В: Breeding Methods for Cultivar Development, Wilcox (Ed.), Amer. Soc. of Agronomy, Madison WI, 1987.
Haymes et al., В: Nucleic acid hybridization, a practical approach, IRL Press, Washington, DC, 1985.
Innis, et al., В: PCR Protocols. A guide to Methods and Application, Academic Press, Inc. San Diego, 1990.
Lewin, В: Genes V, Oxford University Press, NY, 1994.
Nikiforov, et al. Nucleic Acid Res., 22:4167-4175, 1994.
Публикация PCT WO 9200377
Публикация PCT WO/05017181
Rieger et al., В: Glossary of Genetics: Classical and Molecular, 5th Ed., Springer-Verlag: NY, 1991.
Sambrook et al., В: Molecular cloning: a laboratory manual, 2th Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989.
Thompson et al., EMBO J. 6:2519-2523, 1987.
Toki et al., Plant Physiol, 100:1503-1507, 1992.
Tyangi et al., Nature Biotech., 14:303-308, 1996.
Weising et al., Ann. Rev. Genet., 22:421-477, 1988.
Windels et al., Med. Fac. Landbouww, 64/5b:459-462, 1999.
Wingem, Innov. Pharma. Tech., 00:18-24, 2000.
Реферат
Растения и семена сои, включающие генетическую трансформацию MON89788, обладают устойчивостью к глифосату. Раскрываются также способы определения присутствия в образце молекул ДНК, кодирующих указанную генетическую трансформацию. 12 н. и 12 з.п. ф-лы, 3 ил., 3 табл.
Формула
(a) скрещивания первого растения сои, включающего генную модификацию MON89788, со вторым растением сои, не включающим генную модификацию MON89788, для получения растений потомства; и
(b) селекции, по меньшей мере, первого растения потомства, которое включает указанную генную модификацию MON89788 и является устойчивым к глифосату.
(a) приведение образца, включающего ДНК сои, в контакт с набором праймеров по п.12, которые при использовании в реакции амплификации нуклеиновых кислот с геномной ДНК из сои с генной модификацией MON89788 производят диагностический ампликон для генной модификации MON89788 сои;
(b) проведение реакции амплификации нуклеиновых кислот, получая таким образом диагностический ампликон; и
(c) определение диагностического ампликона.
(а) получение образца ДНК сои; и
(b) исследование образца на присутствие последовательности ДНК генной модификации MON89788.
(a) получение растения сои или его части по п.2; и
(b) производство товарного продукта сои из растения сои или его части.

Комментарии