2-арилпропионовые кислоты и содержащие их фармацевтические композиции - RU2317075C2
Код документа: RU2317075C2
Описание
Настоящее изобретение относится к (R,S) 2-арилпропионовым кислотам, их энантиомерам (R) и (S) и к содержащим их фармацевтическим композициям, которые используют для профилактики и лечения повреждений тканей, вызванных усиленным накоплением полиморфоядерных нейтрофилов (PMN лейкоциты) в участках воспалений.
Определенные клетки крови (макрофаги, гранулоциты, нейтрофилы, полиморфоядерные) реагируют на химические стимулы (при стимуляции веществами, называемыми хемокинами) путем миграции в направлении градиента концентрации стимулирующего агента, и процесс этот носит название хемотаксиса. Основные известные стимулирующие агенты или хемокины представлены продуктами разложения комплемента C5a, некоторыми N-формилпептидами, образующимися в результате лизиса поверхностей бактерий, или пептидами синтетического происхождения, такими как формил-метионил-лейцил-фенилаланин (f-MLP) и, главным образом, разнообразными цитокинами, включая интерлейкин-8 (IL-8). Интерлейкин-8 является эндогенным хемотаксическим фактором, продуцируемым большинством содержащих ядра клеток, таких как фибробласты, макрофаги, эндотелиальные и эпителиальные клетки, подвергнутые воздействию TNF-α (фактор некроза опухоли) стимулов, интерлейкины IL-1α и IL-1β и липополисахариды бактериальных стенок (LPS), так же, как и те же нейтрофилы, экспонированные воздействию LPS, или N-формилпептиды бактериального происхождения (f-MLP). К семейству указанного хемотаксического фактора [известного также как активирующий нейтрофилы фактор (NAF), T-лимфоцитный хемотаксический фактор, моноцитпроизводный нейтрофильный хемотаксический фактор (MDNCF)] принадлежит ряд IL-8-подобных хемокинов [GRO α, β, γ и NAP-2], которые связываются с IL-8 рецепторами (Chang et al., J. Immunol., 148, 451, 1992). Нейтрофилы защищают от бактериальной инфекции благодаря способности этих клеток мигрировать из периферической крови через эндотелиальные соединения и тканевые матрицы в направлении активных участков (то есть вдоль градиентов концентрации хемотаксического фактора), где они действуют, атакуя микроорганизмы, удаляя поврежденные клетки и восстанавливая ткани (M.A. Goucerot-Podicalo et al., Pathol. Biol (Paris), 44, 36, 1996).
При некоторых патологических состояниях, характеризуемых усиленным накоплением нейтрофилов, более серьезное повреждение тканей на участке связано с инфильтрацией нейтрофильных клеток. Недавно была продемонстрирована роль активации нейтрофилов в определении повреждений, связанных с пост-ишемической реперфузией и гипероксией легких.
Экспериментальные модели [N. Sekido et al., Nature, 365, 654, 1993 и T. Matsumoto et al., Lab. Investig., 77, 119, 1997] и клинические исследования [A Mazzone et al., Recent Prog. Med., 85, 397, 1994; G. Receipts et al., Atheroscl., 91, 1, 1991] продемонстрировали прямую корреляцию между клеточными повреждениями и степенью инфильтрации PMN лейкоцитов, причем IL-8 являются наиболее специфическими и мощными ее активаторами. У пациентов с острой респираторной недостаточностью (ARDS) усиленное накопление нейтрофилов в воздушных путях и в легочных жидкостях можно хорошо скоррелировать с концентрацией цитокина IL-8 (E.J. Miller et al., Am. Rev. Respir. Dis., 146, 437, 1992) и с тяжестью патологии (Kurodowska et al., Immunol., 157, 2699, 1996). Было показано, что лечение анти-IL-8 антителами является эффективным в моделях острой респираторной недостаточности и легочных повреждений, вызванных эндотоксемией (K. Yokoi et al.; Lab. Invest., 76, 375, 1997).
Была продемонстрирована специфическая роль IL-8 в возникновении поражений после пост-ишемической реперфузии у пациентов с острым разрывом миокарда (Y. Abe et al., Br. Heart J., 70, 132, 1993); ключевая роль, демонстрируемая IL-8 в опосредствовании повреждений, связанных с пост-ишемической реперфузией, поддерживается также результатами, полученными с использованием анти-IL-8 антител в экспериментальной модели фокальной церебральной ишемии у кроликов (T. Matsumoto et al., Lab. invest., 77, 119, 1997).
Биологическая активность IL-8 осуществляется за счет взаимодействия интерлейкина с CXCR1 и CXCR2 мембранными рецепторами, которые относятся к семейству семи трансмембранных рецепторов, экспрессируемых на поверхности человеческих нейтрофилов и некоторых типов T-клеток (L. Xu et al., J.Leukocyte Biol., 57, 335, 1995).
Хотя известно, что CXCR1 активация играет ключевую роль в IL-8-опосредствованном хемотаксисе, недавно было выдвинуто предположение, что CXCR2 активация может играть патофизиологическую роль в хронических воспалительных заболеваниях, таких как псориаз. Действительно, патофизиологическая роль IL-8 в псориазе подтверждается также воздействием IL-8 на функции кератиноцитов.
Действительно, было показано, что IL-8 являются эффективными стимуляторами пролиферации эпидермальных клеток, а также ангиогенеза, обоих важных аспектов псориатического патогенеза (A. Tuschil et al. J Invest Dermatol, 99, 294, 1992; Koch AE et al, Science, 258, 1798, 1992). Кроме того, IL-8 индуцируют экспрессию главного комплекса гистосовместимости II (MHC-II) фрагмент HLA-DR на культивируемых кератиноцитах (L. Kemeny et al., Int Arch Allergy Immunol, 10, 351, 1995). Предполагают, что влияние CXCL8 на функции кератиноцитов опосредствовано CXCR2 активацией. В соответствии с этой гипотезой сообщалось, что CXCR2 чрезмерно экспрессированы в пораженной коже пациентов, больных псориазом (R. Kulke et al., J. Invest. Dermatol, 110, 90, 1998).
Кроме того, доказано, что патофизиологическая роль IL-8 в развитии и метастазах меланомы может быть опосредствована CXCR2 активацией.
Потенциальная патогенетическая роль IL-8 в кожной меланоме не зависит от их хемотаксической активности в отношении человеческих PMNs. Действительно, предполагают, что IL-8 действует как основной фактор роста и образования метастазов для клеток меланомы.
Было обнаружено, что значительное количество CXL8 продуцируется клетками меланомы, и известно, что клетки меланомной опухоли экспрессируют иммунореактивный CXCR2 рецептор (L.R. Bryan et al., Am J Surg, 174, 507, 1997). Известно, что IL-8 вызывает гаптотактическую миграцию, а также пролиферацию меланомных клеток (J.M. Wang et al., Biochem Biophys Res Commun, 169, 165, 1990).
Подробно описана потенциальная патогенная роль IL-8 в легочных заболеваниях (поражения легких, синдром острой респираторной недостаточности, астма, хронические воспаления легких и кистозный фиброз) и особенно в патогенезе COPD (хроническое обструктивное легочное заболевание) через схему CXCR2 рецепторов (D. WP Hay and H.M. Sarau., Current Opinion в Pharmacology 2001, 1:242-247).
Были описаны фенилуреидо соединения, которые могут селективно препятствовать связыванию IL-8 с CXCR2 рецептором (J.R. White et al., J. Biol. Chem., 273, 10095, 1998); использование этих соединений при лечении патологических состояний, опосредствованных интерлейкином-8, заявлено в WO 98/07418.
Изучение вклада отдельных (S) и (R) энантиомеров кетопрофена в противовоспалительную активность рацемата и их роль в модуляции хемокинов продемонстрировали (P. Ghezzi et al., J. Exp. Pharm. Ther., 287, 969, 1998), что два энантиомера и их соли с хиральными и нехиральными органическими основаниями могут ингибировать дозозависимым образом хемотаксис и повышение внутриклеточной концентрации ионов Ca2+, индуцируемое IL-8 в отношении человеческих PMN лейкоцитов (патентная заявка США 6069172). Затем было продемонстрировано (C. Bizzarri et al., Biochem. Pharmacol. 61, 1429, 2001), что кетопрофен участвует в активности ингибирования биологической активности IL-8 с другими молекулами, принадлежащими к классу нестероидных противовоспалительных агентов (NSAID), таких как флурбипрофен, ибупрофен и индометацин. Типичное для NSAID ингибирование активности фермента циклооксигеназы (COX) ограничивает терапевтическое применение этих соединений в контексте лечения нейтрофилзависимых патологических состояний и воспалительных состояний, таких как псориаз, идиопатический легочный фиброз, острая респираторная недостаточность, повреждения, вызванные реперфузией, и гломерулонефрит. Ингибирование синтеза простагландинов, возникающих в результате деятельности ферментов циклооксигеназы, включает увеличение продуцирования цитокинов, которые, подобно TNF-α, играют роль в амплификации нежелательных провоспалительных эффектов нейтрофилов.
Более низкая COX ингибирующая эффективность (R) энантиомеров NSAID, принадлежащих подклассу фенилпропионовых кислот, по сравнению с эффективностью (S) энантиомеров предполагает, что (R) энантиомеры кетопрофена, флурбипрофена и ибупрофена могут быть потенциально полезными агентами при лечении нейтрофилзависимых патологий. Тот факт, что некоторые (R) энантиомеры превращаются in vivo в соответствующие (S) энантиомеры в организмах некоторых видов животных и людей, тем самым проявляя COX ингибирующую активность, является серьезным ограничением использования этих соединений при лечении IL-8-опосредствованных патологий. Вышеуказанные предпосылки объясняют трудности, которые встречаются при идентификации селективности IL-8 ингибиторов, принадлежащих классу 2-фенилпропионовых кислот.
Было высказано предположение, что хиральное превращение R-энантиомеров 2-фенилпропионовых кислот связано со стереоспецифическим образованием промежуточных сложных R-профенил-CoA тиоэфиров; было продемонстрировано, что получение производного по карбоксильной функции позволяет избежать "in vivo" метаболического превращения без изменения эффективности ингибирования IL-8. Исследования взаимосвязи структуры и активности, проведенные для класса производных 2-фенилпропионовых кислот, привели к обнаружению новых классов эффективных и селективных ингибиторов IL-8 биологических активностей, пригодных для "in vivo" введения. Амиды R-2-арилпропионовой кислоты и N-ацилсульфонамиды были раскрыты как эффективные ингибиторы IL-8 индуцируемого хемотаксиса нейтрофилов и дегрануляции (WO 01/58852; WO 00/24710).
Авторы обнаружили, что избранные подклассы 2-арилпропионовых кислот демонстрируют неожиданную способность эффективно ингибировать IL-8-индуцируемый хемотаксис нейтрофилов и дегрануляцию без заметного влияния на активность циклооксигеназ. Как R-, так и S-энантиомеры (R,S)-2-арилпропионовой кислоты, описанные далее, в действительности не активны в отношении ингибирования циклооксигеназ в интервале концентраций от 10-5 до 10-6 М.
В настоящем изобретении предложены (R,S)-2-арилпропионовые кислоты формулы (I) и их (R)- и (S)-энантиомеры:

и их фармацевтически приемлемые соли,
где
Ar представляет фенильное кольцо, замещенное
- группой в 3-(мета) положении, выбранной из линейной или разветвленной C1-C5-алкильной, C2-C5 -алкенильной или C2-C5-алкинильной группы, необязательно замещенной C1-C5-алкоксикарбонилом, замещенного или незамещенного фенила, линейного или разветвленного C1-C5-гидроксиалкила, арилгидроксиметила, или 3-(мета) линейная или разветвленная C1-C5-алкильная группа образует, вместе с заместителем в орто- или пара-положении бензольного кольца, насыщенные или ненасыщенные, замещенные или незамещенные бициклоарилы; или
- группой в 4-(пара) положении, выбранной из C1-C5-ацилокси, замещенного или незамещенного бензоилокси, C1-C5-ациламино, замещенного или незамещенного бензоиламино, C1-C5-сульфонилокси, замещенного или незамещенного бензолсульфонилокси, C1-C5-алкансульфониламино, замещенного или незамещенного бензолсульфониламино, C1-C5-алкансульфонилметила, замещенного или незамещенного бензолсульфонилметила, C3-C6-циклоалкила; 2-фурила; 3-тетрагидрофурила; 2-тиофенила; 2-тетрагидротиофенильной группы или C1-C8 (алканоил, циклоалканоил, арилалканоил)-C1-C5-алкиламино, например, ацетил-N-метиламино, пивалоил-N-этиламиногруппы; или
- группой в 2-(орто) положении, выбранной из замещенного или незамещенного арилметила, замещенного или незамещенного арилокси, замещенного или незамещенного ариламино, где заместители у арильной группы выбирают из C1-C4 -алкила, C1-C4-алкокси, хлора, фтора и/или трифторметильной группы;
для использования в качестве ингибиторов IL-8 индуцируемого хемотаксиса человеческих PMN.
Фенильное кольцо в Ar группе может быть необязательно замещено другими группами, такими как C1-C5-алкил или группа галогена.
Термин "замещенный" в приведенном выше определении означает замещенный группой, выбранной из C1-C5-алкила, галогена, гидрокси, C1-C5-алкокси, амино, C1-C5 -алкиламино, нитро, или цианогрупп.
Предпочтительными Ar в соединениях формулы (I) являются фенильные группы 3-замещенные: изопроп-1-ен-1-илом, этилом, изопропилом, пент-2-ен-3-илом, пент-3-илом, 1-фенилэтилен-1-илом, α-метилбензилом, α-гидроксибензилом, α-гидроксиэтилом, α-гидроксипропилом, бициклические арильные структуры, такие как 3-метилиндан-5-ил, 3-метилиндан-7-ил, 8-метилтетрагидронафт-2-ил, 5-метилтетрагидронафт-1-ил, и фенильные группы 4-замещенные трифторметансульфонилокси, 2-пропансульфонилокси, бензилсульфонилокси, бензолсульфонилокси, 2'-этилбензолсульфонилокси, 2'-хлорбензолсульфонилокси, метансульфониламино, трифторметансульфониламино, 2-пропансульфониламино, бензилсульфониламино, бензолсульфониламино, 2'-этилбензолсульфониламино, аминосульфонилметил, 2'-хлорбензолсульфониламино, трифторметансульфонилметил, бензолсульфонилметил, аминосульфонилокси, аминосульфониламино; и фенильные группы 2-замещенные 2-(2, 6-дихлорфениламино)фенилом, 2-(2,6-дихлорфениламино)-5-хлорфенилом, 2-(2,6-дихлор-3-метилфениламино)фенилом, 2-(3-трифторметилфениламино)фенилом, 2-(2,6-дихлорфенокси)фенилом, 2-(2-хлорфенокси)фенилом, 2-(2,6-дихлорбензил)фенилом, 2-(2-хлорбензил)фенилом.
Особенно предпочтительными соединениями настоящего изобретения являются:
(R,S) 2-[3'-(альфа-этилпропил)фенил]пропионовая кислота
(R) 2-[3'-(альфа-этилпропил)фенил]пропионовая кислота
(S) 2-[3'-(альфа-этилпропил)фенил]пропионовая кислота
2-[3'-(альфа-гидроксиэтил)фенил]пропионовая кислота, и ее диастереоизомеры
2-[3'-(альфа-гидроксипропил)фенил]пропионовая кислота и ее диастереоизомеры
(R,S) 2-[3'-изопропилфенил]пропионовая кислота
(R) 2-[3'-изопропилфенил]пропионовая кислота
(S) 2-[3'-изопропилфенил]пропионовая кислота
(R) 2-(4'-трифторметансульфонилокси)фенилпропионовая кислота
(S) 2-(4'-трифторметансульфонилокси)фенилпропионовая кислота
(R) 2-(4'-бензолсульфонилокси)фенилпропионовая кислота
(S) 2-(4'-бензолсульфонилокси)фенилпропионовая кислота
(R) 2-[4'-(2"-этил)бензолсульфонилокси]фенилпропионовая кислота
(S) 2-[4'-(2"-этил)бензолсульфонилокси]фенилпропионовая кислота
(R) 2-[4'-(2"-хлор)фенилсульфонилокси]фенилпропионовая кислота
(S) 2-[4'-(2"-хлор)фенилсульфонилокси]фенилпропионовая кислота
(R) 2-[4'-(2"-пропан)сульфонилокси]фенилпропионовая кислота
(S) 2-[4'-(2"-пропан)сульфонилокси]фенилпропионовая кислота
(R) 2-(4'-бензилсульфонилокси)фенилпропионовая кислота
(S) 2-(4'-бензилсульфонилокси)фенилпропионовая кислота
(R) 2-(4'-аминосульфонилокси)фенилпропионовая кислота
(S) 2-(4'-аминосульфонилокси)фенилпропионовая кислота
(R) 2-(4'-трифторметансульфониламино)фенилпропионовая кислота
(S) 2-(4'-трифторметансульфониламино)фенилпропионовая кислота
(R) 2-(4'-метансульфониламино)фенилпропионовая кислота
(S) 2-(4'-метансульфониламино)фенилпропионовая кислота
(R) 2-[4'-(2"-пропан)сульфониламино]фенилпропионовая кислота
(S) 2-[4'-(2"-пропан)сульфониламино]фенилпропионовая кислота
(R) 2-(4'-бензолсульфониламино)фенилпропионовая кислота
(S) 2-(4'-бензолсульфониламино)фенилпропионовая кислота
(R) 2-[4'-(2"-этил)бензолсульфониламино]фенилпропионовая кислота
(S) 2-[4'-(2"-этил)бензолсульфониламино]фенилпропионовая кислота
(R) 2-[4'-(2"-хлор)бензолсульфониламино]фенилпропионовая кислота
(S) 2-[4'-(2"-хлор)бензолсульфониламино]фенилпропионовая кислота
(R) 2-(4'-бензилсульфониламино)фенилпропионовая кислота
(S) 2-(4'-бензилсульфониламино)фенилпропионовая кислота
(R) 2-(4'-аминосульфониламино)фенилпропионовая кислота
(S) 2-(4'-аминосульфониламино)фенилпропионовая кислота
(R) 2-(4'-трифторметансульфонилметил)фенилпропионовая кислота
(S) 2-(4'-трифторметансульфонилметил)фенилпропионовая кислота
(R) 2-(4'-бензолсульфонилметил)фенилпропионовая кислота
(S) 2-(4'-бензолсульфонилметил)фенилпропионовая кислота
Следующей задачей настоящего изобретения является получение новых соединений формулы (Ia)

их (R)- и (S)-энантиомеров и их фармацевтически приемлемых солей,
- где Ar представляет фенильное кольцо, замещенное в 4- (пара) положении группой, выбранной из C1-C5-сульфонилокси, замещенного или незамещенного бензолсульфонилокси, C1-C5-алкансульфониламино, замещенного или незамещенного бензолсульфониламино, C1-C5-алкансульфонилметила, замещенного или незамещенного бензолсульфонилметила.
Фенильное кольцо в Ar группе формулы (Ia) может быть необязательно замещено другими группами, такими как C1-C5-алкил или группа галогена.
Термин "замещенный" в вышеуказанном определении означает замещенный группой, выбранной из C1-C5-алкила, галогена, гидрокси, C1-C5-алкокси, амино, C1-C5-алкиламино, нитро или цианогрупп.
Наиболее предпочтительными соединениями формулы Ia, как определено выше, являются:
(R) 2-(4'-трифторметансульфонилокси)фенилпропионовая кислота
(S) 2-(4'-трифторметансульфонилокси)фенилпропионовая кислота
(R) 2-(4'-бензолсульфонилокси)фенилпропионовая кислота
(S) 2-(4'-бензолсульфонилокси)фенилпропионовая кислота
(R) 2-[4'-(2"-этил)бензолсульфонилокси]фенилпропионовая кислота
(S) 2-[4'-(2"-этил)бензолсульфонилокси]фенилпропионовая кислота
(R) 2-[4'-(2"-хлор)фенилсульфонилокси]фенилпропионовая кислота
(S) 2-[4'-(2"-хлор)фенилсульфонилокси]фенилпропионовая кислота
(R) 2-[4'-(2"-пропан)сульфонилокси]фенилпропионовая кислота
(S) 2-[4'-(2"-пропан)сульфонилокси]фенилпропионовая кислота
(R) 2-(4'-бензилсульфонилокси)фенилпропионовая кислота
(S) 2-(4'-бензилсульфонилокси)фенилпропионовая кислота
(R) 2-(4'-аминосульфонилокси)фенилпропионовая кислота
(S) 2-(4'-аминосульфонилокси)фенилпропионовая кислота
(R) 2-(4'-трифторметансульфониламино)фенилпропионовая кислота
(S) 2-(4'-трифторметансульфониламино)фенилпропионовая кислота
(R) 2-(4'-метансульфониламино)фенилпропионовая кислота
(S) 2-(4'-метансульфониламино)фенилпропионовая кислота
(R) 2-[4'-(2"-пропан)сульфониламино]фенилпропионовая кислота
(S) 2-[4'-(2"-пропан)сульфониламино]фенилпропионовая кислота
(R) 2-(4'-бензолсульфониламино)фенилпропионовая кислота
(S) 2-(4'-бензолсульфониламино)фенилпропионовая кислота
(R) 2-[4'-(2"-этил)бензолсульфониламино]фенилпропионовая кислота
(S) 2-[4'-(2"-этил)бензолсульфониламино]фенилпропионовая кислота
(R) 2-[4'-(2"-хлор)бензолсульфониламино]фенилпропионовая кислота
(S) 2-[4'-(2"-хлор)бензолсульфониламино]фенилпропионовая кислота
(R) 2-(4'-бензилсульфониламино)фенилпропионовая кислота
(S) 2-(4'-бензилсульфониламино)фенилпропионовая кислота
(R) 2-(4'-аминосульфониламино)фенилпропионовая кислота
(S) 2-(4'-аминосульфониламино)фенилпропионовая кислота
(R) 2-(4'-трифторметансульфонилметил)фенилпропионовая кислота
(S) 2-(4'-трифторметансульфонилметил)фенилпропионовая кислота
(R) 2-(4'-бензолсульфонилметил)фенилпропионовая кислота
(S) 2-(4'-бензолсульфонилметил)фенилпропионовая кислота.
Соединения настоящего изобретения не влияют на продуцирование PGE2 в мышиных макрофагах, стимулированных липополисахаридами (LPS, 1 мкг/мл) во всем интервале концентраций: от 10-5 до 10-6M, и таким образом лишены какой-либо ингибирующей активности в отношении циклооксигеназ (COX). Благодаря отсутствию COX ингибиторной активности как R-, так и S-энантиомеров описанной 2-фенилпропионовой кислоты, соединения настоящего изобретения являются первыми 2-фенилпропионовыми кислотами с характеристиками, необходимыми для терапевтического использования при лечении патологий, связанных с усиленным хемотаксисом нейтрофилов, и активацией, индуцируемой IL-8. Ожидаемая метаболическая хиральная инверсия R-энантиомеров настоящего изобретения приводит к получению соответствующих S-энантиомеров, которые имеют с R-энантиомерами сопоставимые характеристики с точки зрения IL-8 эффективности и COX селективности.
Соединения настоящего изобретения формулы (I) обычно выделяют в форме их солей присоединения как органических, так и неорганических фармацевтически приемлемых оснований.
Примерами таких оснований являются: гидроксид натрия, гидроксид калия, гидроксид кальция, (D,L)-лизин, L-лизин, трометамин.
3-(Мета) и 2-(орто) замещенные 2-арилпропионовые кислоты формулы (I) и их энантиомеры раскрыты в WO 01/58852 и в WO 00/24710

Кислоты формулы I, как определено выше, получают путем алкилирования станнанами полизамещенной 2-фенилпропионовой кислоты, содержащей перфторбутансульфонатную группу в орто- или мета- или пара-положении, как будет раскрыто далее.
Энантиомеры 2-арилпропионовой кислоты формулы (I) можно получить обычным и стереоспецифическим синтезом: известно также превращение рацематов в один из энантиомеров после превращения в 2-арил-2-пропилкетены, как раскрыто Larse RD et al., J. Am. Chem. Soc., 111, 7650, 1989 и Myers AG, ibidem, 119, 6496, 1997. Стереоселективный синтез 2-арилпропионовой кислоты относится, главным образом, к S-энантиомерам, но их можно модифицировать таким образом, чтобы получить R-энантиомеры, выбирая подходящий хиральный вспомогательный агент. Арилалкилкетоны в качестве субстратов для синтеза α-арилалкановых кислот раскрыты, см. например BM Trost and JH Rigby, J. Org. Chem., 14, 2926, 1978; арилирование Meldrum кислот раскрыто, см. JT Piney и RA Rowe, Tet. Lett., 21, 965, 1980; винная кислота в качестве хирального вспомогательного агента раскрыта, см. Castaldi et al., J. Org. Chem., 52, 3019, 1987; α-гидроксисложные эфиры в качестве хиральных реагентов раскрыты, см. RD Larsen et al., J. Am. Chem. Soc., 1ll, 7650, 1989 и процитированный здесь патент США 4940813.
Способ получения 2-(2-OH-фенил)пропионовых кислот и их сложных эфиров раскрыт в итальянском патенте 1283649. Общепринятым и эффективным способом получения R-энантиомера (R, S)-2-(5-бензоил-2-ацетокси)пропионовой кислоты и кислот формулы (Ia) является превращение хлоридов указанных карбоновых кислот (хлорангидридов) в соответствующие проп-1-кетены при взаимодействии с третичным амином, например диметилэтиламином, с последующим взаимодействием кетена с R(-)пантолактоном с получением сложных эфиров R-энантиомеров указанных кислот с R-дигидро-3-гидрокси-4, 4-диметил-2(3H)фуран-2-оном. В результате последующего омыления сложного эфира LiOH получают соответствующие свободные кислоты.
Общий способ получения R-2-арилпропионовых кислот формулы (Ia) включает, например, осуществление взаимодействия сложных эфиров 4-гидроксифенилпропионовой кислоты или сложных эфиров 4-аминофенилпропионовой кислоты с соответствующими C1 -C5-сульфонилхлоридами или бензолсульфонилхлоридами в присутствии подходящего органического или неорганического основания; или осуществление взаимодействия сложных эфиров 4-хлорметилфенилпропионовых кислот с соответствующими C1-C5-тиолатами или бензолтиолатами в присутствии подходящего органического или неорганического основания, что подробно раскрыто в разделе "Общий способ синтеза (S)- и (R)-2-[(4'-арил/алкилсульфониламино)фенил]пропионовых кислот формулы Ia" и в последующих разделах. Типичный способ получения соединений формулы (Ia) включает осуществление взаимодействия гидроксиарилкетонов формулы (Ia) моно- или полизамещенных перфторбутансульфонилфторидом до получения перфторбутансульфоновых сложных эфиров формулы (IIb), где n представляет целое число от 1 до 9:

Соединения формулы (IIb) подвергают перегруппировке Вилгеродта для того, чтобы получить, после этерификации и метилирования по альфа углероду, арилпропионовые производные формулы (IIc), где n представляет целое число от 1 до 9 и R3 представляет C1-C4-алкил или C2-C4-алкенил.

Соединения формулы (IIc) подвергают взаимодействию с соответствующим трибутилстаннаном формулы Bu3SnR4, где R4 представляет линейный или разветвленный C2-C6-алкил; линейный или разветвленный C2-C6-алкенил, или линейный или разветвленный C2-C6-алкинил, незамещенный или замещенный арильной группой, до получения соответствующих (R,S)-2-арилпропионатов формулы (IId).

Алкенильные или алкинильные группы можно гидрировать в условиях каталитического гидрирования для получения соответствующих насыщенных алкильных групп. Соединения формулы (IId) обрабатывают, используя способ дерацемизации, как было раскрыто выше для превращения соответствующих хлорангидридов в кетены, то есть при взаимодействии с R(-)пантонолактоном и c последующим гидролизом, превращают в чистые R-энантиомеры; в результате реакции промежуточного кетена с хиральным вспомогательным S(+)-пантонолактоном получают соответствующий чистый S-энантиомер.
Соединения настоящего изобретения формулы (I) оценивают in vitro в отношении их способности ингибировать хемотаксис полиморфоядерных лейкоцитов (здесь и далее обозначаемых PMN) и моноцитов, индуцируемых фракциями IL-8 и GRO-α. Для этой цели, чтобы выделить PMN из гепаринизированной человеческой крови, взятой у здоровых взрослых добровольцев, мононуклеаты удаляют осаждением на декстране (в соответствии со способом, раскрытым WJ. Ming et al., J. Immunol, 138, 1469, 1987), а красные кровяные клетки гипотоничным раствором. Жизнеспособность клеток оценивают путем исключения трипанового синего, тогда как отношение циркулирующих полиморфонуклеатов оценивают, используя цитоцентрифугат после окрашивания Diff Quick.
Человеческие рекомбинантные IL-8 (Pepro Tech) используют в качестве стимулирующих агентов в экспериментах по хемотаксису, получая практически идентичные результаты: лиофилизованный белок растворяют в объеме HBSS, содержащем 0,2% альбумина бычьей сыворотки (BSA), чтобы получить таким образом исходный раствор с концентрацией 10-5 M, который далее разбавляют HBSS до концентрации 10-9 M, для анализа хемотаксиса.
Во время анализа хемотаксиса (по способу W. Falket et al., J. Immunol. Methods, 33, 239, 1980) используют фильтры, не содержащие PVP, с пористостью 5 мкм и микрокамеры, пригодные для репликации.
Соединения настоящего изобретения формулы (I) оценивают при концентрации в интервале значений от 10-6 до 10-10 M; для этой цели их добавляют в той же самой концентрации, как в нижние поры, так и в верхние поры микрокамер. Оценку способности соединений настоящего изобретения формулы (I) ингибировать IL-8-индуцируемый хемотаксис человеческих моноцитов осуществляют в соответствии со способом, раскрытым Van Damme J. et al. (Eur. J. Immunol., 19, 2367, 1989).
В качестве примера в следующей таблице приведены результаты по ингибированию (C=10-6 M) для некоторых представителей соединений в тестах по IL-8-индуцируемому PMN хемотаксису:
Вышеперечисленные соединения демонстрируют умеренную эффективность в тесте по GRO-α индуцируемому PMN хемотаксису, что предполагает селективное воздействие на CXCR1 опосредствованную схему.
Особенно предпочтительными соединениями настоящего изобретения являются соединения формулы Ia, которые демонстрируют дополнительное свойство эффективного ингибирования GROα-индуцируемого PMN хемотаксиса; такая активность допускает терапевтическое использование этих соединений в связанных с IL-8 патологиях, где CXCR2 схема участвует специфически или вместе с CXCR1 сигналами.
В приводимой далее таблице приводятся биологические активности соединений, демонстрирующих высокую эффективность ингибирования PMN хемотаксиса, индуцируемого как IL-8, так и селективным CXCR2 агонистом GRO-α.
Представлены некоторые примеры селективных GRO-α эффективных ингибиторов.
Двойственные ингибиторы IL-8 и GRO-α индуцируемых биологических активностей весьма предпочтительны с точки зрения представляющих интерес терапевтических применений, но описываемые соединения, селективно воздействующие на CXCR1 IL-8 рецептор, или CXCR2 GRO-α/IL-8 рецептор, могут найти полезное терапевтическое применение при лечении специфических патологий, как раскрыто далее.
Все соединения настоящего изобретения демонстрируют высокую степень селективности в отношении ингибирования IL-8-индуцируемого хемотаксиса по сравнению с хемотаксисом, индуцируемым C5a (10-9 M) или f-MLP(10-8 M).
Соединения формулы (I), оценивавшиеся ex vivo в крови in toto (в целом) в соответствии с процедурой, раскрытой Patrignani et al., в J. Pharmacol. Exper. Ther., 271, 1705, 1994, как было обнаружено, полностью не эффективны в качестве ингибиторов ферментов циклооксигеназы (COX). Почти во всех случаях соединения формулы (I) не препятствуют продуцированию PGE2, индуцируемым в мышиных макрофагах за счет стимуляции липополисахаридами (LPS, 1 мкг/мл) в концентрационном интервале от 10-5 до 10-7 M. Ингибирование продуцирования PGE2, которое может быть зарегистрировано, в большинстве случаев находится у предела статистической значимости и более часто составляет величину менее 15-20% от базового значения. Пониженная эффективность ингибирования CO является преимуществом для терапевтического применения соединений настоящего изобретения, поскольку ингибирование синтеза простагландинов является стимулом для клеток макрофагов к усилению синтеза TNF-α (индуцируется LPS или перекисью водорода), которые являются важными медиаторами активации нейтрофилов и стимулами продуцирования цитокина интерлейкина-8.
С точки зрения экспериментальных доказательств, обсуждавшихся выше, и роли, которую играет интерлейкин-8 (IL-8), и подобные ему в способах, которые включают активацию и инфильтрацию нейтрофилов, соединения настоящего изобретения особенно полезны для лечения заболеваний, таких как псориаз (R. J. Nicholoff et al., Am. J. Pathol., 138, 129, 1991). Другими заболеваниями, которые можно лечить соединениями настоящего изобретения, являются кишечные хронические воспалительные патологии, такие как язвенные колиты (Y. R. Mahida et al., Clin. Sci., 82, 273, 1992) и меланома, хроническое обструктивное легочное заболевание (COPD), буллезная пузырчатка, ревматоидный артрит (M. Selz et al., J. Clin. Invest., 87, 463, 1981), идиопатический фиброз (E. J. Miller, previously cited, и P. C. Carre et al., J. Clin. Invest., 88, 1882, 1991), гломерулонефрит (T. Wada et al., J. Exp. Med., 180, 1135, 1994) и профилактика и лечение повреждений, вызванных ишемией и реперфузией.
Ингибирование активации CXCR1 и CXCR2 пригодно, как подробно изложено выше, особенно при лечении хронических воспалительных патологий (например, псориаза), при которых предполагается, что активация обоих IL-8 рецепторов играет решающую патофизиологическую роль в развитии заболевания.
Действительно, известно, что активация CXCR1 является существенной в IL-8-опосредствованном PMN хемотаксисе (Hammond M et al., J. Immunol, 155,1428, 1995). С другой стороны, предполагают, что активация CXCR2 является существенной для IL-8-опосредствованной пролиферации эпидермальных клеток и ангиогенеза у больных псориазом (Kulke R et al., J Invest Dermatol, 110, 90, 1998).
Кроме того, CXCR2 селективные антагонисты находят особенно полезные терапевтические применения при лечении важных легочных заболеваний, таких как хроническое обструктивное легочное заболевание COPD (D. WP Hay и H.M. Sarau., Current Opinion в Pharmacology 2001, 1:242-247).
Следующей задачей настоящего изобретения является получение соединений, пригодных для лечения псориаза, язвенного колита, меланомы, хронического обструктивного легочного заболевания (COPD), буллезной пузырчатки, ревматоидного артрита, идиопатического фиброза, гломерулонефрита и для профилактики и лечения повреждений, вызванных ишемией и реперфузией, а также использование таких соединений для получения лекарственных средств для лечения указанных выше заболеваний. Фармацевтические композиции, включающие соединение настоящего изобретения и подходящий носитель, также включены в объем настоящего изобретения. Соединения настоящего изобретения, вместе с обычно используемым адьювантом, носителем, разбавителем или эксципиентом, могут быть приготовлены в форме фармацевтических композиций и их стандартных дозированных форм, и как таковые, могут быть использованы в твердом виде, таком как таблетки, или заполненные капсулы, или в виде жидкостей, таких как растворы, суспензии, эмульсии, эликсиры, или заполненные ими капсулы, все это для перорального введения, или в виде стерильных растворов для инъекций для парентерального (включая подкожное) введения. Такие фармацевтические композиции и их стандартные дозированные формы могут включать ингредиенты в обычных пропорциях, вместе с дополнительными активными соединениями или основами, или без них, и такие стандартные дозированные формы могут содержать любые подходящие эффективные количества активного ингредиента, соответствующие назначенному интервалу дневных доз.
Если кислоты настоящего изобретения используют в качестве лекарственных средств, их обычно вводят в форме фармацевтических композиций. Такие композиции можно получить способом, хорошо известным фармацевтам, и они включают, по крайней мере, одно активное соединение.
Обычно соединения настоящего изобретения вводят в фармацевтически эффективном количестве. Количество действительно вводимого соединения обычно определяет врач, учитывая соответствующие обстоятельства, включая подлежащее лечению состояние, выбранный способ введения, конкретное вводимое соединение, возраст, вес и реакцию индивидуального пациента, тяжесть симптомов заболевания и т.п.
Фармацевтические композиции настоящего изобретения можно вводить различными способами, включая пероральный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и интраназальный. В зависимости от предполагаемого способа введения соединения предпочтительно приготавливают либо в виде композиций для инъекций, либо для перорального введения.
Композиции для перорального введения могут быть в форме жидких растворов или суспензий, или в форме порошков. Однако чаще указанные композиции представлены в стандартных дозированных формах для облегчения точной дозировки. Термин "стандартные дозированные формы" относится к физически дискретным единицам, пригодным для использования в качестве стандартных доз для людей и других млекопитающих, причем каждая доза содержит определенное количество активного ингредиента, рассчитанного таким образом, чтобы оказать нужное терапевтическое действие, вместе с подходящим фармацевтическим эксципиентом. Типичные стандартные дозированные формы включают предварительно заполненные, отмеренные ампулы или шприцы с жидкими композициями или пилюли, таблетки, капсулы или т.п. в случае твердых композиций. В таких композициях кислотные соединения обычно являются меньшей составляющей (от около 0,1 до около 50 вес.%, или предпочтительно от около 1 до около 40% вес %), причем остальное составляют различные наполнители или носители и вспомогательные агенты, облегчающие создание нужных дозированных форм.
Жидкие формы для перорального введения могут включать подходящие водные или не водные носители с буферами, суспендирующие и диспергирующие агенты, красители, вкусовые добавки и т.п. Жидкие формы, включая композиции для инъекций, описанные далее, всегда хранят в темноте, чтобы избежать какого-либо каталитического действия света, такого как образование гидроперекиси или перекиси.
Твердые формы могут включать, например, любые из следующих ингредиентов или соединений аналогичной природы: связующие, такие как микрокристаллическая целлюлоза, смола трагаканта или желатин; эксципиенты, такие как крахмал или лактоза, разрыхляющие агенты, такие как альгиновая кислота, Primogel, или кукурузный крахмал; смазывающие агенты, такие как стеарат магния; замасливающие агенты, такие как коллоидная двуокись кремния; подслащивающие агенты, такие как сахароза или сахарин; или вкусовые агенты, такие как мята, метилсалицилат или агент, придающий вкус апельсина.
Композиции для инъекций обычно основаны на стерильном солевом растворе для инъекций или буферном фосфатном солевом растворе, или других носителях для инъекций, известных специалистам. Как было указано выше, производное кислоты формулы I в такой композиции обычно находится в интервале от 0,05 до 10% от массы носителя для инъекций и т.п. Величина средней дневной дозы будет зависеть от различных факторов, таких как тяжесть заболевания и состояние пациента (возраст, пол и вес). Величина дозы обычно варьируется от 1 мг или нескольких мг вплоть до 1500 мг соединения формулы (I) в день, необязательно разделенной на несколько приемов. Можно также вводить и более высокие дозы, благодаря низкой токсичности соединений настоящего изобретения в течение длительных промежутков времени.
Описанные выше компоненты для композиций для перорального введения или для инъекций являются просто иллюстративными. Другие материалы, также как и способы обработки и т.п. представлены в части 8 "Remington's Pharmaceutical Sciences Handbook", 18th Edition, 1990, Mack Publishing Company, Easton, Pennsylvania, что включено сюда для ссылки.
Соединения настоящего изобретения можно также вводить в формах с замедленным выделением или из систем доставки лекарств с замедленным выделением. Описание представительных материалов с замедленным выделением можно также найти в материалах указанной выше Remington's Handbook.
Настоящее изобретение будет проиллюстрировано следующими примерами, которые не следует рассматривать как ограничивающие объем настоящего изобретения.
При описании соединений настоящего изобретения формулы (I) было принято обозначать абсолютные конфигурации любых хиральных заместителей, которые могут присутствовать в заместителе R' указанных соединений, индексами (например, R', S', S" и т.д.).
Сокращения: ТГФ: тетрагидрофуран; ДМФ: диметилформамид; AcOEt: этилацетат, HOBZ: 1-гидроксибензотриазол, DCC: дициклогексилкарбодиимид.
Материалы и способы
Общий способ синтеза 2-арилпропионовых кислот формулы I и их R-энантиомеров
При перемешивании, при комнатной температуре, и исключая влажность, 12,0 г безводного K2CO3(86,2 ммоль) добавляют к 80,0 ммоль раствора (o,m,p)-гидроксиацетофенона (моно- или полизамещенного по фенилу) в ацетоне (80 мл). Смесь перемешивают в течение 30 минут при комнатной температуре. Затем по каплям добавляют раствор перфторбутансульфонилфторида (15,5 мл, 861 ммоль) в ацетоне (30 мл) и смесь кипятят с обратным холодильником в течение 2 часов. После охлаждения при комнатной температуре твердую часть фильтруют и фильтрат выпаривают досуха. Остаток помещают в EtOAc (100 мл). Органический раствор промывают насыщенным раствором KHCO3 (20 мл) и затем насыщенным раствором NaCl (20 мл). После сушки над Na2SO4 и выпаривания растворителя получают соответствующий сложный эфир перфторбутансульфонила в виде масла, достаточно чистого для того, чтобы его использовать в последующей реакции с практически количественным выходом.
Смесь полученного таким образом сложного эфира ацетофенон перфторбутансульфонила (80,0 ммоль), серы (2,95 г, 92,0 ммоль) и морфолина (8,0 мл; 92,0 ммоль) кипятят с обратным холодильником в течение 6 часов. После охлаждения при комнатной температуре раствор выливают на смесь льда и 6н HCl (40 мл). Смесь экстрагируют CH2Cl2 (2×50 мл); органические экстракты сушат над Na2SO4 и растворитель выпаривают, получая сырое масло желтого цвета, что после хроматографической очистки на силикагеле (элюент: н-гексан/EtOAc 9:1) приводит к получению соответствующего морфолинамида в виде прозрачного масла (выход 73%).
Раствор морфолинамида (58,0 ммоль) в ледяной уксусной кислоте (25,0 мл) добавляют к 37% HCl (40 мл), и затем смесь кипятят с обратным холодильником в течение 16 час при охлаждении. После охлаждения при комнатной температуре смесь фильтруют от выпавшего осадка. После выпаривания фильтрата остаток разбавляют H2O (50 мл) и экстрагируют EtOAc (2×50 мл). Объединенные органические экстракты промывают насыщенным раствором NaCl (20 мл), сушат над Na2SO4 и выпаривают при пониженном давлении, получая масло, из которого в результате кристаллизации из н-гексана получают (o,m,p) перфторбутансульфонат 2-фенилуксусной кислоты в виде твердых кристаллов (выход 90-93%). В результате последующей этерификации концентрированной H2SO4 в горячем абсолютном этаноле получают соответствующий этиловый сложный эфир с практически количественным выходом. Небольшими последовательными порциями 60% суспензию гидрида натрия в минеральном масле (всего 1,6 г; 66,7 ммоль) постепенно добавляют к раствору этил (o,m,p)-перфторбутансульфонилокси-2-фенилацетата (примерно 25 ммоль) в ТГФ (50 мл), охлажденному до T=0,5°C. Через 15 минут по каплям добавляют метилиодид (1,88 мл; 30,2 ммоль) и оставляют реагировать при комнатной температуре в течение 3,5 часа. Реакцию останавливают, добавляя насыщенный раствор NH4Cl (45 мл); растворитель выпаривают при пониженном давлении и водную фазу экстрагируют CH2C12 (3×50 мл); объединенные органические экстракты промывают насыщенным раствором NaCl (200 мл), сушат над N2SO4 и выпаривают при пониженном давлении, получая остаток, который после хроматографической очистки приводит к получению этилового сложного эфира соответствующей (o,m,p) перфторбутансульфонилокси-2-фенилпропионовой кислоты в виде твердого вещества (выход 70%).
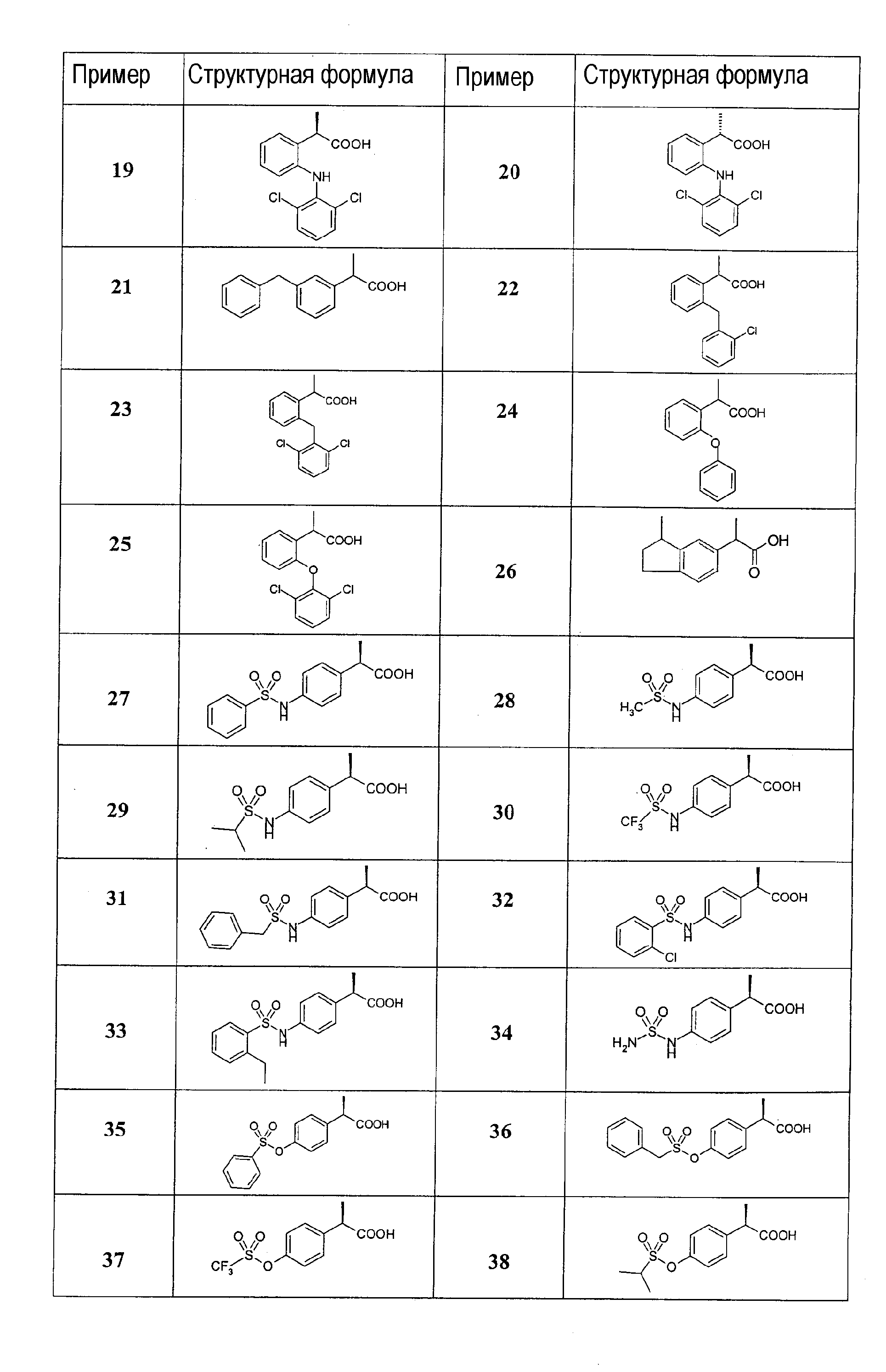
Исходя из рацематов этилового сложного эфира этил (o,m, p)-(нонафторбутансульфонилокси)-2-фенилпропионата получают 2-арилпропионовые кислоты формулы I, в результате осуществления взаимодействия указанных сульфонатов с оловоорганическими соединениями в соответствии со способами, раскрытыми Mitchell T.N., Synthesis, 803, 1992 и Ritter K., Synthesis, 735, 1993. В соответствии с проиллюстрированным выше способом получают следующие соединения:
Пример 1
2-[3'-(изопропенил)фенил]пропионовая кислота
Указанную кислоту получают исходя из этил 3'-перфторбутансульфонилокси-2-фенилпропионата (7,63 ммоль), который растворяют в N-этилпирролидоне (30 мл); к смеси добавляют безводный LiCl (0,94 г, 22,9 ммоль), трифениларсин (90 мг; 0,3 ммоль) и дипалладийтрибензилиденацетон (0,173 г; 0,15 ммоль Pd). Через 5 минут при комнатной температуре добавляют трибутилизопропенилолово (2,83 г; 8,55 ммоль) и раствор перемешивают в течение 5 часов при T=90°C. После охлаждения раствора до комнатной температуры смесь разбавляют гексаном и добавляют насыщенный раствор KF; после фильтрования и разделения фаз органическую фазу сушат над Na2SO4 и выпаривают в вакууме. В результате очистки остатка с помощью флеш-хроматографии получают 2-[3'-изопропенилфенил]этилпропионат (Ritter K., Synthesis, 735, 1993 и Mitchell T. N., Synthesis, 803, 1992).
1н NaOH (5 мл) добавляют к раствору сложного эфира в диоксане (5 мл), и полученный раствор перемешивают при комнатной температуре в течение ночи. После выпаривания органического растворителя смесь подкисляют до pH=2, используя 2н HCl, до полного осаждения продукта, который выделяют фильтрованием в виде твердого вещества белого цвета.
1H ЯМР (CDCl3): δ 10,0 (ушир.с, 1H, COOH); 7,28 (м, 1H); 7,15(м, 1H); 7,05 (м, 2H); 5,02 (с, 2H); 3,75 (м, 1H); 2,34 (м, 1H); 1,8-1,6 (м, 4H); 1,45 (д, 3H, J=7 Гц); 0,78 (с, 3H).
Пример 2
2-[3'-(альфа-этилпропенил)фенил]пропионовая кислота
В соответствии с приведенным выше способом получают указанную кислоту, используя в качестве исходного реагента трибутил-(α -этил)пропенилолово, полученное известными способами (Ritter K., Synthesis, 735, 1993 и Mitchell T. N., Synthesis, 803, 1992).
1H ЯМР (CDCl3): δ) 10,0 (ушир.с, 1H, COOH); 7,28 (м, 1H); 7,15 (м, 1H); 7,05 (м, 2H); 5,5 (м, 1H); 3,75 (м, 1H); 1,8-1,6 (кв, 2H); 1,45 (д, 3H, J=7 Гц); 0,85 (д, 3H, J=7 Гц); 0,78 (т, 3H, J=7 Гц)
Пример 3
3-[3'-(l"-стиренил)фенил]пропионовая кислота
В соответствии с приведенным выше способом указанную кислоту получают, используя в качестве исходного реагента трибутил-α-стиренилолово, полученное известным способом (Ritter K., Synthesis, 735, 1993 и Mitchell T. N., Synthesis, 803, 1992).
1H ЯМР (CDCl3): δ) 11,0 (ушир.с, 1H, COOH); 7,38-7,13 (м, 9H); 3,95 (м, 2H); 3,81 (м, 1H); 1,72 (д, 3H, J=7 Гц)
Пример 4
2-[3'-изобутенилфенил]пропионовая кислота
В соответствии с приведенным выше способом указанную кислоту получают, используя в качестве исходного реагента трибутилизобутенилолово, полученное известным способом (Ritter K., Synthesis, 735, 1993 и Mitchell T. N., Synthesis, 803, 1992).
1H ЯМР (CDCl3): δ 10,0 (ушир.с, 1H, COOH); 7,28 (м, 1H); 7,15 (м, 1H); 7,05 (м, 2H); 5,5 (м, 1H); 3,75 (м, 1H);1,45 (д, 3H, J=7 Гц); 1,45 (с, 3H); 1,35 (с, 3H).
В качестве примера обсуждается получение 2-[(3'-изопропил)фенил]пропионовой кислоты
Пример 5
Смесь 2-[3'-(изопропенил)фенил]этилпропионата, полученного по способу, изложенному выше (1 г; 4,6 ммоль), 95% этилового спирта (10 мл) и Pd/C 10% (100 мг) подвергают каталитическому гидрированию при комнатной температуре и атмосферном давлении до исчезновения исходного реагента (2 часа). Катализатор отфильтровывают на целите, и после выпаривания фильтрата получают прозрачное масло (0,99 г; 4,5 ммоль), которое гидролизуют в растворе KOH в этиловом спирте (10 мл) при T=80°C в течение 2 часов. После охлаждения при комнатной температуре растворители выпаривают при пониженном давлении; остаток отбирают, используя EtOAc (20 мл) и экстрагируют Н2О (3×10 мл); водную фазу подкисляют до pH=2, используя 2н HCl и экстрагируют в противотоке EtOAc (2×10 мл); органические экстракты объединяют и промывают насыщенным раствором NaCl, сушат над Na2SO4 и выпаривают при пониженном давлении, получая 2-[(3'-изопропил)фенил]пропионовую кислоту (0,75 г; 3,6 ммоль).
1H ЯМР (CDCl3): δ 10,5 (ушир.с, 1H, COOH); 7,15-7,08 (м, 4H); 3,55 (м, 1H); 2,91 (м, 1H); 1,45 (д, 3H, J=7 Гц); 1,26 (д, 3H, J=7 Гц).
Тем же способом получают следующие соединения:
Пример 6
(R,S) 2-[3'-(альфа-этилпропил)фенил]пропионовая кислота
1H ЯМР (CDCl3): δ 10,0 (ушир.с, 1H, COOH); 7,28 (м, 1H); 7,15 (м, 1H); 7,05 (м, 2H); 3,75 (м, 1H); 2,34 (м, 1H); 1,8-1,6 (м, 4H); 1,45 (д, 3H, J=7 Гц); 0,78 (т, 6H, J=7 Гц).
Пример 7
(R,S) 3-[3'-(альфа-метил)бензилфенил1пропионовая кислота
1H ЯМР (CDCl3): δ 11,0 (ушир.с, 1H, COOH); 7,38-7,13 (м, 9H); 4,20 (м, 1H); 3,78 (м, 1H); 1,72 (д, 3H, J=7 Гц); 1,55 (д, 3H, J=7 Гц).
Пример 8
(R,S) 2-[3'-изобутилфенил]пропионовая кислота
1H ЯМР (CDCl3): δ 10,0 (ушир.с, 1H, COOH); 7,28 (м, 1H); 7,15 (м, 1H); 7,05 (м, 2H); 3,78 (м, 1H); 2,50 (д, 2H, J=7 Гц); 1,9 (м, 1H); 1,45 (д, 3H, J=7 Гц); 0,98 (д, 6H, J=7 Гц).
Пример 9
(R,S) 2-[(3'-циклогексилметил)фенил]пропионовая кислота
В соответствии с приведенным выше способом указанную кислоту получают, используя в качестве исходных реагентов бромид циклогексилметилцинка, коммерческий реагент и этил-3-перфторбутансульфонилокси-2-фенилпропионат.
1H ЯМР (CDCl3): δ 10,15 (ушир.с, 1H, COO H); 7,1 (с, 1H); 7,25-7,35 (м, 3H,); 3,75 (кв, 1H, J1=15 Гц, J2=7 Гц); 2,48 (д, 2H, J=7 Гц); 1,77-1,70 (м, 4H); 1,60-1,45 (д, 3H, J=7 Гц+м, 1H); 1,30-1,10 (м, 4H); 1,08-0,90 (м, 2H).
Каждый из рацематов кислот формулы

Указанным способом получают следующие соединения:
Пример 10
(R)-2-[(3'-изопропил)фенил]пропионовая кислота
[α]D=-23(c=0,5; CH2C12)
1H ЯМР (CDCl3): δ 10,0 (ушир.с, 1H, COOH); 7,15-7,10 (м, 4H); 3,65 (м, 1H); 2,90 (м, 1H); 1,45 (д, 3H, J=7 Гц); 1,32 (д, 3H, J=7 Гц).
Пример 11
(R)-2-[3'-(l"-этилпропил)фенил]пропионовая кислота
[α]D=-29 (c=0,5; CH2C12)
1H ЯМР (CDCl3): δ 10,25 (ушир.с, 1H, COOH); 7,28 (м, 1H); 7,15 (м, 1H); 7,05 (м, 2H); 3,75 (м, 1H); 2,34 (м, 1H); 1,8-1,6 (м, 4H); 1,45 (д, 3H, J=7 Гц); 0,78 (т, 6H, J=7 Гц).
Пример 12
(R) 2-[3'-изобутилфенил]пропионовая кислота
[α]D=-35 (c=0,5; CH2C12)
1H ЯМР (CDCl3): δ 10,0 (ушир.с, 1H, COOH); 7,28 (м, 1H); 7,15 (м, 1H); 7,05 (м, 2H); 3,78 (м, 1H); 2,50 (д, 2H, J= 7 Гц); 1,9 (м, 1H); 1,45 (д, 3H, J=7 Гц); 0,98 (д, 6Н, J=7 Гц).
Пример 13
(R),(R',S')-3-[(3'-α-метил)бензилфенил]пропионовая кислота
[α]D=-49 (c=0,5; CH2C12)
1H ЯМР (CDCl3): δ 11,0 (ушир.с, 1H, COOH); 7,38-7,13 (м, 9H); 4,20 (м, 1H); 3,78 (м, 1H); 1,72 (д, 3H, J=7 Гц); 1,55 (д, 3H, J=7 Гц).
Описанным выше способом, но используя S-пантолактон, осуществляют стереоспецифическое получение S-энантиомеров:
Пример 14
(S)-2-[(3'-изопропил)фенил]пропионовая кислота
[α]D=+24,2 (c=0,5; CH2C12)
1H ЯМР (CDCl3): δ 10,1 (ушир.с, 1H, COOH); 7,12-7,07 (м, 4H); 3,64 (м, 1H); 2,91 (м, 1H); 1,45 (д, 3H, J=7Гц); 1,30 (д, 3H, J=7 Гц).
Пример 15
(R),(R',S')-2-[(3'-α-гидроксибензил)фенил]пропионовая кислота
К раствору R(-)кетопрофена (0,254 г, 1 ммоль) в этиловом спирте (5 мл) добавляют триэтиламин (0,12 г; 1 ммоль) и катализатор (Pd/C 5% 0,025 г); смесь гидрируют при комнатной температуре и атмосферном давлении в течение 3 часов. После удаления катализатора фильтрованием на слое целита фильтрат выпаривают и остаток очищают на хроматографической колонке. Продукт получают в виде твердого вещества белого цвета (выход 85%).
[α]D=-45,7 (c=l; CHCl3)
1H ЯМР (CDCl3): δ 7,41-7,3 (м, 3H); 7, 31-7,14 (м, 6H); 5,75 (с, 1H); 4,02 (ушир.с, 1H, OH); 3,68 (кв, 1H, J=7Гц); 1,4(д, 3H, J=7 Гц).
По способу примера 15 и исходя из (R,S)-2-[(3'-ацетил)фенил]пропионовой кислоты получают следующие соединения:
Пример 16
(R,S),(R,S) 2-[3'-(альфа-гидроксиэтил)фенил]пропионовая кислота
1H ЯМР (CDCl3): δ 7,40-7,15 (м, 4H); 4,90 (кв, 1H, J=7 Гц); 3,78 (кв, 1H, J=7 Гц); 1,55(м, 6H).
Пример 17
(R),(R',S')-2-[3'-α-гидрокси-α-метилбензил)фенил]пропионовая кислота
К раствору метилового сложного эфира R(-)кетопрофена (0,269, 1 г) в этиловом эфире (10 мл) добавляют 3,0 M раствор метилмагнийбромида в этиловом эфире (2 ммоль); полученный раствор кипятят с обратным холодильником в течение 2 часов. После охлаждения смеси органическую фазу промывают 5%-ным раствором NaH2PO4 (2×10 мл), сушат над Na2SO4 и выпаривают в вакууме. Полученный остаток снова растворяют в смеси 1:1 MeOH/1н NaOH (5 мл) и раствор перемешивают в течение ночи. Органический растворитель удаляют в вакууме и водный раствор подкисляют до pH=2; образовавшийся осадок фильтруют, промывают водой. (R),(R',S')-2-[3'-α-гидрокси-α-метилбензил)фенил]пропионовую кислоту получают в виде порошка белого цвета.
[α]D=-45,3 (c=l; CHCl3)
1H ЯМР (CDCl3): δ 7,41-7,3 (м, 3H); 7,31-7,14 (м, 6H); 4,02 (ушир.с, 1H, OH); 3,68 (кв, 1H, J=7 Гц); 1, 4 (д, 3H, J=7 Гц).
Получение (R,S) 2-[2'-(2",6"-дихлорфенил)аминофенилпропионовой кислоты (Пример 18) (R) 2-[2'-(2",6"-дихлорфенил)аминофенилпропионовой кислоты (Пример 19) и (S) 2-[2'-(2",6"-дихлорфенил]аминофенилпропионовой кислоты (Пример 20).
Соединение получают в виде рацемической смеси в соответствии со способом Geigy, JR; патент Великобритании 1132318 (30.10.1968). Оптическое разрешение для получения соединений примеров 19 и 20 осуществляют путем омыления, используя R(+)-N-метилбензиламин по способу, раскрытому в Arzneim. Forsch. 19' 96, 46:9 891-894 by Akguen et al.
Пример 21
Получение (R,S)-(2-(3'-бензил)фенилпропионовой кислоты
1. Метил 2-бромфенилацетат
К раствору 2-бромфенилуксусной кислоты (2 г; 9,30 ммоль) в метиловом спирте (10 мл) добавляют каталитическое количество концентрированной H2SO4 (3 капли); растворитель перемешивают при комнатной температуре в течение 18 часов и затем выпаривают. Оставшееся масло удаляют с этиловым эфиром (10 мл); затем органическую фазу промывают H2O (3×10 мл), сушат над Na2SO4 и выпаривают, получая 2,12 г метилового сложного эфира в виде прозрачного масла. Выход: количественный.
1H ЯМР (CDCl3): δ 7,60 (д, 1H, J=7 Гц); 7,28-7,20 (м, 2H); 7,1-7,0 (м, 1H); 3,8 (с, 2H), 3,72(с, 3Н).
2. Метил 2-(2'-)бромфенилпропионат
К раствору диизопропиламина (1,66 мл; 11,8 ммоль) в безводном ТГФ (30 мл) в потоке Ar и при охлаждении до T=10°C, добавляют по каплям раствор н-бутиллития в н-гексане (1,6 M; 7,4 мл; 11,8 ммоль); причем добавление осуществляют таким образом, чтобы температура не превышала 0°C. После завершения добавления смесь перемешивают при T=-4°C в течение 30 минут, затем добавляют метил 2-бромфенилацетат (1,9 г; 8,30 ммоль) в безводном ТГФ (8 мл). После завершения добавления смесь перемешивают при комнатной температуре в течение 1 часа. Затем смесь снова охлаждают до T=-2°C и добавляют метилиодид (0,81 мл; 12,75 ммоль). Смесь перемешивают при комнатной температуре в течение 2 часов до тех пор, пока не исчезает исходный продукт; ТГФ выпаривают досуха, остаток отбирают в CHCl3 (10 мл) и мл промывают 1н HCl (3×10) и затем насыщенным раствором NaCl (2×10 мл). Его подкисляют Na2SO4 и выпаривают при пониженном давлении, получая темно-красный маслянистый остаток (1,95 г; 8, 02 ммоль) достаточной степени чистоты, чтобы его можно было использовать на следующих стадиях. Выход 96%.
1H ЯМР (CDCl3): δ 7,60 (д, 1H, J=7 Гц); 7,30-7,26 (м, 2H); 7,2-7,15 (м, 1H); 4,25 (кв, 1H, J=7 Гц); 3,75 (с, 3H); 1,75 (д, 3H, J=7 Гц).
3. Метил 2-(2'-)бензилфенилпропионат
Порошок цинка (2,412 г; 36,9 ммоль) загружают в колбу в атмосфере аргона. Колбу охлаждают до T=0-4°C на бане со смесью лед/вода и медленно добавляют по каплям раствор бензилбромида (2,109 г; 12,3 ммоль) в безводном ТГФ (10 мл). Смесь перемешивают при указанной температуре в течение 3 часов до тех пор, пока не исчезает исходный продукт. Параллельно в другую колбу в атмосфере Ar загружают тетракис(трифенилфосфин)палладий (410 г; 0, 35 ммоль) и метил 2-(2'-бромфенил)пропионат (1,9 г; 7,8 ммоль); добавляют полученный ранее оловоорганический раствор, и когда добавление по каплям заканчивается, раствор кипятят с обратным холодильником в течение 18 часов. После охлаждения до комнатной температуры смесь разбавляют 0,1н HCl (10 мл), и добавляют этиловый эфир (15 мл); смесь встряхивают, и она разделяется на две фазы, водную фазу снова экстрагируют этиловым эфиром (3×15 мл); органические экстракты объединяют, промывают насыщенным раствором NaHCO3, сушат над Na2SO4 и выпаривают при пониженном давлении, получая воскообразный остаток, который после тщательного растирания с изопропиловым эфиром в течение ночи, и фильтрования в вакууме приводит к получению метил 2-(2'-бензилфенил)пропионата в виде твердого вещества белого цвета (1,52 г; 6 ммоль). Выход 77%.
1H ЯМР (CDCl3): δ 7,50-7,25 (м, 5H); 7,24-7,15 (м, 2H); 7, 10-7,05 (м, 2H); 4,25 (кв, 1H, J=7Гц); 4,15 (с, 2H); 3,75 (с, 3H); 1,55 (д, 3H, J=7 Гц).
4. (R,S) 2-(2'-бензилфенил)пропионовая кислота
Метил 2-(2'-бензилфенил)пропионат (1,5 г; 5,9 ммоль) растворяют в метиловом спирте (5 мл). К раствору добавляют 1M NaOH (7,1 мл) и полученный раствор кипятят с обратным холодильником в течение 3 часов; затем его перемешивают при комнатной температуре в течение примерно 18 часов. Спирт затем выпаривают при пониженном давлении, остаток отбирают с водой; величину рН водной фазы доводят до pH=l, используя 1н HCl, и экстрагируют этиловым эфиром (3×5 мл). Объединенные органические экстракты промывают насыщенным раствором NaHCO3, сушат над Na2SO4 и выпаривают при пониженном давлении, получая (R,S) 2-(2'-бензилфенил)пропионовую кислоту (1,06 г; 4,42 ммоль) в виде прозрачного масла желтого цвета. Выход 75%.
1H ЯМР (CDCl3): δ 9,25 (ушир.с, 1H, COOH); 7,55-7,35 (м, 5H); 7,24-7,15 (м, 2H); 7,10-7,05 (м, 2H); 4,25 (кв., 1H, J=7 Гц); 4,15 (с, 2H); 1,50 (д, 3H, J=7 Гц).
Тем же способом получают следующие соединения:
Пример 22
(R,S) 2-[2'-[2"-хлор)бензил]фенилпропионовая кислота
1H ЯМР (CDCl3): δ 10,0 (ушир.с, 1H, COOH); 7,40-7,35 (м, 1H); 7,34-7,25 (м, 3H); 7,20-7,15 (м, 2H); 7,10-7,00 (м, 1H); 6,95-6,80 (м, 1H); 4,20 (кв., 1H, J=7 Гц); 4,12 (с, 2H); 1, 53(д, 3H, J=7 Гц).
Пример 23
(R,S) 2-[2'-(2",6"-дихлор)бензилфенилпропионовая кислота
1H ЯМР (CDCl3): δ 9,55 (ушир.с, 1H, COOH); 7,40-7,30 (д, 2H, J=8 Гц); 7,27-7,15 (м, 4H); 6,70-6,60 (д, 1H, J=8 Гц); 4,27 (с, 2H); 4,15 (кв., 1H, J=7 Гц); 1,55 (д, 3H, J=7 Гц).
Пример 24
Получение (R,S) 2-(2'-фенокси)фенилпропионовой кислоты
1. Метил 2-(2'-гидрокси)фенилпропионат
К раствору 2-(2'-гидрокси)фенилпропионовой кислоты (2 г; 12 ммоль) (полученной известными в литературе способами) в метиловом спирте (10 мл) добавляют каталитическое количество концентрированной H2SO4 (3 капли); смесь перемешивают при комнатной температуре в течение 18 часов. Растворитель затем выпаривают, и полученное в остатке масло отбирают этиловым эфиром (10 мл); органическую фазу затем промывают H2O (3×10 мл), сушат над Na2SO4 и выпаривают, получая 2,17 г (12 ммоль) метилового сложного эфира в виде прозрачного масла. Количественный выход.
1H ЯМР (CDCl3): δ 7,30-7,26 (м, 2H); 7,2-7,15 (м, 1H); 6,75 (д, 1H, J=7 Гц); 5,55 (ушир.с, 1H, OH); 4,15 (кв, 1H, J=7 Гц); 3,70 (с, 3H); 1,75 (д, 3H, J=7 Гц).
2. Метил 2-[2'-(2"-хлор)фенокси]фенилпропионат
Метил 2-(2'-гидрокси)фенилпропионат (2 г; 11,1 ммоль) растворяют в CHCl3 (60 мл); последовательно добавляют 2-хлорфенилбороновую кислоту (7,71 г; 49,3 ммоль), ацетат меди (3,24 г; 17,82 ммоль) и триэтиламин (7,7 мл; 5,54 ммоль). Полученный таким образом раствор кипятят с обратным холодильником в течение 24 часов до тех пор, пока не исчезает исходный продукт. После охлаждения до комнатной температуры соли отфильтровывают на слое целита; фильтрат промывают 2н HCl (3×50 мл) и насыщенным раствором NaCl (2×35 мл); органическую фазу сушат над Na2SO4 и выпаривают при пониженном давлении, получая темный маслянистый остаток, который очищают, используя флеш-хроматографию (элюент CHCl3/CH3OH 9:1). Метил 2-[2'-(2"-хлор)фенокси]фенилпропионат (1,38 г; 5 ммоль) выделяют в виде прозрачного масла. Выход 45%.
1H ЯМР (CDCl3): δ 7,45-7,22 (м, 4H); 7,15-7,08 (м, 2H); 7,05-6,95 (м, 2H); 6,92-6,88 (м, 1H); 4,28 (кв, 1H, J=7 Гц); 3,85 (с, 3H); 1,65 (д, 3H, J=7 Гц).
3. (R,S) 2-[2'-(2"-хлор)фенокси]фенилпропионовая кислота
Метил 2-[2'-(2"-хлор)фенокси]фенилпропионат (1,3 г; 4,7 ммоль) растворяют в диоксане (15 мл). К раствору добавляют 1M NaOH (4,7 мл) и раствор перемешивают при комнатной температуре в течение 18 часов. Растворитель выпаривают при пониженном давлении и остаток отбирают водой; значение рН водной фазы доводят до pH=1, используя концентрированную Н2SO4, и экстрагируют CHCl3 (3×15 мл). Объединенные органические экстракты промывают насыщенным раствором NaHCO3, затем насыщенным раствором NaCl, сушат над Na2SO4 и выпаривают при пониженном давлении, получая (R,S) 2-[2'-(2"-хлор)фенокси]фенил]пропионовую кислоту (1,18 г; 4,5 ммоль) в виде прозрачного воскообразного вещества желтого цвета. Выход 96%.
1H ЯМР (CDCl3): δ 7,45-7,22 (м, 4H); 7,15-7,08 (м, 2H); 7,05-6,95 (м, 2H); 6,92-6,88 (м, 1H); 3,95 (кв, 1H, J=7 Гц); 1,50 (д, 3H, J=7 Гц).
Тем же способом получают следующие соединения:
Пример 25
(R,S) 2-[2'-(2",6"-дихлор)фенокси]фенилпропионовая кислота
1H ЯМР (CDCl3): δ 9,40 (ушир.с, 1H, COOH); 7,40-7,30 (д, 2H, J=8 Гц); 7,27-7,15 (м, 4H); 6,70-6,60 (д, 1H, J=8 Гц); 3,90 (кв, 1H, J=7 Гц); 1,55 (д, 3H, J=7 Гц).
Пример 26
Получение 2-(3-метилиндан-5-ил)пропановой кислоты
Исходя из 6-метокси-l-инданона (коммерческой реагент) получают нужную кислоту известными из литературы способами, в частности, 6-метокси-l-инданон подвергают реакции Виттига (выход 80%) с илидом трифенилметилфосфонийбромида, получая производное эзометилена, которое, используя каталитическое гидрирование (H2/Pd 5%, P атмосферное; выход 95%) восстанавливают до производного метилинданоила. У фенольных групп субстрата, в результате обработки BBr3, оказываются удалены защитные группы (выход >95%); соответствующий трифлат получают в результате обработки промежуточного соединения трифторметансульфоновым ангидридом (выход 80%), полученный трифлат подвергают реакции перекрестного сочетания (описанная ранее реакция Stille) с метил 2-трибутилстаннилакрилатом. Реакция протекает с хорошим выходом (40%), и полученное таким образом промежуточное соединение, 2-метоксикарбонил изопропен-2-ил, после каталитического гидрирования для восстановления двойной связи и омыления KOH/EtOH в хорошо известных условиях, приводит к получению 2-(3-метилиндан-5-ил)пропановой кислоты с высокими выходами. Выход 90%.
1H ЯМР (CDCl3): δ 7,15-7,05 (м, 3H); 3,75 (м, 1H); 3,15 (м, 1H); 2,95-2, 70 (м, 2H); 2,32 (м, 1H); 1,78-1,58 (м, 1H); 1,50 (д, 3H, J=7 Гц); 1,35 (д, 3H, J=7 Гц).
Общий способ получения (S) и (R)-2-[(4'-арил/алкилсульфониламино)фенил]пропионовых кислот формулы Ia
Разделение двух энантиомеров коммерческого реагента, 2-(4'-нитрофенил)пропионовой кислоты, осуществляют путем кристаллизации соответствующих S-(-) или R-(+)-α -фенилэтиламмонийных солей в этанольном растворе способом, раскрытым в Akgun H. et al., Arzneim.-Forsch./Drug Res., 46(11), Nr.9, 891-894 (1996).
(S)-2-(4'-нитрофенил]пропионовая кислота
[α]D =+43,9°(c=2; абсолютный EtOH);
1H ЯМР (CDCl3): δ 8,15 (д, 2H, J=7 Гц); 7,47 (д, 2H, J=7 Гц); 3,95 (ушир.с, 1H, COOH); 3,78 (м, 1H); 1,52 (д, 3H, J=7 Гц).
(R)-2-(4'-нитрофенил)пропионовая кислота
[α]D =-43,5° (c=2; абсолютный EtOH);
1H ЯМР (CDCl3): δ 8,12 (д, 2H, J=7 Гц); 7,49 (д, 2H, J=7 Гц); 3,90 (ушир.с, 1H, СООН); 3,81 (м, 1H); 1,50 (д, 3H, J=7 Гц).
Метиловые сложные эфиры 4'-нитрофенилпропионовой кислоты
(R)-2-(4'-нитрофенил)пропионовую кислоту (4 ммоль) растворяют в метаноле (40 мл) и по каплям добавляют 96% H2SO4 (0,5 мл). Полученный раствор оставляют при перемешивании в течение ночи. После выпаривания растворителей маслянистый остаток растворяют в диэтиловом эфире и органическую фазу промывают насыщенным раствором NaHCO3 (2Ч30 мл), сушат над Na2SO4 и выпаривают при пониженном давлении, получая нужный продукт в виде масла бледно-желтого цвета.
Метиловый сложный эфир (R)-2-(4'-нитрофенил)пропионовой кислоты
[α]D=-48,3°(c=2; абсолютный EtOH);
1H ЯМР (CDCl3): δ 8,12 (д, 2H, J=7 Гц); 7,49 (д, 2H, J=7 Гц); 3,75 (м, 1H); 3,70 (с, 3H); 1,51(д, 3H, J=7 Гц).
Метиловый сложный эфир (S)-2-(4'-нитрофенил)пропионовой кислоты
[α]D=+49°(c=2; абсолютный EtOH);
1H ЯМР (CDCl3): δ 8,11 (д, 2H, J=7 Гц); 7,49 (д, 2H, J=7 Гц); 3,78 (м, 1H); 3,68 (с, 3H); 1,51 (д, 3H, J=7 Гц).
Метиловые сложные эфиры (S)- и (R)-2-(4'-аминофенил)пропионовой кислоты
Оба соединения получают, восстанавливая нитрогруппы по способу Ram S. et al., Tetrahedron Lett., 25, 3415 (1984) и Barrett A.G.M. et al., Tetrahedron Lett., 29, 5733 (1988).
Метиловый сложный эфир (S)-2-(4'-аминофенил)пропионовой кислоты
[α ]D=+16,5°(с=2; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,85 (д, 2H, J=7 Гц); 7,45 (д, 2H, J=7 Гц); 3,81 (м, 1H); 3,67 (с, 3H); 1,62(д, 3H, J=7 Гц).
Метиловый сложный эфир (R)-2-(4'-аминофенил]пропионовой кислоты
[α]D=-17,1°(c=2; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,85 (д, 2H, J=7 Гц); 7,45 (д, 2H, J=7 Гц); 3,81 (м, 1H); 3,66 (с, 3H); 1,65 (д, 3H, J=7 Гц).
(R)-2-[(4'-арил/алкилсульфониламино)фенил]пропионовые кислоты
К раствору вышеуказанного метилового сложного эфира (R)-2-(4'-аминофенил)пропионовой кислоты (10 ммоль) в ацетоне (20 мл) добавляют сухой пиридин (15 ммоль) или эквивалентное органическое/неорганическое основание и арилсульфонил (или алкилсульфонил) хлорид (10 ммоль) и полученный раствор оставляют при перемешивании в течение ночи. После выпаривания растворителя маслянистый остаток растворяют в CHCl3(30 мл) и органическую фазу промывают водой (3×30 мл), сушат над Na2SO4 и выпаривают, получая нужный продукт в виде чистого твердого вещества после обработки при комнатной температуре в течение ночи в изопропиловом эфире и фильтрования осадка в вакууме.
К раствору метилового сложного эфира (6 ммоль) в CH3 OH (25 мл) добавляют 2н NaOH (12 ммоль) и полученную смесь оставляют при перемешивании в течение ночи при комнатной температуре. CH3OH выпаривают и водный основной слой подкисляют до pH=2, добавляя по каплям 12 н HCl; добавляют этилацетат, и смесь разделяется на две фазы. Органические экстракты снова промывают водой (3×20 мл), сушат над Na2SO4и выпаривают при пониженном давлении, получая продукт, который выделяют в чистом виде в виде твердого вещества после обработки при комнатной температуре в течение ночи в н-гексане и фильтрования осадка в вакууме (выход 75%-100%).
В соответствии с описанным выше способом получают следующие соединения:
Пример 27
(R) 2-(4'-(бензолсульфониламино)фенилпропионовая кислота
[α]D=-56,5°(c=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 9,40 (ушир.с, 1H, SO2N H); 7,70 (д, 2H, J=8 Гц); 7,30 (м, 3H); 7,05 (д, 2H, J=8 Гц); 6,92 (д, 2H, J=8 Гц); 3,45 (кв, 1H, J=7 Гц); 1,22 (д, 3H, J=7Гц).
Пример 28
(R) 2-(4'-метансульфониламино)фенилпропионовая кислота
[α]D = -124,3° (с=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,48 (ушир.с, 1H, SO2NH); 7,35 (д, 2H, J=8 Гц); 7,18 (д, 2H, J=8 Гц); 6,55 (ушир.с, 1H, SO2NH); 3,80 (кв, 1H, J=7 Гц); 3,00 (с, 3Н); 1,55 (д, 3H, J=7 Гц).
Пример 29
(R) 2-[4'-(2"-пропан)сульфониламино)фенилпропионовая кислота
[α]D=-110°(c=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,21 (д, 2H, J=8 Гц); 7,05 (д, 2H, J=8 Гц); 6,20 (ушир.с, 1H, SO2NH); 3,65 (кв, 1H, J=7 Гц); 3,23 (м, 1H); 1, 50 (д, 3H, J=7 Гц); 1,30 (д, 6H, J=7 Гц).
Пример 30
(R) 2-(4'-трифторметансульфониламино)фенилпропионовая кислота
[α]D=-84,5° (c=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,25-7,05 (м, 4Н); 7,00 (ушир.с, 1H, SO2NH); 3,60 (кв, 1H, J=7 Гц); 1,41 (д, 3H, J=7 Гц).
Пример 31
(R) 2-(4'-бензилсульфониламино)фенилпропионовая кислота
[α]D=-47°(c=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,53 (м, 5H); 7,31 (д, 2H, J=7 Гц); 7,15 (ушир.с, 1H, SO2NH); 7,02 (д, 2H, J=7 Гц); 4,65 (с, 2H); 3,80 (м, 1H); 1,55 (д, 3H, J=7 Гц).
Пример 32
(R) 2-[4'-(2"-хлор)бензолсульфониламино]фенилпропионовая кислота
[α]D=-81,5° (c=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,95 (д, 1H, J=8 Гц); 7,40 (м, 2H); 7,22 (м, 1H); 7,10 (м, 2H); 6,95 (м, 2H+SO2NH); 3,55 (кв, 1H, J=7 Гц); 1,35 (д, 3H, J=7 Гц).
Пример 33
(R) 2-[4'-(2"-этил)бензолсульфониламино]фенилпропионовая кислота
Получение 2-этилбензолсульфонилхлорида
Исходя из коммерческого 2-этилбензолтиола получают родственную сульфоновую кислоту по способу, раскрытому Trahanovsky W.S., "Oxidation in Organic Chemistry", Vol. 5-D, 201-203 Academic Press, Inc, (London), 1982. В результате обработки сульфоновой кислоты избытком тионилхлорида получают 2-этилбензолсульфонилхлорид, достаточно чистый для того, чтобы использовать в реакции конденсации с метиловым сложным эфиром R(-)-2-(4'-аминофенил)пропионовой кислоты.
[α]D=-95°(с=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 9,30 (ушир.с, 1H, SO2NH); 7,70 (д, 2H, J=8 Гц); 7,25 (м, 4H); 7,08 (д, 2H, J=8 Гц); 3,41 (кв, 1H, J=7 Гц); 2,70 (кв, 2H, J=8 Гц); 1,42 (д, 3H, J=8 Гц); 1,22 (д, 3H, J=7 Гц).
Пример 34
(R) 2-(4'-аминосульфониламино)фенилпропионовая кислота
[α]D=-110°(c=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,95 (д, 2H, J=8 Гц); 7,54 (ушир.с, 2H, NSO2NH2); 6,98 (м, 2H+ SO2NH2); 3,57 (кв, 1H, J=Гц); 1,30 (д, 3H, J=7 Гц).
Общий способ получения (S)- и (R)-2-[(4'-арил/алкилсульфонилокси)фенил]пропионовых кислот формулы Ia
Разделение двух энантиомеров коммерческого реагента 2-(4'-гидроксифенил)пропионовой кислоты осуществляют путем кристаллизации соответствующей S(-) или R(+)-α-фенилэтиламмонийной соли в этанольном растворе, как раскрыто Akgun H. et al., Arzneim.-Forsch./Drug Res., 46(II), Nr.9, 891-894 (1996).
(S)-2-(4'-гидроксифенил)пропионовая кислота
[α]D=+12°(c=2; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,31 (д, 2H, J=7 Гц); 7,05 (д, 2H, J=7 Гц); 6,25 (ушир.с, 1H, OH); 3,80 (кв, 1H, J=7 Гц); 1,52 (д, 3H, J=7 Гц).
(R)-2-(4'-гидроксифенил]пропионовая кислота
[α]D=-1,5°(c=2; абсолютный EtOH);
1H ЯМР (CDCl3 ): δ 7,30 (д, 2H, J=7 Гц); 7,07 (д, 2H, J=7 Гц); 6,35 (ушир.с, 1H, OH); 3,75 (кв, 1H, J=7 Гц); 1,50 (д, 3H, J=7 Гц).
Метиловые сложные эфиры (R)- и (S)-2-(4'-гидроксифенил]-пропионовой кислоты
(2R)-2-(4'-гидроксифенил)пропионовую кислоту (4 ммоль) растворяют в CH3OH (40 мл) и добавляют по каплям концентрированную H2SO4 (0,5 мл). Полученный раствор оставляют при перемешивании в течение ночи. После выпаривания растворителей маслянистый остаток растворяют в диэтиловом эфире и органическую фазу промывают насыщенным раствором NaHCO3 (2×30 мл), сушат над Na2SO4 и выпаривают при пониженном давлении, получая нужный продукт в виде масла бледно-желтого цвета.
Метиловый сложный эфир (R) 2-(4'-гидроксифенил)пропионовой кислоты
[α]D=-78°(c=2; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,32 (д, 2H, J=7 Гц); 7,10 (д, 2H, J=7 Гц); 6,40 (ушир.с, 1H, OH); 3,70 (м, 4Н); 1,53 (д, 3H, J=7 Гц).
(R) 2-[(4'-арил/алкилсульфонилокси)фенил]пропионовые кислоты
Смесь вышеуказанного метилового сложного эфира (2R)-2-(4'-гидроксифенил)пропионовой кислоты (2 ммоль) и арилсульфонил (или алкилсульфонил)хлорида (2 ммоль) в сухом пиридине (1 мл) или в присутствии эквивалентного органического/неорганического основания нагревают при T=60°C в течение 24 часов. После охлаждения до комнатной температуры реакционную смесь выливают в 1 н HCl (5 мл) и водный раствор экстрагируют CH2Cl2 (3×10 мл). Объединенные органические экстракты промывают в противотоке c 1н NaOH (2×10 мл), сушат над Na2SO4 и выпаривают при пониженном давлении, получая сырой остаток, достаточно чистый для того, чтобы использовать его на следующей стадии (выход 80-92%).
Смесь сырого метилового сложного эфира (1,85 ммоль), ледяной уксусной кислоты (2,5 мл) и 37% HCl (0,5 мл) кипятят с обратным холодильником в течение 18 час. Все растворители выпаривают, маслянистый остаток растворяют в CH2Cl2 (5 мл) и органическую фазу промывают NaOH (2×5 мл) и водой (2×10 мл), сушат над Na2SO4 и выпаривают при пониженном давлении, получая чистые (2R) арил (или алкил)сульфонилоксифенилпропионовые кислоты с количественным выходом.
В соответствии с указанным выше способом получают следующие соединения:
Пример 35
(R) 2-(4'-бензолсульфонилокси)фенилпропионовая кислота
[α]D=-66, 2°(c=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,92 (д, 2H, J=7 Гц); 7,70 (т, 1H, J=7 Гц); 7,57 (т, 2H, J=7 Гц); 7,25 (д, 2H, J=7 Гц); 6,95 (д, 2H, J=7 Гц); 3,75 (кв, 1H, J=7 Гц); 1,50 (д, 3H, J=7 Гц).
Пример 36
(R) 2-(4'-бензилсульфонилокси)фенилпропионовая кислота
[α]D=-84,6° (c=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,50 (м, 5H); 7,28 (д, 2H, J=7 Гц); 7,05 (д, 2H, J=7 Гц); 4,53 (с, 2H); 3,77 (м, 1H); 1,52 (д, 3H, J=7 Гц).
Пример 37
(R) 2-(4'-трифторметансульфонилокси)фенилпропионовая кислота
[α]D=-28/5° (c=l; CH3OH);
1H ЯМР (CDCl3): δ 7,45 (д, 2H, J=7 Гц); 7,22 (д, 2H, J=7 Гц); 3,82 (кв, 1H, J=7 Гц); 1,51 (д, 3H, J=7 Гц).
Пример 38
(R) 2-[4'-(2"-пропан)сульфонилокси]фенилпропионовая кислота
[α]D=-42,8° (c=l; CH3OH);
1H ЯМР (CDCl3): δ 7, 41 (д, 2H, J=7 Гц); 7,25 (д, 2H, J=7 Гц); 3,82 (кв, 1H, J=7 Гц); 3,45 (д, 3H, J=7 Гц); 1,52 (м, 9Н).
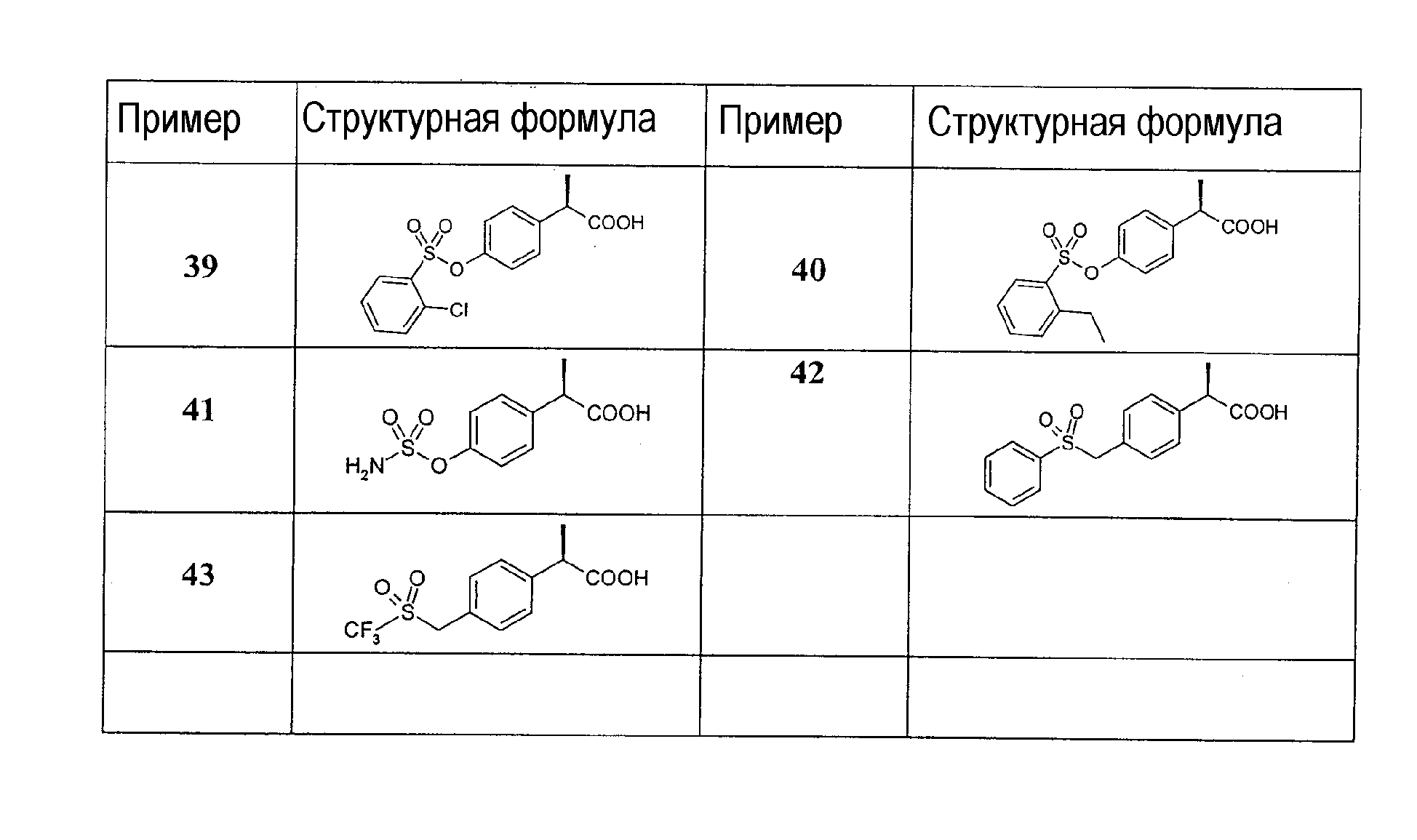
Пример 39
(R) 2-[4'-(2"-хлор)бензолсульфонилокси)фенилпропионовая кислота
[α]D=-43° (c=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,90 (д, 1H, J=8 Гц); 7,44 (м, 2H); 7,20 (м, 1H); 7,12 (м, 2H); 6,95 (д, 2H, J=8 Гц); 3,52 (кв, 1H, J=7 Гц); 1,38 (д, 3H, J=7 Гц).
Пример 40
(R) 2-[4'-(2"-этил)бензолсульфонилокси]фенилпропионовая кислота
Получение 2-этилбензолсульфонилхлорида
Исходя из коммерческого 2-этилбензолтиола получают родственную сульфоновую кислоту по способу, раскрытому Trahanovsky W.S., "Oxidation in Organic Chemistry", Vol. 5-D, 201-203 Academic Press, Inc, (London), 1982.
В результате обработки сульфоновой кислоты избытком тионилхлорида получают 2-этилбензолсульфонилхлорид, достаточно чистый для того, чтобы использовать его в реакции конденсации с (R)-метиловым сложным эфиром 2-(4'-гидроксифенил)пропионовой кислоты.
[α]D=-104° (c=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,71 (д, 2H, J=8 Гц); 7,25 (м, 4H); 7,12 (д, 2H, J=8 Гц); 3,44 (кв, 1H, J=7 Гц); 2,71 (кв, 2H, J=8 Гц); 1,45 (д, 3H, J=8 Гц); 1,20 (д, 3H, J=7 Гц).
Пример 41
(R) 2-(4'-аминосульфонилокси)фенилпропионовая кислота
[α]D=-91,5° (c=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,95 (д, 2H, J=8 Гц); 7,84 (ушир.с, 2H, NSO2NH2); 6,95 (д, 2H, J=8 Гц); 3,61 (кв, 1H, J=7ГЦ); 1,35 (д, 3H, J=7 Гц).
Способ получения (S)- и (R)-2-(4'-арил/алкилсульфонилметилфенил)пропионовых кислот формулы Ia
Пример 42
(R) 2-(4'-бензолсульфонилметил)фенилпропионовая кислота
Указанный в заголовке продукт получают в результате многостадийного синтеза исходя из коммерческой (R)-2-фенилпропионовой кислоты. В соответствии со способом, раскрытым в EP 0889020 (Пример 4), с хорошим выходом получают (R)-2-[(4'-хлорметил)фенил]пропионовую кислоту. Указанную кислоту превращают в метиловый сложный эфир обычным способом и сложный эфир добавляют к холодной смеси бензолтиол/трет-бутоксид калия/18-краун-6 (1:1,1:0,95) и, после реакции в течение ночи и обычной обработки (промывки водой, сушки над Na2 SO4 и выпаривания растворителя), выделяют чистое производное бензолтиометила и используют на следующей стадии окисления. В результате окисления до родственного сульфона двумя эквивалентами 3-хлорпероксибензойной кислоты и окончательной обработки смесью NaOH/диоксан при комнатной температуре выделяют нужный продукт с хорошим конечным выходом (65%) исходя из (R)-2-[(4'-хлорметилтил)фенил]пропионовой кислоты).
[α]D=-125° (c=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,90 (м, 2H); 7,44-7,20 (м, 3H); 7,12 (д, 2H, J=8 Гц); 6,95 (д, 2H, J=8 Гц); 3,72 (с, 2H); 3,55 (кв, 1H, J=7 Гц); 1,43 (д, 3H, J=7 Гц).
Пример 43
(R) 2-(4'-трифторметансульфонилметил)фенилпропионовая кислота
В соответствии со способом, раскрытым в патенте США 5245039 (14/09/1993), и исходя из метилового сложного эфира (R)-2-[(4'-хлорметил)фенил]пропионовой кислоты получают родственную (R)-2-[(4'-тиометил)фенил]пропионовую кислоту с высоким выходом (85%). В результате обработки тиолата (образующегося "in situ" 1 эквивалентом трет-бутоксида калия) коммерческим трифторметилиодидом получают производное трифторметантиометила. Последующее окисление до производного сульфона (путем обработки 2 эквивалентами 3-хлорпероксибензойной кислоты) и конечного гидролиза сложного эфира смесью NaOH/диоксан при комнатной температуре позволяет выделить нужный продукт с достаточно хорошим выходом (47%, исходя из (R)-2-[(4'-хлорметил)фенил]пропионовой кислоты).
[α]D=-86°(c=l; абсолютный EtOH);
1H ЯМР (CDCl3): δ 7,14 (д, 2H, J=8 Гц); 7,02 (д, 2H, J=8 Гц); 3,85 (с, 2H); 3,51 (кв, 1H, J=7 Гц); 1,48 (д, 3H, J=7 Гц).
Список структур примеров

Реферат
Изобретение относится к медицине и касается применения соединений (R, S)-2-арилпропионовых кислот формулы (Ia) и их (R)- и (S)-энантиомеров, в качестве ингибиторов IL-8 индуцируемого хемотаксиса нейтрофилов (PMN лейкоцитов), проявляющих неожиданную способность эффективно ингибировать IL-8-индуцируемый хемотаксис нейтрофилов и дегрануляцию без заметного влияния на активность циклооксигеназ, для лечения таких заболеваний как псориаз, язвенный колит, меланома, хроническое обструктивное легочное заболевание (COPD), буллезная пузырчатка, ревматоидный артрит, идиопатический фиброз, гломерулонефрит, и для профилактики и лечения повреждений, вызванных ишемией и реперфузией. 7 н. и 2 з.п. ф-лы, 3 табл.

Формула


Комментарии