Конъюгат хризофанола, способ его получения, применение его в качестве лекарственного средства для лечения диабетической нефропатии, спаек кишок, остеоартрита - RU2416596C2
Код документа: RU2416596C2
Чертежи



Описание
Изобретение касается конъюгатов хризофанола или его производных, образованных путем взаимодействия хризофанола или его соответствующего производного с различными азотными органическими основаниями, способа получения и применение конъюгата в качестве лекарственных средств для профилактики и лечения диабетической нефропатии, остеоартрита, ревматического или ревматоидного артрита, спаек кишок, восстановления перистальтики кишечника.
Описано применение хризофанола и производных хризофанола в изготовлении различных лекарственных препаратов, например, в Патентной Заявке КНР № 200410049948 описана соль хризофанола, характеризующаяся следующими двумя общими формулами - хризофанолом и солью хризофанола соответственно:


где «М» обозначает щелочной металл, щелочно-земельные металлы, остаток алкалоида.
Хризофанол является соединением, получаемым путем обработки растительного сырья, содержащего в своем составе хризофанол или производные хризофанола, такого как ревень (Rheum palmatum L., Rheum tanruticum Maxim. Ex Balf. или Rheum officinale Baill), горец японский (Polyronum cuspidatum sieb. Et Zucc.), кассия остролистная (Folium sennae), горец многоцветковый (Polyronum multiflorum Thunb., кассия торы (Semen cassiae) и другие, то есть растительного сырья, типовой состав которых по основному действующему веществу характеризуется общей формулой (1).
Данные Медицинских рефератов КНР (поисковое слово «хризофанол»), база данных CNKI (поисковое слово «хризофанол»), Патенты КНР (поисковое слово «хризофанол»), СА (поискать «номер логина № 478-43-3»), Патенты США (поисковое слово «Rhein»), Патенты Европы (поисковое слово «Rhein») показывают, что наиболее известными соединениями хризофанола являются соль натрия хризофанола и соль калия хризофанола (US 6197818, CN 97107137), диацетил хризофанола [13739-02-1] (CN 97192531, CN 93101181, СА 96:193416) и соль калия диацетила хризофанола (ЕР 243968).
Сахарный диабет является болезнью обмена веществ, затрагивающей все системы организма. Хотя механизм заболевания зависит от разных факторов, дефект инсулин рецепторов (IR) и функциональный дефект β-клеток считаются главными звеньями возникновения сахарного диабета. Адипоз, гипертония, гиперлипемия, гиперурикемия и состояние гиперкоагуляции составляют группу заболеваний, являющихся клиническими проявлениями дефекта рецепторов (IR) к инсулину. Дефект рецепторов (IR) к инсулину зачастую существует до появления диабета, он является не только непосредственной причиной возникновения сахарного диабета, но и основой сердечно-сосудистых заболеваний при сахарном диабете.
Диабетическая нефропатия (DN) является распространенным следствием болезни сахарного диабета.
Хризофанол эффективно снижает уровень сахара, регулирует количество жировой ткани, улучшает действие инсулина, снижает выделение мочевого альбумина, поэтому хризофанол играет многоцелевую и многоярусную роль для профилактики и лечения диабетического нефроза.
Абдоминальная хирургия является наиболее распространенной хирургической операцией. Как правило, пациенты после операции имеют относительно слабые функции желудочно-кишечного тракта, поэтому восстановление функции желудочно-кишечного тракта после операции имеет большое значение в реабилитации пациента, в том числе восстановление перистальтики после операции, снижает риск возникновения спаек кишок.
Послеоперационные кишечные спайки кишок являются трудной хирургической проблемой, которая трудно разрешима в клинической практике. Исследовательские работы последних лет показывают, что у 90%-100% пациентов, прошедших операцию в брюшной полости, возникает спайка кишок [Luijendijk RW, etal Foreign material in postoperative Adhesions AnnSurg, 1996,223(3):242; Scott Coombers D.etal Human intraperitoneal fibrinolytic respond to elective surgery BrJSurg, 1995,82:414]. Среди пациентов, у которых возникла спайка кишок, у более 80% это спайка соединительно-тканной пленки, у 50% пациентов это спайка тонких кишок [Menxies D, etal Intestinal obstruction from adhesions: How big is the problem? AnnR Coll Surg Engl, 1990, 72(1):60]. Возникновение спайки кишок связано с брюшным всасыванием и ослаблением кишечной перистальтики. Сокращение экссудации или улучшение энтерокинеза приведет к сокращению числа спаек.
Существующие лекарства для содействия энтерекинезу могут ускорить энтерокинез, но они не уменьшают воспалительные процессы, оказывает слишком мощное воздействие на желудок, поэтому легко вызывают рвоту и плохое самочувствие.
В клинической практике описано использование ревеня для восстановления перистальтики. У пациента сохранялась сильная боль, не удалось фактически восстановлить функционирование желудочно-кишечного тракта [Ли Цисинь и др. Клинический осмотр воздействия ревеня на восстановление функций желудка и кишок пациентов, болеющих диффузным перитонитом и прошедших операцию. Chinese Journal of Coal Industry Medicine, 1998, 1(4):372].
В клинической практике тоже применяется сок сырого ревеня в качестве лекарственного средства [Гэ Хэнвэнь и др. Осмотр при лечебной эффективности сока сырого ревеня для восстановления функций желудка и кишок после операции. Научный вестник Медицинского института санитарных сотрудников провинции Хубэй, 2002, 15(2), 19]. Известно также сочетание ревеня с другими лекарственными растениями китайской медицины для внутреннего приема или приема в качестве настоек. [Хуан Хунхэн и др. Исследование о клиническом применении препаратов для восстановления спайки кишок, Вестники китайской медицины и китайских лекарств, 2006, 5(2), 42]. Но использование в клинической практике затруднительно по причинам нерегулируемости дозы, способов доставки лекарственного средства в организм, в связи с чем клиническое использование средств из ревеня и другого растительного сырья ограничено.
Остеоартрит, ревматический и ревматоидный артриты являются распространенными заболеваниями суставов, имеющие высокую вероятность возникновения. Заболеваемость остеоартритом составляет около 10% от общей численности жителей для пациентов, возраст которых выше 60 лет, более 50% из них подвергаются воздействию данного заболевания, для женщины возрастом моложе 45 лет, а от 45 до 60 лет и свыше 65 лет заболеваемость составляет 2%, 30% и 68% соответственно. А у мужчин - составляет 3%, 24,5% и 58% соответственно.
Существующие лекарственные препараты для лечения остеоартрита в основном включают в себя противовоспалительные средства как стероидного типа, так и нестероидного типа. Всем уже известна негативная реакция стероидного противовоспалительного лекарства. Среди нестероидных препаратов, содержащих ингибитор циклооксигеназы (СОХ) тоже имеет ряд неблагоприятных реакций. Например, при внутреннем приеме или инъекции нестероидных препаратов, содержащих ингибитор циклооксигеназы (СОХ), возникает желудочно-кишечное кровотечение, особенно эти негативные проявления возникают у пожилых людей, что очень вредно для лечения остеоартрита, которое в большей части возникает у пожилых людей.
В связи с тем, что соединение хризофанола нерастворимо в воде, оно не может быть усвоено желудочно-кишечным трактом, что приводит к снижению эффективности биологического применения и ограничивает использование хризофанола. Натриевая соль хризофанола и его производные повышают растворимость хризофанола в воде, вследствие чего повышается биологичекая эффективность при приеме внутрь. Но так как натриевая соль хризофанола, калиевая соль хризофанола (US 6197818, CN 97107137, диацетил хризофанола [13739-02-1] (CN 97192531, CN 93101181, СА 96:193416) и каливая соль диацетил хризофанола (ЕР 243968) являются или сильнощелочными или слабокислыми солями, а водный раствор является щелочным раствором, это делает невозможным их использование в качестве инъекционных растворов, а при снижении значения рН стабильность препаратов снижается.
Технической задачей настоящего изобретения является создание нового конъюгата хризофанола или его производного путем взаимодействия хризофанола или его производного с различными органическими основаниями, которые не только повышают растворимость хризофанола в воде, но и могут преодолеть основной недостаток таких соединений хризофанола, а именно: получение водорастворимого соединения хризофанола с рН, достаточной для использования в инъкционной форме, сохраняющее при этом высокие биологическую активность и стабильность.
Второй задачей настоящего изобретения является создание способа получения водорастворимого конъюгата хризофанола или его производного, путем взаимодействия хризофанола или его производного с органическими основаниями и носителем, допустимым для лекарственного применения.
Третьей задачей настоящего изобретения является применение конъюгата хризофанола или его производного в качестве лекарственного средства для профилактики или лечения диабетической нефропатии, остеоартрита, ревматического или ревматоидного артрита, спаек кишок, восстановления перистальтики кишечника.
Дополнительной задачей является создание стабильного конъюгата хризофанола или его производного с органическим основанием, имеющим в качестве носителя воду.
Лекарственное средство для профилактики или лечения диабетической нефропатии, остеоартрита, ревматического или ревматоидного артрита, спаек кишок, восстановление перистальтики кишечника, содержащее конъюгат хризофанола или его производного с органическими основаниями и носителем в качестве активного ингредиента и носитель, пригодный для лекарственного применения, представляющее собой таблетку, капсулу, желатиновую капсулу, гель, пероральное лекарственное средство, суспензию, настойку, пластырь, мазь, пилюлю, инъекцию, трансфузию, лиофилизированную инъекцию, эмульсию внутреннего вливания, липосомную инъекцию, лекарственное средство для направленной терапии, суппозиторий, лекарственное средство замедленного высвобождения или лекарственное средство с контролируемым высвобождением.
Поставленные изобретательские задачи решаются тем, что конъюгат хризофанола или его производного характеризуются общей формулой (I):
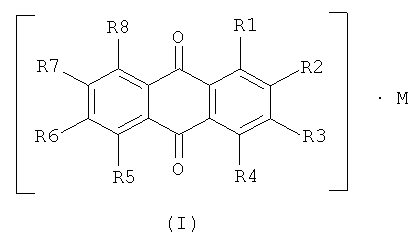
где левая часть возможна в одном из вариантов:
(1) хризофанол или его производное, в котором R1-R8 представляют собой группу, выбранную из групп -Н, -O-глюказа, -ОН, -ОСН3, -СН3, при условии, что не менее двух групп из R1-R8 означают -Н, и при условии, что одна или две группы R2, R3, R6, R7 является группой -СООН;
(2) экстракт растительного сырья, содержащий хризофанол или его производное;
«М» представляет собой азотное органическое основание, выбранное из группы, состоящей из хитозамина, глюкозамина, или основную аминокислоту, выбранную из группы, состоящей из аргинина, лизина, карнитина, и группа М связана с хризофаноловой частью в конъюгат, например, через гидроксил -СООН.
Под экстрактом растительного сырья (2), содержащим хризофанол или его производное, понимается группа соединений, полученная путем экстракции, концентрации, отделением и точной обработкой определенных растений, имеющих единственное действующее активное вещество (материнское ядро). В данном изобретении, действующим активным веществом (материнским ядром) является антрахинон.
Иными словами, его левая часть является экстрактом растительного сырья с содержанием хризофанола, или его производного, в котором R1-R8 представляют собой группу, выбранную из групп -Н, -О-глюказа, -ОН, -ОСН3, -СН3, при условии, что не менее двух групп из R1-R8 означают -Н, и при условии, что одна или две группы R2, R3, R6, R7 является группой -СООН.
R1~R8, выбранные в указанной группе оказывают существенное влияние на лекарственную характеристику вещества, представленного в настоящей заявке.
В указанном решении конъюгат хризофанола или его производного с азотным органическим основанием или основной аминокислотой кардинально отличается от простых солей хризофанола или его производных.
При реакции азотного органического основания или основной аминокислоты с хризофанолом или его производным образуется соль и вода, соединенные ковалентной связью, а при конъюгатном соединении соединение азотного органического основания или основной аминокислоты с хризофанолом или его производным вода не образуется. Конъюгатное соединение образуется с помощью сил межмолекулярного воздействия между двумя молекулами, в реакции отсутствует механизм образования воды и электровалентной связи. Данная структура может быть подтверждена авторами в реакции хризофанола и аргинина до и после проведения реакции, молекулярным весом продукта реакции, элементным анализом двойного соединения хризофанола-аргинина, С-спектром, Н-спектром и другими результатами.
Например данные элементного анализа конъюгата хризофанола-аминокислоты представлены в Табл.2.
Из данных Табл.2, очевидно, что разница между теоретическими и измерительными данными, полученными путем элементного анализа в отношении элементов С, Н, N, S, содержащихся в конъюгате хризофанола-аминокислоты, составляет менее 0,5%. Это объясняет то, что полученный продукт соответствует требуемой молекулярной формуле С15Н8О6·C6H14N4O3, и то, что в данной реакции не возникла дегидратация.
Причем, спектральные данные конъюгата хризофанола-аминокислоты в Табл.2 показывают отсутствие кристаллической воды.
Спектральные данные 13С-ЯМР (ядерно-магнитного резонанса) по атому углерода в конъюгате представлены в Табл.3

При сравнении данных, полученных при измерении спектров 13С-ЯМР в конъюгате, с данными архивных работ, явно понятно, что химическое перемещение 2-й позиции углерода [δ (пик спектра): 147.37(138.18)] и углерода карбоксила со 2-й позиции [δ:172.02(165.06)] перемещается к нижней позиции 9 или 7 единиц, для аргинина в связи с тем, что в его структуре имеется гуанидиновая группа основного радикала, имеющая среднюю интенсивность. В связи с чем можно представить, что карбоксил на 2-й позиии у хризофанола и гуанидиновая группа аргинина образуют соль, смотрите структурную формулу.

После дальнейшего совершенствовании могут появиться следующие оптимальные решения.
1. Левая часть общей формулы (I) является экстрактом растительного сырья,
содержащим хризофанол или его производное в количестве 50-99%.
2. Левая часть общей формулы (I) - хризофанол или его производное, в котором R1-R8 представляют собой группу, выбранную из групп -Н, -O-глюказа, -ОН, -ОСН3, -СН3, при условии, что не менее двух групп из R1-R8 означают -Н, и при условии, что одна или две группы R2, R3, R6, R7 является группой -СООН.
R1~R8 представляют собой следующие варианты групп:
Самым оптимальным вариантом левой части общей формулы (I) является экстракт ревеня (Rhein).
3. В общей формуле (1) «М» может быть: основной аминокислотой, аргинином, лизином или карнитином.
4. В общей формуле (1) «М» может быть: органическое азотное основание, хитозамин, глюкозамин.
Способ получения вышеуказанных конъюгатов хризофанола и его производных заключается во взаимодействии экстракта, содержащего хризофанол или хризофанол и производные хризофанола, с азотным органическим основанием или основной аминокислотой, реакцию проводят в водном и/или спиртовом растворе при соотношении компонентов в молях 1:0,5-4,0. В указанных способах получения описаны азотное органическое основание, выбранное из группы, состоящей из хитозамина, глюкозамина или основной аминокислотой, выбранной из группы, состоящей из аргинина, лизина, карнитина.
Полученный конъюгат хризофанола или его производного с азотным органическим основанием или с основной аминокислотой хорошо растворим в воде, рН его водного раствора наиболее приемлем для человеческого организма, за счет чего снижается его токсичность и побочные действия, что позволяет создать из конъюгата водорастворимый лекарственный препарат, что в свою очередь повышает его биологическую эффективность.
Хризофанол или соединение хризофанола получают путем экстракции и сгущения экстракта лекарственных растений или другим известным способом.
Лекарственное растение ревень (Rheum - корень или стебель растений, относящихся к одинаковому роду) дробят, экстрагируют водой, добавляя в водный раствор неорганическую кислоту и окисляющее средство для осуществления реакции, получают экстракт (часть с содержанием хризофанола), осуществляют разделение смеси на хроматографической колонке с последующим выделением хризофанола.
В том числе 1: способ получения лекарственного конъюгата из экстракта хризофанола и основной аминокислоты или азотного органического основания состоит из следующих этапов.
Смешивают полученный экстракт хризофанола и воду и/или этиловый спирт в пропорции 1:0,5-4,0 (в молях), добавляют основную аминокислоту, выбранную из группы аргинин, лизин или карнитин, проводят реакцию, растворитель удаляют при пониженном давлении; или смешивают полученный экстракт хризофанола и воду и/или этиловый спирт по пропорции 1:0,5-4,0 (в молях), добавляют азотное органическое основание, выбранное из группы хитозамин, аминоглюкоза, выполняют реакцию при постоянном помешивании, растворитель удаляют при пониженном давлении.
В том числе 2: способ получения лекарственного конъюгата из хризофанола основной аминокислоты или азотного органического основания состоит из следующих этапов.
Смешивают хризофанол и воду и/или этиловый спирт по пропорции 1:0,5-4,0 (в молях), добавляют основную аминокислоту, выбранную из группы аргинин, лизин или карнитин, проводят реакцию, растворитель удаляют при пониженном давлении; или смешивают хризофанол и воду и/или этиловый спирт по пропорции 1:0,5-4,0 (в молях), добавляют азотное органическое основание, выбранное из группы хитозамин, аминоглюкоза, выполняют реакцию при постоянном помешивании, растворитель удаляют при пониженном давлении.
Затем конъюгат хризофанола и его производных идут на производство лекарственных средств.
Различные лекарственные формы препаратов из конъюгата хризофанола и его производных могут быть получены простыми способами, принятыми в фармацевтической промышленности, например путем смешения конъюгата по формуле (I) с вспомогательными веществами, с последующим изготовлением требуемого препарата.
Решением третьей задачи по настоящему изобретению является применение конъюгата хризофанола или его производного в любой лекарственной форме, принятой в фармацевтической промышленности, в качестве лекарственного средства для профилактики или лечения диабетической нефропатии, остеоартрита, ревматического или ревматоидного артрита, спаек кишок, восстановления перистальтики кишечника.
При этом содержание конъюгата хризофанола или его производного по формуле (I) в молях составляет 0.1%~99.5%, в том числе содержание хризофанола составляет 1,0%-95%.
Лекарственное средство для профилактики или лечения диабетической нефропатии, остеоартрита, ревматического или ревматоидного артрита, спаек кишок, восстановления перистальтики кишечника, содержащее конъюгат хризофанола или его производного в качестве активного ингредиента, содержит вспомогательное вещество, пригодное для лекарственного применения, представляющее собой таблетку, капсулу, желатиновую капсулу, гель, пероральное лекарственное средство, суспензию, настойку, пластырь, мазь, пилюлю, инъекцию, трансфузию, лиофилизированную инъекцию, эмульсию внутреннего вливания, липосомную инъекцию, лекарственное средство для направленной терапии, суппозиторий, лекарственное средство замедленного высвобождения или лекарственное средство с контролируемым высвобождением.
Вышеуказанные вспомогательные вещества, допустимые в фармацевтике, - это, например, вода и этиловый спирт для настоек, крахмал, используемый в твердых лекарственных формах и в качестве стабилизатора суспензий и эмульсий, тростниковый сахар, молочный сахар, микрокристаллическое волокно др., закрепитель волокнистый дериват, альгинаты - разрыхляющие, эмульгирующие, прологирующие, пленкообразующие вспомогательные вещества, а также для приготовления мазей и паст, агароид обладает стабилизирующими, разрыхляющими и скользящими свойствами, в смеси с глицерином в 1,5% концентрации используется в качестве мазевой основы, желатин - для изготовления мазей, желатиновых капсул, суппозиториев, бентонит - в обеспечивают лекарственным препаратам мягкость, дисперсность, высокие адсорбционные свойства, легкую отдачу лекарственных веществ, аэросил - используют с целью стабилизации сухих экстрактов (уменьшается их гигроскопичность, метилцеллюлоза растворимая - в качестве эмульгатора и стабилизатора при изготовлении суспензий и эмульсий, а также как пролонгирующий компонент, поливинол - синтетический водорастворимый полимер винилацетата, поливинилпирролидон (ПВП), карбоксиметилцеллюлоза поперечной связи, декстрин, агар-агар, углекислый калий, двууглекислый натрий; акселератор абсорбции как четвертичное соединение аммония; поверхностный активатор как сетанол, додецилсульфат натрия; носитель абсорбции как каолин и бентонит; тальк, стеориновокислый калий, стеориновокислый магний, тонкозернистый силикагель, поликликоль и другие вспомогательные вещества, используемые в фармацевтической промышленности.
Инъекционными формами конъюгата хризофанола или его производственных в виде трансфузии, лиофилизированной инъекции, эмульсии внутреннего вливания, липосомной инъекции могут быть получены путем распыления в масле - соевом, полигликоле 400, хлопковом, арахисовом, кунжутном, кукурузном, оливковом - при добавлении солюбилизирующего средства, совместимого растворителя, антиоксиданта, в суспензии, полученной путем смешения измельченного порошка конъюгата и полисорбитола 80, с последующим растворением смеси в водном растворе однозамещенного фосфата калия, фосфата калия двузамещенного, нипакина и карбоксиметилцеллюлозы натрия.
В качестве солюбилизирующего средства могут быть полиоксиэтилен кунжутного масла, гидрированное кунжутное масло полиоксиэтилена, кеторурролидин полиоксиэтилена, полоксамер, полисорбит, полигликоль, плюроник F-68, а указанный совместимый растворитель включает аргинин, лизин, хитозамин, или глюкозамин, диэтиламин, этилиндиамин, карбамид, карнитин, ниацинамид, пролин, глюкозу, лимонную кислоту и соль натрия.
Суточная доза лекарственного средства, содержащего конъюгат хризофанола или его производного в качестве активного ингредиента по формуле (I) в зависимости от назначения, заболевания, возраста, массы тела пациента, может составлять 1~300 мг/м2, а оптимальное значение 10~200 мг/м2.
Приведенные ниже примеры предназначены для демонстрации, но не ограничивают воплощения данного изобретения.
В данном изобретении конъюгат хризофонала или его производного преодолевает недостаток хризофанола или его производных, таких как плохая растворимость, высокое значение рН солей хризофанола, приводящее к нестабильности водного инъекционного раствора и невозможности применения его в качестве лекарственного средства. Конъюгат хризофонала или его производного не только хорошо растворим в воде, но и из него возможно промышленно производить разные препараты различных лекарственных форм, особенно водорастворимые инъкционные формы.
В данном изобретении предложен способ получения лекарственного конъюгата хризофонала путем взаимодействия экстракта, содержащего хризофанол или производные хризофанола, с азотным органическим основанием или основной аминокислотой.
В данном изобретении предложено применение конъюгата хризофонала в изготовления лекарственных средств для лечения диабетической нефропатии.
По данному изобретению рН конъюгата хризофонала имеет диапазон от слабокислого до слабощелочного, а его водный раствор для инъекции, водная настойка для приема внутрь имеют нейтральную рН, что является преимуществом при фармакологической доступности препарата. Стабильность лекарственных средств на основе конъюгата выше стабильности соответствующих солей натрия и калия, что позволяет производить на их основе лекарственные средства против диабетической нефропатии.
Существующая сегодня на рынке продукция является просто сбором лекарственного ревеня или экстрактом ревеня. До сих пор не встречались работы, описавшие конъюгаты хризофанола или его производных с основными аминокислотами и азотными органическими основаниями, на рынке нет фармацевтической продукции на их основе.
Поэтому, в данном изобретении впервые раскрыта информация о конъюгатах хризофанола или его производных, о способе его получения, о применении конъюгата хризофанола в изготовлении лекарственных средств.
Приложенные чертежи:
фиг.1. Результаты элементарного анализа аргинина хризофанола;
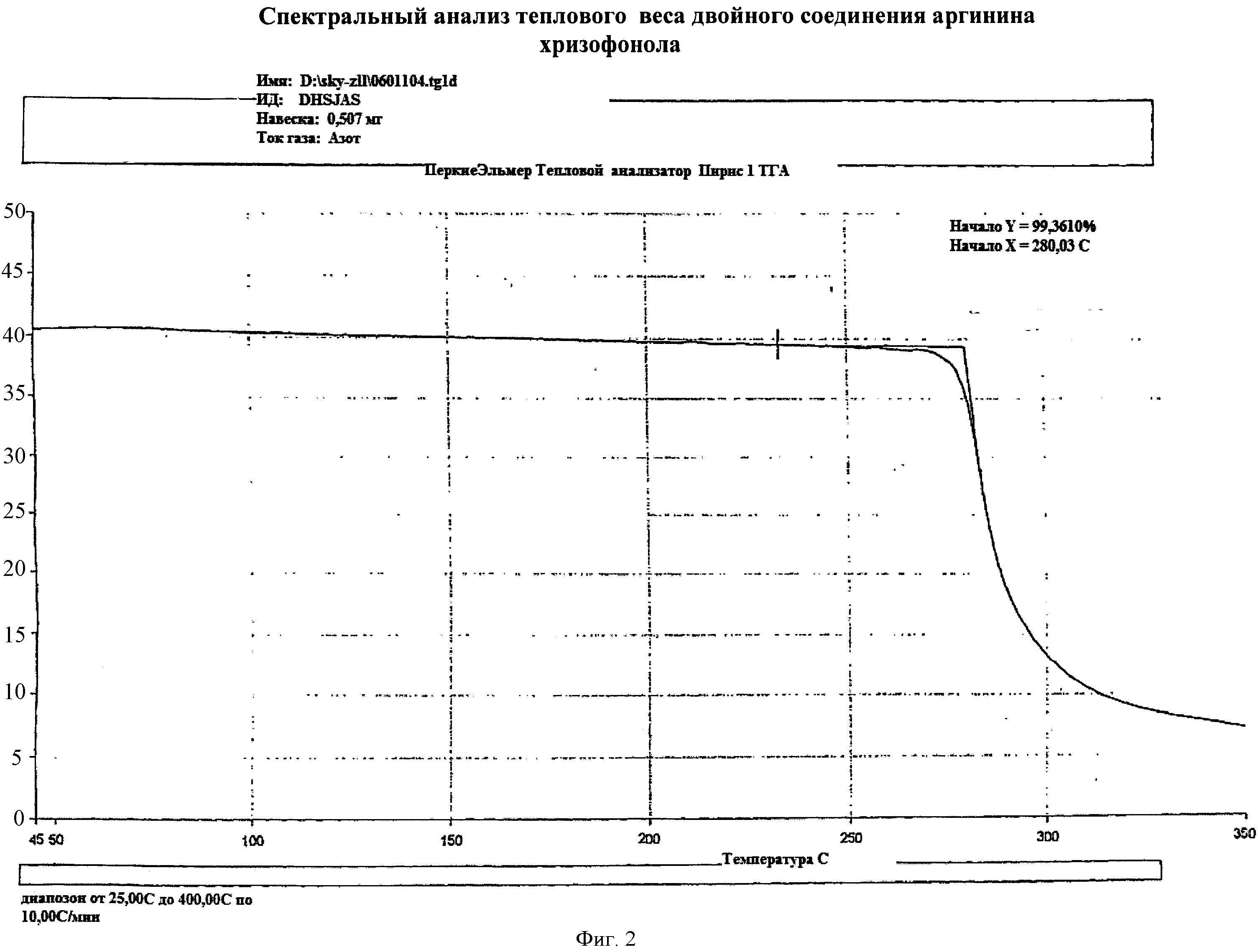
фиг.2. Спектр анализа теплого веса двойного соединения аргинина хризофанола;
фиг.3. фиг.4. Углеродный спектр атомного магнитного резонанса.
Приведенные ниже Примеры предназначены для демонстрации, но не ограничивают воплощения данного изобретения.
Практические примеры:
ПРИМЕР 1. Экстракция и извлечение хризофанола
В 500 г измельченного в порошок ревеня, добавить 2500 мл 60% этилового спирта, в течение 1 часа экстрагировать методом обратной рециркуляции не менее 2-х раз, соединенный экстракт загустить до 1000 мл, дополнить в густой экстракт 100 мл концентрированной соляной кислотой, гидролизовать концентрат в течение 1 часа при температуре в 50°С, остудить, осадок отфильтровать, дополнить 1000 мл 5% раствора NaHCO3, подогреть раствор, отфильтровать, дополнить в фильтрованную жидкость спирт до концентрации его 50-90%, отфильтровать, регулировать значение рН с помощью густой соляной кислоты до того, когда оно станет ниже 3, отфильтровать желтый осадок, промыть водой до нейтрального состояния, перекристаллизовать с помощью ледяной уксусной кислоты до получения вещества, содержание хризофанола в котором должно быть выше 98%.
ПРИМЕР 2. Получение хризофанола
6 г фенола хризофанола поместить в 150 мл раствора смеси уксусного ангидрида и пиридина в соотношении 1:1, оставить полученную смесь на ночь при комнатной температуре, перелить смесь в холодную воду для кристаллизации, отфильтровать, высушить, налить 300 мл раствора смеси уксусного ангидрида и ледяной уксусной кислоты в соотношении 1:1, каплями добавить раствор хромового ангидрида при температуре 45°С, с последующим смешиванием в течение 8 часов при температуре 65°С, вылить полученную смесь в воду, после кристаллизации отфильтровать, дополнить 1000 мл 25% раствора Na2CO3, экстрагировать 3 раза с помощью хлороформа, подогреть раствор Na2CO3 до кипения, дополнить соляной кислотой для окисления, подождать, пока прекратится газообразование, нагревать в течение 1 часа до кипения, остудить, после кристаллизации отфильтровать, промыть водой, перекристаллизовать ледяной уксусной кислотой для получения 2 г вещества, содержание хризофанола в котором будет свыше 98%.
ПРИМЕР 3. Экстракция и извлечение хризофанола с содержанием 50%.
100 г грубого порошка ревеня поместить в подходящую емкость, добавить 2500 мл 60% этилового спирта; подогреть, в течение 1 часа экстрагировать методом обратной рециркуляции не менее 2-х раз, соединенный экстракт загустить до 30% от общего объема оригинального раствора для получения не густого сиропа, при помешивании в течение не более 10 мин добавлять в горячем состоянии концентрированную соляную кислоту в соотношении 1 единица объема густой соляной кислоты на 10 объемов густого экстракта, затем центрифугировать для получения осадка, добавить раствор 5% NaHCO3 в количестве, равном концентрату, подогреть раствор; центрифугировать, отделить верхнюю светлую жидкость, в осадок добавить спирт до достижения его содержания 60-90%, смешивать, центрифугировать, отделить верхнюю светлую жидкость; добавлять концентрированную соляную до значения рН 2, центрифгировать и высушить до получения темно-коричневого порошка.
ПРИМЕР 4. Получение коъюгата хризофанола с аргинином, с 50% содержанием хризофанола
40 г экстракта, содержащего 50% хризофанола, поместить в подходящую емкость, добавить воду, добавить 22 г L-аргинина и подогреть, затем остудить, добавить спирт до достижения его содержания 60-90%, смешивать до растворения, отфильтровать, концентрировать раствор, дбавить этиловый спирт в концентрированный раствор до достижения его содержания 40-80%, выдержать до выпадения осадка, отфильтровать, осушить до получения твердой массы 28 г.
ПРИМЕР 5. Получение коъюгата хризофанола с лизином с 50% содержанием хризофанола
40 г экстракта, содержащего 50% хризофанола, поместить в подходящую емкость, добавить воду, добавить 20 г лизина и подогреть, остудить, затем остудить, добавить спирт до достижения его содержания 50-90%, смешивать до растворения, отфильтровать, концентрировать раствор, добавить этиловый спирт в концентрированный раствор до достижения его содержания 40-80%, выдержать до выпадения осадка, отфильтровать, осушить до получения твердой массы 25 г.
ПРИМЕР 6. Получение конъюгата хризофанола с аргинином
2 г хризофанола поместить в подходящую емкость, добавить этилового спирта до растворения, добавить 2,5 г растворенного в воде L-аргинина, подогреть, перемешивая до растворения хризофанола, отогнать растворитель при пониженном давлении до получения твердого осадка 3,1 г.
ПРИМЕР 7. Получение конъюгата хризофанола с лизином
2 г хризофанола поместить в подходящую емкость, добавить этилового спирта до растворения, добавить растворенного в воде 2,3 г лизина, подогреть, перемешивая до растворения хризофанала, отогнать растворитель при пониженном давлении до получения твердого осадка 2,9 г.
ПРИМЕР 8. Получение конъюгата хризофанола с хитозамином
2 г хризофанола поместить в подходящую емкость, добавить этилового спирта до растворения, добавить растворенного в воде 3 г хитозамина, подогреть, перемешивая до растворения хризофанола, отогнать растворитель при пониженном давлении до получения твердого осадка 3,1 г.
ПРИМЕР 9. Получение конъюгата хризофанола с карнитином
2 г хризофанола поместить в подходящую емкость, добавить этилового спирта до растворения, добавить растворенного в воде 2,5 г карнитина, подогреть, перемешивая до растворения хризофанала, отогнать растворитель при пониженном давлении до получения твердого осадка 3 г.
ПРИМЕР 10. Получение конъюгата хризофанола с глюкозамином
6,3 г глюкозамина растворить в 250 мл дистиллированной воды, при помешивании добавить 2,5 г хризофанола, при нагревании осуществлять рециркуляцию в течение 2-х часов. Затем смесь охладить, добавить 700 мл этилового спирта, центрифугировать и отделить осадок. Часть растворителя отогнать при пониженном давлении до объема 100 мл, затем добавить 70 мл этилового спирта, охладить. Выделенный желтый осадок отфильтровать, перекристаллизовать в этиловом спирте, полученный конъюгат хризофанола-глюкозамина высушить под вакуумом при 40°С.
ПРИМЕР 11. Получение конъюгата экстракта хризофанола с глюкозамином с содержанием хризофанола 50%
6,3 г глюкозамина растворить в 250 мл дистиллированной воды, при помешивании добавить 5 г экстракта, содержащего 50% хризофанола, при нагревании осуществлять рециркуляцию в течение 2-х часов. Затем смесь охладить, добавить 700 мл этилового спирта, центрифугировать и отделить осадок. Часть растворителя отогнать при пониженном давлении до объема 100 мл, затем добавить 70 мл этилового спирта, охладить. Выделенный желтый осадок отфильтровать, перекристаллизовать в этиловом спирте, полученный конъюгат экстракта хризофанола с глюкозамином высушить под вакуумом при 40°С.
ПРИМЕР 12. Получение конъюгата экстракта хризофанола с карнитином с содержанием хризофанола 50%
40 г экстракта, содержащего 50% хризофанола, поместить в подходящую емкость, добавить воду, добавить 22 г карнитина и подогреть, затем остудить, добавить этиловый спирт до достижения его содержания 50-90%, перемешивать до растворения, отфильтровать, концентрировать раствор, затем добавить этиловый спирт до достижения его содержания 40-80%, дать постоять до выпадения осадка, отфильтровать его, высушить до получения твердой массы 27 г.
ПРИМЕР 13. Получение конъюгата экстракта хризофанола с хитозамином с содержанием хризофанола 50%.
40 г экстракта, содержащего 50% хризофанола, поместить в подходящую емкость, добавить воду, добавить 27 г хитозамина и подогреть, затем остудить, добавить этиловый спирт до достижения его содержания 50-90%, перемешивать до растворения, отфильтровать, концентрировать раствор, затем добавить этиловый спирт до достижения его содержания 40-80%, дать постоять до выпадения осадка, отфильтровать его, высушить до получения твердой массы 30 г.
ПРИМЕР 14. Получение 4,5,7-тригидрокси-2-карбоксиантрахинона
6 г эмодина добавить в 200 мл смешанного (1:1) раствора ангидрида уксусной кислоты и пиридина, оставить на ночь при комнатной температуре. Реакционную смесь перекладывают в холодную воду для кристаллизации, затем фильтруют и сушат, добавляют 300 мл смеси (1:1) ангидрида уксусной кислоты и ледяной уксусной кислоты, прокапывают в смесь хромового ангидрида при 45°С, затем перемешивают реакционную смесь в течение 8 часов при температуре 65°С. В реакционную смесь добавить воду, после кристаллизации отфильтровать, добавить 1000 мл 25% раствора (Na2CO3) карбоната натрия, с последующим трехразовым экстрагированием хлороформом. Полученный раствор доводят до кипения, охлаждают и добавляют соляную кислоту для подкисления. После выделения газа, кипятят в течение 1 часа, охлаждают, кристаллизуют выделенные кристаллы фильтруют и промывают водой, затем перекристаллизовывают в ледяной уксусной кислоте до получения 1,9 г 4,5,7-тригидрокси-2-карбоксиантрахинона, содержание которого в сухой массе выше 98%.
ПРИМЕР 15. 1,3-дигидрокси-6-карбоксиантрахинона
Используют 6 г рубиадин-6-метила, далее процесс аналогичен Примеру 16, получают 2 г 11,3-дигидрокси-6-карбоксиантрахинона.
ПРИМЕР 16. Получение конъюгата 4,5,7-тригидрокси-2-карбоксиантрахинона с аргинином
2 г 4,5,7-тригидрокси-2-карбоксиантрахинона помещают в подходящую емкость, для растворения добавляют этанол, добавляют 2,5 г растворенного в воде L-аргинина, добавить раствор хризофанола, нагревать при перемешивании до полного растворения, при пониженном давлении, отогнать растворитель в условиях сниженного давления, полученный осадок является конъюгатом 4,5,7-тригидрокси-2-карбоксиантрахинона с аргинином.
ПРИМЕР 17. Получение конъюгата 4,5,7-тригидрокси-2-карбоксиантрахинона с лизином
2 г 4,5,7-тригидрокси-2-карбоксиантрахинона помещают в подходящую емкость, для растворения добавляют этанол, добавляют 2,2 г растворенного в воде L-аргинина, добавить раствор хризофанола, нагревать при перемешивании до полного растворения, при пониженном давлении отогнать растворитель в условиях сниженного давления, полученный осадок является конъюгатом 4,5,7-тригидрокси-2-карбоксиантрахинона с лизином.
ПРИМЕР 18. Получение конъюгата 4,5,7-тригидрокси-2-карбоксиантрахинона с глюкозамином
Процесс аналогичен Примеру 11, но в нем хризофанол заменен на 4,5,7-тригидрокси-2-карбоксиантрахинон.
ПРИМЕР 19. Получение конъюгата 4,5,7-тригидрокси-2-карбоксиантрахинона с хитозамином
Процесс аналогичен Примеру 8, но в нем хризофанол заменен на 4,5,7-тригидрокси-2-карбоксиантрахинон.
ПРИМЕР 20. Получение конъюгата 4,5,7-тригидрокси-2-карбоксиантрахинона с карнитином
Процесс аналогичен Примеру 9, но в нем хризофанол заменен на 4,5,7-тригидрокси-2-карбоксиантрахинон.
Конъюгаты, полученные способами в примерах 4-14, 15-20, применяются в качестве лекарственного средства для профилактики или лечения диабетической нефропатии, остеоартрита, ревматического или ревматоидного артрита, спаек кишок, восстановления перистальтики кишечника.
ПРИМЕР 21. Получение капсулы хризофанола или экстракта, содержащего хризофанол
Смешивают хризофанол или экстракт, содержащий хризофанол с микрокристаллическим волокном, молочным сахаром, натрия карбоксиметилкрахмалом до равномерного состава, затем смесь протирают через сито 100 мкм, полученный порошок смачивают раствором НРМСЕ5 с содержанием полисорбата 80, затем просеивают полученные гранулы через сито с 20 мкм, полученные влажные гранулы сушат в духовом шкафу под током воздуха при температуре в 50-60°С; сформированные и просеянные гранулы смешивают с стеариновокислым магнием, затем наполняют гранулы в капсулы.
ПРИМЕР 22. Получение капсулы конъюгата хризофанола или экстракта, содержащего хризофанол
Смешивают конъюгат хризофанола или экстракта, содержащего хризофанол, с микрокристаллическим волокном, молочным сахаром, натрия карбоксиметилкрахмалом до равномерного состава, затем смесь протирают через сито 100 мкм, полученный порошок смачивают раствором НРМСЕ5 с содержанием полисорбата 80, затем просеивают полученные гранулы через сито с 20 мкм, полученные влажные гранулы сушат в духовом шкафу под током воздуха при температуре в 50-60°С; сформированные и просеянные гранулы смешивают с стеариновокислым магнием, затем наполняют гранулы в капсулы.
ПРИМЕР 23. Получение таблетки хризофанола или экстракта, содержащего хризофанол
Смешивают хризофанол или экстракт, содержащий хризофанол, с микрокристаллическим волокном, молочным сахаром, натрия карбоксиметилкрахмалом до равномерного состава, затем смесь протирают через сито 100 мкм, полученный порошок смачивают раствором НРМСЕ5 с содержанием полисорбата 80, затем просеивают полученные гранулы через сито с 20 мкм, полученные влажные гранулы сушат в духовом шкафу под током воздуха при температуре в 50-60°С, сформированные и просеянные гранулы смешивают с стеариновокислым магнием, затем смесь таблетируют.
ПРИМЕР 23. Получение таблетки конъюгата хризофанола или экстракта, содержащего хризофанол
Смешивают конъюгат хризофанола или экстракта, содержащего хризофанол, с микрокристаллическим волокном, молочным сахаром, натрия карбоксиметилкрахмалом до равномерного состава, затем смесь протирают через сито 100 мкм, полученный порошок смачивают раствором НРМСЕ5 с содержанием полисорбата 80, затем просеивают полученные гранулы через сито с 20 мкм, полученные влажные гранулы сушат в духовом шкафу под током воздуха при температуре в 50-60°С, сформированные и просеянные гранулы смешивают с стеариновокислым магнием, затем смесь таблетируют.
ПРИМЕР 25. Получение кишечнорастворимой таблетки конъюгата хризофанола или экстракта, содержащего хризофанол
С высушенным конъюгатом хризофанола или экстракта, содержащего хризофанол, смешали в равных долях крахмал, затем смесь гранулировали путем добавления раствора 0,5% камфарного масла в этаноле, из высушенного гранулята сделали 1000 таблеток. Покрытием 600 мл, представляющим собой хорошо смешанную смесь акриловой кислоты 2 с добавлением касторового масла и 95% этанола, покрывают таблетки методом распыления.
ПРИМЕР 26. Получение кишечнорастворимой таблетки хризофанола или экстракта, содержащего хризофанол
Конъюгат хризофанола или экстракта, содержащего хризофанол, фталевый ангидрид растворить в 500 мл растворе смеси ацетона и алкоголя (1:1). Полученный раствор медленно залить в н-гексан до формирования осадка, который затем сушат и направляют на капсулирование в простые кишечнорастворимые желатиновые капсулы.
ПРИМЕР 27. Получение капсул с замедленным высвобождением из хризофанола или экстракта, содержащего хризофанол
Растворить хризофанол или экстракт, содержащий хризофанол, и поливидон распустить в некотором количестве этанола. Смесь нагреть при пониженном давлении до испарения этанола, полученный твердый осадок протереть через сито 100 мкм, затем смешать с микрокристаллическим волокном и гипромелозой К4М, просеять через сито 60 мкм, для гранулирования добавить соответствующее количество 3% водного раствора гипромелозы (Е5), затем смесь продавливают через сито 20 мкм.
Высушенные в токе воздуха при температуре в 40-50°С гранулы просеивают через сито 20 мкм, добавляют тальк в предусмотренном количестве, после тщательного перемешивания капсулируют в требуемом по рецепту количестве.
ПРИМЕР 28. Получение капсул с замедленным высвобождением из конъюгата хризофанола или экстракта, содержащего хризофанол
Тщательно смешать конъюгат хризофанола или экстракта, содержащего хризофанол, с микрокристаллическим волокном и гипромелозой К4М, просеять через сито 60 мкм. Для гранулирования добавить соответствующее количество 3% водного раствора гипромелозы (Е5), полученные гранулы продавить через сито 20 мкм. Высушенные в токе воздуха при температуре в 40-50°С гранулы просеивают через сито 20 мкм, добавляют тальк в предусмотренном количестве, после тщательного перемешивания капсулируют в требуемом по рецепту количестве.
ПРИМЕР 29. Получение таблетки с замедленным высвобождением из хризофанола или экстракта, содержащего хризофанол
Растворить хризофанол или экстракт, содержащий хризофанол, и поливидон распуститьв некотором количестве этанола. Смесь нагреть при пониженном давлении до испарения этанола, полученный твердый осадок протереть через сито 100 мкм, затем смешать с молочным сахаром гипромелозой К4М, просеять через сито 60 мкм, для гранулирования добавить соответствующее количество 3% водного раствора гипромелозы (Е5), затем смесь продавливают через сито 20 мкм. Высушенные в токе воздуха при температуре в 40-50°С гранулы просеивают через сито 20 мкм, добавляют тальк в предусмотренном количестве, после тщательного перемешивания направляют на таблетирование для получения нужной таблетки.
ПРИМЕР 30. Получение таблетки замедленного высвобождения из конъюгата хризофанола или экстракта, содержащего хризофанол
Тщательно смешать конъюгат хризофанола или экстракта, содержащего хризофанол, с молочным сахаром и гипромелозой К4М, просеять через сито 60 мкм. Для гранулирования добавить соответствующее количество 3% водного раствора гипромелозы (Е5), полученные гранулы продавить через сито 20 мкм. Высушенные в токе воздуха при температуре в 40-50°С гранулы просеивают через сито 20 мкм, добавляют тальк в предусмотренном количестве, после тщательного перемешивания смесь таблетируют.
В указанном примере еще могут быть выбраны другие вспомогательные вещества, а именно: гидроксипропил крахмал, гидроксипропил целлюлоза, натрия карбоксиметилкрахмал, карбоксиметилцеллюлоза, кальция карбоксил этилцеллюлоза, декстрин, крахмал, фосфат кальция, дифосфат кальция, сульфат кальция, карбонат кальция, циклодекстрин, микрокристаллическая целлюлоза и др.; смачивающие и клеи, такие как тальк, поливидон, натрия карбоксиметилцеллюлоза, гипромеллоза; смазывающие материалы, такие как тальк, стеариновая кислота, стеарат магния, стеарат кальция, мелкозернистый силикагель, гидрогенизированное растительное масло, полиэтиленгликоль 4000 и 6000; увлажнители, такие как додецилсульфат натрия, полисарбит 80; конструкционные материалы, такие как гипромеллоза, этилцеллюлоза и т.д.
ПРИМЕР 31. Желатиновая капсула хризофанола или экстракта, содержащего хризофанол
Растворить хризофанол или экстракт, содержащий хризофанол, в растворе соевого масла, изготовить из этого раствора желатиновую капсулу. В каждой капсуле содержание хризофанола или общее содержание хризофанола составляет 50 мг.
В указанном примере в составе желатиновой капсулы можно выбрать еще следующие добавки: растворитель, как поликликоль 400, масло хлопчатника, масло арахиса, кунжутное масло, кукурузное масло, оливковое масло и др.; средства солюбилизации и совместимые растворители, как полисорбат 80, кунжутное масло полиоксиэтилена, бензиловый эфир бензойной кислоты, лактиловый этиловый эфир, фосфатид, и т.д.; антиокислитель, как пропиловый эфир галловой кислоты, бутил-фенол (ВНТ), витамин Е, и т.д. Пропорция желатина, глицерина и воды в желатиновой капсуле может быть следующей, например, целесообразная пропорция желатина/глицерина/воды соответственно 1:0.3~0.4:0.7-1.4. Другие компоненты могут быть добавлены в оболочку капсулы: консерванты, такие как метил-р-гидроксибензоат, этил-р-гидроксибензоат, пропил параксидрокси бензоат, бутил-п-гидроксибензоат и т.д.; пластификаторы, такие как сорбидол и т.д.; стабилизаторы, например гуммиарабик и т.д.; двуокись титана, бария сульфат, осажденный карбонат кальция и т.д.
ПРИМЕР 32. Получение инъекционной суспензии из хризофанола или экстракта, содержащего хризофанол
В токе азота добавлять фофолипид сои в соевое масло и смешивать их до растворения, добавить глицерин, хризофанол или экстракт, содержащий хризофанол, перемешивать смесь до растворения. При постоянном перемешивании медленно добавлять инъекционную воду, эмульгировать в двухстепенном эмульгаторе. В токе азота при пониженном давлении профильтровать через стеклянный фильтр №4, разлить продукцию в бутылки, закупорить путем закатки, стерилизовать за 15 минут при температуре в 121°С, после стерилизации постепенно охладить.
В данном примере еще можно выбрать следующие добавки, например инъекционные масла, как этиловый олеат, полиэтиленгликоль 400, хлопковое масло, арахисовое масло, кунжутное масло, кукурузное масло, оливковое масло, изопропилмиристат и т.д.; антиоксиданты, такие как пропилгаллат, Т-бутил фенол (ВНТ), витамин Е, и т.д.; поверхностно-активные вещества, такие как полисорбит, эфир полиоксиэтилена касторового масла, фосфолипиды, плюроник т.д.
ПРИМЕР 33. Получение инъекции конъюгата хризофанола или экстракта, содержащего хризофанол
В конъюгат хризофанола или экстракта, содержащего хризофанол, добавить инъекционную воду до полного растворения, добавить 0,1% активный уголь, нагреть в течение 15 минут до кипения. Полученную смесь фильтруют до удаления поверхностных веществ, корректируют значение рН до 5.0~7.0, если не была измерено значение рН в промежуточном продукте, после чего разливают во флаконы, укупоренные флаконы стерилизуют в течение 30 мин при температуре 100°С.
ПРИМЕР 34. Получение инъекции из хризофанола или экстракта, содержащего хризофанол
Хризофанол или экстракт, содержащий хризофанол (или его конъюгат), поместить в подходящую емкость, добавить 9000 мл инъекционной воды, тщательно перемешивать до растворения при ультразвуковой обработке, добавить хлористый натрий и смешивать до полного растворения, дополнительно добавить инъекционную воду до 10000 мл, профильтровать через 0,22 мкм микропористую мембрану, после чего разливают во флаконы, укупоренные флаконы стерилизуют в течение 30 мин при температуре 100°С.
ПРИМЕР 35. Получение лиофилизированной инъекции из хризофанола или экстракта, содержащего хризофанол
Хризофанол или экстракт, содержащий хризофанол, аргинин или лизин помещают в подходящую емкость, добавляют 9000 мл инъекционной воды, тщательно перемешивают до растворения при ультразвуковой обработке, добавляют маннитол и перемешивают до полного растворения. В течение 30 мин добавляют 0,1% инъекционный активированный уголь, обезуглероженный раствор отсасывают в чистую емкость через титановой фильтр, добавляют инъекционную воду до 10000 мл, в течение 5 минут перемешать раствор до равномерного смешивания, профильтровать через 0,22 мкм микропористую мембрану, затем разлить во флаконы, частично укупоренные флаконы подаются в шкаф для лиофилизации, установить датчики температуры, закрыть дверку шкафа, осуществить лиофилизацию по предусмотренным требованиям. Окончательная сушка может быть осуществлена при температуре 35°С или выше в течение 2 часов. Затем флаконы герметизируют, выпускают газ и вынимают из шкафа.
ПРИМЕР 36. Получение лиофилизированной инъекции из конъюгата хризофанола или экстракта, содержащего хризофанол
В конъюгат хризофанола (может быть конъюгат хризофанола с аргинином, лизином глюкозамином, хитозамином) добавляют 9000 мл инъекционной воды, тщательно перемешивают до растворения при ультразвуковой обработке, добавляют маннитол и перемешивают до полного растворения. В течение 30 мин добавляют 0,1% инъекционный активированный уголь, обезуглероженный раствор отсасывают в чистую емкость через титановой фильтр, добавляют инъекционную воду до 10000 мл. В течение 5 мин перемешать раствор до равномерного смешивания, профильтровать через 0,22 мкм микропористую мембрану, затем разлить во флаконы, частично укупоренные флаконы подаются в шкаф для лиофилизации, установить датчики температуры, закрыть дверку шкафа, осуществить лиофилизацию по предусмотренным требованиям. Окончательная сушка может быть осуществлена при температуре 35°С или выше в течение 2 часов. Затем флаконы герметизируют, выпускают газ и вынимают из шкафа.
ПРИМЕР 37. Получение инъекционной суспензии из хризофанола или экстракта, содержащего хризофанол
Хризофанол или экстракт, содержащий хризофанол, раздробить при помощи струи газа до получения гранул зернистостью менее 10 мкм. Растворить фосфат гидрофосфат калия и дигидрофосфат калия в инъекционной воде, добавить натрия карбоксиметилкрахмал, затем растворить полностью при температуре в 60°С, отфильтровать. Полученный после микронизации хризофанол или экстракт, содержащий хризофанол, поместить в емкость, добавить полисорбит 80 и измельчать до мелкой пасты, перемешивать в коллоидной мельнице 5-10 раз. Полученная смесь была измерена и квалифицирована в соответствии с обычными требованиями, ампутирована и стерилизована в токе пара в течение 30 мин при 100°С.
В данном примере в составе инъекции еще могут быть выбраны следующие добавки: средство солюбилизации, как полисорбат, плюроник F-68, кунжутное масло полиоксиэтилена, и т.д.; совместный растворитель, как соединения аминокислоты, включая гистамин, лизин, карнитин, соединения амидоорнитина включая мочевину, ацетамид, тиокарбамид, бензамид, и т.д., соединение с гидроксилом или карбоксилом, как сахароза, лимонная кислота и соль лимонной кислоты, молочная кислота, салициловокислый натрий, и т.д.; суспензивное средство, как натрия карбоксиметилкрахмал, полиприн, карбоксиметилцеллюлоза и др.; регулятор рН-значения, как лимонная кислота или соль лимонной кислоты, фосфат и др.; растворитель, как инъекционная вода, инъекционный активированный уголь, инъекции спирт, пропилен гликоль и др.
ПРИМЕР 38. Получение раствора для приема внутрь конъюгата хризофанола-аргинина
Конъюгат хризофанола-аргинина при помешивании растворить в отчищенной воде до полного растворения, добавить 85% сироп моносахарида, довести значение рН до 3.5~7.0, затем добавить консервант 0,3% бензоат натрия, довести до кипения в течение 30 мин, затем фильтруют через 0,8 мкм микропористых мембран, разливают и укупоривают в темно-коричневый стеклянный флакон емкостью 20 мл, затем стерилизуют в течение 30 мин при температуре в 100°С.
ПРИМЕР 39. Получение инъекции конъюгата хризофанола-аргинина
В конъюгат хризофанола-аргинина, добавить инъекционную воду, перемешивать до полного растворения, добавить 0.1% активный инъекционный уголь, нагреть, довести до кипения в течение 15 мин, отфильтровать для удаления угля, скорректировать значение рН до 5.0~7.0, измерить содержание и рН промежуточного продукта, после подтверждения соответствия ампутировать и стерилизовать в течение 30 мин при температуре 100°С.
ПРИМЕР 40. Получение инъекционной суспензии конъюгата хризофанола-аргинина (98.0-99.9%:0.1-2.0%)
Поместить хризофанол в резервуар-смеситель и нагреть до 80°С, добавить соевый фосфолипид, тщательно перемешать до однородной массы. Добавить инъекционную воду в циркуляционный резервуар для гомогенизации под высоким давлением, затем добавить глицерин, смесь нагревают до 75°С и смешивают до однородной массы. Затем медленно через дополнительное отверстие добавляют смесь конъюгата хризофанола-аргинина и фофолипида. После добавления смеси отверстие закрыть, отрегулировать давление для гомогенизации между 10 МПа и 32 МПа, осуществлять циркуляцию пять раз, добавить небольшое количество L-аргинина или лизина, затем один раз осуществить отбор пробы для теста, затем разлить, укупорить и стерилизовать.
ПРИМЕР 41. Получение таблетки конъюгата хризофанола-лизина
Конъюгат хризофанола-лизина просеять через сито 160 мкм, добавить микрокристаллическое волокно, молочный сахар, натрия карбоксиметил крахмала, просеянные через решето с сито 100 мкм, смешать конъюгат с указанными вспомогательными веществами, для гранулирования добавить соответствующее количество 10% суспензии крахмала, продавить гранулы через сито 20 мкм, просушить их в токе воздуха при температуре 60°С, сформированные сухие гранулы просеять через сито 20 мкм, затем смешать гранулы с стеариновокислым магнием, направить на таблетирование, затем покрыть пленочной оболочкой или кишечнорастворимой оболочкой.
ПРИМЕР 42. Получение капсулы конъюгата хризофанола-лизина
Конъюгат хризофанола-лизина просеять через сито 160 мкм, добавить микрокристаллическое волокно, молочный сахар, натрия карбоксиметилкрахмал, просеянные через решето с сито 100, смешать конъюгат с указанными вспомогательными веществами, для гранулирования добавить соответствующее количество 10% суспензии крахмала, продавить гранулы через сито 20 мкм, просушить их в токе воздуха при температуре 50°С; сформированные сухие гранулы просеять через сито 20 мкм, затем смешать гранулы с стеариновокислым магнием и тонкозернистым силикагелем и направить на капсулирование.
ПРИМЕР 43. Получение раствора для приема внутрь конъюгата хризофанола-лизина
Конъюгат хризофанола-лизина растворить при помешивании до полного растворения в отчищенной воде, добавить 85% раствор моносахарида, скорректировать значение рН до 5.5~8.5, добавить 0,3% консервант бензоат натрия в качестве 0,3% консерванта, профильтровать через 0,22 мкм микропористую мембрану, после чего разливают во флаконы, укупоренные флаконы стерилизуют в течение 30 мин при температуре 100°С.
ПРИМЕР 44. Получение инъекции конъюгата хризофанола-лизина
В конъюгат хризофанола-лизина, добавляют инъекционную воду до полного растворения, добавляют 0,1% инъекционные активный уголь, доводят до кипения в течение 15 мин, фильтруют для удаления угля, корректируют значение рН до 5.5~8.5, измеряют содержание промежуточного продукта и значение рН, после чего ампулируют, стерилизуют в течение 30 минут при температуре в 100°С.
ПРИМЕР 45. Получение инъекции конъюгата хризофанола-аминокислоты, применяемой в остеопатии
В конъюгат хризофанола-аминокислоты добавляют инъекционную воду до полного растворения, добавляют 0,1% инъекционный активный уголь, доводят до кипения в течение 15 мин, фильтруют для удаления угля, корректируют значение рН до 5.5-8.5, измеряют содержание промежуточного продукта и значение рН, после чего ампулируют, стерилизуют в течение 30 мин при температуре в 100°С.
ПРИМЕР 46. Сравнение водных инъекций солей хризофанола и конъюгатов хризофанола или его производного или экстракта, содержащего хризофанол
Соответствующее количество соли хризофанола или конъюгатов хризофанола или его производного или экстракта, содержащего хризофанол, поместили в 10 мл пробирку, добавили воды, помешивали до полного растворения, получили препарат с водным носителем, скорректировали значения рН натриевой и калиевой соли хризофанола или экстракта, содержащего хризофанол. Результат представлен в Таблице 4.
ПРИМЕР 47. Сравнение безопасности водных инъекций натриевой соли хризофанола и конъюгата хризофанола-аргинина
Три раза через день в ухо кроликов в краевую вену в стерильных условиях инъекционно вводили натриевую соль хризофанола, конъюгат хризофанола-аргинина и 0,9% хлористый натрий. Результаты показали, что, по сравнению с контрольной группой, конъюгат хризофанола-аргинина не раздражает «маргинальные вены» уха кролика, не возникает тромбоза и других фармакологических изменений. Натриевая соль хризофанола раздражает «маргинальные вены» ушей и сосудов уха кролика, наблюдается некоторое расширение вен, незначительный некроз и воспалительная реакция окружающих тканей.
ПРИМЕР 48. Эффективность лечения 2-го типа диабетической нефропатии у крыс конъюгатом хризофанола-аргинина.
Тест 1. Влияние конъюгата хризофанола-лизина на диабет и диабетическую нефропатию крыс, страдающих ожирением
Лекарственное средство: конъюгат хризофанола-лизина
Животной модели крысы, страдающей диабетом: крыса (вес около 180 г), после кормления пищей с высоким содержанием жира и сахара осуществить вспрыскивание стрептозотоцина (STZ) по сублетальной дозе (25 мг/кг), чтобы индуктировать сахарный диабет от патогенных доз (25 мг/кг) стрептозотоцина (СТЗ), чтобы вызвать появление диабета. Модель обладает характеристиками умеренной гипергликемии, гиперлипидемии и резистентности к инсулину, а также наблюдаются патологические изменения типичные при диабетической нефропатии.
Экспериментальная группа
1. Сравнительная группа «Обыкновенный корм»: дистиллированная вода.
2. Группа «Модель сахарного диабета»: дистиллированная вода.
3. Группа «Лечение сахарного диабета конъюгатом хризофанола-аргинина»: через 1 месяц после вспрыскивания стрептозотоцина (STZ) вводили конъюгат хризофанола-аргинина [подготовлен на дистиллированной воде, внутрижелудочный настой для крыс по 90 мг/кг (0,209 ммоль/кг) доза], далее по сокращенной форме «Группа лечения-1».
4. Группа «Лечения сахарного диабета с натриевой солью хризофанола: через 1 месяц после вспрыскивания стрептозотоцина (STZ) вводили натриевую соль хризофанола [подготовлен с дистиллированной водой, внутрижелудочный настой для крыс, по 65 мг/кг (0,212 ммоль/кг) доза)], далее по сокращенной форме «Группа лечения-2»
5. Группа «Профилактика сахарного диабета с хризофанолом-аргинином»: через 1 неделю после вспрыскивания стрептозотоцина (STZ) вводили конъюгат хризофанола-аргинина [готовился на дистиллированной воде и внутрижелудочном настое для крыс, по 90 мг/кг (0,209 ммоль/кг) доза], далее по сокращенной форме «Группа профилактики-1».
6. Группа «Профилактика сахарного диабета с натрием хризофанола» через 1 неделю после вспрыскивания стрептозотоцина (STZ) вводили натриевую соль хризофанола [готовится на дистиллированной воде и внутрижелудочном настое для крыс, по 65 мг/кг (0,212 ммоль/кг) доза], далее по сокращенной форме «Группа профилактики-2».
Результаты представлены в Таблицах 5 и 6.
1. Влияние на выделение белка в моче
Для крыс группы по предотвращению и лечению группы, содержание белка моче значительно ниже, чем у модели группы 6 месяцев после введения конъюгата хризофанола-лизина, существует значительная разница между ними, как показано в таблице 1, 2.
2. Влияние на показатели индекса массы почки
Для крыс группы «Группы профилактики» по предотвращению и лечению группы, почки вес и индекс веса почек значительно ниже, чем у модели «Модельной группы», после введения конъюгата хризофанола-лизина, наблюдается существенное различие между ними, как показано в таблице 1.
3. Влияние на сахар крови
Через 6 месяцев после принятия крысой «Группа профилактики» препарата конъюгата хризофанола-лизина уровень сахара крови оказывается ниже уровня у «Модельной группы», тем не менее, разница имеет заметное значение; а для «Модельной группы» уровень сахара крови незаметно изменяется, см. Таблицы 5, 6.
4. Влияние на липиды крови
Через 6 месяцев после принятия крысой «Группа профилактики» и «Группа лечения» препарата конъюгата хризофанола-лизина содержание холестерина и тристеарина в крови оказываются значительно ниже соответствующих величин у «Модельной группы», тем не менее, разница имеет заметное значение, см. Таблицы 1, 2.
5. Влияние на стабильный уровень содержания сахара крови и стабильный уровень содержания инсулина
Уровень базового плазменного уровня глюкозы (steady-state plasma glucose - SSPG) у крысы с сахарным диабетом значительно выше уровня у крысы сравнительной группы «Обыкновенный корм», это объясняется тем, что у заболевшей сахарным диабетом крысы имеется заметное инсулиноустойчивое сопротивление. Через 6 месяцев SSPG у «Группы профилактики» значительно снижается; подобно этому, через 6 месяцев SSPG у «Группы лечения» тоже оказывается значительно ниже SSPG у «Модельной группы» с сахарным диабетом, см. Таблицы 1 и 2.
ПРИМЕР 49. Эксперимент о влиянии хризофанола-лизина на массу тела животного, страдающего ожирением
1. Мыши, страдающие ожирением, гипергликемией
(1) 9-недельные тучные мыши с гипергликемией были случайным образом разделены: «Группа натриевой соли хризофанола», «Группа без лечения», «Группа росиглитазона», «Группа хризофанола-лизина с большой дозой» и «Группа хризофанола-лизина с маленькой дозой», в каждой группе по 6 мышей. Мыши в городе Куньмин были использованы в качестве контрольной группы, получали обычный корм с обычной водой. Конъюгат хризофанола-лизина устраивается с дистиллированной водой по дозе 180 мг/кг (0,418 ммоль/кг) и 90 мг/кг (0,209 ммоль/кг) и вливали в желудок. Доза для «Группы натрия хризофанола» будет 130 мг/кг (0,424 ммоль/кг), смесь растворяли дистиллированной водой для внутрижелудочного введения. Доза для «Группы росиглитазона» будет 4 мг/кг, смесь растворяли дистиллированной водой для внутрижелудочного введения. Другим группам внутрижелудочно вводили дистиллированную воду с одинаковым объемом каждый день и последовательно в течение 12 неделей. Массу тела животных, уровень сахара в крови измеряли регулярно, проводился статистический анализ, результаты были приведены в Таблицах 7 и 8.
(2) Результаты показывают, что по сравнению с «Группой без лечения» через 6 неделей после принятия мышами, страдающими ожирением с гипергликемией, конъюгата хризофанола-лизина вес и уровень сахара крови мыши заметно изменяются; через 9 недель после принятия лекарства значительно изменяются, что объясняет, что конъюгат снижает сахар крови и вес мышей, страдающих ожирением и сахарным диабетом.
2. Крысы, прокормленные пищей с высоким содержанием жира и сахара
(1) Животные и группировка
Группа А: крысы, прокормленные обыкновенным кормом, через 4 недели ежедневно в течение 3-х недель, для контроля, осуществляли внутрижелудочное введение дистиллированной воды.
Группа В: крысы, прокормленные кормом с высоким содержанием сахара и жира, через 4 недели ежедневно в течение 3-х недель, для контроля, в качестве модели, осуществляли внутрижелудочное введение дистиллированной.
Группа С: крысы, прокормленные кормом с высоким содержанием сахара и жира, через 4 недели ежедневно в течение 3-х недель осуществляли внутрижелудочное введение конъюгата хризофанола-лизина [доза 90 мг/кг (0.209 ммоль/кг), в дистиллированной воде].
Группа D: крысы, прокормленные кормом с высоким содержанием сахара и жира, через 4 недели ежедневно в течение 3-х недель осуществляли внутрижелудочное введение конъюгата хризофанола-лизина [доза 45 мг/кг (0. 105 ммоль/кг) в дистиллированной воде).
Группа Е: крысы, прокормленные кормом с высоким содержанием сахара и жира, через 4 недели ежедневно в течение 3-х недель осуществляли внутрижелудочное введение конъюгата хризофанола-лизина [доза 65 мг/кг (0.212 ммоль/кг), в дистиллированной воде]
(2) Результаты
Через 4 недели после кормления с высоким содержанием сахара и жира вес групп В, С, D, Е значительно повышается по сравнению с группой А, что объясняет то, что после принятия корма с высоким содержанием сахара и жира у крысы уже индуктирован адипоз.
ПРИМЕР 50. Получение конъюгата 1,3-дигидрокси-6-карбоксиантрахинона с аргинином.
Процесс аналогичен Примеру 6, но в нем хризофанол заменяется на 1,3-дигидрокси-6-карбоксиантрахинон. Конъюгат используется в качестве лекарственного средства для лечения диабетической нефропатии.
ПРИМЕР 51. Получение конъюгата 1,3-дигидрокси-6-карбоксиантрахинона с лизином.
Процесс аналогичен Примеру 7, но в нем хризофанол заменяется на 1,3-дигидрокси-6-карбоксиантрахинон. Конъюгат используется в качестве лекарственного средства для лечения диабетической нефропатии, остеоартрита, ревматического или ревматоидного артирита.
ПРИМЕР 52. Получение конъюгата 1,3-дигидрокси-6-карбоксиантрахинона с хитозамином.
Процесс аналогичен Примеру 8, но в нем хризофанол заменяется на 1,3-дигидрокси-6-карбоксиантрахинон. Конъюгат используется в качестве лекарственного средства для лечения диабетической нефропатии.
ПРИМЕР 53. Получение конъюгата 1,3-дигидрокси-6-карбоксиантрахинона с карнитином.
Процесс аналогичен Примеру 9, но в нем хризофанол заменяется на 1,3-дигидрокси-6-карбоксиантрахинон. Конъюгат используется в качестве лекарственного средства для лечения диабетической нефропатии, остеоартрита, ревматического или ревматоидного артрита.
ПРИМЕР 54. Получение конъюгата 1,3-дигидрокси-6-карбоксиантрахинона с лиустразином.
Процесс аналогичен Примеру 10, но в нем хризофанол заменяется на 1,3-дигидрокси-6-карбоксиантрахинон. Конъюгат используется в качестве лекарственного средства для лечения диабетической нефропатии.
ПРИМЕР 55. Получение конъюгата 1,3-дигидрокси-6-карбоксиантрахинона с глюкозамином.
Процесс аналогичен Примеру 6, но в нем хризофанол заменяется на 1,3-дигидрокси-6-карбоксиантрахинон. Конъюгат используется в качестве лекарственного средства для лечения диабетической нефропатии.
Полученные в примерах 53~58 конъюгаты применяются в качестве лекарственного средства для излечения или восстановления перистальтики кишечника, или для профилактики спаек кишок, или для лечения остеоартрита, ревматического или ревматоидного артрита
ПРИМЕР 56. Проверка эффективности работы хризофанола-аргинина по восстановлению перистальтики кишечника, или для профилактики спаек Тест 1: Влияние хризофанола-аргинина на проницаемость капилляров мышей
Шестьдесят (60) самцов мышей, весом от 18 до 22 г, были случайным образом разделены на пять групп, а именно: «Сравнительная модельная группа», «Группа Домперидона», «Группа натриевой соли хризофанола», «Группа хризофанола-глюкозамина большой дозы» и «Группа хризофанола-глюкозамина маленькой дозы», в каждой группе по 12 мышей. Количество вводимого препарата рассчитывается из 0.20 мл/10 г, всем одинаковый объем препарата. После введения препарата, испытания проводились в соответствии с методом, описанным в литературе [Чэнци, Методика фармакологического исследования китайского лекарства 1994: 356], полученные значения были измерены и зарегистрированы. Результаты эксперимента представлены в Таблице 10.
Результаты экспериментов показывают, что у «Группы хризофанола-аргинина большой дозы», «Группы хризофанола-аргинина маленькой дозы», «Группы натриевой соли хризофанола» по сравнению в «Сравнительной модельной группой» препарат оказывает заметное влияние на проницаемости капилляров у мышей.
Тест 2: Влияние хризофанола-аргинина на формирование гранулемы у крыс
Крысы были случайным образом разделены на 5 групп (Сравнительная модельная группа, Группа индометацина. Группа хризофанола-аргинина большой дозы, Группа хризофанола-аргинина маленькой дозы, Группа натриевой соли хризофанола), по 10 крыс в каждой группе, построили модели в зависимости от метода, описанного в литературе [Сюй Шуюнь, Методика фармакологического эксперимента (Третье Издание): 918], препарат вводили со дня начала работы. Для крыс индометациновой группы, препарат вводился внутримышечно в дозировке 10 мг/кг, объем внутрижелудочно введенного препарата 0,4 мл/100 г крыс. Через 2 недели у убитых мышей рассчитали вес нетто-грунуляцию по известному способу. Результаты представлены в Таблице 11.
Результаты показывают, что по сравнению со сравнительной модельной группой в группе хризофанола-аргинина большой дозы, группе хризофанола-аргинина маленькой дозы, группе натревой соли хризофанола препарат имеет заметное влияние на торможение образования гранулемы у крыс Р<0.01.
Тест 3: Влияние хризофанола-аргинина на перистальтику у мышей
Пятьдесят мышей самцов весом от 18 до 22 г были случайным образом разделены на пять групп, а именно «Сравнительная модельная группа», «Группа Домперидона», «Группа натрия хризофанола», «Группа хризофанола-глюкозамина большой дозы» и «Группа хризофанола-глюкозамина маленькой дозы», в каждой группе по 10 мышей. Осуществляли запрет на прием пищи, но не был разрешен прием воды, лекарство вводили в вену, затем тотчас же провели испытания согласно известному способу [Сюй Шуюнь, Методика фармакологического эксперимента (Третье Издание): 1313], рассчитали коэффициент реактивности желудочно-кишечного тракта. Результаты эксперимента представлены в Таблице 12.
Результаты испытаний показали, что по сравнению с модельной группой в группах хризофанола-аргинина большой дозы, хризофанола-аргинина маленькой дозы, натриевой соли хризофанола препарат играет заметную роль в реактивности желудочно-кишечного тракта, Р<0.01.
Тест 4: Влияние хризофанола-аргинина на спайку кишок у крыс
В течение 12 ч крысам не давали пищу создания модели описанной в литературе [Сюй Шуюнь, методология в фармакологическом эксперименте (третий вариант): 1335]. Крыс случайным образом разделены на пять групп, а именно: «Сравнительная модельная группа», «Группа дексаметазона», «Группа натрия хризофанола», «Группа хризофанола-глюкозамина большой дозы» и «Группа хризофанола-глюкозамина маленькой дозы», по 12 крыс в каждой группе. Ежедневно один раз вводился препарат из расчета 0,4 мл/100 г, для сравнительной модельной группы вводили NS одинакового объема, в сравнительной группе вводили дексаметазон днем через день по дозе в 10 мг/кг, объем введенного препарата одинаков для всех групп. На 7-й день после эксперимента крысы были убыты, затем проведена лапаротомия. Результаты по анализу классификаций спаек кишок (применялся Ridit-анализ) сведены в Таблицу 13. Результаты эксперимента представлены в Таблице 14.
Результаты показали, что по сравнению с модельной группой группы хризофанола-аргинина большой дозы, хризофанола-аргинина маленькой дозы, натриевой соли хризофанола по классификации спайки кишок имеют статистическое значение (Р<0.05).
ПРИМЕР 57. Влияние конъюгатов хризофанола-глюкозамина для лечения артрита
1. Влияние хризофанола-глюкозамина на ксилол-индуцированную опухоль ушной раковины у мышей
Пятьдесят самцов мышей в г.Куньмин были выбраны, весом 18-22 г каждая, и случайным образом разделены на пять групп, а именно: «Сравнительная модельная группа», «Группа асприна», «Группа натриевой соли хризофанола», «Группа хризофанола-глюкозамина большой дозы» и «Группа хризофанола-глюкозамина маленькой дозы», в каждую группу 10 мышей. Ежедневно в течение 3-х дней вводился препарат путем внутрижелудочного вливания по 0, 2 мл/10 г веса, в сравнительной группе внутрижелудочно вводился физиологический раствор. Через 60 минут после последнего эксперимента были проведены анализы согласно известному способу [Сюй Шуюнь Методика фармакологического эксперимента (Третье Издание): 911], был рассчитан коэффициент опухоли ушной раковины и влияние препарата (коэффициент торможения). Результаты эксперимента представлены в Таблице 15.
Результаты показывают, что хризофанол-аминоглюкоза оказывает заметное влияние на торможение образования опухоли ушной раковины мыши, вызванной н-ксилолфенолом, по сравнению со сравнительной модельной группой (Р<0.01).
2. Влияние хризофанола-глюкозамина на острый экссудативный плеврит и лейкопению
Сорок крыс-самцов 200±20 г веса были отобраны и разделены на 5 групп (Сравнительная модельная группа, Группа индометацина, Группа хризофанола-глюкозамина большой дозы, Группа хризофанола-глюкозамина маленькой дозы, Группа натриевой соли хризофанола), по 8 крыс в каждой группе, после внутрибрюшного введения лекарства на 1 час позже после индуцирования острого плеврита согласно известному способу [Сюй Шуюнь. Методика фармакологического эксперимента (Третье Издание): 916].
Четыре часа спустя крысы были убиты для измерения объем экссудата и общего количества лейкоцитов. Результаты представлены в Таблице 16.
Результаты показывают, что по сравнению со сравнительной модельной группой в группах хризофанола-глюкозамина большой дозы и хризофанола-глюкозамина маленькой дозы лекарство оказывает заметное влияние на острый экссудативный плеврит и лейкопению
3. Влияние хризофанола-глюкозамина на иммунную систему мышей
Пятьдесят мышей из г.Куньмин, половина из которых самцы и половина самки, весом 18-22 г каждая, были отобраны и случайным образом разделены на пять групп, а именно: «Сравнительная модельная группа», «Группа циклофосфамида», «Группа натриевой соли хризофанола», «Группа хризофанола-глюкозамина большой дозы» и «Группа хризофанола-глюкозамина маленькой дозы», в каждой группе по 10 мышей. Препарат вводился внутрибрюшным способом по 0.2 мл/10 г веса 1 раз в день в течение 3 дней. За 30 мин после последнего введения препарата провели эксперимент согласно известному способу [Сюй Шуюнь, Методика фармакологического эксперимента (Третье Издание): 934], рассчитали фагоцитарный индекс К и фагоцитарную активность α. Результаты эксперимента представлены в Таблице 17.
Результаты показывают, что хризофанол-глюкозамин может снижать фагоцитарный индекс К и фагоцитарную активность α у мышей, что говорит о наличии иммунитета.
4. Влияние хризофанола-глюкозамина на формирование гранулемы у крыс
Крысы были случайным образом разделены на 5 групп (Сравнительная модельная группа, Группа индометацина, Группа хризофанола-глюкозамина большой дозы, Группа хризофанола-глюкозамина маленькой дозы, Группа натриевой соли хризофанола), в каждой по 10 крыс, модель сформировали согласно известному способу [Сюй Шуюнь, Методика фармакологического эксперимента (Третье Издание): 918], препарат вводили со дня начала эксперимента. Вводили индометацин в мышцы по дозе 10 мг/кг. Объем введенного препарата 0.4 мл/100 г. Для групп получающих физиологический раствор объем вводимого препарата составляет 0.4 мл/100 г. Препарат вводится внутрибрюшным способом. Через 2 недели мыши были убиты, эксперимент провели по известному способу, рассчитали вес нетто гранулемы. Результаты представлены в Таблице 18.
Результаты показывают, что по сравнению со сравнительной модельной группой в группах хризофанола-глюкозамина большой дозы, хризофанола-глюкозамина препарат оказывает заметное препятствие формированию гранулемы у крыс, Р<0.01.
5. Влияние хризофанола-глюкозамина на торсионный мышечный спазм у мышей, вызванный уксусной кислотой.
Пятьдесят мышей из г. Куньмин, половина самцов и половина самок, весом 18-22 г каждая были выбраны случайным образом и разделены на пять групп, а именно: «Сравнительная модельная группа», «Группа аспирина», «Группа натриевой соли хризофанола», «Группа хризофанола-глюкозамина большой дозы» и «Группа хризофанола-глюкозамина маленькой дозы», по 10 мышей в каждой группе. Препарат вводится внутрибрюшным способом по 0.2 мл/10 г веса 1 раз в день в течение 12 дней, после через 30 мин после последнего введения препарата провели эксперимент согласно известному способу [Сюй Шуюнь, Методика фармакологического эксперимента (Третье Издание): 882]. Рассчитали фагоцитарный индекс К и фагоцитарную активность α, рассчитали коэффициент торможения торсионного спазма. Результаты эксперимента представлены в Таблице 19.
Результаты испытаний показали, что по сравнению с модельной группой очевидно, что у группы хризофанола-глюкозамина большой дозы, группы хризофанола-глюкозамина маленькой дозы введенный препарат заметно препятствует возникновению мышечного торсионного спазма, показано, что хризофанол-глюкозамин имеет успокоительное действие.
Результаты вышеуказанных примеров показывают, что хризофанол-глюкозамин, полученный по данному изобретению, имеет противовоспалительное и успокоительное действие, регулирует иммунитет и может применяться для лечения остеоартрита.
Реферат
Изобретение относится к конъюгату хризофанола или его производного, характеризующемуся общей формулой (I), в которой R1-R8 представляют собой группу, выбранную из групп -Н, -ОН, -ОСН3, -СН3, при условии, что не менее двух групп из R1-R8 означают -Н и при условии, что одна или две группы R2, R3, R6, R7 является группой -СООН, М представляет собой азотное органическое основание, выбранное из группы, состоящей из хитозамина, глюкозамина, или основную аминокислоту, выбранную из группы, состоящей из аргинина, лизина, карнитина, и группа М связана с хризофаноловой частью в конъюгат. Изобретение также относится к способу получения этого конъюгата, к применению конъюгата в качестве лекарственного средства для профилактики или лечения диабетической нефропатии, остеоартрита, ревматического или ревматоидного артрита, спаек кишок, восстановление перистальтики кишечника, и к лекарственному средству на его основе. ! ! 4 н. и 4 з.п. ф-лы, 4 ил., 19 табл.
Формула

в которой R1-R8 представляют собой группу, выбранную из групп -Н, -ОН, -ОСН3, -СН3, при условии, что не менее двух групп из R1-R8 означают -Н и при условии, что одна или две группы R2, R3, R6, R7 является группой -СООН, М представляет собой азотное органическое основание, выбранное из группы, состоящей из хитозамина, глюкозамина, или основную аминокислоту, выбранную из группы, состоящей из аргинина, лизина, карнитина, и группа М связана с хризофаноловой частью в конъюгат.




Комментарии