Биарильное производное в качестве агониста gpr120 - RU2683648C2
Код документа: RU2683648C2
Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к производным новых соединений в качестве агонистов GPR120, к способу их получения, к фармацевтической композиции, включающей их в качестве активных ингредиентов, и к их применению. Здесь агонист GPR120 означает соединение, которое можно эффективно использовать для профилактики или лечения метаболического заболевания, такого как диабет, осложнения диабета, ожирение, неалкогольное ожирение печени, стеатогепатит и остеопороз или воспаление путем промотирования GLP-1 в желудочно-кишечном тракте и противовоспалительного действия.
УРОВЕНЬ ТЕХНИКИ
Диабет в основном делят на два типа ─ т.е. инсулинозависимый диабет 1 типа и инсулинонезависимый (резистентный к инсулину) диабет 2 типа, который обнаруживают у 90% или более страдающих диабетом пациентов.
Известно, что агонисты GPR120, которые известны как способные потенциально лечить диабет 2 типа, обладают (1) антидиабетическим эффектом, вызванным действиями увеличения инкретинового гормона в клетках кишечника, (2) противовоспалительным действием на макрофаги, и (3) действием, снижающим резистентность к инсулину в липоцитах. Они также известны как возможное лечение диабета 1 типа вследствие улучшения, оказываемого на пролиферацию клеток поджелудочной железы в результате противовоспалительного действия.
Рецептор 120, связанный с G-белком (GPR120), обильно экспрессируется в кишечнике, легких, жировой ткани и макрофагах, вызывающих воспаление, и активируется длинноцепочечной свободной жирной кислотой (FFA). GPR120 стимулирует секрецию глюкагоноподобного пептида-1 (GLP-1) через FFA. Известно, что GLP-1, инкретиновый гормон, стимулирует секрецию инсулина в поджелудочной железе в зависимости от уровня глюкозы крови и также имеет эффект улучшения в отношении резистентности к инсулину, пролиферации β-клеток, потери аппетита и усиления чувства насыщения. Недавно было обнаружено, что GPR120 связан с улучшением в отношении резистентности к инсулину и противовоспалительного эффекта, и поэтому он расценивается как мишень для разработки лекарственного средства для эффективного улучшения в отношении резистентности к инсулину, диабета 2 типа и ожирения, включающего низкоуровневое хроническое воспаление. Кроме того, сообщается, что во время экспериментов на животных с диабетом 1 типа, агонисты GPR120 улучшают секрецию инсулина путем действия в отношении пролиферации β-клеток.
Поскольку агонисты GPR 120 также имеют противовоспалительное действие, они, как сообщается, являются возможным средством для лечения связанных с воспалением заболеваний, например, стеатогепатита, ревматоидного артрита и т.д.
В отношении сказанного выше, активно происходят исследования в области агонистов GPR120. В репрезентативных соединениях, представленных как агонисты GPR120, две арильные группы связаны со структурой центрального мостика, и характеристическим признаком является то, что одна из двух арильных групп замещена карбоновой кислотой. Соединения-агонисты GPR120 раскрыты в WO 2013/185766, WO 2013/139341, WO 2011/159297, WO 2010/080537, WO 2010/104195, WO 2010/048207, WO 2009/147990, WO 2008/066131, WO 2008/103500 и WO 2008/139879.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ЗАДАЧА
Целью настоящего изобретения является получение нового биарильного производного в качестве агониста GPR120.
Другой целью настоящего изобретения является разработка способа получения биарильного производного.
Другим объектом настоящего изобретения является получение фармацевтической композиции для профилактики или лечения метаболического заболевания, такого как диабет, осложнения диабета, ожирение, неалкогольное ожирение печени, стеатогепатит и остеопороз или воспаление, включающей биарильное производное в качестве активного ингредиента, и в разработке способа получения композиции.
Следующим объектом настоящего изобретения является разработка способа профилактики и лечения метаболического заболевания, такого как диабет, осложнения диабета, ожирение, неалкогольное ожирение печени, стеатогепатит и остеопороз или воспаление, с использованием биарильного производного в качестве активного ингредиента.
РЕШЕНИЕ ЗАДАЧИ
Для решения задачи настоящее изобретение относится к биарильному производному Формулы 1, или к его фармацевтически приемлемой соли или изомеру:
[Формула 1]

в которой,
A и B независимо обозначают арил или гетероарил;
D и E могут независимо отсутствовать или независимо обозначают C, CH, CH2, N, NH, O или S;
R1 и R2 могут независимо отсутствовать или независимо обозначают водород, галоген, алкил, циклоалкил, гетероциклоалкил, оксо, алкилциклоалкил, циклоалкилалкил, галогеналкил, алкокси, алкоксиалкил, алкоксиарил, циклоалкокси, циклоалкилалкокси, алкилгетероциклоалкил, арил, алкиларил, аралкил, галогенарил, гетероарил, алкилгетероарил или галогеналкиларил;
R1 и R2 могут быть связаны друг с другом или с D и/или E с образованием кольца, или могут образовывать конденсированное кольцо с A; кольцо может быть замещено алкилом, галогеном, алкоксикарбонилом, циклоалкилалкилом, галогенарилом или алкиларилом; и когда D и E обозначают C, CH или N, R1 и R2 могут обозначать два или три алкила, оксо, циклоалкила, алкокси, алкилциклоалкила, арила или алкиларила, которые могут быть одинаковыми или разными;
R3 и R4 независимо обозначают водород, галоген, алкил, циклоалкил, гетероциклоалкил, алкокси, нитрил, оксо, циклоалкокси, арилокси, гетероарилокси, аминоалкил, аминоциклоалкил, аминоарил, алкиламин, циклоалкиламин, аминогетероарил, тиоалкил, тиоарил или тиогетероарил;
m и n независимо обозначают целое число от 0 до 5;
G обозначает -(CR5R6)p-J-(CR5R6)q, в котором J обозначает CH2, O, N, NH, S или двойную связь; R5 и R6 независимо обозначают водород, галоген, алкил или циклоалкил, гидрокси или амин, илимогут быть связаны друг с другом с образованием циклоалкила, и когда J обозначает N, каждый из R5 и R6 на двух (CR5R6) может быть связан с образованием кольца или может быть замещен алкилом; и p и q независимо обозначают целое число от 0 до 6; и
R7 обозначает карбоновую кислоту или изостер карбоновой кислоты.
Соединение Формулы 1 согласно настоящему изобретению может образовывать фармацевтически приемлемую соль, включающую соль присоединения с кислотой, образованную из неорганической кислоты, такой как соляная кислота, серная кислота, азотная кислота, фосфорная кислота, бромистоводородная кислота и йодистоводородная кислота; органической кислоты, такой как винная кислота, муравьиная кислота, лимонная кислота, уксусная кислота, трихлоруксусная кислота, трифторуксусная кислота, глюконовая кислота, бензойная кислота, молочная кислота, фумаровая кислота, малеиновая кислота и салициловая кислота; или сульфоновой кислоты, такой как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота и п-толуолсульфоновая кислота, которые образуют нетоксичную соль присоединения с кислотой, включающую фармацевтически приемлемый анион. Кроме того, фармацевтически приемлемая соль карбоновой кислоты включает соль с щелочным металлом или щелочноземельным металлом, таким как литий, натрий, калий, кальций и магний; соли с аминокислотой, такими как лизин, аргинин и гуанидин; органическую соль, такую как дициклогексиламин, N-метил-D-глюками, трис(гидроксиметил)метиламин, диэтаноламин, холин и триэтиламин. Соединение Формулы 1 согласно настоящему изобретению может быть превращено в их соли обычными способами.
Между тем, так как соединение Формулы 1 согласно настоящему изобретению может иметь асимметрический углеродный центр и асимметрическую ось или плоскость, они могут существовать как Е- или Z-изомер, R- или S-изомер, рацемические смеси или диастереоизомерные смеси и каждый диастереоизомер, все из которых находятся в рамках настоящего изобретения.
Здесь, если не указано иное, термин "соединение Формулы 1" используется для обозначения всех соединений Формулы 1, включая их фармацевтически приемлемые соли и изомеры.
Здесь следующие понятия, определенные для заместителей, используются для определения соединения Формулы 1.
Термин "галоген" означает фтор (F), хлор (Cl), бром (Br) или йод (I).
Термин "изостер карбоновой кислоты" включает, но не ограничен ими, изоксазолол, пиразолол, изотиазолол, тиазолидиндион, пирролидиндион, оксазолидиндион, имидазолидиндион, тиазолидиндион, имидазолдион, пирролдион, фенол, пиридинол, диоксотиадиазолидинон, тетразол, триазол, имидазол, сульфоновую кислоту, сульфонамид, ацетамид, нитрил, гидроксиацетамидин, оксадиазолон, оксадиазолтион и т.п.
Термин "алкил" означает прямые или разветвленные углеводороды, может включать одинарную связь, двойную связь и тройную связь, и предпочтительно обозначает C1-C10-алкил. Примеры алкила включают, но не ограничены ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, ацетилен, винил, трифторметил и т.п.
Термин "циклоалкил" означает частично или полностью насыщенные углеводороды с единственным кольцом или конденсированными кольцами и предпочтительно обозначает C3-C10-циклоалкил. Примеры циклоалкила включают, но не ограничены ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил и т.п.
Если не указано иное, термин "алкокси" означает алкилокси, имеющий от 1 до 10 атомов углерода.
Если не указано иное, термин "циклоалкокси" означает циклоалкилокси, имеющий от 3 до 10 атомов углерода.
Арил означает ароматические углеводороды, предпочтительно C5-C12-арил, более предпочтительно C6-C10-арил, и включает, но не ограничен ими, фенил, нафтил и т.п.
Гетероарил означает 3-12-членный, более предпочтительно 5-10-членный ароматический углеводород, образующий единственное или конденсированное кольцо, который может быть конденсирован с бензо или C3-C8 циклоалкилом, включающий по меньшей мере один гетероатом, выбранный из N, O и S в качестве члена кольца. Примеры гетероарила включают, но не ограничены ими, пиридинил, пиримидинил, пиридазинил, пиразинил, оксадиазолил, изоксадиазолил, тетразолил, триазолил, индолил, индазолил, изоксазолил, оксазолил, тиазолил, изотиазолил, фуранил, бензофуранил, имидазолил, тиофенил, бензотиазол, бензимидазол, хинолинил, индолинил, 1,2,3,4-тетрагидроизохинолил, 3,4-дигидроизохинолинил, тиазолoпиридил, 2,3-дигидробензофуран, 2,3-дигидротиофен, 2,3-дигидроиндол, бензо[1,3]диоксин, хроман, тиохроман, 1,2,3,4-тетрагидрохинолин, 4H-бензо[1,3]диоксин, 2,3-дигидробензо-[1,4]-диоксин, 6,7-дигидро-5H-циклопента[d]пиримидин и т.п.
Гетероциклил обозначает частично или полностью насыщенные углеводороды, образующие единственное или конденсированное кольцо, включающие по меньшей мере один гетероатом, выбранный из N, O и S, и предпочтительно 3-12-членный гетероциклил. Примеры гетероциклила включают, но не ограничены ими, пирролидинил, пиперидинил, морфолинил, имидазолинил, пиперазинил, тетрагидрофуран, тетрагидротиофуран и т.п.
Аралкил, алкиларил и гетероарилалкил обозначают группы, образованные комбинацией вышеупомянутого арила с алкилом или гетероарила с алкилом. Примеры включают, но не ограничены ими, бензил, тиофен метил, пиримидин метил и т.п.
Вышеупомянутый амин, алкил, циклоалкил, арил, гетероарил, гетероциклил, аралкил и гетероарилалкил может быть замещен по меньшей мере одной группой, выбранной из следующих групп: алкил, циклоалкил, гетероциклил, арил, гетероарил, аралкил, гетероарилалкил, гетероциклилалкил, оксо, циано, галоген, нитро, -OR, -OC(O)R, -OC(O)OR, -SR, -S(O)R, -S(O)2R, -C(O)R, -C(O)OR, -C(S)R, -C(O)NRR, -NR2, -NRCHO, -NRC(O)R, -NRC(O)NRR, -C(S)NRR, -NRC(S)R и -NRC(S)NRR, в которых R независимо выбран из водорода, алкила, циклоалкила, гетероциклил, арила, гетероарила, аралкила и гетероарилалкила, и когда две группы R являются замещенными, они могут быть связаны с образованием циклоалкила или гетероциклила.
Согласно одному варианту осуществления настоящего изобретения, в вышеупомянутой Формуле 1
A и B независимо обозначают C5-C12 арил или 3-12-членный гетероарил, имеющий по меньшей мере один гетероатом, выбранный из N, O и S;
D и E могут независимо отсутствовать или обозначать независимо C, CH, CH2, N, NH, O или S;
R1 и R2 могут независимо отсутствовать или независимо обозначают водород, галоген, C1-C10 алкил, C3-C10 циклоалкил, 3-12-членный гетероциклоалкил, оксо, C1-C10 алкил-C3-C10 циклоалкил, C3-C10 циклоалкил-C1-C10 алкил, галоген-C1-C10 алкил, C1-C10 алкокси, C1-C10 алкокси-C1-C10 алкил, C1-C10 алкокси-C5-C12 арил, C3-C10 циклоалкокси, C3-C10 циклоалкил-C1-C10 алкокси, C1-C10 алкил-3-12-членный гетероциклоалкил, C5-C12 арил, C1-C10 алкил-C5-C12 арил, C5-C12 арил-C1-C10 алкил, галоген-C5-C12 арил, 3-12-членный гетероарил, C1-C10 алкил-3-12-членный гетероарил или галоген-C1-C10 алкил-C5-C12 арил, причем гетероциклоалкил и гетероарил имеют по меньшей мере один гетероатом, выбранный из N, O и S;
R1 и R2 могут быть связаны друг с другом или с D и/или E для формирования C3-C10 циклоалкила, C5-C12 арила или 3-12-членного гетероциклоалкила, имеющего по меньшей мере один гетероатом, выбранный из N, O и S, или могут образовываться 3-15-членный гетероцикл или гетероарил, имеющий по меньшей мере один гетероатом, выбранный из N, O и S, конденсированный с A; циклоалкил, арил, гетероциклоалкил, гетероцикл или гетероарил может быть замещен C1-C10 алкилом, галогеном, C1-C10 алкоксикарбонилом, C3-C10 циклоалкил-C1-C10 алкилом, галоген-C5-C12 арилом или C1-C10 алкил-C5-C12 арилом; и когда D и E обозначают C, CH или N, R1 и R2 могут обозначать два или три C1-C10 алкила, оксо, C3-C10 циклоалкила, C1-C10 алкокси, C1-C10 алкил-C3-C10 циклоалкила, C5-C12 арила или C1-C10 алкил-C5-C12 арила, которые могут быть одинаковыми или разными;
R3 и R4 независимо обозначают водород, галоген, C1-C10 алкил, C3-C10 циклоалкил, 3-12-членный гетероциклоалкил, C1-C10 алкокси, нитрил, оксо, C3-C10 циклоалкокси, C5-C12 арилокси, 3-12 членный гетероарилокси, амино-C1-C10 алкил, амино-C3-C10 циклоалкил, амино-C5-C12 арил, C1-C10 алкиламин, C3-C10 циклоалкиламин, амино-3-12-членный гетероарил, тио-C1-C10 алкил, тио-C5-C12 арил или тио-3-12-членный гетероарил;
m и n независимо обозначают целое число от 0 до 3;
G обозначает -(CR5R6)p-J-(CR5R6)q, в котором J обозначает CH2, O, N, NH, S или двойную связь; R5 и R6 независимо обозначают водород, галоген, C1-C10 алкил или C3-C10 циклоалкил, гидрокси или амин илимогут быть связаны друг с другом для формирования C3-C10 циклоалкила, и когда J обозначает N, каждый из R5 и R6 на двух (CR5R6) могут вместе образовывать 3-12-членный гетероарил или 3-12-членный гетероциклоалкил, имеющий 1 или 2 атома N, или может быть замещен C1-C10 алкилом; и p и q независимо обозначают целое число от 0 до 6; и
R7 обозначает карбоновую кислоту или изостер карбоновой кислоты.
Согласно другому варианту осуществления настоящего изобретения, A и B независимо обозначают C6-C10 арил или 5-10-членный гетероарил, имеющий от 1 до 3 гетероатомов, выбранных из N, O и S.
Согласно другому варианту осуществления настоящего изобретения, R1 и R2 могут независимо отсутствовать или независимо обозначают водород, галоген, C1-C8 алкил, C3-C8 циклоалкил, 3-10 членный гетероциклоалкил, оксо, C1-C8 алкил-C3-C8 циклоалкил, C3-C8 циклоалкил-C1-C8 алкил, галоген-C1-C8 алкил, C1-C8 алкокси, C1-C8 алкокси-C1-C8 алкил, C1-C8 алкокси-C6-C10 арил, C3-C8 циклоалкокси, C3-C8 циклоалкил-C1-C8 алкокси, C1-C8 алкил-3-10-членный гетероциклоалкил, C6-C10 арил, C1-C8 алкил-C6-C10 арил, C6-C10 арил-C1-C8 алкил, галоген-C6-C10 арил, 5-10-членный гетероарил, C1-C8 алкил-5-10-членный гетероарил или галоген-C1-C8 алкил-C6-C10 арил, причем гетероциклоалкил и гетероарил имеют 1-3 гетероатома, выбранные из N, O и S;
R1 и R2 могут быть связаны друг с другом или с D и/или E для формирования C3-C8 циклоалкила, C6-C10 арила или 3-12-членного гетероциклоалкила, имеющего от 1 до 3 гетероатомов, выбранных из N, O и S, или могут образовываться 3-14-членный гетероцикл или гетероарил, имеющий от 1 до 4 гетероатомов, выбранных из N, O и S, конденсированный с A; циклоалкил, арил, гетероциклоалкил, гетероцикл или гетероарил может быть замещен C1-C8 алкилом, галогеном, C1-C8 алкоксикарбонилом, C3-C8 циклоалкил-C1-C8 алкилом, галоген-C6-C10 арилом или C1-C8 алкил-C6-C10 арилом; и
когда D и E обозначают C, CH или N, R1 и R2 могут обозначать два или три C1-C8 алкила, оксо, C3-C8 циклоалкила, C1-C8 алкокси, C1-C8 алкил-C3-C8 циклоалкила, C6-C10 арила или C1-C8 алкил-C6-C10 арила, которые могут быть одинаковыми или разными.
Согласно другому варианту осуществления настоящего изобретения, R3 и R4 независимо обозначают водород, галоген, C1-C10 алкил, C3-C10 циклоалкил, 3-12-членный гетероциклоалкил, C1-C10 алкокси, нитрил, оксо или C3-C10 циклоалкокси.
Согласно другому варианту осуществления настоящего изобретения, G обозначает -(CR5R6)p-J-(CR5R6)q, в котором J обозначает CH2, O, N, NH, S или двойную связь; R5 и R6 независимо обозначают водород, галоген, C1-C8 алкил или C3-C8 циклоалкил, гидрокси или амин, илимогут быть связаны друг с другом с образованием C3-C8 циклоалкила, и когда J обозначает N, каждый из R5 и R6 на двух (CR5R6) могут вместе образовывать 3-10-членный гетероарил или 3-12-членный гетероциклоалкил, имеющий 1 или 2 атома N, или может быть замещен алкилом C1-C8; и p и q независимо обозначают целое число от 0 до 5.
Репрезентативные соединения Формулы 1 согласно настоящему изобретению включают, но не ограничены ими, следующие соединения:
3-[6-(2-изопропилсульфанил-пиридин-3-ил)-хинолин-2-ил]-пропионовая кислота,
3-[6-(6-изопропилсульфанил-пиридин-2-ил)-хинолин-2-ил]-пропионовая кислота,
[6-(6-циклопентилокси-пиридин-2-ил)-нафталин-2-илокси]-уксусная кислота,
[6-(2-циклопентилокси-пиридин-3-ил)-нафталин-2-илокси]-уксусная кислота,
4-[6-(2-изопропилсульфанил-пиридин-3-ил)-нафталин-2-илокси]-масляная кислота,
4-[6-(6-изопропилсульфанил-пиридин-2-ил)-нафталин-2-илокси]-масляная кислота,
3-[6-(2-изопропилсульфанил-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота,
3-[6-(6-изопропилсульфанил-пиридин-2-ил)-хроман-2-ил]-пропионовая кислота,
3-[6-(6-циклопентилокси-пиридин-2-ил)-хроман-2-ил]-пропионовая кислота,
3-[6-(2-циклопентилокси-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота,
3-[6-(6-циклопентилокси-пиридин-2-ил)-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовая кислота,
3-[6-(6-циклопентилокси-пиридин-2-ил)-1-метил-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовая кислота,
[6-(2-изопропилсульфанил-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-уксусная кислота,
[6-(6-изопропилсульфанил-пиридин-2-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-уксусная кислота,
3-[6-(2-циклопентилокси-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-пропионовая кислота,
3-[6-(2-изопропилсульфанил-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-пропионовая кислота,
4-(3ʹ-бензилокси-3,5-дифтор-бифенил-4-илокси)-масляная кислота,
4-(3,5-дифтор-3ʹ-изопропокси-бифенил-4-илокси)-масляная кислота,
4-(3,5-дифтор-3ʹ-пропокси-бифенил-4-илокси)-масляная кислота,
4-(3ʹ-циклопропилметокси-3,5-дифтор-бифенил-4-илокси)-масляная кислота,
4-(3ʹ-циклобутокси-3,5-дифтор-бифенил-4-илокси)-масляная кислота,
4-[4-(2,2-диметил-2,3-дигидро-бензофуран-7-ил)-2,6-дифтор-фенокси]-масляная кислота,
4-[4-(2,2-диметил-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенокси]-масляная кислота,
4-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенокси]бутаннитрил,
2-циклобутилсульфанил-3-{3,5-дифтор-4-[3-(1H-тетразол-5-ил)пропокси]фенил}пиридин,
2-циклобутилсульфанил-3-{4-[3-(1H-тетразол-5-ил)пропил]фенил}пиридин,
5-[4-(2-циклобутилсульфанил-3-пиридил)фенил]пентановая кислота,
5-[4-(6-циклопентилсульфанил-2-пиридил)фенил]пентановая кислота,
5-[4-(2-циклопентилсульфанил-3-пиридил)фенил]пентановая кислота,
2-циклобутилсульфанил-3-[3,5-дифтор-4-(1H-тетразол-5-илметокси)фенил]пиридин,
5-[2,6-дифтор-4-(2-пропилсульфанил-3-пиридил)фенил]пентановая кислота,
5-[4-(6-циклобутокси-2-пиридил)-2,6-дифтор-фенил]пентановая кислота,
5-[4-(6-циклопентокси-2-пиридил)-2,6-дифтор-фенил]пентановая кислота,
5-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенил]пентановая кислота,
5-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]пентановая кислота,
5-[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-фенил]пентановая кислота,
5-[4-(2-циклопентокси-3-пиридил)-2,6-дифтор-фенил]пентановая кислота,
{2-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]этокси}уксусная кислота,
5-[4-(2-циклобутилсульфанил-3-пиридил)фенил]гексановая кислота,
5-[4-(6-циклобутокси-2-пиридил)-фенил]гексановая кислота,
5-[4-(6-циклобутокси-2-пиридил)-2,6-дифтор-фенил]гексановая кислота,
5-[4-(2-этилсульфанил-3-пиридил)-2,6-дифтор-фенил]гексановая кислота,
5-[2,6-дифтор-4-(2-пропилсульфанил-3-пиридил)-фенил]гексановая кислота,
4-[1-метил-5-(2-феноксифенил)бензимидазол-2-ил]бутановая кислота,
3-[1-метил-5-(2-феноксифенил)бензимидазол-2-ил]пропановая кислота,
5-[2,6-дифтор-4-(2-изопропокси-3-пиридил)фенил]гексановая кислота,
5-(2ʹ-циклопентиламино-3,5-дифтор-бисфенил-4-ил)гексановая кислота,
5-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]гексановая кислота,
5-[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-фенил]гексановая кислота,
5-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)-фенил]гексановая кислота,
5-[4-(2-циклопентокси-3-пиридил)-2,6-дифтор-фенил]гексановая кислота,
5-(3ʹ-циклопентиламино-3,5-дифтор-бифенил-4-ил)-гексановая кислота,
5-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)-фенил]гексановая кислота,
5-[4-(6-циклопентилсульфанил-2-пиридил)-2,6-дифтор-фенил]гексановая кислота,
5-[2,6-дифтор-4-(6-пропилсульфанил-2-пиридил)фенил]гексановая кислота,
5-[4-(6-циклопентокси-2-пиридил)-2,6-дифтор-фенил]гексановая кислота,
4-[4-(2-изопропокси-3-пиридил)фенил]бутановая кислота,
5-[2,6-дифтор-4-(2-гидрокси-3-пиридил)фенил]гексановая кислота,
5-[4-(2-циклобутокси-3-пиридил)-2,6-дифтор-фенил]гексановая кислота,
5-[4-(2-циклопропилметокси-3-пиридил)-2,6-дифтор-фенил]гексановая кислота,
5-[[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенокси]метил]изоксазол-3-ол,
Nʹ-гидрокси-4-[4-(2-пропилсульфанил-3-пиридил)фенил]бутанамидин,
3-[3-[4-(2-пропилсульфанил-3-пиридил)фенил]пропил]-4H-1,2,4-оксадиазол-5-он,
3-[3-[4-(2-пропилсульфанил-3-пиридил)фенил]пропил]-4H-1,2,4-оксадиазол-5-тион,
5-[[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-фенокси]метил]изоксазол-3-ол,
5-[[2,6-дифтор-4-(2-пропилсульфанил-3-пиридил)фенокси]метил]изоксазол-3-ол,
5-[[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенокси]метил]изоксазол-3-ол,
5-[[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенокси]метил]изоксазол-3-ол,
5-[[2,6-дифтор-4-(2-изопропокси-3-пиридил)фенокси]метил]изоксазол-3-ол,
5-[[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенокси]метил]изоксазол-3-ол,
5-[[2,6-дифтор-4-(6-изопропокси-2-пиридил)фенокси]метил]изоксазол-3-ол,
5-[[4-[6-(циклопропилметокси)-2-пиридил]-2,6-дифтор-фенокси]метил]изоксазол-3-ол,
5-[[2,6-дифтор-4-(6-пропокси-2-пиридил)фенокси]метил]изоксазол-3-ол,
5-[[2,6-дифтор-4-(2-пропокси-3-пиридил)фенокси]метил]изоксазол-3-ол,
5-[(E)-3-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]аллил]тиазолидин-2,4-дион,
5-[[4-[2-(циклобутокси)-3-пиридил]-2,6-дифтор-фенокси]метил]изоксазол-3-ол,
5-[[4-[2-(циклобутилметокси)-3-пиридил]-2,6-дифтор-фенокси]метил]изоксазол-3-ол,
5-[[4-[2-(циклопентокси)-3-пиридил]анилино]метил]изоксазол-3-ол,
5-[[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенокси]метил]пиридин-2-ол,
4-[[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенокси]метил]пиридин-2-ол,
5-[[4-[2-(циклопентокси)-3-пиридил]фенил]сульфанилметил]изоксазол-3-ол,
5-[(E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]аллил]-1,1-диоксо-1,2,5-тиадиазолидин-3-он,
5-[[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]сульфанилметил]изоксазол-3-ол,
5-[[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]метил]изоксазол-3-ол,
5-[3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]пропил]-1,1-диоксо-1,2,5-тиадиазолидин-3-он,
5-[[4-[2-(циклопентокси)-3-пиридил]-N-метил-анилино]метил]изоксазол-3-ол,
5-[2-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]этил]изоксазол-3-ол,
5-[2-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]пропил]изоксазол-3-ол,
5-[2-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенокси]этил]изоксазол-3-ол,
5-[2-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]этил]изоксазол-3-ол,
2-[1-[5-(6-изопропилсульфанил-2-пиридил)-2-пиридил]-3-пиперидил]уксусная кислота,
4-[[5-(6-изопропилсульфанил-2-пиридил)-2-пиридил]амино]бутановая кислота,
2-[1-[4-(2-циклобутилсульфанил-3-пиридил)фенил]пиразол-4-ил]уксусная кислота,
5-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]пентановая кислота,
5-[4-[2-(циклопентокси)-3-пиридил]-N-этил-2,6-дифтор-анилино]пентановая кислота,
5-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)анилино]пентановая кислота,
5-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)анилино]пентановая кислота,
5-[4-[6-(циклопропилметокси)-2-пиридил]-2,6-дифтор-анилино]пентановая кислота,
5-[4-[2-(циклопропилметокси)-3-пиридил]-2,6-дифтор-анилино]пентановая кислота,
2-[1-[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
5-[4-[6-(циклопропилметокси)-2-пиридил]-2,6-дифтор-N-метил-анилино]пентановая кислота,
2-[1-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(2-тетрагидрофуран-3-илокси-3-пиридил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклопропилметокси)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]-3-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-3-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]азетидин-3-ил]уксусная кислота,
6-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-6-азаспиро[2,5]октан-2-карбоновая кислота,
6-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]-6-азаспиро[2,5]октан-2-карбоновая кислота,
2-[1-[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота,
2-[1-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]азетидин-3-ил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-изопропокси-2-пиридил)фенил]азетидин-3-ил]уксусная кислота,
2-[1-[4-[6-(циклопентокси)-2-пиридил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота,
2-[1-[2,6-дифтор-4-(2-пропилсульфанил-3-пиридил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(2-изопропокси-3-пиридил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(2-пропокси-3-пиридил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[2-(циклопропилметокси)-3-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пиразол-4-ил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]пиразол-4-ил]уксусная кислота,
2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пирролидин-3-ил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]пирролидин-3-ил]уксусная кислота,
3-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-4-пиперидил]пропановая кислота,
3-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]-4-пиперидил]пропановая кислота,
2-[2-[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-анилино]этил]циклопропанкарбоновая кислота,
2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-3-пиперидил]ацетамид,
2-[4-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пиперазин-1-ил]уксусная кислота,
3-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пиразол-4-ил]пропановая кислота,
4-[5-(2-циклопентилсульфанил-3-пиридил)индолин-1-ил]бутановая кислота,
3-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]азетидин-3-ил]пропановая кислота,
2-[(3R)-1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пирролидин-3-ил]уксусная кислота,
2-[(3R)-1-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]пирролидин-3-ил]уксусная кислота,
2-[(3S)-1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пирролидин-3-ил]уксусная кислота,
2-[(3S)-1-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]пирролидин-3-ил]уксусная кислота,
2-[1-[2-фтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[2-(циклопентокси)-3-пиридил]-2-фторфенил]-4-пиперидил]уксусная кислота,
3-[6-(6-изопропилсульфанил-пиридин-2-ил)-нафталин-2-ил]-пропановая кислота,
3-[6-(6-фенокси-пиридин-2-ил)-нафталин-2-ил]-пропановая кислота,
3-[6-(2-фенокси-фенил)-нафталин-2-ил]-пропановая кислота,
3-[6-(6-циклопентилсульфанил-пиридин-2-ил)-нафталин-2-ил]-пропановая кислота,
3-[6-(2-фенокси-пиридин-3-ил)-нафталин-2-ил]-пропановая кислота,
3-[6-(3-фенокси-фенил)-нафталин-2-ил]-пропановая кислота,
3-[6-(3-изопропокси-фенил)-нафталин-2-ил]-пропановая кислота,
3-[6-(3-циклобутокси-фенил)-нафталин-2-ил]-пропановая кислота,
3-[6-(6-циклобутокси-пиридин-2-ил)-нафталин-2-ил]-пропановая кислота,
3-[6-(2-изопропокси-пиридин-3-ил)-нафталин-2-ил]-пропановая кислота,
3-[6-(2-циклопентилокси-пиридин-3-ил)-нафталин-2-ил]-пропановая кислота,
3-{6-[2-(2-фторфенокси)-фенил]-нафталин-2-ил}-пропановая кислота,
3-{6-[6-(2-фторфенокси)-пиридин-2-ил]-нафталин-2-ил}-пропановая кислота,
4-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенилсульфанил]-масляная кислота,
4-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2-фтор-фенилсульфанил]-масляная кислота,
4-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-фенилсульфанил]-масляная кислота,
4-(4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-илфенил)сульфанилбутановая кислота,
4-(2-фтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенил)сульфанилбутановая кислота,
5-[4-(2-изопропокси-пиридин-3-ил)-фенил]-5-метил-гексановая кислота,
5-[4-(2-изопропилсульфанил-пиридин-3-ил)-фенил]-5-метил-гексановая кислота,
5-[4-(2-циклопентилокси-пиридин-3-ил)-фенил]-5-метил-гексановая кислота,
5-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенил]-5-метил-гексановая кислота,
5-[4-(2-циклопентилокси-пиридин-3-ил)-2,6-дифтор-фенил]-5-метил-гексановая кислота,
5-[4-(2-циклопентилсульфанил-пиридин-3-ил)-фенил]-5-метил-гексановая кислота,
5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-5-метил-гексановая кислота,
5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-фенил]-5-метил-гексановая кислота,
4-{1-[4-(2-циклопентилокси-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-масляная кислота,
4-{1-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-масляная кислота,
4-{1-[4-(6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-циклопропил}-масляная кислота,
4-{1-[4-(2-циклобутилметокси-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-масляная кислота,
4-{1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-циклопропил}-масляная кислота,
5-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенил]-гексановая кислота,
{2-[4-(2-циклопентилокси-пиридин-3-ил)-фенил]-2,2-дифтор-этокси}-уксусная кислота,
{2-[4-(2-циклобутилсульфанил-пиридин-3-ил)-фенил]-2,2-дифтор-этокси}-уксусная кислота,
{2-[4-(6-циклобутокси-пиридин-2-ил)-фенил]-2,2-дифтор-этокси}-уксусная кислота,
3-{2-[4-(2-циклопентилокси-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота,
3-{2-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота,
5-[4-(2-циклопентилокси-пиридин-3-ил)-фенил]-5,5-дифтор-пентановая кислота,
5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-фенил]-5,5-дифтор-пентановая кислота,
3-{2-[2,6-дифтор-4-(2-пропилсульфанил-пиридин-3-ил)-фенил]-циклопропил}-пропановая кислота,
3-{2-[4-(6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота,
5-[4-(2-циклопропилметокси-пиридин-3-ил)-фенил]-5,5-дифтор-пентановая кислота,
3-{2-[4-(2-циклопентилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота,
3-{2-[4-(2-циклопентиламино-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота,
5-[4-(2-циклопентилсульфанил-пиридин-3-ил)-фенил]-5,5-дифтор-пентановая кислота,
5-[4-(2-циклобутокси-пиридин-3-ил)-фенил]-5,5-дифтор-пентановая кислота,
5-[4-(6-циклобутокси-пиридин-2-ил)-фенил]-5,5-дифтор-пентановая кислота,
{4-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенил]-циклогексил}-уксусная кислота,
3-{2-[4-(2-циклобутокси-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота,
3-{2-[4-(2-циклобутилметокси-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота,
3-(2-{2,6-дифтор-4-[2-(тетрагидро-пиран-4-илокси)-пиридин-3-ил]-фенил}-циклопропил)-пропановая кислота,
3-{2-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота,
5,5-дифтор-5-[4-(6-изопропилсульфанил-пиридин-2-ил)-фенил]-пентановая кислота,
4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-фенокси]-масляная кислота,
4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-2-фторфенокси]-масляная кислота,
4-{[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
4-{[4-(2-циклопентилокси-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
4-{[4-(2-циклопентилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
4-{[2,6-дифтор-4-(2-изопропилсульфанил-пиридин-3-ил)-фенил]-метил-амино}-масляная кислота,
4-[(3ʹ-циклобутокси-3,5-дифтор-бифенил-4-ил)-метил-амино]-масляная кислота,
4-[5-(2-циклопентилсульфанил-пиридин-3-ил)-индол-1-ил]-масляная кислота,
4-[(3,5-дифтор-3ʹ-пирролидин-1-ил-бифенил-4-ил)-метил-амино]-масляная кислота,
4-{[4-(6-циклобутилсульфанил-пиридин-2-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
4-{[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
4-{[4-(6-циклопентилокси-пиридин-2-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
4-{[4-(6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
4-{[4-(2-циклобутокси-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
4-{[2,6-дифтор-4-(2-пропилсульфанил-пиридин-3-ил)-фенил]-метил-амино}-масляная кислота,
4-{[4-(2-этилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
4-{[4-(2-циклобутилсульфанил-пиридин-3-ил)-2-фторфенил]-метил-амино}-масляная кислота,
2-{[4-(2-циклопентилсульфанил-пиридин-3-ил)-2,6-дифтор-фениламино]-метил}-циклопропанкарбоновая кислота,
2-{[4-(2-циклопентилсульфанил-пиридин-3-ил)-фениламино]-метил}-циклопропанкарбоновая кислота,
4-{[2-фтор-4-(2-изопропилсульфанил-пиридин-3-ил)-фенил]-метил-амино}-масляная кислота,
4-{[4-(2-циклопентилсульфанил-пиридин-3-ил)-2-фторфенил]-метил-амино}-масляная кислота,
4-{[2,6-дифтор-4-(2-изопропокси-пиридин-3-ил)-фенил]-метил-амино}-масляная кислота,
4-[(2ʹ-циклопентиламино-3,5-дифтор-бифенил-4-ил)-метил-амино]-масляная кислота,
4-[метил-(3,5,5ʹ-трифтор-2ʹ-изопропокси-бифенил-4-ил)-амино]-масляная кислота,
4-{[4-(2-циклопентилокси-5-метил-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
4-{[4-(2-циклобутилметокси-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
4-{[2,6-дифтор-4-(2-метокси-пиридин-3-ил)-фенил]-метил-амино}-масляная кислота,
4-({2,6-дифтор-4-[2-(тетрагидро-фуран-3-илокси)-пиридин-3-ил]-фенил}-метил-амино)-масляная кислота,
4-[(3,5-дифтор-2ʹ-пирролидин-1-ил-бифенил-4-ил)-метил-амино]-масляная кислота,
4-[(3,5-дифтор-2ʹ-метиламино-бифенил-4-ил)-метил-амино]-масляная кислота,
4-{[3,5-дифтор-2ʹ-(изопропил-метил-амино)-бифенил-4-ил]-метил-амино}-масляная кислота,
4-{[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-этил-амино}-масляная кислота,
4-{[4-(2-циклобутилметокси-пиридин-3-ил)-2,6-дифтор-фенил]-этил-амино}-масляная кислота,
4-{[2,6-дифтор-4-(2-изопропокси-пиридин-3-ил)-фенил]-этил-амино}-масляная кислота,
(R)-5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-гексановая кислота,
(E)-(R)-5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-гекс-2-еновая кислота,
(S)-5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-гексановая кислота,
5-{2,6-дифтор-4-[2-(тетрагидро-фуран-3-илокси)-пиридин-3-ил]-фенил}-гексановая кислота,
5-{2,6-дифтор-4-[2-(тетрагидро-пиран-4-илокси)-пиридин-3-ил]-фенил}-гексановая кислота,
5-{2,6-дифтор-4-[2-(оксетан-3-илокси)-пиридин-3-ил]-фенил}-гексановая кислота,
4-[4-(2-циклобутокси-пиридин-3-ил)-2-фторфенокси]-масляная кислота,
4-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенокси]-масляная кислота,
4-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2-фторфенокси]-масляная кислота,
4-[4-(2-циклопентилсульфанил-пиридин-3-ил)-2-фторфенокси]-масляная кислота,
6-[4-(2-циклопентилокси-пиридин-3-ил)-2,6-дифтор-фенил]-гептановая кислота,
6-[4-(2-циклопентилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-гептановая кислота,
4-[4-(2-циклопропилметокси-пиридин-3-ил)-2-фтор-фенилсульфанил]-масляная кислота,
4-[4-(2-циклопропилметокси-пиридин-3-ил)-2-фторфенокси]-масляная кислота,
4-[4-(2-циклобутилметокси-пиридин-3-ил)-2-фторфенокси]-масляная кислота,
4-[3-(6-циклопентилокси-пиридин-2-ил)-фенокси]-масляная кислота,
4-[3-(2-циклопентилокси-пиридин-3-ил)-фенокси]-масляная кислота,
5-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенил]-пентановая кислота,
5-[4-(2-циклобутокси-пиридин-3-ил)-2-фторфенил]-пентановая кислота,
5-[4-(2-циклобутилметокси-пиридин-3-ил)-2-фторфенил]-пентановая кислота,
5-[4-(2-циклопропилметокси-пиридин-3-ил)-2-фторфенил]-пентановая кислота,
5-[4-(2-циклопентилсульфанил-пиридин-3-ил)-2-фторфенил]-пентановая кислота,
5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2-фторфенил]-пентановая кислота,
5-[4-(2-циклобутилметокси-пиридин-3-ил)-2,6-дифтор-фенил]-пентановая кислота,
5-[4-(2-циклобутокси-пиридин-3-ил)-2,6-дифтор-фенил]-пентановая кислота,
5-[4-(2-циклопропилметокси-пиридин-3-ил)-2,6-дифтор-фенил]-пентановая кислота,
4-[4-(5-хлор-2,2-диметил-2,3-дигидро-бензофуран-7-ил)-2,6-дифтор-фенокси]-масляная кислота,
4-[4-(5-хлор-2,2-диметил-2,3-дигидро-бензофуран-7-ил)-2,6-дифтор-фенилсульфанил]-масляная кислота,
4-{[4-(5-хлор-2,2-диметил-2,3-дигидро-бензофуран-7-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
5-[4-(5-хлор-2,2-диметил-2,3-дигидро-бензофуран-7-ил)-2,6-дифтор-фенил]-гексановая кислота,
4-[2,6-дифтор-4-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил)-фенокси]-масляная кислота,
4-[2,6-дифтор-4-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил)-фенилсульфанил]-масляная кислота,
4-{[2,6-дифтор-4-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил)-фенил]-метил-амино}-масляная кислота,
5-[2,6-дифтор-4-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил-фенил]-гексановая кислота,
4-(2,6-дифтор-4-спиро[3H-бензофуран-2,1ʹ-циклопентан]-7-ил-фенокси)-масляная кислота,
4-(2,6-дифтор-4-спиро[3H-бензофуран-2,1ʹ-циклопентан]-7-ил-фенилсульфанил)-масляная кислота,
4-(2,6-дифтор-N-метил-4-спиро[3H-бензофуран-2,1ʹ-циклопентан]-7-ил-анилино)-масляная кислота,
5-(2,6-дифтор-4-спиро[3H-бензофуран-2,1ʹ-циклопентан]-7-ил-фенил)-гексановая кислота,
метиловый эфир 7-[4-(3-карбокси-пропокси)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты,
4-[2,6-дифтор-4-(5-фтор-2,2-диметил-2,3-дигидро-1H-индол-7-ил)-фенокси]-масляная кислота,
метиловый эфир 4-[4-(3-карбокси-пропокси)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты,
4-[2,6-дифтор-4-(5-фтор-2,2-диметил-2,3-дигидро-1H-индол-4-ил)-фенокси]-масляная кислота,
4-[2,6-дифтор-4-(5-фтор-2,2-диметил-2,3-дигидро-1H-индол-7-ил)-фенилсульфанил]-масляная кислота,
3-[6-(2-изопропилсульфанил-пиридин-3-ил)-тиохроман-2-ил]-пропионовая кислота,
3-[6-(2-циклопентокси-пиридин-3-ил)-тиохроман-2-ил]-пропионовая кислота,
3-[6-(2-циклобутилсульфанил-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота,
3-[6-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил)-хроман-2-ил]-пропионовая кислота,
3-[6-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил)-тиохроман-2-ил]-пропионовая кислота,
3-[6-(2-циклобутилсульфанил-пиридин-3-ил)-тиохроман-2-ил]-пропионовая кислота,
3-[6-(2-циклопропилметокси-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота,
3-[6-(2-циклобутокси-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота,
3-[6-(2-циклобутокси-пиридин-3-ил)-тиохроман-2-ил]-пропионовая кислота,
3-[6-(2-циклопропилметокси-пиридин-3-ил)-тиохроман-2-ил]-пропионовая кислота,
3-[6-(2-циклопентилсульфанил-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота,
3-[6-(2-циклопентилсульфанил-пиридин-3-ил)-тиохроман-2-ил]-пропионовая кислота,
3-[6-(5-хлор-2,2-диметил-2,3-дигидро-бензофуран-7-ил)-тиохроман-2-ил]-пропионовая кислота,
3-(6-спиро[3H-бензофуран-2,1ʹ-циклопентан]-7-ил-тиохроман-2-ил)-пропионовая кислота,
3-{6-[2-(тетрагидро-пиран-4-илокси)-пиридин-3-ил]-тиохроман-2-ил}-пропионовая кислота,
{1-[2,6-дифтор-4-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил)-фенил]-азетидин-3-ил}-уксусная кислота,
3-[6-(6-изопропилсульфанил-пиридин-2-ил)-тиохроман-2-ил]-пропионовая кислота,
4-(2,6-дифтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенокси)бутановая кислота,
4-(4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-илфенокси)бутановая кислота,
4-(2-фтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенокси)бутановая кислота,
4-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенокси]-масляная кислота,
4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-2,6-дифтор-фенокси]-масляная кислота,
4-[4-(2-циклогексилсульфанил-пиридин-3-ил)-2,6-дифтор-фенокси]-масляная кислота,
3-[4-(2-циклопентилокси-пиридин-3-ил)-бензилсульфанил]-пропионовая кислота,
2-[1-[4-[6-(циклобутокси)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-пропокси-2-пиридил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-изопропокси-2-пиридил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-(6-циклобутилсульфанил-2-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-пропилсульфанил-2-пиридил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклопентокси)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[3-(циклобутокси)фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[3-(циклопропилметокси)фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[3-(изопропоксиметил)фенил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[3-(этоксиметил)фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[3-(циклобутокси)-4-фторфенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[3-(циклобутокси)-4-метокси-фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[3-(циклобутокси)-5-фторфенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2-хлор-4-[6-(циклопропилметокси)-2-пиридил]-6-фторфенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклобутилметокси)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-(6-трет-бутокси-2-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[3-(циклобутокси)-2-метил-фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[5-хлор-6-(циклобутокси)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклопропанкарбонил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклобутоксиметил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-(6-этокси-2-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[6-(2,2,2-трифторэтокси)-2-пиридил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[6-(2,2,2-трифтор-1-метил-этокси)-2-пиридил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-(6-циклопентил-2-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-[циклопропил(метокси)метил]-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2-хлор-4-[6-(циклобутокси)-2-пиридил]-6-фторфенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклобутокси)-2-пиридил]-2-фторфенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклобутокси)-2-пиридил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота,
2-[1-[4-[6-(циклопропилметокси)-2-пиридил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота,
2-[1-[4-[4-(циклобутокси)-6-метил-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-(6-бутокси-2-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[2-(циклобутокси)-6-метил-пиримидин-4-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[2-(циклобутокси)тиазол-4-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклобутокси)-4-метил-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(циклобутокси)-6-метил-пиримидин-2-ил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота,
2-[1-[4-[6-(циклобутокси)пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(циклобутокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(циклопропилметокси)-6-метил-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(циклопропилметокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклопропилметокси)пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклобутокси)пиразин-2-ил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота,
2-[1-[4-[6-(циклопропилметокси)пиразин-2-ил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота,
2-[1-[4-[4-(циклобутокси)пиримидин-2-ил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота,
2-[1-[4-[4-(циклопропилметокси)пиримидин-2-ил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота,
2-[1-[4-(6-этоксипиразин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-изопропоксипиразин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-метоксипиразин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-пропоксипиразин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-изобутоксипиразин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-(6-бутоксипиразин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклопентокси)пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-(4-этоксипиримидин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(4-изопропоксипиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(4-пропоксипиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(4-изобутоксипиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-(4-этокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(4-изопропокси-6-метил-пиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(4-метил-6-пропокси-пиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(4-изобутокси-6-метил-пиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-пирролидин-1-илпиразин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[6-(изопропиламино)пиразин-2-ил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(диэтиламино)пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[6-(изобутиламино)пиразин-2-ил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклопентиламино)пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклопентиламино)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(диметиламино)пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[4-(изобутиламино)пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклобутокси)-5-метил-пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-фенилпиразин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-(6-циклопентилпиразин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-изобутилпиразин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(4-изобутилпиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[5-(циклобутокси)-3-метил-изотиазол-4-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
{1-[4-(4-этокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота,
{1-[4-(4-этокси-5-метил-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота,
2-[1-[4-(6-бутилпиразин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-(6-изопентилпиразин-2-ил)фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(циклобутокси)-5-фтор-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(циклопропилметокси)-5-фтор-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-(6-циклобутил-2-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-(6-циклобутилпиразин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклобутилметил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[6-(циклопентилметил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
{1-[4-(4-циклопропилметокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота,
(1-{2,6-дифтор-4-[4-(4-фторфенил)-тиазол-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота,
{1-[4-(4-циклобутокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота,
{1-[4-(4-бутокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота,
2-(1-{2,6-дифтор-4-[7-(пропан-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил]фенил}пиперидин-4-ил)уксусная кислота,
2-[1-[4-(6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(циклобутокси)-6,7-дигидро-5H-циклопента[d]пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(циклобутокси)-5,6-диметил-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
4-[2-хлор-4-[6-(циклобутокси)-2-пиридил]-6-фторфенокси]бутановая кислота,
4-[2,6-дихлор-4-[6-(циклобутокси)-2-пиридил]фенокси]бутановая кислота,
4-[4-[3-(циклопропилметоксиметил)-2-фурил]-2,6-дифтор-фенокси]бутановая кислота,
4-[4-[6-(циклопропилметоксиметил)-2-пиридил]-2,6-дифтор-фенокси]бутановая кислота,
4-[2-хлор-4-[3-(циклобутокси)-5-фторфенил]-6-фторфенокси]бутановая кислота,
4-[4-[3-(циклопропилметоксиметил)-5-метил-изоксазол-4-ил]-2,6-дифтор-фенокси]бутановая кислота,
4-[2-хлор-4-[4-(циклобутокси)-6-метил-пиримидин-2-ил]-6-фторфенокси]бутановая кислота,
4-[2-хлор-4-[2-(циклобутокси)-6-метил-пиримидин-4-ил]-6-фторфенокси]бутановая кислота,
4-[4-[6-хлор-4-(циклобутокси)-2-пиридил]-2,6-дифтор-фенокси]бутановая кислота,
4-[4-[2-(циклобутокси)тиазол-4-ил]-2,6-дифтор-фенокси]бутановая кислота,
4-[4-[6-(циклобутокси)-4-метил-2-пиридил]-2,6-дифтор-фенокси]бутановая кислота,
4-[2-хлор-4-[4-(циклопропилметокси)-6-метил-пиримидин-2-ил]-6-фторфенокси]бутановая кислота,
4-[4-[2-(циклопропилметокси)тиазол-4-ил]-2,6-дифтор-фенокси]бутановая кислота,
4-[4-[6-(циклобутокси)пиразин-2-ил]-2,6-дифтор-фенокси]бутановая кислота,
5-[4-[6-(циклобутокси)пиразин-2-ил]-2,6-дифтор-фенил]гексановая кислота,
4-[2-хлор-4-(6-циклопентилокси-пиридин-2-ил)-6-фторфенокси]-масляная кислота,
4-[2-хлор-4-(6-циклопропилметокси-пиридин-2-ил)-6-фторфенокси]-масляная кислота,
4-[2-хлор-6-фтор-4-(6-изопропокси-пиридин-2-ил)-фенокси]-масляная кислота,
4-[2-хлор-4-(6-циклобутилсульфанил-пиридин-2-ил)-6-фторфенокси]-масляная кислота,
4-[2-хлор-6-фтор-4-(6-изопропилсульфанил-пиридин-2-ил)-фенокси]-масляная кислота,
4-(5-хлор-3ʹ-циклобутокси-3-фтор-бифенил-4-илокси)-масляная кислота,
4-(5-хлор-3ʹ-циклопропилметокси-3-фтор-бифенил-4-илокси)-масляная кислота,
4-(5-хлор-3ʹ-циклопропилметокси-3-фтор-4ʹ-метокси-бифенил-4-илокси)-масляная кислота,
4-(5-хлор-3ʹ-циклопропилметокси-3,4ʹ-дифтор-бифенил-4-илокси)-масляная кислота,
4-(3ʹ-циклобутилсульфанил-3,5-дифтор-бифенил-4-илокси)-масляная кислота,
5-(3ʹ-циклобутокси-3,5-дифтор-бифенил-4-ил)-гексановая кислота,
5-(5ʹ-циклобутокси-3,5,3ʹ-трифтор-бифенил-4-ил)-гексановая кислота,
5-(3ʹ-циклопропилметокси-3,5-дифтор-4ʹ-метокси-бифенил-4-ил)-гексановая кислота,
5-(3ʹ-циклопропилметокси-3,5-дифтор-бифенил-4-ил)-гексановая кислота,
5-(5ʹ-циклобутокси-3ʹ-фтор-бифенил-4-ил)-5,5-дифтор-пентановая кислота,
5-[4-(5-хлор-6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-гексановая кислота,
4-(3ʹ-циклобутансульфонил-3,5-дифтор-бифенил-4-илокси)-масляная кислота,
5-({[4-(6-циклобутокси-пиридин-2-ил)-фенил]-метил-амино}-метил)-изоксазол-3-ол,
5-[4-(2-циклобутокси-6-метил-пиримидин-4-ил)-2,6-дифтор-фенил]-гексановая кислота,
5-[4-(4-циклобутокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-гексановая кислота,
4-[4-(4-циклобутокси-пиримидин-2-ил)-2,6-дифтор-фенокси]-масляная кислота,
4-[4-(2-циклобутокси-пиримидин-4-ил)-2,6-дифтор-фенокси]-масляная кислота,
4-[2-хлор-4-(4-циклобутокси-пиримидин-2-ил)-6-фторфенокси]-масляная кислота,
4-[2-хлор-4-(2-циклобутокси-пиримидин-4-ил)-6-фторфенокси]-масляная кислота,
4-[2-хлор-4-(6-хлор-4-циклобутокси-пиридин-2-ил)-6-фторфенокси]-масляная кислота,
4-[4-(4-циклобутокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенокси]-масляная кислота,
4-[2-хлор-4-(2-циклобутокси-тиазол-4-ил)-6-фторфенокси]-масляная кислота,
4-[2-хлор-4-(2-циклопропилметокси-тиазол-4-ил)-6-фторфенокси]-масляная кислота,
4-[2-хлор-4-(4-циклопропилметокси-пиримидин-2-ил)-6-фторфенокси]-масляная кислота,
4-[2-хлор-4-(6-циклобутокси-4-метил-пиридин-2-ил)-6-фторфенокси]-масляная кислота,
4-[2-хлор-4-(6-циклобутокси-пиразин-2-ил)-6-фторфенокси]-масляная кислота,
4-[2-хлор-4-(6-циклопропилметокси-пиразин-2-ил)-6-фторфенокси]-масляная кислота,
4-[4-(4-циклопропилметокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенокси]-масляная кислота,
4-[4-(4-циклопропилметокси-пиримидин-2-ил)-2,6-дифтор-фенокси]-масляная кислота,
4-[4-(6-циклопропилметокси-пиразин-2-ил)-2,6-дифтор-фенокси]-масляная кислота,
4-[2-хлор-4-(6-циклопропилметокси-4-метил-пиридин-2-ил)-6-фторфенокси]-масляная кислота,
4-[2-хлор-6-фтор-4-(6-изопропокси-пиразин-2-ил)-фенокси]-масляная кислота,
4-[2-хлор-4-(6-этокси-пиразин-2-ил)-6-фторфенокси]-масляная кислота,
{(R)-1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота,
3-[8-фтор-6-(2-изопропилсульфанил-3-пиридил)тиохроман-2-ил]пропановая кислота,
3-[6-[6-(циклобутокси)-2-пиридил]тиохроман-2-ил]пропановая кислота,
3-[2-[2,6-дифтор-4-(7-метокси-2,2-диметил-3H-бензофуран-4-ил)фенил] циклопропил]пропановая кислота,
3-[2-(2,6-дифтор-4-спиро[3H-бензофуран-2,1ʹ-циклопентан]-7-ил-фенил) циклопропил]пропановая кислота,
3-[6-[6-(циклобутокси)-2-пиридил]хроман-2-ил]пропановая кислота,
3-[6-[6-(циклопропилметокси)-2-пиридил]хроман-2-ил]пропановая кислота,
4-[4-(2,3-диметоксифенил)-2,6-дифтор-фенокси]бутановая кислота,
3-[6-[3-(циклопропилметокси)фенил]хроман-2-ил]пропановая кислота,
3-[6-[3-(циклопентокси)фенил]хроман-2-ил]пропановая кислота,
4-(2,6-дифтор-N-метил-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-анилино)бутановая кислота,
5-(2,6-дифтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенил)гексановая кислота,
3-[6-(6-трет-бутилсульфанил-2-пиридил)хроман-2-ил]пропановая кислота,
3-[6-(6-изопропокси-2-пиридил)хроман-2-ил]пропановая кислота,
2-[1-(2,6-дифтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенил)-4-пиперидил]уксусная кислота,
4-[4-(2,3-дипропоксифенил)-2,6-дифтор-фенокси]бутановая кислота,
4-[4-[6-(циклобутокси)-5-метокси-2-пиридил]-2,6-дифтор-фенокси]бутановая кислота,
4-[4-[6-(циклобутокси)-5-метокси-2-пиридил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
2-[1-[4-[6-(циклобутокси)-5-метокси-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-(2,3-дипропоксифенил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
4-[4-[6-(циклопропилметокси)-5-метокси-2-пиридил]-2,6-дифтор-фенокси]бутановая кислота,
4-[4-(2,3-дипропоксифенил)-2,6-дифтор-N-метил-анилино]бутановая кислота,
4-[4-[6-(циклопропилметокси)-5-метокси-2-пиридил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
2-[1-[4-[6-(циклопропилметокси)-5-метокси-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
4-[4-(6-хлориндол-1-ил)-2,6-дифтор-фенокси]бутановая кислота,
5-[4-[6-(циклобутокси)-5-метокси-2-пиридил]фенил]-5,5-дифтор-пентановая кислота,
4-[2,6-дифтор-4-(5-фториндол-1-ил)фенокси]бутановая кислота,
4-[4-[3-(циклопропилметиламино)фенил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
4-[2,6-дифтор-N-метил-4-(6-пирролидин-1-ил-2-пиридил)анилино]бутановая кислота,
4-[2,6-дифтор-4-(5-метоксииндол-1-ил)фенокси]бутановая кислота,
4-[4-(5-цианоиндол-1-ил)-2,6-дифтор-фенокси]бутановая кислота,
4-[4-[3-(циклопропилметоксиметил)-2-фурил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
4-[2,6-дифтор-4-(4-фториндол-1-ил)фенокси]бутановая кислота,
4-[4-(7-хлориндол-1-ил)-2,6-дифтор-фенокси]бутановая кислота,
4-[4-[5-(циклопропилметоксиметил)-2-фурил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
4-[4-[6-(циклопропилметокси)индол-1-ил]-2,6-дифтор-фенокси]бутановая кислота,
4-[4-(7-хлориндол-1-ил)-2,6-дифтор-N-метил-анилино]бутановая кислота,
4-[4-[6-(циклобутокси)индол-1-ил]-2,6-дифтор-фенокси]бутановая кислота,
4-[4-[5-(циклобутокси)индол-1-ил]-2,6-дифтор-фенокси]бутановая кислота,
4-[2,6-дифтор-4-(4-метоксииндол-1-ил)фенокси]бутановая кислота,
4-[2,6-дифтор-4-(7-метоксииндол-1-ил)фенокси]бутановая кислота,
4-[2,6-дифтор-4-[5-(метоксиметил)индазол-1-ил]фенокси]бутановая кислота,
2-[1-[4-(7-хлориндол-1-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
4-[4-[6-(циклобутокси)индазол-1-ил]-2,6-дифтор-фенокси]бутановая кислота,
4-[2-хлор-4-[6-(циклобутокси)индазол-1-ил]-6-фторфенокси]бутановая кислота,
4-[4-[4-(циклобутокси)-6-метил-пиримидин-2-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
4-[4-[4-(циклобутокси)пиримидин-2-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
4-[4-[2-(циклобутокси)тиазол-4-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
2-[1-[4-[6-(циклобутокси)индазол-1-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
4-[4-[6-(циклобутокси)пиразин-2-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
4-[4-[4-(циклопропилметокси)-6-метил-пиримидин-2-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
4-[4-[4-(циклопропилметокси)пиримидин-2-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
4-[4-[6-(циклопропилметокси)пиразин-2-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
4-[4-[6-(циклобутокси)индазол-1-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
4-[4-[6-(циклопропилметокси)-2-пиридил]-2,6-дифтор-N-метил-анилино]бутановая кислота,
2-[1-[4-[6-(циклобутокси)индазол-1-ил]-2,6-дифтор-фенил]пирролидин-3-ил]уксусная кислота,
2-{1-[2,6-дифтор-4-(6-пропокси-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота,
2-{1-[2,6-дифтор-4-(6-изобутокси-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота,
2-{1-[2,6-дифтор-4-(6-циклопентокси-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота,
2-{1-[2,6-дифтор-4-(6-бутокси-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота,
2-{1-[2,6-дифтор-4-(4-пропокси-пиримидин-2-ил)фенил]пирролидин-3-ил}уксусная кислота,
2-{1-[2,6-дифтор-4-(4-изопропокси-пиримидин-2-ил)фенил]пирролидин-3-ил}уксусная кислота,
2-{1-[2,6-дифтор-4-(4-этокси-пиримидин-2-ил)фенил]пирролидин-3-ил}уксусная кислота,
2-{1-[2,6-дифтор-4-(4-изобутокси-пиримидин-2-ил)фенил]пирролидин-3-ил}уксусная кислота,
2-{1-[2,6-дифтор-4-(6-изобутиламино-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота,
2-{1-[2,6-дифтор-4-(6-циклопентиламино-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота,
2-{1-[2,6-дифтор-4-(6-изопропиламино-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота,
2-{1-[2,6-дифтор-4-(6-диэтиламино-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота,
3-[6-(6-циклобутокси-пиразин-2-ил)-тиохроман-2-ил]-пропионовая кислота,
2-[1-[4-[4-(4-хлорфенокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(4-хлорфенокси)пиримидин-2-ил]-2,6-дифтор-фенил]-пирролидин-3-ил]уксусная кислота,
2-[1-[4-[4-фенокси-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(4-фторфенокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(4-пиридин-3-илокси-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[6-(4-фторфенокси)пиразин-2-ил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(4-метоксифенокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[4-(4-фторфенокси)-6-метил-пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(п-толилокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(3,4-дифторфенокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
4-[4-(5-хлор-2-метил-бензофуран-7-ил)-2,6-дифтор-фенокси]-масляная кислота,
5-[4-(5-хлор-2-метил-бензофуран-7-ил)-2,6-дифтор-фенил]-гексановая кислота,
4-[(3ʹ-циклобутилметокси-3,5-дифтор-бифенил-4-ил)-метил-амино]-масляная кислота,
4-(3ʹ-циклобутилметокси-3,5-дифтор-бифенил-4-илокси)-масляная кислота,
4-{[4-(6-циклобутилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
4-[4-(6-циклобутилметокси-пиридин-2-ил)-2,6-дифтор-фенокси]-масляная кислота,
4-[(3ʹ-циклопропилметокси-3,5-дифтор-бифенил-4-ил)-метил-амино]-масляная кислота,
4-[(3ʹ-циклопентилокси-3,5-дифтор-бифенил-4-ил)-метил-амино]-масляная кислота,
4-(3ʹ-циклопропилметокси-3,5-дифтор-4ʹ-метокси-бифенил-4-илокси)-масляная кислота,
4-(3ʹ-циклопропилметокси-3,5,4ʹ-трифтор-бифенил-4-илокси)-масляная кислота,
4-(5ʹ-циклобутокси-3,5,3ʹ-трифтор-бифенил-4-илокси)-масляная кислота,
4-[(5ʹ-циклобутилметокси-3,5-дифтор-2ʹ-метил-бифенил-4-ил)-метил-амино]-масляная кислота,
4-(5ʹ-циклобутилметокси-3,5-дифтор-2ʹ-метил-бифенил-4-илокси)-масляная кислота,
4-{[4-(5-хлор-6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота,
4-(3ʹ-циклопропилметокси-3,5-дифтор-4ʹ-метил-бифенил-4-илокси)-масляная кислота,
4-[4-(5-хлор-6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенокси]-масляная кислота,
4-(4ʹ-хлор-3ʹ-циклопропилметокси-3,5-дифтор-бифенил-4-илокси)-масляная кислота,
5-(5ʹ-циклобутокси-3,3ʹ-дифтор-бифенил-4-ил)-пентановая кислота,
4-(5ʹ-циклобутокси-3,3ʹ-дифтор-бифенил-4-илокси)-масляная кислота,
5-[4-(6-циклобутокси-пиридин-2-ил)-2-фторфенил]-пентановая кислота,
4-[4-(6-циклобутокси-пиридин-2-ил)-2-фторфенокси]-масляная кислота,
4-[4-(6-циклобутилметокси-пиридин-2-ил)-2-фторфенокси]-масляная кислота,
4-[4-(6-циклобутилсульфанил-пиридин-2-ил)-2-фторфенокси]-масляная кислота,
2-(3ʹ-циклобутокси-3,5,5ʹ-трифтор-бифенил-4-илоксиметил)-циклопропан-карбоновая кислота,
2-[4-(4-циклобутокси-6-метил-пиримидин-2-ил)-2,6-дифтор-феноксиметил]-циклопропан-карбоновая кислота,
2-[4-(4-циклобутокси-пиримидин-2-ил)-2,6-дифтор-феноксиметил]-циклопропан-карбоновая кислота,
2-[4-(6-циклобутокси-пиридин-2-ил)-2,6-дифтор-феноксиметил]-циклопропан-карбоновая кислота,
2-[4-(4-циклопропилметокси-пиримидин-2-ил)-2,6-дифтор-феноксиметил]-циклопропан-карбоновая кислота,
2-[4-(4-циклопропилметокси-6-метил-пиримидин-2-ил)-2,6-дифтор-феноксиметил]-циклопропан-карбоновая кислота,
2-[4-(6-циклопропилметокси-пиразин-2-ил)-2,6-дифтор-феноксиметил]-циклопропан-карбоновая кислота,
2-[4-(6-циклобутокси-4-метил-пиридин-2-ил)-2,6-дифтор-феноксиметил]-циклопропан-карбоновая кислота,
2-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-феноксиметил]-циклопропан-карбоновая кислота,
2-[4-(6-циклобутокси-пиразин-2-ил)-2,6-дифтор-феноксиметил]-циклопропан-карбоновая кислота,
2-[4-(2-циклобутокси-тиазол-4-ил)-2,6-дифтор-феноксиметил]-циклопропан-карбоновая кислота,
2-[2-хлор-4-(6-циклопропилметокси-пиридин-2-ил)-6-фтор-феноксиметил]-циклопропан-карбоновая кислота,
2-[2-хлор-4-(4-циклобутокси-6-метил-пиримидин-2-ил)-6-фтор-феноксиметил]-циклопропан-карбоновая кислота,
2-[2-хлор-4-(6-циклобутокси-пиридин-2-ил)-6-фтор-феноксиметил]-циклопропан-карбоновая кислота,
3-[6-(3-циклобутокси-фенил)-хроман-2-ил]-пропионовая кислота,
3-[6-(6-пропокси-пиридин-2-ил)-хроман-2-ил]-пропионовая кислота,
4-[2,6-дифтор-4-(1H-индол-6-ил)-фенокси]-бутановая кислота,
4-[2,6-дифтор-4-(1-изопропил-1H-индол-6-ил)-фенокси]-бутановая кислота,
4-[4-(1-циклопропилметил-1H-индол-6-ил)-2,6-дифтор-фенокси]-бутановая кислота
{1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
4-[4-(3-хлор-1-изопропил-1H-индол-6-ил)-2,6-дифтор-фенокси]-бутановая кислота,
{1-[2,6-дифтор-4-(6-изопропокси-пиридин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(6-циклобутилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
4-[4-(5-циклопропилметоксиметил-тиофeн-2-ил)-2,6-дифтор-фенокси]-бутановая кислота,
4-[4-(5-циклопропилметоксиметил-тиофeн-3-ил)-2,6-дифтор-фенокси]-бутановая кислота,
{1-[4-(5-циклопропилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота,
4-[4-(4-циклопропилметоксиметил-2-метил-тиазол-5-ил)-2,6-дифтор-фенокси]-бутановая кислота,
{1-[4-(5-циклометоксиметил-тиофен-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота,
{1-[4-(4-циклопропилметоксиметил-2-метил-тиазол-5-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота,
4-[4-(5-циклобутилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановая кислота,
4-[2,6-дифтор-4-(5-изобутоксиметил-тиофен-3-ил)-фенокси]-бутановая кислота,
4-[4-(5-циклобутоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановая кислота,
4-[4-(3-циклопропилметоксиметил-тиофен-2-ил)-2,6-дифтор-фенокси]-бутановая кислота,
{1-[4-(4-циклобутокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(4-циклопропилметокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(6-циклобутокси-4-метил-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(6-циклобутокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(4-циклобутокси-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(6-циклопропилметокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(4-циклопропилметокси-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(2-циклобутокси-тиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(2-циклопропилметокси-тиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[2,6-дифтор-4-(6-метокси-пиразин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(6-этокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[2,6-дифтор-4-(6-изопропокси-пиразин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[2,6-дифтор-4-(4-изопропокси-6-метил-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[2,6-дифтор-4-(4-изобутокси-6-метил-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[2,6-дифтор-4-(4-метил-6-пропокси-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(4-этокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(5-циклобутокси-3-метил-изотиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(4-циклобутокси-5-фтор-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[4-(4-циклопропилметокси-5-фтор-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
{1-[2,6-дифтор-4-(5-фтор-4-изобутокси-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота,
(1-{2,6-дифтор-4-[6-(3-метокси-пропокси)-пиридин-2-ил]-фенил}-пирролидин-3-ил)-уксусная кислота,
(1-{2,6-дифтор-4-[6-(тетрагидро-тиопиран-4-илокси-пиридин-2-ил]-фенил}-пирролидин-3-ил)-уксусная кислота,
{1-[2,6-дифтор-4-(5-фтор-4-изобутокси-пиримидин-2-ил)-фенил]-пиперидин-4-ил}-уксусная кислота,
{1-[2,6-дифтор-4-(5-фтор-4-пропокси-пиримидин-2-ил)-фенил]-пиперидин-4-ил}-уксусная кислота,
(1-{2,6-дифтор-4-[4-(3-метил-бутокси)-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота,
(1-{2,6-дифтор-4-[4-(3-метокси-пропокси)-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота,
(1-{2,6-дифтор-4-[4-(3-метокси-пропокси)-6-метил-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота,
(1-{2,6-дифтор-4-[4-(2-метокси-этокси)-6-метил-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота,
(1-{2,6-дифтор-4-[6-(3-метокси-пропокси)-пиридин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота,
{(S)-1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота,
2-[1-[2,6-дифтор-4-[4-[(6-метил-3-пиридил)окси]пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[6-(4-этилфенокси)пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[4-[4-(3-фторфенокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[4-(3,4-фторфенокси)-6-метил-пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[4-(2-пиридилoкси)пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[4-[4-(трифторметил)фенокси]пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[4-[3-(трифторметил)фенокси]пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[4-метил-6-[4-(трифторметил)фенокси]пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота,
2-[1-[2,6-дифтор-4-[4-метил-6-[3-(трифторметил)фенокси]пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота,
{1-[4-(6-циклобутокси-4-трифторметил-пиридин-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота,
(1-{2,6-дифтор-4-[2-(4-фторфенил)-бензо[b]тиофен-4-ил]-фенил}-пиперидин-4-ил)-уксусная кислота,
{1-[2,6-дифтор-4-(2-м-толил-бензо[b]тиофен-4-ил)-фенил]-пиперидин-4-ил}-уксусная кислота,
{1-[4-(4-циклобутокси-6-трифторметил-пиримидин-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота,
{1-[2,6-дифтор-4-(4-пропокси-6-трифторметил-пиримидин-2-ил)-фенил]-пиперидин-4-ил}-уксусная кислота,
(1-{2,6-дифтор-4-[4-(4-фторфенокси)-6-трифторметил-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота,
3-{1-[2,6-дифтор-4-(6-пропокси-пиридин-2-ил)-фенил]-пиперидин-4-ил}-пропионовая кислота,
3-{1-[4-(6-циклобутил-пиридин-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-пропионовая кислота, и
3-{1-[4-(6-этокси-пиридин-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-пропионовая кислота.
Термины и аббревиатуры, используемые здесь, сохраняют свои оригинальные значения, если не указано иное.
Настоящее изобретение также относится к способу получения соединения Формулы 1. В дальнейшем способ получения соединения Формулы 1 объясняется на основе примеров реакций для иллюстрации настоящего изобретения. Однако специалист может получить соединение Формулы 1 различными способами на основе структуры Формулы 1, и такие способы должны интерпретироваться как находящиеся в рамках настоящего изобретения. Т.е., соединение Формулы 1 может быть получено способами, описанными здесь, или путем объединения различных способов, раскрытых в предшествующем уровне техники, которые должны интерпретироваться как находящиеся в рамках настоящего изобретения. Соответственно, способ получения соединения Формулы 1 не ограничен следующими способами.
Как представлено в следующей Реакционной Схеме 1, соединение Формулы 1 согласно настоящему изобретению может быть получено реакцией сочетания C-C Соединения 2 и Соединения 3 в присутствии стандартного металлического катализатора и, при необходимости, дополнительного гидролиза.
[Реакционная Схема 1]

Кроме того, соединение Формулы 1 согласно настоящему изобретению может быть получено реакцией сочетания Соединения 4 и Соединения 5, Соединения 6 или Соединения 7 в присутствии стандартного основания или реактивов сочетания и, при необходимости, дополнительным гидролизом, как представлено в следующей Реакционной Схеме 2. В Реакционной Схеме 2, Z-R7 и J Соединений 4 и 7 независимо обозначают галоген, OH, SH или O-алкил. Когда Z-R7 обозначает O-алкил, он превращается в OH реакцией деалкилирования прежде чем быть подвергнутым реакции сочетания.
[Реакционная Схема 2]

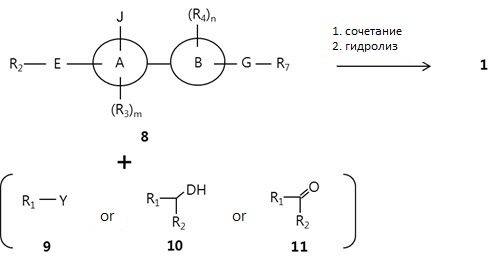
Кроме того, соединение Формулы 1 согласно настоящему изобретению может быть получено путем реакции Соединения 8, замещенного радикалом J, с Соединением 9 или Соединением 10 в присутствии стандартного основания, металлических катализаторов или реактивов сочетания, как представлено в следующей Реакционной Схеме 3. В Реакционной Схеме 3, J и Y независимо обозначают галоген, OH, SH или NH2. Когда J является амином, "реакция восстановительного аминирования" может быть проведена с Соединением 11.
[Реакционная Схема 3]
В Реакционной Схеме 1 Соединение 2 может быть получено реакцией сочетания Соединения 12 и Соединения 13 в присутствии стандартной кислоты, основания или реактива сочетания, как представлено в следующей Реакционной Схеме 4.
[Реакционная Схема 4]

Кроме того, Соединение 2 может быть получено реакцией сочетания Соединения 14 и Соединения 10 в присутствии стандартного основания и металлического катализатора, как представлено в следующей Реакционной Схеме 5.
[Реакционная Схема 5]

Кроме того, Соединение 2, в котором R1 и R2 формируют кольцо с D и E, может быть получено в присутствии стандартной кислоты, как представлено в следующей Реакционной Схеме 6.
[Реакционная Схема 6]

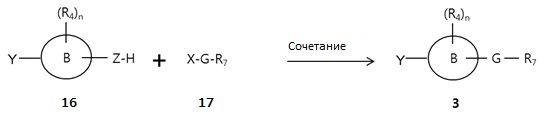
Между тем Соединение 3 может быть получено реакцией сочетания Соединения 16 и Соединения 17 в присутствии стандартного основания или реактива сочетания, как представлено в следующей Реакционной Схеме 7.
[Реакционная Схема 7]
В приведенных выше реакционных схемах 1-7,
X обозначает галоген или -OSO2CF3,
Y обозначает бороновую кислоту или эфир бороновой кислоты, и
A, B, D, E, G, R1, R2, R3, R4, R7, m, n и p совпадают со значениями в приведенной выше Формуле 1.
В вышеупомянутой реакции переходный металл, такой как палладий (Pd) может использоваться в качестве стандартного металлического катализатора. Вышеупомянутые реакции могут быть осуществлены в стандартных растворителях, не оказывающих неблагоприятного эффекта на реакции. Предпочтительные растворители включают, но не ограничены ими, один или несколько растворителей, выбранных из диметилформамида, диметилацетамида, тетрагидрофурана, ацетонитрила, метанола, этанола, воды, 1,2-дихлорэтана, диметилсульфоксида, простого этилового эфира, простого метил-трет-бутилового эфира, метиленхлорида и хлороформа.
В вышеупомянутых реакциях необъясненные соединения представляют собой известные соединения или соединения, легко доступные из известных соединений известными способами или подобными способами.
Соединение Формулы 1, полученное вышеупомянутыми способами, может быть выделено или очищено от продуктов реакции стандартными способами, такими как перекристаллизация, ионофорез, колоночная хроматография на силикагеле или ионообменная хроматография.
Как объяснено выше, соединения согласно настоящему изобретению, исходные материалы или промежуточные соединения для их получения могут быть получены множеством способов, которые должны интерпретироваться как находящиеся в рамках настоящего изобретения.
Соединение Формулы 1 согласно настоящему изобретению имеет эффект агониста GPR120. Соответственно, настоящее изобретение относится к фармацевтической композиции в качестве агониста GPR120, включающей соединение Формулы 1, его фармацевтически приемлемую соль или изомер в качестве активного ингредиента. Различные виды пролекарств, превращающихся в соединение Формулы I in vivo, также находятся в рамках настоящего изобретения.
Примеры заболеваний, которые могут быть предотвращены или вылечены фармацевтической композицией согласно настоящему изобретению в качестве агониста GPR120, включают, но не ограничены ими, метаболическое заболевание, такое как диабет, осложнения диабета, ожирение, неалкогольное ожирение печени, стеатогепатит, остеопороз и т.п. и воспаление. Осложнения диабета включают, но не ограничены ими, нейрогенное заболевание, гиперлипидемию, гипертензию, ретинит и почечную недостаточность.
Кроме того, настоящее изобретение относится к способу получения композиции для профилактики или лечения метаболического заболевания, такого как диабет, осложнения диабета, ожирение, неалкогольное ожирение печени, стеатогепатит, остеопороз и т.п. и воспаление, включающего стадию смешивания соединения Формулы 1, его фармацевтически приемлемой соли или изомера в качестве активного ингредиента и фармацевтически приемлемого носителя.
В настоящем изобретении "фармацевтическая композиция" или "композиция для понижения уровня глюкозы крови" может включать другие компоненты, такие как носители, разбавители, эксципиенты и т.д., в дополнение к активному ингредиенту согласно настоящему изобретению. Соответственно, фармацевтическая композиция может при необходимости включать фармацевтически приемлемые носители, разбавители, эксципиенты или их комбинации. Фармацевтическая композиция облегчает введение соединений в тело. Различные способы введения соединений включают, но не ограничены ими, пероральное, инъекционное, аэрозольное, парентеральное и местное введение.
В рамках изобретения под "носителем" имеется в виду соединение, облегчающее добавление соединений в клетку или ткань. Например, диметилсульфоксид (DMSO) является стандартным носителем, облегчающим введение многих органических соединений в живые клетки или ткани.
В рамках изобретения "разбавитель" означает соединение, не только стабилизирующее биологически активную форму, но и разбавленное в растворителе, растворяющем соединения. Растворенная соль в буфере используется в качестве разбавителя в этой области. Традиционно используемый буфер является солевым раствором фосфатного буфера, имитирующим солевую форму в жидкости организма. Так как буферный раствор может регулировать pH раствора в низкой концентрации, буферный разбавитель не сильно изменяет биологическую активность соединений.
В рамках изобретения "фармацевтически приемлемый" означает такое свойство, которое не ухудшает биологическую активность и физические свойства соединений.
Соединения согласно настоящему изобретению могут быть составлены как различные фармацевтически вводимые лекарственные формы. В получении фармацевтической композиции согласно настоящему изобретению, активный компонент ─ в частности, соединение Формулы 1 или его фармацевтически приемлемую соль или изомер ─ смешивают с выбранными фармацевтически приемлемыми носителями, в зависимости от получаемой лекарственной формы. Например, фармацевтическая композиция согласно настоящему изобретению может быть составлена в форме инъекций, пероральных препаратов и т.п. в соответствии с необходимостью.
Соединение согласно настоящему изобретению может быть составлено стандартными способами с использованием известных фармацевтических носителей и эксципиентов и введено в контейнеры, содержащие одну или несколько доз. Составы могут быть раствором, суспензией или эмульсией в масляном или водном растворителе и могут включать стандартные диспергирующие агенты, суспендирующие агенты или стабилизирующие агенты. Кроме того, соединение может быть, например, в сухой порошковой форме, растворенной в стерилизованной апирогенной воде перед использованием. Соединение согласно настоящему изобретению может быть составлено в суппозитории с использованием стандартной основы для суппозитория, такой как масло какао или другие глицериды. Твердые формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. Капсулы и таблетки являются предпочтительными. Таблетки и пилюли предпочтительно имеют энтеросолюбильное покрытие. Твердые формы получают путем смешивания соединений согласно настоящему изобретению с по меньшей мере одним носителем, выбранным из инертных разбавителей, таких как сахароза, лактоза или крахмал, лубрикантов, таких как стеарат магния, разрыхлителей, связующих и т.п.
Соединение или содержащая его фармацевтическая композиция согласно настоящему изобретению могут при необходимости быть введены в комбинации с другими лекарственными средствами, например, другими антидиабетическими средствами.
Дозировка соединения Формулы 1 согласно настоящему изобретению определяется предписанием врача с учетом массы тела пациента, возраста и болезненного состояния. Типичная доза для взрослых находится в диапазоне приблизительно от 0,3 до 500 мг в сутки в зависимости от частоты и интенсивности введения. Типичная суточная доза для внутримышечного введения или внутривенного введения для взрослых находится в диапазоне приблизительно от 1 до 300 мг в сутки, которые могут быть введены в раздельных лекарственных формах. Некоторым пациентам нужна более высокая суточная доза.
Настоящее изобретение также относится к способу профилактики или лечения заболевания с использованием эффективного количества соединения Формулы 1 или его фармацевтически приемлемой соли или изомера в качестве активного ингредиента агониста GPR120. Репрезентативные заболевания, которые могут быть подвергнуты лечению агонистом GPR120, включают, но не ограничены ими, метаболические заболевания, такие как вышеупомянутый диабет, осложнения диабета, ожирение, неалкогольное ожирение печени, стеатогепатит и остеопороз и воспалительные заболевания. В рамках изобретения термин "лечение" означает задержку, отсрочку или сдерживание прогрессирования заболеваний у пациента, демонстрирующего симптомы заболеваний. Термин "профилактика" означает задержку, отсрочку или облегчение симптома заболеваний у пациента, для которого существует риск проявления симптомов заболеваний, даже если он или она не демонстрирует эти симптомы.
ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Биарильное производное Формулы 1 согласно настоящему изобретению как агонист GPR120 промотирует формирование GLP-1 в желудочно-кишечном тракте и улучшает инсулинорезистентность в печени или в мышцах вследствие противовоспалительного действия на макрофаги, липоциты и т.д., и может, соответственно, эффективно использоваться для профилактики или лечения метаболического заболевания, такого как диабет, осложнения диабета, ожирение, неалкогольное ожирение печени, стеатогепатит, остеопороз и т.п., и воспалительных заболеваний.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение объясняется более подробно следующими Примерами. Однако эти Примеры служат только для иллюстрации настоящего изобретения, и объем настоящего изобретения не ограничен ими.
В дальнейшем M означает молярную концентрацию, и Н означает нормальную концентрацию. Кроме того, аббревиатуры, используемые в следующих Примерах получения и Примерах, являются следующими:
AcCl: ацетилхлорид
AcOH: уксусная кислота
BBr3: трибромид бора
BINAP: 2,2ʹ-бис(дифенилфосфино)-1,1ʹ-бинафтил
Br2: бром
Bu4NI: тетрабутиламмоний йодид
CSA: камфорсульфоновая кислота
CH3CN: ацетонитрил
Cs2CO3: карбонат цезия
DBU: 1,8-диазабицикло[5.4.0]ундец-7-ен
DCE: 1,2-дихлорэтан
DCM: дихлорметан
DIBAL-H: диизобутилалюминий гидрид
DIPEA: N,N-диизопропилэтиламин
DME: 1,2-диметоксиэтан
DMF: N,N-диметилформамид
DMS: диметилсульфид
DMSO: диметил сульфоксид
DPPF: 1,1ʹ-бис(дифенилфосфино)ферроцен
EtOAc: этилацетат
EtOH: этанол
Et2O: простой диэтиловый эфир
Fe(acac)3: ацетилацетонат железа (III)
HCl: соляная кислота
Hex: n-гексан
IBX: 2-йодоксибензойная кислота
K2CO3: карбонат калия
KOAc: ацетат калия
LAH: литий-алюминийгидрид
LiHMDS: бис(триметилсилил)амид лития
MC: метиленхлорид
mCPBA: 3-хлорпербензойная кислота
MeOH: метанол
MgSO4: сульфат магния
MsCl: метансульфонил хлорид
MTBE: метил-трет-бутиловый эфир
NaBH4: боргидрид натрия
NaCl: хлорид натрия
Na2CO3: карбонат натрия
NaH: гидрид натрия
NaOAc: ацетат натрия
NaOEt: этоксид натрия
NaOH: гидроксид натрия
NBS: N-бромсукцинимид
n-BuLi: бутил литий
NCS: N-хлорсукцинимид
NMM: 4-метилморфолин
NMP: 1-метилпирролидин-2-он
Pd/C: палладий/углерод
PdCl2(dppf)-DCM: 1,1ʹ-бис(дифенилфосфино)ферроцен палладий (II) дихлорид-дихлорметан
PdCl2(PPh3)2: бис(трифенилфосфин)палладий (II) дихлорид
Pd2(dba)3: трис(дибензилиденацетон)дипалладий (0)
Pd(OAc)2: палладий (II) ацетат
Pd(PPh3)4: тетракис(трифенилфосфин)палладий (0)
PtO2: оксид платины (IV)
SOCl2: тионилхлорид
SPhos: 2-дициклогексилфосфино-2',6'-диметоксибифенил
TBAB: тетрабутиламмоний бромид
TEA: триэтиламин
TFA: трифторуксусная кислота
THF: тетрагидрофуран
TMEDA: N,N,Nʹ,Nʹ-тетраметилэтилендиамин
TMSCl: хлортриметилсилан
Пример получения 1: этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хинолин-2-ил]-пропионовой кислоты
Стадия A: 6-бром-2-метил-хинолин
4-броманилин (3,0 г, 17,44 ммоль) растворяли в 30 мл 6Н HCl. Кротоновый альдегид (2,44 г, 34,88 ммоли) медленно добавляли, и реакционную смесь перемешивали при 100°C в течение 16 часов. Смесь охлаждали до 0°C, нейтрализовали водным раствором аммиака, экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (2 г, 52%).
1H-ЯМР (CDCl3) δ 8,02~7,92 (2H, m), 7,89 (1H, d), 7,73 (1H, d), 7,32 (1H, d), 1,60 (3H, s)
Стадия B: 6-бром-хинолин-2-карбальдегид
6-бром-2-метил-хинолин (1,0 г, 4,50 ммоль), полученный на Стадии A, растворяли в 1,4-диоксан. Добавляли диоксид селена (0,65 г, 5,85 ммоль), и реакционную смесь перемешивали при 80°C в течение 3 часов. Смесь фильтровали через Целит и отверждали Et2O с получением целевого соединения (0,93 г, 88%).
1H-ЯМР (CDCl3) δ 10,20 (1H, s), 8,22 (1H, d), 8,15~8,02 (3H, m), 7,90 (1H, d)
Стадия C: этиловый эфир (E)-3-(6-бром-хинолин-2-ил)-акриловой кислоты
6-бром-хинолин-2-карбальдегид (0,93 г, 3,95 ммоль), полученный на Стадии B, растворяли в THF. NaH (60%) (0,17 г, 4,35 ммоль) медленно добавляли при 0°C, и реакционную смесь перемешивали в течение 30 минут. Триэтил фосфоноацетат (0,97 г, 4,35 ммоль) добавляли по каплям, и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (0,86 г, 72%).
1H-ЯМР (CDCl3) δ 8,10 (1H, d), 8,00~7,92 (2H, m), 7,82~7,70 (2H, m), 7,63 (1H, d), 6,97 (1H, d), 4,30 (2H, q), 1,36 (3H, t)
Стадия D: этиловый эфир (E)-3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хинолин-2-ил]-акриловой кислоты
Этиловый эфир (E)-3-(6-бром-хинолин-2-ил)-акриловой кислоты (0,86 г, 2,82 ммоль), полученный на Стадии C, бис(пинаколято)диборон (0,86 г, 3,39 ммоль), ацетат калия (0,83 г, 8,47 ммоль) и DPPF (0,11 г, 0,2 ммоль) растворяли в 10 мл 1,4-диоксана и загружали газообразным N2 в течение 5 минут. Добавляли PdCl2(dppf)-DCM (0,16 г, 0,2 ммоль), и реакционную смесь перемешивали при 80°C в течение 4 часов. Реакционный раствор фильтровали через Целит и очищали колоночной хроматографией с получением целевого соединения (0,84 г, 86%).
1H-ЯМР (CDCl3) δ 8,31 (1H, s), 8,20 (1H, d), 8,10~8,05 (2H, m), 7,89 (1H, d), 7,60 (1H, d), 6,98 (1H, d), 4,30 (2H, q), 1,35 (12H, s), 1,25 (3H, t)
Стадия E: этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хинолин-2-ил]-пропионовой кислоты
Этиловый эфир (E)-3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хинолин-2-ил]-акриловой кислоты (0,83 г, 2,35 ммоль), полученный на Стадии D, растворяли в MeOH. Добавляли 10%-й Pd/C (0,08 г), и реакционную смесь перемешивали при комнатной температуре в течение 2 часов в атмосфере водорода. После завершения реакции смесь фильтровали через Целит и концентрировали при пониженном давлении с получением целевого соединения (0,83 г, 99%).
1H-ЯМР (CDCl3) δ 8,29 (1H, s), 8,10~7,90 (3H, m), 7,33 (1H, d), 4,17 (2H, q), 3,32 (2H, t), 2,94 (2H, t), 1,39 (12H, s), 1,25 (3H, t)
Пример получения 2: этиловый эфир [6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-илокси]-уксусной кислоты
Стадия A: этиловый эфир (6-бром-нафталин-2-илокси)-уксусной кислоты
6-бром-нафталин-2-ол (1,0 г, 4,48 ммоль) растворяли в 20 мл DMF и охлаждали до 0°C. Добавляли Cs2CO3 (1,75 г, 5,38 ммоль) и этиловый эфир бромуксусной кислоты (0,75 г, 4,48 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. К реакционному раствору добавляли воду, и раствор экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (1,3 г, 94%).
1H-ЯМР (CDCl3) δ 7,93 (1H, s), 7,70 (1H, d), 7,60 (1H, d), 7,50 (1H, d), 7,24 (1H, d), 7,04 (1H, s), 4,72 (2H, s), 4,29 (2H, q), 1,29 (3H, t)
Стадия B: этиловый эфир [6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-илокси]-уксусной кислоты
Этиловый эфир (6-бром-нафталин-2-илокси)-уксусной кислоты (0,5 г, 1,62 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,48 г, 83%).
1H-ЯМР (CDCl3) δ 8,29 (1H, s), 7,80 (2H, d), 7,68 (1H, d), 7,21 (1H, d), 7,06 (1H, s), 4,74 (2H, s), 4,31 (2H, q), 1,38 (12H, s), 1,29 (3H, t)
Пример получения 3: этиловый эфир 4-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-илокси]-масляной кислоты
Стадия A: этиловый эфир 4-(6-бром-нафталин-2-илокси)-масляной кислоты
6-бром-нафталин-2-ол (1,0 г, 4,48 ммоль) и этиловый эфир 4-бром-масляной кислоты (0,87 г, 4,48 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера Получения 2, с получением целевого соединения (1,5 г, 94%).
1H-ЯМР (CDCl3) δ 7,91 (1H, s), 7,65 (1H, d), 7,57 (1H, d), 7,48 (1H, d), 7,15 (1H, d), 7,08 (1H, s), 4,20~4,10 (4H, m), 2,55 (2H, t), 2,18 (2H, t), 1,25 (3H, t)
Стадия B: этиловый эфир 4-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-илокси]-масляной кислоты
Этиловый эфир 4-(6-бром-нафталин-2-илокси)-масляной кислоты (1 г, 2,96 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,8 г, 70%).
1H-ЯМР (CDCl3) δ 8,27 (1H, s), 7,78~7,75 (2H, m), 7,69 (1H, d), 7,12~7,08 (2H, m), 4,18~4,10 (4H, m), 2,55 (2H, t), 2,18 (2H, t), 1,33 (12H, s), 1,25 (3H, t)
Пример получения 4: этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты
Стадия A: хроман-2-карбоновая кислота
4-оксо-4H-хромен-2-карбоновую кислоту (4,0 г, 21,03 ммоль) растворяли в 20 мл уксусной кислоты. Добавляли 10%-й Pd/C (0,4 г) и перемешивали при комнатной температуре в течение 16 часов при 60 фунтов на квадратный дюйм водорода. Реакционный раствор фильтровали через Целит, разбавляли EtOAc и экстрагировали водным раствором бикарбоната натрия. Водный слой снова подкисляли 6Н HCl и экстрагировали EtOAc. Органический слой высушивали MgSO4 и концентрировали при пониженном давлении с получением целевого соединения (3,0 г, 80%).
1H-ЯМР (CDCl3) δ 7,13 (1H, t), 7,05 (1H, d), 6,95~6,85 (2H, m), 4,75 (1H, m), 3,00~2,80 (2H, m), 2,40 (1H, m), 2,20 (1H, m)
Стадия B: хроман-2-ил-метанол
Хроман-2-карбоновую кислоту (1,0 г, 5,61 ммоль), полученную на Стадии A, растворяли в 20 мл THF и охлаждали до -20°C. Добавляли изобутил хлорформиат (0,84 г, 6,17 ммоль) и NMM (0,65 г, 6,45 ммоль), и смесь перемешивали при той же температуре в течение 1 часа. NaBH4 (0,42 г, 11,22 ммоль) растворяли в THF в другом реакторе и охлаждали до -78 °C. Вышеописанный реакционный раствор фильтровали через Целит, добавляли в другой реактор, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор экстрагировали EtOAc, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,8 г, 87%).
1H-ЯМР (CDCl3) δ 7,15~7,05 (2H, m), 6,90~6,80 (2H, m), 4,15 (1H, m), 3,85~3,70 (2H, m), 2,95~2,75 (2H, m), 2,10~1,80 (3H, m)
Стадия C: этиловый эфир (E)-3-хроман-2-ил-акриловой кислоты
Оксалил хлорид (1,16 г, 9,13 ммоль) добавляли к 30 мл DCM и охлаждали до -78°C. DMSO (1,19 г, 15,22 ммоль) медленно добавляли и перемешивали в течение 0,5 часов. Раствор, в котором хроман-2-ил-метанол (1,0 г, 6,09 ммоль), полученный на Стадии B, растворяли в 5 мл DCM и TEA (2,46 г, 24,36 ммоль), последовательно и медленно добавляли. Смесь перемешивали при комнатной температуре в течение 1 часа и затем добавляли (карбэтоксиметилен)трифенилфосфоран (2,54 г, 7,30 ммоль), и реакцию смеси осуществляли при комнатной температуре в течение 16 часов. К реакционному раствору добавляли воду, и этот раствор экстрагировали DCM для отделения органического слоя. Органический слой высушивали MgSO4 и очищали колоночной хроматографией с получением целевого соединения (1,47 г, 69%).
1H-ЯМР (CDCl3) δ 7,20~7,00 (3H, m), 6,90~6,80 (2H, m), 6,18 (1H, m), 4,75 (1H, m), 4,24 (2H, q), 2,95~2,70 (2H, m), 2,15 (1H, m), 1,85 (1H, m), 1,26 (3H, t)
Стадия D: этиловый эфир 3-хроман-2-ил-пропионовой кислоты
Этиловый эфир (E)-3-хроман-2-ил-акриловой кислоты (0,53 г, 2,28 ммоль), полученный на Стадии C, растворяли в MeOH. Добавляли 10%-й Pd/C (0,05 г), и реакционную смесь перемешивали при комнатной температуре в течение 16 часов в атмосфере водорода. После завершения реакции смесь фильтровали через Целит и концентрировали при пониженном давлении с получением целевого соединения (0,51 г, 96%).
1H-ЯМР (CDCl3) δ 7,12~7,00 (2H, m), 6,84~6,77 (2H, m), 4,16 (2H, q), 4,01 (1H, m), 2,90~2,70 (2H, m), 2,68~2,51 (2H, m), 2,05~1,95 (3H, m), 1,75 (1H, m), 1,22 (3H, t)
Стадия E: этиловый эфир 3-(6-бром-хроман-2-ил)-пропионовой кислоты
Этиловый эфир 3-Хроман-2-ил-пропионовой кислоты (0,2 г, 0,85 ммоль), полученный на Стадии D, растворяли в 15 мл DMF. NBS (0,15 г, 0,85 ммоль) добавляли при 0°C, и реакционную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционный раствор концентрировали и добавляли 50 мл воды. Реакционный раствор экстрагировали Et2O, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,21 г, 80%).
1H-ЯМР (CDCl3) δ 7,17~7,10 (2H, m), 6,65 (1H, d), 4,16 (2H, q), 3,97 (1H, m), 2,90 ~2,70 (2H, m), 2,65~2,50 (2H, m), 2,05~1,95 (3H, m), 1,72 (1H, m), 1,26 (3H, t)
Стадия F: этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты
Этиловый эфир 3-(6-бром-хроман-2-ил)-пропионовой кислоты (0,21 г, 0,67 ммоль), полученный на Стадии E, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,19 г, 79%).
1H-ЯМР (CDCl3) δ 7,56~7,52 (2H, m), 6,76 (1H, d), 4,14 (2H, q), 4,04 (1H, m), 2,90 ~2,75 (2H, m), 2,65~2,50 (2H, m), 2,08~1,97 (3H, m), 1,75 (1H, m), 1,32 (12H, s), 1,26 (3H, t)
Пример получения 5: этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты
Стадия A: 6-бром-4-оксо-тиохроман-2-карбоновая кислота
4-бромтиофенол (5,0 г, 26,45 ммоль) и фуран-2,5-дион (2,6 г, 26,45 ммоль) растворяли в 50 мл толуола и нагревали до 50°C. Медленно добавляли TEA (0,1 мл), и реакционную смесь перемешивали при 50°C в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении, растворяли в 50 мл DCM и охлаждали до 0°C. Добавляли AlCl3 (5,3 г, 39,67 ммоль), и реакционный раствор перемешивали при комнатной температуре в течение 1 часа, медленно добавляли по каплям к холодному концентрированному раствору HCl и экстрагировали DCM. Органический растворитель высушивали MgSO4, концентрировали при пониженном давлении и отверждали с помощью Et2O с получением целевого соединения (4,3 г, 57%).
1H-ЯМР (CDCl3) δ 7,98 (1H, d), 7,65 (1H, dd), 7,31 (1H, d), 4,31 (1H, t), 3,09 (2H, m)
Стадия B: метиловый эфир 6-бром-4-оксо-тиохроман-2-карбоновой кислоты
6-бром-4-оксо-тиохроман-2-карбоновую кислоту (4,3 г, 14,97 ммоль), полученную на Стадии A, растворяли в 50 мл метанола. Добавляли концентрированную серную кислоту (0,8 мл), и смесь перемешивали в течение 18 часов при нагревании с обратным холодильником. Реакционный раствор концентрировали при пониженном давлении, экстрагировали EtOAc, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (4,2 г, 93%).
1H-ЯМР (CDCl3) δ 8,24 (1H, d), 7,51 (1H, dd), 7,13 (1H, d), 4,13 (1H, t), 3,74 (3H, s), 3,17 (2H, d)
Стадия C: метиловый эфир 6-бром-тиохроман-2-карбоновой кислоты
Метиловый эфир 6-бром-4-оксо-тиохроман-2-карбоновой кислоты (2,0 г, 6,64 ммоль), полученный на Стадии B, растворяли в 20 мл TFA. Добавляли триэтилсилан (2,1 мл, 13,28 ммоль), и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении, экстрагировали EtOAc, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (1,5 г, 78%).
1H-ЯМР (CDCl3) δ 7,22 (2H, m), 7,00 (1H, d), 4,02 (1H, m), 3,76 (3H, s), 2,96~2,72 (2H, m), 2,33~2,18 (2H, m)
Стадия D: 6-бром-тиохроман-2-карбоновая кислота
Метиловый эфир 6-бром-тиохроман-2-карбоновой кислоты (1,5 г, 5,22 ммоль), полученный на Стадии C, растворяли в 15 мл каждого из THF, MeOH и 1Н водного раствора NaOH, и смесь перемешивали при комнатной температуре в течение 2 часов. Органический растворитель удаляли, и к pH доводили до 3 при помощи 1Н водного раствора HCl и экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали MgSO4 и концентрировали при пониженном давлении с получением целевого соединения (1,4 г, 98%).
Стадия E: (6-бром-тиохроман-2-ил)-метанол
6-бром-тиохроман-2-карбоновую кислоту (1,4 г, 5,13 ммоль), полученную на Стадии D, растворяли в 50 мл THF и охлаждали до -20°C. Добавляли изобутил хлорформиат (0,74 мл, 5,64 ммоль) и NMM (0,71 мл, 6,48 ммоль), и смесь перемешивали при той же температуре в течение 1,5 часов. NaBH4 (0,38 г, 10,26 ммоль) растворяли в 20 мл THF и 5 мл MeOH в другом реакторе и охлаждали до -78°C. Вышеупомянутый реакционный раствор фильтровали через Целит и добавляли в другой реактор, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор экстрагировали EtOAc, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (1,3 г, 98%).
1H-ЯМР (CDCl3) δ 7,19 (2H, m), 7,00 (1H, d), 3,78~3,66 (2H, m), 3,49 (1H, m), 2,83~2,71 (2H, m), 2,22 (1H, m), 1,88 ~ 1,78 (2H, m)
Стадия F: этиловый эфир (E)-3-(6-бром-тиохроман-2-ил)-акриловой кислоты
Оксалил хлорид (0,64 мл, 7,53 ммоль) добавляли к 30 мл DCM и охлаждали до -78°C. Медленно добавляли DMSO (0,9 мл, 12,55 ммоль), и смесь перемешивали в течение 0,5 часов. Последовательно добавляли раствор, в котором (6-бром-тиохроман-2-ил)-метанол (1,3 г, 5,02 ммоль), полученный на Стадии E, растворяли в 5 мл DCM и TEA (2,8 мл, 20,08 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли (карбэтоксиметилен)трифенилфосфоран (2,1 г, 6,02 ммоль), и реакцию осуществляли при комнатной температуре в течение 18 часов. К реакционному раствору добавляли воду, и смесь экстрагировали с помощью DCM для отделения органического слоя. Органический слой высушивали MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,90 г, 55%).
1H-ЯМР (CDCl3) δ 7,20 (2H, m), 6,97 (1H, m), 6,90 (1H, m), 6,00 (1H, d), 4,20 (2H, q), 4,02 (1H, m), 2,81 (2H, m), 2,28 (1H, m), 1,92 (1H, m), 1,28 (3H, t)
Стадия G: этиловый эфир 3-(6-бром-тиохроман-2-ил)-пропионовой кислоты
Этиловый эфир (E)-3-(6-бром-тиохроман-2-ил)-акриловой кислоты (0,90 г, 2,75 ммоль), полученный на Стадии F, растворяли в 30 мл DME. Гидразид п-толуолсульфонила (3,60 г, 19,25 нмоль) постепенно добавляли и нагревали до 90°C. Добавляли ацетат натрия (2,26 г, 27,50 ммоль, 1,4 М водный раствор), и смесь перемешивали в течение 18 часов при нагревании с обратным холодильником. К реакционному раствору добавляли воду, и смесь экстрагировали с помощью DCM. Органический слой высушивали MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,80 г, 88%).
1H-ЯМР (CDCl3) δ 7,16 (2H, m), 6,93 (1H, d), 4,14 (2H, q), 3,29 (1H, m), 2,80 (2H, m), 2,49 (2H, m), 2,20 (1H, m), 2,02 (1H, m), 1,92 (1H, m), 1,77 (1H, m), 1,25 (3H, t)
Стадия H: этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты
Этиловый эфир 3-(6-бром-тиохроман-2-ил)-пропионовой кислоты (0,80 г, 2,43 ммоль), полученный на Стадии G, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,68 г, 74%).
1H-ЯМР (CDCl3) δ 7,47 (2H, m), 7,08 (1H, d), 4,14 (2H, q), 3,32 (1H, m), 2,84 (2H, m), 2,49 (2H, m), 2,22 (1H, m), 2,00 (2H, m), 1,81 (1H, m), 1,32 (12H, s), 1,25 (3H, t)
Пример получения 6: этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовой кислоты
Стадия A: этиловый эфир 3-(1,2,3,4-тетрагидро-хинолин-2-ил)-пропионовой кислоты
Хинолин-2-карбальдегид (1 г, 6,36 ммоль) растворяли в THF. NaH (60%) (0,28 г, 7,00 ммоль) медленно добавляли при 0°C и смесь перемешивали в течение 30 минут. Триэтил фосфоноацетат (1,57 г, 7,00 ммоль) добавляли по каплям, и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор экстрагировали EtOAc, очищали колоночной хроматографией и растворяли в 30 мл метанола. Добавляли 10%-й PtO2 (0,1 г), и смесь перемешивали при комнатной температуре в течение 16 часов в атмосфере водорода. После завершения реакции продукт реакции фильтровали через Целит и концентрировали при пониженном давлении с получением целевого соединения (0,7 г, 47%).
1H-ЯМР (CDCl3) δ 7,00~6,90 (2H, m), 6,62 (1H, t), 6,46 (1H, d), 4,15 (2H, q), 3,85 (1H, ушир.), 3,32 (1H, m), 2,84~2,70 (2H, m), 2,45 (2H, m), 1,97~1,80 (3H, m), 1,65 (1H, m), 1,24 (3H, t)
Стадия B: этиловый эфир 3-(6-бром-1,2,3,4-тетрагидро-хинолин-2-ил)-пропионовой кислоты
Этиловый эфир 3-(1,2,3,4-Тетрагидро-хинолин-2-ил)-пропионовой кислоты (0,7 г, 3,00 ммоль), полученный на Стадии A, растворяли в 15 мл DMF. NBS (0,53 г, 3,00 ммоль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционный раствор концентрировали и добавляли 50 мл воды. Смесь экстрагировали с помощью Et2O, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,85 г, 91%).
1H-ЯМР (CDCl3) δ 7,08~7,00 (2H, m), 6,37 (1H, d), 4,12 (2H, q), 3,30 (1H, m), 2,80~2,65 (2H, m), 2,41 (2H, m), 1,95~1,80 (3H, m), 1,50 (1H, m), 1,25 (3H, t)
Стадия C: этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовой кислоты
Этиловый эфир 3-(6-бром-1,2,3,4-тетрагидро-хинолин-2-ил)-пропионовой кислоты (0,33 г, 1,07 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,11 г, 29%).
1H-ЯМР (CDCl3) δ 7,42 (2H, m), 6,44 (1H, d), 4,20~4,05 (3H, m), 3,34 (1H, m), 2,80~2,70 (2H, m), 2,50~2,35 (2H, m), 1,95~1,80 (3H, m), 1,75 (1H, m), 1,31 (12H, s), 1,24 (3H, t)
Пример получения 7: этиловый эфир [1-оксо-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,4-дигидро-1H-изохинолин-2-ил]-уксусной кислоты
Стадия A: 6-бром-3,4-дигидро-2H-изохинолин-1-он
5-бром-индан-1-он (2,35 г, 11,13 ммоль) растворяли в 10 мл DCM и 10 мл метансульфоновой кислоты и охлаждали до 0°C. Добавляли азид натрия (1,45 г, 22,27 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор охлаждали до 0°C, нейтрализовали с помощью NaOH и экстрагировали EtOAc. Экстракт высушивали MgSO4 и очищали колоночной хроматографией с получением целевого соединения (1,14 г, 45%).
1H-ЯМР (CDCl3) δ 7,92 (1H, d), 7,48 (1H, d), 7,39 (1H, s), 6,10 (1H, ушир.), 3,57 (2H, t), 2,99 (2H, t)
Стадия B: этиловый эфир (6-бром-1-оксо-3,4-дигидро-1H-изохинолин-2-ил)-уксусной кислоты
6-бром-3,4-дигидро-2H-изохинолин-1-он (0,4 г, 1,77 ммоль), полученный на Стадии A, растворяли в 10 мл THF и охлаждали до 0°C. Добавляли NaH (60%) (0,14 г, 3,54 ммоль), и смесь перемешивали при комнатной температуре 0,5 часа. Этил бромацетат (0,44 г, 2,65 ммоль) добавляли к реакционному раствору, и смесь перемешивали в течение 2 часов при нагревании с обратным холодильником. Реакционный раствор экстрагировали EtOAc, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,49 г, 89%).
1H-ЯМР (CDCl3) δ 7,93 (1H, d), 7,47 (1H, d), 7,37 (1H, s), 4,32 (2H, s), 4,23 (2H, q), 3,66 (2H, t), 3,05 (2H, t), 1,29 (3H, t)
Стадия C: этиловый эфир [1-оксо-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,4-дигидро-1H-изохинолин-2-ил]-уксусной кислоты
Этиловый эфир (6-бром-1-оксо-3,4-дигидро-1H-изохинолин-2-ил)-уксусной кислоты (0,79 г, 1,57 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,54 г, 96%).
1H-ЯМР (CDCl3) δ 8,06 (1H, d), 7,76 (1H, d), 7,64 (1H, s), 4,34 (2H, s), 4,21 (2H, q), 3,65 (2H, t), 3,07 (2H, t), 1,30 (12H, s), 1,26 (3H, t)
Пример получения 8: метиловый эфир 3-[1-оксо-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,4-дигидро-1H-изохинолин-2-ил]пропионовой кислоты
Стадия A: метиловый эфир 3-(6-бром-1-оксо-3,4-дигидро-1H-изохинолин-2-ил)пропионовой кислоты
6-бром-3,4-дигидро-2H-изохинолин-1-он (0,3 г, 1,32 ммоль), полученный на Стадии A Примера Получения 7, растворяли в 10 мл THF и охлаждали до 0°C. Добавляли NaH (60%) (0,11 г, 2,65 ммоль), и смесь перемешивали при комнатной температуре в течение 0,5 часов. Метиловый эфир 3-бром-пропионовой кислоты (0,33 г, 2,00 ммоль) добавляли к реакционному раствору, и смесь перемешивали в течение 2 часов при нагревании с обратным холодильником. Реакционный раствор экстрагировали EtOAc, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,38 г, 92%).
1H-ЯМР (CDCl3) δ 7,90 (1H, d), 7,47 (1H, d), 7,34 (1H, s), 3,80 (2H, t), 3,69 (3H, s), 3,63 (2H, t), 2,94 (2H, t), 2,73 (2H, t)
Стадия B: метиловый эфир 3-[1-оксо-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,4-дигидро-1H-изохинолин-2-ил]пропионовой кислоты
Метиловый эфир 3-(6-бром-1-оксо-3,4-дигидро-1H-изохинолин-2-ил)пропионовой кислоты (0,38 г, 1,22 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,36 г, 82%).
1H-ЯМР (CDCl3) δ 8,03 (1H, d), 7,77 (1H, d), 7,61 (1H, s), 3,82 (2H, t), 3,68 (3H, s), 3,63 (2H, t), 2,98 (2H, t), 2,72 (2H, t), 1,35 (12H, s)
Пример получения 9: 3-йод-2-изопропилсульфанил-пиридин
2-Фтор-3-йод-пиридин (0,3 г, 1,34 ммоль), Cs2CO3 (0,66 г, 1,34 ммоль) и пропан-2-тиол (0,125 мл, 1,34 ммоль) добавляли в реактор, и смесь перемешивали при комнатной температуре в течение 8 часов. К реакционному раствору добавляли воду, и смесь экстрагировали с помощью EtOAc. Отделяли органический слой, и отделенный органический слой высушивали MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,21 г, 56%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,92 (1H, m), 6,69 (1H, m), 3,95 (1H, m), 1,39 (6H, d)
Пример получения 10: 2-хлор-6-изопропилсульфанил-пиридин
2,6-дихлорпиридин (3,0 г, 20,3 ммоль) и пропан-2-тиол (1,88 мл, 20,3 ммоль) вводили в реакцию таким же образом, как в Примере Получения 9, с получением целевого соединения (3,63 г, 95%).
1H-ЯМР (CDCl3) δ 7,40 (1H, t), 7,05 (1H, t), 6,98 (1H, t), 4,00 (1H, m), 1,40 (6H, d)
Пример получения 11: 2-циклопентилокси-3-йод-пиридин
Циклопентанол (0,038 г, 0,44 ммоль) и 2-фтор-3-йод-пиридин (0,10 г, 0,44 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,091 г, 70%).
1H-ЯМР (CDCl3) δ 8,09 (1H, m), 7,99 (1H, m), 6,59 (1H, m), 5,43 (1H, m), 2,00 (2H, m), 1,94 (4H, m), 1,66 (2H, m)
Пример получения 12: 2-хлор-6-циклопентилокси-пиридин
6-хлор-2-пиридинол (1,95 г, 15 ммоль) и K2CO3 (4,16 г, 30 ммоль) растворяли в 50 мл DMF. Добавляли циклопентил бромид (1,94 мл, 18 ммоль), и смесь перемешивали при 80°C в течение 24 часов. Твердые вещества удаляли, и фильтрат концентрировали с получением целевого соединения (2,92 г, 98%).
1H-ЯМР (CDCl3) δ 7,47 (1H, t), 6,84 (1H, d), 6,51 (1H, d), 5,38 (1H, m), 1,97 (2H, m), 1,79 (4H, m), 1,62 (2H, m)
Пример получения 13: 2-циклобутилсульфанил-3-йод-пиридин
Стадия A: циклобутан тиол
Магний (0,99 г, 40,74 ммоль) растворяли в THF (20 мл). Циклобутил бромид (5,0 г, 37,03 ммоль) растворяли в THF (5 мл) при 50°C и добавляли к реакционной смеси, и смесь перемешивали в течение 2 часов при нагревании с обратным холодильником. Серу (1,06 г, 33,33 ммоль) медленно добавляли при 0°C, и смесь перемешивали при 50°C в течение 2 часов. LAH (0,843 г, 22,22 ммоль) медленно добавляли при 0°C, и смесь перемешивали в течение 30 минут при перемешивании при нагревании с обратным холодильником. После завершения реакции при помощи аммонийхлорида (20 мл) и 1Н водного раствора HCl (20 мл) при 0°C органический слой отделяли и экстрагировали Et2O (30 мл х 3). Органический слой высушивали с помощью MgSO4 и использовали для следующей стадии.
Стадия B: 2-циклобутилсульфанил-3-йод-пиридин
Циклобутан тиол (0,069 г, 0,782 ммоль), полученный на Стадии A, и 2-фтор-3-йод-пиридин (0,1 г, 0,43 ммоль) растворяли в DMF (3 мл). Добавляли Cs2CO3 (0,26 г, 0,86 ммоль), и смесь нагревали до 80°C и перемешивали. Водный раствор NaCl добавляли к реакционному раствору, и смесь экстрагировали с помощью EtOAc. Органический слой высушивали MgSO4 и очищали колоночной хроматографией (элюент EtOAc/Hex=1/4) с получением целевого соединения (0,115 г, 91%).
1H-ЯМР (CDCl3) δ 8,36 (1H, m), 7,90 (1H, m), 6,69 (1H, m), 4,33 (1H, m), 2,54 (2H, m), 2,14 (2H, m), 2,05 (2H, m)
Пример получения 14: 2-хлор-6-циклопентилсульфанил-пиридин
2,6-дихлорпиридин (3,08 г, 20,7 ммоль) и Cs2CO3 (6,8 г, 20,7 ммоль) растворяли в 40 мл DMF. Добавляли циклопентилтиол (2,17 мл, 20,7 ммоль), и смесь перемешивали при 80°C в течение 16 часов. Твердые вещества отфильтровывали, и фильтрат концентрировали с получением целевого соединения (4,24 г, 95%).
1H-ЯМР (CDCl3) δ 7,40 (1H, t), 7,06 (1H, d), 6,97 (1H, d), 4,01 (1H, m), 2,22 (2H, m), 1,76 (2H, m), 1,64 (4H, m)
Пример получения 15: 2-циклопентилсульфанил-3-йод-пиридин
2-Фтор-3-йод-пиридин (0,065 г, 0,29 ммоль), Cs2CO3 (0,19 г, 0,58 ммоль) и циклопентилтиол (0,03 г, 0,291 ммоль) растворяли в 2 мл DMF, и смесь перемешивали при 80°C в течение 2 часов. Водный раствор NaCl добавляли к реакционному раствору, и смесь экстрагировали с помощью EtOAc для отделения органического слоя. Органический слой высушивали MgSO4 и очищали колоночной хроматографией (элюент EtOAc/Hex=1/4) с получением целевого соединения (0,053 г, 65%).
1H-ЯМР (CDCl3) δ 8,38 (1H, m), 7,89 (1H, m), 6,68 (1H, m), 4,00 (1H, m), 2,22 (2H, m), 1,80 (2H, m), 1,66 (4H, m)
Пример получения 16: этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты
Стадия A: 4-бром-2,6-дифтор-фенол
2,6-дифторфенол (1,02 г, 7,8 ммоль) растворяли в 15 мл DMF. NBS (1,40 г, 7,84 ммоль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционный раствор концентрировали и добавляли 50 мл воды. Реакционный раствор экстрагировали Et2O и высушивали с помощью MgSO4 с получением целевого соединения (1,41 г, 86%).
1H-ЯМР (CDCl3) δ 7,08 (2H, m), 5,42 (1H, ушир.)
Стадия B: 2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол
4-бром-2,6-дифтор-фенол (1,414 г, 6,76 ммоль), полученный на Стадии A, бис(пинаколято)диборон (1,8 г, 7,09 ммоль), ацетат калия (2,66 г, 27 ммоль) и DPPF (0,19 г, 0,34 ммоль) растворяли в 23 мл 1,4-диоксана. Смесь загружали газообразным N2 в течение 5 минут и добавляли PdCl2(dppf)-DCM (0,27 г, 0,34 ммоль). Смесь перемешивали при 80°C в течение 3 часов, фильтровали через Целит и очищали колоночной хроматографией с получением целевого соединения (1,366 г, 79%).
1H-ЯМР (CDCl3) δ 7,33 (2H, m), 5,25 (1H, s), 1,32 (12H, s)
Стадия C: этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты
2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол (1,87 г, 7,3 ммоль), полученный на Стадии B, Cs2CO3 (4,76 г, 14,6 ммоль) и этиловый эфир 4-бром-масляной кислоты (1,42 г, 7,3 ммоль) растворяли в 24 мл DMF. Смесь перемешивали при комнатной температуре в течение 24 часов. Твердые вещества отфильтровывали и очищали колоночной хроматографией с получением целевого соединения (1,66 г, 61%).
1H-ЯМР (CDCl3) δ 7,29 (2H, m), 4,21 (2H, t), 4,14 (2H, q), 2,56 (2H, t), 2,07 (2H, m), 1,32 (12H, s), 1,25 (3H, t)
Пример получения 17: 1-бензилокси-3-йод-бензол
3-йод-фенол (0,5 г, 2,27 ммоль) растворяли в ацетонитриле (5 мл). Последовательно добавляли Cs2CO3 (2,22 г, 6,81 ммоль) и бромметилбензол (0,27 мл, 2,27 ммоль). Смесь перемешивали при 80-85°C в течение 2 часов. После завершения реакции реакционный раствор охлаждали и фильтровали через Целит. Фильтрат концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (0,7 г, 99%).
1H-ЯМР (400 МГц, CDCl3) δ 7,39-7,23 (m, 7H), 6,97-6,87 (m, 2H), 4,95 (s, 2H)
Пример получения 18: 1-йод-3-изопропокси-бензол
3-йод-фенол (0,5 г, 2,27 ммоль) и 2-бром-пропан (0,21 мл, 2,27 ммоль) вводили в реакцию таким же образом, как в Примере Получения 17, с получением целевого соединения (0,59 г, 99%).
1H-ЯМР (400 МГц, CDCl3) δ 7,27-7,22 (m, 2H), 6,96 (t, 1H), 6,86-6,81 (m, 1H), 4,54-4,44 (m, 1H), 1,31 (d, 6H)
Пример получения 19: 1-йод-3-пропокси-бензол
3-йод-фенол (0,5 г, 2,27 ммоль) и 1-бром-пропан (0,21 мл, 2,27 ммоль) вводили в реакцию таким же образом, как в Примере Получения 17, с получением целевого соединения (0,58 г, 97%).
1H-ЯМР (400 МГц, CDCl3) δ 7,28-7,23 (m, 2H), 6,97 (t, 1H), 6,87-6,82 (m, 1H), 3,85 (t, 2H), 1,83-1,71 (m, 2H), 1,02 (t, 3H)
Пример получения 20: 1-циклопропилметокси-3-йод-бензол
3-йод-фенол (0,5 г, 2,27 ммоль) и бромметил-циклопропан (0,22 мл, 2,27 ммоль) вводили в реакцию таким же образом, как в Примере Получения 17, с получением целевого соединения (0,59 г, 95%).
1H-ЯМР (400 МГц, CDCl3) δ 7,26-7,20 (m, 2H), 6,93 (t, 1H), 6,84-6,80 (m, 1H), 3,71 (d, 2H), 1,28-1,15 (m, 1H), 0,63-0,57 (m, 2H), 0,33-0,28 (m, 2H)
Пример получения 21: 1-циклобутокси-3-йод-бензол
3-йод-фенол (0,5 г, 2,27 ммоль) растворяли в ацетонитриле (5 мл). Последовательно добавляли Cs2CO3 (2,22 г, 6,81 ммоль) и бромциклобутан (0,21 мл, 2,27 ммоль). Смесь перемешивали при 80-85°C в течение 10 часов, и реакционный раствор охлаждали и фильтровали через Целит. Фильтрат концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (0,45 г, 72%).
1H-ЯМР (400 МГц, CDCl3) δ 7,25-7,20 (m, 1H), 7,17-7,13 (m, 1H), 6,92 (t, 1H), 6,77-6,72 (m, 1H), 4,59-4,50 (m, 1H), 2,44-2,33 (m, 2H), 2,19-2,05 (m, 2H), 1,88-1,77 (m, 1H), 1,70-1,57 (m, 1H)
Пример получения 22: 7-йод-2,2-диметил-2,3-дигидро-бензофуран
Стадия A: 1-йод-2-(2-метил-аллилокси)-бензол
2-йод-фенол (0,93 г, 4,23 ммоль) растворяли в DMF (5 мл). Последовательно добавляли K2CO3 (0,82 г, 5,92 ммоль) и 3-хлор-2-метил-пропен (0,5 мл, 5,08 ммоль). Смесь перемешивали при 70-75°C в течение 12 часов. После завершения реакции реакционный раствор охлаждали. К реакционному раствору добавляли воду, и реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (1,05 г, 91%).
1H-ЯМР (500 МГц, CDCl3) δ 7,77 (d, 1H), 7,27 (t, 1H), 6,79 (d, 1H), 6,70 (t, 1H), 5,19 (s, 1H), 5,02 (s, 1H), 4,48 (s, 2H), 1,87 (s, 3H)
Стадия B: 2-йод-6-(2-метил-аллил)-фенол
1-Йод-2-(2-метил-аллилокси)-бензол (1,05 г, 3,83 ммоль), полученный на Стадии A, добавляли в закупоренную пробирку и затем добавляли NMP (5 мл). Смесь перемешивали при 200°C в течение 12 часов. После завершения реакции реакционный раствор охлаждали. К реакционному раствору добавляли воду, и реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (0,25 г, 24%).
1H-ЯМР (500 МГц, CDCl3) δ 7,46-6,54 (m, 3H), 3,11 (s, 1H), 3,01 (s, 1H), 1,50 (s, 2H), 1,47 (s, 3H)
Стадия C: 7-йод-2,2-диметил-2,3-дигидро-бензофуран
HCOOH (5 мл) и воду (0,5 мл) добавляли к 2-йод-6-(2-метил-аллил)-фенолу (0,25 г, 0,91 ммоль), полученному на Стадии B. Смесь перемешивали в течение 12 часов при нагревании с обратным холодильником. После завершения реакции реакционный раствор охлаждали. К реакционному раствору добавляли воду, и реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (0,07 г, 24%).
1H-ЯМР (500 МГц, CDCl3) δ 7,44 (d, 1H), 7,06 (d, 1H), 6,56 (t, 1H), 3,11 (s, 2H), 1,50 (s, 6H)
Пример получения 23: 4-йод-2,2-диметил-бензо[1,3]диоксол
Стадия A: 1-йод-2,3-диметокси-бензол
THF (5 мл) добавляли к 1,2-диметокси-бензолу (0,5 г, 3,62 ммоль) и охлаждали до 0-5°C. n-BuLi (1,6 мл, 3,98 ммоль) медленно добавляли по каплям, и смесь перемешивали при 0-5°C в течение 2 часов. Реакционный раствор охлаждали до -78°C, и добавляли раствор I2 (1,01 г, 3,98 ммоль)/THF (5 мл). Температуру повышали до комнатной температуры, и реакционный раствор перемешивали в течение 2 часов. После завершения реакции реакционный раствор концентрировали при пониженном давлении. Насыщенный раствор NaHCO3 добавляли к реакционному раствору и экстрагировали DCM для отделения органического слоя. Органический слой концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (0,62 г, 65%).
1H-ЯМР (500 МГц, CDCl3) δ 7,36-7,32 (m, 1H), 6,90-6,86 (m, 1H), 6,79 (t, 1H), 3,85 (s, 3H), 3,83 (s, 3H)
Стадия B: 3-йод-бензол-1,2-диол
1-Йод-2,3-диметокси-бензол (0,62 г, 2,35 ммоль), полученный на Стадии A, растворяли в DCM (23 мл) и охлаждали до 0-5°C. Медленно добавляли 1M BBr3 (0,276 мл, 7,05 ммоль), и смесь перемешивали при комнатной температуре в течение 3 часов. После завершения реакции реакционный раствор охлаждали до -20°C и разбавляли путем медленного добавления этанола. Смесь перемешивали при комнатной температуре в течение 30 минут и добавляли насыщенный водный раствор NaHCO3. Смесь экстрагировали с помощью DCM. Органический слой высушивали MgSO4, концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/4) с получением целевого соединения (0,12 г, 22%).
1H-ЯМР (500 МГц, CDCl3) δ 7,18 (d, 1H), 6,87 (d, 1H), 6,60 (t, 1H), 5,64 (s, ушир., 2H)
Стадия C: 4-йод-2,2-диметил-бензо[1,3]диоксол
Бензол (5 мл) добавляли к 3-йод-бензол-1,2-диолу (50 мг, 0,21 ммоль), полученному на Стадии B. Добавляли 2,2-диметокси-пропан (0,052 мл, 0,42 ммоль) и p-TsOH.H2O (каталитическое количество), и смесь перемешивали в течение 2 часов при нагревании с обратным холодильником. После завершения реакции реакционный раствор охлаждали и добавляли насыщенный раствор NaHCO3. Реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (40 мг, 58%).
1H-ЯМР (500 МГц, CDCl3) δ 7,08 (d, 1H), 6,68 (d, 1H), 6,55 (t, 1H), 1,71 (s, 6H)
Пример получения 24: 4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенол
2-циклобутилсульфанил-3-йод-пиридин (0,193 г, 0,66 ммоль), полученный в Примере Получения 13, и 2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол (0,254 г, 0,992 ммоль), полученный на Стадии B Примера Получения 16, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,078 г, 40%).
1H-ЯМР (CDCl3) δ 8,39 (1H, m), 7,30 (1H, m), 6,98 (3H, m), 5,15 (1H, s), 4,40 (1H, m), 2,49 (2H, m), 2,02 (4H, m)
Пример получения 25: 4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]бутаннитрил
Стадия A: 3-(4-бромфенил)пропан-1-ол
3-(4-бромфенил)пропановую кислоту (1,41 г, 6,16 ммоль) растворяли в THF (20 мл). Раствор 1,0 М боран-THF (18,5 мл, 18,5 ммоль) медленно добавляли по каплям при 0°C. Смесь перемешивали при комнатной температуре в течение 16 часов. После завершения реакции реакционный раствор разбавляли водой при 0°C и промывали 1Н HCl. Реакционный раствор экстрагировали EtOAc, и органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/5) с получением целевого соединения (1,31 г, 99%).
ЯМР:1H-ЯМР (CDCl3) δ 7,39 (2H, m), 7,09 (2H, m), 3,67 (2H, m), 2,67 (2H, t), 1,87 (2H, m)
Стадия B: 3-(4-бромфенил)пропил метансульфонат
3-(4-бромфенил)пропан-1-ол (1,07 г, 4,97 ммоль), полученный на Стадии A, растворяли в DCM (12 мл). Добавляли TEA (1,04 мл, 7,46 ммоль), и метансульфонил хлорид (0,46 мл, 5,96 ммоль) затем медленно добавляли при 0°C. Смесь перемешивали в течение 2 часов. После завершения реакции реакционный раствор разбавляли водой при 0°C, промывали 1Н HCl и экстрагировали DCM. Органический слой высушивали безводным сульфатом магния для получения 1,4 г целевого соединения, который использовали на следующей стадии без очистки.
Стадия C: 4-(4-бромфенил)бутаннитрил
3-(4-бромфенил)пропил метансульфонат (0,557 г, 1,899 ммоль), полученный на Стадии B, растворяли в DMF (9 мл). Добавляли цианид натрия (0,372 г, 7,599 ммоль), и реакцию осуществляли при 70°C в течение 16 часов. После завершения реакции реакционный раствор разбавляли раствором бикарбоната натрия и экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (0,273 г, 64%).
ЯМР:1H-ЯМР (CDCl3) δ 7,43 (2H, m), 7,05 (2H, m), 2,73 (2H, t), 2,31 (2H, t), 1,95 (2H, m)
Стадия D: 4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]бутаннитрил
4-(4-бромфенил)бутаннитрил (0,273 г, 1,299 ммоль), полученный на Стадии C, бис(пинаколято)диборон (0,346 г, 1,364 ммоль), ацетат калия (0,51 г, 5,196 ммоль) и DPPF (0,036 г, 0,065 ммоль) растворяли в 1,4-диоксане (10 мл). Смесь загружали газообразным N2 в течение 5 минут и добавляли PdCl2(dppf)-DCM (0,053 г, 0,065 ммоль). Реакционный раствор перемешивали при 80°C в течение 16 часов, фильтровали через Целит, разбавляли водой и экстрагировали этилацетатом. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (0,203 г, 57%).
ЯМР:1H-ЯМР (CDCl3) δ 7,74 (2H, m), 7,19 (2H, m), 2,78 (2H, t), 2,29 (2H, t), 1,97 (2H, m), 1,33 (12H, s)
Пример получения 26: этиловый эфир 5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты
Стадия A: 3-(4-бромфенил)пропионовый альдегид
Оксалил хлорид (0,599 мл, 6,973 ммоль) растворяли в DCM (15 мл), и DMSO (0,99 мл, 13,94 ммоль), растворенный в DCM (10 мл), медленно добавляли при -78°C. Смесь перемешивали в течение 15 минут, и 3-(4-бромфенил)пропан-1-ол (1,0 г, 4,64 ммоль), растворенный в DCM (10 мл), медленно добавляли при -78°C. Смесь перемешивали в течение 30 минут, и TEA (1,96 мл) медленно добавляли при -78°C. Температуру медленно повышали до комнатной температуры, и реакционный раствор перемешивали в течение 3 часов. После завершения реакции реакционный раствор разбавляли водой и экстрагировали DCM. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/5) с получением целевого соединения (0,859 г, 86%).
ЯМР:1H-ЯМР (CDCl3) δ 9,81 (1H, s), 7,40 (2H, d), 7,07 (2H, d), 2,91 (2H, m), 2,77 (2H, t)
Стадия B: этиловый эфир (E)-5-(4-бромфенил)пент-2-еновой кислоты
3-(4-бромфенил)пропионовый альдегид (0,859 г, 4,031 ммоль), полученный на Стадии A, и (1-этоксикарбонилэтилиден)трифенилфосфоран (1,685 г, 4,837 ммоль) растворяли в бензоле (15 мл), и смесь перемешивали при 60°C в течение 16 часов. После завершения реакции растворитель отгоняли при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (0,903 г, 79%).
ЯМР:1H-ЯМР (CDCl3) δ 7,40 (2H, m), 7,06 (2H, m), 6,94 (1H, m), 5,82 (1H, m), 4,18 (2H, q), 2,72 (2H, m), 2,49 (2H, m), 1,28 (3H, t)
Стадия C: этиловый эфир (E)-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пент-2-еновой кислоты
Этиловый эфир (E)-5-(4-бромфенил)пент-2-еновой кислоты (0,903 г, 3,18 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии D Примера Получения 25, с получением целевого соединения (0,429 г, 40%).
ЯМР:1H-ЯМР (CDCl3) δ 7,73 (2H, m), 7,18 (2H, m), 6,97 (1H, m), 5,82 (1H, m), 4,16 (2H, q), 2,76 (2H, m), 2,51 (2H, m), 1,33 (12H, s), 1,28 (3H, t)
Стадия D: этиловый эфир 5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты
Этиловый эфир (E)-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пент-2-еновой кислоты (0,429 г, 1,29 ммоль) и Pd/C (0,05 г) растворяли в метаноле (13 мл). Смесь загружали газообразным H2 и перемешивали при комнатной температуре в течение 8 часов. После завершения реакции продукт реакции фильтровали через Целит с получением целевого соединения (0,425 г, 99%).
ЯМР:1H-ЯМР (CDCl3) δ 7,74 (2H, m), 7,19 (2H, m), 4,10 (2H, q), 2,63 (2H, m), 2,30 (2H, m), 1,64 (4H, m), 1,34 (12H, s), 1,25 (3H, t)
Пример получения 27: этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты
Стадия A: 3-(4-бром-2,6-дифтор-фенил)проп-2-еналь
4-бром-2,6-дифтор-бензальдегид (1,21 г, 5,47 ммоль) и этил(трифенилфосфоранилиден)ацетальдегид (1,83 г, 6,022 ммоль) растворяли в бензоле (11 мл), и смесь перемешивали при 70°C в течение 16 часов. После завершения реакции продукт реакции концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/20) с получением целевого соединения (1,27 г, 93%).
ЯМР:1H-ЯМР (CDCl3) δ 9,67 (1H, m), 7,51 (1H, m), 7,18 (2H, m), 6,95 (1H, m)
Стадия B: этиловый эфир (E)-5-(4-бром-2,6-дифтор-фенил)пента-2,4-диеновой кислоты
3-(4-бром-2,6-дифтор-фенил)проп-2-еналь (1,27 г, 5,14 ммоль), полученный на Стадии A, и (1-этоксикарбонилэтилиден)трифенилфосфоран (2,15 г, 6,168 ммоль) растворяли в бензоле (11 мл), и смесь перемешивали при 70°C в течение 16 часов. После завершения реакции продукт реакции концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/20) с получением целевого соединения (1,61 г, 98%).
ЯМР:1H-ЯМР (CDCl3) δ 7,40 (1H, m), 7,15 (3H, m), 6,83 (1H, d), 6,03 (1H, d), 4,22 (2H, q), 1,30 (3H, t)
Стадия C: этиловый эфир (E)-5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пента-2,4-диеновой кислоты
Этиловый эфир (E)-5-(4-бром-2,6-дифтор-фенил)пента-2,4-диеновой кислоты (0,09 г, 0,283 ммоль), полученный на Стадии B, растворяли в DME (4 мл) и добавляли бис(пинаколято)диборон (0,086 г, 0,034 ммоль), ацетат калия (0,083 г, 0,85 ммоль) и PdCl2(PPh3)2 (0,012 г, 0,014 ммоль). Смесь перемешивали при 80°C в течение 16 часов, фильтровали через Целит, разбавляли водой и экстрагировали этилацетатом. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/7) с получением целевого соединения (0,068 г, 66%).
ЯМР:1H-ЯМР (CDCl3) δ 7,43 (1H, m), 7,30~7,20 (3H, m), 6,95 (1H, d), 6,03 (1H, d), 4,23 (2H, q), 1,32 (15H, m)
Стадия D: этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты
Этиловый эфир (E)-5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пента-2,4-диеновой кислоты (0,068 г, 0,18 ммоль), полученный на Стадии C, и Pd/C (0,01 г) растворяли в метаноле (3 мл). Смесь загружали газообразным H2 и перемешивали при комнатной температуре в течение 8 часов. После завершения реакции продукт реакции фильтровали через Целит с получением целевого соединения (0,063 г, 92%).
ЯМР:1H-ЯМР (CDCl3) δ 7,25 (2H, m), 4,10 (2H, q), 2,69 (2H, m), 2,30 (2H, t), 1,70~1,60 (4H, m), 1,32 (12H, s), 1,23 (3H, t)
Пример получения 28: 3-йод-2-пропилсульфанил-пиридин
После добавления 31 мл CH3CN к 2-фтор-3-йод-пиридину (2,08 г, 9,3 ммоль) и пропан-1-тиолу (0,89 мл, 9,8 ммоль), добавляли Cs2CO3 (3,33 г, 10,2 ммоль), и смесь перемешивали в течение 5 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. Твердые вещества отфильтровывали, и фильтрат очищали колоночной хроматографией с получением целевого соединения (1,58 г, 60%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,92 (1H, m), 6,71 (1H, m), 3,13 (2H, t), 1,75 (2H, m), 1,06 (3H, t)
Пример получения 29: 2-хлор-6-циклобутокси-пиридин
5 мл DMF добавляли к 6-хлор-2-пиридону (0,2 г, 1,5 ммоль), бромциклобутану (0,26 г, 1,8 ммоль) и K2CO3 (0,43 г. 3 ммоль), и смесь перемешивали при 80°C в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (0,28 г, 98%).
1H-ЯМР (CDCl3) δ 7,49 (1H, t), 6,86 (1H, d), 6,59 (1H, d), 5,16 (1H, m), 2,46 (2H, m), 2,13 (2H, m), 1,83 (1H, m), 1,66 (1H, m)
Пример получения 30: трет-бутиловый эфир {2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил] этокси}уксусной кислоты
Стадия A: трет-бутиловый эфир [2-(4-бром-2,6-дифтор-фенил)этокси]уксусной кислоты
2-(4-бром-2,6-дифтор-фенил)этанол (0,116 г, 0,489 ммоль), трет-бутилбромацетат (0,57 мл, 3,91 ммоль), трет-бутил аммоний гидросульфат (0,133 г, 0,391 ммоль) растворяли в толуоле (2,5 мл). Добавляли 6Н NaOH (8 мл), и смесь перемешивали в течение 5 часов. После завершения реакции реакционный раствор разбавляли водой, экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/8) с получением целевого соединения (0,15 г, 77%).
ЯМР:1H-ЯМР (CDCl3) δ 7,06 (2H, m), 3,95 (2H, s), 3,69 (2H, t), 2,96 (2H, t), 1,46 (9H, s)
Стадия B: трет-бутиловый эфир {2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]этокси}уксусной кислоты
[2-(4-бром-2,6-дифтор-фенил)этокси]уксусной кислоты трет-бутиловый эфир (0,15 г, 0,42 ммоль), полученный на Стадии A вводили в реакцию таким же образом, как на Стадии C Примера Получения 27 с получением целевого соединения (0,09 г, 53%).
ЯМР:1H-ЯМР (CDCl3) δ 7,26 (2H, m), 3,96 (2H, s), 3,70 (2H, t), 3,03 (2H, t), 1,49 (9H, s), 1,33 (12H, s)
Пример получения 31: этиловый эфир 5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты
Стадия A: этиловый эфир 3-(4-бромфенил)бут-2-еновой кислоты
NaH (60%) растворяли в THF (20 мл) и этиловый эфир 2-диэтоксифосфорил уксусной кислоты (3,29 мл, 16,57 ммоль) медленно добавляли при 0°C. Через 30 минут медленно добавляли 1-(4-бромфенил)кетен (2,0 г, 10,04 ммоль), растворенный в THF (10 мл). Смесь перемешивали при комнатной температуре в течение 16 часов. После завершения реакции реакционный раствор разбавляли водой и экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (1,89 г, 70%).
ЯМР:1H-ЯМР (CDCl3) δ 7,51 (2H, m), 7,35 (2H, m), 6,11 (1H, s), 4,22 (2H, q), 2,55 (3H, s), 1,32 (3H, t)
Стадия B: 3-(4-бромфенил)бутан-1-ол
Этиловый эфир 3-(4-бромфенил)бут-2-еновой кислоты (1,89 г, 7,02 ммоль), полученный на Стадии A, растворяли в THF (22 мл), и LAH (0,48 г, 12,86 ммоль) добавляли постепенно при 0°C. Смесь перемешивали при комнатной температуре в течение 16 часов. После завершения реакции реакционный раствор разбавляли 1Н HCl при 0°C и экстрагировали DCM. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент Et2O/Hex=1/2) с получением целевого соединения (0,437 г, 25%).
ЯМР:1H-ЯМР (CDCl3) δ 7,41 (2H, m), 7,08 (2H, m), 3,58 (2H, m), 2,88 (1H, m), 1,85 (2H, t), 1,28 (3H, d), 0,88 (1H, t)
Стадия C: 3-(4-бромфенил)бутаналь
3-(4-бромфенил)бутан-1-ол (0,437 г, 1,90 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии A Примера Получения 26, с получением целевого соединения (0,386 г, 89%).
ЯМР:1H-ЯМР (CDCl3) δ 9,70 (1H, s), 7,42 (2H, m), 7,10 (2H, m), 3,33 (1H, m), 2,68 (2H, m), 1,30 (3H, d)
Стадия D: этиловый эфир (E)-5-(4-бромфенил)гекс-2-еновой кислоты
3-(4-бромфенил)бутаналь (0,386 г, 1,69 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии B Примера Получения 26, с получением целевого соединения (0,508 г, 99%).
ЯМР:1H-ЯМР (CDCl3) δ 7,41 (2H, m), 7,06 (2H, m), 6,83 (1H, m), 5,76 (1H, d), 4,15 (2H, q), 2,87 (1H, m), 2,45 (2H, m), 1,27 (6H, m)
Стадия E: этиловый эфир (E)-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гекс-2-еновой кислоты
Этиловый эфир (E)-5-(4-бромфенил)гекс-2-еновой кислоты (0,508 г, 1,70 ммоль), полученный на Стадии D, вводили в реакцию таким же образом, как на Стадии C Примера Получения 26, с получением целевого соединения (0,214 г, 42%).
ЯМР:1H-ЯМР (CDCl3) δ 7,75 (2H, m), 7,20 (2H, m), 6,85 (1H, m), 5,79 (1H, d), 4,15 (2H, q), 2,89 (1H, m), 2,49 (2H, m), 1,34 (12H, s), 1,27 (6H, m)
Стадия F: этиловый эфир 5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты
Этиловый эфир (E)-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гекс-2-еновой кислоты (0,314 г, 0,825 ммоль), полученный на Стадии E, и Pd/C (0,035 г) растворяли в метаноле (6 мл). Смесь загружали газообразным H2 и перемешивали при комнатной температуре в течение 8 часов. После завершения реакции продукт реакции фильтровали через Целит с получением целевого соединения (0,314 г, 99%).
ЯМР:1H-ЯМР (CDCl3) δ 7,74 (2H, m), 7,19 (2H, m), 4,09 (2H, q), 2,71 (1H, m), 2,24 (2H, m), 1,60 (3H, m), 1,40 (1H), 1,34 (12H, s), 1,25 (6H, m)
Пример получения 32: этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты
Стадия A: этиловый эфир (E)-4-диэтоксифосфорилбут-2-еновой кислоты (75%)
Этиловый эфир (E)-4-бромбут-2-еновой кислоты (75%) (10 г, 51,80 ммоль) и триэтил-фосфат (8,88 мл, 51,80 ммоль) перемешивали при 130°C в течение 16 часов. Продукт реакции промывали толуолом и перегоняли при пониженном давлении. Полученное целевое соединение использовали для следующей стадии без очистки.
Стадия B: (4-бром-2,6-дифтор-фенил)-триметил-силан
Диизопропиламин (16,11 мл, 113,99 мл) растворяли в THF (100 мл) и 2,3 М n-BuLi (50 мл) медленно добавляли при -100°C. Смесь перемешивали в течение 20 минут, и 1-бром-3,5-дифтор-бензол (20 г, 103,63 ммоль) растворяли в THF (30 мл) при -100°C и медленно добавляли к реакционной смеси. Смесь перемешивали в течение 2 часов. TMSCl растворяли в THF (20 мл) при -100°C и медленно добавляли к реакционной смеси. Смесь перемешивали при комнатной температуре в течение 16 часов. После завершения реакции реакционный раствор разбавляли водой при 0°C и экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и перегоняли при пониженном давлении при 30°C или ниже. Полученное целевое соединение использовали для следующей стадии без очистки.
ЯМР:1H-ЯМР (CDCl3) δ 6,98 (2H, m), 0,35 (9H, s)
Стадия C: 1-(4-бром-2,6-дифтор-фенил)кетен
AlCl3 (16,89 г, 126,7 ммоль) растворяли в DCM (130 мл), и AcCl (9 мл, 126,7 ммоль) добавляли при 0°C. Смесь перемешивали в течение 1 часа. (4-бром-2,6-дифтор-фенил)-триметил-силан (27,48 г, 105,59 ммоль), полученный на Стадии B, растворяли в DCM (70 мл) и медленно добавляли при -80°C. Смесь перемешивали в течение 16 часов. После завершения реакции реакционный раствор разбавляли водным раствором хлорида аммония при 0°C и экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (19,89 г, 74%).
ЯМР:1H-ЯМР (CDCl3) δ 7,16 (2H, m), 2,58 (3H, s)
Стадия D: этиловый эфир (2E,4E)-5-(4-бром-2,6-дифтор-фенил)гекса-2,4-диеновой кислоты
Этиловый эфир (E)-4-диэтоксифосфорилбут-2-еновой кислоты (75%) (9,21 г, 36,806 ммоль), полученный на Стадии A, растворяли в THF (70 мл), и LiHMDS (37 мл, 36,80 ммоль) медленно добавляли при -78°C. Смесь перемешивали в течение 30 минут и охлаждали до -78°C. 1-(4-бром-2,6-дифтор-фенил)кетен (7,16 г, 28,31 ммоль), полученный на Стадии C, растворяли в THF (25 мл) и медленно добавляли. Смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор разбавляли водным раствором хлорида аммония при 0°C и экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/20) с получением целевого соединения (7,95 г, 84%).
ЯМР:1H-ЯМР (CDCl3) δ 7,67 (1H, m), 7,12 (2H, m), 6,26 (1H, d), 5,96 (1H, d), 4,23 (2H, q), 2,20 (3H, m), 1,31 (3H, t)
Стадия E: этиловый эфир (E)-5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гекса-2,4-диеновой кислоты
Этиловый эфир (2E,4E)-5-(4-бром-2,6-дифтор-фенил)гекса-2,4-диеновой кислоты (7,95 г, 24,0 ммоль), полученный на Стадии D, растворяли в 1,4-диоксане (80 мл) и вводили в реакцию таким же образом, как на Стадии C Примера Получения 27, с получением целевого соединения (7,25 г, 79%).
ЯМР:1H-ЯМР (CDCl3) δ 7,69 (1H, m), 7,34 (2H, m), 6,29 (1H, d), 5,92 (1H, d), 4,22 (2H, q), 2,20 (3H, m), 1,35 (15H, m)
Стадия F: этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты
Этиловый эфир (E)-5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гекса-2,4-диеновой кислоты (7,25 г, 19,16 ммоль), Pd/C (0,70 г), полученные на Стадии E, растворяли в метаноле (100 мл), загружали газообразным H2 и перемешивали при комнатной температуре в течение 8 часов. После завершения реакции реакционный раствор фильтровали через Целит с получением целевого соединения (7,16 г, 97%).
ЯМР:1H-ЯМР (CDCl3) δ 7,22 (2H, m), 4,08 (2H, q), 3,21 (1H, m), 2,24 (2H, m), 1,80 (1H, m), 1,65 (1H, m), 1,60 (1H, m), 1,45 (1H, m), 1,30 (15H, m), 1,20 (3H, t)
Пример получения 33: 2-этилсульфанил-3-йод-пиридин
2-Фтор-3-йод-пиридин (0,475 г, 2,13 ммоль), Cs2CO3 (3,47 г, 10,65 ммоль), этантиол (0,239 мл, 3,19 ммоль) вводили в реакцию таким же образом, как в Примере Получения 28, с получением целевого соединения (0,512 г, 90%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,92 (1H, m), 6,72 (1H, m), 3,16 (2H, q), 1,39 (3H, t)
Пример получения 34: 3-йод-2-изопропокси-пиридин
Изопропиловый спирт (0,043 г, 717 ммоль) растворяли в сухом DMF (3 мл). NaH (60%) (0,03 г, 0,71 ммоль) медленно добавляли по каплям при 0°C, и смесь перемешивали в течение 30 минут. Смесь медленно добавляли в колбу, содержащую 2-фтор-3-йод-пиридин (0,10 г, 0,44 ммоль), и перемешивали при комнатной температуре в течение 1 часа. Водный раствор NH4Cl добавляли к реакционному раствору, и реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали безводным MgSO4 и очищали колоночной хроматографией (элюент EtOAc/Hex=1/4) с получением целевого соединения (0,029 г, 24%).
1H-ЯМР (CDCl3) δ 8,08 (1H, m), 8,00 (1H, m), 6,59 (1H, m), 5,27 (1H, m), 1,38 (6H, d)
Пример получения 35: N-циклопентил-2-йод-анилин
2-Йоданилин (0,39 г, 1,78 ммоль) растворяли в 6 мл дихлорэтана. Добавляли циклопентанон (0,15 г, 1,78 ммоль) и уксусную кислоту (0,11 мл, 1,96 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. Добавляли натрий триацетоксиборгидрид (0,56 г, 2,67 ммоль), и смесь перемешивали в течение 5 часов. Реакционный раствор разбавляли водой и экстрагировали DCM для отделения органического слоя. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,12 г, 23%).
1H-ЯМР (CDCl3) δ 7,64 (1H, d), 7,18 (1H, t), 6,60 (1H, d), 6,40 (1H, t), 4,14 (1H, ушир.), 3,80 (1H, m), 2,02 (2H, m), 1,76 (2H, m), 1,63 (2H, m), 1,53 (2H, m)
Пример получения 36: 3-бром-N-циклопентил-анилин
3-броманилин (0,306 г, 1,78 ммоль) и циклопентанон (0,15 г, 1,78 ммоль) вводили в реакцию таким же образом, как в Примере Получения 35, с получением целевого соединения (0,347 г, 81%).
1H-ЯМР (CDCl3) δ 6,98 (1H, t), 6,77 (1H, d), 6,72 (1H, m), 6,49 (1H, m), 3,77 (2H, m), 2,02 (2H, m) 1,72 (2H, m), 1,62 (2H, m), 1,45 (2H, m)
Пример получения 37: 2-бром-6-пропилсульфанил-пиридин
2,6-дибромпиридин (0,2 г, 0,84 ммоль), Cs2CO3 (0,412 г, 1,27 ммоль) и пропантиол (0,076 мл, 0,84 ммоль) вводили в реакцию таким же образом, как в Примере Получения 28, с получением целевого соединения (0,184 г, 93%).
1H-ЯМР (CDCl3) δ 7,27 (1H, t), 7,11 (2H, m), 3,13 (2H, t), 1,74 (2H, m), 1,04 (3H, t)
Пример получения 38: метиловый эфир 4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]бутановой кислоты
Стадия A: метиловый эфир 4-(4-бромфенил)бутановой кислоты
4-(4-Аминофенил)бутановую кислоту (0,5 г, 2,87 ммоль) растворяли в HBr (2 мл) при 0°C и перемешивали в течение 10 минут. Нитрит натрия (0,192 г, 2,78 ммоль) растворяли в воде (1,3 мл) при 0°C и добавляли. CuBr (0,22 г, 1,53 ммоль) растворяли в HBr (2 мл) при 0°C и добавляли. Смесь перемешивали при 80°C в течение 4 часов. После завершения реакции растворитель реакции разбавляли метанолом при 0°C и экстрагировали этилацетатом. Органический слой высушивали безводным сульфатом магния, и добавляли без очистки диазометан (6 мл). Растворитель отгоняли при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/4) с получением целевого соединения (0,139 г, 19%).
ЯМР:1H-ЯМР (CDCl3) δ 7,42 (2H, m), 7,04 (2H, m), 3,66 (3H, s), 2,59 (2H, t), 2,31 (2H, m), 1,93 (2H, m)
Стадия B: метиловый эфир 4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]бутановой кислоты
Метиловый эфир 4-(4-бромфенил)бутановой кислоты (0,165 г, 0,64 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии C Примера Получения 27, с получением целевого соединения (0,039 г, 57%).
ЯМР:1H-ЯМР (CDCl3) δ 7,72 (2H, m), 7,19 (2H, m), 3,66 (3H, s), 2,67 (2H, t), 2,32 (2H, t), 1,96 (2H, m), 1,34 (12H, s)
Пример получения 39: 2-циклобутокси-3-йод-пиридин
Циклобутанол (0,064 г, 1,34 ммоль) и 2-фтор-3-йод-пиридин (0,2 г, 0,89 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,16 г, 66%).
1H-ЯМР (CDCl3) δ 8,07 (1H, m), 8,00 (1H, m), 6,61 (1H, m), 5,18 (1H, m), 2,47 (2H, m), 2,20 (2H, m), 1,84 (1H, m), 1,67 (1H, m)
Пример получения 40: 2-циклопропилметокси-3-йод-пиридин
Циклопропил-метанол (0,089 г, 1,23 ммоль) растворяли в безводном DMF (2 мл), и NaH (60%) (0,054 г, 1,35 ммоль) медленно добавляли по каплям при 0°C. Смесь перемешивали в течение 30 минут. Смесь медленно добавляли в колбу, содержащую 2-фтор-3-йод-пиридин (0,137 г, 0,617 ммоль), и перемешивали при комнатной температуре в течение 1 часа. Водный раствор NH4Cl добавляли к реакционному раствору, и реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали MgSO4 и очищали колоночной хроматографией (элюент EtOAc/Hex=1/5) с получением целевого соединения (0,141 г, 83%).
1H-ЯМР (CDCl3) δ 8,07 (1H, m), 8,00 (1H, m), 6,61 (1H, m), 4,20 (2H, d), 1,32 (1H, m), 0,60 (2H, m), 0,39 (2H, m)
Пример получения 41: 2-циклобутокси-3-йод-пиридин
Циклобутанол (0,064 г, 1,34 ммоль) и 2-фтор-3-йод-пиридин (0,2 г, 0,89 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,16 г, 66%).
1H-ЯМР (CDCl3) δ 8,07 (1H, m), 8,00 (1H, m), 6,61 (1H, m), 5,18 (1H, m), 2,47 (2H, m), 2,20 (2H, m), 1,84 (1H, m), 1,67 (1H, m)
Пример получения 42: 2-бром-6-изопропокси-пиридин
Пропан-2-ол (0,065 мл, 0,84 ммоль) и 2,6-дибромпиридин (0,2 г, 0,84 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,027 г, 14%).
1H-ЯМР (CDCl3) δ 7,37 (1H, t), 7,00 (1H, d), 6,60 (1H, d), 5,27 (1H, m), 1,33 (6H, d)
Пример получения 43: 2-хлор-6-циклопропилметокси-пиридин
6-хлор-2-пиридон (1,0 г, 7,7 ммоль), K2CO3 (2,13 г, 15,4 ммоль) и (бромметил)циклопропан (1,1 г, 8,1 ммоль) добавляли к 15 мл DMF, и смесь перемешивали при 80°C в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (0,65 г, 45%).
1H-ЯМР (CDCl3) δ 7,50 (1H, t), 6,87 (1H, d), 6,67 (1H, d), 4,12 (2H, d), 1,26 (1H, m), 0,62 (2H, m), 0,36 (2H, m)
Пример получения 44: 2-бром-6-циклопропилметокси-пиридин
Циклопропилметанол (0,068 мл, 0,84 ммоль) и 2,6-дибромпиридин (0,2 г, 0,84 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,1 г, 53%).
1H-ЯМР (CDCl3) δ 7,39 (1H, t), 7,03 (1H, d), 6,70 (1H, d), 4,12 (2H, d), 1,24 (1H, m), 0,59 (2H, m), 0,35 (2H, m)
Пример получения 45: 2-бром-6-пропокси-пиридин
Пропанол (0,07 мл, 0,92 ммоль) и 2,6-дибромпиридин (0,2 г, 0,84 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,067 г, 36%).
1H-ЯМР (CDCl3) δ 7,39 (1H, t), 7,03 (1H, d), 6,65 (1H, d), 4,23 (2H, t), 1,76 (2H, m), 1,00 (3H, t)
Пример получения 46: 2-хлор-6-изопропокси-пиридин
Изопропанол (0,97 г, 16,1 ммоль) растворяли в 45 мл THF и охлаждали до 0°C. Добавляли NaH (55% в нефти, 0,7 г, 16 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли 2,6-дихлорпиридин (2,0 г, 13,5 ммоль), и смесь перемешивали в течение 16 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры, разбавляли 20 мл воды и экстрагировали EtOAc. Отделенный органический слой высушивали MgSO4 и очищали колоночной хроматографией с получением целевого соединения (1,917 г, 82%).
1H-ЯМР (CDCl3) δ 7,48 (1H, t), 6,83 (1H, d), 6,58 (1H, d), 5,29 (1H, m), 1,34 (6H, d)
Пример получения 47: 3-йод-2-пропокси-пиридин
Пропанол (0,1 мл, 1,34 ммоль) и 2-фтор-3-йод-пиридин (0,2 г, 0,89 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,11 г, 46%).
1H-ЯМР (CDCl3) δ 8,08 (1H, m), 8,00 (1H, m), 6,61 (1H, m), 4,28 (2H, t), 1,82 (2H, m), 1,04 (3H, t)
Пример получения 48: 2-циклобутилметокси-3-йод-пиридин
Циклобутил-метанол (0,37 г, 4,31 ммоль) и 2-фтор-3-йод-пиридин (0,60 г, 2,69 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,75 г, 96%).
1H-ЯМР (CDCl3) δ 8,08 (1H, m), 8,02 (1H, m), 6,63 (1H, m), 4,29 (2H, d), 2,79 (1H, m), 2,12 (2H, m), 1,96 (4H, m)
Пример получения 49: 3-йод-2-(тетрагидро-фуран-3-илокси)-пиридин
Тетрагидро-фуран-3-ол (0,39 г, 4,44 ммоль) и 2-фтор-3-йод-пиридин (0,66 г, 2,96 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,68 г, 80%).
1H-ЯМР (CDCl3) δ 8,08 (1H, m), 8,03 (1H, m), 6,65 (1H, m), 5,53 (1H, m), 4,12 (1H, m), 4,06 (1H, m), 3,94 (2H, m), 2,23 (2H, m)
Пример получения 50: 3-йод-2-(тетрагидро-пиран-4-илокси)-пиридин
Тетрагидро-пиран-4-ол (0,45 г, 4,44 ммоль) и 2-фтор-3-йод-пиридин (0,66 г, 2,96 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,80 г, 89%).
1H-ЯМР (CDCl3) δ 8,07 (1H, d), 8,01 (1H, d), 6,63 (1H, m), 5,30 (1H, m), 4,01 (2H, m), 3,68 (2H, m), 2,04 (2H, m), 1,85 (2H, m)
Пример получения 51: N-циклопентил-3-йод-пиридин-2-амин
2-Фтор-3-йод-пиридин (0,3 г, 1,34 ммоль), циклопентиламин (0,34 г, 4 ммоль) и диизопропилэтиламин (0,46 мл, 2,68 ммоль) растворяли в 3,3 мл CH3CN, и смесь перемешивали при 110°C в течение 2 часов при помощи микроволновой печи. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (0,155 г, 40%).
1H-ЯМР (CDCl3) δ 8,07 (1H, d), 7,80 (1H, d), 6,28 (1H, m), 4,88 (1H, ушир.), 4,30 (1H, m), 2,10 (2H, m), 1,75 (2H, m), 1,65 (2H, m), 1,48 (2H, m)
Пример получения 52: 2-бром-6-циклобутилсульфанил-пиридин
Циклобутилтиол (0,074 г, 0,84 ммоль) и 2,6-дибромпиридин (0,2 г, 0,84 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,047 г, 22%).
1H-ЯМР (CDCl3) δ 7,27 (1H, t), 7,11 (1H, d), 7,00 (1H, d), 4,28 (1H, m), 2,53 (2H, m), 2,08 (4H, m)
Пример получения 53: 1-(3-бромфенил)пирролидин
1,3-дибромбензол (1,0 г, 4,24 ммоль), пирролидин (0,43 мл, 5,0 ммоль), трет-бутоксид натрия (1,14 г, 11,87 ммоль) и BINAP (0,2 г, 0,32 ммоль) растворяли в 17 мл толуола. Добавляли Pd2(dba)3(0,097 г, 0,1 ммоль), и смесь перемешивали 4 часа при нагревании с обратным холодильником. Твердые вещества фильтровали через Целит и очищали колоночной хроматографией с получением целевого соединения (0,52 г, 54%).
1H-ЯМР (CDCl3) δ 7,05 (1H, t), 6,75 (1H, d), 6,67 (1H, m), 6,45 (1H, m), 3,26 (4H, m), 2,00 (4H, m)
Пример получения 54: 2-хлор-6-фенокси-пиридин
2,6-дихлорпиридин (2,0 г, 13,5 ммоль) и фенол (1,4 мл, 14,9 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (3,5 г, 84%).
1H-ЯМР (CDCl3) δ 7,62 (1H, t), 7,41 (2H, m), 7,21 (1H, t), 7,14 (2H, d), 6,74 (2H, d)
Пример получения 55: 2-бром-4-фтор-1-изопропокси-бензол
2-бром-4-фтор-фенол (0,3 г, 1,57 ммоль), 2-бром-пропан (0,22 мл) и Cs2CO3 (1,53 г) вводили в реакцию таким же образом, как в Примере Получения 28, с получением целевого соединения (0,33 г, 89%).
1H-ЯМР (CDCl3) δ 7,28 (1H, m), 6,94 (1H, m), 6,88 (1H, m), 4,44 (1H, m), 1,32 (6H, d).
Пример получения 56: 3-бром-5-метил-пиридин-2-ол
5-Метил-пиридин-2-ол (1 г, 9,16 ммоль) растворяли в 4 мл CS2. Добавляли Br2 (0,47 мл), и смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли водный раствор тиосульфата натрия (Na2S2O3), и реакционный раствор экстрагировали EtOAc. Отделенный органический слой высушивали с помощью MgSO4 и концентрировали при пониженном давлении с получением целевого соединения (1,7 г, 98%) в твердой форме.
1H-ЯМР (CDCl3) δ 7,73 (1H, s), 7,22 (1H, s), 2,10 (3H, s).
Пример получения 57: 3-бром-2-циклопентилокси-5-метил-пиридин
3-бром-5-метил-пиридин-2-ол (0,5 г, 2,66 ммоль), полученный в Примере Получения 56, бром-циклопентан (0,43 мл) и Cs2CO3 (2,6 г) вводили в реакцию таким же образом, как в Примере Получения 28, с получением целевого соединения (0,25 г, 37%).
H-ЯМР (CDCl3) δ 7,86 (1H, s), 7,60 (1H, s), 5,38 (1H, m), 2,21 (3H, s), 1,93 (2H, m), 1,82 (4H, m), 1,61 (2H, m).
Пример получения 58: метиловый эфир 3-[(4-метоксифенил)метокси]изоксазол-5-карбоновой кислоты
Метиловый эфир 3-Гидроксиизоксазол-5-карбоновой кислоты (4,73 г, 33 ммоль) растворяли в 66 мл DMF. K2CO3 (5,0 г, 36,3 ммоль) и 4-метоксибензил хлорид (4,5 мл, 33 ммоль) добавляли при 0°C, и смесь перемешивали при 60°C в течение 10 часов. Реакционный раствор концентрировали при пониженном давлении, разбавляли водой и экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (4,06 г, 47%).
1H-ЯМР (CDCl3) δ 7,39 (2H, d), 6,92 (2H, d), 6,54 (1H, s), 5,24 (2H, s), 3,95 (3H, s), 3,81 (3H, s)
Пример получения 59: [3-[(4-метоксифенил)метокси]изоксазол-5-ил]метанол
Метиловый эфир 3-[(4-Метоксифенил)метокси]изоксазол-5-карбоновой кислоты (4,06 г, 15,4 ммоль), полученный в Примере Получения 58, растворяли в 51 мл MeOH. Добавляли NaBH4 (0,87 г, 23 ммоль), и смесь перемешивали в течение 4 часов при нагревании с обратным холодильником. Реакционный раствор разбавляли водой и экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (2,58 г, 71%).
1H-ЯМР (CDCl3) δ 7,38 (2H, d), 6,92 (2H, d), 5,89 (1H, s), 5,19 (2H, s), 4,66 (2H, d), 3,82 (3H, s), 1,95 (1H, t)
Пример получения 60: [3-[(4-метоксифенил)метокси]изоксазол-5-ил]метил метансульфонат
[3-[(4-Метоксифенил)метокси]изоксазол-5-ил]метанол (0,19 г, 0,82 ммоль), полученный в Примере Получения 59, растворяли в 4 мл DCM. DIPEA (0,29 мл, 1,64 ммоль) и метансульфонил хлорид (0,07 мл, 0,9 ммоль) последовательно добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 80 минут. Реакционный раствор разбавляли водой и экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и использовался для следующей реакции без очистки.
1H-ЯМР (CDCl3) δ 7,38 (2H, d), 6,93 (2H, d), 6,08 (1H, s), 5,21 (2H, s), 5,18 (2H, s), 3,82 (3H, s), 3,06 (3H, s)
Пример получения 61: 3-[(4-метоксифенил)метокси]изоксазол-5-карбальдегид
[3-[(4-Метоксифенил)метокси]изоксазол-5-ил]метанол (0,4 г, 1,7 ммоль), полученный в Примере Получения 59, растворяли в 8 мл DCM. Добавляли хлорохромат пиридина (0,74 г, 3,4 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. Продукт реакции фильтровали через силикагель с получением целевого соединения (0,22 г, 55%).
1H-ЯМР (CDCl3) δ 9,84 (1H, s), 7,39 (2H, d), 6,93 (2H, d), 6,57 (1H, s), 5,27 (2H, s), 3,83 (3H, s)
Пример получения 62: 5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол
К 2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенолу (2,42 г, 9,43 ммоль), полученному на Стадии B Примера Получения 16, [3-[(4-метоксифенил)метокси]изоксазол-5-ил]метанолу (2,19 г, 9,31 ммоль), полученному в Примере Получения 59, и трифенилфосфину (2,44 г, 9,31 ммоль) добавляли 93 мл THF и охлаждали до 0°C. Добавляли диизопропил азодикарбоксилат (1,83 мл, 9,31 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (3,07 г, 70%).
1H-ЯМР (CDCl3) δ 7,37 (2H, d), 7,32 (2H, m), 6,91 (2H, d), 6,00 (1H, s), 5,18 (2H, s), 5,17 (2H, s), 3,82 (3H, s), 1,33 (12H, s)
Пример получения 63: 3-[(4-метоксифенил)метокси]-5-метил-изоксазол
5-Метилизоксазол-3-ол (0,64 г, 6,46 ммоль) растворяли в 13 мл DMF. Добавляли K2CO3 (0,98 г, 7,1 ммоль) и 4-метоксибензил хлорид (0,88 мл, 6,46 ммоль), и смесь перемешивали при 60°C в течение 4 часов. Фильтрат, полученный путем фильтрации твердых веществ, очищали колоночной хроматографией с получением целевого соединения (0,53 г, 40%).
1H-ЯМР (CDCl3) δ 7,37 (2H, d), 6,91 (2H, d), 5,62 (1H, s), 5,17 (2H, s), 3,82 (3H, s), 2,33 (3H, s)
Пример получения 64: 4-[2-(циклопентокси)-3-пиридил]анилин
2-циклопентокси-3-йод-пиридин (0,3 г, 1 ммоль), полученный в Примере Получения 11, и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (0,22 г, 1 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,18 г, 72%).
1H-ЯМР (CDCl3) δ 8,06 (1H, m), 7,56 (1H, m), 7,39 (2H, d), 6,89 (1H, m), 6,72 (2H, d), 5,50 (1H, m), 3,73 (2H, ушир.), 1,95 (2H, m), 1,83 (2H, m), 1,75 (2H, m), 1,62 (2H, m)
Пример получения 65: 4-[2-(циклопентокси)-3-пиридил]тиофенол
Каталитическое количество хлорида меди (I) добавляли к 12 мл воды. SOCl2 (0,2 мл, 2,58 ммоль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 16 часов. 4-[2-(Циклопентокси)-3-пиридил]анилин (0,18 г, 0,71 ммоль), полученный в Примере Получения 64, получали в другом сосуде с реагентом, и добавляли 7,1 мл водного раствора 3М HCl. Нитрит натрия (0,054 г, 0,78 ммоль, водный раствор 5 М) медленно добавляли при -5°C, и смесь перемешивали при 0°C в течение 1 часа и медленно добавляли к раствору смеси хлорида меди (I) и SOCl2. Реакционный раствор перемешивали при 0°C в течение 3 часов и экстрагировали EtOAc. Органический слой высушивали на MgSO4, и 20 мл THF добавляли и охлаждали до 0°C. Добавляли трифенилфосфин (0,27 г, 1 ммоль), и смесь перемешивали. Через 15 минут добавляли 20 мл воды, и реакционный раствор перемешивали при комнатной температуре в течение 16 часов и экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,022 г, 11%).
1H-ЯМР (CDCl3) δ 8,12 (1H, m), 7,56 (1H, m), 7,44 (2H, d), 7,30 (2H, d), 6,91 (1H, m), 5,50 (1H, m), 1,94 (2H, m), 1,80 (2H, m), 1,72 (2H, m), 1,62 (2H, m)
Пример получения 66: 2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин
2,6-дифтор-4-йод-анилин (9,35 г, 36,7 ммоль) вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (6,46 г, 69%).
1H-ЯМР (CDCl3) δ 7,24 (2H, m), 3,93 (2H, ушир.), 1,31 (12H, s)
Пример получения 67: 4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилин
2-циклопентокси-3-йод-пиридин (1,09 г, 3,8 ммоль), полученный в Примере Получения 11, и 2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (0,925 г, 3,62 ммоль), полученный в Примере Получения 66, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,6 г, 57%).
1H-ЯМР (CDCl3) δ 8,10 (1H, m), 7,54 (1H, m), 7,11 (2H, m), 6,90 (1H, m), 5,51 (1H, m), 3,78 (2H, ушир.), 1,95 (2H, m), 1,83 (2H, m), 1,76 (2H, m), 1,65 (2H, m)
Пример получения 68: 4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-бензолтиол
4-[2-(Циклопентокси)-3-пиридил]-2,6-дифтор-анилин (0,42 г, 1,47 ммоль), полученный в Примере Получения 67, вводили в реакцию таким же образом, как в Примере Получения 65, с получением целевого соединения (0,046 г, 10%).
1H-ЯМР (CDCl3) δ 8,20 (1H, m), 7,61 (1H, m), 7,22 (2H, m), 7,00 (1H, m), 5,56 (1H, m), 1,99 (2H, m), 1,86 (2H, m), 1,80 (2H, m), 1,70 (2H, m)
Пример получения 69: метиловый эфир 2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензойной кислоты
Стадия A: 4-бром-2,6-дифтор-бензойная кислота
70 мл THF охлаждали до -78°C и последовательно добавляли диизопропиламин (4 мл, 28,5 ммоль) и бутиллитий (13 мл, 27,2 ммоль, раствор 2,1 М в гексане). Смесь перемешивали при -78°C в течение 1 часа и медленно добавляли 1-бром-3,5-дифторбензол (5,0 г, 25,9 ммоль), растворенный в 15 мл. Смесь перемешивали при -78°C в течение 45 минут, и реакционный раствор переносили в мензурку, содержащую нелетучий диоксид углерода, и перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор подкисляли до pH 3 добавлением водного раствора 1Н HCl и экстрагировали EtOAc. Органический слой собирали и высушивали с помощью MgSO4 с получением целевого соединения (5,15 г, 84%).
1H-ЯМР (CDCl3) δ 7,20 (2H, m)
Стадия B: метиловый эфир 4-бром-2,6-дифтор-бензойной кислоты
4-бром-2,6-дифтор-бензойную кислоту (5,15 г, 21,7 ммоль), полученную на Стадии A, растворяли в 54 мл MeOH. Добавляли SOCl2 (2,4 мл, 32,6 ммоль), и смесь перемешивали в течение 3 часов при нагревании с обратным холодильником. Реакционный раствор концентрировали при пониженном давлении, разбавляли водным раствором бикарбоната натрия и экстрагировали EtOAc. Органический слой собирали и высушивали с помощью MgSO4 с получением целевого соединения (2,9 г, 53%).
1H-ЯМР (CDCl3) δ 7,16 (2H, m), 3,95 (3H, s)
Стадия C: метиловый эфир 2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензойной кислоты
Метиловый эфир 4-бром-2,6-дифтор-бензойной кислоты (1,27 г, 5,0 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (1,20 г, 80%).
1H-ЯМР (CDCl3) δ 7,34 (2H, m), 3,95 (3H, s), 1,34 (12H, s)
Пример получения 70: 3-[4-(хлорметил)-3,5-дифтор-фенил]-2-(циклопентокси)пиридин
Стадия A: метиловый эфир 4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-бензойной кислоты
2-циклопентокси-3-йод-пиридин (0,96 г, 3,3 ммоль), полученный в Примере Получения 11, и метиловый эфир 2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензойной кислоты (1,04 г, 3,5 ммоль), полученный в Примере Получения 69, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,47 г, 42%).
1H-ЯМР (CDCl3) δ 8,20 (1H, m), 7,61 (1H, m), 7,21 (2H, m), 6,95 (1H, m), 5,53 (1H, m), 3,97 (3H, s), 1,95 (2H, m), 1,81 (2H, m), 1,74 (2H, m), 1,65 (2H, m)
Стадия B: [4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]метанол
Метиловый эфир 4-[2-(Циклопентокси)-3-пиридил]-2,6-дифтор-бензойной кислоты (0,47 г, 1,41 ммоль), полученный на Стадии A, растворяли в 7 мл THF. Диизобутилалюминий гидрид (1,32 мл, 2,1 ммоль, раствор 1,6 М в толуоле) медленно добавляли при -78°C. Реакционный раствор перемешивали при -78°C в течение 2 часов и дополнительно перемешивали при комнатной температуре в течение 1 часа. После завершения реакции реакционный раствор охлаждали до -78°C и добавляли MeOH. После добавления водного раствора HCl при 0°C реакционный раствор перемешивали в течение 1 часа. Твердые вещества фильтровали через Целит и к фильтрату добавляли воду. Фильтрат экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 с получением целевого соединения (0,38 г, 90%).
1H-ЯМР (CDCl3) δ 8,17 (1H, m), 7,58 (1H, m), 7,16 (2H, m), 6,95 (1H, m), 5,53 (1H, m), 4,82 (2H, d), 1,95 (2H, m), 1,89 (1H, t, OH), 1,82 (2H, m), 1,75 (2H, m), 1,64 (2H, m)
Стадия C: 3-[4-(хлорметил)-3,5-дифтор-фенил]-2-(циклопентокси)пиридин
[4-[2-(Циклопентокси)-3-пиридил]-2,6-дифтор-фенил]метанол (0,38 г, 1,27 ммоль), полученный на Стадии B, растворяли в 6,4 мл CH3CN и медленно добавляли SOCl2 (0,19 мл, 2,54 ммоль). Смесь перемешивали при комнатной температуре в течение 90 минут. Реакционный раствор концентрировали при пониженном давлении, и добавляли воду. Реакционный раствор экстрагировали EtOAc, и органический слой высушивали с помощью MgSO4 с получением целевого соединения (0,40 г, 99%).
1H-ЯМР (CDCl3) δ 8,19 (1H, m), 7,59 (1H, m), 7,18 (2H, m), 6,99 (1H, m), 5,53 (1H, m), 4,71 (2H, s), 1,96 (2H, m), 1,82~1,63 (6H, m)
Пример получения 71: 4-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]бутаннитрил
Стадия A: 3-(4-бромфенил)пропан-1-ол
3-(4-бромфенил)пропановую кислоту (1,67 г, 7,3 ммоль) растворяли в 24 мл THF и охлаждали до 0°C. Добавляли боран-THF (22 мл, 22 ммоль, раствор 1,0 М в THF), и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор охлаждали до 0°C и последовательно добавляли воду и водный раствор 1Н HCl. Реакционный раствор экстрагировали EtOAc, и органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (1,46 г, 93%).
1H-ЯМР (CDCl3) δ 7,40 (2H, d), 7,08 (2H, d), 3,66 (2H, m), 2,67 (2H, m), 1,86 (2H, m), 1,26 (1H, t, OH)
Стадия B: 3-(4-бромфенил)пропил метансульфонат
3-(4-бромфенил)пропан-1-ол (1,46 г, 6,79 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как в Примере Получения 60, с получением целевого соединения (1,87 г, 93%).
1H-ЯМР (CDCl3) δ 7,42 (2H, d), 7,07 (2H, d), 4,22 (2H, t), 3,00 (3H, s), 2,72 (2H, t), 2,05 (2H, m)
Стадия C: 4-(4-бромфенил)бутаннитрил
3-(4-бромфенил)пропил метансульфонат (1,04 г, 3,55 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии E Примера Получения 81, с получением целевого соединения (0,73 г, 99%).
1H-ЯМР (CDCl3) δ 7,44 (2H, d), 7,07 (2H, d), 2,74 (2H, t), 2,32 (2H, t), 1,96 (2H, m)
Стадия D: 4-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]бутаннитрил
4-(4-бромфенил)бутаннитрил (0,73 г, 3,5 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,7 г, 73%).
1H-ЯМР (CDCl3) δ 7,70 (2H, d), 7,20 (2H, d), 2,79 (2H, t), 2,30 (2H, t), 1,99 (2H, m), 1,34 (12H, s)
Пример получения 72: 5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-2-[(4-метоксифенил)метокси]пиридин
Стадия A: 6-[(4-метоксифенил)метокси]пиридин-3-карбоновая кислота
(4-Метоксифенил)метанол (2,6 мл, 21 ммоль) растворяли в 47 мл DMF. NaH (1,23 г, 28,1 ммоль, 55 вес.% в масле) добавляли при 0°C, и смесь перемешивали в течение 30 минут. Добавляли 6-хлорпиридин-3-карбоновую кислоту (2,22 г, 14 ммоль), и смесь перемешивали при 80°C в течение 7 часов. Реакционный раствор концентрировали при пониженном давлении и добавляли воду. Реакционный раствор подкисляли до pH 3 при помощи водного раствора 1Н HCl. Осадок отфильтровывали и высушивали с получением целевого соединения (1,67 г, 45%).
1H-ЯМР (CDCl3) δ 8,92 (1H, s), 8,20 (1H, m), 7,41 (2H, d), 6,92 (2H, d), 6,82 (1H, m), 5,40 (2H, s), 3,82 (3H, s)
Стадия B: этиловый эфир 6-[(4-метоксифенил)метокси]пиридин-3-карбоновой кислоты
6-[(4-Метоксифенил)метокси]пиридин-3-карбоновую кислоту (1,67 г, 6,4 ммоль), полученную на Стадии A, растворяли в 13 мл THF. Добавляли 1,1-Карбонилдиимидазол (1,03 г, 6,4 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли 13 мл безводного этанола, и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (1,49 г, 80%).
1H-ЯМР (CDCl3) δ 8,85 (1H, m), 8,15 (1H, m), 7,40 (2H, d), 6,93 (2H, d), 6,79 (1H, m), 5,37 (2H, s), 4,38 (2H, q), 3,83 (3H, s), 1,39 (3H, t)
Стадия C: [6-[(4-метоксифенил)метокси]-3-пиридил]метанол
Этиловый эфир 6-[(4-Метоксифенил)метокси]пиридин-3-карбоновой кислоты (1,48 г, 5,18 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии B Примера Получения 70, с получением целевого соединения (0,96 г, 76%).
1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,62 (1H, m), 7,39 (2H, d), 6,92 (2H, d), 6,79 (1H, m), 5,31 (2H, s), 4,63 (2H, s), 3,81 (3H, s)
Стадия D: 5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-2-[(4-метоксифенил)метокси]пиридин
[6-[(4-Метоксифенил)метокси]-3-пиридил]метанол (0,144 г, 0,58 ммоль), полученный на Стадии C и 2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол (0,15 г, 0,58 ммоль), полученный на Стадии B Примера Получения 16, вводили в реакцию таким же образом, как в Примере Получения 62, с получением целевого соединения (0,155 г, 55%).
1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,70 (1H, m), 7,38 (2H, d), 7,28 (2H, m), 6,90 (2H, d), 6,76 (1H, m), 5,29 (2H, s), 5,13 (2H, s), 3,80 (3H, s), 1,32 (12H, s)
Пример получения 73: 4-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-2-[(4-метоксифенил)метокси]пиридин
Стадия A: 2-[(4-метоксифенил)метокси]пиридин-4-карбоновая кислота
2-хлорпиридин-4-карбоновую кислоту (2,22 г, 14 ммоль) и (4-метоксифенил)метанол (2,6 мл, 21 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера Получения 72, с получением целевого соединения (1,86 г, 51%).
1H-ЯМР (CDCl3) δ 8,33 (1H, m), 7,45 (1H, m), 7,39 (3H, m), 6,92 (2H, d), 5,35 (2H, s), 3,82 (3H, s)
Стадия B: этиловый эфир 2-[(4-метоксифенил)метокси]пиридин-4-карбоновой кислоты
2-[(4-Метоксифенил)метокси]пиридин-4-карбоновую кислоту (0,51 г, 1,97 ммоль), полученную на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера Получения 72, с получением целевого соединения (0,39 г, 68%).
1H-ЯМР (CDCl3) δ 8,28 (1H, m), 7,38 (4H, m), 6,92 (2H, d), 5,36 (2H, s), 4,42 (2H, q), 3,88 (3H, s), 1,38 (3H, t)
Стадия C: [2-[(4-метоксифенил)метокси]-4-пиридил]метанол
Этиловый эфир 2-[(4-Метоксифенил)метокси]пиридин-4-карбоновой кислоты (0,39 г, 1,34 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии C Примера Получения 72, с получением целевого соединения (0,25 г, 75%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,39 (2H, d), 6,90 (4H, m), 5,32 (2H, s), 4,69 (2H, s), 3,81 (3H, s)
Стадия D: 4-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-2-[(4-метоксифенил)метокси]пиридин
[2-[(4-Метоксифенил)метокси]-4-пиридил]метанол (0,25 г, 1 ммоль), полученный на Стадии C, и 2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол (0,26 г, 1 ммоль), полученный на Стадии B Примера Получения 16, вводили в реакцию таким же образом, как в Примере Получения 62, с получением целевого соединения (0,09 г, 18%).
1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,40 (2H, d), 7,28 (2H, m), 6,96 (1H, m), 6,90 (3H, m), 5,30 (2H, s), 5,17 (2H, s), 3,81 (3H, s), 1,32 (12H, s)
Пример получения 74: 3-[4-(1-хлорэтил)-2,6-дифтор-фенил]-2-(циклопентокси)пиридин
Стадия A: 1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]этанон
1-(4-бром-2,6-дифтор-фенил)этанон (0,97 г, 4,13 ммоль), полученный на Стадии C Примера Получения 32, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,9 г, 77%).
1H-ЯМР (CDCl3) δ 7,35 (2H, m), 2,59 (3H, s), 1,34 (12H, s)
Стадия B: 1-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]этанон
1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]этанон (0,24 г, 0,89 ммоль), полученный на Стадии A, и 2-циклопентокси-3-йод-пиридин (0,024 г, 0,84 ммоль), полученный в Примере Получения 11, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,13 г, 48%).
1H-ЯМР (CDCl3) δ 8,20 (1H, m), 7,60 (1H, m), 7,21 (2H, m), 6,95 (1H, m), 5,54 (1H, m), 2,64 (3H, s), 1,96 (2H, m), 1,82 (2H, m), 1,75 (2H, m), 1,65 (2H, m)
Стадия C: 1-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]этанол
1-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]этанон (0,13 г, 0,41 ммоль), полученный на Стадии B, растворяли в 2 мл MeOH. Добавляли NaBH4 (0,031 г, 0,82 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 с получением целевого соединения (0,12 г, 92%).
1H-ЯМР (CDCl3) δ 8,16 (1H, m), 7,58 (1H, m), 7,12 (2H, m), 6,93 (1H, m), 5,53 (1H, m), 5,28 (1H, m), 2,22 (1H, d, OH), 1,96 (2H, m), 1,80 (4H, m), 1,68 (5H, m)
Стадия D: 3-[4-(1-хлорэтил)-2,6-дифтор-фенил]-2-(циклопентокси)пиридин
1-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]этанол (0,12 г, 0,37 ммоль), полученный на Стадии C, растворяли в 3,5 мл хлороформа. Добавляли SOCl2 (0,055 мл, 0,75 ммоль), и смесь перемешивали при 60°C в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении с получением целевого соединения (0,12 г, 98%).
1H-ЯМР (CDCl3) δ 8,34 (1H, m), 7,86 (1H, m), 7,18 (1H, m), 7,11 (2H, m), 5,87 (1H, m), 5,48 (1H, m), 2,16 (2H, m), 1,99 (3H, d), 1,89 (2H, m), 1,74 (4H, m)
Пример получения 75: этиловый эфир 2-[[(E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]аллил]-сульфамоил-амино]уксусной кислоты
Стадия A: этиловый эфир (E)-3-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]проп-2-еновой кислоты
Этиловый эфир (E)-3-(4-бром-2,6-дифтор-фенил)проп-2-еновой кислоты (3,8 г, 13 ммоль), полученный на Стадии A Примера Получения 195, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (2,16 г, 49%).
1H-ЯМР (CDCl3) δ 7,79 (1H, d), 7,33 (2H, m), 6,78 (1H, d), 4,27 (2H, q), 1,34 (15H, m)
Стадия B: этиловый эфир (E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]проп-2-еновой кислоты
Этиловый эфир (E)-3-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]проп-2-еновой кислоты (0,67 г, 1,98 ммоль), полученный на Стадии A, и 2-циклопентокси-3-йод-пиридин (0,55 г, 1,89 ммоль), полученный в Примере Получения 11, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,56 г, 80%).
1H-ЯМР (CDCl3) δ 8,19 (1H, m), 7,82 (1H, d), 7,61 (1H, m), 7,21 (2H, m), 6,96 (1H, m), 6,76 (1H, d), 5,54 (1H, m), 4,28 (2H, q), 1,96 (2H, m), 1,75 (4H, m), 1,66 (2H, m), 1,35 (3H, t)
Стадия C: (E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]проп-2-ен-1-ол
Этиловый эфир (E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]проп-2-еновой кислоты (0,4 г, 1,07 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии B Примера Получения 70, с получением целевого соединения (0,28 г, 78%).
1H-ЯМР (CDCl3) δ 8,17 (1H, m), 7,60 (1H, m), 7,15 (2H, m), 6,93 (1H, m), 6,72 (2H, m), 5,53 (1H, m), 4,40 (2H, m), 1,95 (2H, m), 1,83 (2H, m), 1,76 (2H, m), 1,65 (2H, m), 1,50 (1H, t, OH)
Стадия D: [(E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]аллил]метансульфонат
(E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]проп-2-ен-1-ол (0,28 г, 0,84 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как в Примере Получения 60, с получением целевого соединения (0,28 г, 83%).
1H-ЯМР (CDCl3) δ 8,18 (1H, m), 7,61 (1H, m), 7,17 (2H, m), 6,94 (1H, m), 6,81 (1H, d), 6,67 (1H, m), 5,53 (1H, m), 4,93 (2H, d), 3,07~2,80 (3H, s), 1,95 (2H, m), 1,85 (2H, m), 1,76 (2H, m), 1,66 (2H, m)
Стадия E: этиловый эфир 2-[[(E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]аллил]амино]уксусной кислоты
[(E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]аллил]метансульфонат (0,28 г, 0,7 ммоль), полученный на Стадии D, растворяли в 3,5 мл THF. Добавляли гидрохлоридную соль этилового эфира глицина (0,098 г, 0,7 ммоль) и TEA (0,58 мл, 4,2 ммоль), и смесь перемешивали в течение 16 часов при нагревании с обратным холодильником. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (0,076 г, 26%).
1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,60 (1H, m), 7,13 (2H, m), 6,92 (1H, m), 6,60 (2H, m), 5,52 (1H, m), 4,20 (2H, q), 3,50 (2H, d), 3,47 (2H, s), 1,95 (2H, m), 1,82 (2H, m), 1,76 (2H, m), 1,65 (2H, m), 1,30 (3H, t)
Стадия F: этиловый эфир 2-[[(E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]аллил]-сульфамоил-амино]уксусной кислоты
Хлорсульфонил изоцианат (0,024 мл, 0,27 ммоль) растворяли в 1 мл DCM и охлаждали до 0°C. Добавляли трет-бутиловый спирт (0,02 г, 0,27 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли этиловый эфир 2-[[(E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]аллил]амино]уксусной кислоты (0,076 г, 0,18 ммоль, 0,2M раствор DCM), полученный на Стадии E, и TEA (0,05 мл, 0,36 ммоль), и смесь перемешивали при комнатной температуре в течение 90 минут. После добавления воды реакционный раствор экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (0,038 г, 28%).
1H-ЯМР (CDCl3) δ 8,17 (1H, m), 7,59 (1H, m), 7,15 (2H, m), 6,93 (1H, m), 6,61 (2H, m), 5,53 (1H, m), 4,68 (2H, ушир.), 4,22 (2H, q), 4,14 (2H, d), 4,11 (2H, s), 1,95 (2H, m), 1,82 (2H, m), 1,75 (2H, m), 1,65 (2H, m), 1,28 (3H, t)
Пример получения 76: [(E)-3-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]аллил]метансульфонат
Стадия A: этиловый эфир (E)-3-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]проп-2-еновой кислоты
Этиловый эфир (E)-3-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]проп-2-еновой кислоты (0,19 г, 0,57 ммоль), полученный на Стадии A Примера Получения 75, и 3-йод-2-циклобутилсульфанил-пиридин (0,15 г, 0,51 ммоль), полученный в Примере Получения 13, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,15 г, 80%).
1H-ЯМР (CDCl3) δ 8,44 (1H, m), 7,80 (1H, d), 7,36 (1H, m), 7,05 (3H, m), 6,79 (1H, d), 4,44 (1H, m), 4,29 (2H, q), 2,51 (2H, m), 2,05 (4H, m), 1,36 (3H, t)
Стадия B: (E)-3-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]проп-2-ен-1-ол
Этиловый эфир (E)-3-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]проп-2-еновой кислоты (0,15 г, 0,41 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера Получения 70, с получением целевого соединения (0,13 г, 99%).
1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,35 (1H, m), 7,04 (1H, m), 6,99 (2H, m), 6,73 (2H, m), 4,41 (3H, m), 2,51 (2H, m), 2,04 (4H, m)
Стадия C: [(E)-3-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]аллил]метансульфонат
(E)-3-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]проп-2-ен-1-ол (0,13 г, 0,4 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как в Примере Получения 60, с получением целевого соединения (0,14 г, 87%).
1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,36 (1H, m), 7,02 (3H, m), 6,81 (1H, d), 6,68 (1H, m), 4,94 (2H, d), 4,44 (1H, m), 3,08 (3H, s), 2,52 (2H, m), 2,04 (4H, m)
Пример получения 77: 5-[2-[трет-бутил(дифенил)силил]оксиэтил]изоксазол-3-ол
Гидрохлорид гидроксиламина (0,63 г, 9 ммоль) растворяли в 13 мл MeOH и добавляли NaOH (0,96 г, 24 ммоль, 10%-й водный раствор). Добавляли 5-[Трет-бутил(дифенил)силил]оксипент-2-метиловый эфир (2,77 г, 7,5 ммоль, раствор 1,0 М в MeOH), и смесь перемешивали при комнатной температуре в течение 48 часов. Реакционный раствор подкисляли до pH 2 при помощи 6 М водного раствора HCl, экстрагировали Et2O и очищали колоночной хроматографией с получением целевого соединения (1,0 г, 36%).
1H-ЯМР (CDCl3) δ 7,62 (4H, m), 7,43 (6H, m), 5,76 (1H, s), 3,91 (2H, t), 2,87 (2H, t), 1,03 (9H, s)
Пример получения 78: трет-бутил-[2-[3-[(4-метоксифенил)метокси]изоксазол-5-ил]этокси]-дифенил-силан
5-[2-[Трет-бутил(дифенил)силил]оксиэтил]изоксазол-3-ол (0,28 г, 0,76 ммоль), полученный в Примере Получения 77, растворяли в 2,5 мл DMF. Добавляли K2CO3 (0,21 г, 1,52 ммоль) и 4-метоксибензил хлорид (0,1 мл, 0,76 ммоль), и смесь перемешивали при 60°C в течение 10 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,26 г, 70%).
1H-ЯМР (CDCl3) δ 7,72~7,37 (12H, m), 6,91 (2H, d), 5,71 (1H, s), 5,17 (2H, s), 3,89 (2H, t), 3,81 (3H, s), 2,87 (2H, t), 1,02 (9H, s)
Пример получения 79: 2-[3-[(4-метоксифенил)метокси]изоксазол-5-ил]этанол
Трет-бутил-[2-[3-[(4-метоксифенил)метокси]изоксазол-5-ил]этокси]-дифенил-силан (0,26 г, 0,53 ммоль), полученный в Примере Получения 78, растворяли в 10 мл THF. Тетрабутиламмоний фторид (0,53 мл, 0,53 ммоль, раствор 1,0 М в THF) медленно добавляли при 0°C, и смесь перемешивали в течение 30 минут. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,075 г, 56%).
1H-ЯМР (CDCl3) δ 7,38 (2H, d), 6,90 (2H, d), 5,75 (1H, s), 5,17 (2H, s), 3,93 (2H, m), 3,82 (3H, s), 2,92 (2H, t), 1,70 (1H, ушир.)
Пример получения 80: 2-фтор-5-(6-изопропилсульфанил-2-пиридил)пиридин
Стадия A: 2-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин
5-бром-2-фторпиридин (2,0 г, 11,3 ммоль), K2CO3 (4,46 г, 45 ммоль) и бис(пинаколято)диборон (3,17 г, 12,4 ммоль) растворяли в 38 мл DMF и загружали газообразным азотом в течение 5 минут. После добавления каталитического количества PdCl2(dppf)-DCM, смесь перемешивали при 80°C в течение 3 часов. Твердые вещества отфильтровывали и очищали колоночной хроматографией с получением целевого соединения (1,59 г, 60%).
1H-ЯМР (DMSO-d6) δ 8,45 (1H, d), 8,16 (1H, m), 7,20 (1H, dd), 1,30 (12H, s)
Стадия B: 2-фтор-5-(6-изопропилсульфанил2-пиридил)пиридин
2-хлор-6-изопропилсульфанил-пиридин (0,14 г, 0,7 ммоль), полученный в Примере Получения 10, и 2-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин (0,2 г, 0,9 ммоль), полученный на Стадии A, растворяли в 1,1 мл 2 М водного раствора Na2CO3 и 5 мл 1,4-диоксана и загружали газообразным азотом в течение 5 минут. После добавления Pd(PPh3)4(43 мг, 0,04 ммоль), смесь перемешивали в течение 4 часов при нагревании с обратным холодильником. Реакционный раствор разбавляли водой и экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,114 г, 62%).
1H-ЯМР (CDCl3) δ 8,84 (1H, d), 8,43 (1H, m), 7,56 (1H, t), 7,39 (1H, d), 7,13 (1H, d), 7,04 (1H, dd), 4,13 (1H, m), 1,46 (6H, d)
Пример получения 81: метиловый эфир 2-[1-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиразол-4-ил]уксусной кислоты
Стадия A: 1-(4-бромфенил)пиразол
1H-пиразол (1,0 г, 14,7 ммоль) и 4-бромфторбензол (5,14 г, 29,4 ммоль) растворяли в 80 мл DMF. Добавляли фосфат калия (15,6 г, 73,5 ммоль), и смесь перемешивали при 150°C в течение 27 часов. После добавления 150 мл воды реакционный раствор экстрагировали Et2O с получением целевого соединения (3,45 г, 99%).
1H-ЯМР (CDCl3) δ 7,90 (1H, m), 7,72 (1H, m), 7,58 (4H, m), 6,48 (1H, m)
Стадия B: 1-(4-бромфенил)пиразол-4-карбальдегид
50 мл DMF охлаждали до 0°C и добавляли POCl3. Смесь перемешивали в течение 15 минут. Медленно добавляли 1-(4-бромфенил)пиразол (3,45 г, 14,7 ммоль), полученный на Стадии A, и смесь перемешивали при 110°C в течение 3 часов. После охлаждения до комнатной температуры добавляли водный раствор бикарбоната натрия, и смесь перемешивали в течение 30 минут. Реакционный раствор экстрагировали Et2O и очищали колоночной хроматографией с получением целевого соединения (0,45 г, 12%).
1H-ЯМР (CDCl3) δ 9,97 (1H, s), 8,42 (1H, s), 8,17 (1H, s), 7,62 (4H, m)
Стадия C: [1-(4-бромфенил)пиразол-4-ил]метанол
1-(4-бромфенил)пиразол-4-карбальдегид (0,45 г, 1,79 ммоль), полученный на Стадии B, растворяли в 3 мл THF и медленно добавляли 3,6 мл MeOH. NaBH4 (0,14 г, 3,76 ммоль), и смесь перемешивали в течение 90 минут. Подкисляли до pH 1 при 0°C. После добавления водного раствора 1 М NaOH (4 мл, 4 ммоль), реакционный раствор экстрагировали EtOAc с получением целевого соединения (0,39 г, 87%).
1H-ЯМР (CDCl3) δ 7,91 (1H, s), 7,72 (1H, s), 7,57 (4H, m), 4,68 (2H, m), 1,60 (1H, ушир.)
Стадия D: 1-(4-бромфенил)-4-(хлорметил)пиразол
[1-(4-бромфенил)пиразол-4-ил]метанол (0,39 г, 1,55 ммоль), полученный на Стадии C, растворяли в 8 мл DCM. DIPEA (0,4 мл, 2,3 ммоль) и метансульфонил хлорид (0,13 мл, 1,7 ммоль) последовательно добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 90 минут. После добавления воды органический слой, экстрагированный DCM, очищали колоночной хроматографией с получением целевого соединения (0,25 г, 58%).
1H-ЯМР (CDCl3) δ 7,92 (1H, s), 7,73 (1H, s), 7,57 (4H, m), 4,60 (2H, s)
Стадия E: 2-[1-(4-бромфенил)пиразол-4-ил]ацетонитрил
1-(4-бромфенил)-4-(хлорметил)пиразол (0,25 г, 0,9 ммоль), полученный на Стадии D, растворяли в 4,5 мл DMSO. Добавляли цианид натрия (0,18 г, 3,6 ммоль), и смесь перемешивали при комнатной температуре. После добавления воды реакционный раствор экстрагировали EtOAc с получением целевого соединения (0,19 г, 80%).
1H-ЯМР (CDCl3) δ 7,93 (1H, s), 7,67 (1H, s), 7,58 (4H, m), 3,68 (2H, s)
Стадия F: 2-[1-(4-бромфенил)пиразол-4-ил]уксусная кислота
2-[1-(4-бромфенил)пиразол-4-ил]ацетонитрил (0,19 г, 0,76 ммоль), полученный на Стадии E, растворяли в 0,45 мл воды и 0,4 мл концентрированной серной кислоты, и смесь перемешивали в течение 3 часов при нагревании с обратным холодильником. Осадок, сформированный добавлением воды, высушивали с получением целевого соединения (0,2 г, 98%).
1H-ЯМР (DMSO-d6) δ 8,39 (1H, s), 7,76 (2H, d), 7,67 (3H, m), 3,50 (2H, s)
Стадия G: метиловый эфир 2-[1-(4-бромфенил)пиразол-4-ил]уксусной кислоты
2-[1-(4-бромфенил)пиразол-4-ил]уксусную кислоту (0,2 г, 0,71 ммоль), полученную на Стадии F, растворяли в 2,4 мл THF. Добавляли диазометан (3 мл, 0,78 ммоль, раствор 0,25 М в Et2O), и смесь перемешивали в течение 20 минут. Реакционный раствор концентрировали при пониженном давлении с получением целевого соединения (0,21 г, 99%).
1H-ЯМР (CDCl3) δ 7,89 (1H, s), 7,64 (1H, s), 7,55 (4H, m), 3,73 (3H, s), 3,73 (2H, s)
Стадия H: метиловый эфир 2-[1-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиразол-4-ил]уксусной кислоты
Метиловый эфир 2-[1-(4-бромфенил)пиразол-4-ил]уксусной кислоты (0,21 г, 0,71 ммоль), полученный на Стадии G, бис(пинаколято)диборон (0,19 г, 0,74 ммоль) и DPPF (0,02 г, 0,035 ммоль) растворяли в 3,6 мл 1,4-диоксана и загружали газообразным азотом. Добавляли PdCl2(dppf)-DCM (0,03 г, 0,035 ммоль), и смесь перемешивали в течение 1 часа при нагревании с обратным холодильником. Твердые вещества фильтровали через Целит, и фильтрат концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (0,096 г, 40%).
1H-ЯМР (CDCl3) δ 7,97 (1H, s), 7,88 (2H, d), 7,67 (3H, m), 3,73 (3H, s), 3,59 (2H, s), 1,36 (12H, s)
Пример получения 82: бензил-N-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]карбамат
Бензил-N-(4-бром-2,6-дифтор-фенил)карбамат (1,61 г, 4,7 ммоль) вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (1,5 г, 82%).
1H-ЯМР (CDCl3) δ 7,36 (7-й, m), 6,20 (1H, ушир.), 5,21 (2H, s), 1,33 (12H, s)
Пример получения 83: этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилино]пентановой кислоты
Стадия A: этиловый эфир 5-[N-бензилоксикарбонил-2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилино]пентановой кислоты
Бензил-N-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]карбамат (0,79 г, 2 ммоль), полученный в Примере Получения 82, растворяли в 6,7 мл DMF. NaH (0,18 г, 55 вес.% в масле, 4 ммоль) и этиловый эфир 5-бромпентановой кислоты (0,44 г, 2,1 ммоль) последовательно добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали EtOAc. Органический слой собирали, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,447 г, 45%).
1H-ЯМР (CDCl3) δ 7,40~7,18 (7H, m), 5,10 (2H, s), 4,08 (2H, q), 3,64 (2H, t), 2,28 (2H, t), 1,62 (2H, m), 1,54 (2H, m), 1,33 (12H, s), 1,21 (3H, t)
Стадия B: этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилино]пентановой кислоты
Этиловый эфир 5-[N-бензилоксикарбонил-2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилино]пентановой кислоты (0,46 г, 0,89 ммоль), полученный на Стадии A, растворяли в 5 мл MeOH. Добавляли 10 вес.% Pd/C (0,05 г), и смесь перемешивали в течение 16 часов в атмосфере водорода. Твердые вещества фильтровали через Целит, и фильтрат концентрировали при пониженном давлении с получением целевого соединения (0,35 г, 99%).
1H-ЯМР (CDCl3) δ 7,21 (2H, m), 4,12 (2H, q), 3,39 (2H, t), 2,33 (2H, t), 1,71 (2H, m), 1,62 (2H, m), 1,32 (12H, s), 1,25 (3H, t)
Пример получения 84: метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты
Стадия A: метиловый эфир 2-[1-(2,6-дифтор-4-nitro-фенил)-4-пиперидил] уксусной кислоты
3,4,5-Трифторнитробензол (1,68 г, 9,43 ммоль) растворяли в 24 мл DMF. Последовательно добавляли гидрохлоридную соль метиового эфира (4-пиперидил)уксусной кислоты (2,02 г, 10,4 ммоль) и DIPEA (4,1 мл, 23,5 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой собирали и высушивали с помощью MgSO4 с получением целевого соединения (3,0 г, 99%), который использовали для следующей стадии без очистки.
1H-ЯМР (CDCl3) δ 7,74 (2H, m), 3,69 (3H, s), 3,50 (2H, m), 3,20 (2H, m), 2,31 (2H, d), 2,01 (1H, m), 1,80 (2H, m), 1,42 (2H, m)
Стадия B: метиловый эфир 2-[1-(4-амино-2,6-дифтор-фенил)-4-пиперидил] уксусной кислоты
К метиловому эфиру 2-[1-(2,6-дифтор-4-нитро-фенил)-4-пиперидил]уксусной кислоты (1,1 г, 3,5 ммоль), полученному на Стадии A, добавляли по 12 мл THF, MeOH и воды. Добавляли хлорид аммония (1,31 г, 24,5 ммоль) и железо (1,37 г, 24,5 ммоль), и смесь перемешивали в течение 2 часов при нагревании с обратным холодильником. После завершения реакции твердые вещества фильтровали через Целит. После добавления воды фильтрат экстрагировали EtOAc. Органический слой собирали и высушивали с помощью MgSO4 с получением целевого соединения (0,82 г, 80%), который использовали для следующей стадии без очистки.
1H-ЯМР (CDCl3) δ 6,15 (2H, m), 3,68 (3H, s), 3,04 (4H, m), 2,28 (2H, d), 1,90 (1H, m), 1,82 (2H, m), 1,43 (2H, m)
Стадия C: метиловый эфир 2-[1-(4-бром-2,6-дифтор-фенил)-4-пиперидил]уксусной кислоты
CuBr2 (0,75 г, 3,36 ммоль) растворяли в 7 мл CH3CN. Добавляли трет-бутил нитрит (0,5 мл, 4,2 ммоль), и смесь перемешивали при комнатной температуре в течение 5 минут. Метиловый эфир 2-[1-(4-Амино-2,6-дифтор-фенил)-4-пиперидил]уксусной кислоты (0,8 г, 2,8 ммоль), полученный на Стадии B, растворяли в 1,5 мл CH3CN и добавляли. Реакционный раствор перемешивали при комнатной температуре в течение 1 часа и концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой очищали колоночной хроматографией с получением целевого соединения (0,61 г, 60%).
1H-ЯМР (CDCl3) δ 7,00 (2H, m), 3,68 (3H, s), 3,19 (2H, m), 3,09 (2H, m), 2,29 (2H, d), 1,93 (1H, m), 1,75 (2H, m), 1,42 (2H, m)
Стадия D: метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты
Метиловый эфир 2-[1-(4-бром-2,6-дифтор-фенил)-4-пиперидил]уксусной кислоты (0,61 г, 1,7 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,52 г, 77%).
1H-ЯМР (CDCl3) δ 7,22 (2H, m), 3,68 (3H, s), 3,31 (2H, m), 3,10 (2H, m), 2,29 (2H, d), 1,95 (1H, m), 1,74 (2H, m), 1,43 (2H, m), 1,32 (12H, s)
Пример получения 85: этиловый эфир 2-[2-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилино]этил]циклопропанкарбоновой кислоты
Стадия A: этиловый эфир (E)-5-(1,3-диоксоизоиндолин-2-ил)пент-2-еновой кислоты
3-(1,3-Диоксоизоиндолин-2-ил)пропионовый альдегид (2,5 г, 12,3 ммоль) растворяли в 80 мл DCM. Добавляли (1-Этоксикарбонилэтилиден)трифенилфосфоран (4,50 г, 12,9 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (2,99 г, 89%).
1H-ЯМР (CDCl3) δ7,83 (2H, m), 7,72 (2H, m), 6,91 (1H, m), 5,90 (1H, d), 4,16 (2H, q), 3,83 (2H, t), 2,60 (2H, m), 1,26 (3H, t)
Стадия B: этиловый эфир 2-[2-(1,3-диоксоизоиндолин-2-ил)этил]циклопропанкарбоновой кислоты
Этиловый эфир (E)-5-(1,3-диоксоизоиндолин-2-ил)пент-2-еновой кислоты (2,0 г, 7,32 ммоль), полученный на Стадии A, растворяли в 10 мл THF. Добавляли диазометан (88 мл, 22 ммоль, 0,25M раствор в Et2O) и затем медленно добавляли ацетат палладия (II) (0,18 г, 0,8 ммоль). Смесь перемешивали при комнатной температуре в течение 16 часов и добавляли воду. Реакционный раствор экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (1,72 г, 82%).
1H-ЯМР (CDCl3) δ 7,84 (2H, m), 7,72 (2H, m), 4,10 (2H, q), 3,79 (2H, m), 1,69 (2H, m), 1,38 (2H, m), 1,23 (3H, t), 1,17 (1H, m), 0,72 (1H, m)
Стадия C: этиловый эфир 2-[2-(2,6-дифтор-4-нитро-анилино)этил]циклопропанкарбоновой кислоты
Этиловый эфир 2-[2-(1,3-Диоксоизоиндолин-2-ил)этил]циклопропанкарбоновой кислоты (1,72 г, 6 ммоль), полученный на Стадии B, растворяли в 40 мл EtOH. Добавляли гидразин гидрат (1,4 мл, 30 ммоль), и смесь перемешивали при комнатной температуре в течение 3 часов. К осадку, сформированному добавлением 20 мл Et2O, последовательно добавляли DMF, 3,4,5-трифторнитробензол (1,06 г, 6 ммоль) и DIPEA (1,57 мл, 9 ммоль), и смесь перемешивали при комнатной температуре в течение 72 часов. Реакционный раствор концентрировали при пониженном давлении и добавляли воду. Органический слой, экстрагированный с EtOAc, очищали колоночной хроматографией с получением целевого соединения (1,1 г, 58%).
1H-ЯМР (CDCl3) δ 7,78 (2H, m), 4,42 (1H, ушир.), 4,12 (2H, q), 3,62 (2H, m), 1,65 (2H, m), 1,42 (2H, m), 1,27 (3H, t), 1,22 (1H, m), 0,73 (1H, m)
Стадия D: этиловый эфир 2-[2-(4-амино-2,6-дифтор-анилино)этил]циклопропанкарбоновой кислоты
Этиловый эфир 2-[2-(2,6-дифтор-4-нитро-анилино)этил]циклопропанкарбоновой кислоты (1,1 г, 3,5 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии B Примера Получения 84, с получением целевого соединения (0,88 г, 88%).
1H-ЯМР (CDCl3) δ 6,20 (2H, m), 4,12 (2H, q), 3,22 (2H, t), 1,58 (1H, m), 1,49 (1H, m), 1,40 (2H, m), 1,26 (3H, t), 1,18 (1H, m), 0,72 (1H, m)
Стадия E: этиловый эфир 2-[2-(4-бром-2,6-дифтор-анилино)этил]циклопропанкарбоновой кислоты
Этиловый эфир 2-[2-(4-Амино-2,6-дифтор-анилино)этил]циклопропанкарбоновой кислоты (0,88 г, 3,09 ммоль), полученный на Стадии D, вводили в реакцию таким же образом, как на Стадии C Примера Получения 84, с получением целевого соединения (0,085 г, 8%).
1H-ЯМР (CDCl3) δ 6,97 (2H, m), 4,10 (2H, q), 3,66 (1H, ушир.), 3,41 (2H, m), 1,56 (2H, m), 1,39 (2H, m), 1,27 (3H, t), 1,19 (1H, m), 0,72 (1H, m)
Стадия F: этиловый эфир 2-[2-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилино]этил]циклопропанкарбоновой кислоты
Этиловый эфир 2-[2-(4-бром-2,6-дифтор-анилино)этил]циклопропанкарбоновой кислоты (0,085 г, 0,24 ммоль), полученный на Стадии E, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,05 г, 50%).
1H-ЯМР (CDCl3) δ 7,22 (2H, m), 4,10 (2H, q), 3,92 (1H, ушир.), 3,48 (2H, t), 1,58 (2H, m), 1,40 (2H, m), 1,31 (12H, s), 1,26 (3H, t), 1,20 (1H, m), 0,71 (1H, m)
Пример получения 86: 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-3-пиперидил]ацетонитрил
Стадия A: трет-бутил-3-(гидроксиметил)пиперидин-1-карбоксилат
3-Пиперидинeметанол (0,91 г, 7,9 ммоль) растворяли в 13 мл 1,4-диоксана и 8 мл воды. Добавляли ди-трет-бутил бикарбонат (1,81 г, 8,3 ммоль) и 8 мл 1Н водного раствора NaOH. Смесь перемешивали при комнатной температуре в течение 5 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой отделяли и высушивали с помощью MgSO4 с получением целевого соединения (1,5 г, 90%).
1H-ЯМР (DMSO-d6) δ 4,51 (1H, t), 3,94 (1H, ушир.), 3,78 (1H, m), 3,36 (1H, m), 3,29 (1H, m), 3,19 (1H, m), 2,69 (1H, m), 1,67 (1H, m), 1,59 (1H, m), 1,46 (1H, m), 1,38 (9H, s), 1,29 (1H, m), 1,09 (1H, m)
Стадия B: трет-бутил-3-(метилсульфонилоксиметил)пиперидин-1-карбоксилат
Трет-бутил-3-(гидроксиметил)пиперидин-1-карбоксилат (0,31 г, 1,4 ммоль), полученный на Стадии A, растворяли в 7 мл DCM и охлаждали до 0°C. Добавляли DIPEA (0,57 мл, 3,3 ммоль) и метансульфонил хлорид (0,12 мл, 1,54 ммоль), и смесь перемешивали в течение 3 часов. После добавления воды реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали с помощью MgSO4 с получением целевого соединения (0,41 г, 98%).
1H-ЯМР (CDCl3) δ 4,10 (2H, m), 3,95 (1H, m), 3,80 (1H, m), 3,02 (3H, s), 2,93 (1H, m), 2,79 (1H, m), 1,96 (1H, m), 1,82 (1H, m), 1,66 (1H, m), 1,49 (1H, m), 1,45 (9H, s), 1,33 (1H, m)
Стадия C: трет-бутил-3-(цианометил)пиперидин-1-карбоксилат
Трет-бутил-3-(метилсульфонилоксиметил)пиперидин-1-карбоксилат (0,41 г, 1,4 ммоль), полученный на Стадии B, растворяли в 7 мл DMF. Добавляли цианид натрия (0,075 г, 1,54 ммоль), и смесь перемешивали при 60°C в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении, разбавляли водой и экстрагировали EtOAc. Органический слой отделяли и высушивали с помощью MgSO4 с получением целевого соединения (0,29 г, 93%).
1H-ЯМР (CDCl3) δ 3,90 (1H, m), 3,82 (1H, m), 2,92 (2H, m), 2,30 (2H, m), 1,92 (2H, m), 1,68 (1H, m), 1,49 (1H, m), 1,46 (9H, s), 1,35 (1H, m)
Стадия D: 2-(3-пиперидил)ацетонитрил гидрохлорид
Трет-бутил-3-(цианометил)пиперидин-1-карбоксилат (0,292 г, 1,3 ммоль), полученный на Стадии C, растворяли в 13 мл DCM и охлаждали до 0°C. Медленно добавляли HCl (1,3 мл, 5,6 ммоль, раствор 4 М в 1,4-диоксане). После перемешивания при 0°C в течение 1 часа реакционный раствор концентрировали при пониженном давлении с получением целевого соединения (0,18 г, 86%).
1H-ЯМР (DMSO-d6) δ 9,16 (2H, ушир.), 3,21 (2H, t), 2,73 (1H, m), 2,61 (3H, m), 2,11 (1H, m), 1,81 (2H, m), 1,69 (1H, m), 1,27 (1H, m)
Стадия E: 2-[1-(2,6-дифтор-4-нитро-фенил)-3-пиперидил]ацетонитрил
2-(3-Пиперидил)ацетонитрил гидрохлорид (1,67 г, 10,4 ммоль), полученный на Стадии D, и 3,4,5-трифторнитробензол (1,67 г, 9,45 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера Получения 84, с получением целевого соединения (2,53 г, 95%).
1H-ЯМР (CDCl3) δ 7,76 (2H, m), 3,50 (1H, m), 3,40 (1H, m), 3,17 (1H, m), 3,04 (1H, m), 2,42 (2H, d), 2,16 (1H, m), 2,00 (1H, m), 1,82 (1H, m), 1,74 (1H, m), 1,44 (1H, m)
Стадия F: 2-[1-(4-бром-2,6-дифтор-фенил)-3-пиперидил]ацетонитрил
2-[1-(2,6-дифтор-4-нитро-фенил)-3-пиперидил]ацетонитрил (2,53 г, 9 ммоль), полученный на Стадии E, вводили в реакцию таким же образом, как на Стадиях B и C Примера Получения 84, с получением целевого соединения (1,16 г, 41%).
1H-ЯМР (CDCl3) δ 7,00 (2H, m), 3,25 (1H, m), 3,13 (1H, m), 3,02 (1H, m), 2,90 (1H, m), 2,44 (2H, m), 2,13 (1H, m), 1,90 (1H, m), 1,76 (1H, m), 1,70 (1H, m), 1,42 (1H, m)
Стадия G: 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-3-пиперидил]ацетонитрил
2-[1-(4-бром-2,6-дифтор-фенил)-3-пиперидил]ацетонитрил (1,16 г, 3,7 ммоль), полученный на Стадии F, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,91 г, 68%).
1H-ЯМР (CDCl3) δ 7,23 (2H, m), 3,34 (1H, m), 3,22 (1H, m), 3,07 (1H, m), 2,94 (1H, m), 2,44 (2H, m), 2,13 (1H, m), 1,92 (1H, m), 1,76 (1H, m), 1,70 (1H, m), 1,43 (1H, m), 1,32 (12H, s)
Пример получения 87: этиловый эфир 5-[N-бензилоксикарбонил-4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]пентановой кислоты
Стадия A: бензил N-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]карбамат
2-циклопентокси-3-йод-пиридин (0,42 г, 1,47 ммоль), полученный в Примере Получения 11, и бензил-N-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]карбамат (0,063 г, 1,61 ммоль), полученный в Примере Получения 82, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,5 г, 80%).
1H-ЯМР (CDCl3) δ 8,16 (1H, m), 7,58 (1H, m), 7,37 (5H, m), 7,19 (2H, m), 6,93 (1H, m), 6,18 (1H, ушир.), 5,52 (1H, m), 5,24 (2H, s), 1,96 (2H, m), 1,81 (2H, m), 1,76 (2H, m), 1,63 (2H, m)
Стадия B: этиловый эфир 5-[N-бензилоксикарбонил-4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]пентановой кислоты
Бензил-N-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]карбамат (0,23 г, 0,54 ммоль), полученный на Стадии A, и этиловый эфир 5-бромпентановой кислоты (0,12 г, 0,57 ммоль) растворяли в 3,6 мл DMF. Добавляли NaH (0,032 г, 0,81 ммоль, 55% в минеральном масле), и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления воды и 1Н водного раствора HCl реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,14 г, 47%).
1H-ЯМР (CDCl3) δ 8,17 (1H, m), 7,59 (1H, m), 7,40-7,20 (7H, m), 6,95 (1H, m), 5,53 (1H, m), 5,13 (2H, s), 4,09 (2H, q), 3,67 (2H, t), 2,33 (2H, t), 1,97 (2H, m), 1,80-1,60 (10H, m), 1,23 (3H, t)
Пример получения 88: этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты
Стадия A: 1-(2,6-дифтор-4-нитро-фенил)азетидин-3-ол
3,4,5-Трифторнитробензол (5,58 г, 31,5 ммоль) и гидрохлоридную соль 3-гидроксиазетидина (3,8 г, 34,7 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера Получения 84, с получением целевого соединения (7,25 г, 99%).
1H-ЯМР (CDCl3) δ 7,71 (2H, m), 4,80 (1H, m), 4,65 (2H, m), 4,27 (2H, m), 1,85 (1H, ушир.)
Стадия B: этиловый эфир 2-[1-(2,6-дифтор-4-нитро-фенил)азетидин-3-илиден]уксусной кислоты
Оксалил хлорид (1,68 мл, 19,6 ммоль) добавляли к 130 мл DCM и охлаждали до -78°C. Добавляли DMSO (2,77 мл, 39 ммоль), и смесь перемешивали в течение 10 минут. Медленно добавляли 1-(2,6-дифтор-4-нитро-фенил азетидин-3-ол (3 г, 13 ммоль), полученный на Стадии A, и смесь перемешивали при -78°C в течение 15 минут. Добавляли TEA (8,88 мл, 63,7 ммоль), и смесь перемешивали при -78°C в течение 40 минут и дополнительно перемешивали при комнатной температуре в течение 30 минут. Добавляли (1-этоксикарбонилэтилиден)трифенилфосфоран (4,53 г, 13 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления воды реакционный раствор экстрагировали DCM и очищали колоночной хроматографией с получением целевого соединения (2,84 г, 73%).
1H-ЯМР (CDCl3) δ 7,74 (2H, m), 5,81 (1H, m), 5,33 (2H, m), 5,10 (2H, m), 4,21 (2H, q), 1,30 (3H, t)
Стадия C: этиловый эфир 2-[1-(4-амино-2,6-дифтор-фенил)азетидин-3-ил]уксусной кислоты
Этиловый эфир 2-[1-(2,6-дифтор-4-нитро-фенил)азетидин-3-илиден]уксусной кислоты (2,84 г, 9,52 ммоль), полученный на Стадии B, растворяли в 80 мл MeOH и 40 мл THF. После добавления 0,5 г 10 вес.% Pd/C смесь перемешивали в течение 16 часов в атмосфере водорода. Твердые вещества фильтровали через Целит с получением целевого соединения (2,36 г, 92%).
1H-ЯМР (CDCl3) δ 6,14 (2H, m), 4,21 (2H, m), 4,13 (2H, q), 3,72 (2H, m), 3,44 (2H, ушир.), 2,95 (1H, m), 2,66 (2H, d), 1,26 (3H, t)
Стадия D: этиловый эфир 2-[1-(4-бром-2,6-дифтор-фенил)азетидин-3-ил]уксусной кислоты
Этиловый эфир 2-[1-(4-Амино-2,6-дифтор-фенил)азетидин-3-ил]уксусной кислоты (2,36 г, 8,7 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии C Примера Получения 84, с получением целевого соединения (1,04 г, 36%).
1H-ЯМР (CDCl3) δ 6,89 (2H, m), 4,34 (2H, m), 4,15 (2H, q), 3,84 (2H, m), 3,01 (1H, m), 2,67 (2H, d), 1,26 (3H, t)
Стадия E: этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты
Этиловый эфир 2-[1-(4-бром-2,6-дифтор-фенил)азетидин-3-ил]уксусной кислоты (1,04 г, 3,11 ммоль), полученный на Стадии D, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,62 г, 51%).
1H-ЯМР (CDCl3) δ 7,15 (2H, m), 4,41 (2H, m), 4,14 (2H, q), 3,91 (2H, m), 3,05 (1H, m), 2,68 (2H, d), 1,31 (12H, s), 1,27 (3H, t)
Пример получения 89: этиловый эфир 6-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-6-азаспиро[2,5]октан-2-карбоновой кислоты
Стадия A: 1-(2,6-дифтор-4-нитро-фенил)пиперидин-4-он
3,4,5-Трифторнитробензол (4,0 г, 22,6 ммоль) и пиперидин-4-он гидрохлорид (3,37 г, 24,8 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера Получения 84, с получением целевого соединения (5,38 г, 93%).
1H-ЯМР (CDCl3) δ 7,82 (2H, m), 3,66 (4H, m), 2,62 (4H, m)
Стадия B: этиловый эфир 2-[1-(2,6-дифтор-4-нитро-фенил)-4-пиперидилиден]уксусной кислоты
190 мл THF охлаждали до 0°C и добавляли NaH (1,83 г, 42 ммоль, 55 вес.% в масле). Добавляли триэтил фосфоноацетат (9,7 г, 43,3 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли 1-(2,6-дифтор-4-нитро-фенил)пиперидин-4-он (5,38 г, 21 ммоль), полученный на Стадии A, и смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли EtOAc, и реакционный раствор подкисляли до pH 4 добавлением 1Н водного раствора HCl. Органический слой, экстрагированный EtOAc, очищали колоночной хроматографией с получением целевого соединения (6,85 г, 99%).
1H-ЯМР (CDCl3) δ 7,78 (2H, m), 5,75 (1H, s), 4,17 (2H, q), 3,45 (2H, t), 3,42 (2H, t), 3,12 (2H, t), 2,45 (2H, t), 1,31 (3H, t)
Стадия C: этиловый эфир 6-(2,6-дифтор-4-нитро-фенил)-6-азаспиро[2,5]октан-2-карбоновой кислоты
Этиловый эфир 2-[1-(2,6-дифтор-4-нитро-фенил)-4-пиперидилиден]уксусной кислоты (0,55 г, 1,68 ммоль), полученный на Стадии B, растворяли в 5,6 мл THF. После добавления диазометана (40 мл, 10 ммоль, раствор 0,25 М в Et2O), добавляли каталитическое количество ацетата палладия (II), и смесь перемешивали при комнатной температуре. После завершения реакции реакционный раствор концентрировали и очищали колоночной хроматографией с получением целевого соединения (0,4 г, 65%).
1H-ЯМР (CDCl3) δ 7,77 (2H, m), 4,15 (2H, q), 3,45-3,24 (4H, m), 1,88 (2H, m), 1,59 (3H, m), 1,30 (3H, t), 1,23 (1H, m), 0,97 (1H, m)
Стадия D: этиловый эфир 6-(4-бром-2,6-дифтор-фенил)-6-азаспиро[2,5]октан-2-карбоновой кислоты
Этиловый эфир 6-(2,6-дифтор-4-нитро-фенил)-6-азаспиро[2,5]октан-2-карбоновой кислоты (0,4 г, 1,1 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадиях B и C Примера Получения 84, с получением целевого соединения (0,22 г, 52%).
1H-ЯМР (CDCl3) δ 7,00 (2H, m), 4,16 (2H, q), 3,21~3,04 (4H, m), 1,84 (2H, m), 1,56 (3H, m), 1,28 (3H, t), 1,18 (1H, m), 0,94 (1H, m)
Стадия E: этиловый эфир 6-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-6-азаспиро[2,5]октан-2-карбоновой кислоты
Этиловый эфир 6-(4-бром-2,6-дифтор-фенил)-6-азаспиро[2,5]октан-2-карбоновой кислоты (0,22 г, 0,58 ммоль), полученный на Стадии D, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,15 г, 60%).
1H-ЯМР (CDCl3) δ 7,22 (2H, m), 4,14 (2H, q), 3,32~3,10 (4H, m), 1,84 (2H, m), 1,55 (3H, m), 1,30 (12H, s), 1,27 (3H, t), 1,18 (1H, m), 0,94 (1H, m)
Пример получения 90: метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиразол-4-ил]уксусной кислоты
Стадия A: этиловый эфир 1-(2,6-дифтор-4-нитро-фенил)пиразол-4-карбоновой кислоты
3,4,5-Трифторнитробензол (3,17 г, 17,9 ммоль) и 4-пиразолкарбоновой кислоты этиловый эфир (2,50 г, 17,9 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера Получения 84, с получением целевого соединения (3,70 г, 70%).
1H-ЯМР (CDCl3) δ 8,25 (1H, s), 8,23 (1H, s), 8,05 (2H, m), 4,36 (2H, q), 1,38 (3H, t)
Стадия B: этиловый эфир 1-(4-бром-2,6-дифтор-фенил)пиразол-4-карбоновой кислоты
Этиловый эфир 1-(2,6-дифтор-4-нитро-фенил)пиразол-4-карбоновой кислоты (3,7 г, 12,4 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадиях B и C Примера Получения 84, с получением целевого соединения (3,0 г, 74%).
1H-ЯМР (CDCl3) δ 8,17 (1H, s), 8,14 (1H, s), 7,31 (2H, m), 4,34 (2H, q), 1,37 (3H, t)
Стадия C: [1-(4-бром-2,6-дифтор-фенил)пиразол-4-ил]метанол
Этиловый эфир 1-(4-бром-2,6-дифтор-фенил)пиразол-4-карбоновой кислоты (3,0 г, 9,16 ммоль), полученный на Стадии B, растворяли в 46 мл Et2O и охлаждали до -78°C. Медленно добавляли диизобутилалюминий гидрид (15,2 мл, 23 ммоль, раствор 1,5 М в толуоле), и смесь перемешивали при комнатной температуре в течение 16 часов. Твердые вещества, которые были сформированы последовательным добавлением MeOH и водного раствора смешанного тартрата калия-натрия, фильтровали через Целит. Фильтрат высушивали с помощью MgSO4 с получением целевого соединения (2,6 г, 99%).
1H-ЯМР (CDCl3) δ 7,81 (1H, s), 7,64 (1H, s), 7,28 (2H, m), 4,70 (2H, d), 1,60 (1H, t)
Стадия D: 1-(4-бром-2,6-дифтор-фенил)-4-(хлорметил)пиразол
[1-(4-бром-2,6-дифтор-фенил)пиразол-4-ил]метанол (2,6 г, 9,16 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии D Примера Получения 81, с получением целевого соединения (1,5 г, 53%).
1H-ЯМР (CDCl3) δ 7,82 (1H, s), 7,67 (1H, s), 7,28 (2H, m), 4,61 (2H, s)
Стадия E: 2-[1-(4-бром-2,6-дифтор-фенил)пиразол-4-ил]ацетонитрил
1-(4-бром-2,6-дифтор-фенил)-4-(хлорметил)пиразол (1,5 г, 4,9 ммоль), полученный на Стадии D, вводили в реакцию таким же образом, как на Стадии E Примера Получения 81, с получением целевого соединения (0,66 г, 45%).
1H-ЯМР (CDCl3) δ 7,76 (1H, s), 7,67 (1H, s), 7,30 (2H, m), 3,69 (2H, s)
Стадия F: 2-[1-(4-бром-2,6-дифтор-фенил)пиразол-4-ил]уксусная кислота
2-[1-(4-бром-2,6-дифтор-фенил)пиразол-4-ил]ацетонитрил (0,66 г, 2,21 ммоль), полученный на Стадии E, вводили в реакцию таким же образом, как на Стадии F Примера Получения 81, с получением целевого соединения (0,58 г, 82%).
1H-ЯМР (CDCl3) δ 7,76 (1H, s), 7,66 (1H, s), 7,27 (2H, m), 3,65 (2H, s)
Стадия G: метиловый эфир 2-[1-(4-бром-2,6-дифтор-фенил)пиразол-4-ил]уксусной кислоты
2-[1-(4-бром-2,6-дифтор-фенил)пиразол-4-ил]уксусную кислоту (0,58 г, 1,83 ммоль), полученную на Стадии F, растворяли в 6 мл THF. Добавляли диазометан (13 мл, 3,25 ммоль, раствор Et2O на 0,25 М), и смесь перемешивали при комнатной температуре в течение 40 минут. Реакционный раствор концентрировали при пониженном давлении с получением целевого соединения (0,6 г, 99%).
1H-ЯМР (CDCl3) δ 7,74 (1H, s), 7,65 (1H, s), 7,27 (2H, m), 3,74 (3H, s), 3,60 (2H, s)
Стадия H: метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиразол-4-ил]уксусной кислоты
Метиловый эфир 2-[1-(4-бром-2,6-дифтор-фенил)пиразол-4-ил]уксусной кислоты (0,6 г, 1,82 ммоль), полученный на Стадии G, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,52 г, 76%).
1H-ЯМР (CDCl3) δ 7,75 (1H, s), 7,69 (1H, s), 7,46 (2H, m), 3,74 (3H, s), 3,60 (2H, s), 1,35 (12H, s)
Пример получения 91: этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты
Стадия A: трет-бутил-3-гидроксипирролидин-1-карбоксилат
3-Пирролидинол (4,66 г, 53 ммоль) растворяли в 90 мл DCM. Добавляли диметиламинопиридин (0,65 г, 5,3 ммоль) и TEA (8,1 мл, 58,3 ммоль). Реакционный раствор охлаждали до 0°C и добавляли ди-трет-бутил бикарбонат (12,84 г, 58,8 ммоль). Смесь перемешивали при комнатной температуре в течение 48 часов. Добавляли 1М водный раствор NaOH (53 мл, 53 ммоль), и смесь перемешивали в течение 10 минут. После добавления воды реакционный раствор экстрагировали DCM и высушивали с помощью MgSO4. Органический слой очищали колоночной хроматографией с получением целевого соединения (8,98 г, 90%).
1H-ЯМР (CDCl3) δ 4,45 (1H, m), 3,46 (3H, m), 3,33 (1H, m), 1,97 (2H, m), 1,42 (9H, s)
Стадия B: трет-бутил-3-оксопирролидин-1-карбоксилат
Оксалил хлорид (6,0 мл, 70,5 ммоль) добавляли к 300 мл DCM и охлаждали до -78°C. Добавляли DMSO (9,9 мл, 139 ммоль), и смесь перемешивали в течение 15 минут. Добавляли трет-бутил-3-гидроксипирролидин-1-карбоксилат (8,98 г, 48 ммоль), полученный на Стадии A, и смесь перемешивали в течение 20 минут. Добавляли TEA (32 мл, 0,23 моль), и смесь перемешивали при -78°C в течение 1 часа и дополнительно перемешивали при комнатной температуре в течение 1 часа. После добавления воды реакционный раствор экстрагировали DCM. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (7,92 г, 89%).
1H-ЯМР (CDCl3) δ 3,77 (4H, m), 2,59 (2H, t), 1,48 (9H, s)
Стадия C: трет-бутил-3-(2-этокси-2-оксо-этилиден)пирролидин-1-карбоксилат
Трет-бутил-3-оксопирролидин-1-карбоксилат (1,82 г, 9,82 ммоль), полученный на Стадии B, растворяли в 49 мл DCM. Добавляли (1-Этоксикарбонилэтилиден)трифенилфосфоран (3,59 г, 10,3 ммоль), и смесь перемешивали в течение 72 часов при нагревании с обратным холодильником. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (2,0 г, 80%).
1H-ЯМР (CDCl3) δ 5,81 (1H, s), 4,42-4,13 (2H, m), 4,18 (2H, q), 3,56 (2H, m), 3,12-2,74 (2H, t), 1,46 (9H, s), 1,28 (3H, t)
Стадия D: трет-бутил-3-(2-этокси-2-оксо-этил)пирролидин-1-карбоксилат
Трет-бутил-3-(2-этокси-2-оксо-этилиден)пирролидин-1-карбоксилат (2,0 г, 7,83 ммоль), полученный на Стадии C, растворяли в 40 мл EtOH. Добавляли 0,2 г 10 вес.% Pd/C, и смесь перемешивали в течение 24 часов в атмосфере водорода. Твердые вещества отфильтровывали и концентрировали при пониженном давлении с получением целевого соединения (1,95 г, 97%).
1H-ЯМР (CDCl3) δ 4,14 (2H, q), 3,58 (1H, m), 3,45 (1H, m), 3,29 (1H, m), 2,92 (1H, m), 2,56 (1H, m), 2,38 (2H, d), 2,07 (1H, m), 1,51 (1H, m), 1,46 (9H, s), 1,26 (3H, t)
Стадия E: этиловый эфир 2-[1-(2,6-дифтор-4-нитро-фенил)пирролидин-3-ил]уксусной кислоты
Трет-бутил-3-(2-этокси-2-оксо-этил)пирролидин-1-карбоксилат (1,95 г, 7,57 ммоль), полученный на Стадии D, растворяли в 7 мл DCM. Добавляли HCl (7,8 мл, 30 ммоль, раствор 4 М в 1,4-диоксане), и смесь перемешивали при комнатной температуре в течение 90 минут. Реакционный раствор концентрировали при пониженном давлении для получения гидрохлоридной соли этилового эфира 2-пирролидин-3-илуксусной кислоты. Полученную гидрохлоридную соль этилового эфира 2-пирролидин-3-илуксусной кислоты и 3,4,5-трифторнитробензол (1,34 г, 7,57 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера Получения 84, с получением целевого соединения (2,24 г, 94%).
1H-ЯМР (CDCl3) δ 7,72 (2H, m), 4,17 (2H, q), 3,89 (1H, m), 3,81 (1H, m), 3,76 (1H, m), 3,47 (1H, m), 2,62 (1H, m), 2,46 (2H, d), 2,16 (1H, m), 1,65 (1H, m), 1,27 (3H, t)
Стадия F: этиловый эфир 2-[1-(4-бром-2,6-дифтор-фенил)пирролидин-3-ил]уксусной кислоты
Этиловый эфир 2-[1-(2,6-дифтор-4-нитро-фенил)пирролидин-3-ил]уксусной кислоты (2,24 г, 7,12 ммоль), полученный на Стадии E, вводили в реакцию таким же образом, как на Стадиях B и C Примера Получения 84, с получением целевого соединения (0,92 г, 37%).
1H-ЯМР (CDCl3) δ 6,93 (2H, m), 4,15 (2H, q), 3,60 (2H, m), 3,49 (1H, m), 3,24 (1H, m), 2,62 (1H, m), 2,44 (2H, d), 2,13 (1H, m), 1,63 (1H, m), 1,26 (3H, t)
Стадия G: этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты
Этиловый эфир 2-[1-(4-бром-2,6-дифтор-фенил)пирролидин-3-ил]уксусной кислоты (0,92 г, 2,64 ммоль), полученный на Стадии F, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,82 г, 79%).
1H-ЯМР (CDCl3) δ 7,18 (2H, m), 4,15 (2H, q), 3,70 (2H, m), 3,59 (1H, m), 3,35 (1H, m), 2,60 (1H, m), 2,44 (2H, m), 2,14 (1H, m), 1,61 (1H, m), 1,36 (12H, s), 1,27 (3H, t)
Пример получения 92: этиловый эфир 3-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]пропановой кислоты
Стадия A: трет-бутил-4-[(E)-3-этокси-3-оксо-проп-1-енил] пиперидин-1-карбоксилат
Трет-бутил-4-(гидроксиметил)пиперидин-1-карбоксилат (4,0 г, 18,6 ммоль) вводили в реакцию таким же образом, как на Стадии B Примера Получения 88, с получением целевого соединения (4,36 г, 83%).
1H-ЯМР (CDCl3) δ 6,89 (1H, dd), 5,78 (1H, d), 4,21 (2H, q), 4,12 (2H, m), 2,76 (2H, m), 2,28 (1H, m), 1,72 (2H, m), 1,45 (9H, s), 1,33 (2H, m), 1,28 (3H, t)
Стадия B: этиловый эфир (E)-3-[1-(2,6-дифтор-4-нитро-фенил)-4-пиперидил] проп-2-еновой кислоты
Трет-бутил-4-[(E)-3-этокси-3-оксо-проп-1-енил] пиперидин-1-карбоксилат (4,33 г, 15,1 ммоль), полученный на Стадии A, растворяли в HCl (15 мл, 60 ммоль, раствор 4 М в 1,4-диоксане) и перемешивали при 60°C в течение 90 минут. После добавления Et2O реакционный раствор концентрировали при пониженном давлении для получения гидрохлоридной соли этилового эфира (E)-3-(4-пиперидил)проп-2-еновой кислоты. Полученную гидрохлоридную соль этилового эфира (E)-3-(4-пиперидил)проп-2-еновой кислоты и 3,4,5-трифторнитробензол (2,67 г, 15,1 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера Получения 84, с получением целевого соединения (5,1 г, 99%).
1H-ЯМР (CDCl3) δ 7,75 (2H, m), 6,94 (1H, dd), 5,86 (1H, d), 4,20 (2H, q), 3,54 (2H, m), 3,22 (2H, m), 2,36 (1H, m), 1,84 (2H, m), 1,64 (2H, m), 1,30 (3H, t)
Стадия C: этиловый эфир (E)-3-[1-(4-бром-2,6-дифтор-фенил)-4-пиперидил]проп-2-еновой кислоты
Этиловый эфир (E)-3-[1-(2,6-дифтор-4-нитро-фенил)-4-пиперидил]проп-2-еновой кислоты (5,1 г, 15 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадиях B и C Примера Получения 84, с получением целевого соединения (2,45 г, 43%).
1H-ЯМР (CDCl3) δ 7,00 (2H, m), 6,95 (1H, dd), 5,84 (1H, d), 4,20 (2H, q), 3,23 (2H, m), 3,10 (2H, m), 2,29 (1H, m), 1,78 (2H, m), 1,61 (2H, m), 1,30 (3H, t)
Стадия D: этиловый эфир 3-[1-(4-бром-2,6-дифтор-фенил)-4-пиперидил]пропановой кислоты
Этиловый эфир (E)-3-[1-(4-бром-2,6-дифтор-фенил)-4-пиперидил]проп-2-еновой кислоты (2,45 г, 6,54 ммоль), полученный на Стадии C, растворяли в 70 мл DME. Гидразид п-толуолсульфонила (8,52 г, 45,6 нмоль) добавляли постепенно, и смесь нагревали до 90°C. Добавляли ацетат натрия (5,36 г, 65,4 ммоль, водный аствор 1,4 М), и смесь перемешивали в течение 9 часов при нагревании с обратным холодильником. После добавления воды реакционный раствор экстрагировали DCM. Органический слой высушивали с помощью MgSO4 с получением целевого соединения (2,46 г, 99%).
1H-ЯМР (CDCl3) δ 6,99 (2H, m), 4,13 (2H, q), 3,18 (2H, m), 3,01 (2H, m), 2,34 (2H, m), 1,71 (2H, m), 1,63 (2H, m), 1,37 (3H, m), 1,26 (3H, t)
Стадия E: этиловый эфир 3-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]пропановой кислоты
Этиловый эфир 3-[1-(4-бром-2,6-дифтор-фенил)-4-пиперидил]пропановой кислоты (2,46 г, 6,54 ммоль), полученный на Стадии D, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (2,02 г, 73%).
1H-ЯМР (CDCl3) δ 7,23 (2H, m), 4,14 (2H, q), 3,31 (2H, m), 3,05 (2H, m), 2,34 (2H, m), 1,71 (2H, m), 1,62 (2H, m), 1,36 (3H, m), 1,32 (12H, s), 1,25 (3H, t)
Пример получения 93: этиловый эфир 2-[4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиперазин-1-ил]уксусной кислоты
Стадия A: бензиловый эфир 4-(2-этокси-2-оксо-этил)пиперазин-1-карбоновой кислоты
Бензиловый эфир 1-Пиперазинкарбоновой кислоты (3,12 г, 14,2 ммоль) растворяли в 47 мл THF. Последовательно добавляли этиловый эфир бромуксусной кислоты (1,73 мл, 15,6 ммоль) и TEA (5,92 мл, 42,5 ммоль), и смесь перемешивали в течение 90 минут при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. Твердые вещества отфильтровывали и добавляли воду. Органический слой, экстрагированный EtOAc, высушивали с помощью MgSO4 с получением целевого соединения (4,3 г, 99%).
1H-ЯМР (CDCl3) δ 7,35 (5H, m), 5,13 (2H, s), 4,19 (2H, q), 3,56 (4H, m), 3,22 (2H, s), 2,55 (4H, m), 1,27 (3H, t)
Стадия B: этиловый эфир 2-пиперазин-1-илуксусной кислоты
Бензиловый эфир 4-(2-Этокси-2-оксо-этил)пиперазин-1-карбоновой кислоты (4,30 г, 14,0 ммоль), полученный на Стадии A, растворяли в 70 мл MeOH. добавляли 0,43 г 10 вес.% Pd/C, и смесь перемешивали в течение 24 часов в атмосфере водорода. Твердые вещества фильтровали через Целит с получением целевого соединения (2,40 г, 99%).
1H-ЯМР (CDCl3) δ 4,19 (2H, q), 3,20 (2H, s), 2,94 (4H, m), 2,57 (4H, m), 1,28 (3H, t)
Стадия C: этиловый эфир 2-[4-(2,6-дифтор-4-нитро-фенил)пиперазин-1-ил]уксусной кислоты
Этиловый эфир 2-Пиперазин-1-илуксусной кислоты (2,40 г, 13,9 ммоль), полученный на Стадии B, 3,4,5-трифторнитробензол (2,35 г, 13,3 ммоль) и DIPEA (3,50 мл, 13,9 ммоль) растворяли в 33 мл DMF и перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали EtOAc с получением целевого соединения (4,37 г, 99%).
1H-ЯМР (CDCl3) δ 7,78 (2H, m), 4,22 (2H, q), 3,50 (4H, m), 3,38 (2H, s), 2,85 (4H, m), 1,30 (3H, t)
Стадия D: этиловый эфир 2-[4-(4-бром-2,6-дифтор-фенил)пиперазин-1-ил]уксусной кислоты
Этиловый эфир 2-[4-(2,6-дифтор-4-нитро-фенил)пиперазин-1-ил]уксусной кислоты (4,34 г, 13,2 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадиях B и C Примера Получения 84, с получением целевого соединения (0,27 г, 6%).
1H-ЯМР (CDCl3) δ 7,00 (2H, m), 4,20 (2H, q), 3,26 (2H, s), 3,24 (4H, m), 2,70 (4H, m), 1,27 (3H, t)
Стадия E: этиловый эфир 2-[4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиперазин-1-ил]уксусной кислоты
Этиловый эфир 2-[4-(4-бром-2,6-дифтор-фенил)пиперазин-1-ил]уксусной кислоты (0,27 г, 0,74 ммоль), полученный на Стадии D, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,12 г, 39%).
1H-ЯМР (CDCl3) δ 7,23 (2H, m), 4,20 (2H, q), 3,30 (4H, m), 3,25 (2H, s), 2,70 (4H, m), 1,33 (12H, s), 1,28 (3H, t)
Пример получения 94: этиловый эфир 3-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиразол-4-ил]пропановой кислоты
Стадия A: трет-бутил-4-(гидроксиметил)пиразол-1-карбоксилат
Этиловый эфир 4-Пиразолкарбоновой кислоты (4,45 г, 31,7 ммоль) растворяли в 30 мл THF. Последовательно добавляли диметиламинопиридин (0,19 г, 1,59 ммоль), TEA (5,3 мл, 38,1 ммоль) и ди-трет-бутиловый бикарбонат (8,31 г, 38,1 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и добавляли 140 мл Et2O. После охлаждения до -78°C смесь вводили в реакцию таким же образом, как на Стадии C Примера Получения 90, с получением целевого соединения (1,42 г, 22%).
1H-ЯМР (CDCl3) δ 8,02 (1H, s), 7,68 (1H, s), 4,60 (2H, s), 1,63 (9H, s)
Стадия B: трет-бутил-4-формилпиразол-1-карбоксилат
Трет-бутил-4-(гидроксиметил)пиразол-1-карбоксилат (1,42 г, 7,1 ммоль), полученный на Стадии A, растворяли в 40 мл DCM. Добавляли MgSO4 (1,2 г, 9,9 ммоль) и диоксид марганца (4,32 г, 50 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. Твердые вещества отфильтровывали и очищали колоночной хроматографией с получением целевого соединения (1,03 г, 74%).
1H-ЯМР (CDCl3) δ 9,96 (1H, s), 8,61 (1H, s), 8,13 (1H, s), 1,67 (9H, s)
Стадия C: трет-бутил-4-[(E)-3-этокси-3-оксо-проп-1-енил]пиразол-1-карбоксилат
Трет-бутил-4-формилпиразол-1-карбоксилат (1,0 г, 5,28 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии A Примера Получения 85, с получением целевого соединения (1,05 г, 74%).
1H-ЯМР (CDCl3) δ 8,21 (1H, s), 7,89 (1H, s), 7,54 (1H, d), 6,29 (1H, d), 4,25 (2H, q), 1,66 (9H, s), 1,31 (3H, t)
Стадия D: этиловый эфир (E)-3-[1-(2,6-дифтор-4-нитро-фенил)пиразол-4-ил]проп-2-еновой кислоты
Трет-бутил-4-[(E)-3-этокси-3-оксо-проп-1-енил]пиразол-1-карбоксилат (0,88 г, 3,3 ммоль), полученный на Стадии C, растворяли в 22 мл DCM. Добавляли 11 мл TFA, и смесь перемешивали при комнатной температуре в течение 6 часов. После добавления Et2O реакционный раствор концентрировали при пониженном давлении для получения твердых веществ. 11 мл DMSO, 3,4,5-трифторнитробензол (0,58 г, 3,3 ммоль) и K2CO3 (1,37 г, 9,9 ммоль) последовательно добавляли к твердым веществам, и смесь перемешивали при 90°C в течение 16 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,73 г, 41%).
1H-ЯМР (CDCl3) δ 8,04 (3H, m), 7,92 (1H, s), 7,62 (1H, d), 6,32 (1H, d), 4,27 (2H, q), 1,33 (3H, t)
Стадия E: этиловый эфир 3-[1-(4-бром-2,6-дифтор-фенил)пиразол-4-ил]пропановой кислоты
Этиловый эфир (E)-3-[1-(2,6-дифтор-4-нитро-фенил)пиразол-4-ил]проп-2-еновой кислоты (0,71 г, 2,2 ммоль), полученный на Стадии D, вводили в реакцию таким же образом, как на Стадиях C и D Примера Получения 88, с получением целевого соединения (0,68 г, 86%).
1H-ЯМР (CDCl3) δ 7,66 (1H, s), 7,47 (1H, s), 7,26 (2H, m), 4,14 (2H, q), 2,88 (2H, t), 2,62 (2H, t), 1,25 (3H, t)
Стадия F: этиловый эфир 3-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиразол-4-ил]пропановой кислоты
Этиловый эфир 3-[1-(4-бром-2,6-дифтор-фенил)пиразол-4-ил]пропановой кислоты (0,075 г, 0,21 ммоль), полученный на Стадии E, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,03 г, 36%).
1H-ЯМР (CDCl3) δ 7,66 (1H, s). 7,52 (1H, m), 7,47 (2H, m), 4,15 (2H, q), 2,89 (2H, t), 2,63 (2H, t), 1,35 (12H, s), 1,24 (3H, t)
Пример получения 95: этиловый эфир 4-[5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-1-ил]бутановой кислоты
Стадия A: 5-броминдолин
10 мл уксусной кислоты добавляли к 5-броминдолу (2,5 г, 12,8 ммоль) и охлаждали до 0°C. Добавляли натрий триацетоксиборгидрид (2,38 г, 37,9 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления воды реакционный раствор экстрагировали Et2O, и органический слой промывали водным раствором бикарбоната натрия. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,95 г, 38%).
1H-ЯМР (CDCl3) δ 7,19 (1H, d), 7,09 (1H, dd), 6,50 (1H, d), 3,74 (1H, ушир.), 3,56 (2H, t), 3,02 (2H, t)
Стадия B: этиловый эфир 4-(5-броминдолин-1-ил)бутановой кислоты
5-броминдолин (0,95 г, 4,8 ммоль), полученный на Стадии A, растворяли в 16 мл DMF. K2CO3 (1,32 г, 9,6 ммоль) и добавляли этиловый эфир 4-бромбутановой кислоты (0,94 г, 4,8 ммоль), и смесь перемешивали при 70°C в течение 24 часов. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (0,59 г, 39%).
1H-ЯМР (CDCl3) δ 7,12 (2H, m), 6,30 (1H, d), 4,11 (2H, q), 3,35 (2H, t), 3,06 (2H, t), 2,94 (2H, t), 2,39 (2H, t), 1,91 (2H, m), 1,24 (3H, t)
Стадия C: этиловый эфир 4-[5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)индолин-1-ил]бутановой кислоты
Этиловый эфир 4-(5-броминдолин-1-ил)бутановой кислоты (0,59 г, 1,88 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,48 г, 70%).
1H-ЯМР (CDCl3) δ 7,55 (1H, dd), 7,49 (1H, m), 6,41 (1H, d), 4,11 (2H, q), 3,40 (2H, t), 3,15 (2H, t), 2,96 (2H, t), 2,39 (2H, t), 1,92 (2H, m), 1,31 (12H, s), 1,25 (3H, t)
Пример получения 96: этиловый эфир 3-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]пропановой кислоты
Стадия A:1-трет-бутоксикарбонилазетидин-3-карбоновая кислота
60 мл THF и 60 мл водного раствора 0,5 М NaOH добавляли к азетидин-3-карбоновой кислоте (3 г, 30 ммоль). Медленно добавляли ди-трет-бутил бикарбонат (6,8 г, 31,1 ммоль), и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционный раствор концентрировали при пониженном давлении. Реакционный раствор подкисляли до pH 4 добавлением воды и водного раствора HCl и экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 с получением целевого соединения (4,5 г, 73%).
1H-ЯМР (CDCl3) δ 4,12 (4H, m), 3,38 (1H, m), 1,44 (9H, s)
Стадия B: этиловый эфир (E)-3-[1-(2,6-дифтор-4-нитро-фенил)азетидин-3-ил]проп-2-еновой кислоты
1-Трет-бутоксикарбонилазетидин-3-карбоновую кислоту (3,5 г, 17,4 ммоль), полученную на Стадии A, последовательно вводили в реакцию таким же образом, как на Стадии A Примера Получения 71, Стадии E Примера Получения 86 и Стадии B Примера Получения 88, с получением целевого соединения (0,5 г, 9%).
1H-ЯМР (CDCl3) δ 7,70 (2H, m), 7,14 (1H, m), 5,93 (1H, d), 4,62 (2H, m), 4,28 (2H, m), 4,22 (2H, q), 3,60 (1H, m), 1,30 (3H, t)
Стадия C: этиловый эфир 3-[1-(4-бром-2,6-дифтор-фенил)азетидин-3-ил]пропановой кислоты
Этиловый эфир (E)-3-[1-(2,6-дифтор-4-нитро-фенил)азетидин-3-ил]проп-2-еновой кислоты (0,66 г, 2,1 ммоль), полученный на Стадии B, последовательно вводили в реакцию таким же образом, как на Стадии C Примера Получения 88 и Стадии C Примера Получения 84, с получением целевого соединения (0,14 г, 19%).
1H-ЯМР (CDCl3) δ 6,88 (2H, m), 4,25 (2H, m), 4,14 (2H, q), 3,78 (2H, m), 2,67 (1H, m), 2,29 (2H, t), 1,96 (2H, m), 1,26 (3H, t)
Стадия D: этиловый эфир 3-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]пропановой кислоты
Этиловый эфир 3-[1-(4-бром-2,6-дифтор-фенил)азетидин-3-ил]пропановой кислоты (0,13 г, 0,38 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,032 г, 21%).
1H-ЯМР (CDCl3) δ 7,15 (2H, m), 4,32 (2H, m), 4,12 (2H, q), 3,85 (2H, m), 2,67 (1H, m), 2,29 (2H, t), 1,97 (2H, m), 1,32 (12H, s), 1,27 (3H, t)
Пример получения 97: метиловый эфир 2-[(3S)-1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты
Стадия A: этиловый эфир 2-[(3S)-1-трет-бутоксикарбонилпирролидин-3-ил]пропандиовой кислоты
Трет-бутиловый эфир (3S)-3-гидроксипирролидин-1-карбоновой кислоты (1,5 г, 8 ммоль) растворяли в 16 мл толуола и охлаждали до -10°C. Медленно добавляли TEA (1,7 мл, 12 ммоль) и метансульфонил хлорид (0,8 мл, 10,1 ммоль). Смесь перемешивали при комнатной температуре в течение 80 минут, и твердые вещества отфильтровывали. Фильтрат промывали водным раствором бикарбоната натрия, высушивали с помощью MgSO4 и концентрировали при пониженном давлении для получения трет-бутилового эфира (3S)-3-метилсульфонилоксипирролидин-1-карбоновой кислоты. 27 мл EtOH и этиловый эфир малоновой кислоты (2,62 г, 16,4 ммоль) получали в другой колбе и добавляли постепенно натрий (0,37 г, 16 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли трет-бутиловый эфир (3S)-3-метилсульфонилоксипирролидин-1-карбоновой кислоты, и смесь перемешивали в течение 16 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры и подкисляли до pH 4 добавлением воды и водного раствора 1Н HCl. Реакционный раствор экстрагировали MTBE с получением целевого соединения (2,08 г, 79%).
1H-ЯМР (CDCl3) δ 4,22 (2H, q), 3,64 (1H, m), 3,50 (1H, m), 3,28 (2H, m), 3,03 (1H, m), 2,81 (1H, m), 2,08 (1H, m), 1,63 (1H, m), 1,45 (9H, s), 1,27 (6H, t)
Стадия B: 2-[(3S)-1-трет-бутоксикарбонилпирролидин-3-ил]пропандиовая кислота
Этиловый эфир 2-[(3S)-1-трет-бутоксикарбонилпирролидин-3-ил]пропандиовой кислоты (2,08 г, 6,3 ммоль), полученный на Стадии A, растворяли в 9 мл THF. Добавляли 44 вес.% водного раствора KOH (5 г, 39 ммоль), и смесь перемешивали при 45°C в течение 24 часов. Реакционный раствор охлаждали до комнатной температуры и промывали MTBE. Водный слой подкисляли до pH 4 и экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 с получением целевого соединения (1,42 г, 83%).
1H-ЯМР (CD3OD) δ 3,63 (1H, m), 3,45 (1H, m), 3,30 (2H, m), 3,05 (1H, m), 2,74 (1H, m), 2,10 (1H, m), 1,71 (1H, m), 1,45 (9H, s)
Стадия C: 2-[(3S)-1-трет-бутоксикарбонилпирролидин-3-ил]уксусная кислота
2-[(3S)-1-трет-бутоксикарбонилпирролидин-3-ил]пропандиовую кислоту (1,42 г, 5,22 ммоль), полученную на Стадии B, растворяли в 15 мл толуола и 0,2 мл DMSO и перемешивали в течение 16 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. После добавления воды реакционный раствор экстрагировали MTBE. Органический слой высушивали с помощью MgSO4 с получением целевого соединения (1,05 г, 87%).
1H-ЯМР (CD3OD) δ 3,58 (1H, m), 3,43 (1H, m), 3,27 (1H, m), 2,93 (1H, m), 2,52 (1H, m), 2,40 (2H, d), 2,08 (1H, m), 1,58 (1H, m), 1,45 (9H, s)
Стадия D: метиловый эфир 2-[(3S)-1-(2,6-дифтор-4-нитро-фенил)пирролидин-3-ил]уксусной кислоты
2-[(3S)-1-трет-бутоксикарбонилпирролидин-3-ил]уксусную кислоту (1,05 г, 4,58 ммоль), полученную на Стадии C, растворяли в 15 мл THF. Добавляли диазометан (раствор Et2O на 0,25 М, 27 мл, 6,87 ммоль), и смесь перемешивали при комнатной температуре в течение 40 минут. Реакционный раствор концентрировали при пониженном давлении. После добавления 15 мл DCM и HCl (раствор 4 М в 1,4-диоксане, 4,6 мл), реакционный раствор перемешивали при комнатной температуре в течение 90 минут. Реакционный раствор концентрировали при пониженном давлении и растворяли в 15 мл DMF. Последовательно добавляли TEA (1,6 мл, 11,5 ммоль) и 3,4,5-трифторнитробензол (0,81 г, 4,58 ммоль), и смесь перемешивали при комнатной температуре в течение 48 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали EtOAc с получением целевого соединения (1,33 г, 97%).
1H-ЯМР (CDCl3) δ 7,72 (2H, m), 3,89 (1H, m), 3,82 (1H, m), 3,76 (1H, m), 3,71 (3H, s), 3,47 (1H, m), 2,63 (1H, m), 2,49 (2H, d), 2,18 (1H, m), 1,64 (1H, m)
Стадия E: метиловый эфир 2-[(3S)-1-(4-бром-2,6-дифтор-фенил)пирролидин-3-ил]уксусной кислоты
Метиловый эфир 2-[(3S)-1-(2,6-дифтор-4-нитро-фенил)пирролидин-3-ил]уксусной кислоты (1,33 г, 4,43 ммоль), полученный на Стадии D, последовательно вводили в реакцию таким же образом, как на Стадиях B и C Примера Получения 84, с получением целевого соединения (0,38 г, 25%).
1H-ЯМР (CDCl3) δ 6,93 (2H, m), 3,69 (3H, s), 3,60 (2H, m), 3,48 (1H, m), 3,24 (1H, m), 2,63 (1H, m), 2,45 (2H, d), 2,13 (1H, m), 1,62 (1H, m)
Стадия F: метиловый эфир 2-[(3S)-1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты
Метиловый эфир 2-[(3S)-1-(4-бром-2,6-дифтор-фенил)пирролидин-3-ил]уксусной кислоты (0,37 г, 1,1 ммоль), полученный на Стадии E, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,18 г, 43%).
1H-ЯМР (CDCl3) δ 7,17 (2H, m), 3,70 (5H, m), 3,59 (1H, m), 3,35 (1H, m), 2,61 (1H, m), 2,46 (2H, m), 2,12 (1H, m), 1,62 (1H, m), 1,31 (12H, s)
Пример получения 98: метиловый эфир 2-[(3R)-1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты
Трет-бутиловый эфир (3R)-3-гидроксипирролидин-1-карбоновой кислоты (1,0 г, 5,34 ммоль) вводили в реакцию таким же образом, как на Стадиях A, B, C, D, E и F Примера Получения 97, с получением целевого соединения (0,14 г, 7%).
1H-ЯМР (CDCl3) δ 7,17 (2H, m), 3,70 (5H, m), 3,59 (1H, m), 3,35 (1H, m), 2,61 (1H, m), 2,46 (2H, m), 2,12 (1H, m), 1,62 (1H, m), 1,31 (12H, s)
Пример получения 99: этиловый эфир 2-[1-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты
Стадия A: 1-(2-фтор-4-нитро-фенил)пиперидин-4-он
1,2-дифтор-4-нитро-бензол (1,50 г, 9,42 ммоль) растворяли в 31 мл DMF. Последовательно добавляли TEA (3,3 мл, 23,5 ммоль) и 4-пиперидон гидрохлорид гидрат (1,52 г, 9,9 ммоль), и смесь перемешивали при комнатной температуре в течение 48 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 с получением целевого соединения (2,03 г, 91%).
1H-ЯМР (CDCl3) δ 8,02 (1H, m), 7,96 (1H, m), 6,98 (1H, t), 3,65 (4H, t), 2,65 (4H, t)
Стадия B: этиловый эфир 2-[1-(2-фтор-4-нитро-фенил)-4-пиперидилиден]уксусной кислоты
1-(2-Фтор-4-нитро-фенил)пиперидин-4-он (2,03 г, 8,55 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера Получения 89, с получением целевого соединения (2,65 г, 99%).
1H-ЯМР (CDCl3) δ 7,95 (1H, m), 7,92 (1H, m), 6,91 (1H, m), 5,76 (1H, s), 4,17 (2H, q), 3,43 (2H, m), 3,38 (2H, m), 3,16 (2H, m), 2,50 (2H, m), 1,30 (3H, t)
Стадия C: Этиловый эфир 2-[1-(4-бром-2-фтор-фенил)-4-пиперидил]уксусной кислоты
Этиловый эфир 2-[1-(2-Фтор-4-нитро-фенил)-4-пиперидилиден]уксусной кислоты (2,65 г, 8,6 ммоль), полученный на Стадии B, последовательно вводили в реакцию таким же образом, как на Стадии C Примера Получения 88 и Стадии C Примера Получения 84, с получением целевого соединения (0,72 г, 24%).
1H-ЯМР (CDCl3) δ 7,15 (2H, m), 6,81 (1H, t), 4,14 (2H, q), 3,38 (2H, m), 2,67 (2H, m), 2,29 (2H, d), 1,92 (1H, m), 1,82 (2H, m), 1,48 (2H, m), 1,26 (3H, t)
Стадия D: этиловый эфир 2-[1-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты
Этиловый эфир 2-[1-(4-бром-2-фтор-фенил)-4-пиперидил]уксусной кислоты (0,22 г, 0,64 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,20 г, 80%).
1H-ЯМР (CDCl3) δ 7,48 (1H, m), 7,41 (1H, m), 6,92 (1H, t), 4,14 (2H, q), 3,52 (2H, m), 2,72 (2H, m), 2,29 (2H, d), 1,94 (1H, m), 1,83 (2H, m), 1,50 (2H, m), 1,32 (12H, s), 1,27 (3H, t)
Пример получения 100: 1-(6-бром-нафталин-2-ил)-этанон
2-бромнафталин (0,5 г, 2,41 ммоль), AlCl3 (0,338 г, 2,53 ммоль) и AcCl (0,172 мл, 2,41 ммоль) растворяли в 3,4 мл нитробензола и перемешивали при 100°C в течение 4 часов при нагревании с обратным холодильником. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,3 г, 49%).
1H-ЯМР (CDCl3) δ 8,43 (1H, s), 8,06 (2H, m), 7,82 (2H, t), 7,63 (1H, m), 2,72 (3H, s).
Пример получения 101: 6-бром-нафталин-2-карбоновая кислота
1-(6-бром-нафталин-2-ил)-этанон (0,22 г, 0,88 ммоль), полученный в Примере Получения 100, растворяли в 3 мл 1,4-диоксана. Добавляли NaOH (0,353 г, 8,8 ммоль), растворенный в 3 мл воды и 9-11% раствора NaOCl (1,67 мл, 2,64 ммоль), и смесь нагревали до 70°C и перемешивали в течение 4 часов. После добавления водного раствора NaHSO3 и воды, реакционный раствор экстрагировали простым эфиром. Добавляли 1Н HCl, и органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,156 г, 70%).
1H-ЯМР (CDCl3) δ 8,56 (1H, s), 8,05 (2H, m), 7,79 (2H, m), 7,58 (1H, m).
Пример получения 102: (6-бром-нафталин-2-ил)-метанол
6-бром-нафталин-2-карбоновую кислоту (0,42 г, 1,67 ммоль), полученную в Примере Получения 101, вводили в реакцию таким же образом, как на Стадии B Примера Получения 31, с получением целевого соединения (0,307 г, 77%).
1H-ЯМР (CDCl3) δ 8,00 (1H, s), 7,83-7,69 (3H, m), 7,57-7,52 (2H, m), 4,85 (2H, m), 1,75 (1H, t).
Пример получения 103: 2-бром-6-хлорметил-нафталин
(6-бром-нафталин-2-ил)-метанол (0,307 г, 1,29 ммоль), полученный в Примере Получения 102, растворяли в 5 мл ацетонитрила. Тионилхлорид (0,188 мл, 2,59 ммоль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционный раствор отгоняли при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (0,248 г, 75%).
1H-ЯМР (CDCl3) δ 8,00 (1H, s), 7,83-7,68 (3H, m), 7,58-7,53 (2H, m), 4,73 (2H, s).
Пример получения 104: диметиловый эфир 2-(6-бром-нафталин-2-илметил)-малоновой кислоты
NaH (60% в масле, 0,058 г, 1,45 ммоль) растворяли в 3 мл DMF. Добавляли диметилмалонат (0,166 мл, 1,45 ммоль), и смесь перемешивали в течение 15 минут. Добавляли 2-бром-6-хлорметил-нафталин (0,248 г, 0,97 ммоль), полученный в Примере Получения 103, и смесь нагревали до 60°C и перемешивали в течение 4 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,26 г, 76%).
1H-ЯМР (CDCl3) δ 7,96 (1H, s), 7,71-7,62 (3H, m), 7,52 (1H, m), 7,36 (1H, m), 3,75 (1H, m), 3,69 (6H, s), 3,87 (2H, d).
Пример получения 105: 3-(6-бром-нафталин-2-ил)-пропионовая кислота
Диметиловый эфир 2-(6-бром-нафталин-2-илметил)-малоновой кислоты (0,26 г, 0,74 ммоль), полученный в Примере Получения 104, растворяли в 12 мл этанола и 12 мл THF. Добавляли 6 мл 4Н KOH, и смесь нагревали до 60°C и перемешивали в течение 1 часа. Реакционный раствор отгоняли при пониженном давлении. Твердые вещества, полученные добавлением 2Н HCl, растворяли в 6 мл пиридина, нагревали до 60°C и перемешивали в течение 1 часа. Реакционный раствор отгоняли при пониженном давлении. После добавления 2Н HCl и воды, реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,055 г, 26%).
1H-ЯМР (CDCl3) δ 7,96 (1H, s), 7,70-7,62 (3H, m), 7,53 (1H, m), 7,36 (1H, m), 3,11 (2H, t), 2,77 (2H, t).
Пример получения 106: метиловый эфир 3-(6-бром-нафталин-2-ил)пропионовой кислоты
3-(6-бром-нафталин-2-ил)-пропионовую кислоту (0,055 г, 0,2 ммоль), полученную в Примере Получения 105, вводили в реакцию таким же образом, как на Стадии G Примера Получения 81, с получением целевого соединения (0,052 г, 91%).
1H-ЯМР (CDCl3) δ 7,96 (1H, s), 7,70-7,61 (3H, m), 7,53 (1H, m), 7,36 (1H, m), 3,67 (3H, s), 3,10 (2H, t), 2,72 (2H, t).
Пример получения 107: метиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-ил]пропионовой кислоты
Метиловый эфир 3-(6-бром-нафталин-2-ил)пропионовой кислоты (0,085 г, 0,29 ммоль), полученный в Примере Получения 106, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,083 г, 84%).
1H-ЯМР (CDCl3) δ 8,32 (1H, s), 7,80 (2H, d), 7,75 (1H, d), 7,62 (1H, s), 7,32 (1H, d), 3,67 (3H, s), 3,12 (2H, t), 2,73 (2H, t), 1,39 (12H, s).
Пример получения 108: метиловый эфир 6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-карбоновой кислоты
Метиловый эфир 6-бром-нафталин-2-карбоновой кислоты (1 г, 3,77 ммоль) вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,824 г, 70%).
1H-ЯМР (CDCl3) δ 8,59 (1H, s), 8,39 (1H, s), 8,05 (1H, d), 7,92 (3H, m), 3,98 (3H, s), 1,40 (12H, s).
Пример получения 109: метиловый эфир 6-(6-фенокси-пиридин-2-ил)-нафталин-2-карбоновой кислоты
Метиловый эфир 6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-карбоновой кислоты (0,2 г, 0,64 ммоль), полученный в Примере Получения 108, и 2-хлор-6-фенокси-пиридин (0,132 г, 0,64 ммоль), полученный в Примере Получения 54, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,17 г, 74%).
1H-ЯМР (CDCl3) δ 8,58 (1H, s), 8,45 (1H, s), 8,06 (2H, m), 7,93 (2H, m), 7,78 (1H, t), 7,63 (1H, d), 7,44 (2H, m), 7,24 (3H, m), 6,82 (1H, d), 3,98 (3H, s).
Пример получения 110: диметиловый эфир 2-[6-(6-фенокси-пиридин-2-ил)-нафталин-2-илметил]-малоновой кислоты
Метиловый эфир 6-(6-Фенокси-пиридин-2-ил)-нафталин-2-карбоновой кислоты (0,17 г, 0,48 ммоль), полученный в Примере Получения 109, последовательно вводили в реакцию таким же образом, как в Примерах Получения 102, 103 и 104, с получением целевого соединения (0,125 г, 59%).
1H-ЯМР (CDCl3) δ 8,39 (1H, s), 8,02 (1H, m), 7,82-7,74 (3H, m), 7,61 (2H, m), 7,43 (2H, m), 7,32 (1H, m), 7,23 (3H, m), 6,78 (1H, d), 3,78 (1H, t), 3,69 (6H, s), 3,38 (2H, d).
Пример получения 111: метиловый эфир 6-(2-фенокси-фенил)-нафталин-2-карбоновой кислоты
Метиловый эфир 6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-карбоновой кислоты (0,62 г, 2,34 ммоль), полученный в Примере Получения 108, и 2-феноксифенилбороновую кислоту (0,5 г, 2,34 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,8 г, 96%).
1H-ЯМР (CDCl3) δ 8,57 (1H, s), 8,03 (2H, m), 7,92 (1H, d), 7,86 (1H, d), 7,77 (1H, m), 7,56 (1H, m), 7,35 (1H, m), 7,24 (3H, m), 7,05 (2H, m), 6,94 (2H, m), 3,98 (3H, s).
Пример получения 112: диметиловый эфир 2-[6-(2-фенокси-фенил)-нафталин-2-илметил]-малоновой кислоты
Метиловый эфир 6-(2-фенокси-фенил)-нафталин-2-карбоновой кислоты (0,8 г, 2,26 ммоль), полученный в Примере Получения 111, последовательно вводили в реакцию таким же образом, как в Примерах Получения 102, 103 и 104, с получением целевого соединения (0,64 г, 64%).
1H-ЯМР (CDCl3) δ 7,95 (1H, s), 7,74 (2H, m), 7,68 (1H, m), 7,61 (1H, m), 7,55 (1H, m), 7,32 (2H, m), 7,25 (3H, m), 7,04 (2H, m), 6,94 (2H, m), 3,79 (1H, m), 3,68 (6H, s), 3,38 (2H, d).
Пример получения 113: метиловый эфир 6-(6-циклопентилсульфанил-пиридин-2-ил)-нафталин-2-карбоновой кислоты
метиловый эфир 6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-карбоновой кислоты (0,2 г, 0,64 ммоль), полученный в Примере Получения 108, и 2-хлор-6-циклопентилсульфанил-пиридин (0,136 г, 0,64 ммоль), полученный в Примере Получения 14, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,03 г, 13%).
1H-ЯМР (CDCl3) δ 8,62 (1H, s), 8,52 (1H, s), 8,25 (1H, m), 8,08 (1H, m), 8,03 (1H, d), 7,97 (1H, d), 7,58 (2H, m), 7,15 (1H, m), 4,25 (1H, m), 4,00 (3H, s), 2,30 (2H, m), 1,84-1,73 (6H, m).
Пример получения 114: диметиловый эфир 2-[6-(6-циклопентилсульфанил-пиридин-2-ил)-нафталин-2-илметил]-малоновой кислоты
Метиловый эфир 6-(6-циклопентилсульфанил-пиридин-2-ил)-нафталин-2-карбоновой кислоты (0,03 г, 0,08 ммоль), полученный в Примере Получения 113, последовательно вводили в реакцию таким же образом, как в Примерах Получения 102, 103 и 104, с получением целевого соединения (0,019 г, 51%).
1H-ЯМР (CDCl3) δ 8,45 (1H, s), 8,16 (1H, m), 7,86 (2H, m), 7,68 (1H, s), 7,55 (2H, m), 7,35 (1H, m), 7,13 (1H, m), 4,25 (1H, m), 3,80 (1H, t), 3,70 (6H, s), 3,41 (2H, d), 2,31 (2H, m), 1,73-1,60 (6H, m).
Пример получения 115: метиловый эфир 6-(2-фенокси-пиридин-3-ил)-нафталин-2-карбоновой кислоты
Стадия A: 3-хлор-2-фенокси-пиридин
2,3-дихлор-пиридин (0,3 г, 2,03 ммоль), фенол (0,286 г, 3,04 ммоль), медь (0,257 г, 4,05 ммоль) и Cs2CO3 (1,98 г, 6,08 ммоль) вводили в реакцию таким же образом, как в Примере Получения 17, с получением целевого соединения (0,193 г, 77%).
Стадия B: метиловый эфир 6-(2-фенокси-пиридин-3-ил)-нафталин-2-карбоновой кислоты
Метиловый эфир 6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-карбоновой кислоты (0,242 г, 0,78 ммоль), полученный в Примере Получения 108, и 3-хлор-2-фенокси-пиридин (0,16 г, 0,78 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,06 г, 22%).
1H-ЯМР (CDCl3) δ 8,63 (1H, s), 8,20 (1H, m), 8,12 (1H, s), 8,08 (1H, m), 7,92 (1H, m), 7,86 (2H, m), 7,39 (2H, m), 7,20-7,13 (4H, m), 6,80 (1H, m), 4,00 (3H, s).
Пример получения 116: [6-(2-фенокси-пиридин-3-ил)-нафталин-2-ил]-метанол
Метиловый эфир 6-(2-Фенокси-пиридин-3-ил)-нафталин-2-карбоновой кислоты (0,06 г, 0,17 ммоль), полученный в Примере Получения 115, вводили в реакцию таким же образом, как на Стадии B Примера Получения 31, с получением целевого соединения (0,024 г, 43%).
1H-ЯМР (CDCl3) δ 8,18 (1H, m), 8,08 (1H, s), 7,88 (3H, m), 7,82 (2H, m), 7,51 (1H, d), 7,38 (2H, t), 7,19-7,12 (4H, m), 4,87 (2H, d), 1,78 (1H, t).
Пример получения 117: метиловый эфир 6-(3-фенокси-фенил)-нафталин-2-карбоновой кислоты
Метиловый эфир 6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-карбоновой кислоты (0,125 г, 0,40 ммоль), полученный в Примере Получения 108, и 1-бром-3-фенокси-бензол (0,1 г, 0,40 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,032 г, 22%).
1H-ЯМР (CDCl3) δ 8,62 (1H, s), 8,09-8,00 (3H, m), 7,92 (1H, d), 7,76 (1H, m), 7,46 (2H, m), 7,37 (3H, m), 7,10 (4H, m), 3,99 (3H, s).
Пример получения 118: [6-(3-фенокси-фенил)-нафталин-2-ил]-метанол
Метиловый эфир 6-(3-фенокси-фенил)-нафталин-2-карбоновой кислоты (0,032 г, 0,09 ммоль), полученный в Примере Получения 117, вводили в реакцию таким же образом, как на Стадии B Примера Получения 31, с получением целевого соединения (0,029 г, 98%).
1H-ЯМР (CDCl3) δ 8,01 (1H, s), 7,88 (3H, m), 7,71 (1H, m), 7,52-7,34 (6H, m), 7,14-7,03 (4H, m), 4,88 (2H, d), 1,75 (1H, t).
Пример получения 119: метиловый эфир 6-(3-изопропокси-фенил)-нафталин-2-карбоновой кислоты
Стадия A: 1-бром-3-изопропокси-бензол
3-бром-фенол (0,2 г, 1,16 ммоль) и 2-бром-пропана(0,163 мл, 1,73 ммоль) вводили в реакцию таким же образом, как в Примере Получения 17, с получением целевого соединения (0,193 г, 77%).
Стадия B: метиловый эфир 6-(3-изопропокси-фенил)-нафталин-2-карбоновой кислоты
Метиловый эфир 6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-карбоновой кислоты (0,280 г, 0,89 ммоль), полученный в Примере Получения 108, и 1-бром-3-изопропокси-бензол (0,193 г, 1,39 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,078 г, 27%).
1H-ЯМР (CDCl3) δ 8,63 (1H, s), 8,10-8,00 (3H, m), 7,92 (1H, m), 7,80 (1H, m), 7,39 (1H, m), 7,26 (2H, m), 6,93 (1H, m), 4,66 (1H, m), 3,99 (3H, s), 1,39 (6H, d).
Пример получения 120: [6-(3-изопропокси-фенил)-нафталин-2-ил]-метанол
Метиловый эфир 6-(3-изопропокси-фенил)-нафталин-2-карбоновой кислоты (0,305 г, 0,9 ммоль), полученный в Примере Получения 119, вводили в реакцию таким же образом, как на Стадии B Примера Получения 31, с получением целевого соединения (0,196 г, 70%).
1H-ЯМР (CDCl3) δ 8,03 (1H, s), 7,88 (3H, m), 7,73 (1H, m), 7,50 (1H, m), 7,36 (1H, m), 7,26 (2H, m), 6,91 (1H, m), 4,88 (2H, d), 4,66 (1H, m), 1,77 (1H, t), 1,39 (6H, d).
Пример получения 121: метиловый эфир 6-(3-циклобутокси-фенил)-нафталин-2-карбоновой кислоты
Стадия A: 1-бром-3-циклобутокси-бензол
3-бром-фенол (0,2 г, 1,16 ммоль) и бромциклобутан (0,163 мл, 1,73 ммоль) вводили в реакцию таким же образом, как в Примере Получения 17, с получением целевого соединения (0,262 г, 100%).
Стадия B: метиловый эфир 6-(3-циклобутокси-фенил)-нафталин-2-карбоновой кислоты
Метиловый эфир 6-(4,4,5,5-тетраметил-[1,3,2]диоксоборолан-2-ил)-нафталин-2-карбоновой кислоты (0,435 г, 1,39 ммоль), полученный в Примере Получения 108, и 1-бром-3-циклобутокси-бензол (0,317 г, 1,39 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,305 г, 65%).
1H-ЯМР (CDCl3) δ 8,63 (1H, s), 8,10-8,00 (3H, m), 7,92 (1H, m), 7,79 (1H, m), 7,38 (1H, m), 7,26 (1H, m), 7,17 (1H, s), 6,86 (1H, m), 4,74 (1H, m), 3,99 (3H, s), 2,50 (2H, m), 2,24 (2H, m), 1,90 (1H, m), 1,72 (1H, m).
Пример получения 122: [6-(3-циклобутокси-фенил)-нафталин-2-ил]-метанол
Метиловый эфир 6-(3-циклобутокси-фенил)-нафталин-2-карбоновой кислоты (0,305 г, 0,9 ммоль), полученный в Примере Получения 121, вводили в реакцию таким же образом, как на Стадии B Примера Получения 31, с получением целевого соединения (0,196 г, 70%).
1H-ЯМР (CDCl3) δ 8,02 (1H, s), 7,88 (3H, m), 7,74 (1H, m), 7,50 (1H, m), 7,36 (1H, m), 7,26 (1H, m), 7,17 (1H, s), 6,83 (1H, m), 4,88 (2H, d), 4,74 (1H, m), 2,50 (2H, m), 2,23 (2H, m), 1,90 (1H, m), 1,73 (2H, m).
Пример получения 123: метиловый эфир 6-(6-циклобутокси-пиридин-2-ил)-нафталин-2-карбоновой кислоты
Метиловый эфир 6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-карбоновой кислоты (0,39 г, 1,25 ммоль), полученный в Примере Получения 108, и 2-хлор-6-циклобутокси-пиридин (0,23 г, 1,25 ммоль), полученный в Примере Получения 29, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,21 г, 50%).
1H-ЯМР (CDCl3) δ 8,62 (1H, s), 8,51 (1H, s), 8,22 (1H, m), 8,10-7,91 (3H, m), 7,68 (1H, t), 7,48 (1H, m), 6,70 (1H, d), 5,35 (1H, m), 3,98 (3H, s), 2,60 (2H, m), 2,24 (2H, m), 1,89 (1H, m), 1,76 (1H, m).
Пример получения 124: [6-(6-циклобутокси-пиридин-2-ил)-нафталин-2-ил]-метанол
Метиловый эфир 6-(6-циклобутокси-пиридин-2-ил)-нафталин-2-карбоновой кислоты (0,21 г, 0,6 ммоль), полученный в Примере Получения 123, вводили в реакцию таким же образом, как на Стадии B Примера Получения 31, с получением целевого соединения (0,155 г, 80%).
1H-ЯМР (CDCl3) δ 8,47 (1H, s), 8,17 (1H, m), 7,93 (2H, m), 7,84 (1H, s), 7,66 (1H, t), 7,48 (2H, m), 6,67 (1H, d), 5,35 (1H, m), 4,89 (2H, d), 2,57 (2H, m), 2,24 (2H, m), 1,89 (1H, m), 1,78 (2H, m).
Пример получения 125: метиловый эфир 6-(2-изопропокси-пиридин-3-ил)-нафталин-2-карбоновой кислоты
Метиловый эфир 6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-карбоновой кислоты (0,144 г, 0,46 ммоль), полученный в Примере Получения 108, и 3-йод-2-изопропокси-пиридин (0,124 г, 0,46 ммоль), полученный в Примере Получения 34, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,092 г, 62%).
1H-ЯМР (CDCl3) δ 8,62 (1H, s), 8,18 (1H, m), 8,06 (2H, m), 7,97 (1H, d), 7,89 (1H, d), 7,80 (1H, m), 7,72 (1H, m), 6,97 (1H, m), 5,45 (1H, m), 3,99 (3H, s), 1,36 (6H, d).
Пример получения 126: метиловый эфир 6-(2-циклопентилокси-пиридин-3-ил)-нафталин-2-карбоновой кислоты
Метиловый эфир 6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-карбоновой кислоты (0,223 г, 0,7 ммоль), полученный в Примере Получения 108, и 2-циклопентилокси-3-йод-пиридин (0,207 г, 0,7 ммоль), полученный в Примере Получения 11, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,123 г, 49%).
1H-ЯМР (CDCl3) δ 8,62 (1H, s), 8,19 (1H, m), 8,08 (1H, m), 8,03 (1H, s), 7,96 (1H, d), 7,89 (1H, d), 7,77 (1H, m), 7,73 (1H, m), 6,97 (1H, m), 5,57 (1H, m), 4,00 (3H, s), 1,95 (2H, m), 1,85 (2H, m), 1,73 (2H, m), 1,63 (2H, m).
Пример получения 127: 2-хлор-6-(2-фторфенокси)-пиридин
2,6-дихлорпиридин (0,2 г, 1,35 ммоль) и 2-фтор-фенол (0,151 г, 1,35 ммоль) вводили в реакцию таким же образом, как в Примере Получения 12, с получением целевого соединения (0,045 г, 15%).
1H-ЯМР (CDCl3) δ 7,64 (1H, m), 7,27 (2H, m), 7,20 (2H, m), 7,05 (1H, d), 6,85 (1H, d).
Пример получения 128: метиловый эфир 3-[6-(2-бромфенил)-нафталин-2-ил]пропионовой кислоты
Метиловый эфир 3-(6-бром-нафталин-2-ил)пропионовой кислоты (0,1 г, 0,34 ммоль), полученный в Примере Получения 106, и 2-бромфенилбороновую кислоту (0,068 г, 0,34 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,012 г, 9%).
1H-ЯМР (CDCl3) δ 7,81-7,23 (9H, m), 7,10 (1H, m), 3,70 (3H, s), 3,07 (2H, t), 2,72 (2H, t).
Пример получения 129: метиловый эфир 3-{6-[2-(2-фторфенокси)-фенил]-нафталин-2-ил}-пропионовой кислоты
Метиловый эфир 3-[6-(2-бромфенил)-нафталин-2-ил]пропионовой кислоты (0,012 г, 0,03 ммоль), полученный в Примере Получения 128, растворяли в 1 мл 1,4-диоксана. Добавляли CuI (0,001 г, 0,006 ммоль), Cs2CO3 (0,021 г, 0,06 ммоль) и 2-фторфенол (0,006 мл, 0,06 ммоль), и смесь перемешивали в течение 18 часов при нагревании с обратным холодильником. Реакционный раствор фильтровали через Целит и очищали колоночной хроматографией с получением целевого соединения (0,012 г, 92%).
1H-ЯМР (CDCl3) δ 7,82-7,35 (4H, m), 7,20-7,04 (8H, m), 6,80 (2H, m) 3,67 (3H, s), 3,06 (2H, t), 2,70 (2H, t).
Пример получения 130: этиловый эфир 2-(4-бромфенил)-2-метилпропионовой кислоты
Этиловый эфир (4-бромфенил)-уксусной кислоты (0,1 г, 0,41 ммоль) растворяли в 1 мл THF. Добавляли t-BuOK (0,092 г, 0,82 ммоль), и йодметан (0,051 мл, 0,82 ммоль) добавляли при 0°C. Смесь перемешивали при комнатной температуре в течение 18 часов. После добавления 1Н HCl и воды, реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,047 г, 42%).
1H-ЯМР (CDCl3) δ 7,42 (2H, d), 7,21 (2H, d), 4,11 (2H, q), 1,54 (6H, s), 1,18 (3H, t).
Пример получения 131: 2-(4-бромфенил)-2-метил-пропан-1-ол
Этиловый эфир 2-(4-бромфенил)-2-метилпропионовой кислоты (0,236 г, 0,87 ммоль), полученный в Примере Получения 130, вводили в реакцию таким же образом, как на Стадии B Примера Получения 31, с получением целевого соединения (0,17 г, 85%).
1H-ЯМР (CDCl3) δ 7,45 (2H, d), 7,26 (2H, d), 3,61 (2H, d), 1,55 (1H, m), 1,31 (6H, s).
Пример получения 132: 2-(4-бромфенил)-2-метил-пропиональдегид
2-(4-бромфенил)-2-метил-пропан-1-ол (0,17 г, 0,74 ммоль), полученный в Примере Получения 131, растворяли в 2,5 мл MC и 0,5 мл DMSO. IBX (0,249 г, 0,89 ммоль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 4 часов. После добавления воды реакционный раствор экстрагировали MC. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,052 г, 30%).
1H-ЯМР (CDCl3) δ 9,46 (1H, s), 7,50 (2H, d), 7,13 (2H, d), 1,44 (6H, s)
Пример получения 133: 3-(4-бромфенил)-3-метил-масляный альдегид
2-(4-бромфенил)-2-метил-пропиональдегид (0,33 г, 1,45 ммоль), полученный в Примере Получения 132, вводили в реакцию таким же образом, как в Примере Получения 152, с получением целевого соединения (0,275 г, 78%).
1H-ЯМР (CDCl3) δ 9,52 (1H, m), 7,45 (2H, d), 7,24 (2H, d), 2,66 (2H, m), 1,44 (6H, s).
Пример получения 134: этиловый эфир (E)-5-(4-бромфенил)-5-метил-гекс-2-еновой кислоты
3-(4-бромфенил)-3-метил-масляный альдегид (0,275 г, 1,14 ммоль), полученный в Примере Получения 133, вводили в реакцию таким же образом, как на Стадии A Примера Получения 85, с получением целевого соединения (0,348 г, 98%).
1H-ЯМР (CDCl3) δ 7,42 (2H, d), 7,19 (2H, d), 6,69 (1H, m), 5,74 (1H, d), 4,15 (2H, q), 2,48 (2H, d), 1,32 (6H, s), 1,25 (3H, t).
Пример получения 135: этиловый эфир (E)-5-метил-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гекс-2-еновой кислоты
Этиловый эфир (E)-5-(4-бромфенил)-5-метил-гекс-2-еновой кислоты (0,348 г, 1,12 ммоль), полученный в Примере Получения 134, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,291 г, 72%).
1H-ЯМР (CDCl3) δ 7,75 (2H, d), 7,34 (2H, d), 6,70 (1H, m), 5,76 (1H, d), 4,12 (2H, q), 2,50 (2H, d), 1,33 (18H, s), 1,24 (3H, t).
Пример получения 136: этиловый эфир 5-метил-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гексановой кислоты
Этиловый эфир (E)-5-метил-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гекс-2-еновой кислоты (0,291 г, 0,81 ммоль), полученный в Примере Получения 135, вводили в реакцию таким же образом, как на Стадии E Примера Получения 1 с получением целевого соединения (0,248 г, 84%).
1H-ЯМР (CDCl3) δ 7,75 (2H, d), 7,33 (2H, d), 4,08 (2H, q), 2,17 (2H, t), 1,65 (2H, m), 1,35 (20-й, m), 1,22 (3H, t).
Пример получения 137: 2-(4-бром-2-фтор-фенил)-2-метил-пропионитрил
Стадия A: (4-бром-2-фтор-фенил)-ацетонитрил
4-бром-1-бромметил-2-фтор-бензол (0,5 г, 1,87 ммоль) вводили в реакцию таким же образом, как в Примере Получения 149, с получением целевого соединения (0,386 г, 96%).
Стадия B: 2-(4-бром-2-фтор-фенил)-2-метил-пропионитрил
(4-бром-2-фтор-фенил)-ацетонитрил (0,24 г, 1,12 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как в Примере Получения 143, с получением целевого соединения (0,235 г, 86%).
1H-ЯМР (CDCl3) δ 7,40-7,26 (3H, m), 1,78 (6H, s).
Пример получения 138: 2-(4-бром-2-фтор-фенил)-2-метил-пропиональдегид
2-(4-бром-2-фтор-фенил)-2-метил-пропионитрил (0,235 г, 0,97 ммоль), полученный в Примере Получения 137, вводили в реакцию таким же образом, как в Примере Получения 151, с получением целевого соединения (0,2 г, 84%).
1H-ЯМР (CDCl3) δ 9,61 (1H, m), 7,34 (1H, m), 7,26 (1H, m), 7,16 (1H, t), 1,44 (6H, s).
Пример получения 139: 3-(4-бром-2-фтор-фенил)-3-метил-масляный альдегид
2-(4-бром-2-фтор-фенил)-2-метил-пропиональдегид (0,2 г, 0,82 ммоль), полученный в Примере Получения 138, вводили в реакцию таким же образом, как в Примере Получения 152, с получением целевого соединения (0,067 г, 31%).
1H-ЯМР (CDCl3) δ 9,51 (1H, t), 7,25-7,16 (3H, m), 2,81 (2H, s), 1,43 (6H, s).
Пример получения 140: этиловый эфир (E)-5-(4-бром-2-фтор-фенил)-5-метил-гекс-2-еновой кислоты
3-(4-бром-2-фтор-фенил)-3-метил-масляный альдегид (0,067 г, 0,26 ммоль), полученный в Примере Получения 139, вводили в реакцию таким же образом, как на Стадии A Примера Получения 85, с получением целевого соединения (0,072 г, 84%).
1H-ЯМР (CDCl3) δ 7,20 (2H, m), 7,08 (1H, t), 6,66 (1H, m), 5,79 (1H, d), 4,14 (2H, q), 2,62 (2H, d), 1,37 (6H, s), 1,25 (3H, t).
Пример получения 141: этиловый эфир (E)-5-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-5-метил-гекс-2-еновой кислоты
Этиловый эфир (E)-5-(4-бром-2-фтор-фенил)-5-метил-гекс-2-еновой кислоты (0,072 г, 0,22 ммоль), полученный в Примере Получения 140, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,045 г, 54%).
1H-ЯМР (CDCl3) δ 7,47 (1H, d), 7,42 (1H, d), 7,23 (1H, t), 6,66 (1H, m), 5,75 (1H, d), 4,11 (2H, q), 2,65 (2H, d), 1,32 (18H, s), 1,23 (3H, t).
Пример получения 142: этиловый эфир 5-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-5-метил-гексановой кислоты
Этиловый эфир (E)-5-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-5-метил-гекс-2-еновой кислоты (0,045 г, 0,12 ммоль), полученный в Примере Получения 141, вводили в реакцию таким же образом, как на Стадии E Примера Получения 1, с получением целевого соединения (0,02 г, 44%).
1H-ЯМР (CDCl3) δ 7,47 (1H, d), 7,38 (1H, d), 7,23 (1H, t), 4,06 (2H, q), 2,19 (2H, t), 1,75 (2H, m), 1,35 (20-й, m), 1,21 (3H, t).
Пример получения 143: 2-(4-бром-2,6-дифтор-фенил)-2-метил-пропионитрил
(4-бром-2,6-дифтор-фенил)-ацетонитрил (0,4 г, 1,72 ммоль), полученный в Примере Получения 149, растворяли в 2 мл DMF и 2 мл THF. NaH (60% в масле, 0,152 г, 3,79 ммоль) и йодметан (0,236 мл, 3,79 ммоль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 3 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,372 г, 83%).
1H-ЯМР (CDCl3) δ 7,12 (2H, m), 1,86 (6H, s).
Пример получения 144: 2-(4-бром-2,6-дифтор-фенил)-2-метил-пропиональдегид
2-(4-бром-2,6-дифтор-фенил)-2-метил-пропионитрил (0,372 г, 1,43 ммоль), полученный в Примере Получения 143, вводили в реакцию таким же образом, как в Примере Получения 151, с получением целевого соединения (0,328 г, 87%).
1H-ЯМР (CDCl3) δ 9,60 (1H, m), 7,08 (2H, m), 1,50 (6H, s).
Пример получения 145: 3-(4-бром-2,6-дифтор-фенил)-3-метил-масляный альдегид
2-(4-бром-2,6-дифтор-фенил)-2-метил-пропиональдегид (0,328 г, 1,25 ммоль), полученный в Примере Получения 144, вводили в реакцию таким же образом, как в Примере Получения 152, с получением целевого соединения (0,16 г, 46%).
1H-ЯМР (CDCl3) δ 9,61 (1H, s), 7,01 (2H, m), 2,86 (2H, s), 1,54 (6H, s).
Пример получения 146: этиловый эфир (E)-5-(4-бром-2,6-дифтор-фенил)-5-метил-гекс-2-еновой кислоты
3-(4-бром-2,6-дифтор-фенил)-3-метил-масляный альдегид (0,16 г, 0,58 ммоль), полученный в Примере Получения 145, вводили в реакцию таким же образом, как на Стадии A Примера Получения 85, с получением целевого соединения (0,17 г, 85%).
1H-ЯМР (CDCl3) δ 6,98 (2H, m), 6,74 (1H, m), 5,78 (1H, d), 4,14 (2H, q), 2,64 (2H, d), 1,46 (6H, s), 1,25 (3H, t).
Пример получения 147: этиловый эфир 5-(4-бром-2,6-дифтор-фенил)-5-метил-гексановой кислоты
Этиловый эфир (E)-5-(4-бром-2,6-дифтор-фенил)-5-метил-гекс-2-еновой кислоты (0,17 г, 0,49 ммоль), полученный в Примере Получения 146, вводили в реакцию таким же образом, как в Примере Получения 174, с получением целевого соединения (0,15 г, 87%).
1H-ЯМР (CDCl3) δ 6,96 (2H, m), 4,08 (2H, q), 2,23 (2H, t), 1,72 (2H, m), 1,43 (8H, m), 1,22 (3H, t).
Пример получения 148: этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-5-метил-гексановой кислоты
Этиловый эфир 5-(4-бром-2,6-дифтор-фенил)-5-метил-гексановой кислоты (0,15 г, 0,43 ммоль), полученный в Примере Получения 147, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,07 г, 41%).
1H-ЯМР (CDCl3) δ 7,20 (2H, m), 4,08 (2H, q), 2,21 (2H, t), 1,75 (2H, m), 1,46 (8H, m), 1,32 (12H, s), 1,21 (3H, t).
Пример получения 149: (4-бром-2,6-дифтор-фенил)-ацетонитрил
5-бром-2-бромметил-1,3-дифтор-бензол (1,1 г, 3,85 ммоль) растворяли в 6 мл этанола и 2 мл воды. Добавляли KCN (0,268 г, 4,12 ммоль) и нагревали до 60°C, и смесь перемешивали в течение 2 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,8 г, 89%).
1H-ЯМР (CDCl3) δ 7,17 (2H, m), 3,69 (2H, s).
Пример получения 150: 1-(4-бром-2,6-дифтор-фенил)-циклопропанкарбонитрил
(4-бром-2,6-дифтор-фенил)-ацетонитрил (0,4 г, 1,72 ммоль), полученный в Примере Получения 149, растворяли в 1 мл толуола и 1,7 мл 50% водного раствора NaOH. 1-бром-2-хлорэтан (0,287 мл, 3,44 ммоль) и бензилтриэтиламмоний хлорид (0,098 г, 0,43 ммоль) добавляли при 0°C, смесь нагревали до 40°C и перемешивали в течение 18 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,27 г, 60%).
1H-ЯМР (CDCl3) δ 7,12 (2H, m), 1,76 (2H, m), 1,36 (2H, m).
Пример получения 151: 1-(4-бром-2,6-дифтор-фенил)-циклопропанкарбальдегид
1-(4-бром-2,6-дифтор-фенил)-циклопропанкарбонитрил (0,270 г, 1,05 ммоль), полученный в Примере Получения 150, растворяли в 5 мл MC. DIBAL-H (0,77 мл, 1,15 ммоль) добавляли при -78°C, и смесь перемешивали в течение 2 часов и дополнительно перемешивали при комнатной температуре в течение 1 часа. После добавления 1Н HCl и водного раствора тартрата KNa, реакционный раствор экстрагировали MC. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,216 г, 79%).
1H-ЯМР (CDCl3) δ 8,83 (1H, s), 7,10 (2H, m), 1,70 (2H, m), 1,46 (2H, m).
Пример получения 152: [1-(4-бром-2,6-дифтор-фенил)-циклопропил]-ацетальдегид
(Метоксиметил)трифенилфосфоний хлорид (0,425 г, 1,24 ммоль) растворяли в 3 мл THF. LiHMDS (1,24 мл, 1,24 ммоль) добавляли при 0°C, и смесь перемешивали в течение 15 минут. 1-(4-бром-2,6-дифтор-фенил)-циклопропанкарбальдегид (0,216 г, 0,83 ммоль), полученный в Примере Получения 151, добавляли при 0 °C, и смесь перемешивали при комнатной температуре в течение 18 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией. Очищенный органический слой растворяли в 2Н HCl (0,2 М) и THF (0,1 М) и нагревали до 70°C, смесь перемешивали в течение 18 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,375 г, 84%).
1H-ЯМР (CDCl3) δ 9,77 (1H, s), 7,02 (2H, m), 2,49 (2H, d), 0,99 (4H, m).
Пример получения 153: этиловый эфир (E)-4-[1-(4-бром-2,6-дифтор-фенил)-циклопропил]-бут-2-еновой кислоты
[1-(4-бром-2,6-дифтор-фенил)-циклопропил]-ацетальдегид (0,375 г, 1,36 ммоль), полученный в Примере Получения 152, вводили в реакцию таким же образом, как на Стадии A Примера Получения 85, с получением целевого соединения (0,443 г, 94%).
1H-ЯМР (CDCl3) δ 7,00 (2H, m), 6,90 (1H, m), 5,72 (1H, d), 4,15 (2H, q), 2,37 (2H, d), 1,27 (3H, t), 0,87 (4H, m).
Пример получения 154: этиловый эфир 4-[1-(4-бром-2,6-дифтор-фенил)-циклопропил]-масляной кислоты
Этиловый эфир (E)-4-[1-(4-бром-2,6-дифтор-фенил)-циклопропил]-бут-2-еновой кислоты (0,443 г, 1,28 ммоль), полученный в Примере Получения 153, вводили в реакцию таким же образом, как в Примере Получения 174, с получением целевого соединения (0,414 г, 93%).
1H-ЯМР (CDCl3) δ 7,02 (2H, m), 4,10 (2H, q), 2,26 (2H, t), 1,63 (2H, m), 1,50 (2H, m), 1,24 (3H, t), 0,79 (4H, s).
Пример получения 155: этиловый эфир 4-{1-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-масляной кислоты
Этиловый эфир 4-[1-(4-бром-2,6-дифтор-фенил)-циклопропил]-масляной кислоты (0,414 г, 1,19 ммоль), полученный в Примере Получения 154, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,322 г, 70%).
1H-ЯМР (CDCl3) δ 7,20 (2H, m), 4,08 (2H, q), 2,24 (2H, t), 1,62 (2H, m), 1,54 (2H, m), 1,32 (12H, s), 1,20 (3H, t), 0,80 (4H, m).
Пример получения 156: 1-бром-4-(2-бром-1,1-дифтор-этил)-бензол
2-бром-1-(4-бромфенил)-этанон (0,5 г, 1,8 ммоль) растворяли в 4 мл MC. DAST (трифторид диэтиламиносеры, 0,58 г, 3,6 ммоль) добавляли в 0°C, и смесь перемешивали при 0°C в течение 1 часа при комнатной температуре в течение 2 часов и при 40°C в течение 4 часов. После добавления воды реакционный раствор экстрагировали MC. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,345 г, 64%).
1H-ЯМР (CDCl3) δ 7,60 (2H, d), 7,38 (2H, d), 3,72 (2H, t).
Пример получения 157: 2-(4-бромфенил)-2,2-дифтор-этиловый эфир уксусной кислоты
1-бром-4-(2-бром-1,1-дифтор-этил)-бензол (0,324 г, 1,08 ммоль), полученный в Примере Получения 156, растворяли в 4 мл DMF. KOAc (0,424 г, 4,32 ммоль) и 18-crown-6 (0,028 г, 0,11 ммоль) добавляли и нагревали до 80°C, и смесь перемешивали в течение 18 часов. После добавления воды реакционный раствор экстрагировали простым эфиром. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,216 г, 71%).
1H-ЯМР (CDCl3) δ 7,59 (2H, d), 7,38 (2H, d), 4,44 (2H, t), 2,06 (3H, s).
Пример получения 158: 2-(4-бромфенил)-2,2-дифтор-этанол
2-(4-бромфенил)-2,2-дифтор-этиловый эфир уксусной кислоты (0,21 г, 0,77 ммоль), полученный в Примере Получения 157, растворяли в 4 мл этанола и 1 мл воды. Добавляли NaOH (0,062 г, 1,55 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,176 г, 96%).
1H-ЯМР (CDCl3) δ 7,59 (2H, d), 7,40 (2H, d), 3,96 (2H, m), 1,87 (1H, m).
Пример получения 159: этиловый эфир [2-(4-бромфенил)-2,2-дифтор-этокси]-уксусной кислоты
2-(4-бромфенил)-2,2-дифтор-этанол (0,24 г, 1,01 ммоль), полученный в Примере Получения 158, вводили в реакцию таким же образом, как в Примере Получения 164, с получением целевого соединения (0,24 г, 70%).
1H-ЯМР (CDCl3) δ 7,57 (2H, d), 7,42 (2H, d), 4,20 (2H, q), 4,18 (2H, s), 3,99 (2H, t), 1,26 (3H, t).
Пример получения 160: этиловый эфир {2,2-дифтор-2-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-этокси}-уксусной кислоты
Этиловый эфир [2-(4-бромфенил)-2,2-дифтор-этокси]-уксусной кислоты (0,24 г, 0,74 ммоль), полученный в Примере Получения 159, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,22 г, 80%).
1H-ЯМР (CDCl3) δ 7,86 (2H, d), 7,51 (2H, d), 4,20 (2H, q), 4,14 (2H, s), 4,00 (2H, t), 1,34 (12H, s), 1,25 (3H, t).
Пример получения 161: этиловый эфир (E)-4-(4-бромфенил)-4,4-дифтор-бут-2-еновой кислоты
2-(4-бромфенил)-2,2-дифтор-этанол (0,5 г, 2,11 ммоль), полученный в Примере Получения 158, вводили в реакцию таким же образом, как на Стадии C Примера Получения 4, с получением целевого соединения (0,42 г, 65%).
1H-ЯМР (CDCl3) δ 7,59 (2H, d), 7,35 (2H, d), 6,95 (1H, m), 6,26 (1H, d), 4,23 (2H, q), 1,28 (3H, t).
Пример получения 162: этиловый эфир 4-(4-бромфенил)-4,4-дифтор-масляной кислоты
Этиловый эфир (E)-4-(4-бромфенил)-4,4-дифтор-бут-2-еновой кислоты (0,42 г, 1,38 ммоль), полученный в Примере Получения 161, вводили в реакцию таким же образом, как в Примере Получения 174, с получением целевого соединения (0,24 г, 57%).
1H-ЯМР (CDCl3) δ 7,56 (2H, d), 7,34 (2H, d), 4,11 (2H, q), 2,47 (4H, m), 1,22 (3H, t).
Пример получения 163: 4-(4-бромфенил)-4,4-дифтор-бутан-1-ол
Этиловый эфир 4-(4-бромфенил)-4,4-дифтор-масляной кислоты (0,244 г, 0,79 ммоль), полученный в Примере Получения 162, вводили в реакцию таким же образом, как на Стадии C Примера Получения 90, с получением целевого соединения (0,2 г, 95%).
1H-ЯМР (CDCl3) δ 7,56 (2H, d), 7,34 (2H, d), 3,66 (2H, m), 2,20 (2H, m), 1,70 (2H, m), 1,26 (1H, m).
Пример получения 164: этиловый эфир 4-(4-бром-фенилсульфанил)-масляной кислоты
4-бромтиофенол (0,5 г, 2,64 ммоль) растворяли в 5 мл THF и охлаждали до 0°C. Добавляли NaH (60% в масле, 0,11 г, 2,64 ммоль), и смесь перемешивали в течение 30 минут. Добавляли этиловый эфир 4-бром-масляной кислоты (0,42 мл, 2,91 ммоль), и смесь перемешивали при комнатной температуре в течение 4 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,80 г, 99%).
1H-ЯМР (CDCl3) δ 7,38 (2H, d), 7,19 (2H, d), 4,13 (2H, q), 2,93 (2H, t), 2,43 (2H, t), 1,93 (2H, m), 1,24 (3H, t).
Пример получения 165: 4-(4-бромфенил)-4,4-дифтор-бутиловый эфир метансульфоновой кислоты
4-(4-бромфенил)-4,4-дифтор-бутан-1-ол (0,263 г, 0,99 ммоль), полученный в Примере Получения 163, вводили в реакцию таким же образом, как на Стадии B Примера Получения 25, с получением целевого соединения (0,28 г, 82%).
1H-ЯМР (CDCl3) δ 7,56 (2H, d), 7,32 (2H, d), 4,26 (2H, t), 3,00 (3H, s), 2,23 (2H, m), 1,94 (2H, m).
Пример получения 166: 5-(4-бромфенил)-5,5-дифтор-пентанeнитрил
4-(4-бромфенил)-4,4-дифтор-бутиловый эфир метансульфоновой кислоты (0,28 г, 0,82 ммоль), полученный в Примере Получения 165, вводили в реакцию таким же образом, как на Стадии C Примера Получения 25, с получением целевого соединения (0,21 г, 94%).
1H-ЯМР (CDCl3) δ 7,58 (2H, d), 7,34 (2H, d), 2,42 (2H, t), 2,24 (2H, m), 1,87 (2H, m).
Пример получения 167: 5-(4-бромфенил)-5,5-дифтор-пентановая кислота
5-(4-бромфенил)-5,5-дифтор-пентанeнитрил (0,21 г, 0,77 ммоль), полученный в Примере Получения 166, растворяли в 2 мл этанола и 2 мл воды. Добавляли NaOH (0,107 г, 2,68 ммоль), и смесь перемешивали в течение 3 часов при нагревании с обратным холодильником. После добавления 1Н HCl реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,26 г, 48%).
1H-ЯМР (CDCl3) δ 7,56 (2H, d), 7,34 (2H, d), 2,41 (2H, t), 2,15 (2H, m), 1,78 (2H, m).
Пример получения 168: метиловый эфир 5-(4-бромфенил)-5,5-дифтор-пентановой кислоты
5-(4-бромфенил)-5,5-дифтор-пентановую кислоту (0,212 г, 0,72 ммоль), полученную в Примере Получения 167, вводили в реакцию таким же образом, как на Стадии G Примера Получения 81, с получением целевого соединения (0,19 г, 85%).
1H-ЯМР (CDCl3) δ 7,57 (2H, d), 7,34 (2H, d), 3,66 (3H, s), 2,35 (2H, t), 2,15 (2H, m), 1,76 (2H, m).
Пример получения 169: метиловый эфир 5,5-дифтор-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты
Метиловый эфир 5-(4-бромфенил)-5,5-дифтор-пентановой кислоты (0,190 г, 0,62 ммоль), полученный в Примере Получения 168, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,13 г, 59%).
1H-ЯМР (CDCl3) δ 7,85 (2H, d), 7,46 (2H, d), 3,65 (3H, s), 2,34 (2H, t), 2,16 (2H, m), 1,76 (2H, m), 1,35 (12H, s).
Пример получения 170: этиловый эфир (E)-3-(4-бром-2,6-дифтор-фенил)-акриловой кислоты
4-бром-2,6-дифтор-бензальдегид (1,52 г, 6,88 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера Получения 85, с получением целевого соединения (1,3 г, 65%).
1H-ЯМР (CDCl3) δ 7,66 (1H, d), 7,13 (2H, m), 6,70 (1H, d), 4,27 (2H, q), 1,32 (3H, t).
Пример получения 171: этиловый эфир 2-(4-бром-2,6-дифтор-фенил)-циклопропанкарбоновой кислоты
Триметилсульфоксоний йодид (0,462 г, 2,10 ммоль) растворяли в 5 мл DMSO. Добавляли NaH (60% в масле, 0,084 г, 2,10 ммоль), и смесь перемешивали в течение 30 минут. После охлаждения до 0°C добавляли этиловый эфир (E)-3-(4-бром-2,6-дифтор-фенил)-акриловой кислоты (0,51 г, 1,75 ммоль), полученный в Примере Получения 170, и смесь перемешивали при комнатной температуре в течение 4 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,26 г, 48%).
1H-ЯМР (CDCl3) δ 7,02 (2H, m), 4,19 (2H, q), 2,42 (1H, m), 2,14 (1H, m), 1,54 (2H, m), 1,28 (3H, t).
Пример получения 172: [2-(4-бром-2,6-дифтор-фенил)-циклопропил]-метанол
Этиловый эфир 2-(4-бром-2,6-дифтор-фенил)-циклопропанкарбоновой кислоты (0,26 г, 0,85 ммоль), полученный в Примере Получения 171, вводили в реакцию таким же образом, как на Стадии C Примера Получения 90, с получением целевого соединения (0,17 г, 76%).
1H-ЯМР (CDCl3) δ 7,00 (2H, m), 3,70 (1H, m), 3,57 (1H, m), 1,66 (2H, m), 1,45 (1H, t), 1,19 (1H, m), 0,93 (1H, m).
Пример получения 173: этиловый эфир (E)-3-[2-(4-бром-2,6-дифтор-фенил)-циклопропил]-акриловой кислоты
[2-(4-бром-2,6-дифтор-фенил)-циклопропил]-метанол (0,314 г, 1,19 ммоль), полученный в Примере Получения 172, вводили в реакцию таким же образом, как на Стадии C Примера Получения 4, с получением целевого соединения (0,36 г, 91%).
1H-ЯМР (CDCl3) δ 7,00 (2H, m), 6,56 (1H, m), 5,93 (1H, d), 4,19 (2H, q), 2,04 (2H, m), 1,63 (1H, m), 1,28 (4H, m).
Пример получения 174: этиловый эфир 3-[2-(4-бром-2,6-дифтор-фенил)-циклопропил]-пропионовой кислоты
Этиловый эфир (E)-3-[2-(4-бром-2,6-дифтор-фенил)-циклопропил]-акриловой кислоты (0,228 г, 0,69 ммоль), полученный в Примере Получения 173, растворяли в 5 мл DME. Добавляли п- толуолсульфонгидразид (0,897 г, 4,82 ммоль), и смесь перемешивали в течение 5 минут при нагревании с обратным холодильником. Добавляли 4,9 мл 1,4 М раствора NaOAc, и смесь перемешивали в течение 18 часов при нагревании с обратным холодильником. Реакционный раствор был разбавляли водой и экстрагировали DCM для отделения органического слоя. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,19 г, 82%).
1H-ЯМР (CDCl3) δ 6,99 (2H, m), 4,12 (2H, q), 2,48 (2H, t), 1,77 (1H, m), 1,67 (1H, m), 1,53 (1H, m), 1,32 (1H, m), 1,26 (3H, t), 1,12 (1H, m), 0,80 (1H, m).
Пример получения 175: этиловый эфир 3-{2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-пропионовой кислоты
Этиловый эфир 3-[2-(4-бром-2,6-дифтор-фенил)-циклопропил]-пропионовой кислоты (0,190 г, 0,57 ммоль), полученный в Примере Получения 174, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,183 г, 84%).
1H-ЯМР (CDCl3) δ 7,18 (2H, m), 4,14 (2H, q), 2,49 (2H, t), 1,77 (1H, m), 1,68 (2H, m), 1,38 (1H, m), 1,32 (12H, s), 1,24 (4H, m), 0,81 (1H, m).
Пример получения 176: 8-(4-бром-2-фтор-фенил)-1,4-диокса-спиро[4,5]дец-7-ен
4-бром-2-фтор-1-йод-бензол (0,68 г, 2,25 ммоль) и 8-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1,4-диокса-спиро[4,5]дец-7-ен (0,5 г, 1,88 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,4 г, 68%).
1H-ЯМР (CDCl3) δ 7,20 (2H, m), 7,12 (1H, t), 5,84 (1H, m), 4,01 (4H, s), 2,58 (2H, m), 2,44 (2H, m), 1,88 (2H, t).
Пример получения 177: 8-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-1,4-диокса-спиро[4,5]дец-7-ен
8-(4-бром-2-фтор-фенил)-1,4-диокса-спиро[4,5]дец-7-ен (0,27 г, 0,86 ммоль), полученный в Примере Получения 176, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,2 г, 64%).
1H-ЯМР (CDCl3) δ 7,50 (1H, m), 7,43 (1H, m), 7,27 (1H, m), 5,89 (1H, m), 4,02 (4H, s), 2,64 (2H, m), 2,48 (2H, m), 1,90 (2H, t), 1,34 (12H, s).
Пример получения 178: 8-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-1,4-диокса-спиро[4,5]декан
8-[2-Фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-1,4-диокса-спиро[4,5]дец-7-ен (0,2 г, 0,55 ммоль), полученный в Примере Получения 177, вводили в реакцию таким же образом, как на Стадии E Примера Получения 1, с получением целевого соединения (0,17 г, 84%).
1H-ЯМР (CDCl3) δ 7,52 (1H, m), 7,43 (1H, m), 7,28 (1H, m), 3,98 (4H, s), 2,94 (1H, m), 1,87-1,68 (8H, m), 1,33 (12H, s).
Пример получения 179: 2-циклопентилокси-3-[4-(1,4-диокса-спиро[4,5]дец-8-ил)-3-фторфенил]-пиридин
8-[2-Фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-1,4-диокса-спиро[4,5]декан (0,17 г, 0,47 ммоль), полученный в Примере Получения 178, и 2-циклопентилокси-3-йод-пиридин (0,2 г, 0,7 ммоль), полученный в Примере Получения 11, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,113 г, 60%).
1H-ЯМР (CDCl3) δ 8,12 (1H, m), 7,58 (1H, m), 7,28 (3H, m), 6,90 (1H, m), 3,99 (4H, s), 2,94 (1H, m), 1,89-1,72 (14-й, m), 1,54 (2H, m).
Пример получения 180: 4-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенил]-циклогексанон
2-циклопентилокси-3-[4-(1,4-диокса-спиро[4,5]дец-8-ил)-3-фторфенил]-пиридин (0,113 г, 0,28 ммоль), полученный в Примере Получения 179, добавляли к 1Н HCl (0,15 мл), растворенной в 3 мл THF, и перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор разбавляли раствором бикарбоната натрия и экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,048 г, 48%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,58 (1H, m), 7,30 (2H, m), 7,25 (1H, m), 6,92 (1H, m), 5,51 (1H, m), 3,37 (1H, m), 2,53 (4H, m), 2,25 (2H, m), 1,97 (4H, m), 1,75 (4H, m), 1,62 (2H, m).
Пример получения 181: этиловый эфир {4-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенил]-циклогексилиден}-уксусной кислоты
4-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенил]-циклогексанон (0,045 г, 0,13 ммоль), полученный в Примере Получения 180, вводили в реакцию таким же образом, как на Стадии C Примера Получения 1 с получением целевого соединения (0,045 г, 83%).
1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,59 (1H, m), 7,29 (2H, m), 7,20 (1H, m), 6,91 (1H, m), 5,70 (1H, s), 5,52 (1H, m), 4,16 (2H, q), 4,00 (1H, m), 3,17 (1H, m), 2,42 (2H, m), 2,10 (3H, m), 1,95 (2H, m), 1,84-1,62 (8H, m), 1,30 (3H, t).
Пример получения 182: этиловый эфир {4-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенил]-циклогексил}-уксусной кислоты
Этиловый эфир {4-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенил]-циклогексилиден}-уксусной кислоты (0,045 г, 0,11 ммоль), полученный в Примере Получения 181, вводили в реакцию таким же образом, как на Стадии E Примера Получения 1, с получением целевого соединения (0,045 г, 99%).
1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,60 (1H, m), 7,27 (3H, m), 6,91 (1H, m), 5,51 (1H, m), 4,15 (2H, q), 2,85 (1H, m), 2,49-2,25 (2H, m), 1,95-1,59 (16H, m), 1,26 (3H, t), 1,22 (1H, m).
Пример получения 183: метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты
3,4,5-Трифторнитробензол (9,4 г, 53 ммоль) и гидрохлоридную соль метилового эфира 4-метиламино-маслной кислоты (8,9 г, 53 ммоль) вводили в реакцию таким же образом, как в Примере Получения 84, с получением целевого соединения (10 г, 51%).
1H-ЯМР (CDCl3) δ 7,24 (2H, d), 3,64 (3H, s), 3,16 (2H, t), 2,88 (3H, m), 2,36 (2H, t), 1,85 (2H, m), 1,31 (12H, s)
Пример получения 184: этиловый эфир 4-[5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-индол-1-ил]-масляной кислоты
5-бром-1H-индол (0,10 г, 0,51 ммоль) и этиловый эфир 4-бром-масляной кислоты (0,10 г, 0,51 ммоль) вводили в реакцию таким же образом, как в Примере Получения 3, с получением целевого соединения (0,060 г, 33%).
1H-ЯМР (CDCl3) δ 8,15 (1H, s), 7,65 (1H, d), 7,34 (1H, d), 7,07 (1H, d), 6,51 (1H, d), 4,21 (2H, t), 4,11 (2H, m), 2,25 (2H, t), 2,14 (2H, m), 1,36 (12H, s), 1,24 (3H, t)
Пример получения 185: 2-бром-6-циклопентилокси-пиридин
Циклопентанол (0,077 мл, 0,84 ммоль) и 2,6-дибромпиридин (0,2 г, 0,84 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,09 г, 44%).
1H-ЯМР (CDCl3) δ 7,36 (1H, t), 7,00 (1H, d), 6,60 (1H, d), 5,36 (1H, m), 1,98 (2H, m), 1,77 (4H, m), 1,61 (2H, m)
Пример получения 186: 2-бром-6-циклобутокси-пиридин
Циклобутанол (0,06 мл, 0,84 ммоль) и 2,6-дибромпиридин (0,2 г, 0,84 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,06 г, 31%).
1H-ЯМР (CDCl3) δ 7,39 (1H, t), 7,01 (1H, d), 6,61 (1H, d), 5,14 (1H, m), 2,45 (2H, m), 2,11 (2H, m), 1,82 (1H, m), 1,65 (1H, m)
Пример получения 187: метиловый эфир 4-{[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты
3,4-дифторнитробензол (1,30 г, 8,17 ммоль) и гидрохлоридную соль метилового эфира 4-метиламино-масляной кислоты (1,64 г, 9,81 ммоль) вводили в реакцию таким же образом, как в Примере Получения 84, с получением целевого соединения (0,25 г, 8,7%).
1H-ЯМР (CDCl3) δ 7,45 (1H, m), 7,40 (1H, m), 6,83 (1H, m), 3,65 (3H, s), 3,25 (2H, t), 2,86 (3H, s), 2,36 (2H, t), 1,91 (2H, m), 1,31 (12H, s)
Пример получения 188: 4-(2-циклопентилсульфанил-пиридин-3-ил)-2,6-дифтор-фениламин
2-циклопентилсульфанил-3-йод-пиридин (0,70 г, 2,29 ммоль), полученный в Примере Получения 15, и 2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (0,59 г, 2,29 ммоль), полученный в Примере Получения 66, вводили в реакцию таким же образом, как в Примере Получения 67, с получением целевого соединения (0,40 г, 57%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,31 (1H, m), 6,99 (1H, m), 6,93 (2H, m), 4,07 (1H, m), 3,82 (2H, s), 2,19 (2H, m), 1,71 (2H, m), 1,61 (4H, m)
Пример получения 189: 4-(2-циклопентилсульфанил-пиридин-3-ил)-анилин
2-циклопентилсульфанил-3-йод-пиридин (1,2 г, 3,9 ммоль), полученный в Примере Получения 15, и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (0,86 г, 3,9 ммоль) вводили в реакцию таким же образом, как в Примере Получения 67, с получением целевого соединения (1,0 г, 94%).
1H-ЯМР (CDCl3) δ 8,37 (1H, m), 7,33 (1H, m), 7,23 (2H, d), 7,00 (1H, m), 6,74 (2H, d), 4,08 (1H, m), 3,76 (2H, s), 2,19 (2H, m), 1,70 (2H, m), 1,59 (4H, m)
Пример получения 190: метиловый эфир 4-{[2,6-дифтор-4-(2-фтор-пиридин-3-ил)-фенил]-метил-амино}-масляной кислоты
2-Фтор-3-йод-пиридин (0,20 г, 0,90 ммоль) и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,33 г, 0,90 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,25 г, 82%).
1H-ЯМР (CDCl3) δ 8,20 (1H, m), 7,82 (1H, m), 7,28 (1H, m), 7,09 (2H, m), 3,66 (3H, s), 3,18 (2H, t), 2,90 (3H, s), 2,40 (2H, t), 1,88 (2H, m), 1,59 (4H, m)
Пример получения 191: 1-(2-йод-фенил)-пирролидин
Стадия A: 2-пирролидин-1-ил-фениламин
Фтор-2-нитро-бензол (0,70 г, 4,96 ммоль) и пирролидин (0,42 г, 5,95 ммоль) последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера Получения 84, с получением целевого соединения (0,70 г, 87%).
Стадия B: 1-(2-йод-фенил)-пирролидин
2-Пирролидин-1-ил-фениламин (0,70 г, 4,31 ммоль), полученный на Стадии А, добавляли к 19 мл воды и охлаждали до 0°C, добавляли 5 мл серной кислоты и затем медленно добавляли нитрит натрия (0,30 г, 4,31 ммоль), растворенного в 5 мл воды. При поддержании температуры смесь перемешивали в течение 30 минут. Добавляли йодид калия (0,93 г, 5,60 ммоль), растворенный в 10 мл воды. Температуру повышали до 60°C, и смесь перемешивали в течение 3 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой очищали колоночной хроматографией с получением целевого соединения (0,18 г, 12%).
1H-ЯМР (CDCl3) δ 7,83 (1H, m), 7,25 (1H, m), 6,95 (1H, m), 6,67 (1H, m), 3,29 (4H, m), 1,94 (4H, m)
Пример получения 192: (2-йод-фенил)-метил-амин
Фтор-2-нитро-бензол (1,00 г, 7,09 ммоль) и метиламин гидрохлорид (0,57 г, 8,50 ммоль) вводили в реакцию таким же образом, как в Примере Получения 191, с получением целевого соединения (0,35 г, 21%).
1H-ЯМР (CDCl3) δ 7,65 (1H, m), 7,25 (1H, m), 6,57 (1H, m), 6,46 (1H, m), 4,20 (1H, s), 2,89 (3H, d)
Пример получения 193: (2-йод-фенил)-изопропил метиламин
Фтор-2-нитро-бензол (1,30 г, 9,21 ммоль) и изопропил метиламин (0,81 г, 11,1 ммоль) вводили в реакцию таким же образом, как в Примере Получения 191, с получением целевого соединения (0,35 г, 14%).
1H-ЯМР (CDCl3) δ 7,85 (1H, m), 7,28 (1H, m), 7,06 (1H, m), 6,77 (1H, m), 3,48 (1H, m), 2,62 (3H, s), 1,12 (6H, d)
Пример получения 194: метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-этил-амино}-масляной кислоты
3,4,5-Трифторнитробензол (0,68 г, 3,84 ммоль) и гидрохлоридную соль метилового эфира 4-этиламино-масляной кислоты (0,58 г, 3,20 ммоль) вводили в реакцию таким же образом, как в Примере Получения 84, с получением целевого соединения (0,38 г, 31%).
1H-ЯМР (CDCl3) δ 7,25 (2H, m), 3,63 (3H, s), 3,18 (4H, m), 2,35 (2H, t), 1,74 (2H, m), 1,32 (12H, s), 1,02 (3H, t)
Пример получения 195: этиловый эфир (R)-5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гексановой кислоты
Стадия A: этиловый эфир (E)-3-(4-бром-2,6-дифтор-фенил)проп-2-еновой кислоты
4-бром-2,6-дифтор-бензальдегид (2,0 г, 13,6 ммоль) и (1-этоксикарбонилэтилиден)трифенилфосфоран (5,7 г, 16,3 ммоль) вводили в реакцию таким же образом, как на Стадии B Примера Получения 27, с получением целевого соединения (3,9 г, 99%).
Стадия B: (E)-3-(4-бром-2,6-дифтор-фенил)-акриловая кислота
Этиловый эфир (E)-3-(4-бром-2,6-дифтор-фенил)проп-2-еновой кислоты (1,13 г, 3,88 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (1,0 г, 98%).
Стадия C: (R)-3-[(E)-3-(4-бром-2,6-дифтор-фенил)-акрилоил]-4-фенил-оксазолидин-2-он
(E)-3-(4-бром-2,6-дифтор-фенил)-акриловую кислоту (0,50 г, 1,9 ммоль), полученную на Стадии B, растворяли в 10 мл THF и охлаждали до -78°C. Добавляли триметилацетил хлорид (0,29 г, 2,4 ммоль), и смесь перемешивали в течение 15 минут. (R)-4-фенил-оксазолидин-2-он (0,42 г, 2,6 ммоль) растворяли в 10 мл THF и охлаждали до -78°C, и затем добавляли н-бутиллитий (1,16 мл, 2,7 ммоль). Этот раствор добавляли к первому раствору при помощи канюли. При поддержании температуры смесь перемешивали в течение 1,5 часов. Температуру повышали до комнатной температуры, и смесь перемешивали в течение 16 часов. После завершения реакции с использованием насыщенного раствора хлорида аммония реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,50 г, 64%).
Стадия D: (R)-3-[(R)-3-(4-бром-2,6-дифтор-фенил)-бутирил]-4-фенил-оксазолидин-2-он
CuBr-DMS (1,18 г, 5,7 ммоль) добавляли к 10 мл THF и перемешивали при -40°C в течение 30 минут. Добавляли DMS (3,38 г, 54,4 ммоль) и метилмагний бромид (1,74 мл, 5,2 ммоль), и смесь перемешивали в течение 30 минут. Температуру повышали до -20°C и (R)-3-[(E)-3-(4-бром-2,6-дифтор-фенил)-акрилоил]-4-фенил-оксазолидин-2-он (0,52 г, 1,3 ммоль), полученный на Стадии C, растворяли в 3 мл THF и медленно добавляли к реакционной смеси. При поддержании температуры смесь перемешивали в течение 2,5 часов. Температуру медленно повышали до комнатной температуры, и смесь перемешивали при комнатной температуре в течение 72 часов. После завершения реакции с использованием насыщенного раствора хлорида аммония реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,33 г, 61%).
Стадия E: этиловый эфир (E)-(R)-5-(4-бром-2,6-дифтор-фенил)-гекс-2-еновой кислоты
(R)-3-[(R)-3-(4-бром-2,6-дифтор-фенил)-бутирил]-4-фенил-оксазолидин-2-он (0,33 г, 0,78 ммоль), полученный на Стадии D, последовательно вводили в реакцию таким же образом, как в Примере Получения 151 и Стадии A Примера Получения 85, с получением целевого соединения (0,11 г, 42%).
Стадия F: этиловый эфир (R)-5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гексановой кислоты
Этиловый эфир (E)-(R)-5-(4-бром-2,6-дифтор-фенил)-гекс-2-еновой кислоты (0,15 г, 0,45 ммоль), полученный на Стадии E, последовательно вводили в реакцию таким же образом, как на Стадиях G и H Примера Получения 5, с получением целевого соединения (0,070 г, 40%).
ЯМР:1H-ЯМР (CDCl3) δ 7,22 (2H, m), 4,08 (2H, q), 3,21 (1H, m), 2,24 (2H, m), 1,80 (1H, m), 1,65 (1H, m), 1,60 (1H, m), 1,45 (1H, m), 1,30 (15H, m), 1,20 (3H, t)
Пример получения 196: этиловый эфир (E)-(R)-5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гекс-2-еновой кислоты
Этиловый эфир (E)-(R)-5-(4-бром-2,6-дифтор-фенил)-гекс-2-еновой кислоты (0,11 г, 0,33 ммоль), полученный на Стадии E Примера Получения 195, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,10 г, 80%).
1H-ЯМР (CDCl3) δ 7,24 (2H, m), 6,84 (1H, m), 5,80 (1H, m), 4,15 (2H, m), 3,40 (1H, m), 2,66 (2H, m), 1,30 (18H, m)
Пример получения 197: этиловый эфир (S)-5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гексановой кислоты
Стадия A: (S)-3-[(E)-3-(4-бром-2,6-дифтор-фенил)-акрилоил]-4-фенил-оксазолидин-2-он
(E)-3-(4-бром-2,6-дифтор-фенил)-акриловую кислоту (1,03 г, 3,9 ммоль), полученную на Стадии B Примера Получения 195, и (S)-4-фенил-оксазолидин-2-он (0,86 г, 5,3 ммоль) вводили в реакцию таким же образом, как на Стадии C Примера Получения 195, с получением целевого соединения (1,30 г, 81%).
Стадия B: (S)-3-[(S)-3-(4-бром-2,6-дифтор-фенил)-бутирил]-4-фенил-оксазолидин-2-он
(S)-3-[(E)-3-(4-бром-2,6-дифтор-фенил)-акрилоил]-4-фенил-оксазолидин-2-он (1,30 г, 3,2 ммоль), полученный на Стадии A Примера Получения 197, вводили в реакцию таким же образом, как на Стадии D Примера Получения 195, с получением целевого соединения (1,0 г, 74%).
Стадия C: этиловый эфир (E)-(S)-5-(4-бром-2,6-дифтор-фенил)-гекс-2-еновой кислоты
(S)-3-[(S)-3-(4-бром-2,6-дифтор-фенил)-бутирил]-4-фенил-оксазолидин-2-он (0,70 г, 1,6 ммоль), полученный в Примере Получения 197 на Стадии B, вводили в реакцию таким же образом, как на Стадии E Примера Получения 195, с получением целевого соединения (0,50 г, 91%).
Стадия D: этиловый эфир (S)-5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гексановой кислоты
Этиловый эфир ((E)-(S)-5-(4-бром-2,6-дифтор-фенил)-гекс-2-еновой кислоты (0,37 г, 1,12 ммоль), полученный на Стадии C Примера Получения 197, вводили в реакцию таким же образом, как на Стадии F Примера Получения 195, с получением целевого соединения (0,16 г, 37%).
ЯМР:1H-ЯМР (CDCl3) δ 7,22 (2H, m), 4,08 (2H, q), 3,21 (1H, m), 2,24 (2H, m), 1,80 (1H, m), 1,65 (1H, m), 1,60 (1H, m), 1,45 (1H, m), 1,30 (15H, m), 1,20 (3H, t)
Пример получения 198: этиловый эфир 4-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты
Стадия A: 2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол
4-бром-2-фторфенол (1,9 г, 9,9 ммоль), бис(пинаколято)диборон (2,9 г, 11,4 ммоль), ацетат калия (3,90 г, 39,7 ммоль) и DPPF (0,27 г, 0,49 ммоль) растворяли в 32 мл 1,4-диоксана и загружали газообразным N2 в течение 5 минут. Добавляли PdCl2(dppf)-DCM (0,4 г, 0,49 ммоль), и смесь перемешивали в течение 4 часов при нагревании с обратным холодильником. Реакционный раствор фильтровали через Целит и очищали колоночной хроматографией с получением целевого соединения (2,2 г, 93%).
1H-ЯМР (CDCl3) δ 7,49 (2H, m), 6,98 (1H, t), 5,31 (1H, ушир.), 1,33 (12H, s)
Стадия B: этиловый эфир 4-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты
2-Фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол (0,56 г, 2,3 ммоль), полученный на Стадии A, этиловый эфир 4-бром-масляной кислоты (0,34 мл, 2,3 ммоль) и Cs2CO3 (0,92 г, 2,8 ммоль) растворяли в 8 мл DMF и перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали и очищали колоночной хроматографией с получением целевого соединения (0,52 г, 63%).
1H-ЯМР (CDCl3) δ 7,49 (2H, m), 6,93 (1H, t), 4,15 (2H, t), 4,10 (2H, q), 2,53 (2H, t), 2,15 (2H, m), 1,33 (12H, s), 1,25 (3H, t)
Пример получения 199: этиловый эфир 6-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гептановой кислоты
1-(4-бром-2,6-дифтор-фенил)этанон (2,50 г, 10,6 ммоль), полученный на Стадии C Примера Получения 32, и (метоксиметил)трифенилфосфоний хлорид (4,38 г, 12,8 ммоль) последовательно вводили в реакцию таким же образом, как в Примере Получения 152, Стадии A Примера Получения 85, Стадии B Примера Получения 70, Стадии C Примера Получения 4, Стадии C Примера Получения 26 и Стадии D Примера Получения 26, с получением целевого соединения (0,50 г, 13%).
1H-ЯМР (CDCl3) δ 7,23 (2H, m), 4,09 (2H, m), 3,22 (1H, m), 2,22 (2H, t), 1,77 (1H, m), 1,61 (5H, m), 1,33 (18H, s)
Пример получения 200: этиловый эфир 4-[3-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-масляной кислоты
3-бромфенол (0,75 г, 4,34 ммоль) и этиловый эфир 4-бром-масляной кислоты (1,01 г, 5,20 ммоль) вводили в реакцию таким же образом, как в Примере Получения 3, с получением целевого соединения (1,1 г, 76%).
1H-ЯМР (CDCl3) δ 7,37 (1H, d), 7,31 (2H, m), 6,99 (1H, m), 4,14 (2H, m), 4,03 (2H, t), 2,52 (2H, t), 2,11 (2H, m), 1,33 (12H, s), 1,27 (3H, t)
Пример получения 201: этиловый эфир 5-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты
4-бром-2-фтор-бензальдегид (0,40 г, 1,97 ммоль) и этил(трифенилфосфоранилиден)ацетальдегид (0,66 г, 2,17 ммоль) вводили в реакцию таким же образом, как в Примере Получения 27, с получением целевого соединения (0,35 г, 51%).
1H-ЯМР (CDCl3) δ 7,48 (1H, d), 7,42 (1H, d), 7,17 (1H, t), 4,12 (2H, m), 2,68 (2H, t), 2,33 (2H, t), 1,67 (4H, m), 1,34 (12H, s), 1,25 (3H, t)
Пример получения 202: этиловый эфир 4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенилсульфанил]-масляной кислоты
Этиловый эфир 4-(4-бром-фенилсульфанил)-масляной кислоты (0,83 г, 2,7 ммоль), полученный в Примере Получения 164, и бис(пинаколято)диборон (0,76 г, 3,0 ммоль) вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,73 г, 75%).
1H-ЯМР (CDCl3) δ 7,70 (2H, d), 7,27 (2H, d), 4,11 (2H, q), 2,99 (2H, t), 2,44 (2H, t), 1,96 (2H, m), 1,32 (12H, s), 1,24 (3H, t).
Пример получения 203: 4-бром-2-фтор-бензолтиол
Стадия A: 4-бром-2-фтор-бензолсульфонил хлорид
4-бром-2-фторанилин (1 г, 5,26 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера Получения 206, с получением целевого соединения (0,49 г, 34%).
1H-ЯМР (CDCl3) δ 7,85 (1H, m), 7,55 (2H, m).
Стадия B: 4-бром-2-фтор-бензолтиол
4-бром-2-фтор-бензолсульфонил хлорид (0,49 г, 1,79 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера Получения 206, с получением целевого соединения (0,37 г, 99%).
1H-ЯМР (CDCl3) δ 7,23 (1H, m), 7,16 (2H, m), 3,57 (1H, s).
Пример получения 204: этиловый эфир 4-(4-бром-2-фтор-фенилсульфанил)-масляной кислоты
4-бром-2-фтор-бензолтиол (0,37 г, 1,81 ммоль), полученный в Примере Получения 203, NaH (60% в масле, 0,07 г, 1,81 ммоль) и этиловый эфир 4-бром-масляной кислоты (0,28 мл, 1,99 ммоль) вводили в реакцию таким же образом, как в Примере Получения 164, с получением целевого соединения (0,43 г, 75%).
1H-ЯМР (CDCl3) δ 7,23 (3H, m), 4,12 (2H, q), 2,92 (2H, t), 2,44 (2H, t), 1,90 (2H, m), 1,25 (3H, t).
Пример получения 205: этиловый эфир 4-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенилсульфанил]-масляной кислоты
Этиловый эфир 4-(4-бром-2-фтор-фенилсульфанил)-масляной кислоты (0,43 г, 1,36 ммоль), полученный в Примере Получения 204, и бис(пинаколято)диборон (0,34 г, 1,50 ммоль) вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,27 г, 53%).
1H-ЯМР (CDCl3) δ 7,50 (1H, d), 7,43 (1H, d), 7,32 (1H, t), 4,11 (2H, q), 2,98 (2H, t), 2,45 (2H, t), 1,93 (2H, m), 1,33 (12H, s), 1,24 (3H, t).
Пример получения 206: 4-бром-2,6-дифтор-бензолтиол
Стадия A: 4-бром-2,6-дифтор-бензолсульфонил хлорид
CuCl2 (0,77 г, 5,77 ммоль) растворяли в 200 мл воды. SOCl2 (29 мл, 0,40 моль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 18 часов. 4-бром-2,6-дифторанилин (20 г, 0,096 моль) растворяли в 240 мл HCl и 900 мл воды, и раствор, в котором NaNO2 (7 г, 0,10 моль) растворяли в 200 мл воды, добавляли при 0°C. Добавляли вышеупомянутый раствор тионилхлорида, и реакцию осуществляли при комнатной температуре в течение 1 часа с получением целевого соединения (24 г, 85%) в твердой форме.
Стадия B: 4-бром-2,6-дифтор-бензолтиол
4-бром-2,6-дифтор-бензолсульфонил хлорид (24 г, 0,08 моль), полученный на Стадии A, растворяли в 270 мл THF. Добавляли PPh3 (75 г, 0,28 моль), и смесь перемешивали при комнатной температуре в течение 15 минут. После добавления воды смесь перемешивали при комнатной температуре в течение 18 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (15 г, 83%).
1H-ЯМР (CDCl3) δ 7,10 (2H, d), 3,58 (1H, s).
Пример получения 207: этиловый эфир 4-(4-бром-2,6-дифтор-фенилсульфанил)-масляной кислоты
4-бром-2,6-дифтор-бензолтиол (15 г, 0,066 моль), полученный в Примере Получения 206, NaH (60% в масле, 2,6 г, 0,066 моль) и этиловый эфир 4-бром-масляной кислоты (10 мл, 0,073 моль) вводили в реакцию таким же образом, как в Примере Получения 164, с получением целевого соединения (18,56 г, 82%).
1H-ЯМР (CDCl3) δ 7,11 (2H, d), 4,11 (2H, q), 2,90 (2H, t), 2,43 (2H, t), 1,82 (2H, m), 1,24 (3H, t).
Пример получения 208: этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенилсульфанил]-масляной кислоты
Этиловый эфир 4-(4-бром-2,6-дифтор-фенилсульфанил)-масляной кислоты (11,6 г, 0,034 моль), полученный в Примере Получения 207, и бис(пинаколято)диборон (9,5 г, 0,038 моль) вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (10,6 г, 80%).
1H-ЯМР (CDCl3) δ 7,30 (2H, d), 4,09 (2H, q), 2,94 (2H, t), 2,43 (2H, t), 1,83 (2H, m), 1,33 (12H, s), 1,22 (3H, t).
Пример получения 209: 3-йод-2-(оксетан-3-илокси)-пиридин
Оксетан-3-ол (0,93 г, 12,6 ммоль) и 2-фтор-3-йод-пиридин (1,40 г, 6,30 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (1,60 г, 92%).
1H-ЯМР (CDCl3) δ 8,05 (2H, m), 6,67 (1H, m), 5,61 (1H, m), 5,01 (2H, t), 4,79 (2H, m)
Пример получения 210: 7-бром-5-хлор-2,2-диметил-2,3-дигидро-бензофуран
Целевое соединение было получено способом, раскрытым в WO 2009/119088 A1.
1H-ЯМР (CDCl3) δ 7,25 (2H, s), 7,02 (1H, m), 3,06 (2H, s), 1,50 (6H, s)
Пример получения 211: 4-бром-7-метокси-2,2-диметил-2,3-дигидро-бензофуран
Целевое соединение было получено способом, раскрытым в WO 2005/075456 A1.
1H-ЯМР (CDCl3) δ 6,94 (1H, d), 6,67 (1H, d), 3,88 (3H, s), 3,08 (2H, s), 1,57 (6H, s)
Пример получения 212: 7-бромспиро[3H-бензофуран-2,1ʹ-циклопентан]
Целевое соединение было получено способом, раскрытым в WO 2011/159297 A1.
1H-ЯМР (CDCl3) δ 7,23 (1H, d), 7,04 (1H, d), 6,67 (1H, t), 3,23 (2H, s), 2,14 (2H, m), 1,93 (2H, m), 1,72 (4H, m)
Пример получения 213: метиловый эфир 5-фтор-7-йод-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты
Стадия A: метиловый эфир 5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты
Целевое соединение было получено способом, раскрытым в US 2013/0109734 A1.
1H-ЯМР (CDCl3) δ 7,71 (1H, ушир.), 6,83 (2H, m), 3,84 (3H, s), 2,99 (2H, s), 1,55 (6H, s)
Стадия B: метиловый эфир 5-фтор-7-йод-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты
Метиловый эфир 5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты (0,1 г, 0,45 ммоль), полученный на Стадии A, растворяли в 3 мл THF и охлаждали до -78°C. 1,7M раствор трет-бутиллития в пентане (0,7 мл, 1,16 ммоль) добавляли по каплям к реакционной смеси, и смесь перемешивали при -78°C в течение 1 часа. 1,2-дийод-этан (0,38 г, 1,35 ммоль) растворяли в 1 мл THF и медленно добавляли по каплям к реакционной смеси, и смесь перемешивали при -78°C в течение 30 минут. Температуру повышали до комнатной температуры, и смесь дополнительно перемешивали в течение 1 часа. После завершения реакции добавлением водного раствора бикарбоната натрия и водного раствора тиосульфата натрия реакционный раствор экстрагировали этилацетатом для отделения органического слоя. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,074 г, 47%).
1H-ЯМР (CDCl3) δ 7,78 (1H, ушир.), 6,89 (1H, t), 3,88 (3H, s), 3,00 (2H, s), 1,61 (6H, s)
Пример получения 214: метиловый эфир 5-фтор-4-йод-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты
Метиловый эфир 5-Фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты (0,26 г, 1,16 ммоль), полученный на Стадии A Примера Получения 213, растворяли в 10 мл THF. TMEDA (0,8 мл, 5,22 ммоль) добавляли по каплям к и охлаждали до -78°C. 1,4M раствор втор-BuLi в гексане (2,5 мл, 3,49 ммоль) добавляли по каплям, и смесь перемешивали при -78°C в течение 1 часа. 1,2-дийод-этан (0,38 г, 1,35 ммоль) растворяли в 5 мл THF и медленно добавляли по каплям к реакционной смеси. Смесь перемешивали при -78°C в течение 30 минут. Температуру повышали до комнатной температуры, и смесь дополнительно перемешивали в течение 1,5 часов. После завершения реакции добавлением водного раствора бикарбоната натрия и водного раствора тиосульфата натрия реакционный раствор экстрагировали этилацетатом для отделения органического слоя. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,170 г, 42%).
1H-ЯМР (CDCl3) δ 7,35 (1H, dd), 6,86 (1H, dd), 3,81 (3H, s), 2,96 (2H, s), 1,48 (6H, s)
Пример получения 215: 4-йодспиро[1,3-бензодиоксол-2,1ʹ-циклопентан]
Стадия A: 1-йод-2,3-диметокси-бензол
1,2-диметоксибензол (500 мг, 3,62 ммоль) растворяли в THF (5 мл) и охлаждали до 0-5°C. n-BuLi (2,5 М в Гексане, 1,6 мл, 3,98 ммоль) медленно добавляли по каплям к реакционной смеси, и смесь перемешивали при 0-5°C в течение 2 часов и охлаждали до -78°C. Медленно добавляли раствор I2 (1,01 г, 3,98 ммоль)/THF (5 мл), и смесь перемешивали при комнатной температуре в течение 2 часов и концентрировали при пониженном давлении. Концентрированный раствор разбавляли насыщенным раствором NaHCO3, экстрагировали DCM и разделяли. Раствор экстракта концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (620 мг, 65%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,36-7,32 (m, 1H), 6,90-6,86 (m, 1H), 6,79 (dd, 1H), 3,85 (s, 3H), 3,83 (s, 3H)
Стадия B: 3-йод-бензол-1,2-диол
1-Йод-2,3-диметокси-бензол (0,62 г, 2,35 ммоль), полученный на Стадии A, растворяли в DCM (3 мл) и охлаждали до 0-5°C. Добавляли 1M BBr3 (7,04 мл, 7,05 ммоль), и смесь перемешивали при комнатной температуре в течение 3 часов. После завершения реакции реакционный раствор охлаждали до -20°C и разбавляли путем медленного добавления этанола. Смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли насыщенный водный раствор NaHCO3, и реакционный раствор экстрагировали DCM. Органический слой высушивали безводным сульфатом магния, концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/4) с получением целевого соединения (0,12 г, 22%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,18 (d, 1H), 6,87 (d, 1H), 6,60 (dd, 1H), 5,64 (s, ушир., 2H)
Стадия C: 4-йодспиро[1,3-бензодиоксол-2,1ʹ-циклопентан]
Толуол (5 мл) добавляли к 3-йод-бензол-1,2-диолу (60 мг, 0,254 ммоль), полученному на Стадии B. Добавляли циклопентанон (0,025 мл, 0,28 ммоль) и p-TsOH.H2O (каталитическое количество), и смесь перемешивали при 130-140°C в течение 12 часов при помощи аппарата Дина-Старка. После завершения реакции реакционный раствор охлаждали. После добавления насыщенного раствора NaHCO3, реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/4) с получением целевого соединения (25 мг, 33%).
1H-ЯМР (500 МГц, CDCl3) δ 7,08 (d, 1H), 6,68 (d, 1H), 6,55 (dd, 1H), 2,20-2,06 (m, 4H), 1,90-1,79 (m, 4H)
Пример получения 216: 2-бром-3-йодфенол
Стадия A: 2-бром-3-метокси-фениламин
2-бром-1-метокси-3-нитробензол (1 г, 4,31 ммоль), Fe (1,68 г, 30,17 ммоль) и NH4Cl (1,61 г, 30,17 ммоль) растворяли в растворе THF (4 мл)/MeOH (4 мл)/H2O (2 мл) и перемешивали в течение 1 часа при нагревании с обратным холодильником. После завершения реакции реакционный раствор охлаждали до комнатной температуры, разбавляли насыщенным раствором NaHCO3 и экстрагировали EtOAc. Раствор экстракта концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/5) с получением целевого соединения (0,83 г, 95%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,05 (dd, 1H), 6,42 (d, 1H), 6,31 (d, 1H), 3,86 (s, 3H)
Стадия B: 2-бром-1-йод-3-метоксибензол
35%-й HCl (3 мл) и лед (3 г) добавляли к 2-бром-3-метокси-фениламину (0,83 г, 4,11 ммоль), полученному на Стадии A, и охлаждали до 0-5°C. Медленно добавляли раствор NaNO2 (0,31 г, 4,52 ммоль)/H2O (2 мл), и смесь перемешивали при 0-5°C в течение 20 минут. Предварительно полученный раствор KI (6,82 г, 41,1 ммоль)/H2O (10 мл) медленно добавляли по каплям к реакционному раствору, и реакцию осуществляли при комнатной температуре в течение 12 часов. После завершения реакции добавляли раствор NaOH, и реакционный раствор экстрагировали DCM. Органический слой промывали насыщенным водным раствором NaHCO3 и водой. Экстрагированный органический слой концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (0,88 г, 68%).
1H-ЯМР (500 МГц, CDCl3) δ 7,48 (d, 1H), 7,00 (dd, 1H), 6,85 (d, 1H), 3,87 (s, 3H)
Стадия C: 2-бром-3-йодфенол
2-бром-1-йод-3-метоксибензол (0,88 г, 2,81 ммоль), полученный на Стадии B, растворяли в DCM (4 мл) и охлаждали до 0-5°C. 1M BBr3 (8,4 мл, 8,43 ммоль) медленно добавляли по каплям к реакционной смеси, и смесь перемешивали при 0-5°C в течение 1 часа и дополнительно перемешивали при комнатной температуре в течение 1 часа. После завершения реакции реакционный раствор охлаждали до -20°C и разбавляли путем медленного добавления метанола. Смесь перемешивали при комнатной температуре в течение 30 минут. После добавления насыщенного водного раствора NaHCO3 реакционный раствор экстрагировали DCM. Органический слой высушивали безводным сульфатом магния, концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/5) с получением целевого соединения (0,723 г, 86%).
1H-ЯМР (500 МГц, CDCl3) δ 7,43-7,39 (m, 1H), 7,02-6,92 (m, 2H), 5,61 (s, 1H)
Пример получения 217: 4-бром-2,6-дифтор-бензолтиол
Стадия A: 4-бром-2,6-дифтор-бензолсульфонил хлорид
CuCl2 (0,77 г, 5,77 ммоль) растворяли в 200 мл воды. SOCl2 (29 мл, 0,40 моль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 18 часов. 4-бром-2,6-дифторанилин (20 г, 0,096 моль) растворяли в 240 мл HCl и 900 мл воды, и раствор, в котором NaNO2 (7 г, 0,10 моль) растворяли в 200 мл воды, добавляли при 0°C. Добавляли вышеупомянутый раствор тионилхлорида, и реакцию осуществляли при комнатной температуре в течение 1 часа с получением целевого соединения (24 г, 85%) в твердой форме.
Стадия B: 4-бром-2,6-дифтор-бензолтиол
4-бром-2,6-дифтор-бензолсульфонил хлорид (24 г, 0,08 моль), полученный на Стадии A, растворяли в 270 мл THF. Добавляли PPh3 (75 г, 0,28 моль), и смесь перемешивали при комнатной температуре в течение 15 минут. После добавления воды смесь перемешивали при комнатной температуре 18 часов. После добавления воды, реакционный раствор экстрагировали EtOAc. Органический слой отделяли, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (15 г, 83%).
1H-ЯМР (CDCl3) δ 7,10 (2H, d), 3,58 (1H, s).
Пример получения 218: этиловый эфир 4-(4-бром-2,6-дифтор-фенилсульфанил)-масляной кислоты
4-бром-2,6-дифтор-бензолтиол (15 г, 0,066 моль), полученный в Примере Получения 217, NaH (60% в масле, 2,6 г, 0,066 моль) и этиловый эфир 4-бром-масляной кислоты (10 мл, 0,073 моль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (18,56 г, 82%).
1H-ЯМР (CDCl3) δ 7,11 (2H, d), 4,11 (2H, q), 2,90 (2H, t), 2,43 (2H, t), 1,82 (2H, m), 1,24 (3H, t).
Пример получения 219: этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенилсульфанил]-масляной кислоты
Этиловый эфир 4-(4-бром-2,6-дифтор-фенилсульфанил)-масляной кислоты (11,6 г, 0,034 моль), полученный в Примере Получения 218, бис(пинаколо)диборон (9,5 г, 0,038 моль), ацетат калия (8,4 г, 0,085 моль) и дихлор[1,1′-бис(дифенилфосфино)ферроцен]палладий (II) (2,5 г, 0,003 моль) вводили в реакцию таким же образом, как на Стадии D Примера 1, с получением целевого соединения (10,6 г, 80%).
1H-ЯМР (CDCl3) δ 7,30 (2H, d), 4,09 (2H, q), 2,94 (2H, t), 2,43 (2H, t), 1,83 (2H, m), 1,33 (12H, s), 1,22 (3H, t).
Пример получения 220: этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты
Стадия A: этиловый эфир 2-[1-(4-бром-2,6-дифтор-фенил)-4-пиперидил]уксусной кислоты
Этиловый эфир 2-[1-(2,6-дифтор-4-нитро-фенил)-4-пиперидилиден]уксусной кислоты (11,44 г, 35 ммоль), полученный на Стадии B Примера Получения 89, растворяли в 100 мл MeOH и 50 мл DCM. Добавляли 0,7 г 10 вес.% Pd/C, и смесь перемешивали в течение 20 минут при 40 фунтов на квадратный дюйм атмосферы водорода. Твердые вещества фильтровали через Целит и концентрировали при пониженном давлении, получая этиловый эфир 2-[1-(4-амино-2,6-дифтор-фенил)-4-пиперидил]уксусной кислоты. Это соединение вводили в реакцию таким же образом, как на Стадии C Примера Получения 84, с получением целевого соединения (6,53 г, 52%).
1H-ЯМР (CDCl3) δ 6,99 (2H, m), 4,14 (2H, q), 3,18 (2H, m), 3,08 (2H, m), 2,28 (2H, d), 1,93 (1H, m), 1,75 (2H, m), 1,46 (2H, m), 1,27 (3H, m)
Стадия B: этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты
Этиловый эфир 2-[1-(4-бром-2,6-дифтор-фенил)-4-пиперидил]уксусной кислоты (6,53 г, 18 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии D Примера Получения 84, с получением целевого соединения (4,68 г, 63%).
1H-ЯМР (CDCl3) δ 7,22 (2H, m), 4,14 (2H, q), 3,31 (2H, m), 3,10 (2H, m), 2,28 (2H, d), 1,96 (1H, m), 1,74 (2H, m), 1,42 (2H, m), 1,32 (12H, s), 1,26 (3H, t)
Пример получения 221: этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты
Стадия A: этиловый эфир 4-(4-бром-2-хлор-6-фтор-фенокси)бутановой кислоты
После добавления 15 мл DMF 4-бром-2-хлор-6-фтор-фенола (2,25 г, 10,0 ммоль), K2CO3 (2,07 г, 15,0 ммоль) и этиловый эфир 4-бромбутановой кислоты (1,95 г, 10,0 ммоль) перемешивали при 80°C в течение 5 часов. Реакционный раствор охлаждали до комнатной температуры. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (3,29 г, 97%).
1H-ЯМР (CDCl3) δ 7,32 (1H, m), 7,18 (1H, m), 4,12 (4H, m), 2,60 (2H, t), 2,10 (2H, m), 1,27 (3H, t)
Стадия B: этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты
Этиловый эфир 4-(4-бром-2-хлор-6-фтор-фенокси)бутановой кислоты (1,45 г, 4,27 ммоль), полученный на Стадии А, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (1,42 г, 86%).
1H-ЯМР (CDCl3) δ 7,58 (1H, m), 7,41 (1H, m), 4,16 (4H, m), 2,60 (2H, t), 2,10 (2H, m), 1,32 (12H, s), 1,26 (3H, t)
Пример получения 222: этиловый эфир 4-[2,6-дихлор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты
Стадия A: этиловый эфир 4-(4-бром-2,6-дихлор-фенокси)бутановой кислоты
После добавления 15 мл DMF 4-бром-2,6-дихлор-фенола (2,42 г, 10,0 ммоль), K2CO3 (2,07 г, 15,0 ммоль) и этиловый эфир 4-бромбутановой кислоты (1,95 г, 10,0 ммоль) перемешивали при 80°C в течение 5 часов. Реакционный раствор охлаждали до комнатной температуры. После добавления воды, реакционный раствор экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (3,10 г, 87%).
1H-ЯМР (CDCl3) δ 7,44 (2H, s), 4,16 (2H, q), 4,04 (2H, t), 2,63 (2H, t), 2,16 (2H, m), 1,27 (3H, t)
Стадия B: этиловый эфир 4-[2,6-дихлор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты
Этиловый эфир 4-(4-бром-2,6-дихлор-фенокси)бутановой кислоты (1,20 г, 3,37 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,825 г, 61%).
1H-ЯМР (CDCl3) δ 7,70 (2H, s), 4,16 (2H, q), 4,07 (2H, t), 2,65 (2H, t), 2,16 (2H, m), 1,33 (12H, s), 1,27 (3H, t)
Пример получения 223: этиловый эфир 2-[1-[2,6-дифтор-4-фенил (3-гидроксифенил)]-4-пиперидил]уксусной кислоты
3-Йодфенол (0,17 г, 0,77 ммоль) и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,35 г, 0,85 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,21 г, 75%).
1H-ЯМР (CDCl3) δ 7,30 (1H, m), 7,06 (3H, m), 6,97 (1H, m), 6,81 (1H, m), 4,88 (1H, ушир.), 4,15 (2H, q), 3,27 (2H, m), 3,13 (2H, m), 2,29 (2H, d), 1,96 (1H, m), 1,77 (2H, m), 1,47 (2H, m), 1,27 (3H, t)
Пример получения 224: этиловый эфир [1-(2,6-дифтор-4-тиокарбамоил-фенил)-пиперидин-4-ил]-уксусной кислоты
Стадия A: этиловый эфир [1-(4-циано-2,6-дифтор-фенил)-пиперидин-4-ил]-уксусной кислоты
3,4,5-Трифторбензонитрил (3,14 г, 20 ммоль) и гидрохлоридную соль этилового эфира 2-(4-пиперидин)уксусной кислоты (4,15 г, 20 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера Получения 84, с получением целевого соединения (4,80 г, 78%).
1H-ЯМР (CDCl3) δ 7,16 (2H, m), 4,19 (2H, q), 3,45 (2H, m), 3. 19 (2H, m), 2,32 (2H, d), 2,03 (1H, m), 1,82 (2H, m), 1,43 (2H, m), 1,31 (3H, t)
Стадия B: этиловый эфир [1-(2,6-дифтор-4-тиокарбамоил-фенил)-пиперидин-4-ил]-уксусной кислоты
Этиловый эфир [1-(4-Циано-2,6-дифтор-фенил)-пиперидин-4-ил]-уксусной кислоты (1,54 г, 5,0 ммоль), полученный на Стадии A, гексагидрат дихлорида магния (4,07 г, 40,0 ммоль) и гидрат тиолата натрия (3,70 г, 50,0 ммоль) растворяли в DMF (20 мл) и перемешивали в течение 3 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой промывали водным раствором хлорида натрия, высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (1,41 г, 82%).
1H-ЯМР (CDCl3) δ 7,64 (1H, s), 7,45 (2H, m), 7,16 (1H, s), 4,19 (2H, q), 3,42 (2H, m), 3. 17 (2H, m), 2,32 (2H, d), 2,00 (1H, m), 1,80 (2H, m), 1,46 (2H, m), 1,31 (3H, t)
Пример получения 225: 2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин
Стадия A: 4-бром-2-хлор-6-фтор-анилин
4-бром-2-фтор-анилин (5,0 г, 26 ммоль) растворяли в 52 мл CH3CN. Добавляли N-хлорсукцинимид (4,37 г, 33 ммоль), и смесь перемешивали в течение 3 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. После добавления водного раствора NaHCO3 реакционный раствор экстрагировали DCM. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (4,41 г, 75%).
1H-ЯМР (CDCl3) δ 7,21 (1H, m), 7,09 (1H, m), 4,08 (2H, ушир.)
Стадия B: 2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин
4-бром-2-хлор-6-фтор-анилин (4,4 г, 20 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (3,68 г, 67%).
1H-ЯМР (CDCl3) δ 7,50 (1H, m), 7,32 (1H, m), 4,28 (2H, ушир.), 1,33 (12H, s)
Пример получения 226: 4-хлор-2-(циклопропилметокси)-6-метил-пиримидин
20 мл THF добавляли к циклопропилметанолу (0,36 г, 5,0 ммоль) и охлаждали до 0°C. Добавляли NaH (60 вес.% в масле, 0,24 г, 6,0 ммоль), и смесь перемешивали в течение 30 минут. Добавляли 2,6-дихлор-4-метил-пиримидин (0,815 г, 5,0 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой очищали колоночной хроматографией с получением целевого соединения (0,37 г, 37%).
1H-ЯМР (CDCl3) δ 6,83 (1H, s), 4,19 (2H, d), 2,43 (3H, s), 1,31 (1H, m), 0,61 (2H, m), 0,37 (2H, m)
Пример получения 227: 2-хлор-4-(циклопропилметокси)-6-метил-пиримидин
20 мл THF добавляли к циклопропилметанолу (0,36 г, 5,0 ммоль) и охлаждали до 0°C. Добавляли NaH (60 вес.% в масле, 0,24 г, 6,0 ммоль), и смесь перемешивали в течение 30 минут. После добавления 2,6-дихлор-4-метил-пиримидина (0,815 г, 5,0 ммоль), смесь перемешивали при комнатной температуре в течение 16 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой очищали колоночной хроматографией с получением целевого соединения (0,41 г, 41%).
1H-ЯМР (CDCl3) δ 6,54 (1H, s), 4,23 (2H, d), 2,46 (3H, s), 1,30 (1H, m), 0,56 (2H, m), 0,40 (2H, m)
Пример получения 228: 2-хлор-4-(циклобутокси)-6-метил-пиримидин
2,6-дихлор-4-метил-пиримидин (0,815 г, 5,0 ммоль) и циклобутанол (0,36 г, 5,0 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,455 г, 46%).
1H-ЯМР (CDCl3) δ 6,44 (1H, s), 5,21 (1H, m), 2,45 (2H, m), 2,41 (3H, s), 2,14 (2H, m), 1,85 (1H, m), 1,67 (1H, m)
Пример получения 229: 4-хлор-2-(циклобутокси)-6-метил-пиримидин
2,6-дихлор-4-метил-пиримидин (0,815 г, 5,0 ммоль) и циклобутанол (0,36 г, 5,0 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,455 г, 46%).
1H-ЯМР (CDCl3) δ 6,81 (1H, s), 5,21 (1H, m), 2,45 (2H, m), 2,41 (3H, s), 2,14 (2H, m), 1,85 (1H, m), 1,67 (1H, m)
Пример получения 230: 2-хлор-4-(циклобутокси)пиримидин
Циклобутанол (0,58 г, 8,05 ммоль) и 2,4-дихлорпиримидин (1 г, 6,71 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,4 г, 32%) и побочного продукта, 4-хлор-2-циклобутокси-пиримидина (0,4 г, 32%).
1H-ЯМР (CDCl3) δ 8,27 (1H, d), 6,61 (1H, d), 5,26 (1H, m), 2,48 (2H, m), 2,16 (2H, m), 1,88 (1H, m), 1,70 (1H, m).
Пример получения 231: 2-хлор-4-(циклопропилметокси)пиримидин
Циклопропилметанол (0,72 г, 10,0 ммоль) и 2,4-дихлорпиримидин (1,49 г, 10,0 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,78 г, 42%).
1H-ЯМР (CDCl3) δ 8,32 (1H, m), 6,71 (1H, m), 4,26 (2H, d), 1,30 (1H, m), 0,68 (2H, m), 0,42 (2H, m)
Пример получения 232: 2-хлор-6-(циклобутокси)пиразин
Циклобутанол (0,36 г, 5,0 ммоль) и 2,6-дихлорпиразин (0,745 г, 5,0 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,53 г, 57%).
1H-ЯМР (CDCl3) δ 8,15 (1H, s), 8,11 (1H, s), 5,22 (1H, m), 2,53 (2H, m), 2,20 (2H, m), 1,91 (1H, m), 1,73 (1H, m)
Пример получения 233: 2-хлор-6-(циклопропилметокси)пиразин
Циклопропилметанол (0,72 г, 10,0 ммоль) и 2,6-дихлорпиразин (1,49 г, 10,0 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,49 г, 81%).
1H-ЯМР (CDCl3) δ 8,18 (1H, s), 8,16 (1H, s), 4,21 (2H, d), 1,33 (1H, m), 0,68 (2H, m), 0,42 (2H, m)
Пример получения 234: 2-хлор-6-метокси-пиразин
MeOH (0,27 мл, 6,7 ммоль) растворяли в 15 мл THF. Добавляли NaH (60 вес.% в масле, 0,32 г, 8,0 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Медленно добавляли 2,6-дихлорпиразин (1,0 г, 6,7 ммоль), растворенный в 20 мл THF, и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,71 г, 73%).
1H-ЯМР (CDCl3) δ 8,14 (1H, s), 8,13 (1H, s), 3,99 (3H, s)
Пример получения 235: 2-хлор-6-пропокси-пиразин
Пропан-1-ол (0,4 г, 6,7 ммоль) растворяли в 15 мл THF. Добавляли NaH (60 вес.% в масле, 0,32 г, 8,0 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Медленно добавляли 2,6-дихлорпиразин (1,0 г, 6,7 ммоль), растворенный в 20 мл THF, и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,77 г, 66%).
1H-ЯМР (CDCl3) δ 8,12 (1H, s), 8,11 (1H, s), 4,29 (2H, t), 1,82 (2H, m), 1,03 (3H, t)
Пример получения 236: 2-бутокси-6-хлор-пиразин
Бутан-1-ол (0,5 г, 6,7 ммоль) растворяли в 15 мл THF. Добавляли NaH (60 вес.% в масле, 0,32 г, 8,0 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Медленно добавляли 2,6-дихлорпиразин (1,0 г, 6,7 ммоль), растворенный в 20 мл THF, и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (1,15 г, 92%).
1H-ЯМР (CDCl3) δ 8,11 (1H, s), 8,10 (1H, s), 4,33 (2H, t), 1,78 (2H, m), 1,48 (2H, m), 0,98 (3H, t)
Пример получения 237: 2-хлор-6-изобутокси-пиразин
2-Метилпропан-1-ол (0,5 г, 6,7 ммоль) растворяли в 15 мл THF. Добавляли NaH (60 вес.% в масле, 0,32 г, 8,0 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Медленно добавляли 2,6-дихлорпиразин (1,0 г, 6,7 ммоль), растворенный в 20 мл THF, и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (1,04 г, 83%).
1H-ЯМР (CDCl3) δ 8,12 (2H, s), 4,10 (2H, d), 2,11 (1H, m), 1,03 (6H, d)
Пример получения 238: 2-хлор-6-(циклопентокси)пиразин
Циклопентанол (0,58 г, 6,7 ммоль) растворяли в 15 мл THF. Добавляли NaH (60 вес.% в масле, 0,32 г, 8,0 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Медленно добавляли 2,6-дихлорпиразин (1,0 г, 6,7 ммоль), растворенный в 20 мл THF, и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (1,07 г, 80%).
1H-ЯМР (CDCl3) δ 8,09 (1H, s), 8,05 (1H, s), 5,40 (1H, m), 1,98 (2H, m), 1,80 (4H, m), 1,65 (2H, m)
Пример получения 239: 2-хлор-4-этокси-пиримидин
2,4-дихлорпиримидин (3,0 г, 20,1 ммоль) растворяли в 40 мл EtOH. Добавляли NaOEt (1,0 М в EtOH, 20 мл, 20 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (1,41 г, 44%).
1H-ЯМР (CDCl3) δ 8,27 (1H, d), 6,64 (1H, d), 4,45 (2H, q), 1,40 (3H, t)
Пример получения 240: 2-хлор-4-изопропокси-пиримидин
Cs2CO3 (7,15 г, 21,9 ммоль) и 50 мл пропан-2-ол добавляли к 2,4-дихлорпиримидину (3,0 г, 20,1 ммоль), и смесь перемешивали в течение 24 часов при нагревании с обратным холодильником. После фильтрации твердых веществ фильтрат очищали колоночной хроматографией с получением целевого соединения (2,24 г, 65%).
1H-ЯМР (CDCl3) δ 8,25 (1H, d), 6,58 (1H, d), 5,40 (1H, m), 1,37 (6H, d)
Пример получения 241: 2-хлор-4-пропокси-пиримидин
Пропан-1-ол (1,33 г, 22,1 ммоль) растворяли в 60 мл THF. Добавляли NaH (60 вес.% в масле, 0,96 г, 24,1 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли 2,4-дихлорпиримидин (3,0 г, 22,1 ммоль), и смесь перемешивали при комнатной температуре в течение 24 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (2,06 г, 59%).
1H-ЯМР (CDCl3) δ 8,27 (1H, d), 6,65 (1H, d), 4,34 (2H, t), 1,81 (2H, m), 1,03 (3H, t)
Пример получения 242: 2-хлор-4-изобутокси-пиримидин
2-Метилпропан-1-ол (1,64 г, 22,1 ммоль) растворяли в 60 мл THF. Добавляли NaH (60 вес.% в масле, 0,96 г, 24,1 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли 2,4-дихлорпиримидин (3,0 г, 22,1 ммоль), и смесь перемешивали при комнатной температуре в течение 24 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения.
1H-ЯМР (CDCl3) δ 8,27 (1H, d), 6,65 (1H, d), 4,15 (2H, d), 2,09 (1H, m), 1,00 (6H, d)
Пример получения 243: 2-хлор-4-этокси-6-метил-пиримидин
Cs2CO3 (6,6 г, 20,2 ммоль) и 46 мл EtOH добавляли к 2,4-дихлор-6-метил-пиримидину (3,0 г, 18,4 ммоль), и смесь перемешивали в течение 48 часов при нагревании с обратным холодильником. После фильтрации твердых веществ фильтрат очищали колоночной хроматографией с получением целевого соединения (1,88 г, 59%).
1H-ЯМР (CDCl3) δ 6,47 (1H, s), 4,41 (2H, q), 2,42 (3H, s), 1,39 (3H, t)
Пример получения 244: 2-хлор-4-изопропокси-6-метил-пиримидин
Cs2CO3 (6,6 г, 20,2 ммоль) и 46 мл пропан-2-ол добавляли к 2,4-дихлор-6-метил-пиримидину (3,0 г, 18,4 ммоль), и смесь перемешивали в течение 16 часов при нагревании с обратным холодильником. После фильтрации твердых веществ фильтрат очищали колоночной хроматографией с получением целевого соединения (1,18 г, 34%).
1H-ЯМР (CDCl3) δ 6,41 (1H, s), 5,38 (1H, m), 2,40 (3H, s), 1,34 (6H, d)
Пример получения 245: 2-хлор-4-метил-6-пропокси-пиримидин
Cs2CO3 (6,6 г, 20,2 ммоль) и 46 мл пропан-1-ол добавляли к 2,4-дихлор-6-метил-пиримидину (3,0 г, 18,4 ммоль), и смесь перемешивали в течение 16 часов при нагревании с обратным холодильником. После фильтрации твердых веществ фильтрат очищали колоночной хроматографией с получением целевого соединения (1,72 г, 50%).
1H-ЯМР (CDCl3) δ 6,48 (1H, s), 4,31 (2H, t), 2,42 (3H, s), 1,79 (2H, m), 1,00 (3H, t)
Пример получения 246: 2-хлор-4-изобутокси-6-метил-пиримидин
2-Метилпропан-1-ол (3,5 г, 21,4 ммоль) растворяли в 50 мл THF. Добавляли NaH (60 вес.% в масле, 1,03 г, 25,7 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли 2,4-дихлор-6-метил-пиримидин (3,0 г, 18,4 ммоль), растворенный в 20 мл THF, и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (1,75 г, 41%).
1H-ЯМР (CDCl3) δ 6,49 (1H, s), 4,13 (2H, d), 2,42 (3H, s), 2,07 (1H, m), 1,00 (6H, d)
Пример получения 247: 2-хлор-4-(2-метоксиэтокси)-6-метил-пиримидин
2,6-дихлор-4-метил-пиримидин (1,63 г, 10,0 ммоль) и 2-метоксиэтанол (0,76 г, 10,0 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,03 г, 51%).
1H-ЯМР (CDCl3) δ 6,59 (1H, s), 4,56 (2H, m), 3,75 (2H, m), 3,45 (3H, s), 2,45 (3H, s)
Пример получения 248: 2-хлор-4-(3-метокси-пропокси)-6-метил-пиримидин
2,6-дихлор-4-метил-пиримидин (1,63 г, 10,0 ммоль) и 3-метоксипропанол (0,90 г, 10,0 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,05 г, 48%).
1H-ЯМР (CDCl3) δ 6,52 (1H, s), 4,47 (2H, t), 3,54 (2H, t), 3,38 (3H, s), 2,48 (3H, s), 2,06 (2H, m)
Пример получения 249: 2-хлор-6-пирролидин-1-ил-пиразин
2,6-дихлорпиразин (2,0 г, 13,4 ммоль) растворяли в 13 мл DMSO. Последовательно добавляли пирролидин (1,05 г, 14,7 ммоль) и DIPEA (2,92 мл, 16,7 ммоль), и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционный раствор разбавляли водой, экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (2,36 г, 96%).
1H-ЯМР (CDCl3) δ 7,74 (1H, s), 7,71 (1H, s), 3,49 (4H, m), 2,03 (4H, m)
Пример получения 250: 6-хлор-N-изопропил-пиразин-2-амин
Пропан-2-амин (1,7 мл, 20,1 ммоль), 1 мл TEA и 2 мл THF добавляли к 2,6-дихлорпиразину (2,0 г, 13,4 ммоль), и смесь перемешивали при 60°C в течение 24 часов. После фильтрации твердых веществ фильтрат очищали колоночной хроматографией с получением целевого соединения (1,35 г, 59%).
1H-ЯМР (CDCl3) δ 7,75 (1H, s), 7,71 (1H, s), 4,61 (1H, ушир.), 4,00 (1H, m), 1,26 (6H, d)
Пример получения 251: 6-хлор-N-изобутил-пиразин-2-амин
2-Метилпропан-1-амин (2 мл, 20,1 ммоль), 1 мл TEA и 3 мл THF добавляли к 2,6-дихлорпиразину (2,0 г, 13,4 ммоль), и смесь перемешивали при 60°C в течение 24 часов. После фильтрации твердых веществ фильтрат очищали колоночной хроматографией с получением целевого соединения (1,95 г, 78%).
1H-ЯМР (CDCl3) δ 7,77 (1H, s), 7,75 (1H, s), 4,97 (1H, ушир.), 3,17 (2H, m), 1,90 (1H, m), 0,99 (6H, d)
Пример получения 252: 6-хлор-N-циклопентил-пиразин-2-амин
Циклопентанамин (1,48 г, 17,4 ммоль), 1 мл TEA и 3 мл THF добавляли к 2,6-дихлорпиразину (2,0 г, 13,4 ммоль), и смесь перемешивали при 60°C в течение 24 часов. После фильтрации твердых веществ фильтрат очищали колоночной хроматографией с получением целевого соединения (1,84 г, 69%).
1H-ЯМР (CDCl3) δ 7,77 (1H, s), 7,74 (1H, s), 4,80 (1H, ушир.), 4,09 (1H, m), 2,07 (2H, m), 1,74 (2H, m), 1,67 (2H, m), 1,48 (2H, m)
Пример получения 253: 6-хлор-N,N-диэтил-пиразин-2-амин
2,6-дихлорпиразин (2,0 г, 13,4 ммоль) растворяли в 13 мл DMSO. Последовательно добавляли диэтиламин (1,53 мл, 14,7 ммоль) и DIPEA (2,92 мл, 16,7 ммоль), и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционный раствор разбавляли водой, экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (1,44 г, 58%).
1H-ЯМР (CDCl3) δ 7,80 (1H, s), 7,70 (1H, s), 3,51 (4H, q), 1,21 (6H, t)
Пример получения 254: 6-хлор-N,N-диметил-пиразин-2-амин
2,6-дихлорпиразин (2,0 г, 13,4 ммоль) растворяли в 13 мл DMSO. Последовательно добавляли гидрохлорид диметиламина (1,31 г, 16,08 ммоль) и DIPEA (5,2 мл, 30 ммоль), и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционный раствор разбавляли водой, экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (1,82 г, 86%).
1H-ЯМР (CDCl3) δ 7,87 (1H, s), 7,77 (1H, s), 3,13 (6H, s)
Пример получения 255: 2-хлор-N-изобутил-пиримидин-4-амин
15 мл THF, 2-метилпропан-1-амин (2,6 мл, 26,1 ммоль) и DIPEA (5,3 мл, 30 ммоль) добавляли к 2,4-дихлорпиримидину (3,0 г, 20,1 ммоль), смесь перемешивали при 65°C в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (2,57 г, 69%).
1H-ЯМР (CDCl3) δ 8,03 (1H, m), 6,23 (1H, d), 5,40 (1H, ушир.), 3,07 (2H, m), 1,89 (1H, m), 0,98 (6H, d)
Пример получения 256: 5-хлор-3-(циклобутокси)-2-метил-пиразин
Стадия A: 3,5-дихлор-2-метил-пиразин
110 мл THF добавляли к 2,2,6,6-тетраметилпиперидину (3,3 мл, 20 ммоль) и охлаждали до -78°C. Добавляли n-BuLi (раствор 2,5 М в гексане, 8 мл, 20 ммоль), и смесь перемешивали при -78°C в течение 30 минут. Добавляли 2,6-дихлорпиразин (2,0 г, 13,4 ммоль), растворенный в 20 мл, и смесь перемешивали при -78°C в течение 90 минут. Добавляли йодметан (3,8 мл, 60 ммоль), и смесь перемешивали при комнатной температуре в течение 3 часов. Твердые вещества удаляли фильтрацией, и фильтрат очищали колоночной хроматографией с получением целевого соединения (0,77 г, 35%).
1H-ЯМР (CDCl3) δ 8,41 (1H, s), 2,65 (3H, s)
Стадия B: 5-хлор-3-(циклобутокси)-2-метил-пиразин
3,5-дихлор-2-метил-пиразин (0,62 г, 3,8 ммоль), полученный на Стадии A, и циклобутанол (0,3 г, 4,18 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,54 г, 71%).
1H-ЯМР (CDCl3) δ 7,98 (1H, s), 5,20 (1H, m), 2,48 (2H, m), 2,43 (3H, s), 2,15 (2H, m), 1,86 (1H, m), 1,70 (1H, m)
Пример получения 257: 2-хлор-6-изобутил-пиразин
50 мл THF, 5 мл NMP и Fe(acac)3(0,24 г, 0,67 ммоль) добавляли к 2,6-дихлорпиразину (2,0 г, 13,4 ммоль), и смесь охлаждали до 0°C. медленно добавляли изобутилмагний бромид (раствор 2,0 М в Et2O, 12 мл, 24 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 24 часов. После добавления воды, реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,32 г, 14%).
1H-ЯМР (CDCl3) δ 8,43 (1H, s), 8,31 (1H, s), 2,66 (2H, d), 2,13 (1H, m), 0,95 (6H, d)
Пример получения 258: 2-хлор-6-циклопентил-пиразин
13 мл толуола, SPhos (1,37 г, 3,3 ммоль) и Pd(OAc)2(0,38 г, 1,67 ммоль) добавляли к 2,6-дихлорпиразину (1,0 г, 6,7 ммоль). Добавляли бромид циклопентилцинка (раствор 0,5 М в THF, 20 мл, 10 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали EtOAc. Органический слой очищали колоночной хроматографией с получением целевого соединения (0,19 г, 15%).
1H-ЯМР (CDCl3) δ 8,39 (1H, s), 8,36 (1H, s), 3,18 (1H, m), 2,10 (2H, m), 1,85 (4H, m), 1,71 (2H, m)
Пример получения 259: 2-хлор-4-изобутил-пиримидин
40 мл THF, Pd(PPh3)4(1,0 г, 0,9 ммоль) и триизобутилалюминий (раствор 1,0 М в гексане, 16 мл, 16 ммоль) добавляли к 2,4-дихлорпиримидину (2,0 г, 13,4 ммоль), и смесь перемешивали в течение 20 часов при нагревании с обратным холодильником. После охлаждения и добавления воды, реакционный раствор экстрагировали Et2O. Органический слой очищали колоночной хроматографией с получением целевого соединения (0,32 г, 14%).
1H-ЯМР (CDCl3) δ 8,49 (1H, d), 7,08 (1H, d), 2,63 (2H, d), 2,14 (1H, m), 0,95 (6H, d)
Пример получения 260: 2-бутил-6-хлор-пиразин
50 мл THF, 5 мл NMP и Fe(acac)3(0,24 г, 0,67 ммоль) добавляли к 2,6-дихлорпиразину (2,0 г, 13,4 ммоль), и смесь охлаждали до 0°C. Медленно добавляли бутилмагний хлорид (раствор 0,9 М в THF, 16 мл, 14,4 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 24 часов. После добавления воды реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,38 г, 17%).
1H-ЯМР (CDCl3) δ 8,42 (1H, s), 8,35 (1H, s), 2,79 (2H, t), 1,73 (2H, m), 1,39 (2H, m), 0,95 (3H, t)
Пример получения 261: 2-хлор-6-изопентил-пиразин
50 мл THF, 5 мл NMP и Fe(acac)3(0,24 г, 0,67 ммоль) добавляли к 2,6-дихлорпиразину (2,0 г, 13,4 ммоль), и смесь охлаждали до 0°C. Медленно добавляли изопентилмагний бромид (раствор 0,9 М в THF, 16 мл, 14,4 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 24 часов. После добавления воды реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,36 г, 15%).
1H-ЯМР (CDCl3) δ 8,41 (1H, s), 8,35 (1H, s), 2,79 (2H, m), 1,62 (3H, m), 0,95 (6H, d)
Пример получения 262: 2-хлор-6-циклобутил-пиразин
Магний (0,326 г, 13,4 мл) и 13,4 мл THF добавляли в высушенную колбу. Медленно добавляли бромциклобутан (1,81 г, 13,4 ммоль), и смесь перемешивали в течение 1 часа при нагревании с обратным холодильником. Реакционный раствор охлаждали до 0°C. Добавляли Fe(acac)3(0,24 г, 16 ммоль), растворенный в 2 мл THF, и смесь перемешивали в течение 5 минут. Добавляли 2,6-дихлорпиразин (2,0 г, 13,4 ммоль), растворенный в 20 мл THF, и 2 мл NMP, и смесь перемешивали в течение 2 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали Et2O и очищали колоночной хроматографией с получением целевого соединения (0,05 г, 2%).
1H-ЯМР (CDCl3) δ 8,40 (1H, s), 8,33 (1H, s), 3,68 (1H, m), 2,38 (4H, m), 2,10 (1H, m), 1,96 (1H, m)
Пример получения 263: 4-хлор-6,7-дигидро-5H-циклопента[d]пиримидин
Стадия A: метиловый эфир 2-аминоциклопентен-1-карбоновой кислоты
Метиловый эфир 2-оксоциклопентанкарбоновой кислоты (9,86 г, 69,3 ммоль) растворяли в 140 мл MeOH. Добавляли формиат аммония (21,9 г, 350 ммоль), и смесь перемешивали в течение 24 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. Добавляли небольшое количество SiO2, и реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (9,49 г, 97%).
1H-ЯМР (DMSO-d6) δ 6,76 (2H, ушир.), 3,53 (3H, s), 2,39 (4H, m), 1,70 (2H, m)
Стадия B: метиловый эфир 2-формамидоциклопентен-1-карбоновой кислоты
21 мл муравьиной кислоты охлаждали до 0°C. Добавляли 30 мл уксусного ангидрида и затем добавляли постепенно метиловый эфир 2-аминоциклопентен-1-карбоновой кислоты (4,76 г, 33,7 ммоль), полученный на Стадии A. Реакционный раствор перемешивали при комнатной температуре в течение 16 часов. Органический слой, экстрагированный EtOAc, очищали колоночной хроматографией с получением целевого соединения (4,95 г, 87%).
1H-ЯМР (DMSO-d6) δ 10,28 (0,5H, ушир.), 9,72 (0,5H, ушир.), 8,57 (0,5H, ушир.), 8,28 (0,5H, ушир.), 3,68 (3H, s), 3,05 (1H, m), 2,88 (1H, m), 2,46 (2H, m), 1,86 (2H, m)
Стадия C: 6,7-дигидро-5H-циклопента[d]пиримидин-4-ол
Формиат аммония (9,94 г, 157 ммоль) растворяли в 15 мл формамида. Добавляли метиловый эфир 2-Формамидоциклопентен-1-карбоновой кислоты (4,94 г, 29,2 ммоль), полученный на Стадии B, и смесь перемешивали при 150°C в течение 4 часов. После охлаждения до комнатной температуры реакционный раствор перемешивали в течение 16 часов. Сформированный осадок высушивали с получением целевого соединения (1,56 г, 39%).
1H-ЯМР (DMSO-d6) δ 12,28 (1H, ушир.), 8,02 (1H, s), 2,75 (2H, t), 2,62 (2H, t), 1,95 (2H, m)
Стадия D: 4-хлор-6,7-дигидро-5H-циклопента[d]пиримидин
11 мл оксихлорида фосфора добавляли к 6,7-дигидро-5H-циклопента[d]пиримидин-4-олу (1,56 г, 11,4 ммоль), полученному на Стадии C, и смесь перемешивали в течение 4 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. Добавляли DCM и затем добавляли воду. Водный слой экстрагировали DCM, и органический слой очищали колоночной хроматографией с получением целевого соединения (1,67 г, 95%).
1H-ЯМР (DMSO-d6) δ 8,78 (1H, s), 3,03 (2H, t), 2,99 (2H, t), 2,10 (2H, m)
Пример получения 264: 2-хлор-4-(циклобутокси)-6,7-дигидро-5H-циклопента[d]пиримидин
Стадия A: 2,4-дихлор-6,7-дигидро-5H-циклопента[d]пиримидин
12 мл EtOH и 0,6 мл концентрированной HCl добавляли к метиловому эфиру 2-оксоциклопентанкарбоновой кислоты (5,2 г, 36,6 ммоль) и мочевине (2,42 г, 40,2 ммоль), и смесь перемешивали в течение 3 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. Сформированные твердые вещества растворяли в 12 мл 5% водного раствора NaOH, и реакционный раствор перемешивали в течение 2 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до 0°C и подкисляли до pH 3. Сформированные твердые вещества отфильтровывали для получения 6,7-дигидро-5H-циклопента[d]пиримидин-2,4-диола (3,34 г, 60%). Это соединение растворяли в 7 мл оксихлорида фосфора, и смесь перемешивали в течение 4 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. После добавления холодной воды реакционный раствор экстрагировали DCM с получением целевого соединения (0,98 г, 24%).
1H-ЯМР (CDCl3) δ 3,08 (2H, t), 2,99 (2H, t), 2,22 (2H, m)
Стадия B: 2-хлор-4-(циклобутокси)-6,7-дигидро-5H-циклопента[d]пиримидин
Циклобутанол (0,34 г, 4,75 ммоль) растворяли в 30 мл THF и охлаждали до 0°C. Добавляли NaH (60 вес.% в масле, 0,21 г, 5,18 ммоль), и смесь перемешивали в течение 30 минут. 2,4-дихлор-6,7-дигидро-5H-циклопента[d]пиримидин (0,82 г, 4,32 ммоль), полученный на Стадии A, растворяли в 13 мл THF и добавляли. Смесь перемешивали при комнатной температуре в течение 16 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой очищали колоночной хроматографией с получением целевого соединения (0,59 г, 61%).
1H-ЯМР (CDCl3) δ 5,28 (1H, m), 2,93 (2H, m), 2,82 (2H, m), 2,48 (2H, m), 2,13 (4H, m), 1,84 (1H, m), 1,67 (1H, m)
Пример получения 265: 2-хлор-4-(циклобутокси)-5,6-диметил-пиримидин
Стадия A: 2,4-дихлор-5,6-диметил-пиримидин
5,6-диметил-1H-пиримидин-2,4-дион (2,5 г, 17,8 ммоль) растворяли в 12 мл оксихлорида фосфора, и смесь перемешивали в течение 4 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры и добавляли к холодной воде. Сформированный осадок высушивали с получением целевого соединения (3,08 г, 98%).
1H-ЯМР (DMSO-d6) δ 2,51 (3H, s), 2,30 (3H, s)
Стадия B: 2-хлор-4-(циклобутокси)-5,6-диметил-пиримидин
Циклобутанол (0,45 г, 6,21 ммоль) растворяли в 40 мл THF и охлаждали до 0°C. Добавляли NaH (60 вес.% в масле, 0,27 г, 6,77 ммоль), и смесь перемешивали в течение 30 минут. 2,4-дихлор-5,6-диметил-пиримидин (1,0 г, 5,64 ммоль), полученный на Стадии A, растворяли в 15 мл THF и добавляли. Смесь перемешивали при комнатной температуре в течение 16 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой очищали колоночной хроматографией с получением целевого соединения (0,84 г, 70%).
1H-ЯМР (CDCl3) δ 5,24 (1H, m), 2,48 (2H, m), 2,40 (3H, s), 2,13 (2H, m), 2,08 (3H, s), 1,84 (1H, m), 1,68 (1H, m)
Пример получения 266: (6-бром-2-пиридил)метанол
6-бромпиридин-2-карбальдегид (1,86 г, 10,0 ммоль) растворяли в 30 мл MeOH и охлаждали до 0°C. Медленно добавляли NaBH4 (0,38 г, 10,0 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. После добавления воды органический слой, экстрагированный EtOAc, очищали колоночной хроматографией с получением целевого соединения (1,86 г, 99%).
1H-ЯМР (CDCl3) δ 7,56 (1H, t), 7,40 (1H, m), 7,28 (1H, m), 4,75 (2H, d), 3,02 (1H, t)
Пример получения 267: 2-бром-6-(циклопропилметоксиметил)пиридин
(6-бром-2-пиридил)метанол (0,376 г, 2,0 ммоль), полученный в Примере Получения 266, растворяли в 8 мл THF. Добавляли NaH (60 вес.% в масле, 0,088 г, 2,2 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Последовательно добавляли бромметилциклопропан (0,297 г, 2,2 ммоль) и Bu4NI (0,074 г, 0,2 ммоль), и смесь перемешивали при комнатной температуре. Реакционный раствор подкисляли до pH 4 добавлением воды. Органический слой, экстрагированный DCM, очищали колоночной хроматографией с получением целевого соединения (0,283 г. 58%).
1H-ЯМР (CDCl3) δ 7,56 (1H, t), 7,47 (1H, m), 7,37 (1H, m), 4,63 (2H, s), 3,41 (2H, d), 1,10 (1H, m), 0,56 (2H, m), 0,24 (2H, m)
Пример получения 268: (6-бром-2-пиридил)-циклопропил-метанол
6-бромпиридин-2-карбальдегид (0,93 г, 5,0 ммоль) растворяли в 20 мл THF. Медленно добавляли циклопропил магний бромид (0,5 М в THF, 11 мл, 5,5 ммоль), и смесь перемешивали при комнатной температуре в течение 15 минут. После добавления водного раствора хлорида аммония органический слой, экстрагированный DCM, очищали колоночной хроматографией с получением целевого соединения (1,09 г, 96%).
1H-ЯМР (CDCl3) δ 7,55 (1H, t), 7,40 (1H, d), 7,37 (1H, d), 4,09 (1H, m), 3,62 (1H, d), 1,12 (1H, m), 0,55 (4H, m)
Пример получения 269: 2-бром-6-(циклобутоксиметил)пиридин
(6-бром-2-пиридил)метанол (0,38 г, 2,0 ммоль), полученный в Примере Получения 266, растворяли в 5 мл DCM. 2-бром-6-(хлорметил)пиридин, полученный добавлением 1,2 мл SOCl2 и циклобутанола (0,145 г, 2,0 ммоль), вводили в реакцию таким же образом, как в Примере Получения 267, с получением целевого соединения (0,365 г, 75%).
1H-ЯМР (CDCl3) δ 7,55 (1H, t), 7,43 (1H, d), 7,38 (1H, d), 4,51 (2H, s), 4,06 (1H, m), 2,23 (2H, m), 2,00 (2H, m), 1,73 (1H, m), 3,53 (1H, m)
Пример получения 270: 2,6-дихлор-4-(циклобутокси)пиридин
2-хлор-6-циклобутокси-пиридин (0,88 г, 4,8 ммоль) растворяли в 50 мл DCM. Добавляли mCPBA (4,45 г, 17,8 ммоль), и смесь перемешивали при комнатной температуре в течение 3 дней. Осадок удаляли фильтрацией, и фильтрат промывали 1Н водным раствором NaOH и экстрагировали хлороформом. Органический слой высушивали безводным сульфатом магния для концентрации. Добавляли 15 мл POCl3, и смесь перемешивали при 90°C в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении. Последовательно добавляли холодную воду и 1Н водный раствор NaOH, и реакционный раствор экстрагировали DCM. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,956 г, 91%).
1H-ЯМР (CDCl3) δ 6,67 (2H, s), 4,66 (1H, m), 2,46 (2H, m), 2,19 (2H, m), 1,90 (1H, m), 1,70 (1H, m)
Пример получения 271: 2-хлор-6-(циклобутокси)-4-метил-пиридин
Стадия A: 2-(циклобутокси)-4-метил-пиридин
2-хлор-4-метил-пиридин (0,89 г, 7,0 ммоль) и циклобутанол (0,05 г, 7,0 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,827 г, 72%).
1H-ЯМР (CDCl3) δ 8,03 (1H, m), 6,71 (1H, m), 6,54 (1H, m), 5,19 (1H, m), 2,49 (2H, m), 2,32 (3H, s), 2,16 (2H, m), 1,86 (1H, m), 1,70 (1H, m)
Стадия B: 2-хлор-6-(циклобутокси)-4-метил-пиридин
2-(Циклобутокси)-4-метил-пиридин (0,0827 г, 5,07 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как в Примере Получения 270, с получением целевого соединения (0,405 г, 40%).
1H-ЯМР (CDCl3) δ 6,75 (1H, m), 6,44 (1H, m), 5,18 (1H, m), 2,49 (2H, m), 2,30 (3H, s), 2,12 (2H, m), 1,85 (1H, m), 1,70 (1H, m)
Пример получения 272: 2-трет-бутокси-6-хлор-пиридин
45 мл толуола и трет-бутоксида калия (2,77 г, 24,6 ммоль) добавляли к 2,6-дихлорпиридину (3,04 г, 20,5 ммоль), и смесь перемешивали в течение 24 часов при нагревании с обратным холодильником. Твердые вещества фильтровали через Целит, и фильтрат очищали колоночной хроматографией с получением целевого соединения (1,57 г, 41%).
1H-ЯМР (CDCl3) δ 7,44 (1H, t), 6,82 (1H, d), 6,54 (1H, d), 1,58 (9H, s)
Пример получения 273: 2-хлор-6-этокси-пиридин
EtOH (2,8 мл, 47 ммоль) добавляли к 80 мл THF, и смесь охлаждали до 0°C. Медленно добавляли натрий (0,57 г, 25 ммоль), и смесь перемешивали при 40°C в течение 30 минут. Добавляли 2,6-дихлорпиридин (3,51 г, 23,7 ммоль), и смесь перемешивали при 50°C в течение 16 часов. После добавления воды реакционный раствор экстрагировали Et2O и очищали колоночной хроматографией с получением целевого соединения (2,27 г, 61%).
1H-ЯМР (CDCl3) δ 7,50 (1H, t), 6,87 (1H, d), 6,62 (1H, d), 4,36 (2H, q), 1,38 (3H, t)
Пример получения 274: 2-хлор-6-(2,2,2-трифторэтокси)пиридин
2,2,2-Трифторэтанол (2,42 г, 24 ммоль) растворяли в 67 мл THF. Добавляли NaH (55 вес.% в масле, 1,06 г, 24 ммоль), и смесь перемешивали при комнатной температуре в течение 45 минут. Добавляли 2,6-дихлорпиридин (3,0 г, 20 ммоль), и смесь перемешивали при 70°C в течение 16 часов. После добавления воды реакционный раствор экстрагировали Et2O и очищали колоночной хроматографией с получением целевого соединения (2,17 г, 51%).
1H-ЯМР (CDCl3) δ 7,60 (1H, t), 7,00 (1H, d), 6,79 (1H, d), 4,73 (2H, m)
Пример получения 275: 2-хлор-6-(2,2,2-трифтор-1-метил-этокси)пиридин
1,1,1-Трифтор-2-пропанол (2,76 г, 24 ммоль) растворяли в 67 мл THF. Добавляли NaH (55 вес.% в масле, 1,06 г, 24 ммоль), и смесь перемешивали при комнатной температуре в течение 45 минут. Добавляли 2,6-дихлорпиридин (3,0 г, 20 ммоль), и смесь перемешивали при 70°C в течение 16 часов. После добавления воды реакционный раствор экстрагировали Et2O и очищали колоночной хроматографией с получением целевого соединения (3,58 г, 79%).
1H-ЯМР (CDCl3) δ 7,57 (1H, t), 6,97 (1H, d), 6,73 (1H, d), 5,72 (1H, m), 1,50 (3H, d)
Пример получения 276: 2-бутокси-6-хлор-пиридин
Бутан-1-ол (1,87 г, 25,2 ммоль) растворяли в 50 мл DMF и охлаждали до 0°C. Добавляли NaH (55 вес.% в масле, 1,10 г, 25,2 ммоль), и смесь перемешивали при комнатной температуре в течение 45 минут. Добавляли 2,6-дихлорпиридин (3,55 г, 24,0 ммоль), и смесь перемешивали в течение 16 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали Et2O и очищали колоночной хроматографией с получением целевого соединения (4,05 г, 91%).
1H-ЯМР (CDCl3) δ 7,50 (1H, t), 6,87 (1H, d), 6,63 (1H, d), 4,28 (2H, t), 1,74 (2H, m), 1,46 (2H, m), 0,97 (3H, t)
Пример получения 277: 2-хлор-6-циклобутил-пиридин
2,6-дихлорпиридин (1,98 г, 13,4 ммоль) и Fe(acac)3(0,24 г, 0,67 ммоль) растворяли в 49 мл THF и 5 мл NMP и охлаждали до 0°C. Медленно добавляли циклобутилмагний бромид (раствор 0,9 М в THF, 18 мл, 16 ммоль), и смесь перемешивали при 0°C в течение 6 часов. После завершения реакции добавлением водного раствора хлорида аммония реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,43 г, 19%).
1H-ЯМР (CDCl3) δ 7,54 (1H, t), 7,12 (1H, d), 7,08 (1H, d), 3,63 (1H, m), 2,33 (4H, m), 2,05 (1H, m), 1,90 (1H, m)
Пример получения 278: 2-бром-6-(циклобутилиденметил)пиридин
35 мл THF добавляли к 2-бром-6-(диэтоксифосфорилметил)пиридину (2,2 г, 7,14 ммоль), и смесь охлаждали до 0°C. Добавляли LiHMDS (раствор THF на 1,0 М, 8,6 мл, 8,6 ммоль), и смесь перемешивали при 0°C в течение 30 минут. Добавляли циклобутанон (0,50 г, 7,14 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (1,02 г, 64%).
1H-ЯМР (CDCl3) δ 7,42 (1H, t), 7,20 (1H, d), 7,04 (1H, d), 6,19 (1H, m), 3,13 (2H, m), 2,91 (2H, m), 2,14 (2H, m)
Пример получения 279: 2-бром-6-(циклопентилиденметил)пиридин
35 мл THF добавляли к 2-бром-6-(диэтоксифосфорилметил)пиридину (2,2 г, 7,14 ммоль), и смесь охлаждали до 0°C. Добавляли LiHMDS (раствор 1,0 М в THF, 8,6 мл, 8,6 ммоль), и смесь перемешивали при 0°C в течение 30 минут. Добавляли циклопентанон (0,6 г, 7,14 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (1,17 г, 69%).
1H-ЯМР (CDCl3) δ 7,43 (1H, t), 7,20 (1H, d), 7,13 (1H, d), 6,41 (1H, m), 2,73 (2H, m), 2,52 (2H, m), 1,81 (2H, m), 1,68 (2H, m)
Пример получения 280: 1-бром-3-(циклопропилметокси)бензол
3-бромфенол (0,865 г, 5,0 ммоль) и бромметилциклопропан (1,01 г, 7,5 ммоль) вводили в реакцию таким же образом, как в Примере Получения 12, с получением целевого соединения (1,09 г, 96%).
1H-ЯМР (CDCl3) δ 7,13 (1H, m), 7,06 (2H, m), 6,88 (1H, m), 3,82 (2H, d), 1,28 (1H, m), 0,65 (2H, m), 0,35 (2H, m)
Пример получения 281: 1-бром-3-(циклобутокси)бензол
3-бромфенол (0,865 г, 5,0 ммоль) и бромциклобутан (1,01 г, 7,5 ммоль) вводили в реакцию таким же образом, как в Примере Получения 12, с получением целевого соединения (1,04 г, 91%).
1H-ЯМР (CDCl3) δ 7,10 (1H, t), 7,05 (1H, m), 6,95 (1H, m), 6,74 (1H, m), 4,60 (1H, m), 2,44 (2H, m), 2,14 (2H, m), 1,85 (1H, m), 1,69 (1H, m)
Пример получения 282: 4-бром-2-(циклопропилметокси)-1-метокси-бензол
20 мл DMF добавляли к 5-бром-2-метокси-фенолу (1,8 г, 8,87 ммоль), бромметилциклопропану (1,44 г, 10,7 ммоль), K2CO3 (1,84 г, 13,3 ммоль) и Bu4NI (0,33 г, 0,88 ммоль), и смесь перемешивали при 80°C. После завершения реакции реакционный раствор охлаждали до комнатной температуры. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (2,21 г, 97%).
1H-ЯМР (CDCl3) δ 7,02 (1H, m), 6,97 (1H, d), 6,74 (1H, d), 3,85 (3H, s), 3,82 (2H, d), 1,33 (1H, m), 0,65 (2H, m), 0,35 (2H, m)
Пример получения 283: 4-бром-2-(циклопропилметокси)-1-фторбензол
5-бром-2-фтор-фенол (0,955 г, 5,0 ммоль) и бромметилциклопропан (0,81 г, 6,0 ммоль) вводили в реакцию таким же образом, как в Примере Получения 12, с получением целевого соединения (1,22 г, 99%).
1H-ЯМР (CDCl3) δ 7,06 (1H, m), 6,95 (2H, m), 3,85 (2H, d), 1,30 (1H, m), 0,66 (2H, m), 0,36 (2H, m)
Пример получения 284: 1-бром-3-(циклобутокси)-5-фторбензол
3-бром-5-фтор-фенол (0,955 г, 5,0 ммоль) и бромциклобутан (0,81 г, 6,0 ммоль) вводили в реакцию таким же образом, как в Примере Получения 12, с получением целевого соединения (1,19 г, 97%).
1H-ЯМР (CDCl3) δ 6,84 (1H, m), 6,76 (1H, m), 6,46 (1H, m), 4,57 (1H, m), 2,44 (2H, m), 2,15 (2H, m), 1,88 (1H, m), 1,70 (1H, m)
Пример получения 285: 1-бром-3-циклобутилсульфонил-бензол
20 мл THF и 20 мл MeOH добавляли к 1-бром-3-циклобутилсульфанил-бензолу (0,73 г, 3,0 ммоль), полученному в Примере Получения 293. Добавляли оксон (9,2 г, 30 ммоль), растворенный в 40 мл воды, и смесь перемешивали при комнатной температуре в течение 5 часов. После завершения реакции добавляли воду, и реакционный раствор экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,81 г, 98%).
1H-ЯМР (CDCl3) δ 8,01 (1H, d), 7,79 (2H, m), 7,44 (1H, t), 3,85 (1H, m), 2,60 (2H, m), 2,20 (2H, m), 1,98 (2H, m)
Пример получения 286: 1-бром-3-(изопропоксиметил)бензол
10 мл 2-пропанол и гептагидрат сульфата железа (II) (2,78 г, 6 ммоль) добавляли к 1-бром-3-(бромметил)бензолу (2,5 г, 10 ммоль), и смесь перемешивали в течение 36 часов при нагревании с обратным холодильником. Твердые вещества фильтровали через Целит и очищали колоночной хроматографией с получением целевого соединения (1,5 г, 65%).
1H-ЯМР (CDCl3) δ 7,50 (1H, m), 7,39 (1H, m), 7,27 (1H, m), 7,19 (1H, t), 4,47 (2H, s), 3,67 (1H, m), 1,22 (6H, d)
Пример получения 287: 1-бром-3-(этоксиметил)бензол
10 мл EtOH и гептагидрат сульфата железа (II) (2,78 г, 6 ммоль) добавляли к 1-бром-3-(бромметил)бензолу (2,5 г, 10 ммоль), и смесь перемешивали в течение 36 часов при нагревании с обратным холодильником. Твердые вещества фильтровали через Целит и очищали колоночной хроматографией с получением целевого соединения (1,54 г, 71%).
1H-ЯМР (CDCl3) δ 7,50 (1H, m), 7,40 (1H, m), 7,26 (1H, m), 7,21 (1H, t), 4,47 (2H, s), 3,53 (2H, q), 1,26 (3H, t)
Пример получения 288: 1-бром-3-(циклобутокси)-2-метилбензол
Стадия A: 3-бром-2-метил-фенол
31 мл 1Н водного раствора серной кислоты добавляли к 3-бром-2-метил-анилину (4,04 г, 21,7 ммоль), и смесь охлаждали до 0°C. Медленно добавляли нитрит натрия (водный раствор 6,0 М, 4,3 мл). Через 15 минут добавляли 10 мл серной кислоты, и смесь перемешивали в течение 1 часа при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. После добавления воды реакционный раствор экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (2,34 г, 58%).
1H-ЯМР (CDCl3) δ 7,14 (1H, d), 6,92 (1H, t), 6,71 (1H, d), 4,83 (1H, ушир.), 2,34 (3H, s)
Стадия B: 1-бром-3-(циклобутокси)-2-метилбензол
3-бром-2-метил-фенол (0,2 г, 1 ммоль), полученный на Стадии A, растворяли в 3,6 мл DMF. Добавляли бромциклобутан (0,17 г, 1,28 ммоль) и Cs2CO3 (0,7 г, 2,14 ммоль), и смесь перемешивали при 50°C в течение 24 часов. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (0,2 г, 83%).
1H-ЯМР (CDCl3) δ 7,12 (1H, d), 6,95 (1H, t), 6,61 (1H, d), 4,60 (1H, m), 2,44 (2H, m), 2,30 (3H, s), 2,16 (2H, m), 1,86 (1H, m), 1,69 (1H, m)
Пример получения 289: 4-бром-2-(циклобутокси)тиазол
Циклобутанол (0,065 г, 0,9 ммоль) растворяли в 8 мл THF. Добавляли NaH (55 вес.% в масле, 0,04 г, 0,9 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли 2,4-дибромтиазол (0,2 г, 0,82 ммоль), и смесь перемешивали в течение 16 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (0,13 г, 68%).
1H-ЯМР (CDCl3) δ 6,56 (1H, s), 5,17 (1H, m), 2,48 (2H, m), 2,20 (2H, m), 1,84 (1H, m), 1,65 (1H, m)
Пример получения 290: 4-бром-2-(циклопропилметокси)тиазол
Циклопропилметанол (0,14 г, 2,0 ммоль) растворяли в 16 мл THF. Добавляли NaH (55 вес.% в масле, 0,086 г, 2,0 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли 2,4-дибромтиазол (0,4 г, 1,64 ммоль), и смесь перемешивали в течение 24 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали Et2O и очищали колоночной хроматографией с получением целевого соединения (0,23 г, 60%).
1H-ЯМР (CDCl3) δ 6,57 (1H, s), 4,25 (2H, d), 1,30 (1H, m), 0,65 (2H, m), 0,37 (2H, m)
Пример получения 291: 4-бром-3-(циклопропилметоксиметил)-5-метил-изоксазол
Стадия A: 3-(циклопропилметоксиметил)-5-метил-изоксазол
Метиловый эфир 5-Метилизоксазол-3-карбоновой кислоты (1,5 г, 10,5 ммоль) растворяли в 27 мл EtOH. Медленно добавляли NaBH4 (0,8 г, 21 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор нейтрализовали добавлением водного раствора HCl, экстрагировали EtOAc и высушивали безводным сульфатом магния для концентрации. Полученный концентрат растворяли в 20 мл DCM. Добавляли 1,4 мл SOCl2, и смесь перемешивали при комнатной температуре в течение 16 часов и концентрировали. Добавляли смешанный раствор циклопропилметанола (0,31 г, 4,2 ммоль), NaH (55 вес.% в масле, 0,19 г, 4,2 ммоль) и DMF (20 мл), и смесь перемешивали при комнатной температуре в течение 72 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (0,074 г, 4%).
1H-ЯМР (CDCl3) δ 6,05 (1H, s), 4,56 (2H, s), 3,31 (2H, d), 2,42 (3H, s), 1,07 (1H, m), 0,55 (2H, m), 0,21 (2H, m)
Стадия B: 4-бром-3-(циклопропилметоксиметил)-5-метил-изоксазол
3-(Циклопропилметоксиметил)-5-метил-изоксазол (0,074 г, 0,44 ммоль), полученный на Стадии A, растворяли в 1,5 мл DMF. Добавляли N-бромсукцинимид (0,078 г, 0,44 ммоль), и смесь перемешивали при комнатной температуре в течение 48 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали Et2O и очищали колоночной хроматографией с получением целевого соединения (0,069 г, 55%).
1H-ЯМР (CDCl3) δ 4,57 (2H, s), 3,35 (2H, d), 2,42 (3H, s), 1,10 (1H, m), 0,54 (2H, m), 0,23 (2H, m)
Пример получения 292: 4-бром-5-(циклобутокси)-3-метил-изотиазол
Циклобутанол (0,32 г, 4,4 ммоль) и 4,5-дибром-3-метил-изотиазол (1,03 г, 4,0 ммоль, WO2013 132376A1) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,120 г, 12%).
1H-ЯМР (CDCl3) δ 4,68 (1H, m), 2,52 (2H, m), 2,45 (3H, s), 2,35 (2H, m), 1,94 (1H, m), 1,72 (1H, m)
Пример получения 293: 1-бром-3-циклобутилсульфанил-бензол
3-бромтиофенол (3 г, 15,87 ммоль) и бромциклобутан (2,25 мл, 23,80 ммоль) вводили в реакцию таким же образом, как в Примере Получения 17, с получением целевого соединения (3,36 г, 87%).
1H-ЯМР (CDCl3) δ 7,33 (1H, s), 7,26 (1H, m), 7,12 (2H, m), 3,89 (1H, m), 2,47 (2H, m), 2,07 (3H, m), 2,04 (1H, m).
Пример получения 294: 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-анилин
4-броманилин (1 г, 5,81 ммоль), бис(пинаколято)диборон (1,6 г, 6,39 ммоль) и ацетат калия (1,43 г, 14,53 ммоль) растворяли в 20 мл 1,4-диоксана и загружали газообразным N2 в течение 5 минут. Добавляли PdCl2(dppf)-DCM (0,425 г, 0,58 ммоль), и смесь перемешивали при 80°C в течение 16 часов. Реакционный раствор фильтровали через Целит, разбавляли водой и экстрагировали этилацетатом. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,764 г, 60%).
1H-ЯМР (CDCl3) δ 7,60 (2H, d), 6,66 (2H, d), 3,82 (2H, ушир.), 1,31 (12H, s).
Пример получения 295: 4-(6-циклобутокси-пиридин-2-ил)-анилин
2-бром-6-циклобутокси-пиридин (0,251 г, 1,37 ммоль), полученный в Примере Получения 186, и 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-анилин (0,2 г, 0,91 ммоль), полученный в Примере Получения 294, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,17 г, 77%).
1H-ЯМР (CDCl3) δ 7,85 (2H, d), 7,55 (1H, t), 7,21 (1H, d), 6,72 (2H, d), 6,51 (1H, d), 5,26 (1H, m), 3,79 (2H, ушир.), 2,51 (2H, m), 2,18 (2H, m), 1,86 (1H, m), 1,72 (1H, m).
Пример получения 296: 4-(6-циклобутокси-пиридин-2-ил)-фенил]-[3-(4-метокси-фенокси)-изоксазол-5-илметил]-амин
4-(6-циклобутокси-пиридин-2-ил)-анилин (0,17 г, 0,71 ммоль), полученный в Примере Получения 295, и 3-[(4-метоксифенил)метокси]изоксазол-5-карбальдегид (0,122 г, 0,71 ммоль), полученный в Примере Получения 61, растворяли в 2,3 мл DCE. Добавляли натрий триацетоксиборгидрид (0,225 г, 1,06 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного раствора бикарбоната натрия реакционный раствор экстрагировали DCM и очищали колоночной хроматографией. Полученное соединение растворяли в 2 мл метанола. Добавляли NaBH4 (0,053 г, 1,41 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор разбавляли водой и экстрагировали этилацетатом. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,1 г, 30%).
1H-ЯМР (CDCl3) δ 7,87 (2H, d), 7,54 (1H, t), 7,34 (2H, d), 7,20 (1H, d), 6,90 (2H, d), 6,69 (2H, d), 6,53 (1H, d), 5,81 (1H, s), 5,25 (1H, m), 4,40 (2H, d), 3,80 (3H, s), 2,52 (2H, m), 2,18 (2H, m), 1,83 (1H, m), 1,72 (1H, m).
Пример получения 297: 1-бром-3-(циклопентокси)бензол
Целевое соединение было получено способом, раскрытым в WO 2014/209034 A1.
1H-ЯМР (CDCl3) δ 7,11 (1H, t), 7,02 (2H, m), 6,80 (1H, dd), 4,72 (1H, m), 1,94-1,73 (6H, m), 1,62 (2H, m)
Пример получения 298: 3,6-дихлор-2-циклобутокси-пиридин
Стадия A: 6-хлор-2-циклобутокси-3-нитро-пиримидин
2,6-дихлор-3-нитро-пиримидин (1,93 г, 10,0 ммоль) и циклобутанол (0,645 г, 9,0 ммоль) вводили в реакцию таким же образом, как в Примере Получения 227, с получением целевого соединения (1,92 г, 93%).
1H-ЯМР (CDCl3) δ 8,27 (1H, d), 7,04 (2H, t), 5,39 (1H, m), 2,56 (2H, m), 2,30 (2H, m), 1,93 (1H, m), 1,78 (1H, m)
Стадия B: 3,6-дихлор-2-циклобутокси-пиримидин
Метанол (60 мл) добавляли к гексагидрату хлорида никеля (II) (NiCl2 6H2O) (1,0 г, 4,21 ммоль), и затем постепенно добавляли боргидрид натрия (0,30 г, 7,93 ммоль). Смесь перемешивали в течение 30 минут и добавляли 6-хлор-2-циклобутокси-3-нитро-пиримидин (1,92 г, 8,40 ммоль), полученный на Стадии A. Боргидрид натрия (0,65 г, 17,2 ммоль) медленно добавляли в течение 10 минут, и смесь перемешивали в течение 30 минут. Продукт реакции фильтровали через Целит, и фильтрат концентрировали при пониженном давлении и экстрагировали водой и EtOAc. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией для получения 6-хлор-2-циклобутокси-пиридин-3-иламина (1,37 г, 82%).
6-хлор-2-циклобутокси-пиридин-3-иламин (0,60 г, 3,0 ммоль), хлорид меди (II) (0,484 г, 3,6 ммоль) и tBuONO (0,464 г, 4,5 ммоль) вводили в реакцию таким же образом, как на Стадии C Примера Получения 84, с получением целевого соединения (0,341 г, 52%).
1H-ЯМР (CDCl3) δ 7,58 (1H, d), 6,87 (1H, d), 5,26 (1H, m), 2,53 (2H, m), 2,24 (2H, m), 1,88 (1H, m), 1,74 (1H, m)
Пример получения 299: 2-хлор-6-циклобутилсульфанил-пиридин
Целевое соединение было получено способом, раскрытым в WO 2014/209034 A1.
1H-ЯМР (CDCl3) δ 7,40 (1H, t), 6,98 (2H, m), 4,30 (1H, m), 2,56 (2H, m), 2,08 (4H, m)
Пример получения 300: 2-хлор-6-циклопропилметокси-4-метил-пиридин
Циклопропилметанол (0,979 г, 13,58 ммоль) и 2,6-дихлор-4-метил-пиридин (2 г, 12,34 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,62 г, 66%).
1H-ЯМР (CDCl3) δ 6,75 (1H, s), 6,43 (1H, s), 5,18 (1H, m), 2,48 (2H, m), 2,30 (3H, s), 2,14 (2H, m), 1,84 (1H, m), 1,68 (1H, m).
Пример получения 301: 2-хлор-6-изопропокси-пиразин
Изопропанол (1,85 мл, 24,16 ммоль) и 2,6-дихлорпиразин (3 г, 20,13 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (2,77 г, 79%).
1H-ЯМР (CDCl3) δ 8,04-8,09 (2H, d), 5,28 (1H, m), 1,36 (6H, d).
Пример получения 302: 2-хлор-6-этокси-пиразин
Этанол (1,17 мл, 24,16 ммоль) и 2,6-дихлорпиразин (3 г, 20,13 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (2,63 г, 82%).
1H-ЯМР (CDCl3) δ 8,12 (2H, d), 4,39 (2H, q), 1,40 (3H, t).
Пример получения 303: метиловый эфир {(R)-1-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты
Стадия A: диэтиловый эфир 2-(R)-1-трет-бутоксикарбонил-пирролидин-3-ил)-малоновой кислоты
Трет-бутиловый эфир (R)-3-гидрокси-пирролидин-1-карбоновой кислоты (1 г, 5,34 ммоль) растворяли в 18 мл MC. Et3N (2,22 мл, 16,02 ммоль) добавляли при 0°C и затем добавляли MsCl (0,62 мл, 8,01 ммоль). Смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор разбавляли водой и экстрагировали MC. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией для получения трет-бутилового эфира (R)-3-метансульфонилокси-пирролидин-1-карбоновой кислоты. В другой колбе диэтилмалонат (1,7 мл, 11,3 ммоль) растворяли в 10 мл этанола. Добавляли NaOEt (21 вес.%, 4,2 мл, 11,3 ммоль), и смесь перемешивали при 40°C в течение 1 часа. Полученный трет-бутиловый эфир (R)-3-метансульфонилокси-пирролидин-1-карбоновой кислоты (1,5 г, 5,65 ммоль) растворяли в 8 мл этанола и добавляли. Смесь перемешивали при 80°C в течение 16 часов. Реакционный раствор подкисляли до pH 2 при помощи 6Н водного раствора HCl и экстрагировали простым эфиром. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,785 г, 44%).
1H-ЯМР (CDCl3) δ 4,21 (4H, m), 3,63 (1H, m), 3,47 (1H, m), 3,25 (2H, m), 3,01 (1H, m), 2,80 (1H, m), 2,06 (1H, m), 1,62 (1H, m), 1,42 (9H, s), 1,26 (6H, m).
Стадия B: трет-бутиловый эфир (R)-3-карбоксиметил-пирролидин-1-карбоновой кислоты
Диэтиловый эфир 2-(R)-1-трет-бутоксикарбонил-пирролидин-3-ил)-малоновой кислоты (0,785 г, 2,38 ммоль), полученный на Стадии A, растворяли в 8 мл THF. Добавляли 6Н NaOH (2 мл, 11,9 ммоль), и смесь перемешивали при 40°C в течение 16 часов. Реакционный раствор подкисляли до рН 2 при помощи водного раствора 6Н HCl и экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и концентрировали при пониженном давлении для получения 2-(R)-1-трет-бутоксикарбонил-пирролидин-3-ил)-малоновой кислоты. Полученное соединение растворяли в 4,5 мл толуола. Добавляли 0,06 мл DMSO, и смесь перемешивали в течение 4 часов при нагревании с обратным холодильником. После добавления 10%-й лимонной кислоты реакционный раствор экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,29 г, 53%).
1H-ЯМР (CDCl3) δ 3,62 (1H, m), 3,45 (1H, m), 3,29 (1H, m), 2,96 (1H, m), 2,56 (1H, m), 2,44 (2H, d), 2,07 (1H, m), 1,57 (1H, m), 1,44 (9H, s).
Стадия C: метиловый эфир (R)-1-(2,6-дифтор-4-нитро-фенил)-пирролидин-3-ил]-уксусной кислоты
Трет-бутиловый эфир (R)-3-карбоксиметил-пирролидин-1-карбоновой кислоты (0,29 г, 1,26 ммоль), полученный на Стадии B, растворяли в 10 мл MC. 0,25 M CH2N2 (10 мл, 2,53 ммоль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении для получения трет-бутилового эфира (R)-3-метоксикарбонилметил-пирролидин-1-карбоновой кислоты. Полученное соединение растворяли в 5 мл MC. HCl (1,58 мл, 6,32 ммоль, раствор 4 М в 1,4-диоксане) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении для получения гидрохлоридной соли метилового эфира (R)-пирролидин-3-ил-уксусной кислоты. Полученное соединение и 3,4,5-трифторнитробензол (0,163 мл, 1,42 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера Получения 84, с получением целевого соединения (0,38 г, 98%).
1H-ЯМР (CDCl3) δ 7,73 (2H, m), 3,91-3,75 (3H, m), 3,71 (3H, s), 3,48 (1H, m), 2,64 (1H, m), 2,48 (2H, m), 2,18 (1H, m), 1,65 (1H, m).
Стадия D: метиловый эфир [(R)-1-(4-амино-2,6-дифтор-фенил)-пирролидин-3-ил]-уксусной кислоты
Метиловый эфир (R)-1-(2,6-дифтор-4-нитро-фенил)-пирролидин-3-ил]-уксусной кислоты (0,38 г, 1,26 ммоль), полученный на Стадии C, растворяли в 4 мл EtOAc. Добавляли 0,04 г 10 вес.% Pd/C, и смесь перемешивали в течение 24 часов в атмосфере водорода. Твердые вещества отфильтровывали и концентрировали при пониженном давлении с получением целевого соединения (0,315 г, 92%).
1H-ЯМР (CDCl3) δ 6,17 (2H, m), 3,66 (3H, s), 3,41 (1H, m), 3,28 (2H, m), 2,98 (1H, m), 2,66 (1H, m), 2,45 (2H, m), 2,13 (1H, m), 1,60 (1H, m).
Стадия E: метиловый эфир [(R)-1-(4-бром-2,6-дифтор-фенил)-пирролидин-3-ил]-уксусной кислоты
Метиловый эфир [(R)-1-(4-амино-2,6-дифтор-фенил)-пирролидин-3-ил]-уксусной кислоты (0,315 г, 1,16 ммоль), полученный на Стадии D, растворяли в 3 мл CH3CN. Добавляли CSA (0,345 г, 1,40 ммоль), трет-бутил нитрит (0,166 мл, 1,40 ммоль), TBAB (0,751 г, 2,33 ммоль) и CuBr2 (0,003 г, 0,01 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. Твердые вещества отфильтровывали и концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,2 г, 51%).
1H-ЯМР (CDCl3) δ 6,93 (2H, m), 3,68 (3H, s), 3,59 (2H, m), 3,47 (1H, m), 3,23 (1H, m), 2,61 (1H, m), 2,45 (2H, m), 2,11 (1H, m), 1,59 (1H, m).
Стадия F: метиловый эфир {(R)-1-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты
Метиловый эфир [(R)-1-(4-бром-2,6-дифтор-фенил)-пирролидин-3-ил]-уксусной кислоты (0,225 г, 0,67 ммоль), полученный на Стадии E, вводили в реакцию таким же образом, как в Примере Получения 294, с получением целевого соединения (0,09 г, 33%).
1H-ЯМР (CDCl3) δ 7,16 (2H, m), 3,71 (5H, m), 3,60 (1H, m), 3,32 (1H, m), 2,61 (1H, m), 2,44 (2H, d), 2,11 (1H, m), 1,61 (1H, m), 1,30 (12H, s)
Пример получения 304: этиловый эфир 3-[8-фтор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил) тиохроман-2-ил]пропановой кислоты
Стадия A: 4-бром-2-фтор-бензолтиол
Целевое соединение было получено способом, раскрытым в WO 2006/21759 A1.
1H-ЯМР (CDCl3) δ 7,24 (2H, m), 7,16 (2H, m), 3,58 (1H, s)
Стадия B: 6-бром-8-фтор-4-оксо-тиохроман-2-карбоновая кислота
4-бром-2-фтор-бензолтиол (3,0 г, 14,48 ммоль) и фуран-2,5-дион (1,4 г, 14,48 ммоль) растворяли в 50 мл толуола и нагревали до 50°C. Медленно добавляли TEA (0,1 мл), и смесь перемешивали при 50°C в течение 1 часа. Реакционный раствор концентрировали при пониженном давлении, растворяли в 50 мл DCM и охлаждали до 0°C. Добавляли AlCl3 (2,9 г, 21,73 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. После медленного добавления по каплям холодного концентрированного раствора HCl, реакционный раствор экстрагировали DCM. Органический растворитель высушивали с помощью MgSO4, концентрировали при пониженном давлении и отверждали с помощью Et2O с получением целевого соединения (2,3 г, 52%).
1H-ЯМР (DMSO-d6) δ 7,89 (2H, m), 4,55 (1H, t), 3,14 (2H, m)
Стадия C: метиловый эфир 6-бром-8-фтор-4-оксо-тиохроман-2-карбоновой кислоты
6-бром-8-фтор-4-оксо-тиохроман-2-карбоновую кислоту (2,3 г, 7,54 ммоль), полученную на Стадии B, растворяли в 50 мл метанола. Добавляли концентрированную серную кислоту (0,8 мл), и смесь перемешивали в течение 18 часов при нагревании с обратным холодильником. Реакционный раствор концентрировали при пониженном давлении, экстрагировали EtOAc, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (1,5 г, 62%).
1H-ЯМР (CDCl3) δ 8,08 (1H, m), 7,37 (1H, dd), 4,15 (1H, t), 3,76 (3H, s), 3,18 (2H, d)
Стадия D: метиловый эфир 6-бром-8-фтор-тиохроман-2-карбоновой кислоты
Метиловый эфир 6-бром-8-фтор-4-оксо-тиохроман-2-карбоновой кислоты (1,5 г, 4,70 ммоль), полученный на Стадии C, растворяли в 20 мл TFA. Добавляли триэтилсилан (1,5 мл, 9,40 ммоль), и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор концентрировали при пониженном давлении, экстрагировали EtOAc, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,34 г, 24%).
1H-ЯМР (CDCl3) δ 7,06 (2H, m), 4,01 (1H, m), 3,78 (3H, s), 3,01~2,93 (1H, m), 2,84~2,77 (1H, m), 2,34~2,20 (2H, m)
Стадия E: 6-бром-8-фтор-тиохроман-2-карбоновая кислота
Метиловый эфир 6-бром-8-фтор-тиохроман-2-карбоновой кислоты (0,340 г, 1,11 ммоль), полученный на Стадии D, растворяли в 5 мл каждого из THF, MeOH и 1Н водного раствора NaOH, и смесь перемешивали при комнатной температуре в течение 2 часов. После удаления органического растворителя реакционный раствор подкисляли до рН 3 при помощи 1Н водного раствора HCl и экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали с помощью MgSO4 и концентрировали при пониженном давлении с получением целевого соединения (0,280 г, 86%).
Стадия F: (6-бром-8-фтор-тиохроман-2-ил)-метанол
6-бром-8-фтор-тиохроман-2-карбоновую кислоту (0,28 г, 0,96 ммоль), полученную на Стадии E, растворяли в 10 мл THF и охлаждали до -20°C. Добавляли изобутил хлорформиат (0,14 мл, 1,06 ммоль) и NMM (0,12 мл, 1,10 ммоль), и смесь перемешивали при той же температуре в течение 1,5 часов. В другом реакторе NaBH4 (0,073 г, 1,92 ммоль) растворяли в 4 мл THF и 1 мл MeOH и охлаждали до -78°C. Вышеупомянутый реакционный раствор фильтровали через Целит и добавляли. Смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор экстрагировали EtOAc, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,175 г, 66%).
1H-ЯМР (CDCl3) δ 7,06 (2H, m), 3,77 (2H, m), 3,49 (1H, m), 2,90~2,73 (2H, m), 2,22 (1H, m), 1,88 (2H, m)
Стадия G: этиловый эфир (E)-3-(6-бром-8-фтор-тиохроман-2-ил)проп-2-еновой кислоты
Оксалил хлорид (0,1 мл, 0,95 ммоль) добавляли к 5 мл DCM и охлаждали до -78°C. Медленно добавляли DMSO (0,11 мл, 1,57 ммоль), и смесь перемешивали в течение 0,5 часов. Последовательно добавляли раствор, в котором (6-бром-8-фтор-тиохроман-2-ил)-метанол (0,175 г, 0,63 ммоль), полученный на Стадии F, растворяли в 2 мл DCM и TEA (0,35 мл, 2,52 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли (карбэтоксиметилен)трифенилфосфоран (0,263 г, 0,76 ммоль), и смесь перемешивали при комнатной температуре в течение 18 часов. После добавления воды реакционный раствор экстрагировали DCM для отделения органического слоя. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,180 г, 83%).
1H-ЯМР (CDCl3) δ 7,06 (2H, m), 6,91 (1H, m), 6,03 (1H, d), 4,19 (2H, q), 4,01 (1H, m), 2,82 (2H, m), 2,28 (1H, m), 1,95 (1H, m), 1,28 (3H, t)
Стадия H: этиловый эфир 3-(6-бром-8-фтор-тиохроман-2-ил)пропановой кислоты
Этиловый эфир (E)-3-(6-бром-8-фтор-тиохроман-2-ил)-уксусной кислоты (0,180 г, 0,52 ммоль), полученный на Стадии G, растворяли в 10 мл DME. Постепенно добавляли п-толуолсульфонил гидразид (0,680 г, 3,65 нмоль) и нагревали до 90°C. Добавляли ацетат натрия (0,427 г, 5,20 ммоль, водный раствор 1,4 М), и смесь перемешивали в течение 18 часов при нагревании с обратным холодильником. После добавления воды реакционный раствор экстрагировали DCM. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,030 г, 17%).
1H-ЯМР (CDCl3) δ 7,02 (2H, m), 4,14 (2H, q), 3,29 (1H, m), 2,83 (2H, m), 2,49 (2H, m), 2,21 (1H, m), 2,03 (1H, m), 1,94 (1H, m), 1,78 (1H, m), 1,25 (3H, t)
Стадия I: этиловый эфир 3-[8-фтор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)тиохроман-2-ил]пропановой кислоты
Этиловый эфир 3-(6-бром-8-фтор-тиохроман-2-ил)-пропионовой кислоты (0,070 мг, 0,21 ммоль), полученный на Стадии H, вводили в реакцию таким же образом, как на Стадии D Примера Получения 1, с получением целевого соединения (0,046 г, 57%).
1H-ЯМР (CDCl3) δ 7,27 (2H, m), 4,14 (2H, q), 3,30 (1H, m), 2,88 (2H, m), 2,51 (2H, m), 2,22 (1H, m), 2,00 (2H, m), 1,82 (1H, m), 1,32 (12H, s), 1,26 (3H, t)
Пример получения 305: 1-йод-2,3-дипропокси-бензол
7 мл DMF добавляли к 3-йод-бензол-1,2-диолу (0,28 г, 1,18 ммоль), 1-йодпропану (0,3 мл, 2,96 ммоль) и K2CO3 (0,49 г. 3,54 ммоль), и смесь перемешивали при 80°C в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (0,24 г, 64%).
1H-ЯМР (CDCl3) δ 7,32 (1H, m), 6,85 (1H, m), 6,74 (1H, t), 3,94 (4H, m), 1,83 (4H, m), 1,07 (6H, m)
Пример получения 306: 2-(циклопропилметокси)-6-йод-3-метокси-пиридин
Стадия A: 2-бром-6-йод-3-метокси-пиридин
Целевое соединение было получено способом, раскрытым в WO 2006/21759 A1.
1H-ЯМР (MeOH-d4) δ 7,64 (1H, d), 7,08 (1H, d), 3,83 (3H, s)
Стадия B: 2-(циклопропилметокси)-6-йод-3-метокси-пиридин
Циклопропил метанол (0,54 мл, 6,62 ммоль) растворяли в сухом DMF (5 мл). NaH (60%) (0,248 г, 6,21 ммоль) медленно добавляли по каплям при 0°C, и смесь перемешивали в течение 30 минут. Добавляли 2-бром-6-йод-3-метокси-пиридин (1,3 г, 4,14 ммоль), полученный на Стадии A, и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой очищали колоночной хроматографией с получением целевого соединения (0,89 г, 70%).
1H-ЯМР (CDCl3) δ 7,20 (1H, d), 6,73 (1H, d), 4,19 (2H, d), 3,84 (3H, s), 1,31 (1H, m), 0,60 (2H, m), 0,38 (2H, m)
Пример получения 307: 2-(циклобутокси)-6-йод-3-метокси-пиридин
2-бром-6-йод-3-метокси-пиридин (1,5 г, 4,78 ммоль) и циклобутанол (0,6 мл, 7,17 ммоль) вводили в реакцию таким же образом, как в Примере Получения 306, с получением целевого соединения (0,92 г, 63%).
1H-ЯМР (CDCl3) δ 7,19 (1H, d), 6,72 (1H, d), 5,22 (1H, m), 3,83 (3H, s), 2,48 (2H, m), 2,21 (2H, m), 1,83 (1H, m), 1,67 (1H, m)
Пример получения 308: 6-(циклобутокси)-1H-индол
1H-индол-6-ол (0,1 г, 0,75 ммоль) и бромциклобутан (0,203 г, 1,50 ммоль) вводили в реакцию таким же образом, как в Примере Получения 12, с получением целевого соединения (0,068 г, 28%).
1H-ЯМР (CDCl3) δ 7,99 (1H, ушир.), 7,48 (1H, d), 7,07 (1H, m), 6,77 (1H, m), 6,73 (1H, m), 6,46 (1H, m), 4,66 (1H, m), 2,46 (2H, m), 2,20 (2H, m), 1,85 (1H, m), 1,70 (1H, m)
Пример получения 309: 6-(циклобутокси)-1H-индазол
1H-индазол-6-ол (0,5 г, 3,72 ммоль) и бромциклобутан (0,7 мл, 1,50 ммоль) вводили в реакцию таким же образом, как в Примере Получения 12, с получением целевого соединения (0,4 г, 57%).
1H-ЯМР (CDCl3) δ 10,07 (1H, ушир.), 7,96 (1H, m), 7,60 (1H, m), 6,78 (1H, m), 6,73 (1H, m), 4,68 (1H, m), 2,50 (2H, m), 2,22 (2H, m), 1,89 (1H, m), 1,74 (1H, m)
Пример получения 310: 5-(циклобутокси)-1H-индол
1H-индол-5-ол (0,1 г, 0,75 ммоль) и бромциклобутан (0,203 г, 1,50 ммоль) вводили в реакцию таким же образом, как в Примере Получения 12, с получением целевого соединения (0,021 г, 19%).
1H-ЯМР (CDCl3) δ 8,06 (1H, s), 7,27 (1H, m), 7,16 (1H, t), 7,00 (1H, m), 6,81 (1H, m), 6,45 (1H, m), 4,66 (1H, m), 2,47 (2H, m), 2,19 (2H, m), 1,85 (1H, m), 1,69 (1H, m)
Пример получения 311: 6-(циклопропилметокси)-1H-индол
1H-индол-6-ол (0,05 г, 0,38 ммоль) и бромметилциклопропан (0,061 г, 0,45 ммоль) вводили в реакцию таким же образом, как в Примере Получения 12, с получением целевого соединения (0,018 г, 24%).
1H-ЯМР (CDCl3) δ 7,99 (1H, s), 7,50 (1H, d), 7,09 (1H, m), 6,89 (1H, m), 6,81 (1H, m), 6,47 (1H, m), 3,83 (2H, d), 1,31 (1H, m), 0,64 (2H, m), 0,36 (2H, m)
Пример получения 312: 2-хлор-4-(4-хлор-фенокси)-пиримидин
2,4-дихлор-пиримидин (1,16 г, 7,78 ммоль) и 4-хлор-фенол (1,0 г, 7,78 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,735 г, 39%).
1H-ЯМР (CDCl3) δ 8,45 (1H, d), 7,40 (2H, m), 7,10 (2H, m), 6,83 (1H, d)
Пример получения 313: 2-хлор-4-фенокси-пиримидин
2,4-дихлор-пиримидин (1,6 г, 10,62 ммоль) и фенол (1,0 г, 10,62 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,9 г, 86%).
1H-ЯМР (CDCl3) δ 8,43 (1H, d), 7,46 (2H, m), 7,31 (1H, m), 7,15 (2H, m), 6,77 (1H, d)
Пример получения 314: 2-хлор-4-(4-фторфенокси)-пиримидин
2,4-дихлор-пиримидин (1,3 г, 8,92 ммоль) и 4-фторфенол (1,0 г, 8,92 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,1 г, 55%).
1H-ЯМР (CDCl3) δ 8,44 (1H, d), 7,12 (4H, d), 6,81 (1H, d)
Пример получения 315: 2-хлор-4-(4-пиридин-3-илокси)-пиримидин
2,4-дихлор-пиримидин (1,57 г, 10,51 ммоль) и пиридин-3-ол (1,0 г, 10,51 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,52 г, 24%).
1H-ЯМР (CDCl3) δ 8,56 (1H, dd), 8,53 (1H, d), 8,50 (1H, d), 7,57 (1H, m), 7,40 (1H, m), 6,93 (1H, d)
Пример получения 316: 2-хлор-4-(4-фторфенокси)-пиразин
2,6-дихлор-пиразин (1,3 г, 8,92 ммоль) и 4-фторфенол (1,0 г, 8,92 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,1 г, 55%).
1H-ЯМР (CDCl3) δ 8,29 (2H, s), 7,12 (4H, m)
Пример получения 317: 2-хлор-4-(4-метокси-фенокси)-пиримидин
2,4-дихлор-пиримидин (1,2 г, 8,05 ммоль) и 4-метокси-фенол (1,0 г, 8,05 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,5 г, 79%).
1H-ЯМР (CDCl3) δ 8,41 (1H, d), 7,07 (2H, m), 6,94 (2H, m), 6,74 (1H, d), 3,83 (3H, s)
Пример получения 318: 2-хлор-4-(4-фторфенокси)-6-метил-пиримидин
2,4-дихлор-6-метил-пиримидин (1,45 г, 8,92 ммоль) и 4-фторфенол (1,0 г, 8,92 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,7 г, 80%).
1H-ЯМР (CDCl3) δ 7,11 (4H, m), 6,61 (1H, d)
Пример получения 319: 2-хлор-4-п-толилоксипиримидин
2,4-дихлор-пиримидин (1,38 г, 9,24 ммоль) и 4-метил-фенол (1,0 г, 9,24 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,4 г, 69%).
1H-ЯМР (CDCl3) δ 8,41 (1H, d), 7,24 (2H, m), 7,05 (2H, m), 6,75 (1H, d), 2,38 (3H, s)
Пример получения 320: 2-хлор-4-(3,4-дифтор-фенокси)-пиримидин
2,4-дихлор-пиримидин (1,14 г, 7,69 ммоль) и 3,4-дифтор-фенол (1,0 г, 7,69 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,8 г, 43%).
1H-ЯМР (CDCl3) δ 8,47 (1H, d), 7,24 (1H, m), 7,04 (1H, m), 6,93 (1H, m), 6,85 (1H, d)
Пример получения 321: этиловый эфир 2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты
2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол (0,2 г, 0,78 ммоль), полученный на Стадии B Примера Получения 16, этиловый эфир 2-гидроксиметил-циклопропанкарбоновой кислоты (0,17 г, 1,17 ммоль), трифенилфосфин (0,51 г, 1,95 ммоль) и диизопропил азодикарбоксилат (0,39 г, 1,95 ммоль) вводили в реакцию таким же образом, как в Примере Получения 62, с получением целевого соединения (0,25 г, 84%).
1H-ЯМР (CDCl3) δ 7,30 (2H, m), 4,13 (3H, m), 4,03 (1H, m), 1,86 (1H, m), 1,64 (1H, m), 1,32 (12H, s), 1,26 (4H, m), 0,93 (1H, m)
Пример получения 322: этиловый эфир 2-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты
2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол (0,75 г, 2,8 ммоль), этиловый эфир 2-гидроксиметил-циклопропанкарбоновой кислоты (0,48 г, 6,9 ммоль), трифенилфосфин (1,80 г, 6,9 ммоль) и диизопропил азодикарбоксилат (1,39 г, 6,9 ммоль) вводили в реакцию таким же образом, как в Примере Получения 62, с получением целевого соединения (0,82 г, 75%).
1H-ЯМР (CDCl3) δ 7,58 (1H, s), 7,41 (1H, d), 4,13 (3H, m), 3,99 (1H, m), 1,89 (1H, m), 1,65 (1H, m), 1,32 (12H, s), 1,25 (4H, m), 0,95 (1H, m)
Пример получения 323: 1-бром-3-циклобутилметокси-бензол
3-бромфенола (1,2 г, 6,94 ммоль), Cs2CO3 (4,52 г, 13,9 ммоль) и бромметил-циклобутан (0,86 мл, 7,63 ммоль) вводили в реакцию таким же образом, как в Примере Получения 28, с получением целевого соединения (1,70 г, 99%).
1H-ЯМР (CDCl3) δ 7,12 (1H, m), 7,06 (2H, m), 6,83 (1H, m), 3,90 (2H, d), 2,76 (1H, m), 2,14 (2H, m), 1,96 (4H, m)
Пример получения 324: 2-хлор-6-циклобутилметокси-пиридин
6-хлор-пиридин-2-ол (2,0 г, 15,4 ммоль), K2CO3 (4,27 г, 30,1 ммоль) и бромметил-циклобутан (1,91 мл, 17,0 ммоль) вводили в реакцию таким же образом, как в Примере Получения 12, с получением целевого соединения (2,30 г, 75%).
1H-ЯМР (CDCl3) δ 7,50 (1H, t), 6,87 (1H, d), 6,64 (1H, d), 4,26 (2H, d), 2,76 (1H, m), 2,12 (2H, m), 1,94 (4H, m)
Пример получения 325: 2-бром-4-циклобутилметокси-1-метил-бензол
3-бром-4-метил-фенол (0,5 г, 2,67 ммоль), Cs2CO3 (1,74 г, 5,35 ммоль) и бромметил-циклобутан (0,33 мл, 2,94 ммоль) вводили в реакцию таким же образом, как в Примере Получения 28, с получением целевого соединения (0,65 г, 95%).
1H-ЯМР (CDCl3) δ 7,09 (2H, m), 6,76 (1H, m), 3,88 (2H, d), 2,76 (1H, m), 2,31 (3H, s), 2,13 (2H, m), 1,95 (4H, m)
Пример получения 326: 4-бром-1-хлор-2-циклопропилметокси-бензол
5-бром-2-хлор-фенол (0,5 г, 2,41 ммоль), Cs2CO3 (1,60 г, 4,82 ммоль) и бромметил-циклопропан (0,26 мл, 2,65 ммоль) вводили в реакцию таким же образом, как в Примере Получения 28, с получением целевого соединения (0,60 г, 95%).
1H-ЯМР (CDCl3) δ 7,22 (1H, d), 7,02 (2H, m), 3,87 (2H, d), 1,32 (1H, m), 0,67 (2H, m), 0,40 (2H, m)
Пример получения 327: 4-бром-2-циклопропилметокси-1-метил-бензол
5-бром-2-метил-фенол (0,5 г, 2,67 ммоль), Cs2CO3 (1,70 г, 5,35 ммоль) и бромметил-циклопропан (0,29 мл, 2,94 ммоль) вводили в реакцию таким же образом, как в Примере Получения 28, с получением целевого соединения (0,63 г, 98%).
1H-ЯМР (CDCl3) δ 6,97 (2H, m), 6,89 (1H, s), 3,79 (2H, d), 2,18 (3H, s), 1,26 (1H, m), 0,63 (2H, m), 0,35 (2H, m)
Пример получения 328: 7-бром-5-хлор-2-метил-бензофуран
Стадия A: 2-бром-4-хлор-1-проп-2-инилокси-бензол
2-бром-4-хлор-фенол (1,0 г, 4,82 ммоль), 3-бромпропин (0,79 г, 5,30 ммоль) и K2CO3 (1,47 г, 10,6 ммоль) вводили в реакцию таким же образом, как в Примере Получения 12, с получением целевого соединения (1,1 г, 93%).
1H-ЯМР (CDCl3) δ 7,55 (1H, d), 7,24 (1H, m), 6,99 (1H, d), 4,76 (2H, d), 2,55 (1H, t)
Стадия B: 7-бром-5-хлор-2-метил-бензофуран
2-бром-4-хлор-1-проп-2-инилокси-бензол (1,1 г, 4,48 ммоль), полученный на Стадии A, и фторид цезия (0,95 г, 6,27 ммоль) растворяли в 7,5 мл диэтил фениламина и перемешивали при 210°C в течение 4 часов. Реакционный раствор охлаждали до комнатной температуры и разбавляли гексаном. После трехкратной промывки 1Н HCl отделяли органический слой. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,65 г, 59%).
1H-ЯМР (CDCl3) δ 7,37 (2H, d), 6,39 (1H, s), 2,49 (3H, s)
Пример получения 329: 2-хлор-4-циклобутокси-5-фтор-пиримидин
2,4-дихлор-5-фтор-пиримидин (0,50 г, 2,99 ммоль) и циклобутанол (0,26 мл, 3,29 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,57 г, 89%).
1H-ЯМР (400 МГц, CDCl3); δ 8,17 (d, 1H), 5,37-5,29 (m, 1H), 2,55-2,48 (m, 2H), 2,30-2,20 (m, 2H), 1,94-1,86 (m, 1H), 1,77-1,67 (m, 1H)
Пример получения 330: 2-хлор-4-циклопропилметокси-5-фтор-пиримидин
2,4-дихлор-5-фтор-пиримидин (0,50 г, 2,99 ммоль) и циклопропилметанол (0,27 мл, 3,29 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,52 г, 81%).
1H-ЯМР (400 МГц, CDCl3); δ 8,19-8,18 (d, 1H), 4,32-4,31 (d, 2H), 1,37-1,30 (m, 1H), 0,70-0,65 (m, 2H), 0,43-0,39 (m, 2H)
Пример получения 331: 2-хлор-5-фтор-4-изобутокси-пиримидин
2,4-дихлор-5-фтор-пиримидин (0,50 г, 2,99 ммоль) и 2-метил-пропан-1-ол (0,30 мл, 3,29 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,51 г, 79%).
1H-ЯМР (400 МГц, CDCl3); δ 8,18 (d, 1H), 4,25-4,10 (d, 2H), 2,21-2,11 (m, 1H), 1,05-1,03 (d, 6H)
Пример получения 332: 2-хлор-6-(3-метокси-пропокси)-пиридин
2,6-дихлорпиридин (0,50 г, 3,38 ммоль) и 3-метокси-пропан-1ol (0,40 мл, 4,05 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,37 г, 51%).
1H-ЯМР (400 МГц, CDCl3); δ 8,18 (d, 1H), 4,25-4,10 (d, 2H), 2,21-2,11 (m, 1H), 1,05-1,03 (d, 6H)
Пример получения 333: 2-хлор-6-(тетрагидро-тиопиран-4-илокси)-пиридин
2,6-дихлорпиридин (0,50 г, 3,38 ммоль) и тетрагидро-2H-тиопиран-4-ол (0,44 г, 3,72 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,36 г, 44%).
1H-ЯМР (400 МГц, CDCl3); δ 8,18 (d, 1H), 4,25-4,10 (d, 2H), 2,21-2,11 (m, 1H), 1,05-1,03 (d, 6H)
Пример получения 334: 2-хлор-5-фтор-4-пропокси-пиримидин
2,4-дихлор-5-фтор-пиримидин (0,40 г, 2,40 ммоль) и пропан-1-ол (0,20 мл, 2,64 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,35 г, 77%).
1H-ЯМР (500 МГц, CDCl3); δ 8,17-8,16 (d, 1H), 4,43-4,41 (t, 2H), 1,89-1,82 (m, 1H), 1,05-1,02 (t, 3H)
Пример получения 335: 2-хлор-4-(3-метил-бутокси)-пиримидин
2,4-дихлорпиримидин (0,50 г, 3,36 ммоль) и 3-метилбутан-1-ол (0,40 мл, 3,69 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,59 г, 87%).
1H-ЯМР (500 МГц, CDCl3); δ 8,27-8,25 (d, 1H), 6,63-6,62 (d, 1H), 4,41-4,39 (t, 2H), 1,80-1,75 (m, 1H), 1,70-1,65 (q, 2H), 0,96-0,94 (d, 6H)
Пример получения 336: 2-хлор-4-(3-метокси-пропокси)-пиримидин
2,4-дихлорпиримидин (0,50 г, 3,36 ммоль) и 3-метоксипропан-1-ол (0,35 мл, 3,69 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,34 г, 50%).
1H-ЯМР (500 МГц, CDCl3); δ 8,28-8,27 (d, 1H), 6,65-6,64 (d, 1H), 4,48-4,45 (t, 2H), 3,52-3,50 (t, 2H), 3,34 (s, 3H), 2,05-2,02 (m, 2H)
Пример получения 337: 5-бром-4-циклопропилметоксиметил-2-метил-тиазол
Стадия A: 4-циклопропилметоксиметил-2-метил-тиазол
Циклопропил-метанол (0,65 мл, 7,93 ммоль) и 4-хлорметил-2-метил-тиазол (0,78 г, 5,28 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,83 г, 80%).
1H-ЯМР (400 МГц CDCl3); δ 7,06 (s, 1H), 4,61 (s, 2H), 3,46-3,40 (d, 2H), 2,71 (s, 3H), 1,15-1,09 (m, 1H), 0,58-0,53 (m, 2H), 0,25-0,21 (m, 2H)
Стадия B: 5-бром-4-циклопропилметоксиметил-2-метил-тиазол
4-циклопропилметоксиметил-2-метил-тиазол (0,52 г, 2,64 ммоль) и 1,3-дибром-5,5-диметил-имидазолин-2,4-дион (0,74 г, 2,64 ммоль) вводили в реакцию таким же образом, как на Стадии B Примера Получения 6, с получением целевого соединения (0,66 г, 96%).
1H-ЯМР (400 МГц CDCl3); δ 4,46 (s, 2H), 3,39-3,38 (d, 2H), 2,66 (s, 3H), 1,16-1,09 (m, 1H), 0,57-0,53 (m, 2H), 0,25-0,22 (m, 2H)
Пример получения 338: 4-бром-2-циклобутоксиметил-тиофен
4-бром-2-хлорметил-тиофен (0,30 г, 1,42 ммоль) и циклобутанол (0,14 мл, 1,84 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,065 г, 19%).
1H-ЯМР (400 МГц CDCl3); δ 7,17-7,16 (d, 1H), 6,90 (d, 1H), 4,52 (s, 2H), 4,06-3,99 (m, 1H), 2,24-2,16 (m, 2H), 2,01-1,92 (m, 2H), 1,75-1,68 (m, 1H), 1,52-1,47 (m, 1H)
Пример получения 339: этиловый эфир 4-(4-бром-2,6-дифтор-фенокси)-бутановой кислоты
4-бром-2,6-дифтор-фенол (19,5 г, 93,3 ммоль), полученный на Стадии A Примера Получения 16, и этиловый эфир 4-бром-масляной кислоты (21,82 г, 112 ммоль) вводили в реакцию таким же образом, как на Стадии C Примера Получения 16, с получением целевого соединения (30,0 г, 99%).
1H-ЯМР (CDCl3) δ 7,09 (2H, m), 4,16 (4H, m), 2,57 (2H, t), 2,08 (2H, m), 1,28 (3H, t)
Пример получения 340: 2-хлор-4-(6-метил-пиридин-3-илокси)-пиримидин
2,4-дихлор-пиримидин (1,36 г, 9,16 ммоль) и 6-метил-пиридин-3-ол (1,0 г, 9,16 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,850 г, 42%).
1H-ЯМР (CDCl3) δ 8,47 (1H, d), 8,38 (1H, d), 7,44 (1H, m), 7,24 (1H, m), 6,89 (1H, d)
Пример получения 341: 2-хлор-4-(4 фенокси этила)-пиримидин
2,4-дихлор-пиримидин (1,22 г, 8,18 ммоль) и 4 фенола этила (1,0 г, 8,18 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,5 г, 78%).
1H-ЯМР (CDCl3) δ 8,41 (1H, d), 7,26 (2H, m), 7,06 (2H, m), 6,74 (1H, d), 2,67 (2H, q), 1,27 (3H, t)
Пример получения 342: 2-хлор-4-(3-фторфенокси)-пиримидин
2,4-дихлор-пиримидин (1,3 г, 8,92 ммоль) и 3-фторфенол (1,0 г, 8,92 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,2 г, 59%).
1H-ЯМР (CDCl3) δ 8,47 (1H, d), 7,40 (1H, m), 7,04~6,91 (3H, m), 6,84 (1H, d)
Пример получения 343: 2-хлор-4-(3,4-дифтор-фенокси)-6-метил-пиримидин
2,4-дихлор-6-метил-пиримидин (1,25 г, 7,69 ммоль) и 3,4-дифтор-фенол (1,0 г, 7,69 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,1 г, 55%).
1H-ЯМР (CDCl3) δ7,22 (1H, q), 7,03 (1H, m), 6,90 (1H, m), 6,67 (1H, s), 2,51 (3H, s)
Пример получения 344: 2-хлор-4-(пиридин-2-илокси)-пиримидин
2,4-дихлор-пиримидин (1,57 г, 10,51 ммоль) и пиридин-2-ол (1,0 г, 10,51 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,1 г, 4%).
1H-ЯМР (CDCl3) δ 8,52 (1H, d), 8,38 (1H, m), 7,85 (1H, m), 7,25 (1H, m), 7,15 (1H, d), 7,03 (1H, d)
Пример получения 345: 2-хлор-4-[4-(трифторметил)фенокси]пиримидин
2,4-дихлорпиримидин (2,0 г, 13,4 ммоль) и 4-(трифторметил)фенол (2,17 г, 13,4 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (2,62 г, 71%).
1H-ЯМР (CDCl3) δ 8,50 (1H, d), 7,72 (2H, d), 7,30 (2H, d), 6,89 (1H, d)
Пример получения 346: 2-хлор-4-[3-(трифторметил)фенокси]пиримидин
2,4-дихлорпиримидин (2,0 г, 13,4 ммоль) и 3-(трифторметил)фенол (2,17 г, 13,4 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (2,7 г, 73%).
1H-ЯМР (CDCl3) δ 8,50 (1H, d), 7,57 (2H, m), 7,44 (1H, m), 7,38 (1H, m), 6,88 (1H, d)
Пример получения 347: 2-хлор-4-метил-6-[4-(трифторметил)фенокси]пиримидин
2,6-дихлор-4-метил-пиримидин (3,0 г, 18,4 ммоль) и 4-(трифторметил)фенол (2,98 г, 18,4 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (3,2 г, 62%).
1H-ЯМР (CDCl3) δ 7,70 (2H, d), 7,27 (2H, d), 6,70 (1H, s), 2,52 (3H, s)
Пример получения 348: 2-хлор-4-метил-6-[3-(трифторметил)фенокси]пиримидин
2,6-дихлор-4-метил-пиримидин (3,0 г, 18,4 ммоль) и 3-(трифторметил)фенол (2,98 г, 18,4 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (3,0 г, 57%).
1H-ЯМР (CDCl3) δ 7,56 (2H, m), 7,42 (1H, m), 7,36 (1H, m), 6,69 (1H, s), 2,52 (3H, s)
Пример получения 349: 2-хлор-4-циклобутокси-6-трифторметил-пиримидин
2,6-дихлор-6-трифторметил-пиримидин (0,40 г, 1,85 ммоль) и циклобутанол (0,17 мл, 2,22 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,40 г, 86%).
1H-ЯМР (400 МГц CDCl3); δ 7,08 (s, 1H), 6,83 (s, 1H), 5,24-5,15 (m, 1H), 2,52 (m, 2H), 2,17-2,11 (m, 2H), 1,87-1,84 (m, 1H), 1,73-1,65 (m, 1H)
Пример получения 350: 4-бром-бензо[b]тиофен
3-бромтиофенола (0,5 г, 2,64 ммоль) растворяли в 8 мл DMF. Добавляли бромацетальдегид диэтил ацеталь (0,52 г, 2,64 ммоль) и K2CO3 (0,548 г, 3,97 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и концентрировали при пониженном давлении для получения 1-бром-3-(2,2-диэтокси-этилсульфанил)-бензола. Полученное соединение растворяли в 8 мл MC. Добавляли 0,7 г PPA (полифосфорная кислота), и смесь перемешивали в течение 4 часов при нагревании с обратным холодильником. После добавления водного раствора Na2CO3 реакционный раствор экстрагировали MC. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией для получения смеси 4-бром-бензо[b]тиофена и 6-бром-бензо[b]тиофена (1:1, 0,33 г, 58%).
1H-ЯМР (CDCl3) δ 8,01 (1H, s), 7,80 (1H, d), 7,66 (1H, d), 7,50 (4H, m), 7,41 (1H, d), 7,29 (1H, d), 7,19 (1H, t)
Пример получения 351: этиловый эфир [1-(4-бензо[b]тиофен-4-ил-2,6-дифтор-фенил)-пиперидин-4-ил]-уксусной кислоты
Смесь 4-бром-бензо[b]тиофена и 6-бром-бензо[b]тиофена (0,19 г, 0,89 ммоль), полученную в Примере Получения 350, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,365 г, 0,89 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,11 г, 29%).
1H-ЯМР (CDCl3) δ 7,87 (1H, d), 7,46 (2H, s), 7,39 (1H, t), 7,29 (1H, d), 7,04 (2H, m), 4,14 (2H, q), 3,32 (2H, m), 3,16 (2H, m), 2,29 (2H, d), 1,96 (1H, m), 1,77 (2H, m), 1,46 (2H, m), 1,26 (3H, t)
Пример получения 352: 2-хлор-4-циклобутокси-6-трифторметил-пиримидин
Циклобутанол (0,365 г, 5,07 ммоль) и 2,4-дихлор-6-трифторметил-пиримидин (1 г, 4,61 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,603 г, 51%).
1H-ЯМР (CDCl3) δ 6,93 (1H, s), 5,30 (1H, m), 2,50 (2H, m), 2,18 (2H, m), 1,87 (1H, m), 1,71 (1H, m)
Пример получения 353: 2-хлор-4-пропокси-6-трифторметил-пиримидин
Пропанол (0,304 г, 5,07 ммоль) и 2,4-дихлор-6-трифторметил-пиримидин (1 г, 4,61 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (0,602 г, 54%).
1H-ЯМР (CDCl3) δ 6,97 (1H, s), 4,41 (2H, t), 1,83 (2H, m), 1,02 (3H, t)
Пример получения 354: 2-хлор-4-(4-фторфенокси)-6-трифторметил-пиримидин
4-фторфенол (0,568 г, 5,07 ммоль) и 2,4-дихлор-6-трифторметил-пиримидин (1 г, 4,61 ммоль) вводили в реакцию таким же образом, как в Примере Получения 226, с получением целевого соединения (1,07 г, 79%).
1H-ЯМР (CDCl3) δ 7,15 (5H, m)
Пример 1: 3-[6-(2-изопропилсульфанил-пиридин-3-ил)-хинолин-2-ил]-пропионовая кислота

Стадия A: этиловый эфир 3-[6-(2-изопропилсульфанил-пиридин-3-ил)-хинолин-2-ил]-пропионовой кислоты

Этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хинолин-2-ил]-пропионовой кислоты (0,06 г, 0,17 ммоль), полученный в Примере Получения 1, и 3-йод-2-изопропилсульфанил-пиридин (0,047 г, 0,17 ммоль), полученный в Примере Получения 9, растворяли в 0,25 мл 2M карбоната натрия и 2 мл DME и загружали азотом в течение 5 минут. Добавляли PdCl2(PPh3)2(0,006 г, 0,008 ммоль), и смесь перемешивали в течение 4 часов при нагревании с обратным холодильником. После добавления воды реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,040 г, 63%).
1H-ЯМР (CDCl3) δ 8,53 (1H, d), 8,15~8,08 (2H, m), 7,82 (1H, s), 7,78 (1H, d), 7,50 (1H, d), 7,39 (1H, d), 7,12 (1H, m), 4,15~4,10 (3H, m), 3,34 (2H, t), 2,97 (2H, t), 1,40 (6H, d), 1,30 (3H, t)
Стадия B: 3-[6-(2-изопропилсульфанил-пиридин-3-ил)-хинолин-2-ил]-пропионовая кислота
Этиловый эфир 3-[6-(2-Изопропилсульфанил-пиридин-3-ил)-хинолин-2-ил]-пропионовой кислоты (0,040 г, 0,10 ммоль), полученный на Стадии A, растворяли в 0,3 мл каждого из THF, MeOH и 1Н водного раствора NaOH, и смесь перемешивали при комнатной температуре в течение 2 часов. После удаления органического растворителя реакционный раствор подкисляли до рН 3 при помощи водного раствора 1Н HCl и экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали с помощью MgSO4 и концентрировали при пониженном давлении с получением целевого соединения (0,030 г, 86%).
1H-ЯМР (CDCl3) δ 8,51 (1H, d), 8,26 (1H, d), 8,11 (1H, d), 7,92~7,80 (2H, m), 7,46 (1H, d), 7,40 (1H, d), 7,10 (1H, m), 4,15 (1H, m), 3,38 (2H, t), 2,98 (2H, t), 1,35 (6H, d)
Пример 2: 3-[6-(6-изопропилсульфанил-пиридин-2-ил)-хинолин-2-ил]-пропионовая кислота
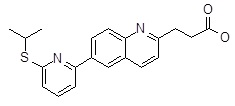
Стадия A: этиловый эфир 3-[6-(6-изопропилсульфанил-пиридин-2-ил)-хинолин-2-ил]-пропионовой кислоты

Этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хинолин-2-ил]-пропионовой кислоты (0,06 г, 0,17 ммоль), полученный в Примере Получения 1, и 2-хлор-6-изопропилсульфанил-пиридин (0,032 г, 0,17 ммоль), полученный в Примере Получения 10, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,021 г, 33%).
1H-ЯМР (CDCl3) δ 8,50 (1H, s), 8,43 (1H, d), 8,20 (1H, d), 8,14 (1H, d), 7,65~7,60 (2H, m), 7,40 (1H, d), 7,16 (1H, m), 4,31~4,17 (3H, m), 3,34 (2H, t), 2,96 (2H, t), 1,54 (6H, d), 1,29 (3H, t)
Стадия B: 3-[6-(6-изопропилсульфанил-пиридин-2-ил)-хинолин-2-ил]-пропионовая кислота
Этиловый эфир 3-[6-(6-Изопропилсульфанил-пиридин-2-ил)-хинолин-2-ил]-пропионовой кислоты (0,021 г, 0,06 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,016 г, 83%).
1H-ЯМР (CDCl3) δ 8,51~8,46 (2H, m), 8,32 (1H, d), 8,11 (1H, d), 7,65~7,55 (2H, m), 7,41 (1H, d), 7,15 (1H, m), 4,20 (1H, m), 3,39 (2H, t), 2,98 (2H, t), 1,50 (6H, d)
Пример 3: [6-(6-циклопентилокси-пиридин-2-ил)-нафталин-2-илокси]-уксусная кислота

Стадия A: этиловый эфир [6-(6-циклопентилокси-пиридин-2-ил)-нафталин-2-илокси]-уксусной кислоты

Этиловый эфир [6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-илокси]-уксусной кислоты (0,06 г, 0,17 ммоль), полученный в Примере Получения 2, и 2-хлор-6-циклопентилокси-пиридин (0,033 г, 0,17 ммоль), полученный в Примере Получения 12, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,013 г, 20%).
1H-ЯМР (CDCl3) δ 8,43 (1H, s), 8,17 (1H, d), 7,86 (1H, d), 7,77 (1H, t), 7,62 (1H, d), 7,42 (1H, d), 7,25 (1H, d), 7,12 (1H, s), 6,63 (1H, d), 5,60 (1H, m), 4,75 (2H, s), 4,30 (2H, q), 2,20~1,60 (8H, m), 1,22 (3H, t)
Стадия B: [6-(6-циклопентилокси-пиридин-2-ил)-нафталин-2-илокси]-уксусная кислота
Этиловый эфир [6-(6-циклопентилокси-пиридин-2-ил)-нафталин-2-илокси]-уксусной кислоты (0,013 г, 0,03 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,010 г, 83%).
1H-ЯМР (CDCl3) δ 8,48 (1H, s), 8,22 (1H, d), 7,94 (1H, d), 7,83 (1H, d), 7,70 (1H, t), 7,47 (1H, d), 7,25 (1H, d), 7,20 (1H, s), 6,70 (1H, d), 5,63 (1H, m), 4,87 (2H, s), 2,20~1,70 (8H, m)
Пример 4: [6-(2-циклопентилокси-пиридин-3-ил)-нафталин-2-илокси]-уксусная кислота

Стадия A: этиловый эфир [6-(2-циклопентилокси-пиридин-3-ил)-нафталин-2-илокси]-уксусной кислоты

Этиловый эфир [6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-илокси]-уксусной кислоты (0,06 г, 0,17 ммоль), полученный в Примере Получения 2, и 2-циклопентилокси-3-йод-пиридин (0,049 г, 0,17 ммоль), полученный в Примере Получения 11, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,030 г, 45%).
1H-ЯМР (CDCl3) δ 8,21 (1H, d), 8,00 (1H, s), 7,85~7,70 (4H, m), 7,24 (1H, d), 7,18 (1H, s), 6,99 (1H, t), 5,60 (1H, m), 4,80 (2H, s), 4,36 (2H, q), 2,10~1,60 (8H, m), 1,35 (3H, t)
Стадия B: [6-(2-циклопентилокси-пиридин-3-ил)-нафталин-2-илокси]-уксусная кислота
Этиловый эфир [6-(2-циклопентилокси-пиридин-3-ил)-нафталин-2-илокси]-уксусной кислоты (0,030 г, 0,08 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,018 г, 67%).
1H-ЯМР (CDCl3) δ 8,24 (1H, d), 7,97 (1H, s), 7,85~7,70 (4H, m), 7,30 (1H, d), 7,20 (1H, s), 7,00 (1H, t), 5,57 (1H, m), 4,87 (2H, s), 2,10~1,65 (8H, m)
Пример 5: 4-[6-(2-изопропилсульфанил-пиридин-3-ил)-нафталин-2-илокси]-масляная кислота
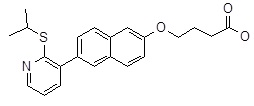
Стадия A: этиловый эфир 4-[6-(2-изопропилсульфанил-пиридин-3-ил)-нафталин-2-илокси]-масляной кислоты
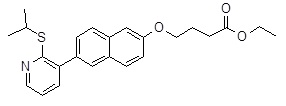
Этиловый эфир 4-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-илокси]-масляной кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 3, и 3-йод-2-изопропилсульфанил-пиридин (0,036 г, 0,13 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,035 г, 66%).
1H-ЯМР (CDCl3) δ 8,50 (1H, d), 7,82~7,75 (3H, m), 7,62~7,48 (2H, m), 7,20 (2H, m), 7,10 (1H, m), 4,25~4,05 (5H, m), 2,63 (2H, t), 2,22 (2H, t), 1,39 (6H, d), 1,30 (3H, t)
Стадия B: 4-[6-(2-изопропилсульфанил-пиридин-3-ил)-нафталин-2-илокси]-масляная кислота
Этиловый эфир 4-[6-(2-Изопропилсульфанил-пиридин-3-ил)-нафталин-2-илокси]-масляной кислоты (0,035 г, 0,09 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,025 г, 78%).
1H-ЯМР (CDCl3) δ 8,46 (1H, d), 7,80~7,75 (3H, m), 7,52 (1H, d), 7,45 (1H, d), 7,15 (2H, m), 7,05 (1H, m), 4,18 (2H, t), 4,07 (1H, m), 2,65 (2H, t), 2,22 (2H, t), 1,34 (6H, d)
Пример 6: 4-[6-(6-изопропилсульфанил-пиридин-2-ил)-нафталин-2-илокси]-масляная кислота

Стадия A: этиловый эфир 4-[6-(6-изопропилсульфанил-пиридин-2-ил)-нафталин-2-илокси]-масляной кислоты

Этиловый эфир 4-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-илокси]-масляной кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 3, и 2-хлор-6-изопропилсульфанил-пиридин (0,024 г, 0,13 ммоль), полученный в Примере Получения 10, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,012 г, 23%).
1H-ЯМР (CDCl3) δ 8,46 (1H, s), 8,20 (1H, d), 7,90~7,80 (2H, m), 7,60 (2H, m), 7,22~7,12 (3H, m), 4,35~4,15 (5H, m), 2,61 (2H, t), 2,22 (2H, t), 1,54 (6H, d), 1,30 (3H, t)
Стадия B: 4-[6-(6-изопропилсульфанил-пиридин-2-ил)-нафталин-2-илокси]-масляная кислота
Этиловый эфир 4-[6-(6-Изопропилсульфанил-пиридин-2-ил)-нафталин-2-илокси]-масляной кислоты (0,012 г, 0,03 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,010 г, 88%).
1H-ЯМР (CDCl3) δ 8,41 (1H, s), 8,15 (1H, d), 7,84~7,77 (2H, m), 7,53 (2H, m), 7,16~7,12 (2H, m), 7,09 (1H, d), 4,24~4,12 (3H, m), 2,65 (2H, t), 2,21 (2H, t), 1,49 (6H, d)
Пример 7: 3-[6-(2-изопропилсульфанил-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота

Стадия A: этиловый эфир 3-[6-(2-изопропилсульфанил-пиридин-3-ил)-хроман-2-ил]-пропионовой кислоты

Этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,06 г, 0,16 ммоль), полученный в Примере Получения 4, и 3-йод-2-изопропилсульфанил-пиридин (0,046 г, 0,16 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,040 г, 66%).
1H-ЯМР (CDCl3) δ 8,40 (1H, d), 7,35 (1H, d), 7,18 (1H, d), 7,08 (1H, s), 7,00 (1H, t), 6,82 (1H, d), 4,17 (2H, q), 4,15~4,00 (2H, m), 2,95~2,80 (2H, m), 2,70~2,50 (2H, m), 2,05 (3H, m), 1,80 (1H, m), 1,35 (6H, d), 1,28 (3H, t)
Стадия B: 3-[6-(2-изопропилсульфанил-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота
Этиловый эфир 3-[6-(2-Изопропилсульфанил-пиридин-3-ил)-хроман-2-ил]-пропионовой кислоты (0,040 г, 0,10 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,028 г, 76%).
1H-ЯМР (CDCl3) δ 8,38 (1H, d), 7,33 (1H, d), 7,14 (1H, d), 7,07 (1H, s), 7,00 (1H, t), 6,83 (1H, d), 4,15~4,00 (2H, m), 2,95~2,75 (2H, m), 2,70~2,50 (2H, m), 2,05~1,90 (3H, m), 1,80 (1H, m), 1,34 (6H, d)
Пример 8: 3-[6-(6-изопропилсульфанил-пиридин-2-ил)-хроман-2-ил]-пропионовая кислота

Стадия A: этиловый эфир 3-[6-(6-изопропилсульфанил-пиридин-2-ил)-хроман-2-ил]-пропионовой кислоты
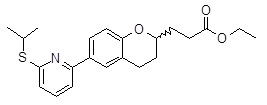
Этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,06 г, 0,16 ммоль), полученный в Примере Получения 4, и 2-хлор-6-изопропилсульфанил-пиридин (0,031 г, 0,16 ммоль), полученный в Примере Получения 10, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,020 г, 33%).
1H-ЯМР (CDCl3) δ 7,79~7,72 (2H, m), 7,49 (1H, t), 7,33 (1H, d), 7,02 (1H, d), 6,84 (1H, d), 4,20~4,05 (4H, m), 2,97~2,80 (2H, m), 2,70~2,50 (2H, m), 2,10~2,00 (3H, m), 1,82 (1H, m), 1,45 (6H, d), 1,26 (3H, t)
Стадия B: 3-[6-(6-изопропилсульфанил-пиридин-2-ил)-хроман-2-ил]-пропионовая кислота
Этиловый эфир 3-[6-(6-Изопропилсульфанил-пиридин-2-ил)-хроман-2-ил]-пропионовой кислоты (0,020 г, 0,05 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,014 г, 75%).
1H-ЯМР (CDCl3) δ 7,78~7,73 (2H, m), 7,46 (1H, t), 7,32 (1H, d), 7,01 (1H, d), 6,85 (1H, d), 4,14~4,07 (2H, m), 2,97~2,82 (2H, m), 2,75~2,60 (2H, m), 2,08~2,00 (3H, m), 1,80 (1H, m), 1,45 (6H, m)
Пример 9: 3-[6-(6-циклопентилокси-пиридин-2-ил)-хроман-2-ил]-пропионовая кислота

Стадия A: этиловый эфир 3-[6-(6-циклопентилокси-пиридин-2-ил)-хроман-2-ил]-пропионовой кислоты

Этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,06 г, 0,16 ммоль), полученный в Примере Получения 4, и 2-хлор-6-циклопентилокси-пиридин (0,033 г, 0,16 ммоль), полученный в Примере Получения 12, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,013 г, 21%).
1H-ЯМР (CDCl3) δ 7,77~7,70 (2H, m), 7,54 (1H, t), 7,20 (1H, d), 6,85 (1H, d), 6,54 (1H, d), 5,50 (1H, m), 4,13 (2H, q), 4,08 (1H, m), 3,00~2,50 (4H, m), 2,10~1,55 (12H, m), 1,24 (3H, t)
Стадия B: 3-[6-(6-циклопентилокси-пиридин-2-ил)-хроман-2-ил]-пропионовая кислота
Этиловый эфир 3-[6-(6-циклопентилокси-пиридин-2-ил)-хроман-2-ил]-пропионовой кислоты (0,013 г, 0,03 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,010 г, 83%).
1H-ЯМР (CDCl3) δ 7,72~7,65 (2H, m), 7,45 (1H, t), 7,11 (1H, d), 6,79 (1H, d), 6,49 (1H, d), 5,45 (1H, m), 4,04 (1H, m), 2,95~2,50 (4H, m), 2,10~1,65 (12H, m)
Пример 10: 3-[6-(2-циклопентилокси-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота
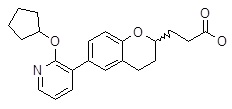
Стадия A: этиловый эфир 3-[6-(2-циклопентилокси-пиридин-3-ил)-хроман-2-ил]-пропионовой кислоты

Этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,06 г, 0,16 ммоль), полученный в Примере Получения 4, и 2-циклопентилокси-3-йод-пиридин (0,049 г, 0,16 ммоль), полученный в Примере Получения 11, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,030 г, 48%).
1H-ЯМР (CDCl3) δ 8,07 (1H, d), 7,56 (1H, d), 7,32~7,26 (2H, m), 6,85 (1H, t), 6,80 (1H, d), 5,49 (1H, m), 4,15 (2H, q), 4,10 (1H, m), 2,95~2,55 (4H, m), 2,10~1,55 (12H, m), 1,26 (3H, t)
Стадия B: 3-[6-(2-циклопентилокси-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота
Этиловый эфир 3-[6-(2-циклопентилокси-пиридин-3-ил)-хроман-2-ил]-пропионовой кислоты (0,030 г, 0,08 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,018 г, 67%).
1H-ЯМР (CDCl3) δ 8,09 (1H, d), 7,56 (1H, d), 7,31~7,26 (2H, m), 6,88 (1H, t), 6,81 (1H, d), 5,49 (1H, m), 4,08 (1H, m), 2,95~2,60 (4H, m), 2,10~1,65 (12H, m)
Пример 11: 3-[6-(6-циклопентилокси-пиридин-2-ил)-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовая кислота
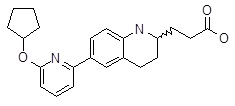
Стадия A: этиловый эфир 3-[6-(6-циклопентилокси-пиридин-2-ил)-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовой кислоты

Этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовой кислоты (0,1 г, 0,30 ммоль), полученный в Примере Получения 6, и 2-хлор-6-циклопентилокси-пиридин (0,06 г, 0,30 ммоль), полученный в Примере Получения 12, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,035 г, 30%).
1H-ЯМР (CDCl3) δ 7,68 (2H, m), 7,51 (1H, t), 7,15 (1H, d), 6,56~6,48 (2H, m), 5,51 (1H, m), 4,16 (2H, q), 4,05 (1H, ушир.), 3,40 (1H, m), 2,90~2,80 (2H, m), 2,55~2,40 (2H, m), 2,10~1,60 (12H, m), 1,25 (3H, t)
Стадия B: 3-[6-(6-циклопентилокси-пиридин-2-ил)-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовая кислота
Этиловый эфир 3-[6-(6-циклопентилокси-пиридин-2-ил)-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовой кислоты (0,012 г, 0,03 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,010 г, 91%).
1H-ЯМР (CDCl3) δ 7,68 (2H, m), 7,52 (1H, t), 7,16 (1H, d), 6,60~6,48 (2H, m), 5,52 (1H, m), 3,42 (1H, m), 2,90~2,80 (2H, m), 2,60~2,50 (2H, m), 2,05~1,60 (12H, m)
Пример 12: 3-[6-(6-циклопентилокси-пиридин-2-ил)-1-метил-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовая кислота

Стадия A: этиловый эфир 3-[6-(6-циклопентилокси-пиридин-2-ил)-1-метил-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовой кислоты

Этиловый эфир 3-[6-(6-циклопентилокси-пиридин-2-ил)-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовой кислоты (0,012 г, 0,03 ммоль), полученный на Стадии A Примера 11, растворяли в 5 мл DCE. Добавляли формальдегид (0,005 г, 0,06 ммоль) и уксусную кислоту (0,002 г, 0,036 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. Натрий триацетоксиборгидрид (0,013 г, 0,06 ммоль) добавляли к реакционному раствору, и реакцию осуществляли при комнатной температуре в течение 16 часов. После добавления 50 мл воды реакционный раствор экстрагировали DCM, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,007 г, 58%).
1H-ЯМР (CDCl3) δ 7,79 (1H, d), 7,68 (1H, s), 7,54 (1H, t), 7,16 (1H, d), 6,61 (1H, d), 6,47 (1H, d), 5,52 (1H, m), 4,13 (2H, q), 3,32 (1H, m), 3,01 (3H, s), 2,95~2,75 (2H, m), 2,50~2,30 (2H, m), 2,10~1,60 (12H, m), 1,24 (3H, t)
Стадия B: 3-[6-(6-циклопентилокси-пиридин-2-ил)-1-метил-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовая кислота
Этиловый эфир 3-[6-(6-циклопентилокси-пиридин-2-ил)-1-метил-1,2,3,4-тетрагидро-хинолин-2-ил]-пропионовой кислоты (0,007 г, 0,02 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,006 г, 92%).
1H-ЯМР (CDCl3) δ 7,80 (1H, d), 7,68 (1H, s), 7,54 (1H, t), 7,18 (1H, d), 6,65 (1H, d), 6,47 (1H, d), 5,52 (1H, m), 3,36 (1H, m), 3,02 (3H, s), 2,95~2,70 (2H, m), 2,55~2,30 (2H, m), 2,10~1,60 (12H, m)
Пример 13: [6-(2-изопропилсульфанил-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-уксусная кислота

Стадия A: этиловый эфир [6-(2-изопропилсульфанил-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-уксусной кислоты
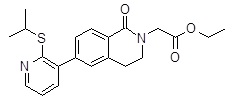
Этиловый эфир [1-оксо-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,4-дигидро-1H-изохинолин-2-ил]-уксусной кислоты (0,06 г, 0,16 ммоль), полученный в Примере Получения 7, и 3-йод-2-изопропилсульфанил-пиридин (0,047 г, 0,16 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,020 г, 33%).
1H-ЯМР (CDCl3) δ 8,46 (1H, d), 8,15 (1H, d), 7,41~7,35 (2H, m), 7,25 (1H, d), 7,04 (1H, t), 4,36 (2H, s), 4,22 (2H, q), 4,07 (1H, m), 3,73 (2H, t), 3,10 (2H, t), 1,37 (6H, d), 1,26 (3H, t)
Стадия B: [6-(2-изопропилсульфанил-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-уксусная кислота
Этиловый эфир [6-(2-Изопропилсульфанил-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-уксусной кислоты (0,020 г, 0,05 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,012 г, 63%).
1H-ЯМР (CDCl3) δ 8,47 (1H, d), 8,13 (1H, d), 7,43~7,35 (2H, m), 7,25 (1H, d), 7,05 (1H, t), 4,40 (2H, s), 4,13 (1H, m), 3,74 (2H, t), 3,13 (2H, t), 1,36 (6H, d)
Пример 14: [6-(6-изопропилсульфанил-пиридин-2-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-уксусная кислота

Стадия A: этиловый эфир [6-(6-изопропилсульфанил-пиридин-2-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-уксусной кислоты

Этиловый эфир [1-оксо-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,4-дигидро-1H-изохинолин-2-ил]-уксусной кислоты (0,06 г, 0,16 ммоль), полученный в Примере Получения 7, и 2-хлор-6-изопропилсульфанил-пиридин (0,031 г, 0,16 ммоль), полученный в Примере Получения 10, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,014 г, 23%).
1H-ЯМР (CDCl3) δ 8,17 (1H, d), 7,98 (1H, d), 7,89 (1H, s), 7,55 (1H, t), 7,47 (1H, d), 7,12 (1H, d), 4,36 (2H, s), 4,30~4,15 (3H, m), 3,72 (2H, t), 3,17 (2H, t), 1,47 (6H, d), 1,28 (3H, t)
Стадия B: [6-(6-изопропилсульфанил-пиридин-2-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-уксусная кислота
Этиловый эфир [6-(6-Изопропилсульфанил-пиридин-2-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-уксусной кислоты (0,014 г, 0,04 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,010 г, 78%).
1H-ЯМР (CDCl3) δ 8,17 (1H, d), 7,98 (1H, d), 7,89 (1H, s), 7,53 (1H, t), 7,45 (1H, d), 7,12 (1H, d), 4,40 (2H, s), 4,15 (1H, m), 3,75 (2H, t), 3,16 (2H, t), 1,48 (6H, d)
Пример 15: 3-[6-(2-циклопентилокси-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-пропионовая кислота

Стадия A: метиловый эфир 3-[6-(2-циклопентилокси-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]пропионовой кислоты

Метиловый эфир 3-[1-оксо-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,4-дигидро-1H-изохинолин-2-ил]пропионовой кислоты (0,06 г, 0,16 ммоль), полученный в Примере Получения 8, и 2-циклопентилокси-3-йод-пиридин (0,048 г, 0,16 ммоль), полученный в Примере Получения 11, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,015 г, 23%).
1H-ЯМР (CDCl3) δ 8,17 (1H, d), 8,09 (1H, d), 7,62 (1H, d), 7,53 (1H, d), 7,37 (1H, s), 6,93 (1H, t), 5,53 (1H, m), 3,85 (2H, t), 3,77~3,70 (5H, m), 3,00 (2H, t), 2,74 (2H, t), 2,00~1,60 (8H, m)
Стадия B: 3-[6-(2-циклопентилокси-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-пропионовая кислота
Метиловый эфир 3-[6-(2-циклопентилокси-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]пропионовой кислоты (0,015 г, 0,04 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,020 г, 56%).
1H-ЯМР (CDCl3) δ 8,17 (1H, d), 8,06 (1H, d), 7,62 (1H, d), 7,52 (1H, d), 7,37 (1H, s), 6,93 (1H, t), 5,52 (1H, m), 3,85 (2H, t), 3,71 (2H, t), 3,05 (2H, t), 2,82 (2H, t), 2,00~1,60 (8H, m)
Пример 16: 3-[6-(2-изопропилсульфанил-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-пропионовая кислота
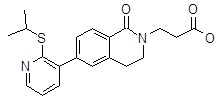
Стадия A: метиловый эфир 3-[6-(2-изопропилсульфанил-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]пропионовой кислоты

Метиловый эфир 3-[1-оксо-6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,4-дигидро-1H-изохинолин-2-ил]пропионовой кислоты (0,06 г, 0,16 ммоль), полученный в Примере Получения 8, и 3-йод-2-изопропилсульфанил-пиридин (0,047 г, 0,16 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,030 г, 46%).
1H-ЯМР (CDCl3) δ 8,46 (1H, d), 8,11 (1H, d), 7,45~7,35 (2H, m), 7,25 (1H, d), 7,03 (1H, t), 4,07 (1H, m), 3,85 (2H, t), 3,75~3,65 (5H, m), 3,05 (2H, t), 2,75 (2H, t), 1,35 (6H, d)
Стадия B: 3-[6-(2-изопропилсульфанил-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]-пропионовая кислота
Метиловый эфир 3-[6-(2-Изопропилсульфанил-пиридин-3-ил)-1-оксо-3,4-дигидро-1H-изохинолин-2-ил]пропионовой кислоты (0,030 г, 0,08 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,020 г, 69%).
1H-ЯМР (CDCl3) δ 8,46 (1H, d), 8,10 (1H, d), 7,45~7,35 (2H, m), 7,25 (1H, d), 7,05 (1H, t), 4,05 (1H, m), 3,90 (2H, t), 3,75 (2H, t), 3,05 (2H, t), 2,80 (2H, t), 1,34 (6H, d)
Пример 17: 4-(3ʹ-бензилокси-3,5-дифтор-бифенил-4-илокси)-масляная кислота
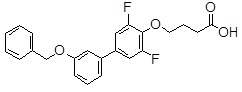
Стадия A: этиловый эфир 4-(3ʹ-бензилокси-3,5-дифтор-бифенил-4-илокси)-масляной кислоты
2Н Na2CO3 (0,5 мл) и 1,4-диоксан (5 мл) добавляли к 1-бензилокси-3-йод-бензолу (42 мг, 0,135 ммоль), полученному в Примере Получения 17, этиловому эфиру 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (50 мг, 0,135 ммоль), полученному в Примере Получения 16, и PdCl2(dppf)-DCM (5,5 мг, 0,0068 ммоль), и смесь перемешивали 2 часа при нагревании с обратным холодильником. После завершения реакции реакционный раствор охлаждали и фильтровали через Целит. После добавления воды реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали с помощью MgSO4, концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (20 мг, 35%).
1H-ЯМР (400 МГц, CDCl3) δ 7,48-7,43 (m, 2H), 7,43-7,37 (m, 2H), 7,37-7,31 (m, 2H), 7,13-7,06 (m, 4H), 6,99-6,95 (m, 1H), 4,12 (s, 2H), 4,21 (t, 2H), 4,16 (q, 2H), 2,58 (t, 2H), 2,15-2,06 (m, 2H), 1,27 (t, 3H)
Стадия B: 4-(3ʹ-бензилокси-3,5-дифтор-бифенил-4-илокси)-масляная кислота
Этиловый эфир 4-(3ʹ-Бензилокси-3,5-дифтор-бифенил-4-илокси)-масляной кислоты (20 мг, 0,047 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (18 мг, 96%).
1H-ЯМР (400 МГц, CDCl3) δ 7,48-7,43 (m, 2H), 7,43-7,36 (m, 2H), 7,37-7,31 (m, 2H), 7,13-7,06 (m, 4H), 6,99-6,95 (m, 1H), 4,12 (s, 2H), 4,21 (t, 2H), 4,16 (q, 2H), 2,66 (t, 2H), 2,15-2,05 (m, 2H), 1,27 (t, 3H)
Пример 18: 4-(3,5-дифтор-3ʹ-изопропокси-бифенил-4-илокси)-масляная кислота

Стадия A: этиловый эфир 4-(3,5-дифтор-3ʹ-изопропокси-бифенил-4-илокси)-масляной кислоты
2Н Na2CO3 (0,5 мл) и 1,4-диоксан (5 мл) добавляли к 1-йод-3-изопропокси-бензолу (35 мг, 0,135 ммоль), полученному в Примере Получения 18, этиловому эфиру 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (50 мг, 0,135 ммоль), полученному в Примере Получения 16, и PdCl2(dppf)-DCM (5,5 мг, 0,0068 ммоль), и смесь перемешивали в течение 2 часов при нагревании с обратным холодильником. После завершения реакции реакционный раствор охлаждали и фильтровали через Целит. После добавления воды реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали с помощью MgSO4, концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (32 мг, 63%).
1H-ЯМР (400 МГц, CDCl3) δ 7,40-7,34 (m, 1H), 7,29-6,97 (m, 4H), 6,96-7,182 (m, 1H), 4,70-4,52 (m, 1H), 4,28-4,08 (m, 4H), 2,69-2,52 (m, 2H), 2,20-2,03 (m, 2H), 1,37 (d, 6H), 1,25 (t, 3H)
Стадия B: 4-(3,5-дифтор-3ʹ-изопропокси-бифенил-4-илокси)-масляная кислота
Этиловый эфир 4-(3,5-дифтор-3ʹ-изопропокси-бифенил-4-илокси)-масляной кислоты (32 мг, 0,085 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (28 мг, 95%).
1H-ЯМР (400 МГц, CDCl3) δ 7,32 (t, 1H), 7,15-7,07 (m, 2H), 7,07-7,03 (m, 1H), 7,03-7,00 (m, 1H), 6,91-6,86 (m, 1H), 4,66-4,56 (m, 1H), 4,22 (t, 2H), 2,67 (t, 2H), 2,16-2,07 (m, 2H), 1,36 (d, 6H)
Пример 19: 4-(3,5-дифтор-3ʹ-пропокси-бифенил-4-илокси)-масляная кислота

Стадия A: этиловый эфир 4-(3,5-дифтор-3ʹ-пропокси-бифенил-4-илокси)-масляной кислоты
1-Йод-3-пропокси-бензол (35 мг, 0,135 ммоль), полученный в Примере Получения 19, этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (50 мг, 0,135 ммоль), полученный в Примере Получения 16, и PdCl2(dppf)-DCM (5,5 мг, 0,0068 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 18, с получением целевого соединения (42 мг, 83%).
1H-ЯМР (400 МГц, CDCl3) δ 7,32 (t, 1H), 7,16-7,09 (m, 2H), 7,09-7,04 (m, 1H), 7,04-7,00 (m, 1H), 6,92-6,87 (m, 1H), 4,20 (t, 2H), 4,16 (q, 2H), 3,97 (t, 2H), 2,57 (t, 2H), 2,15-2,04 (m, 2H), 1,89-1,78 (m, 2H), 1,28 (t, 3H), 1,06 (t, 3H)
Стадия B: 4-(3,5-дифтор-3ʹ-пропокси-бифенил-4-илокси)-масляная кислота
Этиловый эфир 4-(3,5-дифтор-3ʹ-пропокси-бифенил-4-илокси)-масляной кислоты (42 мг, 0,11 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (37 мг, 95%).
1H-ЯМР (400 МГц, CDCl3) δ 7,32 (t, 1H), 7,16-7,09 (m, 2H), 7,09-7,00 (m, 2H), 6,93-6,87 (m, 1H), 4,22 (t, 2H), 3,97 (t, 2H), 2,67 (t, 2H), 2,19-2,06 (m, 2H), 1,89-1,78 (m, 2H), 1,05 (t, 3H)
Пример 20: 4-(3ʹ-циклопропилметокси-3,5-дифтор-бифенил-4-илокси)-масляная кислота

Стадия A: этиловый эфир 4-(3ʹ-циклопропилметокси-3,5-дифтор-бифенил-4-илокси)-масляной кислоты
1-циклопропилметокси-3-йод-бензол (37 мг, 0,135 ммоль), полученный в Примере Получения 20, этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (50 мг, 0,135 ммоль), полученный в Примере Получения 16, и PdCl2(dppf)-DCM (5,5 мг, 0,0068 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 18, с получением целевого соединения (20 мг, 38%).
1H-ЯМР (400 МГц, CDCl3) δ 7,32 (t, 1H), 7,16-7,09 (m, 2H), 7,09-7,05 (m, 1H), 7,05-7,02 (m, 1H), 6,92-6,87 (m, 1H), 4,20 (t, 2H), 4,16 (q, 2H), 3,85 (d, 2H), 2,59 (t, 2H), 2,15-2,05 (m, 2H), 1,35-1,21 (m, 1H), 1,27 (t, 3H), 0,71-0,62 (m, 2H), 0,41-0,34 (m, 2H)
Стадия B: 4-(3ʹ-циклопропилметокси-3,5-дифтор-бифенил-4-илокси)-масляная кислота
Этиловый эфир 4-(3ʹ-циклопропилметокси-3,5-дифтор-бифенил-4-илокси)-масляной кислоты (20 мг, 0,05 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (18,4 мг, 99%).
1H-ЯМР (400 МГц, CDCl3) δ 7,32 (t, 1H), 7,15-7,09 (m, 2H), 7,09-7,05 (m, 1H), 7,05-7,02 (m, 1H), 6,92-6,87 (m, 1H), 4,22 (t, 2H), 3,85 (d, 2H), 2,67 (t, 2H), 2,15-2,06 (m, 2H), 1,33-1,21 (m, 1H), 0,70-0,62 (m, 2H), 0,41-0,33 (m, 2H)
Пример 21: 4-(3ʹ-циклобутокси-3,5-дифтор-бифенил-4-илокси)-масляная кислота

Стадия A: этиловый эфир 4-(3ʹ-циклобутокси-3,5-дифтор-бифенил-4-илокси)-масляной кислоты
1-циклобутокси-3-йод-бензол (37 мг, 0,135 ммоль), полученный в Примере Получения 21, этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (50 мг, 0,135 ммоль), полученный в Примере Получения 16, и PdCl2(dppf)-DCM (5,5 мг, 0,0068 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 18, с получением целевого соединения (30 мг, 57%).
1H-ЯМР (400 МГц, CDCl3) δ 7,31 (t, 1H), 7,14-7,07 (m, 2H), 7,07-7,04 (m, 1H), 6,96-6,92 (m, 1H), 6,83-6,79 (m, 1H), 4,73-4,64 (m, 1H), 4,20 (t, 2H), 4,16 (q, 2H), 2,59 (t, 2H), 2,52-2,41 (m, 2H), 2,26-2,13 (m, 2H), 2,13-2,04 (m, 2H), 1,93-1,82 (m, 1H), 1,78-1,67 (m, 1H), 1,28 (t, 3H)
Стадия B: 4-(3ʹ-циклобутокси-3,5-дифтор-бифенил-4-илокси)-масляная кислота
Этиловый эфир 4-(3ʹ-циклобутокси-3,5-дифтор-бифенил-4-илокси)-масляной кислоты (30 мг, 0,077 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (27 мг, 97%).
1H-ЯМР (400 МГц, CDCl3) δ 7,31 (t, 1H), 7,14-7,08 (m, 2H), 7,08-7,03 (m, 1H), 6,96-6,92 (m, 1H), 6,83-6,78 (m, 1H), 4,73-4,64 (m, 1H), 4,22 (t, 2H), 2,67 (t, 2H), 2,51-2,42 (m, 2H), 2,28-2,17 (m, 2H), 2,17-2,07 (m, 2H), 1,92-1,82 (m, 1H), 1,78-1,64 (m, 1H)
Пример 22: 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-7-ил)-2,6-дифтор-фенокси]-масляная кислота

Стадия A: этиловый эфир 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-7-ил)-2,6-дифтор-фенокси]-масляной кислоты
7-Йод-2,2-диметил-2,3-дигидро-бензофуран (35 мг, 0,13 ммоль), полученный в Примере Получения 22, этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (47 мг, 0,13 ммоль), полученный в Примере Получения 16, и PdCl2(dppf)-DCM (5,2 мг, 0,0065 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 18, с получением целевого соединения (20 мг, 40%).
1H-ЯМР (400 МГц, CDCl3) δ 7,35-7,27 (m, 2H), 7,20 (d, 1H), 7,11 (d, 1H), 6,88 (t, 1H), 4,23-4,12 (m, 4H), 3,04 (s, 2H), 2,58 (t, 2H), 2,14-2,04 (m, 2H), 1,51 (s, 6H), 1,26 (t, 3H)
Стадия B: 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-7-ил)-2,6-дифтор-фенокси]-масляная кислота
Этиловый эфир 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-7-ил)-2,6-дифтор-фенокси]-масляной кислоты (20 мг, 0,051 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (17 мг, 92%).
1H-ЯМР (400 МГц, CDCl3) δ 7,34-7,27 (m, 2H), 7,20 (d, 1H), 7,11 (d, 1H), 6,88 (t, 1H), 4,20 (t, 2H), 3,04 (s, 2H), 2,67 (t, 2H), 2,14-2,06 (m, 2H), 1,51 (s, 6H)
Пример 23: 4-[4-(2,2-диметил-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенокси]-масляная кислота

Стадия A: этиловый эфир 4-[4-(2,2-диметил-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенокси]-масляной кислоты
4-Йод-2,2-диметил-бензо[1,3]диоксол (40 мг, 0,145 ммоль), полученный в Примере Получения 23, этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (53,6 мг, 0,145 ммоль), полученный в Примере Получения 16, и PdCl2(dppf)-DCM (5,9 мг, 0,0073 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 18, с получением целевого соединения (19 мг, 33%).
1H-ЯМР (400 МГц, CDCl3) δ 7,32-7,24 (m, 2H), 6,94-6,81 (m, 2H), 6,74-6,70 (m, 1H), 4,20 (t, 2H), 4,15 (q, 2H), 2,58 (t, 2H), 2,13-2,05 (m, 2H), 1,72 (s, 6H), 1,26 (t, 3H)
Стадия B: 4-[4-(2,2-диметил-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенокси]-масляная кислота
Этиловый эфир 4-[4-(2,2-диметил-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенокси]-масляной кислоты (19 мг, 0,048 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (16 мг, 91%).
1H-ЯМР (400 МГц, CDCl3) δ 7,32-7,22 (m, 2H), 6,94-6,78 (m, 2H), 6,74-6,68 (m, 1H), 4,21 (t, 2H), 2,65 (t, 2H), 2,14-2,03 (m, 2H), 1,72 (s, 6H)
Пример 24: 4-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенокси]бутаннитрил

4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенол (0,06 г, 0,204 ммоль), полученный в Примере Получения 24, растворяли в DMF (3 мл) и добавляли 4-бромбутаннитрил (0,02 мл, 0,204 ммоль). Добавляли Cs2CO3 (0,133 г, 0,108 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного солевого раствора реакционный раствор экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/2,5) с получением целевого соединения (0,056 г, 76%).
ЯМР:1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,32 (1H, m), 7,01 (3H, m), 4,43 (1H, m), 4,30 (2H, t), 2,69 (2H, t), 2,52 (2H, m), 2,15 (2H, m), 2,04 (4H, m)
Пример 25: 2-циклобутилсульфанил-3-{3,5-дифтор-4-[3-(1H-тетразол-5-ил)пропокси]фенил}пиридин
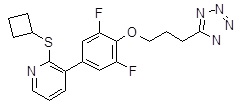
4-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенокси]бутаннитрил (0,056 г, 0,155 ммоль), полученный в Примере 24, азид натрия (0,029 г, 0,434 ммоль) и хлорид аммония (0,024 г, 0,434 ммоль) растворяли в DMF (3 мл), и смесь перемешивали при 120°C в течение 16 часов. После завершения реакции реакционный раствор разбавляли водой и экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент MeOH/DCM=1/20) с получением целевого соединения (0,004 г, 7,2%).
ЯМР:1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,32 (1H, m), 7,03 (3H, m), 4,43 (1H, m), 4,31 (2H, t), 3,34 (2H, t), 2,53 (2H, m), 2,32 (2H, m), 2,06 (4H, m)
Пример 26: 2-циклобутилсульфанил-3-{4-[3-(1H-тетразол-5-ил)пропил]фенил}пиридин

Стадия A: 4-[4-(2-циклобутилсульфанил-3-пиридил)фенил]бутаннитрил

2-циклобутилсульфанил-3-йод-пиридин (0,038 г, 0,177 ммоль), полученный в Примере Получения 13, и 4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]бутаннитрил (0,045 г, 0,166 ммоль), полученный в Примере Получения 25, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,03 г, 55%).
ЯМР:1H-ЯМР (CDCl3) δ 8,39 (1H, m), 7,34 (3H, m), 7,26 (2H, m), 7,00 (1H, m), 4,22 (1H, m), 2,83 (2H, t), 2,48 (2H, m), 2,37 (2H, t), 2,03 (6H, m)
Стадия B: 2-циклобутилсульфанил-3-{4-[3-(1H-тетразол-5-ил)пропил]фенил}пиридин
4-[4-(2-циклобутилсульфанил-пиридин-3-ил)фенил]бутаннитрил (0,03 г, 0,097 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как в Примере 25 с получением целевого соединения (0,001 г, 4,6%).
ЯМР:1H-ЯМР (CDCl3) δ 8,39 (1H, m), 7,34 (3H, m), 7,26 (2H, m), 7,03 (1H, m), 4,41 (1H, m), 3,00 (2H, t), 2,77 (2H, m), 2,49 (2H, m), 2,20 (2H, m), 2,01 (4H, m)
Пример 27: 5-[4-(2-циклобутилсульфанил-3-пиридил)фенил]пентановая кислота
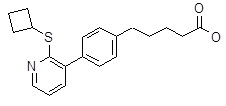
Стадия A: этиловый эфир 5-[4-(2-циклобутилсульфанил-3-пиридил)фенил]пентановой кислоты

2-циклобутилсульфанил-3-йод-пиридин (0,08 г, 0,27 ммоль), полученный в Примере Получения 13, и этиловый эфир 5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты (0,085 г, 0,25 ммоль), полученный в Примере Получения 26, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,063 г, 62%).
ЯМР:1H-ЯМР (CDCl3) δ 8,37 (1H, m), 7,33 (3H, m), 7,26 (2H, m), 7,00 (1H, m), 4,41 (1H, m), 4,12 (2H, q), 2,68 (2H, m), 2,48 (2H, m), 2,33 (2H, m), 1,99 (4H, m), 1,71 (4H, m), 1,24 (3H, t)
Стадия B: 5-[4-(2-циклобутилсульфанил-3-пиридил)фенил]пентановая кислота
Этиловый эфир 5-[4-(2-циклобутилсульфанил-3-пиридил)фенил]пентановой кислоты (0,063 г, 0,17 ммоль), полученный на Стадии A, растворяли в EtOH (2 мл). Добавляли 1Н NaOH (1 мл), и смесь перемешивали при комнатной температуре в течение 3 часов. После завершения реакции реакционный раствор концентрировали при пониженном давлении, и остатки разбавляли водой. Водный слой подкисляли до рН 2-3 при помощи 1Н HCl и экстрагировали этилацетатом. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/2) с получением целевого соединения (0,044 г, 75%).
ЯМР:1H-ЯМР (CDCl3) δ 8,37 (1H, m), 7,31 (3H, m), 7,26 (2H, m), 7,00 (1H, m), 4,41 (1H, m), 2,68 (2H, m), 2,48 (2H, m), 2,40 (2H, m), 1,99 (4H, m), 1,72 (4H, m)
Пример 28: 5-[4-(6-циклопентилсульфанил-2-пиридил)фенил]пентановая кислота

2-хлор-6-циклопентилсульфанил-пиридин (0,042 г, 0,196 ммоль), полученный в Примере Получения 14, и этиловый эфир 5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты (0,061 г, 0,183 ммоль), полученный в Примере Получения 26, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,015 г, 21%).
ЯМР:1H-ЯМР (CDCl3) δ 7,94 (2H, m), 7,49 (1H, m), 7,38 (1H, m), 7,26 (2H, m), 7,06 (1H, m), 4,18 (1H, m), 2,68 (2H, m), 2,38 (2H, m), 2,24 (2H, m), 1,76 (2H, m), 1,72~1,60 (8H, m)
Пример 29: 5-[4-(2-циклопентилсульфанил-3-пиридил)фенил]пентановая кислота

2-циклопентилсульфанил-3-йод-пиридин (0,03 г, 0,14 ммоль), полученный в Примере Получения 15, и этиловый эфир 5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты (0,044 г, 0,131 ммоль), полученный в Примере Получения 26, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,017 г, 34%).
ЯМР:1H-ЯМР (CDCl3) δ 8,39 (1H, m), 7,33 (3H, m), 7,26 (2H, m), 7,01 (1H, m), 4,07 (1H, m), 2,67 (2H, m), 2,39 (2H, m), 2,17 (2H, m), 1,70 (6H, m), 1,65 (4H, m)
Пример 30: 2-циклобутилсульфанил-3-[3,5-дифтор-4-(1H-тетразол-5-илметокси)фенил]пиридин

Стадия A: 2-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенокси]ацетонитрил

4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенол (0,103 г, 0,351 ммоль), полученный в Примере Получения 24, растворяли в ацетоне (5 мл). Добавляли бромацетонитрил (0,03 мл, 0,421 ммоль) и K2CO3 (0,058 г, 0,421 ммоль), и смесь перемешивали при 70°C в течение 2 часов и перемешивали при комнатной температуре в течение 16 часов. После завершения реакции реакционный раствор разбавляли водой и экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент MeOH/DCM=1/21) с получением целевого соединения (0,104 г, 89%).
1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,33 (1H, m), 7,05 (3H, m), 4,91 (2H, s), 4,41 (1H, m), 2,52 (2H, m), 2,05 (4H, m)
Стадия B: 2-циклобутилсульфанил-3-[3,5-дифтор-4-(1H-тетразол-5-илметокси)фенил]пиридин
2-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенокси]ацетонитрил (0,104 г, 0,312 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как в Примере 25 с получением целевого соединения (0,024 г, 20%).
ЯМР:1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,31 (1H, m), 7,04 (3H, m), 5,63 (2H, s), 4,41 (1H, m), 2,50 (2H, m), 2,03 (4H, m)
Пример 31: 5-[2,6-дифтор-4-(2-пропилсульфанил-3-пиридил)фенил]пентановая кислота
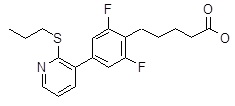
3-Йод-2-пропилсульфанил-пиридин (0,082 г, 0,293 ммоль), полученный в Примере Получения 28, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты (0,10 г, 0,274 ммоль), полученный в Примере Получения 27, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,057 г, 48%).
ЯМР:1H-ЯМР (CDCl3) δ 8,44 (1H, m), 7,35 (1H, m), 7,04 (1H, m), 6,94 (2H, m), 3,14 (2H, t), 2,74 (2H, t), 2,42 (2H, t), 1,70 (6H, m), 1,00 (3H, t)
Пример 32: 5-[4-(6-циклобутокси-2-пиридил)-2,6-дифтор-фенил]пентановая кислота
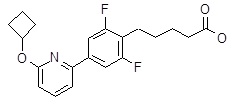
2-хлор-6-циклобутокси-пиридин (0,017 г, 0,091 ммоль), полученный в Примере Получения 29, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты (0,031 г, 0,085 ммоль), полученный в Примере Получения 27, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,015 г, 49%).
ЯМР:1H-ЯМР (CDCl3) δ 7,60 (1H, t), 7,50 (2H, m), 7,28 (1H, m), 6,66 (1H, d), 5,27 (1H, m), 2,73 (2H, t), 2,52 (2H, m), 2,41 (2H, t), 2,19 (2H, m), 1,85 (1H, m), 1,72 (5H, m)
Пример 33: 5-[4-(6-циклопентокси-2-пиридил)-2,6-дифтор-фенил]пентановая кислота

2-хлор-6-циклопентилокси-пиридин (0,018 г, 0,091 ммоль), полученный в Примере Получения 12, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты (0,031 г, 0,085 ммоль), полученный в Примере Получения 27, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,017 г, 47%).
ЯМР:1H-ЯМР (CDCl3) δ 7,49 (1H, t), 7,52 (2H, m), 7,22 (1H, m), 6,64 (1H, d), 5,51 (1H, m), 2,73 (2H, t), 2,40 (2H, t), 2,05 (2H, m), 1,82~1,60 (10H, m)
Пример 34: 5-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенил]пентановая кислота
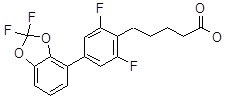
4-бром-2,2-дифтор-бензо[1,3]диоксол (0,059 г, 0,248 ммоль) и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты (0,086 г, 0,232 ммоль), полученный в Примере Получения 27, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,038 г, 44%).
ЯМР:1H-ЯМР (CDCl3) δ 7,26~7,17 (3H, m), 7,07 (1H, m), 7,05 (1H, m), 2,75 (2H, m), 2,41 (2H, m), 1,71~1,60 (4H, m)
Пример 35: 5-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]пентановая кислота

2-циклобутилсульфанил-3-йод-пиридин (0,025 г, 0,084 ммоль), полученный в Примере Получения 13, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты (0,029 г, 0,078 ммоль), полученный в Примере Получения 27, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,01 г, 34%).
ЯМР:1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,33 (1H, m), 7,03 (1H, m), 6,93 (2H, m), 4,42 (1H, m), 2,73 (2H, t), 2,49 (2H, m), 2,42 (2H, t), 2,10~1,95 (4H, m), 1,73 (4H, m)
Пример 36: 5-[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-фенил]пентановая кислота

2-циклопентилсульфанил-3-йод-пиридин (0,034 г, 0,159 ммоль), полученный в Примере Получения 15, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты (0,044 г, 0,12 ммоль), полученный в Примере Получения 27, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,015 г, 33%).
ЯМР:1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,33 (1H, m), 7,03 (1H, m), 6,94 (2H, m), 4,09 (1H, m), 2,73 (2H, t), 2,42 (2H, m), 2,21 (2H, m), 1,71~1,57 (10H, m)
Пример 37: 5-[4-(2-циклопентокси-3-пиридил)-2,6-дифтор-фенил]пентановая кислота
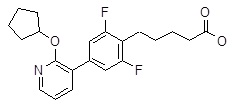
2-циклопентилокси-3-йод-пиридин (0,026 г, 0,089 ммоль), полученный в Примере Получения 11, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты (0,03 г, 0,084 ммоль), полученный в Примере Получения 27, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,014 г, 44%).
ЯМР:1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,58 (1H, m), 7,09 (2H, m), 6,93 (1H, m), 5,52 (1H, m), 2,73 (2H, t), 2,42 (2H, m), 1,95 (2H, m), 1,71~1,57 (10H, m)
Пример 38: {2-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]этокси}уксусная кислота
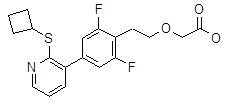
Стадия A: трет-бутиловый эфир {2-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]этокси}уксусной кислоты

2-циклобутилсульфанил-3-йод-пиридин (0,031 г, 0,107 ммоль), полученный в Примере Получения 13, и трет-бутиловый эфир {2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]этокси}уксусной кислоты (0,04 г, 0,10 ммоль), полученный в Примере Получения 30, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,025 г, 58%).
Стадия B: {2-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]этокси}уксусная кислота
Трет-бутиловый эфир {2-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]этокси}уксусной кислоты (0,025 г, 0,057 ммоль), полученный на Стадии A, растворяли в DCM (3 мл). Добавляли TFA (1 мл), и смесь перемешивали в течение 4 часов. После завершения реакции реакционный раствор концентрировали при пониженном давлении и промывали Et2O и DCM. Продукт реакции высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/2) с получением целевого соединения (0,016 г, 76%).
ЯМР:1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,33 (1H, m), 7,03 (1H, m), 6,97 (2H, m), 4,42 (1H, m), 4,13 (2H, s), 3,83 (2H, t), 3,07 (2H, m), 2,51 (2H, m), 2,10~1,95 (4H, m)
Пример 39: 5-[4-(2-циклобутилсульфанил-3-пиридил)фенил]гексановая кислота

2-циклобутилсульфанил-3-йод-пиридин (0,033 г, 0,111 ммоль), полученный в Примере Получения 13, и этиловый эфир 5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,04 г, 0,104 ммоль), полученный в Примере Получения 31, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,021 г, 51%).
ЯМР:1H-ЯМР (CDCl3) δ 8,38 (1H, m), 7,36 (3H, m), 7,26 (2H, m), 7,01 (1H, m), 4,42 (1H, m), 2,75 (1H, m), 2,49 (2H, m), 2,36 (2H, m), 2,10~2,00 (4H, m), 1,67~1,50 (4H, m), 1,30 (3H, d)
Пример 40: 5-[4-(6-циклобутокси-2-пиридил)-фенил]гексановая кислота
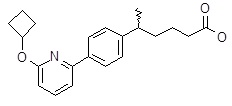
2-хлор-6-циклобутокси-пиридин (0,038 г, 0,206 ммоль), полученный в Примере Получения 29, и этиловый эфир 5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,051 г, 0,147 ммоль), полученный в Примере Получения 31, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,032 г, 63%).
ЯМР:1H-ЯМР (CDCl3) δ 7,94 (2H, d), 7,59 (1H, m), 7,23 (3H, m), 6,61 (1H, d), 5,29 (1H, m), 2,76 (1H, m), 2,53 (2H, m), 2,33 (2H, m), 2,20 (2H, m), 1,90 (1H, m), 1,80~1,50 (5H, m), 1,28 (3H, d)
Пример 41: 5-[4-(6-циклобутокси-2-пиридил)-2,6-дифтор-фенил]гексановая кислота

2-хлор-6-циклобутокси-пиридин (0,068 г, 0,371 ммоль), полученный в Примере Получения 29, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]гексановой кислоты (0,062 г, 0,337 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,030 г, 23%).
ЯМР:1H-ЯМР (CDCl3) δ 7,61 (1H, t), 7,49 (2H, d), 7,23 (1H, m), 6,66 (1H, d), 5,27 (1H, m), 3,24 (1H, m), 2,54 (2H, m), 2,35 (2H, t), 2,20 (2H, m), 1,87 (2H, m), 1,74 (2H, m), 1,70~1,45 (2H, m), 1,25 (3H, d)
Пример 42: 5-[4-(2-этилсульфанил-3-пиридил)-2,6-дифтор-фенил]гексановая кислота

2-Этилсульфанил-3-йод-пиридин (0,041 г, 0,154 ммоль), полученный в Примере Получения 33, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,047 г, 0,144 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,011 г, 21%).
ЯМР:1H-ЯМР (CDCl3) δ 8,44 (1H, m), 7,37 (1H, m), 7,04 (1H, m), 6,93 (2H, d), 3,27 (1H, m), 3,18 (2H, q), 2,37 (2H, t), 1,85 (1H, m), 1,80~1,50 (3H, m), 1,40~1,30 (6H, m)
Пример 43: 5-[2,6-дифтор-4-(2-пропилсульфанил-3-пиридил)-фенил]гексановая кислота

3-Йод-2-пропилсульфанил-пиридин (0,040 г, 0,143 ммоль), полученный в Примере Получения 28, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,044 г, 0,133 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,01 г, 18%).
ЯМР:1H-ЯМР (CDCl3) δ 8,44 (1H, m), 7,35 (1H, m), 7,04 (1H, m), 6,94 (2H, d), 3,24 (1H, m), 3,14 (2H, t), 2,38 (2H, t), 1,85 (1H, m), 1,75~1,60 (5H, m), 1,38 (3H, d), 1,02 (3H, t)
Пример 44: 4-[1-метил-5-(2-феноксифенил)бензимидазол-2-ил]бутановая кислота

Стадия A: этиловый эфир 5-[(2-амино-4-бром-N-метил-анилино)-5-оксо-пентановой кислоты

4-бром-N,N-диметиланилин (0,341 г, 1,69 ммоль) растворяли в DCM (8 мл). Этиловый эфир 5-хлор-5-оксо-пентановой кислоты (0,217 мл, 1,54 ммоль) медленно добавляли при 0°C. TEA (0,472 мл, 3,39 ммоль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 16 часов. После завершения реакции реакционный раствор разбавляли водой и экстрагировали DCM. Органический слой высушивали безводным сульфатом магния и использовали для следующей стадии без очистки.
Стадия B: 4-(5-бром-1-метил-бензимидазол-2-ил)бутановая кислота

Этиловый эфир 5-[(2-Амино-4-бром-N-метил-анилино)-5-оксо-пентановой кислоты, полученный на Стадии A, растворяли в AcOH (4 мл) и перемешивали при 75°C в течение 16 часов. Растворитель отгоняли при пониженном давлении, и продукт реакции промывали толуолом и перегоняли при пониженном давлении. Полученный продукт использовали для следующей стадии без очистки.
Стадия C: метиловый эфир 4-(5-бром-1-метил-бензимидазол-2-ил)бутановой кислоты

Диазометан (2,5 мл) добавляли к 4-(5-бром-1-метил-бензимидазол-2-ил)бутановой кислоте (0,091 г, 0,30 ммоль), полученной на Стадии B, и растворитель отгоняли при пониженном давлении с получением целевого соединения (0,58 г, 63%).
ЯМР:1H-ЯМР (CDCl3) δ 7,84 (1H, s), 7,35 (1H, d), 7,17 (1H, d), 3,74 (3H, s), 3,67 (3H, s), 2,95 (2H, t), 2,52 (2H, t), 2,21 (2H, m)
Стадия D: метиловый эфир 4-[1-метил-5-(2-феноксифенил)бензимидазол-2-ил]бутановой кислоты

2-Феноксифенилбороновую кислоту (0,058 г, 0,269 ммоль) и метиловый эфир 4-(5-бром-1-метил-бензимидазол-2-ил)бутановой кислоты (0,04 г, 0,134 ммоль), полученный на Стадии C, растворяли в DME (3 мл) и воде (0,3 мл) и загружали газообразным N2 в течение 5 минут. Добавляли тетракис(трифенилфосфин)палладий (0) (0,005 г, 0,004 ммоль) и Cs2CO3 (0,175 г, 0,538 ммоль), и смесь перемешивали при 80°C в течение 8 часов. После завершения реакции реакционный раствор разбавляли водой и экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/1) с получением целевого соединения (0,023 г, 21%).
ЯМР:1H-ЯМР (CDCl3) δ 7,88 (1H, m), 7,70~7,60 (5H, m), 7,20 (4H, m), 7,10 (1H, m), 6,90 (1H, m), 3,74 (3H, s), 3,64 (3H, s), 2,95 (2H, t), 2,51 (2H, t), 2,19 (2H, m)
Стадия E: 4-[1-метил-5-(2-феноксифенил)бензимидазол-2-ил]бутановая кислота
Метиловый эфир 4-[1-Метил-5-(2-феноксифенил)бензимидазол-2-ил]бутановой кислоты (0,023 г, 0,057 ммоль), полученный на Стадии D, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,003 г, 14%).
ЯМР:1H-ЯМР (MeOD) δ 7,74 (1H, m), 7,53 (1H, m), 7,45 (2H, s), 7,35 (1H, m), 7,29 (1H, m), 7,21 (2H, m), 7,06 (1H, m), 6,95 (1H, m), 6,85 (2H, d), 3,82 (3H, s), 3,02 (2H, t), 2,42 (2H, t), 2,13 (2H, m)
Пример 45: 3-[1-метил-5-(2-феноксифенил)бензимидазол-2-ил]пропановая кислота
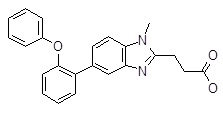
Стадия A: этиловый эфир 4-(2-амино-4-бром-N-метил-анилино)-4-оксо-бутановой кислоты

4-бром-N,N-диметиланилин (0,196 г, 0,974 ммоль) растворяли в DCM (8 мл). Этиловый эфир 3-хлоркарбонил-пропионовой кислоты (0,125 мл, 0,886 ммоль) медленно добавляли при 0°C. TEA (0,273 мл, 1,955 ммоль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 16 часов. После завершения реакции реакционный раствор разбавляли водой и экстрагировали DCM. Органический слой высушивали безводным сульфатом магния и использовали для следующей стадии с простой очисткой фильтрацией.
Стадия B: этиловый эфир 3-(5-бром-1-метил-бензимидазол-2-ил)пропановой кислоты

Этиловый эфир 4-(2-Амино-4-бром-N-метил-анилино)-4-оксо-бутановой кислоты (0,238 г, 0,722 ммоль), полученный на Стадии A, растворяли в AcOH (5 мл) и перемешивали при 75°C в течение 16 часов. Растворитель отгоняли при пониженном давлении, и продукт промывали толуолом и перегоняли при пониженном давлении. Полученный продукт использовали для следующей стадии с простой очисткой фильтрацией.
ЯМР:1H-ЯМР (CDCl3) δ 7,83 (1H, s), 7,34 (1H, d), 7,17 (1H, d), 4,14 (2H, q), 3,76 (3H, s), 3,15 (2H, t), 3,01 (2H, t), 1,26 (2H, t)
Стадия C: 3-[1-метил-5-(2-феноксифенил)бензимидазол-2-ил]пропановая кислота
2-Феноксифенилбороновую кислоту (0,109 г, 0,507 ммоль) и этиловый эфир 3-(5-бром-1-метил-бензимидазол-2-ил)пропановой кислоты (0,079 г, 0,253 ммоль), полученный на Стадии B, последовательно вводили в реакцию таким же образом, как на Стадии D Примера 44 и Стадии B Примера 1, с получением целевого соединения (0,011 г, 11%).
ЯМР:1H-ЯМР (MeOD) δ 7,74 (1H, m), 7,53 (1H, m), 7,47 (2H, s), 7,36 (1H, m), 7,33 (1H, m), 7,23 (2H, m), 7,05 (1H, m), 7,03 (1H, m), 6,84 (2H, d), 3,83 (3H, s), 3,19 (2H, t), 2,92 (2H, t)
Пример 46: 5-[2,6-дифтор-4-(2-изопропокси-3-пиридил)фенил]гексановая кислота

3-Йод-2-изопропокси-пиридин (0,052 г, 0,197 ммоль), полученный в Примере Получения 34, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,071 г, 0,184 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,039 г, 57%).
ЯМР:1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,59 (1H, m), 7,10 (2H, m), 6,92 (1H, m), 5,42 (1H, m), 3,23 (1H, m), 2,37 (2H, t), 1,85 (1H, m), 1,80~1,50 (3H, m), 1,37 (9H, m)
Пример 47: 5-(2ʹ-циклопентиламино-3,5-дифтор-бисфенил-4-ил)гексановая кислота
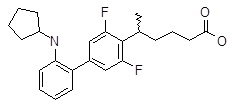
N-циклопентил-2-йод-анилин (0,056 г, 0,195 ммоль), полученный в Примере Получения 35, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,07 г, 0,182 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,035 г, 50%).
ЯМР:1H-ЯМР (CDCl3) δ 7,25 (1H, m), 7,03 (1H, m), 6,90 (2H, d), 6,70 (2H, m), 4,12 (1H, m), 3,23 (1H, m), 2,38 (2H, t), 2,00 (2H, m), 1,85 (1H, m), 1,80~1,50 (8H, m), 1,50~1,40 (5H, m)
Пример 48: 5-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]гексановая кислота
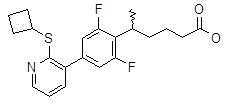
2-циклобутилсульфанил-3-йод-пиридин (0,047 г, 0,161 ммоль), полученный в Примере Получения 13, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]гексановой кислоты (0,049 г, 0,128 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,018 г, 39%).
ЯМР:1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,34 (1H, m), 7,03 (1H, m), 6,93 (2H, d), 4,43 (1H, m), 3,25 (1H, m), 2,52 (2H, m), 2,38 (2H, t), 2,12~2,00 (4H, m), 1,85 (1H, m), 1,75 (2H, m), 1,58 (1H, m), 1,38 (3H, d)
Пример 49: 5-[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-фенил]гексановая кислота

2-циклопентилсульфанил-3-йод-пиридин (0,03 г, 0,14 ммоль), полученный в Примере Получения 15, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]гексановой кислоты (0,043 г, 0,131 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,015 г, 28%).
ЯМР:1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,33 (1H, m), 7,02 (1H, m), 6,92 (2H, d), 4,08 (1H, m), 3,23 (1H, m), 2,37 (2H, t), 2,20 (2H, m), 1,80 (1H, m), 1,80~1,50 (9H, m), 1,36 (3H, d)
Пример 50: 5-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)-фенил]гексановая кислота

3-Йод-2-изопропилсульфанил-пиридин (0,039 г, 0,139 ммоль), полученный в Примере Получения 9, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,043 г, 0,131 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,013 г, 28%).
ЯМР:1H-ЯМР (CDCl3) δ 8,44 (1H, m), 7,35 (1H, m), 7,04 (1H, m), 6,92 (2H, d), 4,06 (1H, m), 3,25 (1H, m), 2,38 (2H, t), 1,83 (1H, m), 1,74 (2H, m), 1,58 (1H, m), 1,36 (9H, m)
Пример 51: 5-[4-(2-циклопентокси-3-пиридил)-2,6-дифтор-фенил]гексановая кислота

2-циклопентилокси-3-йод-пиридин (0,049 г, 0,169 ммоль), полученный в Примере Получения 11, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,052 г, 0,158 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,026 г, 40%).
ЯМР:1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,59 (1H, m), 7,09 (2H, d), 6,92 (1H, m), 5,52 (1H, m), 3,23 (1H, m), 2,37 (2H, t), 1,96 (2H, m), 1,80~1,50 (10H, m), 1,37 (3H, d)
Пример 52: 5-(3ʹ-циклопентиламино-3,5-дифтор-бифенил-4-ил)-гексановая кислота
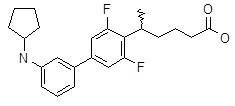
3-бром-N-циклопентил-анилин (0,043 г, 0,178 ммоль), полученный в Примере Получения 36, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,062 г, 0,162 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,03 г, 47%).
ЯМР:1H-ЯМР (CDCl3) δ 7,20 (1H, m), 7,02 (2H, d), 6,80 (1H, m), 6,70 (1H, m), 6,60 (1H, m), 3,80 (1H, m), 3,20 (1H, m), 2,35 (2H, m), 2,10 (2H, m), 1,85 (1H, m), 1,80~1,42 (9H, m), 1,35 (3H, d)
Пример 53: 5-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)-фенил]гексановая кислота

2-хлор-6-изопропилсульфанил-пиридин (0,025 г, 0,134 ммоль), полученный в Примере Получения 10, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,048 г, 0,125 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,019 г, 38%).
ЯМР:1H-ЯМР (CDCl3) δ 7,53 (3H, m), 7,35 (1H, m), 7,10 (1H, m), 4,15 (1H, m), 3,24 (1H, m), 2,36 (2H, t), 1,83 (1H, m), 1,70~1,60 (3H, m), 1,47 (6H, d), 1,37 (3H, d)
Пример 54: 5-[4-(6-циклопентилсульфанил-2-пиридил)-2,6-дифтор-фенил]гексановая кислота

2-хлор-6-циклопентилсульфанил-пиридин (0,03 г, 0,142 ммоль), полученный в Примере Получения 14, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,051 г, 0,133 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,015 г, 29%).
ЯМР:1H-ЯМР (CDCl3) δ 7,52 (3H, m), 7,33 (1H, m), 7,11 (1H, m), 4,18 (1H, m), 3,26 (1H, m), 2,37 (2H, t), 2,26 (2H, m), 1,90~1,60 (10H, m), 1,36 (3H, d)
Пример 55: 5-[2,6-дифтор-4-(6-пропилсульфанил-2-пиридил)фенил]гексановая кислота

2-бром-6-пропилсульфанил-пиридин (0,046 г, 0,195 ммоль), полученный в Примере Получения 37, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,07 г, 0,183 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,034 г, 49%).
ЯМР:1H-ЯМР (CDCl3) δ 7,52 (3H, m), 7,33 (1H, m), 7,13 (1H, m), 3,23 (3H, m), 2,34 (2H, t), 1,84 (3H, m), 1,70~1,60 (3H, m), 1,35 (3H, d), 1,09 (3H, t)
Пример 56: 5-[4-(6-циклопентокси-2-пиридил)-2,6-дифтор-фенил]гексановая кислота
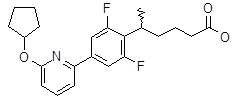
2-хлор-6-циклопентилокси-пиридин (0,035 г, 0,176 ммоль), полученный в Примере Получения 12, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,063 г, 0,164 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,024 г, 37%).
ЯМР:1H-ЯМР (CDCl3) δ 7,59 (1H, t), 7,49 (2H, m), 7,21 (1H, d), 6,64 (1H, d), 5,50 (1H, m), 3,22 (1H, m), 2,33 (2H, t), 2,03 (2H, m), 1,84 (4H, m), 1,75~1,40 (6H, m), 1,34 (3H, d)
Пример 57: 4-[4-(2-изопропокси-3-пиридил)фенил]бутановая кислота

3-Йод-2-изопропокси-пиридин (0,066 г, 0,249 ммоль), полученный в Примере Получения 34, и метиловый эфир 4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]бутановой кислоты (0,069 г, 0,226 ммоль), полученный в Примере Получения 38, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,01 г, 15%).
ЯМР:1H-ЯМР (CDCl3) δ 8,11 (1H, m), 7,60 (1H, m), 7,51 (2H, m), 7,23 (2H, m), 6,90 (1H, m), 5,40 (1H, m), 2,72 (2H, t), 2,43 (2H, m), 2,02 (2H, m), 1,34 (6H, d)
Пример 58: 5-[2,6-дифтор-4-(2-гидрокси-3-пиридил)фенил]гексановая кислота

Стадия A: 3-йод-2-(4-метокси-бензилокси)-пиридин

(4-метокси-фенил)-метанол (0,34 г, 2,46 ммоль) растворяли в DMF (7,5 мл). NaH (60%) (0,107 г, 2,69 ммоль) добавляли при 0°C, и смесь перемешивали. Добавляли 2-Фтор-3-йод-пиридин (0,5 г, 2,24 ммоль), и смесь перемешивали в течение 16 часов. После завершения реакции реакционный раствор разбавляли водой и экстрагировали Et2O. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (0,726 г, 95%).
ЯМР:1H-ЯМР (CDCl3) δ 8,12 (1H, d), 8,03 (1H, d), 7,44 (2H, d), 6,91 (2H, d), 6,65 (1H, m), 5,37 (2H, s), 3,82 (3H, s)
Стадия B: метиловый эфир 5-{2,6-дифтор-4-[2-(4-метокси-бензилокси)-пиридин-3-ил]фенил}гексановой кислоты
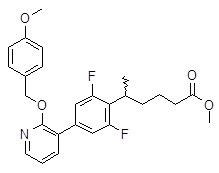
3-Йод-2-(4-метокси-бензилокси)-пиридин (0,102 г, 0,299 ммоль), полученный на Стадии A, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,107 г, 0,279 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,099 г, 75%).
ЯМР:1H-ЯМР (CDCl3) δ 8,18 (1H, d), 7,62 (1H, d), 7,37 (2H, d), 7,09 (2H, d), 6,98 (1H, m), 6,89 (2H, d), 5,43 (2H, s), 4,11 (2H, q), 3,81 (3H, s), 3,21 (1H, m), 2,30 (2H, t), 1,81 (1H, m), 1,66~1,55 (3H, m), 1,35 (3H, d), 1,24 (3H, t)
Стадия C: метиловый эфир 5-[2,6-дифтор-4-(2-гидрокси-3-пиридил)фенил]гексановой кислоты
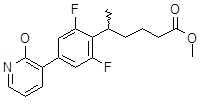
Метиловый эфир 5-{2,6-дифтор-4-[2-(4-метокси-бензилокси)-пиридин-3-ил]фенил}гексановой кислоты (0,099 г, 0,21 ммоль), полученный на Стадии B, растворяли в TFA/DCM (1/1) и перемешивали в течение 2 часов. Растворитель отгоняли при пониженном давлении, и продукт промывали Et2O и использовали для следующей стадии без очистки.
Стадия D: 5-[2,6-дифтор-4-(2-гидрокси-3-пиридил)фенил]гексановая кислота
Метиловый эфир 5-[2,6-дифтор-4-(2-гидрокси-3-пиридил)фенил]гексановой кислоты (0,039 г, 0,116 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,029 г, 78%).
ЯМР:1H-ЯМР (MeOD) δ 7,81 (1H, m), 7,46 (1H, m), 7,44 (2H, d), 6,50 (1H, t), 3,25 (1H, m), 2,27 (2H, t), 1,80 (1H, m), 1,75 (1H, m), 1,70~1,40 (2H, m), 1,36 (3H, d)
Пример 59: 5-[4-(2-циклобутокси-3-пиридил)-2,6-дифтор-фенил]гексановая кислота

2-циклобутокси-3-йод-пиридин (0,06 г, 0,218 ммоль), полученный в Примере Получения 39, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,078 г, 0,203 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,043 г, 56%).
ЯМР:1H-ЯМР (CDCl3) δ 8,12 (1H, m), 7,59 (1H, m), 7,12 (2H, d), 6,93 (1H, d), 5,28 (1H, m), 3,24 (1H, m), 2,47 (2H, m), 2,37 (2H, t), 2,15 (2H, m), 1,90 (2H, m), 1,70~1,50 (4H, m), 1,37 (3H, d)
Пример 60: 5-[4-(2-циклопропилметокси-3-пиридил)-2,6-дифтор-фенил]гексановая кислота

2-циклопропилметокси-3-йод-пиридин (0,062 г, 0,225 ммоль), полученный в Примере Получения 40, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,080 г, 0,21 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,036 г, 47%).
ЯМР:1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,61 (1H, m), 7,14 (2H, d), 6,95 (1H, d), 4,23 (2H, d), 3,24 (1H, m), 2,37 (2H, t), 1,85 (1H, m), 1,84~1,50 (3H, m), 1,40~1,30 (4H, m), 0,61 (2H, m), 0,36 (2H, m)
Пример 61: 5-[[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенокси]метил]изоксазол-3-ол

Стадия A: 5-[[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол
5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,21 г, 0,45 ммоль), полученный в Примере Получения 62, и 3-йод-2-циклобутилсульфанил-пиридин (0,12 г, 0,41 ммоль), полученный в Примере Получения 13, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,14 г, 65%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,39 (2H, d), 7,32 (1H, m), 7,03 (3H, m), 6,92 (2H, d), 6,07 (1H, s), 5,21 (2H, s), 5,20 (2H, s), 4,41 (1H, m), 3,82 (3H, s), 2,50 (2H, m), 2,05 (4H, m)
Стадия B: 5-[[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенокси]метил]изоксазол-3-ол
5-[[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,1 г, 0,19 ммоль), полученный на Стадии A, растворяли в 1,3 мл DCM. Добавляли 0,6 мл TFA и 0,15 мл анизола, и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления водного раствора бикарбоната натрия реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,053 г, 73%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,33 (1H, m), 7,03 (3H, m), 6,13 (1H, s), 5,20 (2H, s), 4,41 (1H, m), 2,52 (2H, m), 2,06 (4H, m)
Пример 62: Nʹ-гидрокси-4-[4-(2-пропилсульфанил-3-пиридил)фенил]бутанамидин

Стадия A: 4-[4-(2-пропилсульфанил-3-пиридил)фенил]бутаннитрил
4-[4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил]бутаннитрил (0,52 г, 1,9 ммоль), полученный в Примере Получения 71, и 3-йод-2-пропилсульфанил-пиридин (0,5 г, 1,79 ммоль), полученный в Примере Получения 28, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,31 г, 56%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,36 (3H, m), 7,26 (2H, d), 7,03 (1H, m), 3,13 (2H, t), 2,82 (2H, t), 2,38 (2H, t), 2,04 (2H, m), 1,70 (2H, m), 1,01 (3H, t)
Стадия B: Nʹ-гидрокси-4-[4-(2-пропилсульфанил-3-пиридил)фенил]бутанамидин
4-[4-(2-Пропилсульфанил-3-пиридил)фенил]бутаннитрил (0,31 г, 1 ммоль), полученный на Стадии A, растворяли в 0,6 мл EtOH. добавляли 0,3 мл 50 вес.% водного раствора гидроксиламина, и смесь перемешивали в течение 16 часов при нагревании с обратным холодильником. Реакционный раствор концентрировали при пониженном давлении и экстрагировали EtOAc с получением целевого соединения (0,32 г, 99%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,36 (3H, m), 7,26 (2H, d), 7,04 (1H, m), 4,53 (2H, ушир.), 3,13 (2H, t), 2,71 (2H, t), 2,22 (2H, t), 1,95 (2H, m), 1,70 (2H, m), 1,00 (3H, t)
Пример 63: 3-[3-[4-(2-пропилсульфанил-3-пиридил)фенил]пропил]-4H-1,2,4-оксадиазол-5-он

Nʹ-гидрокси-4-[4-(2-пропилсульфанил-3-пиридил)фенил]бутанамидин (0,08 г, 0,24 ммоль), полученный в Примере 62, растворяли в 1 мл пиридина. Этиловый эфир хлормуравьиной кислоты (0,023 мл, 0,24 ммоль) добавляли при 0°C, и смесь перемешивали при 100°C в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,018 г, 21%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,36 (3H, m), 7,25 (2H, d), 7,05 (1H, m), 3,12 (2H, t), 2,77 (2H, t), 2,61 (2H, t), 2,08 (2H, m), 1,68 (2H, m), 1,01 (3H, t)
Пример 64: 3-[3-[4-(2-пропилсульфанил-3-пиридил)фенил]пропил]-4H-1,2,4-оксадиазол-5-тион

Nʹ-гидрокси-4-[4-(2-пропилсульфанил-3-пиридил)фенил]бутанамидин (0,11 г, 0,33 ммоль), полученный в Примере 62, растворяли в 1,1 мл CH3CN. Добавляли 1,1ʹ-тиокарбонилдиимидазол (0,079 г, 0,4 ммоль) и DBU (0,064 г, 0,43 ммоль), и смесь перемешивали при комнатной температуре в течение 48 часов. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (0,005 г, 4%).
1H-ЯМР (CDCl3) δ 8,36 (1H, m), 7,26 (3H, m), 7,15 (2H, m), 6,95 (1H, m), 3,06 (2H, t), 2,64 (2H, m), 2,58 (2H, m), 1,99 (2H, m), 1,68 (2H, m), 0,94 (3H, t)
Пример 65: 5-[[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-фенокси]метил]изоксазол-3-ол

5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,087 г, 0,18 ммоль), полученный в Примере Получения 62, и 2-циклопентилсульфанил-3-йод-пиридин (0,056 г, 0,18 ммоль), полученный в Примере Получения 15, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,027 г, 34%).
1H-ЯМР (CDCl3) δ 8,45 (1H, m), 7,34 (1H, m), 7,04 (3H, m), 6,15 (1H, s), 5,19 (2H, s), 4,10 (1H, m), 2,21 (2H, m), 1,73 (2H, m), 1,60 (4H, m)
Пример 66: 5-[[2,6-дифтор-4-(2-пропилсульфанил-3-пиридил)фенокси]метил]изоксазол-3-ол

5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,12 г, 0,25 ммоль), полученный в Примере Получения 62, и 3-йод-2-пропилсульфанил-пиридин (0,064 г, 0,23 ммоль), полученный в Примере Получения 28, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,017 г, 20%).
1H-ЯМР (CDCl3) δ 8,44 (1H, m), 7,34 (1H, m), 7,04 (3H, m), 6,12 (1H, s), 5,19 (2H, s), 1,44 (2H, t), 1,69 (2H, m), 1,02 (3H, t)
Пример 67: 5-[[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенокси]метил]изоксазол-3-ол
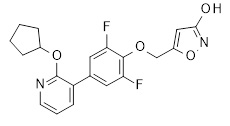
5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,2 г, 0,42 ммоль), полученный в Примере Получения 62, и 2-циклопентокси-3-йод-пиридин (0,1 г, 0,35 ммоль), полученный в Примере Получения 11, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,06 г, 50%).
1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,56 (1H, m), 7,18 (2H, m), 6,92 (1H, m), 6,10 (1H, s), 5,52 (1H, m), 5,18 (2H, s), 1,97 (2H, m), 1,93 (2H, m), 1,74 (2H, m), 1,65 (2H, m)
Пример 68: 5-[[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенокси]метил]изоксазол-3-ол

5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,2 г, 0,43 ммоль), полученный в Примере Получения 62, и 3-йод-2-изопропилсульфанил-пиридин (0,11 г, 0,39 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,033 г, 22%).
1H-ЯМР (CDCl3) δ 8,45 (1H, m), 7,34 (1H, m), 7,03 (3H, m), 6,12 (1H, s), 5,19 (2H, s), 4,06 (1H, m), 1,37 (6H, d)
Пример 69: 5-[[2,6-дифтор-4-(2-изопропокси-3-пиридил)фенокси]метил]изоксазол-3-ол

5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,06 г, 0,13 ммоль), полученный в Примере Получения 62, и 3-йод-2-изопропокси-пиридин (0,03 г, 0,11 ммоль), полученный в Примере Получения 34, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,005 г, 12%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,55 (1H, m), 7,20 (2H, m), 6,92 (1H, m), 6,12 (1H, s), 5,41 (1H, m), 5,18 (2H, s), 1,35 (6H, d)
Пример 70: 5-[[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенокси]метил]изоксазол-3-ол

5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,093 г, 0,2 ммоль), полученный в Примере Получения 62, и 2-хлор-6-изопропилсульфанил-пиридин (0,034 г, 0,18 ммоль), полученный в Примере Получения 10, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,013 г, 19%).
1H-ЯМР (CDCl3) δ 7,59 (2H, m), 7,53 (1H, t), 7,32 (1H, d), 7,10 (1H, d), 6,10 (1H, s), 5,18 (2H, s), 4,13 (1H, m), 1,46 (6H, d)
Пример 71: 5-[[2,6-дифтор-4-(6-изопропокси-2-пиридил)фенокси]метил]изоксазол-3-ол
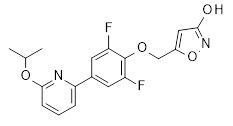
5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,12 г, 0,24 ммоль), полученный в Примере Получения 62, и 2-бром-6-изопропокси-пиридин (0,053 г, 0,24 ммоль), полученный в Примере Получения 42, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,035 г, 40%).
1H-ЯМР (CDCl3) δ 7,58 (3H, m), 7,20 (1H, d), 6,65 (1H, d), 6,10 (1H, s), 5,44 (1H, m), 5,18 (2H, s), 1,40 (6H, d)
Пример 72: 5-[[4-[6-(циклопропилметокси)-2-пиридил]-2,6-дифтор-фенокси]метил]изоксазол-3-ол

5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,094 г, 0,2 ммоль), полученный в Примере Получения 62, и 2-бром-6-(циклопропилметокси)пиридин (0,038 г, 0,16 ммоль), полученный в Примере Получения 44, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,006 г, 10%).
1H-ЯМР (CDCl3) δ 7,61 (3H, m), 7,22 (1H, d), 6,74 (1H, d), 6,10 (1H, s), 5,18 (2H, s), 4,23 (2H, d), 1,35 (1H, m), 0,64 (2H, m), 0,39 (2H, m)
Пример 73: 5-[[2,6-дифтор-4-(6-пропокси-2-пиридил)фенокси]метил]изоксазол-3-ол

5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,094 г, 0,2 ммоль), полученный в Примере Получения 62, и 2-бром-6-пропокси-пиридин (0,036 г, 0,16 ммоль), полученный в Примере Получения 45, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,006 г, 10%).
1H-ЯМР (CDCl3) δ 7,60 (3H, m), 7,22 (1H, d), 6,70 (1H, d), 6,10 (1H, s), 5,18 (2H, s), 4,36 (2H, t), 1,85 (2H, m), 1,06 (3H, t)
Пример 74: 5-[[2,6-дифтор-4-(2-пропокси-3-пиридил)фенокси]метил]изоксазол-3-ол
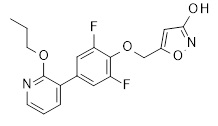
5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,094 г, 0,2 ммоль), полученный в Примере Получения 62, и 3-йод-2-пропокси-пиридин (0,044 г, 0,16 ммоль), полученный в Примере Получения 47, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,023 г, 38%).
1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,57 (1H, m), 7,19 (2H, m), 6,95 (1H, m), 6,11 (1H, s), 5,18 (2H, s), 4,33 (2H, t), 1,80 (2H, m), 1,01 (3H, t)
Пример 75: 5-[(E)-3-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]аллил]тиазолидин-2,4-дион

Тиазолидиндион (0,041 г, 0,35 ммоль) растворяли в 1,4 мл THF и охлаждали до -78°C. Добавляли бутиллитий (0,36 мл, 0,73 ммоль, раствор 2,0 М в гексане), и смесь перемешивали при 0°C в течение 30 минут. Реакционный раствор охлаждали до -78°C и добавляли [(E)-3-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил], аллил]метансульфонат (0,14 г, 0,35 ммоль), полученный в Примере Получения 76, и смесь перемешивали при комнатной температуре в течение 4 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (0,025 г, 16%).
1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,95 (1H, ушир.), 7,34 (1H, m), 7,05 (1H, m), 6,99 (2H, m), 6,63 (1H, d), 6,53 (1H, m), 4,48 (1H, m), 4,43 (1H, m), 3,14 (1H, m), 2,90 (1H, m), 2,51 (2H, m), 2,04 (4H, m)
Пример 76: 5-[[4-[2-(циклобутокси)-3-пиридил]-2,6-дифтор-фенокси]метил]изоксазол-3-ол
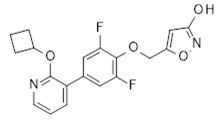
5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,06 г, 0,12 ммоль), полученный в Примере Получения 62, и 2-циклобутокси-3-йод-пиридин (0,032 г, 0,11 ммоль), полученный в Примере Получения 41, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,01 г, 23%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,58 (1H, m), 7,22 (2H, m), 6,95 (1H, m), 6,12 (1H, s), 5,27 (1H, m), 5,18 (2H, s), 2,47 (2H, m), 2,13 (2H, m), 1,84 (1H, m), 1,69 (1H, m)
Пример 77: 5-[[4-[2-(циклобутилметокси)-3-пиридил]-2,6-дифтор-фенокси]метил]изоксазол-3-ол

5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-3-[(4-метоксифенил)метокси]изоксазол (0,06 г, 0,12 ммоль), полученный в Примере Получения 62, и 2-циклобутилметокси-3-йод-пиридин (0,033 г, 0,11 ммоль), полученный в Примере Получения 48, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,011 г, 26%).
1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,58 (1H, m), 7,21 (2H, m), 6,96 (1H, m), 6,11 (1H, s), 5,19 (2H, s), 4,32 (2H, d), 2,78 (1H, m), 2,11 (2H, m), 1,95~1,85 (4H, m)
Пример 78: 5-[[4-[2-(циклопентокси)-3-пиридил] анилино]метил]изоксазол-3-ол

Стадия A: 4-[2-(циклопентокси)-3-пиридил]-N-[[3-[(4-метоксифенил)метокси]изоксазол-5-ил]метил]анилин
4-[2-(Циклопентокси)-3-пиридил]-анилин (0,11 г, 0,45 ммоль), полученный в Примере Получения 64, и 3-[(4-метоксифенил)метокси]изоксазол-5-карбальдегид (0,10 г, 0,45 ммоль), полученный в Примере Получения 61, растворяли в 4,5 мл DCE. Добавляли натрий триацетоксиборгидрид (0,14 г, 0,68 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного раствора бикарбоната натрия реакционный раствор экстрагировали DCM и очищали колоночной хроматографией с получением целевого соединения (0,09 г, 43%).
1H-ЯМР (CDCl3) δ 8,07 (1H, m), 7,54 (1H, m), 7,43 (2H, d), 7,35 (2H, d), 6,92 (2H, d), 6,88 (1H, m), 6,87 (2H, d), 5,84 (1H, s), 5,50 (1H, m), 5,17 (2H, s), 4,40 (2H, d), 4,20 (1H, t, NH), 3,82 (3H, s), 1,93 (2H, m), 1,82 (2H, m), 1,73 (2H, m), 1,61 (2H, m)
Стадия B: 5-[[4-[2-(циклопентокси)-3-пиридил]анилино]метил]изоксазол-3-ол
4-[2-(Циклопентокси)-3-пиридил]-N-[[3-[(4-метоксифенил)метокси]изоксазол-5-ил]метил]анилин (0,033 г, 0,07 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 61, с получением целевого соединения (0,02 г, 84%).
1H-ЯМР (CDCl3) δ 8,07 (1H, m), 7,56 (1H, m), 7,45 (2H, d), 6,88 (1H, m), 6,67 (2H, d), 5,90 (1H, s), 5,49 (1H, m), 4,41 (2H, s), 1,95 (2H, m), 1,83 (2H, m), 1,75 (2H, m), 1,62 (2H, m)
Пример 79: 5-[[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенокси]метил]пиридин-2-ол

2-циклопентокси-3-йод-пиридин (0,08 г, 0,28 ммоль), полученный в Примере Получения 11, и 5-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-2-[(4-метоксифенил)метокси]пиридин (0,14 г, 0,3 ммоль), полученный в Примере Получения 72, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,018 г, 16%).
1H-ЯМР (CDCl3) δ 12,8 (1H, ушир.), 8,14 (1H, m), 7,66 (1H, m), 7,55 (1H, m), 7,41 (1H, m), 7,15 (2H, m), 6,92 (1H, m), 6,62 (1H, m), 5,50 (1H, m), 4,96 (2H, s), 1,94 (2H, m), 1,78 (2H, m), 1,73 (2H, m), 1,65 (2H, m)
Пример 80: 4-[[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенокси]метил]пиридин-2-ол

2-циклопентокси-3-йод-пиридин (0,05 г, 0,18 ммоль), полученный в Примере Получения 11, и 4-[[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]метил]-2-[(4-метоксифенил)метокси]пиридин (0,08 г, 0,18 ммоль), полученный в Примере Получения 73, вводили в реакцию таким же образом, как в Примере 61, с получением целевого соединения (0,018 г, 16%).
1H-ЯМР (CDCl3) δ 12,2 (1H, ушир.), 8,15 (1H, m), 7,54 (1H, m), 7,38 (1H, m), 7,14 (2H, m), 6,90 (1H, m), 6,73 (1H, m), 6,48 (1H, m), 5,50 (1H, m), 5,07 (2H, s), 1,94 (2H, m), 1,81 (2H, m), 1,74 (2H, m), 1,65 (2H, m)
Пример 81: 5-[[4-[2-(циклопентокси)-3-пиридил]фенил] сульфанилметил]изоксазол-3-ол

4-[2-(Циклопентокси)-3-пиридил]тиофенол (0,022 г, 0,08 ммоль), полученный в Примере Получения 65, и [3-[(4-метоксифенил)метокси]изоксазол-5-ил]метил метансульфонат (0,03 г, 0,1 ммоль), полученный в Примере Получения 60, растворяли в 0,8 мл DMF. Добавляли K2CO3 (0,022 г, 0,16 ммоль), и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционный раствор концентрировали при пониженном давлении, и твердые вещества отфильтровывали добавлением EtOAc. Фильтрат очищали колоночной хроматографией для получения 5-[[4-[2-(циклопентокси)-3-пиридил]фенил]сульфанилметил]-3-[(4-метоксифенил)метокси]изоксазола. Полученное соединение вводили в реакцию таким же образом, как на Стадии B Примера 61, с получением целевого соединения (0,01 г, 36%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,58 (1H, m), 7,52 (2H, d), 7,38 (2H, d), 6,93 (1H, m), 5,78 (1H, s), 5,50 (1H, m), 4,05 (2H, s), 1,93 (2H, m), 1,81 (2H, m), 1,72 (2H, m), 1,63 (2H, m)
Пример 82: 5-[(E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]аллил]-1,1-диоксо-1,2,5-тиадиазолидин-3-он

Этиловый эфир 2-[[(E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]аллил]-сульфамоил-амино]уксусной кислоты (0,038 г, 0,08 ммоль), полученный в Примере Получения 75, растворяли в 0,8 мл THF. Добавляли NaH (0,005 г, 0,11 ммоль, 55 вес.% в масле), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали EtOAc. Органический слой очищали колоночной хроматографией с получением целевого соединения (0,022 г, 65%).
1H-ЯМР (CDCl3) δ 8,17 (1H, m), 7,90 (1H, ушир.), 7,60 (1H, m), 7,15 (2H, m), 6,94 (1H, m), 6,64 (1H, d), 6,47 (1H, m), 5,53 (1H, m), 4,20 (2H, d), 3,97 (2H, s), 1,95 (2H, m), 1,80 (2H, m), 1,75 (2H, m), 1,66 (2H, m)
Пример 83: 5-[[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]сульфанилметил]изоксазол-3-ол

Стадия A: 5-[[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]сульфанилметил]-3-[(4-метоксифенил)метокси]изоксазол
4-[2-(Циклопентокси)-3-пиридил]-2,6-дифтор-бензолтиол (0,077 г, 0,25 ммоль), полученный в Примере Получения 68, и [3-[(4-метоксифенил)метокси]изоксазол-5-ил]метил метансульфонат (0,08 г, 0,25 ммоль), полученный в Примере Получения 60, растворяли в 1,5 мл DMF. Добавляли K2CO3 (0,042 г, 0,3 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления воды реакционный раствор экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (0,1 г, 80%).
1H-ЯМР (CDCl3) δ 8,18 (1H, m), 7,60 (1H, m), 7,35 (2H, d), 7,18 (2H, m), 6,96 (1H, m), 6,89 (2H, d), 5,76 (1H, s), 5,53 (1H, m), 5,14 (2H, s), 4,04 (2H, s), 3,80 (3H, s), 1,97 (2H, m), 1,81 (2H, m), 1,75 (2H, m), 1,63 (2H, m)
Стадия B: 5-[[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]сульфанилметил]изоксазол-3-ол
5-[[4-[2-(Циклопентокси)-3-пиридил]-2,6-дифтор-фенил]сульфанилметил]-3-[(4-метоксифенил)метокси]изоксазол (0,1 г, 0,2 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 61, с получением целевого соединения (0,067 г, 85%).
1H-ЯМР (CDCl3) δ 8,18 (1H, m), 7,60 (1H, m), 7,19 (2H, m), 6,93 (1H, m), 5,76 (1H, s), 5,52 (1H, m), 4,01 (2H, s), 1,96 (2H, m), 1,81 (2H, m), 1,75 (2H, m), 1,63 (2H, m)
Пример 84: 5-[[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]метил]изоксазол-3-ол

Стадия A: 4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-N-[[3-[(4-метоксифенил)метокси]изоксазол-5-ил]метил]анилин
4-[2-(Циклопентокси)-3-пиридил]-2,6-дифтор-анилин (0,17 г, 0,6 ммоль), полученный в Примере Получения 67, и 3-[(4-метоксифенил)метокси]изоксазол-5-карбальдегид (0,14 г, 0,6 ммоль), полученный в Примере Получения 61, растворяли в 6 мл DCE. Добавляли натрий триацетоксиборгидрид (0,25 г, 1,2 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления водного раствора бикарбоната натрия реакционный раствор экстрагировали DCM и очищали колоночной хроматографией с получением целевого соединения (0,013 г, 4%).
1H-ЯМР (CDCl3) δ 8,11 (1H, m), 7,54 (1H, m), 7,34 (2H, d), 7,10 (2H, m), 6,90 (3H, m), 5,81 (1H, s), 5,51 (1H, m), 5,16 (2H, s), 4,55 (2H, d), 4,12 (1H, m, NH), 3,81 (3H, s), 1,95 (2H, m), 1,78 (4H, m), 1,64 (2H, m)
Стадия B: 5-[[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]метил]изоксазол-3-ол
4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-N-[[3-[(4-метоксифенил)метокси]изоксазол-5-ил]метил]анилин (0,013 г, 0,026 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 61, с получением целевого соединения (0,007 г, 65%).
1H-ЯМР (CDCl3) δ 8,11 (1H, m), 7,55 (1H, m), 7,12 (2H, m), 6,90 (1H, m), 5,86 (1H, s), 5,51 (1H, m), 4,54 (2H, s), 4,10 (1H, ушир.), 1,95 (2H, m), 1,78 (4H, m), 1,63 (2H, m)
Пример 85: 5-[3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]пропил]-1,1-диоксо-1,2,5-тиадиазолидин-3-он

5-[(E)-3-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]аллил]-1,1-диоксо-1,2,5-тиадиазолидин-3-он (0,016 г, 0,035 ммоль), полученный в Примере 82, растворяли в 0,4 мл MeOH. Добавляли каталитическое количество 10 вес.% Pd/C, и смесь перемешивали в течение 16 часов в атмосфере водорода. Твердые вещества фильтровали через Целит, и фильтрат концентрировали с получением целевого соединения (0,015 г, 94%).
1H-ЯМР (CDCl3) δ 8,16 (1H, m), 7,65 (1H, ушир.), 7,58 (1H, m), 7,12 (2H, m), 6,93 (1H, m), 5,52 (1H, m), 3,94 (2H, s), 3,47 (2H, t), 2,74 (2H, t), 1,96 (2H, m), 1,92 (2H, m), 1,78 (2H, m), 1,75 (2H, m), 1,65 (2H, m)
Пример 86: 5-[[4-[2-(циклопентокси)-3-пиридил]-N-метил-анилино]метил]изоксазол-3-ол
4-[2-(Циклопентокси)-3-пиридил]-N-[[3-[(4-метоксифенил)метокси]изоксазол-5-ил]метил]анилин (0,057 г, 0,12 ммоль), полученный на Стадии A Примера 78, растворяли в 1,2 мл DMF. NaH (0,008 г, 0,18 ммоль, 55 вес.% в масле) добавляли при 0°C, и смесь перемешивали в течение 30 минут. Добавляли йодметан (0,01 г, 0,13 ммоль), и смесь перемешивали при комнатной температуре в течение 72 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали EtOAc и очищали колоночной хроматографией для получения 4-[2-(циклопентокси)-3-пиридил]-N-[[3-[(4-метоксифенил)метокси]изоксазол-5-ил]метил]-N-толуидина (0,023 г, 39%). Полученное соединение вводили в реакцию таким же образом, как на Стадии B Примера 61, с получением целевого соединения (0,001 г, 6%).
1H-ЯМР (CDCl3) δ 8,08 (1H, m), 7,57 (1H, m), 7,51 (2H, d), 6,90 (1H, m), 6,79 (2H, d), 5,78 (1H, s), 5,50 (1H, m), 4,52 (2H, s), 3,08 (3H, s), 1,95 (2H, m), 1,83 (2H, m), 1,75 (2H, m), 1,63 (2H, m)
Пример 87: 5-[2-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]этил]изоксазол-3-ол

Диизопропиламин (0,13 мл, 0,92 ммоль) растворяли в 3,3 мл THF. Бутиллитий (0,35 мл, 0,87 ммоль, раствор 2,5 М в гексане) добавляли при -78°C, и смесь перемешивали в течение 15 минут. Добавляли 5-метилизоксазол-3-ол (0,033 г, 0,33 ммоль), и смесь перемешивали при -78°C в течение 2 часов. Добавляли 3-[4-(Хлорметил)-3,5-дифтор-фенил]-2-(циклопентокси)пиридин (0,16 г, 0,5 ммоль), полученный в Примере Получения 70, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор разбавляли Et2O и охлаждали до 0°C. Реакционный раствор подкисляли до рН 3 и экстрагировали EtOAc. Продукт высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,032 г, 26%).
1H-ЯМР (CDCl3) δ 8,16 (1H, m), 7,58 (1H, m), 7,11 (2H, m), 6,92 (1H, m), 5,71 (1H, s), 5,52 (1H, m), 3,06 (2H, m), 2,98 (2H, m), 1,95 (2H, m), 1,82 (2H, m), 1,75 (2H, m), 1,65 (2H, m)
Пример 88: 5-[2-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]пропил]изоксазол-3-ол

5-Метилизоксазол-3-ол (0,028 г, 0,28 ммоль) и 3-[4-(1-хлорэтил)-3,5-дифтор-фенил]-2-(циклопентокси)пиридин (0,12 г, 0,37 ммоль), полученный в Примере Получения 74, вводили в реакцию таким же образом, как в Примере 87, с получением целевого соединения (0,007 г, 6%).
1H-ЯМР (CDCl3) δ 8,16 (1H, m), 7,59 (1H, m), 7,08 (2H, m), 6,92 (1H, m), 5,61 (1H, s), 5,52 (1H, m), 3,64 (1H, m), 3,14 (1H, m), 3,07 (1H, m), 1,95 (2H, m), 1,83~1,63 (6H, m), 1,43 (3H, d)
Пример 89: 5-[2-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенокси]этил]изоксазол-3-ол

Стадия A: 5-[2-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенокси]этил]-3-[(4-метоксифенил)метокси]изоксазол
4-[2-(Циклопентокси)-3-пиридил]-2,6-дифтор-фенол (0,087 г, 0,3 ммоль) и 2-[3-[(4-метоксифенил)метокси]изоксазол-5-ил]этанол (0,075 г, 0,3 ммоль) вводили в реакцию таким же образом, как в Примере Получения 62, с получением целевого соединения (0,065 г, 40%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,56 (1H, m), 7,39 (2H, d), 7,16 (2H, m), 6,92 (3H, m), 5,90 (1H, s), 5,52 (1H, m), 5,19 (2H, s), 4,43 (2H, t), 3,82 (3H, s), 3,16 (2H, t), 1,95 (2H, m), 1,82 (2H, m), 1,76 (2H, m), 1,64 (2H, m)
Стадия B: 5-[2-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенокси]этил]изоксазол-3-ол
5-[2-[4-[2-(Циклопентокси)-3-пиридил]-2,6-дифтор-фенокси]этил]-3-[(4-метоксифенил)метокси]изоксазол (0,065 г, 0,12 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 61, с получением целевого соединения (0,038 г, 79%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,55 (1H, m), 7,17 (2H, m), 6,92 (1H, m), 5,95 (1H, s), 5,52 (1H, m), 4,44 (2H, t), 3,16 (2H, t), 1,95 (2H, m), 1,82 (2H, m), 1,74 (2H, m), 1,65 (2H, m)
Пример 90: 5-[2-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]этил]изоксазол-3-ол

Стадия A: N-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]-2-(3-гидроксиизоксазол-5-ил)ацетамид
4-[2-(Циклопентокси)-3-пиридил]-2,6-дифтор-анилин (0,17 г, 0,58 ммоль), полученный в Примере Получения 67, и N,Nʹ-дициклогексилкарбодиимид (0,13 г, 0,61 ммоль) растворяли в 2 мл THF. Добавляли 2-(3-Гидроксиизоксазол-5-ил)уксусную кислоту (0,083 г, 0,58 ммоль), и смесь перемешивали при комнатной температуре в течение 72 часов. Дополнительно добавляли 2-(3-Гидроксиизоксазол-5-ил)уксусную кислоту (0,040 г, 0,28 ммоль), и смесь перемешивали при 70°C в течение 90 минут. Реакционный раствор охлаждали до комнатной температуры, и твердые вещества отфильтровывали. Фильтрат очищали колоночной хроматографией с получением целевого соединения (0,067 г, 28%).
1H-ЯМР (CDCl3) δ 8,17 (1H, m), 7,57 (1H, m), 7,22 (2H, m), 7,00 (1H, ушир.), 6,93 (1H, m), 6,07 (1H, s), 5,52 (1H, m), 3,89 (1H, ушир.), 2,33 (2H, s), 1,94 (2H, m), 1,81 (2H, m), 1,74 (2H, m), 1,65 (2H, m)
Стадия B: 5-[2-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]этил]изоксазол-3-ол
N-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]-2-(3-гидроксиизоксазол-5-ил)ацетамид (0,066 г, 0,16 ммоль), полученный на Стадии A, растворяли в 1,6 мл THF. Добавляли боран-диметилсульфид (0,14 мл, 0,67 ммоль, раствор 5,0 М в Et2O), и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор концентрировали при пониженном давлении. После последовательного добавления MeOH и 1Н водного раствора HCl, реакционный раствор концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой очищали колоночной хроматографией с получением целевого соединения (0,02 г, 31%).
1H-ЯМР (CDCl3) δ 8,11 (1H, m), 7,56 (1H, m), 7,12 (2H, m), 6,89 (1H, m), 5,77 (1H, s), 5,52 (1H, m), 3,71 (2H, m), 2,96 (2H, m), 1,97 (2H, m), 1,83 (2H, m), 1,77 (2H, m), 1,65 (2H, m)
Пример 91: 2-[1-[5-(6-изопропилсульфанил-2-пиридил)-2-пиридил]-3-пиперидил]уксусная кислота
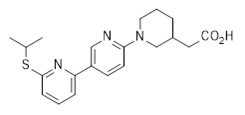
Стадия A: 2-[1-[5-(6-изопропилсульфанил-2-пиридил)-2-пиридил]-3-пиперидил]ацетонитрил
2-Фтор-5-(6-изопропилсульфанил-2-пиридил)пиридин (0,025 г, 0,1 ммоль), полученный на Стадии B Примера Получения 80, и гидрохлоридную соль 2-(3-пиперидил)ацетонитрила (0,06 г, 0,37 ммоль), полученную на Стадии D Примера Получения 86, растворяли в 0,5 мл DMF. Добавляли Cs2CO3 (0,165 г, 0,5 ммоль), и смесь перемешивали при 50°C в течение 4 часов. После удаления твердых веществ продукт очищали колоночной хроматографией с получением целевого соединения (0,015 г, 42%).
1H-ЯМР (CDCl3) δ 8,86 (1H, d), 8,14 (1H, dd), 7,47 (1H, t), 7,30 (1H, d), 7,01 (1H, d), 6,75 (1H, d), 4,38 (1H, m), 4,17 (1H, m), 4,10 (1H, m), 3,09 (1H, m), 2,91 (1H, m), 2,39 (2H, m), 2,05 (2H, m), 1,82 (1H, m), 1,67 (1H, m), 1,50 (1H, m), 1,44 (6H, d)
Стадия B: 2-[1-[5-(6-изопропилсульфанил-2-пиридил)-2-пиридил]-3-пиперидил]уксусная кислота
0,4 мл EtOH и 6Н водный раствор NaOH (0,04 мл, 0,25 ммоль) добавляли к 2-[1-[5-(6-изопропилсульфанил-2-пиридил)-2-пиридил]-3-пиперидил]ацетонитрилу (0,015 г, 0,042 ммоль), полученному на Стадии A, и смесь перемешивали в течение 16 часов при нагревании с обратным холодильником. Реакционный раствор концентрировали при пониженном давлении и подкисляли до pH 5 при помощи 1Н водного раствора HCl. Реакционный раствор экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (0,005 г, 32%).
1H-ЯМР (CDCl3) δ 8,76 (1H, d), 8,18 (1H, m), 7,47 (1H, t), 7,29 (1H, m), 7,01 (1H, d), 6,78 (1H, d), 4,14 (1H, m), 3,84 (1H, m), 3,76 (1H, m), 3,60 (1H, m), 3,48 (1H, m), 2,49 (1H, m), 2,30 (1H, m), 2,23 (1H, m), 1,98 (1H, m), 1,68 (2H, m), 1,50 (1H, m), 1,44 (6H, d)
Пример 92: 4-[[5-(6-изопропилсульфанил-2-пиридил)-2-пиридил]амино]бутановая кислота

Стадия A: этиловый эфир 4-[[5-(6-изопропилсульфанил-2-пиридил)-2-пиридил]амино]бутановой кислоты
3 мл ацетона добавляли к 2-фтор-5-(6-изопропилсульфанил-2-пиридил)пиридину (0,088 г, 0,35 ммоль), полученному на Стадии B Примера Получения 80, гидрохлоридной соли этилового эфира 4-аминобутановой кислоты (0,065 г, 0,39 ммоль) и K2CO3 (0,147 г, 1,06 ммоль), и смесь перемешивали при 70°C в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (0,02 г, 16%).
1H-ЯМР (CDCl3) δ 8,78 (1H, m), 8,09 (1H, m), 7,46 (1H, t), 7,27 (1H, d), 7,00 (1H, d), 6,47 (1H, d), 4,88 (1H, ушир.), 4,14 (3H, m), 3,42 (2H, m), 2,44 (2H, t), 2,00 (2H, m), 1,45 (6H, d), 1,25 (3H, t)
Стадия B: 4-[[5-(6-изопропилсульфанил-2-пиридил)-2-пиридил]амино]бутановая кислота
Этиловый эфир 4-[[5-(6-Изопропилсульфанил-2-пиридил)-2-пиридил]амино]бутановой кислоты (0,02 г, 0,055 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,01 г, 55%).
1H-ЯМР (MeOH-d4) δ 8,63 (1H, m), 8,16 (1H, m), 7,55 (1H, t), 7,40 (1H, d), 7,03 (1H, d), 6,70 (1H, d), 4,07 (1H, m), 3,39 (2H, t), 2,40 (2H, t), 1,92 (2H, m), 1,41 (6H, d)
Пример 93: 2-[1-[4-(2-циклобутилсульфанил-3-пиридил)фенил]пиразол-4-ил]уксусная кислота

Стадия A: метиловый эфир 2-[1-[4-(2-циклобутилсульфанил-3-пиридил)фенил]пиразол-4-ил]уксусной кислоты
Метиловый эфир 2-[1-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиразол-4-ил]уксусной кислоты (0,04 г, 0,11 ммоль), полученный в Примере Получения 81, и 3-йод-2-циклобутилсульфанил-пиридин (0,034 г, 0,11 ммоль), полученный в Примере Получения 13, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,021 г, 47%).
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,97 (1H, s), 7,75 (2H, d), 7,67 (1H, s), 7,50 (2H, d), 7,40 (1H, m), 7,05 (1H, m), 4,43 (1H, m), 3,74 (3H, s), 3,60 (2H, s), 2,51 (2H, m), 2,03 (4H, m)
Стадия B: 2-[1-[4-(2-циклобутилсульфанил-3-пиридил)фенил]пиразол-4-ил]уксусная кислота
Метиловый эфир 2-[1-[4-(2-циклобутилсульфанил-3-пиридил)фенил]пиразол-4-ил]уксусной кислоты (0,021 г, 0,05 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,006 г, 30%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,99 (1H, s), 7,76 (2H, d), 7,70 (1H, s), 7,51 (2H, d), 7,40 (1H, m), 7,06 (1H, m), 4,43 (1H, m), 3,67 (2H, s), 2,51 (2H, m), 2,03 (4H, m)
Пример 94: 5-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]пентановая кислота

Стадия A: этиловый эфир 5-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]-5-оксо-пентановой кислоты
4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилин (0,09 г, 0,31 ммоль), полученный в Примере Получения 67, растворяли в 1,6 мл DCM. Добавляли DIPEA (0,054 мл, 0,31 ммоль) и этил глутарил хлорид (0,05 мл, 0,31 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,09 г, 67%).
1H-ЯМР (CDCl3) δ 8,17 (1H, m), 7,57 (1H, m), 7,20 (2H, m), 7,00 (1H, ушир.), 6,93 (1H, m), 5,52 (1H, m), 4,15 (2H, q), 2,54 (2H, m), 2,46 (2H, m), 2,08 (2H, m), 1,93 (2H, m), 1,79 (2H, m), 1,74 (2H, m), 1,63 (2H, m), 1,27 (3H, t)
Стадия B: этиловый эфир 5-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]пентановой кислоты
Этиловый эфир 5-[4-[2-(Циклопентокси)-3-пиридил]-2,6-дифтор-анилино]-5-оксо-пентановой кислоты (0,06 г, 0,14 ммоль), полученный на Стадии A, растворяли в 1,4 мл THF. Добавляли боран-диметилсульфид (0,06 мл, 0,28 ммоль, раствор 5,0 М в Et2O), и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,009 г, 15%).
1H-ЯМР (CDCl3) δ 8,09 (1H, m), 7,54 (1H, m), 7,10 (2H, m), 6,88 (1H, m), 5,52 (1H, m), 4,13 (2H, q), 3,65 (1H, ушир.), 3,38 (2H, t), 2,35 (2H, t), 1,96 (2H, m), 1,83 (2H, m), 1,75 (4H, m), 1,65 (4H, m), 1,25 (3H, t)
Стадия C: 5-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]пентановая кислота
Этиловый эфир 5-[4-[2-(Циклопентокси)-3-пиридил]-2,6-дифтор-анилино]пентановой кислоты (0,009 г, 0,021 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,004 г, 48%).
1H-ЯМР (CDCl3) δ 8,10 (1H, m), 7,55 (1H, m), 7,12 (2H, m), 6,99 (1H, m), 5,51 (1H, m), 3,39 (2H, t), 2,41 (2H, t), 1,95 (2H, m), 1,83 (2H, m), 1,75 (4H, m), 1,65 (4H, m)
Пример 95: 5-[4-[2-(циклопентокси)-3-пиридил]-N-этил-2,6-дифтор-анилино]пентановая кислота

Стадия A: этиловый эфир 5-[N-ацетил-4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]пентановой кислоты
Этиловый эфир 5-[N-бензилоксикарбонил-4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]пентановой кислоты (0,14 г, 0,25 ммоль), полученный в Примере Получения 87, растворяли в 1,3 мл MeOH. Добавляли каталитическое количество 10 вес.% Pd/C, и смесь перемешивали в течение 16 часов в атмосфере водорода. Твердые вещества отфильтровывали для получения этилового эфира 5-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]пентановой кислоты (0,11 г, 99%). Полученное соединение (0,09 г, 0,21 ммоль) растворяли в 2,1 мл DCM. DIPEA (0,04 мл, 0,23 ммоль) и добавляли ацетилхлорид (0,015 мл, 0,21 ммоль), и смесь перемешивали при комнатной температуре в течение 72 часов. После добавления воды реакционный раствор экстрагировали EtOAc и очищали колоночной хроматографией с получением целевого соединения (0,064 г, 66%).
1H-ЯМР (CDCl3) δ 8,20 (1H, m), 7,62 (1H, m), 7,28 (2H, m), 6,96 (1H, m), 5,55 (1H, m), 4,10 (2H, q), 3,69 (2H, t), 2,31 (2H, t), 1,99 (2H, m), 1,92 (3H, s), 1,83 (2H, m), 1,76 (2H, m), 1,66 (4H, m), 1,57 (2H, m), 1,24 (3H, t)
Стадия B: этиловый эфир 5-[4-[2-(циклопентокси)-3-пиридил]-N-этил-2,6-дифтор-анилино]пентановой кислоты
Этиловый эфир 5-[N-ацетил-4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-анилино]пентановой кислоты (0,06 г, 0,13 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 94, с получением целевого соединения (0,019 г, 33%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,58 (1H, m), 7,12 (2H, m), 6,92 (1H, m), 5,52 (1H, m), 4,11 (2H, q), 3,16 (4H, m), 2,29 (2H, t), 1,97 (2H, m), 1,83 (2H, m), 1,76 (2H, m), 1,65 (4H, m), 1,50 (2H, m), 1,23 (3H, t), 1,05 (3H, t)
Стадия C: 5-[4-[2-(циклопентокси)-3-пиридил]-N-этил-2,6-дифтор-анилино]пентановая кислота
Этиловый эфир 5-[4-[2-(Циклопентокси)-3-пиридил]-N-этил-2,6-дифтор-анилино]пентановой кислоты (0,019 г, 0,04 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,018 г, 99%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,59 (1H, m), 7,12 (2H, m), 6,92 (1H, m), 5,52 (1H, m), 3,17 (4H, m), 2,35 (2H, t), 1,97 (2H, m), 1,83 (2H, m), 1,76 (2H, m), 1,68 (4H, m), 1,53 (2H, m), 1,05 (3H, t)
Пример 96: 5-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)анилино]пентановая кислота

Стадия A: этиловый эфир 5-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)анилино]пентановой кислоты
0,7 мл диметоксиэтан и 2M Na2CO3 (0,3 мл, 0,6 ммоль) добавляли к этиловому эфиру 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилино]пентановой кислоты (0,087 г, 0,23 ммоль), полученному в Примере Получения 83, и 2-хлор-6-изопропилсульфанил-пиридину (0,038 г, 0,2 ммоль), полученному в Примере Получения 10, и загружали азотом в течение 5 минут. Добавляли Pd(PPh3)4(12 мг, 0,01 ммоль), и смесь перемешивали в течение 16 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры, и твердые вещества фильтровали через Целит. Фильтрат очищали колоночной хроматографией с получением целевого соединения (0,057 г, 70%).
1H-ЯМР (CDCl3) δ 7,53 (2H, m), 7,47 (1H, t), 7,26 (1H, d), 7,02 (1H, d), 4,14 (3H, m), 3,77 (1H, ушир.), 3,41 (2H, m), 2,35 (2H, t), 1,74 (2H, m), 1,65 (2H, m), 1,45 (6H, d), 1,26 (3H, t)
Стадия B: 5-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)анилино]пентановая кислота
Этиловый эфир 5-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)анилино]пентановой кислоты (0,057 г, 0,14 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,037 г, 69%).
1H-ЯМР (CDCl3) δ 7,53 (2H, m), 7,47 (1H, t), 7,26 (1H, d), 7,02 (1H, d), 4,13 (1H, m), 3,42 (2H, m), 2,41 (2H, t), 1,75 (2H, m), 1,68 (2H, m), 1,46 (6H, d)
Пример 97: 5-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)анилино]пентановая кислота

Этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилино]пентановой кислоты (0,087 г, 0,23 ммоль), полученный в Примере Получения 83, и 3-йод-2-изопропилсульфанил-пиридин (0,038 г, 0,2 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,043 г, 56%).
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,32 (1H, m), 7,02 (1H, m), 6,90 (2H, m), 4,05 (1H, m), 3,41 (2H, m), 2,43 (2H, t), 1,77 (2H, m), 1,69 (2H, m), 1,37 (6H, d)
Пример 98: 5-[4-[6-(циклопропилметокси)-2-пиридил]-2,6-дифтор-анилино]пентановая кислота

Этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилино]пентановой кислоты (0,087 г, 0,23 ммоль), полученный в Примере Получения 83, и 2-хлор-6-циклопропилметокси-пиридин (0,037 г, 0,2 ммоль), полученный в Примере Получения 43, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,046 г, 61%).
1H-ЯМР (CDCl3) δ 7,58 (1H, m), 7,52 (2H, m), 7,16 (1H, d), 6,65 (1H, d), 4,23 (2H, d), 3,41 (2H, m), 2,42 (2H, t), 1,76 (2H, m), 1,67 (2H, m), 1,33 (1H, m), 0,63 (2H, m), 0,38 (2H, m)
Пример 99: 5-[4-[2-(циклопропилметокси)-3-пиридил]-2,6-дифтор-анилино]пентановая кислота

Этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилино]пентановой кислоты (0,087 г, 0,23 ммоль), полученный в Примере Получения 83, и 2-циклопропилметокси-3-йод-пиридин (0,055 г, 0,2 ммоль), полученный в Примере Получения 40, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,042 г, 57%).
1H-ЯМР (CDCl3) δ 8,08 (1H, m), 7,57 (1H, m), 7,17 (2H, m), 6,92 (1H, m), 4,22 (2H, d), 3,40 (2H, m), 2,42 (2H, t), 1,77 (2H, m), 1,68 (2H, m), 1,30 (1H, m), 0,60 (2H, m), 0,35 (2H, m)
Пример 100: 2-[1-[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

Стадия A: метиловый эфир 2-[1-[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты
Метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,082 г, 0,21 ммоль), полученный в Примере Получения 84, и 2-циклопентилсульфанил-3-йод-пиридин (0,053 г, 0,19 ммоль), полученный в Примере Получения 15, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,052 г, 66%).
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,32 (1H, m), 7,01 (1H, m), 6,93 (2H, m), 4,08 (1H, m), 3,69 (3H, s), 3,31 (2H, m), 3,14 (2H, m), 2,31 (2H, d), 2,03 (2H, m), 1,95 (1H, m), 1,77 (4H, m), 1,72 (4H, m), 1,45 (2H, m)
Стадия B: 2-[1-[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
Метиловый эфир 2-[1-[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты (0,052 г, 0,12 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,024 г, 48%).
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,30 (1H, m), 7,01 (1H, m), 6,92 (2H, m), 4,08 (1H, m), 3,33 (2H, m), 3,15 (2H, m), 2,36 (2H, d), 2,20 (2H, m), 1,95 (1H, m), 1,82 (2H, m), 1,72 (2H, m), 1,62-1,48 (6H, m)
Пример 101: 5-[4-[6-(циклопропилметокси)-2-пиридил]-2,6-дифтор-N-метил-анилино]пентановая кислота

5-[4-[6-(Циклопропилметокси)-2-пиридил]-2,6-дифтор-анилино]пентановую кислоту (0,023 г, 0,06 ммоль), полученную в Примере 98, растворяли в 3 мл DMF. Последовательно добавляли NaH (0,008 г, 55 вес.% в масле, 0,18 ммоль) и йодметан (0,011 мл, 0,18 ммоль), и смесь перемешивали при комнатной температуре в течение 1 часа. После добавления водного раствора хлорида аммония реакционный раствор экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,013 г, 54%).
1H-ЯМР (CDCl3) δ 7,60 (1H, t), 7,50 (2H, m), 7,21 (1H, d), 6,70 (1H, d), 4,24 (2H, d), 3,14 (2H, t), 2,90 (3H, s), 2,35 (2H, t), 1,67 (2H, m), 1,59 (2H, m), 1,33 (1H, m), 0,63 (2H, m), 0,39 (2H, m)
Пример 102: 2-[1-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

Метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,082 г, 0,21 ммоль), полученный в Примере Получения 84, и 2-циклопентокси-3-йод-пиридин (0,055 г, 0,19 ммоль), полученный в Примере Получения 11, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,04 г, 42%).
1H-ЯМР (CDCl3) δ 8,12 (1H, m), 7,55 (1H, m), 7,08 (2H, m), 6,90 (1H, m), 5,51 (1H, m), 3,32 (2H, m), 3,15 (2H, m), 2,36 (2H, d), 1,95 (3H, m), 1,84 (6H, m), 1,50 (2H, m), 1,47 (2H, m)
Пример 103: 2-[1-[2,6-дифтор-4-(2-тетрагидрофуран-3-илокси-3-пиридил)фенил]-4-пиперидил]уксусная кислота

Метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,082 г, 0,21 ммоль), полученный в Примере Получения 84, и и 3-йод-2-(тетрагидро-фуран-3-илокси)-пиридин (0,055 г, 0,19 ммоль), полученный в Примере Получения 49, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,036 г, 46%).
1H-ЯМР (CDCl3) δ 8,10 (1H, m), 7,58 (1H, m), 7,10 (2H, m), 6,96 (1H, m), 5,64 (1H, m), 4,13 (1H, m), 3,93 (3H, m), 3,32 (2H, m), 3,15 (2H, m), 2,36 (2H, d), 2,25 (1H, m), 2,13 (1H, m), 1,98 (1H, m), 1,82 (2H, m), 1,50 (2H, m)
Пример 104: 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-4-пиперидил]уксусная кислота

Метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,082 г, 0,21 ммоль), полученный в Примере Получения 84, и 3-йод-2-изопропилсульфанил-пиридин (0,05 г, 0,19 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,024 г, 32%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,33 (1H, m), 7,02 (1H, m), 6,91 (2H, m), 4,06 (1H, m), 3,32 (2H, m), 3,16 (2H, m), 2,36 (2H, d), 1,98 (1H, m), 1,83 (2H, m), 1,51 (2H, m), 1,37 (6H, d)
Пример 105: 2-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]-4-пиперидил]уксусная кислота

Метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,082 г, 0,21 ммоль), полученный в Примере Получения 84, и 2-хлор-6-изопропилсульфанил-пиридин (0,035 г, 0,19 ммоль), полученный в Примере Получения 10, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,024 г, 31%).
1H-ЯМР (CDCl3) δ 7,53 (3H, m), 7,27 (1H, d), 7,05 (1H, d), 4,13 (1H, m), 3,32 (2H, m), 3,17 (2H, m), 2,37 (2H, d), 1,98 (1H, m), 1,97 (2H, m), 1,49 (8H, m)
Пример 106: 2-[1-[4-[6-(циклопропилметокси)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
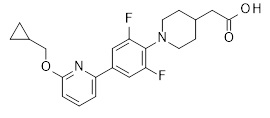
Метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,082 г, 0,21 ммоль), полученный в Примере Получения 84, и 2-хлор-6-циклопропилметокси-пиридин (0,035 г, 0,19 ммоль), полученный в Примере Получения 43, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,027 г, 35%).
1H-ЯМР (CDCl3) δ 7,60 (1H, t), 7,51 (2H, m), 7,20 (1H, d), 6,70 (1H, d), 4,23 (2H, d), 3,32 (2H, m), 3,16 (2H, m), 2,35 (2H, d), 1,98 (1H, m), 1,82 (2H, m), 1,50 (2H, m), 1,34 (1H, m), 0,64 (2H, m), 0,40 (2H, m)
Пример 107: 2-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]-3-пиперидил]уксусная кислота
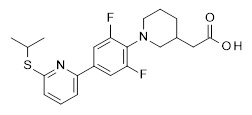
Стадия A: 2-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]-3-пиперидил]ацетонитрил
2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-3-пиперидил]ацетонитрил (0,12 г, 0,33 ммоль), полученный в Примере Получения 86, и 2-хлор-6-изопропилсульфанил-пиридин (0,056 г, 0,3 ммоль), полученный в Примере Получения 10, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,081 г, 70%).
1H-ЯМР (CDCl3) δ 7,52 (3H, m), 7,30 (1H, d), 7,07 (1H, d), 4,13 (1H, m), 3,36 (1H, m), 3,25 (1H, m), 3,11 (1H, m), 2,98 (1H, m), 2,47 (2H, m), 2,17 (1H, m), 1,93 (1H, m), 1,80 (1H, m), 1,73 (1H, m), 1,47 (7H, m)
Стадия B: 2-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]-3-пиперидил]уксусная кислота
2-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]-3-пиперидил]ацетонитрил (0,081 г, 0,21 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 91, с получением целевого соединения (0,046 г, 54%).
1H-ЯМР (CDCl3) δ 7,50 (3H, m), 7,28 (1H, d), 7,05 (1H, d), 4,13 (1H, m), 3,35 (1H, m), 3,25 (1H, m), 3,07 (1H, m), 2,90 (1H, m), 2,46 (1H, m), 2,35 (1H, m), 2,45 (1H, m), 1,90 (1H, m), 1,75 (2H, m), 1,46 (6H, d), 1,25 (1H, m)
Пример 108: 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-3-пиперидил]уксусная кислота

Стадия A: 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-3-пиперидил]ацетонитрил
2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-3-пиперидил]ацетонитрил (0,12 г, 0,33 ммоль), полученный в Примере Получения 86, и 3-йод-2-изопропилсульфанил-пиридин (0,084 г, 0,3 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,072 г, 63%).
1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,32 (1H, m), 7,02 (1H, m), 6,95 (2H, m), 4,07 (1H, m), 3,36 (1H, m), 3,24 (1H, m), 3,10 (1H, m), 2,98 (1H, m), 2,47 (2H, m), 2,16 (1H, m), 1,92 (1H, m), 1,80 (1H, m), 1,73 (1H, m), 1,43 (1H, m), 1,36 (6H, d)
Стадия B: 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-3-пиперидил]уксусная кислота
2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-3-пиперидил]ацетонитрил (0,072 г, 0,19 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 91, с получением целевого соединения (0,023 г, 30%).
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,33 (1H, m), 7,02 (1H, m), 6,92 (2H, m), 4,06 (1H, m), 3,35 (1H, m), 3,24 (1H, m), 3,07 (1H, m), 2,90 (1H, m), 2,45 (1H, m), 2,35 (1H, m), 2,24 (1H, m), 1,89 (1H, m), 1,73 (2H, m), 1,36 (6H, d), 1,26 (1H, m)
Пример 109: 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]азетидин-3-ил]уксусная кислота

Стадия A: этиловый эфир 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]азетидин-3-ил]уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,076 г, 0,2 ммоль), полученный в Примере Получения 88, и 3-йод-2-изопропилсульфанил-пиридин (0,05 г, 0,18 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,046 г, 63%).
1H-ЯМР (CDCl3) δ 8,39 (1H, m), 7,31 (1H, m), 7,00 (1H, m), 6,84 (2H, m), 4,40 (2H, m), 4,15 (2H, q), 4,05 (1H, m), 3,92 (2H, m), 3,05 (1H, m), 2,71 (2H, d), 1,37 (6H, d), 1,27 (3H, t)
Стадия B: 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]азетидин-3-ил]уксусная кислота
Этиловый эфир 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]азетидин-3-ил]уксусной кислоты (0,046 г, 0,11 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,016 г, 40%).
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,31 (1H, m), 7,00 (1H, m), 6,86 (2H, m), 4,42 (2H, m), 4,03 (1H, m), 3,93 (2H, m), 3,07 (1H, m), 2,78 (2H, d), 1,36 (6H, d)
Пример 110: 6-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-6-азаспиро[2,5]октан-2-карбоновая кислота

Стадия A: этиловый эфир 6-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-6-азаспиро[2,5]октан-2-карбоновой кислоты
Этиловый эфир 6-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-6-азаспиро[2,5]октан-2-карбоновой кислоты (0,092 г, 0,21 ммоль), полученный в Примере Получения 89, и 3-йод-2-изопропилсульфанил-пиридин (0,053 г, 0,19 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,061 г, 72%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,33 (1H, m), 7,02 (1H, m), 6,92 (2H, m), 4,17 (2H, q), 4,06 (1H, m), 3,32~3,11 (4H, m), 1,86 (2H, m), 1,59 (3H, m), 1,34 (6H, d), 1,30 (3H, t), 1,20 (1H, m), 0,96 (1H, m)
Стадия B: 6-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-6-азаспиро[2,5]октан-2-карбоновая кислота
Этиловый эфир 6-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-6-азаспиро[2,5]октан-2-карбоновой кислоты (0,061 г, 0,13 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,04 г, 70%).
1H-ЯМР (CDCl3+MeOH-d4) δ 8,42 (1H, m), 7,34 (1H, m), 7,04 (1H, m), 6,94 (2H, m), 4,05 (1H, m), 3,40~3,10 (4H, m), 1,90 (2H, m), 1,60 (3H, m), 1,36 (6H, d), 1,19 (1H, m), 0,99 (1H, m)
Пример 111: 6-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]-6-азаспиро[2,5]октан-2-карбоновая кислота
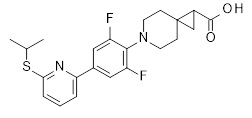
Этиловый эфир 6-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-6-азаспиро[2,5]октан-2-карбоновой кислоты (0,092 г, 0,21 ммоль), полученный в Примере Получения 89, и 2-хлор-6-изопропилсульфанил-пиридин (0,036 г, 0,19 ммоль), полученный в Примере Получения 10, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,045 г, 57%).
1H-ЯМР (CDCl3) δ 7,51 (3H, m), 7,30 (1H, m), 7,07 (1H, m), 4,12 (1H, m), 3,30~3,19 (4H, m), 1,93 (2H, m), 1,62 (3H, m), 1,46 (6H, d), 1,26 (1H, m), 1,05 (1H, m)
Пример 112: 2-[1-[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота

Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,10 г, 0,26 ммоль), полученный в Примере Получения 88, и 2-циклопентилсульфанил-3-йод-пиридин (0,072 г, 0,24 ммоль), полученный в Примере Получения 15, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,045 г, 46%).
1H-ЯМР (CDCl3) δ 8,39 (1H, m), 7,29 (1H, m), 6,99 (1H, m), 6,85 (2H, m), 4,42 (2H, m), 4,07 (1H, m), 3,94 (2H, m), 3,05 (1H, m), 2,78 (2H, d), 2,20 (2H, m), 1,74 (2H, m), 1,56 (4H, m)
Пример 113: 2-[1-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота
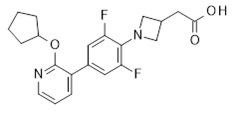
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,10 г, 0,26 ммоль), полученный в Примере Получения 88, и 2-циклопентокси-3-йод-пиридин (0,070 г, 0,24 ммоль), полученный в Примере Получения 11, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,035 г, 37%).
1H-ЯМР (CDCl3) δ 8,10 (1H, m), 7,54 (1H, m), 7,05 (2H, m), 6,89 (1H, m), 5,50 (1H, m), 4,41 (2H, m), 3,93 (2H, m), 3,05 (1H, m), 2,80 (2H, d), 1,95 (2H, m), 1,83 (2H, m), 1,77 (2H, m), 1,64 (2H, m)
Пример 114: 2-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]азетидин-3-ил]уксусная кислота

Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,10 г, 0,26 ммоль), полученный в Примере Получения 88, и 2-хлор-6-изопропилсульфанил-пиридин (0,045 г, 0,24 ммоль), полученный в Примере Получения 10, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,048 г, 52%).
1H-ЯМР (CDCl3) δ 7,46 (3H, m), 7,25 (1H, d), 7,00 (1H, d), 4,43 (2H, m), 4,12 (1H, m), 3,95 (2H, m), 3,05 (1H, m), 2,79 (2H, d), 1,46 (6H, d)
Пример 115: 2-[1-[2,6-дифтор-4-(6-изопропокси-2-пиридил)фенил]азетидин-3-ил]уксусная кислота

Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,10 г, 0,26 ммоль), полученный в Примере Получения 88, и 2-хлор-6-изопропокси-пиридин (0,041 г, 0,24 ммоль), полученный в Примере Получения 46, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,012 г, 13%).
1H-ЯМР (CDCl3) δ 7,54 (1H, t), 7,45 (2H, m), 7,12 (1H, d), 6,56 (1H, d), 5,44 (1H, m), 4,42 (2H, m), 3,94 (2H, m), 3,05 (1H, m), 2,79 (2H, d), 1,39 (6H, d)
Пример 116: 2-[1-[4-[6-(циклопентокси)-2-пиридил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота

Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,10 г, 0,26 ммоль), полученный в Примере Получения 88, и 2-хлор-6-циклопентокси-пиридин (0,047 г, 0,24 ммоль), полученный в Примере Получения 12, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,012 г, 12%).
1H-ЯМР (CDCl3) δ 7,54 (1H, t), 7,47 (2H, m), 7,12 (1H, d), 6,56 (1H, d), 5,50 (1H, m), 4,42 (2H, m), 3,95 (2H, m), 3,05 (1H, m), 2,79 (2H, d), 2,05 (2H, m), 1,83 (4H, m), 1,65 (2H, m)
Пример 117: 2-[1-[2,6-дифтор-4-(2-пропилсульфанил-3-пиридил)фенил]-4-пиперидил]уксусная кислота
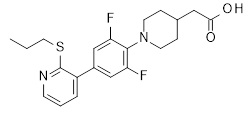
Метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,11 г, 0,28 ммоль), полученный в Примере Получения 84, и 3-йод-2-пропилсульфанил-пиридин (0,071 г, 0,25 ммоль), полученный в Примере Получения 28, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,038 г, 37%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,33 (1H, m), 7,02 (1H, m), 6,95 (2H, m), 3,32 (2H, m), 3,14 (4H, m), 2,37 (2H, d), 1,98 (1H, m), 1,83 (2H, m), 1,70 (2H, m), 1,50 (2H, m), 1,01 (3H, t)
Пример 118: 2-[1-[4-(2-циклобутилсульфанил-3-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

Метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,11 г, 0,28 ммоль), полученный в Примере Получения 84, и 3-йод-2-циклобутилсульфанил-пиридин (0,075 г, 0,25 ммоль), полученный в Примере Получения 13, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,031 г, 29%).
1H-ЯМР (CDCl3) δ 8,39 (1H, m), 7,31 (1H, m), 7,01 (1H, m), 6,93 (2H, m), 4,42 (1H, m), 3,32 (2H, m), 3,15 (2H, m), 2,50 (2H, m), 2,37 (2H, d), 2,05 (5H, m), 1,83 (2H, m), 1,50 (2H, m)
Пример 119: 2-[1-[2,6-дифтор-4-(2-изопропокси-3-пиридил)фенил]-4-пиперидил]уксусная кислота
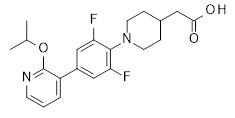
Метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,11 г, 0,28 ммоль), полученный в Примере Получения 84, и 3-йод-2-изопропокси-пиридин (0,067 г, 0,25 ммоль), полученный в Примере Получения 34, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,046 г, 47%).
1H-ЯМР (CDCl3) δ 8,11 (1H, m), 7,55 (1H, m), 7,11 (2H, m), 6,90 (1H, m), 5,40 (1H, m), 3,31 (2H, m), 3,15 (2H, m), 2,37 (2H, d), 1,97 (1H, m), 1,82 (2H, m), 1,50 (2H, m), 1,36 (6H, d)
Пример 120: 2-[1-[2,6-дифтор-4-(2-пропокси-3-пиридил)фенил]-4-пиперидил]уксусная кислота

Метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,11 г, 0,28 ммоль), полученный в Примере Получения 84, и 3-йод-2-пропокси-пиридин (0,067 г, 0,25 ммоль), полученный в Примере Получения 47, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,032 г, 33%).
1H-ЯМР (CDCl3) δ 8,12 (1H, m), 7,57 (1H, m), 7,10 (2H, m), 6,93 (1H, m), 4,32 (2H, t), 3,31 (2H, m), 3,15 (2H, m), 2,37 (2H, d), 1,97 (1H, m), 1,82 (4H, m), 1,50 (2H, m), 1,02 (3H, t)
Пример 121: 2-[1-[4-[2-(циклопропилметокси)-3-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

Метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,11 г, 0,28 ммоль), полученный в Примере Получения 84, и 2-циклопропилметокси-3-йод-пиридин (0,07 г, 0,25 ммоль), полученный в Примере Получения 40, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,046 г, 45%).
1H-ЯМР (CDCl3) δ 8,10 (1H, m), 7,58 (1H, m), 7,16 (2H, m), 6,93 (1H, m), 4,22 (2H, d), 3,31 (2H, m), 3,15 (2H, m), 2,37 (2H, d), 1,98 (1H, m), 1,82 (2H, m), 1,50 (2H, m), 1,30 (1H, m), 0,59 (2H, m), 0,35 (2H, m)
Пример 122: 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пиразол-4-ил]уксусная кислота

Стадия A: метиловый эфир 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пиразол-4-ил]уксусной кислоты
Метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиразол-4-ил]уксусной кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 90, и 3-йод-2-изопропилсульфанил-пиридин (0,066 г, 0,23 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,065 г, 70%).
1H-ЯМР (CDCl3) δ 8,48 (1H, m), 7,77 (1H, s), 7,72 (1H, s), 7,39 (1H, m), 7,16 (2H, m), 7,07 (1H, m), 4,10 (1H, m), 3,75 (3H, s), 3,63 (2H, s), 1,38 (6H, d)
Стадия B: 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пиразол-4-ил]уксусная кислота
Метиловый эфир 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пиразол-4-ил]уксусной кислоты (0,065 г, 0,16 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,021 г, 33%).
1H-ЯМР (CDCl3) δ 8,48 (1H, m), 7,80 (1H, s), 7,74 (1H, s), 7,40 (1H, m), 7,16 (2H, m), 7,08 (1H, m), 4,09 (1H, m), 3,67 (2H, s), 1,38 (6H, d)
Пример 123: 2-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]пиразол-4-ил]уксусная кислота

Метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиразол-4-ил]уксусной кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 90, и 2-хлор-6-изопропилсульфанил-пиридин (0,044 г, 0,23 ммоль), полученный в Примере Получения 10, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,032 г, 37%).
1H-ЯМР (CDCl3) δ 7,80 (1H, s), 7,75 (2H, m), 7,74 (1H, s), 7,57 (1H, t), 7,41 (1H, d), 7,16 (1H, d), 4,14 (1H, m), 3,68 (2H, s), 1,48 (6H, d)
Пример 124: 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пирролидин-3-ил]уксусная кислота

Стадия A: этиловый эфир 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пирролидин-3-ил]уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,105 г, 0,26 ммоль), полученный в Примере Получения 91, и 3-йод-2-изопропилсульфанил-пиридин (0,062 г, 0,22 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,055 г, 59%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,32 (1H, m), 7,01 (1H, m), 6,88 (2H, m), 4,16 (2H, q), 4,05 (1H, m), 3,72 (1H, m), 3,67 (1H, m), 3,60 (1H, m), 3,33 (1H, m), 2,64 (1H, m), 2,46 (2H, m), 2,13 (1H, m), 1,63 (1H, m), 1,36 (6H, d), 1,27 (3H, t)
Стадия B: 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пирролидин-3-ил]уксусная кислота
Этиловый эфир 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пирролидин-3-ил]уксусной кислоты (0,055 г, 0,13 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,038 г, 74%).
1H-ЯМР (CDCl3) δ 8,39 (1H, m), 7,32 (1H, m), 7,01 (1H, m), 6,89 (2H, m), 4,04 (1H, m), 3,74 (1H, m), 3,66 (1H, m), 3,60 (1H, m), 3,35 (1H, m), 2,65 (1H, m), 2,53 (2H, m), 2,18 (1H, m), 1,65 (1H, m), 1,36 (6H, d)
Пример 125: 2-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]пирролидин-3-ил]уксусная кислота

Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,105 г, 0,26 ммоль), полученный в Примере Получения 91, и 2-хлор-6-изопропилсульфанил-пиридин (0,042 г, 0,22 ммоль), полученный в Примере Получения 10, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,04 г, 46%).
1H-ЯМР (CDCl3) δ 7,48 (3H, m), 7,26 (1H, d), 7,02 (1H, d), 4,13 (1H, m), 3,76 (1H, m), 3,70 (1H, m), 3,62 (1H, m), 3,38 (1H, m), 2,66 (1H, m), 2,54 (2H, m), 2,20 (1H, m), 1,66 (1H, m), 1,46 (6H, d)
Пример 126: 3-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-4-пиперидил]пропановая кислота

Стадия A: этиловый эфир 3-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-4-пиперидил]пропановой кислоты
Этиловый эфир 3-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]пропановой кислоты (0,11 г, 0,26 ммоль), полученный в Примере Получения 92, и 3-йод-2-изопропилсульфанил-пиридин (0,062 г, 0,22 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,069 г, 69%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 73,2 (1H, m), 7,02 (1H, m), 6,92 (2H, m), 4,15 (2H, q), 4,06 (1H, m), 3,31 (2H, m), 3,10 (2H, m), 2,36 (2H, m), 1,74 (2H, m), 1,65 (2H, m), 1,41 (3H, m), 1,36 (6H, d), 1,27 (3H, t)
Стадия B: 3-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-4-пиперидил]пропановая кислота
Этиловый эфир 3-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-4-пиперидил]пропановой кислоты (0,069 г, 0,15 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,04 г, 62%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,33 (1H, m), 7,02 (1H, m), 6,91 (2H, m), 4,06 (1H, m), 3,32 (2H, m), 3,10 (2H, m), 2,43 (2H, m), 1,75 (2H, m), 1,67 (2H, m), 1,45 (3H, m), 1,35 (6H, d)
Пример 127: 3-[1-[2,6-дифтор-4-(6-изопропилсульфанил-2-пиридил)фенил]-4-пиперидил]пропановая кислота

Этиловый эфир 3-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]пропановой кислоты (0,11 г, 0,26 ммоль), полученный в Примере Получения 92, и 2-хлор-6-изопропилсульфанил-пиридин (0,042 г, 0,22 ммоль), полученный в Примере Получения 10, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,052 г, 56%).
1H-ЯМР (CDCl3) δ 7,51 (3H, m), 7,29 (1H, d), 7,06 (1H, d), 4,13 (1H, m), 3,33 (2H, m), 3,10 (2H, m), 2,43 (2H, m), 1,75 (2H, m), 1,68 (2H, m), 1,45 (9H, m)
Пример 128: 2-[2-[4-(2-циклопентилсульфанил-3-пиридил)-2,6-дифтор-анилино]этил]циклопропанкарбоновая кислота

Этиловый эфир 2-[2-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилино]этил]циклопропанкарбоновой кислоты (0,04 г, 0,1 ммоль), полученный в Примере Получения 85, и 2-циклопентилсульфанил-3-йод-пиридин (0,031 г, 0,1 ммоль), полученный в Примере Получения 15, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,021 г, 50%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,31 (1H, m), 7,00 (1H, m), 6,91 (2H, m), 4,08 (1H, m), 3,49 (2H, t), 2,20 (2H, m), 1,72~1,45 (9H, m), 1,36 (2H, m), 0,85 (1H, m)
Пример 129: 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-3-пиперидил]ацетамид
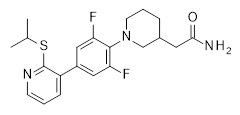
1,9 мл EtOH и 0,19 мл 6М водного раствора NaOH добавляли к 2-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-3-пиперидил]ацетонитрилу (0,072 г, 0,18 ммоль), полученному на Стадии A Примера 108, и смесь перемешивали в течение 24 часов при нагревании с обратным холодильником. Реакционный раствор концентрировали при пониженном давлении. После добавления воды реакционный раствор подкисляли до рН 5 при помощи 1Н водного раствора HCl и экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,025 г, 33%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,32 (1H, m), 7,02 (1H, m), 6,92 (2H, m), 5,56 (1H, ушир.), 5,51 (1H, ушир.), 4,06 (1H, m), 3,33 (1H, m), 3,24 (1H, m), 3,08 (1H, m), 2,89 (1H, m), 2,37 (1H, m), 2,26~2,18 (2H, m), 1,89 (1H, m), 1,74 (2H, m), 1,37 (6H, d), 1,30 (1H, m)
Пример 130: 2-[4-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пиперазин-1-ил]уксусная кислота

Этиловый эфир 2-[4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиперазин-1-ил]уксусной кислоты (0,12 г, 0,29 ммоль), полученный в Примере Получения 93, и 3-йод-2-изопропилсульфанил-пиридин (0,074 г, 0,26 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,002 г, 2%).
1H-ЯМР (MeOH-d4) δ 8,47 (1H, m), 7,56 (1H, m), 7,19 (1H, m), 7,07 (2H, m), 3,99 (1H, m), 3,17 (4H, m), 2,74 (2H, s), 2,57 (4H, m), 1,30 (6H, d)
Пример 131: 3-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пиразол-4-ил]пропановая кислота

Этиловый эфир 3-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиразол-4-ил]пропановой кислоты (0,03 г, 0,07 ммоль), полученный в Примере Получения 94, и 3-йод-2-изопропилсульфанил-пиридин (0,019 г, 0,066 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,013 г, 49%).
1H-ЯМР (CDCl3) δ 8,48 (1H, m), 7,70 (1H, s), 7,57 (1H, m), 7,38 (1H, m), 7,15 (2H, m), 7,06 (1H, m), 4,10 (1H, m), 2,92 (2H, t), 2,71 (2H, t), 1,38 (6H, d)
Пример 132: 4-[5-(2-циклопентилсульфанил-3-пиридил)индолин-1-ил]бутановая кислота
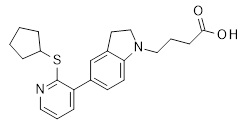
Стадия A: этиловый эфир 4-[5-(2-циклопентилсульфанил-3-пиридил)индолин-1-ил]бутановой кислоты

Этиловый эфир 4-[5-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)индолин-1-ил]бутановой кислоты (0,11 г, 0,26 ммоль), полученный в Примере Получения 95, и 2-циклопентилсульфанил-3-йод-пиридин (0,074 г, 0,24 ммоль), полученный в Примере Получения 15, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,05 г, 50%).
1H-ЯМР (CDCl3) δ 8,35 (1H, m), 7,32 (1H, m), 7,11 (2H, m), 6,98 (1H, m), 6,47 (1H, m), 4,14 (2H, q), 4,06 (1H, m), 3,42 (2H, t), 3,14 (2H, t), 3,01 (2H, t), 2,43 (2H, t), 2,20 (2H, m), 1,97 (2H, m), 1,72~1,65 (6H, m), 1,24 (3H, t)
Стадия B: 4-[5-(2-циклопентилсульфанил-3-пиридил)индолин-1-ил]бутановая кислота
Этиловый эфир 4-[5-(2-циклопентилсульфанил-3-пиридил)индолин-1-ил]бутановой кислоты (0,05 г, 0,12 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,034 г, 74%).
1H-ЯМР (CDCl3) δ 8,35 (1H, m), 7,32 (1H, m), 7,13 (2H, m), 6,99 (1H, m), 6,50 (1H, m), 4,06 (1H, m), 3,42 (2H, t), 3,17 (2H, t), 3,02 (2H, t), 2,51 (2H, t), 2,20 (2H, m), 1,98 (2H, m), 1,71~1,52 (6H, m)
Пример 133: 3-[1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]азетидин-3-ил]пропановая кислота

Этиловый эфир 3-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]пропановой кислоты (0,032 г, 0,08 ммоль), полученный в Примере Получения 96, и 3-йод-2-изопропилсульфанил-пиридин (0,023 г, 0,08 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,002 г, 6%).
1H-ЯМР (CDCl3) δ 8,34 (1H, m), 7,32 (1H, m), 7,01 (1H, m), 6,85 (2H, m), 4,35 (2H, m), 4,05 (1H, m), 3,87 (2H, m), 2,74 (1H, m), 2,37 (2H, m), 2,01 (2H, m), 1,35 (6H, d)
Пример 134: 2-[(3R)-1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пирролидин-3-ил]уксусная кислота

Метиловый эфир 2-[(3R)-1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,07 г, 0,18 ммоль), полученный в Примере Получения 98, и 3-йод-2-изопропилсульфанил-пиридин (0,046 г, 0,16 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,031 г, 49%).
1H-ЯМР (CDCl3) δ 8,39 (1H, m), 7,32 (1H, m), 7,01 (1H, m), 6,89 (2H, m), 4,04 (1H, m), 3,74 (1H, m), 3,66 (1H, m), 3,60 (1H, m), 3,35 (1H, m), 2,65 (1H, m), 2,53 (2H, m), 2,18 (1H, m), 1,65 (1H, m), 1,36 (6H, d)
Пример 135: 2-[(3R)-1-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]пирролидин-3-ил]уксусная кислота

Метиловый эфир 2-[(3R)-1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,07 г, 0,18 ммоль), полученный в Примере Получения 98, и 2-циклопентокси-3-йод-пиридин (0,048 г, 0,16 ммоль), полученный в Примере Получения 11, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,032 г, 50%).
1H-ЯМР (CDCl3) δ 8,10 (1H, m), 7,55 (1H, m), 7,10 (2H, m), 6,89 (1H, m), 5,51 (1H, m), 3,73 (1H, m), 3,66 (1H, m), 3,59 (1H, m), 3,35 (1H, m), 2,66 (1H, m), 2,54 (2H, m), 2,18 (1H, m), 1,95 (2H, m), 1,84~1,75 (4H, m), 1,65 (3H, m)
Пример 136: 2-[(3S)-1-[2,6-дифтор-4-(2-изопропилсульфанил-3-пиридил)фенил]пирролидин-3-ил]уксусная кислота
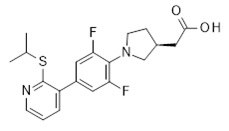
Метиловый эфир 2-[(3S)-1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,085 г, 0,22 ммоль), полученный в Примере Получения 97, и 3-йод-2-изопропилсульфанил-пиридин (0,056 г, 0,2 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,042 г, 54%).
1H-ЯМР (CDCl3) δ 8,39 (1H, m), 7,32 (1H, m), 7,01 (1H, m), 6,89 (2H, m), 4,04 (1H, m), 3,74 (1H, m), 3,66 (1H, m), 3,60 (1H, m), 3,35 (1H, m), 2,65 (1H, m), 2,53 (2H, m), 2,18 (1H, m), 1,65 (1H, m), 1,36 (6H, d)
Пример 137: 2-[(3S)-1-[4-[2-(циклопентокси)-3-пиридил]-2,6-дифтор-фенил]пирролидин-3-ил]уксусная кислота

Метиловый эфир 2-[(3S)-1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,085 г, 0,22 ммоль), полученный в Примере Получения 97, и 2-циклопентокси-3-йод-пиридин (0,059 г, 0,2 ммоль), полученный в Примере Получения 11, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,032 г, 40%).
1H-ЯМР (CDCl3) δ 8,10 (1H, m), 7,55 (1H, m), 7,10 (2H, m), 6,89 (1H, m), 5,51 (1H, m), 3,73 (1H, m), 3,66 (1H, m), 3,59 (1H, m), 3,35 (1H, m), 2,66 (1H, m), 2,54 (2H, m), 2,18 (1H, m), 1,95 (2H, m), 1,84~1,75 (4H, m), 1,65 (3H, m)
Пример 138: 2-[1-[2-фтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-4-пиперидил]уксусная кислота

Стадия A: этиловый эфир 2-[1-[2-фтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-4-пиперидил]уксусной кислоты

Этиловый эфир 2-[1-[2-Фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,10 г, 0,25 ммоль), полученный в Примере Получения 99, и 3-йод-2-изопропилсульфанил-пиридин (0,063 г, 0,227 ммоль), полученный в Примере Получения 9, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,07 г, 74%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,35 (1H, m), 7,12 (2H, m), 7,01 (2H, m), 4,14 (2H, q), 4,04 (1H, m), 3,51 (2H, m), 2,75 (2H, m), 2,31 (2H, d), 1,96 (1H, m), 1,85 (2H, m), 1,50 (2H, m), 1,36 (6H, d), 1,27 (3H, t)
Стадия B: 2-[1-[2-фтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-4-пиперидил]уксусная кислота
Этиловый эфир 2-[1-[2-Фтор-4-(2-изопропилсульфанил-3-пиридил)фенил]-4-пиперидил]уксусной кислоты (0,07 г, 0,17 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,044 г, 68%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,34 (1H, m), 7,11 (2H, m), 7,00 (2H, m), 4,05 (1H, m), 3,52 (2H, m), 2,76 (2H, m), 2,37 (2H, d), 1,97 (1H, m), 1,91 (2H, m), 1,55 (2H, m), 1,35 (6H, d)
Пример 139: 2-[1-[4-[2-(циклопентокси)-3-пиридил]-2-фторфенил]-4-пиперидил]уксусная кислота

Стадия A: этиловый эфир 2-[1-[4-[2-(циклопентокси)-3-пиридил]-2-фторфенил]-4-пиперидил]уксусной кислоты
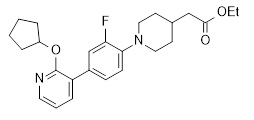
Этиловый эфир 2-[1-[2-Фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,10 г, 0,25 ммоль), полученный в Примере Получения 99, и 2-циклопентокси-3-йод-пиридин (0,066 г, 0,227 ммоль), полученный в Примере Получения 11, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,072 г, 74%).
1H-ЯМР (CDCl3) δ 8,10 (1H, m), 7,57 (1H, m), 7,32 (1H, m), 7,25 (1H, m), 6,97 (1H, t), 6,90 (1H, m), 5,51 (1H, m), 4,16 (2H, q), 3,51 (2H, m), 2,74 (2H, m), 2,30 (2H, d), 1,95 (3H, m), 1,87~1,72 (6H, m), 1,64~1,47 (4H, m), 1,28 (3H, t)
Стадия B: 2-[1-[4-[2-(циклопентокси)-3-пиридил]-2-фторфенил]-4-пиперидил]уксусная кислота
Этиловый эфир 2-[1-[4-[2-(Циклопентокси)-3-пиридил]-2-фторфенил]-4-пиперидил]уксусной кислоты (0,072 г, 0,17 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,043 г, 64%).
1H-ЯМР (CDCl3) δ 8,11 (1H, m), 7,57 (1H, m), 7,31 (1H, m), 7,25 (1H, m), 6,97 (1H, t), 6,90 (1H, m), 5,50 (1H, m), 3,51 (2H, m), 2,75 (2H, m), 2,38 (2H, d), 2,00~1,88 (5H, m), 1,86~1,72 (4H, m), 1,68~1,52 (4H, m)
Пример 140: 3-[6-(6-изопропилсульфанил-пиридин-2-ил)-нафталин-2-ил]-пропановая кислота

Метиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксоборолан-2-ил)-нафталин-2-ил]-пропановой кислоты (0,082 г, 0,24 ммоль), полученный в Примере Получения 107, и 2-хлор-6-изопропилсульфанил-пиридин (0,045 г, 0,24 ммоль), полученный в Примере Получения 10, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,003 г, 3%).
1H-ЯМР (CDCl3) δ 8,46 (1H, s), 8,18 (1H, dd), 7,87 (2H, m), 7,68 (1H, s), 7,56 (2H, m), 7,38 (1H, m), 7,11 (1H, m), 4,22 (1H, m), 3,15 (2H, t), 2,80 (2H, t), 1,50 (6H, d).
Пример 141: 3-[6-(6-фенокси-пиридин-2-ил)-нафталин-2-ил]-пропановая кислота
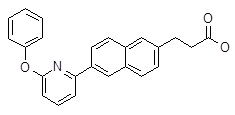
Диметиловый эфир 2-[6-(6-Фенокси-пиридин-2-ил)-нафталин-2-илметил]-малоновой кислоты (0,125 г, 0,28 ммоль), полученный в Примере Получения 110, вводили в реакцию таким же образом, как в Примере Получения 105, с получением целевого соединения (0,039 г, 37%).
1H-ЯМР (CDCl3) δ 8,40 (1H, s), 8,03 (1H, dd), 7,85-7,73 (3H, m), 7,64-7,59 (2H, m), 7,43 (2H, m), 7,34 (1H, dd), 7,25 (3H, m), 6,78 (1H, d), 3,13 (2H, t), 2,78 (2H, t).
Пример 142: 3-[6-(2-фенокси-фенил)-нафталин-2-ил]-пропановая кислота

Диметиловый эфир 2-[6-(2-фенокси-фенил)-нафталин-2-илметил]-малоновой кислоты (0,640 г, 1,45 ммоль), полученный в Примере Получения 112, вводили в реакцию таким же образом, как в Примере Получения 105, с получением целевого соединения (0,126 г, 23%).
1H-ЯМР (CDCl3) δ 7,94 (1H, s), 7,76-7,73 (2H, m), 7,68 (1H, dd), 7,61 (1H, s), 7,54 (1H, dd), 7,33-7,29 (2H, m), 7,26-7,21 (3H, m), 7,04-6,98 (2H, m), 6,93 (2H, m), 3,10 (2H, t), 2,75 (2H, t).
Пример 143: 3-[6-(6-циклопентилсульфанил-пиридин-2-ил)-нафталин-2-ил]-пропановая кислота
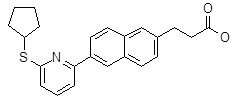
Диметиловый эфир 2-[6-(6-циклопентилсульфанил-пиридин-2-ил)-нафталин-2-илметил]-малоновой кислоты (0,019 г, 0,04 ммоль), полученный в Примере Получения 114, вводили в реакцию таким же образом, как в Примере Получения 105, с получением целевого соединения (0,005 г, 33%).
1H-ЯМР (CDCl3) δ 8,46 (1H, s), 8,16 (1H, dd), 7,86 (2H, q), 7,67 (1H, s), 7,56 (2H, m), 7,37 (1H, dd), 7,12 (1H, m), 4,23 (1H, m), 3,15 (2H, t), 2,80 (2H, t), 2,31 (2H, m), 1,83-1,72 (6H, m).
Пример 144: 3-[6-(2-фенокси-пиридин-3-ил)-нафталин-2-ил]-пропановая кислота
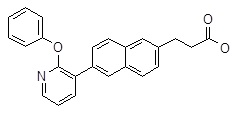
[6-(2-Фенокси-пиридин-3-ил)-нафталин-2-ил]-метанол (0,024 г, 0,07 ммоль), полученный в Примере Получения 116, последовательно вводили в реакцию таким же образом, как в Примерах Получения 103, 104 и 105, с получением целевого соединения (0,009 г, 33%).
1H-ЯМР (CDCl3) δ 8,17 (1H, m), 8,04 (1H, s), 7,87-7,77 (4H, m), 7,67 (1H, s), 7,39-7,37 (3H, m), 7,18-7,11 (4H, m), 3,13 (2H, t), 2,77 (2H, t).
Пример 145: 3-[6-(3-фенокси-фенил)-нафталин-2-ил]-пропановая кислота

[6-(3-фенокси-фенил)-нафталин-2-ил]-метанол (0,029 г, 0,09 ммоль), полученный в Примере Получения 118, последовательно вводили в реакцию таким же образом, как в Примерах Получения 103, 104 и 105, с получением целевого соединения (0,013 г, 40%).
1H-ЯМР (CDCl3) δ 7,97 (1H, s), 7,82 (2H, m), 7,69-7,66 (2H, m), 7,42 (2H, m), 7,35 (4H, m), 7,13-7,07 (3H, m), 6,99 (1H, m), 3,13 (2H, t), 2,78 (2H, t).
Пример 146: 3-[6-(3-изопропокси-фенил)-нафталин-2-ил]-пропановая кислота

[6-(3-изопропокси-фенил)-нафталин-2-ил]-метанол (0,054 г, 0,18 ммоль), полученный в Примере Получения 120, последовательно вводили в реакцию таким же образом, как в Примерах Получения 103, 104 и 105, с получением целевого соединения (0,013 г, 20%).
1H-ЯМР (CDCl3) δ 7,99 (1H, s), 7,82 (2H, m), 7,70 (2H, m), 7,37 (2H, m), 7,26 (2H, m), 6,89 (1H, dd), 4,65 (1H, m), 3,14 (2H, t), 2,78 (2H, t), 1,38 (6H, d).
Пример 147: 3-[6-(3-циклобутокси-фенил)-нафталин-2-ил]-пропановая кислота

[6-(3-циклобутокси-фенил)-нафталин-2-ил]-метанол (0,196 г, 0,64 ммоль), полученный в Примере Получения 122, последовательно вводили в реакцию таким же образом, как в Примерах Получения 103, 104 и 105, с получением целевого соединения (0,03 г, 13%).
1H-ЯМР (CDCl3) δ 8,00 (1H, s), 7,86-7,82 (2H, m), 7,74-7,67 (2H, m), 7,35 (2H, m), 7,26 (1H, m), 7,15 (1H, s), 6,82 (1H, m), 4,73 (1H, m), 3,15 (2H, t), 2,78 (2H, t), 2,50 (2H, m), 2,20 (2H, m), 1,89 (1H, m), 1,70 (1H, m).
Пример 148: 3-[6-(6-циклобутокси-пиридин-2-ил)-нафталин-2-ил]-пропановая кислота

[6-(6-циклобутокси-пиридин-2-ил)-нафталин-2-ил]-метанол (0,155 г, 0,5 ммоль), полученный в Примере Получения 124, последовательно вводили в реакцию таким же образом, как в Примерах Получения 103, 104 и 105, с получением целевого соединения (0,012 г, 7%).
1H-ЯМР (CDCl3) δ 8,43 (1H, s), 8,14 (1H, m), 7,86 (2H, m), 7,64 (2H, m), 7,44 (1H, m), 7,36 (1H, m), 6,65 (1H, d), 5,34 (1H, m), 3,14 (2H, t), 2,80 (2H, t), 2,57 (2H, m), 2,24 (2H, m), 1,87 (1H, m), 1,77 (1H, m).
Пример 149: 3-[6-(2-изопропокси-пиридин-3-ил)-нафталин-2-ил]-пропановая кислота
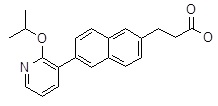
Метиловый эфир 6-(2-изопропокси-пиридин-3-ил)-нафталин-2-карбоновой кислоты (0,092 г, 0,29 ммоль), полученный в Примере Получения 125, последовательно вводили в реакцию таким же образом, как в Примерах Получения 102, 103, 104 и 105, с получением целевого соединения (0,033 г, 34%).
1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,96 (1H, s), 7,80 (2H, d), 7,72-7,68 (3H, m), 7,36 (1H, d), 6,95 (1H, m), 5,42 (1H, m), 3,15 (2H, t), 2,79 (2H, t), 1,34 (6H, d).
Пример 150: 3-[6-(2-циклопентилокси-пиридин-3-ил)-нафталин-2-ил]-пропановая кислота

Метиловый эфир 6-(2-циклопентилокси-пиридин-3-ил)-нафталин-2-карбоновой кислоты (0,123 г, 0,35 ммоль), полученный в Примере Получения 126, последовательно вводили в реакцию таким же образом, как в Примере Получения 102, 103, 104 и 105, с получением целевого соединения (0,043 г, 33%).
1H-ЯМР (CDCl3) δ 8,16 (1H, m), 7,96 (1H, s), 7,80 (2H, d), 7,71-7,67 (3H, m), 7,36 (1H, m), 6,96 (1H, m), 5,55 (1H, m), 3,15 (2H, t), 2,80 (2H, t), 1,93 (2H, m), 1,73 (2H, m), 1,62 (2H, m), 1,36 (2H, m).
Пример 151: 3-{6-[2-(2-фторфенокси)-фенил]-нафталин-2-ил}-пропановая кислота

Метиловый эфир 3-{6-[2-(2-фторфенокси)-фенил]-нафталин-2-ил}-пропановой кислоты (0,012 г, 0,03 ммоль), полученный в Примере Получения 129, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,005 г, 45%).
1H-ЯМР (CDCl3) δ 7,64-7,29 (10H, m), 7,23 (1H, m), 7,10 (2H, m), 7,03 (1H, m), 3,09 (2H, t), 2,75 (2H, t).
Пример 152: 3-{6-[6-(2-фторфенокси)-пиридин-2-ил]-нафталин-2-ил}-пропановая кислота

Метиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-нафталин-2-ил]-пропановой кислоты (0,067 г, 0,2 ммоль), полученный в Примере Получения 107, и 2-хлор-6-(2-фторфенокси)-пиридин (0,045 г, 0,2 ммоль), полученный в Примере Получения 127, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,001 г, 1%).
1H-ЯМР (CDCl3) δ 8,48 (1H, s), 8,10 (1H, m), 7,93 (2H, m), 7,79-7,60 (6H, m), 7,40-7,24 (3H, m), 3,15 (2H, t), 2,80 (2H, t).
Пример 153: 4-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенилсульфанил]-масляная кислота
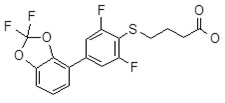
Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенилсульфанил]-масляной кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 208, и 4-бром-2,2-дифтор-бензо[1,3]диоксол (0,034 г, 0,14 ммоль) последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,027 г, 54%).
1H-ЯМР (CDCl3) δ 7,30 (2H, m), 7,25 (1H, m), 7,17 (1H, t), 7,09 (1H, d), 2,98 (2H, t), 2,55 (2H, t), 1,90 (2H, m).
Пример 154: 4-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2-фтор-фенилсульфанил]-масляная кислота

Этиловый эфир 4-[2-Фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенилсульфанил]-масляной кислоты (0,1 г, 0,27 ммоль), полученный в Примере Получения 205, и 4-бром-2,2-дифтор-бензо[1,3]диоксол (0,07 г, 0,3 ммоль) последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,035 г, 35%).
1H-ЯМР (CDCl3) δ 7,46-7,40 (3H, m), 7,25 (1H, m), 7,14 (1H, t), 7,05 (1H, d), 3,02 (2H, t), 2,56 (2H, t), 1,99 (2H, m).
Пример 155: 4-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-фенилсульфанил]-масляная кислота

Этиловый эфир 4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенилсульфанил]-масляной кислоты (0,1 г, 0,28 ммоль), полученный в Примере Получения 202 и 4-бром-2,2-дифтор-бензо[1,3]диоксол (0,074 г, 0,31 ммоль) последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,022 г, 22%).
1H-ЯМР (CDCl3) δ 7,62 (2H, d), 7,40 (2H, d), 7,25 (1H, m), 7,12 (1H, t), 7,02 (1H, d), 3,03 (2H, t), 2,55 (2H, t), 2,00 (2H, m).
Пример 156: 4-(4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-илфенил)сульфанилбутановая кислота

Этиловый эфир 4-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенилсульфанил]-масляной кислоты (0,05 г, 0,14 ммоль), полученный в Примере Получения 202, и 4-йодспиро[1,3-бензодиоксол-2,1ʹ-циклопентан] (0,047 г, 0,16 ммоль), полученный в Примере Получения 215, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,027 г, 51%).
1H-ЯМР (CDCl3) δ 7,65 (2H, d), 7,38 (2H, d), 6,97 (1H, d), 6,84 (1H, t), 6,71 (1H, d), 3,01 (2H, t), 2,54 (2H, t), 2,11 (4H, m), 1,99 (2H, m), 1,84 (4H, m).
Пример 157: 4-(2-фтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенил)сульфанилбутановая кислота

Этиловый эфир 4-[2-Фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенилсульфанил]-масляной кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 205, и 4-йодспиро[1,3-бензодиоксол-2,1ʹ-циклопентан] (0,045 г, 0,15 ммоль), полученный в Примере Получения 215, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,024 г, 45%).
1H-ЯМР (CDCl3) δ 7,48-7,41 (3H, m), 6,96 (1H, d), 6,85 (1H, t), 6,73 (1H, d), 2,99 (2H, t), 2,55 (2H, t), 2,13 (4H, m), 1,96 (2H, m), 1,85 (4H, m).
Пример 158: 5-[4-(2-изопропокси-пиридин-3-ил)-фенил]-5-метил-гексановая кислота

Этиловый эфир 5-Метил-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гексановой кислоты (0,05 г, 0,14 ммоль), полученный в Примере Получения 136, и 3-йод-2-изопропокси-пиридин (0,055 г, 0,21 ммоль), полученный в Примере Получения 34, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,017 г, 36%).
1H-ЯМР (CDCl3) δ 8,10 (1H, m), 7,61 (1H, m), 7,53 (2H, d), 7,35 (2H, d), 6,90 (1H, m), 5,39 (1H, m), 2,30 (2H, t), 1,67 (2H, m), 1,47 (2H, m), 1,34 (12H, m).
Пример 159: 5-[4-(2-изопропилсульфанил-пиридин-3-ил)-фенил]-5-метил-гексановая кислота

Этиловый эфир 5-Метил-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гексановой кислоты (0,05 г, 0,14 ммоль), полученный в Примере Получения 136, и 3-йод-2-изопропилсульфанил-пиридин (0,058 г, 0,21 ммоль), полученный в Примере Получения 9, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,022 г, 44%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,36 (5H, m), 7,02 (1H, m), 4,06 (1H, m), 2,26 (2H, t), 1,68 (2H, m), 1,48 (2H, m), 1,31 (12H, m).
Пример 160: 5-[4-(2-циклопентилокси-пиридин-3-ил)-фенил]-5-метил-гексановая кислота
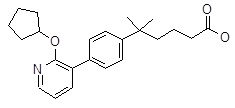
Этиловый эфир 5-Метил-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гексановой кислоты (0,05 г, 0,14 ммоль), полученный в Примере Получения 136, и 2-циклопентилокси-3-йод-пиридин (0,06 г, 0,21 ммоль), полученный в Примере Получения 11, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,026 г, 47%).
1H-ЯМР (CDCl3) δ 8,12 (1H, m), 7,62 (1H, m), 7,52 (2H, d), 7,36 (2H, d), 6,91 (1H, m), 5,50 (1H, m), 2,27 (2H, t), 1,94 (2H, m), 1,83-1,60 (8H, m), 1,46 (2H, m), 1,35 (6H, s).
Пример 161: 5-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенил]-5-метил-гексановая кислота

Этиловый эфир 5-[2-Фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-5-метил-гексановой кислоты (0,02 г, 0,05 ммоль), полученный в Примере Получения 142, и 2-циклопентилокси-3-йод-пиридин (0,023 г, 0,08 ммоль), полученный в Примере Получения 11, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,011 г, 50%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,61 (1H, m), 7,27 (3H, m), 6,91 (1H, m), 5,52 (1H, m), 2,30 (2H, t), 1,97 (2H, m), 1,82-1,73 (6H, m), 1,63 (2H, m), 1,44 (2H, m), 1,40 (6H, s).
Пример 162: 5-[4-(2-циклопентилокси-пиридин-3-ил)-2,6-дифтор-фенил]-5-метил-гексановая кислота

Этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-5-метил-гексановой кислоты (0,035 г, 0,09 ммоль), полученный в Примере Получения 148, и 2-циклопентилокси-3-йод-пиридин (0,038 г, 0,13 ммоль), полученный в Примере Получения 11, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,022 г, 62%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,60 (1H, m), 7,07 (2H, m), 6,92 (1H, m), 5,51 (1H, m), 2,31 (2H, t), 1,95 (2H, m), 1,87-1,72 (6H, m), 1,63 (2H, m), 1,52 (2H, m), 1,49 (6H, s).
Пример 163: 5-[4-(2-циклопентилсульфанил-пиридин-3-ил)-фенил]-5-метил-гексановая кислота

Этиловый эфир 5-Метил-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гексановой кислоты (0,05 г, 0,14 ммоль), полученный в Примере Получения 136, и 2-циклопентилсульфанил-3-йод-пиридин (0,063 г, 0,21 ммоль), полученный в Примере Получения 15, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,032 г, 60%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,37 (5H, m), 7,01 (1H, m), 4,07 (1H, m), 2,28 (2H, t), 2,18 (2H, m), 1,69-1,46 (10H, m), 1,34 (6H, s).
Пример 164: 5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-5-метил-гексановая кислота

Этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-5-метил-гексановой кислоты (0,035 г, 0,09 ммоль), полученный в Примере Получения 148, и 2-циклобутилсульфанил-3-йод-пиридин (0,038 г, 0,13 ммоль), полученный в Примере Получения 13, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,025 г, 71%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,33 (1H, m), 7,02 (1H, m), 6,90 (2H, m), 4,42 (1H, m), 2,50 (2H, m), 2,32 (2H, t), 2,07-2,00 (4H, m), 1,80 (2H, m), 1,54 (2H, m), 1,49 (6H, s).
Пример 165: 5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-фенил]-5-метил-гексановая кислота
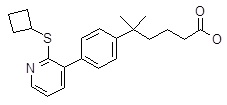
Этиловый эфир 5-Метил-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гексановой кислоты (0,05 г, 0,14 ммоль), полученный в Примере Получения 136, и 2-циклобутилсульфанил-3-йод-пиридин (0,06 г, 0,21 ммоль), полученный в Примере Получения 13, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,035 г, 68%).
1H-ЯМР (CDCl3) δ 8,38 (1H, m), 7,36 (5H, m), 7,01 (1H, m), 4,41 (1H, m), 2,49 (2H, m), 2,27 (2H, t), 2,06-1,98 (4H, m), 1,67 (2H, m), 1,48 (2H, m), 1,34 (6H, s).
Пример 166: 4-{1-[4-(2-циклопентилокси-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-масляная кислота

Этиловый эфир 4-{1-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-масляной кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 155, и 2-циклопентилокси-3-йод-пиридин (0,055 г, 0,19 ммоль), полученный в Примере Получения 11, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,014 г, 27%).
1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,58 (1H, m), 7,08 (2H, m), 6,91 (1H, m), 5,51 (1H, m), 2,31 (2H, t), 1,95 (2H, m), 1,82-1,57 (10H, m), 0,87-0,81 (4H, m).
Пример 167: 4-{1-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-масляная кислота

Этиловый эфир 4-{1-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-масляной кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 155, и 2-циклобутилсульфанил-3-йод-пиридин (0,055 г, 0,19 ммоль), полученный в Примере Получения 13, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,016 г, 31%).
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,33 (1H, m), 7,01 (1H, m), 6,92 (2H, m), 4,42 (1H, m), 2,49 (2H, m), 2,36 (2H, t), 2,07-2,00 (4H, m), 1,71 (2H, m), 1,58 (2H, m), 0,88-0,82 (4H, m).
Пример 168: 4-{1-[4-(6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-циклопропил}-масляная кислота

Этиловый эфир 4-{1-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-масляной кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 155, и 2-хлор-6-циклобутокси-пиридин (0,035 г, 0,19 ммоль), полученный в Примере Получения 29, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,007 г, 14%).
1H-ЯМР (CDCl3) δ 7,60 (1H, t), 7,46 (2H, m), 7,23 (1H, d), 6,66 (1H, d), 5,26 (1H, m), 2,52 (2H, m), 2,33 (2H, t), 2,18 (2H, m), 1,85 (1H, m), 1,80-1,69 (3H, m), 1,58 (2H, m), 0,86-0,82 (4H, m).
Пример 169: 4-{1-[4-(2-циклобутилметокси-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-масляная кислота

Этиловый эфир 4-{1-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-масляной кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 155, и 2-циклобутилметокси-3-йод-пиридин (0,055 г, 0,19 ммоль), полученный в Примере Получения 48, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,012 г, 23%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,59 (1H, m), 7,09 (2H, m), 6,94 (1H, m), 4,32 (2H, d), 2,79 (1H, m), 2,35 (2H, t), 2,11 (2H, m), 2,0-1,85 (4H, m), 1,70 (2H, m), 1,58 (2H, m), 0,86-0,81 (4H, m).
Пример 170: 4-{1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-циклопропил}-масляная кислота

Этиловый эфир 4-{1-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-масляной кислоты (0,09 г, 0,23 ммоль), полученный в Примере Получения 155, и 2-хлор-6-циклопропилметокси-пиридин (0,063 г, 0,34 ммоль), полученный в Примере Получения 43, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,018 г, 20%).
1H-ЯМР (CDCl3) δ 7,61 (1H, t), 7,48 (2H, m), 7,24 (1H, d), 6,73 (1H, d), 4,22 (2H, d), 2,33 (2H, t), 1,69 (2H, m), 1,58 (2H, m), 1,32 (1H, m), 0,89-0,81 (4H, m), 0,62 (2H, m), 0,38 (2H, m).
Пример 171: 5-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенил]-гексановая кислота

Этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 32, и 4-бром-2,2-дифтор-бензо[1,3]диоксол (0,027 г, 0,2 ммоль) последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,022 г, 44%).
1H-ЯМР (CDCl3) δ 7,25-7,12 (4H, m), 7,06 (1H, d), 3,24 (1H, m), 2,35 (2H, t), 1,84 (1H, m), 1,74 (1H, m), 1,64 (1H, m), 1,53 (1H, m), 1,35 (3H, d).
Пример 172: {2-[4-(2-циклопентилокси-пиридин-3-ил)-фенил]-2,2-дифтор-этокси}-уксусная кислота

Этиловый эфир {2,2-дифтор-2-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-этокси}-уксусной кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 160, и 2-циклопентилокси-3-йод-пиридин (0,058 г, 0,2 ммоль), полученный в Примере Получения 11, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,008 г, 15%).
1H-ЯМР (CDCl3) δ 8,17 (1H, m), 7,63 (3H, m), 7,55 (2H, d), 6,93 (1H, m), 5,51 (1H, m), 4,28 (2H, s), 4,05 (2H, t), 1,93 (2H, m), 1,81 (2H, m), 1,71 (2H, m), 1,62 (2H, m).
Пример 173: {2-[4-(2-циклобутилсульфанил-пиридин-3-ил)-фенил]-2,2-дифтор-этокси}-уксусная кислота

Этиловый эфир {2,2-дифтор-2-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-этокси}-уксусной кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 160, и 2-циклобутилсульфанил-3-йод-пиридин (0,059 г, 0,2 ммоль), полученный в Примере Получения 13, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,005 г, 10%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,55 (2H, d), 7,46 (2H, d), 7,30 (1H, m), 7,00 (1H, m), 4,39 (1H, m), 4,21 (2H, s), 4,02 (2H, t), 2,47 (2H, m), 1,99 (4H, m).
Пример 174: {2-[4-(6-циклобутокси-пиридин-2-ил)-фенил]-2,2-дифтор-этокси}-уксусная кислота

Этиловый эфир {2,2-дифтор-2-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-этокси}-уксусной кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 160, и 2-хлор-6-циклобутокси-пиридин (0,037 г, 0,2 ммоль), полученный в Примере Получения 29, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,008 г, 16%).
1H-ЯМР (CDCl3) δ 8,01 (2H, d), 7,57-7,51 (3H, m), 7,26 (1H, m), 6,64 (1H, d), 5,24 (1H, m), 4,18 (2H, s), 4,00 (2H, t), 2,49 (2H, m), 2,16 (2H, m), 1,84 (1H, m), 1,70 (1H, m).
Пример 175: 3-{2-[4-(2-циклопентилокси-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота

Этиловый эфир 3-{2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-пропановой кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 175, и 2-циклопентилокси-3-йод-пиридин (0,057 г, 0,2 ммоль), полученный в Примере Получения 11, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,024 г, 47%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,55 (1H, m), 7,06 (2H, m), 6,91 (1H, m), 5,51 (1H, m), 2,58 (2H, t), 1,96 (2H, m), 1,83-1,63 (9H, m), 1,42 (1H, m), 1,24 (1H, m), 0,82 (1H, m).
Пример 176: 3-{2-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота
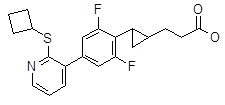
Этиловый эфир 3-{2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-пропановой кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 175, и 2-циклобутилсульфанил-3-йод-пиридин (0,057 г, 0,2 ммоль), полученный в Примере Получения 13, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,024 г, 47%).
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,32 (1H, m), 7,02 (1H, m), 6,90 (2H, m), 4,42 (1H, m), 2,59 (2H, t), 2,50 (2H, m), 2,09-2,00 (4H, m), 1,82 (1H, m), 1,73-1,63 (2H, m), 1,43 (1H, m), 1,26 (1H, m), 0,83 (1H, m).
Пример 177: 5-[4-(2-циклопентилокси-пиридин-3-ил)-фенил]-5,5-дифтор-пентановая кислота

Метиловый эфир 5,5-дифтор-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,05 г, 0,14 ммоль), полученный в Примере Получения 169, и 2-циклопентилокси-3-йод-пиридин (0,061 г, 0,21 ммоль), полученный в Примере Получения 11, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,03 г, 56%).
1H-ЯМР (CDCl3) δ 8,16 (1H, m), 7,62-7,59 (3H, m), 7,49 (2H, m), 6,93 (1H, m), 5,51 (1H, m), 2,44 (2H, t), 2,22 (2H, m), 1,97-1,61 (10H, m).
Пример 178: 5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-фенил]-5,5-дифтор-пентановая кислота

Метиловый эфир 5,5-дифтор-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,05 г, 0,14 ммоль), полученный в Примере Получения 169, и 2-циклобутилсульфанил-3-йод-пиридин (0,061 г, 0,21 ммоль), полученный в Примере Получения 13, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,025 г, 47%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,55-7,47 (4H, m), 7,35 (1H, m), 7,04 (1H, m), 4,43 (1H, m), 2,51-2,43 (4H, m), 2,25 (2H, m), 2,09-1,98 (4H, m), 1,87 (2H, m).
Пример 179: 3-{2-[2,6-дифтор-4-(2-пропилсульфанил-пиридин-3-ил)-фенил]-циклопропил}-пропановая кислота

Этиловый эфир 3-{2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-пропановой кислоты (0,04 г, 0,1 ммоль), полученный в Примере Получения 175, и 3-йод-2-пропилсульфанил-пиридин (0,044 г, 0,16 ммоль), полученный в Примере Получения 28, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,016 г, 40%).
1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,33 (1H, m), 7,03 (1H, m), 6,91 (2H, m), 3,14 (2H, t), 2,59 (2H, t), 1,84 (1H, m), 1,73-1,63 (4H, m), 1,43 (1H, m), 1,26 (1H, m), 1,01 (3H, t), 0,85 (1H, m).
Пример 180: 3-{2-[4-(6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота

Этиловый эфир 3-{2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-пропановой кислоты (0,05 г, 0,13 ммоль), полученный в Примере Получения 175, и 2-хлор-6-циклобутокси-пиридин (0,036 г, 0,2 ммоль), полученный в Примере Получения 29, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,005 г, 10%).
1H-ЯМР (CDCl3) δ 7,61 (1H, t), 7,43 (2H, m), 7,25 (1H, d), 6,65 (1H, d), 5,25 (1H, m), 2,59 (2H, t), 2,52 (2H, m), 2,18 (2H, m), 1,85 (2H, m), 1,69-1,62 (3H, m), 1,39 (1H, m), 1,24 (1H, m), 0,84 (1H, m).
Пример 181: 5-[4-(2-циклопропилметокси-пиридин-3-ил)-фенил]-5,5-дифтор-пентановая кислота

Метиловый эфир 5,5-дифтор-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,027 г, 0,08 ммоль), полученный в Примере Получения 169, и 2-циклопропилметокси-3-йод-пиридин (0,031 г, 0,11 ммоль), полученный в Примере Получения 40, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,015 г, 55%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,67 (2H, d), 7,62 (1H, m), 7,52 (2H, d), 6,95 (1H, m), 4,22 (2H, d), 2,43 (2H, t), 2,24 (2H, m), 1,86 (2H, m), 1,26 (1H, m), 0,56 (2H, m), 0,32 (2H, m).
Пример 182: 3-{2-[4-(2-циклопентилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота

Этиловый эфир 3-{2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-пропановой кислоты (0,027 г, 0,07 ммоль), полученный в Примере Получения 175, и 2-циклопентилсульфанил-3-йод-пиридин (0,032 г, 0,11 ммоль), полученный в Примере Получения 15, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,007 г, 25%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,29 (1H, m), 7,02 (1H, m), 6,87 (2H, m), 4,07 (1H, m), 2,57 (2H, t), 2,19 (2H, m), 1,81 (1H, m), 1,72-1,53 (8H, m), 1,42 (1H, m), 1,25 (1H, m), 0,82 (1H, m).
Пример 183: 3-{2-[4-(2-циклопентиламино-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота

Этиловый эфир 3-{2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-пропановой кислоты (0,027 г, 0,07 ммоль), полученный в Примере Получения 175, и N-циклопентил-3-йод-пиридин-2-амин (0,031 г, 0,11 ммоль), полученный в Примере Получения 51, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,005 г, 18%).
1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,17 (1H, m), 6,84 (2H, m), 6,59 (1H, m), 4,49 (1H, ушир.), 4,33 (1H, m), 2,58 (2H, t), 2,04 (2H, m), 1,83 (1H, m), 1,74-1,58 (6H, m), 1,43 (1H, m), 1,33 (2H, m), 1,24 (1H, m), 0,84 (1H, m).
Пример 184: 5-[4-(2-циклопентилсульфанил-пиридин-3-ил)-фенил]-5,5-дифтор-пентановая кислота

Метиловый эфир 5,5-дифтор-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,04 г, 0,11 ммоль), полученный в Примере Получения 169, и 2-циклопентилсульфанил-3-йод-пиридин (0,052 г, 0,17 ммоль), полученный в Примере Получения 15, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,016 г, 36%).
1H-ЯМР (CDCl3) δ 8,44 (1H, m), 7,54-7,47 (4H, m), 7,35 (1H, m), 7,05 (1H, m), 4,11 (1H, m), 2,45 (2H, t), 2,31-2,20 (4H, m), 1,87 (2H, m), 1,70-1,52 (6H, m).
Пример 185: 5-[4-(2-циклобутокси-пиридин-3-ил)-фенил]-5,5-дифтор-пентановая кислота
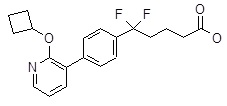
Метиловый эфир 5,5-дифтор-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,04 г, 0,11 ммоль), полученный в Примере Получения 169, и 2-циклобутокси-3-йод-пиридин (0,046 г, 0,17 ммоль), полученный в Примере Получения 41, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,017 г, 42%).
1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,65 (2H, d), 7,59 (1H, m), 7,51 (2H, d), 6,94 (1H, m), 5,27 (1H, m), 2,45 (4H, m), 2,24 (2H, m), 2,11 (2H, m), 1,87-1,79 (3H, m), 1,67 (1H, m).
Пример 186: 5-[4-(6-циклобутокси-пиридин-2-ил)-фенил]-5,5-дифтор-пентановая кислота

Метиловый эфир 5,5-дифтор-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,04 г, 0,11 ммоль), полученный в Примере Получения 169, и 2-хлор-6-циклобутокси-пиридин (0,03 г, 0,17 ммоль), полученный в Примере Получения 29, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,004 г, 10%).
1H-ЯМР (CDCl3) δ 8,06 (2H, d), 7,63 (1H, t), 7,54 (2H, d), 7,33 (1H, d), 6,66 (1H, d), 5,28 (1H, m), 2,54 (2H, m), 2,42 (2H, t), 2,22 (4H, m), 1,88-1,71 (4H, m).
Пример 187: {4-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенил]-циклогексил}-уксусная кислота
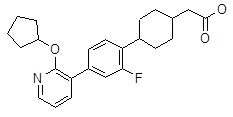
Этиловый эфир {4-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенил]-циклогексил}-уксусной кислоты (0,045 г, 0,11 ммоль), полученный в Примере Получения 182, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,039 г, 92%).
1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,60 (1H, m), 7,27 (3H, m), 6,91 (1H, m), 5,51 (1H, m), 2,87 (1H, m), 2,56-2,33 (2H, m), 1,95-1,54 (16H, m), 1,26 (1H, m).
Пример 188: 3-{2-[4-(2-циклобутокси-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота
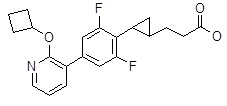
Этиловый эфир 3-{2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-пропановой кислоты (0,04 г, 0,1 ммоль), полученный в Примере Получения 175, и 2-циклобутокси-3-йод-пиридин (0,043 г, 0,16 ммоль), полученный в Примере Получения 41, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,018 г, 46%).
1H-ЯМР (CDCl3) δ 8,11 (1H, m), 7,54 (1H, m), 7,06 (2H, m), 6,92 (1H, m), 5,25 (1H, m), 2,60 (2H, t), 2,45 (2H, m), 2,12 (2H, m), 1,82 (2H, m), 1,68 (3H, m), 1,41 (1H, m), 1,24 (1H, m), 0,83 (1H, m).
Пример 189: 3-{2-[4-(2-циклобутилметокси-пиридин-3-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота

Этиловый эфир 3-{2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-пропановой кислоты (0,04 г, 0,1 ммоль), полученный в Примере Получения 175, и 2-циклобутилметокси-3-йод-пиридин (0,046 г, 0,16 ммоль), полученный в Примере Получения 48, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,025 г, 62%).
1H-ЯМР (CDCl3) δ 8,12 (1H, m), 7,57 (1H, m), 7,07 (2H, m), 6,93 (1H, m), 4,30 (2H, d), 2,78 (1H, m), 2,58 (2H, t), 2,11 (2H, m), 1,99-1,78 (5H, m), 1,71-1,62 (2H, m), 1,40 (1H, m), 1,23 (1H, m), 0,83 (1H, m).
Пример 190: 3-(2-{2,6-дифтор-4-[2-(тетрагидро-пиран-4-илокси)-пиридин-3-ил]-фенил}-циклопропил)-пропановая кислота
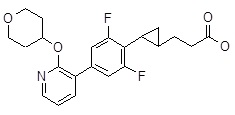
Этиловый эфир 3-{2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-пропановой кислоты (0,04 г, 0,1 ммоль), полученный в Примере Получения 175, и 3-йод-2-(тетрагидро-пиран-4-илокси)-пиридин (0,048 г, 0,16 ммоль), полученный в Примере Получения 50, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,024 г, 57%).
1H-ЯМР (CDCl3) δ 8,11 (1H, m), 7,57 (1H, m), 7,06 (2H, m), 6,92 (1H, m), 5,36 (1H, m), 3,89 (2H, m), 3,63 (2H, m), 2,58 (2H, t), 2,05 (2H, m), 1,82 (3H, m), 1,73-1,62 (2H, m), 1,41 (1H, m), 1,24 (1H, m), 0,83 (1H, m).
Пример 191: 3-{2-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-циклопропил}-пропановая кислота

Этиловый эфир 3-{2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-пропановой кислоты (0,04 г, 0,1 ммоль), полученный в Примере Получения 175, и 2-хлор-6-циклопропилметокси-пиридин (0,03 г, 0,16 ммоль), полученный в Примере Получения 43, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,0045 г, 11%).
1H-ЯМР (CDCl3) δ 7,60 (1H, t), 7,45 (2H, m), 7,23 (1H, d), 6,71 (1H, d), 4,22 (2H, d), 2,57 (2H, t), 1,82 (1H, m), 1,65 (2H, m), 1,38 (1H, m), 1,31 (1H, m), 1,22 (1H, m), 0,83 (1H, m), 0,63 (2H, m), 0,38 (2H, m).
Пример 192: 5,5-дифтор-5-[4-(6-изопропилсульфанил-пиридин-2-ил)-фенил]-пентановая кислота

Метиловый эфир 5,5-дифтор-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,04 г, 0,11 ммоль), полученный в Примере Получения 169, и 2-хлор-6-изопропилсульфанил-пиридин (0,03 г, 0,17 ммоль), полученный в Примере Получения 10, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,005 г, 13%).
1H-ЯМР (CDCl3) δ 8,10 (2H, d), 7,54 (3H, m), 7,43 (1H, d), 7,10 (1H, d), 4,15 (1H, m), 2,43 (2H, t), 2,23 (2H, m), 1,82 (2H, m), 1,47 (6H, d).
Пример 193: 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-фенокси]-масляная кислота

Стадия A: этиловый эфир 4-[3ʹ-гидрокси-2ʹ-(2-метил-пропенил)-бифенил-4-илокси]-масляной кислоты
Этиловый эфир 4-(2ʹ-бром-3ʹ-гидрокси-бифенил-4-илокси)-масляной кислоты (36 мг, 0,095 ммоль) и 4,4,5,5-тетраметил-2-(2-метил-пропенил)-[1,3,2]диоксаборолан (35 мг, 0,19 ммоль) растворяли в 0,5 мл 1М карбоната натрия и 4 мл диметоксиэтана и загружали азотом в течение 5 минут. Добавляли PdCl2(PPh3)2(3,3 мг, 0,00475 ммоль), и смесь перемешивали в течение 4 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. После добавления воды, реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/4) с получением целевого соединения (17 мг, 51%-й выход).
1H-ЯМР (400 МГц, CDCl3) δ 7,23-7,17 (m, 3H), 6,93-6,89 (m, 1H), 6,89-6,84 (m, 3H), 5,85 (s, 1H), 5,36 (s, 1H), 4,16 (q, 2H), 4,03 (t, 2H), 2,53 (t, 2H), 2,17-2,08 (m, 2H), 1,84 (s, 3H), 1,58 (s, 3H), 1,27 (t, 3H)
Стадия B: этиловый эфир 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-фенокси]-масляной кислоты
Этиловый эфир 4-[3ʹ-Гидрокси-2ʹ-(2-метил-пропенил)-бифенил-4-илокси]-масляной кислоты (17 мг, 0,048 ммоль), полученный на Стадии A, и смолу Amberlyst 15 (17 мг) вводили в реакцию таким же образом, как на Стадии C Примера 291, с получением целевого соединения (10 мг, 59%-й выход).
Стадия C: 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-фенокси]-масляная кислота
Этиловый эфир 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-фенокси]-масляной кислоты (10 мг, 0,028 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии B Примера 287, с получением целевого соединения (7 мг, 76%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,37 (d, 2H), 7,16 (dd, 1H), 6,93 (d, 2H), 6,87 (d, 1H), 6,70 (d, 1H), 4,06 (t, 2H), 3,09 (s, 2H), 2,61 (t, 2H), 2,20-2,10 (m, 2H), 1,46 (s, 6H)
Пример 194: 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-2-фторфенокси]-масляная кислота

Стадия A: этиловый эфир 4-[3-фтор-3ʹ-гидрокси-2ʹ-(2-метил-пропенил)-бифенил-4-илокси]-масляной кислоты
Этиловый эфир 4-(2ʹ-бром-3-фтор-3ʹ-гидрокси-бифенил-4-илокси)-масляной кислоты (140 мг, 0,35 ммоль) и 4,4,5,5-тетраметил-2-(2-метил-пропенил)-[1,3,2]диоксаборолан (141 мг, 0,77 ммоль) растворяли в 1 мл 1М карбоната натрия и 6 мл диметоксиэтана и загружали азотом в течение 5 минут. Добавляли PdCl2(PPh3)2 (12 мг, 0,0175 ммоль), и смесь вводили в реакцию таким же образом, как на Стадии A Примера 193, с получением целевого соединения (70 мг, 53%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,20 (dd, 1H), 7,04-6,99 (m, 1H), 6,99-6,95 (m, 1H), 6,95-6,89 (m, 2H), 6,84 (d, 1H), 5,83 (s, 1H), 5,42 (s, 1H), 4,15 (q, 2H), 4,10 (t, 2H), 2,55 (t, 2H), 2,19-2,12 (m, 2H), 1,85 (s, 3H), 1,57 (s, 3H), 1,26 (t, 3H)
Стадия B: этиловый эфир 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-2-фторфенокси]-масляной кислоты
Этиловый эфир 4-[3-фтор-3ʹ-гидрокси-2ʹ-(2-метил-пропенил)-бифенил-4-илокси]-масляной кислоты (70 мг, 0,188 ммоль), полученный на Стадии A, и смолу Amberlyst 15 (70 мг) вводили в реакцию таким же образом, как на Стадии C Примера 291, с получением целевого соединения (40 мг, 57%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,20-7,11 (m, 3H), 7,00 (dd, 1H), 6,85 (d, 1H), 6,72 (d, 1H), 4,15 (q, 2H), 4,11 (t, 2H), 3,08 (s, 2H), 2,56 (t, 2H), 2,20-2,12 (m, 2H), 1,47 (s, 6H), 1,26 (t, 3H)
Стадия C: 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-2-фторфенокси]-масляная кислота
Этиловый эфир 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-2-фторфенокси]-масляной кислоты (40 мг, 0,107 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии B Примера 287, с получением целевого соединения (36 мг, 97%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,20-7,11 (m, 3H), 6,99 (dd, 1H), 6,85 (d, 1H), 6,72 (d, 1H), 4,13 (t, 2H), 3,08 (s, 2H), 2,64 (t, 2H), 2,21-2,14 (m, 2H), 1,47 (s, 6H)
Пример 195: 4-{[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота

2-циклобутилсульфанил-3-йод-пиридин (0,045 г, 0,15 ммоль), полученный в Примере Получения 13, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,057 г, 0,15 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,040 г, 66%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,32 (1H, m), 7,02 (1H, m), 6,94 (2H, m), 4,44 (1H, m), 3,18 (2H, t), 2,89 (3H, s), 2,50 (4H, m), 2,05 (4H, m), 1,90 (2H, m)
Пример 196:4-{[4-(2-циклопентилокси-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота

2-циклопентилокси-3-йод-пиридин (0,030 г, 0,10 ммоль), полученный в Примере Получения 11, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,038 г, 0,10 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,015 г, 37%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,57 (1H, m), 7,11 (2H, m), 6,92 (1H, m), 5,52 (1H, m), 3,19 (2H, t), 2,88 (3H, s), 2,48 (2H, t), 1,95 (2H, m), 1,89 (6H, m), 1,64 (2H, m)
Пример 197:4-{[4-(2-циклопентилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота
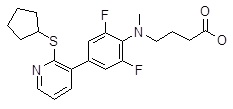
2-циклопентилсульфанил-3-йод-пиридин (0,037 г, 0,12 ммоль), полученный в Примере Получения 15, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,045 г, 0,12 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,015 г, 30%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,31 (1H, m), 7,03 (1H, m), 6,95 (2H, m), 4,10 (1H, m), 3,20 (2H, t), 2,89 (3H, s), 2,50 (2H, t), 2,20 (2H, m), 1,90 (2H, m), 1,62 (6H, m)
Пример 198:4-{[2,6-дифтор-4-(2-изопропилсульфанил-пиридин-3-ил)-фенил]-метил-амино}-масляная кислота

3-Йод-2-изопропилсульфанил-пиридин (0,030 г, 0,11 ммоль), полученный в Примере Получения 9, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,040 г, 0,11 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 61%).
1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,34 (1H, m), 7,02 (1H, m), 6,94 (2H, m), 4,09 (1H, m), 3,19 (2H, t), 2,89 (3H, s), 2,49 (2H, t), 1,90 (2H, m), 1,37 (6H, d)
Пример 199:4-[(3ʹ-циклобутокси-3,5-дифтор-бифенил-4-ил)-метил-амино]-масляная кислота

1-циклобутокси-3-йод-бензол (0,035 г, 0,13 ммоль), полученный в Примере Получения 21, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,047 г, 0,13 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,030 г, 62%).
1H-ЯМР (CDCl3) δ 7,31 (1H, t), 7,07 (3H, m), 6,94 (1H, m), 6,81 (1H, m), 4,70 (1H, m), 3,16 (2H, t), 2,91 (3H, s), 2,47 (4H, m), 2,21 (2H, m), 1,88 (3H, m), 1,71 (1H, m)
Пример 200:4-[5-(2-циклопентилсульфанил-пиридин-3-ил)-индол-1-ил]-масляная кислота

2-циклопентилсульфанил-3-йод-пиридин (0,010 г, 0,03 ммоль), полученный в Примере Получения 15, и этиловый эфир 4-[5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-индол-1-ил]-масляной кислоты (0,012 г, 0,03 ммоль), полученный в Примере Получения 184, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,006 г, 48%).
1H-ЯМР (CDCl3) δ 7,31 (1H, t), 7,07 (3H, m), 6,94 (1H, m), 6,81 (1H, m), 4,70 (1H, m), 3,16 (2H, t), 2,91 (3H, s), 2,47 (4H, m), 2,21 (2H, m), 1,88 (3H, m), 1,71 (1H, m)
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,65 (1H, s), 7,41 (2H, m), 7,28 (1H, m), 7,13 (1H, m), 7,03 (1H, m), 6,54 (1H, d), 4,25 (2H, t), 4,10 (1H, m), 2,40 (2H, t), 2,22 (4H, m), 1,68 (2H, m), 1,60 (4H, m)
Пример 201:4-[(3,5-дифтор-3ʹ-пирролидин-1-ил-бифенил-4-ил)-метил-амино]-масляная кислота

1-(3-бромфенил)пирролидин (0,030 г, 0,13 ммоль), полученный в Примере Получения 53, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,049 г, 0,13 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 50%).
1H-ЯМР (CDCl3) δ 7,25 (1H, m), 7,06 (2H, m), 6,78 (1H, d), 6,62 (1H, s), 6,56 (1H, m), 3,33 (4H, m), 3,17 (2H, t), 2,86 (3H, s), 2,46 (2H, m), 2,03 (4H, m), 1,86 (2H, m)
Пример 202: 4-{[4-(6-циклобутилсульфанил-пиридин-2-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота
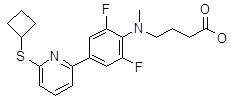
2-бром-6-циклобутилсульфанил-пиридин (0,025 г, 0,10 ммоль), полученный в Примере Получения 52, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,038 г, 0,10 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,026 г, 65%).
1H-ЯМР (CDCl3) δ 7,54 (3H, m), 7,30 (1H, d), 7,09 (1H, d), 4,17 (1H, m), 3,21 (2H, t), 2,90 (3H, s), 2,46 (2H, t), 2,26 (2H, m), 1,89 (2H, m), 1,70 (4H, m)
Пример 203:4-{[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота
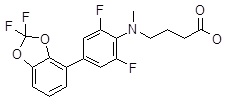
4-бром-2,2-дифтор-1,3-бензодиоксол (0,025 г, 0,11 ммоль) и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,039 г, 0,11 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 61%).
1H-ЯМР (CDCl3) δ 7,22 (3H, m), 7,15 (1H, t), 7,04 (1H, d), 3,21 (2H, t), 2,90 (3H, s), 2,47 (2H, t), 1,89 (2H, m)
Пример 204:4-{[4-(6-циклопентилокси-пиридин-2-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота

2-бром-6-циклопентилокси-пиридин (0,030 г, 0,12 ммоль), полученный в Примере Получения 185, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,046 г, 0,12 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 52%).
1H-ЯМР (CDCl3) δ 7,58 (1H, t), 7,53 (2H, m), 7,19 (1H, d), 6,63 (1H, d), 5,51 (1H, m), 3,20 (2H, t), 2,89 (3H, s), 2,47 (2H, t), 2,03 (2H, m), 1,88 (6H, m), 1,65 (2H, m)
Пример 205:4-{[4-(6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота

2-бром-6-циклобутокси-пиридин (0,030 г, 0,13 ммоль), полученный в Примере Получения 186, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,049 г, 0,13 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,020 г, 41%).
1H-ЯМР (CDCl3) δ 7,61 (1H, t), 7,51 (2H, m), 7,21 (1H, d), 6,64 (1H, d), 5,27 (1H, m), 3,20 (2H, t), 2,89 (3H, s), 2,51 (2H, m), 2,47 (2H, t), 2,20 (2H, m), 1,88 (3H, m), 1,75 (1H, m)
Пример 206:4-{[4-(2-циклобутокси-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота

2-циклобутокси-3-йод-пиридин (0,030 г, 0,11 ммоль), полученный в Примере Получения 41, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,040 г, 0,11 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,022 г, 54%).
1H-ЯМР (CDCl3) δ 8,11 (1H, m), 7,58 (1H, m), 7,15 (2H, m), 6,94 (1H, m), 5,29 (1H, m), 3,20 (2H, t), 2,89 (3H, s), 2,50 (4H, m), 2,16 (2H, m), 1,90 (3H, m), 1,69 (1H, m)
Пример 207:4-{[2,6-дифтор-4-(2-пропилсульфанил-пиридин-3-ил)-фенил]-метил-амино}-масляная кислота

3-Йод-2-пропилсульфанил-пиридин (0,030 г, 0,11 ммоль), полученный в Примере Получения 28, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,040 г, 0,11 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,021 г, 51%).
1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,34 (1H, m), 7,02 (1H, m), 6,96 (2H, m), 3,19 (2H, t), 3,14 (2H, t), 2,89 (3H, s), 2,50 (2H, m), 1,91 (2H, m), 1,72 (2H, m), 1,03 (3H, t)
Пример 208:4-{[4-(2-этилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота

2-Этилсульфанил-3-йод-пиридин (0,030 г, 0,11 ммоль), полученный в Примере Получения 33, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,042 г, 0,11 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,018 г, 43%).
1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,35 (1H, m), 7,05 (1H, m), 6,96 (2H, m), 3,19 (4H, m), 2,93 (3H, s), 2,49 (2H, t), 1,92 (2H, m), 1,35 (3H, t)
Пример 209: 4-{[4-(2-циклобутилсульфанил-пиридин-3-ил)-2-фторфенил]-метил-амино}-масляная кислота

2-циклобутилсульфанил-3-йод-пиридин (0,040 г, 0,14 ммоль), полученный в Примере Получения 13, и метиловый эфир 4-{[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,048 г, 0,14 ммоль), полученный в Примере Получения 187, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 48%).
1H-ЯМР (CDCl3) δ 8,38 (1H, m), 7,34 (1H, m), 7,12 (2H, m), 7,01 (2H, m), 4,43 (1H, m), 3,25 (2H, t), 2,87 (3H, s), 2,51 (4H, m), 2,01 (6H, m)
Пример 210:2-{[4-(2-циклопентилсульфанил-пиридин-3-ил)-2,6-дифтор-фениламино]-метил}-циклопропанкарбоновая кислота
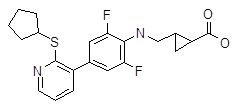
4-(2-циклопентилсульфанил-пиридин-3-ил)-2,6-дифтор-фениламин (0,050 г, 0,16 ммоль), полученный в Примере Получения 188, и этиловый эфир 2-формил-циклопропанкарбоновой кислоты (0,026 г, 0,18 ммоль) последовательно вводили в реакцию таким же образом, как в Примере Получения 35 и на Стадии B Примера 1, с получением целевого соединения (0,009 г, 14%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,30 (1H, m), 7,00 (1H, m), 6,92 (2H, m), 4,09 (1H, m), 3,37 (2H, d), 2,20 (2H, m), 1,82 (1H, m), 1,72 (2H, m), 1,62 (5H, m), 1,32 (2H, m), 0,98 (1H, m)
Пример 211:2-{[4-(2-циклопентилсульфанил-пиридин-3-ил)-фениламино]-метил}-циклопропанкарбоновая кислота

Стадия A: этиловый эфир 2-{[4-(2-циклопентилсульфанил-пиридин-3-ил)-фениламино]-метил}-циклопропанкарбоновой кислоты
4-(2-циклопентилсульфанил-пиридин-3-ил)-анилин (0,140 г, 0,52 ммоль), полученный в Примере Получения 189, и этиловый эфир 2-формил-циклопропанкарбоновой кислоты (0,081 г, 0,57 ммоль) вводили в реакцию таким же образом, как в Примере Получения 35, с получением целевого соединения (0,150 г, 73%).
Стадия B: 2-{[4-(2-циклопентилсульфанил-пиридин-3-ил)-фениламино]-метил}-циклопропанкарбоновая кислота
Этиловый эфир 2-{[4-(2-циклопентилсульфанил-пиридин-3-ил)-фениламино]-метил}-циклопропанкарбоновой кислоты (0,030 г, 0,08 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,025 г, 90%).
1H-ЯМР (CDCl3) δ 8,37 (1H, m), 7,34 (1H, m), 7,26 (2H, d), 7,00 (1H, m), 6,66 (2H, d), 4,09 (1H, m), 3,20 (1H, m), 3,09 (1H, m), 2,19 (2H, m), 1,84 (1H, m), 1,72 (2H, m), 1,60 (5H, m), 1,35 (1H, m), 0,99 (1H, m)
Пример 212:4-{[2-фтор-4-(2-изопропилсульфанил-пиридин-3-ил)-фенил]-метил-амино}-масляная кислота

3-Йод-2-изопропилсульфанил-пиридин (0,030 г, 0,11 ммоль), полученный в Примере Получения 9, и метиловый эфир 4-{[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,038 г, 0,11 ммоль), полученный в Примере Получения 187, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,021 г, 54%).
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,35 (1H, m), 7,11 (2H, m), 7,01 (2H, m), 4,06 (1H, m), 3,25 (2H, t), 2,87 (3H, s), 2,51 (2H, t), 1,97 (2H, m), 1,36 (6H, d)
Пример 213:4-{[4-(2-циклопентилсульфанил-пиридин-3-ил)-2-фторфенил]-метил-амино}-масляная кислота
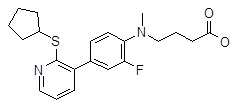
2-циклопентилсульфанил-3-йод-пиридин (0,030 г, 0,10 ммоль), полученный в Примере Получения 15, и метиловый эфир 4-{[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,035 г, 0,10 ммоль), полученный в Примере Получения 187, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,017 г, 45%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,34 (1H, m), 7,12 (2H, m), 7,01 (2H, m), 4,09 (1H, m), 3,25 (2H, t), 2,87 (3H, s), 2,51 (2H, t), 2,20 (2H, m), 1,97 (2H, m), 1,63 (6H, m)
Пример 214:4-{[2,6-дифтор-4-(2-изопропокси-пиридин-3-ил)-фенил]-метил-амино}-масляная кислота
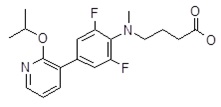
3-Йод-2-изопропокси-пиридин (0,030 г, 0,11 ммоль), полученный в Примере Получения 34, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,042 г, 0,11 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,022 г, 55%).
1H-ЯМР (CDCl3) δ 8,11 (1H, m), 7,55 (1H, m), 7,10 (2H, m), 6,90 (1H, m), 5,41 (1H, m), 3,14 (2H, t), 2,88 (3H, s), 2,41 (2H, t), 1,86 (2H, m), 1,37 (6H, d)
Пример 215:4-[(2ʹ-циклопентиламино-3,5-дифтор-бифенил-4-ил)-метил-амино]-масляная кислота
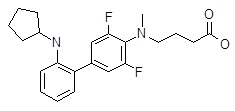
N-циклопентил-2-йод-анилин (0,030 г, 0,10 ммоль), полученный в Примере Получения 35, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,039 г, 0,10 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,015 г, 37%).
1H-ЯМР (CDCl3) δ 7,23 (1H, m), 7,01 (1H, m), 6,93 (2H, m), 6,72 (2H, m), 3,77 (1H, m), 3,19 (2H, t), 2,88 (3H, s), 2,49 (2H, t), 2,01 (2H, m), 1,90 (2H, m), 1,67 (4H, m), 1,43 (2H, m)
Пример 216:4-[метил-(3,5,5ʹ-трифтор-2ʹ-изопропокси-бифенил-4-ил)-амино]-масляная кислота

2-бром-4-фтор-1-изопропокси-бензол (0,030 г, 0,13 ммоль), полученный в Примере Получения 55, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,048 г, 0,13 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,030 г, 61%).
1H-ЯМР (CDCl3) δ 7,08 (2H, m), 6,98 (2H, m), 6,91 (1H, m), 4,37 (1H, m), 3,16 (2H, t), 2,88 (3H, s), 2,47 (2H, t), 1,87 (2H, m), 1,25 (6H, d)
Пример 217:4-{[4-(2-циклопентилокси-5-метил-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота

3-бром-2-циклопентилокси-5-метил-пиридин (0,030 г, 0,12 ммоль), полученный в Примере Получения 57, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,043 г, 0,12 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 53%).
1H-ЯМР (CDCl3) δ 7,94 (1H, m), 7,40 (1H, m), 7,13 (2H, m), 5,47 (1H, m), 3,19 (2H, t), 2,88 (3H, s), 2,50 (2H, t), 2,27 (3H, s), 1,94 (2H, m), 1,89 (2H, m), 1,78 (4H, m), 1,63 (2H, m)
Пример 218:4-{[4-(2-циклобутилметокси-пиридин-3-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота
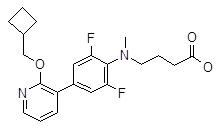
Метиловый эфир 4-{[2,6-дифтор-4-(2-фтор-пиридин-3-ил)-фенил]-метил-амино}-масляной кислоты (0,050 г, 0,15 ммоль), полученный в Примере Получения 190, и циклобутил-метанол (0,026 г, 0,30 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34 с получением целевого соединения (0,020 г, 35%).
1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,59 (1H, m), 7,14 (2H, m), 6,95 (1H, m), 4,32 (2H, d), 3,17 (2H, t), 2,88 (3H, s), 2,80 (1H, m), 2,48 (2H, t), 2,10 (2H, m), 1,89 (6H, m)
Пример 219:4-{[2,6-дифтор-4-(2-метокси-пиридин-3-ил)-фенил]-метил-амино}-масляная кислота
В процессе синтеза Примера 218, целевое соединение (5 мг, 10%) было получено как побочный продукт.
1H-ЯМР (CDCl3) δ 8,16 (1H, m), 7,58 (1H, m), 7,11 (2H, m), 6,98 (1H, m), 3,98 (3H, s), 3,19 (2H, t), 2,87 (3H, s), 2,48 (2H, t), 1,90 (2H, m)
Пример 220:4-({2,6-дифтор-4-[2-(тетрагидро-фуран-3-илокси)-пиридин-3-ил]-фенил}-метил-амино)-масляная кислота

Метиловый эфир 4-{[2,6-дифтор-4-(2-фтор-пиридин-3-ил)-фенил]-метил-амино}-масляной кислоты (0,050 г, 0,15 ммоль), полученный в Примере Получения 190, и тетрагидро-фуран-3-ол (0,026 г, 0,30 ммоль) вводили в реакцию таким же образом, как в Примере Получения 34, с получением целевого соединения (0,023 г, 40%).
1H-ЯМР (CDCl3) δ 8,11 (1H, m), 7,59 (1H, m), 7,09 (2H, m), 6,97 (1H, m), 5,64 (1H, m), 4,06 (1H, m), 3,94 (3H, m), 3,19 (2H, t), 2,89 (3H, s), 2,46 (2H, t), 2,26 (1H, m), 2,16 (1H, m), 1,88 (2H, m)
Пример 221:4-[(3,5-дифтор-2ʹ-пирролидин-1-ил-бифенил-4-ил)-метил-амино]-масляная кислота
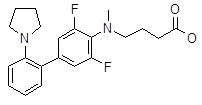
1-(2-йод-фенил)-пирролидин (0,030 г, 0,11 ммоль), полученный в Примере Получения 191, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,041 г, 0,11 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,020 г, 48%).
1H-ЯМР (CDCl3) δ 7,26 (1H, m), 7,12 (1H, m), 6,97 (2H, m), 6,84 (2H, m), 3,16 (2H, t), 2,94 (4H, m), 2,87 (3H, s), 2,48 (2H, t), 1,88 (2H, m), 1,80 (4H, m)
Пример 222:4-[(3,5-дифтор-2ʹ-метиламино-бифенил-4-ил)-метил-амино]-масляная кислота

(2-йод-фенил)-амин-метил-(0,030 г, 0,13 ммоль), полученный в Примере Получения 192, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,048 г, 0,13 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,023 г, 54%).
1H-ЯМР (CDCl3) δ 7,27 (1H, m), 7,04 (1H, m), 6,93 (2H, m), 6,76 (1H, t), 6,69 (1H, d), 3,18 (2H, t), 2,88 (3H, s), 2,81 (3H, s), 2,48 (2H, t), 2,00 (2H, m)
Пример 223: 4-{[3,5-дифтор-2ʹ-(изопропил-метил-амино)-бифенил-4-ил]-метил-амино}-масляная кислота

(2-йод-фенил)-изопропиловый метиламин (0,030 г, 0,11 ммоль), полученный в Примере Получения 193, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,040 г, 0,11 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,020 г, 48%).
1H-ЯМР (CDCl3) δ 7,25 (1H, m), 7,16 (1H, m), 7,12 (2H, m), 7,05 (2H, m), 3,18 (3H, m), 2,87 (3H, s), 2,58 (3H, s), 2,50 (2H, t), 1,87 (2H, m), 0,85 (6H, d)
Пример 224:4-{[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-этил-амино}-масляная кислота

2-циклобутилсульфанил-3-йод-пиридин (0,050 г, 0,17 ммоль), полученный в Примере Получения 13, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-этил-амино}-масляной кислоты (0,066 г, 0,17 ммоль), полученный в Примере Получения 194, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,026 г, 38%).
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,35 (1H, m), 7,02 (1H, m), 6,96 (2H, m), 4,44 (1H, m), 3,24 (2H, t), 3,18 (2H, m), 2,49 (4H, m), 2,04 (4H, m), 1,83 (2H, m), 1,08 (3H, t)
Пример 225:4-{[4-(2-циклобутилметокси-пиридин-3-ил)-2,6-дифтор-фенил]-этил-амино}-масляная кислота

2-циклобутилметокси-3-йод-пиридин (0,050 г, 0,17 ммоль), полученный в Примере Получения 48, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-этил-амино}-масляной кислоты (0,066 г, 0,17 ммоль), полученный в Примере Получения 194, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 35%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,61 (1H, m), 7,15 (2H, m), 6,96 (1H, m), 4,33 (2H, d), 3,20 (4H, m), 2,81 (1H, m), 2,48 (2H, t), 2,12 (2H, m), 1,88 (4H, m), 1,79 (2H, m), 1,06 (3H, t)
Пример 226:4-{[2,6-дифтор-4-(2-изопропокси-пиридин-3-ил)-фенил]-этил-амино}-масляная кислота
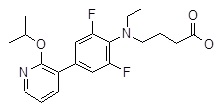
3-Йод-2-изопропокси-пиридин (0,050 г, 0,19 ммоль), полученный в Примере Получения 34, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-этил-амино}-масляной кислоты (0,073 г, 0,19 ммоль), полученный в Примере Получения 194, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,027 г, 37%).
1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,57 (1H, m), 7,14 (2H, m), 6,92 (1H, m), 5,42 (1H, m), 3,20 (4H, m), 2,48 (2H, t), 1,82 (2H, m), 1,37 (6H, d), 1,06 (3H, t)
Пример 227:(R)-5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-гексановая кислота

2-циклобутилсульфанил-3-йод-пиридин (0,050 г, 0,17 ммоль), полученный в Примере Получения 13, и этиловый эфир (R)-5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гексановой кислоты (0,066 г, 0,17 ммоль), полученный в Примере Получения 195, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,038 г, 56%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,36 (1H, m), 7,04 (1H, m), 6,93 (2H, m), 4,44 (1H, m), 3,25 (1H, m), 2,51 (2H, m), 2,38 (2H, t), 2,09 (4H, m), 1,85 (1H, m), 1,70 (2H, m), 1,55 (1H, m), 1,38 (3H, d)
Пример 228:(E)-(R)-5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-гекс-2-еновая кислота

2-циклобутилсульфанил-3-йод-пиридин (0,015 г, 0,05 ммоль), полученный в Примере Получения 13, и этиловый эфир (E)-(R)-5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гекс-2-еновой кислоты (0,020 г, 0,05 ммоль), полученный в Примере Получения 196, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,010 г, 50%).
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,35 (1H, m), 7,03 (4H, m), 5,87 (1H, d), 4,43 (1H, m), 3,42 (1H, m), 2,70 (2H, m), 2,52 (2H, m), 2,05 (4H, m), 1,39 (3H, d)
Пример 229:(S)-5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-гексановая кислота

2-циклобутилсульфанил-3-йод-пиридин (0,040 г, 0,14 ммоль), полученный в Примере Получения 13, и этиловый эфир (S)-5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гексановой кислоты (0,049 г, 0,13 ммоль), полученный в Примере Получения 197, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,020 г, 39%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,36 (1H, m), 7,04 (1H, m), 6,93 (2H, m), 4,44 (1H, m), 3,25 (1H, m), 2,51 (2H, m), 2,38 (2H, t), 2,09 (4H, m), 1,85 (1H, m), 1,70 (2H, m), 1,55 (1H, m), 1,38 (3H, d)
Пример 230:5-{2,6-дифтор-4-[2-(тетрагидро-фуран-3-илокси)-пиридин-3-ил]-фенил}-гексановая кислота

3-Йод-2-(тетрагидро-фуран-3-илокси)-пиридин (0,040 г, 0,14 ммоль), полученный в Примере Получения 49, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,049 г, 0,13 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,030 г, 56%).
1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,62 (1H, m), 7,07 (2H, m), 6,98 (1H, m), 5,65 (1H, m), 4,07 (1H, m), 3,95 (3H, m), 3,23 (1H, m), 2,36 (3H, m), 2,17 (1H, m), 1,83 (1H, m), 1,72 (2H, m), 1,55 (1H, m), 1,36 (3H, d)
Пример 231:5-{2,6-дифтор-4-[2-(тетрагидро-пиран-4-илокси)-пиридин-3-ил]-фенил}-гексановая кислота

3-Йод-2-(тетрагидро-пиран-4-илокси)-пиридин (0,040 г, 0,13 ммоль), полученный в Примере Получения 50, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,050 г, 0,13 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,020 г, 43%).
1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,62 (1H, m), 7,10 (2H, m), 6,95 (1H, m), 5,38 (1H, m), 3,91 (2H, m), 3,64 (2H, m), 3,24 (1H, m), 2,37 (2H, m), 2,09 (2H, m), 1,85 (3H, m), 1,70 (2H, m), 1,55 (1H, m), 1,37 (3H, d)
Пример 232:5-{2,6-дифтор-4-[2-(оксетан-3-илокси)-пиридин-3-ил]-фенил}-гексановая кислота

3-Йод-2-(оксетан-3-илокси)-пиридин (0,030 г, 0,11 ммоль), полученный в Примере Получения 209, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,041 г, 0,11 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,013 г, 32%).
1H-ЯМР (CDCl3) δ 8,07 (1H, m), 7,64 (1H, m), 7,12 (2H, m), 7,01 (1H, m), 5,66 (1H, m), 5,02 (2H, m), 4,76 (2H, m), 3,25 (1H, m), 2,36 (2H, m), 1,85 (1H, m), 1,73 (2H, m), 1,54 (1H, m), 1,37 (3H, d)
Пример 233:4-[4-(2-циклобутокси-пиридин-3-ил)-2-фторфенокси]-масляная кислота
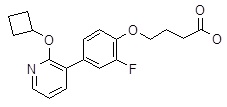
2-циклобутокси-3-йод-пиридин (0,030 г, 0,11 ммоль), полученный в Примере Получения 41, и этиловый эфир 4-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,038 г, 0,11 ммоль), полученный в Примере Получения 198, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 66%).
1H-ЯМР (CDCl3) δ 8,09 (1H, m), 7,55 (1H, m), 7,40 (1H, m), 7,26 (1H, m), 7,00 (1H, m), 6,92 (1H, m), 5,29 (1H, m), 4,15 (2H, t), 2,64 (2H, t), 2,46 (2H, m), 2,20 (4H, m), 1,82 (1H, m), 1,68 (1H, m)
Пример 234:4-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенокси]-масляная кислота

2-циклопентилокси-3-йод-пиридин (0,030 г, 0,10 ммоль), полученный в Примере Получения 11, и этиловый эфир 4-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,037 г, 0,10 ммоль), полученный в Примере Получения 198, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,024 г, 64%).
1H-ЯМР (CDCl3) δ 8,12 (1H, m), 7,56 (1H, m), 7,36 (1H, m), 7,25 (1H, m), 6,97 (1H, m), 6,90 (1H, m), 5,50 (1H, m), 4,14 (2H, t), 2,64 (2H, t), 2,21 (2H, m), 1,93 (2H, m), 1,81 (4H, m), 1,62 (2H, m)
Пример 235:4-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2-фторфенокси]-масляная кислота

2-циклобутилсульфанил-3-йод-пиридин (0,030 г, 0,10 ммоль), полученный в Примере Получения 13, и этиловый эфир 4-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,036 г, 0,10 ммоль), полученный в Примере Получения 198, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,022 г, 59%).
1H-ЯМР (CDCl3) δ 8,39 (1H, m), 7,32 (1H, m), 7,18 (2H, m), 7,02 (2H, m), 4,42 (1H, m), 4,16 (2H, t), 2,65 (2H, t), 2,49 (2H, m), 2,20 (2H, m), 2,01 (4H, m)
Пример 236:4-[4-(2-циклопентилсульфанил-пиридин-3-ил)-2-фторфенокси]-масляная кислота

2-циклопентилсульфанил-3-йод-пиридин (0,030 г, 0,10 ммоль), полученный в Примере Получения 15, и этиловый эфир 4-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,035 г, 0,10 ммоль), полученный в Примере Получения 198, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,020 г, 54%).
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,33 (1H, m), 7,16 (1H, m), 7,12 (1H, m), 7,02 (2H, m), 4,15 (2H, t), 4,07 (1H, m), 2,63 (2H, t), 2,19 (4H, m), 1,70 (2H, m), 1,61 (4H, m)
Пример 237:6-[4-(2-циклопентилокси-пиридин-3-ил)-2,6-дифтор-фенил]-гептановая кислота

2-циклопентилокси-3-йод-пиридин (0,040 г, 0,14 ммоль), полученный в Примере Получения 11, и этиловый эфир 6-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гептановой кислоты (0,055 г, 0,14 ммоль), полученный в Примере Получения 199, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,028 г, 50%).
1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,60 (1H, m), 7,09 (2H, m), 6,93 (1H, m), 5,52 (1H, m), 3,23 (1H, m), 2,33 (2H, t), 1,97 (2H, m), 1,85 (5H, m), 1,64 (5H, m), 1,35 (4H, m), 1,25 (1H, m)
Пример 238:6-[4-(2-циклопентилсульфанил-пиридин-3-ил)-2,6-дифтор-фенил]-гептановая кислота
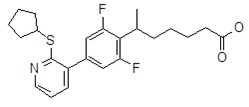
2-циклопентилсульфанил-3-йод-пиридин (0,040 г, 0,13 ммоль), полученный в Примере Получения 15, и этиловый эфир 6-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-гептановой кислоты (0,052 г, 0,13 ммоль), полученный в Примере Получения 199, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 45%).
1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,33 (1H, m), 7,03 (1H, m), 6,93 (2H, m), 4,15 (1H, m), 3,24 (1H, m), 2,34 (2H, t), 2,20 (2H, m), 1,82 (1H, m), 1,64 (10H, m), 1,36 (3H, d), 1,25 (1H, m)
Пример 239:4-[4-(2-циклопропилметокси-пиридин-3-ил)-2-фтор-фенилсульфанил]-масляная кислота
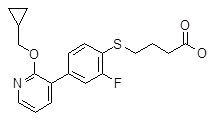
Этиловый эфир 4-[2-Фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенилсульфанил]-масляной кислоты (0,04 г, 0,11 ммоль), полученный в Примере Получения 205, и 2-циклопропилметокси-3-йод-пиридин (0,03 г, 0,11 ммоль), полученный в Примере Получения 40, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,020 г, 51%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,63 (1H, m), 7,44 (3H, m), 6,97 (1H, m), 4,23 (2H, d), 3,04 (2H, t), 2,58 (2H, t), 2,02 (2H, m), 1,29 (1H, m), 0,61 (2H, m), 0,36 (2H, m)
Пример 240:4-[4-(2-циклопропилметокси-пиридин-3-ил)-2-фторфенокси]-масляная кислота
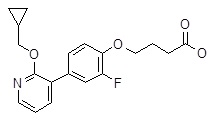
2-циклопропилметокси-3-йод-пиридин (0,030 г, 0,11 ммоль), полученный в Примере Получения 40, и этиловый эфир 4-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,038 г, 0,11 ммоль), полученный в Примере Получения 198, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,018 г, 48%).
1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,64 (1H, m), 7,49 (1H, d), 7,36 (1H, d), 7,07 (1H, t), 7,00 (1H, m), 4,27 (2H, d), 4,21 (2H, t), 2,71 (2H, t), 2,27 (2H, m), 1,34 (1H, m), 0,65 (2H, m), 0,40 (2H, m)
Пример 241:4-[4-(2-циклобутилметокси-пиридин-3-ил)-2-фторфенокси]-масляная кислота
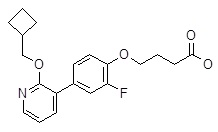
2-циклобутилметокси-3-йод-пиридин (0,030 г, 0,10 ммоль), полученный в Примере Получения 48, и этиловый эфир 4-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,037 г, 0,10 ммоль), полученный в Примере Получения 198, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,022 г, 59%).
1H-ЯМР (CDCl3) δ 8,16 (1H, m), 7,64 (1H, m), 7,45 (1H, m), 7,32 (1H, m), 7,05 (2H, m), 4,37 (2H, d), 4,21 (2H, t), 2,85 (1H, m), 2,71 (2H, t), 2,26 (2H, m), 2,12 (2H, m), 1,98 (4H, m)
Пример 242:4-[3-(6-циклопентилокси-пиридин-2-ил)-фенокси]-масляная кислота

2-хлор-6-циклопентилокси-пиридин (0,030 г, 0,15 ммоль), полученный в Примере Получения 12, и этиловый эфир 4-[3-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-масляной кислоты (0,051 г, 0,15 ммоль), полученный в Примере Получения 200, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,035 г, 68%).
1H-ЯМР (CDCl3) δ 7,60 (3H, m), 7,34 (1H, m), 7,27 (1H, m), 6,92 (1H, m), 6,63 (1H, m), 5,53 (1H, m), 4,12 (2H, t), 2,63 (2H, t), 2,17 (2H, m), 2,04 (2H, m), 1,84 (2H, m), 1,65 (4H, m)
Пример 243: 4-[3-(2-циклопентилокси-пиридин-3-ил)-фенокси]-масляная кислота
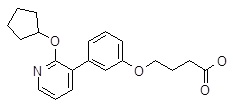
2-циклопентилокси-3-йод-пиридин (0,030 г, 0,10 ммоль), полученный в Примере Получения 11, и этиловый эфир 4-[3-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенокси]-масляной кислоты (0,035 г, 0,10 ммоль), полученный в Примере Получения 200, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,015 г, 42%).
1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,61 (1H, m), 7,29 (1H, m), 7,12 (2H, m), 6,92 (1H, m), 6,87 (1H, m), 5,51 (1H, m), 4,07 (2H, t), 2,61 (2H, t), 2,15 (2H, m), 1,98 (2H, m), 1,82 (2H, m), 1,70 (4H, m)
Пример 244: 5-[4-(2-циклопентилокси-пиридин-3-ил)-2-фторфенил]-пентановая кислота

2-циклопентилокси-3-йод-пиридин (0,030 г, 0,10 ммоль), полученный в Примере Получения 11, и этиловый эфир 5-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,036 г, 0,10 ммоль), полученный в Примере Получения 201, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,021 г, 57%).
1H-ЯМР (CDCl3) δ 8,14 (1H, m), 7,58 (1H, m), 7,25 (2H, m), 7,20 (1H, m), 6,91 (1H, m), 5,51 (1H, m), 2,71 (2H, t), 2,43 (2H, t), 1,95 (2H, m), 1,82 (2H, m), 1,74 (5H, m), 1,66 (3H, m)
Пример 245: 5-[4-(2-циклобутокси-пиридин-3-ил)-2-фторфенил]-пентановая кислота

2-циклобутокси-3-йод-пиридин (0,030 г, 0,10 ммоль), полученный в Примере Получения 41, и этиловый эфир 5-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,036 г, 0,10 ммоль), полученный в Примере Получения 201, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,021 г, 57%).
1H-ЯМР (CDCl3) δ 8,11 (1H, m), 7,59 (1H, m), 7,29 (3H, m), 6,94 (1H, m), 5,28 (1H, m), 2,71 (2H, t), 2,45 (4H, m), 2,15 (2H, m), 1,74 (6H, m)
Пример 246: 5-[4-(2-циклобутилметокси-пиридин-3-ил)-2-фторфенил]-пентановая кислота

2-циклобутилметокси-3-йод-пиридин (0,030 г, 0,10 ммоль), полученный в Примере Получения 48, и этиловый эфир 5-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,036 г, 0,10 ммоль), полученный в Примере Получения 201, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,022 г, 59%).
1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,62 (1H, m), 7,26 (2H, m), 7,20 (1H, m), 7,95 (1H, m), 4,32 (2H, m), 2,77 (1H, t), 2,71 (2H, t), 2,42 (2H, t), 2,10 (2H, m), 1,88 (4H, m), 1,72 (4H, m)
Пример 247: 5-[4-(2-циклопропилметокси-пиридин-3-ил)-2-фторфенил]-пентановая кислота
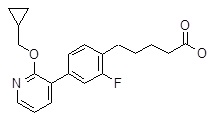
2-циклопропилметокси-3-йод-пиридин (0,030 г, 0,11 ммоль), полученный в Примере Получения 40, и этиловый эфир 5-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,038 г, 0,11 ммоль), полученный в Примере Получения 201, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,020 г, 53%).
1H-ЯМР (CDCl3) δ 8,11 (1H, m), 7,60 (1H, m), 7,30 (2H, m), 7,21 (1H, m), 6,95 (1H, m), 4,22 (2H, d), 2,71 (2H, t), 2,43 (2H, m), 1,73 (4H, m), 1,29 (1H, m), 0,58 (2H, m), 0,34 (2H, m)
Пример 248: 5-[4-(2-циклопентилсульфанил-пиридин-3-ил)-2-фторфенил]-пентановая кислота
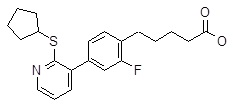
2-циклопентилсульфанил-3-йод-пиридин (0,030 г, 0,10 ммоль), полученный в Примере Получения 15, и этиловый эфир 5-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,034 г, 0,10 ммоль), полученный в Примере Получения 201, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,023 г, 63%).
1H-ЯМР (CDCl3) δ 8,42 (1H, m), 7,35 (1H, m), 7,25 (1H, m), 7,13 (2H, m), 7,02 (1H, m), 4,09 (1H, m), 2,72 (2H, t), 2,43 (2H, t), 2,19 (2H, m), 1,73 (6H, m), 1,69 (4H, m)
Пример 249: 5-[4-(2-циклобутилсульфанил-пиридин-3-ил)-2-фторфенил]-пентановая кислота
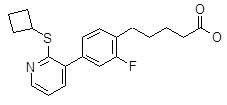
2-циклобутилсульфанил-3-йод-пиридин (0,030 г, 0,10 ммоль), полученный в Примере Получения 13, и этиловый эфир 5-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,039 г, 0,10 ммоль), полученный в Примере Получения 201, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,024 г, 65%).
1H-ЯМР (CDCl3) δ 8,41 (1H, m), 7,34 (1H, m), 7,25 (1H, m), 7,13 (2H, m), 7,02 (1H, m), 4,43 (1H, m), 2,72 (2H, t), 2,50 (2H, m), 2,42 (2H, t), 2,06 (4H, m), 1,74 (4H, m)
Пример 250: 5-[4-(2-циклобутилметокси-пиридин-3-ил)-2,6-дифтор-фенил]-пентановая кислота

2-циклобутилметокси-3-йод-пиридин (0,030 г, 0,10 ммоль), полученный в Примере Получения 48, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты (0,038 г, 0,10 ммоль), полученный в Примере Получения 27, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,024 г, 62%).
1H-ЯМР (CDCl3) δ 8,15 (1H, m), 7,61 (1H, m), 7,12 (2H, m), 6,96 (1H, m), 4,29 (2H, d), 2,78 (3H, m), 2,42 (2H, t), 2,11 (2H, m), 1,88 (4H, m), 1,71 (4H, m)
Пример 251: 5-[4-(2-циклобутокси-пиридин-3-ил)-2,6-дифтор-фенил]-пентановая кислота

2-циклобутокси-3-йод-пиридин (0,030 г, 0,11 ммоль), полученный в Примере Получения 41, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты (0,040 г, 0,11 ммоль), полученный в Примере Получения 27, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,021 г, 53%).
1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,59 (1H, m), 7,13 (2H, m), 6,94 (1H, m), 5,28 (1H, m), 2,74 (2H, t), 2,46 (4H, m), 2,15 (2H, m), 1,88 (1H, m), 1,71 (5H, m)
Пример 252: 5-[4-(2-циклопропилметокси-пиридин-3-ил)-2,6-дифтор-фенил]-пентановая кислота
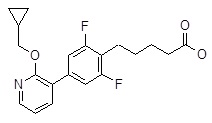
2-циклопропилметокси-3-йод-пиридин (0,030 г, 0,11 ммоль), полученный в Примере Получения 40, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пентановой кислоты (0,040 г, 0,11 ммоль), полученный в Примере Получения 27, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,026 г, 66%).
1H-ЯМР (CDCl3) δ 8,13 (1H, m), 7,61 (1H, m), 7,16 (2H, m), 6,96 (1H, m), 4,22 (2H, d), 2,74 (2H, t), 2,43 (2H, t), 1,72 (4H, m), 1,31 (1H, m), 0,60 (2H, m), 0,36 (2H, m)
Пример 253: 4-[4-(5-хлор-2,2-диметил-2,3-дигидро-бензофуран-7-ил)-2,6-дифтор-фенокси]-масляная кислота

7-бром-5-хлор-2,2-диметил-2,3-дигидро-бензофуран (0,093 г, 0,36 ммоль), полученный в Примере Получения 210, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (89 мг, 0,24 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,053 г, 56%).
1H-ЯМР (CDCl3) δ 7,27 (2H, m), 7,18 (1H, m), 7,07 (1H, m), 4,21 (2H, t), 3,02 (2H, s), 2,66 (2H, t), 2,10 (2H, m), 1,50 (6H, s)
Пример 254: 4-[4-(5-хлор-2,2-диметил-2,3-дигидро-бензофуран-7-ил)-2,6-дифтор-фенилсульфанил]-масляная кислота

7-бром-5-хлор-2,2-диметил-2,3-дигидро-бензофуран (0,098 г, 0,37 ммоль), полученный в Примере Получения 210, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]-диоксаборолан-2-ил)-фенилсульфанил]масляной кислоты (0,096 г, 0,25 ммоль), полученный в Примере Получения 219, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,024 г, 23%).
1H-ЯМР (CDCl3) δ 7,31 (2H, m), 7,23 (1H, m), 7,10 (1H, m), 3,03 (2H, s), 2,95 (2H, t), 2,56 (2H, t), 1,89 (2H, m), 1,51 (6H, s)
Пример 255: 4-{[4-(5-хлор-2,2-диметил-2,3-дигидро-бензофуран-7-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота

7-бром-5-хлор-2,2-диметил-2,3-дигидро-бензофуран (0,101 г, 0,39 ммоль), полученный в Примере Получения 210, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,160 г, 0,42 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,101 г, 63%).
1H-ЯМР (CDCl3) δ 7,24 (1H, m), 7,21 (1H, m), 7,19 (1H, m), 7,05 (1H, m), 3,16 (2H, t), 3,02 (2H, s), 2,87 (3H, s), 2,45 (2H, t), 1,86 (2H, m), 1,51 (6H, s)
Пример 256: 5-[4-(5-хлор-2,2-диметил-2,3-дигидро-бензофуран-7-ил)-2,6-дифтор-фенил]-гексановая кислота

7-бром-5-хлор-2,2-диметил-2,3-дигидро-бензофуран (0,082 г, 0,31 ммоль), полученный в Примере Получения 210, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,130 г, 0,34 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,094 г, 74%).
1H-ЯМР (CDCl3) δ 7,22 (2H, m), 7,19 (1H, m), 7,07 (1H, m), 3,22 (1H, m), 3,02 (2H, s), 2,35 (2H, t), 1,84 (1H, m), 1,68 (2H, m), 1,52 (1H, m), 1,51 (6H, s), 1,34 (3H, d)
Пример 257: 4-[2,6-дифтор-4-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил)-фенокси]-масляная кислота

4-бром-7-метокси-2,2-диметил-2,3-дигидро-бензофуран (0,083 г, 0,32 ммоль), полученный в Примере Получения 211, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,133 г, 0,36 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,097 г, 79%).
1H-ЯМР (CDCl3) δ 6,94 (2H, m), 6,81 (2H, s), 4,21 (2H, t), 3,90 (3H, s), 3,11 (2H, s), 2,67 (2H, t), 2,11 (2H, m), 1,52 (6H, s)
Пример 258: 4-[2,6-дифтор-4-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил)-фенилсульфанил]-масляная кислота

4-бром-7-метокси-2,2-диметил-2,3-дигидро-бензофуран (0,061 г, 0,24 ммоль), полученный в Примере Получения 211, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]-диоксаборолан-2-ил)-фенилсульфанил]масляной кислоты (0,100 г, 0,26 ммоль), полученный в Примере Получения 219, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,047 г, 48%).
1H-ЯМР (CDCl3) δ 6,98 (2H, m), 6,84 (2H, m), 3,91 (3H, s), 3,14 (2H, s), 2,96 (2H, t), 2,55 (2H, t), 1,88 (2H, m), 1,53 (6H, s)
Пример 259: 4-{[2,6-дифтор-4-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил)-фенил]-метил-амино}-масляная кислота

4-бром-7-метокси-2,2-диметил-2,3-дигидро-бензофуран (0,061 г, 0,24 ммоль), полученный в Примере Получения 211, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,100 г, 0,26 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,107 г, 100%).
1H-ЯМР (CDCl3) δ 6,89 (2H, m), 6,81 (2H, s), 3,90 (3H, s), 3,15 (2H, t), 3,13 (2H, s), 2,46 (2H, t), 1,86 (2H, m), 1,52 (6H, s)
Пример 260: 5-[2,6-дифтор-4-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил-фенил]-гексановая кислота
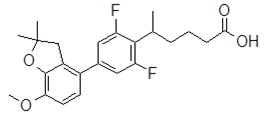
4-бром-7-метокси-2,2-диметил-2,3-дигидро-бензофуран (0,061 г, 0,24 ммоль), полученный в Примере Получения 211, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,099 г, 0,26 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,077 г, 79%).
1H-ЯМР (CDCl3) δ 6,88 (2H, m), 6,82 (2H, m), 3,90 (3H, s), 3,21 (1H, m), 3,14 (2H, s), 2,35 (2H, t), 1,83 (1H, m), 1,68 (2H, m), 1,53 (1H, m), 1,52 (6H, s), 1,35 (3H, d)
Пример 261: 4-(2,6-дифтор-4-спиро[3H-бензофуран-2,1ʹ-циклопентан]-7-ил-фенокси)-масляная кислота

7-бромспиро[3H-бензофуран-2,1ʹ-циклопентан] (0,062 г, 0,24 ммоль), полученный в Примере Получения 212, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,100 г, 0,27 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,087 г, 93%).
1H-ЯМР (CDCl3) δ 7,32 (2H, m), 7,21 (1H, d), 7,12 (1H, m), 6,88 (1H, t), 4,21 (2H, t), 3,20 (2H, s), 2,67 (2H, t), 2,11 (4H, m), 1,92 (2H, m), 1,75 (4H, m)
Пример 262: 4-(2,6-дифтор-4-спиро[3H-бензофуран-2,1ʹ-циклопентан]-7-ил-фенилсульфанил)-масляная кислота
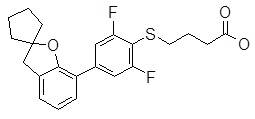
7-бромспиро[3H-бензофуран-2,1ʹ-циклопентан] (0,067 г, 0,26 ммоль), полученный в Примере Получения 212, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]-диоксаборолан-2-ил)-фенилсульфанил]масляной кислоты (0,112 г, 0,29 ммоль), полученный в Примере Получения 219, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,053 г, 50%).
1H-ЯМР (CDCl3) δ 7,36 (2H, m), 7,25 (1H, d), 7,15 (1H, m), 6,89 (1H, t), 3,21 (2H, s), 2,94 (2H, t), 2,56 (2H, t), 2,11 (2H, m), 1,89 (4H, m), 1,75 (4H, m)
Пример 263: 4-(2,6-дифтор-N-метил-4-спиро[3H-бензофуран-2,1ʹ-циклопентан]-7-ил-анилино)-масляная кислота

7-бромспиро[3H-бензофуран-2,1ʹ-циклопентан] (0,067 г, 0,26 ммоль), полученный в Примере Получения 212, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,111 г, 0,29 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,064 г, 61%).
1H-ЯМР (CDCl3) δ 7,28 (2H, m), 7,22 (1H, d), 7,11 (1H, m), 6,87 (1H, t), 3,20 (2H, s), 3,17 (2H, t), 2,87 (3H, s), 2,47 (2H, t), 2,13 (2H, m), 1,90 (4H, m), 1,75 (4H, m)
Пример 264: 5-(2,6-дифтор-4-спиро[3H-бензофуран-2,1ʹ-циклопентан]-7-ил-фенил)-гексановая кислота
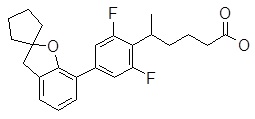
7-бромспиро[3H-бензофуран-2,1ʹ-циклопентан] (0,067 г, 0,26 ммоль), полученный в Примере Получения 212, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,100 г, 0,26 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,039 г, 37%).
1H-ЯМР (CDCl3) δ 7,26 (2H, m), 7,23 (1H, m), 7,12 (1H, m), 6,88 (1H, t), 3,22 (1H, m), 3,20 (2H, s), 2,35 (2H, t), 2,15 (2H, m), 1,93 (2H, m), 1,90 ~ 1,52 (8H, m), 1,32 (3H, d)
Пример 265: метиловый эфир 7-[4-(3-карбокси-пропокси)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты

Стадия A: метиловый эфир 7-[4-(3-этоксикарбонил-пропокси)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты

Метиловый эфир 5-Фтор-7-йод-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты (0,074 г, 0,21 ммоль), полученный в Примере Получения 213, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,063 г, 0,17 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,045 г, 46%).
1H-ЯМР (CDCl3) δ 7,73 (1H, ушир.), 6,96 (1H, t), 6,91 (2H, m), 4,23 (2H, t), 4,15 (2H, q), 3,86 (3H, s), 2,91 (2H, s), 2,59 (2H, t), 2,11 (2H, m), 1,53 (6H, s), 1,27 (3H, t)
Стадия B: метиловый эфир 7-[4-(3-карбокси-пропокси)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты
Метиловый эфир 7-[4-(3-этоксикарбонил-пропокси)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты (0,010 г, 0,021 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,006 г, 64%).
1H-ЯМР (CDCl3) δ 7,73 (1H, ушир.), 6,97 (1H, t), 6,90 (2H, m), 4,25 (2H, t), 3,86 (3H, s), 2,91 (2H, s), 2,67 (2H, t), 2,13 (2H, m), 1,53 (6H, s)
Пример 266: 4-[2,6-дифтор-4-(5-фтор-2,2-диметил-2,3-дигидро-1H-индол-7-ил)-фенокси]-масляная кислота

Метиловый эфир 7-[4-(3-карбокси-пропокси)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты (0,030 г, 0,07 ммоль), полученный в Примере 265, растворяли в 3 мл MeOH и 1 мл 6Н водного раствора NaOH, и смесь перемешивали при 80°C в течение 24 часов при нагревании с обратным холодильником. После удаления органического растворителя реакционный раствор подкисляли до рН 3 при помощи 6Н водного раствора HCl и экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали с помощью MgSO4 и концентрировали при пониженном давлении с получением целевого соединения (0,002 г, 8%).
1H-ЯМР (CDCl3) δ 6,97 (2H, m), 6,85 (1H, m), 6,52 (1H, m), 4,28 (2H, t), 2,83 (2H, s), 2,71 (2H, t), 2,17 (2H, m), 1,35 (6H, s)
Пример 267: метиловый эфир 4-[4-(3-карбокси-пропокси)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты

Стадия A: метиловый эфир 4-[4-(3-этоксикарбонил-пропокси)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты

Метиловый эфир 5-Фтор-4-йод-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты (0,085 г, 0,24 ммоль), полученный в Примере Получения 214, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,089 г, 0,24 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,050 г, 45%).
1H-ЯМР (CDCl3) δ 6,89 ~ 6,77 (4H, m), 4,18 (2H, q), 4,17 (2H, t), 3,11 (3H, s), 2,97 (2H, s), 2,57 (2H, t), 2,08 (2H, m), 1,57 (6H, s), 1,27 (3H, t)
Стадия B: метиловый эфир 4-[4-(3-карбокси-пропокси)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты
Метиловый эфир 4-[4-(3-Этоксикарбонил-пропокси)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты (0,010 г, 0,021 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,009 г, 100%).
1H-ЯМР (CDCl3) δ 6,87 ~ 6,78 (4H, m), 4,20 (2H, t), 3,12 (3H, s), 2,97 (2H, s), 2,65 (2H, t), 2,11 (2H, m), 1,57 (6H, s)
Пример 268: 4-[2,6-дифтор-4-(5-фтор-2,2-диметил-2,3-дигидро-1H-индол-4-ил)-фенокси]-масляная кислота

Метиловый эфир 4-[4-(3-Этоксикарбонил-пропокси)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты (0,04 г, 0,085 ммоль), полученный на Стадии A Примера 267, разбавляли 2 мл каждого из MeOH и 6Н водного раствора NaOH, и смесь перемешивали при 80°C в течение 48 часов при нагревании с обратным холодильником. После удаления органического растворителя реакционный раствор подкисляли до рН 3 при помощи 6Н водного раствора HCl и экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали с помощью MgSO4 и концентрировали при пониженном давлении с получением целевого соединения (0,001 г, 3%).
1H-ЯМР (CDCl3) δ 7,08 (2H, m), 6,78 (1H, m), 6,71 (1H, m), 4,21 (2H, t), 2,86 (2H, s), 2,66 (2H, t), 2,11 (2H, m), 1,31 (6H, s)
Пример 269: 4-[2,6-дифтор-4-(5-фтор-2,2-диметил-2,3-дигидро-1H-индол-7-ил)-фенилсульфанил]-масляная кислота
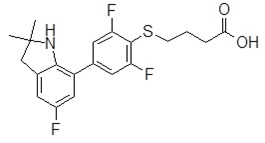
Стадия A: метиловый эфир 7-[4-(3-этоксикарбонил-пропилсульфанил)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты

Метиловый эфир 5-Фтор-7-йод-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты (0,148 г, 0,42 ммоль), полученный в Примере Получения 213, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]-диоксаборолан-2-ил)-фенилсульфанил]масляной кислоты (0,162 г, 0,42 ммоль), полученный в Примере Получения 219, вводили в реакцию таким же образом, как на Стадии A Примера 17, с получением целевого соединения (0,135 г, 67%).
1H-ЯМР (CDCl3) δ 7,79 (1H, ушир.), 7,02 (1H, t), 6,98 (2H, m), 4,17 (2H, q), 3,90 (2H, s), 3,02 (2H, t), 2,97 (2H, s), 2,54 (2H, t), 1,96 (2H, m), 1,59 (6H, s), 1,29 (3H, t)
Стадия B: 4-[2,6-дифтор-4-(5-фтор-2,2-диметил-2,3-дигидро-1H-индол-7-ил)-фенилсульфанил]-масляная кислота
Метиловый эфир 7-[4-(3-Этоксикарбонил-пропилсульфанил)-3,5-дифтор-фенил]-5-фтор-2,2-диметил-2,3-дигидро-индол-1-карбоновой кислоты (0,065 г, 0,134 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как в Примере 266, с получением целевого соединения (0,005 г, 9%).
1H-ЯМР (CDCl3) δ 6,96 (2H, m), 6,81 (1H, m), 6,50 (1H, m), 2,95 (2H, t), 2,80 (2H, s), 2,54 (2H, t), 1,90 (2H, m), 1,30 (6H, s)
Пример 270: 3-[6-(2-изопропилсульфанил-пиридин-3-ил)-тиохроман-2-ил]-пропионовая кислота

3-Йод-2-изопропилсульфанил-пиридин (0,060 г, 0,21 ммоль), полученный в Примере Получения 9, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты (0,079 г, 0,21 ммоль), полученный в Примере Получения 5, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,050 г, 64%).
1H-ЯМР (CDCl3) δ 8,40 (1H, m), 7,34 (1H, m), 7,13 (2H, s), 7,06 (1H, s), 7,01 (1H, m), 4,04 (1H, m), 3,37 (1H, m), 2,89 (2H, m), 2,59 (2H, m), 2,25 (1H, m), 2,06 (1H, m), 1,99 (1H, m), 1,86 (1H, m), 1,35 (6H, d)
Пример 271: 3-[6-(2-циклопентокси-пиридин-3-ил)-тиохроман-2-ил]-пропионовая кислота

2-циклопентилокси-3-йод-пиридин (0,072 г, 0,25 ммоль), полученный в Примере Получения 11, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты (0,095 г, 0,25 ммоль), полученный в Примере Получения 5, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,071 г, 74%).
1H-ЯМР (CDCl3) δ 8,09 (1H, m), 7,56 (1H, m), 7,27 (1H, m), 7,10 (1H, d), 6,89 (1H, m), 5,49 (1H, m), 3,37 (1H, m), 2,87 (2H, m), 2,59 (2H, m), 2,25 (1H, m), 2,11 ~ 1,58 (11H, m)
Пример 272: 3-[6-(2-циклобутилсульфанил-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота

2-циклобутилсульфанил-3-йод-пиридин (0,050 г, 0,17 ммоль), полученный в Примере Получения 13, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,061 г, 0,17 ммоль), полученный в Примере Получения 4, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,038 г, 61%).
1H-ЯМР (CDCl3) δ 8,36 (1H, m), 7,33 (1H, dd), 7,14 (1H, dd), 6,99 (1H, m), 6,85 (1H, d), 4,42 (1H, t), 4,10 (1H, m), 2,91 (1H, m), 2,80 (1H, m), 2,68 (2H, m), 2,51 (2H, m), 2,01 (7H, m), 1,81 (1H, m)
Пример 273: 3-[6-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил)-хроман-2-ил]-пропионовая кислота
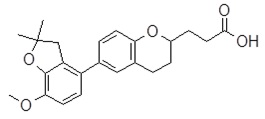
4-бром-7-метокси-2,2-диметил-2,3-дигидро-бензофуран (0,068 г, 0,26 ммоль), полученный в Примере Получения 211, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,094 г, 0,26 ммоль), полученный в Примере Получения 4, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,054 г, 54%).
1H-ЯМР (CDCl3) δ 7,13 (1H, m), 7,08 (1H, m), 6,80 (3H, m), 4,08 (1H, m), 3,88 (3H, s), 3,11 (2H, d), 2,88 (1H, m), 2,80 (1H, m), 2,65 (2H, m), 2,02 (3H, m), 1,78 (1H, m), 1,50 (6H, d)
Пример 274: 3-[6-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил)-тиохроман-2-ил]-пропионовая кислота

4-бром-7-метокси-2,2-диметил-2,3-дигидро-бензофуран (0,068 г, 0,26 ммоль), полученный в Примере Получения 211, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты (0,098 г, 0,26 ммоль), полученный в Примере Получения 5, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,038 г, 37%).
1H-ЯМР (CDCl3) δ 7,10 (3H, m), 6,80 (2H, m), 3,88 (3H, s), 3,36 (1H, m), 3,11 (2H, s), 2,89 (2H, m), 2,59 (2H, m), 2,26 (1H, m), 2,06 (1H, m), 1,98 (1H, m), 1,84 (1H, m), 1,50 (6H, s)
Пример 275: 3-[6-(2-циклобутилсульфанил-пиридин-3-ил)-тиохроман-2-ил]-пропионовая кислота

2-циклобутилсульфанил-3-йод-пиридин (0,060 г, 0,20 ммоль), полученный в Примере Получения 13, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты (0,075 г, 0,20 ммоль), полученный в Примере Получения 5, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,051 г, 66%).
1H-ЯМР (CDCl3) δ 8,38 (1H, m), 7,34 (1H, dd), 7,14 (2H, s), 7,09 (1H, s), 7,00 (1H, m), 4,41 (1H, m), 3,38 (1H, m), 2,91 (2H, m), 2,63 (2H, m), 2,49 (2H, m), 2,26 (1H, m), 2,13 ~ 1,98 (6H, m), 1,87 (1H, m)
Пример 276: 3-[6-(2-циклопропилметокси-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота

2-циклопропилметокси-3-йод-пиридин (0,062 г, 0,23 ммоль), полученный в Примере Получения 40, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,083 г, 0,23 ммоль), полученный в Примере Получения 4, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,057 г, 70%).
1H-ЯМР (CDCl3) δ 8,07 (1H, m), 7,58 (1H, dd), 7,36 (1H, m), 7,33 (1H, s), 6,91 (1H, m), 6,84 (1H, d), 4,20 (2H, d), 4,09 (1H, m), 2,92 (1H, m), 2,82 (1H, m), 2,65 (2H, m), 2,04 (3H, m), 1,81 (1H, m), 1,29 (1H, m), 0,56 (2H, m), 0,35 (2H, m)
Пример 277: 3-[6-(2-циклобутокси-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота

2-циклобутокси-3-йод-пиридин (0,062 г, 0,22 ммоль), полученный в Примере Получения 41, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,083 г, 0,22 ммоль), полученный в Примере Получения 4, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,054 г, 69%).
1H-ЯМР (CDCl3) δ 8,06 (1H, m), 7,55 (1H, dd), 7,35 (1H, dd), 7,28 (1H, m), 6,90 (1H, m), 6,84 (1H, d), 5,25 (1H, m), 4,11 (1H, m), 2,91 (1H, m), 2,81 (1H, m), 2,65 (2H, m), 2,46 (2H, m), 2,12 (2H, m), 2,02 (3H, m), 1,80 (2H, m), 1,67 (1H, m)
Пример 278: 3-[6-(2-циклобутокси-пиридин-3-ил)-тиохроман-2-ил]-пропионовая кислота

2-циклобутокси-3-йод-пиридин (0,062 г, 0,22 ммоль), полученный в Примере Получения 41, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты (0,083 г, 0,22 ммоль), полученный в Примере Получения 5, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,051 г, 62%).
1H-ЯМР (CDCl3) δ 8,08 (1H, m), 7,57 (1H, dd), 7,34 (1H, dd), 7,28 (1H, m), 7,13 (1H, d), 6,91 (1H, m), 5,26 (1H, m), 3,38 (1H, m), 2,91 (2H, m), 2,62 (2H, m), 2,46 (2H, m), 2,26 (1H, m), 2,13 ~ 1,98 (4H, m), 1,85 (2H, m), 1,68 (1H, m)
Пример 279: 3-[6-(2-циклопропилметокси-пиридин-3-ил)-тиохроман-2-ил]-пропионовая кислота

2-циклопропилметокси-3-йод-пиридин (0,065 г, 0,24 ммоль), полученный в Примере Получения 40, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты (0,090 г, 0,24 ммоль), полученный в Примере Получения 5, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,053 г, 59%).
1H-ЯМР (CDCl3) δ 8,08 (1H, dd), 7,58 (1H, dd), 7,34 (2H, m), 7,13 (1H, d), 6,92 (1H, m), 4,20 (2H, d), 3,38 (1H, m), 2,91 (2H, m), 2,61 (2H, m), 2,29 (1H, m), 2,06 (2H, m), 1,88 (2H, m), 1,28 (1H, m), 0,56 (2H, m), 0,34 (2H, m)
Пример 280: 3-[6-(2-циклопентилсульфанил-пиридин-3-ил)-хроман-2-ил]-пропионовая кислота

2-циклопентилсульфанил-3-йод-пиридин (0,068 г, 0,22 ммоль), полученный в Примере Получения 15, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,079 г, 0,22 ммоль), полученный в Примере Получения 4, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,057 г, 67%).
1H-ЯМР (CDCl3) δ 8,39 (1H, dd), 7,33 (1H, dd), 7,15 (1H, dd), 7,09 (1H, s), 7,00 (1H, m), 6,84 (1H, d), 4,08 (2H, m), 2,93 (1H, m), 2,75 (1H, m), 2,66 (2H, m), 2,19 (2H, m), 2,03 (3H, m), 1,85 ~ 1,52 (7H, m)
Пример 281: 3-[6-(2-циклопентилсульфанил-пиридин-3-ил)-тиохроман-2-ил]-пропионовая кислота

2-циклопентилсульфанил-3-йод-пиридин (0,072 г, 0,23 ммоль), полученный в Примере Получения 15, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты (0,087 г, 0,23 ммоль), полученный в Примере Получения 5, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,074 г, 80%).
1H-ЯМР (CDCl3) δ 8,40 (1H, dd), 7,32 (1H, dd), 7,14 (2H, m), 7,09 (1H, m), 7,00 (1H, m), 4,07 (1H, m), 3,38 (1H, m), 2,89 (2H, m), 2,59 (2H, m), 2,20 (3H, m), 2,03 (2H, m), 1,85 (2H, m), 1,75 ~ 1,49 (5H, m)
Пример 282: 3-[6-(5-хлор-2,2-диметил-2,3-дигидро-бензофуран-7-ил)-тиохроман-2-ил]-пропионовая кислота

7-бром-5-хлор-2,2-диметил-2,3-дигидро-бензофуран (0,063 г, 0,24 ммоль), полученный в Примере Получения 210, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты (0,090 г, 0,24 ммоль), полученный в Примере Получения 5, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,076 г, 78%).
1H-ЯМР (CDCl3) δ 7,41 (1H, dd), 7,33 (1H, s), 7,20 (1H, s), 7,11 (1H, d), 7,02 (1H, s), 3,36 (1H, m), 3,01 (2H, s), 2,90 (2H, m), 2,59 (2H, m), 2,26 (1H, m), 2,02 (2H, m), 1,85 (1H, m), 1,48 (6H, s)
Пример 283: 3-(6-спиро[3H-бензофуран-2,1ʹ-циклопентан]-7-ил-тиохроман-2-ил)-пропионовая кислота

7-бромспиро[3H-бензофуран-2,1ʹ-циклопентан] (0,058 г, 0,23 ммоль), полученный в Примере Получения 212, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты (0,090 г, 0,23 ммоль), полученный в Примере Получения 5, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,047 г, 52%).
1H-ЯМР (CDCl3) δ 7,46 (1H, dd), 7,23 (1H, m), 7,11 (1H, d), 7,08 (1H, dd), 6,86 (1H, m), 3,36 (1H, m), 3,19 (2H, s), 2,90 (2H, m), 2,59 (2H, m), 2,26 (1H, m), 2,11 (3H, m), 1,97 (1H, m), 1,87 (3H, m), 1,73 (4H, m)
Пример 284: 3-{6-[2-(тетрагидро-пиран-4-илокси)-пиридин-3-ил]-тиохроман-2-ил}-пропионовая кислота

3-Йод-2-(тетрагидро-пиран-4-илокси)-пиридин (0,080 г, 0,26 ммоль), полученный в Примере Получения 50, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты (0,098 г, 0,26 ммоль), полученный в Примере Получения 5, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,090 г, 86%).
1H-ЯМР (CDCl3) δ 8,08 (1H, dd), 7,59 (1H, dd), 7,30 (2H, m), 7,13 (1H, d), 6,92 (1H, m), 5,35 (1H, m), 3,91 (2H, m), 3,63 (2H, m), 3,38 (1H, m), 2,90 (2H, m), 2,58 (2H, m), 2,28 (1H, m), 2,04 (4H, m), 1,82 (3H, m)
Пример 285: {1-[2,6-дифтор-4-(7-метокси-2,2-диметил-2,3-дигидро-бензофуран-4-ил)-фенил]-азетидин-3-ил}-уксусная кислота
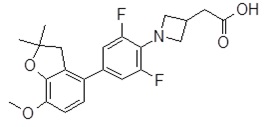
4-бром-7-метокси-2,2-диметил-2,3-дигидро-бензофуран (0,083 г, 0,32 ммоль), полученный в Примере Получения 211, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,121 г, 0,32 ммоль), полученный в Примере Получения 88, вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,047 г, 36%).
1H-ЯМР (CDCl3) δ 6,82 (2H, m), 6,78 (2H, s), 4,39 (2H, m), 3,89 (2H, m), 3,88 (3H, s), 3,11 (2H, s), 3,03 (1H, m), 2,78 (2H, d), 1,51 (6H, s)
Пример 286: 3-[6-(6-изопропилсульфанил-пиридин-2-ил)-тиохроман-2-ил]-пропионовая кислота

2-хлор-6-изопропилсульфанил-пиридин (0,028 г, 0,15 ммоль), полученный в Примере Получения 10, этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты (0,057 г, 0,15 ммоль), полученный в Примере Получения 5, и Pd(PPh3)4 вводили в реакцию таким же образом, как в Примере 17, с получением целевого соединения (0,010 г, 18%).
1H-ЯМР (CDCl3) δ 7,72 (2H, m), 7,48 (1H, m), 7,34 (1H, d), 7,15 (1H, d), 7,03 (1H, d), 4,13 (1H, m), 3,39 (1H, m), 2,96 (2H, m), 2,62 (2H, m), 2,28 (1H, m), 2,05 (2H, m), 1,86 (1H, m), 1,45 (6H, d)
Пример 287: 4-(2,6-дифтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенокси)бутановая кислота

Стадия A: этил 4-(2,6-дифтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенокси)бутаноат
4-Йодспиро[1,3-бензодиоксол-2,1ʹ-циклопентан] (25 мг, 0,083 ммоль), полученный на Стадии C Примера Получения 215, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (30,6 мг, 0,083 ммоль) растворяли в 0,2 мл 2М карбоната натрия и 2 мл 1,4-диоксана и загружали азотом в течение 5 минут. Добавляли PdCl2(dppf) (3,4 мг, 0,004 ммоль), и смесь перемешивали в течение 1 часа при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. После добавления воды реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/4) с получением целевого соединения (9 мг, 26%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,32-7,24 (m, 2H), 6,93-6,90 (m, 1H), 6,84 (dd, 1H), 6,74-6,70 (m, 1H), 4,20 (t, 2H), 4,15 (q, 2H), 2,58 (t, 2H), 2,17-2,11 (m, 4H), 2,10-2,05 (m, 2H), 1,90-1,81 (m, 4H), 1,26 (t, 3H)
Стадия B: 4-(2,6-дифтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенокси)бутановая кислота
Этил-4-(2,6-дифтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенокси)бутаноат (9 мг, 0,022 ммоль), полученный на Стадии A, растворяли в THF/MeOH/H2O (2:2:1, 1 мл). Добавляли LiOH (5,15 мг, 0,22 ммоль), и смесь перемешивали при комнатной температуре в течение 4 часов. После завершения реакции реакционный раствор концентрировали при пониженном давлении, подкисляли до рН 3 при помощи 1Н водного раствора HCl и экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и концентрировали при пониженном давлении с получением целевого соединения (8,3 мг, 95%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,32-7,24 (m, 2H), 6,93-6,90 (m, 1H), 6,84 (dd, 1H), 6,74-6,70 (m, 1H), 4,21 (t, 2H), 2,67 (t, 2H), 2,18-2,05 (m, 6H), 1,90-1,81 (m, 4H)
Пример 288: 4-(4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-илфенокси)бутановая кислота

Стадия A: 4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-илфенол
4-Йодспиро[1,3-бензодиоксол-2,1ʹ-циклопентан] (50 мг, 0,166 ммоль), полученный на Стадии C Примера Получения 215, 4-гидроксифенилбороновую кислоту (23 мг, 0,166 ммоль) и K2CO3 (46 мг, 0,33 ммоль) растворяли в смеси 1,4-диоксан/H2O (4:1, 2 мл) и загружали газообразным азотом в течение 5 минут. Добавляли Pd(PPh3)4(9,6 мг, 0,0083 ммоль), и смесь перемешивали в течение 1 часа при нагревании с обратным холодильником. После завершения реакции реакционный раствор разбавляли водой и экстрагировали EtOAc для отделения органического слоя. Органический слой концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/2) с получением целевого соединения (41 мг, 92%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,61 (d, 2H), 6,95 (d, 1H), 6,88 (d, 2H), 6,83 (dd, 1H), 6,68 (d, 1H), 2,17-2,08 (m, 4H), 1,88-1,80 (m, 4H)
Стадия B: этил-4-(4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-илфенокси)бутаноат
4-Спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-илфенол (41 мг, 0,153 ммоль), полученный на Стадии A, растворяли в AN (5 мл) и добавляли Cs2CO3 (124 мг, 0,38 ммоль). Добавляли этиловый эфир 4-бром-масляной кислоты (26 мкл, 0,18 ммоль), и смесь перемешивали в течение 1 часа при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. Реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (28 мг, 48%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,65 (d, 2H), 6,98-6,92 (m, 3H), 6,83 (dd, 1H), 6,68 (d, 1H), 4,15 (q, 2H), 4,04 (t, 2H), 2,53 (t, 2H), 2,16-2,08 (m, 6H), 1,88-1,80 (m, 4H), 1,26 (t, 3H)
Стадия C: 4-(4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-илфенокси)бутановая кислота
Этил-4-(4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-илфенокси)бутаноат (28 мг, 0,073 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии B Примера 287, с получением целевого соединения (25 мг, 96%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,65 (d, 2H), 6,98-6,92 (m, 3H), 6,83 (dd, 1H), 6,68 (d, 1H), 4,04 (t, 2H), 2,62 (t, 2H), 2,17-2,09 (m, 6H), 1,88-1,80 (m, 4H)
Пример 289: 4-(2-фтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенокси)бутановая кислота

Стадия A: этил-4-(2-фтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенокси)бутаноат
2-Фтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенол (28 мг, 0,098 ммоль) вводили в реакцию таким же образом, как на Стадии B Примера 288, с получением целевого соединения (37 мг, 94%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,50 (dd, 1H), 7,44-7,40 (m, 1H), 7,00 (dd, 1H), 6,95 (d, 1H), 6,83 (dd, 1H), 6,70 (d, 1H), 4,18-4,09 (m, 4H), 2,55 (t, 2H), 2,19-2,09 (m, 6H), 1,89-1,80 (m, 4H), 1,26 (t, 3H)
Стадия B: 4-(2-фтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенокси)бутановая кислота
Этил-4-(2-фтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенокси)бутаноат (28 мг, 0,073 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 287, с получением целевого соединения (25 мг, 96%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,50 (dd, 1H), 7,44-7,40 (m, 1H), 7,00 (dd, 1H), 6,95 (d, 1H), 6,83 (dd, 1H), 6,70 (d, 1H), 4,12 (t, 2H), 2,64 (t, 2H), 2,19-2,09 (m, 6H), 1,89-1,80 (m, 4H)
Пример 290: 4-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенокси]-масляная кислота

Стадия A: этиловый эфир 4-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенокси]-масляной кислоты
4-бром-2,2-дифтор-бензо[1,3]диоксол (50 мг, 0,21 ммоль), этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (78 мг, 0,21 ммоль), полученный в Примере Получения 16, и NaOH (25 мг, 0,63 ммоль) растворяли в смеси 1,4-диоксан/H2O (4:1, 5 мл) и загружали азотом в течение 5 минут. Добавляли Pd(PPh3)4(12 мг, 0,0105 ммоль), и смесь перемешивали в течение 1 часа при нагревании с обратным холодильником. После завершения реакции реакционный раствор разбавляли водой и экстрагировали EtOAc для отделения органического слоя. Органический слой концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/3) с получением целевого соединения (20 мг, 24%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,29-7,22 (m, 2H), 7,21-7,17 (m, 1H), 7,14 (dd, 1H), 7,07-7,03 (m, 1H), 4,23 (t, 2H), 4,15 (q, 2H), 2,58 (t, 2H), 2,15-2,06 (m, 2H), 1,26 (t, 3H)
Стадия B: 4-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенокси]-масляная кислота
Этиловый эфир 4-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенокси]-масляной кислоты (20 мг, 0,045 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 287, с получением целевого соединения (16 мг, 86%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,29-7,23 (m, 2H), 7,21-7,17 (m, 1H), 7,14 (dd, 1H), 7,06-7,03 (dd, 1H), 4,25 (t, 2H), 2,67 (t, 2H), 2,16-2,07 (m, 2H)
Пример 291: 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-2,6-дифтор-фенокси]-масляная кислота

Стадия A: этиловый эфир 4-(2ʹ-бром-3,5-дифтор-3ʹ-гидрокси-бифенил-4-илокси)-масляной кислоты
2-бром-3-йодфенол (100 мг, 0,335 ммоль), полученный на Стадии C Примера Получения 216, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (124 мг, 0,335 ммоль), полученный в Примере Получения 16, растворяли в 0,4 мл 2М карбоната натрия и 4 мл 1,4-диоксана и загружали газообразным азотом в течение 5 минут. Добавляли PdCl2(dppf) (14 мг, 0,0168 ммоль), и смесь перемешивали в течение 1 часа при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. После добавления воды реакционный раствор экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/4) с получением целевого соединения (70 мг, 50%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,24 (dd, 1H), 7,03 (d, 1H), 6,97-6,88 (m, 2H), 6,83 (d, 1H), 5,85 (s, 1H), 4,23 (t, 2H), 4,15 (q, 2H), 2,59 (t, 2H), 2,15-2,07 (m, 2H), 1,27 (t, 3H)
Стадия B: этиловый эфир 4-[3,5-дифтор-3ʹ-гидрокси-2ʹ-(2-метил-пропенил)-бифенил-4-илокси]-масляной кислоты
Этиловый эфир 4-(2ʹ-бром-3,5-дифтор-3ʹ-гидрокси-бифенил-4-илокси)-масляной кислоты (70 мг, 0,169 ммоль), полученный на Стадии A, и 4,4,5,5-тетраметил-2-(2-метил-пропенил)-[1,3,2]диоксаборолан (93 мг, 0,507 ммоль) растворяли в 0,4 мл 2М карбоната натрия и 4 мл 1,4-диоксана и загружали азотом в течение 5 минут. Добавляли PdCl2(dppf) (7 мг, 0,0085 ммоль), и смесь перемешивали в течение 12 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры. После добавления воды и EtOAc, реакционный раствор перемешивали в течение 30 минут и фильтровали через Целит. Разделение слоев осуществляли для отделения органического слоя. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией (элюент EtOAc/Hex=1/3) с получением целевого соединения (17 мг, 26%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,21 (dd, 1H), 6,94 (d, 1H), 6,86-6,78 (m, 3H), 5,83 (s, 1H), 5,36 (s, 1H), 4,19 (t, 2H), 4,15 (q, 2H), 2,58 (t, 2H), 2,13-2,06 (m, 2H), 1,87 (s, 3H), 1,57 (s, 3H), 1,26 (t, 3H)
Стадия C: этиловый эфир 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-2,6-дифтор-фенокси]-масляной кислоты
Этиловый эфир 4-[3,5-дифтор-3ʹ-гидрокси-2ʹ-(2-метил-пропенил)-бифенил-4-илокси]-масляной кислоты (17 мг, 0,044 ммоль), полученный на Стадии B, растворяли в толуоле (2 мл). Добавляли смолу Amberlyst 15 (17 мг), и смесь перемешивали в течение 4 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры, фильтровали, концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/4) с получением целевого соединения (9 мг, 53%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,17 (dd, 1H), 7,01-6,93 (m, 2H), 6,82 (d, 1H), 6,74 (d, 1H), 4,20 (t, 2H), 4,15 (q, 2H), 3,08 (s, 2H), 2,58 (t, 2H), 2,13-2,06 (m, 2H), 1,48 (s, 6H), 1,27 (t, 3H)
Стадия D: 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-2,6-дифтор-фенокси]-масляная кислота
Этиловый эфир 4-[4-(2,2-диметил-2,3-дигидро-бензофуран-4-ил)-2,6-дифтор-фенокси]-масляной кислоты (9 мг, 0,023 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии B Примера 287, с получением целевого соединения (8,2 мг, 98%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 7,17 (dd, 1H), 7,01-6,94 (m, 2H), 6,82 (d, 1H), 6,74 (d, 1H), 4,22 (t, 2H), 3,08 (s, 2H), 2,67 (t, 2H), 2,15-2,07 (m, 2H), 1,48 (s, 6H)
Пример 292: 4-[4-(2-циклогексилсульфанил-пиридин-3-ил)-2,6-дифтор-фенокси]-масляная кислота
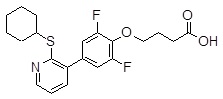
Стадия A: этиловый эфир 4-[4-(2-циклогексилсульфанил-пиридин-3-ил)-2,6-дифтор-фенокси]-масляной кислоты
Этиловый эфир 4-[2,6-дифтор-4-(2-фтор-пиридин-3-ил)-фенокси]-масляной кислоты (50 мг, 0,147 ммоль), Cs2CO3 (192 мг, 0,588 ммоль) и циклогексантиол (36 мкл, 0,294 ммоль) вводили в реакцию таким же образом, как на Стадии B Примера 288, с получением целевого соединения (5 мг, 8%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 8,42 (d, 1H), 7,32 (d, 1H), 7,03-6,93 (m, 3H), 4,23 (t, 2H), 4,16 (q, 2H), 3,95-3,86 (m, 1H), 2,59 (t, 2H), 2,14-2,07 (m, 2H), 2,07-2,01 (m, 2H), 1,78-1,69 (m, 2H), 1,66-1,57 (m, 1H), 1,49-1,36 (m, 4H), 1,35-1,23 (m, 1H), 1,27 (t, 3H)
Стадия B: 4-[4-(2-циклогексилсульфанил-пиридин-3-ил)-2,6-дифтор-фенокси]-масляная кислота
Этиловый эфир 4-[4-(2-циклогексилсульфанил-пиридин-3-ил)-2,6-дифтор-фенокси]-масляной кислоты (5 мг, 0,0115 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 287, с получением целевого соединения (4,2 мг, 90%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 8,84 (d, 1H), 7,67 (d, 1H), 7,51-7,45 (m, 1H), 7,02-6,93 (m, 2H), 4,29 (t, 2H), 3,32-3,23 (m, 1H), 2,65 (t, 2H), 2,17-1,98 (m, 4H), 1,90-1,81 (m, 1H), 1,68-1,23 (m, 7H)
Пример 293: 3-[4-(2-циклопентилокси-пиридин-3-ил)-бензилсульфанил]-пропионовая кислота

Стадия A: [4-(2-циклопентилокси-пиридин-3-ил)-фенил]-метанол
2-циклопентилокси-3-йод-пиридин (100 мг, 0,346 ммоль), [4-(гидроксиметил)-фенил]бороновую кислоту (52,6 мг, 0,346 ммоль) и K2CO3 (96 мг, 0,692 ммоль) растворяли в смеси 1,4-диоксан/H2O (4:1, 4 мл) и загружали азотом в течение 5 минут. Добавляли Pd(PPh3)4 (20 мг, 0,0173 ммоль), и смесь перемешивали в течение 1 часа при нагревании с обратным холодильником. После завершения реакции реакционный раствор разбавляли водой и экстрагировали EtOAc для отделения органического слоя. Органический слой концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/4) с получением целевого соединения (88 мг, 94%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 8,12 (dd, 1H), 7,58 (dd, 1H), 7,54 (d, 2H), 7,39 (d, 2H), 6,90 (dd, 1H), 5,53-5,47 (m, 1H), 4,72 (s, 2H), 2,09 (s, 1H), 1,98-1,88 (m, 2H), 1,85-1,76 (m, 2H), 1,76-1,67 (m, 2H), 1,65-1,55 (m, 2H)
Стадия B: 3-(4-бромметил-фенил)-2-циклопентилокси-пиридин
[4-(2-циклопентилокси-пиридин-3-ил)-фенил]-метанол (70 мг, 0,26 ммоль) растворяли в DCM. Добавляли NBS (69 мг, 0,39 ммоль) и трифенилфосфин (102 мг, 0,39 ммоль), и смесь перемешивали при комнатной температуре в течение 2 часов. После завершения реакции реакционный раствор разбавляли водой и экстрагировали DCM для отделения органического слоя. Органический слой концентрировали при пониженном давлении и очищали колоночной хроматографией (элюент EtOAc/Hex=1/10) с получением целевого соединения (80 мг, 93%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 8,14 (dd, 1H), 7,59 (dd, 1H), 7,54 (d, 2H), 7,42 (d, 2H), 6,91 (dd, 1H), 5,55-5,50 (m, 1H), 4,54 (s, 2H), 2,00-1,90 (m, 2H), 1,85-1,77 (m, 2H), 1,76-1,68 (m, 2H), 1,67-1,57 (m, 2H)
Стадия C: 3-[4-(2-циклопентилокси-пиридин-3-ил)-бензилсульфанил]-пропионовая кислота
EtOH (2 мл) и NaOH (19 мг, 0,48 ммоль) добавляли к 3-меркапто-пропионовой кислоте (21 мкл, 0,24 ммоль), и смесь перемешивали при комнатной температуре в течение 15 минут. 3-(4-бромметил-фенил)-2-циклопентилокси-пиридин (80 мг, 0,24 ммоль), полученный на Стадии B, растворяли в EtOH (2 мл) и THF (0,5 мл) и медленно добавляли по каплям к вышеупомянутому раствору. Смесь перемешивали при комнатной температуре в течение 3 часов. Реакционный раствор подкисляли до рН 3 при помощи 1Н водного раствора HCl и экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и концентрировали при пониженном давлении с получением целевого соединения (83 мг, 97%-й выход).
1H-ЯМР (500 МГц, CDCl3) δ 8,14 (dd, 1H), 7,60 (dd, 1H), 7,50 (d, 2H), 7,34 (d, 2H), 6,92 (dd, 1H), 5,53-5,46 (m, 1H), 3,78 (s, 2H), 2,72 (t, 2H), 2,62 (t, 2H), 1,98-1,88 (m, 2H), 1,84-1,75 (m, 2H), 1,75-1,65 (m, 2H), 1,65-1,55 (m, 2H)
Пример 294: 2-[1-[4-[6-(циклобутокси)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-6-циклобутокси-пиридин (0,062 г, 0,33 ммоль), полученный в Примере Получения 29, и метиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,147 г, 0,37 ммоль), полученный в Примере Получения 84, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,058 г, 44%).
1H-ЯМР (CDCl3) δ 7,57 (1H, t), 7,49 (2H, m), 7,20 (1H, d), 6,62 (1H, d), 5,26 (1H, m), 3,32 (2H, m), 3,16 (2H, m), 2,52 (2H, m), 2,36 (2H, d), 2,19 (2H, m), 1,98 (1H, m), 1,84 (3H, m), 1,75 (1H, m), 1,48 (2H, m)
Пример 295: 2-[1-[2,6-дифтор-4-(6-пропокси-2-пиридил)фенил]-4-пиперидил]уксусная кислота

2-хлор-6-пропокси-пиридин (0,057 г, 0,33 ммоль) и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,097 г, 75%).
1H-ЯМР (CDCl3) δ 7,60 (1H, t), 7,50 (2H, m), 7,19 (1H, d), 6,66 (1H, d), 4,35 (2H, t), 3,31 (2H, m), 3,15 (2H, m), 2,36 (2H, d), 1,98 (1H, m), 1,83 (4H, m), 1,49 (2H, m), 1,05 (3H, t)
Пример 296: 2-[1-[2,6-дифтор-4-(6-изопропокси-2-пиридил)фенил]-4-пиперидил]уксусная кислота

2-хлор-6-изопропокси-пиридин (0,057 г, 0,33 ммоль), полученный в Примере Получения 46, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,097 г, 75%).
1H-ЯМР (CDCl3) δ 7,58 (1H, t), 7,49 (2H, m), 7,16 (1H, d), 6,61 (1H, d), 5,44 (1H, m), 3,31 (2H, m), 3,14 (2H, m), 2,36 (2H, d), 1,98 (1H, m), 1,82 (2H, m), 1,50 (2H, m), 1,39 (6H, d)
Пример 297: 2-[1-[4-(6-циклобутилсульфанил-2-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-6-циклобутилсульфанил-пиридин (0,066 г, 0,33 ммоль) и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,036 г, 26%).
1H-ЯМР (CDCl3) δ 7,52 (3H, m), 7,29 (1H, d), 7,01 (1H, d), 4,42 (1H, m), 3,34 (2H, m), 3,18 (2H, m), 2,60 (2H, m), 2,37 (2H, d), 2,15 (4H, m), 1,99 (1H, m), 1,82 (2H, m), 1,50 (2H, m)
Пример 298: 2-[1-[2,6-дифтор-4-(6-пропилсульфанил-2-пиридил)фенил]-4-пиперидил]уксусная кислота

2-хлор-6-пропилсульфанил-пиридин (0,077 г, 0,33 ммоль) и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,032 г, 24%).
1H-ЯМР (CDCl3) δ 7,51 (3H, m), 7,29 (1H, d), 7,09 (1H, d), 3,33 (2H, m), 3,23 (2H, t), 3,15 (2H, m), 2,37 (2H, d), 1,99 (1H, m), 1,82 (4H, m), 1,50 (2H, m), 1,08 (3H, t)
Пример 299: 2-[1-[4-[6-(циклопентокси)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-6-циклопентилокси-пиридин (0,066 г, 0,33 ммоль), полученный в Примере Получения 12, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,099 г, 72%).
1H-ЯМР (CDCl3) δ 7,57 (1H, t), 7,51 (2H, m), 7,17 (1H, d), 6,61 (1H, d), 5,51 (1H, m), 3,32 (2H, m), 3,15 (2H, m), 2,37 (2H, d), 2,05 (3H, m), 1,84 (6H, m), 1,65 (2H, m), 1,49 (2H, m)
Пример 300: 2-[1-[4-[3-(циклобутокси)фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

Стадия A: этиловый эфир 2-[1-[4-[3-(циклобутокси)фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты
этиловый эфир 2-[1-[2,6-дифтор-4-фенил(3-гидроксифенил)]-4-пиперидил]уксусной кислоты (0,095 г, 0,25 ммоль), полученный в Примере Получения 223, растворяли в 0,85 мл DMF. Добавляли K2CO3 (0,07 г, 0,5 ммоль) и бромциклобутан (0,037 г, 0,27 ммоль), и смесь перемешивали при 60°C в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении. Твердые вещества отфильтровывали, и фильтрат очищали колоночной хроматографией с получением целевого соединения (0,049 г, 44%).
1H-ЯМР (CDCl3) δ 7,30 (1H, t), 7,05 (3H, m), 6,94 (1H, m), 6,79 (1H, m), 4,68 (1H, m), 4,15 (2H, q), 3,27 (2H, m), 3,13 (2H, m), 2,45 (2H, m), 2,29 (2H, d), 2,19 (2H, m), 1,96 (1H, m), 1,88 (1H, m), 1,77 (2H, m), 1,70 (1H, m), 1,45 (2H, m), 1,27 (3H, t)
Стадия B: 2-[1-[4-[3-(циклобутокси)фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
Этиловый эфир 2-[1-[4-[3-(циклобутокси)фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты (0,049 г, 0,11 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,033 г, 75%).
1H-ЯМР (CDCl3) δ 7,30 (1H, t), 7,05 (3H, m), 6,94 (1H, m), 6,78 (1H, m), 4,68 (1H, m), 3,27 (2H, m), 3,14 (2H, m), 2,47 (2H, m), 2,35 (2H, d), 2,19 (2H, m), 1,96 (1H, m), 1,86 (1H, m), 1,82 (2H, m), 1,71 (1H, m), 1,49 (2H, m)
Пример 301: 2-[1-[4-[3-(циклопропилметокси)фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

Стадия A: этиловый эфир 2-[1-[4-[3-(циклопропилметокси)фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-фенил(3-гидроксифенил)]-4-пиперидил]уксусной кислоты (0,095 г, 0,25 ммоль), полученный в Примере Получения 223, растворяли в 0,85 мл DMF. Добавляли K2CO3 (0,07 г, 0,5 ммоль) и бромметилциклопропан (0,037 г, 0,27 ммоль), и смесь перемешивали при 60°C в течение 16 часов. Реакционный раствор концентрировали при пониженном давлении. Твердые вещества отфильтровывали, и фильтрат очищали колоночной хроматографией с получением целевого соединения (0,059 г, 55%).
1H-ЯМР (CDCl3) δ 7,31 (1H, t), 7,05 (4H, m), 6,88 (1H, m), 4,15 (2H, q), 3,85 (2H, d), 3,27 (2H, m), 3,13 (2H, m), 2,29 (2H, d), 1,96 (1H, m), 1,77 (2H, m), 1,45 (2H, m), 1,27 (4H, m), 0,67 (2H, m), 0,37 (2H, m)
Стадия B: 2-[1-[4-[3-(циклопропилметокси)фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
Этиловый эфир 2-[1-[4-[3-(Циклопропилметокси)фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты (0,059 г, 0,14 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,055 г, 99%).
1H-ЯМР (CDCl3) δ 7,31 (1H, t), 7,05 (4H, m), 6,88 (1H, m), 3,85 (2H, d), 3,28 (2H, m), 3,14 (2H, m), 2,36 (2H, d), 1,97 (1H, m), 1,82 (2H, m), 1,50 (2H, m), 1,29 (1H, m), 0,67 (2H, m), 0,36 (2H, m)
Пример 302: 2-[1-[2,6-дифтор-4-[3-(изопропоксиметил)фенил]фенил]-4-пиперидил]уксусная кислота

1-бром-3-(изопропоксиметил)бензол (0,076 г, 0,33 ммоль), полученный в Примере Получения 286, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,09 г, 68%).
1H-ЯМР (CDCl3) δ 7,49 (1H, m), 7,41 (2H, m), 7,33 (1H, m), 7,08 (2H, m), 4,55 (2H, s), 3,72 (1H, m), 3,28 (2H, m), 3,14 (2H, m), 2,36 (2H, d), 1,97 (1H, m), 1,82 (2H, m), 1,49 (2H, m), 1,23 (6H, d)
Пример 303: 2-[1-[4-[3-(этоксиметил)фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

1-бром-3-(этоксиметил)бензол (0,072 г, 0,33 ммоль), полученный в Примере Получения 287, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,07 г, 54%).
1H-ЯМР (CDCl3) δ 7,49 (1H, m), 7,41 (2H, m), 7,32 (1H, m), 7,08 (2H, m), 4,55 (2H, s), 3,58 (2H, q), 3,28 (2H, m), 3,15 (2H, m), 2,37 (2H, d), 1,97 (1H, m), 1,83 (2H, m), 1,50 (2H, m), 1,27 (3H, t)
Пример 304: 2-[1-[4-[3-(циклобутокси)-4-фторфенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
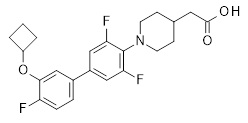
Стадия A: этиловый эфир 2-[1-[2,6-дифтор-4-(4-фтор-3-гидрокси-фенил)фенил]-4-пиперидил]уксусной кислоты
5-бром-2-фтор-фенол (0,127 г, 0,66 ммоль) и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,30 г, 0,73 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96, с получением целевого соединения (0,19 г, 73%).
1H-ЯМР (CDCl3) δ 7,12 (2H, m), 6,99 (3H, m), 5,22 (1H, ушир.), 4,14 (2H, q), 3,26 (2H, m), 3,13 (2H, m), 2,30 (2H, d), 1,96 (1H, m), 1,77 (2H, m), 1,45 (2H, m), 1,27 (3H, t)
Стадия B: этиловый эфир 2-[1-[4-[3-(циклобутокси)-4-фторфенил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты
1 мл DMF, бромциклобутан (0,032 г, 0,23 ммоль) и Cs2CO3 (0,136 г, 0,42 ммоль) добавляли к этиловому эфиру 2-[1-[2,6-дифтор-4-(4-фтор-3-гидрокси-фенил)фенил]-4-пиперидил]уксусной кислоты (0,084 г, 0,21 ммоль), полученному на Стадии A, и смесь перемешивали при 50°C в течение 16 часов. Твердые вещества отфильтровывали, и фильтрат очищали колоночной хроматографией с получением целевого соединения (0,068 г, 72%).
1H-ЯМР (CDCl3) δ 7,10 (1H, m), 6,98 (3H, m), 6,92 (1H, m), 4,73 (1H, m), 4,14 (2H, q), 3,26 (2H, m), 3,13 (2H, m), 2,48 (2H, m), 2,39 (4H, m), 1,97 (1H, m), 1,88 (1H, m), 1,77 (2H, m), 1,70 (1H, m), 1,45 (2H, m), 1,26 (3H, t)
Стадия C: 2-[1-[4-[3-(циклобутокси)-4-фторфенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
Этиловый эфир 2-[1-[4-[3-(Циклобутокси)-4-фторфенил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты (0,068 г, 0,15 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,03 г, 71%).
1H-ЯМР (CDCl3) δ 7,10 (1H, m), 6,98 (3H, m), 6,92 (1H, m), 4,73 (1H, m), 3,27 (2H, m), 3,14 (2H, m), 2,47 (2H, m), 2,36 (2H, d), 2,26 (2H, m), 1,97 (1H, m), 1,89 (1H, m), 1,82 (2H, m), 1,70 (1H, m), 1,50 (2H, m)
Пример 305: 2-[1-[4-[3-(циклобутокси)-4-метокси-фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

Стадия A: Этиловый эфир 2-[1-[2,6-дифтор-4-(3-гидрокси-4-метокси-фенил)фенил]-4-пиперидил]уксусной кислоты
5-бром-2-метокси-фенол (0,135 г, 0,66 ммоль) и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,30 г, 0,73 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96, с получением целевого соединения (0,167 г, 62%).
1H-ЯМР (CDCl3) δ 7,09 (1H, m), 7,01 (3H, m), 6,89 (1H, m), 5,64 (1H, ушир.), 4,16 (2H, q), 3,92 (3H, s), 3,25 (2H, m), 3,14 (2H, m), 2,29 (2H, d), 1,97 (1H, m), 1,77 (2H, m), 1,46 (2H, m), 1,27 (3H, t)
Стадия B: этиловый эфир 2-[1-[4-[3-(циклобутокси)-4-метокси-фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты
1 мл DMF, бромциклобутан (0,032 г, 0,23 ммоль) и Cs2CO3 (0,136 г, 0,42 ммоль) добавляли к этиловому эфиру 2-[1-[2,6-дифтор-4-(3-гидрокси-4-метокси-фенил)фенил]-4-пиперидил]уксусной кислоты (0,08 г, 0,2 ммоль), полученному на Стадии A, и смесь перемешивали при 50°C в течение 16 часов. Твердые вещества отфильтровывали, и фильтрат очищали колоночной хроматографией с получением целевого соединения (0,045 г, 49%).
1H-ЯМР (CDCl3) δ 7,04 (1H, m), 6,93 (2H, m), 6,90 (1H, m), 6,85 (1H, m), 4,72 (1H, m), 4,14 (2H, q), 3,90 (3H, s), 3,2 (2H, m), 3,13 (2H, m), 2,50 (2H, m), 2,30 (4H, m), 1,95 (1H, m), 1,88 (1H, m), 1,76 (2H, m), 1,70 (1H, m), 1,47 (2H, m), 1,27 (3H, t)
Стадия C: 2-[1-[4-[3-(циклобутокси)-4-метокси-фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
Этиловый эфир 2-[1-[4-[3-(Циклобутокси)-4-метокси-фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты (0,045 г, 0,10 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,04 г, 94%).
1H-ЯМР (CDCl3) δ 7,04 (1H, m), 6,99 (2H, m), 6,90 (1H, m), 6,86 (1H, m), 4,72 (1H, m), 3,90 (3H, s), 3,26 (2H, m), 3,14 (2H, m), 2,50 (2H, m), 2,36 (2H, d), 2,30 (2H, m), 1,96 (1H, m), 1,88 (1H, m), 1,82 (2H, m), 1,71 (1H, m), 1,50 (2H, m)
Пример 306: 2-[1-[4-[3-(циклобутокси)-5-фторфенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

Стадия A: этиловый эфир 2-[1-[2,6-дифтор-4-(3-фтор-5-гидрокси-фенил)фенил]-4-пиперидил]уксусной кислоты
3-бром-5-фтор-фенол (0,127 г, 0,66 ммоль) и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,30 г, 0,73 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96, с получением целевого соединения (0,24 г, 85%).
1H-ЯМР (CDCl3) δ 7,02 (2H, m), 6,79 (1H, m), 6,75 (1H, m), 6,55 (1H, m), 5,02 (1H, ушир.), 4,14 (2H, q), 3,28 (2H, m), 3,13 (2H, m), 2,30 (2H, d), 1,95 (1H, m), 1,77 (2H, m), 1,45 (2H, m), 1,27 (3H, t)
Стадия B: этиловый эфир 2-[1-[4-[3-(циклобутокси)-5-фторфенил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты
2 мл DMF, бромциклобутан (0,058 г, 0,43 ммоль) и Cs2CO3 (0,25 г, 0,76 ммоль) добавляли к этиловому эфиру 2-[1-[2,6-дифтор-4-(3-фтор-5-гидрокси-фенил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,39 ммоль), полученному на Стадии A, и смесь перемешивали при 50°C в течение 16 часов. Твердые вещества отфильтровывали, и фильтрат очищали колоночной хроматографией с получением целевого соединения (0,072 г, 41%).
1H-ЯМР (CDCl3) δ 7,01 (2H, m), 6,76 (1H, m), 6,73 (1H, m), 6,48 (1H, m), 4,64 (1H, m), 4,14 (2H, q), 3,28 (2H, m), 3,13 (2H, m), 2,47 (2H, m), 2,28 (2H, d), 2,18 (2H, m), 1,96 (1H, m), 1,88 (1H, m), 1,77 (2H, m), 1,70 (1H, m), 1,47 (2H, m), 1,27 (3H, t)
Стадия C: 2-[1-[4-[3-(циклобутокси)-5-фторфенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
Этиловый эфир 2-[1-[4-[3-(Циклобутокси)-5-фторфенил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты (0,072 г, 0,16 ммоль), полученный на Стадии B, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,037 г, 55%).
1H-ЯМР (CDCl3) δ 7,00 (2H, m), 6,77 (1H, m), 6,73 (1H, m), 6,49 (1H, m), 4,65 (1H, m), 3,29 (2H, m), 3,14 (2H, m), 2,47 (2H, m), 2,35 (2H, d), 2,18 (2H, m), 1,96 (1H, m), 1,88 (1H, m), 1,82 (2H, m), 1,71 (1H, m), 1,48 (2H, m)
Пример 307: 2-[1-[2-хлор-4-[6-(циклопропилметокси)-2-пиридил]-6-фторфенил]-4-пиперидил]уксусная кислота
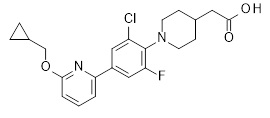
Стадия A: 2-хлор-4-[6-(циклопропилметокси)-2-пиридил]-6-фторанилин
2-хлор-6-циклопропилметокси-пиридин (0,23 г, 1,25 ммоль), полученный в Примере Получения 43, и 2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (0,37 г, 1,37 ммоль), полученный в Примере Получения 225, вводили в реакцию таким же образом, как на Стадии A Примера 96, с получением целевого соединения (0,28 г, 77%).
1H-ЯМР (CDCl3) δ 7,74 (1H, m), 7,64 (1H, m), 7,58 (1H, m), 7,18 (1H, m), 6,65 (1H, m), 4,22 (2H, d), 4,21 (2H, ушир.), 1,33 (1H, m), 0,64 (2H, m), 0,39 (2H, m)
Стадия B: 2-(4-бром-3-хлор-5-фтор-фенил)-6-(циклопропилметокси)пиридин
2-хлор-4-[6-(циклопропилметокси)-2-пиридил]-6-фторанилин (0,27 г, 0,95 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии C Примера Получения 84, с получением целевого соединения (0,146 г, 43%).
1H-ЯМР (CDCl3) δ 7,90 (1H, m), 7,71 (1H, m), 7,65 (1H, m), 7,28 (1H, m), 6,78 (1H, m), 4,23 (2H, d), 1,32 (1H, m), 0,64 (2H, m), 0,40 (2H, m)
Стадия C: этиловый эфир 2-[1-[2-хлор-4-[6-(циклопропилметокси)-2-пиридил]-6-фторфенил]-4-пиперидил]уксусной кислоты
2,7 мл 1,4-диоксана добавляли к 2-(4-бром-3-хлор-5-фтор-фенил)-6-(циклопропилметокси)пиридину (0,145 г, 0,4 ммоль), полученному на Стадии B, гидрохлоридной соли этилового эфира 2-(4-пиперидил)уксусной кислоты (0,084 г, 0,4 ммоль), 2-дициклогексилфосфино-2ʹ,6ʹ-диметоксибифенилу (0,041 г, 0,1 ммоль) и Cs2CO3 (0,52 г, 1,6 ммоль), и загружали газообразным азотом в течение 5 минут. Добавляли Pd2(dba)3(0,036 г, 0,04 ммоль), и смесь перемешивали при 70°C в течение 16 часов. Твердые вещества фильтровали через Целит, и фильтрат очищали колоночной хроматографией с получением целевого соединения (0,015 г, 8%).
1H-ЯМР (CDCl3) δ 7,79 (1H, m), 7,60 (2H, m), 7,21 (1H, m), 6,71 (1H, m), 4,23 (2H, d), 4,14 (2H, q), 3,22 (2H, m), 3,15 (2H, m), 2,31 (2H, d), 1,96 (1H, m), 1,76 (2H, m), 1,49 (2H, m), 1,32 (1H, m), 1,27 (3H, t), 0,64 (2H, m), 0,40 (2H, m)
Стадия D: 2-[1-[2-хлор-4-[6-(циклопропилметокси)-2-пиридил]-6-фторфенил]-4-пиперидил]уксусная кислота
Этиловый эфир 2-[1-[2-хлор-4-[6-(циклопропилметокси)-2-пиридил]-6-фторфенил]-4-пиперидил]уксусной кислоты (0,015 г, 0,033 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,014 г, 99%).
1H-ЯМР (CDCl3) δ 7,79 (1H, m), 7,60 (2H, m), 7,21 (1H, m), 6,71 (1H, m), 4,23 (2H, d), 3,23 (2H, m), 3,16 (2H, m), 2,38 (2H, d), 2,00 (1H, m), 1,82 (2H, m), 1,51 (2H, m), 1,32 (1H, m), 0,64 (2H, m), 0,40 (2H, m)
Пример 308: 2-[1-[4-[6-(циклобутилметокси)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
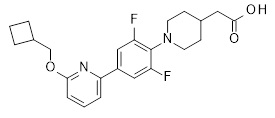
2-хлор-6-(циклобутилметокси)пиридин (0,066 г, 0,33 ммоль), полученный в Примере Получения 324, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,11 г, 80%).
1H-ЯМР (CDCl3) δ 7,59 (1H, t), 7,51 (2H, m), 7,19 (1H, m), 6,66 (1H, m), 4,36 (2H, d), 3,32 (2H, m), 3,16 (2H, m), 2,80 (1H, m), 2,37 (2H, d), 2,14 (2H, m), 1,93 (5H, m), 1,82 (2H, m), 1,51 (2H, m)
Пример 309: 2-[1-[4-(6-трет-бутокси-2-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-Трет-бутокси-6-хлор-пиридин (0,062 г, 0,33 ммоль), полученный в Примере Получения 272, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,10 г, 78%).
1H-ЯМР (CDCl3) δ 7,55 (1H, t), 7,45 (2H, m), 7,17 (1H, m), 6,58 (1H, m), 3,32 (2H, m), 3,15 (2H, m), 2,37 (2H, d), 1,97 (1H, m), 1,83 (2H, m), 1,65 (9H, s), 1,50 (2H, m)
Пример 310: 2-[1-[4-[3-(циклобутокси)-2-метил-фенил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

1-бром-3-(циклобутокси)-2-метилбензол (0,08 г, 0,33 ммоль), полученный в Примере Получения 288, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,055 г, 40%).
1H-ЯМР (CDCl3) δ 7,12 (1H, t), 6,77 (3H, m), 6,68 (1H, m), 4,65 (1H, m), 3,29 (2H, m), 3,15 (2H, m), 2,46 (2H, m), 2,36 (2H, d), 2,19 (2H, m), 2,12 (3H, s), 1,97 (1H, m), 1,85 (3H, m), 1,70 (1H, m), 1,50 (2H, m)
Пример 311: 2-[1-[4-[5-хлор-6-(циклобутокси)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

3,6-дихлор-2-(циклобутокси)пиридин (0,080 г, 0,36 ммоль), полученный в Примере Получения 298, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,16 г, 0,39 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,02 г, 13%).
1H-ЯМР (CDCl3) δ 7,63 (1H, d), 7,46 (2H, m), 7,15 (1H, d), 5,32 (1H, m), 3,32 (2H, m), 3,15 (2H, m), 2,54 (2H, m), 2,37 (2H, d), 2,26 (2H, m), 1,98 (1H, m), 1,80 (4H, m), 1,48 (2H, m)
Пример 312: 2-[1-[4-[6-(циклопропанкарбонил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

Стадия A: этиловый эфир 2-[1-[4-[6-[циклопропил(гидрокси)метил]-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,205 г, 0,50 ммоль), полученный в Примере Получения 220, и (6-бром-2-пиридил)-циклопропил-метанол (0,125 г, 0,55 ммоль), полученный в Примере Получения 268, вводили в реакцию таким же образом, как на Стадии A Примера 96, с получением целевого соединения (0,165 г, 77%).
1H-ЯМР (CDCl3) δ 7,77 (1H, m), 7,58 (2H, m), 7,36 (2H, m), 4,58 (1H, m), 4,14 (2H, m), 3,33 (2H, m), 3,16 (2H, m), 2,30 (2H, m), 1,97 (1H, m), 1,79 (2H, m), 1,46 (2H, m), 1,32 (3H, t), 1,15 (1H, m), 0,60 (4H, m)
Стадия B: 2-[1-[4-[6-(циклопропанкарбонил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
4 мл DMSO добавляли к этиловому эфиру 2-[1-[4-[6-[циклопропил(гидрокси)метил]-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты (0,053 г, 0,123 ммоль), полученному на Стадии A. Добавляли IBX (0,103 г, 0,368 ммоль), и смесь перемешивали при комнатной температуре для получения этилового эфира 2-[1-[4-[6-(циклопропанкарбонил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты (0,05 г, 95%). Полученное соединение вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,038 г, 81%).
1H-ЯМР (CDCl3) δ 7,98 (1H, d), 7,95 (1H, t), 7,81 (1H, d), 7,66 (2H, m), 3,67 (1H, m), 3,36 (2H, m), 3,18 (2H, m), 2,37 (2H, d), 2,00 (1H, m), 1,85 (2H, m), 1,50 (2H, m), 1,29 (2H, m), 1,17 (2H, m)
Пример 313: 2-[1-[4-[6-(циклобутоксиметил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
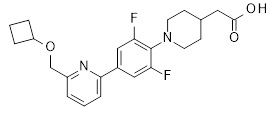
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,082 г, 0,20 ммоль), полученный в Примере Получения 220, и 2-бром-6-(циклобутоксиметил)пиридин (0,053 г, 0,22 ммоль), полученный в Примере Получения 269, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,039 г, 47%).
1H-ЯМР (CDCl3) δ 7,72 (1H, t), 7,49 (3H, m), 7,39 (1H, d), 4,58 (2H, s), 4,10 (1H, m), 3,31 (2H, m), 3,14 (2H, m), 2,35 (2H, d), 2,25 (2H, m), 2,02 (3H, m), 1,81 (2H, m), 1,73 (1H, m), 1,48 (3H, m)
Пример 314: 2-[1-[4-(6-этокси-2-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-6-этокси-пиридин (0,053 г, 0,33 ммоль), полученный в Примере Получения 273, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,10 г, 80%).
1H-ЯМР (CDCl3) δ 7,60 (1H, t), 7,51 (2H, m), 7,20 (1H, d), 6,65 (1H, d), 4,45 (2H, q), 3,31 (2H, m), 3,15 (2H, m), 2,37 (2H, d), 1,97 (1H, m), 1,82 (2H, m), 1,50 (2H, m), 1,43 (3H, t)
Пример 315: 2-[1-[2,6-дифтор-4-[6-(2,2,2-трифторэтокси)-2-пиридил]фенил]-4-пиперидил]уксусная кислота

2-хлор-6-(2,2,2-трифторэтокси)пиридин (0,071 г, 0,33 ммоль), полученный в Примере Получения 274, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль) 220 вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,082 г, 58%).
1H-ЯМР (CDCl3) δ 7,69 (1H, t), 7,46 (2H, m), 7,31 (1H, d), 6,80 (1H, d), 4,84 (2H, q), 3,33 (2H, m), 3,16 (2H, m), 2,37 (2H, d), 1,98 (1H, m), 1,83 (2H, m), 1,50 (2H, m)
Пример 316: 2-[1-[2,6-дифтор-4-[6-(2,2,2-трифтор-1-метил-этокси)-2-пиридил]фенил]-4-пиперидил]уксусная кислота

2-хлор-6-(2,2,2-трифтор-1-метил-этокси)пиридин (0,075 г, 0,33 ммоль), полученный в Примере Получения 275, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,127 г, 86%).
1H-ЯМР (CDCl3) δ 7,67 (1H, t), 7,45 (2H, m), 7,28 (1H, d), 6,74 (1H, d), 5,89 (1H, m), 3,33 (2H, m), 3,16 (2H, m), 2,37 (2H, d), 1,98 (1H, m), 1,83 (2H, m), 1,55 (3H, d), 1,50 (2H, m)
Пример 317: 2-[1-[4-(6-циклопентил-2-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-бром-6-циклопентил-пиридин (0,067 г, 0,3 ммоль) и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,13 г, 0,32 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,06 г, 50%).
1H-ЯМР (CDCl3) δ 7,61 (1H, t), 7,53 (2H, m), 7,41 (1H, d), 7,09 (1H, d), 3,31 (2H, m), 3,22 (1H, m), 3,15 (2H, m), 2,37 (2H, d), 2,10 (2H, m), 1,97 (1H, m), 1,85 (6H, m), 1,70 (2H, m), 1,50 (2H, m)
Пример 318: 2-[1-[4-[6-[циклопропил(метокси)метил]-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

Этиловый эфир 2-[1-[4-[6-[Циклопропил(гидрокси)метил]-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты (0,054 г, 0,125 ммоль), полученный на Стадии A Примера 312, растворяли в 4 мл CH3CN. Добавляли Ag2O (0,032 г, 0,138 ммоль) и йодметан (0,08 мл, 1,29 ммоль), и смесь перемешивали при комнатной температуре в течение 7 дней. После завершения реакции твердые вещества фильтровали через Целит, и фильтрат очищали колоночной хроматографией для получения этилового эфира 2-[1-[4-[6-[циклопропил(метокси)метил]-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты (0,015 г, 27%). Полученное соединение вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,012 г, 86%).
1H-ЯМР (CDCl3) δ 7,76 (1H, t), 2,52 (3H, m), 7,36 (1H, d), 3,81 (1H, d), 3,35 (3H, s), 3,32 (2H, m), 3,15 (2H, m), 2,36 (2H, d), 1,96 (1H, m), 1,85 (2H, m), 1,49 (2H, m), 1,20 (1H, m), 0,64 (1H, m), 0,50 (3H, m)
Пример 319: 2-[1-[2-хлор-4-[6-(циклобутокси)-2-пиридил]-6-фторфенил]-4-пиперидил]уксусная кислота

2-хлор-6-циклобутокси-пиридин (0,23 г, 1,25 ммоль), полученный в Примере Получения 29, и 2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (0,374 г, 1,37 ммоль), полученный в Примере Получения 225, вводили в реакцию таким же образом, как в Примере 307, с получением целевого соединения (0,01 г, 2%).
1H-ЯМР (CDCl3) δ 7,78 (1H, m), 7,60 (2H, m), 7,21 (1H, m), 6,63 (1H, m), 5,25 (1H, m), 3,23 (2H, m), 3,17 (2H, m), 2,53 (2H, m), 2,38 (2H, d), 2,19 (2H, m), 1,99 (1H, m) 1,88 (1H, m), 1,81 (2H, m), 1,74 (1H, m), 1,50 (2H, m)
Пример 320: 2-[1-[4-[6-(циклобутокси)-2-пиридил]-2-фторфенил]-4-пиперидил]уксусная кислота

2-хлор-6-циклобутокси-пиридин (0,034 г, 0,185 ммоль), полученный в Примере Получения 29, и этиловый эфир 2-[1-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,08 г, 0,2 ммоль), полученный в Примере Получения 99, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,009 г, 13%).
1H-ЯМР (CDCl3) δ 7,72 (2H, m), 7,58 (1H, m), 7,24 (1H, m), 7,00 (1H, m), 6,60 (1H, m), 5,27 (1H, m), 3,53 (2H, m), 2,76 (2H, m), 2,53 (2H, m), 2,38 (2H, m), 2,19 (2H, m), 1,98 (1H, m), 1,89 (3H, m), 1,74 (1H, m), 1,58 (2H, m)
Пример 321: 2-[1-[4-[6-(циклобутокси)-2-пиридил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота

2-хлор-6-циклобутокси-пиридин (0,057 г, 0,31 ммоль), полученный в Примере Получения 29, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,13 г, 0,34 ммоль), полученный в Примере Получения 88, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,018 г, 16%).
1H-ЯМР (CDCl3) δ 7,56 (1H, t), 7,45 (2H, m), 7,15 (1H, m), 6,56 (1H, m), 5,29 (1H, m), 4,42 (2H, m), 3,95 (2H, m), 3,05 (1H, m), 2,79 (2H, d), 2,51 (2H, m), 2,18 (2H, m), 1,86 (1H, m), 1,74 (1H, m)
Пример 322: 2-[1-[4-[6-(циклопропилметокси)-2-пиридил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота
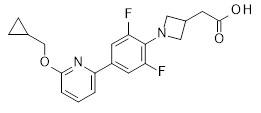
2-хлор-6-циклопропилметокси-пиридин (0,057 г, 0,31 ммоль), полученный в Примере Получения 43, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,13 г, 0,34 ммоль), полученный в Примере Получения 88, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,008 г, 7%).
1H-ЯМР (CDCl3) δ 7,57 (1H, t), 7,45 (2H, m), 7,15 (1H, m), 6,65 (1H, m), 4,43 (2H, m), 4,21 (2H, d), 3,94 (2H, m), 3,05 (1H, m), 2,79 (2H, d), 1,23 (1H, m), 0,63 (2H, m), 0,40 (2H, m)
Пример 323: 2-[1-[4-[4-(циклобутокси)-6-метил-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(циклобутокси)-6-метил-пиримидин(0,079 г, 0,4 ммоль), полученный в Примере Получения 228, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,165 г, 0,4 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,08 г, 48%).
1H-ЯМР (CDCl3) δ 7,87 (2H, m), 6,39 (1H, s), 5,31 (1H, m), 3,35 (2H, m), 3,17 (2H, m), 2,52 (2H, m), 2,45 (3H, s), 2,36 (2H, d), 2,18 (2H, m), 1,95 (1H, m), 1,90 (1H, m), 1,82 (2H, m), 1,75 (1H, m), 1,50 (2H, m)
Пример 324: 2-[1-[4-(6-бутокси-2-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
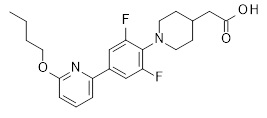
2-Бутокси-6-хлор-пиридин (0,075 г, 0,4 ммоль), полученный в Примере Получения 276, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,165 г, 0,4 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,06 г, 37%).
1H-ЯМР (CDCl3) δ 7,59 (1H, t), 7,51 (2H, m), 7,19 (1H, m), 6,65 (1H, m), 4,40 (2H, t), 3,32 (2H, m), 3,15 (2H, m), 2,37 (2H, d), 1,97 (1H, m), 1,81 (4H, m), 1,52 (4H, m), 0,99 (3H, t)
Пример 325: 2-[1-[4-[2-(циклобутокси)-6-метил-пиримидин-4-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

4-хлор-2-(циклобутокси)-6-метил-пиримидин (0,051 г, 0,25 ммоль), полученный в Примере Получения 229, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,116 г, 0,28 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,06 г, 57%).
1H-ЯМР (CDCl3) δ 7,57 (2H, m), 7,07 (1H, s), 5,27 (1H, m), 3,38 (2H, m), 3,16 (2H, m), 2,52 (2H, m), 2,48 (3H, s), 2,36 (2H, d), 2,24 (2H, m), 1,98 (1H, m), 1,86 (3H, m), 1,75 (1H, m), 1,47 (2H, m)
Пример 326: 2-[1-[4-[2-(циклобутокси)тиазол-4-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

4-бром-2-(циклобутокси)тиазол (0,062 г, 0,26 ммоль), полученный в Примере Получения 289, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,12 г, 0,29 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,04 г, 38%).
1H-ЯМР (MeOH-d4) δ 7,33 (2H, m), 7,12 (1H, s), 5,18 (1H, m), 3,21 (2H, m), 3,10 (2H, m), 2,51 (2H, m), 2,24 (4H, m), 1,87 (2H, m), 1,76 (3H, m), 1,41 (2H, m)
Пример 327: 2-[1-[4-[6-(циклобутокси)-4-метил-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-6-(циклобутокси)-4-метил-пиридин (0,06 г, 0,3 ммоль), полученный в Примере Получения 271, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,137 г, 0,33 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,038 г, 30%).
1H-ЯМР (CDCl3) δ 7,47 (2H, m), 7,03 (1H, s), 6,44 (1H, s), 5,23 (1H, m), 3,32 (2H, m), 3,14 (2H, m), 2,50 (2H, m), 2,36 (2H, d), 2,32 (3H, s), 2,17 (2H, m), 1,97 (1H, m), 1,84 (3H, m), 1,75 (1H, m), 1,49 (2H, m)
Пример 328: 2-[1-[4-[4-(циклобутокси)-6-метил-пиримидин-2-ил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота
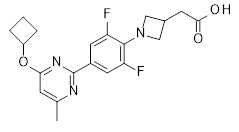
2-хлор-4-(циклобутокси)-6-метил-пиримидин (0,08 г, 0,4 ммоль), полученный в Примере Получения 228, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,17 г, 0,44 ммоль), полученный в Примере Получения 88, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,124 г, 80%).
1H-ЯМР (CDCl3) δ 7,82 (2H, m), 6,34 (1H, s), 5,28 (1H, m), 4,46 (2H, m), 3,98 (2H, m), 3,06 (1H, m), 2,79 (2H, d), 2,52 (2H, m), 2,43 (3H, s), 2,18 (2H, m), 1,87 (1H, m), 1,75 (1H, m)
Пример 329: 2-[1-[4-[6-(циклобутокси)пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-6-(циклобутокси)пиразин (0,07 г, 0,38 ммоль), полученный в Примере Получения 232, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,17 г, 0,42 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,12 г, 78%).
1H-ЯМР (CDCl3) δ 8,46 (1H, s), 8,08 (1H, s), 7,48 (2H, m), 5,26 (1H, m), 3,36 (2H, m), 3,17 (2H, m), 2,53 (2H, m), 2,37 (2H, d), 2,22 (2H, m), 1,99 (1H, m), 1,91 (1H, m), 1,84 (2H, m), 1,76 (1H, m), 1,50 (2H, m)
Пример 330: 2-[1-[4-[4-(циклобутокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
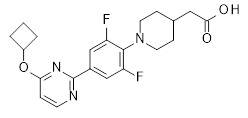
2-хлор-4-(циклобутокси)пиримидин (0,07 г, 0,38 ммоль), полученный в Примере Получения 230, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,17 г, 0,42 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,135 г, 88%).
1H-ЯМР (CDCl3) δ 8,45 (1H, d), 7,87 (2H, m), 6,54 (1H, d), 5,32 (1H, m), 3,37 (2H, m), 3,18 (2H, m), 2,54 (2H, m), 2,37 (2H, d), 2,20 (2H, m), 1,99 (1H, m), 1,89 (1H, m), 1,83 (2H, m), 1,77 (1H, m), 1,49 (2H, m)
Пример 331: 2-[1-[4-[4-(циклопропилметокси)-6-метил-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(циклопропилметокси)-6-метил-пиримидин (0,073 г, 0,367 ммоль), полученный в Примере Получения 227, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,165 г, 0,40 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,13 г, 85%).
1H-ЯМР (CDCl3) δ 7,88 (2H, m), 6,46 (1H, s), 4,27 (2H, d), 3,35 (2H, m), 3,16 (2H, m), 2,46 (3H, s), 2,36 (2H, d), 1,99 (1H, m), 1,82 (2H, m), 1,48 (2H, m), 1,31 (1H, m), 0,64 (2H, m), 0,40 (2H, m)
Пример 332: 2-[1-[4-[4-(циклопропилметокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(циклопропилметокси)пиримидин (0,07 г, 0,38 ммоль), полученный в Примере Получения 231, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,17 г, 0,42 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,12 г, 78%).
1H-ЯМР (CDCl3) δ 8,45 (1H, d), 7,87 (2H, m), 6,62 (1H, d), 4,30 (2H, d), 3,38 (2H, m), 3,18 (2H, m), 2,37 (2H, d), 1,99 (1H, m), 1,83 (2H, m), 1,50 (2H, m), 1,33 (1H, m), 0,66 (2H, m), 0,41 (2H, m)
Пример 333: 2-[1-[4-[6-(циклопропилметокси)пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
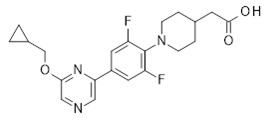
2-хлор-6-(циклопропилметокси)пиразин (0,07 г, 0,38 ммоль), полученный в Примере Получения 233, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,17 г, 0,42 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,13 г, 85%).
1H-ЯМР (CDCl3) δ 8,46 (1H, s), 8,15 (1H, s), 7,50 (2H, m), 4,25 (2H, d), 3,35 (2H, m), 3,16 (2H, m), 2,37 (2H, d), 1,99 (1H, m), 1,84 (2H, m), 1,51 (2H, m), 1,33 (1H, m), 0,66 (2H, m), 0,41 (2H, m)
Пример 334: 2-[1-[4-[6-(циклобутокси)пиразин-2-ил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота

2-хлор-6-(циклобутокси)пиразин (0,048 г, 0,26 ммоль), полученный в Примере Получения 232, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,10 г, 0,26 ммоль), полученный в Примере Получения 88, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,06 г, 61%).
1H-ЯМР (CDCl3) δ 8,41 (1H, s), 8,02 (1H, s), 7,44 (2H, m), 5,25 (1H, m), 4,46 (2H, m), 3,98 (2H, m), 3,07 (1H, m), 2,80 (2H, d), 2,52 (2H, m), 2,21 (2H, m), 1,90 (1H, m), 1,77 (1H, m)
Пример 335: 2-[1-[4-[6-(циклопропилметокси)пиразин-2-ил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота

2-хлор-6-(циклопропилметокси)пиразин (0,048 г, 0,26 ммоль), полученный в Примере Получения 233, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,10 г, 0,26 ммоль), полученный в Примере Получения 88, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,058 г, 59%).
1H-ЯМР (CDCl3) δ 8,41 (1H, s), 8,09 (1H, s), 7,45 (2H, m), 4,45 (2H, m), 4,24 (2H, d), 3,98 (2H, m), 3,06 (1H, m), 2,80 (2H, d), 1,33 (1H, m), 0,66 (2H, m), 0,40 (2H, m)
Пример 336: 2-[1-[4-[4-(циклобутокси)пиримидин-2-ил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота

2-хлор-4-(циклобутокси)пиримидин (0,048 г, 0,26 ммоль), полученный в Примере Получения 230, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,10 г, 0,26 ммоль), полученный в Примере Получения 88, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,024 г, 25%).
1H-ЯМР (CDCl3) δ 8,41 (1H, d), 7,81 (2H, m), 6,49 (1H, d), 5,31 (1H, m), 4,48 (2H, m), 3,99 (2H, m), 3,08 (1H, m), 2,79 (2H, d), 2,53 (2H, m), 2,20 (2H, m), 1,90 (1H, m), 1,78 (1H, m)
Пример 337: 2-[1-[4-[4-(циклопропилметокси)пиримидин-2-ил]-2,6-дифтор-фенил]азетидин-3-ил]уксусная кислота

2-хлор-4-(циклопропилметокси)пиримидин (0,048 г, 0,26 ммоль), полученный в Примере Получения 231, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]азетидин-3-ил]уксусной кислоты (0,10 г, 0,26 ммоль), полученный в Примере Получения 88, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,054 г, 55%).
1H-ЯМР (CDCl3) δ 8,41 (1H, d), 7,82 (2H, m), 6,56 (1H, d), 4,47 (2H, m), 4,28 (2H, d), 3,99 (2H, m), 3,07 (1H, m), 2,79 (2H, d), 1,32 (1H, m), 0,64 (2H, m), 0,40 (2H, m)
Пример 338: 2-[1-[4-(6-этоксипиразин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-6-этокси-пиразин (0,051 г, 0,32 ммоль), полученный в Примере Получения 302, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,144 г, 0,35 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,083 г, 69%).
1H-ЯМР (CDCl3) δ 8,46 (1H, s), 8,11 (1H, s), 7,51 (2H, m), 4,48 (2H, q), 3,35 (2H, m), 3,16 (2H, m), 2,37 (2H, d), 1,98 (1H, m), 1,83 (2H, m), 1,45 (5H, m)
Пример 339: 2-[1-[2,6-дифтор-4-(6-изопропоксипиразин-2-ил)фенил]-4-пиперидил]уксусная кислота

2-хлор-6-изопропокси-пиразин (0,055 г, 0,32 ммоль), полученный в Примере Получения 301, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,144 г, 0,35 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,108 г, 87%).
1H-ЯМР (CDCl3) δ 8,44 (1H, s), 8,06 (1H, s), 7,49 (2H, m), 5,43 (1H, m), 3,35 (2H, m), 3,16 (2H, m), 2,37 (2H, d), 1,99 (1H, m), 1,84 (2H, m), 1,51 (2H, m), 1,42 (6H, d)
Пример 340: 2-[1-[2,6-дифтор-4-(6-метоксипиразин-2-ил)фенил]-4-пиперидил]уксусная кислота
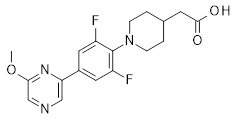
2-хлор-6-метокси-пиразин (0,044 г, 0,3 ммоль), полученный в Примере Получения 234, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,135 г, 0,33 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,053 г, 49%).
1H-ЯМР (CDCl3) δ 8,48 (1H, s), 8,14 (1H, s), 7,52 (2H, m), 4,05 (3H, s), 3,35 (2H, m), 3,17 (2H, m), 2,36 (2H, d), 1,99 (1H, m), 1,83 (2H, m), 1,50 (2H, m)
Пример 341: 2-[1-[2,6-дифтор-4-(6-пропоксипиразин-2-ил)фенил]-4-пиперидил]уксусная кислота

2-хлор-6-пропокси-пиразин (0,052 г, 0,3 ммоль), полученный в Примере Получения 235, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,135 г, 0,33 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,057 г, 51%).
1H-ЯМР (CDCl3) δ 8,46 (1H, s), 8,12 (1H, s), 7,50 (2H, m), 4,38 (2H, t), 3,35 (2H, m), 3,16 (2H, m), 2,37 (2H, d), 1,99 (1H, m), 1,86 (4H, m), 1,48 (2H, m), 1,06 (3H, t)
Пример 342: 2-[1-[2,6-дифтор-4-(6-изобутоксипиразин-2-ил)фенил]-4-пиперидил]уксусная кислота

2-хлор-6-изобутокси-пиразин (0,056 г, 0,3 ммоль), полученный в Примере Получения 237, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,135 г, 0,33 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,053 г, 44%).
1H-ЯМР (CDCl3) δ 8,45 (1H, s), 8,12 (1H, s), 7,49 (2H, m), 4,18 (2H, d), 3,35 (2H, m), 3,16 (2H, m), 2,37 (2H, d), 2,15 (1H, m), 1,99 (1H, m), 1,83 (2H, m), 1,50 (2H, m), 1,06 (6H, d)
Пример 343: 2-[1-[4-(6-бутоксипиразин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
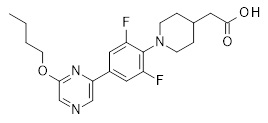
2-Бутокси-6-хлор-пиразин (0,056 г, 0,3 ммоль), полученный в Примере Получения 236, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,135 г, 0,33 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,044 г, 36%).
1H-ЯМР (CDCl3) δ 8,45 (1H, s), 8,10 (1H, s), 7,50 (2H, m), 4,41 (2H, t), 3,33 (2H, m), 3,15 (2H, m), 2,36 (2H, d), 1,98 (1H, m), 1,80 (4H, m), 1,49 (4H, m), 1,00 (3H, t)
Пример 344: 2-[1-[4-[6-(циклопентокси)пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
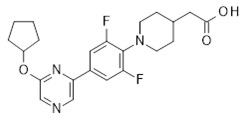
2-хлор-6-(циклопентокси)пиразин (0,06 г, 0,3 ммоль), полученный в Примере Получения 238, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,135 г, 0,33 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,061 г, 49%).
1H-ЯМР (CDCl3) δ 8,43 (1H, s), 8,06 (1H, s), 7,50 (2H, m), 5,50 (1H, m), 3,34 (2H, m), 3,16 (2H, m), 2,37 (2H, d), 2,02 (2H, m), 1,99 (1H, m), 1,82 (6H, m), 1,67 (2H, m), 1,50 (2H, m)
Пример 345: 2-[1-[4-(4-этоксипиримидин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
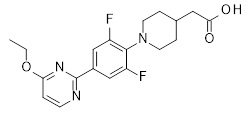
2-хлор-4-этокси-пиримидин (0,049 г, 0,31 ммоль), полученный в Примере Получения 239, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,156 г, 0,38 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,074 г, 64%).
1H-ЯМР (CDCl3) δ 8,44 (1H, d), 7,87 (2H, m), 6,57 (1H, d), 4,52 (2H, q), 3,37 (2H, m), 3,16 (2H, m), 2,36 (2H, d), 1,98 (1H, m), 1,82 (2H, m), 1,48 (2H, m), 1,45 (3H, t)
Пример 346: 2-[1-[2,6-дифтор-4-(4-изопропоксипиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота
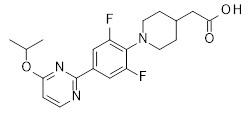
2-хлор-4-изопропокси-пиримидин (0,059 г, 0,34 ммоль), полученный в Примере Получения 240, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,156 г, 0,38 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,089 г, 67%).
1H-ЯМР (CDCl3) δ 8,43 (1H, d), 7,86 (2H, m), 6,53 (1H, d), 5,52 (1H, m), 3,37 (2H, m), 3,17 (2H, m), 2,36 (2H, d), 1,98 (1H, m), 1,83 (2H, m), 1,48 (2H, m), 1,41 (6H, d)
Пример 347: 2-[1-[2,6-дифтор-4-(4-пропоксипиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота

2-хлор-4-пропокси-пиримидин (0,055 г, 0,32 ммоль), полученный в Примере Получения 241, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,156 г, 0,38 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,079 г, 63%).
1H-ЯМР (CDCl3) δ 8,45 (1H, d), 7,88 (2H, m), 6,58 (1H, d), 4,42 (2H, t), 3,37 (2H, m), 3,16 (2H, m), 2,36 (2H, d), 1,98 (1H, m), 1,83 (4H, m), 1,48 (2H, m), 1,06 (3H, t)
Пример 348: 2-[1-[2,6-дифтор-4-(4-изобутоксипиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота

2-хлор-4-изобутокси-пиримидин (0,059 г, 0,31 ммоль), полученный в Примере Получения 242, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,156 г, 0,38 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,066 г, 52%).
1H-ЯМР (CDCl3) δ 8,44 (1H, d), 7,88 (2H, m), 6,59 (1H, d), 4,23 (2H, d), 3,37 (2H, m), 3,18 (2H, m), 2,37 (2H, d), 2,15 (1H, m), 1,99 (1H, m), 1,83 (2H, m), 1,48 (2H, m), 1,04 (6H, d)
Пример 349: 2-[1-[4-(4-этокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-4-этокси-6-метил-пиримидин (0,056 г, 0,32 ммоль), полученный в Примере Получения 243, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,148 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,085 г, 67%).
1H-ЯМР (CDCl3) δ7,89 (2H, m), 6,42 (1H, s), 4,50 (2H, q), 3,36 (2H, m), 3,16 (2H, m), 2,46 (3H, s), 2,36 (2H, d), 1,98 (1H, m), 1,82 (2H, m), 1,48 (2H, m), 1,42 (3H, t)
Пример 350: 2-[1-[2,6-дифтор-4-(4-изопропокси-6-метил-пиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота
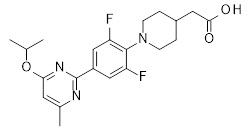
2-хлор-4-изопропокси-6-метил-пиримидин (0,06 г, 0,32 ммоль), полученный в Примере Получения 244, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,148 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,09 г, 69%).
1H-ЯМР (CDCl3) δ 7,88 (2H, m), 6,38 (1H, s), 5,50 (1H, m), 3,36 (2H, m), 3,16 (2H, m), 2,45 (3H, s), 2,36 (2H, d), 1,98 (1H, m), 1,82 (2H, m), 1,49 (2H, m), 1,39 (6H, d)
Пример 351: 2-[1-[2,6-дифтор-4-(4-метил-6-пропокси-пиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота
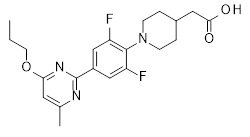
2-хлор-4-метил-6-пропокси-пиримидин (0,061 г, 0,32 ммоль), полученный в Примере Получения 245, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,147 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,085 г, 66%).
1H-ЯМР (CDCl3) δ 7,88 (2H, m), 6,42 (1H, s), 4,39 (2H, t), 3,36 (2H, m), 3,15 (2H, m), 2,45 (3H, s), 2,36 (2H, d), 1,98 (1H, m), 1,81 (4H, m), 1,48 (2H, m), 1,03 (3H, t)
Пример 352: 2-[1-[2,6-дифтор-4-(4-изобутокси-6-метил-пиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота

2-хлор-4-изобутокси-6-метил-пиримидин (0,058 г, 0,29 ммоль), полученный в Примере Получения 246, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,149 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,079 г, 65%).
1H-ЯМР (CDCl3) δ 7,88 (2H, m), 6,44 (1H, s), 4,21 (2H, d), 3,36 (2H, m), 3,16 (2H, m), 2,46 (3H, s), 2,36 (2H, d), 2,11 (1H, m), 1,98 (1H, m), 1,82 (2H, m), 1,48 (2H, m), 1,03 (6H, d)
Пример 353: 2-[1-[2,6-дифтор-4-(6-пирролидин-1-илпиразин-2-ил)фенил]-4-пиперидил]уксусная кислота

2-хлор-6-пирролидин-1-ил-пиразин (0,061 г, 0,33 ммоль), полученный в Примере Получения 249, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,098 г, 74%).
1H-ЯМР (CDCl3) δ 8,12 (1H, s), 7,77 (1H, s), 7,52 (2H, m), 3,56 (4H, m), 3,32 (2H, m), 3,15 (2H, m), 2,32 (2H, d), 2,05 (4H, m), 1,96 (1H, m), 1,82 (2H, m), 1,47 (2H, m)
Пример 354: 2-[1-[2,6-дифтор-4-[6-(изопропиламино)пиразин-2-ил]фенил]-4-пиперидил]уксусная кислота
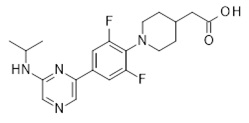
6-хлор-N-изопропил-пиразин-2-амин (0,057 г, 0,33 ммоль), полученный в Примере Получения 250, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,051 г, 40%).
1H-ЯМР (CDCl3) δ 8,11 (1H, s), 7,75 (1H, s), 7,46 (2H, m), 4,72 (1H, ушир.), 4,12 (1H, m), 3,33 (2H, m), 3,15 (2H, m), 2,32 (2H, d), 1,96 (1H, m), 1,83 (2H, m), 1,48 (2H, m), 1,29 (6H, d)
Пример 355: 2-[1-[4-[6-(диэтиламино)пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

6-хлор-N,N-диэтил-пиразин-2-амин (0,055 г, 0,3 ммоль), полученный в Примере Получения 253, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,17 г, 0,41 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,1 г, 82%).
1H-ЯМР (CDCl3) δ 8,11 (1H, s), 7,89 (1H, s), 7,48 (2H, m), 3,60 (4H, q), 3,33 (2H, m), 3,16 (2H, m), 2,36 (2H, d), 1,99 (1H, m), 1,83 (2H, m), 1,50 (2H, m), 1,25 (6H, t)
Пример 356: 2-[1-[2,6-дифтор-4-[6-(изобутиламино)пиразин-2-ил]фенил]-4-пиперидил]уксусная кислота

6-хлор-N-изобутил-пиразин-2-амин (0,052 г, 0,28 ммоль), полученный в Примере Получения 251, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,08 г, 72%).
1H-ЯМР (CDCl3) δ 8,15 (1H, s), 7,80 (1H, s), 7,45 (2H, m), 4,75 (1H, m), 3,32 (2H, m), 3,25 (2H, t), 3,15 (2H, m), 2,36 (2H, d), 1,95 (2H, m), 1,83 (2H, m), 1,48 (2H, m), 1,02 (6H, d)
Пример 357: 2-[1-[4-[6-(циклопентиламино)пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

6-хлор-N-циклопентил-пиразин-2-амин (0,056 г, 0,28 ммоль), полученный в Примере Получения 252, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,085 г, 72%).
1H-ЯМР (CDCl3) δ 8,15 (1H, s), 7,79 (1H, s), 7,47 (2H, m), 4,71 (1H, ушир.), 4,17 (1H, m), 3,32 (2H, m), 3,15 (2H, m), 2,36 (2H, d), 2,12 (2H, m), 1,97 (1H, m), 1,82~1,46 (10H, m)
Пример 358: 2-[1-[4-[6-(циклопентиламино)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

6-хлор-N-циклопентил-пиридин-2-амин (0,065 г, 0,33 ммоль) и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,149 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,048 г, 34%).
1H-ЯМР (CDCl3) δ 7,49 (1H, t), 7,34 (2H, m), 6,82 (1H, d), 6,37 (1H, d), 3,95 (1H, m), 3,28 (2H, m), 3,13 (2H, m), 2,31 (2H, d), 2,05 (2H, m), 1,93 (1H, m), 1,79 (4H, m), 1,64 (2H, m), 1,57 (2H, m), 1,45 (2H, m)
Пример 359: 2-[1-[4-[6-(диметиламино)пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

6-хлор-N,N-диметил-пиразин-2-амин (0,053 г, 0,33 ммоль), полученный в Примере Получения 254, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,19 г, 0,47 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,06 г, 47%).
1H-ЯМР (CDCl3+MeOH-d4) δ 8,13 (1H, m), 7,91 (1H, m), 7,51 (2H, m), 3,32 (2H, m), 3,19 (6H, s), 3,15 (2H, m), 2,31 (2H, d), 1,96 (1H, m), 1,82 (2H, m), 1,48 (2H, m)
Пример 360: 2-[1-[2,6-дифтор-4-[4-(изобутиламино)пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота
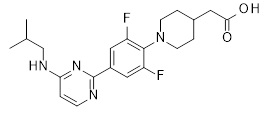
2-хлор-N-изобутил-пиримидин-4-амин (0,054 г, 0,29 ммоль), полученный в Примере Получения 255, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,166 г, 0,4 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,035 г, 35%).
1H-ЯМР (CDCl3) δ 8,24 (1H, m), 7,80 (2H, m), 6,21 (1H, d), 3,35 (2H, m), 3,15 (4H, m), 2,35 (2H, d), 1,94 (2H, m), 1,82 (2H, m), 1,48 (2H, m), 1,00 (6H, d)
Пример 361: 2-[1-[4-[6-(циклобутокси)-5-метил-пиразин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

5-хлор-3-(циклобутокси)-2-метил-пиразин (0,061 г, 0,3 ммоль), полученный в Примере Получения 256, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,064 г, 48%).
1H-ЯМР (CDCl3) δ 8,33 (1H, s), 7,46 (2H, m), 5,27 (1H, m), 3,31 (2H, m), 3,16 (2H, m), 2,53 (2H, m), 2,49 (3H, s), 2,37 (2H, d), 2,23 (2H, m), 1,99 (1H, m), 1,81 (4H, m), 1,48 (2H, m)
Пример 362: 2-[1-[2,6-дифтор-4-(6-фенилпиразин-2-ил)фенил]-4-пиперидил]уксусная кислота
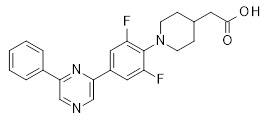
2-хлор-6-фенил-пиразин (0,058 г, 0,3 ммоль) и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,12 г, 98%).
1H-ЯМР (CDCl3) δ 8,95 (1H, s), 8,86 (1H, s), 8,13 (2H, m), 7,66 (2H, m), 7,54 (3H, m), 3,37 (2H, m), 3,19 (2H, m), 2,38 (2H, d), 1,99 (1H, m), 1,82 (2H, m), 1,48 (2H, m)
Пример 363: 2-[1-[4-(6-циклопентилпиразин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-6-циклопентил-пиразин (0,058 г, 0,32 ммоль), полученный в Примере Получения 258, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,155 г, 0,38 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,087 г, 66%).
1H-ЯМР (CDCl3) δ 8,71 (1H, s), 8,37 (1H, s), 7,55 (2H, m), 3,35 (2H, m), 3,26 (1H, m), 3,17 (2H, m), 2,37 (2H, d), 2,10 (2H, m), 1,99 (1H, m), 1,88 (6H, m), 1,74 (2H, m), 1,49 (2H, m)
Пример 364: 2-[1-[2,6-дифтор-4-(6-изобутилпиразин-2-ил)фенил]-4-пиперидил]уксусная кислота

2-хлор-6-изобутил-пиразин (0,055 г, 0,32 ммоль), полученный в Примере Получения 257, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,158 г, 0,38 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,10 г, 80%).
1H-ЯМР (CDCl3) δ 8,73 (1H, s), 8,31 (1H, s), 7,54 (2H, m), 3,35 (2H, m), 3,17 (2H, m), 2,71 (2H, d), 2,37 (2H, d), 2,20 (1H, m), 1,99 (1H, m), 1,83 (2H, m), 1,48 (2H, m), 0,98 (6H, d)
Пример 365: 2-[1-[2,6-дифтор-4-(4-изобутилпиримидин-2-ил)фенил]-4-пиперидил]уксусная кислота

2-хлор-4-изобутил-пиримидин (0,055 г, 0,32 ммоль), полученный в Примере Получения 259, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,158 г, 0,38 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,102 г, 82%).
1H-ЯМР (CDCl3) δ 8,60 (1H, d), 7,94 (2H, m), 6,97 (1H, d), 3,37 (2H, m), 3,17 (2H, m), 2,65 (2H, d), 2,37 (2H, d), 2,22 (1H, m), 1,98 (1H, m), 1,83 (2H, m), 1,49 (2H, m), 0,97 (6H, d)
Пример 366: 2-[1-[4-[5-(циклобутокси)-3-метил-изотиазол-4-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

4-бром-5-(циклобутокси)-3-метил-изотиазол (0,046 г, 0,19 ммоль), полученный в Примере Получения 292, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,091 г, 0,22 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,05 г, 62%).
1H-ЯМР (CDCl3) δ 6,83 (2H, m), 4,60 (1H, m), 3,30 (2H, m), 3,15 (2H, m), 2,47 (2H, m), 2,37 (5H, m), 2,24 (2H, m), 1,97 (1H, m), 1,84 (3H, m), 1,67 (1H, m), 1,48 (2H, m)
Пример 367: {1-[4-(4-этокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота
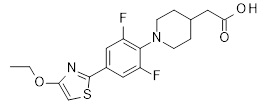
Стадия A: этиловый эфир {1-[4-(4-этокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусной кислоты
Этиловый эфир [1-(2,6-дифтор-4-тиокарбамоил-фенил)-пиперидин-4-ил]уксусной кислоты (0,160 г, 0,47 ммоль), полученный в Примере Получения 224, и этиловый эфир хлоруксусной кислоты (0,115 г, 0,93 ммоль) растворяли в EtOH и перемешивали в течение 5 часов при нагревании с обратным холодильником. Реакционный раствор охлаждали до комнатной температуры, концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (0,061 г, 32%).
1H-ЯМР (CDCl3) δ 7,42 (2H, m), 6,07 (1H, s), 4,24~4,15 (4H, m), 3,35 (2H, m), 3,16 (2H, m), 2,32 (2H, d), 1,99 (1H, m), 1,80 (2H, m), 1,49 (3H, t), 1,43 (2H, m), 1,30 (3H, t)
Стадия B: {1-[4-(4-этокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота
Этиловый эфир {1-[4-(4-Этокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусной кислоты (0,061 г, 0,15 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,046 г, 81%).
1H-ЯМР (CDCl3) δ 7,43 (2H, m), 6,09 (1H, s), 4,22 (2H, q), 3,37 (2H, m), 3,18 (2H, m), 2,40 (2H, d), 2,01 (1H, m), 1,86 (2H, m), 1,52~1,47 (5H, m)
Пример 368: {1-[4-(4-этокси-5-метил-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота

Стадия A: этиловый эфир {1-[4-(4-этокси-5-метил-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусной кислоты
Этиловый эфир [1-(2,6-дифтор-4-тиокарбамоил-фенил)-пиперидин-4-ил]уксусной кислоты (0,089 г, 0,26 ммоль), полученный в Примере Получения 224, и этиловый эфир 2-бромпропановой кислоты (0,095 г, 0,52 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 367, с получением целевого соединения (0,059 г, 53%).
1H-ЯМР (CDCl3) δ 7,33 (2H, m), 4,41 (2H, q), 4,19 (2H, q), 3,33 (2H, m), 3,15 (2H, m), 2,32 (2H, d), 2,31 (3H, s), 1,99 (1H, m), 1,80 (2H, m), 1,49 (2H, m), 1,39 (3H, t), 1,29 (3H, t)
Стадия B: {1-[4-(4-этокси-5-метил-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота
Этиловый эфир {1-[4-(4-Этокси-5-метил-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусной кислоты (0,059 г, 0,14 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,045 г, 82%).
1H-ЯМР (CDCl3) δ 7,35 (2H, m), 4,41 (2H, q), 3,34 (2H, m), 3,17 (2H, m), 2,40 (2H, d), 2,32 (3H, s), 2,01 (1H, m), 1,86 (2H, m), 1,52 (2H, m), 1,42 (3H, t)
Пример 369: 2-[1-[4-(6-бутилпиразин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-Бутил-6-хлор-пиразин (0,06 г, 0,35 ммоль), полученный в Примере Получения 260, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,158 г, 0,39 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,11 г, 81%).
1H-ЯМР (CDCl3) δ 8,72 (1H, s), 8,35 (1H, s), 7,55 (2H, m), 3,34 (2H, m), 3,16 (2H, m), 2,84 (2H, t), 2,37 (2H, d), 2,00 (1H, m), 1,80 (4H, m), 1,44 (4H, m), 0,97 (3H, t)
Пример 370: 2-[1-[2,6-дифтор-4-(6-изопентилпиразин-2-ил)фенил]-4-пиперидил]уксусная кислота

2-хлор-6-изопентил-пиразин (0,06 г, 0,32 ммоль), полученный в Примере Получения 261, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,146 г, 0,36 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,11 г, 88%).
1H-ЯМР (CDCl3) δ 8,72 (1H, s), 8,35 (1H, s), 7,54 (2H, m), 3,35 (2H, m), 3,17 (2H, m), 2,85 (2H, m), 2,37 (2H, d), 2,00 (1H, m), 1,83 (2H, m), 1,68 (3H, m), 1,52 (2H, m), 0,98 (6H, d)
Пример 371: 2-[1-[4-[4-(циклобутокси)-5-фтор-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(циклобутокси)-5-фтор-пиримидин (0,05 г, 0,25 ммоль), полученный в Примере Получения 329, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,11 г, 0,27 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,072 г, 69%).
1H-ЯМР (CDCl3) δ 8,31 (1H, m), 7,78 (2H, m), 5,40 (1H, m), 3,37 (2H, m), 3,16 (2H, m), 2,55 (2H, m), 2,37 (2H, d), 2,23 (2H, m), 1,95 (2H, m), 1,83 (3H, m), 1,49 (2H, m)
Пример 372: 2-[1-[4-[4-(циклопропилметокси)-5-фтор-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(циклопропилметокси)-5-фтор-пиримидин (0,05 г, 0,25 ммоль), полученный в Примере Получения 330, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,11 г, 0,27 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,08 г, 77%).
1H-ЯМР (CDCl3) δ 8,32 (1H, m), 7,79 (2H, m), 4,39 (2H, d), 3,36 (2H, m), 3,16 (2H, m), 2,36 (2H, d), 1,99 (1H, m), 1,82 (2H, m), 1,48 (2H, m), 1,39 (1H, m), 0,68 (2H, m), 0,44 (2H, m)
Пример 373: 2-[1-[4-(6-циклобутил-2-пиридил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-6-циклобутил-пиридин (0,05 г, 0,3 ммоль), полученный в Примере Получения 277, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,134 г, 0,33 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,093 г, 80%).
1H-ЯМР (CDCl3) δ 7,63 (1H, t), 7,56 (2H, m), 7,42 (1H, d), 7,08 (1H, d), 3,70 (1H, m), 3,31 (2H, m), 3,16 (2H, m), 2,36 (6H, m), 2,09 (1H, m), 1,97 (2H, m), 1,82 (2H, m), 1,51 (2H, m)
Пример 374: 2-[1-[4-(6-циклобутилпиразин-2-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
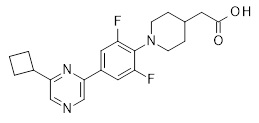
2-хлор-6-циклобутил-пиразин (0,05 г, 0,3 ммоль), полученный в Примере Получения 262, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,134 г, 0,33 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,042 г, 36%).
1H-ЯМР (CDCl3) δ 8,72 (1H, s), 8,33 (1H, s), 7,59 (2H, m), 3,74 (1H, m), 3,35 (2H, m), 3,17 (2H, m), 2,38 (6H, m), 2,11 (1H, m), 1,99 (2H, m), 1,84 (2H, m), 1,48 (2H, m)
Пример 375: 2-[1-[4-[6-(циклобутилметил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-бром-6-(циклобутилиденметил)пиридин (0,074 г, 0,33 ммоль), полученный в Примере Получения 278, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,150 г, 0,366 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96, для получения этилового эфира 2-[1-[4-[6-(циклобутилиденметил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты (0,128 г, 0,3 ммоль). Добавляли 3 мл MeOH и каталитическое количество Pd/C, и смесь перемешивали в течение 150 минут в атмосфере водорода. Твердые вещества фильтровали через Целит для получения этилового эфира 2-[1-[4-[6-(циклобутилметил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты. Полученное соединение вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,108 г, 89%).
1H-ЯМР (CDCl3) δ 7,61 (1H, t), 7,51 (2H, m), 7,41 (1H, d), 7,02 (1H, d), 3,31 (2H, m), 3,16 (2H, m), 2,93 (2H, d), 2,79 (1H, m), 2,37 (2H, d), 2,10 (2H, m), 1,98 (1H, m), 1,87 (2H, m), 1,81 (4H, m), 1,48 (2H, m)
Пример 376: 2-[1-[4-[6-(циклопентилметил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-бром-6-(циклопентилиденметил)пиридин (0,080 г, 0,33 ммоль), полученный в Примере Получения 279, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,150 г, 0,366 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96, для получения этилового эфира 2-[1-[4-[6-(циклопентилиденметил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты (0,128 г, 0,29 ммоль). Добавляли 3 мл MeOH и каталитическое количество Pd/C, и смесь перемешивали в течение 150 минут в атмосфере водорода. Твердые вещества фильтровали через Целит для получения этилового эфира 2-[1-[4-[6-(циклопентилметил)-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусной кислоты. Полученное соединение вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,106, 88%).
1H-ЯМР (CDCl3) δ 7,61 (1H, t), 7,50 (2H, m), 7,41 (1H, d), 7,05 (1H, d), 3,30 (2H, m), 3,15 (2H, m), 2,83 (2H, d), 2,36 (2H, d), 2,32 (1H, m), 1,97 (1H, m), 1,82 (2H, m), 1,74 (2H, m), 1,65 (2H, m), 1,54 (2H, m), 1,48 (2H, m), 1,26 (2H, m)
Пример 377: {1-[4-(4-циклопропилметокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота

Стадия A: этиловый эфир {1-[4-(4-циклопропилметокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусной кислоты
Этиловый эфир [1-(2,6-дифтор-4-тиокарбамоил-фенил)-пиперидин-4-ил]уксусной кислоты (0,137 г, 0,40 ммоль), полученный в Примере Получения 224, и циклопропилметиловый эфир хлоруксусной кислоты (0,119 г, 0,80 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 367, с получением целевого соединения (0,090 г, 52%).
1H-ЯМР (CDCl3) δ 7,44 (2H, m), 6,08 (1H, s), 4,18 (2H, q), 3,98 (2H, d), 3,35 (2H, m), 3,16 (2H, m), 2,32 (2H, d), 1,99 (1H, m), 1,80 (2H, m), 1,47 (2H, m), 1,35 (1H, m), 1,31 (3H, t), 0,69 (2H, m), 0,41 (2H, m)
Стадия B: {1-[4-(4-циклопропилметокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота
Этиловый эфир {1-[4-(4-циклопропилметокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусной кислоты (0,090 г, 0,21 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,071 г, 83%).
1H-ЯМР (CDCl3) δ 7,45 (2H, m), 6,09 (1H, s), 4,02 (2H, d), 3,37 (2H, m), 3,18 (2H, m), 2,40 (2H, d), 2,01 (1H, m), 1,86 (2H, m), 1,52 (2H, m), 1,37 (1H, m), 0,69 (2H, m), 0,42 (2H, m)
Пример 378: (1-{2,6-дифтор-4-[4-(4-фторфенил)-тиазол-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота
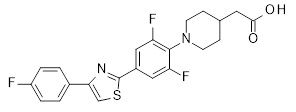
Стадия A: этиловый эфир (1-{2,6-дифтор-4-[4-(4-фторфенил)-тиазол-2-ил]-фенил}-пиперидин-4-ил)-уксусной кислоты
Этиловый эфир [1-(2,6-дифтор-4-тиокарбамоил-фенил)-пиперидин-4-ил]уксусной кислоты (0,123 г, 0,36 ммоль), полученный в Примере Получения 224, и 2-хлор-1-(4-фторфенил)-этанон (0,052 г, 0,30 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 367, с получением целевого соединения (0,107 г, 77%).
1H-ЯМР (CDCl3) δ 7,97 (2H, m), 7,52 (2H, m), 7,42 (1H, s), 7,17 (2H, m), 4,20 (2H, q), 3,39 (2H, m), 3,19 (2H, m), 2,34 (2H, d), 2,02 (1H, m), 1,83 (2H, m), 1,50 (2H, m), 1,32 (3H, t)
Стадия B: (1-{2,6-дифтор-4-[4-(4-фторфенил)-тиазол-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота
Этиловый эфир (1-{2,6-дифтор-4-[4-(4-фторфенил)-тиазол-2-ил]-фенил}-пиперидин-4-ил)-уксусной кислоты (0,107 г, 0,23 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,063 г, 63%).
1H-ЯМР (DMSO-d6) δ 8,19 (1H, s), 8,11 (2H, m), 7,67 (2H, m), 7,32 (2H, t), 3,34 (2H, m), 3,10 (2H, m), 2,23 (2H, d), 1,85 (1H, m), 1,76 (2H, m), 1,34 (2H, m)
Пример 379: {1-[4-(4-циклобутокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота

Стадия A: этиловый эфир {1-[4-(4-циклобутокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусной кислоты
Этиловый эфир [1-(2,6-дифтор-4-тиокарбамоил-фенил)-пиперидин-4-ил]уксусной кислоты (0,103 г, 0,30 ммоль), полученный в Примере Получения 224, и циклобутиловый эфир хлоруксусной кислоты (0,09 г, 0,60 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 367, с получением целевого соединения (0,072 г, 55%).
1H-ЯМР (CDCl3) δ 7,42 (2H, m), 5,99 (1H, s), 4,80 (1H, m), 4,18 (2H, q), 3,36 (2H, m), 3,16 (2H, m), 2,50 (2H, m), 2,32 (2H, d), 2,29 (2H, m), 1,96~1,45 (5H, m), 1,47 (2H, m), 1,31 (3H, t)
Стадия B: {1-[4-(4-циклобутокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота
Этиловый эфир {1-[4-(4-циклобутокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусной кислоты (0,090 г, 0,21 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,071 г, 83%).
1H-ЯМР (CDCl3) δ 7,45 (2H, m), 6,00 (1H, s), 4,80 (1H, m), 3,37 (2H, m), 3,18 (2H, m), 2,50 (2H, m), 2,40 (2H, d), 2,29 (2H, m), 1,94~1,84 (4H, m), 1,73 (1H, m), 1,51 (2H, m)
Пример 380: {1-[4-(4-бутокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота

Стадия A: этиловый эфир {1-[4-(4-бутокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусной кислоты
Этиловый эфир [1-(2,6-дифтор-4-тиокарбамоил-фенил)-пиперидин-4-ил]уксусной кислоты (0,103 г, 0,30 ммоль), полученный в Примере Получения 224, и бутиловый эфир хлоруксусной кислоты (0,091 г, 0,60 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 367, с получением целевого соединения (0,061 г, 46%).
1H-ЯМР (CDCl3) δ 7,42 (2H, m), 6,07 (1H, s), 4,32 (2H, t), 4,19 (2H, q), 3,42 (2H, m), 3,16 (2H, m), 2,32 (2H, d), 2,03 (1H, m), 1,86~1,78 (4H, m), 1,56~1,42 (4H, m), 1,30 (3H, t), 1,01 (3H, t)
Стадия B: {1-[4-(4-бутокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусная кислота
Этиловый эфир {1-[4-(4-Бутокси-тиазол-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}уксусной кислоты (0,061 г, 0,14 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,044 г, 77%).
1H-ЯМР (CDCl3) δ 7,45 (2H, m), 6,08 (1H, s), 4,15 (2H, t), 3,37 (2H, m), 3,18 (2H, m), 2,40 (2H, d), 2,01 (1H, m), 1,87~1,82 (4H, m), 1,61~1,47 (4H, m), 1,02 (3H, t)
Пример 381: 2-(1-{2,6-дифтор-4-[7-(пропан-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил]фенил}пиперидин-4-ил) уксусная кислота
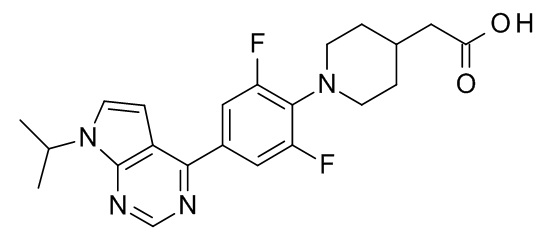
Стадия A: этиловый эфир 2-(1-{2,6-дифтор-4-[7-(пропан-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил]фенил}пиперидин-4-ил)уксусной кислоты
4-хлор-7H-пирроло[2,3-d]пиримидин (0,097 г, 0,63 ммоль) и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,284 г, 0,69 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96, для получения этилового эфира 2-[1-[2,6-дифтор-4-(7H-пирроло[2,3-d]пиримидин-4-ил)фенил]-4-пиперидил]уксусной кислоты. Полученное соединение растворяли в 1,6 мл CH3CN. Добавляли Cs2CO3 (0,244 г, 0,75 ммоль) и 2-йодпропан (0,075 мл, 0,75 ммоль), и смесь перемешивали в течение 1 часа при нагревании с обратным холодильником. Реакционный раствор очищали колоночной хроматографией с получением целевого соединения (0,16 г, 58%).
1H-ЯМР (CDCl3) δ 8,90 (1H, s), 7,66 (2H, m), 7,38 (1H, m), 6,80 (1H, m), 5,20 (1H, m), 4,15 (2H, m), 3,38 (2H, m), 3,18 (2H, m), 2,30 (2H, d), 1,98 (1H, m), 1,79 (2H, m), 1,55 (6H, d), 1,47 (2H, m), 1,28 (3H, t)
Стадия B: 2-(1-{2,6-дифтор-4-[7-(пропан-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил]фенил}пиперидин-4-ил)уксусная кислота
Этиловый эфир 2-(1-{2,6-дифтор-4-[7-(пропан-2-ил)-7H-пирроло[2,3-d]пиримидин-4-ил]фенил}пиперидин-4-ил)уксусной кислоты (0,16 г, 0,36 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,135 г, 95%).
1H-ЯМР (CDCl3) δ 8,90 (1H, s), 7,65 (2H, m), 7,40 (1H, m), 6,81 (1H, m), 5,19 (1H, m), 3,39 (2H, m), 3,19 (2H, m), 2,34 (2H, d), 1,99 (1H, m), 1,83 (2H, m), 1,56 (6H, d), 1,51 (2H, m)
Пример 382: 2-[1-[4-(6,7-дигидро-5H-циклопента[d]пиримидин-4-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

4-хлор-6,7-дигидро-5H-циклопента[d]пиримидин (0,052 г, 0,33 ммоль), полученный в Примере Получения 263, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,366 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,016 г, 12%).
1H-ЯМР (CDCl3) δ 9,00 (1H, s), 7,48 (2H, m), 3,39 (2H, m), 3,21 (2H, t), 3,17 (2H, m), 3,07 (2H, t), 2,36 (2H, d), 2,18 (2H, m), 1,99 (1H, m), 1,84 (2H, m), 1,48 (2H, m)
Пример 383: 2-[1-[4-[4-(циклобутокси)-6,7-дигидро-5H-циклопента[d]пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(циклобутокси)-6,7-дигидро-5H-циклопента[d]пиримидин (0,052 г, 0,33 ммоль), полученный в Примере Получения 264, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,366 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,12 г, 82%).
1H-ЯМР (CDCl3) δ 7,84 (2H, m), 5,35 (1H, m), 3,34 (2H, m), 3,15 (2H, m), 2,97 (2H, t), 2,85 (2H, t), 2,53 (2H, m), 2,35 (2H, d), 2,19 (2H, m), 2,12 (2H, m), 1,97 (1H, m), 1,87 (1H, m), 1,81 (2H, m), 1,75 (1H, m), 1,47 (2H, m)
Пример 384: 2-[1-[4-[4-(циклобутокси)-5,6-диметил-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
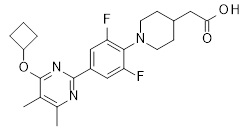
2-хлор-4-(циклобутокси)-5,6-диметил-пиримидин (0,052 г, 0,33 ммоль), полученный в Примере Получения 265, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,366 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,105 г, 74%).
1H-ЯМР (CDCl3) δ 7,84 (2H, m), 5,31 (1H, m), 3,33 (2H, m), 3,16 (2H, m), 2,54 (2H, m), 2,45 (3H, s), 2,36 (2H, d), 2,18 (2H, m), 2,13 (3H, s), 1,97 (1H, m), 1,87 (1H, m), 1,82 (2H, m), 1,77 (1H, m), 1,49 (2H, m)
Пример 385: 4-[2-хлор-4-[6-(циклобутокси)-2-пиридил]-6-фторфенокси]бутановая кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,255 г, 0,66 ммоль), полученный в Примере Получения 221, и 2-хлор-6-циклобутокси-пиридин (0,11 г, 0,60 ммоль), полученный в Примере Получения 29, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,136 г, 60%).
1H-ЯМР (CDCl3) δ 7,79 (1H, m), 7,70 (1H, m), 7,61 (1H, t), 7,22 (1H, m), 6,65 (1H, d), 5,25 (1H, m), 4,21 (2H, t), 2,72 (2H, t), 2,53 (2H, m), 2,18 (4H, m), 1,87 (1H, m), 1,76 (1H, m)
Пример 386: 4-[2,6-дихлор-4-[6-(циклобутокси)-2-пиридил]фенокси]бутановая кислота

Этиловый эфир 4-[2,6-дихлор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,222 г, 0,55 ммоль), полученный в Примере Получения 222, и 2-хлор-6-циклобутокси-пиридин (0,092 г, 0,50 ммоль), полученный в Примере Получения 29, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,038 г, 19%).
1H-ЯМР (CDCl3) δ 7,92 (2H, s), 7,62 (1H, t), 7,22 (1H, m), 6,66 (1H, m), 5,25 (1H, m), 4,12 (2H, t), 2,77 (2H, t), 2,53 (2H, m), 2,20 (4H, m), 1,88 (1H, m), 1,77 (1H, m)
Пример 387: 4-[4-[3-(циклопропилметоксиметил)-2-фурил]-2,6-дифтор-фенокси]бутановая кислота

Стадия A: этиловый эфир 4-[2,6-дифтор-4-(3-формил-2-фурил)фенокси]бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,26 г, 0,8 ммоль), полученный в Примере Получения 16, и (3-формил-2-фурил)бороновую кислоту (0,168 г, 1,2 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 96, с получением целевого соединения (0,191 г, 71%).
1H-ЯМР (CDCl3) δ 10,07 (1H, s), 7,41 (3H, m), 6,90 (1H, m), 4,26 (2H, t), 4,14 (2H, q), 2,58 (2H, t), 2,12 (2H, m), 1,26 (3H, t)
Стадия B: этиловый эфир 4-[2,6-дифтор-4-[3-(гидроксиметил)-2-фурил]фенокси]бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(3-формил-2-фурил) фенокси]бутановой кислоты (0,191 г, 0,56 ммоль), полученный на Стадии A, растворяли в 10 мл MeOH и охлаждали до 0°C. Добавляли NaBH4 (0,022 г, 0,58 ммоль), и смесь перемешивали при комнатной температуре в течение 30 минут. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,189 г, 99%).
1H-ЯМР (CDCl3) δ 7,40 (1H, d), 7,26 (2H, m), 6,53 (1H, d), 4,70 (2H, d), 4,20 (2H, t), 4,14 (2H, q), 2,58 (2H, t), 2,10 (2H, m), 1,63 (1H, t), 1,26 (3H, t)
Стадия C: 4-[4-[3-(циклопропилметоксиметил)-2-фурил]-2,6-дифтор-фенокси]бутановая кислота
Этиловый эфир 4-[2,6-дифтор-4-[3-(гидроксиметил)-2-фурил]фенокси]бутановой кислоты (0,189 г, 0,55 ммоль), полученный на Стадии B, и бромметилциклопропан (0,082 г, 0,61 ммоль) вводили в реакцию таким же образом, как в Примере Получения 267, для получения этилового эфира 4-[4-[3-(циклопропилметоксиметил)-2-фурил]-2,6-дифтор-фенокси]бутановой кислоты этиловый эфир (0,105 г, 48%). Полученное соединение вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,087 г, 89%).
1H-ЯМР (CDCl3) δ 7,40 (1H, d), 7,28 (2H, m), 6,49 (1H, d), 4,46 (2H, s), 4,21 (2H, t), 3,37 (2H, d), 2,66 (2H, t), 2,10 (2H, m), 1,13 (1H, m), 0,56 (2H, m), 0,25 (2H, m)
Пример 388: 4-[4-[6-(циклопропилметоксиметил)-2-пиридил]-2,6-дифтор-фенокси]бутановая кислота
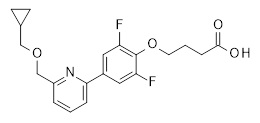
Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,163 г, 0,44 ммоль), полученный в Примере Получения 16, и 2-бром-6-(циклопропилметоксиметил)пиридин (0,097 г, 0,40 ммоль), полученный в Примере Получения 267, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,133 г, 88%).
1H-ЯМР (CDCl3) δ 7,76 (1H, t), 7,57 (2H, m), 7,51 (1H, m), 7,45 (1H, m), 4,72 (2H, s), 4,24 (2H, t), 3,44 (2H, d), 2,67 (2H, t), 2,11 (2H, m), 2,08 (1H, m), 0,58 (2H, m), 0,26 (2H, m)
Пример 389: 4-[2-хлор-4-[3-(циклобутокси)-5-фторфенил]-6-фторфенокси]бутановая кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (1,55 г, 4,0 ммоль), полученный в Примере Получения 221, и 1-бром-3-(циклобутокси)-5-фторбензол (1,08 г, 4,4 ммоль), полученный в Примере Получения 284, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (1,25 г, 79%).
1H-ЯМР (CDCl3) δ 7,34 (1H, m), 7,18 (1H, m), 6,78 (1H, m), 6,77 (1H, m), 6,51 (1H, m), 4,64 (1H, m), 4,20 (2H, t), 2,72 (2H, t), 2,58 (2H, m), 2,19 (4H, m), 1,89 (1H, m), 1,72 (1H, m)
Пример 390: 4-[4-[3-(циклопропилметоксиметил)-5-метил-изоксазол-4-ил]-2,6-дифтор-фенокси]бутановая кислота

4-бром-3-(циклопропилметоксиметил)-5-метил-изоксазол (0,058 г, 0,24 ммоль), полученный в Примере Получения 291, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,098 г, 0,26 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,015 г, 16%).
1H-ЯМР (CDCl3) δ 7,05 (2H, m), 4,50 (2H, s), 4,24 (2H, t), 3,35 (2H, d), 2,67 (2H, t), 2,47 (3H, s), 2,12 (2H, m), 1,06 (1H, m), 0,55 (2H, m), 0,20 (2H, m)
Пример 391: 4-[2-хлор-4-[4-(циклобутокси)-6-метил-пиримидин-2-ил]-6-фторфенокси]бутановая кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,193 г, 0,5 ммоль), полученный в Примере Получения 221, и 2-хлор-4-(циклобутокси)-6-метил-пиримидин(0,10 г, 0,5 ммоль), полученный в Примере Получения 228, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,081 г, 41%).
1H-ЯМР (CDCl3) δ 8,27 (1H, d), 8,11 (1H, m), 6,46 (1H, s), 5,34 (1H, m), 4,27 (2H, t), 2,76 (2H, t), 2,56 (2H, m), 2,51 (3H, s), 2,24 (4H, m), 1,93 (1H, m), 1,80 (1H, m)
Пример 392: 4-[2-хлор-4-[2-(циклобутокси)-6-метил-пиримидин-4-ил]-6-фторфенокси]бутановая кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,193 г, 0,5 ммоль), полученный в Примере Получения 221, и 4-хлор-2-(циклобутокси)-6-метил-пиримидин(0,10 г, 0,5 ммоль), полученный в Примере Получения 229, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,166 г, 84%).
1H-ЯМР (CDCl3) δ 7,92 (1H, d), 7,80 (1H, m), 7,14 (1H, s), 5,30 (1H, m), 4,29 (2H, t), 2,75 (2H, t), 2,54 (5H, m), 2,29 (2H, m), 2,19 (2H, m), 1,91 (1H, m), 1,77 (1H, m)
Пример 393: 4-[4-[6-хлор-4-(циклобутокси)-2-пиридил]-2,6-дифтор-фенокси]бутановая кислота

2,6-дихлор-4-(циклобутокси)пиридин (0,06 г, 0,27 ммоль), полученный в Примере Получения 270, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,122 г, 0,33 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,021 г, 20%).
1H-ЯМР (CDCl3) δ 7,51 (2H, m), 6,97 (1H, m), 6,66 (1H, m), 4,73 (1H, m), 4,25 (2H, t), 2,66 (2H, m), 2,52 (2H, m), 2,22 (2H, m), 2,11 (2H, m), 1,95 (1H, m), 1,77 (1H, m)
Пример 394: 4-[4-[2-(циклобутокси)тиазол-4-ил]-2,6-дифтор-фенокси]бутановая кислота

4-бром-2-(циклобутокси)тиазол (0,07 г, 0,3 ммоль), полученный в Примере Получения 289, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,122 г, 0,33 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,91 г, 82%).
1H-ЯМР (CDCl3) δ 7,34 (2H, m), 6,78 (1H, s), 5,18 (1H, m), 4,20 (2H, t), 2,65 (2H, t), 2,54 (2H, m), 2,25 (2H, m), 2,10 (2H, m), 1,88 (1H, m), 1,70 (1H, m)
Пример 395: 4-[4-[6-(циклобутокси)-4-метил-2-пиридил]-2,6-дифтор-фенокси]бутановая кислота

2-хлор-6-(циклобутокси)-4-метил-пиридин (0,06 г, 0,3 ммоль), полученный в Примере Получения 271, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,124 г, 0,33 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,04 г, 35%).
1H-ЯМР (CDCl3) δ 7,56 (2H, m), 7,04 (1H, s), 6,47 (1H, s), 5,23 (1H, m), 4,23 (2H, t), 2,67 (2H, m), 2,51 (2H, m), 2,33 (3H, s), 2,14 (4H, m), 1,85 (1H, m), 1,74 (1H, m)
Пример 396: 4-[2-хлор-4-[4-(циклопропилметокси)-6-метил-пиримидин-2-ил]-6-фторфенокси]бутановая кислота

2-хлор-4-(циклопропилметокси)-6-метил-пиримидин (0,065 г, 0,33 ммоль), полученный в Примере Получения 227, и этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,139 г, 0,36 ммоль), полученный в Примере Получения 221, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,10 г, 72%).
1H-ЯМР (CDCl3) δ 8,24 (1H, d), 8,07 (1H, m), 6,49 (1H, s), 4,28 (2H, d), 4,23 (2H, t), 2,72 (2H, t), 2,47 (3H, s), 2,15 (2H, m), 1,31 (1H, m), 0,66 (2H, m), 0,40 (2H, m)
Пример 397: 4-[4-[2-(циклопропилметокси)тиазол-4-ил]-2,6-дифтор-фенокси]бутановая кислота
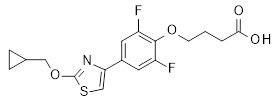
4-бром-2-(циклопропилметокси)тиазол (0,07 г, 0,3 ммоль), полученный в Примере Получения 290, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,122 г, 0,33 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,073 г, 66%).
1H-ЯМР (CDCl3) δ 7,34 (2H, m), 6,78 (1H, s), 4,30 (2H, d), 4,20 (2H, t), 2,66 (2H, m), 2,10 (2H, m), 1,35 (1H, m), 0,67 (2H, m), 0,42 (2H, m)
Пример 398: 4-[4-[6-(циклобутокси)пиразин-2-ил]-2,6-дифтор-фенокси]бутановая кислота

2-хлор-6-(циклобутокси)пиразин (0,07 г, 0,38 ммоль), полученный в Примере Получения 232, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,154 г, 0,42 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,12 г, 87%).
1H-ЯМР (CDCl3) δ 8,48 (1H, s), 8,12 (1H, s), 7,57 (2H, m), 5,26 (1H, m), 4,27 (2H, t), 2,68 (2H, t), 2,53 (2H, m), 2,22 (2H, m), 2,14 (2H, m), 1,91 (1H, m), 1,77 (1H, m)
Пример 399: 5-[4-[6-(циклобутокси)пиразин-2-ил]-2,6-дифтор-фенил]гексановая кислота

2-хлор-6-(циклобутокси)пиразин (0,053 г, 0,28 ммоль), полученный в Примере Получения 232, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,12 г, 0,31 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,10 г, 98%).
1H-ЯМР (CDCl3) δ 8,50 (1H, s), 8,14 (1H, s), 7,48 (2H, m), 5,27 (1H, m), 3,26 (1H, m), 2,55 (2H, m), 2,38 (2H, m), 2,21 (2H, m), 1,90 (2H, m), 1,75 (2H, m), 1,64 (2H, m), 1,37 (3H, d)
Пример 400: 4-[2-хлор-4-(6-циклопентилокси-пиридин-2-ил)-6-фторфенокси]-масляная кислота
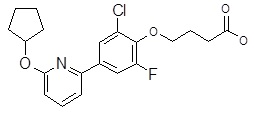
Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 2-хлор-6-циклопентилокси-пиридин (0,077 г, 0,39 ммоль), полученный в Примере Получения 12, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,059 г, 57%).
1H-ЯМР (CDCl3) δ 7,80 (1H, s), 7,70 (1H, dd), 7,58 (1H, t), 7,20 (1H, d), 6,63 (1H, d), 5,49 (1H, m), 4,20 (2H, t), 2,72 (2H, t), 2,15 (2H, t), 2,04 (2H, m), 1,81 (4H, m), 1,64 (2H, m).
Пример 401: 4-[2-хлор-4-(6-циклопропилметокси-пиридин-2-ил)-6-фторфенокси]-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 2-хлор-6-циклопропилметокси-пиридин (0,07 г, 0,39 ммоль), полученный в Примере Получения 43, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,053 г, 53%).
1H-ЯМР (CDCl3) δ 7,78 (1H, s), 7,69 (1H, dd), 7,61 (1H, t), 7,22 (1H, d), 6,71 (1H, d), 4,21 (4H, m), 2,71 (2H, t), 2,13 (2H, m), 1,32 (1H, m), 0,62 (2H, m), 0,38 (2H, m).
Пример 402: 4-[2-хлор-6-фтор-4-(6-изопропокси-пиридин-2-ил)-фенокси]-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 2-хлор-6-изопропокси-пиридин (0,066 г, 0,39 ммоль), полученный в Примере Получения 46, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,053 г, 55%).
1H-ЯМР (CDCl3) δ 7,79 (1H, s), 7,69 (1H, dd), 7,59 (1H, t), 7,18 (1H, d), 6,64 (1H, d), 5,43 (1H, m), 4,20 (2H, t), 2,72 (2H, t), 2,15 (2H, m), 1,39 (6H, d).
Пример 403: 4-[2-хлор-4-(6-циклобутилсульфанил-пиридин-2-ил)-6-фторфенокси]-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 2-хлор-6-циклобутилсульфанил-пиридин (0,077 г, 0,39 ммоль), полученный в Примере Получения 299, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,04 г, 39%).
1H-ЯМР (CDCl3) δ 7,81 (1H, s), 7,71 (1H, dd), 7,51 (1H, t), 7,31 (1H, d), 7,02 (1H, d), 4,40 (1H, m), 4,21 (2H, t), 2,72 (2H, t), 2,59 (2H, m), 2,14 (6H, m).
Пример 404: 4-[2-хлор-6-фтор-4-(6-изопропилсульфанил-пиридин-2-ил)-фенокси]-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221 и 2-хлор-6-изопропилсульфанил-пиридин (0,073 г, 0,39 ммоль), полученный в Примере Получения 10, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,038 г, 38%).
1H-ЯМР (CDCl3) δ 7,81 (1H, s), 7,70 (1H, dd), 7,51 (1H, t), 7,31 (1H, d), 7,08 (1H, d), 4,22 (2H, t), 4,11 (1H, m), 2,72 (2H, t), 2,14 (2H, m), 1,48 (6H, d).
Пример 405: 4-(5-хлор-3ʹ-циклобутокси-3-фтор-бифенил-4-илокси)-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 1-бром-3-циклобутокси-бензол (0,088 г, 0,39 ммоль), полученный на Стадии A Примера Получения 121, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,059 г, 60%).
1H-ЯМР (CDCl3) δ 7,35 (1H, s), 7,30 (1H, t), 7,21 (1H, m), 7,05 (1H, m), 6,93 (1H, s), 6,79 (1H, m), 4,68 (1H, m), 4,18 (2H, t), 2,71 (2H, t), 2,46 (2H, m), 2,15 (4H, m), 1,86 (1H, m), 1,71 (1H, m).
Пример 406: 4-(5-хлор-3ʹ-циклопропилметокси-3-фтор-бифенил-4-илокси)-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 1-бром-3-(циклопропилметокси) бензол (0,088 г, 0,39 ммоль), полученный в Примере Получения 280, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,051 г, 52%).
1H-ЯМР (CDCl3) δ 7,37 (1H, s), 7,32 (1H, t), 7,22 (1H, m), 7,04 (1H, m), 7,01 (1H, s), 6,89 (1H, m), 4,18 (2H, t), 3,83 (2H, d), 2,71 (2H, t), 2,14 (2H, m), 1,28 (1H, m), 0,65 (2H, m), 0,37 (2H, m).
Пример 407: 4-(5-хлор-3ʹ-циклопропилметокси-3-фтор-4ʹ-метокси-бифенил-4-илокси)-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 4-бром-2-(циклопропилметокси)-1-метоксибензол (0,1 г, 0,39 ммоль), полученный в Примере Получения 282, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,055 г, 52%).
1H-ЯМР (CDCl3) δ 7,31 (1H, s), 7,16 (1H, m), 7,03 (1H, m), 6,98 (1H, m), 6,92 (1H, d), 4,17 (2H, t), 3,90 (5H, m), 2,71 (2H, t), 2,14 (2H, m), 1,36 (1H, m), 0,65 (2H, m), 0,38 (2H, m).
Пример 408: 4-(5-хлор-3ʹ-циклопропилметокси-3,4ʹ-дифтор-бифенил-4-илокси)-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 4-бром-2-(циклопропилметокси)-1-фторбензол (0,095 г, 0,39 ммоль), полученный в Примере Получения 283, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,048 г, 46%).
1H-ЯМР (CDCl3) δ 7,30 (1H, s), 7,13 (2H, m), 7,02 (2H, m), 4,18 (2H, t), 3,93 (2H, d), 2,71 (2H, t), 2,13 (2H, m), 1,32 (1H, m), 0,66 (2H, m), 0,37 (2H, m).
Пример 409: 4-(3ʹ-циклобутилсульфанил-3,5-дифтор-бифенил-4-илокси)-масляная кислота

Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,1 г, 0,27 ммоль), полученный в Примере Получения 16, и 1-бром-3-циклобутилсульфанил-бензол (0,098 г, 0,40 ммоль), полученный в Примере Получения 293, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,036 г, 35%).
1H-ЯМР (CDCl3) δ 7,33 (2H, m), 7,25 (2H, m), 7,07 (2H, m), 4,22 (2H, t), 3,93 (1H, m), 2,66 (2H, t), 2,48 (2H, m), 2,10 (6H, m).
Пример 410: 5-(3ʹ-циклобутокси-3,5-дифтор-бифенил-4-ил)-гексановая кислота

Этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 32, и 1-бром-3-циклобутокси-бензол (0,089 г, 0,39 ммоль), полученный на Стадии A Примера Получения 121, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,058 г, 59%).
1H-ЯМР (CDCl3) δ 7,30 (1H, t), 7,08 (1H, m), 7,03 (2H, m), 6,95 (1H, s), 6,82 (1H, m), 4,68 (1H, m), 3,21 (1H, m), 2,46 (2H, m), 2,35 (2H, m), 2,19 (2H, m), 1,86 (2H, m), 1,72 (2H, m), 1,65 (1H, m), 1,52 (1H, m), 1,35 (3H, d).
Пример 411: 5-(5ʹ-циклобутокси-3,5,3ʹ-трифтор-бифенил-4-ил)-гексановая кислота

Этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 32, и 1-бром-3-(циклобутокси)-5-фторбензол (0,096 г, 0,39 ммоль), полученный в Примере Получения 284, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,058 г, 56%).
1H-ЯМР (CDCl3) δ 7,00 (2H, m), 6,77 (1H, m), 6,74 (1H, s), 6,52 (1H, m), 4,65 (1H, m), 3,21 (1H, m), 2,46 (2H, m), 2,36 (2H, m), 2,18 (2H, m), 1,87 (2H, m), 1,73 (2H, m), 1,65 (1H, m), 1,52 (1H, m), 1,35 (3H, d).
Пример 412: 5-(3ʹ-циклопропилметокси-3,5-дифтор-4ʹ-метокси-бифенил-4-ил)-гексановая кислота
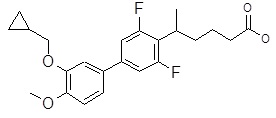
Этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 32, и 4-бром-2-(циклопропилметокси)-1-метоксибензол (0,1 г, 0,39 ммоль), полученный в Примере Получения 282, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,046 г, 43%).
1H-ЯМР (CDCl3) δ 7,08 (1H, m), 7,00 (3H, m), 6,92 (1H, d), 3,91 (5H, m), 3,20 (1H, m), 2,34 (2H, m), 1,82 (1H, m), 1,71 (1H, m), 1,62 (1H, m), 1,52 (1H, m), 1,33 (4H, m), 0,65 (2H, m), 0,37 (2H, m).
Пример 413: 5-(3ʹ-циклопропилметокси-3,5-дифтор-бифенил-4-ил)-гексановая кислота

Этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 32, и 1-бром-3-(циклопропилметокси)бензол (0,089 г, 0,39 ммоль), полученный в Примере Получения 280, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,028 г, 28%).
1H-ЯМР (CDCl3) δ 7,32 (1H, t), 7,09 (1H, m), 7,03 (3H, m), 6,90 (1H, m), 3,85 (2H, d), 3,21 (1H, m), 2,36 (2H, m), 1,83 (1H, m), 1,71 (1H, m), 1,63 (1H, m), 1,52 (1H, m), 1,34 (3H, d), 1,29 (1H, m), 0,66 (2H, m), 0,37 (2H, m).
Пример 414: 5-(5ʹ-циклобутокси-3ʹ-фтор-бифенил-4-ил)-5,5-дифтор-пентановая кислота
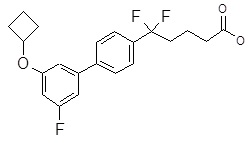
Метиловый эфир 5,5-дифтор-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,1 г, 0,28 ммоль), полученный в Примере Получения 169, и 1-бром-3-(циклобутокси)-5-фторбензол (0,104 г, 0,42 ммоль), полученный в Примере Получения 284, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,038 г, 35%).
1H-ЯМР (CDCl3) δ 7,58 (2H, d), 7,53 (2H, d), 6,84 (1H, m), 6,81 (1H, s), 6,51 (1H, m), 4,66 (1H, m), 2,43 (4H, m), 2,21 (4H, m), 1,83 (3H, m), 1,71 (1H, m).
Пример 415: 5-[4-(5-хлор-6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-гексановая кислота

Этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,08 г, 0,21 ммоль), полученный в Примере Получения 32, и 3,6-дихлор-2-циклобутокси-пиридин (0,068 г, 0,31 ммоль), полученный в Примере Получения 298, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,032 г, 37%).
1H-ЯМР (CDCl3) δ 7,66 (1H, d), 7,43 (2H, m), 67,18 (1H, d), 5,31 (1H, m), 3,24 (1H, m), 2,54 (2H, m), 2,35 (2H, m), 2,25 (2H, m), 1,88-1,52 (6H, m), 1,35 (3H, d).
Пример 416: 4-(3ʹ-циклобутансульфонил-3,5-дифтор-бифенил-4-илокси)-масляная кислота

2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол (0,1 г, 0,27 ммоль), полученный на Стадии B Примера Получения 16, и 1-бром-3-циклобутилсульфонил-бензол (0,111 г, 0,40 ммоль), полученный в Примере Получения 285, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,052 г, 47%).
1H-ЯМР (CDCl3) δ 8,00 (1H, s), 7,86 (1H, d), 7,76 (1H, d), 7,64 (1H, t), 7,17 (2H, m), 4,26 (2H, t), 3,83 (1H, m), 2,63 (4H, m), 2,16 (4H, m), 2,02 (2H, m).
Пример 417: 5-({[4-(6-циклобутокси-пиридин-2-ил)-фенил]-метил-амино}-метил)-изоксазол-3-ол

4-(6-циклобутокси-пиридин-2-ил)-фенил]-[3-(4-метокси-фенокси)-изоксазол-5-илметил]-амин (0,07 г, 0,15 ммоль), полученный в Примере Получения 296, растворяли в 2 мл метанола. Добавляли 0,3 мл 37%-го раствора формальдегида и 0,3 мл HCl. Натрий цианоборгидрид (0,014 г, 0,23 ммоль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор разбавляли водой и экстрагировали этилацетатом. Органический слой высушивали безводным сульфатом магния и очищали колоночной хроматографией с получением целевого соединения (0,02 г, 37%).
1H-ЯМР (CDCl3) δ 7,94 (2H, d), 7,54 (1H, t), 7,22 (1H, d), 6,79 (2H, d), 6,53 (1H, d), 5,73 (1H, s), 5,26 (1H, m), 4,52 (2H, s), 3,07 (3H, s), 2,52 (2H, m), 2,18 (2H, m), 1,83 (1H, m), 1,69 (1H, m).
Пример 418: 5-[4-(2-циклобутокси-6-метил-пиримидин-4-ил)-2,6-дифтор-фенил]-гексановая кислота

Этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 32, и 4-хлор-2-(циклобутокси)-6-метил-пиримидин (0,062 г, 0,39 ммоль), полученный в Примере Получения 229, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,056 г, 54%).
1H-ЯМР (CDCl3) δ 7,54 (2H, d), 7,12 (1H, s), 5,28 (1H, m), 3,25 (1H, m), 2,51 (5H, m), 2,26 (4H, m), 1,86 (2H, m), 1,73 (2H, m), 1,55 (1H, m), 1,45 (1H, m), 1,35 (3H, d).
Пример 419: 5-[4-(4-циклобутокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-гексановая кислота

Этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 32, и 2-хлор-4-(циклобутокси)-6-метил-пиримидин (0,062 г, 0,39 ммоль), полученный в Примере Получения 228, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,042 г, 41%).
1H-ЯМР (CDCl3) δ 7,86 (2H, d), 6,44 (1H, s), 5,30 (1H, m), 3,25 (1H, m), 2,53 (2H, m), 2,47 (3H, s), 2,34 (2H, t), 2,19 (2H, m), 1,87 (2H, m), 1,74 (2H, m), 1,63 (1H, m), 1,51 (1H, m), 1,35 (3H, d).
Пример 420: 4-[4-(4-циклобутокси-пиримидин-2-ил)-2,6-дифтор-фенокси]-масляная кислота
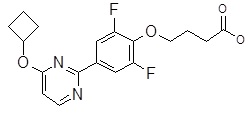
Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,2 г, 0,54 ммоль), полученный в Примере Получения 16, и смесь (0,11 г, 0,59 ммоль) 2-хлор-4-(циклобутокси)пиримидина, полученного в Примере Получения 230, и 4-хлор-2-циклобутокси-пиримидина последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, для получения 4-[4-(4-циклобутокси-пиримидин-2-ил)-2,6-дифтор-фенокси]-масляной кислоты (0,015 г, 7%) и 4-[4-(2-циклобутокси-пиримидин-4-ил)-2,6-дифтор-фенокси]-масляной кислоты (0,088 г, 44%).
1H-ЯМР (CDCl3) δ 8,48 (1H, d), 7,97 (2H, m), 6,58 (1H, d), 5,33 (1H, m), 4,28 (2H, t), 2,67 (2H, t), 2,53 (2H, m), 2,22 (2H, m), 2,14 (2H, m), 1,89 (1H, m), 1,76 (1H, m).
Пример 421: 4-[4-(2-циклобутокси-пиримидин-4-ил)-2,6-дифтор-фенокси]-масляная кислота

Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,2 г, 0,54 ммоль), полученный в Примере Получения 16, и смесь (0,11 г, 0,59 ммоль) 2-хлор-4-(циклобутокси)пиримидина, полученного в Примере Получения 230, и 4-хлор-2-циклобутокси-пиримидина последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, для получения 4-[4-(4-циклобутокси-пиримидин-2-ил)-2,6-дифтор-фенокси]-масляной кислоты (0,015 г, 7%) и 4-[4-(2-циклобутокси-пиримидин-4-ил)-2,6-дифтор-фенокси]-масляной кислоты (0,088 г, 44%).
1H-ЯМР (CDCl3) δ 8,54 (1H, d), 7,65 (2H, m), 7,21 (1H, d), 5,27 (1H, m), 4,29 (2H, t), 2,66 (2H, t), 2,50 (2H, m), 2,27 (2H, m), 2,12 (2H, m), 1,87 (1H, m), 1,73 (1H, m).
Пример 422: 4-[2-хлор-4-(4-циклобутокси-пиримидин-2-ил)-6-фторфенокси]-масляная кислота
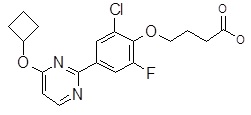
Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,2 г, 0,52 ммоль), полученный в Примере Получения 221, и смесь (0,105 г, 0,57 ммоль) 2-хлор-4-(циклобутокси)пиримидина, полученного в Примере Получения 230, и 4-хлор-2-циклобутокси-пиримидина последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, для получения 4-[2-хлор-4-(4-циклобутокси-пиримидин-2-ил)-6-фторфенокси]-масляной кислоты (0,012 г, 6%) и 4-[2-хлор-4-(2-циклобутокси-пиримидин-4-ил)-6-фторфенокси]-масляной кислоты (0,083 г, 42%).
1H-ЯМР (CDCl3) δ 8,46 (1H, d), 8,22 (1H, s), 8,04 (1H, m), 6,58 (1H, d), 5,33 (1H, m), 4,24 (2H, t), 2,72 (2H, t), 2,54 (2H, m), 2,18 (4H, m), 1,89 (1H, m), 1,79 (1H, m).
Пример 423: 4-[2-хлор-4-(2-циклобутокси-пиримидин-4-ил)-6-фторфенокси]-масляная кислота
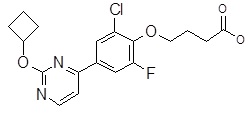
Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,2 г, 0,52 ммоль), полученный в Примере Получения 221, и смесь (0,105 г, 0,57 ммоль) 2-хлор-4-(циклобутокси)пиримидина, полученного в Примере Получения 230, и 4-хлор-2-циклобутокси-пиримидина последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, для получения 4-[2-хлор-4-(4-циклобутокси-пиримидин-2-ил)-6-фторфенокси]-масляной кислоты (0,012 г, 6%) и 4-[2-хлор-4-(2-циклобутокси-пиримидин-4-ил)-6-фторфенокси]-масляной кислоты (0,083 г, 42%).
1H-ЯМР (CDCl3) δ 8,54 (1H, d), 7,90 (1H, s), 7,77 (1H, m), 7,24 (1H, d), 5,27 (1H, m), 4,27 (2H, t), 2,70 (2H, t), 2,51 (2H, m), 2,28 (2H, m), 2,17 (2H, m), 1,88 (1H, m), 1,74 (1H, m).
Пример 424: 4-[2-хлор-4-(6-хлор-4-циклобутокси-пиридин-2-ил)-6-фторфенокси]-масляная кислота
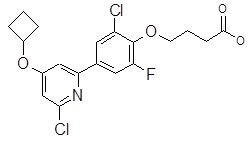
Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 2,6-дихлор-4-(циклобутокси)пиридин (0,068 г, 0,31 ммоль), полученный в Примере Получения 270, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,028 г, 26%).
1H-ЯМР (CDCl3) δ 7,49 (1H, s), 7,64 (1H, m), 6,97 (1H, s), 6,66 (1H, s), 4,73 (1H, m), 4,21 (2H, t), 2,71 (2H, t), 2,50 (2H, m), 2,15 (4H, m), 1,94 (1H, m), 1,76 (1H, m).
Пример 425: 4-[4-(4-циклобутокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенокси]-масляная кислота

Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,1 г, 0,27 ммоль), полученный в Примере Получения 16, и 2-хлор-4-(циклобутокси)-6-метил-пиримидин (0,059 г, 0,3 ммоль), полученный в Примере Получения 228, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,042 г, 41%).
1H-ЯМР (CDCl3) δ 7,98 (2H, m), 6,42 (1H, s), 5,30 (1H, m), 4,27 (2H, t), 2,67 (2H, t), 2,52 (2H, m), 2,46 (3H, s), 2,15 (4H, m), 1,87 (1H, m), 1,74 (1H, m).
Пример 426: 4-[2-хлор-4-(2-циклобутокси-тиазол-4-ил)-6-фторфенокси]-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 4-бром-2-(циклобутокси) тиазол (0,073 г, 0,31 ммоль), полученный в Примере Получения 289, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,037 г, 37%).
1H-ЯМР (CDCl3) δ 7,58 (1H, s), 7,43 (1H, m), 6,78 (1H, s), 5,16 (1H, m), 4,16 (2H, t), 2,68 (2H, t), 2,51 (2H, m), 2,24 (2H, m), 2,12 (2H, m), 1,86 (1H, m), 1,68 (1H, m).
Пример 427: 4-[2-хлор-4-(2-циклопропилметокси-тиазол-4-ил)-6-фторфенокси]-масляная кислота
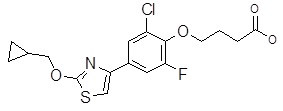
Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 4-бром-2-(циклопропилметокси)тиазол (0,073 г, 0,31 ммоль), полученный в Примере Получения 290, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,033 г, 33%).
1H-ЯМР (CDCl3) δ 7,59 (1H, s), 7,43 (1H, m), 6,78 (1H, s), 4,28 (2H, d), 4,16 (2H, t), 2,70 (2H, t), 2,13 (2H, m), 1,34 (1H, m), 0,65 (2H, m), 0,40 (2H, m).
Пример 428: 4-[2-хлор-4-(4-циклопропилметокси-пиримидин-2-ил)-6-фторфенокси]-масляная кислота
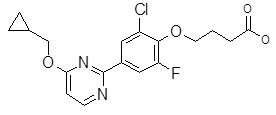
Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 2-хлор-4-(циклопропилметокси)пиримидин (0,057 г, 0,31 ммоль), полученный в Примере Получения 231, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,038 г, 38%).
1H-ЯМР (CDCl3) δ 8,46 (1H, d), 8,22 (1H, s), 8,04 (1H, m), 6,64 (1H, d), 4,29 (2H, d), 4,24 (2H, t), 2,71 (2H, t), 2,14 (2H, m), 1,32 (1H, m), 0,65 (2H, m), 0,40 (2H, m).
Пример 429: 4-[2-хлор-4-(6-циклобутокси-4-метил-пиридин-2-ил)-6-фторфенокси]-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (1 г, 2,59 ммоль), полученный в Примере Получения 221, и 2-хлор-6-(циклобутокси)-4-метил-пиридин (0,613 г, 3,10 ммоль), полученный в Примере Получения 271, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,8 г, 78%).
1H-ЯМР (CDCl3) δ 7,77 (1H, s), 7,65 (1H, m), 7,04 (1H, s), 6,46 (1H, s), 5,22 (1H, m), 4,19 (2H, t), 2,71 (2H, t), 2,51 (2H, m), 2,32 (3H, s), 2,16 (4H, m), 1,84 (1H, m), 1,73 (1H, m).
Пример 430: 4-[2-хлор-4-(6-циклобутокси-пиразин-2-ил)-6-фторфенокси]-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 2-хлор-6-(циклобутокси)пиразин (0,057 г, 0,31 ммоль), полученный в Примере Получения 232, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,036 г, 36%).
1H-ЯМР (CDCl3) δ 8,48 (1H, s), 8,11 (1H, s), 7,79 (1H, s), 7,65 (1H, m), 5,26 (1H, m), 4,24 (2H, t), 2,70 (2H, t), 2,51 (2H, m), 2,20 (4H, m), 1,90 (1H, m), 1,75 (1H, m).
Пример 431: 4-[2-хлор-4-(6-циклопропилметокси-пиразин-2-ил)-6-фторфенокси]-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 2-хлор-6-(циклопропилметокси)пиразин (0,057 г, 0,31 ммоль), полученный в Примере Получения 233, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,028 г, 28%).
1H-ЯМР (CDCl3) δ 8,46 (1H, s), 8,18 (1H, s), 7,80 (1H, s), 7,65 (1H, m), 4,24 (4H, m), 2,71 (2H, t), 2,14 (2H, m), 1,32 (1H, m), 0,65 (2H, m), 0,39 (2H, m).
Пример 432: 4-[4-(4-циклопропилметокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенокси]-масляная кислота
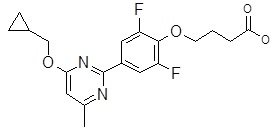
Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,1 г, 0,27 ммоль), полученный в Примере Получения 16, и 2-хлор-4-(циклопропилметокси)-6-метил-пиримидин (0,064 г, 0,32 ммоль), полученный в Примере Получения 227, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,045 г, 44%).
1H-ЯМР (CDCl3) δ 7,99 (2H, m), 6,49 (1H, s), 4,27 (4H, m), 2,67 (2H, t), 2,47 (3H, s), 2,12 (2H, m), 1,32 (1H, m), 0,64 (2H, m), 0,39 (2H, m).
Пример 433: 4-[4-(4-циклопропилметокси-пиримидин-2-ил)-2,6-дифтор-фенокси]-масляная кислота
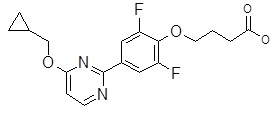
Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,1 г, 0,27 ммоль), полученный в Примере Получения 16, и 2-хлор-4-(циклопропилметокси)пиримидин (0,06 г, 0,32 ммоль), полученный в Примере Получения 231, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,048 г, 48%).
1H-ЯМР (CDCl3) δ 8,46 (1H, d), 7,98 (2H, m), 6,64 (1H, d), 4,28 (4H, m), 2,67 (2H, t), 2,12 (2H, m), 1,33 (1H, m), 0,67 (2H, m), 0,41 (2H, m).
Пример 434: 4-[4-(6-циклопропилметокси-пиразин-2-ил)-2,6-дифтор-фенокси]-масляная кислота
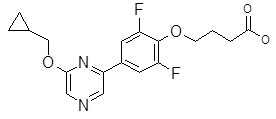
Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,1 г, 0,27 ммоль), полученный в Примере Получения 16, и 2-хлор-6-(циклопропилметокси)пиразин (0,06 г, 0,32 ммоль), полученный в Примере Получения 233, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,047 г, 47%).
1H-ЯМР (CDCl3) δ 8,48 (1H, s), 8,18 (1H, s), 7,56 (2H, m), 4,26 (4H, m), 2,67 (2H, t), 2,14 (2H, m), 1,33 (1H, m), 0,67 (2H, m), 0,40 (2H, m).
Пример 435: 4-[2-хлор-4-(6-циклопропилметокси-4-метил-пиридин-2-ил)-6-фторфенокси]-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 2-хлор-6-циклопропилметокси-4-метил-пиридин (0,061 г, 0,31 ммоль), полученный в Примере Получения 300, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,053 г, 52%).
1H-ЯМР (CDCl3) δ 7,77 (1H, s), 7,66 (1H, m), 7,05 (1H, s), 6,54 (1H, s), 4,19 (4H, m), 2,71 (2H, t), 2,33 (3H, s), 2,12 (2H, m), 1,30 (1H, m), 0,61 (2H, m), 0,36 (2H, m).
Пример 436: 4-[2-хлор-6-фтор-4-(6-изопропокси-пиразин-2-ил)-фенокси]-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 2-хлор-6-изопропокси-пиразин (0,053 г, 0,31 ммоль), полученный в Примере Получения 301, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,043 г, 45%).
1H-ЯМР (CDCl3) δ 8,48 (1H, s), 8,09 (1H, s), 7,79 (1H, s), 7,67 (1H, m), 5,42 (1H, m), 4,23 (2H, t), 2,71 (2H, t), 2,15 (2H, m), 1,40 (6H, d).
Пример 437: 4-[2-хлор-4-(6-этокси-пиразин-2-ил)-6-фторфенокси]-масляная кислота

Этиловый эфир 4-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,1 г, 0,26 ммоль), полученный в Примере Получения 221, и 2-хлор-6-этокси-пиразин (0,049 г, 0,31 ммоль), полученный в Примере Получения 302, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,032 г, 32%).
1H-ЯМР (CDCl3) δ 8,48 (1H, s), 8,14 (1H, s), 7,81 (1H, s), 7,69 (1H, m), 4,49 (2H, q), 4,23 (2H, t), 2,71 (2H, t), 2,14 (2H, m), 1,45 (3H, t).
Пример 438: {(R)-1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота

Метиловый эфир {(R)-1-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты (0,090 г, 0,23 ммоль), полученный в Примере Получения 303, и 2-хлор-6-циклопропилметокси-пиридин (0,084 г, 0,45 ммоль), полученный в Примере Получения 43, последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,017 г, 19%).
1H-ЯМР (CDCl3) δ 7,58 (1H, t), 7,48 (2H, m), 7,16 (1H, d), 6,65 (1H, d), 4,23 (2H, d), 3,74 (2H, m), 3,61 (1H, m), 3,36 (1H, m), 2,65 (1H, m), 2,53 (2H, m), 2,16 (1H, m), 1,65 (1H, m), 1,32 (1H, m), 0,63 (2H, m), 0,37 (2H, m).
Пример 439: {1-[4-(2,2-дифтор-бензо[1,3]диоксол-4-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота

Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, и 4-бром-2,2-дифтор-бензо[1,3]диоксол (0,081 мл, 0,59 ммоль) последовательно вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,090 г, 44%).
1H-ЯМР (CDCl3) δ 7,20 (3H, m), 7,12 (1H, t), 7,02 (1H, d), 3,31 (2H, m), 3,13 (2H, m), 2,35 (2H, d), 1,98 (1H, m), 1,81 (2H, m), 1,49 (2H, m).
Пример 440: 3-[8-фтор-6-(2-изопропилсульфанил-3-пиридил) тиохроман-2-ил]пропановая кислота

3-Йод-2-изопропилсульфанил-пиридин (0,033 г, 0,12 ммоль), полученный в Примере Получения 9, и этиловый эфир 3-[8-фтор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)тиохроман-2-ил]пропановой кислоты (0,046 г, 0,12 ммоль), полученный в Примере Получения 304, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,027 г, 57%).
1H-ЯМР (CDCl3) δ 8,43 (1H, m), 7,34 (1H, m), 7,02 (1H, m), 6,97 (1H, m), 6,92 (1H, m), 4,09 (1H, m), 3,36 (1H, m), 2,94 (2H, m), 2,61 (2H, m), 2,24 (1H, m), 2,07 (2H, m), 1,87 (1H, m), 1,36 (6H, d)
Пример 441: 3-[6-[6-(циклобутокси)-2-пиридил]тиохроман-2-ил]пропановая кислота

2-хлор-6-циклобутокси-пиридин (0,062 г, 0,34 ммоль), полученный в Примере Получения 29, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты (0,13 г, 0,34 ммоль), полученный в Примере Получения 5, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,067 г, 53%).
1H-ЯМР (CDCl3) δ 7,71 (2H, m), 7,58 (1H, t), 7,25 (1H, d), 7,15 (1H, d), 6,59 (1H, d), 5,25 (1H, m), 3,38 (1H, m), 2,94 (2H, m), 2,62 (2H, m), 2,52 (2H, m), 2,24 (3H, m), 2,05 (2H, m), 1,85 (2H, m), 1,72 (1H, m)
Пример 442: 3-[2-[2,6-дифтор-4-(7-метокси-2,2-диметил-3H-бензофуран-4-ил)фенил] циклопропил]пропановая кислота

4-бром-7-метокси-2,2-диметил-2,3-дигидро-бензофуран (0,067 г, 0,26 ммоль), полученный в Примере Получения 211, и этиловый эфир 4-{1-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-масляной кислоты (0,099 г, 0,26 ммоль), полученный в Примере Получения 155, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,07 г, 67%).
1H-ЯМР (CDCl3) δ 6,85 (4H, m), 3,90 (3H, s), 3,12 (2H, s), 2,59 (2H, t), 1,84 (1H, m), 1,65 (2H, m), 1,52 (6H, s), 1,38 (1H, m), 1,22 (1H, m), 0,82 (1H, m)
Пример 443: 3-[2-(2,6-дифтор-4-спиро[3H-бензофуран-2,1ʹ-циклопентан]-7-ил-фенил) циклопропил]пропановая кислота

7-бромспиро[3H-бензофуран-2,1ʹ-циклопентан] (0,067 г, 0,26 ммоль), полученный в Примере Получения 212, и этиловый эфир 4-{1-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-циклопропил}-масляной кислоты (0,099 г, 0,26 ммоль), полученный в Примере Получения 155, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,056 г, 54%).
1H-ЯМР (CDCl3) δ 7,22 (3H, m), 7,12 (1H, m), 6,88 (1H, t), 3,20 (2H, s), 2,59 (2H, t), 2,12 (2H, m), 1,93-1,60 (9H, m), 1,37 (1H, m), 1,22 (1H, m), 0,81 (1H, m)
Пример 444: 3-[6-[6-(циклобутокси)-2-пиридил]хроман-2-ил]пропановая кислота

2-хлор-6-циклобутокси-пиридин (0,069 г, 0,37 ммоль), полученный в Примере Получения 29, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,133 г, 0,37 ммоль), полученный в Примере Получения 4, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,050 г, 38%).
1H-ЯМР (CDCl3) δ 7,73 (2H, m), 7,55 (1H, t), 7,21 (1H, d), 6,85 (1H, d), 6,65 (1H, d), 5,25 (1H, m), 4,09 (1H, m), 2,87 (3H, m), 2,66 (2H, m), 2,20 (2H, m), 2,03 (4H, m), 1,78 (3H, m)
Пример 445: 3-[6-[6-(циклопропилметокси)-2-пиридил]хроман-2-ил]пропановая кислота
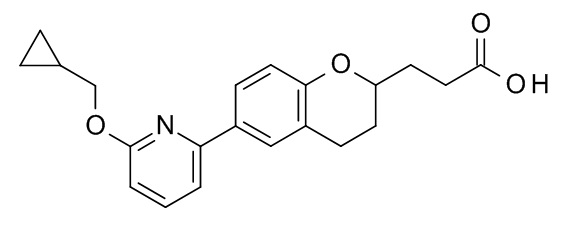
2-хлор-6-циклопропилметокси-пиридин (0,090 г, 0,49 ммоль), полученный в Примере Получения 43, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,176 г, 0,49 ммоль), полученный в Примере Получения 4, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,080 г, 46%).
1H-ЯМР (CDCl3) δ 7,72 (2H, m), 7,57 (1H, t), 7,21 (1H, d), 6,85 (1H, d), 6,63 (1H, d), 4,24 (2H, d), 4,10 (1H, m), 2,87 (2H, m), 2,65 (2H, m), 2,04 (3H, m), 1,78 (1H, m), 1,33 (1H, m), 0,62 (2H, m), 0,38 (2H, m)
Пример 446: 4-[4-(2,3-диметоксифенил)-2,6-дифтор-фенокси]бутановая кислота

1-Йод-2,3-диметокси-бензол (0,054 г, 0,20 ммоль), полученный на Стадии A Примера Получения 215, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,075 г, 0,20 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,030 г, 43%).
1H-ЯМР (CDCl3) δ 7,11 (3H, m), 6,93 (1H, m), 6,88 (1H, m), 4,23 (2H, t), 3,90 (3H, s), 3,63 (3H, s), 2,68 (2H, t), 2,12 (2H, m)
Пример 447: 3-[6-[3-(циклопропилметокси)фенил]хроман-2-ил]пропановая кислота

1-бром-3-(циклопропилметокси)бензол (0,098 г, 0,43 ммоль), полученный в Примере Получения 280, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,154 г, 0,43 ммоль), полученный в Примере Получения 4, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,056 г, 37%).
1H-ЯМР (CDCl3) δ 7,30 (3H, m), 7,14 (1H, m), 7,11 (1H, m), 6,88 (2H, m), 4,13 (1H, m), 3,89 (2H, d), 2,96 (1H, m), 2,86 (1H, m), 2,70 (2H, m), 2,08 (3H, m), 1,87 (1H, m), 1,35 (1H, m), 0,70 (2H, m), 0,41 (2H, m)
Пример 448: 3-[6-[3-(циклопентокси)фенил]хроман-2-ил]пропановая кислота

1-бром-3-(циклопентокси)бензол (0,097 г, 0,40 ммоль), полученный в Примере Получения 297, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,144 г, 0,40 ммоль), полученный в Примере Получения 4, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,064 г, 44%).
1H-ЯМР (CDCl3) δ 7,28 (3H, m), 7,07 (1H, d), 7,03 (1H, m), 6,84 (1H, d), 6,80 (1H, m), 4,81 (1H, m), 4,08 (1H, m), 2,91 (1H, m), 2,81 (1H, m), 2,64 (2H, m), 2,03 (3H, m), 1,86 (7H, m), 1,62 (2H, m)
Пример 449: 4-(2,6-дифтор-N-метил-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-анилино)бутановая кислота

4-Йодспиро[1,3-бензодиоксол-2,1ʹ-циклопентан] (0,089 г, 0,29 ммоль), полученный в Примере Получения 215, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,111 г, 0,29 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,031 г, 26%).
1H-ЯМР (CDCl3) δ 7,27 (2H, m), 6,92 (1H, d), 6,84 (1H, t), 6,72 (1H, d), 3,18 (2H, t), 2,87 (3H, s), 2,48 (2H, t), 2,13 (4H, m), 1,87 (6H, m)
Пример 450: 5-(2,6-дифтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенил)гексановая кислота

4-Йодспиро[1,3-бензодиоксол-2,1ʹ-циклопентан] (0,107 г, 0,35 ммоль), полученный в Примере Получения 215, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,107 г, 0,35 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,065 г, 46%).
1H-ЯМР (CDCl3) δ 7,23 (2H, m), 6,96 (1H, d), 6,85 (1H, t), 6,73 (1H, d), 3,23 (1H, m), 2,36 (2H, t), 2,15 (4H, m), 1,86 (5H, m), 1,72 (1H, m), 1,64 (1H, m), 1,56 (1H, m), 1,35 (3H, d)
Пример 451: 3-[6-(6-трет-бутилсульфанил-2-пиридил)хроман-2-ил]пропановая кислота

2-Трет-бутилсульфанил-6-хлор-пиридин (0,092 г, 0,45 ммоль) и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,162 г, 0,45 ммоль), полученный в Примере Получения 4, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,045 г, 27%).
1H-ЯМР (CDCl3) δ 7,75 (2H, m), 7,53 (1H, m), 7,43 (1H, m), 7,17 (1H, m), 6,86 (1H, m), 4,11 (1H, m), 2,90 (2H, m), 2,66 (2H, m), 2,03 (3H, m), 1,81 (1H, m), 1,60 (9H, s)
Пример 452: 3-[6-(6-изопропокси-2-пиридил)хроман-2-ил]пропановая кислота

2-хлор-6-изопропокси-пиридин (0,084 г, 0,48 ммоль), полученный в Примере Получения 46, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,172 г, 0,48 ммоль), полученный в Примере Получения 4, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,065 г, 39%).
1H-ЯМР (CDCl3) δ 7,73 (2H, m), 7,60 (1H, t), 7,20 (1H, d), 6,85 (1H, d), 6,58 (1H, d), 5,42 (1H, m), 4,09 (1H, m), 2,88 (2H, m), 2,65 (2H, m), 2,04 (3H, m), 1,80 (1H, m), 1,41 (6H, d)
Пример 453: 2-[1-(2,6-дифтор-4-спиро[1,3-бензодиоксол-2,1ʹ-циклопентан]-4-ил-фенил)-4-пиперидил]уксусная кислота

4-Йодспиро[1,3-бензодиоксол-2,1ʹ-циклопентан] (0,80 г, 0,26 ммоль), полученный в Примере Получения 215, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,106 г, 0,26 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,057 г, 51%).
1H-ЯМР (CDCl3) δ 7,26 (2H, m), 6,93 (1H, d), 6,84 (1H, t), 6,72 (1H, d), 3,35 (2H, m), 3,21 (2H, m), 2,38 (2H, d), 2,12 (4H, m), 1,99 (1H, m), 1,86 (6H, m), 1,62 (2H, m)
Пример 454: 4-[4-(2,3-дипропоксифенил)-2,6-дифтор-фенокси]бутановая кислота
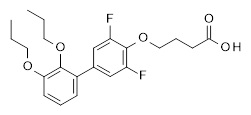
1-Йод-2,3-дипропокси-бензол (0,086 г, 0,26 ммоль), полученный в Примере Получения 305, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,096 г, 0,26 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,041 г, 39%).
1H-ЯМР (CDCl3) δ 7,14 (2H, m), 7,06 (1H, t), 6,91 (1H, m), 6,87 (1H, m), 4,22 (2H, t), 3,98 (2H, t), 3,70 (2H, t), 2,68 (2H, t), 2,11 (2H, m), 1,88 (2H, m), 1,57 (2H, m), 1,07 (3H, t), 0,84 (3H, t)
Пример 455: 4-[4-[6-(циклобутокси)-5-метокси-2-пиридил]-2,6-дифтор-фенокси]бутановая кислота

2-(Циклобутокси)-6-йод-3-метокси-пиридин (0,095 г, 0,31 ммоль), полученный в Примере Получения 307, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,115 г, 0,31 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,046 г, 38%).
1H-ЯМР (CDCl3) δ 7,48 (2H, m), 7,18 (1H, d), 7,06 (1H, d), 5,32 (1H, m), 4,22 (2H, t), 3,89 (3H, s), 2,67 (2H, t), 2,55 (2H, m), 2,27 (2H, m), 2,11 (2H, m), 1,88 (1H, m), 1,77 (1H, m)
Пример 456: 4-[4-[6-(циклобутокси)-5-метокси-2-пиридил]-2,6-дифтор-N-метил-анилино]бутановая кислота

2-(Циклобутокси)-6-йод-3-метокси-пиридин (0,076 г, 0,25 ммоль), полученный в Примере Получения 307, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,096 г, 0,25 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,059 г, 58%).
1H-ЯМР (CDCl3) δ 7,43 (2H, m), 7,19 (1H, m), 7,07 (1H, m), 5,33 (1H, m), 3,90 (3H, s), 3,17 (2H, t), 2,88 (3H, s), 2,57 (2H, m), 2,46 (2H, t), 2,27 (2H, m), 1,86 (3H, m), 1,76 (1H, m)
Пример 457: 2-[1-[4-[6-(циклобутокси)-5-метокси-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-(Циклобутокси)-6-йод-3-метокси-пиридин (0,088 г, 0,29 ммоль), полученный в Примере Получения 307, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,118 г, 0,29 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,076 г, 60%).
1H-ЯМР (CDCl3) δ 7,41 (2H, m), 7,17 (1H, d), 7,06 (1H, d), 5,33 (1H, m), 3,89 (3H, s), 3,29 (2H, m), 3,14 (2H, m), 2,57 (2H, m), 2,33 (2H, d), 2,27 (2H, m), 1,97 (1H, m), 1,81 (4H, m), 1,50 (2H, m)
Пример 458: 2-[1-[4-(2,3-дипропоксифенил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
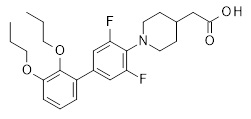
1-Йод-2,3-дипропокси-бензол (0,091 г, 0,28 ммоль), полученный в Примере Получения 305, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,115 г, 0,28 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,069 г, 55%).
1H-ЯМР (CDCl3) δ 7,08 (2H, m), 7,05 (1H, t), 6,88 (2H, m), 3,98 (2H, t), 3,71 (2H, t), 3,30 (2H, m), 3,15 (2H, m), 2,37 (2H, d), 1,98 (1H, m), 1,83 (4H, m), 1,58 (2H, m), 1,49 (2H, m), 1,07 (3H, t), 0,86 (3H, t)
Пример 459: 4-[4-[6-(циклопропилметокси)-5-метокси-2-пиридил]-2,6-дифтор-фенокси]бутановая кислота
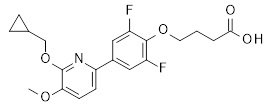
2-(Циклопропилметокси)-6-йод-3-метокси-пиридин (0,085 г, 0,28 ммоль), полученный в Примере Получения 306, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,104 г, 0,28 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,07 г, 57%).
1H-ЯМР (CDCl3) δ 7,49 (2H, m), 7,19 (1H, d), 7,08 (1H, d), 4,32 (2H, d), 4,22 (2H, t), 3,91 (3H, s), 2,67 (2H, t), 2,10 (2H, m), 1,43 (1H, m), 0,64 (2H, m), 0,42 (2H, m)
Пример 460: 4-[4-(2,3-дипропоксифенил)-2,6-дифтор-N-метил-анилино]бутановая кислота

1-Йод-2,3-дипропокси-бензол (0,10 г, 0,31 ммоль), полученный в Примере Получения 305, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,118 г, 0,31 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,045 г, 34%).
1H-ЯМР (CDCl3) δ 7,10 (2H, m), 7,06 (1H, t), 6,88 (2H, m), 3,98 (2H, t), 3,72 (2H, t), 3,18 (2H, m), 2,89 (3H, s), 2,48 (2H, t), 1,87 (4H, m), 1,58 (2H, m), 1,08 (3H, t), 0,84 (3H, t)
Пример 461: 4-[4-[6-(циклопропилметокси)-5-метокси-2-пиридил]-2,6-дифтор-N-метил-анилино]бутановая кислота

2-(Циклопропилметокси)-6-йод-3-метокси-пиридин (0,09 г, 0,29 ммоль), полученный в Примере Получения 306, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,111 г, 0,29 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,076 г, 64%).
1H-ЯМР (CDCl3) δ 7,45 (2H, m), 7,20 (1H, d), 7,08 (1H, d), 4,32 (2H, d), 3,91 (3H, s), 3,19 (2H, t), 2,88 (3H, s), 2,48 (2H, t), 1,88 (2H, m), 1,45 (1H, m), 0,54 (2H, m), 0,42 (2H, m)
Пример 462: 2-[1-[4-[6-(циклопропилметокси)-5-метокси-2-пиридил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-(Циклопропилметокси)-6-йод-3-метокси-пиридин (0,097 г, 0,31 ммоль), полученный в Примере Получения 306, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,126 г, 0,31 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,064 г, 47%).
1H-ЯМР (CDCl3) δ 7,41 (2H, m), 7,17 (1H, d), 7,07 (1H, d), 4,32 (2H, d), 3,90 (3H, s), 3,29 (2H, m), 3,14 (2H, m), 2,36 (2H, d), 1,97 (1H, m), 1,83 (2H, m), 1,47 (3H, m), 0,63 (2H, m), 0,42 (2H, m)
Пример 463: 4-[4-(6-хлориндол-1-ил)-2,6-дифтор-фенокси]бутановая кислота

Стадия A: этиловый эфир 4-[4-(6-хлориндол-1-ил)-2,6-дифтор-фенокси]бутановой кислоты
6-хлор-1H-индол (0,042 г, 0,28 ммоль), этиловый эфир 4-(4-бром-2,6-дифтор-фенокси)бутановой кислоты (0,18 г, 0,56 ммоль), полученный в Примере Получения 339, йодид меди (0,006 г, 0,028 ммоль), фосфат калия (0,12 г, 0,56 ммоль), циклогексан-1,2-диамин (0,007 мл, 0,056 ммоль) и додекан (0,007 мл, 0,028 ммоль) добавляли в закупоренную пробирку. Добавляли 1,4-диоксан (1 мл), и смесь перемешивали при 110°C в течение 18 часов. После завершения реакции реакционный раствор охлаждали и фильтровали через Целит. Органический слой концентрировали при пониженном давлении и очищали колоночной хроматографией с получением целевого соединения (0,083 г, 75%).
1H-ЯМР (CDCl3) δ 7,57 (1H, d), 7,50 (1H, d), 7,22 (1H, d), 7,15 (1H, m), 7,05 (2H, m), 6,65 (1H, d), 4,26 (2H, t) 4,18 (2H, q), 2,60 (2H, t), 2,15 (2H, m), 1,28 (3H, t)
Стадия B: 4-[4-(6-хлориндол-1-ил)-2,6-дифтор-фенокси]бутановая кислота
Этиловый эфир 4-[4-(6-хлориндол-1-ил)-2,6-дифтор-фенокси]бутановой кислоты (0,083 г, 0,21 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,067 г, 65%).
1H-ЯМР (CDCl3) δ 7,57 (1H, d), 7,50 (1H, d), 7,22 (1H, d), 7,15 (1H, m), 7,05 (2H, m), 6,65 (1H, d), 4,26 (2H, t), 2,70 (2H, t), 2,15 (2H, m)
Пример 464: 5-[4-[6-(циклобутокси)-5-метокси-2-пиридил]фенил]-5,5-дифтор-пентановая кислота
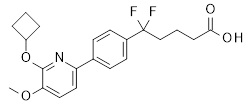
2-(Циклобутокси)-6-йод-3-метокси-пиридин (0,088 г, 0,29 ммоль), полученный в Примере Получения 307, и метиловый эфир 5,5-дифтор-5-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,101 г, 0,29 ммоль), полученный в Примере Получения 169, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,023 г, 20%).
1H-ЯМР (CDCl3) δ 8,00 (2H, d), 7,52 (2H, d), 7,32 (1H, d), 7,10 (1H, d), 5,35 (1H, m), 3,91 (3H, s), 2,57 (2H, m), 2,42 (2H, t), 2,26 (4H, m), 1,80 (4H, m)
Пример 465: 4-[2,6-дифтор-4-(5-фториндол-1-ил)фенокси]бутановая кислота

5-Фтор-1H-индол (0,042 г, 0,31 ммоль) и этиловый эфир 4-(4-бром-2,6-дифтор-фенокси)бутановой кислоты (0,20 г, 0,62 ммоль), полученный в Примере Получения 339, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,05 г, 46%).
1H-ЯМР (CDCl3) δ 7,44 (1H, m), 7,30 (1H, m), 7,27 (1H, d), 7,05 (2H, m), 6,99 (1H, m), 6,63 (1H, d), 4,25 (2H, t), 2,69 (2H, t), 2,14 (2H, m)
Пример 466: 4-[4-[3-(циклопропилметиламино)фенил]-2,6-дифтор-N-метил-анилино]бутановая кислота

3-бром-N-(циклопропилметил)анилин (0,087 г, 0,38 ммоль) и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,146 г, 0,38 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,057 г, 40%).
1H-ЯМР (CDCl3) δ 7,26 (1H, t), 7,03 (2H, m), 6,96 (2H, m), 6,83 (1H, m), 3,16 (2H, t), 3,05 (2H, d), 2,86 (3H, s), 2,45 (2H, t), 1,85 (2H, m), 1,12 (1H, m), 0,57 (2H, m), 0,28 (2H, m)
Пример 467: 4-[2,6-дифтор-N-метил-4-(6-пирролидин-1-ил-2-пиридил)анилино]бутановая кислота
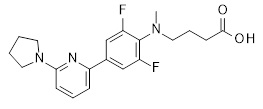
2-хлор-6-пирролидин-1-ил-пиридин (0,099 г, 0,54 ммоль) и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,206 г, 0,54 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадиях A и B Примера 1, с получением целевого соединения (0,108 г, 53%).
1H-ЯМР (CDCl3) δ 7,53 (2H, m), 7,46 (1H, t), 6,88 (1H, d), 6,31 (1H, d), 3,52 (4H, m), 3,16 (2H, t), 2,88 (3H, s), 2,45 (2H, t), 2,02 (4H, m), 1,85 (2H, m)
Пример 468: 4-[2,6-дифтор-4-(5-метоксииндол-1-ил)фенокси]бутановая кислота

5-Метокси-1H-индол (0,046 г, 0,31 ммоль) и этиловый эфир 4-(4-бром-2,6-дифтор-фенокси)бутановой кислоты (0,20 г, 0,62 ммоль), полученный в Примере Получения 339, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,019 г, 17%).
1H-ЯМР (CDCl3) δ 7,44 (1H, d), 7,21 (1H, d), 7,11 (1H, d), 7,06 (2H, m), 6,90 (1H, m), 6,60 (1H, d), 4,24 (2H, t), 3,87 (3H, s), 2,69 (2H, t), 2,13 (2H, m)
Пример 469: 4-[4-(5-цианоиндол-1-ил)-2,6-дифтор-фенокси]бутановая кислота

1H-Индол-5-карбонитрил (0,044 г, 0,31 ммоль) и этиловый эфир 4-(4-бром-2,6-дифтор-фенокси)бутановой кислоты (0,20 г, 0,62 ммоль), полученный в Примере Получения 339, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,034 г, 31%).
1H-ЯМР (CDCl3) δ 8,02 (1H, m), 7,55 (1H, d), 7,48 (1H, m), 7,36 (1H, m), 7,06 (2H, m), 6,76 (1H, m), 4,28 (2H, t), 2,69 (2H, t), 2,14 (2H, m)
Пример 470: 4-[4-[3-(циклопропилметоксиметил)-2-фурил]-2,6-дифтор-N-метил-анилино]бутановая кислота

Стадия A: метиловый эфир 4-[2,6-дифтор-4-(3-формил-2-фурил)-N-метил-анилино]бутановой кислоты
(3-Формил-2-фурил) бороновая кислота (0,05 г, 0,36 ммоль) и метиловый эфир 4-(4-бром-2,6-дифтор-N-метил-анилино)бутановой кислоты (0,11 г, 0,32 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,027 г, 22%).
1H-ЯМР (CDCl3) δ 10,10 (1H, s), 7,45 (1H, d), 7,35 (2H, m), 6,89 (1H, d), 3,66 (3H, s), 3,22 (2H, t), 2,94 (3H, t), 2,39 (2H, t), 1,89 (2H, m)
Стадия B: метиловый эфир 4-[2,6-дифтор-4-[3-(гидроксиметил)-2-фурил]-N-метил-анилино]бутановой кислоты
Метиловый эфир 4-[2,6-дифтор-4-(3-формил-2-фурил)-N-метил-анилино]бутановой кислоты (0,027 г, 0,08 ммоль), полученный на Стадии A, растворяли в 3 мл MeOH. NaBH4 (0,003 г, 0,08 ммоль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 2 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,027 г, 99%).
1H-ЯМР (CDCl3) δ 7,39 (1H, d), 7,17 (2H, m), 6,52 (1H, d), 4,69 (2H, s), 3,65 (3H, s), 3,13 (2H, t), 2,87 (3H, s), 2,38 (2H, t), 1,84 (2H, m), 1,70 (1H, ушир.)
Стадия C: циклопропилметиловый эфир 4-[4-[3-(циклопропилметоксиметил)-2-фурил]-2,6-дифтор-N-метил-анилино]бутановой кислоты
Метиловый эфир 4-[2,6-дифтор-4-[3-(гидроксиметил)-2-фурил]-N-метил-анилино]бутановой кислоты (0,027 г, 0,08 ммоль), полученный на Стадии B, растворяли в 3 мл DMF и охлаждали до 0°C. Добавляли NaH (60%) (0,004 г, 0,09 ммоль) и 18-crown-6 (0,024 г, 0,09 ммоль), и смесь перемешивали в течение 0,5 часов. Добавляли бромметил-циклопропан (0,014 г, 0,10 ммоль), и смесь перемешивали при комнатной температуре в течение 18 часов. Реакционный раствор экстрагировали EtOAc, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,005 г, 14%).
1H-ЯМР (CDCl3) δ 7,40 (1H, d), 7,20 (2H, m), 6,50 (1H, d), 4,47 (2H, s), 3,89 (2H, d), 3,38 (2H, d), 3,15 (2H, t), 2,89 (3H, s), 2,40 (2H, t), 1,86 (2H, m), 1,12 (2H, m), 0,56 (4H, m), 0,25 (4H, m)
Стадия D: 4-[4-[3-(циклопропилметоксиметил)-2-фурил]-2,6-дифтор-N-метил-анилино]бутановая кислота
Циклопропилметиловый эфир 4-[4-[3-(Циклопропилметоксиметил)-2-фурил]-2,6-дифтор-N-метил-анилино]бутановой кислоты (0,005 г, 0,01 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,003 г, 79%).
1H-ЯМР (CDCl3) δ 7,35 (1H, d), 7,22 (2H, m), 6,50 (1H, d), 4,47 (2H, s), 3,38 (2H, d), 3,17 (2H, t), 2,87 (3H, s), 2,46 (2H, t), 1,86 (2H, m), 1,14 (1H, m), 0,57 (2H, m), 0,25 (2H, m)
Пример 471: 4-[2,6-дифтор-4-(4-фториндол-1-ил)фенокси]бутановая кислота

Этиловый эфир 4-Фтор-1H-индол (0,05 г, 0,37 ммоль) и 4-(4-бром-2,6-дифтор-фенокси)бутановой кислоты (0,18 г, 0,55 ммоль), полученный в Примере Получения 339, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,056 г, 43%).
1H-ЯМР (CDCl3) δ 7,30 (1H, m), 7,21 (1H, m), 7,17 (1H, m), 7,01 (2H, m), 6,86 (1H, m), 6,77 (1H, m), 4,26 (2H, t), 2,69 (2H, t), 2,15 (2H, m)
Пример 472: 4-[4-(7-хлориндол-1-ил)-2,6-дифтор-фенокси]бутановая кислота

Этиловый эфир 7-хлор-1H-индол (0,05 г, 0,37 ммоль) и 4-(4-бром-2,6-дифтор-фенокси)бутановой кислоты (0,18 г, 0,55 ммоль), полученный в Примере Получения 339, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,049 г, 36%).
1H-ЯМР (CDCl3) δ7,57 (1H, m), 7,19 (1H, m), 7,10 (2H, m), 6,98 (2H, m), 6,65 (1H, d), 4,28 (2H, t), 2,69 (2H, t), 2,15 (2H, m)
Пример 473: 4-[4-[5-(циклопропилметоксиметил)-2-фурил]-2,6-дифтор-N-метил-анилино]бутановая кислота
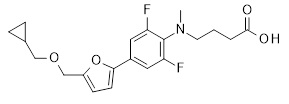
Стадия A: метиловый эфир 4-[2,6-дифтор-4-(5-формил-2-фурил)-N-метил-анилино]бутановой кислоты
(5-Формил-2-фурил)бороновую кислоту (0,05 г, 0,36 ммоль) и метиловый эфир 4-(4-бром-2,6-дифтор-N-метил-анилино)бутановой кислоты (0,11 г, 0,32 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 96, с получением целевого соединения (0,025 г, 22%).
Стадия B: метиловый эфир 4-[2,6-дифтор-4-[5-(гидроксиметил)-2-фурил]-N-метил-анилино]бутановой кислоты
Метиловый эфир 4-[2,6-дифтор-4-(5-формил-2-фурил)-N-метил-анилино]бутановой кислоты (0,025 г, 0,074 ммоль), полученный на Стадии A, растворяли в 3 мл MeOH. NaBH4 (0,003 г, 0,074 ммоль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 30 минут. После добавления уксусной кислоты реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,018 г, 72%).
Стадия C: метиловый эфир 4-[4-[5-(циклопропилметоксиметил)-2-фурил]-2,6-дифтор-N-метил-анилино]бутановой кислоты
Метиловый эфир 4-[2,6-дифтор-4-[5-(гидроксиметил)-2-фурил]-N-метил-анилино]бутановой кислоты (0,018 г, 0,053 ммоль), полученный на Стадии B, растворяли в 5 мл DCM и охлаждали до 0°C. Добавляли PBr3 (0,016 г, 0,058 ммоль), и смесь перемешивали в течение 0,5 часов. Реакционный раствор экстрагировали DCM, высушивали с помощью MgSO4 и растворяли в 5 мл DMF. Добавляли циклопропилметанол и K2CO3, и смесь перемешивали при 50°C в течение 18 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,003 г, 14%).
1H-ЯМР (CDCl3) δ 7,14 (2H, m), 6,52 (1H, d), 6,38 (1H, d), 4,50 (2H, s), 3,65 (3H, s), 3,34 (2H, d), 3,12 (2H, t), 2,86 (3H, s), 2,38 (2H, t), 1,86 (2H, m), 1,09 (1H, m), 0,55 (2H, m), 0,22 (2H, m)
Стадия D: 4-[4-[5-(циклопропилметоксиметил)-2-фурил]-2,6-дифтор-N-метил-анилино]бутановая кислота
Метиловый эфир 4-[4-[5-(Циклопропилметоксиметил)-2-фурил]-2,6-дифтор-N-метил-анилино]бутановой кислоты, полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,002 г, 69%).
1H-ЯМР (CDCl3) δ 7,14 (2H, m), 6,53 (1H, d), 6,38 (1H, d), 4,51 (2H, s), 3,35 (2H, d), 3,15 (2H, t), 2,86 (3H, s), 2,46 (2H, t), 1,86 (2H, m), 1,09 (1H, m), 0,55 (2H, m), 0,22 (2H, m)
Пример 474: 4-[4-[6-(циклопропилметокси)индол-1-ил]-2,6-дифтор-фенокси]бутановая кислота
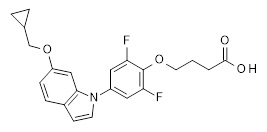
6-(Циклопропилметокси)-1H-индол (0,017 г, 0,09 ммоль), полученный в Примере Получения 311, и этиловый эфир 4-(4-бром-2,6-дифтор-фенокси)бутановой кислоты (0,060 г, 0,18 ммоль), полученный в Примере Получения 339, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,004 г, 11%).
1H-ЯМР (CDCl3) δ 7,52 (1H, m), 7,11 (1H, m), 7,05 (2H, m), 7,01 (1H, m), 6,87 (1H, m), 6,59 (1H, m), 4,25 (2H, t), 3,82 (2H, d), 2,70 (2H, t), 2,15 (2H, m), 1,26 (1H, m), 0,65 (2H, m), 0,37 (2H, m)
Пример 475: 4-[4-(7-хлориндол-1-ил)-2,6-дифтор-N-метил-анилино]бутановая кислота

7-хлор-1H-индол (0,047 г, 0,31 ммоль) и метиловый эфир 4-(4-бром-2,6-дифтор-N-метил-анилино)бутановой кислоты (0,1 г, 0,31 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,042 г, 36%).
1H-ЯМР (CDCl3) δ 7,57 (1H, m), 7,19 (1H, m), 7,12 (1H, m), 7,08 (1H, t), 6,93 (2H, m), 6,65 (1H, m), 3,21 (2H, m), 2,92 (3H, s), 2,50 (2H, m), 1,90 (2H, m)
Пример 476: 4-[4-[6-(циклобутокси)индол-1-ил]-2,6-дифтор-фенокси]бутановая кислота

6-(Циклобутокси)-1H-индол (0,026 г, 0,14 ммоль), полученный в Примере Получения 308, и этиловый эфир 4-(4-бром-2,6-дифтор-фенокси)бутановой кислоты (0,068 г, 0,21 ммоль), полученный в Примере Получения 339, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,008 г, 14%).
1H-ЯМР (CDCl3) δ 7,50 (1H, m), 7,11 (1H, m), 7,06 (2H, m), 6,94 (1H, m), 6,77 (1H, m), 6,58 (1H, m), 4,66 (1H, m), 4,24 (2H, t), 2,69 (2H, t), 2,45 (2H, m), 2,16 (4H, m), 1,86 (1H, m), 1,70 (1H, m)
Пример 477: 4-[4-[5-(циклобутокси)индол-1-ил]-2,6-дифтор-фенокси]бутановая кислота

5-(Циклобутокси)-1H-индол (0,021 г, 0,14 ммоль), полученный в Примере Получения 310, и этиловый эфир 4-(4-бром-2,6-дифтор-фенокси)бутановой кислоты (0,068 г, 0,21 ммоль), полученный в Примере Получения 339, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,002 г, 3%).
1H-ЯМР (CDCl3) δ 7,41 (1H, m), 7,21 (1H, m), 7,02 (3H, m), 6,85 (1H, m), 6,58 (1H, m), 4,68 (1H, m), 4,24 (2H, t), 2,67 (2H, m), 2,48 (2H, m), 2,17 (4H, m), 1,81 (1H, m), 1,69 (1H, m)
Пример 478: 4-[2,6-дифтор-4-(4-метоксииндол-1-ил)фенокси]бутановая кислота

Этиловый эфир 4-Метокси-1H-индол (0,055 г, 0,37 ммоль) и 4-(4-бром-2,6-дифтор-фенокси)бутановой кислоты (0,180 г, 0,55 ммоль), полученный в Примере Получения 339, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,011 г, 8%).
1H-ЯМР (CDCl3) δ 7,15 (3H, m), 7,08 (2H, m), 6,78 (1H, m), 6,59 (1H, m), 4,24 (2H, t), 3,97 (3H, s), 2,68 (2H, t), 2,14 (2H, m)
Пример 479: 4-[2,6-дифтор-4-(7-метоксииндол-1-ил)фенокси]бутановая кислота

7-Метокси-1H-индол (0,055 г, 0,37 ммоль) и этиловый эфир 4-(4-бром-2,6-дифтор-фенокси)бутановой кислоты (0,180 г, 0,55 ммоль), полученный в Примере Получения 339, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,045 г, 34%).
1H-ЯМР (CDCl3) δ 7,26 (1H, m), 7,08 (2H, m), 6,96 (2H, m), 6,69 (1H, m), 6,62 (1H, m), 4,24 (2H, t), 3,76 (3H, s), 2,69 (2H, t), 2,14 (2H, m)
Пример 480: 4-[2,6-дифтор-4-[5-(метоксиметил)индазол-1-ил]фенокси]бутановая кислота

Стадия A: этиловый эфир 4-[2,6-дифтор-4-(5-формилиндазол-1-ил)фенокси]бутановой кислоты
1H-индазол-5-карбальдегид (0,054 г, 0,37 ммоль) и этиловый эфир 4-(4-бром-2,6-дифтор-фенокси)бутановой кислоты (0,180 г, 0,55 ммоль), полученный в Примере Получения 339, вводили в реакцию таким же образом, как на Стадии A Примера 463, с получением целевого соединения (0,022 г, 15%).
1H-ЯМР (CDCl3) δ 10,10 (1H, s), 8,35 (2H, m), 8,04 (1H, m), 7,81 (1H, m), 7,34 (2H, m), 4,26 (2H, t), 4,17 (2H, q), 2,61 (2H, t), 2,14 (2H, m), 1,28 (3H, t)
Стадия B: этиловый эфир 4-[2,6-дифтор-4-[5-(гидроксиметил)индазол-1-ил]фенокси]бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(5-формилиндазол-1-ил)фенокси]бутановой кислоты (0,022 г, 0,057 ммоль), полученный на Стадии A, растворяли в 3 мл MeOH. NaBH4 (0,003 г, 0,057 ммоль) добавляли при 0°C, и смесь перемешивали при комнатной температуре в течение 30 минут. После добавления уксусной кислоты реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,020 г, 98%).
1H-ЯМР (CDCl3) δ 8,18 (1H, s), 7,79 (1H, m), 7,73 (1H, m), 7,50 (1H, m), 7,34 (2H, m), 4,83 (2H, s), 4,23 (2H, t), 4,17 (2H, q), 2,60 (2H, t), 2,12 (2H, m), 1,78 (1H, ушир.), 1,28 (3H, t)
Стадия C: этиловый эфир 4-[2,6-дифтор-4-[5-(метоксиметил)индазол-1-ил]фенокси]бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-[5-(гидроксиметил)индазол-1-ил]фенокси]бутановой кислоты (0,020 г, 0,057 ммоль), полученный на Стадии B, растворяли в 1 мл DMF и охлаждали до 0°C. Добавляли NaH (60%) (0,003 г, 0,007 ммоль) и тетрабутиламмоний йодид (0,021 г, 0,057 ммоль), и смесь перемешивали в течение 0,5 часов. Добавляли метилйодид (0,012 г, 0,086 ммоль), и смесь перемешивали при комнатной температуре в течение 18 часов. Реакционный раствор экстрагировали EtOAc, высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,002 г, 9%).
Стадия D: 4-[2,6-дифтор-4-[5-(метоксиметил)индазол-1-ил]фенокси]бутановая кислота
Этиловый эфир 4-[2,6-дифтор-4-[5-(метоксиметил)индазол-1-ил]фенокси]бутановой кислоты (0,002 г, 0,005 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,0007 г, 37%).
1H-ЯМР (CDCl3) δ 8,16 (1H, m), 7,50 (2H, m), 7,47 (1H, m), 7,34 (2H, m), 4,58 (2H, s), 4,25 (2H, t), 3,42 (3H, s), 2,69 (2H, t), 2,14 (2H, m)
Пример 481: 2-[1-[4-(7-хлориндол-1-ил)-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

Этиловый эфир 7-хлор-1H-индол (0,042 г, 0,28 ммоль) и 2-[1-(4-бром-2,6-дифтор-фенил)-4-пиперидил]уксусной кислоты (0,1 г, 0,28 ммоль), полученный на Стадии A Примера Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,045 г, 40%).
1H-ЯМР (CDCl3) δ 7,56 (1H, m), 7,18 (1H, m), 7,08 (2H, m), 6,91 (2H, m), 6,63 (1H, m), 3,32 (2H, m), 3,18 (2H, m), 2,40 (2H, m), 2,00 (1H, m), 1,90 (2H, m), 1,52 (2H, m)
Пример 482: 4-[4-[6-(циклобутокси)индазол-1-ил]-2,6-дифтор-фенокси]бутановая кислота

6-(Циклобутокси)-1H-индазол (0,04 г, 0,21 ммоль), полученный в Примере Получения 309, и этиловый эфир 4-(4-бром-2,6-дифтор-фенокси)бутановой кислоты (0,103 г, 0,32 ммоль), полученный в Примере Получения 339, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,05 г, 59%).
1H-ЯМР (CDCl3) δ 8,06 (1H, m), 7,63 (1H, m), 7,29 (2H, m), 6,96 (1H, m), 6,84 (1H, m), 4,72 (1H, m), 4,25 (2H, m), 2,68 (2H, m), 2,50 (2H, m), 2,23 (2H, m), 2,16 (2H, m), 1,90 (1H, m), 1,75 (1H, m)
Пример 483: 4-[2-хлор-4-[6-(циклобутокси)индазол-1-ил]-6-фторфенокси]бутановая кислота

6-(Циклобутокси)-1H-индазол (0,1 г, 0,53 ммоль), полученный в Примере Получения 309, и этиловый эфир 4-(4-бром-2-хлор-6-фтор-фенокси)бутановой кислоты (0,2 г, 0,58 ммоль), полученный на Стадии A Примера Получения 221, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,048 г, 22%).
1H-ЯМР (CDCl3) δ 8,06 (1H, m), 7,63 (1H, m), 7,54 (1H, m), 7,41 (1H, m), 6,96 (1H, m), 6,84 (1H, m), 4,72 (1H, m), 4,22 (2H, t), 2,74 (2H, t), 2,48 (2H, m), 2,19 (4H, m), 1,91 (1H, m), 1,76 (1H, m)
Пример 484: 4-[4-[4-(циклобутокси)-6-метил-пиримидин-2-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота

2-хлор-4-(циклобутокси)-6-метил-пиримидин (0,082 г, 0,41 ммоль), полученный в Примере Получения 228, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,157 г, 0,41 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,118 г, 73%).
1H-ЯМР (CDCl3) δ 7,88 (2H, m), 6,40 (1H, s), 5,29 (1H, m), 3,21 (2H, t), 2,92 (3H, s), 2,53 (2H, m), 2,45 (3H, s), 2,43 (2H, m), 2,19 (2H, m), 1,87 (3H, m), 1,73 (1H, m)
Пример 485: 4-[4-[4-(циклобутокси)пиримидин-2-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота
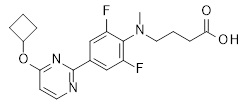
2-хлор-4-(циклобутокси)пиримидин (0,081 г, 0,44 ммоль), полученный в Примере Получения 230, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-бутановой кислоты (0,168 г, 0,44 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,119 г, 72%).
1H-ЯМР (CDCl3) δ 8,46 (1H, d), 7,87 (2H, m), 6,56 (1H, d), 5,32 (1H, m), 3,22 (2H, t), 2,93 (3H, s), 2,53 (2H, m), 2,44 (2H, t), 2,20 (2H, m), 1,88 (3H, m), 1,78 (1H, m)
Пример 486: 4-[4-[2-(циклобутокси) тиазол-4-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота

4-бром-2-(циклобутокси)тиазол (0,083 г, 0,35 ммоль), полученный в Примере Получения 289, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,134 г, 0,35 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,085 г, 63%).
1H-ЯМР (CDCl3) δ 7,28 (2H, m), 6,77 (1H, s), 5,18 (1H, m), 3,15 (2H, t), 2,86 (3H, s), 2,54 (2H, m), 2,45 (2H, t), 2,25 (2H, m), 1,85 (3H, m), 1,67 (1H, m)
Пример 487: 2-[1-[4-[6-(циклобутокси)индазол-1-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

6-(Циклобутокси)-1H-индазол (0,1 г, 0,53 ммоль), полученный в Примере Получения 309, и этиловый эфир 2-[1-(4-бром-2,6-дифтор-фенил)-4-пиперидил]уксусной кислоты (0,21 г, 0,58 ммоль), полученный на Стадии A Примера Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,026 г, 11%).
1H-ЯМР (CDCl3) δ 8,09 (1H, s), 7,67 (1H, d), 7,26 (2H, m), 7,00 (1H, m), 6,87 (1H, m), 4,76 (1H, m), 3,34 (2H, m), 3,22 (2H, t), 2,53 (2H, m), 2,42 (2H, d), 2,27 (2H, m), 2,03 (1H, m), 1,93 (3H, m), 1,80 (1H, m), 1,56 (2H, m)
Пример 488: 4-[4-[6-(циклобутокси)пиразин-2-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота
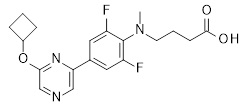
2-хлор-6-(циклобутокси)пиразин (0,06 г, 0,32 ммоль), полученный в Примере Получения 232, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,123 г, 0,32 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,079 г, 65%).
1H-ЯМР (CDCl3) δ 8,46 (1H, s), 8,09 (1H, s), 7,50 (2H, m), 5,26 (1H, m), 3,21 (2H, t), 2,92 (3H, s), 2,54 (2H, m), 2,44 (2H, t), 2,21 (2H, m), 1,89 (3H, m), 1,75 (1H, m)
Пример 489: 4-[4-[4-(циклопропилметокси)-6-метил-пиримидин-2-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота

2-хлор-4-(циклопропилметокси)-6-метил-пиримидин (0,067 г, 0,34 ммоль), полученный в Примере Получения 227, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,13 г, 0,34 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,086 г, 64%).
1H-ЯМР (CDCl3) δ 7,89 (2H, m), 6,46 (1H, s), 4,27 (2H, d), 3,21 (2H, t), 2,92 (3H, s), 2,46 (3H, s), 2,43 (2H, t), 1,88 (2H, m), 1,32 (1H, m), 0,63 (2H, m), 0,39 (2H, m)
Пример 490: 4-[4-[4-(циклопропилметокси)пиримидин-2-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота

2-хлор-4-(циклопропилметокси)пиримидин (0,073 г, 0,39 ммоль), полученный в Примере Получения 231, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,15 г, 0,39 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,097 г, 66%).
1H-ЯМР (CDCl3) δ 8,46 (1H, d), 7,88 (2H, m), 6,62 (1H, d), 4,30 (2H, d), 3,22 (2H, t), 2,92 (3H, s), 2,44 (2H, t), 1,89 (2H, m), 1,33 (1H, m), 0,65 (2H, m), 0,41 (2H, m)
Пример 491: 4-[4-[6-(циклопропилметокси)пиразин-2-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота

2-хлор-6-(циклопропилметокси)пиразин (0,065 г, 0,35 ммоль), полученный в Примере Получения 233, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,134 г, 0,35 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,071 г, 53%).
1H-ЯМР (CDCl3) δ8,47 (1H, s), 8,16 (1H, s), 7,50 (2H, m), 4,25 (2H, d), 3,21 (2H, t), 2,92 (3H, s), 2,44 (2H, t), 1,89 (2H, m), 1,33 (1H, m), 0,66 (2H, m), 0,40 (2H, m)
Пример 492: 4-[4-[6-(циклобутокси)индазол-1-ил]-2,6-дифтор-N-метил-анилино]бутановая кислота

6-(Циклобутокси)-1H-индазол (0,1 г, 0,53 ммоль), полученный в Примере Получения 309, и метиловый эфир 4-(4-бром-2,6-дифтор-N-метил-анилино)бутановой кислоты (0,187 г, 0,58 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,079 г, 35%).
1H-ЯМР (CDCl3) δ 8,05 (1H, m), 7,63 (1H, d), 7,25 (2H, m), 6,99 (1H, m), 6,83 (1H, m), 4,73 (1H, m), 3,18 (2H, t), 2,90 (3H, s), 2,50 (4H, m), 2,22 (2H, m), 1,88 (3H, m), 1,77 (1H, m)
Пример 493: 4-[4-[6-(циклопропилметокси)-2-пиридил]-2,6-дифтор-N-метил-анилино]бутановая кислота
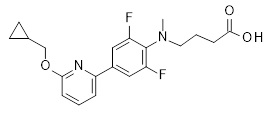
2-хлор-6-циклопропилметокси-пиридин (0,083 г, 0,45 ммоль), полученный в Примере Получения 43, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,172 г, 0,45 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,14 г, 82%).
1H-ЯМР (CDCl3) δ 7,60 (1H, t), 7,50 (2H, m), 7,20 (1H, d), 6,70 (1H, d), 4,23 (2H, d), 3,17 (2H, t), 2,89 (3H, s), 2,45 (2H, t), 1,87 (2H, m), 1,32 (1H, m), 0,61 (2H, m), 0,39 (2H, m)
Пример 494: 2-[1-[4-[6-(циклобутокси)индазол-1-ил]-2,6-дифтор-фенил]пирролидин-3-ил]уксусная кислота

6-(Циклобутокси)-1H-индазол (0,15 г, 0,79 ммоль), полученный в Примере Получения 309, и этиловый эфир 2-[1-(4-бром-2,6-дифтор-фенил)пирролидин-3-ил]уксусной кислоты (0,302 г, 0,87 ммоль), полученный на Стадии F Примера Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 463 и Стадии B Примера 1, с получением целевого соединения (0,05 г, 15%).
1H-ЯМР (CDCl3) δ 8,04 (1H, m), 7,61 (1H, d), 7,17 (2H, m), 6,92 (1H, m), 6,82 (1H, m), 4,71 (1H, m), 3,77 (1H, m), 3,62 (2H, m), 3,36 (1H, m), 2,70 (1H, m), 2,57 (2H, m), 2,48 (2H, m), 2,27 (3H, m), 1,89 (1H, m), 1,71 (2H, m)
Пример 495: 2-{1-[2,6-дифтор-4-(6-пропокси-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота

2-хлор-6-пропокси-пиразин (0,063 г, 0,36 ммоль), полученный в Примере Получения 235, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,119 г, 0,30 ммоль), полученный в Примере Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,029 г, 21%).
1H-ЯМР (CDCl3) δ8,44 (1H, s), 8,07 (1H, s), 7,49 (2H, m), 4,37 (2H, t), 3,79 (2H, m), 3,64 (1H, m), 3,41 (1H, m), 2,67 (1H, m), 2,55 (2H, m), 2,19 (1H, m), 1,83 (2H, q), 1,65 (1H, m), 1,06 (3H, t)
Пример 496: 2-{1-[2,6-дифтор-4-(6-изобутокси-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота

2-хлор-6-изобутокси-пиразин (0,061 г, 0,33 ммоль), полученный в Примере Получения 237, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,107 г, 0,27 ммоль), полученный в Примере Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,049 г, 38%).
1H-ЯМР (DMSO-d6) δ8,77 (1H, s), 8,17 (1H, s), 7,74 (2H, m), 4,19 (2H, d), 3,69 (2H, m), 3,57 (1H, m), 3,34 (1H, m), 2,49 (1H, m), 2,41 (2H, m), 2,10 (2H, m), 1,60 (1H, m), 1,02 (6H, d)
Пример 497: 2-{1-[2,6-дифтор-4-(6-циклопентокси-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота

2-хлор-6-циклопентокси-пиразин (0,075 г, 0,38 ммоль), полученный в Примере Получения 238, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,123 г, 0,31 ммоль), полученный в Примере Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,056 г, 36%).
1H-ЯМР (DMSO-d6) δ8,75 (1H, s), 8,11 (1H, s), 7,74 (2H, m), 5,49 (1H, m), 3,69 (2H, m), 3,57 (1H, m), 3,34 (1H, m), 2,51 (1H, m), 2,41 (2H, m), 2,04 (3H, m), 1,81~1,52 (7H, m)
Пример 498: 2-{1-[2,6-дифтор-4-(6-бутокси-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота
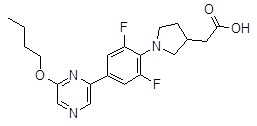
2-Бутокси-6-хлор-пиразин (0,071 г, 0,38 ммоль), полученный в Примере Получения 236, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,123 г, 0,31 ммоль), полученный в Примере Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,1 г, 67%).
1H-ЯМР (DMSO-d6) δ8,77 (1H, s), 8,16 (1H, s), 7,74 (2H, m), 4,41 (2H, t), 3,69 (2H, m), 3,57 (1H, m), 3,34 (1H, m), 2,49 (1H, m), 2,41 (2H, m), 2,09 (1H, m), 1,77 (2H, m), 1,59 (1H, m), 1,47 (2H, m), 0,96 (3H, t)
Пример 499: 2-{1-[2,6-дифтор-4-(4-пропокси-пиримидин-2-ил)фенил]пирролидин-3-ил}уксусная кислота
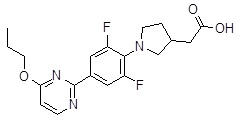
2-хлор-4-пропокси-пиримидин (0,068 г, 0,39 ммоль), полученный в Примере Получения 241, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,130 г, 0,33 ммоль), полученный в Примере Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,034 г, 23%).
1H-ЯМР (DMSO-d6) δ8,53 (1H, d), 7,82 (2H, m), 6,77 (1H, d), 4,41 (2H, t), 3,71 (2H, m), 3,59 (1H, m), 3,34 (1H, m), 2,49 (1H, m), 2,41 (2H, m), 2,07 (1H, m), 1,80 (2H, q), 1,59 (1H, m), 1,00 (3H, t)
Пример 500: 2-{1-[2,6-дифтор-4-(4-изопропокси-пиримидин-2-ил)фенил]пирролидин-3-ил}уксусная кислота
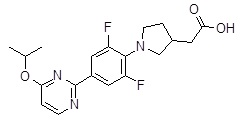
2-хлор-4-изопропокси-пиримидин (0,073 г, 0,42 ммоль), полученный в Примере Получения 240, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,138 г, 0,35 ммоль), полученный в Примере Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,042 г, 26%).
1H-ЯМР (DMSO-d6) δ8,52 (1H, d), 7,83 (2H, m), 6,72 (1H, d), 5,49 (1H, m), 3,71 (2H, m), 3,59 (1H, m), 3,34 (1H, m), 2,50 (1H, m), 2,41 (2H, m), 2,07 (1H, m), 1,59 (1H, m), 1,37 (6H, d)
Пример 501: 2-{1-[2,6-дифтор-4-(4-этокси-пиримидин-2-ил)фенил]пирролидин-3-ил}уксусная кислота

2-хлор-4-этокси-пиримидин (0,098 г, 0,61 ммоль), полученный в Примере Получения 239, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,197 г, 0,50 ммоль), полученный в Примере Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,071 г, 32%).
1H-ЯМР (DMSO-d6) δ8,52 (1H, d), 7,84 (2H, m), 6,76 (1H, d), 4,51 (2H, q), 3,70 (2H, m), 3,59 (1H, m), 3,34 (1H, m), 2,51 (1H, m), 2,41 (2H, m), 2,09 (1H, m), 1,58 (1H, m), 1,37 (3H, t)
Пример 502: 2-{1-[2,6-дифтор-4-(4-изобутокси-пиримидин-2-ил)фенил]пирролидин-3-ил}уксусная кислота

2-хлор-4-изобутокси-пиримидин (0,083 г, 0,44 ммоль), полученный в Примере Получения 242, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,146 г, 0,37 ммоль), полученный в Примере Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,059 г, 34%).
1H-ЯМР (DMSO-d6) δ8,53 (1H, d), 7,82 (2H, m), 6,78 (1H, d), 4,24 (2H, d), 3,70 (2H, m), 3,60 (1H, m), 3,35 (1H, m), 2,51 (1H, m), 2,42 (2H, m), 2,09 (2H, m), 1,59 (1H, m), 1,01 (6H, d)
Пример 503: 2-{1-[2,6-дифтор-4-(6-изобутиламино-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота

6-хлор-N-изобутил-пиразин-2-амин (0,278 г, 1,50 ммоль), полученный в Примере Получения 251, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,3 г, 0,75 ммоль), полученный в Примере Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,172 г, 58%).
1H-ЯМР (CDCl3) δ8,10 (1H, s), 7,75 (1H, s), 7,43 (2H, m), 4,89 (1H, ушир.), 3,71 (2H, m), 3,61 (1H, m), 3,39 (1H, m), 3,22 (2H, d), 2,64 (1H, m), 2,52 (2H, m), 2,16 (1H, m), 1,93 (1H, m), 1,65 (1H, m), 0,99 (6H, d)
Пример 504: 2-{1-[2,6-дифтор-4-(6-циклопентиламино-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота
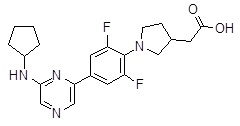
6-хлор-N-циклопентил-пиразин-2-амин (0,297 г, 1,50 ммоль), полученный в Примере Получения 252, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,3 г, 0,75 ммоль), полученный в Примере Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,17 г, 56%).
1H-ЯМР (DMSO-d6) δ8,17 (1H, s), 7,75 (1H, s), 7,60 (2H, m), 7,07 (1H, d), 4,14 (1H, m), 3,61 (2H, m), 3,49 (1H, m), 3,29 (1H, m), 2,47 (1H, m), 2,36 (2H, m), 2,03 (1H, m), 1,94 (2H, m), 1,66 (2H, m), 1,54 (3H, m), 1,44 (2H, m)
Пример 505: 2-{1-[2,6-дифтор-4-(6-изопропиламино-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота
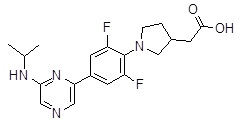
6-хлор-N-изопропил-пиразин-2-амин (0,257 г, 1,50 ммоль), полученный в Примере Получения 250, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,3 г, 0,75 ммоль), полученный в Примере Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,12 г, 42%).
1H-ЯМР (DMSO-d6) δ8,21 (1H, s), 7,78 (1H, s), 7,64 (2H, m), 6,99 (1H, d), 4,11 (1H, m), 3,65 (2H, m), 3,53 (1H, m), 3,33 (1H, m), 2,51 (1H, m), 2,40 (2H, m), 2,09 (1H, m), 1,58 (1H, m), 1,21 (6H, d)
Пример 506: 2-{1-[2,6-дифтор-4-(6-диэтиламино-пиразин-2-ил)фенил]пирролидин-3-ил}уксусная кислота

6-хлор-N,N-диэтил-пиразин-2-амин (0,278 г, 1,50 ммоль), полученный в Примере Получения 253, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,3 г, 0,75 ммоль), полученный в Примере Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,17 г, 58%).
1H-ЯМР (DMSO-d6) δ8,31 (1H, s), 8,00 (1H, s), 7,66 (2H, m), 3,67 (2H, m), 3,59 (4H, q), 3,56 (1H, m), 3,33 (1H, m), 2,50 (1H, m), 2,41 (2H, m), 2,09 (1H, m), 1,58 (1H, m), 1,17 (6H, t)
Пример 507: 3-[6-(6-циклобутокси-пиразин-2-ил)-тиохроман-2-ил]-пропионовая кислота

2-хлор-6-(циклобутокси)пиразин (0,137 г, 0,74 ммоль), полученный в Примере Получения 232, и этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-тиохроман-2-ил]-пропионовой кислоты (0,14 г, 0,37 ммоль), полученный в Примере Получения 5, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,085 г, 62%).
1H-ЯМР (CDCl3) δ8,51 (1H, s), 8,05 (1H, s), 7,70 (2H, m), 7,18 (1H, d), 5,26 (1H, m), 3,43 (1H, m), 2,97 (2H, m), 2,60 (2H, m), 2,51 (2H, m), 2,26~2,18 (3H, m), 2,07 (2H, m), 1,91~1,70 (3H, m)
Пример 508: 2-[1-[4-[4-(4-хлорфенокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
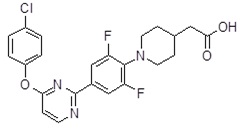
2-хлор-4-(4-хлор-фенокси)-пиримидин (0,235 г, 0,98 ммоль), полученный в Примере Получения 312, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,014 г, 6%).
1H-ЯМР (CDCl3) δ 8,60 (1H, d), 7,71 (2H, m), 7,41 (2H, m), 7,15 (2H, m), 6,73 (1H, d), 3,35 (2H, m), 3,13 (2H, m), 2,35 (2H, d), 1,97 (1H, m), 1,80 (2H, m), 1,47 (2H, m)
Пример 509: 2-[1-[4-[4-(4-хлорфенокси)пиримидин-2-ил]-2,6-дифтор-фенил]-пирролидин-3-ил]уксусная кислота

2-хлор-4-(4-хлор-фенокси)-пиримидин (0,145 г, 0,60 ммоль), полученный в Примере Получения 312, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,2 г, 0,50 ммоль), полученный в Примере Получения 91, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,014 г, 10%).
1H-ЯМР (CDCl3) δ 8,56 (1H, d), 7,68 (2H, m), 7,42 (2H, m), 7,15 (2H, m), 6,67 (1H, d), 3,76 (2H, m), 3,64 (1H, m), 3,42 (1H, m), 2,63 (1H, m), 2,52 (2H, m), 2,16 (1H, m), 1,64 (1H, m)
Пример 510: 2-[1-[4-[4-фенокси-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-4-фенокси-пиримидин (0,122 г, 0,59 ммоль), полученный в Примере Получения 313, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,075 г, 36%).
1H-ЯМР (CDCl3) δ 8,58 (1H, d), 7,74 (2H, m), 7,46 (2H, m), 7,30 (1H, m), 7,20 (2H, m), 6,69 (1H, d), 3,36 (2H, m), 3,13 (2H, m), 2,34 (2H, d), 1,96 (1H, m), 1,80 (2H, m), 1,45 (2H, m)
Пример 511: 2-[1-[4-[4-(4-фторфенокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(4-фторфенокси)-пиримидин (0,133 г, 0,59 ммоль), полученный в Примере Получения 314, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,061 г, 28%).
1H-ЯМР (DMSO-d6) δ 8,70 (1H, d), 7,60 (2H, m), 7,31 (4H, m), 6,98 (1H, d), 3,35 (2H, m), 3,01 (2H, m), 2,16 (2H, d), 1,78 (1H, m), 1,68 (2H, m), 1,27 (2H, m)
Пример 512: 2-[1-[4-[4-(4-пиридин-3-илокси-пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(4-пиридин-3-илокси)-пиримидин (0,122 г, 0,59 ммоль), полученный в Примере Получения 315, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,081 г, 38%).
1H-ЯМР (CDCl3) δ 8,64 (2H, m), 8,57 (1H, d), 7,65 (2H, m), 7,62 (1H, m), 7,45 (1H, m), 6,83 (1H, d), 3,34 (2H, m), 3,11 (2H, m), 2,33 (2H, d), 1,96 (1H, m), 1,80 (2H, m), 1,45 (2H, m)
Пример 513: 2-[1-[2,6-дифтор-4-[6-(4-фторфенокси)пиразин-2-ил]фенил]-4-пиперидил]уксусная кислота
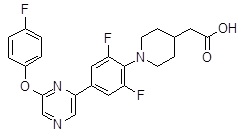
2-хлор-4-(4-фторфенокси)-пиразин (0,133 г, 0,59 ммоль), полученный в Примере Получения 316, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,143 г, 65%).
1H-ЯМР (CDCl3) δ 8,62 (1H, s), 8,28 (1H, s), 7,34 (2H, m), 7,20~7,11 (4H, m), 3,33 (2H, m), 3,13 (2H, m), 2,35 (2H, d), 1,97 (1H, m), 1,82 (2H, m), 1,45 (2H, m)
Пример 514: 2-[1-[4-[4-(4-метоксифенокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(4-метокси-фенокси)-пиримидин (0,140 г, 0,59 ммоль), полученный в Примере Получения 317, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,059 г, 26%).
1H-ЯМР (CDCl3) δ 8,56 (1H, d), 7,75 (2H, m), 7,11 (2H, m), 6,96 (2H, m), 6,65 (1H, d), 3,85 (3H, s), 3,36 (2H, m), 3,13 (2H, m), 2,35 (2H, d), 1,97 (1H, m), 1,80 (2H, m), 1,47 (2H, m)
Пример 515: 2-[1-[2,6-дифтор-4-[4-(4-фторфенокси)-6-метил-пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(4-фторфенокси)-6-метил-пиримидин (0,140 г, 0,59 ммоль), полученный в Примере Получения 318, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,097 г, 43%).
1H-ЯМР (CDCl3) δ 7,74 (2H, m), 7,13 (4H, m), 6,52 (1H, s), 3,34 (2H, m), 3,13 (2H, m), 2,51 (3H, s), 2,34 (2H, d), 1,96 (1H, m), 1,80 (2H, m), 1,47 (2H, m)
Пример 516: 2-[1-[4-[4-(п-толилокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-4-п-толилоксипиримидин (0,130 г, 0,59 ммоль), полученный в Примере Получения 319, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,07 г, 32%).
1H-ЯМР (CDCl3) δ 8,56 (1H, d), 7,76 (2H, m), 7,24 (2H, d), 7,08 (2H, d), 6,66 (1H, d), 3,36 (2H, m), 3,13 (2H, m), 2,40 (3H, s), 2,35 (2H, d), 1,97 (1H, m), 1,80 (2H, m), 1,47 (2H, m)
Пример 517: 2-[1-[4-[4-(3,4-дифторфенокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота
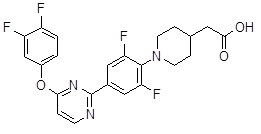
2-хлор-4-(3,4-дифтор-фенокси)-пиримидин (0,143 г, 0,59 ммоль), полученный в Примере Получения 320, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,08 г, 35%).
1H-ЯМР (CDCl3) δ 8,61 (1H, d), 7,69 (2H, m), 7,24 (1H, m), 7,09 (1H, m), 6,96 (1H, m), 6,76 (1H, d), 3,36 (2H, m), 3,14 (2H, m), 2,35 (2H, d), 1,97 (1H, m), 1,80 (2H, m), 1,47 (2H, m)
Пример 518: 4-[4-(5-хлор-2-метил-бензофуран-7-ил)-2,6-дифтор-фенокси]-масляная кислота

7-бром-5-хлор-2-метил-бензофуран (0,030 г, 0,12 ммоль), полученный в Примере Получения 328, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,045 г, 0,12 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,023 г, 49%).
1H-ЯМР (CDCl3) δ 7,41 (3H, m), 7,24 (1H, s), 6,38 (1H, s), 4,27 (2H, t), 2,70 (2H, t), 2,49 (3H, s), 2,14 (2H, m)
Пример 519: 5-[4-(5-хлор-2-метил-бензофуран-7-ил)-2,6-дифтор-фенил]-гексановая кислота
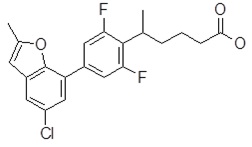
7-бром-5-хлор-2-метил-бензофуран (0,030 г, 0,12 ммоль), полученный в Примере Получения 328, и этиловый эфир 5-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]гексановой кислоты (0,047 г, 0,12 ммоль), полученный в Примере Получения 32, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 53%).
1H-ЯМР (CDCl3) δ 7,41 (1H, s), 7,32 (2H, d), 7,29 (1H, s), 6,38 (1H, s), 3,27 (1H, m), 2,89 (3H, s), 2,38 (2H, t), 1,86 (1H, m), 1,75 (1H, m), 1,66 (1H, m), 1,55 (1H, m), 1,38 (3H, d)
Пример 520: 4-[(3ʹ-циклобутилметокси-3,5-дифтор-бифенил-4-ил)-метил-амино]-масляная кислота
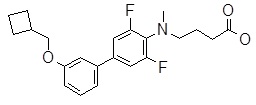
1-бром-3-циклобутилметокси-бензол (0,050 г, 0,21 ммоль), полученный в Примере Получения 323, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,077 г, 0,21 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 31%).
1H-ЯМР (CDCl3) δ 7,43 (1H, t), 7,08 (4H, m), 6,90 (1H, m), 3,97 (2H, d), 3,18 (2H, t), 2,87 (3H, s), 2,81 (1H, m), 2,48 (2H, t), 2,16 (2H, m), 1,91 (6H, m)
Пример 521: 4-(3ʹ-циклобутилметокси-3,5-дифтор-бифенил-4-илокси)-масляная кислота

1-бром-3-циклобутилметокси-бензол (0,030 г, 0,12 ммоль), полученный в Примере Получения 323, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,046 г, 0,12 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,015 г, 32%).
1H-ЯМР (CDCl3) δ 7,32 (1H, t), 7,12 (2H, m), 7,16 (1H, m), 7,02 (1H, m), 6,90 (1H, m), 4,23 (2H, t), 3,97 (2H, d), 2,80 (1H, m), 2,69 (2H, t), 2,16 (4H, m), 1,91 (4H, m)
Пример 522: 4-{[4-(6-циклобутилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота

2-хлор-6-циклобутилметокси-пиридин (0,050 г, 0,25 ммоль), полученный в Примере Получения 324, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,093 г, 0,25 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,030 г, 30%).
1H-ЯМР (CDCl3) δ 7,61 (1H, t), 7,53 (2H, m), 7,20 (1H, d), 6,68 (1H, d), 4,37 (2H, d), 3,20 (2H, t), 2,89 (3H, s), 2,81 (1H, m), 2,47 (2H, t), 2,15 (2H, m), 1,92 (6H, m)
Пример 523: 4-[4-(6-циклобутилметокси-пиридин-2-ил)-2,6-дифтор-фенокси]-масляная кислота
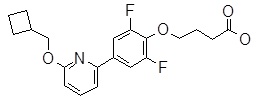
2-хлор-6-циклобутилметокси-пиридин (0,030 г, 0,15 ммоль), полученный в Примере Получения 324, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,056 г, 0,15 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,018 г, 31%).
1H-ЯМР (CDCl3) δ 7,60 (3H, m), 7,21 (1H, d), 6,69 (1H, d), 4,36 (2H, d), 4,24 (2H, t), 2,81 (1H, m), 2,69 (2H, t), 2,14 (4H, m), 1,92 (4H, m)
Пример 524: 4-[(3ʹ-циклопропилметокси-3,5-дифтор-бифенил-4-ил)-метил-амино]-масляная кислота
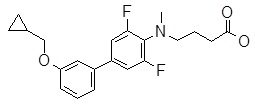
1-бром-3-циклопропилметокси-бензол (0,050 г, 0,22 ммоль), полученный в Примере Получения 280, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,081 г, 0,22 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 30%).
1H-ЯМР (CDCl3) δ 7,32 (1H, t), 7,07 (4H, m), 6,89 (1H, m), 3,85 (2H, d), 3,16 (2H, t), 2,87 (3H, s), 2,48 (2H, t), 1,87 (2H, m), 1,31 (1H, m), 0,66 (2H, m), 0,38 (2H, m)
Пример 525: 4-[(3ʹ-циклопентилокси-3,5-дифтор-бифенил-4-ил)-метил-амино]-масляная кислота
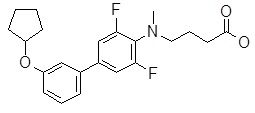
1-бром-3-циклопентилокси-бензол (0,050 г, 0,21 ммоль), полученный в Примере Получения 297, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,077 г, 0,21 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,026 г, 32%).
1H-ЯМР (CDCl3) δ 7,32 (1H, t), 7,07 (3H, m), 7,00 (1H, m), 6,85 (1H, m), 4,81 (1H, m), 3,16 (2H, t), 2,87 (3H, s), 2,48 (2H, t), 1,92 (8H, m), 1,64 (2H, m)
Пример 526: 4-(3ʹ-циклопропилметокси-3,5-дифтор-4ʹ-метокси-бифенил-4-илокси)-масляная кислота

4-бром-2-циклопропилметокси-1-метокси-бензол (0,050 г, 0,19 ммоль), полученный в Примере Получения 282, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,072 г, 0,19 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,032 г, 42%).
1H-ЯМР (CDCl3) δ 7,06 (3H, m), 6,99 (1H, m), 6,93 (1H, d), 4,21 (2H, t), 3,94 (5H, m), 2,68 (2H, t), 2,13 (2H, m), 1,37 (1H, m), 0,67 (2H, m), 0,39 (2H, m)
Пример 527: 4-(3ʹ-циклопропилметокси-3,5,4ʹ-трифтор-бифенил-4-илокси)-масляная кислота
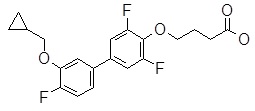
4-бром-2-циклопропилметокси-1-фтор-бензол (0,050 г, 0,20 ммоль), полученный в Примере Получения 283, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,076 г, 0,20 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 32%).
1H-ЯМР (CDCl3) δ 7,13 (1H, m), 7,05 (4H, m), 4,21 (2H, t), 3,93 (2H, d), 2,68 (2H, t), 2,12 (2H, m), 1,34 (1H, m), 0,67 (2H, m), 0,39 (2H, m)
Пример 528: 4-(5ʹ-циклобутокси-3,5,3ʹ-трифтор-бифенил-4-илокси)-масляная кислота
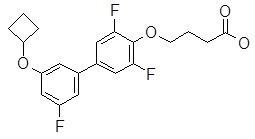
1-бром-3-циклобутокси-5-фтор-бензол (0,050 г, 0,20 ммоль), полученный в Примере Получения 284, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,076 г, 0,20 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,030 г, 39%).
1H-ЯМР (CDCl3) δ 7,08 (2H, m), 6,77 (1H, m), 6,72 (1H, m), 6,51 (1H, m), 4,66 (1H, m), 4,24 (2H, t), 2,68 (2H, t), 2,47 (2H, m), 2,12 (4H, m), 1,89 (1H, m), 1,74 (1H, m)
Пример 529: 4-[(5ʹ-циклобутилметокси-3,5-дифтор-2ʹ-метил-бифенил-4-ил)-метил-амино]-масляная кислота
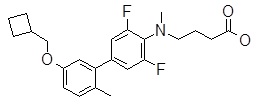
2-бром-4-циклобутилметокси-1-метил-бензол (0,050 г, 0,20 ммоль), полученный в Примере Получения 325, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,072 г, 0,20 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,024 г, 30%).
1H-ЯМР (CDCl3) δ 7,14 (1H, d), 6,83 (3H, m), 6,74 (1H, m), 3,92 (2H, d), 3,19 (2H, t), 2,88 (3H, s), 2,76 (1H, m), 2,51 (2H, t), 2,20 (3H, s), 2,14 (2H, m), 1,95 (6H, m)
Пример 530: 4-(5ʹ-циклобутилметокси-3,5-дифтор-2ʹ-метил-бифенил-4-илокси)-масляная кислота

2-бром-4-циклобутилметокси-1-метил-бензол (0,025 г, 0,10 ммоль), полученный в Примере Получения 325, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,036 г, 0,10 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,020 г, 52%).
1H-ЯМР (CDCl3) δ 7,14 (1H, d), 6,86 (3H, m), 6,73 (1H, m), 4,24 (2H, t), 3,91 (2H, d), 2,75 (1H, m), 2,70 (2H, t), 2,18 (3H, s), 2,14 (4H, m), 1,95 (4H, m)
Пример 531: 4-{[4-(5-хлор-6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-метил-амино}-масляная кислота

3,6-дихлор-2-циклобутокси-пиридин (0,050 г, 0,23 ммоль), полученный в Примере Получения 298, и метиловый эфир 4-{[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-метил-амино}-масляной кислоты (0,085 г, 0,23 ммоль), полученный в Примере Получения 183, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,015 г, 16%).
1H-ЯМР (CDCl3) δ 7,64 (1H, d), 7,46 (2H, m), 7,16 (1H, d), 5,33 (1H, m), 3,19 (2H, t), 2,89 (3H, s), 2,54 (2H, m), 2,46 (2H, t), 2,28 (2H, m), 1,89 (3H, m), 1,77 (1H, m)
Пример 532: 4-(3ʹ-циклопропилметокси-3,5-дифтор-4ʹ-метил-бифенил-4-илокси)-масляная кислота

4-бром-2-циклопропилметокси-1-метил-бензол (0,050 г, 0,21 ммоль), полученный в Примере Получения 327, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,077 г, 0,21 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 32%).
1H-ЯМР (CDCl3) δ 7,18 (1H, d), 7,09 (2H, m), 6,99 (1H, d), 6,88 (1H, s), 4,22 (2H, t), 3,88 (2H, d), 2,68 (2H, t), 2,27 (3H, s), 2,12 (2H, m), 1,29 (1H, m), 0,64 (2H, m), 0,39 (2H, m)
Пример 533: 4-[4-(5-хлор-6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенокси]-масляная кислота

3,6-дихлор-2-циклобутокси-пиридин (0,050 г, 0,23 ммоль), полученный в Примере Получения 298, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,085 г, 0,23 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,020 г, 22%).
1H-ЯМР (CDCl3) δ 7,65 (1H, d), 7,53 (2H, m), 7,16 (1H, d), 5,33 (1H, m), 4,25 (2H, t), 2,68 (2H, t), 2,55 (2H, m), 2,26 (2H, m), 2,12 (2H, m), 1,90 (1H, m), 1,77 (1H, m)
Пример 534: 4-(4ʹ-хлор-3ʹ-циклопропилметокси-3,5-дифтор-бифенил-4-илокси)-масляная кислота

4-бром-1-хлор-2-циклопропилметокси-бензол (0,050 г, 0,19 ммоль), полученный в Примере Получения 326, и этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,071 г, 0,19 ммоль), полученный в Примере Получения 16, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,015 г, 20%).
1H-ЯМР (CDCl3) δ 7,40 (1H, d), 7,08 (2H, m), 6,99 (2H, m), 4,23 (2H, t), 3,95 (2H, d), 2,68 (2H, t), 2,13 (2H, m), 1,35 (1H, m), 0,68 (2H, m), 0,42 (2H, m)
Пример 535: 5-(5ʹ-циклобутокси-3,3ʹ-дифтор-бифенил-4-ил)-пентановая кислота

1-бром-3-циклобутокси-5-фтор-бензол (0,050 г, 0,20 ммоль), полученный в Примере Получения 284, и этиловый эфир 5-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,072 г, 0,20 ммоль), полученный в Примере Получения 201, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 34%).
1H-ЯМР (CDCl3) δ 7,22 (3H, m), 6,78 (2H, m), 6,51 (1H, m), 4,67 (1H, m), 2,70 (2H, t), 2,46 (4H, m), 2,21 (2H, m), 1,89 (1H, m), 1,71 (5H, m)
Пример 536: 4-(5ʹ-циклобутокси-3,3ʹ-дифтор-бифенил-4-илокси)-масляная кислота
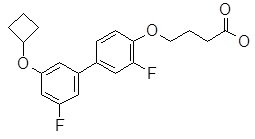
1-бром-3-циклобутокси-5-фтор-бензол (0,025 г, 0,10 ммоль), полученный в Примере Получения 284, и этиловый эфир 4-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,036 г, 0,10 ммоль), полученный в Примере Получения 198, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,021 г, 57%).
1H-ЯМР (CDCl3) δ 7,52 (2H, m), 7,01 (1H, t), 6,75 (2H, m), 6,48 (1H, m), 4,66 (1H, m), 4,14 (2H, t), 2,65 (2H, t), 2,47 (2H, m), 2,19 (4H, m), 1,89 (1H, m), 1,71 (1H, m)
Пример 537: 5-[4-(6-циклобутокси-пиридин-2-ил)-2-фторфенил]-пентановая кислота

2-хлор-6-циклобутокси-пиридин (0,050 г, 0,27 ммоль), полученный в Примере Получения 29, и этиловый эфир 5-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-фенил]-пентановой кислоты (0,095 г, 0,27 ммоль), полученный в Примере Получения 201, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,019 г, 20%).
1H-ЯМР (CDCl3) δ 7,70 (2H, m), 7,51 (1H, t), 7,36 (1H, d), 7,25 (1H, m), 7,03 (1H, d), 4,46 (1H, m), 2,72 (2H, m), 2,61 (2H, m), 2,42 (2H, m), 2,20 (4H, m), 1,72 (4H, m)
Пример 538: 4-[4-(6-циклобутокси-пиридин-2-ил)-2-фторфенокси]-масляная кислота

2-хлор-6-циклобутокси-пиридин (0,035 г, 0,19 ммоль), полученный в Примере Получения 29, и этиловый эфир 4-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,067 г, 0,19 ммоль), полученный в Примере Получения 198, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,030 г, 46%).
1H-ЯМР (CDCl3) δ 7,81 (1H, m), 7,73 (1H, d), 7,49 (1H, t), 7,32 (1H, d), 7,01 (2H, m), 4,44 (1H, m), 4,17 (2H, t), 2,65 (4H, m), 2,20 (6H, m)
Пример 539: 4-[4-(6-циклобутилметокси-пиридин-2-ил)-2-фторфенокси]-масляная кислота
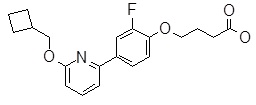
2-хлор-6-циклобутилметокси-пиридин (0,030 г, 0,15 ммоль), полученный в Примере Получения 324, и этиловый эфир 4-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,054 г, 0,15 ммоль), полученный в Примере Получения 198, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,024 г, 44%).
1H-ЯМР (CDCl3) δ 7,81 (1H, m), 7,70 (1H, d), 7,59 (1H, t), 7,22 (1H, d), 7,02 (1H, t), 6,64 (1H, d), 4,37 (2H, d), 4,15 (2H, t), 2,82 (1H, m), 2,65 (2H, t), 2,20 (4H, m), 1,92 (4H, m)
Пример 540: 4-[4-(6-циклобутилсульфанил-пиридин-2-ил)-2-фторфенокси]-масляная кислота

2-хлор-6-циклобутилсульфанил-пиридин (0,030 г, 0,15 ммоль), полученный в Примере Получения 299, и этиловый эфир 4-[2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,053 г, 0,15 ммоль), полученный в Примере Получения 198, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,025 г, 46%).
1H-ЯМР (CDCl3) δ 7,81 (1H, m), 7,73 (1H, d), 7,49 (1H, t), 7,31 (1H, d), 7,01 (2H, m), 4,44 (1H, m), 4,17 (2H, t), 2,65 (4H, m), 2,20 (6H, m)
Пример 541: 2-(3ʹ-циклобутокси-3,5,5ʹ-трифтор-бифенил-4-илоксиметил)-циклопропанкарбоновая кислота

Стадия A: 5ʹ-циклобутокси-3,5,3ʹ-трифтор-бифенил-4-ол
1-бром-3-циклобутокси-5-фтор-бензол (1,0 г, 4,08 ммоль), полученный в Примере Получения 284, и 2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол (1,04 г, 4,08 ммоль), полученный на Стадии B Примера Получения 16, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,50 г, 42%).
1H-ЯМР (CDCl3) δ 7,10 (2H, m), 6,72 (2H, m), 6,51 (1H, m), 5,21 (1H, s), 4,67 (1H, m), 2,47 (2H, m), 2,19 (2H, m), 1,89 (1H, m), 1,72 (1H, m)
Стадия B: 2-(3ʹ-циклобутокси-3,5,5ʹ-трифтор-бифенил-4-илоксиметил)-циклопропанкарбоновая кислота
5ʹ-циклобутокси-3,5,3ʹ-трифтор-бифенил-4-ол (0,045 г, 0,15 ммоль), полученный на Стадии A, и этиловый эфир 2-гидроксиметил-циклопропанкарбоновой кислоты (0,033 г, 0,23 ммоль) последовательно вводили в реакцию таким же образом, как в Примере Получения 62 и Стадия B Примера 1, с получением целевого соединения (0,035 г, 58%).
1H-ЯМР (CDCl3) δ 7,08 (2H, m), 6,77 (1H, d), 6,72 (1H, s), 6,51 (1H, m), 4,67 (1H, m), 4,17 (1H, m), 4,03 (1H, m), 2,48 (2H, m), 2,20 (2H, m), 1,96 (1H, m), 1,90 (1H, m), 1,72 (2H, m), 1,36 (1H, m), 1,06 (1H, m)
Пример 542: 2-[4-(4-циклобутокси-6-метил-пиримидин-2-ил)-2,6-дифтор-феноксиметил]-циклопропанкарбоновая кислота

2-хлор-4-циклобутокси-6-метил-пиримидин (0,050 г, 0,25 ммоль), полученный в Примере Получения 228, и этиловый эфир 2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты (0,096 г, 0,25 ммоль), полученный в Примере Получения 321, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,030 г, 31%).
1H-ЯМР (CDCl3) δ 7,99 (2H, m), 6,42 (1H, s), 5,31 (1H, m), 4,12 (2H, m), 2,51 (2H, m), 2,46 (3H, s), 2,20 (2H, m), 1,96 (1H, m), 1,89 (1H, m), 1,72 (2H, m), 1,35 (1H, m), 1,08 (1H, m)
Пример 543: 2-[4-(4-циклобутокси-пиримидин-2-ил)-2,6-дифтор-феноксиметил]-циклопропанкарбоновая кислота
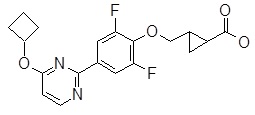
2-хлор-4-циклобутокси-пиримидин (0,050 г, 0,27 ммоль), полученный в Примере Получения 230, и этиловый эфир 2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты (0,104 г, 0,27 ммоль), полученный в Примере Получения 321, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,022 г, 22%).
1H-ЯМР (CDCl3) δ 8,46 (1H, d), 7,98 (2H, m), 6,59 (1H, d), 5,34 (1H, m), 4,17 (1H, m), 4,10 (1H, m), 2,55 (2H, m), 2,23 (2H, m), 1,88 (2H, m), 1,78 (2H, m), 1,35 (1H, m), 1,07 (1H, m)
Пример 544: 2-[4-(6-циклобутокси-пиридин-2-ил)-2,6-дифтор-феноксиметил]-циклопропанкарбоновая кислота

2-хлор-6-циклобутокси-пиридин (0,030 г, 0,16 ммоль), полученный в Примере Получения 29, и этиловый эфир 2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты (0,062 г, 0,16 ммоль), полученный в Примере Получения 321, вводили в реакцию таким же образом, как в Примере 1, с получением целевого соединения (0,026 г, 42%).
1H-ЯМР (CDCl3) δ 7,60 (3H, m), 7,21 (1H, d), 6,65 (1H, d), 5,26 (1H, m), 4,14 (1H, m), 4,06 (1H, m), 2,52 (2H, m), 2,20 (2H, m), 2,01 (1H, m), 1,85 (1H, m), 1,75 (2H, m), 1,35 (1H, m), 1,06 (1H, m)
Пример 545: 2-[4-(4-циклопропилметокси-пиримидин-2-ил)-2,6-дифтор-феноксиметил]-циклопропанкарбоновая кислота
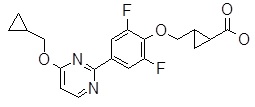
2-хлор-4-циклопропилметокси-пиримидин (0,035 г, 0,19 ммоль), полученный в Примере Получения 231, и этиловый эфир 2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты (0,073 г, 0,16 ммоль), полученный в Примере Получения 321, вводили в реакцию таким же образом, как в Примере 96, с получением целевого соединения (0,030 г, 42%).
1H-ЯМР (CDCl3) δ 8,47 (1H, d), 7,99 (2H, m), 6,65 (1H, d), 4,30 (2H, d), 4,18 (1H, m), 4,12 (1H, m), 1,97 (1H, m), 1,71 (1H, m), 1,36 (2H, m), 1,07 (1H, m), 0,66 (2H, m), 0,41 (2H, m)
Пример 546: 2-[4-(4-циклопропилметокси-6-метил-пиримидин-2-ил)-2,6-дифтор-феноксиметил]-циклопропанкарбоновая кислота

2-хлор-4-циклопропилметокси-6-метил-пиримидин (0,030 г, 0,15 ммоль), полученный в Примере Получения 227, и этиловый эфир 2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты (0,058 г, 0,25 ммоль), полученный в Примере Получения 321, вводили в реакцию таким же образом, как в Примере 96, с получением целевого соединения (0,026 г, 44%).
1H-ЯМР (CDCl3) δ 7,99 (2H, m), 6,50 (1H, s), 4,28 (2H, d), 4,12 (2H, m), 2,47 (3H, s), 1,98 (1H, m), 1,71 (1H, m), 1,34 (2H, m), 1,07 (1H, m), 0,65 (2H, m), 0,40 (2H, m)
Пример 547: 2-[4-(6-циклопропилметокси-пиразин-2-ил)-2,6-дифтор-феноксиметил]-циклопропанкарбоновая кислота

2-хлор-6-циклопропилметокси-пиразин (0,030 г, 0,16 ммоль), полученный в Примере Получения 233, и этиловый эфир 2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты (0,062 г, 0,25 ммоль), полученный в Примере Получения 321, вводили в реакцию таким же образом, как в Примере 96, с получением целевого соединения (0,015 г, 25%).
1H-ЯМР (CDCl3) δ 8,48 (1H, s), 8,19 (1H, s), 7,59 (2H, m), 4,26 (2H, d), 4,19 (1H, m), 4,06 (1H, m), 1,98 (1H, m), 1,72 (1H, m), 1,36 (2H, m), 1,06 (1H, m), 0,67 (2H, m), 0,41 (2H, m)
Пример 548: 2-[4-(6-циклобутокси-4-метил-пиридин-2-ил)-2,6-дифтор-феноксиметил]-циклопропанкарбоновая кислота

2-хлор-6-циклобутокси-4-метил-пиридин (0,030 г, 0,15 ммоль), полученный в Примере Получения 271, и этиловый эфир 2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты (0,058 г, 0,15 ммоль), полученный в Примере Получения 321, вводили в реакцию таким же образом, как в Примере 96, с получением целевого соединения (0,025 г, 42%).
1H-ЯМР (CDCl3) δ 7,58 (2H, m), 7,05 (1H, s), 6,47 (1H, s), 5,25 (1H, m), 4,14 (1H, m), 4,04 (1H, m), 2,51 (2H, m), 2,33 (3H, s), 2,17 (2H, m), 1,98 (1H, m), 1,87 (1H, m), 1,72 (2H, m), 1,35 (1H, m), 1,07 (1H, m)
Пример 549: 2-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-феноксиметил]-циклопропанкарбоновая кислота

2-хлор-6-циклопропилметокси-пиридин (0,030 г, 0,16 ммоль), полученный в Примере Получения 43, и этиловый эфир 2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты (0,062 г, 0,15 ммоль), полученный в Примере Получения 321, вводили в реакцию таким же образом, как в Примере 96, с получением целевого соединения (0,024 г, 36%).
1H-ЯМР (CDCl3) δ 7,62 (3H, m), 7,22 (1H, d), 6,73 (1H, d), 4,24 (1H, d), 4,15 (1H, m), 4,04 (1H, m), 1,98 (2H, m), 1,72 (1H, m), 1,35 (2H, m), 1,07 (1H, m), 0,65 (2H, m), 0,39 (2H, m)
Пример 550: 2-[4-(6-циклобутокси-пиразин-2-ил)-2,6-дифтор-феноксиметил]-циклопропанкарбоновая кислота
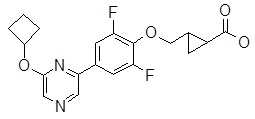
2-хлор-6-циклобутокси-пиразин (0,030 г, 0,16 ммоль), полученный в Примере Получения 232, и этиловый эфир 2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты (0,062 г, 0,15 ммоль), полученный в Примере Получения 321, вводили в реакцию таким же образом, как в Примере 96, с получением целевого соединения (0,026 г, 40%).
1H-ЯМР (CDCl3) δ 8,52 (1H, s), 8,17 (1H, s), 7,57 (2H, m), 5,28 (1H, d), 4,18 (1H, m), 4,07 (1H, m), 2,54 (2H, m), 2,23 (2H, m), 1,98 (2H, m), 1,77 (2H, m), 1,36 (1H, m), 1,07 (1H, m)
Пример 551: 2-[4-(2-циклобутокси-тиазол-4-ил)-2,6-дифтор-феноксиметил]-циклопропанкарбоновая кислота
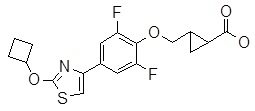
4-бром-2-циклобутокси-тиазол (0,030 г, 0,13 ммоль), полученный в Примере Получения 289, и этиловый эфир 2-[2,6-дифтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты (0,049 г, 0,13 ммоль), полученный в Примере Получения 321, вводили в реакцию таким же образом, как в Примере 96, с получением целевого соединения (0,023 г, 44%).
1H-ЯМР (CDCl3) δ 7,35 (2H, m), 6,78 (1H, s), 5,19 (1H, d), 4,12 (1H, m), 4,02 (1H, m), 2,53 (2H, m), 2,27 (2H, m), 1,95 (1H, m), 1,89 (1H, m), 1,70 (2H, m), 1,31 (1H, m), 1,04 (1H, m)
Пример 552: 2-[2-хлор-4-(6-циклопропилметокси-пиридин-2-ил)-6-фтор-феноксиметил]-циклопропанкарбоновая кислота

2-хлор-6-циклопропилметокси-пиридин (0,030 г, 0,16 ммоль), полученный в Примере Получения 43, и этиловый эфир 2-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты (0,065 г, 0,16 ммоль), полученный в Примере Получения 322, вводили в реакцию таким же образом, как в Примере 96, с получением целевого соединения (0,021 г, 33%).
1H-ЯМР (CDCl3) δ 7,80 (1H, s), 7,70 (1H, m), 7,62 (1H, t), 7,23 (1H, d), 6,73 (1H, d), 4,24 (2H, d), 4,15 (1H, m), 4,01 (1H, m), 2,00 (1H, m), 1,75 (1H, m), 1,36 (2H, m), 1,09 (1H, m), 0,65 (2H, m), 0,44 (2H, m)
Пример 553: 2-[2-хлор-4-(4-циклобутокси-6-метил-пиримидин-2-ил)-6-фтор-феноксиметил]-циклопропанкарбоновая кислота

2-хлор-4-циклобутокси-6-метил-пиримидин (0,030 г, 0,15 ммоль), полученный в Примере Получения 228, и этиловый эфир 2-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты (0,060 г, 0,15 ммоль), полученный в Примере Получения 322, вводили в реакцию таким же образом, как в Примере 96, с получением целевого соединения (0,020 г, 33%).
1H-ЯМР (CDCl3) δ 8,24 (1H, s), 8,08 (1H, d), 6,42 (1H, s), 5,31 (1H, m), 4,17 (1H, m), 4,06 (1H, m), 2,51 (2H, m), 2,46 (3H, s), 2,21 (2H, m), 2,02 (1H, m), 1,91 (1H, m), 1,77 (2H, m), 1,36 (1H, m), 1,09 (1H, m)
Пример 554: 2-[2-хлор-4-(6-циклобутокси-пиридин-2-ил)-6-фтор-феноксиметил]-циклопропанкарбоновая кислота

2-хлор-6-циклобутокси-пиридин (0,030 г, 0,16 ммоль), полученный в Примере Получения 29, и этиловый эфир 2-[2-хлор-6-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-феноксиметил]-циклопропанкарбоновой кислоты (0,065 г, 0,16 ммоль), полученный в Примере Получения 322, вводили в реакцию таким же образом, как в Примере 96, с получением целевого соединения (0,024 г, 37%).
1H-ЯМР (CDCl3) δ 7,79 (1H, s), 7,70 (1H, m), 7,60 (1H, t), 7,22 (1H, d), 6,66 (1H, d), 5,26 (1H, m), 4,18 (1H, m), 4,02 (1H, m), 2,53 (2H, m), 2,19 (2H, m), 2,04 (1H, m), 1,89 (1H, m), 1,76 (2H, m), 1,36 (1H, m), 1,09 (1H, m)
Пример 555: 3-[6-(3-циклобутокси-фенил)-хроман-2-ил]-пропионовая кислота

Стадия A: этиловый эфир 3-[6-(3-циклобутокси-фенил)-хроман-2-ил]-пропионовой кислоты
Этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,069 г, 0,19 ммоль), полученный в Примере Получения 4, и 1-циклобутокси-3-йод-бензол (0,058 г, 0,21 ммоль), полученный в Примере Получения 21, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,048 г, 66%).
1H-ЯМР (400 МГц, CDCl3); δ 7,33-7,27 (m, 3H), 7,10-7,08 (m, 1H), 6,98-6,97 (m, 1H), 6,85-6,83 (d, 1H), 6,75-6,72 (m, 1H), 4,72-4,65 (m, 1H), 4,18-4,13 (q, 2H), 4,09-4,03 (m, 1H), 2,93-2,79 (m, 2H), 2,64-2,43 (m, 4H), 2,24-2,17 (m, 2H), 2,04-2,00 (m, 3H), 1,88-1,58 (m, 3H), 1,29-1,25 (t, 3H)
Стадия B: 3-[6-(3-циклобутокси-фенил)-хроман-2-ил]-пропионовая кислота
Этиловый эфир 3-[6-(3-циклобутокси-фенил)-хроман-2-ил]-пропионовой кислоты (0,048 г, 0,126 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,042 г, 94%).
1H-ЯМР (400 МГц, CDCl3); δ 7,31-7,27 (m, 3H), 7,10-7,08 (m, 1H), 6,98-3,97 (m, 1H), 6,85-6,83 (d, 1H), 6,75-6,73 (m, 1H), 4,73-7,65 (m, 1H), 4,09-4,06 (m, 1H), 2,94-2,72 (m, 2H), 2,69-2,61 (m, 2H), 2,50-2,43 (m, 2H), 2,22-2,17 (m, 2H), 2,06-2,01 (m, 3H), 1,88-1,66 (m, 3H)
Пример 556: 3-[6-(6-пропокси-пиридин-2-ил)-хроман-2-ил]-пропионовая кислота

Стадия A: этиловый эфир 3-[6-(6-пропокси-пиридин-2-ил)-хроман-2-ил]-пропионовой кислоты
Этиловый эфир 3-[6-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-хроман-2-ил]-пропионовой кислоты (0,09 г, 0,24 ммоль), полученный в Примере Получения 4, и 2-хлор-6-пропокси-пиридин (0,044 г, 0,26 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,023 г, 27%).
1H-ЯМР (500 МГц, CDCl3); δ 7,75-7,73 (m, 2H), 7,58-7,55 (t, 1H), 7,22-7,20 (d, 1H), 6,85-6,83 (d, 1H), 6,60-6,58 (d, 1H), 4,37-4,34 (t, 2H), 4,18-4,13 (q, 2H), 4,09-4,02 (m, 1H), 2,92-2,81 (m, 2H), 2,65-2,52 (m, 2H), 2,06-2,00 (m, 3H), 1,88-1,74 (m, 3H), 1,28-1,25 (t, 3H), 1,06-1,03 (t, 3H)
Стадия B: 3-[6-(6-пропокси-пиридин-2-ил)-хроман-2-ил]-пропионовая кислота
Этиловый эфир 3-[6-(6-Пропокси-пиридин-2-ил)-хроман-2-ил]-пропионовой кислоты (0,048 г, 0,126 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,042 г, 94%).
1H-ЯМР (400 МГц, CDCl3); δ 7,75-7,73 (m, 2H), 7,58-7,52 (m, 1H), 7,22-7,20 (d, 1H0, 6,86-6,84 (m, 1H), 6,61-6,59 (m, 1H), 4,38-4,34 (t, 2H), 4,11-4,09 (m, 1H), 2,93-2,83 (m, 2H), 2,72-2,60 (m, 2H), 2,06-2,01 (m, 3H), 1,88-1,80 (m, 3H), 1,07-1,03 (t, 3H)
Пример 557: 4-[2,6-дифтор-4-(1H-индол-6-ил)-фенокси]-бутановая кислота
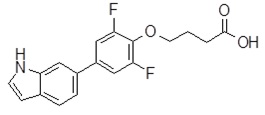
Стадия A: этиловый эфир 4-[2,6-дифтор-4-(1H-индол-6-ил)-фенокси]-бутановой кислоты
Этиловый эфир 4-(4-бром-2,6-дифтор-фенокси)-бутановой кислоты (0,20 г, 0,62 ммоль), полученный в Примере Получения 339, и 6-индолилбороновую кислоту (0,11 г, 0,68 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,21 г, 94%).
1H-ЯМР (400 МГц, CDCl3); δ 8,23 (s ушир., 1H), 7,69-7,67 (d, 1H), 7,52 (s, 1H), 7,28-7,27 (m, 2H), 7,20-7,13 (m, 2H), 6,58-6,57 (m, 1H), 4,21-4,13 (m, 4H), 2,61-2,58 (t, 2H), 2,13-2,09 (m, 2H), 1,28-1,25 (t, 3H)
Стадия B: 4-[2,6-дифтор-4-(1H-индол-6-ил)-фенокси]-бутановая кислота
Этиловый эфир 4-[2,6-дифтор-4-(1H-индол-6-ил)-фенокси]-бутановой кислоты (0,025 г, 0,07 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,019 г, 84%).
1H-ЯМР (400 МГц, MeOD-d4); δ 7,63-7,61 (m, 2H), 7,33-7,26 (m, 4H), 6,48-6,47 (m, 1H), 4,22-4,19 (t, 2H), 2,60-2,56 (t, 2H), 2,10-2,03 (m, 2H)
Пример 558: 4-[2,6-дифтор-4-(1-изопропил-1H-индол-6-ил)-фенокси]-бутановая кислота
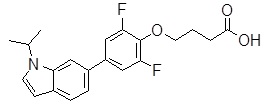
Стадия A: этиловый эфир 4-[2,6-дифтор-4-(1-изопропил-1H-индол-6-ил)-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(1H-индол-6-ил)-фенокси]-бутановой кислоты (0,05 г, 0,14 ммоль), полученный на Стадии A Примера 557, растворяли в N,N-диметилформамиде (5 мл) и охлаждали до 0°C. Добавляли NaH (60%) (0,003 г, 0,21 ммоль) и 2-йодпропан (0,02 мл, 0,21 ммоль), и смесь перемешивали при комнатной температуре в течение 16 часов. После добавления воды реакционный раствор экстрагировали для отделения органического слоя. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,03 г, 54%).
1H-ЯМР (400 МГц, CDCl3); δ 7,67-7,65 (d, 1H), 7,47 (s, 1H), 7,28-7,17 (m, 4H), 6,53-6,52 (d, 1H), 4,75-4,73 (m, 1H), 4,21-4,14 (m, 4H), 2,61-2,59 (t, 2H), 2,14-2,10 (m, 2H), 1,56-1,55 (dd, 6H), 1,29-1,26 (t, 3H)
Стадия B: 4-[2,6-дифтор-4-(1-изопропил-1H-индол-6-ил)-фенокси]-бутановая кислота
Этиловый эфир 4-[2,6-дифтор-4-(1-изопропил-1H-индол-6-ил)-фенокси]-бутановой кислоты (0,03 г, 0,075 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,02 г, 72%).
1H-ЯМР (400 МГц, CDCl3); δ7,67-7,65 (d, 1H), 7,47 (s, 1H), 7,28-7,17 (m, 4H), 6,54-6,53 (d, 1H), 4,78-4,71 (m, 1H), 4,24-4,21 (t, 2H), 2,71-2,67 (t, 2H), 2,16-2,09 (m, 2H), 1,57-1,55 (d, 6H)
Пример 559: 4-[4-(1-циклопропилметил-1H-индол-6-ил)-2,6-дифтор-фенокси]-бутановая кислота

Стадия A: этиловый эфир 4-[4-(1-циклопропилметил-1H-индол-6-ил)-2,6-дифтор-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(1H-индол-6-ил)-фенокси]-бутановой кислоты (0,05 г, 0,14 ммоль), полученный на Стадии A Примера 557, и йодметил-циклопропан (0,02 мл, 0,21 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,03 г, 52%).
1H-ЯМР (400 МГц, CDCl3); δ 7,68-7,66 (d, 1H), 7,47 (s, 1H), 7,28-7,24 (m, 2H), 7,22-7,16 (m, 2H), 6,52-6,51 (m, 1H), 4,22-4,19 (t, 2H), 4,04-4,02 (d, 2H), 3,71 (s, 3H), 2,64-2,60 (t, 2H), 2,15-2,08 (m, 2H), 1,32-1,25 (m, 1H), 0,68-0,63 (m, 2H), 0,41-0,37 (m, 2H)
Стадия B: 4-[4-(1-циклопропилметил-1H-индол-6-ил)-2,6-дифтор-фенокси]-бутановая кислота
Этиловый эфир 4-[4-(1-циклопропилметил-1H-индол-6-ил)-2,6-дифтор-фенокси]-бутановой кислоты (0,03 г, 0,073 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,02 г, 72%).
1H-ЯМР (400 МГц, CDCl3); δ 7,67-7,65 (d, 1H), 7,47 (s, 1H), 7,27-7,24 (m, 2H), 7,23-7,16 (m, 2H), 6,52-6,51 (m, 1H), 4,24-4,21 (t, 2H), 4,03-4,02 (d, 2H), 2,71-2,67 (t, 2H), 2,16-2,09 (m, 2H), 1,35-1,23 (m, 1H), 0,69-0,64 (m, 2H), 0,45-0,37 (m, 2H)
Пример 560: {1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,09 г, 0,23 ммоль), полученный в Примере Получения 91, и 2-хлор-6-циклопропилметокси-пиридин (0,046 г, 0,25 ммоль), полученный в Примере Получения 43, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,043 г, 45%).
1H-ЯМР (400 МГц, CDCl3); δ 7,60-7,56 (t, 1H), 7,53-7,45 (m, 2H), 7,18-7,16 (d, 1H), 6,66-6,64 (d, 1H), 4,24-4,22 (d, 2H), 4,19-4,13 (q, 2H), 3,76-3,60 (m, 3H), 3,37 (m, 1H), 2,68-2,63 (m, 1H), 2,53-2,47 (m, 2H), 2,18-2,14 (m, 1H), 1,68-1,63 (m, 1H), 1,35-1,30 (m, 1H), 1,28-1,24 (t, 3H), 0,66-0,61 (m, 2H), 0,41-0,37 (m, 2H)
Стадия B: {1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,043 г, 0,10 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,037 г, 93%).
1H-ЯМР (400 МГц, CDCl3); δ 7,60-7,56 (t, 1H), 7,52-7,44 (m, 2H), 7,18-7,16 (d, 1H), 6,66-6,64 (d, 1H), 4,24-4,22 (d, 2H), 3,77-3,61 (m, 3H), 3,40-3,36 (m, 1H), 2,68-2,63 (m, 1H), 2,56-2,52 (m, 2H), 2,21-2,17 (m, 1H), 1,69-1,64 (m, 1H), 1,35-1,31 (m, 1H), 0,66-0,61 (m, 2H), 0,41-0,37 (m, 2H)
Пример 561: {1-[4-(6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
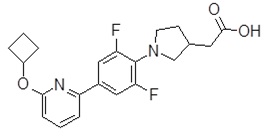
Стадия A: этиловый эфир {1-[4-(6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,09 г, 0,23 ммоль), полученный в Примере Получения 91, и 2-хлор-6-циклобутокси-пиридин (0,046 г, 0,25 ммоль), полученный в Примере Получения 29, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,05 г, 53%).
1H-ЯМР (400 МГц, CDCl3); δ 7,59-7,55 (t, 1H), 7,52-7,46 (m, 2H), 7,17-7,15 (d, 1H), 6,59-6,57 (d, 1H), 5,28-5,24 (m, 1H), 4,19-4,14 (q, 2H), 3,76-3,60 (m, 3H), 3,39-3,35 (m, 1H), 2,68-2,56 (m, 1H), 2,53-2,47 (m, 4H), 2,21-2,14 (m, 3H), 1,88-1,62 (m, 3H), 1,30-1,26 (t, 3H)
Стадия B: {1-[4-(6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(6-циклобутокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,05 г, 0,12 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,048 г, 96%).
1H-ЯМР (400 МГц, CDCl3); δ 7,59-7,55 (t, 1H), 7,52-7,46 (m, 2H), 7,17-7,16 (d, 1H), 6,59-6,57 (d, 1H), 5,30-5,24 (m, 1H), 3,78-3,61 (m, 3H), 3,40-3,36 (m, 1H), 2,69-2,61 (m, 1H), 2,57-2,49 (m, 4H), 2,21-2,16 (m, 3H), 1,88-1,64 (m, 3H)
Пример 562: 4-[4-(3-хлор-1-изопропил-1H-индол-6-ил)-2,6-дифтор-фенокси]-бутановая кислота

Стадия A: этиловый эфир 4-[4-(3-хлор-1-изопропил-1H-индол-6-ил)-2,6-дифтор-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(1-изопропил-1H-индол-6-ил)-фенокси]бутановой кислоты (0,048 г, 0,12 ммоль), полученный на Стадии A Примера 558, и NCS (0,018 г, 0,13 ммоль) вводили в реакцию таким же образом, как на Стадии E Примера Получения 4, с получением целевого соединения (0,031 г, 59%).
1H-ЯМР (400 МГц, CDCl3); δ 7,66-7,64 (d, 1H), 7,45 (s, 1H), 7,33-7,30 (m, 1H), 7,23 (s, 1H), 7,21-7,14 (m, 2H), 4,75-4,67 (m, 1H), 4,23-4,20 (t, 2H), 4,19-4,14 (q, 2H), 2,62-2,58 (t, 2H), 2,15-2,04 (m, 2H), 1,55-1,53 (d, 6H), 1,29-1,26 (t, 3H)
Стадия B: 4-[4-(3-хлор-1-изопропил-1H-индол-6-ил)-2,6-дифтор-фенокси]-бутановая кислота
Этиловый эфир 4-[4-(3-хлор-1-изопропил-1H-индол-6-ил)-2,6-дифтор-фенокси]-бутановой кислоты (0,031 г, 0,071 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,018 г, 63%).
1H-ЯМР (500 МГц, CDCl3); δ 7,66-7,64 (d, 1H), 7,44 (s, 1H), 7,32-7,30 (m, 1H), 7,22 (s, 1H), 7,21-7,15 (m, 2H), 4,73-4,69 (m, 1H), 4,24-4,21 (t, 2H), 2,70-2,67 (t, 2H), 2,15-2,11 (m, 2H), 1,56-1,53 (d, 6H)
Пример 563: {1-[2,6-дифтор-4-(6-изопропокси-пиридин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота
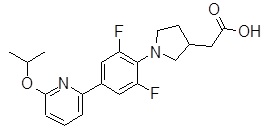
Стадия A: этиловый эфир {1-[2,6-дифтор-4-(6-изопропокси-пиридин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,16 г, 0,40 ммоль), полученный в Примере Получения 91, и 2-хлор-6-изопропокси-пиридин (0,076 г, 0,44 ммоль), полученный в Примере Получения 46, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,071 г, 44%).
1H-ЯМР (400 МГц, MeOD-d4); δ 7,64-7,60 (t, 1H), 7,58-7,48 (m, 2H), 7,28-7,26 (d, 1H), 6,58-6,56 (d, 1H), 5,46-5,37 (m, 1H), 4,19-4,13 (q, 2H), 3,70-3,66 (m, 2H), 3,64-3,54 (m, 1H), 3,36-3,30 (m, 1H), 2,64-2,56 (m, 1H), 2,50-2,48 (d, 2H), 2,18-2,10 (m, 1H), 1,67-1,58 (m, 1H), 1,40-1,38 (d, 6H), 1,29-1,26 (t, 3H)
Стадия B: {1-[2,6-дифтор-4-(6-изопропокси-пиридин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[2,6-дифтор-4-(6-изопропокси-пиридин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты (0,071 г, 0,18 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,060 г, 90%).
1H-ЯМР (500 МГц, CDCl3); δ 7,58-7,54 (t, 1H), 7,53-7,44 (m, 2H), 7,15-7,13 (d, 1H), 6,58-6,55 (d, 1H), 5,48-5,42 (m, 1H), 3,77-3,61 (m, 3H), 3,40-3,36 (m, 1H), 2,70-2,63 (m, 1H), 2,60-2,50 (m, 2H), 2,21-2,17 (m, 1H), 1,71-1,62 (m, 1H), 1,40-1,38 (d, 6H)
Пример 564: {1-[4-(6-циклобутилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[4-(6-циклобутилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,16 г, 0,4 ммоль), полученный в Примере Получения 91, и 2-хлор-6-циклобутилметокси-пиридин (0,087 г, 0,44 ммоль), полученный в Примере Получения 324, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,053 г, 31%).
1H-ЯМР (500 МГц, CDCl3); δ 7,57-7,54 (t, 1H), 7,52-7,45 (m, 2H), 7,16-7,14 (d, 1H), 6,61-6,60 (d, 1H), 4,37-4,35 (d, 2H), 4,18-4,13 (q, 2H), 3,72-3,67 (m, 2H), 3,61-3,57 (m, 1H), 3,36-3,33 (m, 1H), 2,83-2,78 (m, 1H), 2,67-2,62 (m, 1H), 2,51-2,43 (m, 2H), 2,18-2,12 (m, 3H), 1,96-1,86 (m, 4H), 1,65-1,59 (m, 1H), 1,29-1,26 (t, 3H)
Стадия B: {1-[4-(6-циклобутилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(6-циклобутилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,053 г, 0,12 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,029 г, 59%).
1H-ЯМР (400 МГц, CDCl3); δ 7,59-7,55 (t, 1H), 7,53-7,46 (m, 2H), 7,17-7,15 (d, 1H), 6,63-6,61 (d, 1H), 4,38-1,36 (d, 2H), 3,78-3,61 (m, 3H), 3,40-3,36 (m, 1H), 2,84-2,71 (m, 1H), 2,69-2,61 (m, 1H), 2,57-2,50 (m, 2H), 2,21-2,12 (m, 3H), 2,00-1,88 (m, 4H), 1,71-1,62 (m, 1H)
Пример 565: 4-[4-(5-циклопропилметоксиметил-тиофен-2-ил)-2,6-дифтор-фенокси]-бутановая кислота

Стадия A: этиловый эфир 4-[2,6-дифтор-4-(5-формил-тиофен-2-ил)-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,11 г, 0,40 ммоль), полученный в Примере Получения 16, и 5-бром-тиофен-2-карбальдегид (0,084 г, 0,44 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,052 г, 37%).
1H-ЯМР (400 МГц CDCl3); δ 9,89 (s, 1H), 7,73-7,72 (d, 1H), 7,32-7,31 (d, 1H), 7,22-7,19 (m, 2H), 4,26-4,23 (t, 2H), 4,19-4,13 (q, 2H), 2,59-2,56 (t, 2H0, 2,14-2,07 (m, 2H), 1,29-1,25 (t, 3H)
Стадия B: этиловый эфир 4-[2,6-дифтор-4-(5-гидроксиметил-тиофен-2-ил)-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(5-формил-тиофен-2-ил)-фенокси]-бутановой кислоты (0,052 г, 0,15 ммоль), полученный на Стадии A, растворяли в MeOH (5 мл). Добавляли NaBH4 (0,006 г, 0,15 ммоль), и смесь перемешивали в течение 30 минут. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,052 г, 99%).
1H-ЯМР (400 МГц CDCl3); δ 7,13-7,04 (m, 3H), 6,96-6,95 (d, 1H), 4,82 (s, 2H), 4,20-4,02 (m, 4H), 2,59-2,55 (t, 2H), 2,12-2,05 (m, 2H), 1,94 (s ушир., 1H), 1,28-1,26 (t, 3H)
Стадия C: этиловый эфир 4-[4-(5-циклопропилметоксиметил-тиофен-2-ил)-2,6-дифтор-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(5-гидроксиметил-тиофен-2-ил)-фенокси]-бутановой кислоты (0,052 г, 0,15 ммоль), полученный на Стадии B, растворяли в THF (5 мл). NaH (60%) (0,009 мг, 0,22 ммоль) добавляли при 0°C, и смесь перемешивали в течение 10 минут. Последовательно добавляли бромметил-циклопропан (0,029 мл, 0,29 ммоль) и тетрабутиламмоний йодид (0,054 г, 0,15 ммоль), и смесь перемешивали при 50°C в течение 16 часов. После добавления воды реакционный раствор экстрагировали EtOAc. Органический слой высушивали с помощью MgSO4 и очищали колоночной хроматографией с получением целевого соединения (0,015 г, 25%).
1H-ЯМР (400 МГц CDCl3); δ 7,13-7,07 (m, 3H), 6,94-6,93 (d, 1H), 4,67 (s, 2H), 4,20-4,13 (m, 4H), 3,36-3,34 (d, 2H), 2,60-2,56 (t, 2H), 2,12-2,05 (m, 2H), 1,29-1,25 (t, 3H), 1,13-1,07 (m, 1H), 0,59-0,54 (m, 2H), 0,28-0,20 (m, 2H)
Стадия D: 4-[4-(5-циклопропилметоксиметил-тиофен-2-ил)-2,6-дифтор-фенокси]-бутановая кислота
Этиловый эфир 4-[4-(5-циклопропилметоксиметил-тиофен-2-ил)-2,6-дифтор-фенокси]-бутановой кислоты (0,015 г, 0,037 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,014 г, 97%).
1H-ЯМР (400 МГц CDCl3); δ 7,11-7,07 (m, 3H), 6,94-6,93 (d, 1H), 4,67 (s, 2H), 4,22-4,19 (t, 2H), 3,36-3,34 (d, 2H), 2,68-2,66 (t, 2H), 2,10-2,04 (m, 2H), 1,10 (m, 1H), 0,58-0,54 (m, 2H), 0,24-0,22 (m, 2H)
Пример 566: 4-[4-(5-циклопропилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановая кислота

Стадия A: этиловый эфир 4-[2,6-дифтор-4-(5-формил-тиофен-3-ил)-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,19 г, 0,50 ммоль), полученный в Примере Получения 16, и 4-бром-тиофен-карбальдегид (0,11 г, 0,55 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 565, с получением целевого соединения (0,11 г, 62%).
1H-ЯМР (400 МГц CDCl3); δ 9,97 (s, 1H), 7,93 (s, 1H), 7,79 (s, 1H), 7,15-7,09 (m, 2H), 4,24-4,21 (t, 2H), 4,19-4,13 (q, 2H), 2,60-2,56 (t, 2H), 2,14-2,09 (m, 2H), 1,29-1,25 (t, 3H)
Стадия B: этиловый эфир 4-[2,6-дифтор-4-(5-гидроксиметил-тиофен-3-ил)-фенокси]-бутановая кислота
Этиловый эфир 4-[2,6-дифтор-4-(5-формил-тиофен-3-ил)-фенокси]-бутановой кислоты (0,11 г, 0,21 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 565, с получением целевого соединения (0,10 г, 90%).
1H-ЯМР (500 МГц CDCl3); δ 7,31 (s, 1H), 7,17 (s, 1H), 7,09-7,04 (m, 2H), 4,84-4,83 (d, 2H), 4,19-4,09 (m, 4H), 2,58-2,55 (t, 2H), 2,10-2,05 (m, 2H), 1,98 (s ушир., 1H), 1,27-1,24 (t, 3H)
Стадия C: этиловый эфир 4-[4-(5-циклопропилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(5-гидроксиметил-тиофен-3-ил)-фенокси]-бутановая кислота (0,10 г, 0,28 ммоль), полученный на Стадии B, и бромметил-циклопропан (0,055 мл, 0,56 ммоль) вводили в реакцию таким же образом, как на Стадии C Примера 565, с получением целевого соединения (0,027 г, 23%).
1H-ЯМР (400 МГц CDCl3); δ 7,32 (d, 1H), 7,17 (m, 1H), 7,11-7,04 (m, 2H), 4,69 (s, 2H), 4,20-4,13 (m, 4H), 3,37-3,35 (d, 2H), 2,60-2,56 (t, 2H), 2,14-2,05 (m, 2H), 1,29-1,25 (t, 3H), 1,14-1,07 (m, 1H), 0,58-0,54 (m, 2H), 0,24-0,21 (m, 2H)
Стадия D: 4-[4-(5-циклопропилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановая кислота
Этиловый эфир 4-[4-(5-циклопропилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановой кислоты (0,027 г, 0,066 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии D Примера 565, с получением целевого соединения (0,015 г, 61%).
1H-ЯМР (400 МГц CDCl3); δ 7,33-7,32 (d, 1H), 7,17-7,16 (m, 1H), 7,11-7,05 (m, 2H), 4,70-4,69 (d, 2H), 4,21-4,18 (t, 2H), 3,37-3,35 (d, 2H), 2,68-2,64 (t, 2H), 2,13-2,04 (m, 2H), 1,15-1,07 (m, 1H), 0,58-0,54 (m, 2H), 0,24-0,21 (m, 2H)
Пример 567: {1-[4-(5-циклопропилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[2,6-дифтор-4-(5-формил-тиофен-3-ил)-фенил]-пиперидин-4-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,21 г, 0,50 ммоль), полученный в Примере Получения 220, и 4-бром-тиофен-карбальдегид (0,11 г, 0,55 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 565, с получением целевого соединения (0,053 г, 27%).
1H-ЯМР (400 МГц CDCl3); δ 9,96-9,95 (d, 1H), 7,93-7,92 (d, 1H), 7,77-7,76 (t, 1H), 7,08-7,03 (m, 2H), 4,18-4,13 (q, 2H), 3,30-3,27 (m, 2H), 3,16-3,11 (m, 2H), 2,31-2,29 (d, 2H), 1,97-1,95 (m, 1H), 1,80-1,77 (m, 2H), 1,50-1,41 (m, 2H), 1,29-1,26 (t, 3H)
Стадия B: этиловый эфир {1-[2,6-дифтор-4-(5-гидроксиметил-тиофен-3-ил)-фенил]-пиперидин-4-ил}-уксусной кислоты
Этиловый эфир {1-[2,6-дифтор-4-(5-формил-тиофен-3-ил)-фенил]-пиперидин-4-ил}-уксусной кислоты (0,053 г, 0,14 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 565, с получением целевого соединения (0,053 г, 99%).
1H-ЯМР (400 МГц CDCl3); δ 7,31-7,30 (d, 1H), 7,19 (s, 1H), 7,05-6,98 (m, 2H), 4,84 (s, 2H), 4,18-4,12 (q, 2H), 3,26-3,23 (m, 2H), 3,15-3,09 (m, 2H), 2,30-2,28 (d, 2H), 2,00-1,90 (m, 2H), 1,78-1,75 (m, 2H), 1,50-1,40 (m, 2H), 1,29-1,26 (t, 3H)
Стадия C: этиловый эфир {1-[4-(5-циклопропилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусной кислоты
Этиловый эфир {1-[2,6-дифтор-4-(5-гидроксиметил-тиофен-3-ил)-фенил]-пиперидин-4-ил}-уксусной кислоты (0,053 г, 0,13 ммоль), полученный на Стадии B, и бромметил-циклопропан (0,026 мл, 0,27 ммоль) вводили в реакцию таким же образом, как на Стадии C Примера 565, с получением целевого соединения (0,046 г, 76%).
1H-ЯМР (400 МГц CDCl3); δ 7,31-7,30 (d, 1H), 7,17 (s, 1H), 7,05-6,98 (m, 2H), 4,69 (s, 2H), 4,18-4,12 (q, 2H), 3,41-3,36 (d, 2H), 3,26-3,23 (m, 2H), 3,14-3,08 (m, 2H), 2,30-2,28 (d, 2H), 1,98-1,93 (m, 1H), 1,78-1,75 (m, 2H), 1,58-1,43 (m, 2H), 1,29-1,26 (t, 3H), 1,12-1,08 (m, 1H), 0,58-0,53 (m, 2H), 0,24-0,20 (m, 2H)
Стадия D: {1-[4-(5-циклопропилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота
Этиловый эфир {1-[4-(5-циклопропилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусной кислоты (0,046 г, 0,10 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,040 г, 92%).
1H-ЯМР (400 МГц CDCl3); δ 7,31 (d, 1H), 7,18 (s, 1H), 7,05-7,00 (m, 2H), 4,69 (s, 2H), 3,36-3,34 (d, 2H), 3,28-3,25 (m, 2H), 3,16-3,10 (m, 2H), 2,37-2,35 (d, 2H), 1,96-1,95 (m, 1H), 1,83-1,80 (m, 2H), 1,52-1,44 (m, 2H), 1,12-1,08 (m, 1H), 0,58-0,54 (m, 2H), 0,24-0,20 (m, 2H)
Пример 568: 4-[4-(4-циклопропилметоксиметил-2-метил-тиазол-5-ил)-2,6-дифтор-фенокси]-бутановая кислота

Стадия A: этиловый эфир 4-[4-(4-циклопропилметоксиметил-2-метил-тиазол-5-ил)-2,6-дифтор-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]бутановой кислоты (0,15 г, 0,40 ммоль), полученный в Примере Получения 16, и 5-бром-4-циклопропилметоксиметил-2-метил-тиазол (0,12 г, 0,44 ммоль), полученный в Примере Получения 337, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,077 г, 45%).
1H-ЯМР (400 МГц CDCl3); δ 7,22-7,09 (m, 2H), 4,49 (s, 2H), 4,23-4,21 (t, 2H), 4,19-4,10 (q, 2H), 3,45-3,43 (d, 2H), 2,70 (s, 3H), 2,60-2,57 (t, 2H), 2,18-2,07 (m, 2H), 1,29-1,26 (t, 3H), 1,21-1,12 (m, 1H), 0,61-0,52 (m, 2H), 0,31-0,25 (m, 2H)
Стадия B: 4-[4-(4-циклопропилметоксиметил-2-метил-тиазол-5-ил)-2,6-дифтор-фенокси]-бутановая кислота
Этиловый эфир 4-[4-(4-циклопропилметоксиметил-2-метил-тиазол-5-ил)-2,6-дифтор-фенокси]-бутановой кислоты (0,077 г, 0,18 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,063 г, 88%).
1H-ЯМР (400 МГц CDCl3); δ 7,19-7,13 (m, 2H), 4,49 (s, 2H), 4,25-4,22 (t, 2H), 3,44-3,42 (d, 2H), 2,70 (s, 3H), 2,68-2,65 (t, 2H), 2,15-2,08 (m, 2H), 1,18-1,14 (m, 1H), 0,60-0,56 (m, 2H), 0,28-0,24 (m, 2H)
Пример 569: {1-[4-(5-циклометоксиметил-тиофен-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота
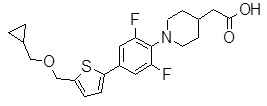
Стадия A: этиловый эфир {1-[2,6-дифтор-4-(5-формил-тиофен-2-ил)-фенил]-пиперидин-4-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,33 г, 0,80 ммоль), полученный в Примере Получения 220, и 5-бром-тиофен-2-карбальдегид (0,17 г, 0,88 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,16 г, 51%).
1H-ЯМР (400 МГц CDCl3); δ 9,98 (s, 1H), 7,72-7,71 (d, 1H), 7,30-7,29 (d, 1H0, 7,16-7,10 (m, 2H), 4,18-4,13 (q, 2H), 3,34-3,31 (m, 2H), 3,17-3,11 (m, 2H), 2,30-2,29 (d, 2H), 1,97-1,80 (m, 1H), 1,97-1,77 (m, 2H), 1,55-1,40 (m, 2H), 1,28-1,26 (t, 3H)
Стадия B: этиловый эфир {1-[2,6-дифтор-4-(5-гидроксиметил-тиофен-2-ил)-фенил]-пиперидин-4-ил}-уксусной кислоты
Этиловый эфир {1-[2,6-дифтор-4-(5-формил-тиофен-2-ил)-фенил]-пиперидин-4-ил}-уксусной кислоты (0,16 г, 0,40 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 565, с получением целевого соединения (0,14 г, 89%).
1H-ЯМР (400 МГц CDCl3); δ 7,08-7,03 (m, 3H), 6,96-9,95 (d, 1H), 4,82 (s, 2H), 4,18-4,12 (q, 2H), 3,28-3,26 (m, 2H), 3,16-3,10 (m, 2H), 2,30-2,28 (d, 2H), 1,79-1,76 (m, 1H), 1,79-1,76 (m, 2H), 1,49-1,46 (m, 2H), 1,29-1,26 (t, 3H)
Стадия C: этиловый эфир {1-[4-(5-циклометоксиметил-тиофен-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусной кислоты
Этиловый эфир {1-[2,6-дифтор-4-(5-гидроксиметил-тиофен-2-ил)-фенил]-пиперидин-4-ил}-уксусной кислоты (0,14 г, 0,36 ммоль), полученный на Стадии B, и бромметил-циклопропан (0,070 мл, 0,54 ммоль) вводили в реакцию таким же образом, как на Стадии C Примера 565, с получением целевого соединения (0,12 г, 75%).
1H-ЯМР (400 МГц CDCl3); δ 7,06-7,00 (m, 3H), 6,92-6,91 (d, 1H), 4,67 (s, 2H), 4,18-4,12 (q, 2H), 3,35-3,33 (d, 2H), 3,27-3,24 (m, 2H), 3,14-3,09 (m, 2H), 2,30-2,28 (d, 2H), 1,95 (m, 1H), 1,78-1,75 (m, 2H0, 1,48-1,40 (m, 2H), 1,29-1,26 (t, 3H), 1,11-1,08 (m, 1H), 0,58-0,53 (m, 2H), 0,24-0,20 (m, 2H)
Стадия D: {1-[4-(5-циклометоксиметил-тиофен-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота
Этиловый эфир {1-[4-(5-циклометоксиметил-тиофен-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусной кислоты (0,12 г, 0,27 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,10 г, 89%).
1H-ЯМР (400 МГц CDCl3); δ 7,07-7,01 (m, 3H), 6,93-6,92 (d, 1H), 4,67 (s, 2H), 3,35-3,34 (d, 2H), 3,28-3,25 (m, 2H), 3,15-3,10 (m, 2H), 3,67-3,35 (d, 2H), 1,96 (m, 1H), 1,83-1,80 (m, 2H), 1,51-1,43 (m, 2H), 1,15-1,08 (m, 1H), 0,58-0,53 (m, 2H), 0,24-0,20 (m, 2H)
Пример 570: {1-[4-(4-циклопропилметоксиметил-2-метил-тиазол-5-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[4-(4-циклопропилметоксиметил-2-метил-тиазол-5-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,16 г, 0,40 ммоль), полученный в Примере Получения 220, и 5-бром-4-циклопропилметоксиметил-2-метил-тиазол (0,12 г, 0,44 ммоль), полученный в Примере Получения 337, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,059 г, 32%).
1H-ЯМР (400 МГц CDCl3); δ 7,11-7,01 (m, 2H), 4,49 (s, 2H), 4,20-4,13 (q, 2H), 3,45-3,42 (d, 2H), 3,31-3,28 (m, 2H), 3,16-3,10 (m, 2H), 2,75 (s, 3H), 2,30-2,28 (d, 2H), 1,98-1,94 (m, 1H), 1,79-1,76 (m, 2H), 1,49-1,43 (m, 2H), 1,29-1,26 (t, 3H), 1,18-1,14 (m, 1H), 0,60-0,55 (m, 2H), 0,28-0,24 (m, 2H)
Стадия B: {1-[4-(4-циклопропилметоксиметил-2-метил-тиазол-5-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота
Этиловый эфир {1-[4-(4-циклопропилметоксиметил-2-метил-тиазол-5-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусной кислоты (0,059 г, 0,13 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,050 г, 88%).
1H-ЯМР (500 МГц CDCl3); δ 7,08-7,06 (m, 2H), 4,48 (s, 2H), 3,43-3,42 (d, 2H), 3,31-3,28 (m, 2H), 3,16-3,11 (m, 2H), 2,69 (s, 3H), 2,36-2,35 (d, 2H), 1,98 (m, 1H), 1,83-1,81 (m, 2H), 1,49-1,46 (m, 2H), 1,16 (m, 1H), 0,59-0,54 (m, 2H), 0,27-0,25 (m, 2H)
Пример 571: 4-[4-(5-циклобутилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановая кислота

Стадия A: этиловый эфир 4-[4-(5-циклобутилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(5-гидроксиметил-тиофен-3-ил)-фенокси]-бутановой кислоты (0,10 г, 0,29 ммоль), полученный на Стадии B Примера 566, и бромметил-циклобутан (0,062 мл, 0,58 ммоль) вводили в реакцию таким же образом, как на Стадии C Примера 565, с получением целевого соединения (0,016 г, 13%).
1H-ЯМР (400 МГц CDCl3); δ 7,32 (d, 1H), 7,16 (m, 1H), 7,11-7,05 (m, 2H), 4,66 (s, 2H), 4,20-4,15 (q, 2H), 3,49-3,48 (d, 2H), 2,65-2,56 (m, 3H), 2,27-2,03 (m, 4H), 1,96-1,73 (m, 4H), 1,29-1,27 (t, 3H)
Стадия B: 4-[4-(5-циклобутилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановая кислота
Этиловый эфир 4-[4-(5-циклобутилметоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановой кислоты (0,016 г, 0,038 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,014 г, 92%).
1H-ЯМР (400 МГц CDCl3); δ 7,32 (d, 1H), 7,16 (m, 1H), 7,17-7,05 (m, 2H), 4,66 (s, 2H), 4,21-4,10 (t, 2H), 2,68-2,64 (t, 2H), 2,63-2,57 (m, 1H), 2,13-2,03 (m, 4H), 1,96-1,73 (m, 4H)
Пример 572: 4-[2,6-дифтор-4-(5-изобутоксиметил-тиофен-3-ил)-фенокси]-бутановая кислота
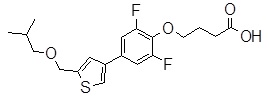
Стадия A: этиловый эфир 4-[2,6-дифтор-4-(5-изобутоксиметил-тиофен-3-ил)-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(5-гидроксиметил-тиофен-3-ил)-фенокси]-бутановой кислоты (0,12 г, 0,34 ммоль), полученный на Стадии B Примера 566, и 1-йод-2-метил-пропан (0,090 мл, 0,67 ммоль) вводили в реакцию таким же образом, как на Стадии C Примера 565, с получением целевого соединения (0,014 г, 10%).
1H-ЯМР (400 МГц CDCl3); δ 7,32 (d, 1H), 7,15 (m, 1H), 7,09-7,05 (m, 2H), 4,66 (s, 2H), 4,20-4,15 (q, 2H), 3,29-3,27 (d, 2H), 2,58-2,56 (t, 2H), 2,12-2,06 (m, 2H), 1,96-1,86 (m, 1H), 1,29-1,25 (t, 3H), 0,94-0,92 (t, 3H)
Стадия B: 4-[2,6-дифтор-4-(5-изобутоксиметил-тиофен-3-ил)-фенокси]-бутановая кислота
Этиловый эфир 4-[2,6-дифтор-4-(5-изобутоксиметил-тиофен-3-ил)-фенокси]-бутановой кислоты (0,014 г, 0,034 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,006 г, 42%).
1H-ЯМР (400 МГц CDCl3); δ 7,32 (d, 1H), 7,15 (m, 1H), 7,10-7,07 (m, 2H), 4,66 (s, 2H), 4,22-4,19 (t, 2H), 3,29-3,27 (d, 2H), 2,68-2,65 (t, 2H), 2,14-2,05 (m, 2H), 1,94-1,87 (m, 1H), 0,94-0,92 (d, 6H)
Пример 573: 4-[4-(5-циклобутоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановая кислота

Стадия A: этиловый эфир 4-[4-(5-циклобутоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]масляной кислоты (0,10 г, 0,28 ммоль), полученный в Примере Получения 16, и 4-бром-2-циклобутоксиметил-тиофен (0,069 мл, 0,28 ммоль), полученный в Примере Получения 338, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,035 г, 30%).
1H-ЯМР (500 МГц CDCl3); δ 7,31-7,30 (d, 1H), 7,15 (m, 1H), 7,09-7,05 (m, 2H), 4,56 (s, 2H), 4,19-4,12 (m, 4H), 4,09-4,03 (m, 1H), 2,58-2,55 (t, 2H), 2,25-1,98 (m, 2H), 2,11-2,06 (m, 2H), 2,05-1,95 (m, 2H), 1,78-1,68 (m, 1H), 1,56-1,48 (m, 1H), 1,27-1,25 (t, 3H)
Стадия B: 4-[4-(5-циклобутоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановая кислота
Этиловый эфир 4-[4-(5-циклобутоксиметил-тиофен-3-ил)-2,6-дифтор-фенокси]-бутановой кислоты (0,035 г, 0,085 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,030 г, 90%).
1H-ЯМР (400 МГц CDCl3); δ 7,31 (d, 1H), 7,16 (m, 1H), 7,10-7,05 (m, 2H), 4,57 (s, 2H), 4,22-4,19 (t, 2H), 4,10-4,03 (m, 1H), 2,68-2,65 (t, 2H), 2,26-2,19 (m, 2H), 2,14-1,97 (m, 4H), 1,76-1,69 (m, 1H), 1,58-1,48 (m, 1H)
Пример 574: 4-[4-(3-циклопропилметоксиметил-тиофен-2-ил)-2,6-дифтор-фенокси]-бутановая кислота
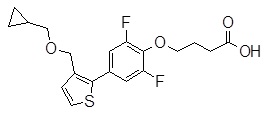
Стадия A: этиловый эфир 4-[2,6-дифтор-4-(3-формил-тиофен-2-ил)-фенокси]-бутановой кислоты
Этиловый эфир 4-(4-бром-2,6-дифтор-фенокси)-бутановой кислоты (0,23 г, 0,70 ммоль), полученный в Примере Получения 339, и 3-формил-2-тиофенбороновая кислота (0,11 г, 0,70 ммоль) вводили в реакцию таким же образом, как на Стадии A Примера 565, с получением целевого соединения (0,16 г, 66%).
1H-ЯМР (400 МГц CDCl3); δ 9,90-9,89 (d, 1H), 7,76-7,75 (d, 1H), 7,18-7,16 (d, 1H), 7,04-7,00 (m, 2H), 4,28-4,25 (t, 2H), 4,19-4,14 (q, 2H), 2,61-2,57 (t, 2H), 2,16-2,09 (m, 2H), 1,29-1,26 (t, 3H)
Стадия B: этиловый эфир 4-[2,6-дифтор-4-(3-гидроксиметил-тиофен-2-ил)-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(3-формил-тиофен-2-ил)-фенокси]-бутановой кислоты (0,16 г, 0,46 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 565, с получением целевого соединения (0,15 г, 92%).
1H-ЯМР (500 МГц CDCl3); δ 7,32-7,30 (d, 1H), 7,08-7,01 (m, 3H), 4,81-4,80 (d, 2H), 4,23-4,20 (t, 2H), 4,19-4,13 (q, 2H), 2,61-2,57 (t, 2H), 2,14-2,07 (m, 2H), 1,87-1,84 (t, 1H), 1,29-1,25 (t, 3H)
Стадия C: этиловый эфир 4-[4-(3-циклопропилметоксиметил-тиофен-2-ил)-2,6-дифтор-фенокси]-бутановой кислоты
Этиловый эфир 4-[2,6-дифтор-4-(3-гидроксиметил-тиофен-2-ил)-фенокси]-бутановой кислоты (0,15 г, 0,43 ммоль), полученный на Стадии B, и бромметил-циклопропан (0,16 мл, 0,43 ммоль) вводили в реакцию таким же образом, как на Стадии C Примера 565, с получением целевого соединения (0,082 г, 47%).
1H-ЯМР (400 МГц CDCl3); δ 7,29-7,28 (d, 1H), 7,10-7,04 (m, 3H), 4,57 (s, 2H), 4,21-4,14 (m, 4H), 3,39-3,37 (d, 2H), 2,61-2,57 (t, 2H), 2,11-2,08 (m, 2H), 1,28-1,25 (t, 2H), 1,14-1,11 (m, 1H), 0,58-0,55 (m, 2H), 0,26-0,24 (m, 2H)
Стадия D: 4-[4-(3-циклопропилметоксиметил-тиофен-2-ил)-2,6-дифтор-фенокси]-бутановая кислота
Этиловый эфир 4-[4-(3-циклопропилметоксиметил-тиофен-2-ил)-2,6-дифтор-фенокси]-бутановой кислоты (0,082 г, 0,20 ммоль), полученный на Стадии C, вводили в реакцию таким же образом, как на Стадии D Примера 565, с получением целевого соединения (0,074 г, 97%).
1H-ЯМР (400 МГц CDCl3); δ 7,29-7,28 (d, 1H), 7,10-7,04 (m, 3H), 4,57 (s, 2H), 4,23-4,21 (t, 2H), 3,39-3,37 (d, 2H), 2,68-2,66 (t, 2H), 2,12-2,09 (m, 2H), 1,13-1,11 (m, 1H), 0,58-0,55 (m, 2H), 0,25-0,23 (m, 2H)
Пример 575: {1-[4-(4-циклобутокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
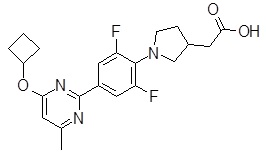
Стадия A: этиловый эфир {1-[4-(4-циклобутокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,099 г, 0,25 ммоль), полученный в Примере Получения 91, и 2-хлор-4-(циклобутокси)-6-метил-пиримидин (0,099 г, 0,50 ммоль), полученный в Примере Получения 228, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,057 г, 53%).
1H-ЯМР (400 МГц, CDCl3); δ 7,86-7,81 (m, 2H), 6,34 (s, 1H), 5,33-5,26 (m, 1H), 4,19-4,14 (q, 2H), 3,79-3,64 (m, 3H), 3,42-3,38 (m, 1H), 2,68-2,55 (m, 1H), 2,53-2,46 (m, 4H), 2,44 (s, 3H), 2,23-2,14 (m, 3H), 1,91-1,55 (m, 3H), 1,30-1,26 (t, 3H)
Стадия B: {1-[4-(4-циклобутокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(4-циклобутокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,053 г, 0,13 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,048 г, 90%).
1H-ЯМР (400 МГц, CDCl3); δ 7,88-7,81 (m, 2H), 6,34 (s, 1H), 5,33-5,26 (m, 1H), 3,79-3,64 (m, 3H), 3,44-3,39 (m, 1H), 2,67-2,59 (m, 1H), 2,56-2,48 (m, 4H), 2,44 (s, 3H), 2,21-2,16 (m, 3H), 1,91-1,63 (m, 3H)
Пример 576: {1-[4-(4-циклопропилметокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[4-(4-циклопропилметокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,099 г, 0,25 ммоль), полученный в Примере Получения 91, и 2-хлор-4-(циклопропилметокси)-6-метил-пиримидин (0,099 г, 0,50 ммоль), полученный в Примере Получения 227, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,068 г, 63%).
1H-ЯМР (400 МГц, CDCl3); δ 7,90-7,81 (m, 2H), 6,41 (s, 1H), 4,28-4,26 (d, 2H), 4,19-4,14 (q, 2H), 3,79-3,70 (m, 2H), 3,65-3,63 (m, 1H), 3,43-3,37 (m, 1H), 2,68-2,60 (m, 1H), 2,52-2,46 (m, 2H), 2,45 (s, 3H), 2,18-2,11 (m, 1H), 1,67-1,58 (m, 1H), 1,35-1,31 (m, 1H), 1,30-1,26 (t, 3H), 0,66-0,61 (m, 2H), 0,41-0,37 (m, 2H)
Стадия B: {1-[4-(4-циклопропилметокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(4-циклопропилметокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,068 г, 0,016 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,062 г, 97%).
1H-ЯМР (400 МГц, CDCl3); δ 7,87-7,84 (m, 2H), 6,41 (s, 1H), 4,28-4,26 (d, 2H), 3,79-3,65 (m, 3H), 3,41 (m, 1H), 2,67-2,64 (m, 1H), 2,56-2,53 (m, 2H), 2,45 (s, 3H), 2,17 (m, 1H), 1,68-1,63 (m, 1H), 1,31-1,29 (m, 1H), 0,66-0,61 (m, 2H), 0,41-0,38 (m, 2H)
Пример 577: {1-[4-(6-циклобутокси-4-метил-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[4-(6-циклобутокси-4-метил-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,099 г, 0,25 ммоль), полученный в Примере Получения 91, и 2-хлор-6-(циклобутокси)-4-метил-пиридин(0,099 г, 0,50 ммоль), полученный в Примере Получения 271, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,075 г, 69%).
1H-ЯМР (400 МГц, CDCl3); δ 7,51-7,42 (m, 2H), 7,00 (s, 1H), 6,40 (s, 1H), 5,27-5,20 (m, 1H), 4,19-7,13 (q, 2H), 3,74-3,67 (m, 2H), 3,62-3,58 (m, 1H), 3,37-3,33 (m, 1H), 2,67-2,63 (m, 1H), 2,55-2,46 (m, 4H), 2,31 (s, 3H), 2,19-2,12 (m, 3H), 1,46-1,42 (m, 3H), 1,29-1,26 (t, 3H)
Стадия B: {1-[4-(6-циклобутокси-4-метил-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(6-циклобутокси-4-метил-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,075 г, 0,17 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,069 г, 98%).
1H-ЯМР (400 МГц, CDCl3); δ 7,51-7,43 (m, 2H), 7,00 (s, 1H), 6,40 (s, 1H), 5,27-5,20 (m, 1H), 3,77-3,60 (m, 3H), 3,39-3,35 (m, 1H), 2,68-2,60 (m, 1H), 2,56-2,48 (m, 4H), 2,31 (s, 3H), 2,19-2,12 (m, 3H), 1,86-1,64 (m, 3H)
Пример 578: {1-[4-(6-циклобутокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[4-(6-циклобутокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,099 г, 0,25 ммоль), полученный в Примере Получения 91, и 2-хлор-6-(циклобутокси)пиразин (0,099 г, 0,50 ммоль), полученный в Примере Получения 232, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,083 г, 80%).
1H-ЯМР (400 МГц, CDCl3); δ 8,43 (s, 1H), 8,02 (s, 1H), 7,50-7,42 (m, 2H), 5,30-5,23 (m, 1H), 4,19-4,14 (q, 2H), 3,78-3,63 (m, 3H), 3,41-3,37 (m, 1H), 2,69-2,61 (m, 1H), 2,57-2,46 (m, 4H), 2,26-2,14 (m, 3H), 1,96-1,59 (m, 3H), 1,30-1,26 (t, 3H)
Стадия B: {1-[4-(6-циклобутокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
{1-[4-(6-циклобутокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота (0,083 г, 0,20 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,067 г, 86%).
1H-ЯМР (500 МГц, MeOD-d4); δ 8,73 (s, 1H), 8,09 (s, 1H), 7,69-7,67 (m, 2H), 5,23-5,19 (m, 1H), 3,65 (m, 2H), 3,53 (m, 1H), 3,29 (m, 1H), 2,45-2,41 (m, 34-й), 2,38 (m, 2H), 2,11-2,21 (m, 3H), 1,82-1,68 (m, 2H), 1,59-1,51 (m, 1H)
Пример 579: {1-[4-(4-циклобутокси-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
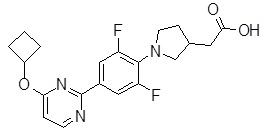
Стадия A: этиловый эфир {1-[4-(4-циклобутокси-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,099 г, 0,25 ммоль), полученный в Примере Получения 91, и 2-хлор-4-(циклобутокси)пиримидин (0,099 г, 0,50 ммоль), полученный в Примере Получения 230, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,047 г, 44%).
1H-ЯМР (400 МГц, CDCl3); δ 8,42-8,40 (d, 1H), 7,88-7,78 (m, 2H), 6,50-6,48 (d, 1H), 5,36-5,29 (m, 1H), 4,19-4,14 (q, 2H), 3,80-3,64 (m, 2H), 3,44-3,38 (m, 2H), 2,68-2,46 (m, 5H), 2,23-2,13 (m, 3H), 1,90-1,61 (m, 3H), 1,30-1,26 (t, 3H)
Стадия B: {1-[4-(4-циклобутокси-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(4-циклобутокси-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,047 г, 0,11 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,042 г, 99%).
1H-ЯМР (500 МГц, CDCl3); δ 8,43-8,42 (d, 1H), 7,86-7,79 (m, 2H), 6,50-6,49 (d, 1H), 5,35-5,29 (m, 1H), 3,83-3,71 (m, 2H), 3,65 (m, 1H), 3,45-3,41 (m, 1H), 2,68-2,61 (m, 1H), 2,59-2,49 (m, 4H), 2,24-2,15 (m, 3H), 1,89-1,63 (m, 3H)
Пример 580: {1-[4-(6-циклопропилметокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[4-(6-циклопропилметокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,099 г, 0,25 ммоль), полученный в Примере Получения 91, и 2-хлор-6-(циклопропилметокси)пиразин (0,099 г, 0,50 ммоль), полученный в Примере Получения 233, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,041 г, 38%).
1H-ЯМР (400 МГц, CDCl3); δ 8,43 (s, 1H), 8,09 (s, 1H), 7,52-7,42 (m, 2H), 4,26-4,24 (d, 2H), 4,19-1,14 (q, 2H), 3,78-3,71 (m, 2H), 3,64-3,63 (m, 1H), 3,42-3,37 (m, 1H), 2,69-2,52 (m, 1H), 2,51-2,42 (m, 2H), 2,19-2,12 (m, 1H), 1,68-1,61 (m, 1H), 1,39-1,32 (m, 1H), 1,30-1,26 (t, 3H), 0,68-0,64 (m, 2H), 0,46-0,39 (m, 2H)
Стадия B: {1-[4-(6-циклопропилметокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(6-циклопропилметокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,041 г, 0,095 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,036 г, 98%).
1H-ЯМР (400 МГц, MeOD-d4); δ 8,75 (s, 1H), 8,17 (s, 1H), 7,75-7,72 (m, 2H), 4,26-4,24 (d, 2H), 3,68 (m, 2H), 3,56 (m, 1H), 3,32 (m, 1H), 2,47 (m, 1H), 2,41-2,39 (m, 2H), 2,07 (m, 1H), 1,60-1,55 (m, 1H), 1,29-1,23 (m, 1H), 0,61-0,57 (m, 2H), 0,41-0,38 (m, 2H)
Пример 581: {1-[4-(4-циклопропилметокси-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[4-(4-циклопропилметокси-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,099 г, 0,25 ммоль), полученный в Примере Получения 91, и 2-хлор-4-(циклопропилметокси)пиримидин (0,099 г, 0,50 ммоль), полученный в Примере Получения 231, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,039 г, 36%).
1H-ЯМР (500 МГц, CDCl3); δ 8,41-8,40 (d, 1H), 7,86-7,81 (m, 2H), 6,55-6,54 (d, 1H), 4,29-4,27 (d, 2H), 4,16-4,13 (q, 2H), 3,79-3,63 (m, 3H), 3,42-3,38 (m, 1H), 2,69-2,59 (m, 1H), 2,49-2,42 (m, 2H), 2,18-2,12 (m, 1H), 1,67-1,62 (m, 1H), 1,35-1,29 (m, 1H), 1,28-1,25 (t, 3H), 0,66-0,63 (m, 2H), 0,41-0,38 (m, 2H)
Стадия B: {1-[4-(4-циклопропилметокси-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(4-циклопропилметокси-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,039 г, 0,090 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,035 г, 98%).
1H-ЯМР (400 МГц, MeOD-d4); δ 8,53-8,51 (d, 1H), 7,83-7,80 (m, 2H), 6,79-6,77 (d, 1H), 4,30-4,28 (d, 2H), 3,70 (m, 2H), 3,58 (m, 1H), 3,32 (m, 1H), 2,49 (m, 1H), 2,41-2,39 (m, 2H), 2,07 (m, 1H), 1,60-1,55 (m, 1H), 1,29-1,27 (m, 1H), 0,61-0,56 (m, 2H), 0,42-0,39 (m, 2H)
Пример 582: {1-[4-(2-циклобутокси-тиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[4-(2-циклобутокси-тиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,099 г, 0,25 ммоль), полученный в Примере Получения 91, и 4-бром-2-(циклобутокси) тиазол (0,099 г, 0,50 ммоль), полученный в Примере Получения 289, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,041 г, 39%).
1H-ЯМР (400 МГц, CDCl3); δ 7,28-7,19 (m, 2H), 6,67 (s, 1H), 5,21-5,14 (m, 1H), 4,18-4,11 (q, 2H), 3,70-3,61 (m, 2H), 3,57-3,54 (m, 1H), 3,34-3,28 (m, 1H), 2,66-2,62 (m, 1H), 2,55-2,45 (m, 4H), 2,28-2,22 (m, 2H), 2,16-2,12 (m, 1H), 1,89-1,86 (m, 1H), 1,73-1,57 (m, 2H), 1,29-1,25 (t, 3H)
Стадия B: {1-[4-(2-циклобутокси-тиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(2-циклобутокси-тиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,041 г, 0,097 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,033 г, 87%).
1H-ЯМР (400 МГц, CDCl3); δ 7,25-7,20 (m, 2H), 6,68 (s, 1H), 5,19-5,14 (m, 1H), 3,72-3,56 (m, 3H), 3,35-3,31 (m, 1H), 2,67-2,59 (m, 1H), 2,55-2,49 (m, 4H), 2,30-2,16 (m, 3H), 1,89-1,86 (m, 1H), 1,75-1,63 (m, 2H)
Пример 583: {1-[4-(2-циклопропилметокси-тиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[4-(2-циклопропилметокси-тиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,099 г, 0,25 ммоль), полученный в Примере Получения 91, и 4-бром-2-(циклопропилметокси)тиазол (0,099 г, 0,50 ммоль), полученный в Примере Получения 290, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,048 г, 45%).
1H-ЯМР (500 МГц, CDCl3); δ 7,25-7,20 (m, 2H), 6,66 (s, 1H), 4,29-4,28 (d, 2H), 4,18-4,12 (q, 2H), 3,69-3,51 (m, 4H), 3,32-3,28 (m, 1H), 2,62-2,59 (m, 1H), 2,47-2,44 (m, 2H), 2,14-2,11 (m, 1H), 1,63-1,59 (m, 1H), 1,38-1,31 (m, 1H), 1,28-1,25 (t, 3H), 0,68-0,63 (m, 2H), 0,41-0,39 (m, 2H)
Стадия B: {1-[4-(2-циклопропилметокси-тиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(2-циклопропилметокси-тиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,048 г, 0,11 ммоль), полученный на Стадии А, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,031 г, 70%).
1H-ЯМР (400 МГц, CDCl3); δ 7,26-7,23 (m, 2H), 6,69 (s, 1H), 4,30-4,29 (d, 2H), 3,73-3,56 (m, 3H), 3,34 (m, 1H), 2,68-2,60 (m, 1H), 2,56-2,53 (m, 2H), 2,19-2,16 (m, 1H), 1,69-1,64 (m, 1H), 1,37-1,32 (m, 1H), 0,69-0,64 (m, 2H), 0,43-0,39 (m, 2H)
Пример 584: {1-[2,6-дифтор-4-(6-метокси-пиразин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[2,6-дифтор-4-(6-метокси-пиразин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,099 г, 0,25 ммоль), полученный в Примере Получения 91, и 2-хлор-6-метокси-пиразин (0,072 г, 0,50 ммоль), полученный в Примере Получения 234, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,069 г, 73%).
1H-ЯМР (400 МГц, CDCl3); δ 8,45 (s, 1H), 8,08 (s, 1H), 7,52 (m, 2H), 4,19-4,14 (q, 2H), 4,05 (s, 3H), 3,76-3,64 (m, 3H), 3,40 (m, 1H), 2,67-2,61 (m, 1H), 2,49-2,47 (m, 2H), 2,17-2,15 9 м, 1H), 1,67-1,61 (m, 1H), 1,30-1,26 (t, 3H)
Стадия B: {1-[2,6-дифтор-4-(6-метокси-пиразин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[2,6-дифтор-4-(6-метокси-пиразин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты (0,069 г, 0,18 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,048 г, 75%).
1H-ЯМР (400 МГц, CDCl3+MeOD-d4); δ 8,43 (s, 1H), 8,04 (s, 1H), 7,55-7,50 (m, 2H), 4,06 (s, 3H), 3,79-3,64 (m, 3H), 3,41 (m, 1H), 2,67-2,63 (m, 1H), 2,49-2,48 (m, 2H), 2,20-2,16 (m, 1H), 1,70-1,63 (m, 1H)
Пример 585: {1-[4-(6-этокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
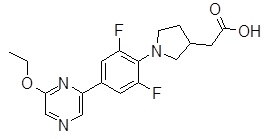
Стадия A: этиловый эфир {1-[4-(6-этокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,099 г, 0,25 ммоль), полученный в Примере Получения 91, и 2-хлор-6-этокси-пиразин (0,079 г, 0,50 ммоль), полученный в Примере Получения 302, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,031 г, 32%).
1H-ЯМР (400 МГц, CDCl3); δ 8,43 (s, 1H), 8,05 (s, 1H), 7,52-7,44 (m, 2H), 4,51-4,46 (q, 2H), 4,19-4,14 (q, 2H), 3,78-3,71 (m, 3H), 3,41-3,37 (m, 1H), 2,67-2,61 (m, 1H), 2,48-2,46 (m, 2H), 2,18-2,13 (m, 1H), 1,68-1,61 (m, 1H), 1,47-1,44 (t, 3H), 1,30-1,25 (t, 3H)
Стадия B: {1-[4-(6-этокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
{1-[4-(6-Этокси-пиразин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусную кислоту (0,031 г, 0,079 ммоль), полученную на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,023 г, 80%).
1H-ЯМР (400 МГц, DMSO-d6) δ 8,77 (s, 1H), 8,15 (s, 1H), 7,77-7,73 (m, 2H), 4,49-4,44 (q, 2H), 3,69-3,57 (m, 3H), 3,33 (m, 1H), 2. 47 (m, 1H), 2,43-2,41 (m, 2H), 2,08 (m, 1H), 1,62-1,56 (m, 1H), 1,41-1,38 (t, 3H)
Пример 586: {1-[2,6-дифтор-4-(6-изопропокси-пиразин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота
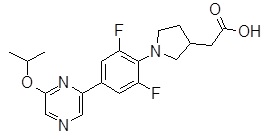
Стадия A: этиловый эфир {1-[2,6-дифтор-4-(6-изопропокси-пиразин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0099 г, 0,25 ммоль), полученный в Примере Получения 91, и 2-хлор-6-изопропокси-пиразин (0,086 г, 0,50 ммоль), полученный в Примере Получения 301, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,076 г, 75%).
1H-ЯМР (400 МГц, CDCl3); δ 8,40 (s, 1H), 8,00 (s, 1H), 7,48-7,45 (m, 1H), 5,45-5,39 (m, 1H), 4,19-4,14 (q, 2H), 3,76-3,63 (m, 3H), 3,39-3,37 (m, 1H), 2,67-2,63 (m, 1H). 2,48-2,46 (m, 2H), 2,15 (m, 1H), 1,66-1,61 (m, 1H), 1,42-1,40 (d, 6H), 1,30-1,26 (t, 3H)
Стадия B: {1-[2,6-дифтор-4-(6-изопропокси-пиразин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[2,6-дифтор-4-(6-изопропокси-пиразин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты (0,076 г, 0,19 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,067 г, 95%).
1H-ЯМР (400 МГц, DMSO-d6) δ 8,73 (s, 1H), 8,09 (s, 1H), 7,74-7,70 (m, 2H), 5,40-5,35 (m, 1H), 3,68-3,56 (m, 2H), 3,33 (m, 1H), 2,45 (m, 1H), 2,41-2,40 (m, 2H), 2,07 (m, 1H), 1,60-1,55 (m, 1H), 1,37-1,36 (d, 6H)
Пример 587: {1-[2,6-дифтор-4-(4-изопропокси-6-метил-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[2,6-дифтор-4-(4-изопропокси-6-метил-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,30 г, 0,75 ммоль), полученный в Примере Получения 91, и 2-хлор-4-изопропокси-6-метил-пиримидин (0,28 г, 1,50 ммоль), полученный в Примере Получения 244, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,254 г, 81%).
1H-ЯМР (400 МГц, CDCl3); δ 7,90-7,80 (m, 2H), 6,33 (s, 1H), 5,53-5,46 (m, 1H), 4,19-4,14 (q, 2H), 3,79-3,70 (m, 2H), 3,64 (m, 1H), 3,42-3,37 (m, 1H), 2,68 (m, 1H), 2,48-2,46 (m, 2H), 2,43 (s, 3H), 2,18-2,13 (m, 1H), 1,68-1,60 (m, 1H), 1,40-1,38 (d, 6H), 1,30-1,26 (t, 3H)
Стадия B: {1-[2,6-дифтор-4-(4-изопропокси-6-метил-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[2,6-дифтор-4-(4-изопропокси-6-метил-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты (0,254 г, 0,61 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,235 г, 99%).
1H-ЯМР (400 МГц, CDCl3); δ 7,90-7,81 (m, 2H), 6,34-6,33 (d, 1H), 5,53-5,46 (m, 1H), 3,81-3,65 (m, 3H), 3,44-3,40 (m, 1H), 2,69-2,61 (m, 1H), 2,55-2,51 (m, 2H), 2,44 (s, 3H), 2,20-2,16 (m, 1H), 1,70-1,61 (m, 1H), 1,40-1,38 (d, 6H)
Пример 588: {1-[2,6-дифтор-4-(4-изобутокси-6-метил-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[2,6-дифтор-4-(4-изобутокси-6-метил-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,30 г, 0,75 ммоль), полученный в Примере Получения 91, и 2-хлор-4-изобутокси-6-метил-пиримидин (0,30 г, 1,50 ммоль), полученный в Примере Получения 246, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,176 г, 54%).
1H-ЯМР (400 МГц, CDCl3); δ 7,88-7,84 (m, 2H), 6,39 (s, 1H), 4,21-4,14 (m, 4H), 3,76-3,63 (m, 3H), 3,40 (m, 1H), 2,66-2,63 (m, 1H), 2,48-2,46 (m, 2H), 2,45 (s, 3H), 2,15-2,08 (m, 2H), 1,66-1,61 (m, 1H), 1,30-1,26 (t, 3H), 1,04-1,03 (d, 6H)
Стадия B: {1-[2,6-дифтор-4-(4-изобутокси-6-метил-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[2,6-дифтор-4-(4-изобутокси-6-метил-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты (0,176 г, 0,41 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,164 г, 99%).
1H-ЯМР (400 МГц, CDCl3); δ 7,89-7,85 (m, 2H), 6,40 (s, 1H), 4,21-4,20 (d, 2H), 3,79-3,65 (m, 3H), 3,44-3,42 (m, 1H), 2,68-2,62 (m, 1H), 2,56-2,51 (m, 2H), 2,46 (s, 3H), 2,17-2,08 (m, 2H), 1,68-1,63 (m, 1H), 1,04-1,03 (d, 6H)
Пример 589: {1-[2,6-дифтор-4-(4-метил-6-пропокси-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота
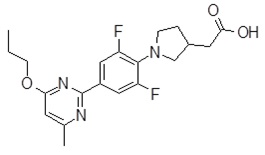
Стадия A: этиловый эфир {1-[2,6-дифтор-4-(4-метил-6-пропокси-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,30 г, 0,75 ммоль), полученный в Примере Получения 91, и 2-хлор-4-метил-6-пропокси-пиримидин (0,28 г, 1,50 ммоль), полученный в Примере Получения 245, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,281 г, 89%).
1H-ЯМР (400 МГц, CDCl3); δ 7,89-7,85 (m, 2H), 6,40 (s, 1H), 4,21-4,20 (d, 2H), 3,79-3,65 (m, 3H), 3,44-3,42 (m, 1H), 2,68-2,62 (m, 1H), 2,56-2,51 (m, 2H), 2,46 (s, 3H), 2,17-2,08 (m, 2H), 1,68-1,63 (m, 1H), 1,04-1,03 (d, 6H)
Стадия B: {1-[2,6-дифтор-4-(4-метил-6-пропокси-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[2,6-дифтор-4-(4-метил-6-пропокси-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты (0,281 г, 0,67 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,183 г, 70%).
1H-ЯМР (400 МГц, CDCl3); δ 7,90-7,85 (m, 2H), 6,39 (s, 1H), 4,41-4,37 (t, 2H), 3,82-3,65 (m, 3H), 3,44-3,40 (m, 1H), 2,69-2,59 (m, 1H), 2,55-2,51 (m, 2H), 2,45 (s, 3H), 2,20-2,16 (m, 1H), 1,87-1,78 (m, 2H), 1,68-1,61 (m, 1H), 1,06-1,03 (t, 2H)
Пример 590: {1-[4-(4-этокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
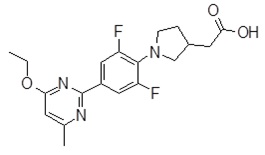
Стадия A: этиловый эфир {1-[4-(4-этокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,30 г, 0,75 ммоль), полученный в Примере Получения 91, и 2-хлор-4-этокси-6-метил-пиримидин (0,259 г, 1,50 ммоль), полученный в Примере Получения 243, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,266 г, 88%).
1H-ЯМР (400 МГц, CDCl3); δ 7,88-7,85 (m, 2H), 6,37 (s, 1H), 4,52-4,47 (t, 2H), 4,19-4,14 (q, 2H), 3,77-3,64 (m, 3H), 3,40 (m, 1H), 2,66-2,61 (m, 1H), 2,48-2,46 (m, 2H), 2,45 (s, 3H), 2,05 (m, 1H) 1,65-1,60 (m, 1H), 1,44-1,41 (t, 3H), 1,30-1,26 (t, 3H)
Стадия B: {1-[4-(4-этокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(4-Этокси-6-метил-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,266 г, 0,66 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,234 г, 94%).
1H-ЯМР (400 МГц, CDCl3); δ 7,90-7,82 (m, 2H), 6,37 (s, 1H), 4,52-4,47 (q, 2H), 3,79-3,64 (m, 3H), 3,49-3,40 (m, 1H), 2,69-2,62 (m, 1H), 2,55-2,51 (m, 2H), 2,45 (s, 3H), 2,20-2,16 (m, 1H), 1,70-1,63 (m, 1H), 1,44-1,41 (t, 3H)
Пример 591: {1-[4-(5-циклобутокси-3-метил-изотиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[4-(5-циклобутокси-3-метил-изотиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,094 г, 0,24 ммоль), полученный в Примере Получения 91, и 4-бром-5-(циклобутокси)-3-метил-изотиазол (0,060 г, 0,24 ммоль), полученный в Примере Получения 292, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,048 г, 46%).
1H-ЯМР (400 МГц, CDCl3); δ 6,82-6,77 (m, 2H), 4,62-4,57 (m, 1H), 4,19-4,13 (q, 2H), 3,72-3,58 (m, 3H), 3,34-3,30 (m, 1H), 2,67-2,62 (m, 1H), 2,48-2,46 (m, 4H), 2,36 (s, 3H), 2,26-2,13 (m, 3H), 1,87-1,82 (m, 1H), 1,69-1,63 (m, 2H), 1,30-1,26 (t, 3H)
Стадия B: {1-[4-(5-циклобутокси-3-метил-изотиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(5-циклобутокси-3-метил-изотиазол-4-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,048 г, 0,11 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,038 г, 80%).
1H-ЯМР (400 МГц, CDCl3); δ 6,82-6,79 (m, 2H), 4,61-4,58 (m, 1H), 3,72-3,58 (m, 3H), 3,34 (m, 1H), 2,69-2,65 (m, 1H), 2,55-2,53 (m, 2H), 2,49-2,43 (m, 2H), 2,36 (s, 3H), 2,26-2,18 (m, 3H), 1,87-1,85 (m, 1H), 1,69-1,62 (m, 2H)
Пример 592: {1-[4-(4-циклобутокси-5-фтор-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[4-(4-циклобутокси-5-фтор-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,20 г, 0,5 ммоль), полученный в Примере Получения 91, и 2-хлор-4-циклобутокси-5-фторпиримидин (0,15 г, 0,75 ммоль), полученный в Примере Получения 329, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,16 г, 72%).
1H-ЯМР (400 МГц, CDCl3); δ 8,29-8,27 (d, 1H), 7,78-7,72 (m, 2H), 5,42-5,38 (m, 1H), 4,19-4,4 (q, 2H), 3,77-3,75 (m, 2H), 6,64 (m, 2H), 3,42-3,38 (m, 1H), 2,66-2,53 (m, 3H0, 2,48-2,46 (m, 2H), 2,31-2,26 (m, 2H), 2,17-2,13 (m, 1H), 1,94-1,91 (m, 1H), 1,82-1,75 (m, 1H), 1,66-1,61 (m, 1H), 1,30-1,26 (t, 3H)
Стадия B: {1-[4-(4-циклобутокси-5-фтор-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(4-циклобутокси-5-фтор-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,14 г, 0,31 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,10 г, 78%).
1H-ЯМР (400 МГц, CDCl3); δ 8,28-8,27 (d, 1H), 7,74-7,71 (m, 2H), 5,40-5,37 (m, 1H), 3,79-3,64 (m, 3H), 4,43-3,39 (m, 1H), 2,69-2,62 (m, 1H), 2,61-2,52 (m, 4H), 2,31-2,23 (m, 2H), 2,19-2,15 (m, 1H), 1,93-1,90 (m, 1H), 1,80-1,73 (m, 1H), 1,69-1,62 (m, 1H)
Пример 593: {1-[4-(4-циклопропилметокси-5-фтор-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
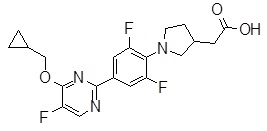
Стадия A: этиловый эфир {1-[4-(4-циклопропилметокси-5-фтор-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,2 г, 0,5 ммоль), полученный в Примере Получения 91, и 2-хлор-4-циклопропилметокси-5-фтор-пиримидин (0,15 г, 0,75 ммоль), полученный в Примере Получения 330, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,16 г, 69%).
1H-ЯМР (400 МГц, CDCl3); δ 8,29-8,28 (d, 1H), 7,79-7,71 (m, 2H), 4,39-7,37 (d, 2H), 4,19-4,14 (q, 2H), 3,77-3,64 (m, 3H), 3,42-3,38 (m, 1H), 2,66-2,62 (m, 1H), 2,48-2,46 (m, 2H), 2,17-2,13 (m, 1H), 1,68-1,61 (m, 1H), 1,40-1,37 (m, 1H), 1,30-1,26 (t, 3H), 0,70-0,66 (m, 2H), 0,46-0,42 (m, 2H)
Стадия B: {1-[4-(4-циклопропилметокси-5-фтор-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[4-(4-циклопропилметокси-5-фтор-пиримидин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,12 г, 0,27 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,096 г, 81%).
1H-ЯМР (400 МГц, CDCl3); δ 8,29-8,28 (d, 1H), 7,74-7,72 (m, 2H), 4,38-4,36 (d, 2H), 3,81-3,63 (m, 3H), 3,48-3,39 (m, 1H), 2,68-2,61 (m, 1H), 2,54-2,50 (m, 2H), 2,18-2,15 (m, 1H), 1,66-1,64 (m, 1H), 1,39-1,36 (m, 1H), 0,69-0,66 (m, 2H), 0,44-0,42 (m, 2H)
Пример 594: {1-[2,6-дифтор-4-(5-фтор-4-изобутокси-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[2,6-дифтор-4-(5-фтор-4-изобутокси-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,16 г, 0,40 ммоль), полученный в Примере Получения 91, и 2-хлор-5-фтор-4-изобутокси-пиримидин (0,12 г, 0,60 ммоль), полученный в Примере Получения 331, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,12 г, 63%).
1H-ЯМР (400 МГц, CDCl3); δ 8,28-8,27 (d, 1H), 7,77-7,74 (m, 2H), 4,32-4,30 (d, 2H), 4,19-4,14 (q, 2H), 3,77-3,64 (m, 3H), 3,41 (m, 1H), 2,64-2,63 (m, 1H), 2,48-2,46 (m, 2H), 2,23-2,18 (m, 2H), 1,66-1,61 (m, 1H), 1,30-1,26 (t, 3H), 1,08-1,06 (d, 6H)
Стадия B: {1-[2,6-дифтор-4-(5-фтор-4-изобутокси-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусная кислота
Этиловый эфир {1-[2,6-дифтор-4-(5-фтор-4-изобутокси-пиримидин-2-ил)-фенил]-пирролидин-3-ил}-уксусной кислоты (0,12 г, 0,27 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,074 г, 68%).
1H-ЯМР (400 МГц, CDCl3); δ 8,28-8,27 (d, 1H), 7,75-7,73 (m, 2H), 4,30-4,29 (d, 2H), 3,79-3,64 (m, 3H), 3,43-3,41 (m, 1H), 2,64-2,62 (m, 1H), 2,54-2,52 (m, 2H), 2,20-2,17 (m, 2H), 1,67-1,64 (m, 1H), 1,07-1,05 (d, 6H)
Пример 595: (1-{2,6-дифтор-4-[6-(3-метокси-пропокси)-пиридин-2-ил]-фенил}-пирролидин-3-ил)-уксусная кислота

Стадия A: этиловый эфир (1-{2,6-дифтор-4-[6-(3-метокси-пропокси)-пиридин-2-ил]-фенил}-пирролидин-3-ил)-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,099 г, 0,25 ммоль), полученный в Примере Получения 91, и 2-хлор-6-(3-метокси-пропокси)-пиридин (0,076 г, 0,38 ммоль), полученный в Примере Получения 332, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,039 г, 34%).
1H-ЯМР (400 МГц, CDCl3); δ 7,59-7,55 (t, 1H), 7,54-7,45 (m, 2H), 7,18-7,16 (d, 1H), 6,62-6,60 (d, 1H), 4,50-4,47 (t, 2H), 4,19-4,14 (q, 2H), 3,75-3,66 (m, 2H), 3,62-3,55 (m, 3H), 3,38 (s, 3H), 3,36-3,33 (m, 1H), 2,69-2,61 (m, 1H), 2,52-2,42 (m, 2H), 2,17-2,06 (m, 3H), 1,68-1,61 (m, 1H), 1,30-1,26 (t, 3H)
Стадия B: (1-{2,6-дифтор-4-[6-(3-метокси-пропокси)-пиридин-2-ил]-фенил}-пирролидин-3-ил)-уксусная кислота
Этиловый эфир (1-{2,6-дифтор-4-[6-(3-метокси-пропокси)-пиридин-2-ил]-фенил}-пирролидин-3-ил)-уксусной кислоты (0,039 г, 0,089 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,031 г, 85%).
1H-ЯМР (400 МГц, CDCl3); δ7,58-7,55 (t, 1H), 7,55-7,47 (m, 2H), 7,17-7,15 (d, 1H), 6,61-6,59 (d, 1H), 4,49-4,46 (t, 2H), 3,74-3,67 (m, 2H), 3,60-3,55 (m, 3H), 3,38-3,35 (m, 4H), 2,66-2,61 (m, 1H), 2,58-2,52 (m, 2H), 2,21-2,14 (m, 1H), 2,11-2,05 (m, 2H), 1,67-1,62 (m, 1H)
Пример 596: (1-{2,6-дифтор-4-[6-(тетрагидро-тиопиран-4-илокси-пиридин-2-ил]-фенил}-пирролидин-3-ил)-уксусная кислота

Стадия A: этиловый эфир (1-{2,6-дифтор-4-[6-(тетрагидро-тиопиран-4-илокси-пиридин-2-ил]-фенил}-пирролидин-3-ил)-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,099 г, 0,25 ммоль), полученный в Примере Получения 91, и 2-хлор-6-(тетрагидро-тиопиран-4-илокси)-пиридин (0,086 г, 0,38 ммоль), полученный в Примере Получения 333, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,063 г, 52%).
1H-ЯМР (400 МГц, CDCl3); δ 7,60-7,56 (t, 1H), 7,47-7,39 (m, 2H), 7,17-7,15 (d, 1H), 6,61-6,59 (d, 1H), 5,32-5,28 (m, 1H), 4,19-4,14 (q, 2H), 3,75-3,60 (m, 3H), 3,38-3,34 (m, 1H), 2,95-2,90 (m, 2H), 2,70-2,61 (m, 3H), 2,52-2,46 (m, 2H), 2,31-2,25 (m, 2H), 2,17-2,04 (m, 3H), 1,68-1,63 (m, 1H), 1,30-1,26 (t, 3H)
Стадия B: (1-{2,6-дифтор-4-[6-(тетрагидро-тиопиран-4-илокси-пиридин-2-ил]-фенил}-пирролидин-3-ил)-уксусная кислота
Этиловый эфир (1-{2,6-дифтор-4-[6-(тетрагидро-тиопиран-4-илокси-пиридин-2-ил]-фенил}-пирролидин-3-ил)-уксусной кислоты (0,063 г, 0,14 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,052 г, 89%).
1H-ЯМР (400 МГц, CDCl3); δ 7,60-7,56 (t, 1H), 7,47-7,39 (m, 2H), 7,17-7,15 (d, 1H), 6,62-6,60 (d, 1H), 5,32-5,28 (m, 1H), 3,78-3,61 (m, 3H), 3,40-3,36 (m, 1H), 2,95-2,91 (m, 2H), 2,70-2,65 (m, 3H), 2,56-2,53 (m, 2H), 2,31-2,04 (m, 5H), 1,71-1,64 (m, 1H)
Пример 597: {1-[2,6-дифтор-4-(5-фтор-4-изобутокси-пиримидин-2-ил)-фенил]-пиперидин-4-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[2,6-дифтор-4-(5-фтор-4-изобутокси-пиримидин-2-ил)-фенил]-пиперидин-4-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,16 г, 0,40 ммоль), полученный в Примере Получения 220, и 2-хлор-5-фтор-4-изобутокси-пиримидин (0,12 г, 0,60 ммоль), полученный в Примере Получения 331, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,11 г, 62%).
1H-ЯМР (500 МГц, CDCl3); δ 8,30-8,29 (d, 1H), 7,82-7,77 (m, 2H), 4,31-4,30 (d, 2H), 4,17-4,12 (q, 2H), 3,36-3,34 (m, 2H), 3,17-3,12 (m, 2H), 2,30-2,28 (d, 2H), 2,22-2,16 (m, 1H), 1,98-1,94 (m, 1H), 1,79-1,76 (m, 2H), 1,49-1,41 (m, 2H), 1,28-1,24 (t, 3H), 1,08-1,05 (d, 6H)
Стадия B: {1-[2,6-дифтор-4-(5-фтор-4-изобутокси-пиримидин-2-ил)-фенил]-пиперидин-4-ил}-уксусная кислота
Этиловый эфир {1-[2,6-дифтор-4-(5-фтор-4-изобутокси-пиримидин-2-ил)-фенил]-пиперидин-4-ил}-уксусной кислоты (0,11 г, 0,25 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,095 г, 90%).
1H-ЯМР (500 МГц, CDCl3); δ 8,31-8,30 (d, 1H), 7,79-7,76 (m, 2H), 4,31-4,30 (d, 2H), 3,37-3,35 (m, 2H), 3,18-3,13 (m, 2H), 2,37-2,35 (d, 2H), 2,21-2,17 (m, 1H), 1,98-1,97 (m, 1H), 1,83-1,81 (m, 2H), 1,51-1,46 (m, 2H), 1,07-1,05 (d, 6H)
Пример 598: {1-[2,6-дифтор-4-(5-фтор-4-пропокси-пиримидин-2-ил)-фенил]-пиперидин-4-ил}-уксусная кислота
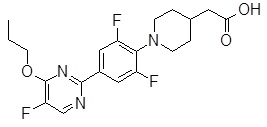
Стадия A: этиловый эфир {1-[2,6-дифтор-4-(5-фтор-4-пропокси-пиримидин-2-ил)-фенил]-пиперидин-4-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,16 г, 0,40 ммоль), полученный в Примере Получения 220, и 2-хлор-5-фтор-4-пропокси-пиримидин (0,11 г, 0,60 ммоль), полученный в Примере Получения 334, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,11 г, 60%).
1H-ЯМР (500 МГц, CDCl3); δ 8,30-8,29 (d, 1H), 7,80-7,78 (m, 2H), 4,52-4,49 (t, 2H), 4,15-4,12 (q, 2H), 3,36-3,34 (m, 2H), 3,17-3,12 (m, 2H), 2,30-2,28 (d, 2H), 1,96 (m, 1H), 1,92-1,87 (q, 2H), 1,79-1,76 (m, 2H), 1,51-1,43 (m, 2H), 1,28-1,25 (t, 3H), 1,09-1,06 (t, 3H)
Стадия B: {1-[2,6-дифтор-4-(5-фтор-4-пропокси-пиримидин-2-ил)-фенил]-пиперидин-4-ил}-уксусная кислота
Этиловый эфир {1-[2,6-дифтор-4-(5-фтор-4-пропокси-пиримидин-2-ил)-фенил]-пиперидин-4-ил}-уксусной кислоты (0,11 г, 0,24 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,092 г, 93%).
1H-ЯМР (500 МГц, CDCl3); δ 8,31-8,30 (d, 1H), 7,80-7,78 (m, 2H), 4,51-4,49 (t, 2H), 3,37-3,35 (m, 2H), 3,18-3,13 (m, 2H), 2,37-2,35 (d, 2H), 1,98 (m, 1H), 1,92-1,87 (m, 2H), 1,83-1,81 (m, 2H), 1,49-1,46 (m, 2H), 1,09-1,06 (t, 3H)
Пример 599: (1-{2,6-дифтор-4-[4-(3-метил-бутокси)-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота

Стадия A: этиловый эфир (1-{2,6-дифтор-4-[4-(3-метил-бутокси)-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,21 г, 0,50 ммоль), полученный в Примере Получения 220, и 2-хлор-4-(3-метил-бутокси)-пиримидин (0,15 г, 0,75 ммоль), полученный в Примере Получения 335, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,079 г, 35%).
1H-ЯМР (500 МГц, CDCl3); δ 8,43-8,42 (d, 1H), 7,90-7,85 (m, 2H), 6,56-6,55 (d, 1H), 4,50-4,47 (t, 2H), 4,15-4,12 (q, 2H), 3,37-3,35 (m, 2H), 3,17-3,14 (m, 2H), 2,29-2,28 (d, 2H), 1,98-1,95 (m, 1H), 1,84-1,80 (m, 1H), 1,79-1,76 (m, 2H), 1,72-1,68 (q, 2H), 1,49-1,42 (m, 2H), 1,29-1,24 (t, 3H), 0,99-0,96 (d, 6H)
Стадия B: (1-{2,6-дифтор-4-[4-(3-метил-бутокси)-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота
Этиловый эфир (1-{2,6-дифтор-4-[4-(3-метил-бутокси)-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусной кислоты (0,079 г, 0,18 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,067 г, 90%).
1H-ЯМР (500 МГц, CDCl3); δ 8,44-,43 (d, 1H), 7,90-7,86 (m, 2H), 6,57-6,56 (d, 1H), 4,50-4,48 (t, 2H), 3,39-3,36 (m, 2H), 3,18-3,14 (m, 2H), 2,37-2,35 (d, 2H), 2,0-1,96 (m, 1H), 1,84-1,78 (m, 3H), 1,72-1,68 (m, 2H), 1,52-1,45 (m, 2H), 0,99-0,98 (d, 6H)
Пример 600: (1-{2,6-дифтор-4-[4-(3-метокси-пропокси)-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота

Стадия A: этиловый эфир (1-{2,6-дифтор-4-[4-(3-метокси-пропокси)-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,16 г, 0,40 ммоль), полученный в Примере Получения 220, и 2-хлор-4-(3-метокси-пропокси)-пиримидин (0,12 г, 0,60 ммоль), полученный в Примере Получения 336, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,10 г, 56%).
1H-ЯМР (500 МГц, CDCl3); δ 8,44-8,43 (d, 1H), 7,90-7,88 (m, 2H), 6,58-6,57 (d, 1H), 4,56-4,54 (t, 2H), 4,17-4,13 (q, 2H), 3,56-3,54 (t, 2H), 3,36 (s, 3H), 3,35 (m, 2H), 3,17-3,13 (m, 2H), 2,30-2,28 (d, 2H), 2,11-2,17 (m, 2H), 1,97 (m, 1H), 1,79-1,76 (m, 2H), 1,48-1,42 (m, 2H), 1,28-1,25 (t, 3H)
Стадия B: (1-{2,6-дифтор-4-[4-(3-метокси-пропокси)-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота
Этиловый эфир (1-{2,6-дифтор-4-[4-(3-метокси-пропокси)-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусной кислоты (0,10 г, 0,23 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,086 г, 90%).
1H-ЯМР (500 МГц, CDCl3); δ 8,45-8,44 (d, 1H), 7,91-7,86 (m, 2H), 6,59-6,58 (d, 1H), 4,57-4,54 (t, 2H), 3,57-3,54 (t, 2H), 3,38-3,34 (m, 5H), 3,18-3,14 (m, 2H), 2,37-2,35 (d, 2H), 2,12-2,07 (m, 2H), 1,99-1,97 (m, 1H), 1,84-1,81 (m, 2H) 1,52-1,44 (m, 2H)
Пример 601: (1-{2,6-дифтор-4-[4-(3-метокси-пропокси)-6-метил-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота
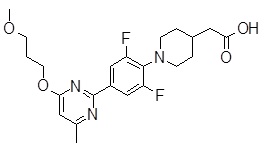
Стадия A: этиловый эфир (1-{2,6-дифтор-4-[4-(3-метокси-пропокси)-6-метил-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,16 г, 0,40 ммоль), полученный в Примере Получения 220, и 2-хлор-4-(3-метокси-пропокси)-6-метил-пиримидин (0,17 г, 0,80 ммоль), полученный в Примере Получения 248, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,15 г, 82%).
1H-ЯМР (500 МГц, CDCl3); δ 7,92-7,87 (m, 2H), 6,42 (s, 1H), 4,53-4,51 (t, 2H), 4,17-4,13 (q, 2H), 3,55-3,53 (t, 2H), 3,36 (s, 3H), 3,34 (m, 2H), 3,17-3,12 (m, 2H), 2,45 (s, 3H), 2,30-2,28 (d, 2H), 2,10-2,05 (m, 2H), 1,97-1,95 (m, 1H), 1,78-1,76 (m, 2H), 1,49-1,41 (m, 2H), 1,28-1,24 (t, 3H)
Стадия B: (1-{2,6-дифтор-4-[4-(3-метокси-пропокси)-6-метил-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота
Этиловый эфир (1-{2,6-дифтор-4-[4-(3-метокси-пропокси)-6-метил-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусной кислоты (0,15 г, 0,33 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,13 г, 90%).
1H-ЯМР (500 МГц, CDCl3); δ 7,92-7,87 (m, 2H), 6,43 (s, 1H), 4,54-4,51 (t, 2H), 3,56-3,53 (t, 2H), 3,36 (s, 3H), 3,34-3,33 (m, 2H), 3,18-3,13 (m, 2H), 2,46 (s, 3H), 2,36-2,35 (d, 2H), 2,09-2,05 (m, 2H), 1,99-1,96 (m, 1H), 1,83-1,81 (m, 2H), 1,52-1,46 (m, 2H)
Пример 602: (1-{2,6-дифтор-4-[4-(2-метокси-этокси)-6-метил-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота

Стадия A: этиловый эфир (1-{2,6-дифтор-4-[4-(2-метокси-этокси)-6-метил-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,16 г, 0,40 ммоль), полученный в Примере Получения 220, и (2-метоксиэтокси) 2-хлор-4-6-метил-пиримидин (0,16 г, 0,80 ммоль), полученный в Примере Получения 247, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,15 г, 82%).
1H-ЯМР (500 МГц, CDCl3); δ 7,89-7,86 (m, 2H), 6,50 (s, 1H), 4,62-4,60 (t, 2H), 4,17-4,13 (q, 2H), 3,78-3,76 (t, 2H), 3,44 (s, 3H), 3,36-3,33 (m, 2H), 3,17-3,12 (m, 2H), 2,46 (s, 3H), 2,30-2,28 (d, 2H), 1,97-1,95 (m, 1H), 1,79-1,76 (m, 2H), 1,51-1,42 (m, 2H), 1,28-1,25 (t, 3H)
Стадия B: (1-{2,6-дифтор-4-[4-(2-метокси-этокси)-6-метил-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота
Этиловый эфир (1-{2,6-дифтор-4-[4-(2-метокси-этокси)-6-метил-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусной кислоты (0,15 г, 0,33 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,13 г, 90%).
1H-ЯМР (500 МГц, CDCl3); δ 7,91-7,86 (m, 2H), 6,50 (s, 1H), 4,62-4,60 (t, 2H), 3,78-3,76 (t, 2H), 3,44 (s, 3H), 3,37-3,34 (m, 2H), 3,18-3,13 (m, 2H), 2,46 (s, 3H), 2,36-2,35 (d, 2H), 1,99-1,95 (m, 1H), 1,83-1,81 (m, 2H), 1,52-1,46 (m, 2H)
Пример 603: (1-{2,6-дифтор-4-[6-(3-метокси-пропокси)-пиридин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота

Стадия A: этиловый эфир (1-{2,6-дифтор-4-[6-(3-метокси-пропокси)-пиридин-2-ил]-фенил}-пиперидин-4-ил)-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,16 г, 0,40 ммоль), полученный в Примере Получения 220, и 2-хлор-6-(3-метокси-пропокси)-пиридин (0,16 г, 0,80 ммоль), полученный в Примере Получения 332, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,14 г, 76%).
1H-ЯМР (400 МГц, CDCl3); δ 7,61-7,58 (t, 1H), 7,54-7,49 (m, 2H), 7,21-7,19 (d, 1H), 6,66-6,64 (d, 1H), 4,49-4,47 (t, 2H), 4,17-4,13 (q, 2H), 3,58-3,55 (t, 2H), 3,37 (s, 3H), 3,34-3,30 (m, 2H), 3,17-3,12 (m, 2H), 2,30-2,28 (d, 2H), 2,11-2,06 (m, 2H), 1,97-1,94 (m, 1H), 1,79-1,76 (m, 2H), 1,51-1,43 (m, 2H), 1,28-1,26 (t, 3H)
Стадия B: (1-{2,6-дифтор-4-[6-(3-метокси-пропокси)-пиридин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота
Этиловый эфир (1-{2,6-дифтор-4-[6-(3-метокси-пропокси)-пиридин-2-ил]-фенил}-пиперидин-4-ил)-уксусной кислоты (0,14 г, 0,31 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,12 г, 90%).
1H-ЯМР (400 МГц, CDCl3); δ 7,61-7,58 (t, 1H), 7,54-7,50 (m, 2H), 7,21-7,19 (d, 1H), 6,66-6,65 (d, 1H), 4,49-4,47 (t, 2H), 3,58-3,56 (t, 2H), 3,37 (s, 3H), 3,33-3,31 (m, 2H), 3,18-3,13 (m, 2H), 2,37-2,35 (d, 2H), 2,11-2,06 (m, 2H), 1,98-1,95 (m, 1H), 1,83-1,81 (m, 2H), 1,53-1,46 (m, 2H)
Пример 604: {(S)-1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
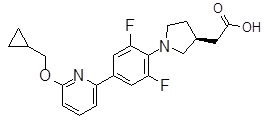
Стадия A: метиловый эфир {(S)-1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты
Метиловый эфир 2-[(3S)-1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пирролидин-3-ил]уксусной кислоты (0,02 г, 0,53 ммоль), полученный в Примере Получения 97, и 2-хлор-6-циклопропилметокси-пиридин (0,19 г, 1,05 ммоль), полученный в Примере Получения 43, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,15 г, 70%).
1H-ЯМР (400 МГц, CDCl3); δ 7,60-7,56 (t, 1H), 7,53-7,45 (m, 2H), 7,18-7,16 (d, 1H), 6,67-6,65 (d, 1H), 4,24-4,22 (d, 2H), 3,76-3,61 (m, 6H), 3,39-3,35 (m, 1H), 2,69-2,64 (m, 1H), 2,51-2,46 (m, 2H), 2,18-2,14 (m, 1H), 1,68-1,63 (m, 1H), 1,36-1,30 (m, 1H), 0,66-0,61 (m, 2H), 0,41-0,37 (m, 2H)
Стадия B: {(S)-1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусная кислота
Метиловый эфир {(S)-1-[4-(6-циклопропилметокси-пиридин-2-ил)-2,6-дифтор-фенил]-пирролидин-3-ил}-уксусной кислоты (0,15 г, 0,37 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,14 г, 97%).
1H-ЯМР (400 МГц, CDCl3); δ 7,60-7,56 (t, 1H), 7,52-7,44 (m, 2H), 7,18-7,16 (d, 1H), 6,67-6,64 (d, 1H), 4,24-4,22 (d, 2H), 3,77-3,61 (m, 3H), 3,40-3,36 (m, 1H), 2,70-2,63 (m, 1H), 2,56-2,50 (m, 2H), 2,23-2,17 (m, 1H), 1,71-1,62 (m, 1H), 1,35-1,30 (m, 1H), 0,66-0,61 (m, 2H), 0,41-0,37 (m, 2H)
Пример 605: 2-[1-[2,6-дифтор-4-[4-[(6-метил-3-пиридил)окси]пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(6-метил-пиридин-3-илокси)-пиримидин (0,131 г, 0,59 ммоль), полученный в Примере Получения 340, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,037 г, 17%).
1H-ЯМР (CDCl3) δ 8,63 (1H, d), 8,56 (1H, d), 7,70 (2H, m), 7,50 (1H, dd), 7,27 (1H, d), 6,81 (1H, d), 3,34 (2H, m), 3,12 (2H, m), 2,64 (3H, s), 2,34 (2H, d), 1,97 (1H, m), 1,81 (2H, m), 1,43 (2H, m)
Пример 606: 2-[1-[2,6-дифтор-4-[6-(4-этилфенокси)пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(4 фенокси этила)-пиримидин (0,138 г, 0,59 ммоль), полученный в Примере Получения 341, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,097 г, 43%).
1H-ЯМР (CDCl3) δ 8,56 (1H, d), 7,75 (2H, m), 7,27 (2H, m), 7,11 (2H, m), 6,66 (1H, d), 3,35 (2H, m), 3,14 (2H, m), 2,71 (2H, q), 2,35 (2H, d), 1,97 (1H, m), 1,82 (2H, m), 1,45 (2H, m), 1,29 (3H, t)
Пример 607: 2-[1-[4-[4-(3-фторфенокси)пиримидин-2-ил]-2,6-дифтор-фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(3-фторфенокси)-пиримидин (0,133 г, 0,59 ммоль), полученный в Примере Получения 342, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,091 г, 41%).
1H-ЯМР (CDCl3) δ 8,62 (1H, d), 7,72 (2H, m), 7,41 (1H, m), 7,05~6,95 (3H, m), 6,74 (1H, d), 3,36 (2H, m), 3,13 (2H, m), 2,35 (2H, d), 1,97 (1H, m), 1,80 (2H, m), 1,45 (2H, m)
Пример 608: 2-[1-[2,6-дифтор-4-[4-(3,4-фторфенокси)-6-метил-пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота

2-хлор-4-(3,4-дифтор-фенокси)-6-метил-пиримидин (0,151 г, 0,59 ммоль), полученный в Примере Получения 343, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,2 г, 0,49 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,133 г, 57%).
1H-ЯМР (CDCl3) δ 7,72 (2H, m), 7,23 (1H, m), 7,05 (1H, m), 6,94 (1H, m), 6,57 (1H, s), 3,34 (2H, m), 3,13 (2H, m), 2,53 (3H, s), 2,34 (2H, d), 1,97 (1H, m), 1,80 (2H, m), 1,47 (2H, m)
Пример 609: 2-[1-[2,6-дифтор-4-[4-(2-пиридилокси)пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота
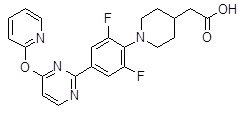
2-хлор-4-(пиридин-2-илокси)-пиримидин (0,10 г, 0,48 ммоль), полученный в Примере Получения 344, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,164 г, 0,40 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,037 г, 21%).
1H-ЯМР (CDCl3) δ 8,56 (1H, d), 8,41 (1H, m), 7,87 (1H, m), 7,72 (2H, m), 7,27 (1H, m), 7,19 (1H, d), 6,90 (1H, d), 3,35 (2H, m), 3,12 (2H, m), 2,34 (2H, d), 1,95 (1H, m), 1,80 (2H, m), 1,43 (2H, m)
Пример 610: 2-[1-[2,6-дифтор-4-[4-[4-(трифторметил)фенокси]пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота
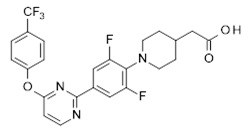
2-хлор-4-[4-(трифторметил)фенокси]пиримидин (0,088 г, 0,32 ммоль), полученный в Примере Получения 345, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,144 г, 0,35 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,12 г, 76%).
1H-ЯМР (CDCl3) δ 8,54 (1H, d), 7,70 (4H, m), 7,35 (2H, d), 6,80 (1H, d), 3,36 (2H, m), 3,13 (2H, m), 2,34 (2H, d), 1,97 (1H, m), 1,81 (2H, m), 1,47 (2H, m)
Пример 611: 2-[1-[2,6-дифтор-4-[4-[3-(трифторметил)фенокси]пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота
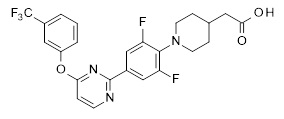
2-хлор-4-[3-(трифторметил)фенокси]пиримидин (0,092 г, 0,33 ммоль), полученный в Примере Получения 346, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,15 г, 0,37 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,07 г, 51%).
1H-ЯМР (CDCl3) δ 8,64 (1H, d), 7,68 (2H, m), 7,58 (3H, m), 7,43 (1H, m), 6,80 (1H, d), 3,36 (2H, m), 3,13 (2H, m), 2,34 (2H, d), 1,97 (1H, m), 1,80 (2H, m), 1,45 (2H, m)
Пример 612: 2-[1-[2,6-дифтор-4-[4-метил-6-[4-(трифторметил)фенокси]пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота
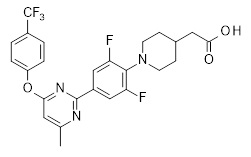
2-хлор-4-метил-6-[4-(трифторметил)фенокси]пиримидин (0,088 г, 0,3 ммоль), полученный в Примере Получения 347, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,135 г, 0,33 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,118 г, 77%).
1H-ЯМР (CDCl3) δ 7,72 (4H, m), 7,32 (2H, d), 6,61 (1H, s), 3,35 (2H, m), 3,13 (2H, m), 2,55 (3H, s), 2,35 (2H, d), 1,97 (1H, m), 1,80 (2H, m), 1,46 (2H, m)
Пример 613: 2-[1-[2,6-дифтор-4-[4-метил-6-[3-(трифторметил)фенокси]пиримидин-2-ил]фенил]-4-пиперидил]уксусная кислота

2-хлор-4-метил-6-[3-(трифторметил)фенокси]пиримидин (0,087 г, 0,3 ммоль), полученный в Примере Получения 348, и этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,135 г, 0,33 ммоль), полученный в Примере Получения 220, вводили в реакцию таким же образом, как на Стадии A Примера 96 и Стадии B Примера 1, с получением целевого соединения (0,124 г, 81%).
1H-ЯМР (CDCl3) δ 7,71 (2H, m), 7,56 (3H, m), 7,39 (1H, m), 6,62 (1H, s), 3,35 (2H, m), 3,13 (2H, m), 2,55 (3H, s), 2,35 (2H, d), 1,97 (1H, m), 1,80 (2H, m), 1,46 (2H, m)
Пример 614: {1-[4-(6-циклобутокси-4-трифторметил-пиридин-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота

Стадия A: этиловый эфир {1-[4-(6-циклобутокси-4-трифторметил-пиридин-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусной кислоты
Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,16 г, 0,40 ммоль), полученный в Примере Получения 220, и 2-хлор-4-циклобутокси-6-трифторметил-пиримидин (0,15 г, 0,60 ммоль), полученный в Примере Получения 349, вводили в реакцию таким же образом, как на Стадии A Примера 1, с получением целевого соединения (0,09 г, 45%).
1H-ЯМР (400 МГц, CDCl3); δ 7,54-7,47 (m, 2H), 7,35 (s, 1H), 6,84 (s, 1H), 5,33-5,26 (m, 1H), 4,18-4,11 (q, 2H), 3,36-3,33 (m, 2H), 3,19-3,13 (m, 2H), 2,57-2,50 (m, 2H), 2,33-2,30 (d, 2H), 2,22-2,19 (m, 2H), 2,05-1,88 (m, 2H), 1,80-1,75 (m, 3H), 1,51-1,42 (m, 2H), 1,30-1,26 (t, 3H)
Стадия B: {1-[4-(6-циклобутокси-4-трифторметил-пиридин-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота
Этиловый эфир {1-[4-(6-циклобутокси-4-трифторметил-пиридин-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусной кислоты (0,09 г, 0,18 ммоль), полученный на Стадии A, вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,076 г, 89%).
1H-ЯМР (400 МГц, CDCl3); δ 7,52-7,43 (m, 2H), 7,35 (s, 1H), 6,84 (s, 1H), 5,33-5,25 (m, 1H), 3,37-3,34 (m, 2H), 3,19-3,14 (m, 2H), 2,56-2,50 (m, 2H), 2,38-2,36 (d, 2H), 2,22-2,17 (m, 2H), 1,99 (m, 1H), 1,94-1,73 (m, 4H), 1,53-1,43 (m, 2H)
Пример 615: (1-{2,6-дифтор-4-[2-(4-фторфенил)-бензо[b]тиофен-4-ил]-фенил}-пиперидин-4-ил)-уксусная кислота

Этиловый эфир [1-(4-Бензо[b]тиофен-4-ил-2,6-дифтор-фенил)-пиперидин-4-ил]-уксусной кислоты (0,11 г, 0,26 ммоль), полученный в Примере Получения 351, растворяли в 2 мл DMF. Добавляли 1-бром-4-фтор-бензол (0,03 г, 0,17 ммоль), Pd(OAc)2(0,5 мол.%) и KOAc (0,034 г, 0,34 ммоль), и смесь перемешивали при 140°C в течение 24 часов. Твердые вещества отфильтровывали, и реакционный раствор концентрировали при пониженном давлении и очищали колоночной хроматографией для получения этилового эфира (1-{2,6-дифтор-4-[2-(4-фторфенил)-бензо[b]тиофен-4-ил]-фенил-пиперидин-4-ил)-уксусной кислоты. Полученное соединение вводили в реакцию таким же образом, как на Стадии B Примера 1, с получением целевого соединения (0,008 г, 9%).
1H-ЯМР (CDCl3) δ 7,82 (1H, d), 7,65 (2H, m), 7,55 (1H, s), 7,35 (1H, t), 7,27 (1H, m), 7,08 (4H, m), 3,36 (2H, m), 3,21 (2H, m), 2,37 (2H, d), 1,99 (1H, m), 1,84 (2H, m), 1,52 (2H, m).
Пример 616: {1-[2,6-дифтор-4-(2-m-толил-бензо[b]тиофен-4-ил)-фенил]-пиперидин-4-ил}-уксусная кислота

Этиловый эфир [1-(4-Бензо[b]тиофен-4-ил-2,6-дифтор-фенил)-пиперидин-4-ил]-уксусной кислоты (0,07 г, 0,17 ммоль), полученный в Примере Получения 351, 1-бром-3-метил-бензол (0,029 г, 0,17 ммоль), Pd(OAc)2(0,5 мол.%) и KOAc (0,034 г, 0,34 ммоль) вводили в реакцию таким же образом, как в Примере 615, с получением целевого соединения (0,004 г, 5%).
1H-ЯМР (CDCl3) δ 7,81 (1H, d), 7,61 (1H, s), 7,48 (2H, m), 7,29 (3H, m), 7,14 (1H, d), 7,08 (2H, m), 3,36 (2H, m), 3,20 (2H, m), 2,41 (3H, s), 2,39 (2H, d), 2,00 (1H, m), 1,84 (2H, m), 1,53 (2H, m).
Пример 617: {1-[4-(4-циклобутокси-6-трифторметил-пиримидин-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусная кислота

Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,1 г, 0,24 ммоль), полученный в Примере Получения 220, и 2-хлор-4-циклобутокси-6-трифторметил-пиримидин (0,074 г, 0,29 ммоль), полученный в Примере Получения 352, вводили в реакцию таким же образом, как на Стадии A Примера 1, для получения этилового эфира 1-[4-(4-циклобутокси-6-трифторметил-пиримидин-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-уксусной кислоты. Полученное соединение растворяли в 2 мл 1,4-диоксана. Добавляли 0,45 мл 1Н NaOH, и смесь перемешивали при 60°C в течение 4 часов. Органический растворитель удаляли, и продукт реакции подкисляли до рН 3 при помощи 1Н водного раствора HCl и экстрагировали EtOAc для отделения органического слоя. Органический слой высушивали безводным сульфатом магния и концентрировали при пониженном давлении с получением целевого соединения (0,072 г, 62%).
1H-ЯМР (CDCl3) δ 7,90 (2H, m), 6,84 (1H, s), 5,38 (1H, m), 3,40 (2H, m), 3,16 (2H, m), 2,53 (2H, m), 2,37 (2H, d), 2,21 (2H, m), 2,04 (1H, m), 1,89 (1H, m), 1,81 (3H, m), 1,47 (2H, m).
Пример 618: {1-[2,6-дифтор-4-(4-пропокси-6-трифторметил-пиримидин-2-ил)-фенил]-пиперидин-4-ил}-уксусная кислота

Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,1 г, 0,24 ммоль), полученный в Примере Получения 220, и 2-хлор-4-пропокси-6-трифторметил-пиримидин (0,07 г, 0,29 ммоль), полученный в Примере Получения 353, вводили в реакцию таким же образом, как в Примере 617, с получением целевого соединения (0,064 г, 57%).
1H-ЯМР (CDCl3) δ 7,90 (2H, m), 6,88 (1H, s), 4,47 (2H, t), 3,40 (2H, m), 3,16 (2H, m), 2,37 (2H, d), 2,04 (1H, m), 1,85 (4H, m), 1,47 (2H, m), 1,06 (3H, t).
Пример 619: (1-{2,6-дифтор-4-[4-(4-фторфенокси)-6-трифторметил-пиримидин-2-ил]-фенил}-пиперидин-4-ил)-уксусная кислота

Этиловый эфир 2-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]уксусной кислоты (0,1 г, 0,24 ммоль), полученный в Примере Получения 220, и 2-хлор-4-(4-фторфенокси)-6-трифторметил-пиримидин (0,086 г, 0,29 ммоль), полученный в Примере Получения 354, вводили в реакцию таким же образом, как в Примере 617, с получением целевого соединения (0,039 г, 31%).
1H-ЯМР (CDCl3) δ 7,71 (2H, m), 7,17 (4H, d), 7,04 (1H, s), 3,38 (2H, m), 3,13 (2H, m), 2,35 (2H, d), 1,96 (1H, m), 1,79 (2H, m), 1,45 (2H, m).
Пример 620: 3-{1-[2,6-дифтор-4-(6-пропокси-пиридин-2-ил)-фенил]-пиперидин-4-ил}-пропионовая кислота
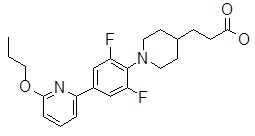
Этиловый эфир 3-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]пропановой кислоты (0,059 г, 0,14 ммоль), полученный в Примере Получения 92, и 2-бром-6-пропокси-пиридин (0,030 г, 0,14 ммоль), полученный в Примере Получения 45, вводили в реакцию таким же образом, как в Примере 96, с получением целевого соединения (0,025 г, 45%).
1H-ЯМР (CDCl3) δ 7,59 (1H, t), 7,51 (2H, m), 7,20 (1H, d), 6,66 (1H, d), 4,36 (2H, t), 3,32 (2H, d), 3,12 (2H, t), 2,44 (2H, t), 1,84 (2H, m), 1,76 (2H, d), 1,67 (2H, m), 1,43 (3H, m), 1,06 (3H, t)
Пример 621: 3-{1-[4-(6-циклобутил-пиридин-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-пропионовая кислота

Этиловый эфир 3-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]пропановой кислоты (0,076 г, 0,18 ммоль), полученный в Примере Получения 92, и 2-хлор-6-циклобутил-пиридин (0,030 г, 0,18 ммоль), полученный в Примере Получения 277, вводили в реакцию таким же образом, как в Примере 96, с получением целевого соединения (0,025 г, 35%).
1H-ЯМР (CDCl3) δ 7,63 (1H, t), 7,56 (2H, m), 7,42 (1H, d), 7,08 (1H, d), 3,71 (1H, m), 3,32 (2H, d), 3,12 (2H, t), 2,43 (6H, m), 2,07 (1H, m), 1,94 (1H, m), 1,76~1,40 (7H, m)
Пример 622: 3-{1-[4-(6-этокси-пиридин-2-ил)-2,6-дифтор-фенил]-пиперидин-4-ил}-пропионовая кислота
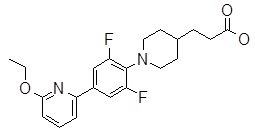
Этиловый эфир 3-[1-[2,6-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-пиперидил]пропановой кислоты (0,081 г, 0,19 ммоль), полученный в Примере Получения 92, и 2-хлор-6-этокси-пиридин (0,030 г, 0,19 ммоль), полученный в Примере Получения 273, вводили в реакцию таким же образом, как в Примере 96, с получением целевого соединения (0,030 г, 40%).
1H-ЯМР (CDCl3) δ 7,59 (1H, t), 7,51 (2H, m), 7,20 (1H, d), 6,65 (1H, d), 4,46 (2H, m), 3,32 (2H, d), 3,12 (2H, t), 2,44 (2H, t), 1,76 (2H, d), 1,67 (2H, m), 1,44 (6H, m)
Экспериментальный Пример: Измерение активности агониста GPR120 (клеточный тест)
Клетки CHO-K1, экспрессирующие Ga16 и hGPR120, распределяли в каждую лунку планшета с 96 лунками (3×104 клеток/100 мкл/лунка) и затем инкубировали в инкубаторе при 5%-м CO2, 37°C в течение 18 часов. Каждую лунку обрабатывали 100 мкл раствора красителя Кальций 5 (Molecular Devices), включающего 2% DMSO и затем инкубировали в инкубаторе при 5%-м CO2, 37°C в течение 1 часа. Последовательно разбавленные агонисты GPR120 получали в конечной концентрации 0,5% в DMSO в планшете с 96 лунками. Каждую лунку обрабатывали 50 мкл соединений-агонистов с помощью Plexstation II, и затем флуоресценцию измеряли при Возб. 485 нм и Эм. 525 нм.
Флуоресценция, увеличенная последовательно разбавленными агонистами GPR120, вычисляется как относительный процент (%) на основе флуоресценции, представленной обработкой только 1% DMSO. EC50 относится к концентрации агониста, показывающего 50% максимальной флуоресценции, увеличенной обработкой агонистом. Вычисление измерения было выполнено при помощи статистического программного обеспечения (Prizm).
Агонистические эффекты соединений, представленных в Примерах, полученные в вышеупомянутом эксперименте, показаны в следующей Таблице 1 в единицах EC50 (мкM). Активность обозначена на основе следующих критериев:
A=> 20 мкМ, B=20-2 мкМ, C=2-0,2 мкМ, D=< 0,2 мкМ
Как показано в таблице, большинство новых соединений согласно настоящему изобретению демонстрирует превосходные агонистические эффекты GPR120 (EC50), менее 0,2 мкМ.
[Таблица 1]
Реферат
Изобретение относится к биарильному производному, представленному химической формулой 1, или к его фармацевтически приемлемой соли или изомеру, где A и B независимо обозначают C-Cарил или 5-12-членный гетероарил, содержащий 1-3 гетероатома, выбранных из N, O и S; D и E могут независимо отсутствовать или независимо обозначают C, CH, CH, N, NH, O или S; Rи Rмогут независимо отсутствовать или независимо обозначают водород, C-Cалкил, C-Cциклоалкил, 3-6-членный гетероциклоалкил, C-Cалкил-C-Cциклоалкил, C-Cциклоалкил-C-Cалкил, галоген-C-Cалкил, C-Cалкокси, C-Cалкокси-C-Cалкил, C-Cалкокси-фенил, C-Cциклоалкокси, C-Cциклоалкил-C-Cалкокси, фенил, C-Cалкил-фенил, фенил-C-Cалкил, галоген-фенил, пиридинил, C-Cалкил-пиридинил или галоген-C-Cалкил-фенил, где гетероциклоалкил содержит по меньшей мере один гетероатом, выбранный из O и S; Rи Rмогут быть связаны друг с другом или с D и/или E с образованием 5-15-членного гетероцикла, содержащего 1-3 гетероатома, выбранных из N и O, конденсированного с A; где указанный гетероцикл необязательно замещен C-Cалкилом, галогеном, C-Cалкоксикарбонилом, C-Cциклоалкил-C-Cалкилом, галоген-фенилом или C-Cалкил-фенилом; и когда D и E обозначают C, CH, S или N, Rи Rмогут обозначать два или три C-Cалкила, оксо, C-Cциклоалкила или C-Cалкокси, которые могут быть одинаковыми или разными; Rи Rнезависимо обозначают водород, галоген, C-Cалкил, C-Cциклоалкил, C-Cалкокси, нитрил, оксо, C-Cалкиламин или C-Cциклоалкиламин; m и n независимо обозначают целое число от 0 до 2; G обозначает -(CRR)-J-(CRR), причем J обозначает CH, O, N, NH, S или двойную связь; Rи Rнезависимо обозначают водород, галоген или C-Cалкил, илимогут быть связаны друг с другом с образованием C-Cциклоалкила, и когда J обозначает N, каждый из Rи Rв двух (CRR) может быть связан с образованием 5-6-членного гетероарила или 5-6-членного гетероциклоалкила, содержащих 1 или 2 атома N, или может быть замещен C-Cалкилом; и p и q независимо обозначают целое число от 0 до 4; и Rобозначает группу -COOH или ее изостер, выбранный из группы, состоящей из изоксазолола, пиразолола, изотиазолола, тиадиазолидинона, тиазолидиндиона, пиридинола, диоксотиадиазолидинона, тетразола, триазола, сульфонамида, ацетамида, нитрила, гидроксиацетамидина, оксадиазолона и оксадиазолтиона. Изобретение также относится к фармацевтической композиции, обладающей свойствами агониста GPR120, на основе указанного соединения. Технический результат – получено новое соединение и фармацевтическая композиция на его основе, которые могут найти применение в медицине для лечения воспаления или метаболических заболеваний, таких как диабет, осложнения диабета, ожирение, неалкогольное ожирение печени, ожирение печени и остеопороз. 4 н. и 2 з.п. ф-лы, 1 табл., 622 пр.[Формула 1]
Формула
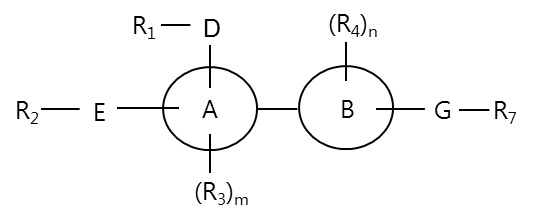

Комментарии