Применение производных колхинола в качестве средств, повреждающих сосуды - RU2232021C2
Код документа: RU2232021C2
Описание
Данное изобретение относится к средствам, повреждающим сосуды, которое используется, в частности, при получении средств для лечения процесса образования в тканях новых сосудов, из группы производных колхинола, некоторые из которых являются новыми соединениями.
Образование новой сети кровеносных сосудов посредством развития кровеносных сосудов (ангиогенеза) является ключом к пониманию особенности патологии некоторых заболеваний (J. Folkman, New England Journal of Medicine 333, 1757, (1995)). Например, твердая опухоль для того, чтобы расти, должна создать свое кровоснабжение, от которого решающим образом зависит ее обеспечение кислородом и питательными веществами; если эта система кровоснабжения механически отключается, опухоль подвергается некротической гибели. Образование новых сосудов является также клинической особенностью повреждений кожи при псориазе, инвазивного паннуса в суставах больных ревматоидным артритом и атеросклеротических бляшек. Ретинальное образование новых сосудов является патологическим при дегенерации желтого пятна и при диабетической ретинопатии. Во всех этих заболеваниях изменение направления (реверсия) образования новых сосудов посредством повреждения вновь образованного сосудистого эндотелия, как ожидается, имеет преимущественное терапевтические действие.
Производные колхинола, например, N-ацетил-колхинол, хорошо известны. Противоопухолевое действие отмечалось на моделях животных (см., например, JNCI (Journal National Cancer Institute), pages 379-392, 1952, Vol. 13). Однако изученное действие наносило значительное повреждение (haemorrhage, размягчение и некроз), в связи с чем и не было предложено лечить неадекватный процесс образования сосудов посредством деструкции образования новых сосудов.
Поиск по Chemical Abstracts (с 1955 года) на основе структуры
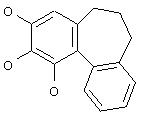
выявил ряд структур, относящихся к производным колхинола.
В некоторой степени любое из этих соединений было изучено на противораковую активность, поскольку тубулин-связывающие средства могли бы, как ожидалось, быть антимитотическими средствами и, следовательно, обладать прямым действием на опухолевые клетки.
В процессе работы над данным изобретением изучалась проблема релевантности тубулин-связывающих свойств для возможной эффективности в качестве сосудоразрушающего средства, но возможность предсказания не была выявлена. Например, доцетаксел (docetaxel) (Lancet, 344, 1267-1271, 1994), который является тубулин-связывающим средством, не обладал сосудоразрушающим действием даже при введении в Максимальной Допустимой Дозе. Даже когда авторы данного изобретения испытывали некоторые соединения, структурно подобные соединениям данного изобретения, терапевтическое окно (отношение MTD (максимальной допустимой дозы) к MED (минимальной эффективной дозе)), как было установлено, являлось слишком небольшим для потенциальной клинической эффективности.
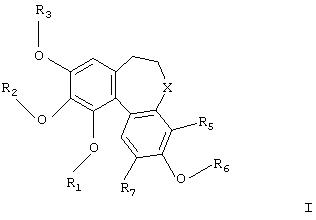
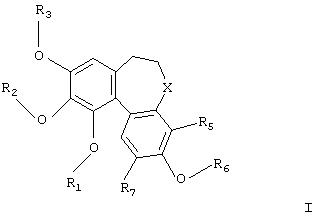
В соответствии с данным изобретением обеспечивается применение производных колхинола для получения композиций для лечения заболеваний, затрагивающих процесс образования новых сосудов, в которых производное колхинола имеет формулу
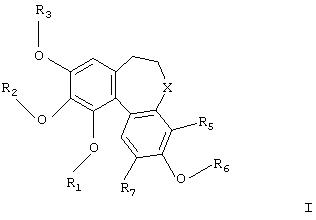
где
R1, R2, R3 и R6 независимо представляют Н, необязательно замещенный алкил, циклоалкил, алкенил, алкинил, аралкил, алканоил, РО3Н2;
Х представляет карбонил (СО), тиокарбонил (CS), метилен (СH2) или группу CHR4;
R4 представляет ОН, O-алкил или NR8R9;
R5 и R7 независимо представляют Н, алкил, галоген, гидрокси-, алкокси-, нитро- или аминогруппу;
R8 представляет Н, необязательно замещенный алкил, циклоалкил, алканоил, тиоалканоил, арил, гетероарил, арилкарбонил, гетероарилкарбонил, алкоксикарбонил, арилоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, ариламинокарбонил, алкилсульфонил, арилсульфонил, аминосульфонил, алкиламиносульфонил, диалкиламиносульфонил или ариламиносульфонил;
и R9 представляет - Н, алкил или циклоалкил;
и их фармацевтически приемлемых солей, сольватов и гидратов.
Полагают, хотя это не является ограничением изобретения, что применение соединений данного изобретения повреждает вновь образованную сосудистую сеть, например сосудистую сеть опухолей, эффективно меняя таким образом направление процесса образования сосудистой сети, тогда как известные антиангиогенические средства имеют тенденцию к снижению эффективности при завершении образования сосудистой сети.
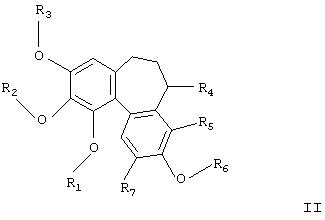
Некоторые из этих соединений являются новыми. В одном воплощении новые соединения являются соединениями формулы I, в которых по меньшей мере один из R1, R2, R3, R6 представляет собой РО3Н2. В особенно предпочтительном воплощении R6 представляет РО3Н2. Особенно предпочтительны соединения формулы
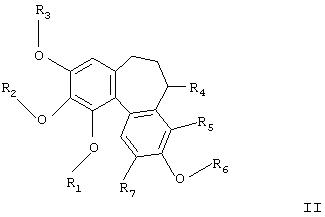
где
R1, R2 и R3 независимо представляют собой Н, необязательно замещенный алкил, циклоалкил, алкенил, алкинил, алканоил или РО3Н2;
R6 представляет РО3Н2;
R4 представляет Н или NR8R9;
R5 и R7 независимо представляют Н, алкил, галоген, алкокси-, нитро- или аминогруппу;
R8 представляет Н, необязательно замещенный алкил, циклоалкил, алканоил, тиоалканоил, арил, гетероарил, арилкарбонил, гетероарилкарбокил, алкоксикарбонил, арилоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, ариламинокарбонил, алкилсульфонил, арилсульфонил, аминосульфонил, алкиламиносульфонил, диалкиламиносульфонил или ариламиносульфонил;
R9 представляет Н, алкил или циклоалкил,
и их фармацевтически приемлемые соли, сольваты и гидраты.
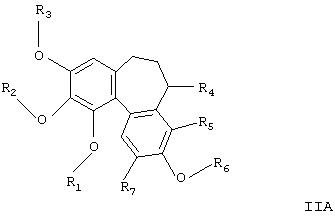
В другом аспекте изобретения новые соединения представляют собой соединения формулы
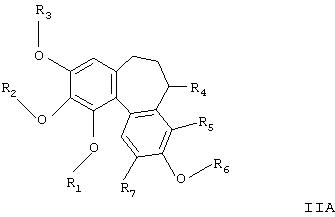
где
R1, R2 и R3 независимо представляют Н, необязательно замещенный алкил, циклоалкил, алкенил, алкинил, алканоил или РО3Н2;
R6 представляет Н, необязательно замещенный алкил, циклоалкил, алкенил, алкинил или РО3Н2;
R4 представляет Н или NR8R9;
R5 и R7 независимо представляют собой Н, алкил, галоген, нитро- или аминогруппу;
R8 представляет Н, необязательно замещенный алкил, циклоалкил, алканоил, тиоалканоил, арил, гетероарил, арилкарбонил, гетероарилкарбонил, алкоксикарбонил, арилоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, ариламинокарбонил, алкилсульфонил, арилсульфонил, аминосульфонил, алкиламиносульфонил, диалкиламиносульфонил или ариламиносульфонил;
и R9 представляет Н, алкил или циклоалкил при условии, что когда R1, R2 и R3 являются метильными группами и R4 представляет водород, ацетиламино-, ацетилметиламино-, амино-, метиламино- или диметиламиногруппу, тогда R6 не является водородом, метилом, гидроксиэтилом или ацетоксиэтилом, и их фармацевтически приемлемые соли, сольваты и гидраты.
Предпочтительными соединениями, используемыми в изобретении, являются соединения, в которых R1, R2 и R3 представляют алкил, и соединения, в которых R4 представляет ациламиногруппу.
Термин “алкил”, используемый в данном изобретении (включающий любую цепь алифатической структуры, относящуюся к алкилу), относится к группе с прямой или разветвленной цепью, содержащей от одного до семи, предпочтительно максимально четыре атома углерода, такой как метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил и пентил. Необязательные заместители, которые могут присутствовать в алкильных группах, включают один или большее количество заместителей, выбранных из галогена, амино-, моноалкиламино, диалкиламино, гидрокси, алкокси, алкилтиогруппы, алкилсульфонила, ациламино, алкоксикарбониламино, алканоила, ацилоксигруппы, карбоксила, сульфатной или фосфатной групп. Примерами алкоксигрупп являются метокси-, этокси-, пропокси-, изопропокси-, бутокси и третбутоксигруппы. Термин “галоген” означает фтор, хлор, бром или йод.
Алкенильная группа представляет собой олефиновую группу, содержащую от двух до семи атомов углерода, например метилен, этилен, н-пропилен, изопропилен, н-бутилен, изобутилен, втор-бутилен и трет-бутилен. Алкильная группа представляет собой группу, состоящую из 2-7 атомов углерода, например, этинильную, пропинильную или бутинильную группу.
Термин “арил”, сам по себе или в сочетании, относится к незамещенной фенильной группе или к фенильной группе, содержащей один или более, предпочтительно от одного до трех, заместителей, примерами которых являются галоген, алкил, галогеналкил, гидрокси, нитро-, циано-, амино- и алкоксигруппа. Галогеналкильная группа может содержать один или более атомов галогена, примерами таких групп являются трифторметил и дихлорметил.
Термин “гетероарил” в данном описании относится к моно- или бициклической ароматической группе, содержащей от одного до четырех гетероатомов, выбранных в любом сочетании из атомов N, S или О, самое большее - из 9 атомов углерода. Примеры гетероарильных групп включают пиридил, пиримидил, фурил, тиенил, пирролил, пиразолил, индолил, бензофурил, бензотиенил, бензотиазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, триазолил, хинолил и изохинолил.
Термин “аралкил” в данном описании относится к алкильной группе как определено ранее, в которой один из атомов водорода замещен арильной или гетероарильной группой, как определено в описании.
В том случае, когда одна или более функциональных групп соединений формул I, II, IIА являются основными или кислотными, возможно образование солей. Подходящие соли включают фармацевтически приемлемые соли, например кислотно-аддитивные соли, в том числе гидрохлориды, гидробромиды, фосфаты, сульфаты, гидросульфаты, алкилсульфонаты, арилсульфонаты, ацетаты, бензоаты, цитраты, малеаты, фумараты, сукцинаты, лактаты и тартраты, соли, полученные из неорганических оснований, в том числе соли щелочных металлов, такие как соли натрия или калия, соли щелочноземельных металлов, такие как соли кальция или магния, и соли, полученные из органических аминов, такие как соли морфолина, пиперидина или диметиламина.
Квалифицированному специалисту понятно, что соединения формул I, II, IIА могут существовать в виде стереоизомеров и/или геометрических изомеров, и соответственно, данное изобретение включает все такие изомеры и их смеси.
Группа полезных соединений включает соединения, в которых каждый из R1, R2 и R3 представляет собой алкил.
Другая группа полезных соединений включает соединения, в которых каждый из R1, R2 и R3 представляет собой алкил и каждый из R5 и R7 представляет собой водород. Предпочтительно подгруппу полезных соединений составляют соединения, в которых каждый из R1, R2 и R3 представляет собой метил и R6 представляет собой водород, алкил или РО3Н2.
Предпочтительно полезные соединения в соответствии с изобретением включают N-ацетилколхинол-О-фосфат и его соли, сольваты и гидраты.
Соединения формул I, II или IIА могут быть получены с помощью ряда способов, как описано ниже в общем виде и более подробно далее в примерах. В следующем далее описании способов R1, R2, R3, R4, R5, R6 и R7 в приведенных формулах представляют группы, описанные выше для формул I, II или IIА, если не указано другого значения. В схемах, описанных ниже, может потребоваться применение защитных групп, которые затем на конечных стадиях синтеза удаляются. Соответствующее применение таких защитных групп и способы их удаления будут очевидны для квалифицированного специалиста.
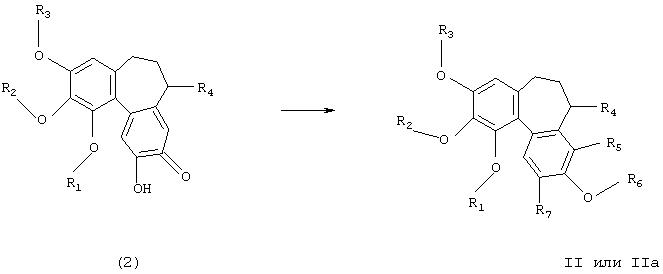
Таким образом, в соответствии с еще одним аспектом изобретения соединения формул II или IIА, в которых каждый из R5, R6 и R7 представляет собой водород, могут быть получены обработкой соединения формулы (2) щелочным пероксидом водорода. Реакция может удобно проводиться в водном растворе гидроксида натрия в отсутствии или в присутствии совместного растворителя, такого как спирт, например этанол, при температуре в интервале, например, 0-100°С, предпочтительно при 60°С или близкой температуре 60°С.
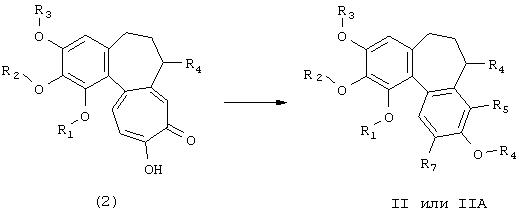
Промежуточные продукты формулы (2) могут быть получены кислотным гидролизом соединений формул (3). Реакцию стандартно проводят в водной кислоте, такой как соляная кислота, при повышенной температуре, например, при 100°С или близкой температуре 100°C.
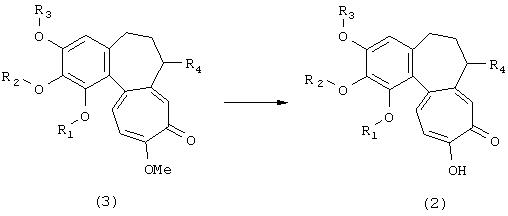
Соединения формулы (3) являются известными соединениями или могут быть получены из колхицина стандартными способами.
Соединения формул I, II или IIА также могут быть получены из других соединений формул I, II или IIА посредством химических превращений. Примерами химических превращений, которые могут применяться для этого, являются стандартное алкилирование, арилирование, гетероарилирование, ацилирование, тиоацилирование, сульфонилирование, сульфатирование, фосфорилирование, ароматическое галогенирование и реакции сочетания (связывания). Эти реакции могут использоваться для введения новых или для модификации уже имеющихся заместителей. Альтернативно, заместители, имеющиеся в соединениях формул I, II или IIА, могут быть модифицированы, например, окислением, восстановлением, элиминированием, гидролизом или другими реакциями расщепления для получения других соединений формул I, II или IIА.
Следовательно, соединение формул II или IIА, содержащее, например, аминогруппу, может ацилироваться по аминогруппе обработкой, например, ацилгалогенидом или галогенангидридом в присутствии основания, например, третичного аминного основания, такого как триэтиламин, например, в растворителе, таком как углеводородный растворитель, например, дихлорметан, при температуре в интервале, например, от -30 до 120°С, обычно при комнатной температуре или близкой к комнатной.
В другом общем примере взаимного превращения аминогруппа в соединении формул II или IIА может сульфонилироваться обработкой, например, алкил- или арилсульфонилхлоридом или алкил- или арилсульфоновым ангидридом в присутствии основания, например, третичного аминного основания, такого как триэтиламин, например, в растворителе, таком как углеводородный растворитель, например, дихлорметан, при температуре в интервале, например, от -30 до 120°С, обычно при комнатной температуре или близкой к комнатной.
В еще одном общем примере соединение формулы II или IIА, содержащее гидроксигруппу, может превращаться в соответствующий сложный дигидрофосфатный эфир обработкой, например, ди-трет-бутилдиэтилфосфорамидитом (diethylphosphoramidite) в присутствии подходящего катализатора, например тетразола. В растворителе, таком как эфирный растворитель, например, тетрагидрофуран, при температуре в интервале от -40 до 40°С, обычно при комнатной температуре или температуре, близкой к комнатной, с последующей обработкой окислителем, например, 3-хлорпероксибензойной кислотой, при температуре в интервале от -78 до 40°С, предпочтительно от -40 до -10°С. Образующийся промежуточный фосфатный триэфир обрабатывают кислотой, например, трифторуксусной кислотой, в растворителе, таком как хлорированный растворитель, например, дихлорметан, при температуре в интервале от -30 до 40°С, обычно при температуре 0°С или близкой к ней, для получения соединения формулы (2), содержащего сложный дигидрофосфатный эфир.
В еще одном общем примере соединение формулы (2), содержащее амидогруппу, может быть гидролизовано обработкой, например, кислотой, такой как соляная кислота, в растворителе, таком как спирт, например, метанол, при повышенной температуре, обычно при кипении с обратным холодильником.
В другом общем примере O-алкильная группа может расщепляться с образованием соответствующего спирта (ОН) при взаимодействии с трибромидом бора в растворителе, таком как хлорированный растворитель, например, дихлорметан, при низкой температуре, например, около -78°С.
В еще одном общем примере соединения формул II или IIА могут алкилироваться взаимодействием с подходящим алкилирующим агентом, таким как алкилгалогенид, алкилтолуолсульфонат, алкилметансульфонат или алкилтрифлат (alkyi triflate). Реакция алкилирования может проводиться в присутствии основания, например, неорганического основания, такого как карбонат, например, карбонат кальция или калия, гидрида, такого как гидрид натрия, или алкоксида, такого как трет-бутоксид калия, в подходящем растворителе, таком как апротонный растворитель, например, диметилформамид, или эфирный растворитель, такой как тетрагидрофуран, при температуре примерно от -10 до 80°С.
Получение соединения формул II или IIА в виде единственного энантиомера или, когда это подходит, диастереомера, может проводиться посредством синтеза из энантиометрически чистого исходного материала или промежуточного продукта или посредством разделения конечного продукта стандартным способом.
Кислотно-аддитивные соли соединений формул II или IIА получают стандартным способом обработкой раствора или суспензии свободного основания II или IIА приблизительно одним эквивалентом фармацевтически приемлемой кислоты. Соли соединений формул I, II или IIА и неорганических или органических оснований получают стандартным способом обработки раствора или суспензии свободной кислоты I, II или IIА приблизительно одним эквивалентом фармацевтически приемлемого органического или неорганического основания. Альтернативно и кислотно-аддитивные соли, и соли оснований могут быть получены обработкой исходного соединения подходящей ионно-обменной смолой стандартным способом. Стандартные способы концентрирования и перекристаллизации применимы для выделения солей.
Соединения согласно данному изобретения способны разрушать сосудистую сеть опухоли и вновь образованную сосудистую сеть, оставляя без изменений нормальную зрелую сосудистую сеть. Способность соединений действовать таким образом может быть установлена с помощью испытаний, описанных в примерах далее.
Таким образом, соединения согласно данному изобретению особенно полезны для профилактики и лечения раковых заболеваний, включая твердые опухоли, для профилактики и лечения заболеваний, при которых имеет место неадекватное развитие кровеносных сосудов, таких как диабетическая ретинопатия, псориаз, ревматоидный артрит, атеросклероз и дегенерация желтого пятна.
Соединения данного изобретения могут вводиться в качестве единственных терапевтических средств или в сочетании с другими средствами лечения. Для лечения твердых опухолей соединения данного изобретения могут вводиться в сочетании с радиотерапией или в сочетании с другими противоопухолевыми веществами, выбранными, например, из митотических ингибиторов, например, с винбластином, паклитакселем и доцетакселем; с алкилирующими агентами, например, с цисплатином, карбоплатином и циклофосфамидином, антиметаболитами, например, с 5-фторурацилом, цитозинарабиносидом (cytosine arabinoside) и гидроксимочевиной; с интеркалатирующими средствами, например, с адриамицином и блеомицином; с ферментами, например, с аспарагиназой; с ингибиторами топоизомеразы, например, с этопозидом, топотеканом и иринотеканом; с ингибиторами тимидилатсинтазы, например, с ралтитрекседом; с модификаторами биологического ответа, например, с интерфероном; с антителами, например, с эдреколомабом, и с антигормонами, например, с тамоксифеном. Такое комбинированное лечение может включать одновременное или последовательное применение отдельных компонентов лечения.
Для профилактики и лечения заболеваний соединения согласно изобретению могут вводиться в виде фармацевтических композиций, выбранных с учетом предлагаемого способа введения и стандартной фармацевтической практики. Такие фармацевтические композиции могут иметь форму, приемлемую для перорального, трансбуккального, назального, местного, ректального или парентерального введения, и могут быть получены стандартным способом с использованием стандартных наполнителей. Например, фармацевтические композиции для перорального введения могут принимать форму таблеток или капсул. Для назального введения или введения ингаляцией соединения могут удобно доставляться в виде порошка или раствора. Местное введение может осуществляться в виде мази или крема, и ректальное введение может осуществляться в виде свечи. Для парентеральной инъекции (включая внутривенную, подкожную, внутримышечную, внутрисосудистую инъекцию или вливание) композиция может принимать форму, например, стерильного раствора, суспензии или эмульсии.
Доза соединения изобретения, необходимая для профилактики или лечения конкретного состояния, будет изменяться в зависимости от выбранного соединения, способа введения, формы и тяжести состояния и в зависимости от того, предназначается ли соединение для введения само по себе или в сочетании с другим лекарственным средством. Следовательно, точная доза будет определяться лечащим врачом, но обычно ежедневные дозы могут заключаться в интервале от 0,001 до 100 мг/кг, предпочтительно от 0,1 до 50 мг/кг.
Биологическая активность
Описанные далее испытания были использованы для демонстрации активности и селективности соединений согласно изобретению.
Активность в отношении сосудистой сети опухоли, измеренная с помощью радиоактивного индикатора
Описанный далее эксперимент показывает способность соединений селективно повреждать сосудистую сеть опухоли.
Подкожные CaNT опухоли инициируют инъекцией мыши в возрасте 16 недель 0,05 мл неочищенной суспензии клеток опухоли, приблизительно 106 клеток, подкожно выше тыльной поверхности задней конечности (overlying the rear dorsum). Животных отбирают для лечения через приблизительно 3-4 недели, когда их опухоли достигают диаметра 5,5-6,5 мм. Соединения растворяют в стерильном физиологическом растворе и вводят интраперитонеально в объеме 0,1 мл на 10 г массы тела. Кровоснабжение опухоли измеряют через 6 часов после интраперитонеального введения в опухоле, почке, печени, коже, мышцах, кишечнике и мозге методом86RbCl экстракции (Sapirstein, Amer J. Physiol, 193, 161-168, 1958). Радиоактивность ткани, измеренную через 1 минуту после внутривенного введения86RbCl, используют для вычисления относительного кровотока как части полученных данных для работы сердца (as a proportion of cardiac output) (Hill and Denekamp, Brit J. Radiol., 55, 905-913, 1982). Для контроля и в обрабатываемых группах используют пять животных. Результаты представляют в виде процента от кровотока в соответствующих тканях у животных, обработанных физиологическим раствором.
Активность в отношении сосудистой сети, измеренная с помощью флуоресцентного красителя
Описанный далее эксперимент дополнительно показывает способность соединений повреждать сосудистую сеть опухоли.
Объем сосудистой сети опухоли CaNT опухоль содержащих мышей измеряют с использованием флуоресцентного красителя Hoechst 33342 согласно методу Smith et al. (Brit. J. Cancer 57, 247-253, 1988). В контрольной и обработанной группах используют по пять животных. Флуоресцентный краситель растворяют в физиологическом растворе, получая концентрацию 6,25 мг/мл, и вводят внутривенно из расчета на 10 мг/кг через 6 часов после интраперитонеального введения лекарственного средства. Спустя 1 минуту животных умерщвляют, опухоли иссекают и замораживают; на 3 различных уровнях вырезают участки размером 10 мкм и исследуют их под УФ-освещением с использованием Olympus микроскопа, снабженного эпифлуоресценцией. Кровеносные сосуды идентифицируют посредством их флуоресцентных схем, и объем сосудистой сети вычисляют с использованием point scoring системы, описанной в публикации Chalkley, J. Natl Cancer Inst., 5, 47-53, 1943). Все оценки основываются на вычислении минимальной из 100 областей секций, взятых из 3 различных уровней. Соединения изобретения уменьшают функциональный объем сосудистой сети опухоли на более чем 20% в дозах 50 мг/кг или ниже.
Следующие не ограничивающие примеры иллюстрируют изобретение. В примерах все1H-ЯМР спектры получены при 300 МГц, если не указано другого значения. Колоночную хроматографию проводят на силикагеле. Все температуры приводятся в °С. Используются следующие аббревиатуры: THF - тетрагидрофуран; DMSO - диметилсульфоксид; МСРВА - 3-хлорпероксибензойная кислота.
Пример 1
N-ацетилколхинол-О-фосфат
Раствор N-ацетилколхинола (260 мг, 0,76 ммоль) в безводном THF (2 мл) в атмосфере азота обрабатывают ди-трет-бутилдиэтилфосфорамидитом (189 мг, 0,75 ммоль) и 1(Н)-тетразолом (0,14 г, 1,99 ммоля), раствор перемешивают при 20°С в течение 0,5 часа. Раствор охлаждают до -40°С и добавляют раствор 85% МСРВА (202 мг, 0,99 ммоля) в безводном дихлорметане (2 мл) с такой скоростью, чтобы температура оставалась ниже -10°С. Раствор оставляют нагреваться до комнатной температуры, добавляют диэтиловый эфир (30 мл) и полученный раствор промывают последовательно 10% водным метабисульфитом натрия (2×25 мл), 5% водным гидрокарбонатом натрия (2× 25 мл), 5% водной лимонной кислотой (30 мл), 5% водным гидрокарбонатом натрия и насыщенным раствором соли. Органический раствор концентрируют при пониженном давлении, остаток очищают колоночной хроматографией, получают белую пену (170 мг), содержащую N-ацетилколхинол-О-ди-трет-бутилфосфат, который повторно растворяют в дихлорметане (5 мл), охлаждают до 0°С и обрабатывают трифторуксусной кислотой (0,5 мл).
Раствор оставляют нагреваться до комнатной температуры и перемешивают 1 час, затем концентрируют при пониженном давлении и растирают с эфиром, получают целевое соединение (110 мг) в виде твердого белого вещества, т.пл. 233-235°С. δ Н (d6-DMSO), 8,38 (д, 1Н, J=8 Гц), 7,27 (д, 1Н, J=7 Гц), 7,12 (д, 1Н, J=8 Гц), 7,10 (с, 1Н), 6, 77 (с, 1Н), 4,48 (М, 1Н), 3,81 (с, 3Н), 3,76 (с, 3Н), 3,49 (с, 3Н), 2,5 (сигнал, частично затененный DMSO), 1,9-2,2 (м, 2Н), 1,86 (с, 3Н).
Активность фосфатного соединения измеряют методом радиоактивного индикатора, описанным ранее: соединение данного примера дает 65% снижение кровотока в опухоли в дозе 125 мг/кг при незначительном снижении кровотока в коже, мышцах, печени, почке, кишечнике или сердце.
Фосфатное соединение сравнивают с исходным N-ацетилколхинолом по максимальной толерантной дозе (MTD) (отсутствие смерти у трех животных), минимальной эффективной дозе (MED), измеренной методом флуоресцентного красителя, описанным выше, и терапевтическому окну (MTD/MED) (табл.1).
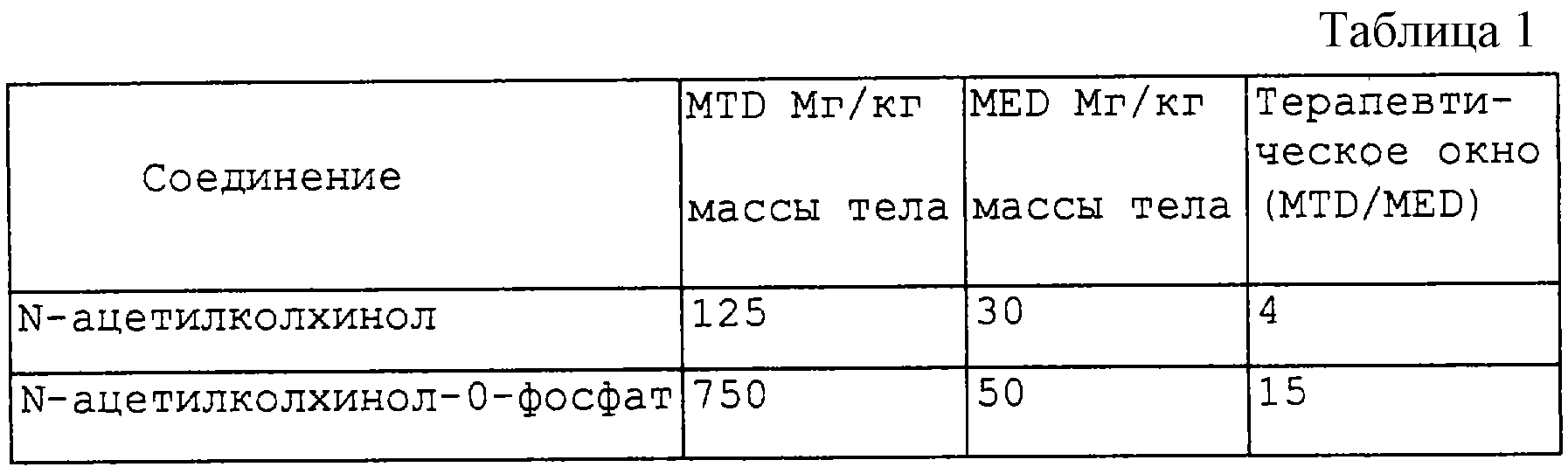
Хотя фосфат имеет несколько более высокую MED, его “окно” значительно больше. Это было неожиданным. Фосфат также дает большую растворимость.
Для сравнения “терапевтические окна” колхицина (наиболее близкая структура к данным соединениям) и доцетакселя (тубулин-связывающее лекарство, продаваемое как “Taxotere”, которое не обладает сосудоразрушающей активностью) представлены в табл.2.

Пример 2
N-Этилколхинол
Раствор N-ацетилколхинола (500 мг, 1,4 ммоль) в THF (15 мл) по каплям в течение 15 минут добавляют к суспензии алюмогидрида лития (106 мг, 2,74 ммоль) в THF (10 мл) с охлаждением на ледяной бане. Смесь кипятят с обратным холодильником в течение 15 часов, дают ей охладиться и обрабатывают дополнительным количеством алюмогидрида лития (53 мг, 1,4 ммоля), затем кипятят с обратным холодильником в течение дополнительных 3 часов. Смесь охлаждают (ледяная баня) и по каплям добавляют воду (10 мл), затем экстрагируют тремя порциями этилацетата. Объединенные, высушенные (MgSO4) экстракты концентрируют при пониженном давлении до зеленой смолы, которая при растирании с эфиром дает целевое соединение в виде твердого вещества светло-зеленого цвета, т.пл. 185°С (разл.), m/е 343 (М+). Элементный анализ: вычислено для C20H25NCO4·H2 O: С 66,46; Н 7,53; N 3,88; найдено: С 66,50; Н 7,17; N 3,79.
Пример 3
N-Бензилоксикарбонилколхинол
Раствор колхинола (625 мг, 1,98 ммоль) в сухом пиридине (10 мл) обрабатывают бензилхлорформиатом (0, 566 мл, 3,97 ммоль), добавляя его по каплям, и смесь перемешивают в течение 16 часов. Растворитель отгоняют при пониженном давлении, добавляют воду и полученную смесь экстрагируют тремя порциями хлороформа. Объединенные, высушенные (МgSO4) экстракты упаривают при пониженном давлении до темно-коричневой смолы, которую подвергают очистке колоночной хроматографией на силикагеле (элюирование: 50% этилацетат/петролейный эфир). Полученную оранжевую смолу кристаллизуют из смеси эфир/петролейным эфир, получают целевое соединение (346 мг) в виде твердого вещества бледно-желтого цвета, т.пл. 79-81°С, m/е 449 (М+). Элементный анализ для С26Н27NО6·0,33 H2O: вычислено: С 68,57; Н 6,07; N 3,08; найдено С 68,71; Н 6,18; N 2, 91.
Пример 4
N-(Фенилкарбамоил)колхинол
Раствор колхинола (400 мг, 1,27 ммоль) в сухом пиридине (10 мл) обрабатывают фенилизоцианатом (0,151 мл, 1,39 ммоль), добавляя его по каплям, смесь перемешивают в течение 18 часов, затем кипятят с обратным холодильником в течение 2 часов. Растворитель отгоняют при пониженном давлении, добавляют воду и полученную смесь экстрагируют тремя порциями хлороформа. Объединенные, высушенные экстракты концентрируют при пониженном давлении до темно-коричневой смолы, которую очищают колоночной хроматографией на силикагеле (элюирование: 35% этилацетат/петролейный эфир). Полученную смолу кристаллизуют из смеси эфир/петролейный эфир, получают целевое соединение (261 мг) в виде твердого вещества светло-оранжевого цвета, т.пл. 145-146°С, m/е 434 (М+).
Пример 5
N-Мезилколхинол
Раствор N, O-димезилколхинола (234 мг, 0,5 ммоль) в метаноле (8 мл) обрабатывают гидроксидом натрия (40 мг, 1 ммоль), смесь кипятят с обратным холодильником в течение 3 часов. Растворитель отгоняют при пониженном давлении, добавляют воду (5 мл). Среду раствора делают нейтральной с помощью 1 М соляной кислоты и экстрагируют тремя порциями дихлорметана. Объединенные, высушенные (МgSО4) упаривают при пониженном давлении, получают целевое соединение (123 мг) в виде твердого вещества розового цвета, т.пл. 234-236°С, m/е 393 (М+).
N, O-Димезилколхинол, используемый в качестве исходного материала, получают следующим образом. Раствор колхинола (500 мг, 1,6 ммоля) в сухом пиридине (15 мл) обрабатывают мезилхлоридом (0,135 мл, 1,7 ммоля) и смесь перемешивают при комнатной температуре в течение 36 часов. Добавляют дополнительное количество мезилхлорида (0,135 мл, 1,7 ммоль) и перемешивание продолжают еще 16 часов. Растворитель отгоняют при пониженном давлении, добавляют воду (5 мл). Раствор экстрагируют тремя порциями хлороформа и соединенные высушенные экстракты упаривают при пониженном давлении, получают коричневую смолу, которая после очистки колоночной хроматографией на силикагеле (элюирование: этилацетат) дает N, O-димезилколхинол (292 мг) в виде твердого вещества светло-оранжевого цвета.
Пример 6
N-Диметилсульфамоилколхинол
Раствор колхинола (50 мг, 0,16 ммоль) в сухом ацетонитриле (3 мл) и триэтиламине (0,022 мл, 0,16 ммоль) обрабатывают диметилсульфамоилхлоридом, смесь перемешивают 30 минут, затем кипятят с обратным холодильником в течение 15 часов. Растворитель отгоняют при пониженном давлении, добавляют воду и полученную смесь экстрагируют тремя порциями хлороформа. Объединенные, высушенные (Na2 SO4) экстракты упаривают при пониженном давлении до темно-коричневой смолы, которую очищают колоночной хроматографией на силикагеле (элюирование: этилацетат), получают целевое соединение (46 мг) в виде светло-оранжевой смолы, которая затвердевает, т.пл. 82-85°С, m/е 422 (М+).
Пример 7
N-Ацетил-О-метоксикарбонилметилколхинол
Раствор N-ацетилколхинола (500 мл, 1,4 ммоль) в сухом DMF (5 мл) при 0°С обрабатывают метилбромацетатом (322 мг, 2,1 ммоль) и гидридом натрия (84 мг, 60% суспензия в масле, 2,1 ммоль), смесь перемешивают 30 минут. Добавляют воду (50 мл) и смесь экстрагируют четырьмя порциями этилацетата. Объединенные экстракты промывают последовательно четырьмя порциями воды и двумя порциями насыщенного водного раствора хлорида натрия, сушат (MgSO4), растворитель отгоняют при пониженном давлении, получают целевое соединение (280 мг) в виде твердого белого вещества, т.пл. 82-83°С, m/e 429,2 (M+). Элементный анализ для C23H27NO7·0,33Н2О: вычислено: С 63,45; Н 6,40; N 3,22; найдено: С 63,53; Н 6,29; N 3,17.
Пример 8
N-Ацетил-О-карбоксиметилколхинол
Раствор N-ацетил-О-метоксикарбонилметилколхинола (140 мг, 0,33 ммоль) в ацетонитриле (5 мл) обрабатывают водным раствором гидроксида калия (1,0 М, 5 мл), смесь нагревают до 80°С и выдерживают при этой температуре в течение 30 минут. рН Охлажденной смеси доводят до 3 в помощью 2 М соляной кислоты и экстрагируют ее четырьмя порциями этилацетата. Объединенные экстракты промывают двумя порциями насыщенного раствора хлорида натрия, сушат (MgSO4) и упаривают при пониженном давлении. Добавление ацетона (2 мл) и гексана (1 мл) приводит к получению целевого соединения (58 мг) в виде твердого белого вещества, т.пл. 220-221°С, m/е 415,3 (М+). Элементный анализ для C22H25NO7·0,33Н2O: вычислено: С 62,71; Н 6,14; N 3,32; найдено: С 62,63; Н 6,02; N 3,26.
Пример 9
N-Ацетил-О-циклопентилколхинол
Раствор N-ацетилколхинола (200 мг, 0,56 ммоль) в сухом DMF (2 мл) при 0°С обрабатывают гидридом натрия (33 мг, 60% суспензия в масле, 0,84 ммоль), затем циклопентилбромидом (125 мг, 0,84 ммоля) и смесь перемешивают 1 час. Добавляют дополнительное количество гидрида натрия (17 мг, 60% суспензия в масле, 0,42 ммоль) и циклопентилбромида (63 мг, 0,42 ммоль) и смесь перемешивают в течение ночи при комнатной температуре. Добавляют воду (10 мл) и смесь экстрагируют четырьмя порциями этилацетата. Объединенные экстракты промывают двумя порциями насыщенного водного раствора хлорида натрия, сушат (МgSO4) и упаривают при пониженном давлении. Целевое соединение (160 мг) получают в виде твердого белого вещества, т.пл. 89-94°С, m/е 425,3 (М+). Элементный анализ для C25H31NO5: Вычислено: С 70,54; Н 7,35; N 3,29; найдено: С 70,55; Н 7,35; N 3,25.
Пример 10
N-Ацетил-10-нитроколхинол
Раствор N-ацетилколхинола (100 мг, 0, 27 ммоль) в ледяной уксусной кислоте (20 мл) медленно обрабатывают 20 мл раствора концентрированной азотной кислоты (0,34 мл) в уксусной кислоте (100 мл), сохраняя температуру на уровне приблизительно 12°С. Смесь перемешивают при комнатной температуре в течение 18 часов, добавляют дополнительно 1 мл раствора азотной кислоты в уксусной кислоте и перемешивание продолжают в течение 2 часов. Смесь выливают в лед и экстрагируют тремя порциями этилацетата. Объединенные экстракты промывают двумя порциями насыщенного водного раствора хлорида натрия, сушат (MgSO4) и упаривают при пониженном давлении. Очистка на силикагеле (элюирование: этилацет) приводит к получению целевого соединения (50 мг) в виде твердого вещества светло-желтого цвета, т.пл. 117-118°С, m/е 401,9 (М+). Элементный анализ для C20H22N2O7·0,33H2O: вычислено: С 58,82; Н 5,56; N 6,86; найдено: С 58,87; Н 5,66; N 6, 55.
Пример 11
Для соединений примеров 1-10 и N-ацетилколхинола определяют активность в отношении сосудистой сети опухоли методом флуоресцентного красителя, описанным выше, введением 50 мг/кг.

Реферат
Изобретение относится к области медицины и касается новых производных колхинола, обладающих свойством повреждать кровеносные сосуды, которые могут найти применение при лечении опухолей. 5 н. и 12 з.п. ф-лы, 2 табл.
Формула

Комментарии