Соль азотсодержащего гетероциклического соединения или ее кристаллическая форма, фармацевтическая композиция и ингибитор flt3 - RU2641106C2
Код документа: RU2641106C2
Чертежи



Описание
Область техники
Изобретение относится к соли азотсодержащего гетероциклического соединения или ее кристаллической форме, которую применяют в качестве ингибитора Fms-подобной тирозинкиназы 3.
Уровень техники
Fms-подобная тирозинкиназа 3 (FLT3) является белком, принадлежащим к III классу рецепторов тирозинкиназ, и она имеет пять иммуноглобулиноподобных мотивов в N-окончании внеклеточного домена, и два киназных домена в C-окончании. Экспрессия FLT3 наблюдается в нормальных CD34-положительных клетках-предшественниках костного мозга человека и дендритных клетках, и она играет важную роль для пролиферации, дифференциации и так далее этих клеток (непатентный документ 1). Кроме того, лиганд (FL) FLT3 экспрессируется в стромальных клетках и Т клетках костного мозга, и является одним из цитокинов, которые влияют на цитогенез многих видов гематогенных систем, и стимулируют пролиферацию стволовых клеток, клеток-предшественников, дендритных клеток и естественных киллеров через взаимодействия с другими факторами роста.
FLT3 димеризуется при связывании FL и активируется аутофосфорилированием. В результате вызывается фосфорилирование PI3, а также AKT и ERK в RAS пути сигнальной трансдукции. FLT3 играет важную роль для пролиферации и дифференциации гемопоэтических клеток.
В нормальном костном мозге экспрессия FLT3 ограничена до ранних клеток-предшественников, но при карциноме крови FLT3 чрезмерно экспрессируется, или FLT3 вызывает мутацию и тем самым участвует в пролиферации и злокачественном изменении карциномы через активацию указанного выше пути сигнальной трансдукции. Карцинома крови включает, например, острый лимфатический лейкоз (ОЛЛ), острый миелоидный лейкоз (ОМЛ), острый промиелоцитарный лейкоз (ОПЛ), хронический лимфоцитарный лейкоз (ХЛЛ), хронический миелоидный лейкоз (ХМЛ), хронический нейтрофильный лейкоз (ХНЛ), острый недифференцированный лейкоз (ОНЛ), анапластическую крупноклеточную лимфому (АККЛ), пролимфатический лейкоз (ПМЛ), ювенильный миеломоноцитарный лейкоз (ЮММЛ), Т-клеточный лейкоз у взрослых (ВТЛ), миелодиспластический синдром (МДС) и миелопролиферативное расстройство (МПР).
Для ОМЛ, среди карцином крови, несколько существующих терапий являются эффективными только до определенной степени, при этом часто наблюдаются рецидивы и резистентность, и до сих пор она является настолько неустранимой карциномой, что доля выживания в течение пяти лет для этой карциномы составляет около 24% (в США) (непатентный документ 2). Одной из причин рецидива и резистентности является мутация гена FLT3, наиболее часто подтверждаемая. Известно, что мутация гена FLT3 включает мутацию внутреннюю тандемную дупликацию (ВТД), наблюдаемую рядом с мембраной (непатентный документ 3) и активацию мутации сайта тирозинкиназы (непатентный документ 4), и FLT3 постоянно активирована, даже при отсутствии лиганда, с усилением пролиферации раковых клеток.
Было описано, что мутация ВТД mutation, в частности, наблюдается у около 30% пациентов с ОМЛ, и прогноз жизнеспособности у пациентов, имеющих подобную мутацию, плохой (непатентный документ 5).
Считается, что подавление активации FLT3 и ее активации через мутацию гена является важным для лечения ОМЛ и улучшения прогноза, и поэтому проводят разработку ингибитора FLT3.
Например, AC220 (Амбит) является соединением, которое селективно ингибирует тирозинкиназы III типа (FLT3, c-KIT, FMS, PDGFR), и он разработан для нацеливания на ОМЛ (патентный документ 1).
Кроме того, разработаны и продаются на рынке лекарственные средства, демонстрирующие превосходную активность и долговечность благодаря ковалентному связыванию с биологическим белком. Например, Афатиниб (BIBW2992) был описан как ингибитор РЭФР, имеющий акрилатную группу в молекуле (патентный документ 2), и продается в США.
Ссылки известного уровня техники
Патентные документы
Патентный документ 1: WO2007/109120A2
Патентный документ 2: публикация заявки на патент Японии, не прошедшей экспертизу (Kohyo) № 2009-515851
Непатентные документы
Непатентный документ 1: Brown P. et al., European Journal of Cancer, vol. 40, pp.707-721, 2004
Непатентный документ 2: American Cancer Society, Cancer Facts and Figures, pp.9-24, 2012
Непатентный документ 3: Yokota S. et al., Leukemia, vol. 11, pp.1605-1609, 1997
Непатентный документ 4: Choudhary C. et al., Blood, vol. 106, pp.265-273, 2005
Непатентный документ 5: Kiyoi H. et al., Oncogene, vol. 21, pp.2555-2563, 2002
Сущность изобретения
Объект, достигаемый изобретением
Обычные ингибиторы FLT3 не обязательно обладают достаточным ингибирующим действием на FLT3, и желательны соединения и фармацевтические композиции, демонстрирующие более высокое ингибирующее действие на FLT3. Более того, существует желаемое соединение и фармацевтическая композиция, обладающая ингибирующим действием на FLT3, которая демонстрирует превосходную стабильность при хранении и/или растворимость и т.д., и которые поэтому могут применяться в качестве активного ингредиента лекарственных средств.
Средства достижения объекта
Авторы данного изобретения провели различные исследования в описанной выше ситуации. В результате они обнаружили, что соль (S,E)-N-(1-((5-(2-((4-цианофенил)амино)-4-(пропиламино)пиримидин-5-ил)пент-4-ин-1-ил)амино)-1-оксопропан-2-ил)-4-(диметиламино)-N-метилбут-2-енамида (далее обозначенная как соединение A) или ее кристаллическая форма обладают превосходным ингибирующим действием на FLT3, стабильностью при хранении и/или растворимостью, и так далее, и, таким образом, могут применяться в качестве активного ингредиента лекарственных средств, и реализует данное изобретение на основании этих открытий.
Таким образом, в данном изобретении представлено следующее.
[1] Соль карбоновой кислоты (карбоксилат), соль минеральной кислоты или соль сульфоновой кислоты (сульфонат) соединения A.
[2] Соль по пункту [1], которой является карбоксилат.
[3] Соль по пункту [1], которой является соль минеральной кислоты.
[4] Соль по пункту [2], где карбоксилатом является формиат, ацетат, лактат, бензоат, цитрат, оксалат, фумарат, малеат, сукцинат, малат, тартрат, аспартат, трихлорацетат, трифторацетат или памоат.
[5] Соль по пункту [2], где карбоксилатом является фумарат, сукцинат или памоат.
[6] Соль по пункту [3], где солью минеральной кислоты является гидрохлорид, гидробромид, гидроиодид, нитрат, фосфат или сульфат.
[7] Соль по пункту [3], где солью минеральной кислоты является гидрохлорид или гидробромид.
[8] Кристаллическая форма сукцината соединения A, которая демонстрирует пики дифракции при углах дифракции (2θ) 10,5, 17,1, 19,1 и 22,4° на порошковой рентгеновской дифрактограмме.
[9] Кристаллическая форма сукцината соединения A, которая демонстрирует пики дифракции при углах дифракции (2θ) 12,8, 16,1, 21,4 и 28,0° на порошковой рентгеновской дифрактограмме.
[10] Кристаллическая форма фумарата соединения A, котораяй демонстрирует пики дифракции при углах дифракции (2θ) 8,6, 13,7, 17,8 и 23,0° на порошковой рентгеновской дифрактограмме.
[11] Фармацевтическая композиция, содержащая соль по любому из пунктов [1]-[7], или ее кристаллическую форму по любому из пунктов [8]-[10].
[12] Ингибитор FLT3, содержащий соль по любому из пунктов [1]-[7], или ее кристаллическую форму по любому из пунктов [8]-[10].
В данном изобретении далее представлено следующее.
(a) Соль соединения A или ее кристаллическая форма для применения в качестве лекарственного средства.
(b) Соль соединения A или ее кристаллическая форма для применения в лечении заболевания или состояния, связанного с FLT3, предпочтительно, для применения в лечении ОЛЛ, ОМЛ, ОПЛ, ХЛЛ, ХМЛ, ХНЛ, ОНЛ, АККЛ, ПМЛ, ЮММЛ, ВТЛ, МДС или МПР, более предпочтительно, для применения в лечении ОМЛ или ОПЛ, еще более предпочтительно, для применения в лечении ОМЛ.
(c) Фармацевтическая композиция, содержащая соль соединения A или ее кристаллическую форму и фармацевтически приемлемую добавку.
(d) Применение соли соединения A или ее кристаллической формы для производства лекарственного средства для применения в лечении заболевания или состояния, связанного с FLT3, предпочтительно, для применения в лечении ОЛЛ, ОМЛ, ОПЛ, ХЛЛ, ХМЛ, ХНЛ, ОНЛ, АККЛ, ПМЛ, ЮММЛ, ВТЛ, МДС или МПР, более предпочтительно, для применения в лечении ОМЛ или ОПЛ, еще более предпочтительно, для применения в лечении ОМЛ.
(e) Способ лечения заболевания, связанного с FLT3, предпочтительно, для применения в лечении ОЛЛ, ОМЛ, ОПЛ, ХЛЛ, ХМЛ, ХНЛ, ОНЛ, АККЛ, ПМЛ, ЮММЛ, ВТЛ, МДС или МПР, более предпочтительно, для применения в лечении ОМЛ или ОПЛ, еще более предпочтительно, для применения в лечении ОМЛ, который включает стадию введения терапевтически эффективного количества соли соединения A или ее кристаллической формы пациенту (млекопитающему, включая человека), нуждающемуся в таком лечении.
(f) Способ получения соли по любому из пунктов [1]-[7], или кристаллической формы по любому из пунктов [8]-[10], который включает стадию превращения соединения A в его фармацевтически приемлемую соль.
Эффект изобретения
В соответствии с данным изобретением, может быть получена соль азотсодержащего гетероциклического соединения или ее кристалл, демонстрирующая превосходное ингибирующее действие на FLT3, стабильность при хранении и/или растворимость и т.д. и поэтому полезная в качестве активного ингредиента лекарственных средств.
Краткое описание чертежей
На Фиг. 1 показан пример спектра инфракрасной абсорбции (метод НПВО) α кристаллов сукцината соединения A.
На Фиг. 2 показан пример порошковой рентгенограммы α кристаллов сукцината соединения A.
На Фиг. 3 показан пример спектра инфракрасной абсорбции (метод НПВО) β кристалла сукцината соединения A.
На Фиг. 4 показан пример порошковой рентгенограммы β кристаллов сукцината соединения A.
На Фиг. 5 показан пример спектра инфракрасной абсорбции (метод НПВО) кристаллов фумарата соединения A.
На Фиг. 6 показан пример порошковой рентгенограммы кристаллов фумарата соединения A.
Способы проведения изобретения
Далее данное изобретение объяснено более подробно.
В данном изобретении интервалы численных значений, в которых стоит "до" означает интервалы, включающие численные значения, указанных до и после "до" в качестве минимального и максимального значений, соответственно. В данном изобретении, если два или более типа веществ, соответствующих ингредиенту композиции, присутствуют в композиции, количество ингредиента означает общее количество двух или более типов веществ, присутствующих в композиции, если не указано иначе.
В данном изобретении термины имеют следующие значения, если не указано иначе.
Атом галогена означает атом фтора, атом хлора, атом брома или атом йода.
C1-6 алкильная группа означает линейную или разветвленную C1-6 алкильную группу, такую как метильная, этильная, пропильная, изопропильная, бутильная, втор-бутильная, изобутильная, трет-бутильная, пентильная, изопентильная, 2-метилбутильная, 2-пентильная, 3-пентильная и гексильная группы.
Ар(C1-6 алкильная) группа означает ар(C1-6 алкильную) группу, такую как бензильная, дифенилметильная, тритильная, фенэтильная, 2-фенилпропильная, 3-фенилпропильная и нафтилметильная группы.
C1-6 алкоксигруппа означает линейную, разветвленную или циклическую C1-6 алкилоксигруппу, такую как метокси, этокси, пропокси, изопропокси, циклопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, циклобутокси, пентилокси и гексилокси группы.
(C1-6 алкокси)(C1-6 алкильная) группа означает (C1-6 алкилокси)(C1-6 алкильную) группу, такую как метоксиметильная и 1-этоксиэтильная группы.
C2-6 алканоильная группа означает линейную или разветвленную C2-6 алканоильную группу, такую как ацетильная, пропионильная, валерильная, изовалерильная и пивалоильная группы.
Ароильная группа означает бензильную или нафтоильную группу.
Гетероциклилкарбонильная группа означает фуроильную, теноильную, пирролидинилкарбонильную, пиперидинилкарбонильную, пиперазинилкарбонильную, морфолинилкарбонильную или пиридинилкарбонильную группу.
Ацильная группа означает формильную группу, сукцинильную группу, глутарильную группу, малеоильную группу, фталоильную группу, C2-6 алканоильную группу, ароильную группу или гетероциклилкарбонильную группу.
C1-6 алкоксикарбонильная группа означает линейную или разветвленную C1-6 алкилоксикарбонильную группу, такую как метоксикарбонильная, этоксикарбонильная, изопропоксикарбонильная, трет-бутоксикарбонильная и 1,1-диметилпропоксикарбонильная группы.
Ар(C1-6 алкокси)карбонильная группа означает ар(C1-6 алкилокси)карбонильную группу, такую как бензилоксикарбонильная и фенэтилоксикарбонильная группы.
Арилоксикарбонильная группа означает фенилоксикарбонильную или нафтилоксикарбонильную группу.
C1-6 алкилсульфонильная группа означает C1-6 алкилсульфонильную группу, такую как метилсульфонильная, этилсульфонильная и пропилсульфонильная группы.
Арилсульфонильная группа означает бензолсульфонильную, п-толуолсульфонильную или нафталинсульфонильную группу.
C1-6 алкилсульфонилоксигруппа означает C1-6 алкилсульфонилоксигруппу, такую как метилсульфонилокси- и этилсульфонилоксигруппы.
Арилсульфонилоксигруппа означает бензолсульфонилокси- или п-толуолсульфонилоксигруппу.
Силильная группа означает триметилсилильную, триэтилсилильную или трибутилсилильную группу.
Уходящая группа означает атом галогена, C1-6 алкилсульфонилоксигруппу или арилсульфонилоксигруппу. C1-6 алкилсульфонилоксигруппа и арилсульфонилоксигруппа могут быть замещены одной или более группами, выбранными из атома галогена, нитрогруппы, C1-6 алкильной группы и C1-6 алкоксигруппы.
Амино-защитной группой может быть любая группа, которая может применяться в качестве обычной защитной группы аминогруппы. Примеры включают, например, группы, указанные у T.W. Greene et al., Protective Groups in Organic Synthesis, 4th Edition, pp,696-926, 2007, John Wiley & Sons, Inc. Конкретные примеры включают ар(C1-6 алкильную) группу, (C1-6алкокси)(C1-6 алкильную) группу, ацильную группу, C1-6 алкоксикарбонильную группу, ар(C1-6 алкокси)карбонильную группу, арилоксикарбонильную группу, C1-6 алкилсульфонильную группу, арилсульфонильную группу и силильную группу.
Алифатические углеводороды означают пентан, гексан, гептан, циклогексан, метилциклогексан или этилциклогексан.
Галогенированный углеводород означает дихлорметан, хлороформ или дихлорэтан.
Простой эфир означает диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, 2-метилтетрагидрофуран, 1,4-диоксан, анизол, диметиловый эфир этиленгликоля, диметиловый эфир диэтиленгликоля или диэтиловый эфир диэтиленгликоля.
Спирт означает метанол, этанол, пропанол, 2-пропанол, бутанол, 2-метил-2-пропанол, этиленгликоль, пропиленгликоль или диэтиленгликоль.
Кетон означает ацетон, 2-бутанон, 4-метил-2-пентaнон или метилизобутилкетон.
Сложный эфир означает метилацетат, этилацетат, пропилацетат, изопропилацетат или бутилацетат.
Амид означает N,N-диметилформамид, N,N-диметилацетамид или N-метилпирролидон.
Нитрил означает ацетонитрил или пропионитрил.
Сульфоксид означает диметилсульфоксид или сульфолан.
Ароматический углеводород означает бензол, толуол или ксилол.
Неорганическое основание означает гидроксид натрия, гидроксид калия, метоксид натрия, трет-бутоксид натрия, трет-бутоксид калия, гидрокарбонат натрия, карбонат натрия, карбонат калия, трикалийфосфат, ацетат калия, фторид цезия или карбонат цезия.
Органическое основание означает триэтиламин, N,N-диизопропилэтиламин, 1,8-диазабицикло(5,4,0)ундец-7-ен (ДБУ), пиридин, 4-диметиламинопиридин или N-метилморфолин.
Профилактическое лечение означает лечение для ингибирования наступления, снижения риска наступления, замедления наступления и т.д.
Терапевтическое лечение означает лечения для улучшения целевого заболевания или состояния, или подавления (сохранения или замедления) ухудшения заболевания или состояния.
Лечение означает профилактическое лечение, терапевтическое лечение или подобное для любого из различных заболеваний.
Далее объясняются способы получения соединения в соответствии с данным изобретением.
Соль соединения A получают объединением известных способов и, например, она может быть получена способами получения, показанными ниже.
[Способ получения 1]
[Формула 1]

Соль соединения A может быть получена суспендированием соединения A (соединение формула [1]) в растворителе, добавлением кислоты к суспензии, нагреванием смеси для растворения соединения и, затем, охлаждением раствора.
Примеры растворителя, применяемого для этой реакции, включают, например, простые эфиры, спирты, кетоны, сложные эфиры, нитрилы, сульфоксиды, ароматические углеводороды и воду, и они могут применяться в виде смеси двух или более из них.
Предпочтительные примеры растворителя включают тетрагидрофуран, 2-метилтетрагидрофуран, 1,4-диоксан, метанол, этанол, 2-пропанол, 1-бутанол, 2-бутанол, ацетон, 2-бутанон, метилизобутилкетон, этилацетат, изопропилацетат, ацетонитрил, диметилсульфоксид, толуол и воду, и более предпочтительны 1,4-диоксан, этанол, ацетон, ацетонитрил и вода.
Объем растворителя, применяемого по отношению к соединению A, может составлять от 2- до 120-кратного объема (об./масс.), предпочтительно от 4- до 60-кратного объема (об./масс.), более предпочтительно от 5- до 30-кратного объема (об./масс.).
Примеры кислоты, применяемой для этой реакции, включают карбоновую кислоту, минеральную кислоту и сульфоновую кислоту.
Примеры карбоновой кислоты включают муравьиную кислоту, уксусную кислоту, молочную кислоту, бензойную кислоту, лимонную кислоту, щавелевую кислоту, фумаровую кислоту, яблочную кислоту, янтарную кислоту, яблочную кислоту, винную кислоту, аспарагиновую кислоту, трихлоруксусную кислоту, трифторуксусную кислоту и памовую кислоту. Предпочтительны уксусная кислота, молочная кислота, бензойная кислота, лимонная кислота, щавелевая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, яблочная кислота, винная кислота и памовая кислота, более предпочтительны фумаровая кислота, янтарная кислота и памовая кислота, еще более предпочтительны фумаровая кислота и янтарная кислота, наиболее предпочтительна янтарная кислота.
Примеры минеральной кислоты включают хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, азотную кислоту, фосфорную кислоту и серную кислоту. Предпочтительны хлористоводородная кислота, бромистоводородная кислота, азотная кислота, фосфорная кислота и серная кислота, более предпочтительны хлористоводородная кислота и бромистоводородная кислота.
Примеры сульфоновой кислоты включают метансульфоновую кислоту, бензолсульфоновую кислоту, п-толуолсульфоновую кислоту, мезитиленсульфоновую кислоту и нафталинсульфоновую кислоту, предпочтительна бензолсульфоновая кислота.
Количество применяемой кислоты составляет, хотя и зависит от типа кислоты, от 0,5 до 4,0 эквивалентов, предпочтительно от 1,0 до 2,0 эквивалентов, более предпочтительно от 1,0 до 1,5 эквивалентов, по отношению к соединению A.
[Способ получения 2]
Соль соединения A может быть получена суспендированием соединения A в растворителе 1, добавлением кислоты к суспензии, нагреванием смеси для растворения соединения, охлаждением смеси и последующим добавлением растворителя 2.
Тип и количество растворителя 1, применяемого для этой реакции, такие же, как описаны в способе получения 1.
Тип и количество кислоты, применяемой для этой реакции, такие же, как описаны в способе получения 1.
Примеры растворителя 2, применяемого для этой реакции, включают, например, алифатические углеводороды, галогенированные углеводороды, простые эфиры, спирты, кетоны, сложные эфиры, нитрилы и ароматические углеводороды, и они могут применяться в виде смеси двух или более из них.
Предпочтительные примеры растворителя 2 включают тетрагидрофуран, этанол, 2-пропанол, ацетон, метилэтилкетон, этилацетат, изопропилацетат, ацетонитрил и толуол.
Объем растворителя 2, применяемый по отношению к соединению A, может составлять от 2- до 120-кратный объем (об./масс.), предпочтительно от 4- до 60-кратный объем (об./масс.), более предпочтительно от 5- до 30-кратный объем (об./масс.).
Соль соединения A, полученная указанными выше способами получения, может быть очищена обычными методами, такими как перекристаллизация.
Далее объясняются способы получения соединения A, применяемые для получения соединения в соответствии с данным изобретением.
Соединение A может быть получено, например, следующим способом получения.
[Способ получения A]
[Формула 2]

В формуле R1 является амино-защитной группой; X1, X2 и X3 являются одинаковыми или разными, и являются уходящей группой; X4 и X5 являются одинаковыми или разными и являются гидроксильной группой или уходящей группой.
(1)
В качестве соединения общей формулы [2] применяют, например, 2,4-дихлор-5-йодпиримидин.
Соединения общей формулы [3] или их соль могут быть получены взаимодействием соединения общей формулы [2] с соединением формулы [4] или его солью в присутствии основания.
Растворитель, применяемый для этой реакции, особенно не ограничен, пока растворитель не влияет на выбранную реакцию. Примеры включают, например, галогенированные углеводороды, простые эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды, и эти растворители могут применяться в виде смеси двух или более из них.
Предпочтительные примеры растворителя включают простые эфиры, и более предпочтителен тетрагидрофуран.
Хотя объем применяемого растворителя особенно не ограничен, он может составлять от 1- до 500-кратного объема (об./масс.) по отношению к соединению общей формулы [2].
Количество применяемого соединения формулы [4] может составлять от 1- до 50-кратного молярного количества, предпочтительно от 1- до 5-кратного молярного количества, по отношению к соединению общей формулы [2].
Примеры основания, применяемого для этой реакции, включают неорганические основания и органические основания.
Предпочтительные примеры основания включают органические основания. Более предпочтительны триэтиламин и диизопропилэтиламин, и еще более предпочтителен диизопропилэтиламин.
Количество применяемого основания может составлять от 1- до 50-кратное молярное количество, предпочтительно от 1- до 5-кратное молярное количество, по отношению к соединению общей формулы [2].
Эта реакция может проводиться при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение от 30 минут до 48 часов.
(2)
Соединения общей формулы [5] могут быть получены взаимодействием соединения общей формулы [3] с соединением формулы [6].
Растворитель, применяемый для этой реакции, особенно не ограничен, пока растворитель не влияет на выбранную реакцию. Примеры включают, например, галогенированные углеводороды, простые эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды, и эти растворители могут применяться в виде смеси двух или более из них.
Предпочтительные примеры растворителя включают амиды, более предпочтителен N-метилпирролидон.
Хотя объем применяемого растворителя особенно не ограничен, он может составлять от 1- до 500-кратного объема (об./масс.) по отношению к соединению общей формулы [3].
Применяемое количество соединения формулы [6] может составлять от 1- до 50-кратного молярного количества, предпочтительно от 1- до 10-кратного молярного количества, по отношению к соединению общей формулы [3].
Предпочтительно применять протоновую кислоту для этой реакции.
Примеры протоновой кислоты включают сульфоновые кислоты и минеральные кислоты. Предпочтительны метансульфоновая кислота, камфорсульфоновая кислота и хлористоводородная кислота, и более предпочтительна камфорсульфоновая кислота.
Количество применяемой протоновой кислоты может составлять от 1- до 50-кратного молярного количества, предпочтительно от 1- до 10-кратного молярного количества, по отношению к соединению общей формулы [3].
Эта реакция может проводиться при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение от 30 минут до 48 часов.
(3)
Соединение формулы [7] может быть получено взаимодействием соединения общей формулы [5] с соединением формулы [8] в присутствии палладиевого катализатора, соли меди и основания.
Растворитель, применяемый для этой реакции, особенно не ограничен, пока растворитель не влияет на выбранную реакцию. Примеры включают, например, галогенированные углеводороды, простые эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды, и эти растворители могут применяться в виде смеси двух или более из них.
Предпочтительные примеры растворителя включают амиды, и более предпочтительным является N,N-диметилформамид.
Хотя объем применяемого растворителя особенно не ограничен, он может составлять от 1- до 500-кратного объема (об./масс.) по отношению к соединению общей формулы [5].
Применяемое количество соединения формулы [8] может составлять от 1- до 50-кратного молярного количества, предпочтительно от 1- до 5-кратного молярного количества, по отношению к соединению общей формулы [5].
Примеры палладиевого катализатора, применяемого для этой реакции, включают металлический палладий, такой как палладий/уголь и палладиевая сажа; неорганические соли палладия, таким как хлорид палладия; органические соли палладия, такие как ацетат палладия; органические комплексы палладия, такие как хлор(2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил)(2-(2-аминоэтил)фенил)палладий(II), тетракис(трифенилфосфин)палладий(0), дихлорид бис(трифенилфосфин)палладия(II), бис(ди-трет-бутил(4-диметиламинофенил)фосфин)дихлорпалладий(II), дихлорид 1,1'-бис(дифенилфосфино)ферроценпалладия(II), (E)-ди(μ-ацетато)бис(o-(ди-o-толилфосфино)бензил)дипалладий (II) и трис(дибензилиденацетон)дипалладий(0); органические комплексы палладия на полимерной подложке, такие как бис(ацетато)трифенилфосфинпалладий(II) на полимерной подложке и ди(ацетато)дициклогексилфенилфосфинпалладий(II) на полимерной подложке, и так далее, предпочтительны органические комплексы палладия.
Количество применяемого палладиевого катализатора может составлять от 0,0001- до 2-кратного молярного количества, предпочтительно от 0,001- до 0,2-кратного молярного количества, по отношению к соединению общей формулы [5].
Примеры соли меди, применяемой в данной реакции, включают хлорид меди(I), бромид меди(I), йодид меди(I) и ацетат меди(II), предпочтителен йодид меди(I).
Количество применяемой соли меди может составлять от 0,0001- до 2-кратного молярного количества, предпочтительно от 0,001- до 0,5-кратного молярного количества, по отношению к соединению общей формулы [5].
Примеры основания, применяемого для этой реакции, включают органические основания. Предпочтительны триэтиламин и диизопропилэтиламин, и более предпочтителен триэтиламин.
Количество применяемого основания может составлять от 0,1- до 50-кратного молярного количества, предпочтительно от 1- до 10-кратного молярного количества, по отношению к соединению общей формулы [5].
Эта реакция может проводиться при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение от 30 минут до 48 часов.
(4)
Соединение формулы [9] может быть получено снятием защиты с соединения формулы [7].
Эта реакция может проводиться способом, описанным у T.W. Greene et al., Protective Groups in Organic Synthesis, 4th edition, pp,790-793, 2007, John Wiley & Sons, Inc.
(5)
(5-A) Если X4 является гидроксильной группой:
В качестве соединений общей формулы [11] известен, например, N-(трет-бутоксикарбонил)-N-метил-L-аланин.
Соединения общей формулы [10] могут быть получены взаимодействием соединения формулы [9] с соединением общей формулы [11] в присутствии конденсирующего агента или галоидангидрида.
Эта реакция может проводиться, например, способом, описанным в Chemical Reviews, vol. 97, p.2243, 1997, Chemical Synthesis of Natural Product Peptides: Coupling Methods for the Incorporation of Noncoded Amino Acids into Peptides, или Tetrahedron, vol. 60, p.2447, 2004, Recent development of peptide coupling reagents in organic synthesis.
Растворитель, применяемый для этой реакции, особенно не ограничен, пока растворитель не влияет на выбранную реакцию. Примеры включают, например, галогенированные углеводороды, простые эфиры, сложные эфиры, амиды, нитрилы, сульфоксиды и ароматические углеводороды, и эти растворители могут применяться в виде смеси двух или более из них.
Предпочтительные примеры растворителя включают амиды, и более предпочтителен N,N-диметилформамид.
Хотя объем применяемого растворителя особенно не ограничен, он может составлять от 1- до 500-кратного объема (об./масс.) по отношению к соединению формулы [9].
Примеры основания, применяемого для этой реакции, включают неорганические основания и органические основания.
Предпочтительные примеры основания включают органические основания. Предпочтительны триэтиламин и диизопропилэтиламин, и более предпочтителен диизопропилэтиламин.
Количество применяемого основания может составлять от 1- до 50-кратного молярного количества, предпочтительно от 1- до 10-кратного молярного количества, по отношению к соединению формулы [9].
Примеры конденсирующего агента, применяемого для этой реакции, включают, например, карбодиимиды, такие как N,N'-дициклогексилкарбодиимид и 1-этил-3-(3-диметиламинопропил)карбодиимид; соединения карбонила, такие как карбонилдиимидазол; азиды кислоты, такие как азид дифенилфосфорила; цианиды кислоты, такие как цианид диэтилфосфорила; 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин; гексафторфосфат O-бензотриазол-1-ил-1,1,3,3-тетраметилурония; гексафторфосфат O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония и так далее. Карбодиимиды предпочтительны, и более предпочтителен 1-этил-3-(3-диметиламинопропил)карбодиимид.
Если карбодиимид применяют в качестве конденсирующего агента, предпочтительно применять добавку.
Примеры добавки включают N-гидроксисукцинимид, 1-гидроксибензотриазол и 1-гидрокси-7-азаaбензотриазол, и предпочтителен 1-гидроксибензотриазол.
Количество применяемой добавки может составлять от 0,01- до 10-кратного молярного количества, предпочтительно от 0,1- до 1-кратного молярного количества, по отношению к соединению формулы [9].
Примеры галоидангидрида, применяемого для этой реакции, включают, например, галогениды карбоновой кислоты, такие как ацетилхлорид и трифторацетилхлорид; галогениды сульфоновой кислоты, такие как метансульфонилхлорид и пара-толуолсульфонилхлорид; и сложные эфиры хлормуравьиной кислоты, такие как этилхлороформиат и изобутилхлороформиат.
Применяемое количество соединения общей формулы [11] особенно не ограничено, и оно может составлять от 1- до 10-кратного молярного количества по отношению к соединению формулы [9].
Эта реакция может проводиться при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение от 30 минут до 48 часов.
(5-B) Если X4 является уходящей группой:
Соединения общей формулы формула [10] могут быть получены взаимодействием соединения формулы [9] с соединением общей формулы [11] в присутствии основания.
Растворитель, применяемый для этой реакции, особенно не ограничен, пока растворитель не влияет на выбранную реакцию, и его примеры включают, например, галогенированные углеводороды, простые эфиры, сложные эфиры, амиды, нитрилы и ароматические углеводороды, и эти растворители могут применяться в виде смеси двух или более из них.
Хотя объем применяемого растворителя особенно не ограничен, он может составлять от 1- до 500-кратного объема (об./масс.) по отношению к соединению формулы [9].
Примеры основания, применяемого для этой реакции, включают неорганические основания и органические основания.
Количество применяемого основания может составлять от 1- до 50-кратного молярного количества, предпочтительно от 1- до 5-кратного молярного количества, по отношению к соединению формулы [9].
Хотя применяемое количество соединения общей формулы [11] особенно не ограничено, оно может составлять от 1- до 10-кратного молярного количества по отношению к соединению формулы [9].
Эта реакция может проводиться при температуре от -30 до 150°C, предпочтительно от 0 до 100°C, в течение от 30 минут до 48 часов.
(6)
Соединение формулы [12] может быть получено снятием защиты с соединения формулы [10].
Эта реакция может проводиться способом, описанным у T.W. Greene et al., Protective Группs in Organic Synthesis, 4th Edition, pp,696-926, 2007, John Wiley & Sons, Inc.
(7)
Соединение формулы [1] может быть получено взаимодействием соединения формулы [12] с соединением общей формулы [13] в присутствии конденсирующего агента или галоидангидрида.
Эта реакция может проводиться методом, описанным для [Способа получения A], (5).
Если имеются сольваты, гидраты и кристаллы различных форм соединений, применяющихся в указанных выше способах получения, эти сольваты гидраты и кристаллы различных форм также могут применяться.
Для соединений, применяемых в указанных выше способах получения, имеющих, например, аминогруппу, гидроксильную группу, карбоксильную группу или подобные, эти группы могут быть защищены обычными защитными группами, описанными выше, и после реакций защитные группы могут быть удалены известными способами.
Соединения, полученные указанными выше способами получении, могут быть превращены в другие соединения известными реакциями, такими как конденсация, присоединение, окисление, восстановление, перестановка, замещение, галогенирование, дегидратирование, гидролиз или подходящее их сочетание.
Солью соединения A в соответствии с данным изобретением может быть ангидрид, гидрат или сольват. Если только термин "соль" применяется в данном изобретении, соль может быть в форме ангидрида, гидрата или сольвата.
"Ангидрид" в данном изобретении означает вещество в форме ни гидрата, ни сольвата, если не указано иначе. Ангидрид также может быть назван "ангидрат".
Количество молекул воды, содержащееся в гидрате, особенно не ограничено, и гидратом может быть моногидрат, дигидрат или подобные.
Примеры карбоксилата соединения A включают, например, формиат, ацетат, лактат, бензоат, цитрат, оксалат, фумарат, малеат, сукцинат, малат, тартрат, аспартат, трихлорацетат, трифторацетат и памоат соединения A. Предпочтительны ацетат, лактат, бензоат, цитрат, оксалат, фумарат, малат, сукцинат, малат, тартрат и памоат соединения A, более предпочтительны фумарат, сукцинат и памоат соединения A, еще более предпочтительны фумарат и сукцинат соединения A, и наиболее предпочтителен сукцинат соединения A.
Примеры минеральной кислоты соединения A включают, например, гидрохлорид, гидробромид, гидройодид, нитрат, фосфат и сульфат соединения A. Предпочтительны гидрохлорид, гидробромид, нитрат, фосфат и сульфат соединения A, и более предпочтительны гидрохлорид и гидробромид соединения A.
Примеры сульфоната соединения A включают, например, метансульфонат, бензолсульфонат, п-толуолсульфонат, мезитиленсульфонат и нафталинсульфонат, предпочтителен бензолсульфонат.
Солью соединения A или ее кристаллом в соответствии с данным изобретением является, предпочтительно, карбоксилат соединения A или его кристалл с точки зрения стабильности при хранении, и сукцинат или фумарат соединения A и их кристаллы более предпочтительны.
Кристаллы соли соединения A в соответствии с данным изобретением характеризуются пиками дифракции, наблюдаемыми при порошковой рентгеновской дифрактометрии.
Предпочтительным примером кристаллов соли соединения A в соответствии с данным изобретением являются кристаллы сукцината соединения A, демонстрирующий пики дифракции при углах дифракции (2θ) 10,5, 17,1, 19,1 и 22,4° при порошковой рентгеновской дифрактометрии (также обозначенный как α кристаллы).
Другой предпочтительный пример кристаллов сукцината соединения A демонстрирует пики дифракции при углах дифракции (2θ) 12,8, 16,1, 21,4 и 28,0° при порошковой рентгеновской дифрактометрии (также обозначенный как β кристаллы).
Еще одним предпочтительным примером являются кристаллы фумарата соединения A, демонстрирующие пики дифракции при углах дифракции (2θ) 8,6, 13,7, 17,8 and 23,0° при порошковой рентгеновской дифрактометрии.
Кристаллы соли соединения A в соответствии с данным изобретением также характеризуются пиками абсорбции, наблюдаемыми в инфракрасном спектре абсорбции (Метод НПВО).
Предпочтительным примером кристаллов соли соединения A в соответствии с данным изобретением является α кристаллы сукцината соединения A, демонстрирующие пики абсорбции при волновом числе 2937, 2218, 1441, 1304 и 1242 см-1 в инфракрасном спектре абсорбции (Метод НПВО).
Другим предпочтительным примером является β кристаллы сукцината соединения A, демонстрирующие пики абсорбции при волновом числе 2219, 1660, 1512, 1239 и 1121 см-1 в инфракрасном спектре абсорбции (Метод НПВО).
Еще одним предпочтительным примером является кристаллы фумарата соединения A, демонстрирующие пики абсорбции при волновом числе 2220, 1594, 1517, 1428 и 1080 см-1 в инфракрасном спектре абсорбции (Метод НПВО).
Углы дифракции (2θ), определенные в порошковой рентгеновской дифрактометрии, обычно содержат ошибки в интервале ±0,2°. Поэтому выражение "угол дифракции (2θ) X°", применяемое в данном изобретении, означает "угол дифракции (2θ) от (X–0,2) до (X+0,2)°", если не указано иначе. Поэтому не только кристаллы, демонстрирующие углы дифракции, полностью соответствующие определенным выше углам дифракции в порошковой рентгеновской дифрактометрии, но также кристаллы, демонстрирующие углы дифракции, соответствующие определенным выше углам дифракции с учетом интервала ошибки ±0,2°, попадают в объем данного изобретения.
Значения волнового числа (см-1), определенные в инфракрасном спектре абсорбции (Метод НПВО), обычно содержит ошибки в интервале ±2 см-1. Поэтому выражение "волновое число Y", применяемое в данном изобретении, означает "волновое число от (Y–2) до (Y+2) см-1", если не указано иначе. Поэтому не только кристаллы, демонстрирующие волновые числа пиков абсорбции, полностью соответствующие волновым числам пиков абсорбции, указанным выше, в инфракрасном спектре абсорбции, но также кристаллы, демонстрирующие волновые числа пиков абсорбции, соответствующие волновым числам пиков абсорбции, указанным выше, с учетом интервала ошибки ±2 см-1, попадают в объем данного изобретения.
Соль соединения A или ее кристаллическая форма в соответствии с данным изобретением обладают превосходным ингибирующим действием на FLT3, демонстрируют превосходную стабильность при хранении и/или растворимость, и так далее, и поэтому полезны в качестве активного ингредиента лекарственных средств, и применяется для лечения заболевания или состояния, связанного с FLT3. Конкретно, соль соединения A или ее кристаллическую форму в соответствии с данным изобретением применяют для лечения ОЛЛ, ОМЛ, ОПЛ, ХЛЛ, ХМЛ, ХНЛ, ОНЛ, АККЛ, ПМЛ, ЮММЛ, ВТЛ, МДС или МПР, предпочтительно лечения ОМЛ или ОПЛ, более предпочтительно лечения ОМЛ.
Фармацевтическая композиция, содержащая соль соединения A или ее кристаллическую форму в соответствии с данным изобретением, может обычно содержать добавки, применяемые для получения фармацевтических композиций, такие как наполнители, связующие агенты, смазывающие агенты, разрыхляющие агенты, красители, корригирующие агенты, эмульгаторы, поверхностно-активные вещества, растворяющие добавки, суспендирующие агенты, изотонические агенты, буферные агенты, консерванты, антиоксиданты, стабилизаторы и улучшители абсорбции.
Фармацевтическая композиция в соответствии с данным изобретением означает фармацевтическую композицию, полученную с применением соли соединения A или ее кристалла в соответствии с данным изобретением.
Фармацевтическая композиция, содержащая соль соединения A или ее кристаллическую форму в соответствии с данным изобретением, может содержать только один вид или два или более видов солей соединения A или их кристаллов в соответствии с данным изобретением среди различных солей соединения A или их кристаллов в соответствии с данным изобретением.
Примеры способов введения фармацевтической композиции в соответствии с данным изобретением включают, например, внутривенные, внутриартериальные, интраректальные, внутрибрюшинные, внутримышечные, внутриопухолевые и внутрикистозные инъекции, пероральное введение, кожное введение, применение суппозиториев и так далее. Доза и частота введения составляет, например, от 0,01 до 1000 мг/кг в сутки соли в соответствии с данным изобретением при пероральном или парентеральном введении (например, инъекцией, капельным введением, введение в прямую кишку или подобными) взрослому человеку один раз в сутки или несколько раз в сутки, разделяя указанную выше дозу. Примеры лекарственных форм фармацевтической композиции включают таблетку, капсулу, порошок, сироп, гранулу, пилюлю, суспензию, эмульсию, раствор, порошковые препараты, суппозитории, глазные капли, назальные капли, ушные капли, пластырь, мазь и инъекцию.
Примеры
Далее данное изобретение объясняется со ссылкой на примеры. Однако данное изобретение не ограничено этими примерами. Процент (%) означает массовый %, если не указано иначе.
Автоматическую систему очистки ISOLERA (производства Biotage) применяют для очистки хроматографией на колонке.
Картридж SNAP KP-Sil Cartridge (производства Biotage) применяют в качестве носителя для хроматографии на колонке с силикагелем, и картридж SNAP KP-NH Cartridge (производства Biotage) применяют в качестве носителя для щелочной хроматографии.
1H-ЯМР спектр измеряют с применением тетраметилсилана в качестве внутреннего стандарта, на аппарате Bruker AV300 (производства Bruker), и все значения δ указаны в ч./млн.
МС спектр измеряют с применением системы ACQUITY SQD LC/MS System (Waters).
Инфракрасный спектр абсорбции измеряют с применением аппарата Spectrum 100S (PerkinElmer) согласно описаниям, данным в Japanese Pharmacopoeia, General Test Procedures, Attenuated Total Reflection Fourier Transform Infrared Spectrometry Method (Метод НПВО).
Спектр порошковой рентгеновской дифракции измеряют с применением аппарата RINT-2000 (Rigaku International) в следующих условиях.
(Условия измерения)
Применяемые рентгеновские лучи: CuKα
Напряжение трубки: 55 кВ
Ток трубки: 280 мА
Оси сканирования: 2θ
Содержание влаги измеряют с применением Karl-Fischer Aquameter MKC-610 (Kyoto Electronics Manufacturing).
Чистоту представляют как % площади, измеренный высокоэффективной жидкостной хроматографией (ВЭЖХ). Измерение ВЭЖХ проводят с применением аппарата Prominence (Shimadzu) в следующих условиях.
(Условия измерения)
Длина волны измерения: 220 нм
Колонка: CAPCELL PAK C18 MGII (внутренний диаметр 4,6 мм × длину 250 мм)
Температура колонки: 40°C
Скорость потока: 1,0 мл/минуту
Подвижная фаза A: 22 ммоль/л водной фосфорной кислоты
Подвижная фаза B: 22 ммоль/л раствора фосфорной кислоты в ацетонитриле/воде=90/10
Цикл градиента: 0,0 мин (Раствор A/Раствор B=80/20), 20,0 мин (Раствор A/Раствор B=60/40), 50,0 мин (Раствор A/Раствор B=0/100), 60,0 мин (Раствор A/Раствор B=0/100), 60,1 мин (Раствор A/Раствор B=80/20), 75,0 мин (Раствор A/Раствор B=80/20)
Пример получения
(1)
[Формула 3]
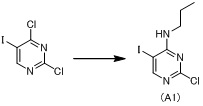
К раствору 2,4-дихлор-5-йодпиримидина (5,77 г), синтезированного способом, описанным в WO2008/155140A1, и N,N-диизопропилэтиламина (7,86 мл) в тетрагидрофуране (83 мл) добавляют пропиламин (3,55 мл) при охлаждении на льду и смесь перемешивают при комнатной температуре в течение 1 часа. Воду и этилацетат добавляют к реакционной смеси. Органический слой отделяют и водный слой экстрагируют этилацетатом. Органический слой и экстракт объединяют, последовательно промывают 1,0 моль/л водной хлористоводородной кислотой, водой, насыщенным водным гидрокарбонатом натрия и насыщенным водным хлоридом натрия и сушат над безводным сульфатом магния. Растворитель выпаривают при пониженном давлении с получением 2-хлор-5-йод-N-пропилпиримидин-4-амина (A1, 6,44 г) в виде масла.
МС m/z (M+H): 298,3
(2)
[Формула 4]

К раствору 2-хлор-5-йод-N-пропилпиримидин-4-амина (A1, 9,12 г) в N-метилпирролидоне (120 мл) добавляют 4-аминобензонитрил (18,1 г) и (1S)-(+)-10-камфорсульфоновую кислоту (35,6 г) при комнатной температуре и смеси перемешивают при 50°C в течение 9 часов. Реакционную смесь охлаждают до комнатной температуры и затем выливают в насыщенный водный гидрокарбонат натрия. Твердое вещество собирают фильтрацией, промывают водой, затем перекристаллизовывают из ацетонитрила и сушат при пониженном давлении с получением N2-(4-цианофенил)-5-йод-N4-пропилпиримидин-2,4-диамина (A2, 4,64 г) в виде белого твердого вещества.
МС m/z (M+H): 380,2
МС m/z (M-H): 378,2
1H-ЯМР (CDCl3) δ: 8,16 (1H, с), 7,73 (2H, д, J=8,7 Гц), 7,57 (2H, д, J=8,7 Гц), 7,21 (1H, шс), 5,34 (1H, шс), 3,50-3,42 (2H, м), 1,77-1,64 (2H, м), 1,02 (3H, т, J=7,6 Гц)
[0061]
(3)
[Формула 5]

К раствору N2-(4-цианофенил)-5-йод-N4-пропилпиримидин-2,4-диамина (A2, 687 мг) в N,N-диметилформамиде (10 мл) добавляют дихлорид бис(трифенилфосфин)палладия(II) (127 мг), йодид меди(I) (104 мг), триэтиламин (1,0 мл) и N-(4-пентинил)фталимид (464 мг) при комнатной температуре в атмосфере азота и смесь перемешивают при той же температуре в течение 2 часов. К реакционной смеси добавляют воду. Твердое вещество собирают фильтрацией, промывают водой и затем сушат при пониженном давлении с получением 2-(5-(2-((4-цианофенил)амино)-4-(пропиламино)пиримидин-5-ил)-4-пентин-1-ил)изоиндолин-1,3-диона (A3, 1,14 г) в виде желтого твердого вещества.
МС m/z (M+H): 465,3
(4)
[Формула 6]
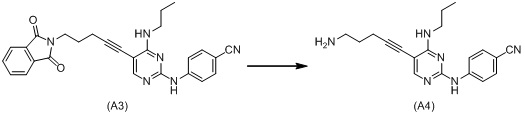
К раствору 2-(5-(2-((4-цианофенил)амино)-4-(пропиламино)пиримидин-5-ил)-4-пентин-1-ил)изоиндолин-1,3-диона (A3, 1,14 г) в тетрагидрофуране (15 мл) и этаноле (15 мл) добавляют моногидрат гидразина (2,0 мл) при комнатной температуре и смесь перемешивают в течение 45 мин при кипении с обратным холодильником при нагревании. Реакционную смесь охлаждают до комнатной температуры и затем разбавленную водную хлористоводородную кислоту добавляют к реакционной смеси до тех пор, пока смесь не станет кислой. Нерастворимое вещество удаляют фильтрацией и насыщенный водный гидрокарбонат натрия добавляют к реакционной смеси до тех пор, пока смесь не станет щелочной. Твердое вещество собирают фильтрацией, промывают водой и затем сушат при пониженном давлении с получением 5-(5-амино-1-пентин-1-ил)-N2-(4-цианофенил)-N4-пропилпиримидин-2,4-диамина (A4, 459 мг) в виде белого твердого вещества.
МС m/z (M+H): 335,3
(5)
[Формула 7]

К раствору 5-(5-амино-1-пентин-1-ил)-N2-(4-цианофенил)-N4-пропилпиримидин-2,4-диамина (A4, 7,89 г), N-(трет-бутоксикарбонил)-N-метил-L-аланина (5,76 г), гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (6,80 г) и моногидрата 1-гидроксибензотриазола (4,80 г) в N,N-диметилформамиде (100 мл) добавляют N,N-диизопропилэтиламин (8,5 мл) при комнатной температуре и смесь перемешивают при той же температуре в течение 1 часа 30 минут. Насыщенный водный гидрокарбонат натрия и этилацетат добавляют к реакционной смеси. Органический слой отделяют, промывают насыщенным водным хлоридом натрия и затем сушат над безводным сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем (элюент, 50% гексан/50% этилацетат) с получением (S)-трет-бутил (1-((5-(2-((4-цианофенил)амино)-4-(пропиламино)пиримидин-5-ил)-4-пентин-1-ил)амино)-1-оксопропан-2-ил)(метил)карбамата (A5, 9,40 г).
МС m/z (M+H): 520,6
МС m/z (M-H): 518,6
1H-ЯМР (CDCl3) δ: 7,98 (1H, с), 7,76 (2H, д, J=8,6 Гц), 7,57 (2H, д, J=8,6 Гц), 7,30 (1H, шс), 6,41 (1H, шс), 6,38-6,08 (1H, шс), 4,72-4,62 (1H, м), 3,58-3,38 (4H, м), 2,80 (3H, с), 2,48 (2H, т, J=6,6 Гц), 1,82-1,68 (4H, м), 1,49 (9H, с), 1,35 (3H, д, J=7,3 Гц), 1,00 (3H, т, J=7,3 Гц)
(6)
[Формула 8]
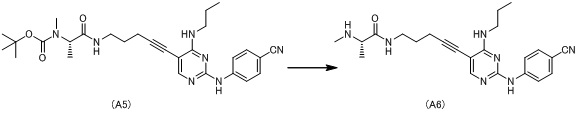
К раствору (S)-трет-бутил (1-((5-(2-((4-цианофенил)амино)-4-(пропиламино)пиримидин-5-ил)-4-пентин-1-ил)амино)-1-оксопропан-2-ил)(метил)карбамата (A5, 1,26 г) в 1,4-диоксане (10 мл) добавляют 4,0 моль/л раствор хлористоводородной кислоты в 1,4-диоксане (10 мл) при комнатной температуре и смесь перемешивают при той же температуре в течение 3 часов. Растворитель выпаривают при пониженном давлении и этилацетат добавляют к полученному остатку. Твердое вещество собирают фильтрацией, промывают этилацетатом и затем сушат при пониженном давлении с получением дигидрохлорида (S)-N-(5-(2-((4-цианофенил)амино)-4-(пропиламино)пиримидин-5-ил)-4-пентин-1-ил)-2-(метиламино)пропанамида (A6) (1,12 г) в виде белого твердого вещества.
МС m/z (M+H): 420,4
МС m/z (M-H): 418,4
(7)
[Формула 9]

К раствору дигидрохлорида (S)-N-(5-(2-((4-цианофенил)амино)-4-(пропиламино)пиримидин-5-ил-4-пентин-1-ил-2-(метиламино)пропанамида (A6) (19,0 г) и гидрохлорида 4-диметиламинокротоновой кислоты (22,3 г) в N,N-диметилформамиде (550 мл) добавляют N-метилморфолин (42,4 мл) при комнатной температуре и смесь перемешивают при той же температуре в течение 10 минут. Затем изобутилхлорформиат (15,2 мл) добавляют по каплям к смеси при охлаждении на льду и смесь перемешивают при той же температуре в течение 1 часа 30 минут. Насыщенный водный гидрокарбонат натрия (200 мл) добавляют к реакционной смеси и растворитель выпаривают при пониженном давлении. Воду и этилацетат добавляют к полученному остатку. Органический слой отделяют и водный слой экстрагируют этилацетатом. Органический слой и экстракт объединяют и сушат над безводным сульфатом натрия и растворитель выпаривают при пониженном давлении. Ацетонитрил добавляют к полученному остатку и твердое вещество собирают фильтрацией и очищают хроматографией на колонке со щелочным силикагелем (элюент, 95% этилацетат/5% метанол) с получением (S,E)-N-(1-(5-(2-((4-цианофенил)амино)-4-(пропиламино)пиримидин-5-ил)пент-4-ин-1-ил)амино)-1-оксопропан-2-ил)-4-(диметиламино)-N-метилбут-2-енамида (соединение A, 12,5 г).
МС m/z (M+H): 531,5
МС m/z (M-H): 529,5
1H-ЯМР (CDCl3) δ: 8,05 (1H, с), 7,97 (1H, с), 7,79 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=9,2 Гц), 6,94 (1H, дт, J=15,2, 5,3 Гц), 6,71 (1H, т, J=5,6 Гц), 6,44-6,42 (2H, м), 5,20 (1H, кв, J=7,3 Гц), 3,49-3,45 (4H, м), 3,11 (2H, д, J=5,3 Гц), 3,01 (3H, с), 2,45 (2H, т, ÅJ=6,6 Гц), 2,27 (6H, с), 1,77-1,66 (4H, м), 1,36 (3H, д, J=7,3 Гц), 1,00 (3H, т, J=7,3 Гц)
Пример 1
К суспензии соединения A (3,50 г) в ацетоне (70 мл) добавляют янтарную кислоту (779 мг) при комнатной температуре и растворение подтверждают визуально при кипячении с обратным холодильником при нагревании. Реакционную смесь постепенно охлаждают до комнатной температуры и выстаивают в течение одного дня. Твердое вещество собирают фильтрацией, промывают ацетоном и затем сушат при пониженном давлении с получением белого твердого вещества(4,08 г).
Суспензию полученного белого твердого вещества (1,20 г) в ацетонитриле (24 мл) кипятят с обратным холодильником при нагревании и растворение подтверждают визуально. Этот раствор постепенно охлаждают до комнатной температуры и выстаивают в течение 3 дней. Твердое вещество собирают фильтрацией, промывают ацетонитрилом и затем сушат при пониженном давлении с получением α кристаллов сукцината соединения A (1,02 г).
Содержание влаги: 0,50% (массовое отношение)
1H-ЯМР (ДМСО-D6) δ: 9,79 (1H, с), 8,00-7,88 (4H, м), 7,68 (2H, д, J=8,6 Гц), 7,20-7,10 (1H, м), 6,68-6,50 (2H, м), 5,01 (1H, кв, J=7,0 Гц), 3,40 (2H, дт, J=6,8, 6,8 Гц), 3,32-3,20 (2H, м), 3,12 (2H, д, J=5,3 Гц), 2,95 (3H, с), 2,47-2,38 (6H, м), 2,21 (6H, с), 1,72-1,54 (4H, м), 1,34-1,24 (3H, м), 0,91 (3H, т, J=7,3 Гц)
Спектр инфракрасной абсорбции (Метод НПВО) полученных α кристаллов сукцината соединения A показан на Фиг. 1 и в таблице 1, и порошковая рентгенограмма его же показана на Фиг. 2 и в таблице 2.
Пример 2
К суспензии соединения A (5,50 г) в ацетоне (110 мл) добавляют янтарную кислоту (1,22 г) при комнатной температуре и растворение подтверждают визуально при кипячении с обратным холодильником при нагревании. Реакционную смесь постепенно охлаждают до комнатной температуры и выстаивают в течение одного дня. Твердое вещество собирают фильтрацией, промывают ацетоном и затем сушат при пониженном давлении с получением бледно-желтого твердого вещества(6,22 г).
Суспензию полученного бледно-желтого твердого вещества (150 мг) в 1,4-диоксане (3,0 мл) кипятят с обратным холодильником при нагревании и растворение подтверждают визуально. Этот раствор постепенно охлаждают до комнатной температуры и выстаивают в течение 12 дней. Твердое вещество собирают фильтрацией, промывают 1,4-диоксаном и затем сушат при пониженном давлении с получением β кристаллов сукцината соединения A (141 мг).
1H-ЯМР (ДМСО-D6) δ: 9,79 (1H, с), 8,00-7,88 (4H, м), 7,68 (2H, д, J=8,6 Гц) 7,20-7,10 (1H, м), 6,68-6,50 (2H, м), 5,00 (1H, кв, J=6,8 Гц), 3,40 (2H, дт, J=6,8, 6,8 Гц), 3,32-3,20 (2H, м), 3,10 (2H, д, J=5,3 Гц), 2,95 (3H, с), 2,47-2,38 (6H, м), 2,20 (6H, с), 1,72-1,54 (4H, м), 1,34-1,24 (3H, м), 0,91 (3H, т, J=7,3 Гц).
Спектр инфракрасной абсорбции полученных β кристаллов сукцината соединения A показан на Фиг. 3 и в таблице 3, и порошковая рентгенограмма его же показана на Фиг. 4 и в таблице 4.
Пример 3
К суспензии соединения A (1,50 г) в этаноле (30 мл) добавляют фумаровую кислоту (328 мг) при комнатной температуре, смесь перемешивают при нагревании при 70°C и растворение подтверждают визуально. Реакционную смесь постепенно охлаждают до комнатной температуры и выстаивают в течение 3 дней. Твердое вещество собирают фильтрацией, промывают этанолом и затем сушат при пониженном давлении с получением белого твердого вещества (1,67 г).
Соединение A (0,53 г) добавляют к суспензии полученного белого твердого вещества (1,67 г) в этаноле (30 мл), смесь перемешивают при нагревании при 80°C и растворение подтверждают визуально. Этот раствор постепенно охлаждают до комнатной температуры и выстаивают в течение 6 часов. Твердое вещество собирают фильтрацией, промывают этанолом и затем сушат при пониженном давлении с получением фумарата соединения A (1,96 г) в виде белого твердого вещества.
Содержание влаги: 1,0% (массовое отношение)
1H-ЯМР (ДМСО-D6) δ: 9,79 (1H, с), 8,00-7,90 (4H, м), 7,68 (2H, д, J=8,6 Гц) 7,20-7,12 (1H, м), 6,67-6,55 (4H, м), 5,00 (1H, кв, J=7,3 Гц), 3,40 (2H, кв, J=6,6 Гц), 3,34-3,22 (4H, м), 2,95 (3H, с), 2,44 (2H, т, J=6,6 Гц), 2,24 (6H, с), 1,72-1,56 (4H, м), 1,34-1,24 (3H, м), 0,91 (3H, т, J=7,3 Гц)
Спектр инфракрасной абсорбции полученного фумарата соединения A показан на Фиг. 5 и в таблице 5, и порошковая рентгенограмма его же показана на Фиг. 6 и в таблице 6.
Пример 4
К суспензии памовой кислоты (73 мг) в воде добавляют 3,0 моль/л водный гидроксид натрия (126 мкл) при комнатной температуре (раствор 1). Суспензию соединения A (100 мг) в ацетоне (10 мл) перемешивают при нагревании при 60°C и растворение подтверждают визуально (раствор 2). Раствор 2 добавляют к раствору раствор 1 при комнатной температуре, затем уксусную кислоту (22 мкл), ацетон и воду добавляют к смеси и смесь перемешивают в течение 30 минут. Твердое вещество собирают фильтрацией, промывают водой и затем сушат при пониженном давлении с получением памоата соединения A (132 мг) в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-D6) δ: 9,79 (1H, с), 8,32 (2H, с), 8,16 (2H, д, J=8,6 Гц), 8,00-7,94 (4H, м), 7,76 (2H, д, J=7,3 Гц), 7,68 (2H, д, J=8,6 Гц), 7,25 (2H, т, J=7,3 Гц), 7,18-7,06 (3H, м), 6,86 (1H, д, J=15,2 Гц), 6,68-6,54 (1H, м), 4,99 (1H, кв, J=7,3 Гц), 4,74 (2H, с), 3,92-3,82 (2H, м), 3,60-3,20 (4H, м), 2,98 (3H, с), 2,77 (6H, с), 2,44 (2H, т, J=6,6 Гц), 1,72-1,54 (4H, м), 1,36-1,25 (3H, м), 0,91 (3H, т, J=7,6 Гц)
Пример 5
Суспензию соединения A (150 мг) в ацетоне (4,5 мл) кипятят с обратным холодильником при нагревании и растворение подтверждают визуально. Этот раствор постепенно охлаждают до 40°C, 4,0 моль/л раствор хлористоводородной кислоты в 1,4-диоксане (141 мкл) добавляют к раствору и смесь выстаивают в течение 5 дней. Твердое вещество собирают фильтрацией, промывают ацетоном и затем сушат при пониженном давлении с получением гидрохлорида соединения A (112 мг) в виде белого твердого вещества.
1H-ЯМР (ДМСО-D6) δ: 8,73-8,65 (1H, м), 8,17 (1H, с), 8,15-8,10 (1H, м), 7,87-7,84 (4H, м), 7,86-7,83 (1H, м), 7,09-6,88 (1H, м), 6,75-6,58 (1H, м), 4,99 (1H, кв, J=7,3 Гц), 3,93-3,86 (2H, м), 3,49-3,42 (2H, м), 3,28-3,22 (2H, м), 3,00 (3H, с), 2,75-2,72 (6H, м), 2,48 (2H, т, J=6,6 Гц), 1,73-1,59 (4H, м), 1,37-1,28 (3H, м), 0,92 (3H, т, J=7,3 Гц)
Пример 6
Суспензию соединения A (1,00 г) в этаноле (20 мл) перемешивают при нагревании при 70°C и растворение подтверждают визуально. Фосфорную кислоту (238 мкл) добавляют к этому раствору и смесь постепенно охлаждают до комнатной температуры и выстаивают в течение 3 часов 30 минут. Твердое вещество собирают фильтрацией, дважды промывают этанолом и затем сушат при пониженном давлении с получением фосфата соединения A (0,75 г) в виде бледно-желтого твердого вещества.
1H-ЯМР (ДМСО-D6) δ: 9,84 (1H, с), 8,02-7,95 (3H, м), 7,69 (2H, д, J=9,2 Гц), 7,22-7,13 (1H, м), 6,89-6,77 (1H, м), 6,71-6,55 (2H, м), 5,02 (1H, кв, J=6,6 Гц), 3,74-3,62 (2H, м), 3,51-3,35 (2H, м), 3,49-3,20 (2H, м), 2,99 (3H, с), 2,61 (6H, с), 2,45 (2H, т, J=6,3 Гц), 1,75-1,57 (4H, м), 1,37-1,27 (3H, м), 0,92 (3H, т, J=7,6 Гц)
Пример 7
Суспензию соединения A (1,00 г) в этаноле (20 мл) перемешивают при нагревании при 70°C и растворение подтверждают визуально. Серную кислоту (211 мкл) добавляют к этому раствору и смесь постепенно охлаждают до комнатной температуры и выстаивают в течение 3 часов. Твердое вещество собирают фильтрацией, дважды промывают этанолом и затем сушат при пониженном давлении с получением сульфата соединения A (1,10 г) в виде белого твердого вещества.
1H-ЯМР (ДМСО-D6) δ: 9,67 (1H, с), 8,36-8,27 (1H, м), 8,11-8,07 (1H, м), 8,04-7,98 (1H, м), 7,88-7,80 (4H, м), 6,95-6,85 (1H, м), 6,66-6,50 (1H, м), 4,99 (1H, кв, J=7,0 Гц), 3,96-3,88 (2H, м), 3,47-3,39 (2H, м), 3,30-3,22 (2H, м), 2,99 (3H, с), 2,80 (6H, с), 2,48 (2H, т, J=6,6 Гц), 1,74-1,56 (4H, м), 1,37-1,27 (3H, м), 0,91 (3H, т, J=7,6 Гц)
Пример 8
Моногидрат бензолсульфоновой кислоты (132 мг) добавляют к суспензии соединения A (200 мг) в воде (5 мл) при комнатной температуре, смесь перемешивают при нагревании при 50°C и растворение подтверждают визуально. Реакционную смесь охлаждают до комнатной температуры и затем растворитель выпаривают при пониженном давлении с получением бензолсульфоната соединения A в виде масла.
Пример 9
Суспензию соединения A (150 мг) в ацетоне (4,5 мл) кипятят с обратным холодильником и растворение подтверждают визуально. Бромистоводородную кислоту (64 мкл) добавляют к этому раствору и смесь постепенно охлаждают до комнатной температуры. Твердое вещество собирают фильтрацией, промывают ацетоном и затем сушат при пониженном давлении с получением гидробромида соединения A (98 мг) в виде бледно-желтого твердого вещества.
Далее польза соединений в соответствии с данным изобретением объясняется с помощью представленных ниже примеров тестирования.
Пример тестирования 1: Тест на ингибирование FLT3
Для тестирования ингибирования FLT3 фермента применяют глутатион S-трансфераза (GST)-слитый человеческий FLT3 белок (внутриклеточная область, ак 564-993, Carna Biosciences), полученный с применением системы экспрессии бакуловируса.
Реакционную смесь (9 мкл), содержащую FLT3 белок и тестируемое соединение в предварительно определенной концентрации (1,2 мкг FLT3, 100 мМ HEPES, 10 мМ MgCl2, 25 мМ NaCl, 0,01% АБС, 1 мМ ДТТ, pH 7,5) выдерживают при температуре 25°C в течение 15 минут. Затем 3 мкл (конечная концентрация 0,25 мкМ) субстратного пептида, биотин-AAA-AEEEEYFELVAKKK (Toray Industries) и 3 мкл (конечная концентрация 50 мкМ) АТФ (Sigma-Aldrich) добавляют к реакционной смеси и смесь встряхивают в течение 2 минут и затем выстаивают при 25°C в течение 30 минут для проведения ферментной реакции.
Затем 30 мкл раствора для окончания ферментной реакции, содержащего Стрептавидин-Кслент (Cisbio) и Mab PT66-K (Cisbio) (5 мкг/мл стрептавидина, 0,19 мкг/мл PT66-K, 30 мМ HEPES (pH 7,0), 150 мМ KF, 75 мМ ЭДТК, 0,15% АБС, 0,075% Tween 20) добавляют к реакционной смеси для окончания ферментной реакции и реакционную смесь вытаивают при комнатной температуре в течение 1 часа для проведения реакции антиген-антитело. Затем фосфорилирование субстратного пептида измеряют через измерение разложение флуоресценции со временем (615 нм и 665 нм) с применением Envision (PerkinElmer).
Результаты показаны в таблице 7.
Пример тестирования 2: Тест на ингибирование роста лейкозных клеток
Тест на ингибирование роста лейкозных клеток проводят с применением штаммов лейкозных клеток MV4-11 (номер в ATCC, CRL-9591) и MOLM-13 (номер в DSMZ, ACC554).
Тест на ингибирование роста лейкозных клеток проводят описанным ниже способом.
Для измерения ингибирования роста тестируемым соединением общее число клеток подсчитывают на основе общей концентрации АТФ в клетках с применением реагента CellTitet-Glo (PerkinElmer), который позволяет подсчитать концентрацию АТФ на основе реакции люциферин-люцифераза. Клетки MOLM-13 или MV4-11 добавляют в среду RPMI, содержащую пенициллин (100 единиц/мл), стрептомицин (100 мкг/мл) и 10% ФБС с плотностью 2×105 клеток/ml, и 50 мкл (10000 клеток) вмеси инокулируют в каждую лунку 96-луночного планшета (Corning).
Серийно разведенный раствор тестируемого соединения или 0,1% ДМСО (контрольный растворитель) в объеме 50 мкл добавляют к клеткам и затем клетки культивируют в течение 72 часов в стандартных условиях для пролиферации клеток (37°C, 5% CO2) для пролиферации клеток. Для измерения общей пролиферации клеток равный объем реакционной смеси CellTitet-Glo добавляют в каждую лунку согласно инструкциям, данным для CellTitet-Glo, и подсчитывают люминесценцию (относительные световые единицы, ОСЕ).
Сигнал ОСЕ, полученный для ДМСО контрольного растворителя через 72 часа культивирования определяют как сигнал, показывающий 0% ингибирования, и значение GI50 для ингибирования роста соответствует концентрации соединения, которая обеспечивает 50% ингибирование общей пролиферации клеток, полученной в ДМСО контрольном растворителе. Каждый замер получают из образцов, приготовленных в двойном экземпляре. Значения GI50 рассчитывают нелинейной регрессией (Fit Model (205)) согласно сигмовидному уравнению доза-реакция с применением программного обеспечения XLfit.
Результаты показаны в таблице 7.
Соли соединения A в соответствии с данным изобретением демонстрируют выдающееся ингибирование фермента и ингибирование роста лейкозных клеток.
Пример тестирования 3: Тестирование растворимости
Соединения из примеров 1 и 3 выбирают в качестве тестируемых соединений.
Соединение A выбирают в качестве сравнительного соединения.
Тестируемые соединения и сравнительное соединение добавляют в воду и каждую смесь перемешивают при комнатной температуре в течение 24 часов. Нерастворимое вещество удаляют фильтрацией с применением мембранного фильтра (0,2 мкм). Фильтрат анализируют ВЭЖХ с получением растворимости.
Результаты показаны в таблице 8.
Соли соединения A в соответствии с данным изобретением показали выдающуюся растворимость.
Пример тестирования 4: Тестирование стабильности при хранении (1)
Кристаллы соединений из примеров 1 и 3 выбирают в качестве тестируемых веществ.
Каждое тестируемое вещество (200 мг) помещают в стеклянную бутылку в открытом состоянии и хранят в течение 2 недель в условиях хранения 1 (25°C, относительная влажность 75%) или условиях хранения 2 (40°C, относительная влажность 75%). Чистоту и содержание влаги в тестируемом веществе измеряют до начала тестирования и после окончания тестирования.
Чистота и содержание влаги в тестируемых веществах, измеренные до начала тестирования и после окончания тестирования, показаны в таблице 9.
Соли соединения A в соответствии с данным изобретением демонстрируют выдающуюся стабильность при хранении.
Кристаллы, полученные в примерах 1 и 3, демонстрируют незначительное изменение чистоты и содержания влаги даже после хранения в течение 2 недель и, следовательно, демонстрируют превосходную стабильность при хранении.
Пример тестирования 4: Тестирование стабильности при хранении (2)
Кристаллы соединения из примера 1 выбирают в качестве тестируемого вещества.
Тестируемое вещество (200 мг) помещают в двойной пластиковый пакет и отверстие завязывают. Пакет хранят в течение 4 недель в условиях хранения 1 (25°C, относительная влажность 75%) или условиях хранения 2 (40°C, относительная влажность 75%). Чистоту и содержание влаги в тестируемом веществе измеряют до начала тестирования и после окончания тестирования.
Чистота и содержание влаги в тестируемом веществе, измеренные до начала тестирования и после окончания тестирования, показаны в таблице 10.
Соль соединения A в соответствии с данным изобретением демонстрирует выдающуюся стабильность при хранении.
Промышленная применимость
Соль соединения A или ее кристаллы в соответствии с данным изобретением обладают выдающимся ингибирующим действием на FLT3 и превосходными физико-химическими свойствами в качестве лекарственных средств, такими как стабильность при хранении и растворимость. Поэтому она полезна для лечения заболевания или состояния, связанного с FLT3.
Реферат
Изобретение относится к новым солям (S,E)-N-(1-((5-(2-((4-цианофенил)амино)-4-(пропиламино)пиримидин-5-ил)пент-4-ин-1-ил)амино)-1-оксопропан-2-ил)-4-(диметиламино)-N-метилбут-2-енамида, выбранным из сукцината, фумарата, памоата, гидрохлорида, фосфата, сульфата и гидробромида, а также к кристаллическим формам солей. Соединения обладают свойствами ингибитора FLT3 (Fms-подобной тирозинкиназы 3) и могут быть использованы для лечения карциномы крови, включающей различные формы лейкоза, например острого лимфатического лейкоза (ОЛЛ), острого миелоидного лейкоза (ОМЛ), острого промиелоцитарного лейкоза (ОПЛ), хронического лимфоцитарного лейкоза (ХЛЛ) и др. Кристаллическая α-форма сукцината (S,E)-N-(1-((5-(2-((4-цианофенил)амино)-4-(пропиламино)пиримидин-5-ил)пент-4-ин-1-ил)амино)-1-оксопропан-2-ил)-4-(диметиламино)-N-метилбут-2-енамида на порошковой рентгеновской дифрактограмме демонстрирует пики дифракции при углах дифракции (2θ) 10,5, 17,1, 19,1 и 22,4°; кристаллическая β-форма сукцината этого соединения демонстрирует пики дифракции при углах дифракции (2θ) 12,8, 16,1, 21,4 и 28,0°. Кристаллическая форма фумарата указанного соединения на порошковой рентгеновской дифрактограмме демонстрирует пики дифракции при углах дифракции (2θ) 8,6, 13,7, 17,8 и 23,0°. Предлагаемые соли обладают стабильностью при хранении и/или высокой растворимостью. 6 н. и 3 з.п. ф-лы, 6 ил., 10 табл., 13 пр.


Комментарии