Комплексы технеция и рения с бис(гетероарилами) и способы их применения - RU2539584C2
Код документа: RU2539584C2
Чертежи










Описание
Область техники, к которой относится изобретение
Изобретение касается гетероциклических комплексов радионуклидов, которые могут быть использованы в качестве диагностических и терапевтических средств.
Уровень техники
Радиофармацевтические средства можно использовать в качестве диагностических или терапевтических средств в соответствии с физическими свойствами содержащихся в них радионуклидов. Таким образом, их применение не основано на каком-либо фармакологическом действии как таковом. Большая часть клинических лекарств данного класса являются диагностическими средствами, содержащими гамма-излучающий нуклид, который, благодаря физическим, метаболическим или биохимическим свойствам скоординированных лигандов, локализуется в конкретном органе после внутривенной инъекции. Полученные в результате изображения могут отображать структуру или деятельность органа. Данные изображения получают с помощью гамма-камеры, которая определяет распределение ионизирующего излучения, испускаемого радиоактивными молекулами.
В радиовизуализации радиоактивная метка представляет собой радионуклид, испускающий гамма-лучи, и расположение радиоактивных атомов определяют с помощью камеры, детектирующей гамма-излучение (этот процесс обычно называют гамма-сцинтиграфия). Визуализируемый участок можно детектировать благодаря тому, что меченые атомы подбирают таким образом, чтобы они либо локализовались в патологическом участке (положительный контраст) или, альтернативно, меченые атомы специально подбирают таким образом, чтобы они не локализовались в таких патологических участках (отрицательный контраст).
Многие практикуемые в настоящее время в области ядерной медицины методики включают использование радиофармацевтических средств, которые предоставляют диагностические изображения потока крови (перфузии) в основных органах и в опухолях. Локальное накопление этих радиофармацевтических средств в рассматриваемом органе пропорционально кровотоку; участки с наибольшим кровотоком демонстрируют наиболее высокую концентрацию радиофармацевтических средств, в то время как участки с низким кровотоком или без кровотока имеют относительно низкие концентрации. Диагностические изображения, демонстрирующие эти локальные различия, пригодны для определения участков с плохой перфузией, но не дают биохимическую или метаболическую информацию о состоянии ткани на данном участке с очевидно низкой перфузией.
Хорошо известно, что опухоли могут выделять уникальные белки, связанные с их злокачественным фенотипом, или могут выделять избыточное количество обычных белков по сравнению с нормальными клетками. Выделение определенных белков на поверхности опухолевых клеток предоставляет возможность диагностировать и охарактеризовать заболевание посредством исследования фенотипической идентичности и биохимического состава, а также активности опухоли. Радиоактивные молекулы, которые селективно связываются с определенными белками поверхности опухолевой клетки, позволяют использовать методики неинвазивной визуализации, такие как молекулярная диагностика или ядерная медицина, для определения присутствия и количества выделяемых опухолью белков, таким образом предоставляя важнейшую информацию о диагнозе и степени заболевания, прогноза и возможностях терапевтического лечения. Кроме того, поскольку есть возможность создавать радиофармацевтические средства, которые способны не только визуализировать заболевание, но также доставлять терапевтический радионуклид к пораженной ткани, можно осуществлять терапию, в частности терапию рака. Выработка рецепторов пептидов и рецепторов других лигандов на опухолях делает их привлекательными мишенями для разработки неинвазионной визуализации, а также направленной радиотерапии.
Как известно, для радиовизуализации применимы разнообразные радионуклиды, включая Ga-67, Tc-99m, In-111,1-123 и 1-131. Возможно наиболее широко используемый радиоизотоп для медицинской визуализации - это Tc-99m. Его 140 кэВ гамма-фотон идеален для использования с широкодоступными гамма-камерами. Он обладает коротким (6 часов) периодом полураспада, что является желательным с точки зрения получаемой пациентом дозы. Tc-99m широко доступен по относительно низкой цене посредством коммерчески производимых99Мо/Тс-99m генераторных систем.
Комбинация пригодных для медицинского использования радионуклидов, технеция-99m (99mТе) и рения-186/188 (186/188Re), привлекательна для развития молекулярной визуализации и разработки молекулярных радиотерапевтических средств, благодаря сходству их координационного поведения и отличным физическим характеристикам их распада, которые делают возможными визуализацию и терапию соответственно. Координационная химия99mТc и186/188Rc удивительна схожа, если рассматривать ядро М(СО)3L3, где координационные комплексы Те и Re являются изоструктурными. Получаемые комплексы демонстрируют высокую устойчивость даже в присутствии 1000-кратного избытка конкурирующих хелатов и лигандов, при экстремальных условиях рН и в течение продолжительного времени.
Раскрытие изобретения
В целом, описаны лиганды, содержащие гетероциклические группы, такие как пиридил и имидазолоил, и комплексы технеция (Тc) и рения (Re) с этими лигандами. Гетероциклические лиганды являются гидрофильными, что обеспечивает улучшенное почечное выведение по сравнению с более липофильными аналогами. Также описано использование лигандов и их металлокомплексов в радиовизуализации для различных клинических диагностических применений, а также в качестве радиофармацевтических средств для терапевтических применений. Лиганды также можно использовать для присоединения металлов, таких как Те и Re, к биомолекулам, таким как пептиды, которые включают соматостатины, и к низкомолекулярным антагонистам, которые включают PSMA, CA-IX или сепразу, для использования в визуализации и терапевтических применениях. Также описаны способы получения лигандов, комплексов технеция и рения и меченых биомолекул. Кроме того, описаны способы визуализации участков организма млекопитающих с помощью этих комплексов.
Краткое описание чертежей
Фиг.1 представляет собой диаграмму биораспределения в тканях связанного с SSRT2 рецептором111In-DOTA-Эдотреотида (верхняя диаграмма) в сравнении с99mТс-DpK-Эдотреотидом (средняя диаграмма) и99mТс-СООН-имидазолом (соединение 2)-Эдотреотидом (нижняя диаграмма) в модели AR42J опухоли у мышей.
Фиг.2 представляет собой диаграмму биораспределения в тканях комплекса99mТc с соединением 22 в HeLa ксенографических моделях, выраженную в %ID/r ± (SEM).
Фиг.3 представляет собой диаграмму биораспределения в тканях у здоровых мышей комплекса99mТc с соединением 48, выраженного% ID/r ± (SEM).
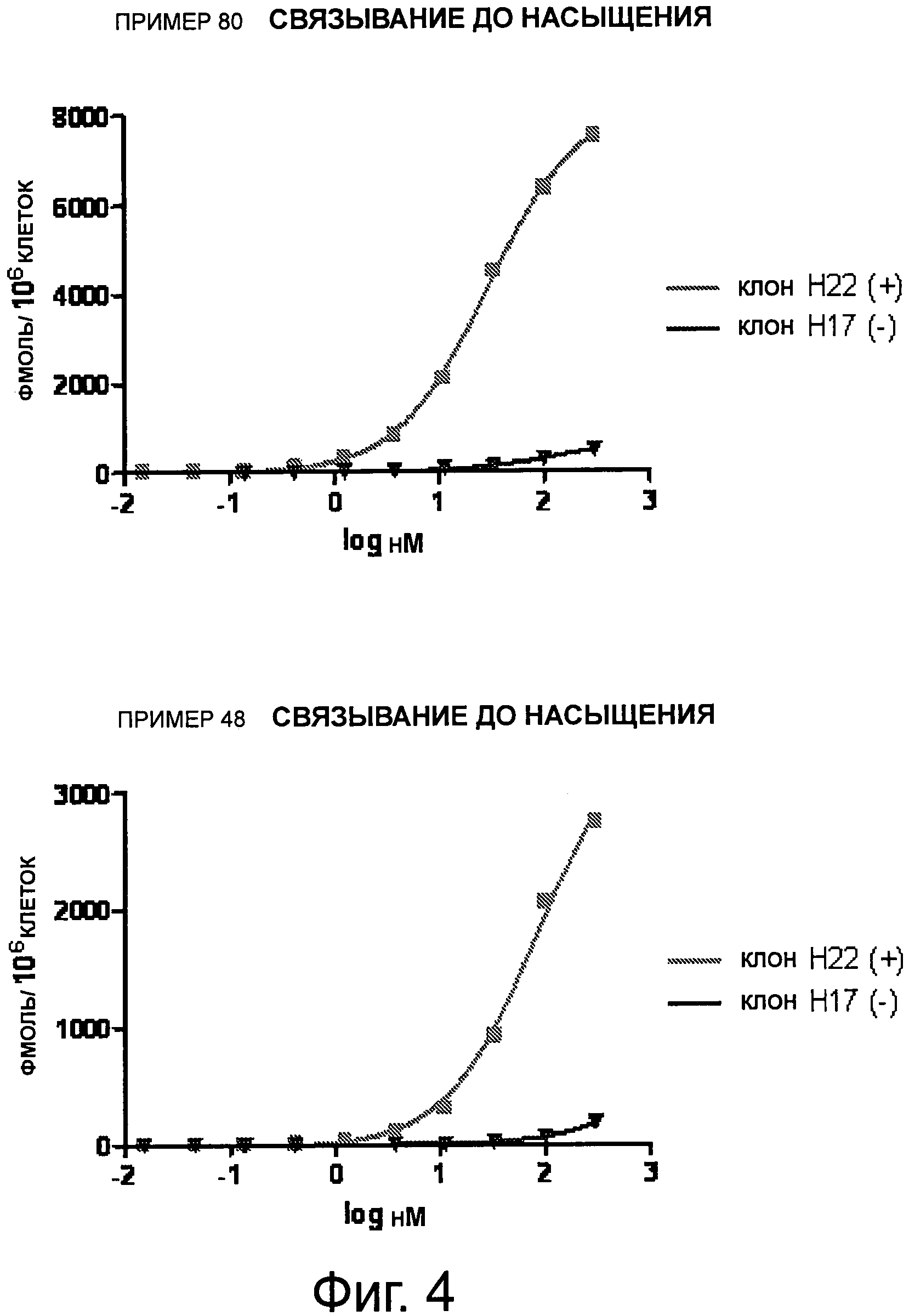
На Фиг.4 изображены результаты экспериментов по связыванию соединений 80 и 48А с экспрессирующейся на поверхности клеток протеазой (сепразой) +/- клеток.
Фиг.5 представляет собой диаграмму распределения в тканях соединения 80 у мышей с FaDu ксенотрансплантантом (%ID/г).
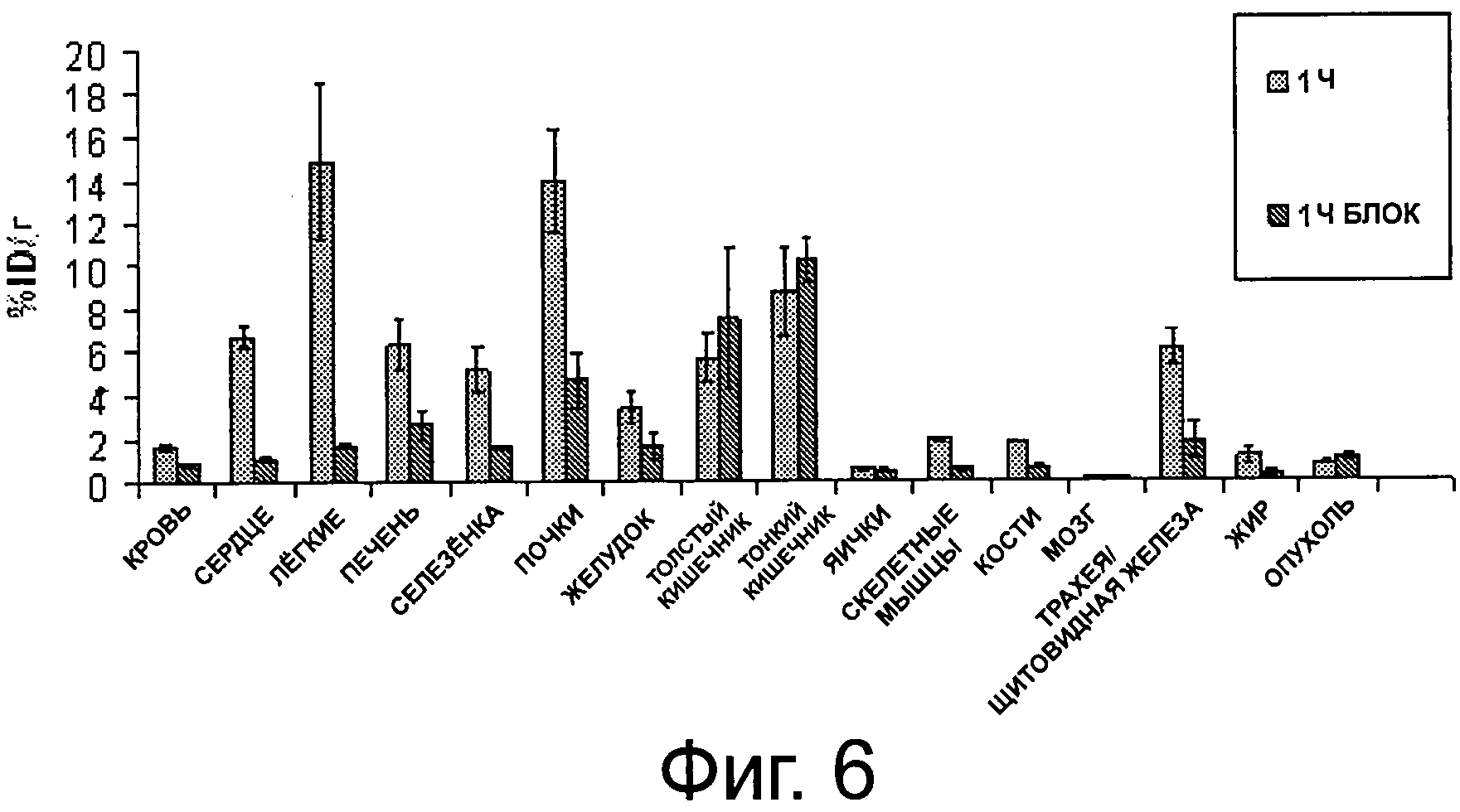
Фиг.6, 7 и 8 представляют собой диаграммы распределения в тканях соединения 80 у мышей с FaDu, H22(+) и Н17(-) ксенотрансплантантом, выраженного в (%ID/г), соответственно.
Фиг.9 представляет собой таблицу распределения в тканях для комплекса99mТc с соединением 16А у мышей с HeLa ксенотрансплантантом, в%ID/r.
Фиг.10 представляет собой диаграмму распределения в тканях для комплекса99mТc с соединением 26 у мышей с HeLa ксенотрансплантантом, в %ID/r.
Фиг.11 представляет собой диаграмму распределения в тканях для комплексов различных соединений у мышей с HeLa ксенотрансплантантом, в %ID/r.
Фиг.12 представляет собой диаграмму распределения в тканях для комплекса99mТc с соединением 36 у мышей с LNCaP ксенотрансплантантом, в %ID/r.
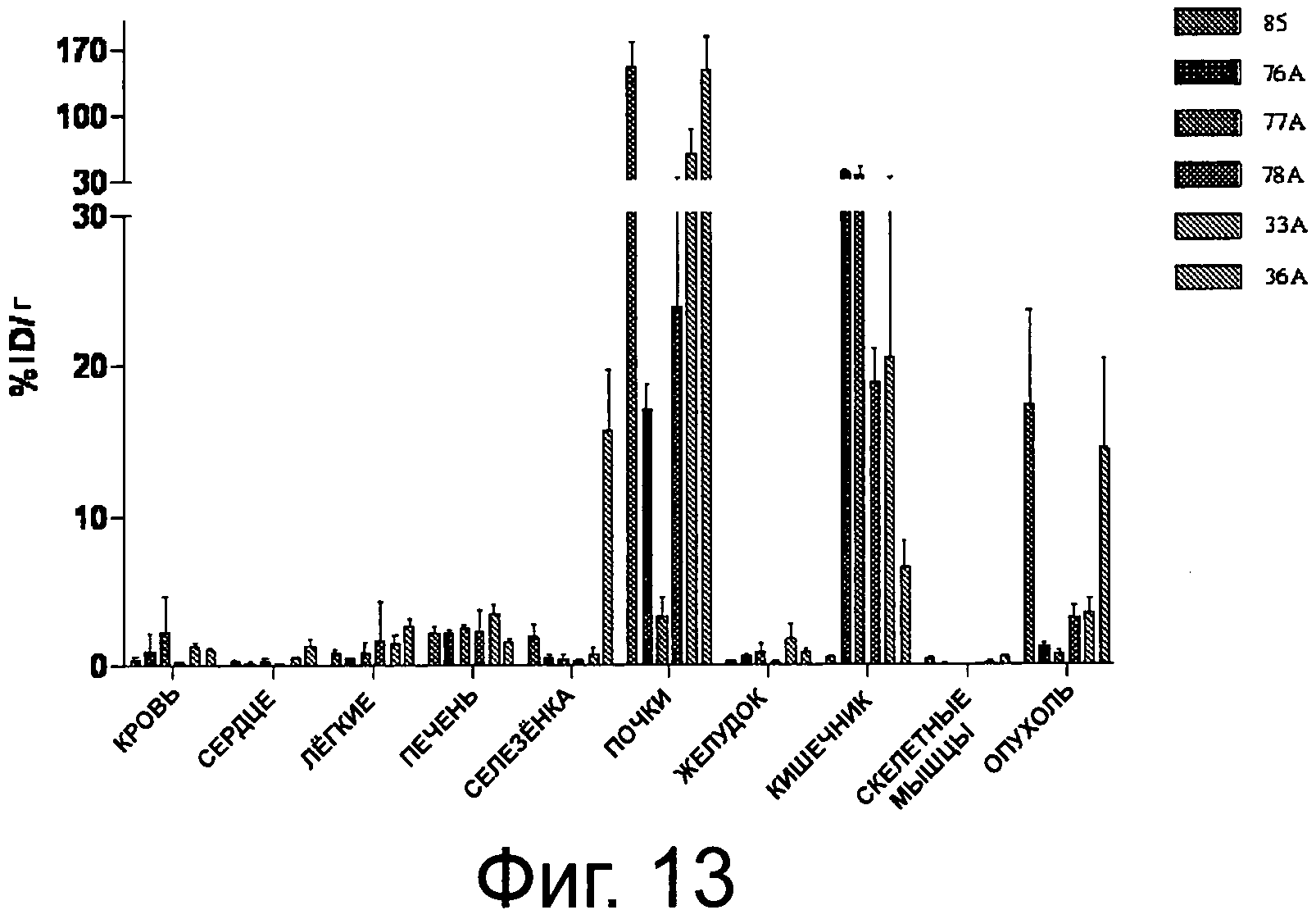
Фиг.13 представляет собой диаграмму распределения в тканях для комплексов различных соединений у мышей с LNCaP ксенотрансплантантом, в %ID/r.
Осуществление изобретения
В одном аспекте, описаны соединения, которые представляют собой тридентатные хелатирующие лиганды, содержащие одну аминокислоту (tridentate single aminoacid chelator, SAAC). В некоторых вариантах осуществления, данные лиганды можно использовать в позитронно-эмиссионной-томографии (PET) и однофотонной эмиссионной компьютерной томографии (SPECT). Данные соединения обеспечивают возможность визуализации за счет улучшенных кинетических свойств и пониженной липофильности, что обеспечивает быстрое и устойчивое хелатирование металлоцентра. Например, в некоторых вариантах осуществления металлоцентр представляет собой группу М(СО)з. В других вариантах осуществления, хелатирование происходит в мягких условиях, например при комнатной температуре, нейтральном рН и/или в водных растворителях.
В целом, SAAC соединения содержат функционализированные, полярные, гетероциклические циклы в качестве хелатирующих групп, для снижения общей липофильности данных хелаторов при их связывании с небольшими молекулами или при включении в молекулы пептидов (включая SSTR2 пептиды). Эти соединения локализуются в опухолевых ксенотрансплантатах и существенно улучшают почечный клиренс и уменьшают накопление в печени и желчных путях. Для SAAC соединений продемонстрировано легкое введение меток радиоактивных металлов и высокая устойчивость комплексов. SAAC соединения, поскольку они представляют собой аналоги аминокислот, можно включать непосредственно в пептидные последовательности.
В другом аспекте, описано использование таких SAAC лигандов для модифицирования и изменения фармакокинетического профиля соединений с99mТc радиоактивной меткой, к которым они присоединены. Такие модифицированные соединения могут служить основой для99mTс-меченых радиофармацевтических средств. В одном варианте осуществления, модифицируют лизин по эпсилон-амину двумя различными наборами функциональных групп с донорными атомами, содержащих одну или более циклических групп, для создания тридентатных хелаторов с пониженной липофильностью благодаря кислород- и азотсодержащим заместителям у циклических групп. Например, в некоторых вариантах осуществления циклические группы представляют собой производные имидазолила и/или пиридила. Эти модифицированные соединения могут демонстрировать улучшенный почечный клиренс и быстрый фоновый клиренс.
Определения
Для удобства в данном разделе собраны некоторые термины, применяемые в настоящем тексте и в прилагаемой формуле изобретения.
Термин "около" будет понятен специалистам в данной области техники. Он варьируется в определенной степени в зависимости от контекста, в котором он используется. Если есть случаи использования этого термина, которые не понятны специалистам в данной области техники, в контексте, в котором он используется, термин "около" означает плюс или минус 10% от указанного значения.
Варианты осуществления, иллюстративно описанные в настоящем тексте, можно осуществлять в отсутствие какого-либо элемента или элементов, ограничения или ограничений, конкретно не указанных в настоящем тексте. Так, например, термины "включающий в состав", "включающий", "содержащий" и т.д. должны пониматься в широком смысле и без ограничения. Кроме того, термины и выражения, употребляемые в настоящем тексте, использовались в качестве средств описания, а не ограничения, и в использовании данных терминов и выражений нет намерения исключить какие-либо эквиваленты указанных или описанных признаков или их частей, но следует понимать, что различные модификации возможны в рамках объема заявленной технологии. Кроме того, выражение "в значительной степени состоящий из" понимается как включающее конкретно перечисленные элементы и дополнительные элементы, которые не влияют существенно на основные и новые особенности заявленной технологии. Выражение "состоящий из" исключает любой не перечисленный элемент.
Использование терминов "один" и "какой-либо" и "данный", и аналогичных указаний в контексте описаний элементов (особенно в контексте формулы изобретения) необходимо понимать как включающие как единственное, так и множественное число, если иное не указано в настоящем тексте или явно не противоречит контексту.
Термины "липофильная группа" и "липофильный фрагмент" при использовании в настоящем тексте относятся к группе, фрагменту или заместителю, который обладает большим сродством к неполярному или безводному окружению, чем к полярному или водному окружению. Например, Merriam Webster's онлайн словарь определяет "липофильный" как "имеющий сродство к липидам (таким как жиры)". Примеры липофильных фрагментов включают алифатические углеводородные радикалы, например алкильные радикалы, ароматические углеводородные радикалы и длинноцепочечные ацильные радикалы; у каждого из перечисленных липофильность повышается при увеличении числа содержащихся атомов углерода. В целом, добавление липофильного фрагмента к конкретному соединению повышает сродство соединения к октанолу в стандартной методике определения коэффициента распределения в системе октанол/вода; данную методику можно использовать для измерения относительной гидрофобности (липофильности) и гидрофильности соединения.
Термины "основание Льюиса" и "основный по Льюису" относятся к химическому фрагменту, способному выступать в качестве донора пары электронов при определенных условиях реакции. Можно охарактеризовать основание по Льюису как донор одного электрона в определенных комплексах в зависимости от природы основания Льюиса и иона металла, но в большинстве случаев, однако, основание Льюиса лучше понимать как донор для двух электронов. Примеры основных по Льюису фрагментов включают незаряженные соединения, такие как спирты, тиолы и амины, и заряженные фрагменты, такие как алкоксиды, тиолаты, карбанионы, и различные другие органические анионы. В некоторых примерах основание Льюиса может состоять из одного атома, например в случае оксида (02'). В некоторых, реже встречающихся случаях, основание или лиганд Льюиса могут быть положительно заряжены. Основание Льюиса, скоординированное с ионом металла, часто называют лигандом.
Термин "лиганд" относится к веществу, которое некоторым образом взаимодействует с другими веществами. В одном примере лиганд может представлять собой основание Льюиса, которое способно образовывать координационную связь с кислотой Льюиса. В других примерах лиганд представляет собой вещество, обычно органическое, которое образует координационную связь с ионом металла. Лиганды при координации с ионом металла могут демонстрировать различные способы связывания, известные квалифицированным специалистам в данной области техники, которые включают, например, терминальное связывание (т.е. связывание с одним ионом металла) и мостиковое связывание (т.е. один атом основания Льюиса соединен с более чем одним ионом металла).
Термин "хелатирующий агент" относится к молекуле, часто органической молекуле и часто являющейся основанием Льюиса, содержащей две или более неподеленные пары электронов, доступные для донирования иону металла. С ионом металла обычно скоординированы две или более пары электронов хелатирующего агента. Термины "бидентатный хелатирующий агент", "тридентатный хелатирующий агент" и "тетрадентатный хелатирующий агент" относятся к хелатирующим агентам, имеющим соответственно две, три и четыре пары электронов, доступные для одновременного донирования иону металла, координирующемуся с хелатирующим агентом. Обычно электронные пары хелатирующего агента образуют координационные связи с одним ионом металла; однако в некоторых примерах хелатирующий агент может образовывать координационные связи с более чем одним ионом металла, при этом возможны различные способы присоединения.
Термин "координация" означает взаимодействие, при котором один донор электронных пар координационно связывается ("координируется") с одним ионом металла.
Термин "комплекс" относится к соединению, образованному при объединении одной или более богатой электронами и бедной электронами молекул или атомов, которые способны существовать независимо, с одной или более бедными электронами молекулами или атомами, каждый из которых также способен к независимому существованию.
Фраза "терапевтически эффективное количество" при использовании в настоящем тексте означает количество соединения, вещества или композиции, содержащей соединение, которое является эффективным для достижения некого желательного терапевтического эффекта, по меньшей мере, в субпопуляции клеток у животного при разумном соотношении пользы/риска, применимое к любому медицинскому препарату.
Термины "лечение" или "обработка" также включают диагностику, профилактику, терапию и излечение. Пациент, получающий лечение, представляет собой любое животное, нуждающееся в лечении, включая приматов, в частности людей, и других млекопитающих, таких как лошади, крупный рогатый скот, свиньи и овцы; а также домашнюю птицу и домашних животных в целом.
Выражение "фармацевтически приемлемый" используется в настоящем тексте для обозначения тех соединений, веществ, композиций и/или лекарственных форм, которые, в рамках тщательной медицинской оценки, подходят для взаимодействия с тканями людей и животных без излишней токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, в соответствии с разумным соотношением пользы/риска.
Выражение "фармацевтически приемлемый носитель" при использовании в настоящем тексте означает фармацевтически-приемлемое вещество, композицию или носитель, такие как жидкий или твердый наполнитель, разбавитель, наполнитель или материал для инкапсулирования растворителя, участвующие в доставке или транспортировке целевого соединения из одного органа или участка организма к другому органу или участку организма. Каждый носитель должен быть "приемлемым" в смысле совместимости с другими ингредиентами препарата и не наносящим вреда пациенту. Некоторые примеры веществ, которые могут выступать в качестве фармацевтически-приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) наполнители, такие как масло какао и суппозиторные воски; (9) масла, такие как арахисовое масло, хлопковое масло, подсолнечное масло, сезамовое масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные средства, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) физиологический раствор; (18) раствор Рингера; (19) этиловый спирт; (20) рН буферные растворы; (21) полиэфиры, поликарбонаты и/или полиангидриды; и (22) другие нетоксичные совместимые вещества, используемые в фармацевтических препаратах.
Выражения "парентеральное введение" и "вводят парентерально" при использовании в настоящем тексте означают способы введения, отличные от энтерального и местного введения, обычно посредством инъекции, и включают (не ограничиваясь только ими) внутривенную, внутримышечную, внутриартериальную, интратекальную, внутрисуставную, интраорбитальную, внутрисердечную, внутрикожную, интраперитонеальную, транстрахеальную, подкожную, подкутикульную, внутрисуставную, подкапсулярную, субарахноидальную, интраспинальную и внутригрудинную инъекцию и инфузию.
Выражения "системное введение", "вводят системно", "периферическое введение" и "вводят периферически" при использовании в настоящем тексте означают введение соединения, лекарства или другого вещества, отличное от прямого введения в центральную нервную систему, так что оно поступает в систему пациента и, таким образом, является субъектом метаболизма и аналогичных процессов, например подкожное введение.
Термин "аминокислота" относится ко всем соединениям, природным или синтетическим, которые включают аминную функциональную группу и кислотную функциональную группу, включая аналоги и производные аминокислот.
Термин "гетероатом" относится к атому любого элемента, отличного от углерода или водорода. Иллюстративные гетероатомы включают бор, азот, кислород, фосфор, серу и селен.
В целом, термин "замещенный" относится к алкильной или алкенильной группе, как определено ниже (например, к алкильной группе), в которой одна или более связей с атомом водорода заменены связью с неводородными или неуглеродными атомами. Замещенные группы также включают группы, в которых одна или более связей с атомом(-ами) углерода или водорода заменены одной или более связями, включая двойные или тройные связи, с гетероатомом. Таким образом, замещенная группа имеет один или более заместителей, если не указано иное. В некоторых вариантах осуществления, замещенная группа имеет 1, 2, 3, 4, 5 или 6 заместителей. Примеры групп-заместителей включают: атомы галогена (т.е. F, Cl, Br и I); гидроксилы; алкокси, алкенокси, алкинокси, арилокси, аралкилокси, гетероциклилокси и гетероциклилалкоксигруппы; карбонилы (оксо); карбоксилы; сложные эфиры; уретаны; оксимы; гидроксиламины; алкоксиамины; аралкоксиамины; тиолы; сульфиды; сульфоксиды; сульфоны; сульфонилы; сульфонамиды; амины; N-оксиды; гидразины; гидразиды; гидразоны; азиды; амиды; мочевины; амидины; гуанидины; енамины; имиды; изоцианаты; изотиоцианаты; цианаты; тиоцианаты; имины; нитрогруппы; нитрилы (т.е. CN); и тому подобные.
Алкильные группы включают алкильные группы с прямой и разветвленной цепью, содержащие от 1 до 12 атомов углерода, и обычно от 1 до 10 атомов углерода или, в некоторых вариантах осуществления от 1 до 8, от 1 до 6, или от 1 до 4 атомов углерода. Примеры алкильных групп с прямой цепью включают такие группы, как метильная, этильная, н-пропильная, н-бутильная, н-пентильная, н-гексильная, н-гептильная и н-октильная группы. Примеры разветвленных алкильных групп включают (но не ограничены только ими) изопропильную, изо-бутильную, втор-бутильную, трет-бутильную, неопентильную, изопентильную и 2,2-диметилпропильную группы. Алкильные группы могут быть замещенными или незамещенными. Если не указано иное, количество атомов углерода, термин "низший алкил" относится к алкильной группе, как определено выше, но содержащей от одного до около десяти атомов углерода, альтернативно от одного до около шести атомов углерода в основной цепи. Аналогично, "низший алкенил" и "низший алкинил" имеют аналогичную длину цепи.
Термины "циклический алкил" или "циклоалкил" относятся к насыщенным или частично насыщенным неароматическим циклическим алкильным группам, содержащим от 3 до 14 атомов углерода и не содержащим гетероатомы в цикле и содержащим один цикл или несколько циклов, включая конденсированные и мостиковые циклические системы. Циклоалкильные группы могут быть замещенными или незамещенными. Циклоалкильные или циклические алкильные группы включают моно-, би- или трициклические алкильные группы, содержащие от 3 до 14 атомов углерода в цикле(циклах), или, в некоторых вариантах осуществления, от 3 до 12, от 3 до 10, от 3 до 8, или от 3 до 4, 5, 6 или 7 атомов углерода. Примеры моноциклических циклоалкильных групп включают (но не ограничены только ими) циклопропильную, циклобутильную, циклопентильную, циклогексильную, циклогептильную, и циклооктильную группы. Би- и трициклические циклические системы включают мостиковые Циклоалкильные группы и конденсированные циклы, такие как (но не ограниченные только ими) бицикло[2,1,1]гексан, адамантил, декалинил и тому подобные.
Алкенильные группы включают Циклоалкильные группы с прямой и разветвленной цепью, как определено выше, за исключением того, что между двумя атомами углерода имеется по меньшей мере одна двойная связь. Таким образом, алкенильные группы содержат от 2 до около 12 атомов углерода в некоторых вариантах осуществления, от 2 до 10 атомов углерода в других вариантах осуществления и от 2 до 8 атомов углерода в других вариантах осуществления. Примеры, среди прочих, включают (но не ограничены только ими) винил, аллил, -СН-СН(СН3), -СН=С(СН3)2, -С(СН3)=СН2, -С(СН3)=СН(СН3), -С(СН2СН3)=СН2, циклогексенил, циклопентенил, циклогексадиенил, бутадиенил, пентадиенил и гексадиенил. Алкенильные группы могут быть замещенными или незамещенными. Репрезентативные замещенные алкенильные группы могут быть монозамещенными или иметь более одного заместителя, такие как (но не ограничиваясь только ими) моно-, ди- или три-замещенные такими заместителями, как перечисленные выше.
Арильные группы представляют собой циклические ароматические углеводороды, которые не содержат гетероатомов. Арильные группы включают моноциклические, бициклические и полициклические системы. Так, арильные группы включают (но не ограничены только ими) фенильную, азуленильную, гепталенильную, бифениленильную, индаценильную, флуоренильную, фенантренильную, трифениленильную, пиренильную, нафтаценильную, хризенильную, бифенильную, антраценильную, инденильную, инданильную, пенталенильную и нафтильную группы. В некоторых вариантах осуществления, арильные группы содержат 6-14 атомов углерода, а в других вариантах осуществления - от 6 до 12 или даже 6-10 атомов углерода в циклических частях групп. Арильная группа включает замещенные и незамещенные арильные группы. Замещенные арильные группы могут быть монозамещенными или иметь более одного заместителя. Например, монозамещенные арильные группы включают (но не ограничены только ими) 2-, 3-, 4-, 5-, или 6-замещенные фенильные или нафтильные группы, которые могут быть замещены заместителями, такими как перечисленные выше.
Аралкильные группы представляют собой алкильные группы, как определено выше, в которых связь с атомом водорода или углерода заменена на связь с арильной группой, как определено выше. В некоторых вариантах осуществления, аралкильные группы содержат от 7 до 20 атомов углерода, от 7 до 14 атомов углерода или от 7 до 10 атомов углерода.
Гетероциклильные группы включают неароматические циклические соединения, содержащие 3 или более членов в цикле, из которых один или более представляет собой гетероатом, такой как (но, не ограничиваясь только ими) N, О, и S. В некоторых вариантах осуществления, гетероциклильные группы имеют от 3 до 20 членов в цикле, тогда как другие такие группы имеют от 3 до 6, от 3 до 10, от 3 до 12, или от 3 до 15 членов в цикле. Гетероциклильные группы включают ненасыщенные, частично насыщенные и насыщенные циклические системы, такие как, например, имидазолильные, имидазолинильные и имидазолидинильные группы. Гетероциклильные группы могут быть замещенными или незамещенными. Гетероциклильные группы включают (но не ограничены только ими) следующие группы: азиридинил, азетидинил, пирролидинил, имидазолидинил, пиразолидинил, тиазолидинил, тетрагидротиофенил, тетрагидрофуранил, диоксолил, фуранил, тиофенил, пирролил, пирролинил, имидазолил, имидазолинил, пиразолил, пиразолинил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, тиазолинил, изотиазолил, тиадиазолил, оксадиазолил, пиперидил, пиперазинил, морфолинил, тиоморфолинил, тетрагидропиранил, тетрагидротиопиранил, оксатиан, диоксил, дитианил, пиранил, пиридил, пиримидинил, пиридазинил, пиразинил, триазинил, дигидропиридил, дигидродитиинил, дигидродитионил, гомопиперазинил, хинуклидил, индолил, индолинил, изоиндолил, азаиндолил (пирролопиридил), индазолил, индолизинил, бензотриазолил, бензимидазолил, бензофуранил, бензотиофенил, бензотиазолил, бензоксадиазолил, бензоксазинил, бензодитиинил, бензоксатиинил, бензотиазинил, бензоксазолил, бензотиазолил, бензотиадиазолил, бензо[1,3]диоксолил, пиразолопиридил, имидазопиридил (азабензимидазолил), триазолопиридил, изоксазолопиридил, пуринил, ксантйнил, аденинил, гуанинил, хинолинил, изохинолинил, хинолизинил, хиноксалинил, хиназолинил, циннолинил, фталазинил, нафтиридинил, птеридинил, тианафталенил, дигидробензотиазинил, дигидробензофуранил, дигидроиндолил, дигидробензодиоксинил, тетрагидроиндолил, тетрагидроиндазолил, тетрагидробензимидазолил, тетрагидробензотриазолил, тетрагидропирролопиридил, тетрагидропиразолопиридил, тетрагидроимидазопиридил, тетрагидротриазолопиридил и тетрагидрохинолинил. Гетероциклильные группы могут быть замещенными или незамещенными. Репрезентативные замещенные гетероциклильные группы могут быть монозамещенными или иметь более одного заместителя, такие как (но, не ограничиваясь только ими) пиридильные или морфолинильные группы, которые являются 2-, 3-, 4-, 5-или 6-замещенными, или дизамещенными различными заместителями, такими как перечисленные выше.
Гетероарильные группы представляют собой ароматические циклические соединения, содержащие 5 или более членов в цикле, из которых один или более представляет собой гетероатом, такой как (но, не ограничиваясь только ими) N, О, и S. Гетероарильные группы могут быть замещенными или незамещенными. Гетероарильные группы включают (но не ограничены только ими) такие группы, как пирролил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, тиофенил, бензотиофенил, фуранил, бензофуранил, индолил, азаиндолил (пирролопиридил), индазолил, бензимидазолил, имидазопиридил (азабензимидазолил), пиразолопиридил, триазолопиридил, бензотриазолил, бензоксазолил, бензотиазолил, бензотиадиазолил, имидазопиридил, изоксазолопиридил, тианафталенил, пуринил, ксантйнил, аденинил, гуанинил, хинолинил, изохинолинил, тетрагидрохинолинил, хиноксалинил и хиназолинил.
Алкоксигруппы представляют собой гидроксильные группы (-ОН), в которых связь с атомом водорода заменена на связь с атомом углерода замещенной или незамещенной алкильной группы, как определено выше. Примеры линейных алкоксигрупп включают (но не ограничены только ими) метокси, этокси, пропокси, бутокси, пентокси, гексокси и тому подобные. Примеры разветвленных алкоксигрупп включают (но не ограничены только ими) изопропокси, втор-бутокси, трет-бутокси, изопентокси, изогексокси и тому подобные. Примеры циклоалкокси-групп включают (но не ограничены только ими) циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и тому подобные. Алкоксигруппы могут быть замещенными или незамещенными. Репрезентативные замещенные алкоксигруппы могут быть замещены один или более раз заместителями, такими как перечисленные выше.
Термины "полициклил" или "полициклическая группа" относятся к двум или более циклам (например, к циклоалкилам, циклоалкенилам, циклоалкинилам, арилам и/или гетероциклилам), в которых два или более атома углерода являются общими для двух смежных циклов, т.е. данные циклы являются "конденсированными циклами". Циклы, которые соединены посредством несмежных атомов, обозначаются термином "мостиковые" циклы. Каждый из циклов в полицикле может быть замещен такими заместителями, как описано выше, как, например, галоген, алкил, аралкил, алкенил, алкинил, циклоалкил, гидроксил, амино, моноалкиламино, диалкиламино, нитро, сульфгидрил, имино, амидо, фосфонат, фосфинат, карбонил, карбоксил, силил, простой эфир, алкилтио, сульфонил, кетон, альдегид, сложный эфир, гетероциклил, ароматический или гетероароматический фрагмент, -CF3, -CN и тому подобные.
Термин "карбоцикл" относится к ароматическому или неароматическому циклу, в котором каждый атом в цикле представляет собой углерод. Термин "нитро" означает -NO2; термин "галоген" относится к -F, -Сl, -Br или -I; термин "сульфгидрил" означает -SH; термин "гидроксил" означает -ОН; и термин "сульфонил" означает -SO2-. Термин "галогенид" означает соответствующий анион, образованный из атомов галогена, а термин "псевдогалогенид" имеет определение, приведенное на странице 560 книги "Advanced Inorganic Chemistry" by Cotton and Wilkinson.
Термины "амин" и "амино" относятся к незамещенным и замещенным аминам, например, к фрагменту, который может быть представлен общими формулами, -HRαRβ и -[NαRβRγ]+, в которых каждый из Rα, Rβ и Rγ независимо представляет собой атом водорода, алкил, алкенил, -(CH2)m-Rδ, или Rα и Rβ, вместе с атомом N, к которому они присоединены, образуют гетероцикл, содержащий от 4 до 8 атомов в циклической структуре; Rδ представляет собой арил, циклоалкил, циклоалкенил, гетеродикл или полицикл; и m равно нулю или целому числу в интервале от 1 до 8. В других вариантах осуществления, каждый из Rα и Rβ (и опционально Rγ) независимо представляет собой атом водорода, алкил, алкенил, или -(CH2)m-Rδ. Таким образом, термин "алкиламин" включает аминогруппу, как определено выше, содержащую присоединенный к ней замещенный или незамещенный алкил, т.е. по меньшей мере один из Rα и Rβ представляет собой алкильную группу.
Термин "ациламино" относится к фрагменту, который может быть представлен общей формулой -N(Rα)C(O)Rβ, в которой Rα и Rβ такие, как определено выше.
Термин "амидо" представляет собой аминозамещенный карбонил и включает фрагмент, который может быть представлен общей формулой -C(O)NRαRβ, где Rα, Rβ и m такие, как определено выше. В некоторых вариантах осуществления, амид не включает имиды, которые могут быть неустойчивы.
Термин "алкилтио" относится к алкильной группе, как определено выше, содержащей присоединенный к ней радикал серы. В определенных вариантах осуществления, "алкилтио" фрагмент представлен одним из -S-алкила, -S-алкенила, -S-алкинила и -S-(CH2)m-Rδ, где m и Rδ определены выше. Репрезентативные алкилтиогруппы включают метилтио, этилтио и тому подобные.
Термины "карбоксил" и "карбоксилат" включают фрагменты, которые можно представить общими формулами:

где Е' представляет собой связь, О или S; и Rα и Rβ такие, как определено выше. Когда Е' представляет собой О и Rα и Rβ не являются атомом водорода, данная формула представляет собой сложный эфир. Когда Е' представляет собой О и Rα такой, как определено выше, данный фрагмент в настоящем тексте называют карбоксильной группой, а когда Rα представляет собой атом водорода, данная формула представляет собой карбоновую кислоту. Когда Е' представляет собой О и Rβ представляет собой атом водорода, данная формула представляет собой формиат. В целом, когда О из вышеуказанной формулы заменен на S, формула представляет собой тиолкарбонильную группу. Когда Е' представляет собой S и Rα и Rβ не являются атомом водорода, формула представляет собой тиолэфир. Когда Е' представляет собой S и Rα представляет собой атом водорода, формула представляет собой тиолкарбоновую кислоту. Когда Е' представляет собой S и Rβ представляет собой атом водорода, формула представляет собой тиолформиат. С другой стороны, когда Е' представляет собой связь и Rα не является атомом водорода, вышеуказанная формула представляет собой кетон. Когда Е' представляет собой связь и Rα представляет собой атом водорода, вышеуказанная формула представляет собой альдегидную группу.
Термин "карбамоил" означает -O(C=O)NRεRk, где R6 и Rк независимо представляют собой Н, алифатические группы, арильные группы или гетероарильные группы. Термин "оксо" относится к карбонильному кислороду (=O).
Термины "оксим" и " простой эфир оксима" относятся к фрагментам, которые можно представить общей формулой:

где Rτ представляет собой атом водорода, алкил, циклоалкил, алкенил, алкинил, арил, аралкил или -(CH2)m-Rδ, и Rδ такой, как определено выше. Данный фрагмент представляет собой "оксим", когда R представляет собой Н; и фрагмент представляет собой "простой эфир оксима", когда Rω представляет собой алкил, циклоалкил, алкенил, алкинил, арил, аралкил или -(CH2)m-Rδ.
Термины "алкоксил" или "алкокси" относятся к алкильной группе, как определено выше, содержащей присоединенный к ней кислородный радикал. Репрезентативные алкоксильные группы включают метокси, этокси, пропокси, бутокси, трет-бутокси и тому подобные. "Простой эфир" представляет собой два углеводорода, ковалентно связанные атомом кислорода. Соответственно, заместитель у алкила, который превращает данный алкил в простой эфир, представляет собой алкоксил или аналогичен алкоксилу, примерами может являться один из следующих: -O-алкил, -O-алкенил, -O-алкинил или -(CH2)m-R5, где m и Рδ описаны выше. Термин "простой эфир" также охватывает полиэфиры, где в указанной группе может присутствовать более одной эфирных групп или связей. Термин "простой эфир" также охватывает циклические простые эфиры и краун-эфиры, где простоэфирная связь находится внутри циклической группы.
Термин "сульфонат" относится к фрагменту, который может быть представлен общей формулой -S(O)2ORπ, в которой Rπ представляет собой электронную пару, связь, атом водорода, алкил, циклоалкил или арил. Термин "сульфат" включает фрагмент, который может быть представлен общей формулой -OS(O)2ORπ. Термин "сульфонамидо" включает фрагмент, который может быть представлен общей формулой -N(Rα) S(O)2ORδ, где Rα и Rβ такие, как определено выше. Термин "сульфамоил" относится к фрагменту, который может быть представлен общей формулой -S(О)2NRαRβ, где Rα и Rδи Rβ такие, как определено выше. Термин "сульфонил" относится к фрагменту, который может быть представлен общей формулой -S(O)2Rη, где Rη представляет собой атом водорода, алкил, алкенил, алкинил, циклоалкил, гетероциклил, арил или гетероарил. Термин "сульфоксидо" относится к фрагменту, который может быть представлен общей формулой -S(O)Rη, где Rη определен выше.
Термин "фосфорил" в целом может быть представлен формулой:
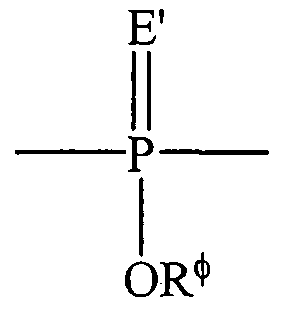
где Е' представляет собой S или О и Rф представляет собой атом водорода, низший алкил или арил. При использовании для замещения, например, алкила, фосфорильная группа фосфорилалкила может быть представлена общими формулами:

где каждый из Е' и Rф независимо определен выше, и Е" представляет собой О, S или N. Когда Е' представляет собой S, фосфорильный фрагмент представляет собой "фосфоротиоат".
Предполагается, что определение каждого значения, например, алкила, m, n, и тому подобных, когда они встречаются более одного раза в какой-либо структуре, независимо от его определения в других случаях для данной структуры.
Термины трифлил, тозил, мезил и нонафлил относятся к трифторметансульфонилу, и-толуолсульфонилу, метансульфонилу и нонафторбутансульфонилу соответственно. Термины трифлат, тозилат, мезилат и нонафлат относятся к функциональным группам, представляющим собой трифторметансульфонатный эфир, и-толуолсульфонатный эфир, метансульфонатный эфир и нонафторбутансульфонатный эфир, и молекулам, которые содержат указанные группы соответственно. Аббревиатуры Me, Et, Ph, Tf, Nf, Ts и Ms представляют собой метил, этил, фенил, трифторметансульфонил, нонафторбутансульфонил, и-толуолсульфонил и метансульфонил, соответственно. Более подробный список аббревиатур, используемых квалифицированными специалистами в органической химии, представлен в первой главе каждого тома Journal of Organic Chemistry; данный список обычно представлен в таблице под названием Стандартный список аббревиатур (Standard List of Abbreviations).
Некоторые соединения, содержащиеся в композициях, могут существовать в определенных геометрических или стереоизомерных формах. Кроме того, соединения также могут быть оптически активными. Данные соединения также могут включать цис- и транс-изомеры, R- и S-энантиомеры, диастереоизомеры, (D)-изомеры, (L)-изомеры, их рацемические смеси и другие их смеси. Дополнительные ассиметрические атомы углерода могут присутствовать в заместителе, таком как алкильная группа. Если, например, желательным является конкретный энантиомер соединения, его можно получить путем асимметрического синтеза, или путем модификации с помощью хирального вспомогательного средства, и полученную диастереоизомерную смесь разделяют, а вспомогательную группу отщепляют, получая требуемые чистые энантиомеры. Альтернативно, когда молекула содержит основную функциональную группу, такую как аминогруппа, или кислотную функциональную группу, такую как карбоксил, формируют диастереоизомерные соли с подходящей оптически активной кислотой или основанием, с последующим разделением полученных таким образом диастереоизомеров посредством дробной кристаллизации или хроматографией, хорошо известными в данной области техники, с последующим выделением чистых энантиомеров.
Выражение "защитная группа" при использовании в настоящем тексте означает временные заместители, которые защищают потенциально реакционно-способную функциональную группу от нежелательных химических превращений. Примеры защитных групп включают сложные эфиры карбоновых кислот, силиловые эфиры спиртов, и ацетали и кетали альдегидов и кетонов, соответственно. Обзор химии защитных групп приведен в монографии (Greene, T.W.; Wuts, P.G.M. Protective groups in Organic Synthesis, 3rd ed.; Wiley: New York, 1999).
В одном аспекте, описано соединение формулы I:

где R представляет собой Н, алкил, гидроксиалкил, алкоксиалкил, аминоалкил, тиоалкил, алкенил, алкинил, арил, гетероарил, аралкил, гетероаралкил, ацил, аминоацил, гидроксиацил, тиоацил, -CO2H, -(CH2)d-R80 или аминокислотный радикал; R80 в каждом случае независимо представляет собой карбоксальдегид, карбоксилат, карбоксамидо, алкоксикарбонил, арилоксикарбонил, аммоний, арил, гетероарил, циклоалкил, циклоалкенил, гетероциклил, полициклил, аминокислоту, пептид, сахарид, рибонуклеиновую кислоту, (деокси)рибонуклеиновую кислоту, или лиганд для G-белок-сопряженного рецептора, оксоредуктазу, трансферазу, гидролазу, лигазу, изомеразу, лигазу, GPCR, рецептор лигандзависимого канала, рецептор цитокина, рецептор интегрина, рецептор тирозинкиназы, ядерный рецептор, пептидный рецептор, трансмембранный рецептор, транскрипционный фактор, белок цитоскелета, структурный белок или сигнальный белок; d представляет собой целое число в интервале от 0 до 12; m представляет собой целое число в интервале от 0 до 6; n представляет собой целое число в интервале от 0 до 6; и каждый из R70, R71, R72, R73, R74, R75, R76 и R77 независимо представляет собой атом водорода, галоген, алкил, алкенил, алкинил, гидроксил, алкоксил, ацил, ацилокси, ациламино, силилокси, амино, моноалкиламино, диалкиламино, нитро, сульфгидрил, алкилтио, имино, амидо, фосфорил, фосфонат, фосфин, карбонил, карбоксил, карбоксамид, ангидрид, силил, тиоалкил, алкилсульфонил, арилсульфонил, селеноалкил, кетон, альдегид, сложный эфир, гетероалкил, циано, гуанидин, амидин, ацеталь, кеталь, аминоксид, арил, гетероарил, аралкил, гетероаралкил, азидо, азиридин, карбамоил, эпоксид, гидроксамовую кислоту, имид, оксим, сульфонамид, тиоамид, тиокарбамат, мочевину, тиомочевину или -(CH2)d-R80. Альтернативно, R70 и R71; R72 и R72; или R72 и R73 могут объединяться с образованием цикла; и R74 и R75; R75 и R76; или R76 и R77 могут объединяться с образованием цикла. В некоторых вариантах осуществления, соединение формулы I должно удовлетворять условию, согласно которому по меньшей мере один из R70, R71 R72 или R73 отличен от атома водорода и по меньшей мере один из R74, R75, R76 или R77 отличен от атома водорода.
В некоторых вариантах осуществления, соединение формулы I имеет общую структуру, соответствующую одной из следующих:

где Rv представляет собой алкил. В некоторых вариантах осуществления, Rv представляет собой метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, или трет-бутил. В других вариантах осуществления, Rv представляет собой метил. В некоторых вариантах осуществления, R представляет собой гидроксиалкил, алкоксиалкил, аминоалкил, тиоалкил, аралкил, гетероаралкил, ацил, аминоацил, гидроксиацил, тиоацил, -СO2Н, -(CH2)d-R80 или аминокислотный радикал; R80 в каждом случае независимо представляет собой карбоксальдегид, карбоксилат, карбоксамидо, алкоксикарбонил, арилоксикарбонил, аммоний, арил, гетероарил, циклоалкил, циклоалкенил, гетероциклил, полициклил, аминокислота, пептид, сахарид, рибонуклеиновую кислоту, (деокси)рибонуклеиновую кислоту, или лиганд для G-белок-сопряженного рецептора, оксоредуктазу, трансферазу, гидролазу, лигазу, изомеразу, лигазу, GPCR, рецептор лигандзависимого канала, рецептор цитокина, рецептор интегрина, рецептор тирозинкиназы, ядерный рецептор, пептидный рецептор, трансмембранный рецептор, транскрипционный фактор, белок цитоскелета, структурный белок или сигнальный белок;
d представляет собой целое число в интервале от 0 до 12; m представляет собой целое число в интервале от 0 до 6; n представляет собой целое число в интервале от 0 до 6. В другом аспекте описано соединение формулы II:

где R, m и n такие, как определено выше для соединения формулы I. В формуле II, Z представляет собой тиоалкил, карбоксилат, 2-(карбокси)арил, 2-(карбокси)гетероарил, 2-(гидрокси)арил, 2-(гидрокси)гетероарил, 2-(тиол)арил или 2-(тиол)гетероарил; и каждый из R70, Ryi, R72 и R73 независимо представляет собой атом водорода, галоген, алкил, алкенил, алкинил, гидроксил, алкоксил, ацил, ацилокси, ациламино, силилокси, амино, моноалкиламино, диалкиламино, нитро, сульфгидрил, алкилтио, имино, амидо, фосфорил, фосфонат, фосфин, карбонил, карбоксил, карбоксамид, ангидрид, силил, тиоалкил, алкилсульфонил, арилсульфонил, селеноалкил, кетон, альдегид, сложный эфир, гетероалкил, циано, гуанидин, амидин, ацеталь, кеталь, аминоксид, арил, гетероарил, аралкил, гетероаралкил, азидо, азиридин, карбамоил, эпоксид, гидроксамовую кислоту, имид, оксим, сульфонамид, тиоамид, тиокарбамат, мочевину, тиомочевину или -(СН2)d-R80- Альтернативно, R70 и R71; R71 и R72; или R72 и R73 могут объединяться с образованием цикла. В некоторых вариантах осуществления, соединение формулы II должно удовлетворять условию, согласно которому по меньшей мере один из R70, R71, R72 и R73 отличен от атома водорода, и по меньшей мере один из R74, R75, R76 и R77 отличен от атома водорода.
В некоторых вариантах осуществления, соединение формулы II имеет общую структуру

где Rt представляет собой Н, C1-C8 алкильную группу, ион аммония, или ион щелочного или щелочноземельного металла. В некоторых вариантах осуществления, Rt представляет собой Н или трет-бутил. В других вариантах осуществления, Rt представляет собой Н.
В некоторых вариантах осуществления, соединение формулы I или II образует комплекс с радионуклидом. В некоторых вариантах осуществления, соединение формулы I или II образует комплекс с радионуклидом, где радионуклид представляет собой технеций или рений.
В некоторых вариантах осуществления, в соединении формулы I или II, m равно 1. В некоторых вариантах осуществления, в соединении формулы I или II, n равно 1. В некоторых вариантах осуществления, в соединении формулы I или II, m равно 1; и n равно 1.
В некоторых вариантах осуществления, в соединении формулы I или II, по меньшей мере один из R70, R71, R72 или R73 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы I или II, по меньшей мере один из R74, R75, R76 или R77 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы I или II, по меньшей мере один из R70, R71, R72 или R73 представляет собой амино, и по меньшей мере один из R74, R75, R76 или R77 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы I или II, R71 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы I или II, R72 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы I или II, R75 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы I или II, R76 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы I или II, R72 представляет собой -N(СН3)2. В некоторых вариантах осуществления, в соединении формулы I или II, R75 представляет собой -N(СН3)2. В некоторых вариантах осуществления, в соединении формулы I или II, R71 представляет собой -N(R90)2. В некоторых вариантах осуществления, в соединении формулы I или II, R76 представляет собой -N(R90)2. В некоторых вариантах осуществления, -N(R90)2 представляет собой:

В некоторых вариантах осуществления, в соединении формулы I или II, R представляет собой -(CH2)d-R80. В некоторых вариантах осуществления, в соединении формулы I или II, m равно 1; n равно 1; и R представляет собой -(СН2)d-R80. В некоторых вариантах осуществления, в соединении формулы I или II, R представляет собой аминокислотный радикал. В некоторых вариантах осуществления, аминокислотный радикал представляет собой -CH2CH2CH2CH2CH(NH2)CO2H, -CH(CO2H)CH2CH2CH2CH2NH2, -CH2CH2CO2H, -СН2СН2СН2СO2Н, -СН2(СН2)хСO2Н, -CH2(CH2)xCO2H, -CH2(CH2)xCH(NH2)CO2H или -CH(CO2H)(CH2)xCH(NH2)CO2H, где х представляет собой целое число от 3 до 9.
В некоторых вариантах осуществления, в соединении формулы II, Z представляет собой карбоксилат. В некоторых вариантах осуществления, в соединении формулы II, Z представляет собой карбоксилат; m равно 1; и n равно 1.
В другом аспекте, описан препарат, включающий соединение ормулы фI или II и фармацевтически приемлемый наполнитель.
В другом аспекте, способ визуализации части тела пациента включает стадию введения пациенту диагностически эффективного количества соединения формулы I или II. В некоторых вариантах осуществления, способ также включает стадию получения изображения указанной части тела указанного пациента.
В другом аспекте, способ получения пептидного конъюгата, содержащего соединение формулы I или II, включает стадию синтеза пептидного конъюгата с помощью методик твердофазного пептидного синтеза.
В другом аспекте, описано соединение формулы III:

где R представляет собой Н, алкил, гидроксиалкил, алкоксиалкил, аминоалкил, тиоалкил, алкенил, алкинил, арил, гетероарил, аралкил, гетероаралкил, ацил, аминоацил, гидроксиацил, тиоацил, -СO2Н, -(СH2)d-R80 или аминокислотный радикал; R80 в каждом случае независимо представляет собой карбоксальдегид, карбоксилат, карбоксамидо, алкоксикарбонил, арилоксикарбонил, аммоний, арил, гетероарил, циклоалкил, циклоалкенил, гетероциклил, полициклил, аминокислоту, пептид, сахарид, рибонуклеиновую кислоту, (деокси)рибонуклеиновую кислоту, или лиганд для G-белок-сопряженного рецептора, оксоредуктазу, трансферазу, гидролазу, лигазу, изомеразу, лигазу, GPCR, рецептор лигандзависимого канала, рецептор цитокина, рецептор интегрина, рецептор тирозинкиназы, ядерный рецептор, пептидный рецептор, трансмембранный рецептор, транскрипционный фактор, белок цитоскелета, структурный белок или сигнальный белок; d представляет собой целое число в интервале от 0 до 12; m представляет собой целое число в интервале от 0 до 6; n представляет собой целое число в интервале от 0 до 6; D представляет собой

R70, R71, R72, R73, R74, R75, R76 и R77 в каждом отдельном случае независимо представляют собой атом водорода, галоген, алкил, алкенил, алкинил, гидроксил, алкоксил, ацил, ацилокси, ациламино, силилокси, амино, моноалкиламино, диалкиламино, нитро, сульфгидрил, алкилтио, имино, амидо, фосфорил, фосфонат, фосфин, карбонил, карбоксил, карбоксамид, ангидрид, силил, тиоалкил, алкилсульфонил, арилсульфонил, селеноалкил, кетон, альдегид, сложный эфир, гетероалкил, циано, гуанидин, амидин, ацеталь, кеталь, аминоксид, арил, гетероарил, аралкил, гетероаралкил, азидо, азиридин, карбамоил, эпоксид, гидроксамовую кислоту, имид, оксим, сульфонамид, тиоамид, тиокарбамат, мочевину, тиомочевину или -(CH2)d-R80.
В другом аспекте, описано соединение Формулы IV:

где R представляет собой Н, алкил, гидроксиалкил, алкоксиалкил, аминоалкил, тиоалкил, алкенил, алкинил, арил, гетероарил, аралкил, гетероаралкил, ацил, аминоацил, гидроксиацил, тиоацил, -СO2Н, -(CH2)d-R80 или аминокислотный радикал; R80 в каждом случае независимо представляет собой карбоксальдегид, карбоксилат, карбоксамидо, алкоксикарбонил, арилоксикарбонил, аммоний, арил, гетероарил, циклоалкил, циклоалкенил, гетероциклил, полициклил, аминокислоту, пептид, сахарид, рибонуклеиновую кислоту, (деокси)рибонуклеиновую кислоту, или лиганд для G-белок-сопряженного рецептора, оксоредуктазу, трансферазу, гидролазу, лигазу, изомеразу, лигазу, GPCR, рецептор лигандзависимого канала, рецептор цитокина, рецептор интегрина, рецептор тирозинкиназы, ядерный рецептор, пептидный рецептор, трансмембранный рецептор, транскрипционный фактор, белок цитоскелета, структурный белок или сигнальный белок; d представляет собой целое число в интервале от 0 до 12; m представляет собой целое число в интервале от 0 до 6; n представляет собой целое число в интервале от 0 до 6; Z представляет собой тиоалкил, карбоксилат, 2-(карбокси)арил, 2-(карбокси)гетероарил, 2-(гидрокси)арил, 2-(гидрокси)гетероарил, 2-(тиол)арил или. 2-(тиол)гетероарил; D представляет собой

и
R70, R71, R72, R73, R74, R75, R76 и R77 в каждом отдельном случае независимо представляют собой атом водорода, галоген, алкил, алкенил, алкинил, гидроксил, алкоксил, ацил, ацилокси, ациламино, силилокси, амино, моноалкиламино, диалкиламино, нитро, сульфгидрил, алкилтио, имино, амидо, фосфорил, фосфонат, фосфин, карбонил, карбоксил, карбоксамид, ангидрид, силил, тиоалкил, алкилсульфонил, арилсульфонил, селеноалкил, кетон, альдегид, сложный эфир, гетероалкил, циано, гуанидин, амидин, ацеталь, кеталь, аминоксид, арил, гетероарил, аралкил, гетероаралкил, азидо, азиридин, карбамоил, эпоксид, гидроксамовую кислоту, имид, оксим, сульфонамид, тиоамид, тиокарбамат, мочевину, тиомочевину или -(СH2)d-R80.
В некоторых вариантах осуществления, соединение формулы III или IV образует комплекс с радионуклидом. В некоторых вариантах осуществления, соединение формулы III или IV образует комплекс с радионуклидом, где радионуклеид представляет собой технеций или рений.
В некоторых вариантах осуществления, в соединении формулы III или IV, m равно 1. В некоторых вариантах осуществления, в соединении формулы III или IV, n равно 1. В некоторых вариантах осуществления, в соединении формулы III или IV, m равно 1; и n равно 1.
В некоторых вариантах осуществления, в соединении формулы III или IV, по меньшей мере один из R70, R71; R72 или R73 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы III или IV, по меньшей мере один из R74, R75, R76 или R77 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы III или IV, по меньшей мере один из R70, R71, R72 или R77 представляет собой амино, и по меньшей мере один из R74, R75, R76 или R77 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы III или IV, R75 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы III или IV, R72 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы III или IV, R75 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы III или IV, R76 представляет собой амино. В некоторых вариантах осуществления, в соединении формулы III или IV, R72 представляет собой -N(СН3)2. В некоторых вариантах осуществления, в соединении формулы III или IV, R75 представляет собой -Н(СН3)2. В некоторых вариантах осуществления, в соединении формулы III или IV, R71 представляет собой -N(R90)2. В некоторых вариантах осуществления, в соединении формулы III или IV, Ry6 представляет собой -N(R90)2. В некоторых вариантах осуществления, -N(R90)2 представляет собой:

В некоторых вариантах осуществления, в соединении формулы III или IV, R представляет собой -(CH2)d-R80- В некоторых вариантах осуществления, в соединении формулы III или IV, m равно 1; n равно 1; и R представляет собой -(CH2)d-R80. В некоторых вариантах осуществления, в соединении формулы III или IV, R представляет собой аминокислотный радикал. В некоторых вариантах осуществления, аминокислотный радикал представляет собой -CH2CH2CH2CH2CHCH(NH2)CO2H, -CH(CO2H)CH2CH2CH2CH2NH2, -CH2CH2CO2H, -СН2СН2СН2С02Н, -СН2(СН2)хСO2Н, -CH2(CH2)xCH(NH2)CO2H или -CH(CO2H)(CH2)xCH(NH2)CO2H, где х представляет собой целое число от 3 до 9.
В некоторых вариантах осуществления, в соединении формулы IV, Z представляет собой карбоксилат. В некоторых вариантах осуществления, в соединении формулы IV, Z представляет собой карбоксилат; m равно 1; и n равно 1.
В другом аспекте, описан препарат, включающий соединение формулы III или IV, и фармацевтически приемлемый носитель.
В другом аспекте, способ визуализации части тела пациента включает стадию введения пациенту диагностически эффективного количества соединения формулы III или IV. В некоторых вариантах осуществления, способ также включает стадию получения изображения указанной части тела указанного пациента.
В другом аспекте, способ получения пептидного конъюгата, содержащего соединение формулы III или IV, включает стадию синтеза пептидного конъюгата с помощью методик твердофазного пептидного синтеза.
В другом аспекте, описано соединение формулы V:

где R представляет собой Н или замещенный или незамещенный алкил, гидроксиалкил, алкоксиалкил, аминоалкил, тиоалкил, алкенил, алкинил, арил, гетероарил, аралкил, гетероаралкил, ацил, аминоацил, гидроксиацил, тиоацил, алкилкето, аминоалкоксилалкил, боратоалкил, фосфонатоалкил, фосфинатоалкил, (CH2)4CH(NH2)CO2H, (СН2)3СН(NH3)СO2Н, (CH2)2CH(NH2)CO2H, C(O)CH2(CH)NH2CO2H, C(O)(CH2)2(CH)NH2CO2H, (CC)(CH2)2CH(NH2)CO2H, (CHCH)(CH2)2CHNH2CO2H, (СН2)2(СНОН)(СН2)СНМН2СO2Н или (CH2)(CHOH)(CH2)2CHNH2CO2H, (СO2Н)2, -СO2Н, -(CH2)d-R80, -C(O)(CH2)d-R80 или аминокислотный радикал; R80 в каждом случае независимо представляет собой карбоксальдегид, карбоксилат, карбоксамидо, алкоксикарбонил, арилоксикарбонил, аммоний, арил, гетероарил, циклоалкил, циклоалкенил, гетероциклил, полициклил, аминокислоту, СН2СН2OСН2СН3, СН2С(ОСН3)2, (СН2СН2O)dСН2СН3, (CH2)dNH2, (CH2)dC(O)NH2, (CH2)dN(CH3)2, CH2CH2OH, (CH2)dC(C02H)2, (CH2)dP(O)(OH)2, (СН2)dВ(ОН)2, пептид, сахарид, рибонуклеиновую кислоту, (деокси)рибонуклеиновую кислоту, или лиганд для G-белок-сопряженного рецептора, оксоредуктазу, трансферазу, гидролазу, лигазу, изомеразу, лигазу, GPCR, рецептор лигандзависимого канала, рецептор цитокина, рецептор интегрина, рецептор тирозинкиназы, ядерный рецептор, пептидный рецептор, трансмембранный рецептор, транскрипционный фактор, белок цитоскелета, структурный белок или сигнальный белок; d представляет собой целое число в интервале от 0 до 12; m представляет собой целое число в интервале от 0 до 6; n представляет собой целое число в интервале от 0 до 6; каждый из R81, R82, R83, R84, R85 и R86 независимо представляет собой атом водорода, галоген, или замещенный или незамещенный алкил, алкенил, алкинил, гидроксил, алкоксил, ацил, ацилокси, ациламино, силилокси, амино, моноалкиламино, диалкиламино, нитро, сульфгидрил, алкилтио, имино, амидо, фосфорил, фосфонат, фосфин, карбонил, карбоксил, карбоксамид, ангидрид, силил, тиоалкил, алкилсульфонил, арилсульфонил, селеноалкил, кетон, альдегид, простой эфир, сложный эфир, гетероалкил, циано, гуанидин, амидин, ацеталь, кеталь, аминоксид, арил, гетероарил, аралкил, простой ариловый эфир, гетероаралкил, азидо, азиридин, карбамоил, эпоксид, гидроксамовую кислоту, имид, оксим, сульфонамид, тиоамид, тиокарбамат, мочевину, тиомочевину, -(СH2)d-R80. (СН2)d(СO2Н)2, СН2CH2ОCH2СН3, СН2С(ОСН3)2, (CH2CH2O)dCН2СH3, -(CH2)dNH2, (CH2)dC(O)NH2, (CH2)dN(CH3)2, CH2CH2OH, (СН2)nС(СO2Н)2, (СН2)dР(O)(ОН)2, (CH2)dB(OH)2, -(CH2)d-R80, (CH2)dR87 или -(CH2)d-R88; и каждый из R87 и R88 независимо представляет собой 15-краун-5, 18-краун-б, тетразол, оксазол, азиридин, триазол, имидазол, пиразол, тиазол, гидроксамовую кислоту, фосфонат, фосфинат, тиол, тиоэфир, полисахарид, сахарид, нуклеотид или олигонуклеотид. В некоторых вариантах осуществления, соединение формулы V должно удовлетворять условию, согласно которому по меньшей мере один из R81, R82 или R83 представляет собой гидрофильную группу. В некоторых вариантах осуществления, соединение формулы V должно удовлетворять условию, согласно которому по меньшей мере один из R84, R85 или R86 представляет собой гидрофильную группу. В некоторых вариантах осуществления, соединение формулы V должно удовлетворять условию, согласно которому по меньшей мере один из R81, R82 или R83 представляет собой гидрофильную группу, и по меньшей мере один из R84, R85 представляет собой гидрофильную группу. В некоторых вариантах осуществления, соединение формулы V должно удовлетворять условию, согласно которому по меньшей мере один из R81 и R84 представляет собой гидрофильную группу. В некоторых вариантах осуществления, гидрофильная группа представляет собой простой эфир, алкоксиаралкил, карбоксилат, спирт или амид. В некоторых вариантах осуществления, соединение формулы V должно удовлетворять условию, согласно которому по меньшей мере один из R81, R82 или R83 представляет собой гидрофильную группу.
В некоторых вариантах осуществления, R представляет собой Н, СН3, (CH2)dCH3, СН2СН2OСН2СН3, (CH2)dC(O)NH2, СН2С(ОСН3)2, СН2(18-краун-6), CH(15-краун-5), C(O)(CH2)d(CH)(NH2)CO2H, (CH2CH2O)dCH2CH3, (CH2)dPh(SO2NH2), (CH2)dP(O)OH2, (CH2)dOCH2NH2, (CH2)dNHCH2NH2, (CH2)dNHCH2CO2H, (CH2)dNH2, (CH2)dN(CH3)2, (СН2)dCO2H, (CH2)dCO2H, (CH2)dCH(CO2H)(NHC(S)NH)Ph(SO2NH2), (CH2)dC(CO2H)2, (CH2)dB(OH)3, (CH)2(триазол), (СН2)d(тол), (СH2)d(тоэфир), (СН2)d(тиазол), (СН2)d(тетразол), (СН2)d(сахарид), (СH2)d(пиразол), (СH2)d(полисахарид), (СH2)d(фосфонат), (СH2)d(фосфинат), (СH2)d(оксазол), (СH2)d(олигонуклеотид), (СH2)d(нуклеотид), (СH2)d(имидазол), (СH2)d(гидроксамовая кислота), (СH2)d(CO2H)2, (CH2)d(CHOH)(CH2)dCH(NH2)CO2H, (СН2)d(азиридин), (CH2)dOH, (CH2)dОCН2CO2H, (СН2)dО(СН2)nСН3, (CH2)dNH2, (CH2)dCH(NH2)CO2H, (CH2)(CHOH)(CH2)dCH(NH2)CO2H, (CH=CH)(CH2)dCH(NH2)CO2H, (C≡C)(CH2)dCH(NH2)CO2H; и каждый из R81, R82, R83, R84, R86 и R86 независимо представляет собой Н, F, Cl, Br, I, NO2, СН3, (CH2)dCH3, СН2СН2OСН2СН3, (CH2)dC(O)NH2, СН2С(ОСН3)2, СН2(18-краун-6), СН2(15-краун-5), C(O)(CH2)d(CH)(NH2)CO2H, (CH2CH2O)dCH2CH3, (CH2)dPh(SO2NH2), (CH2)dP(O)OH2, (CH2)dOCH2NH2, (CH2)dNHCH2NH2, (CH2)dNHCH2CO2H, (CH2)dNH2, (СН2)dН(СН3)2, (CH2)dCO2H, (CH2)dCO2H, (CH2)dCH(CO2H)(NHC(S)NH)Ph(SO2NH2), (CH2)dC(CO2H)2, (CH2)dB(OH)3, (CH2)d(триазол), (CH2)d(тиол), (СH2)d(тиоэфир), (СH2)d(тиазол), (CH2)d(триазол), (CH2)d(сахарид), (CH2)d(пиразол), (CH2)d(полисахарид), (CH2)d(фосфонат), (CH2)d(фосфинат), (CH2)d(оксазол), (CH2)d(олигонуклеотид), (CH2)d(нуклеотид), (CH2)d(имидазол), (CH2)d(гидроксамовая кислота), (CH2)d(CO2H)2, (CH2)d(CHOH)(CH2)dCH(NH2)CO2H, (СH2)d(азиридин), (CH2)dOH, (CH2)dOCH2CO2H, (CH2)dO(CH2)nCH3, (CH2)dNH2, (CH2)dCH(NH2)CO2H, (CH2)(CHOH)(CH2)dCH(NH2)CO2H, (CH≡CH)(CH2)dCH(NH2)CO2H, (C=C)(CH2)dCH(NH2)CO2H; каждый d независимо представляет собой целое число в интервале от 0 до 6.
В другом аспекте, описано соединение формулы VI:
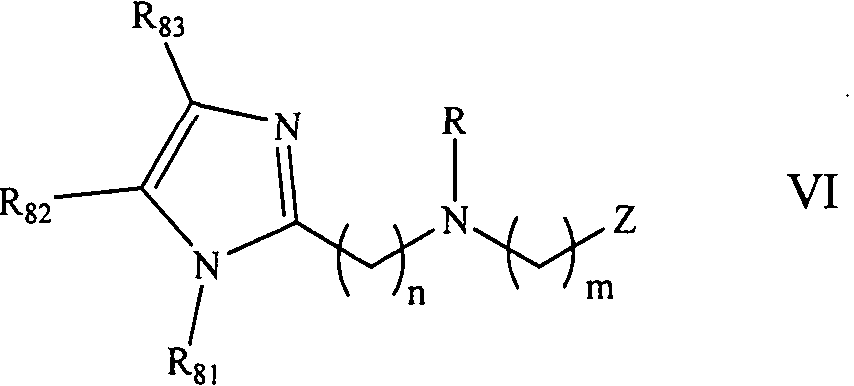
где R представляет собой Н, алкил, гидроксиалкил, алкоксиалкил, аминоалкил, тиоалкил, алкенил, алкинил, арил, гетероарил, аралкил, гетероаралкил, ацил, аминоацил, гидроксиацил, тиоацил, (CH2)4CH(NH2)CO2H, (CH2)3CH(NH2)CO2H, (CH2)2CH(NH2)CO2H, C(O)CH2(CH)NH2CO2H, С(O)(СН2)2(СН)NH2СО2Н, (CC)(CH2)2CH(NH2)CO2H, (CHCH)(CH2)2CHNH2CO2H, (CH2)2(CHOH)(CH2)CHNH2CO2H или (CH2)(CHOH)(CH2)2CHNH2CO2H, (CO2H)2, -CO2H, -(CH2)d-R80 или аминокислотный радикал; R80 в каждом случае независимо представляет собой карбоксальдегид, карбоксилат, карбоксамидо, алкоксикарбонил, арилоксикарбонил, аммоний, арил, гетероарил, циклоалкил, циклоалкенил, гетероциклил, полициклил, аминокислоту, СН2СН2OСН2СН3, СН2С(ОСН3)2, (CH2CH2O)dCH2CH3, (CH2)dNH2, (CH2)dC(O)NH2, (CH2)dN(CH3)2, CH2CH2OH, (CH2)dC(CO2H)2, (CH2)dP(O)(OH)2, (CH2)dB(OH)2, пептид, сахарид, рибонуклеиновую кислоту, (деокси)рибонуклеиновую кислоту, или лиганд для G-белок-сопряженного рецептора, оксоредуктазу, трансферазу, гидролазу, лигазу, изомеразу, лигазу, GPCR, рецептор лигандзависимого канала, рецептор цитокина, рецептор интегрина, рецептор тирозинкиназы, ядерный рецептор, пептидный рецептор, трансмембранный рецептор, транскрипционный фактор, белок цитоскелета, структурный белок или сигнальный белок; d представляет собой целое число в интервале от 0 до 12; m представляет собой целое число в интервале от 0 до 6; n представляет собой целое число в интервале от 0 до 6; и Z представляет собой замещенный или незамещенный тиоалкил, карбоксилат, 2-(карбокси)арил, 2-(карбокси)гетероарил, 2-(гидрокси)арил, 2-(гидрокси)гетероарил, 2-(тиол)арил, 2-пирролидинбориновую кислоту или 2-(тиол)гетероарил; каждый из R81, R82 и R83 независимо представляет собой атом водорода, галоген, алкил, алкенил, алкинил, гидроксил, алкоксил, ацил, ацилокси, ациламино, силилокси, амино, моноалкиламино, диалкиламино, нитро, сульфгидрил, алкилтио, имино, амидо, фосфорил, фосфонат, фосфин, карбонил, карбоксил, карбоксамид, ангидрид, силил, тиоалкил, алкилсульфонил, арилсульфонил, селеноалкил, кетон, альдегид, простой эфир, сложный эфир, гетероалкил, циано, гуанидин, амидин, ацеталь, кеталь, аминоксид, арил, гетероарил, аралкил, простой ариловый эфир, гетероаралкил, азидо, азиридин, карбамоил, эпоксид, гидроксамовую кислоту, имид, оксим, сульфонамид, тиоамид, тиокарбамат, мочевину, тиомочевину, -(CH2)d-R80, (CH2)d(CO2H)2, СН2СН2OСН2СН3, СН2С(ОСН3)2, (CH2CH2O)dCH2CH3, (CH2)dNH2, (CH2)dC(O)NH2, (CH2)dN(CH3)2, CH2CH2OH, (CH2)dC(CO2H)2, (CH2)dP(O)(OH)2, (CH2)dB(OH)2. -(CH2)d-R80, (CH2)dR87 или -(CH2)d-R88; и каждый из R87 и R88 независимо представляет собой 15-краун-5, 18-краун-6, тетразол, оксазол, азиридин, триазол, имидазол, пиразол, тиазол, гидроксамовую кислоту, фосфонат, фосфинат, тиол, тиоэфир, полисахарид, сахарид, нуклеотид или олигонуклеотид. В некоторых вариантах осуществления, соединение формулы VI должно удовлетворять условию, согласно которому по меньшей мере один из R81, R82 или рез представляет собой гидрофильную группу. В некоторых вариантах осуществления, соединение формулы VI должно удовлетворять условию, согласно которому R81 представляет собой гидрофильную группу. В некоторых вариантах осуществления, гидрофильная группа представляет собой простой эфир, алкоксиаралкил, карбоксилат, спирт или амид.
В некоторых вариантах осуществления, R представляет собой Н, СН3, (CH2)dCH3, СН2СН2OСН2СН3, (CH2)dC(O)NH2, СН2С(ОСН3)2, СН2(18-краун-6), CH(15-краун-5), C(O)(CH2)d(CH)(NH2)CO2H, (CH2CH2O)dCH2CH3, (CH2)dPh(SO2NH2), (CH2)dP(O)OH2, (CH2)dOCH2NH2, (CH2)dNHCH2NH2, (CH2)dNHCH2CO2H, (CH2)dNH2, (CH2)dN(CH3)2(СН2)dCO2H, (CH2)dCO2H, (CH2)dCH(CO2H)(NHC(S)NH)Ph(SO2NH2), (CH2)dC(CO2H)2, (CH2)dB(OH)3, (CH)2(триазол), (СН2)d(тол), (СH2)d(тоэфир), (СН2)d(тиазол), (СН2)d(тетразол), (СН2)d(сахарид), (СH2)d(пиразол), (СH2)d(полисахарид), (СH2)d(фосфонат), (СH2)d(фосфинат), (СH2)d(оксазол), (СH2)d(олигонуклеотид), (СH2)d(нуклеотид), (СH2)d(имидазол), (СH2)d(гидроксамовая кислота), (СH2)d(CO2H)2, (CH2)d(CHOH)(CH2)dCH(NH2)CO2H, (СН2)d(азиридин), (CH2)dOH, (CH2)dОCН2CO2H, (СН2)dО(СН2)nСН3, (CH2)dNH2, (CH2)dCH(NH2)CO2H, (CH2)(CHOH)(CH2)dCH(NH2)CO2H, (CH=CH)(CH2)dCH(NH2)CO2H, (C≡C)(CH2)dCH(NH2)CO2H; и каждый из R81, R82 и R83 независимо представляет собой Н, F, Cl, Br, I, NO2, СН3, (CH2)dCH3, СН2СН2OСН2СН3, (CH2)dC(O)NH2, СН2С(ОСН3)2, СН2(18-краун-6), СН2(15-краун-5), C(O)(CH2)d(CH)(NH2)CO2H, (CH2CH2O)dCH2CH3, (CH2)dPh(SO2NH2), (CH2)dP(O)OH2, (CH2)dOCH2NH2, (CH2)dNHCH2NH2, (CH2)dNHCH2CO2H, (CH2)dNH2, (СН2)dН(СН3)2, (CH2)dCO2H, (CH2)dCO2H, (CH2)dCH(CO2H)(NHC(S)NH)Ph(SO2NH2), (CH2)dC(CO2H)2, (CH2)dB(OH)3, (CH2)d(триазол), (CH2)d(тиол), (СH2)d(тиоэфир), (СH2)d(тиазол), (CH2)d(триазол), (CH2)d(сахарид), (CH2)d(пиразол), (CH2)d(полисахарид), (CH2)d(фосфонат), (CH2)d(фосфинат), (CH2)d(оксазол), (CH2)d(олигонуклеотид), (CH2)d(нуклеотид), (CH2)d(имидазол), (CH2)d(гидроксамовая кислота), (CH2)d(CO2H)2, (CH2)d(CHOH)(CH2)dCH(NH2)CO2H, (СH2)d(азиридин), (CH2)dOH, (CH2)dOCH2CO2H, (CH2)dO(CH2)nCH3, (CH2)dNH2, (CH2)dCH(NH2)CO2H, (CH2)(CHOH)(CH2)dCH(NH2)CO2H, (CH≡CH)(CH2)dCH(NH2)CO2H, (C=C)(CH2)dCH(NH2)CO2H; и каждый d независимо представляет собой целое число в интервале от 0 до 6.
В некоторых вариантах осуществления, соединение формулы V имеет общую структуру, соответствующую одной из следующих:









где Rt представляет собой H, C1-C8 алкильную группу, ион аммония, ион щелочного или щелочноземельного металла; и Rv представляет собой алкил. В некоторых вариантах осуществления, Rv представляет собой метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил или трет-бутил. В других вариантах осуществления, Rv представляет собой метил. В некоторых вариантах осуществления, каждый Rt независимо представляет собой H или трет-бутил. В других вариантах осуществления, Rt представляет собой H. В некоторых вариантах осуществления, R представляет собой гидроксиалкил, алкоксиалкил, аминоалкил, тиоалкил, аралкил, гетероаралкил, гидроксиацил, СH2)d-R80 или аминокислотный радикал; R80 в каждом случае независимо представляет собой карбоксилат, карбоксамидо, алкоксикарбонил, арилоксикарбонил, амино, аминокислоту, пептид, сахарид, рибонуклеиновую кислоту, (деокси)рибонуклеиновую кислоту, или лиганд для G-белок-сопряженного рецептора, или лиганды для оксоредуктазы, трансферазы, гидролазы, лигазы, изомеразы, лигазы, рецептор лигандзависимого канала, рецептор цитокина, рецептор интегрина, рецептор тирозинкиназы, ядерный рецептор, пептидный рецептор, трансмембранный рецептор, транскрипционный фактор, белок цитоскелета, структурный белок или сигнальный белок; d представляет собой целое число в интервале от 0 до 12; m представляет собой целое число в интервале от 0 до 6; n представляет собой целое число в интервале от 0 до 6.
В некоторых вариантах осуществления, соединение формулы VI имеет общую структуру, соответствующую одной из следующих:

где Rt представляет собой Н, C1-C8 алкильную группу, ион аммония, ион щелочного или щелочноземельного металла; и Rv представляет собой Н или алкил. В некоторых вариантах осуществления, Rv представляет собой Н, метил, этил, н-ропил, изо-пропил, н-бутил, изо-бутил или трет-бутил. В других вариантах осуществления, Rv представляет собой метил. В других вариантах осуществления, Rv представляет собой Н. В некоторых вариантах осуществления, каждый Rt независимо представляет собой Н или трет-бутил. В других вариантах осуществления, Rt представляет собой Н. В некоторых вариантах осуществления, Rt представляет собой гидроксиалкил, алкоксиалкил, аминоалкил, тиоалкил, аралкил, гетероаралкил, гидроксиацил, CH2)d-R80 или аминокислотный радикал; R80 в каждом случае независимо представляет собой карбоксилат, карбоксамидо, алкоксикарбонил, арилоксикарбонил, амино, аминокислоту, пептид, сахарид, рибонуклеиновую кислоту, (деокси)рибонуклеиновую кислоту, или лиганд для G-белок-сопряженного рецептора, или лиганды для оксоредуктазы, трансферазы, гидролазы, лигазы, изомеразы, лигазы, рецептор лигандзависимого канала, рецептор цитокина, рецептор интегрина, рецептор тирозинкиназы, ядерный рецептор, пептидный рецептор, трансмембранный рецептор, транскрипционный фактор, белок цитоскелета, структурный белок или сигнальный белок; d представляет собой целое число в интервале от 0 до 12; m представляет собой целое число в интервале от 0 до 6; n представляет собой целое число в интервале от 0 до 6.
В некоторых вариантах осуществления, соединение формулы V или VI образует комплекс с радионуклидом. В некоторых вариантах осуществления, соединение формулы V или VI образует комплекс с радионуклидом, где радионуклид представляет собой технеций или рений.
В некоторых вариантах осуществления, в соединении формулы V или VI, m равно 1. В некоторых вариантах осуществления, в соединении формулы V или VI, n равно 1. В некоторых вариантах осуществления, в соединении формулы V или VI, m равно 1; и n равно 1.
В некоторых вариантах осуществления, в соединении формулы V или VI по меньшей мере один из R81, R82 или R83 представляет собой простой эфир, алкоксиаралкил, карбоксилат, спирт или амид. В некоторых вариантах осуществления, в соединении формулы V, по меньшей мере один из R84, R85 или R86 представляет собой простой эфир, алкоксиаралкил, карбоксилат, спирт или амид. В некоторых вариантах осуществления, в соединении формулы V, по меньшей мере один из R81, R82 или R83, и по меньшей мере один из R84, R85 или R86 представляет собой простой эфир, алкоксиаралкил, карбоксилат, спирт или амид. В некоторых вариантах осуществления, в соединении формулы V или VI, R81 представляет собой простой эфир, алкоксиаралкил, карбоксилат, спирт или амид. В некоторых вариантах осуществления, в соединении формулы V, R84 представляет собой простой эфир, алкоксиаралкил, карбоксилат, спирт или амид. В некоторых вариантах осуществления, R81 и/или R84 отдельно представляют собой 2-этоксиэтильную группу, 2-(этоксиметоксиметокси)этильную группу, 2,2-диметоксиэтильную группу, диметоксифенилметильную группу, 2-гидроксиэтаноловую группу, остаток 3-пропановой кислоты, 3-пропоксиамидную группу или 15-краун-5-эфир. Примеры соединений формулы V, содержащих лизиновый остаток, приведены ниже:



В некоторых вариантах осуществления, в соединении формулы V или VI, R представляет собой -(CH2)d-R80. В некоторых вариантах осуществления, в соединении формулы V или VI, m равно 1; n равно 1; и R представляет собой -(CH2)d-R80. В некоторых вариантах осуществления, в соединении формулы V или VI, R представляет собой аминокислотный радикал. В некоторых вариантах осуществления, аминокислотный радикал представляет собой -СН2СН2СН2СН2СН(NH2)СO2Н, -CH(CO2H)CH2CH2CH2CH2NH2, -СН2СН2СO2Н, -СН2СН2СН2СO2Н, -СН2(СН2)хСO2Н, -CH2(CH2)xCH(NH2)CO2H или -CH(CO2H)(CH2)xCH(NH2)CO2H, где х представляет собой целое число от 3 до 9.
В некоторых вариантах осуществления, в соединении формулы VI, Z представляет собой карбоксилат. В некоторых вариантах осуществления, в соединении формулы VI, Z представляет собой карбоксилат; m равно 1; и n равно 1.
В другом аспекте, описан препарат, включающий соединение формулы V или VI и фармацевтически приемлемый наполнитель.
В другом аспекте, описан способ визуализации ткани млекопитающего, включающий введение млекопитающему визуализирующего средства, содержащего радионуклид в виде хелата с соединением, содержащим замещенный или незамещенный ди(имидазолилалкил)амин, имеющий по меньшей мере один гидрофильный заместитель;
и определение пространственного распределения визуализирующего средства в млекопитающем.
В другом аспекте, способ визуализации части тела пациента включает стадию введения пациенту диагностически эффективного количества соединения формулы V или VI. В некоторых вариантах осуществления, данный способ также включает стадию получения изображения указанной части тела указанного пациента.
В другом аспекте, способ получения пептидного конъюгата, содержащего соединение формулы V или VI, включает стадию синтеза пептидного конъюгата с помощью методик твердофазного пептидного синтеза.
В другом аспекте, описано соединение формулы VII, которое содержит хелатор на основе 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты (DOTA).

В соединении, представленном формулой VII, R представляет собой алкоксиалкил, аминоалкил, тиоалкил, алкенил, алкинил, арил, гетероарил, аралкил, гетероаралкил, ацил, аминоацил, гидроксиацил, тиоацил, (CH2)4CH(NH2)CO2H, (CH2)3CH(NH2)CO2H, (CH2)2CH(NH2)CO2H, C(O)CH2(CH)NH2CO2H, С(O)(СН2)2(СН)NH2СО2Н, (CC)(CH2)2CH(NH2)CO2H, (CHCH)(CH2)2CHNH2CO2H, (CH2)2(CHOH)(CH2)CHNH2CO2H или (CH2)(CHOH)(CH2)2CHNH2CO2H, (CO2H)2, -CO2H, -(CH2)d-R80 или аминокислотный радикал; R80 в каждом случае независимо представляет собой карбоксальдегид, карбоксилат, карбоксамидо, алкоксикарбонил, арилоксикарбонил, аммоний, арил, гетероарил, циклоалкил, циклоалкенил, гетероциклил, полициклил, аминокислоту, СН2СН2OСН2СН3, СН2С(ОСН3)2, (CH2CH2O)dCH2CH3, (CH2)dNH2, (CH2)dC(O)NH2, (CH2)dN(CH3)2, CH2CH2OH, (CH2)dC(CO2H)2, (CH2)dP(O)(OH)2, (CH2)dB(OH)2, пептид, сахарид, рибонуклеиновую кислоту, (деокси)рибонуклеиновую кислоту, или лиганд для G-белок-сопряженного рецептора, оксоредуктазу, трансферазу, гидролазу, лигазу, изомеразу, лигазу, GPCR, рецептор лигандзависимого канала, рецептор цитокина, рецептор интегрина, рецептор тирозинкиназы, ядерный рецептор, пептидный рецептор, трансмембранный рецептор, транскрипционный фактор, белок цитоскелета, структурный белок или сигнальный белок; d представляет собой целое число в интервале от 0 до 12; и R84, R85 и R86 независимо представляют собой Н или алкил.
В некоторых вариантах осуществления, R представляет собой СН2СН2OСН2СН3, (CH2)dC(O)NH2, СН2С(ОСН3)2, СН2(18-краун-6), CH(15-краун-5), C(O)(CH2)d(CH)(NH2)CO2H, (CH2CH2O)dCH2CH3, (CH2)dPh(SO2NH2), (CH2)dP(O)OH2, (CH2)dOCH2NH2, (CH2)dNHCH2NH2, (CH2)dNHCH2CO2H, (CH2)dNH2, (CH2)dN(CH3)2(СН2)dCO2H, (CH2)dCO2H, (CH2)dCH(CO2H)(NHC(S)NH)Ph(SO2NH2), (CH2)dC(CO2H)2, (CH2)dB(OH)3, (CH)2(триазол), (СН2)d(тол), (СH2)d(тоэфир), (СН2)d(тиазол), (СН2)d(тетразол), (СН2)d(сахарид), (СH2)d(пиразол), (СH2)d(полисахарид), (СH2)d(фосфонат), (СH2)d(фосфинат), (СH2)d(оксазол), (СH2)d(олигонуклеотид), (СH2)d(нуклеотид), (СH2)d(имидазол), (СH2)d(гидроксамовая кислота), (СH2)d(CO2H)2, (CH2)d(CHOH)(CH2)dCH(NH2)CO2H, (СН2)d(азиридин), (CH2)dOH, (CH2)dОCН2CO2H, (СН2)dО(СН2)nСН3, (CH2)dNH2, (CH2)dCH(NH2)CO2H, (CH2)(CHOH)(CH2)dCH(NH2)CO2H, (CH=CH)(CH2)dCH(NH2)CO2H, (C≡C)(CH2)dCH(NH2)CO2H. В некоторых вариантах осуществления, R84, R85 и R86 представляют собой Н.
В некоторых вариантах осуществления, такие хелаторы на основе DOTA можно использовать для хелатирования металла, включая (но не ограничиваясь только ими) иттрий, лютеций, галлий и индий. Такие металлохелатные соединения могут иметь общую формулу VII-M, где М представляет собой Y, Lu, Ga или In:

В другом аспекте, описан препарат, включающий соединение формулы VII или VII-M и фармацевтически приемлемый наполнитель.
В другом аспекте, способ визуализации части тела пациента включает стадию введения пациенту диагностически эффективного количества соединения формулы VII или VII-M. В некоторых вариантах осуществления, способ также включает стадию получения изображения указанной части тела указанного пациента.
В другом аспекте, способ получения пептидного конъюгата, содержащего соединение формулы VII или VII-M, включает стадию синтеза пептидного конъюгата с помощью методик твердофазного пептидного синтеза.
Описанные выше лиганды/хелаторы можно включать в комплексы радионуклидов, используемые в качестве радиографических визуализирующих средств. Также, данные лиганды или комплексы могут быть ковалентно или нековалентно присоединены к биологически активным молекулам-носителям, таким как антитела, ферменты, пептиды, пептидомиметики, гормоны и тому подобные. Комплексы получают взаимодействием одного из вышеуказанных лигандов с раствором, содержащим радионуклид, в условиях реакции образования комплекса радионуклида. В частности, если целевым является агент на основе технеция, реакцию проводят с раствором пертехнетата в условиях реакции образования комплекса технеция-99m. Растворитель затем можно удалять любым подходящим способом, таким как упаривание. Затем комплексы готовят для введения пациенту посредством растворения или суспендирования в фармацевтически приемлемом носителе.
В другом аспекте, описаны визуализирующие средства, содержащие комплекс радионуклида, как описано выше, в количестве, достаточном для визуализации, вместе с фармацевтически приемлемым радиологическим носителем. Радиологический носитель должен подходить для инъекции или аспирации, такой как сывороточный альбумин человека; водные буферные растворы, например трис(гидрометил)аминометан (и его соли), фосфат, цитрат, бикарбонат и т.д.; стерильная вода; физиологический раствор; и сбалансированные ионные растворы, содержащие хлоридные и/или бикарбонатные соли или катионы нормальной плазмы крови, такие как кальций, калий, натрий и магний.
Концентрация визуализирующего средства в радиологическом носителе должна быть достаточной для обеспечения удовлетворительного изображения. Например, при использовании водного раствора, дозировка составляет от около 1,0 до 50 милликюри. Визуализирующее средство необходимо вводить так, чтобы оно оставалось в организме пациента в течение периода времени от около 1 до 3 часов, однако как более длительный, так и более короткий период времени также приемлемы. Следовательно, можно готовить подходящие ампулы, содержащие от 1 до 10 мл водного раствора.
Визуализацию можно осуществлять обычным способом, например посредством инъекции достаточного количества визуализирующей композиции для обеспечения адекватной визуализации и затем сканирование подходящим аппаратом, таким как гамма-камера. В определенных вариантах осуществления, способ визуализации части тела пациента включает следующие стадии: введение пациенту диагностически эффективного количества соединения в виде комплекса с радионуклидом; облучение части тела указанного пациента; и получение изображения указанной части тела указанного пациента. В определенных вариантах осуществления способа визуализации части тела пациента, указанная чать тела указанного пациента представляет собой голову или грудную клетку.
В другом аспекте, способ улучшения почечного клиренса радиофармацевтического соединения у пациента включает введение пациенту комплекса формул I, II, III, IV, VI или VII. В некоторых вариантах осуществления, данное соединение представляет собой соединение формулы V или VI. В других вариантах осуществления, R представляет собой гидрофильную группу. В некоторых вариантах осуществления, данное соединение имеет следующую формулу:

В другом аспекте, описано соединение формулы Y-Мишень, где Y является производным соединений, представленных формулами I, II, III, IV, V, VI и VII, Мишень представляет собой интересующую мишень для лекарственного средства, включая (но не ограничиваясь только ими) следующие: оксоредуктазы, например (но не ограничиваясь только ими) циклооксигеназы, ароматазы, дигидрофолатредуктазы, ксантиноксидазы и 5-альфатестостеронредуктазы; трансферазы, например (но не ограничиваясь только ими) протеинкиназа С, ДНК и РНК полимеразы и тирозинкиназы; гидролазы, например (но не ограничиваясь только ими) аспартилпротеазы, серин-протеазы (например, плазминоген, тромбин), металлопротеазы (например, АСЕ, сепраза, PSMA, DPPIV), цистеинпротеазы (каспаза), желатиназы (ММР-9), липазы, фосфатазы, фосфорилазы и ГТФазы; лиазы, например (но не ограничиваясь только ими) карбоангидраза, особенно CA-IX, и гуанилил циклаза; изомеразы, например (но, не ограничиваясь только ими) ДНК-гиразы и топоизомеразы; лигазы, также известные как синтазы, например (но не ограничиваясь только ими) тимидилатсинтаза и mTOR; GPCR, например (но не ограничиваясь только ими) пептидные рецепторы, например соматостатиновый рецептор и рецептор GRP/бомбезина, ангиотензиновые рецепторы, каннабиноидные рецепторы, аденозиновые рецепторы, рецепторы GLP-1, опиоидные рецепторы, адренорецепторы, простаноидные рецепторы, серотониновые рецепторы, допаминовые рецепторы и вазопрессиновые рецепторы; рецепторы лигандзависимого канала, например (но не ограничиваясь только ими) рецепторы GABA и глютаматные рецепторы; цитокиновые рецепторы, например (но не ограничиваясь только ими) TNF-альфа рецептор; рецепторы интегрина, например (но не ограничиваясь только ими) VLA-4, гликопротеин IIb/IIIa, αvβ3 и αvβ6; тирозинкиназные рецепторы, например (но не ограничиваясь только ими) инсулиновый рецептор; ядерные рецепторы (рецепторы стероидных гормонов) например (но не ограничиваясь только ими) рецепторы прогестерона, рецепторы эстрогена, рецепторы андрогена; пептидные рецепторы, например (но не ограничиваясь только ими) соматостаниновые рецепторы, рецепторы GRP/бомбезина, адгезивные белки;
трансмембранные рецепторы, такие как Notch; транскрипционные факторы; белки цитоскелета; структурные белки; и сигнальные белки.
В другом аспекте, описаны соединения формулы Y-мишень. В некоторых вариантах осуществления, мишень представляет собой соматостатин таким образом, что Y-мишень представляет собой соединение формулы Y-соматостатин. В данных вариантах осуществления, Y является производным соединений, представленных формулами I, II, III, IV, V, VI и VII. В некоторых вариантах осуществления, соматостатин представляет собой октреотид или 3-tyr-октреотид. В некоторых вариантах осуществления, R в каждой из модифицированных формул I, II, III, IV, V, VI и VII является производным -CH2CH2CH2CH2CH(NH2)CO2H. В качестве примера, модифицированный Tyr-3 -октреотид (эдотреотид) может иметь формулу DpK-эдотреотид:

В данном примере DpK - это аббревиатура для [ε-{N,N-ди(пиридил-2-метил)}α-лизин], однако возможны другие SAAC - производные, такие как ди(пиридинметил)амин (DPMA) и ди(имидазолилметил)амин (DIMA) производные. Дополнительные SAAC-производные соматостатинов, такие как эдотреотид и октреотид, включают производные DOTA,

Эти соединения могут иметь общую структуру SAAC-эдотреотид:

В некоторых вариантах осуществления, описано радиофармацевтическое средство или биомолекула, меченные хелатированным Тс-99m, в которых биологическое поведение фармацевтического средства или биомолекулы не изменилось. В таких подходах с введением радиоактивной метки хелатированный радионуклид связан с биомолекулой через цепь-подвеску, удаленную от сайта связывания с рецептором. Преимущества такого дизайна включают возможность изменять длину и расположение цепи-подвески, а также возможность варьирования хелатирующих фрагментов.
В некторых аспектах, соединения конструируют таким образом, чтобы обеспечить почечный клиренс у пациента. В некоторых вариантах осуществления, описаны соединения с пониженной липофильностью. В некоторых вариантах осуществления, снижение липофильности достигается посредством включения в циклические системы SAAC лигандов различных простоэфирных, аминовых, кислотных и других растворимых в воде функциональных групп. За счет введения растворимых в воде функциональных групп, можно реализовать фармакокинетические свойства SAAC лигандов и биологически активных молекул, к которым присоединены SAAC лиганды.
В некоторых вариантах соединения формулы Y-соматостатин соединение имеет следующую формулу:

В этих вариантах осуществления, Y представляет собой:

или

Специалисты в данной области техники понимают, что присоединение вышеуказанных комплексов через карбоксильную группу является не единственным способом присоединения, так как лизин или аминокислотный остаток имеет или может иметь аминную функциональную группу, которая может использоваться для присоединения. Аналогично комплексам, указанным выше, которые присоединяются к соматостатину через карбоксильную группу, другие способы присоединения к пептиду или соматостатину можно реализовать через аминогруппу.
В другом аспекте, описана готовая форма соединения Y-соматостатин, включающая фармацевтически приемлемый наполнитель.
В другом аспекте, описан способ визуализации части тела пациента, включающий следующие стадии: введение пациенту диагностически эффективного количества соединения формулы Y-соматостатин, получение изображения указанной части тела указанного пациента.
В одном неограничивающем примере получения соединений формулы I или II синтез можно начать с получения пиридилальдегида, как показано на схеме 1:
Схема 1: Реагенты/условия: (i) реакция с диметиламином при 110°С; (ii) диоксид марганца.

Как показано на схеме 2, продукт схемы 1 затем можно функционализировать далее, получая SAAC лиганд.
Схема 2: Синтез аналога DPMA из двух эквивалентов 4-диметиламинопиридин-2-карбоксальдегида восстановительным алкилированием защищенного лизинового остатка.

Другие аналоги DPMA можно синтезировать в соответствии с другими вариантами осуществления. Например, также можно получать галогенированные аналоги пиридила. Например, 4-бром-3-хлор-1 -гидроксиметанолпиридин, 4-фтор-3-хлор-1 -гидроксиметанолпиридин, 3,4-дихлор-1-гидроксиметанолпиридин и 3-хлор-2-фтор-1-гидроксиметанолпиридин можно использовать в качестве исходных материалов для получения альдегида, изображенного на схеме 1. Схема 3 иллюстрирует альтернативный способ получения аналогов DPMA посредством аминирования по Бухвальду-Хартвигу.
Схема 3. Реагенты/условия: (iii) Pd(0), NH(R90)2.

Как известно специалистам в данной области техники, пиридиновые группы, представленные на схемах 1, 2, и 3, богаче электронами, чем незамещенная пиридиновая группа, благодаря замещению аминогруппой. Полярность пиридильной группы, являющаяся результатом данного замещения, также повышает растворимость данных соединений в воде. Указанные соединения также демонстрируют улучшенное хелатирование металлов.
Способность атомов азота образовывать комплекс с технецием можно связать с рКа донорного атома азота, участвующего в образовании комплекса. Гетероциклы с циклическими системами, которые богаче электронами, чем незамещенные 2-пиридин циклические системы, будут наиболее вероятно иметь более высокий рКа и поэтому они будут более слабыми кислотами и, следовательно, более сильными основаниями (схема 4). Повышенная донорная способность должна улучшать связывание с99mТc и/или Re, что приводит к более высокой специфической активности соединений с одинаковой устойчивостью.
Схема 4: Влияние дополнительных атомов азота и азотных заместителей в цикле на рКа пиридиновых циклических систем.

Аналогично соединениям, изображенным на схемах 2 и 3, в которых дипиридильные соединения, представленные формулой I, включены в аналоги DPMA, то же самое возможно для соединений, представленных формулой II. Такие соответствующие соединения, в которых R представляет собой лизинил, могут быть представлены формулой VIII:

где R70, R71, R72, R73, m, n и Z такие, как определено выше, и где группа NHz может быть такой, как представлено, или может быть защищенной. В некоторых вариантах осуществления Z представляет собой карбоксильную группу. Вследствие меньшего стерического объема группы Z по сравнению с пиридильной группой, такие SAAC лиганды меньше по размеру и менее затрудненные у металлоцентра.
Также можно использовать альтернативные схемы синтеза соединений формул II, IV или VI. Например, когда R представляет собой лизин, такие соединения можно получать двумя поседовательными восстановительными алкилированиями защищенного лизина. Добавление первого альдегида с последующим восстановлением может приводить к образованию из соединения формулы II, IV или VI соединения формулы IX. Последующая обработка IX оксалатом с последующим снятием защиты приводит к получению соединений формулы II, IV или VI, где R представляет собой лизиновую группу. Это проиллюстрировано ниже на Схеме 5:
Схема 5: X' представляет собой имидазолильную или пиридильную группу, как показано для соединений, представленных формулами II, IV или VI.

В одном варианте осуществления имидазолсодержащие простые эфиры модифицируют с образованием имидазолсодержащих простых эфиров лизина (LIMES). Один пример схемы синтеза представлен на схеме 6. Описанные выше и представленные в качестве варианта соединения, представленного формулами V и VI, LIMES соединения можно получать наряду с частными соединениями, представленными в качестве примера формулы V, где R81 и R84 представляют собой группы, в которых этиленовая группа связывает спиртовую, простоэфирную, кислотную или амидную группу с имидазолильными циклами.
Схема 6: Получение LIMES соединений.

В другом аспекте, описано соединение, содержащее замещенный или незамещенный ди(имидазолилалкил)амин, имеющий по меньшей мере один гидрофильный заместитель, или его фармацевтически приемлемую соль, и физиологически приемлемый носитель.
В другом аспекте, описаны фармацевтически приемлемые композиции, которые включают терапевтически эффективное количество одного или более из описанных выше соединений, входящие в состав композиции вместе с одним или более фармацевтически приемлемыми носителями (добавками) и/или растворителями. Как подробно описано ниже, фармацевтические композиции можно выпускать специально для введения в твердой или жидкой форме, включая композиции, адаптированные для следующего: (1) пероральное введение, например для вливания в полость рта (водные или неводные растворы или суспензии), таблетки, например предназначенные для всасывания в ротовой полости, сублингвально и системно, пилюли, порошки, гранулы, пасты для нанесения на язык; (2) парентеральное введение, например подкожная, внутримышечная, внутривенная или эпидуральная инъекция в форме, например, стерильного раствора или суспензии, или препарат с замедленным высвобождением; (3) местное нанесение, например в виде крема, мази или пластыря с контролируемым высвобождением, или наносимого на кожу спрея;
(4) интравагинально или ректально, например, в виде суппозитория, крема или пены; (5) подъязычно; (6) внутриглазное введение; (7) трансдермально; или (8) назально.
Готовые формы соединений могут быть частично основаны на липосомах. Липосомы состоят из двойного слоя фосфолипидов, который образует оболочку вокруг водного внутреннего слоя. Способы получения липосом для введения пациенту известны квалифицированным специалистам в данной области техники; например, в U.S. Pat. No. 4,798,734 описаны способы инкапсулирования биологических материалов в липосомы. Биологический материал растворяют в водном растворе и добавляют подходящие фосфолипиды и липиды, совместно с поверхностно-активными веществами, если необходимо. Полученную смесь затем диализируют или обрабатывают ультразвуком, по необходимости. Обзор известных способов представлен в следующей работе: G.Gregoriadis, Chapter 14 ("Liposomes"), in Drug Carriers in Biology and Medicine, c.287-341 (Academic Press, 1979).
Готовые формы соединений могут быть частично основаны на полимерных микрочастицах. Микросферы, образуемые из полимеров или белков, также хорошо известны квалифицированным специалистам в данной области техники, и могут быть приспособлены для прохождения через желудочно-кишечный тракт, как описано, например, в U.S. Pat. Nos. 4,906,474, 4,925,673 и 3,625,214. Существует много хорошо известных способов получения микросфер, включая упаривание растворителя и коацервацию/фазоразделение. Биоразрушаемые микросферы можно получать с использованием любого из способов, разработанных для получения микросфер для доставки лекарств, как описано, например, в работе Mathiowitz et al., J.Appl. Polymer Sci. 35, 755-774 (1988), и в работе Р. Deasy, in Microencapsulation and Related Drug Processes, c.61-193, (Dekker, 1984), основные положения которых включены в настоящий текст. Выбор способа зависит от свойств лекарственного средства и выбора полимера, а также от размера, внешней морфологии и требуемой степени кристалличности, как описано, например, в работе Benita et al., J. Pharm. Sci. 73, 1721-1724 (1984), Jalil and Nixon, J. Microencapsulation, 7, 297-325(1990), и Mathiowitz et al.. Scanning Microscopy 4, 329-340(1990), основные положения которых включены в настоящий текст.
При упаривании растворителя, описанного, например, в работе Mathiowitz et al., (1990), Benita, и U.S. Pat. No. 4,272,398, выданном на имя Jaffe, полимер растворяют в летучем органическом растворителе. Лекарственное средство, в растворимой форме или в форме частиц, добавляют в раствор полимера, и полученную смесь суспендируют в водной фазе, содержащей поверхностно-активное вещество, такое как поли(виниловый спирт). Полученную эмульсию перемешивают до упаривания большей части органического растворителя, получая твердые микросферы. Микросферы различных размеров (1-1000 микрон) и морфологии можно получать с помощью данного способа, который подходит для нелабильных полимеров,
Методики коацервации/фазоразделения использовали для инкапсулирования твердых и жидких материалов внутреннего слоя с различными полимерными покрытиями. В U.S. Pat. Nos. 2,730,456, 2,730,457 и 2,800,457, выданных на имя Green и Schleichter, описаны, например, желатиновые и желатин-акациевые (гуммиарабик) системы покрытий. В обычной коацервации используют один коллоид (например, желатин в воде) и удаляют связанную воду из диспергированного коллоида с помощью средств, обладающих более высоким сродством с водой, таких как спирты и соли. В комплексной коацервации используют более одного коллоида, и разделение осуществляют в основном за счет нейтрализации зарядов коллоидов, имеющих противоположные заряды, а не за счет дегидратации. Коацервацию также можно инициировать с использованием неводных носителей, как описано, например, в работе Nakano et al.. Int. J. Pharm, 4, 29-298 (1980).
Гидрогелевые микросферы, полученные из гелеобразных полимеров, таких как альгинат или полифосфазены или другие дикарбоксильные полимеры, можно получать растворением полимера в водном растворе, суспендированием вводимого вещества в полученной смеси и экструзией смеси полимеров через устройство формирования микрокапель со струей сжатого азота. Полученные микросферы падают в медленно перемешиваемую ванну с дубящим ионным раствором, как проиллюстрировано, например, в работе Salib, et al., Pharmazeutische Industrie 40-11А, 1230 (1978), основные положения которой включены в настоящий текст. Преимуществом данной системы является возможность дальнейшей модификации поверхности микросфер путем покрытия их поликатионными полимерами (такими как полилизин) после изготовления, как описано, например, в работе Lim et al, J. Pharm Sci. 70, 351-354 (1981). Размер частиц микросфер зависит от размера экструдера, а также от скорости потока полимеров и газа.
Примеры полимеров, которые можно использовать, включают полиамиды, поликарбонаты, полиалкилены и их производные, включая полиалкиленгликоли, полиалкиленоксиды, полиалкилентерефталаты, полимеры акрилового и метакрилового эфиров, включая поли(метилметакрилат), поли(этилметакрилат), поли(бутилметакрилат), поли(изобутилметакрилат), поли(гексилметакрилат), поли(изодецилметакрилат), поли(лаурилметакрилат), поли(фенилметакрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат) и поли(октадецилакрилат), поливиниловые полимеры, включая поливиниловые спирты, поливиниловые простые эфиры, поливиниловые сложные эфиры, поливинилгалогениды, поли(винилацетат) и поливинилпирролидон, полигликолиды, полисилоксаны, полиуретаны и их сополимеры, целлюлозы, включая алкилцеллюлозу, гидроксиалкилцеллюлозы, простые эфиры целлюлозы, сложные эфиры целлюлозы, нитроцеллюлозы, метилцеллюлозу, этилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксибутилметилцеллюлозу, ацетат целлюлозы, пропионат целлюлозы, ацетат бутират целлюлозы, ацетат фталат целлюлозы, карбоксилэтилцеллюлозу, триацетат целлюлозы и натриевую соль сульфата целлюлозы, полипропилен, полиэтилены, включая поли(этиленгликоль), поли(этиленоксид) и поли(этилентерефталат), и полистирол.
Примеры биоразлагаемых полимеров включают синтетические полимеры, такие как полимеры молочной кислоты и гликолевой кислоты, полиангидриды, поли(орто)эфиры, полиуретаны, поли(масляная кислота), поли(валериановая кислота), и поли(лактид-кокапролактон), и натуральные полимеры, такие как альгинат и другие полисахариды, включая декстран и целлюлозу, коллаген, их химические производные (замещения, добавления химических групп, например алкила, алкилена, гидроксилирования, окисления и другие модификации, обычно осуществляемые квалифицированными специалистами в данной области техники), альбумин и другие гидрофильные протеины, зеин и другие проламины и гидрофобные белки, их сополимеры и смеси. В целом, данные вещества разлагаются ферментативным гидролизом или воздействием воды in vivo, поверхностной эрозией или эрозией в объеме.
Представляющие особый интерес биоадгезивные полимеры включают биоразрушаемые гидрогели, описанные в работе Н. S. Sawhney, С. Р. Pathak and J. A. Hubbell in Macromolecules, 1993, 26, 581-587, основные положения которой включены в настоящий текст, полигиалуроновые кислоты, казеин, желатин, глутин, полиангидриды, полиакриловая кислота, альгинат, хитозан, поли(метилметакрилаты), поли(этилметакрилаты), поли(бутилметакрилат), поли(изобутилметакрилат), поли(гексилметакрилат), поли(изодецилметакрилат), поли(лаурилметакрилат), поли(фенилметакрилат), поли(метилакрилат), поли(изопропилакрилат), поли(изобутилакрилат) и поли(октадецилакрилат).
Разбавитель, используемый в настоящих композициях, может представлять собой одно или более соединений, которые способны уплотнять действующее соединение для достижения требуемой массы. Предпочтительные разбавители представляют собой неорганические фосфаты, такие как фосфаты кальция; сахара, такие как гидратированная или безводная лактоза или маннит; и целлюлоза или производные целлюлозы, например микрокристаллическая целлюлоза, крахмал, кукурузный крахмал или прежелатинизированный крахмал. Особенно предпочтительные разбавители представляют собой моногидрат лактозы, маннит, микрокристаллическую целлюлозу и кукурузный крахмал, используемые отдельно или в смеси, например смесь моногидрата лактозы и кукурузного крахмала или смесь моногидрата лактозы, кукурузного крахмала и микрокристаллической целлюлозы.
Связующее средство, используемое в настоящих композициях, может представлять собой одно или более соединений, которые способны уплотнять соединение формулы (I), превращая его в более крупные и плотные частицы с лучшими свойствами текучести. Предпочтительные связующие средства представляют собой альгиновую кислоту или альгинат натрия; целлюлозу и производные целлюлозы, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза или метилцеллюлоза, желатин; полимеры акриловой кислоты; и повидон, например, повидон К-30; при этом гидроксипропилметилцеллюлоза и повидон К-30 являются особенно предпочтительными связующими средствами.
В композиции можно включать дезинтегрирующее средство, и оно включает одно или более соединений, которые улучшают распадаемость полученной готовой формы при помещении в водную среду. Предпочтительные дезинтегрирующие средства представляют собой целлюлозу или производные целлюлозы, такие как натрийкарбоксиметилцеллюлоза, сшитая натрийкарбоксиметилцеллюлоза, микрокристаллическая целлюлоза, целлюлозный порошок, кросповидон; прежелатинизированный крахмал, натрийкрахмалглюконат, натрийкарбоксиметилкрахмал или крахмал. Кросповидон, сшитая натрийкарбоксиметилцеллюлоза и натрий карбоксиметилкрахмал являются предпочтительными дезинтегрирующими средствами.
Антиадгезивное средство, используемое в композициях, может представлять собой одно или более соединений, которые могут снижать липкость готовой формы, например предотвращать прилипание к металлической поверхности. Подходящие антиадгезивы включают соединения, содержащие кремний, например силикагель или тальк.
В некоторых вариантах осуществления, в композиции можно включать средства для улучшения текучести. Средство для улучшения текучести может представлять собой одно или более соединений, которые способны улучшать текучесть полученной готовой формы. Подходящие средства для улучшения текучести включают соединения, содержащие кремний, например безводный коллоидный диоксид кремния или осажденный диоксид кремния.
В некоторых вариантах осуществления, в композиции можно включать смазывающее средство. Смазывающее средство может представлять собой одно или более соединений, которые способны предотвращать проблемы, связанные с приготовлением сухих форм, такие как проблемы с липкостью и/или схватыванием, которые возникают в аппаратах при сжатии или наполнении. Подходящие смазывающие средства включают жирные кислоты или производные жирных кислот, такие как стеарат кальция, глицерил моностеарат, глицерил пальмитостеарат, стеарат магния, лаурилсульфат натрия, стеарилфумарат натрия, стеарат цинка или стеариновая кислота; гидрогенизованные растительные масла, например гидрогенизованное касторовое масло; полиалкиленгликоли или полиэтиленгликоли; бензоат натрия; или тальк. В некоторых вариантах осуществления, смазывающее средство представляет собой стеарат магния или стеарилфумарат натрия.
В некоторых вариантах осуществления, в композиции можно включать краситель. Краситель может представлять собой одно или более соединений, которые способны придавать необходимый цвет получаемой готовой форме. Добавление красителя может служить, например, для различения готовых форм, содержащих разные дозировки действующего вещества. Предпочтительными красителями являются оксиды железа.
Как описано выше, некоторые варианты описываемых соединений могут содержать основную функциональную группу, такую как амино или алкиламино, и, таким образом, способны образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми кислотами. Соли можно получать in situ в носителе для введения, или в процессе изготовления дозированной формы, или отдельной реакцией очищенного соединения в форме свободного основания с подходящей органической или неорганической кислотой, и выделением полученной таким образом соли во время последующей очистки. Репрезентативные соли включают гидробромиды, гидрохлориды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, валераты, олеаты, пальмитаты, стеараты, лаураты, бензоаты, лактаты, фосфаты, тозилаты, цитраты, малеаты, фумараты, оукцинаты, тартраты, нафтилаты, мезилаты, глюкогептонаты, лактобионаты и лаурилсульфонатные соли и тому подобные (смотри, например, Berge et al. (1977) "Pharmaceutical Salts"/ Pharm. Sci. 66:1-19).
Фармацевтически приемлемые соли включают нетоксичные соли или четвертичные аммониевые соли соединений, например, из нетоксичных органических или неорганических кислот. Например, такие традиционные нетоксичные соли включают соли, полученные из неорганических кислот, таких как хлороводородная, бромоводородная, серная, сульфаминовая, фосфорная, азотная и тому подобные; и соли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, лимонная, аскорбиновая, пальмитиновая, малеиновая, гидроксималеиновая, фенилуксусная, глютаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изотионовая и тому подобные.
В некоторых вариантах осуществления, соединения содержат одну или более кислотных функциональных групп и, таким образом, способны образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми основаниями. Данные соли можно аналогичным образом получать in situ в носителе для введения или в процессе изготовления дозированной формы или отдельным взаимодействием очищенного соединения в форме свободной кислоты с подходящим основанием, таким как гидроксид, карбонат или бикарбонат катиона фармацевтически приемлемого металла, с аммиаком, или с фармацевтически приемлемым органическим первичным, вторичным или третичным амином. Репрезентативные щелочные или щелочноземельные соли включают соли лития, натрия, калия, кальция, магния и алюминия и тому подобные. Репрезентативные органические амины, используемые для формирования солей, образующихся при добавлении основания, включают этиламин, диэтиламин, этилендиамин, этаноламин, диэтаноламин, пиперазин и тому подобные. Смотри выше статью Berge et al.
Смачивающие средства, эмульгаторы и смазывающие средства, такие как лаурилсульфат натрия и стеарат магния, а также красители, разделительные средства, покрывающие средства, подсластители, ароматизаторы и отдушки, консерванты и антиоксиданты, также могут присутствовать в данных композициях.
Примеры фармацевтически приемлемых антиоксидантов включают: (1) растворимые в воде антиоксиданты, такие как аскорбиновая кислота, цистеин гидрохлорид, натрия бисульфат, натрия метабисульфит, натрия сульфит и тому подобные; (2) растворимые в масле антиоксиданты, такие как аскорбил пальмитат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат, альфа-токоферол и тому подобные; и (3) металл-хелатирующие агенты, такие как лимонная кислота, этилендиамин-тетрауксусная кислота (EDTA), сорбит, винная кислота, фосфорная кислота и тому подобные.
Готовые формы соединений включают препараты, пригодные для перорального, назального, местного (включая буккальное и сублингвальное), ректального, вагинального и/или парэнтерального введения. Готовые формы могут выпускаться в дозированной лекарственной форме и могут быть получены любыми известными в данной области фармакологии способами. Количество действующего вещества, которое можно комбинировать с носителем для получения дозированной лекарственной формы, варьируется в зависимости от пациента, подвергающегося лечению, конкретного способа введения. Количество действующего вещества, которое можно комбинировать с носителем для получения дозированной лекарственной формы, в целом составляет количество соединения, которое оказывает терапевтическое воздействие. В целом, из суммы в сто процентов данное количество может варьироваться от около 1 процента до около девяноста девяти процентов действующего вещества, от около 5 процентов до около 70 процентов или от около 10 процентов до около 30 процентов.
В определенных вариантах осуществления, готовая форма соединений включает наполнитель, выбранный из циклодекстринов, липосом, мицеллообразующих средств, например, желчных кислот, и полимерных носителей, например полиэфиров или полиангидридов. В определенных вариантах осуществления, вышеуказанная готовая форма делает соединения биодоступными.
Способы получения данных готовых форм или композиций включают стадию комбинирования настоящего соединения и носителя и, при желани, одного или более дополнительных ингредиентов. В целом, готовые формы получают равномерным и тщательным комбинированием настоящего соединения и жидких носителей, или тонкоизмельченных твердых носителей, или и тех и других и затем, при необходимости, приданием продукту нужной формы.
Фармацевтические композиции, пригодные для парэнтерального введения, могут включать одно или более соединений в комбинации с одним или более фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями или стерильными порошками, которые можно преобразовывать в стерильные растворы или дисперсии для инъекций непосредственно перед использованием, которые могут содержать сахара, спирты, антиоксиданты, буферные средства, бактериостаты, растворы, которые делают препарат изотоничным с кровью заданного реципиента, или суспендирующие средства или загустители.
Примеры подходящих водных и неводных носителей, которые можно использовать в фармацевтических композициях, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и тому подобные), и их подходящие смеси, растительные масла, такие как оливковое масло, и органические сложные эфиры для инъекций, такие как этилолеат. Необходимой текучести можно достичь, например, путем использования покрывающих веществ, таких как лецитин, за счет поддержания требуемого размера частиц в случае дисперсий, и за счет использования поверхностно-активных средств.
Композиции также могут содержать добавки, такие как консерванты, смачивающие средства, эмульгаторы и диспергирующие средства. Предотвращение воздействия микроорганизмов на рассматриваемые соединения может быть обеспечено посредством включения различных антибактериальных и противогрибковых средств, например парабена, хлорбутанола, фенолсорбиновой кислоты и тому подобных. Также может быть предпочтительным включение в композиции изотонических средств, таких как сахара, хлорид натрия и тому подобные. Кроме того, пролонгированное всасывание инъецируемой фармацевтической формы может быть достигнуто за счет включения средств, которые замедляют всасывание, таких как моностеарат алюминия и желатин.
В некоторых случаях, для продления воздействия лекарственного средства, желательно замедлить всасывание лекарственного средства после подкожной или внутримышечной инъекции. Этого можно достичь путем использования жидкой суспензии кристаллического или аморфного вещества, обладающего низкой растворимостью в воде. Скорость всасывания лекарственного средства в данном случае зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Альтернативно, замедленное всасывание парентерально вводимого лекарственного средства достигается за счет растворения или суспендирования данного лекарственного средства в масляном носителе.
Инъецируемые формы замедленного всасывания получают путем формирования микрокапсульных матриц обсуждаемых соединений в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения лекарственного средства и полимера, а также от природы конкретного используемого полимера, можно контролировать скорость высвобождения лекарственного средства. Примеры других биоразлагаемых полимеров включают поли(ортиоэфиры) и поли(ангидриды). Инъецируемые препараты замедленного всасывания также получают посредством заключения лекарственного средства в липосомы или микроэмульсии, совместимые с тканями организма.
При введении соединений в качестве фармацевтических средств людям и животным их можно вводить как таковые или в виде фармацевтической композиции, содержащей, например, от 0,1 до 99,5% (более предпочтительно от 0,5 до 90%) действующего вещества в комбинации с фармацевтически приемлемым носителем.
Фармацевтические препараты можно вводить перорально, парентерально, местно или ректально. Разумеется, эти препараты вводят в форме, подходящей для каждого способа введения. Например, их вводят в форме таблеток или капсул, инъекции, ингаляции, глазного лосьона, мази, суппозитория и т.д., путем инъекции, инфузии или ингаляции; местно в виде лосьона или мази; и ректально суппозиториями. В некоторых вариантах осуществления препарат вводят перорально.
Вне зависимости от выбранного способа введения обсуждаемые соединения можно использовать в подходящей гидратной форме и/или фармацевтическим композициям придают форму фармацевтически приемлемых дозированных лекарственных форм с помощью традиционных способов, известных квалифицированным специалистам в данной области техники.
Фактические уровни дозировок действующих веществ в фармацевтических композициях можно варьировать таким образом, чтобы получить количество действующего вещества, эффективное для достижения требуемого терапевтического эффекта у конкретного пациента, при этом композиция и способ введения не должны быть токсичными для пациента. Выбранный уровень дозировки зависит от различных факторов, включая активность конкретного используемого соединения или его сложного эфира, соли или амида, способа введения, времени введения, скорости выведения или метаболизма конкретного используемого соединения, длительности лечения, других лекарственных средств, соединений и/или веществ, используемых в комбинации с конкретным используемым соединением, возраста, пола, веса, состояния, общего состояния здоровья и предшествующей истории болезни пациента, подвергающегося. лечению, и тому подобных факторов, хорошо известных в медицине. В целом, подходящая суточная дозировка обсуждаемых соединений может представлять собой то количество соединения, которое является минимальной дозировкой, эффективной для оказания терапевтического эффекта. Эффективная дозировка в целом зависит от описанных выше факторов. В целом, внутривенные, интрацеребровентрикулярные и подкожные дозировки соединений для пациента, при использовании для достижения обозначенного анальгезирующего действия, варьируются от около 0,0001 до около 100 мг на килограмм массы тела в сутки. При желании эффективную суточную дозировку действующего соединения можно вводить в виде двух, трех, четырех, пяти, шести или более доз, вводимых раздельно через подходящие интервалы времени в течение дня, при желании в виде дозированных лекарственных форм.
В другом аспекте, описаны фармацевтически приемлемые композиции. В некоторых вариантах осуществления, фармацевтически приемлемые композиции включают терапевтически эффективное количество одного или более соединений формул I, II, III, IV, V, VI, VII или VIII, входящих в состав наряду с одним или более фармацевтически приемлемыми носителями (добавками) и/или растворителями. Как подробно описано ниже, фармацевтические композиции могут специально выпускаться для введения в твердой или жидкой форме, включая адаптированные для следующего: (1) пероральное введение, например, для вливания в полость рта (водные или неводные растворы или суспензии), таблетки, болюсы, пилюли, порошки, гранулы, пасты для нанесения на язык; (2) парэнтеральное введение, например, подкожная, внутримышечная или внутривенная инъекция в форме, например, стерильного раствора или суспензии; (3) местное нанесение, например, в виде крема, мази или спрея, наносимых на кожу, легкие или в ротовую полость; или (4) интравагинально или ректально, например, в виде суппозитория, крема или пены; (5) подъязычно; (б) внутриглазное введение; (7) трансдермально; или (8) назально.
Соединения формул I, II, III, IV, V, VI, VII или VIII можно вводить сами по себе или в виде смеси с фармацевтически приемлемыми носителями, а также их можно вводить в сочетании с противомикробными средствами, такими как пенициллины, цефалоспорины, аминогликозиды и гликопептиды. Комбинированная терапия включает последовательное, одновременное и раздельное введение действующего вещества таким образом, что терапевтические воздействия первого вводимого вещества не прекращаются полностью при введении последующего.
В одном аспекте, описан способ терапевтического лечения, включающий введение млекопитающему, нуждающемуся в данном лечении, терапевтического средства, содержащего замещенный или незамещенный ди(имидазолилалкил)амин, имеющий по меньшей мере один гидрофильный заместитель, в фармацевтически приемлемом носителе.
Настоящее изобретение, описанное таким образом в целом, легче понять с учетом представленных далее примеров, которые приведены только в целях иллюстрации и не должны пониматься как ограничивающие настоящее изобретение.
Примеры
Настоящее описание дополнительно проиллюстрировано представленными далее примерами и примерами соединений, которые не должны пониматься как каким-либо образом ограничивающие объем настоящего изобретения.
Общие методы. Все реакции проводили в сухой стеклянной посуде в атмосфере аргона, если не указано иное. Очистку реакционных смесей осуществляли колоночной хроматографией, при среднем давлении на приборе Biotage SP4 или препаративной высокоэффективной жидкостной хроматографией с помощью препаративной ВЭЖХ системы Varian Prostar 210, оснащенной полупрепаративной обращенно-фазной колонкой Vydac С 18 (250 мм × 10 мм × 5 мкм), соединенной с детектором в УФ-видимом диапазоне Varian Prostar model 320, имеющим рабочую длину волны 254 нм. Окончательную очистку комплексов технеция осуществляли в градиенте бинарного растворителя 5-50% в течение 21 минуты (А=триэтиламмония фосфат (ТЕАР) рН 3, В=метанол). Аналитическую ВЭЖХ меченных радиоактивным иодом соединений проводили по аналогичной методике с использованием аналитической обращенно-фазной колонки Vydac С 18 (250 мм × 4,6 мм × 5 мкм).1Н ЯМР спектры регистрировали на приборе Bruker с рабочей частотой 400 МГц. Хим. сдвиги выражены в м.д. и приведены относительно сигналов растворителей в CDCl3, ДМСО-d6 или метаноле-d4. Элементный анализ осуществлялся фирмой Prevalere Life Sciences, Inc.99mТc использовали в виде раствора Na99mTcO4 в растворе соли как коммерческого элюента-генератора99Мо/99mТс (Cardinal Health).99mTс-содержащие растворы всегда хранили за свинцовым экраном достаточной толщины. Использующийся [99mTc(CO)3(H2O)3]+ готовили из коммерчески доступных наборов Isolink™ (Mallinckrodt). Все растворители приобретали у Sigma Aldrich. Реагенты приобретали у Sigma Aldrich (St. Louis, МО), Bachem (Switzerland), Akaal (Long Beach, CA) или Anaspec (San Jose, CA). Используются следующие сокращения: Fmoc = Флуоренилметоксикарбонил, DPMA = N,N-диметиламинопиридин, ДМФА = N,N - диметилформамид, ДХМ = дихлорметан, NaOH = гидроксид натрия, ID/г = вводимая доза на грамм, PBS = фосфатно-буферный солевой раствор, RCP = радиохимическая чистота, RCY = радиохимический выход.
На приведенной выше схеме 6 проиллюстрирована общая методика, которая была использована и может использоваться для получения аналогов SAAC. На данной схеме основанием может являться основание, известное квалифицированным специалистам в данной области, такое как основание аминного типа. Примеры оснований аминного типа включают аммиак; триалкиламин, такой как триметиламин, триэтиламин, три(н- или изо) пропиламин, три(н-, изо- или трет- )бутиламин; смешанные триалкиламины, такие как диэтилметиламин; гетероциклические амины, такие как замещенные или незамещенные пиридины и пиперидины или диазабициклоундецен. R представляет собой гидрофильную группу.
К раствору 2-имидазолкарбоксальдегида в ДМФА (1 мл) добавляли по 1 экв. алкилбромида и карбоната калия и каталитическое количество иодида калия. Реакционные смеси нагревали до температуры примерно 110°С в течение 18 ч, после чего упаривали досуха. Неочищенный R-алкилимидазолкарбоксальдегид можно затем очистить на приборе Biotage SP4 в градиенте 5-50% метанола в ДХМ.
К раствору L-Fmoc-лизин-ОН НС1 (90 мг, 0,185 ммоль) в дихлорэтане (ДХЭ) (2 мл) добавляли 2,1 экв. R- алкилимидазолкарбоксальдегида. Реакционную смесь нагревали до температуры примерно 50°С в течение 1 ч, после чего добавляли триацетоксиборгидрид натрия (36 мг, 0,185 ммоль). Реакционную смесь затем перемешивали при комнатной температуре в течение 12 часов и затем упаривали досуха. Fmoc-защищенное соединение затем можно очистить на приборе Biotage SP4 в градиенте 5-50% метанола в ДХМ. С очищенного Fmoc-защищенного соединения (24 мг, 0,034 ммоль) затем снимали защиту путем обработки пиперидином в ДМФА ("основание", 1:1,1 мл), после чего реакционную смесь перемешивали при комнатной температуре в течение 2 ч. После упаривания летучих компонентов остаток экстрагировали водой и промывали избытком метиленхлорида, получая целевые соединения в виде не совсем белого твердого вещества.
Соединение 1: трет-Бутил 2-(2-формил-1Н-имидазол-1-ил)ацетат

К раствору 2-имидазолкарбоксальдегида (1,00 г, 10,4 ммоль) в ДМФА (1 мл) добавляли 1 экв. трет-бутилбромацетата, карбоната калия и каталитическое количество иодида калия. Реакционную смесь нагревали до 110°С в течение 18 часов, после чего упаривали досуха и очищали остаток на приборе Biotage SP4 в градиенте 5-50% метанола в ДХМ, получая целевое соединение (850 мг, 4,03 ммоль, 39% выход).1Н ЯМР (400 МГц, ДМСО-d6) δ 7,6 (с, Н), 7,23 (с, Н), 5,15 (с, 2Н), 1,40 (с, 9Н).
Соединение 2: 2,2'-(2,2'-(5-амино-5-карбоксипентилазандиил)бис(метилен) бис(1Н-имидазол-2,1-диил))диуксусная кислота:

К раствору L-Fmoc-лизин-ОН НС1 (200 мг, 0,494 ммоль) в ДХЭ (20 мл) добавляли трет-бутил 2-(2-формил-1Н-имидазол-1-ил)ацетат (219 мг, 1,04 ммоль). Реакционную смесь нагревали до 50°С в течение 1 ч, затем добавляли триацетоксиборгидрид натрия (219 мг, 1,04 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, после чего упаривали досуха и очищали в виде Fmoc-защищенного продукта на приборе Biotage SP-4 в градиенте 5-50% метанола в ДХМ (155 мг, 0,205 ммоль, 42% выход).1Н ЯМР (400 МГц, ДМСО-d6) δ 7,67 (д, 2Н), 7,35 (м, 4Н), 7,30 (м, 2Н), 7,05 (с, Н), 6,7 (с, Н), 4,70 (с, 4Н), 4,2 (м, 4Н), 3,4 (д, 2Н), 2,4 (м, 2Н), 1,8 (с, 2Н), 1,39 (с, 18Н). 1,2 (м, 2Н). ESMS m/z. 758 (М+Н)+. С очищенного соединения снимали защиту обработкой смесью пиперидин/ДМФА 1:1 (1 мл), и реакционную смесь перемешивали при комнатной температуре 18 часов. После упаривания водная экстракция остатка из метиленхлорида дала целевой продукт (25 мг, 0,047 ммоль, 25% выход) в виде не совсем белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 7,0 (с, 2Н), 6,65 (с, Н), 4,70 (с, 4Н), 4,2 (м, 4Н), 3,2 (д, 2Н), 2,4 (м, 2Н), 1,8 (с, 2Н), 1,39 (с, 18Н). 1,15 (м, 2Н). ESMS т/г. 535 (М+Н)+.
Соединение 3: 1-(2-этоксиэтил)-1Н-имидазол-2-карбальдегид
К раствору имидазол-2- карбоксальдегида (2,00 г, 21 ммоль) в ДМФА (1 мл) добавляли 1,1 экв. 1-бром-2-этоксиэтана (3,51 г, 22 ммоль), карбонат калия и каталитическое количество иодида калия. Реакционную смесь нагревали до 110°С в течение 18 часов, после чего упаривали досуха и очищали остаток на приборе Biotage SP4 в градиенте 5-50% метанола в ДХМ, получая целевое соединение (580 мг, 3,56 ммоль, 17% выход). 'Н ЯМР (400 МГц, ДМСО-d6) δ 9,63 (с, Н), 7,6 (с, Н), 7,21 (с, Н). 4,45 (дд, 2Н), 3,62 (дд, 2Н),3.38(м, 2Н),1,05(т, 3Н).
Соединение 4: 2-амино-6-(бис((1-(2-этоксиэтил)-1Н-имидазол-2-ил)метил)амино)гексановая кислота

К раствору L-Fmoc-лизин-ОН НС1 (200 мг, 0,494 ммоль) в ДХЭ (20 мл) добавляли 1-(2-этоксиэтил)-1Н-имидазол-2-карбальдегид (169 мг, 1,04 ммоль). Реакционную смесь нагревали до 50°С в течение 1ч, после чего добавляли триацетоксиборгидрид натрия (219 мг, 1,04 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, после чего упаривали досуха и очищали в виде Fmoc-защищенного продукта на приборе Biotage SP-4 в градиенте 5-50% метанола в ДХМ (141 мг, 0,210 ммоль, 44% выход).1Н ЯМР (400 МГц, ДМСО-d6) δ 7,67 (д, 2Н), 7,35 (м, 4Н), 7,30 (м, 2Н), 7,05 (с, Н), 6,75 (с, Н), 3,95 (м, 4Н), 3,58 (д, 4Н), 3,55 (с, 4Н), 3,3 (с, 4Н), 2,30 (м, 2Н), 2,15 (м, 2Н), 1,50 (м, 2Н). 1,15 (с, 2Н), 1,05 (т, 6Н). ESMS m/z: 674 (M+H)+. С очищенного соединения снимали защиту обработкой смесью пиперидин/ДМФА 1:1 (1 мл), и реакционную смесь перемешивали при комнатной температуре 18 часов. После упаривания путем водной экстракции остатка от упаривания из метиленхлоридного раствора получали целевой продукт (31 мг, 0,069 ммоль, 91% выход) в виде не совсем белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 8,35 (с, Н), 7,98 (с, Н), 7,05 (с, Н), 6,75 (с, Н), 3,95 (м, 4Н), 3,58 (д, 4Н), 3,55 (с, 4Н), 3,3 (с, 4Н), 2,30 (м, 2Н), 2,15 (м, 2Н), 1,50 (м, 2Н). 1,15 (с, 2Н), 1,05 (т, 6Н). ESMS m/z: 451 (М+Н)+.
Соединение 5: 1-(2,2-диметоксиэтил)-1Н-имидазол-2-карбальдегид

К раствору имидазол-2-карбоксальдегида (0,41 г, 4,27 ммоль) в ДМФА (1 мл) добавляли 1,1 экв. 2-бром-1,1-диметоксиэтана (0,79 г, 4,69 ммоль), карбонат калия и каталитическое количество иодида калия. Реакционную смесь нагревали до 110°С в течение 18 часов, после чего упаривали досуха и очищали остаток на приборе Biotage SP4 в градиенте 5-50% метанола в ДХМ, получая целевое соединение (248 мг, 1,35 ммоль, 32% выход).1Н ЯМР (400 МГц, ДМСО-d6) δ 9,9 (с. Н), 7,85 (с, Н), 7,55 (с, Н), 5,82 (м, Н), 4,75 (д, 2Н), 3,45 (с, 6Н).
Соединение 6: 2-амино-6-(бис((1- (2,2-диметоксиэтил)-1Н-имидазол-2-ил)метил)амино)гексановая кислота

К раствору L-Fmoc-лизин-ОН НС1 (100 мг, 0,250 ммоль) в ДХЭ (20 мл) добавляли 1-(2,2-диметоксиэтил)-1Н-имидазол-2-карбальдегид (95 мг, 0,52 ммоль). Реакционную смесь нагревали до 50°С в течение 1 ч, после чего добавляли триацетоксиборгидрид натрия (110 мг, 0,52 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, после чего упаривали досуха и очищали в виде Fmoc-защищенного продукта на приборе Biotage SP-4 в градиенте 5-50% метанола в ДХМ (93 мг, 0,132 ммоль, 54% выход). 'Н ЯМР (400 МГц, ДМСО-d6,) δ 7,90 (д, 2Н), 7,72 (д, 2Н), 7.41 (м, 2Н), 7,30 (м, 2Н), 7,05 (с, Н), 6,75 (с, Н), 4,45 (м, ЗН), 4,2 (м, 4Н), 3,95 (д, 2Н), 3,80 (м, Н), 3,55 (с, 2Н), 3,2 (с, 6Н), 2,3 (м, 2Н), 1,60 (м, Н), 1,35 (м, Н) 1,15 (м, 2Н). ESMS m/z:
705 (М+Н)"1'. С очищенного соединения снимали защиту обработкой смесью пиперидин/ДМФА 1:1 (1 мл), и реакционную смесь перемешивали при комнатной температуре 18 часов. После упаривания путем водной экстракции остатка от упаривания из метиленхлоридного раствора получали целевой продукт (44 мг, 0,093 ммоль, 76% выход) в виде не совсем белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 7,98 (с, Н), 7,05 (с, Н), 6,85 (с, Н), 4,45 (с, 2Н), 3,95 (м, 4Н), 3,55 (с, 2Н), 3,2 (с, 6Н), 2,85 (м, 2Н), 2,15 (м, 2Н), 1,40 (м, 2Н). 1,15 (м, 2Н). ESMS m/z: 483 (М+Н)+.
Соединение 7: 2,2'-(5-амино-5-карбоксипентилазандиил)диуксусная кислота

К раствору L-Fmoc-лизин-ОН НС1 (200 мг, 0,494 ммоль) в ДХЭ (20 мл) добавляли трет-бутил 2-оксоацетат (134 мг, 1,04 ммоль). Реакционную смесь нагревали до 50°С в течение 1 ч, после чего добавляли триацетоксиборгидрид натрия (219 мг, 1,04 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов, после чего упаривали досуха и очищали в виде Fmoc-защищенного продукта на приборе Biotage SP-4 в градиенте 5-50% метанола в ДХМ (100 мг, 0,168 ммоль, 34% выход).1Н ЯМР (400 МГц, ДМСО-d6) δ 7,67 (д, 2Н), 7,35 (м, 4Н), 7,30 (м, 2Н), 4,70 (м, 2Н), 4,55 (м, 2Н), 3,3 (д. 2Н), 2,4 (м, 2Н), 1,8 (с, 2Н), 1,45 (м, 2Н). ESMS m/z: 484 (М+Н)+ С очищенного соединения снимали защиту обработкой смесью пиперидин/ДМФА 1:1 (1 мл), и реакционную смесь перемешивали при комнатной температуре 18 часов. После упаривания путем водной экстракции остатка от упаривания из метиленхлоридного раствора получали целевой продукт (3 мг, 0,11 ммоль, 55% выход) в виде не совсем белого твердого вещества. 'Н ЯМР (400 МГц, ДМСО-d6) δ 7,9 (с, 2Н), 3,5 (м, Н), 3,3 (д, 2Н), 2,4 (м, 2Н), 1,8 (с, 2Н), 1,45 (м, 2Н). 1,15 (м, 2Н). ESMS m/z: 263 (М+Н)+.
Соединение 8: (S)-1 -(9Н-флуорен-9-ил)-14,14-диметил-3,12-диоксо-10-(пиридин-2-илметил)-2,13-диокса-4,10-диазапентадекан-5-карбоновая кислота (РАМА-К)

Суспензию Fmoc-Lys-OH-HCl (4,859 г, 12 ммоль) и 2-пиридинкарбоксальдегида (1,285 г, 12 ммоль) в ДХЭ (100 мл) кипятили 30 мин в атмосфере азота. Реакционную смесь охлаждали до 0°С и последовательно добавляли NaBH(OAc)3 (6,36 г, 30 ммоль) и неочищенный трет-бутилглиоксалат (2,34 г, 18 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и разлагали водой. Реакционную смесь экстрагировали дихлорметаном. Органический слой сушили и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, получая ((S)-1 -(9Н-флуорен-9-ил)-14,14-диметил-3,12-диоксо-10-(пиридин-2-илметил)-2,13-диокса-4,10-диазапентадекан-5-карбоновую кислоту (1,924 г, 28%).1Н ЯМР (400 МГц, CDCl3) 8,89 (д, J=4,4 Гц, 1 Н), 8,06 (д, J=8,0 Гц, 1 Н), 8,02 (д, J=7,6 Гц, 2 Н), 7,88 (т, J=5,8 Гц, 2 Н), 7,81 (д, J=7,6 Гц, 1 Н), 7,66 (т, J=7,4 Гц, 2 Н), 7,60-7,53 (м, 4 Н), 6,03 (д, J=7,2 Гц, 1 Н), 4,67-4,22 (м, 8Н), 3,64-3,53 (м, 2Н), 3,12 (т, J=6,8 Гц, 2Н), 2,19-2,08 (м, 2Н), 1,92-1,79 (м, 2Н), 1,73 (с, 9Н); МС (ESI), 564 (М+Н)+.
Соединение 9: (S)-10-(2-трет-бутокси-2-оксоэтил)-1 -(9Н-флуорен-9-ил)-14,14-диметил-3,12-диоксо-2,13-диокса-4, Ю-диазапентадекан-5-карбоновая кислота

Раствор Fmoc-Lys-OH (1,47 г, 4,0 ммоль) и неочищенного трет-бутилглиоксалата (3,60 г) в ДХЭ (50 мл) перемешивали при 75°С в течение 30 мин в атмосфере азота. Реакционную смесь охлаждали до 0°С и добавляли NaBH(OAc)3 (2,12 г, 10 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч и разлагали водой. Реакционную смесь экстрагировали дихлорметаном, органический слой сушили и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, получая (S)-10-(2-трет-бутокси-2-оксоэтил)-1 -(9Н-флуорен-9-ил)-14,14-диметил-3,12-диоксо-2,13-диокса-4,10-диазапентадекан-5-карбоновую кислоту (1,70 г, 71%).1Н ЯМР (400 МГц, CDCl3) 7,76 (д, J=7,2 Гц, 2Н), 7,60 (д, J=7,2 Гц, 2Н), 7,40 (т, J=7,2 Гц, 2Н), 7,30 (т, J=7,2 Гц, 2Н), 6,63 (д, J=7,6 Гц, 1 Н), 4,40-4,34 (м, 3Н), 4,22 (т, J=7,2 Гц, 1Н), 3,49 (с, 4Н), 2,83-2,64 (м, 4Н), 1,96-1,77 (м, 4Н), 1,40 (с, 18Н); МС (ESI), 564 (M+H)+.
Соединение 10: (S)-1 -(9Н-флуорен-9-ил)-14,14-диметил-3,12-диоксо-10-(тиазол-2-илметил)-2,13-диокса-4,10-диазапентадекан-5-карбоновая кислота (МТМА-К)
Суспензию Fmoc-Lys-OH-HCl (6,07 г, 15 ммоль) и тиазол-2-карбальдегида (1,697 г, 15 ммоль) в ДХЭ (100 мл) кипятили 30 мин в атмосфере азота. Реакционную смесь охлаждали до 0°С и последовательно добавляли NaBH(ОАс)3 (7,95 г, 37,5 ммоль) и неочищенный трет-бутилглиоксалат (3,53 г). Реакционную смесь перемешивали при комнатной температуре в течение ночи и разлагали водой. Реакционную смесь экстрагировали дихлорметаном. Органический слой сушили и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, получая (S)-1-(9Н-флуорен-9-ил)- 14,14-диметил-3,12-диоксо-10-(тиазол-2-илметил)-2,13-диокса-4,10-диазапентадекан-5-карбоновую кислоту (1,85 г, 21%). МС (ESI), 580 (М+Н)+.
Соединение 11; (S)-2-амино-6-((2- трет-бутокси-2-оксоэтил)(тиазол-2-илметил)амино)гексановая кислота

Пиперидин (0,20 мл) добавляли к раствору (8)-1-(9Н-флуорен-9-ил)-14,14-диметил-3,12-диоксо-10-(тиазол-2-илметил)-2,13-диокса-4,10-диазапентадекан-5-карбоновой кислоты (72,5 мг, 0,125 ммоль) в ДМФА (1,0 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель упаривали при пониженном давлении, получая остаток, который очищали флэш-хроматографией на силикагеле, получая (8)-2-амино-6-((2-трет-бутокси-2-оксоэтил)(тиазол-2-илметил)амино)гексановую кислоту (25 мг, 35%). 'Н ЯМР (400 МГц, CD3OD) 7,70 (д, J=3,6 Гц, 1Н), 7,53 (д, J=3,2 Гц, 1 Н), 4,15 (с, 2Н), 3,52 (дд, J=7,2, 5,2 Гц, 1Н), 3,38 (с, 2Н), 2,73 (т, J=7,2 Гц, 2Н), 1,91-1,76 (м, 2Н), 1,60-1,44 (м, 13Н); МС (ESI), 358 (M+H)+.
Соединение 12: (S)-2-(((9Н-флуорен-9-ил)метокси)карбониламино)-б-(бис((1-метил-1 Н-имидазол-2-ил)метил)амино)гексановая кислота

Раствор Fmoc-Lys-OH-HCl (1,822 г, 4,5 ммоль) и 1 -метил-1Н-имидазол-2-карбальдегида (1,10 г, 10 ммоль) в ДХЭ (50 мл) перемешивали при 75°С в течение 30 мин в атмосфере азота. Реакционную смесь охлаждали до 0°С и добавляли NaBH(ОАс)3 (3,165 г, 15 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и разлагали водой. Реакционную смесь экстрагировали дихлорметаном, органический слой сушили и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, получая (S)-2-(((9Н-флуорен-9-ил)метокси)карбониламино)-6-(бис(( 1 -метил-1 Н-имидазол-2-ил)метил)амино)гексановую кислоту (2,30 г, 92%). МС (ESI), 557 (М+Н)+.
Соединение 13: (S)-2-амино-6- (бис((1-метил-1Н-имидазол-2-ил)метил)-амино)гексановая кислота

Пиперидин (0,80 мл) добавляли к раствору (8)-2-(((9Н-флуорен-9-ил)метокси)карбониламино)-6-(бис(( 1 -метил-1 Н-имидазол-2-ил)метил)амино)гексановой кислоты (556 мг, 1,00 ммоль) в ДМФА (4,0 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель упаривали при пониженном давлении, получая остаток, который очищали на приборе Amberchrom, получая (S)-2-амино-6-(бис((1-метил-1Н-имидазол-2-ил)метил)амино)гексановую кислоту (330 мг, 99%).1Н ЯМР (400 МГц, ДМСО-d6) 7,94 (с, 1 Н), 7,04 (д, J=3=1,2 Гц, 2Н), 6,74 (д, J=1,2 Гц, 2Н), 3,54 (с, 4Н), 3,98 (ушир.с, 1Н), 2,88 (с, 3Н), 2,72 (с, 3Н), 2,35 (т, J=6,8 Гц, 2Н), 1,60-1,54 (м, 1Н), 1,43-1,29 (м, 3Н), 1,16-1,11 (м, 2Н); МС (ESI), 335 (М+Н)+.
Соединение 14: (S)-1 -(9Н-флуорен-9-ил)-14,14-диметил-10-(( 1 -метил-1 Н-имидазол-2-ил)метил)-3,12-диоксо-2,13-диокса-4,10-диазапентадекан-5-карбоновая кислота

Указанное в заголовке соединение получали по методике, аналогичной описанной для получения Соединения 1, за исключением того, что 1-метил-1H-имидазол-2-карбальдегид применяли вместо 2-пиридинкарбоксальдегида.1Н ЯМР (400 МГц, CDCl3) 7,88 (д. J=7,2 Гц, 2 Н), 7,71 (дд,J=7,2, 2,4 Гц, 2 Н), 7,55 (д, J= 8,0 Гц, 1 Н), 7,40 (т, J=7,6 Гц, 2 Н), 7,31 (т, J=7,6 Гц, 4 Н), 7,01 (с, 1Н), 6,71 (с, 1Н), 4,27-4,18 (м, 3Н), 3,88-3,83 (м, 1Н), 3,72 (с, 2Н), 3,14 (с, 2Н), 1,62-1,50 (м, 2Н), 1,38 (с, 9Н), 1,33-1,21 (м, 4Н); МС (ESI), 577 (М+Н)+.
Соединение 15: (S)-2-амино-6-((2-трет-бутокси-2-оксоэтил)((1-метил-1Н-имидазол-2-ил)метил)амино)гексановая кислота

Пиперидин (0,40 мл) добавляли к раствору (S)-1-(9Н-флуорен-9-ил)-14,14-диметил-10-((1-метил-1 Н-имидазол-2-ил)метил)-3,12-диоксо-2,13-диокса-4,10-диазапентадекан-5-карбоновой кислоты (190 мг, 0,33 ммоль) в ДМФА (2,0 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель упаривали при пониженном давлении, получая остаток, который очищали на приборе Amberchrom, получая (S)-2-амино-6-((2-трет-бутокси-2-оксоэтил)((1-метил-1 Н-имидазол-2-ил)метил)амино)гексановую кислоту (115 мг, 100%).1Н ЯМР (400 МГц, ДМСО) 7,27 (ушир.с, 1Н), 7,04 (с, 1Н), 6,72 (с, 1Н), 3,73 (с, 2Н), 3,64 (с, 3Н), 3,15 (с, 2Н), 3,04 (дд, J=6,8, 5,2 Гц, 1Н), 2,47 (т, J=7,2 Гц, 2Н), 1,65-1,46 (м, 2Н), 1,39 (с, 9Н), 1,30-1,21 (м, 4Н); МС (ESI), 355 (М+Н)+.
Соединение 16 (защищенное): 2,2'-(2,2'-(4-сульфамоилфенетилазандиил)-бис(метилен) бис(1Н-имидазол-2,1-диил))диуксусная кислота

Раствор 4-(2-аминоэтил)бензолсульфонамида (110 мг, 0,55 ммоль), АсОН (0,10 мл) и трет-бутил 2-(2-формил-1Н-имидазол-1-ил)ацетата (250 мг, 1,19 ммоль) в ДХЭ (20 мл) перемешивали при 80°С в течение 30 мин в атмосфере азота. Реакционную смесь охлаждали до 0°С и добавляли NaBH(OAc)3 (3,165 г, 15 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и разлагали водой. Реакционную смесь экстрагировали дихлорметаном. Органический слой сушили и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, получая трет-бутил 2,2'-(2,2'-(4-сульфамоилфенетилазандиил)бис(метилен) бис(1Н-имидазол-2,1-диил))диацетат (132 мг, 41%).1Н ЯМР (400 МГц, CD3OD) 7,75 (д, J=8,4 Гц, 2 Н), 7,18 (д, J=8,4 Гц, 2Н), 7,07 (с, 2Н), 6,93 (с, 2Н), 4,58 (с, 4Н), 3,68 (с, 4Н), 2,84-2,74 (м, 4Н), 1,44 (с, 18Н); МС (ESI), 589,4 (М+Н)+.
Соединение 17 (защищенное, до образования комплекса с металлом): 2-(2-(((карбоксиметил)(4-сульфамоилфенетил)амино)метил)-1H-имидазол-1-ил)уксусная кислота

Раствор 4-(2-аминоэтил)бензолсульфонамида (0,70 г, 3,5 ммоль), АсОН (0,20 мл) и трет-бутил 2-(2-формил-1Н-имидазол-1-ил)ацетата (0,735 г, 3,5 ммоль) в ДХЭ (20 мл) нагревали до 80°С в течение 30 мин в атмосфере азота. Реакционную смесь охлаждали до 0°С и последовательно добавляли NaBH(OAc)3 (2,25 г, 10,5 ммоль) и неочищенный трет-бутилглиоксалат (1,80 г)1. Реакционную смесь перемешивали при комнатной температуре в течение ночи и разлагали водой. Реакционную смесь экстрагировали дихлорметаном. Органический слой сушили и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, получая трет-бутил 2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенетил)амино)ацетат (0,63 г, 35%).1Н ЯМР (400 МГц, ДМСО-d6) 7,67 (д, J=8,4 Гц, 2Н), 7,25 (с, 2Н). 7,23 (д, J=8,4 Гц, 2Н), 7,04 (д, J=1,2 Гц, 1 Н), 6,76 (д, J=1,2 Гц, 1Н), 4,82 (с, 2Н), 3,74 (с, 2Н), 3,24 (с, 2Н). 2,69-2,66 (м, 4Н), 1,41 (с, 9 Н), 1,40 (с, 9Н); МС (ESI), 509 (М+Н)+.
Как описано выше и как очевидно из данного выше описания защищенных примеров 16 и 17, соединения, приведенные ниже в Таблице 1, могут выделяться или не выделяться. Скорее, кислотная или другие группы могут быть защищены.
Соединение 24: 4-(2-(бис(изохинолин-1-илметил)амино)этил) бензолсульфонамид:

Раствор 4-(2- аминоэтил)бензолсульфонамида (1,0 г, 5,0 ммоль), АсОН (1,0 мл) и изохинолин-1-карбальдегида (2,09 г, 13,3 ммоль) в ДХЭ (50 мл) перемешивали при 75 °С в течение 30 мин в атмосфере азота. Реакционную смесь охлаждали до 0°С и добавляли NaBH(OAc)3 (3,165 г, 15 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и разлагали водой. Реакционную смесь экстрагировали дихлорметаном. Органический слой сушили и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, получая 4-(2-(бис(изохинолин-1 -илметил)амино)этил)бензолсульфонамид (1,86 г, 77%).1H ЯМР (400 МГц, ДМСО-d6) 8,24 (д, J=8,8 Гц, 2Н), 7,96 (д, J=8,4 Гц, 2Н), 7,91 (д, J=8,0 Гц, 2Н), 7,72 (т. J=7,8 Гц, 2Н), 7,65 (д, J=8,4 Гц, 2Н), 7,55 (т, J=7,6 Гц, 2Н), 7,50 (д. J=8,4 Гц, 2Н), 7,30 (д, J=6,0 Гц, 2Н), 7,29 (с, 2Н), 4,01 (с, 4Н), 2,94 (т, J=7,0 Гц, 2Н), 2,78 (т, J=7,0 Гц, 2Н); МС (ESI), 483,3 (М+Н)+.
Приведенные далее примеры были получены с помощью описанных выше методов либо в выделенном виде, либо in situ, как описано выше, с учетом защищенных групп:





Соединение 214: [Re(СО)3][(S)-6-(бис((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)амино)-2-(3-((S)-1-карбокси-4-оксо-4-(4-сульфамоилфенетиламино)бутил)уреидо)гексановая кислота] (214-Re)

Стадия 1. (98,138)-15-бензил 13,9-ди-трет-бутил 3,11-диоксо-1-фенил-2-окса-4,10,12-триазапентадекан-9,13,15 -трикарбоксилат

К раствору L-Glu(OBn)-OtBu гидрохлорида (3,13 мг, 9,49 ммоль) и трифосгена (923 мг, 3,13 ммоль) в ДХЭ (70 мл), охлажденному до -78°С, добавляли триэтиламин (2,80 мл) в атмосфере азота. После перемешивания при -78°С в течение 2 ч, добавляли раствор L-Lys(Z)-CYBu (3,88 г, 10,40 ммоль) и ТЭА (1,5 мл) в ДХЭ (10 мл). Смесь оставляли нагреваться до комнатной температуры в течение 1 часа и перемешивали при комнатной температуре в течение ночи. Реакцию гасили добавлением 1 н. раствора НС1 и экстрагировали дихлорметаном. Органический слой сушили и упаривали при пониженном давлении, и остаток очищали на приборе Biotage SP4, получая (98,138)-15-бензил 13,9-ди-трет-бутил 3,11 -диоксо-1 -фенил-2-окса-4,10,12-триазапентадекан-9,13,15-трикарбоксилат в виде бесцветного масла (4,71 г, 76%).1Н ЯМР (400 МГц, CDCl) δ 7,34-7,29 (м, 10Н), 5,13-5,04 (м, 6Н), 4,97 (ушир.с, 1Н), 4,38-4,28 (м, 2Н), 3,18-3,14 (м, 2Н), 2,50-2,35 (м, 2Н), 2,19-2,10 (м, 1Н), 1,94-1,85 (м, 1Н), 1,79-1,72 (м, 1Н), 1,58-1,33 (м, 21Н).
Стадия 2. (S)-4-(3-((S)-6-амино-1-трет-бутокси-1-оксогексан-2-ил)уреидо)-5-трет-бутокси-5-оксопентановая кислота

Суспензию (95,13S)-15-бензил 13,9-ди -трет-бутил 3,11-диоксо-1-фенил-2-окса-4,10,12-триазапентадекан-9,13,15-трикарбоксилата (4,30 г, 6,64 ммоль), 10% Pd/C (1,0 г) и формиата аммония (4,0 г) в EtOH (70 мл) под пустым шариком перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали через слой целита и промывали EtOAc. Растворитель упаривали, получая (S)-4-(3-((S)-6-амино-1-трет-бутокси-1-оксогексан-2-ил)уреидо)-5-тирет-бутокси-5-оксопентановую кислоту (4,07 г, 70%), которую использовали далее без очистки. ESMS m/z: 432,3 (М/2+Н)+.
Стадия 3. (S)-4-(3-((S)-6-(бис((1-(2-трет-бутокси-2-оксоэтил)-1H-имидазол-2-ил)метил)амино)-1-трет-бутокси-1-оксогексан-2-ил)уреидо)-5-отретэт-бутокси-5-оксопентановая кислота

Раствор (S)-4-(3-((S)-6-амино-1-трет-бутокси-1-оксогексан-2-ил)уреидо)-5-трет-бутокси-5-оксопентановой кислоты (432 мг, 70% чистота, 0,70 ммоль), АсОН (0,10 мл) и трет-бутил 2-(2-формил-1Н-имидазол-1-ил)ацетата (470 мг, 2,0 ммоль) в ДХЭ (20 мл) перемешивали при 75°С в течение 30 мин в атмосфере азота. Реакционную смесь охлаждали до 0°С и добавляли NaBH(OAc)3 (0,633 г, 3,0 ммоль). Реакцию оставляли перемешиваться на ночь при комнатной температуре. Реакцию гасили водой и упаривали при пониженном давлении, получая остаток, который очищали на приборе Biotage SP4 в градиенте 5-50% МеОН в ДХМ, получая (S)-4-(3-((S)-6-(бис((1-(2-трет-бутокси-2-оксоэтил)-1H-имидазол-2-ил)метил)амино)-1 -трет-бутокси-1 -оксогексан-2-ил)уреидо)-5-трет-бутокси-5-оксопентановую кислоту (300 мг, 52%) в виде бесцветного масла.1Н ЯМР (400 МГц, CDCl3) δ 6.99 (с, 2Н), 6,84 (с, 2Н), 4,57 (с, 4Н), 4,29-4,19 (м, 2Н), 3,66-3,56 (м, 4Н), 2,98-2,90 (м, 2Н), 2,49-2,37 (м, 4Н), 1,95-1,41 (м, 42Н); ESMS m/z: 410,8 (М/2+Н)+
Стадия 4. (S)-трет-бутил 6-(бис((1- (2-трет-бутокси-2-оксоэтил)-1H-имидазол-2-ил)метил)амино)-2-(3-((5)-1-трет-бутокси-1,5-диоксо-5-(4-сульфамоилфенетиламино)пентан-2-ил)уреидо)гексаноат

Раствор (S)-4-(3-((S)-6-(бис((1-(2-трет-бутокси-2-оксоэтил)-1H-имидазол-2-ил)метил)амино)-1-трет-бутокси-1-оксогексан-2-ил)уреидо)-5-трет-бутокси-5-оксопентановой кислоты (80 мг, 0,098 ммоль), 4-(2-аминоэтил)бензолсульфонамида (30 мг, 0,15 ммоль), 2-(1-Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфата метанаминия (HATU, 50 мг, 0,17 ммоль) и DIPEA (0,50 мл) в ДМФА (5 мл) перемешивали при 40°С в течение ночи. Растворители упаривали при пониженном давлении с получением остатка, который очищали на приборе Biotage SP4 в градиенте 0-20% МеОН в ДХМ, получая (S)-трет-бутил 6-(бис((1-(2-трет-бутокси-2-оксоэтил)-1H-имидазол-2-ил)метил)амино)-2-(3-((8)-1-трет-бутокси-1,5-диоксо-5-(4-сульфамоилфенетиламино)пентан-2-ил)уреидо)гексаноат (100 мг, 100%). ESMS т/г. 501,9 (М/2+Н)+.
Стадия 5. [Re(СО)3][(S)-6-(бис((1-(карбоксиметил)-7Я-имидазол-2-ил)метил)амино)-2-(3-((8)-1-карбокси-4-оксо-4-(4-сульфамоилфенетиламино)бутил) уреидо)гексановая кислота] (214). Раствор (S)-трет-бугия 6-(бис((1-(2-трет-бутокси-2-оксоэтил)-1H-имидазол-2-ил)метил)амино)-2-(3-((S)-1-трет-бутокси-1,5-диоксо-5-(4-сульфамоилфенетиламино)пентан-2-ил)уреидо)гексаноата (60 мг, 0,060 ммоль) и [NEt4]2[ReBr3(СО)3] (60 мг, 0,077 ммоль) в МеОН (4,0 мл) перемешивали при 80°С в течение ночи в герметично закрытой ампуле для проведения реакций при повышенном давлении. Растворитель упаривали при пониженном давлении с получением остатка. Остаток, получение которого описано выше, растворяли в ДХМ (2,0 мл), добавляли трифторуксусную кислоту (ТФУК) (2,0 мл), и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель удаляли при пониженном давлении, получая остаток, который очищали методом ВЭЖХ, получая [Re(СО)3][ (S)-6-(бис((1-(карбоксиметил)-1H-имидазол-2-ил)метил)амино)-2-(3-((S)-1-карбокси-4-оксо-4-(4- сульфамоилфенетиламино)бутил)уреидо)гексановая кислота] (16 мг, 25% за 2 стадии) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 7,94 (ушир.с, 1Н), 7,71 (д, J= 8,4 Гц, 2Н), 7,35 (д, J=8.4 Гц, 2Н), 7,26 (с, 2Н), 7,17 (с, 2Н), 7,03 (с, 2Н), 6,37-6,33 (м, 2Н), 4,83 (с, 4Н), 4,55 (д, J=16,4 Гц, 2Н), 4,39 (д, J=16,4 Гц, 2Н), 4,14-4,02 (м, 2Н), 3,65-3,61 (м, 2Н), 3,25-3,22 (м, 2Н), 2,74 (т, J=7,0 Гц, 2Н), 2,05-1,30 (м, 10Н); ESMS m/z: 524,8 (M/2+H)+.
Соединения 217-220, 230 и 231 a, b и с были получены с общим выходом 20-40% по методу, изображенному на Схеме 7. На первой стадии, проводимой при 0°С в инертной атмосфере, осуществляли реакцию ди-m-бутилового эфира глутаминовой кислоты с CDI в присутствии основания, получая промежуточное производное Glu-мочевина-имидазол 2. Данное промежуточное соединение активировали с помощью MeOTf в основных условиях, получая метилированный имидазол 3, который в инертной атмосфере легко реагировал с аминами трет-бутиловые сложноэфирные защитные группы удаляли с помощью 20%-ной ТФУК в ДХМ в течение 1-4 часов при комнатной температуре. По окончании снятия защиты реакционные смеси упаривали на роторном испарителе или продували досуха азотом и очищали колоночной хроматографией на силикагеле или перекристаллизовывали. Конечные вещества тестировали in vitro и in vivo.
Схема 7.

Соединение 217: [Re(СО)3{(S)-2-(3-((R)-5-(бис((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)амино)-1-карбоксипентил)уреидо)пентандиовая кислота}]

(S)-2-(3-((R)-5-(бис(( 1 -(карбоксиметил)-1 Н-имидазол-2-ил)метил)амино)-1 -карбоксипентил)уреидо)пентандиовую кислоту получали по той же общей методике, которая изображена на Схеме 7, используя 2-[3-(5-амино-1-карбокси-пентил)-уреидо]-пентандиовой кислоты ди-т-бутиловый эфир. Рениевый комплекс со сложным эфиром получали по методике, описанной в общей экспериментальной части, касающейся рения. С полученного соединения снимали защиту по описанным ранее методикам с применением ТФУК, получая целевой продукт (4,0 мг, 29%) в виде не совсем белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 7,2 (с, 2Н), 7,0 (с, 2Н), 6,3 (с, 2Н), 4,85 (с, 4Н), 4,55 (д, 2Н), 4,4 (д, 2Н), 4,10 (с, 2Н), 3,5 (с, 2Н), 2,2 (м, 2Н), 1,7 (м, 6Н), 1,25 (м, 2Н). ESMS m/z: 866 (М+Н)+.
Соединение 218: [Re(СО)3{(14R,18S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)- 1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновая кислота}]

(14R, 18S)-1 -(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-(( 1 -(карбоксиметил)-1 Н-имидазол-2-ил)метил)-8,1 б-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновую кислоту получали по той же общей методике, которая изображена на Схеме 7, используя ранее полученный и защищенный 2-[3-(5-амино-1-карбокси-пентил)-уреидо]-пентандиовой кислоты ди-т-бутиловый эфир. Рениевый комплекс со сложным эфиром получали по методике, описанной в общей экспериментальной части, касающейся рения. С полученного соединения снимали защиту по описанным ранее методикам с применением ТФУК, получая целевой продукт (8,0 мг, 13%) в виде не совсем белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 7,9 (с, Н), 7,2 (с, 2Н), 7,0 (2, 2Н), 6,3 (с, 2Н), 4,85 (с, 4Н), 4,55 (д, 2Н), 4,4 (д, 2Н), 4,1 (м, 2Н), 3,5 (с, 2Н), 2,9 (с, 4Н), 2,2 (м, 2Н), 2,05 (м, 2Н), 1,85 (м, 2Н), 1,6 (м, 6Н), 1,3 (м, 4Н). ESMS m/z: 979 (М+Н)+.
Соединение 219: [Re(СО)3{(19R,23S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоновая кислота} ]

(19R,23S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1 Н-имидазол-2-ил)метил)-13,21 -диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоновую кислоту получали по той же общей методике, которая изображена на Схеме 7, используя ранее полученный и защищенный 2-[3-(5-амино-1-карбокси-пентил)-уреидо]-пентандиовой кислоты ди-т-бутиловый эфир. Рениевый комплекс со сложным эфиром получали по методике, описанной в общей экспериментальной части, касающейся рения. С полученного соединения снимали защиту по описанным ранее методикам с применением ТФУК, получая целевой продукт (7,0 мг, 24%) в виде не совсем белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 7,8 (с, Н), 7,2 (с, 2Н), 7,0 (2, 2Н), 6,3 (с, 2Н), 4,8 (с, 4Н), 4,55 (д, 2Н), 4,4 (д, 2Н), 4,1 (м, 2Н), 3,5 (м, 2Н), 2,9 (м, 2Н), 2,2 (м, 2Н), 2,05 (м, 4Н), 1,9 (м, 4Н), 1,6 (м, 4Н), 1,4 (м, 2Н), 1,3 (м, 16Н). ESMS m/z: 525 (M/2).
Соединение 230: [Re(СО)3{(19R,23S)-13,21-диоксо-2-(пиридин-2-илметил)-2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоновая кислота} ]

Соединение C11-PAMA, (19R, 23S)-13,21 -диоксо-2-(пиридин-2-илметил)-2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоновую кислоту, получали по той же общей методике, которая изображена на Схеме 7, используя ранее полученный и защищенный 2-[3-(5-амино-1-карбокси-пентил)-уреидо]-пентандиовой кислоты ди-т-бутиловый эфир. Рениевый комплекс со сложным эфиром получали по методике, описанной в общей экспериментальной части, касающейся рения. С полученного соединения снимали защиту по описанным ранее методикам, получая целевой продукт (3,0 мг, 75%) в виде не совсем белого твердого вещества. ESMS m/z: 922 (М+Н)+.
Соединение 220: [Re(СО)3{(17К,21S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1 Н-имидазол-2-ил)метил)-11,19-диоксо-5,8-диокса-2,12,18,20-тетраазатрикозан-17,21,23-трикарбоновая кислота} ]

(17R, 21S)-1-(1 -(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-11,19-диоксо-5,8-диокса-2,12,18,20-тетраазатрикозан-17,21,23-трикарбоновую кислоту получали по той же общей методике, которая изображена на Схеме 7, используя ранее полученный и защищенный 2-[3-(5-амино-1-карбокси-пентил)-уреидо]-пентандиовой кислоты ди-т-бутиловый эфир. Рениевый комплекс со сложным эфиром получали по методике, описанной в общей экспериментальной части, касающейся рения. С полученного соединения снимали защиту по описанным ранее методикам с применением ТФУК, получая целевой продукт (6,0 мг, 38%) в виде не совсем белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 7,9 (с, Н), 7,2 (с, 2Н), 7,0 (с, 2Н), 6,3 (с, 2Н), 4,85 (с, 4Н), 4,6 (д, 2Н), 4,5 (д, 2Н), 3,80 (м, 12Н), 3,5 (м, 10Н), 2,4 (м, 4Н). ESMS m/z. 738 (М+Н)+.
Соединения 231а, b и с:

Соединение 231а (n=2): Gly-мочевина-Lys-РЕG2-ReDP: [Re(СО)3{(17К,21S)-11,19-диоксо-1-(пиридин-2-ил)-2-(пиридин-2-илметил)-5,8-диокса-2,12,18,20-тетраазатрикозан-17,21,23-трикарбоновая кислота }][Br]. PEG2 дипиридильное соединение, (17R, 21S)-11,19-диоксо-1 -(пиридин-2-ил)-2-(пиридин-2-илметил)-5,8-диокса-2,12,18,20-тетраазатрикозан-17,21,23-трикарбоновую кислоту, получали по той же общей методике, которая описана для Соединения 220, используя ранее полученный и защищенный 2-[3-(5-амино-1-карбокси-пентил)-уреидо]-пентандиовой кислоты ди-т-бутиловый эфир. Рениевый комплекс со сложным эфиром получали по методике, описанной в общей экспериментальной части, касающейся рения. С полученного соединения снимали защиту по описанным ранее методикам, получая целевой продукт (2 мг, 20%) в виде не совсем белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 8,8 (д), 8,00 (дд), 7,55 (д), 7,42 (дд), 6,45 (с), 3,95 (м), 3,4-3.6 (м), 2,45 (м), 1,25 (м), 1,1 (м), 0,8 (м). ESMS т/г. 931 (М+Н)+.
Соединение 231b (n=4): Glu-мочевина-Lys-PEG4-ReDP: [Re(СО)3{(23R,278)-17,25-диоксо-1 -(пиридин-2-ил)-2-(пиридин-2-илметил)-5,8,11,14-тетраокса-2,18,24,26-тетраазанонакозан-23,27,29-трикарбоновая кислота} ][Br]. PEG4 дипиридильное соединение, (23R,27S)-17,25-диоксо-1 -(пиридин-2-ил)-2-(пиридин-2-илметил)-5,8,11,14-тетраокса-2,18,24,26-тетраазанонакозан-23,27,29-трикарбоновую кислоту, получали по той же общей методике, которая описана для Соединения 231а, используя ранее полученный и защищенный 2-[3-(5-амино-1-карбокси-пентил)-уреидо]-пентандиовой кислоты ди-т-бутиловый эфир. Рениевый комплекс со сложным эфиром получали по методике, описанной в общей экспериментальной части, касающейся рения. С полученного соединения снимали защиту по описанным ранее методикам, получая целевой продукт (5,1 мг, 29,6%) в виде белого твердого вещества. ESMS m/z. 1019 (М+Н)+.
Соединение 231с (n=8): Glu-мочевина-Lys-РЕG8-ReDP: [Re(СО)3{(35R,39S)-29,37-диоксо-1-(пиридин-2-ил)-2-(пиридин-2-илметил)-5,8,11,14,17,20,23,26-октаокса-2,30,36,38-тетраазагентетраконтан-35,39,41-трикарбоновая кислота} ][Br]. PEG8 дипиридильное соединение, (35R,39S)-29,37-диоксо-1-(пиридин-2-ил)-2-(пиридин-2-илметил)-5,8,11,14,17,20,23,26-октаокса-2,30,36,38-тетраазагентетраконтан-35,39,41-трикарбоновую кислоту, получали по той же общей методике, которая описана для Соединения 23la, используя ранее полученный и защищенный 2-[3-(5-амино-1-карбокси-пентил)-уреидо]-пентандиовой кислоты ди-т-бутиловый эфир. Рениевый комплекс со сложным эфиром получали по методике, описанной в общей экспериментальной части, касающейся рения. С полученного соединения снимали защиту по описанным ранее методикам, получая целевой продукт (8,0 мг, 30,4%) в виде белого твердого вещества. ESMSm/z: П95(M+H)+.
Соединение 221: [Re(СО)3][(198,238)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-13,21 -диоксо-2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоновая кислота]

Стадия 1. 11 -((2-терет-бутокси-2-оксоэтил)((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)-метил)амино)ундекановая кислота

Суспензию 11-аминоундекановой кислоты (603 мг, 3,0 ммоль), 2-пиридинкарбоксальдегида (630 мг, 3,0 ммоль) и АсОН (0,20 мл) в ДХЭ (20 мл) кипятили 30 мин в атмосфере азота. Реакционную смесь охлаждали до 0°С, и последовательно добавляли NaBH(ОАс)3 (1,908 г, 9,0 ммоль) и неочищенный трет-бутилглиоксалат (1,50 г, 11,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и разлагали водой. Реакционную смесь экстрагировали дихлорметаном. Органический слой сушили и упаривали при пониженном давлении. Полученный остаток очищали на приборе Biotage на колонке с силикагелем, получая 11-((2-трет-бутокси-2-оксоэтил)((1-(2-трети-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)ундекановую кислоту (343 мг, 22%) в виде желтого масла.1Н ЯМР (400 МГц, CDCl3) 7,01 (д, J=1,2 Гц, 0.46 Н), 6,99 (д, J=1,2 Гц, 0,54 Н), 6,88 (д, J=1,2 Гц, 0,54 Н), 6,86 (д, J=1,2 Гц, 0,46 Н), 5.30 (с, 1,08 Н), 5,07 (с, 0,92 Н), 4,67 (с, 2 Н), 4,66 (с, 2 Н), 3,83 (с, 0,92 Н), 3,17 (с, 1,08 Н), 2,41-2,32 (м, 2 Н), 1,66-1,63 (м, 2 Н), 1,47 (с, 9 Н), 1,45 (с, 9 Н), 1,42-1,10 (м, 14 Н); МС (ESI), 510 (М+Н)+.
Стадия 2. (19S,23S)-тетра-трет-бутил2-((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)-метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоксилат

Раствор (S)-ди-трет-бутил 2-(3-((S)-6-амино-1-трет-бутокси-1 -оксогексан-2-ил)уреидо)пентандиоата (85 мг, 0,175 ммоль), 11-((2-трет-бутокси-2-оксоэтил)((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)ундекановой кислоты (89 мг, 0,175 ммоль), EDCI (38 мг, 0,20 ммоль), HOBt (26 мг, 0,20 ммоль) и DIPEA (0,30 мл) в ДХМ (5,0 мл) перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь очищали на приборе Biotage, элюируя 1-10% МеОН в ДХМ, получая (19S,23S)-тетра-трет-бутил, 2-((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)-13,21 -диоксо-2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоксилат (111 мг, 65%) в виде желтого масла. МС (ESI), 490,5 (М/2+Н)+.
Стадия 3. [Re(СО)3][(19S,23S)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-13,21 -диоксо-2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоновая кислота] (221).
Раствор (19S,235)-тетра-трет-бутил 2-((1-(2-трет-бутокси-2-оксоэтил)-1Н- имидазол-2-ил)метил)-13,21 -диоксо- 2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоксилата (18,8 мг, 0,019 ммоль) в ТФУК (1,0 мл)/ДХМ (1,0 мл) перемешивали при комнатной температуре в течение ночи. Растворитель упаривали, получая 19S,23S)-2-((1 -(карбоксиметил)-1 Н-имидазол-2-ил)метил)-13,21 -диоксо-2,14,20,22-тетраазапентакозан-1,19,23,25-тетракарбоновую кислоту в виде бесцветного масла. К раствору описанного выше продукта со снятой защитой в воде (1,0 мл), значение рН которого доводили до 9 добавлением 2 н. раствора NaOH, добавляли Re(СО)3(Н2O)OTf (0,50 мл, 0,10 мл/ммоль). Реакционные смеси перемешивали при комнатной температуре в течение ночи и очищали методом ВЭЖХ, получая указанное в заголовке соединение (4,0 мг, 19%) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) 7,70 (т, J=5,6 Гц, 1Н), 7,33 (с, 1Н), 7,13 (с, 2Н). 6,29 (д, J=8,4 Гц, 1 Н), 6,26 (д, J=8,4 Гц, 1 Н), 4,96 (д, J=4,8 Гц, 2 Н), 4,56 (д, J=16,4 Гц, 1 Н), 4,12 (д, J=16,8 Гц, 1 Н), 4,07-3,90 (м, 2 Н), 3,70 (д, J=17,2 Гц, 1 Н), 3,40 (д, J=17,2 Гц, 1 Н), 2,98-2,94 (м, 4 Н), 2,21 (кв., J=7,73, 2 Н). 1,99 (т, J=7,6 Гц, 2 Н), 1,70-1,22 (м, 24 Н); МС (ESI), 485,2 (М/2+Н)+.
Соединение 222: [Re(СО)3][(7S,14S,18S)-7-амино-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-(( 1 -(карбоксиметил)-1 Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновая кислота]

Стадия 1. (58,128,168)-три-трет-бутил 5-(4-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-1-(9Н-флуорен-9-ил)-3,6,14-триоксо-2-окса-4,7,13,15-тетрааза-октадекан-12,16,18-трикарбоксилат
Раствор (S)-ди-трет-бутил 2-(3-((S)-6-амино-1-трет-бутокси-1 -оксогексан-2-ил)уреидо)пентандиоата (97 мг, 0,20 ммоль), Соединения 2 (151 мг, 0,20 ммоль), EDCI (38 мг, 0,20 ммоль), HOBt (26 мг, 0,20 ммоль) и DIPEA (0,30 мл) в ДХМ (5,0 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь очищали на приборе Biotage, элюируя 1 - 10% МеОН в ДХМ, получая (58,128,168)-три-трет-бутил 5-(4-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-1-(9Н-флуорен-9-ил)-3,6,14-триоксо-2-окса-4,7,13,15-тетраазаоктадекан-12,16,18-трикарбоксилат (85,7 мг, 35%) в виде белого твердого вещества.1Н ЯМР (400 МГц, СDС13) 7,75 (д, J=7,6 Гц, 2 Н), 7,64 (д, J=7,6 Гц, 2 Н), 7,38 (т, J=7,4 Гц, 2 Н), 7,29 (дц, J=7,6, 4,4 Гц, 2 Н), 7,02 (ушир.с, 1 Н), 6,93 (с, 2Н), 6,80 (с, 2Н), 6,08 (д, J=8,0 Гц, 1Н), 5,75 (д, J=8,8 Гц, 1Н), 5,67 (д, J=7,6 Гц, 1Н), 4,58 (с, 2Н), 4,56 (с, 2Н), 4,55-4,52 (м, 1Н), 4,36-4,29 (м, 3 Н), 4,21 (д, J=7,0 Гц, 1Н), 4,13 (т, J=6,8 Гц, 1Н), 3,63 (с, 4 Н), 3,48-3,46 (м, 1Н), 3,05-3,01 (м, 1Н), 2,53 (т, J=7,2 Гц, 2Н), 2,33-2,26 (м, 2Н), 2,07-2,00 (м, 2Н), 1,77-1,26 (м, 55Н); МС (ESI), 614,0 (M/2+H)+.
Стадия 2. (78,148,188)-три-трет-бутил 7-амино-1-(1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-трет-бутокси-2-оксоэтил)-1 Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоксилат.

К раствору (5S,12S,16S)-три-трет- бутил 5-(4-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-1-(9Н-флуорен-9-ил)-3,6,14-триоксо-2-окса-4,7,13,15-тетраазаоктадекан-12,16,18-трикарбоксилата (84 мг, 0,069 ммоль) в ДМФА (0,50 мл) добавляли пиперидин (0,50 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель упаривали при пониженном давлении, получая остаток, который очищали на приборе Biotage, элюируя 5-25% МеОН в ДХМ, получая (7S,14S,18S)-три-трет-бутил 7-амино-1-(1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-трет-бутокси-2-оксоэтил)-1 Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоксилат (59 мг, 86%).1Н ЯМР (400 МГц, CDCl3) 6,96 (д, J=0,8 Гц, 2Н), 6,85 (д, J=0,8 Гц, 2Н), 5,55 (ушир.с, 1Н), 5,43 (ушир.с, 1Н), 4,59 (с, 4Н), 4,37-4,28 (м, 2Н), 3,61 (с, 4Н), 3,35-3,27 (м, 2Н), 3,18-3,12 (м, 1Н), 2,53 (т, J=7,4 Гц, 2Н), 2,34-2,28 (м, 2Н), 2,10-2,00 (м, 2Н), 1,85-1,26 (м, 55Н); МС (ESI), 503,0 (М/2+Н)+.
Стадия 3. [Re(СО)3][(7S,14S,18S)-7-амино-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-8,1 6-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновая кислота]. Раствор (78,148,185)-три-трет-бутил 7-амино-1 -(1 -(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоксилата (42 мг, 0,042 ммоль) и [NEt4]2[Re(CO)3Br3](42 мг, 0,055 ммоль) в МеОН (5 мл) в ампуле для проведения реакций при повышенном давлении перемешивали при 90°С в течение 4 ч. Растворитель упаривали, получая остаток, который напрямую использовали в следующей стадии. Раствор описанного выше продукта в ТФУК (3,0 мл)/ДХМ (3,0 мл) перемешивали при комнатной температуре в течение ночи. Растворитель упаривали с получением неочищенного продукта, который очищали методом ВЭЖХ, получая указанное в заголовке соединение (27,9 мг, 67% за 2 стадии) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) 8,42 (ушир.с, 1 Н), 8,10 (ушир.с, 2 Н), 7,18 (с, 2 Н), 7,04 (с, 2 Н), 6,32 (д, J= 8,4 Гц, 1 Н), 6,29 (д, J= 8,0 Гц, 1 Н), 4,02 (с, 4 Н), 4,56-4,37 (м, 4 Н), 4,08-4,01 (м, 2 Н), 3,68-3,61 (м, 3 Н), 3,11-3,08 (м, 2 Н), 2,23-1,29 (м, 16 Н); МС (ESI), 497,7 (М/2+Н)+
Соединение 223: [Re(СО)3][(19S,23S)-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-(( 1 -(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-13,21 -диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоновая кислота]

Стадия 1. трет-Бутил 2,2'-(2-бромацетилазандиил)диацетат. К раствору трет-бутил 2,2'-азандиилдиацетата (3,00 г, 12,24 ммоль) и 2-бромацетилбромида (1,39 мл, 3,23 г, 16,00 ммоль) в ДХМ (100 мл) добавляли Et3N (2,0 мл) при комнатной температуре. Реакционные смеси перемешивали при комнатной температуре в течение 2 ч. Реакционные смеси разбавляли дихлорметаном (300 мл), промывали водой и сушили над Na2SO4. Растворитель упаривали при пониженном давлении, получая остаток, который очищали на приборе Biotage, элюируя 10-50% гексана в ЕЮАс, получая трет-бутил 2,2'-(2-бромацетилазандиил)диацетат (4,68 г, 100%).1Н ЯМР (400 МГц, CDCl3) 4,09 (с, 2Н), 4,07 (с, 2 Н), 3,86 (с, 2Н), 1,49 (с, 9Н), 1,46 (с, 9Н); МС (ESI), 388, 390 (M+Na)+.
Стадия 2. трет-Бутил 2,2'-(2-(2-формил-1Н-имидазол-1-ил)ацетилазандиил)диацетат.
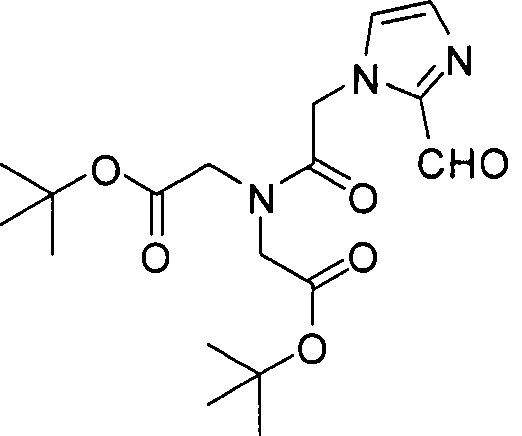
Раствор трет-бутил 2,2'-(2-бромацетилазандиил)диацетата (4,55 г, 12,43 ммоль), 1H-имидазол-2-карбальдегида (1,536 г, 16,0 ммоль), DIPEA (5,0 мл) и KI (0,64 г, 4,0 ммоль) перемешивали при 80°С в течение ночи. После удаления растворителя при пониженном давлении, реакционную смесь разбавляли дихлорметаном, промывали водой и сушили. Растворитель упаривали при пониженном давлении, получая остаток, который очищали на приборе Biotage, элюируя сначала дихлорметаном, потом 3% МеОН в ДХМ, получая трет-бутил 2,2'-(2-(2-формил-1Н-имидазол-1-ил)ацетилазандиил)диацетат (3,96 г, 84%).1Н ЯМР (400 МГц, CDCl3) 9,76 (с, 1Н), 7,31 (с, 1Н), 7,25 (с, 1Н), 5,30 (с, 2Н), 4,14 (с, 2Н), 4,07 (с, 2Н), 1,51 (с, 9Н), 1,43 (с, 9H); MC (ESI), 382 (M+H)+.
Стадия 3. 11-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)ундекановая кислота

Раствор 11-аминоундекановой кислоты (100 мг, 0,50 ммоль), трет-бутил 2,2'-(2-(2-формил-1Н-имидазол-1-ил)ацетилазандиил)диацетата (381 мг, 1,0 ммоль) и АсОН (0,02 мл) в ДХЭ (30 мл) перемешивали при 75°С в течение 30 мин в атмосфере азота. Реакционную смесь охлаждали до 0°С и добавляли NaBH(OAc)3 (0,3165 г, 1,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и разлагали водой. Растворитель упаривали при пониженном давлении, получая остаток, который очищали на приборе Biotage, элюируя 1-10% МеОН в ДХМ, получая 11-(бис((1-(2-(бис(2-тре/м-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)ундекановую кислоту (368 мг, 79%).1Н ЯМР (400 МГц, ДМСО-d6) 6,93 (с, 2Н), 6,76 (с, 2Н), 5,02 (с, 4Н), 4,29 (с, 4Н), 3,93 (с, 4Н), 3,44 (с, 4Н), 2,30 (т, J=7,6 Гц, 2Н), 2,09 (т, J=7,6 Гц, 2Н), 1,43 (с, 18Н), 1,35 (с, 18Н), 1,29-1,00 (м, 16Н); MC (ESI), 466,9 (М/2+Н)+
Стадия 4. (19S,23S)-TpH-трет-бутил 1-(1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1 Н-имидазол-2-ил)-2-((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1 Н-имидазол-2-ил)метил)-13,21 -диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоксилат
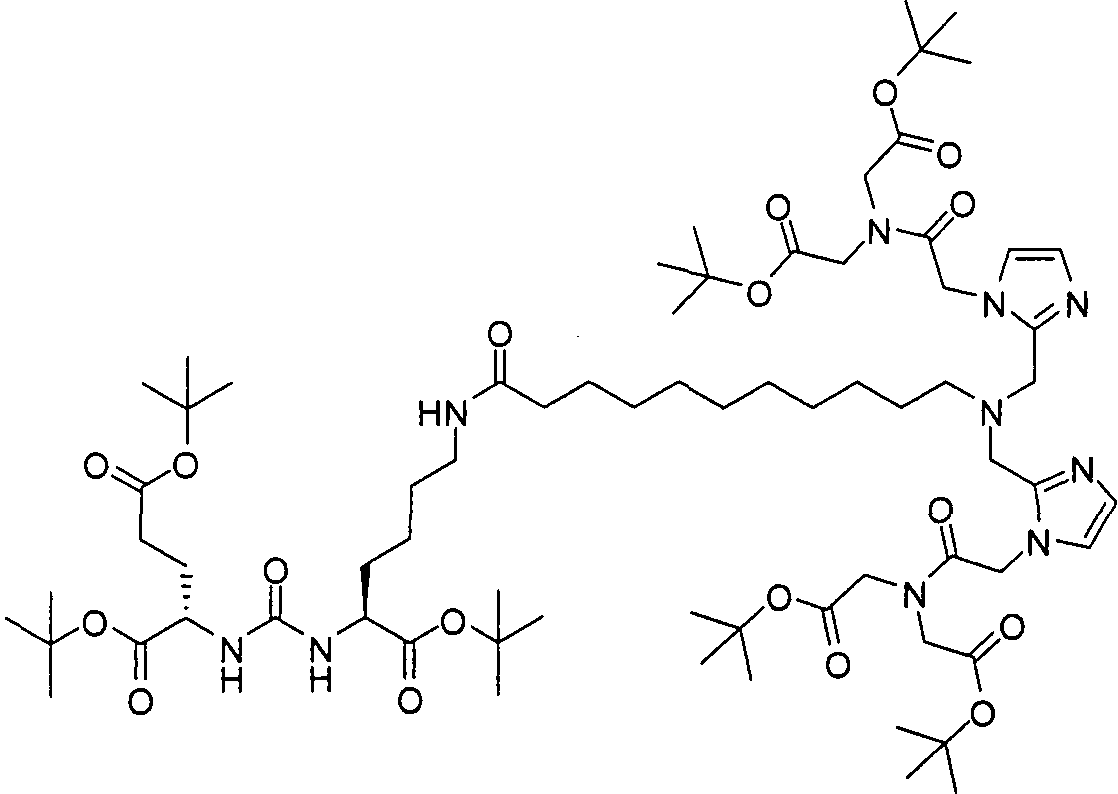
Раствор (S)-ди-трет-бутил 2-(3-((S)-6-амино-1-трет-бутокси-1-оксогексан-2-ил)уреидо)пентандиоата (85 мг, 0,174 ммоль), 11-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)ундекановой кислоты (118 мг, 0,127 ммоль), EDCI (38 мг, 0,20 ммоль), HOBt (26 мг, 0,20 ммоль) и DIPEA (0,30 мл) в ДХМ (5,0 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь очищали на приборе Biotage, элюируя 1-10% МеОН в ДХМ, получая (19S, 23S)-три-трет-бутил 1-(1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-13,21-диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоксилат (38 мг, 21%) в виде бесцветного масла.1Н ЯМР (400 МГц, CDCl) 6,95 (д, J=1,2 Гц, 2Н), 6,83 (д, J=0,80 Гц, 2Н), 5,97 (с, 1Н), 5,28 (д, J=7,6 Гц, 1Н), 5,23 (д, J=8,4 Гц, 1Н), 4,94 (с, 4Н), 4,33-4,25 (м, 2Н), 4,12 (с. 4Н), 4,03 (с, 4Н), 3,63 (с, 4Н), 3,25-3,16 (м, 2Н), 2,53 (т, J=7,4 Гц, 2Н), 2,33-2,24 (м, 2Н), 2,15 (т, J=7,6 Гц, 2Н), 2,08-2,03 (м, 2Н), 2,02-1,20 (м, 85Н); MC (ESI), 701,6 (М/2+Н)+.
Стадия 5. [Re(СО)3] [(19S, 23S)-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1H-имидазол-2-ил)-2-((1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-13,21 -диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоновая кислота] (223). Раствор (198,238)-три-трет-бутил 1-(1-(2-(бис(2-?мре?и-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1 Н-имидазол-2-ил)метил)-13,21 -диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоксилата (28 мг, 0,02 ммоль) и [NEt4]2[Re(CO)3Br3] (30 мг, 0,039 ммоль) в МеОН (5 мл) в ампуле для проведения реакций при повышенном давлении перемешивали при 90°С в течение ночи. Растворитель упаривали, получая остаток, который напрямую использовали в следующей стадии. Раствор описанного выше продукта в ТФУК (3,0 мл)/ДХМ (3,0 мл) перемешивали при комнатной температуре в течение 3 ч. Растворитель упаривали с получением неочищенного продукта, который очищали методом ВЭЖХ, получая указанное в заголовке соединение (17,6 мг, 69% за 2 стадии) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) 7,70 (т, J=4,8 Гц, 1Н), 7,10 (с, 2Н), 7,03 (с, 2Н), 6,29 (д, J=8,4 Гц, 1Н), 6,26 (д, J=8,4 Гц, 1Н), 5,02 (с, 4Н), 4,37-3,97 (м, 14Н), 3,60-3,57 (м, 2Н), 3,01-2,94 (м, 2Н), 2,24-1,22 (м, 28Н); MC (ESI), 640,3 (M/2+H)+
Соединение 224: [Re(СО)3][(7S,14S,18S)-7-амино-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1 Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновая кислота]

Стадия 1. 2-(((9Н-флуорен-9-ил)метокси)карбониламино)-6-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановая кислота.

Суспензию L-Fmoc-лизин-ОН (0,202 г, 0,50 ммоль), трет-бутил 2,2'-(2-(2-формил-1Н-имидазол-1-ил)ацетилазандиил)диацетата (0,381 г, 1,00 ммоль) в ДХЭ (30 мл) нагревали до 80°С в течение 30 мин. Реакционную смесь охлаждали до 0°С и добавляли МаВН(ОАс)3 (0,3165 г, 1,50 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 часов и разлагали водой. Реакционную смесь экстрагировали дихлорметаном. Органический слой сушили и упаривали при пониженном давлении. Полученный остаток очищали на приборе Biotage SP4 в градиенте 5-25% метанола в ДХМ, получая 2-(((9Н-флуорен-9-ил)метокси)карбониламино)-6-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановую
кислоту в виде белого твердого вещества (0,408 г, 74% выход).1Н ЯМР (400 МГц, CDCl3) 7,74 (д, J=7,6 Гц, 2Н), 7,67 (т, J=6,0 Гц, 2 Н), 7,38 (т, J=7,4 Гц, 2Н), 7,29 (д, J=7,6 Гц, 2Н), 6,92 (с, 2Н), 6,29 (с, 2Н), 6,19 (ушир.с, 1 Н), 5,09-5,04 (м, 2Н), 4,81-4,79 (м, 1Н), 4,39-4,30 (м, 4Н), 4,23 (т, J=7,2 Гц, 1 Н), 4,22-3,58 (м, 10Н), 3,48 (с, 2Н), 2,34-2,30 (м, 2Н), 1,67-1,26 (м, 6Н), 1,50 (с, 18Н), 1,42 (с, 18Н). ESMS m/z: 550,5 (M/2+H)+
Стадия 2. (78,148,185)-три-трет-бутил 7-амино-1-(1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1 Н-имидазол-2-ил)-2-((1-(2-(бис(2-трет-бутокси-2- оксоэтил)амино)-2-оксоэтил)-1H-имидазол- 2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоксилат

Раствор (3)-ди-трет-бутил 2-(3-((5)-6-амино-1 -трет-бутокси-1 -оксогексан-2-ил)уреидо)пентандиоата (97 мг, 0,20 ммоль), 2-(((9Н-флуорен-9-ил)метокси)карбониламино)-6-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановой кислоты (132 мг, 0,12 ммоль), EDCI (38 мг, 0,20 ммоль), HOBt (26 мг, 0,20 ммоль) и DIPEA (0,30 мл) в ДХМ (5,0 мл) перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь очищали на приборе Biotage, элюируя 1% МеОН в ДХМ, получая (58,128,1б8)-три-трет-бутил 5-(4-(бис(( 1 -(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-1-(9Н-флуорен-9-ил)-3,б,14-триоксо-2-окса-4,7,13,15-тетраазаоктадекан-12,16,18-трикарбоксилат (содержит примеси) в виде масла.
К раствору описанного выше продукта, (5S,12S,16S)-три-трет-бутил 5-(4-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-1-(9Н-флуорен-9-ил)-3,6,14-триоксо-2-окса-4,7,13,15-тетраазаоктадекан-12,1б,18-трикарбоксилата, в ДМФА (1,0 мл) добавляли пиперидин (0,50 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель упаривали при пониженном давлении, получая остаток, который очищали на приборе Biotage, элюируя от 5% МеОН до 50% МеОН в ДХМ, получая (78,148,188)-три-трет-бутил 7-амино-1 -(1 -(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1 Н-имидазол-2-ил)-2-(( 1 -(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1 Н-имидазол-2-ил)метил)-8,1б-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоксилат (40 мг, 25%) в виде белого твердого вещества.1Н ЯМР (400 МГц,, CDCl3) 6,96 (с, 2Н), 6,83 (д, 2Н), 6,37 (ушир.с, 1Н), 6,33 (ушир.с, 1Н), 5,05 (с, 4Н), 4,87 (ушир.с, 2Н), 4,27-4,24 (м, 2Н), 4,18 (с, 4Н), 4,10 (с, 4Н), 3,88 (д, J=15,2 Гц, 2Н). 3,62 (д, J=15,2 Гц, 2 Н), 3,14-3,12 (м, 1Н), 2,30-1,24 (м, 83Н); MC (ESI), 674,1 (M/2+H)+
Стадия 3. [Re(СО)3][(7S,14S,18S)-7-амино-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1 Н-имидазол-2-ил)-2-((1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1 Н-имидазол-2-ил)метил)-8,1 б-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновая кислота] (224). Раствор (7S,14S,18S)-три-трет-бутил 7-амино-1-(1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1 Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоксилата (19 мг, 0,014 ммоль) и [NEt4[Re(СО)3Br3] (19 мг, 0,024 ммоль) в МеОН (3 мл) в ампуле для проведения реакций при повышенном давлении перемешивали при 90°С в течение 3 ч. Растворитель упаривали, получая остаток, который напрямую использовали в следующей стадии. Раствор описанного выше продукта в ТФУК (3,0 мл)/ДХМ (3,0 мл) перемешивали при комнатной температуре в течение ночи. Растворитель упаривали с получением неочищенного продукта, который очищали методом ВЭЖХ, получая [Re(СО)3][(7S,14S,18S)-7-амино-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1 Н-имидазол-2-ил)-2-(( 1 -(2-(бис(карбоксиметил)амино)-2-оксоэтил)- 1Н-имидазол-2-ил)метил)-8,16-диоксо-2,9,15,17-тетраазаикозан-14,18,20-трикарбоновая кислота] (14,1 мг, 82% за 2 стадии) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) 8,43 (ушир.с, 1Н), 8,09 (ушир.с, 3Н), 7,10 (с, 2Н), 7,03 (с, 2Н), 6,51 (ушир.с, 1Н), 6,31 (д, J=8,0 Гц, 1Н), 6,28 (д, J=8,4 Гц, 1Н), 5,00 (с, 4Н), 4,40-4,01 (м, 14Н), 3,70-3,64 (м, 3Н), 3,11-3,08 (м, 2Н), 2,26-1,29 (м, 16Н); MC (ESI), 612,8 (M+H)+.
Соединение 225: Re(СО)3] [(7S, 12S, 16S)-1 -(1 -(карбоксиметил)-1 Н-имидазол-2-ил)-2-(( 1 -(карбоксиметил)-1 Н-имидазол-2-ил)метил)-9,14-диоксо-2,8,13,15-тетраазаоктадекан-7,12,16,18-тетракарбоновая кислота]

Стадия 1. (S)-ди-трет-бутил 2-(3-((S)-1-трет-бутокси-5-(2,5-диоксопирролидин-1-илокси)-1,5-диоксопентан-2-ил)уреидо)пентандиоат

Раствор (S)-5-трет-бутокси-4-(3-((S)-1,5-ди-трет-бутокси-1,5-диоксопентан-2-ил)уреидо)-5-оксопентановой кислоты (Kularatne, S. A.; et. Al., Mol. Pharmaceutics, 2009, 6, 790-800) (164 мг, 0,336 ммоль), N, N'-дисукцинимидилкарбоната (128 мг, 0,50 ммоль) и пиридина (0,10 мл) в CH3CN (5,0 мл) перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении с получением остатка, который очищали на приборе Biotage, элюируя от 10% до 70% EtOAc в гексане, получая (S)-ди-трет-бутил 2-(3-((S)-1-трет-бутокси-5-(2,5-диоксопирролидин-1-илокси)-1,5-диоксопентан-2-ил)уреидо)пентандиоат (190 мг, 97%) в виде белого твердого вещества.
Стадия 2. (2S,7S,11S)-2-(4-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-7,11 -бис(трет-бутоксикарбонил)-16,16-диметил-4,9,14-триоксо-15-окса-3,8,10-триазагептадекан-1-овая кислота

Раствор (S)-ди-трет-бутил 2-(3-((S)-1-трет-бутокси-5-(2,5-диоксопирролидин-1-илокси)-1,5-диоксопентан-2-ил)уреидо)пентандиоата (138 мг, 0,236 ммоль), (8)-2-амино-6-(бис(( 1 -(2-трет-бутокси-2-оксоэтил)-1 Н-имидазол-2-ил)метил)амино)гексановой кислоты (127 мг, 0,237 ммоль) и DIPEA (0,50 мл) в ДМФА (1,0 мл) перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении с получением остатка, который очищали на приборе Biotage, элюируя от 1% до 50% МеОН в ДХМ, получая (2S,7S,11S)-2-(4-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-7,11 -бис(трет-бутоксикарбонил)-16,16-диметил-4,9,14-триоксо-15-окса-3,8,10-триазагептадекан-1-овую кислоту (203 мг, 86%) в виде белого твердого вещества.1Н ЯМР (400 МГц, CDCl3) 7,40 (ушир.с, 1Н), 6,99 (с, 2Н), 6,79 (с, 2Н), 6,12 (ушир.с, 1Н), 5,62 (ушир.с, 1Н), 4,67-4,28 (м, 7Н), 3,68 (д, J=14,0 Гц, 2 Н), 3,62 (д, J=14,0 Гц, 2Н), 2,62-2,53 (м, 2Н), 2,34-2,02 (м, 8Н), 1,83-1,42 (м, 51Н); МС (ESI), 503,5 (M/2+H)+.
Стадия 3. [Re(СО)3] [(7S, 12S, 16S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-9,14-диоксо-2,8,13,15 -тетраазаоктадекан-7,12,16,18-тетракарбоновая кислота] (225). Раствор ((2S,7S,11S)-2-(4-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-16,16-диметил-4,9,14-триоксо-15-окса-3,8,10-триазагептадекан-1 -овой кислоты (45 мг, 0,0448 ммоль) и[Net4]2[Re(CO)3Br3] (45 мг, 0,058 ммоль) в МеОН (5 мл) в ампуле для проведения реакций при повышенном давлении перемешивали при 90°С в течение 4 ч. Растворитель упаривали, получая остаток, который напрямую использовали в следующей стадии. Раствор описанного выше продукта в ТФУК (2,0 мл)/ДХМ (3,0 мл) перемешивали при комнатной температуре в течение ночи. Растворитель упаривали с получением неочищенного продукта, который очищали методом ВЭЖХ, получая [Re(СО)3] [(7S, 12S, 16S)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-(( 1 -(карбоксиметил)-1Н-имидазол-2-ил)метил)-9,14-диоксо-2,8,13,15-тетраазаоктадекан-7,12,16,18-тетракарбоновая кислота] (30 мг, 67% за 2 стадии) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) 8,14 (д, J=7,2 Гц, 1 Н), 7,19 (д, J=0,8 Гц, 2 Н), 7,05 (д, J=1,2 Гц, 2Н), 6,37-6,34 (м, 2Н), 4,85 (с, 4Н), 4,58 (дп, J=16,4, 2,8 Гц, 2 Н), 4,40 (дд, J=16,0, 2,8 Гц, 2Н), 4,22-4,04 (м, 3Н), 3,65 (т, J=7,6 Гц, 2Н), 2,25-1,32 (м, 16Н); МС (ESI), 995,3 М+.
Соединение 226: [Re(СО)3] [(7S, 12S, 16S)-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1 Н-имидазол-2-ил)-2-(( 1 -(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1 Н-имидазол-2-ил)метил)-9,14-диоксо-2,8,13,15-тетраазаоктадекан-7,12,16,18-тетракарбоновая кислота]

Стадия 1. (S)-2-амино-6-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановая кислота

Раствор 2-(((9Н-флуорен-9-ил)метокси)карбониламино)-6-(бис(( 1 -(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановой кислоты (190 мг, 0,173 ммоль) и пиперидина (0,50 мл) в ДМФА (0,50 мл) перемешивали при комнатной температуре в течение 1 ч. Растворитель упаривали при пониженном давлении, получая неочищенный продукт. Сырой продукт очищали на приборе Biotage SP4 в градиенте 5-50% метанола в ДХМ, получая (S)-2-амино-6-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановую кислоту (0,120 г, 79%).1Н ЯМР (400 МГц, ДМСО-d6) 6,92 (с, 2Н), 6,76 (с, 2Н), 5,01 (с, 4Н), 4,32 (с, 2Н), 4,31 (с, 2Н), 3,92 (с, 4Н), 3,44 (с, 4Н), 3,01-2.99 (м, 1Н), 2,30 (т, J=7,2 Гц, 2Н), 1,60-1,57 (м, 2Н), 1,43 (с, 18Н), 1,35 (м, 18Н). 1,30-1,12 (м, 4Н); МС (ESI), 439,4 (М/2+Н)+.
Стадия 2. (2S,7S,11S)-2-(4-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-16,16-диметил-4,9,14-триоксо-15-окса-3,8,10-триазагептадекан-1-овая кислота
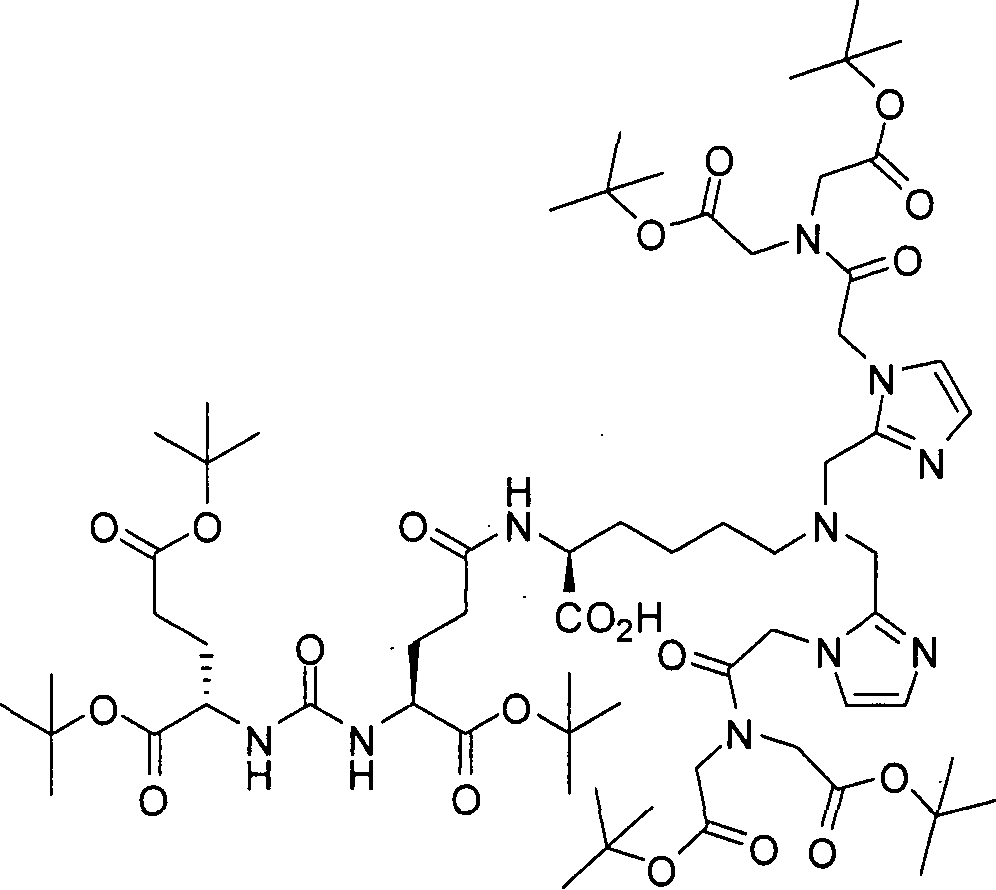
Раствор (S)-ди-трет-бутил 2-(3-((S)-1-трет-бутокси-5-(2,5-диоксопирролидин-1-илокси)-1,5-диоксопентан-2-ил)уреидо)пентандиоата (82 мг, 0,14 ммоль), ((S)-2-амино-6- (бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановой кислоты (98 мг, 0,11 ммоль) и DIPEA (0,50 мл) в ДМФА (2,0 мл) перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении с получением остатка, который очищали на приборе Biotage, элюируя от 1% до 40% МеОН в ДХМ, получая (28,78,118)-2-(4-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-16,1 б-диметил-4,9,14-триоксо-15-окса-3,8,10-триазагептадекан-1-овую кислоту (125 мг, 84%) в виде белого твердого вещества. МС (ESI), 674,6 (М/2+Н)+.
Стадия 3. [Re(СО)3] [(7S, 12S, 16S)-1-(1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)-2-((1-(2-(бис(карбоксиметил)амино)-2-оксоэтил)-1Н-имидазол-2-ил)метил)-9,14-диоксо-2,8,13,15-тетраазаоктадекан-7,12,16,18-тетракарбоновая кислота] (226). Раствор (2S,7S,11S)-2-(4-(бис((1-(2-(бис(2-трет-бутокси-2-оксоэтил)амино)-2-оксоэтил)- 1Н-имидазол-2-ил)метил)амино)бутил)-7,11 -бис(трет-бутоксикарбонил)-16,16-диметил-4,9,14-триоксо-15-окса-3,8,10-триазагептадекан-1-овой кислоты (54 мг, 0,040 ммоль) и [NEt4]2[Re(СО)3Br3] (47 мг, 0,060 ммоль) в МеОН (5 мл) в ампуле для проведения реакций при повышенном давлении перемешивали при 90°С в течение 4 ч. Растворитель упаривали, получая остаток, который напрямую использовали в следующей стадии. Раствор описанного выше продукта в ТФУК (2,0 мл)/ДХМ (3,0 мл) перемешивали при комнатной температуре в течение ночи. Растворитель упаривали с получением неочищенного продукта, который очищали методом ВЭЖХ, получая указанное в заголовке соединение (44,8 мг, 91% за 2 стадии) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) 8,17 (д, J=7,6 Гц, 1Н), 7,11 (д, J=1,2 Гц, 2Н), 7,03 (д, J=1,2 Гц, 2Н), 6,37-6,33 (м, 2Н), 5,02 (с, 4Н), 4,40-3,98 (м, 15Н), 3,65 (т, J=7,6 Гц, 2Н), 2,25-1,32 (м, 14Н); МС (ESI), 613,3 (M+H)/2+.
Дополнительные соединения, полученные описанными выше методами при соответствующем выборе реагентов, включают соединения 32-37 и 50, представленные ниже.
Соединение 32: (7S,22S,26S)- 9,16,24-триоксо-1-(хинолин-2-ил)-2-(хинолин-2-илметил)-2,8,17,23,25-пентаазаоктакозан-7,22,26,28-тетракарбоновая кислота
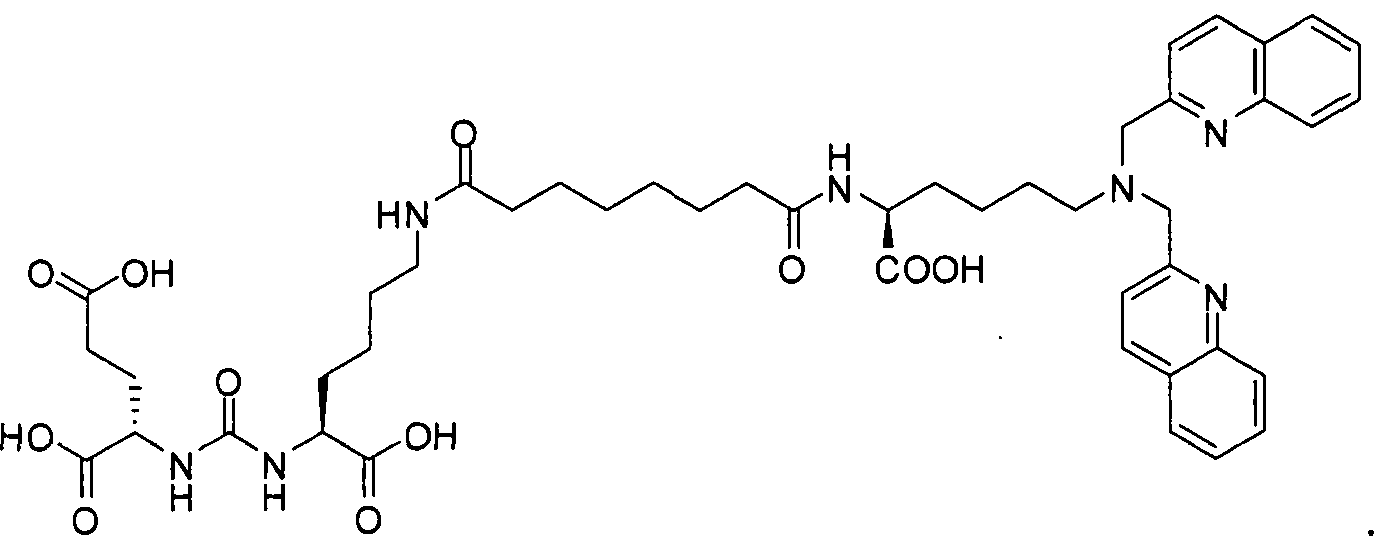
Соединение 33: (7S,22S,26S)-9,16,24-триоксо-1 -(пиридин-2-ил)-2-(пиридин-2-илметил)-2,8,17,23,25-пентаазаоктакозан-7,22,26,28-тетракарбоновая кислота

Соединение 34: (22S,26S)-9,16,24-триоксо-2-(пиридин-2-илметил)-2,8,17,23,25-пентаазаоктакозан-1,7,22,2б,28-пентакарбоновая кислота

Соединение 35: (7S,22S,26S)-1-(1- (карбоксиметил)-1Н-имидазол-2-ил)-2-((3-(карбоксиметил)-ЗН-пиррол -2-ил)метил)-9,16,24-триоксо-2,8,17,23,25-пентаазаоктакозан-7,22,26,28-тетракарбоновая кислота

Соединение 36: (19S,23 S)-1 -(1 -(карбоксиметил)-1 Н-имидазол-2-ил)-2-((1(карбоксиметил)-1Н-имидазол-2-ил)метил)-13,21 -диоксо-2,14,20,22-тетраазапентакозан-19,23,25-трикарбоновая кислота
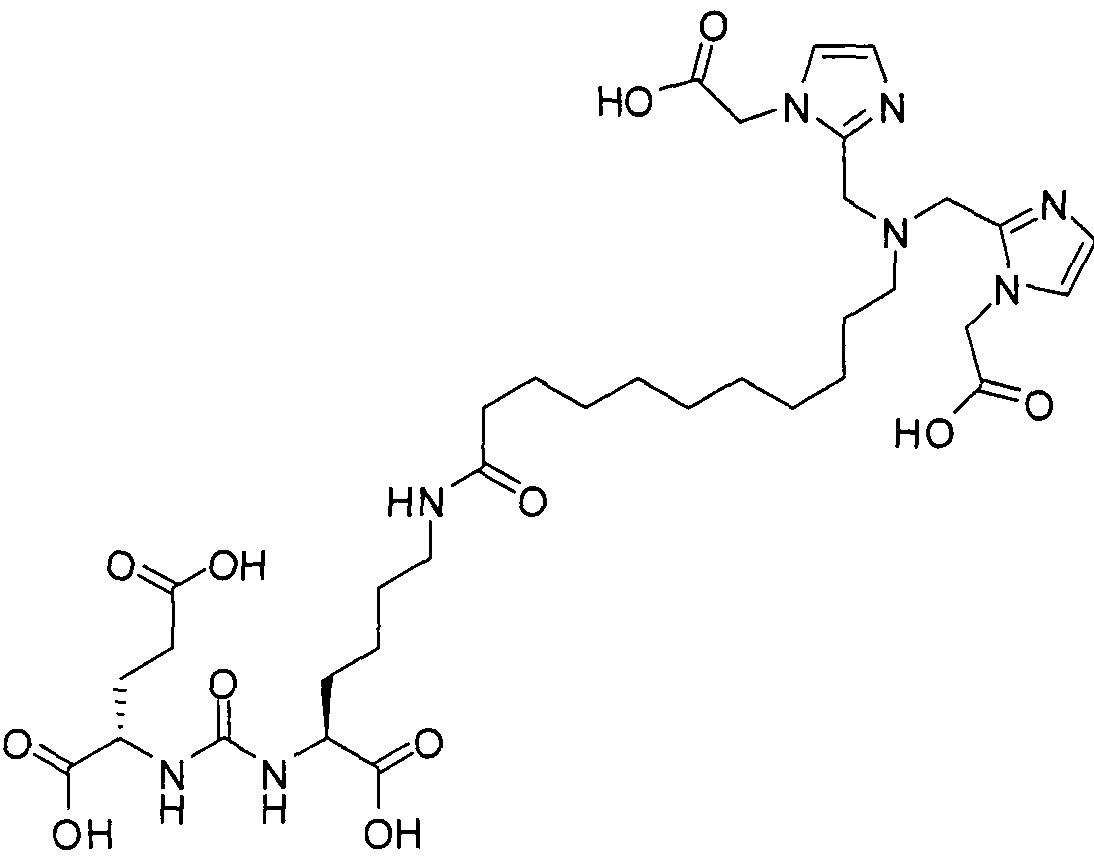
Соединение 50: (7S,11S,26S)-26-(4-(бис((1-метил-1Н-имидазол-2-ил)метил)амино)бутил)-7,11 -бис(трет-бутоксикарбонил)-2,2-диметил-4,9,17,24-тетраоксо-3-окса-8,10,16,25-тетраазагептакозан-27-овая кислота

Можно получить другие соединения, вводя в состав хелатор на основе 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусной кислоты (DOTA). Такие хелаторы на основе DOTA можно использовать для хелатирования визуализирующих металлов, включая (но не ограничиваясь только ими) иттрий, лютеций, галлий и индий. Хелаторы на основе DOTA можно получить как описано выше, используя одну из кислотных групп DOTA для связывания с другими R-группами. Примеры соединений на основе DOTA включают (но не ограничиваются только ими) приведенные далее соединения, в которых М представляет собой Y, Lu, Ga или In; и n равен 0-20;
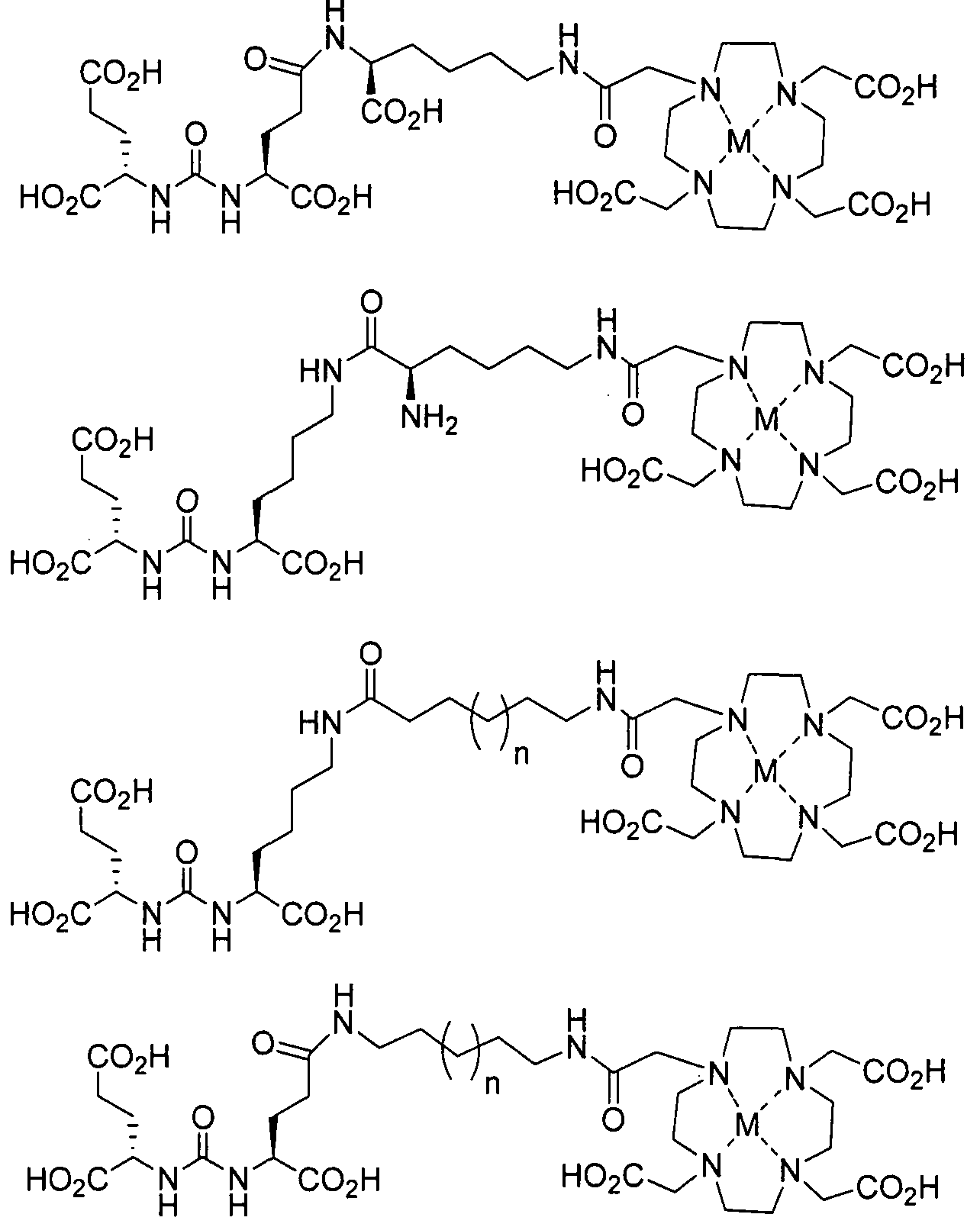
Общая методика получения комплексов99mТе и Re. Введение радиоактивной метки в99mTc-SAAC. Введение радиоактивной метки в SAAC системы проводили с образованием комплексов либо со свободными а-аминокислотами, либо с подходящим образом N-защищенным аминокислотным производным, применяя аналогичную методологию, демонстрирующую легкость получения и вариабельность дизайна SAAC систем. Введение99mTc(I)(CO)з+ метки осуществляли в две стадии, используя коммерчески доступные наборы IsoLink™ (Covidien), с образованием промежуточного продукта [99mTc(CO)3(H2O)3]+, который вводили в реакцию с подходящим SAAC лигандом (10-6М -10-4М) в эквивалентном объеме смеси 1:1 ацетонитрила и фосфатного буфера. Герметично закрытую амупулу нагревали до 100°С в течение 30 минут. После охлаждения чистоту реакционной смеси анализировали методом обращенно-фазной ВЭЖХ. Радиохимическую чистоту (RCP) после ВЭЖХ-очистки, дающей "не содержащие носителя" продукты, определяли методом ВЭЖХ, и она неизменно составляла > 95%. Хотя первые результаты демонстрировали введение радиоактивной метки при низких концентрациях до 10-6 М, значение RCY составляло ≤80%. Для достижения значения RCY > 95% при 75°С, концентрацию реакционной смеси необходимо повысить до 10-4 М. Во многих случаях соответствующие Re-комплексы получали и тестировали как Те-комплексы, для получения нерадиоактивных аналогов для отработки тестирования и работы с комплексами. Поэтому, в случаях когда изображен конкретно Re, следует понимать, что также включены Те-комплексы.
Соединение 16-Re. Re(СО)3 комплекс соединения из примера 16. Раствор трет-бутил 2,2'-(2,2'-(4-сульфамоилфенетилазандиил) бис(метилен)бис(1Н-имидазол-2,1-диил))диацетата (65 мг, 0,11 ммоль) и [NEt4]2[ReBr3(СО)3] (92,4 мг, 0,12 ммоль) в МеОН (3,0 мл) перемешивали при 95°С в течение 4 ч в ампуле для проведения реакций при повышенном давлении. Реакционную смесь очищали на приборе Amberchrom, элюируя смесью МеОН/Н2О, получая [Re(СО)3] [трет-бутил 2,2'-(2,2'-(4-сульфамоилфенетил-азандиил)бис(метилен)бис(1Н-имидазол-2,1-диил))диацетат] (51 мг, 54%) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) 7,81 (д, J=8,4 Гц, 2Н), 7,60 (д, J=8,4 Гц, 2Н), 7,31 (с, 2Н), 7,26 (д, J=1,2 Гц, 2Н), 7,12 (д, J=1,2 Гц, 2Н), 4,95 (с, 4Н), 4,74 (д, J=16,4 Гц, 2Н), 4,62 (д, J=16,4 Гц, 2Н), 3,90-3,86 (м, 2Н), 3,16-3,14 (м, 2Н), 1,45 (с, 18Н); МС (ESI), 859,3 М+. Раствор [Re(СО)3] [трет-бутил 2,2'-(2,2'-(4-сульфамоилфенетилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил))диацетата] (20 мг) в ТФУК (1,0 мл) и ДХМ (1,0 мл) затем перемешивали при комнатной температуре в течение 4 ч. Затем удаляли растворитель при пониженном давлении, получая [Re(СО)3][2,2'-(2,2'-(4-сульфамоилфенетилазандиил) бис(метилен)бис( 1 Н-имидазол-2,1 -диил))диуксусная кислота] (21,5 мг).1Н ЯМР (400 МГц, ДМСО-d6) 7,81 (д, J=8,0 Гц, 2Н), 7.60 (д, J=8,4 Гц, 2Н), 7,30 (с, 2Н), 7,23 (д, J=1,2 Гц, 2Н), 7.08 (д, J=1,2 Гц, 2Н), 4,91 (с, 4Н), 4,72 (с, 4Н), 3,89-3,85 (м, 2Н), 3,18-3,14 (м, 2Н); МС (ESI), 747,2 М+
Соединение 17-Re. Re(СО)3 комплекс соединения из примера 17.

Стадия 1. Раствор 4-(2-аминоэтил)бензолсульфонамида (0,70 г, 3,5 ммоль), АсОН (0,20 мл) и трет-бутил 2-(2-формил-1Н-имидазол-1-ил)ацетата (0,735 г, 3,5 ммоль) в ДХЭ (20 мл) нагревали до 80°С в течение 30 мин в атмосфере азота. Реакционную смесь охлаждали до 0°С, и последовательно добавляли NaBH(OAc)3 (2,25 г, 10,5 ммоль) и неочищенный трет-бутилглиоксалат (1,80 г)1. Реакционную смесь перемешивали при комнатной температуре в течение ночи и разлагали водой. Реакционную смесь экстрагировали дихлорметаном. Органический слой сушили и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, получая трет-бутил 2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенетил)амино)ацетат (0,63 г, 35%).1H ЯМР (400 МГц, ДМСО-d6) 7,67 (д, J=8,4 Гц, 2Н), 7,25 (с, 2Н), 7,23 (д, J=8,4 Гц, 2Н), 7,04 (д, J=1,2 Гц, 1Н), 6,76 (д, J=1,2 Гц, 1Н), 4,82 (с, 2Н), 3,74 (с, 2Н), 3,24 (с, 2Н), 2,69-2,66 (м, 4Н), 1,41 (с, 9Н), 1,40 (с, 9Н); МС (ESI), 509 (М+Н)+.
Стадия 2. Раствор трет-бутил 2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенетил)амино)ацетата (40 мг, 0,079 ммоль) в ДХМ (2,0 мл) и ТФУК (2,0 мл) перемешивали при комнатной температуре в течение 3 ч. Растворитель удаляли при пониженном давлении, получая 2-(2-(((карбоксиметил)(4-сульфамоилфенетил)амино)метил)-1Н-имидазол-1-ил)уксусную кислоту. Раствор 2-(2-(((карбоксиметил)(4-сульфамоилфенетил)амино)метил)-1 Н-имидазол-1-ил)уксусной кислоты и [HEt4]2[ReBr3(СО)3] (70 мг, 0,09 ммоль) в NeOH (2,0 мл) и H2O (2,0 мл) доводили до значения рН=9 с помощью 2 н. раствора NaOH. Полученную смесь перемешивали при 95°С в течение ночи в ампуле для проведения реакций при повышенном давлении. Реакционную смесь очищали методом ВЭЖХ, получая [Re(СО)3] [2-(2-(((карбоксиметил)(4-сульфамоилфенетил)амино)метил)-1Н-имидазол-1 -ил)уксусная кислота] (20 мг, 38%) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-(d6) 7,76 (д, J=8,0 Гц, 2Н), 7,57 (д, J=8,0 Гц, 2Н), 7,36 (д, J=1,6 Гц, 1Н), 7,26 (с, 2Н), 7,16 (д, J=1,6 Гц, 1Н), 5,05 (д, J=16,4 Гц, 1Н), 4,98 (д, J=16,4 Гц, 1Н), 4,73 (д, J=16,0 Гц, 1Н), 4,43 (д, J=16,0 Гц, 1Н), 4,00(д, J=16,8 Гц, 1Н), 3,60-3,51 (м, 3Н), 3,10-3,05 (м, 2Н); МС (ESI), 667,2 (M+H)+.
Соединение 23-Re. Ке(СО)з комплекс соединения из примера 23.

Стадия 1. Раствор 4-(2-аминоэтил)бензолсульфонамида (1,60 г, 8,0 ммоль), АсОН (0,30 мл) и 2-пиридинкарбоксальдегида (0,76 мл, 8,0 ммоль) в ДХЭ (50 мл) нагревали до 75°С в течение 30 мин в атмосфере азота. Реакционную смесь охлаждали до 0°С, и последовательно добавляли НаВН(ОАс)3 (6,36 г, 30 ммоль) и неочищенный трет-бутилглиоксалат (2,08 г)1. Реакционную смесь перемешивали при комнатной температуре в течение ночи и разлагали водой. Реакционную смесь экстрагировали дихлорметаном. Органический слой сушили и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, получая трет-бутил 2-((пиридин-2-илметил)(4-сульфамоилфенетил)амино)ацетат (1,04 г, 32%) и трет-бутил 2,2'-(4-сульфамоилфенетилазандиил)диацетат (0,624 г, 18%). трет-Бутил 2-((пиридин-2-илметил)(4-сульфамоилфенетил)амино)ацетат:1Н ЯМР (400 МГц, CD3OD) 8,45 (д, J=4,8 Гц, 0,42Н), 8,40 (д, J=4,8 Гц, 0,58Н), 7,83 (т, J=6,4 Гц, 0,42Н), 7,77 (д, J=8,4 Гц, 1,58 Н), 7,69 (т, J=8.0 Гц, 0,58Н), 7,56 (д, J=7,6 Гц, 0,58Н), 7,34-7,24 (м, 4 Н), 5,49 (с, 1Н), 4,70 (с, 1Н), 3,93 (с, 2Н), 2,91 (т, J= 6,8 Гц, 2Н), 2,83 (т, J= 6,8 Гц, 2 Н), 1,47 (с, 9 Н); МС (ESI), 406 (М+Н)+ трет-бутил 2,2'-(4-сульфамоилфенетилазандиил)диацетат: 'Н ЯМР (400 МГц, CD3Сl3) 7,83 (д, J=8,4 Гц, 2Н), 3,45 (с, 4Н), 2.97 (т, J=5,6 Гц, 2Н), 2,87 (т, J=6,0 Гц, 2Н), 1,49 (с, 18Н); МС (ESI), 429 (M+H)+.
Стадия 2. Раствор трет-бутил 2-((пиридин-2-илметил)(4-сульфамоил-фенетил)амино)ацетата (150 мг, 0,37 ммоль) в ДХМ (3,0 мл) и ТФУК (3,0 мл) перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении, получая 2-((пиридин-2-илметил)(4-сульфамоилфенетил)амино)уксусную кислоту (129 мг, 100%).1Н ЯМР (400 МГц, CD3OD) 8,73 (д, J=5,6 Гц, 0,46 Н), 8,58 (д, J=4,4 Гц, 1Н), 8,57 (т, J=8,0 Гц, 0,46Н), 8,16 (т, J=7,6 Гц, 1Н), 8,01 (д, J =8,4 Гц, 0,54 Н), 7,96 (т, J=6,8 Гц, 0,54Н), 7,79 (д, J=8,4 Гц, 2Н), 7,66 (д, J=7,2 Гц, 2Н), 7,35 (д, J- 8,4 Гц, 2 Н), 4,51 (с, 2Н), 4,06 (с, 2Н), 3,36 (т, J=7,6 Гц, 2Н), 3,05 (т, J=7,6 Гц, 2 Н); МС (ESI), 355 (M+Н)+.
Стадия 3. Раствор 2-((пиридин-2-илметил)(4-сульфамоилфенетил)амино)уксусной кислоты (61 мг, 0,173 ммоль), [NEt4]2[ReBr3(СО)3] (192 мг, 0,25 ммоль) и K2СО3 (30 мг) в МеОН (6,0 мл) перемешивали при 100°С в течение 5 ч в ампуле для проведения реакций при повышенном давлении. Реакционную смесь очищали на приборе Amberchrom (CG-161), элюируя смесью МеОН/Н2O, получая [Re(СО)3][2-((пиридин-2-илметил)(4-сульфамоилфенетил)амино)уксусную кислоту] (18,9 мг, 18%) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) 8,77 (д, J=5,6 Гц, 1Н), 8,17 (т, J=7,8 Гц, 1Н), 7,79 (д, J=8,0 Гц, 2Н), 7,74 (д, J=7,6 Гц, 1Н), 7,59 (д, J=8,0 Гц, 2Н), 7,58 (д, J=6,0 Гц, 1Н), 7,29 (с, 2Н), 4,92 (д, J=16,0 Гц, 1Н), 4,77 (д, J=16,0 Гц, 1Н). 4,10 (д, J=16,4 Гц. 1Н), 3,74-3,68 (м, 1Н), 3,64-3,58 (м, 1Н), 3,53 (д, J=16,8 Гц, 1Н), 3,14-3,08 (м, 2Н); МС (ESI), 620 (М+Н)+.
Соединение 24-Re. Re(СО)3 комплекс соединения из примера 24.

Раствор соединения 24 (230 мг, 0,477 ммоль) и [NEt4]2[ReBr3(СО)3] (367 мг, 0,477 ммоль) в МеОН (6,0 мл) перемешивали при 100°С в течение 3 ч в ампуле для проведения реакций при повышенном давлении. Реакционную смесь очищали на приборе Amberchrom, элюируя смесью МеОН/Н2O, получая [Re(СО)3][4-(2-(бис(изохинолин-1-илметил)амино)этил)бензолсульфонамид] (173 мг, 48%) в виде желтого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) 8,69 (д, J=8,4 Гц, 2Н), 8,36 (д, J=8,8 Гц, 2Н), 8,12 (д, J=8,4 Гц, 2Н), 7,95 (т, J=7,4 Гц, 2 Н), 7,82 (д. J=8,4 Гц, 2Н), 7,75 (т, J=7,6 Гц, 2Н), 7,70 (д, J=8,4 Гц, 2Н), 7,62 (д, J=8,4 Гц, 2Н), 7,34 (с, 2Н), 5,46 (д, J=18,0 Гц, 2Н), 5,25 (д, J=18,0 Гц, 2Н), 4,07-4,03 (м, 2Н), 3,32-2,99 (м, 2Н); МС (ESI), 753,2 М+.
Соединение 25-Re. Re(СО)3 комплекс соединения из примера 25.
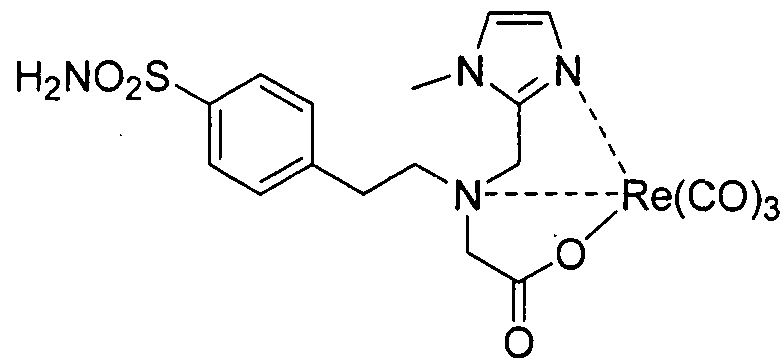
Стадия 1. Раствор 4-(2-аминоэтил)бензолсульфонамида (1,40 г, 7,0 ммоль), АсОН (0,30 мл) и 1 -метил-1H-имидазол-2-карбальдегида (0,77 г, 7,0 ммоль) в ДХЭ (40 мл) нагревали до 80°С в течение 30 мин в атмосфере азота. Реакционную смесь охлаждали до 0°С, и последовательно добавляли NaBH(ОАс)3 (4,45 г, 21 ммоль) и неочищенный трет-бутилглиоксалат(1,80 г)1. Реакционную смесь перемешивали при комнатной температуре в течение ночи и разлагали водой. Реакционную смесь экстрагировали дихлорметаном. Органический слой сушили и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, получая трет-бутил 2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенетил)амино)ацетат (0,63 г, 22%).1Н ЯМР (400 МГц, ДМСО-d6) 7,65 (д, J=8,4 Гц, 2Н), 7,26 (с, 2Н), 7,21 (д, J=8,0 Гц, 2Н), 6,99 (д, J=0,8 Гц, 1Н), 6,73 (д, J=0,8 Гц, 1Н), 3,76 (с, 2Н), 3,38 (с, 3Н), 3,28 (с, 2Н), 2,79 (т, J=7,2 Гц, 2Н), 2,69 (т, J=6,8 Гц, 2Н), 1,40 (с, 9Н); МС (ESI), 409 (М+Н)+.
Стадия 2. Раствор трет-бутил 2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенетил)амино)ацетата (110 мг, 0,27 ммоль) в ДХМ (3,0 мл) и ТФУК (3,0 мл) перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении, получая 2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенетил)амино)уксусную кислоту. Раствор 2-(((1 -метил-1H-имидазол-2-ил)метил)(4-сульфамоилфенетил)амино)уксусной кислоты, [NEt4]2[ReBr3(СО)3] (270 мг, 0,35 ммоль) и К2СО3 (78 мг) в МеОН (6,0 мл) перемешивали при 90°С в течение 4 ч в ампуле для проведения реакций при повышенном давлении. Реакционную смесь очищали на приборе Amberchrom (CG-161), элюируя смесью МеОН/Н2О, получая [Re(СО)3][2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенетил)-амино)уксусная кислота] (105 мг, 63%) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) 7,79 (д, J=8,0 Гц, 2Н), 7,57 (д, J=8,0 Гц, 2Н), 7,36 (д, J= 0,8 Гц; 1Н), 7,25 (с, 2Н), 7,15 (д, J=1,2 Гц, 1Н), 4,76 (д, J=16,4Гц, 1Н),4,58(д, J=16,0Гц, 1 Н), 4,03 (д, J=16,8Гц, 1Н), 3,67 (д, J=16,8 Гц. 1Н), 3,65-3,49 (м, 2Н), 3,17-3,09 (м, 2Н); МС (ESI), 623 (М+Н)+.
Соединение 34-Re. Re(СО)3 комплекс соединения из примера 34.

Раствор РАМА-К (0,600 г, 1,047 ммоль) и пиперидина (1,0 мл) в ДМФА (5,0 мл) перемешивали при комнатной температуре в течение 3 ч. Растворитель упаривали при пониженном давлении, получая остаток, который очищали на приборе Amberchrom (CG-161 С), элюируя смесью МеОН/Н20, получая (S)-2-амино-6-((2-трет-бутокси-2-оксоэтил)(пиридин-2-илметил)амино)гексановую кислоту (0,256 г, 70%). МС (ESI), 352 (М+Н)+.
Раствор (S)-ди-трет-бутил 2-(3-((S)-1 -трет-бутокси-6-(8-(2,5-диоксопирролидин-1 -илокси)-8-оксооктанамидо)-1-оксогексан-2-ил)уреидо)пентандиоата (0,528 г, 0,712 ммоль), (S)-2-амино-6-((2-трет-бутокси-2-оксоэтил)(пиридин-2-илметил)амино)гексановой кислоты (0,25 г, 0,712 ммоль) и DIPEA (1,0 мл) в ДМФА (5,0 мл) перемешивали при комнатной температуре в течение ночи. Растворитель упаривали, получая остаток, который очищали на приборе Biotage, элюируя ДХМ/МеОН, получая (7S, 118,2б8)-26-(4-((2-трет-бутокси-2-оксоэтил)(пиридин-2-илметил)амино)бутил)-7,11 -бис(трет-бутоксикарбонил)-2,2-диметил -4,9,17,24-тетраоксо-3-окса-8,10,16,25-тетраазагептакозан-27-овую кислоту (0,226 г, 32%). МС (ESI), 489,5 (M/2+H)+.
Раствор (7S, 11S,26S)-26-(4-((2-трет-бутокси-2-оксоэтил)(пиридин-2-илметил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-2,2-диметил-4,9,17,24-тетраоксо-3-окса-8,10,16,25-тетраазагептакозан-27-овой кислоты (56,5 мг, 0,075 ммоль) в ТФУК (1,0 мл) и ДХМ (1,0 мл) перемешивали при комнатной температуре. Растворитель упаривали при пониженном давлении с получением остатка. Раствор полученного остатка в МеОН (1,0 мл) и H2O (1,0 мл) доводили до значения рН=9 с помощью 2 н. раствора NaOH. В реакционную смесь добавляли [NEt4]2[Re(СО)3Br3] (50 мг, 0,064 ммоль) и перемешивали при 95°С в ампуле для проведения реакций при повышенном давлении в течение 4 ч. Растворитель упаривали, получая остаток, который очищали методом ВЭЖХ, получая [Re(СО)3][(7S,22S,26S)-9,16,24-триоксо-2-(пиридин-2-илметил)-2,8,17,23,25-пентаазаоктакозан-1,7,22,26,28-пентакарбоновая кислота] (13,3 мг) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) 12,5 (ушир.с, 4 Н), 8,74 (д, J=5,2 Гц, 1 Н), 8,13 (тд, J=7,8, 1,2 Гц, 1 Н), 8,06 (д, J=8,0 Гц. 1Н), 7,72-7,68 (м, 2Н), 7,57 (т, J=6,6 Гц, 1Н), 6,31 (д, J=8,0 Гц, 1Н), 6,28 (д, J = 8,4 Гц, 1Н), 4,74 (д, J=16,0 Гц, 1Н), 4,52 (д, J=16,0 Гц, 1 Н), 4,24-3,98 (м, 3Н), 3,80 (д, J=16,8 Гц, 1Н), 3,38 (д, J=16,8 Гц. 1 Н), 2,97-2,95 (м, 2Н), 2,22 (кв., J=7,7 Гц, 2Н), 2,11 (т, J=7,4 Гц, 2 Н), 2,00 (т, J=7,2 Гц, 2Н), 1,78-1,60 (м, 8Н), 1,52-1,19 (м, 16 Н); МС (ESI), 512,3 (M/2+H)+.
Соединение 35-Re. Re(CO)3комплекс соединения из примера 35.

Раствор соединения 2 (300 мг, 0,396 ммоль) и пиперидина (0,40 мл) в ДМФА (2,0 мл) перемешивали при комнатной температуре в течение 2 ч. Растворитель упаривали при пониженном давлении? получая неочищенный продукт. Полученный сырой продукт очищали на приборе Amberchrom (CG-161C), элюируя смесью H2O/AcCN, получая (S)-2-амино-6-(бис(( 1 -(2-трет-бутокси-2-оксоэтил)-1 Н-имидазол-2-ил)метил)амино)гексановую кислоту (0,211 г, 100%).1Н ЯМР (400 МГц, ДМСО-d6) 7,0 (с, 2Н), 6,65 (с, 2Н), 4,70 (с, 4Н), 4,2 (м, 4Н), 3.2 (д, 2Н), 2,4 (м, 2Н), 1,8 (с. 2Н), 1,39 (с, 18Н). 1,15 (м, 2Н); МС (ESI), 535,4 (М+Н)+.
Раствор (S)-ди-трет-бутил 2-(3-((S)-6-амино-1-трет-бутокси-1 -оксогексан-2-ил)уреидо)пентандиоата (0,488 г, 1,0 ммоль) в ДМФА (20 мл) прикалывали к раствору бис(ЪГ-гидроксисукцинимидного эфира) субериновой кислоты (1,47 г, 4,0 ммоль) в ДМФА (80 мл) через поршневой насос. Через 2 ч растворитель упаривали при пониженном давлении с получением остатка, который очищали флэш-хроматографией на силикагеле, элюируя смесью AcCN/ДХМ, с получением (S)-ди-трет-бутил 2-(3-((S)-1-трет-бутокси-6-(8-(2,5-диоксопирролидин-1-илокси)-8-оксооктанамидо)-1-оксогексан-2-ил)уреидо)пентандиоата (0,54 г, 73%). МС (ESI), 741,6 (М+Н)+.
Раствор (S)-ди-трет-бутил 2-(3-((S)-1 -трет-бутокси-6-(8-(2,5-диоксопирролидин-1 -илокси)-8-оксооктанамидо)-1-оксогексан-2-ил)уреидо)пентандиоата (0,291 г, 0,45 ммоль), (8)-2-амино-6-(бис((1-(2-трет-бутокси-2-оксоэтил)-1Н-имидазол-2-ил)метил)амино)гексановой кислоты (0,22 г, 0,412 ммоль) и DIPEA (1,0 мл) в ДМФА (4,0 мл) перемешивали при комнатной температуре в течение ночи. Растворитель упаривали, получая остаток, который очищали на приборе Biotage, элюируя смесью ДХМ/МеОН, получая (78,118,268)-26-(4-(бис(( 1 -(2-трет-бутокси-2-оксоэтил)-1 Н-имидазол-2-ил)метил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-2,2-диметил-4,9,17,24-тетраоксо-3-окса-8,10,16,25-тетраазагептакозан-27-овую кислоту (0,1089 г, 21%). МС (ESI), 581 (М/2+Н)+.
Раствор (7S, 11S, 26S)-26-(4-(бис(( 1 -(2-трет-бутокси-2-оксоэтил)-1 Н-имидазол-2-ил)метил)амино)бутил)-7,11 -бис(трет-бутоксикарбонил)-2,2-диметил-4,9,17,24-тетраоксо-3-окса-8,10,16,25-тетраазагептакозан-27-овой кислоты (30 мг, 0,029 ммоль) и [NEt4]2[Re(СО)3Br3] (30 мг, 0,039 ммоль) в МеОН (4 мл) в ампуле для проведения реакций при повышенном давлении перемешивали при 95°С в течение 4 ч. Растворитель упаривали, получая остаток, который напрямую использовали в следующей стадии. Раствор описанного выше продукта в ТФУК/ДХМ перемешивали при комнатной температуре в течение 5 ч. Растворитель упаривали с получением неочищенного продукта, который очищали методом ВЭЖХ, получая [Re(СО)3][(225,265)-1-(1-(карбоксиметил)-1Н-имидазол-2-ил)-2-((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)-9,16,24-триоксо-2,8,17,23,25-пентаазаоктакозан-7,22,26,28-тетракарбоновая кислота] (2,2 мг) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) 8,06 (д, J=8,0 Гц, 1Н), 7,71 (д, J=5,6 Гц, 1Н), 7,17 (д, J=1,2 Гц, 2Н), 7,04 (д, J=1,2 Гц, 2Н), 6,30 (д, J= 8,4 Гц, 1 Н), 6,27 (д, J=8,0 Гц, 1Н), 4,84 (с. 4Н), 4,56 (д, J=16,8 Гц, 2Н), 4,38 (д, J=16,4 Гц, 2Н), 4,30-4,18 (м, 1Н), 4,01-3,98 (м, 2Н), 3,60-3,58 (м, 2Н), 2,97-2,92 (м, 2Н), 2,24-2,11 (м, 2Н), 2,07 (т, J=8,0 Гц, 2Н), 1,99 (т, J=7,6 Гц, 2Н), 1,80-1,19 (м, 22 Н); МС (ESI), 575,9 (M/2+H)+.
Соединение 49-Тс: Радиоактивно меченное соединение 49. В соединение 49 вводили радиоактивную метку Тс-99m путем комплексообразования Тс(СО)3 с бис-имидазольным соединением, получая комплекс с m-бутил защищенной дикислотой, с которой затем снимали защиту с помощью ТФУК, получая изображенный ниже целевой комплекс.
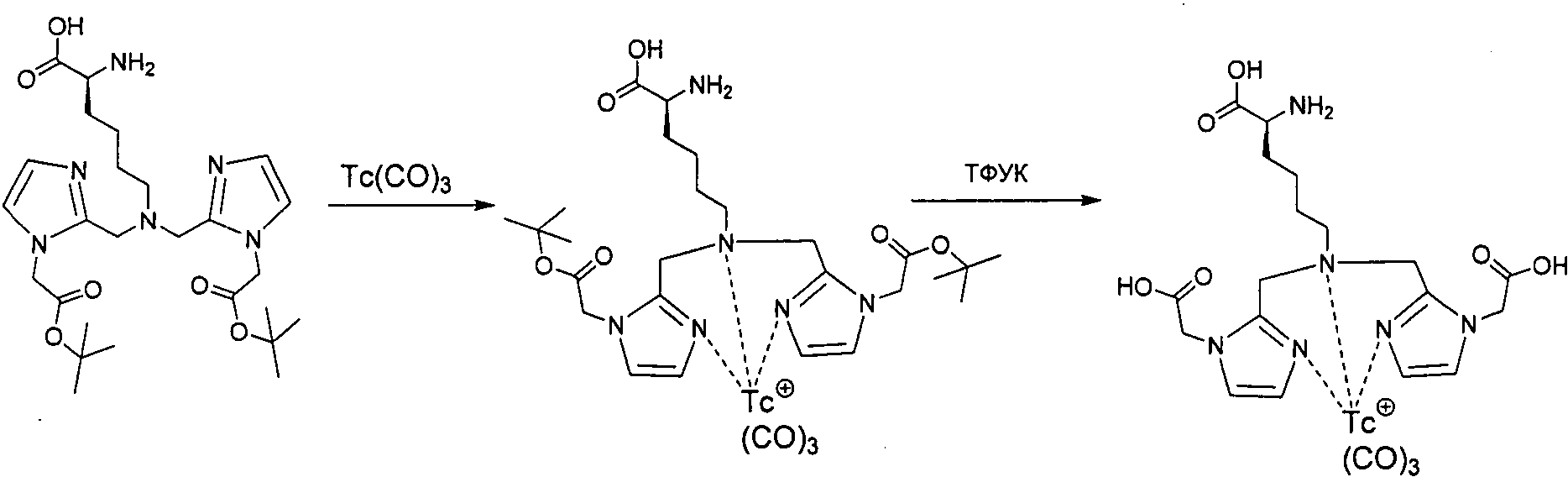
Соединение 50-Re. Re(СО)3 комплекс соединения из примера 50.

Раствор (S)-ди-трет-бутил 2-(3-((S)-1 -трет-бутокси-6-(8-(2,5-диоксопирролидин-1 -илокси)-8-оксооктанамидо)-1-оксогексан-2-ил)уреидо)пентандиоата (0,356 г, 0,48 ммоль), соединения 13 (0,16 г, 0,48 ммоль) и DIPEA (1,0 мл) в ДМФА (5,0 мл) перемешивали при комнатной температуре в течение ночи. Растворитель упаривали, получая остаток, который очищали на приборе Biotage, элюируя смесью ДХМ/МеОН, получая (7S,11S,26S)-26-(4-(бис((1-метил-1Н- имидазол-2-ил)метил)амино)бутил)-7,11-бис(трет-бутоксикарбонил)-2,2-диметил-4,9,17,24-тетраоксо-3-окса-8,10,16,25-тетраазагептакозан-27-овую кислоту (81 мг, 18%). МС (ESI), 481 (М/2+Н)+.
Раствор (7S,11S,26S)-26-(4-(бис((1-метил-1Н-имидазол-2-ил)метил)амино)бутил)-7,11 -бис(трет-бутоксикарбонил)-2,2-диметил-4,9,17,24-тетраоксо-3-окса-8,10,16,25-тетраазагептакозан-27-овой кислоты (72 мг, 0,075 ммоль) и [NEt4]2[Re(СО)3Br3] (72 мг, 0,094 ммоль) в МеОН (4 мл) в ампуле для проведения реакций при повышенном давлении перемешивали при 95°С в течение 4 ч. Растворитель упаривали, получая остаток, который напрямую использовали в следующей стадии. Раствор описанного выше продукта в ТФУК/ДХМ перемешивали при комнатной температуре в течение ночи. Растворитель упаривали с получением неочищенного продукта, который очищали методом ВЭЖХ, получая [Re(СО)3] [(7S,22S,26S)-1 -(1 -метил-1 Н-имидазол-2-ил)-2-(( 1 -метил-1 Н-имидазол-2-ил)метил)-9,16,24-триоксо-2,8,17,23,25-пентаазаоктакозан-7,22,26,28-тетракарбоновая кислота] (4,0 мг) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) 8,08 (д, J=8,0 Гц, 1Н), 7,72 (т, J=5,4 Гц, 1Н), 7,24 (д, J=1,2 Гц, 2Н), 7,05 (д, J=1,2 Гц, 2 Н), 6,31 (д, J= 8,4 Гц, 1 Н), 6.28 (д, J=8,0 Гц, 1 Н), 4,69 (д, J=16,8 Гц, 2Н), 4,54 (д, J=16,8 Гц, 2 Н), 4,28-4,23 (м, 1 Н), 4,11-4,03 (м, 2Н), 3,78 (с, 6 Н), 2,97-2,92 (м, 2Н), 2,26-2,20 (м, 2Н), 2,11 (т, J=7,2 Гц, 2 Н), 1,99 (т, J=7,6 Гц, 2 Н), 1,90-1,20 (м, 24 Н); МС (ESI), 531,8 (M/2+H)+.
Другие рений-меченные, технеций-меченные или меченные другим металлом соединения можно получить по методикам, примеры которых приведены выше. Полученные соединения включают соединения, перечисленные в Таблице 2. Вследствие лантанидного сжатия рений и технеций имеют близкий размер и реакционную способность, однако у рения есть несколько устойчивых изотопов, не являющихся радиоактивными, и поэтому соединения рения представляют собой хорошую синтетическую и тестовую модель для исследования соответствующих радиоактивных соединений технеция. Поэтому каждое из соединений в Таблице 2 может также быть получено как Тс-аналог, однако оно могло не быть получено на самом деле, в свете соображений безопасности для сотрудников, работающих с данным материалом.
Пример 1: Определение значений Log P. Значения Log P для99mTс(I)-комплесов определяли следующим образом.99mTc-SAAC комплексы получали и очищали методом обращенно-фазной ВЭЖХ. Пик целевого вещества собирали, и нужную фракцию упаривали в токе азота. Остаток растворяли в 25 мкл солевого раствора и помещали в равный объем н-октанола (3 мл) и 25 мМ рН = 7,4 фосфатного буфера (3 мл). Образцы перемешивали на вихревой мешалке в течение 20 мин, центрифугировали при 8000 об/мин в течение 5 мин и отбирали три аликвоты по 100 мкл из водного и органического слоев для анализа на гамма-счетчике (Wallac 1282). Затем отделяли 1 мл раствора фосфатного буфера/Тс-комплекса, и процесс повторяли со свежим н-октанолом, всего осуществляли шесть экстракций для гарантированной экстракции всех органических компонентов. Коэффициенты распределения вычисляли по уравнению: Р=(объемная активность в н-октаноле)/(объемная активность в водном слое). Представленные значения Log P вычисляли как средние для различных измерений.
Таблица 3. Сравнение коэффициентов распределения (Log P) и времен. удерживания на ВЭЖХ для99mTc-SAAC комплексов.
н.о.=не определялось
Пример 2: Исследование распределения в тканях крыс. Распределение и фармакокинетику для избранных99mTc-saac комплексов изучали на нормальных самцах крыс Sprague Dawley (180-200 граммов) при введении через хвостовую вену в виде болюсного вливания (примерно 10 мкКи/крысу) в постоянном объеме 0,1 мл. Животных (n=5 в каждый момент времени) умерщвляли путем асфиксии с помощью диоксида углерода через 5, 30, 60 и 120 мин после вливания. Ткани (кровь, сердце, легкие, печень, селезенку, почки, надпочечники, желудок, кишечник (с содержимым), яички, скелетные мышцы, кости и мозг) отделяли, удаляли, взвешивали во влажном состоянии и замеряли радиоактивность в автоматическом γ-счетчике (LKB Model 1282, Wallac Oy, Финляндия). Определяли уровни радиоактивности в тканях для каждого момента времени, выраженные в процентах от введенной дозы на грамм ткани (%ID/г).
Пример 3: Получение соединения 51 и исследования по введению Тс-99m метки. Стадия 1. [ε-{N,N-ди(пиридил-2-метил)}α-(fmoc)лизин] (Fmoc-DpK).

Fmoc-лизин, 2-пиридинкарбоксальдегид и триацетоксиборгидрид натрия смешивали в 1,2-дихлорэтане. Полученную суспензию перемешивали при комнатной температуре в атмосфере аргона 1 час. Реакционную смесь разделяли между хлороформом и водой. Остаток очищали, пропуская через слой силикагеля с использованием смеси растворителей метанол-хлороформ, получая продукт с выходом 85%. Снятие Fmoc-защиты проводили путем перемешивания с 4-диметиламинопиридином в смеси ДМФА/метанол при 25°С в течение 12 ч. Подтверждение структуры проводили методом1Н и13С ЯМР.1Н ЯМР (CDCl3): δ 10,85 (ушир.с, 1Н, СO2Н), 8,50 (д, 7=5,10 Гц, 2Н, РуН), 7,70 (д, J=7,24 Гц, 2Н, F1H), 7,55 (м, 4Н, РуН, F1H), 7,46 (д, J=7,24, 2Н, F1H), 7,32 (т, J=7,72, 2Н, Ру), 7,22(т, J=7,52, 2Н, Ру), 7,09 (т, J=6,20, 2Н, F1H), 6,0 (д, J=9,31, 1Н, NH), 4,29 (м, 3Н, ОСН2, NCHCO2), 4,17 (т, J=6,20, 1Н, СН), 3,86 (с, 4Н, РуСНз), 2,57 (т, 2Н, NCH2), 1,90-1,20 (м, 6Н, СН2).13С ЯМР (CDCl3): δ 175,96 (С, СO2Н), 157,74 (2С, Ру), 156,15 (С, CONH), 148,29 (2СН, Ру), 144.12 (2С, Fl), 141,27(2C, F1), 137,38 (2СН, Ру), 127,68 (2СН, Ру), 127,08 (2СН, Ру), 125,26 (2СН, Fl), 123,92 (2СН, Fl), 122,64 (2СН, Fl), 119,96 (2СН, Fl), 66,81 (1C, ОСН2), 59,03 (2С, PyCH2), 54,48 (C, NCHCO2), 53,87 (С, NCH2), 47,24 (C, Fl), 32,54 (С, СН2), 26,04(С, СН2), 22,86 (С, СН2).
Стадия 2. [Re(CO)3{η3-ε-[(N,N-ди(пиридил-2-метил)]α(fmoc)лизин}][Br]. Соединение 51. К перемешиваемому раствору [NEt4]2[Re(СО)3Br3] (1,12 г, 1,45 ммоль) в метаноле (20 мл) добавляли [ε-{N,N-ди(пиридил-2-метил)}α-(fmoc)лизин] (0,8 г, 1,45 ммоль) в 2 мл метанола, после чего полученный раствор кипятили 5 часов и упаривали. Остаток растворяли в хлороформе, промывали водой, сушили (NaSO4) и упаривали досуха, получая бесцветный продукт (1,04 г, 80%).1Н ЯМР (МеОН-d4): δ 8,88 (д, J=5,29, 2Н), 8,02-7,37 (м, 14Н), 5,05 (д, J=17,64 Гц, 2Н, PyCH2), 4,82 (д, J=17,64 Гц, 2Н, PyCH2), 4,44-4,35 (м, 4Н), 3,88 (м, 2Н), 2,20-1,50 (м, 6Н, СН2).13С ЯМР (МеОН-d4): δ 197,47, 196,44 (fac-Re-СО3), 175,42 (С, CO2H), 161,82 (2С, Ру), 158,30(С, CONH),152,87 (2СН, Ру), 145,13 (2С, F1H), 142,29 (2С, F1H), 141,48 (2СН, Ру), 129,07 (2СН, Ру), 128,46 (2СН, Ру), 126,94 (2СН, F1H), 126,58 (2СН, F1H), 124,83 (2СН, F1H), 121,23 (2СН, F1H), 71,66 (NCH2), 68,72 (2С, PyCH2), 67,70 (C, ОСН2), 55,27 (NCHCO2), 32,15 (C, СН2), 25,71 (2С, СН2), 24,39 (C, СН2).
3. Введение Тс-99m метки. [99mTc(CO)3(H2O)3]+ нагревали с [ε-{N,N-ди(пиридил-2-метил)}α-(fmoc)лизин] (DpK) в 0,5 мл (1 мг/мл) метанола при 100°С в течение 30 минут. Анализ чистоты на С 18 ВЭЖХ показал значение >99% RCY. В испытании на устойчивость продукт, очищенный методом ВЭЖХ, продемонстрировал отсутствие разложения в 100 мМ растворе цистеина или гистидина в PBS рН 7,2 при 37°С в течение 18 ч. Выход введения метки > 50% RCY достигался уже при концентрациях 2 мкг/мл.
Таблица 4. Результаты введения метки для Tc99m-DpK комплексов.
Пример 4: Введение Tc-99m метки в аналоги DPMA с использованием методов введения метки на основе Тс(V)-oкco и Тс(1)(СО)3L3 элементов.
(a) Тс(V)-оксо элемент: Получение производных DPMA, меченных Tc-99m, осуществляли добавлением 10 мКи ТсO4- в 0,9%-ный солевой раствор DPMA-производного (200 мг/3 мл). Полученную смесь нагревали до 80°С в течение 30 мин. В зависимости от биологического лиганда раствор использовали по необходимости, или смесь экстрагировали этилацетатом (3, 1 мл порции), сушили над сульфатом натрия и сушили в атмосфере N2. Полученный остаток затем растворяли в этаноле (400 мкл) и проверяли чистоту методом ВЭЖХ на колонке Vydac С 18 (5 м, 25 см), используя метанол для элюирования продуктов реакции.
(b) Tc(I)(CO)3+ элемент: Химия карбонилов Тс(I) дает возможность применить альтернативный метод формирования устойчивых99mTc-dpma комплексов. Для испытания возможностей данного метода, мы начали с помещения Na2CO3 (0,004 г, 0,038 ммоль), NaBH4 (0,005 г, 0,13 ммоль) и 2 мг DPMA-производного в ампулу. После этого ампулу герметично закрывали и продували СО в течение 10 мин. В ампулу добавляли 1 мл Na99mTcO4- в солевом растворе. Наконец, раствор нагревали до 100°С в течение 30 минут. После охлаждения чистоту реакционной смеси проверяли методом ВЭЖХ на колонке Vydac С 18 (5 мм, 25 см), используя метанол для элюирования продуктов реакции.
Альтернативно, можно проводить «двухреакторный» синтез, в ходе которого DPMA-производное добавляли после формирования [99mTc(OH2)3(CO)3]+. После охлаждения добавляли 0,3 мл 1М раствора PBS (рН 7,4), достигая стабильного формирования [99mTc(OH2)3(CO)3]+. Данные Тс(I) трикарбонильные вещества нагревали при 75°С в течение 30 минут с DPMA-производным, получая99mTc-DPMA-комплекс. Затем чистоту реакционной смеси проверяли методом ВЭЖХ на колонке Vydac С 18 (5 мм, 25 см), используя метанол для элюирования продуктов реакции. Гибкость данной реакции позволяет проводить реакцию разнообразных чувствительных биологических DPMA-производных лигандов в идеальных условиях.
Пример 5: Получение SAAC лигандов. Химия, использованная для получения SAAC лигандов, основана на применении реакции восстановительного алкилирования, как отмечено выше. Полученные соединения можно очищать методом колоночной хроматографии с получением чистых прототипных SAAC систем, (дипиридил)лизин (DpK), (дитиазол)лизин (DTK), (пиридиламин)моноуксусная кислота лизин (РАМАК), и Дифенол лизин (Дифенол К). Введение SAAC в пептидную последовательность или связывание с малой молекулой осуществляют стандартной реакцией амидного сочетания либо с карбоксильной, либо с аминной функциональной группой SAAC.
Пример 6: Введение радиоактивной метки в SAAC (99mTc-SAAC комплексы). Введение радиоактивной метки в SAAC лиганды можно проводить либо на свободных аминокислотах, либо с соответствующим образом N-защищенными производными аминокислот, используя сходные методики, демонстрирующие легкость получения и вариабельность дизайна SAAC лигандов. Введение99mTc(I)(CO)3+ радиоактивной метки осуществляли в две стадии, используя коммерчески доступные наборы IsoLink (Mallinckrodt), формируя промежуточное соединение [99mTc(СO3)3(Н2O)3]+, которое вводили в реакцию с подходящим SAAC (1×10-4M) в 0,5 мл ацетонитрила. Герметично закрытую ампулу нагревали до 75°С в течение 30 минут. После охлаждения чистоту реакционной смеси анализировали методом ВЭЖХ на колонке Vydac С 18 (4,6 мм, 25 см). Радиохимическую чистоту (RCP) определяли методом С 18 высокоэффективной жидкостной хроматографии (ВЭЖХ), и ее значение составило 85%. Хотя предварительные результаты показали введение радиоактивной метки уже при концентрациях 10-6 в некоторых случаях, значения радиохимического выхода (RCY) были всего лишь умеренными и в лучшем случае составляли ≤55%.
Пример 7: Устойчивость комплексов: проверка устойчивости для99mТc. Полученные комплексы анализировали методом ВЭЖХ на предмет устойчивости с течением времени в отношении цистеина и гистидина. Для продуктов (не содержащих носитель) не было обнаружено разложения методом ВЭЖХ после инкубирования с 100 мМ раствором цистеина или 100 мМ раствором гистидина в фосфатном буфере (PBS), рН=7,2 при 37°С в течение 18ч. Комплексы99mTc-SAAC были устойчивы при воздействии избытка цистеина и гистидина в течение более 18 ч при 37°С для хелаторов DpK, DTK и РАМАК, однако анионный комплекс99mТс-ДифенолК был намного менее устойчив.
Пример 8: Синтез и охарактеризование пептидов. Пептиды получали на синтезаторе пептидов Advanced ChemTech 348 Ω, Peptide Synthesizer с использованием пара-бензотриазол-N,N,N',N'- тетраметилурония гексафторфосфата (HBTU) в качестве агента сочетания. Fmoc-защищенный хелат, или его металлоорганический комплекс в виде бромидной соли растворяли в ДМФА и присоединяли к растущей пептидной цепи, используя примерно 4-кратный избыток лиганда. Продолжительность стадий сочетания до достижения полной конверсии определяли, погружая образцы полимера, взятого из реакционных смесей, в раствор, содержащий нингидрин. Время, необходимое для полной конверсии амина в амид, в обоих случаях идентично условиям, применявшимся для производных природных аминокислот. В результате, не требуется модификации стандартных протоколов пептидного синтеза. Пептиды отщепляли от полимера с помощью раствора ТФУК, содержащего этандитиол (EDT, 2%), воду (2%) и триизопропилсилан (TIS, 2%). Вследствие присутствия метионина необходимо отсутствие кислорода и использование свежеперегнанного EDT, чтобы избежать окисления тиоэфира в сульфоксид. Высаживание солей пептидов с ТФУК осуществляли обработкой холодным эфиром. Полученные твердые вещества отделяли центрифугированием и промывали холодным эфиром. После растворения в дистиллированной воде и лиофилизации получали соединения в виде твердых веществ.
Пример 9: Исследование распределения в тканях нормальных крыс. Исследование распределения в тканях нормальных крыс проводили с [99mТс(СО)3{η3-(DPK)}], [Тс(СО)3{η3-(DTK)}] и [Тс(СО)3{η3-(РАМАК)}] в группах самцов крыс Sprague Dawley (n=4/группа, 180-200 грамм каждый) через 5, 30, 60 и 120 минут после вливания. Соединения вводили в хвостовую вену в физрастворе (10 мкКи/100 мкл). Выведение из некоторых тканей описано в Таблице 5. Каждый из трех SAAC лигандов, [99mТс(СО)3{η3-(DPK)}], [Тс(СО)3{η3-(DTK)}] и [Тс(СО)3{η3-(РАМАК)}], продемонстрировали заметно различающиеся фармакокинетические профили и характеристики выведения в почках и печени. [Tc(CO)3{η3-(DTK)}] медленнее выводился из крови, чем [99mTc(CO)3{η3-(DPK)}] или [Тс(СO)3{η3-(РАМАК)}]. Все три SAAC лиганда характеризуются очень высоким накоплением и удерживанием в желудочно-кишечном тракте (ЖКТ). Полученные данные показывают, что, в целом, SAAC лиганды с липофильными заместителями характеризуются высокой гепатобилиарной экскрецией. Дизайн гидрофильных SAAC лигандов может изменить фармакокинетику за счет уменьшения липофильности комплекса и, потенциально, благоприятствования почечному выведению в сравнении с выведением через печень и ЖКТ. Такой результат может облегчить разработку применимых в клинике радиофармацевтических средств для молекулярной диагностики, обладающих желаемыми фармакокинетическими свойствами.
Пример 10: Оценка фармакокинетических характеристик SAAC и DOTA соматостатинов в мышах с опухолью AR42J. SAAC DpK вводили по N-концу Tyr-3-Октреотида, селективного пептидного агониста соматостатинового рецептора II (SSTRII). SAAC DpK сравнивали с111In-DOTA-Tyr-3-Октреотидом, визуализирующим средством для выявления карциноидных и других нейроэндокринных опухолей, на предмет распределения в тканях, поглощения и удерживания опухолью, выведения и пути экскреции у мышей с AR42J ксенотрансплантантами. Результаты представлены на Фиг.1. В то время как99mTc-DpK-Tyr-3-Октреотид и111In-DOTA-Tyr-3-Октреотид демонстрируют поглощение и удерживание в тканях-мишенях, таких как опухоль и поджелудочная железа, поглощение99mTc-DpK-Tyr-3-Октреотида в печени и ЖКТ значительно выше, чем99mTc-ООТА-Tyr-3-Октреотида. Этот результат аналогичен данным, полученным на крысах для хелатора в отдельности, что подчеркивает необходимость разработки SAAC лигандов с фармакокинетическим профилем, благоприятствующим почечному выведению.
Пример 11: Комплексы99mТc с различными примерами лигандов в крысах Sprague-Dawley. Полученные данные представлены в таблице 6
Пример 12: Селективное ингибирование ферментативной активности карбоангидразы (СА). Соединения были проверены на их способность подавлять изоферменты II и IX карбоангидразы in vitro. Очищенный человеческий фермент был получен от компании R&D Systems (Миннеаполис, США). Константы ингибирования (Кi) для CA-II и CA-IX определялись методом Покера и Стоуна. Начальные скорости гидролиза 4-нитрофенилацетата, катализируемого различными изоферментами карбоангидразы, измеряли спектрофотометрически при длине волны 400 нм. Растворы субстрата (от 1×10-2M до 2×10-6М) готовились в безводном ацетонитриле. Для 4-нитрофенолята, образовавшегося в ходе гидролиза в условиях эксперимента (9 мМ Tris-HCl, 81 мМ NaCI, pH 7,4, 25°С), использовался коэффициент молярной экстинкции 18000 М-1·см-1. Концентрации ферментов составляли соответственно 100 нМ для CA-IX и 30 нМ для CA-II. Неферментативные скорости гидролиза, определенные в отсутствие фермента, вычитали из полученных значений. Исходные растворы ингибитора были приготовлены на деионизованной воде с 10-20% ДМСО (который не подавляет ферментативную активность). Растворы ингибитора добавлялись к растворам ферментов и преинкубировались 10 минут для формирования E-I-комплекса до добавления субстрата. Ацетазоламид был включен во все тесты в качестве положительных контролей. Результаты некоторых тестирований представлены в таблице 7.
Таблица 7: Результаты теста на CA-IX
Пример 13: Изучение распределения в тканях соединения 22. Данные распределения в тканях получали с помощью99mTc-хелатного аналога соединения 22-Re на мышах с HeLa ксенотрансплантантом. Полученные данные представлены на фиг.2.
Пример 14: Изучение распределения в тканях соединения 16. Данные распределения в тканях получали с помощью99mТс-хелатного аналога соединения 16-Re на мышах с HeLa ксенотрансплантантом. Полученные данные представлены на фиг.9.
Пример 15: Эксперименты по связыванию соединений до насыщения проводили на примере связывания соединения 80 и соединения 48-Re с экспрессирующейся на поверхности клеток протеазой (сепразой) +/- клеток. Результаты графически изображены на фиг.4.123I-меченое соединение 80 имеет следующую структуру:

Пример 16: Был проведен анализ для экспрессирующихся на поверхности клеток ферментов (сепраз), и полученные для нескольких соединений результаты представлены в таблице 8.
Пример 17: Данные распределения в тканях получали с помощью Тс-хелатного аналога соединения 48-Re на нормальных мышах. Полученные данные представлены на фиг.3.
Пример 18: Данные распределения в тканях получали для123I -соединения 80 на мышах с FaDu ксенотрансплантантом, выражали в (%ID/г). Полученные данные представлены на фиг.5.
Пример 19: Сравнительные данные распределения в тканях123I -соединения 80 на мышах с FaDu, Н22(+) и Н17(-) ксенотрансплантантом (%ID/г), представлены на фиг.6, 7 и 8 соответственно. Данные получали спустя 1 час путем блокады.
Пример 20: Данные распределения в тканях получали с помощью99mТс-хелатного аналога соединения 26-Re (т.е. 26-Тс) на мышах с HeLa ксенотрансплантантом. Полученные данные представлены на фиг.10.
Пример 21: Значения IC50 определены для нескольких примеров несвязанных лигандов для Tc-PSMA комплексов и представлены в таблице 9.
Пример 22: Сравнительные данные распределения в тканях соединения 36 в мышах с LNCaP ксенотрансплантантом, выраженные в% ID/г, представлены на фиг.12.
Пример 23: Сравнительные данные распределения в тканях соединений 85, 76-Re, 77-Re, 78-Re, 33-Re и 36-Re в мышах с LNCaP ксенотрансплантантом, представлены на фиг.13.123I-меченное соединение представляет собой 2-{3-[1-карбокси-5-(4-иод-бензиламино)-пентил]-уреидо}-пентандиовую кислоту:

Следующая далее таблица (таблица 10) представляет собой список соединений Формулы VII, VIII, IX и X, которые в целом могут быть получены с помощью описанных выше методик. Ожидается, что перечисленные соединения будут проявлять свойства и активность, аналогичную приведенным выше примерам.
Таблица 10. Соединения формул VIII, IX, X, XI и XIII, где R100, R101, R102 и Х взаимозаменяемы, как пояснено на примерах ниже, где n равно 1-12.

ЭКВИВАЛЕНТЫ
Хотя некоторые варианты осуществления были проиллюстрированы и описаны, необходимо понимать, что в них возможны изменения и модификации в соответствии с квалификацией специалиста в данной области техники без отклонения от технологии в более широких аспектах, в соответствии с приведенной далее формулой изобретения.
Настоящее изобретение не должно ограничиваться конкретными вариантами осуществления, описанными в настоящей заявке. Многие модификации и изменения могут быть внесены без отклонения от ее сути и объема, как понятно специалистам в данной области техники. Функционально эквивалентные способы и композиции в рамках объема настоящего изобретения, помимо перечисленных в настоящем тексте, будут понятны специалистам в данной области техники из предшествующего описания. Предполагается, что такие модификации и изменения находятся в рамках прилагаемой формулы изобретения. Настоящее изобретение должно ограничиваться только пунктами прилагаемой формулы изобретения, наряду с полным объемом эквивалентов, к которым относится данная формула изобретения. Необходимо понимать, что настоящее изобретение не ограничивается частными способами, реагентами, соединениями, композициями или биологическими системами, которые, разумеется, могут варьироваться. Также необходимо понимать, что используемая в данном тексте терминология приведена только в целях описания частных вариантов осуществления и не является ограничивающей.
Кроме того, при описании признаков или аспектов настоящего изобретения в терминах групп Маркуша, специалисту в данной области техники будет понятно, что настоящее изобретение тем самым описано также для любого индивидуального члена или подгруппы членов группы Маркуша.
Как понятно специалисту в данной области техники, для любой и для всех целей, особенно в случае предоставления письменного описания, все интервалы, применяемые в данном тексте, также включают любые и все их возможные подинтервалы и комбинации подинтервалов. Любой указанный интервал бесспорно можно понимать как достаточным образом описывающий и позволяющий разбить данный интервал по меньшей мере на равные половины, трети, четверти, пятые части, десятые части и т.д. В качестве неограничивающего примера, каждый обсуждаемый в настоящем тексте интервал можно легко разделить на низшую треть, среднюю треть и верхнюю треть и т.д. Как также будет понятно специалисту в данной области техники, все выражения, такие как "до", "по меньшей мере", "более чем", "менее чем" и тому подобные, включают указанное число и относятся к интервалам, которые можно последовательно разбивать на подинтервалы, как описано выше. Наконец, как понятно специалисту в данной области техники, интервал включает каждый индивидуальный член интервала.
Все публикации, патентные заявки, выданные патенты и другие документы, указанные в настоящем тексте, включены в данный текст в виде ссылки, как если бы каждая отдельная публикация, патентная заявка, выданный патент или другой документ был в полном объеме включен в данный текст в виде ссылки. Определения, содержащиеся в тексте, включенном в данный текст в виде ссылки, исключаются в случае, если они противоречат определениям настоящего изобретения.
Другие варианты осуществления представлены в следующей далее формуле изобретения.
Реферат
Изобретение относится к соединению, представленному формулой,или его фармацевтически приемлемой соли, или сольвату. Значения радикалов следующие: R- Н, C-Cалкильная группа, ион аммония, ион щелочного или щелочноземельного металла; R- незамещенный Cалкил; R - Сгидроксиалкил, Cалкоксиалкил, Cаминоалкил, (CH)(NHC(S)NH)Ph(SONH), (CH)Ph(SONH), (CH)C(O)NH-(1-ацетилпирролидин-2-ил)борная кислота, (1-ацетилпирролидин-2-ил)борная кислота, (CH)CH(NH)COH, (CH)CH(NH)COH, (CH)CH(NH)COH, -(CH)-R, -C(O)(CH)-R, или аминокислотный радикал; R- карбоксилат, Сарил, 3-6 членный гетероциклил, аминокислота; d представляет собой целое число в интервале от 0 до 12 включительно; и R, R, Rи R- водород, или замещенный или незамещенный алкил, простой эфир, сложный эфир, СНСНОСНСН, СНСН(ОСН), -(CH)-R, или (CH)R; где Rпредставляет собой фосфонат или фосфинат. Также предложен комплекс, содержащий вышеуказанное соединение и радионуклид. Заявленное соединение может быть использовано в качестве диагностических или терапевтических средств. 2 н. и 9 з.п. ф-лы, 13 ил., 10 табл., 23 пр.
Формула

или его фармацевтически приемлемая соль, или сольват;
где
Rt представляет собой Н, C1-C8 алкильную группу, ион аммония, ион щелочного или щелочноземельного металла;
R84 представляет собой незамещенный C1-8алкил;
R представляет собой С1-8гидроксиалкил, C1-8алкоксиалкил, C1-8аминоалкил, (CH2)8(NHC(S)NH)Ph(SO2NH2), (CH2)dPh(SO2NH2), (CH2)5C(O)NH-(1-ацетилпирролидин-2-ил)борная кислота, (1-ацетилпирролидин-2-ил)борная кислота, (CH2)4CH(NH2)CO2H, (CH2)3CH(NH2)CO2H, (CH2)2CH(NH2)CO2H, -(CH2)d-R80, -C(O)(CH2)d-R80, или аминокислотный радикал;
R80 в каждом случае независимо представляет собой карбоксилат, С6-10арил, 3-6-членный гетероциклил, аминокислоту;
d представляет собой целое число в интервале от 0 до 12 включительно; и
каждый из R82, R83, R85 и R86 независимо представляет собой водород или замещенный или незамещенный алкил, простой эфир, сложный эфир, СН2СН2ОСН2СН3, СН2СН(ОСН3)2, -(CH2)d-R80, или (CH2)dR87; R87 представляет собой фосфонат или фосфинат.

где значения радикалов, как указано выше.
-СН2СН2ОСН2СО3 или -СН2СН(ОСН3)2.



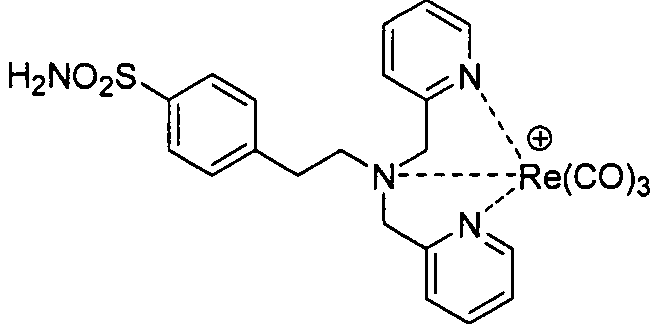

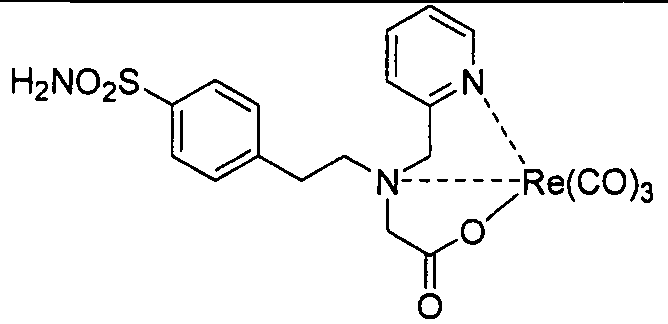
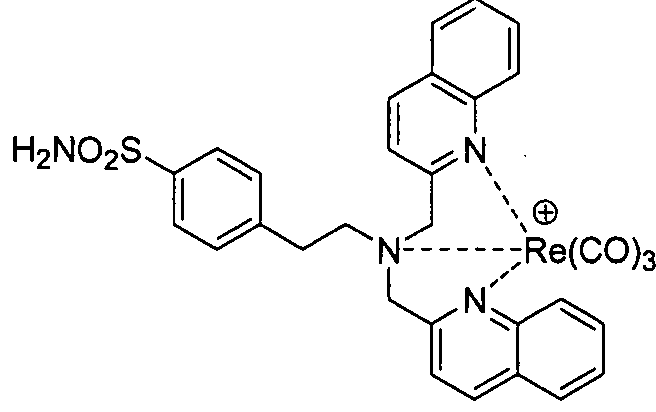
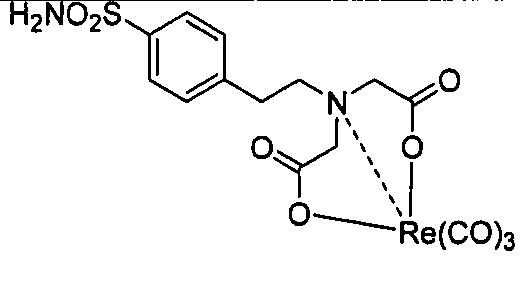

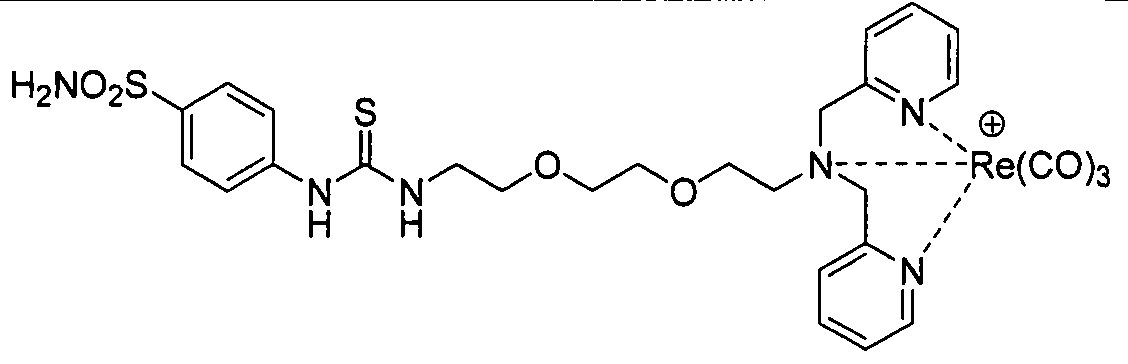




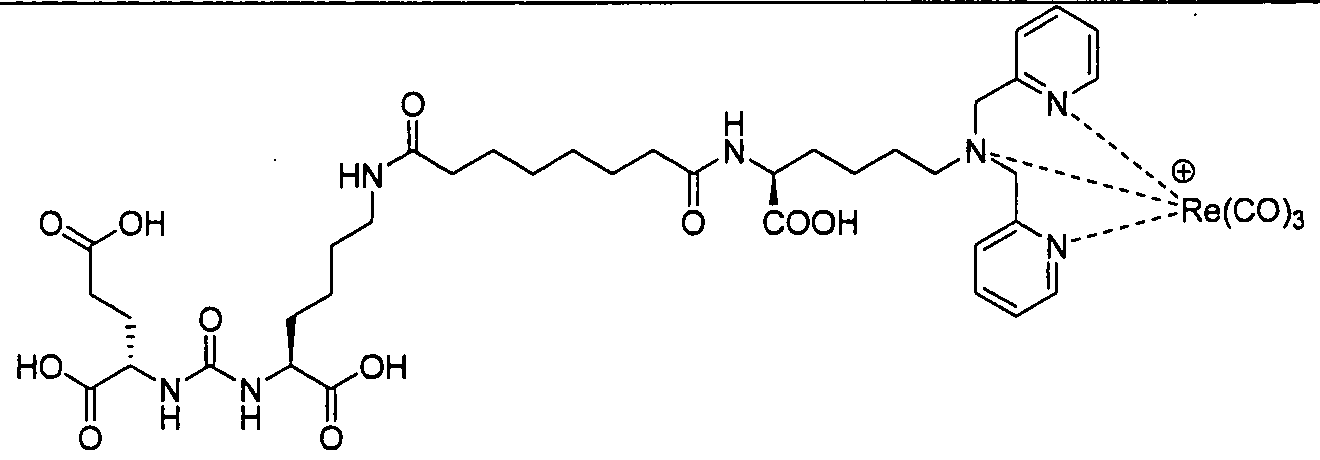















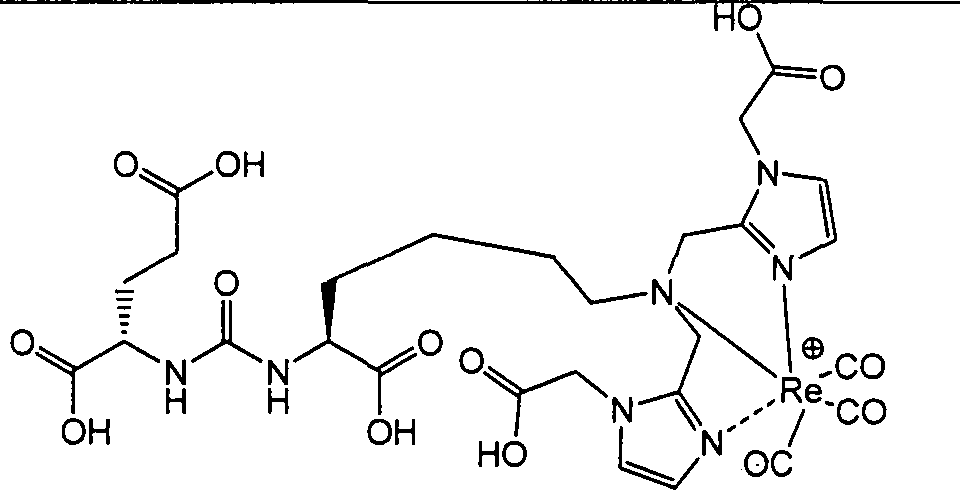














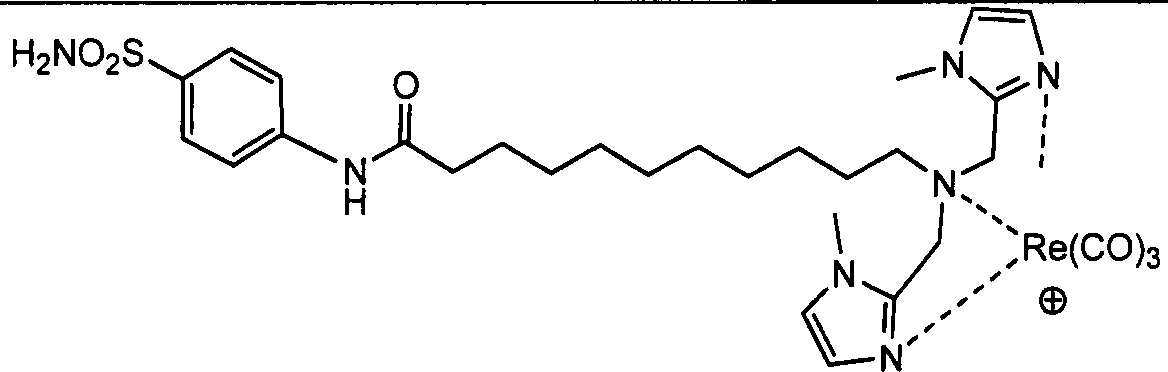


Комментарии