Са-ix специфические радиофармпрепараты для лечения и визуалазиции злокачественных опухолей - RU2539565C2
Код документа: RU2539565C2
Чертежи




Описание
Область техники, к которой относится изобретение
Настоящая технология, в общем, относится к области радиофармпрепаратов и их использованию в ядерной медицине в качестве трасеров, визуализирующих средств и для лечения болезней в различных состояниях. Хорошо известно, что опухоли могут синтезировать специфические протеины, связанные с их злокачественным фенотипом или могут осуществлять сверхсинтез нормальных протеинов в большем количестве, чем нормальные клетки. Синтез отдельных протеинов на поверхности злокачественных клеток дает возможность диагностировать и характеризовать болезнь определением феноотипической идентичности и биохимического состава и активности опухоли. Радиоактивные молекулы, которые селективно связаны со специфическими злокачественными клетками, обеспечивают привлекательный путь визуализации и лечения опухолей безоперационным способом. В частности, авторы настоящего изобретения установили, что меченные радиоактивным изотопом лиганды для CA-IX протеина, часто в результате сверхсинтеза многими злокачественными клетками, обеспечивают привлекательный путь безоперационной визуализации и селективного воздействия на злокачественные клетки-мишени.
Уровень техники
Карбоангидраза (СА) карбонатдегидраза является семейством энзимов, которые катализируют быстрое превращение диоксида углерода в бикарбонат и протон в присутствии воды. Поэтому, карбоангидраза играет важную роль в поддержании кислотно-основного равновесия (рН) в крови и тканях и также играет роль в выводе диоксида углерода из тканей. СА является металлоэнзимом, содержащим цинк, в активном центре цинк координирован тремя остатками имидазола трех боковых гистидиновых цепей.
Существует, по меньшей мере, 16 изоэнзимов в семействе карбоангидразы. Специфические изоэнзимы обнаружены либо в цитозоле, фиксированные на мембране, в митохондрии, либо секретируемыми клетками. Хорошо изученный конститутивно экспрессируемый изоэнзим, карбоангидраза II (CA-II), обнаружена в цитозоле большинства типов клеток и является основной изоформой, отвечающей за регулировку внутриклеточного рН.
CA-IX является изоформой энзима, фиксированной мембраной, с его каталитической областью во внеклеточном пространстве. Она обладает ограниченным распределением в ткани и обнаруживается в низкой концентрации в основном в желудочно-кишечном трактате. Синтез CA-IX контролируется HIF-1 α, и этот изоэнзим значительно синтезируется клетками опухолей, в условиях гипоксии и в лабораторных условиях и в организме. Повышенный синтез CA-IX был обнаружен в карциномах шейки, яичника, почки, пищевода, легкого, груди и мозга. Низкий внеклеточный рН, как результат активности CA-IX, приводит к канцерогенной трансформации, хромосомной перестройке, внеклеточному разрушению ткани, миграции и инвазии, индукции факторов роста, активации протеазы, и хеморезистентности. Соответственно, может быть установлена корреляция между содержанием CA-IX в клетках и развитием опухоли. Радиофармпрепараты, направленные на CA-IX протеин, обеспечивают таким образом новое средство для безоперационного лечения рака.
Селективное воздействие на злокачественные клетки радиофармпрепаратами для визуализации или в терапевтических целях является перспективным. Ряд радионуклидов, как известно, пригодны для изотопной визуализации, включая Ga-67, Tc-99m, In-111, I-123 и 1-131. Предпочтительным радиоизотопом для медицинской визуализации является Tc-99m, потому что у него короткий период полураспада (6 часов), легко он доступен по относительно низкой цене и излучает гамма-кванты 140 кэВ. Кроме того, комплексы Tc-99m, такие как устойчивый к воде и воздуху комплекс Тс(I), [99mТс(ОН2)3(CO)3]+ комплекс, может быть легко получен в физиологическом растворе при 1 атм монооксида углерода (СО). Соответственно, бифункциональные молекулы, которые включают специфический рецептор, воздействуя на биологически активную молекулу, ковалентно связанную с координационным комплексом99mТc или186/188Re обеспечивают новую систему для селективной визуализации и воздействия на злокачественные клетки.
Раскрытие изобретения
В одном аспекте предложено соединение формулы I

где: W является связью, (C1-С8)алкилом, (С2-С8)алкенилом, арилом, гетероарилом, -NHC(O), -C(O)NH, -NH-C(O)-NH- или -NH-C(S)-NH-; V является связью, (C1-С8)алкилом, (C2-С8)алкенилом, арилом, гетероарилом, -NH-C(O)-NH- или -NH-C(S)-NH-; NRaRb является хелатной группой формулы:

где Rt является Н, C1-C8 алкильной группой, ионом аммония или ионом щелочного или щелочноземельного металла; Rv является алкилом; Rx и Ry каждый независимо выбран из группы, состоящей из водорода, C1-C8 алкила, аминоалкила, гидроксиалкила или карбоксиалкила; m является целым числом 0-15; и n является целым числом 0-15; при условии, что W и V оба не могут быть NH-C(O)-NH- или -NH-C(S)-NH-. В некоторых осуществлениях Rv является метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом или трет-бутилом. В некоторых осуществлениях Rv является метилом. В некоторых осуществлениях Rx является метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом или трет-бутилом. В некоторых осуществлениях Ry является метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом или трет-бутилом. В некоторых осуществлениях каждый Rt независимо является Н или трет-бутилом. В некоторых осуществлениях Rt является Н. В некоторых осуществлениях m равно 0 или 1, и n является целым числом 0-8. В некоторых осуществлениях W является -NH-C(S)-NH-.
В некоторых осуществлениях NRaRb является хелатной группой формулы:

В некоторых осуществлениях NRaRb является хелатной группой формулы:

В некоторых осуществлениях NRaRb является хелатной группой формулы:

Однако, когда NRaRb является бис(метилен)бис(1Н-имидазол-2,1-диил))диуксусной кислотой (вышеуказанная формула I не включает следующие соединения 2,2'-(2,2'-(8-(3-(4-сульфамоилфенил)тиоуреидо)октилазандиил)-бис(метилен)бис(1Н-имидазол-2,1-диил))диуксусную кислоту; 2,2'-(2,2(4-сульфамоилфенилазандиил)-бис(1Н-имидазол-2,1-диил))диуксусную кислоту; или 2,2'-(2,2'-(5-(4-сульфамоилбензамидо)пентилазандиил)-бис(метилен)бис(1Н-имидазол-2,1-диил))диуксусную кислоту.
В некоторых осуществлениях NRaRb является хелатной группой формулы:

В некоторых осуществлениях структура соединения формулы I следующая:

В другом аспекте предложено соединение формулы II:

где L-NRaRb является хелатной группой, определенной для соединения формулы I, или группой формулы:

W и Х независимо являются О или S; р является целым числом 0-5; q является целым числом 0-8; Rt является Н, C1-C8 алкильной группой, ионом аммония или ионом щелочного или щелочноземельного металла; и Rv является алкилом. В некоторых осуществлениях Rv является метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом или трет-бутилом. В некоторых осуществлениях Rv является метилом. В некоторых осуществлениях каждый Rt независимо является Н или трет-бутилом. В некоторых осуществлениях Rt является Н.
В некоторых осуществлениях в соединениях формулы II L группа формулы:

где, йод является 1-123 или 1-133. В других осуществлениях L является группой формулы:
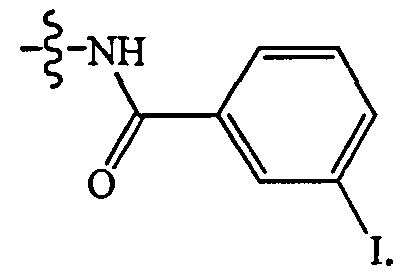
В некоторых таких осуществлениях йод является I-123 или I-133
В некоторых осуществлениях NRaRb является хелатной группой формулы:

В некоторых осуществлениях NRaRb является хелатной группой формулы:

В некоторых осуществлениях NRaRb является хелатной группой формулы:

В другом аспекте предложено соединение формулы III:

где, J является арилом; Z является О или S; La является NRaRb хелатной группой, соответствующей группе формулы I, или группой формулы:

d является целым числом 0-5; е является целым числом 0-8; Rt является Н, C1-C8 алкильной группой, ионом аммония или ионом щелочного или щелочноземельного металла; и Rv является алкилом. В некоторых осуществлениях J является фенилом, нафтилом или антраценом. В некоторых осуществлениях J является монозамещенной или двухзамещенной фенильной группой. В некоторых таких осуществлениях фенил является монозамещенным I, (C1-C8) алкилом, (С2-C8) алкенилом, -CN, -NO2, -О, -SH, -SO2NH2 или -NRcRd; где Rc и Rd независимо являются Н, (C1-С4) алкилом, или арилом; и второй заместитель является (C1-C8) алкилом, (C2-C8) алкенилом, -ОН, -SH или галогеном. В некоторых осуществлениях Rv является метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом или трет-бутилом. В некоторых осуществлениях Rv является метилом. В некоторых осуществлениях каждый Rt независимо является Н или трет-бутилом. В некоторых осуществлениях Rt является Н.
В некоторых осуществлениях в соединениях формулы III La является

В некоторых осуществлениях NRaRb является хелатной группой формулы:
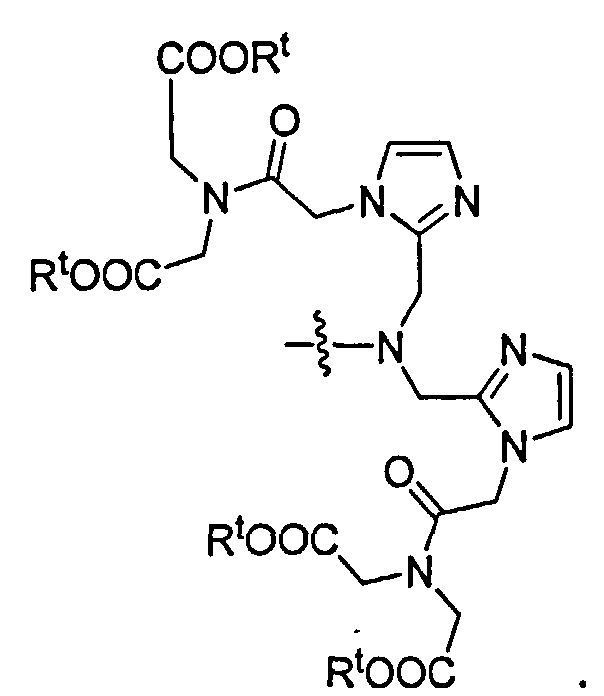
В некоторых осуществлениях NRaRb является хелатной группой формулы:

В некоторых осуществлениях NRaRb является хелатной группой формулы:

В некоторых осуществлениях предложен комплекс, включающий соединение формулы III, La является NRaRb хелатной группой, и соединение связано в комплекс с металлом.
В другом аспекте предложено соединений формулы IV:

где NRaRb является хелатной группой, соответствующей группе формулы I; Y является О или S; А является (C1-C8) алкилом, -(СН2)х-(ОСН2СН2)у- или -(ОСН2СН2)у(СН2)х-; х является целым числом 0-3; у является целым числом 0-3; г является целым числом 0-5; s является целым числом 0-10; Rt является Н, C1-C8 алкильной группой, ионом аммония или ионом щелочного или щелочноземельного металла; и Rv является алкилом. В некоторых осуществлениях г равно 0, 1 или 2. В некоторых осуществлениях s равно 0, 5, или 10. В некоторых осуществлениях Rv является метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом или трет-бутилом. В некоторых осуществлениях Rt является метилом. В некоторых осуществлениях каждый Rv независимо является Н или трет-бутилом. В некоторых осуществлениях Rt является Н. В некоторых осуществлениях NRaRb является хелатной группой формулы:

В некоторых осуществлениях NRaRb является хелатной группой формулы:

В некоторых осуществлениях NRaRb является хелатной группой формулы:

В другом аспекте предложен комплекс соединения формулы I, II, III или IV, содержащий NRaRb хелатную группу и металл. В некоторых осуществлениях металл является Ре, Те, Y, Lu, Ga или In. В некоторых осуществлениях металл является радионуклидом. В некоторых осуществлениях металл является технецием-99m, или рением-186m и/или рением-188m.
В другом аспекте, комплекс включает соединение формулы I, II, III или IV, где соединение включает NRaRb хелатную группу формулы:

и металл, выбранный из группы, состоящей из Y, Ga, Lu и In. В другом аспекте комплекс включает металл и соединение формулы I, II, III или IV, где соединение включает NRaRb хелатную группу формулы:

В другом аспекте комплекс включает металл и соединение формулы I, II, III или IV, где соединение включает NRaRb хелатную группу формулы:

В другом аспекте предложен комплекс, а именно:

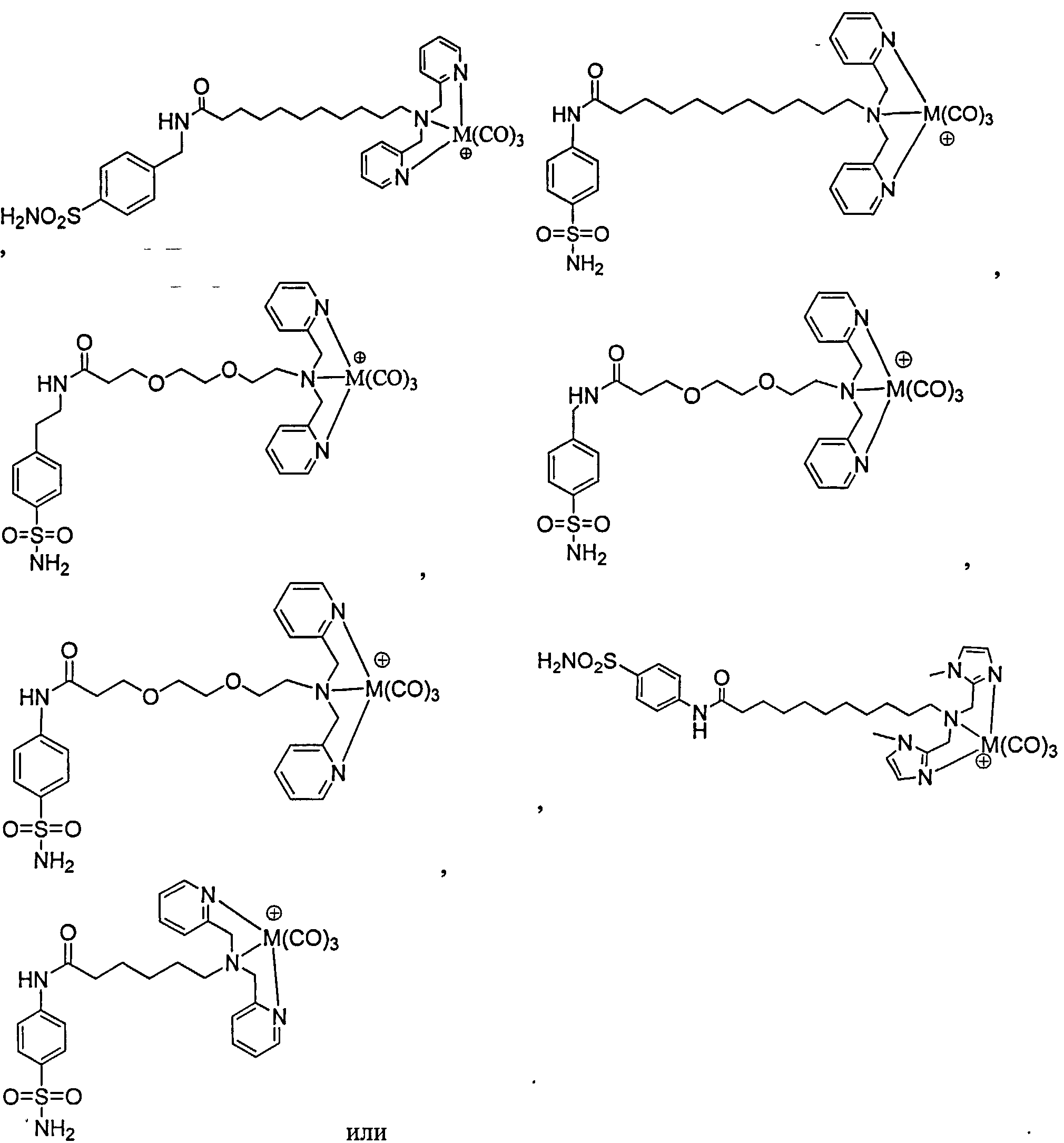
его фармацевтически приемлемые соли и сольваты; где М является Тc или Re.
В другом аспекте предложена фармацевтическая композиция, включая любое из соединений формул I, II, III, IV, фармацевтически приемлемые их соли или сольваты, и фармацевтически приемлемый эксципиент, причем соединение включает радионуклид. В некоторых осуществлениях радионуклидом является йод. В других осуществлениях радионуклидом является металл. В некоторых осуществлениях металлом является Re, Тc, Y, Lu, Ga или In.
В другом аспекте предложен способ визуализации области тела пациента, включающий стадии: введение пациенту количества, достаточного для диагностики, любого из соединений формул I, II, III, IV, фармацевтически приемлемой соли их или сольвата и визуализации области тела пациента, в котором соединение включает радионуклид. В некоторых осуществлениях радионуклид является йодом. В других осуществлениях радионуклид является металлом. В некоторых осуществлениях металлом является Re, Те, Y, Lu, Ga или In.
Краткое описание чертежей
Фиг.1 является графиком биораспределения в тканях ксенотрансплантата HeLa мыши99mТc аналога соединения примера 8, выраженный в % ID/г ± (SEM стандартная погрешность средней величины).
Фиг.2 является графиком, сравнивающим биораспределение в тканях ксенотрансплантата HeLa мыши,99mТc аналогов примеров 1, 3, 7, и 8, выраженный в % ID/г ± (SEM).
Фиг.3 является графиком распределения в тканях комплекса99mТc соединения примера 7 в ксенотрансплантате HeLa мыши, выраженное в % ID/г ± (SEM).
Фиг.4 является графиком распределения в тканях комплекса99mТc соединения примера 3 в ксенотрансплантате HeLa мыши, выраженное в % ID/г ± (SEM).
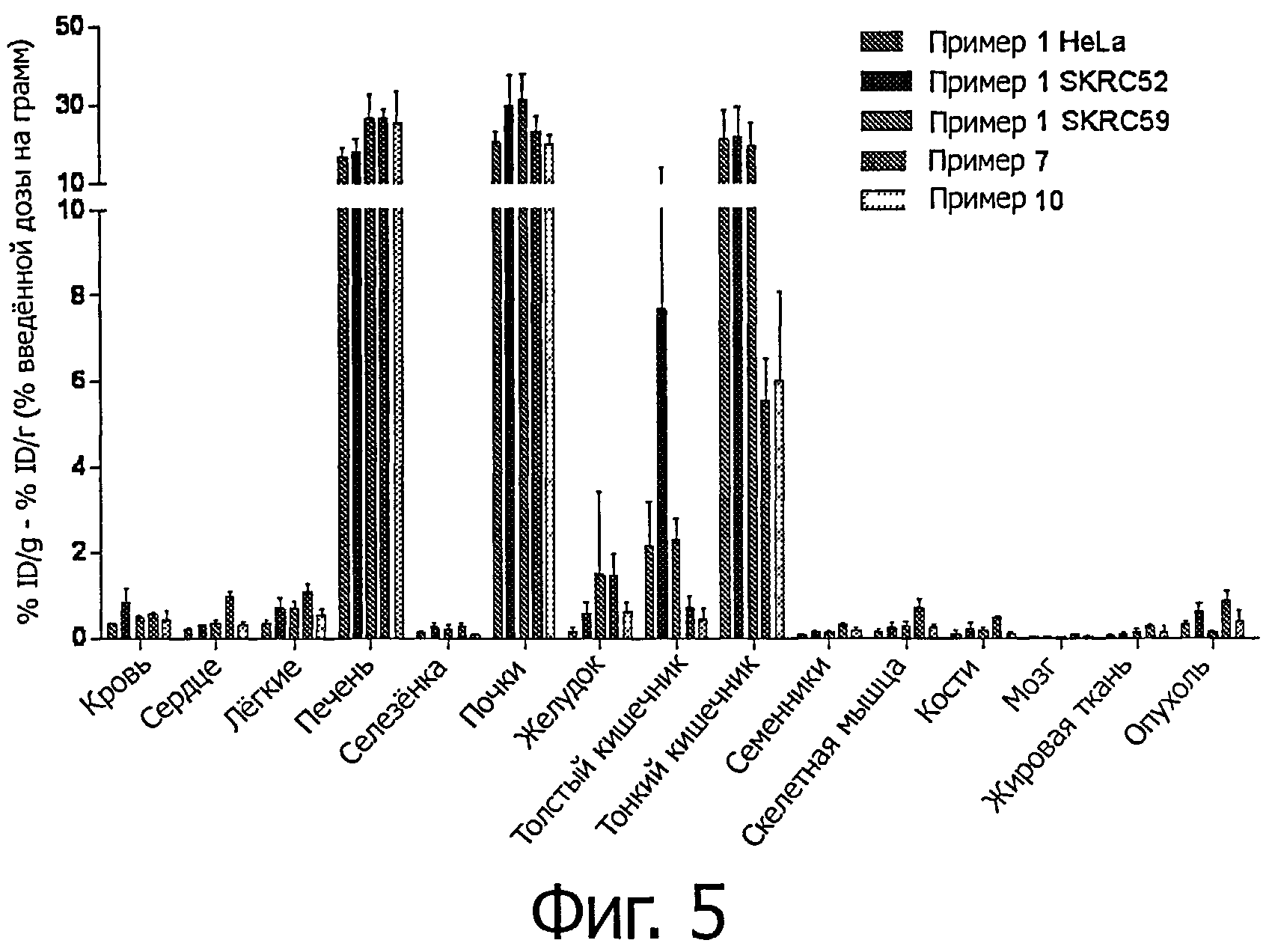
Фиг.5 является графиком распределения в тканях соединения99mТc примера 1 в ксенотрансплантатах HeLa, SKRC 52 и SKRC 59 мышей и соединений примеров 7 и 10 в ксенотрансплантате HeLa мыши, выраженные в % ID/г ± (SEM).
Осуществление изобретения
Есть две категории радиофармпрепаратов: (i) с биологическим распределением, определяемым в основном кровотоком или перфузией и воздействующим на системы с высокой емкостью, такие как клубочковая фильтрация в почках, фагоцитоз, клиренс печени и поглощение костной тканью и (ii) с распределением, определяемым специфическим связывающим взаимодействием энзимов или рецепторов, которые являются участками с низкой емкостью. Настоящие радиофармпрепараты принадлежат ко второй категории и синтезируются, конъюгированием координационного комплекса радионуклида с биологически активной молекулой, селективной к определенному протеину или рецептору, представляющему интерес.
В то время как множество биологически активных молекул (БАМы) может быть использовано в качестве * обладают преимуществами по сравнению с антителами или протеинами. Например, небольшие молекулы и небольшие пептиды обладают повышенной диффузией, более быстрый клиренс крови, и более низким фоновым излучением. Эти носители позволяют легко синтезировать аналоги с высокой производительностью. Кроме того, небольшие пептиды легко могут быть превращены в миметические пептиды или аналоги небольших молекул, с повышенной стабильностью и улучшенным сродством к целевому энзиму или рецептору.
Соответственно, в одном аспекте предложен синтез соединений формулы I, II, III или IV. В некоторых осуществлениях соединение включает радиоактивный элемент, которое может быть использовано для применения соединения в радиоизотопной визуализации. В некоторых осуществлениях радиоактивный элемент является одним из нестабильных изотопов Re, Тc, In, Ga, Y, Lu или I. Радиоактивное соединение также может быть использовано в качестве радиофармпрепаратов для лечения и визуализации раковых клеток. В частности, соединение могут быть использованы для воздействия на карциному шейки, мозга, почек, яичника, груди, легкого и пищевода.

Определения
Для удобства определенные термины, используемые в описании и в прилагаемой формуле изобретения, собраны здесь.
В соответствии с использованием в заявке, термин "около" понятен обычным специалистам в данной области техники и меняется в некоторой степени в зависимости от контекста, в котором оно используются. Если использование термина в данном контексте не ясно обычным специалистам в данной области техники, "около" будет означать до плюс или минус 10% определенного термина.
Осуществления, иллюстративно описанные в заявке, соответственно могут быть осуществлены в отсутствии любого элемента или элементов, ограничения или ограничений, не раскрытых конкретно в заявке. Таким образом, например, термины "содержащий", "включающий" и т.д. должны рассматриваться расширительно и без ограничения. Кроме того, термины и выражения, используемые в заявке, использованы в качестве терминов описания, а не ограничения, и не предназначены для использования таких терминов и выражений, исключающих эквиваленты представленных и описанных признаков или их частей, но дают возможность различных модификаций в объеме притязаний заявленной технологии. Кроме того, формулировку, "состоящий по существу из", следует понимать, как включающую эти элементы, определенно указанные, и те дополнительные элементы, которые существенно не затрагивают основные и новые признаки заявленной технологии. Формулировка "состоящий из", исключает любой не указанный элемент.
Использование неопределенных и определенного артикля и подобного в контексте описания элементов (особенно в контексте последующей формулы изобретения) следует рассматривать как включающее и единственное и множественное число, если не оговорено иное в описании или ясно противоречит контексту.
Термины "липофильная группа" и "липофильная часть" в соответствии с использованием в описании относятся к группе, части или заместителю, с большим сродством к неполярной или неводной среде по сравнению с неполярной или водной средой. Например, онлайн словарь Merriam Webster's определяет "липофильный" как "обладающий сродством к липидам (таким как жиры)" Примеры липофильных частей включают алифатические углеводородные радикалы, например, алкильные радикалы, углеводородные ароматические радикалы и ацильные радикалы с длинной цепью; у всех у них увеличивается липофильность с увеличением числа содержащихся атомов углерода. Обычно, добавление липофильной части к определенному соединению увеличивает сродство соединения к октанолу в стандартной методике определения коэффициента распределения октанол/вода; эта методика может быть использована для определения относительной гидрофобности соединения (липофильность) и гидрофильности.
Термин "основание Льюиса" относится к химическому веществу, способному к отдаче электронной пары при определенных реакционных условиях. Основание Льюиса может быть охарактеризовано как донор единственного электрона в определенных комплексах, в зависимости от природы основания Льюиса и иона металла, но для большинства целей, однако, под основанием Льюиса в основном подразумевается донор двух электронов. Примеры соединений оснований Льюиса включают незаряженные соединения, такие как спирты, тиолы и амины и заряженные молекулы, такие как алкоксиды, тиолаты, карбанионы и ряд других органических анионов. В определенных примерах основание Льюиса может состоять из единственного атома, такого как оксид (О2-). При определенных, менее обычных обстоятельствах, основание Льюиса или лиганд может быть положительно заряженным. Основание Льюиса, когда координирует ион металла, обычно упоминается как лиганд.
Термин "лиганд" относится к частице, которая взаимодействует некоторым способом с другой частицей. В одном примере лиганд может быть основанием Льюиса, которое способно к образованию координационной связи с кислотой Льюиса. В других примерах лиганд является частицей, часто органической, которая образует координационную связь с ионом металла. Лиганды, при координации с ионом металла, могут иметь несколько видов связи, известных специалистам в данной области техники, которые включают, например, концевую (то есть связь с единственным ионом металла) и мостиковую (то есть, один атом основания Льюиса, связанный более чем с одним ионом металла).
Термин "хелатирующий агент" относится к молекуле, часто органической, и часто основанию Льюиса, обладающей двумя или более неподеленными электронными парами, способными быть акцептированными ионом металла. Ион металла обычно координирован двумя или большим числом электронных пар хелатирующего агента. Термины "бидентатный хелатирующий агент", "тридентатный хелатирующий агент" и "тетрадентатный хелатирующий агент" известны в современном уровне техники и относятся к хелатирующий агентам, имеющим, соответственно, две, три и четыре электронные пары, доступные для одновременного акцептирования ионом металла, координированным хелатирующим агентом. Обычно, электронные пары хелатирующего агента образует координационные связи с единственным ионом металла; однако, в определенных примерах, хелатирующий агент может образовывать координационные связи более чем с одним ионом металла с рядом возможных типов связи.
Термин "координация" относится к взаимодействию, при котором мультиэлектронный донор пар координационно связан ("координирован") с одним ионом металла.
Термин "комплекс" относится к соединению, образованному объединением одной или более богатых по электронам и обедненных по электронам молекул или атомов, способных существовать отдельно с одной или более молекулами или атомами, обедненными по электронами, каждые из которых также способны существовать отдельно.
Выражение "терапевтически эффективное количество" в соответствии с использованием в описании означает количество соединения, материала или композиции, содержащих соединение, которое эффективно для получения желательного терапевтического эффекта, по меньшей мере, в субпопуляции клеток животного с приемлемым отношением эффект/риск, применимом для любого лечения.
В соответствии с использованием в описании термины "лечение" или "терапия" предназначены для включения также диагноза, профилактики, терапии и лечения. Пациент, получающий эту терапию, является при необходимости любым животным, включая приматов, в частности людей и других млекопитающих, таких как лошади, рогатый скот, свиньи и овцы; и домашняя птица и домашние животные в целом.
Выражение "фармацевтически приемлемый" применяется в описании для обозначения соединений, материалов, композиций и/и форм дозировки, которые являются, в рамках тщательной медицинской оценки, подходящими для использования в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, соразмерного с приемлемым отношением эффект/риск.
Выражение "фармацевтически приемлемый носитель" в соответствии с использованием в описании означает фармацевтически приемлемый материал, композицию или наполнитель, такой как жидкий или твердый наполнитель, разбавитель, эксципиент или материал для инкапсулирования растворителя, вовлеченный в перенос или доставку действующего соединения из одного органа, или части тела, к другому органу или части тела. Каждый носитель должен быть "приемлемым" в смысле совместимости с другими компонентами рецептуры и безвредности для пациента. Некоторые примеры материалов, которые могут служить фармацевтически приемлемыми носителями, включают: (1) сахар, такой как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлоза, и ее производные, такие как натрий карбоксиметилцеллюлоза, эитлцеллюлоза и ацетат целлюлозы; (4) порошковый трагакант; (5) солод; (6) желатин; (7) тальк; (8) формообразующие, такие как масло какао и воск суппозитория; (9) масла, такие как арахисовое масло, хлопковое масло, - сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбитол, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферирующие добавки, такие как гидроксид магния и гидроксид алюминия; (15) альгиновая кислота; (16) апирогенная вода; (17) изотонический раствор; (18) раствор Рингера; (19) этанол; (20) рН буферирующие растворы; (21) сложные полиэфиры, поликарбонаты и/или полиангидриды; и (22) другие нетоксичные совместимые вещества, используемые в фармацевтических композициях.
Формулировки "парентеральное введение" и "введенный парентерально" в соответствии с использованием в описании означают способы введения, отличные от энтерального и локального введения, обычно инъекцией, и включают без ограничения внутривенные, внутримышечные, внутриартериальные, интратекальные, интракапсулярные, внутриглазничные, интракардиальные, интрадермальные, внутрибрюшинные, транстрахеальные, подкожные, подкутикулярные, внутрисуставные, подкапсульные, субарахноидальные, интраспинальные и надчревные инъекции и вливания.
Формулировки "соматическое введение", "вводимый соматически", "периферическое введение" и "вводимый периферически" в соответствии с использованием в описании означает введение соединения, препарата или другого материала, отличающееся от непосредственного введения в центральную нервную систему, таким образом, что оно входит в систему пациента и, таким образом, подвергается метаболизму и другим процессам, например, подкожное введение.
Термин "аминокислота" относится ко всем соединениям природным или синтетическим, которые включают и функциональную аминогруппу и функциональную группу кислоты, включая аналоги аминокислот и производные.
Термин "гетероатом" относится к атому любого элемента кроме углерода или водорода. Примеры гетероатомов включают бор, азот, кислород, фосфор, серу и селен.
В основном термин "замещенный" относится к алкильной или алкенильной группе, как определено далее (например, алкильная группа), в которой одна или более связей с атомом водорода, содержащихся в ней, замещены связью с неводородными или неуглеродными атомами. Замещенные группы также включают группы, в которых одна или более связей с атомом(амии) углерода или водорода, замещены одной или большим числом связей, включая двойные или тройные связи с гетероатомами. Таким образом, замещенная группа замещена одним или большим числом заместителей, если не оговорено иное. В некоторых осуществлениях замещенная группа замещена 1, 2, 3, 4, 5 или 6 заместителями. Примеры групп заместителей включают: галогены (то есть F, Cl, Br и I); гидроксильные; алкокси, алкенокси, алкинокси, арилокси, аралкилокси, гетороциклилиокси и гетероциклилалкокси группы; карбонилы (оксо); карбоксилы; сложные эфиры; уретаны; оксимы; гидроксиламины; алкоксиамины; аралкоксиамины; тиолы; сульфиды; сульфоксиды; сульфоны; сульфонилы; сульфонамиды; амины; N-оксиды; гидразины; гидразиды; гидразоны; азиды; амиды; мочевины; амидины; гуанидины; енамины; имиды; изоцианаты; изотиоцианаты; цианаты; тиоцианаты; имины; нитро группы; нитрилы (то есть CN); и т.п.
Алкильные группы включают алкильные группы с прямой цепью и разветвленной - цепью, 1-12 атомами углерода, и обычно 1-10 углеродов или, в некоторых осуществлениях, 1-8, 1-6 или 1-4 атомами углерода. Примеры алкильной группы с прямой цепью включают группы, такие как метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, н-гептил и н-октил группы. Примеры разветвленных алкильных групп включают, но не ограничены, изопропильной, изобутильной, втор-бутильной, трет-бутильной, неопентильной, изопентильной и 2,2-метилпропильной группой. Алкильные группы могут быть замещенными или незамещенными. Если число атомов углерода не определено, "низший алкил" относится к алкильной группе, определенной выше, но имеющей около 1-10 атомов углерода, альтернативно около 1-6 атомов углерода в структуре его основной цепи. Аналогично у "низшего алкенила", и "низшего алкинила" подобная длина цепи.
Термин "гидроксиалкил", относится к алкильной группе с указанным числом атомов углерода, в которой один или более атомов водорода алкильной группы замещены -ОН группой. Примеры гидроксиалкильных групп включают, но не ограничены, -СН2OН, -СН2СН2OН, -СН2СН2СН2OН, -СН2СН2СН2СН2OН, -СН2СН2СН2СН2СН2OН, -СН2СН2СН2СН2СН2СН2OН, и их разветвленными вариантами.
Термин "аминоалкил" относится к алкильной группе с указанным числом атомов углерода, в которой один или более атомов водорода алкильной группы замещены -NR1R2группой, в которой R1 и R2, каждый независимо относится к водороду, незамещенному (C1-C8) алкилу, незамещенному арилу и арилу, замещенному одним-тремя заместителями, выбранными из галогена, незамещенной алкокси, тиола и CN. Когда R1 и R2присоединены к одному атому азота, они могут быть связаны с атомом азота для формирования 5-, 6- или 7-членного цикла. Неограничивающие примеры аминоалкильных групп включают, но не ограничены, -CH2NH2, -CH2CH2NH2, -CH2CH2CH2NH2, -CH2CH2CH2CH2NH2, -CH2CH2CH2CH2CH2NH2, CH2CH2CH2CH2CH2CH2NH2 и их разветвленными вариантами.
Термин "алкилкарбонил" означает -(С1-С8)алкил-С(O) группу, в которой один или более метиленов в алкильной группе C1-C8 замещены С(O) группой. Представительные примеры включают, но не ограничены, ацетильной, пропионильной и СН3(СН2)2С(O)- группой.
Термины, "циклический алкил" или "циклоалкил", относятся к насыщенным или частично насыщенным неароматическим циклическим алкильным группам с 3-14 атомами углерода и гетероатомами вне кольца с единственным кольцом или полициклическим, включая конденсированные и мостиковые циклические системы. Циклоалкильные или циклические алкильные группы могут быть замещенными или незамещенными. Циклоалкильные или циклические алкильные группы включают моно- би- или трициклические алкильные группы с 3-14 атомами углерода в кольце(цах) или, в некоторых осуществлениях, с 3-12, 3-10, 3-8, или 3-4, 5, 6 или 7 атомов углерода. Примеры моноциклических циклоалкильных групп включают, но не ограничены циклопропильной, циклобутильной, циклопентильной, циклогексильной, циклогептильной и циклооктильной группой. Би- и трициклические системы включают и мостиковые Циклоалкильные группы и конденсированные циклы, такие как, но не ограниченные бицикло[2.1.1]гексаном, адамантилом, декалинилом и т.п.
Алкенильные группы включают прямую и разветвленную цепь и Циклоалкильные группы, как определено выше, за исключением того, что, по меньшей мере, одна двойная связь существует между двумя атомами углерода. Таким образом, алкенильные группы имеют около 2-12 атомов углерода в некоторых осуществлениях, 2-10 атомов углерода в других осуществлениях и 2-8 атомов углерода в других осуществлениях. Примеры включают, но не ограничены винилом, аллилом, -СН=СН(СН3), -СН=С(СН3)2, -С(СH3)=СН2, -С(СН3)=СН(СН3), -С(СН2СН3)=СН2, циклогексенилом, циклопентенилом, циклогексадиенилом, бутадиенилом, пентадиенилом и гексадиенилом среди прочих. Алкенильные группы могут быть замещенными или незамещенными. Примерами замещенных алкенильных групп могут быть монозамещенные или замещенные более одного раза, такие как, но не ограниченные, моно- ди- или три-замещенными заместителями, такими как, указаны выше.
Алкинильные группы включают прямую и разветвленную цепь и Циклоалкильные группы, определенные выше, за исключением того, что, по меньшей мере, одна тройная связь существует между двумя атомами углерода. Примеры (С1-С8)алкинильной группы включают, но не ограничены, ацетиленом, пропином, 1-бутаном, 2-бутином, 1-пентином, 2-пенитом, 1-гексином, 2- гексином, 3-гексином, 1-гептином, 2- гептином, 3- гептином, 1-октином, 2-октином, 3-октином и 4-октином. Актинильная группа может быть незамещенной или необязательно замещенной одним или большим числом заместителей, как описано в заявке далее.
Арильные группы являются циклическими ароматическими углеводородами, которые не содержат гетероатомов. Арильные группы включают моноциклические, бициклические и полициклические системы. Таким образом, арильные группы включают, но не ограничены, фенильной, азуленильной, гепталенильной, бифениленильной, индаценильной, флуоренильной, фенантренильной, трифенилениленильной, пиренильной, нафтаценильной, хризенильной, бифенильной, антраценильной, инеденильной, инданильной, пентаденильной и нафтильной группой. В некоторых осуществлениях арильные группы содержат 6-14 углеродов и в других 6-12 или даже 6-10 атомов углерода в циклических частях групп. Арильная группа включает и замещенные и незамещенные арильные группы. Замещенные арильные группы могут быть монозамещенными или замещенными более одного раза. Например, монозамещенные арильные группы включают, но не ограничены 2-, 3-, 4-, 5- или 6-замещенной фенильной или нафтильной группой, которые могут быть замещены заместителями, такими как указаны выше.
Аралкильные группы являются алкильными группами, определенными выше, в которых связь водорода или углерода алкильной группы заменена связью с арильной группой, определенной выше. В некоторых осуществлениях аралкильные группы содержат 7-20 атомов углерода, 7-14 атомов углерода или 7-10 атомов углерода.
Гетероциклические группы включают неароматические циклические соединения, содержащие 3 или более членов цикла, из которых один или более являются гетероатомом, таким как, но не ограниченным, N, О и S. В некоторых осуществлениях, гетероциклические группы включают 3-20 членов цикла, тогда как другие подобные группы имеют 3-6, 3-10, 3-12 или 3-15 членов цикла. Гетероциклические группы включают ненасыщенные, частично насыщенные и насыщенные циклические системы, такие как, например, имидазолильные, имидазолинильные и имидазолидинильные группы. Гетероциклические группы могут быть замещенными или незамещенными. Гетероциклические группы включают, но не ограничены, азиридинильной, азетидинильной, пирролидинильной, имидазолидинильной, пиразолидинильной, тиазолидинильной, тетрагидротиофенильной, тетрагидрофуранильной, диоксолильной, фуранильной, тиофенильной, пирролильной, пирролинильной, имидазолильной, имидазолинильной, пиразолильной, пиразолинильной, тиазолильной, тетразолильной, оксазолильной, изоксазолильной, тиазолильной, тиазолинильной, изотиазолильной, тиадиазолильной, оксадиазолильной, пиперидильной, пиперазинильной, морфолильной, тиоморфолильной, тетрагидропиранильной, тетрагидротиопиранильной, оксатиановой, диоксильной, дитианильной, пиранильной, пиридильной, пиримидильной, пиридазинильной, пиразинильной, триазинильной, дигидропиридильной, дигидротиинильной, дигидротионильной, гомопиперазинильной, хинуклидильной, индолильной, индолинильной, изоиндолильной, азаиндолильной (пирролопиридильной), индазолильной, индолизинильной, бензотиазолильной, бензимидазолильной, бензофуранильной, бензотиофенильной, бензтиазолильной, бензоксадиазолильной, бензоксазинильной, бензодитиинильной, бензоксатиинильной, бензотиазинильной, бензоксазолильной, бензотиазолильной, бензотиадиазолильной, бензо[1,3]диоксолильной, пиразолопиридильной, имидазопиридильной (азабензимидазолильной), триазолопиридильной, изоксазолопиридильной, пуринильной, ксантинильной, аденинильной, гуанинильной, хинолинильной, изохинолинильной, хинолизинильной, хиноксалинильной, хиназолинильной, циннолинильной, фталазинильной, нафтиридинильной, птеридинильной, тианафталенильной, дигидробензотиазинильной, дигидробензофуранильной, дигидроиндолильной, дигидробензодиоксинильной, тетрагидроиндолильной, тетрагидроиндазолильной, тетрагидробензимидазолильной, тетрагидробензотиазолильной, тетрагидропирролопиридильной, тетрагидропиразолопиридильной, тетрагидроимидазопиридильной, тетрагидротриазолопиридильной и тетрагидрохинолинильной группами. Гетероциклические группы могут быть замещенными или незамещенными. Примером замещенных гетероциклических групп могут быть монозамещенные или замещенные более одного раза, такие как, но не ограниченные пиридильной или морфолильной группами, которые являются 2-, 3-, 4-, 5- или 6-замещенными, или дважды замещенными различными заместителями, такими как указаны выше.
Гетероарильные группы являются циклическими ароматическими соединениями, содержащими 5 или более членов цикла, из которых, один или более являются гетероатомом таким как, но не ограниченными N, О и S. Гетероарильные группы могут быть замещенными или незамещенными. Гетероарильные группы включают, но не ограничены группами, такими как пирролильная, пиразолильная, тиазолильная, тетразолильная, оксазолильная, изоксазолильная, тиазолильная, пиридильная, пиридазинильная, пиримидильная, пиразинильная, тиофенильная, бензотиофенильная, фуранильная, бензофуранильная, индолильная, азаиндолильная (пирролопиридильная), индазолильная, бензимидазолильная, имидазопиридильная (азабензимидазолильная), пиразолопиридильная, триизолопиридильная, бензотиазолильная, бензоксазолильная, бензотиазолильная, бензотиадиазолильная, имидазопиридильная, изоксазолопиридильная, тианафталенильная, пуринильная, ксантинильная, аденинильная, гуанинильная, хинолинильная, изохинолинильная, тетрагидрохинолинильная, хиноксалинильная и хиназолинильная группы.
Алкокси группы являются гидроксильными группами (-ОН), в которых связь с атомом водорода замещена на связь с атомом углерода замещенной или незамещенной алкильной группы, определенной выше. Примеры линейных алкокси групп включают, но не ограничены метокси, этокси, пропокси, бутокси, пентокси, гексокси и т.п. Примеры разветвленных алкокси групп включают, но не ограничены изопропокси, втор-бутокси, трет-бутокси, изопентокси, изогексокси и т.п. Примеры циклоалкокси групп включают, но не ограничены циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и т.п. Алкокси группы могут быть замещенными или незамещенными. Примером замещенных алкокси групп могут быть замещенные одним или большим числом заместителей, такими как указаны выше.
Термины "полициклил" или "полициклическая группа" относятся к двум или большему числу циклов (например, циклоалкилы, циклоалкенилы, циклоалкинилы, арилы и/или гетероциклилы), в котором два или более атомов углерода являются общими для двух смежных циклов, например, "конденсированные циклы". Циклы, связанные через несмежные атомы, называют "мостиковыми" циклами. Каждый цикл полицикла может быть замещен такими заместителями, как описаны выше, как, например, галоген, алкил, аралкил, алкенил, алкинил, циклоалкил, гидроксил, амино, моноалкиламино, диалкиламино, нитро, сульфгидрил, имино, амидо, фосфонат, фосфинат, карбонил, карбоксил, силил, простой эфир, алкилтио, сульфонил, кетон, альдегид, сложный эфир, гетероциклическая, ароматическая или гетероароматическая группа, -CF3, -CN или подобные.
Термин "карбоцикл" относится к ароматическому или неароматическому циклу, в котором каждый атом цикла является углеродом.
Термин "нитро" относится к -NO2;
термин "галоген" является принятым в данной области техники и относится к -F, -Сl, -Br или -I;
термин "сульфгидрил" является принятым в данной области техники и относится к -SH;
термин "гидроксил" означает -ОН и термин "сульфонил" является принятым в данной области техники и относится к -SO2-.
"Галид" определяет соответствующий анион галогенов и определение "псевдогалида" сформулировано на с.560 "Современной Неорганической Химии" Коттона и Уилкинсона (Advanced Inorganic Chemistry, Cotton and Wilkinson).
Термин "амин или амино" относится к -NRcRd группе, в которой Rc и Rd каждый независимо относится к водороду, (C1-C8) алкилу, арилу, гетероарилу и гетероциклоалкилу. Когда R0 и R1 связаны с одним атомом азота, они могут быть связаны с атомом азота, для формирования 5-, 6- или 7-членного цикла. Например, -NRcRd может включать цикл 1-пирролидинила, пиридинила или 4-морфолила.
Термин "амидо" является принятым в данной области техники как амино замещенный карбонил, и включает часть, - которая может быть представлена общей формулой -C(O)NRcRd группы, в которой Rc и Rd определены выше. Согласно некоторым осуществлениям, амид не включает имиды, которые могут быть нестабильными.
Термины "карбоксил" и "карбоксилат", включают такие группы, которые могут быть представлены общими формулами:


где Е является связью или представляет О или S, и Rf и Rf' независимо являются Н, алкилом, алкенилом, арилом или фармацевтически приемлемой солью. Когда Е является О, и Rf как определен выше, группа относится в описании к карбоксильной группе, и, в частности, когда R является водородом, формула представляет "карбоновую кислоту". Обычно, когда явно обозначенный кислород заменен серой, формула представляет "тиокарбонильную" группу.
Термины "алкоксил" или "алкокси" относятся к алкильной группе, определенной выше, со связанным с ней кислородным радикалом. Примеры алкоксильной группы включают метокси, этокси, пропокси, бутокси, трет-бутокси и т.п.
"Простой эфир" представляет собой два углеводорода, ковалентно связанные кислородом. "Простой эфир" также включает полиэфиры, где больше чем одна эфирная группа или связь может присутствовать в данной группе. "Простой эфир" также включает циклические эфиры и краун-эфиры, где эфирная связь находится в циклической группе.
Термин "сульфонат" относится к группе, которая может быть представлена общей формулой -S(O)2ORg, в которой Rg является электронной парой, водородом, алкилом, циклоалкилом или арилом. Термин "сульфат" включает группу, которая может быть представлена общей формулой -OS(O)2ORg, в которой Rg определен выше. Термин "сульфонамидо" включает группу, которая может быть представлена общей формулой: -N(Rf)S(O)2ORf', в которой Rf и Rf' определены выше. Термин "сульфамид" относится к группе, которая может быть представлена общей формулой -S(O)2NReRf, в которой Re и Rf являются водородом, (C1-C8) алкилом или арилом. Термин "сульфонил" относится к группе, которая может быть представлена общей формулой: -S(O)2Rh, в которой Rh является одним из следующих: водород, алкил, алкенил, алкинил, циклоалкил, гетероциклил, арил или гетероарил.
Определение каждой формулировки, например алкил, m, n, и т.п., когда они встречаются более одного раза в любой структуре, считаются независимыми от их определения в другом месте той же структуры.
Термины трифлил, тозил, мезил и нонафлил относятся к трифторметансульфонильной, p-толулосульфонильной, метансульфонильной и нонафторбутансульфонильной группе, соответственно. Термины трифлат, тозилат, мезилат и нонафлат являются принятым в данной области техники и относятся к функциональным группам эфира трифторметансульфоната, эфира p-толуолсульфоната, эфира метасульфоната и эфира нонафторбутансульфоната и соответственно молекулам, которые содержат группы. Аббревиатуры Me, Et, Ph, Tf, Nf, Ts и Ms представляют метил, этил, фенил, трифторметансульфонил, нонафторбутансульфонил, p-толуолсульфонил и метансульфонил, соответственно. Более подробный список сокращений, используемых химиками органиками специалистами в данной области техники, выходит в первом выпуске каждого тома Журнала Органической Химии (Journal of Organic Chemistry): этот список обычно представлен в таблице, названной стандартный список аббревиатур.
Некоторые соединения, содержащиеся в композициях, могут существовать в особых геометрических или стереоизомерных формах. Кроме того, соединения также могут быть оптически активными. Соединения также могут включать цис- и трансизомеры, R- и S-энантиомеры, диастереомеры, (D)-изомеры, (L)-изомеры, их рацемические смеси и их другие смеси. Дополнительные асимметрические атомы углерода могут присутствовать в заместителе, таком как алкильная группа. Если, например, необходим определенный энантиомер соединения, оно может быть получено асимметричным синтезом, или производным с хиральным вспомогательным элементов, где получающаяся диастереомерная смесь отделяется, и вспомогательную группу отщепляют для получения чистых искомых энантиомеров. Альтернативно, когда молекула содержит основную функциональную группу такую как амино, или кислую функциональную группу, такую как карбоксил, диастереомерные соли формируют с соответствующей оптически активной кислотой или основанием с последующим разделением диастереомеров, полученных таким образом, фракционной кристаллизацией или хроматографическими средствами, известного уровня техники, и последующим выделением чистых энантиомеров.
Выражение "защитная группа" в соответствии с использованием в описании означает временные заместители, которые защищают потенциально реакционноспособную функциональную группу от нежеланных химических превращений. Примеры таких защитных группы включают эфиры карбоновых кислот, силильные эфиры спиртов и ацетали и кетали альдегидов и кетонов соответственно. Область химии защитных групп представлена в обзоре (Грин Т.В. Вате П.Дж.М. (Greene, T.W.; Wuts, P.G.M.) Защитные Группы в Органическом Синтезе (Protective Groups in OrganicSynthesis), 3-е издание; Wiley: Нью-Йорк, 1999).
Если не оговорено иное, "стереоизомер" означает один стереоизомер соединения, которое по существу свободно от других стереоизомеров этого соединения. Таким образом, стереометрически чистое соединение с одним хиральным центром, будет по существу свободно от противоположного энантиомера соединения. Стереометрически чистое соединение с двумя хиральными центрами, будет по существу свободно от других диастереомеров соединения. Обычное стереометрически чистое соединение включает более около 80% масс. одного стереоизомера соединения и менее около 20% масс. других стереоизомеров соединения, например более около 90% масс. одного стереоизомера соединения и менее около 10% масс. других стереоизомеров соединения, или более около 95% масс. одного стереоизомера соединения и менее около 5% масс. других стереоизомеров соединения или более около 97% масс. одного стереоизомера соединения и менее около 3% масс. других стереоизомеров соединения.
Если имеется несоответствие между изображением структуры и названием, данным этой структуре, то изображение структуры является приоритетным. Дополнительно, если стереохимия структуры или части структуры не указана, например, жирными или прерывистыми линиями, структура или часть структуры должны интерпретироваться как включающие все его стереоизомеры.
Хелатные соединения и их синтез
В одном аспекте предложено соединение формулы I, фармацевтически приемлемые его соли и сольваты:
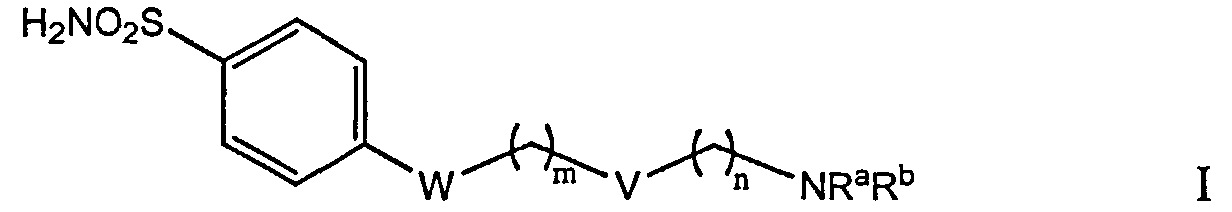
Согласно некоторым осуществлениям формулы I, W является связью, (C1-C8) алкилом, (C2-C8) алкенилом, арилом, гетероарилом, -NHC(O), мочевиной (-NH-C(O)-NH-) или тиомочевиной (-NH-C(S)-NH-); V является связью, (C1-C8) алкилом, (С2-С8) алкенилом, арилом, гетероарилом, -NHC(O), мочевиной (-NH-C(O)-NH-) или тиомочевинной (-NH-C(S)-NH-); m является целым числом 0-15, и n является целым числом 0-15. В некоторых осуществлениях, W и V оба не являются мочевиной или тиомочевинной.
Группа NRaRb формулы I является одной из следующих хелатных групп, где Rtявляется Н, алкильной группой C1-R8, ионом аммония или ионом щелочного или щелочноземельного металла; и Rv является алкилом:

или
Согласно некоторым осуществлениям, Rv является метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом или трет-бутилом. В других осуществлениях У является метилом. В некоторых осуществлениях каждый Rv независимо является Н или трет-бутилом. В других осуществлениях Rt является Н.
Согласно некоторым осуществлениям группа NRaRb соединения формулы I представляет собой:

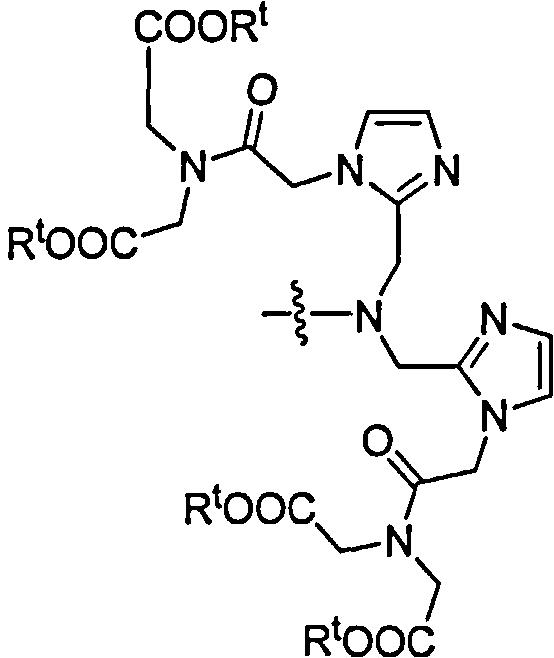
В осуществлениях, где NRaRb является бис(метилен)бис(1Н-имидазол-2,1-диил))диуксусной кислотой, соединение формулы I не является 2,2'-(2,2'-(8-(3-(4-сульфамоилфенил)тиоуреидо)октилазандиил)-бис(метилен)бис(1Н-имидазол-2,1-диил))диуксусной кислотой; 2,2'-(2,2(4-сульфамоилфенилазандиил)-бис(1Н-имидазол-2,1-диил))диуксусной кислотой; или 2,2'-(2,2'-(5-(4-сульфамоилбензамидо)пентилазандиил)-бис(метилен)бис(1Н-имидазол-2,1-диил))диуксусной кислотой.
Согласно различным осуществлениям группа NRaRb соединения может дополнительно образовывать хелат с металлом. В некоторых осуществлениях металл является радионуклидом. Например, металл может быть технецием-99m или рением-186m/188m. Комплексы, такие как [NEt4]2[MBr3(СО)3]; М является Тc или Re, может взаимодействовать с соединениями формулы I в спиртовом растворителе для получения хелатных соединений формулы "1-М", как описано далее.
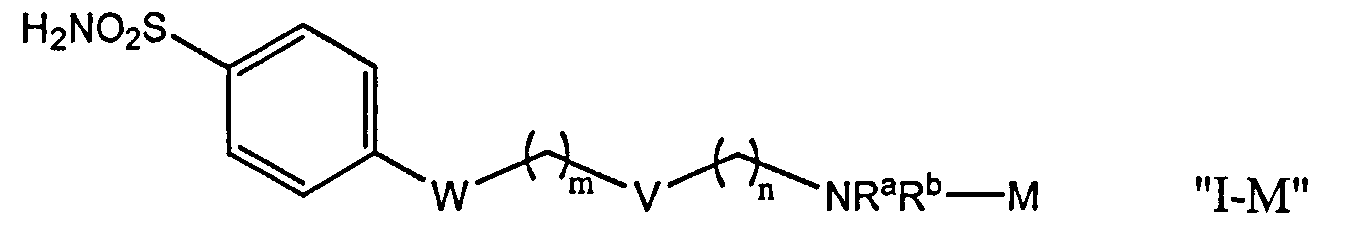
Примеры соединения формулы "IM", включают, но не ограничены ни одним из следующих соединений:
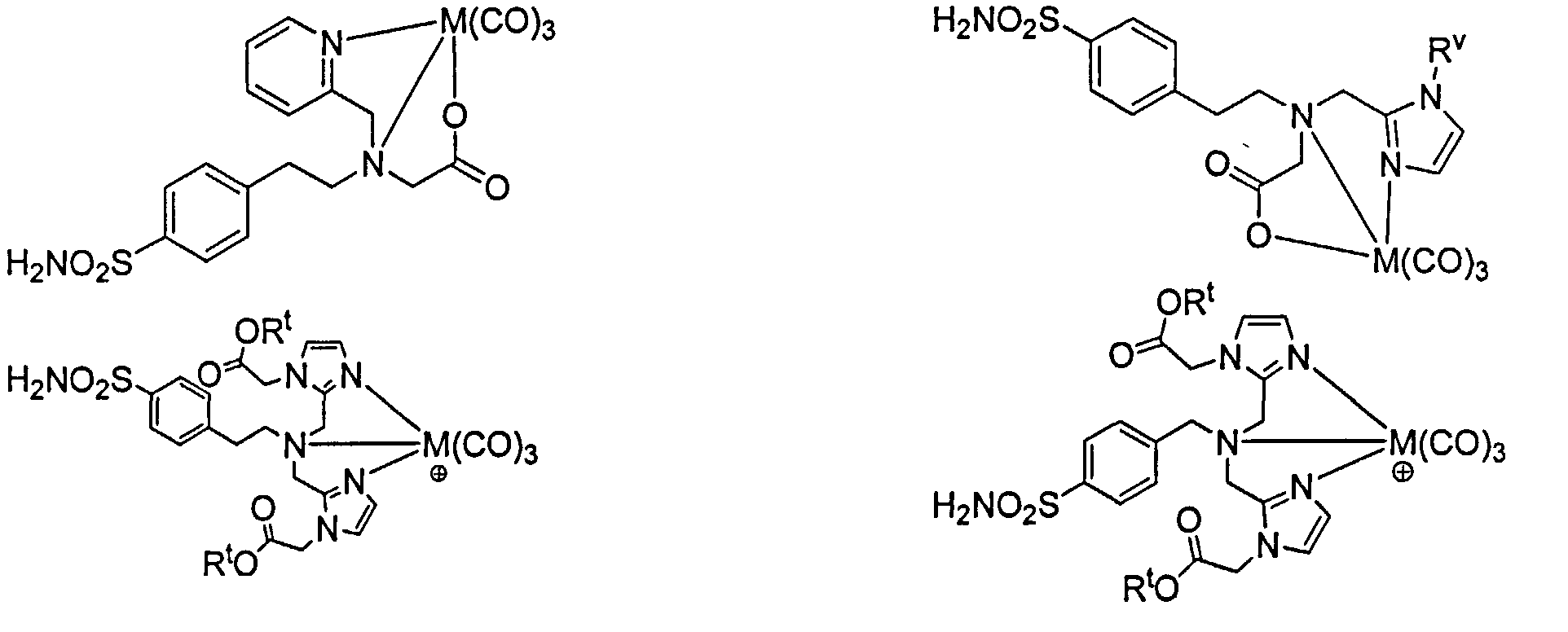

при условии, что комплекс формулы "I-М" не является:


[Re(СО)3][2-(2-((((1Н-имидазол-2-ил)метил)(4-сульфамоилфенил)-амино)метил)-1Н-имидазол-1-ил)уксусной кислотой],

[Тс(СО)3][2-(2-((((1H-имидазол-2-ил)метил)(4-сульфамоилфенил)-амино)метил)-1Н-имидазол-1-ил)уксусной кислотой]:
или

[Re(СО)3[2,2'-(8-(3-(4-сульфамоилфенил)тиоуреидо)октилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил))диуксусной кислотой.
В некоторых осуществлениях также предложены фармацевтически приемлемые соли, сольваты, стереоизомеры, таутомеры и пролекарства таких соединений. В другом осуществлении фармацевтическая композиция включает соединение формулы "1-М" и фармацевтически приемлемый эксципиент.
В другом аспекте предложено соединение формулы II, так же как фармацевтически приемлемые его соли и сольваты.
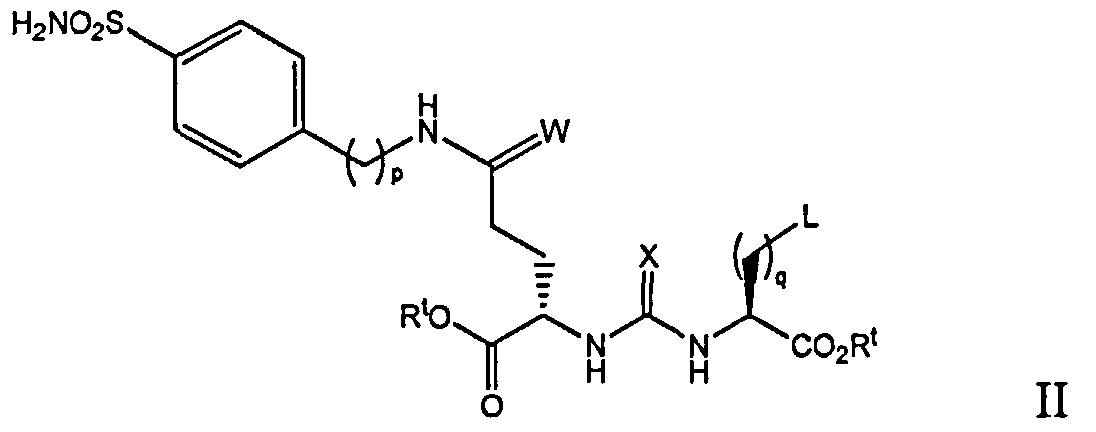
В Формуле II L является группой NRaRb, определенной выше для формулы I, или группой формулы

где йод может быть в орто, мета или пара положении к карбоксамидной группе; W и Х независимо являются кислородом или серой; каждый Rt независимо является Н, алкильной группой C1-C8, ионом аммония или ионом щелочного или щелочноземельного металла; р является целым числом 0-5; и q является целым числом 0-8. В некоторых осуществлениях каждый Rt независимо является Н или трет-бутилом. В других осуществлениях Rt является Н. В некоторых осуществлениях, W и Х оба представляют собой кислород. В некоторых осуществлениях, где L является группой формулы
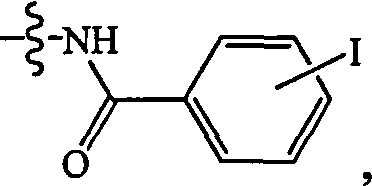
йод является радиоактивным изотопом йода, например, 1-123 или 1-131. В некоторых осуществлениях L является группой формулы
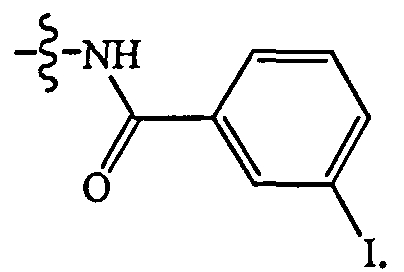
Согласно некоторым осуществлениям соединение формулы II, в которой L является 3-йодбензамидом, йод является радиоактивным изотопом, например, 1-123 или I-131, и может быть использован в терапевтических препаратах для лечения рака. Согласно другому аспекту также предложена фармацевтическая композиция, которая включает 3-йодбензамидный аналог соединения формулы II, и фармацевтически приемлемый эксципиент для лечения рака.
Согласно различным осуществлениям соединения могут быть дополнительно хелатированы с металлом для получения комплекса. В некоторых осуществлениях металл является радионуклидом. Например, металл может быть технецием-99т, или рением-186/188. Комплексы, такие как [NE4]2[MBr3(СО)3]; М является Тc или Re, могут взаимодействовать с соединениями формулы II в спиртовом растворителе для получения хелатированных соединений формулы II-M, как описано далее.

Примеры соединений формулы II и II-М, включают, но не ограничены ни одним из следующих соединений:

В некоторых осуществлениях предложены фармацевтически приемлемые соли, сольваты, стереоизомеры, таутомеры и пролекарства соединений формулы II-M. В другом осуществлении фармацевтическая композиция включает соединение формулы II-М и фармацевтически приемлемый эксципиент.
В другом аспекте предложено соединение формулы III, фармацевтически приемлемые ее соли или сольваты:

Согласно формуле III, Rt определенный выше; d является целым числом 0-5, е является целым числом 0-8; J является необязательно замещенной арильной группой; и La является группой NRaRb, определенной выше для формулы I, или группой формулы

Согласно некоторым осуществлениям J является фенилом, нафтилом, или антраценом. В одном осуществлении J является монозамещенным или дизамещенным фенилом. Например, фенил может быть замещен I, (C1-C8) алкилом, (С1-C8) алкенилом, -CN, -NO2, -ОН, -SH, -SO2NH2 или -NRcRd, где R0 и Rd независимо являются Н, (C1-С4) алкилом, или арилом. Когда J является дизамещенным, дополнительный заместитель R" является (C1-C8) алкилом, (С2-C8) алкенилом, -ОН, -SH или галогеном. Кроме того, группа дополнительного заместителя может быть или орто, мета или пара относительно группы первого заместителя. Кроме того, один или более заместителей могут быть модифицированы добавлением одной или более других групп.
Иллюстративные примеры соединения формулы III, включают, но не ограничены:

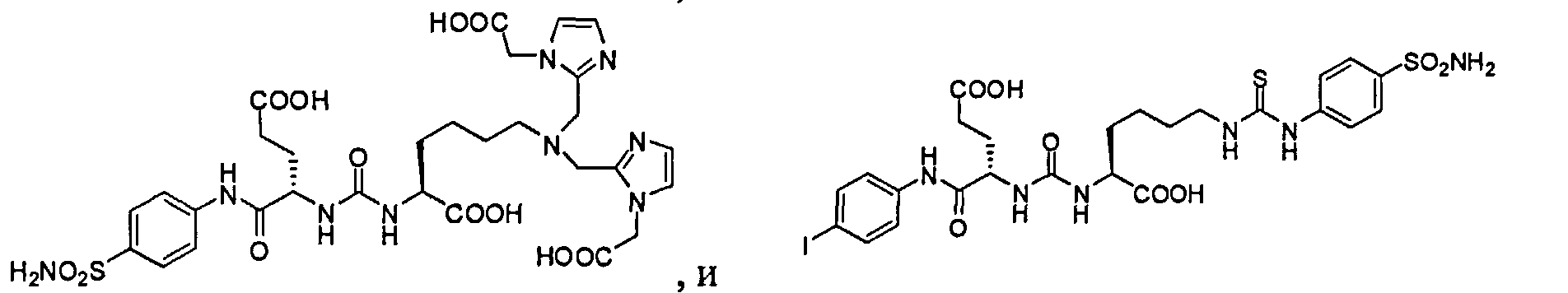
Согласно различным осуществлениям соединения формулы III могут далее быть дополнительно хелатированы с металлом, где La представляет собой -NRaRb хелатную группу, определенную выше. В некоторых осуществлениях металл является радионуклидом. Например, металл может быть технецием-99m, или рением-186/188.
Комплексы, такие как [NEt4]2[MBr3(СО)3]; М. является Тc или Re, могут взаимодействовать с соединениями формулы III в спиртовом растворителе для получения хелатных соединений формулы III-M, как описано далее.

Примеры хелатированных соединений формулы III-M, включают, но не ограничены:
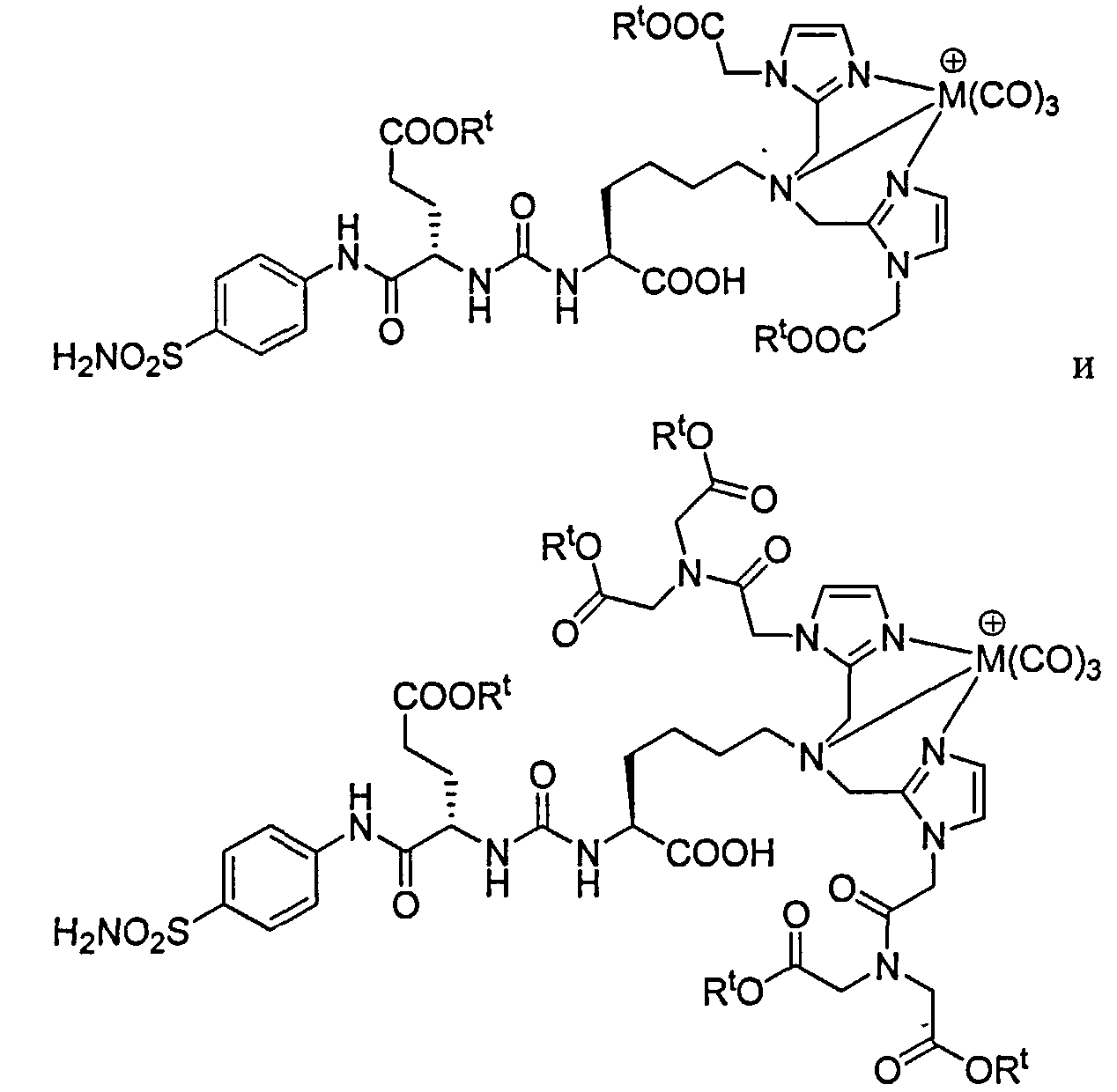
В другом аспекте предложено соединение формулы IV:
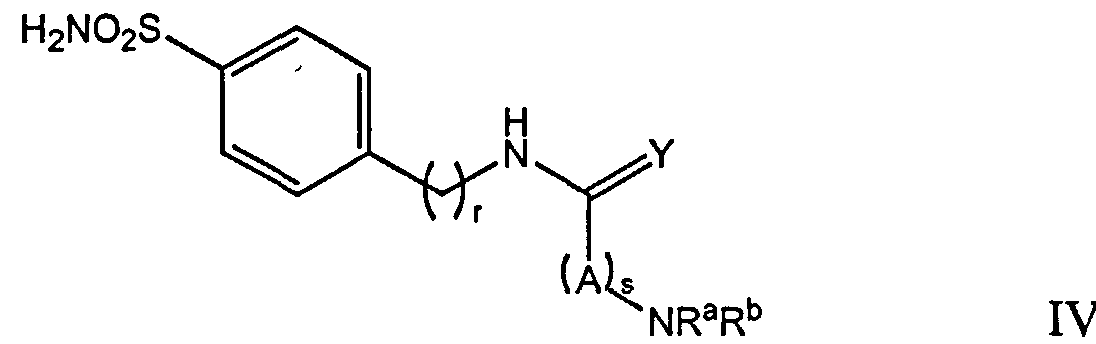
где NRaRb определенный выше для соединения формулы I; Y является О или S; А является (C1-C8) алкилом, -(СН2)х(ОСН2СН2)у- или -(ОСН2СН2)у(СН2)х-; х и у независимые целые числа 0-3; r целое число 0-5; и s целое число 0-5.
Согласно различным осуществлениям группа NRaRb соединения может дополнительно образовывать хелат с металлом. В некоторых осуществлениях металл является радионуклидом. Например, металл может быть технецием-99т, или рением-186m/188m. Комплексы, такие как [NEt4]2[MBr3(СО)3]; М является Тc или Re, могут взаимодействовать с соединениями формулы IV в спиртовом растворителе для получения хелатных соединений формулы IV-М, как описано далее.

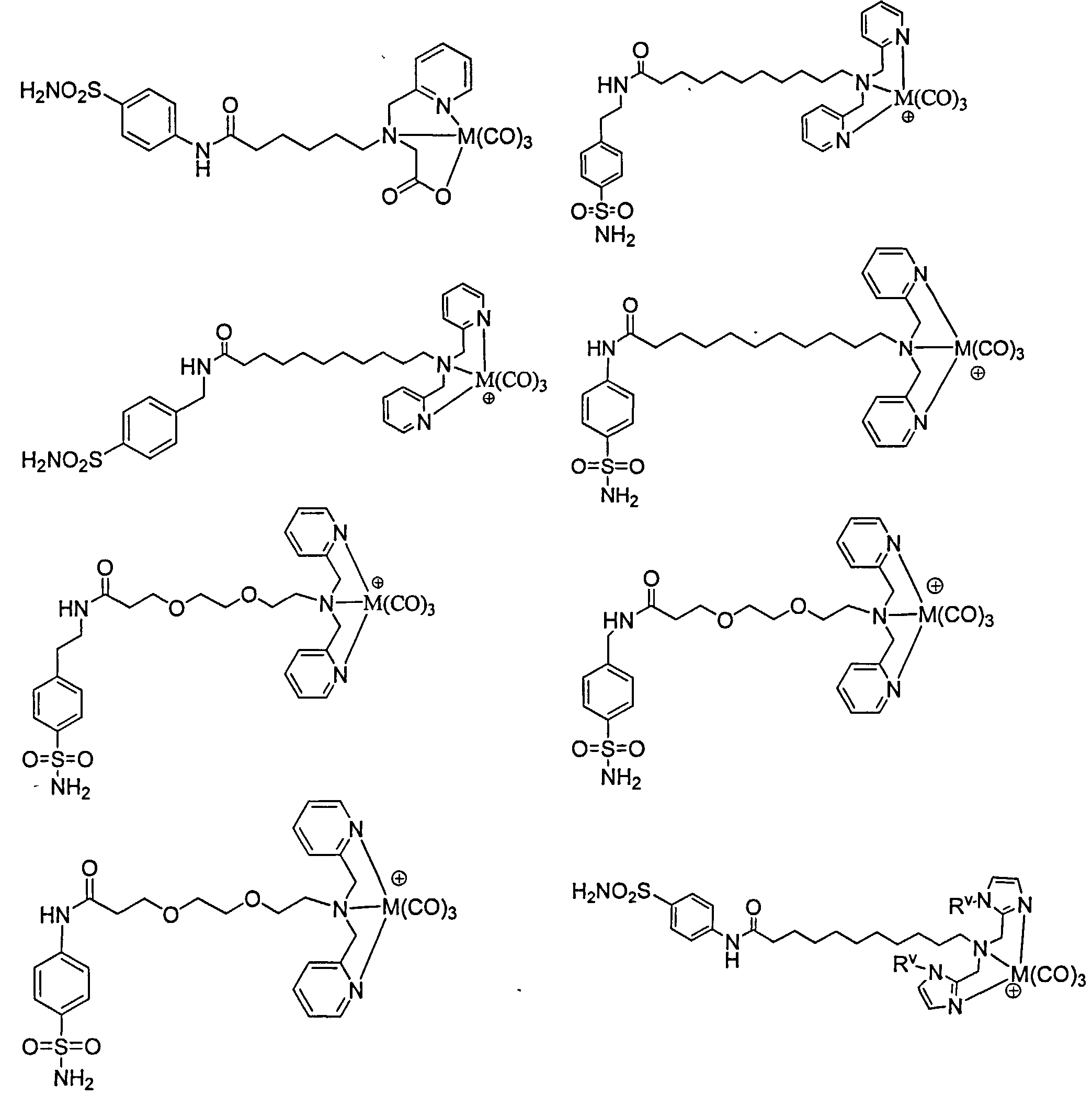
Примеры соединений формулы IV-M включают, но не ограничены

Фармацевтические составы
Соединения формул I-М, II-M, III-M и IV-M могут содержать один или более радионуклидов, которые являются подходящими для использования в качестве средств радионуклидной визуализации и терапии для лечения быстро пролиферирующих клеток. Соответственно в одном осуществлении предложена фармацевтическая композиция, включающая соединение формулы I-М, II-M, III-M и IV-M, ее соль, сольват, стереоизомер или таутомер и фармацевтически приемлемый носитель.
В основном соединения формул I-М, II-M, III-M и IV-M, или их фармацевтические композиции могут применяться орально или парентерально, обычно инъекцией. Парентеральные пути включают, но не ограничены, внутривенными, внутримышечными, внутриартериальными, интратекалными, внутрикапсульными, внутриглазничными, внутрисердечными, внутрикожными, внутрибрюшинными, транстрахеальными, подкожными, подкутикулярными, внутрисуставными, подкапсульными, субарахноидальными, интраспинальными и надчревными инъекцией и вливанием. В некоторых осуществлениях соединение или его фармацевтическая композиция вводятся орально. Такие соединения могут быть в форме таблеток, пилюль, капсул, полужидких продуктов, порошков, растворов, суспензий, эликсиров, аэрозолей или любых других подходящих композиций.
Согласно другому аспекту предложена фармацевтическая композиция, который является подходящей для визуализации в организме. Такие подходящие фармацевтические композиции содержат средство визуализации, в котором присутствует радионуклид или в качестве элемента, от. е. радиоактивный йод, или в качестве хелата радиоактивного металла, соответственно соединения формул I, II, III или IV, в количестве, достаточном для визуализации, вместе с фармацевтически приемлемым радиологическим носителем. Радиологический носитель должен быть подходящим для инъекции или аспирации, таким как альбумин сыворотки человека; водные буферные растворы, например трис(гидрометил)аминометан (и его соли), фосфат, цитрат, бикарбонат, и т.д.; стерильная вода; физиологический раствор; и сбалансированные ионные растворы, содержащие хлорид и или соли бикарбоната или нормальные катионы плазмы крови, такие как кальций, калий, натрий и магний.
Концентрация средства визуализации в радиологическом носителе должна быть достаточной для обеспечения удовлетворительной визуализации. Например, при использовании водного раствора, дозировка составляет около 1,0-50 мКюри. Средство визуализации следует вводить так, чтобы оставалось в пациенте в течение около 1-3 часов, хотя и более длительные и более короткие периоды времени являются приемлемыми. Поэтому, могут быть изготовлены удобные ампулы, содержащие 1-10 мл водного раствора.
Визуализация может быть выполнена обычным путем, например введением достаточного количества средства визуализации для обеспечения адекватной визуализации с последующим сканированием подходящим аппаратом, например, гамма камерой. В определенных осуществлениях способ визуализации области тела пациента включает стадии: введение пациенту диагностически эффективного количества соединения, связанного в комплекс с радионуклидом; облучение области тела пациента; и визуализации области тела пациента. В определенных осуществлениях визуализируемыми областями тела являются голова или грудная клетка.
Настоящее изобретение, описанное таким образом в целом, будет легче понято со ссылкой на следующие примеры, которые представлены для иллюстрации и не предназначены для ограничения настоящего изобретения.
Примеры
Общие методы синтеза
Общая методика алкилирования имидазол-2-карбоксальдегида. К раствору имидазол-2-карбоксальдегида, растворенного в ДМФА (1 мл), добавляют 1 эквивалент алкилбромида, избыток карбоната калия и каталитическое количество йодида калия. Реакционную смесь нагревают до 110°С 18 ч, с последующим выпариванием досуха и очисткой с использованием Biotage SP4 методом градиента метанола 5-50% в ДХМ.
Общая методика образования гомогенного хелатора восстановительным аминированием. В обычной методике раствор искомого амина, растворенного в ДХЭ (2 мл), добавляют к 2,1 эквивалента альдегида. Реакционную смесь нагревают до 50°С в течение одного часа, с последующим добавлением триацетоксиборогидрида натрия (36 мг, 0,19 ммоль). После перемешивания при комнатной температуре 12 ч раствор выпаривают досуха и очищают с использованием Biotage SP4; с градиентом метанола 5-50% в ДХМ. Защитную группу очищенного соединения (24 мг, 0,034 ммоль) удаляют обработкой пиперидин/ДМФА 1:1 (1 мл), при комнатной температуре 2 ч, с последующим выпариванием досуха. Остаток растворяют в ДХМ и экстрагируют водой. Водный слой реэкстрагируют избытком ДХМ. Испарение органического слоя дает искомые соединения в виде грязно-белых твердых веществ.
Общий синтез аналогов бензолсульфонамида с амидной связью. К раствору карбоновой кислоты (1 экв) в ДМФА добавляют ТЭА (2 экв) с последующим добавлением 2-(1-Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат метанаминия (HATU, 1,4 экв), и сульфонамид, соответственно замещенный (1 экв). Реакционную смесь перемешивают при 40°С в течение ночи. Концентрирование с последующей очисткой с использованием Biotage SP4 методом градиента метанола 5-50% в ДХМ дают искомые свободные лиганды.
Общая методика синтез комплексов соединений с металлом. Применяемый в качестве примера в описании рений, используется в качестве металла, принимая во внимание доступность нерадиоактивных изотопов и безопасность сотрудников. Однако следует понимать, что подобные методики синтеза могут быть повторены с использованием технециевых аналогов, поскольку технеций и рений вступают в одинаковые реакции и имеют близкие размеры из-за лантанидного сжатия. Поэтому, когда может быть определенно представлен Re, следует понимать, что также включены комплексы Те.
Если не оговорено иное синтез комплексов Re(I) проводят реакцией [NEt4]2[ReBr3(СО)3] (или [99mТс(CO)3С(H2O)3]+] с соответствующим лигандом (10-6-10-4 М) в отношении 1:1,2 в 10 мл метанола. Закрытую пробирку нагревают и оставляют нагретой при 100°С в течение 4 часов. После охлаждения анализируют чистоту продукта реакции RP-HPLC (Высокоэффективная жидкостная хроматография с обращенными фазами), и продукт очищают с использованием колонки с диоксидом кремния с метанолом в качестве элюента. Радиохимическую чистоту (RCP) после очистки HPLC, приводящей к продуктам "без носителя", определяют HPLC, что постоянно дает ≥ 95%. Хотя начальные результаты введения радиоактивной метки приведены при концентрациях ниже 10-6 М, RCY составляет ≤80%. RCY является аббревиатурой радиохимического выхода. Для достижения RCY> 95% при 75°С, концентрация в реакционной смеси должна была быть повышена до 10-4 М. Во многих случаях соответствующие комплексы Те получают и тестируют на примере комплексов Re для получения нерадиоактивных аналогов для тестирования и обращения.
Примеры синтеза соединений формулы I
Схема 1 является иллюстрацией общего пути синтеза аналогов 4-аминоэтилбензолсульфонамида. Восстановительное аминирование имина, полученного взаимодействием 4-аминоэтилбензолсульфонамида с соответствующим альдегидом, с последующей реакцией тридентатного лиганда с радионуклидом, дает соединения, которые соответствуют формуле I. Схема 1

где (i) 2-pyridinecarboxaldehyde - (1)2-пиридинкарбоксальдегид;
2-pyridinecarboxaldehyde or 1-methyl-1H-imidazole-2-carbaldehyde - 2-пиридинкарбоксальдегид или 1-метил-1 Н-имидазол-2-карбальдегид;
reflux - кипячение с обратным холодильником;
pyridyl - пиридил;
R=N-methylimidazole - К=К-метилимидазол;
R=2-pyridyl; N-methylimidazolyl; 2-qwnolinyl; or acetyl - К=2-пиридил; N-метилимидазолил; 2-хинолинил; или ацетил;
R-2-quinolinyl - R-2-хинолинил;
R=acetyl - R=ацетил
Схема 2 иллюстрирует общий путь синтеза аналогов бензолсульфонамида тиомочевины. Реакция N,N-бис(пиридин-2-илметил)алкил-1,6-диамина с 4-изотиоцианатобензолсульфонамидом с последующий реакцией с радионуклидом дает соответствующие аналоги тиомочевины, которые также соответствуют формуле I.
Схема 2

Пример 1. [Re(СО)3][2-((пиридин-2-илметил)(4-сульфамоилфенэтил)амино)уксусная кислота]:

А. Синтез трет-бутил 2-((пиридин-2-илметил)(4-сульфамоилфенэтил)амино)ацетата и трет-бутил 2,2'-(4-сульфамоилфенэтилазандиил)диацетата:


Раствор 4-(2-аминоэтил)бензолсульфонамида (1,60 г, 8,0 ммоль), АсОН (0,30 мл) и 2-пиридинкарбоксальдегида (0,76 мл, 8,0 ммоль) в ДХЭ (50 мл) нагревают до 75°С в течение 30 минут в атмосфере азота. Реакционную смесь охлаждают до 0°С и последовательно обрабатывают NaBH(OAc)3 (6,36 г, 30 ммоль) и неочищенным трет-бутилглиоксалатом (Яо З., Баумик Дж., Даналекшми С., Пташек М., Родригес, П.А., Линдсей Дж.С. (Yao, Z.; Bhaumik, J.; Dhanalekshmi, S.; Ptaszek, М.; Rodriguez P.A.; Lindsey, J.S.) Tetrahedron, 2007, 63, 10657-10670) (2,08 г). Реакционную смесь перемешивают при комнатной температуре в течение ночи и обрабатывают водой. Реакционную смесь экстрагируют ДХМ. Органический слой высушивают и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле для получения трет-бутил 2-((пиридин-2-илметил)(4-сульфамоилфенэтил)аминоацетата (1,04 г, 32%) и mpem-бутил 2,2'-(4-сульфамоилфенэтилазандиил)диацетата (0,624 г, 18%).1Н ЯМР (400 МГц, CD3OD): трет-бутил 2-((пиридин-2-илметил)(4-сульфамоилфенэтил)амино)ацетат: δ 8,45 (d, J=4,8 Гц, 0,42Н), 8,40 (d, J=4,8 Гц, 0,58Н), 7,83 (t, J=6,4 Гц, 0,42Н), 7,77 (d, J=8,4 Гц, 1,58Н), 7,69 (t, J=8,0 Гц, 0,58Н), 7,56 (d, J=7,6 Гц, 0,58Н), 7,34-7,24 (m, 4H), 5,49 (s, 1H), 4,70 (s, 1H), 3,93 (s, 2H), 2,91 (t, J=6,8 Гц, 2H), 2,83 (t, J=6,8 Гц, 2Н), 1,47 (s, 9H); МСЭР m/z: 406 (М+Н)+.1Н ЯМР (400 МГц, CD3Сl3): трет-бутил 2,2'-(4-сульфамоилфенэтилазандиил)диацетат: δ 7,83 (d, J= 8,4 Гц, 2H), 3,45 (s, 4H), 2,97 (t, J=5,6 Гц, 2H), 2,87 (t, J=6,0 Гц, 2H), 1,49 (s, 18H); МСЭР m/z: 429 (M+H)+.
В. Синтез 2-((пиридин-2-илметил)(4-сульфамоилфенэтил)амино)уксусной кислоты:

К раствору трет-бутил 2-((пиридин-2-илметил)(4-сульфамоилфенэтил)амино)ацетата (150 мг, 0,37 ммоль) в ДХМ (3,0 мл) и ТФУ (3,0 мл) перемешивают при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении для получения 2-((пиридин-2-илметил)(4-сульфамоилфенэтил)амино)уксусной кислоты (129 мг, 100%).1H ЯМР (400 МГц, CD3OD) δ 8,73 (d, J=5,6 Гц, 0,46 Н), 8,58 (d, J=4,4 Гц, 1H), 8,57 (t, J=8,0 Гц, 0,46Н), 8,16 (t, J=7,6 Гц, 1H), 8,01 (d, J=8,4 Гц, 0,54 Н), 7,96 (t, J=6,8 Гц, 0,54Н), 7,79 (d, J=8,4 Гц, 2H), 7,66 (d, J=7,2 Гц, 2H), 7,35 (d, J=8,4 Гц, 2H), 4,51 (s, 2H), 4,06 (s, 2H), 3,36 (t, J=7,6 Гц, 2H), 3,05 (t, J=7,6 Гц, 2H); МСЭР m/z: 355 (M+Н)+.
С. Синтез [Re(СО)3][2-((пиридин-2-илметил)(4-сульфамоилфенэтил)амино)уксусной кислоты]. Раствор 2-((пиридин-2-илметил)(4-сульфамоилфенэтил)амино)уксусной кислоты (61 мг, 0,173 ммоль), [NEt4]2[ReBr3(СО)3] (192 мг, 0,25 ммоль) и K2СО3 (30 мг) в МеОН (6,0 мл) перемешивают при 100°С 5 ч в закрытой пробирке под давлением. Реакционную смесь очищают с использованием смолы Amberchrom™ (CG 161), элюируя МеОН/Н2O для получения указанного соединения (18,9 мг, 18%) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 8,77 (d, J=5,6 Hz, 1H), 8,17 (t, J=7,8 Hz, 1H), 7,79 (d, J=8,0 Hz, 2H), 7,74 (d, J=7,6 Hz, 1H), 7,59 (d, J=8,0 Hz, 2H), 7,58 (d, J=6,0 Hz, 1H), 7.29 (s, 2H), 4,92 (d, J=16,0 Hz, 1H), 4,77 (d, J=16,0 Hz, 1H), 4,10 (d, J=16,4 Hz, 1H), 3,74-3,68 (m, 1H), 3,64-3,58 (m, 1H), 3,53 (d, J=16,8 Hz, 1Н), 3,14-3,08 (m, 2H); МСЭР m/z: 620 (M+H)+.
Пример 2. [Re(СО)3][2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенэтил)-амино)уксусная кислота]:
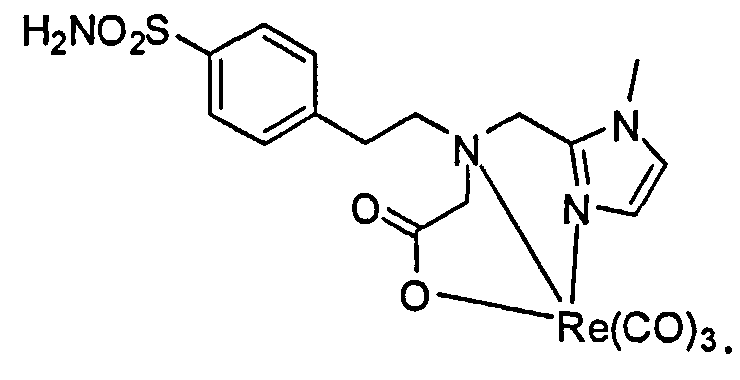
А. Синтез трет-бутил 2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенэтил)амино)ацетата:

Раствор 4-(2-аминоэтил)бензолсульфонамида (1,40 г, 7,0 ммоль), АсОН (0,30 мл) и 1-метил-1Н-имидазол-2-карбоксальдегида (0,77 г, 7,0 ммоль) в ДХЭ (40 мл) нагревают до 80°С в течение 30 минут в атмосфере азота. Реакционную смесь охлаждают до 0°С, и последовательно обрабатывают NaBH(OAc)3 (4,45 г, 21 ммоль) и трет-бутилглиоксалатом (1,80 г). Реакционную смесь перемешивают при комнатной температуре в течение ночи и обрабатывают водой. Реакционную смесь экстрагируют ДХМ и органический слой высушивают и концентрируют при пониженном давлении. Полученный остаток очищают флэш-хроматографией на силикагеле до трет-бутил 2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенэтил)амино)ацетата (0,63 г, 22%).1H ЯМР (400 МГц, ДМСО-d6) δ 7,65 (d, J=8,4 Гц, 2Н), 7,26 (s, 2H), 7,21 (d, J=8,0 Гц, 2Н), 6,99 (d, J=0,8 Гц, 1Н), 6,73 (d, J=0,8 Гц, 1Н), 3,76 (s, 2 Н), 3,38 (s, 3Н), 3,28 (s, 2Н), 2,79 (t, J=7,2 Гц, 2Н), 2,69 (t, J=6,8 Гц, 2Н), 1,40 (s, 9Н); МСЭР m/z: 409 (M+H)+.
В. Синтез [Re(СО)3][2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенэтил)-амино)уксусной кислоты]. Раствор трет-бутил 2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенэтил)амино)ацетата (110 мг, 0,27 ммоль) в ДХМ (3,0 мл) и ТФУ (3,0 мл) перемешивают при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении для получения 2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенэтил)амино)уксусной кислоты. Раствор 2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенэтил)амино)уксусной кислоты, [NEt4]2[ReBr3(СО)3] (270 мг, 0,35 ммоль) и K2СО3 (78 мг) в МеОН (6,0 мл) перемешивают при 90°С 4 ч в пробирке под давлением. Реакционную смесь очищают с использованием смолы Amberchrom™ (CG 161), элюируя МеОН/Н2O для получения указанного соединения (105 мг, 63%) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 7,79 (d, J= 8,0 Гц, 2Н), 7,57 (d, J= 8,0 Гц, 2Н), 7,36 (d, J= 0,8 Гц, 1Н), 7,25 (s, 2Н), 7,15 (d, J=1,2 Гц, 1Н), 4,76 (d, J= 16,4 Гц, 1Н), 4,58 (d, J=16,0 Гц, 1Н), 4,03 (d, J=16,8 Гц, 1Н), 3,67 (d, J=16,8 Гц, 1Н), 3,65-3,49 (m, 2Н), 3,17-3,09 (m, 2Н); МСЭР m/z: 623 (M+H)+.
Пример 3. [Re(CO)3][2,2'-(2,2'-(4-сульфамоилфенэтилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил))диуксусная кислота]:

А. Трет-бутил 2,2'-(2,2'-(4-сульфамоилфенэтилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил))диацетат:

Раствор 4-(2-аминоэтил)бензолсульфонамида (110 мг, 0,55 ммоль), АсОН (0,10 мл) и трет-бутил 2-(2-формил-1Н-имидазол-1-ил)ацетата (250 мг, 1,19 ммоль) в ДХЭ (20 мл) перемешивают при 80°С в течение 30 минут в атмосфере азота. Реакционную смесь охлаждают до 0°С и обрабатывают NaBH(ОАс)3 (0,423 г, 2,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и обрабатывают водой. Реакционную смесь экстрагируют ДХМ. Органический слой высушивают и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле для получения трет-бутил 2,2'-(2,2'-(4-сульфамоилфенэтилазандиил)бис(метилен)бис( 1Н-имидазол-2,1-диил))диацетата (132 мг, 41%).1Н ЯМР (400 МГц, CD3OD) δ 7,75 (d, J=8,4 Гц, 2Н), 7,18 (d, J=8,4 Гц, 2Н), 7,07 (s, 2Н), 6,93 (s, 2Н), 4,58 (s, 4H), 3,68 (s, 4H), 2,84-2,74 (m, 4H), 1,44 (s, 18H); МСЭР m/z: 589,4 (M+H)+.
В. [Re(СО)3][трет-бутил 2,2'-(2,2'-(4-сульфамоилфенэтилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил))диацетат].
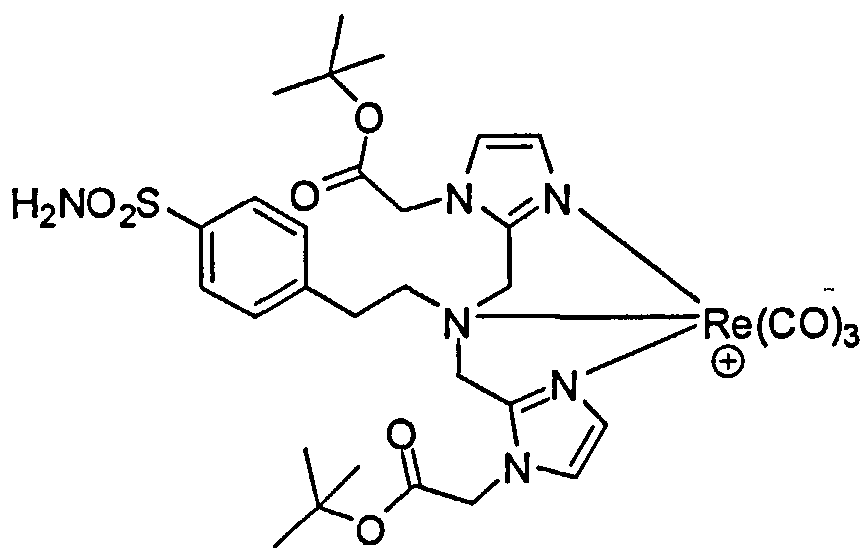
Раствор трет-бутил 2,2'-(2,2'-(4-сульфамоилфенэтилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил))диацетата (65 мг, 0,11 ммоль) и [NEt4]2[ReBr3(СО)3] (92,4 мг, 0,12 ммоль) в МеОН (3,0 мл), перемешивают при 95°С 4 ч в пробирке под давлением. Реакционную смесь очищают на смоле Amberchrom™ (CG 161), элюируя МеОН/Н2O для получения указанного соединения (51 мг, 54%) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 7,81 (d, J=8,4 Гц, 2Н), 7,60 (d, J=8,4 Гц, 2Н), 7,31 (s, 2Н), 7,26 (d, J=1,2 Гц, 2H), 7,12 (d, J=1,2 Гц, 2Н), 4,95 (s, 4H), 4,74 (d, J=16,4 Гц, 2Н), 4,62 (d, J=16,4 Гц, 2Н), 3,90-3,86 (m, 2Н), 3,16-3,14 (m, 2Н), 1,45 (s, 18H); МСЭР m/z: 859,3 M+.
С. [Re(СО)3][2,2'-(2,2'-(4-сульфамоилфенэтилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил))диуксусная кислота]. Раствор [Re(СО)3][трет-бутил 2,2'-(2,2(4-сульфамоилфенэтилазандиил)-бис(метилен)бис(1Н-имидазол-2,1-диил))диацетат] (20 мг) в ТФУ (1,0 мл) и ДХМ (1,0 мл) перемешивают при комнатной температуре 4 ч. Растворитель удаляют при пониженном давлении для получения указанного соединения (21,5 мг).1Н ЯМР (400 МГц, ДМСО-d6) δ 7,81 (d, J=8,0 Гц, 2Н), 7,60 (d, J=8,4 Гц, 2Н), 7,30 (s, 2Н), 7,23 (d, J=1,2 Гц, 2Н), 7,08 (d, J=1,2 Гц, 2Н), 4,91 (s, 4H), 4,72 (s, 4H), 3,89-3,85 (m, 2Н), 3,18-3,14 (m, 2H); МСЭР m/z: 7471,2.
Пример 4. [Re(СО)3][2,2'-(2,2'-(4-сульфамоилбензилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил))диуксусная кислота]:

А. Синтез трет-бутил 2,2'-(2,2'-(4-сульфамоилбензилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил))диацетата:
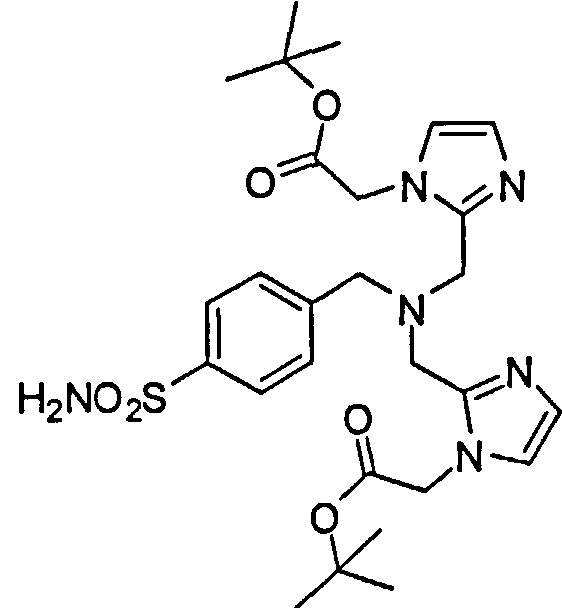
Раствор гидрохлорида 4-(2-аминометил)бензолсульфонамида (223 мг, 1,0 ммоль) и трет-бутил 2-(2-формил-1Н-имидазол-1-ил)ацетата (441 мг, 2,1 ммоль) в ДХЭ (20 мл) перемешивают при 75°С в течение 30 минут в атмосфере азота. Реакционную смесь охлаждают до 0°С и обрабатывают NaBH(OAc)3 (0,633 г, 3,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и обрабатывают водой. Реакционную смесь концентрируют при пониженном давлении. Остаток очищают флеш-хроматографической системой biotage с градиентом МеОН 0-10% в ДХМ до трет-бутил 2,2'-(2,2'-(4-сульфамоилбензилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил))диацетата (569 мг, 99%) в виде желтого масла.1Н ЯМР (400 МГц, CD3Сl3) δ 7,83 (d, J=8,4 Гц, 2Н), 7,41 (d, J=8,4 Гц, 2Н), 6,97 (s, 2Н), 6,82 (s, 2H), 4,66 (s, 2H), 4,43 (s, 2H), 3,83 (s, 1H), 3,73 (s, 1H), 3,61 (s, 2H), 3,48 (s, 4H), 1,39 (s, 18H); MC (ИЭС)(М8 (ESI)), 575,3 (M+H)+.
В. [Re(СО)3][2,2'-(2,2'-(4-сульфамоилбензилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил))диуксусная кислота]. Раствор трет-бутил 2,2'-(2,2'-(4-сульфамоилбензилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил))диацетат (40 мг, 0,070 ммоль) и [NEt4]2[ReBr3(СО)3] (60 мг, 0,077 ммоль) в МеОН (3,0 мл) перемешивают при 90°С 5 ч в пробирке под давлением. Растворитель испаряют при пониженном давлении для получения остатка. Раствор вышеуказанного остатка в ТФУ (3,0 мл) и ДХМ (3,0 мл) перемешивают при комнатной температуре 3 ч. Растворитель удаляют при пониженном давлении до остатка, который очищают HPLC для получения указанного соединения (23 мг, 45% более чем за 2 стадии) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 7,93 (d, J=8,0 Гц, 2H), 7,86 (d, J=8,4 Гц, 2H), 7,47 (s, 2H), 7,14 (d, J=1,2 Гц, 2H), 7,06 (d, J=1,2 Гц, 2H), 4,92 (s, 2H), 4,79 (d, J=16,0 Гц, 2H), 4,76 (s, 4H), 4,20 (d, J=16,0 Гц, 2H); МСЭР m/z: 733,1.
Пример 5. [Re(СО)3][4-(2-(бис (изохинолин-1-илметил)амино)этил)бензолсульфонамид]

А. 4-(2-(бис(изохинолин-1-илметил)амино) этил)бензолсульфонамид:

Раствор 4-(2-аминоэтил)бензолсульфонамида (1,0 г, 5,0 ммоль), АсОН (1,0 мл) и изохинолин-1-карбальдегида (2,09 г, 13,3 ммоль) в ДХЭ (50 мл) перемешивают при 75°С в течение 30 минут в атмосфере азота. Реакционную смесь охлаждают до 0°С и обрабатывают NaBH(ОАс)3 (3,165 г, 15 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и обрабатывают водой. Реакционную смесь экстрагируют ДХМ. Органический слой высушивают и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле для получения 4-(2-(бис(изохинолин-1-илметил)амино)этил)бензолсульфонамида (1,86 г, 77%).1Н ЯМР (400 МГц, ДМСО-d6) δ 8,24 (d, J=8,8 Гц, 2Н), 7,96 (d, J=8,4 Гц, 2Н), 7,91 (d, J=8,0 Гц, 2Н), 7,72 (t, J= 7,8 Гц, 2Н), 7,65 (d, J=8,4 Гц, 2Н), 7,55 (t, J=7,6 Гц, 2Н), 7,50 (d, J= 8,4 Гц, 2Н), 7,30 (d, J=6,0 Гц, 2Н), 7,29 (s, 2Н), 4,01 (s, 4 H), 2,94 (t, J=7,0 Гц, 2Н), 2,78 (t, J=7,0 Гц, 2Н); МСЭР m/z: 483,3 (М+Н)+.
В. [Re(СО)3][4-(2-(бис(изохинолин-1-илметил)амино)этил)бензолсульфонамид]. Раствор 4-(2-(бис(изохинолин-1-илметил)амино)этил)бензолсульфонамида (230 мг, 0,477 ммоль) и [NEt4]2[ReBr3(СО)3] (367 мг, 0,477 ммоль) в МеОН (6,0 мл) перемешивают при 100°С в течение 3 часов в пробирке под давлением. Реакционную смесь очищают смолой Amberchrom™, элюируя МеОН/Н2О для получения продукта (173 мг, 48%) в виде желтого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 8,69 (d, J=8,4 Гц, 2Н), 8,36 (d, J=8,8 Гц, 2Н), 8,12 (d, J=8,4 Гц, 2Н), 7,95 (t, J=7,4 Гц, 2Н), 7,82 (d, J=8,4 Гц, 2Н), 7,75 (t, J=7,6 Гц, 2H), 7,70 (d, J=8,4 Гц, 2H), 7,62 (d, J=8,4 Гц, 2H), 7,34 (s, 2H), 5,46 (d, J=18,0 Гц, 2H), 5,25 (d, J=18,0 Гц, 2H), 4,07-4,03,(m, 2H), 3,32-2,99, (m, 2H), МСЭР m/z: 7534,2 M+.
Пример 6. [Re(СО)3][2-(2-(((карбоксиметил)(4-сульфамоилфенэтил)амино)метил)-1Н-имидазол-1-ил)уксусная кислота]:

А. Трет-бутил 2-(2-(((2-трет-бутокси-2-оксоэтил)(4-сульфамоилфенэтил)амино)метил)-1Н-имидазол-1-ил)ацетат

Раствор 4-(2-аминоэтил)бензолсульфонамида (0,70 г, 3,5 ммоль), АсОН (0,20 мл) и трет-бутил 2-(2-формил-1Н-имидазол-1-ил)ацетат (0,735 г, 3,5 ммоль) в ДХЭ (20 мл) нагревают до 80°С в течение 30 минут в атмосфере азота. Реакционную смесь охлаждают до 0°С и последовательно обрабатывают NaBH(ОАс)3 (2,25 г, 10,5 ммоль) и трет-бутилглиоксиматом (1,80 г). Реакционную смесь перемешивают при комнатной температуре в течение ночи и обрабатывают водой. Реакционную смесь экстрагируют ДХМ и органический слой высушивают и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле для получения трет-бутил 2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенэтил)амино)ацетата (0,63 г, 35%).1Н ЯМР (400 МГц, ДМСО-d6) δ 7,67 (d, J=8,4 Гц, 2H), 7,25 (s, 2H), 7,23 (d, J=8,4 Гц, 2H), 7,04 (d, J=1,2 Гц, 1Н), 6,76 (d, J=1,2 Гц, 1Н), 4,82 (s, 2H), 3,74 (s, 2H), 3,24 (s, 2H), 2,69-2,66 (m, 4H), 1,41 (s, 9H), 1,40 (s, 9H); МСЭР m/z: 509 (M+H)+.
В. [Re(СО)3][2-(2-(((карбоксиметил)(4-сульфамоилфенэтил)амино)метил)-1Н-имидазол-1-ил)уксусная кислота]. Раствор трет-бутил 2-(((1-метил-1Н-имидазол-2-ил)метил)(4-сульфамоилфенэтил)амино)ацетата (40 мг, 0,079 ммоль) в ДХМ (2,0 мл) и ТФУ (2,0 мл) перемешивают при комнатной температуре в течение 3 часов. Растворитель удаляют при пониженном давлении для получения 2-(2-(((карбоксиметил)(4-сульфамоилфенэтил)амино)метил)-1Н-имидазол-1-ил)уксусной кислоты. В растворе 2-(2-(((карбоксиметил)(4-сульфамоилфенэтил)амино)метил)-1H-имидазол-1-ил)уксусной кислоты и [NEt4]2[ReBr3(СО)3] (70 мг, 0,09 ммоль) в МеОН (2,0 мл) и Н2О (2,0 мл) рН доводят до 9 с использованием 2 N NaOH. Смесь перемешивают при 95°С в течение ночи в пробирке под давлением. Реакционную смесь очищают HPLC для получения продукта (20 мг, 38%) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 7,76 (d, J=8,0 Гц, 2Н), 7,57 (d, J=8,0 Гц, 2H), 7,36 (d, J=1,6 Гц, 1H), 7,26 (s, 2H), 7,16 (d, J=1,6 Гц, 1Н), 5,05 (d, J=16,4 Гц, 1H), 4,98 (d, J=16,4 Гц, 1H), 4,73 (d, J=16,0 Гц, 1H), 4,43 (d, J=16,0 Гц, 1H), 4,00 (d, J=16,8 Гц, 1H), 3,60-3,51 (m, 3H), 3,10-3,05 (m, 2H); МСЭР m/z: 667,2 (M+H)+.
Пример 7. [Re(СО)3][2,2'-(4-сульфамоилфенэтилазандиил)диуксусная кислота]:
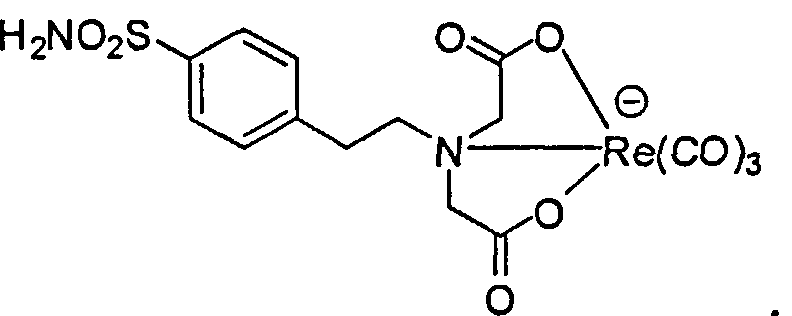
Раствор трет-бутил 2,2'-(4-сульфамоилфенэтилазандиил)диацетата (40 мг, 0,094 ммоль) в ДХМ (2,0 мл) и ТФУ (2,0 мл) перемешивают при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении для получения 2,2'-(4-сульфамоилфенэтилазандиил)диуксусной кислоты. В растворе 2,2'-(4-сульфамоилфенэтилазандиил)диуксусной кислоты и Re(СО)3(Н2O)3OTf (1,5 мл, 0,10 ммоль/мл в воде, 0,15 ммоль) в воде (3,0 мл) значение рН доводят до 9 с использованием 2N NaOH. Смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь очищают HPLC для получения продукта (19,2 мг, 31%) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 7,73 (d, J=8,4 Гц, 2H), 7,53 (d, J=8,4 Гц, 2H), 7,24 (s, 2H), 3,74 (d, J=15,6 Гц, 2H), 3,47 (d, J=15,6 Гц, 2H).
Пример 8. [Re(СО)3][2,2'-(2,2'-(4-сульфамоилфенэтилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил-ацетилазандиил))диуксусная кислота]:

А. Синтез трет-бутил 2,2'-(2-бромацетилазандиил)диацетата
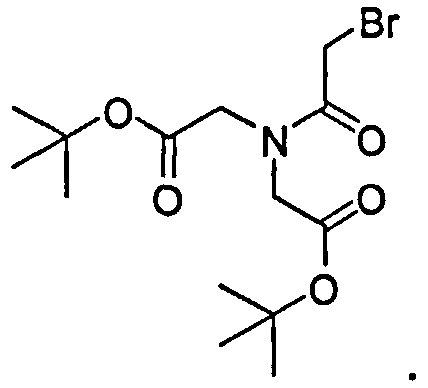
К раствору трет-бутил 2,2'-азандиилдиацетата (3,00 г, 12,24 ммоль) и 2-бромацетилбромида (1,39 мл, 3,23 г, 16,00 ммоль) в ДХМ (100 мл) добавляют Et3N (2,0 мл) при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре 2 ч. Реакционную смесь разбавляют ДХМ (300 мл), промывают водой и высушивают над сульфатом натрия. Растворитель испаряют при пониженном давлении для получения остатка, который очищают Biotage SP4, элюируя 10% гексана в этилацетате до 50% гексана в EtOAc до трет-бутил 2,2'-(2-бромацетилазандиил)диацетата (4,68 г, 100%).1Н ЯМР (400 МГц, CDCl3) δ 4,09 (s, 2H), 4,07 (s, 2H), 3,86 (s, 2H), 1,49 (s, 9H), 1,46 (s, 9H); МСЭР m/z: 388,390 (M+Na)+.
В. Синтез трет-бутил 2,2'-(2-(2-формил-1Н-имидазол-1-ил)ацетилазандиил)диацетата:

Раствор трет-бутил 2,2'-(2-бромацетилазандиил)диацетата (4,55 г, 12,43 ммоль), 1H-имидазол-2-карбальдегида (1,54 г, 16,0 ммоль), DIPEA (5,0 мл) и йодида калия (0,64 г, 4,0 ммоль) перемешивают при 80°С в течение ночи. После испарения растворителя при пониженном давлении реакционную смесь разбавляют ДХМ, промывают водой и высушивают. Растворитель испаряют при пониженном давлении для получения остатка, который очищают с использованием Biotage SP4, элюируя ДХМ - 3% МеОН в ДХМ до трет-бутил 2,2'-(2-(2-формил-1Н-имидазол-1-ил)ацетилазандиил)диацетата (3,96 г, 84%).1Н ЯМР (400 МГц, CDCl3) δ 9,76 (s, 1H), 7,31 (s, 1H), 7,25 (s, 1H), 5,30 (s, 2H), 4,14 (s, 2H), 4,07 (s, 2H), 1,51 (s, 9H), 1,43 (s, 9H); МСЭР m/z: 382 (M+H)+.
С. Синтез трет-бутил 2,2'-(2,2'-(4-сульфамоилфенэтилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил-ацетилазандиил))диацетата:

Раствор 4-(2-аминоэтил)бензолсульфонамид (100 мг, 0,50 ммоль), АсОН (0,10 мл) и трет-бутил 2,2'-(2-(2-формил-1Н-имидазол-1-ил)ацетилазандиил)диацетата (457 мг, 1,2 ммоль) в ДХЭ (30 мл) перемешивают при 75°С в течение 30 минут в атмосфере азота. Реакционную смесь охлаждают до 0°С и обрабатывают NaBH(ОАс)3 (0,423 г, 2,0 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и обрабатывают водой. Реакционную затем экстрагируют ДХМ и органический слой высушивают и концентрируют при пониженном давлении. Остаток очищают Biotage SP4 на силикагеле для получения соединения (465 мг, 100%).1Н ЯМР (400 МГц, ДМСО-d6) δ 7,63 (d, J=8,0 Гц, 2Н), 7,23-7,21 (m, 4Н), 6,96 (s, 2Н), 6,79 (s, 2Н), 5,00 (s, 4H), 4,30 (s, 4H), 3,95 (s, 4H), 3,59 (s, 4H), 2,70-2,66 (m, 2Н), 2,59-2,55 (m, 2Н), 1,42 (s, 18H), 1,33 (s, 18H); МСЭР m/z: 466,4 (M/2+H)+.
D. [Re(СО)3][2,2'-(2,2'-(4-сульфамоилфенэтилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил-ацетилазандиил))диуксусная кислота]. Раствор трет-бутил 2,2'-(2,2'-(4-сульфамоилфенэтилазандиил)бис(метилен)бис(1Н-имидазол-2,1-диил-ацетилазандиил))диацетата (32 мг, 0,34 ммоль) и [NEt4]2[ReBr3(СО)3] (30 мг, 0,39 ммоль) в МеОН (3,0 мл), перемешивают при 95°С 4 ч в закрытой пробирке под давлением. Растворитель испаряют при пониженном давлении для получения неочищенного продукта. Раствор неочищенного продукта в ТФУ (1,0 мл) и ДХМ (1,0 мл) перемешивают при комнатной температуре 3 ч. Растворитель удаляют при пониженном давлении для получения остатка, который очищают HPLC, для получения указанного соединения в виде белого твердого вещества (33 мг, 27%).1Н ЯМР (400 МГц, ДМСО-d6) δ 7,79 (d, J=8,4 Гц, 2Н), 7,58 (d, J=8,0 Гц, 2Н), 7,29 (s, 2Н), 7,13 (s, 2Н), 7,06 (s, 2Н), 5,06 (s, 4H), 4,65 (d, J=16,4 Гц, 2Н), 4,40 (d, J=16,4 Гц, 2Н), 4.29 (s, 4H), 4,05 (d, J= 5,6 Гц. 4H), 3,87-3,83 (m, 2Н), 3,11-3,08 (m, 2Н); МСЭР m/z: 978 M+.
Пример 9. [Re(СО)3][4-(3-(5-(бис(пиридин-2-илметил)амино)пентил)тиоуреидо)бензолсульфонамид]:

А. 4-(3-(5-(Бис(пиридин-2-илметил)амино)пентил)тиоуреидо)бензолсульфонамид:

Раствор трет-бутил 5-(бис(пиридин-2-илметил)амино)пентилкарбамата (0,63 г, 1,64 ммоль) в ДХМ (10 мл) и ТФУ (1,0 мл) перемешивают при комнатной температуре 3 ч. После завершения растворитель испаряют и реакционную смесь разбавляют ДХМ, промывают насыщенным водным карбонатом калия и концентрируют в вакууме для получения N,N-бис(пиридин-2-илметил)пентан-1,5-диамина. Раствор вышеуказанного продукта N,N-бис(пиридин-2-илметил)пентан-1,5-диамина, 4-изотиоцианатобензолсульфонамида (0,35 г, 1,64 ммоль) в ацетонитриле (10 мл) и DIPEA (0,40 мл) перемешивают при 50°С в атмосфере азота 3 ч. Растворитель испаряют при пониженном давлении для получения неочищенного продукта, который очищают флэш-хроматографией, элюируя с использованием 5% МеОН в ДХМ, с последующим 15% МеОН в ДХМ для получения 4-(3-(5-(бис(пиридин-2-илметил)амино)пентил)тиоуреидо)бензолсульфонамида (0,145 г, 19%) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 9,75 (s, 1Н), 8,48 (d, 2H), 7,98 (s, 1H), 7,78-7,69 (m, 4Н), 7,63 (d, 2H), 7,53 (d, 2H), 7,29-7,21 (m, 4Н), 3,55 (s, 4H), 3,46-3,44 (m, 2H), 2,49-2,47 (m, 2H), 1,56-1,42 (m, 2H), 1,32-1,28 (m, 2H); МСЭР m/z: 499,5 (M+H)+.
В. [Re(СО)3][4-(3-(5-(бис(пиридин-2-илметил)амино)пентил)тиоуреидо)бензолсульфонамид]. Раствор 4-(3-(5-(бис(пиридин-2-илметил)амино)пентил)тиоуреидо)бензолсульфонамида (30 мг, 0,060 ммоль) и [NEt4]2[ReBr3(СО)3] (43 мг, 0,06 ммоль) в МеОН (6,0 мл) перемешивают при 100°С 5 ч в закрытой пробирке под давлением. Реакционную смесь очищают смолой Amberchrom™, элюируя МеОН/Н2O для получения [Re(СО)3][2-((пиридин-2-илметил)(4-сульфамоилфенэтил)амино)уксусная кислота] (31 мг, 67%) в виде белого твердого 51 вещества. МСЭР m/z: 769,2 (M+H)+.
Пример 10. [Re(СО)3][2-((пиридин-2-илметил)(8-(3-(4-сульфамоилфенил)тиоуреидо)октил)амино)уксусная кислота]:

А. Трет-бутил 2-((8-(трет-бутоксикарбониламино)октил)(пиридин-2-илметил)амино)ацетат:

Раствор трет-бутил 8-аминооктилкарбамата (1,61 г, 6,588 ммоль), 2-пиридинкарбоксальдегида (0,63 мл, 6,588 ммоль) и АсОН (0,10 мл) в ДХЭ (30 мл) нагревают до 75°С в течение 30 минут в атмосфере азота. Реакционную смесь охлаждают до 0°С и последовательно обрабатывают NaBH(ОАс)3 (3,708 г, 17,5 ммоль) и трет-бутилглиоксиматом (1,53 г)1. Реакционную смесь перемешивают при комнатной температуре в течение ночи и обрабатывают водой. Реакционную смесь затем экстрагируют ДХМ, и органические слои высушивают и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле для получения трет-бутил 2-((8-(трет-бутоксикарбониламино)октил)(пиридин-2-илметил)амино)ацетата (1,71 г, 58%) в виде желтого масла.1Н ЯМР (400 МГц, CD3Cl3) δ 8,52 (d, J= 4,8 Гц, 1Н), 7,65 (td, J=7,8,1,6 Гц, 1Н), 7,56 (d, J=1,6, 1Н), 7,18-7,12 (m, 1Н), 4,50 (s, 1Н), 3,90 (s, 2H), 3,28 (s, 2H), 3,07 (q, J= 6,3 Гц, 2H), 2,61 (t, J= 7,6 Гц, 2H), 1,50-1,24 (М, 30Н); МСЭР m/z: 450,4 (М+Н)+.
В. 2-((Пиридин-2-илметил)(8-(3-(4-сульфамоилфенил)тиоуреидо)октил)амино)уксусная кислота. Раствор трет-бутил 2-((8-(трет-бутоксикарбониламино)октил)(пиридин-2-илметил)амино)ацетата (0,449 г, 1,0 ммоль) в ДХМ (4 мл) и ТФУ (4,0 мл) перемешивают при комнатной температуре в течение ночи. Растворитель испаряют для получения 2-((8-аминооктил)(пиридин-2-илметил)амино)уксусной кислоты. Раствор вышеуказанного продукта 2-((8-аминооктил)(пиридин-2-илметил)амино)уксусной кислоты, 4-изотиоцианатобензолсульфонамида (0,278 г, 1,3 ммоль) в СН3СK (40 мл) и DIPEA (3,0 мл), перемешивают при 50°С в атмосфере азота 48 ч. Растворитель испаряют при пониженном давлении для получения сырого продукта, который очищают Amberchrom™ элюируя ацетонитрил/вода для получения 2-((пиридин-2-илметил)(8-(3-(4-сульфамоилфенил)тиоуреидо)октил)амино)уксусной кислоты (0,500 г) в виде бесцветного масла.1Н ЯМР (400 МГц, ДМСО-d6) δ 9,84 (s, 1Н), 8,65 (d, J=4,4 Гц, 1H), 8,11 (s, 1H), 7,94 (td, J=7,6, 1,6 Гц, 1H), 7,70 (d, J=8,8 Гц, 2 Н), 7,63 (d, J=8,8 Гц, 2H), 7,57 (d, J=7,6 Гц, 1H), 7,50-7,47 (m, 1H), 7,26 (s, 2H), 4,53 (s, 2H), 4,14 (s, 2H), 3,44-3,40 (m, 2H), 3,14-3,08 (m, 2H), 1,64-1,24 (m, 1 Н); МСЭР m/z: 508,3 (М+Н)+.
С. [Re(СО)3][2-((пиридин-2-илметил)(8-(3-(4-сульфамоилфенил)тиоуреидо)октил)амино)уксусная кислота]. Раствор 2-((пиридин-2-илметил)(8-(3-(4-сульфамоилфенил)тиоуреидо)октил)амино)уксусной кислоты (60 мг) и [NEt4]2[ReBr3(СО)3] (77 мг, 0,10 ммоль) в МеОН (4,0 мл) и воде (0,20 мл) перемешивают при 90°С в течение ночи в пробирке под давлением. Реакционную смесь очищают HPLC для получения указанного соединения (7,2 мг) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 9,76 (s, 1H), 8,74 (d, J=5,2 Hz, 1H), 8,13 (td, J=7,6, 1,2 Hz, 1H), 8,04 (s, 1H), 7,72-7,62 (m, 5H), 7,56 (t, J=6,4 Hz, 1H), 7,25 (s, 2H), 4,74 (d, J=15,6 Hz, 1H), 4,52 (d, J=15,6 Hz, 1H), 3,80 (d, J=16,8 Hz, 1H), 3,54-3,40 (m, 4H), 3,38 (d, J=16,8 Hz, 1H), 1,76-1,31 (m, 12H); МСЭР m/z: 778,1 (M+H)+.
Примеры синтеза соединений формулы II
Пример 11. [Re(СО)3][(8)-6-(бис((1-(карбоксиметил)-1Н-имидазол-2-ил)метил)амино)-2-(3-((S)-1-карбокси-4-оксо-4-(4-сульфамоилфенэтиламино)бутил)уреидо)капроновая кислота]:
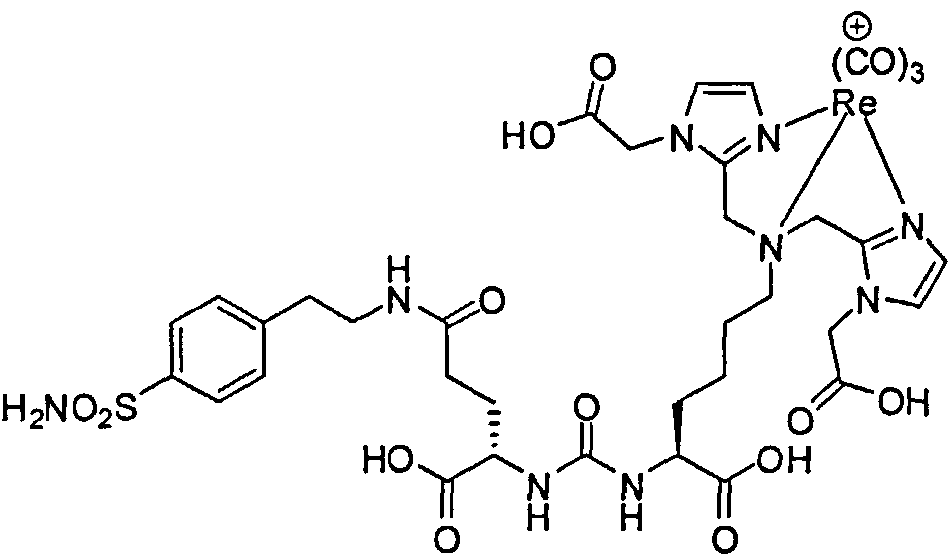
А. Синтез (9S,13)-15-бензил 13,9-ди-трет-бутил 3,11-диоксо-1-фенил-2-окса-4,10,12-триазапентадекан-9,13,15-трикарбоксилата:

К раствору гидрохлорида L-Glu(OBn)-OtBu (3,13 мг, 9,49 ммоль) и трифосгена (923 мг, 3,13 ммоль) в ДХЭ (70 мл), охлажденному до -78°С, добавляют триэтиламин (2,80 мл) в атмосфере азота. После перемешивания при -78°С 2 ч добавляют раствор L-Lys(Z)-OtBu (3,88 г, 10,40 ммоль) и ТЭА (1,5 мл) в ДХЭ (10 мл). Смеси оставляют до достижения комнатной температуры в течение 1 ч и перемешивают при комнатной температуре в течение ночи. Реакционную смесь обрабатывают 1N HCl и экстрагируют ДХМ. Органический слой высушивают и концентрируют при пониженном давлении и остаток очищают с использованием Biotage SP4 для получения (9S,13)-15-бензил 13,9-ди-трет-бутил 3,11-диоксо-1-фенил-2-окса-4,10,12-триазапентадекан-9,13,15-трикарбоксилат в виде бесцветного масла (4,71 г, 76%).1Н ЯМР (400 МГц, CDCl3) δ 7,34-7,29 (m, 10Н), 5,13-5,04 (m, 6H), 4,97 (brs, 1H), 4,38-4,28 (m, 2H), 3,18-3,14 (m, 2H), 2,50-2,35 (m, 2H), 2,19-2,10 (m, 1H), 1,94-1,85 (m, 1H), 1,79-1,72 (m, 1H), 1,58-1,33 (m, 21H).
В. Синтез (S)-4-(3-((S)-6-амино-1-трет-бутокси-1-оксогексан-2-ил)уреидо)-5-трет-бутокси-5-оксовалериановой кислоты:

Суспензию (9S,13)-15-бензил 13,9-ди-трет-бутил 3,11-диоксо-1-фенил-2-окса-4,10,12-триазапентадекан-9,13,15-трикарбокислата (4,30 г, 6,64 ммоль), 10% Pd/C (1,0 г) и формиата аммония (4,0 г) в EtOH (70 мл) под вакуумным колоколом перемешивают при комнатной температуре в течение ночи. Реакционную смесь фильтруют через слой Celite и промывают EtOAc. Растворитель испаряют для получения (8)-4-(3-((8)-б-амино-1-трет-бутокси-1-оксогексан-2-ил)уреидо)-5-трет-бутокси-5-оксовалериановой кислоты (4,07 г, 70%), которая используется без дальнейшей очистки. МСЭР m/z: 432,3 (М/2+Н)+.
С. Синтез (S)-4-(3-((S)-6-(бис((1-(2-трет-бутокси-2-оксоэтил)-1H-имидазол-2-ил)метил)амино)-1-трет-бутокси-1-оксогексан-2-ил)уреидо)-5-трет-бутокси-5-оксовалериановой кислоты:

Раствор (S)-4-(3-((S)-6-амино-1-трет-бутокси-1-оксогексан-2-ил)уреидо)-5-трет-бутокси-5-оксовалериановой кислоты (432 мг, 70% чистоты, 0,70 ммоль), АсОН (0,10 мл) и трет-бутил 2-(2-формил-1Н-имидазол-1-ил)ацетата (470 мг, 2,0 ммоль) в ДХЭ (20 мл) перемешивают при 75°С в течение 30 минут в атмосфере азота. Реакционную смесь охлаждают до 0°С и обрабатывают NaBH(ОАс)3 (0,633 г, 3,0 ммоль). Реакцию оставляют на ночь с перемешиванием при комнатной температуре. Реакционную смесь обрабатывают водой и концентрируют при пониженном давлении для получения остатка, который очищают на Biotage SP4 с использованием градиента МеОН 5-50% в ДХМ для получения (S)-4-(3-((S)-6-(бис((1-(2-трет-бутокси-2-оксоэтил)-1H-имидазол-2-ил)метил)амино)-1-трет-бутокси-1-оксогексан-2-ил)уреидо)-5-трет-бутокси-5- оксовалериановой кислоты (300 мг, 52%) в виде бесцветного масла.1Н ЯМР (400 МГц, CDCl3) 6,99 (s, 2Н), 6,84 (s, 2H), 4,57 (s, 4H), 4,29-4,19 (m, 2H), 3,66-3,56 (m, 4H), 2,98-2,90 (m, 2H), 2,49-2,37 (m, 4H), 1,95-1,41 (m, 42H); МСЭР m/z: 410,8 (M/2+H)+.
D. Синтез (S)-трет-бутил 6-(бис((1-(2-трет-бутокси-2-оксоэтил)-1H-имидазол-2-ил)метил)амино)-2-(3-((S)-1-трет-бутокси-1,5-диоксо-5-(4-сульфамоилфенэтиламино)пентан-2-ил)уреидо)гексаноата:

Раствор (S)-4-(3-((S)-6-(бис((1-(2-трет-бутокси-2-оксоэтил)-1H-имидазол-2-ил)метил)амино)-1-трет-бутокси-1-оксогексан-2-ил)уреидо)-5-трет-бутокси-5-оксовалериановой кислоты (80 мг, 0,098 ммоль), 4-(2-аминоэтил)бензолсульфонамида (30 мг, 0,15 ммоль), HATU (50 мг, 0,17 ммоль) и DIPEA (0,50 мл) в ДМФА (5 мл) перемешивают при 40°С в течение ночи. Растворители испаряют при пониженном давлении для получения остатка, который очищают Biotage SP4 с использованием градиента МеОН 0 - 20% в ДХМ для получения (S)-трет-бутил 6-(бис((1-(2-трет-бутокси-2-оксоэтил)-1H-имидазол-2-ил)метил)амино)-2-(3-((S)-1-трет-бутокси-1,5-диоксо-5-(4-сульфамоилфенэтиламино)пентан-2-ил)уреидо)гексаноата (100 мг, 100%). МСЭР m/z: 501,9 (М/2+Н)+.
Е. [Re(СО)3][(S)-6-(бис((1-(карбоксиметил)-1H-имидазол-2-ил)метил)амино)-2-(3-((S)-1-карбокси-4-оксо-4-(4-сульфамоилфенэтиламино)бутил)уреидо)капроновая кислота]. Раствор (S)-трет-бутил 6-(бис((1-(2-трет-бутокси-2-оксоэтил)-1H-имидазол-2-ил)метил)амино)-2-(3-((S)-1-трет-бутокси-1,5-диоксо-5-(4-сульфамоилфенэтиламино)пентан-2-ил)уреидо)гексаноата (60 мг, 0,060 ммоль) и [NEt4]2[ReBr3(СО)3] (60 мг, 0,077 ммоль) в МеОН (4,0 мл) перемешивают при 80°С в течение ночи в закрытой пробирке под давлением. Растворитель испаряют при пониженном давлении для получения остатка. Раствор вышеуказанного выделенного остатка растворяют в ДХМ (2,0 мл) и добавляют ТФУ (2,0 мл), реакционную смесь перемешивают при комнатной температуре 2 ч. Растворитель удаляют при пониженном давлении для получения остатка, который очищают HPLC, для получения указанного соединения (16 мг, 25% более чем за 2 стадии) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 7,94 (brs, 1Н), 7,71 (d, J=8,4 Hz, 2H), 7,35 (d, J=8,4 Hz, 2H), 7,26 (s, 2H), 7,17 (s, 2H), 7,03 (s, 2H), 6,37-6,33 (m, 2H), 4,83 (s, 4H), 4,55 (d, J=16,4 Hz, 2H), 4,39 (d, J=16,4 Hz, 2H), 4,14-4,02 (m, 2H), 3,65-3,61 (m, 2H), 3,25-3,22 (m, 2H), 2,74 (t, J=7,0 Hz, 2H), 2,05-1,30 (m, 10H); МСЭР m/z: 524,8 (M/2+H)+.
Пример 12. (S)-2-(3-((S)-1-карбокси-4-оксо-4-(4-сульфамоилфениламино)бутил)уреидо)-6-(3-йодбензамидо)капроновая кислота:

А. 2,5-Диоксопирролидин-1-ил 3-йодбензоат:

Раствор 3-йодбензойной кислоты (744 мг, 3,0 ммоль), карбоната N N'-дисукцинимидила (920 мг, 3,6 ммоль) и пиридина (0,30 мл) в ацетонитриле (30 мл) перемешивают при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении для получения остатка, который очищают с использованием Biotage SP4, элюируя 10%-100% EtOAc в гексане для получения 3-йодбензоата 2,5-диоксопирролидин-1-ила (946 мг, 91%) в виде белого твердого вещества.1Н ЯМР (400 МГц, CDCl3) δ 8,46 (s, 1H), 8,10 (d, J=7,6, 1H), 8,00 (d, J=8,0 Hz, 1H), 7,26 (t, J=7,8 Hz, 1H), 2,91 (s, 4 H); МСЭР m/z: 368 (M+Na)+.
В. (S)-5-трет-бутокси-4-(3-((S)-1-трет-бутокси-6-(3-йодбензамидо)-1-оксогексан-2-ил)уреидо)-5-оксовалериановая кислота:

Раствор (S)-4-(3-((S)-6-амино-1-трет-бутокси-1-оксогексан-2-ил)уреидо)-5-трет-бутокси-5-оксовалериановой кислоты (260 мг, 0,60 ммоль), 5-диоксопирролидин-1-ил-3-йодбензоата (276 мг, 0,80 ммоль) и DIPEA (1,0 мл) в ДМФА (5,0 мл) перемешивают при комнатной температуре в течение ночи. Растворители удаляют, при пониженном давлении для получения остатка, который очищают с использованием Biotage SP4, элюируя 10-100% EtOAc в гексане для получения (S)-5-трет-бутокси-4-(3-((S)-1-трет-бутокси-6-(3-йодбензамидо)-1-оксогексан-2-ил)уреидо)-5-оксовалериановой кислоты (343 мг, 86%) в виде бесцветного масла. МСЭР m/z: 332 (М+Н)/2+.
С. (S)-2-(3-((S)-1-карбокси-4-оксо-4-(4-сульфамоилфениламино)бутил)уреидо)-6-(3-йодбензамидо)капроновая кислота. Раствор (S)-5-трет-бутокси-4-(3-((S)-l-трет-бутокси-6-(3-йодбензамидо)-1-оксогексан-2-ил)уреидо)-5-оксовалериановой кислоты (98 мг, 0,148 ммоль), сульфаниламида (34,4 мг, 0,20 ммоль), HATU (76 мг, 0,20 ммоль) и DIPEA (0,50 мл) в ДМФА (5 мл) перемешивают при 50°С в течение ночи. Растворители испаряют при пониженном давлении для получения остатка, который очищают с использованием Biotage SP4 с градиентом EtOAc 10-100% в гексане для получения (S)-трет-бутил 2-(3-((S)-1-трет-бутокси-1,5-диоксо-5-(4-сульфамоилфениламино)пентан-2-ил)уреидо)-б-(3-йодбензамидо)гексаноата. Раствор вышеуказанного выделенного материала растворяют в смеси ТФУ (2,0 мл)/ДХМ (2,0 мл) и перемешивают при комнатной температуре 3 ч. Растворители удаляют при пониженном давлении для получения остатка, который очищают HPLC для получения указанного соединения (20 мг, 19% более чем за 2 стадии) в виде белого твердого вещества. МСЭР m/z: 704,2 (М+Н)+.
Пример 13. (S)-2-(3-((S)-1-карбокси-4-оксо-4-(4-сульфамоилфенэтиламино)бутил)уреидо)-6-(3-йодбензамидо)капроновая кислота:

Раствор (S)-5-трет-бутокси-4-(3-((S)-1-трет-бутокси-6-(3-йодбензамидо)-1-оксогексан-2-ил)уреидо)-5-оксовалериновой кислоты (212 мг, 0,32 ммоль), 4-(2-аминоэтил)бензолсульфонамида (80 мг, 0,40 ммоль), HATU (152 мг, 0,40 ммоль) и DIPEA (0,50 мл) в ДМФА (5 мл) перемешивают при 50°С в течение ночи. Растворители испаряют при пониженном давлении для получения остатка, который очищают, используя Biotage SP4 с градиентом EtOAc 10-100% в гексане для получения (S)-трет-бутил 2-(3-((S)-1-трет-бутокси-1,5-диоксо-5-(4-сульфамоилфениламино)пентан-2-ил)уреидо)-6-(3-йодбензамидо)гексаноата. Раствор вышеуказанного продукта растворяют в ТФУ (2,0 мл)/ДХМ (2,0 мл) и перемешивают при комнатной температуре 3 ч. Растворители удаляют при пониженном давлении для получения остатка, который очищают Amberchrom™ для получения ((S)-2-(3-((S)-1-карбокси-4-оксо-4-(4-сульфамоилфенэтиламино)бутил)уреидо)-6-(3-йодбензамидо)капроновой кислоты (40 мг, 17% более чем за 2 стадии) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 8,54 (t, J=5,4 Hz, 1H), 8,17 (s, 1H), 7,97 (t, J=5,4 Hz, 1H), 7,86 (d, J=8,0 Hz, 1H), 7,83 (d, 7=8,0 Hz, 1H), 7,72 (d, J=8,4 Hz, 2H), 7,37 (d, J=8,0 Hz, 2H), 7,28-7,23 (m, 3H), 6,32 (t, J=7,0 Hz, 2H), 4,07-3,99 (m, 2 H), 3,27-2,80 (m, 2H), 2,75 (t, J=7,2 Hz, 2H), 2,10-1,29 (m, 10Н); МСЭР m/z: 732,2 (M+H)+.
Примеры синтеза соединений формулы IV
Пример 14. [Re(СО)3] [2-((6-оксо-6-(4-сульфамоилфениламино)гексил)(пиридин-2-илметил)амино)уксусная кислота]:

А. 6-((2-Трет-бутокси-2-оксоэтил)(пиридин-2-илметил)амино)капроновая кислота:

Раствор 6-аминокапроновой кислоты (1,97 г, 15 ммоль) и 2-пиридинкарбоксальдегида (1,61 г, 15 ммоль) в ДХЭ (30 мл) нагревают до 75°С в течение 30 минут в атмосфере азота. Реакционную смесь охлаждают до 0°С и последовательно обрабатывают NaBH(OAc)3 (7,95 г, 37,5 ммоль) и трет-бутилглиоксалатом (2,80 г)1. Реакционную смесь перемешивают при комнатной температуре в течение ночи и обрабатывают водой. Реакционную смесь экстрагируют ДХМ и объединенные органические слои сушат и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией на силикагеле для получения 6-((2-треот-бутокси-2-оксоэтил)(пиридин-2-илметил) амино)капроновой кислоты (1,78 г, 35%) в виде желтого масла.1Н ЯМР (400 МГц, CD3Сl3) δ 8,57 (ddd, J=4,8,1,6, 0,8 Hz, 1H), 7,70 (td, J=7,6, 1,6 Hz, 1H), 7,56 (d, J=7,6, 1H), 7,22-7,18 (m, 1H), 3,93 (s, 2H), 3,29 (s, 2H), 2,65 (t, J= 7,4 Hz, 2H), 2,33 (t, J= 7,6 Hz, 2H), 1,67-1,32 (m, 15H); МСЭР m/z: 337,2 (M+H)+.
В. Трет-бутил 2-((6-оксо-6-(4-сульфамоилфениламино)гексил)(пиридин-2-илметил)амино)ацетат

Раствор 6-((2-трет-бутокси-2-оксоэтил)(пиридин-2-илметил)амино)капроновой кислоты (0,6545 г, 1,95 ммоль), сульфониламида (0,362 г, 2,10 ммоль) и HATU (0,798 г, 2,10 ммоль) в ДМФА (10 мл) и Et3N (1,0 мл) перемешивают при 40°С в течение ночи. Реакционную смесь очищают флэш-хроматографией на силикагеле, элюируя МеОН/ДХМ для получения трет-бутил 2-((6-оксо-6-(4-сульфамоилфениламино)гексил)(пиридин-2-илметил)амино)ацетата (297 мг, 31%). МСЭР m/z: 491,3 (М+Н)+.
С. [Re(СО)3][2-((6-оксо-6-(4-сульфамоилфениламино)гексил)(пиридин-2-илметил)амино)уксусная кислота]. Раствор трет-бутил 2-((6-оксо-6-(4-сульфамоилфениламино)гексил)(пиридин-2-илметил) амино)ацетата (70 мг, 0,14 ммоль) в ДХМ (1,0 мл) и ТФУ (1,0 мл) перемешивают при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении для получения 2-((6-оксо-6-(4-сульфамоилфениламино)гексил)(пиридин-2-илметил)амино)уксусной кислоты. Раствор вышеуказанного выделенного продукта, 2-((6-оксо-6-(4-сульфамоилфениламино)гексил)(пиридин-2-илметил)амино)уксусной кислоты, [NEt4]2[ReBr3(СО)3] (108 мг, 0,14 ммоль) и карбонат калия (30 мг) в МеОН (4,0 мл) и воде (1,0 мл) 100°С 4 ч в закрытой пробирке под давлением. Реакционную смесь очищают Amberchrom™, элюируя МеОН/Н2О для получения указанного соединения (64 мг, 65%) в виде белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 10,25 (s, 1H), 8,74 (d, J= 5,2 Hz, 1H), 8,13 (td, J= 7,6, 1,2 Hz, 1H), 7,76-7,55 (m, 5H), 7,56 (t, J= 6,4 Hz, 1H), 7,23 (s, 2H), 4,74 (d, J= 16,0 Hz, 1H), 4,53 (d, J= 16,0 Hz, 1H), 3,82 (d, J= 16,8 Hz, 1H), 3,54-3,40 (m, 2H), 3,38 (d, J= 16,8 Hz, 1H), 2,38 (t, J= 7,4 Hz, 2H), 1,76-1,31 (m, 6H); МСЭР m/z: 705,3 (M+H)+.
Пример 15. Рений(трикарбонил)(11-(бис(пиридин-2-илметил)амино)-N-(4-сульфамоилфенэтил)ундеканамид):

А. 11-(Бис(пиридин-2-илметил)амино)-N-(4-сульфамоилфенэтил)ундеканамид получают по методикам, описанным в разделе"Общие методы синтеза" (139 мг, 31%). МСЭР m/z: 568 (М+Н)+.
В. Рений(трикарбонил)(11-(бис(пиридин-2-илметил)амино)-N-(4-сульфамоилфенэтил)ундеканамид)) получают из соединения стадии А, по методике, описанной в разделе "Общая методика синтеза комплексов рения", и выделяют (10 мг, 19%) в виде грязно-белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 8,75 (d, 2H), 7,95 (m, 2H), 7,90 (t, H), 7,7 (d, 2H), 7,55 (d, 2H), 7,3 (m, 4H), 7,2 (m, 2H), 4,8 (m, 4H), 4,15 (d, 2H), 3,75 (m, 2H), 3,3 (m, 2H), 2,83 (m, 2H), 1,85 (m, 2H), 1,35 (m, 14H). МСЭР m/z: 460 (M+H)+.
Пример 16. Рений(трикарбонил)(11-(бис(пиридин-2-илметил)амино)-N-(4-сульфамоилбензил)ундеканамид):
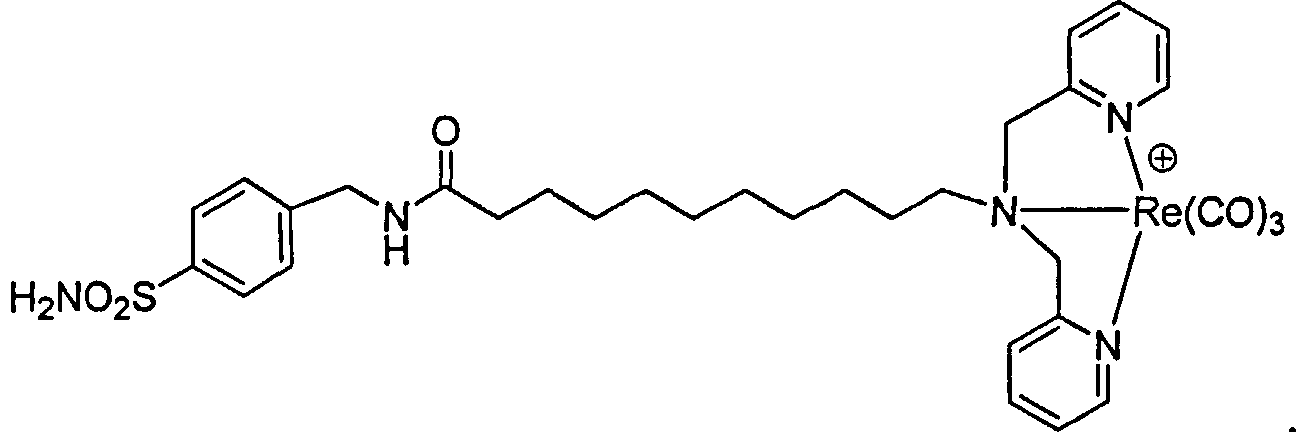
А. 11-(Бис(пиридин-2-илметил)амино)-N-(4-сульфамоилбензил)ундеканамид получают по методике, описанной выше в разделе "Общие методы синтеза" (100 мг, 23%). МСЭР m/z: 552 (М+Н)+.
В. Рений(трикарбонил)(11-(бис(пиридин-2-илметил)амино)-N-(4-сульфамоилбензил)ундеканамид)) получают из соединения стадии А, как описано выше в разделе "Общая методика синтеза комплексов рения", и выделяют (22 мг, 36%) в виде грязно-белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 8,82 (d, 2H), 8,45 (t, 1H), 8,0 (m, 2H), 7,8 (d, 2H), 7,55 (d, 2H), 7,40 (m, 4H), 7,30 (s, 2H), 4,90 (d, 4H), 4,30 (m, 2H), 3,70 (m, 2H), 1,80 (bs, 2H), 1,57 (m, 2H), 1,38 (m, 14H). МСЭР m/z: 823 (M+H)+.
Пример 17. Рений(трикарбонил)(11-(бис(пиридин-2-илметил)амино)-N-(4-сульфамоилфенил)ундеканамид):

А. 11-(Бис(пиридин-2-илметил)амино)-N-(4-сульфамоилбензил)ундеканамид получают как описано выше в разделе "Общие методы синтеза" (41 мг, 15%). МСЭР m/z: 538 (М+Н)+.
В. Рений(трикарбонил)(11-(бис(пиридин-2-илметил)амино)-N-(4-сульфамоилфенил)ундеканамид) получают из соединения А, как описано выше в разделе "Общая методика синтеза комплексов рения" (15 мг, 33%), в виде грязно-белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 10,25 (s, 1H), 8,83 (d, 2H), 8,00 (m, 2H), 7,80 (s, 4H), 7,55 (d, 2H), 7,40 (m, 2H), 7,20 (s, 2H), 4,90 (d, 4H), 4,30 (m, 2H), 3,60 (m, 2H), 2,30 (m, 2H), 1,80 (bs, 2H), 1,57 (m, 2H), 1,38 (m, 10Н). МСЭР m/z: 808 (М+Н)+.
Пример 18. Рений(трикарбонил)(3-(2-(2-(бис(пиридин-2-илметил)амино) этокси) этокси)-N-(4-сульфамоилфенэтил)пропанамид):

А. 3-(2-(2-(Бис(пиридин-2-илметил)амино)этокси)этокси)-N-(4-сульфамоилфенэтил)пропанамид получают, как описано выше в разделе "Общие методы синтеза, дающей искомый продукт (70 мг, 16%). МСЭР т/г. 542 (М+Н)+.
В. Рений(трикарбонил)(3-(2-(2-(бис(пиридин-2-илметил)амино)этокси)этокси)-N-(4-сульфамоилфенэтил)пропанамид), получают из соединения стадии А, как описано выше в разделе "Общая методика синтеза комплексов рения" (36 мг, 44%), в виде грязно-белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 8,75 (d, 2H), 7,95 (m, 3H), 7,7 (d, 4H), 7,55 (d, 2H), 7,30 (m, 6H), 4,90 (d, 4H), 4,30 (m, H), 3,80 (m, 2H), 3,55 (m, 4H) 3,40 (m, 2H), 3,30 (s, 2H), 3,17 (m, 2H), 2,72 (t, 2H), 2,25 (t, 2H). МСЭР m/z: 812 (M+H)+.
Пример 19. Рений(трикарбонил)(3-(2-(2-(бис(пиридин-2-илметил)амино)этокси)этокси)-N-(4-сульфамоилбензил)пропанамид):

А. 3-(2-(2-(Бис(пиридин-2-илметил)амино)этокси)этокси)-N-(4-сульфамоилбензил)пропанамид получают, как описано выше в разделе "Общие методы синтеза, предоставляющий искомый продукт (126 мг, 43%). МСЭР m/z: 542 (М+Н)+.
В. Рений(трикарбонил)(3-(2-(2-(бис(пиридин-2-илметил)амино)этокси)этокси)-N-(4-сульфамоилбензил)пропанамид) получают из соединения стадии А, как описано выше в разделе "Общая методика синтеза комплексов рения" (31 мг, 41%), в виде грязно-белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 8,60 (d, 2H), 8,55 (m, H), 7,75 (m, 2H), 7,55 (d, 2H), 7,35 (d, 2H), 7,15 (m, 4H), 4,8 (d, 4H), 4,15 (d, 2H), 3,75 (m, 4H), 3,6 (m, 2H), 3,45 (m, 4H), 3,2 (m, H), 2,25 (t, 2H). МСЭР m/z: 798 (M+H)+.
Пример 20. Рений(трикарбонил)(3-(2-(2-(бис(пиридин-2-илметил)амино)этокси)этокси)-N-(4-сульфамоилбензил)пропанамид:
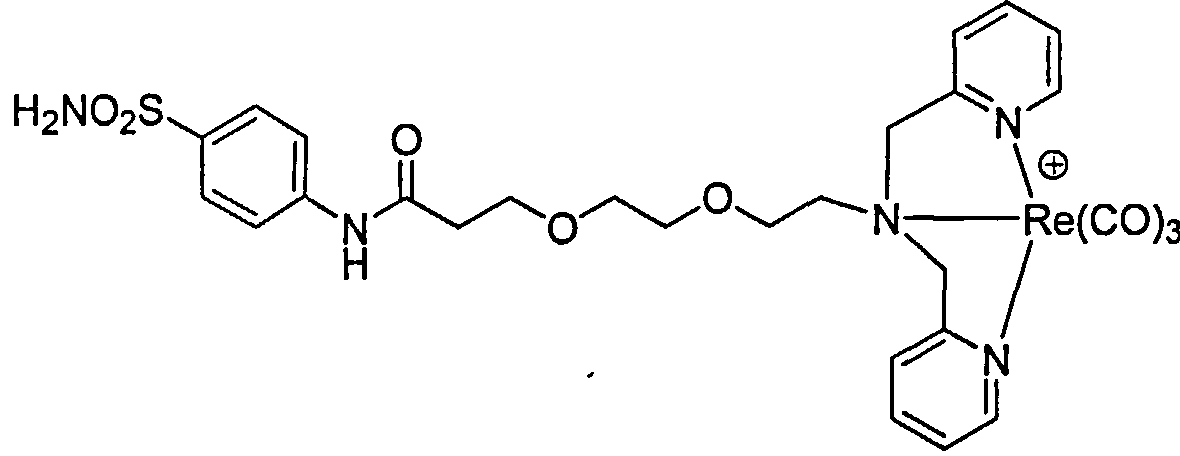
А. 3-(2-(2-(Бис(пиридин-2-илметил)амино)этокси)этокси)-N-(4-сульфамоилбензил)пропанамид получают, как описано выше в разделе "Общие методы синтеза, представляющий искомый продукт (41 мг, 10%). МСЭР m/z: 512 (М+Н)+.
В. Рений(трикарбонил)(3-(2-(2-(бис(пиридин-2-илметил)амино)этокси)этокси)-N-(4-сульфамоилбензил)пропанамид получают из соединения стадии А, как описано выше в разделе "Общая методика синтеза комплексов рения" (24 мг, 52%), в виде грязно-белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 8,80 (m, 2Н), 7,95 (m, 2H), 7,60 (m, 4H), 7,4 (m, 4H), 4,95 (m, 4H), 3,95 (m, 4H), 3,65 (m, 4H), 2,65 (m, 4H). МСЭР m/z: 798 (M+H)+.
Пример 21. Рений(трикарбонил)11-(бис((1-метил-1Н-имидазол-2-ил)метил)амино)-N-(4-сульфамоилфенил)ундеканамид:

А. 11-(Бис((1-метил-1Н-имидазол-2-ил)метил)амино)-N-(4-сульфамоилфенил)ундеканамид получают как описано выше в разделе "Общие методы синтеза, приводящий к 1 (38 мг, 10%). МСЭР m/z: 544 (М+Н)+.
В. Рений(трикарбонил) 11-(бис((1-метил-1H-имидазол-2-ил)метил)амино)-N(4-сульфамоилфенил)ундеканамид получают из соединения стадии А, как описано выше в разделе "Общая методика синтеза комплексов рения" (18 мг, 36%), в виде грязно-белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 10,30 (s, H), 7,30 (d, 2H), 7,05 (d, 2H), 6,43 (d, 2H), 5,65 (d, 2H), 4,65 (m, 2H), 3,60 (s, 6H), 2,30 (m, 2H), 1,85 (m, 2H), 1,35 (m, 14H). МСЭР m/z: 817 (M+H)+.
Пример 21А. Рений(трикарбонил) 11 -(бис((1-метил-1H-имидазол-2-ил)метил)амино)-N-(4-сульфамоилфенил)октанамид может быть получен по методике, аналогичной из примера 22:

Пример 22. Рений(трикарбонил)6-(бис(пиридин-2-илметил)амино)-N-(4-сульфамоилфенил)гексанамид:

А. 6-(Бис(пиридин-2-илметил)амино)-N-(4-сульфамоилфенил)гексанамид получают по той же методике, что описана в разделе "Общие методы синтеза" (162 мг, 22%). МСЭР m/z: 468 (М+Н)+.
В. Рений(трикарбонил)6-(бис(пиридин-2-илметил)амино)-N-(4-сульфамоилфенил)гексанамид получают из соединения вышеуказанной стадии А, и последующей методики, описанной в "Общая методика синтеза комплексов рения" (13 мг, 11%), в виде грязно-белого твердого вещества.1Н ЯМР (400 МГц, ДМСО-d6) δ 10,30 (s, Н), 8,82 (d, 2H), 7,98 (t, 2H), 7,75 (m, 4H), 7,55 (d, 2H), 7,40 (m, 2H), 7,20 (d, 2H), 4,90 (m, 4H), 2,45 (m, 4H), 1,85 (m, 2H), 1,65 (m, 2H), 1,35 (m, 2H). МСЭР m/z: 742 (M+H)+.
Аналоги бензолсульфонамида с этилендиаминтетрауксусной кислотой в качестве линкера
Соединения синтезируют с использованием методики, представленной ниже на схеме 3. Реакция 4,4'-(этан-1,2-диил)диморфолино-2,6-диона с эквивалентом 4-аминобензолсульфоамида, далее с эквивалентом N,N-бис(пиридин-2-илметил)алкил-1,6 диамина дает указанное соединения, которые затем координируют с радионуклидом, с использованием общей методики, обсужденной выше.
Схема 3

где: reflux - кипячение с обратным холодильником
Пример 23А. Раствор диангидрида ЭДТА (130 мг, 0,50 ммоль) и сульфаниламида (86 мг, 0,50 ммоль) в ДМФА (3,0 мл) перемешивают при комнатной температуре 4 ч. N1,N1-бис(пиридин-2-илметил)октан-1,8-диамин (162 мг, 0,50 ммоль) добавляют к реакционной смеси и реакционную смесь перемешивают при комнатной температуре в течение ночи. Растворители испаряют при пониженном давлении и очищают HPLC для получения искомого продукта (110 мг, 29%) в виде белого твердого вещества. МСЭР m/z: 378,2 (М/2+Н)+.

В. Раствор вышеуказанного соединения стадии А (20 мг, 0,026 ммоль), [NEt4]2[ReBr3(СО)3] (23 мг, 0,030 ммоль) и карбонат калия (5 мг) в МеОН (5,0 мл) перемешивают при 100°С в течение ночи в пробирке под давлением. Реакционную смесь затем концентрируют и очищают HPLC для получения искомого соединения (5,3 мг) в виде белого твердого вещества. МСЭР m/z: 513,3 (М/2+Н)+.

Пример 24. Соединение следующей формулы получают по методике, аналогичной примера 24:

Пример 25. Рений(трикарбонил)[4-[3-(2-{2-[2-(бис-пиридин-2-илметил-амино)-этокси]-этокси}-этил)-тиоуреидо]-бензолсульфонамид] может быть получен соответствующей модификацией вышеуказанных методов синтеза.

Селективное ингибирование активности карбоангидразы
Соединения тестируют на их способность ингибировать изозимы II и IX карбоангидразы in vitro. Очищенные энзимы человека поставлены R&D Systems (Minneapolis MN (Миннеаполис, Миннесота). Константы ингибирования (Ki) для САII и CA-IX определяют методом Покера и Стоуна (Pocker and Stone) [25]. Начальные скорости гидролиза 4-нитрофенилацетата, катализируемого различными изозимами карбоангидразы, измеряют спектрофотометрически при в 400 нм. Раствор субстрата (1×10-2-1×10-6 М) готовят в безводном ацетонитриле. Используют молярный коэффициент погашения 18 000 M-1·cm-1 для 4-нитрофенолята, образующегося при гидролизе в условиях эксперимента (9 ммоль Tris-HCl, 81-ммоль NaCl, pH 7,4, 25°С). Концентрации энзима составляют 100 нмоль для CA-IX и 30 нмоль для СА-II. Скорость неэнзимативного гидролиза, определенную в отсутствии добавленного энзима, вычитают из наблюдаемой скорости. Запасной раствор ингибитора готовят в деионизированной воде с 10-20% ДМСО (который не ингибирует энзимативную активность) [12]. Разбавления ингибитора добавляют к растворам энзима и предварительно инкубируют в течение 10 минут, чтобы дать возможность формированию комплекса E-I до добавления субстрата. Ацетазоламид включают во все тесты в качестве положительного контроля.
Таблица 1. Результаты IC50 (нмоль) некоторых примеров и сравнительных примеров
Структура сравнительного примера 1:

Структура сравнительного примера 2:

Структура сравнительного ацетазоламида:

Биораспределение в тканях мыши с ксенотрансплантатом человека Введение CA-IX ингибиторов с радиоактивной меткой в модели ксенотрансплантата опухоли человека выполняют опубликованными способами [20]. На основе данных вестерн-блоттинга и по клеточной культуре, описанных в особой цели 3, мы решили исследовать способность наших соединений достигать CA-IX в HeLa ксенотрансплантатах так же как в SK-RC-52 ксенотрансплантатах. Кратко, HeLa, SK-RC-52 и SK-RC-59 клетки инкубируют по методике поставщика. До инокуляции клетки трипсинизируют, подсчитывают и суспендируют в 50% PBS с 1 мг/мл D-глюкозы, 36 мкг/мл пирувата натрия, 50% Matrigel (BD Biosciences, Franklin Lakes, NJ). Мышей NCrnu/nu анестезируют внутрибрюшинной инъекцией 0,5 мл авертина (20 мг/мл) (Sigma-Aldrich, St. Louis, МО), затем подкожно инокулируют в задний пах 2×106 клеток в объеме 0,25 мл суспензии. Исследования поглощения опухолью проводят по достижению размера опухоли 100-200 мм3. Распределение в тканях анализируют введением в вену хвоста инъекцией дозы около 2 мкКи/мышь CA-IX ингибиторов с радиоактивной меткой в постоянном объеме 0,1 мл. Группы из пяти животных подвергают эвтаназии асфикцией диоксидом углерода через 1, 4 и 24 часа после инъекции. Определение специфического связывания CA-IX достигают со-инъекцией дозы ацетазоламида 10 мг/кг. Ткани (опухоль, кровь, сердце, печень, легкие, селезенка, толстая и тонкая кишка, живот, почки, скелетная мышца и мозг) препарируют, вырезают, взвешивают во влажном состоянии, помещают в пластиковые пробирки и определяют активность автоматизированным γ-счетчиком (LKB Model 282, Wallac Oy, Финляндия (Finland). Радиоактивность в тканях во времени выражена в % от введенной в ткань дозы на грамм ткани (% ID/г) и % веденной дозы на орган (% DPO).
Образцы аналогов99mТc вводят в вену хвоста безтимусных мышей NCr, содержащих СА-IХ, синтезирующие SK-RC-52 ксенотрансплантаты или HeLa клетки. Группы мышей (n=5) выводят из эксперимента после инъекции через 1 и 4 часа и собирают следующие ткани: кровь, сердце, легкие, печень, селезенка, почки, живот, толстые и тонкие кишки (с содержимым), семенники, скелетную мышцу, кости, мозг, жировую ткань и опухоль. В обе временные точки дополнительной группе мышей (n=5) осуществляют со-инъекцию 10 мг/кг ацетазоламида, чтобы заблокировать связывание карбоангидраз. Фиг.1 и 2 показывают распределение в ткани различных радиофармпрепаратов.
Данные распределения в ткани получают с99mТc аналогом соединения примера 8 в HeLa ксенотрансплантате HeLa мыши, выраженного в % ID/г ±(SEM). Данные представлены на фиг.1.
Для ссылки, на фиг.2 тестируемые соединения являются99mТc аналогами соединений примеров 1, 3, 7 и 8 в ксенотрансплантате HeLa мыши.
Данные распределения в ткани получают с99mТc аналогом соединения примера 7 в HeLa ксенотрансплантате HeLa мыши. Данные представлены на фиг.3.
Данные распределения в ткани получают с99mТc аналогом соединения примера 3 в ксенотрансплантате HeLa мыши, выраженные как % ID/г ±(SEM). Данные представлены на фиг.4.
Данные распределения в ткани получают с99mТc аналогом соединения примера 1 в ксенотрансплантате HeLa, SKRC 52 и SKRC 59 мыши, соединений примеров 7 и 10 в ксенотрансплантате HeLa мыши. Данные представлены на фиг.5.
Эквиваленты
В то время как представлены и описаны определенные осуществления, специалистам в данной области техники следует понимать, что изменения и модификации могут быть сделаны в описании, не выходя за рамки технологии в ее широких аспектах, определенных в последующей формуле изобретения,
Настоящее раскрытие не должно быть ограничено определенными осуществлениями, описанными в настоящей заявке. Много модификаций и изменений могут быть сделаны, не выходя за рамки притязаний, как очевидно специалистам в данной области техники. Функционально эквивалентные способы и соединения в рамках раскрытия, в дополнение к перечисленным в описании, являются очевидными специалистам в данной области техники из предшествующего описания. Такие модификации и изменения предназначены соответствовать объему притязаний прилагаемой формулы изобретения. Настоящее раскрытие должно быть ограничено только в соответствии с прилагаемой формулой изобретения, наряду со всеми эквивалентами, на которые распространяется формула изобретения. Следует понимать, что это раскрытие не ограничено определенными способами, реактивами, составом соединений или биологическими системами, которые конечно могут меняться. Также нужно понимать, что терминология, используется в заявке только с целью описания определенных осуществлений и не предназначена для ограничения.
Кроме того, там, где признаки или аспекты раскрытия описаны на основе групп Маркуша, специалисты в данной области техники должны понимать, что поэтому раскрытие также описано на основе независимого члена или подгруппы членов группы Маркуша.
Специалистам в данной области техники следует понимать, что для всех целей, в частности, относительно письменного описания, все диапазоны, раскрытые в заявке, также включают любые и все возможные поддиапазоны и комбинации этих поддиапазонов. Любой указанный диапазон может быть легко признан как достаточное описание и дающий возможность разбиения этого диапазона, по меньшей мере, на равные половины, трети, четверти, пятые, десятые части и т.д. В качестве не ограничивающего примера, каждый диапазон, обсужденный в описании, может быть легко разбит на меньшую треть, среднюю третья и большую треть и т.д. Специалистам в данной области техники следует также понимать, что все формулировки, такие как "до", "по меньшей мере" "более", "менее" и т.п., включают указанное число и относятся к диапазонам, которые могут быть впоследствии разбиты на поддиапазоны, как обсуждено выше. Наконец, специалистам в данной области техники следует понимать, что диапазон включает каждый независимый член, включая первое и последнее число, указанное для диапазона.
Все публикации, заявки на патент, выданные патенты и другие документы, указанные в настоящей заявке, включены в описание ссылкой, как если бы каждая независимая публикация, заявка на патент, выданный патент или другой документ были определенно и независимо указаны, были включены ссылкой во всей их полноте. Определения, которые содержатся в тексте, включенном ссылкой, исключены так, чтобы они не противоречили определениям настоящего раскрытие.
Другие осуществления сформулированы в следующей формуле изобретения.
Реферат
Изобретение относится к соединениям формулы I, II или IVгде значения радикалов W, V, R, R, X, L, R, A представлены в формуле изобретения. Заявленные соединения распознают и связывают CA-IX протеин, могут включать радиоактивный элемент для радионуклидной визуализации или терапевтического применения. 10 н. и 17 з.п. ф-лы, 1 табл., 5 ил., 25 пр.
Формула

где W является связью, (C1-C8)алкилом, (C2-C8)алкенилом, арилом, гетероарилом,
-NHC(O),
-C(O)NH, -NH-C(O)-NH- или -NH-C(S)-NH-;
V является связью, (C1-C8)алкилом, (C2-C8)алкенилом, арилом, гетероарилом, -NH-C(O)-NH- или -NH-C(S)-NH-;
NRaRb является хелатной группой формулы:

Rt является H, C1-C8 алкильной группой;
Rx и Ry каждый независимо является водородом, алкилом, аминоалкилом, гидроксиалкилом или карбоксиалкилом;
Rv является алкилом;
m является целым числом 0-15; и
n является целым числом 0-15; при условии, что W и V оба не могут быть NH-С(O)-NH- или -NH-C(S)-NH-; и при условии, что соединение не является 2,2′-(2,2′-(8-(3-(4-сульфамоилфенил)тиоуреидо)октилазандиил)-бис(метилен)бис(1H-имидазол-2,1-диил))диуксусной кислотой;
2,2′-(2,2-(4-сульфамоилфенилазандиил)-бис(1Н-имидазол-2,1-диил))диуксусной кислотой; или 2,2′-(2,2′-(5-(4-сульфамоилбензамидо)пентилазандиил)-бис(метилен)бис(1Н-имидазол-2,1-диил))диуксусной кислотой.





или его фармацевтически приемлемые соли; и
M является радиоактивным металлом, выбранным из группы, состоящей из Re и Tc.

где
L является NRaRb хелатной группой формулы:

или группой формулы:

W и X независимо являются О или S;
p является целым числом 0-5;
q является целым числом 0-8;
Rt является H, C1-C8 алкильной группой;
Rx и Ry каждый независимо является водородом, алкилом, аминоалкилом, гидроксиалкилом или карбоксиалкилом;
Rv является алкилом.

где
NRaRb является хелатной группой формулы:

Y является О или S;
А является (C1-C8) алкилом, -(CH2)x-(OCH2CH2)y- или -(OCH2CH2)y(CH2)x-;
x является целым числом 0-3;
y является целым числом 0-3;
r является целым числом 0-5;
s является целым числом 0-10;
Rt является H, C1-C8 алкильной группой;
Rx и Ry каждый независимо является водородом, алкилом, аминоалкилом, гидроксиалкилом или карбоксиалкилом; и
Rv является алкилом.



Комментарии