Brassica juncea качества омега-9 - RU2557316C2
Код документа: RU2557316C2
Чертежи





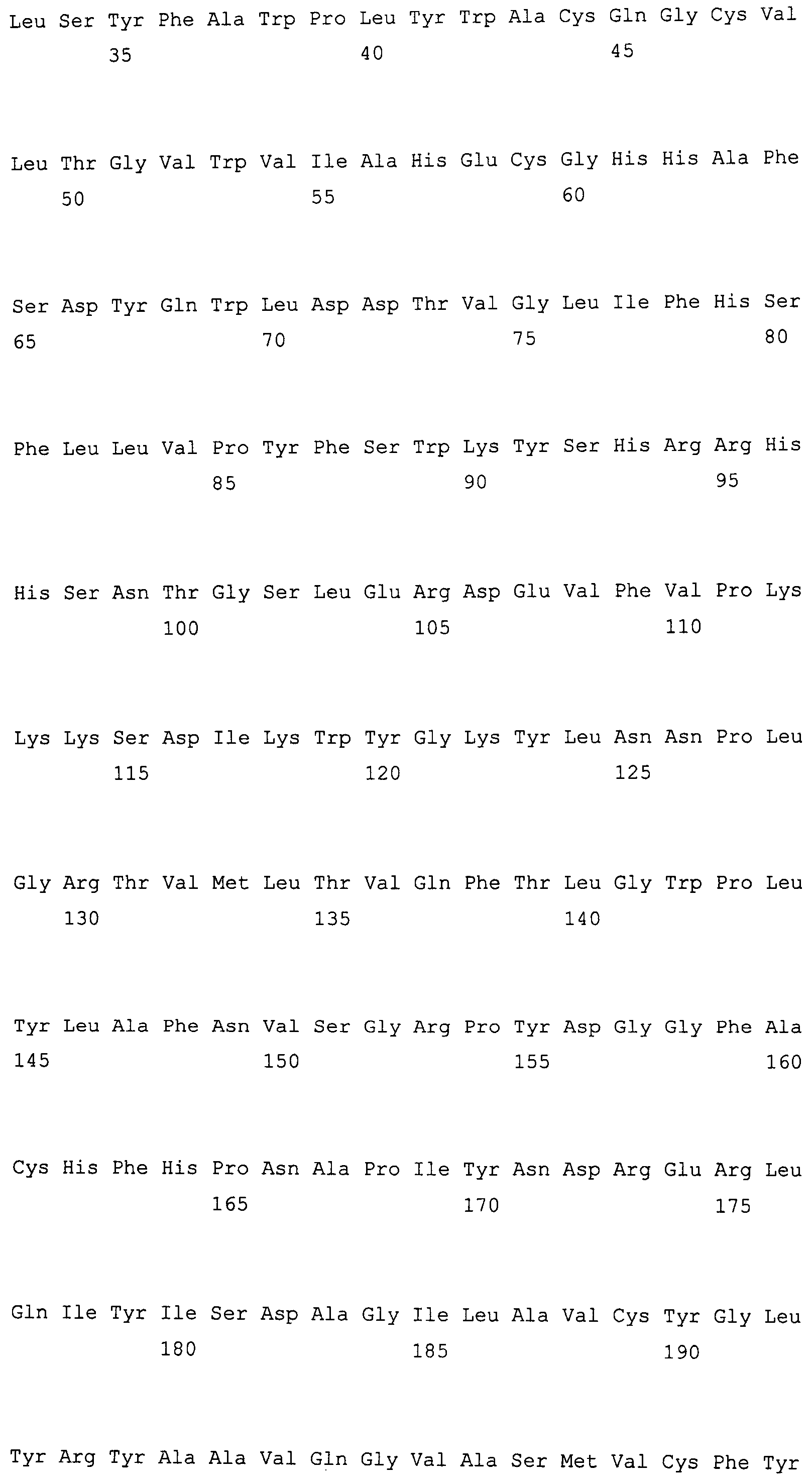
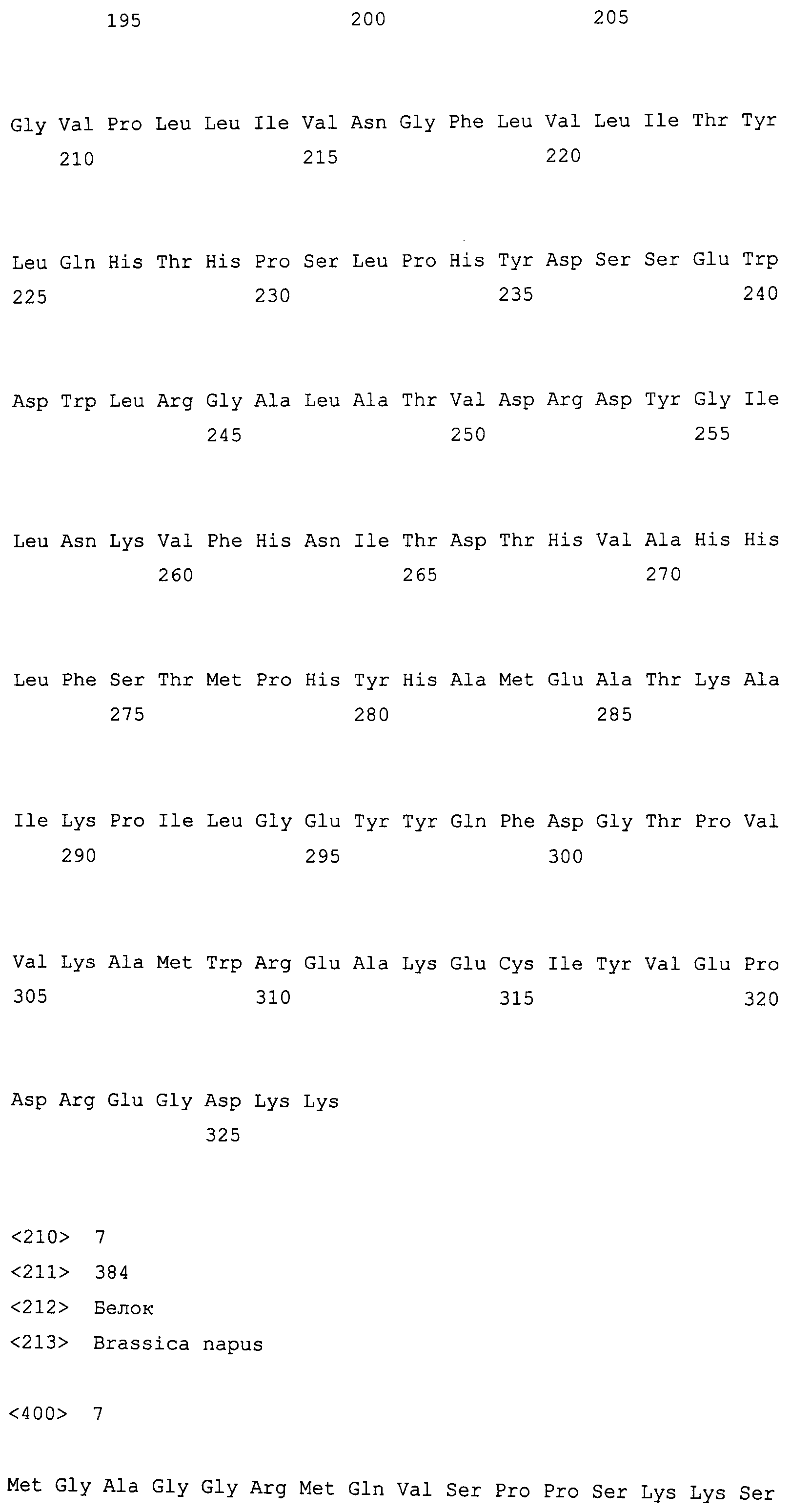
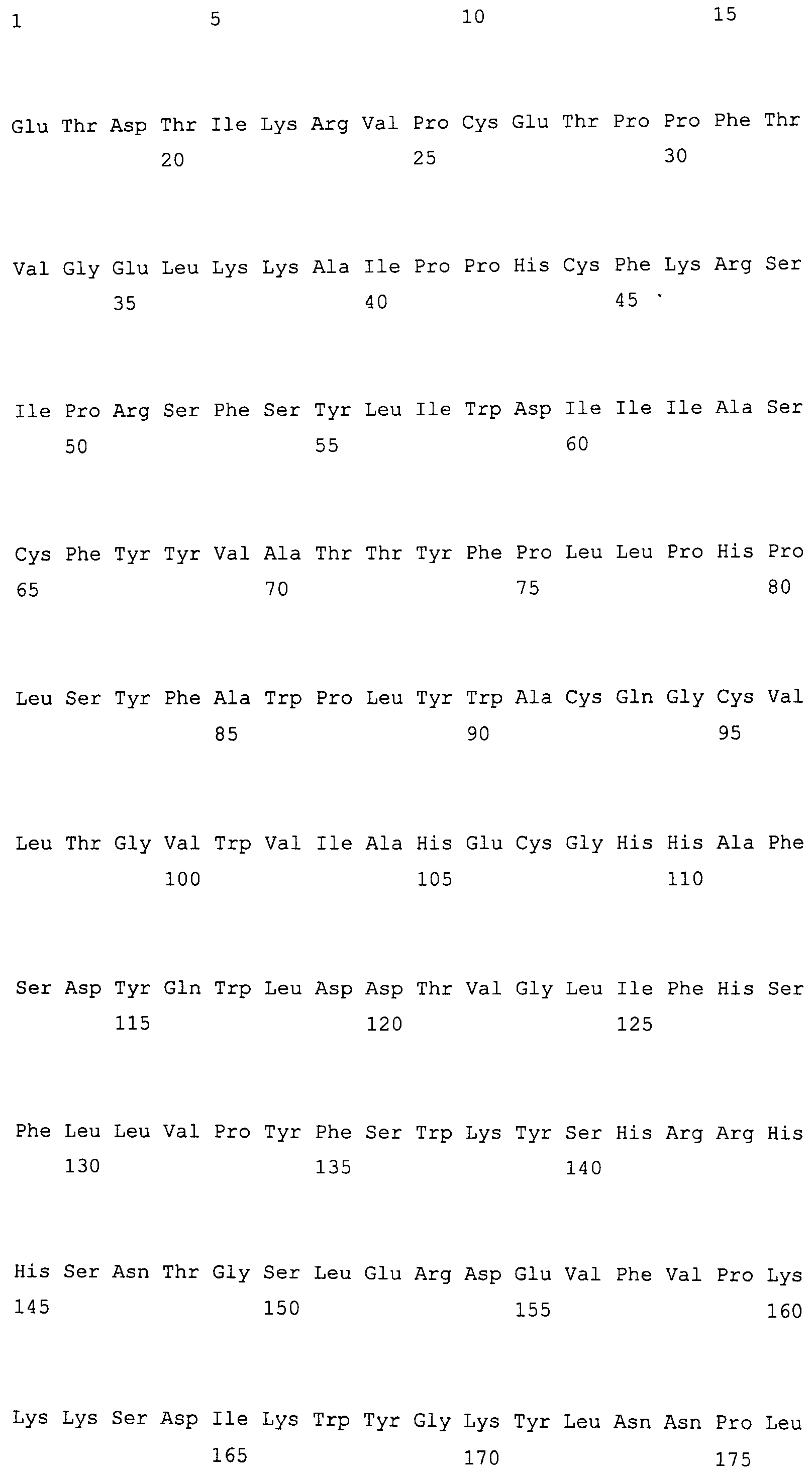




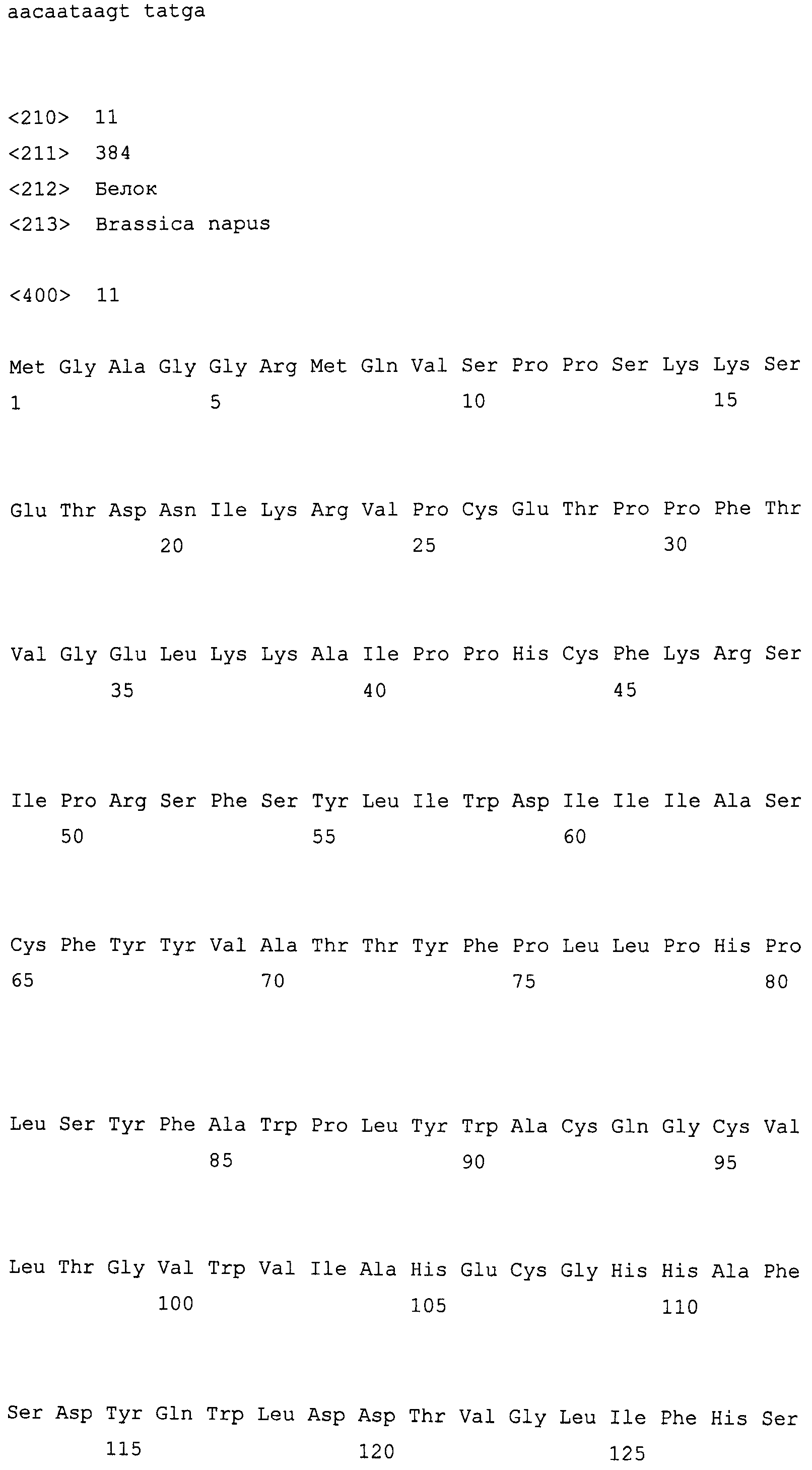
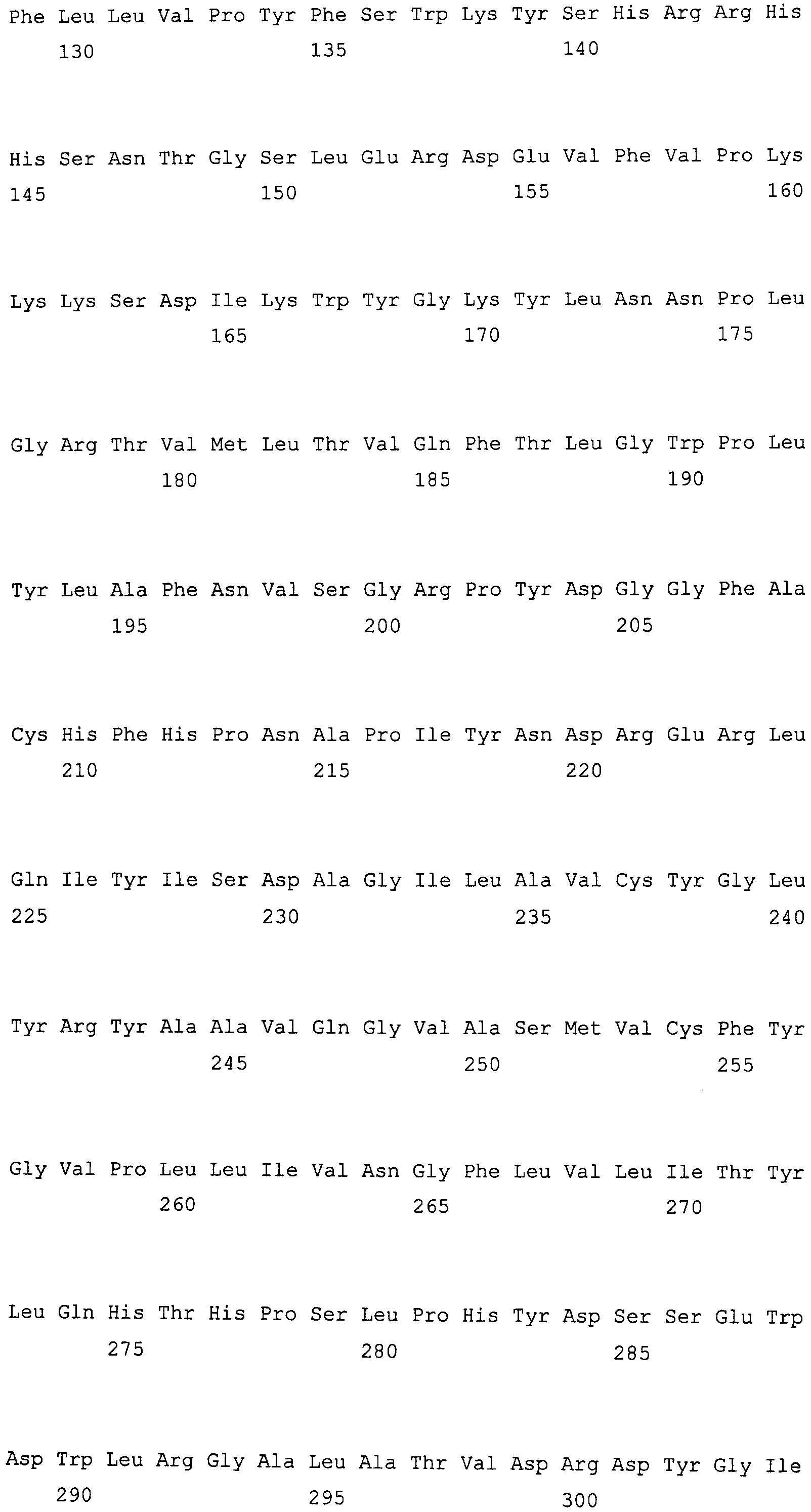





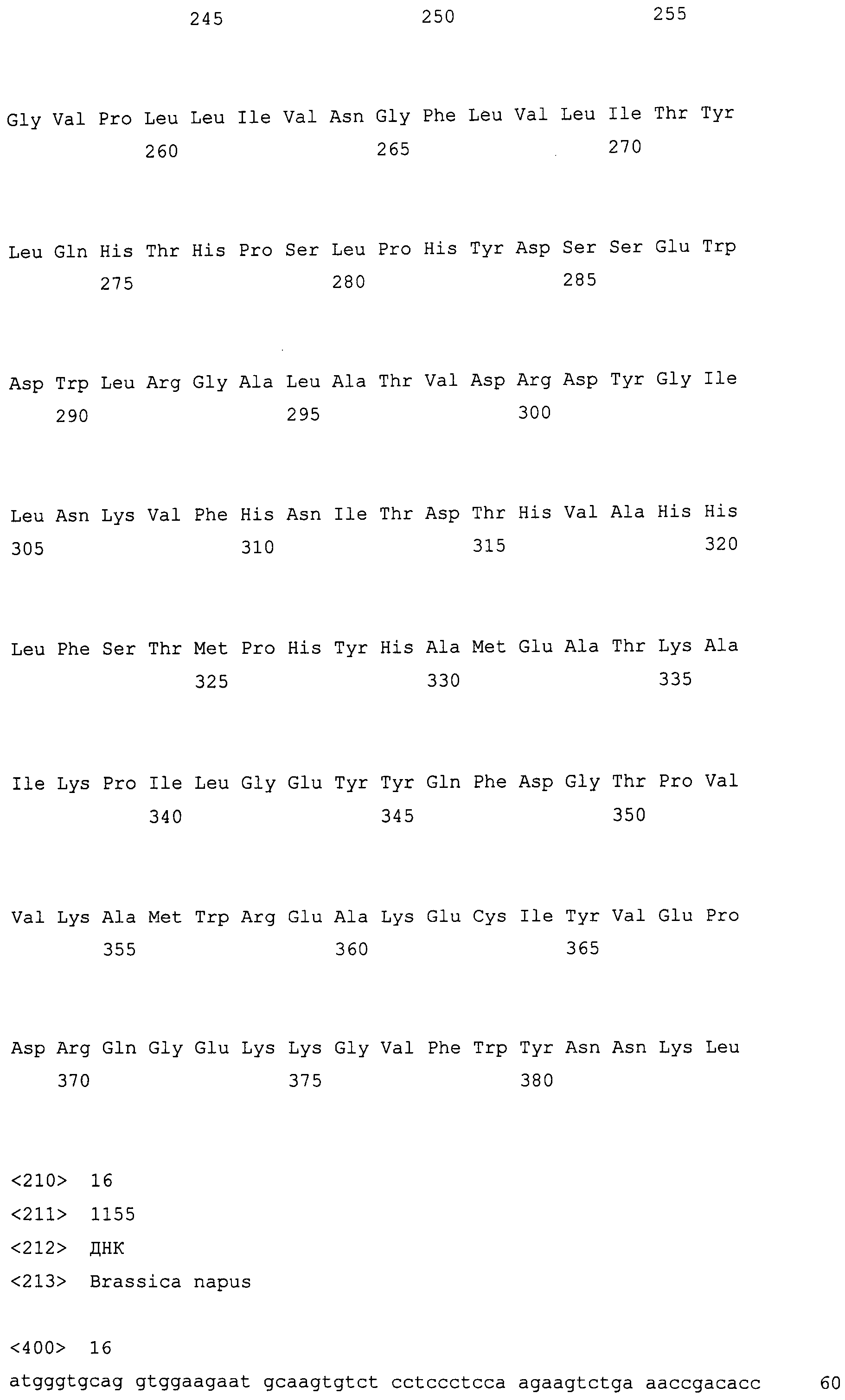






















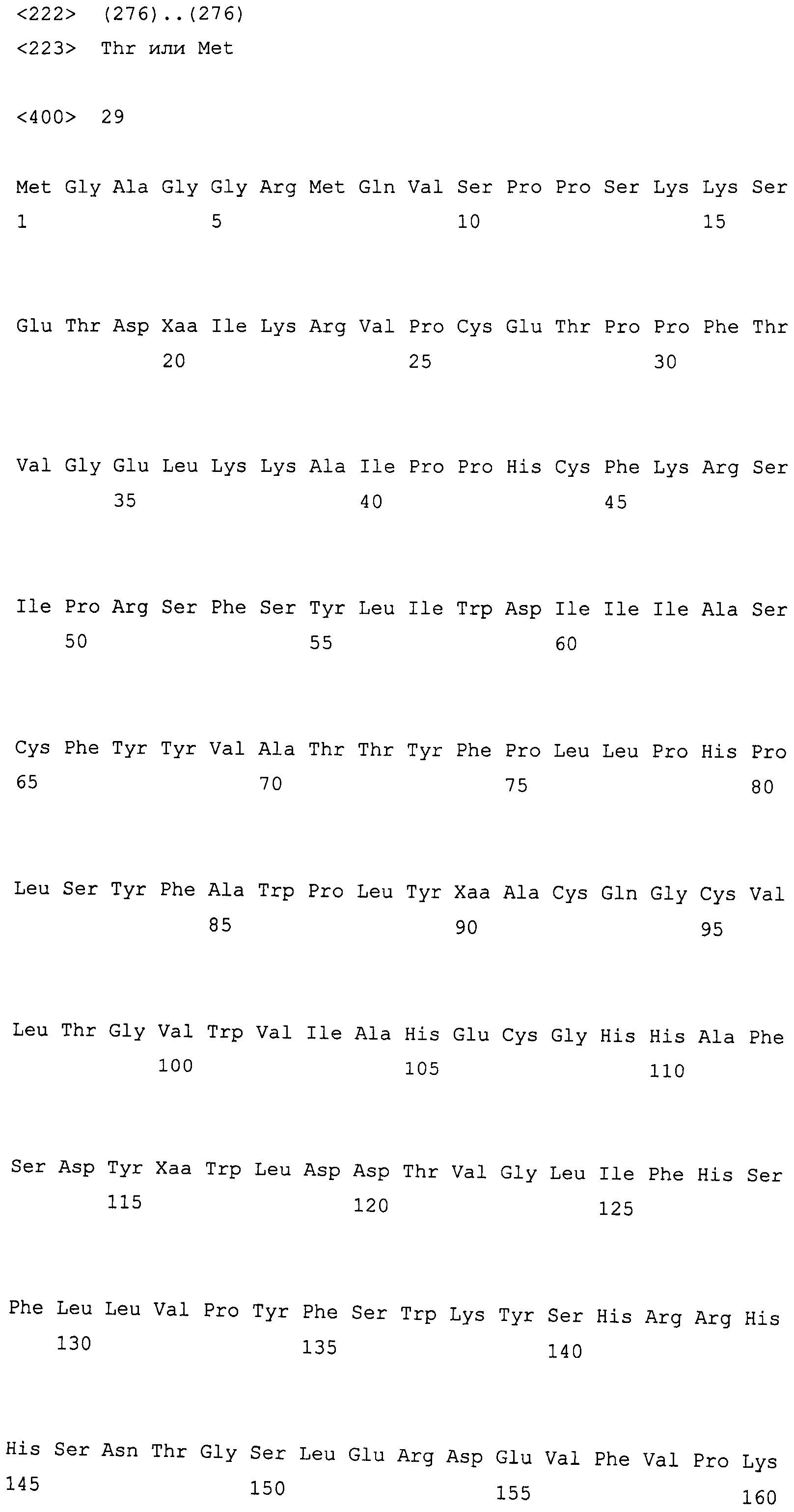
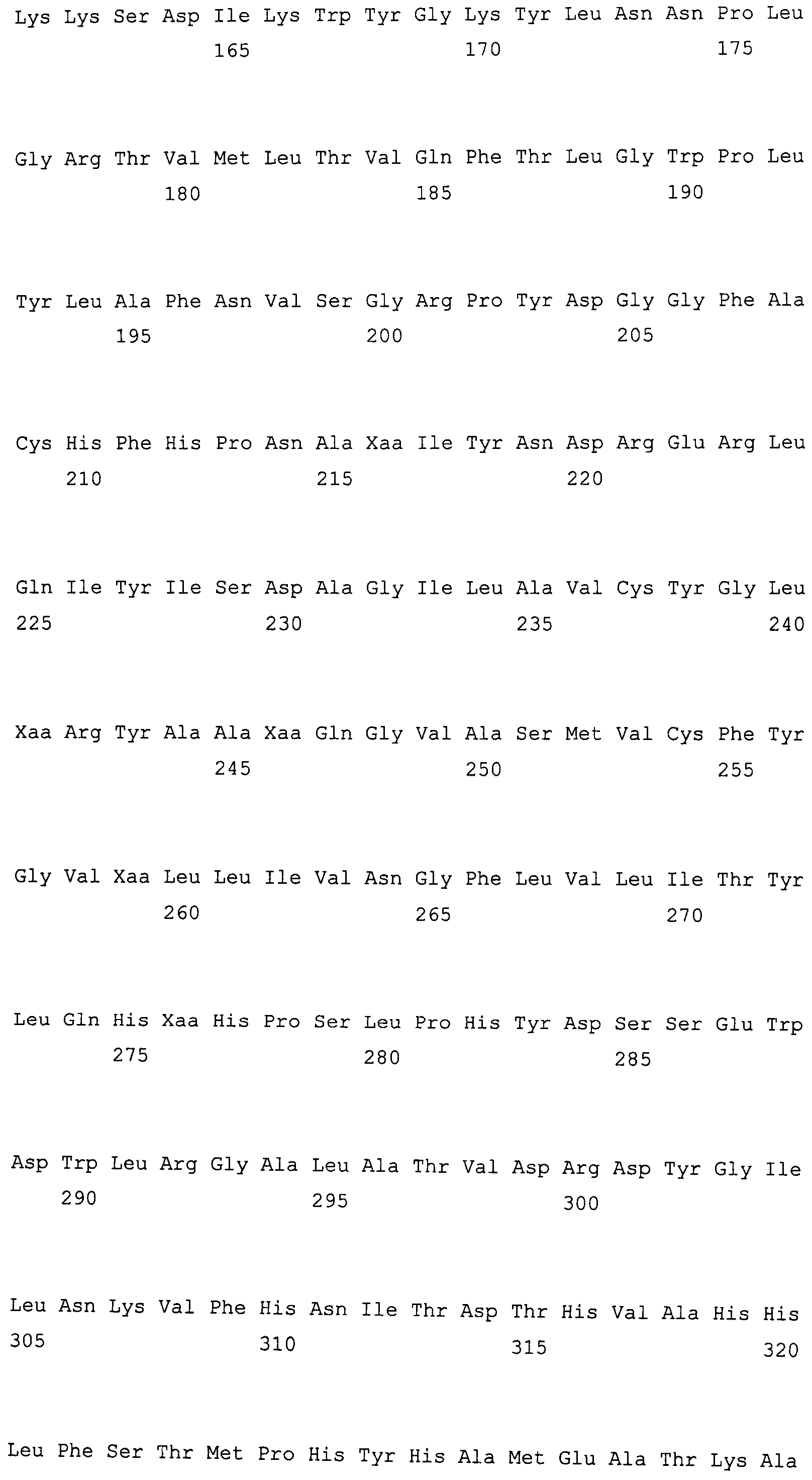






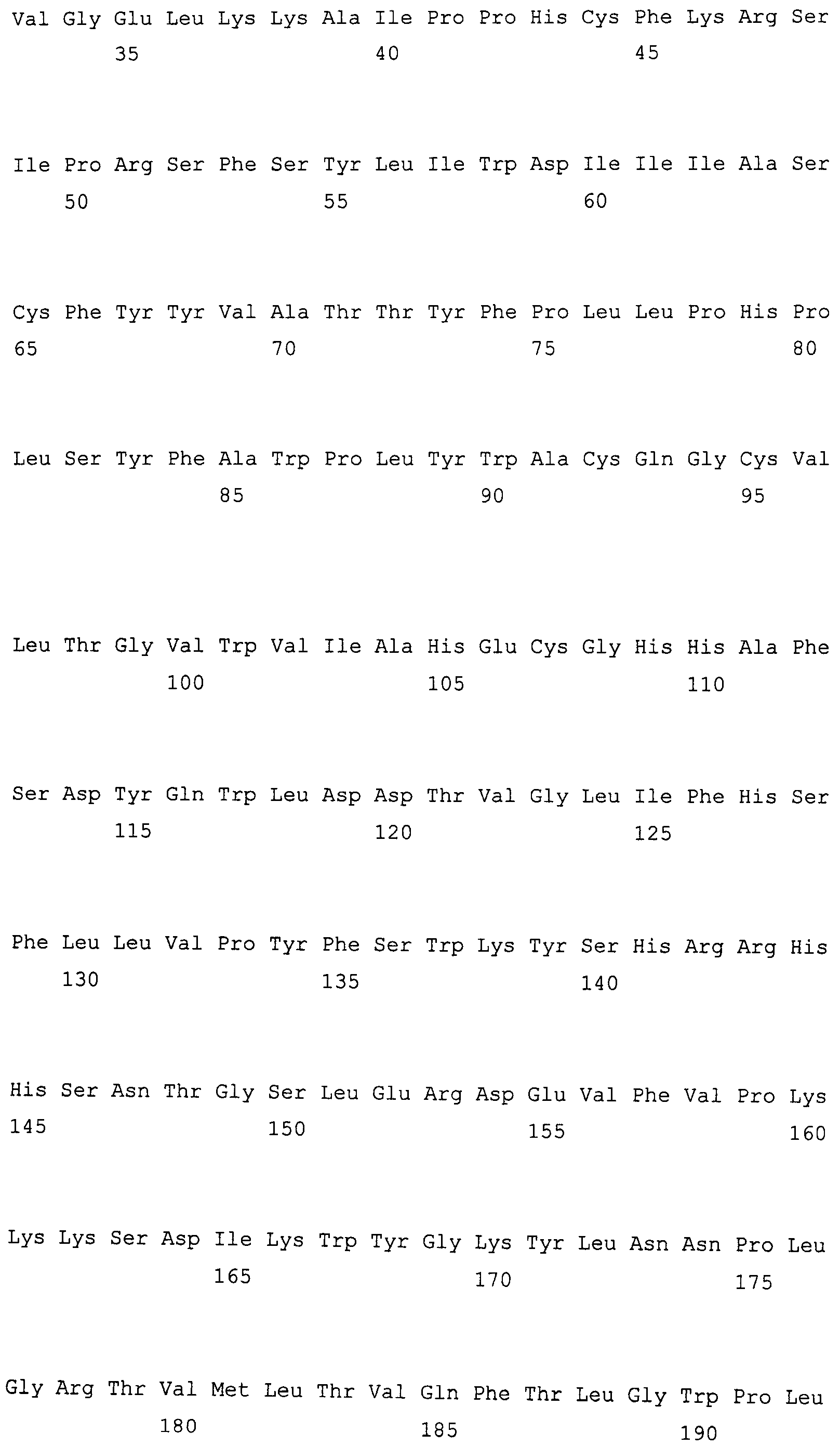



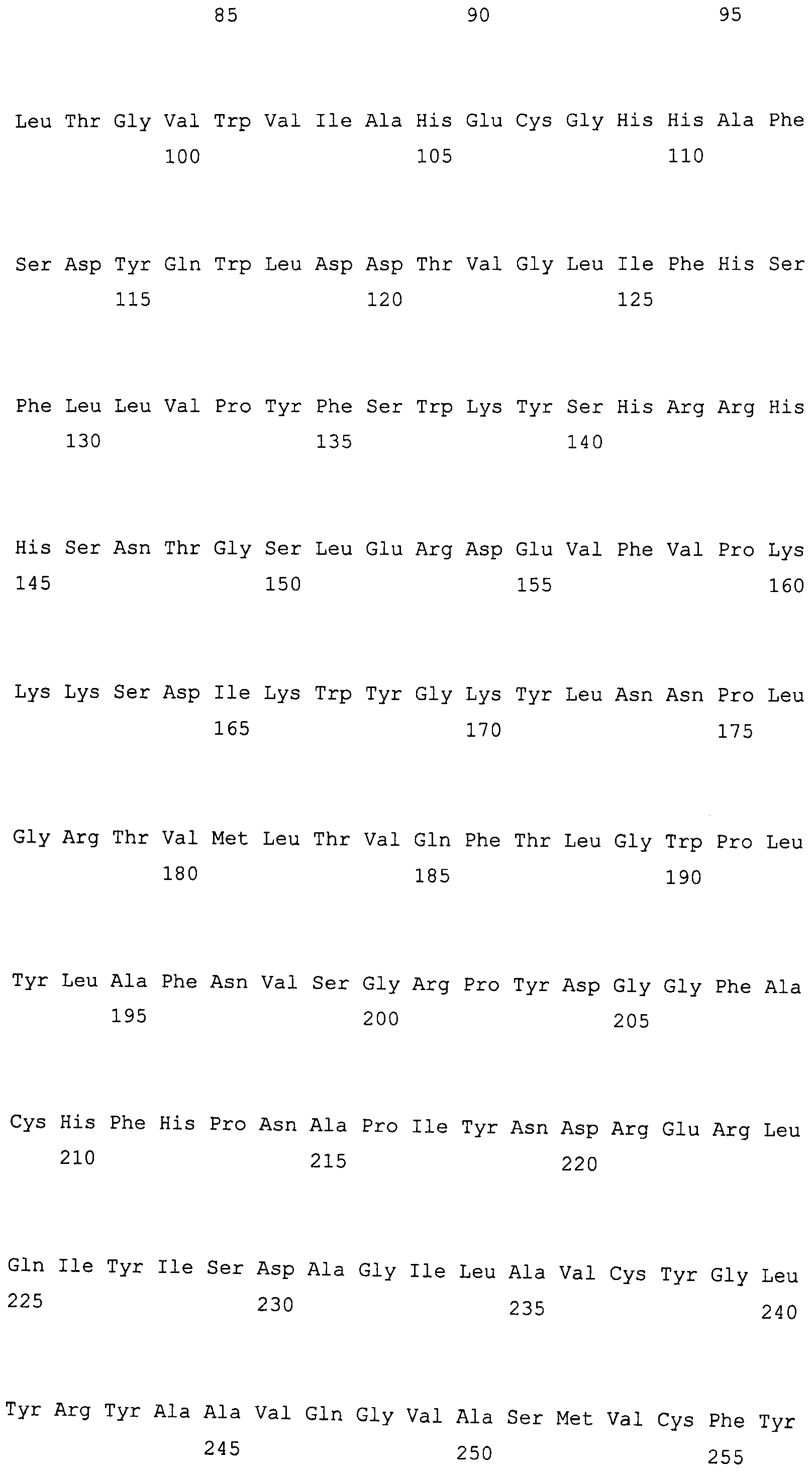



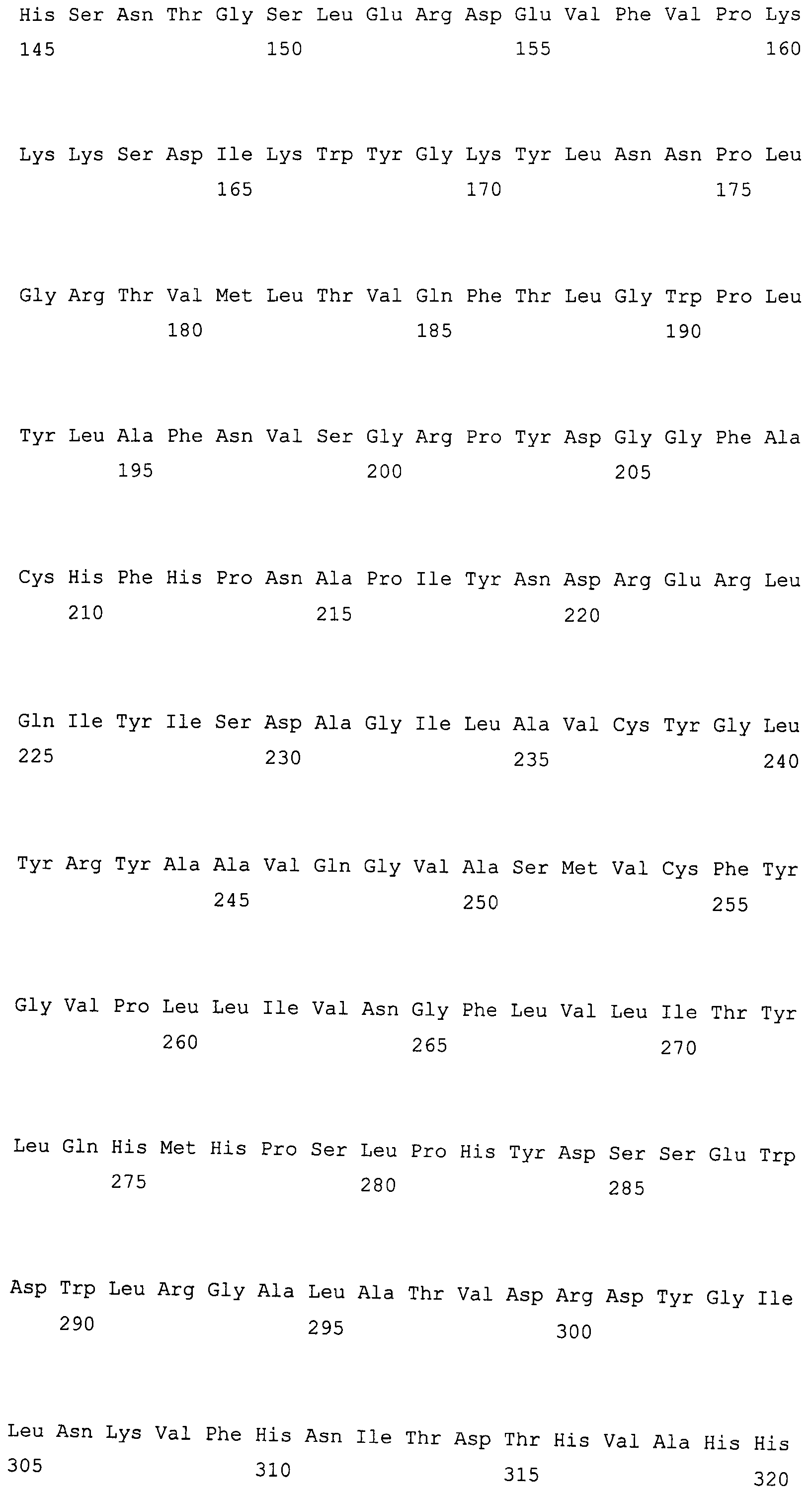
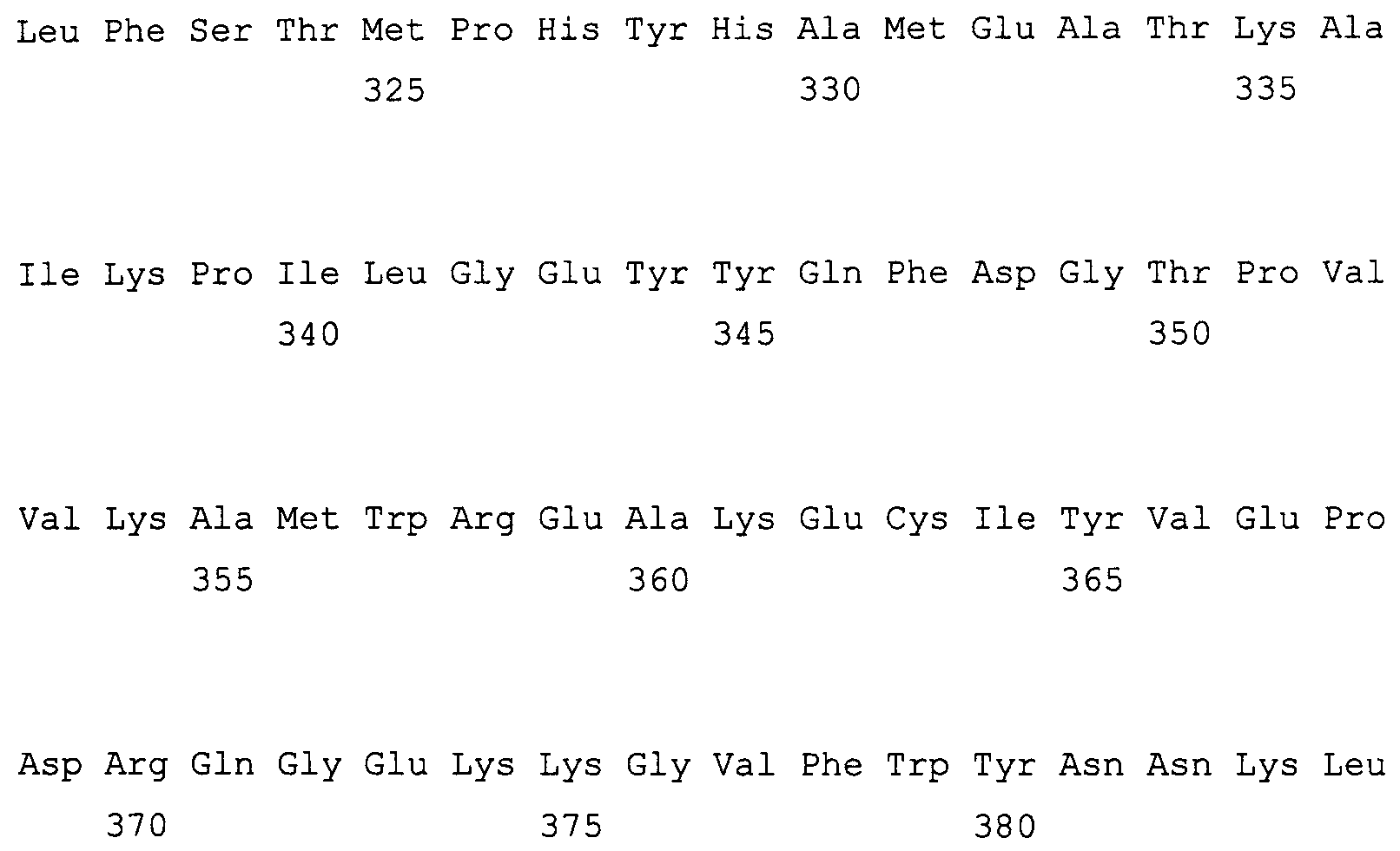



Описание
ЗАЯВКА НА ПРИОРИТЕТ
По настоящей заявке испрашивается приоритет по дате подачи предварительной патентной заявки США с серийным номером 61/198422, поданной 4 ноября 2008 года, под названием "Omega-9 Quality Brassica Juncea".
ОБЛАСТЬ ТЕХНИКИ
Изобретение принадлежит области улучшенных видов Brassica, включая Brassica juncea, улучшенных масла и муки из Brassica juncea, способов получения таких улучшенных видов Brassica и способов селекции линий Brassica. Дополнительные варианты осуществления относятся к семенам Brassica juncea, содержащим эндогенное масло с увеличенным содержанием олеиновой кислоты и сниженным содержанием линоленовой кислоты относительно существующих в настоящее время коммерческих культиваров Brassica juncea, и к семенам Brassica juncea со стабильно внесенными в них характеристиками увеличенного содержания олеиновой кислоты и сниженного содержания линоленовой кислоты в масле семян.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Канола представляет собой генетическую вариацию рапса, специально разработанную канадскими растениеводами из-за характеристик ее масла и муки, в частности ее низкого уровня насыщенных жиров. Как правило, "канола" относится к растениям вида Brassica, которые содержат в масле семян менее 2% эруковой кислоты (Δ13-22:1) по массе и менее чем 30 микромоль глюкозинолатов на грамм не содержащей масла муки. Как правило, масло канолы может включать насыщенные жирные кислоты, известные как пальмитиновая кислота и стеариновая кислота, мононенасыщенную жирную кислоту, известную как олеиновая кислота, и полиненасыщенные жирные кислоты, известные как линолевая кислота и линоленовая кислота. Эти жирные кислоты иногда указывают по длине их углеродной цепи и количеству двойных связей в цепи. Например, олеиновую кислоту иногда обозначают как C18:1, так как она содержит цепь из 18 атомов углерода и одну двойную связь, линолевую кислоту иногда обозначают как C18:2, так как она содержит цепь из 18 атомов углерода и две двойных связи, а линоленовая кислота иногда обозначают как C18:3, так как она содержит цепь из 18 атомов углерода и три двойных связи. Масло канолы может содержать менее чем приблизительно 7% всех насыщенных жирных кислот (в основном пальмитиновой кислоты и стеариновой кислоты) и более 60% олеиновой кислоты (как процент от всех жирных кислот). Как правило, культуры канолы включают сорта Brassica napus и Brassica rapa. Недавно к семейству культур канолы добавлен сорт Brassica juncea качества канолы с качеством масла и муки, сходным с другими типичными представителями канолы (патент США № 6303849 Potts et al., выданный 16 октября 2001 года; патент США № 7423198 Yao et al.; Potts and Males, 1999).
Состав жирных кислот растительного масла влияет на качество масла, устойчивость и полезные для здоровья характеристики. Например, признано, что олеиновая кислота (C18:1 мононенасыщенная жирная кислота) обладает определенной пользой для здоровья, включая эффективность в снижении уровней холестерина в плазме, что делает повышенные уровни содержания олеиновой кислоты в масле семян (>70%) желательной характеристикой. Кроме того, не все жирные кислоты в растительных маслах одинаково чувствительны к высокой температуре и окислению. Скорее, чувствительность индивидуальных жирных кислот к окислению зависит от степени их ненасыщенности. Например, линоленовая кислота (C18:3), содержащая три двойных связи углерод-углерод, окисляется в 98 раз быстрее, чем олеиновая кислота, содержащая только одну двойную связь углерод-углерод, а линолевая кислота, содержащая две двойные связх углерод-углерод, окисляется в 41 раз быстрее, чем олеиновая кислота (R.T. Holman and O.C. Elmer, "The rates of oxidation of unsaturated fatty acid esters", J. Am. Oil Chem. Soc. 24, 127-129 1947). Для дополнительной информации относительно относительных скоростей окисления олеиновой, линолевой и линоленовой жирных кислот, см. Hawrysh, "Stability of Canola Oil", Chap. 7, pp. 99-122, Canola and Rapeseed: Production, Chemistry, Nutrition, and Processing Technology, Shahidi, ed., Van Nostrand Reinhold, NY, 1990.
"Устойчивость" растительного масла можно определить как устойчивость масла к окислению и обусловленной им порче вследствие образования продуктов, вызывающих прогоркание и снижающих качество продукта питания. В условиях одинаковой обработки, технологии получения, упаковки и условий хранения, основные отличия в устойчивости между различными растительными маслами происходят вследствие различия их профилей жирных кислот. Таким образом, растительное масло с высоким содержанием олеиновой кислоты предпочтительно в кулинарном применении вследствие его увеличенной устойчивости к окислению при нагревании. Плохая устойчивость к окислению приводит, например, к сокращению продолжительности эксплуатации в случае, когда масло используют в качестве масла для жарки, так как окисление приводит к неприятным вкусам и запахам, которые могут значительно снизить рыночную стоимость масла. По этим причинам высокое содержание олеиновой кислоты и низкое содержание линоленовой кислоты могут являться желательными характеристиками в растительных маслах.
Растения синтезируют жирные кислоты в своих пластидах в виде пальмитоил-ACP (16:0-ACP) и стеароил-ACP. Преобразование стеароил-ACP в олеоил-ACP (18:1-ACP) катализирует растворимый фермент стеароил-ACP-Δ9-десатуразу (Shanklin and Somerville, 1991). Эти ацил-ACP используются или для синтеза гликолипидов в хлоропластах, или транспортируются из хлоропластов в цитоплазму в виде ацил-CoA. Дополнительная десатурация олеиновой кислоты происходит только после того, как она будет использована при синтезе глицеролипидов и встроится в мембраны, что приводит к синтезу полиненасыщенных жирных кислот.
Специалистам в данной области широко известно, что ненасыщенность жирных кислот в семенах масличных культур частично контролируется ферментами десатуразами жирных кислот (FAD). Ферменты FAD регулируют ненасыщенность жирных кислот, таких как стеариновая кислота (C18:0), олеиновая кислота (C18:l) и линолевая кислота (C18:2), посредством отщепления атомов водорода от определенных атомов углерода ацильной цепи жирной кислоты, образуя двойные связи углерод-углерод. Синтез полиненасыщенных жирных кислот, линолевой (Δ9, 12-18:2) и α-линолевой (Δ9, 12, 15-18:3), начинается с преобразования олеиновой кислоты (Δ9-18:1) в линолевую кислоту, ферментативный этап, катализируемый микросомальной ω-6-десатуразой олеиновой кислоты (FAD2). Затем линолевая кислота преобразуется в ω-линоленовую кислоту посредством дополнительной десатурации ω-3-десатуразой линолевой кислоты (FAD3). Существуют публикации, что манипуляции с геном FAD2 посредством генетической инженерии могут изменять профили жирных кислот. Например, гетерологическая экспрессия гена fad2 сои в мутантной линии Arabidopsis приводит к значительному увеличению накопления полиненасыщенных жирных кислот (Heppard et al., 1996). В отличие от этого, мутантная линия Arabidopsisfad2-5, где транскрипция гена fad2 значимо снижена вследствие вставки Т-ДНК, демонстрирует значительное увеличение накопления олеиновой кислоты и значимое снижение уровней линолевой кислоты и линоленовой кислоты (Okuley et al., 1994). Эти изыскания позволяют предположить, что ген FAD2 играет важную роль в контроле преобразования олеиновой кислоты в линолевую кислоту у хранящихся в семенах липидов.
Предприняты значительные усилия для манипуляции профилем жирных кислот растений, в частности сортов с маслосодержащими семенами, таких как виды Brassica, которые используют для широкомасштабного производства коммерческих жиров и масел (см., например, патенты США №№ 5625130, выданный 29 апреля 1997 года, 5668299, выданный 16 сентября 1997 года, 5767338, выданный 16 июня 1998 года, 5840946, выданный 24 ноября 1998 года, 5850026, выданный 15 декабря 1998 года, 5861187, выданный 19 января 1999 года, 6063947, выданный 16 мая 2000 года, 6084157, выданный 4 июля 2000 года, 6169190, выданный 2 января 2001 года, 6323392, выданный 27 ноября 2001 года, и международные патентные заявки WO 97/43907, опубликованную 27 ноября 1997 года, и WO 00/51415, опубликованную 8 сентября 2000 года).
Brassica juncea (геном AA BB; n=18) (также обозначаемая в настоящем документе как "B. juncea") представляет собой амфидиплоидное растение рода Brassica, которое, как в основном полагают, является результатом гибридизации Brassica rapa (геном AA; n=10) и Brassica nigra (геном BB; n=8). Brassica napus (геном AA CC; n=19) (также обозначаемая в настоящем документе как "B. napus") также представляет собой амфидиплоидное растение гена Brassica, но, как полагают, являющаяся результатом гибридизации Brassica rapa и Brassica oleracea (геном CC; n=9). В некоторых условиях роста B. juncea может обладать определенными превосходными признаками B. napus. Эти превосходные признаки могут включать повышенную урожайность, улучшенную засухо- и жароустойчивость и лучшую устойчивость к заболеваниям. Интенсивные попытки селекции позволили получить растения видов Brassica, масло семян которых содержит менее 2% эруковой кислоты, и обезжиренная мука которых содержит менее 30 микромоль глюкозинолатов на грамм. Термин "канола" используют для описания сортов видов Brassica, содержащих малые количества эруковой кислоты (Δ13-22:1) и малые количества глюкозинолатов. Как правило, масло канолы может содержать менее чем приблизительно 7% всех насыщенных жирных кислот и более 60% олеиновой кислоты (как процент от всех жирных кислот). Например, в Соединенных Штатах Америки, по 21 CFR 184.1555, рапсовое масло с низким содержанием эруковой кислоты, полученное из Brassica napus или Brassica rapa, признают маслом канолы, когда его содержание эруковой кислоты составляет не более 2% от компонента жирных кислот, содержание олеиновой кислоты (C18:1) составляет более 50,0% по массе, содержание линолевой кислоты (C18:2) составляет менее 40,0% по массе, а содержание линоленовой кислоты (C18:3) составляет менее 14,0% по массе. В Канаде добавление Brassica juncea к определению канолы Canola Council of Canada устанавливает дополнительные требования, чтобы сорта канолы Brassica juncea должны давать семена, содержание олеиновой кислоты в масле которых равно или больше 55% от всех жирных кислот в семенах, а мука, получаемая из семян канолы Brassica juncea, должна содержать менее 1 микромоль аллил-(2-пропенил)глюкозинолатов на грамм не содержащей масла муки.
Различия между составами масел Brassica juncea и Brassica napus хорошо известны в данной области. Например, известно, что у Brassica juncea существуют различия по многим составляющим, включая в качестве неограничивающих примеров фенольные составляющие (например, токоферолы), стеролы, сульфиды, составы жирных кислот, минеральные вещества и изотиоцианаты. Brassica juncea также содержит летучие вещества с сильными противомикробными (бактерии и грибы) свойствами.
Растениеводы-селекционеры уже селекционировали сорта канолы с низким содержанием глюкозинолатов, таких как 3-бутенил-, 4-пентенил-, 2-гидрокси-3-бутенил- или 2-гидрокси-4-пентенилглюкозинолат. Муку качества канолы можно определить, например, как содержащую глюкозинолатов менее чем 30 микромоль алифатических глюкозинолатов на грамм не содержащей масла муки. В настоящее время основные коммерческие культуры канолы включают сорта Brassica napus и Brassica rapa (campestris). В патенте США № 6303849, выданном Potts et al. 16 октября 2001 года, описаны линии Brassica juncea, содержащие пищевое масло со свойствами, сходными с канолой. Описанные в нем линии Brassica juncea имеют происхождение, включающее линии Brassica juncea J90-3450 и J90-4316, депонированные под инвентарными номерами ATCC 203389 и 203390, соответственно (которые обе депонированы Agriculture and Agri-Food Canada по условиям Budapest Treaty 23 октября 1998 года в American Type Culture Collection, 10801 University Blvd., Manassas, Va. USA 20110-2209).
Указанные выше примеры из связанной области и связанные с ними ограничения предназначены для иллюстрации, а не для исключения. Другие ограничения связанной области будут очевидны специалистам в данной области при чтении описания и изучения фигур.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Приведенные ниже варианты осуществления и его аспекты описаны и проиллюстрированы в сочетании с системами, средствами и способами, которые полагают приведенными для примера и иллюстративными, не ограничивающими объема. В различных вариантах осуществления уменьшены или устранены одна или несколько из описанных выше проблем, тогда как другие варианты осуществления относятся к другим улучшениям.
Изобретение в различных аспектах относится к растениям, семенам, клеткам, аллельным вариантам последовательностей нуклеиновой кислоты и маслам Brassica juncea. Пищевое масло в семенах растений по изобретению может иметь значимо большее содержание олеиновой кислоты и меньшее содержание линоленовой кислоты, чем находится в семенах других растений Brassica juncea. Ряд линий с высоким содержанием олеиновой кислоты/низким содержанием линоленовой кислоты ("HOLL") Brassica juncea описаны в настоящем изобретении. В одном из вариантов осуществления линия Brassica juncea содержит гены FAD2 и FAD3, как описано в международной публикации № US 2006/0248611 A1 (содержание которой включено в настоящий документ в качестве ссылки), которые проиллюстрированы на фиг. 1 и 3 и в SEQ ID NO: 1-4. Полученный мутантный аллель кодирует белки дельта-12-десатураз жирных кислот, которые проиллюстрированы на фиг. 2 и в SEQ ID NO: 5-7. В других вариантах осуществления линия Brassica juncea может содержать мутации в генных локусах fad2-a и fad3-a, и полученные мутантные аллели могут кодировать одну или несколько мутаций в последовательности прогнозируемых белков BjFAD2-A и BjFAD3-A. Характерные примеры мутантных генов fad2-a и fad3-a и белков, пригодных для использования по настоящему изобретению, также включают в качестве неограничивающих примеров белки и гены, описанные в: международной публикации № WO 2006/079567 A2 (например, фиг. 1 и 2), такие как SEQ ID NO: 8 и 9; международной публикации № WO 2007/107590 A2, такие как SEQ ID NO: 10-21; патент США № 6967243 B2 (например, фиг. 2 и 3), такие как SEQ ID NO: 22-27; и европейская публикация No. 1862551 A1 (например, фиг. 1-10), такие как SEQ ID NO: 28-39. Содержание каждой из указанных выше патентных публикаций включено в настоящий документ в качестве ссылки. В альтернативных вариантах осуществления преобразованные линии BNfad2-a и Bnfad23-a можно использовать для поиска природных вариаций в BJFAD2B и BJFAD3B в растениях Brassica, так как в растениях Brassica juncea, содержащих BnFad2A, BnFad3A, можно выявить значительные вариации профилей жирных кислот.
В одном из аспектов изобретения неожиданно обнаружили, что замена, делеция или сайленсинг ферментативной активности FAD2 и/или FAD3 в растении Brassica приводит к растениям, способным к продукции масла с содержанием олеиновой кислоты более чем приблизительно 70% по массе и с содержанием линоленовой кислоты менее чем приблизительно 5% по массе. В другом варианте осуществления неожиданно обнаружили, что удаление или перенос генов, модифицирующих ферментативную активность FAD2 и/или FAD3 в растении Brassica, приводит к растениям, способным к продукции масла с содержанием олеиновой кислоты более чем приблизительно 70% по массе и с содержанием линоленовой кислоты менее чем приблизительно 5% по массе. Такие растения, например, могут представлять собой тетраплоидные растения или амфидиплоидные растения, такие как Brassica juncea или Brassica napus. Таким образом, в одном из аспектов изобретение относится к делеции или сайленсингу в растении, таком как в линиях Brassica juncea, выбранных кодирующих последовательностей FAD2 и FAD3. Пищевое масло, получаемое из растений по изобретению, можно охарактеризовать одной или несколькими из следующих характеристик: содержание олеиновой кислоты по меньшей мере 70% по массе, содержание линоленовой кислоты менее чем приблизительно 5% по массе, и общее содержание насыщенных жирных кислот менее чем приблизительно 7% по массе.
Альтернативные аспекты изобретения включают растения и части растений. Как применяют в настоящем документе, "части растений" включают растительные клетки, семена, пыльцу, содержащие нуклеиновые кислоты по изобретению, или содержащие кодирующие последовательности fad2/fad3 по изобретению, или содержащие регуляторные последовательности, такие как последовательности, расположенные выше кодирующих последовательностей FAD2/FAD3, которые экспрессируют ферменты FAD2 и/или FAD3 из Brassica napus. Предоставлены способы использования растений по изобретению, включая растения-потомки, выбираемые по маркерам по изобретению, с получением растительных продуктов. Как применяют в настоящем документе, "растительные продукты" включают все, что получают из растения по изобретению, включая части растений, такие как семена, муку, жиры или масла, включая растительные продукты с измененными концентрациями олеиновой кислоты и линоленовой кислоты. Предоставлены способы модификации растений так, чтобы они содержали перенесенные кодирующие последовательности fad2/fad3 из Brassica napus, способные к экспрессии активного фермента FAD2 и/или фермента FAD3. Например, такие способы могут включать перенос одной или нескольких кодирующих последовательностей fad2-a и/или fad3-a из Brassica napus в растение посредством межвидовой гибридизации так, чтобы растение содержало замещенные кодирующие последовательности fad2 и/или fad3a. Такие способы обеспечивают идентификацию и точное введение проводимых мутаций в Brassica juncea.
Предоставлены праймеры для амплификации для идентификации частей кодирующих последовательностей fad2/fad3 по изобретению, которые можно использовать, например, для определения различных аллелей выбранных локусов FAD2 и/или FAD3. Предоставлены способы получения растений с использованием кодирующих последовательностей fad2/fad3 по изобретению или областей, расположенных выше кодирующих последовательностей fad2/fad3 по изобретению. Например, последовательности по изобретению можно использовать для проведения или направления сайт-специфических мутаций, которые могут подавлять или изменять экспрессию выбранных кодирующих последовательностей FAD2 и/или FAD3, так как посредством подавления или изменения экспрессии гена FAD2 и/или FAD3 из выбранного локуса FAD2 или FAD3 или посредством укорочения белка FAD2 и/или FAD3, кодируемого геном FAD2 и/или FAD3. Для введения кодирующих последовательностей fad2 и/или fad3a по изобретению в потомство растений по изобретению можно использовать общепринятые способы селекции растений, такие как скрещивание и обратное скрещивание, и другие способы селекции.
Альтернативный вариант осуществления включает масло в семенах сорта Brassica juncea с содержанием жирных кислот, включающим, по меньшей мере, 68,0% олеиновой кислоты по массе и менее чем 4,0% линоленовой кислоты по массе.
Кроме того, настоящее изобретение включает муку, получаемую из семян растений B. Juncea, описываемых в настоящем документе, где такая мука может находиться в форме молотых семян, жмыха, белых хлопьев или муки после применения общепринятых способов помола и экстракции растворителем.
В дополнение к иллюстративным аспектам и вариантам осуществления, описанным выше, дополнительные аспекты и варианты осуществления станут очевидны на основе рисунков и при изучении следующего описания.
КРАТКОЕ ОПИСАНИЕ ФИГУР
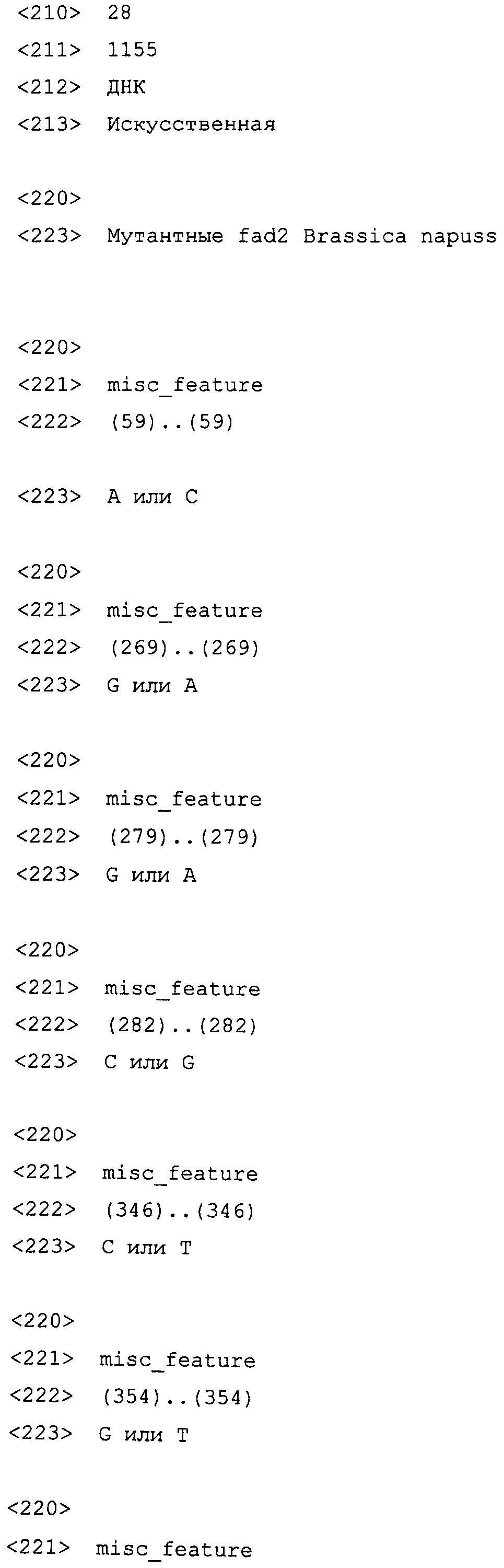
На фиг. 1 проиллюстрированы частичные геномные нуклеотидные последовательности гена fad2, клонированные из DMS100 и Quantum. Вверху представлена последовательность DMS100 ( SEQ ID NO: 1), а внизу представлена последовательность Quantum ( SEQ ID NO: 2). Стрелкой указана однонуклеотидная мутация C в T, приводящая к образованию стоп-кодона (TAG) (заштриховано). Прямой и обратный праймеры для основанного на ПЦР аллелеспецифического маркера мутантного аллеля приведены полужирным шрифтом и подчеркнуты.
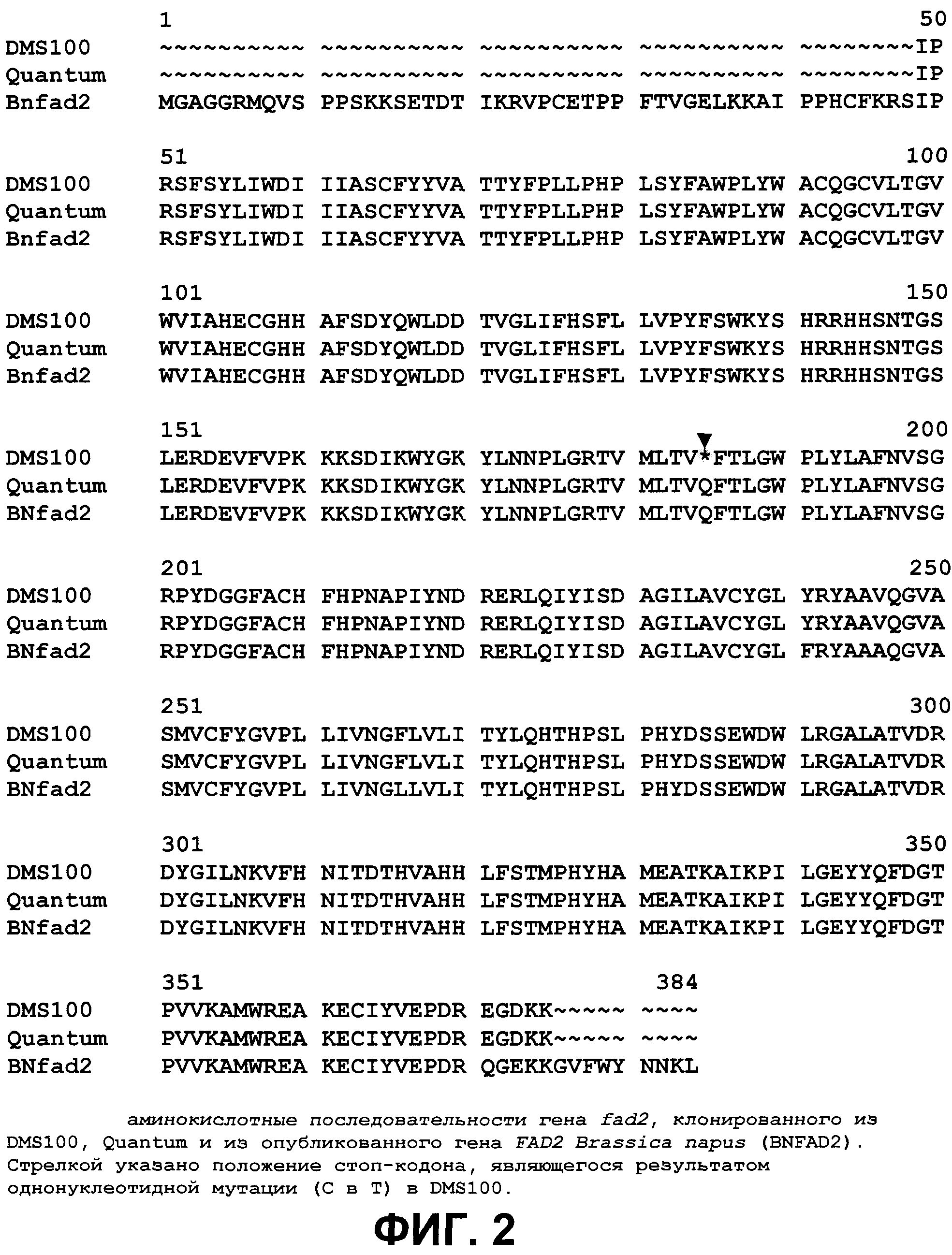
На фиг. 2 предоставлены аминокислотные последовательности гена fad2, вырожденные с геномной нуклеотидной последовательностью, клонированные из DMS100 ( SEQ ID NO: 5), Quantum ( SEQ ID NO: 6) и из опубликованного гена FAD2Brassica napus (BNFAD2) ( SEQ ID NO: 7). Стрелкой указано положение стоп-кодона, являющегося результатом однонуклеотидной мутации (C в T) в DMS100.
На фиг. 3 представлены геномные нуклеотидные последовательности гена fad3c, клонированные из DMS100 и Quantum. Вверху представлена последовательность DMS100 ( SEQ ID NO: 3), а внизу представлена последовательность Quantum ( SEQ ID NO: 4). Экзоны заключены в рамки, интроны не заключены в рамки, что соответствует экзонам 4, 5, 6 и 7 и интронам 4, 5 и 6 гена fad3 в Brassica rapa и Arabidopsis. Стрелкой указана однонуклеотидная мутация G в A. Прямой и обратный праймеры для основанного на ПЦР аллелеспецифического маркера мутантного аллеля приведены полужирным шрифтом и подчеркнуты.
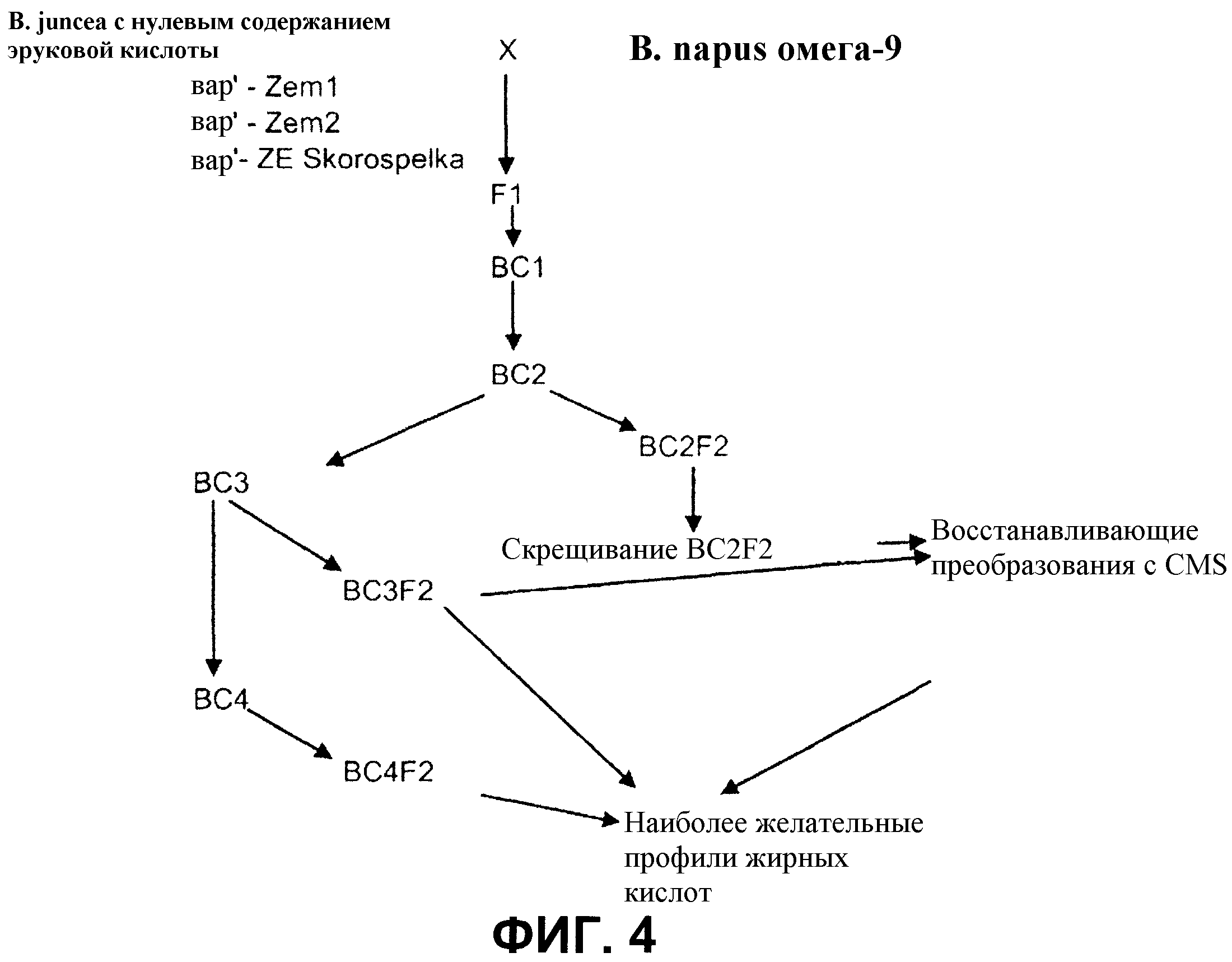
На фиг. 4 проиллюстрированы одно или несколько обратных скрещиваний (BC3 и BC4) между родителями вариантов отбора с высоким содержанием олеиновой кислоты - низким содержанием линоленовой кислоты и B. juncea (Zem1, Zem2 и ZE Skorospelka) в соответствии с основными положениями настоящего изобретения.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Последовательности нуклеиновых кислот, перечисленные в приложенном списке последовательностей, приведены с использованием стандартных буквенных сокращений для нуклеиновых оснований, как определено в 37 C.F.R. § 1.822. Приведена только одна цепь каждой последовательности нуклеиновой кислоты, но понятно, что комплементарная цепь включена в качестве ссылки на приведенную цепь. В приложенном списке последовательностей:
SEQ ID NO: 1 демонстрирует ген FAD2, клонированный из сорта Brassica napus, DMSI00, обозначаемый в международной публикации № US 2006/0248611 A1 как SEQ ID NO: 7.
SEQ ID NO: 2 демонстрирует ген FAD2, клонированный из сорта B. napus Quantum, обозначаемый в международной публикации № US 2006/0248611 A1 как SEQ ID NO: 9.
SEQ ID NO: 3 демонстрирует ген FAD3, клонированный из сорта B. napus DMS100, обозначаемый в международной публикации № US 2006/0248611 A1 как SEQ ID NO: 12.
SEQ ID NO: 4 демонстрирует ген FAD3, клонированный из сорта B. napus Quantum, обозначаемый в международной публикации № US 2006/0248611 A1 как SEQ ID NO: 13.
SEQ ID NO: 5 демонстрирует аминокислотную последовательность белка дельта-12-десатуразы жирных кислот, кодируемую геном FAD2, клонированным из сорта B. napus DMS100, обозначаемую в международной публикации № US 2006/0248611 A1 как SEQ ID NO: 8.
SEQ ID NO: 6 демонстрирует аминокислотную последовательность белка дельта-12-десатуразы жирных кислот, кодируемую геном FAD2, клонированным из сорта B. napus Quantum, обозначаемую в международной публикации № US 2006/0248611 A1 как SEQ ID NO: 10.
SEQ ID NO: 7 демонстрирует аминокислотную последовательность белка дельта-12-десатуразы жирных кислот, кодируемую опубликованным геном FAD2 (Bnfad2), клонированным из B. napus, обозначаемую в международной публикации № US 2006/0248611 A1 как SEQ ID NO: 11.
SEQ ID NO: 8 демонстрирует мутантный ген fad2-a, как описано в международной публикации № WO 2006/079567 A2.
SEQ ID NO: 9 демонстрирует мутантный белок fad2-a, кодируемый SEQ ID NO: 8.
SEQ ID NO: 10 демонстрирует ген fad2-aB. napus, обозначаемый в международной публикации № WO 2007/107590 A2 как SEQ ID NO: 1.
SEQ ID NO: 11 демонстрирует аминокислотную последовательность белка fad2-a, кодируемую SEQ ID NO: 10.
SEQ ID NO: 12 демонстрирует ген fad2-aB. napus, обозначаемый в международной публикации № WO 2007/107590 A2 как SEQ ID NO: 3.
SEQ ID NO: 13 демонстрирует аминокислотную последовательность белка fad2-a, кодируемую SEQ ID NO: 12.
SEQ ID NO: 14 демонстрирует ген fad2-aB. napus, обозначаемый в международной публикации № WO 2007/107590 A2 как SEQ ID NO: 5.
SEQ ID NO: 15 демонстрирует аминокислотную последовательность белка fad2-a, кодируемую SEQ ID NO: 14.
SEQ ID NO: 16 демонстрирует ген fad2-aB. napus, обозначаемый в международной публикации № WO 2007/107590 A2 как SEQ ID NO: 7.
SEQ ID NO: 17 демонстрирует аминокислотную последовательность белка fad2-a, кодируемую SEQ ID NO: 16.
SEQ ID NO: 18 демонстрирует ген fad2-aB. napus, обозначаемый в международной публикации № WO 2007/107590 A2 как SEQ ID NO: 9.
SEQ ID NO: 10 демонстрирует ген fad2-aB. napus, обозначаемый в международной публикации № WO 2007/107590 A2 как SEQ ID NO: 10.
SEQ ID NO: 20 демонстрирует ген fad2-aB. napus, обозначаемый в международной публикации № WO 2007/107590 A2 как SEQ ID NO: 11.
SEQ ID NO: 21 демонстрирует ген fad2-aB. napus, обозначаемый в международной публикации № WO 2007/107590 A2 как SEQ ID NO: 12.
SEQ ID NO: 22 демонстрирует мутантный ген "Fad2-D" B. napus, обозначаемый в патенте США 6967243 как SEQ ID NO: 11.
SEQ ID NO: 23 демонстрирует аминокислотную последовательность, кодируемую SEQ ID NO: 22, обозначаемую в патенте США 6067243 как SEQ ID NO: 12.
SEQ ID NO: 24 демонстрирует мутантный ген "Fad2-F" B. napus, обозначаемый в патенте США 6067243 как SEQ ID NO: 15.
SEQ ID NO: 25 демонстрирует аминокислотную последовательность, кодируемую SEQ ID NO: 24, обозначаемую в патенте США 6067243 как SEQ ID NO: 16.
SEQ ID NO: 26 демонстрирует мутантный ген "Fad2-F" B. napus, обозначаемый в патенте США 6067243 как SEQ ID NO: 17.
SEQ ID NO: 27 демонстрирует аминокислотную последовательность, кодируемую SEQ ID NO: 26, обозначаемую в патенте США 6067243 как SEQ ID NO: 18.
SEQ ID NO: 28 демонстрирует мутантный ген FAD2B. napus, обозначаемый в публикации европейского патента № 1862551 A1 как SEQ ID NO: 22.
SEQ ID NO: 29 демонстрирует продукт мутантного гена FAD2B. napus, обозначаемый в публикации европейского патента № 1862551 A1 как SEQ ID NO: 23.
SEQ ID NO: 30 демонстрирует мутантный ген fad2-aB. napus, обозначаемый в публикации европейского патента № 1862551 A1 как SEQ ID NO: 24.
SEQ ID NO: 31 демонстрирует аминокислотную последовательность, кодируемую мутантным геном fad2-aB. napus с SEQ ID NO: 30, которая в публикации европейского патента № 1862551 A1 обозначена как SEQ ID NO: 25.
SEQ ID NO: 32 демонстрирует мутантный ген fad2-aB. napus, обозначаемый в публикации европейского патента № 1862551 A1 как SEQ ID NO: 26.
SEQ ID NO: 33 демонстрирует аминокислотную последовательность, кодируемую мутантным геном fad2-aB. napus с SEQ ID NO: 32, которая в публикации европейского патента № 1862551 A1 обозначена как SEQ ID NO: 27.
SEQ ID NO: 34 демонстрирует мутантный ген fad2-aB. napus, обозначаемый в публикации европейского патента № 1862551 A1 как SEQ ID NO: 28.
SEQ ID NO: 35 демонстрирует аминокислотную последовательность, кодируемую мутантным геном fad2-aB. napus с SEQ ID NO: 34, которая в публикации европейского патента № 1862551 A1 обозначена как SEQ ID NO: 29.
SEQ ID NO: 36 демонстрирует мутантный ген fad2-aB. napus, обозначаемый в публикации европейского патента № 1862551 A1 как SEQ ID NO: 30.
SEQ ID NO: 37 демонстрирует аминокислотную последовательность, кодируемую мутантным геном fad2-aB. napus с SBQ ID NO: 36, которая в публикации европейского патента № 1862551 A1 обозначена как SEQ ID NO: 31.
SEQ ID NO: 38 демонстрирует мутантный ген fad2-aB. napus, обозначаемый в публикации европейского патента № 1862551 A1 как SEQ ID NO: 32.
SEQ ID NO: 39 демонстрирует аминокислотную последовательность, кодируемую мутантным геном fad2-aB. napus с SEQ ID NO: 38, которая в публикации европейского патента № 1862551 A1 обозначена как SEQ ID NO: 33.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Для ясности описания ниже определены некоторые термины, еприменяемые в настоящем документе.
Термин "линия" относится к группе растений, демонстрирующий очень небольшую общую вариативность между индивидуальными растениями, к которым относится это обозначение. Как правило, "линия" относится к группе растений, демонстрирующей небольшую генетическую вариативность или ее отсутствие между индивидуальными растениями по меньшей мере для одного признака. Как применяют в настоящей заявке, "DH (двойная гаплоидная) линия" относится к группе растений, получаемой посредством культивирования гаплоидной ткани, а затем удвоения содержания хромосом без сопровождающего клеточного деления с получением растения с диплоидном количеством хромосом, где каждая пара хромосом состоит из двух дуплицированных хромосом. Таким образом, DH линия в норме демонстрирует небольшую генетическую вариативность признаков или ее отсутствие между индивидуальными растениями.
"Сорт" или "культивар" представляет собой линию растений, которые используют для коммерческого получения, которая четко отличима, устойчива и однородна по своим признакам при выращивании.
"Двойная гаплоидная" (DH) линия относится к линии, получаемой способом микроспорического эмбриогенеза, при котором растение получают из отдельной микроспоры. Этим способом получают линии, которые гомогенны, т.е. все растения в линии имеют одинаковую генетическую структуру. Исходное DH растение обозначают как DH1, тогда как последующие поколения обозначают как DH2, DH3 и т.д. Способы двойных гаплоидов хорошо известны и разработаны для нескольких культур. Способ для Brassica juncea описан Thiagrarajah and Stringham (1993) (A comparison of genetic segregation in traditional and microspore-derived populations of Brassica juncea в L. Czern and Coss. Plant Breeding 111:330-334).
Термин "высокое содержание олеиновой кислоты" относится к Brassica juncea или другим видам Brassica, как может быть продиктовано контекстом, с содержанием олеиновой кислоты большим, чем содержание олеиновой кислоты в диком типе или у других эталонных сорте или линии, более широко, это указывает на состав жирных кислот, содержащий по меньшей мере 70,0% по массе олеиновой кислоты.
"Все насыщенные углеводородные соединения" относится к объединенной доле пальмитиновой (C16:0), стеариновой (C18:0), арахидиновой (C20:0), бегеновой (C22:0) и тетракозановой (C24:0) жирных кислот. Концентрации жирных кислот, описываемые в настоящем документе, определяют стандартными способами, хорошо известными специалистам в данной области. Конкретные способы описаны в примерах. Концентрации жирных кислот выражают в виде процента по массе от содержания всех жирных кислот.
Анализ "полусемени" относится к способу, в котором анализ жирных кислот проводят на одной семядоле (полусемени), а оставшееся полусемя используют для получения растения, если результат анализа является положительным.
"Мутагенез" представляет собой способ, в котором к растительному материалу применяют средство, о котором известно, что оно вызывает мутации в генетическом материале. Используемое в экспериментальной работе мутагенное средство представляло собой этилметилсульфонат (EMS). Целью является получение новой генетической изменчивости в видах, и, как правило, ее осуществляют, имея в виду конкретный признак. Пример мутагенеза, используемого для гаплоидов с индукцией новой изменчивости, описан в Swanson et al. (Plant cell Rep. 7:83-87, 1988). Следует понимать, что для получения мутантов может подходить ряд других способов, таких как рекомбинация с фрагментами чужеродной нуклеиновой кислоты, и что, используя различные способы, получение мутантов можно проводить в направлении замены конкретных нуклеотидов или аминокислот, а не оставлять его полностью случайным. Следует понимать, что все такие способы проведения замен последовательности нуклеиновой кислоты включены в термин "мутагенез", как применяют в настоящем документе.
"Регенерация" включает отбор из селекционируемого растения или сорта клеток, способных к регенерации (например, семян, микроспор, яйцеклеток, пыльцы, вегетативных частей). Эти клетки необязательно можно подвергать мутагенезу, после чего из клеток выращивают растение с использованием регенерации, опыления и/или способов выращивания на основе видов клеток, подвергаемых мутагенезу. Применимые способы регенерации известны специалистам в данной области; см., например, Pua et al., Bio/Technology 5:815-817 (1987); Jain et al., Euphytica 40:75-81 (1989); Szarejko et al., Proceedings of an International Symposium on the Contribution of Plant Mutation Breeding to Crop Improvement, 2:355-378 (1991); Cegielska-Taras and Szala, Rosliny Oleiste - Oilseed Crops, XVIII, 21-30 (1997); Ferrie and Keller, Proc. 9th International Rapeseed Congr., Cambridge, 3:807-809 (1995); Martini et al., Vortr. Pfl anzenzüchtg. 45:133-154 (1999); Swanson et al., Theoretical and Applied Genetics. 78:525-530 (1989); и Kirti and Chopra, Plant Breeding 102:1, 73-78 (1988). В этом контексте "M0" относится к необработанным семенам; "M1" относится к семенам, подвергаемым действию мутагенов, и полученным растениям; "M2" представляет собой потомство (семена и растения) самоопыляемых растений M1; "M3" представляет собой потомство (семена и растения) самоопыляемых растений M2; "M4" представляет собой потомство (семена и растения) самоопыляемых растений M3; "M5" представляет собой потомство (семена и растения) самоопыляемых растений M4 и т.д.
Как применяют в настоящем документе, термин "устойчивость" или "устойчивый" в отношении данного генетически контролируемого компонента жирных кислот означает, что компонент жирных кислот сохраняется от поколения к поколению в течение по меньшей мере двух поколений, а предпочтительно - по меньшей мере три поколения по существу на одинаковом уровне, например, предпочтительно ±5%. Способы по изобретению могут приводить к получению линии Brassica juncea с улучшенным составом жирных кислот, устойчивым в пределах ±5% от поколения к поколению. Специалистам в данной области следует понимать, что на указанную выше устойчивость может влиять температура, местоположение, давление и время выращивания. Таким образом, сравнения профилей жирных кислот между линиями канолы следует проводить с использованием семян, полученных в сходных условиях выращивания.
Когда в контексте настоящего изобретения используют термин "растение Brassica", он также включает любые конверсии одного гена в этой группе. Как применяют в настоящем документе, термин "растение с конверсией одного гена" относится к растениям Brassica, которые получают способом селекции растений, называемым обратным скрещиванием, где в дополнение к одному гену, переносимому в сорт способом обратного скрещивания, восстанавливают по существу все из желаемых морфологических и физиологических признаков сорта. Способы обратного скрещивания можно использовать по настоящему изобретению для улучшения признака в сорте или введения признака в сорт. Как применяют в настоящем документе, термин "обратное скрещивание" относится к повторному скрещиванию гибридного потомства снова с рекуррентным родителем, т.е. к обратному скрещиванию один или несколько раз с рекуррентным родителем (определяемым как "BC1", "BC2" и т.д.). Родительское растение Brassica, которое предоставляет ген для получения желаемого признака, называют "нерекуррентным" или "донорским родителем". Эта терминология относится к тому обстоятельству, что нерекуррентного родителя используют в протоколе обратного скрещивания один раз и, таким образом, его использование не повторяется. Родительское растение Brassica, которому переносят ген или гены от нерекуррентного родителя, известно как рекуррентный родитель, так как в протоколе обратного скрещивания его используют в нескольких циклах (Poehiman & Sleper, 1994; Fehr, 1987). В типичном протоколе обратного скрещивания исходный сорт, представляющий интерес (рекуррентный родитель), скрещивают со вторым сортом (нерекуррентный родитель), который несет один представляющий интерес ген для переноса. Затем полученное потомство этого скрещивания снова скрещивают с рекуррентным родителем и процесс повторяют до получения растения Brassica, где в изменяемом растении восстановлены по существу все из желаемых морфологических и физиологических признаков рекуррентного родителя, кроме одного переносимого гена от нерекуррентного родителя, как определяют на уровне значимости 5% при выращивании в одинаковых условиях окружающей среды.
Выбор подходящего рекуррентного родителя является важным этапом для успешной процедуры обратного скрещивания. Целью протокола обратного скрещивания является изменение или замена конкретного свойства или признака в исходном сорте. Для осуществления этого один ген рекуррентного сорта модифицируют или заменяют желаемым геном от нерекуррентного родителя, оставляя по существу весь оставшийся желательный генетический материал и, таким образом, желательное физиологическое и морфологическое строение исходного сорта. Выбор конкретного нерекуррентного родителя зависит от цели обратного скрещивания. Одной из основных целей является добавление растению коммерчески желательного, агрономически важного свойства. Точный протокол обратного скрещивания зависит от изменяемого признака или свойства для определения соответствующего протокола тестирования. Хотя способы обратного скрещивания, когда признак для переноса представляет собой доминантный аллель, упрощаются, рецессивный аллель также можно переносить. В этом случае для определения того, что желаемый признак успешно перенесен, может являться необходимым применять тестирование потомства.
Определено множество контролируемых одним геном свойств, которые регулярно не отбирают при получении нового сорта, но которые можно улучшать способами обратного скрещивания. Контролируемые одним геном свойства могут являться трансгенными или нет, примеры этих свойств включают в качестве неограничивающих примеров мужскуую стерильность, восковой крахмал, устойчивость к гербицидам, устойчивость к бактериальным, грибковым или вирусным заболеваниям, устойчивость к насекомым, улучшенные питательные качества, промышленную применимость, устойчивость урожая и увеличение урожайности. Эти гены, как правило, наследуются посредством ядра. Некоторые из этих контролируемых одним геном свойств описаны в патентах США №№ 5959185, 5973234 и 5977445.
В некоторых вариантах осуществления для определения присутствия или экспрессии одного из описываемых аллелей и для различения мутантных белков и белков дикого типа или других мутантов можно получать антитела к любому из полипептидов, описываемых в настоящем документе или получаемых из них.
В данной заявке "улучшенные признаки" означает, что рассматриваемые признаки изменяют таким способом, который желателен или выгоден, или и то, и другое, в сравнении с эталонным значением или признаком, которые могут относиться к эквивалентному признаку линии дикого типа Brassica juncea или какой-либо другой рассматриваемой линии Brassica. Одной из возможных линий дикого типа Brassica juncea, признаки которой можно взять за эталон (или в качестве контроля), является J96D-4830, но возможны и многие другие линии и их легко определят специалисты в данной области.
В данной заявке "потомство" означает всех потомков, включая потомков и производные растения или растений, и включает первое, второе, третье и последующие поколения и может образовываться посредством самоопыления или скрещивания с растениями с тем же или другими генотипами, и может быть модифицировано рядом подходящих способов генетической инженерии.
В данной заявке "селекция" включает все способы развития или размножения растений и включает внутри- и межвидовые и внутри- и межлинейные скрещивания, а также все подходящие общепринятые способы селекции и искусственной селекции. Желательные свойства можно переносить в другие линии Brassica juncea общепринятыми способами селекции, а также можно переносить в другие виды Brassica, такие как Brassica napus и Brassica rapa посредством межвидового скрещивания. Общепринятые способы селекции и способы межвидового скрещивания, а также другие способы переноса генетического материала между растениями хорошо документированы в литературе.
В данной заявке "молекулярно-биологические способы" означают все формы манипуляции с последовательностью нуклеиновой кислоты с изменением последовательности и ее экспрессией, и включают вставку, удаление или модификацию последовательностей или фрагментов последовательностей и прямое введение новых последовательностей в геном организма посредством направленной или случайной рекомбинации с использованием любых подходящих векторов и/или способов.
В данной заявке "генетически наследуемый", как используют, например, во фразе "генетически наследуемый от родительских линий", означает, что рассматриваемый признак полностью или частично обусловлен свойствами генетического состава рассматриваемого растения.
В данной заявке термин "Brassica" может включать любой или все из видов, относящихся к роду Brassica, включая Brassica napus, Brassica juncea, Brassica nigra, Brassica carinata, Brassica oleracea и Brassica rapa.
Как применяют в настоящей заявке, канола Brassica juncea относится к Brassica juncea, которая дает семена с качеством масла и муки, удовлетворяющим требованиям для коммерческого обозначения как масло или мука "канолы", соответственно, (т.е. растений вида Brassica juncea, содержащих менее 2% эруковой кислоты (Δ13-22:1) по массе в масле семян и менее 30 микромоль глюкозинолатов на грамм не содержащей масла муки).
Различные гены и последовательности нуклеиновой кислоты по изобретению могут являться рекомбинантными последовательностями. Термин "рекомбинантный" означает, что что-либо рекомбинировано, так что, когда его применяют в отношении конструкции нуклеиновой кислоты, термин относится к молекуле, содержащей последовательности нуклеиновой кислоты, которые связаны вместе и получены молекулярно-биологическими способами. Когда термин "рекомбинантный" применяют в отношении белка или полипептида, он относится к белковой или полипептидной молекуле, экспрессируемой с использованием рекомбинантной конструкции нуклеиновой кислоты, полученной молекулярно-биологическими способами. Когда термин "рекомбинантный" используют в отношении генетической структуры, он относится к гамете или потомству с новыми комбинациями аллелей, которых нет в родительских геномах. Конструкции рекомбинантных нуклеиновых кислот могут содержать нуклеотидную последовательность, которая может быть связана, или с которой провели манипуляцию, так, чтобы она связалась, с последовательностью нуклеиновой кислоты, с которой она не связана в природе, или с которой в природе она связана в другом положении. Таким образом, указание конструкции нуклеиновой кислоты как "рекомбинантной" означает, что молекулу нуклеиновой кислоты подвергали манипуляциям с применением генетической инженерии, т.е. посредством вмешательства человека. Конструкции рекомбинантных нуклеиновых кислот можно, например, вводить в клетку-хозяина посредством трансформации. Такие конструкции рекомбинантных нуклеиновых кислот могут содержать последовательности, получаемые из клетки-хозяина того же вида или из клетки-хозяина другого вида, которые выделили и вновь внесли в клетки вида-хозяина. Последовательности рекомбинантных конструкций нуклеиновых кислот могут интегрироваться в геном клетки-хозяина, или в результате исходной трансформации клеток-хозяев, или в результате последующих событий рекомбинации и/или репарации.
Все проценты жирных кислот в настоящем документе относятся к проценту по массе от всех жирных кислот масла, в котором жирная кислота является компонентом. Например, указание растения, как имеющего 70%-содержание олеиновой кислоты означает, что компонент жирной кислоты масла содержит 70% олеиновой кислоты.
"Полиморфизм" в популяции относится к состоянию, при котором наиболее частый вариант (или аллель) конкретного локуса имеет популяционную частоту, не превосходящую 99%.
Термин "гетерозиготность" (H) используют, когда часть индивидуумов в популяции несет различные аллели конкретного локуса (в противоположность двум копиям одного и того же аллеля). Гетерозиготность представляет собой вероятность того, что индивидуум в популяции гетерозиготен по локусу. Как правило, гетерозиготность выражают в виде процента (%) в диапазоне от 0 до 100% или по шкале от 0 до 1.
"Гомозиготность" или "гомозиготный" означает, что часть индивидуумов в популяции несет две копии одного и того же аллеля конкретного локуса. Когда растения являются двойными гаплоидами, предполагают, что, допуская любые спонтанные мутации, происходящие при дупликации гаплотипа, все локусы являются гомозиготными. Растения могут являться гомозиготными по одному, нескольким или всем локусам в зависимости от контекста.
"Праймеры" представляют собой короткие полинуклеотиды или олигонуклеотиды, необходимые для полимеразной цепной реакции, которые комплементарны части амплифицируемого полинуклеотида. Например, длина праймера может составлять не более 50 нуклеотидов, предпочтительно - менее чем приблизительно 30 нуклеотидов, а наиболее предпочтительно - менее чем приблизительно 24 нуклеотида.
Как применяют в настоящем документе, "выделенные" нуклеиновая кислота или полинуклеотид относятся к компоненту, который выделен из его исходного окружения (например, его природного окружения, если он является природным). Выделенные нуклеиновая кислота или полипептид могут содержать менее 50%, менее 75%, менее 90% и менее 99,9% или менее чем любое целое значение между 50 и 99,9% клеточных компонентов, с которыми они исходно ассоциированы. Например, полинуклеотид, амплифицированный с применением ПЦР так, что он в достаточной степени отличим (например, на геле) от остальных клеточных компонентов, можно рассматривать как "выделенный". Полинуклеотиды по изобретению могут являться "по существу чистыми", т.е. обладающими наивысшей степенью чистоты, которой можно достичь с применением конкретного способа очистки, известного в данной области.
"Гибридизация" относится к способу, в котором цепь нуклеиновой кислоты связывается с комплементарной цепью посредством спаривания оснований. Полинуклеотиды являются "гибридизуемыми" друг с другом, когда по меньшей мере одна цепь одного полинуклеотида может гибридизоваться с цепью другого полинуклеотида в условиях с определенной строгостью. Для гибридизации необходимо, чтобы два полинуклеотида содержали по существу комплементарные последовательности; однако в зависимости от строгости гибридизации могут быть допустимы несоответствия. Как правило, для гибридизации двух последовательностей с высокой строгостью (например, такой как в водном растворе 0,5×SSC при 65°C) необходимо, чтобы последовательности демонстрировали определенную высокую степень комплементарности по всей их последовательности. Условия с промежуточной строгостью (например, такие как водный раствор 2×SSC при 65°C) и с низкой строгостью (например, такие как водный раствор 2×SSC при 55°C) требуют соответственно меньшей общей комплементарности между гибридизующимися последовательностями (1×SSC представляет собой 0,15 М NaCl, 0,015 М цитрат Na). Как применяют в настоящем документе, приведенные выше растворы и температуры относятся к стадии отмывки зонда способа гибридизации. Термин "полинуклеотид, гибридизующийся в строгих (нестрогих, промежуточных) условиях" предназначен для включения и одно- и двухцепочечных полинуклеотидов, хотя с комплементарной цепью другого полинуклеотида будет гибридизоваться только одна цепь. Отмывку в указанных растворах можно проводить в течение диапазона времен от нескольких минут до нескольких суток, и специалисты в данной области для распознания различных уровней гомологии связанных последовательностей легко выберут соответствующие времена отмывки.
В одном из аспектов изобретение относится к растениям Brassica, таким как растения Brassica juncea, способным давать семена с эндогенным содержанием жирных кислот, содержащих высокий процент олеиновой кислоты и низкий процент линоленовой кислоты по массе. В конкретных вариантах осуществления содержание олеиновой кислоты может составлять более чем приблизительно 70,0%, 71,0%, 72,0%, 73,0%, 74,0%, 75,0%, 76,0%, 77,0%, 78,0%, 79,0%, 80,0%, 81,0%, 82,0%, 83,0%, 84,0% или 85,0%, включая все целые числа и их доли или любое целое число со значением, большим 85%, олеиновой кислоты. В конкретных вариантах осуществления содержание линоленовой кислоты жирных кислот может составлять менее чем приблизительно 5%, 4%, 3%, 2,5%, 2,0%, 1,5%, 1,0%, 0,5% или 0%, включая все целые числа и их доли. В одном иллюстративном варианте осуществления растение представляет собой Brassica juncea, эндогенное содержание жирных кислот семян которого включает, по меньшей мере, 70% олеиновой кислоты по массе и менее чем 3% линоленовой кислоты по массе. В дополнительном варианте осуществления растение представляет собой растение Brassica juncea, эндогенное содержание жирных кислот семян которого включает, по меньшей мере, 70,0% олеиновой кислоты по массе и не более чем приблизительно 5% линоленовой кислоты по массе.
В одном из аспектов изобретение относится к растениям Brassica, таким как растения Brassica juncea, способным давать семена с эндогенным содержанием жирных кислот, включающим высокий процент олеиновой кислоты и низкий процент линоленовой кислоты по массе и низкое количество всех насыщенных жирных кислот или высокое количество всех насыщенных жирных кислот, которое может составлять менее чем приблизительно 5,5% всех насыщенных жирных кислот или >10% всех насыщенных жирные кислоты
Известно, что состав масла из семян Brassica juncea отличается от состава масла из семян Brassica napus по обоим компонентам жирных кислот (например, более высокое содержание эруковой кислоты), эфирным маслам (например, аллилизотиоцианату) и минорным составляющим (например, токоферолам, металлам, танинам, фенольным составляющим, фосфолипидам, обуславливающим цвет веществам и т.п.). Выявлено, что масла из семян (включая выделенные масла) Brassica juncea являются более устойчивыми к окислению по сравнению с маслами из Brassica napus, несмотря на то, что масла из Brassica juncea, как правило, содержат более высокие уровни C18:3. (C. Wijesundera et al., "Canola Quality Indian Mustard oil (Brassica juncea) is More Stable to Oxidation than Conventional Canola oil (Brassica napus)", J. Am. Oil Chem. Soc. (2008) 85:693-699).
В альтернативном аспекте изобретение относится к способам увеличения содержания олеиновой кислоты и снижения содержания линоленовой кислоты в растениях Brassica. Такие способы могут включать: (a) индукцию мутагенеза по меньшей мере в некоторых клетках из линии Brassica с содержанием олеиновой кислоты более 55% и содержанием линоленовой кислоты менее 14%; (b) регенерацию растений по меньшей мере из одной из указанных мутировавших клеток и отбор регенерированных растений с содержанием жирных кислот, включающим по меньшей мере 70% олеиновой кислоты (или альтернативную предельную концентрацию олеиновой кислоты, как указано выше) и менее 3% линоленовой кислоты (или альтернативную предельную концентрацию линоленовой кислоты, как указано выше); и (c) выведение дальнейших поколений растений из указанных регенерированных растений, где содержание жирных кислот индивидуальных растений указанных дальнейших поколений растений включает, по меньшей мере, 70% олеиновой кислоты (или альтернативную предельную концентрацию) и менее 3% линоленовой кислоты (или альтернативную предельную концентрацию). В некоторых вариантах осуществления Brassica может представлять собой Brassica juncea. Термин "высокое содержание олеиновой кислоты" и "низкое содержание линоленовой кислоты" включает полный диапазон возможных значений, описанных выше. В альтернативных вариантах осуществления способы по изобретению могут дополнительно включать отбор одного или нескольких из линий, регенерированных растений и дальнейших поколений растений на основе сниженного содержания линолевой кислоты, такого как диапазон возможных значений, описанных выше. В дополнительных вариантах осуществления стадия (c) может включать отбор и выращивание семян регенерированных растений со стадии (b). В дополнительных вариантах осуществления способы по изобретению могут включать повторение указанных стадий до того, пока не будет достигнуто желаемые содержание олеиновой кислоты, содержание линолевой кислоты или оба.
В альтернативных вариантах осуществления предоставлены способы скрининга отдельных семян на увеличенное содержание олеиновой кислоты и сниженное содержание линолевой кислоты, включающие: определение одного или нескольких из содержания олеиновой кислоты; или содержания линолевой кислоты; или содержания олеиновой кислоты и содержания линолевой кислоты в жирных кислотах части проростка семени; сравнение одного или нескольких из содержаний с эталонным значением; и получение заключения о вероятном относительном содержании олеиновой кислоты, линолевой кислоты или олеиновой кислоты и линолевой кислоты в семенах. В конкретных вариантах осуществления часть растения, используемого для анализа, может представлять собой часть листа или весь лист, семядолю, стебель, черешок, цветоножку или любую другую ткань или фрагмент ткани, такие как ткани с составом, который демонстрирует достоверную корреляцию с составом семян. В одной группе вариантов осуществления часть проростка может представлять собой часть листа. В определенных вариантах осуществления этап получения заключения о составе жирных кислот в семенах может включать допущение, что значимо измененный уровень данной кислоты в указанном листе отражает сходное относительное изменение в уровне этой кислоты в семенах. В конкретном варианте осуществления настоящего изобретения предоставлен способ скрининга растений Brassica на конкретные линии растений, семена которых имеют эндогенное содержание жирных кислот, включающее по меньшей мере 70% олеиновой кислоты и менее 3% линоленовой кислоты по массе, посредством анализа ткани листа. Кроме того, ткань листа можно анализировать на состав жирных кислот посредством газожидкостной хроматографии, где выделение жирных кислот можно проводить такими способами, как анализ партии семян или анализ полусемени.
В альтернативных вариантах осуществления изобретение относится к растениям Brassica, которые могут представлять собой растения Brassica juncea, содержащим ранее описанные аллели генов из линий Brassica juncea. В определенных вариантах осуществления растение может быть гомозиготным по локусам fad2-a и fad3-a, представленным мутантными аллелями. В дополнительном варианте осуществления растение Brassica juncea, его растительная клетка или часть несет аллели генов с последовательностями нуклеиновой кислоты из ранее описанных последовательностей, представленных в настоящем документе.
В некоторых вариантах осуществления изобретение может включать различение HOLL, Brassica juncea качества канолы по настоящему изобретению (≥70% олеиновой кислоты и ≤5% линоленовой кислоты) от Brassica juncea с низким содержанием олеиновой кислоты/высоким содержанием линоленовой кислоты (≈45% олеиновой кислоты и ≈14% линоленовой кислоты) посредством проверки присутствия или отсутствия гена BJfad2b (для ссылки см. патентную публикацию США № 20030221217, Yao et al.). Это различение может включать подтверждение того, что ген BJfad2a является функциональным геном олеатдесатуразы жирных кислот только в линии Brassica juncea качества канолы, как известно в данной области.
В одном из вариантов осуществления линия Brassica juncea несет гены fad2 и fad3, как описано в международной публикации № US 2006/0248611 A1 (содержание которой включено в настоящий документ в качестве ссылки), которые проиллюстрированы на фиг. 1 и 3 в ней. Гены fad2 и fad3 проиллюстрированы в настоящем документе посредством SEQ ID NO: 1-4. Полученные мутантные аллели кодируют белки дельта-12-десатураз жирных кислот, которые проиллюстрированы на фиг. 2 международной публикации № US 2006/0248611 A1 и дополнительно проиллюстрированы посредством SEQ ID NO: 5-7 настоящего документа. В других вариантах осуществления линия Brassica juncea может содержать мутации в генных локусах fad2-a и fad3-a, и полученные мутантные аллели могут кодировать одну или несколько мутаций в последовательности прогнозируемых белков BjFAD2-a и BjFAD3-a. Характерные примеры мутантных генов fad2-a и fad3-a и белков, пригодных для использования по настоящему изобретению, также включают в качестве неограничивающих примеров белки и гены, описанные в: международной публикации № WO 2006/079567 A3 (например, фиг. 1 и 2), такие как SEQ ID NO: 8 и 9; международной публикации № WO 2005/107590 A2, такие как SEQ ID NO: 10-21; патенте США № 6967243 B2 (например, фиг. 2 и 3), такие как SEQ ID NO: 22-27; и европейской публикации № 1862551 A1 (например, фиг. 1-10), такие как SEQ ID NO: 28-39). Содержание каждой из приведенных выше патентных публикаций включено в настоящий документ в качестве ссылки.
Гомологию с последовательностями по изобретению можно детектировать посредством гибридизации с соответствующими зондами нуклеиновой кислоты, способами ПЦР с подходящими праймерами или любыми другими широко используемыми способами. В конкретных вариантах осуществления предоставлены зонды нуклеиновой кислоты, которые могут содержать последовательности, гомологичные участкам аллелей по изобретению. Дополнительные варианты осуществления могут включать использование подходящих пар праймеров для амплификации или детекции присутствия последовательности по изобретению, например, последовательности, которая ассоциирована с увеличенным содержанием олеиновой кислоты.
Для описания родства последовательностей двух или более нуклеиновых кислот или полинуклеотидов используют следующие термины: (a) "эталонная последовательность", (b) "окно сравнения", (c) "идентичность последовательностей", (d) "процент идентичности последовательностей" и (e) "существенная идентичность".
Как применяют в настоящем документе, "эталонная последовательность" представляет собой определенную последовательность, используемую в качестве основы для сравнения последовательностей. Эталонная последовательность может представлять собой часть указанной последовательности или целую указанную последовательность; например, в виде участка полноразмерной последовательности кДНК или гена или полной последовательности кДНК или гена.
Как применяют в настоящем документе, "окно сравнения" указывает на непрерывный и точно определенный сегмент полинуклеотидной последовательности, где полинуклеотидная последовательность в окне сравнения может содержать добавления или делеции (т.е. пропуски) по сравнению с эталонной последовательностью (которая не содержит добавлений или делеций) для оптимального выравнивания двух последовательностей. Как правило, длина окна сравнения составляет по меньшей мере 20 смежных нуклеотидов, и необязательно может представлять собой 30, 40, 50, 100 или длиннее. Специалисты в данной области понимают, что во избежание высокого сходства с эталонной последовательностью вследствие добавления пропусков в полинуклеотидную последовательность, как правило, вводят штраф за пропуск и вычитают из количества совпадений.
Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Таким образом, определение процента идентичности любых двух последовательностей можно проводить с использованием математического алгоритма. Неограничивающие примеры таких математических алгоритмов представляют собой Myers and Miller (1988) CABIOS 4:11-17; алгоритм локальной гомологии Smith et al. (1981) Adv. Appl Math. 2:482; алгоритм выравнивания по гомологии Needleman and Wunsch (1970) J. Mol. Biol. 48:443-453; способ поиска по сходству Pearson and Lipman (1988) Proc. Natl. Acad. Sci. 85:2444-2448; алгоритм Karlin and Altschul (1990) Proc. Natl. Acad. Sci. USA 872264, модифицированный Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877.
Для сравнения последовательностей с определением идентичности последовательностей можно использовать компьютерные реализации этих математических алгоритмов. Такие реализации включают в качестве неограничивающих примеров: CLUSTAL в программе PC/Gene (доступно в Intelligenetics, Mountain View, Calif.); программу ALIGN (версии 2.0) и GAP, BESTFIT, BLAST, FASTA и TFASTA в программном пакете Wisconsin Genetics Software Package, версии 8 (доступном в Genetics Computer Group (GCG), 575 Science Drive, Madison, Wis., USA). Выравнивания с использованием этих программ можно проводить с применением параметров по умолчанию. Программа CLUSTAL хорошо описана в Higgins et al. (1988) Gene 73:237-244 (1988); Higgins et al. (1989) CABIOS 5:151-153; Corpet et al. (1988) Nucleic Acids Res. 16:10881-90; Huang et al. (1992) CABIOS 8:155-65; и Pearson et al. (1994) Meth. Mol. Biol. 24:307-331. Программа ALIGN основана на алгоритме Myers and Miller (1988), выше. При сравнении аминокислотных последовательностей для программы ALIGN можно использовать таблицу весов остатков PAM120, штраф за продолжение пропуска 12 и штраф за пропуск 4. Программы BLAST Altschul et al. (1990) J. Mol. Biol. 215:403 основаны на алгоритме Karlin and Altschul (1990), выше. Поиск нуклеотидов посредством BLAST для получения нуклеотидных последовательностей, гомологичных нуклеотидной последовательности, кодирующей белок по изобретению, можно проводить с использованием программы BLASTN, score (показателя) = 100, wordlength (длины слова) = 12. Поиски белков посредством BLAST для получения аминокислотных последовательностей, гомологичных белку или полипептиду по изобретению, можно проводить с использованием программы BLASTX, score (показателя) = 50, wordlength (длины слова) = 3. Для получения выравниваний с пропусками с целью сравнения можно использовать Gapped BLAST (в BLAST 2.0), как описано в Altschul et al. (1997) Nucleic Acids Res. 25:3389. Альтернативно, для проведения итерационного поиска, позволяющего определять родство молекул, можно использовать PSI-BLAST (в BLAST 2,0). См. Altschul et al. (1997), выше. Когда используют BLAST, Gapped BLAST, PSI-BLAST, можно использовать параметры по умолчанию соответствующих программ (например, BLASTN для нуклеотидных последовательностей, BLASTX для белков). Выравнивание также можно проводить вручную посредством просмотра. Для определения гомологий и вариаций, если они существуют, у выравниваемых последовательностей выравнивания также можно проводить с применением программного обеспечения Sequencher™ (из Gene Codes Corporation, Ann Arbor, MI).
Как применяют в настоящем документе, "идентичность последовательностей" или "идентичность" в контексте двух последовательностей нуклеиновых кислот или полипептидов указывает на остатки в двух последовательностях, которые являются одинаковыми при выравнивании при максимальном соответствии в указанном окне сравнения. Когда процент идентичности последовательностей используют по отношению к белкам, полагают, что положения остатков, которые не идентичны, часто отличаются консервативными аминокислотными заменами, где аминокислотные остатки замещены другими аминокислотными остатками со сходными химическими свойствами (например, зарядом или гидрофобностью) и, таким образом, не изменяют функциональные свойства молекулы. Когда последовательности отличаются консервативными заменами, процент идентичности последовательностей можно повышать для коррекции на консервативную природу замены. Считают, что у последовательностей, отличающихся такими консервативными заменами, существует "сходство последовательностей" или "сходство". Средства для проведения такой регулировки хорошо известны специалистам в данной области. Как правило, они включают оценку консервативной замены как частичного, а не полного несовпадения, таким образом, повышая процент идентичности последовательностей. Например, таким образом, когда идентичная аминокислота дает показатель 1, а неконсервативная замена дает показатель ноль, консервативная замена дает показатель между нулем и 1. Оценки консервативных замен подсчитывают, например, как применяют в программе PC/GENE (Intelligenetics, Mountain View, Calif.).
Как применяют в настоящем документе, "процент идентичности последовательностей" означает показатель, определяемый посредством сравнения двух оптимально выровненных последовательности в окне сравнения, где часть полинуклеотидной последовательности в окне сравнения может содержать добавления или делеции (т.е. пропуски) по сравнению с эталонной последовательностью (которая не содержит добавлений или делеций) для оптимального выравнивания двух последовательностей. Процент рассчитывают, определяя количество положений, в которых в обеих последовательностях находятся идентичные остатки нуклеиновой кислоты или аминокислотные остатки, с получением количества совпадающих положений, разделяя количество совпадающих положений на общее количество положений в окне сравнения и умножая результат на 100 с получением процента идентичности последовательностей.
Термин "существенная идентичность" полинуклеотидных последовательностей означает, что полинуклеотид содержит последовательность по меньшей мере с 70% идентичностью последовательности, предпочтительно - по меньшей мере с 80%, более предпочтительно - по меньшей мере с 90%, а наиболее предпочтительно - по меньшей мере с 95%, по сравнению с эталонной последовательностью при применении одной из программ выравнивания, описанных с применением стандартных параметров. Специалист в данной области поймет, что эти значения можно соответствующим образом скорректировать для определения соответствующей идентичности белков, кодируемых двумя нуклеотидными последовательностями, принимая во внимание вырожденность кодонов, сходство аминокислот, положение рамки считывания и т.п. Термин "существенная идентичность" в контексте пептидов означает, что пептид содержит последовательность, по меньшей мере, с 70% идентичностью последовательности с эталонной последовательностью, предпочтительно - 80%, более предпочтительно - 85%, наиболее предпочтительно - по меньшей мере 90% или 95% идентичности последовательности с эталонной последовательностью в указанном окне сравнения. Предпочтительно оптимальное выравнивание проводят с применением алгоритма выравнивания по гомологии Needleman et al. (1970) J. Mol. Biol. 48:443. Показателем того, что две пептидные последовательности являются по существу идентичными, является то, что один пептид иммунологически реагирует с антителами, индуцированными ко второму пептиду. Таким образом, пептид является по существу идентичным со вторым пептидом, например, когда два пептида отличаются только консервативными заменами. Пептиды, которые являются "по существу сходными", содержат общие последовательности, как указано выше, за исключением того, что положения остатков, которые не одинаковы, могут отличаться заменами консервативных аминокислот.
Как применяют в настоящем документе, термин "Омега-9" в отношении профиля масла их канолы означает негидрогенизированное масло с содержанием жирных кислот, включающих по меньшей мере 68,0% олеиновой кислоты по массе и менее или равных 4,0% линоленовой кислоты по массе. В отношении растения канолы, термин "Омега-9" означает растение канолы, дающее семена с эндогенным содержанием жирных кислот, включающих по меньшей мере 68,0% олеиновой кислоты по массе и менее 4,0% линоленовой кислоты по массе.
В выбранных вариантах осуществления изобретение относится к выделенным последовательностям ДНК, содержащим целые открытые рамки считывания (ORF) и/или вышележащие 5' области ранее описанных мутантных генов fad2 и fad3. Таким образом, изобретение также относится к полипептидным последовательностям прогнозируемых мутантных белков, содержащих мутации из ранее описанных мутантных аллелей. Известно, что мембраносвязанные десатуразы, такие как FAD2, содержат консервативные гистидиновые участки. Замены аминокислотных остатков вне этих гистидиновых участков также могут влиять на ферментативную активность FAD2 (Tanhuanpää et al., Molecular Breeding 4:543-550, 1998).
В одном из аспектов изобретения мутантные аллели, описываемые в настоящем документе, можно использовать при селекции растений. В частности, аллели по изобретению можно использовать для селекции видов Brassica с высоким содержанием олеиновой кислоты, таких как Brassica juncea, Brassica napus, Brassica rapa, Brassica nigra и Brassica carinata. Изобретение относится к молекулярным маркерам для различения мутантных аллелей от альтернативных последовательностей. Таким образом, изобретение относится к способам сегрегационного и селекционного анализа генетических скрещиваний, в которых участвуют растения с аллелями по изобретению. Таким образом, изобретение относится к способам сегрегационного и селекционного анализа потомков, получаемых от генетического скрещивания, в которых участвуют растения с аллелями по изобретению.
В альтернативных вариантах осуществления изобретение относится к способам определения растений Brassica, таких как растения Brassica juncea, с желаемым составом жирных кислот или желаемыми геномными признаками. Например, способы по изобретению могут включать определение присутствия в геноме конкретных аллелей FAD2 и/или FAD3, таких как аллели по изобретению или аллель J96D-4830/BJfad2a дикого типа. В конкретных вариантах осуществления способы могут включать определение присутствия полиморфизма нуклеиновой кислоты, ассоциированного с одним из определяемых аллелей, или антигенной детерминанты, ассоциированной с одним из аллелей по изобретению. Такое определение можно проводить рядом способов, таких как амплификация ПЦР соответствующего фрагмента ДНК, ДНК-фингерпринтинг, РНК-фингерпринтинг, гель-блоттинг и анализ ПДРФ, анализы защиты от нуклеаз, секвенирование соответствующего фрагмента нуклеиновой кислоты, получение антител (моноклональных или поликлональных) или альтернативные способы, адаптированные для различения белка, продуцируемого соответствующими аллелями от других вариантов или форм дикого типа этого белка. Настоящее изобретение также относится к способу определения растений B. juncea, эндогенное содержание жирных кислот в семенах которых включает по меньшей мере 70% олеиновой кислоты по массе, посредством определения присутствия мутантных аллелей по изобретению.
В некоторых из выбранных вариантов осуществления для конструирования аллелеспецифических праймеров для ПЦР можно использовать конкретные замены одиночных пар оснований мутантных аллелей по изобретению, например, используя несоответствия на 3'-концах. Можно получать различные комбинации праймеров, таких как прямые праймеры или обратные праймеры, с "G/C" на 3'-конце (для амплификации аллеля дикого типа) или "A/T" на 3'-конце (для амплификации мутантного аллеля). В других выбранных вариантах осуществления для конструирования аллелеспецифических праймеров для ПЦР можно использовать конкретные замены одиночных пар оснований мутантных аллелей по изобретению, например, используя несоответствия на 3'-концах. Можно получать различные комбинации праймеров, таких как прямые праймеры или обратные праймеры, с "G/C" на 3'-конце (для амплификации аллеля дикого типа) или "A/T" на 3'-конце (для амплификации мутантного аллеля). Для иллюстративного изложения протоколов аллелеспецифической ПЦР см. Myakishev et al., 2001, Genome Research 11:163-169 или Tanhuanpää et al., 1999, Molecular Breeding 4:543-550.
В альтернативных вариантах осуществления для определения аллелей по изобретению можно использовать различные способы определения однонуклеотидных полиморфизмом (SNP). Например, такие способы могут включать анализы TaqMan или анализы молекулярных маяков (Tapp et al., BioTechniques 28:732-738), анализы Invader (Mein et al., Mein et al., Genome Research 10:330-343, 2000), анализы Illlumina® Golden Gate (www.illumina.com) или анализы на основе конформационного полиморфизма одиночной цепи (SSCP) (Orita et al., Proc. Natl. Acad Sci. U.S.A. 86:2766-2770, 1989).
В альтернативных вариантах осуществления изобретение относится к растениям Brassica, содержащим кодирующие последовательности fad2 и fad3, кодирующие мутантные белки FAD2 и FAD3 белки. Такие мутантные белки FAD2/FAD3 могут содержать только одну аминокислотную замену по сравнению с белком FAD2 дикого типа. В характерных вариантах осуществления различные линии Brassica juncea содержат ранее описанные мутантные белки FAD2, кодируемые ранее описанными аллелями. Такие аллели можно выбирать так, чтобы они были эффективны для получения увеличенного содержания олеиновой кислоты и сниженного содержания линоленовой кислоты в растениях по изобретению. В конкретных вариантах осуществления желательный аллель можно вводить в растения способами селекции. В альтернативных вариантах осуществления аллели по изобретению можно вводить молекулярно-биологическими способами, включая трансформацию растений. В таких вариантах осуществления растения по изобретению могут давать семена с эндогенным содержанием жирных кислот, включающим: по меньшей мере приблизительно 70% олеиновой кислоты по массе и менее чем приблизительно 3% линоленовой кислоты по массе, или любой другой предел содержания олеиновой кислоты и линоленовой кислоты, как указано выше. Растения по изобретению также могут содержать приблизительно от 70% до приблизительно 85% по массе олеиновой кислоты, приблизительно от 70% до приблизительно 78% олеиновой кислоты и приблизительно от 0,1% до приблизительно 3% линолевой кислоты, где состав масла генетически наследуется от родительской линии. Содержание всех жирных кислот в растениях по изобретению также может составлять менее чем от 7,1% до менее чем приблизительно 6,2% по массе. В одном из вариантов осуществления растение дает семена с эндогенным содержанием жирных кислот, включающим, по меньшей мере, приблизительно 70% олеиновой кислоты и менее чем 3% линолевой кислоты, где состав масла генетически наследуется от родительской линии.
В выбранных вариантах осуществления изобретение относится к семенам Brassica, которые могут представлять собой семена Brassica juncea с эндогенным содержанием масла с составом жирных кислот, предусмотренным для одного или нескольких из указанных выше вариантов осуществления, и где генетические детерминанты для эндогенного содержания масла получают на основе мутантных аллелей по изобретению. Например, такие семена можно получать посредством самоопыления каждой линии с мутантным аллелем по изобретению. Альтернативно такие семена можно получать, например, посредством скрещивания линий с мутантным аллелем со вторым родителем с последующей селекцией, где второй родитель может представлять собой другие линии Brassica, такие как линия Brassica juncea, являющуюся Brassica juncea качества канолы или Brassica juncea без качества канолы, или любые другие линии Brassica, такие как Brassica napus, Brassica rapa, Brassica nigra и Brassica carinata. Эти способы селекции хорошо известны специалистам в данной области.
В альтернативных вариантах осуществления изобретение относится к генетически устойчивым растениям рода Brassica, таким как растения Brassica juncea, дающим зрелые семена с составом, описываемым в одном или нескольких из указанных выше вариантов осуществления. Такие растения можно получать из линий Brassica juncea с мутантными аллелями по изобретению. Состав масла таких растений может генетически наследоваться от родительских линий.
В альтернативных вариантах осуществления изобретение относится к способам получения генетически устойчивого растения Brassica, такого как растение Brassica juncea, дающего зрелые семена с эндогенным содержанием жирных кислот, включающим состав, определенный для одного или нескольких из указанных выше вариантов осуществления. Способы по изобретению могут включать этапы: скрещивания генов омега-9 (например, fad2a и fad3a) из Brassica napus с другими растениями Brassica, такими как Brassica juncea, с образованием потомства F1. Потомство F1 можно выращивать, например, способами, которые могут включать самоопыление или выращивание двойных гаплоидных растений. При комбинации мутантных аллелей FAD2 и мутантных аллелей FAD3, растения с двумя мутантными аллелями генов (fad2 и fad3) могут содержать превосходный профиль жирных кислот масла, чем любые растения с одиночными мутациями. Получаемое потомство можно подвергать отбору на генетически устойчивые растения, дающие семена с составом, описываемым для одного или нескольких из указанных выше вариантов осуществления. Например, такие семена могут иметь стабилизированный профиль жирных кислот, включающий содержание всех насыщенных углеводородных соединений приблизительно от 7,1% до приблизительно 6,5% во всех выделяемых маслах. В определенных вариантах потомство может самостоятельно давать семена или, в качестве альтернативных вариантов осуществления, из него можно получать масло с составом, как указано выше с содержанием олеиновой кислоты более чем приблизительно 70% по массе и содержанием линоленовой кислоты менее чем приблизительно 3% по массе.
В выбранных вариантах осуществления увеличение содержания олеиновой кислоты в растениях по изобретению, таких как растения, получаемые на основе мутантных аллелей по настоящему изобретению, может сопровождаться соответствующим снижением содержания линолевой кислоты и линоленовой кислоты, тогда как содержание других жирных кислот может оставаться фактически неизмененным.
В одном из аспектов изобретение относится к растениям с устойчивым, наследуемым фенотипом с высоким содержанием олеиновой кислоты и низким содержанием линоленовой кислоты. Например, фенотип с высоким содержанием олеиновой кислоты и низким содержанием линоленовой кислоты, образующийся в результате присутствия мутантных аллелей по изобретению, генетически наследуется в поколениях M2, M3 и M4.
В различных аспектах изобретение включает изменение количества копий экспрессируемой кодирующей последовательности в геноме растения. Под "экспрессируемым" подразумевают, что первичная структура, т.е. последовательность кодирующей последовательности означает, что последовательность кодирует активный белок. Однако экспрессируемые кодирующие последовательности могут не экспрессироваться в качестве активного белка в конкретной клетке. Например, этот "генный сайленсинг" может происходить вследствие действия различных механизмов инактивации гомологичных трансгенов in vivo. Инактивация гомологичных трансгенов описана в растениях, где трансген вводили в смысловой ориентации с неожиданным результатом, что активность и гена, и трансгена подавлялась (Napoli et al., 1990 Plant Cell 2:279-289). Точный молекулярный механизм такой косупрессии неизвестен, хотя существуют по меньшей мере два предполагаемых механизма инактивации гомологичных генетических последовательностей. В качестве одного из механизмов предложена инактивация транскрипции посредством метилирования, где сигнал эндогенным механизмам генного сайленсинга дают области дуплицированной ДНК. Также предложен посттранскрипционный механизм, при котором, как полагают, совместные уровни экспрессии гена и трансгена приводят к высоким уровням транскрипта, запускающим деградацию обоих транскриптов, индуцируемую пороговым уровнем (van Bokland et al., 1994, Plant J. 6:861-877). Таким образом, в настоящем изобретении экспрессируемые кодирующие последовательности в геноме могут не экспрессироваться в конкретной клетке.
В альтернативных вариантах осуществления изобретение относится к растениям Brassica juncea, где изменена десатуразная активность жирных кислот, изменено содержание олеиновой кислоты или изменено содержание линоленовой кислоты относительно B. juncea дикого типа, которую использовали для эксперимента по мутагенезу. Под десатуразой жирных кислот ("FAD") подразумевают, что белок проявляет активность введения двойных связей при биосинтезе жирной кислоты. Например, ферменты FAD2/FAD3 могут характеризоваться активностью введения второй двойной связи при биосинтезе линолевой кислоты из олеиновой кислоты. Измененная десатуразная активность может включать увеличение, снижение или устранение десатуразной активности по сравнению с эталонными растением, клеткой или образцом.
В других аспектах снижение десатуразной активности может включать устранение экспрессии последовательности нуклеиновой кислоты, кодирующей десатуразу, такой как последовательность нуклеиновой кислоты по изобретению. Под устранением экспрессии в настоящем документе подразумевают, что функциональная аминокислотная последовательность, кодируемая последовательность нуклеиновой кислоты, не продуцируется на детектируемом уровне. Снижение десатуразной активности может включать устранение транскрипции последовательности нуклеиновой кислоты, кодирующей десатуразу, такой как последовательность по изобретению, кодирующая фермент FAD2 или фермент FAD3. Под устранением транскрипции в настоящем документе подразумевают, что последовательность мРНК, кодируемая последовательностью нуклеиновой кислоты, не транскрибируется на детектируемых уровнях. Снижение десатуразной активности также может включать продукцию с последовательностью нуклеиновой кислоты, кодирующей десатуразу, укороченной аминокислотной последовательностью. Под продукцией укороченной аминокислотной последовательности в настоящем документе подразумевают, что в аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты, отсутствует одна или несколько аминокислот функциональной аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты дикого типа. Кроме того, снижение десатуразной активности может включать продукцию варианта аминокислотной последовательности десатуразы. Под продукцией варианта аминокислотной последовательности в настоящем документе подразумевают, что аминокислотная последовательность содержит одну или несколько аминокислот, отличающихся от аминокислотной последовательности, кодируемой последовательностью нуклеиновой кислоты дикого типа. Как обсуждается в настоящем документе более подробно, в настоящем изобретении описано, что мутантные линии по изобретению продуцируют ферменты FAD2 и FAD3 с измененными аминокислотами по сравнению с линией J96D-4830 дикого типа. В последовательности нуклеиновой кислоты с целью снижения десатуразной активности можно осуществлять множество типов мутаций, таких как мутации со сдвигом рамки, замены и делеции.
В некоторых вариантах осуществления изобретение относится к новым полипептидным последовательностям FAD2/FAD3, которые можно модифицировать в соответствии с альтернативными вариантами осуществления изобретения. В данной области хорошо известно, что в структуре полипептида можно проводить некоторые модификации и замены по существу без изменения биологической функции этого пептида с получением биологически эквивалентного полипептида. Как применяют в настоящем документе, термин "консервативные аминокислотные замены" относится к замене одной аминокислоты в данном положении пептида на другую, где замену можно проводить без каких-либо заметных потери или приобретения функции с получением биологически эквивалентного полипептида. При проведении таких замен замены сходных аминокислотных остатков можно проводить на основании относительного сходства заместителей боковой цепи, например, их размера, заряда, гидрофобности, гидрофильности и т.п., и такие замены можно оценивать по их влиянию на функцию пептида посредством стандартного тестирования. И наоборот, как применяют в настоящем документе, термин "неконсервативные аминокислотные замены" относится к замене одной в данном положении пептида аминокислоты на другую, где замена вызывает ощутимые потерю или приобретение функции пептида с получением полипептида, который не является биологически эквивалентным.
В некоторых вариантах осуществления можно проводить консервативные аминокислотные замены, где аминокислотный остаток замещают на другой со сходным значением гидрофильности (например, в пределах значений плюс или минус 2,0), где аминокислотным остаткам присвоены следующие значения гидрофильности (как подробно изложено в патенте США № 4554101): Arg (+3,0); Lys (+3,0); Asp (+3,0); Glu (+3,0); Ser (+0,3); Asn (+0,2); Gln (+0,2); Gly (0); Pro (-0,5); Thr (-0,4); Ala (-0,5); His (-0,5); Cys (-1,0); Met (-1,3); Val (-1,5); Leu (-1,8); Ile (-1,8); Tyr (-2,3); Phe (-2,5) и Trp (-3,4). Можно проводить неконсервативные аминокислотные замены, где значение гидрофильности остатков значительно отличается, например, отличаясь более чем на 2,0.
В альтернативных вариантах осуществления можно проводить консервативные аминокислотные замены, где аминокислотный остаток замещают на другой со сходным значением индекса гидрофобности (например, в пределах значений плюс или минус 2,0). В таких вариантах осуществления каждому аминокислотному остатку можно присвоить индекс гидрофобности на основании его характеристик гидрофобности и заряда, следующим образом: Ile (+4,5); Val (+4,2); Leu (+3,8); Phe (+2,8); Cys (+2,5); Met (+1,9); Ala (+1,8); Gly (-0,4); Thr (-0,7); Ser (-0,8); Trp (-0,9); Tyr (-1,3); Pro (-1,6); His (-3,2); Glu (-3,5); Gln (-3,5); Asp (-3,5); Asn (-3,5); Lys (-3,9) и Arg (-4,5). Можно проводить неконсервативные аминокислотные замены, где индекс гидрофобности остатков значительно отличается, например, отличаясь более чем на 2,0. Например, на этой основе, неконсервативными заменами будут следующие замены аминокислоты дикого типа His (-3,2) в положении, соответствующем аминокислоте 105 в BJfad2-a: Ile (+4,5); Val (+4,2); Leu (+3,8); Phe (+2,8); Cys (+2,5); Met (+1,9); Ala (+1,8); Gly (-0,4); Thr (-0,7); Ser (-0,8) и Trp (-0,9).
В альтернативных вариантах осуществления можно проводить консервативные аминокислотные замены, где аминокислотный остаток замещают на другой, принадлежащий тому же классу, где аминокислоты разделяют на классы неполярных, кислых, основных и нейтральных следующим образом: неполярные: Ala, Val, Leu, Ile, Phe, Trp, Pro, Met; кислые: Asp, Glu; основные: Lys, Arg, His; нейтральные: Gly, Ser, Thr, Cys, Asn, Gln, Tyr. Можно проводить неконсервативные аминокислотные замены, где остатки не попадают в один и тот же класс, например, замену основной аминокислоты на нейтральную или неполярную аминокислоту.
Настоящее изобретение дополнительно относится к муке, получаемой из семян растений B. juncea, описываемых в настоящем документе, где такая мука может находиться в форме молотых семян, жмыха (семян, которые спрессовывали для выдавливания масла, но не подвергали действию растворителя или другим способам химической экстракции), белых хлопьев (семян, которые размололи и подвергли экстракции растворителем, таким как гексан, с выделением большего количества масла) или муки после общепринятых способов помола и экстракции растворителем. В одном конкретном варианте осуществления семена B. juncea подвергают водной обработке типа, описываемого, например, в WO2008024840 A2, WO03/053157, патенте США № 5844086; WO 97/27761; патентной заявке США 2005/0031767, или J. Caviedes, "Aqueous Processing Of Rapeseed (Canola)", Thesis For Degree Of Master Of Applied Science, University Of Toronto 1996, p.p. 1-147.
Масла по настоящему изобретению также можно использовать в некулинарных или пищевых способах и композициях. Некоторые из этих применений могут являться производственными, косметическими или медицинскими. Масла по настоящему изобретению также можно использовать в любом применении, для которого подходят масла по настоящему изобретению. В основном масла по настоящему изобретению можно использовать для замены, например, минеральных масел, сложных эфиров, жирных кислот или животных жиров в ряде применений, таких как смазочные средства, добавки к смазочным средствам, технологические масла, гидравлические жидкости и огнестойкие гидравлические жидкости. Масла по настоящему изобретению также можно использовать в качестве материалов в процессе получения модифицированных масел. Примеры способов модификации масел по настоящему изобретению включают фракционирование, гидрирование, изменение содержания олеиновой кислоты или содержания линоленовой кислоты в масле и другие способы модификации, известные специалистам в данной области. В некоторых вариантах осуществления масла по настоящему изобретению используют для получения переэтерифицированных масел, для получения тристеаринов или в композициях жидких диэлектриков, которые можно включать в электрические устройства.
Примеры индустриальных применений масел по настоящему изобретению включают составляющую часть смазочной композиции (патент США № 6689722; также см. WO 2004/0009789A1); топливо, например, биодизельное топливо (патент США No. 6887283; также см. WO 2009/038108A1); регистрирующий материал для применения в репрографирующем оборудовании (патент США № 6310002); имитирующие нефть композиции (патент США № 7528097); герметизирующие композиции для бетона (патент США № 5647899); вулканизирующее покрывающее средство (патент США № 7384989); промышленные масла для жарки; чистящие составы (WO 2007/104102A1; также см. WO 2009/007166A1) и растворители в присадке для пайки (WO 2009/069600A1). Масла по настоящему изобретению также можно использовать в промышленных способах, например, получении биопластика (патент США № 7538236); и получении полиакриламида инверсной эмульсионной полимеризацией (патент США № 6686417).
Примеры косметических применений масел по настоящему изобретению включают использование в качестве смягчающего средства в косметической композиции; в качестве замены геля из нефтепродуктов (патент США № 5976560); в качестве составляющей части мыла или в качестве материала в обработке для получения мыла (WO 97/26318; патент США № 5750481; WO 2009/078857A1); в качестве составляющей части раствора для перорального введения (WO 00/62748A1); в качестве составляющей части композиции против старения (WO 91/11169) и в качестве составляющей части аэрозольного пенного препарата для кожи или волос (патент США № 6045779).
Кроме того, масла по настоящему изобретению можно использовать в медицинских применениях. Например, масла по настоящему изобретению можно использовать в защитном барьере против инфекции (Barclay and Vega, "Sunflower oil may help reduce nosocomial infections in preterm infants." Medscape Medical News
Следует понимать, что приведенное выше представляет собой неограничивающие примеры некулинарных применений, для которых подходят масла по настоящему изобретению. Как указано ранее, масла и модифицированные масла по настоящему изобретению можно использовать, например, для замены минеральных масел, сложных эфиров, жирных кислот или животных жиров во всех применениях, известных специалистам в данной области.
Следует понимать, что могут существовать различные модификации и альтернативы по настоящему изобретению. Его определенные конкретные варианты осуществления описаны в общих способах и дополнительно разъяснены в следующих примерах. Изобретение безусловно относится ко всем видам Brassica juncea качества канолы, а также ко всем видам Brassica juncea, не обладающим качеством канолы. Изобретение можно применять ко всем другим видам Brassica, включая Brassica juncea, Brassica nigra и Brassica carinata, с получением по существу сходных результатов. Также следует понимать, что приведенные ниже примеры не предназначены для ограничения изобретения конкретными описанными формами, но вместо этого изобретение предназначено для включения всех модификаций, эквивалентов и альтернатив, находящихся в объеме изобретения.
ПРИМЕРЫ
ПРИМЕР 1
Обратное скрещивание
Относительно фиг. 1, одно или несколько обратных скрещиваний (BC3 и BC4) между отобранными вариантами с высоким содержанием олеиновой кислоты - низким содержанием линоленовой кислоты и партнерами B. juncea (Zem1, Zem2 и ZE Skorospelka) для полного восстановления генетического окружения B. juncea. в программе обратного скрещивания использовали только линии с отсутствием эруковой кислоты B. juncea, так как это могло обеспечить полную экспрессию мутантных аллелей fad2 и fad3 в неконкурирующих условиях с геном(ами) FAE.
После каждого успешного обратного скрещивания (например, BC3, BC4) и последующего самоопыления (например, BC3F2, BC4F2), семена потомства сначала подвергали скринингу ткани на присутствие генов fad2a и fad3a (с применением маркеров, как более подробно описано в настоящем документе), затем выращивали до цветения для использования в последующих обратных скрещиваниях. Собранные семена из отобранных линий подвергают анализу профиля масла с применением полусемени, неразрушающего NIR анализа целых семян или NIR одного семени (FTNIR). Затем образцы, содержащие увеличенные уровни олеиновой кислоты и сниженные уровни линоленовой кислоты, выращивали в почве и выращивали до созревания. От этих растений получают самоопыленные семена, и партию семян анализируют на профиль масла, представляющий высокое содержание олеиновой и низкое содержание линоленовой кислоты. Определяют отобранные варианты, содержащие олеиновую кислоту в диапазоне 67-80% и менее 5% линоленовой кислоты. Эти отобранные варианты скрещивали между собой с получением желательного профиля жирных кислот.
Выделяли геномную ДНК тканей листьев и скринировали на присутствие мутаций, специфичных для генов fad2a и fad3a, для которых известно, что они обуславливают фенотипы с высоким содержанием олеиновой кислоты и низким содержанием линоленовой кислоты в масле семян. Растения по своему фенотипу (листа и строение листа) были высоко сходными с родительскими растениями B. juncea. Растения также демонстрировали устойчивость к разрушению стручков и устойчивость к засухе в полевых условиях, сходные с родительской B. juncea.
SSR-маркеры, специфичные для генома CC и нежелательные области генома AA, больше не присутствуют в потомстве при обратном скрещивании B. juncea × B. napus с B. juncea.
Ткани листьев, полученные из линий B. juncea и омега-9 B. Napus, лиофилизировали для проведения генетического фингерпринтинга. В случаях, когда для получения индивидуальных растений F1 использовали несколько растений, также собирали ткань от всех предков для учета аллелей, которые можно наблюдать в следующих поколениях. Если родительскую ткань не собирали, осуществляли альтернативный вариант, когда собирали случайные образцы шести растений из каждой партии родительских семян (источника). ДНК выделяли из растений в количестве до шести индивидуальных растений на линию и равные аликвоты от каждого индивидуального растения объединяли с получением родительского контроля для генетического фингерпринтинга. Предварительно получали генетические отпечатки всех линий омега-9 B. napus, используемых в программе скрещивания, и представляли данные, собранные во всех группах сцепления генома A и генома C в этих линиях.
Для дальнейшего улучшения интерпретации и обоснованности результатов, собирали ткани листа, выделяли ДНК и также получали совокупности образцов ДНК для оценки(ок) B. rapa, B. nigra и B. oleracea с целью возможной идентификации аллелей, соответствующих геномам A, B и C, соответственно.
Совокупности B. juncea, B. napus, B. rapa, B. nigra и B. oleracea подвергали скринингу с панелью маркеров SSR. В дополнение к собранной информации о наблюдаемых фрагментах ДНК, отмечали информацию о нулевых аллелях. Собранную информацию по генотипированию хранили в базе данных генотипирования Geneflow™. Идентификацию информативных маркеров SSR для выбранных линий B. juncea и B. napus проводили с применением функции отчета о полиморфизмах в базе данных генотипирования Geneflow™.
Для уменьшения сокращения областей, специфичных для B. napus, с использованием полиморфных маркеров SSR, идентифицированных при скрининге родителей, в поколениях обратного скрещивания посредством скрининга популяций обратного скрещивания проводят селекцию с помощью маркеров. В дополнение к полиморфным кодоминантным маркерам, для получения желательных областей геномов A и B для селекции с помощью маркеров также используют маркеры, учитывающие нулевые аллели для линий B.juncea. Отбор растений для улучшений проводят посредством селекции и лабораторных исследований с использованием фенотипических и генотипических исследований. Растения-потомки, не имеющие CC генома омега-9 B. napus, а также нежелательных участков генома AA на основе профилей маркеров, выбирают для улучшения на следующем этапе.
Пример 2
Получение маркеров, специфичных для B. juncea
Получали маркеры ДНК, посредством которых можно детектировать присутствие ДНК генома BB, относящейся к FAD2b и другим доступным последовательностям из B. nigra и B. juncea (представляющим геном BB). Для получения маркеров получали картированные популяции двойных гаплоидов. Кроме того, маркеры ДНК (SSR и SNP) получали из известных последовательностей генома B. Эти маркеры могут подтверждать степень восстановления исходной основы B. juncea в преобразуемых линиях.
Для скрининга родителей всего доступны 1931 маркеров SSR B. napus, преимущественно содержащих мотивы ди- и тринуклеотидных повторов. Эти маркеры в настоящее время подвергают скринингу на панели линий Brassica, принадлежащих B. juncea (линии Zem1, Zem2 и ZE Skorospelka), омега-9 B. napus, B. rapa, B. nigra и B. oleracea. Этот скрининг предоставляет информацию двух видов. Во-первых, так как эти маркеры SSR получены из генома B. napus, скрининг предоставляет информацию об их применимости для других геномов и обеспечивает идентификацию аллелей, специфически соответствующих геномам AA, BB или CC. Во-вторых, скрининг обеспечивает идентификацию основного набора маркеров для применения в картировании B. juncea и введении признака.
В дополнение к указанным выше маркерам, для получения маркеров SSR проводился поиск в общедоступных базах данных на маркеры SSR, которые можно использовать для B. juncea. Всего в общедоступных базах данных идентифицировано 438 SSR, из которых 101 происходят из B. napus (геном AA CC), 113 из B. nigra (геном BB), 95 из B. oleracea (геном CC) и 129 из B. rapa (геном AA). Из них 113 SSR из B. nigra, 129 SSR из B. rapa и некоторые из SSR из B. napus идентифицированы, как потенциально пригодные для B. juncea.
Выбранные маркеры из текущей коллекции авторов изобретения, а также маркеры SSR и SNP, полученные из известных последовательностей генома B, использовали для подтверждения присутствия исходного окружения B. juncea при селекции обратным скрещиванием. Для конструирования карты сцепления B. juncea, а также сравнительной карты B. juncea и B. napus для идентификации общих маркерных локусов также использовали информативные маркеры, идентифицированные при скрининге родителей. Вводимые локусы fad2a и fad3a картируются в B. juncea, что представляет доказательство того, что они успешно введены в геном AA B. juncea.
Используя эти специфичные для B. juncea маркеры, идентифицируют наследуемые последовательности fad2a, fad2b, fad3a и fad3b для локализации вариаций fad2 и fad3 в выбранных линиях с улучшенными профилями жирных кислот.
Пример 3
Восстановление и определение генома B
Самоопыляемые и двойные гаплоидные растения, демонстрирующие профиль масла в семенах с высоким содержанием олеиновой и низким содержанием линоленовой кислот, как описано ранее, подвергают скринингу с применением маркеров, выбранных для генома BB. Подтверждают присутствие генома BB в конвертированных линиях. Эти мутантные линии B. juncea также демонстрируют снижение (или полное отсутствие) количества положительных маркеров генома C, выбранных для B. napus. Эти профили дополнительно улучшают, посредством обратных скрещиваний и способов самоопыления, известных в данной области, которые улучшают агрономические качества линии, например, снижают задержку урожая, снижают ломкость стручков, изменяют период созревания для различных зон роста, увеличивают устойчивость к стрессам, увеличивают устойчивость к заболеваниям и т.п.
Для определения генома B в самоопыляемом и DH потомстве после межвидовых скрещиваний B. napus и B. juncea, демонстрирующем желаемый профиль масла семян, используют три различных способа.
A) Молекулярные маркеры
Идентифицированы молекулярные маркеры, дающие возможность определять генетические полиморфизмы у линий B. napus и B. juncea. Всего для определения основного набора SSR, позволяющего различать геномы B. juncea и B. napus, подвергнуто скринингу 1931 маркеров SSR B. napus. Кроме того, как описано в примере 2, для идентификации дополнительных маркеров для скрининга родителей проводили поиск в общедоступных базах данных. Таким образом, исследовано более 2300 маркеров SSR на возможность с помощью них различать B. juncea от B. napus. Набор маркеров из этого скрининга использовали для определения накопления генома B. juncea в потомстве или уменьшения или отсутствия генома B. napus. Другая система маркеров включает использование маркеров SNP. В сообществе получены более 3000 SNP. Проводили два высокопроизводительных анализа Illumina (т.е. две OPA (совокупность аллелеспецифичных олигонуклеотидов) с 1536 SNP). Обе этих OPA (всего 3072 анализов SNP) подвергали скринингу по родительской панели, состоящей из линий всех трех тетраплоидов B. napus, B. juncea и B. carinata, и всех трех диплоидных предшественников Brassica "Треугольник У" (1935) - B. nigra, B. oleracea и B. rapa. Определяют набор SNP, посредством которого можно однозначно отследить фрагменты B. juncea в потомстве. В частности в набор включают те SNP, посредством которых можно подтвердить присутствие генома B в потомстве. Таким образом, используя для скрининга растений-потомков большое количество информативных SSR и SNP, определяют растения, содержащие высокий процент генома B. После характеристики самоопыляемого и DH потомства, картированные положения маркерных локусов подтверждают по отношению к карте сцепления B. napus и B. juncea, строя сравнительную карту с использованием сегрегирующего потомства. Сравнительная карта позволяет определять потенциальную перестановку, добавление или делецию маркерных локусов после межвидового скрещивания.
B) Флуоресцентная гибридизация in situ
Для определения присутствия или накопления генома B в потомстве используют способ флуоресцентной гибридизации in situ (FISH). Растения-потомки используют для анализа маркеров и для цитологических исследований, таких как определение количества хромосом, наличие анеуплоидии, и для определения представляющих интерес геномных сегментов. FISH является эффективным инструментом, который может дополнительно усилить информацию, полученную посредством молекулярных маркеров. С этой целью последовательности-кандидаты для маркеров SSR и SNP, посредством которых можно однозначно определить присутствие генома B, используют для получения больших клонов BAC, которые затем используют в качестве зондов на метафазных пластинках являющихся кандидатами растений-потомков, идентифицированных как содержащих высокий процент генома B. Последовательности BAC также определяют компьютерными способами, при условии, что последовательности BAC доступны в базах данных. В этом случае BAC, определенные in silico, можно получать из соответствующего источника и использовать в экспериментах FISH.
C) Геномная гибридизация in situ
Способ геномной гибридизации in situ (GISH) используют, когда хромосомы являющихся кандидатами растений-потомков можно зондировать всей ядерной ДНК генома BB с использованием всей ДНК B. juncea в качестве конкурирующего немеченого зонда. Сильная гибридизация с хромосомами генома BB B. juncea указывает на присутствие генома BB в потомстве.
Образцы с желаемым профилем масла семян и аллелями, относящимися к B. juncea, используют для обратного скрещивания и дополнительного самоопыления. Для восстановления элитного генотипа по максимально возможному количеству полиморфных локусов при сохранении желаемого фенотипа в сегрегирующих популяциях используют MAS. Потомство обратного скрещивания генотипируют с маркерами SSR или SNP с акцентом при выборе против образцов, содержащих аллели из геномов A и C, ассоциированные с B. napus. Этот процесс эффективен, когда для получения желаемого фенотипа необходимо большое количество локусов.
Пример 4
Дополнительные модификации для профилей масел и тестирования профилей масел
Дополнительное улучшение масличных семян осуществляют, комбинируя мутации fad2, fad3 генома B, описанные в публикации № US2008/0168587, или мутации, вновь создаваемые в семенах B. nigra или B. juncea. В одном из примеров проводят скрещивания различных линий, определяют выбранные варианты и, комбинируя эти отобранные варианты, получают дополнительные отобранные варианты со стабильным высоким содержанием олеиновой кислоты и низким содержанием линоленовой кислоты со сравнимым агротехническим выходом продукции.
Другие потенциальные способы получения и/или определения других источников мутантных генов fad2b и/или fad3b включают, например: на основе известной зародышевой плазмы, на основе мутантов при использовании быстрых нейтронов/EMS, на основе применения РНКи, на основе опосредуемого цинковыми пальцами контроля регуляции экспрессии гена. Уровни экспрессии ферментов fad2b и fad3b можно снижать или экспрессию ферментов fad2b и fad3b можно устранять любыми из известных способов, описанных выше.
После получения/определения генов, мутантные гены FAD переносят в растения B. juncea посредством: (a) скрещивания линии B. juncea DAS со вторым растением B. nigra, B. carinata или B. juncea с мутантным геном fad2b и/или геном fad3b; (b) с применением молекулярных маркеров для отслеживания введения гена fad2b и/или гена fad3b; (c) получая семена от скрещивания на этапе (a); (d) анализируя FAP семян, затем выращивание фертильных растений из выбранных вариантов семян; (e) получая семена потомства из самоопыляющихся растений с этапа (d); (f) тестирование потомства в теплицах и полевых условиях в изменяющихся условиях окружающей среды; и (g) определяя семена потомства, имеющих величину содержания линоленовой кислоты <3% и величину содержания олеиновой кислоты приблизительно от 68% до приблизительно 80%.
Негативную регуляцию ферментов FAD2B и FAD3B осуществляют делецией, инсерционным мутагенезом в кодирующих областях или регуляторных доменах в пределах природных последовательностей.
Пример 5
Профиль масла семян гибрида B. Juncea
Профиль масла HOLL представлен в гибридах, получаемых созданием родительских линий HOLL, содержащих цитоплазматические мужские стерильные системы (см., например, Ogura, B. napus CMS 126-1) и соответствующее им восстанавливающее фертильность окружение.
Пример 6
Введение агрономических свойств, свойств устойчивости к гербицидам и инсектицидам в HOLL Juncea
Свойство устойчивости к гербицидам (устойчивость к имидазолинону): свойство устойчивости к имидазолинону в B. napus (BASF) включает участок мутации PM2, расположенный в LG01 (геном AA, приблизительно 20 сМ от участка вставки устойчивости к глифосату), и участок мутации PM1, расположенный в LG11 (геном CC). Полагают, что ahas3 соответствует геному AA, тогда как AHAS1 соответствует геному CC. Swanson et al. (Theor. Appl Genet. 78:525-530, 1989) показали, что ген ahas3 отдельно обеспечивает устойчивость к имидазолиноновым гербицидам. Существуют два других гена AHAS, находящихся в геноме AA: ahas2 и ahas4. Гены AHAS, находящиеся в геноме BB, можно определять для мутагенеза, если для устойчивости к имидазолиноновым гербицидам необходимы два гена ahas. Выявлено, что при наличии в B. juncea только PM2 получают недостаточную устойчивость. Таким образом, в B. juncea для обеспечения достаточной устойчивости к имидазолинону вводят два или более гена.
С B. juncea скрещиваютомега-9 B. napus IMI. Фертильные семена высаживают, и потомство межвидового скрещивания опрыскивают имидазолиноновыми гербицидами для анализа на устойчивость. Наличие PM2 при применении анализа Invader подтверждает присутствие мутации PM2. Проводят анализ на мутацию PM1 для определения того, что спаривание хромосом генома BB и генома CC приводит к генетическому переносу PM1 из генома CC B. napus в геном B B. juncea.
Если одиночная мутация в гене AHAS3 обеспечивает устойчивость к имидазолиноновым гербицидам, для проведения скрещивания с линией B. juncea используют линию омега-9 B. napus, содержащую PM2, с устранением необходимости повторного введения зародышевой плазмы B. napus в конечные линии HOLL B. juncea. Селекция с помощью маркеров устойчивой к имидазолинону B. juncea проводят одновременно с восстановлением и определением генома BB. После получения линии HOLL B. juncea, устойчивой к имидазолинону, ее используют для последующего введения свойств в другие культивары B. juncea.
Введение новых гербицидных свойств в HOLL B. juncea: Получение устойчивой к глифосату B. juncea проводят посредством введения в B. juncea мутации TIPS посредством применения технологии цинковых пальцев. В B. napus идентифицировано пять паралогов, где один или два из них являются наиболее сильно экспрессирующими варианты гена EPSPS. Выявлено, что модифицированные гены epsps, способные приводить к фенотипу с устойчивостью к глифосату, находятся в геноме A и посредством скрещивания их вводят в омега-9 B. juncea с получением устойчивой к глифосату омега-9 B. juncea.
Сегрегирующее потомство (T1SI, F2 или BC1) высаживают. Собирают образцы листьев для выделения ДНК. Образцы опрыскивают для анализа на селективный маркер устойчивости к гербициду, с последующим тестированием зиготности с использованием геноспецифического маркера. Формируют совокупности для анализа объединенных сегрегантов (BSA) посредством объединения ДНК случайных образцов устойчивых и чувствительных растений, чтобы они содержали классы устойчивости и чувствительности. Совокупности R и S, а также элитный культивар и трансформированный донорский культивар генотипируют с использованием маркеров SSR или SNP для определения предполагаемой хромосомной вставки. На хромосоме проводили селективное генотипирование с ассиметричными группами для идентификации участка вставки гена. Для введения представляющего интерес гена в желаемую HOLL B. juncea использовали введение с помощью маркеров.
ДОПОЛНИТЕЛЬНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
С появлением способов молекулярной биологии, позволивших выделять и характеризовать гены, кодирующие конкретные белковые продукты, у ученых в области биологии растений развился большой интерес к конструированию генома растения так, чтобы он содержал и экспрессировал чужеродные или дополнительные гены или экспрессировал модифицированные варианты исходных генов (возможно под контролем других промоторов) для изменения свойств растений в определенном направлении. Такие чужеродные дополнительные и/или модифицированные гены в настоящем документе обобщенно обозначают как "трансгены". В течение последних 20 лет для различных культур разработано несколько способов получения трансгенных растений, которые включают опосредованную агробактериями трансформацию и бомбардировку частицами. Для ознакомления с конкретными протоколами трансформации Brassica для справки см. патенты (патент США № 5188958, выданный Moloney et al., 23 февраля 1993 года; патент США № 6051756, выданный Chen et al., 18 апреля 2000 года; патент США № 6297056, выданный Tulsieram et al., 2 октября 2001 года). Настоящее изобретение в конкретных вариантах осуществления также относится к трансформированным версиям заявляемых сортов и линий.
Трансформация растений включает конструирование экспрессирующего вектора, который будет функционировать в растительных клетках. Такой вектор содержит ДНК, несущую ген под контролем регуляторного элемента (например, промотора) или функционально связанный с ним. Экспрессирующий вектор может содержать один или несколько таких функционально связанных комбинаций ген/регуляторный элемент. Вектор(ы) могут находиться в форме плазмиды, и их можно использовать отдельно или в комбинации с другими плазмидами для получения трансформированных растений Brassica способами трансформации, как описано ниже, с введением трансгенов в генетический материал растения(ий) Brassica.
Экспрессирующие векторы для трансформации Brassica: маркерные гены - экспрессирующие векторы включают по меньшей мере один генетический маркер, функционально связанный с регуляторным элементом (например, промотор), позволяющий выделять трансформированные клетки, содержащие маркер, посредством отрицательной селекции, т.е. ингибируя рост клеток, не содержащих ген селективного маркера, или посредством положительной селекции, т.е. проводя скрининг на продукт, кодируемый генетическим маркером. В области трансформации хорошо известно множество широко используемых генов селективных маркеров для трансформации растений, и они включают, например, гены, кодирующие ферменты, обеспечивающие метаболическую детоксикацию выбранного химического средства, которое может представлять собой антибиотик или гербицид, или гены, кодирующие измененную мишень, которая нечувствительна к ингибитору. Способов положительной селекции в данной области известно мало.
Одним широко используемым геном селективного маркера для трансформации растений является ген неомицинфосфотрансферазы II (nptll), который, когда он находится под контролем регуляторных сигналов растения, придает устойчивость к канамицину (Fraley et al., Proc. Natl. Acad. Sci. U.S.A., 80:4803, 1983). Другим широко используемым геном селективного маркера является ген гигромицинфосфотрансферазы, который придает устойчивость к антибиотику гигромицину (Vanden Elzen et al., Plant Mol. Biol., 5:299, 1985).
Дополнительные гены селективных маркеров бактериального происхождения, придающие устойчивость к антибиотикам, включают гентамицинацетилтрансферазу, стрептомицинфосфотрансферазу и аминогликозид-3'-аденилтрансферазу, детерминанту устойчивости к блеомицину (Hayford et al., Plant Physiol. 86:1216, 1988; Jones et al., Mol. Gen. Genet., 210:86, 1987; Svab et al., Plant Mol. Biol. 14:197, 1990; Hille et al., Plant Mol. Biol. 7:171,1986). Другие гены селективных маркеров, придающие устойчивость к гербицидам, таким как глифосат, глюфосинат, 2,4-D или бромоксинил (Comai et al., Nature 317:741-744, 1985; Lira et al., WO 2008/070845; Wright et al., WO 2005/107437 и WO 2007/053482; Gordon-Kamm et al., Plant Cell 2:603-618, 1990; Stalker et al., Science 242:419-423, 1988). Другие гены селективных маркеров для трансформации растений небактериального происхождения включают, например, дигидрофолатредуктазу мыши, растительную 5-енолпирувилшикимат-3-фосфатсинтетазу и растительную ацетолактатсинтазу (Eichholtz et al., Somatic Cell Mol. Genet. 13:67, 1987; Shah et al., Science 233:478, 1986; Charest et al., Plant Cell Rep. 8:643, 1990). В качестве маркера экспрессии гена в прокариотических и эукариотических клетках использовали ген, кодирующий зеленый флуоресцентный белок (GFP) (Chalfie et al., Science 263:802, 1994). GFP и мутанты GFP можно использовать в качестве селективных маркеров
Промоторы: Гены, включаемые в экспрессирующие векторы, должны находиться под контролем нуклеотидной последовательности, содержащей регуляторный элемент, например, промотор. В настоящее время в области трансформации хорошо известны несколько типов промоторов, а также другие регуляторные элементы, которые можно использовать отдельно или в комбинации с промоторами. Как применяют в настоящем документе, "промотор" включает указание на область ДНК, выше старта транскрипции и вовлеченную в распознавание и связывание РНК-полимеразы и других белков для инициации транскрипции. "Промотор растения" представляет собой промотор, способный к инициации транскрипции в растительных клетках. Примеры промоторов под контролем развития включают промоторы, которые преимущественно инициируют транскрипцию в определенных тканях, таких как листья, корни, семена, жилки, сосуды ксилемы, трахеиды или склеренхима. Такие промоторы обозначают как "с тканевым предпочтением". Промоторы, инициирующие транскрипцию только в определенных тканях, обозначают как "тканеспецифические". Специфический для "типа клеток" промотор преимущественно контролирует экспрессию в определенных типах клеток в одном или нескольких органах, например, в клетках сосудов в корнях или листьях. "Индуцибельным" промотором является промотор, который находится под контролем условий окружающей среды. Примеры условий окружающей среды, которые могут влиять на транскрипцию индуцибельными промоторами, включают анаэробные условия или наличие света. Тканеспецифические промоторы, промоторы с тканевым предпочтением, специфичные для типа клеток, и индуцибельные промоторы составляют класс неконститутивных промоторов. Конститутивный промотор представляет собой промотор, который активен при большинстве условий окружающей среды.
Индуцибельные промоторы: Индуцибельный промотор функционально связан с геном для экспрессии в Brassica. Необязательно, индуцибельный промотор функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая функционально связана с геном для экспрессии в Brassica. С индуцибельным промотором скорость транскрипции возрастает в ответ на индуцирующее средство. По настоящему изобретению можно использовать любой индуцибельный промотор. См. Ward et al., Plant Mol Biol. 22:361-366 (1993). Иллюстративные индуцибельные промоторы включают в качестве неограничивающих примеров промотор из системы ACEI, отвечающий на медь (Mett et al., PNAS 90:4567-4571, 1993); ген In2 из кукурузы, отвечающий на антидот гербицида бензолсульфонамида (Hershey et al., Mol. Gen. Genetics 227:229-237 (1991); и Gatz et al., Mol. Gen. Genetics 243:32-38 (1994)) или репрессор Tet из Tn10 (Gatz et al., Mol. Gen. Genetics 227:229-237 (1991)). Особенно предпочтительным индуцибельным промотором является промотор, отвечающий на индуцирующее средство, на которое растение обычно не реагирует. Иллюстративным индуцибельным промотором является индуцибельный промотор гена стероидного гормона, транскрипционная активность которого индуцируется глюкокортикостероидным гормоном (Schena et al., Proc. Natl. Acad. Sci. U.S.A. 88:0421 (1991)).
Конститутивные промоторы: Конститутивный промотор функционально связан с геном для экспрессии в Brassica, или конститутивный промотор функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, которая функционально связана с геном для экспрессии в Brassica. По настоящему изобретению можно использовать множество различных конститутивных промоторов. Иллюстративные конститутивные промоторы включают в качестве неограничивающих примеров промоторы из вирусов растений, такие как промотор 35S из CaMV (Odell et al., Nature 313:810-812, 1985) и промоторы таких генов, как актин риса (McElroy et al., Plant Cell 2:163-171, 1990); убиквитин (Christensen et al., Plant Mol. Biol 12:619-632, 1989; Christensen et al., Plant Mol Biol 18:675-689 (1992); pEMU (Last et al., Theor. Appl Genet. 81:581-588, 1991); MAS (Velten et al., EMBOJ. 3:2723-2730, 1984); гистона H3 кукурузы (Lepetit et al., Mol Gen. Genetics 231:276-285, 1992; Atanassova et al., Plant Journal 2 (3):291-300, 1992). Особенно пригодным конститутивным промотором является промотор ALS, 5' фрагмент Xba1/Nco1 структурного гена ALS3 Brassica napus (или нуклеотидная последовательность, сходная с указанным фрагментом Xba1/Nco1). См. заявку PCT WO 96/30530.
Тканеспецифические промоторы или промоторы с тканевым предпочтением: Тканеспецифический промотор функционально связан с геном для экспрессии в Brassica. Необязательно, тканеспецифический промотор функционально связан с нуклеотидной последовательностью, кодирующей сигнальную последовательность, функционально связанную с геном для экспрессии в Brassica. Растения, трансформируемые представляющим интерес геном, функционально связанным с тканеспецифическим промотором, продуцируют белковый продукт трансгена, исключительно или преимущественно, в конкретной ткани. По настоящему изобретению можно использовать любой тканеспецифический промотор или промотор с тканевым предпочтением. Иллюстративные тканеспецифические промоторы или промоторы с тканевым предпочтением включают в качестве неограничивающих примеров предпочтительный для корня промотор, такой как промотор as гена фазеолина (Murai et al., Science 23:476-482 (1983) и Sengupta-Gopalan et al., Proc. Natl. Acad. Sci. U.S.A. 82:3320-3324 (1985)); специфичный для листьев и индуцируемый светом промотор, такой как промотор cab или rubisco (Simpson et al., EMBOJ. 4(11):2723-2729 (1985), и Timko et al., Nature 318:579-582 (1985)); специфичный для пыльника промотор, такой как промотор LAT52 (Twell et al., Mol Gen. Genetics 217:240-245 (1989)); специфичный для пыльцы промотор, такой как промотор Zm13 (Guerrero et al., Mol Gen. Genetics 244:161-168 (1993)), или предпочтительный для микроспор промотор, такой как промотор apg (Twell et al., Sex. Plant Reprod. 6:217-224 (1993)).
Транспорт белка, продуцируемого с трансгенов в субклеточный компартмент, такой как хлоропласт, вакуоль, пероксисома, глиоксисома, клеточная стенка или митохондрия, или для секреции в апопласт, осуществляют посредством функционального связывания с 5'- и/или 3'-областью гена, кодирующего представляющий интерес белок, нуклеотидной последовательности, кодирующей сигнальную последовательность. Размещая последовательности на 5'- и/или 3'-конце структурного гена, можно в течение синтеза и процессинга белка определять, где кодируемый белок, в конечном счете, будет компартментализован.
Наличие сигнальной последовательности направляет полипептид или во внутриклеточную органеллу или в субклеточный компартмент или для секреции в апопласт. В данной области известно множество сигнальных последовательностей. См., например, Becker et al., Plant Mol Biol 20:49 (1992); C. Knox et al., Plant Mol Biol. 9:3-17 (1987); Lerner et al., Plant Physiol 91:124-129 (1989); Fontes et al., Plant Cell 3:483-496 (1991); Matsuoka et al., Proc. Natl. Acad. Sci. 88:834 (1991); Gould et al., J. Cell Biol 108:1657 (1989); Creissen et al., Plant J. 2:129 (1991); Kalderon, et al., Cell 39:499-509 (1984); Steifel et al., Plant Cell 2:785-793 (1990).
C применением трансгенных растений по настоящему изобретению чужеродный белок можно получать в коммерческих количествах. Таким образом, способы селекции и выращивания трансформированных растений, которые широко распространены в данной области, позволяют получать множество трансгенных растений, которые собирают общепринятым способом, а затем из представляющей интерес ткани или из общей биомассы можно выделять чужеродный белок. Выделение белка из биомассы растений можно проводить известными способами, которые описаны, например, в Heney and Orr, Anal Biochem. 114:92-6 (1981).
В соответствии с конкретным вариантом осуществления изобретения трансгенное растение, предоставляемое для коммерческого получения чужеродного белка, представляет собой растение Brassica. В другом варианте осуществления представляющая интерес биомасса представляет собой семена. Для относительно небольшого количества трансгенных растений, демонстрирующих повышенные уровни экспрессии, можно получать генетическую карту, преимущественно посредством общепринятых анализов ПДРФ, ПЦР и SSR, которая идентифицирует приблизительное положение интегрированной молекулы ДНК в хромосоме. Для получения информации об иллюстративных способах в этом отношении см. Glick and Thompson, Methods in Plant Molecular Biology and Biotechnology, CRC Press, Boca Raton 269:284 (1993). Информация из карты относительно положения в хромосоме пригодна для патентной защиты трансгенного растения по изобретению. Если предпринимается неправомерное выращивание и проводится скрещивание с другой зародышевой линией, карту области интеграции можно сравнивать со сходными картами подозреваемых растений для определения того, имеют ли последние общее происхождение с растением по изобретению. Сравнение карт может включать гибридизацию, ПДРФ, ПЦР, SSR и секвенирование, которые все являются общепринятыми способами.
Способы трансформации Brassica: Разработано множество способов трансформации растений, включая протоколы биологической и физической трансформации растений. См., например, Miki et al., "Procedures for Introducing Foreign DNA into Plants" в Methods in Plant Molecular Biology and Biotechnology, B.R. Glick and J.E. Thompson, Eds. (CRC Press, Inc., Boca Raton, 1993) p.p. 67-88. Кроме того, для трансформации растительных клеток или тканей и регенерации растений доступны экспрессирующие векторы и способы культивирования in vitro. См., например, Gruber et al., "Vectors for Plant Transformation" в Methods in Plant Molecular Biology and Biotechnology, B.R. Glick and J.E. Thompson, Eds. (CRC Press, Inc., Boca Raton, 1993) p.p. 89-119.
Опосредованная агробактериями трансформация: Один из способов введения экспрессирующего вектора в растения основан на природной системе трансформации Agrobacterium. См., например, Horsch et al., Science 227:1229 (1985). A. tumefaciens и A. rhizogenes представляют собой патогенные для растений почвенные бактерии, которые генетически трансформируют растительные клетки. Плазмиды Ti и Ri A. tumefaciens и A. rhizogenes, соответственно, несут гены, ответственные за генетическую трансформацию растений. См., например, C.I. Kado, Crit. Rev. Plant Sci. 10:1 (1991). Описания векторных систем Agrobacterium и способов опосредованного Agrobacterium переноса генов, подходящих для целей настоящего изобретения, предоставлены в Bhalla and Singh, Nature Protocols 3(2):181-9 (2008), Cardoza and Stewart, Methods Mol Biol. 343:257-66 (2006), Gruber et al., выше, Miki et al., выше, and Moloney et al., Plant Cell Reports 8:238 (1989). Также см. патент США № 5563055 (Townsend и Thomas), выданный 8 октября 1996 года.
Прямой перенос генов: В качестве альтернативы опосредованной агробактериями трансформации разработано несколько способов трансформации растений, совместно обозначаемых как прямой перенос генов. Общеприменимый способ трансформации растений представляет собой опосредованную микрочастицами трансформацию, где ДНК находится на поверхности микрочастиц с размерами от 1 до 4 мкм. Экспрессирующий вектор вводят в ткани растения посредством биолистического устройства, ускоряющего микрочастицы до скоростей от 300 до 600 м/сек, которых достаточно для прохождения через клеточные стенки и мембраны растений. Sanford et al., Part. Sci. Technol. 5:27 (1987), J.C. Sanford, Trends Biotech. 6:299 (1988), Klein et al., Bio/Technology 6:559-563 (1988), J.C. Sanford, Physiol. Plant 7:206 (1990), Klein et al., Biotechnology 10:268 (1992). Также см. патент США № 5015580 (Christou, et al.), выданный 14 мая 1991 года; патент США № 5322783 (Tomes, et al.), выданный 21 июня 1994 года.
Другим способом физической доставки ДНК в растения является обработка клеток-мишеней ультразвуком. Zhang et al., Bio/Technology 9:996 (1991). Альтернативно, для введения экспрессирующих векторов в растения можно использовать слияние липосом и сферопластов. Deshayes et al., EMBOJ. 4:2731 (1985), Christou et al., Proc Natl Acad. Sci. U.S.A. 84:3962 (1987). Также сообщалось о прямом захвате ДНК в протопласты с использованием осаждения CaCl2, поливиниловым спиртом или поли-L-орнитином. Hain et al., Mol Gen. Genet. 199:161 (1985) и Draper et al., Plant Cell Physiol 23:451 (1982). Также описана электропорация протопластов и целых клеток, и тканей. Donn et al., In Abstracts of VIIth International Congress on Plant Cell and Tissue Culture IAPTQ A2-38, p 53 (1990); D'Halluin et al., Plant Cell 4:1495-1505 (1992), и Spencer et al., Plant Mol Biol 24:51-61 (1994).
После трансформации тканей-мишеней Brassica экспрессия описанных выше генов селективных маркеров позволяет преимущественную селекцию трансформированных клеток, тканей и/или растений с использованием способов регенерации и селекции, в настоящее время хорошо известных в данной области.
Указанные способы трансформации, как правило, можно использовать для получения трансгенного сорта. Затем трансгенный сорт можно скрещивать с другим (нетрансформированным или трансформированным) сортом для получения нового трансгенного сорта. Альтернативно генетический признак, введенный в конкретную линию Brassica указанными выше способами трансформации, можно переносить в другую линию традиционными способами обратного скрещивания, которые хорошо известны в области селекции растений. Например, подход обратного скрещивания можно использовать для переноса введенного признака из общего, неэлитного сорта в элитный сорт или из сорта, содержащего чужеродный ген в своем геноме, в сорт или сорта, которые не содержат этого гена. Как применяют в настоящем документе, в зависимости от контекста "скрещивание" может относиться к простому скрещиванию X с Y или к способу обратного скрещивания.
Тканевая культура Brassica: Кроме того, получение линий B. juncea можно осуществлять посредством самоопыления или посредством тканевой культуры и регенерации. Тканевая культура различных тканей Brassica и регенерация из нее растений известны. Например, выращивание культивара Brassica посредством тканевой культуры описано в любом из следующего, но не ограничиваясь ничем из следующего: Chuong et al., "A Simple Culture Method for Brassica Hypocotyl Protoplasts", Plant Cell Reports 4:4-6 (1985); T.L. Barsby et al., "A Rapid and Efficient Alternative Procedure for the Regeneration of Plants from Hypocotyl Protoplasts of Brassica napus", Plant Cell Reports (Spring, 1996); K. Kartha et al., "In vitro Plant Formation from Stem Explants of Rape", Physiol. Plant, 31:217-220 (1974); S. Narasimhulu et al., "Species Specific Shoot Regeneration Response of Cotyledonary Explants of Brassicas", Plant Cell Reports (Spring 1988); E. Swanson, "Microspore Culture in Brassica" Methods in Molecular Biology, Vol. 6, Chapter 17, p. 159 (1990).
Таким образом, в другом аспекте настоящее изобретение относится к клеткам, которые при росте и дифференцировке дают растения Brassica с физиологическими и морфологическими характеристиками линий B. juncea по настоящему изобретению.
Как применяют в настоящем документе, термин "тканевая культура" означает состав, содержащий выделенные клетки одного или различных классов или группу таких клеток, организованных в части растения. Иллюстративными типами тканевых культур являются протопласты, каллюс, скопления растительных клеток и растительные клетки, которые могут давать тканевую культуру, интактные в растениях или частях растений, таких как зародыши, пыльца, цветы, семена, стручки, листья, стебли, корни, корневые кончики, пыльники, пестики и т.п. Способы получения и поддержания тканевой культуры растения хорошо известны в данной области. В качестве примера, для получения регенерированных растений использовали тканевую культуру, содержащую органы. Некоторые способы описаны в патентах США №№ 5959185, 5973234 и 5977445.
Данное изобретение также относится к способам получения растения Brassica посредством скрещивания первого родительского растения Brassica со вторым родительским растением Brassica, где первое или второе родительское растение Brassica представляет собой растение Brassica, несущее по меньшей мере один мутантный ген FAD (т.е. FAD2 и/или FAD3). Таким образом, любые такие способы с применением линии Brassica juncea по настоящему изобретению представляют собой часть настоящего изобретения: самоопыление, обратные скрещивания, получение гибридов, скрещивания с получением популяций и т.п.
Гены чужеродных белков и агрономические гены
С применением трансгенных растений по настоящему изобретению чужеродный белок можно получать в коммерческих количествах. Таким образом, способы селекции и выращивания трансформированных растений, которые хорошо известны в данной области, дают множество трансгенных растений, которые собирают общепринятым способом, а затем чужеродный белок можно выделять из представляющей интерес ткани или из общей биомассы. Выделение белка из биомассы растений можно проводить известными способами, которые описаны, например, в Heney and Orr, Anal. Biochem. 114:92-6 (1981).
По предпочтительному варианту осуществления трансгенное растение, предоставляемое для коммерческого получения чужеродного белка, представляет собой растение канолы. В другом предпочтительном варианте осуществления представляющая интерес биомасса представляет собой семена. Для относительно небольшого количества трансгенных растений, демонстрирующих повышенные уровни экспрессии, можно получать генетическую карту, преимущественно посредством общепринятых анализов ПДРФ, ПЦР и SSR, которая идентифицирует приблизительное положение интегрированной молекулы ДНК в хромосоме. Для получения информации об иллюстративных способах в этом отношении см. Glick and Thompson, Methods in Plant Molecular Biology and Biotechnology, CRC Press, Boca Raton 269:284 (1993). Информация из карты относительно положения в хромосоме пригодна для патентной защиты трансгенного растения по изобретению. Если предпринимается неправомерное выращивание и проводится скрещивание с другой зародышевой линией, карту области интеграции можно сравнивать со сходными картами подозреваемых растений для определения того, имеют ли последние общее происхождение с растением по изобретению. Сравнение карт может включать гибридизацию, ПДРФ, ПЦР, SSR и секвенирование, которые все являются общепринятыми способами.
Подобным образом, в трансформированных растениях способами по настоящему изобретению можно экспрессировать агрономические гены. Более конкретно, растения можно сконструировать генетически с экспрессией различных фенотипов, представляющих агрономический интерес. Иллюстративные гены, относящиеся к этому, включают в качестве неограничивающих примеров гены, сгруппированные ниже:
1. Гены, придающие устойчивость к паразитам или заболеванию и кодирующие:
A. Гены устойчивости к заболеваниям растений. Защита растений часто активируется специфическим взаимодействием между продуктом гена устойчивости к заболеваниям (R) в растении и продуктом соответствующего гена авирулентности (Avr) в патогене. Сорт растения можно трансформировать клонированными генами устойчивости с конструированием растения, которое устойчиво к конкретным штаммам патогена. См., например Jones et al., Science 266:789 (1994) (клонирование гена Cf-9 томата для устойчивости к Cladosporium fulvum); Martin et al., Science 262:1432 (1993) (ген Pto томата для устойчивости к Pseudomonas syringae pv. tomato кодирует протеинкиназу); Mindrinos et al., Cell 78:1089 (1994) (ген Arabidopsis RSP2 для устойчивости к Pseudomonas syringae).
B. Ген, придающий устойчивость к вредителям, таким как нематода соевых бобов. См. например, заявку PCT WO 96/30517; заявку PCT WO 93/19181.
C. Белок Bacillus thuringiensis, его производное или моделирующий его синтетический полипептид. См., например, Geiser et al., Gene 48:109 (1986), где описано клонирование и нуклеотидная последовательность гена δ-эндотоксина Bt. Кроме того, молекулы ДНК, кодирующие гены δ-эндотоксина, можно приобрести в American Type Culture Collection, Manassas, Va., например, под инвентарными номерами ATCC 40098, 67136, 31995 и 31998.
D. Лектин. Например, см. описание Van Damme et al., Plant Molec. Biol. 24:25 (1994), где описаны нуклеотидные последовательности нескольких генов связывающих маннозу лектинов Clivia miniata.
E. Связывающий витамины белок, такой как авидин. См. заявку PCT US93/06487. В заявке описано применение авидина и гомологов авидина в качестве ларвицидов против насекомых-вредителей.
F. Ингибитор фермента, например, ингибитор протеазы или протеиназы или ингибитор амилазы. См., например, Abe et al., J. Biol Chem. 262:16793 (1987) (нуклеотидная последовательность ингибитора цистеиновой протеиназы риса); Huub et al., Plant Molec. Biol 21:985 (1993) (нуклеотидная последовательность кДНК, кодирующей ингибитор протеиназы табака 1); Sumitani et al., Biosci. Biotech. Biochem. 57:1243 (1993) (нуклеотидная последовательность ингибитора α-амилазы Streptomyces nitrosporeus); и патент США № 5494813 (Hepher and Atkinson, выданный 27 февраля 1996 года).
G. Специфичный для насекомого гормон или феромон, такой как экдистероид или ювенильный гормон, их вариант, миметик на их основе или их антагонист или агонист. См., например, описание Hammock et al., Nature 344:458 (1990), бакуловирусной экспрессии клонированной эстеразы ювенильного гормона, инактиватора ювенильного гормона.
H. Специфичный для насекомых пептид или нейропептид, который при экспрессии нарушает физиологию поддающегося действию вредителя. Например, см. описания Regan, J. Biol Chem. 269:9 (1994) (экспрессионное клонирование, дающее ДНК, кодирующую рецептор диуретического гормона насекомых); и Pratt et al., Biochem. Biophys. Res. Comm. 163:1243 (1989) (аллостатин, идентифицированный у Diploptera puntata). Также см. патент США № 5266317 Tomalski et al., в котором описаны гены, кодирующие специфичные для насекомых паралитические нейротоксины.
I. Специфичный для насекомых яд, продуцируемый в природе змеями, осами и т.д. Например, см. Pang et al., Gene 116:165 (1992), где описана гетерологическая экспрессия в растениях гена, кодирующего инсектотоксичный пептид скорпиона.
J. Фермент, ответственный за гипернакопление монотерпена, сесквитерпена, стероида, гидроксамовой кислоты, фенилпропаноидного производного или другой небелковой молекулы с инсектицидной активностью.
K. Фермент, вовлеченный в модификацию, включая посттрансляционную модификацию, биологически активной молекулы; например, гликолитический фермент, протеолитический фермент, липолитический фермент, нуклеаза, циклаза, трансаминаза, эстераза, гидролаза, фосфатаза, киназа, фосфорилаза, полимераза, эластаза, хитиназа и глюканаза, природные или синтетические. См. заявку PCT WO 93/02197 на имя Scott et al., в которой описана нуклеотидная последовательность гена каллазы. Молекулы ДНК, содержащие кодирующие хитиназу последовательности, можно получать, например, из ATCC под инвентарными №№ 39637 и 67152. Также см. Kramer et al., Insect Biochem. Molec. Biol. 23:691 (1993), в которой описана нуклеотидная последовательность кДНК, кодирующей хитиназу бражника табака, и Kawalleck et al., Plant Molec. Biol. 21:673 (1993), в которой описана нуклеотидная последовательность гена полиубиквитина ubi4-2 петрушки.
L. Молекула, стимулирующая передачу сигнала. Например, см. описание Botella et al., Plant Molec. Biol. 24:757 (1994) нуклеотидных последовательностей клонов кДНК кальмодулина золотистой фасоли; и Griess et al., Plant Physiol. 104:1467 (1994), где описана нуклеотидная последовательность клона кДНК кальмодулина кукурузы.
M. Пептид с гидрофобным моментом. См. заявку PCT WO 95/16776 (описание пептидных производных тахиплезина, ингибирующих грибковые патогенные организмы растений) и заявку PCT WO 95/18855 (описывающую синтетические антимикробные пептиды, придающие устойчивость к заболеваниям).
N. Мембранная пермеаза, формирователь каналов или блокатор каналов. Например, см. описание Jaynes et al., Plant Sci. 89:43 (1993) гетерологической экспрессии цекропина-β, литического пептидного аналога, делающего трансгенные растения табака устойчивыми к Pseudomonas solanacearum.
O. Вирусный инвазивный белок или получаемый из него комплексный токсин. Например, накопление белков вирусной оболочки в трансформированных растительных клетках придает устойчивость к развитию вирусной инфекции и/или вирусного заболевания, осуществляемого вирусом, из которого получен белок вирусной оболочки, а также родственными вирусами. См. Beachy et al., Ann. Rev. Phytopathol. 28:451 (1990). Опосредованную белками оболочки устойчивость придают трансформированным растениям против вируса мозаики люцерны, вируса мозаики огурца, вируса полосатости табака, вируса X картофеля, вирус Y картофеля, вирус гравировки табака, вируса пятнистости табака и вируса табачной мозаики. Там же.
P. Специфичное для насекомых антитело или получаемый из него иммунотоксин. Таким образом, антитело, направленное на решающую метаболическую функцию пищеварительного канала насекомого, может инактивировать поддающийся воздействию фермент, убивая насекомого. См. Taylor et al., Abstract #497, Seventh Int'l Symposium on Molecular Plant-Microbe Interactions (Edinburgh, Scotland) (1994) (ферментативная инактивация у трансгенных растений табака посредством продукции одноцепочечных фрагментов антител).
Q. Вирусоспецифичное антитело. См., например, Tavladoraki et al., Nature 366:469 (1993), где показано, что трансгенные растения, экспрессирующие рекомбинантные гены антител, защищены от поражения вирусами.
R. Задерживающий развитие белок, продуцируемый в природе патогеном или паразитом. Таким образом, грибковые эндо-α-1,4-D-полигалактуроназы облегчают грибковую колонизацию и высвобождение растительных питательных веществ посредством растворения гомо-α-1,4-D-галактуроназы клеточной стенки растений. См. Lamb et al., Bio/Technology 10:1436 (1992). В Toubart et al., Plant J. 2:367 (1992) описано клонирование и характеристика гена, кодирующего ингибирующий эндополигалактуроназу фасоли белок.
S. Задерживающий развитие белок, продуцируемый в природе растениями. Например, Logemann et al., Bio/Technology 10:305 (1992) показали, что трансгенные растения, экспрессирующие инактивирующий рибосому ячменя ген, обладают увеличенной устойчивостью к грибковым заболеваниям.
2. Гены, придающие устойчивость к гербицидам:
A. Гербицид, ингибирующий точку роста или меристему, такой как имидазолинон или сульфонилкарбамид. Иллюстративные гены в этой категории кодируют мутантные ферменты ALS и AHAS, как описано, например, в Lee et al., EMBOJ. 7:1241 (1988) и Miki et al., Theor. Appl. Genet. 80:449 (1990), соответственно.
B. Гены устойчивости к глифосату (устойчивость, придаваемая например, мутантной 5-енолпирувилшикимат-3-фосфатсинтетазой (EPSP) (посредством введения рекомбинантных нуклеиновых кислот и/или различных форм мутагенеза in vivo природных генов EPSP), гены aroA и гены глифосатацетилтрансферазы (GAT), соответственно), гены устойчивости к другим фосфоновым соединениям, таким как глюфосинат (гены фосфинотрицинацетилтрансферазы (PAT) из видов Streptomyces, включая Streptomyces hygroscopicus и Streptomyces viridichromoгены) и пиридинокси- или феноксипропионовая кислоты и циклогексаны (гены, кодирующие ингибитор ACC-азы). См., например, патент США № 4940835 Shah et al. и патент США № 6248876 Barry et al., в которых описаны нуклеотидные последовательности форм EPSP, которые могут придавать растениям устойчивость к глифосату. Молекулу ДНК, кодирующую мутантный ген aroA, можно получать под инвентарным номером ATCC 39256, а нуклеотидная последовательность мутантного гена описана в патенте США № 4769061 Comai. В европейской патентной заявке № 0333033 Kumada et al. и в патенте США № 4975374 Goodman et al. описаны нуклеотидные последовательности генов глутаминсинтетазы, которые придают устойчивость к гербицидам, таким как L-фосфинотрицин. В европейской заявке № 0242246 Leemans et al. предоставлена нуклеотидная последовательность гена PAT. DeGreef et al., Bio/Technology 7:61 (1989) описывают получение трансгенных растений, экспрессирующих химерные гены bar, кодирующие активность PAT. Примеры генов, придающих устойчивость к феноксипропионовым кислотам и циклогексонам, таким как сетоксидим и галоксифоп, представляют собой гены Acc1-S1, Acc1-S2 и Acc1-S3, описанные Marshall et al., Theor. Appl. Genet. 83:435 (1992). В WO 2005012515 Castle et al. описаны гены GAT, способные придавать устойчивость к глифосату. В WO 2005107437 и патентной заявке США с серийным № 11/587893, обе принадлежащие Dow AgroSciences LLC, описаны гены, придающие устойчивость к гербицидам 2,4-D, fop и пиридилоксиауксину.
C. Гербицид, ингибирующий фотосинтез, такой как триазин (гены psbA и gs+) или бензонитрил (ген нитрилазы). В Przibila et al., Plant Cell 3:169 (1991) описана трансформация Chlamydomonas плазмидами, кодирующими мутантные гены psbA. Нуклеотидные последовательности генов нитрилазы описаны в патенте США № 4810648 Stalker, а молекулы ДНК, содержащие эти гены, доступны под инвентарными номерами ATCC 53435, 67441 и 67442. В Hayes et al., Biochem. J. 285:173 (1992) описаны клонирование и экспрессия ДНК, кодирующей глутатион-S-трансферазу.
3. Гены, обеспечивающие или вносящие вклад в свойство с улучшенной характеристикой, такие как:
A. Метаболизм модифицированной жирной кислоты, например, посредством трансформации растения антисмысловым геном стеарил-ACP-десатуразы, для увеличения содержания стеариновой кислоты в растениях. См. Knultzon et al., Proc. Natl. Acad. Sci. U.S.A. 89:2624 (1992).
B. Сниженное содержание фитата 1) Введение кодирующего фитазу гена может усилить разрушение фитата, добавляя больше свободного фосфата в трансформированное растение. Например, см. Van Hartingsveldt et al., Gene 127:87 (1993) для описания нуклеотидной последовательности гена фитазы Aspergillus niger. 2) Можно вводить ген, который снижает содержание фитата. Например, для кукурузы это можно осуществлять, клонируя, а затем повторно вводя ДНК, ассоциированную с одним аллелем, ответственным за мутантную кукурузу, характеризующуюся низкими уровнями фитиновой кислоты. См. Raboy et al., Maydica 35:383 (1990).
C. Модифицированный углеводный состав, осуществляемый, например, посредством трансформации растений геном, кодирующим фермент, изменяющий профиль ветвления крахмала. См. Shiroza et al., J. Bacteriol. 170:810 (1988) (нуклеотидная последовательность мутантного гена фруктозилтрансферазы Streptococcus), Steinmetz et al., Mol. Gen. Genet. 20:220 (1985) (нуклеотидная последовательность гена левансахаразы Bacillus subtilis), Pen et al., Bio/Technology 10:292 (1992) (получение трансгенных растений, экспрессирующих α-амилазы Bacillus lichenifonnis), Elliot et al., Plant Molec. Biol. 21:515 (1993) (нуклеотидные последовательности генов инвертазы томата), Sogaard et al., J. Biol. Chem. 268:22480 (1993) (сайт-специфический мутагенез гена α-амилазы ячменя) и Fisher et al., Plant Physiol. 102:1045 (1993) (фермент ветвления крахмала эндосперма II кукурузы).
Депозит Dow AgroSciences, Inc. патентованной линии Brassica juncea ________, описанной выше и приведенной в приложенной формуле изобретения, сделан в American Type Culture Collection (ATCC), 10801 University Boulevard, Manassas, Va. 20110. Дата депозита была ________. Депозит семян ______ взят из того же депозита, поддерживаемого Dow AgroSciences, Inc., до даты подачи этой заявки. Все ограничения на депозит устранены и подразумевается, что депозит удовлетворяет всем требованиям 37 C.F.R. 1.801-1.809. Инвентарный номер ATCC представляет собой PTA-_____. Депозит поддерживается в депозитарии в течение периода 30 лет или 5 лет после последнего запроса, или в течение срока действия патента, в зависимости от того, что дольше, и в течение этого периода в случае необходимости будет заменяться.
Хотя в настоящем документе описаны различные варианты осуществления изобретения, в объем изобретения можно включать множество адаптаций и модификаций в соответствии с общим уровнем знаний специалистов в данной области. Такие модификации включают замену известными эквивалентами любого аспекта изобретения с достижением того же результата по существу тем же способом. Числовые диапазоны включают числа, определяющие диапазон. Изобретение включает все варианты осуществления и вариации, по существу как описано ранее в настоящем документе и со ссылкой на примеры и фигуры.
Реферат
Изобретение относится к области биохимии, в частности к трансгенному растению Brassica juncea, эндогенное содержание жирных кислот семян которого включает от примерно 70% до 78% олеиновой кислоты по массе и от примерно 2% до 3% линоленовой кислоты по массе, где растение содержит fad2 или fad3 аллель, кодирующую мутантный белок дельта-12-десатураз жирных кислот, имеющий аминокислотную последовательность, выбранную из группы, состоящую из SEQ ID NO:5-7, а также к семени вышеуказанного растения и к маслу указанного семени, содержание жирных кислот которого включает от примерно 70,0% до 78% олеиновой кислоты по массе и от примерно 2% до 3% линоленовой кислоты по массе, в остальном имеющее свойства масла семян Brassica juncea. Изобретение позволяет эффективно получать масло семян Brassica juncea, содержание жирных кислот которого включает от примерно 70,0% до 78% олеиновой кислоты по массе и от примерно 2% до 3% линоленовой кислоты по массе. 3 н. и 4 з.п. ф-лы, 4 ил., 6 пр.

Комментарии